Решение Коллегии Евразийской экономической комиссии от 17.07.2018 N 113
КОЛЛЕГИЯ ЕВРАЗИЙСКОЙ ЭКОНОМИЧЕСКОЙ КОМИССИИ
РЕШЕНИЕ
от 17 июля 2018 г. N 113
ОБ УТВЕРЖДЕНИИ РУКОВОДСТВА
ПО ВАЛИДАЦИИ АНАЛИТИЧЕСКИХ МЕТОДИК ПРОВЕДЕНИЯ ИСПЫТАНИЙ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
В соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая 2014 года и пунктом 2 статьи 3 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года Коллегия Евразийской экономической комиссии решила:
1. Утвердить прилагаемое Руководство по валидации аналитических методик проведения испытаний лекарственных средств.
2. Настоящее Решение вступает в силу по истечении 6 месяцев с даты его официального опубликования.
Председатель Коллегии
Евразийской экономической комиссии
Т.САРКИСЯН
Утверждено
Решением Коллегии
Евразийской экономической комиссии
от 17 июля 2018 г. N 113
РУКОВОДСТВО
ПО ВАЛИДАЦИИ АНАЛИТИЧЕСКИХ МЕТОДИК ПРОВЕДЕНИЯ ИСПЫТАНИЙ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
I. Общие положения
1. В настоящем Руководстве определяются правила валидации аналитических методик проведения испытаний лекарственных средств, а также перечень характеристик, подлежащих оценке при валидации указанных методик и включению в регистрационные досье, подаваемые в уполномоченные органы государств - членов Евразийского экономического союза (далее соответственно - государства-члены, Союз).
2. Целью валидации аналитической методики проведения испытаний лекарственных средств является документированное подтверждение ее пригодности для целевого назначения.
II. Определения
3. Для целей настоящего Руководства используются понятия, которые означают следующее:
"аналитическая методика" (analytical procedure) - методика проведения испытаний лекарственных средств, которая включает в себя подробное описание последовательности действий, необходимых для выполнения аналитического испытания (в том числе описание подготовки испытуемых образцов, стандартных образцов, реактивов, использования оборудования, построения градуировочной кривой, используемых расчетных формул и т.д.);
"воспроизводимость" (reproducibility) - свойство, характеризующее прецизионность в межлабораторных испытаниях;
"диапазон применения (аналитическая область)" (range) - интервал между наибольшей и наименьшей концентрациями (количеством) определяемого вещества в образце (включая эти концентрации), для которого показано, что аналитическая методика имеет приемлемый уровень прецизионности, правильности и линейности;
"линейность" (linearity) - прямо пропорциональная зависимость аналитического сигнала от концентрации (количества) определяемого вещества в образце в пределах диапазона применения (аналитической области) методики;
"открываемость (извлекаемость)" (recovery) - соотношение между полученным средним и истинным (опорным) значениями с учетом соответствующих доверительных интервалов;
"повторяемость (прецизионность внутри методики)" (repeatability (intra-assay precision)) - прецизионность методики при выполнении повторных испытаний в одинаковых рабочих условиях (например, одним и тем же аналитиком или группой аналитиков, на одном и том же оборудовании, с одними и теми же реактивами и т.д.) в течение короткого промежутка времени;
"правильность" (accuracy, trueness) - близость между принятым истинным (опорным) значением и полученным значением, которая выражается величиной открываемости;
"предел количественного определения" (quantitation limit) - наименьшее количество вещества в образце, которое можно количественно определить с соответствующей прецизионностью и правильностью;
"предел обнаружения" (detection limit) - наименьшее количество определяемого вещества в образце, которое может быть обнаружено, но необязательно точно количественно определено;
"прецизионность" (precision) - выражение близости (степени разброса) результатов (значений) между сериями измерений, проведенных на множестве проб, взятых из одной и той же однородной пробы, в предписанных методикой условиях;
"промежуточная (внутрилабораторная) прецизионность" (intermediate precision) - влияние вариаций внутри лаборатории (разные дни, разные аналитики, разное оборудование, разные серии (партии) реактивов и т.д.) на результаты испытаний идентичных образцов, отобранных из одной и той же серии;
"специфичность" (specificity) - способность аналитической методики однозначно оценивать определяемое вещество независимо от других веществ (примеси, продукты деградации, вспомогательные вещества, матрица (среда) и др.), присутствующих в испытуемом образце;
"устойчивость (робастность)" (robustness) - способность аналитической методики быть устойчивой к влиянию небольших задаваемых изменений в условиях проведения испытания, которая указывает на ее надежность при обычном (стандартном) использовании.
III. Типы аналитических методик, подлежащих валидации
4. В настоящем Руководстве рассматриваются подходы к валидации 4 наиболее распространенных типов аналитических методик:
а) испытания на идентификацию (подлинность);
б) испытания для определения количественного содержания примесей (quantitative tests for impurities content);
в) испытания для определения предельного содержания примесей в пробе (limit tests for the control impurities);
г) количественные испытания (на содержание или активность) (quantitative tests of the active moiety) для определения активной части молекулы действующего вещества в испытуемом образце.
5. Все аналитические методики, используемые для контроля качества лекарственных средств, необходимо валидировать. В настоящем Руководстве не рассматривается валидация аналитических методик для видов испытаний, не включенных в пункт 4 настоящего Руководства (например, испытания на растворение или определение размера частиц (дисперсности) фармацевтической субстанции и др.).
6. Испытания на идентификацию (подлинность) заключаются, как правило, в сравнении свойств (например, спектральных характеристик, хроматографического поведения, химической активности и т.д.) испытуемого и стандартного образцов.
7. Испытания для определения количественного содержания примесей и испытания для определения предельного содержания примесей в пробе направлены на правильное описание показателей чистоты пробы. Требования к валидации методик количественного определения примесей отличаются от требований к валидации методик определения предельного содержания примесей в пробе.
8. Методики количественных испытаний направлены на измерение содержания определяемого вещества в испытуемом образце. В настоящем Руководстве под количественным определением понимается количественное измерение основных компонентов фармацевтической субстанции. Сходные валидационные параметры применимы в отношении количественного определения действующего вещества или других компонентов лекарственного препарата. Допускается использовать валидационные параметры количественного определения в других аналитических методиках (например, при испытании на растворение).
Назначение аналитических методик должно быть четко определено, так как от этого зависит выбор валидационных характеристик, которые должны быть оценены в ходе валидации.
9. Оценке подлежат следующие типичные валидационные характеристики аналитической методики:
а) правильность (accuracy (trueness));
б) прецизионность (precision):
повторяемость (repeatability);
промежуточная (внутрилабораторная) прецизионность (intermediate precision);
в) специфичность (specificity);
г) предел обнаружения (detection limit);
д) предел количественного определения (quantitation limit);
е) линейность (linearity);
ж) диапазон применения (аналитическая область) (range).
10. Наиболее важные валидационные характеристики для валидации различных типов аналитических методик приведены в таблице.
Таблица
Валидационные характеристики для валидации различных типов
аналитических методик
Валидационная характеристика
Тип аналитической методики
испытания на идентификацию (подлинность)
испытания на примеси
количественные испытания
количественное содержание
предельное содержание
растворение (только измерение), содержание (активность)
Правильность
-
+
-
+
Прецизионность
повторяемость
-
+
-
+
промежуточная прецизионность
-
+ <*>
-
+ <*>
Специфичность <**>
+
+
+
+
Предел обнаружения
-
- <***>
+
-
Предел количественного определения
-
+
-
-
Линейность
-
+
-
+
Диапазон применения
-
+
-
+
--------------------------------
<*> Если определена воспроизводимость, определение промежуточной прецизионности не требуется.
<**> Недостаточная специфичность одной аналитической методики может быть компенсирована использованием одной или нескольких дополнительных аналитических методик.
<***> Может потребоваться в некоторых случаях (например, когда предел обнаружения и нормируемый предел содержания определяемой примеси близки).
Примечание. "-" - характеристика не оценивается, "+" - характеристика оценивается.
Указанный перечень следует рассматривать как типовой при валидации аналитических методик. Возможны исключения, требующие отдельного обоснования производителем лекарственного средства. Такая характеристика аналитической методики, как устойчивость (робастность), не приведена в таблице, но ее следует рассматривать на соответствующем этапе разработки аналитической методики.
Повторная валидация (ревалидация) может быть необходима в следующих случаях (но не ограничивается ими):
изменение схемы синтеза фармацевтической субстанции;
изменение состава лекарственного препарата;
изменение аналитической методики.
Повторная валидация не проводится, если производителем представлено соответствующее обоснование. Объем повторной валидации зависит от характера внесенных изменений.
IV. Методология валидации аналитических методик
1. Общие требования к методологии валидации
аналитических методик
11. В настоящем разделе приведены характеристики, учитываемые при валидации аналитических методик, а также представлены некоторые подходы и рекомендации для установления различных валидационных характеристик каждой аналитической методики.
12. В некоторых случаях (например, при доказательстве специфичности) для обеспечения качества фармацевтической субстанции или лекарственного препарата может быть использовано сочетание нескольких аналитических методик.
13. Необходимо представить и проанализировать все соответствующие данные, собранные в ходе валидации, и формулы, использованные для расчета валидационных характеристик.
14. Допускается использовать иные подходы, чем подходы, изложенные в настоящем Руководстве. За выбор процедуры и протокола валидации несет ответственность заявитель. При этом основная цель валидации аналитической методики состоит в подтверждении пригодности методики для целевого назначения. Ввиду своей сложности подходы к аналитическим методикам для биологических и биотехнологических препаратов могут отличаться от описанных в настоящем Руководстве.
15. На протяжении всего исследования валидационных характеристик следует использовать стандартные образцы с известными характеристиками, подтвержденными документально. Необходимая степень чистоты стандартных образцов зависит от целевого назначения.
16. В отдельных подразделах настоящего раздела рассматриваются различные валидационные характеристики. Структура настоящего раздела отражает ход процесса разработки и оценки аналитической методики.
17. Экспериментальную работу следует планировать таким образом, чтобы соответствующие валидационные характеристики изучить одновременно, получая надежные данные о возможностях аналитической методики (например, о специфичности, линейности, диапазоне применения, правильности и прецизионности).
2. Специфичность
18. Изучение специфичности необходимо осуществлять в ходе валидации испытаний на идентификацию, примеси и количественное определение. Процедуры подтверждения специфичности зависят от целевого назначения аналитической методики.
19. Способ подтверждения специфичности зависит от задач, для решения которых предназначена данная аналитическая методика. Не во всех случаях удается подтвердить, что аналитическая методика специфична в отношении данного определяемого вещества (полная избирательность). В этом случае рекомендуется использовать сочетание 2 и более аналитических методик.
Недостаточная специфичность одной аналитической методики может быть компенсирована использованием одной или нескольких дополнительных аналитических методик.
20. Специфичность для различных видов испытаний означает следующее:
а) при испытании на идентификацию - подтверждение того, что методика позволяет идентифицировать именно определяемое вещество;
б) при испытании на примеси - подтверждение того, что методика позволяет правильно распознать примеси в образце (например, испытание на родственные соединения, тяжелые металлы, содержание остаточных растворителей и т.д.);
в) при количественных испытаниях - подтверждение того, что методика позволяет установить содержание или активность именно определяемого вещества в образце.
Идентификация
21. Удовлетворительные испытания на идентификацию должны обладать способностью различать между собой структурно близкородственные соединения, которые могут присутствовать в пробе. Избирательность аналитической методики может быть подтверждена путем получения положительных результатов (возможно, путем сравнения с известным стандартным образцом) для образцов, содержащих определяемый компонент, и отрицательных результатов для образцов, не содержащих его.
22. Для подтверждения отсутствия ложноположительных результатов испытание на идентификацию может быть проведено для веществ с близким строением или веществ, сопутствующих определяемому веществу.
23. Выбор потенциально мешающих проведению испытания веществ должен быть обоснован.
Количественное определение и испытания на примеси
24. При подтверждении специфичности для аналитической методики с использованием метода хроматографического разделения следует представлять репрезентативные хроматограммы с надлежащим указанием индивидуальных компонентов. Необходимо использовать аналогичные подходы к другим методикам, основанным на разделении.
25. Критичные разделения в хроматографии подлежат изучению на соответствующем уровне. В случае критичных разделений должна быть установлена величина разрешения 2 наиболее близко элюируемых компонентов.
26. При использовании неспецифического метода количественного определения следует применять дополнительные аналитические методики и подтверждать специфичность всего комплекса методик. Например, если при выпуске фармацевтической субстанции количественное определение проводится титриметрическим методом, можно его дополнить соответствующим испытанием на примеси.
27. Подход аналогичен как для количественного определения, так и для испытаний на примеси.
Наличие образцов примесей
28. При наличии образцов примесей определение специфичности аналитической методики состоит в следующем:
а) при количественном определении необходимо подтвердить избирательность определения вещества в присутствии примесей и (или) других компонентов образца. Практически это осуществляется путем добавления к образцу (фармацевтической субстанции или лекарственному препарату) примесей и (или) вспомогательных веществ в соответствующем количестве и при наличии доказательства отсутствия их влияния на результат количественного определения действующего вещества;
б) при испытаниях на примеси специфичность может быть установлена путем добавления в фармацевтическую субстанцию или лекарственный препарат примесей в определенных количествах и при наличии доказательства разделения этих примесей друг от друга и (или) от других компонентов образца.
Отсутствие образцов примесей
29. Если стандартные образцы примесей или продуктов деградации отсутствуют, специфичность можно подтвердить путем сравнения результатов испытаний проб, содержащих примеси или продукты деградации, с результатами другой валидированной методики (например, фармакопейной или иной валидированной аналитической (независимой) методики). В соответствующих случаях стандартные образцы примесей должны включать в себя пробы, подвергшиеся хранению в определенных стрессовых условиях (свет, нагревание, влажность, кислотный (основный) гидролиз и окисление).
30. В случае количественного определения необходимо сравнить 2 результата.
31. В случае испытаний на примеси необходимо сравнить профили примесей.
32. Для доказательства соответствия пика определяемого вещества только одному компоненту целесообразно провести исследования на чистоту пиков (например, использование диодно-матричного детектирования, масс-спектрометрии).
3. Линейность
33. Линейную зависимость необходимо оценить в пределах всего диапазона применения аналитической методики. Ее можно подтвердить напрямую на фармацевтической субстанции (путем разведения основного стандартного раствора) и (или) на отдельных навесках искусственных (модельных) смесей компонентов лекарственного препарата, используя предложенную методику. Последний аспект допускается изучить в ходе определения диапазона применения (аналитической области) методики.
34. Линейность оценивается визуально по графику зависимости аналитического сигнала как функции от концентрации или количества определяемого вещества. При наличии четкой линейной зависимости полученные результаты необходимо обработать подходящими статистическими методами (например, путем вычисления регрессионной линии методом наименьших квадратов). Для получения линейности между результатами количественного определения и концентрациями проб до проведения регрессионного анализа может потребоваться математическое преобразование результатов испытаний. Результаты анализа линии регрессии могут быть использованы для математической оценки степени линейности.
35. При отсутствии линейности данные испытаний следует подвергнуть математическому преобразованию до проведения регрессионного анализа.
36. Для подтверждения линейности должны быть определены и представлены коэффициент корреляции или коэффициент детерминации, свободный член линейной регрессии, тангенс угла наклона линии регрессии и остаточная сумма квадратов отклонений, а также приложен график со всеми экспериментальными данными.
37. Если линейность не наблюдается ни при каких видах математических преобразований (например, при валидации иммуноаналитических методик), аналитический сигнал необходимо описать с помощью соответствующей функции концентрации (количества) определяемого компонента в пробе.
38. Для установления линейности рекомендуется использовать как минимум 5 концентраций. Применение других подходов требует обоснования.
V. Диапазон применения (аналитическая область)
39. Диапазон применения аналитической методики зависит от ее назначения и определяется при изучении линейности. В пределах диапазона применения методика должна обеспечивать требуемую линейность, правильность и прецизионность.
40. В качестве минимально допустимых должны быть рассмотрены следующие диапазоны применения (аналитические области) аналитических методик:
а) для количественного определения действующего вещества в фармацевтической субстанции или лекарственном препарате - от концентрации (содержания) 80 процентов до концентрации (содержания) 120 процентов от номинальной концентрации (содержания);
б) для однородности дозирования - от концентрации (содержания) 70 процентов до концентрации (содержания) 130 процентов, если для лекарственного препарата не обоснован более широкий диапазон в зависимости от лекарственной формы (например, дозированные ингаляторы);
в) для испытания на растворение - ![]() 20 процентов (абсолютных) от номинального диапазона применения. Например, если спецификации препарата с модифицированным высвобождением охватывают область от 20 процентов за первый час до 90 процентов от заявленного содержания за 24 часа, валидированный диапазон применения должен быть от 0 до 110 процентов от заявленного содержания;
20 процентов (абсолютных) от номинального диапазона применения. Например, если спецификации препарата с модифицированным высвобождением охватывают область от 20 процентов за первый час до 90 процентов от заявленного содержания за 24 часа, валидированный диапазон применения должен быть от 0 до 110 процентов от заявленного содержания;
г) для определения примесей - от предела обнаружения примеси до 120-процентного значения, указанного в спецификации;
д) для примесей, обладающих чрезвычайно сильным действием или имеющих токсический или непредвиденный фармакологический эффект, предел обнаружения и предел количественного определения должны быть соразмерны тому уровню, на котором эти примеси должны контролироваться. В целях валидации методик испытания на примеси, применяемых в ходе разработки, может потребоваться задать аналитическую область вблизи предполагаемого (возможного) предела;
е) если количественное определение и чистота изучаются одновременно с помощью одного испытания и используется только 100-процентный стандарт, линейная зависимость должна быть во всем диапазоне применения аналитической методики начиная с порога информирования для примеси (в соответствии с правилами изучения примесей в лекарственных средствах и установления требований к ним в спецификациях, утверждаемыми Евразийской экономической комиссией) до 120-процентного содержания, указанного в спецификации для количественного определения.
VI. Правильность
41. Правильность должна быть установлена для всего диапазона применения аналитической методики.
1. Количественное определение активной
фармацевтической субстанции
Фармацевтическая субстанция
42. Могут быть использованы несколько способов оценки правильности:
применение аналитической методики к анализируемой субстанции с известной степенью чистоты (например, к стандартному материалу);
сравнение результатов анализа, полученных с использованием валидируемой аналитической методики, и результатов, полученных с помощью методики, правильность которой известна, и (или) независимой методики.
Заключение о правильности можно сделать после установления прецизионности, линейности и специфичности.
Лекарственный препарат
43. Могут быть использованы несколько способов оценки правильности:
применение аналитической методики к искусственным (модельным) смесям компонентов лекарственного препарата, в которые было добавлено заранее известное количество определяемого вещества;
при отсутствии образцов всех компонентов лекарственного препарата возможно добавление заранее известного количества фармацевтической субстанции к лекарственному препарату или сравнение результатов, полученных с помощью другой методики, правильность которой известна, и (или) независимой методики.
Заключение о правильности можно сделать после определения прецизионности, линейности и специфичности.
2. Количественное определение примесей
44. Правильность определяется на пробах (фармацевтической субстанции и лекарственного препарата), в которые добавлено известное количество примесей.
45. При отсутствии образцов определяемых примесей и (или) продуктов деградации приемлемо сравнение результатов с результатами, полученными с помощью независимой методики. Допускается использование аналитического сигнала действующего вещества.
46. Необходимо указать конкретный способ выражения содержания индивидуальных примесей или их суммы (например, в массовых процентах или в процентах по отношению к площади пика, но во всех случаях по отношению к основному определяемому веществу).
3. Рекомендуемый объем исследований
и показатели правильности
47. Правильность оценивается не менее чем для 9 определений 3 различных концентраций, охватывающих весь диапазон применения (то есть 3 концентрации и 3 повтора для каждой концентрации). Определения должны включать в себя все стадии методики.
48. Правильность выражается величиной открываемости в процентах по результатам количественного определения вещества, добавленного в известном количестве в анализируемый образец, или разностью между полученным средним и истинным (опорным) значениями с учетом соответствующих доверительных интервалов.
VII. Прецизионность
49. Валидация испытаний на количественное определение и примеси предусматривает определение прецизионности.
50. Прецизионность устанавливается на 3 уровнях: повторяемость, промежуточная прецизионность и воспроизводимость. Прецизионность следует устанавливать с использованием однородных аутентичных образцов. В случае невозможности получения однородного образца допускается определение прецизионности с помощью искусственно приготовленных (модельных) образцов или раствора образца. Прецизионность аналитической методики, как правило, выражается величиной дисперсии, стандартного отклонения или коэффициента вариации серии измерений.
VIII. Повторяемость
51. Повторяемость определяется путем выполнения не менее 9 определений концентраций, входящих в диапазон применения аналитической методики (3 концентрации и 3 повтора для каждой концентрации), или не менее 6 определений концентрации для образцов со 100-процентным содержанием определяемого вещества.
IX. Промежуточная (внутрилабораторная) прецизионность
52. Степень установления промежуточной прецизионности зависит от условий использования аналитической методики. Заявитель должен установить влияние случайных факторов на прецизионность аналитической методики. Типичными исследуемыми (вариабельными) факторами являются разные дни, аналитики, оборудование и т.д. Изучать указанные влияния по отдельности не требуется. При изучении влияния различных факторов предпочтительно использовать планирование эксперимента.
X. Воспроизводимость
53. Воспроизводимость характеризует прецизионность в межлабораторном эксперименте. Воспроизводимость следует определять в случае стандартизации аналитической методики (например, при ее включении в Фармакопею Союза или в фармакопеи государств-членов). Включение данных о воспроизводимости в регистрационное досье не требуется.
XI. Представление данных
54. Для каждого вида прецизионности необходимо указывать стандартное отклонение, относительное стандартное отклонение (коэффициент вариации) и доверительный интервал.
XII. Предел обнаружения
55. Возможны различные подходы к определению предела обнаружения в зависимости от того, является методика инструментальной или неинструментальной. Допускается использовать и другие подходы.
XIII. Визуальная оценка
56. Визуальная оценка может использоваться как для неинструментальных, так и для инструментальных методик. Предел обнаружения устанавливается путем анализа проб с известными концентрациями определяемого вещества и определения его минимального содержания, при котором оно достоверно обнаруживается.
XIV. Оценка предела обнаружения по отношению "сигнал/шум"
57. Данный подход применим только к аналитическим методикам, для которых наблюдается шум базовой линии.
58. Определение отношения "сигнал/шум" проводится методом сравнения сигналов, полученных от проб с известными низкими концентрациями, с сигналами, полученными от холостых проб, и установления минимальной концентрации, при которой определяемое вещество может быть достоверно обнаружено. Для оценки предела обнаружения приемлемой считается величина отношения "сигнал/шум" от 3:1 до 2:1.
XV. Оценка предела обнаружения по стандартному отклонению
аналитического сигнала и наклону градуировочной кривой
59. Предел обнаружения (ПО) может быть выражен следующим образом:
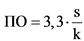 ,
,
где:
s - стандартное отклонение аналитического сигнала;
k - тангенс угла наклона градуировочной кривой.
60. Значение k вычисляется из градуировочной кривой для определяемого вещества. Оценка s может осуществляться несколькими способами:
а) по стандартному отклонению холостой пробы. Измеряется величина аналитического сигнала для достаточного количества холостых проб, и рассчитывается стандартное отклонение их значений;
б) по градуировочной кривой. Следует проанализировать полученную градуировочную кривую, построенную для образцов с содержанием определяемого вещества, близким к пределу обнаружения. В качестве стандартного отклонения может быть использовано остаточное стандартное отклонение регрессионной прямой или стандартное отклонение точки пересечения с осью ординат (стандартное отклонение свободного члена линейной регрессии).
XVI. Представление данных
61. Необходимо указать предел обнаружения и метод его определения. Если определение предела обнаружения основывается на визуальной оценке или оценке отношения "сигнал/шум", представление соответствующих хроматограмм считается достаточным для его обоснования.
62. Если значение предела обнаружения получено путем расчета или экстраполяции, оценка должна быть подтверждена посредством независимого испытания достаточного количества образцов с содержанием определяемого вещества, соответствующим пределу обнаружения или близкому к нему значению.
XVII. Предел количественного определения
63. Предел количественного определения является необходимой валидационной характеристикой методик, используемых для определения низкого содержания веществ в образце, в частности для определения примесей и (или) продуктов деградации.
64. Возможно несколько подходов к определению предела количественного определения в зависимости от того, является методика инструментальной или неинструментальной. Допускается использовать другие подходы.
XVIII. Визуальная оценка
65. Визуальная оценка может использоваться как для неинструментальных методик, так и для инструментальных.
66. Предел количественного определения обычно устанавливается путем анализа проб с известными концентрациями определяемого вещества и оценки минимального содержания, при котором определяемое вещество поддается количественному определению с приемлемой правильностью и прецизионностью.
XIX. Оценка предела количественного определения
по отношению "сигнал/шум"
67. Данный подход применим только к методам измерений, при которых наблюдается шум базовой линии.
68. Определение отношения "сигнал/шум" проводится методом сравнения измеряемых сигналов, полученных от образцов с известными низкими концентрациями определяемого вещества, с сигналами, полученными от холостых проб, и установления минимальной концентрации, при которой определяемое вещество может быть достоверно определено количественно. Обычное отношение "сигнал/шум" составляет 10:1.
XX. Оценка предела количественного
определения по стандартному отклонению сигнала и наклону
градуировочной кривой
69. Предел количественного определения (ПКО) может быть выражен следующим образом:
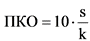 ,
,
где:
s - стандартное отклонение аналитического сигнала;
k - тангенс угла наклона градуировочной кривой.
70. Значение k вычисляется из градуировочной кривой для определяемого вещества. Оценка s может осуществляться несколькими способами:
а) по стандартному отклонению холостой пробы. Измеряется величина аналитического сигнала для достаточного количества холостых проб, и рассчитывается стандартное отклонение их значений;
б) по градуировочной кривой. Следует проанализировать полученную градуировочную кривую, построенную для образцов с содержанием определяемого вещества, близким к пределу количественного определения. В качестве стандартного отклонения может быть использовано остаточное стандартное отклонение регрессионной прямой или стандартное отклонение точки пересечения с осью ординат (стандартное отклонение свободного члена линейной регрессии).
XXI. Представление данных
71. Необходимо указать предел количественного определения и метод его определения.
72. Предел количественного определения необходимо впоследствии подтвердить с помощью анализа достаточного числа проб с содержанием определяемого вещества, равным пределу количественного определения или близкому к нему значению.
73. Могут быть приемлемы и другие подходы, отличающиеся от перечисленных выше.
XXII. Устойчивость (робастность)
74. Изучение устойчивости (робастности) необходимо осуществлять на стадии разработки, объем исследований зависит от рассматриваемой аналитической методики. Необходимо показать надежность анализа при преднамеренных вариациях параметров (условий) методики.
75. Если результаты измерений зависят от изменений в условиях применения аналитической методики, необходимо строго контролировать соблюдение таких условий или оговорить меры предосторожности при проведении испытания.
76. В целях обеспечения поддержания валидности аналитической методики при ее использовании одним из последствий изучения устойчивости (робастности) должно стать установление серий параметров пригодности системы (например, испытание на разрешение (resolution test)).
77. Общими вариациями параметров являются:
стабильность растворов, используемых в аналитических методиках;
время экстрагирования.
Параметрами вариации для жидкостной хроматографии являются:
изменение pH подвижной фазы;
изменение состава подвижной фазы;
разные колонки (разные серии и поставщики);
температура;
скорость подвижной фазы (скорость потока).
Параметрами вариации для газовой хроматографии являются:
различные колонки (разные серии и поставщики);
температура;
скорость газа-носителя.
XXIII. Оценка пригодности системы
78. Оценка пригодности системы является неотъемлемой частью многих аналитических методик. Эти испытания основаны на концепции, что оборудование, электронная техника, аналитические операции и анализируемые образцы составляют целостную систему и требуют оценки в качестве таковой. Критерии пригодности системы должны быть установлены для конкретной методики и зависят от типа валидируемой аналитической методики. Дополнительную информацию можно получить в Фармакопее Союза или в фармакопеях государств-членов.
