"Клинические рекомендации "Увеальная меланома"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
УВЕАЛЬНАЯ МЕЛАНОМА
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C69.3, C69.4, C69.8
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 100_2
Возрастная категория: Взрослые
Специальность: Онкология, Офтальмология
Разработчик клинической рекомендации
Общероссийская общественная организация "Ассоциация врачей-офтальмологов", Ассоциация онкологов России, Ассоциация специалистов по проблемам меланомы, Общероссийская общественная организация "Общество офтальмологов России"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
Для оценки соответствия терминов, используемых в клинической рекомендации, и терминов из актуальной номенклатуры медицинских услуг - см. таблицу А3-1 (Приложение А3)
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
БТ - Брахитерапия при новообразованиях глаза с использованием радиоактивного офтальмоаппликатора
в/в - внутривенный
ВБП - выживаемость без прогрессирования
ВГД - внутриглазное давление
ВОЗ - Всемирная организация здравоохранения
ГГТ - гамма-глутаминтрансфераза
Гр - Грей
ДИ - доверительный интервал
ЗНО - злокачественное новообразование
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
ЛФК - лечебная физкультура
МКА - моноклональные антитела (код АТХ-классификации: L01XС)
МКБ-10 - Международная классификация болезней 10-го пересмотра
МРТ - магнитно-резонансная томография
МХ - меланома хориоидеи
ОА - офтальмоаппликатор
ОВ - общая выживаемость
ОДМ - окулодермальный меланоз
ОКТ - оптическая когерентная томография
ОР - отношение рисков
ПЭТ - позитронно-эмиссионная томография
ПЭТ/КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией
РЛК - разрушающая лазеркоагуляция
РОД - разовая очаговая доза
рТ - патоморфологическая классификация
РЧА - радиочастотная абляция
СОД - суммарная очаговая доза
СРТ - стереотаксическая радиотерапия
СРХ - стереотаксическая радиохирургия
ТАХЭ - трансартериальная химиоэмболизация
ТИАБ - тонкоигольная аспирационная биопсия
ТТТ - транспупиллярная термотерапия
УЗИ - ультразвуковое исследование
УМ - увеальная меланома
ФАГ - флюоресцентная ангиография глазного дна
ЦХО - цилиохориоидальная отслойка
ЩФ - щелочная фосфатаза
AJCC - Американский объединенный комитет по раку
ASCO - Американское общество клинической онкологии
CTCAE - Общие терминологические критерии неблагоприятных эффектов
ECOG - Восточная объединенная группа онкологов
RECIST - Критерии ответа солидных опухолей на терапию
TNM (аббревиатура от tumor, nodus и metastasis) - международная классификация стадий злокачественных новообразований
UICC - Международный союз по борьбе с раком
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
CTLA4 - антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула B7.1 или B7.2.
PD1 - рецептор программируемой смерти 1.
Блокатор CTLA4 (также в тексте ингибитор CTLA4, МКА-блокатор CTLA4, блокатор CTLA4, анти-CTLA4) - АТХ класс L01FX (Прочие моноклональные антитела)) - моноклональное антитело, блокирующее тормозные сигналы каскада CTLA4.
Блокатор PD1 (также в тексте МКА-блокатор PD1, анти-PD1, МКА-блокатор aPD1, МКА-блокаторами PD1/PDl1) - L01FF Ингибиторы PD-1/PDL-1 (белок запрограммированной гибели клеток 1/лиганд запрограммированной смерти 1) - моноклональное антитело, блокирующее взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами.
Блокэксцизия - хирургическое лечение опухоли иридоцилиохориоидальной зоны, которое заключаются в удалении опухоли вместе с прилежащими тканями единым блоком в виде иридэктомии, иридоциклосклерэктомии, циклохориоидсклерэктомии и иридоциклохориоидсклерэктомии с захватом окружающих здоровых тканей на 2 мм.
Брахитерапия (БТ) - Брахитерапия при новообразованиях глаза - метод контактного облучения опухоли с использованием радиоактивных офтальмоаппликаторов, является "золотым стандартом" органосохраняющего лечения внутриглазных опухолей.
Компьютерная томография (КТ) - метод исследования, основанный на математической послойной реконструкции изображений, полученных с помощью рентгеновского излучения.
Магнитно-резонансная томография (МРТ) - способ получения томографических медицинских изображений для исследования внутренних органов и тканей с использованием явления ядерного магнитного резонанса.
Оптическая когерентная томография (ОКТ) - неинвазивный информативный, чувствительный метод, позволяющий количественно и качественно оценить состояние сетчатки, провести прижизненную "оптическую биомикрометрию" прилежащих к ней отделов стекловидного тела и хориоидеи.
Протонотерапия - вид дистанционного облучения опухоли с использованием энергии протонов. Протонный пучок имеет незначительное поперечное рассеивание, определенный пробег в биологических тканях и пик ионизации в конце пробега (пик Брегга). Это позволяет формировать дозные поля, соответствующие объему и форме опухоли (конформные), с высоким градиентом дозы на границе опухоли и здоровых тканей, благодаря чему к новообразованию можно подвести радикальные дозы излучения при минимальном лучевом поражении здоровых тканей глаза.
Разрушающая лазерная коагуляция (РЛК) - метод лазерного разрушения опухоли с использованием зеленого лазера с длиной волны 532 мкм.
Стереотаксическая радиохирургия "Гамма-нож" - это высокоточное однократное облучение с конвергенцией множества лучей в изоцентре с высоким градиентом дозы, на патологические очаги малого размера с обязательным применением стереотаксической рамы. Гамма-нож позволяет концентрировать высокую тумороцидную дозу в опухоли (около 30 Гр), но объем облучения здоровых тканей значителен по сравнению с протонным пучком.
Транспупиллярная термотерапия (ТТТ) - термотерапия новообразований сетчатки, сосудистой оболочки глаза - лазерный метод лечения с термическим воздействием на опухоль (42 - 60°) с использованием диодного лазера с длиной волны 810 нм, механизм действия которого связан с субкоагуляционным некрозом тромбозом и некрозом собственных сосудов опухоли.
Тонкоигольная аспирационная биопсия (ТИАБ) - метод прижизненной цитологической диагностики, позволяет с определенной достоверностью высказать суждение о меланоме, проводят в операционной.
Ультразвуковое исследование (УЗИ) глазного яблока и орбиты - неинвазивный, контактный, высокоинформативный инструментальный вы метод в диагностике УМ и контроля эффективности ее локального лечения.
Флюоресцентная ангиография глазного дна (ФАГ) - метод инструментальной диагностики патологии глазного дна с использованием внутривенного контрастного вещества флуоресцеина натрия (АТХ S01JA Красящие средства).
Второй этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Радиологическая оценка ответа на лечение - оценка ответа на лечение с использованием результатов радиологических исследований (компьютерной томографии, магнитно-резонансной томографии, позитронно-эмиссионной томографии, рентгенографии и т.д.) в сравнении с результатами ранее проведенных радиологических исследований в соответствии с одной или несколькими системами оценки ответа (такими как RECIST или ВОЗ).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Увеальная меланома - это опухоль нейроэктодермального происхождения, развивающаяся из меланоцитов увеального тракта (хориоидеи, цилиарного тела, радужки) [1 - 4].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
УМ - это редкий подтип меланомы (3,7 - 5% всех типов меланомы), который возникает в результате злокачественной трансформации меланоцитов сосудистой оболочки глазного яблока. Риск возникновения УМ повышен у лиц со светлой кожей, а также у лиц с голубым и серым цветом радужки [5 - 7]. В США, в подавляющем числе случаев, заболеваемость УМ отмечается у белокожего населения - 97,8% [8 - 10]. До сих пор остается не до конца ясным влияние ультрафиолетового излучения на образование меланомы глаза. Ряд авторов считают неубедительными данные, свидетельствующие о влиянии естественного ультрафиолетового излучения на развитие УМ [6, 11]. При этом отмечается роль искусственного ультрафиолетового излучения (солярий) в развитии увеальной меланомы [12, 13]. В литературе дискутируется вопрос о развитии УМ на фоне диспластических невусов, окулярного и окулодермального меланоза, развитие de novo. Так, по данным E. Richtig и соавт., у трети больных УМ (35,3%) выявили более пяти диспластических невусов в сравнении с 1,2% таковых в общей популяции [14]. Вероятность риска развития меланомы сосудистой оболочки у больных с диспластическими невусами сопоставима с риском возникновения меланомы кожи: соотношение рисков (RR) составило 4,36 и 4,32, соответственно [5, 15]. Также прослеживается связь между окулодермальным меланозом и УМ среди белого населения. По данным A.D. Singh, риск заболеть УМ в течение жизни оценивается в 2,6 x 10-3. Биологической основой развития УМ при окулярном и окулодермальным меланозом является большое количество меланоцитов в увеальном тракте у данной категории пациентов [16 - 24]. Одним из механизмов развития УМ является генетическая предрасположенность. Чаще всего наследственная УМ является одной из манифестаций так называемого TPS-синдрома, вызываемого герминальными мутациями в гене BAP1 (OMIM ID #614327 - около 3% всех УМ); описаны также единичные случаи УМ при герминальных мутациях в гене MBD4 (OMIM ID *603574) и при синдроме Линча (OMIM ID #276300).
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Среди злокачественных опухолей глаза меланома является самой распространенной. Около 95% всех глазных меланом приходится на сосудистый (увеальный) тракт глаза (передний-радужка и задний-цилиарное тело и хориоидея), оставшиеся 5% разделяют между собой меланомы конъюнктивы, орбиты и века [9, 10].
Ежегодная заболеваемость УМ в мире составляет 6 случаев на 1 млн населения [9, 10]. Среднеевропейский показатель заболеваемости УМ находится в пределах от 5 до 8 на 1 млн жителей [1, 25, 26]. Разброс в показателях заболеваемости связан с географической широтой: в Северной Европе зарегистрировано более 8 случаев на 1 млн (Норвегия и Дания), в Южной Европе - 2 случая на 1 млн (Испания и Италия). Данные, согласно которым у жителей южных стран УМ встречается реже, чем у жителей северных регионов, подтверждают и другие исследования [27, 28]. Возможно, обнаруженная эпидемиологическая особенность связана с защитным свойством пигментации [26]. УМ в странах Европы занимает одно из первых мест среди меланом редких локализаций (47,8%) [1].
УМ в Российской Федерации учитывается в совокупности с другими злокачественными новообразованиями глаза и его придаточного аппарата, однако среди прочих видов ЗНО глаза на УМ приходится до 70% всех новых выявленных случаев.
В 2023 г. в Российской Федерации ЗНО глаза и его придаточного аппарата заболело 1184 человека [29]. В 2023 г. грубый показатель заболеваемости 0,74 на 100 тыс. населения у мужчин и 0,87 на 100 тыс. населения у женщин (оба пола - 0,81 на 100 тыс.).
Стандартизованный показатель заболеваемости составил 0,58 и 0,56 на 100 тыс. населения у мужчин и женщин соответственно. В структуре заболеваемости ЗНО глаза и его придаточного аппарата составляет 0,18%.
Среднегодовой темп прироста грубого показателя заболеваемости за 10 лет составляет +1,77% (оба пола) [29].
Показатели смертности от ЗНО глаза и его придаточного аппарата в России отдельно не публикуются [29].
Под наблюдением на конец 2023 г. состояли 13810 пациентов (9,44 на 100 000 населения), из них 5 лет и более наблюдались 9 253 пациента (67%). Индекс накопления контингентов составил 12,87, а летальность - 2,76% (в сравнении с 2,55% в 2022 г.) [30].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее - МКБ-10) такие опухоли классифицируются в соответствии с топографическим расположением первичного очага [31]:
- C69.3 ЗНО сосудистой оболочки;
- C69.4 ЗНО ресничного (цилиарного) тела;
- C69.8 Поражение глаза, выходящее за пределы вышеуказанных локализаций;
Данные клинические рекомендации посвящены злокачественным новообразованиям сосудистой оболочки (C69.3), ЗНО ресничного (цилиарного) тела (C69.4) и поражению глаза, выходящему за пределы вышеуказанных локализаций (C69.8). В связи с тем, что подходы к лечению этих форм отличаются от подходов к терапии, например, C69.0, которые рассмотрены в клинических рекомендациях по меланоме кожи и слизистых оболочек.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Международная гистологическая классификация меланоцитарных опухолей
Классификация ВОЗ, 4-е издание, 2018 г. [32, 33]:
Меланоцитарные опухоли глаза
Увеальная меланома
Эпителиодноклеточная меланома 8771/3
Веретеноклеточная меланома, тип А 8773/3
Веретеноклеточная меланома, тип В 8774/3
1.5.2. Стадирование
Стадирование меланомы кожи по классификации TNM AJCC/UICC 8-го пересмотра (2017 г.) [34, 35].
Классификация основана на данных, полученных до начала лечения при осмотре, различных техниках визуализации глаза (УЗИ и КТ/МРТ орбит) для оценки категории T и дополненных данных, выявленных при хирургическом вмешательстве или исследовании операционного материала. Указанная ниже классификация применяется только для опухолей радужки, цилиарного тела и хориоидеи.
Критерий T отражает распространенность первичной опухоли. Классификация по критерию T возможна только после удаления первичной опухоли и ее гистологического исследования (Таблица 1).
Таблица 1. Критерий T (первичная опухоль)
Критерий T (соответствует рТ)
Радужка
Цилиарное тело и хориоидея
Tx:
Первичную опухоль оценить невозможно
Первичную опухоль оценить невозможно
T0
нет признаков первичной опухоли
Нет признаков первичной опухоли
T1:
Опухоль ограничена радужкой <1>
Диаметр опухоли 12,0 мм при толщине ![]() 3,0 мм или диаметр 9,0 мм при толщине опухоли 3,1 - 6 мм
3,0 мм или диаметр 9,0 мм при толщине опухоли 3,1 - 6 мм
T1a
< 3 часов условного циферблата по размерам
Без вовлечения цилиарного тела и распространения за пределы глаза
T1b
> 3 часов условного циферблата по размерам
С вовлечением цилиарного тела
T1c
сопровождается вторичной глаукомой
Без вовлечения цилиарного тела, но с распространением за пределы глаза менее 5 мм
T1d
-
С вовлечением цилиарного тела, но с распространением за пределы глаза менее 5 мм
T2
Опухоль соприкасается с или распространяется на цилиарное тело и/или сосудистую оболочку
Диаметр опухоли менее 12 мм при толщине 6,1 - 9 мм или диаметр 9,1 - 15 мм при толщине 3,1 - 6 мм или диаметр 12,1 - 18 мм при толщине 3,0 мм
T2a
Опухоль соприкасается с или распространяется на цилиарное тело без вторичной глаукомы
Без вовлечения цилиарного тела и распространения за пределы глаза
T2b
Опухоль соприкасается с или распространяется на сосудистую оболочку без вторичной глаукомы
С вовлечением цилиарного тела
T2c
Опухоль соприкасается с или распространяется на цилиарное тело и/или сосудистую оболочку с вторичной глаукомой
Без вовлечения цилиарного тела, но с распространением за пределы глаза менее 5 мм в диаметре
T2d
-
С вовлечением цилиарного тела, но с распространением за пределы глаза менее 5 мм в диаметре
T3
Инвазия в склеру
Диаметр ![]() 15,0 мм при толщине 12,1 - 15 мм или диаметр 18,0 мм при толщине опухоли 9,1 - 12 мм или диаметр 12,1 - 18 мм при толщине 6,1 - 9 мм или диаметр 15,1 - 18 мм при толщине 3,1 - 6 мм
15,0 мм при толщине 12,1 - 15 мм или диаметр 18,0 мм при толщине опухоли 9,1 - 12 мм или диаметр 12,1 - 18 мм при толщине 6,1 - 9 мм или диаметр 15,1 - 18 мм при толщине 3,1 - 6 мм
T3a
-
Без вовлечения цилиарного тела и распространения за пределы глаза
T3b
-
С вовлечением цилиарного тела
T3c
-
Без вовлечения цилиарного тела, но с распространением за пределы глаза менее 5 мм в диаметре
T3d
-
С вовлечением цилиарного тела, но с распространением за пределы глаза менее 5 мм в диаметре
T4
Инвазия за пределы склеры
Толщина опухоли > 15 мм или диаметр > 18 мм или толщина 12,1 - 15 мм при диаметре 15,1 - 18 мм
T4a
![]() 5,0 мм в диаметре
5,0 мм в диаметре
Без вовлечения цилиарного тела и распространения за пределы глаза
T4b
> 5,0 мм в диаметре
С вовлечением цилиарного тела
T4c
-
Без вовлечения цилиарного тела, но с распространением за пределы глаза менее 5 мм в диаметре
T4d
-
С вовлечением цилиарного тела, но с распространением за пределы глаза менее 5 мм в диаметре
T4e
-
Распространение за пределы глаза более 5 мм в диаметре при любом размере опухоли
--------------------------------
<1> Меланома радужной оболочки происходит из этой области сосудистой оболочки глаза и преимущественно расположена в ней. Если в радужной оболочке находится менее половины объема опухоли, возможно, опухоль возникла в цилиарном теле, и следует ее классифицировать соответствующим образом.
В таблице 2 также приведена зависимость критерия T от толщины и базального диаметра первичной меланомы сосудистой оболочки глаза.
Таблица 2. Классификация меланомы сосудистой оболочки глаза и цилиарного тела в зависимости от толщины и диаметра (категория T) [36].

Комментарий:
1) В клинической практике наибольший базальный диаметр опухоли может быть оценен в диаметрах диска зрительного нерва (дд, в среднем: 1 дд = 1,5 мм). Толщина опухоли может быть оценена в диоптриях (в среднем 2,5 дптр = 1 мм). Однако более точные результаты измерений дают такие методы, как ультрасонография и фотографирование глазного дна. Вовлечение цилиарного тела можно оценить с помощью щелевой лампы (биомикроскопии), офтальмоскопии, гониоскопии и трансиллюминации (диафаноскопии). Тем не менее, для более точной оценки используется высокочастотная ультрасонография (ультразвуковая биомикроскопия) (см. Таблицу А3-1). Распространение сквозь склеру оценивается визуально до и во время операции, а также с помощью УЗИ, компьютерной томографии или магнитно-резонансной томографии [36].
2) Когда патологоанатомическое исследование проводится после фиксации материала, диаметр и толщина опухоли могут быть недооценены из-за сморщивания ткани [36].
Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (Таблица 3).
Регионарными лимфатическими узлами следует считать:
- Предушные лимфатические узлы
- Подчелюстные лимфатические узлы
- Шейные лимфатические узлы
Таблица 3 Критерий N (поражение регионарных лимфатических узлов) [36]
Критерий N (соответствует pN)
Определение
Nx
регионарные лимфоузлы не могут быть оценены
N0
нет признаков поражения регионарных лимфоузлов
N1
есть признаки поражения лимфатических узлов
Критерий M характеризует наличие или отсутствие отдаленных метастазов (Таблица 4).
Таблица 4 Критерий M (отдаленные метастазы) [36]
Критерий M
Определение
M0
нет признаков отдаленных метастазов
M1
есть отдаленные метастазы
M1a
Метастазы наибольшим размером 3 см
M1b
Метастазы наибольшим размером от 3 до 8 см
M1c
Метастазы наибольшим размером более 8 см
Группировка по стадиям представлена в таблице 5.
Таблица 5 Группировка по стадиям [36]
T
N
M
Группировка по стадиям
T1a
N0
M0
IA
T1b - d, T2a
N0
M0
IIA
T2b, T3a
N0
M0
IIB
T2c-d
N0
M0
IIIA
T3b-c
N0
M0
IIIA
T4a
N0
M0
IIIA
T3d
N0
M0
IIIB
T4b-c
N0
M0
IIIB
T4d-e
N0
M0
IIIC
Любая T
N1
M0
IV
Любая T
Любая категория N
M1
IV
Патоморфологическая классификация pT
Критерии выделения категории pT соответствуют таковым для категории T.
Гистологический тип (G) [36]
GX - тип не может быть определен;
G1 - - веретеноклеточная меланома (![]() 90% веретеноподобных клеток,
90% веретеноподобных клеток, ![]() 10% эпителиоидных клеток);
10% эпителиоидных клеток);
G2 - смешанноклеточная меланома (доля веретеноподобных и эпителиоидных клеток > 10%, но <90%);
G3 - эпителиоидноклеточная меланома (![]() 10% веретеноподобных клеток,
10% веретеноподобных клеток, ![]() 90% эпителиоидных клеток).
90% эпителиоидных клеток).
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Меланома радужки. Узловая форма имеет вид нечетко отграниченного узла. Цвет от розового до темно-коричневого. На поверхности опухоли видны сосуды, контуры нечеткие. Смешанная форма характеризуется наличием узла на фоне плоскостного роста с распылением пигмента вокруг и опухолевыми сателлитами на поверхности радужки. Поверхность узла неровная, глубина передней камеры неравномерная. Врастание опухоли в дилятатор зрачка приводит к изменению его формы. Прорастание новообразования в заднюю камеру приводит к дислокации и помутнению хрусталика. На поверхности радужки можно видеть опухолевые сателлиты. Прорастание опухолью угла передней камеры в зависимости от площади прорастания приводит к стойкой гипертензии глаз. Диффузная форма меланомы характеризуется плоскостным ростом с распылением пигмента вокруг и прорастает в угол передней камеры глаза, рано приводя к стойкой гипертензии. Анулярная форма, как вариант диффузной, растет длительно, бессимптомно и проявляется гетерохромией радужки, сглаженностью ее рисунка. Поверхность приобретает шагреневый вид. Такая форма приводит к повышению внутриглазного давления. Меланома тапиока - редкая форма. Растет медленно, бессимптомно. На поверхности радужки видны бледно-серые полупрозрачные узелки с тенденцией к слиянию. Видны сосуды опухоли. Возможно образование гифемы. По краю зрачка скопление пигмента. Меланома радужки, распространяясь по сосудистой оболочке, образует иридоцилиарную меланому. Аналогичным образом, меланома цилиарного тела может распространяться в радужку, образуя иридоцилиарную форму опухоли. При дальнейшей прогрессии данных опухолей образуется иридоцилиохориоидальная меланома.
Меланома цилиарного тела. Изолированное поражение цилиарного тела встречается редко, значительно чаще встречается комбинированное поражение - иридоцилиарное или цилиохориоидальное. Опухоль может быть пигментированной или беспигментной, растет медленно, долгое время бессимптомно, на ранних стадиях роста новообразования может появиться гипотония. Увеличение размеров новообразования приводит к дислокации хрусталика и локальному помутнению его капсулы, что вызывает зрительные нарушения. Прорастание в угол передней камеры приводит к появлению складок радужки, ложного иридодиализа. Прорастание опухоли в радужку вызывает изменение формы зрачка, его край уплощается, реакция на свет снижается или отсутствует. В секторе роста опухоли появляются застойные извитые эписклеральные сосуды. Возможна неоваскуляризация радужки, повышение ВГД.
Меланома хориоидеи. Большинство меланом хориоидеи (МХ) (80 - 90%) локализуются постэкваториально, около 1/4 - в зоне экватора глаза. Очень редко встречаются бинокулярные и мультицентрические формы опухоли (0,1 - 0,3%). МХ имеет узловую форму роста или, реже, диффузную. В начальной стадии роста меланома хориоидеи выглядит как округлый, слегка проминирующий очаг серо-зеленого или желто-коричневого цвета с нечеткими, неровными границами. Часто на поверхности опухоли видны поля оранжевого пигмента (липофусцин). По мере роста меланомы в ней появляются собственные сосуды, может усиливаться пигментация. Рост опухоли сопровождается отслойкой сетчатки, возникающей вследствие транссудации и экссудации из сосудов новообразования и сетчатки. При прорыве стекловидной пластинки возможно формирование "грибовидной" формы опухоли. Нередко на поверхности меланомы появляются единичные или множественные геморрагии. Как правило, кровоизлияния в сетчатку, окружающую опухоль, наблюдаются при быстрорастущем новообразовании. Рост МХ может сопровождаться косвенными признаками: отслойкой сетчатки, увеитом, иридоциклитом, склеритом, рубеозом радужки, расширением эписклеральных сосудов, гемофтальмом, вторичной гипертензией, эндофтальмитом, помутнением хрусталика, субатрофией глаза. Диффузная МХ характеризуется распространенным утолщением хориоидеи, ее толщина обычно не превышает 2,5 мм, но при этом имеется большой диаметр основания. Для диффузной МХ характерно раннее врастание опухоли в зрительный нерв и распространение за пределы склеры [25, 37 - 40].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
1. данные жалоб и анамнеза
2. данные физикального обследования
3. данные инструментального обследования
4. в некоторых случаях данные патологоанатомического исследования операционного или биопсийного материала или цитологического исследования аспирата опухоли
2.1 Жалобы и анамнез
Введение в подраздел. Основные жалобы
- ухудшение зрения;
- искажение предметов;
- появлении "шторки" перед глазом;
- появление расширенных извитых сосудов на поверхности глаза;
- изменение цвета радужки и появление пятен.
- Рекомендуется врачу-офтальмологу для постановки диагноза УМ провести тщательный сбор жалоб и анамнеза пациента, и составить алгоритм диагностического поиска [2, 3, 41 - 45].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3).
Комментарий: при появлении вышеперечисленных жалоб врач (врач общей практики, врач-терапевт, врач-невролог, и т.д.) направляет пациента к врачу-офтальмологу.
- Рекомендуется врачу-онкологу и врачу-офтальмологу проводить тщательный опрос пациента с целью выявления таких жалоб как: тяжесть в правом подреберье, тошнота, изжога, отрыжка и пр., что может быть первыми симптомами метастазов в печени [2, 3, 42 - 45].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
2.2 Физикальное обследование
- Рекомендуется врачу-офтальмологу всем пациентам с подозрением на внутриглазную опухоль провести внешний осмотр органа зрения, оценить состояние периорбитальных тканей, положение глаза в орбите с целью выявления видимых изменений органа зрения [2, 3, 25, 37 - 41, 44, 45].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
- Рекомендуется врачу-офтальмологу направить к врачу-онкологу для проведения дополнительных исследований [46 - 48].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
2.3 Лабораторные диагностические исследования
- Рекомендуется врачу-патологоанатому во всех случаях, когда проведена биопсия новообразования глаза, а также первичное хирургическое лечение в объеме блокэксцизии, энуклеации, экзентерации отражать в заключении следующие характеристики [49 - 51] [47 - 49]:
- размер первичной опухоли (базальный диаметр и толщина) (кроме случаев частичного удаления - биопсии опухоли);
- локализацию опухоли;
- вовлеченность оболочек глаза (их инфильтрация, прорастание, отслойка);
- состояние краев резекции (при блокэксцизиях);
- наличие экстраокулярного роста и его размеры;
- длину зрительного нерва, ее инфильтрация опухолью на линии среза (после энуклеации, экзентерации);
- в опухолевой ткани - число митозов в поле зрения, пигментацию опухоли, лимфоцитарную и макрофагальную инфильтрацию, наличие некрозов, геморрагий;
- гистологический тип.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется всем пациентам при установлении диагноза первичной УМ выполнять лабораторные тесты: анализ крови биохимический общетерапевтический с включением таких параметров, как определение активности щелочной фосфатазы (ЩФ), гамма-глутамилтрансферазы (ГГТ), аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), лактатдегидрогеназы (ЛДГ) в крови, исследование уровня общего билирубина в крови для раннего выявления повышения этих параметров [47, 52 - 57].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам с УМ (или при подозрении на УМ) проводить комплекс стандартных офтальмологических методов обследования: визометрию, тонометрию, биомикроскопию глаза, при опухолях иридоцилиарной и иридоцилиохориоидальной локализации - гониоскопию, офтальмоскопию [39, 42 - 44, 58].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: врач-офтальмолог 1-го - 3-го звеньев проводит вышеперечисленные офтальмологические методы исследования и, при выявлении внутриглазной опухоли, направляет пациента в медицинское учреждение 3-го звена для дополнительного инструментального офтальмологического обследования. Офтальмоскопия проводится в условиях максимального мидриаза (при отсутствии у больного противопоказаний к расширению зрачка, синехий).
- Рекомендуется проводить ультразвуковое исследование глазного яблока и ультразвуковое сканирование глазницы всем пациентам с внутриглазными опухолями для оценки распространенности опухолевого процесса [59 - 68].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: ультразвуковые исследования проводят в медицинском учреждении 3-го звена. УЗИ является основным инструментальным методом диагностики внутриглазных опухолей. Исследование в режиме серошкальной эхографии (В-режиме) позволяет определить размеры новообразования (проминенцию и диаметр основания), локализацию и распространенность опухоли, состояние оболочек глаза. При использовании режимов цветового допплеровского картирования и спектрального допплеровского анализа потоков определяют наличие собственной неоваскулярной сети опухоли и регистрируются гемодинамические характеристики кровотока в сосудах опухоли [69].
- Рекомендуется выполнять ультразвуковое сканирование переднего отдела глаза при локализации опухоли в иридоцилиарной зоне для оценки распространенности опухолевого процесса [70].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется проведение оптического исследования заднего отдела глаза с помощью компьютерного анализатора (ОКТ) при МХ малых размеров и локализующихся в постэкваториальной зоне при условии прозрачных оптических средах глаза для оценки распространенности опухолевого процесса [71 - 74].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3).
Комментарии: ОКТ - высокоинформативный неинвазивный метод, позволяющий определять морфометрические признаки, характерные для МХ (дугообразное изменение хориоидального профиля, утолщение сетчатки за счет скопления интра- и субретинальной жидкости, наличие диффузного, кистовидного отека, отслойки нейроэпителия, дезорганизации пигмента в ретинальном пигментном эпителии с формированием пигментных фокусов и окончатых дефектов, компрессии хориокапилляров с эффектом "тени", отслойки нейроэпителия в сопредельной с опухолью зоне) [71 - 74].
- Рекомендуется тонкоигольная аспирационная биопсия (ТИАБ) при внутриглазных опухолях в трудных случаях, когда комплексное клинико-инструментальное обследование не позволяет установить точный диагноз для морфологической верификации диагноза и уточнения прогноза заболевания при помощи молекулярно-генетических тестов. ТИАБ опухоли проводят только в офтальмологических отделениях, специализирующихся на лечении онкологических заболеваний глаз, с последующим проведением брахитерапии или энуклеации при подтверждении диагноза УМ [25, 75 - 83].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется проведение магнитно-резонансной томографии (МРТ) глазницы (при противопоказаниях к МРТ-КТ глазницы) при подозрении прорастания УМ в зрительный нерв для оценки распространенности опухолевого процесса [38 - 40, 84 - 86].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарий: КТ и МРТ глазницы проводят с минимальным шагом (0,5 - 1,0) мм в двух взаимно перпендикулярных проекциях.
- Рекомендуется всем пациентам с УМ выполнять лучевую диагностику в оптимальном объеме: МРТ органов брюшной полости с внутривенным контрастным усилением для исключения метастатического поражения печени, КТ органов грудной полости для исключения метастатического поражения легких. При невозможности выполнения МРТ органов брюшной полости с внутривенным контрастным усилением возможно использование КТ органов брюшной полости с внутривенным болюсным контрастированием [47, 58, 87 - 95] [96, 97].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется направить пациента к врачу-онкологу при выявлении или подозрении на метастатический процесс в органах для консультации и проведения дополнительного обследования [58, 71, 72, 98].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
- Рекомендуется выполнение МРТ головного мозга с контрастированием всем пациентам при наличии симптомов или жалоб со стороны ЦНС (наличие неврологической симптоматики) с целью подтверждения или исключения метастатического поражения головного мозга [99, 100].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
2.5 Иные диагностические исследования
- Рекомендовано при наличии морфологического материала полученного после проведенного хирургического лечения или тонкоигольной биопсии (ТИАБ) при условии технических возможностей медицинского учреждения выполнение молекулярного профилирования опухоли для определения индивидуального риска прогрессирования и прогноза с целью определения сроков и объемов динамического наблюдения после первичного лечения [101 - 104].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии:
1) При УМ "драйверами" канцерогенеза являются соматические мутации в "горячих точках" генов GNAQ, GNA11 и реже - других генов того же сигнального каскада (CYSLTR2, PLCB4 и, возможно, также PLCB3). Тестирование образцов ткани УМ на мутации в генах GNAQ, GNA11, CYSLTR2, PLCB4 и PLCB3 имеет существенную ценность для дифференциальной диагностики УМ, но не для определения ее прогноза [101 - 105].
2) Молекулярные нарушения-"модификаторы", появляющиеся на более поздних стадиях канцерогенеза, такие как делеция 3p, амплификация 8q и мутации в генах EIF1AX, SF3B1, SRSF2 и BAP1, при УМ существенно коррелируют с индивидуальным риском метастазирования [102 - 104]. Тестирование образцов ткани УМ на делецию 3p, амплификацию 8q и мутации в генах EIF1AX, SF3B1, SRSF2 и BAP1 имеет существенную ценность для определения прогноза (подробнее см. таблицу 6).
3) "Драйверные" мутации в "горячих точках" генов BRAF, NRAS и KIT, характерные для меланомы кожи и слизистых оболочек, при УМ практически не встречаются (нет ни одного достоверно описанного случая). Тестирование образцов ткани УМ на мутации в генах BRAF, NRAS и KIT представляется нецелесообразным [101 - 105].
4) Небольшой процент случаев УМ (не более 3%) ассоциирован с наследственной предрасположенностью. Чаще всего наследственная (семейная) форма УМ является одной из манифестаций так называемого TPS-синдрома, вызываемого герминальными мутациями в гене BAP1 (OMIM ID #614327 - около 2% всех увеальных меланом); описаны также единичные случаи УМ при герминальных мутациях в гене MBD4 (OMIM ID *603574) и при синдроме Линча (OMIM ID #276300). Тестирование пациентов с УМ на герминальные мутации целесообразно только при подозрении на наследственный характер заболевания (возраст пациента до 45 лет и/или билатеральная УМ и/или первично-множественные злокачественные опухоли и/или отягощенный семейный анамнез). По некоторым данным, частота встречаемости некоторых молекулярных нарушений в клетках УМ составляет: моносомия хромосомы 3 - 52,2% (полная - 37,3%, частичная - 14,9%), потеря гетерозиготности в хромосоме 1p - 29,1%, в хромосоме 8p - 20,0%; метилирование гена RASSF1A - 23,9%, мутации в генах GNAQ/GNA11 - 90,0%. Доказано, что моносомии хромосомы 3 значительно снижает выживаемость пациентов УМ (до 46,8%) [101 - 104].
- Рекомендуется определение индивидуального риска прогрессирования для более точного планирования объема обследований и сроков проведения динамического наблюдения после проведенного лечения (Таблица 6) [41, 75, 104, 106 - 113].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: Основные прогностические факторы при увеальной меланоме:
1) клинические - размер первичной опухоли (T4 vs T1 - T3), вовлечение цилиарного тела (есть vs нет), выход за пределы глазного яблока (есть vs нет);
2) морфологические - тип опухоли (эпителиоидноклеточная vs смешанноклеточная vs веретеноклеточная);
3) молекулярно-генетические - профиль молекулярных нарушений в опухоли (см. таблицу 7 и [104]).
Пояснения:
1. В случае расхождения прогностической информации, полученной различными методами, целесообразно ориентироваться на "худший" из полученных вариантов.
2. Вследствие этого молекулярно-генетическое тестирование для определения прогноза показано в первую очередь пациентам без клинических и морфологических факторов неблагоприятного прогноза (т.е. пациентам с веретеноклеточной и смешанноклеточной меланомой T1 - T3 без вовлечения цилиарного тела и без выхода за пределы глазного яблока). Однако данное тестирование может быть использовано и у пациентов с наличием одного или нескольких факторов неблагоприятного прогноза - в частности, для уточнения прогноза ("плохой" vs "очень плохой") и для решения вопроса об участии пациента в клинических исследованиях адъювантной терапии.
3. Оценка клинических, морфологических и молекулярно-генетических факторов прогноза у пациентов с метастатической увеальной меланомой может быть использована для уточнения стратегии и тактики противоопухолевого лечения.
4. Тестирование молекулярно-генетических факторов прогноза при увеальной меланоме рекомендуется выполнять с использованием двух методов - цитогенетического и мутационного. Использование в рутинной практике третьего метода - экспрессионного - в настоящее время не может быть рекомендовано в связи с отсутствием доступных в России валидированных методик. В связи с существенным процентом расхождения прогностической информации между методами [104] представляется целесообразным выполнение теста обоими методами для каждого исследуемого образца. В случае расхождения прогностической информации, полученной различными методами, целесообразно ориентироваться на "худший" из полученных вариантов. Допускается использование только валидированных методик тестирования.
5. Тестирование морфологических и молекулярно-генетических факторов прогноза при увеальной меланоме может быть проведено как на гистологическом, так и на цитологическом материале. В случае использования цитологического материала невозможно различение трех типов опухоли (эпителиоидноклеточный vs смешанноклеточный vs веретеноклеточный) и в морфологическом заключении должно быть указано наличие или отсутствие в препарате значимого количества эпителиоидных клеток. При молекулярно-генетическом тестировании цитологического материала следует использовать только методики, прицельно валидированные для данного типа биоматериала, и уделять особое внимание входному контролю количества и качества предоставленного материала.
Таблица 6. Основные молекулярные классы увеальной меланомы и их прогностическая значимость [104].
Метод тестирования
Маркеры молекулярных классов при увеальной меланоме
---
Тип I:
благоприятный прогноз
Тип II:
неблагоприятный прогноз
Класс 1 [IA]: "хороший" прогноз
Класс 2 [IB]: "средний" прогноз
Класс 3 [IIA]: "плохой" прогноз
Класс 4 [IIB]: "очень плохой" прогноз
Цито-генетический
Дисомия по хромосоме 3
Моносомия по хромосоме 3
Дисомия по хромосоме 8
Аберрации хромосомы 8 (8q![]() <*>
<*> ![]() 8p
8p![]() <*>)
<*>)
Дисомия по хромосоме 8
Аберрации хромосомы 8 (8q![]() <*>
<*> ![]() 8p
8p![]() <*>)
<*>)
Мутационный
Отсутствие вакцинации гена BAP 1
Инактивация гена BAP 1
Мутации в гене EIF1AX
Мутации в гене SF3B1 или SRSF2
---
Мутации в гене SF3B1 или SRSF2
Экспрессионный
Экспрессионный тип 1 <**>
Экспрессионный тип 2 <**>
Отсутствие экспрессии гена PRAME
Экспрессия гена PRAME
Отсутствие экспрессии гена PRAME
Экспрессия гена PRAME
--------------------------------
Примечания.
<*> 8q![]() - увеличение количества копий длинного плеча хромосомы 8 (8q), 8p
- увеличение количества копий длинного плеча хромосомы 8 (8q), 8p![]() - уменьшение количества копий короткого плеча хромосомы 8 (8p).
- уменьшение количества копий короткого плеча хромосомы 8 (8p).
<**> Экспрессионные типы 1 и 2 - многокомпонентные маркеры: принадлежность образца УМ к одному из них определяется по специальному алгоритму с использованием данных об уровне экспрессии мРНК ряда генов в опухолевых клетках.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Лечение пациентов с локализованными формами УМ
- Рекомендуется проведение локального лечения при клинически установленном диагнозе локальной формы УМ [41].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
- Рекомендуется проводить локальное лечение УМ в офтальмологических отделениях, специализирующихся на лечении онкологических заболеваний глаз при локальной форме заболевания [41].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: локальное ликвидационное лечение УМ (энуклеация, экзентерация орбиты) проводят также в офтальмологических отделениях общего профиля 2 - 3 уровня, не специализирующихся на лечении онкологических заболеваний глаз. Экзентерацию орбиты также проводят в онкологических медицинских организациях (отделение опухолей головы и шеи).
- Рекомендуется проводить локальное хирургическое и лучевое лечение УМ (первичной интраокулярной меланомы) строго персонифицировано с учетом клинической картины, биометрических показателей опухоли, зрительных функций и согласия больного [2, 3, 45, 98, 114 - 127].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: Локальное лечение УМ представляет собой комплекс ликвидационных (энуклеация, экзентерация орбиты) и органосохранных мероприятий, включающих хирургические (блокэксцизии), лучевые и лазерные методы и планируется в зависимости от размеров и локализации первичной опухоли. До планирования локального лечения пациенту назначают полное клиническое обследование для исключения отдаленных метастазов опухоли. При наличии отдаленных метастазов локальное лечение (энуклеация) проводится при осложнениях, вызванных ростом опухоли (болевом синдроме, перфорации глаза и др.). При наличии одиночного отдаленного метастаза, в исключительных случаях возможно проведение органосохранного лечения.
Не проводят.
- Рекомендуется планировать органосохранное лечение с учетом размеров и локализации опухоли, возраста пациента и его соматического состояния, функции глаза, состояния парного глаза, возможных осложнений, а так же предусмотреть меры их профилактики [25, 28, 37 - 39, 114 - 128].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарий: органосохранное лечение УМ проводят только в офтальмологических отделениях, специализирующихся на лечении онкологических заболеваний глаз.
- Рекомендуется блокэксцизия опухолей иридоцилиарной зоны при распространении не более 1/4 окружности [25, 114, 115].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: Локальное удаление опухоли - блокэксцизия заключается в иссечении опухоли единым блоком с запасом окружающих здоровых тканей. Распространенность новообразования определяет объем операции (иридэктомия, иридоциклэктомия, иридоциклосклерэктомия и иридоциклохориоидсклерэтомия, хориоидсклерэктомия). С целью восстановления диафрагмальной функции радужки, уменьшения световых аббераций и повышения остроты зрения после удаления опухоли радужки одномоментно производят иридопластику, которая возможна при образовавшемся дефекте радужки не более 5 часов ее окружности. Удаленный блок тканей подлежит обязательному патологоанатомическому исследованию. Проводят только в офтальмологических отделениях, специализирующихся на лечение онкологических заболеваний глаз.
Абсолютные противопоказания к проведению блокэксцизии:
- вторичная гипертензия;
- отсутствие зрения
- неоваскуляризация радужки;
- анулярный рост новообразования по структурам УПК;
- экстрабульбарный рост опухоли;
- тяжелая сопутствующая соматическая и психическая патология.
- Рекомендуется эндорезекция в отдельных случаях после локального разрушения МХ с целью уменьшения ее токсического эффекта, для профилактики воспалительных процессов и симпатической офтальмии [127, 129 - 133].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется энуклеация глазного яблока при проминенции УМ более 6 - 7 мм, диаметра основания опухоли свыше 16 мм, вторичной гипертензии, тотальной отслойке сетчатки, организовавшемся гемофтальме, непрозрачности оптических сред, экстрабульбарном росте опухоли, при любых размерах опухоли с распространением на диск зрительного нерва, при анулярной юкстапапиллярной МХ, при отсутствии зрения, при отказе больного от органосохранного лечения [25, 37 - 39, 134 - 136].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: Выполнение энуклеации глазного яблока по поводу УМ требует соблюдение определенных правил: операцию проводят в условиях наркоза с использованием микрохирургической техники; все манипуляции с глазом и экстраокулярными мышцами проводят бережно, избегая деформации и давления на глаз. Необходимо выполнение энуклеации глазного яблока с одновременным формированием опорно-двигательной культи с использованием имплантата орбитального*** при отсутствии экстрабульбарного роста. Длина зрительного нерва после неврэктомии при энуклеации глазного яблока - не менее 10 мм. По окончании операции в конъюнктивальную полость имплантируют имплантат орбитальный***, энуклеированный глаз направляют на патологоанатомическое исследование.
- Рекомендуется экзентерация орбиты при формировании большого узла опухоли в орбите с/без инфильтрации мышц и жировой клетчатки [25, 37 - 39].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: Экзентерацию орбиты проводят под наркозом, с одномоментной пластикой орбитальной полости, с использованием микрохирургической техники. Эктопротезирование пациентов проводят отсрочено после заживления операционной раны.
Контактная лучевая терапия проводится в условиях офтальмологических стационаров, специализирующихся на оказании помощи пациентам с онкологическими заболеваниями глаз.
Дистанционная лучевая терапия проводится в радиологических отделениях врачами-радиотерапевтами.
- Рекомендуется проведение брахитерапии (БТ) меланомы цилиарного тела и хориоидеи (Брахитерапия при новообразованиях глаза с использованием радиоактивного офтальмоаппликатора). Выбор типа офтальмоаппликатора определяется толщиной и диаметром опухоли, проникающей способностью бета-излучения [116 - 119, 121, 127, 137 - 140].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3).
Комментарии: БТ ОА с изотопами Ru106 + Rh106 применяют при проминенции опухоли до 6 - 7 мм: с изотопами Sr90 + Y90 - при толщине опухоли не более 3,0 мм. Подбор размера ОА определяется диаметром опухоли и должен перекрывать ее на 2 мм: оптимальная доза излучения при БТ рассчитывается индивидуально с учетом размеров, локализации и клинической картины опухоли, необходимая для облучения всего ее объема и составляет 120 - 140 Гр на вершину опухоли при использовании Ru106 + Rh106 и аппликаторов и 160 - 180 Гр при использовании изотопов Sr90 + Y90 БТ в основном проводится при МХ и меланомах цилиохориоидальной локализации, но в ряде случаях может быть проведена и при иридоцилиарной локализации опухоли.
Противопоказания к БТ:
1. Превышение указанных размеров опухоли;
2. Подозрение на прорастание опухоли за пределы склеры;
3. Офтальмогипертензия.
Относительные противопоказания к БТ:
- тяжелые и средней тяжести заболевания крови (лейкопения, агранулоцитоз, пойкилоцитоз, анемия различного генеза, гемофилия и другие);
- острые воспалительные заболевания глаза и его придаточного аппарата;
- гемофтальм;
- обширная отслойка сетчатки;
- тяжелая сопутствующая соматическая и психическая патология.
Выполнение БТ следует проводить под наркозом. При использовании высоких доз (более 1100 - 1300 Гр на склере) одномоментно с брахитерапией, после удаления ОА, проводят склеропластику донорской склерой [41, 137, 140]. Возможно проведение повторного этапа лечения при наличии остаточной опухоли после БТ. Выбор повторного метода лечения зависит от параметров опухоли и клинической картины.
- Рекомендуется протонотерапия для лечения МХ и меланоме цилиохориоидальной локализации [122 - 125, 127]. Планирование лечения строго индивидуальное с суммарной очаговой дозой 70 Гр за 5 - 6 фракций [122 - 125, 127, 141, 142].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: Протонотерапия - дистанционный метод лучевой терапии УМ. Постлучевая резорбция после протонотерапии продолжается длительно. Наиболее частым осложнением протонотерапии является лучевая катаракта, реже развивается глаукома, ретинопатия, отслойка сетчатки, некроз склеры.
- Рекомендуется проведение лазерного лечения при начальной МХ [25, 37 - 39, 121].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарий: лазерное лечение МХ является эффективным методом локального разрушения опухоли, позволяющая сохранить зрительные функции (кроме опухолей центральной локализации) и приводит к минимальным побочным эффектам по сравнению с лучевой терапией. Лазерное лечение можно проводить в амбулаторных условиях, не требует анестезиологического пособия и возможно лечение у соматически отягощенных пациентов. Лазерное разрушение опухоли проводят при условии прозрачных оптических сред глаза с максимальным медикаментозным мидриазом. Лазерное лечение МХ включает разрушающую лазерную коагуляцию (РЛК), которую используют при толщине опухоли не более 1,5 мм и максимальном диаметре основания до 10 мм с применением диодного зеленого лазера с длиной волны 532 мкм и транспупиллярную термотерацию (ТТТ (см. Таблицу А3-1), которую используют при толщине опухоли не более 2,5 мм, диаметре основания опухоли не более 10 мм с применением диодного лазера с длиной волны 810 нм. Лазерное лечение можно проводить как самостоятельный метод лечения, так и как дополнение к другим методам лечения. Лазерное лечение можно проводить как при первичной МХ, так и при остаточных МХ и при продолженном росте.
- Рекомендуется проведение повторного этапа лечения при наличии остаточном опухоли после проведения БТ. Выбор метода лечения зависит от параметров опухоли, включая ее прогностический класс, и от клинической картины [121, 127, 143].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется проведение стереотаксической радиохирургии на аппарате "Гамма-нож" с использованием 60Co либо на аппарате "Кибер-нож" с роботизированным управлением и использованием фотонного пучка мощностью 6 МэВ, что позволяет достигать высокого градиента дозы за пределами опухоли и является эффективным методом лечения увеальных меланом, не подходящих для брахитерапии. Предписанная доза радиации составляет от 25 до 40 Гр, предписанной по 50% краевой изодозе, охватывающей таргетный объем облучения [121, 127, 143 - 145].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется проведение протонной лучевой терапии после энуклеации в послеоперационном периоде у пациентов с экстрабульбарным ростом опухоли для профилактики рецидива опухоли в орбите [122, 125].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- В зависимости от состояния пациента, наличия осложнений и течения послеоперационного или постлучевого периода рекомендуется назначить сопроводительную медикаментозную терапию после локального хирургического и лучевого лечения (лекарственные препараты назначаются в строгом соответствии с официальными инструкциями по их применению) [25, 37, 39, 40]:
- Инстилляционная (противовоспалительные препараты, противомикробные препараты или антибиотики, противоглаукомные препараты и миотические средства, другие препараты для лечения заболеваний глаз (в том числе с кератопротективным эффектом), мидриатические и циклоплегические средства).
- Системная (анальгетики, нестероидные противовоспалительные и противоревматические средства, антигистаминные средства системного действия, кортикостероиды системного действия).
- Локальная (глюкокортикоидная в виде парабульбарных инъекций короткого и длительного действия).
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
3.2 Адъювантная терапия после радикального лечения первичной увеальной меланомы
Не рекомендуется рутинное назначение адъювантной терапии после локального хирургического и лучевого лечения в виду отсутствия однозначных данных об ее эффективности [146].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3).
Комментарий: адъювантная терапия УМ нуждается в дальнейшем научном изучении. При возможности предпочтительным является участие пациентов в клинических исследованиях адъювантной терапии.
3.3. Лечение распространенных/метастатических форм увеальной меланомы
Введение в подраздел: наиболее часто УМ метастазирует в печень (по данным исследований - в 70 90% всех случаев), легкие (29%), кости (17%), кожу (12%) и лимфатические узлы (11%). У 46% больных печень является единственным пораженным метастазами органом, и только у 11% больных с метастатической болезнью печень не поражена [46, 47, 147, 148]. Основные особенности метастазирования: отсутствие лимфатических сосудов в глазу и тропность клеток УМ к паренхиме печени. Особенности метастазирования УМ в ряде случаев определяют возможности лечения (хирургическое лечение или локальное лечение метастатического поражения печени). Хирургическое лечение используют нечасто, учитывая нередко обширную распространенность метастатического процесса и, вследствие этого, невозможность проведения радикального оперативного вмешательства. За последнее время опубликованы результаты клинических исследований по хирургическому лечению метастатической УМ, проведенных в отдельных онкологических институтах. В исследовании, проведенном на базе Curie Institute (Франция) из 798 пациентов с метастазами УМ в печень 250 пациентов были прооперированы. У 76 больных (29% из прооперированных) удалось выполнить визуально радикальное удаление метастазов (R0), что составило 9% всей популяции больных с метастазами. Медиана выживаемости в группе радикально прооперированных больных (R0) составила 27 мес. против 11 мес. в группе нерадикально прооперированных больных. При анализе этих данных следует принять во внимание также и то, что хирургическое лечение выполняли больным с благоприятным прогнозом (на основании биологических свойств первичной опухоли), объем операции был радикальным (R0). В другом одноцентровом исследовании из 73 больных с метастазами УМ в печень 35 пациентам были выполнены циторедуктивные операции. У прооперированных больных медиана общей продолжительности жизни составила 23 мес., в группе неоперированных больных - 6,8 мес. Таким образом, ретроспективные исследования показывают, что хирургическая резекция единичных метастатических очагов в печени может быть излечивающей при тщательном отборе пациентов.
- Рекомендуется пациентам с благоприятным прогнозом (время от лечения первичной опухоли до появления метастазов > 5 лет), с единичными метастазами в печени, которые могут быть оперированы радикально (в объеме R0-резекции), выполнение врачом-хирургом хирургического удаления метастазов в печени, как единственного проявления заболевания [41, 149 - 156].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии: В мета-анализ вошло 22 исследования, включивших 579 пациентов, которым было была выполнена резекция печени. Медиана ВБП варьировала от 8 до 23 мес., а медиана ОВ - 14 - 41 мес. при сроке наблюдения от 9 до 59 мес. При этом для группы пациентов, которым удалось выполнить R0 - резекцию она составила 22 - 66 мес., а для R2 резекции - 10 - 16 мес., при этом снижение риска летального исхода наблюдалось на 48% при выполнении R0 по сравнению с R1/R2 (95% ДИ, 0.37 - 0.73). Также наблюдалось снижение риска летального исхода на 68% среди пациентов подвергшихся резекции по сравнению с пациентами, лечение которых не включало хирургическое вмешательство (ОР 0.32, 95% ДИ 0,22 - 0,46) [155].
Пациентам с изолированным нерезектабельным метастатическим поражением печени при удовлетворительном общем состоянии и сохраненной функции печени, а также суммарным объемом метастатического поражения печени не более 50%, рекомендуется проведение врачом-онкологом изолированной химиоперфузии печени (ИХП). Применение ИХП приводит к увеличению показателей выживаемости у этих пациентов [157 - 159].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
Комментарии: ИХП целесообразно выполнять в условиях высокоспециализированного стационара с наличием аппарата искусственного кровообращения. В качестве противоопухолевого препарата применяется введение #мелфалана** в дозировке 1,5 мг/кг. Перед введением #мелфалана** в печень, необходимо удостовериться в отсутствии утечки в системный кровоток. Оптимальное время ИХП составляет - 60 мин. По данным мета-анализа M.S. Bethlehem и соавт. (2021) медиана общей выживаемость в группе пациентов с применением ИХП составила - 17,1 мес. [159] В рандомизированном мультицентровом клиническом исследовании SCANDIUM, медиана безрецидивной выживаемости составила - 7,4 мес. в группе ИХП, против - 3,3 мес. в контрольной (95% ДИ от 0,12 до 0,36), при этом медиана безрецидивной выживаемости по печени составила - 9,1 мес. в группе ИХП, против - 3,3 мес. в группе сравнения. (95% ДИ от 5,6 до 13,4). Медиана общей выживаемости составила 21,4 мес. против 17,3 мес. (p = 0.11 [158]].
- Рекомендуется пациентам с изолированным метастатическим поражением печени при адекватной функции печени выполнение врачом-радиотерапевтом стереотаксической лучевой терапии метастатических очагов в печени, что приводит к улучшению показателей выживаемости у этих пациентов [160 - 162].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
- Рекомендуется пациентам с изолированным метастатическим поражением печени при адекватной функции печени выполнение врачом-онкологом радиочастотной абляции метастатических очагов в печени, что приводит к улучшению показателей выживаемости у этих пациентов [41, 146].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
- Рекомендуется пациентам с изолированным метастатическим поражением печени при адекватной функции печени, суммарным объемом метастатического поражения печеночной ткани не более 75% при отсутствии тромбоза портальных вен и признаков обструкции желчных путей выполнять врачом-онкологом трансартериальную химиоэмболизацию (ТАХЭ) (см. Приложение А3, таб. А3-1) метастазов меланомы в печени, что приводит к улучшению показателей выживаемости у этих пациентов [41, 146, 163, 164].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
Комментарий: ТАХЭ печени выполняется с минимальным воздействием на интактную паренхиму. При узловом характере поражения выполняется селективная (суперселективная) трансартериальная химиоэмболизация с применением микросфер (диаметр 150 - 600 мкм) в растворе с химиопрепаратом, либо ТАХЭ насыщаемыми микросферами (с адсорбированным на их поверхности противоопухолевым препаратом (Код АТХ L01)). При многоочаговом характере поражения выполняется жировая химиоэмболизация (жировая эмульсия + противоопухолевый препарат). В случае билобарного поражения - проводится этапная подолевая ТАХЭ. На первом этапе - селективная ТАХЭ одной доли печени, через 4 - 6 недель - второй этап - селективная ТАХЭ другой доли печени. В качестве противоопухолевого препарата применяют #доксорубицин** в дозировке 100 мг (на одну эмболизацию) или #гемцитабин** 1 - 2 г (на одну эмболизацию) или #карбоплатин** 450 мг (на одну эмболизацию).
Количество ТАХЭ может быть многократным. При изолированном метастатическом поражении печени ТАХЭ может выполняться в качестве первой линии лечения либо при неэффективности системного лечения. Локальный ответ в виде уменьшения опухолевых узлов в печени или стабилизация наблюдались после проведенного ТАХЭ печени примерно в 65 - 70% случаев. Общая выживаемость у данной группы пациентов, рассчитанная методом Kaplan-Meier, составила: 1-летняя 51,0 ![]() 9,5%; 2-летняя 34,0
9,5%; 2-летняя 34,0 ![]() 15,2%. Медиана выживаемости - 12,9 мес.
15,2%. Медиана выживаемости - 12,9 мес.
Введение в подраздел. Для лечения метастатической/распространенной формы УМ применяют различные режимы лекарственного лечения (Таблица 7). Частота ответа варьирует от 0% до 20% с медианой выживаемости от 4 до 28 мес [165, 166].
- Рекомендуется перед выбором лечебного режима врачу-онкологу тщательно провести оценку общего состояния пациента по шкале ВОЗ/ECOG (см. Приложение Г), распространенности метастатического процесса по данным инструментального обследования, сопутствующей патологии, ожидаемой продолжительности жизни, результатов анализов крови, в особенности печеночных трансаминаз и уровня ЛДГ [41, 42, 167].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется врачу-онкологу назначить пациенту с метастатической увеальной меланомой при общем состоянии по шкале ECOG 0-1 и ожидаемой продолжительности жизни более 12 недель, при отсутствии противопоказаний со стороны сопутствующих болезней, при удовлетворительной функции печени и нормальном уровне ЛДГ комбинированную иммунотерапию: блокатор PD-1 и блокатор CTLA4 или блокатор PD-1 (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1) в монорежиме [162, 165, 168 - 177].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии: режимы применения лекарственных препаратов приведены в таблице 7.
Таблица 7. Режимы лекарственной терапии при метастатической или нерезектабельной увеальной меланоме.
Схема терапии
Препарат
Доза
Путь введения
Дни введения
Длительность цикла, дни, режим
Ссылка
УДД/УУР
Ниволумаб**
3 мг/кг массы тела
в/в капельно 30 - 60 мин
1 раз в 14 дней
До прогрессирования или непереносимости
[169, 172, 178 - 180]
2B
Ниволумаб**
240 мг
в/в капельно 30 - 60 мин
1 раз в 14 дней
До прогрессирования или непереносимости
[169, 172, 178 - 180]
4C
Ниволумаб**
480 мг
в/в капельно 30 - 60 мин
1 раз в 28 дней
До прогрессирования или непереносимости
[169, 172, 178 - 180]
5C
Пембролизумаб**
200 мг
в/в капельно 30 мин
1 раз в 21 день
До прогрессирования или непереносимости
[171, 174, 181 - 184]
5C
Пембролизумаб**
2 мг/кг
в/в капельно 30 мин
1 раз в 21 день
До прогрессирования или непереносимости
[171, 174, 181 - 184]
2B
Пролголимаб**
1 мг/кг массы тела
в/в капельно 30 мин
1 раз в 14 дней
До прогрессирования или непереносимости
[185, 186]
2B
Комбинированная терапия МКА блокаторами PD1/CTLA4 (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1)
#Ниволумаб** (в один день с ипилимумабом**)
1 мг/кг
в/в капельно 30 минут
1 раз в 21 день
суммарно не более 4 введений
[168, 170, 180, 187 - 189]
2B
#Ипилимумаб** (в один день с ниволумабом**)
3мг/кг
в/в капельно 30 минут
1 раз в 21 день
суммарно не более 4 введений
[168, 170, 180, 187 - 189]
2B
Поддерживающая фаза: Ниволумаб**
3 мг/кг
в/в капельно
1 раз в 14 дней
До прогрессирования или непереносимости
[168, 170, 180, 187 - 189]
2B
Поддерживающая фаза: Ниволумаб**
ИЛИ 240 мг)
в/в капельно
1 раз в 14 дней
До прогрессирования или непереносимости
[168, 170, 180, 187 - 189]
4C
Поддерживающая фаза: Ниволумаб**
ИЛИ 480 мг
в/в капельно
1 раз в 28 дней
До прогрессирования или непереносимости
[168, 170, 180, 187 - 189]
5C
Монохимиотерапия
#Дакарбазин**
1000 мг/м2
в/в
1-й
28
[190 - 195]
2B
Дакарбазин**
250 мг/м2
в/в
1-й - 5-й
28
[190 - 193]
3B
Темозоломид**
150 мг/м2
Внутрь
День 1 - 5
28
[196, 231, 232]
4C
Полихимиотерапия
#Паклитаксел**
175 мг/м2
в/в
1
21
[193, 198 - 200]
4C
#Карбоплатин**
AUC=5
в/в
1
21
Полихимиотерапия
#Паклитаксел**
225 мг/м2
в/в
1
21
[198]
2B
#Карбоплатин**
AUC 6
в/в
1
21
- Рекомендуется врачу-онкологу всем пациентам с метастатической увеальной меланомой и ожидаемой продолжительностью жизни более 12 недель при прогрессировании на фоне монотерапии МКА-блокаторами PD-1 или комбинацией МКА-блокаторов PD-1 и CTLA4, или, при наличии противопоказаний к началу или продолжению терапии МКА-блокаторами PD-1 и CTLA4 (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1) и, при отсутствии противопоказаний, проводить моно- или полихимиотерапию. Режимы применения лекарственных препаратов приведены в таблице 7 [193 - 195, 201].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии: Прогноз пациентов с метастатической увеальной меланомой остается неблагоприятным, медиана ОВ составляет примерно 12 мес. после выявления метастатического процесса. Принимая во внимание достижения в терапии меланомы кожи и несмотря на различную биологию УМ и МК, большинство экспертов рекомендуют проводить пациентам с метастатической УМ в качестве терапии первой линии (при отсутствии возможности принять участие в клиническом исследовании) иммунотерапию комбинацией МКА блокаторов PD-1 и CTLA4 или МКА-блокаторами PD-1 (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1) [168 - 174]. В метаанализе Yamada К. и соавт. было показано преимущество комбинации МКА-блокаторов PD-1 и CTLA4 (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1) по сравнению с монотерапией МКА-блокаторами PD-1 - частота объективного ответа составила 3,4% (95% ДИ 1,8 - 5,1) против 12,4% (95% ДИ 8,0 - 16,9) (P < 0,001). Медиана общей выживаемости оказалась значимо выше в группе комбинации МКА-блокаторов PD-1 и CTLA4, (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1), чем в группе МКА-блокаторов PD-1 - 16,3 месяца (95% ДИ 13,5 - 19,7) против 9,8 месяцев (95% ДИ 8,0 - 12,2) (P < 0,001). Эти данные подчеркивают потенциальное преимущество комбинированной иммунотерапии, несмотря на более высокий риск развития нежелательных явлений [165, 168, 201].
- Рекомендуется проводить округление фактических доз в пределах 5% от расчетных при проведении противоопухолевого лекарственного лечения при расчете доз препаратов на поверхность тела или вес [202, 203].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При развитии иммуноопосредованных нежелательных явлений 3 ст. на фоне комбинированной иммунотерапии, после их купировании рекомендуется переход на монотерапию анти-PD-1 препаратами (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1). Продолжение комбинированной иммунотерапии до 4 циклов не рекомендовано [204].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: возобновление комбинированной иммунотерапии или монотерапии анти-PD-1 препаратами (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1) возможно в качестве реиндукции лечения в случае достижения эффекта при ее предшествующем применении и развития в дальнейшем прогрессирования процесса [204].
- Всем пациентам с меланомой на фоне лечения МКА-блокаторами PD1 или CTLA4 рекомендуется проводить первоначальную радиологическую оценку ответа на лечение не ранее 12 недель от начала терапии (при отсутствии клинического ухудшения состояния пациента). Повторные исследования проводятся через 8 - 12 недель (при отсутствии клинического ухудшения состояния пациента) [205].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется для оценки ответа на лечение МКА-блокаторами PD1 или CTLA4 (См. "Термины и определения") использовать модифицированные критерии ответа на лечение, которые допускают появление новых очагов (при отсутствии клинического ухудшения состояния пациента) [205] (Таблица 8).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Таблица 8. Сравнение традиционных критериев (на примере RECIST) и критериев оценки ответа на МКА-блокаторы PD1 или CTLA4 (Ингибиторы PD-1/PDL-1 (белок запрограммированной клеточной смерти 1/лиганд смерти 1) (mRECIST или irRC).
Опухолевый ответ
RECIST
irRC
Полный ответ
Исчезновение всех очагов
Исчезновение всех очагов, в том числе новых
Частичный ответ
Уменьшение суммы максимальных диаметров таргетных очагов более чем на 30% при отсутствии прогрессирования со стороны других очагов поражения либо появления новых
Уменьшение суммы произведений поперечных диаметров таргетных и новых очагов более чем на 30%. Допускается появление новых очагов
Стабилизация
Уменьшение опухолевых образований менее чем на 30% или увеличение не более чем на 20% при отсутствии новых поражений
Уменьшение опухолевых образований менее чем на 30% при отсутствии новых поражений или увеличение не более чем на 20%. Допускается появление новых очагов
Прогрессирование
Увеличение сумы максимальных диаметров таргетных очагов более чем на 20% и/или появление новых очагов
Увеличение суммы произведений поперечных диаметров таргетных и новых очагов более чем на 20%
- При проведении химиотерапии оценку эффекта лечения рекомендовано проводить каждые 7 - 9 нед., а при проведении иммунотерапии - каждые 11 - 13 нед. Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики, использованные до начала терапии, а также стандартные критерии ответа на терапию - RECIST 1.1 для химиотерапии, iRECIST или iRC для иммунотерапии [206 - 208].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.5 Обезболивание
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов с увеальной меланомой с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях "Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи" [209].
3.6. Сопутствующая терапия у больных меланомой глаза
изложены в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТОШНОТЫ И РВОТЫ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ" [210].
изложены в методических рекомендациях "ИСПОЛЬЗОВАНИЕ ОСТЕОМОДИФИЦИРУЮЩИХ АГЕНТОВ (ОМА) ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПАТОЛОГИИ КОСТНОЙ ТКАНИ ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ" [211].
соответствуют принципам, изложенным в методических рекомендациях ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО УПРАВЛЕНИЮ ИММУНООПОСРЕДОВАННЫМИ НЕЖЕЛАТЕЛЬНЫМИ ЯВЛЕНИЯМИ" [204].
соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ФЕБРИЛЬНОЙ НЕЙТРОПЕНИИ" [212].
соответствуют принципам, изложенным в методических рекомендациях "КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ ГЕПАТОТОКСИЧНОСТИ, ИНДУЦИРОВАННОЙ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИЕЙ" [213].
соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ КАРДИОВАСКУЛЯРНОЙ ТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВОЙ ЛЕКАРСТВЕННОЙ ТЕРАПИИ" [214].
соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕКАРСТВЕННОМУ ЛЕЧЕНИЮ ДЕРМАТОЛОГИЧЕСКИХ РЕАКЦИЙ У ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ПРОТИВООПУХОЛЕВУЮ ЛЕКАРСТВЕННУЮ ТЕРАПИЮ" [215].
соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НУТРИТИВНОИ ПОДДЕРЖКЕ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ" [216].
соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ" [217].
соответствуют принципам, изложенным в методических рекомендациях ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ НЕФРОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ" [218].
соответствуют принципам, изложенным в методических рекомендациях "РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ПОСЛЕДСТВИЙ ЭКСТРАВАЗАЦИИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ" [219].
3.7 Диетотерапия
- К настоящему моменту не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть меланомой глаза, меланомой иных локализаций или на риск рецидива или прогрессирования этого заболевания у лиц с уже установленным диагнозом. В этой связи не рекомендованы какие-либо изменения в привычном рационе пациентов, если только они не продиктованы необходимостью коррекции коморбидных состояний или купирования или профилактики осложнений проводимого лечения (хирургического, лекарственного или лучевого) [220].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется протезирование глазным протезом после удаления глаза [3, 25, 37 - 39, 221].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется проведение эктопротезирования после экзентерации орбиты [3, 25, 37 - 39, 221, 222].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется проводить коррекцию очками и (или) контактной линзой при развитии рефракционных нарушений после блокэксцизий [25, 37 - 39].
Уровень убедительности рекомендации C (уровень достоверности доказательности - 4).
- Рекомендуется проводить коррекцию контактной линзой с целью уменьшения светорассеяния [25, 37 - 39].
Уровень убедительности рекомендации C (уровень достоверности доказательности - 4).
- Рекомендуется проведение первичной пластики культи с имплантацией орбитального имплантата*** для профилактики развитии анофтальмического синдрома при отсутствии экстрабульбарного роста [3, 25, 37 - 39, 223, 224].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
- Рекомендуется проведение отсроченной пластики культи с имплантацией имплантата орбитального*** при развитии анофтальмического синдрома и при отсутствии рецидива в орбите [3, 25, 37 - 39, 223, 224].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Профилактика
Не разработана.
5.2. Диспансерное наблюдение
Диспансерному наблюдению подлежат взрослые с онкологическими заболеваниями, включенными в рубрики C00 - D09 МКБ-10.
Диспансерное наблюдение организуется в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете медицинской организации, онкологическом диспансере (онкологической больнице) или иных медицинских организациях, оказывающих медицинскую помощь больным с онкологическими заболеваниями.
Комментарии: на сегодняшний день нет единого мнения относительно частоты и интенсивности наблюдения за пациентами с меланомой глаза. Целями наблюдения за пациентами следует считать раннее выявление рецидива заболевания (в особенности отдаленных метастазов), ранее выявление 2-х опухолей (в частности, новых меланом), а также психосоциальную поддержку пациентов.
- Рекомендуется соблюдение мер профилактики и регулярные профессиональные осмотры 1 раз в год населения, работающего с производственными и промышленными канцерогенными факторами [3, 25, 37 - 39, 225].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
- Рекомендуется направлять пациентов с первично выявленной интраокулярной меланомой к врачу-офтальмологу в офтальмологические отделения, специализирующихся на лечении онкологических заболеваний глаз и проводящих локальное лечение внутриглазных опухолей [2, 3, 25, 37 - 39, 45, 115].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
- Рекомендуется регулярное динамическое пожизненное наблюдение врачом-офтальмологом и врачом-онкологом за пациентами, получившим лечение по поводу УМ, для более раннего выявления рецидива или прогрессирования заболевания. Сроки и необходимый объем обследования представлен в таблице 9 [2, 3, 41, 45, 75, 106 - 109].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарий: Рекомендуемый режим диспансерного наблюдения и содержание визитов диспансерного наблюдения приведены в таблице 9. Факторы риска прогрессирования при увеальной меланоме приведены в таблице 10. Если присутствует хотя бы один фактор неблагоприятного прогноза, то группа риска повышается. В случае проведения локального лечения без морфологической верификации диагноза следует ориентироваться на клиническую стадию TNM UICC (см. также таблицы 1 - 5) [41, 42, 92, 226, 227].
Таблица 9. Рекомендуемый в рамках диспансерного наблюдения график обследований пациента с ранее установленным диагнозом, составленный на основании рекомендаций, данных в разделе "Диагностика" и на рисках возникновения прогрессирования болезни (см. также Таблицу А3-1).
(см. также Таблицу А3-1).
Риск рецидива/прогрессирования
Осмотр врача-офтальмолога (+ необходимая локальная диагностика)
Осмотр врача-онколога
МРТ органов брюшной полости с в/в контрастированием
КТ органов грудной полости
Интервалы после окончания локального лечения
1 год
2 - 3 год
4 - 10 год
1 - 3 год
4 - 10 год
1 - 3 год
4 - 10 год
1 - 3 год
4 - 10 год
Низкий риск
1 раз в 3 мес.
1 раз в 6 мес.
1 раз в 12 мес.
1 раз в 6 мес.
1 раз в 12 мес.
1 раз в 12 мес.
1 раз в 12 мес.
1 раз в 12 мес. или по показаниям
1 раз в 12 мес. или по показаниям
Средний риск
1 раз в 3 мес.
1 раз в 6 мес.
1 раз в 12 мес.
1 раз в 6 мес.
1 раз в 12 мес.
1 раз в 6 мес.
1 раз в 12 мес.
1 раз в 6 мес.
1 раз в 12 мес.
Высокий или очень высокий риск
1 раз в 3 мес.
1 раз в 6 мес.
1 раз в 12 мес.
1 раз в 3 мес.
1 раз в 12 мес.
1 раз в 6 мес.
1 раз в 12 мес.
1 раз в 6 мес.
1 раз в 12 мес.
Таблица 10. Факторы риска прогрессирования при увеальной меланоме [41, 42, 92, 226, 227].
Факторы/Риск
Низкий риск
Средний
Высокий или очень высокий
1.
Стадия UICC TNM (см. таблицу 1 и таблицу 6)
Т1
Т2-Т3
Т4
2.
Морфологические факторы (см. раздел 1.5.1.)
Веретеноклеточная
Смешанноклеточная
Эпителиодноклеточная
3.
Прогностический класс (см. таблицу 7)
Класс IA
Класс IB
Класс II (IIA и IIB)
3A.
Цитогенетические маркеры прогноза (см. таблицу 7)
Дисомия по хромосоме 3
+
Дисомия
по хромосоме 8
Дисомия по хромосоме 3
+
Аберрации хромосомы 8
Моносомия по хромосоме 3
или
Делеция ее короткого плеча (3p)
3B.
Мутационные маркеры прогноза (см. таблицу 7)
Отсутствие инактивации гена BAP1
+
Мутация в гене EIF1AX
+
Отсутствие мутаций
в генах SF3B1 и SRSF2
Отсутствие инактивации гена BAP1
+
(Отсутствие мутаций в гене EIF1AX
или
Мутация в гене SF3B1 или SRSF2)
Инактивация гена BAP1
- Рекомендуется после лучевой, лазерной терапии и локальной эксцизии опухоли пациентов с интраокулярной увеальной меланомой осматривать врачом-офтальмологом каждые 3 месяца в течение первого года, далее 1 раз в 6 месяцев в течение последующих 2 лет, далее 1 раз в год - в последующие годы при безрецидивном течении заболевания пожизненно [2, 3, 25, 37 - 39, 45].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарий: в послеоперационном периоде у пациентов с локальной формой увеальной меланомы развивается лучевая реакция, проявляющаяся отеком ткани опухоли, усилением вторичной отслойки сетчатки, транзиторным повышением внутриглазного давления. Симптомы лучевой реакции могут периодически проявляться в течение года. В связи с этим динамическое наблюдение пациентов с локальной формой увеальной меланомы осуществляется врачом-офтальмологом с целью профилактики и лечения лучевой реакции.
- Рекомендуется обращать внимание на появление поздних осложнений после лучевого лечения. При выявлении поздних осложнений вопрос об их лечении рекомендуется индивидуально решать врачом-офтальмологом, специализирующемся на лечении онкологических заболеваний глаз [2, 3, 25, 37 - 39, 45, 116].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: Лучевая терапия УМ приводит к развитию ряда побочных лучевых эффектов (осложнений), которые наблюдают как в ранние (до 6 месяцев), так и в поздние (после 6 месяцев) сроки. К ранним осложнениям после БТ относят: вторичную гипертензию, ограничение подвижности глаза, кровоизлияния в полость глаза, отек и гиперемия слизистой глаза и периорбитальных тканей, требующие своевременного выявления и лечения. К поздним осложнениям после БТ относят: лучевую катаракту, вторичную глаукому (в том числе неоваскулярную), гемофтальм, нейроретинопатию (вплоть до атрофии зрительного нерва), постлучевые изменения склеры (некроз), субатрофию глаза. Факторами риска возникновения поздних осложнений являются высокая доза облучения склеры, диаметр облученной склеры более 14 мм, преэкваториальная и юкстапапиллярная локализации опухоли, неоднократное органосохранное лечение (ТТТ, БТ). Внимание поликлинического врача-офтальмолога должно быть направлено на раннее выявление и коррекцию указанных осложнений.
- Рекомендуется проводить КТ или рентгенографию легких, МРТ (при невозможности МРТ - КТ с в/в контрастом) органов брюшной полости, осмотр у онколога для исключения метастатической болезни 1 - 2 раза в год в зависимости от рисков прогрессирования заболевания (Таблица 9) [2, 3, 25, 37 - 39, 45].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарий: в проспективном рандомизированном клиническом исследовании среди пациентов с УМ и высоким риском прогрессирования (N=188) показано, что выполнение МРТ органов брюшной полости с в/в контрастированием каждые 6 месяцев после первичного локального лечения у врачей-офтальмологов выявило у 50% пациентов асимптомное метастатическое поражение печени в первые полтора года от первичного лечения (и 12 пациентам удалось выполнить R0 резекции метастазов в печени, как единственного проявление заболевания, которое выявлено своевременно) [47, 228]. Исследование, включающее прямое сравнение МРТ органов брюшной полости с в/в контрастированием и ПЭТ-КТ в режиме "все тело" с ФДГ продемонстрировало большую чувствительность МРТ (67% vs. 41%, p = 0.01) [47].
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядками оказания медицинской помощи, утверждаемыми уполномоченным федеральным органом исполнительной власти и обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию к офтальмологу в офтальмологические отделения, специализирующихся на оказании помощи больным с онкологическими заболеваниями глаза для оказания ему первичной специализированной медико-санитарной помощи.
Для исключения метастатической болезни пациент направляется на консультацию к врачу-онкологу. При отсутствии метастатического поражения пациент направляется на лечение в офтальмологические отделения, специализирующиеся на оказании помощи больным с онкологическими заболеваниями глаза. При выявлении метастатического поражения при первичном обследовании и в ходе динамического наблюдения пациент направляется к врачу-онкологу.
При подтверждении наличия метастазов помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении локальной (интраокулярной) формы увеальной меланомы пациент направляется на консультацию и лечение к врачу-офтальмологу в связи с соответствующей квалификацией специалиста в офтальмологическое отделение, специализирующееся на оказании помощи больным с онкологическими заболеваниями глаз. При подозрении или выявлении у больного распространенной формы УМ врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты (врачи-офтальмологи), средние медицинские работники в установленном порядке направляют больного на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
После установления диагноза УМ (врачом-офтальмологом) пациент должен быть направлен врачом-офтальмологом (самостоятельно, без дополнительного визита пациента к врачу-онкологу) на МРТ (Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием), КТ органов брюшной полости с внутривенным болюсным контрастированием и КТ органов грудной полости для исключения диссеминации процесса.
При установленном диагнозе или подозрении на УМ (интраокулярная форма) в регионе пациент должен направляться к врачу-офтальмологу в связи с соответствующей квалификацией специалиста в офтальмологическое отделение, специализирующееся на оказании помощи больным с онкологическими заболеваниями глаз для постановки (подтверждении) диагноза и определения объема и характера локального лечения.
При выявлении (подозрении) диссеминации УМ при первичном обращении к врачу в регионе пациент направляется на консультацию врача-онколога для уточнения характера процесса.
После завершения локального лечения пациент направляется на диспансерное наблюдение к врачу-офтальмологу и врачу-онкологу. После локального лечения опухоли врач-офтальмолог осматривает пациента каждые 3 месяца в течение первого года, далее 1 раз в 6 месяцев в течение последующих 2 лет, далее 1 раз в год - в последующие годы при безрецидивном течении заболевания пожизненно.
Консультация в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. При подозрении на дистантный метастаз врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
При подозрении на дистантный метастаз врач-онколог в случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь больным с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у больного онкологического заболевания в ходе оказания ему скорой медицинской помощи таких больных переводят или направляют в медицинские организации, оказывающие медицинскую помощь больным с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения. При подозрении или выявлении локальной (интраокулярной) формы УМ пациент направляется на консультацию и лечение к врачу-офтальмологу в офтальмологическое отделение, специализирующееся на оказании помощи больным с онкологическими заболеваниями глаз.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) при подозрении на внутриглазную меланому исключает диссеминацию опухоли и направляет больного к врачу-офтальмологу в офтальмологическое отделение, специализирующееся на оказании помощи больным с онкологическими заболеваниями глаз.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи больным с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь больным с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации или инструментального подтверждения (при органосохраняющих операциях) злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь при увеальной меланоме оказывается врачами-офтальмологами, специализирующихся на лечении онкологических заболеваний глаз, врачами-радиотерапевтами в офтальмологическом отделении, специализирующееся на оказании помощи больным с онкологическими заболеваниями глаз, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
При выявлении локальной формы увеальной меланомы в медицинской организации, специализирующейся на оказании помощи больным с онкологическими заболеваниями глаз, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов, врачей-радиотерапевтов, врачей-офтальмологов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию больного.
Специализированная, в том числе высокотехнологичная, медицинская помощь при метастатической увеальной меланоме оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь больным с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю "онкология" определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
- наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
- наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т.д.) онкологического заболевания.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
- необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
- наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
- завершение курса лечения, или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- отказ больного или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- необходимость перевода больного в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами специалистами медицинской организации, в которую планируется перевод.
Показания для направления пациента в другую медицинскую организацию:
- исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациентам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи (например, отсутствует возможность проведения процедуры биопсии сторожевого лимфатического узла), рекомендуется воспользоваться системой маршрутизации в федеральные центры, имеющие соответствующую оснащенность и кадры;
- с учетом редкости данной патологии, все случаи увеальной меланомы рекомендуется направлять на консультацию очно или посредством телемедицинских технологий для получения второго мнения относительно тактики дальнейшего лечения;
- клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне применения рекомендуемых видов лечения и т.д.), рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения;
- выявление или обострение сопутствующей патологии, не относящейся к профилю онкологического учреждения, которая препятствует проведению данного этапа лечения требует маршрутизации в профильные медицинские организации.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Таблица 11. Прогностические факторы при увеальной меланома (UICC TNM 8 пересмотр) [36].
Факторы прогноза
Основные
Наибольший диаметр первичной опухоли
Стадия по первичной опухоли (T UICC)
(чем больше стадия, тем хуже прогноз)
Дополнительные
Экстрасклеральное распространение
Локализация (меланома радужки обычно меньшего размера в момент постановки диагноза, чем опухоли цилиарного тела)
Морфологический тип: веретеноклеточный тип более благоприятный, чем эпителиоидноклеточный
Митотическая активность
Наличие микроваскулярной инвазии
Дополнительные новые
Молекулярный профиль опухоли (4 прогностических класса)
Критерии оценки качества медицинской помощи
Критерии оценки качества медицинской помощи приведены в табл. 12.
Таблица 12. Критерии оценки качества медицинской помощи
N п/п
Критерии оценки качества
Оценка выполнения
1.
Выполнена магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием и/или компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием (при отсутствии проведения исследования на предыдущем этапе и/или не информативности проведенного исследования) (при отсутствии медицинских противопоказаний)
Да/Нет
2.
Выполнен прием (осмотр, консультация) врача-офтальмолога первичный (при локальной форме увеальной меланомы)
Да/Нет
3.
Выполнено ультразвуковое исследование глазного яблока и биомикроскопия глаза и оптическое исследование заднего отдела глаза с помощью компьютерного анализатора (при локальной форме увеальной меланомы)
Да/Нет
4.
Выполнена компьютерная томография органов грудной полости (при отсутствии проведения исследования на предыдущем этапе и/или не информативности проведенного исследования)
Да/Нет
5.
Выполнено патолого-анатомическое исследование биопсийного (операционного) материала (при хирургическом лечении)
Да/Нет
6.
Проведено лазерное, хирургическое лечение и/или лучевая терапия (при локальной форме увеальной меланомы) (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний)
Да/Нет
7.
Проведено хирургическое лечение и/или лекарственная противоопухолевая терапия, и/или лучевая терапия (при метастатической увеальной меланоме) (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний)
Да/Нет
8.
"Выполнена оценка эффективности терапии не реже 1 раза в 3 мес. при иммунотерапии и 1 раза в 2 мес. при химиотерапии
Да/Нет
Список литературы
1. Mallone S., De Vries E., Guzzo M., Midena E., Verne J., Coebergh J.W., Marcos-Gragera R., Ardanaz E., Martinez R., Chirlaque M.D., Navarro C., Virgili G., Rarecare W.G. Descriptive epidemiology of malignant mucosal and uveal melanomas and adnexal skin carcinomas in Europe//Eur J Cancer. - 2012. - T. 48, N 8. - C. 1167 - 75.
2. Steeb T., Hayani K.M., Forster P., Liegl R., Toussaint F., Schlaak M., Berking C., Heppt M.V. Guidelines for uveal melanoma: a critical appraisal of systematically identified guidelines using the AGREE II and AGREE-REX instrument//J Cancer Res Clin Oncol. - 2020.10.1007/s00432-020-03141-w.
3. Rao Y.J., Sein J., Badiyan S., Schwarz J.K., DeWees T., Grigsby P., Rao P.K. Patterns of care and survival outcomes after treatment for uveal melanoma in the post-coms era (2004-2013): a surveillance, epidemiology, and end results analysis//J Contemp Brachytherapy. - 2017. - T. 9, N 5. - C. 453 - 465.
4. Singh N., Bergman L., Seregard S., Singh A.D. Uveal Melanoma: Epidemiologic Aspects//Clinical Ophthalmic Oncology: Uveal Tumors/Damato B., Singh A D. - Berlin, Heidelberg: Springer Berlin Heidelberg, 2014. - C. 75 - 87.
5. van Hees C.L., de Boer A., Jager M.J., Bleeker J.C., Kakebeeke H.M., Crijns M.B., Vandenbroucke J.P., Bergman W. Are atypical nevi a risk factor for uveal melanoma? A case-control study//J Invest Dermatol. - 1994. - T. 103, N 2. - C. 202 - 5.
6. Guenel P., Laforest L., Cyr D., Fevotte J., Sabroe S., Dufour C., Lutz J.M., Lynge E. Occupational risk factors, ultraviolet radiation, and ocular melanoma: a case-control study in France//Cancer Causes Control. - 2001. - T. 12, N 5. - C. 451 - 9.
7. Shah C.P., Weis E., Lajous M., Shields J.A., Shields C.L. Intermittent and chronic ultraviolet light exposure and uveal melanoma: a meta-analysis//Ophthalmology. - 2005. - T. 112, N 9. - C. 1599 - 607.
8. Aronow M.E., Topham A.K., Singh A.D. Uveal Melanoma: 5-Year Update on Incidence, Treatment, and Survival (SEER 1973-2013)//Ocul Oncol Pathol. - 2018. - T. 4, N 3. - C. 145 - 151.
9. Singh A.D., Topham A. Incidence of uveal melanoma in the United States: 1973-1997//Ophthalmology. - 2003. - T. 110, N 5. - C. 956 - 61.
10. Singh A.D., Turell M.E., Topham A.K. Uveal melanoma: trends in incidence, treatment, and survival//Ophthalmology. - 2011. - T. 118, N 9. - C. 1881 - 5.
11. Schmidt-Pokrzywniak A., Jockel K.H., Bornfeld N., Sauerwein W., Stang A. Positive interaction between light iris color and ultraviolet radiation in relation to the risk of uveal melanoma: a case-control study//Ophthalmology. - 2009. - T. 116, N 2. - C. 340 - 8.
12. Seddon J.M., Gragoudas E.S., Glynn R.J., Egan K.M., Albert D.M., Blitzer P.H. Host factors, UV radiation, and risk of uveal melanoma. A case-control study//Arch Ophthalmol. - 1990. - T. 108, N 9. - C. 1274 - 80.
13. Holly E.A., Aston D.A., Char D.H., Kristiansen J.J., Ahn D.K. Uveal melanoma in relation to ultraviolet light exposure and host factors//Cancer Res. - 1990. - T. 50, N 18. - C. 5773 - 7.
14. Richtig E., Langmann G., Mullner K., Smolle J. Ocular melanoma: epidemiology, clinical presentation and relationship with dysplastic nevi//Ophthalmologica. - 2004. - T. 218, N 2. - C. 111 - 4.
15. Hammer H., Olah J., Toth-Molnar E. Dysplastic nevi are a risk factor for uveal melanoma//Eur J Ophthalmol. - 1996. - T. 6, N 4. - C. 472 - 4.
16. Bajaj M.S., Khuraijam N., Sen S., Pushker N. Congenital melanocytoma manifesting as proptosis with multiple cutaneous melanocytic nevi and oculodermal melanosis//Arch Ophthalmol. - 2009. - T. 127, N 7. - C. 937 - 9.
17. Al-Sadhan Y., Shawaf S., Tabbara K. Oculodermal melanosis with choroidal melanoma in a black patient: a case report//Eye (Lond). - 2006. - T. 20, N 12. - C. 1437 - 8.
18. Jay B. Malignant melanoma of the orbit in a case of oculodermal melanosis. (Naevus of Ota)//Br J Ophthalmol. - 1965. - T. 49, N 7. - C. 359 - 63.
19. Toomey C.B., Fraser K., Thorson J.A., Goldbaum M.H., Lin J.H. GNAQ and PMS1 Mutations Associated with Uveal Melanoma, Ocular Surface Melanosis, and Nevus of Ota//Ocul Oncol Pathol. - 2019. - T. 5, N 4. - C. 267 - 272.
20. Lopez-Caballero C., Saornil-Alvarez M.A., Blanco-Mateos G., Frutos-Baraja J.M., Lopez-Lara F., Gonzalez-Sansegundo C. [Choroidal melanoma in ocular melanosis]//Arch Soc Esp Oftalmol. - 2003. - T. 78, N 2. - C. 99 - 102.
21. Stoll A. [A case from practice (345). 1. Suspicion of right-sided choroid melanoma--right-sided ocular melanosis. 2. Suspicion of type II neurofibromatosis--status following surgery of right-sided acoustic neurinoma in 1992]//Praxis (Bern 1994). - 1996. - T. 85, N 13. - C. 420 - 1.
22. Jordano J., Carreras B., Jr., Serrano D., Robles J., Guirao A. [Precancerous and cancerous melanosis of ocular localization]//Rev Clin Esp. - 1979. - T. 152, N 2. - C. 117 - 21.
23. Manschot W.A. Congenital ocular melanosis, conjunctival naevus, conjunctival melanosis, conjunctival melanoma//Ophthalmologica. - 1966. - T. 152, N 6. - C. 495 - 505.
24. Obarrio P., Deane L.C. Ocular Melanosis-Its Surgical and Radium Aspects: Case Report//Cal West Med. - 1927. - T. 27, N 4. - C. 506 - 8.
25. Офтальмоонкология: руководство для врачей/. - Москва: Медицина, 2002. - 424 с.
26. Virgili G., Gatta G., Ciccolallo L., Capocaccia R., Biggeri A., Crocetti E., Lutz J.M., Paci E., Group E.W. Incidence of uveal melanoma in Europe//Ophthalmology. - 2007. - T. 114, N 12. - C. 2309 - 15.
27. Seregard S. Posterior uveal melanoma. The Swedish perspective//Acta Ophthalmol Scand. - 1996. - T. 74, N 4. - C. 315 - 29.
28. Singh A.D., Bergman L., Seregard S. Uveal melanoma: epidemiologic aspects//Ophthalmol Clin North Am. - 2005. - T. 18, N 1. - C. 75 - 84, viii.
29. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность)/. - Москва: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава.
России,, 2021. - 252 с.
30. Состояние онкологической помощи населению России в 2019 году./. - Москва: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" 2020. - 239 с.
31. International Statistical Classification of Diseases and Related Health Problems 10th Revision. - 2016. - URL: http://apps.who.int/classifications/icd10/browse/2016/en (дата обращения: 08JAN2017.2017).
32. WHO Classification of Skin Tumours. WHO Classification of Tumours, 4th Edition, Volume 11. - 4th изд., 2018. WHO Classification of Tumours, 4th Edition, Volume 11.
33. Состояние онкологической помощи населению России в 2017 году/. - М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2018.
34. Gershenwald J., Scolyer R., Hess K., al. e. Melanoma of the skin//AJCC Cancer Staging Manual 8th ed/Amin M. и др. - New York: Springer International Publishing, 2017. - C. 563 - 585.
35. Barr R.G. Foreword to the Second Set of WFUMB Guidelines and Recommendations on the Clinical Use of Ultrasound Elastography//Ultrasound Med Biol. - 2017. - T. 43, N 1. - C. 1 - 3.
36. TNM classification of malignant tumours/. - Oxford, UK; Hoboken, NJ: John Wiley & Sons, Inc, 2017.
37. Руководство по клинической офтальмологии/. - Москва: МИА, 2014. - 960 с.
38. Бровкина А.Ф., Панова И.Е., Саакян С.В. Офтальмоонкология: новое за последние два десятилетия//Вестник офтальмологии. - 2014. - T. 130, N 6. - C. 13 - 19.
39. Офтальмология. Клинические рекомендации/. - Москва: ГЭОТАР-Медиа, 2019. - 496 с.
40. Офтальмология. Национальное руководство/. - Москва: ГЭОТАР-Медиа, 2018.
41. Coit D.G., Thompson J.A., Albertini M., Barker C., Carson W.E. r., Contreras C., Daniels G.A., DiMaio D., Durham A., Fields R.C., Fleming M.D., al:. e. NCCN Clinical Practice Guidelines in Oncology. Uveal Melanoma. Version 1.2019//Book NCCN Clinical Practice Guidelines in Oncology. Uveal Melanoma. Version 1.2019/EditorNational Comprehensive Cancer Network, 2019. - C. 24.
42. Rao P.K., Barker C., Coit D.G., Joseph R.W., Materin M., Rengan R., Sosman J., Thompson J.A., Albertini M.R., Boland G., Carson Iii W.E., Contreras C., Daniels G.A., DiMaio D., Durham A., Fields R.C., Fleming M.D., Galan A., Gastman B., Grossman K., Guild V., Johnson D., Karakousis G., Lange J.R., ScM, Margolin K., Nath S., Olszanski A.J., Ott P.A., Ross M.I., Salama A.K., Skitzki J., Swetter S.M., Wuthrick E., McMillian N.R., Engh A. NCCN Guidelines Insights: Uveal Melanoma, Version 1.2019//J Natl Compr Canc Netw. - 2020. - T. 18, N 2. - C. 120 - 131.
43. Barker C.A., Salama A.K. New NCCN Guidelines for Uveal Melanoma and Treatment of Recurrent or Progressive Distant Metastatic Melanoma//J Natl Compr Canc Netw. - 2018. - T. 16, N 5S. - C. 646 - 650.
44. Nathan P., Cohen V., Coupland S., Curtis K., Damato B., Evans J., Fenwick S., Kirkpatrick L., Li O., Marshall E., McGuirk K., Ottensmeier C., Pearce N., Salvi S., Stedman B., Szlosarek P., Turnbull N., United Kingdom Uveal Melanoma Guideline Development Working G. Uveal Melanoma UK National Guidelines//Eur J Cancer. - 2015. - T. 51, N 16. - C. 2404 - 12.
45. Nayman T., Bostan C., Logan P., Burnier M. N., Jr. Uveal Melanoma Risk Factors: A Systematic Review of Meta-Analyses//Curr Eye Res. - 2017. - T. 42, N 8. - C. 1085 - 1093.
46. Панова И.Е., Власова О.С., Гюнтнер Е.И., Самкович Е.В., Шаманова А.Ю. Клинико-инструментальные критерии риска метастазирования меланомы хориоидеи//Российский офтальмологический журнал. - 2019. - T. 12, N 3. - C. 30 - 36.
47. Diener-West M., Reynolds S.M., Agugliaro D.J., Caldwell R., Cumming K., Earle J.D., Green D.L., Hawkins B.S., Hayman J., Jaiyesimi I., Kirkwood J.M., Koh W.J., Robertson D.M., Shaw J.M., Thoma J., Collaborative Ocular Melanoma Study Group R. Screening for metastasis from choroidal melanoma: the Collaborative Ocular Melanoma Study Group Report 23//J Clin Oncol. - 2004. - T. 22, N 12. - C. 2438 - 44.
48. Cheng C.I., Park S.S., Aronowitz P. More than Meets the Eye: Metastatic Uveal Melanoma//J Gen Intern Med. - 2016. - T. 31, N 11. - C. 1397.
49. Histopathologic characteristics of uveal melanomas in eyes enucleated from the Collaborative Ocular Melanoma Study. COMS report no. 6//Am J Ophthalmol. - 1998. - T. 125, N 6. - C. 745 - 66.
50. Singh H., Coupland S.E. Dataset for histopathological reporting of uveal melanoma//Book Dataset for histopathological reporting of uveal melanoma/Editor. - Registered charity in England and Wales, no. 261035, 2017.
51. Albert D., Syed N., Cancer Committee C. o. A. P. Protocol for the examination of specimens from patients with uveal melanoma: a basis for checklists//Arch Pathol Lab Med. - 2001. - T. 125, N 9. - C. 1177 - 82.
52. Nudleman E., Harbour J.W. Evaluation Of The Role Of Liver Function Tests In Screening For Metastatic Uveal Melanoma//Investigative Ophthalmology & Visual Science. - 2012. - T. 53, N 14. - C. 3420 - 3420.
53. Diorio C., Bergeron D., Berchi C., Rousseau A. Are liver function tests relevant for early detection of liver metastasis of uveal melanoma?//Acta Ophthalmologica. - 2011. - T. 89.
54. Triozzi P.L., Singh A.D. Blood biomarkers for uveal melanoma//Future Oncol. - 2012. - T. 8, N 2. - C. 205 - 15.
55. Mouriaux F., Diorio C., Bergeron D., Berchi C., Rousseau A. Liver function testing is not helpful for early diagnosis of metastatic uveal melanoma//Ophthalmology. - 2012. - T. 119, N 8. - C. 1590 - 5.
56. Bande Rodriguez M.F., Fernandez Marta B., Lago Baameiro N., Santiago-Varela M., Silva-Rodriguez P., Blanco-Teijeiro M. J., Pardo Perez M., Pineiro Ces A. Blood Biomarkers of Uveal Melanoma: Current Perspectives//Clin Ophthalmol. - 2020. - T. 14. - C. 157 - 169.
57. Kaiserman I., Amer R., Pe'er J. Liver function tests in metastatic uveal melanoma//Am J Ophthalmol. - 2004. - T. 137, N 2. - C. 236 - 43.
58. Coit D.G., Thompson J.A., Albertini M., Barker C., Carson W.E. r., Contreras C., Daniels G.A., DiMaio D., Durham A., Fields R.C., Fleming M.D., al:. e. NCCN Clinical Practice Guidelines in Oncology. Uveal Melanoma. Version 1.2019//Book NCCN Clinical Practice Guidelines in Oncology. Uveal Melanoma. Version 1.2019/EditorNational Comprehensive Cancer Network, 2019. - C. 24.
59. Нероев В.В., Саакян С.В., Амирян А.Г., Кружкова Г.В. Ультразвуковой денситометрический анализ структуры увеальной меланомы//Российский офтальмологический журнал. - 2012. N 2. - C. 45 - 48.
60. Coleman D.J., Silverman R.H., Rondeau M.J., Boldt H.C., Lloyd H.O., Lizzi F.L., Weingeist T.A., Chen X., Vangveeravong S., Folberg R. Noninvasive in vivo detection of prognostic indicators for high-risk uveal melanoma: ultrasound parameter imaging//Ophthalmology. - 2004. - T. 111, N 3. - C. 558 - 64.
61. Daftari I., Barash D., Lin S., O'Brien J. Use of high-frequency ultrasound imaging to improve delineation of anterior uveal melanoma for proton irradiation//Phys Med Biol. - 2001. - T. 46, N 2. - C. 579 - 90.
62. Delgado S., Rodriguez Reyes A., Mora Rios L., Duenas-Gonzalez A., Taja-Chayeb L., Moragrega Adame E. Ultrasound, histopathological, and genetic features of uveal melanoma in a Mexican-Mestizo population//Arch Soc Esp Oftalmol (Engl Ed). - 2018. - T. 93, N 1. - C. 15 - 21.
63. Kat'kova E.A. [Ultrasound monitoring of the course of uveal melanoma]//Vestn Oftalmol. - 2006. - T. 122, N 4. - C. 3 - 6.
64. Romanowska-Dixon B., Jakubowska B., Markiewicz A., Pawlikowski R. [Ultrasound techniques in diagnosis of extrabulbar extension of uveal melanoma]//Klin Oczna. - 2013. - T. 115, N 3. - C. 204 - 7.
65. Rusakevich A.M., Schefler A.C., Zhou B., Brown A., Robe C., Bretana M.E. Association of Ultrasound Features in Uveal Melanoma With Metastatic Risk as Defined by Preferentially Expressed Antigen in Melanoma Status//Ophthalmic Surg Lasers Imaging Retina. - 2022. - T. 53, N 7. - C. 374 - 378.
66. Spungen H., Weingrow D. Uveal Melanoma Identified as Ocular Mass on Point-of-care Ultrasound//Clin Pract Cases Emerg Med. - 2021. - T. 5, N 3. - C. 367 - 368.
67. Stael Apolo J.A., Conde I., Fernandez D., Fernandez S., Bande M., Pardo M., Ruiz-Oliva F., Blanco M.J., Pineiro A. Identification of extraocular extension in uveal melanoma by ophthalmological ultrasound//Arch Soc Esp Oftalmol (Engl Ed). - 2022. - T. 97, N 2. - C. 70 - 76.
68. Zografos L., Chamot L., Bercher L., Schalenbourg A., Egger E., Gailloud C. [Contribution of ultrasound biomicroscopy to conservative treatment of anterior uveal melanoma]//Klin Monbl Augenheilkd. - 1996. - T. 208, N 5. - C. 414 - 7.
69. Ivekovic R., Lovrencic-Huzjan A., Mandic Z., Talan-Hranilovic J. Color Doppler flow imaging of ocular tumors//Croat Med J. - 2000. - T. 41, N 1. - C. 72 - 5.
70. Maberly D.A., Pavlin C.J., McGowan H.D., Foster F.S., Simpson E.R. Ultrasound biomicroscopic imaging of the anterior aspect of peripheral choroidal melanomas//Am J Ophthalmol. - 1997. - T. 123, N 4. - C. 506 - 14.
71. Мякошина Е.Б. Комплексная диагностика начальной меланомы хориоидеи.//Russian Electronic Journal of radiology. - 2016. - Т. 6, N 4. - С. 19 - 28.
72. Нероев В.В., Саакян С.В., Мякошина Е.Б., Юровская Н.Н., Рябина М.В., Зайцева О.В., Лысенко В.С. Дифференциальная диагностика начальной меланомы хориоидеи центральной локализации и поздней стадии возрастной макулярной дегенерации//Вестник офтальмологии. - 2013. - Т. 1. - С. 39 - 45.
73. Саакян С.В., Нероев В.В., Юровская Н.Н., Рябина М.В., Мякошина Е.Б., Пармон Я.В. Оптическая когерентная томография опухоле-ассоциированных изменений сетчатки при новообразованиях хориоидеи//Российский офтальмологический журнал. - 2009. N 2. - С. 35 - 41.
74. Саакян С.В., Мякошина Е.Б., Юровская Н.Н. Спектральная оптическая когерентная томография в оценке эффективности транспупиллярной термотерапии начальной меланомы хориоидеи//Вестник офтальмологии. - 2013. N 3. - С. 32 - 37.
75. Shields C.L., Ganguly A., Bianciotto C.G., Turaka K., Tavallali A., Shields J.A. Prognosis of uveal melanoma in 500 cases using genetic testing of fine-needle aspiration biopsy specimens//Ophthalmology. - 2011. - T. 118, N 2. - C. 396 - 401.
76. Chang M.Y., McCannel T.A. Comparison of uveal melanoma cytopathologic sample retrieval in trans-scleral versus vitrectomy-assisted transvitreal fine needle aspiration biopsy//Br J Ophthalmol. - 2014. - T. 98, N 12. - C. 1654 - 8.
77. Char D.H., Miller T.R., Ljung B.M., Howes E.L., Jr., Stoloff A. Fine needle aspiration biopsy in uveal melanoma//Acta Cytol. - 1989. - T. 33, N 5. - C. 599 - 605.
78. Klofas L.K., Bogan C.M., Coogan A.C., Schultenover S.J., Weiss V.L., Daniels A.B. Instrument Gauge and Type in Uveal Melanoma Fine Needle Biopsy: Implications for Diagnostic Yield and Molecular Prognostication//Am J Ophthalmol. - 2021. - T. 221. - C. 83 - 90.
79. Onken M.D., Worley L.A., Davila R.M., Char D.H., Harbour J.W. Prognostic testing in uveal melanoma by transcriptomic profiling of fine needle biopsy specimens//J Mol Diagn. - 2006. - T. 8, N 5. - C. 567 - 73.
80. Sellam A., Desjardins L., Barnhill R., Plancher C., Asselain B., Savignoni A., Pierron G., Cassoux N. Fine Needle Aspiration Biopsy in Uveal Melanoma: Technique, Complications, and Outcomes//Am J Ophthalmol. - 2016. - T. 162. - C. 28 - 34 e1.
81. Shahlaee A., Abdelaziz M., Seider M.I. Novel Guarded Needle Trans-Scleral Biopsy for Uveal Melanoma: A Pilot Study//Ocul Oncol Pathol. - 2021. - T. 7, N 5. - C. 326 - 329.
82. Singh A.D., Medina C.A., Singh N., Aronow M.E., Biscotti C.V., Triozzi P.L. Fine-needle aspiration biopsy of uveal melanoma: outcomes and complications//Br J Ophthalmol. - 2016. - T. 100, N 4. - C. 456 - 62.
83. Vongsachang H., Stagner A.M., Aronow M.E., Wolkow N. Extrascleral Extension of Uveal Melanoma Along Intravitreal Needle Tracts Associated With Periodic Anti-Vascular Endothelial Growth Factor Therapy for Neovascular Age-Related Macular Degeneration//JAMA Ophthalmol. - 2023. - T. 141, N 8. - C. 801 - 803.
84. de Keizer R.J., Vielvoye G.J., de Wolff-Rouendaal D. CT-scan and intraocular tumours: detection and assessment of size and extrascleral growth of uveal melanomas//Doc Ophthalmol. - 1986. - T. 61, N 3-4. - C. 285 - 94.
85. Ferreira T.A., Grech Fonk L., Jaarsma-Coes M.G., van Haren G.G.R., Marinkovic M., Beenakker J.M. MRI of Uveal Melanoma//Cancers (Basel). - 2019. - T. 11, N 3.
86. Purohit B.S., Vargas M.I., Ailianou A., Merlini L., Poletti P.A., Platon A., Delattre B.M., Rager O., Burkhardt K., Becker M. Orbital tumours and tumour-like lesions: exploring the armamentarium of multiparametric imaging//Insights Imaging. - 2016. - T. 7, N 1. - C. 43 - 68.
87. Balasubramanya R., Selvarajan S.K., Cox M., Joshi G., Deshmukh S., Mitchell D.G., O'Kane P. Imaging of ocular melanoma metastasis//Br J Radiol. - 2016. - T. 89, N 1065. - C. 20160092.
88. Damato B., Eleuteri A., Taktak A.F., Coupland S.E. Estimating prognosis for survival after treatment of choroidal melanoma//Prog Retin Eye Res. - 2011. - T. 30, N 5. - C. 285 - 95.
89. Diener-West M., Reynolds S.M., Agugliaro D.J., Caldwell R., Cumming K., Earle J.D., Hawkins B.S., Hayman J.A., Jaiyesimi I., Jampol L.M., Kirkwood J.M., Koh W.J., Robertson D.M., Shaw J.M., Straatsma B.R., Thoma J., Collaborative Ocular Melanoma Study G. Development of metastatic disease after enrollment in the COMS trials for treatment of choroidal melanoma: Collaborative Ocular Melanoma Study Group Report No. 26//Arch Ophthalmol. - 2005. - T. 123, N 12. - C. 1639 - 43.
90. Francis J.H., Patel S.P., Gombos D.S., Carvajal R.D. Surveillance options for patients with uveal melanoma following definitive management//Am Soc Clin Oncol Educ Book. - 2013.10.1200/EdBook_AM.2013.33.382
10. 14694/EdBook_AM.2013.33.382. - C. 382 - 7.
91. Maeda T., Tateishi U., Suzuki S., Arai Y., Kim E.E., Sugimura K. Magnetic resonance screening trial for hepatic metastasis in patients with locally controlled choroidal melanoma//Jpn J Clin Oncol. - 2007. - T. 37, N 4. - C. 282 - 6.
92. Marshall E., Romaniuk C., Ghaneh P., Wong H., McKay M., Chopra M., Coupland S.E., Damato B.E. MRI in the detection of hepatic metastases from high-risk uveal melanoma: a prospective study in 188 patients//Br J Ophthalmol. - 2013. - T. 97, N 2. - C. 159 - 63.
93. Orcurto V., Denys A., Voelter V., Schalenbourg A., Schnyder P., Zografos L., Leyvraz S., Delaloye A.B., Prior J.O. (18)F-fluorodeoxyglucose positron emission tomography/computed tomography and magnetic resonance imaging in patients with liver metastases from uveal melanoma: results from a pilot study//Melanoma Res. - 2012. - T. 22, N 1. - C. 63 - 9.
94. Patel M., Winston C.B., Marr B.P., Carvajal R.D., Schwartz G.K., Wolchok J., Busam K., Abramson D.H. Characterization of computed tomography scan abnormalities in patients with biopsy-proven hepatic metastases from uveal melanoma//Arch Ophthalmol. - 2011. - T. 129, N 12. - C. 1576 - 82.
95. Servois V., Mariani P., Malhaire C., Petras S., Piperno-Neumann S., Plancher C., Levy-Gabriel C., Lumbroso-le Rouic L., Desjardins L., Salmon R.J. Preoperative staging of liver metastases from uveal melanoma by magnetic resonance imaging (MRI) and fluorodeoxyglucose-positron emission tomography (FDG-PET)//Eur J Surg Oncol. - 2010. - T. 36, N 2. - C. 189 - 94.
96. Altenbernd J., Wetter A., Forsting M., Umutlu L. Dual-energy CT of liver metastases in patients with uveal melanoma//Eur J Radiol Open. - 2016. - T. 3. - C. 254 - 258.
97. Strobel K., Bode B., Dummer R., Veit-Haibach P., Fischer D.R., Imhof L., Goldinger S., Steinert H.C., von Schulthess G.K. Limited value of 18F-FDG PET/CT and S-100B tumour marker in the detection of liver metastases from uveal melanoma compared to liver metastases from cutaneous melanoma//Eur J Nucl Med Mol Imaging. - 2009. - T. 36, N 11. - C. 1774 - 82.
98. Seider M.I., Berry D.E., Schefler A.C., Materin M., Stinnett S., Mruthyunjaya P., Ocular Oncology Study C. Multi-center analysis of intraocular biopsy technique and outcomes for uveal melanoma: Ocular Oncology Study Consortium report 4//Graefes Arch Clin Exp Ophthalmol. - 2020. - T. 258, N 2. - C. 427 - 435.
99. Gaviani P., Mullins M.E., Braga T.A., Hedley-Whyte E.T., Halpern E.F., Schaefer P.S., Henson J.W. Improved detection of metastatic melanoma by T2*-weighted imaging//AJNR Am J Neuroradiol. - 2006. - T. 27, N 3. - C. 605 - 8.
100. Gramsch C., Goricke S.L., Behrens F., Zimmer L., Schadendorf D., Krasny A., Forsting M., Schlamann M.U. Isolated cerebral susceptibility artefacts in patients with malignant melanoma: metastasis or not?//Eur Radiol. - 2013. - T. 23, N 9. - C. 2622 - 7.
101. Манохина И.К., Склярова Н.В., Саакян С.В., Залетаев Д.В. Статус метилирования промоторных областей некоторых генов - супрессоров онкогенеза в увеальных меланомах//Молекулярная медицина. - 2009. N 2. - С. 53 - 56.
102. Саакян С.В., Амирян А.Г., Цыганков А.Ю., Логинов В.И. Роль молекулярно-генетических факторов в патогенезе увеальной меланомы//Молекулярная медицина. - 2017. - Т. 15, N 6. - С. 46 - 51.
103. Саакян С.В., Амирян А.Г., Цыганков А.Ю., Бурденный А.М. Анализ статуса метилирования CPG-островков генов-супрессоров опухолевого роста RASSF1A и SEMA3B при увеальной меланоме//Молекулярная медицина. - 2018. - Т. 16, N 1. - С. 51 - 54.
104. Зарецкий А.Р., Яровая В.А., Чудакова Л.В., Назарова В.В., Демидов Л.В., Яровой А.А. Опыт молекулярного тестирования увеальной меланомы I - III стадии при консервативном и хирургическом лечении//Вопросы онкологии. - 2018. N 5. - С. 625 - 632.
105. Robertson A.G., Shih J., Yau C., Gibb E.A., Oba J., Mungall K.L., Hess J.M., Uzunangelov V., Walter V., Danilova L., Lichtenberg T.M., Kucherlapati M., Kimes P.K., Tang M., Penson A., Babur O., Akbani R., Bristow C.A., Hoadley K.A., Iype L., Chang M.T., Network T.R., Cherniack A.D., Benz C., Mills G.B., Verhaak R.G. W., Griewank K.G., Felau I., Zenklusen J.C., Gershenwald J.E., Schoenfield L., Lazar A.J., Abdel-Rahman M.H., Roman-Roman S., Stern M.H., Cebulla C.M., Williams M.D., Jager M.J., Coupland S.E., Esmaeli B., Kandoth C., Woodman S.E. Integrative Analysis Identifies Four Molecular and Clinical Subsets in Uveal Melanoma//Cancer Cell. - 2018. - T. 33, N 1. - C. 151.
106. Folberg R., Rummelt V., Parys-Van Ginderdeuren R., Hwang T., Woolson R.F., Pe'er J., Gruman L. M. The prognostic value of tumor blood vessel morphology in primary uveal melanoma//Ophthalmology. - 1993. - T. 100, N 9. - C. 1389 - 98.
107. Prescher G., Bornfeld N., Hirche H., Horsthemke B., Jockel K.H., Becher R. Prognostic implications of monosomy 3 in uveal melanoma//Lancet. - 1996. - T. 347, N 9010. - C. 1222 - 5.
108. White V.A., Chambers J.D., Courtright P.D., Chang W.Y., Horsman D.E. Correlation of cytogenetic abnormalities with the outcome of patients with uveal melanoma//Cancer. - 1998. - T. 83, N 2. - C. 354 - 9.
109. Kilic E., van Gils W., Lodder E., Beverloo H.B., van Til M.E., Mooy C.M., Paridaens D., de Klein A., Luyten G.P. Clinical and cytogenetic analyses in uveal melanoma//Invest Ophthalmol Vis Sci. - 2006. - T. 47, N 9. - C. 3703 - 7.
110. Lorenzo D., Ochoa M., Piulats J.M., Gutierrez C., Arias L., Catala J., Grau M., Penafiel J., Cobos E., Garcia-Bru P., Rubio M.J., Padron-Perez N., Dias B., Pera J., Caminal J.M. Prognostic Factors and Decision Tree for Long-Term Survival in Metastatic Uveal Melanoma//Cancer Res Treat. - 2018. - T. 50, N 4. - C. 1130 - 1139.
111. Bellerive C., Grossniklaus H.E., Singh A.D. Prognostication for Uveal Melanoma: Are Two Tests Better than One?//Ocul Oncol Pathol. - 2017. - T. 3, N 4. - C. 301 - 303.
112. Singh A.D., Shields C.L., Shields J.A. Prognostic factors in uveal melanoma//Melanoma Res. - 2001. - T. 11, N 3. - C. 255 - 63.
113. Kaliki S., Shields C.L., Shields J.A. Uveal melanoma: estimating prognosis//Indian J Ophthalmol. - 2015. - T. 63, N 2. - C. 93 - 102.
114. Саакян С.В., Ченцова Е.В., Андреева Т.А. Имплантация иридохрусталиковой диафрагмы после блокэксцизий опухоли иридоцилиарной зоны//Офтальмохирургия. - 2009. N 5. - С. 52 - 54.
115. Саакян С.В., Ченцова Е.В., Андреева Т.А. Функциональные исходы у больных с опухолями иридоцилиарной зоны после блокэксцизий с одномоментной и отсроченной экстракцией катаракты//Российский офтальмологический журнал - 2010. N 1. - С. 23 - 28.
116. Бровкина А.Ф. Лучевая терапия в лечении опухолей органа зрения//Клиническая офтальмология. - 2003. - Т. 4, N 1. - С. 15 - 19.
117. American Brachytherapy Society - Ophthalmic Oncology Task Force. Electronic address p. e. c., Committee A. O. The American Brachytherapy Society consensus guidelines for plaque brachytherapy of uveal melanoma and retinoblastoma//Brachytherapy. - 2014. - T. 13, N 1. - C. 1 - 14.
118. Саакян С.В., Амирян А.Г., Вальский В.В., Миронова И.С. Брахитерапия увеальной меланомы передней локализации Вестник офтальмологии//Вестник офтальмологии. - 2015. - T. 131, N 2. - C. 5 - 12.
119. Doyen J., Bondiau P.Y., Benezery K., Thariat J., Vidal M., Gerard A., Herault J., Carrie C., Hannoun-Levi J.M. [Indications and results for protontherapy in cancer treatments]//Cancer Radiother. - 2016. - T. 20, N 6 - 7. - C. 513 - 8.
120. Doyen J., Falk A.T., Floquet V., Herault J., Hannoun-Levi J.M. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy//Cancer Treat Rev. - 2016. - T. 43. - C. 104 - 12.
121. Messineo D., Barile G., Morrone S., La Torre G., Turchetti P., Accetta L., Trovato Battagliola E., Agostinelli E., Pacella F. Meta-analysis on the utility of radiotherapy for the treatment of Ocular Melanoma//Clin Ter. - 2020. - T. 170, N 1. - C. e89 - e98.
122. Саакян С.В., Бородин Ю.И., Ширина Т.В. Оценка эффективности лечения и выживаемости больных увеальной меланомой после лечения медицинским узким протонным пучком//Радиология-практика. - 2012. N 6. - С. 49 - 53.
123. Вальский В.В., Саакян С.В., Бородин Ю.И. Осложнения после протонной лучевой терапии меланом сосудистой оболочки глаза, их лечение и профилактика//Российский офтальмологический журнал. - 2013. - Т. 6, N 3. - С. 12 - 15.
124. Бородин Ю.И., Вальский В.В., Ерохин И.Н., Канчели И.Н., Ломанов М.Ф., Люлевич В.И., Орлов Д.Г., Саакян С.В., Хорошков В.С., Черных А.Н. Инновационные разработки технических средств для протонной терапии внутриглазных новообразований. Часть I.//Российский офтальмологический журнал. - 2015. N 2. - С. 3 - 4.
125. Бородин Ю.И., Вальский В.В., Ерохин И.Н., Канчели И.Н., Ломанов М.Ф., Люлевич В.И., Орлов Д.Г., Саакян С.В., Хорошков В.С., Черных А.Н. Инновационные разработки технических средств для протонной терапии внутриглазных новообразований. Часть II//Российский офтальмологический журнал. - 2015. N 2. - С. 11 - 17.
126. Tagliaferri L., Pagliara M.M., Fionda B., Scupola A., Azario L., Sammarco M.G., Autorino R., Lancellotta V., Cammelli S., Caputo C.G., Martinez-Monge R., Kovacs G., Gambacorta M.A., Valentini V., Blasi M.A. Personalized re-treatment strategy for uveal melanoma local recurrences after interventional radiotherapy (brachytherapy): single institution experience and systematic literature review//J Contemp Brachytherapy. - 2019. - T. 11, N 1. - C. 54 - 60.
127. Lin A.J., Rao Y.J., Acharya S., Schwarz J., Rao P.K., Grigsby P. Patterns of care and outcomes of proton and eye plaque brachytherapy for uveal melanoma: Review of the National Cancer Database//Brachytherapy. - 2017. - T. 16, N 6. - C. 1225 - 1231.
128. Reichstein D., Karan K. Endoresection utilizing pars plana vitrectomy for benign and malignant intraocular tumors//Curr Opin Ophthalmol. - 2019. - T. 30, N 3. - C. 151 - 158.
129. Gunduz K., Bechrakis N.E. Exoresection and endoresection for uveal melanoma//Middle East Afr J Ophthalmol. - 2010. - T. 17, N 3. - C. 210 - 6.
130. Mazzini C., Vicini G., Di Leo L., Massi D., Rizzo S., Giansanti F. Anatomical and Functional Outcomes after Endoresection and Adjuvant Ruthenium Brachytherapy for Uveal Melanoma: A Single-Center Experience//Life (Basel). - 2023. - T. 13, N 4.
131. Romano M.R., Ferrara M., Feo A., Merico A., Angi M. Optimizing surgical performance and safety in endoresection of uveal melanoma//Retina. - 2024.10.1097/IAE.0000000000004273.
132. Rospond-Kubiak I., Groenewald C., Coupland S.E., Damato B. Core Endoresection as Neoadjuvant Treatment of Uveal Melanoma//Ocul Oncol Pathol. - 2015. - T. 2, N 2. - C. 91 - 3.
133. Susskind D., Durr C., Paulsen F., Kaulich T., Bartz-Schmidt K.U. Endoresection with adjuvant ruthenium brachytherapy for selected uveal melanoma patients - the Tuebingen experience//Acta Ophthalmol. - 2017. - T. 95, N 8. - C. e727 - e733.
134. Стоюхина А.С., Давыдов Д.В., Гришина Е.Е. Результаты энуклеаций как метода лечения больших увеальных меланом//Офтальмологические ведомости. - 2010. - Т. 111, N 1. - С. 16 - 21.
135. Горбунова Е.А., Запускалов И.В. Клиническая эффективность нового метода энуклеации глазного яблока//Современные проблемы науки и образования. - 2014. N 5.
136. Стоюхина А.С., Давыдов Д.В., Гришина Е.Е. Энуклеации при увеальной меланоме (анализ архивного материала)//Вестник офтальмологии. - 2010. - Т. 126, N 2. - С. 30 - 34.
137. Саакян С.В., Амирян А.Г., Вальский В.В., Миронова И.С., Иомдина Е.Н., Маркосян Г.А. Некроз склеры после брахитерапии увеальной меланомы и методы его устранения//Российский офтальмологический журнал. - 2017. N 1. - С. 43 - 48.
138. Панова И.Е., Гюнтнер Е.И., Павленко Е.С., Семенова Л.Е. Глава 7. Злокачественные новообразования органа зрения//Терапевтическая радиология: национальное руководство/Каприн А.Д., Мардынский Ю.С. - Москва: ГЭОТАР-Медиа, 2018. - С. 704.
139. Яровой А.А., Демидов Л.В., Горшков И.М., Коробов Е.Н., Яровая В.А. Сравнительный анализ результатов лечения большой меланомы хориоидеи брахитерапией Ru-106 с последующей эндовитреальной хирургией и брахитерапией Ru-106 в качестве монотерапии//Злокачественные опухоли. - 2019. - Т. 9, N 3s1. - С. 46.
140. Магарамов Д.А., Яровой А.А., Булгакова Е.С., Костина В.А. 12-летний опыт использования органосохраняющего лечения меланомы хориоидеи на основе брахитерапии с Ru-106+Rh-106 и лазерной транспупиллярной термотерапии//Практическая медицина. - 2012. - Т. 2, N 4. - С. 114 - 116.
141. Панова И.Е., Воробьев Н.А., Самкович Е.В., Быховский А.А., Мартынова Н.И., Свистунова Е.М. Протонотерапия увеальной меланомы (предварительные результаты)//Офтальмохирургия. - 2023. - Т. 3S. - С. 90 - 101.
142. Канчели И.Н., Хорошков В.С., Бородин Ю.И., Саакян С.В., Вальский В.В. Протонная лучевая терапия опухолей сосудистой оболочки глаза и орбиты//Альманах клинической медицины. - 2008. - T. ХVII. - C. 292 - 296.
143. Ophthalmic Oncology Task F. Local Recurrence Significantly Increases the Risk of Metastatic Uveal Melanoma//Ophthalmology. - 2016. - T. 123, N 1. - C. 86 - 91.
144. Mazzini C., Pieretti G., Vicini G., Nicolosi C., Scoccianti S., Pertici M., Greto D., Desideri I., Bordi L., Pecchioli G., Virgili G. Clinical outcomes and secondary glaucoma after gamma-knife radiosurgery and Ruthenium-106 brachytherapy for uveal melanoma: a single institution experience//Melanoma Res. - 2021. - T. 31, N 1. - C. 38 - 48.
145. Venturini M., Colantoni C., Modorati G., Di Nicola M., Colucci A., Agostini G., Picozzi P., De Cobelli F., Parmiani G., Mortini P., Bandello F., Del Maschio A. Preliminary results of contrast-enhanced sonography in the evaluation of the response of uveal melanoma to gamma-knife radiosurgery//J Clin Ultrasound. - 2015. - T. 43, N 7. - C. 421 - 30.
146. Binkley E., Triozzi P.L., Rybicki L., Achberger S., Aldrich W., Singh A. A prospective trial of adjuvant therapy for high-risk uveal melanoma: assessing 5-year survival outcomes//Br J Ophthalmol. - 2019.10.1136/bjophthalmol-2019-314461.
147. Гришина Е.Е., Степанова Е.А., Богатырев Ф.М. Диагностика метастатической увеальной меланомы. Что изменилось за 10 лет?//Альманах клинической медицины. - 2019. - Т. 47, N 8. - С. 712 - 720.
148. Казимирова Е.Г., Гришина Е.Е. Ранняя диагностика метастатической увеальной меланомы: современные возможности и перспективы развития//Современная онкология. - 2008. - Т. 1, N 10. - С. 37 - 41.
149. Mariani P., Piperno-Neumann S., Servois V., Berry M.G., Dorval T., Plancher C., Couturier J., Levy-Gabriel C., Lumbroso-Le Rouic L., Desjardins L., Salmon R.J. Surgical management of liver metastases from uveal melanoma: 16 years' experience at the Institut Curie//Eur J Surg Oncol. - 2009. - T. 35, N 11. - C. 1192 - 7.
150. Frenkel S., Nir I., Hendler K., Lotem M., Eid A., Jurim O., Pe'er J. Long-term survival of uveal melanoma patients after surgery for liver metastases//Br J Ophthalmol. - 2009. - T. 93, N 8. - C. 1042 - 6.
151. Aoyama T., Mastrangelo M.J., Berd D., Nathan F.E., Shields C.L., Shields J.A., Rosato E.L., Rosato F.E., Sato T. Protracted survival after resection of metastatic uveal melanoma//Cancer. - 2000. - T. 89, N 7. - C. 1561 - 8.
152. Hau H.M., Tautenhahn H.M., Schoenberg M.B., Atanasov G., Wiltberger G., Morgul M.H., Uhlmann D., Seitz A.T., Simon J.C., Schmelzle M., Bartels M. Liver resection in multimodal concepts improves survival of metastatic melanoma: a single-centre case-matched control study//Anticancer Res. - 2014. - T. 34, N 11. - C. 6633 - 9.
153. Lin S., Wan D., Chen H., Chen K., Zheng S. Complete resection of isolated hepatic metastatic uveal melanoma with a notably long disease-free period: A case report and review of the literature//Oncol Lett. - 2015. - T. 10, N 1. - C. 196 - 200.
154. Hameed A.M., Ng E.E., Johnston E., Hollands M.J., Richardson A.J., Pleass H.C., Lam V.W. Hepatic resection for metastatic melanoma: a systematic review//Melanoma Res. - 2014. - T. 24, N 1. - C. 1 - 10.
155. Aubin J.M., Rekman J., Vandenbroucke-Menu F., Lapointe R., Fairfull-Smith R.J., Mimeault R., Balaa F.K., Martel G. Systematic review and meta-analysis of liver resection for metastatic melanoma//Br J Surg. - 2013. - T. 100, N 9. - C. 1138 - 47.
156. Akyuz M., Yazici P., Dural C., Yigitbas H., Okoh A., Bucak E., McNamara M., Singh A., Berber E. Laparoscopic management of liver metastases from uveal melanoma//Surg Endosc. - 2016. - T. 30, N 6. - C. 2567 - 71.
157. Alexander H.R., Jr., Libutti S.K., Pingpank J.F., Steinberg S.M., Bartlett D.L., Helsabeck C., Beresneva T. Hyperthermic isolated hepatic perfusion using melphalan for patients with ocular melanoma metastatic to liver//Clin Cancer Res. - 2003. - T. 9, N 17. - C. 6343 - 9.
158. Olofsson Bagge R., Nelson A., Shafazand A., All-Eriksson C., Cahlin C., Elander N., Helgadottir H., Kiilgaard J.F., Kinhult S., Ljuslinder I., Mattsson J., Rizell M., Sternby Eilard M., Ullenhag G.J., Nilsson J.A., Ny L., Lindner P. Isolated Hepatic Perfusion With Melphalan for Patients With Isolated Uveal Melanoma Liver Metastases: A Multicenter, Randomized, Open-Label, Phase III Trial (the SCANDIUM Trial)//J Clin Oncol. - 2023. - T. 41, N 16. - C. 3042 - 3050.
159. Bethlehem M.S., Katsarelias D., Olofsson Bagge R. Meta-Analysis of Isolated Hepatic Perfusion and Percutaneous Hepatic Perfusion as a Treatment for Uveal Melanoma Liver Metastases//Cancers (Basel). - 2021. - T. 13, N 18.
160. Palma D.A., Olson R., Harrow S., Gaede S., Louie A.V., Haasbeek C., Mulroy L., Lock M., Rodrigues G.B., Yaremko B.P., Schellenberg D., Ahmad B., Senthi S., Swaminath A., Kopek N., Liu M., Moore K., Currie S., Schlijper R., Bauman G.S., Laba J., Qu X.M., Warner A., Senan S. Stereotactic Ablative Radiotherapy for the Comprehensive Treatment of Oligometastatic Cancers: Long-Term Results of the SABR-COMET Phase II Randomized Trial//J Clin Oncol. - 2020. - T. 38, N 25. - C. 2830 - 2838.
161. Chalkidou A., Macmillan T., Grzeda M.T., Peacock J., Summers J., Eddy S., Coker B., Patrick H., Powell H., Berry L., Webster G., Ostler P., Dickinson P.D., Hatton M.Q., Henry A., Keevil S., Hawkins M.A., Slevin N., van As N. Stereotactic ablative body radiotherapy in patients with oligometastatic cancers: a prospective, registry-based, single-arm, observational, evaluation study//Lancet Oncol. - 2021. - T. 22, N 1. - C. 98 - 106.
162. Magomedova Z., Nazarova V., Orlova K.V., Romanov D., Demidov L. 156P Stereotactic radiotherapy and immunotherapy for metastatic uveal melanoma: A retrospective observational study//ESMO Open. - 2025. - T. 10.
163. Долгушин Б.И., Косырев В.Ю., Виршке Э.Р., Мартынков Д.В. Возможности использования трансартериальной химиоэмболизации у пациентов с метастазами меланомы хориоидеи в печени//Онкологический журнал: лучевая диагностика, лучевая терапия. - 2018. - Т. 1, N 1. - С. 45 - 52.
164. Мартынков Д.В., Косырев В.Ю. Обзор возможностей регионарного лечения метастазов меланомы хориоидеи в печени//Современные проблемы науки и образования. - 2019. - Т. 1. - С. 34.
165. Yamada K., Takeuchi M., Fukumoto T., Suzuki M., Kato A., Mizuki Y., Yamada N., Kaneko T., Mizuki N., Horita N. Immune checkpoint inhibitors for metastatic uveal melanoma: a meta-analysis//Sci Rep. - 2024. - T. 14, N 1. - C. 7887.
166. Lane A.M., Kim I.K., Gragoudas E.S. Survival Rates in Patients After Treatment for Metastasis From Uveal Melanoma//JAMA Ophthalmol. - 2018. - T. 136, N 9. - C. 981 - 986.
167. Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am J Clin Oncol. - 1982. - T. 5, N 6. - C. 649 - 55.
168. Pelster M., Gruschkus S.K., Bassett R., Gombos D.S., Shephard M., Posada L., Glover M., Diab A., Hwu P., Patel S.P. Phase II study of ipilimumab and nivolumab (ipi/nivo) in metastatic uveal melanoma (UM)//Journal of Clinical Oncology. - 2019. - T. 37, N 15_suppl. - C. 9522 - 9522.
169. Algazi A.P., Tsai K.K., Shoushtari A.N., Munhoz R.R., Eroglu Z., Piulats J.M., Ott P.A., Johnson D.B., Hwang J., Daud A.I., Sosman J.A., Carvajal R.D., Chmielowski B., Postow M.A., Weber J.S., Sullivan R.J. Clinical outcomes in metastatic uveal melanoma treated with PD-1 and PD-L1 antibodies//Cancer. - 2016. - T. 122, N 21. - C. 3344 - 3353.
170. Karivedu V., Eldessouki I., Taftaf A., Zhu Z., Makramalla A., Karim N.A. Nivolumab and Ipilimumab in the Treatment of Metastatic Uveal Melanoma: A Single-Center Experience//Case Rep Oncol Med. - 2019. - T. 2019. - C. 3560640.
171. Kottschade L.A., McWilliams R.R., Markovic S.N., Block M.S., Villasboas Bisneto J., Pham A.Q., Esplin B.L., Dronca R.S. The use of pembrolizumab for the treatment of metastatic uveal melanoma//Melanoma Res. - 2016. - T. 26, N 3. - C. 300 - 3.
172. Namikawa K., Takahashi A., Mori T., Tsutsumida A., Suzuki S., Motoi N., Jinnai S., Kage Y., Mizuta H., Muto Y., Nakano E., Yamazaki N. Nivolumab for patients with metastatic uveal melanoma previously untreated with ipilimumab: a single-institution retrospective study//Melanoma Res. - 2020. - T. 30, N 1. - C. 76 - 84.
173. Rantala E.S., Hernberg M., Kivela T.T. Overall survival after treatment for metastatic uveal melanoma: a systematic review and meta-analysis//Melanoma Res. - 2019. - T. 29, N 6. - C. 561 - 568.
174. Rossi E., Pagliara M.M., Orteschi D., Dosa T., Sammarco M.G., Caputo C.G., Petrone G., Rindi G., Zollino M., Blasi M.A., Cassano A., Bria E., Tortora G., Schinzari G. Pembrolizumab as first-line treatment for metastatic uveal melanoma//Cancer Immunol Immunother. - 2019. - T. 68, N 7. - C. 1179 - 1185.
175. Nazarova V.V., Magomedova Z.R., Orlova K.V., Unguryan V., Romanov D., Yarovaya V., Yarovoy A., Trofimova O., Demidov L.V. First-line therapy for metastatic uveal melanoma: Experience from a single reference center//Journal of Clinical Oncology. - 2024. - T. 42, N 16_suppl. - C. e21514 - e21514.
176. Piulats J.M., Espinosa E., de la Cruz Merino L., Varela M., Alonso Carrion L., Martin-Algarra S., Lopez Castro R., Curiel T., Rodriguez-Abreu D., Redrado M., Goma M., Rullan A.J., Calvo Gonzalez A., Berrocal-Jaime A. Nivolumab Plus Ipilimumab for Treatment-Naive Metastatic Uveal Melanoma: An Open-Label, Multicenter, Phase II Trial by the Spanish Multidisciplinary Melanoma Group (GEM-1402)//J Clin Oncol. - 2021. - T. 39, N 6. - C. 586 - 598.
177. Pelster M.S., Gruschkus S.K., Bassett R., Gombos D.S., Shephard M., Posada L., Glover M.S., Simien R., Diab A., Hwu P., Carter B.W., Patel S.P. Nivolumab and Ipilimumab in Metastatic Uveal Melanoma: Results From a Single-Arm Phase II Study//J Clin Oncol. - 2021. - T. 39, N 6. - C. 599 - 607.
178. Weber J.S., D'Angelo S.P., Minor D., Hodi F.S., Gutzmer R., Neyns B., Hoeller C., Khushalani N.I., Miller W.H., Jr., Lao C.D., Linette G.P., Thomas L., Lorigan P., Grossmann K.F., Hassel J.C., Maio M., Sznol M., Ascierto P.A., Mohr P., Chmielowski B., Bryce A., Svane I.M., Grob J.J., Krackhardt A.M., Horak C., Lambert A., Yang A.S., Larkin J. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial//Lancet Oncol. - 2015. - T. 16, N 4. - C. 375 - 84.
179. Robert C., Long G.V., Brady B., Dutriaux C., Maio M., Mortier L., Hassel J.C., Rutkowski P., McNeil C., Kalinka-Warzocha E., Savage K.J., Hernberg M.M., Lebbe C., Charles J., Mihalcioiu C., Chiarion-Sileni V., Mauch C., Cognetti F., Arance A., Schmidt H., Schadendorf D., Gogas H., Lundgren-Eriksson L., Horak C., Sharkey B., Waxman I.M., Atkinson V., Ascierto P.A. Nivolumab in previously untreated melanoma without BRAF mutation//N Engl J Med. - 2015. - T. 372, N 4. - C. 320 - 30.
180. Larkin J., Chiarion-Sileni V., Gonzalez R., Grob J.J., Cowey C.L., Lao C.D., Schadendorf D., Dummer R., Smylie M., Rutkowski P., Ferrucci P.F., Hill A., Wagstaff J., Carlino M.S., Haanen J.B., Maio M., Marquez-Rodas I., McArthur G.A., Ascierto P.A., Long G.V., Callahan M.K., Postow M.A., Grossmann K., Sznol M., Dreno B., Bastholt L., Yang A., Rollin L.M., Horak C., Hodi F.S., Wolchok J.D. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma//N Engl J Med. - 2015. - T. 373, N 1. - C. 23 - 34.
181. Robert C., Ribas A., Wolchok J.D., Hodi F.S., Hamid O., Kefford R., Weber J.S., Joshua A.M., Hwu W.J., Gangadhar T.C., Patnaik A., Dronca R., Zarour H., Joseph R.W., Boasberg P., Chmielowski B., Mateus C., Postow M.A., Gergich K., Elassaiss-Schaap J., Li X.N., Iannone R., Ebbinghaus S.W., Kang S.P., Daud A. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial//Lancet. - 2014. - T. 384, N 9948. - C. 1109 - 17.
182. Robert C., Schachter J., Long G.V., Arance A., Grob J.J., Mortier L., Daud A., Carlino M.S., McNeil C., Lotem M., Larkin J., Lorigan P., Neyns B., Blank C.U., Hamid O., Mateus C., Shapira-Frommer R., Kosh M., Zhou H., Ibrahim N., Ebbinghaus S., Ribas A., investigators K.-. Pembrolizumab versus Ipilimumab in Advanced Melanoma//N Engl J Med. - 2015. - T. 372, N 26. - C. 2521 - 32.
183. Ribas A., Puzanov I., Dummer R., Schadendorf D., Hamid O., Robert C., Hodi F.S., Schachter J., Pavlick A.C., Lewis K.D., Cranmer L.D., Blank C.U., O'Day S.J., Ascierto P.A., Salama A.K., Margolin K.A., Loquai C., Eigentler T.K., Gangadhar T.C., Carlino M.S., Agarwala S.S., Moschos S.J., Sosman J.A., Goldinger S.M., Shapira-Frommer R., Gonzalez R., Kirkwood J.M., Wolchok J.D., Eggermont A., Li X.N., Zhou W., Zernhelt A.M., Lis J., Ebbinghaus S., Kang S.P., Daud A. Pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory melanoma (KEYNOTE-002): a randomised, controlled, phase 2 trial//Lancet Oncol. - 2015. - T. 16, N 8. - C. 908 - 18.
184. Ribas A., Hamid O., Daud A., Hodi F.S., Wolchok J.D., Kefford R., Joshua A.M., Patnaik A., Hwu W.J., Weber J.S., Gangadhar T.C., Hersey P., Dronca R., Joseph R.W., Zarour H., Chmielowski B., Lawrence D.P., Algazi A., Rizvi N.A., Hoffner B., Mateus C., Gergich K., Lindia J.A., Giannotti M., Li X.N., Ebbinghaus S., Kang S.P., Robert C. Association of Pembrolizumab With Tumor Response and Survival Among Patients With Advanced Melanoma//JAMA. - 2016. - T. 315, N 15. - C. 1600 - 9.
185. Orlova K.V., Fedyanin M.I., Simanenkov K.E., Dergunov A.S., Goldshmidt P.R., Saydullaeva A.F., Bogacheva D.V., Yavorskaya M.A., Azanov A.Z., Fedenko A.A., Bolotina L.V., Deshkina T.I., Babina K.G., Kuzevanova E.A., Zhukova L.G., Feoktistova P.S., Polshina N.I., Peganova E.V., Shikina V.E., Sobolev M.M., Mironov O.V., Vaschenko V.A., Ershova M.M., Mezhueva A.O., Orlova S.A., Tantsyrev D.A., Taskina D.K., Teterich A.A., Karabina E.V., Kostalanova Y.V., Bogacheva M.V., Zhukova N.V., Orlova R.V., Zinkevich M.V., Kazmin A.I., Volkonskiy M.V., Voronkova L.M., Karpova A.S., Maleyko M.L., Gorshenina M.N., Kryuchkova E.I., al. e. Final data on the efficacy of the FORA study (FOrteca Real practice Assessment): a multicenter prospective observational study on the real-world efficacy of prolgolimab in patients with metastatic melanoma in Russia//Journal of Modern Oncology. - 2024. - T. 26, N 1. - C. 20.
186. Tjulandin S., Demidov L., Moiseyenko V., Protsenko S., Semiglazova T., Odintsova S., Zukov R., Lazarev S., Makarova Y., Nechaeva M., Sakaeva D., Andreev A., Tarasova A., Fadeyeva N., Shustova M., Kuryshev I. Novel PD-1 inhibitor prolgolimab: expanding non-resectable/metastatic melanoma therapy choice//Eur J Cancer. - 2021. - T. 149. - C. 222 - 232.
187. Larkin J., Chiarion-Sileni V., Gonzalez R., Rutkowski P., Grob J., Cowey C.L., Lao C.D., Schadendorf D., Ferrucci P.F., Smylie M., Dummer R., Hill A., Haanen J., Maio M., McArthur G., Walker D., Rollin L., Horak C., Hodi F.S., Wolchok J.D. Overall Survival Results From a Phase III Trial of Nivolumab Combined With Ipilimumab in  Patients With Advanced Melanoma (CheckMate 067)//AACR Annual Meeting - Walter E. Washington Convention Center, Washington, D.C., USA, 2017. -.
Patients With Advanced Melanoma (CheckMate 067)//AACR Annual Meeting - Walter E. Washington Convention Center, Washington, D.C., USA, 2017. -.
188. Long G.V., Atkinson V., Lo S., Sandhu S., Guminski A.D., Brown M.P., Wilmott J.S., Edwards J., Gonzalez M., Scolyer R.A., Menzies A.M., McArthur G.A. Combination nivolumab and ipilimumab or nivolumab alone in melanoma brain metastases: a multicentre randomised phase 2 study//Lancet Oncol. - 2018. - T. 19, N 5. - C. 672 - 681.
189. Zimmer L., Vaubel J., Mohr P., Hauschild A., Utikal J., Simon J., Garbe C., Herbst R., Enk A., Kampgen E., Livingstone E., Bluhm L., Rompel R., Griewank K.G., Fluck M., Schilling B., Schadendorf D. Phase II DeCOG-study of ipilimumab in pretreated and treatment-naive patients with metastatic uveal melanoma//PLoS One. - 2015. - T. 10, N 3. - C. e0118564.
190. Yi J.H., Yi S.Y., Lee H.R., Lee S.I., Lim D.H., Kim J.H., Park K.W., Lee J. Dacarbazine-based chemotherapy as first-line treatment in noncutaneous metastatic melanoma: multicenter, retrospective analysis in Asia//Melanoma Res. - 2011. - T. 21, N 3. - C. 223 - 7.
191. Serrone L., Zeuli M., Sega F.M., Cognetti F. Dacarbazine-based chemotherapy for metastatic melanoma: thirty-year experience overview//J Exp Clin Cancer Res. - 2000. - T. 19, N 1. - C. 21 - 34.
192. Hill G.J., 2nd, Krementz E.T., Hill H.Z. Dimethyl triazeno imidazole carboxamide and combination therapy for melanoma. IV. Late results after complete response to chemotherapy (Central Oncology Group protocols 7130, 7131, and 7131A)//Cancer. - 1984. - T. 53, N 6. - C. 1299 - 305.
193. Назарова В.В. Лечение и прогноз метастатической увеальной меланомы/Демидов Л.В.; ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России. - Москва, 2019. - 136 c.
194. Carvajal R.D., Piperno-Neumann S., Kapiteijn E., Chapman P.B., Frank S., Joshua A.M., Piulats J.M., Wolter P., Cocquyt V., Chmielowski B., Evans T.R.J., Gastaud L., Linette G., Berking C., Schachter J., Rodrigues M.J., Shoushtari A.N., Clemett D., Ghiorghiu D., Mariani G., Spratt S., Lovick S., Barker P., Kilgour E., Lai Z., Schwartz G.K., Nathan P. Selumetinib in Combination With Dacarbazine in Patients With Metastatic Uveal Melanoma: A Phase III, Multicenter, Randomized Trial (SUMIT)//J Clin Oncol. - 2018. - T. 36, N 12. - C. 1232 - 1239.
195. Carvajal R.D., Schwartz G.K., Mann H., Smith I., Nathan P.D. Study design and rationale for a randomised, placebo-controlled, double-blind study to assess the efficacy of selumetinib (AZD6244; ARRY-142886) in combination with dacarbazine in patients with metastatic uveal melanoma (SUMIT)//BMC Cancer. - 2015. - T. 15. - C. 467.
196. Carvajal R.D., Sosman J.A., Quevedo J.F., Milhem M.M., Joshua A.M., Kudchadkar R.R., Linette G.P., Gajewski T.F., Lutzky J., Lawson D.H., Lao C.D., Flynn P.J., Albertini M.R., Sato T., Lewis K., Doyle A., Ancell K., Panageas K.S., Bluth M., Hedvat C., Erinjeri J., Ambrosini G., Marr B., Abramson D.H., Dickson M.A., Wolchok J.D., Chapman P.B., Schwartz G.K. Effect of selumetinib vs chemotherapy on progression-free survival in uveal melanoma: a randomized clinical trial//JAMA. - 2014. - T. 311, N 23. - C. 2397 - 405.
197. Larkin J.M., Hughes S.A., Beirne D.A., Patel P.M., Gibbens I.M., Bate S.C., Thomas K., Eisen T.G., Gore M.E. A phase I/II study of lomustine and temozolomide in patients with cerebral metastases from malignant melanoma//Br J Cancer. - 2007. - T. 96, N 1. - C. 44 - 8.
198. Hauschild A., Agarwala S.S., Trefzer U., Hogg D., Robert C., Hersey P., Eggermont A., Grabbe S., Gonzalez R., Gille J., Peschel C., Schadendorf D., Garbe C., O'Day S., Daud A., White J.M., Xia C., Patel K., Kirkwood J.M., Keilholz U. Results of a phase III, randomized, placebo-controlled study of sorafenib in combination with carboplatin and paclitaxel as second-line treatment in patients with unresectable stage III or stage IV melanoma//J Clin Oncol. - 2009. - T. 27, N 17. - C. 2823 - 30.
199. Samoylenko I., Kharkevich G., Petenko N.N., Orlova K., Sinelnikov I., Utyashev I., Vikhrova A., Markina I., Demidov L. Paclitaxel and carboplatin chemotherapy in patients with metaststic melanoma refractory to BRAF/MEK inhibitors//J Clin Oncol. - 2016. - T. 34. - C. No 15_suppl (May 20 Supplement), 2016: 9552.
200. Larkin J., Minor D., D'Angelo S., Neyns B., Smylie M., Miller W.H., Jr., Gutzmer R., Linette G., Chmielowski B., Lao C.D., Lorigan P., Grossmann K., Hassel J.C., Sznol M., Daud A., Sosman J., Khushalani N., Schadendorf D., Hoeller C., Walker D., Kong G., Horak C., Weber J. Overall Survival in Patients With Advanced Melanoma Who Received Nivolumab Versus Investigator's Choice Chemotherapy in CheckMate 037: A Randomized, Controlled, Open-Label Phase III Trial//J Clin Oncol. - 2017.10.1200/JCO.2016.71.8023. - C. JCO2016718023.
201. Schinzari G., Rossi E., Cassano A., Dadduzio V., Quirino M., Pagliara M., Blasi M.A., Barone C. Cisplatin, dacarbazine and vinblastine as first line chemotherapy for liver metastatic uveal melanoma in the era of immunotherapy: a single institution phase II study//Melanoma Res. - 2017. - T. 27, N 6. - C. 591 - 595.
202. Gurney H. How to calculate the dose of chemotherapy//Br J Cancer. - 2002. - T. 86, N 8. - C. 1297 - 302.
203. de Jongh F.E., Verweij J., Loos W.J., de Wit R., de Jonge M.J., Planting A.S., Nooter K., Stoter G., Sparreboom A. Body-surface area-based dosing does not increase accuracy of predicting cisplatin exposure//J Clin Oncol. - 2001. - T. 19, N 17. - C. 3733 - 9.
204. Проценко С.А., Антимоник Н.Ю., Берштейн Л.М., Жукова Н.В., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Чубенко В.А., Харкевич Г.Ю., Юдин Д.И. Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями//Злокачественные опухоли. - 2020. - Т. 10, N 3s2-2. - С. 168 - 199.
205. Wolchok J.D., Hoos A., O'Day S., Weber J.S., Hamid O., Lebbe C., Maio M., Binder M., Bohnsack O., Nichol G., Humphrey R., Hodi F.S. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria//Clin Cancer Res. - 2009. - T. 15, N 23. - C. 7412 - 20.
206. Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M., Rubinstein L., Shankar L., Dodd L., Kaplan R., Lacombe D., Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)//Eur J Cancer. - 2009. - T. 45, N 2. - C. 228 - 47.
207. Miller A.B., Hoogstraten B., Staquet M., Winkler A. Reporting results of cancer treatment//Cancer. - 1981. - T. 47, N 1. - C. 207 - 14.
208. Larkin J., Ascierto P.A., Dreno B., Atkinson V., Liszkay G., Maio M., Mandala M., Demidov L., Stroyakovskiy D., Thomas L., de la Cruz-Merino L., Dutriaux C., Garbe C., Sovak M.A., Chang I., Choong N., Hack S.P., McArthur G.A., Ribas A. Combined vemurafenib and cobimetinib in BRAF-mutated melanoma//N Engl J Med. - 2014. - T. 371, N 20. - C. 1867 - 76.
209. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи. - 2023. - URL: https://cr.minzdrav.gov.ru/preview-cr/400_2 (дата обращения: 27.01.2025.
210. Владимирова Л.Ю., Гладков О.А., Королева И.А., Румянцев А.А., Семиглазова Т.Ю., Трякин А.А., Кутукова С.И., Овчинникова Е.Г., Новикова О.Ю., А.Л. К. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных//Злокачественные опухоли. - 2021. - Т. 11, N 3s2-2. - С. 25 - 38.
211. Багрова С.Г., Копп М.В., Кутукова С.И., Манзюк Л.В., Семиглазова Т.Ю. Использование остеомодифицирующих агентов (ома) для профилактики и лечения патологии костной ткани при злокачественных новообразованиях.//Злокачественные опухоли. - 2020. - Т. 10, N 3s2-2. - С. 35 - 44.
212. Сакаева Д.Д., Борисов К.Е., Булавина И.С., Когония Л.М., Курмуков И.А., Орлова Р.В., Шабаева М.М. Практические рекомендации по диагностике и лечению фебрильной нейтропении.//Злокачественные опухоли. - 2021. - Т. 11, N 3s2-2. - С. 55 - 63.
213. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией//Злокачественные опухоли. - 2021. - Т. 11, N 3s2-2. - С. 64 - 77.
214. Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии//Злокачественные опухоли. - 2021. - Т. 11, N 3s2-2. - С. 78 - 98.
215. Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Е.В., Орлова Р.В. Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию//Злокачественные опухоли. - 2020. - Т. 10, N 3s2-2. - С. 88 - 101.
216. Сытов А.В., Зузов С.А., Кукош М.Ю., Лейдерман И.Н., Потапов А.Л., Хотеев А.Ж. Практические рекомендации по нутритивной поддержке онкологических больных//Злокачественные опухоли. - 2021. - Т. 11, N 3s2-2. - С. 114 - 122.
217. Сомонова О.В., Антух Э.А., Варданян А.В., Громова Е.Г., Долгушин Б.И., Елизарова А.Л., Сакаева Д.Д., Сельчук В.Ю., Трякин А.А., Черкасов В.А. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных//Злокачественные опухоли. - 2021. - Т. 11, N 3s2-2. - С. 145 - 155.
218. Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов//Злокачественные опухоли. - 2021. - Т. 11, N 3s2-2. - С. 132 - 144.
219. Буйденок Ю.В. Рекомендации по лечению последствий экстравазации противоопухолевых препаратов//Злокачественные опухоли. - 2020. - Т. 10, N 3s2-2. - С. 141 - 147.
220. Millen A.E., Tucker M.A., Hartge P., Halpern A., Elder D.E., Guerry D. t., Holly E.A., Sagebiel R.W., Potischman N. Diet and melanoma in a case-control study//Cancer Epidemiol Biomarkers Prev. - 2004. - T. 13, N 6. - C. 1042 - 51.
221. Вериго Е.Н., Макаров П.В. Протезирование в комплексной медико-социальной реабилитации пациентов при офтальмопатологии//Медико-социальная экспертиза и реабилитация. - 2016. N 4. - С. 182 - 185.
222. Иволгина И.В. Особенности применения различных имплантатов при формировании опорно-двигательной культи после энуклеации//Вестник ТГУ. - 2015. - Т. 20, N 3. - С. 577 - 579.
223. Сельский Н.Е., Коротик И.О., Мухамедиев Д.М. Отдаленные результаты использования различных фиксирующих элементов в лицевом протезировании//. - 2016. - Т. 2, N 34 - 42.
224. Вериго Е.Н., Филатова И.А., Ткаченко О.Н. Возможности эктопротезирования в реабилитации пациентов с патологией орбиты.//Вестник офтальмологии. - 2017. - Т. 133, N 5. - С. 64 - 68.
225. Гришина Е.Е. Анализ выживаемости больных увеальной меланомой при органосохранном и ликвидационном лечении//Альманах клинической медицины. - 2018. - Т. 46, N 1. - С. 68 - 65.
226. Piperno-Neumann S., Servois V., Mariani P., Plancher C., Levy-Gabriel C., Lumbroso-Le Rouic L., Couturier J., Asselain B., Desjardins L., Cassoux N. Prospective study of surveillance testing for metastasis in 100 high-risk uveal melanoma patients//J Fr Ophtalmol. - 2015. - T. 38, N 6. - C. 526 - 34.
227. Chadha V., Cauchi P., Kincaid W., Schipani W., Waterston A., Cram O., Ritchie D., Salvi S., Nathan P., Blair R. Consensus statement on metastatic surveillance for uveal melanoma in Scotland//. - 2019. - URL: https://www.parliament.scot/S5_PublicPetitionsCommittee/Submissions%202019/PE1629_FF.pdf (дата обращения: 10.03.2020).
228. Seedor R.S., Eschelman D.J., Gonsalves C.F., Adamo R.D., Orloff M.M., Amjad A., Sharpe-Mills E., Weight R.M., Gradone A., Shields C.L., Shields J.A., Mastrangelo M.J., Sato T. Liver-directed treatment for patients with uveal melanoma hepatic metastasis: A retrospective analysis of overall survival//Journal of Clinical Oncology. - 2018. - T. 36, N 15_suppl. - C. 9592 - 9592.
229. Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer//Evaluation of chemotherapeutic agents/MacLeod C. - New York: Columbia University Press, 1949. - C. 191 - 205.
230. Гомболевский В. Методические рекомендации по применению критериев ответа солидных опухолей на химиотерапевтическое лечение (RECIST 1.1)//Методические рекомендации N 46. - г. Москва: "Научно-практический центр медицинской радиологии" департамента здравоохранения города Москвы 2018.
231. Wilson MA, Schuchter LM. Chemotherapy for Melanoma. Cancer Treat Res. 2016; 167: 209 - 29. doi: 10.1007/978-3-319-22539-5_8. PMID: 26601864.
232. Garbe, C., & Eigentler, T.K. (2004). Therapie des malignen Melanoms im Stadium der Fernmetastasierung. Der Hautarzt, 55(2), 195 - 213. doi:10.1007/s00105-003-0684-1.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Модератор рабочей группы:
Самойленко И.В., к.м.н., старший научный сотрудник отделения опухолей кожи отдела лекарственного лечения ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России; член правления Ассоциации специалистов по проблемам меланомы.
Рабочая группа
Блок по лечению интраокулярной формы меланомы и медицинской реабилитации:
1. Амирян А.Г., д.м.н., доцент кафедры непрерывного медицинского образования, главный научный сотрудник отдела офтальмоонкологии и радиологии ФГБУ "НМИЦ ГБ им. Гельмгольца" МЗ РФ.
2. Бородин Ю.И., к.м.н., зав.отделением радиологии ФГБУ "НМИЦ ГБ им. Гельмгольца" МЗ РФ, ООО "Ассоциация врачей-офтальмологов".
3. Бровкина А.Ф., академик РАН, профессор кафедры офтальмологии с курсом детской офтальмологии и курсом офтальмоонкологии и орбитальной патологии ГБОУ ДПО "Российская государственная медицинская академия последипломного образования" Министерства здравоохранения Российской Федерации, Заслуженный деятель науки РФ, ООО "Ассоциация врачей-офтальмологов".
4. Панова Е.Е., д.м.н., профессор, Заслуженный врач Российской Федерации, заместитель директора по научной работе СПб филиала ФГАУ "НМИЦ "МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова" Минздрава России, профессор кафедры офтальмологии ФГБОУ ВО "Северо-Западный государственный медицинский университет им. И.И. Мечникова" Минздрава России, ООО "Ассоциация врачей-офтальмологов".
5. Пантелеева О.Г., д.м.н., доцент кафедры непрерывного медицинского образования, ведущий научный сотрудник, врач-офтальмолог отдела офтальмоонкологии и радиологии ФГБУ "НМИЦ ГБ им. Гельмгольца", ООО "Ассоциация врачей-офтальмологов".
6. Саакян С.В., д.м.н., профессор, заслуженный врач России, врач-офтальмолог, врач-онколог МЦ "МирА", ООО "Ассоциация врачей-офтальмологов".
7. Пармон Я.В., к.м.н., заведующая офтальмологическим отделением по лечению онкологических заболеваний глаз, врач-офтальмолог, ООО "Ассоциация врачей офтальмологов".
8. Цыганков А.Ю., к.м.н., научный сотрудник, врач-офтальмолог отдела офтальмоонкологии и радиологии ФГБУ "НМИЦ ГБ им. Гельмгольца", ООО "Ассоциация врачей-офтальмологов".
9. Яровой А.А., д.м.н., зав отделом офтальмоонкологии и радиологии "НМИЦ "МНТК "Микрохирургия глаза" им. С.Н. Федорова" Минздрава России, Общество офтальмологов России.
10. Яровая В.А., к.м.н., врач-офтальмолог отделения офтальмоонкологии и радиологии "НМИЦ "МНТК "Микрохирургия глаза" им. С.Н. Федорова" Минздрава России, Общество офтальмологов России.
Блок по диспансерному наблюдению и лечению метастатической и нерезектабельной увеальной меланомы:
1. Демидов Л.В., д.м.н., профессор, заведующий онкологическим отделением опухолей кожи отдела лекарственного лечения ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России, председатель правления Ассоциации специалистов по проблемам меланомы.
2. Долгушин Б.И., д.м.н., профессор, академик РАН, директор НИИ клинической и экспериментальной радиологии ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России, Президент национального общества интервенционных онкорадиологов.
3. Зарецкий А.Р., руководитель онкологического направления Ассоциации специалистов в области молекулярной медицины, лабораторной и клинической генетики им. Е.И. Шварца, заведующий лабораторией молекулярной онкогенетики ФГБУ "НМИЦ АГП им. акад. В.И. Кулакова" Минздрава России, с.н.с. Отдела молекулярных технологий НИИ трансляционной медицины ФГАОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России.
4. Назарова В.В., к.м.н., врач-онколог отделения опухолей кожи отдела лекарственного лечения ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России, член Ассоциации специалистов по проблемам меланомы.
5. Новик А.В., д.м.н., ведущий научный сотрудник научного отдела онкоиммунологии, врач-онколог отделения противоопухолевого лекарственного лечения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент кафедры онкологии, детской онкологии и лучевой терапии ФГБОУ ВО СПбГПМУ Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
6. Орлова К.В. к.м.н., старший научный сотрудник отделения опухолей кожи отдела лекарственного лечения ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
7. Самойленко И.В., к.м.н., старший научный сотрудник отделения опухолей кожи отдела лекарственного лечения ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России, член правления Ассоциации специалистов по проблемам меланомы;
8. Утяшев И.А., к.м.н., Лидер группы по меланоме, опухолям кожи и саркомам Института Онкологии Хадасса Москва, заведующий отделением клинических исследований Клиники Хадасса Москва, Директор Департамента Клинических Исследований группы компаний Медскан.
9. Унгурян В.М., к.м.н., главный врач Костромского клинического онкологического диспансера, главный внештатный специалист онколог Департамента здравоохранения Костромской области.
Блок по организации медицинской помощи:
1. Невольских А.А., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
2. Иванов С.А., д.м.н., профессор, член-корреспондент РАН, заслуженный врач РФ, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России, главный внештатный специалист-онколог ЦФО Минздрава России.
3. Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Геворкян Т.Г., заместитель директора по реализации федеральных проектов ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
5. Комаров Ю.И., к.м.н., заместитель директора по организационно-методической работе ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
Конфликта интересов нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. врачи-офтальмологи;
2. врачи-онкологи;
3. врачи-хирурги;
4. врачи-радиологи;
5. врачи-радиотерапевты;
6. врачи-генетики;
7. врачи-дерматовенерологи;
8. врачи-патологоанатомы;
9. врачи-терапевты;
10. врачи-терапевты участковые;
11. врачи общей практики (семейные врачи);
12. студенты медицинских вузов, ординаторы и аспиранты;
13. врачи клинической лабораторной диагностики;
14. врачи клинической лабораторной диагностики;
Таблица 12. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 13. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематический обзор рандомизированных контролируемых исследований с применением метаанализа
2
Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 14. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендаций
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Минздрава России от 19.02.2021 N 116н "Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях".
2. Приказ Минздрава России от 04.06.2020 N 548н "Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями".
3. Приказ Минздрава России от 27.04.2021 N 404н "Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения".
4. Приказ Минздрава России от 10.05.2017 N 203н "Об утверждении критериев оценки качества медицинской помощи".
5. Приказ Минздрава России от 11.03.2021 N 194н "Об утверждении стандартов медицинской помощи взрослым при меланоме кожи и слизистых оболочек".
6. Приказ Минздрава России от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации" (зарегистрировано в Минюсте России 08.05.2019 N 54588).
7. Методические рекомендации по проведению оценки научной обоснованности, включаемой в клинические рекомендации информации, ФГБУ "Центр экспертизы и контроля качества" Министерства здравоохранения Российской Федерации, 2019 г.
8. Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
9. Приказ Минздрава России от 13.10.2017 N 804н "Об утверждении номенклатуры медицинских услуг".
В таблице А3-1 приведены термины, описывающие процедуры в клинической рекомендации и возможные (наиболее близкие) термины из действующей номенклатуры медицинских услуг.
Таблица А3-1. Термины, описывающие процедуры в клинической рекомендации и возможные (наиболее близкие) термины из действующей номенклатуры медицинских услуг
Термин, встречающийся в клинической рекомендации
Виды и подвиды медицинских услуг, наиболее подходящих под термин клинической рекомендации (на основании номенклатуры медицинских услуг, утвержденной приказом от 13 октября 2017 г. N 804н МЗ РФ)
Биомикроскопия
A03.26.001 Биомикроскопия глаза
A03.26.018 Биомикроскопия глазного дна
Блокэксцизия
A16.26.060 Иридэктомия
A16.26.062 Иридопластика
A16.26.064 Иридосклерэктомия
A16.26.151 Иридоциклохориоидсклерэктомия
A16.26.065 Циклэктомия, циклотомия
Брахитерапия
А07.26.001 Брахитерапия при новообразованиях глаза с использованием радиоактивного офтальмоаппликатора
Визометрия
A02.26.004 Визометрия
Гамма-терапия
A07.01.004 Дистанционная гамма-терапия при новообразованиях кожи
Гипофракционированная лучевая терапия
A07.30.025 Дистанционная лучевая терапия при поражении мягких тканей
Гониоскопия
A03.26.002 Гониоскопия
Диафаноскопия
A02.26.021 Диафаноскопия глаза
Дистанционная лучевая терапия электронным или фотонным пучком
A07.30.025 Дистанционная лучевая терапия при поражении мягких тканей
Изолированная химиоперфузия печени (ИХП)
A11.12.008 Внутриартериальное введение лекарственных препаратов
Компьютерная томография (КТ) с внутривенным контрастом пораженной анатомической области
A06.08.007.004 Компьютерная томография придаточных пазух носа с внутривенным болюсным контрастированием
A06.08.009.002 Компьютерная томография шеи с внутривенным болюсным контрастированием
A06.09.005.002 Компьютерная томография органов грудной полости с внутривенным болюсным контрастированием
A06.30.005.002 Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием
A06.20.002.003 Компьютерная томография органов малого таза у женщин с контрастированием
A06.21.003.003 Компьютерная томография органов таза у мужчин с контрастированием
A06.23.004.002 Компьютерная томография мягких тканей головы контрастированием A06.23.004.006 Компьютерная томография головного мозга с внутривенным контрастированием
A06.12.050 Компьютерно-томографическая ангиография одной анатомической области
Компьютерная томография глазницы
A06.26.006 Компьютерная томография глазницы
A06.26.006.001 Компьютерная томография глазницы с внутривенным болюсным контрастированием
Компьютерная томография органов грудной клетки
A06.09.005 Компьютерная томография органов грудной полости
Лазерное лечение
А22.26.015 Термотерапия новообразований сетчатки, сосудистой оболочки глаза
А22.26.011 Лазерная деструкция новообразований сетчатки, век, конъюнктивы, сосудистой оболочки глаза
Магнитно-резонансная томография (МРТ) с внутривенным контрастом пораженной анатомической области
A05.01.002 Магнитно-резонансная томография мягких тканей A05.01.002.001 Магнитно-резонансная томография мягких тканей с контрастированием
A05.03.004 Магнитно-резонансная томография лицевого отдела черепа
A05.03.004.001 Магнитно-резонансная томография лицевого отдела черепа с внутривенным контрастированием
A05.30.005 Магнитно-резонансная томография органов брюшной полости
A05.30.005.001 Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием
A05.30.005.002 Магнитно-резонансная томография органов брюшной полости с внутривенным введением гепатотропного контрастного препарата
Магнитно-резонансная томография глазницы с контрастом (шаг 1 мм)
A05.26.008 Магнитно-резонансная томография глазницы
A05.26.008.001 Магнитно-резонансная томография глазниц с контрастированием
Медико-генетическое консультирование
B01.006.001 Прием (осмотр, консультация) врача-генетика первичный
B01.006.002 Прием (осмотр, консультация) врача-генетика повторный
A01.30.013 Сбор анамнеза и жалоб при генетическом консультировании
A01.30.014 Визуальное исследование при генетическом консультировании
A01.30.015 Составление родословной
Молекулярное профилирование опухоли
A27.05.059 Молекулярно-генетическое исследование мутаций в гене SF3B1 в крови
Оптическая когерентная томография (ОКТ)
A03.26.019.001 Оптическое исследование переднего отдела глаза с помощью компьютерного анализатора
A03.26.019.002 Оптическое исследование заднего отдела глаза с помощью компьютерного анализатора
А03.26.019 Оптическое исследование сетчатки с помощью компьютерного анализатора
Осмотр онколога
B01.027.001 Прием (осмотр, консультация) врача-онколога первичный
B01.027.002 Прием (осмотр, консультация) врача-онколога повторный
B04.027.001 Диспансерный прием (осмотр, консультация) врача-онколога
Осмотр офтальмолога
B01.029.001 Прием (осмотр, консультация) врача-офтальмолога первичный
B01.029.002 Прием (осмотр, консультация) врача-офтальмолога повторный
B04.029.001 Диспансерный прием (осмотр, консультация) врача-офтальмолога
B01.029.003 Прием (осмотр, консультация) врача-офтальмолога-протезиста первичный
B01.029.004 Прием (осмотр, консультация) врача-офтальмолога-протезиста повторный
B04.029.003 Диспансерный прием (осмотр, консультация) врача-офтальмолога-протезиста
Офтальмоскопия
A02.26.003 Офтальмоскопия
Прижизненное патолого-анатомическое исследование биопсийного материала
A10.30.001 Макроскопическое исследование удаленного операционного материала
A08.01.001 Патолого-анатомическое исследование биопсийного (операционного) материала кожи;
A08.01.001.002 Патолого-анатомическое исследование биопсийного (операционного) материала кожи с применением иммуногистохимических методов
Протонотерапия
A07.26.002.001 Дистанционная лучевая терапия новообразований глаза и его придаточного аппарата стереотаксическим методом пучками нейтронов, протонов и тяжелых ионов
A07.30.009.002 Конформная дистанционная лучевая терапия пучками нейтронов, протонов и тяжелых ионов
A07.30.056 Стереотаксически ориентированное дистанционное лучевое лечение с использованием медицинских специализированных ускорителей протонов
Радиочастотная абляция (РЧА)
A16.14.037.003 Чрескожная радиочастотная абляция опухолей печени под контролем ультразвукового исследования
A22.14.004 Абляция при новообразованиях печени
A22.14.004.001 Абляция радиочастотная при новообразованиях печени
A22.14.004.002 Электроабляция новообразований печени чрескожная
A22.14.004.003 Абляция при новообразованиях печени с использованием видеоэндоскопических технологий
A22.14.004.004 Чрескожная радиочастотная термоабляция опухолей печени с ультразвуковой и/или компьютерно-томографической навигацией
Склеропластика
A16.26.075Склеропластика
A16.26.075.001Склеропластика с использованием трансплантатов
Стереотаксическая лучевая терапия
A07.03.002.004 Дистанционная лучевая терапия при поражении костей стереотаксическая
A07.30.009.001 Конформная дистанционная лучевая терапия, в том числе IMRT, IGRT, ViMAT, стереотаксическая
A07.14.001 Дистанционная лучевая терапия при поражении печени и желчевыводящих путей
A07.14.001.003 Дистанционная лучевая терапия опухолей поджелудочной железы стереотаксическим методом пучками нейтронов, протонов и тяжелых ионов
A07.14.001.004 Дистанционная лучевая терапия опухолей желчевыводящих путей стереотаксическим методом пучками нейтронов, протонов и тяжелых ионов
Тонкоигольная аспирационная биопсия
A11.26.017 Тонкоигольная аспирационная биопсия при внутриглазных опухолях
A11.26.017.001 Тонкоигольная аспирационная биопсия опухоли орбиты
Тонометрия
A02.26.015 Офтальмотонометрия
Трансартериальная химиоэмболизация (ТАХЭ)
A16.14.044 Селективная эмболизация/химиоэмболизация ветвей воротной вены
A16.28.068 Селективная и суперселективная эмболизация/химиоэмболизация опухолевых сосудов
A16.12.051 Эндоваскулярная эмболизация сосудов
A16.12.051.002 Эндоваскулярная эмболизация сосудов микроэмболами
A16.12.051.006 Эндоваскулярная эмболизация сосудов при новообразованиях печени и желчевыводящих путей
A11.14.005 Эмболизация печени с использованием лекарственных препаратов
УЗИ регионарных лимфоузлов
A04.06.002 Ультразвуковое исследование лимфатических узлов (одна анатомическая зона)
Ультразвуковое исследование (УЗИ) глазного яблока и орбиты
A04.12.007 Ультразвуковая допплерография сосудов глаза
A04.26.002 Ультразвуковое исследование глазного яблока
A04.26.003 Ультразвуковое сканирование глазницы
Флюоресцентная ангиография глазного дна (ФАГ)
A03.26.006 Флюоресцентная ангиография глаза
Цитологического исследования опухолевого материала
A08.01.002 Цитологическое исследование микропрепарата кожи
Дисомия по хромосоме 3, Моносомия по хромосоме 3,
Дисомия по хромосоме 8,
Аберрации хромосомы 8
A08.30.035 Цитогенетическое исследование биопсийного (операционного) материала
B03.019.001 Молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом
Цифровая дерматоскопическая визуализация
A03.01.001 Осмотр кожи под увеличением (дерматоскопия)
A03.01.001.001 Конфокальная отражательная микроскопия кожи
Ээкзентерация орбиты
A16.26.107 Экзентерация глазницы
А16.26.107.001 Частичная экзентерация глазницы с сохранением век
Эктопротезирование
A16.26.126 Протезирование глазного яблока
Электронная терапия
A07.30.025.001 Дистанционная лучевая терапия при поражении мягких тканей на медицинских ускорителях электронов
Ээнуклеация
A16.26.098 Энуклеация глазного яблока
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
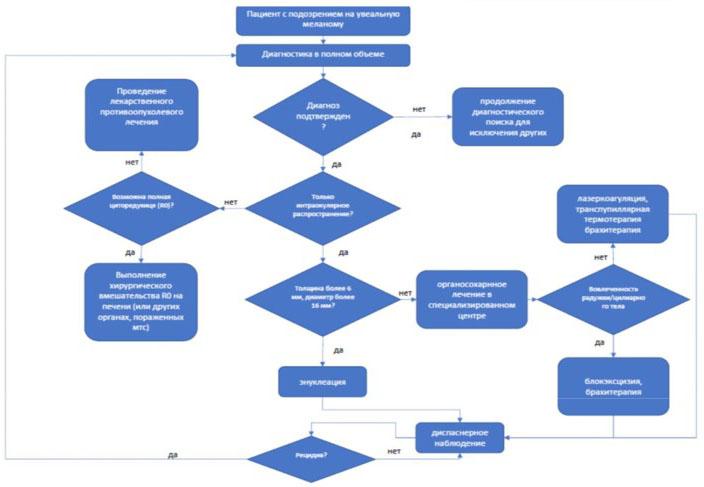
Рисунок 1 Схема диагностики и лечения пациентов
при интраокулярной форме УМ
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Рекомендации по самостоятельному осмотру кожи и первичной профилактике меланомы
Рекомендации после проведения локального лечения УМ.
- Необходимо пожизненное наблюдение врача-офтальмолога и врача-онколога.
- Взаимодействие пациента с лечащим врачом является важной составляющей помощи в процессе лечения.
- После проведения органосохраняющего лечения УМ исключена физическая нагрузка (занятия спортом, подъем тяжести более 5 кг) в течение первых 6 месяцев после операции.
- Пациент должен быть обучен самоконтролю зрительных функций (при сохранении зрения после лечения) и уметь оценить снижения зрения.
- При появлении отека век, покраснения глаза, снижении зрения, появлении болей в глазу незамедлительно обратиться к врачу-офтальмологу.
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (врачом-химиотерапевтом).
1. При повышении температуры тела до +38 °C и выше начать прием антибактериальных препаратов системного действия в соответствии с назначением врача-онколога.
2. При стоматите:
- диета - механическое, термическое щажение;
- часто (каждый час) полоскать полость рта отварами ромашки, коры дуба, шалфея, смазывать десна облепиховым (персиковым) маслом;
- обрабатывать полость рта по рекомендации врача-онколога.
3. При диарее:
- диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно употреблять нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- принимать лекарственные препараты в соответствии с назначением врача-онколога.
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
Информация для пациента, получающего терапию моноклональными антителами - блокаторами CTLA4 и/или PD1 (См. Термины и определения)
Своевременное взаимодействие с вашим лечащим врачом и медицинской сестрой по поводу состояния вашего здоровья является важной составляющей помощи медицинской команде в защите вас в процессе лечения настолько безопасно, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами CTLA4 и/или PD1 (См. Термины и определения), были выявлены и излечены в самом начале их проявлении, это поможет предотвратить их переход в более тяжелые степени.
Блокаторы CTLA4 и/или МКА-блокаторы PD1 (См. Термины и определения) разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом. Наиболее частые побочные эффекты, с которыми Вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей.
Побочные явления, которые могут появиться у вас, обычно возникают в первые 12 нед лечения, но могут появиться и позже.
Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами CTLA4 и/или PD1 (См. Термины и определения). Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые степени.
Если после лечения блокаторами CTLA4 и/или МКА-блокаторами PD1 (См. Термины и определения) у вас возникли симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные явления после терапии блокаторами CTLA4 и/или PD1:
- увеличение числа актов дефекации до 2 и более в день или любая диарея в ночное время, любой стул со слизью и кровью;
- боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства;
- красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
- желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи на солнце;
- вновь возникший кашель или одышка;
- усталость или сонливость;
- затрудненная концентрация внимания или спутанность сознания;
- головная боль, боль в теле или в месте опухоли;
- лихорадка (повышение температура тела до +38 °C);
- внезапное снижение или увеличение массы тела;
- вновь появившаяся эректильная дисфункция или потеря интереса к интимной жизни.
Пожалуйста, уделите особое внимание любым изменениям в актах дефекации. Записываете количество актов каждый день. Если у вас диарея, попробуйте ее описать, используя один из нижеприведенных терминов, и определите уровень срочности в вашем конкретном случае:
- стул неплотный;
- водянистый;
- болезненный;
- кровянистый;
- слизистый.
Диарея не всегда может проявляться в виде жидкого стула. Увеличение числа актов дефекации в день даже при твердом стуле потенциально может указывать на проблему.
Важно: побочные эффекты могут возникнуть в период от 1 нед до нескольких месяцев от начала лечения блокаторами CTLA4 и/или PD1 (См. Термины и определения). Если у вас возник любой из вышеназванных симптомов, незамедлительно сообщите об этом вашему лечащему врачу или медицинской сестре.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6): 649 - 655 [167]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.)
Содержание:
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
5
Пациент мертв
Ключ (интерпретация): приведен в самой шкале
Приложение Г2
ШКАЛА КАРНОВСКОГО
Название на русском языке: Шкала Карновского
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky D.A., Burchenal J.H.: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod C. New York: Columbia University Press; 1949: 191 - 205 [229]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.)
Содержание (шаблон):
Шкала Карновского
100 - Состояние нормальное, жалоб нет
90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 - Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 - Нуждается в значительной помощи и медицинском обслуживании
40 - Инвалид, нуждается в специальной помощи, в т.ч. медицинской
30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20 - Тяжелый больной. Необходимы госпитализация и активное лечение
10 - Умирающий
0 - Смерть
Ключ (интерпретация): приведен в самой шкале
Приложение Г3
КРИТЕРИИ ОЦЕНКИ ОТВЕТА ОПУХОЛИ НА ЛЕЧЕНИЕ (RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1)
Оригинальное название (если есть): Response evaluation criteria in solid tumors 1.1
Источник (официальный сайт разработчиков, публикация с валидацией):
Оригинальная публикация: Eisenhauer E.A,. Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M. et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J. Cancer 2009, 45(2): 228 - 247
Тип: шкала оценки
Назначение: оценка ответа на химиотерапевтическое лечение
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях N 46 ГБУЗ "Научно-практический центр медицинской радиологии" Департамента здравоохранения города Москвы [230]
Содержание:
1. Область применения: хотя настоящее руководство может быть применимо при проведении исследований злокачественных опухолей головного мозга, для данной нозологической категории также опубликованы отдельные критерии оценки ответа на лечение. Настоящий документ не предназначен для использования в исследованиях, касающихся злокачественных лимфом, поскольку для оценки ответа при лимфомах существуют международные руководства, опубликованные отдельно.
2. Следует также отметить, что в повседневной клинической практике онкологи нередко осуществляют мониторинг злокачественного процесса у пациентов посредством серии визуализирующих исследований и принимают решения о продолжении терапии на основании как объективных данных, так и клинической симптоматики. Руководство RECIST не предполагается в качестве обязательного инструмента для поддержки таких решений, за исключением случаев, когда лечащий врач сочтет его применение целесообразным.
3. Оценка измеримости опухолевого процесса до начала лекарственного лечения
3.1. Определения
Исходно (до начала терапии) опухолевые очаги и/или лимфатические узлы классифицируются как измеряемые либо неизмеряемые по следующим критериям:
3.1.1. Измеряемые поражения
Опухолевые очаги: подлежат точному измерению по крайней мере в одном измерении (необходимо фиксировать наибольший диаметр в плоскости измерения), при этом минимальный размер должен составлять:
- 10 мм по данным КТ (при толщине среза не более 5 мм);
- 10 мм при измерении штангенциркулем во время клинического осмотра (если точное измерение невозможно - очаг считается неизмеряемым);
- 20 мм по рентгенограмме органов грудной клетки.
Метастатически измененные лимфатические узлы: признаются патологически увеличенными и измеряемыми, если их короткая ось составляет 15 мм и более (по данным КТ при толщине среза не более 5 мм). До лечения и в дальнейшем следует измерять и отслеживать только короткую ось узла.
3.1.2. Неизмеряемые поражения
К таковым относятся:
- Очаги с наибольшим диаметром менее 10 мм;
- Лимфатические узлы с короткой осью от 10 до < 15 мм;
- Очаги, объективно не поддающиеся измерению, в том числе:
- лептоменингеальный карциноматоз;
- асцит;
- плевральный или перикардиальный выпот;
- воспалительный рак молочной железы;
- лимфангит легких или кожи;
- абдоминальные массы или гепато-/спленомегалия, выявленные при физикальном осмотре, но не поддающиеся воспроизводимому визуализирующему измерению.
3.1.3. Особые соображения по измеримости очагов
3.1.3.1. Костные поражения:
Остеосцинтиграфия, ПЭТ или обычные рентгеновские снимки не считаются адекватными методами визуализации для измерения костных поражений. Однако они могут быть использованы для подтверждения наличия или исчезновения костных очагов.
Литические или смешанные литико-склеротические поражения, обладающие измеряемыми мягкотканными компонентами, которые могут быть оценены с помощью КТ или МРТ, могут считаться измеряемыми, если соответствуют критериям измеримости, изложенным выше.
Бластические костные поражения считаются неизмеряемыми.
3.1.3.2. Кистозные поражения:
Очаги, соответствующие признакам простых кист, по данным визуализации, не должны расцениваться как злокачественные и, соответственно, не подлежат классификации как измеряемые или неизмеряемые.
Так называемые "кистозные поражения", предполагаемые как кистозные метастазы, могут рассматриваться как измеряемые, если соответствуют установленным критериям. Однако при наличии других (некистозных) поражений предпочтение следует отдавать последним при выборе целевых очагов.
3.1.3.3. Поражения после локального лечения:
Опухолевые очаги, расположенные в ранее облученных зонах или в областях, подвергшихся иному локорегионарному воздействию, обычно не считаются измеряемыми, если только не продемонстрировано достоверное прогрессирование в данных очагах.
3.2. Спецификации по методам измерений
3.2.1. Измерение очагов
Все измерения должны фиксироваться в метрических единицах, предпочтительно с использованием штангенциркуля при клинической оценке.
Первичное обследование должно проводиться максимально приближенно к началу терапии, но не позднее, чем за 4 недели до старта лечения.
3.2.2. Метод оценки
Следует использовать один и тот же метод визуализации и одинаковую технику на всех этапах - как на исходном, так и при последующих контролях.
Оценка с применением визуализирующих методов предпочтительна, если только очаг не может быть визуализирован, но доступен для объективной клинической оценки.
- Клинически определяемые очаги: рассматриваются как измеряемые только в случае, если они поверхностны и имеют диаметр ![]() 10 мм при измерении штангенциркулем (например, кожные узлы). Рекомендуется фотодокументация с цветной фотографией и линейкой для определения размеров. Если очаг доступен как для клинической оценки, так и для визуализации, предпочтение следует отдавать визуализирующей методике, поскольку она более объективна и позволяет провести последующий аудит.
10 мм при измерении штангенциркулем (например, кожные узлы). Рекомендуется фотодокументация с цветной фотографией и линейкой для определения размеров. Если очаг доступен как для клинической оценки, так и для визуализации, предпочтение следует отдавать визуализирующей методике, поскольку она более объективна и позволяет провести последующий аудит.
- Рентгенография органов грудной клетки: предпочтение следует отдавать компьютерной томографии (КТ) перед рентгенографией, особенно в случаях, когда прогрессирование заболевания является важной конечной точкой. КТ обладает большей чувствительностью в выявлении новых очагов. Однако очаги, визуализируемые на рентгенограмме грудной клетки, могут считаться измеряемыми, если они четко определяются и окружены аэрированным легким.
- КТ и МРТ: КТ на текущий момент считается наиболее предпочтительным и воспроизводимым методом измерения очагов, выбранных для оценки ответа. Настоящее руководство определяет измеримость очагов на КТ, исходя из предположения, что толщина среза составляет не более 5 мм. В случаях, когда используется КТ срезом более 5 мм, минимальный размер измеряемого очага должен быть в два раза больше толщины среза. МРТ также допустима в отдельных ситуациях, особенно для обследования определенных областей тела.
- Ультразвуковое исследование (УЗИ): УЗИ не является надежным методом измерения размеров опухолевых очагов и не должно использоваться в качестве основного метода оценки. Ультразвуковые исследования невоспроизводимы в полном объеме при повторных оценках и зависят от оператора, что делает затруднительным получение сопоставимых данных при разных временных точках. При выявлении новых очагов на УЗИ во время исследования рекомендуется подтверждение данных КТ или МРТ. При наличии противопоказаний к КТ (например, опасения по поводу облучения) может рассматриваться МРТ как альтернатива.
- Эндоскопия, лапароскопия: Использование этих методов не рекомендуется для объективной оценки опухоли. Однако они могут быть полезны в подтверждении полного патоморфологического ответа (например, при биопсии) или в установлении рецидива в исследованиях, где рецидив после полной резекции или ремиссии является конечной точкой.
- Опухолевые маркеры: Опухолевые маркеры не могут использоваться самостоятельно для определения объективного ответа опухоли. Если уровень маркеров изначально был выше нормы, их нормализация может свидетельствовать о полном ответе (CR). Поскольку маркеры являются специфичными для конкретных заболеваний, их использование должно быть четко описано в протоколах в зависимости от типа опухоли. Существуют отдельные рекомендации для CA-125 (рецидивирующий рак яичников) и ПСА (рецидивирующий рак простаты). Кроме того, Гинекологическая онкологическая группа разработала критерии прогрессирования по CA-125, которые интегрируются с объективной оценкой опухоли для использования в исследованиях первой линии при раке яичников.
- Цитология и гистология: Эти методы могут применяться для дифференциации между частичным и полным ответом, в редких случаях, если это предусмотрено протоколом (например, при опухолях яичка, где возможно наличие остаточной доброкачественной ткани). В случае появления или усиления экссудативных проявлений (например, плевральный выпот), цитологическое подтверждение злокачественного характера может использоваться для разграничения между стабильным состоянием/ответом и прогрессированием заболевания, если при этом достигнуты критерии ответа или стабилизации по измеряемым очагам.
4. Оценка общей опухолевой нагрузки и измеряемого заболевания
4.1. Для оценки объективного ответа на лечение или последующего прогрессирования необходимо определить общую опухолевую нагрузку на исходном этапе (до лечения), величина которой затем используется в качестве контрольной точки для всех последующих измерений.
4.2. Документация "целевых" и "нецелевых" очагов на исходном этапе
Если на исходном этапе выявлено несколько измеряемых очагов, следует выбрать не более пяти очагов в сумме, при этом не более двух очагов на один орган, чтобы они представляли все вовлеченные органы. Эти очаги считаются целевыми и подлежат фиксации и измерению на исходной визуализации. (Пример: если поражены один или два органа - будет выбрано, соответственно, максимум два или четыре очага.) Целевые очаги должны отбираться с учетом:
- их размера (наибольший диаметр),
- репрезентативности пораженных органов,
- и возможности для воспроизводимых повторных измерений.
Если самый крупный очаг не позволяет провести воспроизводимое измерение, следует выбрать следующий по размеру, но воспроизводимый очаг.
Особое внимание лимфатическим узлам:
Лимфоузлы - это нормальные анатомические структуры, которые могут визуализироваться даже при отсутствии метастатического поражения. Как указано в разделе 3, патологически измененные лимфоузлы, подлежащие оценке как целевые, должны иметь короткую ось ![]() 15 мм по данным КТ. Только короткая ось узла включается в расчет общей суммы измерений. Короткая ось - это наименьшее измерение из двух, зафиксированных в плоскости изображения (при КТ - чаще всего аксиальная плоскость; при МРТ - аксиальная, сагиттальная или корональная). Например, лимфоузел 20 x 30 мм (в аксиальной плоскости) имеет короткую ось 20 мм и считается измеряемым злокачественным узлом. Именно это значение - 20 мм - подлежит регистрации.
15 мм по данным КТ. Только короткая ось узла включается в расчет общей суммы измерений. Короткая ось - это наименьшее измерение из двух, зафиксированных в плоскости изображения (при КТ - чаще всего аксиальная плоскость; при МРТ - аксиальная, сагиттальная или корональная). Например, лимфоузел 20 x 30 мм (в аксиальной плоскости) имеет короткую ось 20 мм и считается измеряемым злокачественным узлом. Именно это значение - 20 мм - подлежит регистрации.
4.3. Критерии оценки ответа
4.3.1. Оценка целевых очагов
4.3.2. Таблица Г3-1. Оценка целевых очагов
Категория
Критерии
Полный ответ (ПО)
Исчезновение всех целевых очагов. Все патологические лимфоузлы (в том числе нецелевые) должны уменьшиться до короткой оси менее 10 мм.
Частичный ответ (ЧО)
Уменьшение суммы диаметров целевых очагов минимум на 30% по сравнению с исходной суммой.
Прогрессирование заболевания (ПР)
Увеличение суммы диаметров целевых очагов минимум на 20% по сравнению с минимальной зафиксированной суммой на исследовании (включая исходную, если она минимальна), и увеличение хотя бы на 5 мм в абсолютном выражении. Также появление одного или более новых очагов считается прогрессированием.
Стабильное заболевание (СТ)
Не соответствует критериям ни для ПО, ни для ПР (то есть недостаточное уменьшение и недостаточное увеличение).
4.3.2. Особые примечания по оценке целевых очагов
- Лимфатические узлы: даже если лимфоузлы регрессировали до < 10 мм (норма), их фактическое значение короткой оси следует фиксировать при каждом обследовании, даже при достижении полного ответа. Поэтому суммарное измерение может не равняться нулю даже при наличии CR.
- Очаги, ставшие "слишком маленькими для измерения": если очаг визуализируется, но радиолог не может точно измерить его размер, следует:
- поставить 0 мм, если, по мнению радиолога, очаг исчез;
- поставить 5 мм, если очаг "едва различим", но присутствует.
Это позволяет избежать ложных заключений об ответе или прогрессировании.
- Слияние или фрагментация очагов:
- При фрагментации: суммируются длины всех видимых частей.
- При слиянии: измеряется наибольший диаметр объединенного очага.
4.3.3. Оценка нецелевых очагов
Таблица Г3-2. Оценка нецелевых очагов
Категория
Критерии
Полный ответ (ПО)
Исчезновение всех нецелевых очагов и нормализация уровня опухолевых маркеров. Все лимфоузлы - <10 мм по короткой оси.
Не ПО/не ПР
Сохраняются один или несколько нецелевых очагов и/или уровень маркеров остается повышенным.
Прогрессирование (ПР)
Недвусмысленное прогрессирование существующих нецелевых очагов. Также появление новых очагов считается прогрессом.
4.3.4. Примечания по прогрессированию нецелевых очагов
- Если у пациента также есть измеряемые очаги, то прогрессирование по нецелевым очагам считается достоверным, только если есть значительное ухудшение общего состояния, даже при наличии ЧО или СТ в целевых очагах.
- Если у пациента только нецелевые очаги, прогресс считается "достоверным", если степень ухудшения сопоставима с увеличением опухолевого объема на 73% (эквивалент 20% увеличения диаметра).
4.3.5. Новые очаги
- Появление новых злокачественных очагов свидетельствует о прогрессировании.
- Очаг должен быть недвусмысленно новым - важно исключить артефакты, изменение методики, или естественные изменения (например, некроз в ответ на терапию).
- Если очаг обнаружен в области, не охваченной исходной визуализацией, он считается новым.
- При сомнительных находках - лечение может продолжаться до следующей оценки для подтверждения.
Наилучший общий ответ - это наиболее выраженный ответ на лечение, зафиксированный с начала терапии и до ее окончания, с учетом необходимости подтверждения (если это предусмотрено протоколом).
Иногда ответ может быть зафиксирован уже после завершения терапии, поэтому протокол должен четко указывать, учитываются ли такие постлечебные оценки при определении наилучшего ответа.
Если до прогрессирования у пациента начинается новая терапия, протокол также должен содержать указания, влияет ли это на классификацию ответа.
Оценка наилучшего ответа должна учитывать:
- изменения целевых и нецелевых очагов,
- появление новых очагов,
- необходимость подтверждения ответа (см. раздел 4.6).
Таблица Г3-3. Ответ на лечение в определенную временную точку: пациенты с целевыми (![]() нецелевыми) очагами
нецелевыми) очагами
Целевые очаги
Нецелевые очаги
Новые очаги
Общий ответ
ПО
ПО
Нет
ПО
ПО
Не ПО/не ПР
Нет
ЧО
ПО
Не оценен
Нет
ЧО
ЧО
ПО
Нет
ЧО
ЧО
Не ПР или не все очаги оценены
Нет
ЧО
СТ
Не ПР или не все очаги оценены
Нет
СТ
Не все оценены
Не ПР
Нет
NE (неоценимо)
ПР
Любые
Есть или нет
ПР
Любые
ПР
Есть или нет
ПР
Любые
Любые
Да
ПР
Обозначения:
- ПО - Полный ответ (Complete Response)
- ЧО - Частичный ответ (Partial Response)
- СТ - Стабильное заболевание (Stable Disease)
- ПР - Прогрессирование заболевания (Progressive Disease)
- NE - Не оценен (Not Evaluable)
