"Клинические рекомендации "Нодальные Т-клеточные лимфомы"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
НОДАЛЬНЫЕ Т-КЛЕТОЧНЫЕ ЛИМФОМЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C84.5, C84.6, C84.7, C84.9, C86.0, C86.5, C86.1
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 138_2
Возрастная категория: Взрослые, Дети
Специальность:
Разработчик клинической рекомендации
Ассоциация онкологов России, Национальное общество детских гематологов, онкологов, Российское общество онкогематологов, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АЛК - киназа анапластической лимфомы
ПТКЛн - периферическая Т-клеточная лимфома, неспецифицированная
АИТЛ - ангиоиммунобластная Т-клеточная лимфома
АККЛ - анапластическая крупноклеточная лимфома
ВОЗ - Всемирная Организация Здравоохранения
ИФТ - иммунофенотипирование
ПЭТ/КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией
ПТКЛ - периферические Т-клеточные лимфомы
18F-ФДГ - Флудезоксиглюкоза [18F]
СОЭ - скорость оседания эритроцитов
ХТ - химиотерапия
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
ECOG - оценка общего состояния пациента по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) - см. приложение Г1.
В-симптомы - неспецифические симптомы опухолевой интоксикации, включающие лихорадку выше 38 °C не менее трех дней подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Нодальные периферические Т-клеточные лимфомы (ПТКЛ) представляют довольно редкую группу лимфопролиферативных заболеваний, субстратом которых является зрелый (посттимический) активированный T-лимфоцит. Несмотря на различные патоморфологические и биологические особенности, нодальные Т-клеточные лимфомы за редким исключением представляют собой агрессивные заболевания с крайне неблагоприятным прогнозом [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология периферических нодальных Т-клеточных лимфом остается недостаточно изученной [2], однако некоторые нозологические формы напрямую связаны с обнаружением в крови и/или экспрессией на опухолевых клетках вируса Эптштейна-Барр [3] или человеческого Т-клеточного лимфотропного вируса I типа [4]. Также показано, что риск возникновения лимфом увеличивается при иммунодефицитных состояниях [5].
Патогенез развития Т-клеточных лимфом индивидуален в зависимости от нозологической принадлежности, наличия или отсутствия определенных хромосомных аномалий, реакции микроокружения опухоли, и включает в себя подавление иммунного ответа и ингибирование апоптоза через различные сигнальные пути [1].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Периферические Т-клеточные лимфомы диагностируются примерно в 10% случаев всех неходжкинских лимфом [6, 7]. В этой группе лимфом наиболее распространенным подтипом является периферическая Т-клеточная лимфома, неспецифицированная (ПТКЛн, 26%), ангиоиммунобластная Т-клеточная лимфома (АИТЛ, 19%), анапластическая крупноклеточная лимфома (АККЛ): позитивная по киназе анапластической лимфомы (АЛК-позитивная) (7%) и АЛК-негативная (6%). В детском возрасте встречается в основном АККЛ АЛК+ (примерно 13% от всех неходжкинских лимфом у пациентов до 18 лет) и ПТКЛн (1 - 2%).
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
- C84.5 Другие зрелые T/NK-клеточные лимфомы
Если Т-клеточное происхождение или вовлечение упоминается в связи со специфической лимфомой, следует кодировать более специфическое описание.
- C84.6 Анапластическая крупноклеточная лимфома, АЛК-положительная
- C84.7 Анапластическая крупноклеточная лимфома, АЛК-отрицательная
- C84.9 Зрелая T/NK-клеточная лимфома неуточненная
- C86.0 Экстранодальная NK/Т-клеточная лимфома, назальный тип
- C86.1 Печеночно-селезеночная (гепатолиенальная) Т-клеточная лимфома
- C86.5 Ангиоиммунобластная Т-клеточная лимфома
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В пересмотренной классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ 2022 г. нодальные ПТКЛ подразделяются на следующие нозологические варианты [8]:
- Нодальная Т-клеточная лимфома из фолликулярных хелперов:
- ангиоиммунобластный тип;
- фолликулярный тип;
- неспецифицированная
- Анапластическая крупноклеточная лимфома, АЛК-позитивная
- Анапластическая крупноклеточная лимфома, АЛК-негативная
- Анапластическая крупноклеточная лимфома, ассоциированная с грудными имплантами
Морфологическое и иммуногистохимическое описание различных вариантов ПТКЛ описано в разделе 7.2 данных рекомендаций.
Кроме определения варианта ПТКЛ, у каждого пациента нодальной ПТКЛ должна быть определена стадия заболевания согласно классификации Ann Arbor [9] (см. раздел 7.3 данных рекомендаций), а также группа риска согласно одной из прогностических моделей для ПТКЛ [10] (см. раздел 7.4 данных рекомендаций).
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Группа ПТКЛ гетерогенна, в связи с чем, помимо общей клинической картины (слабость, ночная потливость, повышение температуры тела, снижением массы тела), для некоторых нозологических форм специфичны определенные клинические признаки [7].
При ПТКЛн заболевание чаще манифестирует с увеличения лимфатических узлов любой локализации, вторично вовлекаются костный мозг, селезенка, экстранодальные ткани (кожа, желудочно-кишечный тракт, реже легкие, центральная нервная система), часто заболевание протекает с наличием В-симптомов.
Ангиоиммунобластный тип - заболевание, протекающее агрессивно, со стремительной манифестацией, выраженными общими симптомами, гепатоспленомегалией, генерализованной лимфаденопатией, поражением костного мозга, поликлональной гипергаммаглобулинемией, нередко с вовлечением серозных оболочек и картиной экссудативного плеврита, асцита, артритов. Клиническая картина и данные инструментальных исследований при других нодальных Т-клеточных лимфомах с Tfh-фенотипом неотличимы, однако заболевание первично возникает в лимфатических узлах, реже поражаются кожа и костный мозг [11].
При АККЛ АЛК+ поражаются как лимфатические узлы, так и экстранодальные области, такие как кожа, кости, мягкие ткани, легкие и печень. Вовлечение кишечника и ЦНС редки. Около 30% пациентов имеют поражение костного мозга, иногда выявляемое только с помощью ИГХ исследования трепанобиоптата или с применением молекулярно-генетического исследований (наличие транскрипта NPM-ALK). У большинства пациентов (около 70%) заболевание дебютирует с III - IV стадии с наличием периферической/абдоминальной лимфаденопатии, часто с вовлечением экстранодальных очагов и костного мозга. Большинство пациентов имеют общие симптомы, наиболее часто лихорадку.
При АККЛ АЛК- могут поражаться как лимфатические узлы, так и экстранодальные области, однако, вовлечение экстралимфатических тканей не такое частое, как при АККЛ АЛК+. У большинства пациентов заболевание манифестирует с III - IV стадии с периферической/абдоминальной лимфаденопатией, большинство пациентов имеют общие симптомы [12].
При АККЛ, ассоциированной с грудным имплантом опухолевые клетки могут локализоваться в послеоперационной сероме, или инфильтрируют фиброзную перикапсулярную ткань, при этом могут также вовлекаться локо-регионарные л/у, что и определяет клиническую картину заболевания. Около трети пациентов имеют увеличенные аксиллярные л/у, в редких случаях на момент установления диагноза болезнь имеет диссеминированный характер [13].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УРР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза/состояния: диагноз ПТКЛ устанавливается на основе патолого-анатомического исследований биопсийного материала с применением иммуногистохимических методов и формулируется в соответствии с пересмотренной классификацией опухолей гемопоэтической и лимфоидной тканей ВОЗ 2017 г. [1, 8].
2.1 Жалобы и анамнез
- Всем пациентам с подозрением на Т-клеточную лимфому, а также всем пациентам с верифицированной ПТКЛ на каждом врачебном приеме рекомендуется сбор анамнеза для оценки состояния пациента, а также для установления факторов, которые могут оказать влияние на определение лечебной тактики пациента [1, 2]. Всем пациентам до 18 лет с ПТКЛ рекомендуется прием (осмотр, консультация) врача-аллерголога-иммунолога первичный и при необходимости оценка иммунного статуса [55].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: при нодальных Т-клеточных лимфомах больной достаточно часто может предъявлять жалобы на общее недомогание, увеличение в размерах лимфатических узлов, ночную потливость, снижение массы тела, кожный зуд. Анамнез заболевания, как правило, краткосрочный (не более 6 месяцев).
Нодальные Т-клеточные лимфомы являются крайне редкими для пациентов младшего возраста, поэтому необходим прием (осмотр, консультация) врача-аллерголога-иммунолога первичный для диагностики возможно первичного иммунодефицитного состояния.
2.2 Физикальное обследование
- Всем пациентам с подозрением на ПТКЛ, или с выявленной ПТКЛ, при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической для уточнения распространенности заболевания и оценки состояния пациента по органам и системам [1, 2, 14]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: при осмотре необходимо оценить общее состояние пациента по шкале ECOG (см. приложение Г1), а также осмотреть кожные покровы, миндалины и полость рта; пальпация должна включать в себя пальпацию всех доступных групп периферических лимфатических узлов, печени, селезенки.
2.3 Лабораторные диагностические исследования
- Всем пациентам с подозрением на ПТКЛ или выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, и при подозрении на рецидив заболевания рекомендуется для уточнения состояния пациента, планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии выполнить следующие диагностические исследования [1]:
- общий (клинический) анализ крови развернутый с исследованием уровней общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов в крови, с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула), с исследованием уровня ретикулоцитов в крови, а также с исследованием скорости оседания эритроцитов;
- общий (клинический) анализ мочи;
- анализ крови биохимический общетерапевтический с определениями активностей лактатдегидрогеназы (ЛДГ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы в крови, исследованиями уровней мочевины, креатинина, альбумина, общего белка, общего билирубина, калия, натрия, общего кальция, хлоридов в крови, исследованием уровня бета-2-микроглобулина в крови (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
- Коагулограмма (ориентировочное исследование системы гемостаза) с включением следующих параметров: протромбин, Определение международного нормализованного отношения (МНО), Активированное частичное тромбопластиновое время (АЧТВ), Исследование уровня фибриногена в крови, Определение тромбинового времени в крови, Определение активности антитромбина III в крови I, Исследование уровня плазминогена в крови, Определение концентрации Д-димера в крови для отдельных показателей- для оценки необходимости профилакти ки ВТЭО [1, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: объем исследования включает в себя дифференциальный подсчет клеток крови с использованием автоматического анализатора; исследование морфологии эритроцитов, тромбоцитов, лейкоцитов по мазку, при необходимости - оптический подсчет количества тромбоцитов (по Фонио).
- Всем пациентам с ПТКЛ при наличии клинических или лабораторных признаков гемолиза перед проведением первой линии противоопухолевой терапии рекомендуется прямой антиглобулиновый тест (прямая проба Кумбса) для уточнения причины гемолиза [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем ранее не получавшим лечение пациентам с ПТКЛ перед проведением первой линии противоопухолевой терапии для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии рекомендуется [1]:
- определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактора);
- определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем ранее не получавшим лечение пациентам с ПТКЛ перед проведением первой линии противоопухолевой терапии рекомендуется для уточнения наличия сопутствующих инфекционных заболеваний и планирования необходимой сопутствующей терапии выполнение следующих исследований [1]:
- молекулярно-биологического исследования крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus);
- молекулярно-биологического исследования крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1).
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам с ПТКЛ младше 18 лет до начала противоопухолевой терапии, а также всем пациентам с ПТКЛ независимо от возраста, получающим или получавшим противоопухолевую терапию, после первого эпизода тяжелой инфекции рекомендуется определение иммунного статуса - исследования уровня иммуноглобулинов G, A и M в крови для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [1, 17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: если IgG < 4 г/л, клиническая ситуация расценивается как симптоматическая гипогаммаглобулинемия. В этих случаях показана заместительная терапия иммуноглобулинами (см. раздел "Сопутствующая и сопроводительная терапия)
- Пациентам старше 18 лет с верифицированной экстранодальной NK/Т-клеточной лимфомой перед началом и после завершения специфической терапии рекомендуется молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein-Barr virus) для возможности мониторирования количества копий с целью оценки эффективности проводимой терапии [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам старше 18 лет с верифицированной нодальной Т-клеточной лимфомой с Tfh-фенотипом, ангиоиммунобластный тип перед началом специфической терапии рекомендуется молекулярно-биологическое исследование на выявление мутаций G17V гена RHOA (количественное) в биоптате опухоли с целью верификации диагноза [18]
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
- Пациентам с подозрением на ПТКЛ рекомендуется выполнение молекулярно-генетического исследования биоптата опухоли для выявления клональной реаранжировки генов Т-клеточного рецептора по гамма цепи (при отрицательном результате - дополнительно исследование бэта-цепи ТКР) [19]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии - выполнение дифференциальной диагностики нодальных Т-клеточных лимфом с неопухолевыми заболеваниями, другими лимфопролиферациями может вызывать определенные сложности ввиду отсутствия характерных иммунофенотипических и цитогенетических характеристик при многих формах Т-клеточных лимфом. Выявление перестроек генов Т-клеточного рецептора является вспомогательным высокочувствительным методом диагностики.
- Пациентам до 18 лет с верифицированной АККЛ АЛК+ перед началом специфической терапии рекомендуется определение экспрессии мNPM-ALK (количественное) в периферической крови или костном мозге с целью определения прогноза заболевания [144]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии - выявление в крови транскрипта химерного гена NPM-ALK, который кодирует белок с активностью тирозинкиназы, запускающий злокачественную трансформацию, является одним из факторов риска, определяющим лечение и прогноз этих пациентов [144]
2.4 Инструментальные диагностические исследования
- Всем пациентам при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с противопоказаниями к КТ, либо при невозможности выполнения КТ, при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов выполнить следующие диагностические исследования [1]:
- прицельную рентгенографию органов грудной клетки в двух проекциях;
- ультразвуковое исследование лимфатических узлов и внутренних органов.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: при ультразвуковом исследовании необходимо оценить периферические лимфатические узлы, внутрибрюшные, забрюшинные узлы, органы брюшной полости и малого таза. Лимфоузлы диаметром менее 1 см считаются непораженными, лимфоузлы диаметром 1 - 2 см требуют динамического наблюдения в процессе терапии, лимфоузлы диаметром более 2 см считаются пораженными.
- Всем пациентам при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется при наличии возможности выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ/КТ) с туморотропными радиофармпрепаратами (РФП) или (хуже, при отсутствии технической возможности выполнить ПЭТ/КТ) позитронную эмиссионную томографию (ПЭТ) всего тела с туморотропными РФП для более точного стадирования заболевания и лучшей оценки эффекта на терапию [1, 20 - 22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: позитронная эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ/КТ), высокоинформативным методом диагностики. ПЭТ/КТ, выполненная до начала лечения, позволяет не только уточнить стадию, но и более точно определить локализацию очагов поражения, особенно экстранодальные вовлечения, которые могут плохо диагностироваться при КТ, что имеет существенное значение для последующей оценки эффекта терапии индукции и качественного планирования последующей лучевой терапии и минимизации облучения здоровых тканей. При наличии возможности выполнения ПЭТ/КТ, она может быть применена в соответствии с пересмотренными критериями оценки ответа, в первую очередь у больных с минимальным объемом опухоли, а также с учетом возможной коррекции лечения.
При наличии технической возможности ПЭТ/КТ должна оцениваться по шкале Deauville (см. приложение Г2).
- Всем пациентам с установленным диагнозом ПТКЛ, которым планируется лечение по поводу впервые установленного заболевания, либо по поводу рецидива, рекомендуется для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой, дыхательной и пищеварительной систем и для определения необходимости их профилактики или лечения рекомендуется выполнить следующие исследования [1]:
- регистрацию электрокардиограммы;
- эхокардиографию;
- эзофагогастродуоденоскопию;
- ультразвуковую допплерографию сосудов (артерий и вен) нижних конечностей [23, 26]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
2.5 Иные диагностические исследования
- Всем пациентам с подозрением на ПТКЛ, с подозрением на рецидив ПТКЛ, а также при неоднозначности трактовки противоопухолевого ответа после завершения лечения рекомендуется выполнить биопсию (взятие биопсийного материала) лимфатического узла либо другого очага поражения, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для верификации диагноза [1, 2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: выбор ткани и объем биопсии должны быть адекватны поставленной диагностической задаче.
- Для диагностики строго рекомендуется выполнять расширенную биопсию опухоли или эксцизионную биопсию лимфатического узла.
- Методика тонкоигольной биопсии, краевые биопсии лимфоузла/опухолевого образования не рекомендуется, так как редко позволяет получить диагностически значимый материал, в связи с чем может быть использована только при наличии труднодоступного для биопсии опухолевого очага (например, ЦНС), а также при высоком риске осложнений после хирургического вмешательства.
- Фрагментация материала крайне затрудняет его оценку.
- Материал для патолого-анатомического исследования должен быть помещен в фиксирующую среду как можно быстрее. Нельзя допускать высыхания материала.
- Соотношение объема фиксирующей среды к объему фиксируемого объекта не менее чем 10:1
- Время фиксации не должно быть менее 12 и более 48 часов.
Неадекватная (слабая или чрезмерная) фиксация приводит к изменению морфологических свойств ткани и артефициальным результатам ИГХ.
Гистологический материал должен сопровождаться направлением, содержащим информацию о пациенте, длительности и характере заболевания, локализации очага поражения, описании биопсии [24].
Диагностические полостные операции - торакоскопия/томия, лапароскопия/томия с биопсией внутригрудных, внутрибрюшных л/у или печени проводятся только при отсутствии увеличенных периферических лимфоузлов и невозможности верификации диагноза.
Гистологические и иммуногистохимические характеристики различных ПТКЛ, а также обязательные требования к патолого-анатомическому заключению представлены в разделе 7.1 данных рекомендаций. Описание морфологической и иммуногистохимической картины различных ПТКЛ представлено в разделе 7.2 данных рекомендаций
- Всем пациентам при подозрении или наличии подтвержденного диагноза ПТКЛ первично (для стадирования заболевания), после завершения терапии (для оценки противоопухолевого ответа), при подозрении на рецидив заболевания рекомендуется [1, 2]:
- получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма), а при повышении количества лимфоидных клеток, наличия атипичных лимфоцитов или клеток с бластной морфологией в костном мозге - исследование биологического материала (аспирата костного мозга) методом проточной цитофлуориметрии. У пациентов до 18 лет при инициальном поражении костного мозга контрольная пункция проводится после 1 курса терапии или далее, но только до достижения ремиссии
- получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: исследование костного мозга (аспират и трепанат) также рекомендуется при появлении клинически немотивированных цитопении и лихорадки (вне зависимости от наличия исходного поражения).
У детей костномозговая пункция или трепанобиопсия подвздошной кости должна обязательно проводиться под общей анестезией.
- Пациентам с верифицированной ПТКЛ с абсолютным лимфоцитозом в периферической крови при первичном обследовании рекомендуется иммунофенотипирование биологического материала (периферической крови) для дифференциальной диагностики с реактивным лимфоцитозом [25, 147, 163].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: выполнение иммунофенотипического исследования (ИФТ) обязательно при наличии лимфоцитоза в общем (клиническом) анализе крови (независимо от числа лейкоцитов), или в миелограмме, а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента.
- Пациентам с верифицированной ПТКЛ при первичном обследовании и планировании терапии рекомендуется в зависимости от сопутствующей патологии прием (осмотр, консультация) врача-кардиолога, врача-эндокринолога, врача-невропатолога, врача-инфекциониста и других врачей-специалистов первичный для определения необходимости терапии сопутствующих заболеваний [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с верифицированной ПТКЛ при первичном обследовании и планировании терапии рекомендуется оценить риск развития венозных тромбоэмболических осложнений (шкала оценки риска ВТЭО по Khorana - см. приложение Г3 данных рекомендаций) для выявления пациентов, требующих назначения и определения способов профилактики тромботических осложнений при проведении цитостатической терапии [15, 16, 26 - 28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем женщинам детородного возраста с впервые выявленной ПТКЛ, а также с рецидивом ПТКЛ, перед началом терапии рекомендуется выполнение комплекса исследований по определению беременности для коррекции терапевтической тактики и прием (осмотр, консультация) врача-акушера-гинеколога первичный в случае наличия беременности и желания женщины ее сохранить [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
При выборе тактики и проведении терапии следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Учитывая наличие неудовлетворенных медицинских потребностей (большое количество рецидивов, недостаточная эффективность и высокая токсичность существующих методов лечения), а также интенсивное изучение новых методов диагностики и лечения, рекомендуется участие пациентов в исследовательских проектах.
Каждый цикл терапии начинается, если состояние пациента удовлетворяет следующим критериям:
- гранулоциты > 1 x 109/л,
- тромбоциты > 100 x 109/л.
Для больных с цитопенией, обусловленной поражением костного мозга, специфическая терапия возможна и при более низких показателях лейкоцитов и тромбоцитов, однако в этих случаях должна быть обеспечена соответствующая сопроводительная терапия.
Пациент прекращает лечение по протоколу в случаях прогрессии заболевания или токсических эффектов, не позволяющих продолжать химиотерапию в необходимом объеме.
3.1 Первая линия терапии взрослых пациентов с периферическими Т-клеточными лимфомами
Пациентам с ПТКЛ (включая периферическую Т-клеточную лимфому неспецифицированную (ПТКЛн), нодальные Т-клеточные лимфомы с Tfh-фенотипом, системную анапластическую крупноклеточную лимфому АЛК-позитивную и АЛК-негативную, гепатолиенальную Т-клеточную лимфому), рекомендуется один из следующих режимов:
- Для пациентов моложе 65 лет и/или при отсутствии тяжелой сопутствующей патологии рекомендовано применение программ лечения BV-CHEP каждые 3 недели продолжительностью не более 6 циклов (см. приложение А3.1) [29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Для пациентов старше 65 лет и/или при наличии тяжелой сопутствующей патологии рекомендовано применение программы химиотерапии BV-CHP (см. приложение А3.1) [30].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Для пациентов младше 18 лет с ПТКЛН терапией выбора является CHOP (4 - 6 курсов) (см. приложение А3.1) с последующей аллоТГСК, т.к. как правило, эти дети имеют подлежащий первичный иммунодефицит. При инициальном уровне ЛДГ > 2N, рекомендовано проведение спинномозговых пункций на каждом блоке с введением метотрексата** в возрастной дозировке [146, 162, 163]. При наличии экспрессии CD30 на клетках опухоли возможно рассмотреть назначение #бренутксимаба ведотина** в дозе 1,4 - 1,8 мг/кг 1 раз в 21 день в/в [160]
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарий: согласно результатам проспективного рандомизированного исследования ECHELON-2 включение в состав системной химиотерапии #брентуксима ведотина** позволило достичь клинически значимого улучшения ВБП и ОВ по сравнению с режимом CHOP: ВБП: ОР 0,70 (95% ДИ: 0,53, 0,91); снижение риска события прогрессирования на 30%, ОВ: ОР 0,72 (95% ДИ: 0,53, 0,99); снижение риска смерти на 28%).
В нескольких сериях проспективных рандомизированных исследований, выполненных немецкой группой DSHNHL у пациентов старше 18 лет, продемонстрировано улучшение результатов лечения при добавлении этопозида** к курсам CHOP у пациентов моложе 60 лет, особенно с нормальным уровнем ЛДГ. Применение данного режима терапии позволило добиться более высокой частоты полных ремиссий (88% против 79% в группе, получавших лечение по схеме СНОР) и более высокой выживаемости без прогрессии (69% и 58% соответственно).
В связи с более высокой частотой развития фебрильной нейтропении при применении режима A-CHP по сравнению с режимом CHOP, при проведении терапии A-CHP необходимо осуществлять профилактику фебрильной нейтропении Г-КСФ.
Повышение вероятности нейрорецидива у пациентов с повышением активности ЛДГ привело к выводам о необходимости регионарной интратекальной терапии [146]
- Пациентам с ПТКЛ с I - II стадией старше 65 лет и/или с тяжелой коморбидностью рекомендовано проведение полихимиотерапии по схеме CHOP (см. приложение А3.1) [31, 161, 162].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: В ретроспективных клинических исследованиях показано, что применение стандартных режимов химиотерапии по программе CHOP-21/14 позволяет достичь 5-летней общей выживаемости и выживаемости без прогрессирования у 35% и 29% пациентов, соответственно, при этом показатели 5-летней ОВ выше у пациентов из группы с низким IPI по сравнению с высоким риском (66% и 22% соответственно).
Больные с впервые установленным диагнозом ПТКЛ старше 65 лет чаще всего не включаются в протокол высокодозной химиотерапии. Исследования, оценивающие роль антрациклинов и родственных соединений в лечении этой группы пациентов, остаются противоречивыми, но не позволяют на сегодняшний день исключить данную группу препаратов из терапии первой линии, в связи с чем режим CHOP остается терапией выбора. Добавление этопозида** не улучшает результаты лечения пожилых пациентов в связи с высокой токсичностью схемы СНОЕР.
- Пациентам 18 - 60 лет с ПТКЛ, достигшим ПР после индукционной терапии, рекомендовано проведение стимуляции гемопоэза с мобилизацией и последующим сбором гемопоэтических стволовых клеток (ГСК), после чего проведение высокодозной терапии одним из режимов кондиционирования (описание режимов - см. приложение А3.1.5) с последующей трансплантацией ГСК [33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам старше 18 лет с локализованными (I - II) стадиями ПТКЛ, у которых достигнута частичная ремиссия или более, которым не планируется аутоТГСК, после завершения индукционной терапии, рекомендовано проведение лучевой терапии на зоны исходного поражения 30 - 36 Гр (в случае достижения ПР после ХТ) или 40 - 50 Гр (в случае достижения ЧР после ХТ) с целью консолидации достигнутого противоопухолевого ответа [34, 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам старше 18 лет с нодальными Т-клеточными лимфомами с TFH-фенотипом, у которых после программы индукционной химиотерапии, был достигнут противоопухолевый ответ, вне зависимости от проведения ауто-ТГСК, рекомендовано проведение поддерживающей терапии в течение 1 года (метахромное применение метотрексата** или с применением иммуномодуляторов) [36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: Углубленное изучение патогенеза предположило гипотезу, что АИТЛ и МДС могут иметь единую клетку-предшественницу, и, как следствие, идентичные мутации, в том числе мутации TET2. Экстраполируя эти данные на практику, разрабатываются протоколы лечения с включением аналогов пиримидина (#азацитидин**), и подтверждается обоснованное применение поддерживающей терапии после завершения индукционного лечения.
С 2010 г. коллективом авторов НМИЦ гематологии впервые для лечения АИТЛ был использован и модернизирован протокол ОЛЛ-2009, успешно применяемый в клинике для лечения острых лимфобластных лейкозов. В отличие от СНОР-подобных курсов в основе протокола лежит принцип непрерывности и длительности противоопухолевого воздействия [18]. 5-летняя ОВ и БРВ составили 76% и 43% соответственно, максимальный срок наблюдения 8 лет. Одной из новых опций терапии АИТЛ в рамках проводимого протокола явилось применение поддерживающей терапии после завершения индукционной и консолидирующей программ. Поддерживающая терапия включала в себя применение малых доз метотрексата** или #леналидомида**. При анализе результатов лечения было отмечено положительное влияние поддерживающей терапии: 5-летняя ОВ и БСВ при ее выполнении составили 75% и 49% против 41% и 20% в случае ее отсутствия.
- Пациентам с впервые диагностированной гепатолиенальной Т-клеточной лимфомой при достижении ПР/ЧР рекомендована консультация в специализированном центре, проводящем трансплантацию аутологичных и аллогенных гемопоэтических стволовых клеток, для решения вопроса о возможности проведения аллогенной трансплантации костного мозга (при невозможности - ауто-ТГСК) У детей для достижения ремиссии используются блоки ICE и БФМ-ориентированный протокол для лечения ОЛЛ [37].
Комментарий: гепатолиенальная Т-клеточная лимфома - самая неблагоприятная форма Т-клеточных лимфом с медианой выживаемости менее 12 месяцев при невыполнении консолидации алло-ТКМ.
3.2 Первая линия терапии пациентов с экстранодальной NK/Т-клеточной лимфомой у взрослых и детей
- Ранее не получавшим лечение пациентам старше 18 лет с I - II стадиями экстранодальной NK/Т-клеточной лимфомы, назальный тип, рекомендовано проведение одного из следующих вариантов лечения [38]
- для пациентов категории "fit" рекомендовано проведение модифицированных курсов SMILE x 2 цикла или DDGP x 3 цикла с последующей ЛТ СОД 45 Гр или P-GEMOX x 2 курса с последующей ЛТ и после еще 2 - 4 курса P-GEMOX [39, 40].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- для пациентов категории "unfit" рекомендованы следующие режимы: одновременная химиолучевая терапия: ЛТ СОД 50 Гр и выполнение 3 курсов DeVIC (см. приложение А3.1) [41];
- либо ЛТ СОД 40 - 44 Гр и еженедельное введение #цисплатина** (30 мг/м2), с последующей консолидацией - 3 курса VIPD (см. приложение А3.1) [42];
- или последовательная химиолучевая терапия: ХТ по схеме VIPD с последующей ЛТ 36 - 44 Гр [43].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Ранее не получавшим лечение пациентам старше 18 лет с I - II стадиями экстранодальной NK/Т-клеточной лимфомы, назальный тип, при наличии противопоказаний к ХТ рекомендовано проведение ЛТ СОД 50-55 Гр. [38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Ранее не получавшим лечение пациентам старше и младше 18 лет с распространенными стадиями экстранодальной NK/Т-клеточной лимфомы, назальный тип, а также с неназальными формами экстранодальной NK/Т-клеточной лимфомы рекомендовано проведение химиотерапии с включением аспарагиназы** (4 - 6 курсов SMILE (старше и младше 18 лет), DDGP (старше и младше 18 лет), GELOX или P-GEMOX (старше 18 лет) или AspMetDex (старше 18 лет и преимущественно для пациентов категории "unfit" - см. приложение А3.1), +/- ЛТ 45 - 50 Гр с целью индукции ремиссии [38, 44 - 46, 154 - 155]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам 18 - 60 лет с неназальной или с распространенными стадиями назальной экстранодальной NK/Т-клеточной лимфомы, достигшим ПР после индукционной терапии, рекомендовано проведение стимуляции гемопоэза с мобилизацией и последующим сбором гемопоэтических стволовых клеток (ГСК), после чего проведение высокодозной терапии одним из режимов кондиционирования (описание режимов - см. приложение А3.1.5) с последующей трансплантацией ГСК [33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
3.3 Первая линия терапии пациентов с имплант-ассоциированной анапластической крупноклеточной лимфомой
- Пациентам старше 18 лет с имплант-ассоциированной анапластической крупноклеточной лимфомой, рекомендовано хирургическое удаление импланта вместе с окружающей имплант фиброзной капсулой и любым образованием, прилежащим к капсуле [47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам старше 18 лет с имплант-ассоциированной анапластической крупноклеточной лимфомой, в случае очагового поражения паренхимы молочной железы и/или вовлечения региональных лимфоузлов рекомендовано проведение химиотерапии преимущественно с включением брентуксимаб ведотина** (+CHP) (см. приложение А3.1) [47, 148].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: имплант-ассоциированная анапластическая крупноклеточная лимфома имеет индолентное течение и, как правило, характеризуется благоприятным прогнозом, поэтому агрессивные терапевтические подходы при этом заболевании не рекомендованы. В случае возникновения заболевания только в виде выпота вокруг молочной железы послеоперационное лекарственное лечение не требуется [47].
3.4 Первая линия терапии у пациентов с интестинальными Т-клеточными лимфомами
- Пациентам с впервые установленным диагнозом интестинальная Т-клеточная лимфома (Т-клеточная лимфома, ассоциированная с энтеропатией, мономорфный эпителиотропный тип интестинальной Т-клеточной лимфомы) в возрасте 18 - 65 лет без тяжелой сопутствующей патологии рекомендовано применение интенсивных программ химиотерапии (ЛБ-М-04, Hyper-CVAD), и в случае достижения противоопухолевого ответа, проведение ВХТ с трансплантацией аутологичных стволовых клеток крови с целью консолидации ремиссии [36, 48, 49].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5). - для Hyper-CVAD
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4). - для ЛБ-М-04
Комментарий: эскалация терапии с использованием высоких доз метотрексата** и трансплантации аутологичных гемопоэтических стволовых клеток (ауто-ТГСКК) продемонстрировала высокую эффективность - общая 5-летняя выживаемость достигла 60% [4, 23]. Таким образом, наиболее важными прогностическими факторами в данном случае являются соматический статус и возраст больного - факторы, позволяющие проводить высокодозную химиотерапию.
Хирургическое лечение неэффективно; оперативные вмешательства возможны при высоком риске обструкции, кровотечения или перфорации и в тоже время являются причиной задержки в начале адекватной полихимиотерапии, особенно в случаях послеоперационных инфекционных осложнений.
Из-за редкости заболевания крупных клинических исследований, посвященных терапии ИТКЛ, нет.
Проведение интенсивных программ терапии рекомендовано проводить в гематологических отделениях многопрофильных региональных/областных/районных стационаров, которые соответствуют современным стандартам оказания высокотехнологичных методов лечения и обеспечены адекватной трансфузионной, реанимационной, диализной и другими службами.
- Пациентам с впервые установленным диагнозом интестинальная Т-клеточная лимфома (Т-клеточная лимфома, ассоциированная с энтеропатией, мономорфный эпителиотропный тип интестинальной Т-клеточной лимфомы) в возрасте старше 60 лет и/или с тяжелой сопутствующей патологией рекомендовано применение программ лечения BV-CHEP каждые 3 недели продолжительностью не более 6 циклов (см. приложение А3.1) [29].
- Для пациентов старше 65 лет рекомендовано применение программы химиотерапии BV-CHP (см. приложение А3.1)
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: согласно результатам проспективного рандомизированного исследования ECHELON-2 включение в состав системной химиотерапии брентуксима ведотина** позволило достичь клинически значимого улучшения ВБП и ОВ по сравнению с режимом CHOP: ВБП: ОР 0,70 (95% ДИ: 0,53, 0,91); снижение риска события прогрессирования на 30%, ОВ: ОР 0,72 (95% ДИ: 0,53, 0,99); снижение риска смерти на 28%).
3.5 Первая линия терапии АККЛ АЛК+ у детей и подростков до 18 лет
- Пациентам до 18 лет с АККЛ АЛК+ без исходного поражения ЦНС рекомендовано проведение полихимиотерапии по протоколу ALCL99 - предфазу и 6 альтернирующих циклов А-В-А-В-А-В (см. приложение А3.1). При наличии факторов высокого риска - транскрипт NPM-ALK в крови, non-common гистологический вариант, плохой ответ после 1 блока терапии - к терапии добавляется АЛК-ингибитор (#кризотиниб** 165 мг/м/сут) [51, 145, 152 - 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: наличие остаточной опухоли после терапии в объеме менее 30% от исходной у детей до 18 лет не рассматривается как неудача и не подразумевает каких-либо модификаций лечения.
- Пациентам до 18 лет с первичной АЛК+ АККЛ с поражением ЦНС рекомендовано проведение лечения в соответствии с рекомендациями по лечению пациентов с агрессивными нефолликулярными В-клеточными лимфомами у детей с поражением ЦНС, без применения #ритуксимаба** [52] и лучевая терапия на головной мозг СОД 18 Гр.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
3.6 Лечение рецидивов ПТКЛ
- Пациентам старше 18 лет с рецидивами или рефрактерными формами ПТКЛ (включая ПТКЛн, нодальные Т-клеточные лимфомы с Tfh-фенотипом, системную анапластическую крупноклеточную лимфому АЛК-позитивную и АЛК-негативную (АККЛ), гепатолиенальную Т-клеточную лимфому, интестинальные Т-клеточные лимфомы) рекомендовано проведение терапии брентуксимабом ведотином** как впервые примененного, так и повторного назначения препарата, даже если последний был применен в первую линию лечения; возможно применение в монорежиме или в сочетании с режимом химиотерапии для лечения рецидивов (см. приложение А3.1) [53, 54].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: в рандомизированном проспективном ECHELON-2 при анализе эффективности было показано, что после терапии первой линии ответ на повторное лечение БВ** составил 59% в группе A+CHP, а ответ на первое лечение БВ** - 50% в группе CHOP.
- Пациентам с поздним (продолжительность ремиссии более 1 года) рецидивом АККЛ АЛК-позитивная рекомендована терапия #винбластином** [55] и #кризотинибом** [145, 152 - 153] (см. приложение А3.1).
- Пациентам до 18 лет с ранним (до 1 года) рецидивом АЛК+ АККЛ показана терапия второй линии - блоки CC, CVA с #кризотинибом** до 1 года [152].
- Пациентам до 18 лет с прогрессией на терапии показано проведение блоков CC, ICM, ICI с #кризотинибом** и ТГСК [152-153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам старше 18 лет с ранним рецидивом или прогрессией АККЛ АЛК-позитивной лимфомы показано проведение курсов терапии второй линии (как при других типах ПТКЛ) с добавлением # кризотиниба** [151].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с рецидивами или рефрактерными формами ПТКЛ моложе 65 лет без тяжелой коморбидности рекомендована консультация в специализированном центре, проводящем трансплантацию аутологичных и аллогенных гемопоэтических стволовых клеток, для решения вопроса о целесообразности и возможности проведения одной из этих двух процедур и о дальнейшей тактике ведения пациента [56 - 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: детям до 18 лет с ранними рецидивами АККЛ, после достижения ремиссии, показана только аллогенная ТГСК
- Пациентам старше 18 лет с рецидивами или рефрактерными формами ПТКЛ, за исключением пациентов, которым показана и может быть проведена терапия брентуксимабом ведотином**, рекомендуется проведение химиотерапии рецидива по одной из схем терапии второй линии на выбор лечащего врача либо (в случае планирования ауто- или алло-ТГСК) по рекомендации трансплантационного центра (описание режимов - см. приложение А3.1) [35]:
- ESHAP [64]
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- DHAP [65]
- GDP [66]
- ICE [67]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам старше 18 лет с рецидивами или рефрактерными формами ALK-позитивной АККЛ рекомендовано в качестве альтернативы цитостатической терапии применение селективного ингибитора ALK (#кризотиниб** 250 мг/м2 внутрь 2 раза в день до прогрессирования) [68, 145].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- При рецидивах и/или рефрактерном течении нодальных Т-клеточных лимфом с Tfh-фенотипом у пациентов старше 18 лет после системной терапии (в том числе, CHOP/CHOEP и брентуксимаба ведотина**) рекомендуется применение #леналидомида** 25 мг ежедневно 21 день 28-дневного цикла в монорежиме [69 - 71].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с рецидивами или рефрактерными формами экстранодальной NK/Т-клеточной лимфомы рекомендуется проведение химиотерапии рецидива по одной из схем терапии второй линии на основе #аспарагиназы** (4 - 6 курсов SMILE (старше и младше 18 лет), DDGP (старше и младше 18 лет), P-GEMOX (старше 18 лет) или AspMetDex (старше 18 лет) и преимущественно для пациентов категории "unfit" - см. приложение А3.1) [45, 46, 149, 150, 154 - 155].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4). - для схем AspMetDex, SMILE, DDGP
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5). - для схемы P-GEMOX
- Пациентам старше 18 лет с распространенными формами и не назальным типом экстранодальной NK/Т-клеточной лимфомы после неудач 2 линий терапии, включая режимы с #цисплатином** и #аспарагиназой**, а также с рецидивами или прогрессированием локальных форм экстранодальной NK/Т-клеточной лимфомы, назальный тип после лучевой и химиотерапии, рекомендуется применение #пембролизумаба** 2 мг/кг 1 раз в 3 недели или #ниволумаба** 40 мг 1 раз в 14 дней [72, 73].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
3.7 Оценка ответа на лечение
- Всем пациентам с ПТКЛ, после 3 циклов химиотерапии и после завершения всей программы лечения, рекомендуется оценка ответа на терапию в соответствии со стандартными критериями ответа на лечение лимфом (см. раздел 7.5 данных рекомендаций) [1, 74].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
3.8 Сопутствующая и сопроводительная терапия
- Пациентам с ПТКЛ с массивным опухолевым поражением рекомендуется профилактика гиперурикемии: #аллопуринол** 10 мг/кг/сут и инфузионная терапия 3 л/м2/сут с защелачиванием раствора натрия гидрокарбоната** 40 - 80 ммоль/л под контролем диуреза и плановым назначением "петлевых диуретиков", лабораторным контролем кислотно-основного состояния [75, 76, 151].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
- Пациентам с ПТКЛ на фоне приема глюкокортикоидов рекомендуется проведение профилактики язвенной болезни желудка и 12-перстной кишки [77].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1)
Комментарии: язва желудка или двенадцатиперстной кишки является одним из серьезных побочных эффектов терапии ГКС (включены в профилактику осложнений АТГ**). Механизм ульцерогенного действия ГКС заключается в повышении секреции соляной кислоты в желудке, изменении качественного состава слизи, торможении регенерации поверхностного эпителия. В связи с ульцерогенностью, при использовании ГКС необходимо проводить антисекреторную терапию с целью профилактики стероидных язв.
По результатам мета-анализа 300 работ [78], язвы желудка и двенадцатиперстной кишки рубцуются практически во всех случаях, если pH внутрижелудочного содержимого поддерживается более 3 в течение суток на протяжении 18 часов. С учетом указанного правила в качестве противоязвенной терапии в настоящее время могут рассматриваться антациды, блокаторы Н2-гистаминовых рецепторов и ингибиторы протонного насоса (ИПН). Согласно одному из последних мета-анализов, при использовании ИПН или блокаторов Н2-гистаминовых рецепторов достоверно эффективнее достигается рубцевание язвенного дефекта, а также снижается риск повторного кровотечения. Лишь препараты этих двух групп позволяют достигать и поддерживать необходимую pH-среду желудка, при которой происходит заживление гастродуоденальных язв.
В настоящее время с антисекреторной целью для профилактики язвенной болезни желудка и двенадцатиперстной кишки, в том числе на фоне терапии глюкокортикоидами, применяются два класса препаратов: ингибиторы протонного насоса и блокаторы Н2-гистаминовых рецепторов [79, 80].
- Пациентам c ПТКЛ, получающим противоопухолевую химио- или лучевую терапию, рекомендована для профилактики тошноты и рвоты применение противорвотных препаратов (блокаторы серотониновых 5НТ3-рецепторов А04АА по АТХ классификации), глюкокортикоиды (#дексаметазон** Н02АВ по АТХ классификации) [81 - 83].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: выбор метода профилактики тошноты и рвоты определяется эметогенностью режима терапии, индивидуальным порогом тошноты и рвоты, сопутствующими заболеваниями.
- Пациентам с ПТКЛ старше 18 лет при проведении курсов химиоиммунотерапии с высоким риском фебрильной нейтропении, превышающем 20%, или с промежуточным риском ФН 10 - 20% с наличием факторов риска (возраст 65 лет; тяжелые сопутствующие заболевания; почечная, печеночная недостаточность; гемоглобин менее 12 г/дл; недостаточное питание; длительная нейтропения или ФН в анамнезе; отсутствие антимикробной профилактики; ECOG ![]() 2; открытые раны или раневая инфекция; недавние обширные хирургические вмешательства; женский пол; химиолучевая терапия; цитопения вследствие опухолевого поражения костного мозга; ВИЧ инфекция) рекомендовано назначение колониестимулирующих факторов для снижения продолжительности и частоты возникновения нейтропении препаратами Г-КСФ группы L03AA по ATX классификации [84]
2; открытые раны или раневая инфекция; недавние обширные хирургические вмешательства; женский пол; химиолучевая терапия; цитопения вследствие опухолевого поражения костного мозга; ВИЧ инфекция) рекомендовано назначение колониестимулирующих факторов для снижения продолжительности и частоты возникновения нейтропении препаратами Г-КСФ группы L03AA по ATX классификации [84]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: профилактическое назначение гранулоцитарного колониестимулирующего фактора (Г-КСФ): филграстим** 5 мкг/кг подкожно (п/к) через 24 - 72 часа после окончания введения противоопухолевых препаратов и до восстановления нормального числа нейтрофилов после надира или пэгфилграстим в дозе 6 мг или эмпэгфилграстим** в дозе 7,5 мг подкожно, однократно, не менее чем через 24 часа после окончания введения противоопухолевых препаратов в соответствии с инструкцией по медицинскому применению с целью предупреждения развития и лечения нейтропении, вызванной цитотоксической химиотерапией опухолей.
- Пациентам с ПТКЛ старше 18 лет после зафиксированного ранее эпизода ФН, дозолимитирующей афебрильной нейтропении (после единственного эпизода удлинения интервалов между курсами и/или редукции дозы) рекомендована назначение колониестимулирующих факторов для снижения продолжительности и частоты возникновения нейтропении препаратами Г-КСФ группы L03AA по ATX классификации [84]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: назначение колониестимулирующих факторов для снижения продолжительности и частоты возникновения нейтропении: филграстим** 5 мкг/кг подкожно (п/к) через 24 - 72 часа после окончания введения противоопухолевых препаратов и до восстановления нормального числа нейтрофилов или пэгфилграстим в дозе 6 мг или эмпэгфилграстим** в дозе 7,5 мг подкожно, однократно, не менее чем через 24 часа после окончания введения противоопухолевых препаратов в соответствии с инструкцией по медицинскому применению для лечения нейтропении, вызванной цитотоксической химиотерапией опухолей.
- Пациентам с ПТКЛ на фоне проведения химиотерапии и в межкурсовых интервалах рекомендуется проведение профилактики пневмоцистной пневмонии [85].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: препаратом выбора для профилактики пневмоцистной пневмонии является ко-тримоксазол [сульфаметоксазол+триметоприм]**. Использование ко-тримоксазола [сульфаметоксазол+триметоприм]** ежедневно одновременно предупреждает инфекции, вызываемые Toxoplasma gondii, Listeria monocytogenes, Nocardia asteroides. Пациенты, инфицированные Pneumocystis jirovecii, не должны находиться в одной палате с другими иммунокомпрометированными пациентами.
- Пациентам c ПТКЛ старше 18 лет с планируемыми интенсивными режимами химиотерапии рекомендуется устанавливать центральный венозный катетер для проведения ХТ и сопроводительной терапии (см. раздел 7.11) [86].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с ПТКЛ и факторами риска тромботических осложнений с целью профилактики венозных тромбоэмболических осложнений рекомендуется применение антикоагулянтов (В01 по АТХ классификации), методов физического воздействия (компрессионный трикотаж, пневмомассаж конечностей) [87, 88].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам с ПТКЛ при проведении цитотоксической химиотерапии для профилактики водно-электролитных нарушений рекомендуется нутритивная поддержка [90, 91].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1)
- Для пациентов с ПТКЛ детородного возраста рекомендуется обсуждать вопрос о возможности криоконсервации спермы или ооцитов/эмбрионов перед началом терапии [92].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Для пациенток с ПТКЛ - девочек и молодых женщин, у которых планируется лучевая терапия на подвздошную область, рекомендуется рассмотрение вопроса о необходимости гомолатеральной овариопексии для защиты яичников [93].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: овариопексия особенно показана, если ожидаемая доза облучения на яичники составит более 5 Гр, так как при этом может возникнуть длительная дисфункция яичника. Этого можно избежать, если лучевая терапия проводится с противоположных полей в СОД 20 Гр и яичник находится, как минимум, на расстоянии 2 см от границы лучевой области.
При проведении овариопексии нить должна быть обязательно помечена клипсой. Процедура выполняется врачом-хирургом после консультации врача-радиолога до начала лучевой терапии на поддиафрагмальную область.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Пациентам с ПТКЛ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также, при необходимости, поддерживающая терапия [94].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: Специальных методов реабилитации при ПТКЛ не существует. Реабилитация пациентов с ПТКЛ должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия социальных работников и медицинских психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем.
Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Методов профилактики ПТКЛ в настоящее время не существует, поскольку неизвестны этиологические факторы, ведущие к развитию заболевания.
- Взрослым пациентам, завершившим лечение по поводу ПТКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога или врача-гематолога в течение первого года после завершения терапии каждые 3 месяца, 2-го года - каждые 6 месяцев, в дальнейшем - ежегодно, после 5 лет - каждые 2 года [1, 2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: диспансерное наблюдение должно включать тщательный сбор жалоб, физикальное обследование, прицельную рентгенографию органов грудной клетки в двух проекциях или КТ органов грудной полости, УЗИ брюшной полости (комплексное) и периферических лимфатических коллекторов. Для пациентов, получавших антрациклины и родственные соединения в сочетании с облучением средостения - исследование функции сердца (регистрация электрокардиограммы (ЭКГ) и эхокардиография (ЭхоКГ)) и легких (исследование неспровоцированных дыхательных объемов и потоков).
- Детям и подросткам, завершившим лечение по поводу ПТКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога/врача-детского онколога или врача-гематолога по графику, представленному в табл. 5.1, 5.2 и 5.3 [1, 95, 96].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий:
Таблица 5.1. График диспансерного наблюдения детей после завершения терапии по поводу ПТКЛ (время от окончания ЛТ)
Обследование
1-ый год
2-ой год
3-ий год
4-ый год
5-ый год
6-ой год
Клинический осмотр
4 - 8x
4 - 8x
4x
2x
2x
Индивидуально
Общий (клинический) анализ крови
4x
4x
2x
2x
2x
Исследование неспровоцированных дыхательных объемов и потоков
1x
Индивидуально
Ультразвуковое исследование периферических л/у, брюшной полости и малого таза (комплексное)
4x
4x
2x
2x
2x
Компьютерная томография органов грудной полости и зоны исходного поражения
2x
2 - 1x
1x
1x
1x
Исследование уровня тиреотропного гормона (ТТГ) в крови
1x
1x
1x
1x
1x
регистрация электрокардиограммы, эхокардиография
1x
1x
Таблица 5.2. Скрининг по кардиотоксическим эффектам
Функция сердца
Возраст
Облучение средостения
Доза антрациклинов и родственных соединений
ЭхоКГ
< 1 года
+
любая
раз в год
-
< 200 мг/м2
каждые 2 года
> 200 мг/м2
раз в год
1 - 4 лет
+
любая
раз в год
-
< 100 мг/м2
каждые 5 лет
100 - 300 мг/м2
каждые 2 года
> 300 мг/м2
раз в год
> 5 лет
+
< 300 мг/м2
каждые 2 года
> 300 мг/м2
раз в год
-
< 200 мг/м2
каждые 5 лет
200 - 300 мг/м2
каждые 2 года
> 300 мг/м2
раз в год
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю "гематология", "онкология" обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом/онгологом и иными врачами-специалистами в центре стационарной и амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента агрессивных В-клеточных лимфом или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический/онкологический кабинет, гематологическое/онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог/онколог амбулаторного или стационарного звена гематологической/онкологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь пациентам с гематологическими/онкологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении агрессивной лимфомы или подозрении на нее в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с гематологическими/онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами/онкологами в медицинских организациях, оказывающих медицинскую помощь пациентам с агрессивными лимфомами, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с агрессивными лимфомами, тактика медицинского обследования и лечения устанавливается врачами-гематологами/онкологами с привлечением при необходимости других врачей-специалистов, при необходимости - с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "гематология", "онкология" определяются врачом-гематологом/онкологам/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
1. Начало специфической терапии.
2. Плановое продолжение специфической терапии.
3. Диагностические процедуры, для проведения которых необходимы стационарные условия.
Показания для экстренной госпитализации:
1. Осложнения основного заболевания, требующие специфического лечения в условиях стационара.
2. Осложнения специфической терапии, угрожающие жизни больного и требующие соответствующего лечения в условиях стационара
Показания к выписке пациента из стационара:
1. Окончание специфической терапии (при отсутствии осложнений специфической терапии, угрожающих жизни больного).
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1 Общие требования к морфологической диагностике лимфом
Диагноз периферической Т-клеточной лимфомы устанавливают на основании морфологического и иммуногистохимического исследования биопсийного или операционного материала. В части случаев необходимо проведение молекулярно-биологических и генетических тестов: исследование Т-клеточной клональности по генам гамма (при необходимости бэта или дэльта) цепей Т-клеточного рецептора, исследование мутации G17V гена RHOA (особенно при дифференциальной диагностики с нодальными Tfh лимфомами, ангиоиммунобластный тип), мутации гена ТР53 (может влиять на прогноз и выбор терапии).
Необходимый объем исследований для диагностики различных вариантов нодальных Т-клеточных лимфом подробно представлен в руководстве "Алгоритмы диагностики и протоколы лечения заболеваний системы крови" под редакцией Е.Н. Паровичниковой 2024 г. [151]
7.2 Морфологическая и иммуногистохимическая диагностика ПТКЛ
Лимфома из [с иммунофенотипом] периферических Т-лимфоцитов, неуточненная
Лимфома из периферических Т-лимфоцитов, неуточненная (ПТКЛн) представляет собой группу неходжкинских лимфом различного гистологического строения, не обладающих специфическими признаками, которые позволили бы отнести эти опухоли к любой иной из форм Т-клеточных лимфом, перечисленных в классификации ВОЗ 2017 г. Эпитет "неуточненная" подчеркивает отсутствие специфических гистологических и иммунофенотипических характеристик. Гистологическое строение ПТКЛн и клеточный состав довольно разнообразны. В опухолевом пролиферате чаще всего преобладают клетки среднего и крупного размера с ядрами неправильной формы, хроматин бывает мелкодисперсным или гиперхромным, в крупных клетках заметны ядрышки. В части наблюдений основную массу составляют лимфоидные клетки мелкого размера. Гетерогенность пролиферата обусловлена, как правило, выраженным реактивным микроокружением (в том или ином количестве присутствуют эозинофильные гранулоциты, плазматические клетки, эпителиоидные гистиоциты).
В подавляющем большинстве случаев ПТКЛн имеет иммунофенотип CD4+/CD8-, варианты с CD4-/CD8+, CD4+/CD8+, CD4-/CD8- встречаются реже. Часто отмечается аберрантная утрата одного или нескольких пан-Т-клеточных антигенов (CD2, CD3, CD5, CD7). Может встречаться цитотоксический фенотип (TIA-1, перфорин, гранзим B). Обычно экспрессирован ![]() -рецепор Т-лимфоцитов (
-рецепор Т-лимфоцитов (![]() F1) в отличие от
F1) в отличие от ![]() Т-клеточных лимфом и NK-клеточных лимфом. В некоторых случаях часть опухолевых лимфоцитов экспрессирует CD30 (< 80%), исключительно редко в сопровождении CD15+, что может создать трудности дифференциальной диагностики с классической лимфомой Ходжкина, или анапластической крупноклеточной лимфомой, ALK+ или ALK- с коэкспрессией CD15 и CD30.
Т-клеточных лимфом и NK-клеточных лимфом. В некоторых случаях часть опухолевых лимфоцитов экспрессирует CD30 (< 80%), исключительно редко в сопровождении CD15+, что может создать трудности дифференциальной диагностики с классической лимфомой Ходжкина, или анапластической крупноклеточной лимфомой, ALK+ или ALK- с коэкспрессией CD15 и CD30.
С учетом особенностей гистоархитектоники, клеточного состава и иммунофенотипа опухолевых клеток выделяют варианты:
1. лимфоэпителиоидную лимфому (лимфома Леннерта) - в опухолевом пролиферате присутствуют многочисленные эпителиоидные гистиоциты, образующие кластеры, опухолевые Т-клетки обычно CD8+.
2. Первичную EBV+ нодальную Т- или NK-клеточную лимфому
В большинстве случаев гены Т-клеточных рецепторов клонально перестроены.
Ангиоиммунобластная Т-клеточная лимфома и другие лимфомы с фенотипом фолликулярных Т-хелперов
Неопухолевым аналогом ангиоиммунобластной Т-клеточной лимфомы (АИТЛ) считается субпопуляция Т-лимфоцитов с фенотипом Т-хелперов фолликулярного центра (TFH). Наряду с Т-клеточными антигенами они экспрессируют маркеры, характерные для В-лимфоцитов из центра размножения фолликулов - BCL6 и CD10. Биологическая роль TFH заключается в выработке хемокинов/рецепторов (CXCL13 и CXCR5), индуцирующих пролиферацию фолликулярных дендритических клеток и миграцию В-лимфоцитов в лимфатический узел за счет усиления их адгезии к эндотелию венул, что облегчает прохождение В-лимфоцитов через сосудистую стенку.
АИТЛ характеризуется полным или частичным стиранием рисунка строения лимфатического узла. Гистологическое строение АИТЛ представлено тремя морфологическимии вариантами. В первом варианте (ранняя стадия АИТЛ) опухолевые клетки окружают гиперплазированные фолликулы с хорошо сформированными центрами размножения, но часто без различимой зоны мантии. Во втором варианте (интерфолликулярный рост) сохраняются заметные остатки фолликулов с проявлениями регрессии, опухолевые клетки занимают паракортикальную зону, что приводит к ее расширению. Полное или почти полное стирание рисунка строения лимфатического узла в результате вытеснения опухолевым пролифератом фолликулов характерно для третьего (диффузного) варианта гистологического строения АИТЛ.
Опухолевый пролиферат имеет полиморфный характер и состоит из Т-клеток мелкого и среднего размера, обычно имеющих светлоокрашенную или оптически пустую цитоплазму с четкими границами. Опухолевые лимфоидные клетки малочисленны (< 10%) по сравнению с реактивным микроокружением: Т-клетками, эозинофильными гранулоцитами, гистиоцитами, плазматическими клетками, характерна пролиферация фолликулярных дендритических клеток (хорошо визуализируется с помощью антитела к CD21, иногда следует дополнительно использовать антитела к CD23 или CD35), встречаются малочисленные иммунобласты. Типичным гистологическим признаком является пролиферация посткапиллярных венул, которые образуют древовидную сеть.
Опухолевые клетки экспрессируют CD3, CD4, а также CD10, BCL-6, CD279 (PD-1), CXCL13, CD278 (ICOS), т.е. имеют иммунофенотип, характерный для TFH (необходима экспрессия минимум двух из пяти перечисленных маркеров TFH). Крупные активированные клетки с морфологией центробластов/иммунобластов, входящие в состав реактивного микроокружения опухоли, имеют В-клеточный фенотип и могут содержать вирус Эпштейна-Барр. В редких случаях эти клетки становятся источником трансформации в EBV-позитивную В-клеточную крупноклеточную лимфому.
Фолликулярная Т-клеточная лимфома характеризуется нодулярным/фолликулярным типом роста довольно однообразного пролиферата из лимфоидных клеток средних размеров, чем создает большое сходство с фолликулярными В-клеточными лимфомами. Другой вариант строения фолликулярной Т-клеточной лимфомы имеет сходство с прогрессивно трансформированными фолликулами в лимфатическом узле. Фенотип опухолевых лимфоцитов соответствует TFH: CD3, CD4, CD10, BCL-6, CD279 (PD-1), CXCL13, CD278 (ICOS). От АИТЛ отличается отсутствием как пролиферирующих венул с высоким эндотелием, так и развитой сети фолликулярных дендритических клеток за пределами фолликулов. Есть описания случаев с несколькими биопсиями, выполненными в разное время, где строение опухоли за время наблюдения меняется с фолликулярной Т-клеточной лимфомы на типичную АИТЛ и наоборот.
Часть лимфом, которые ранее считались лимфомами с иммунофенотипом периферических Т-лимфоцитов, неуточненными, имеют фенотип TFH и некоторые черты строения АИТЛ. В первую очередь это относится к росту опухолевого пролиферата в Т-зоне (морфологический эквивалент лимфомы Т-зоны), но без значительного неопухолевого реактивного компонента, разветвленных посткапиллярных венул и развитой сети фолликулярных дендритических клеток. Эти опухоли получили название лимфом с иммунофенотипом фолликулярных Т-хелперов и в классификации ВОЗ 2017 г. определены как самостоятельная клинико-морфологическая (нозологическая) форма.
Анапластическая крупноклеточная лимфома, ALK-позитивная
Анапластическая крупноклеточная лимфома (АККЛ), ALK-позитивная чаще всего образована крупными атипичными лимфоидными клетками с хорошо развитой цитоплазмой с перинуклеарным эозинофильным включением (в зоне Гольджи) и полиморфными ядрами, среди которых можно обнаружить бобовидные и подковообразные формы. Кроме "типичного" (common) варианта АККЛ, ALK+ из крупных клеток, встречаются лимфо-гистиоцитарный, мелкоклеточный, ходжкиноподобный (напоминающий лимфому Ходжкина с нодулярным склерозом), гипоклеточный (non-common) варианты. На ранних стадиях заболевания опухоль поражает лимфатический узел частично, нередко отмечается рост опухолевых клеток в краевом и промежуточных синусах.
Важнейшим критерием диагностики АККЛ, ALK+ является интенсивная экспрессия CD30 на мембране и в зоне Гольджи крупных опухолевых клеток. Мелкие опухолевые клетки могут экспрессировать CD30 слабее или даже быть негативными. В опухолевых клетках выявляется один или более Т-клеточных антигенов - CD2, CD3, CD4, CD5, CD7, CD8, хотя возможна утрата экспрессии части или даже всех этих антигенов. До 30 - 50% опухолей по данным иммуногистохимического исследования имеет "нулевой" фенотип. В клетках большинства АККЛ, ALK+ обнаруживается экспрессия EMA, CD25, CD43, цитотоксических молекул TIA-1, гранзима B и перфорина.
Экспрессия ALK происходит чаще всего в результате синтеза химерного белка ALK-NPM - продукта химерного гена, который образуется в результате транслокации участков хромосом 2 и 5. Локус р23 на хромосоме 2 кодирует киназу анапластической лимфомы (ALK), а локус q35 5-й хромосомы содержит ген нуклеофосмина (NPM1), кодирующий кислый фосфопротеин, который локализуется в ядре и в зоне расположения ядрышковых организаторов. Транслокация t(2;5) чаще всего сопровождается экспрессией ALK-протеина в ядре и цитоплазме крупных опухолевых клеток и ядрах мелких клеток. При других вариантах транслокации, когда партнером ALK при образовании химерного гена становятся другие гены, а не NPM1, в иммуногистохимических реакциях чаще всего окрашивается только цитоплазма или реже - цитоплазматическая мембрана.
Анапластическая крупноклеточная лимфома, ALK-негативная
Этот клинико-морфологический вариант Т-клеточной CD30-позитивной лимфомы отличается от АККЛ, ALK+ генетическими аномалиями, которые не затрагивают ген ALK, и отсутствием по этой причине экспрессии химерного ALK-протеина. Морфологическое строение и иммунофенотипические характеристики АККЛ, ALK+ и АККЛ, ALK- практически одинаковы. В классификации ВОЗ 2017 г. их считают самостоятельными нозологическими формами на основании существенных клинических отличий (медиана возраста пациентов с АККЛ, ALK- больше, клиническое течение более агрессивное). Некоторые генетические аномалии, встречающиеся в значительной части случаев АККЛ, ALK- (например, перестройки DUSP22 или TP63), никогда не обнаруживались при АККЛ, ALK+, хотя отмечены в некоторых случаях лимфомы из периферических Т-лимфоцитов, неуточненной. АККЛ, ALK- с перестройкой TP63 имеют плохой прогноз, в случаях с перестройкой DUSP22 прогноз хороший, а при отсутствии этих перестроек прогноз промежуточный.
Экстранодальная NK/Т-клеточная лимфома, назальный тип
NK/Т-клеточная лимфома, назальный тип - опухоль, аналогом которой считают активированные NK-клетки или цитотоксические Т-лимфоциты. Название "назальный тип" обусловлено частой первичной локализацией опухоли в срединных структурах лицевого черепа. Опухоль также часто поражает кожу, легкие, тонкую кишку, почки. Лимфома характеризуется диффузным ростом, нередко в сочетании с ангиоцентрическим (инфильтрация сосудистой стенки) и ангиодеструктивным (разрушение сосудов) компонентами. Поражение кровеносных сосудов приводит к массивным ишемическим некрозам ткани опухоли. Эти морфологические особенности могут привести к ошибочной диагностике гранулематоза с полиангиитом. Опухоль характеризуется экспрессией CD2, CD3 (клон ![]() , цитоплазматическая), CD56+/-, TIA-1+, гранзим В+, перфорин+; отсутствует экспрессия CD4, CD5, CD8, CD16, CD57. Для опухоли типична ассоциация с вирусом Эпштейна-Барр. Обнаружение вируса методом гибридизации in situ (CISH EBER) в большинстве опухолевых клеток необходимо для диагноза этой лимфомы. Иммуногистохимическое исследование экспрессии антигена латентного мембранного протеина вируса Эпштейна-Барр LMP-1 недостаточно, поскольку в клетках NK/Т-клеточных лимфом назального типа этот белок обычно отсутствует.
, цитоплазматическая), CD56+/-, TIA-1+, гранзим В+, перфорин+; отсутствует экспрессия CD4, CD5, CD8, CD16, CD57. Для опухоли типична ассоциация с вирусом Эпштейна-Барр. Обнаружение вируса методом гибридизации in situ (CISH EBER) в большинстве опухолевых клеток необходимо для диагноза этой лимфомы. Иммуногистохимическое исследование экспрессии антигена латентного мембранного протеина вируса Эпштейна-Барр LMP-1 недостаточно, поскольку в клетках NK/Т-клеточных лимфом назального типа этот белок обычно отсутствует.
Т-клеточные лимфомы с преимущественным поражением кишечника
Категоризация Т-клеточных лимфом с преимущественным поражением тонкой кишки претерпела изменения в классификации ВОЗ 2017 г. Как самостоятельные нозологические формы в ней рассматриваются Т-клеточная лимфома, ассоциированная с энтеропатией (ЭАТЛ), и мономорфная эпителиотропная интестинальная Т-клеточная лимфома (МЭИТЛ). Последняя ранее обозначалась как ЭАТЛ 2-го типа.
ЭАТЛ - опухоль из интраэпителиальных Т-лимфоцитов с преимущественным поражением тонкой кишки. Она встречается у пациентов с целиакией, отличается агрессивным течением и плохим прогнозом. При макроскопическом исследовании обычно обнаруживаются многочисленные изъязвленные узлы и бляшки на слизистой оболочке кишки, стриктуры и реже - объемные экзофитные образования. Часто поражены брыжейка и лимфатические узлы в ней.
Гистологически ЭАТЛ представляет собой полиморфный пролиферат с большим количеством крупных клеток с округлыми или неправильной формы ядрами, часто везикулярного типа, и хорошо выраженными ядрышками. Цитоплазма опухолевых клеток довольно широкая, бледно окрашенная. Характерны ангиоцентрический и ангиоинвазивный рост и, как следствие, возникновение распространенных зон некроза, обнаруживается значительная примесь клеток реактивного происхождения (Т-клеток, гистиоцитов, эозинофильных лейкоцитов). Опухолевые лимфоидные клетки обычно CD3+, CD5-, CD7+, CD4-, CD8-/+, CD56- и CD103+, экспрессируют цитотоксические молекулы (TIA-1, гранзим B, перфорин). Варианты крупноклеточного строения почти всегда CD30+.
МЭИТЛ не имеет определенной связи с целиакией. Эта лимфома чаще поражает тощую кишку, чем подвздошную, может распространяться на желудок (5% случаев). Опухоль представляет собой мономорфный пролиферат из клеток мелких и средних размеров, с округлыми ядрами, содержащими конденсированный хроматин и незаметные ядрышки. Цитоплазма умеренно широкая, светлая. Фенотип характеризуется экспрессией CD3, CD8, CD56 и отсутствием CD5. Из цитотоксических молекул обнаруживается TIA-1, а гранзим B и перфорин выявляются непостоянно. Чувствительным и специфичным маркером с ядерной экспрессией в клетках МЭИТЛ является MATK.
Т-клеточные лимфомы желудочно-кишечного тракта, диагностические характеристики которых не соответствуют ЭАТЛ или МЭИТЛ, получили название "Т-клеточная интестинальная лимфома, неуточненная", с оговоркой, что это не определенная нозологическая форма, а диагностическое определение. Его применение может быть оправдано в некоторых ситуациях, например, когда биопсийный материал неадекватный или данные иммуногистохимического исследования неполные.
Индолентное Т-клеточное лимфопролиферативное заболевание желудочно-кишечного тракта - результат клональной пролиферации лимфоидных Т-клеток в слизистой оболочке желудочно-кишечного тракта, преимущественно - тонкой или толстой кишки (чаще). Лимфоидные клетки занимают собственную пластинку слизистой оболочки и подслизистую основу, но в эпителий не проникают. Лимфоидный инфильтрат чаще характеризуется иммунофенотипом: CD3+, CD8+, TIA+, гранзим B-, перфорин-. Течение процесса индолентное, но без ответа на цитостатическую терапию.
7.3 Стадирование нодальных ПТКЛ
Стадирование нодальных ПТКЛ осуществляется по результатам обследования в соответствии с критериями классификации Ann Arbor (табл. 7.3.1).
Таблица 7.3.1. Стадирование лимфом по Ann Arbor (модификация Лугано, 2014) [9]:
Стадия
Поражение лимфоузлов
Экстранодальное поражение
Стадия I
Вовлечение одного ЛУ или одной группы ЛУ
Локализованное поражение одного экстралимфатического органа или ткани без поражения ЛУ
Стадия II
Вовлечение ![]() 2 групп ЛУ по одну сторону диафрагмы
2 групп ЛУ по одну сторону диафрагмы
Стадия II bulky - стадия II с массивным поражением ЛУ
Локализованное поражение экстралимфатического органа или ткани + поражение регионарных ЛУ по одну сторону диафрагмы
Стадия III
Вовлечение ЛУ по обе стороны диафрагмы или вовлечение ЛУ выше диафрагмы с поражением селезенки
Стадия IV
Диффузное или диссеминированное поражение экстралимфатического органа или ткани с/без вовлечения ЛУ либо поражение экстранодального органа или ткани + поражение нерегионарных ЛУ
Комментарии: миндалины, кольцо Вальдейера, селезенка относятся к нодальным образованиям
Таблица 7.3.2 Стадирование имплант-ассоциированной анапластической крупноклеточной лимфомы.
TNM
Описание
T:
T1
Ограничен выпотом или слоем на просветной стороне капсулы
T2
Начальная стадия инфильтрации капсулы
T3
Пласты клеток, инфильтрирующие капсулу
T4
Инфильтрат выходит за пределы капсулы
N:
N0
Нет поражения лимфоузлов
N1
Поражение одного регионарного л/у
N2
Множественное поражение регионарных л/у
M:
M0
Нет распространения на другие органы и/или отдаленные локализации
M1
Распространение на другие органы и/или отдаленные локализации
Стадия
Описание
IA
T1N0M0
IB
T2N0M0
IC
T3N0M0
IIA
T4N0M0
IIB
T1 - 3N1M0
III
T4N1 - 2M0
IV
T0 - 4 N0 - 2 M1
7.4 Определение групп риска ПТКЛ
Для анализа индивидуального риска раннего прогрессирования у пациентов старше 18 лет используются международный прогностический индекс IPI и скорректированный по возрасту aaIPI (табл. 7.4.1) [97], которые не потеряли своего значения в условиях современных программ лечения. Также могут применяться предикативные модели, разработанные для периферических Т-клеточных лимфом и демонстрирующих зависимость прогноза от других факторов: вовлечения костного мозга (индекс PIT) [98], индекса пролиферативной активности опухоли - Ki-67 (индекс mPIT) [99].
Таблица 7.4.1. Прогностические индексы, применяемые у пациентов с ПТКЛ
Прогностический индекс
Факторы риска
Категория риска
IPI
- Возраст > 60 лет
- ECOG ![]() 2
2
- Повышение ЛДГ
- Стадия III - IV
- > 1 экстранодальной зоны поражения
Низкий (0 - 1 фактор)
Низкий промежуточный (2 фактора)
Высокий промежуточный (3 фактора)
Высокий (4 - 5 факторов)
aaIPI (для пациентов моложе 60 лет)
- ECOG ![]() 2
2
- Повышение ЛДГ
- Стадия III-IV
Низкий (0 факторов)
Низкий промежуточный (1 фактор)
Высокий промежуточный (2 фактора)
Высокий (3 фактора)
PIT (для ПТКЛн)
- Возраст > 60 лет
- ECOG ![]() 2
2
- Повышение ЛДГ
- Вовлечение костного мозга
Низкий (0 факторов)
Низкий промежуточный (1 фактор)
Высокий промежуточный (2 фактора)
Высокий (3 - 4 фактора)
mPIT
- Возраст > 60 лет
- ECOG ![]() 2
2
- Повышение ЛДГ
- Ki67 ![]() 80%
80%
Низкий (0 факторов)
Низкий промежуточный (1 фактор)
Высокий промежуточный (2 фактора)
Высокий (3 - 4 фактора)
К прогностическим факторам при отнесении к группе риска АЛК+ АККЛ у пациентов до 18 лет относятся: стадия (по Ann-Arbor), гистологический вариант (common или non-common), минимальная диссеминированная болезнь (NPM-ALK транскрип в крови или костном мозе до начала терапии)
7.5 Оценка ответа на лечение при лимфомах
Оценка ответа на лечение проводится в соответствии с обновленными критериями, предложенными Международной рабочей группой по лимфомам в 2007 году [74].
Полная ремиссия (ПР):
1. Полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
2. Размеры лимфатических узлов:
a. ![]() 1,5 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см
1,5 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см
b. ![]() 1,0 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5 - 1,1 см
1,0 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5 - 1,1 см
3. Печень, селезенка, если были увеличены до начала лечения, не пальпируются, по данным лучевых методов объемные образования в них не выявляются.
4. Костный мозг без признаков опухолевого поражения. Если результат морфологического исследования костного мозга неоднозначный, наличие или отсутствие поражения должно определяться иммуногистохимически.
Для ЛХ ПР считается подтвержденной, если достигнутый эффект сохраняется не менее 3 месяцев или констатируется дальнейшее улучшение.
Неуверенная полная ремиссия (ПРн) констатируется только у больных, которым не выполнялась ПЭТ-КТ для оценки эффекта:
1. Остаточные изменения, выявляемые только при помощи лучевых методов исследования (особенно это касается остаточных объемных образований в месте массивного опухолевого поражения, чаще всего в средостении), в случае сокращения опухоли более чем на 75% от исходных размеров по сумме двух наибольших ее диаметров. Эти остаточные изменения не должны увеличиваться в течение более чем 3 месяцев.
2. По другим показателям - соответствие критериям полной ремиссии.
Частичная ремиссия (ЧР):
1. Уменьшение суммы диаметров всех измеряемых очагов (лимфоузлов и/или очагов экстранодального поражения) не менее чем на 50%. Если размеры пораженных очагов менее 3 см по наибольшему диаметру, то 2 наибольших очага должны уменьшиться не менее, чем на 50% по наибольшему диаметру. При наличии более чем 6 очагов поражения более 3 см, достаточна оценка 6 наибольших очагов, доступных четкому измерению в двух перпендикулярных направлениях. При наличии медиастинальных и/или ретроперитонеальных очагов поражения, они обязательно должны учитываться при измерении.
2. Отсутствие новых очагов поражения, отсутствие признаков увеличения какого-либо из ранее диагностированных очагов поражения.
3. В случае исходного поражения костного мозга, статус костного мозга для определения ЧР не значим. Однако при сохранении поражения костного мозга в процессе и/или после завершения лечения, обязательно уточнение характеристики опухолевых клеток. Больные с исходным поражением костного мозга, у которых после завершения лечения клинически диагностируется ПР, но при этом сохраняется поражение костного мозга или костный мозг не может быть оценен, относятся к ЧР.
Стабилизация
Показатели опухоли не соответствуют ни критериям ПР или ЧР, ни критериям прогрессирования.
Рецидив (после ПР) или прогрессирование (после ЧР или стабилизации)
1. Появление новых очагов (увеличение лимфатических узлов или объемных образований экстранодальных локализаций) более 1,5 см в наибольшем измерении в процессе или после завершения лечения, вне зависимости от изменения размеров других очагов поражения.
2. Увеличение как минимум одного уже известного очага более чем на 25% от минимального. Для очагов менее 1 см в наибольшем измерении - увеличение до 1,5 см и более.
7.6 Особенности планирования дозы ЛТ на критические структуры при облучении пациентов с NK-Т клеточной лимфомой или неспецифицированной Т-лимфомой младше 18 лет [50, 157]
Костная система.
Радиочувствительность является наибольшей у детей младшего возраста (до 6 лет) и в препубертатном периоде (11 - 13 лет). Следует ограничивать дозу на ростовые пластинки трубчатых костей (не более 20 Гр). Несимметричное облучение осевого скелета может привести к кифозу или сколиозу, тогда как симметричное облучение приводит к уменьшению роста. Чтобы избежать развития сколиоза облучение позвоночника на всем протяжении PTV должно быть симметричным. Не допустимо создавать градиент дозы в телах позвонков более 20%.
Спинной мозг.
У детей до шести лет ЦНС проходит процесс созревания и поэтому она особенно радиочувствительна. Максимальная доза на шейный отдел спинного мозга не должна превышать 20 Гр. Следует избегать доз больше 30 Гр на спинной мозг, и индивидуальное планирование должно быть направлено на минимизацию дозы на спинной мозг без влияния на запланированную дозу в мишени.
Легкие.
Толерантность легких у детей малоизучена и, по-видимому, существенно не различается у взрослых и детей школьного возраста. Доза, указанная в данных рекомендациях (12 - 15 Гр) для тотального облучения легкого с малой вероятностью может привести к значительному ухудшению функции легких. Тем не менее, облучение всего легкого в дозе 12 Гр у детей младше 6 лет может привести к постоянному снижению жизненной емкости легких.
Сердце.
Нарушение функции миокарда и артерий может произойти после длительного латентного периода (20 лет и более) как отдаленное последствие радиационно-индуцированной пролиферации эндотелия. Нет четкой информации о влиянии возраста на момент облучения. Облучение сердца должно быть максимально сокращено, особенно в сочетании с применением кардиотоксических антрациклинов и родственных соединений, которые могут снизить общую толерантность сердца. Возможен фиброз и кальциноз клапанов вплоть до образования пороков. Таким образом, облучаемый объем сердца и доза на сердце должны быть сведены к минимуму. Не рекомендуется превышение дозы на сердце 30 Гр.
Молочные железы.
Поздних неблагоприятных детерминированных эффектов на полностью развитые молочные железы не следует ожидать. В то же время, неразвитые ювенильные молочные железы обладают высокой радиочувствительностью. После облучения неразвитой молочной железы в дозе от 5 до 10 Гр, может возникнуть гипоплазия или аплазия всей молочной железы или ее части в подростковом возрасте.
Почки.
Почки очень радиочувствительны. Нет четкой информации о влиянии возраста на момент облучения. Рекомендуемая толерантная доза облучения всей почки составляет 12 Гр. При облучении целого органа в данной дозе не ожидается никаких существенных долгосрочных неблагоприятных последствий. Частичное облучении почки (например, верхний левый полюс почки при облучении селезенки и ножки селезенки) в дозе 20 Гр или более может привести к фиброзу верхнего полюса почки и вызвать локальные функциональные нарушения.
Печень.
Рекомендуется рассматривать толерантную дозу для всего органа 15 Гр. Это относится и к лучевой терапии печени при диссеминированном заболевании органа. Частичное облучение печени (например, при лучевой терапии верхней части парааортальной области) в дозах 20 Гр и более, не приведет к клинически значимому снижению функции печени в целом.
Щитовидная железа.
У пациентов может развиться субклинический гипотиреоз после латентного периода 3 - 4 года или более после облучения органа в дозе 20 Гр или более. Субклинический гипотиреоз может разрешиться спонтанно и потребность проведения терапии в данном случае является спорной. Риск снижения функции щитовидной железы возрастает с увеличением дозы облучения до 30 Гр и может привести к клиническому гипотиреозу, который потребует проведения заместительной гормональной терапии.
Яички.
Яички являются наиболее радиочувствительным органом. Доза 1 - 2 Гр может привести к необратимому нарушению сперматогенеза. Поэтому яички должны быть защищены вовремя облучение подвздошной и/или паховой областей с помощью современных методик облучения или путем прямого экранирования.
Яичники.
После накопленной дозы 5 - 10 Гр в яичниках индуцируется гибель клеток ооцитов, что приводит к бесплодию. Эндокринная недостаточность возникает после достижения более высоких доз (около 10 - 15 Гр). В таких случаях может потребоваться заместительная гормональная терапия в зависимости от гормонального статуса в пубертатный период. Чтобы избежать нарушения функции яичников, по крайней мере один яичник должен быть защищен от действия в том числе и рассеянного излучения. Рекомендуется рассмотреть оперативное выведение яичников из полей предполагаемого облучения (овариопексия).
Вторичные опухоли
Лучевая терапия в детском возрасте увеличивает риск развития широкого спектра вторичных опухолей. Наиболее часто встречается рак молочной железы у женщин, которым в детском возрасте проводилась лучевая терапия на область средостения и подмышечные области. В связи с этим рекомендуется регулярное обследование молочных желез на выявление рака у женщин старше 25 лет или через 8 лет после проведения ЛТ. После облучения шейных лимфоузлов повышается риск развития опухолей, в т.ч. злокачественных, щитовидной железы.
7.7 Инфузионная и трансфузионная терапия у пациентов с нодальными Т-клеточными лимфомами
Показания к проведению и объем как инфузионной, так и трансфузионной терапиипри нодальных Т-клеточных лимфомах у взрослых подробно описаны в руководстве "Алгоритмы диагностики и протоколы лечения заболеваний системы крови" под редакцией Е.Н. Паровичниковой 2024 г. [89, 100, 151]
7.8 Протоколы выполнения аспирационного и биопсийного исследования костного мозга
Процедуры аспирационного и биопсийного исследования костного мозга являются рутинными и проводятся как в амбулаторных, так и в стационраных условиях. Показания/противопоказания к проведению и техника выполнения у взрослых больных подробно описана в руководстве "Алгоритмы диагностики и протоколы лечения заболеваний системы крови" под редакцией Е.Н. Паровичниковой 2024 г. [151] и ссылке [101 - 102].
7.9 Обеспечение сосудистого доступа
Обеспечение сосудистого доступа является неотъемлемой составляющей частью современной химиотерапии онкогематологических больных. Показания к катетеризации и техника выполнения, ее особенности у взрослых подробно описана в руководстве "Алгоритмы диагностики и протоколы лечения заболеваний системы крови" под редакцией Е.Н. Паровичниковой 2024 г. [151] и ссылках [103 - 121].
7.10 Лечение гематологического пациента в отделении реанимации и интенсивной терапии
У пациентов с гематологическими заболеваниями на этапах диагностики, лечения, наблюдения могут развиваться различные критические состояния вследствие разнообразных причин. Показания к переводу и принципы терапии у взрослых описаны в руководстве "Алгоритмы диагностики и протоколы лечения заболеваний системы крови" под редакцией Е.Н. Паровичниковой 2024 г. [151] и ссылках [122 - 131].
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения (да/нет)
1.
Пациенту с подозрением на ПТКЛ или с выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнен общий (клинический) анализ крови развернутый с исследованием уровней общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов в крови, с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула), с исследованием уровня ретикулоцитов в крови, а также с исследованием скорости оседания эритроцитов
Да/нет
2.
Пациенту с подозрением на ПТКЛ или с выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнен анализ крови биохимический общетерапевтический с определениями активностей лактатдегидрогеназы (ЛДГ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы в крови, исследованиями уровней мочевины, креатинина, альбумина, общего белка, общего билирубина, калия, натрия, общего кальция, хлоридов в крови, исследованием уровня бета-2-микроглобулина в крови
Да/нет
3.
Пациенту с подозрением на ПТКЛ или с выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнено исследование свертывающей системы крови (коагулограмма) с включением следующих параметров: протромбин, Определение международного нормализованного отношения (МНО), Активированное частичное тромбопластиновое время (АЧТВ), Исследование уровня фибриногена в крови, Определение тромбинового времени в крови, Определение активности антитромбина III в крови I, Исследование уровня плазминогена в крови, Определение концентрации Д-димера в крови
Да/нет
4.
Пациенту с верифицированной экстранодальной T/NK-клеточной лимфомой перед началом и после завершения специфической терапии выполнено молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein-Barr virus)
Да/нет
5.
Пациенту при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания выполнено КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) либо (при противопоказаниях против КТ или невозможности его выполнения) выполнены прицельная рентгенография органов грудной клетки в двух проекциях и ультразвуковое исследование лимфатических узлов и комплексное ультразвуковое исследование внутренних органов.
Да/нет
6.
Пациенту с подозрением на ПТКЛ, с подозрением на рецидив ПТКЛ, а также при неоднозначности трактовки противоопухолевого ответа после завершения лечения выполнена биопсия (взятие биопсийного материала) лимфатического узла либо другого очага поражения, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для верификации диагноза
Да/нет
7.
Пациенту при подозрении или наличии подтвержденного диагноза ПТКЛ первично, после завершения терапии, при подозрении на рецидив заболевания выполнены получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма), а также получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов.
Да/нет
Список литературы
1. Демина Е.А. et al. Общие принципы диагностики лимфом//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 9 - 27.
2. Тумян Г.С. et al. Нодальные Т-клеточные лимфомы//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 98 - 105
3. Dupuis J. et al. Prognostic significance of Epstein-Barr virus in nodal peripheral T-cell lymphoma, unspecified: A Groupe d'Etude des Lymphomes de l'Adulte (GELA) study//Blood. 2006. Vol. 108, N 13. P. 4163 - 4169.
4. Gon alves D.U. et al. Epidemiology, treatment, and prevention of human T-cell leukemia virus type 1-associated diseases//Clinical Microbiology Reviews. American Society for Microbiology, 2010. Vol. 23, N 3. P. 577 - 589.
5. Nijland M.L. et al. Clinicopathological characteristics of T-cell non-Hodgkin lymphoma arising in patients with immunodeficiencies: A single-center case series of 25 patients and a review of the literature//Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, N 3. P. 486 - 496.
6. Armitage J.O. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin's lymphoma//Blood. 1997. Vol. 89, N 11. P. 3909 - 3918.
7. Vose J.M., Neumann M., Harris M.E. International peripheral T-cell and natural killer/T-cell lymphoma study: Pathology findings and clinical outcomes international T-cell lymphoma project//J. Clin. Oncol. 2008. Vol. 26, N 25. P. 4124 - 4130.
8. Falini B., Lazzi S., Pileri S. A comparison of the International Consensus and 5th WHO classifications of T-cell lymphomas and histiocytic/dendritic cell tumours. Br J Haematol. 2023;203(3):369-383. DOI: 10.1111/bjh.18940.
9. Cheson B.D. et al. Recommendations for initial evaluation, staging, and response assessment of hodgkin and non-hodgkin lymphoma: The lugano classification//Journal of Clinical Oncology. American Society of Clinical Oncology, 2014. Vol. 32, N 27. P. 3059 - 3067.
10.  a G. et al. Comparison of four prognostic scores in peripheral T-cell lymphoma//Ann. Oncol. 2011. Vol. 22, N 2. P. 397 - 404.
a G. et al. Comparison of four prognostic scores in peripheral T-cell lymphoma//Ann. Oncol. 2011. Vol. 22, N 2. P. 397 - 404.
11. Dogan A., Attygalle A.D., Kyriakou C. Angioimmunoblastic T-cell lymphoma//British Journal of Haematology. 2003. Vol. 121, N 5. P. 681 - 691.
12. Savage K.J. et al. ALK - anaplastic large-cell lymphoma is clinically and immunophenotypically different from both ALK + ALCL and peripheral T-cell lymphoma, not otherwise specified: Report from the International Peripheral T-Cell Lymphoma Project//Blood. 2008. Vol. 111, N 12. P. 5496 - 5504.
13. Miranda R.N. et al. Breast implant-associated anaplastic large-cell lymphoma: Long-term follow-up of 60 patients//J. Clin. Oncol. American Society of Clinical Oncology, 2014. Vol. 32, N 2. P. 114 - 120.
14. Dreyling M. et al. ESMO Consensus conferences: guidelines on malignant lymphoma. part 2: marginal zone lymphoma, mantle cell lymphoma, peripheral T-cell lymphoma//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. Ann Oncol, 2013. Vol. 24, N 4. P. 857 - 877.
15. Lan Y, et al. Venous thromboembolic events in T-cell lymphoma patients: Incidence, risk factors and clinical features. Leuk Res. 2021 Apr;103:106537. doi: 10.1016/j.leukres.2021.106537. Epub 2021 Feb 15. PMID: 33631621.
16. Частота встречаемости венозных тромбозов у детей и подростков с первично диагностированными лимфомами/Д.А. Евстратов, Л.Х. Андержанова, А.В. Пшонкин [и др.]//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2021. - Т. 20, N 3. - С. 46 - 50. - DOI 10.24287/1726-1708-2021-20-3-46-50. - EDN YNZPZK.
17. Srivastava S., Wood P. Secondary antibody deficiency-causes and approach to diagnosis//Clin. Med. J. R. Coll. Physicians London. 2016.
18. Чернова, Н.Г. Ангиоиммунобластная Т-клеточная лимфома: клиника, диагностика, лечение: специальность 14.01.21 "Гематология и переливание крови": автореферат диссертации на соискание ученой степени доктора медицинских наук/Н.Г. Чернова. - Москва, 2020. - 51 с. - EDN EDWKFJ.
19. Boone E, et al. PCR GeneScan Analysis of Rearranged Immunoglobulin or T-Cell Receptor Genes for Clonality Diagnostics in Suspect Lymphoproliferations. Methods Mol Biol. 2025; 2865: 77-102. doi: 10.1007/978-1-0716-4188-0_4. PMID: 39424721.
20. Cottereau A.S. et al. Predictive value of PET response combined with baseline metabolic tumor volume in peripheral T-Cell lymphoma patients//J. Nucl. Med. Society of Nuclear Medicine Inc., 2018. Vol. 59, N 4. P. 589 - 595.
21. Pellegrini C. et al. Prognostic Value of Interim Positron Emission Tomography in Patients With Peripheral T-Cell Lymphoma//Oncologist. Alphamed Press, 2014. Vol. 19, N 7. P. 746 - 750.
22. Tomita N. et al. Post-therapy 18F-fluorodeoxyglucose positron emission tomography for predicting outcome in patients with peripheral T cell lymphoma//Ann. Hematol. Springer Verlag, 2015. Vol. 94, N 3. P. 431 - 436.
23. Fekri M.S., Zade M.K., Fatehi S. The association of deep vein thrombosis with cancer treatment modality: Chemotherapy or surgery?//Iran. Red Crescent Med. J. Kowsar Medical Publishing Company, 2014. Vol. 16, N 9.
24. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. КОСТА, Санкт-Петербург, 2006.
25. Hapgood G. et al. Flow Cytometric Characterization of 129 Cases of Peripheral T Cell Lymphoma Not Otherwise Specified (PTCL NOS) and Angioimmunoblastic T Cell Lymphoma (AITL)//Blood. American Society of Hematology, 2015. Vol. 126, N 23. P. 2667 - 2667.
26. Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО).//Флебология. 2015. Vol. 4, N 2. P. 3 - 52.
27. Кириенко А.И., Галстян Г.М., Савченко В.Г. Профилактика венозных тромбоэмболических осложнений при лимфопролиферативных заболеваниях//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 268 - 278.
28. Santi R.M. et al. Khorana score and histotype predicts incidence of early venous thromboembolism in Non-Hodgkin lymphomas: A Pooled-Data analysis of 12 clinical trials of fondazione italiana linfomi (FIL)//Thromb. Haemost. Schattauer GmbH, 2017. Vol. 117, N 8. P. 1615 - 1621.
29. Herrera, Alex & Zain, Jasmine & Savage, Kerry & Feldman, Tatyana & Brammer, Jonathan & Chen, Lu & Popplewell, Leslie & Budde, Lihua & Peters, Lacolle & Kurtzman, Yaira & Forman, Stephen & Rosen, Steven & Kwak, Larry & Iyer, Swaminathan. (2019). Preliminary Results from a Phase 2 Trial of Brentuximab Vedotin Plus Cyclophosphamide, Doxorubicin, Etoposide, and Prednisone (CHEP-BV) Followed By BV Consolidation in Patients with CD30-Positive Peripheral T-Cell Lymphomas. Blood. 134. 4023 - 4023. 10.1182/blood-2019-123166.
30. Horwitz S. et al. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial//Lancet (London, England). Lancet, 2019. Vol. 393, N 10168. P. 229 - 240.
31. Schmitz N. et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma: An analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group//Blood. American Society of Hematology, 2010. Vol. 116, N 18. P. 3418 - 3425.
32. Л.Г. Горенкова, и др. Промежуточные результаты проспективного рандомизированного сравнительного исследования эффективности программ NHL BFM-90 и СНОЕР у первичных пациентов с ALK-позитивной анапластической крупноклеточной лимфомой///Клиническая онкогематология. Фундаментальные исследования и клиническая практика. - 2020. - Т. 13, N 4. - С. 382 - 388. - DOI 10.21320/2500-2139-2020-13-4-382-388. - EDN ATXHWY.
33. Giulia P., Corradini P. Autologous Stem Cell Transplantation for T-Cell Lymphomas//Semin. Hematol. 2014. Vol. 51, N 1. P. 59 - 66.
34. Illidge T. et al. Modern radiation therapy for nodal non-hodgkin lymphoma - Target definition and dose guidelines from the international lymphoma radiation oncology group//International Journal of Radiation Oncology Biology Physics. Elsevier Inc., 2014. Vol. 89, N 1. P. 49 - 58.
35. Horwitz S.M. et al. T-Cell Lymphomas. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Version 1.2023. 2023.
36. Горенкова Л.Г., Мангасарова Я.К., Ковригина А.М., Кравченко С.К., Клебанова Е.Е., Багова М.О., Чабаева Ю.А., Марголин О.В., Звонков Е.Е. Как я лечу периферические Т-клеточные лимфомы. Гематология и трансфузиология. 2024; 69(1): 89 - 103. https://doi.org/10.35754/0234-5730-2024-69-1-89-103.
37. Klebaner D, Koura D, Tzachanis D, et al. Intensive induction therapy compared with CHOP for hepatosplenic T-cell lymphoma. Clin Lymphoma Myeloma Leuk 2020; 20: 431-437 e432.
38. Yamaguchi M., Suzuki R., Oguchi M. Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type//Blood. American Society of Hematology, 2018. Vol. 131, N 23. P. 2528 - 2540.
39. Bi XW, Xia Y, Zhang WW, et al. Radiotherapy and PGEMOX/GELOX regimen improved prognosis in elderly patients with early-stage extranodal NK/T-cell lymphoma. Ann Hematol 2015; 94: 1525 - 1533.
40. Wang X, Zhang L, Liu X, et al. Efficacy and survival in newly diagnosed advanced extranodal natural killer/T-cell lymphoma: A randomized, controlled, multicenter and open-labeled study with DDGP regimen versus SMILE regimen [abstract]. Blood 2019; 134: Abstract 463.
41. Yamaguchi M. et al. Phase I/II study of concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: Japan clinical oncology group study JCOG0211//J. Clin. Oncol. 2009. Vol. 27, N 33. P. 5594 - 5600.
42. Oh D. et al. Concurrent Chemoradiation Therapy Followed by Consolidation Chemotherapy for Localized Extranodal Natural Killer/T-Cell Lymphoma, Nasal Type//Int. J. Radiat. Oncol. Biol. Phys. Elsevier Inc., 2015. Vol. 93, N 3. P. 677 - 683.
43. Kim S.M. et al. Extra-nodal natural killer/T cell lymphoma in elderly patients: the impact of aging on clinical outcomes and treatment tolerability//Ann. Hematol. Springer Verlag, 2016. Vol. 95, N 4. P. 581 - 591.
44. Li Y.Y. et al. Radiotherapy improves survival in early stage extranodal natural killer/T cell lymphoma patients receiving asparaginase-based chemotherapy//Oncotarget. Impact Journals, LLC, 2017. Vol. 8, N 7. P. 11480.
45. Jaccard A. et al. Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study//Blood. 2011. Vol. 117, N 6. P. 1834 - 1839.
46. Kwong Y.L. et al. SMILE for natural killer/T-cell lymphoma: Analysis of safety and efficacy from the Asia Lymphoma Study Group//Blood. 2012. Vol. 120, N 15. P. 2973 - 2980.
47. Clemens M.W., Jacobsen E.D., Horwitz S.M. 2019 NCCN Consensus Guidelines on the Diagnosis and Treatment of Breast Implant-Associated Anaplastic Large Cell Lymphoma (BIA-ALCL)//Aesthetic Surg. J. 2019. Vol. 39, N Supplement_1. P. S3 - S13.
48. Sabatino A, Biagi F, Gobbi PG et al. How I treat enteropathy-associated T-cell lymphoma, Blood 2012; 119: 2458 - 2468.
49. Jantunen E, Boumendil A, Finel H et al. Autologous stem cell transplantation for enteropathy-associated T-cell lymphoma: a retrospective study by the EBMT. Blood 2013; 121: 2529 - 2532.
50. Yan Z, Yao S, Wang Z, Zhou W, Yao Z and Liu Y (2023) Treatment of extranodal NK/Tcell lymphoma: From past to future. Front. Immunol. 14: 1088685. doi: 10.3389/fimmu.2023.1088685.
51. Wrobel G. et al. Safety assessment of intensive induction therapy in childhood anaplastic large cell lymphoma: Report of the ALCL99 randomised trial//Pediatr. Blood Cancer. 2011. Vol. 56, N 7. P. 1071 - 1077.
52. Abla O. et al. Primary CNS lymphoma in children and adolescents: A descriptive analysis from the International Primary CNS Lymphoma Collaborative Group (IPCG)//Clin. Cancer Res. 2011. Vol. 17, N 2. P. 346 - 352.
53. Pro B. et al. Five-year results of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma//Blood. American Society of Hematology, 2017. Vol. 130, N 25. P. 2709 - 2717.
54. Heidegger S. et al. Combination therapy with brentuximab vedotin and cisplatin/cytarabine in a patient with primarily refractory anaplastic lymphoma kinase positive anaplastic large cell lymphoma//Onco. Targets. Ther. Dove Medical Press Ltd., 2014. Vol. 7. P. 1123 - 1127.
55.  et al. Single-drug vinblastine as salvage treatment for refractory or relapsed anaplastic large-cell lymphoma: A report from the french society of pediatric oncology//J. Clin. Oncol. 2009. Vol. 27, N 30. P. 5056 - 5061.
et al. Single-drug vinblastine as salvage treatment for refractory or relapsed anaplastic large-cell lymphoma: A report from the french society of pediatric oncology//J. Clin. Oncol. 2009. Vol. 27, N 30. P. 5056 - 5061.
56.  et al. High-dose chemotherapy and autologous stem cell transplantation in peripheral T-cell lymphoma: The GEL-TAMO experience//Ann. Oncol. 2003. Vol. 14, N 12. P. 1768 - 1775.
et al. High-dose chemotherapy and autologous stem cell transplantation in peripheral T-cell lymphoma: The GEL-TAMO experience//Ann. Oncol. 2003. Vol. 14, N 12. P. 1768 - 1775.
57. Song K.W. et al. Autologous stem cell transplant for relapsed and refractory peripheral T-cell lymphoma: Variable outcome according to pathological subtype//Br. J. Haematol. 2003. Vol. 120, N 6. P. 978 - 985.
58. Kewalramani T. et al. Autologous transplantation for relapsed or primary refractory peripheral T-cell lymphoma//British Journal of Haematology. 2006. Vol. 134, N 2. P. 202 - 207.
59. Chen A.I. et al. Long-Term Results Of Autologous Hematopoietic Cell Transplantation For Peripheral T Cell Lymphoma: The Stanford Experience//Biol. Blood Marrow Transplant. 2008. Vol. 14, N 7. P. 741 - 747.
60. Corradini P. et al. Graft-versus-lymphoma effect in relapsed peripheral T-cell non-Hodgkin's lymphomas after reduced-intensity conditioning followed by allogeneic transplantation of hematopoietic cells//J. Clin. Oncol. 2004. Vol. 22, N 11. P. 2172 - 2176
61. Le Gouill S. et al. Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: A study by the Soci t Fran aise de Greffe de Mo lle et de Th rapie Cellulaire//J. Clin. Oncol. 2008. Vol. 26, N 14. P. 2264 - 2271.
62. Kyriakou C. et al. Allogeneic stem cell transplantation is able to induce long-term remissions in angioimmunoblastic T-cell lymphoma: A retrospective study from the lymphoma working party of the European group for blood and marrow transplantation//J. Clin. Oncol. 2009. Vol. 27, N 24. P. 3951 - 3958.
63. Dodero A. et al. Allogeneic transplantation following a reduced-intensity conditioning regimen in relapsed/refractory peripheral T-cell lymphomas: Long-term remissions and response to donor lymphocyte infusions support the role of a graft-versus-lymphoma effect//Leukemia. 2012. Vol. 26, N 3. P. 520 - 526.
64. Velasquez W.S. et al. ESHAP - An effective chemotherapy regimen in refractory and relapsing lymphoma: A 4-year follow-up study//J. Clin. Oncol. American Society of Clinical Oncology, 1994. Vol. 12, N 6. P. 1169 - 1176.
65. Velasquez W.S. et al. Effective salvagae therapy for lymphoma with cisplatin in combination with high-dose ara-C and dexamethasone (DHAP)//Blood. 1988. Vol. 71, N 1. P. 117 - 122.
66. Park B.B. et al. Salvage chemotherapy of gemcitabine, dexamethasone, and cisplatin (GDP) for patients with relapsed or refractory peripheral T-cell lymphomas: a consortium for improving survival of lymphoma (CISL) trial//Ann. Hematol. Springer Verlag, 2015. Vol. 94, N 11. P. 1845 - 1851.
67. Hertzberg M.S. Outpatient-based ifosfamide, carboplatin and etoposide (ICE) chemotherapy in transplant-eligible patients with non-Hodgkin's lymphoma and Hodgkin's disease//Ann. Oncol. Oxford University Press (OUP), 2003. Vol. 14, N 90001. P. 11i - 16.
68. Passerini C.G. et al. Crizotinib in advanced, chemoresistant anaplastic lymphoma kinase-positive lymphoma patients//J. Natl. Cancer Inst. Oxford University Press, 2014. Vol. 106, N 2.
69. Morschhauser F. et al. A phase 2, multicentre, single-arm, open-label study to evaluate the safety and efficacy of single-agent lenalidomide (Revlimid) in subjects with relapsed or refractory peripheral T-cell non-Hodgkin lymphoma: the EXPECT trial//Eur. J. Cancer. Eur J Cancer, 2013. Vol. 49, N 13. P. 2869 - 2876.
70. Toumishey E. et al. Final report of a phase 2 clinical trial of lenalidomide monotherapy for patients with T-cell lymphoma//Cancer. Cancer, 2015. Vol. 121, N 5. P. 716 - 723.
71. Горенкова Л.Г. et al. Результаты применения леналидомида в протоколах лечения ангиоиммунобластной Т-клеточной лимфомы//Гематология и трансфузилогия. 2020. Vol. 65, N S1. P. 67.
72. Kwong Y.L. et al. PD1 blockade with pembrolizumab is highly effective in relapsed or refractory NK/T-cell lymphoma failing l-asparaginase//Blood. Blood, 2017. Vol. 129, N 17. P. 2437 - 2442.
73. Chan T.S.Y. et al. PD1 blockade with low-dose nivolumab in NK/T cell lymphoma failing L-asparaginase: efficacy and safety//Ann. Hematol. Ann Hematol, 2018. Vol. 97, N 1. P. 193 - 196.
74. Cheson B.D. et al. Revised response criteria for malignant lymphoma//Journal of Clinical Oncology. 2007. Vol. 25, N 5. P. 579 - 586.
75. Барях Е.А., Мякова Н.В., Поддубная И.В. Профилактика и лечение синдрома лизиса опухоли//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 251 - 253.
76. Барях Е.А. et al. Лейкоз/лимфома Беркитта: клинические особенности, диагностические критерии, терапевтическая тактика//Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2010. Vol. 3, N 2. P. 138 - 143.
77. Narum S., Westergren T., Klemp M. Corticosteroids and risk of gastrointestinal bleeding: A systematic review and meta-analysis//BMJ Open. 2014. Vol. 4, N 5. P. e004587.
78. Burget D.W., Chiverton S.G., Hunt R.H. Is there an optimal degree of acid suppression for healing of duodenal ulcers? A model of the relationship between ulcer healing and acid suppression//Gastroenterology. Gastroenterology, 1990. Vol. 99, N 2. P. 345 - 351.
79. Ивашкин В.Т. et al. Диагностика и лечение язвенной болезни у взрослых (Клинические рекомендации Российской гастроэнтерологической ассоциации, Российского общества колоректальных хирургов и Российского эндоскопического общества).//Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2020. Vol. 30, N 1. P. 49 - 70.
80. Scally B. et al. Effects of gastroprotectant drugs for the prevention and treatment of peptic ulcer disease and its complications: a meta-analysis of randomised trials//Lancet Gastroenterol. Hepatol. Elsevier Ltd, 2018. Vol. 3, N 4. P. 231 - 241.
81. Владимирова Л.Ю. et al. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных//Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 502 - 511.
82. Navari R.M., Gray S.E., Kerr A.C. Olanzapine versus aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a randomized phase III trial//J. Support. Oncol. J Support Oncol, 2011. Vol. 9, N 5. P. 188 - 195.
83. Navari R.M., Aapro M. Antiemetic Prophylaxis for Chemotherapy-Induced Nausea and Vomiting//N. Engl. J. Med. New England Journal of Medicine (NEJM/MMS), 2016. Vol. 374, N 14. P. 1356 - 1367.
84. Roy V. et al. Hematopoietic Growth Factors. NCCN Guidelines. Ver 1.2022. 2022.
85. Neumann S. et al. Primary prophylaxis of bacterial infections and Pneumocystis jirovecii pneumonia in patients with hematological malignancies and solid tumors: Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DG//Annals of Hematology. Ann Hematol, 2013. Vol. 92, N 4. P. 433 - 442.
86. Spirin M., Galstyan G., Drokov M. Central venous access in lymphoma patients (pts) with superior vena cava syndrome (SVCS)//Intensive Care Med. E[perimental. 2019. Vol. 7, N Suppl. 3: 001341. P. 388 - 389.
87. Сомонова О.В. et al. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных//Злокачественные опухоли: Практические рекомендации RUSSCO. 2021. Vol. 11, N 3S2. P. 47.
88. Lyman G.H. et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer//Blood Adv. Blood Adv, 2021. Vol. 5, N 4. P. 927 - 974.
89. Аксельрод Б.А. et al. Клиническое использование эритроцитсодержащих компонентов донорской крови//Гематология и трансфузиология. 2018. Vol. 63, N 4. P. 372 - 435.
90. Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В. Х.А.Ж.. Практические рекомендации по нутритивной поддержке онкологических больных//RUSSCO. 2017. P. 524 - 532.
91. de van der Schueren M.A.E. et al. Systematic review and meta-analysis of the evidence for oral nutritional intervention on nutritional and clinical outcomes during chemo(radio)therapy: current evidence and guidance for design of future trials//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. Ann Oncol, 2018. Vol. 29, N 5. P. 1141 - 1153.
92. Oktay K. et al. Fertility Preservation in Patients With Cancer: ASCO Clinical Practice Guideline Update//J. Clin. Oncol. J Clin Oncol, 2018. Vol. 36, N 19. P. 1994 - 2001.
93. Meirow D., Nugent D. The effects of radiotherapy and chemotherapy on female reproduction//Hum. Reprod. Update. 2001. Vol. 7, N 6. P. 535 - 543.
94. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
95. Румянцев А.Г., Самочатова Е.В. Практическое руководство по детским болезням. Том 4. Гематология и онкология детского возраста/ed. Коколина В.Ф., Румянцев А.Г. Медпрактика-М., 2004. 792 p.
96. Демина Е.А. et al. Лимфома Ходжкина//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 28 - 43.
97. A Predictive Model for Aggressive Non-Hodgkin's Lymphoma//N. Engl. J. Med. 1993. Vol. 329, N 14. P. 987 - 994.
98. Gallamini A. et al. Peripheral T-cell lymphoma unspecified (PTCL-U): A new prognostic model from a retrospective multicentric clinical study//Blood. 2004. Vol. 103, N 7. P. 2474 - 2479.
99. Went P. et al. Marker expression in peripheral T-cell lymphoma: A proposed clinical-pathologic prognostic score//J. Clin. Oncol. 2006. Vol. 24, N 16. P. 2472 - 2479.
100. Шихмирзаев Т.А. et al. Фармакопрофилактика трансфузионных реакций//Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2018. Vol. 13, N 2. P. 95 - 99.
101. Криволапов Ю.А. Технические аспекты выполнения трепанобиопсий костного мозга. Клиническая онкогематология 2014; 7: 290 - 295//Клиническая онкогематология. 2014. Vol. 7. P. 290 - 295.
102. Wang J. et al. Diagnostic utility of bilateral bone marrow examination: Significance of morphologic and ancillary technique study in malignancy//Cancer. Cancer, 2002. Vol. 94, N 5. P. 1522 - 1531.
103. Pluschnig U. et al. Extravasation emergencies: state-of-the-art management and progress in clinical research.//Memo. Springer, 2016. Vol. 9, N 4. P. 226 - 230.
104. Zeidler K. et al. Optimal preprocedural platelet transfusion threshold for central venous catheter insertions in patients with thrombocytopenia.//Transfusion. 2011. Vol. 51, N 11. P. 2269 - 2276.
105. Zerati A.E. et al. Totally implantable venous catheters: history, implantation technique and complications.//J Vasc Bras. 2017. Vol. 16, N 2. P. 128 - 139.
106. Gow K.W., Tapper D., Hickman R.O. Between the lines: The 50th anniversary of long-term central venous catheters//Am. J. Surg. Elsevier Ltd, 2017. Vol. 213, N 5. P. 837 - 848.
107. Yeral M. et al. Tunnelled central venous catheter-related problems in the early phase of haematopoietic stem cell transplantation and effects on transplant outcome.//Turkish J. Haematol. Off. J. Turkish Soc. Haematol. Galenos Yayinevi, 2015. Vol. 32, N 1. P. 51 - 57.
108. Maki D.G., Kluger D.M., Crnich C.J. The Risk of Bloodstream Infection in Adults With Different Intravascular Devices: A Systematic Review of 200 Published Prospective Studies//Mayo Clin. Proc. Elsevier, 2006. Vol. 81, N 9. P. 1159 - 1171.
109. Hamilton H. Central Venous Catheters/ed. Bodenham A.R. Oxford, UK: Wiley-Blackwell, 2009.
110. Biffi R. Introduction and Overview of PICC History//Peripherally Inserted Central Venous Catheters. Milano: Springer Milan, 2014. P. 1 - 6.
111. Linenberger M.L. Catheter-related thrombosis: risks, diagnosis, and management.//J. Natl. Compr. Canc. Netw. 2006. Vol. 4, N 9. P. 889 - 901.
112. Lee A.Y.Y., Kamphuisen P.W. Epidemiology and prevention of catheter-related thrombosis in patients with cancer//J. Thromb. Haemost. 2012. N 10. P. 1491 - 1499.
113. Цепенщинков Л., Лядов В.К. Периферически имплантируемый центральный венозный катетер: обзор литераутры.//Клиническая онкогематология. 2014. Vol. 7, N 2. P. 220 - 228.
114. Linder L.E. et al. Material thrombogenicity in central venous catheterization: a comparison between soft, antebrachial catheters of silicone elastomer and polyurethane.//JPEN. J. Parenter. Enteral Nutr. 1984. Vol. 8, N 4. P. 399 - 406.
115. Watters V.A., Grant J.P. Use of Electrocardiogram to Position Right Atrial Catheters During Surgery//Ann. Surg. Vol. 225, N 2. P. 165 - 171.
116. Taal M.W., Chesterton L.J., McIntyre C.W. Venography at insertion of tunnelled internal jugular vein dialysis catheters reveals significant occult stenosis//Nephrol. Dial. Transplant. Oxford University Press, 2004. Vol. 19, N 6. P. 1542 - 1545.
117. Lobato E.B. et al. Cross-sectional area of the right and left internal jugular veins.//J. Cardiothorac. Vasc. Anesth. 1999. Vol. 13, N 2. P. 136 - 138.
118. Червонцева А.М. Повреждение сосудистого эндотелия в процессе лечения острых миелоидных лейкозов. 2008.
119. Багирова Н.С. Инфекции, связанные с внутрисосудистыми устройствами: терминология, диагностика, профилактика и терапия//Злокачественные опухоли. 2014. N 3. P. 164 - 171.
120. Bannon M.P., Heller S.F., Rivera M. Anatomic considerations for central venous cannulation.//Risk Manag. Healthc. Policy. Dove Press, 2011. Vol. 4. P. 27 - 39.
121. Milling T.J. et al. Randomized, controlled clinical trial of point-of-care limited ultrasonography assistance of central venous cannulation: The Third Sonography Outcomes Assessment Program (SOAP-3) Trial*//Crit. Care Med. 2005. Vol. 33, N 8. P. 1764 - 1769.
122. Воробьев А.И. et al. Критические состояния при гемобластозах (типичные формы и выживаемость в условиях отделения реанимации).//Терапевтический архив. 1993. Vol. 65, N 7. P. 3 - 6.
123. Галстян Г.М., Городецкий В.М. Опыт работы отделения реанимации и интенсивной терапии ФГБУ ГНЦ МЗиСР РФ//Клиническая онкогематология. 2011. Vol. 4, N 1. P. 75 - 78.
124. Lamia B. et al. Changes in severity and organ failure scores as prognostic factors in onco-hematological malignancy patients admitted to the ICU//Intensive Care Med. Intensive Care Med, 2006. Vol. 32, N 10. P. 1560 - 1568.
125. Evison J.M. et al. Intensive care unit admission in patients with haematological disease: incidence, outcome and prognostic factors. 2001.
126. Silfvast T. et al. Multiple organ failure and outcome of critically ill patients with haematological malignancy//Acta Anaesthesiol. Scand. Acta Anaesthesiol Scand, 2003. Vol. 47, N 3. P. 301 - 306.
127. Benoit D.D. et al. Outcome and early prognostic indicators in patients with a hematologic malignancy admitted to the intensive care unit for a life-threatening complication//Crit. Care Med. Crit Care Med, 2003. Vol. 31, N 1. P. 104 - 112.
128. Schellongowski P. et al. Prognostic factors for intensive care unit admission, intensive care outcome, and post-intensive care survival in patients with de novo acute myeloid leukemia: a single center experience//Haematologica. 2011. Vol. 96, N 2. P. 231 - 237.
129.  et al. Hematologic malignancies in the medical intensive care unit - Outcomes and prognostic factors//Hematology. Maney Publishing, 2015. Vol. 20, N 5. P. 247 - 253.
et al. Hematologic malignancies in the medical intensive care unit - Outcomes and prognostic factors//Hematology. Maney Publishing, 2015. Vol. 20, N 5. P. 247 - 253.
130. Jackson K. et al. Outcomes and prognostic factors for patients with acute myeloid leukemia admitted to the intensive care unit//Leuk. Lymphoma. Leuk Lymphoma, 2013. Vol. 55, N April. P. 1 - 8.
131. Ahmed T. et al. Outcomes and changes in code status of patients with acute myeloid leukemia undergoing induction chemotherapy who were transferred to the intensive care unit//Leuk. Res. Elsevier Ltd, 2017. Vol. 62. P. 51 - 55.
132. Protocol ALCL-99 [Electronic resource]. URL: https://ptohd.pl/download/alcl-99/.
133. Wrobel G. et al. Safety assessment of intensive induction therapy in childhood anaplastic large cell lymphoma: Report of the ALCL99 randomised trial//Pediatr. Blood Cancer. 2011. Vol. 56, N 7. P. 1071 - 1077. 134.
134. Caballero M.D. et al. BEAM chemotherapy followed by autologous stem cell support in lymphoma patients: analysis of efficacy, toxicity and prognostic factors//Bone Marrow Transplant. Bone Marrow Transplant, 1997. Vol. 20, N 6.
135. Mills W. et al. BEAM chemotherapy and autologous bone marrow transplantation for patients with relapsed or refractory non-Hodgkin's lymphoma.//J. Clin. Oncol. J Clin Oncol, 1995. Vol. 13, N 3. P. 588 - 595.
136. Colita A. et al. LEAM vs. BEAM vs. CLV Conditioning Regimen for Autologous Stem Cell Transplantation in Malignant Lymphomas. Retrospective Comparison of Toxicity and Efficacy on 222 Patients in the First 100 Days After Transplant, On Behalf of the Romanian Society for Bon//Front. Oncol. Front Oncol, 2019. Vol. 9. P. 892.
137. Sharma A. et al. Comparison of BEAM vs. LEAM regimen in autologous transplant for lymphoma at AIIMS.//Springerplus. Springerplus, 2013. Vol. 2. P. 489.
138. Perz J.B. et al. LACE-conditioned autologous stem cell transplantation for relapsed or refractory Hodgkin's lymphoma: treatment outcome and risk factor analysis in 67 patients from a single centre.//Bone Marrow Transplant. Bone Marrow Transplant, 2007. Vol. 39, N 1. P. 41 - 47.
139. Ramzi M. et al. Autologous noncryopreserved hematopoietic stem cell transplant with CEAM as a modified conditioning regimen in patients with Hodgkin lymphoma: a single-center experience with a new protocol.//Exp. Clin. Transplant. Exp Clin Transplant, 2012. Vol. 10, N 2. P. 163 - 167.
140. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
141. Meignan M., Gallamini A., Haioun C. Report on the First International Workshop on interim-PET scan in lymphoma//Leukemia and Lymphoma. 2009. Vol. 50, N 8. P. 1257 - 1260.
142. Khorana A. et al. Development and validation of a predictive model for chemotherapy-associated thrombosis//Blood. 2008. Vol. 111, N 10. P. 4902 - 4907.
143. Luedersen J, Stadt UZ, Richter J et al. Variant ALK-fusion positive anaplastic large cell lymphoma (ALCL): A population-based paediatric study of the NHL-BFM study group.//.Br J Haematol. 2024 May; 204(5): 1894-1898.
144.  , Cozic N, Houot R et al. Efficacy and safety of crizotinib in ALK-positive systemic anaplastic large-cell lymphoma in children, adolescents, and adult patients: results of the French AcSe-crizotinib trial.//Eur J Cancer. 2023 Sep; 191: 112984. doi: 10.1016/j.ejca.2023.112984. Epub 2023 Jul 17.
, Cozic N, Houot R et al. Efficacy and safety of crizotinib in ALK-positive systemic anaplastic large-cell lymphoma in children, adolescents, and adult patients: results of the French AcSe-crizotinib trial.//Eur J Cancer. 2023 Sep; 191: 112984. doi: 10.1016/j.ejca.2023.112984. Epub 2023 Jul 17.
145. Protocol ALCL-Relapse [Electronic resource]. URL:https://ascopubs.org/action/downloadSupplement?doi=10.1200%2FJCO.20.00157&file=protocol_jco.20.00157.pdf.
146. Прогностическое значение морфологических типов ALK-позитивной анапластической крупноклеточной лимфомы у детей/Д.С. Абрамов, А.С. Федорова, К.А. Воронин [и др.]//Вопросы гематологии/онкологии и иммун опатологии в педиатрии. - 2024. - Т. 23, N 3. - С. 80 - 90. - DOI 10.24287/1726-1708-2024-23-3-80-90. - EDN GFNRFL. 148. Joks MM, et al. Breast Implant-Associated Anaplastic Large Cell Lymphoma: Where Hematology and Plastic Surgery Meet. Clin Lymphoma Myeloma Leuk. 2024 Sep; 24(9): e293 - e300. doi: 10.1016/j.clml.2024.05.008. Epub 2024 May 8. PMID: 38839449.
147. Yoon SE, Kim WS. Promising clinical efficacy and acceptable safety profile of sequential P-GEMOX and radiotherapy for localized ENKTL. Hematol Oncol. 2022 Aug; 40(3): 341 - 342. doi: 10.1002/hon.2970. Epub 2022 Feb 12. PMID: 35114729.
148. Wang X, et al. Should DDGP Regimen Be the Standard of Care for Advanced Extranodal NK/T-Cell Lymphoma? The New Staging System Matters-Reply. JAMA Oncol. 2023 Feb 1; 9(2): 279 - 280. doi: 10.1001/jamaoncol.2022.6463. PMID: 36480197.
149. Паровичникова Е.Н. и другие. "Алгоритмы диагностики и протоколы лечения заболеваний системы крови"/ed. Паровичникова Е.Н. Москва: Практика, 2024. Vol. 2.
150.  , Schellekens KPJ, Schoot RA et al. Combination therapy with crizotinib and vinblastine for relapsed or refractory pediatric ALK positive anaplastic large cell lymphoma.//J.Haematologica. 2023 May 1; 108(5): 1442 - 1446. doi: 10.3324/haematol.2022.281896.
, Schellekens KPJ, Schoot RA et al. Combination therapy with crizotinib and vinblastine for relapsed or refractory pediatric ALK positive anaplastic large cell lymphoma.//J.Haematologica. 2023 May 1; 108(5): 1442 - 1446. doi: 10.3324/haematol.2022.281896.
151. Eric J Lowe 1, Anne F Reilly 2, Megan S Lim et al Crizotinib in Combination With Chemotherapy for Pediatric Patients With ALK+ Anaplastic Large-Cell Lymphoma: The Results of Children's Oncology Group Trial ANHL12P1//J Clin Oncol. 2023 Apr 10; 41(11): 2043 - 2053.
152. Shen CQ, He GQ, Wan Z et al "Sandwich" protocol based on modified SMILE regimen for children with newly extranodal NK/T cell lymphoma, nasal type: a single-arm, single-center clinical study.//Ann Hematol. 2023 Nov; 102(11): 3143-3152. doi: 10.1007/s00277-023-05375-3. Epub 2023 Jul 24.
153. Yingjuan Zheng 1, Chunzhao Yang 1, Tiansong Liang ey al. Combined use of DDGP and IMRT has a good effect on extranodal natural killer/T-cell lymphoma, nasal type//Hematol Oncol 2020 Feb; 38(1): 103 - 105.
154. Attarbaschi A, Abla O, Arias Padilla L et al. Rare non-Hodgkin lymphoma of childhood and adolescence: A consensus diagnostic and therapeutic approach to pediatric-type follicular lymphoma, marginal zone lymphoma, and nonanaplastic peripheral T-cell lymphoma.//Pediatr Blood Cancer. 2020 Aug; 67(8): e28416. doi: 10.1002/pbc.28416. Epub 2020 May 26.
155. Zhao-Yang Wang, Ye-Xiong Li, Wei-Hu Wang, Jing Jin, Hua Wang. Primary radiotherapy showed favorable outcome in treating extranodal nasal-type NK/T-cell lymphoma in children and adolescents. Blood 2009; 114 (23): 4771-4776. doi: https://doi.org/10.1182/blood-2009-07-235853158. Шелихова Л.Н., Фоминых В.В., Абрамов Д.С., Мякова Н.В., Масчан М.А., Масчан А.А. Применение кризотиниба при рефрактерных формах ALK-позитивных лимфом. Терапевтический архив. 2017; 89(7): 51-56.
156. Волкова А.С., Валиев Т.Т. Дифференцированная, иммуноориентированная терапия анапластической крупноклеточной лимфомы у детей и подростков: обзор литературы и результаты лечения по протоколу АККЛ-НИИ ДОГ-2003//ОГ. 2023. N 2. URL: https://cyberleninka.ru/article/n/differentsirovannaya-immunoorientirovannaya-terapiya-anaplasticheskoy-krupnokletochnoy-limfomy-u-detey-i-podrostkov-obzor.
157. Locatelli F, Mauz Koerholz C, Neville K, et al. A phase 1/2 study of brentuximab vedotin in pediatric patients with relapsed/refractory (R/R) systemic anaplastic large cell lymphoma (sALCL) or R/R Hodgkin lymphoma (HL). Hematol Oncol. 2017; 35: 248 - 9.
158. Cai MC, Cheng S, Jing H. Targeted agents plus CHOP compared with CHOP as the first-line treatment for newly diagnosed patients with peripheral T-cell lymphoma (GUIDANCE-03): an open-label, multicentre phase 2 clinical trial. Lancet Reg Health West Pac. 2024 Jul 29; 50: 101160. doi: 10.1016/j.lanwpc.2024.101160. PMID: 39175480; PMCID: PMC11339047.
159. Treatment of Peripheral T-cell Lymphoma, ClinicalTrials.gov ID NCT01664975 [Electronic resource]. URL: https://clinicaltrials.gov/study/NCT01664975.
160. Maciejka-Kemblowska, L. et al. Clinical features and treatment outcomes of peripheral T-cell lymphoma in children. A current data report from Polish Pediatric Leukemia/Lymphoma Study Group (PPLLSG). Adv. Med. Sci. 61, 311 - 316. https://doi.org/10.1016/j.advms.2016.03.002 (2016).
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Паровичникова Елена Николаевна - д.м.н., генеральный директор ФГБУ "НМИЦ гематологии" Минздрава России, председатель Ассоциации содействия развитию гематологии и трансплантации костного мозга "Национальное гематологическое общество", главный внештатный специалист гематолог Минздрава России
2. Поддубная Ирина Владимировна - академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов
3. Тумян Гаяне Сергеевна - д.м.н., профессор, профессор кафедры онкологии и паллиативной медицины Российской медицинской академии непрерывного профессионального образования Минздрава России, ведущий научный сотрудник отделения химиотерапии гемобластозов "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член правления Российского общества онкогематологов
4. Горенкова Лилия Гамилевна - к.м.н., заведующая отделением гематологии и химиотерапии сотрых лейкозов и лимфом ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
5. Чернова Наталья Геннадьевна - д.м.н., заведующая медицинским центром ГБУЗ "ММКЦ Коммунарка" ДЗМ
6. Мякова Наталья Валерьевна - д.м.н., Заместитель главного врача по лечебной работе, зав. отделением онкогематологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член Национального общества детских гематологов и онкологов
7. Румянцев Александр Григорьевич - академин РАН, д.м.н., профессор, генеральный директор ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, президент Национального общества детских гематологов и онкологов тоже
8. Масчан Алексей Александрович - член-корр. РАН, д.м.н., профессор, зам. Генерального директора ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член правления Национального общества детских гематологов и онкологов
9. Звонков Евгений Евгеньевич - д.м.н., заведующий отделом лимфопролифертивных заболеваний, заведующий отделением гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ "НМИЦ гематологии" Минздрава России, член Ассоциации содействия развитию гематологии и трансплантации костного мозга "Национальное гематологическое общество"
10. Османов Евгений Александрович - д.м.н., профессор, зав. отделом гематологии и трансплантации костного мозга ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, профессор кафедры онкологии ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России, член правления Российского общества онкогематологов
11. Кравченко Сергей Кириллович - к.м.н., доцент, зав. отделением интенсивной высокодозной химиотерапии с круглосуточным и дневным стационаром ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
12. Фалалеева Наталья Александровна - д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов
13. Блинов Дмитрий Сергеевич, д.м.н., зав. научно-организационным отделом, ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
14. Шифрин Юрий Александрович - младший научный сотрудник лаборатории фармакологии и оценки технологий здравоохранения, врач-клинический фармаколог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
15. Михайлова Наталья Борисовна - д.м.н., руководитель отдела клинической онкологии (химиотерапии) НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, член Российского общества онкогематологов
16. Птушкин Вадим Вадимович - д.м.н., профессор, заместитель главного врача по гематологии ГБУЗ "ГКБ им. С.П. Боткина", главный внештатный специалист-гематолог Департамента здравоохранения города Москвы, член Национального гематологического общества и Российского общества онкогематологов
17. Байков Вадим Валентинович - д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. Акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов
18. Ковригина Алла Михайловна - д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением "НМИЦ гематологии" Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов
19. Криволапов Юрий Александрович - д.м.н., профессор, зав. патологоанатомическим отделением клинической молекулярной морфологии клиники им. Э.Э. Эйхвальда ФГБОУ СЗГМУ им. И.И. Мечникова Минздрава России, член панели патологов Европейской сети исследования лимфом, член Европейской рабочей группы исследования костного мозга, член президиума Российского общества патологоанатомов
20. Коновалов Дмитрий Михайлович - к.м.н., зав. патологанатомическим отделением ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член президиума Российского общества патологоанатомов
21. Аль-Ради Любовь Саттаровна - к.м.н., старший научный сотрудник консультативного гематологического отделения с дневным стационаром по проведению химиотерапии ФГБУ "НМИЦ гематологии" Минздрава России, член Ассоциации содействия развитию гематологии и трансплантации костного мозга "Национальное гематологическое общество"
22. Байков Вадим Валентинович - д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов
23. Трофимова Оксана Петровна - д.м.н., ведущий научный сотрудник радиологического отделения ФГБУ "НМИЦ им. Н.Н. Блохина" Минздрава России, доцент кафедры онкологии ГБОУ ДПО РМАНПО Минздрава России, член Российской Ассоциации терапевтических радиационных онкологов
24. Сотников Владимир Михайлович - д.м.н., руководитель лаборатории лучевой терапии ФГБУ "РНЦРР" Минздрава России
25. Ильин Николай Васильевич - д.м.н., профессор, профессор кафедры радиологии, хирургии и онкологии, главный научный сотрудник отдела лучевых и комбинированных методов лечения ФГБУ "Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова" Минздрава России
26. Виноградова Юлия Николаевна - д.м.н., руководитель отдела лучевых и комбинированных методов лечения, главный научный сотрудник отдела лучевых и комбинированных методов лечения ФГБУ "Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова" Минздрава России
27. Невольских Алексей Алексеевич - д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России
28. Мухортова Ольга Валентиновна - д.м.н., профессор кафедры лучевой диагностики, ведущий научный сотрудник отдела ядерной диагностики ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" Минздрава России
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гематологи.
2. Врачи-онкологи.
3. Врачи-детские гематологи-онкологи.
4. Врачи-радиологи.
5. Студенты медицинских вузов.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
- поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0.3;
- поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств. Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных мета-анализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. 4, 5).
В настоящих клинических рекомендациях в скобках приведены уровни доказательности рекомендаций в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа.
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования.
4
Несравнительные исследования, описание клинического случая.
5
Имеется лишь обоснование механизма действия или мнение экспертов.
Таблица А2.2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематический обзор РКИ с применением метаанализа.
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа.
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования.
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль".
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов.
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендаций
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными).
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными).
C
Слабая рекомендация (отсутствие доказательств надлежащего качества, все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными).
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание методики валидизации рекомендаций. Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2017 - 2018 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний "Лимфорум", ежегодной Российской конференции с международным участием "Злокачественные лимфомы", а также в рамках IV Конгресса гематологов России.
Окончательная редакция. Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
РЕЖИМЫ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ
При проведении химиотерапии рекомендуется контролировать вес пациента и производить пересчет доз противоопухолевых препаратов при изменении веса.
3.1.1 Схемы 1 линии терапии у пациентов старше 18 лет с нодальными Т-клеточными лимфомами
BV-CHP [30, 156]
Препарат
Стандартная доза
Путь введения
Дни введения
Брентуксимаб ведотин**
1,8 мг/кг
в/в капельно в течение 30 мин
1
Доксорубицин**
50 мг/м2
в/в капельно
1
Циклофосфамид**
750 мг/м2
в/в капельно
1
#Преднизолон**
100 мг
Внутрь
1 - 5
Лечение возобновляется на 22 день
BV-CHEP [29]
Препарат
Стандартная доза
Путь введения
Дни введения
Брентуксимаб ведотин**
1,8 мг/кг
в/в капельно в течение 30 мин
1
Доксорубицин**
50 мг/м2
в/в капельно
1
Циклофосфамид**
750 мг/м2
в/в капельно
1
#Этопозид **
100 мг/м2
в/в капельно или внутрь
1 - 3
#Преднизолон**
100 мг
Внутрь
1 - 5
Лечение возобновляется на 22 день
CHOEP [31, 32, 151]
Препарат
Стандартная доза
Путь введения
Дни введения
Доксорубицин**
50 мг/м2
в/в капельно
1
Циклофосфамид**
750 мг/м2
в/в капельно
1
#Этопозид**
100 мг/м2
в/в капельно
1 - 3
Винкристин**
2 мг
в/в
1
#Преднизолон**
100 мг
Внутрь
1 - 5
BV-CHP [30, 156]
Лечение возобновляется на 22 день (CHOEP-21)
CHOP [161 - 163]
Препарат
Стандартная доза
Путь введения
Дни введения
Доксорубицин**
50 мг/м2
в/в
1
Циклофосфамид**
750 мг/м2
в/в
1
Винкристин**
1,4 мг/м2 (максимум 2 мг)
в/в
1
#Преднизолон**
60 мг/м2 (максимум 100 мг)
Внутрь
1 - 5
Цикл каждый 21 день (CHOP-21)
Поддерживающая терапия у пациентов старше 18 лет при нодальных Т-клеточных лимфомах с Tfh-фенотипом [151]:
#дексаметазон** 10 мг/м2 внутрь дни 1 - 3
#метотрексат** 20 мг/м2 в/в или в/м дни 2, 9, 16, 23
Проводится в течение 24 месяцев с момента окончания терапии индукции.
Или
#леналидомид** 15 - 25 мг внутрь ежедневно 21-день 28-дневного
Проводится в течение 24 месяцев с момента окончания терапии индукции.
ЛБ-М-04 [151]
Блок A:
- #Дексаметазон**, 10 мг/м2 в/в капельно, дни 1 - 5.
- Винкристин**, 1,4 мг/м2 в/в струйно (не более 2 мг), день 1.
- #Метотрексат**, 1500 мг/м2 в/в капельно за 12 часов, день 1, через 12 часов после окончания введения #метотрексата** вводится кальция фолинат**.
- Цитарабин**, 150 мг/м2 в/в капельно каждые 12 часов, дни 4 - 5.
- #Этопозид**, 100 мг/м2 в/в капельно, дни 4 - 5.
- #Ифосфамид**, 800 мг/м2 в/в капельно, дни 1 - 5 (обязательно с месной** - во время инфузии, через 4 и 8 часов после окончания введения #ифосфамида**, из расчета 60% от дозы вводимого #ифосфамида**).
Блок C:
- #Дексаметазон**, 10 мг/м2 в/в капельно, дни 1 - 5.
- #Метотрексат**, 1500 мг/м2 в/в капельно за 12 часов, день 1, через 12 часов после окончания введения #метотрексата** вводится кальция фолинат**.
- #Винбластин**, 10 мг в/в струйно, день 1.
- #Цитарабин**, 2 г/м2 каждые 12 часов, инфузия в течение 3 ч в/в капельно, дни 2 - 3.
- #Этопозид**, 150 мг/м2 в/в капельно, дни 3 - 5.
3.1.2 Схемы терапии рецидивов нодальных Т-клеточных лимфом
Монотерапия брентуксимабом ведотином** [53]
Препарат
Стандартная доза
Путь введения
Дни введения
Брентуксимаб ведотин**
1,8 мг/кг
в/в в течение 30 минут
1
Введения повторяются каждые 3 недели.
Если масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг.
У пациентов, не кандидатов на ВХТ с аутоТГСК, при достижении стабилизации или при положительной динамике заболевания, лечение продолжают до 16, но не менее 8 циклов, при отсутствии прогрессирования и с оценкой чувствительности каждые 4 введения. Полная длительность лечения составляет приблизительно 1 год.
DHAP [65]
Препарат
Стандартная доза
Путь введения
Дни введения
#Дексаметазон**
40 мг
в/в или внутрь
1 - 4
#Цисплатин**
100 мг/м2
в/в кап. 24-часовая инфузия
1
#Цитарабин**
2 г/м2
в/в кап. 2 раза в день
2
Лечение возобновляется на 22 или 29 день
DHAP + #брентуксимаб ведотин** [54]
Препарат
Стандартная доза
Путь введения
Дни введения
#Брентуксимаб ведотин**
1,2 мг/кг
в/в в течение 30 минут
0
#Дексаметазон**
40 мг
в/в
2 - 5
#Цисплатин**
70 мг/м2
в/в кап. 22-часовая инфузия
1
#Цитарабин**
2 г/м2
в/в кап. 2 раза в день
2
Лечение возобновляется на 22 день
ESHAP [64]
Препарат
Стандартная доза
Путь введения
Дни введения
#Этопозид**
40 мг/м2
в/в кап.
1 - 4
Метилпреднизолон**
500 мг
в/в кап
1 - 5
#Цисплатин**
25 мг/м2/сут
в/в непрерывная инфузия
1 - 4
#Цитарабин**
2000 мг/м2
в/в кап.,
5
Лечение возобновляется на 22 или 29 день
ICE [67]
Препарат
Стандартная доза
Путь введения
Дни введения
#Этопозид**
100 мг/м2
в/в кап
1 - 3
#Ифосфамид**
1700 мг/м2
в/в
1, 2
1600 мг/м2
в/в
3
#Карбоплатин**
AUC 5
в/в кап.
1
Лечение возобновляется на 22 день
GDP [66]
Препарат
Стандартная доза
Путь введения
Дни введения
#Цисплатин**
70 мг/м2
в/в кап
1
#Гемцитабин**
1000 мг/м2
в/в кап
1, 8
#Дексаметазон**
40 мг
внутрь
1 - 4
Лечение возобновляется на 22 день
3.1.3 Схемы терапии NK/Т-клеточных лимфом у пациентов старше 18 лет
DeVic [41]
Препарат
Стандартная доза
Путь введения
Дни введения
#Карбоплатин**
200 мг/м2
в/в
1
#Этопозид**
67 мг/м2
в/в
1 - 3
#Ифосфамид**
1 г/м2
в/в
1 - 3
#Дексаметазон**
40 мг
в/в
1 - 3
Лечение возобновляется на 22 день
VIPD [42]
Препарат
Стандартная доза
Путь введения
Дни введения
#Цисплатин**
33 мг/м2
в/в
1 - 3
#Этопозид**
100 мг/м2
в/в
1 - 3
#Ифосфамид**
1,2 г/м2
в/в
1 - 3
#Дексаметазон**
40 мг
в/в
1 - 4
Лечение возобновляется на 22 день
AspMetDex [45]
Препарат
Стандартная доза
Путь введения
Дни введения
#Аспарагиназа**
6 000 МЕ/м2
в/м
2, 4, 6, 8
#Метотрексат**
3 г/м2
в/в капельно в течение 6 часов
1
#Дексаметазон**
40 мг
в/в или внутрь
1 - 4
Лечение возобновляется на 21 день
SMILE [40]
Препарат
Стандартная доза
Путь введения
Дни введения
#Метотрексат**
2000 мг/м2
в/в капельно за 6 часов
1
#Дексаметазон**
40 мг/м2
в/в капельно
2 - 4 день
#Ифосфамид**
1500 мг/м2
в/в капельно
2 - 4 день
#Этопозид**
100 мг/м2
в/в капельно
2 - 4 день
#месна
#аспарагиназа**
300 мг/м2
6000 МЕ/м2
в/в капельно
в/в капельно
2 - 4 день
3 - 9 день
Лечение возобновляется на 28 день
GELOX или P-GEMOX [39]
Препарат
Стандартная доза
Путь введения
Дни введения
#Гемцитабин** (GELOX)
или
(P-GEMOX)
1000 мг/м2
800 мг/м2
в/в капельно
1, 8
#Оксалиплатин** (GELOX)
Или (P-GEMOX)
130 мг/м2
100 мг/м2
в/в капельно
1
#аспарагиназа**
** (GELOX)
Или
6000 МЕ/м2
в/в капельно
1 - 7
#Пэгаспаргаза**
2500 МЕ/м2
в/м
1
Лечение возобновляется на 22 день
DDGP [40]
Препарат
Стандартная доза
Путь введения
Дни введения
#Гемцитабин**
800 мг/м2
в/в капельно
1, 8
#Цисплатин**
20 мг/м2
в/в капельно
1 - 4 день
#Дексаметазон**
15 мг/м2
в/в капельно
1 - 5 день
#Пэгаспаргаза**
1500 - 2500 МЕ/м2
в/м
1 день
Лечение возобновляется на 21 день
Схемы терапии NK/Т-клеточных лимфом у пациентов младше 18 лет
SMILE (mSMILE) [154]
Препарат
Стандартная доза
Путь введения
Дни введения
#Метотрексат**
2000 мг/м2
в/в капельно за 6 часов
1
#Дексаметазон**
40 мг
в/в капельно
2 - 4 день
#Ифосфамид**
1500 мг/м2
в/в капельно
2 - 4 день
#Этопозид**
100 мг/м2
в/в капельно
2 - 4 день
#Пэгаспаргаза** (mSMILE)
Или
1500 - 2500 МЕ/м2
в/м
5 день
#Аспарагиназа** (SMILE)
6000 МЕ/м2
в/в капельно
8, 10, 12, 14, 16, 18, 20 день
Лечение возобновляется на 21 день (mSMILE) или 28 день (SMILE)
DDGP [40, 151]
Препарат
Стандартная доза
Путь введения
Дни введения
#Гемцитабин**
800 мг/м2
в/в капельно
1, 8
#Цисплатин**
20 мг/м2
в/в капельно
1 - 4 день
#Дексаметазон**
15 мг/м2
в/в капельно
1 - 5 день
#Пэгаспаргаза**
1500 - 2500 МЕ/м2
в/м
1 день
Лечение возобновляется на 21 день
Интратекальное введение препаратов (у пациентов младше 18 лет ППТЛ NOS) [132]
Возраст
Дозировка препарата
#Метотрексат** (L01BA01)
Цитарабин** (L01BC01)
#Преднизолон** (H02AB06)
< 1 года
6 мг
16 мг
4 мг
1 - 2 года
8 мг
20 мг
6 мг
2 - 3 года
10 мг
26 мг
8 мг
> 3 лет
12 мг
30 мг
10 мг
3.1.4 Схема терапии АККЛ у пациентов до 18 лет
Протокол лечения ALCL 99 [51, 132, 153]:
Предфаза (соответствует циторедуктивной фазе протокола для лечения В-НХЛ) начинать, как только подтвержден диагноз.
Препарат
АТХ
Стандартная доза
Путь введения
Дни введения
#Дексаметазон**
H02AB02
5 мг/м2/сут в 1 прием
в/в или внутрь
1, 2
10 мг/м2/сут за 2 приема
в/в или внутрь
3 - 5
#Циклофосфамид**
L01AA01
200 мг/м2
в/в в течение 60 минут
1, 2
Инфузия (Натрия хлорид**, Декстроза**)
B05BB01
B05BA03
3000 мл/м2/сут
в/в
#Аллопуринол [132]**
M04AA01
300 мг/м2
Внутрь
Ежедневно, начиная с -1 дня, до завершения всего протокола лечения
Не менее одного раза в день оценивать анализ крови биохимический общетерапевтический (B03.016.004) с обязательным контролем уровней калия, натрия, общего кальция, хлоридов в крови, неорганического фосфора, мочевины в крови, в зависимости от размеров опухоли.
Определение ответа опухоли на 5-й день терапии основано на клинической оценке; рентгенологическое и ультразвуковое обследование - по показаниям
Блок или АМ
Препарат
АТХ
Стандартная доза
Путь введения
Дни введения
#Дексаметазон**
H02AB02
10 мг/м2 за 2 приема
в/в или внутрь
1 - 5
#Метотрексат**
3 г/м2
в/в в течение 24 часов (10% дозы от общей дозы за 30 минут, затем 90% инфузией за 23,5 часа)
1
Кальция фолинат**
V03AF03
15 мг/м2
в/в
При назначении #метотрексата** 3 г/м2 - начинать через 24 часа от начала инфузии #метотрексата**, далее - каждые 6 часов, суммарно 12 доз (или по требованию в зависимости от уровня #метотрексата**)
#Ифосфамид**
L01AA06
800 мг/м2
в/в за 1 час
1 - 5 (в день 1 вводить за 6 часов до начала инфузии #метотрексата**)
Месна** [132]
V03AF01
330 мг/м2
в/в струйно
0, 4 и 8 час после инфузии #ифосфамида**
#Цитарабин**
L01BC01
150 мг/м2 каждые 12 часов (суммарно 300 мг/м2/сут)
в/в за 1 час
4, 5
#Этопозид**
L01CB01
100 мг/м2
в/в за 2 часа (разведение 0,4 мг/мл)
4, 5 (после инфузии #цитарабина**)
Инфузия (Натрия хлорид**, Декстроза**, Натрия бикарбонат **)
B05BB01
B05BA03
B05CB04
Защелачивание в течение 48 часов после инфузии #метотрексата**
В/в или оральная гидратация в объеме 3000 мл/м2/день должна быть продолжена в течение 12 часов после введения последней дозы #ифосфамида**.
Курс АМ начинается на 6-й день терапии. Последующие курсы начинать по восстановлении показателей периферической крови: нейтрофилы > 0,5 x 109/л, тромбоциты > 50 x 109/л, при удовлетворительном общем состоянии пациента и отсутствии лихорадки в течение более 3 дней (по данным группы BFM, в среднем, этот период занимает ~ 21 день).
Блок ВМ
Препарат
АТХ
Стандартная доза
Путь введения
Дни введения
#Дексаметазон**
H02AB02
10 мг/м2 за 2 приема
в/в или внутрь
1 - 5
#Метотрексат**
L01BA01
3 г/м2
в/в в течение 24 часов (10% дозы от общей дозы за 30 минут, затем 90% инфузией за 23,5 часа)
1
Кальция фолинат**
V03AF03
15 мг/м2
в/в
При назначении #метотрексата** 3 г/м2 - начинать через 24 часа от начала инфузии #метотрексата**, далее - каждые 6 часов, суммарно 12 доз (или по требованию в зависимости от уровня #метотрексата**)
#Циклофосфамид**
L01AA01
200 мг/м2
в/в в течение 60 минут
1 - 5 (в день 1 назначить за 6 часов до начала инфузии #метотрексата**)
#Доксорубицин**
L01DB01
25 мг/м2
в/в в течение 60 минут
4, 5
Инфузия (Натрия хлорид**, Декстроза**, Натрия бикарбонат **)
B05BB01
B05BA03
B05CB04
Защелачивание в течение 48 часов после инфузии #метотрексата**
В/в или оральная гидратация в объеме 3000 мл/м2/день должна быть продолжена в течение 12 часов после введения последней дозы #циклофосфамида**
Курс В1 начинать по восстановлении показателей периферической крови: нейтрофилы > 0,5 x 109/л, тромбоциты > 50 x 109/л, при удовлетворительном состоянии пациента и отсутствием лихорадки в течение более 3 дней (по данным группы BFM, в среднем, этот период занимает ~ 21 день).
При отнесении пациента в группу высокого риска к терапии со 2-го блока и в течение последующих 3-х лет прибавляется #кризотиниб** в дозе 165 мг/м2/сут. [153]
Схема лечения рецидивов АЛК+ АККЛ у пациентов младше 18 лет [152]:
Группа SR (группа стандартного риска)
Курсы #винбластина** (L01CA01) в течение 24 мес и #кризотиниба** (L01ED01) в течение 36 мес (схемы и дозировки указаны ниже)
#ВИНБЛАСТИН** (L01CA01)
6 мг/м2 (суммарная доза ![]() 10 мг) в/в болюсное введение в день 1-й еженедельно в течение 24 мес.
10 мг) в/в болюсное введение в день 1-й еженедельно в течение 24 мес.
Модификация дозировок:
Раз в 14 дней необходимо делать анализ крови и прерывать лечение при уровне нейтрофилов < 0.5 x 109/л (если анализ без лейкоцитарной формулы, то при уровне лейкоцитов < 1 x 109) или уровне тромбоцитов < 50 x 109/л. Прием винбластина** возобновляется, когда число нейтрофилов становится > 0.5 x 109/л, а тромбоцитов > 50 x 109/л.
Дозу винбластина** следует снизить до 4 мг/м2 в случае продолжительной цитопении, требующей пропуска более 2 введений. Если следующие два курса будут хорошо переноситься, следует опять попробовать использование стандартной дозы 6 мг/м2.
Ежемесячно должно производиться исследование неврологического статуса в рамках клинической оценки состояния больного. Предполагается, что дозу #винбластина** следует снизить вдвое (до 3 мг/м2), если появятся данные, свидетельствующие о симптоматической периферической нейропатии.
#Кризотиниб** (L01ED01) 165 мг/м2 в сутки перорально длительно до 36 месяцев [152 - 153]
Группа HR (группа высокого риска)
Все пациенты получают профазу.
CC
CC + #кризотиниб**
CVA + #кризотиниб**
#Кризотиниб** до 36 мес
Курс CC [146]
#Дексаметазон**
H02AB02
20 мг/м2/сут на 3 введения, в/в или р.о
1 - 5 дни
Винбластин** [152]
L01CA01
6 мг/м2 в/в стр за 1 час до #цитарабина**
1 сут
#Цитарабин**
L01BC01
3 г/м2 на введение за 3 часа в/в кап
1 и 2 дни, всего 4 дозы с интервалом 12 часов
#Этопозид **
L01CB01
100 мг/м2 на введение за 2 часа в/в кап
дни 3 - 5 (5 введений с интервалом 12 часов), разводить 1:50/1:100 мл натрия хлорида**
1 - 3-дни - увлажняющие капли в глаза
При развитии нистагма/атаксии - остановить введение #цитарабина**, при повторении - отменить совсем
Мониторировать АД, аллергические реакции и аритмию во время и 5 часов после инфузии #этопозида**
Инфузия (Натрия хлорид**, Декстроза**)
Вводится 3000 мл/м2/сут.
Курс CVA [146]
#Ломустин**
L01AD02
100 мг/м2
день 1
#Винбластин**
L01CA0
6 мг/м2/сут (максимум 10 мг)
дни 1, 8, 15, 22
Цитарабин**
L01BC01
100 мг/м2 за 1 час
1 - 5 дни
Группа VHR (группа сверхвысокого риска)
Все пациенты получают профазу [152, 153]
Рецидив до 12 мес
Прогрессия на терапии
CC
ICM + #кризотиниб**
CC + #кризотиниб**
ICI + #кризотиниб**
#Кризотиниб** 36 мес
После достижения ПЭТ-негативной ремиссии
аллоТГСК
#Кризотиниб** при MRD+ после аллоТГСК - 36 мес
ICM [146]
#Митоксантрон**
L01DB07
8 мг/м2/сут за 30 мин
1 и 2 дни
#Карбоплатин**
L01XA02
200 мг/м2/сут постоянной инфузией 96 часов (4 дня)
с 2 дня
#Ифосфамид**
L01AA06
2 г/м2/сут постоянной инфузией 120 часов (5 дней)
с 2 дня
Месна**
V03AF01
500 мг/м2 в/в перед #ифосфамидом**, день 2
3 г/м2/сут продленной инфузией 168 часов (7 дней)
- с 2 дня
Инфузия (Натрия хлорид**, Декстроза**)
Вводится 3000 мл/м2/сут.
ICI [146]
#Карбоплатин**
L01XA02
200 мг/м2/сут постоянной инфузией 96 часов (4 дня)
- с 2 дня
#Ифосфамид**
L01AA06
2 г/м2/сут постоянной инфузией 120 часов (5 дней
с 2 дня
#Идарубицин**
L01DB06
10 мг/м2/сут за 4 часа
дни 1 и 2
Месна**
V03AF01
500 мг/м2 в/в перед #ифосфамидом**, день 2 - 3 г/м2/сут продленной инфузией 168 часов (7 дней)
- с 2 дня
#КРИЗОТИНИБ**
#Кризотиниб** получают все пациенты высокого риска, начиная со второго блока химиотерапии и те пациенты среднего риска, у которых остается позитивная MRD после 1-го блока химиотерапии. Препарат принимают внутрь в дозе 165 мг/м2 постоянно до 24 мес. Рекомендуется обязательное назначение антиэметической терапии [152 - 153].
Лечение рецидивов АККЛ АЛК+ у пациентов старше 18 лет
Поздние рецидивы: монотерапия #винбластином**и #кризотинибом** в течение 24 месяцев [55, 151, 156]
ВИНБЛАСТИН** (L01CA01) [55]
6 мг/м2 (суммарная доза ![]() 10 мг) в/в болюсное введение в день 1-й еженедельно в течение 24 мес.
10 мг) в/в болюсное введение в день 1-й еженедельно в течение 24 мес.
Модификация дозировок:
Раз в 14 дней необходимо делать анализ крови и прерывать лечение при уровне нейтрофилов < 0.5 x 109/л (если анализ без лейкоцитарной формулы, то при уровне лейкоцитов < 1 x 109) или уровне тромбоцитов < 50 x 109/л. Прием винбластина** возобновляется, когда число нейтрофилов становится > 0.5 x 109/л, а тромбоцитов > 50 x 109/л.
Дозу #винбластина** следует снизить до 4 мг/м2 в случае продолжительной цитопении, требующей пропуска более 2 введений. Если следующие два курса будут хорошо переноситься, следует опять попробовать использование стандартной дозы 6 мг/м2.
Ежемесячно должно производиться исследование неврологического статуса в рамках клинической оценки состояния больного. Предполагается, что дозу #винбластина** следует снизить вдвое (до 3 мг/м2), если появятся данные, свидительствующие о симптоматической периферической нейропатии.
#КРИЗОТИНИБ** [151, 157]
Препарат принимают внутрь в дозе 250 мг 2 раза в день постоянно до прогрессирования или неприемлемой токсичности (по аналогии с педиатрической практикой продолжительность лечения - 24 месяца). Рекомендуется обязательное назначение антиэметической терапии.
Приложение А3.2
РЕКОМЕНДАЦИИ
ПО РЕДУКЦИИ ДОЗ ИЛИ УВЕЛИЧЕНИЮ ПРОМЕЖУТКОВ ПРИ ПРОВЕДЕНИИ
МИЕЛОСУПРЕССИВНОЙ ЦИТОСТАТИЧЕСКОЙ ТЕРАПИИ
Лечение следует проводить в полных дозах в соответствии со схемой, если в день введения противоопухолевых препаратов уровень нейтрофилов > 1 x 109/л и тромбоцитов > 100 x 109, но только в том случае, если пик падения уже пройден.
Если необходимый уровень нейтрофилов не достигается к плановому дню введения противоопухолевых препаратов, введение колониестимулирующих факторов продолжается в прежних дозах до достижения уровня нейтрофилов > 1 x 109 при ежедневном контроле анализов крови, далее исследование крови повторяется через день. Лечение возобновляется при достижении вышеуказанных параметров.
В том случае, если показатели крови восстанавливаются в течение последующих 14 дней, следующий цикл проводится в полных дозах.
В случае, если показатели крови не восстанавливаются дольше дополнительных 14 дней, а также в случае повторной отсрочки курса вследствие миелотоксичности более 10 дней, проводится снижение доз препаратов до 75% от исходной дозы (кроме доз винкристина**, #преднизолона**).
Если к плановому дню введения противоопухолевых препаратов необходимый уровень тромбоцитов не достигается, в дальнейшем исследование крови повторяется на 3, 7, 10 и 14 дни; лечение возобновляется при достижении вышеуказанных параметров. Если показатели крови восстанавливаются в течение дополнительных 14 дней, цикл проводится в полных дозах. В случае, если показатели крови не восстанавливаются дольше дополнительных 14 дней, в следующем цикле производится редукция доз по той же схеме, как и при длительной нейтропении.
Приложение А3.3
ТРАНСПЛАНТАЦИЯ АУТОЛОГИЧНЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Мобилизация и сбор гемопоэтических стволовых клеток крови
Мобилизация - резкое увеличение количества гемопоэтических стволовых клеток (ГСК) в периферической крови под воздействием ростовых факторов.
Разработано несколько схем мобилизации ГСК, используемых в онкогематологии, в каждой из которых применяется Г-КСФ (ATX L03AA Колониестимулирующие факторы).
Алгоритм принятия решения перед мобилизацией ГСК
- оценка статуса больного (наличие показаний для трансплантации аутологичных гемопоэтических стволовых клеток (ауто-ТГСК), стандартное обследование для исключения факторов, препятствующих проведению высокодозного лечения, коморбидность, согласие больного, изучение предшествующей терапии - количество курсов и сроки окончания лечения, использование лучевой терапии)
- оценка статуса болезни - глубина противоопухолевого ответа, наличие ремиссии, сроки ее достижения;
- оценка состояния кроветворения (гистологическое исследование костного мозга позволит выявить угнетение ростков кроветворения, а также инфильтрацию костного мозга опухолевыми клетками)
Режимы предтрансплантационной подготовки при ауто-ТГСК
Для предтрансплантационной подготовки при НХЛ используют режим кондиционирования BEAM, который, состоит из #кармустина** (300 мг/м2, день -6), #этопозида** (200 мг/м2, дни от -5 до -2), #цитарабина** (200 мг/м2 дважды в день, дни от -5 до -2), и #мелфалана** (140 мг/м2/день, день -1) [134 - 135]. Схемы введения препаратов и дозы представлены в таблице 4.
Ранняя токсичность режима BEAM включает тяжелый мукозит, тошноту и рвоту, диарею, гепатотоксичность, нефротоксичность и неинфекционные легочные осложнения.
Поздняя токсичность включает легочные осложнения, такие как хронический интерстициальный фиброз и снижение диффузионной способности легких (21%), инфекция (30%), метаболический синдром (17%), сердечно-сосудистые осложнения (12%), вторичные опухоли (20%).
Таблица 4. Схема предтрансплантационного кондиционирования BEAM у больных старше 18 лет [134, 135 - 137]
Препарат
Дни введения перед ауто-ТГСК
Разовая доза
Суточная доза
Курсовая доза
Особенности введения
#Кармустин**
-6 день
300 мг/м2
300 мг/м2
300 мг/м2
Вводится в/в в виде инфузии в течение 2 ч в 500 мл 0,9% натрия хлорида**
#Этопозид**
-5, -4, -3, -2 дни
200 мг/м2
200 мг/м2
800 мг/м2
Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида**
Цитарабин**
-5, -4, -3, -2 дни
200 мг/м2
400 мг/м2
1600 мг/м2
Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида**
#Мелфалан**
-1 день
140 мг/м2
140 мг/м2
140 мг/м2
Вводится в/в в виде инфузии в течение 1ч в 500 мл 0,9% натрия хлорида**
Для снижения токсичности режима предтрансплантационной подготовки BEAM в ряде случаев вместо #кармустина** используется #ломустин** (CEAM/LEAM). Схема введения препаратов и дозы представлены в таблице 5.
Таблица 5. Схема предтрансплантационного кондиционирования LEAM 137-140]
Препарат
Дни введения перед ауто-ТГСК
Разовая доза
Суточная доза
Курсовая доза
Особенности введения
#Ломустин**
-6 день
200 мг/м2
200 мг/м2
200 мг/м2
Внутрь
#Этопозид**
-5, -4, -3, -2 дни
200 мг/м2
200 мг/м2
800 мг/м2
Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида**
Цитарабин**
-5, -4, -3, -2 дни
200 мг/м2
400 мг/ м2
1600 мг/м2
Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида**
#Мелфалан**
-1 день
140 мг/м2
140 мг/м2
140 мг/м2
Вводится в/в в виде инфузии в течение 1 ч в 500 мл 0,9% натрия хлорида**
#Мелфалан**
-1 день
140 мг/м2
140 мг/м2
140 мг/м2
Вводится в/в в виде инфузии в течение 1 ч в 500 мл 0,9% натрия хлорида**
Антисекреторная терапия
В настоящее время с антисекреторной целью применяются два класса препаратов: ингибиторы протонного насоса (ИПН) и блокаторы Н2-гистаминовых рецепторов [7].
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
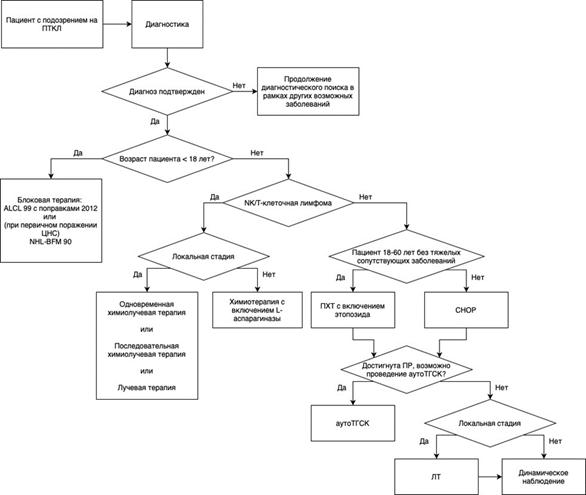
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Лимфомы - это опухоли из лимфоидных клеток. Лимфома - не одна болезнь, это большая группа, включающая более 30 разных заболеваний, которые отличаются друг от друга по своим проявлениям, по течению, по ответу на лечение. Лимфомы ведут себя и лечатся совершенно по-разному. Поэтому просто слово "лимфома" ни о чем не говорит - чтобы понимать, как лечить, надо знать конкретный вариант лимфомы.
Периферическая Т-клеточная лимфома относится к группе заболеваний, которые составляют 10 - 15% всех лимфом человека. Название показывает, что опухоль состоит из Т-клеток. Т-лимфоциты - это самые грозные бойцы иммунитета, так как именно они уничтожают чужеродные бактерии и собственные больные клетки организма. Подобно яблоку на дереве, весь период превращения (созревания) молодой клетки в зрелый Т-лимфоцит проходит несколько этапов. На каждом этапе возможен сбой и образование больной опухолевой группы клеток. При периферической Т-клеточной лимфоме опухоль появляется на последнем этапе созревания, на уровне зрелой Т-клетки. Опухолевые Т-лимфоциты похожи на нормальные, которые находятся в периферической (циркулирующей) крови, отсюда и название - "периферическая".
Некоторые из Т-клеточных периферических лимфом имеют свои особенности, например, периферическая Т-клеточная лимфома кожи чаще появляется в коже и подкожной клетчатке. Однако самая частая "периферическая Т-клеточная лимфома неуточненная" характерных особенностей не имеет и может появляться во всех органах и тканях. Проявления этой болезни совпадают с признаками других лимфом. Пациенты обычно жалуются на боль из-за роста опухоли, которая может появиться в любой точке тела. При этой болезни увеличиваются лимфатические узлы группами на шее, подмышками, в паху и в других местах. Больного могут беспокоить и такие признаки болезни, которые называются "В-симптомы": у него поднимается температура, он быстро худеет и сильно потеет вечером и ночью. При Т-клеточных периферических лимфомах обыкновенно возникает сыпь и уплотнения в коже.
Чтобы поставить правильный диагноз, обязательно берут кусочек опухоли или увеличенный лимфатический узел для морфологического и иммуногистохимического исследования. Только такой сложный, комплексный анализ позволяет поставить точный диагноз и провести эффективное лечение.
Чтобы точно узнать, есть ли увеличенные лимфатические узлы и каково их количество в тех частях тела, которые нельзя увидеть при внешнем осмотре, необходимо сделать компьютерную томографию. Стадию болезни устанавливают по системе "Ann-Arbor", которая отражает, какие органы и лимфатические узлы поражены.
Лечить неуточненную Т-клеточную лимфому непросто. Успешно лечится около 40% случаев заболевания. В то же время врачи постоянно продолжают улучшать результаты лечения, используют новые методы и применяют новые лекарства.
Ангиоиммунобластная лимфома относится к группе Т-клеточных лимфом. Проявления болезни в целом совпадают с проявлениями иных лимфом: опухают лимфатические узлы группами на шее, подмышками, в паху и в других местах, часто увеличиваются печень и селезенка, появляется жидкость в околосердечной и окололегочной полостях. Пациенты обычно жалуются на боль из-за роста опухоли, которая может появиться в любой точке тела. Как и при других Т-клеточных лимфомах, бывает разнообразная сыпь и уплотнения в коже. Возможны также аутоиммунные осложнения.
Лечить ангиоиммунобластную лимфому непросто. Успешно лечится около 60% случаев заболевания. В то же время врачи постоянно продолжают улучшать результаты лечения, используют новые методы и применяют новые лекарства.
Анапластическая крупноклеточная лимфома относится к агрессивному классу Т-клеточных лимфом, при котором в основном увеличиваются лимфатические узлы. При анапластической лимфоме опухолевые клетки настолько изменяются, что полностью теряют все признаки созревания и выглядят как молодые клетки. Это обозначается словом "анаплазия".
Лечение анапластической крупноклеточной лимфомы зависит от наличия или отсутствия в опухоли фермента под названием "ALK". Выявляют его во время иммуногистохимического исследования лимфатического узла. Если фермент ALK есть, то лимфома называется ALK-позитивной. Такие лимфомы лечатся успешно в 70% случаев. Если более мягкими, относительно небольшими дозами лекарств не удается вылечить больного, то проводят высокодозную химиотерапию с поддержкой собственными клетками. Если фермента ALK нет, то лимфома называется ALK-негативной. Результаты лечения ALK-негативных лимфом несколько хуже, однако постоянно появляются новые препараты, которые помогают улучшить лечение таких больных.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА
ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ВОСТОЧНОЙ ОБЪЕДИНЕННОЙ
ОНКОЛОГИЧЕСКОЙ ГРУППЫ (ECOG)
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5(6): 649 - 65 [141]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания.
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу).
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования.
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели.
5
Смерть пациента
Приложение Г2
ШКАЛА ВИЗУАЛЬНОЙ ОЦЕНКИ ПЭТ-ДАННЫХ
Оригинальное название: The Deauville five point scale
Источник: Meignan M. et al. Report on the First International Workshop on Interim-PET-Scan in Lymphoma. Leuk Lymphoma. 2009; 50(8): 1257 - 1260 [142]
Тип: шкала оценки
Назначение: оценка результатов ПЭТ/КТ исследования
Содержание и интерпретация: для стандартизации, воспроизводимости и возможности сравнения результатов ПЭТ/КТ, полученных в различных медицинских учреждениях, при оценке эффективности лечения у больных лимфомами используется визуальный анализ ПЭТ-данных по 5-балльной шкале [142]. При этом интенсивность накопления Флудезоксиглюкозы [18F] в патологическом очаге сравнивается с интенсивностью накопления препарата в неизмененных отделах средостения или в правой доле печени:
1 балл - характеризуется отсутствием накопления препарата в определяемом ранее патологическом очаге;
2 балла - накопление препарата в патологическом очаге не превышает по интенсивности накопление препарата в неизмененных отделах средостения;
3 балла - накопление препарата в патологическом очаге выше, чем в средостении, но не превышает накопление препарата в правой доле печени;
4 балла - накопление препарата в патологическом очаге несколько выше, чем в печени;
5 баллов - накопление препарата в патологическом очаге значительно выше, чем в печени, или определяется появление новых патологических очагов, связанных с заболеванием.
Также введено понятие Х-баллов, характеризующих наличие очагов накопления Флудезоксиглюкозы [18F] неясного, скорее воспалительного генеза, связь которых с основным заболеванием маловероятна.
Интерпретация результатов ПЭТ по шкале Deauville проводится комплексно с учетом клинических и исходных ПЭТ-данных, этапа лечения, а также других показателей ответа на лечение.
Приложение Г3
ШКАЛА
KHORANA ДЛЯ ОЦЕНКИ РИСКА ВТЭО У ПАЦИЕНТОВ,
ПОЛУЧАЮЩИХ ХИМИОТЕРАПИЮ
Оригинальное название:
Источник: Development and Validation of a predictive model for chemotherapyassociated thrombosis. Blood. 2008; 111(10): 4902 - 4907 [143]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
ФАКТОРЫ РИСКА БАЛЛЫ
ФАКТОРЫ РИСКА БАЛЛЫ
Локализация опухоли
Очень высокий риск (желудок, поджелудочная железа)
2
Высокий риск (легкие, лимфома, кровь, яички, яичники, матка)
1
Количество тромбоцитов в крови перед началом химиотерапии ![]() 350 000/мл3
350 000/мл3
1
Уровень гемоглобина менее 10 г/дл или использование эритропоэтинов
1
Количество лейкоцитов в крови перед началом химиотерапии > 11 000/мл3
1
Ожирение (индекс массы тела выше 35 кг/м2) и выше
1
Риск развития ВТЭО
за 2 - 5 мес. (%)
Высокий риск, сумма баллов ![]() 3
3
6,7 - 7,1
Средний риск, сумма баллов 1 - 2
1,8 - 2
Низкий риск, сумма баллов 0
0,3 - 0,8
