"Клинические рекомендации "Неэпителильные опухоли яичников"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
НЕЭПИТЕЛИЛЬНЫЕ ОПУХОЛИ ЯИЧНИКОВ
МКБ 10: C56
Год утверждения (частота пересмотра): 2020
ID: КР541/1
URL
Профессиональные ассоциации
- Общероссийский национальный союз "Ассоциация онкологов России" - Общероссийская общественная организация "Российское общество клинической онкологии" - Общероссийская общественная организация "Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы"
Ключевые слова
Список сокращений
Р-ХГЧ - субъединица хорионического гонадотропина человека АФП - альфа-фетопротеин
АЧТВ - активированное частичное тромбопластиновое время ГОЯ - герминогенная опухоль яичников ГРГ - гонадо-релизинг гормон ГТ - гормонотерапия
КТ - компьютерная томография ЛДГ - лактатдегидрогеназа ЛТ - лучевая терапия ЛФК - лечебная физкультура
МНО - международное нормализованное отношение МРТ - магниторезонансная томография НОЯ - неэпителиальные опухоли яичников
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией
РФП - радиофармармацевтический препарат СА125 - опухолевый антиген 125 УЗДГ - ультразвуковая доплерография УЗИ - ультразвуковое исследование ХТ - химиотерапия
ЭГДС - эзофагогастродуоденоскопия HE4 - человеческий протеин эпидидимиса 4
Термины и определения
Неэпителиальные опухоли яичников - гетерогенная группа злокачественных опухолей яичников, исходящих не из покровного эпителия яичников.
Герминогенные опухоли яичников - редкие формы неэпителиальной опухоли яичников, которые представляют собой гетерогенную группу новообразований, развивающихся из так называемых "зародышевых клеток", то есть клеток, участвующих в формировании половых желез и процессах гаметогенеза.
Дисгерминома - наиболее часто встречающийся гистологический вариант злокачественных герминогенных опухолей яичников и представляет собой аналог семиномы у мужчин.
Недисгерминома - герминогенные опухоли, к которым относятся опухоли желточного мешка, эмбриональный рак, хориокарцинома, полиэмбриома, незрелая тератома, смешанная герминогенная опухоль.
Опухоли стромы и полового тяжа - составляют гетерогенную группу опухолей и различаются по их способности продуцировать стероидные гормоны.
Гранулезоклеточная опухоль яичника - это гормонально-активный тип опухоли яичников, происходящий из гранулярных клеток стромы.
Опухоли из клеток Сертоли-Лейдига - злокачественные андрогенпродуцирующие новообразования яичников, состоящее из клеток Сертоли, полового тяжа и стромальных клеток, аналогичным по строению клеткам Лейдига мужских гонад. Чаще встречается у женщин репродуктивного возраста.
Нейроэндокринные опухоли яичников - это редкие опухоли яичников, возникающие из клеток нейроэндокринной системы, принимающих непосредственное участие в регуляции гомеостаза путем паракринного и эндокринного механизмов воздействия.
Пререабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
I. этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания;
II. этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III. этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в т.ч. в условиях санаторнокурортных организаций).
1. Краткая информация
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Неэпителиальные опухоли яичников (НОЯ) - гетерогенная группа злокачественных опухолей яичников, исходящих не из покровного эпителия яичников.
1.2. Этиология и патогенез заболевания или состояния (группы заболевания или состояний)
Причина возникновения НОЯ до сих пор четко не установлена. Большинство НОЯ развиваются из специфических клеток яичника (герминогенных или "зародышевых", клеток гранулезы, тека-клеток, стромальных фибробластов и стероидных клеток) [1].
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
НОЯ составляют приблизительно 10% от всех злокачественных новообразований яичников. Ежегодно в Европе регистрируется 3,7 случая герминогенных опухолей яичников (ГОЯ) на 100 тыс. женщин и 2,1 случая гранулезоклеточных опухолей на 1 млн [1, 2]. Статистический учет заболеваемости НОЯ в РФ не ведется.
Герминогенные опухоли обычно диагностируются в первые 20 лет жизни, тогда как для опухолей стромы и полового тяжа характерен возраст 40 - 50 лет [1, 2]. Нейроэндокринные опухоли яичников встречаются не более, чем в 1% случаев, пик заболеваемости приходится на период пери- и постменопаузы [3].
1.4. Особенности кодирования заболевания или состояния (группы заболеваний состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Злокачественное новообразование яичников (C56)
1.5. Классификация заболевания или состояния (группы заболеваний или состояний.)
1.5.1. Международная гистологическая классификация (ВОЗ, 4-е издание, 2013 г.)
Герминогенные опухоли
9060/3 Дисгерминома
9071/3 Опухоль желточного мешка
9070/3 Эмбриональный рак
9100/3 Негестационная хориокарцинома
9080/0 Зрелая тератома
9080/3 Незрелая тератома
9085/3 Смешанная герминогенная опухоль
Монодермальная тератома/Соматический тип Опухоли, происходящие из дермоидной кисты
9090/0 Струма яичника доброкачественная 9090/3 Струма яичника злокачественная
8240/3 Карциноид
9091/1 Струмальный карциноид 8243/3 Муцинозный карциноид
Нейроэктодермальный тип
8410/0 Опухоль сальных желез (аденома)
8410/3 Опухоль сальных желез (карцинома)
Другие редкие монодермальные тератомы
8070/3 Плоскоклеточный рак
Герминогенные опухоли в сочетании с опухолями стромы и полового тяжа
9073/1 Гонадобластома, включающая гонадобластому с злокачественной герминогенной опухолью
8594/1 Смешанная герминогенная опухоль и опухоль стромы и полового тяжа, неклассифицируемая
Опухоли стромы и полового тяжа Стромальные опухоли:
8810/0 Фиброма
8810/1 Клеточная фиброма Cellular fibroma 8600/0 Текома
8606/0 Текома с лютеинизацией, ассоциированная со склерозирующим перитонитом 8810/3 Фибросаркома
8602/0 Склерозирующая стромальная опухоль
8590/0 Перстневидно-клеточная стромальная опухоль
8590/0 Микрокистозная стромальная опухоль
8650/0 Опухоль из клеток Лейдига
8760/0 Стериодноклеточная опухоль, доброкачественная
8760/3 Стериодноклеточная опухоль, злокачественная
Опухоли полового тяжа:
8620/3 Гранулезоклеточная опухоль взрослого типа 8622/1 Гранулезоклеточная опухоль ювенильного типа
8640/1 Опухоль из клеток Сертоли
8623/1 Опухоль полового тяжа с трубчатыми структурами
Смешанные опухоли стромы и полового тяжа
Опухоль из клеток Сертоли-Лейдига 8631/0 Высокодифференцированная 8631/1 Умереннодифференцированная 8634/1 С гетерологическими элементами
8631/3 Низкодифференцированная 8634/3 С гетерологическими элементами
8633/1 Ретиформная
8634/1 С гетерологическими элементами
8590/1 Опухоли стромы полового тяжа, не классифицируемые
(Пограничная - непредсказуемое течение)
0 - доброкачественная опухоль
1. - неопределенный потенциал злокачественности или пограничная
2. - карцинома in situ или интраэпителиальная неоплазия III степени
3. - злокачественная инвазивная опухоль
Нейроэндокринный рак
8041/3 Мелкоклеточный нейроэндокринный рак
1.5.2. Стадирование
Стадирование НОЯ проводится по аналогии с эпителиальными опухолями яичников по результатам патолого-анатомического исследования операционного (биопсийного) материала и интраоперационной ревизии по классификации FIGO (2014 г.) и TNM (8-е издание, 2017 г.) (табл. 1).
Таблица 1. Стадирование рака яичников по TNM (8-е издание, 2017 г.) и FIGO
TNM
FIGO
Расшифровка
T1
I
Опухоль ограничена яичниками
T1a
IA
Опухоль ограничена одним яичником, капсула не повреждена, нет опухолевых разрастаний на поверхности яичника, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости
T1b
IB
Опухоль ограничена двумя яичниками, их капсулы не повреждены, нет опухолевых разрастаний на поверхности яичников, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости
T1c
IC
Опухоль ограничена одним или двумя яичниками и сопровождается любым из следующих факторов
T1c1
IC1
Повреждение капсулы во время операции
T1c2
IC2
Повреждение капсулы до операции или опухоль на поверхности яичника/маточной трубы
T1c3
IC3
Злокачественные клетки в асцитической жидкости или смывах с брюшины
T2
II
Опухоль поражает один или два яичника с распространением на малый таз
T2a
IIA
Врастание и/или метастазирование в матку и/или в одну или обе маточные трубы
T2b
IIB
Распространение на другие ткани таза
T3 и/или N1
III
Опухоль поражает один или оба яичника с гистологически подтвержденными внутрибрюшинными метастазами за пределами таза и/или метастазами в регионарных лимфатических узлах (внутренних, наружных и общих подвздошных, запирательных, крестцовых или поясничных лимфоузлах)
N1
IIIA1
Метастазы только в забрюшинных лимфатических узлах
IIIA1(i)
Метастазы в лимфатических узлах размерами до 10 мм
IIIA(ii)
Метастазы в лимфатических узлах размерами более 10 мм
T3a
IIIA2
Микроскопические, гистологически подтвержденные внутрибрюшинные метастазы за пределами таза с/без метастазов в забрюшинных лимфатических узлах
T3b
IIIB
Макроскопические внутрибрюшинные метастазы за пределами таза до 2 см включительно в наибольшем измерении с/без метастазов в забрюшинных лимфатических узлах
T3c
IIIC
Внутрибрюшинные метастазы за пределами таза более 2 см в наибольшем измерении с/без метастазов в забрюшинных лимфатических узлах (включая распространение опухоли на капсулу печени и селезенки без поражения паренхимы органов)
M1
IV
Отдаленные метастазы (исключая внутрибрюшинные метастазы)
IVA
Плевральный выпот со злокачественными клетками
IVB
Метастазы в паренхиматозных органах и других органах вне брюшной полости (в том числе паховых лимфатических узлах и лимфатических узлах за пределами брюшной полости)
1.6. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
На ранних стадиях болезнь может протекать бессимптомно или с незначительными явлениями дискомфорта. Симптомами заболевания на всех стадиях также могут быть боли в малом тазу, дисменорея. При распространенном процессе заболевание манифестирует неспецифическими симптомами: увеличение живота в объеме, потеря веса, болевой синдром в животе, одышка, общая слабость.
2. Диагностика
Критерии установления заболевания или состояния
Диагноз устанавливается на основании:
анамнестических данных;
данных физикально-инструментального обследовании обследования;
морфологической верификации;
данных, полученных при лучевых методов иссследования пациентов, других уточняющих исследований, выполненных по показаниям.
2.1. Жалобы и анамнез
- Рекомендуется тщательный сбор жалоб и анамнеза у всех пациентов с целью выявления факторов, которые могут повлиять на выбор тактики лечения [4].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: На ранних стадиях болезнь может протекать бессимптомно или с незначительными явлениями дискомфорта. Начальными симптомами заболевания могут быть боли в малом тазу, дисменорея [4]. Особое внимание следует обращать на возраст, нарушения менструального цикла и семейный анамнез, т.к. герминогенные опухоли преимущественно выявляются у подростков и женщин молодого возраста. В некоторых случаях при НОЯ отмечается симптоматика, связанная с нехарактерной гормональной активностью.
2.2. Физикальное обследование
- Рекомендуется у всех пациентов с подозрением на НОЯ проводить тщательное физикальное обследование, включающее вагинальное и ректальное исследования, пальпацию органов брюшной полости, аускультацию и перкуссию легких [5, 6].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: особое внимание следует уделять внешнему виду пациентки во время осмотра и оценке состояния тяжести пациентки по версии ВОЗ/ECOG и/или шкале Карновского (см. приложение Г1-2), оценке алиментарного статуса. Также необходимо обратить внимание на температуру тела, болевой синдром, наличие плеврита, асцита. При нарушении менструального цикла требуется консультация ряда специалистов: гинеколога, эндокринолога, генетика.
2.3. Лабораторные диагностические исследования
При первичной диагностике рекомендуется выполнять:
- общий (клинический) анализ крови развернутый (гемоглобин, гематокрит, эритроциты, средний объем эритроцитов, распределение эритроцитов по величине, среднее содержание гемоглобина в эритроцитах, средняя концентрация гемоглобина в эритроцитах, тромбоциты лейкоциты, лейкоцитарная формула, скорость оседания эритроцитов);
- анализ крови биохимический общетерапевтический с оценкой показателей функции печени, почек (общий белок, глюкоза, креатинин, мочевина, железо, аланинаминотрасфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин общий, лактатдегидрогеназа (ЛДГ), щелочная фосфатаза (ЩФ), электролиты плазмы (калий, натрий, хлор);
- общий (клинический) анализ мочи (определение цвета, прозрачности мочи, ее удельного веса, белка в моче, pH, глюкозы, кетоновых тел, уробилиногена, лейкоцитарной эстеразы, путем аппаратной микроскопии-клеток эпителия, эритроцитов, цилиндров, соли, слизи, бактерий и грибов),
- исследование уровня показателей свертывающей системы крови (исследование уровня фибриногена в крови, определение международного нормализованного отношения (МНО), определение протромбинового (тромбопластинового) времени в крови или в плазме, активированное частичное тромбопластиновое время (АЧТВ), определение тромбинового времени в крови, определение концентрации Д-димера в крови, по показаниям, дополнительно-определение активности антитромбина III в крови, исследование уровня ингибитора активаторов плазминогена в крови).
- панель онкомаркеров (исследование уровня альфа-фетопротеина (АФП) в сыворотке крови, исследование уровня хорионического гонадотропина в крови (Р-ХГЧ) и ЛДГ, исследование уровня антигена аденогенных раков CA 125 в крови, определение секреторного белка эпидидимиса человека 4 (HE4) в крови, исследование уровня ингибина B в крови, исследование уровня антимюллерова гормона в крови) всем пациентам с подозрением НОЯ [7 - 10, 45, 115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Увеличение показателей уровня АФП, fi-ХГЧ и ЛДГ выше референсных значений характерен для ГОЯ. Продуцирование АФП более соответствует проявлениям опухоли желточного мешка, ft-ХГЧ - для хорионкарциномы. Повышение АФП и в-ХГЧ свойственно эмбриональному раку и полиэмбриоме. Около одной трети незрелых тератом продуцируют АФП [12].
Диагноз "дисгерминома" устанавливают не только на основании морфологического заключения. Для этого необходимы нормальный уровень АФП и уровень в-ХГЧ, не превышающий 200 Ед/мл. В остальных случаях опухоль должна трактоваться как недисгерминома и лечиться соответственно. Наличие повышенных уровней АФП или fi-ХГЧу пациентов со зрелой тератомой свидетельствует о наличии в опухоли злокачественного компонента. Такие пациентки должны лечиться по принципам терапии недисгерминомы.
Уровень CA-125 и HE4 может незначительно повышаться при герминогенных опухолях и карциносаркомах и данные маркеры не имеют диагностическое значение при герминогенных опухолях, гранулезоклеточных опухолях и опухолях стромы и полового тяжа.
У ингибина B высокая специфичность как опухолевого маркера. При типичной гранулезоклеточной опухоли повышение уровня ингибина B отмечается практически у всех пациентов и его концентрация в сыворотке крови находится в прямой зависимости от статуса опухоли. В редких случаях ингибин B может отсутствовать, что является признаком крайней злокачественности. Концентрация антимюллерова гормона при гранулезоклеточной опухоли менее показательна [4].
- Всем пациентам с подозрением на НОЯ рекомендуется исследование уровня общего тестостерона в крови и уровня общего эстрадиола в крови с целью верификации диагноза и определения тактики дальнейшего лечения [12, 13, 119, 107].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: часто опухоли стромы и полового тяжа характеризуются наличием тестикулярных структур, которые продуцируют половые гормоны [12, 13]. При опухолях из клеток Сертоли-Лейдига и других гормоноактивных опухолях может повышаться уровень общего тестостерона и эстрадиола в крови (вирилизация отмечается у 70 - 85% пациентов) [106, 107].
- Всем пациентам с подозрением на НОЯ рекомендуется исследование уровня общего кальция в крови с целью верификации диагноза и определения тактики дальнейшего лечения [124, 125, 126].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Гиперкальциемия встречается в 70% случаев при мелкоклеточном раке яичников гиперкальциемического типа, что позволяет заподозрить данную опухоль еще на этапе комплексного обследования [13].
- Всем пациентам с НОЯ после хирургического вмешательства рекомендовано повторное исследование уровня АФП в крови, исследование уровня Р-ХГЧ, если они были повышены исходно с целью определения тактики дальнейшего ведения и прогноза заболевания [7, 32, 118].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Сохраняющиеся повышенными уровни маркеров свидетельствует о наличии резидуальной опухоли.
- Рекомендуется всем пациентам перед каждым курсом ХТ выполнять исследование уровня АФП в сыворотке крови, исследование уровня Р-ХГЧ с целью верификации диагноза и определения тактики дальнейшего ведения [30, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: у пациентов с недисгерминомой увеличение в размерах или появление новых очагов при снижающихся или нормальных на фоне терапии опухолевых маркерах (АФП и в-ХГЧ) далеко не всегда является проявлением прогрессирования (синдром растущей зрелой тератомы). В данных ситуациях необходимо завершение начатого запланированного объема ХТ с последующим хирургическим удалением опухоли.
2.4. Инструментальные диагностические исследования
- Рекомендуется ультразвуковое исследование органов малого таза, брюшной полости, почек, забрюшинного пространства [11, 44, 45, 108].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: УЗИ - наиболее простой метод визуализации образований в брюшной полости, полости малого таза и забрюшинном пространстве, однако он значительно уступает КТ/МРТ при оценке распространенности процесса.
- Рекомендовано выполнить КТ органов грудной клетки, КТ/МРТ исследования брюшной полости, забрюшинного пространства и органов малого таза с внутривенным контрастированием пациентам с НОЯ и подозрением на НОЯ с целью верификации диагноза и определения дальнейшей тактики лечения [8, 15 - 17, 45, 108].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: КТ с внутривенным контрастированием является наиболее точным методом диагностики для определения распространенности опухолевого процесса, а также эффективности проводимого лечения.
- Рекомендуется выполнить рентгенографию органов грудной клетки всем пациентам с НОЯ при невозможности выполнить КТ исследование органов грудной клетки [16, 18, 45, 68].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: КТ органов грудной клетки с большей чувствительностью и специфичностью способно выявить метастазы в легких, а также в лимфоузлах средостения.
- При подозрении на отдаленное метастазирование у пациентов с НОЯ рекомендуется проведение ПЭТ/КТ [45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: ПЭТ/КТ может быть полезно у пациентов с ГОЯ для определения диссеминации процесса.
- При высоком уровне Р-ХГЧ (свыше 50 000 мМЕ/мл) или множественных метастазах в легкие в связи с высоким риском метастатического поражения головного мозга рекомендовано МРТ головного мозга [115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с НОЯ или подозрением на НОЯ рекомендуется выполнить эзофагогастродуоденоскопию (ЭГДС) в целях исключения первичной опухоли желудочно-кишечного тракта (ЖКТ) и оценки наличия сопутствующих заболеваний ЖКТ [115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: ЭГДС - обязательный метод исследования пациентов с подозрением на НОЯ, позволяющий исключить вторичное (метастатическое) поражение яичников при злокачественных новообразованиях (ЗНО) ЖКТ.
- Всем пациентам с НОЯ или подозрением на НОЯ рекомендуется выполнить колоноскопию в целях дифференциальной диагностики с ЗНО ЖКТ и оценки наличия сопутствующих заболеваний ЖКТ [115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.5. Иные диагностические исследования
- Рекомендуется перед началом противоопухолевого лечения всем пациентам с НОЯ по назначению врача-терапевта, врача-анестезиолога и остальных врачей-специалистов (невролога, кардиолога, эндокринолога, уролога, сосудистого хирурга, эндоскописта и т.д.) проводить дополнительное обследование в рекомендуемом объеме с целью выявления у пациентов сопутствующей соматической патологии и профилактики жизнеугрожающих состояний [115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с НОЯ моложе 40 лет с первичной аменореей консультация врача-генетика с целью исследования кариотипа для исключения дисгенезии гонад (синдром Swire ХУ-генотип). [109].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В связи с редкостью и сложностью морфологической верификации рекомендован пересмотр стекол и блоков в медицинской организации, оказывающей медицинскую помощь по профилю онкология, имеющем опыт лечения пациентов с НОЯ, для подтверждения морфологического диагноза [45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с НОЯ и подозрением на НОЯ с целью морфологической верификации диагноза проводить патолого-анатомическое исследование биопсийного (операционного) материала яичника с отражением в заключении следующих параметров [3, 8, 14]:
- размеры опухоли, повреждение капсулы или распространение опухоли на капсулу;
- гистологическое строение опухоли;
- степень злокачественности опухоли;
- наличие злокачественных клеток в каждом отдельно взятом биоптате брюшины, а также большом сальнике;
- указание общего числа исследованных и пораженных лимфоузлов;
- степень лечебного патоморфоза в случае проведенной химиотерапии [3, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий:
- Часто пациентов с герминогенными опухолями оперируют экстренно в гинекологических стационарах в связи с выраженным болевым синдромом в следствии разрыва капсулы, кровоизлияния или перекрута ножки опухоли. В большинстве случаев морфологическая верификация диагноза может быть получена во время хирургического этапа лечения или диагностической лапароскопии.
- При распространенном опухолевом процессе и начале системного лечения по жизненным показаниям у пациентов герминогенными опухолями для постановки диагноза достаточно наличие высокого уровня маркеров АФП и/или (3-ХГЧ.
- В отдельных ситуациях опухоли яичников могут иметь внегонадное расположение, в этом случае рекомендовано выполнение биопсии под контролем УЗИ/КТ первичного очага.
- При необходимости морфологической верификации диагноза паталого-анатомическое исследование биопсийного (операционного) материала может дополняться иммуногистохимическим типированием, особенно, при ГОЯ и опухолях стромы полового тяжа.
- Рекомендуется у всех пациентов с НОЯ при наличии выпота в брюшной и/или плевральной полостях его аспирация для цитологического исследования, цитологическое исследование микропрепаратов тканей брюшины с целью уточнения стадии заболевания и определения дальнейшего алгоритма лечения [2, 10, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с ПОЯ и подозрением на ПОЯ цитологическое исследование микропрепаратов шейки матки, цервикального канала и цитологическое исследование аспирата из полости матки с целью верификации диагноза [3, 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется по окончании ХТ всем пациентам с НОЯ повторить КТ исходных зон поражения [45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3. Лечение
3.1. Герминогенные опухоли яичника
3.1.1. Хирургическое лечение герминогенных опухолей яичников
- Пациентам, желающим сохранить фертильность, вне зависимости от распространенности процесса рекомендуется односторонняя сальпингоовариоэктомия [7 - 10, 16, 18, 22, 23, 27 - 31, 110].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 3).
- Пациентам, не желающим сохранить фертильность, вне зависимости от распространенности процесса рекомендуется выполнение экстирпации матки с придатками [7 - 10, 16, 18, 22, 23, 27 - 31, 110].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 3).
Комментарии: Хирургическое стадирование имеет большое значение для определения тактики последующего лечения. Хирургическое лечение включает срединную или нижнесрединную лапаротомию. Лапароскопический доступ возможен при ранней стадии болезни и опухоли яичников небольшого размера. Срочное интраоперационная гистологическое исследование удаленного яичника является обязательным для определения адекватного хирургического объема.
Односторонняя сальпингоовариоэктомия является рекомендуемым объемом хирургического вмешательства вне зависимости от распространенности процесса у пациентов, желающих сохранить фертильность. У пациентов без репродуктивного потенциала или не желающих сохранить фертильность рекомендуется выполнение экстирпации матки с придатками. Резекция контралатерального яичника выполняется только при макроскопических признаках поражения. При дисгенезии гонад (кариотип XY, устанавливается на этапе обследования генетиком) производят двустороннюю аднексэктомию. Выполнение оменэктомии по поперечной ободочной кишке рекомендовано с целью стадирования. Для определения стадии болезни также обязателен забор смывов с париетальной брюшины диафрагмы, латеральных каналов, малого таза для дальнейшего цитологического исследования, производится биопсия подозрительных участков брюшины. Подвздошная и/или парааортальная лимфодиссекция выполняется только у пациентов при наличии увеличенных лимфоузлов. Принцип хирургического лечения включает удаление всех видимых метастатических образований без резекции смежных органов. Учитывая высокую чувствительность опухоли к химиотерапии, объем циторедуктивного вмешательства не должен носить калечащего характера, а также не приводить к потенциальному росту частоты послеоперационных осложнений, которые могут задержать начало химиотерапии.
При неадекватном стадировании повторная циторедукция с целью рестадирования рекомендуется только в случае, если в дальнейшем может рассматриваться такая опция как наблюдение.
3.1.2. Тактика лечения после хирургического стадирования
Дальнейшая лечебная тактика зависит от гистологического типа опухоли и стадии заболевания. Все ГОЯ разделяются на два подтипа: "дисгерминома", диагноз которой устанавливается на основании морфологического заключения и данных маркеров (АФП в пределах нормальных значения, Р-ХГЧ не должен превышать 200 мМЕ/мл). К "недисгерминоме" относят незрелую тератому, опухоль желточного мешка, эмбриональный рак, хорионкарциному, полиэмбриому, смешанную герминогенную опухоль. Лечение других видов "недисгерминомы", за исключением незрелой тератомы, аналогично лечению опухоли желточного мешка. В случае смешанного типа ГОЯ лечение планируется по наиболее неблагоприятному варианту [17, 21]. В таблице 2 представлена тактика лечения после стадирования пациентов ГОЯ.
Редкость герминогенных опухолей осложняет проведение крупных клинических исследований, поэтому вся доказательная база по химиотерапии (ХТ) экстраполирована из клинических исследований при герминогенных опухолях у мужчин, поскольку эти опухоли имеют единую природу гистогенеза, но у мужчин такие опухоли встречаются чаще, чем у женщин и их терапия основана на более обширной доказательной базе.
Таблица 2. Тактика лечения пациентов ГОЯ после хирургического стадирования
Вид ГОЯ
Стадия заболевания
IA G1
IA G2-3
IB - IC
IIA - IV
Дисгерминома
Наблюдение
2 курса карбоплатин AUC7
3 курса BEP
Незрелая тератома
Наблюдение
3 курса BEP
3 курса BEP
3 - 4 курса BEP <*>
Опухоль желточного мешка
3 курса BEP
3 курса BEP
3 курса BEP
3 - 4 курса BEP <*>
--------------------------------
<*> При отсутствии резидуальной опухоли показано 3 курса химиотерапии (ХТ) по схеме BEP, при наличии резидуальной опухоли рекомендовано 4 курса ХТ по схеме BEP.
3.1.2.1. Лечение дисгерминомы
- IA стадия. При адекватном стадировании и подтверждении IA стадии дисгерминомы яичников рекомендовано динамическое наблюдение (график наблюдения см. пункт 3.1.3) [32, 33, 111].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- IB - IC стадии. При адекватном стадировании и подтверждении у пациентов IB - IC стадии дисгерминомы, а также пациентам с I стадией без адекватного хирургического стадирования рекомендовано 2 курса адъювантной ХТ карбоплатином** в монорежиме AUC 7 [45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: при неадекватном стадировании целесообразно применение режима BEP.
- IIA - IV стадии. Рекомендовано проведение 3 курсов ХТ по схеме BEP [7, 45]. Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: при наличии повышенном уровне ЛДГ выше 2 верхних границ нормы или при наличии висцеральных метастазов рекомендуется проведение 4 курсов BEP [7].
3.1.2.2. Лечение незрелой тератомы
- IA G1 стадия. При адекватном стадировании и подтверждении IA G1 стадии незрелой тератомы яичников рекомендовано динамическое наблюдение (график наблюдения см. пункт 3.1.3) [4, 36, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- IA G2-IC стадии. Рекомендовано проведение ХТ по схеме BEP (3 курса) [4, 45]. Уровень убедительности рекомендаций - С (уровень достоверности докозательств - 5).
- IIA - IV стадии. Рекомендовано проведение ХТ по схеме BEP [6, 7, 11, 17, 35, 45]. Уровень убедительности рекомендаций - С (уровень достоверности докаозательств - 5).
Комментарий: число курсов химиотерапии зависит от наличия резидуальной опухоли после хирургического лечения: при отсутствии резидуальной опухоли показано 3 курса ХТ по схеме BEP, при наличии остаточной опухоли рекомендовано проведение 4 курсов ХТ по схеме BEP. Наличие повышенных уровней опухолевых маркеров АФП или ХГЧ свидетельствует о наличии резидуальной опухоли.
3.1.2.3. Опухоль желточного мешка
Опухоль желточного мешка относится к подтипу опухоли неблагоприятного прогноза.
- Пациентам с опухолей желточного мешка рекомендовано назначение химиотерапии при любой стадии заболевания [36, 113].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Пациентам с ранними стадиями и/или отсутствием резидуальной опухоли рекомендовано 3 курса ХЕ по схеме ВЕР [113].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Пациентам с ранними стадиями при наличии резидуальной болезни рекомендовано 4 курса ХТ по схеме BEP [113].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.1.3. Принципы динамического наблюдения после хирургического лечения при IA стадии у пациентов дисгерминомой и незрелой тератомой
- Пациентам рекомендовано тщательное динамическое наблюдение согласно графику при условии выполненного хирургического стадирования [45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: график наблюдения при дисгерминоме (проводится в условиях поликлиники территориального онкологического диспансера или у районного врача-онколога). Физикальный и гинекологический осмотр, уровни АФП, fi-ХГЧ, ЛДГ; УЗИ органов брюшной полости и малого таза каждые 3 месяца в течении 1-го года; каждые 4 месяца - 2-й и 3-й год; каждые 6 месяцев - 4-й год; далее - ежегодно (до 10 лет). Рентгенография или КТ органов грудной клетки выполняется каждые 6 месяцев первые два года, далее ежегодно (до 5 лет).
График наблюдения при незрелой тератоме: физикальный и гинекологический осмотр, уровни АФП, fl-ХГЧкаждые 1 - 2 месяца; УЗИ органов брюшной полости и малого таза каждые 2 месяца в течении 1-го года; каждые 3 месяца - 2-й и 3-й год; каждые 6 месяцев - 4-й год; далее - ежегодно (до 10 лет). Рентгенография или КТ органов грудной клетки выполняется каждые 6 месяцев первые два года, далее ежегодно (до 5 лет).
3.1.4. Принципы проведения химиотерапии
ХТ после проведения хирургического этапа лечения и интраоперационого стадирования целесообразно начинать, при возможности, в кратчайшие сроки, до 10 - 14 дня. [16, 40] по схемам, указанным в. табл. 3.
- При противопоказаниях к назначению блеомицина** рекомендуется проведение ХТ по программе EP в количестве 3 при отсутствии остаточной опухоли и 4 курсов при наличии остаточной опухоли [6, 18, 23, 45, 114].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: вследствие развития поздней токсичности блеомицина** в виде пульмонитов, исключить блеомицин** из схемы терапии рекомендовано пациентам старше 40 лет или с ранее перенесенными заболеваниями легких. У пациентов с распространенной недисгерминомой равноэффективной, но более миелотоксичной альтернативой режиму ВЕР является комбинация PEI (этопозид**, цисплатин**, ифосфамид**).
Таблица 3. Основные режимы 1 линии химиотерапии при герминогенных опухолях [109].
Режим
Препараты
Введение
Дни лечения
Блеомицин** <%> 30 мг
в/в, 2 20 мин
1, 3, 5 дни
BEP [109]
Этопозид** 100 мг/м2
в/в, 40 мин
1 - 5 дни
Цисплатин** <§> 20 мг/м2
в/в 1 час
1 - 5 дни
EP [109]
Этопозид** 100 мг/м2
Цисплатин** <§> 20 мг/м2
в/в, 40 мин
1 - 5 дни
в/в 1 час
1 - 5 дни
Этопозид** 75 мг/м2
в/в, 40 мин
1 - 5 дни
PEI [109]
Ифосфамид** 1200 мг/м2
в/в, 1 - 2 часа
1 - 5 дни
Цисплатин** <§> 20 мг/м2
в/в, 1 ч
1 - 5 дни
Месна***
в/в, струйно*
1 - 5 дни
--------------------------------
<%> блеомицетина гидрохлорид (изомер A5) и блеомицина сульфат (смесь изомеров A2 и B2) не являются идентичными лекарственными средствами. При использовании блеомицина сульфата в режиме ВЕР используются дозы по 30 мг 1, 3, 5 (или 1, 8, 15 дни).
При использовании менее изученного блеомицетина гидрохлорида используются меньшие на 30 - 40% курсовые дозы препарата, например, по 30 мг 1, 5 дни;
§введение цисплатина** осуществляется на фоне внутривенной гидратации физиологическим раствором натрия хлорида ** (суммарный суточный объем 2,5 л), необходимой для поддержания диуреза >100 мл/час в процессе введения цисплатина** и в последующие 3 часа;
месна** применяется в суточной дозе, составляющей 100% от дозы ифосфамида** и разделенной на три введения в течение дня: непосредственно перед ифосфамидом** и далее через 4 и 8 часов после начала его инфузии.
Все циклы химиотерапии проводятся каждые 3 недели (считая от начала предыдущего курса химиотерапии). Возможна задержка очередного курса лечения при наличии инфекции, нейтропении менее 500/мкл или тромбоцитопении менее 50 000/мкл в первый день планируемого курса (см. таблицу редукции доз препаратов). Если при проведении предыдущего курса химиотерапии отмечена фебрильная нейтропения, нейтропения IV степени длительностью свыше 7 дней или осложненная инфекцией, обосновано профилактическое назначение Г-КСФ при проведении всех последующих курсов химиотерапии. У пациентов в тяжелом общем состоянии, обусловленном распространенностью опухолевого процесса, первый курс может быть проведен в редуцированном на 40 - 60% виде (например, этопозид** и цисплатин** в течение двух дней) [4, 11, 21, 24, 35, 40 - 44, 121]. Алгоритм редукции доз представлен в таблице 4.
Таблица 4. Алгоритм редукции доз химиопрепаратов в режиме BEP в зависимости от гематологической токсичности <*> [6]
Число тромбоцитов, * 109/л
> 100
75 - 99
50 - 74
< 50
Число нейтрофилов, * 109/л
Этопозид**
Цисплатин**
Этопоз ид**
Циспла тин**
Этопозид**
Цисплатин**
Этопозид**
Цисплатин**
> 1,0
100%
100%
75%
100%
50%
100%
отсрочка на 4 дня
0,5 - 0,99
100%
100%
50%
100%
отсрочка на 4 дня
отсрочка на 4 дня
< 0,5
отсрочка на 4 дня
отсрочка на 4 дня
отсрочка на 4 дня
отсрочка на 4 дня
--------------------------------
<*> определяется по анализам на день начала очередного курса химиотерапии, указан % дозы препарата.
- Необходимо перед каждым курсом 1 линии ХТ определять опухолевые маркеры, по окончании химиотерапии - повторить КТ исходных зон поражения для определения дальнейшей тактики лечения [18, 19, 22, 23, 30 - 32, 37].
- У пациентов с недисгерминомой увеличение в размерах или появление новых очагов при снижающихся или нормальных на фоне терапии опухолевых маркерах (АФП и ХГЧ) далеко не всегда является проявлением прогрессирования (синдром растущей зрелой тератомы). В данных ситуациях необходимо завершение начатого запланированного объема химиотерапии с последующим хирургическим удалением опухоли.
3.1.5. Лечение остаточной опухоли после химиотерапии
- При наличии остаточной опухоли при дисгерминоме (по брюшине, в забрюшинных лимфоузлах, легких, лимфоузлах средостения и др.) после завершения ХТ и нормализации опухолевых маркеров дальнейшее лечение не рекомендуется, рекомендуется динамическое наблюдение [11].
Уровень убедительности рекомендаций - 5 (уровень достоверности доказательств - C).
Комментарий: при размере остаточной опухоли > 3 см возможно выполнение ПЭТ/КТ. При патологическом накоплении радиофармармацевтического препарата (РФП) в остаточной опухоли целесообразно ее удаление. При отказе пациентки или технической невозможности хирургического лечения рекомендуется повторное ПЭТ/КТ через 2 - 3 месяца. При сохраняющемся повышенном уровне накопления целесообразно повторно рассмотреть вопрос о хирургическом лечении или динамическое наблюдение.
- При наличии остаточной опухоли при недисгерминоме (по брюшине, в забрюшинных лимфоузлах, легких, лимфоузлах средостения и др.) < 1 см после завершения химиотерапии и нормализации опухолевых маркеров дальнейшее лечение не рекомендуется, рекомендуется динамическое наблюдение [11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: при размере остаточной опухоли > 1 см показано ее удаление. В случае поражения нескольких анатомических областей хирургическое лечение начинается с зоны максимального поражения. Пациентки с полным регрессом, либо те, у которых в резецированной резидуальной опухоли обнаружены некроз или тератома, подлежат наблюдению. В сомнительных случаях при наличии небольшой опухоли и нормальном уровне маркеров рекомендована консультация в экспертном центре.
- При обнаружении в остаточной опухоли элементов злокачественной герминогенной опухоли рекомендуется проведение химиотерапии второй линии (режимы TIP или VelPy. 2 курса в случае радикального объема операции, 4 курса - при нерадикальном хирургическом вмешательстве [21, 29, 35, 45 - 48, 115, 109].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.1.6. Лечение рецидивов герминогенных опухолей
- Перед началом химиотерапии рецидива рекомендуется исключить синдром "растущей зрелой тератомы" - появление или увеличение в размерах метастазов на фоне снижающихся/нормальных опухолевых маркеров [109].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В случае подтверждения синдрома синдром "растущей зрелой тератомы" всем пациентам рекомендуется хирургическое лечение в виде резекции метастазов или, при невозможности, их биопсии [115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: При подтверждении данного синдрома химиотерапия не показана.
- При рецидиве герминогенных опухолей рекомендуется химиотерапия на основе комбинации ифосфамида** и цисплатина ** (табл. 5) [6, 42 - 44].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии:
Оптимальный режим ХТ - TIP, позволяющий добиться длительной выживаемости у 25% пациентов. Альтернативой может служить режим VeIP. Обычно проводится 4 цикла [45, 47]. Не показано преимущество того или иного режима в качестве второй линии терапии.
Таблица 5. Режимы химиотерапии, используемые при лечении рецидивов ГОЯ
Режим
Препараты
Введение
Дни лечения
Показания
Режимы второй линии химиотерапии
TIP
Паклитаксел** 175 мг/м2
в/в, 3 ч
1 день
4 курса -
[123,
Ифосфамид** 1500 мг/м2
в/в, 1 - 2 ч
2 - 5 дни
предпочтительный
115]
Цисплатин* <^> ** 25 мг/м2
в/в, 1 ч
2 - 5 дни
режим второй линии, длительность курса - 21 день
Месна <§> **
в/в, струйно*
2 - 5 дни
#Филграстим** 5 мкг/кг
п/к
6 - 15 дни
PEI
Этопозид** 75мг/м2
в/в, 40 мин.
1 - 5 дни
4 курса -
[116]
Ифосфамид** 1200 мг/м2
в/в, 1 - 2 часа
1 - 5 дни
предпочтительный режим второй линии, длительность курса - 21 день
Цисплатин** 20 мг/м2
в/в, 1 ч
1 - 5 дни
Месна**
в/в, струйно*
1 - 5 дни
VeIP
Ифосфамид ** 1200 мг/м2
в/в, 1 - 2 часа
1 - 5 дни
4 курса -
[48,
Месна**
в/в, струйно*
1 - 5 дни
стандартный
116]
Цисплатин** 20 мг/м2
в/в, 1 час
1 - 5 дни
режим второй линии, длительность курса - 21 день
Винбластин** 0,11 мг/кг
в/в струйно
1, 2 дни
#Филграстим** 5 мкг/кг
п/к
6 - 15 дни
Режимы третьей линии химиотерапии
TGO [123]
Паклитаксел** 80 мг/м2
в/в, 1 час
1,8 дни
4 длительность - 21 день
курса, курса
#Гемцитабин** 800 мг/м2
в/в, 30 мин
1,8 дни
#Оксалиплатин** мг/м2
130
в/в, 2 ч
1 день
GemOX
#Гемцитабин**
1000
в/в, 1 час
1,8 дни
4
курса,
[123]
мг/м2
#Оксалиплатин** мг/м2
130
в/в, 30 мин
1 день
длительность - 21 день
курса
--------------------------------
<^> введение цисплатина осуществляется на фоне внутривенной гидратации физиологическим раствором хлорида натрия (суммарный суточный объем 2,5 л), необходимой для поддержания диуреза > 100 мл/час в процессе введения цисплатина и в последующие 3 часа;
<§> месна применяется в суточной дозе, составляющей 100% от дозы ифосфамида и разделенной на три введения в течение дня: непосредственно перед ифосфамидом и далее через 4 и 8 часов после начала его инфузии.
- После завершения химиотерапии пациентам по поводу рецидива НОЯ рекомендовано хирургическое удаление всей резидуальной опухоли [45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В случае роста АФП и/или Р-ХГЧ несмотря на проводимую терапию, в случае исчерпанности возможностей химиотерапии, локализации опухоли в одной анатомической области рекомендуется ее удаление [21, 24, 42, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: этот подход дает шанс излечить около 25% пациентов, особенно с поздними рецидивами, умеренно повышенным уровнем АФП и забрюшинной локализацией резидуальной опухоли. При бурном прогрессировании с ростом fi-ХГЧ оперативное лечение бессмысленно. [46]
- В лечении поздних рецидивов герминогенных опухолей (после 2 лет по окончании предшествующей химиотерапии) рекомендуется хирургическое лечение [15, 42, 45, 54, 106].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: доля поздних рецидивов от общего числа рецидивов не превышает 5%. Особенностью поздних рецидивов является низкая чувствительность к химиотерапии, что позволяет рекомендовать в случае потенциально резектабельных опухолей на первом этапе выполнять хирургическое лечение даже в случае повышенных маркеров. При невозможности радикального удаления опухоли и повышенных маркерах необходимо начинать химиотерапию второй линии с последующим выполнением операции.
3.2. Опухоли стромы и полового тяжа
3.2.1. Хирургическое лечение опухолей стромы и полового тяжа
- Рекомендовано всем пациентам с опухолями стромы полового тяжа хирургическое лечение с использованием лапаратомического доступа в объеме экстирпации матки с придатками, удаления большого сальника, выполнения процедур хирургического стадирования, в случае их увеличения лимфатических узлов (тазовых, парааортальных) - удаления лимфатических узлов [40].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарии: лапароскопический доступ целесообразен на ранних (IA - IB) стадиях при опухолях небольших размеров. Биопсию контралатерального яичника выполнять нецелесообразно, если он визуально не изменен.
- У молодых пациентов с нереализованным репродуктивным потенциалом при ранней стадии (при одностороннем поражении яичников) заболевания рекомендовано выполнение органосохранной операции в объеме удаления придатков матки со стороны поражения, большого сальника, выполнение процедур стадирования [40].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарий: с учетом высокой вероятности одностороннего поражения яичника и молодого возраста заболевших при опухолях стромы полового тяжа преимущество отдается органосохраняющим объемам хирургического вмешательства. Оценить состояние эндометрия. При УЗИ признаках для исключения патологического процесса эндометрия рекомендована аспирационная биопсия эндометрия или раздельное диагностическое выскабливание. Биопсию контралатерального яичника выполнять нецелесообразно, если он визуально не изменен.
3.2.2. Опухоли полового тяжа (гранулезоклеточная опузоль)
- При IA - B стадии и адекватном стадировании опухолей стромы и полового тяжа рекомендовано наблюдение после хирургического вмешательства [45], при размерах опухоли более 10 - 15 см показана адъювантная ХТ [13, 17, 26, 45, 54, 56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При I стадии при наличии факторов высокого риска рецидива рекомендовано проведение адъювантной химиотерапии [13, 17, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Для пациентов IC стадиями показания к адъювантной химиотерапии до конца не изучены. К факторам высокого риска при I стадии относятся:
разрыв опухоли, стадия IC, низкая дифференцировка опухоли, размер опухоли свыше 10 - 15 см.
- Адъювантная или терапия первой линии для IC - IV стадий при опухолях полового тяжа включает в себя 3 - 4 курса ХТ по схеме BEP или 6 курсов ХТ #карбоплатином** и #паклитакселом** [45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Возможность лечения локальных рецидивов необходимо обсудить на консилиуме с участием врача-радиолога.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.2.3. Лечение стромальных опухолей яичников (опухоли из клеток Сертоли-Лейдига)
- При IA стадии стромальных опухолей яичников рекомендовано динамическое наблюдение, у молодых пациентов с низкодифференцированной опухолью или при наличии гетерологичных элементов в опухоли) рекомендуется адъювантная химиотерапия по схеме BEP (3 курса), EP (4 курса) или 6 курсов по схеме #паклитаксел** и #карбоплатин** (табл. 6) [13, 45, 57].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Таблица 6. Режимы химиотерапии при опухолях стромы и полового тяжа
Режимы адъювантной/первой линии химиотерапии
BEP [123]
#Блеомицин <§> ** 30 мг в/в 2 - 20 мин в 1-й, 3-й и 5-й дни + #этопозид** 100 мг/м2 в/в 40 мин в 1 - 5-й дни + #цисплатин** 20мг/м2 в/в 2 ч в 1 - 5-й дни, 4 курса каждые 3 нед
CPtx [123]
#Карбоплатин** AUC6 в/в 1 ч в 1-й день + #паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день, 4 курса каждые 3 нед
EP [115,123]
#Этопозид** 100 мг/м2 в/в 40 мин в 1 - 5-й дни + #цисплатин** 20 мг/м2 в/в 2 ч в 1 - 5-й дни, 4 курса каждые 3 нед
Режимы ХТ при распространенных стадиях и рецидивах опухолей стромы и полового тяжа (у пациентов, получавших ранее режим BEP)
CPtx [123]
#Карбоплатин** AUC6 в/в 2 ч в 1-й день + #паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день, 4 - 6 курсов каждые 3 нед
TIP [115, 123]
#Паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день + #цисплатин** 25 мг/м2 в/в 2 ч во 2-5-й дни + #ифосфамид** 1500 мг/м2 в/в 2 ч во 2 - 5-й дни (+ месна по 400 мг/м2 в/в 3 раза в день во 2 - 5-й дни + Г-КСФ (#филграстим**) 5 мкг/кг п/к в 6 - 12-й дни), 4 курса каждые 3 нед
CDE [123]
#Циклофосфамид** 1000 мг/м2 в/в 30 мин в 1-й день + #доксорубицин** 45 мг/м2 в/в 10 - 20 мин в 1-й день + #этопозид** 100 мг/м2 в/в 40 мин в 1 - 3-й дни, 4 - 6 курсов каждые 3 нед
CAV [123]
#Циклофосфамид** 1000 мг/м2 в/в 30 мин в 1-й день + #доксорубицин** 50 мг/м2 в/в 10 - 20 мин в 1-й день + #винкристин** 1,4 мг/м2 в/в 1 мин в 1-й день, 4 - 6 курсов каждые 3 нед
Режимы лекарственной терапии II - III линий при распространенных стадиях и рецидивах опухолей стромы полового тяжа и стероидноклеточных опухолях
#Ифосфамид** 1,6 мг/м2 в/в в 1 - 3-й дни 1-часовая нфузия (+ #месна** из расчета 100% от дозы ифосфамида в/в стр одновременно с ним в 1 - 3-й дни) + #паклитаксел** 175 мг/м2 в/в 3 ч в 3-й день каждые 3 нед [115]
#Доцетаксел ** 75 мг/м2 в/в 1 ч каждые 3 нед [115]
#Бевацизумаб** 15 мг/кг в/в 30 - 90 мин каждые 3 нед [58]
#Тамоксифен**20 мг 2 раза в сутки ежедневно [115]
Ингибиторы ароматазы [130, 131, 115]
- #летрозол** 2,5 мг/сут внутрь ежедневно [130]
- #анастрозол** 1 мг/сут внутрь ежедневно [131]
- #эксеместан** 25 мг/сут внутрь ежедневно [115]
Аналоги ГРГ [51, 115, 132]
- #лейпрорелин** 3,75 мг в/м 1 раз в 28 дней [115]
- #гозерелин** 3,6мг п/к 1 раз в 28 дней ли 10,8 мг п/к 1 раз в 84 дня [132, 115]
- #бусерелин** 3,75 мг в/м 1 раз в 28 дней [115]
--------------------------------
<§> доза блеомицина могут быть уменьшены у пациентов старше 40 лет (например, отмена блеомицина на 4-м курсе). При использовании вместо блеомицина сульфата отечественного препарата блеомицетина гидрохлорида необходимо использовать меньшие на треть курсовые дозы препарата (например, по 30 мг 1-й и 5-й дни).
- У пациентов, начиная с IB - IV стадии, рекомендована адъювантная химиотерапия:
3 - 4 курса BEP или 6 курсов ХТ по схеме #паклитаксел** и #карбоплатин** [12, 45, 57].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.2.4. Лечение распространенных стадий и рецидивов опухолей стромы и полового тяжа
- В связи с низкой чувствительностью опухоли к цитостатическим агентам пациентам с распространенными стадиями и рецидивами опухолей стромы и полового тяжа рекомендовано рассматривать вопрос о целесообразности выполнения хирургического лечения с последующей химиотерапией [2, 14, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: наиболее эффективными являются оптимальные циторедуктивные операции. При распространенных стадиях и рецидиве заболевания на I этапе выполняется хирургическое вмешательство с последующими 3 - 4 курсами химиотерапии по схеме BEP или 6 курсами по схеме для РЯ - #паклитаксел** + #карбоплатин** (см. табл. 6) Если ранее проводилась терапия по схеме BEP, то возможны следующие комбинации лекарственного лечения по схемам для РЯ: "#паклитаксел** + #карбоплатин**" или "#циклофосфамид** + #доксорубицин** + #цисплатин**" (см. табл. 6). Есть данные об эффективности гормонотерапии (аналоги гонадотропин-релизинг гормона (ГРГ), антиэстрогенов, ингибиторов ароматазы) при гранулезоклеточных опухолях яичника [55]. Гранулезоклеточные опухоли могут рецидивировать спустя годы, вплоть до 20 лет, что требует длительного наблюдения за пациентами.
- Пациентам при отсутствии возможности хирургического лечения с последующей химиотерапией с массивными и остаточными опухолями, при рецидивахболезни рекомендована консультация врача-радиолога для решения вопроса о целесообразности проведения лучевой терапии в паллиативном режиме [128, 129].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.2.5. Нейроэндокринные опухоли (мелкоклеточный рак яичников гиперкальцемического типа)
Это редкий высоко агрессивный тип неэпителиальной опухоли яичников [24], требующий индивидуального клинического подхода к каждой пациентке, в связи с чем лечение целесообразно осуществлять в медицинской организации, имеющей опыт ведения таких пациентов [24].
- Рекомендовано пациентам при мелкоклеточном РЯ гиперкальцемического типа хирургическое лечение с выполнением лапаротомным доступом экстирпации матки с придатками, удаление большого сальника. выполнение процедур хирургического стадирования. Органосохранное лечение не рекомендовано [3, 59]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с IC - IV стадий рекомендована адъювантная или 1-я линия ХТ, включающая в себя препараты платины, например EP (режим дозирования см. таблицу 6) [59].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с мелкоклеточным РЯ при прогрессировании заболевания рекомендовано лечение аналогично мелкоклеточному раку легкого в виду их общности гистогенеза. [24, 26, 59].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.3 Обезболивание
Порядок и рекомендации по обезболиванию при НОЯ соответствуют рекомендациям, представленным в рубрикаторе "Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи" [http://cr.rosminzdrav.ru/#!/recomend/708].
3.4. Диетотерапия
- К настоящему моменту имеются данные о повышенном риске развития онкологических заболеваний у пациентов с избыточной массой тела (ожирением), в этой связи рекомендованы мероприятия, направленные на снижение избыточного веса пациентов до нормальных значений. Коррекция привычного рациона питания у таких пациентов будет способствовать профилактике осложнений проводимого лечения (хирургического, лекарственного или лучевого). [1]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
4. Реабилитация
4.1. Пререабилитация
Проведение пререабилитации значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкологического заболевания. Пререабилитация включает в себя физическую подготовку (лечебную физкультуру (ЛФК)), психологическую и нутритивную поддержку, информирование больных [63].
Физическая пререабилитация состоит из комбинации аэробной и анаэробной нагрузки. Подобная комбинация улучшает толерантность к физическим нагрузкам, улучшает качество жизни и увеличивает тонус мышц.
Увеличение физической активности за 2 недели до операции улучшает качество жизни в послеоперационном периоде, позволяя вернуться к полноценной повседневной активности уже через 3 недели после операции [64].
Повышенный уровень физической активности значительно улучшает качество жизни и выживаемость пациентов с РЯ [77].
- Всем пациентам с НОЯ рекомендуется проведение ЛФК на предоперационном этапе с целью уменьшения частоты и вероятности развития послеоперационных осложнений [65].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 3).
- Рекомендуется тренировка дыхательных мышц всем пациентам в ходе пререабилитации в целях снижения послеоперационных легочных осложнений и продолжительности пребывания в стационаре [63].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам рекомендуется психологическая поддержка в рамках пререабилитации в целях снижения послеоперационных легочных осложнений и продолжительности пребывания в стационаре [65].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 3).
Комментарий: психологическая поддержка улучшает настроение, снижает уровень тревоги и депрессии у пациентов. Пациентки, прошедшие курс психологической пререабилитации, лучше адаптируются к повседневной жизни после хирургического лечения
- Рекомендуется в психологической пререабилитации и поддержки пациентов использовать методики, направленные на работу со стрессом (методики релаксации, формирование позитивного настроя), в течение 40 - 60 минут 6 дней в неделю, которая начинается за 5 дней до операции и продолжается 30 дней после, что значительно улучшает качество жизни пациентов [66].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
4.2. I этап реабилитации при хирургическом лечении
- В целях уменьшения длительности пребывания пациентов в стационаре и частоты послеоперационных осложнений рекомендуется проводить реабилитацию пациентов при хирургическом лечении по программе fast track rehabilitation ("быстрый путь") и ERAS ("early rehabilitation after surgery" - "ранняя реабилитация после операции"), включающую в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, ранняя мобилизация (активизация и вертикализация) пациентов уже с 1 - 2 суток после операции не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций [67, 68].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется в рамках ранней реабилитации пациентов раннее начало выполнения комплекса ЛФК с включением в программу аэробной, силовой нагрузок и упражнений на растяжку в целях повышения физической выносливости пациентов. [69].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: Раннее начало ЛФК не увеличивает частоту послеоперационных осложнений, улучшая качество жизни.
- Рекомендуется применение побудительной спирометрии, подъем головного конца кровати более чем на 30 градусов, раннее начало дыхательной гимнастики, гигиена полости рта 2 раза в день и ранняя активизация пациентов в целях профилактики застойных явлений в легких и послеоперационной пневмонии в послеоперационном периоде [70].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется профилактика венозной тромбоэмболии (ранняя активизация, назначение антикоагулянтов с профилактической целью и ношение компрессионного трикотажа) у всех пациентов в послеоперационном периоде [71].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 3).
Комментарий; в послеоперационном периоде - более чем у 75% пациентов она выявляется более чем через 7 дней после операции, кроме того пациентки с РЯ, длительной госпитализацией и наличием венозной тромбоэмболии в анамнезе имеют повышенный риск ее развития.
- Всем пациентам рекомендуется купирование болевого синдрома в послеоперационном периоде осуществлять с использованием междисциплинарного подхода, а также помимо медикаментозной коррекции использовать следующие методы - физическую реабилитацию (ЛФК), лечение положением, психологические методы коррекции боли (релаксация), чрескожную электростимуляцию, аккупунктуру [72].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам рекомендуется проведение сеансов массажа медицинского, начиная со 2-х суток после операции в целях уменьшения интенсивности болевого синдрома, беспокойства, напряжения, улучшения качества жизни пациентки [73].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациента рекомендовано проведение психологической коррекции и методик релаксации в послеоперационном периоде, что позволяет снизить тревожность, напряжения пациентов, кратность обезболивания и улучшить качество жизни онкогинекологических пациентов [74].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
4.3. II этап реабилитации при хирургическом лечении
- Всем пациентам рекомендуется вести активный образ жизни после завершения лечения [75].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: ожирение и малоподвижный образ жизни после комплексного лечения РЯ являются самостоятельными факторами, ухудшающими качество жизни пациентов, приводя к дистрессу
- Всем пациентам рекомендуется физическая активность - сочетание силовых нагрузок, аэробных, упражнений на растяжку, что значительно улучшает качество жизни пациентов, позволяет контролировать вес [76].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам при возникновении лимфедемы нижних конечностей рекомендуется проводить полную противоотечную терапию, включающую в себя мануальный лимфодренаж, ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [78, 79].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Всем пациентам при возникновении лимфедемы нижних конечностей рекомендуется также назначить:
- перемежающую пневмокомпрессию конечностей в сочетании с полной противоотечной терапией [79]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5);
- низкоинтенсивную лазеротерапию в сочетании с полной противоотечной терапией [80]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - С);
- электротерапию в сочетании с полной противоотечной терапией [81]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2);
- низкочастотную магнитотерапию в сочетании с полной противоотечной терапией [82].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5);
- глубокую осцилляцию (массаж переменным электрическим полем) в сочетании с полной противоотечной терапией [83].
- Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам рекомендованы сеансы аккупунктуры, так как она значительно уменьшает слабость и улучшает качество жизни [84].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
4.4. III этап реабилитации при хирургическом лечении
Функциональные нарушения органов малого таза в значительной степени затрудняют социальную адаптацию пациентов с опухолями женской репродуктивной системы, приводя их к физической и психологической инвалидизации [89].
Здоровый образ жизни, ежедневная физическая нагрузка позволяет контролировать такие клинические проявления менопаузы, как депрессия, слабость, а также проводить профилактику сердечно-сосудистых осложнений и осложнений, связанных с остеопорозом, у пациентов после комбинированного лечения злокачественных новообразований [85, 86]. Повышение уровня физической активности положительно влияет на сексуальную функцию у пациентов с гинекологическим раком [88].
- Всем пациентам с гинекологическим раком на фоне менопаузы рекомендованы психологическая поддержка и информирование с целью улучшения качества [86].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам рекомендовано проведение периодических курсов медицинского массажа, так как они значительно улучшают качество жизни, уменьшая слабость, депрессию, клинические проявления менопаузы [95].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
4.5. Реабилитация при химиотерапии
- Рекомендовано всем пациентам ежедневное выполнение комплекса ЛФК в процессе комбинированного лечения и после его окончания - ежедневная физическая активность увеличивает мышечную силу, улучшает работу сердечно-сосудистой системы, уменьшает опасность развития тревоги и депрессии, уменьшает слабость, тошноту, рвоту, болевой синдром, улучшает настроение [91, 92].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарии: Дозированная, постепенно нарастающая физическая нагрузка улучшает переносимость химиотерапии у пациентов с онкогинекоогическими заболеваниями [92].
- Рекомендовано пациентам с анемией применение аэробной нагрузки на фоне высокодозной химиотерапии, так как аэробная нагрузка положительно влияет на уровень гемоглобина и эритроцитов и снижает длительность лейко- и тромбоцитопении [93].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Для уменьшения усталости, слабости и депрессии на фоне химиотерапии рекомендовано проведение ЛФК. Сочетание ЛФК с психологической поддержкой в лечении слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [94].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендовано для уменьшения усталости, слабости и депрессии проведение курса массажа медицинского пациентам в течение 6 недель на фоне комбинированного лечения [96].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: данная рекомендация сделана на основании результатов исследования влияния массажа на состояние пациентов с раком молочной железы, нет оснований предполагать, что данная терапия не будет эффективна у пациентов с РЯ.
- Рекомендованы упражнения на тренировку баланса для корекции полинейропатии, так как они более эффективны, чем сочетание упражнений на выносливость и силовых упражнений [97].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Пациентам, получающим ХТ, рекомендован курс терренного лечения (лечения ходьбой) длительностью 6 недель в целях контроля клинических проявлений полинейропатии [98].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендуется применение низкоинтенсивной лазеротерапии в лечении периферической полинейропатии на фоне химиотерапии [99].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендована низкочастотная магнитотерапия для лечения периферической полинейропатии, возникшей на фоне ХТ [100].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендована низкоинтенсивная лазеротерапия в целях профилактики мукозитов полости рта на фоне ХТ пациенту [102].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендуется применение системы охлаждения головы при проведении химиотерапия (аппарата для профилактики алопеции при ХТ) в целях профилактики алопеции [103, 104].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
- Всем пациентам рекомендуется выполнение комплекса ЛФК в целях снижения частоту развития кардиальных осложнений на фоне химиотерапии [105].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
5. Профилактика
Учитывая высокую курабельность герминогенных опухолей и длительную ожидаемую продолжительность жизни пациентов, необходима профилактика и ранняя диагностика поздних осложнений химиотерапии (сердечно-сосудистых заболеваний, метаболический синдром, гипогонадизм, инфертильность, легочная токсичность и др.) с привлечением соответствующих профильных специалистов.
- Для пациентов с I стадией недисгерминомы с динамическим наблюдением (химиотерапия не проводилась) рекомендовано [45, 115]:
- физикальный осмотр, опухолевые маркеры - ежемесячно в первый год, каждые 2 месяца во второй год, каждые 3 месяца в третий год, каждые 4 месяца в четвертый год, каждые 6 месяцев в пятый год, далее - ежегодно;
- УЗИ органов брюшной полости, забрюшинного пространства и паховоподвздошных областей - каждые 2 месяца в первый год, каждые 3 месяца - во второй год, каждые 4 месяца - в третий и четвертый годы, далее ежегодно;
- рентгенография органов грудной клетки выполняется каждый второй визит [45, 115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Для пациентов после проведенной химиотерапии, а также для герминомы I стадии рекомендовано:
- физикальный осмотр, опухолевые маркеры, УЗИ органов брюшной полости, забрюшинного пространства и пахово-подвздошных областей - каждые 2 - 3 месяца в первый год, каждые 3 месяца во второй год, затем каждые 4 месяца в третий и четвертый годы, раз в полгода в пятый год и далее ежегодно;
- рентгенография органов грудной клетки выполняется каждый второй визит [45, 115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Опухоли стромы и полового тяжа
- Опухоли стромы и полового тяжа низкого риска, ранние стадии: рекомендовано физикальный осмотр, определение уровня опухолевых маркеровхов (ингибин, антимюллеров гормон, эстрадиол, тестостерон - в зависимости от гистологической формы опухоли), УЗИ органов брюшной полости, забрюшинного пространства и пахово-подвздошных областей - каждые 6 - 12 месяцев в течение 10 и более лет [14, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Опухоли стромы и полового тяжа с ранними стадиями высокого риска и распространенными стадиями: рекомендовано физикальный осмотр, определение уровня опухолевых маркеровхов (ингибин, антимюллеров гормон, эстрадиол, тестостерон - в зависимости от гистологической формы опухоли), УЗИ органов брюшной полости, забрюшинного пространства и пахово-подвздошных областей - каждые 4 - 6 месяцев 10 и более лет. Рентгенография органов грудной клетки - 1 раз в год. КГ органов брюшной полости и/или грудной клетки с в/в контрастированием - по показаниям [14, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на НОЯ у пациентки или ее выявлении врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи - врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на НОЯ или ее выявлении в ходе оказания скорой медицинской помощи пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "онкология", определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений НОЯ, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургическое вмешательство, лучевая терапия (ЛТ), лекарственная терапия и т.д.) НОЯ.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, дистанционная и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или данным предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
Дополнительная информация отсутствует.
Критерии оценки качества медицинской помощи
Критерии оценки качества медицинской помощи взрослым пациентам с диагнозом неэпителиальные опухоли яичников (код по МКБ-10 C56).
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1
Выполнено исследование уровня опухолевых маркеров CA125, HE4, ингибина В, АФП в крови (на диагностическом этапе)
5
С
2
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и забрюшинного пространства и/или компьютерная томография органов брюшной полости и/или ПЭТ-КТ и/или магнитно-резонансная томография органов брюшной полости (на диагностическом этапе)
5
С
3
Выполнено ультразвуковое исследование органов малого таза и/или компьютерная томография органов малого таза и/или ПЭТ-КТ и/или магнитно-резонансная томография органов малого таза (на диагностическом этапе)
5
С
4
Выполнена рентгенография органов грудной клетки и/или компьютерная томография органов грудной клетки (на диагностическом этапе)
5
С
5
Выполнена эзофагогастродуоденоскопия (на диагностическом этапе)
5
С
6
Выполнено цитологическое исследование микропрепарата с шейки матки и цервикального канала (на диагностическом этапе)
5
С
7
Выполнено цитологическое исследование жидкости из брюшной полости при ее наличии, полученной путем пункции/аспирата или интраоперационно (при установлении диагноза)
1
А
8
Выполнено патолого-анатомическое исследование операционного материала (при хирургическом вмешательстве)
1
А
9
Проведена с учетом показаний, стадии НОЯ и морфологической верификации опухоли химиотерапия, и/или гормонотерапия, и/или таргетная терапия, и/или лучевая терапия.
1
А
Список литературы
1. P., Genestie C. et al. Prognostic significance of an early decline in serum alpha-fetoprotein during chemotherapy for ovarian yolk sac tumors. Gynecol Oncol 2016;142:452-7.
2. Matei D., Brown J., Frazier L. Updates in the management of ovarian germ cell tumors. Am Soc Clin Oncol Educ Book 2013;e210.
1. Давыдова И.Ю. Незрелые тератомы Gatta G., van der Zwan J.M., Casali P.G. et al. Rare cancers are not so rare: the rare cancer burden in Europe. Eur J Cancer 2011;47:2493-511.
2. Prat J. Ovarian sex cord-stromal and steroid cell tumors (Chapter 28). In: Mutter G.L., Prat J., editors. Pathology of the Female Reproductive Tract. 3rd ed. Edinburgh: Churchill Livingstone (Elsevier); 2014.
3. Gardener G.J., Reidy-Lagunes D., Gehrig P.A. et al. Neuroendocrine tumors of the gynecological tract: A Society of Gynecologic Oncology (SGO) clinical document. Gynecol Oncol 2011;122(1):190-8.
4. Gershenson D.M. Current advances in the management of malignant germ cell and sex cord-stromal tumors of the ovary. Gynecol Oncol 2012;125:515-7.
5. Lane A.H., Lee M.M., Fuller A.F.Jr et al. Diagnostic utility of Mullerian inhibiting substance determination in patients with primary and recurrent granulosa cell tumors. Gynecol Oncol 1999;73:51-5.
6. Трякин А.А. Лекарственное и комбинированное лечение несеминомных герминогенных опухолей у мужчин. Дис. ... д-ра мед. наук. М.; 2015: 254 с.
7. de Wit R., Roberts J.T., Wilkinson P.M. et al. Equivalence of Three or Four Cycles of Bleomycin, Etoposide, and Cisplatin Chemotherapy and of a 3- or 5-Day Schedule in GoodPrognosis Germ Cell Cancer: A randomized trial of EORTC and MRC. J Clin Oncol 2001;1629- 40.
8. Matei D., Brown J., Frazier L. Updates in the management of ovarian germ cell tumors. Am Soc Clin Oncol Educ Book 2013;e210.
9. Brown J., Friedlander M., Backes F.J. et al. Gynecologic Cancer Intergroup (GCIG) consensus review for ovarian germ cell tumors. Int J Gynecol Cancer 2014;24(9 Suppl 3):S48-54.
10. Vazquez I., Rustin G.J. Current controversies in the management of germ cell ovarian tumours. Curr Opin Oncol 2013;25:539-45.
11. NCCN Clinical Practice Guidelines. Ovarian cancer including fallopian tube cancer and primary teritoneal cancer. Version 1.2019. https://www.nccn.org/professionals/physician_gls/pdf/ovarian.pdf.
12. Vazquez I., Rustin G.J. Current controversies in the management of germ cell ovarian tumours. Curr Opin Oncol 2013;25:539-45.
13. Wilson M.K., Fong P., Mesnage S. et al. Stage I granulosa cell tumours: a management conundrum? Results of long-term follow up. Gynecol Oncol 2015;138:285-91.
14. Prat J., Cao D., Carinelli S. et al. Teratoma (Chapter 1: Tumours of the ovary). In: Kurman R.J., Carcangiu M.L., Herrington C.S., Young R.H., editors. WHO Classification of Tumours of Female Reproductive Organs. 4th ed. IARC: Lyon; 2014. p. 57-62.
15. Low J.J., Perrin L.C., Crandon A.J., Hacker N.F. Conservative surgery to preserve ovarian function in patients with malignant ovarian germ cell tumors. A review of 74 cases. Cancer 2000;89:391-8.
16. Чекини Д.А. Факторы прогноза и тактика лечения больных злокачественными герминогенными опухолями яичников. Дис. ... к-та мед. наук. М.; 2017. 140 с.
17. Billmire D., Vinocur C., Rescorla F. et al. Outcome and staging evaluation in malignant germ cell tumors of the ovary in children and adolescents: an Intergroup study. J Pediatr Surg 2004;39:424-9.
18. Solheim O., Ksrn J., Trope C.G. et al. Malignant ovarian germ cell tumors: presentation, survival and second cancer in a population based Norwegian cohort (1953-2009). Gynecol Oncol 2013;131:330-5.
19. De Giorgi U., Pupi A., Florentini G. et al. FDG-PET in the management of germ cell tumor. Ann Oncol 2005;16Supple4:90-4.
20. Lambertini M., Ceppi M., Poggio F. et al. Ovarian suppression using luteinizing hormone-releasing hormone agonists during chemotherapy to preserve ovarian function and fertility of breast cancer patients: a metaanalysis of randomized studies. Ann Oncol 2015;26:2408- 19.
21. Brown J., Shvartsman H.S., Deavers M.T. et al. The activity of taxanes in the treatment of sex cord-stromal ovarian tumors. J Clin Oncol 2004;22:3517-23.
22. Mangili G., Sigismondi C., Lorusso D. et al. The role of staging and adjuvant chemotherapy in stage I malignant ovarian germ cell tumors (MOGTs): the MITO-9 study. Ann Oncol 2017;28:333-8.
23. Low J.J., Perrin L.C., Crandon A.J., Hacker N.F. Conservative surgery to preserve ovarian function in patients with malignant ovarian germ cell tumors. A review of 74 cases. Cancer 2000;89:391-8.
24. Callegaro-Filho D., Gershenson D.M., Nick A.M. et al. Small cell carcinoma of the ovary-hypercalcemic type (SCCOHT): a review of 47 cases. Gynecol Oncol 2016;140:53-7.
25. van Meurs H.S., van Lonkhuijzen L.R., Limpens J. et al. Hormone therapy in ovarian granulosa cell tumors: a systematic review. Gynecol Oncol 2014;134:196-205.
26. NCT01770301. https://clinicaltrials.gov/show/NCT01770301 (12 March 2018, date last accessed).
27. Bristow R.E., Tomacruz R.S., Armstrong D.K. et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J Clin Oncol 2002;20:1248-59.
28. Mangili G., Sigismondi C., Lorusso D. et al. The role of staging and adjuvant chemotherapy in stage I malignant ovarian germ cell tumors (MOGTs): the MITO-9 study. Ann Oncol 2017;28:333-8.
29. Tandstad T., Cavallin-Stahl E., Dahl O. et al. One course of adjuvant BEP in clinical stage I, nonseminoma: Mature and expanded results from the SWENOTECA group. J Clin Oncol 2013;31(suppl):4553.
30. De la Motte Rouge T., Pautier яичников (клинико-морфологические особенности, лечение). Дис. ... д-ра мед. наук. М.; 2001. С. 265-285.
31. Nasioudis D., Kanninen T.T., Holcomb K. et al. Prevalence of lymph node metastasis and prognostic significance of lymphadenectomy in apparent early-stage malignant ovarian sex cord-stromal tumors. Gynecol Oncol 2017;145:243-7.
32. Champion V., Williams S.D., Miller A. et al. Quality of life in long-term survivors of ovarian germ cell tumors: a Gynecologic Oncology Group study. Gynecol Oncol 2007;105:687- 94.
33. Albers P. Randomized phase III trial comparing retroperitoneal lymph node dissection with one course of bleomycin and etoposide plus cisplatin chemotherapy in the adjuvant treatment of clinical stage I NSGCT: AUO trial AH 01/94 by the German Testicular Cancer Study. J Clin Oncol 2008;26(18):2966-72.
34. Billmire D.F., Cullen J.W., Rescorla F.J. et al. Surveillance after initial surgery for pediatric and adolescent girls with stage I ovarian germ cell tumors: report from the Children"s Oncology Group. J Clin Oncol 2014;32:465-70.
35. Mangili G., Sigismondi C., Gadducci A. et al. Outcome and risk factors for recurrence in malignant ovarian germ cell tumors: a MITO-9 retrospective study. Int J Gynecol Cancer 2011;21:1414-21.
36. Brown J., Friedlander M., Backes F.J. et al. Gynecologic Cancer Intergroup (GCIG) consensus review for ovarian germ cell tumors. Int J Gynecol Cancer 2014;24(9 Suppl 3):S48 - 54.
37. Dark G.G., Bower M., Newlands E.S. et al. Surveillance policy for stage I ovarian germ cell tumors. J Clin Oncol 1997;15:620-4.
38. Pectasides D., Pectasides E., Kassanos D. Germ cell tumors of the ovary. Cancer Treat Rev 2008;34:427-41.
39. Williams S.D. Current management of ovarian germ cell tumors. Oncology (Williston Park) 1994;8:53-60.
40. Williams S.D., Kauderer J., Burnett A.F. et al. Adjuvant therapy of completely resected dysgerminoma with carboplatin and etoposide: a trial of the Gynecologic Oncology Group. Gynecol Oncol 2004;95:496-9.
41. Loehrer P.J.Sr., Lauer R., Roth B.J. et al. Salvage therapy in reccurent germ cell cancer: ifosfamide and cisplatin plus either vinblastine or etoposide. Ann Intern Med 1988;109:540-6.
42. Einhorn L.H. Chemotherapeutic and surgical strategies for germ cell tumors. Chest Surg Clin N Am 2002;12:695-706.
43. Ray-Coquard P., Morice D., Lorusso J., Prat A., Non-epithelial ovarian cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018;29(Supplement 4):iv1-iv18.
44. Motzer R.J., Sheinfeld J., Mazumdar M. et al. Paclitaxel, Ifosfamide, and Cisplatin Second-Line Therapy for Patients With Relapsed Testicular Germ Cell Cancer. J Clin Oncol 2000;18(12):2413-8.
45. Mead G.M., Cullen M.H., Huddart R. et al. A phase II trial of TIP (paclitaxel, ifosfamide and cisplatin) given as second-line (post-BEP) salvage chemotherapy for patients with metastatic germ cell cancer: a medical research council trial. Br J Cancer 2005;93:178-84.
46. Loehrer P.J., Gonin R., Nichols C.R. et al. Vinblastine plus ifosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor. J Clin Oncol 1998;16:2500-4.
47. Ferlay J., Steliarova-Foucher E., Lortet-Tieulent J. et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer 2013 Apr;49(6):1374-403.
48. Тюляндин С.А. Герминогенные опухоли яичников. Практическая онкология 2006;7(1):52-61.
49. Tewari K.S., Di Saia P.J. Ovulatory failure, fertility preservation and reproductive strategies in the setting of gynecologic and non-gynecologic malignancies. Eur J Gynaecol Oncol 2006;27:449-61.
50. Kollmannsberger C., Beyer J., Liersch R. et al. Combination chemotherapy with gemcitabine plus oxaliplatin in patients with intensively pretreated or refractory germ cell cancer: a study of the German Testicular Cancer Study Group. J Clin Oncol 2004;22:108-14.
51. Bokemeyer C, Oechsle K, Honecker F, et al. Combination chemotherapy with gemcitabine, oxaliplatin, and paclitaxel in patients with cisplatin-refractory or multiply relapsed germcell tumors: a study of the German Testicular Cancer Study Group. Ann Oncol 2008;19:448-53.
52. Tomao F., Peccatori F., Del Pup L. et al. Special issues in fertility preservation for gynecologic malignancies. Crit Rev Oncol Hematol 2016;97:206-19.
53. Allen J.C., Kirschner A., Scarpato K.R., Morgans A.K. Current management of refractory germ cell tumors and future directions. Curr Oncol Rep 2017;19:8.
54. Gershenson D.M. Treatment of ovarian cancer in young women. Clin Obstet Gynecol 2012;55:65-74.
55. Wilson M.K., Fong P., Mesnage S. et al. Stage I granulosa cell tumours: a management conundrum? Results of long-term follow up. Gynecol Oncol 2015;138:285-91.
56. Tao X., Sood A.K., Deavers M.T. et al. Anti-angiogenisis therapy with bevacizumab for patients with ovarian granulosa cell tumour. Gynecol Oncol 2009;114:431-6.
57. Ray-Coquard I., Brown J., Harter P. et al. Gynecologic Cancer InterGroup (GCIG) consensus review for ovarian sex cord stromal tumors. Int J Gynecol Cancer 2014;24(9Suppl3):S42-7.
58. Brown J., Shvartsman H.S., Deavers M.T. et al. The activity of taxanes in the treatment of sex cord-stromal ovarian tumors. J Clin Oncol 2004;22:3517-23.
59. Homesley H.D., Bundy B.N., Hurteau J.A. et al. Bleomycin, etoposide, and cisplatin combination therapy of ovarian granulosa cell tumors and other stromal malignancies. Gynecol Oncol 1999;72:131-7.
60. Gurumurthy M., Bryant A., Shnbhang S. et al. Effectiveness of different treatment modalities for the management of adult-onset granulosa cell tumours of the ovary. Cochrane Database Syst Rev 2014;4.
61. Silver J.A., Baima J. Cancer prehabilitation: an opportunity to decrease treatmentrelated morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013;92(8):715-27.
62. Nilsson H., Angeras U., Bock D. et al. Is preoperative physical activity related to postsurgery recovery? BMJ Open 2016;6(1):e007997. DOI: 10.1136/bmjopen-2015-007997.
63. Hijazi Y., Gondal U., Aziz O. et al. A systematic review of prehabilitation programs in abdominal cancer surgery. Int J Surg 2017;39:156-62. DOI: 10.1016/j.ijsu.2017.01.111.
64. Tsimopoulou I., Pasquali S., Howard R. et al. Psychological prehabilitation before cancer surgery: a systematic review. Ann Surg Oncol 2015;22(13):4117-23. DOI: 10.1245/s10434-015-4550-z.
65. Carter J. Fast-Track Surgery in Gynaecology and Gynaecologic Oncology: A Review of a Rolling Clinical Audit. ISRN Surg 2012;2012(368014):19.
66. Nelson G., Bakkum-Gamez J., Kalogera E. et al. Guidelines for perioperative care in gynecologic/oncology: Enhanced Recovery After Surgery (ERAS) Society recommendations - 2019 update. Int J Gynecol Cancer 2019.
67. De Almeida E.P.M., de Almeida J.P., Landoni G. et al. Early mobilization programme improves functional capacity after major abdominal cancer surgery: a randomized controlled trial. Br J Anaesth 2017;119(5):900-7.
68. Wren S.M., Martin M., Yoon J.K., Bech F. Postoperative pneumonia-prevention program for the inpatient surgical ward. J Am Coll Surg 2010;210(4):491-5.
69. Peedicayil A., Weaver A., Li X., Carey E. et al. Incidence and timing of venous thromboembolism after surgery for gynecological cancer. Gynecol Oncol 2011;121(1):64-9.
70. Swarm R., Abernethy A.P., Anghelescu D.L. et al. NCCN Adult Cancer Pain. Adult cancer pain. J Natl Compr Canc Netw 2010;8:1046-86.
71. Ben-Arye E., Samuels N., Lavie O. Integrative medicine for female patients with gynecologic cancer. J Altern Complement Med 2018;24(9,10):881-9.
72. Goerling U., Jaeger C., Walz A. et al. The efficacy of psycho-oncological interventions for women with gynaecological cancer: a randomized study. Oncology 2014;87:114-24.
73. Smits A., Lopes A., Bekkers R. et al. Body mass index and the quality of life of endometrial cancer survivors - a systematic review and meta-analysis. Gynecol Oncol 2015;137:180-7. DOI:10.1016/j.ygyno.2015.01.540.
74. Schmitz K.H., Courneya K.S., Matthews C. et al. American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports Exerc 2010;42(7):1409- 26.
75. Zhou Y., Chlebowski R., La Monte M.J. et al. Body mass index, physical activity, and mortality in women diagnosed with ovarian cancer: results from the Women"s Health Initiative. Gynecol Oncol 2014;133(1):4-10.
76. Biglia N., Zanfagnin V., Daniele A. et al. Lower body lymphedema in patients with gynecologic cancer. Anticancer Res 2017;37(8):4005-15.
77. Shaitelman S.F., Cromwell K.D., Rasmussen J.C., Stout N.L., Armer J.M., Lasinski B.B., Cormier J.N. Recent progress in the treatment and prevention of cancer-related lymphedema. CA Cancer J Clin. 2015 Jan-Feb;65(1):55-81. doi: 10.3322/caac.21253. Epub 2014 Nov 19. Erratum in: CA Cancer J Clin. 2015 May-Jun;65(3):252. PubMed PMID: 25410402; PubMed Central PMCID: PMC4808814.
78. Borman Р. Lymphedema diagnosis, treatment, and follow-up from the view point of physical medicine and rehabilitation specialists. Turk J Phys Med Rehab 2018;64(3):179-197.
79. Piller N., Douglass J., Heidenreich B., Moseley A. Placebo controlled trial of mild electrical stimulation. Journal of Lymphoedema. - 2010. - Vol 5, No 1. - P. 15 - 25.
80. Грушина Т.И. Реабилитация в онкологии: физиотерапия. - М.: ГЭОТАР-Медиа, 2006. - 240 с.
81. McNeely M.L., Peddle C.J., Yurick J.L., Dayes I.S., Mackey J.R. Conservative and dietary interventions for cancer-related lymphedema: A Systematic review and meta-analysis. Cancer. 2011 Mar 15;117(6):1136-48.
82. Zhang Y.L., Huiling L., Yan L., Li H., Tian В. Effects of acupuncture on cancer-related fatigue: a meta-analysis//Supportive Care in Cancer. - 2018. - V. 26, Issue 2. - Pp. 415-425.
83. Carmody J.F., Crawford S., Salmoirago-Blotcher E., Leung K., Churchill L., Olendzki N. Mindfulness training for coping with hot flashes: results of a randomized trial. Menopause. 2011 June;18(6):611-20. doi: 10.1097/gme.0b013e318204a05c.
84. Ferrandina G., Petrillo M., Mantegna G., Fuoco G., Terzano S., Venditti L., Marcellusi A., De Vincenzo R., Scambia G. Evaluation of quality of life and emotional distress in endometrial cancer patients: a 2-year prospective, longitudinal study. Gynecol Oncol. 2014 Jun;133(3):518-25. doi: 10.1016/j.ygyno.2014.03.015.
85. Donoyama N., Satoh T., Hamano T. et al. Physical effects of Anma therapy (Japanese massage) for gynecologic cancer survivors: A randomized controlled trial. Gynecol Oncol 2016;142:531-538. Crossref, Medline, Google Scholar.
86. Armbruster S.D., Song J., Bradford A. et al. Sexual health of endometrial cancer survivors before and after a physical activity intervention: A retrospective cohort analysis. Gynecol Oncol 2016;143:589-595. Crossref, Medline, Google Scholar.
87. Huffman L.B., Hartenbach E.M., Carter J., Rash J.K., Kushner D.M. Maintaining sexual health throughout gynecologic cancer survivorship: A comprehensive review and clinical guide. Gynecol Oncol. 2016 Feb;140(2):359-68. doi: 10.1016/j.ygyno.2015.11.010. Epub 2015 Nov 7. PubMed PMID: 26556768; PubMed Central PMCID: PMC4835814.
88. Dumoulin C., Cacciari L.P., Hay-Smith E.J.C. Pelvic floor muscle training versus no treatment, or inactive control treatments, for urinary incontinence in women. Cochrane Database of Systematic Reviews 2018, Issue 10.
89. Hu H., Xie Z.G., Qin W.L. Effect of electroacupuncture intervention at different phases of post-operation on bladder function in patients undergoing cervical cancer operation. Zhen Ci Yan Jiu 2013;38:64-67, 77. Medline, Google Scholar.
90. Cannioto R.A., Moysich K.B. Epithelial ovarian cancer and recreational physical activity: A review of the epidemiological literature and implications for exercise prescription. Gynecol Oncol, 2015. 137(3): P. 559-73.
91. Hu M., Lin W. Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol. 2012;127(3):156-64. Epub 2012 Jan 31.
92. Mustian K.M., Alfano C.M., Heckler C. et al: Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017;3:961-968.
93. Lawvere, Silvana. (2002). The effect of massage therapy in ovarian cancer patients. 10.1016/B978-0-7234-3217-3.50009-0.
94. Kinkead B., Schettler P.J., Larson E.R., Carroll D., Sharenko M., Nettles J., Edwards S.A., Miller A.H1., Torres M.A., Dunlop B.W., Rakofsky J.J., Rapaport M.H. Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. Cancer. 2018 Feb 1;124(3):546-554. doi: 10.1002/cncr.31064.
95. Streckmann F., Zopf E.M., Lehmann H.C. et al: Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014;44:1289-1304.
96. Kleckner I.R., Kamen C., Gewandter J.S. et al. Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support Care Cancer 2018;26:1019-1028.
97. Muzi J.L., Look R.M., Turner C., Gardiner S.K., Wagie T., Douglas J., Sorenson L., Evans L., Kirchner S., Dashkoff C., Garrett K., Johnson N. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. Journal of Clinical Oncology 30, no. 15_suppl (May 2012) 9019-9019.
98. Rick O., von Hehn U., Mikus E., Dertinger H. & Geiger G. (2016). Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo- controlled phase-III study. Bioelectromagnetics, 38(2), 85-94.
99. Kiling M., Livanelioglu A., Yildirim S.A., Tan E. Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med. 2014 May;46(5):454-60. doi: 10.2340/16501977-1271.
100. Oberoi S., Zamperlini-Netto G., Beyene J., Treister N.S., Sung L. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. Send to PLoS One. 2014 Sep 8;9(9):e107418. doi: 10.1371/journal.pone.0107418. eCollection 2014.
101. Ross M., Fischer-Cartlidge E. Scalp Cooling: A Literature Review of Efficacy, Safety, and Tolerability for Chemotherapy-Induced Alopecia. Clin J Oncol Nurs. 2017 Apr 1;21(2):226-233. doi: 10.1188/17.CJON.226-233.
102. Avci P., Gupta G.K., Clark J., Wikonkal N. & Hamblin M.R. (2013). Low-level laser (light) therapy (LLLT) for treatment of hair loss. Lasers in surgery and medicine, 46(2), 144-51.
103. Spence Rosalind R. et al. Exercise and cancer rehabilitation: A systematic review. Cancer Treatment Reviews. - V. 36, Issue 2. - P. 185 - 194.
104. Park S, Lee S, Lee J, Park SH, Park JO, Kang WK, Park YS, Lim HY. Salvage chemotherapy with paclitaxel, ifosfamide, and cisplatin (TIP) in relapsed or cisplatin-refractory germ cell tumors. Onkologie. 2011;34(8-9):416-20. doi: 10.1159/000331129.
105. Tohya, T. Ovarian sex cord-stromal tumor, unclassified: case report of endocrinologic findings and review of the literature. International Journal of Gynecological Cancer, 2005, 15(6), 1153-1155.
106. Shaaban A. M. et al. Ovarian malignant germ cell tumors: cellular classification and clinical and imaging features//Radiographics. - 2014. - Т. 34. - N. 3. - С. 777 - 801.
107. Хохлова С.В., Давыдова И.Ю., Новикова Е.Г., Телетаева Г.М., Трякин А.А., Урманчеева А.Ф. практические рекомендации по лекарственному лечению неэпителиальных опухолей яичников//Злокачественные опухоли. - 2016. - N 4. Спецвыпуск 2. - С. 135 - 146.
108. Johansen G. et al. Fertility-sparing surgery for treatment of non-epithelial ovarian cancer: Oncological and reproductive outcomes in a prospective nationwide population-based cohort study //Gynecologic oncology. - 2019. - Т. 155. - N. 2. - С. 287 - 293.
109. Dark G. G. et al. Surveillance policy for stage I ovarian germ cell tumors//Journal of clinical oncology. - 1997. - Т. 15. - N. 2. - С. 620 - 624.
110. Oliver RT, Mead GM, Rustin GJ et al Rindomized trial of carboplatin versus radiotherapy for stade I seminoma: mature results on relapse and contralaterated testis cancer rates in MRS TE19/EORTC 30982 study. JCO 2011; 29: 957 - 962.
111. Satoh T. et al. Administration of standard-dose BEP regimen (bleomycin+ etoposide+ cisplatin) is essential for treatment of ovarian yolk sac tumour//European journal of cancer. - 2015 - Т. 51. - N. 3. - С. 340 - 351.
112. Bosl, G. J., Geller, N. L., Bajorin, D., Leitner, S. P., Yagoda, A., Golbey, R. B.,... Whitmore, W. (1989). A Randomized Trial of Etoposide + Cisplatin Versus Vinblastine + Bleomycin + Cisplatin + Cyclophosphamide + Dactinomycin in Patients with Good-Prognosis Germ Cell Tumors. The Journal of Urology, 141(6), 1499-1500. doi:10.1016/s0022- 5347(17) 41358-9.
113. Хохлова С.В, Давыдова И.Ю., Коломиец Л.А., Кузнецов В.В., Новикова Е.Г., Трякин А.А.и соавт. Практические рекомендации по лекарственному лечению злокачественных неэпителиальных опухолей яичников. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2019 (том 9). С. 177 - 191.
114. Pico, J.-L., Rosti, G., Kramar, A., Wandt, H., Koza, V., Salvioni, R.,. Biron, P. (2005). A randomised trial of high-dose chemotherapy in the salvage treatment of patients failing first-line platinum chemotherapy for advanced germ cell tumours. Annals of Oncology, 16(7) 1152-1159. doi:10.1093/annonc/mdi228.
115. Pautier P1, Gutierrez-Bonnaire M, Rey A et al. Combination of bleomycin, etoposide, and cisplatin for the treatment of advanced ovarian granulosa cell tumors. Int J Gynecol Cancer. 2008 May-Jun;18(3):446-52.
116. Stenman U. H. et al. Markers supplementing CA 125 in ovarian cancer//Annals of medicine. - 1995. - Т. 27. - N. 1. - С. 115 - 120.
117. Yesilyurt H. et al. Parameters for predicting granulosa cell tumor of the ovary: a single center retrospective comparative study//Asian Pac J Cancer Prev. - 2014. - Т. 15. - N. 19. - С. 8447 - 8450.
118. Tohya, T. Ovarian sex cord-stromal tumor, unclassified: case report of endocrinologic findings and review of the literature. International Journal of Gynecological Cancer, 2005, 15(6), 1153 - 1155.
119. Tryakin A, Fedyanin M, Bulanov A, Kashia S, Kurmukov I, Matveev V, Fainstein I, Gordeeva O, Zakharova T, Tjulandin S. Dose-reduced first cycle of chemotherapy for prevention of life-threatening acute complications in nonseminomatous germ cell tumor patients with ultra high tumor markers and/or poor performance status. J Cancer Res Clin Oncol. 2018 Sep;144(9):1817-1823. doi: 10.1007/s00432-018-2695-4.
120. Aapro MS, Bohlius J, Cameron DA et al. 2010 Update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer 2011; 47: 8-32.
121. Хохлова С.В., Давыдова И.Ю., Коломиец Л.А., Кравец О.А., Крикунова Л.И., Кузнецов В.В. и соавт. Практические рекомендации по лекарственному лечению неэпителиальных опухолей яичников//Злокачественные опухоли. - 2015. - N 4, спецвыпуск. - С. 127-138. DOI: 10.18027/2224-5057-2015-4s-127-138
122. С. А. Тюляндин, Д. А. Носов, Н. И. Переводчикова. Минимальные клинические рекомендации Европейского Общества Медицинской Онкологии (ESMO) - М.: Издательская группа РОНЦ им. Н. Н. Блохина РАМН, 2010. - 436 с.
123. Хохлова С. В, Давыдова И.Ю., Коломиец Л.А., Новикова Е.Г., Трякин А.А., Ур-манчеева А.Ф. Практические рекомендации по лекарственному лечению злокачественных неэпителиальных опухолей яичников//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2017 (том 7). С. 146 - 157.
124. Colombo, N., Peiretti, M., Garbi, A., Carinelli, S., Marini, C., & Sessa, C. (2012). Non-epithelial ovarian cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 23(suppl 7), vii20-vii26. doi:10.1093/annonc/mds223
125. Hardy R.D., Bell J.G., Nicely C.J. et al.Hormonal treatment of a recurrent granulosa cell tumor of the ovary: case report and review of the literature. Gynecol Oncol 2005;96(3):865865
126. Samant R., Fung M.F., Choan E. et al.Palliative radiotherapy for recurrent granulose cell tumor of the ovary: a report of 3 cases with radiological evidence of response. Gynecol Oncol 2006;102(2):406:406
127. Елманов А.В. и соавт. Гранулезоклеточная опухоль яичников с множественными метастазами в кожу (клинический случай)./ Сибирский онкологический журнал. 2011. N 5 (47)
128. Kourie HR et al. Letrozole efficacy in the treatment of granulosa cell tumor of the ovary: a case report/ Onkologie. 2013;36(9):498-500. doi: 10.1159/000354635. Epub 2013 Aug 19.
129. Freeman SA, Modesitt SC: Anastrozole therapy in recurrent ovarian adult granulosa cell tumors: a report of 2 cases. Gynecol Oncol 2006;103:755-8.
130. Kauppila A GnRH agonist analog therapy in advanced/recurrent granulosa cell tumors: further evidence of a role of inhibin in monitoring response to treatment Gynecol Endocrinol. 1992 Dec;6(4):271-4.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Кузнецов В.В., д.м.н., профессор, ведущий научный сотрудник
2. Ашрафян Л.А., академик РАН, д.м.н., профессор, заместитель директора ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, директор института онкогинекологии и маммологии.
3. Тюляндина А.С., д.м.н., с.н.с. онкологического отделения лекарственных методов лечения (химиотерапевтического) N 2 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
4. Берлев И.В., д.м.н., профессор, заведующий научным отделением онкогинекологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
5. Шевчук А.С., к.м.н. заведующий отделением онкогинекологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
6. Новикова Е.Г., д.м.н., профессор МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
7. Урманчеева А.Ф., д.м.н., профессор, ведущий научный сотрудник отделения онкогинекологии ФГБУ "НМИЦ онкологии им Н.Н. Петрова" Минздрава России, Санкт-Петербург.
8. Вереникина Е.В., к.м.н., заведующая отделением онкогинекологии ФГБУ "РНИОИ" Минздрава России.
9. Давыдова И.Ю., д.м.н., старший научный сотрудник отделения гинекологического, ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
10. Демидова Л.В., д.м.н., в.н.с. отдела лучевой терапии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
11. Жорданиа К.И., д.м.н., профессор, ведущий сотрудник отделения онкогинекологического ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
12. Антонова И.Б., д.м.н., заведующая лабораторией профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний ФГБУ РНЦРР Минздрава России.
13. Бабаева Н.А., д.м.н., ведущий научный сотрудник лаборатории профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний ФГБУ РНЦРР Минздрава России.
14. Кравец О.А., д.м.н., руководитель группы лучевой терапии онкогинекологических заболеваний ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
15. Крикунова Л.И., д.м.н., профессор, зав. отд. лучевых и комбинированных методов лечения гинекологических заболеваний. ФГБУ "НМИЦ радиологии" Минздрава России.
16. Коломиец Л.А., д.м.н., профессор, заведующая гинекологическим отделением НИИ онкологии ФГБНУ "Томский НИМЦ РАН".
17. Крейнина Ю.М., д.м.н., в.н.с. лаборатории инновационных технологий радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ РНЦРР Минздрава России.
18. Мухтаруллина С.В., д.м.н., заведующая отделением онкогинекологии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
19. Снеговой А.В., д.м.н., заведующий отделением онкологического дневного стационара ФБГУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
20. Трякин А.А., д.м.н., главный научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) N 2 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
21. Тюляндин С.А., д.м.н., профессор, онкологического отделения лекарственных методов лечения (химиотерапевтического) N 2 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
22. Ульрих Е.А., д.м.н., профессор кафедры детской гинекологии и женской репродуктологии факультета повышения квалификации и профессиональной переподготовки ФГБОУ ВО "Санкт-Петербургский государственный педиатрический медицинский университет" Минздрава России и кафедры онкологии ФГБОУ ВО "СевероЗападный государственный медицинский университет им. И.И. Мечникова" Минздрава России, Санкт-Петербург.
23. Герфанова Е.В., онкогинеколог ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, институт онкогинекологии и маммологии.
Блок по медицинской реабилитации
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
3. Гильмутдинова И.Р., к.м.н., заведующая отделом биомедицинских технологий и лаборатория клеточных технологий, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
4. Буланов А.А., д.м.н., с.н.с. отделения клинической фармакологии и химиотерапии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
5. Бутенко А.В., д.м.н., профессор, главный врач НИИ клинической онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, председатель НС "Ассоциация специалистов по онкологической реабилитации".
6. Назаренко А.В., к.м.н., врач высшей квалификационной категории, заведующий отделением радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Российской ассоциации терапевтических радиационных онкологов (РАТРО), European Society for Radiotherapy & Oncology (ESTRO), Российско-американского альянса по изучению рака (ARCA), представитель России в МАГАТЭ.
7. Обухова О.А., к.м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN).
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
9. Ткаченко Г.А., психолог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
10. Петрова Т.А., логопед-педагог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
11. Семиглазова Т.Ю., д.м.н., в.н.с. научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент кафедры онкологии ФГБОУ ВО "СЗГМУ им. И.И. Мечникова" Минздрава России.
12. Пономаренко Г.Н., д.м.н., профессор, заслуженный деятель науки РФ, генеральный директор ФГБУ "ФНЦРИ им. Г.А. Альбрехта" Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Минобороны России.
13. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Минобороны России.
14. Каспаров Б.С., к.м.н., заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
15. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
16. Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
17. Кондратьева К.О., медицинский психолог ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
18. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России.
19. Романов А.И., академик РАН, д.м.н., профессор, главный врач ФГБУ "Центр реабилитации" Управления делами Президента РФ.
20. Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, врач-онколог.
21. Степанова А.М., заместитель директора по науке, заведующая отделением реабилитации частного многопрофильного диагностического и реабилитационного центра "Восстановление".
Блок по организации медицинской помощи:
1. Невольских А.А., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
2. Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
3. Иванов С.А., д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ "НМИЦ онкологии им. Н.Н. Блохина".
Конфликта интересов нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- врачи-онкологи;
- врачи-хирурги;
- врачи-радиологи;
- студенты медицинских вузов, врачи-стажеры, врачи, обучающиеся в ординатуреуе и аспирантуреуре.
Таблица А1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных контролируемых исследований с применением метаанализа
2
Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с РТМ, но не чаще чем раз в 6 месяцев.. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
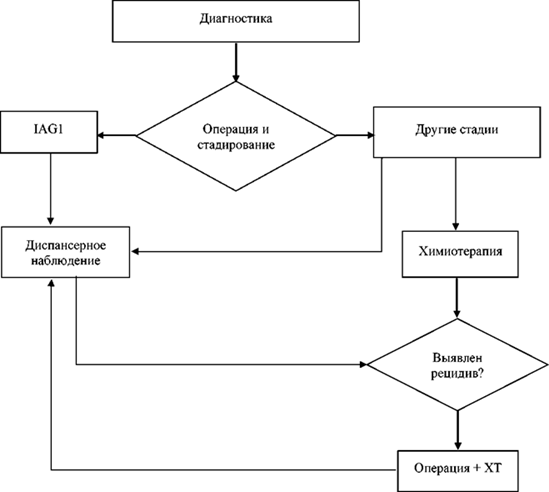
Схема 1. Блок-схема диагностики и лечения пациентов опухолью стромы полового тяжа
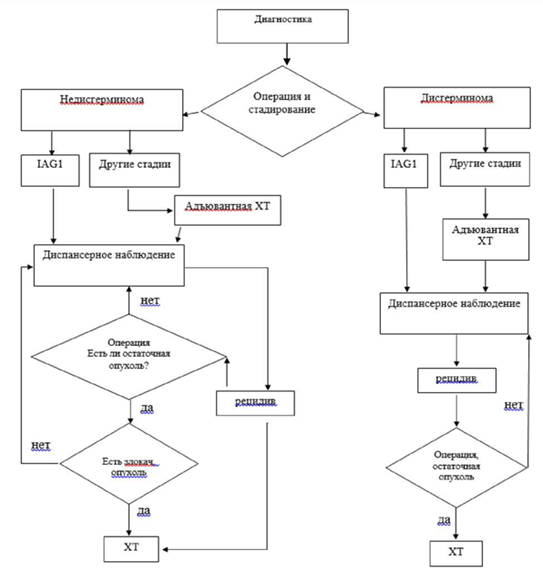
Схема 2. Блок-схема диагностики и лечения пациенток герминогенной опухолью яичника
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендуется: при осложнениях ХТ - связаться с врачом-онкологом.
1. При повышении температуры тела до 38 °C и выше:
- Обратиться к врачу-онкологу для решения вопроса о целесообразности начала прием антибиотиков
2. При стоматите:
- диета - механическое,
- Обратиться к врачу
- обрабатывать полость рта по рекомендации врача-онколога.
3. При диарее:
- диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку.
Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
- Обратиться к врачу
4. При тошноте:
- Обратиться к врачу
Приложение Г
Приложение Г1
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrm.org/resources/ecog-perfOrmance-statushttps://ecog-acrm.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание:
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Смерть
Ключ (интерпретация): приведен в самой шкале
Приложение Г2
ШКАЛА КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky DA, Burchenal
JH: The clinical evaluation of chemotherapeutic agents in cancer. In:
Evaluation of chemotherapeutic agents. edn. Edited by MacLeod C. New York: Columbia University Press; 1949: 191-205
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Шкала Карновского
100 - Состояние нормальное, жалоб нет
90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 - Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 - Нуждается в значительной помощи и медицинском обслуживании
40 - Инвалид, нуждается в специальной помощи, в т.ч. медицинской
30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20 - Тяжелый больной. Необходимы госпитализация и активное лечение
10 - Умирающий
0 - Смерть
Ключ (интерпретация): приведен в самой шкале
- Рекомендована чрескожная электростимуляция в течение 20 минут в день 4 недели в дополнение к стандартной противорвотной терапии для контроля контроля тошноты и рвоты пациентам, получающих ХТ основе цисплатина-** [101].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
