"Клинические рекомендации "Атеросклероз мезентериальных артерий"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
АТЕРОСКЛЕРОЗ МЕЗЕНТЕРИАЛЬНЫХ АРТЕРИЙ
МКБ 10: K55.1
Год утверждения (частота пересмотра): 2018 (не реже 1 раза в 3 года)
ID: КР95
URL
Профессиональные ассоциации
- Ассоциация сердечно-сосудистых хирургов России
Ключевые слова
- аортомезентериальное шунтирование;
- артерии кишечника;
- атеросклероз мезентериальных артерий;
- верхняя брыжеечная артерия;
- инфаркт кишечника;
- компьютерная томография;
- магнитно-резонансная томография;
- мезентериальный тромбоз;
- национальные рекомендации;
- нижняя брыжеечная артерия;
- острое нарушение мезентериального кровообращения;
- протезирование мезентериальных артерий;
- реимплантация мезентериальных артерий;
- селезеночная артерия;
- стандартная ангиография;
- стентирование мезентериальных артерий;
- торакофренолюмботомия;
- транслюминальная баллонная ангиопластика;
- хроническая ишемия органов пищеварения;
- хроническая мезентериальная ишемия;
- чревный ствол.
Список сокращений
БСЖК - белок, связывающий жирные кислоты
ВБА - верхняя брыжеечная артерия
ЖКТ - желудочно-кишечный тракт
КТ - компьютерная томография
КТА - компьютерная томографическая ангиография
МР - магнитно-резонансный
МРА - магнитно-резонансная ангиография
МРТ - магнитно-резонансная томография
ОМИ - острая мезентериальная ишемия
УЗДС - ультразвуковое дуплексное сканирование
ФК - функциональный класс
ХИОП - хроническая ишемия органов пищеварения
ХМИ - хроническая мезентериальная ишемия
ЧС - чревный ствол
Термины и определения
Интестинальная ишемия - состояние, возникающее при нарушении кровоснабжения мезентериального кровообращения и характеризующееся специфическим абдоминальным симптомокомплексом.
Кахексия - комбинированный метаболический синдром, сопровождающийся потерей мышечной, нередко жировой массы, который приводит к ухудшению течения заболевания, снижению эффективности специфической терапии и повышению смертности.
Острый мезентериальный тромбоз - острое нарушение магистрального и органного кровотока в бассейне брюшной аорты и ее непарных висцеральных ветвей.
Реваскуляризация - восстановление кровоснабжения какого-либо сосудистого бассейна в результате одного из вариантов лечения, сопровождающееся купированием (уменьшения) ишемического синдрома, вызванного тяжелыми морфофункциональными изменениями артериального русла.
Ситофобия - боязнь приема пищи, навязчивый страх с полным или частичным отказом от пищи при наличии сохранного аппетита.
Стентирование - медицинское оперативное вмешательство, проводимое с целью установки стента - специального каркаса, который помещается в просвет полых органов человека и обеспечивает расширение участка, суженного патологическим процессом.
Хроническая мезентериальная ишемия - заболевание, возникающее при хроническом нарушении кровообращения по непарным висцеральным ветвям брюшной аорты, клинически проявляющееся болями в животе, возникающими после приема пищи, нарушениями моторно-секреторной и абсорбционной функции кишечника, прогрессирующим похуданием.
1. Краткая информация
1.1 Определение
Атеросклероз мезентериальных артерий - это системное обменное заболевание с поражением стенки артерий, кровоснабжающих органы брюшной полости, сопровождающееся постепенным сужением (стенозом) их просвета и окклюзией (закупоркой), и вызывающее синдром хронической мезентериальной ишемии с характерным симптомокомплексом.
1.2 Этиология и патогенез
К основным причинам и факторам риска развития атеросклероза мезентериальных артерий относят:
Возраст. Возникновение стенозирующего поражения мезентериальных артерий находится в тесной корреляционной связи с возрастом пациента. В исследовании O.Jarvinen и соавторов по данным аутопсий 120 пациентов без предварительной выборки стенозы брыжеечных артерий были выявлены у 67% пациентов в возрасте 80 лет и более, в то время как у пациентов в возрасте до 40 лет этот показатель составил всего 6% [1]. Однако, согласно данным K.Hansen, использовавшей скрининговую ультразвуковую верификацию поражений, несмотря на высокую частоту (17,5%) выявляемости стенозов мезентериальных артерий у пожилых пациентов в возрасте старше 65 лет, частота стенозов для разных возрастных групп варьировала в диапазоне 14,5 - 21,1%, без тенденции к прогрессированию в зависимости от возраста (65 - 69 лет - 21,1%; 70 - 74 года - 14,2%; 75 - 79 лет - 19.7%; 80 лет и старше - 18,6%) [2].
Курение. Курение является одним из основных факторов риска развития атеросклероза мезентериальных артерий. По данным разных авторов среди пациентов с хронической мезентериальной ишемией курильщиками являются 52 - 75% [3, 4].
Другие факторы риска атеросклероза. Принято считать, что сахарный диабет [5], курение [6], артериальная гипертензия и увеличение уровня холестерина представляют собой факторы риска развития атеросклероза [7]. Однако, при анализе доступной медицинской литературы не выявлено прямой корреляционной связи между группой системных факторов риска, таких как, пол, сахарный диабет, артериальная гипертензия, ожирение, дислипидемия, перемежающаяся хромота и наличие трофических нарушений у пациентов с хронической ишемией нижних конечностей, и атеросклеротическим поражением чревного ствола и верхней брыжеечной артерии. При этом в большинстве оцениваемых групп пациентов с ХМИ, эти факторы встречаются достаточно часто: артериальная гипертензия - 37 - 67%, атеросклероз артерий нижних конечностей до 55%, сахарный диабет до 48%, ишемическая болезнь сердца - до 43%, дислипидемия до 10% пациентов.
При ХМИ пусковыми моментами развития ишемии являются постепенное снижение кровоснабжения органов пищеварения вследствие прогрессирования атеросклеротических поражений мезентериальных артерий и потенцирование дисбаланса между поступающим и требуемым количеством крови, возникающего на высоте функциональной нагрузке кишечника.
В норме на долю мезентериального кровотока приходится около 25% от всего объема циркулирующей крови. На высоте функциональной нагрузки, в частности после приема пищи, этот показатель может увеличиваться до 35% [8]. Отображением такой нагрузки является прирост базового кровоснабжения желудочно-кишечного тракта с 1000 до 2000 мл/мин. Объемный кровоток по чревному стволу увеличивается сразу после приема пищи и возвращается к исходным показателям через 20 минут после еды. Реакция бассейна верхней брыжеечной артерии отличается более пролонгированным эффектом, при котором объемный кровоток артерии возрастает сразу после приема пищи, достигает максимума к 30 - 45 минутам и возвращается к исходному уровню лишь через 2 - 3 часа после интестинальной нагрузки [9, 10]. Также считается, что вместе с увеличением скоростей мезентериального кровотока на высоте нагрузке происходит увеличение диаметров ЧС и ВБА [10].
В условиях нарушенной проходимости мезентериальных артерий организму сложно обеспечить желудочно-кишечный тракт необходимым количеством крови и включаются механизмы компенсации. Основным таким механизмом является формирование широкой сети коллетералей в результате длительного прогрессирования мезентериальных стенозов [11]. Благодаря хорошей компенсаторной возможности характерная клиническая картина ХМИ развивается при вовлечении в патологический процесс 2-х и более мезентериальных артерий, преимущественно ЧС и ВБА [12]. Но вопрос зависимости развития ХМИ от количества пораженных мезентериальных артерий до сих пор остается объектом дискуссии [13]. Манифестация клинической картины ХМИ является многофакторным явлением и зависит от сочетания таких факторов, как скорость прогрессирования стенозирующего поражения, индивидуальные особенности анатомии спланхнического бассейна, уровень поражения мезентериальной артерии, возможной комбинации этиологических факторов и других.
Наименее устойчивым к хронической ишемии органом пищеварения является желудочно-кишечный тракт. На микроциркуляторном уровне на долю слизистого слоя стенки ЖКТ приходится более 80% потока крови, поступающего к ее различным слоям [14, 15]. В результате такого распределения кровотока в стенке ЖКТ, его слизистая оболочка является мишенью, которая в первую очередь вовлекается в патологические процессы, обусловленные сниженной перфузией и ишемией [16, 17]. Отчасти это связано с анатомическими особенностями строения системы кровоснабжения ворсин слизистой оболочки, которые являются наиболее чувствительными к ишемии.
Первым компенсаторным патофизиологическим механизмом ЖКТ в ответ на снижение перфузии является увеличение скорости извлечения кислорода из капиллярного русла. При недостаточности такого механизма для поддержания аэробного метаболизма, ткани ЖКТ переключаются на анаэробный метаболизм, продуктами которого являются углекислота, молочная кислота и другие маркеры ишемии. Далее развивается классическая картина метаболических расстройств в стенке кишки с формированием митохондриальной недостаточности, нарушением функции мембранных насосов клетки, плотных межклеточных соединений, отека клеток и их разрушения с поступлением содержимого клетки в окружающие ткани и кровоток. Образующиеся продукты патологического обмена, разрушения клеток и физиологически активные вещества (брадикинин, субстанция P, биогенные амины и другие), попадая в околоклеточное пространство вызывают раздражение нервных окончаний и обуславливают развитие парестезий и боли.
1.3 Эпидемиология
При проведении исследований, основанных на результатах аутопсий пациентов группы с сердечно-сосудистой патологией, распространенность атеросклероза мезентериальных артерий в общей популяции находится в диапазоне от 6% до 24% [18, 19], в среднем составляя около 10% у пациентов старше 65% [20]. Похожие цифры поражения мезентериальных артерий приводятся K.Hansen и соавторами, с частотой 17,5% у пациентов старше 65%, имеющих гемодинамически значимое поражение одной и более мезентериальной артерии [2]. Стенозирование 2-х и более артерий в данном исследовании выявлено у 1,3% пациентов, что подтверждает результаты, приводимые группой итальянских авторов [21].
Основная масса пациентов преклонного возраста, при наличии выявленных значимых сосудистых факторов риска, имеет сочетанное атеросклеротическое поражение нескольких артериальных бассейнов. Согласно целому ряду проведенных статистических исследований среди пациентов с клинической манифестацией мультифокального атеросклероза у 8 - 70% встречается ХМИ различной степени выраженности [1, 22, 23, 24], что еще раз подтверждает необходимость проведения скрининговой диагностики у данной группы пациентов.
Системное атеросклеротическое поражение брюшной аорты и артерий нижних конечностей является одним из маркеров возможного поражения мезентериальных артерий. Это подтверждает исследование, при котором диагностическое использование ангиографии сосудистого бассейна брюшной аорты позволило у 40%, 29% и 25% пациентов с аневризмой брюшной аорты, окклюзирующим поражением аорто-подвздошного сегмента и хронической ишемией нижних конечностей, соответственно, выявить поражение одной и более висцеральных артерий [25]. В этой исследуемой группе пациентов частота поражения одной из висцеральных артерий уже достигает 27%, а на долю многососудистого поражения мезентериальных артерий приходится 3,4%. Также выявлена корреляционная связь между частотой выявленных стенозов ЧС и ВБА и гемодинамически значимым поражением почечных артерий.
В популяции характерную клиническую картину хронической мезентериальной ишемии имеет 1 - 4 человека на 100.000 населения [26, 27, 28], с такой же низкой частотой течения заболевания, требующего госпитализации. На долю ХМИ, как причины обращения в стационар приходится не более 1 из 1000 госпитализаций при манифестации патологии в виде абдоминальных болей [20].
Низкая частота заболеваемости и формирования характерной симптоматики ХМИ обусловлена хорошими компенсаторными возможностями спланхнического артериального бассейна и формированием сети развитых коллатералей при прогрессирующем окклюзионно-стенозирующем поражении. При анализе аортограмм, выполненных 980 пациентам для выявления патологии мезентериальных артерий, стенозы > 50% одной из мезентериальных артерий диагностированы в 82 (8%) случаев, а у 60 (6%) пациентов подтвержден окклюзионный характер одного, двух или всех мезентериальных сосудов. Выявленные поражения манифестировали хронической мезентериальной ишемией только у 4 (0,4%) пациентов, причем каждый из них имел трехсосудистое поражение [27]. И даже трехсосудистое поражение не всегда проявляется характерной картиной ХМИ. Приводятся данные, согласно которым при обнаружении гемодинамически значимого поражения 2-х и более мезентериальных артерий, выявленном при ангиографии и на аутопсии, в 10 - 25% случаев заболевание протекает без клинических проявлений интестинальной ишемии [18, 29].
Прогноз и естественное течение. Наличие поражения мезентериальных артерий является предпосылкой для развития острого мезентериального тромбоза. В среднем частота развития ОМИ достигает 10 - 12% у пациентов с нелеченной ХМИ. Такое осложненное течение ХМИ возможно, как у симптомных, так и у асимптомных пациентов [30]. По данным Park W. и соавторов из клиники Мейо ретроспективный анализ 10-летнего периода лечения пациентов с острой мезентериальной ишемией показал, что 43% пациентов имели признаки нелеченной хронической мезентериальной ишемии [31]. Сходные цифры 52 и 64% демонстрируют исследователи из госпиталя Генри Форда [32] и университетской клиники Уэйк-Форест, соответственно [33].
Практика показывает, что используемые методы консервативной терапии у пациентов с клиническими проявлениями ХМИ не в силах остановить дальнейшее прогрессирование заболевания и характеризуется неблагоприятными отдаленными результатами. В анализе А.В. Гавриленко на фоне консервативного лечения в 56% случаев состояние пациентов с ХМИ не изменилось, а 33% пациентов отметили ухудшение, при этом положительного клинического эффекта лечения удалось добиться всего в 2% в отличие от хирургической группы (72,5%) [34]. Без хирургического лечения пятилетняя летальность среди пациентов с асимптомным течением ХМИ может составлять до 40%, а при наличии симптомов ХМИ и поражения 2-х и более ветвей может достигать 86% [35]. По данным ряда авторов осложненное течение может наступить в 90% случаев через 2 года после выявления гемодинамически значимого стеноза висцеральной артерии, чем постулируют о необходимости выполнения профилактической реваскуляризации даже при асимптомном и однососудистом поражении [36, 37, 38].
Интенсивность прогрессирования ХМИ находится в прямой зависимости от распространенности атеросклероза, и количества вовлеченных в патологический процесс висцеральных ветвей. Изучение клинического течения асимптомного атеросклероза брыжеечных артерий показало, что при динамическом наблюдении со средним сроком 2,6 года у 27% пациентов с трехсосудистым поражением, в конечном счете, развивались признаки интестинальной ишемии [27].
1.4 Кодирование по МКБ 10
Сосудистые болезни кишечника (K55)
K55.1 - Атеросклероз мезентериальных артерий
1.5 Классификация
Несмотря на достаточно длительный период изучения данной патологии, единой общепринятой классификации ХМИ по настоящее время так и не принято. Предложенные классификации J. Vollmar (1967), V. Cicala (1970), Ю.Л. Шалькова (1970), G. Freidman и W. Sloan (1972) либо учитывали этиологический принцип, либо основывались преимущественно на клинических проявлениях заболевания. При этом не учитывалась степень развившихся циркуляторных расстройств и компенсации нарушения кровообращения в органах пищеварения.
Первая классификация, соответствующая этим требованиям, была предложена А.В. Покровским и соавт. [39] в 1982 г. и включала этиологические факторы (интравазальные, экстравазальные) врожденные или приобретенные, клинические формы (чревную и брыжеечную), а также 3 стадии в течение ХМИ (компенсированную доклиническую, субкомпенсированную и декомпенсированную). Данная классификация, несмотря на свое 30-летнее существование, не утратила свою актуальность, а по некоторым позициям и в настоящее время широко применяется практикующими врачами [40].
С практической точки зрения для пациентов с ХМИ, обусловленной атеросклеротическом поражением мезентериальных артерий, наибольшей информативностью в плане определения показаний к хирургическому лечению, прогнозирования и оценки результатов лечения являются классификации с выделением степеней нарушения спланхнического кровообращения и соответствующей этому нарушению клинической картины. Этому требованию соответствуют несколько отечественных классификаций. Прежде всего это хирургическая классификация А.А. Спиридонова и соавт. (1996), которая предполагает деление на 4 стадии развития хронической ишемии органов пищеварения (ХИОП). Стадия компенсации включает асимптомное течение заболевания (Iа) и стадию микросимптоматики (Iб) - ишемию в результате функциональной перегрузки органов пищеварения. Стадия субкомпенсации (II) - ишемия вследствие функциональной нагрузки на органы пищеварения. Стадия декомпенсации (III) - ишемия функционального покоя органов пищеварения. Стадия язвенно-некротических изменений (IV) в органах пищеварения (язвы желудка и двенадцатиперстной кишки, энтериты, колиты, стриктуры тонкой и толстой кишки) [41].
По тождественному принципу построена классификация, используемая в клиниках гастроэнтерологии. В классификации Л.Б. Лазебника и соавторов помимо этиологических и клинических форм выделяется функциональные классы (ФК) хронической ишемической болезни органов пищеварения: I ФК - без выраженной клинической симптоматики, характерно отсутствие нарушения кровотока в покое и появления абдоминальной боли лишь после нагрузочной пробы; II ФК - наличие признаков расстройства кровообращения в покое и усиление их после функциональной нагрузки, выраженная клиническая симптоматика (болевой, диспепсический синдром, похудание), нарушение функции поджелудочной железы, дисфункция кишечника; к III ФК отнесены пациенты с выраженными циркуляторными расстройствами, выявляемые в покое и сочетающиеся с постоянным болевым синдромом, органическими изменениями органов пищеварения; IV ФК - стадия деструктивных изменений органов пищеварения [42].
1.6 Клиническая картина
Основной жалобой пациентов при синдроме хронической абдоминальной ишемии является боль как результат ишемии органов пищеварения, которая ведет к гипоксии и метаболическим нарушениям. Последние передают раздражение в солнечное или верхнебрыжеечное нервное сплетение. При поражении чревного ствола болевой синдром связан и с гипоксией печени и ишемией слизистой желудка. Боль обычно появляется через 20 - 25 мин после приема пищи и продолжается 1 - 2 часа, т.е. в течение всего периода пассажа пищи через кишечник. Обычно боль стихает самостоятельно и возникает вновь при приеме пищи, при прогрессировании заболевания нередко приобретает постоянный характер, вплоть до развития абдоминальных болей покоя. Боль может локализоваться в эпигастральной области и иррадиирует в правое подреберье (зона ишемии бассейна чревного ствола), или же распространяться от околопупочной области по всему живота, особенно на высоте функциональной нагрузки кишечника. Болевой синдром уменьшается при резком ограничении приема пищи - синдром малой пищи. Некоторые пациенты отмечают чувство постоянной тяжести в животе, особенно в эпигастральной области. Редко наблюдается рвота. Вторым основным симптомом хронической абдоминальной ишемии является дисфункция кишечника, выражающаяся нарушениями моторной, секреторной и абсорбционной функций. Третий основной симптом хронической абдоминальной ишемии - прогрессирующее похудание. Оно обусловлено несколькими факторами: во-первых, болевой симптом заставляет сократить объем, а затем и уменьшить частоту приемов пищи; во-вторых, возникающие из-за ишемии слизистой резкие нарушения секреторной и абсорбционной функций кишечника также ведут к потере массы тела. В связи с этим похудание фактически обусловлено тремя факторами: алиментарным (отказ от еды, фобия перед едой и последствия нарушений секреторно-абсорбционной и моторной функций кишечника); обезвоживанием организма вследствие поноса, искусственно вызываемой рвоты, приема слабительных средств; вследствие болевого фактора [39].
2. Диагностика
2.1 Жалобы и анамнез
- Рекомендуется всем пациентам с подозрением на ХМИ для верификации диагноза провести сбор жалоб и анамнеза для определения характеристик абдоминального болевого синдрома и выявления его связи с приемом пищи, диспепсическими явлениями, динамикой массы тела [39].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: ХМИ, вызванная атеросклеротическом поражением висцеральных ветвей брюшной аорты, манифестирует абдоминальными болями, возникающими после приема пищи и ассоциированными с прогрессирующим похуданием (кахексией), боязнью приема пищи (ситофобией), тошнотой, рвотой, диареей и другими малоспецифическими проявлениями дисфункции кишечника. Классические боли при ХМИ возникают через 15 - 30 минут после приема пищи и в среднем сохраняется в течение 1 - 2 часов. Регулярное появление болей после приема пищи заставляет пациентов отказываться от питания, опосредованно приводя к прогрессирующей потере веса. В дальнейшим кахексия приобретает комбинированный характер (алиментарный, психосоматический, дистрофический и др.) на фоне прогрессирования дисфункции ЖКТ. Симптомы хронической мезентериальной ишемии могут возникать и при наличии нормального веса, что требует дополнительной диагностики для определения альтернативного диагноза. К сожалению, наличие функциональной абдоминальной дисфункции, сочетанных гастроэнтерологических заболеваний, длительный онкопоиск при наличии малоспецифичных симптомов (постоянный дискомфорт в животе, тошнота, рвота, диарея, запоры и т.д.) часто становятся причиной задержки в определении ХМИ и постановки правильного диагноза [39].
- Рекомендуется расценивать стено-окклюзионное поражение двух и более мезентериальных артерий при ХМИ в качестве основной причины появления симптомов у пациентов с малоспецифичными абдоминальными симптомами [2, 27, 43, 44].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Предполагается, что обильная артериальная сосудистая сеть желудочно-кишечного тракта и формирование развитых коллатералей, в случае прогрессирующего поражения мезентериальных ветвей брюшной аорты, предотвращает развитие мезентериальной ишемии при однососудистом поражении. Это подтверждает большинство исследований, в которых подтверждено, что несмотря на высокую частоту встречаемости (до 18%) в общей популяции у пациентов пожилого возраста, симптомы хронической мезентериальной ишемии появляются очень редко. Симптомы ХМИ не возникают до тех пор, пока 2 из 3 мезентериальных артерий не будут гемодинамически стенозированы или окклюзированы. Тем не менее, это утверждение не исключает факта возможного наличия взаимосвязи между симптомами ХМИ и однососудистым стено-окклюзионным поражением.
2.2 Физикальное обследование
- Рекомендуется физикальный осмотр всем пациентам с подозрением на ХМИ для верификации диагноза [39, 45].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Принципы физикального обследования пациента с ХМИ направлены на выявление объективных признаков стено-окклюзирующего поражения мезентериальных артерий и косвенных признаков возникшей на этом фоне мезентериальной ишемии. Основным критерием предположения сосудистого генеза возникшей абдоминальной патологии является системный характер атеросклероза, как причины ХМИ, и наличие сочетанной патологии других артериальных бассейнов организма. Для этого пациентам необходимо проводить полное сосудистое пальпаторное и аускультативное обследование с обязательным изучением абдоминальной полости.
Ключевое диагностическое значение нередко имеет систолический шум, определяемый в эпигастральной области, в проекции отхождения висцеральных артерий от брюшной аорты и являющийся отображением нарушения проходимости таких крупных магистральных артерий, как ЧС и ВБА. Выявление систолического шума в группе пациентов с подозрением на ХМИ варьирует в диапазоне 50,5 - 78,5% [39, 45].
При пальпации брюшной полости возможно выявление аневризмы брюшной аорты, при инструментальной диагностике которой ассоциированно повышается частота атеросклеротического поражения мезентериальных артерий. Внешние признаки астенизации пациента на фоне болей в животе, других проявлений системного атеросклероза, боязни приема пищи и дисфункции кишечника являются критерием для проведения инструментальной диагностики ХМИ. ХМИ-ассоциированная кахексия по данным некоторых авторов может достигать 53 - 77% [46, 47].
2.3 Инструментальная диагностика
Диагноз ХМИ следует считать маловероятным при отсутствии стеноза или окклюзии сразу нескольких мезентериальных артерий и необходима тщательная инструментальная диагностика альтернативных причин абдоминального синдрома [2, 27, 43].
Ультразвуковая диагностика
Ультразвуковое дуплексное сканирование (УЗДС) чаще всего используется в качестве метода скрининга и первичной диагностики гемодинамически значимых мезентериальных стенозов и окклюзий. В качестве ключевых критериев используются пиковая систолическая и конечная диастолическая скорости кровотока по артериям (см. Приложение Г). При сравнении диагностических возможностей ультразвукового исследования с информативностью дигитальной субтракционной ангиографией подтверждена высокая диагностическая точность ультразвука, достигающая 85 - 90% при выявлении > 70% стенозов мезентериальных артерий [48 - 50].
- Ультразвуковое дуплексное сканирование брыжеечных артерий рекомендуется в качестве метода первичной диагностики всем пациентам с подозрением на ХМИ для диагностики гемодинамически значимых стенозов и окклюзий мезентериальных артерий [2, 48, 49, 51].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: В целом ряде сравнительных исследований показана высокая диагностическая точность ультразвукового метода при сопоставлении с ангиографией. Ультразвуковое дуплексное сканирование с оценкой скоростных показателей кровотока позволяет визуализировать стенозы ЧС и ВБА в 83 и 93% случаев, соответственно, в то время, как при ангиографии это показатель достигает 100 и 99% [49]. Тем не менее, приложением достаточно высокой диагностической точности ультразвукового исследования является его абсолютная безопасность и неинвазивность, что делает его универсальным методом скрининга сосудистой патологии. Диагностические возможности ультразвука позволяют на этапе обследования определить выбор предпочтительного варианта реваскуляризации - хирургического или эндоваскулярного. Проведение исследования после нагрузочной пищевой пробы может быть также полезно и предполагает расширение протокола исследования мезентериальных артерий. При интерпретации скоростных показателей кровотока по брыжеечным артериям обязательно необходимо учитывать влияние на них дыхательного цикла [51, 52]. УЗДС также может быть использовано в качестве метода интраоперационной оценки эффективности выполненной реконструкции. В одном одноцентровом исследовании частота ошибок, допущенных при реконструктивных вмешательствах и выявленных при помощи интраоперационного ультразвукового дуплексного сканирования, достигла 8% случаев [53]. Использование УЗДС является хорошим диагностическим дополнением при оценке клинической эффективности после эндоваскулярных вмешательств на висцеральных артериях. В настоящее время отсутствует общепринятый консенсус в отношении ультразвуковых критериев гемодинамически значимых рестенозов после открытой или эндоваскулярной реваскуляризации мезентериальных артерий, но как показано в некоторых исследованиях увеличение пиковой систолической и конечной диастолической скорости кровотока при контрольных стандартизированных ультразвуковых исследованиях указывает на наличие прогрессирующего стеноза [54].
Ангиография
Ангиографическое исследование исторически является золотым стандартом диагностики стено-окклюзионных поражения мезентериальных артерий, благодаря возможности прямой и качественной визуализации спланхнического бассейна, а также выявлению коллатеральной артериальной сети. Неоспоримым преимуществом ангиографии, как метода исследования, является возможность быстрого перехода к лечебным мероприятиям и выполнения различных вариантов эндоваскулярного вмешательства. С другой стороны, ангиография является инвазивным исследованием с потенциальным риском процедуро-ассоциированных осложнений и лучевой нагрузки. Из-за неинвазивного характера и высокой диагностической ценности КТ-ангиография практически полностью заменила стандартную ангиографию в качестве метода диагностики, в том числе при планировании открытого или эндоваскулярного вариантов лечения ХМИ. В некоторых центрах во время ангиографии и эндоваскулярных процедур производят измерение градиента артериального давления с помощью размещения датчика в брюшной аорте и дистальнее места стенозирующего поражения, определяя гемодинамическую эффективность выполненного вмешательства [55, 56].
Компьютерная и магнитно-резонансная томографическая ангиография
- КТ-ангиографию рекомендуется выполнить для визуализации стено-окклюзионного поражения и выявления/исключения абдоминальной патологии всем пациентам с подозрением на ХМИ [46, 56 - 59].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: КТ-ангиография в настоящее время является методом выбора при необходимости визуализации патологии мезентериальных артерий при ХМИ. При формировании 3D-реконструкции спланхнического бассейна КТ-ангиография обеспечивает полную картину патологии с чувствительностью и специфичностью 96% и 94%, соответственно, в отношении выявления стено-окклюзионных поражений. Важной отличительной особенностью метода от стандартной ангиографии является возможность визуализировать и произвести оценку других органов брюшной полости во время процедуры, что позволяет исключить/подтвердить другую причину хронических болей в животе. КТ-ангиография обладает максимальными диагностическими возможностями выявления кальцинированных атеросклеротических бляшек, что нередко является определяющей информацией при планировании варианта оперативного лечения. Пространственное визуализация позволяет воссоздать всю коллатеральную сосудистую сеть, развивающуюся при ХМИ. Выявление с помощью КТ-ангиографии локализованного поражения чревного ствола с постстенотической дилятацией и отсутствием атеросклеротической бляшки делает высоковероятным диагноз синдрома срединной дугообразной связки.
- МР-ангиография рекомендуется в качестве альтернативы КТ-ангиографии для визуализации стено-окклюзионного поражения и выявления/исключения абдоминальной патологии пациентам с подозрением на ХМИ [60 - 62].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: МР-ангиография обладает хорошим диагностическим потенциалом в качестве метода визуализации патологии мезентериальных артерий при ХМИ. В исследовании с небольшой когортой пациентов МР-ангиография показала высокие показатели чувствительности и специфичности (100% и 95%, соответственно) при сравнении с данными, полученными с помощью ангиографии и интраоперационной картиной патологии. Основное преимущество МР-ангиографии - это отсутствие радиоактивного облучения и возможность проведения измерений потока крови. Однако, сравнительно недавно было проведено исследование, подтвердившее диагностическое превосходство КТА над МРА. Кроме того, большинство экспертов сходится в мнении, что КТ-ангиографии доступна лучшая визуализация нижней брыжеечной артерии и других периферических брыжеечных артерий малого калибра, в том числе коллатератей.
3. Лечение
3.1 Консервативное лечение
К настоящему времени отсутствуют научные доказательства эффективности консервативной терапии при использовании длительного парентерального питания и какого-либо из вариантов неинтервенционного или медикаментозного лечения. Более того, задержка с выполнением реваскуляризации или использование в качестве терапии одного лишь парентерального питания повышают риск ухудшения клинического течения ХМИ, развития инфаркта кишечника и риска септических осложнений, связанных с длительной катетеризацией центральной вены для парентерального питания [63, 64].
- Не рекомендуется откладывать оперативное лечение (реваскуляризацию) пациентам с прогрессирующей ХМИ (выраженная кахексия, диарея, боль покоя) для консервативного восстановления нутритивного статуса в качестве предоперационной подготовки [27, 63, 65].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств III)
Комментарии: Отсутствуют данные об эффективности энтерального или парентерального питания пациентов с ХМИ в плане купирования синдрома мальнутриции и кахексии. Существуют экспериментальные свидетельства того, что энтеральные питание увеличивает метаболизм тканей кишечника и при исходных нарушениях мезентериальной перфузии может спровоцировать развитие некробиотических изменений стенки кишечника [63].
При выборе варианта консервативного лечения и динамического наблюдения пациенты с ХМИ нуждаются в тщательном контроле и консультировании в отношении появления и развития у них симптомов мезентериальной ишемии. Если у пациента развиваются любые симптомы гастроинтестинальной дисфункции, такие, например, как, вздутие живота, диарея, появление нестандартных болей и других, необходимо рассмотреть вопрос о проведении реваскуляризации. Только после проведения реваскуляризации, как основного метода лечения ХМИ, можно возобновить консервативную терапию и оральное питание [65 - 67].
3.2 Хирургическое лечение
- Рекомендуется выполнить ревакуляризацию всем пациентам с симптомной ХМИ, вызванной однососудистым и/или многососудистым стенозирующим атеросклеротическим поражением [27, 63, 65].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIb)
Комментарии: Необходимость реваскуляризации у пациентов с клиническими проявлениями ХМИ не вызывает сомнения. При выполнении реваскуляризации преследуется сразу несколько целей: купирование симптомов ХМИ, улучшение качества жизни, нормализацию веса и питания, увеличение выживаемости за счет профилактики развития острой мезентериальной ишемии и инфаркта кишечника. Профилактическая реваскуляризация у пациентов с асимптомным течением в настоящее время является объектом дискуссий. Профилактическую реваскуляризацию целесообразнее выполнять у пациентов с тяжелым многососудистым поражением, особенно при проживании в труднодоступных местах и отсутствии должного уровня необходимой медицинской помощи [27]. Из-за небольшого материала исследований также остается спорным вопрос мезентериальной реваскуляризация при выполнении сочетанных операций на брюшной аорте, поскольку такие реконструкции ассоциируются с увеличением частоты осложнений и летальности. Актуальность вопроса о реваскуляризации при однососудистом поражении также не вызывает сомнений. Большинством исследований было доказано, что благодаря реваскуляризации можно достигнуть хороших отдаленных клинических результатов, но сложности возникают при отборе пациентов, у которых можно получить пользу от лечения. В двух исследованиях, изучивших этот вопрос, показано, что анализ клинической картины при поражениях мезентериальных артерий имеет низкий прогностический потенциал [65]. При сравнении клинической картины 109 пациентов с ХМИ и 161 пациента без клиники ишемии, некоторое прогностическое значение имели такие проявления как боль после приема пищи, прогрессирующее похудание, отказ от приема пищи (или коррекция режима питания) и диарея. Однако, даже когда присутствовали все четыре симптома вероятность развития ХМИ составила всего 60% [65]. Это еще раз подчеркивает необходимость разработки и внедрения функциональных тестов для определения показаний к оперативному лечению, особенно у пациентов с однососудистым поражением.
- Рекомендуется при планировании оперативного вмешательства для всех пациентов с ХМИ сопоставить отдаленные результаты открытых операций с ранними преимуществами эндоваскулярных операций при ХМИ после анализа возможной периоперационной летальности и осложнений для выбора оптимальной тактики реваскуляризации [66, 67, 68, 69].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIb)
Комментарии: В сравнительно недавно опубликованном систематическом обзоре было показано, что при эндоваскулярной реваскуляризации риск летальности достигает 6% (диапазон 0 - 21%) [68]. По сравнению с открытой мезентериальной реваскуляризацией, эндоваскулярная реваскуляризация ассоциируется со снижением частоты осложнений вмешательств, сокращением сроков пребывания в стационаре и времени реабилитации [67, 68]. Проведенный комитетом по разработке рекомендаций Европейского общества сосудистых хирургов метаанализ смертности после открытой и эндоваскулярной мезентериальной реваскуляризации показал, что летальность после открытых вмешательств была статически выше, чем после эндоваскулярных (9,1 и 2,3%, соответственно) [70]. Однако, исходя из данных этого метаанализа в исследованиях, проведенных на базе одного узкоспециализированного по ХМИ центра, разница в летальности не была выявлена (OR 1.12, 95% CI 0.6 - 2,08).
Тем не менее в административных данных Национального реестра США смертность была достоверно ниже после эндоваскулярной реваскуляризации (OR 0,20, 95% CI 0,17 - 0,24) [66, 70]. Открытые реваскуляризации, в противоположность этим данным, обеспечивают более высокую отдаленную проходимость реконструкций и шунтов, низкую частоту повторных вмешательств и возврата симптомов ХМИ. В настоящее время остается доказать, что эндоваскулярное лечение приводит к тождественным отдаленной проходимости и клиническому улучшению [66, 68, 71, 72 - 84]. Для получения объективных данных наиболее оправданным кажется необходимость проведения рандомизированных контролируемых исследований, которые, к сожалению, являются трудновыполнимыми из-за редкой патологии и невозможности набрать большие статистические группы для анализа.
- При выполнении реваскуляризации мезентериальных артерий при ХМИ рекомендуется восстанавливать бассейн ВБА в первую очередь как при проведении открытой, так и эндоваскулярной техники операции [85 - 87].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIb)
Комментарии: ВБА является основной артерией для реваскуляризации при ХМИ, поскольку развитие острого нарушения мезентериального кровообращения в бассейне ВБА является прогностически более неблагоприятным. Опосредованно возможно восстановление кровоснабжения бассейна ВБА за счет реваскуляризации ЧС и НБА, особенно в случаях, когда ВБА не подходит для реканализации или хронически окклюзирована. Выбор варианта реваскуляризации зависит от диаметра артерии, степени и протяженности стеноза/окклюзии, наличия тандемных поражений, степени кальцификации и особенностей коллатерального русла [69, 74, 75, 76]. Ангиопластика и стентирование показали наилучшую эффективность при относительно локальных непротяженных стенозах или окклюзиях ВБА с минимальной или средней степенью кальцификация или тромбирования. В некоторых публикациях говорится о возможности выполнения эндоваскулярной реваскуляризации при более протяженных сегментарных окклюзия или выраженном кальцинозе [85 - 86]. Баллонная ангиопластика и стентирование ЧС сопровождаются более высокой частотой рестенозов [87] и противопоказана при синдроме компрессии срединной дугообразной связкой. Стентирование ЧС можно рассматривать как вариант лечения при отсутствии инструментальных признаков экстравазальной компрессии или если ранее выполнена лапароскопическая или открытая хирургическая декомпрессия. В настоящее время остается спорным вопрос о необходимости выполнения 2-х сосудистого (ЧС и ВБА) стентирования и в большинстве публикаций представлены результаты однососудистой реваскуляризации. Тем не менее, опубликованы несколько ретроспективных исследований, в которых авторы показали некоторую тенденцию к снижению частоты рецидива заболевания [88, 89] и улучшению отдаленных результатов при двухсосудистом мезентериальном стентировании. В противоположность этим данным представлена работа, в которой сообщается о почти одинаковой частоте рецидива в течение 2-х летнего периода наблюдения после изолированного стентирования ВБА (78%) и двухсосудистого стентирования ЧС и ВБА (60%) [87]. Предпочтительной двухсосудистая реваскуляризация видится в случаях тяжелой мезентериальной ишемии при отсутствии хороших коллатеральных связей между ЧС и ВБА. Считается, что дополнительная реваскуляризация при двухсосудистом стентировании увеличивает потенциальный риск осложнений и стоимость лечения, тем не менее, чаще в исследованиях говорится о лучших результатах полной реваскуляризации по сравнению с однососудистым стентированием [78, 89, 90]. В настоящее время отсутствуют рекомендации о предпочтительном использовании двухсосудистого стентирования, что, вероятно, связано с отсутствием достаточного материала для анализа и крупных статистических исследований. Стентирование ЧС предпочтительно у пациентов с высоким риском кардиальных осложнений, у которых стентирование ВБА не привело к желаемому успеху или реканализация ВБА оказалась неудачной, а также при прогнозировании низкой эффективности стентирования из-за выраженного кальциноза или протяженного окклюзионного поражения ВБА. В некоторых работах выдвинуто мнение о предпочтительном использовании стентирования ЧС, как варианта этапного лечения с целью купирования проявлений ХМИ (особенно кахексии) перед открытой хирургической коррекцией или ретроградным стентированием ВБА [90].
- Рекомендуется при определении тактики и выбора метода реконструкции/реваскуляризации у пациентов с ХМИ оценивать: риски открытого хирургического вмешательства; анатомию поражения мезентериальных артерий; определение степени кахексии и компенсации нутритивного статуса; состояние сердечной, легочной и почечной функции [71, 91 - 95].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Выбор метода открытой хирургической реконструкция мезентериальных артерий включает определение типа хирургического доступа (трансперитонеальный или забрюшинный), типа используемого сосудистого кондуита (вена или протез), конфигурации реконструкции (антеградная и ретроградная), источника притока кровотока (аорта или подвздошная артерия), а также количества артерий, нуждающихся в реконструкции (одно- или многососудистая реваскуляризация). Выбор варианта открытой реконструкции должен зависеть от анатомии поражения мезентериальных артерий и клинического риска пациента [71]. Пациенты с низким функциональным резервом из-за преклонного возраста, кахексии или тяжелой сердечной, легочной и почечной дисфункций не являются хорошими кандидатами для выполнения реконструкции от суправисцерального отдела аорты, но лучше подходят для проведения экстраанатомических реконструкций от инфарренальной аорты или подвздошной артерии. В качестве альтернативы некоторые авторы рекомендуют использование открытого (гибридного) ретроградного мезентериального стентирования за счет открытой экспозиции ВБА и ретроградной имплантации стента путем прямой пункции ВБА [92 - 94]. В наибольшей сравнительно недавно опубликованной серии представлено 14 успешных ретроградных стентирований из 15 случаев с высоким показателем отдаленной вторичной проходимости реконструкций [95].
Методы реваскуляризации
Открытые хирургические вмешательства
Антеградная реконструкция (шунтирование/протезирование)
- Рекомендуется использовать в качестве источника притока дистальный отдел нисходящей грудной аорты или суправисцеральный сегмент аорты для снижения риска деформации шунта или при невозможности имплантации шунта в брюшную аорту и подвздошные артерий из-за их выраженного атеросклероза/атероматоза [96].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: При этом варианте реконструкции в качестве источника притока используется дистальный отдел нисходящей грудной аорты или суправисцеральный сегмент аорты, как отдел меньше всего подверженный атеросклерозу. Данная конфигурация реконструкции имеет потенциальные гемодинамические преимущества из отсутствия риска перегиба сосудистого кондуита, более свойственного для ретроградного шунтирования [96]. В большинстве сообщений двухсосудистая реконструкция ЧС и ВБА осуществляется благодаря использованию линейного или бифуркационного полиэтилентерефталатного протеза [31, 67].
Ретроградная реконструкция (шунтирование)
- Рекомендуется пациентам с ХМИ использование ретроградного шунтирования от инфраренальной аорты или подвздошных артерий в случаях, когда суправисцеральный отдел аорты не может служить источником притока или расширения доступа к этому отделу из-за наличия значимой кардиальной или легочной дисфункции [31, 67].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: В большинстве случаев ретроградная реконструкция используется при выполнении однососудистой мезентериальной реваскуляризации, преимущественно бассейна ВБА, однако возможна реконструкция ЧС или общей печеночной артерии путем проведения сосудистого кондуита в забрюшинное пространство или через брыжейку поперечной ободочной кишки, соответственно. Поскольку сосудистый кондуит при такой реконструкции имеет C-образную конфигурацию, очень важно избегать избыточного удлинения трансплантата, образования углов или перегибов. Важно также позиционировать кондуит таким образом, чтобы избежать контакта со стенкой кишечника. Ряд исследований показывает, что ретроградное шунтирование также популярно, как и антеградные реконструкции и характеризуются схожими результатами [31, 67].
Ретроградное открытое мезентериальное стентирование
- Рекомендуется пациентам с ХМИ рассмотреть использование гибридного варианта оперативного лечения (комбинация открытого доступа путем срединной лапаратомии + эндоваскулярное ретроградное стентирование) при невозможности имплантации стента традиционным трансаортальным способом [92, 93].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Этот метод позволяет избежать расширенной диссекции тканей, необходимости забора аутовены или использования протеза, и может быть идеальным у пациентов с распространенным поражением аортоподвздошного сегмента сосудистого русла и отсутствием хорошего источника притока, а также в случаях контаминации и резекции кишечника при гангрене кишечника. При проведении ретроградного стентирования рекомендуется использовать баллон-расширяемые стенты. Иногда возможно изолированное ретроградное размещение проводника в аорте с последующим выполнением этапа традиционного стентирования через одну из периферических артерий, например, бедренную артерию. Место пункции в ЧС и ВБА ушивают отдельными узловыми швами или, в случае диффузного стенозирующего поражения в этом месте, расширяют продольно и делают пластику заплатой.
Трансаортальная эндартерэктомия
- Рекомендуется проведение трансаортальной эндартерэктомии с использованием торакофренолюмботомического доступа у пациентов с сопутствующей абдоминальной патологией (спаечной болезнью, грыжами живота и т.д.) и перенесенным ранее трансабдоминальным доступом в качестве альтернативного хирургического лечения пациентов с ХМИ [39].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Результаты, получаемые с помощью трансаортальной эндартерэктомии, сопоставимы с результатами антеградных и ретроградных шунтирующих/протезирующих операций.
Эндоваскулярная реваскуляризация
Стратегии хирургического лечения ХМИ постоянно меняются в связи с быстрым развитием новых эндоваскулярных устройств и методов лечения. В течение последнего десятилетия количество мезентериальных реваскуляризаций увеличилось в десять раз в связи с появлением и растущим признанием эндоваскулярной техники вмешательств, являющихся хорошей малоинвазивной альтернативной лечения [66]. В большинстве центров эндоваскулярное стентирование стало основным методом лечения пациентов с ХМИ, а открытая реваскуляризация выполняется только в случае неудачи эндоваскулярного лечения или если пациент не является оптимальным кандидатом для транслюминальной операции [66 - 67].
- Рекомендуется всем пациентам с ХМИ проведение стентирования мезентериальных артерий как более предпочтительного метода эндоваскулярного лечения ХМИ, при отсутствии анатомических и клинических противопоказаний (соматическая патология, экстравазальная компрессия, кальциноз артерий и аорты и др.) [75].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Как показывает ряд сравнительных исследований частота раннего послеоперационного купирования симптомов ХМИ выше в группе открытых операций по сравнению с эндоваскулярными. При среднесрочном периоде наблюдения частота рестеноза и необходимости в повторной реваскуляризации существенно ниже в группе с открытой реваскуляризацией. Первичная и вторичная проходимость трансплантатов была выше после открытой реваскуляризации по сравнению с эндоваскулярным лечением. Однако, при этом эндоваскулярная реваскуляризация показывает значимо более низкие показатели послеоперационной летальности и осложнений, сокращение сроков пребывания в отделении реанимации и в стационаре в целом, что делает этот метод, в частности стентирование, предпочтительным у пациентов с сопутствующей патологией и хирургическими факторами риска [75]. Кроме при проведении современных вариантов эндоваскулярной коррекции ряд авторов отмечает отсутствие статистических различий между хирургическим и эндоваскулярным методом по вторичной проходимости реваскуляризаций при среднесрочном (3 года) периоде наблюдения [67].
- Стентирование в отличие от стандартной баллонной ангиопластики рекомендуется выполнять рутинно при выполнении эндоваскулярного лечения всем пациентам с ХМИ [72, 86, 87, 88, 89, 97 - 108].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIb)
Комментарии: В настоящее время стентирование, как метод лечения, полностью вытеснило баллонную ангиопластику, сопровождающуюся высоким риском рестенозов и необходимостью в повторных вмешательствах. Несмотря на то, что нет проспективных научных сравнительных исследований ангиопластики и стентирования мезентериальных артерий, большинство экспертов согласны с рутинным использованием стентирования при ХМИ из-за схожести выявляемых поражений мезентериальных артерий с атеросклеротической патологией почечных артерий
- Рекомендуется всем пациентам с ХМИ предпочтительное использование стент-графтов при выборе между ними и голометаллическими стентами при стентировании мезентериальных артерий [109].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIb)
Комментарии: Остается актуальными разногласия экспертов относительно использования голометаллических стентов или покрытых конструкций (стент-графтов) для лечения стенозов ВБА. В недавнем ретроспективном нерандомизированном сравнительном исследовании с включением 225 пациентов, которым было проведено лечение голометаллическими и покрытыми стентами, стент-графты обеспечили более низкую частоту рестенозов, возврата клинических симптомов и реинтервенций по сравнению с голометаллическими стентами (примерно на 10% по сравнению с 50%) [105].
- Открытое оперативное вмешательство рекомендуется выполнять пациентам с ХМИ при неудаче эндоваскулярного лечения, при неатеросклеротической причине поражения аорты и ее ветвей у молодых пациентов, неподходящей для эндоваскулярного лечения анатомии (протяженная окклюзия или выраженный кальциноз) [76, 72, 86, 88, 89, 98 - 107, 110, 111].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIb)
Комментарии: Большинством исследователей открытое хирургическое лечение рекомендуется выполнять прежде всего у пациентов с неблагоприятной для стентирования анатомией поражений мезентериальных артерий, после неэффективного эндоваскулярного лечения, с развившимся рестенозом/окклюзией после стентирования. Летальность для открытых мезентериальных реконструкций, выполняемых в крупных медицинских центрах, составляет менее 3%, хотя может увеличиваться при осложненном течении ХМИ [31, 67, 76]. Открытое вмешательство также предпочтительнее у пациентов с неатеросклеротическими причинами, такими как васкулит, нейрофиброматоз и синдром средней аорты [110, 111].
3.3 Иное лечение
Обезболивающая терапия у взрослых
- Рекомендуется пациентам для премедикации с целью седации и обеспечения эмоциональной стабильности вечером накануне операции с целью уменьшения эмоционального стресса назначить транквилизаторы и нейролептики. Для премедикации перед подачей пациента в операционную с целью седации и обеспечения эмоциональной стабильности применяются опиаты и/или бензодиазепины [112 - 114].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Вечером накануне операции: бензодиазепины (бромдигидрохлорфенилбензодиазепин**, лоразепам), атипичные нейролептики (тиоридазин**, сульпирид**) в индивидуальных дозировках. Перед подачей в операционную в/м тримепередин** и/или диазепам**/мидазолам**.
- Рекомендуется пациентам для индукции в наркоз использовать: фентанил**, пропофол**, бензодиазепины, для поддержания анестезии - фентанил**, пропофол**, бензодиазепины, фторсодержащие газовые анестетики. Предпочтение необходимо отдавать проведению комбинированной анестезии с применением галогенсодержащих газовых анестетиков на всех этапах хирургического вмешательства, включая искусственное кровообращение [112 - 114].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: препараты, используемые для индукции и поддержания анестезии:
Индукция: мидазолам**/диазепам**/пропофол** и фентанил** в/в в расчетных дозировках.
Поддержание анестезии: мидазолам**/диазепам**/пропофол** и фентанил** - в/в в расчетных дозировках. Возможно применение галогенсодержащих газовых анестетиков в комбинации с фентанилом**. При превышении дозировок (применении дозировок, превышающих указанные в инструкции к препарату) необходимо решение врачебной комиссии.
- Рекомендуется пациентам для обезболивания в раннем послеоперационном периоде использовать опиаты и НПВП в возрастных дозировках [112 - 114].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: препараты, используемые для обезболивания в послеоперационном периоде:
Первые сутки после операции - тримепередин**, либо морфин** в/м каждые 4 - 8 часов, далее НПВП. При наличии специальных дозаторов эффективно применение пациент-контролируемой анальгезии фентанилом**. При сохранении выраженного болевого синдрома тримепередин**/морфин**/фентанил** по показаниям
4. Реабилитация
Специфической реабилитации после оперативного лечения при ХМИ нет.
Принципы реабилитации пациентов после лечения ХМИ соответствуют основным принципам, используемым при реабилитации пациентов после стандартных абдоминальных операций.
5. Профилактика
Пациентам с выполненной мезентериальной реконструкцией (открытой или эндоваскулярной) необходимо проведение коррекции образа жизни, привычек и медикаментозной терапии, направленной на стабилизацию течения атеросклероза (см. клиническую рекомендацию по ведению пациентов с атеросклерозом) [115 - 118].
- Рекомендуется всем пациентам ежегодное динамическое наблюдение у кардиолога и сердечно-сосудистого хирурга с проведением дуплексного ультразвукового исследования сосудов 1 - 2 раза в год после реваскуляризации целью мониторинга состояния за выполненной реконструкцией, по причине возможного появления клинических симптомов ХМИ и для раннего выявления рецидива заболевания и рестенозирования мезентериальных артерий [119, 120 - 122].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Европейское общество кардиологов в рекомендациях по лечению заболеваний периферических артерий постулирует от необходимости проведения контрольного дуплексного ультразвукового исследования каждые 6 - 12 месяцев [120, 121]. При этом в последних рекомендация Европейского общества сосудистых хирургов нет однозначного ответа на вопрос о возможных преимуществах проведения такого инструментального контроля. Кроме того, даже несмотря на выявление с помощью УЗДС, КТ-ангиографии или МР-ангиографии рестенозов, остается открытым вопрос о том, какой тактики необходимо придерживаться при выявлении асимптомного рестеноза. Как было показано в одном, достаточно крупном относительно проблемы лечения ХМИ, исследовании из 157 пациентов, которым выполнено стентирование мезентериальных артерий, у 57 пациентов (36%) в среднем (29 месяцев) отдаленном периоде развились рестенозы [122]. 30 пациентов были подвергнуты повторному вмешательству, у 24 из которых возник возврат симптомов ХМИ, а у 6 пациентов лечение проведено по поводу предокклюзионного поражения. Повторные мезентериальные реинтервенции характеризуются низкой летальностью (3%), высокой частотой осложнений (27%) (связанных, например, с техническими проблемами при проведении повторных вмешательств, риском развития мезентериальной ишемии, застойной сердечной недостаточности и тромбоза стента) и прекрасной эффективностью в виде купирования симптомов ХМИ (92%). В другом исследовании из 24 пациентов после стентирования ВБА при ХМИ и выполненного динамического ультразвукового контроля, 8 (33,3%) выполнены эффективные повторные вмешательства. Исходя из данных этих и большинства других схожих исследований, основной целью, которую необходимо преследовать при динамическом мониторировании пациентов после мезентериальной реваскуляризации, является оценка и раннее выявление рестеноза после стентирования или хирургической реконструкции. Тем не менее, в большинстве описанных случаев, рестенозы подвергаются повторному лечению только при формировании у пациентов клинического рецидива заболевания. Именно с таким избирательным подходом к тактике лечения при рестенозах и возвратах клиники, а также небольшим материалом, связана невозможность предоставить утвердительные рекомендации относительно регулярного клинического и инструментального контроля и предлагаемые рекомендации носят невысокий уровень доказательности.
- Проведение антиагрегантной терапии (ацетилсалициловая кислота**, клопидогрел** или др.) рекомендуется всем пациентам после открытой хирургической реваскуляризации, выполненной по поводу ХМИ [117, 118].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств I)
Комментарии: Также, как и у пациентов с системным атеросклерозом другой локализации, для пациентов с ХМИ антитромбоцитарная терапия является эффективной, особенно в предотвращении кардиальных событий, инсультов и сохранении компетентности (проходимости) выполненных реваскуляризирующих операций. Длительность терапии - пожизненно (при отсутствии противопоказаний).
- Всем пациентам после эндоваскулярного стентирования, выполненного по поводу ХМИ, рекомендуется двойная антиагрегантная терапия (ацетилсалициловая кислота** + клопидогрел**) в соответствии рекомендациями для пациентов с поражением коронарных артерий после реваскуляризации [87].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: В настоящее время некоторые эксперты для улучшения отдаленных результатов и повышения отдаленной проходимости стентированных мезентериальных артерий рекомендуют проведение двойной антитромбоцитарной терапии, обосновывая ее профилактикой рестенозирования и лучшими результатами по сравнению с однокомпонентной антитромбоцитарной терапией [87].
6. Дополнительная информация, влияющая на течение и исход заболевания
Обследования, используемые для подтверждения ишемии
В настоящий момент наиболее информативным вариантом подтверждения ХМИ является тонометрия, основанная на измерении pCO2 слизистой, показатели которой не зависят от интенсивности метаболизма тканей или характеристик кровотока. Диагностические возможности метода были апробированы на различных моделях животных с модерированием стено-окклюзионного или неокклюзионного характера ишемии [122]. Измерение внутрипросветного pCO2 можно выполнить с использованием назогастрального и назоеюнального катетеров, подключенных к специально разработанному капнографу, который позволяет автоматически измерить pCO2. Появление и увеличение градиента pCO2 возникает при снижении кровотока ниже 50% от исходного потока и его последующего резкого изменения [123, 124]. Повышение уровня CO2 связано с локальным накоплением молочной кислоты (лактата) при включении анаэробного метаболизма тканей.
Как показали исследования наилучшими диагностическим возможностями для подтверждения хронической мезентериальной ишемии обладает тонометрия, выполняемая на фоне функциональной нагрузки или пищевой пробы [125, 126]. Так, например, чувствительность и специфичность нагрузочной тонометрии составляют 76% и 92%, соответственно, для 24-часовой тонометрии эти показатели достигают 92% и 77%, соответственно [126, 127]. Тем не менее, при очевидных диагностических преимуществах тонометрия обладает целым рядом недостатков, из которых ключевыми являются сложность и дороговизна технологии, дискомфорт, испытываемый пациентами во время исследования, длительность исследования, ошибки, возникающие при нарушении технологии измерения. Кроме того, один из основных производителей капнографов для тонометрии, использованных в большинстве исследований, прекратил их производство и обслуживание, несмотря на наличие и доступность тонометрических катетеров. В настоящее время отсутствуют данные о современных работах, проводимых с использованием техники, позволяющей измерять pCO2 слизистой у пациентов с ХМИ.
7. Организация медицинской помощи
Показания для плановой госпитализации:
1) Выявленное по данным УЗДС (или другой инструментальной диагностики) гемодинамически значимое стено-окклюзионное поражение мезентериальных артерий для дообследования и определения тактики лечения;
2) Высокая вероятность поражения мезентериальных артерий у пациентов из категории скрининга (см. алгоритм диагностики и лечения);
3) Необходимость проведения инвазивной инструментальной диагностики (например, ангиографии) для уточнения гемодинамической значимости поражения;
4) Наличие показаний к хирургическому или интервенционному лечению ХМИ.
Показания для экстренной госпитализации:
1) Убедительных показаний к экстренной госпитализации при ХМИ нет;
2) Осложненное течение раннего послеоперационного периода.
Показания к выписке пациента из стационара:
1) Подтверждение при ультразвуковом контроле состоятельности выполненной по поводу ХМИ реваскуляризации;
2) Купирование характерного для ХМИ болевого синдрома.
Пациентам с подозрением и установленным диагнозом ХМИ рекомендуется проводить диагностику и лечение в специализированных центрах с мультидисциплинарным подходом, позволяющим выполнять и эндоваскулярное, и хирургическое лечение при участии команды специалистов, обладающих опытом лечения пациентов с ХМИ.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1
Проведен сбор анамнеза и жалоб всем пациентам с подозрением на хроническую мезентериальную ишемию
C
IIa
2
Проведен визуальный осмотр всем пациентам с подозрением на хроническую мезентериальную ишемию
C
IIa
3
Проведена ультразвуковая визуализирующая диагностика для верификации анатомии поражения мезентериальных артерий и выбора тактики лечения
B
IIa
4
Проведена КТ-ангиография/МР-ангиография с визуализацией мезентериальных артерий для подтверждения патологии спланхнического бассейна и подтверждения/исключения другой абдоминальной патологии
B
IIa
5
Проведена первоочередная реваскуляризация бассейна верхней брыжеечной артерии при наличии симптомов хронической мезентериальной ишемии при распространенном поражении мезентериальных артерий
B
IIa
6
Проведено лечение с преимущественным использованием стентирования при эндоваскулярном подходе
C
IIa
7
Проведено открытое хирургическое лечение при неудаче ранее выполненного эндоваскулярного лечения
B
IIa
8
Проведено открытое хирургическое лечение при неатеросклеротической причине поражения аорты и ее ветвей у молодых пациентов или неподходящей для эндоваскулярного лечения анатомии поражения
B
IIa
9
Проведена антиагрегантная терапия после открытой хирургической реваскуляризации, выполненной по поводу хронической мезентериальной ишемии
C
I
10
Проведена двойная антиагрегантная терапия после эндоваскулярного стентирования, выполненного по поводу хронической мезентериальной ишемии
C
IIa
Список литературы
1. Jarvinen O, Laurikka J, Sisto T, et al. Atherosclerosis of the visceral arteries. Vasa. 1995; 24: 9 - 14
2. Hansen K., Wilson D., Craven T. et al. Mesenteric artery disease in the elderly. J Vasc Surg 2004; 40; 45 - 52
3. REIS, Wenes Pereira et al. Prevalence of atherosclerotic stenosis of celiac trunk and superior mesenteric artery in occlusive arteriopathy of lower limbs. J. vasc. bras. [online]. 2010, vol. 9, n. 1 [cited 2018-10-14], pp. 4 - 13
4. Moawad J, Gewertz BL. Chronic mesenteric ischemia. Surg Clin North Am. 1997; 77: 357 - 69
5. Maffei FHA, Lastoria F. Ateroclerose obliterante  : epidemiologia, fisiopatologia, quadro
: epidemiologia, fisiopatologia, quadro ![]() e
e  .
.  vasculares
vasculares  . 3a ed. Rio de Janeiro: Medsi; 2002. p. 1007 - 24
. 3a ed. Rio de Janeiro: Medsi; 2002. p. 1007 - 24
6. Krupski WC. The peripheral vascular consequences of smoking. Ann Vasc Surg. 1991; 5: 291 - 304
7. Weitz JI, Byrne J, Clagett GP, et al. Diagnosis and treatment of chronic arterial insufficiency of the lower extremities: a critical review. Circulation. 1996; 94: 3026 - 49
8. Chang RW, Chang JB, Longo WE Update in management of mesenteric ischemia. World J Gastroenterol. 2006 May 28; 12(20): 3243 - 7
9. Moneta GL, Taylor DC, Helton WS, Mulholland MW, Strandness DE, Jr. Duplex ultrasound measurement of postprandial intestinal blood flow: Effect of meal composition. Gastroenterology. 1988; 95(5): 1294 - 301
10. Someya N, Endo MY, Fukuba Y, Hayashi N. Blood flow responses in celiac and superior mesenteric arteries in the initial phase of digestion. Am J Physiol Regul Integr Comp Physiol. 2008 Jun; 294(6): R1790 - 6
11. Biebl M, Oldenburg W A, Paz-Fumagalli R, McKinney J M, Hakaim A G. Surgical and interventional visceral revascularization for the treatment of chronic mesenteric ischemia - when to prefer which? World J Surg. 2007; 31: 562 - 568
12. Hohenwalter E. Chronic mesenteric ischemia: diagnosis and treatment. Semin Intervent Radiol. 2009; 26(4): 345 - 51
13. Cognet F, Ben Salem D, Dranssart M, et al. Chronic mesenteric ischemia: Imaging and percutaneous treatment. Radiographics. 2002; 22: 863 - 80
14. Matheson PJ, Wilson MA, Garrison RN. Regulation of intestinal blood flow. The Journal of surgical research. 2000; 93(0022-4804; 1): 182 - 96
15. Kalder J, Ajah D, Keschenau P, Kennes LN, Tolba R, Kokozidou M, et al. Microcirculatory perfusion shift in the gut wall layers induced by extracorporeal circulation. J Vasc Surg. 2015 Feb; 61(2): 497 - 503
16. Vollmar B, Burkhardt M, Minor T, Klauke H, Menger MD. High-resolution microscopic determination of hepatic NADH fluorescence for in vivo monitoring of tissue oxygenation during hemorrhagic shock and resuscitation. Microvasc Res. 1997; 54(2): 164 - 73
17. Grootjans J, Thuijls G, Derikx JP, van Dam RM, Dejong CH, Buurman WA. Rapid lamina propria retraction and zipper-like constriction of the epithelium preserves the epithelial lining in human small intestine exposed to ischaemia-reperfusion. J Pathol. [Research Support, Non-U.S. Gov"t]. 2011 Jul; 224(3): 411 - 9
18. Croft, R.J. Does "intestinal angina" exist? A critical study of obstructed visceral arteries/R.J. Croft, G.P. Menon, A. Marston//Br. J. Surg. - 1981. - vol. 68. - p. 316 - 318
19. McAfee, M.K. Influence of complete revascularization on chronic mesenteric ischemia/M.K. McAfee, K.J. Cherry, J.M. Naessens, P.C. Pairolero, J.W. Hallett, P. Gloviczki et al.//Am. J. Surg. - 1992. - vol. 164. - p. 220 - 224
20. Patel R, Costanza M. Mesenteric Ischemia, Chronic. [Updated 2017 Nov 27]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2018 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK430748
21. Biolato, M., Miele, L., Gasbarrini, G., and Grieco, A. Abdominal angina. Am J Med Sci. 2009; 338: 389 - 395
22. Казанчян, П.О. О синдроме хронической абдоминальной ишемии/П.О. Казанчян//Кардиология. - 1978. - N 2. - с. 43
23. Bron, K.M. Splanchnic artery stenosis and occlusion. Incidence; arteriographic and clinical manifestations/K.M. Bron, H.C. Redman//Radiology. - 1969. - vol. 92. - p. 323 - 328.; 8
24. Derrick, J.R. The pattern of arteriosclerosis narrowing of the celiac and superior mesenteric arteries/J.R. Derrick, J.C. Pollard, R.M. Moore//Ann. Surg. - 1959. - vol. 149. - p. 684 - 689
25. Valentine, R. James et al. Asymptomatic celiac and superior mesenteric artery stenoses are more prevalent among patients with unsuspected renal artery stenosis. Journal of Vascular Surgery, Volume 14, Issue 2, 195 - 199
26. Moawad, J. Chronic mesenteric ischemia. Clinical presentation and diagnosis/J. Moawad, B. Gewertz//Surg. Clin. North. Am. - 1997. - vol. 77. - p. 357 - 369
27. Thomas, J.H. The clinical course of asymptomatic mesenteric arterial stenosis/J.H. Thomas, K. Blake, G.E. Pierce et al.//J. Vasc. Surg. - 1998. - vol. 27. - p. 840 - 844
28. Wolf, A. Mesenteric ischemia. Surgical epidemiology - when to take it into consideration?/A. Wolf, D. Henne-Bruns//Chirurg. - 2003. - vol. 74. - p. 395 - 398
29. Moneta, G. Management of visceral ischaemic syndromes/G. Moneta, R. Lee//In: Rutherford R.B. Vascular Surgery 4th edn. - Philadelphia, W.B. Saunders, 1995. - p. 1267 - 1277
30. Herbert, G. Acute and Chronic Mesenteric Ischemia./G. Herbert, S. Steele//Surgical Clinics of North America. - 2007. - vol. 87. - p. 1115 - 1134
31. Park, W. Current results of open revascularization for chronic mesenteric ischemia: A standard for comparison/W. Park, K. Cherry Jr., H. Chua, R. Clark, G. Jenkins, W. Harmsen, A. Noel, J. Panneton, T. Bower, J. Hallett Jr., P. Gloviczki//J. Vasc. Surg. - 2002. - vol. 35. - p. 853 - 859
32. Cho, J.S. Long-term outcome following mesenteric artery reconstruction: a 37-year experience/J.S. Cho, J.A. Carr, G. Jacobsen, A.D. Shepard, T.J. Nypaver, D.J. Reddy//J. Vasc. Surg. - 2002. - vol. 35. - p. 453 - 460
33. Edwards, M. Acute occlusive mesenteric ischemia: surgical management and outcomes/M. Edwards//Ann. Vasc. Surg. - 2003. - vol. 7. - p. 72 - 79
34. Гавриленко, А.В. Диагностика и лечение хронической абдоминальной ишемии/А.В. Гавриленко, А.Н. Косенков. - М.: Грааль, 2000. - 170 с
35. Van Bockel JH, Geelkerken RH, Wasser MN. Chronic splanchnic ischemia. Best Pract Res Clin Gastroenterol 2001; 15: 99 - 119
36. Baur, G.M. Treatment of chronic visceral ischemia/G.M. Baur, D.J. Millay, L.M. Taylor et al.//Am. J. Surg. - 1984. - vol. 148. - p. 138
37. Illuminati, G. The Surgical Treatment of Chronic Intestinal Ischemia: Results of a recent series/G. Illuminati, F. ![]() , A. D'Urso, V. Papaspiropoulos, P. Mancini, G. Ceccanei//Acta Chir. Belg. - 2004. - vol. 104. - p. 175 - 183
, A. D'Urso, V. Papaspiropoulos, P. Mancini, G. Ceccanei//Acta Chir. Belg. - 2004. - vol. 104. - p. 175 - 183
38. Stoney, R. Revascularization methods in chronic visceral ischemia caused by atherosclerosis/R. Stoney, W. Ehrenfeld, E. Wylie//Ann. Surg. - 1977. - vol. 186. - p. 468 - 475
39. Покровский А.В., Казанчян П.О., Дюжиков А.А. Диагностика и лечение хронической ишемии органов пищеварения. Ростов н/Д: Изд-во Рост. ун-та 1982
40. Кохан Е.П., Белякин С.А., Мироненко Д.А. О классификации хронической абдоминальной ишемии. Кардиология и сердечно-сосудистая хирургия. 2014. Т. 7. N 2. С. 10 - 14
41. Спиридонов А.А., Клионер Л.И. Хроническая ишемия органов пищеварения. В кн.: Бураковский В.И., Бокерия Л.А. (ред.). Сердечно-сосудистая хирургия: Руководство. М: Медицина 1996: 681 - 688
42. Лазебник Л.Б., Звенигородская Л.А. Хроническая ишемическая болезнь органов пищеварения. М: Анахарсис 2003. 136 с
43. van Noord D, Kuipers EJ, Mensink PB. Single vessel abdominal arterial disease. Best Practice Research Clin Gastroenterol 2009; 23(1): 49 - 60
44. Mensink PB, van Petersen AS, Geelkerken RH, Otte JA, Huisman AB, Kolkman JJ. Clinical significance of splanchnic artery stenosis. Br J Surg 2006; 93(11): 1377 - 82
45. Herbert GS, Steele SR. Acute and chronic mesenteric ischemia. Surg Clin North Am 2007; 87: 1115 - 34
46. Barret M., Martineau C., Rahmi G., Pellerin O., Sapoval M., Alsac JM., Fabiani JN., Malamut G., Samaha E., Cellier C. Chronic Mesenteric Ischemia: A Rare Cause of Chronic Abdominal Pain. Am J Med. 2015 Dec; 128(12): 1363. e1 - 8
47. Lejay, A., Georg, Y., Tartaglia, E., Creton, O., Lucereau, B., Thaveau, F., ![]() , B., & Chakfe, N. (2015). Chronic mesenteric ischemia: 20 year experience of open surgical treatment. European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery, 49 5, 587 - 92
, B., & Chakfe, N. (2015). Chronic mesenteric ischemia: 20 year experience of open surgical treatment. European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery, 49 5, 587 - 92
48. Zwolak, R.M., Fillinger, M.F., Walsh, D.B., LaBombard, F.E., Musson, A., Darling, C.E. et al. Mesenteric and celiac duplex scanning: a validation study. J Vasc Surg. 1998; 27: 1078 - 1087
49. Moneta, G.L., Lee, R.W., Yeager, R.A., Taylor, L.M. Jr., and Porter, J.M. Mesenteric duplex scanning: a blinded prospective study. J Vasc Surg. 1993; 17: 79 - 84
50. AbuRahma, A.F., Stone, P.A., Srivastava, M., Dean, L.S., Keiffer, T., Hass, S.M. et al. Mesenteric/celiac duplex ultrasound interpretation criteria revisited. J J Vasc Surg. 2012; 55: 428 - 436
51. van Petersen, A.S., Meerwaldt, R., Kolkman, J.J., Huisman, A.B., van der Palen, J., van Bockel, J.H. et al. The influence of respiration on criteria for transabdominal duplex examination of the splanchnic arteries in patients with suspected chronic splanchnic ischemia. J Vasc Surg. 2013; 57: 1603 - 1611
52. van Petersen AS, Kolkman JJ, Meerwaldt R, Huisman AB, van der Palen J, Zeebregts CJ, et al. Mesenteric stenosis, collaterals, and compensatory blood flow. J Vasc Surg 2014; 60(1): 111 - 119
53. Oderich, G.S., Panneton, J.M., Macedo, T.A., Noel, A.A., Bower, T.C., Lee, R.A. et al. Intraoperative duplex ultrasound of visceral revascularizations: optimizing technical success and outcome. J Vasc Surg. 2003; 38: 684 - 691
54. Hodgkiss-Harlow, K. Interpretation of visceral duplex scanning: before and after intervention for chronic mesenteric ischemia. Semin Vasc Surg. 2013; 26: 127 - 132
55. Dias, N.V., Acosta, S., Resch, T., Sonesson, B., Alhadad, A., Malina, M. et al. Mid-term outcome of endovascular revascularization for chronic mesenteric ischaemia. Br J Surg. 2010; 97: 195 - 201
56. Landis, M.S., Rajan, D.K., Simons, M.E., Hayeems, E.B., Kachura, J.R., and Sniderman, K.W. Percutaneous management of chronic mesenteric ischemia: outcomes after intervention. J Vasc Intervent Radiol. 2005; 16: 1319 - 1325
57. Oliva, I.B., Davarpanah, A.H., Rybicki, F.J., Desjardins, B., Flamm, S.D., Francois, C.J. et al. ACR Appropriateness Criteria (R) imaging of mesenteric ischemia. Abdom Imaging. 2013; 38: 714 - 719
58. Kirkpatrick ID, Kroeker MA, Greenberg HM. Biphasic CT with mesenteric CT angiography in the evaluation of acute mesenteric ischemia: initial experience. Radiology 2003; 229(1): 91 - 98
59. Horton KM, Talamini MA, Fishman EK. Median arcuate ligament syndrome: evaluation with CT angiography. Radiographics 2005; 25(5): 1177 - 1182
60. Schaefer, P.J., Pfarr, J., Trentmann, J., Wulff, A.M., Langer, C., Siggelkow, M. et al. Comparison of noninvasive imaging modalities for stenosis grading in mesenteric arteries. RoFo. 2013; 185: 628 - 634
61. Meaney JF, Prince MR, Nostrant TT, Stanley JC. Gadoliniumenhanced MR angiography of visceral arteries in patients with suspected chronic mesenteric ischemia. J Magn Reson Imaging 1997; 7(1): 171 - 176
62. Laissy JP, Trillaud H, Douek P. MR angiography: noninvasive vascular imaging of the abdomen. Abdom Imaging 2002; 27(5): 488 - 506
63. Rheudasil, J.M., Stewart, M.T., Schellack, J.V., Smith, R.B. 3rd, Salam, A.A., and Perdue, G.D. Surgical treatment of chronic mesenteric arterial insufficiency. J Vasc Surg. 1988; 8: 495 - 500
64. Turza KC, Drenitsky J, Sawyer RG. Nutrition issues in gastroenterology, Sept 009: Series #78, Ed: Parrish CR; 11 - 22
65. ter Steege, R.W., Sloterdijk, H.S., Geelkerken, R.H., Huisman, A.B., van der Palen, J., and Kolkman, J.J. Splanchnic artery stenosis and abdominal complaints: clinical history is of limited value in detection of gastrointestinal ischemia. World J Surg. 2012; 36: 793 - 799
66. Schermerhorn, M.L., Giles, K.A., Hamdan, A.D., Wyers, M.C., and Pomposelli, F.B. Mesenteric revascularization: management and outcomes in the United States, 1988 - 2006. J Vasc Surg. 2009; 50: 341 - 348 (e1)
67. Oderich, G.S., Bower, T.C., Sullivan, T.M., Bjarnason, H., Cha, S., and Gloviczki, P. Open versus endovascular revascularization for chronic mesenteric ischemia: risk-stratified outcomes. J Vasc Surg. 2009; 49: 1472 - 1479 (e3)
68. van Petersen AS, Kolkman JJ, Beuk RJ, Huisman AB, Doelman CJ, Geelkerken RH, et al. Open or percutaneous revascularization for chronic splanchnic syndrome. J Vasc Surg 2010; 51(5): 1309 - 16
69. Moghadamyeghaneh Z, Carmichael JC, Mills SD, Dolich MO, Pigazzi A, Fujitani RM, et al. Early outcome of treatment of chronic mesenteric ischemia. Am Surg 2015; 81(11): 1149 - 56
70. ![]() , M. et al. Editor"s Choice - Management of the Diseases of Mesenteric Arteries and Veins. European Journal of Vascular and Endovascular Surgery, Volume 53, Issue 4, 460 - 510
, M. et al. Editor"s Choice - Management of the Diseases of Mesenteric Arteries and Veins. European Journal of Vascular and Endovascular Surgery, Volume 53, Issue 4, 460 - 510
71. Oderich, G.S., Gloviczki, P., and Bower, T.C. Open surgical treatment for chronic mesenteric ischemia in the endovascular era: when it is necessary and what is the preferred technique?. Semin Vasc Surg. 2010; 23: 36 - 46
72. Malgor, R.D., Oderich, G.S., McKusick, M.A., Misra, S., Kalra, M., Duncan, A.A. et al. Results of single- and two-vessel mesenteric artery stents for chronic mesenteric ischemia. Ann Vasc Surg. 2010; 24: 1094 - 1101
73. Gibbons, C.P. and Roberts, D.E. Endovascular treatment of chronic arterial mesenteric ischemia: a changing perspective?. Semin Vasc Surg. 2010; 23: 47 - 53
74. Kasirajan, K., O"Hara, P.J., Gray, B.H., Hertzer, N.R., Clair, D.G., Greenberg, R.K. et al. Chronic mesenteric ischemia: open surgery versus percutaneous angioplasty and stenting. J Vasc Surg. 2001; 33: 63 - 71
75. Assar, A.N., Abilez, O.J., and Zarins, C.K. Outcome of open versus endovascular revascularization for chronic mesenteric ischemia: review of comparative studies. J Cardiovasc Surg. 2009; 50: 509 - 514
76. Atkins, M.D., Kwolek, C.J., LaMuraglia, G.M., Brewster, D.C., Chung, T.K., and Cambria, R.P. Surgical revascularization versus endovascular therapy for chronic mesenteric ischemia: a comparative experience. J Vasc Surg. 2007; 45: 1162 - 1171
77. Biebl, M., Oldenburg, W.A., Paz-Fumagalli, R., McKinney, J.M., and Hakaim, A.G. Surgical and interventional visceral revascularization for the treatment of chronic mesenteric ischemia - when to prefer which?. World J Surg. 2007; 31: 562 - 568
78. Gupta, P.K., Horan, S.M., Turaga, K.K., Miller, W.J., and Pipinos, I.I. Chronic mesenteric ischemia: endovascular versus open revascularization. J Endovasc Ther. 2010; 17: 540 - 549
79. Indes, J.E., Giacovelli, J.K., Muhs, B.E., Sosa, J.A., and Dardik, A. Outcomes of endovascular and open treatment for chronic mesenteric ischemia. J Endovasc Ther. 2009; 16: 624 - 630
80. Oderich, G.S., Malgor, R.D., and Ricotta, J.J. 2nd. Open and endovascular revascularization for chronic mesenteric ischemia: tabular review of the literature. Ann Vasc Surg. 2009; 23: 700 - 712
81. Rawat, N., Gibbons, C.P., and Joint Vascular Research Group. Surgical or endovascular treatment for chronic mesenteric ischemia: a multicenter study. Ann Vasc Surg. 2010; 24: 935 - 945
82. Rose, S.C., Quigley, T.M., and Raker, E.J. Revascularization for chronic mesenteric ischemia: comparison of operative arterial bypass grafting and percutaneous transluminal angioplasty. J Vasc Intervent Radiol. 1995; 6: 339 - 349
83. Sivamurthy, N., Rhodes, J.M., Lee, D., Waldman, D.L., Green, R.M., and Davies, M.G. Endovascular versus open mesenteric revascularization: immediate benefits do not equate with short-term functional outcomes. J Am Coll Surg. 2006; 202: 859 - 867
84. Zerbib, P., Lebuffe, G., Sergent-Baudson, G., Chamatan, A., Massouille, D., Lions, C. et al. Endovascular versus open revascularization for chronic mesenteric ischemia: a comparative study. Langenbecks Arch Surg. 2008; 393: 865 - 870
85. Manunga, J.M. and Oderich, G.S. Orbital atherectomy as an adjunct to debulk difficult calcified lesions prior to mesenteric artery stenting. J Endovasc Ther. 2012; 19: 489 - 494
86. Sarac, T.P., Altinel, O., Kashyap, V., Bena, J., Lyden, S., Sruvastava, S. et al. Endovascular trgibbeatment of stenotic and occluded visceral arteries for chronic mesenteric ischemia. J Vasc Surg. 2008; 47: 485 - 491
87. Oderich, G. S., Tallarita, T., Gloviczki, P., Duncan, A.A., Kalra, M., Misra, S., Cha, S., and Bower, T.C. Mesenteric artery complications during angioplasty and stent placement for atherosclerotic chronic mesenteric ischemia. J Vasc Surg. 2012 Apr; 55(4): 1063 - 1071
88. Silva, J.A., White, C.J., Collins, T.J., Jenkins, J.S., Andry, M.E., Reilly, J.P. et al. Endovascular therapy for chronic mesenteric ischemia. J Am Coll Cardiol. 2006; 47: 944 - 950
89. Peck, M.A., Conrad, M.F., Kwolek, C.J., LaMuraglia, G.M., Paruchuri, V., and Cambria, R.P. Intermediate-term outcomes of endovascular treatment for symptomatic chronic mesenteric ischemia. J Vasc Surg. 2010; 51: 140 - 147 (e1 - 2)
90. Biebl, M., Oldenburg, W.A., Paz-Fumagalli, R., McKinney, J.M., and Hakaim, A.G. Endovascular treatment as a bridge to successful surgical revascularization for chronic mesenteric ischemia. Am Surg. 2004; 70: 994 - 998
91. Kristensen, S.D., Knuuti, J., Saraste, A., Anker, S., ![]() , H.E., De Hert, S. et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: the Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur Heart J. 2014; 35: 2383 - 2431
, H.E., De Hert, S. et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: the Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur Heart J. 2014; 35: 2383 - 2431
92. Wyers, M.C., Powell, R.J., Nolan, B.W., and Cronenwett, J.L. Retrograde mesenteric stenting during laparotomy for acute occlusive mesenteric ischemia. J Vasc Surg. 2007; 45: 269 - 275
93. Milner, R., Woo, E.Y., and Carpenter, J.P. Superior mesenteric artery angioplasty and stenting via a retrograde approach in a patient with bowel ischemia-a case report. Vasc Endovasc Surg. 2004; 38: 89 - 91
94. Pisimisis, G.T. and Oderich, G.S. Technique of hybrid retrograde superior mesenteric artery stent placement for acute-on-chronic mesenteric ischemia. Ann Vasc Surg. 2011; 25: 132 (e7 - 11)
95. Blauw, J.T., Meerwaldt, R., Brusse-Keizer, M., Kolkman, J.J., Gerrits, D., Geelkerken, R.H. et al. Retrograde open mesenteric stenting for acute mesenteric ischemia. J Vasc Surg. 2014; 60: 726 - 734
96. Farber, M.A., Carlin, R.E., Marston, W.A., Owens, L.V., Burnham, S.J., and Keagy, B.A. Distal thoracic aorta as inflow for the treatment of chronic mesenteric ischemia. J Vasc Surg. 2001; 33: 281 - 287 (discussion 7 - 8)
98. Sharafuddin, M.J., Nicholson, R.M., Kresowik, T.F., Amin, P.B., Hoballah, J.J., and Sharp, W.J. Endovascular recanalization of total occlusions of the mesenteric and celiac arteries. J Vasc Surg. 2012; 55: 1674 - 1681
99. Aksu, C., Demirpolat, G., Oran, I., Demirpolat, G., Parildar, M., and Memis, A. Stent implantation in chronic mesenteric ischemia. Acta Radiol. 2009; 50: 610 - 616
100. Brown, D.J., Schermerhorn, M.L., Powell, R.J., Fillinger, M.F., Rzucidlo, E.M., Walsh, D.B. et al. Mesenteric stenting for chronic mesenteric ischemia. J Vasc Surg. 2005; 42: 268 - 274
101. Daliri, A., Grunwald, C., Jobst, B., Szucs-Farkas, Z., Diehm, N.A., Kickuth, R. et al. Endovascular treatment for chronic atherosclerotic occlusive mesenteric disease: is stenting superior to balloon angioplasty?. Vasa. 2010; 39: 319 - 324
102. Fioole, B., van de Rest, H.J., Meijer, J.R., van Leersum, M., van Koeverden, S., Moll, F.L. et al. Percutaneous transluminal angioplasty and stenting as first-choice treatment in patients with chronic mesenteric ischemia. J Vasc Surg. 2010; 51: 386 - 391
103. Kougias, P., El Sayed, H.F., Zhou, W., and Lin, P.H. Management of chronic mesenteric ischemia. The role of endovascular therapy. J Endovasc Ther. 2007; 14: 395 - 405
104. Kougias, P., Huynh, T.T., and Lin, P.H. Clinical outcomes of mesenteric artery stenting versus surgical revascularization in chronic mesenteric ischemia. Int Angiol. 2009; 28: 132 - 137
105. Matsumoto, A.H., Angle, J.F., Spinosa, D.J., Hagspiel, K.D., Cage, D.L., Leung, D.A. et al. Percutaneous transluminal angioplasty and stenting in the treatment of chronic mesenteric ischemia: results and longterm followup. J Am Coll Surg. 2002; 194: S22 - S31
106. Schaefer, P.J., Schaefer, F.K., Hinrichsen, H., Jahnke, T., Charalambous, N., Heller, M. et al. Stent placement with the monorail technique for treatment of mesenteric artery stenosis. J Vasc Intervent Radiol. 2006; 17: 637 - 643
107. Schaefer, P.J., Schaefer, F.K., Mueller-Huelsbeck, S., and Jahnke, T. Chronic mesenteric ischemia: stenting of mesenteric arteries. Abdom Imaging. 2007; 32: 304 - 309
108. Schoch, D.M., LeSar, C.J., Joels, C.S., Erdoes, L.S., Sprouse, L.R., Fugate, M.W. et al. Management of chronic mesenteric vascular insufficiency: an endovascular approach. J Am Coll Surg. 2011; 212: 668 - 675 (discussion 75-7)
109. Oderich, G.S., Erdoes, L.S., Lesar, C., Mendes, B.C., Gloviczki, P., Cha, S. et al. Comparison of covered stents versus bare metal stents for treatment of chronic atherosclerotic mesenteric arterial disease. J Vasc Surg. 2013; 58: 1316 - 1323
110. Rits, Y., Oderich, G.S., Bower, T.C., Miller, D.V., Cooper, L., Ricotta, J.J. 2nd et al. Interventions for mesenteric vasculitis. J Vasc Surg. 2010; 51: 392 - 400 (e2)
111. Fields, C.E., Bower, T.C., Cooper, L.T., Hoskin, T., Noel, A.A., Panneton, J.M. et al. Takayasu"s arteritis: operative results and influence of disease activity. J Vasc Surg. 2006; 43: 64 - 71
112. Рыбка М.М., Хинчагов Д.Я. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых при ишемической болезни сердца, патологии клапанного аппарата, нарушениях ритма, гипертрофической кардиомиопатии, аневризмах восходящего отдела аорты у пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2015.
113. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Никулкина Е.С. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения рентгенэндоваскулярных и диагностических процедур, выполняемых у кардиохирургических пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2018.
114. Бунятян А.А., Анестезиология: национальное руководство [Электронный ресурс]/под ред. А.А. Бунятяна, В.М. Мизикова - М.: ГЭОТАР-Медиа, 2017. - 656 с. - ISBN 978-5-9704-3953-1 - Режим доступа: http://www.rosmedlib.ru/book/ISBN9785970439531.html, стр 578 - 625
115. Cholesterol Treatment Trialists" Collaboration, Baigent, C., Blackwell, L., Emberson, J., Holland, L.E., Reith, C. et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010; 376: 1670 - 1681
116. Peeters Weem, S.M., van Haelst, S.T., den Ruijter, H.M., Moll, F.L., and de Borst, G.J. Lack of evidence for dual antiplatelet therapy after endovascular arterial procedures: a meta-analysis. Eur J Vasc Endovasc Surg. 2016 Aug; 52: 253 - 262
117. Anand, S. S., Bosch, J., Eikelboom, J. W., Connolly, S. J., Diaz, R., Widimsky, P., ... Yusuf, S. (2018). Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease: an international, randomised, double-blind, placebo-controlled trial. The Lancet, 391(10117), 219 - 229
118. European Stroke, O., Tendera, M., Aboyans, V., Bartelink, M.L., Baumgartner, I., Clement, D. et al. ESC guidelines on the diagnosis and treatment of peripheral artery diseases: document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2011; 32: 2851 - 2906
119. Tallarita, T., Oderich, G.S., Macedo, T.A., Gloviczki, P., Misra, S., Duncan, A.A. et al. Reinterventions for stent restenosis in patients treated for atherosclerotic mesenteric artery disease. J Vasc Surg. 2011; 54: 1422 - 1429 (e1)
120. Baker, A.C., Chew, V., Li, C.S., Lin, T.C., Dawson, D.L., Pevec, W.C. et al. Application of duplex ultrasound imaging in determining in-stent stenosis during surveillance after mesenteric artery revascularization. J Vasc Surg. 2012; 56: 1364 - 1371 (discussion 71)
121. Raupach, J., Lojik, M., Chovanec, V., Renc, O., Strycek, M., Dvorak, P. et al. Endovascular management of acute embolic occlusion of the superior mesenteric artery: a 12-year single-centre experience. Cardiovasc Intervent Radiol. 2016; 39: 195 - 203
122. Mensink, P.B., van Petersen, A.S., Geelkerken, R.H., Otte, J.A., Huisman, A.B., and Kolkman, J.J. Clinical significance of splanchnic artery stenosis. Br J Surg. 2006; 93: 1377 - 1382
123. Otte, J.A., Geelkerken, R.H., Oostveen, E., Mensink, P.B., Huisman, A.B., and Kolkman, J.J. Clinical impact of gastric exercise tonometry on diagnosis and management of chronic gastrointestinal ischemia. Clin Gastroenterol Hepatol. 2005; 3: 660 - 666
124. Sana, A., Vergouwe, Y., van Noord, D., Moons, L.M., Pattynama, P.M., Verhagen, H.J. et al. Radiological imaging and gastrointestinal tonometry add value in diagnosis of chronic gastrointestinal ischemia. Clin Gastroenterol Hepatol. 2011; 9: 234 - 241
125. Thuijls, G., van Wijck, K., Grootjans, J., Derikx, J.P., van Bijnen, A.A., Heineman, E. et al. Early diagnosis of intestinal ischemia using urinary and plasma fatty acid binding proteins. Ann Surg. 2011; 253: 303 - 308
126. Cudnik, M.T., Darbha, S., Jones, J., Macedo, J., Stockton, S.W., and Hiestand, B.C. The diagnosis of acute mesenteric ischemia: a systematic review and meta-analysis. Acad Emerg Med. 2013; 20: 1087 - 1100
127. Acosta, S. and Nilsson, T. Current status on plasma biomarkers for acute mesenteric ischemia. J Thromb Thrombolysis. 2012; 33: 355 - 361
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Академик РАН Л.А. Бокерия - Ассоциация сердечно-сосудистых хирургов России
2. Академик РАН А.В. Покровский - Ассоциация сердечно-сосудистых хирургов России
3. проф. В.С. Аракелян (Москва) - Ассоциация сердечно-сосудистых хирургов России
4. член-корреспондент РАН Л.С. Коков (Москва) - Ассоциация сердечно-сосудистых хирургов России
5. к.м.н. Р.Г. Букацелло (Москва) - Ассоциация сердечно-сосудистых хирургов России
6. проф. С.А. Абугов (Москва) - Ассоциация сердечно-сосудистых хирургов России
7. академик РАН Ю.В. Белов (Москва) - Ассоциация сердечно-сосудистых хирургов России
8. д.м.н. Д.Ф. Белоярцев (Москва) - Ассоциация сердечно-сосудистых хирургов России
9. проф. А.Н. Вачев (Самара) - Ассоциация сердечно-сосудистых хирургов России
10. академик РАН А.В. Гавриленко А.В. (Москва) - Ассоциация сердечно-сосудистых хирургов России
11. проф. А.А. Дюжиков (Ростов-на-Дону) - Ассоциация сердечно-сосудистых хирургов России
12. д.м.н. И.А. Ерошкин (Москва) - Ассоциация сердечно-сосудистых хирургов России
13. академик РАН И.И. Затевахин (Москва) - Ассоциация сердечно-сосудистых хирургов России
14. академик РАН Д.Г. Иоселиани (Москва) - Ассоциация сердечно-сосудистых хирургов России
15. проф. З.А. Кавтеладзе (Москва) - Ассоциация сердечно-сосудистых хирургов России
16. проф. Ю.И. Казаков (Тверь) - Ассоциация сердечно-сосудистых хирургов России
17. проф. А.А. Карпенко (Новосибирск) - Ассоциация сердечно-сосудистых хирургов России
18. проф. И.И. Кательницкий (Ростов-на-Дону) - Ассоциация сердечно-сосудистых хирургов России
19. д.м.н. А.В. Максимов (Казань) - Ассоциация сердечно-сосудистых хирургов России
20. проф. Г.Ю. Сокуренко (Санкт-Петербург) - Ассоциация сердечно-сосудистых хирургов России
21. проф. В.В. Сорока (Санкт-Петербург) - Ассоциация сердечно-сосудистых хирургов России
22. д.м.н. И.Е. Тимина (Москва) - Ассоциация сердечно-сосудистых хирургов России
23. проф. А.В. Троицкий (Москва) - Ассоциация сердечно-сосудистых хирургов России
24. к.м.н. А.Ф. Харазов (Москва) - Ассоциация сердечно-сосудистых хирургов России
25. проф. В.Н. Шиповский (Москва) - Ассоциация сердечно-сосудистых хирургов России
26. проф. А.А. Фокин (Челябинск) - Ассоциация сердечно-сосудистых хирургов России
27. член-корреспондент РАН Э.Р. Чарчян (Москва) - Ассоциация сердечно-сосудистых хирургов России
28. проф. А.М. Чернявкий (Новосибирск) - Ассоциация сердечно-сосудистых хирургов России
29. проф. А.В. Чупин (Москва) - Ассоциация сердечно-сосудистых хирургов России
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория разработанных клинических рекомендаций:
1. Врач - сердечно-сосудистый хирург
2. Врач-хирург
3. Врач - ультразвуковой диагностики
4. Врач-радиолог
5. Врач по рентгенэндоваскулярной диагностике и лечению
6. Врач-онколог
7. Врач-гастроэнтеролог
8. Врач-эндоскопист
9. Врач-кардиолог
Таблица П1. Уровни убедительности рекомендаций
Уровень убедительности рекомендаций
Описание
Уровень I
Процедура или лечение являются полезными/эффективными, они должны быть выполнены/назначены.
Уровень II
Уровень IIa
Процедура или лечение с большой долей вероятности являются полезными/эффективными, их разумно было бы выполнить/назначить.
Уровень IIb
Противоречивые доказательства о пользе/эффективности процедуры или лечения, их выполнение/назначение может быть рассмотрено.
Уровень III
Процедура или лечение являются вредными/неэффективными, они не должны выполняться/назначаться.
Таблица П2. Уровни достоверности доказательств
Уровень достоверности доказательств
Описание
Уровень A
Мета-анализы, систематические обзоры, рандомизированные контролируемые исследования
Уровень B
Когортные исследования, исследования "случай-контроль", исследования с историческим контролем, ретроспективные исследования, исследования серии случаев.
Уровень C
Мнение экспертов
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
1. Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Министерства здравоохранения РФ от 15.11.2012 г. N 918н)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Алгоритм ведения пациентов с ХМИ
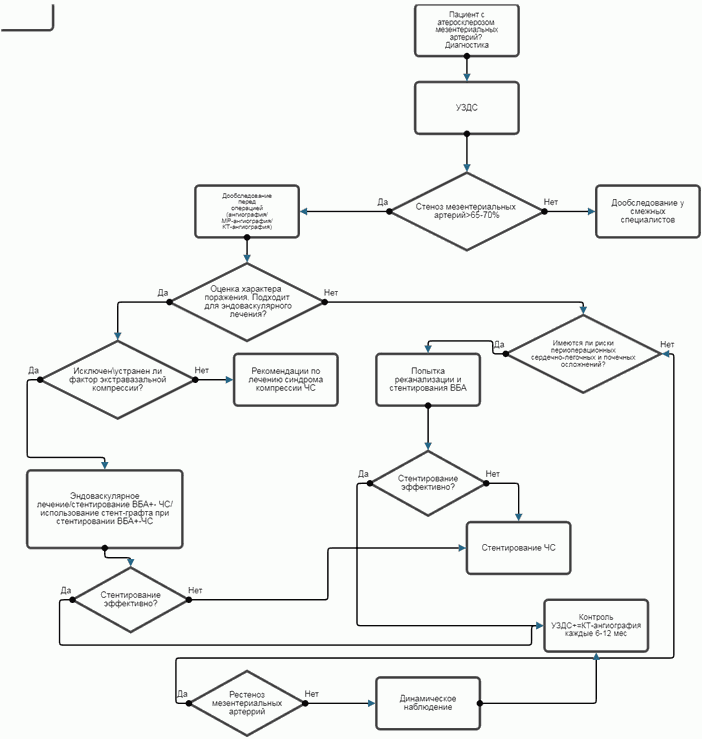
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Пациенты с хронической мезентериальной ишемией должны быть информированы, что точный анатомический диагноз будет установлен с помощью современных методов исследования (УЗДС, КТ-ангиографии, МР-ангиографии, стандартной ангиографии, желудочной и тонкокишечной тонометрии и других). Подобные исследования обеспечивают информацией с целью определения плана лечения.
Ниже представлена памятка для пациента, нуждающего в оперативном (хирургическом или эндоваскулярном) лечении ХМИ.
Уважаемый пациент,
Результаты обследования выявили у Вас заболевание артерий, кровоснабжающих органы пищеварения и ЖКТ, которое нужно лечить оперативно. Перед запланированным вмешательством ваш лечащий врач объяснит вам суть и возможности операции. Вы должны, зная о возможном риске, добровольно решиться на операцию. Данная информация должна помочь вам подготовиться к встрече с врачом.
Что такое хроническая мезентериальная ишемия?
Атеросклероз - системное заболевание, при котором достаточно часто поражаются артериальные сосуды по всему организму, в том числе и сосуды, обеспечивающие кровоснабжение ЖКТ. Атеросклероз приводит к отложению кальция в стенке сосуда и тем самым к сужению сосуда. Основные изменения при атеросклерозе развиваются в интиме (внутренней оболочке) артерий, где формируется фиброзная бляшка. На бляшках оседают тромбоциты и сгустки фибрина. Одновременно в измененных тканях бляшек откладываются соли кальция, что является конечным этапом в развитии атеросклероза и ведет к нарушению проходимости сосуда. Результатом такого поражения сосудов становится нарушение проходимости артерий кишечника и постепенное формирование клинических симптомов недостаточности кровообращения органов ЖКТ.
Такие изменения сосудистой стенки встречаются чаще у курильщиков, пациентов с сахарным диабетом, при повышенном артериальном давлении и при повышенном содержании в крови липидов (жиров) у пациентов с избыточной массой тела. Это факторы, которые могут увеличивать риск развития хронической ишемии ЖКТ.
Что может произойти без лечения?
Течение заболевания может быть весьма различным, нередко достаточно драматичным. Из-за высокого риска ишемии и инфаркта кишечника при осложненном течении консервативное лечение хронической ишемии кишечника характеризуется крайне неблагоприятным исходом, в том числе летальным. При развитии острого нарушения мезентериального кровообращения летальность может достигать 70 - 90%. Приблизительно у 35 - 40% пациентов даже на фоне терапии возникает осложненное течение, у остальных при проведении консервативной терапии не удается достичь клинического эффекта лечения.
Операция при хронической мезентериальной ишемии у подавляющего большинства пациентов устраняет симптомы ишемии, позволяют вернуться к нормальному образу жизни и избежать такого фатального осложнения как острая закупорка сосудов кишечника.
Как проводится операция?
Открытое оперативное вмешательство проходит под наркозом. Риск анестезии вам детально объяснит врач-анестезиолог. В редких случаях может потребоваться применение аппарата искусственного кровообращения и общей гипотермии (охлаждения), что оговаривается лечащим врачом.
Существуют различные виды операций:
- Шунтирование сосудов;
- Протезирование сосудов;
- Тромбэндартерэктомия;
- Пластика артерий.
Целью всех операций является восстановление проходимости артерий или пуск кровотока по сосудистой системе ЖКТ.
Вместе с лечашим врачом накануне операции необходимо обсудить преимущества и особенности каждого из вариантов лечения, возможные осложнения, результаты и перспективы последующей реабилитации.
Врач обсуждает с вами этапы оперативного вмешательства, однако во время операции может возникнуть необходимости в проведении дополнительных незапланированных этапов. На это также должно быть получено ваше согласие, в противном случае, операция не будет выполнена. Повторная операция будет проводиться после дополнительного обсуждения с вами, поскольку она может увеличить сроки лечения и повысит вероятность опасных осложнений и неблагоприятного исхода.
Какие могут быть осложнения?
В отдельных случаях при тяжелых операциях могут возникать осложнения.
Общие осложнения:
- Послеоперационные кровотечения, крупные гематомы;
- Инфекционные осложнения. Возникает нагноение раны, которое требует дальнейших лечебных мероприятий. При этом раны заживают долго, с образованием келоидных рубцов;
- Образование тромбов в венах с возможной эмболией легочных артерий. При повышенном риске вы будете получать медикаментозные препараты с профилактической целью, которые понижают свертываемость крови. При применении этих препаратов может повыситься склонность к кровотечениям. При инъекции этих препаратов, также, как и при инъекции любых других, в единичных случаях могут возникать абсцессы;
- Сдавление нервов и мягких тканей из-за необходимого при операции длительного неподвижного положения тела. Эти осложнения встречаются очень редко и, как правило, проходят в течение недели. В отдельных случаях могут оставаться жалобы (например, чувство онемения) и рубцы. Также может встречаться поражение кожи дезинфектантами;
- Переливание крови или компонентов крови, которое может потребоваться при определенных обстоятельствах. Крайне редко может возникнуть заражение (например, вирусами гепатита, ВИЧ/СПИД);
- Реакции гиперчувствительности (аллергии) на медикаменты, средства для наркоза и рентгенологического исследования, которые могут проявляться, например, зудом. Крайне редко встречаются сильно выраженные реакции, такие как коллапс, судороги и нарушение дыхания, которые требуют стационарного лечения и могут приводить к необратимым последствиям;
- Избыточное рубцевание. При соответствующей предрасположенности могут, как и при другой операции, возникать толстые бугристые и/или болезненные рубцы (келоиды);
Специфические осложнения
- Повреждения соседних органов таких, как легкие, сердце (легочная артерия); при этом может возникнуть массивное кровотечение, которое потребует соответствующего расширения операции (наложение шва на легкое или удаление его доли, наложение шва на легочную артерию, применение аппарата искусственного кровообращения) - крайне редкое состояние;
- Повреждение нервов, что иногда может привести к чувству онемения или наоборот жжения/болей в области оперативного вмешательства или пункции сосудов;
- Закупорка (окклюзия) протеза, ниже- и вышележащих участков сосуда. У оперированных пациентов симптомы могут появиться вновь в связи с постепенным сужением оперированного сегмента артерии из-за прогрессирования процесса или разрастания внутреннего слоя сосуда в области анастомозов. Следствием является уменьшение кровоснабжения органов брюшной полости. В этом случае будет обсуждаться необходимость повторного оперативного или консервативного лечения.
- Тромбоз протеза или реконструированной артерии более опасное осложнение и связан с острой закупоркой сосуда, и возможным развитием инфаркта кишечника. В этой ситуации при появлении минимальных клинических проявлений неблагополучения в животе необходимо обратиться за медицинской помощью, предпочтительно в многопрофильный стационар, обладающий опытом лечения острой ишемии кишечника.
- Инфицирование протеза, что может привести к кровотечению из швов протеза; при прогрессировании инфекции может потребоваться удаление протеза, следствием чего станет значительное ухудшение кровоснабжения органов.
- Послеоперационное расширение протеза в месте прикрепления протеза к артерии; большое расширение должно быть удалено повторным оперативным вмешательством.
- Все вышеназванные осложнения могут возникнуть после операции. Но серьезные осложнения встречаются редко: при повторных операциях (если возникает рецидив), при прогрессировании болезни, при избыточной массе тела или при наличии сопутствующих заболеваний. Для примера: при избыточном весе чаще возникают инфекционные осложнения, тромбозы, ТЭЛА.
Каковы перспективы лечения?
В большинстве случаев операция приводит к улучшению состояния и исчезновению жалоб. Для сохранения положительного результата операции необходимо ваше активное участие. Требуется лечение и профилактика прогрессирования основного заболевания. Для этого вы должны полностью отказаться от курения, обсудить с вашим лечащим врачом специальную диету и возможность устранения факторов риска, постоянно принимать назначенное в послеоперационном периоде лечение.
На что следует обратить внимание после операции?
Особенно важными являются контрольные обследования после операции для своевременного выявления оценки состояния оперированного сосуда и выявлении возможных осложнений.
Для этого можно самостоятельно контролировать функциональное состояние ЖКТ, оценивать такие характеристики режим питания, характеристики стула, интенсивность газообразования в кишечнике, реакции на различную пищу (иногда при помощи родственников, близких), возможное появление явлений воспаления, объемных образований, избыточной пульсации, раневого отделяемого или отека тканей в области хирургических ран.
Важно регулярно наблюдаться у профильного хирурга, в том числе сосудистого, по месту жительства, сопоставлять данные и состояние до и после проведенной операции, проходить контрольные ультразвуковые исследования, соблюдать рекомендации лечащего врача при выписке. Частота контрольного посещения врача и проведения дополнительных инструментальных исследований после операции строго индивидуальна и определяется совместно с лечащим врачом или врачом поликлиники.
Ниже приведены основные критерии, на основании которых пациенту необходимо обратиться к врачу за помощью, при этом характер экстренности обращения необходимо согласовать с профильными службами оказания медицинской помощи (скорая медицинская помощь, амбулаторно-поликлиническая помощь и т.д.):
- Возврат болей к исходному уровню или появление интенсивных болей в животе
- Появление тошноты, рвоты, резкого вздутия живота и других признаков дисфункции кишечника
- Отсутствие прибавки в весе или прогрессирующее похудание несмотря на проведенное оперативное лечение
- Появление признаков воспаление ран, интенсивного отделяемого из раны и т.д.
- Отсутствие эффекта от консервативного лечения при возврате симптомов заболевания
Приложение Г
КРИТЕРИИ УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ ПРИ ХМИ
Автор и год публикации
ВБА ПСС, стеноз > 50%
ВБА ПСС, стеноз > 70%
ЧС ПСС, стеноз > 50%
ЧС ПСС, стеноз > 70%
ВБА КДС, стеноз > 50%
ВБА КДС, стеноз > 70%
ЧС КДС, стеноз > 50%
ЧС КДС, стеноз > 70%
Moneta at al 1993 [49] (n = 100)
275 см/сек
200 см/сек
чувст - 92%
чувст - 87%
спец - 96%
спец - 80%
AbuRahma at al 2012 [50] (n = 150)
295 см/сек
400 см/сек
240 см/сек
320 см/сек
45 см/сек
70 см/сек
40 см/сек
100 см/сек
чувст - 87%
чувст - 72%
чувст - 87%
чувст - 80%
чувст - 79%
чувст - 65%
чувст - 84%
чувст - 58%
спец - 89%
спец - 93%
спец - 83%
спец - 89%
спец - 79%
спец - 95%
спец - 48%
спец - 91%
van Petesen at al 2013 [51] (n = 324)
220 см/сек на выдохе
268 см/сек на выдохе
268 см/сек на выдохе
280 см/сек на выдохе
62 см/сек на выдохе
101 см/сек на выдохе
64 см/сек на выдохе
57 см/сек на выдохе
чувст - 84%
чувст - 75%
чувст - 66%
чувст - 66%
чувст - 75%
чувст - 74%
чувст - 78%
чувст - 83%
спец - 76%
спец - 86%
спец - 80%
спец - 77%
спец - 94%
спец - 96%
спец - 65%
спец - 56%
205 см/сек на вдохе
277 см/сек на вдохе
243 см/сек на вдохе
272 см/сек на вдохе
52 см/сек на вдохе
52 см/сек на вдохе
83 см/сек на вдохе
84 см/сек на вдохе
чувст - 68%
чувст - 78%
чувст - 68%
чувст - 72%
чувст - 76%
чувст - 78%
чувст - 53%
чувст - 66%
спец - 93%
спец - 84%
спец - 71%
спец - 77%
спец - 93%
спец - 93%
спец - 81%
спец - 81%
ВБА - верхняя брыжеечная артерия; ЧС - чревный ствол; ПСС - пиковая систолическая скорость; КДС - конечнодиастолическая скорость; чувст - чувствительность; спец - специфичность.
