"Клинические рекомендации "Метастатическое поражение головного мозга"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ГОЛОВНОГО МОЗГА
МКБ 10: C79.3
Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года)
ID: КР503
URL
Профессиональные ассоциации
- Ассоциация нейрохирургов России Ассоциация онкологов России Российское общество клинической онкологии
Ключевые слова
метастазы в головной мозг
злокачественные опухоли
хирургическое лечение
стереотаксическая радиотерапия
радиохирургия
гипофракционирование
облучение всего головного мозга
химиотерапия
таргетная терапия
иммунотерапия
взрослые
новообразование
онкология
Список сокращений
МГМ - метастазы в головной мозг
ОВГМ - облучение всего головного мозга
СРТ - стереотаксическая радиотерапия
СОД - суммарная очаговая доза
РОД - разовая очаговая доза
Гр - Грей
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
МЗ РФ - Министерство здравоохранения Российской Федерации
РКИ - рандомизированное контролируемое исследование
УЗИ - ультразвуковое исследование
ПХТ - полихимиотерапия
в/в инф. - внутривенная инфузия
в/в бол. - внутривенно, болюсно
мг/м2 - миллиграмм на метр квадратный
TNM - (аббревиатура от tumor, nodus и metastasis) международная классификация стадий развития злокачественных опухолей
WHO - World Health Organization (Всемирная организация здравоохранения)
Термины и определения
Стереотаксическая радиотерапия - вариант дистанционной лучевой терапии с использованием методов стереотаксической навигации и соответствующего технического оборудования, обеспечивающие прецизионную доставку максимальной дозы ионизирующего излучения к четко отграниченной мишени за минимально возможное число фракций. Величина дозы ионизирующего излучения при проведении стереотаксической радиотерапии ограничивается риском развития лучевых осложнений.
Стереотаксическая радиотерапия может быть реализована в режиме радиохирургии, когда доза ионизирующего излучения подводится за одну фракцию и в режиме гипофракционирования, когда доза ионизирующего излучения подводится за несколько (чаще от 2 до 7) фракций.
1. Краткая информация
1.1. Определение
Метастатическое поражение головного мозга - гетерогенная группа внутричерепных новообразований, являющихся следствием гематогенного метастазирования экстракраниальных злокачественных опухолей.
Синонимы: метастазы в головной мозг; вторичные опухоли головного мозга.
1.2. Этиология
Мозг - это уникальный "орган-мишень", который характеризуется наличием гематоэнцефалического барьера и недостатком лимфатического дренажа. Развитие МГМ происходит вследствие гематогенной диссеминации опухолевых клеток из первичного очага, с последующей фиксацией на эндотелии микрососудистого русла, проникновением в паренхиму мозга, что сопровождается неоангиогенезом и пролиферацией в ответ на выделяемые факторы роста. Высокое содержание хлорида в межклеточной жидкости препятствует образованию клонов из клеток эпителиального происхождения. Вероятно, что особая среда мозга привлекает клетки нейроэпителиального происхождения, такие как небольших размеров клетки рака легкого или меланомы. Это объясняет различия во встречаемости метастазов в головной мозг при разных первичных опухолях. Клетки метастатической меланомы тропны к ткани мозга, так как меланоциты и клетки нейронных субпопуляций имеют общий эмбриогенез, что обусловливает высокую частоту развития МГМ.
Интракраниальные метастазы могут локализоваться в разных анатомических образованиях мозга. По данным Patchell R.A. и Tibbs P.A. (1998), супратенториальные метастазы составляют 80 - 85%, метастазы в мозжечок - 10 - 15%, в ствол мозга - 3 - 5%, поражение мозговых оболочек - 1 - 2%. Такое распределение, вероятно, зависит от кровоснабжения. Чаще опухолевые клетки фиксируются на эндотелии капилляров в области перехода серого и белого вещества головного мозга.
Злокачественные эпителиальные опухоли и саркомы чаще метастазируют интрапаренхиматозно. МГМ при лейкозах преимущественно поражают мягкие мозговые оболочки, аденокарцинома молочной железы имеет тенденцию к метастазированию как в мозговые оболочки, так и в ткань мозга. Для карциномы предстательной железы наиболее распространенным является непосредственное поражение костей черепа, что приводит к развитию субдуральных поражений. Прорастая через твердую мозговую оболочку, метастазы могут врастать и дислоцировать ткань головного и спинного мозга.
При определенных биологических подтипах злокачественных опухолей метастазы в головном мозге встречаются чаще. Например, у больных раком молочной железы с гиперэкспрессией HER-2 риск метастатического поражения головного мозга достигает 30 - 55%.
1.3. Эпидемиология
У 8% - 10% онкологических пациентов развиваются метастазы в головном мозге, которые часто определяют основную клиническую симптоматику. По данным популяционного канцер-регистра (Population-based Maastricht Cancer Registry) из 2724 больных злокачественными опухолями, которые получили специфическое лечение в период с 1986 по 1995 гг., МГМ развились у 232 пациентов (8,5%). При этом, в течение первого месяца после постановки диагноза, МГМ развились у 84 пациентов (3,1%), в течение 1 года - у 82 (3,0%) пациентов, после 1 года от момента постановки диагноза - у 66 (2,4%) пациентов. Актуриальная частота развития МГМ после 5 лет наблюдения составила 16,3% у пациентов с диагнозом рак легких, 9,8% при почечно-клеточном раке, 7,4% при меланоме, 5,1% при раке молочной железы, 1,2% при колоректальном раке.
По данным другого канцер регистра (Metropolitan Detroit Cancer Surveillance System, 1973 - 2001 гг.) частота метастатического поражения головного мозга составила 9,5% от всех случаев онкологических заболеваний. Частота метастатического поражения головного мозга составляет: при раке легкого - 19,9%, меланоме - 6,5%, раке почки - 6,5%, РМЖ - 5,1% и 1,8% в случае колоректального рака.
1.4. Кодирование по МКБ 10
C79.3 - Вторичное злокачественное новообразование головного мозга и мозговых оболочек
1.5. Классификация
В зависимости от количества очагов в головном мозге выделяют: единичные - 1 очаг в головном мозге (или солитарные - один очаг в головном мозге и отсутствие других проявлений отдаленного метастазирования опухолевого процесса); олигометастатическое поражение головного мозга - 2 - 4 очага в головном мозге; множественные метастазы - 5 и более очагов в головном мозге. В зависимости от макроструктуры метастазы в головном мозге могут быть солидной, кистозной и кистозно-солидной структуры. Метастатическое поражение головного мозга - это IV стадия опухолевого процесса, по классификации TNM - M1.
2. Диагностика
2.1 Жалобы и анамнез
- Рекомендуется сбор жалоб и анамнеза у пациента с целью выявления факторов, которые могут повлиять на выбор тактики лечения.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: головная боль, тошнота, рвота и головокружение наиболее частые симптомы пациентов с метастатическим поражением головного мозга. Эти симптомы отражают повышение внутричерепного давления и смещение структур мозга (общемозговая симптоматика). Нарушение чувствительности, памяти, двигательными нарушения (парезы и параличи), нарушение зрения и слуха, эпилептические припадки определяются локализацией метастатического очага в различных структурах мозга. (локальная симптоматика). Множественные метастатические очаги в головном мозге часто сопровождаются нарушением координации, когнитивными расстройствами и нарушением интеллекта и эмоциональной сферы.
2.2 Физикальное обследование
- Рекомендуется начать с общего физикального осмотра, измерения роста, массы тела, пальпацию всех групп периферических лимфоузлов уровня физического развития
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется оценить функциональный статус пациента с балльной оценкой по шкале Карновского или ECOG [4].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: Оценка роста и массы тела позволяет рассчитать площадь тела, необходимую для расчета доз химиотерапевтических препаратов. Пальпация периферических лимфоузлов позволяет выявить метастатические лимфоузлы и оценить распространенность болезни. Общий физикальный осмотр проводится для изучения общего состояния пациента с последующей оценкой функционального статуса по шкале Карновского или ECOG. Точная оценка функционального статуса необходима для дальнейшего планирования лечения. Шкала Карновского и ECOG приведены в приложении
2.3 Лабораторная диагностика
- Рекомендуется провести общий анализ крови с исследованием лейкоцитарной формулы, общий анализ мочи, биохимический анализ крови: общий белок, альбумин, мочевина, креатинин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), исследование электролитов крови (натрий, калий, хлор) [4].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
Комментарии: результаты лабораторных исследований необходимы для оценки ресурсов организма перед проведением хирургического, химиотерапевтического и лучевого лечения, а также для своевременной коррекции выявленных изменений.
- Рекомендуется проведение морфологического, иммуногистохимического и генетического исследования опухолевой ткани из первичного очага, и/или удаленного метастаза в головном мозге [4; 13; 14].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарии: проведение морфологического и иммуногистохимического исследования позволяют определить подтипы опухоли, чувствительные к проведению таргетной терапии (Her2 позитивный рак молочной железы, EGFR мутированный рак легкого, Braf мутированная меланома). Эти пациенты имеют лучший прогноз общей выживаемости. В случае хирургического удаления метастатического очага в головном мозге морфологическое и иммуногистохимическое исследование проводится в случае отсутствия этой информации или при подозрении на изменение биологических свойств опухоли.
- При наличии у пациента готовых стекол и блоков (биопсия проведена по месту жительства) рекомендуется выполнить пересмотр имеющегося морфологического материала в условиях патоморфологического отделения специализированных онкологических организаций
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
2.4 Инструментальная диагностика
- Рекомендуется проведение магнитно-резонансной томографии головного мозга с внутривенным контрастированием [8].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1b)
Комментарии: МРТ головного мозга рекомендуется выполнять в следующих режимах: до внутривенного введения контрастного вещества в режимах T1, T2, ДВИ, FLAIR. После внутривенного введения контрастного вещества: SPGR (vibe) +/- fatsat (0,7 - 1,5 мм) в аксиальной проекции, либо T1 в аксиальной, сагиттальной и фронтальной проекция с минимальным шагом. Геометрия аксиальных проекций должна полностью совпадать друг с другом для всех импульсных последовательностей. В качестве дополнительных МР-последовательностей рекомендуется применение: SWI - для всех метастазов, кроме меланомы и рака толстой кишки характерно небольшое количество гипоинтенсивных включений; МР-спектроскопии - для метастатических опухолей характерно повышение Lip-Lac комплекса, редко умеренное повышение пика Cho, остальные пики редуцированы; при ASL, МР-перфузии так же, как и при КТ-перфузии отмечается повышение перфузионных показателей.
- Рекомендуется проведение компьютерной томографии с контрастированием для диагностики метастатического поражения головного мозга только при наличии противопоказаний к проведению магнитно-резонансной томографии.
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1b)
- Рекомендуется проведение рентгенографии легких; ультразвукового исследования брюшной полости, всех групп периферических лимфоузлов, забрюшинного пространства; сцинтиграфии костей [8]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - Ib)
- Рекомендуется проведение дополнительных исследований: КТ легких, брюшной полости с контрастированием или ПЭТ-КТ всего тела для уточнения распространенности болезни, если полученные данные изменят тактику или если они необходимы для локального лечения (хирургии, радиотерапии) [14]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - Ib)
Комментарии: Проведение инструментального обследования необходимо для выявления экстракраниальных метастазов. Наличие экстракраниальных метастазов, их распространенность и количество является фактором неблагоприятного прогноза общей выживаемости и высокого риска развития новых (дистантных) метастазов в головной мозг.
2.5 Иная диагностика
- Рекомендуется проведение неврологического и офтальмологического осмотра [4].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1a)
Комментарии: офтальмологический осмотр необходим для уточнения наличия или отсутствия застойных явлений на глазном дне, с целью оценки степени внутричерепной гипертензии. Неврологический осмотр позволяет установить наличие неврологического дефицита и скорость его нарастания.
- Рекомендуется проведение осмотра нейрохирурга, онколога, радиотерапевта [4]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1a)
Комментарии: Консультация онколога, нейрохирурга и радиотерапевта необходима для определения оптимальной тактики лечения в рамках мультидисциплинарного подхода.
3. Лечение
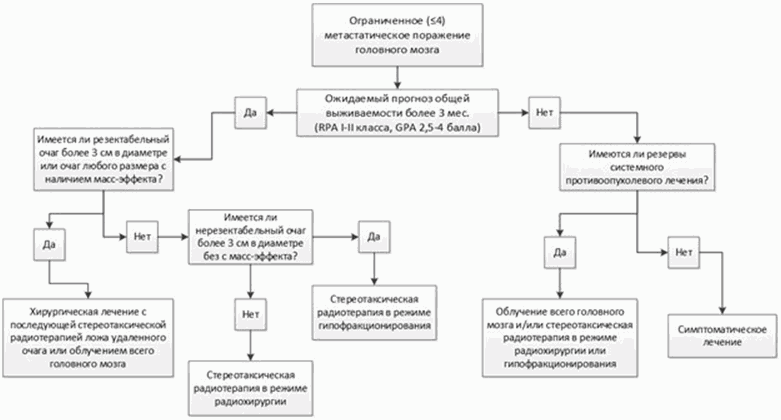
3.1. Хирургическое лечение
Проведение хирургического лечения рекомендуется:
- При наличии метастатического очага более 3 см в диаметре [9].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1a)
- При наличии метастатического очага любых размеров, вызывающего прогрессирующую неврологическую симптоматику, включая клиническую картину внутричерепной гипертензии, дислокации срединных структур мозга, обширного перифокального отека, а также при наличии угрозы блокирования ликворных путей [9; 4].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1b)
Комментарии: Лучшие показатели общей выживаемости достигаются у больных с высоким функциональным статусом (индекс Карновского >= 80) и контролем экстракраниального опухолевого процесса. Удаление метастаза единым блоком с окружающей перифокальной и периваскулярной зоной является оптимальным хирургическим подходом. Такая методика удаления снижает риск локального рецидива и лептоменингеальной прогрессии.
Не имеется достаточно клинических данных, чтобы рекомендовать плановое хирургическое лечение для пациентов с плохим прогнозом или с множественными метастазами в головном мозге. Необходимым условием хирургического лечения является расположение метастатического очага в зонах мозга, где его удаление не сопровождается развитием неврологического дефицита.
- Для установления/уточнения морфологического диагноза [9]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - III
Комментарии: Метастатический очаг в головном мозге, в ряде случаев, может быть единственным проявлением болезни. В этом случае удаление очага с последующим морфологическим и иммуногистохимическим исследованием позволит установить диагноз и начать системное лечение.
3.2. Консервативное лечение
3.2.1. Лучевая терапия
Цель лучевого лечения - профилактика смерти от интракраниальной прогрессии, локальный контроль интракраниальных метастатических очагов, сохранение качества жизни и улучшение общей выживаемости в отдельных клинических ситуациях.
3.2.1.1. Облучение всего головного мозга
Проведение облучения всего головного мозга рекомендуется:
- пациентам после хирургического удаления метастатического очага [1; 15]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - Ia)
Комментарии: проведение облучения всего головного мозга увеличивает общую выживаемость у пациентов с одиночным МГМ после хирургического лечения.
- пациентам с лептоменингеальной и пахименингеальной прогрессией болезни
Уровень убедительности рекомендаций B (уровень достоверности доказательств - III)
- пациентам с множественными (4 и более очага) МГМ [15].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2b)
- пациентам с низким функциональным статусом и плохим прогнозом общей выживаемости [16]
Комментарии: Плохим прогнозом общей выживаемости пациентов с МГМ считается медиана общей выживаемости менее 3 месяцев по шкале GPA или RPA (см. приложение). Стандартным режимом фракционирования ОВГМ является СОД 30 Гр, РОД 3 Гр (10 фракций) или СОД 37,5 РОД 2,5 (15 фракций). Увеличение РОД, при ОВГМ, более 3 Гр приводит к увеличению частоты нейрокогнитивных расстройств. Имеются крайне ограниченные данные и отсутствуют доказательства любого уровня, чтобы рекомендовать изменение режима дозирования и фракционирования ОВГМ в зависимости от гистологической структуры опухоли
3.2.1.2. Стереотаксическая радиотерапия
У пациентов с ограниченным (3 и менее очага) метастатическим поражением головного мозга и хорошим прогнозом общей выживаемости (индекс Карновского >= 80, ECOG 0 - 1, RPA 1 - 2 класса, GPA - 2,5 - 4 балла, с отсутствием или ограниченным числом экстракраниальных метастазов/контролируемыми проявлениями экстракраниальной болезни и имеющимися резервами системного противоопухолевого лечения):
- Рекомендуется проведение радиохирургии при наличии МГМ до 3 см в диаметре без клинических проявлений масс-эффекта, локализованных вне функциональных зон мозга [16; 10].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1b)
Комментарии: Дозы ионизирующего излучения при проведении радиохирургии составляют: 15 Гр для МГМ с максимальным диаметром 3 - 4 см.; 18 Гр для МГМ с максимальным диаметром 2 - 3 см.; 24 Гр для МГМ с максимальным диаметром до 2 см. Доза ионизирующего излучения для каждого очага нормируется таким образом, чтобы объем, нормальной ткани мозга, облученный дозой выше 12 Гр, не превышал 10 см3.
Добавление к стереотаксической радиотерапии облучения всего головного мозга улучшает локальный контроль метастатических очагов в мозге, не увеличивает общую выживаемость и увеличивает риск развития нейрокогнитивных расстройств.
- Рекомендуется проведение стереотаксической радиотерапии в режиме гипофракционирования при наличии очага с максимальным диаметром 3 см и более, без клинических проявлений масс-эффекта и наличии противопоказаний к проведению хирургического лечения или очагов любых размеров, локализованных в функциональных зонах мозга [10]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - III)
Комментарии: Эквивалентными режимами фракционирования являются: 3 фракции по 8 Гр, СОД = 24 Гр; 5 фракций по 6 Гр, СОД = 30 Гр; 7 фракций по 5 Гр, СОД = 35 Гр.
У пациентов с ограниченным (3 и менее очага) метастатическим поражением головного мозга и плохим прогнозом общей выживаемости (индекс Карновского <= 70, ECOG 2 - 4, RPA 3 класса, GPA 0 - 2 балла, множественные экстракраниальные метастазы, не контролируемые проявления экстракраниальной болезни, отсутствуют резервы системного лечения):
- Рекомендуется проведение симптоматического лечения [16].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2a)
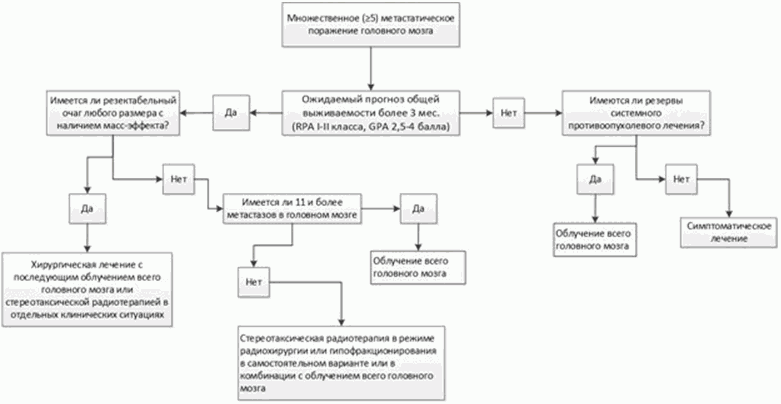
У пациентов с множественными (4 и более очагов) метастатическим поражением головного мозга и хорошим прогнозом общей выживаемости (индекс Карновского >= 80, ECOG 0 - 1, RPA 1 - 2 класса, GPA - 2,5 - 4 балла, с отсутствием или ограниченным числом экстракраниальных метастазов, контролируемыми проявлениями экстракраниальной болезни и имеющимися резервами системного противоопухолевого лечения):
- Рекомендуется облучение всего головного мозга в самостоятельном варианте лечения или в комбинации со стереотаксической радиотерапией [16; 17]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2b)
Комментарии: в случае наличия очагов до 3 см в диаметре проводится радиохирургия. При наличии очагов 3 и более см в диаметре проводится СРТ в режиме гипофракционирования.
- при наличии 11 и более МГМ  рекомендуется проведение облучения всего головного мозга в самостоятельном варианте лечения [15]
рекомендуется проведение облучения всего головного мозга в самостоятельном варианте лечения [15]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2b)
У пациентов с ограниченным (3 и менее очага) метастатическим поражением головного мозга и плохим прогнозом общей выживаемости (индекс Карновского <= 70, ECOG 2 - 4, RPA 3 класса, GPA 0 - 2 балла, множественные экстракраниальные метастазы, не контролируемые проявления экстракраниальной болезни, отсутствуют резервы системного лечения)
- Рекомендуется проведение симптоматического лечения [16].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - III)
3.2.2. Противоопухолевое лекарственное лечение
Основной целью противоопухолевого лекарственного лечения пациентов с МГМ является достижение контроля экстракраниальных очагов, профилактика развития новых МГМ, а также лечение интракраниальных очагов в отдельных клинических ситуациях. Системное противоопухолевое лечение проводится согласно рекомендациям по лечению первичного опухолевого очага.
- Проведение системной противоопухолевой терапии (химиотерапия и таргетная терапия) на первом этапе лечения рекомендуется:
- пациентам с бессимптомным метастатическим поражением головного мозга при опухолях, чувствительных к лекарственному лечению и молекулярно-генетическими изменениями, определяющих возможность проведения таргетной терапии: у больных раком молочной железы (при наличии гиперэкспрессии Her-2); у больных немелкоклеточным раком легкого (при наличии EGFR мутации или ALK транслокации); меланомой (при наличии B-raf мутации) [5].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - III)
- в случае изолированного метастатического поражения головного мозга или при прогрессировании опухолевого процесса в головном мозге, в сочетании с локальными методами лечения МГМ (хирургическое лечение, стереотаксическая радиотерапия, ОВГМ) [5; 2].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - III)
Комментарии: Выбор схемы противоопухолевого лекарственного лечения пациента с метастатическим опухолевым процессом в головном мозге зависит, в первую очередь, от морфологии первичной опухоли и ее биологических характеристик (приложение Г6).
3.2.3. Стероидная терапия
- Не рекомендуется проведение стероидной терапии у больных с МГМ без клинической симптоматики и масс-эффекта [10].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2b)
- У пациентов с МГМ и умеренно выраженными симптомами, связанными с масс-эффектом: рекомендуется назначение стероидной терапии (дексаметазон) для ликвидации или временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Начальная доза дексаметазона 4 - 8 мг/сутки [10].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2b)
- У пациентов с МГМ и сильно выраженными симптомами, связанными с масс-эффектом: рекомендуется назначение стероидной терапии (дексаметазон) для временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Начальная доза дексаметазона - от 16 мг/сутки [11; 10].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2b)
Комментарии: Дозы дексаметазона снижаются постепенно, в течение 2-х недель и более, основываясь на индивидуальной клинической симптоматике и учитывая осложнения стероидной терапии. В отдельных клинических ситуациях возможно длительное/постоянное применение дексаметазона в поддерживающих дозах (0,5 - 4 мг/сутки). Снижение/отмена дозировки дексаметазона до хирургического удаления и/или проведения лучевого лечения нецелесообразно.
3.2.4. Лечение осложнений и симптоматическая терапия
- Рекомендуется проведение терапии бевацизумабом при наличии стойкого, нарастающего отека после стереотаксической радиотерапии, резистентного к стероидной терапии и вызывающий нарастание неврологической симптоматики [3; 6]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Для контроля тошноты и рвоты, возникающих на фоне химиотерапии, рекомендуется применение антагонистов 5-НТ3 рецепторов [12].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1b)
Комментарии: Рекомендовано назначение ондансетрона в дозе 8 - 16 мг за 30 - 60 минут до начала химиотерапии. Антиэметогенное действие антагонистов 5-НТ3 рецепторов усиливается при комбинации с дексаметазоном. с целью так называемой "наилучшей поддерживающей терапии" (best supportive care) является профилактика и облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких, независимо от стадии заболевания и потребности в других видах терапии. В случае МГМ меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни.
Лечение интракраниальных рецидивов
Стандартных подходов к применению хирургического лечения, радиотерапии и химиотерапии у пациентов с интракраниальными рецидивами не существует. Стратегия лечения вырабатывается на совместном консилиуме радиолога, нейрохирурга, онколога, радиотерапевта. Принципы лечения пациентов с первично выявленными МГМ распространяются на пациентов с интракраниальными рецидивами.
4. Реабилитация
Реабилитационные мероприятия у пациентов с метастазами в головной мозг проводятся после проведения лечения. Объем реабилитационных мероприятий определяется степенью выраженности неврологического дефицита и проводится в специализированных лечебно-реабилитационных отделениях.
5. Профилактика
Рекомендуется соблюдать следующую периодичность и методы наблюдения после проведения лечения по поводу метастатического поражения головного мозга: в первые 1 - 2 года физикальный осмотр и сбор жалоб рекомендуется проводить каждые 3 месяца, на сроке 3 - 5 лет - 1 раз в 6 месяцев. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен. Объем обследования: анамнез и физикальное обследование, МРТ головного мозга с в/венным контрастированием каждые 3 мес. Обследование на наличие экстракраниальных метастазов проводится в соответствии с первичным очагом - источником метастазирования в головной мозг [4].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала лучевого, химиотерапевтического или хирургического лечения интракраниальных рецидивов.
6. Дополнительная информация, влияющая на течение и исход заболевания
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Этап постановки диагноза
1
Выполнено МРТ исследование головного мозга с контрастированием
1b
A
2
Выполнен офтальмологический и неврологический осмотр
1b
A
3
Выполнено гистологическое и иммуногистохимическое исследование материала первичной опухоли
1b
A
4
Выполнен осмотр нейрохирурга, радиотерапевта
4
C
5
Выполнен осмотр онколога
1b
A
6
Проведена рентгенографии органов грудной клетки; ультразвукового исследования брюшной полости, всех групп периферических лимфоузлов, забрюшинного пространства; сцинтиграфии костей
4
C
7
Выполнен общий клинический анализ крови, биохимический анализ крови (мочевина, креатинин, общий белок, альбумин, общий билирубин, АЛТ, АСТ, ЛДГ), общий анализ мочи
1b
A
8
Выполнен пересмотр гистологических препаратов в условиях патоморфологического отделения онкологического учреждения (при выполнении биопсии в условиях онкодиспансера или онкологического отделения многопрофильной больницы)
4
C
Этап лечения
1
Назначена стероидная терапия (при наличии показаний)
1a
A
2
Проведено хирургическое лечение (при наличии показаний) в течение 14 дней с момента постановки диагноза (при отсутствии витальных показаний)
1a
A
3
Проведено облучение всего головного мозга (при наличии показаний как метода первичного лечения) в течение 2 - 4 недель с момента постановки диагноза МГМ
1a
A
4
Проведена стереотаксическая радиотерапия (при наличии показаний как метода первичного лечения) в течение 2 - 4 недель с момента постановки диагноза МГМ
1a
A
5
Проведено противоопухолевое лекарственное лечение после получения результатов гистологического и иммуногистохимического исследования после проведения локального лечения, в пределах 2 - 4 недель после проведения локального лечения МГМ
2a
B
6
Соблюдены интервалы между курсами противоопухолевой лекарственной терапии от 21 до 28 дней
2a
B
7
Выполнено введение противоопухолевых лекарственных препаратов вместе с инфузионной терапией
1a
A
8
Выполнен общий клинический анализ крови, биохимический анализ крови (мочевина, креатинин, общий белок, альбумин, общий билирубин, АЛТ, АСТ, ЛДГ), общий анализ мочи в процессе лечения
1a
A
Этап контроля эффективности лечения
1
Выполнено МРТ исследование головного мозга с контрастированием после окончания лечения и, в дальнейшем, через каждые 3 месяца в течение 1-го года после лечения
1b
A
2
Проведена рентгенография органов грудной клетки; ультразвуковое исследования брюшной полости, всех групп периферических лимфоузлов, забрюшинного пространства; сцинтиграфия костей
4
C
Этап проведения сопроводительной терапии
1
Назначена стероидная терапия (при наличии показаний)
4
C
2
Проведена антибактериальной терапии при постановке диагноза фебрильная нейтропения в стартовой комбинации цефалоспорин не ниже 3 - 4 поколения и противогрибковый препарат
4
C
4
Проведена коррекция гематологических расстройств
1b
A
Список литературы
1. E. Abe, H. Aoyama, The role of whole brain radiation therapy for the management of brain metastases in the era of stereotactic radiosurgery//Current oncology reports. - 2012. - T. 14. N 1. C. 79 - 84.
2. Zarmeneh Aly, David M. Peereboom, Combination of Radiotherapy and Targeted Agents in Brain Metastasis: An Update//Current treatment options in neurology. - 2016. - T. 18. N 7. C. 32.
3. Benjamin Besse, Susan F. Lasserre, Peter Compton, Jane Huang, Stella Augustus, Ulrich-Peter Rohr, Bevacizumab safety in patients with central nervous system metastases//Clinical cancer research: an official journal of the American Association for Cancer Research. - 2010. - T. 16. N 1. C. 269 - 278.
4. Sandeep S. Bhangoo, Mark E. Linskey, Steven N. Kalkanis, Evidence-based guidelines for the management of brainmetastases//Neurosurgery clinics of North America. - 2011. - T. 22. N 1. C. 97.
5. Jan-Paul Bohn, Georg Pall, Guenther Stockhammer, Michael Steurer, Targeted Therapies for the Treatment of Brain Metastases in Solid Tumors//Targeted Oncology. - 2016.
6. Dustin Boothe, Robert Young, Yoshiya Yamada, Alisa Prager, Timothy Chan, Kathryn Beal, Bevacizumab as atreatment for radiation necrosis of brain metastases post stereotactic radiosurgery//Neuro-oncology. - 2013. - T. 15. N 9. C. 1257 - 1263.
7. E. A. Eisenhauer, P. Therasse, J. Bogaerts, L. H. Schwartz, D. Sargent, R. Ford, J. Dancey, S. Arbuck, S. Gwyther, M. Mooney, L. Rubinstein, L. Shankar, L. Dodd, R. Kaplan, D. Lacombe, J. Verweij, New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)//European journal of cancer (Oxford, England: 1990). - 2009. - T. 45. N 2. C. 228 - 247.
8. Patrick Hanssens, Bengt Karlsson, Tseng Tsai Yeo, Ning Chou, Guus Beute, Detection of brain micrometastases by high-resolution stereotactic magnetic resonance imaging and its impact on the timing of and risk for distant recurrences//Journal of neurosurgery. - 2011. - T. 115. N 3. C. 499 - 504.
9. Steven N. Kalkanis, Douglas Kondziolka, Laurie E. Gaspar, Stuart H. Burri, Anthony L. Asher, Charles S. Cobbs, Mario Ammirati, Paula D. Robinson, David W. Andrews, Jay S. Loeffler, Michael McDermott, Minesh P. Mehta, Tom Mikkelsen, Jeffrey J. Olson, Nina A. Paleologos, Roy A. Patchell, Timothy C. Ryken, Mark E. Linskey, The role of surgical resection in the management of newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline//Journal of neuro-oncology. - 2010. - T. 96. N 1. C. 33 - 43.
10. Mark E. Linskey, David W. Andrews, Anthony L. Asher, Stuart H. Burri, Douglas Kondziolka, Paula D. Robinson, Mario Ammirati, Charles S. Cobbs, Laurie E. Gaspar, Jay S. Loeffler, Michael McDermott, Minesh P. Mehta, Tom Mikkelsen, Jeffrey J. Olson, Nina A. Paleologos, Roy A. Patchell, Timothy C. Ryken, Steven N. Kalkanis, The role of stereotactic radiosurgery in the management of patients with newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline//Journal of neuro-oncology. - 2010. - T. 96. N 1. C. 45 - 68.
11. Minesh P. Mehta, Nina A. Paleologos, Tom Mikkelsen, Paula D. Robinson, Mario Ammirati, David W. Andrews, Anthony L. Asher, Stuart H. Burri, Charles S. Cobbs, Laurie E. Gaspar, Douglas Kondziolka, Mark E. Linskey, Jay S. Loeffler, Michael McDermott, Jeffrey J. Olson, Roy A. Patchell, Timothy C. Ryken, Steven N. Kalkanis, The role of chemotherapy in the management of newly diagnosed brain metastases//Journal of neuro-oncology. - 2010. - T. 96. N 1. C. 71 - 83.
13. Minesh P. Mehta, May N. Tsao, Timothy J. Whelan, David E. Morris, James A. Hayman, John C. Flickinger, Michael Mills, C. Leland Rogers, Luis Souhami, The American Society for Therapeutic Radiology and Oncology (ASTRO) evidence-based review of the role of radiosurgery for brain metastases//International journal of radiation oncology, biology, physics. - 2005. - T. 63. N 1. C. 37 - 46.
14. NCCN.org, Central Nervous System Cancers. - 2016. - Version 1.
15. May N. Tsao, Nancy Lloyd, Rebecca K. S. Wong, Edward Chow, Eileen Rakovitch, Normand Laperriere, Wei Xu, Arjun Sahgal, Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases//The Cochrane database of systematic reviews. - 2012. N 4. CD003869.
16. May N. Tsao, Dirk Rades, Andrew Wirth, Simon S. Lo, Brita L. Danielson, Laurie E. Gaspar, Paul W. Sperduto, Michael A. Vogelbaum, Jeffrey D. Radawski, Jian Z. Wang, Michael T. Gillin, Najeeb Mohideen, Carol A. Hahn, Eric L. Chang, Radiotherapeutic and surgical management for newly diagnosed brain metastasis(es): An American Society for Radiation Oncology evidence-based guideline//Practical radiation oncology. - 2012. - T. 2. N 3. C. 210 - 225.
17. Masaaki Yamamoto, Takuya Kawabe, Yasunori Sato, Yoshinori Higuchi, Tadashi Nariai, Shinya Watanabe, Hidetoshi Kasuya, Stereotactic radiosurgery for patients with multiple brain metastases: a case-matched study comparing treatment results for patients with 2 - 9 versus 10 or more tumors//Journal of neurosurgery. - 2014. - 121 Suppl. C. 16 - 25.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Голанов А.В., член-корреспондент РАН, профессор, д.м.н., зав. отделением радиологии и радиохирургии ФГАУ "Национальный научно-практический центр нейрохирургии имени академика Н.Н. Бурденко" МЗ РФ, Москва (Golanov@nsi.ru)/Ассоциация нейрохирургов России (mailto:Golanov@nsi.ru)%20/%20Ассоциация)
2. Бекяшев А.Х., профессор, д.м.н., зав. отделением нейрохирургии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, Москва ((mailto:Бекяшев%20А.Х.,%20профессор,%20д.м.н.,%20зав.%20отделением%20нейрохирургии%20ФГБУ%20)bekyashev@gmail.com/Ассоциация нейрохирургов России, Ассоциация онкологов России (mailto:bekyashev@gmail.com)
3. Банов С.М., к.м.н., врач-онколог, ФГАУ "Национальный научно-практический центр нейрохирургии имени академика Н.Н. Бурденко" МЗ РФ, Центр Гамма-нож, Москва ((mailto:bekyashev@gmail.com)smbanov@gmail.com)/Российская Ассоциация терапевтических радиационных онкологов (РАТРО) (mailto:smbanov@gmail.com)
4. Ветлова Е.Р., к.м.н., врач-радиотерапевт, ФГАУ "Национальный научно-практический центр нейрохирургии имени академика Н.Н. Бурденко" МЗ РФ, Москва ((mailto:smbanov@gmail.com)evetlova@nsi.ru)/Российская Ассоциация терапевтических радиационных онкологов (РАТРО) (mailto:evetlova@nsi.ru)
5. Долгушин М.Б., профессор, д.м.н., зав. отделением ПЭТ, ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, Москва
6. Ильялов С.Р., к.м.н., врач-радиотерапевт, ФГАУ "Национальный научно-практический центр нейрохирургии имени академика Н.Н. Бурденко" МЗ РФ, Центр Гамма-нож, Москва ((mailto:evetlova@nsi.ru)Sergio@nsi.ru)/Ассоциация нейрохирургов России (mailto:Sergio@nsi.ru)
7. Насхлеташвили Д.Р., к.м.н., врач-онколог, ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, Москва ((mailto:Sergio@nsi.ru)nas-david@yandex.ru)/Ассоциация онкологов России (mailto:nasdavid@yandex.ru)
8. Назаренко А.В., к.м.н., зав. отделением лучевой терапии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, Москва ((mailto:nas-david@yandex.ru)llexoff@ya.ru)/Ассоциация онкологов России (mailto:llexoff@ya.ru)
9. Смолин Алексей Владимирович, к.м.н., начальник радиологического центра, Главный военный клинический госпиталь им. Бурденко, Москва (smolingvkg@gmail.com)/Ассоциация онкологов России (mailto:llexoff@ya.ru)
Конфликта интересов нет (mailto:llexoff@ya.ru)
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-онкологи;
2. Врачи-хирурги;
3. Врачи-радиологи;
4. Врачи-радиотерапевты;
5. Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1. Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
Уровни достоверности доказательств
Описание
Ia
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований
Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
IIa
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании
IIb
Доказательность, основанная как минимум на одном квазиэкспериментальном исследовании с хорошим дизайном
III
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов
Таблица П2. Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
Уровень убедительности рекомендации
Уровни достоверности доказательств
Описание
A
Ia, Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
B
IIa, IIb, III
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях
C
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества
Методы, использованные для формулирования рекомендаций - консенсус экспертов. Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Нормативно-правовые документы, в соответствии с которыми разрабатывались клинические рекомендации:
1. Федеральный закон от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации"
2. Приказ Министерства здравоохранения РФ от 15 ноября 2012 г. N 915н "Об утверждении Порядка оказания медицинской помощи населению по профилю "онкология"
3. Приказ Министерства здравоохранения и социального развития РФ от 27 декабря 2011 г. N 1664н "Об утверждении номенклатуры медицинских услуг"
4. Приказ Министерства здравоохранения и социального развития РФ от 2 июня 2006 г. N 447 "Об утверждении стандарта медицинской помощи больным со злокачественными новообразованиями оболочек головного мозга"
5. Постановление Правительства РФ от 19 декабря 2015 г. N 1382 "О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2016 год"
6. Приказ Министерства здравоохранения РФ от 9 ноября 2012 г. N 715н "Об утверждении стандарта специализированной медицинской помощи при новообразованиях головного мозга и мозговых оболочек"
7. Национальный стандарт РФ ГОСТ Р 56607-2015 "Изделия медицинские электрические "Гамма-ножи" для лучевой терапии. Технические требования для государственных закупок" (утв. приказом Федерального агентства по техническому регулированию и метрологии от 5 октября 2015 г. N 1452-ст)
8. Приказ Министерства здравоохранения и социального развития РФ от 2 июня 2006 г. N 453 "Об утверждении стандарта медицинской помощи больным со злокачественным новообразованием лобной, височной, теменной, затылочной долей головного мозга"
9. Приказ Министерства здравоохранения и социального развития РФ от 26 мая 2006 г. N 398 "Об утверждении стандарта медицинской помощи больным со вторичным злокачественным новообразованием головного мозга и мозговых оболочек"
10. Приказ Министерства здравоохранения и социального развития РФ от 1 декабря 2005 г. N 742 "Об утверждении стандарта медицинской помощи больным со злокачественным новообразованием легкого и бронхов"
11. Постановление Правительства РФ от 28 ноября 2014 г. N 1273 "О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2015 год и на плановый период 2016 и 2017 годов"
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи (http://cr.rosminzdrav.ru/#!/schema/708)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Алгоритм лечения пациентов с 4 и менее метастазами в головном мозге.
Алгоритм лечения пациентов с 5 и более метастазами в головном мозге.
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендуется при развитии осложнений - связаться с врачом-радиотерапевтом, онкологом или хирургом.
При наличии неврологических симптомов после проведенного лечения необходимо обратиться за консультацией к лечащему врачу. Для профилактики развития новых метастазов в головном мозге необходимо проходить обследование согласно рекомендациям лечащего врача.
При развитии тошноты (рвоты) необходима консультация лечащего врача с целью возможной коррекции противоотечной терапии. Отмена (или прекращение) стероидной терапии возможна только после консультации с лечащим врачом.
В период лечения и наблюдения желательно ограничить прием спиртного и табакокурение. При повышении температуры тела 38 °C и выше обратиться к лечащему врачу для решения вопроса о назначении антибиотикотерапии.
Приложение Г
Приложение Г1
ШКАЛА ОЦЕНКИ РЕГРЕССИИ ИНТРАКРАНИАЛЬНЫХ ОЧАГОВ
(RECIST) ПОСЛЕ ЛЕЧЕНИЯ [7].
Измеряемые очаги <1>
Полная регрессия
Все измеряемые очаги не визуализируются на контрольной МРТ с контрастированием
Частичная регрессия
Сумма двух перпендикулярных диаметров всех измеряемых очагов уменьшается более чем на 30% от исходной величины.
Стабилизация
Сумма двух перпендикулярных диаметров всех измеряемых очагов уменьшается менее чем на 30% или увеличивается менее чем на 20% от исходной величины.
Прогрессия
Сумма двух перпендикулярных диаметров всех измеряемых очагов увеличивается более чем на 20% от исходной величины. Появление новых очагов.
<1> - два перпендикулярных диаметра размером >= 10 мм, каждый (в изменения не включаются киста, полость, некроз)
Неизмеряемые очаги <1>
Полная регрессия
Все не измеряемые очаги не визуализируются на контрольной МРТ
Стабилизация
Сохранение прежних размеров всех не измеряемых очагов по результатам контрольной МРТ
Прогрессия
Увеличение <2> размеров одного или нескольких не измеряемых очагов или
Или появление новых очагов.
<1> - один из перпендикулярных диаметров размером <= 10 мм.
<2> - в случае проведения радиохирургии, увеличение очагов требует дифф. диагностики с радионекрозом.
Приложение Г2
ИНДЕКС КАРНОВСКОГО
Нормальная физическая активность, больной не нуждается в специальном уходе
100%
Состояние нормальное, нет жалоб и симптомов заболевания
90%
Нормальная активность сохранена, но имеются незначительные симптомы заболевания
80%
Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания
Ограничение нормальной активности при сохранении полной независимости больного
70%
Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе
60%
Больной иногда нуждается в помощи, но в основном обслуживает себя сам
50%
Больному часто требуется помощь и медицинское обслуживание
Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация
40%
Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь
30%
Больной прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно
20%
Сильные проявления болезни, необходима госпитализация и поддерживающая терапия
10%
Умирающий больной, быстрое прогрессирование заболевания
0%
Смерть
Приложение Г3
ОЦЕНКА СТАТУСА БОЛЬНОГО ПО ШКАЛЕ ECOG
0
Больной полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно в вертикальном положении (50 - 60% по шкале Карновского)
3
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Приложение Г4
ШКАЛА ПРОГНОЗА ОБЩЕЙ ВЫЖИВАЕМОСТИ GPA
Клинические факторы
БАЛЛЫ
РЕЗУЛЬТАТ
0
0,5
1,0
1,5
2
Сумма баллов
Медиана общей выживаемости
25 - 75 процентиль
НЕМЕЛКОКЛЕТОЧНЫЙ РАК ЛЕГКОГО
Возраст
>= 70
< 70
-
-
-
0 - 1
6,9
2,6 - 15,3
ИК
<= 70
80
90 - 100
-
-
1,5 - 2,0
13,7
5,5 - 24,6
ЭКМ
есть
-
нет
-
-
2,5 - 3,0
26,5
10,7 - 53,8
Число МГМ
> 4
1 - 4
-
-
-
3,5 - 4
46,8
от 25,8
EGFR/ALK
нет
-
есть
-
-
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Возраст
>= 60
< 60
-
0 - 1
3,4
1,4 - 7,3
ИК
< 50
60
70 - 80
90 - 100
1,5 - 2,0
7,7
3,0 - 15,2
Подтип РМЖ
TNF
-
Lum A
Her-2
Lum B
2,5 - 3,0
15,1
5,9 - 27,4
3,5 - 4
25,3
12,8 - 45,8
МЕЛАНОМА
ИК
<= 70
-
70 - 80
-
90 - 100
0 - 1
3,4
1,6 - 6,0
Число МГМ
> 3
-
2 - 3
-
1
1,5 - 2,0
4,7
2,5 - 11,0
2,5 - 3,0
8,8
4,6 - 14,6
3,5 - 4
13,2
7,1 - 25,8
РАК ПОЧКИ
ИК
<= 70
-
70 - 80
-
90 - 100
0 - 1
3,3
1,3 - 7,5
Число МГМ
> 3
-
2 - 3
-
1
1,5 - 2,0
7,3
2,9 - 15,8
2,5 - 3,0
11,3
5,0 - 18,9
3,5 - 4
14,8
6,6 - 32,2
КОЛОРЕКТАЛЬНЫЙ РАК
ИК
<= 70
70
80
90
100
0 - 1
3,1
1,8 - 6,2
1,5 - 2,0
4,4
2,4 - 10,4
2,5 - 3,0
6,9
4,1 - 15,2
3,5 - 4
13,5
9,9 - 27,1
ИК
Индекс Карновского
ЭКМ
Экстракраниальные метастазы
МГМ
Метастазы в головной мозг
РМЖ
Рак молочной железы
Lum A
Люминальный подтип A
Lum B
Люминальный подтип B
Her-2
Her-2 подтип
TNF
Триплет - негативный подтип
EGFR
Наличие или отсутствие мутации в гене EGFR (только для аденокарциномы)
ALK
Наличие или отсутствие транслокации ALK (только для аденокарциномы)
Приложение Г5
ШКАЛА ПРОГНОЗА ОБЩЕЙ ВЫЖИВАЕМОСТИ RPA
Класс
Рекурсивный парциальный анализ (RPA)
Медиана общей выживаемости (мес.)
I класс
Индекс Карновского >= 70
Возраст <= 65 лет
Отсутствие (или контроль) экстракраниальных метастазов
7,1
II класс
Все пациенты, не подходящие в I или III класс
4,2
III класс
Индекс Карновского < 70
2,3
Приложение Г6
ПРОТИВООПУХОЛЕВАЯ ЛЕКАРСТВЕННАЯ ТЕРАПИЯ У ПАЦИЕНТОВ С МГМ
Метастазы в головной мозг мелкоклеточного рака легкого
Этопозид и карбоплатин
этопозид - 100 мг/м2 внутривенно в 1-й, 2-й, 3-й дни, карбоплатин (AUC = 5) внутривенно в 1-й день. Курсы химиотерапии - каждые 3 недели (возможно совместное проведение с облучением всего головного мозга)
Схема EP: этопозид + цисплатин
этопозид 100 мг/м2 внутривенно в 1-й, 2-й, 3-й дни, цисплатин 80 мг/м2 внутривенно в 1-й день. Курсы химиотерапии - каждые 3 недели (возможно совместное проведение с облучением всего головного мозга)
Иринотекан и цисплатин
иринотекан 65 мг/м2 внутривенно в 1-й день и 8-й день, цисплатин 80 мг/м2 внутривенно в 1-й день. Курсы химиотерапии - каждые 3 недели.
Иринотекан и карбоплатин
иринотекан 65 мг/м2 внутривенно в 1-й день и в 8-й день, карбоплатин (AUC = 5) внутривенно. Курсы химиотерапии - каждые 3 недели.
Применяется в первой линии лечения у пожилых и ослабленных больных при ECOG = 2 или во второй линии химиотерапии, если в первой линии лечения была схема ЕР);
Топотекан
топотекан - 4 мг/м2 внутривенно в 1-й, 8-й и 15-й дни, каждые 4 недели
Метастазы в головной мозг немелкоклеточного рака легкого (аденокарцинома, без мутации EGFR, без транслокации ALK)
Паклитаксел и карбоплатин
паклитаксел 175 мг/м2 внутривенно в 1-й день, карбоплатин - по AUC = 5 - 6 внутривенно в 1-й день. Курсы химиотерапии - каждые 3 недели (в первой линии лечения)
Пеметрексед и цисплатин
пеметрексед 500 мг/м2 внутривенно в 1-й день, цисплатин 75 мг/м2 внутривенно в 1-й день. Курсы химиотерапии - каждые 3 недели (в первой линии лечения)
Пеметрексед
пеметрексед 500 мг/м2 внутривенно в 1-й день каждые 3 недели (в первой линии лечения (в случае невозможности применения препаратов платины), или во второй линии лечения)
Метастазы в головной мозг немелкоклеточного рака легкого (аденокарцинома с мутацией гена EGFR 19 и 21 экзонов, без транслокации ALK)
Гефитиниб
гефитиниб - 250 мг в сутки внутрь ежедневно, постоянно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Эрлотиниб
эрлотиниб - 150 мг в сутки внутрь ежедневно, постоянно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Афатиниб (аденокацинома с мутацией 19 экзона EGFR)
афатиниб - 40 мг в сутки внутрь ежедневно, постоянно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Метастазы в головной мозг немелкоклеточного рака легкого (аденокарцинома с транслокацией ALK)
Кризотиниб
кризотиниб - 250 мг в сутки внутрь ежедневно, постоянно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Пеметрексед
пеметрексед - 500 мг/м2 внутривенно в 1 день, каждые 3 недели
Рак молочной железы без гиперэкспрессии HER-2
Капецитабин
капецитабин - 2000 мг/м2/сутки внутрь в 1-й - 14-й дни, каждые 3 недели (в том числе, в сочетании с лучевой терапией) - в первой линии лечения
Гемцитабин и цисплатин
гемцитабин - 1000 мг/м2 внутривенно в 1-й и 8-й дни + цисплатин - 50 мг/м2 внутривенно в 1-й и 8-й дни, каждые 3 - 4 недели (у ранее леченых больных, при рецидиве опухолевого процесса в головном мозге после лучевой терапии, у больных с тройным негативным раком молочной железы, в том числе, с мутациями BRCA1 и BRCA2)
Паклитаксел и карбоплатин
паклитаксел - 175 мг/м2 внутривенно в 1-й день + карбоплатин - по AUC = 5 - 6 внутривенно в 1-й день, каждые 3 недели (у больных с тройным негативным раком молочной железы, в том числе с мутациями BRCA1 и BRCA2)
Схема FAC:
5-фторурацил + доксорубицин + циклофосфан
циклофосфан - 500 мг/м2 внутривенно в 1-й день + доксорубицин - 50 мг/м2 внутривенно в 1-й день + 5-фторурацил - 500 мг/м2 внутривенно в 1-й день, каждые 3 недели (у ранее нелеченых больных)
Схема AC:
доксорубицин и циклофосфан
доксорубицин - 50 мг/м2 внутривенно в 1-й день + циклофосфан - 500 мг/м2 внутривенно в 1-й день, каждые 3 недели (у ранее нелеченых больных)
Схема CMF:
циклофосфан + метотрексат + 5-фторурацил
циклофосфан - 100 мг/м2 внутрь или внутримышечно в 1-й - 14-й дни + метотрексат - 40 мг/м2 внутривенно в 1-й и 8-й дни + 5-фторурацил - 600 мг/м2 внутривенно в 1-й и 8-й дни, каждые 3 недели (у ранее нелеченых больных)
Метастазы в головной мозг рака молочной железы с гиперэкспрессией HER-2
Трастузумаб + химиотерапия
трастузумаб - 6 мг/кг внутривенно, 1 раз в 3 недели (в том числе, в тех случаях, если больной ранее уже получал трастузумаб) + химиотерапия с включением таксанов (у ранее не леченых), или смена режима химиотерапии (если пациент ранее уже получал лечение) + локальный контроль опухолевого процесса в головном мозге (лучевая терапия на весь головной мозг или радиохирургическое лечение)
Капецитабин и Лапатиниб
капецитабин - 2000 мг/м2/сутки внутрь в 1-й - 14-й дни, каждые 3 недели + лапатиниб - 1250 мг/сутки внутрь постоянно
Капецитабин + лапатиниб + трастузумаб
капецитабин - 2000 мг/м2/сутки внутрь в 1-й - 14-й дни, каждые 3 недели + лапатиниб - 750 - 1000 мг/сутки внутрь постоянно + трастузумаб - 6 мг/кг внутривенно, 1 раз в 3 недели (нагрузочная доза - 8 мг/кг)
Пертузумаб + трастузумаб + Таксаны
пертузумаб - 420 мг внутривенно в 1-й день (нагрузочная доза - 840 мг) + трастузумаб - 6 мг/кг внутривенно в 1-й день, каждые 3 недели (нагрузочная доза - 8 мг/кг) + таксаны (в первой линии лечения) + локальный контроль опухолевого процесса (лучевая терапия на весь головной мозг или радиохирургическое лечение)
Трастузумаб эмтанзин
трастузумаб эмтанзин (T-DM1) - 3,6 мг/кг внутривенно в 1-й день, каждые 3 недели (при прогрессировании опухолевого процесса на фоне противоопухолевой лекарственной терапии с включением трастузумаба, или трастузумаба + пертузумаба, или лапатиниба) + локальный контроль опухолевого процесса в головном мозге (лучевая терапия на весь головной мозг или радиохирургическое лечение).
Метастазы в головной мозг меланомы без BRAF мутации
Темозоломид
темозоломид - 150 - 200 мг/м2/сутки внутрь в 1-й - 5-й дни, каждые 4 недели
Ломустин
ломустин - 100 мг/м2 внутрь в 1-й день, каждые 6 недель
Темозоломид и Цисплатин
темозоломид - 150 мг/м2/сутки внутрь в 1-й - 5-й дни + цисплатин - 20 мг/м2/сутки внутривенно в 1-й - 5-й дни, каждые 4 недели
Фотемустин
фотемустин - 100 мг/м2 внутривенно в 1-й, 8-й и 15-й дни (индукционный курс); далее - 100 мг/мг/м2 внутривенно в 1-й день, каждые 4 недели.
Ипилимумаб
Ипилимумаб - 3 мг/кг внутривенно, 1 раз в 3 недели, 4 введения (в сочетании с локальным контролем опухолевого процесса в головном мозге)
Метастазы в головной мозг меланомы с наличием BRAF мутации
Вемурафениб
вемурафениб - 960 мг x 2 раза в сутки внутрь, ежедневно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Дабрафениб
дабрафениб - 150 мг x 2 раза в сутки внутрь ежедневно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Вемурафениб и кобиметиниб
вемурафениб - 960 мг 2 раза в сутки внутрь, ежедневно, постоянно + кобиметиниб - 60 мг в сутки внутрь 1 - 21 дни цикла, каждые 28 дней, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Дабрафениб и Траметиниб
дабрафениб - 150 мг 2 раза в сутки внутрь ежедневно, + траметиниб - 2 мг в сутки внутрь ежедневно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Метастазы в головной мозг рака почки
Сунитиниб
сунитиниб - 50 мг/сутки внутрь ежедневно 1 - 28 дней, интервал между циклами - 2 недели (в первой линии лечения), до прогрессирования болезни или до появления признаков неприемлемой токсичности
Сорафениб
сорафениб - 800 мг/сутки ежедневно (в первой линии лечения), до прогрессирования болезни или до появления признаков неприемлемой токсичности
Бевацизумаб и альфа-интерфероны
бевацизумаб - 10 мг/кг внутривенно в 1-й день, каждые 2 недели (в сочетании с альфа-интерферонами), до прогрессирования болезни или до появления признаков неприемлемой токсичности
Пазопаниб
пазопаниб - 800 мг/сутки ежедневно (в первой линии лечения), до прогрессирования болезни или до появления признаков неприемлемой токсичности
Темсиролимус
темсиролимус - 25 мг внутривенно, 1 раз в неделю (у больных несветлоклеточным раком почки) до прогрессирования болезни или до появления признаков неприемлемой токсичности
Эверолимус
эверолимус - 10 мг/сутки внутрь ежедневно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Акситиниб
акситиниб - 10 мг/сутки внутрь ежедневно, до прогрессирования болезни или до появления признаков неприемлемой токсичности
Метастазы в головной мозг колоректального рака
схема CAPOX:
капецитабин и оксалиплатин
капецитабин 2000 мг/м2/сутки внутрь в 1 - 14-й дни + оксалиплатин - 130 мг/м2 внутривенно в 1-й день каждые 3 недели (в первой линии лечения)
Схема FOLFIRI:
иринотекан + лейковорин + 5-фторурацил
иринотекан - 180 мг/м2 внутривенно в 1-й день + лейковорин - 400 мг/м2 внутривенно (инфузия - 2 часа) в 1-й день + 5-фторурацил - 400 мг/м2 внутривенно струйно в 1-й день + 5-фторурацил - 2400 мг/м2 внутривенно (инфузия - 46 часов); курсы химиотерапии - каждые 2 недели
Схема FOLFOX:
оксалиплатин - 85 мг/м2 внутривенно в 1-й день + лейковорин - 400 мг/м2 внутривенно (инфузия - 2 часа) в 1-й день + 5-фторурацил - 400 мг/м2 внутривенно струйно в 1-й день + 5-фторурацил - 2400 мг/м2 внутривенно (инфузия - 46 часов); курсы химиотерапии - каждые 2 Недели
Капецитабин
капецитабин - 2000 - 2500 мг/м2/сутки внутрь в 1 - 14-й дни каждые 3 недели (у пожилых больных, или у больных с плохим соматическим состоянием ECOG 2 - 3)
Ралтитрексед
ралтитрексед - 3 мг/м2 внутривенно в 1-й день, каждые 3 недели (у ранее леченых больных)
Цетуксимаб
цетуксимаб (в сочетании с химиотерапией) - 400 мг/м2 внутривенно (нагрузочная доза, 1-я инфузия), далее - еженедельно в дозе 250 мг/м2
Панитумумаб
панитумумаб (в сочетании с химиотерапией) - 6 мг/кг
внутривенно, 1 раз в 2 недели (нагрузочная доза, 1-я инфузия - 8 мг/кг)
Бевацизумаб
бевацизумаб (в сочетании с химиотерапией) - 7,5 мг/кг внутривенно, 1 раз в 3 недели или 5 мг/кг внутривенно 1 раз в 2 недели
