"Клинические рекомендации "Врожденная нейтропения (ВН)"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ВРОЖДЕННАЯ НЕЙТРОПЕНИЯ (ВН)
МКБ 10: D70, D84.8
Год утверждения (частота пересмотра): 2018 (не реже 1 раза в 3 года)
ID: КР338
URL
Профессиональные ассоциации
- Национальное общество детских гематологов и онкологов, Национальная ассоциация экспертов в области первичных иммунодефицитов Российская ассоциация аллергологов и клинических иммунологов
Ключевые слова
- Тяжелая врожденная нейтропения
- Циклическая нейтропения
- Ген ELANE
- Ген HAX
- Ген WAS
- Агранулоцитоз
- Апоптоз
- Миелопоэз
- Миелограмма
- Гранулоцитарный колониестимулирующий фактор
- Миелодиспластический синдром
- Острый миелобластный лейкоз
- Трансплантация гемопоэтических стволовых клеток
Список сокращений
АКН - абсолютное количество нейтрофилов
АлаТ - аланинамитотрансфераза
АсаТ - аспартатаминотрансфераза
ВН - врожденная нейтропения
Г-КСФ - гранулоцитарный колониестимулирующий фактор
рчГ-КСФ - гранулоцитарный колониестимулирующий фактор рекомбинантный
ГМ-КСФ - гранулоцитарно-макрофагальный колониестимулирующий фактор
ГСК - гемопоэтические стволовые клетки
КМП - пунктат костного мозга (костномозговая пункция)
ЛДГ - лактатдегидрогеназа
МДС - миелодиспластический синдром
МКБ-10 - международная классификация болезней 10-го пересмотра
ОМЛ - острый миелобластный лейкоз
ПИДС - первичное иммунодефицитное состояние
РНБ - реакция "несвернутых" белков
СОЭ - скорость оседания эритроцитов
ТВН - тяжелая врожденная нейтропения
ТГСК - трансплантация гемопоэтических стволовых клеток
ЦГ - цитогенетическое исследование
ЦН - циклическая нейтропения
ЩФ - щелочная фосфотаза
ЭПР - эндоплазматический ретикулум
BCLXL - BCL-2-ассоциированный агонист клеточной гибели
BFL1 - BCL2-зависимый протеин A1
CCAAT - белок активирующий гранулоцитопоэз
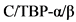 - энхансер-связывающие
- энхансер-связывающие 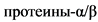
CXCR4 - рецептор к хемокинам
CSF3R - ген рецептора гранулоцитарного колониестимулирующего фактора
eIF2A - фосфорилированный эукариотический фактор инициации трансляции 2A
JAK2 - Janus kinase 2
KIT - рецептор фактора роста стволовых клеток
MCL1 - антиапоптотическая изоформа белка клеточной дифференцировки
NAMPT - никотинамидфосфорибозилтрансфераза
NAD+ - никотинамидадениндинуклеотид
NGS - панель генетических мутаций нового поколения
SIRT - сиртуины
SLPI - антилейкопротеиназа
SCNIR - severe chronic neutropenia international registry = международный регистр тяжелой нейтропении
VCAM - васкулярные молекулы клеточной адгезии.
Термины и определения
Агранулоцитоз - снижение уровня нейтрофилов в периферической крови менее 0,5 x 109/л.
Аутосомно-доминантный тип наследования - тип наследования, при котором одного мутантного аллеля, локализованного в аутосоме, достаточно, чтобы болезнь (или признак) могла быть выражена.
Аутосомно-рецессивный тип наследования - тип наследования признака или болезни, для проявления которых обе копии гена, расположенные на гомологичных аутосомах, должны быть поврежденными.
Врожденные нейтропении (ВН) - группа редких, генетически обусловленных заболеваний, характеризующихся нейтропенией, осложненной тяжелыми, подчас смертельными инфекциями, с или без других (синдромальных) проявлений [1].
Нейтропения - снижение уровня нейтрофилов в периферической крови менее 1,5 x 109/л (для детей первого года жизни - менее 1,0 x 109/л).
Трансплантация гемопоэтических стволовых клеток (ТГСК) - метод лечения некоторых наследственных и приобретенных гематологических, онкологических и иммунологических заболеваний, основанный на замене собственного, патологического кроветворения больного на нормальное кроветворение донора.
Тяжелая врожденная нейтропения (ТВН) - изолированная, несиндромальная форма врожденных нейтропении, отличающаяся ранним началом инфекционных проявлений, их наиболее тяжелым течением на фоне постоянного или циклического агранулоцитоза [2].
X-сцепленный рецессивный тип наследования - наследование мутации генов, расположенных на X хромосоме. При этом лица женского пола как правило являются бессимптомными носителями, а заболеванием страдают лишь лица мужского пола.
Циклическая нейтропения (ЦН) - одна из разновидностей ТВН. ЦН отличается периодичностью снижения нейтрофилов: во время 3 - 5-дневной нейтропенической фазы АКН снижается менее 0,2 x 109/л, а в оставшееся время восстанавливается до нормы. Клинически ЦН протекает более благоприятно по сравнению с ТВН, инфекции возникают, как правило, только во время нейтропенической фазы [3].
1. Краткая информация
1.1 Определение
Врожденная нейтропения - разнородная группа генетически обусловленных заболеваний, основной чертой которых является постоянная или периодическая нейтропения, сопровождающаяся тяжелыми\жизнеугрожающими инфекциями, и, в некоторых случаях, поражением других органов и систем. К основным генам, дефекты которых приводят к развитию ВН, относятся: ELANE (аутосомно-доминантный тип наследования), HAX1 (аутосомно-рецессивный тип наследования), WAS (X-сцепленный тип наследования), синдром Швахмана-Даймонда (аутосомно-рецессивный тип наследования). В более редких случаях встречаются мутации других генов. На сегодняшний день описано более 25 генов, мутации в которых приводят к ВН. Кроме того, существуют больные с неизвестными в настоящий момент генетическими дефектами [4].
Врожденные нейтропении входят в группу наследственных нарушений гемопоэза, которые характеризуются нарушением дифференцировки нейтрофильных гранулоцитов и, в результате, возникает тяжелая хроническая нейтропения (АКН менее 0,5 x 109/л). При исследовании костного мозга у большинства пациентов с ВН диагностируют "обрыв созревания" миелоидных клеток на уровне промиелоцитов/миелоцитов [5], что приводит к снижению количества нейтрофилов и к увеличению количества атипичных промиелоцитов [6].
Риск развития тяжелых, нередко летальных бактериальных инфекций: гнойный отит, гингивит, стоматит, кожные инфекционные процессы, глубокие абсцессы, пневмония, сепсис, менингит у пациентов с ВН может быть уже в раннем неонатальном периоде [1].
Кроме того, при ВН отмечен высокий риск развития миелодиспластического синдрома/острого миелобластного лейкоза (МДС/ОМЛ) [4].
1.2 Этиология и патогенез
Врожденная нейтропения является генетически гетерогенным заболеванием, в основе патогенеза которого лежит нарушение созревания гранулоцитов, с ранним апоптозом гранулоцитарных предшественников. Далее мы подробнее коснемся патогенеза основных генетических вариантов ВН.
1.3 Эпидемиология
Врожденная нейтропения является редкой патологией, ее встречаемость составляет 3 - 8,5 случаев на миллион человек [7].
Уникальность данной патологии затрудняет проведение масштабных исследований. В 1994 году создан международный регистр тяжелых нейтропений (severe chronic neutropenia international registry (SCNIR), который помогает учитывать пациентов с хроническими нейтропеническими состояниями, оценивать распространенность и частоту каждой нозологии [8]. Демография играет важную роль в эпидемиологии ВН.
Пациенты с аутосомно-доминантными мутациями распространены по всему миру, в то время, как пациенты с аутосомно-рецессивными мутациями чаще диагностируются в популяциях, где распространены близкородственные браки. Разный уровень близкородственных браков является основной причиной, которая может объяснить наблюдаемые различия встречаемости генетических мутаций у жителей Европы и Северной Америки. Например, в Европе наблюдается высокая распространенность тяжелой врожденной нейтропении, вызванной мутациями в гене HAX1(кодирует HCLS1 ассоциированный белок X1) - в 11% случаев всех ВН [9] - в основном по причине большого количества близкородственных семей турецкого или арабского происхождения. Напротив, в США до сих пор не обнаружено ни одного пациента с мутациями гена HAX1. В Израиле была обнаружена высокая частота носительства уникальных мутаций гена G6PC3 (кодирует глюкозо-6фосфатазу), и там пациенты с нейтропенией, вызванной гомозиготным дефектом гена G6PC3 составляют 25% всех нейтропений [10].
По данным SCNIR [8], приблизительно у 60% пациентов с ВН выявляется мутация в гене ELANE, что важно учитывать при проведении первичного генетического исследования.
Мутации гена ELANE
Дефекты гена ELANE встречаются при ВН наиболее часто и как правило наследуются аутосомно-доминанто [11]. Ген ELANE кодирует эластазу нейтрофилов, которая является сериновой протеазой, содержится в азурофильных гранулах нейтрофилов и высвобождается после их активации. Эластаза нейтрофилов гидролизует сложные белковые субстраты, включая протеины клеточной мембраны, такие, как рецептор гранулоцитарного колониестимулирующего фактора (Г-КСФ), молекулы клеточной адгезии (VCAM), рецептор фактора роста стволовых клеток (KIT), а также рецептор к хемокинам (CXCR4).
Большое количество лабораторных исследований показывают, что экспрессия мутантного гена ELANE запускает неправильный фолдинг белка (процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру), что приводит к запуску ответа на неправильно свернутые белки ("unfolded protein response - UPR), вызывает апоптоз развивающихся миелоидных предшественников и, в конечном итоге, приводит к неэффективному миелопоэзу [12, 13].
Мутации гена HAX1
Мутации гена HAX1, приводящие к дефициту митохондриального белка HAX1, обнаруживаются у пациентов с аутосомно-рецессивной ВН [14]. Дефицит этого белка приводит к дестабилизации внутреннего потенциала мембраны митохондрии нейтрофила, что приводит к спонтанному апоптозу миелоидных предшественников. У данного белка, по-видимому, есть и другие функции, их роль в механизмах развития ВН не до конца ясна [15].
Исследования взаимосвязи генотип-фенотип показали, что мутации гена HAX1, затрагивающие две изоформы белка (в основном p.Q190X и p.R86X у пациентов японского происхождения), вызывают ВН с неврологическими симптомами (например, задержку психического развития и приступы эпилепсии) [14, 16]. Мутации, которые затрагивают только одну изоформу белка (главным образом p.W44X, найденную в близкородственных семьях турецкого происхождения) приводят к ВН без неврологического компонента [17].
Мутации гена WAS
Одной из редких форм ТВН является X-сцепленная тяжелая врожденная нейтропения, вызванной мутацией в гене WAS (ген синдрома Вискотта-Олдрича). В отличие от ТВН с мутацией в гене ELANE, при данном дефекте не отмечено выраженного моноцитоза. Несмотря на агранулоцитоз, в некоторых случаях данное заболевание диагностируется только в зрелом возрасте, подразумевая, что некоторые пациенты имеют ограниченные инфекционные осложнения. Фенотип этих пациентов полностью отличается от таковой у пациентов с классической формой синдрома Вискотта-Олдрича, для которого характерно иммунодефицитное состояние, тромбоцитопения, атопический дерматит. В отличие от синдрома Вискотта-Олдрича, при X-сцепленной ТВН мутации гена WAS расположены в GTP-связывающем домене. Они нарушают аутоингибирующую конформацию белка WASP и приводят к его постоянной активации, что приводит к раннему апоптозу миелоцитов в костном мозге [2, 4].
Мутации гена CSF3R
Известно, что наличие герминальной биаллельной мутации гена рецептора гранулоцитарного колониестимулирующего фактора (CSF3R) у пациентов с ВН поражает внеклеточную часть рецептора Г-КСФ, что приводит к резкому снижению или полному подавлению передачи сигнала через рецептор Г-КСФ [18 - 20]. Характер наследования этих мутаций (доминантный или рецессивный) может варьировать. Пациенты с герминальной биаллельной мутацией гена CSF3R не отвечают на терапию Г-КСФ, однако отвечают на терапию гранулоцитарно-макрофагальным колониестимулирующим фактором (ГМ-КСФ) [18].
Синдромальные формы ВН
ВН может быть вызвана мутациями других генов, которые приводят к развитию тяжелого нейтропенического синдрома в сочетании с поражениями других органов, не связанных с гемопоэзом (см. таблицу 1). Известно поражение следующих органов: сердце (G6PC3 и TAZ), мочеполовая система (G6PC3), кости (SBDS), экзокринная часть поджелудочной железы (SBDS), кожа (LAMTOR2 и RAB27A), печень (SBDS) и др. Эти генетические повреждения нередко затрагивают и другие гемопоэтические стволовые клетки, поэтому при некоторых формах отмечается лимфопения, анемия, тромбоцитопения [4, 11].
Мультигенные мутации
Некоторые пациенты с ВН имеют мутации в нескольких генах, которые связаны с развитием ВН. Например, комбинации G6PC3 и ELANE или HAX1 и ELANE [21]. В случае сочетания HAX1 и ELANE, влияние каждой мутации трудно определить, так как соматический статус пациентов примерно одинаков. При комбинации мутации в гене G6PC3 и ELANE или G6PC3 и HAX1 у пациентов присутствуют клинические и лабораторные признаки, характерные для обоих заболеваний.
Патологические механизмы
Уровни дисрегуляции молекулярного пути, лежащие в основе нарушения миелопоэза, зависят от того, нарушения каких белков имеются у данного пациента. Однако, базовые патологические механизмы могут быть схожи при разных генетических повреждениях.
Стресс эндоплазматического ретикулума и апоптоз клеток миелоидного ряда
Мутации в гене ELANE нарушают следующие процессы: фолдинг, процессинг, секрецию или деградацию нейтрофильной эластазы в миелоидных клетках. Нарушение того или иного процесса зависит от того, какой домен эластазы был поврежден [22]. Мутации в гене ELANE прерывают начало трансляции, способствуют выработке короткой формы нейтрофильной эластазы, что приводит к изменению локализации мутантного белка [23]. Внутриклеточное накопление и неправильная локализация мутантной нейтрофильной эластазы вызывает стресс эндоплазматического ретикулума (ЭПР), что в свою очередь активирует реакцию несвернутых белков (РНБ) [24 - 26]. Это приводит к увеличению апоптоза, связанному с повышением экспрессии основного белка-шаперона (глюкозо-регулируемый белок - GRP78), сплайсингу XBP1 мРНК и активации ATF6. Степень РНБ варьирует в зависимости от различных типов мутаций гена ELANE [24 - 26]. В плазме крови пациентов с ВН отмечается резкое уменьшение количества ELANE-мРНК в промиелоцитах и нейтрофильной эластазе [27 - 28], в связи с этим возникает вопрос: "Какое количество мутантного белка может стимулировать РНБ?". Возникает также вопрос: "Почему при некоторых мутациях гена ELANE происходит активация РНБ в клетках пациентов с ВН, а у пациентов с ЦН - нет?". У пациентов с ВН отмечается пониженное содержание антилейкопротеиназы (SLPI-секреторный ингибитор протеаз лейкоцитов), естественного ингибитора нейтрофильной эластазы, в промиелоцитах и в плазме крови [29]. Антилейкопротеиназа (SLPI) может регулировать степень РНБ, следовательно, недостаток SLPI может объяснить, как именно низкое содержание мутантной нейтрофильной эластазы может индуцировать появление РНБ. Пациенты с циклической нейтропенией имеют нормальное количество SLPI, которая может защищать клетки от РНБ [29].
Экспрессия в ЭПР стресс-зависимого белка GRP78 и фосфорилированного эукариотического фактора инициации трансляции 2A (eIF2A) также повышена в нейтрофилах у пациентов с мутацией гена G6PC3 [30].
У пациентов с ВН, возникшей в следствие мутаций генов ELANE или HAX1:
- в костном мозге выявлено усиление апоптоза в предшественниках миелоидных клеток [31];
- обнаружено снижение экспрессии антиапоптотических белков Bcl-2, BCL-2ассоциированного агониста клеточной гибели (BCLXL) и бакуловирусного ингибитора апоптозных повторов протеин 5 [32];
- отмечено повышение экспрессии BCL-2-зависимого протеина A1 (BFL1) и антиапоптотической изоформы белка клеточной дифференцировки (MCL1), который индуцирует развитие миелоидной лейкемией [32].
HAX1 также экспрессируется в митохондриях, где он функционирует как антиапоптотический белок, мутантный ген HAX1 вызывает апоптоз миелоидных предшественников вследствие потери митохондриями своих функций [17]. Кроме того, у пациентов с мутациями гена HAX1 отмечалось увеличение цитохрома C в миелоидных предшественниках, который высвобождался из нефункциональных митохондрий [17, 33]. Морфологические исследования и лабораторные данные подтверждают апоптоз и фагоцитоз клеток миелоидного ряда макрофагами костного мозга на окончательных этапах этого процесса.
У пациентов с мутациями гена JAGN1 (кодирует протеин jagunal) также увеличен уровень апоптоза нейтрофилов [34]. Неправильное гликозилирование белков нейтрофилов было описано у пациентов с мутациями генов G6PC3 и SLC37A4, наличие которых приводит к увеличению стресса ЭПР и апоптозу [30, 35].
Нарушение экспрессии факторов транскрипции
Большинство пациентов с ВН имеют повышенное количество моноцитов и эозинофилов (в 2 - 4 раза выше нормального содержания в крови) [36]. Моноцитоз можно объяснить, как компенсаторный механизм врожденной иммунологической защиты при отсутствии нейтрофилов. Также, это может быть следствием нарушения регуляции сигнального пути факторов транскрипции, которые ответственны за направленную дифференцировку миелоидных предшественников в нейтрофилы или моноциты [37, 38]. У пациентов с ВН экспрессия белка, активирующего гранулоцитопоэз - (CCAAT)/энхансерсвязывающих 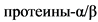
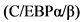 , резко снижена, а экспрессия транскрипционного фактора PU.1, активирующего моноцитопоэз не затронута или повышена [39, 40]. Таким образом, нарушенное соотношение экспрессии C/EBP и PU.1 с сильным сдвигом в сторону экспрессии PU.1 может оказывать существенную роль в нарушении регуляции миелопоэза при ВН. Увеличение количества эозинофилов в крови и костном мозге также обычно имеет место у пациентов с ВН [36]. Постоянная экспрессия транскрипционного фактора ДНК - связывающего белка - ингибитора ID1, в человеческих гемопоэтических клетках повышает дифференцировку нейтрофилов и ингибирует развитие эозинофилов [41]. Г-КСФ вызывает повышение содержания ID1 в клетках предшественниках миелоидного ряда у здоровых людей, но не у людей, страдающих ВН. Таким образом, нарушенная экспрессия ID1 может быть причиной эозинофилии и приводит к недостатку нейтрофильных гранулоцитов у пациентов с ВН [40].
, резко снижена, а экспрессия транскрипционного фактора PU.1, активирующего моноцитопоэз не затронута или повышена [39, 40]. Таким образом, нарушенное соотношение экспрессии C/EBP и PU.1 с сильным сдвигом в сторону экспрессии PU.1 может оказывать существенную роль в нарушении регуляции миелопоэза при ВН. Увеличение количества эозинофилов в крови и костном мозге также обычно имеет место у пациентов с ВН [36]. Постоянная экспрессия транскрипционного фактора ДНК - связывающего белка - ингибитора ID1, в человеческих гемопоэтических клетках повышает дифференцировку нейтрофилов и ингибирует развитие эозинофилов [41]. Г-КСФ вызывает повышение содержания ID1 в клетках предшественниках миелоидного ряда у здоровых людей, но не у людей, страдающих ВН. Таким образом, нарушенная экспрессия ID1 может быть причиной эозинофилии и приводит к недостатку нейтрофильных гранулоцитов у пациентов с ВН [40].
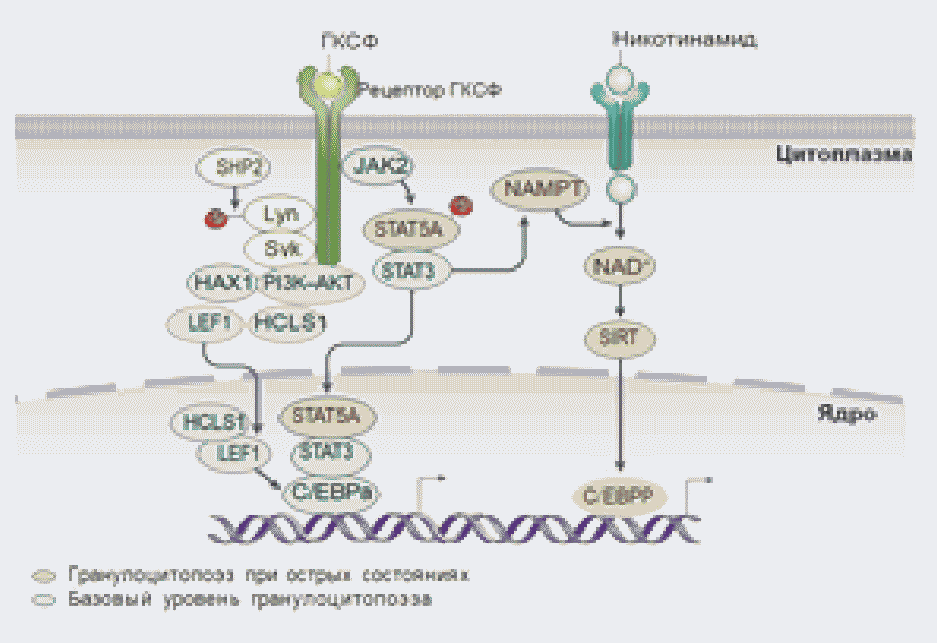
Пути передачи сигнала от рецептора гранулоцитарного колониестимулирующего фактора в ядро клетки. Роль никотинамида в гранулоцитопоэзе.
У пациентов с ВН выявлены мутации белков, участвующих в передаче сигналов через Г-КСФ-сигнальный путь [42]. Это объясняет, почему лечение очень высокими дозами Г-КСФ эффективно в большинстве случаев. Доказано, что у пациентов с ВН нет нарушения продукции Г-КСФ или снижения экспрессии рецепторов Г-КСФ. В сыворотке пациентов содержится повышенная концентрация Г-КСФ [43] и клетки миелоидного ряда экспрессируют повышенное количество рецепторов к Г-КСФ [44].
Передача сигнала с поверхности клетки в ядро опосредуется различными доменами цитоплазматической области рецептора Г-КСФ и представляет собой многоступенчатый процесс, завершающийся активацией транскрипционных факторов, функционирующих непосредственно в ядре клетки. Jan-киназы активируются первыми после гомоолигомеризации связывания Г-КСФ рецептора с его лигандом. Стимуляция Janus kinase 2 (JAK2), экспрессия которой повышена в миелоидных клетках пациентов с ВН, приводит к фосфорилированию и активации различных факторов STAT (3, 5), что способствует повышенной экспансии незрелых миелоидных клеток, дифференцировка в зрелые гранулоциты при этом снижается. Устойчивая активация STAT5A была показана у пациентов с ВН [45].
Другой белок, принимающий участие в этом сигнальном пути, PTPN11, также известный как SHP2 индуцирует дефосфорилирование и, таким образом, активацию протеинкиназы Lyn, которая, связываясь с тирозинкиназой Syk, фосфорилирует и активирует специфический белок HCLS1. Предполагаемая роль этих белков - супрессия апоптоза или дополнительная активация STAT протеинов, что приводит к накоплению незрелых гранулоцитов (экспансии незрелых клеток миелоидной линии) [46, 47, 48]. Отмечено, что у пациентов с ВН - очень высокая экспрессия SHP2 [49].
Фактор LEF1 значительно снижен на миелоидных предшественниках у пациентов с ВН. LEF1 активирует гранулоцито-специфические транскрипционные белки CCAAT, (C/EBP), CCND1, MYC, а также антиапоптотический фактор IAP [39]. Экспрессия этих белков значительно снижена у пациентов с ВН в миелоидных предшественниках. Также снижена активность PI3K, AKT, HCLS1 (HAX1) белков [40, 46].
Терапия гранулоцитарным колониестимулирующим фактором рекомбинантным (рчГ-КСФ) активирует еще один экстренный путь гранулопоэза - никотинамидфосфорибозилтрансферазный путь (NAMPT). NAMPT превращает никотинамид в никотинамидадениндинуклеотид (NAD+), активируя NAD+ зависимые белки деацетилазы сиртуины (SIRT), которые, в свою очередь, активируют C/EBP белки, которые отвечают за гранулопоэз [50]. У пациентов с ВН - Г-КСФ активирует NAMPT и SIRT1 индуцированный гранулопоэз. [50]. Интересный факт, что никотинамид (витамин B3), субстрат NAMPT, способен увеличивать количество нейтрофилов у здоровых людей [50], область его применения в качестве терапии у пациентов с ТВН и ЦН до конца не определена.
Таким образом, нарушение регуляции передачи сигнала через рецепторы Г-КСФ, происходит вследствие снижения экспрессии эффекторных белков, что приводит к резкому снижению транскрипции генов, которые обеспечивают пролиферацию или дифференцировку клеток миелоидного ряда гемопоэза [40, 45, 47]. В результате отмечается уменьшение или отсутствие дифференцировки нейтрофилов (рисунок 2).
Рисунок 1. Внутриклеточные сигнальные пути, активирующиеся Г-КСФ [4].
Прогностические факторы.
В настоящее время выживаемость пациентов с ВН, включая пациентов с развившейся злокачественной трансформацией, составляет около 80% [51], однако, приблизительно 10% пациентов (преимущественно не получающих гранулоцитарный колониестимулирующий фактор (Г-КСФ) или не имеющих гематологического ответа на него) умирают от сепсиса и тяжелых бактериальных инфекций [7, 51, 52], и еще 10% - от других осложнений. У пациентов с ВН выживаемость и прогноз в основном зависит от эффективности ответа на Г-КСФ, в то время, как у пациентов с ВН в составе других заболеваний, выживаемость зависит как от степени нейтропении, так и от степени выраженности органной дисфункции. Например, в случае синдрома Барта, при котором ВН ассоциирована с тяжелой застойной сердечной недостаточностью, выживаемость составляет приблизительно 15% в течение 5 лет и сильно зависит от тяжести сердечной недостаточности, а также от доступности в качестве терапевтической опции трансплантации сердца [53].
Риск развития миелодиспластического и/или острого миелобластного лейкоза у пациентов с врожденной нейтропенией.
Риск развития МДС/ОМЛ у пациентов с ВН известен уже давно. P. Gilman. и соавторы в 1970 г. описали трех пациентов с ВН. По лабораторным данным у всех выявлена нейтропения, моноцитоз, гипергаммаглобулинемия, в клинической картине преобладали тяжелые бактериальные инфекции, плохо поддающиеся терапии, даже на фоне длительной антибактериальной терапии, у одного из этих пациентов описана трансформация заболевания в ОМЛ [54].
M. Freedman и соавт. описали по данным SCNIR в Сиэтле были описаны 696 больных с нейтропенией, в том числе 352 больных с ВН, получивших Г-КСФ с 1987 по 2000 год. 352 пациента с ВН наблюдались в среднем в течение 6 лет (от 0,1 до 11 лет) во время лечения. У 31 (9%) пациента отмечено злокачественная трансформация в МДС/ОМЛ. У пациентов с идиопатической или циклической нейтропенией не было ни одного случая развития ОМЛ/МДС [55]. В 2000 г. M. Freedman и соавт. предполагали, что причиной развития МДС/ОМЛ может быть использование в терапии ВН Г-КСФ [55].
В 2002 г. M. Freedman и соавт. также провели анализ пациентов из SCNIR пациентов с ВН. Они показали, что нет корреляции между возрастом, полом, дебютом МДС/ОМЛ с дозой Г-КСФ, или продолжительностью терапии Г-КСФ [56].
Последние исследования пациентов с ВН из разных регистров, особенно в период появления и использования панелей NGS показали, что злокачественная трансформация в МДС/ОМЛ происходит у больных с ВН, у которых найдены предлейкемические соматические мутации в костно-мозговых предшественниках, что объясняет причину развития лейкемических состояний [57].
Юлия Скокова с соавт. показали в своем исследовании [58], что почти у 70 - 80% пациентов с ВН с трансформацией в ОМЛ или МДС выявляют соматические мутации гена CSF3R. Согласно теории генеза лейкемической трансформации, необходимо минимум два генетических события. Известно, что мутации гена CSF3R являются первичным пусковым механизмом, в результате которого происходит постоянная активация миелоидных предшественников, клональная экспансия гемопоэтических стволовых клеток и миелоидных предшественников. Наличие других соматических мутаций, например, RUNX1 одновременно с мутацией CSF3R способствует реализации трансформации в ОМЛ/МДС [58]. Авторы исследовали возникновение соматических мутаций при помощи NGS у 31 пациента с ВН, у которых отмечено развитие злокачественной трансформации в ОМЛ/МДС. Обнаружено, что у 20 (64,5%) пациентов были выявлены мутации генов RUNX1, STAT5A, NAMPT, а также хромосомные аберрации, такие как моносомия 7 и трисомия 21. У большинства (17, или 85%) пациентов с мутациями гена RUNX1 одновременно имелись приобретенные мутации гена CSF3R. Это были в основном пациенты с ВН с мутациями генов ELANE, HAX1, SLC37A4 (G6PT1), GFI1 и WAS [58].
Типичные для ОМЛ мутации других генов встречались реже: мутация гена ЕРЗОО выявлена у 4 пациентов, гена FLT3-ITD - у 2 пациентов, гена CBL - у 1 пациента, гена SUZ12 - у 1 пациента. Мутаций генов CEBPA, DNMT3A, IDH1, IDH2, NPM1 и TET2 не были выявлены. Таким образом, следует отметить, что наличие одновременно мутации генов RUNX1 и CSF3R является значимым предиктором развития в последующем лейкоза. Такие пациенты должны подвергаться более тщательному диагностическому мониторингу с целью более раннего выявления лейкемического клона [58, 59] и вопрос о проведении ТГСК у них должен рассматриваться еще до его появления.
Генетические предикторы неблагоприятного течения тяжелой врожденной нейтропении у пациентов с мутацией в гене ELANE
Наиболее крупное исследование, целью которого было выявление связи между установленными дефектами гена ELANE и клиническими проявлениями болезни было проведено V. Makarvan и соавт. [63]. Были проанализированы данные из SCNIR у 307 пациентов с различными мутациями в гене ELANE.
У 187 пациентов с ТВН были обнаружены 94 отдельные мутации, а у 120 пациентов с ЦН-22 мутации. Было показано, что, как правило, при ЦН и ТВН встречаются разные мутации, однако 12 мутаций наблюдались у пациентов с обоими заболеваниями. Среди мутаций гена ELANE преобладали миссенс-мутации (n = 65), встречались так же мутации со сдвигом рамки считывания (n = 15), нонсенс мутации (n = 8), интронные мутации (n = 8), а также делеции или вставки без нарушения рамки считывания (n = 7). Интерес представляет тот факт, что миссенс-мутации чаще встречались при ТВН (у 134, или 71,7%, из 187 пациентов), чем при ЦН (у 59, или 49,2% из 120 пациентов, р = 2 x 10-4). Тем не менее, все мутации со сдвигом рамки считывания были ассоциированы исключительно с ТВН [63].
При анализе регистра SCNIR у 30 (16%) из 187 пациентов с ТВН с 25 (24%) различными мутациями в гене ELANE зафиксировано развитие МДС/ОМЛ; 79 (76%) мутаций из 104 не были связаны с трансформацией в МДС/ОМЛ. Развитие лейкемии отмечено у 1/3 пациентов с мутациями со сдвигом рамки считывания (у 6 (31,6%) из 19), у 1/4 пациентов - с нонсенс-мутациями (у 3 (25%) из 12) и у 3 (20%) из 15 пациентов с интронными мутациями, только у 17 (12,7%) из 134 пациентов с миссенс-мутациями [63].
МДС/ОМЛ наиболее часто развивался у пациентов с мутацией в положении C151Y (у 3 (75%) из 4) и у пациентов с мутацией в положении G214R (у 3 (33,3%) из 9). МДС/ОМЛ также развился у 2 (8,3%) из 24 пациентов с мутацией S126L. Наблюдался только один случай МДС/ОМЛ при каждой из других мутаций, ассоциированных с МДС/ОМЛ [63].
Помимо развития МДС/ОМЛ, низкое АКН до начала терапии рчГ-КСФ и отсутствие ответа на рчГ-КСФ также относится к плохим прогностическим факторам и является критерием тяжелого течения ТВН [63, 64]. Эти параметры были оценены у 241 пациента из регистра SCNIR (у 165 пациентов с ТВН и 76 с ЦН). Как и следовало ожидать, среднее АКН у пациентов с ТВН было меньше, чем у пациентов с ЦН (0,10 против 0,40 x 10/л; р = 5 x 10-20), а эффективная доза рчГ-КСФ - выше (6,7 против 2,1 мкг/кг в сутки; р = 2 x 10-14) [63].
В случаи с МДС/ОМЛ, очень низкое количество нейтрофилов (определяемое как 0) значительно чаще встречалось у пациентов с такими мутациями, как A57T (4 случая из 4), C151Y (3 случая из 4) и G214R (3 случая из 9) [63].
Эффективная доза рчГ-КСФ у пациентов с ЦН была примерно одинаковой вне зависимости от типа и локализации мутации. Напротив, в группе больных с ТВН были обнаружены корреляции между средней дозой рчГ-КСФ и расположением мутации, а также между средней дозой рчГ-КСФ и типом мутации. Более высокие дозы препарата связаны с мутациями, расположенными в локусах поблизости от 5` и 3`-UTR, а не во внутренних областях гена. В частности, в более высоких дозах препарата нуждались пациенты с ранее описанными мутациями C151Y и G214R, в то время как более низкие дозы рчГ-КСФ были эффективны у пациентов с мутациями P139L и IVS4+5 G > A. У 5 пациентов с мутацией G214R была выполнена ТГСК в связи с отсутствием ответа на терапию рчГ-КСФ (средняя использованная доза препарата, которая не привела к терапевтическому эффекту, составила 80 мкг/кг/сут) [63].
При суммарном анализе риска таких факторов тяжести заболевания, как развитие МДС/ОМЛ, необходимость проведения ТГСК и смертельный исход так же была выявлена связь с расположением мутации и ее конкретным типом. После 20 лет применения рчГ-КСФ общее количество случаев и доля пациентов, у которых возникли эти угрожающие жизни осложнения, составило 53% для пациентов с мутациями, локализованными в области от 5` UTR до 2-го экзона, 71% для пациентов с мутациями в 5-м экзоне против 35% у пациентов с мутациями во внутренних областях гена (от 3-го экзона до 4 интрона). После 20 лет терапии рчГ-КСФ у всех 9 (100%) пациентов с мутацией G214R и у всех 4 (100%) пациентов с мутацией C151Y были угрожающие жизни осложнения, в то время, как ни у одного из 11 пациентов с мутациями P139L и IVS4+5 G > A угрожающие жизни осложнения не были зарегистрированы, и только у 2 (10%) пациентов из 20 с мутацией S126L также отмечены жизнеугрожающие осложнения. В целом, после 20-летней терапии рчГ-КСФ общее количество случаев угрожающих жизни осложнений составило 46% при ТВН против 7% при ЦН [63].
1.4 Кодирование по МКБ 10
D70 - Агранулоцитоз
Другие иммунодефициты (D84):
D84.8 - Другие уточненные иммунодефицитные нарушения
1.5 Классификация
В соответствии с классификацией, предложенной G. Bohn, K. Welte and C. Klein в 2007 г. [60], группа врожденных нейтропений делится на следующие подгруппы:
1. Изолированная тяжелая врожденная нейтропения/Циклическая нейтропения
2. Нейтропении, ассоциированные с гипопигментацией:
- Синдром Чедиака-Хигаши
- Грисцели синдром тип 2
- Синдром Германского-Пудлака тип 2
- Дефицит р14
- Врожденный дискератоз
3. Синдромальные формы нейтропений без гипопигментации:
- Дефицит ростового фактора
- WHIM синдром
- Синдром Швахмана-Даймонда
- Синдром Коэна
- Барт синдром
- Дисплазия хряща и волос
- Гликогеновая болезнь тип Ib
- Изовалерикацидемия
- Пропионикацидемия
- Метилмалоновая ацидемия и др.
По степени выраженности нейтропения делится [6]:
Степень нейтропении
АКН
легкая
Концентрация между 1,0 - 1,5 x 109/л
средняя
Концентрация между 0,5 - 1,0 x 109/л
тяжелая (агранулоцитоз)
Концентрация менее 0,5 x 109/л
Также ВН можно классифицировать в зависимости от типа наследования:
- Аутосомно-доминантный
- Аутосомно-рецессивный
- X-сцепленный
В связи с большой гетерогенностью группы заболеваний ВН, ниже приведена сводная таблица (таблица Г1), основных известных на сегодняшний день нозологических единиц ВН, в зависимости от типа мутации и сопутствующей патологии, при которых нейтропения является важным лабораторным признаком.
1.6 Клиническая картина
У пациентов с ВН уже в раннем неонатальном периоде развиваются тяжелые, нередко летальные бактериальные инфекции: гнойный отит, гингивит, стоматит, кожные инфекционные процессы, глубокие абсцессы, пневмония, сепсис, менингит [1].
Наиболее часто встречаемым инфекционным процессом являлись рецидивирующие стоматиты/гингивиты, кожные инфекции/абсцессы, рецидивирующие бактериальные инфекции верхних дыхательных путей (синусит, бронхит, гнойный отит). Однако частота и тяжесть инфекционных процессов несколько отличались в зависимости от поврежденного гена. Пациенты с мутацией в гене SBDS имеют наименьшее число инфекционных осложнений, по сравнению с пациентами, имеющими мутацию в гене ELANE, тем не менее, и в этой группе отмечаются значимые инфекции, включая повторные пневмонии. У пациентов с мутациями в генах ELANE, WAS, G6PC3 зафиксировано развитие тяжелых системных инфекций (сепсис, менингит, энцефалит и др). По совокупности, несмотря на вариабельность в составе группы, наибольшая частота инфекционных эпизодов отмечена у больных с мутацией в гене ELANE. Помимо инфекционных эпизодов в клинике у пациентов С ВН может отмечаться сопутствующая патология со стороны других органов и систем (смотри таблицу Г1). У пациентов с мутацией в гене ELANE может отмечаться остеопороз. У пациентов с мутацией в гене G6PC3 может отмечаться усиленный сосудистый рисунок, врожденный порок сердца, врожденная дисплазия тазобедренных суставов, белково-энергетическая недостаточность тяжелой степени, бульбарные нарушения, задержка речевого интеллектуального развития. Для пациентов с синдром Швахмана-Даймонда характерной клинической особенностью были экзокринные нарушения поджелудочной железы, костные аномалии, разной степени выраженности, клинические проявления синдрома цитолиза [4, 8, 63].
Кроме тяжелых бактериальных инфекций, при ВН отмечен высокий риск развития ОМЛ/МДС [3].
2. Диагностика
2.1 Жалобы и анамнез
- Рекомендуется всем пациентам с ВН подробный опрос жалоб, сбор анамнеза заболевания, семейного анамнеза с целью верификации диагноза и оценки тяжести состояния [4, 6, 8, 61, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Основными жалобами при ВН являются рецидивирующие инфекционные заболевания, такие как отиты, тонзиллиты, стоматиты, рецидивирующее течение гингивита, инфекционные поражения кожи (омфалит, абсцессы, фурункулы), пневмония, не мотивированная лихорадка, реже сепсис, менингит.
При сборе семейного анамнеза врожденную нейтропению можно заподозрить при склонности родственников к частым тяжелым инфекционным заболеваниям, ранней потере зубов у членов семьи, наличие в семейном анамнезе случаев смертей детей в раннем возрасте от инфекций. Близкородственный брак между родителями увеличивает вероятность аутосомно-рецессивной патологии.
При опросе родителей всех пациентов с ВН необходимо уточнить сроки возникновения, частоту и тяжесть проявления инфекционных заболеваний у ребенка (омфалита, парапроктита, кожных абсцессов, острых лимфаденитов, стоматитов, гингивитов, отитов, бронхопневмоний и инфекций других локализаций), эпизодов немотивированной лихорадки, сроки и частоту госпитализаций в стационары. Опросить, как у ребенка заживают раны после порезов, ссадин, травм.
При оценке результатов предыдущих анализов крови пациента необходимо уточнять возраст, когда было впервые обнаружено снижение АКН в периферической крови, продолжительность и степень нейтропении. Все клинические анализы крови пациента желательно представить в виде таблицы
2.2 Физикальное обследование
- Рекомендуется всем пациентам с ВН провести полный физикальный осмотр с целью верификации диагноза, оценки тяжести состояния [4, 8, 61, 62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии:
1. Оценка физического развития - из-за перенесенных частых инфекций дети могут отставать в физическом развитии.
2. Термометрия - из-за инфекций возможно повышение температуры тела.
3. Осмотр кожных покровов - важно обратить внимание на наличие кожных сыпей, фурункулов, кожных абсцессов, а также рубцов на местах их предшествующей локализации.
4. Волосы - для пациентов с синдромом Чедиаки-Хигачи, синдромом Грисцелл, синдром Германского-Пудлака 2 типа характерен пепельный цвет волос или седые волосы, альбинизм, для пациентов с синдромом МакКьюсика характерна гипоплазия волос.
5. Оценка состояния слизистой полости рта, зубов - стоматиты, частые гингивиты приводят к расшатыванию и ранней потере зубов. Периодонтиты.
6. Пальпация групп периферических лимфоузлов - оценить размеры, консистенцию, болезненность периферических лимфоузлов. Из-за частых инфекционных заболеваний возможно развитие локализованной или генерализованной лимфоаденопатии.
7. Пальпация селезенки - спленомегалия иногда развивается при длительном применении рчГ-КСФ у пациентов с тяжелой врожденной нейтропенией.
2.3 Лабораторная диагностика
- Рекомендуется всем пациентам с ВН проводить клинический анализ крови с лейкоцитарной формулой и определением СОЭ с целью определения тяжести нейтропении [2, 4, 8, 61, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии:
1. В каждом анализе рассчитывать АКН.
АКН рассчитывается по следующей формуле:
АКН = (палочкоядерные нейтрофилы (%) + сегментоядерные нейтрофилы (%)) x общее число лейкоцитов / 100.
2. Если нейтропения выявлена на фоне инфекционного заболевания, повторить клинический анализ крови дважды, через 1 и 2 недели после выздоровления от инфекции.
3. При подозрении на циклическую нейтропению анализ крови берется 3 раза в неделю в течение 6 недель!!!
4. Пациенты с мутациями в генах SBDS, WAS могут иметь в начале жизни нормальное абсолютное количество нейтрофилов, которое снижается через некоторое время.
- Рекомендуется всем пациентам с ВН проводить биохимический анализ крови с обязательным исследованием общего белка, мочевины, креатинина, билирубина, АлаТ, АсаТ, ЛДГ, ЩФ, глюкозы, амилаза, липаза, холестерин [8, 61, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется пациентам с ВН при наличии признаков острой или хронической инфекции, проведение посевов на флору с определением антибиотикочувствительности из очагов инфекции (включая посев крови, мочи, бронхо-альвеолярного лаважа при соответствующей симптоматике) с целью оценки тяжести состояния и подбора адекватной терапии [2, 8, 61].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
- Рекомендуется пациентам с ВН при подозрении на болезни обмена, а также синдром Швахмана-Даймонда, исследование копрологии, панкреатической эластазы кала с целью верификации диагноза [4, 8, 62, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам с ВН исследование сывороточных иммуноглобулинов крови (IgG, IgA, IgM), иммунофенотипирование лимфоцитов, с целью исключение вариантов врожденной нейтропении в составе синдромов иммунодефицитов [4, 8, 61, 62, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: обследование рекомендовано для исключения нейтропении в составе других ПИДС, а также для проведения дифференциальной диагностики врожденной нейтропении (например, для пациентов с мутацией в гене ELANE характерна гипергаммаглобулинемия, для пациентов с WHIM синдромом и др. характерна гипогаммаглобулинемия).
- Рекомендуется всем пациентам с ВН проведение костномозговой пункции (КМП), с целью оценки морфологического состава костного мозга - при постановке диагноза, и далее 1 раз в год, при необходимости чаще (дебют МДС/ОМЛ) [4, 8, 61, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Костный мозг аспирируется из 2 - 3 анатомических точек. Для пункций используются передние и задние гребни крыльев подвздошных костей. Стернальная пункция вследствие высокого риска повреждения органов грудной клетки, в частности сердца с последующей его тампонадой, у детей ЗАПРЕЩЕНА! У детей в возрасте до года возможно использование для пункции бугристости большеберцовой кости.
При циклической нейтропении пункцию костного мозга проводить во время нейтропенической фазы!!!
- Рекомендуется всем пациентам с ВН проведение цитогенетического исследования (ЦГ) костного мозга, с целью исключения хромосомных перестроек, в том числе и предрасполагающих к развитию МДС - при постановке диагноза, и далее 1 раз в год [4, 8, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется проведение молекулярно-генетического анализа всем пациентам с подозрением на врожденную нейтропению (в зависимости от клинической и лабораторной симптоматики), по Сэнгеру в генах ELANE, WAS, SBDS, при отрицательном результате рекомендовано проведение секвенирование нового поколения (NGS) - таргетная панель или полноэкзомное секвенирование [4, 8, 61, 62, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Фактор наследственности может помочь в установлении диагноза. Например, аутосомно-доминантная мутация в гене ELANE является наиболее часто встречающейся в случае циклической нейтропении и тяжелой врожденной нейтропении. Если ребенок болен и у кого-то из членов семьи уже имеется диагноз ТВН, ассоциированной с мутациями гена ELANE, следует предполагать наличие мутаций в гене ELANE, и их можно выявить в первые месяцы жизни. Напротив, у пациентов с заболеваниями, которые наследуются по аутосомнорецессивному типу, например, ВН вследствие мутаций в генах HAX1, G6PC3, JAGN1, или SBDS, среди прочих, обычно диагноз ВН обнаруживается среди членов семьи впервые. ВН, ассоциированная с мутациями в гене TAZ36 (синдром Барта) или в гене WAS наследуются X-сцеплено. Стандартный подход для детей с тяжелой нейтропенией и "обрывом созревания" в костном мозге, является исследование в гене ELANE, поскольку данные мутации встречаются наиболее часто. Клинические данные, указывающие на синдромальную картину у данного пациента, могут помочь определить, какой именно ген стоит проверить в первую очередь. Например, у новорожденного с нейтропенией также проявляются желудочно-кишечные симптомы - нарушение роста и плохая прибавка в весе (синдром Швахмана-Даймонда), следует провести секвенирование гена SBDS. Подобно этому, у мальчика с нейтропенией, недостаточностью дыхания и симптомами сердечной недостаточности (которые являются признаками синдрома Барта) в первую очередь нужно провести секвенирование гена TAZ или у пациента с тяжелой нейтропенией и аномалиями развития мочеполовой системы или сердца надо провести секвенирование гена G6PC (см. Таблицу Г1).
- Рекомендуется выявление соматических мутации, у пациентов с ТВН, в генах CSF3R, RUNX1, в связи с возможным риском перехода в МДС/ОМЛ [4, 8, 65].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
2.4 Инструментальная диагностика
- Рекомендуется проведение ультразвукового исследования брюшной полости, почек, всем пациентам ВН, с диагностической целью для верификации диагноза или возможного выявления очагов инфекции [8, 61, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется проведение рентгенографии придаточных пазух носа, рентгенография грудной клетки, а также других инструментальных методов исследования только тем пациентам с ВН у кого присутствует соответствующая симптоматика, с целью оценки очагов инфекции и верификации диагноза [2, 8, 61, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
3. Лечение
3.1 Консервативное лечение
Терапия рчГ-КСФ.
- Рекомендуется всем пациентам с врожденной нейтропенией (кроме пациентов с мутацией в CSF3R) назначение препаратов рчГ-КСФ короткого действия для достижения и поддержания абсолютного количества нейтрофилов > 1,0 x 109/л. Препараты рчГ-КСФ, выпускаются в формах ленограстим и филграстим**. Дозировка и кратность введения подбирается индивидуально [4, 8, 61, 62, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Обычно препарат вводится в начальной дозе 5 мкг/кг/сут один раз в день подкожно. При отсутствии ответа примерно каждые 7 дней ежедневная доза увеличивается на 10 мкг/кг/сут до того момента, когда количество нейтрофилов в периферической крови достигнет 1,0 - 1,5 x 109/л. максимально до 100 мкг/кг/сут. Далее возможное изменение интервалов введения препарата (ежедневно, через день, 2 раза в неделю и т.д.). Подобранная доза и режим введения используется длительно (пожизненно), в связи с чем рекомендовано проведение обучение родителей пациента и самого пациента самостоятельному введению рчГ-КСФ.
В случае отсутствия ответа на максимальные дозы рчГКСФ в дозе > 50 мкг/кг/сут, АКН < 0,5 x 109/л, необходимо рассмотреть вопрос о проведении ТГСК (см. ниже)
При циклической нейтропении дозировка препарата в начальной дозе 3 - 5 мкг/кг/сут может вводиться через день, 2 раза в неделю или еженедельно.
Препарат вводится подкожно, рекомендуемые места инъекций - околопупочная область, наружная часть плеча и бедра.
Рекомендуется чередовать места инъекций.
Рисунок 2. Места инъекций и правила введения рчГ-КСФ (ГМКСФ).
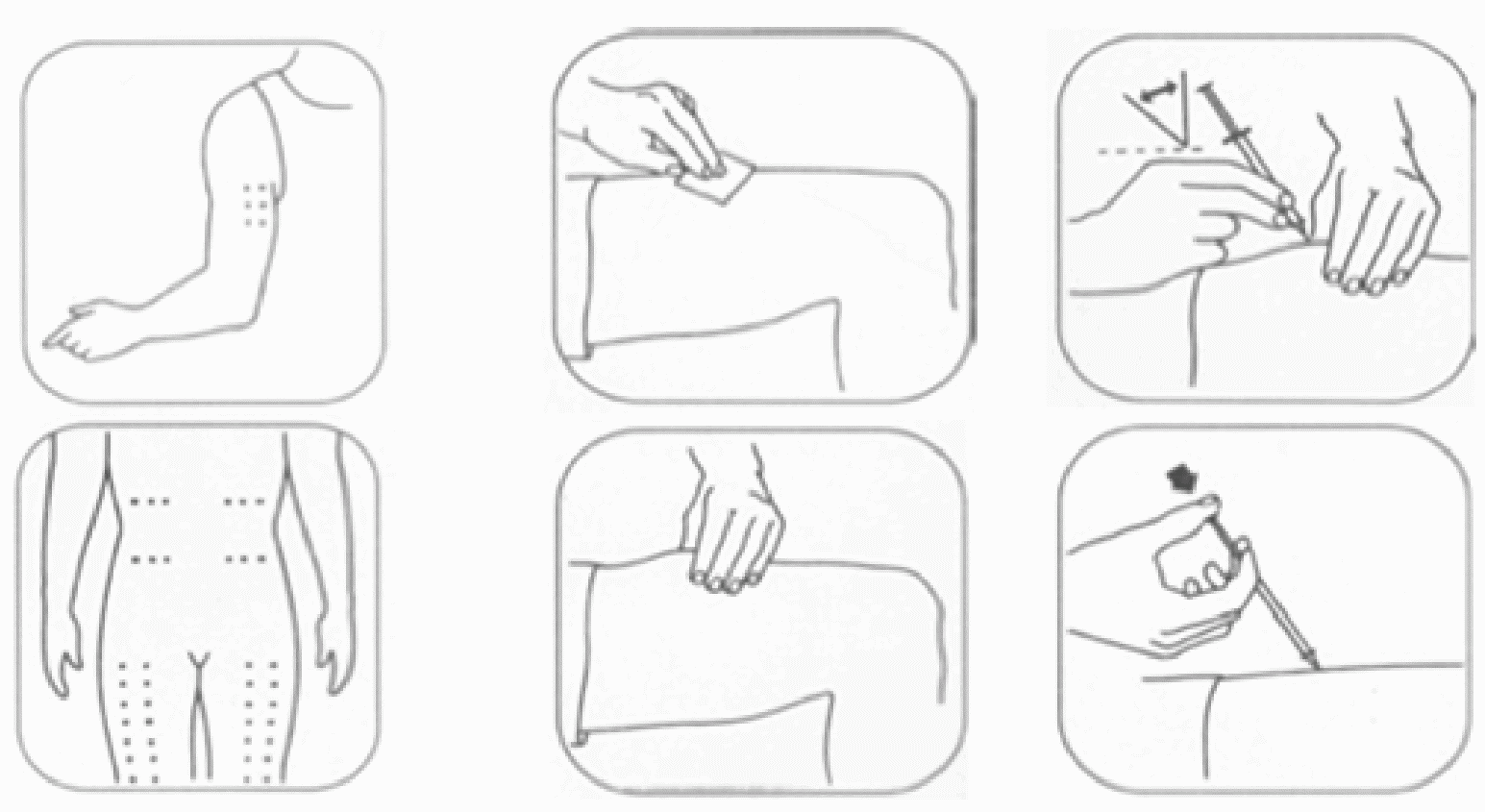
К побочным реакциям относятся гиперемия и болезненность в месте инъекции, повышение температуры, боль в костях и мышцах, боль в животе. Все эти реакции не требуют отмены препарата, однако часто замена одной формы рчГ-КСФ на другую приводит к уменьшению побочных эффектов.
При проведении терапии рекомендовано мониторировать концентрацию нейтрофилов. Во время подбора дозы терапии рчГ-КСФ, ежедневный забор крови. Забор крови производить не ранее чем через 18 часов после введения рчГ-КСФ, при более редком введении - в день инъекции. Такой режим контроля осуществляется в первые 4 - 6 недель лечения или до подбора адекватной дозы рчГ-КСФ. При возникновении инфекции на фоне терапии или без таковой рекомендовано немедленное взятие общего анализа крови с подсчетом лейкоцитарной формулы.
- Терапия ГМ-КСФ рекомендуется пациентам с ТВН имеющим мутацию в гене CSF3R, молграмостимом для достижения и поддержания абсолютного количества нейтрофилов > 1,0 x 109/л [4, 8, 66, 67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: Обычно препарат вводится в начальной дозе 35 мкг/кг/сут один раз в день. При отсутствии ответа примерно каждые 7 дней ежедневная доза увеличивается до 20 мкг/кг/сут. Далее возможное изменение интервалов введения препарата (ежедневно, через день, 2 раза в неделю и т.д.). Подобранная доза и режим введения используется длительно (пожизненно), в связи с чем рекомендовано проведение обучение родителей пациента и самого пациента самостоятельному введению ГМ-КСФ.
При проведении терапии рекомендовано мониторировать концентрацию нейтрофилов. Во время подбора дозы терапии ГМ-КСФ, ежедневный забор крови. Забор крови производить не ранее чем через 18 часов после введения ГМ-КСФ, при более редком введении - в день инъекции. Такой режим контроля осуществляется в первые 4 - 6 недель лечения или до подбора адекватной дозы ГМ-КСФ. При возникновении инфекции на фоне терапии или без таковой рекомендовано немедленное взятие общего анализа крови с подсчетом лейкоцитарной формулы.
- Рекомендуется использование пролонгированного рчГ-КСФ в форме #пэгфилграстим в дозе от 50 до 100 мг/кг/сут 1 раз в 7 - 12 дней у пациентов с ВН находящихся на терапии рчГ-КСФ короткого действия в дозе более 60 мкг/кг/сут ежедневно с сохраняющимся агранулоцитозом [68, 69].
Уровень убедительности рекомендаций B (уровень достоверности 2)
Комментарии: Возможно рассмотреть вопрос о переходе с короткодействующего рчГ-КСФ на пролонгированный рчГ-КСФ при отсутствии адекватного гематологического ответа.
- Рекомендуется пациентам с ВН имеющим недостаточный гематологический ответ на терапию рчГ-КСФ в дозе более 20 мкг/кг/сут, добавить к терапии никотинамид в дозе 20 мг/кг/сут per os ежедневно, длительно [62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендуется назначать пациентам с ВН только при наличии жизнеугрожающей инфекции на фоне агранулоцитоза, отсутствии ответа на терапию рчГ-КСФ (ГМ-КСФ), инфузии донорских гранулоцитов, с целью предотвращения жизнеугрожающих септических состояний [70, 71, 72].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: Гранулоциты изолируются из АВО совместимой крови здоровых доноров. Для мобилизации гранулоцитов как правило используются препараты рчГ-КСФ в дозе 4 - 8 мкг/кг. Гранулоциты выделяются с помощью афереза через 15 - 18 часов после этого. Гранулоциты облучаются и вводятся больному в тот же день в дозе не менее 10 000 кл. Терапия как правило проводится ежедневно или через день до разрешения жизнеугрожающей инфекции.
- Рекомендуется использование профилактической антибактериальной, противогрибковой терапии пациентам с ВН, у которых отмечается отсутствие эффекта от терапии рчГКСФ, а также при наличии хронических очагов инфекции, с целью предотвращения развития тяжелых инфекционных осложнений [4, 8, 62, 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии:
Антибактериальная терапия:
1. Амоксициллин + клавулановая кислота** в дозе 40 мг/кг/сутки в два приема - ежедневно;
2. Азитромицин** 10 мг/кг/сут 1 раз в день - 3 раза в неделю;
3. Ко-тримоксазол** 5 мг/кг/сут по триметоприму в два/три приема - 3 раза в неделю.
Противогрибковая терапия:
1. Флуконазол** 6 мг/кг/сут x 1 раз в день
2. Итраконазол 5 мг/кг/сут x 2 раза в день - по показаниям
На весь период агранулоцитоза
- Рекомендуется проводить трансплантацию гематопоэтических стволовых клеток пациентам с ВН, в следующих случаях:
- Развитие ОМЛ.
- Развитие МДС
- Наличие цитогенетических аномалий с риском развития МДС/ ОМЛ.
- Выявление соматических мутации в генах RUNX1 и CSF3R с риском развития МДС/ОМЛ
- Отсутствие гематологического ответа на рчГ-КСФ в дозе > 50 мкг/кг/сут, АКН < 0,5 x 109/л, у пациентов с тяжелыми инфекционными процессами.
- Наличие прогностически неблагоприятных мутации в гене ELANE (в позиции C151S и G214), сопровождающиеся высоким риском тяжелого течения ВН [4, 8, 62, 73, 74].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Для пациентов с ВН в составе синдромальной патологии вопрос о проведении ТГСК решается индивидуально, с проведением консилиума специалистов, с учетом степени выраженности патологии со стороны других органов и систем, и возможности их коррекции (врожденные пороки сердца, врожденные пороки мочеполовой системы, аномалии костной системы и т.д.).
4. Реабилитация
- Социальная и психологическая реабилитация рекомендована всем пациентам с ВН с целью улучшения качества жизни и возможности социальной адаптации в обществе [4, 8, 77].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии:
Возможность пребывания в организованном коллективе - после подбора дозы и кратности введения рчГ-КСФ (ГМ-КСФ) и поддержания АКН выше 1,5 x 109/л, ограничений для пребывания в детском коллективе нет. 1,5 x 109/л и\или при наличии других иммунологических изменений в составе синдромов вопрос решается индивидуально, при этом учитывается проводимая профилактическая противомикробная терапия и заместительная терапия внутривенными иммуноглобулинами.
- Возможность путешествий, поездок за границу, пребывания в детском оздоровительном лагере - при возможности введения рчГ-КСФ (ГМ-КСФ) в подобранной дозе и поддержания АКН выше 1,5 x 109/л ограничений для путешествий нет. В других случаях ограничения могут быть обусловлены эпидемиологической ситуацией и клинико-лабораторным статусом пациента.
- Возможность нагрузок и занятий спортом - Физические нагрузки не противопоказаны.
- Выбор профессии - при возможности введения рчГ-КСФ (ГМ-КСФ) в подобранной дозе и поддержания АКН выше 1,5 x 109/л ограничений в выборе профессии нет. При невозможности достичь АКН выше 1,5 x 109/л и\или при наличии других иммунологических изменений в составе синдромов вопрос решается индивидуально. Необходимо ограничить пребывания в больших коллективах, а также контакты с возбудителями инфекций (садовничество, воспитатели, педагоги и т.д.).
- Возможность хирургического вмешательства - возможно проведение планового оперативного вмешательства при получении адекватной дозы рчГ-КСФ (ГМ-КСФ) и при АКН более 1,5 x 109/л и/или на фоне упреждающей антибактериальной терапии.
- Возможность ортодонтического лечения - при получении адекватной терапии рчГ-КСФ (ГМ-КСФ) и при АКН более 1,5 x 109/л возможна постановка ортодонтического аппарата, при отсутствии на нем острых краев и шероховатых поверхностей.
5. Профилактика
- Рекомендовано всем пациентам с ВН диспансерное наблюдение педиатра/терапевта по месту жительства с целью оценки состояния здоровья, контроля проводимой терапии, оценки эффективности терапии, после подбора дозы препарата рчГ-КСФ (ГМ-КСФ) [6, 8, 63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендовано диспансерное наблюдение у гематолога или аллерголога-иммунолога всем пациентам с ВН, после подбора индивидуальной дозы и кратности введения препаратов рчГКСФ (ГМ-КСФ), 1 раз в 1 год. При снижении АКН менее 1,0 x 109/л, возникновении тяжелого инфекционного заболевания - чаще. С целью оценки состояния здоровья, контроля проводимой терапии, оценки эффективности терапии, после подбора дозы препарата рчГ-КСФ (ГМ-КСФ) [6, 8, 63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендовано исследование общего анализа крови с подсчетом лейкоцитарной формулы всем пациентам с ВН после подбора индивидуальной дозы и кратности введения препаратов рчГ-КСФ (ГМ-КСФ) 1 раз в месяц, также обязательно проведение исследования перед плановым введением рчГ-КСФ (ГМ-КСФ) [6, 8, 63, 64].
Комментарии: При необходимости исследование проводится чаще (на фоне инфекционного заболевания, немотивированной лихорадки, ухудшения самочувствия).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендовано проведение плановой КМП, ЦГ исследования всем пациентам с ВН находящимся на терапии рчГ-КСФ (ГМКСФ) 1 раз в год, при необходимости чаще [6, 8, 63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Рекомендована терапия препаратами рчГ-КСФ (ГМ-КСФ) всем пациентам с ВН амбулаторно, длительно/пожизненно [6, 8, 63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Больные и члены их семей должны быть обучены навыкам подкожных инъекций и правилам индивидуальной гигиены
- Рекомендовано проведение инструментальных методов исследования (ЭКГ, УЗИ органов брюшной полости, почек, ЭХО-сердца, денситометрия, рентгенография органов грудной клетки, КТ, МРТ) всем пациентам с ВН с целью оценки общего состояния пациента, наличия или отсутствия хронических очагов инфекции [6, 8, 63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии:
- ЭКГ - 1 раз в год
- УЗИ брюшной полости, почки, ЭХО-сердца - 1 раз в год
- Денситометрия - 1 раз в год
- Рентгенография грудной клетки, КТ, МРТ - по показаниям
- Рекомендовано проведение периодических контрольных осмотров специалистами смежных специальностей для всех пациентов с ВН с целью оценки общего состояния здоровья пациентов, в частности для оценки сопутствующей патологии для пациентов с ВН в составе синдромальной патологии [6, 8, 63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии:
- Осмотр врача-хирурга - 1 раз в год
- Осмотр врача-стоматолога - 1 раз в год или по показаниям
- Осмотр врача-отоларинголога - 1 раз в год
- Осмотр врача-кардиолога - 1 раз в год
- Осмотр врача-гастроэнтеролога - 1 раз в год
- Осмотр врача-офтальмолога - 1 раз в год
При наличии синдромальной патологии возможна более частая консультация специалистов, в зависимости от показаний.
- Рекомендовано проведение вакцинации всем пациентам с ВН (детям и взрослым), за исключением пациентов с ВН в составе комбинированных иммунодефицитов, имеющих нарушение гуморального звена иммунитета (при которых вакцинация неэффективна) [8, 62, 75, 76].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Нейтропения не является противопоказанием для вакцинации, вакцинацию следует проводить в соответствии с национальным календарем вакцинации, на фоне стабильного состояния ребенка, отсутствии катаральных проявлений, отсутствии обострения хронических заболеваний. Рекомендовано заменить ОПВ на ИПВ. Противопоказаний для проведения пробы Манту/Диаскин теста нет.
- Рекомендовано всем пациентам с ВН соблюдение правил личной гигиены, во избежание вторичного инфицирования [8].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендовано проводить медико-генетическое консультирование семей и пренатальную/преимплантационную диагностику у всех пациентов с ВН, для ознакомления семьи с возможными рисками рождения ребенка с данной патологией и выявления аналогичных мутаций у плода на максимально ранних сроках беременности. [4, 8, 78].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
6. Дополнительная информация, влияющая на течение и исход заболевания
Использования рчГ-КСФ во время беременности/в период лактации
По данным двух наблюдательных исследований, применение рчГ-КСФ в течение беременности безопасно и хорошо переносится [79, 80]. Также не зафиксировано заметных побочных эффектов для плода. Не было замечено больших различий между исходами беременности и осложнениями у новорожденных детей и у женщин, получавших терапию, по сравнению с не получавшими [80]. Таким образом, рекомендовано продолжение терапии рчГ-КСФ в течение беременности у женщин с ВН.
Использование ГМ-КСФ во время беременности/в период лактации
Безопасность применения ГМ-КСФ при беременности не изучена, поэтому препарат противопоказан к применению при беременности.
7. Организация медицинской помощи
Показания для плановой госпитализации:
1) Плановая КМП + ЦГ исследование;
2) Динамический контроль состояния при хронических очагах инфекции, с целью проведения инструментальных методов исследования, по показаниям (бронхоальвеолярный лаваж, компьютерная томография и т.д.);
3) Подбор дозы и частоты введения рчГКСФ (ГМ-КСФ);
Показания для экстренной госпитализации:
1) Фебрильная лихорадка;
2) Отсутствие ответа на рчГКСФ (ГМ-КСФ) при наличии инфекционного эпизода;
3) Подозрение на развитие онкогематологической патологии;
Показания к выписке пациента из стационара:
1) Стабилизация состояния;
2) Окончание планового обследования;
3) Подбор дозы и кратности введения рчГКСФ (ГМ-КСФ).
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1
Выполнен осмотр врачом гематологом и/или иммунологом
C
4
2
Выполнено определение уровня абсолютного количества нейтрофилов (АКН) в периферической крови
C
4
3
Проведено исследование сывороточных иммуноглобулинов крови (IgG, IgA, IgM)
C
4
4
Проведено цитогенетическое исследование пунктата костного мозга
C
4
5
Проведено молекулярно-генетическое исследование в генах: ELANE, SBDS, WAS. Проведение секвенирование нового поколения (NGS) - таргетная панель или полноэкзомное секвенирование
C
4
6
Проведена терапия рчГ-КСФ короткого действия (ленограстим/филграстим)
C
4
7
Проведена терапия ГМ-КСФ (молграмостим)
C
3
8
Отсутствие гнойно-септических осложнений на момент выписки из стационара
C
4
9
На этапе лечения при отсутствии ответа на терапию рчГ-КСФ, выполнено назначение антибактериальной, противогрибковой терапии с профилактической целью, возможно использование трансфузии гранулоцитов
C
4
10
На этапе лечения при отсутствии ответа у пациента на рчГ-КСФ (ГМ-КСФ), проведена трансплантация гемопоэтических стволовых клеток
B
2
Список литературы
1. Congenital neutropenia in the era of genomics: classification, diagnosis, and natural history/J. Donadieu, B. Beaupain, Odile Fenneteau et al.//British Journal of Haematology. - 2017. - Vol. 179 (4). - P. 557 - 574
2. Congenital neutropenia: diagnosis, molecular bases and patient management/J. Donadieu, O. Fenneteau, B. Beaupain at al.//Orphanet Journal of Rare Diseases. - 2011. - P. 6 - 26.
3. Dale, D.C. Cyclic and chronic neutropenia/D.C. Dale, K. Welte//Cancer Treatmennt and Research. - 2011. - Vol. 157. - P. 97 - 108
4. Sever congenital neutropenias/J. Skokowa, D.C. Dale, K. Welte et al.//Nature Reviews Disease Primers. - 2017. - Vol. 8, N 3. - P. 17032
5. Welte, K. Severe congenital neutropenia/K. Welte, C. Zeidler//Hematoogy/Oncology Clinics of North America. - 2009. - Vol. 23 (2). - P. 307 - 320
6. Практическое руководство по детским болезням. Под ред. В.Ф. Кококлиной и А.Г. Румянцева. Иммунология детского возраста. Под ред. А.Ю. Щербины и Е.Д. Пашанова. Медпрактика - М, 2006: 191 - 197
7. Epidemiology of congenital neutropenia/J. Donadieu, B. Beaupain, N. Mahlaoui, C. Bellanne Chantelot//Hematology/ Oncology Clinics of North America. - 2013. - Vol. 27 (1). - P. 1 - 17.
8. Европейский регистр тяжелой хронической нейтропении. Электронный ресурс. Доступ: http://www.severe-chronic neutropenia.org/forms/Europ_Prot. pdf (http://www.severechronic)
9. Xia, J. Prevalence of mutations in ELANE, GFI1, HAX1, SBDS, WAS and G6PC3 in patients with severe congenital neutropenia/J. Xia, A.A. Bolyard, E. Rodger et al.//British Journal of Hematology. - 2009. - Vol. 147 (4). - P. 535 - 542 (http://www.severe-chronic)
10. Genetic analysis and clinical picture of severe congenital neutropenia in Israel/A. Lebel, J. Yacobovich, T. Krasnov et al.//Pediatric Blood & Cancer. - 2015. - Vol. 62 (1). - P. 103 - 108. (http://www.severe-chronic)
11. Borregaard, N. Severe congenital neutropenia: new lane for ELANE/N. Borregaard//Blood. - 2014. - Vol. 123 (4). - P. 462 - 463 (http://www.severe-chronic)
12. Novel HAX1 mutations in patients with severe congenital neutropenia reveal isoform-dependent genotype-phenotype associations/M. Germeshausen, M. Grudzien, C. Zeidler et al.//(http://www.severe-chronic)Blood. - 2008. - Vol. 111 (10). - P. 4954 - 4957 (https://www.ncbi.nlm.nih.gov/pubmed/18337561)
13. HAX1 mutations causing severe congenital neutropenia and neurological disease lead to cerebral microstructural abnormalities documented by quantitative MRI/K. (https://www.ncbi.nlm.nih.gov/pubmed/18337561)Boztug, X.Q. Ding, H. Hartmann et al.//Am J Medical Genetics A. - 2010. - Vol. 152 (12). - P. 3157 - 3163 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
14. Severe developmental delay and epilepsy in a Japanese patient with severe congenital neutropenia due to HAX1 deficiency/K. Matsubara, K. Imai, S. Okada et al.//Haematologica. - 2007. - Vol. 92 (12). - P. 123 - 125 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
15. HAX1 deficiency causes autosomal recessive severe congenital neutropenia (Kostmann disease)/C. Klein, M. Grudzien, G. Appaswamy et al.//Nature Genetics. - 2007. - Vol. 39. - P. 86 - 92 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
16. GM-CSF stimulates granulopoiesis in a congenital neutropenia patient with loss-of-function biallelic heterozygous CSF3R mutations/M. Klimiankou, O. Klimenkova, M. Uenalan et al.//Blood. - 2015. - Vol. 126 (15). - P. 1865 - 1867 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
17. Novel point mutation in the extracellular domain of the granulocyte colony- stimulating factor (G-CSF) receptor in a case of severe congenital neutropenia hyporesponsive to G-CSF treatment/A.C. Ward, Y.M. van Aesch, J. Gits et al.//Journal of Experimental Medicine. - 1999. - Vol. 214, N 12. - P. 497 - 507 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
18. Inherited biallelic CSF3R mutations in severe congenital neutropenia/A. Triot, P.M. Jrvinen, J.I. Arostegui et al.//Blood. - 2014. - Vol. 123 (24). - P. 3811 - 3817 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
19. Digenic Mutations In Severe Congenital Neutropenia/M. Germeshausen, C. Zeidler, M. Stuhrmann et al.//Haematologica. - 2010. - Vol. 95 (7). - P. 1207 - 1210 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
20. Li, F.Q. Characterization of mutant neutrophil elastase in severe congenital neutropenia/F.Q. Li, M. Horwitz//Joernal Biological Chemhemistry. - 2001. - Vol. 276 (17). - P. 14230 - 14241 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
21. Neutropenia-associated ELANE mutations disrupting translation initiation produce novel neutrophil elastase isoforms/T. Tidwell, J. Wechsler, R.C. Nayak et al.//Blood. - 2014. - Vol. 123 (4). - P. 562 - 569 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
22. Mutations of the ELA2 gene found in patients with severe congenital neutropenia induce the unfolded protein response and cellular apoptosis/D.S. Grenda, M. Marakami, J. Ghatak et al.//Blood. - 2007. - Vol. 110 (13). - P. 4179 - 4187 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
23. Activation of the unfolded protein response is associated with impaired granulopoiesis in transgenic mice expressing mutant Elane/S Nanuna, M. Murakami, J Xia et al.//Blood. - 2011. - Vol. 117 (13). - P. 3539 - 3547 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
24. ELANE mutant-specific activation of different UPR pathways in congenital neutropenia/R. Nustede, M. Klimankou, O. Klimankou et al.//British Journal of Haematology. - 2016. - Vol. 172 (2). - P. 219 - 227 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
25. Neutrophil elastase is severely down-regulated in severe congenital neutropenia independent of ELA2 or HAX1 mutations but dependent on LEF-1/J. Skokowa, J.P. Fobiwe, L. Dan at al.//Blood. - 2009. - Vol. 114. - P. 3044 - 3051 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
26. Dysregulation of transcriptions in primary granule constituents during myeloid proliferation and differentiation in patients with severe congenital neutropenia/H. Kawaguchi, M. Kobayashi, K. Nakamura et al.//JLB Journal of Leukocyte Biology. - 2003. - Vol. 73 (2). - P. 225 - 234 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
27. A lack of secretory leukocyte protease inhibitor (SLPI) causes defects in granulocytic differentiation/O. Klimenkova, W. Ellerbeck, M. Klimiankou et al.//Blood. - 2014. - Vol. 123 (8). - P. 1239 - 1249 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
28. A syndrome with congenital neutropenia and mutations in G6PC3/K. Boztug, G. Appaswamy, A. Ashikov et al.//The New England Journal of Medicine. - 2009. - Vol. 360. - P. 32 - 43 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
29. Heterogeneous expression pattern of pro- and anti-apoptotic factors in myeloid progenitor cells of patients with severe congenital neutropenia treated with granulocyte colonystimulating factor/G. Cario, J. Skokowa, Z. Wang et al.//British Journal of Haematology. - 2005. - Vol. 129 (2). - P. 275 - 278 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
30. Kostmann syndrome: severe congenital neutropenia associated with defective expression of Bcl-2, constitutive mitochondrial release of cytochrome c, and excessive apoptosis of myeloid progenitor cells/G. Carlsson, A. A.G. Aprikyan, R. Tehranchi et al.//Blood. - 2014. - Vol. 103 (9). - P. 3355 - 3361 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
31. Cellular and molecular abnormalities in severe congenital neutropenia predisposing to leukemia/A.A Aprikyan, T. Kutyavin, S Stein et al.//Experimental Hematolology. - 2003. - Vol. 31 (5). - P. 372 - 381 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
32. JAGN1 deficiency causes aberrant myeloid cell homeostasis and congenital neutropenia/K. Boztug,  , E. Salzer et al.//Nature Genetics. - 2014. - Vol. 46. - P. 1021 - 1027 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
, E. Salzer et al.//Nature Genetics. - 2014. - Vol. 46. - P. 1021 - 1027 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
33. G6PC3 mutations are associated with a major defect of glycosylation: a novel mechanism for neutrophil dysfunction/B. Hayee, A. Antonopoulos, E.J. Murphy et al.//Glycobiology. - 2011. - Vol. 21. - P. 914 - 924 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
34. Long-term safety of treatment with recombinant human granulocyte colony-stimulating factor (r-metHuG-CSF) in patients with severe congenital neutropenias/M.A. Bonilla, D. Dali, C. Zeidler et al.//British Journal of Haematology. - 1994. - Vol. 88 (4). - P. 723 - 730 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
35. CCAAT/enhancer binding protein alpha is a regulatory switch sufficient for induction of granulocytic development from bipotential myeloid progenitors/H.S. Radomska, C.S. Huettner, P. Zhang et al.//Molecular and Cellular Biology. - 1998. - Vol. 18 (7). - P. 4301 - 4314 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
36. Rosenbauer, F. Transcription factors in myeloid development: balancing differentiation with transformation/F. Rosenbauer, D.G. Tenen//Nature Reviews Immunoogy. - 2007. - Vol. 7 (2). - P. 105 - 117 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
37. LEF-1 is crucial for neutrophil granulocytopoiesis and its expression is severely reduced in congenital neutropenia/J. Skokowa, G. Cario, M. Uenalan. et al.//Nature Medicine. - 2006. - Vol. 12. - P. 1191 - 1197 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
38. Skokowa, J. Dysregulation of myeloid-specific transcription factors in congenital neutropenia/J. Skokowa, K. Welte//Annals of the NY Academy of Sciences. - 2009. - Vol. 1176. - P. 94 - 100 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
39. Differential regulation of granulopoiesis by the basic helix-loophelix transcriptional inhibitors Id1 and Id2/M. Buitenhuis, H.W. van Deutekom, L.P. Verhagen et al.//Blood. - 2005. - Vol. 105 (11). - P. 4272 - 4281 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
40. Skokowa, J. Defective G-CSFR signaling pathways in congenital neutropenia/J. Skokowa, K. Welte//Hematology/Oncology Clinics of North America. - 2013. - Vol. 27. - P. 75 - 88. (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
41. Increased serum levels of granulocyte colony-stimulating factor in patients with severe congenital neutropenia/K. Mempel, T. Pietsch, T. Menzel et al.//Blood. - 1991. - Vol. 77. - P. 1919 - 922 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
42. Kyas, U. Expression of receptors for granulocyte colony-stimulating factor on neutrophils from patients with severe congenital neutropenia and cyclic neutropenia/U. Kyas, T. Pietsch, K. Welte//Blood. - 1992. - Vol. 79. - P. 1144 - 1147 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
43. Bortezomib inhibits STAT5-dependent degradation of LEF-1, inducing granulocytic differentiation in congenital neutropenia CD34+ cells/K. Gupta, I. Kuznetsova, O. Klimenkova et al.//Blood. - 2014. - Vol. 123 (16). - P. 2550 - 2561 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
44. Interactions among HCLS1, HAX1 and LEF-1 proteins are essential for G-CSF-triggered granulopoiesis/J. Skokowa, M. Klimiankou, O. Klimenkova et al.//Nature Medicine. - 2012. - Vol. 18 (10). - P. 1550 - 1559 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
45. G-CSF receptor activation of the Src kinase Lyn is mediated by Gab2 recruitment of the Shp2 phosphatase/M. Futami, QS Zhu, Z.L. Whichard. et al.//Blood. - 2011. - Vol. 118 (4). - P. 1077 - 1086 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
46. G-CSF-induced tyrosine phosphorylation of Gab2 is Lyn kinase dependent and associated with enhanced Akt and differentiative, not proliferative, responses/Q.S. Zhu, L.J. Robinson, V. Roginskaya, S. Corey//Blood. - 2004. - Vol. 103 (9). - P. 3305 - 3312 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
47. Tidon, N. SH2-containing protein tyrosine phosphatases SHP-1 and SHP-2 are dramatically increased at the protein level in neutrophils from patients with severe congenital neutropenia (Kostmann's syndrome)/N. Tidow, B. Kasper, K. Welte//Experimental Hematollogy. - 1999. - Vol. 27. - P. 1038 - 1045 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
48. NAMPT is essential for the G-CSF-induced myeloid differentiation via a NAD(+)-sirtuin-1-dependent pathway/J. Skokowa, D. Lan, B.K. Thakur et al.//Nature Medicine. - 2009. - Vol. 15 (2). - P. 151 - 158 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
49. Gilman, P.A. Congenital agranulocytosis: prolonged survival and terminal acute leukemia/P.A. Gilman, D.P Jackson, H.G. Guild//Blood. - 1970. - Vol. 36 (5). - P. 576 - 85 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
50. Myelodysplasia syndrome and acute myeloid leukemia in patients with congenital neutropenia receiving G-CSF therapy/M.H. Freedman, M.A. Bonilla, C. Fier C et al.//Blood. - 2000. - Vol. 96 (2). - P. 429 - 36. (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
51. Natural history of Barth syndrome: a national cohort study of 22 patients/C. Rigaud, A.S. Lebre, R. Touraine. et al.//Orphanet Journal of Rare Diseases. - 2013. - Vol. 6. - P. 70 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
52. Mutations in the gene encoding neutrophil elastase in congenital and cyclic neutropenia/D.C. Dale, R.E. Person, A.A. Bolyard et al.//Blood. - 2000. - Vol. 96. - P. 2317 - 2322 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
53. Mutations in neutrophil elastase causing congenital neutropenia lead to cytoplasmic protein accumulation and induction of the unfolded protein response/I. K llner, B. Sodeik, S. Schreek, et al.//Blood. - 2006. - Vol. 108 (2). - P. 493 - 500 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
54. Freedman, M.H. Risk of myelodysplastic syndrome and acute myeloid leukemia in congenital neutropenias/M.H. Freedman, B.P Alter//Semin Hematol. - 2002. - Vol. 39 (21). - P. 128 - 33. Review (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
55. Distinct patterns of mutations occurring in de novo AML versus AML arising in the setting of severe congenital neutropenia/D.C. Link, G. Kunter, Y. Kasai, et al.//Blood. - 2007 - Vol. 110. - P. 1648 - 1655 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
56. Cooperativity of RUNX1** and CSF3R mutations in severe congenital neutropenia: a unique pathway in myeloid leukemogenesis/J. Skokowa, D. Steinemann, J.E. Katsman-Kuipers et al.//Blood. - 2014. - Vol. 123. - P. 2229 - 2237 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
57. Two cases of cyclic neutropenia with acquired CSF3R mutations, with 1 developing AML/M. Klimiankou, S. Mellor-Heineke, O. et al.//Blood. - 2016. - Vol. 127. - P. 2638 - 2641. (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
58. The persity of mutations and clinical outcomes for ELANE-associated neutropenia/V. Makaryan, C. Zeidler, A.A. Bolyard et al.//Curr Opin Hematol. - 2015. - Vol. 22 (1). - P. 3 - 11 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
59. Severe chronic neutropenia: treatment and follow-up of patients in the Severe Chronic Neutropenia International Registry/D.C. Dale, T.E Cottle, C.J. Fier et al.//Am J of Hematology. - 2003. - Vol. 72 (2). - P. 82 - 93 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
60. Bohn, G. Severe congenital neutropenia: new genes explain an old disease/G. Bohn, K. Welte, C. Klein//Curr Opin Rheumatol. - 2007. - Vol. 19 (6). - P. 644 - 650 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
61. Финогенова Н.А., Мамедова Е.А., Половцева Т.В. и др. Критерии диагностики и прогноза нейтропений у детей. Методические рекомендации. Москва 1995 г. (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
62. Е.А. Деордиева/Стратегия терапии детей с врожденной нейтропенией в зависимости от клинических и молекулярно-генетических особенностей//Диссертационная работа на соискание ученой степени кандидата медицинских наук. - 2018 г. (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
63. Деордиева, Е.А. Нейтропения в практике детского гематолога/онколога/Е.А. Деордиева, А.Ю. Щербина//Онкогематология. - 2015. - N 1. - С. 46 - 52 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
64. Краткие рекомендации по ведению больных с синдромом Швахмана-Даймонда/М.Г. Ипатова, С.И. Куцев, П.В. Шумилов, Ю.Г. Мухина, Н.А. Финогенова, С.И. Полякова, Е.Ю. Захарова, А.Ю. Щербина, Е.А. Деордиева и др.//Педиатрия. Журнал им. Г.Н. Сперанского. - 2016. - N 6. - С. 181 - 186 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
65. Генетические предикторы неблагоприятного течения тяжелой врожденной нейтропении у пациентов с мутацией в гене ELANE/Е.А. Деордиева, Т.В. Варламова, Е.В. Райкина, А.Ю. Щербина//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2016. - N 1. - С. 41 - 45 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
66. GM-CSF stimulates granulopoiesis in a congenital neutropenia patient with loss-of-function biallelic heterozygous CSF3R mutations/M. Klimiankou, O. Klimenkova, M. Uenalan et al.//Blood. - 2015. - Vol. 126. - P. - 1865 - 1867 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
67. Management of a Patient With Congenital Biallelic CSF3RMutation With GM-CSF/D.Y. Karapinar,  , B. Akinci//Journal of Pediatric Hematology/Oncology. Publish Ahead of Print, NOV 2018 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
, B. Akinci//Journal of Pediatric Hematology/Oncology. Publish Ahead of Print, NOV 2018 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
68. Long-term use of pegfilgrastim in children with severe congenital neutropenia: clinical and pharmacokinetic data/Francesca Fioredda, Tiziana Lanza, Federica Gallicola//Blood. - 2016 - Vol. 128. - P. 2178 - 2181 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
69. Is pegfilgrastim safe and effective in congenital neutropenia? An analysis of the French Severe Chronic Neutropenia registry/B. Beaupain, T. Leblanc, O. Reman et al.//Pediatric Blood & Cancer.2009. - Vol. 53 - P. 1068 - 1073 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
70. Administration of G-CSF plus dexamethasone produces greater granulocyte concentrate yields while causing no more donor toxicity than G-CSF alone/D.F. Stroncek, Y.Y. Yau, J. Oblitas, S.F. Leitman//Transfusion. - 2001. - Vol. 41. - P. 1037 - 1044 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
71. Effect and safety of granulocyte transfusions in pediatric patients with febrile neutropenia or defective granulocyte functions/D. Atay, G. Ozturk, A. Akcay et al.//Journal of Pediatric Hematology/Oncology. - 2011. - Vol. 33 (6). - P. 220 - 225 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
72. Berliner, N. Congenital and Acquired Neutropenia/N. Berliner, M. Horwitz, T.P. Loughran Jr.//ASH Education Book. - 2004. - Vol. 2004 (1). - P. 63 - 79 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
73. Stem cell transplantation in severe congenital neutropenia: an analysis from the European Society for Blood and Marrow Transplantation/F. Fioredda, S. Iacobelli, B. Gaspar et al.//Blood. - 2015. - Vol. 126. - P. 1885 - 1892 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
74. Hematopoietic stem cell transplantation for severe congenital neutropenia/J.A. Connelly, S.W. Choi, J.E. Levine et al.//Current Opinion Hematology. - 2012. - Vol. 19 (1). - P. 44 - 51 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
75. Weber D.J. Immunization of immunocompromised persons./Weber D.J., Rutala W.A.//Immunol Allergy Clin North Am 2003; 23(4): 605 - 34 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
76. Centers for Disease Control and Prevention. General Recommendations on Immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2011; 60(RR-02): 1 - 61 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
77. Стратегия медико-психолого-социальной реабилитации детей с гематологическими и онкологическими заболеваниями./Н.Н. Володин, В.Н. Касаткин, Г.Я. Цейтлин и др.//Онкогематология. - 2015 - Т. 1 - С. 7 - 15 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
78. Молекулярно-генетическая диагностика первичных иммунодефицитных состояний./Кузьменко Н.Б., Варламова Т.В., Мерсиянова И.В. и др.//Вопросы гематологии\онкологии и иммунопатологии в педиатрии. - 2016 - Т15(1) - С. 10 - 16 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
79. Zeidler, C. et al. Outcome and management of pregnancies in severe chronic neutropenia patients by the European Branch of the Severe Chronic Neutropenia International Registry. Haematologica - 2014 - Vol. 99 - P. 1395 - 1402 (http://www.ncbi.nlm.nih.gov/pubmed/?term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
80. Use of granulocyte colony-stimulating factor during pregnancy in women with chronic neutropenia./Boxer, L. A. et al.//Obstet. Gynecol. - 2015 - Vol. 125 - P. 197 - 203 (http://www.ncbi.nlm.nih.gov/pubmed/? term=Boztug%20K%5BAuthor%5D&cauthor=true&cauthor_uid=21108402)
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Деордиева Екатерина Анатольевна - кандидат медицинских наук, член Национальной ассоциации экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член международного регистра SCNIR.
2. Румянцев Александр Григорьевич - доктор медицинских наук, профессор, академик РАН, президент Национальной ассоциации экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества гематологов.
3. Щербина Анна Юрьевна - доктор медицинских наук, профессор РАН, исполнительный директор Национальной ассоциации экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества иммунодефицитов.
4. Латышева Татьяна Васильевна - доктор медицинских наук, профессор, член президиума Российской ассоциации аллергологов и клинических иммунологов.
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. врач-гематолог
2. врач аллерголог-иммунолог
3. врач-педиатр
4. врач-терапевт
5. Врач общей практики (семейный врач)
Таблица П1 - Уровни достоверности доказательств
Уровень достоверности
Источник доказательств
I (1)
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных
Крупные мета-анализы
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
II (2)
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Хорошо организованные исследования "случай-контроль"
III (3)
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
IV (4)
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
Таблица П2 - Уровни убедительности рекомендаций
Уровень убедительности
Описание
Расшифровка
A
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
B
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений
C
Рекомендация основана на слабом уровне доказательности
(но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или
нет убедительных данных ни о пользе, ни о риске)
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов
D
Отсутствие убедительных публикаций I, II или III уровня доказательности,
показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности,
показывающие значительное превосходство риска над пользой
Не рекомендовано
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи
КР337. Болевой синдром (БС) у детей, нуждающихся в паллиативной медицинской помощи
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
unde ned
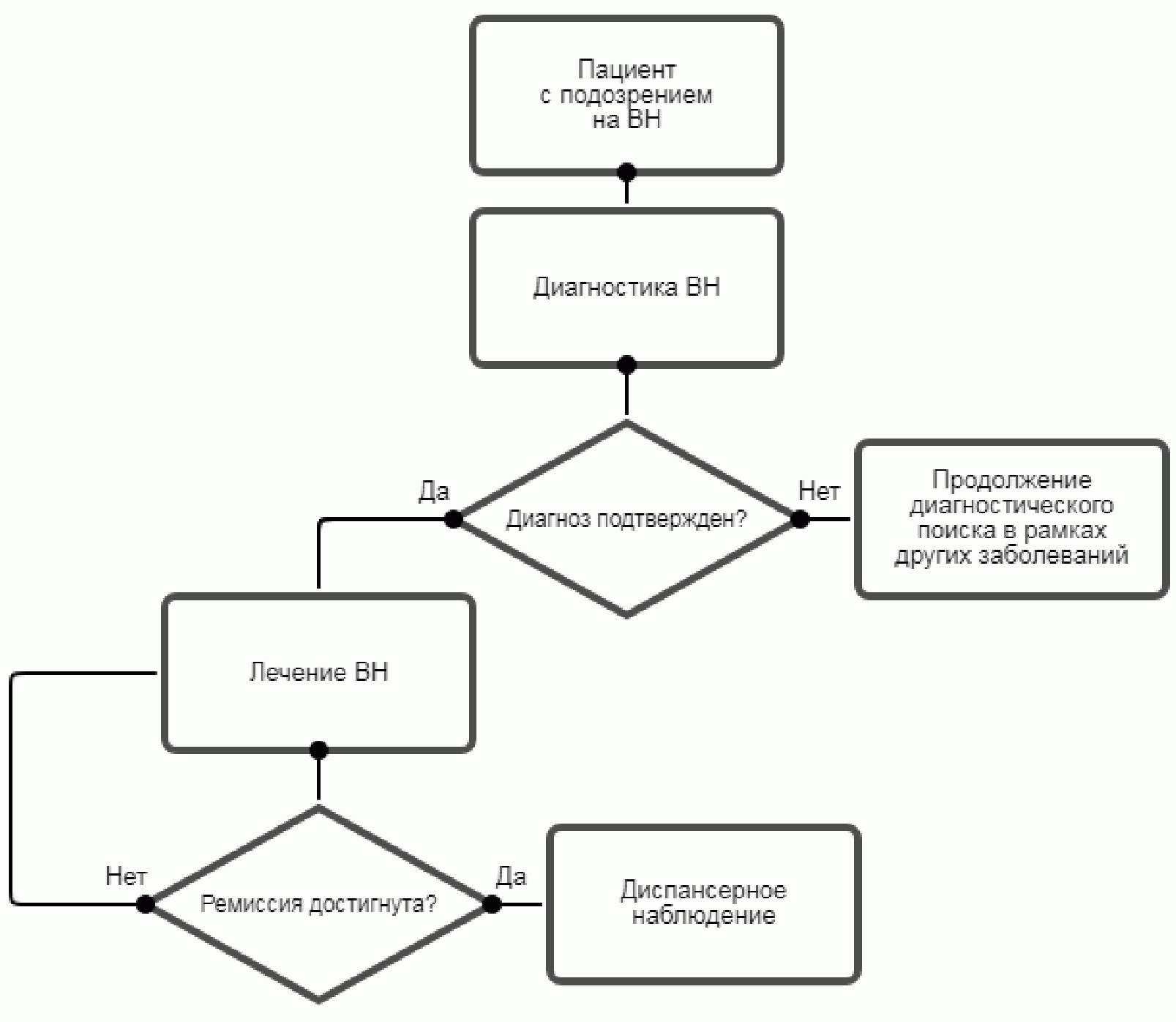
Алгоритм ведения пациента с врожденной нейтропенией
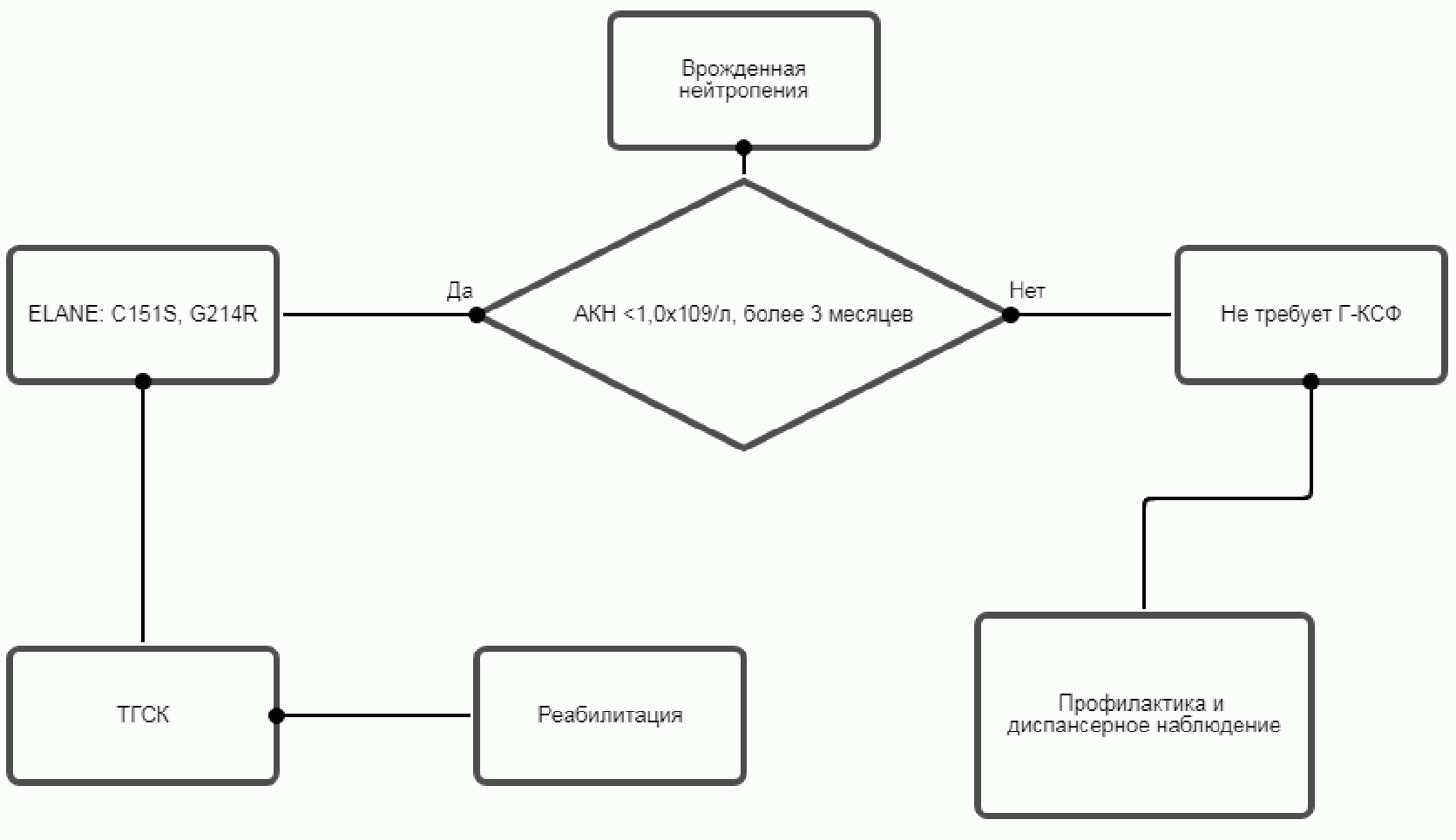
Алгоритм ведения пациента с врожденной нейтропенией

Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Термин нейтропения описывает ситуацию, когда количество нейтрофилов в крови слишком мало (у детей до года менее 1,0 x 109/л, у детей старше года и взрослых менее 1,5 x 109/л). Нейтрофилы очень важны для борьбы с бактериальными инфекциями, следовательно, пациент с низким количеством нейтрофилов может быть подвержен частым бактериальным инфекциям (гнойный отит, омфалит, стоматиты, гингивит, пневмонии, сепсис и менингит).
Врожденные нейтропении (ВН) - группа редких, генетически обусловленных заболеваний, характеризующихся глубокой нейтропенией (агранулоцитозом), осложненной тяжелыми, подчас смертельными инфекциями, с или без других (синдромальных) проявлений
Аутосомно-доминантная ВН обусловлена мутацией в гене ELANE. Это наиболее часто встречаемая мутация, приблизительно в 60 - 70% случаев тяжелой врожденной нейтропении. Одна из ее разновидностей - Циклическая нейтропения (ЦН). ЦН отличается периодичностью снижения нейтрофилов: во время 3 - 5-дневной нейтропенической фазы АКН снижается до уровня 0,2 x 109/л, а в оставшееся время восстанавливается до нормы. Клинически ЦН протекает более благоприятно, инфекции возникают, как правило, только во время нейтропенической фазы. При аутосомно-рецессивном типе наследования встречаются более редкие мутации в генах: HAX1, G6PC3, VPS45, JAGN1. Также встречается X-сцепленная ТВН. При врожденной нейтропении с аутосомно - доминантным типом наследования и при циклической нейтропении риск развития заболевания у ребенка составляет 50%. При врожденной нейтропении с аутосомно - рецессивным типом наследования риск развития заболевания у ребенка составляет 25%.
В связи с чем рекомендовано проведении перинатальной диагностики при планировании следующей беременности.
Для диагностики ВН проводится основные исследования: общий анализ крови с лейкоцитарной формулой, пункция костного мозга, цитогенетическое исследование костного мозга, с целью верификации диагноза проводится молекулярно-генетическое исследование. В последующем костномозговая пункция и цитогенетическое исследование проводится ежегодно.
Все больные с врожденной нейтропенией, в связи с риском развития тяжелых жизнеугрожающих инфекций нуждаются в терапии препаратами гранулоцитарного колониестимулирующего фактора рекомбинантного (рчГ-КСФ). Пациенты с мутацией в гене CSF3R нуждаются в терапии макрофагальным гранулоцитарным колониестимулирующим фактором (ГМ-КСФ). Препарат вводится подкожно, в индивидуально подобранной дозе. Рекомендуемые места инъекций - околопупочная область, наружная часть плеча и бедра (рисунок 1). Рекомендуется чередовать места инъекций.
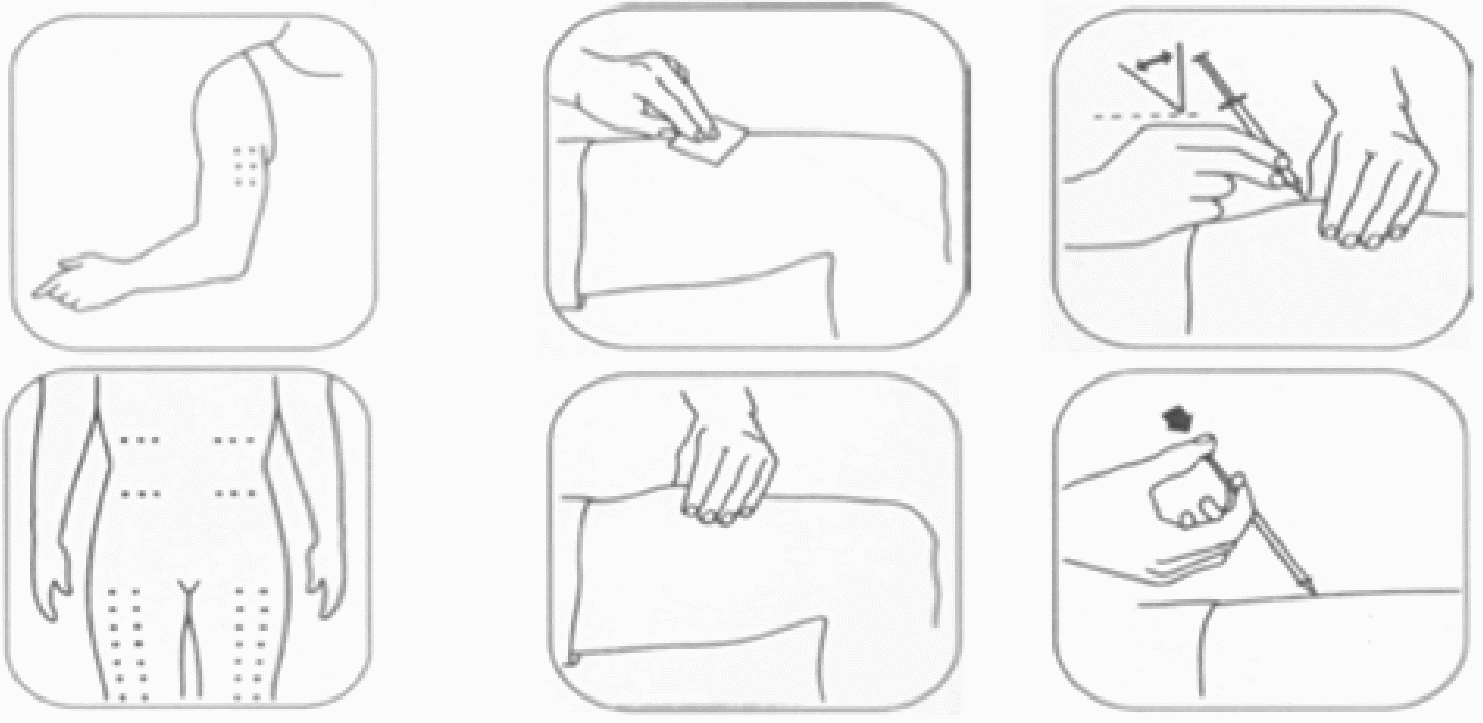
Рисунок 2. Места инъекций и правила введения рчГ-КСФ (ГМ-КСФ).
Как только подобрана доза рчГ-КСФ (ГМ-КСФ) пациенты могут вести нормальный образ жизни, в том числе посещать детские учреждения, заниматься активно спортом.
Альтернативным методом лечения является трансплантация гемопоэтических стволовых клеток (ТГСК). Данная терапия показана пациентам в следующих случаях:
- Развитие ОМЛ.
- Развитие МДС
- Наличие цитогенетических аномалий с риском развития МДС\ОМЛ.
- Выявление соматических мутаций в генах RUNX1 и CSF3R с риском развития МДС\ОМЛ
- Отсутствие гематологического ответа на рчГ-КСФ в дозе > 50 мкг/кг/сут, АКН < 0,5 x 109/л, у пациентов с тяжелыми инфекционными процессами.
- Наличие прогностически неблагоприятных мутаций в гене ELANE (в позиции C151S и G214), сопровождающиеся высоким риском тяжелого течения ВН
Также немаловажную роль в поддержании пациента является соблюдение правил личной гигиены и гигиены полости рта.
Требования к соблюдению пациентами правил личной гигиены:
1. Тщательное, не менее 15 минут, мытье рук (намыливать тыльную, ладонную поверхность и межпальцевые промежутки). Вытирать руки до того, как закрыть кран с водой.
2. Ежедневное мытье под душем.
3. При образовании ран, порезов, мацераций - обработка мест ранений раствором бриллиантовой зелени.
4. Тщательный, но щадящий уход за зубами и деснами; использование только мягких зубных щеток; для лучшего очищения межзубных промежутков использовать специальные "скользкие и плоские" зубные нити.
5. При возникновении афт во рту: 4 раза в день полоскание полости рта дезинфицирующими растворами, 1 - 2 раза в день обработка полости рта вяжущими средствами, при дефектах слизистой полости рта исключить использование зубных щеток и нитей.
6. Питание: использование пищи, прошедшей термическую обработку. Для питья использовать только бутилированную или кипяченую воду
7. Обязательная личная гигиена родителей и посетителей, исключение контактов с инфекционными больными, исключение посещения людных мест.
8. Избегать употребление ректальных свечей, у девушек использование гигиенических прокладок вместо тампонов.
Приложение Г
Таблица Г1. Врожденные нейтропении, распределение в зависимости от типа мутации, с описанием сопутствующей патологии и другими гематологическими нарушениями, помимо нейтропении [4].
Название гена с мутацией
Заболевание
Другие гематологические нарушения
Не гематологические нарушения
Аутосомно-доминантный тип наследования
ELANE
Тяжелая врожденная нейтропения
Моноцитоз, эозинофилия и развитие ОМЛ/МДС
Остеопения
ELANE
Циклическая нейтропения
Циклический гемопоэз и развитие ОМЛ/МДС
Нет
GFI1
тяжелая врожденная нейтропения
Лимфоцитопения и повышенное количество незрелых миелоидных клеток в периферическом кровотоке и развитие ОМЛ/МДС
Нет
GATA2
Врожденная нейтропения
Тяжелая моноцитопения, недостаток дендритных клеток и естественных киллеров, апластическая анемия и развитие нейтропении в ОМЛ/МДС
<...>
TCIRG1
Врожденная нейтропения
Нет
<...>
CXCR4
WHIM-синдром
Дефект B-клеток и гипогаммаглобулинемия
Кожные па<...>
Аутосомно-рецессивное наследование
HAX1
Тяжелая врожденная нейтропения
Развитие ОМЛ/МДС
<...>
JAGN1
Тяжелая врожденная нейтропения
Развитие ОМЛ
<...>
G6PC3
Тяжелая врожденная нейтропения
Тромбоцитопения и развитие ОМЛ/МДС
<...>
SLC37A4
Болезнь накопления гликогена тип Ib
Развитие ОМЛ/МДС
<...>
SBDS
Синдром Швахмана-Даймонда
Тромбоцитопения, анемия, апластическая анемия и развитие ОМЛ/МДС
<...>
STK4
Врожденная нейтропения
Моноцитопения и T- и B-клеточная лимфоцитопения
<...>
CLPB
3-метилглутаконовая ацидурия тип VII
Развитие ОМЛ или МДС
<...>
AP3B1
Синдром Германского-Пудлака 2 типа
Нарушенная функция T-лимфоцитов и естественных киллеров
<...>
LAMTOR2
Недостаток белка р14
Накопление нейтрофилов в костном мозге, нарушение цитотоксичности, иммунодефицит
<...>
USB1
Пойкилодермия по типу Clericuzio
Нет
<...>
VPS13B
Синдром Коэна
Нет
<...>
VPS45
Тяжелая врожденная нейтропения![]()
Анизоцитоз и пойкилоцитоз, гипергаммаглобулинемия, почечный экстрамедуллярный гематопоэз, фиброз костного мозга, прогрессирующая анемия и тромбоцитопения
<...>
CXCR2
Врожденная нейтропения
Миелокатексис вследствие нарушения высвобождения нейтрофилов из костного мозга в периферический кровоток
Нет
EIF2AK3
Синдром Уолкотта-Раллисона
Нет
<...>
LYST
Синдром Чедиака-Хигаши
Нарушение функции естественных киллеров, лизосомные тельца включения в миелобластах, промиелоцитах и гранулоцитах, активация макрофагов и лимфопролиферативный синдром
<...>
RAB27A
Синдром Грисцелли 2 типа
Нарушение цитотоксичности, гипогаммаглобулинемия, тромбоцитопения, анемия и гемофагоцитарный сидндром
<...>
AK2
Недостаток аденилат-киназы 2
Тяжелая лимфоцитопения
<...>
RMRP
Гипоплазия хрящей и волос (синдром Мак Кьюсика)
Иммунодефицит и анемия
<...>
TCN2
Недостаточность транскобаламина II
Мегалобластная анемия и панцитопения
<...>
Смешанно-аутосомные типы наследования§
CSF3R
Тяжелая врожденная нейтропения![]()
Нет
Нет
X-сцепленное наследование
WAS
X-сцепленная тяжелая врожденная нейтропения
Моноцитопения, лимфоцитопения, снижение IgA, сниженное количество естественных киллеров, подавление активности фагоцитов и развитие ОМЛ/МДС
Нет
TAZ
Синдром Барта
Нет
<...>
CD40LG
Гипер-IgM синдром
Комбинированный иммунодефицит; недостаток T-, B- и дендритных клеток, нарушение переключения классов B-лимфоцитов, значительно снижена концентрация IgA, IgG и IgE, однако нормальная или повышенная концентрация IgM, сниженные функции эффектора макрофагов
<...>
Митохондриальный тип наследования
Делеция митохондриальной ДНК
Синдром Пирсона
Не поддающаяся лечению сидеробластная анемия и вакуолизация костномозговых клеток-предшественников и макрофагов
<...>
![]() Плохой ответ или его отсутствие на рчГ-КСФ у некоторых пациентов.
Плохой ответ или его отсутствие на рчГ-КСФ у некоторых пациентов.
§ Доминантный, гомозиготный рецессивный или смешанный гетерозиготный рецессивный тип наследования.
![]() Отсутствие ответа на рчГ-КСФ, хороший ответ на гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ).
Отсутствие ответа на рчГ-КСФ, хороший ответ на гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ).
