"Клинические рекомендации "Миокардиты"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
МИОКАРДИТЫ
МКБ 10: I40.0/I40.1/I40.8/I40.9/I41.0/I41.1/I41.2/I41.8/I51.4
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
ID: КР153
URL
Профессиональные ассоциации
- Национальное общества по изучению сердечной недостаточности и заболеваний миокарда
Ключевые слова
- Миокардит
- Воспалительная кардиомиопатия
- Сердечная недостаточность
- Эндомиокардиальная биопсия
Список сокращений
БЛНПГ - блокада левой ножки пучка Гиса
БМКР - блокаторы минералкортикоидных рецепторов
БРА - блокаторы рецепторов ангиотензина II
ВКМП - воспалительная кардиомиопатия
ГКМП - гипертрофическая кардиомиопатия
ДКМП - дилатационная кардиомиопатия
ДНК - дезоксирибонуклеиновая кислота
ИАПФ - ингибиторы ангиотензинпревращающего фермента
ИБС - ишемическая болезнь сердца
ИКД - имплантируемый кардиовертер-дефибриллятор
КАГ - коронароангиография
КАР - коксаки-аденовирусный рецептор
КМЦ - кардиомиоцит
КФК - креатинфосфокиназа
ЛЖ - левый желудочек
ЛП - левое предсердие
МЖП - межжелудочковая перегородка
МКБ-10 - Международная классификация 10 пересмотра
МРТ - магнитно-резонансная томография
НОИСН - национальное общество по изучению сердечной недостаточности и заболеваний миокарда
НПВС - нестероидные противовоспалительные препараты
НРС - нарушение ритма сердца
НУП - натрийуретический пептид
ПЦР - полимеразно-цепная реакция
РКИ - рандомизированные контролируемые исследования
РНК - рибонуклеиновая кислота
СН - сердечная недостаточность
СОЭ - скорость оседания эритроцитов
СРБ - C-реактивный белок
СРТ - сердечная ресинхронизирующая терапия
СРТ - сердечная ресинхронизирующая терапия
ФВ - фракция выброса
ФВЛЖ - фракция выброса левого желудочка
ФК - функциональный класс
ФП - фибрилляция предсердий
ХСН - хроническая сердечная недостаточность
ЭКГ - электрокардиография
ЭКС - электрокардиостимулятор
ЭМБ - эндомиокардиальная биопсия
ЭХОКГ - эхокардиография
BNP - мозговой натрийуретический пептид
DAF - decay-accelerating factor
NT-proBNP - N-терминальный фрагмент натрийуретического пропептида мозгового
NYHA - New York Heart Association
** - препараты, входящие в список жизненно необходимых и важнейших лекарственных препаратов
Термины и определения
Миокардит - воспалительное поражение миокарда, вызванное инфекционными, токсическими или аллергическими воздействиями.
Воспалительная кардиомиопатия (ВКМП) - миокардит, приводящий к дисфункции сердца.
Дилатационная кардиомиопатия (ДКМП) - это заболевание, сопровождающееся дилатацией и нарушением функции левого или обоих желудочков.
Магнитно-резонансная томография (МРТ) с контрастированием - высокотехнологичный неинвазивный визуализирующий метод диагностики с применением контрастного препарата на основе хелатов гадолиния, который позволяет выявить воспаление, повреждение и фиброзные изменения в миокарде у больных с миокардитом, ВКМП, ДКМП. Иммуногистохимический метод - это метод морфологической диагностики, в основе которого лежит визуализация и оценка с помощью микроскопа результатов реакции антиген-антитело непосредственно в гистологических срезах.
Полимеразно-цепная реакция (ПЦР) - высокоточный метод молекулярно-генетической диагностики, который позволяет непосредственно выявить присутствие возбудителя (специфического участка дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК) возбудителя) в исследуемом образце.
Эндомиокардиальная биопсия (ЭМБ) - это инвазивная процедура, которая позволяет получить прижизненные образцы эндокарда и миокарда.
1. Краткая информация
1.1 Определение
Согласно мнению экспертов Рабочей группы по болезням миокарда и перикарда Европейского общества кардиологов (2013 г.) в настоящее время следует использовать существующие определения миокардита и кардиомиопатии, которые представлены в таблице 1.
Таблица 1 - Определения нозологических единиц
Нозологическая единица
Определение
Признаки
Миокардит [1]
Воспалительное заболевание миокарда, определяемое по установленным гистологическим, иммунологическим и иммуногистохимическим критериям
Далласские морфологические критерии:
доказательства наличия воспалительного инфильтрата в пределах миокарда, ассоциированного с дегенерацией и некрозом миоцитов неишемического генеза.
Иммуногистохимические критерии:
наличие >= 14 лейкоцитов/мм2, в том числе до 4 моноцитов/мм2 в наличием CD3 положительных T-лимфоцитов >= 7 клеток/мм2
Воспалительная кардиомиопатия [1]
Миокардит, ассоциированный с дисфункцией миокарда
Гистологические и иммуногистохимические критерии такие же как при миокардите. Необходимо наличие систолической и/или диастолической дисфункции.
Дилатационная кардиомиопатия
Клиническая форма, характеризующаяся развитием дилатации и нарушением сократительной функции левого или обоих желудочков, которые не могут быть объяснены ишемической болезнью сердца или повышенной нагрузкой.
Дилатация левого или обоих желудочков сердца и снижение их сократительной способности.
1.2 Этиология и патогенез
Этиология миокардитов самая разнообразная. Он может быть вирусным (аденовирус (A1, 2, 3, 5), пикорнавирус (Коксаки вирус A/B, эховирус), цитомегаловирус, эритровирусы (парвовирус B19 (PVB19)), вирус гепатита C, вирус гриппа (1, 2), вирус иммунодефицита человека, вирус герпеса (вирус Эпштейн - Барр, герпес вирусы 1, 2, 6 типа), смешанные инфекции), бактериальным, грибковым, протозойным, паразитарным, токсическим, аллергическим, аутоиммунным [2, 3]. Вирусы являются наиболее частым этиологическим фактором, вызывающим миокардит [4]. В таблице 2 представлены основные этиологические факторы миокардитов [5].
Таблица 2 - Основные этиологические факторы миокардитов (Рабочая группа по миокардитам и перикардитам Европейского общества кардиологов, 2013 г.)
Этиологический фактор
Характеристика
1. Инфекционный
Бактериальные
Staphylococcus spp., Streptococcus spp, в т.ч., Streptococcus pneumoniae, Neisseria meningitidis, Neisseria gonorrhoeae, Salmonella spp., Corynebacterium diphtheriae, Haemophilus influenzae, Mycobacterium tuberculosis, Mycoplasma pneumoniae, Brucella spp.
Спирохеты
Borrelia burgdorferi (болезнь Лайма),
Leptospira icterohemorrhagica (болезнь Вейля)
Грибы
Aspergillus spp, Actinomyces spp, Blastomyces spp., Candida spp., Coccidioides spp., Cryptococcus spp., Histoplasma spp., Mucor spp., Nocardia spp., Sporothrix spp.
Протозоозы
Trypanosoma cruzi, Toxoplasma gondii, Entamoeba, Leishmania
Паразитарные
Trichinella spiralis, Echinococcus granulosus, Taenia solium
Риккетсии
Coxiella burnetii (Q-лихорадка), Rickettsia rickettsii (пятнистая лихорадка Скалистых гор), Rickettsia tsutsugamuschi
Вирусы
РНК вирусы: коксаки A и B, Вирус ECHO, полиовирус, вирусы гриппа A и B, PC-вирус, эпидемического паротита, кори, краснухи, гепатита C, вирус Денге, вирус желтой лихорадки, вирус Чикунгунья, вирус Хунин, вирус лихорадки Ласса, бешенства, вирус иммунодефицита человека-1 (ВИЧ-1)
ДНК-вирусы: аденовирусы, парвовирус - B19, цитомегаловирус, герпес 6 типа, Эпштейн-Барр вирус, вирус ветряной оспы, вирус простого герпеса (ВПГ), вирус натуральной оспы, вирус коровьей оспы
2. Иммуноопосредованный
Аллергены
Столбнячный анатоксин, сывороточная болезнь, вакцины; лекарственные препараты: пенициллин, цефаклор, колхицин, фуросемид, изониазид, лидокаин, тетрациклин, сульфаниламиды, фенитоин, фенилбутазон, метилдопа, тиазидные диуретики, амитриптилин
Аллоантигены
Отторжение трансплантата сердца
Аутоантигены
Неинфекционный лимфоцитарный миокардит. Неинфекционный гигантоклеточный миокардит. Ассоциированные с аутоиммунными или иммуноопосредованными заболеваниями (системная красная волчанка, ревматоидный артрит, синдром Черджа-Стросса, Болезнь Такаясу, болезнь Кавасаки, болезнь Крона, склеродермия, полимиозит, миастения, инсулинзависимый диабет, тиреотоксикоз, саркоидоз, гранулематоз Вегенера, ревматизм (ревматическая лихорадка)
3. Токсический
Лекарственные
Амфетамины, антрациклины, кокаин, циклофосфамид, этанол, фторурацил, литий, катехоламины, интерлейкин-2, трастузумаб, клозапин
Тяжелые металлы
Медь, железо, свинец (редко, чаще накопление внутри кардиомиоцитов)
Разное
Укусы насекомых, змей, скорпионов, отравление мышьяком, угарным газом
Гормоны
Феохромоцитома, авитаминоз B1
Физические
Радиация, электрошок
Современное представление о патогенезе вирусного и аутоиммунного миокардита сформировано на основании экспериментальных данных. Фундаментальные экспериментальные исследования были выполнены на мышах. В качестве инфекционного агента использован вирус Коксаки типа B [6 - 9].
Jay W. Mason и соавт., предложили выделять в развитии миокардита три фазы. Деление на фазы не является догмой, в каждую из трех фаз может преобладать тот или иной патогенетический механизм развития заболевания (рис. 1) [10].
Рис. 1. Схема стадийности развития миокардита (J.W. Mason et al., 2003)
В первую фазу в результате проникновения вирусов путем эндоцитоза через специфические рецепторы внутрь КМЦ происходит активизация защитных механизмов, направленных на сдерживание попадания вирусов в другие, неповрежденные миоциты. Таким образом, проникнув в КМЦ вирусы реплицируются и вызывают миоцитолиз и активизацию синтеза микро-РНК, что в свою очередь приводит к апоптозу и некрозу [10]. В результате прямого цитопатического действия вирусов происходит выход внутриклеточных антигенов и активируется иммунная система. В итоге, развивается воспалительная клеточная инфильтрация (T-киллеры, макрофаги, нейтрофилы). Первая фаза заболевания завершается элиминацией вирусов при адекватном иммунном ответе или переходом во вторую - вторичное аутоиммунное повреждение КМЦ. Рис. 1. Схема стадийности развития миокардита (J.W. Mason et al., 2003)
Экспериментальная Коксаки-вирус индуцированная мышиная модель миокардита легла в основу данной схемы. В патогенезе вирусного воспалительного процесса в миокарде ключевую роль играет непосредственно повреждающее действие вируса, которое может вызвать развитие острых и/или хронических ответных аутоиммунных реакций с возможным последующим ремоделированием сердца [11].
В организм человека вирус Коксаки типа B проникает через желудочно-кишечный тракт или дыхательную систему. В период активной виремии РНК или ДНК кардиотропных вирусов взаимодействуют со специфическими рецепторами эндотелиальных клеток, прежде чем достигают кардиомиоцитов (КМЦ) [12, 13]. В дальнейшем вирусы проникают в КМЦ, взаимодействуя с коксаки-аденовирусным рецептором (КАР) на поверхности КМЦ [14 - 19]. КАР - это интегральный мембранный белок, который состоит из двух внеклеточных иммуноглобулиноподобных доменов [20 - 22]. КАР экспрессируется на высоком уровне в тканях головного мозга и сердца, достигая своего пика в перинатальном периоде, с последующим снижением общего уровня с возрастом [23]. В незрелом сердце КАР обнаружен на всей поверхности КМЦ, а во взрослом сердце, преимущественно во вставочных дисках КМЦ [24]. Основным рецептором для парвовируса B19 являются P-антиген группы крови, который присутствует на эритроцитах, эритробластах, мегакариоцитах, эндотелиальных клетках, а также клетках печени и сердца плода, и другие гликосфинголипиды, для герпеса 6 типа - CD 46 клетки [25]. P-антиген необходим для связывания, но недостаточен для проникновения парвовируса B19 в клетки [26]. Роль корецепторов выполняют альфа-5 бета 1-итегрин Ku 80 аутоантиген [27]. Метод гибридизации in situ показал, что геном PV19 локализован в эндотелии мелких интрамиокардиальных артерий сердца у больных ВКМП [28].
Вторая фаза аутоиммунного миокардиального повреждения имеет место в случае, если элиминация патогена не приводит к инактивации иммунного ответа, а напротив, сопровождается развитием аутоиммунных реакций вследствие нарушения аутотолерантности. Этот процесс реализуется через ряд механизмов: 1) выделение аутоантигенных белков вследствие некроза клеток, 2) поликлональная активация лимфоцитов, 3) активация T клеток вследствие действия ряда факторов, в том числе цитокинов, 3) феномен молекулярной мимикрии [29, 30].
Реализация аутоиммунного процесса происходит также при участии ряда гуморальных факторов, а именно иммуноглобулинов, компонентов комплемента и аутореактивных антител [31].
В третью фазу наблюдаются признаки выраженного ремоделирования миокарда. Цитокины также вносят существенный вклад в развитие ремоделирования миокарда. Они активируют матриксные металлопротеиназы, такие как желатиназы, коллагеназы и эластазы [32, 33] и способны активировать рецепторы апоптотической гибели КМЦ [34, 35].
Необходимо отметить, что четко разделить эти 3 фазы не представляется возможным. Многие процессы переплетены, взаимосвязаны и происходят синхронно [36].
1.3 Эпидемиология
Распространенность миокардита серьезно недооценивается из-за часто бессимптомного течения заболевания или неспецифических симптомов его проявлений. Заболеваемость миокардитом различается в зависимости от возраста, пола, этнической принадлежности [37]. Молодые люди имеют достаточно высокую частоту заболеваемости, особенно лица мужского пола, что предположительно может быть вызвано защитным влиянием половых гормонов в отношении реактивности иммунного ответа у женщин [38, 39]. У новорожденных и детей миокардит протекает молниеносно, и, как правило, они более восприимчивы к миокардиту вирусного генеза [40].
Данные о частоте встречаемости миокардитов достаточно противоречивы. В последние годы во многих странах мира отмечается рост заболеваемости миокардитом, что отчасти может объясняться внедрением в клиническую практику новых более информативных методов диагностики этого заболевания, в частности ЭМБ с применением иммуногистологического исследования и ПЦР для верификации возможных возбудителей миокардитов [41].
Частота миокардитов составляет от 20 до 30% всех некоронарогенных заболеваний сердца [42]. По данным патологоанатомических вскрытий, воспалительное поражение миокарда определяется в 3 - 5% случаев [4, 42] Обнаружено, что у лиц, умерших в возрасте моложе 35 лет с неустановленной причиной смерти миокардит при вскрытии выявляют примерно в 42% случаев [4, 43].
По результатам исследований последнего десятилетия, в Европе наиболее часто в кардиобиоптатах обнаруживается PVB19 [4], в Северной Америке - аденовирус [30], а в Японии - вирус гепатита C [31]. С учетом того, что ЭМБ и молекулярная диагностика вирусов редко проводится во многих регионах мира, распространенность вирусных миокардитов в большинстве стран Африки, Азии, на Ближнем Востоке, и Южной Америки, неизвестна.
Кроме географических особенностей этиологии вирусного миокардита имеются и хронологические. С 1950 по 1990 г наиболее частыми возбудителями вирусного миокардита были энтеровирусы с преобладанием вируса Коксаки типа B [44, 45]. Начиная с 1995 года ведущими вирусными агентами, вызывающими ВКМП, стали аденовирусы [46]. После 2000 года в кардиобиоптатах больных миокардитом чаще стали выявлять PVB19 [4, 47 - 51].
1.4 Кодирование по МКБ 10
Острый миокардит (http://mkb-10.com/index.php?pid=8177) (I40):
I40.0 - Инфекционный миокардит
Септический миокардит. При необходимости идентифицировать инфекционный агент используют дополнительный код (B95 - B97).
I40.1 - Изолированный миокардит
I40.8 - Другие виды острого миокардита
I40.9 - Острый миокардит неуточненный
Миокардит при болезнях, классифицированных в других рубриках (I41):
I41.0* - Миокардит при бактериальных болезнях, классифицированных в других рубриках
Миокардит: дифтерийный (A36.8+). Гонококковый (A54.8+).
Менингококковый (A39.5+). сифилитический (A52.0+).
Туберкулезный (A18.8+).
I41.1* - Миокардит при вирусных болезнях, классифицированных в других рубриках
Гриппозный миокардит (острый): вирус идентифицирован (J10.8+) вирус не идентифицирован (J11.8+). Паротитный миокардит (B26.8+)
I41.2* - Миокардит при других инфекционных и паразитарных болезнях, классифицированных в других рубриках
Миокардит при: болезни Шагаса (хронический) (B57.2+). острой (B57.0+). токсоплазмозе (B58.8+)
I41.8* - Миокардит при других болезнях, классифицированных в других рубриках
Ревматоидный миокардит (M05.3+). Саркоидный миокардит (D86.8+)
Миокардит неуточненный (I51.4):
Фиброз миокарда. Миокардит: без дополнительных уточнений хронический (интерстициальный)
1.5 Классификация
Единая классификация миокардитов отсутствует.
Основываясь на морфологической картине заболевания, все миокардиты, согласно Далласским критериям, можно разделить на активные миокардиты, при которых выявляется воспалительная инфильтрация миокарда с некротическими или дегенеративными изменениями, не характерными для ишемической болезни сердца (ИБС), и пограничные (вероятные) миокардиты, характеризующиеся малым количеством воспалительных инфильтратов или отсутствием признаков повреждения кардиомиоцитов [49].
Рабочей группой Японского кардиологического общества (2009 г.) предложена классификация миокардита с учетом этиологического фактора, гистологии и клинического типа (табл. 3) [50].
В нашей стране Палеевым Н.Р. была предложена классификация, которая предусматривала деление миокардитов по этиологическому фактору, по патогенезу патологического процесса, по морфологии, распространенности, а также клинической картине заболевания, но, с практической точки зрения, она оказалась неудобной для применения (табл. 4) [52].
Таблица 3 - Классификация рабочей группы Японского кардиологического общества (2009 г.)
Этиология
Клеточный тип
Клинический тип
Вирус
Лимфоцитарный
Острый
Бактерия
Гигантоклеточный
Фульминантный
Грибок
Эозинофильный
Хронический
Риккетсия
Гранулематозный
Подострый
Спирохета
-
Латентный
Простейшие, паразиты
-
-
Другие инфекционные причины
-
-
Лекарства, химические вещества
-
-
Аллергия, аутоиммунные процессы
-
-
Коллагенозы
-
-
Болезнь Кавасаки
-
-
Саркоидоз
-
-
Радиация, тепловой удар
-
-
Неизвестные причины
-
-
Идиопатический
-
-
Таблица 4 - Клиническая классификация миокардитов (Палеев Н.Р., Палеев Ф.Н., Гуревич М.А., 2007 г.)
Классификационный признак
Варианты
Этиологическая характеристика и патогенетические варианты
Инфекционно-аллергические и инфекционные
Вирусные (грипп, вирусы Коксаки, ECHO-вирусы, СПИД, полиомиелит), инфекционные (дифтерия, скарлатина, туберкулез, брюшной тиф), при инфекционном эндокардите, спирохетозные (сифилис, возвратный тиф, лептоспироз), риккетсиозные (сыпной тиф, лихорадка Ку), паразитарные (токсоплазмоз, болезнь Чагаса, трихинеллез), грибковые (актиномикоз, кандидоз, кокцидиомикоз, аспергиллез и др.)
Аллергические (иммунологические)
Лекарственные, сывороточные, нутритивные, при системных заболеваниях соединительной ткани, при бронхиальной астме, при синдроме Лайелла, при синдроме Гудпасчера, ожоговые, трансплантационные
Токсикоаллергические
Тиреотоксические, уремические, алкогольные
Патогенетическая фаза
-
Инфекционно-токсическая, иммуноаллергическая, дистрофическая, миокардиосклеротическая
Морфологическая характеристика
-
Альтеративный (дистрофически-некробиотический) экссудативно-пролиферативный (интерстициальный): дистрофический, воспалительно-инфильтративный, васкулярный, смешанный
Распространенность
-
Очаговые, диффузные
Клинические варианты
-
Псевдокоронарный, декомпенсационный, псевдоклапанный, аритмический, тромбоэмболический, смешанный, малосимптомный
Варианты течения
-
Миокардит доброкачественного течения (обычно очаговая форма), острый миокардит тяжелого течения, миокардит рецидивирующего течения с повторяющимися обострениями, миокардит с нарастающей дилатацией полостей сердца и в меньшей степени гипертрофией миокарда (обычно диффузная форма), хронический миокардит
В 1991 году E.B. Liberman и соавторы на основании анализа клинической картины, течения миокардита и результатов гистологического исследования биоптатов миокарда 348 пациентов предложили клинико-патологическую классификацию миокардитов [53]. Во всем мире наиболее часто используется именно эта классификация. Она включает в себя шесть разделов:
1. Молниеносный (фульминантный) миокардит.
Молниеносный миокардит имеет внезапное начало и четкую хронологическую взаимосвязь с перенесенной острой вирусной инфекцией. Как правило, с момента перенесенной вирусной инфекции и манифестации заболевания проходит около 2 недель. Характеризуется значительным снижением сократительной способности сердца при относительно небольших его размерах. При гистологическом исследовании выявляются множественные очаги воспалительной инфильтрации, также возможны очаги некроза. Данный вид заболевания может завершиться полным выздоровлением, но возможны и варианты быстрого прогрессирования сердечной недостаточности, гипотонии, которые часто приводят к летальному исходу в случае отсутствия систем вспомогательного кровообращения.
2. Острый миокардит.
Менее стремительное начало заболевания, тем не менее, манифестирует данный вид миокардитов также с явлений сердечной недостаточности. Для данной формы заболевания характерно расширение полостей сердца и снижение сократительной способности миокарда. В биопсийных образцах выявляются активные или умеренно активные воспалительные инфильтраты. Как правило, в дальнейшем острый миокардит переходит в ДКМП.
3. Хронический активный миокардит.
Начало заболевания настолько размытое, что пациент обычно не может точно сказать о сроках начала болезни. Характерно умеренное снижение сократительной способности миокарда, что приводит к хронической сердечной недостаточности (ХСН). При гистологическом исследовании, наряду с воспалительными инфильтративными изменениями различной степени выраженности, отмечается выраженный фиброз. Так же, как и острый миокардит, часто приводит к формированию ДКМП.
4. Хронический персистирующий миокардит.
Как и хронический активный миокардит, данный вид миокардита начинается постепенно. Гистологически отмечаются длительно существующие воспалительные инфильтративные очаги с некротическими и фиброзными изменениями. Значимой дилатации полостей сердца, снижения фракции выброса левого желудочка (ФВ ЛЖ) не отмечается, что и определяет благоприятный исход заболевания.
5. Гигантоклеточный миокардит.
Этот вид миокардитов характеризуется наличием гигантских многоядерных клеток (видоизмененных макрофагов, внутри которых можно обнаружить сократительные белки - остатки фагоцитированных фрагментов разрушенных КМЦ) с признаками активного воспаления и, возможно, рубцовой тканью. В клинической картине данного вида миокардита отмечается прогрессирующая рефрактерная сердечная недостаточность, а также устойчивые нарушения ритма и проводимости сердца. В анамнезе у таких пациентов могут быть указания на различные аутоиммунные заболевания. Прогноз при данном виде крайне неблагоприятный.
6. Эозинофильный миокардит.
Еще одна форма миокардитов - эозинофильный миокардит. В клинической картине заболевания, кроме явлений сердечной недостаточности при незначительном снижении сократительной способности сердца, характерно образование тромбов в полостях сердца, приводящих к тромбоэмболическим осложнениям. В анамнезе у таких пациентов существуют указания на прием каких-либо лекарственных препаратов. В общем анализе крови может быть выявлена эозинофилия. В образцах биопсийного материала, наряду с очагами некроза КМЦ, можно выявить эозинофильное преобладание в воспалительном клеточном инфильтрате.
2. Диагностика
Современная диагностика миокардита должна основываться на адекватных лабораторных, инструментальных, а также морфологических методах (ЭМБ) [5]. Фактически диагностика начинается на уровне первичного звена медицинской помощи, где и должны возникнуть первые клинические подозрения о наличии миокардита, которые становятся основанием для направления пациента на уровень специализированной помощи для проведения тщательного обследования.
Рабочей группой экспертов Европейского общества кардиологов в 2013 г, предложены критерии, позволяющие заподозрить миокардит, которые представлены в таблицах 5 и 6.
Таблица 5 - Варианты клинических проявлений у пациентов с миокардитом
Клинические варианты
Симптомы/признаки
Клиника, подобная острому коронарному синдрому
Острая боль в груди: часто начинается в течение 1-<...> недель после возникновения или респираторной кишечной инфекции;
часто ассоциируется с тяжелыми и рецидивирующими симптомами;
отсутствуют ангиографические данные в пользу ИБС Изменение ST и T на ЭКГ: подъем или депресси<...> сегмента ST, инверсия зубца T с/без нарушени<...> глобальной или очаговой сократимости или дисфункцией левого или правого желудочка по данным ЭхоКГ или МРТ с/без повышения уровн<...> тропонинов T и I, повышение которых может быть временным как при остром инфаркте миокарда, так длительным в течение нескольких недель или месяцев
Начало или прогрессирование сердечной недостаточности в отсутствие коронарной недостаточности и других известных причин сердечной недостаточности
Начало или прогрессирование СН от 2 недель до месяцев: одышка, периферические отеки, неприятные ощущения в грудной клетке, утомляемость.
Нарушение систолической функции левого и/или правого желудочка с/без утолщения стенок, с/без развития дилатации желудочков на ЭхоКГ или МРТ.
Возможное появление симптомов после респираторной или желудочно-кишечной инфекции либо во время беременности.
Неспецифические ЭКГ-признаки, блокада ножек пучк<...> Гиса, атриовентрикулярная блокада и/или желудочковая аритмия.
Хроническая сердечная недостаточность в отсутствие коронарной недостаточности и других известных причин сердечной недостаточности
Симптомы СН (с рецидивирующими обострениями) на протяжении более 3 месяцев: утомляемость, сердцебиение, одышка, атипичная боль в грудной клетке, аритмия у амбулаторных пациентов.
Нарушение систолической функции левого и/или правого желудочка на эхокардиографии или МРТ, позволяющая предположить ДКМП или другую неишемическую кардиомиопатию.
Неспецифические ЭКГ-признаки, блокада ножек пучк<...> Гиса, атриовентрикулярная блокада и/или желудочковая аритмия
"Опасные для жизни состояния" в отсутствие коронарной недостаточности и других известных причин сердечной недостаточности
Жизнеугрожающие аритмии или внезапная сердечная смерть
Кардиогенный шок
Тяжелые нарушения функции ЛЖ
Таблица 6 - Диагностические критерии при клинически предполагаемом миокардите
Клинические проявления
- Острая боль в груди, в т.ч. по типу перикардита, или псевдоишемическая
- Впервые появление (от дней до 3-х месяцев) или ухудшение одышки в покое или нагрузке, и/или утомляемость, с/без признаков лево и/или правожелудочковой недостаточности
- Подострое/хроническое (> 3 месяцев) или ухудшение тех же симптомов
- Сердцебиение и/или аритмия неясного генеза и/или синкопы и/или предотвращенная внезапная смерть
- Кардиогенный шок без известной причины
Инструментальные диагностические критерии
1. Изменения на ЭКГ/холтеровском мониторировании/стресс-тесте.
появление новых патологических изменений: блокады, изменения ST/T (элевация S, инверсия T), арест синусового узла, желудочковая тахикардия (ЖТ), фибрилляция желудочков, асистолия, фибрилляция предсердий (ФП), снижение высоты R, нарушение в/<...> проводимости с расширением QRS, патологический зубец Q, низкий вольтаж, частая желудочковая экстрасистолия (ЖЭС), наджелудочковая тахикардия (НЖТ).
2. Маркеры цитолиза КМЦ.
Повышение уровня тропонина T/I
3. Функциональные и структурные нарушения при ЭХОКГ/КАГ/МРТ.
Новые и необъяснимые другими причинами функциональные и структурные нарушения ЛЖ и/или ПЖ (включая бессимптомных пациентов).
4. Тканевая характеристика при МРТ.
Отек и/или наличие участков отстроченного контрастирования типичные для миокардита
*Комментарии: Миокардит подозревается если имеется >= 1 клинического признака и >= 1 диагностического инструментального критерия из различных категорий при отсутствии поражения коронарных артерий при коронароангиографии (КАГ) (>= 50%) и других сердечно-сосудистых и экстракардиальных заболеваний, которые могли вызвать данные изменения (например, пороки сердца, артериальная гипертония, тиреотоксикоз). Вероятность миокардита тем выше, чем больше имеется критериев.
Если пациент не имеет симптомов, то необходимо наличие >= 2 диагностических инструментальных критериев из разных категорий
Дополнительные признаки:
- лихорадка >= 38 °C в настоящее время или в предшествующие 30 дней с признаками или без респираторной (озноб, головная боль, мышечные боли, общее недомогание) или гастроинтестинальной (снижение аппетита, тошнота, рвота, диарея) инфекций;
- перипартальный период;
- ранее подозреваемый или доказанный миокардит (в соответствии с критериями, указанными в таблице 6);
- наличие у пациента и/или семейный анамнез астмы, других типов аллергии, экстракардиальных аутоиммунных заболеваний, воздействие токсических агентов;
- семейный анамнез ДКМП и миокардита.
2.1 Жалобы и анамнез
Клиническая картина миокардита разнообразна. Выраженность клинических проявлений варьирует от минимальных симптомов, не сопровождающихся появлением жалоб, до быстро развивающихся нарушений сердечного ритма и внезапной смерти и/или до тяжелой сердечной недостаточности (СН) [54].
- Рекомендуется расспросить пациента о существовании жалоб на одышку (вплоть до ортопноэ и пароксизмальной ночной одышки), отеки нижних конечностей, сердцебиение, эпизоды потери сознания, повышенной утомляемости [55, 56, 57 - 59].
Уровень убедительности рекомендаций I (уровень достоверности доказательств C).
Комментарии: Миокардит следует подозревать во всех случаях необъяснимых СН, тахикардии и аритмии, особенно когда рутинные методы кардиологического обследования не выявляют причину.
- Рекомендуется расспросить пациента о наличии лихорадки в настоящее время или в предшествующие 30 дней с признаками или без респираторной (озноб, головная боль, мышечные боли, общее недомогание) или гастроинтестинальной (снижение аппетита, тошнота, рвота, диарея) инфекций.
Уровень убедительности рекомендаций I (уровень достоверности доказательств C).
Комментарии: Симптомы острого миокардита появляются обычно спустя 7 - 10 дней после вирусоподобной манифестации. Наличие данных состояний увеличивает вероятность миокардита у пациента.
- При сборе анамнеза рекомендуется опросить пациента в отношении наличия у него установленного в прошлом диагноза миокардита, экстракардиальных аутоиммунных заболеваний, бронхиальной астмы и других видов аллергических заболеваний, воздействий токсических агентов и недавней беременности.
Уровень убедительности рекомендаций I (уровень достоверности доказательств C).
Комментарии: Наличие данных состояний увеличивает вероятность развития миокардита у пациента.
- Рекомендуется тщательно собирать семейный анамнез в отношении наличия у родственников ДКМП, миокардита, экстракардиальных аутоиммунных заболеваний, бронхиальной астмы и других типов аллергии.
Уровень убедительности рекомендаций I (уровень достоверности доказательств C).
Комментарии: Наличие данных состояний увеличивает вероятность развития миокардита у пациента.
2.2 Физикальное обследование
- При физикальном обследовании пациента рекомендуется обращать внимание на наличие признаков сердечной недостаточности и инфекции [2, 59].
Уровень убедительности рекомендаций I (уровень достоверности доказательств C).
Комментарии: Специфичных для миокардита признаков нет. Данные объективного обследования могут колебаться от минимальных изменений до признаков кардиогенного шока. В тяжелых случаях возможно вынужденное положение (ортопноэ), акроцианоз, набухание шейных вен, отеки голеней и стоп, гепатомегалия, асцит, гидроторакс. Отмечаются тахипноэ, лихорадка различной степени выраженности (чаще субфебрилитет), синусовая тахикардия, не соответствующая степени повышения температуры (обусловлена активацией симпатической нервной системы и сама по себе ухудшает состояние миокарда), аритмии. Артериальная гипотензия встречается нечасто. При аускультации в легких могут выслушиваться влажные хрипы, при аускультации сердца глухость тонов, протодиастолический ритм галопа (появление III тона), систолический шум на верхушке (обусловлен относительной недостаточностью митрального клапана, дисфункцией папиллярных мышц, снижением тонуса атриовентрикулярного кольца и тахикардией), шум трения перикарда (присоединение перикардита). Перкуторно может определяться расширение границ относительной и абсолютной сердечной тупости. Верхушечный толчок не изменен или умеренно ослаблен, смещен влево в зависимости от степени увеличения размеров сердца [2, 59].
2.3 Лабораторная диагностика
2.3.1 Маркеры воспалительного ответа
- Всем пациентам с подозрением на миокардит рекомендуется определение скорости оседания эритроцитов (СОЭ) и C-реактивного белка (СРБ) [5].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Повышенные значения СОЭ и СРБ позволяют врачу заподозрить миокардит, но эти показатели не могут подтвердить диагноз и часто повышены при остром перикардите [60].
2.3.2 Биомаркеры сердечной недостаточности
Всем пациентам с клиническим подозрением на миокардит рекомендуется исследование уровня натрийуретических пептидов (НУП) (мозгового натрийуретического пептида (BNP) и/или N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) [61, 62].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Повышение данных маркеров, также как и цитокинов, не является специфичным и их нормальные значения не исключают наличие миокардита. Повышение НУП свидетельствует о развитии СН у больного миокардитом. При оценке тяжести СН следует учитывать, что при наличии активного воспаления уровень NT-proBNP будет выше.
2.3.3 Биомаркеры некроза
- Всем пациентам с клиническим подозрением на миокардит рекомендуется определение тропонинов T и I [5].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Тропонины T и I более чувствительны к повреждению миокарда у пациентов с клинически подозреваемым миокардитом, чем креатинфосфокиназа (КФК), но они не являются специфичными и их нормальное значение не исключает миокардит. У пациентов с острым миокардитом, концентрации в сыворотке тропонинов I и T повышаются чаще, чем МВ-фракция КФК, а высокие уровни тропонина T имеют также и прогностическое значение [63 - 66].
2.3.4 Серологическая диагностика вирусных инфекций
- Выявление серологических маркеров вирусных инфекций в периферической крови не рекомендуется для верификации этиологического характера воспалительного процесса в миокарде [5, 67].
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
Комментарии: Положительный серологический анализ на вирусную инфекцию не выявляет миокардиальную инфекцию, а отражает взаимодействие периферической иммунной системы и инфекционного агента. Распространенность в общей популяции циркулирующих антител класса IgG к кардиотропным вирусам при отсутствии вирусного миокардита высокая [4, 68, 69]. Проведенные исследования не показали корреляции между данными полученными при ЭМБ и серологическими тестами [69]. Исключения составляют гепатит C, риккетсиозные инфекции 1 и 2 фазы, болезнь Лайма и ВИЧ.
2.3.5 Иммунологические методы диагностики миокардита
- Исследование параметров клеточного иммунного статуса не рекомендуется для диагностики воспалительного процесса в миокарде [5].
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
Комментарии: Изменения параметров клеточного иммунного статуса неспецифично и дает ограниченную информацию.
- У пациентов с подозрением на миокардит рекомендуется определение содержания антител к антигенам миокарда в крови, специфичных для миокардита [5].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: В настоящее время у пациентов с миокардитом и ДКМП выявлено более 20 аутоантител к различным кардиальным и мышечным антигенам [4, 5, 70]. Наличие тех или иных аутоантител класса IgG может служить маркером неблагоприятного прогноза, эффективности иммуносупрессивной или иммуномодулирующей терапии, проведения иммуноабсорбции и риска возникновения заболевания у родственников пациентов [4, 5, 70]. Однако отсутствие повышения их титра не исключает наличие миокардита, так как воспалительный процесс в миокарде может развиваться без формирования аутоантител, выявляемых в данном тесте.
2.3.6 Исследование препаратов тканей миокарда
- Исследование биоптатов сердца, полученных при ЭМБ, рекомендуется проводить с использованием гистологических, иммуногистохимических и молекулярных-генетических (ПЦР) методов.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: При гистологическом исследовании используют Далласские критерии, в соответствии с которыми диагностика миокардита основывается на трех патоморфологических изменениях ткани миокарда: инфильтрация, миоцитолиз и отек [49]. Однако, применение этих критериев на практике оказалось сопряжено с множеством проблем. Мозаичный характер миокардиального повреждения, существенная разница в размерах и количестве взятых биоптатов, а также субъективный характер гистологической оценки состояния ткани миокарда приводили к выраженным разногласиям среди исследователей [92]. В 1999 г. Всемирной Федерацией сердца был принят консенсус, согласно которому наличие >= 14 лимфоцитов и макрофагов/мм2 свидетельствует об активном воспалительном процессе в миокарде, а применение ПЦР позволяет установить его этиологию. Инфильтрат может включать T-хелперы (>= 7 CD3+ в мм2 или 2 в поле зрения, CD4+), T-супрессоры (CD8+), активированные T-клетки (CD45RO), макрофаги и моноциты (при подсчете учитывается не более 4 CD68+). В соответствии с данной классификацией была предложена следующая терминология: 1) диагноз острого миокардита ставится при наличии >= 14 лейкоцитов/мм2 миокарда в сочетании с признаками некроза и дегенерации, 2) хронический миокардит характеризуется: >= 14 лейкоцитов/мм2, без признаков некроза и дегенерации, при наличии фиброза, 3) отсутствие миокардита подтверждается, если количество инфильтрирующих миокард клеток < 14 лейкоцитов/мм [93, 94]
По данным гистологического исследования существуют степени фиброза: 0 степень - отсутствие, 1 степень - незначительный, 2 степень - умеренный, 3 степень - выраженный фиброз [93].
Одновременно с биоптатами периферическая кровь также должна быть исследована методом ПЦР для исключения активной системной вирусной инфекции, которая может привести к загрязнению образцов тканей, но не указывает на вирусную инфекцию в миокарде.
2.4 Инструментальная диагностика
2.4.1 Электрокардиография
- Проведение стандартной 12-канальной ЭКГ рекомендуется всем пациентам с подозрением на наличие миокардита [5, 50, 66, 71].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Чувствительность ЭКГ в диагностике миокардитов составляет 47% [2, 71]. Хотя специфичных для миокардита электрокардиографических признаков не существует, ценность этого метода в диагностике очень велика, так как наличие изменений на ЭКГ указывает на вовлеченность миокарда в патологический процесс и обосновывает выполнение эхокардиографии и применение других методов обследования [72, 73].
На ЭКГ регистрируются нарушения ритма сердца, признаки нарушения проведения с неспецифическими изменениями сегмента ST и зубца T, признаки расширения камер сердца [70]. Наличие патологического зубца Q или блокады левой ножки пучка Гиса (БЛНПГ) ассоциировано с высоким риском трансплантации сердца или смертью [2].
2.4.2 Рентгенография органов грудной клетки
- Рентгенографию органов грудной клетки рекомендуется проводить всем пациентам с миокардитом.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Метод позволяет выявить кардиомегалию, нарушение легочной гемодинамики, плевральный выпот.
2.4.3 Эхокардиография
- Всем пациентам с подозрением на наличие миокардита рекомендуется проведение трансторакальной эхокардиографии. При ухудшении каких-либо гемодинамических показателей в ходе госпитализации рекомендуется проведение повторного исследования [5].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Трансторакальная эхокардиография (ЭХОКГ) рекомендуется для выявления морфологических изменений в сердце: расширении камер, недостаточности клапанов, наличии гипо- и акинезов, а также о нарушении систолической и диастолической функции. В первую очередь, с целью исключения других причин, приведших к развитию сердечной недостаточности (гипертрофическая или рестриктивная кардиомиопатии, пороки сердца) [74].
Оценка размеров камер сердца, толщины его стенок, а также основных показателей, отражающих систолическую и диастолическую функцию желудочков, также рекомендуется для отслеживания эффективности проводимой терапии.
Пациенты с молниеносной формой миокардита часто имеют резко выраженное снижение фракции выброса, нормальные размеры камер сердца и утолщение межжелудочковой перегородки (МЖП), обусловленное миокардиальным отеком, тогда как у пациентов с острым миокардитом отмечается расширение левого желудочка (ЛЖ) и нормальная толщина его стенок [75, 76].
Для больных с подострыми и хроническими формами миокардита более характерно наличие значительной дилатации камер сердца со снижением общей сократительной способности различной степени.
У больных с миокардитом нередко удается обнаружить наличие зон нарушенной локальной сократимости (гипокинез, акинез), однако подобные изменения не позволяют провести дифференциальный диагноз с ишемической болезнью сердца [5, 74, 75].
2.4.4 Радионуклидная диагностика
- Использование радионуклидных методов для диагностики миокардита не рекомендуется ввиду их вариабельной чувствительности и низкой специфичности [5].
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
Комментарии: Использование радионуклидных методов рекомендуется лишь для выявления саркоидоза. Для выявления саркоидоза может быть использована сцинтиграфия миокарда с талием-201, технецием-99m, галием-67, а также позитронно-эмиссионная томография.
2.4.5 Магнитно-резонансная томография
- МРТ сердца с контрастным усилением рекомендуется проводить клинически стабильным пациентам с подозрением на наличие миокардита до ЭМБ.
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
Комментарии: Чувствительность метода снижается у пациентов с длительным течением заболевания и хроническим миокардитом.
- Пациентам с жизнеугрожающим состоянием проведение МРТ сердца не рекомендуется.
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
Комментарии: Пациенту с жизнеугрожающим состоянием показано срочное проведение ЭМБ, но не МРТ.
- Оценку данных МРТ при диагностике миокардитов рекомендуется проводить согласно установленным критериям, предложенными международной рабочей группой (так называемые "Lake-Louise Criteria" ("Критерии озера Луизы")) [77].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: "Lake-Louise Criteria" включают: 1) локальное или диффузное повышение интенсивности сигнала на T2-взвешенных изображениях; 2) повышение соотношения между интенсивностью сигнала миокарда и скелетной мускулатурой в раннюю фазу контрастирования; 3) наличие как минимум одного участка накопления контрастного препарата в отсроченную фазу, что может свидетельствовать о некротических или фибротических изменениях сердечной мышцы [77]. Наличие не менее двух из этих критериев на фоне клинической симптоматики позволяет диагностировать миокардит. Проведение МРТ сердца позволяет подтвердить наличие повреждения миоцитов и/или рубцовых изменений, вызванных воспалительным процессом, если критерий 3 положительный. Наличие дисфункции ЛЖ или перикардиального выпота дает дополнительную информацию, позволяющую подтвердить наличие миокардита [80]. При комбинированном применении всех трех тканевых маркеров, и при наличии, по крайней мере, двух положительных критериев, определенных с помощью МРТ, диагностическая точность, чувствительность и специфичность метода составляют 78%, 67%, 91%, соответственно. В том, случае, когда учитывается только отсроченное контрастирование, диагностическая точность, чувствительность и специфичность, составляют 68%, 59%, 86%, соответственно [78 - 82]. Следует отметить, что данные результаты получены в небольших клинических исследованиях на ограниченном количестве пациентов.
В настоящее время предложены новые методики МРТ сердца - картирование времени релаксации T1 и T2, определение фракции внеклеточного объема, которые возможно расширят диагностические возможности этого метода у больных с миокардитом [83]. T1 и T2 картирование позволяют качественно оценить диффузные изменения в миокарде (диффузный отек, фиброз) [84 - 90].
- Повторная МРТ сердца через 1 - 2 недели после первичного исследования рекомендуется, если не было ни одного положительного критерия, однако клиническая картина заболевания в большей степени соответствует миокардиту или отмечался один из вышеперечисленных критериев диагностики.
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
2.4.6 Коронароангиография
Диагностика миокардита требует исключения ИБС, как причины имеющихся у пациента симптомов и изменений. Самый информативный метод для этого - коронароангиография.
- Все пациентам с подозрением на миокардит рекомендуется проведение коронароангиографии для исключения ишемической этиологии заболевания.
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
2.4.7 Эндомиокардиальная биопсия
"Золотым стандартом" диагностики миокардита является ЭМБ [91], которая позволяет не только подтвердить диагноз, но и определить этиологию и тип воспаления (например, гигантоклеточный и эозинофильный миокардит, саркоидоз), которые во многом определяют подходы к лечению и прогноз.
В связи с тем, что клиническая картина заболевания у пациентов может значительно различаться, еще в 2007 г Американской Ассоциацией Сердца, Американской Коллегией Кардиологов и Европейским Обществом Кардиологов были выработаны рекомендации проведения ЭМБ в зависимости от так называемого "клинического сценария" [91]. В 2013 году рабочая группа по заболеваниям миокарда и перикарда Европейского общества кардиологов расширила показания к проведению ЭМБ, включив в них всех пациентов, у которых на основании выработанных критериев (таблица 6) клинически подозревается миокардит [5].
- ЭМБ рекомендуется проводить при СН длительностью менее 2 недель с нормальным или дилатированным ЛЖ и нарушением гемодинамики [91].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств B).
- ЭМБ рекомендуется проводить при СН длительностью от 2 недель до 3 месяцев с дилатацией ЛЖ и новыми желудочковыми аритмиями, AB-блокадами 2 - 3 степеней или отсутствием ответа на стандартное лечение в течение 1 - 2 недель [91].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств B).
Комментарии: ЭМБ в этих случаях может выявить такие тяжелые виды миокардитов, как гигантоклеточный и некротизирующий эозинофильный, что является важным для определения дальнейшей тактики лечения.
- ЭМБ рекомендуется проводить при СН длительностью более 3 месяцев с дилатацией ЛЖ и новыми желудочковыми аритмиями, AB-блокадами 2 - 3 степеней или отсутствием ответа на стандартное лечение в течение 1 - 2 недель [91].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- ЭМБ рекомендуется проводить при СН, ассоциированная с ДКМП любой длительности, с наличием аллергической реакции и/или эозинофиллией [91].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- ЭМБ рекомендуется проводить при СН с подозрением на антрациклиновую кардиомиопатию [91].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- ЭМБ рекомендуется проводить при СН с рестриктивной кардиомиопатий неясного генеза [91].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- ЭМБ рекомендуется проводить при кардиомиопатии неизвестного генеза у детей [91].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- ЭМБ рекомендуется проводить при СН длительностью более 2 недель с дилатацией ЛЖ без новых желудочковых аритмий, AB-блокад 2 - 3 степеней и хорошим ответом на стандартное лечение в течение 1 - 2 недель [91].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств B).
- ЭМБ рекомендуется проводить при СН, связанной с изменениями сердца по типу гипертрофической кардиомиопатии (ГКМП) неясного генеза, для исключения инфильтративных заболеваний миокарда [91].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
- ЭМБ рекомендуется проводить при подозрении на аритмогенную дисплазию ПЖ [91].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств B).
- ЭМБ рекомендуется проводить при желудочковой аритмии неизвестного генеза [91].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств B).
- ЭМБ рекомендуется проводить при всех других клинических ситуациях, которые в соответствии с критериями, изложенными в таблице 6, позволяют заподозрить миокардит.
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
Комментарии: Широкое использование ЭМБ у таких пациентов не рекомендуется, так как в настоящее время отсутствуют убедительные данные о влиянии у них специфической терапии на течение и исход миокардита и риск процедуры превышает возможную пользу. Однако в сложной клинической ситуации возможно проведение ЭМБ.
- Выполнение повторной ЭМБ рекомендуется при необходимости контролировать ответ на этиотропную терапию или при подозрении на лабораторную ошибку у пациента с прогрессирующей сердечной недостаточностью неизвестной этиологии.
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
Комментарии: Информативность ЭМБ зависит от соблюдения рекомендаций по забору образцов тканей и их исследовании.
При ЭМБ рекомендуется проводить забор не менее трех образцов тканей сердца размером не менее 1 - 2 мм каждый.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Основным ограничением применения эндомиокардиальной биопсии остается низкая чувствительность, обусловленная локальностью изменений. В этой связи размер и количество взятых эндомиокардиальных биоптатов играет решающее значение. Чувствительность составляет 50% при исследовании 4 - 5 образцов и доходит до 79% при взятии 17 биоптатов [95]. Следует учитывать, что при проведении ЭМБ в 6% случаев могут возникать осложнения, из них в 0,1% - 0,5% случаев такие серьезные как перфорация и тампонада сердца [96, 97].
3. Лечение
- Пациентам с подозрением на миокардит и жизнеугрожающими состояниями (нестабильность гемодинамики, устойчивые желудочковые тахиаритмии) рекомендуется госпитализация в медицинские организации, имеющие возможность проводить мониторирование гемодинамики, катетеризацию полостей сердца и ЭМБ, а также использовать устройства для механической поддержки гемодинамики и лечения аритмий [5, 50, 98].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
- Пациентам с подозрением на наличие миокардита и умеренно выраженной симптоматикой (или даже без симптомов) рекомендуется госпитализация в стационар для мониторирования их состояния вплоть до верификации диагноза [5, 50].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Необходимость госпитализации обусловлена тем, что состояние пациентов с миокардитом даже с первоначально сохранной систолической функцией может быстро и непредсказуемо ухудшится с развитием тяжелых осложнений, таких как жизнеугрожащие аритмии и блокады.
В терапии миокардитов можно выделить 2 направления - неспецифическое, направленное на лечение таких жизнеугрожающих состояний, как СН и нарушения ритма и проводимости сердца (НРС), и специфическое этиопатогенетическое, имеющее своей целью воздействие на причину миокардитов, например, вирусную инфекцию и на основное патофизиологическое звено развития миокардитов - иммунное воспаление.
3.1 Неспецифическая терапия
Клинические исследования по оценке эффективности лечения СН и НРС у больных с миокардитом никогда не проводились, в связи с чем рекомендации основаны на мнении экспертов [5], а также учитывают результаты экспериментальных исследований на животных. Лечение больных СН на фоне развития миокардита должно проводиться в соответствии с текущими рекомендациями по лечению острой и хронической СН в зависимости от клинического состояния [99].
- Пациентам с нестабильной гемодинамикой, кардиогенным шоком, обусловленными острым и фульминантным миокардитом и сохраняющимися, несмотря на применение оптимальной лекарственной терапии, рекомендуется применение устройств для механической поддержки гемодинамики или экстракорпоральной мембранной оксигенации в качестве временного вмешательства до выздоровления больного или выполнения трансплантации сердца [5, 50, 100 - 102].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
Комментарии: Несмотря на исходную тяжесть состояния, прогноз пациентов с фульминантным миокардитом достаточно благоприятный: выживаемость превышает 60 - 80% при высокой частоте восстановления функции желудочков сердца. Применение активной терапии с использованием устройств для механической поддержки гемодинамики крайне желательно и использование таких подходов к лечению следует учитывать в ранние сроки у больных с фульминантным миокардитом в случае неэффективности лекарственной терапии, применяемой в полном объеме.
- Решение вопроса о необходимости трансплантации сердца рекомендуется откладывать до разрешения острой фазы миокардита [5].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
Комментарии: После разрешения острой фазы возможно значительное улучшение состояния пациента и восстановление сократительной функции сердца.
- Проведение трансплантации сердца в отдельных случаях рекомендуется у гемодинамически нестабильных пациентов с острой фазой миокардита, если, несмотря на оптимальную фармакологическую терапию и механическую поддержку, его состояние не удается стабилизировать [5].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
- Пациентам со стабильной СН, развившейся в результате миокардита, рекомендовано проведение терапии в соответствии с клиническими рекомендациями по лечению СН [5, 99, 103].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: В соответствии с клиническими рекомендациями по лечению СН рекомендуется применение бета-адреноблокаторов, диуретиков, ингибиторов ангиотензинпревращающего фермента (ИАПФ), блокаторов рецепторов ангиотензина II (БРА) и блокаторов минералкортикоидных рецепторов (БМКР). За счет рано начатого приема препаратов, блокирующих ренинангиотензиновую систему, возможно уменьшение выраженности дезадаптивного ремоделирования сердца, а также уменьшение вероятности прогрессирования заболевания до ДКМП. В экспериментальных моделях аутоиммунного или вирусного миокардита на мышах применение ИАПФ каптоприла**, а также БРА лозартана**, кандесартана и олмесартана медоксомила приводило к уменьшению выраженности воспаления, некроза, фиброза, аутоиммунного ответа и ремоделирования сердца [104 - 111].
Отсутствие бета-адреноблокаторов в терапии у больных миокардитом ассоциировано с неблагоприятным прогнозом [112]. В экспериментальных работах карведилол**, в отличие от метопролола** и пропранолола**, оказывал защитное действие на сердце крыс с аутоиммунным миокардитом за счет подавления воспалительных цитокинов, а также реализации антиоксидантных свойств [113]. Более того, при использовании метопролола по сравнению с плацебо у мышей с экспериментальным миокардитом, вызванным вирусом Коксаки B3, отмечалось увеличение выраженности воспаления и некроза, а также увеличение смертности животных [114].
Диуретики используют для предупреждения перегрузки жидкостью. Применение торасемида, в отличие от фуросемида, в экспериментальной модели воспалительной кардиомиопатии у крыс приводил к замедлению прогрессирования миокардита до ДКМП за счет уменьшения выраженности фиброза, размера миоцитов, уровней миокардиальных белков, трансформирующего фактор роста b1, коллагена III типа и альдостеронсинтазы [115].
Прием антагонистов минералокортикоидных рецепторов рекомендуют больным со сниженной ФВЛЖ и стойкой СН II - IV функционального класса [98]. У мышей с экспериментальным вирусным миокардитом было обнаружено, что эплеренон ингибирует протеиназы, выделяемых тучными клетками, что приводило к уменьшению выраженности ремоделирования сердца за счет подавления фиброза [116].
- Применение бета-адреноблокаторов для лечения больных в раннюю фазу фульминантного миокардита не рекомендуется.
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
- Применение дигоксина** не рекомендуется у больных с острой СН, вызванной вирусным миокардитом [117].
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
Комментарии: Использование высоких доз дигоксина** приводит к образованию провоспалительных цитокинов и усилению выраженности повреждения миокарда у мышей с вирусным миокардитом. [118]. Кроме того, прием дигоксина** может ограничивать применение максимальной дозы бета-адреноблокаторов вследствие развития брадикардии или атриовентрикулярной блокады.
- Пациентам в острую фазу миокардита и, по крайней мере, в течение последующих 6 месяцев рекомендуется ограничение физической активности [5].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: В экспериментальной модели миокардита, вызванного вирусом Коксаки B3, непрерывная физическая активность сопровождалась увеличением смертности и приводила к подавлению функции T-лимфоцитов [119]. Спортсмены и другие лица с возможным или определенным миокардитом, независимо от возраста, тяжести симптомов и терапевтического режима, должны прекратить участие в соревнованиях, тренировках и занятиях любительским спортом не менее чем на 6 месяцев. Возобновление занятий спортом возможно только в случае восстановления нормальной функции и размеров ЛЖ при отсутствии клинически значимых аритмий после повторного обследования [120, 121]. Нераспознанный миокардит нередко становится причиной смерти молодых спортсменов [122]. Продолжительность периода, в течение которого следует воздерживаться от участия в соревнованиях после выздоровления больных с острым миокардитом, продолжает оставаться предметом обсуждения. В то же время при наличии стабильных симптомов СН после раннее перенесенного миокардита физические нагрузки рекомендуются.
Неблагоприятный прогноз у больных миокардитом во много обусловлен развитием тяжелых желудочковых НРС. Выделяют две клинические ситуации, которые определяют различные подходы к лечению аритмий и профилактике внезапной смерти у таких больных:
- острый и фульминантый миокардиты с рефрактерными злокачественными желудочковыми тахиаритмиями, тяжелой СН и плохим краткосрочным прогнозом, обусловленным мультисистемной недостаточностью. Имплантация постоянных устройств таким пациентам, как правило, нецелесообразна.
- ВКМП с левожелудочковой дисфункцией и высоким риском внезапной сердечной смерти (ВСС) как при ДКМП [98].
- При остром и фульминантном миокардитах использование постоянных электрокардиостимуляторов (ЭКС), кардиовертеров-дефибрилляторов (ИКД) и проведение сердечной ресинхронизирующей терапии (СРТ) не рекомендуется до разрешения острой ситуации и повторной оценки необходимости их применения [5, 98].
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
Комментарии: У таких пациентов, при наличии показаний, рекомендуется использование временной электрокардиостимуляции и носимых дефибрилляторов. Так как состояние пациента может значительно улучшиться вплоть до полного выздоровления, показания и выбор оптимального времени для имплантации постоянных ИКД и ЭКС остаются предметом обсуждения.
- Пациентам с брадикардией и/или блокадой, являющихся триггером желудочковой аритмии, в острую фазу миокардита/панкардита рекомендуется установка временного ЭКС [5, 50, 98].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Нарушения проводимости различной степени тяжести часто развиваются при миокардитах, вызванных болезнью Лайма и дифтерией. Временная электрокардиостимуляция показана при наличии симптомных дисфункции синусового узла и атриовентрикулярной блокады.
- Назначение антиаритмической терапии рекомендуется пациентам с симптомной неустойчивой желудочковой тахикардией в острой фазе миокардита [50, 98].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- Постановка ИКД или ЭКС у пациентов с ВКМП рекомендуется после разрешения острой стадии заболевания [5, 98].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- Пациентам с нарушением гемодинамики и устойчивой желудочковой тахикардией, развившейся вне острого ухудшения, имплантация ИКД рекомендуется, если ожидаемая продолжительность жизни больного больше одного года при хорошем функциональном статусе [98].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- Использование носимых дефибрилляторов рекомендуется пациентам с миокардитом и тяжелой левожелудочковой дисфункцией и/или желудочковой электрической нестабильностью в качестве "моста" до полного восстановления или имплантации ИКД [98].
Уровень убедительности рекомендаций достоверности IIa (Уровень доказательств C).
- Постановка ИКД рекомендуется в более ранние сроки пациентам с гигантоклеточным миокардитом и саркоидозом, у которых были гемодинамически значимые устойчивые желудочковые нарушения ритма сердца или остановка кровообращения, если ожидаемая продолжительность жизни больного больше одного года при хорошем функциональном статусе [98].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
Комментарии: Более ранняя имплантация ИКД у больных гигантоклеточным миокардитом и саркоидозом сердца обусловлена более неблагоприятным прогнозом этих заболеваний и высокой вероятностью развития рефрактерного электрического шторма с устойчивой желудочковой тахикардией и фибрилляцией желудочков, несмотря на агрессивную антиаритмическую терапии [123]
- В качестве дополнительного признака повышенного риска ВСС и показания для имплантации ИКД рекомендуется рассматривать персистирующие воспалительные инфильтраты в миокарде, выявленные иммуногистологическим методом, и/или аномально расположенный фиброз, обнаруженный при МРТ после острого миокардита [98].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
Комментарии: По данным недавно проведенного исследования, включившего 405 пациентов с подозрением на миокардит, у всех умерших внезапно или имевших остановку кровообращения и срабатывания ИКД, при МРТ выявлялись зоны фиброза. [124].
Показания к антиаритмической терапии, имплантации ИКД и ЭКС, а также СРТ у пациентов с ВКМП вне острой стадии такие же, как и при неишемической ДКМП, изложены в клинических рекомендациях по лечению СН, желудочковых аритмий и профилактике внезапной смерти [98, 99].
3.2 Специфическая терапия
Имеются сообщения о результатах более 20 клинических исследований, в ходе которых использовались иммуносупрессивные, иммуномодулирующие или противовоспалительные средства, а также иммуноабсорбционная терапия.
3.2.1 Иммуносупрессивная терапия
Эффективность применения иммуносупрессивной терапии оценивали в ходе выполнения нескольких относительно крупных и большого числа небольших исследований [56, 125, 126]. Результаты этих работ противоречивы и не стали основанием для применения иммуносупрессии в качестве стандартной терапии при лечении больных воспалительной кардиомиопатией.
Обоснованность результатов большинства выполненных на сегодняшний день исследований, по мнению экспертов, ограничена, в первую очередь, в связи с тем, что в них не применялись иммуногистохимические и молекулярно-генетические методы биологического анализа биоптатов. Кроме того, в некоторых исследованиях не было контрольной группы или включались пациенты в ранние сроки миокардита, когда высока вероятность полного выздоровления даже без лечения [127].
Исследование TIMIC (Immunosuppressive Therapy in Patients With Virus Negative Inflammatory Cardiomyopathy) [126] было первым рандомизированным двойным слепым плацебо-контролируемым исследованием, в ходе выполнения которого у использовались гистологические и иммуногистохимические критерии воспаления. Для исключения вирусной инфекции все образцы ткани сердца изучались с помощью ПЦР. Результаты исследования TIMIC показали высокую эффективность применения сочетанной иммуносупрессивной терапии преднизолоном** и азатиоприном** у больных с вируснегативной воспалительной кардиомиопатией. Однако для подтверждения результатов требуется проведение многоцентрового исследования.
Отдельную группу составляют пациенты с доказанными аутоиммуными формами миокардита, включая гигантоклеточный, эозинофильные и токсические миокардиты, саркоидоз сердца и миокардиты, ассоциированные с экстракардиальными аутоиммунными заболеваниями. Назначение таким пациентам иммуносупрессивной терапии (кортикостероиды в виде монотерапи или в сочетании с азатиоприоном или циклоспорином) выглядит более обоснованным [50, 128].
- Иммуносупрессивную терапию рекомендуется начинать только после исключения активной инфекции в миокарде с использованием ЭМБ и ПЦР-диагностики [5].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
- Иммуносупрессивная терапия рекомендуется при доказанных аутоиммунных (инфекций-негативных) формах миокардита, включая гигантоклеточный, эозинофильный и токсический миокардиты, саркоидоз сердца и миокардиты, ассоциированные с экстракардиальными аутоиммунными заболеваниями при отсутствии противопоказаний к иммуносупрессии [5, 50, 128].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
Комментарии: Рекомендации основаны на опыте лечения экстракардиальных аутоиммунных заболеваний. Терапия включает кортикостероиды либо в виде монотерапии (при саркоидозе, эозинофильном и токсическом миокардите), либо в сочетании с иммуносупрессорами (азатиоприн**, циклоспорин**) при других миокардитах. Схема лечения гигантоклеточного миокардита остается дискутабельной. Во многом она схожа с иммуносупрессивной терапией в ранние сроки после трансплантации сердца. Имеющиеся данные свидетельствуют, что использование двойной (метилпреднизолон** и циклоспорин**) или тройной комбинации иммуносупрессивных препаратов различных групп (метилпреднизолон**, циклоспорин** и азатиоприн**) приводит к увеличению продолжительности жизни больных гигантоклеточным миокардитом [128, 129]. Возможно использование и других цитостатиков (микофенолата мофетил**) и ингибиторов кальциневрина (такролимус**). Обсуждается целесообразность использование антилимфоцитарных моно- и поликлональные антитела (антитимоцитарный иммуноглобулин** и другие). Доза метилпреднизолона** в среднем составляет 1 мг/кг/сутки (в первые несколько суток при тяжелом состоянии пациента возможно введение до 1000 мг/сутки), с последующим постепенным снижением дозы до поддерживающей 5 - 10 мг через несколько месяцев терапии, азатиоприна** - 2 мг/кг/сутки, доза циклоспорина** определяется по его концентрации в крови. Длительность терапии не определена, но составляет не менее 1 года. Прекращение применения иммуносупрессантов может приводить к развитию рецидива гигантоклеточного миокардита, а в некоторых случаях к развитию смертельного исхода. Несмотря на активную иммуносупрессивную терапию, смертность и частота направления на трансплантацию больных гигантоклеточным миокардитом остаются достаточно высокими.
- Назначение кортикостероидов рекомендуется больным саркоидозом сердца и дисфункцией желудочков и/или аритмией, а также при некоторых формах инфекционно-негативных эозинофильного и токсического (лекарственного) миокардитов в сочетании с СН и/или аритмией [5, 50].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: При саркоидозе сердца раннее применение иммуносупрессивной терапии, включающей высокие дозы кортикостероидов, сопровождается улучшением функции сердца. Имеется большая вариабельность данных с диапазоном 5-летней выживаемости от 60 до 90%. При саркоидозе сердца стартовая доза преднизолона, как правило, составляет 30 мг/сутки, в последующем - от 5 до 10 мг/сутки [50]. Дозы кортикостероидов в других ситуациях не определены. Описан случай успешного применения метилпреднизолона** у пациента с тяжелым эозинофильным миокардитом и кардиогенным шоком. Стартовая доза составила 1000 мг/сутки внутривенно в течение 3 дней с переходом на 50 мг/сутки [130].
- Пациентам с инфекционно-негативным лимфоцитарным миокардитом, рефрактерным к стандартной терапии, рекомендуется назначение иммуносупрессивной терапии при отсутствии у пациента противопоказаний к ней [5].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
Комментарии: Общепринятая схема иммуносупрессивной терапии при лимфоцитарном миокардите отсутствует. В исследовании TIMIC использовалась комбинация преднизолона** в дозе 1 мг/кг/сутки в течении 4 недель и 0,33 мг/кг/сутки в течение последующих 5 месяцев и азатиоприна** в дозе 2 мг/кг/сутки [126]. Двойная терапия требует еженедельного в течение 1 месяца контроля за количеством лейкоцитов и печеночными ферментами. Снижение количества лейкоцитов до уровня менее 3000 кл/мл или лимфоцитов менее 1000 кл/мл служит показанием для отмены терапии.
- Для определения интенсивности и длительности иммуносупрессивной терапии рекомендуется проведение повторной ЭМБ [5].
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
3.2.2 Иммуноглобулины
- Использование иммунноглобулинов для лечения миокардита у взрослых не рекомендуется.
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C) [131]
Комментарий: Предположение о возможности применения иммуноглобулинов при лечении вирусного миокардита основывается на данных об их противовирусном и иммуномодулирующем эффектах. Однако результаты исследований свидетельствуют о том, что при недавно развившемся миокардите или ДКМП, внутривенное введение иммуноглобулина по сравнению с плацебо не приводило к дополнительному улучшению функции ЛЖ [131]. В то же время применение такой терапии у детей с острым миокардитом сопровождалось улучшением функции ЛЖ и выживаемости в течение первого года после лечения [132]. Следует отметить, что последнее исследование не было рандомизированным.
3.2.3 Иммунноабсорбция
Метод направлен на удаление антикардиальных антител к различным белкам клеток сердца, которые выявляются у больных с ДКМП и миокардитами. Имеются ограниченные данные о том, что удаление циркулирующих антител с помощью иммуноабсорбции приводит к улучшению гемодинамических показателей, уменьшению клинических и гуморальных маркеров тяжести СН, а также выраженности воспаления у больных ДКМП и ВКМП [133 - 138]. Данные исследования были небольшими и их результаты не могут служить обоснованием применения этого метода в клинической практике.
- Использование иммуноабсорбции для лечения миокардита не рекомендуется [131].
Уровень убедительности рекомендаций III, (Уровень достоверности доказательств C)
Комментарии: В настоящее время в Европе проводится многоцентровое рандомизированное двойное слепое проспективное исследование по оценке эффектов иммуноабсорбции на функцию сердца у 200 больных с ДКМП. Завершение исследования ожидается в конце 2019 года. До получения его результатов использование иммуноабсорбции не рекомендуется.
3.2.4 Противовирусная терапия
Лечение ацикловиром**, ганцикловиром** и валацикловиром может рассматриваться у пациентов с герпетической инфекцией [139], однако эффективность этих препаратов при миокардите не доказана. В экспериментальной модели миокардита, вызванного вирусом Коксаки B3 у мышей, были получены данные о том, что применение интерферона бета** защищает миоциты от повреждения и приводит к уменьшению вирусной нагрузки в сердце и инфильтрации миокарда клетками воспаления [140]. В ходе выполнения обсервационного исследования применение интерферона бета** у больных с персистенцией энтеровирусов и аденовирусов в миокарде и дисфункцией ЛЖ приводило к элиминации вирусного генома у всех больных, а также к улучшению функции ЛЖ у 15 из 22 больных [141]. Результаты позднее выполненного рандомизированного плацебо-контролируемого исследования BICC (Betaferon in patients with chronic viral cardiomyopathy), которое включало 143 больных с ДКМП воспалительной природы, с подтвержденной вирусной инфекцией в миокарде, свидетельствовали о том, что применение интерферона бета-1-b, приводило к статистически значимому уменьшению вирусной нагрузки (энтеровирусами) в миокарде, но в целом не позволяло добиться полной элиминации вируса (в первую очередь парвовируса B19) у всех больных. В ходе выполнения этого исследования оценивались разные показатели, но было отмечено лишь улучшение функционального класса СН по классификации NYHA и оценки больными своего состояния в целом [142].
- Использование интерферона бета-1b у больных миокардитом рекомендуется в случае доказанного наличия энтеровирусов в миокарде пациента.
Уровень убедительности рекомендаций IIb (Уровень достоверности доказательств C).
Комментарий: Необходимо привлекать инфекционистов к принятию решения о целесообразности использования специфической противовирусной терапии [5].
3.2.5 Нестероидные противовоспалительные средства
- Назначение нестероидных противовоспалительных средств пациентам с миокардитом не рекомендуется.
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
Комментарии: В экспериментальных моделях острого вирусного миокардита у мышей применение индометацина и других нестероидных противовоспалительных средств (НПВС) приводило к увеличению выраженности воспаления в миокарде и увеличению смертности животных [143, 144]. Применение НПВС в минимально необходимых дозах можно рассматривать только при лечении больных с перимиокардитом, у которых отсутствуют нарушения функции ЛЖ, и имеются выраженные боли в грудной клетке, обусловленные перикардитом.
4. Реабилитация
При проведении реабилитации больных миокардитом следует принять во внимание следующие рекомендации, основанные на мнении экспертов.
- В острую фазу миокардита, рекомендуется избегать аэробных физических нагрузок. В дальнейшем, в зависимости от улучшения симптомов и стабилизации состояния пациента (с исчезновением воспалительных инфильтратов при ЭМБ), рекомендуется физическая активность от низкой до умеренной интенсивности.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
- Рекомендуется прекращение занятий профессиональным и любительским спортом по крайней мере на 6 месяцев от начала миокардита.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: Возобновление занятий спортом возможно, только если функция левого желудочка и размеры камер сердца вернутся к нормальным значениям и будут отсутствовать клинические значимые НРС при холтеровском мониторировании ЭКГ.
- Пациентов в острой фазе миокардита (определенной по данным ЭМБ) или, когда диагноз предполагается на основании клинической картины (сниженная ФВЛЖ, жидкость в перикарде или НРС), не рекомендуется включать в программы тренировок [145].
Уровень убедительности рекомендаций III (Уровень достоверности доказательств C).
- В подострой фазе (по данным ЭМБ), если функция ЛЖ и размеры сердца вернулись к нормальным значениям и отсутствует клинически значимая аритмия, рекомендуется начать тренировочные упражнения низкого уровня (уровень 6 - 8 по шкале Борга (см. приложение Г1)). Рекомендуются низкоинтенсивные непрерывные или интервальные тренировки с медленным и постепенным увеличением частоты сердечных сокращений (ЧСС) [145].
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- После разрешения воспаления по данным ЭМБ, восстановления функции сердца и нормализации ЭКГ рекомендуется выполнение симптом-лимитированного теста для определения программы физических тренировок [145].
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C).
Комментарии: В большинстве случаев ЭМБ не доступна и следует ориентироваться на неинвазивные методы исследования - ЭКГ, 24-часовое мониторирование ЭКГ и ЭХОКГ. Если эти методы выявляют небольшие функциональные или структурные изменения, то проведения симптом-лимитированного стресс-теста (велоэргометрия, тредмилтест, тест 6-минутной ходьбы) является необходимым для начала физических тренировок. Безопасность аэробных тренировок можно повысить если предварительно провести кардиопульмональный стресс-тест с определением анаэробного порога, достижение которого следует в дальнейшем избегать. Физические тренировки должны проводиться под руководством врача и использованием мониторирования ЭКГ. Также необходим частый контроль функции ЛЖ при помощи ЭХОКГ и определение уровня BNP/NT-proBNP.
Выполнение рекомендаций по физическим нагрузкам во многом зависит от взаимодействия между врачом и пациентом, которое необходимо для индивидуализации программы тренировки. Также пациентам и членам семей необходимо оказывать психологическую поддержку и проводить психологическое консультирование с целью разрешения проблем адаптации пациента в семье и обществе, содействия сохранению семейных связей и переориентации семейных ролей в связи с болезнью члена.
Реабилитация пациентов, у которых миокардит осложнился развитием ДКМП и СН, должна проводиться в соответствии с клиническими рекомендациями по лечению СН.
5. Профилактика
- Пациентам после перенесенного острого миокардита рекомендуется диспансерное наблюдение.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств C)
Комментарии: Диспансерное наблюдение проводится с целью мониторинга клинико-лабораторных параметров, оптимизации медикаментозного лечения, раннего выявления рецидива заболевания, а также формирования приверженности пациентов к терапии. Длительность наблюдения и частота визитов зависят от исхода миокардита. В случае развития ДКМП пациенты подлежат диспансерному наблюдению также, как и больные ХСН. Остальные пациенты, в том числе с полным восстановлением функций сердца, по мнению большинства экспертов, должны наблюдаться в течение года.
- Диспансерные визиты к врачу рекомендуется проводить 1 раз в 3 - 4 месяца.
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- В ходе диспансерных визитов к врачу рекомендуется проводить электрокардиографию, ЭХОКГ, холтеровское мониторирование ЭКГ.
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- У пациентов, имевших клиническую картину миокардита по типу инфаркта миокарда, непораженные коронарные артерии и сохранную функцию желудочков при диспансерном наблюдение рекомендуется контролировать уровень биомаркеров некроза миокарда (тропонин T и I).
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
- В случае длительного (недели или месяцы) повышения концентраций биомаркеров некроза миокарда и/или снижения функции левого и/или правого желудочка рекомендуется повторная госпитализация и ЭМБ.
Уровень убедительности рекомендаций IIa (Уровень достоверности доказательств C).
Комментарии: Постоянное повышении концентрации тропонина T может быть обусловлено гетерофильными антителами, в связи с чем необходимо определение тропонина I для исключения аналитической ошибки.
Специфические меры профилактики миокардита не разработаны.
- Для снижения риска заболевания миокардитом рекомендуется соблюдать меры гигиены, предосторожности при контакте с инфекционными больными, избегать укусов клещей, проводить вакцинацию против кори, краснухи, паротита, гриппа, полиомиелита.
Уровень убедительности рекомендаций IIa. (Уровень достоверности доказательств C).
Комментарии: Вакцинация против других кардиотропных вирусов показали хорошие результаты в отношении предотвращения развития миокардитов у животных, но исследований у людей не было.
6. Дополнительная информация, влияющая на течение и исход заболевания
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Этап постановки диагноза
1.
Выполнена регистрация 12-канальной электрокардиографии
C
I
2.
Выполнено исследование концентрации тропонинов T и I
C
I
3.
Выполнено исследование уровня мозгового натрийуретического пептида и/или N-терминального фрагмента натрийуретического пропептида мозгового
4.
Выполнено исследование уровня C-реактивного белка в сыворотке крови
C
I
5.
Выполнено определение содержания антител к антигенам миокарда в крови
C
I
6.
Выполнена трансторакальная эхокардиография
C
I
7.
Выполнена магнитно-резонансная томография сердца с контрастированием (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний)
C
IIa
8.
Выполнена коронароангиография
C
IIa
9.
Выполнена эндомиокардиальная биопсия (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний)
B
I
10.
Выполнено исследование биоптатов сердца с использованием метода полимеразно-цепной реакции перед проведением иммуносупрессивной терапии
C
I
Этап лечения
1.
Проведена терапия бета-блокаторами больным миокардитом и сердечной недостаточностью
C
I
2.
Проведена терапия диуретиками у больных с миокардитом и сердечной недостаточностью для ликвидации симптомов сердечной недостаточности
C
I
3.
Проведена терапия ингибиторами ангиотензинпревращающего фермента или блокаторами рецепторов ангиотензина II у больных миокардитом и сердечной недостаточностью
C
I
4.
Проведена терапия блокаторами минералкортикоидных рецепторов больным миокардитом и симптоматической сердечной недостаточностью
C
I
5.
Выполнена установка временного электрокардиостимулятора пациентам с брадикардией и/или блокадой, являющейся триггером желудочковой аритмии, в острую фазу миокардита или панкардита.
C
I
6.
Применены устройства для механической поддержки гемодинамики или экстракорпоральной мембранной оксигенации в качестве временного вмешательства до выздоровления больного или выполнения трансплантации сердца пациентами с нестабильной гемодинамикой, кардиогенным шоком, обусловленным фульминантным миокардитом
C
IIa
7.
Проведена иммуносупрессивная терапия пациентам с доказанными аутоиммунными (инфекций-негативными) формами миокардита, включая гигантоклеточный, эозинофильный и токсический миокардиты, саркоидоз сердца и миокардиты, ассоциированные с экстракардиальными аутоиммунными заболеваниями при отсутствии противопоказаний к иммуносупрессии
C
IIa
8.
Назначены кортикостероиды больным саркоидозом сердца с дисфункцией желудочков и/или аритмией, инфекционно-негативным эозинофильным и токсическим (лекарственным) миокардитами с сердечной недостаточностью и/или аритмией
C
I
Список литературы
1. Richardson P., McKenna W., Bristow M. et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation 1996; 93: 841 - 842.
2. Cooper L.T. Jr: Myocarditis. N Engl J Med 2009; 360: 1526.
3. Magnani J.W., Deg G.W. Myocarditis: Current Trends in Diagnosis and Treatment. Circulation. 2006; 113: 876 - 890.
4. Dennert R., Crijns H.L., Heymans S. Acute viral myocarditis. Eur. Heart J. 2008; 29: 2073 - 2082.
5. Caforio A.L., Pankuweit S., Arbustini E., Basso C., Gimeno-Blanes J., Felix S.B., Fu M., Helio T., Heymans S., Jahns R., Klingel K., Linhart A., Maisch B., McKenna W., Mogensen J., Pinto Y.M., Ristic A., Schultheiss H.P., Seggewiss H., Tavazzi L., Thiene G., Yilmaz A., Charron P., Elliott P.M. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34: 2636 - 2648.
6. Kawai C. Idiopathic cardiomyopathy: a study on the infectiousimmune theory as a cause of the disease. Jpn Circ J. 1971; 35: 765 - 770.
7. Kawai C, Matsumori A, Kitaura Y, Takatsu T. Viruses and the heart: viral myocarditis and cardiomyopathy. Prog Cardiol. 1978; 7: 141 - 162.
8. Gauntt C. and Huber S. Coxsackievirus experimental heart diseases. Frontiers in Bioscience 2003; 8: 23 - 35.
9. Takeda N. Cardiomyopathy: molecular and immunological aspects. Int J Mol Med. 2003 Jan; 11(1): 13-6.
10. Mason J.W. Myocarditis and dilated cardiomyopathy: an inflammatory link. Cardiovasc Res. 2003 Oct 15; 60(1): 5 - 10.
11. Ellis C.R., Di Salvo T. Myocarditis: basic and clinical aspects. Cardiol. Rev 2007 15; 170 - 177.
12. Lee G.H., Badorff C., Knowlton K.U. Dissociation of sarcoglycans and the dystrophin carboxyl terminus from the sarcolemma in enteroviral cardiomyopathy. Circ Res 2000; 87: 489 - 495.
13. Huber S.A. Animal models: immunological aspects. In: Banatvla JE, ed. Viral Infections in the Heart. London, UK: Edward Arnold; 1993: 82 - 109.
14. Bergelson J.M., Cunningham J.A., Droguett G., et al. Isolation of a common receptor for coxsackie B viruses and adenoviruses 2 and 5. Science 1997; 275: 1320-3.
15. Bergelson J.M., Mohanty J.G., Crowell RL, et al. Coxsackievirus B3 adapted to growth in RD cells binds to decay-accelerating factor (CD55). J Virol 1995; 69: 1903-6.
16. Shafren D.R., Bates R.C., Agrez M.V., et al. Coxsackieviruses B1, B3, and B5 use decay accelerating factor as a receptor for cell attachment. J Virol 1995; 69: 3873-7.
17. Coyne C., Bergelson J. CAR: a virus receptor within the tight junction. Adv Drug Deliv Rev 2005; 57: 869-82.
18. Shi Y., Chen C., Lisewski U., et al. Cardiac deletion of the coxsackievirus-adenovirus receptor abolishes coxsackievirus B3 infection and prevents myocarditis in vivo. J Mol Cell Cardiol 2009; 53 (14): 1219-26.
19. Badorff C., Lee G.H., Lamphear B.J. et al. Enteroviral protease 2A cleaves dystrophin: evidence of cytoskeletal disruption in an acquired cardiomyopathy. Nat Med 1999; 5: 320-6.
20. Tomko R., Xu R., Philipson L. HCAR and MCAR: the human and mouse cellular receptors for subgroup C adenoviruses and group B coxsackieviruses. Proc Natl Acad Sci USA 1997; 94: 3352-6.
21. Huber S.A., Autoimmunity in coxsackievirus B3 induced myocarditis. Autoimmunity 2006; 39: 55 - 61.
22. Wickham T.J., Filardo E.J., Cheresh D.A., et al. Integrin alpha v beta 5 selectively promotes adenovirus mediated cell membrane permeabilization. J Cell Biol 1994; 127: 257 - 264.
23. Fechner H., Noutsias M., Tschoepe C., et al: Induction of coxsackievirus-adenovirus-receptor expression during myocardial tissue formation and remodeling: identification of a cell-to-cell contact-dependent regulatory mechanism. Circulation 2003; 107: 876 - 882.
24. Kashimura T., Kodama M., Hotta Y., et al. Spatiotemporal changes of coxsackievirus and adenovirus receptor in rat hearts during postnatal development and in cultured cardiomyocytes of neonatal rat. Virchows Arch 2004; 444: 283 - 292.
25. Brown K.E., Hibbs J.R., Gallinella G., et al. Resistance to parvovirus B19 infection due to lack of virus receptor (erythrocyte P antigen). N Engl J Med. 1994 Apr 28; 330(17): 1192-6.
26. Weigel-Kelley K.A., Yoder M.C., Srivastava A. Recombinant human parvovirus B19 vectors: erythrocyte P antigen is necessary but not sufficient for successful transduction of human hematopoietic cells. J Virol. 2001; 75(9): 4110.
27 Weigel-Kelley K.A., Yoder M.C., Srivastava A. Alpha5beta1 integrin as a cellular coreceptor for human parvovirus B19: requirement of functional activation of beta1 integrin for viral entry. Blood. 2003 Dec 1; 102(12): 3927-33.
28.  B.D., Sotlar K., Klingel K. Parvovirus B19. N Engl J Med. 2004 May 6; 350(19): 2006-7.
B.D., Sotlar K., Klingel K. Parvovirus B19. N Engl J Med. 2004 May 6; 350(19): 2006-7.
29. Pankuweit S., Ruppert V., Maisch B. Inflammation in dilated cardiomyopathy. Herz 2004; 29: 788 - 793.
30. Pankuweit S., Portig I., Maisch B., et al. Pathophysiology of cardiac inflammation: Molecular mechanisms. Herz 2002; 27: 669 - 676.
31. Maisch B., Ristic A., Hufnagel G., et al. Pathophysiology of viral myocarditis. The role of humoral immune response. Cardiovasc Pathol 2002; 11: 112 - 122.
32. Burch G.E., Giles T.D. The role of viruses in the production of heart disease. Am J Cardiol. 1972 Feb; 29(2): 231-40.
33. Koontz C.H., Ray C.G. The role of coxsackievirus B infections in sporadic myopericarditis. Am Heart J. 1971 Dec; 82(6): 750-8.
34. Pongpanich B., Boonpucknavig S., Was C., et al. Immunopathology of acute rheumatic fever and rheumatic heart disease. The demonstration of Coxsackie group B viral antigen in the myocardium. Clin Rheumatol. 1983 Sep; 2(3): 217-22.
35. Habara M., Fujieda H., Nakamura Y. Images in cardiology. Atrial myocarditis: a possible cause of idiopathic enlargement of bilateral atria. Heart. 2006; 92(6): 842.
36. Frantz S., Kelly R.A., Bourcier T. Toll-like receptors and the cardiovascular system. In: Feuerstein GZ, Libby P, Mann DL, editors. Inflammation and cardiac diseases. Basel, Switzerland: Birkhauser Verlag. 2003: 129-41.
37. Kyto V., Sipila J., Rautava P. The effects of gender and age on occurrence of clinically suspected myocarditis in adulthood. Heart. 2013 Nov. Vol. 99(22). P. 1681 - 1684. doi: 10.1136/heartjnl-2013-304449.
38. Magnani J.W., Danik H.J., Dec G.W. Jr., DiSalvo T.G. Survival in biopsy-proven myocarditis: a long-term retrospective analysis of the histopathologic, clinical, and hemodynamic predictors. Am Heart J. 2006. Vol. 151. P. 463 - 470. doi: 10.1016/j.ahj.2005.03.037.
39. Fairweather D., Cooper L.T.Jr., Blauwet L.A. Sex and gender differences in myocarditis and dilated cardiomyopathy. Curr Probl Cardiol. 2013. Vol. 38. P. 7 - 46. doi: 10.1016/j.cpcardiol.2012.07.003.
40. Saji T., Matsuura H., Hasegawa K., Nishikawa T., Yamamoto E., Ohki H., Yasukochi S., Arakaki Y., Joo K., Nakazawa M. Comparison of the clinical presentation, treatment, and outcome of fulminant and acute myocarditis in children. Circ J. 2012. Vol. 76. P. 1222 - 1228.
41. Kawai C. From myocarditis to cardiomypathy: mechanisms of inflammation and cell death: learning from the past for the future. Circulation 1999; 99: 1091 - 1100.
42. Feldman A.M., McNamara D. Myocarditis. N. Engl. J. Med., 2000. 343: 1388 - 1398.
43. Sekiguchi M., Take M. World survey of catheter biopsy of the heart. In: Sekiguchi M, Olsen EG, editors. Cardiomyopathy: clinical, pathological and theoretical aspects. Baltimore, USA: University Park Press, 1988. p. 217-25.
44. Grist N.R., Bell E.J. A six-year study of coxsackievirus B infections in heart disease. J. Hyg. (London) 73: 165 - 172, 1974.
45. Gaaloul et al. Sudden unexpected death related to enterovirus myocarditis: histopathology, immunohistochemistry and molecular pathology diagnosis at post-mortem. BMC Infectious Diseases 2012 12: 212.
46. Bowles N.E., Ni J., Kearney D.L., et al. Detection of viruses in myocardial tissues by polymerase chain reaction: Evidence of adenovirus as a common cause of myocarditis in children and adults. J Am Coll Cardiol 42: 466, 2003.
47. Mahrholdt H., Wagner A., Deluigi C.C., et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation 2006; 114: 1581 - 1590.
48. Schultz J.C, Hiliard A.A, Cooper L.T. et al. Diagnosis and treatment of viral myocarditis. Mayo Clin Proc. 2009: 84(11): 1001-9.
49. Aretz H.T., Billingham M.E., Edwards W.D. et al. Myocarditis: A histopathologic definition and classification. Am J Cardiovasc Pathol 1: 3, 1987.
50. Guidelines for diagnosis and treatment of myocarditis (JCS 2009): digest version. Circ J 2011 4; 75(3): 734-43. Epub 2011 Feb 4.
51. Klein R.M., Jiang H., Niederacher D., et al. Frequency and quantity of the parvovirus B19 genome in endomyocardial biopsies from patients with suspected myocarditis or idiopathic left ventricular dysfunction. Z Kardiol. 2004; 93: 300 - 309.
52. Палеев Н.Р., Палеев Ф.Н. Классификация некоронарогенных заболеваний миокарда. Кардиология, 2008, N 9, с. 53 - 58.
53. Lieberman E.B., Hutchins G.M., Herskowitz A., Rose N.R., Baughman K.L. Clinicopathologic description of myocarditis. J. Am Coll. Cardiol. - 1991. - Vol. 18, N 7. - P. 1617 - 1626.
54. Dec G.W. Introduction to clinical myocarditis. Cooper L.T. (eds). Totowa, New Jersey: Humana Press; 2003. 257 - 281.
55 Mestroni L., Maisch B., McKenna W.J., et al. Guidelines for the study of familial dilated cardiomyopathies. European Heart Journal. 1999; 20: 93 - 102.
56. Hufnagel G., Pankuweit S., Richter A., Schonian U., Maisch B. The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID): first epidemiological results. Herz. 2000; 25(3): 279 - 285.
57. Brown C.A., O'Connel J.B. Implications of the myocarditis treatment trial for clinical practice. Curr Opin Cardiol. 1996; 11: 332 - 336.
58. Mason J.W., Sanjeev T., Renlund D.G. Myocarditis. Cardiovascular Medicine. - 3rd edition/James T. Willerson, Hein J.J. Wellens, Jay N. Cohn and David R. Holmes Jr. - Springer, 2007. - Vol. 1. - P. 1313 - 1347.
59. Brady W.J., Ferguson J.D., Ullman E.A., Perron A.D. Myocarditis: emergency department recognition and management. Emerg. Med. Clin. North Am. - 2004. - Vol. 22(4). - P. 865 - 885.
60. Caforio A.L.P, Brucato A., Doria A., Brambilla G., Angelini A., Ghirardello A., Bottaro S., Tona F., Betterle C., Daliento L., Thiene G., Iliceto S. Anti-heart and anti-intercalated disk autoantibodies: evidence for autoimmunity in idiopathic recurrent acute pericarditis. Heart 2010; 96: 779 - 784.
61. Deswal A., Petersen N.J., Feldman A.M., Young J.B., White B.G., Mann D.L. Cytokines and cytokine receptors in advanced heart failure: an analysis of the cytokine database from the Vesnarinone trial (VEST). Circulation 2001; 103: 2055 - 2059.
62. Jensen J., Ma L.P., Fu M.L., Svaninger D., Lundberg P.A., Hammarsten O. Inflammation increases NT-proBNP and the NT-proBNP/BNP ratio. Clin Res Cardiol 2010; 99: 445 - 452.
63. Lauer B., Schannwell M., ![]() U., Strauer B.E., Schultheiss H.P. Antimyosin autoantibodies are associated with deterioration of systolic and diastolic left ventricular function in patients with chronic myocarditis. J Am Coll Cardiol 2000; 35: 1106 - 1110.
U., Strauer B.E., Schultheiss H.P. Antimyosin autoantibodies are associated with deterioration of systolic and diastolic left ventricular function in patients with chronic myocarditis. J Am Coll Cardiol 2000; 35: 1106 - 1110.
64. Heymans S. Myocarditis and heart failure: need for better diagnostic, predictive, and therapeutic tools. Eur Heart J 2007; 28: 1279 - 1280.
65. Kuhl U., Schulthheiss H.P. Viral myocarditis. Swiss Md Wkly. 2014; 144: w14010.
66. de Filippi C.R., de Lemos J.A., Christenson R.H., et al. Association of serial measures of cardiac troponin T using a sensitive assay with incident heart failure and cardiovascular mortality in older adults. JAMA 2010; 304: 2494 - 2502.
67 Liu P., Martino T., Opavsky M.A., Penninger J. Viral myocarditis: balance between viral infection and immune response. Can J Cardiol 1996; 12: 935 - 943.
68. ![]() U., Pauschinger M., Noutsias M., Seeberg B., Bock T., Lassner D., Poller W., Kandolf R., Schultheiss H.P. High prevalence of viral genomesand multiple viral infections in the myocardium of adults with 'Idiopathic' left ventricular dysfunction. Circulation 2005; 111: 887 - 893.
U., Pauschinger M., Noutsias M., Seeberg B., Bock T., Lassner D., Poller W., Kandolf R., Schultheiss H.P. High prevalence of viral genomesand multiple viral infections in the myocardium of adults with 'Idiopathic' left ventricular dysfunction. Circulation 2005; 111: 887 - 893.
69. Mahfoud F.,  B., Kindermann M., Ukena C., Gadomski K., Klingel K., Kandolf R.,
B., Kindermann M., Ukena C., Gadomski K., Klingel K., Kandolf R.,  M., Kindermann I. Virus serology in patients with suspected myocarditis: utility or futility?. Eur Heart J 2011; 32: 897 - 903.
M., Kindermann I. Virus serology in patients with suspected myocarditis: utility or futility?. Eur Heart J 2011; 32: 897 - 903.
70. Caforio A.L., Calabrese F., Angelini A., Tona F., Vinci A., Bottaro S., Ramondo A., Carturan E., Iliceto S., Thiene G., Daliento L. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J 2007; 28: 1326 - 1333.
71. Ukena C., Mahfoud F., Kindermann I., Kandolf R., Kindermann M., Bohm M. Prognostic electrocardiographic parameters in patients with suspected myocarditis. Eur JHeart Fail 2011; 13: 398 - 405.
72. Celia M., Oakley. Myocarditis//Education in heart. Series editor Piter Mills. - BMJ Books, 2001. - Vol. 1. - P. 221 - 223.
73. Kuhl U. Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation - 2005. - V. 212. - P. 1965 - 1970.
74. Yilmaz A., Klingel K., Kandolf R., Sechtem U. Imaging in inflammatory heart disease: from the past to current clinical practice. Hellenic J Cardiol 2009; 50: 449 - 460.
75. Felker G.M., Boehmer J.P., Hruban R.H., Hutchins G.M., Kasper E.K., Baughman K.L., Hare J.M. Echocardiographic findings in fulminant and acute myocarditis. J Am Coll Cardiol 2000; 36: 227 - 232.
76. Pinamonti B., Alberti E., Cigalotto A., Dreas L., Salvi A., Silvestri F., Camerini F. Echocardiographic findings in myocarditis. Am J Cardiol 1988; 62: 285 - 291.
77. Friedrich M.G., Sechtem U., Schulz-Menger J., et al. Cardiovascular Magnetic Resonance in Myocarditis: A JACC White Paper. 2009; 53(17): 1475 - 1487.
78. Сафиуллина А.А., Нарусов О.Ю., Шария М.А., Ширяев Г.А., Алаева Е.Н., Щедрина, А.Ю., Скворцов А.А., Терещенко С.Н. Роль магнитно-резонансной томографии в диагностике воспалительных заболеваний миокарда. Кардиологический вестник, 2012; 7(1): 41 - 47.
79. Сафиуллина А.А., Шария М.А., Нарусов О.Ю. Алаева Е.Н., Терещенко С.Н. Диагностические возможности магнитно-резонансной томографии сердца у больных с воспалительной кардиомиопатией: сопоставление результатов с данными эндомиокардиальной биопсии и клинической картиной. Журнал "Терапевтический архив" 2013, N 4, стр. 22 - 28.
80. Voigt A., Elgeti T., Durmus T. et al. Cardiac Magnetic Resonance Imaging in Dilated Cardiomyopathy in Adults-Towards Identification of Myocardial Inflammation. Eur Radiol 2011; 21(5): 925 - 935.
81.  R., Christiani R., Freyhardt P. et al. Magnetic resonance imaging findings in acute myocarditis and correlation with immunohistological parameters. Eur Radiol 2011; 21(6): 1259 - 1266.
R., Christiani R., Freyhardt P. et al. Magnetic resonance imaging findings in acute myocarditis and correlation with immunohistological parameters. Eur Radiol 2011; 21(6): 1259 - 1266.
82. Luetkens J.A., Homsi R., Dabir D., Kuetting D.L., Marx C., Doerner J., Schlesinger-Irsch U., ![]() R., Sprinkart A.M., Schmeel F.C., Stehning C., Fimmers R., Gieseke J., Naehle C.P., Schild H.H., Thomas D.K. Comprehensive Cardiac Magnetic Resonance for Short-Term Follow-Up in Acute Myocarditis. J Am Heart Assoc. 2016 Jul 19; 5(7).
R., Sprinkart A.M., Schmeel F.C., Stehning C., Fimmers R., Gieseke J., Naehle C.P., Schild H.H., Thomas D.K. Comprehensive Cardiac Magnetic Resonance for Short-Term Follow-Up in Acute Myocarditis. J Am Heart Assoc. 2016 Jul 19; 5(7).
83. Roller F.C., Harth S., Schneider C., Krombach G.A. Rofo. T1, T2 Mapping and Extracellular Volume Fraction (ECV): Application, Value and Further Perspectives in Myocardial Inflammation and Cardiomyopathies. 2015 Sep; 187(9): 760-70.
84. Kellman P., Wilson J.R., Xue H., Ugander M., Arai A.E. Extracellular volume fraction mapping in the myocardium, part 1: evaluation of an automated method. J Cardiovasc Magn Reson 2012; 14: 63.
85. Dass S., Suttie JJ, Piechnik SK, Ferreira VM, Holloway CJ, Banerjee R, Mahmod M., Cochlin L., Karamitsos T.D., Robson M.D., Watkins H., Neubauer S. Myocardial tissue characterization using magnetic resonance non contrast T1 mapping in hypertrophic and dilated cardiomyopathy. Circ Cardiovasc Imaging. 2012; 6: 726-33.
86. Puntmann V.O., Voigt T., Chen Z., Mayr M., Karim R., Rhode K., Pastor A., Carr-White G., Razavi R., Schaeffter T., Nagel E. Native T1 mapping in differentiation of normal myocardium from diffuse disease in hypertrophic and dilated cardiomyopathy. J Am Coll Cardiovasc Imgaging 2013; 6: 475-84.
87. Ferreira V.M., Piechnik S.K., Dall'Armellina E., Karamitsos T.D., Francis J.M., Choudhury R.P., Friedrich M.G., Robson M.D., Neubauer S. Non-contrast T1-mapping detects acute myocardial edema with high diagnostic accuracy: a comparison to T2-weighted cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2012; 14: 42.
88. Dall'Armellina E., Piechnik S.K., Ferreira V.M., Si Q.l., Robson M.D., Francis J.M., Cuculi F., Kharbanda R.K., Banning A.P., Choudhury R.P., Karamitsos T.D., Neubauer S. Cardiovascular magnetic resonance by non contrast T1-mapping allows assessment of severity of injury in acute myocardial infarction. J Cardiovasc Magn Reson 2012; 14: 15.
89. Raman F.S., Kawel-Boehm N., Gai N., Freed M., Han J., Liu C.Y., Lima J.A.C., Bluemke D.A., Liu S. Modified look-locker inversion recovery T1 mapping indices: assessment of accuracy and reproducibility between magnetic resonance scanners. J Cardiovasc Magn Reson 2013; 15: 64.
90. Thavendiranathan P., Walls M., Giri S., Verhaert D., Rajagopalan S., Moore S., Simonetti O.P., Raman S.V. Improved detection of myocardial involvement in acute inflammatory cardiomyopathies using T2 Mapping. Circ Cardiovasc Imaging 2012; 5: 102 - 110. 27.
91. Cooper L.T., Baughman K.L., Feldman A.M et al. The Role of Endomyocardial Biopsy in the Management of Cardiovascular Disease: A Scientific Statement From the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. J of the American College of Cardiology 2007; 50(19): 1914 - 1931.
92. Baughman K.L. Diagnosis of myocarditis: death of Dallas criteria. Circulation. 2006; Jan 31; 113(4): 593-5.
93. Maisch B., Beltman Factor S., et al. World Heart Federation consensus conferences' definition of inflammatory cardiomyopathy (myocarditis): report from two expert committees on histology and viral cardiomyopathy. Heartbeat. 1999; 4: 3 - 4. 143.
94. Hershberger R.E., Cowan J., Morales A., Siegfried J.D. Progress with genetic cardiomyopathies: screening, counseling, and testing in dilated, hypertrophic, and arrhythmogenic right dysplasia|cardiomyopathy. Circ heart Fail. 2009; 2(3): 253-61.
95. Chow L.H., Radio S.J., Sears T.D., McManus B.M. Insensitivity of right ventricular endomyocardial biopsy in the diagnosis of myocarditis. J Am Coll Cardiol. 1989; 14: 915 - 920.
96. Deckers J.W., Hare J.M., Baughman K.M. Complications of transvenous right ventricular endomyocardial biopsy in adult patients with cardiomyopathy: a seven-year survey of 546 consecutive diagnostic procedures in a tertiary referral center. J Am Coll Card. 1992; 19: 43 - 47.
97. Shirani J., Freant L.J., Roberts W.C. Gross and semiquantitative histologic findings in mononuclear cell myocarditis causing sudden death, and implications for endomyocardial biopsy. Am J Cardiol 1993; 72: 952 - 957.
98. Priori S.G.,  C., Mazzanti A., Blom N., Borggrefe M., Camm J., Elliott P.M., Fitzsimons D., Hatala R., Hindricks G., Kirchhof P., Kjeldsen K., Kuck K-H., Hernandez-Madrid A., Nikolaou N., Norekva°l T.M., Spaulding C., Van Veldhuisen D.J. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: the Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the Europe. Eur Heart J 2015; 36: 2793 - 2867.
C., Mazzanti A., Blom N., Borggrefe M., Camm J., Elliott P.M., Fitzsimons D., Hatala R., Hindricks G., Kirchhof P., Kjeldsen K., Kuck K-H., Hernandez-Madrid A., Nikolaou N., Norekva°l T.M., Spaulding C., Van Veldhuisen D.J. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: the Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the Europe. Eur Heart J 2015; 36: 2793 - 2867.
99. Ponikowski P., Voors A.A., Anker S.D., Bueno H., Cleland J.G., Coats A.J., Falk V.,  J.R., Harjola V.P., Jankowska E.A., Jessup M., Linde C., Nihoyannopoulos P., Parissis J.T., Pieske B., Riley J.P., Rosano G.M., Ruilope L.M., Ruschitzka F., Rutten F.H., van der Meer P.; Authors/Task Force Members; Document Reviewers. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016 Aug; 18(8): 891 - 975. doi: 10.1002/ejhf.592. Epub 2016 May 20.
J.R., Harjola V.P., Jankowska E.A., Jessup M., Linde C., Nihoyannopoulos P., Parissis J.T., Pieske B., Riley J.P., Rosano G.M., Ruilope L.M., Ruschitzka F., Rutten F.H., van der Meer P.; Authors/Task Force Members; Document Reviewers. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016 Aug; 18(8): 891 - 975. doi: 10.1002/ejhf.592. Epub 2016 May 20.
100. Mirabel M., Luyt C.E., Leprince P., Trouillet J.L., Le'ger P., Pavie A., Chastre J., Combes A. Outcomes, long-term quality of life, and psychologic assessment of fulminant myocarditis patients rescued by mechanical circulatory support. Crit Care Med 2011; 39: 1029 - 1035.
101. Chen Y.S., Wang M.J., Chou N.K., Han Y.Y., Chiu I.S., Lin F.Y., Chu S.H., Ko W.J. Rescue for acute myocarditis with shock by extracorporeal membrane oxygenation. Ann Thorac Surg 1999; 68: 2220 - 2224.
102. Hsu K.H., Chi N.H., Yu H.Y., Wang .CH., Huang SC, Wang SS, Ko WJ, Chen YS. Extracorporeal membranous oxygenation support for acute fulminant myocarditis: analysis of a single center's experience. Eur J Cardiothorac Surg 2011; e-pub, 18 February.doi:10.1016/j.ejcts.2010.12.050.
103. Schultheiss H.P, ![]() U., Cooper L.T. The management of myocarditis. Eur Heart J. 2011 Nov; 32(21): 2616-25. doi: 10.1093/eurheartj/ehr165. Epub 2011 Jun 23. + Blauwet L.A, Cooper L.T. Myocarditis. Progress in Cardiovascular Diseases 52 (2010), 274 - 288.
U., Cooper L.T. The management of myocarditis. Eur Heart J. 2011 Nov; 32(21): 2616-25. doi: 10.1093/eurheartj/ehr165. Epub 2011 Jun 23. + Blauwet L.A, Cooper L.T. Myocarditis. Progress in Cardiovascular Diseases 52 (2010), 274 - 288.
104. Godsel L.M., Leon J.S., Wang K., Fornek J.L., Molteni A., Engman D.M. Captopril prevents experimental autoimmune myocarditis. J Immunol, 171 (2003), pp. 346 - 352.
105. Reyes M.P., Khatib R., Khatib G., Ho K.L., Smith F., Kloner R.A. Prolonged captopril therapy in murine viral myocarditis. J Cardiovasc Pharmacol Ther, 3 (1998), pp. 43 - 50.
106. Bahk T.J., Daniels M.D., Leon J.S., Wang K., Engman D.M. Comparison of angiotensin converting enzyme inhibition and angiotensin II receptor blockade for the prevention of experimental autoimmune myocarditis. Int J Cardiol, 125 (2008), pp. 85 - 93.
107. Zhang Y.Y., Li J.N., Xia H.H., Zhang S.L., Zhong J., Wu Y.Y., Miao S.K., Zhou L.M. Protective effects of losartan in mice with chronic viral myocarditis induced by coxsackievirus B3. Life Sci. 2013 Jul 10; 92(24 - 26): 1186-94. doi: 10.1016/j.lfs.2013.05.010. Epub 2013 May 20.
108. Saegusa S., Fei Y., Takahashi T., Sumino H., Moriya J., Kawaura K., Yamakawa J., Itoh T., Morimoto S., Nakahashi T., Iwai K., Matsumoto M., Kanda T. Oral administration of candesartan improves the survival of mice with viral myocarditis through modification of cardiac adiponectin expression. Cardiovasc Drugs Ther 2007; 21: 155 - 160.
109. Seko Y. Effect of the angiotensin II receptor blocker olmesartan on the development of murine acute myocarditis caused by coxsackievirus B3Clin Sci (Lond), 110 (2006), pp. 379 - 386.
110. Sukumaran V., Watanabe K., Veeraveedu P.T., et al. Beneficial effects of olmesartan, an angiotensin II receptor type 1 antagonist, in rats with dilated cardiomyopathy. Exp Biol Med (Maywood), 235 (2010), pp. 1338 - 1346.
111. Godsel L.M., Leon J.S., Engman D.M. Angiotensin converting enzyme inhibitors and angiotensin II receptor antagonists in experimental myocarditis. Curr Pharm Des, 9 (2003), pp. 723 - 735.
112. Kindermann I., Kindermann M., Kandolf R., et al. Predictors of outcome in patients with suspected myocarditis. Circulation, 118 (2008), pp. 639 - 648.
113. Yuan Z., Shioji K., Kihara Y., Takenaka H., Onozawa Y., Kishimoto C. Cardioprotective effects of carvedilol on acute autoimmune myocarditis: anti-inflammatory effects associated with antioxidant property. Am J Physiol Heart Circ Physiol, 286 (2004), pp. H83 - H90.
114. Rezkalla S., Kloner R.A., Khatib G., Smith F.E., Khatib R. Effect of metoprolol in acute coxsackievirus B3 murine myocarditis J Am Coll Cardiol, 12 (1988), pp. 412 - 414.
115. Veeraveedu P.T., Watanabe K, Ma M., Thandavarayan R.A., Palaniyandi S.S., Yamaguchi K., Suzuki K., Kodama M., Aizawa Y. Comparative effects of torasemide and furosemide in rats with heart failure. Biochem Pharmacol. 2008 Feb 1; 75(3): 649-59. Epub 2007 Oct 5.
116. Xiao J., Shimada M., Liu W., Hu D., Matsumori A. Anti-inflammatory effects of eplerenone on viral myocarditis Eur J Heart Fail, 11 (2009), pp. 349 - 353.
117. Kindermann I., Barth C., Mahfoud F., Ukena C., Lenski M., Yilmaz A., Klingel K., Kandolf R., Sechtem U., Cooper LT., ![]() M. Update on myocarditis. J Am Coll Cardiol. 2012 Feb 28; 59(9): 779-92. doi: 10.1016/j.jacc.2011.09.074.
M. Update on myocarditis. J Am Coll Cardiol. 2012 Feb 28; 59(9): 779-92. doi: 10.1016/j.jacc.2011.09.074.
118. Matsumori A., Igata H., Ono K., et al. High doses of digitalis increase the myocardial production of proinflammatory cytokines and worsen myocardial injury in viral myocarditis: a possible mechanism of digitalis toxicity. Jpn Circ J, 63 (1999), pp. 934 - 940.
119. Cabinian A.E., Kiel R.J., Smith F., Ho K.L., Khatib R., Reyes M.P. Modification of exercise-aggravated coxsackievirus B3 murine myocarditis by T lymphocyte suppression in an inbred model. J Lab Clin Med, 115 (1990), pp. 454 - 462.
120. Basso C., Carturan E., Corrado D., Thiene G. Myocarditis and dilated cardiomyopathy in athletes: diagnosis, management and recommendations for sport activity. Cardiol Clin 2007; 25: 423 - 429.
121. Pelliccia A., Fagard R.,  H.H., et al; Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology; Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Recommendations for competitive sports participation in athletes with cardiovascular disease: a consensus document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2005; 26: 1422 - 1445.
H.H., et al; Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology; Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Recommendations for competitive sports participation in athletes with cardiovascular disease: a consensus document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2005; 26: 1422 - 1445.
122. Maron B.J, Ackerman M.J., Nishimura R.A., Pyeritz R.E, Towbin J.A., Udelson J.E. Task Force 4: HCM and other cardiomyopathies, mitral valve prolapse, myocarditis, and Marfan syndrome J Am Coll Cardiol, 45 (2005), pp. 1340 - 1345.
123. Kandolin R., Lehtonen J., Salmenkivi K., Raisanen-Sokolowski A., Lommi J., Kupari M. Diagnosis, treatment, and outcome of giantcell myocarditis in the era of combined immunosuppression. Circ Heart Fail 2013; 6: 15 - 22.
124. Schumm J., Greulich S., Wagner A., Grun S., Ong P., Bentz K., Klingel K., Kandolf R., Bruder O., Schneider S., Sechtem U., Mahrholdt H. Cardiovascular magnetic resonance risk stratification in patients with clinically suspected myocarditis. J Cardiovasc Magn Reson 2014; 16: 14.
125. Mason J.W., O'Connell J.B., Herskowitz A., et al. A clinical trial of immunosuppressive therapy for myocarditis: The Myocarditis Treatment Trial Investigators. N Engl J Med 1995; 333: 269 - 275.
126. Frustaci A., Russo M.A., Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study Eur Heart J, 30 (2009), pp. 1995 - 2002.
127. McCarthy R.E. III, Boehmer J.P., Hruban R.H., et al. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis N Engl J Med, 342 (2000), pp. 690 - 695.
128. Cooper L.T.Jr., Menon S., Deng M., Mullin G.M., Starling R., Jaski B., Bourge R., Dec G.W., Hare J., Kao A., Leier C., Wagoner L., Zucker M., Skopecki H., Murali S., Mendez J., Caforio A.L., Rodeheffer R., Mason J.W., Ballman K.V., Gersh B.J., Tazelaar H.D., Edwards W.D. Usefulness of immunosuppression for giant cell myocarditis. Am J Cardiol 2008; 102: 1535 - 1539.
129. Kandolin R., Lehtonen J., Salmenkivi K., et al. Diagnosis, treatment, and outcome of giant-cell myocarditis in the era of combined immunosuppression. Circ: Heart Fail. 2013; 6(1): 15 - 22.
130. Ammirati E., Stucchi M., Brambatti M., et al. Eosinophilic myocarditis: a paraneoplastic event. Lancet 2015; 385: 2546.
131. McNamara D.M., Holubkov R., Starling R.C., et al. Controlled trial of intravenous immune globulin in recent-onset dilated cardiomyopathy Circulation, 103 (2001), pp. 2254 - 2259.
132. Drucker N.A., Colan S.D., Lewis A.B, et al. Gamma-globulin treatment of acute myocarditis in the pediatric population Circulation, 89 (1994), pp. 252 - 257.
133. Felix S.B., Staudt A., Landsberger M., et al. Removal of cardiodepressant antibodies in dilated cardiomyopathy by immunoadsorption. J Am Coll Cardiol, 39 (2002), pp. 646 - 652.
134. Doesch A.O., Konstandin M., Celik S., et al. Effects of protein A immunoadsorption in patients with advanced chronic dilated cardiomyopathy. J Clin Apher, 24 (2009), pp. 141 - 149.
135. Herda L.R., Trimpert C., Nauke U., et al. Effects of immunoadsorption and subsequent immunoglobulin G substitution on cardiopulmonary exercise capacity in patients with dilated cardiomyopathy. Am Heart J, 159 (2010), pp. 809 - 816.
136. Felix S.B., Staudt A., Dorffel W.V., et al. Hemodynamic effects of immunoadsorption and subsequent immunoglobulin substitution in dilated cardiomyopathy: three-month results from a randomized study. J Am Coll Cardiol, 35 (2000), pp. 1590 - 1598.
137. Doesch A.O., Konstandin M., Celik S., et al. Effects of protein A immunoadsorption in patients with advanced chronic dilated cardiomyopathy. J Clin Apher, 24 (2009), pp. 141 - 149.
138. Bulut D., Scheeler M., Wichmann T., Borgel J., Miebach T., Mugge A. Effect of protein A immunoadsorption on T cell activation in patients with inflammatory dilated cardiomyopathy. Clin Res Cardiol, 99 (2010), pp. 633 - 638.
139. Krueger G.R., Ablashi D.V. Human herpesvirus-6: a short review of its biological behaviour. Intervirology 2003; 46: 257 - 269.
140. Wang Y.X., da Cunha V., Vincelette J., et al. Antiviral and myocyte protective effects of murine interferon-beta and -{alpha}2 in Coxsackievirus B3-induced myocarditis and epicarditis in Balb/c mice. Am J Physiol Heart Circ Physiol, 293 (2007), pp. H69 - H76.
141. Kuhl U., Pauschinger M., Schwimmbeck P.L., et al. Interferon-beta treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation, 2003; 107: 2793 - 2798.
142. Schultheiss H.P., Piper C., Sowade K., et al. The effect of subcutaneous treatment with interferon-beta-1b over 24 weeks on safety, virus elimination and clinical outcome in patients with chronic viral cardiomyopathy (abstr) Circulation, 118 (2008), p. 3322.
143. Costanzo-Nordin M.R., Reap E.A., O"Connell J.B., Robinson J.A., Scanlon P.J. A nonsteroid anti-inflammatory drug exacerbates Coxsackie B3 murine myocarditis J Am Coll Cardiol, 6 (1985), pp. 1078 - 1082.
144. Khatib R., Reyes M.P., Smith F., Khatib G., Rezkalla S. Enhancement of coxsackievirus B4 virulence by indomethacin J Lab Clin Med, 116, 1990, pp. 116 - 120.
145. ![]() H., Reibis R., Schwaab B., Schmid J-P. Hospital-based rehabilitation units. In Gielen S., De Backer G., Piepoli M., Wood D. The ESC Textbook of Preventive Cardiology. Oxford: Oxford University Press; 2015.
H., Reibis R., Schwaab B., Schmid J-P. Hospital-based rehabilitation units. In Gielen S., De Backer G., Piepoli M., Wood D. The ESC Textbook of Preventive Cardiology. Oxford: Oxford University Press; 2015.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
Рабочая группа по подготовке текста рекомендаций
Председатель рабочей группы
Терещенко С.Н., д.м.н., профессор, заслуженный деятель науки РФ, председатель национального общества по изучению сердечной недостаточности и заболеваний миокарда (НОИСН), председатель секции неотложная кардиология Российского кардиологического общества.
Арутюнов Г.П., д.м.н. профессор, главный внештатный специалист терапевт, заслуженный врач РФ, вице-президент Российского научного медицинского общества терапевтов.
Гиляревский С.Р., д.м.н., профессор, член общества специалистов по сердечной недостаточности.
Жиров И.В., д.м.н., член НОИСН.
Зыков К.А., д.м.н. профессор, член Российского респираторного общества, президент Российского общества воспаления.
Масенко В.П., д.м.н., профессор, член общества "Федерация лабораторной медицины".
Нарусов О.Ю., к.м.н., член НОИСН
Насонова С.Н., к.м.н., член НОИСН
Наумов В.Г., д.м.н., профессор, не является членом профессиональных обществ
Осмоловская Ю.Ф., к.м.н., член НОИСН
Самко А.Н., д.м.н., профессор, председатель секции интервенционной кардиологии Российского кардиологического общества.
Сафиуллина А.А., к.м.н, член НОИСН
Скворцов А.А., д.м.н., член НОИСН
Стукалова О.В., к.м.н., член общества специалистов по лучевой диагностике
Сычев А.В., к.м.н., член НОИСН
Шария М.А., д.м.н., профессор, член общества специалистов по лучевой диагностике
Шевченко А.О., д.м.н., профессор, член НОИСН
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Представленные Рекомендации разработаны на основе доклада рабочей группы по болезням миокарда и перикарда Европейского общества кардиологов 2013 года, посвященного этиологии, диагностике и лечению миокардитов. Кроме того, учтен опыт отечественных исследований, в первую очередь - Российского кардиологического научно-производственного комплекса Минздрава России.
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог.
2. Врач-терапевт.
3. Врач общей практики.
Порядок обновления рекомендаций
Пересмотр существующей редакции рекомендаций планируется проводить каждые 3 года.
Таблица П1. Уровни убедительности рекомендаций
Уровень убедительности рекомендаций
Определение
Предлагаемая формулировка
I
Данные и/или всеобщее согласие, что конкретный метод лечения или процедура полезна, эффективна, имеет преимущества
Рекомендуется/показан
II
Противоречивые данные и/или расхождение мнений о пользе/эффективности конкретного метода лечения или процедуры
IIa
Большинство данных/мнений говорит о пользе/эффективности
Целесообразно применять
IIb
Данные/мнения не столь убедительно говорят о пользе/эффективности
Можно применять
III
Данные и/или всеобщее согласие, что конкретный метод лечения или процедура не являются полезной или эффективной, а в некоторых случаях могут приносить вред
Не рекомендуется
Таблица П2. Уровни достоверности доказательств
Уровень достоверности доказательств A
Данные многочисленных рандомизированных клинических исследований или мета-анализов
Уровень достоверности доказательств B
Данные одного рандомизированного клинического исследования или крупных нерандомизированных исследований
Уровень достоверности доказательств C
Согласованное мнение экспертов и/или небольшие исследования, ретроспективные исследования, регистры
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Минздрава России от 15.11.2012 N 918н "Об утверждении порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями" (Зарегистрировано в Минюсте России 29.12.2012 N 26483).
2. Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. N 520н "Об утверждении критериев оценки качества медицинской помощи"
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи (http://cr.rosminzdrav.ru/#!/schema/708)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
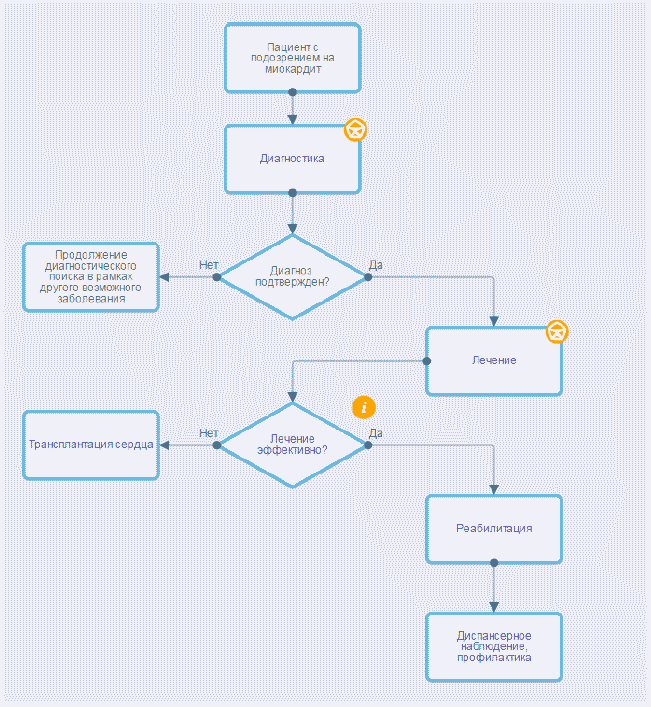
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Миокардит - воспаление сердечной мышцы, которая также называется миокардом. Миокардитом может заболеть любой человек независимо возраста.
Причины миокардита
Миокардиты, как правило, вызываются вирусной (наиболее часто), бактериальной или грибковой инфекцией. Другие причины, такие как побочные действия некоторых лекарств или аллергические реакции на них, употребление наркотиков, отравление тяжелыми металлами и другими ядовитыми веществами, укусы насекомых и змей, ионизирующее излучение, алкоголь встречаются реже. В ряде случае, миокардит может развивается и при других воспалительных заболеваниях - саркоидозе, системной красной волчанке, ревматоидном артрите, системной склеродермии, полимиозите, тиреотоксикозе и других. Часто точную причину миокардита установить не удается, но и в этих случаях наиболее вероятно он вызван вирусной инфекцией, которую не смогли выявить. Ниже более подробно будет рассказано о наиболее частых и значимых причинах миокардита.
Вирусные инфекции
Многие виды вирусов поражают различные органы человека, в том числе сердечную мышцу. Миокардит может развиться во время, но чаще сразу после респираторной вирусной инфекции. В большинстве случаев иммунная система человека в состоянии удалить инфекционные агенты и миокардит самостоятельно проходит в течение недели. Однако иногда, вещества, выделяемые чрезмерно активированной иммунной системой повреждают само сердце. Это приводит к тому, что воспаление в миокарде сохраняется длительное время, даже в отсутствии инфекции, что сопровождается нарушениями в работе сердца.
Наиболее часто миокардит вызывают вирусы Коксаки B, аденовирусы и парвовирус B19. Значительно реже - вирусы гриппа, ветряной оспы, кори, краснухи, паротита, гепатита C, герпеса, бешенства, Эпшейна-Бара (инфекционного мононуклеоза), эховирусы, вирус иммунодефицита человека и некоторые другие.
Бактериальные инфекции
Бактерии являются причиной миокардита реже, чем вирусы. Наиболее значимые из них:
- хламидии (возбудитель хламидиоза - заболевания передающегося половым путем);
- стрептококки (ангина, скарлатина);
- стафилококки (гнойные заболевания);
- трепонема (сифилис);
- боррелии (возбудитель болезни Лайма, или боррелиоза. Заболевание широко распространено в России, заражение происходит при укусе инфицированного клеща);
- микоплазма (вызывает легочную инфекцию).
Грибковая инфекция
Грибковая инфекция (кандидоз, плесневые грибы и другие) также иногда приводят к миокардиту.
Паразиты
В России паразитарные инфекции достаточно редко вызывают миокардиты. К наиболее частым причинам относятся трихинеллы, свиной цепень (заражение происходит при поедании свиного мяса не прошедшего достаточной термической обработки), эхинококки (часто люди инфицируются от собак) и токсоплазма (употребление необработанного мяса, немытых овощей и фруктов, уборка кошачьих туалетов). Тяжелым микардитом сопровождается болезнь Шагаса (Чагаса), широко распространенная в Центральной и Южной Америке, Мексике. Наиболее часто заражение происходит при укусе инфицированного клопа. Поражение сердца может развиться и через много лет после инфицирования. В России это заболевание отсутствует, однако заразиться можно во время путешествия в перечисленые страны.
Симптомы миокардита
Симптомы болезни зависят от причины миокардита и тяжести воспаления. У многих пациентов с вирусным миокардитом отсутствуют какие-либо симптомы, связанные с сердцем, а наличие воспаления в миокарде можно заподозрить лишь по изменениям на электрокардиограмме. Если все же симптомы появляются, то они могут быть следующими:
- боль в грудной клетке;
- лихорадка;
учащенное сердцебиение (тахикардия), более частое, чем обычно при высокой температуре;
- нерегулярное сердцебиение;
- повышенная утомляемость;
- одышка;
- иногда появляются боли в суставах и их отечность.
Часто миокардит проходит самостоятельно и без каких-либо последствий. Но если воспаление серьезно повреждает сердечную мышцу или волокна, которые проводят электрические импульсы в сердце могут развиться тяжелые осложнения, которые включают:
- внезапную потерю сознания;
- нарушения ритма сердца (ненормальное частое, медленное или нерегулярное сердцебиение);
- сердечную недостаточность, которая проявляется одышкой, отеками ног и повышенной утомляемостью.
В одних случаях эти симптомы появляются внезапно, а их тяжесть быстро нарастает, в других - развиваются постепенно. Иногда появление осложнений является первым признаком, что у Вас в прошлом был миокардит.
Как диагностируют миокардит?
Диагностика миокардита требует тщательного обследования. Для этого используют (не всегда все) следующие исследования:
- электрокардиограмму, на которой можно выявить нарушения ритма сердца и признаки повреждения миокарда;
- анализы крови для обнаружения признаков инфекции, воспаления и повреждения миокарда;
- рентгенографию органов грудной клетки, при которой могут определяться увеличение сердца и признаки сердечной недостаточности;
- эхокардиографию (ультразвуковое исследование сердца) для оценки размеров сердца и его сократительной способности. При миокардите сердце может быть увеличено, а его способность перекачивать кровь снижена;
- коронароангиографию - рентгенконтрастный метод, позволяющий оценить состояние артерий сердца и исключить ишемическую болезнь, которая может быть причиной Ваших симптомов;
- магнитно-резонансную томографию для выявления повреждения миокарда;
- эндомиокардиальную биопсию, в ходе которой специальным устройством производят забор небольших кусочков тканей сердца для определения причины заболевания. Это исследование проводится если диагноз остается неясным или состояние пациента не улучшается, не смотря на проводимое лечения.
Как лечат миокардиты?
Лечение миокардитов зависит от его причины и тяжести проявлений. В остром периоде рекомендуется постельный режим и ограничение физических нагрузок в последующие 6 месяцев.
Лекарственных препаратов для специфического лечения вирусных инфекций нет. Однако у большинства пациентов с вирусными миокардитами вирусы удаляются из организма без лечения в течении недели. В тех случаях, когда миокардит вызван бактериями, применяют антибиотики.
При появлении сердечной недостаточности используют препараты для ее лечения. К ним относятся ингибиторы ангиотензин-превращающего фермента, бета-блокаторы, мочегонные средства и другие. В некоторых случаях при неэффективности обычной терапии, а также при таких редких формах миокардита, как гигантоклеточный и саркоидоз сердца, врач может назначить противоспалительное лечение (кортикостероиды, например, преднизолон и цитостатики).
Если имеется высокая вероятность развития жизнеугрожающих нарушений ритма сердца, может потребоваться имплантация ЭКС или ИКД.
В самых тяжелых случаях, когда повреждение сердца слишком большое и лечение не приводит к улучшению состояния пациента, врач может рекомендовать пересадку (трансплантацию) сердца.
Исход миокардита (прогноз)
В большинстве случаев вирусного миокардита заболевание проходит самостоятельно, а симптомы сохраняются в течение нескольких дней или недель. Однако некоторые виды вирусной инфекции являются более тяжелыми и могут приводить к длительному воспалению и осложнениям. Осложнения чаще развиваются при редких типах миокардитов.
Иногда, даже после прекращения воспаления в миокарде, восстановления работы сердца не происходит. Оно остается увеличенным в размере и плохо сокращается. Такое состояние называется ДКМП. Развитие этого тяжелого заболевания приводит к сохранению сердечной недостаточности, которая требует длительного лечения. В целом, более 75% пациентов выздоравливают в течение 2 недель без каких-либо осложнений, еще у 10% развивается ДКМП. Повторные миокардиты случаются не часто.
В ряде случаев миокардит приводит к смерти. Смерть может быть внезапной и являться первым проявлением острого миокардита у ранее здорового человека или произойти на фоне постоянно ухудшающегося состояния.
Советы
В остром периоде миокардита рекомендуется постельный режим. В последующие 6 месяцев Вам необходимо ограничить физические нагрузки, исключить спортивные соревнования и занятия любительским спортом. Расширение двигательного режима после острого периода должно происходить постепенно, начиная с небольших нагрузок с разрешения и под наблюдением Вашего врача. Перед возобновлением занятий спортом необходимо пройти обследование и убедится, что сердце полностью восстановилось, и отсутствуют какие-либо признаки заболевания. Спортсменам рекомендуется проходить повторные обследования каждые 6 месяцев.
Профилактика миокардитов
Мер, способных предотвратить развитие миокардита, нет. Однако вы можете избежать некоторых инфекций, которые вызывают это заболевание. Это простые правила: делать прививки, соблюдать гигиену и защищаться от клещей.
Приложение Г
ШКАЛА ИНДИВИДУАЛЬНОГО ВОСПРИЯТИЯ НАГРУЗКИ ПО БОРГУ
Баллы
Восприятие интенсивности нагрузки
6
Очень, очень легко
7
Исключительно легко
8
Исключительно легко
9
Очень легко
10
Очень легко
11
Довольно легко
12
Легко (комфортно)
13
Немного тяжело
14
Довольно тяжело
15
Трудно/тяжело
16
Трудно/тяжело
17
Очень тяжело
18
Очень тяжело
19
Очень-очень тяжело
20
Максимально тяжело
