"Клинические рекомендации "Адренокортикальный рак"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
АДРЕНОКОРТИКАЛЬНЫЙ РАК
МКБ 10: C74.0
Год утверждения (частота пересмотра): 2018
ID: КР341
URL
Профессиональные ассоциации
- Российская ассоциация эндокринологов Ассоциация онкологов России Российское общество клинической онкологии Профессиональное общество онкологов-химиотерапевтов
Ключевые слова
- Адренокортикальный рак
- Синдром Иценко-Кушинга
- Гиперкортицизм
- Опухоли надпочечника
Список сокращений
АКР - адренокортикальный рак
АКТГ - адренокортикотропный гормон
АРС - альдостерон-рениновое соотношение
ДЛТ - дистанционная лучевая терапия
ИГХ - иммуногистохимия
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
МЭН - синдром множественных эндокринных неоплазий
ПГА - первичный гиперальдостеронизм
ПЭТ-18ФДГ - позитронно-эмиссионная томография с 18-фтордезоксиглюкозой
СИК - синдром Иценко-Кушинга
ТТГ - тиреотропный гормон
УЗИ - ультразвуковое исследование
SUV (standartised uptake value) - накопительный критерий при ПЭТ-FDG
HU (единицы Хаунсфилда) - денситометрические показатели при проведении КТ
Термины и определения
- Острая надпочечниковая недостаточность - симптомокомплекс, обусловленный резким снижением или полным прекращением функциональной деятельности коры надпочечников.
- Синдром "неуправляемой гемодинамики" - патологическое состояние, возникающее на фоне катехоламинпродуцирующей опухоли надпочечника и характеризующееся резким учащением гипертензивных высокоамплитудных кризов с усугубляющейся некурабельной гипотонией в межприступном периоде.
- Первичный гиперальдостеронизм - клинический синдром, развивающийся в результате избыточной продукции альдостерона клубочковой зоной коркового вещества надпочечников, при котором секреция альдостерона полностью или частично автономна по отношению к ренин-ангиотензиновой системе, что обусловливает развитие низкорениновой гипокалиемической артериальной гипертензии.
1. Краткая информация
1.1 Определение
Адренокортикальный рак (АКР) - редкая злокачественная опухоль, исходящая из коркового слоя надпочечника. Заболевание характеризуется поздним сроком выявления, агрессивностью клинического течения и, до настоящего момента, неблагоприятным лечебным прогнозом. АКР может быть гормонально-активным, являясь причиной субклинического или манифестного синдрома Иценко-Кушинга (СИК), и/или вирильного синдрома, или может быть случайно выявленной гормонально-неактивной опухолью надпочечника.
1.2 Этиология и патогенез
Описаны несколько наследственных синдромов, известным компонентом которых является АКР. В рамках всех синдромов отмечается низкая фенотипическая пенетрантность АКР, в связи с чем, проследить наследственный характер заболевания анамнестически достаточно сложно.
Синдром Ли-Фраумени (Li-Fraumeni) связан с инактивирующей мутацией в TP53-гене-супрессоре опухолевого роста, характеризуется развитием сарком мягких тканей, рака молочной железы, новообразований головного мозга и АКР. Интересно, что мутации в TP53 являются причиной высокой заболеваемости АКР в Южной Бразилии, потому что у не имеющих родственной связи пациентов этого региона, определяется R337H мутация в TP53. АКР - также компонент синдрома Беквита-Вайдемана (Beckwith-Wiedemann), который проявляется макроглоссией, дефектами брюшной стенки (эмбриональная пупочная грыжа), гемигипертрофией, нефро-, гепатобластомой. На генетическом уровне этот синдром вызван изменениями в 11p15, генетическое местоположение включает IGF-2, H19 и CDKN1C (p57Kip2) гены.
АКР может выявляться в составе синдрома Гарднера (аденоматозный полипоз кишки), который вызван мутацией АРС-гена-супрессора опухолевого роста (APC - от adenomatosis polyposis coli). При генетическом исследовании опухолей надпочечников у больных с синдромом Гарднера выявляется делеция нормальной АРС-аллели в хромосомах опухоли. Синдром МЭН 1 типа ранее связывали с доброкачественными, гормонально-неактивными опухолями надпочечников, которые отмечались в 20 - 40% наблюдений МЭН1. Недавние исследования показали, что при синдроме МЭН 1 типа гормонально-активный АКР так же не является редкостью [4].
Проанализированы ДНК надпочечниковых опухолей при спорадическом АКР в участках 17p (содержащем TP53-ген) и в 11p15 (содержащим IGF-2/CDKN1C) [5].
Полученные результаты сравнили с морфологическим типом опухолей. Выявлено, что делеция в 17p и структурная перестановка 11p15 (и, как результат - повышенная экспрессия IGF-2) была облигатно связаны со злокачественной структурой опухоли. Предложено использовать этот тест при дифференцировании доброкачественных и злокачественных опухолей надпочечника.
1.3 Эпидемиология
Ежегодное выявление АКР - 0,5 - 2 случая на миллион населения, в структуре онкологической смертности составляет 0,04 - 0,2% [3].
Эпидемиологические данные по Российской Федерации оценить крайне затруднительно, так как онкологическая отчетность отдельно по АКР не формируется, регистр отсутствует.
У детей гормональная активность АКР выявляется чаще, чем у взрослых и составляет 87 - 95%. Большинство опухолей изолированно секретирует кортизол (55%) или андрогены в комбинации с кортизолом (30%). Другие варианты гормональной активности в детском возрасте можно считать казуистическими.
Гормонально-активные опухоли наблюдаются у 60% взрослых. Синдром смешанной гормональной продукции (гиперкортицизм и вирилизация) отмечается у 30 - 40%, изолированный синдром Иценко-Кушинга у 25 - 35%, и изолированная гиперпродукция андрогенов отмечается у 20% больных. Изолированные эстроген- и альдостеронпродуцирующие опухоли являются раритетом, составляют менее 2%. Повышенная продукция альдостерона отмечается несколько чаще в рамках смешанной гормональной продукции.
1.4 Кодирование по МКБ 10
Злокачественное новообразование надпочечника (C74):
C74.0 - Коры надпочечника;
C74.9 - Надпочечника неуточненной части.
1.5 Классификация
1.5.1 Международная гистологическая классификация (классификация ВОЗ, 4-е издание, 2013 г.):
8370/0 Аденома коры надпочечника, БДУ
Опухоль коры надпочечника, БДУ
Опухоль коры надпочечника, доброкачественная
8370/3 Рак коры надпочечника
Аденокарцинома коры надпочечника
Опухоль коры надпочечника, злокачественная
8371/0 Аденома коры надпочечника, компактноклеточная
8372/0 Аденома коры надпочечника, пигментированная
Черная аденома
Пигментированная аденома
8373/0 Аденома коры надпочечника, светлоклеточная
8374/0 Аденома коры надпочечника, из клеток клубочковой зоны
8375/0 Аденома коры надпочечника, смешанноклеточная
1.6 Стадирование
- Для определения лечебной тактики при АКР рекомендовано тщательное топическое обследование в отношении возможных метастазов, опухолевых тромбов и местного распространения опухоли.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарии: 80% взрослых больных на момент выявления имеют размер опухоли не менее 10 см, у 30 - 40% пациентов предоперационно выявляются метастазы [6, 7]. Вероятность наличия отдаленных метастазов при опухолях более 10 см по данным послеоперационного наблюдения составляет более 80%.
Опухолевое стадирование АКР может осуществляться по системе TNM (T - tumor (опухоль), N - node (лимфатические узлы), M - metastasis (метастазирование)) в соответствии с классификацией AJCC (American Joint Commission on Cancer)/UICC (International Union Against Cancer).
Клинически более адаптированной и современной представляется классификация по ENSAT (European Network for the Study of Adrenal Tumors) - европейской рабочей группы по изучению опухолей надпочечников [8, 9].
Таблица 1. Соотношение стадирования АКР между TNM и ENSAT
ENSAT
TNM
Определение
I
(I) T1N0M0
Размер < 5 см
II
(II) T2N0M0
Размер > 5 см
III
(III) T1-2N1M0
(III - IV) T3-4N0-1M0
Метастазы в лимфоузлах, опухолевая инфильтрация в соседние органы и почку и/или тромбоз нижней полой вены
IV
T1-4N0-1M1
Отдаленные метастазы
2. Диагностика
Осуществляется в случае выявления опухоли надпочечника. В этой связи диагностика АКР рассматривается в рамках дифференциального диагноза с другими опухолями надпочечников, наиболее часто выявляемыми случайно.
Термин "инциденталома" надпочечника является собирательным, включающим разнообразную по морфологии группу опухолей более 1 см в диаметре, случайно выявленных при радиологическом обследовании [10]. Выявленное образование может:
- оказаться как гормонально-неактивным, так и активно производить различные гормоны;
- исходить из различных зон надпочечника или иметь неспецифичную органную принадлежность;
- быть злокачественным или доброкачественным.
2.1. Жалобы и анамнез
Жалобы при АКР связаны как с наличием образования в брюшной полости (боль животе или спине, ощущение полноты в животе), так и с гиперсекрецией гормонов: кортизола (общая и мышечная слабость, повышение массы тела, перераспределение подкожно-жировой клетчатки по диспластическому типу, синячковые высыпания, нечистота кожи, переломы, боли в костях, бесплодие/гипогонадизм, повышение АД и др.), альдостерона (повышение АД, слабость мышц вследствие гипокалиемии), тестостерона (рост нежелательных волос на теле, понижение голоса, гипертрофия клитора у женщин, повышение жирности и нечистота кожи), эстрогенов (гинекомастия у мужчин, метрогагии у женщин в постменопаузе) и других стероидных гормонов, таких как предшественники, например, 17OH-прогестерон.
2.2. Физикальное обследование
При гиперсекретирующих вариантах АКР во время осмотра чаще всего наблюдается клиника глюкокортикоидного и андрогенного избытка: акне, гинекомастия, вирилизация, гирсутизм, увеличение массы тела и др.
При АКР без клинической гиперсекреции гормонов надпочечника, при осмотре можно выявить локальные симптомы (боль, наличие объемного образования в брюшной полости, определяемое при пальпации живота).
Может повышаться температура тела вследствие сопутствующего некроза в опухоли.
Клинические проявления могут иметь метастазы АКР в печень, легкие, кости.
2.3. Лабораторная диагностика
- При выявлении опухоли надпочечника размером более 1 см в первую очередь рекомендовано исключить или подтвердить гормональную активность образования, которая может проявляться гиперкатехоламинемией, адренокортикотропный гормон (АКТГ) - независимым гиперкортицизмом, первичным гиперальдостеронизмом [11 - 13].
Для подтверждения/исключения гормональной активности опухоли рекомендованы следующие методы лабораторной диагностики:
- Определение кортизола в ранние утренние часы на фоне подавляющего теста с 1 мг дексаметазона;
- При отсутствии физиологического подавления уровня кортизола - определение адренокортикотропного гормона в утренние часы.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib).
Комментарии:
Отсутствие любых клинических проявлений и манифестных признаков гормональной активности является, недостаточно известной, но довольно распространенной "ловушкой".
Пациенты с инциденталомой надпочечника редко имеют развернутую клиническую картину гиперкортицизма, однако биохимические признаки гиперкортицизма отмечаются примерно у 8 - 12% больных [14, 15].
При назначении низких доз синтетического глюкокортикоида дексаметазона при синдроме эндогенного гиперкортицизма любого генеза не происходит подавления адренокортикотропного гормона (АКТГ) и синтеза кортизола [16]. Ночной тест достаточно прост и выполним в амбулаторных условиях: 1 мг дексаметазона принимается между 23 и 24 часами, кортизол измеряется в крови, взятой следующим утром между 8 и 9 часами. Более высокие дозы (1,5 или 2 мг) не улучшают точность теста [17].
В качестве диагностического критерия с высокой отрицательной прогнозирующей ценностью в отношении субклинического гиперкортицизма считается подавление утреннего кортизола менее 50 нмоль/л (чувствительность более 95%).
При инциденталомах надпочечников определение суточного кортизола мочи обладает меньшей чувствительностью в сравнении с дексаметазоновым тестом и ночным сывороточным кортизолом [18, 19]. Специфичность подавляющего теста при уровне cut-off менее 50 нмоль/л не превышает 80%. Для уменьшения числа ложноположительных результатов в качестве верифицирующего теста рекомендовано определение в утренние часы уровня АКТГ. Подавленный уровень АКТГ подтверждает диагноз синдрома Иценко-Кушинга у пациентов с опухолями надпочечников [20]. Измерение АКТГ не является методом первичной диагностики, однако может служить подтверждающим признаком субклинических проявлений гиперкортицизма в этой группе больных.
Опухоль коры надпочечника, автономно продуцирующая кортизол, является причиной атрофии коры контрлатерального надпочечника. Если при манифестном синдроме Иценко-Кушинга можно оценить продолжительность гиперкортизолизма по давности клинических проявлений, то при субклинических формах длительность гиперкортицизма неизвестна. При длительном течении гиперкортицизма возможна необратимая атрофия коры, требующая длительной, если не пожизненной, заместительной терапии [21].
Недооценка наличия гиперкортицизма (манифестного или субклинического) связана с высоким риском развития острой надпочечниковой недостаточности в послеоперационном периоде.
- Всем пациентам с выявленной опухолью надпочечника рекомендовано определение (нор) метанефрина в суточной моче или плазме [13].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарии: Недооценка наличия катехоламин-секретирующей опухоли может привести к развитию гипертензивных кризов в периоперационном периоде, отека легких, аритмий, синдрома "неуправляемой гемодинамики" [22].
- При наличии у больного с опухолью надпочечника артериальной гипертензии рекомендовано определение соотношения между уровнем альдостерона и активностью ренина плазмы для исключения первичного гиперальдостеронизма (ПГА).
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарии: Изолированная автономная гиперпродукция альдостерона при АКР встречается крайне редко. Альдостерон-продуцирующие опухоли морфологически выглядят как светлоклеточные аденомы небольших размеров [23]. Тестом первичной диагностики является оценка альдостерон-ренинового соотношение (АРС). При подозрении на ПГА по результатам АРС, необходимо проведение одного из подтверждающих методов. Алгоритм обследования при ПГА подробно изложен в клинических рекомендациях по диагностике и лечению данной нозологии [24, 25].
- При клиническом подозрении на изолированную или сочетанную (с гиперкортицизмом) опухолевую гиперпродукцию половых гормонов рекомендовано определение стероидных гормонов сыворотки крови (дегидроэпиандростерон-сульфат, 17-оксипрогестерон, андростендион, тестостерон, 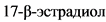 у мужчин и женщин в менопаузе).
у мужчин и женщин в менопаузе).
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
2.4 Морфологическая диагностика
- В дифференциальном диагнозе органоспецифичных опухолей надпочечника пункционная биопсия не имеет доказанных преимуществ, ассоциируется с низкой чувствительностью, специфичностью и высокой вероятностью осложнений, поэтому ее проведение не рекомендуется.
- Пункционная биопсия при опухоли надпочечника рекомендована при подозрении на его метастатическое поражение.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: Тотальное выполнение пункционной биопсии опухолей надпочечников не продемонстрировало улучшения результатов дифференциальной диагностики инциденталом, напротив, привело к росту осложнений, ложноположительным и ложноотрицательным заключениям. В настоящий момент пункция целесообразна лишь при подозрении на метастатическое поражение надпочечников, где чувствительность цитологического исследования составляет 80 - 86%. Также пункционная биопсия показана при подозрении на неходжкинскую лимфому с изолированным поражением надпочечников. Заболевание встречается крайне редко, характеризуется двусторонним инфильтративным поражением надпочечников, быстрым темпом роста опухоли, а также косвенными признаками, позволяющими подозревать лимфому, такими как выраженные явления общей интоксикации, повышение лактат-дегидрогеназы в сыворотке крови и т.д. При других вариантах надпочечниковых опухолей диагностическая ценность предоперационной пункционной биопсии неудовлетворительна (чувствительность не превышает 65%) [26, 27].
2.5. Инструментальная диагностика
- Для диагностики злокачественного потенциала опухоли рекомендована оценка количественных денситометрических показателей при трехфазной компьютерной томографии (КТ):
- плотность тканевого компонента до контрастирования (нативная);
- плотность в тканевую фазу контрастирования (артериальная и венозная фазы);
- плотность в отсроченную (через 10 мин. после введения контраста) фазу контрастирования (фаза вымывания).
При получении высокоплотных КТ-значений в нативную фазу, задержки контраста в отсроченной фазе - злокачественный потенциал опухоли рекомендуется оценивать, как высокий.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарии:
Основным критерием при формировании показаний к операции долгое время являлся размер новообразования, что приводило, с одной стороны, к большому числу необоснованных вмешательств при опухолях более 3 - 4 см, с другой стороны - к недооценке злокачественного потенциала образований малого размера при метастатических поражениях и АКР. После введения денситометрических критериев злокачественности опухоли удалось оптимизировать показания к оперативному лечению не только на основании размеров опухоли. В настоящий момент основное внимание в диагностике АКР сконцентрировано на количественных показателях трехфазной КТ [28, 29].
КТ-семиотика инциденталом надпочечника оценивается в результате определения плотности жировых и нежировых структур в неконтрастную фазу (жировые структуры имеют пониженную плотность). Богатые липидами ткани характерны для доброкачественных аденом коры надпочечника. Однако около 25% доброкачественных аденом могут не иметь низкой "неконтрастной" плотности. При исследовании КТ-плотности на разных фазах выведения контраста получены данные, что аденомы коры надпочечника быстро снижают показатели плотности (через 10 мин. после введения контраста, т.н. показатель "wash-out", более чем на 50%), в то время как другие образования надпочечников имеют тенденцию к задержке контрастного вещества. Измерение этого показателя имеет близкую к абсолютным значениям диагностическую ценность при дифференциальном диагнозе аденом с одной стороны, от феохромоцитомы, АКР и метастатической карциномы с другой.
Низкая (менее 10 - 15 HU) нативная плотность тканевого компонента при КТ или быстрое снижение интенсивности сигнала после внутривенного контрастирования абсолютно нехарактерны для АКР, метастазов и феохромоцитомы. Дифференциальный диагноз с феохромоцитомой осуществляется на основании биохимического исследования (нор)метанефрина.
Дополнительным существенным преимуществом КТ является возможность оценки критерия плотности опухоли в фазу вымывания (wash-out). Метастатическое поражение должно быть исключено/подтверждено в первую очередь у больных с анамнезом онкологического заболевания. Также, вероятность метастатического поражения рассматривается при двустороннем поражении надпочечников, особенно при отсутствии явлений гормональной активности, при наличии КТ-признаков, характерных для метастазов. Пациенты с подобными поражениями должны проходить онкологическое обследование для исключения распространенного опухолевого процесса (в первую очередь рака легкого, желудка, колоректального рака).
- УЗИ органов брюшной полости рекомендовано для первичной диагностики опухолей надпочечников.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
Комментарии: УЗИ обладает высокой чувствительностью, но более низкой, в сравнении с КТ, специфичностью и может быть использовано для первичной диагностики опухолей надпочечников в случае невозможности выполнения компьютерной томографии.
- МРТ рекомендовано для первичной диагностики опухолей надпочечников, а также для исключения метастатического поражения головного мозга.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
Комментарии: МРТ обладает высокой чувствительностью в выявлении опухолей надпочечников оценки распространенности процесса, в том числе поражения смежных структур. Однако специфичность методов значительно ниже в связи с отсутствием четких количественных денситометрических показателей [30].
Остеосцинтиграфия рекомендована при подозрении на метастатическое поражение костей скелета. Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
- При небольших размерах опухоли (до 4 см) в качестве верифицирующего метода рекомендуется выполнение позитронно-эмиссионной томографии с 18-фтордезоксиглюкозой (ПЭТ-18ФДГ). Высокая метаболическая активность (SUV (standartised uptake value) более 3) является критерием, позволяющим с высокой степенью вероятности предполагать злокачественную природу опухоли.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарии: В случае подозрения на АКР или метастазы при КТ-плотных образованиях малого размера (например, до 4 см) рекомендовано проведение ПЭТ-18ФДГ, так как метод позволяет определить не только насыщенность опухолевых липидов, но и метаболическую активность образования. Если определяемый при ПЭТ-18ФДГ накопительный критерий SUV более 3, то вероятность злокачественного поражения приближается к абсолютным значениям [31 - 35].
3. Лечение
Определение распространенности опухолевого процесса крайне важно с точки зрения выбора лечебной тактики. В случае АКР серьезное влияние на тактику может оказать степень гормональной активности опухоли. Так, если при гормонально-неактивной опухоли оперативное лечение распространенных форм АКР не имеет известных преимуществ, то при гормонально-активной опухоли, сопровождающейся тяжелыми соматическими проявлениями гиперкортицизма может быть оправдана тактика, направленная на максимальную циторедукцию.
3.1 Хирургическое лечение
- При I - III стадиях АКР (ENSAT) при возможности адекватной (R0) резекции в специализированном центре рекомендовано хирургическое лечение.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарии: Оперативное пособие рекомендовано провести в кратчайшие сроки после проведения адекватной диагностики в виду метастатической агрессивности АКР. Выполнение операций с попыткой сохранения ткани надпочечника недопустимо [36]. Единственным возможным вариантом полного излечения при АКР в настоящее время является полное хирургическое удаление опухоли сразу после ее обнаружения. Акцент на срочности оперативного вмешательства связан с быстрым увеличением размеров опухоли и высокой вероятностью метастазирования. Если на момент обнаружения опухоли метастазы не выявляются, то выгода операции очевидна, т.к. она нацелена на полное излечение.
- При проведении оперативного лечения рекомендуется проведение мероприятий направленных на:
- снижение риска эмболических осложнений тромботического и опухолевого генеза;
- снижение агрессивности манипуляций, приводящих к нарушению капсулы опухоли;
- выполнение аортокавальной и вазоренальной лимфодиссекции.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: Среди наиболее частых проблем, затрудняющих хирургическое лечение АКР, можно отметить:
- компрессия нижней полой вены, инфильтрация стенки нижней полой вены опухолью. Клинически выраженного синдрома нижней полой вены, как правило, не отмечается в связи с постепенной адаптацией к венозной гипертензии системы кавапортакавальных анастомозов. Дополнительными диагностическими методами являются восходящая каваграфия, допплерографическое исследование кровотока в крупных венозных сосудах. Исходом операции может стать перевязка нижней полой вены или ее протезирование;
- инвазия опухолью печени, печеночно-двенадцатитиперстной связки, поджелудочной железы, почки (местно-распространенная опухоль надпочечников). Проблема сопряжена с возможным расширением объема операции до резекции печени, необходимостью наружного или внутреннего желчеотведения, резекции поджелудочной железы, спленэктомии, нефрэктомии или резекции верхнего полюса почки;
- высокая вероятность эмболических осложнений является основной причиной интраоперационной и ранней послеоперационной смертности у больных АКР. Эмболия может быть обусловлена несколькими факторами или их сочетанием:
- наличием гиперкортицизма/гиперандрогении, способствующих исходной гиперкоагуляции;
- массивной интраоперационной кровопотерей с одномоментным переливанием больших объемов компонентов крови;
- наличием опухолевых тромбов;
- отсутствием предоперационных профилактических мероприятий, снижающих риск тромбоэмболии.
Среди профилактических мероприятий должны рассматриваться гепаринопрофилактика, установка венозных тромбоулавливающих зондов. Последнее может быть затруднено из-за опухолевой компрессии нижней полой вены.
Нарушение капсулы опухоли практически в 100% наблюдений приводит к местным рецидивам АКР. Прецизионность манипуляций при удалении опухоли является чуть ли не основной задачей хирурга, так как местная опухолевая диссеминация практически "сводит на нет" все усилия в отношении выполнения R0-резекции [37 - 39].
Лучшие результаты лечения при АКР достигаются при выполнении превентивной лимфаденэктомии во время хирургического вмешательства [40, 41].
При отсутствии явных признаков инвазии в паренхиму или ворота почки, необходимости в "превентивной" нефрэктомии (нефрадреналэктомии), для повышения радикальности резекции, нет. Достаточна резекция жировой капсулы почки с отступлением от краев опухоли на 2 - 3 см.
- Эндоскопическую адреналэктомию при АКР рекомендовано выполнять только в учреждении, обладающем достаточным опытом подобных вмешательств. Эндоскопический доступ должен быть ограничен I и II стадией заболевания (ENSAT). При большей распространенности процесса эндоскопическая операция противопоказана, так как возможность выполнения лимфаденэктомии и адекватной ревизии и резекции соседних органов ограничена, радикальность вмешательства сомнительна.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV).
Комментарии: Основная проблема лапароскопической адреналэктомии - высокая частота диссеминации опухоли по брюшине после операции, вследствие интраоперационного повреждения капсулы опухоли. Часть экспертов придерживается мнения, что при размере опухоли более 5 см и/или подозрении на злокачественность опухоли по результатам предоперационного обследования - вероятность диссеминации опухоли при нарушении капсулы значительно выше, чем при открытом вмешательстве [42 - 48]. Недискутабельным пунктом данной рекомендации является специализированный характер учреждения и опыт операционной бригады.
- При резектабельных формах местного рецидива или при солитарных/единичных метастазах возникших после операции, повторная R0 резекция рекомендована как наиболее эффективный и предпочтительный вариант лечения, так как обеспечивает наиболее длительный безрецидивный период или продолжительность жизни. Безрецидивный период более 1 года после первой операции является благоприятным прогностическим фактором при хирургическом лечении рецидивов или метастазов АКР.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарии: Частота прогрессирования АКР после хирургического лечения в течение 5 лет достигает до 80 - 85%. Единственным методом, обеспечивающим длительное выживание при рецидивах или метастазах остается повторная "радикальная", то есть R0 резекция - ее возможность следует рассматривать у каждого больного с учетом распространенности процесса, особенностей предыдущего хирургического лечения, биологических особенностей опухоли, таких как степень злокачественности и темп роста [49 - 52].
- Рекомендуется включать в морфологическое исследование опухоли надпочечника одну из принятых систем балльной оценки злокачественного потенциала опухоли и иммунногистохимическое исследование для оценки ее органной принадлежности. При констатации злокачественного потенциала опухоли принципиально важна оценка пролиферативного индекса Ki-67 для оценки прогноза агрессивности заболевания.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib).
Комментарии: Послеоперационная диагностика. В настоящее время наиболее распространена панель по критериям световой микроскопии Weiss [53, 54].
Каждый из 9 критериев оценивается в 1 балл:
- Высокий ядерный индекс;
- Митотический индекс более 5% в 500 полях зрения;
- Атипические митозы;
- Более 75% эозинофильных клеток в опухоли;
- Неструктурированность более 1/3 опухоли;
- Некрозы;
- Опухолевая венозная инвазия;
- Опухолевая синусоидальная инвазия;
- Инвазия в капсулу.
При наборе 3 баллов и более по Weiss-шкале выставляется диагноз АКР.
Существует альтернативная по подсчету баллов, однако схожая по набору параметров световой микроскопии система van Slooten и соавт. [55] для дифференцировки доброкачественных и злокачественных адренокортикальных опухолей, панель включает в себя оценку следующих параметров:
- обширные регрессивные изменения (некроз, кровоизлияния, фиброз, кальцификация) 5,7 баллов;
- потеря нормальной структуры 1,6 баллов;
- ядерная атипия 2,1 баллов;
- ядерная гиперхромия 2,6 баллов;
- неправильные ядрышки 4,1 баллов;
- митотическая активность (>= 2 в 10 полях зрения при большом увеличении) 9,0 баллов;
- сосудистая или капсульная инвазия 3,3 балла;
Гистологический индекс > 8 по шкале van Slooten констатирует высокий злокачественный потенциал опухоли надпочечника.
Сравнительное изучение диагностической ценности балльной оценки перечисленных систем несколько отличается у разных исследователей, однако доказана несомненная польза их применения [56, 57], чувствительность шкал в отношении АКР и метастазов составляет около 92% и значительно возрастает при использовании консилиума патологов.
При сомнительной органной принадлежности или неопределенном злокачественном потенциале опухоли ведущее значение приобретает ИГХ исследование. Наиболее часто с этой целью используют оценку интенсивности экспрессии белка p53, Ki 67, кальретинина, цитокератинов 8 и 18, виментина, ингибина ![]() , мелана A, стероидного рецептора коактиватор-1 (SRC-1), протеина S-100, Pax8, хромогранина A, нейроспецифической энолазы, синаптофизина.
, мелана A, стероидного рецептора коактиватор-1 (SRC-1), протеина S-100, Pax8, хромогранина A, нейроспецифической энолазы, синаптофизина.
Предметом дискуссии являлось прогностическое значение количества Weiss- или van Slooten-баллов, однако балльная система параметров световой микроскопии в качестве прогностического критерия уступает пролиферативному индексу Ki-67. При повышении индекса Ki-67 более 10% вероятность рецидива АКР после R0-резекции составляет не менее 80%. Прогностическое значение других маркеров ИГХ в отношении АКР в настоящий момент находится в стадии исследования и накопления анализируемого материала.
3.2 Химиотерапия АКР
- После выполнения R0-резекции по поводу АКР при Ki-67 более 10% рекомендуется проведение адъювантного лечения орто-пара-DDD (син.: митотан, лизодрен, хлодитан). Уровень препарата в крови требует постоянного лабораторного мониторирования и, при условии его переносимости, рекомендованный диапазон терапевтической концентрации составляет от 14 до 20 мг/л. При отсутствии рецидива АКР адъювантное лечение проводится от 2 до 5 лет.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарии: В 2004 г. по решению EMA (European Medicine Agency) в качестве базового препарата для лечения АКР предложен 1-(2-хлорфенил)-1-(4-хлорфенил)-2,2-дихлорэтан,(o,n"-DDD,митотан,лизодрен,хлодитан). Это единственный, в настоящее время безальтернативный по эффективности препарат, специфично действующий на пучковую, частично сетчатую зону, и приводящий к клеточной дегенерации коры надпочечника, при этом, не затрагивая клубочковую зону. Наряду с противоопухолевым воздействием, митотан повреждает внутриклеточные ферменты, участвующие в синтезе стероидов, таким образом, снижает интенсивность надпочечникового стероидогенеза [58, 59].
Препарат используется в качестве основного средства химиотерапии АКР с 1970 года (рекомендован FDA - Agency of Food and Drug Administration USA) выпускается в таблетках по 0,5 г под названием Lysodren - компания HRA Pharma (Paris, France) и Mitotane - компания Bristol Meyer Squibb (New York, USA). На настоящий момент препарат в России не зарегистрирован, однако, в течение почти 20 лет до 1989 г. в бывшем СССР успешно применялся производимый на Украине хлодитан.
В связи с возможностью блокировать синтез кортизола и опасностью развития острой надпочечниковой недостаточности, больные, получающие митотан, нуждаются в заместительной терапии глюкокортикоидами (Приложение Г).
При резектабельных опухолях (R0-резекции) в качестве адъювантной терапии очевидное преимущество митотана наблюдается при достижении в крови целевого диапазона концентрации (> 14 мг/л) (многоцентровое исследование ADIUVO). При R0-резекции через 35 недель с момента операции у 50% больных, не получающих эффективную адъювантную терапию, отмечается местный рецидив или метастазы, в то время как при эффективной концентрации митотана в крови на этом сроке прогрессия болезни отмечается только у 32% пациентов [60 - 63].
При мультицентровом анализе эффективности митотана у 246 больных распространенными формами АКР (IV стадия ENSAT) в 26% наблюдений отмечен объективный ответ в соответствии с критериями RECIST (11 больных - полный ответ, 52 - частичный ответ) [64]. Если рассмотреть отдельные публикации вне мультицентровых исследований, то на достаточных больших выборках (75 пациентов с распространенным АКР) описана опухолевая регрессия более чем у 60% больных, в том случае, когда была достигнута терапевтическая концентрация митотана (более 14 мг/л) [65]. Нужно отметить, что в большинстве исследований по эффективности митотана при распространенных формах АКР отмечаются следующие общие тенденции и выводы:
- случаи полного излечения имеют место, но являются крайней редкостью;
- частичный или полный опухолевый ответ в подавляющем большинстве отмечается у пациентов с достижением терапевтической концентрации митотана в крови [66 - 69].
- независимо от достижения целевой терапевтической концентрации отмечается увеличение общей выживаемости, более длительной при целевых значениях митотана в крови [70 - 77].
- на фоне приема митотана в большинстве наблюдений удается контролировать проявления гиперкортицизма.
- достижение целевой концентрации митотана в крови не всегда зависит от принимаемой дозы препарата, в большей степени зависит от кумуляции дозы, связанной с длительным периодом полужизни препарата, что доказывает необходимость тщательного мониторинга уровня митотана в крови и постоянной коррекции дозы [68, 69].
- митотан имеет узкий терапевтический диапазон дозирования, ограниченный, с одной стороны, необходимостью быстрейшего достижения терапевтической концентрации препарата более 14 мг/л, с другой - переносимостью препарата. В целевых концентрациях частота побочных эффектов составляет не менее 80% наблюдений (минимум 1 побочный эффект), интенсивность и амплитуда нежелательных клинических проявлений нарастает с проявлениями кумуляции дозы, проявления исчезают с отменой препарата (см. таб. "побочные эффекты").
- уменьшение уровня глюкокортикоидов в крови связано не только с адренолитической активностью митотана, но и с его индукцией печеночного клиренса стероидов [78], в связи с чем необходимо минимум двукратное увеличение стандартной дозы заместительной терапии надпочечниковой недостаточности. Недостаточная доза заместительной терапии снижает переносимость митотана и утяжеляет его побочные эффекты.
Таким образом, митотан показал значительную эффективность в отношении безрецидивной выживаемости после R0-резекций и улучшение показателей общей выживаемости при распространенных формах АКР.
3.3 Цитотокисческая терапия
- Пациентам с неоперабельным АКР, наличием распространенного метастатического процесса после резекции первичной опухоли, быстрым прогрессированием заболевания рекомендуется назначать цитотоксическую терапию по схеме этопозид, доксорубицин, цисплатин, митотан (схема EDP-M). Пациенты с невысокой опухолевой нагрузкой и медленной прогрессией могут в качестве первичного лечения находиться на монотерапии митотаном в комбинации с возможными местными циторедуктивными или радиологическими методами.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: На молекулярном уровне при АКР выявляется высокий уровень P-гликопротеина (в некоторых источниках - MDR-1 multydrug resistance), с которым связывают резистентность опухоли к химиотерапевтическому воздействию. Этот белок функционирует, как АТФ-зависимая лекарственная помпа, транспортирующая из клетки гидрофобные цитостатические препараты. Нормальная ткань коры надпочечника производит большое количество P-гликопротеина, и эта секреция сохраняется в большинстве АКР [79 - 82]. Хотя наличие P-гликопротеина является вероятной и существенной причиной мультилекарственной резистентности в АКР, также есть P-гликопротеин-независимые механизмы мультилекарственной резистентности, которые могут объяснять неэффективность не только гидрофобных, но и гидрофильных лекарственных средств типа цисплатина [83].
Наиболее успешным сочетанием препаратов полихимиотерапии признан "итальянский" протокол: в качестве составляющих используются этопозид, доксорубицин и цисплатин, на фоне постоянного приема митотана (схема EPD-M. Исследование FIRM-ACT включало 304 пациента с распространенным вариантом АКР. При сравнении частоты ответа на терапию EPD-M в сравнении со схемой стрептозотоцин + митотан (S + M) показана достоверно более высокая частота ответа на EPD-M: 23,2% против 9,2% на S + M (P < 0,001), и большее время стабилизации заболевания (5 мес. против 2), но не показало значимых различий в общей выживаемости (14,8 мес. против 12,0) [84].
Режимы химиотерапии, применяемые в 1 линии лечения распространенного рака коры надпочечников представлены в таблице 2.
Таблица 2. Режимы химиотерапии, применяемые в 1 линии лечения распространенного рака коры надпочечников
Схема химиотерапии и EDP-M:
I. этопозид 100 мг/м2 в/в 2 - 4 дни;
доксорубицин 40 мг/м2 в/в 1 день;
цисплатин 40 мг/м2 в/в 3 и 4 дни;
митотан ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии.
Курс химиотерапии повторяется каждые 28 дней.
II. этопозид 100 мг/м2 в/в 5 - 7 дни;
доксорубицин 20 мг/ м2 в/в 1 и 8 дни;
цисплатин 40 мг/м2 в/в 1 и 9 дни;
митотан ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии.
Курс химиотерапии повторяется каждые 28 дней.
- В качестве терапии 2 линии больных распространенным АКР рекомендована комбинация гемцитабина и фторпиримидинов (5-фторурацил или капецитабин) на фоне продолжающегося приема митотана [85].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Режимы химиотерапии, применяемые во 2 линии лечения распространенного рака коры надпочечников представлены в таблице 3.
Таблица 3. Режимы химиотерапии, применяемые во 2 линии лечения распространенного рака коры надпочечников
гемцитабин 800 мг/м2 в/в 1, 8 дни каждые 21 день;
5-фторурацил 200 мг/м2 в/в ежедневно до прогрессирования заболевания;
митотан ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл
гемцитабин 800 мг/м2 1, 8 дни каждые 21 день;
капецитабин 1500 мг/сутки внутрь ежедневно до прогрессирования заболевания;
митотан ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл.
- Таргетная терапия в настоящее время не рекомендована для лечения больных распространенным АКР, т.к. результаты ряда исследований о возможности применения препаратов этого класса при распространенных формах АКР продемонстрировали неудовлетворительные результаты (таблица 6, приложение Г) [86].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии:
Определенные надежды связаны с новым препаратом иммунотерапии авелумабом, блокирующим на опухолевой клетке лиганд PD-L1. В исследовании I фазы из 19 пациентов, получающих препарат после прогрессирования на платиносодержащих схемах химиотерапии, у двух отмечен частичный эффект (10,5%). Стабилизация болезни наблюдалась у 5 пациентов (26,3%). Медиана времени до прогрессирования составила 7,6 недель (95% CI: 5.9, 23.9), выживаемость без прогрессирования в течение 12 недель - 30.3% (95% CI: 12.3, 50.7) [87].
Дальнейший успех будущих исследований связан с пониманием молекулярно-генетических основ распространенных форм АКР.
3.4. Дистанционная лучевая терапия
- Дистанционная лучевая терапия (ДЛТ) рекомендована в качестве паллиативной терапии при метастазах АКР в кости и центральную нервную систему (30 - 40 Грей) [88].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарии: В настоящее время исследуются возможности конформной лучевой терапии с 3D-планировкой как при нерезектабельных формах заболевания, так и в качестве дополнительного метода местного воздействия после нерадикального хирургического лечения [89].
4. Реабилитация
- Рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии.
- Реабилитацию больных, оперированных по поводу гормональноактивной опухоли, рекомендовано направить на профилактику надпочечниковой недостаточности в послеперационном периоде.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
5. Профилактика
6. Дополнительная информация, влияющая на течение и исход заболевания
Прогноз при АКР в основном зависит от стадии заболевания: 5-летняя выживаемость при I стадии - составляет 60%, для II стадии 58%, при III - 24%, при IV - 0 - соответственно. Общая, неранжированная по стадиям, пятилетняя выживаемость колеблется от 16 до 38%. Медиана общей выживаемости при IV ст. менее 12 мес [90 - 94].
При распространенных формах заболевания (более 40% больных на момент диагностики) значительное отрицательное влияние на сроки выживания оказывает синдром гиперкортицизма.
Определенный оптимизм связан с разработкой "стандарта" химиотерапии, и развитием новых подходов в химиотерапии (воздействие на опухолевый ангиогенез, появление низкомолекулярных ингибиторов ферментов, иммунные и генетические методы влияния на опухолевый рост).
Критерии оценки качества медицинской помощи
N
Критерий качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1
На этапе исходной диагностики выполнены исследования: уровень кортизола крови после 1 мг дексаметазонового теста, уровень базального АКТГ крови, метанефрины и норметанефрины суточной мочи/плазмы
Ib
A
2
Выполнено КТ с контрастированием надпочечников с определением плотности по HU для определения злокачественного потенциала
Ib
A
3
Выполнено визуализирующее исследование органов брюшной и грудной полостей для оценки метастатического процесса (КТ/диффузионное МРТ/ПЭТ-КТ)
IIb
B
Список литературы
1. Berruti A, Baudin E, Gelderblom H et al. Adrenal cancer: ESMO (European Society for Medical Oncology) Clinical Practice Guidelines for diagnosis, treatment and follow-up on behalf of the ESMO Guidelines Working Group. Annals of Oncology. 2012; 23: 131 - 138.
2. NCCN Clinical Practice Guidelines in Oncology, Neuroendocrine tumor, Version 1.2014.
3. Schteingart DE, Doherty GM, Gauger PG et al. Management of patients with adrenal cancer: recommendations of an international consensus conference. Endocr Relat Cancer. 2005; 12: 667.
4. Langer P, Cupisti K, Bartsch DK et al. Adrenal involvement in multiple endocrine neoplasia type 1. World J Surg. 2002; 26: 891 - 896.
5. Gicquel C, Le Bouc Y. Molecular markers for malignancy in adrenocortical tumors. Horm Res. 1997; 47: 269 - 272.
6. Бельцевич ДГ, Кузнецов НС, Солдатова ТВ, Ванушко ВЭ. Инциденталома надпочечников. Эндокринная хирургия. 2009. N 1.
7. Funder JW (https://www.ncbi.nlm.nih.gov/pubmed/?term=Funder%20JW%5BAuthor%5D&cauthor=true&cauthor_uid=18552288), Carey RM (https://www.ncbi.nlm.nih.gov/pubmed/?term=Carey%20RM%5BAuthor%5D&cauthor=true&cauthor_uid=18552288) et al. Case detection, diagnosis, and treatment of patients with primary aldosteronism: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. (https://www.ncbi.nlm.nih.gov/pubmed/18552288) 2008; 93(9): 3266-81.
8. Guignat L (https://www.ncbi.nlm.nih.gov/pubmed/? term=Guignat%20L%5BAuthor%5D&cauthor=true&cauthor_uid=20375177), Bertherat J (https://www.ncbi.nlm.nih.gov/pubmed/? term=Bertherat%20J%5BAuthor%5D&cauthor=true&cauthor_uid=20375177). The diagnosis of Cushing"s syndrome: an Endocrine Society Clinical Practice Guideline: commentary from a European perspective. Eur J Endocrinol. (https://www.ncbi.nlm.nih.gov/pubmed/20375177) 2010; 163(1): 9 - 13.
9. Lenders JW (https://www.ncbi.nlm.nih.gov/pubmed/? term=Lenders%20JW%5BAuthor%5D&cauthor=true&cauthor_uid=24893135), Duh QY (https://www.ncbi.nlm.nih.gov/pubmed/?term=Duh%20QY%5BAuthor%5D&cauthor=true&cauthor_uid=24893135), Eisenhofer G (https://www.ncbi.nlm.nih.gov/pubmed/?term=Eisenhofer%20G%5BAuthor%5D&cauthor=true&cauthor_uid=24893135) et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. и J Clin Endocrinol Metab. (https://www.ncbi.nlm.nih.gov/pubmed/24893135) 2014; 99(6): 1915-42.
10. Libe R, Dall'Asta C, Barbetta L et al. Long-term follow-up study of patients with adrenal incidentalomas. Eur J Endocrinol. 2002; 147: 489 - 494.
11. Terzolo M, Reimondo G, Bovio S, Angeli A Subclinical Cushing's syndrome. Pituitary. 2004; 7: 217 - 223.
10. Kirkby-Bott J, Brunaud L, Mathonet M, Hamoir E, Kraimps JL,  C, Amar L, Rault A, Henry JF, Carnaille B. Ectopic hormone-secreting pheochromocytoma: a francophone observational study. World J Surg. 2012; 36(6): 1382 - 1388.
C, Amar L, Rault A, Henry JF, Carnaille B. Ectopic hormone-secreting pheochromocytoma: a francophone observational study. World J Surg. 2012; 36(6): 1382 - 1388.
11. Li XG, Zhang DX, Li X. et al. Adrenocorticotropic hormone-producing pheochromocytoma: a case report and review of the literature. Chin Med J (Engl). 2012; 125(6): 1193 - 1196.
12. Cohade C, Broussaud S, Louiset E, Bennet A, Huyghe E, Caron P. Ectopic Cushing"s syndrome due to a pheochromocytoma: a new case in the postpartum and review of literature. Gynecol Endocrinol. 2009; 25(9): 624 - 627.
13. Gardet V et al. Lessons from an unpleasant surprise: a biochemical strategy for the diagnosis of pheochromocytoma. J Hypertens. 2001; 19: 1029 - 1035.
14. Nieman LK, Biller BMK, Findling JW et al. The diagnosis of Cushing's syndrome: an endocrine society clinical practice guideline Journal of Clin Endoc & Met. 2008; 93(5): 1526 - 1540.
15. Newell-Price J, Trainer P, Besser M, Grossman A The diagnosis and differential diagnosis of Cushing's syndrome and pseudo-Cushing"s states. Endocr Rev 1998; 19: 647 - 672.
16. Pecori Giraldi F, Ambrogio AG, De Martin Met al. Specificity of first-line tests for the diagnosis of Cushing's syndrome: assessment in a large series. J Clin Endocrinol Metab. 2007; 92: 4123 - 4129.
17. Tsagarakis S, Vassiliadi D, Thalassinos N. Endogenous subclinical hypercortisolism: diagnostic uncertainties and clinical implications. J Endocrinol Invest. 2006; 29: 471 - 482.
18. Mitchell IC, Auchus RJ, Juneja K et al. "Subclinical Cushing's syndrome" is not subclinical: improvement after adrenalectomy in 9 patients. Surgery 2007; 142: 900 - 905.
19. Mitchell IC, Auchus RJ, Juneja K et al. "Subclinical Cushing's syndrome" is not subclinical: improvement after adrenalectomy in 9 patients. Surgery 2007; 142: 900 - 905.
20. Reincke M Subclinical Cushing's syndrome. Endocrinol Metab Clin North Am. 2000; 29: 43 - 56.
21. Pacak K Preoperative management of the pheochromocytoma patient. J Clin Endocrinol Metab 2007; 92: 4069 - 4079.
22. Williams DT, Dann S, Wheeler MH. Phaeochromocytoma - views on current management. Eur J Surg Oncol. 2003; 29: 483 - 490.
23. Young W.F., Jr. The Incidentally Discovered Adrenal Mass. N Engl J Med. 2007; 356: 601-10.
24. An Endocrine Society Clinical Practice Guidelines. Case Detection, Diagnosis, and Treatment of Patients with Primary Aldosteronism. J Clin Endocrinol Metab. 2008; 93(9): 3266 - 3281.
25. Трошина ЕА, Бельцевич ДГ, Молашенко НВ. Диагностика и дифференциальная диагностика первичного гиперальдостеронизма. Клиническая медицина. 2009; 5: 15 - 20.
26. Mantero F, Terzolo M, Arnaldi G, et al. A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. J Clin Endocrinol Metab. 2000; 85(2): 637 - 644. (http://www.ncbi.nlm.nih.gov/pubmed/10690869)
27. Angeli A, Osella G, Ali A, Terzolo M. Adrenal incidentaloma: an overview of clinical and epidemiological data from the National Italian Study Group. Horm Res. 1997; 47: 279 - 283. (http://www.ncbi.nlm.nih.gov/pubmed/10690869)
28. Chang A, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Chang%20A%5BAuthor%5D&cauthor=true&cauthor_uid=3823423) Glazer HS. Adrenal gland: MR imaging. (https://www.ncbi.nlm.nih.gov/pubmed/?term=Glazer%20HS%5BAuthor%5D&cauthor=true&cauthor_uid=3823423) Radiology. 1987; 163(1): 123-8. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
29. Metser U, Miller E, Lerman H et al. 18F-FDG PET/CT in the Evaluation of Adrenal Masses. J Nucl Med. 2006; 47(1): 32 - 37. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
30. M. Blake, P. Prakash, C.Cronin. PET/CT for Adrenal Assessment Am J Roentgenology. 2010; 195(2): 195. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
31. Mackie GC, Shulkin BL, Ribeiro RC, et al. Use of [18F]fluorodeoxyglucose positron emission tomography in evaluating locally recurrent and metastatic adrenocortical carcinoma. J Clin Endocrinol Metab. 2006; 91: 2665. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
32. Leboulleux S, Dromain C, Bonniaud G et al. Diagnostic and prognostic value of 18-fluorodeoxyglucose positron emission tomography in adrenocortical carcinoma: a prospective comparison with computed tomography. J Clin Endocrinol Metab. 2006; 91: 920. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
33. Deandreis D, Leboulleux S, Caramella C, et al. FDG PET in the management of patients with adrenal masses and adrenocortical carcinoma. Horm Cancer. 2011; 2: 354. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
34. Harisinghani MG, Maher MM, Hahn PF et al. Predictive value of benign percutaneous adrenal biopsies in oncology patients. Clin Radiol. 2002; 57: 898 - 901. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
35. Arellano RS, Harisinghani MG, Gervais DA et al Imageguided percutaneous biopsy of the adrenal gland: review of indications, technique, and complications. Curr Probl Diagn Radiol. 2003; 32: 3 - 10. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
36. Welch TJ, Sheedy PF II, Stephens DH et al. Percutaneous adrenal biopsy: review of a 10-year experience. Radiology. 1994; 193: 341 - 344. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
37. Casola G, Nicolet V, van Sonnenberg E et al. Unsuspected pheochromocytoma: risk of blood-pressure alterations during percutaneous adrenal biopsy. Radiology. 1986; 159: 733 - 735. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
38. McCorkell SJ, Niles NL. Fine-needle aspiration of catecholamine-producing adrenal masses: a possibly fatal mistake. Am J Roentgenol. 1985; 145: 113 - 114. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
39. Pacak K, Eisenhofer G, Ahlman H et al. Pheochromocytoma: recommendations for clinical practice from the First International Symposium. Nat Clin Pract Endocrinol Metab. 2007; 3: 92 - 102. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
40. Saeger W, Fassnacht M, Chita R. High Diagnostic Accuracy of Adrenal CoreBiopsy: Results of the German and Austrian Adrenal Network Multicenter Trial in 220 Consecutive Patients. Human pathology. 2003; 34(2): 180 - 186. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
41. Dackiw AP, Lee JE, Gagel RF, Evans DB. Adrenal cortical carcinoma. World J Surg. 2001; 25: 914 - 926 (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
42. Ng L, Libertino JM. Adrenocortical carcinoma: diagnosis, evaluation and treatment. J Urol. 2003; 169: 5 - 11. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
43. Miller BS, Gauger PG, Hammer GD et al. Proposal for modification of the ENSAT staging system for adrenocortical carcinoma using tumor grade. Langenbecks Arch Surg. 2010; 395: 955. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
44. Fassnacht M, Johanssen S, Quinkler M et al. Limited prognostic value of the 2004 International Union Against Cancer staging classification for adrenocortical carcinoma: proposal for a Revised TNM Classification. Cancer 2009; 115: 243. (https://www.ncbi.nlm.nih.gov/pubmed/3823423)
45. Shen WT, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Shen%20WT%5BAuthor%5D&cauthor=true&cauthor_uid=15719374)Sturgeon C, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Sturgeon%20C%5BAuthor%5D&cauthor=true&cauthor_uid=15719374)Duh QY. From incidentaloma to adrenocortical carcinoma: the surgical management of adrenal tumors. (https://www.ncbi.nlm.nih.gov/pubmed/? term=Duh%20QY%5BAuthor%5D&cauthor=true&cauthor_uid=15719374)J Surg Oncol. 2005; 89(3): 186-92 (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
46.  B, Khorram-Manesh A, Jansson S, et al. The long-term survival in adrenocortical carcinoma with active surgical management and use of monitored mitotane. Endocr Relat Cancer. 2010; 17: 265. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
B, Khorram-Manesh A, Jansson S, et al. The long-term survival in adrenocortical carcinoma with active surgical management and use of monitored mitotane. Endocr Relat Cancer. 2010; 17: 265. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
47. Allolio B, Fassnacht M. Clinical review: Adrenocortical carcinoma: clinical update. J Clin Endocrinol Metab. 2006; 91: 2027. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
48. Филимонюк А.В., Харченко Н.В., Леонов Б.И., Смирнова Е.А., Антонов А.К., Смелкова Н.И. Непосредственные и отдаленные результаты хирургического лечения больных адренокортикальным раком. Вестник новых медицинских технологий (электронное издание). 2013; 1 [Электронный ресурс]. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
49. Reibetanz J, Jurowich C, Erdogan I et al. Impact of lymphadenectomy on the oncologic outcome of patients with adrenocortical carcinoma. Ann Surg. 2012; 255: 363. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
50. Gaujoux S, Brennan MF. Recommendation for standardized surgical management of primary adrenocortical carcinoma. Surgery. 2012 152(1): 123-32. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
51. Porpiglia F, Miller BS, Manfredi M et al. A debate on laparoscopic versus open adrenalectomy for adrenocortical carcinoma. Horm Cancer. 2011; 2: 372. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
52. Brix D, Allolio B, Fenske W et al. Laparoscopic versus open adrenalectomy for adrenocortical carcinoma: surgical and oncologic outcome in 152 patients. Eur Urol. 2010; 58: 609. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
53. Donatini G, Caiazzo R, Do Cao Ch et al. Long-Term Survival After Adrenalectomy for Stage I/II Adrenocortical Carcinoma (ACC): A Retrospective Comparative Cohort Study of Laparoscopic Versus Open Approach. Ann Surg Oncol. 2014; 21: 284 - 291. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
54. McCauley LR, Nguyen MM. Laparoscopic radical adrenalectomy for cancer: long-term outcomes. Curr Opin Urol. 2008; 18: 134. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
55. Gonzalez RJ, Shapiro S, Sarlis N et al. Laparoscopic resection of adrenal cortical carcinoma: a cautionary note. Surgery. 2005; 138(6): 1078. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
56. Miller BS, Gauger PG, Hammer GD, Doherty GM. Resection of adrenocortical carcinoma is less complete and local recurrence occurs sooner and more often after laparoscopic adrenalectomy than after open adrenalectomy. Surgery. 2012; 152: 1150 - 1157. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
57. Leboulleux S, Deandreis D, Ghuzlan A Al et al. Adrenocortical carcinoma: is the surgical approach a risk factor of peritoneal carcinomatosis? Eur J Endocrinol. 2010; 162: 1147 - 1153 (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
58. Schulick RD, Brennan MF. Long-term survival after complete resection and repeat resection in patients with adrenocortical carcinoma. Ann Surg Oncol. 1999; 6(8): 719 - 726. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
59. Icard P, Chapuis Y, Andreassian B, et al. Adrenocortical carcinoma in surgically treated patients: a retrospective study on 156 cases by the French Association of Endocrine Surgery. Surgery. 1992; 112(6): 972 - 979. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
60. Bellantone R, Ferrante A, Boscherini M, et al.: Role of reoperation in recurrence of adrenal cortical carcinoma: results from 188 cases collected in the Italian National Registry for Adrenal Cortical Carcinoma. Surgery. 1997, 122: 1212 - 1218. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
61. Porpiglia F, Fiori C, Scarpa RM et al. The role of surgery in the management of recurrent adrenocortical carcinoma: results of a retrospective study. Eur Urol Suppl. 2009; 8(4): 305. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
62. Weiss LM. Comparative histologic study of 43 metastasizing and nonmetastasizing adrenocortical tumors. Am J Surg Pathol. 1984; 8(3): 163 - 169. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
63. Lau SK, Weiss LM. The Weiss system for evaluating adrenocortical neoplasms: 25 years later. Hum Pathol. 2009; 40(6): 757 - 768. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
64. van Slooten H, Schaberg A, Smeenk D, Moolenar AJ. Morphologic characteristics of benign and malignant adrenocortical tumors. Cancer. 1985 Feb 15; 55(4): 766 - 773. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
65. Blanes A et al. Histologic criteria for adrenocortical proliferative lesions: value of mitotic figure variability. Am J Clin Pathol. 2007; 127(3): 398 - 408. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
66. Филиппова О.В. Адренокортикальный рак: клинические проявления и морфологическая диагностика/Филиппова О.В., Хмельницкая Н.М.//Медицинский альманах. 2011; 5: 113 - 116. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
67. Hahner S, Fassnacht M. Mitotane for adrenocortical carcinoma treatment. Curr Opin Investig Drugs. 2005; 6: 386 - 394. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
68. Schteingart DE. Conventional and novel strategies in the treatment of adrenocortical cancer. Braz J Med Biol Res. 2000; 33: 1197 - 1200. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
69. Dickstein G. Is there a role of low dose of mitotane as adjuvant therapy in adrenocortical carcinoma? J Clin Endocrinol Metab. 1999; 84: 1488 - 1489. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
70. Vassilopoulou-Sellin R, Guinee VF, Klein MJ, et al. Impact of adjuvant mitotane on the clinical course of patients with adrenocortical cancer. Cancer. 1993; 71: 3119 - 3123. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
71. Terzolo M, Angeli A, Fassnacht M Adjuvant mitotane treatment for adrenocortical carcinoma. N Engl J Med. 2007; 356(23): 2372. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
72. Clinical trials gov. identifier NCT00777244, start 2008, update 2013. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
73. Lubitz JA, Freeman L, Okun R Mitotane use in inoperable adrenalcortical carcinoma. JAMA. 1973; 223: 1109 - 1112. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
74. van Slooten H, Moolenaar AJ, van Seters AP, Smeenk D. The treatment of adrenocortical carcinoma with o,p_-DDD: prognostic implications of serum level monitoring. Eur J Cancer Clin Oncol. 1984; 20: 47 - 53. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
75. Haak HR, Hermans J, van de Velde CJ et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in a consecutive series of 96 patients. Br J Cancer. 1994; 69: 947 - 951. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
76. Baudin E, Pellegriti G, Bonnay M et al. Impact of monitoring plasma 1,1-dichlorodiphenildichloroethane (o,p_DDD) levels on the treatment of patients with adrenocortical carcinoma. Cancer. 2001; 92: 1385 - 1392. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
77. Heilmann P, Wagner P, Nawroth PP, Ziegler R [Therapy of the adrenocortical carcinoma with Lysodren (o,p'-DDD). Therapeutic management by monitoring o,p_-DDD blood levels]. Med Klin. 2001; 96: 371 - 377. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
78. Becker D, Schumacher OP. o,p'DDD therapy in invasive adrenocortical carcinoma. Ann Intern Med. 1975; 82: 677 - 679. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
79. Boven E, Vermorken JB, van Slooten H, Pinedo HM. Complete response of metastasized adrenal cortical carcinoma with o,p_-DDD. Case report and literature review. Cancer. 1984; 53: 26 - 29. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
80. Krzisnik C, Petric G, Jereb B. Complete response of metastatic adrenal cortical carcinoma to o,p_-DDD in a child. Pediatr Hematol Oncol. 1988; 5: 65 - 69. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
81. Lim MC, Tan YO, Chong PY, Cheah JS. Treatment of adrenal cortical carcinoma with mitotane: outcome and complications. Ann Acad Med Singapore. 1990. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
82. Decker RA, Kuehner ME. Adrenocortical carcinoma. Am Surg. 1991; 57: 502 - 513. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
83. Remond S, Bardet S, Charbonnel B. Complete and lasting remission of a metastatic malignant adrenocortical carcinoma under treatment with OP-DDD alone. Presse Med. 1992; 21: 865. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
84. Ilias I, Alevizaki M, Philippou G, Anastasiou E, Souvatzoglou A. Sustained remission of metastatic adrenal carcinoma during long-term administration of low-dose mitotane. J Endocrinol Invest. 2001; 24: 532 - 535. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
85. Allolio B, Hahner S, Weismann D, Fassnacht M. Management of adrenocortical carcinoma. Clin Endocrinol (Oxf). 2004; 60: 273 - 287. 19: 540544. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
86. Fassnacht M, ![]() R, Kroiss M, Allolio B. Adrenocortical carcinoma: a clinician"s update. Nat Rev Endocrinol. 2011; 7: 323. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
R, Kroiss M, Allolio B. Adrenocortical carcinoma: a clinician"s update. Nat Rev Endocrinol. 2011; 7: 323. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
87. Hague RV, May W, Cullen DR. Hepatic microsomal enzyme induction and adrenal crisis due to o,p_DDD therapy for metastatic adrenocortical carcinoma. Clin Endocrinol (Oxf). 1989; 31: 51 - 57. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
88. Cordon-Cardo C, O"Brien JP, Boccia J et al. Expression of the multidrug resistance gene product (P-glycoprotein) in human normal and tumor tissues. J Histochem Cytochem. 1990; 38: 1277 - 1287. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
89. Flynn SD, Murren JR, Kirby WM et al. P-glycoprotein expression and multidrug resistance in adrenocortical carcinoma. Surgery. 1992; 112: 981 - 986. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
90. Goldstein LJ, Galski H, Fojo A, et al. Expression of a multidrug resistance gene in human cancers. J Natl Cancer Inst. 1989; 81: 116 - 124. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
91. Fridborg H, Larsson R, Juhlin C, Rastad J, Akerstrom G, Backlin K, Nygren P P-glycoprotein expression and activity of resistance modifying agents in primary cultures of human renal and adrenocortical carcinoma cells. Anticancer Res. 1994; 14: 1009 - 1016. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
92. Haak HR, van Seters AP, Moolenaar AJ, Fleuren GJ Expression of P-glycoprotein in relation to clinical manifestation, treatment and prognosis of adrenocortical cancer. Eur J Cancer. 1993; 29A: 1036 - 1038. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
93. Fassnacht M, Terzolo M, Allolio B et al. Combination chemotherapy in advanced adrenocortical carcinoma. FIRM-ACT Study GroupN Engl J Med. 2012; 366(23): 2189. (https://www.ncbi.nlm.nih.gov/pubmed/15719374)
94. Sperone P, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Sperone%20P%5BAuthor%5D&cauthor=true&cauthor_uid=20410174) Ferrero A, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Ferrero%20A%5BAuthor%5D&cauthor=true&cauthor_uid=20410174) Daffara F et al. Gemcitabine plus metronomic 5-fluorouracil or capecitabine as a second-/third-line chemotherapy in advanced adrenocortical carcinoma: a multicenter phase II study. (https://www.ncbi.nlm.nih.gov/pubmed/? term=Daffara%20F%5BAuthor%5D&cauthor=true&cauthor_uid=20410174)Endocr Relat Cancer. 2010; 17(2): 445-53 (https://www.ncbi.nlm.nih.gov/pubmed/20410174)
95. Martin Fassnacht, Matthias Kroiss, and Bruno Allolio. Update in Adrenocortical Carcinoma. J Clin Endocrinol Metab. 2013, 98(12): 4551 - 4564. (https://www.ncbi.nlm.nih.gov/pubmed/20410174)
96. Le Tourneau C, Hoimes C. J., Zarwan C. et al. Avelumab (MSB0010718C; anti-PD-L1) in patients with advanced adrenocortical carcinoma from the JAVELIN solid tumor phase Ib trial: Safety and clinical activity. J Clin Oncol 34, 2016 (suppl; abstr 4516) (https://www.ncbi.nlm.nih.gov/pubmed/20410174)
97. Polat B, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Polat%20B%5BAuthor%5D&cauthor=true&cauthor_uid=19402169) Fassnacht M, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Fassnacht%20M%5BAuthor%5D&cauthor=true&cauthor_uid=19402169) Pfreundner L. Radiotherapy in adrenocortical carcinoma. (https://www.ncbi.nlm.nih.gov/pubmed/?term=Pfreundner%20L%5BAuthor%5D&cauthor=true&cauthor_uid=19402169)Cancer. 2009; 115(13): 2816-23 (https://www.ncbi.nlm.nih.gov/pubmed/19402169)
98. Sabolch A, Feng M, Griffith K et al. Adjuvant and definitive radiotherapy for adrenocortical carcinoma. Int J Radiat Oncol Biol Phys. 2011; 80: 1477 - 1484. Habra MA, Ejaz S, Feng L et al. A retrospective cohort analysis of the efficacy of adjuvant radiotherapy after primary surgical resection in patients with adrenocortical carcinoma. J Clin Endocrinol Metab. 2013; 98: 192 - 197 (https://www.ncbi.nlm.nih.gov/pubmed/19402169)
99. Icard P, Goudet P, Charpenay C. Adrenocortical carcinomas: surgical trends and results of a 253-patient series from the French Association of Endocrine Surgeons Study Group. World J Surg. 2001; 25: 891 - 897. (https://www.ncbi.nlm.nih.gov/pubmed/19402169)
100. Crucitti F, Bellantone R, Ferrante A, et al. The Italian Registry for Adrenal Cortical Carcinoma: analysis of a multiinstitutional series of 129 patients. The ACC Italian Registry Study Group. Surgery. 1996; 119: 161 - 170. (https://www.ncbi.nlm.nih.gov/pubmed/19402169)
101. Pommier RF, Brennan MF. An eleven-year experience with adrenocortical carcinoma. Surgery 1992; 112: 963 - 970; discussion, 970 - 971. (https://www.ncbi.nlm.nih.gov/pubmed/19402169)
102. Soreide JA, Brabrand K, Thoresen SO. Adrenal cortical carcinoma in Norway, 1970 - 1984. World J Surg. 1992; 16: 663 - 667; discussion, 668. (https://www.ncbi.nlm.nih.gov/pubmed/19402169)
103. Vassilopoulou-Sellin R, Schultz PN. Adrenocortical carcinoma. Clinical outcome at the end of the 20th century. Cancer. 2001; 92: 1113 - 1121. (https://www.ncbi.nlm.nih.gov/pubmed/19402169)
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Мельниченко Галина Афанасьевна <1> академик РАН, доктор мед. наук, проф.
2. Стилиди Иван Сократович <2>, член-корр. РАН, доктор мед. наук, проф.
3. Горбунова Вера Андреевна <2>, доктор мед. наук, проф.
4. Алексеев Борис Яковлевич <3>, доктор мед. наук, проф.
5. Бельцевич Дмитрий Германович <1>, доктор мед. наук, проф.
6. Коломейцева Алина Андреевна <2>, канд. мед. наук
7. Бохян Ваган Юрикович <2>, канд. мед. наук
8. Райхман Алина Олеговна <4>
9. Кузнецов Николай Сергеевич <1>, доктор мед. наук, проф.
10. Жуков Николай Владимирович <3>, <5>, канд. мед. наук
--------------------------------
<1> ФГБУ "Эндокринологический научный центр" МЗ РФ
<2> ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
<3> ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
<4> ГБОУ ВПО "Первый Московский Государственный Университет им И.М. Сеченова" МЗ РФ
<5> ФГБУ ФНКЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева МЗ РФ
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
У авторов и экспертов не было конфликта интересов при создании клинических рекомендаций.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных по ключевым словам, связанным адренокортикальным раком и соответствующими разделами клинических рекомендаций. Оценка качества и релевантности найденных источников (Agree).
Описание методов, использованных для сбора/селекции доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE, e-library. Глубина поиска составляла до 40 лет.
Методы, использованные для оценки уровня доказательств:
- Консенсус экспертов;
- Оценка значимости в соответствии с уровнями доказательности.
Целевая аудитория данных клинических рекомендаций:
1.
1.
1.
1.
Врачи-онкологи (урологи, хирурги, химиотерапевты);
2.
Врачи-эндокринологи;
3.
Врачи лучевой диагностики;
4
Врачи-патологоанатомы;
5.
Врачи общей практики (семейные врачи).
Таблица П1 - Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
Уровни достоверности доказательств
Описание
Ia
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований
Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
IIa
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании
IIb
Доказательность, основанная как минимум на одном квазиэксперементальном исследовании с хорошим дизайном
III
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов
Таблица П2 - Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
Уровень убедительности рекомендации
Уровни достоверности доказательств
Описание
A
Ia, Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
B
IIa, IIb, III
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях
C
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с КМ. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями.
Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи (http://cr.rosminzdrav.ru/#!/schema/708)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Адренокортикальный рак - потенциально опасное для жизни заболевание, основополагающий этап лечения - удаление первичной опухоли с возможно наиболее радикальным удалением внеопухолевых очагов поражения. К большому сожалению, это не всегда достижимо (по разным причинам - поздняя диагностика, тяжелое состояние пациента при проявлениях гормональной активности, большая распространенность процесса, когда радикальная операция несовместима с жизнью). Пациенту с распространенным процессом важно понимание, что проведение лекарственной терапии возможно, и у значительной части больных (около 50%) возможно достижение достаточно длительных периодов стабилизации заболевания при хорошем качестве жизни и сохранении активности. У некоторого небольшого числа пациентов лекарственная терапия позволяет добиться регрессии опухоли.
Как ни при одном другом заболевании для проведения такого лечения пациент должен проявлять комплаентность (приверженность лечению). При приеме митотана возможны побочные эффекты, которые необходимо немедленно озвучивать курирующему врачу. Вместе с митотаном необходима заместительная терапия гормонами (из-за надпочечниковой, тиреоидной, андрогенной недостаточности) прием стероидных препаратов, тироксина, часто - гепатопротекторов. Лабораторный контроль уровня митотана в крови, биохимическое исследование для контроля терапии требуется достаточно часто, 1 раз в 1 - 3 месяца, контроль за размером опухоли с помощью топических методов (по показаниям - УЗИ, КТ, МРТ, ПЭТ) проводится тоже не реже, чем 1 раз в 3 месяца.
Ключевым моментом в ведении пациента является наличие врача-куратора, который хорошо знаком с проблематикой данного заболевания и способен осуществлять диспетчерские функции в мультидисциплинарной команде врачей.
Приложение Г
Рекомендации
по заместительной терапии при лечении митотаном
Глюкокортикоиды: с начала лечения митотаном дозы превышают обычные:
- Гидрокортизон 50 - 75 мг;
- Кортизона ацетат 75 - 100 мг.
Оценка заместительной терапии производится по клиническим критериям:
- оценивать минералкортикоидную недостаточность по уровню электролитов, коррекция - флудрокортизон (кортинефф);
- гипогонадизм у мужчин оценивается по клиническим проявлениям (эректильная дисфункция и гинекомастия) подтверждается гормональной оценкой. При подтверждении требует заместительной терапии;
- вторичный гипотиреоз (тиреотропный гормон (ТТГ) - норма, снижение св. Т4) - требует заместительной терапии.
Рекомендации
по применению митотана в качестве адъювантной терапии
Начальная доза 1 г в день; и каждые 4 - 7 дней повышение на 1 - 2 г до 8 - 10 г ежедневно, или до максимально переносимой дозы; препарат принимается 2 - 3 раза в день во время еды.
Повышение дозы регулируется:
- Переносимостью препарата;
- Достигнутой терапевтической концентрацией (14 - 20 мг/л).
Оценивать уровень митотана в крови необходимо:
- каждые 4 - 8 нед до достижения целевой зоны;
- при достижении целевой зоны каждые 3 мес в течение 2 лет, затем через более длительные интервалы.
Клиническая и топическая оценка проводится 1 раз в 3 месяца.
Необходимо определение уровня митотана в крови при возникновении побочных эффектов.
При возникновении побочных эффектов:
- незначительные - продолжить митотан, лечить симптомы;
- значительные - вернутся к последней переносимой дозе, лечить симптомы;
- тяжелые - прекратить митотан, провести специфическое лечение симптомов, затем возобновить митотан с малых доз.
Таблица П3. Побочные эффекты митотана (адаптировано по Allolio, Fassnacht, 2006)
Симптомы
Частота
Гастроинтестинальные: тошнота, рвота, диарея
Очень часто
ЦНС: сонливость, заторможенность, атаксия, дизартрия, головокружение, депрессия, снижение памяти, полинейропатия
Очень часто
Надпочечниковая недостаточность
Очень часто
Первичный гипогонадизм у мужчин
Часто
Гинекомастия
Часто
Кожная сыпь
Часто
Аутоиммунный гепатит
Редко
Артериальная гипертензия
Очень редко
Диплопия, ретинопатия, катаракта, макулярный отек
Очень редко
Геморрагический цистит
Очень редко
Вираж печеночных ферментов (в основном Y-ГТ)
Очень часто
Увеличение уровня связывающих белков
Очень часто
Гиперхолестеринемия, гипертриглицеридемия
Очень часто
Увеличение времени кровотечения
Очень часто
Лейкопения
Часто
Тромбоцитопения, анемия
Редко
Индукция микросомальных печеночных ферментов, увеличивающих метаболический клиренс глюкокортикостероидов, барбитуратов, варфарина
Очень часто
Критерии адекватности операции
R0
Полная резекция с отсутствием признаков опухолевого роста
R1
Признаки опухолевого роста в краях удаленной ткани
R2
Остатки опухоли, макроскопически видимые во время операции
Rx
Оценить адекватность операции невозможно или данные сомнительны
Критерии оценки ответа солидных опухолей на лечение по RECIST (Response Evaluation Criteria in Solid Tumors)
Полный ответ (Complete Response - CR)
Полное исчезновение всех опухолевых поражений в течение 4 нед с момента документации полного ответа
Частичный ответ (Partial Response - PR)
Уменьшение, по сравнению с исходным на 50% и более, суммы измерений 2 больших перпендикулярных диаметров, что определяется в 2 наблюдениях по крайней мере в течение 4 нед. При этом должны отсутствовать признаки прогрессирования заболевания
Прогрессирование заболевания (Progressive Disease - PD)
Увеличение размеров опухоли, появление любого нового очага или нового выпота, или асцита, связанного с опухолью
Стабилизация заболевания (Stable Disease - SD)
Несоответствие критериям CR или PR при отсутствии PD
Таблица П6. Оценка размеров основного опухолевого очага
Полный ответ (Complete Response - CR)
Исчезновение всех основных очагов. Любой из увеличенных лимфатических узлов (основных или дополнительных) должен иметь короткую ось менее 10 мм
Частичный ответ (Partial Response - PR)
Уменьшение суммы диаметров основных очагов не менее чем на 30%
Прогрессирование заболевания (Progressive Disease - PD)
Увеличение на 20% и более суммы диаметров основных очагов, которая в абсолютном выражении составляет не менее 5 мм; появление одного или нескольких новых очагов
Стабилизация заболевания (Stable Disease - SD)
Несоответствие критериям CR или PR при отсутствии PD
Таблица П7. Оценка метастатических очагов
Полный ответ (Complete Response - CR)
Исчезновение всех дополнительных очагов и нормализация уровня опухолевых маркеров. Все лимфатические узлы должны иметь размер менее 10 мм по короткой оси
Сомнительный ответ (Non-CR/Non-PD)
Сохранение одного или нескольких основных очагов и/или сохранение уровня опухолевого маркера выше нормы
Прогрессирование заболевания (Progressive Disease - PD)
Однозначная прогрессия дополнительных очагов, появление одного или нескольких новых очагов
Опубликованные результаты таргетной терапии АКР (адаптировано по M. Fassnacht, M. Kroiss, B. Allolio. Update in Adrenocortical Carcinoma. 2013)
Препараты
Механизм действия, мишень
Количество пациентов
Исходы
Сунитиниб
Мультикиназный ингибитор (VEGFR, PDGFR, c-kit, FLT3, RET)
35
Стабилизация заболевания - 5
Циксутумумаб + темзиролимус
Комбинация киназных ингибиторов (IGF-1R, mTOR)
26
Стабилизация заболевания - 11
Гефитиниб
Ингибитор EGFR-сигнального пути
19
Отсутствие ответа
Довитиниб
Мультикиназный ингибитор (FGFR, PDGFR, VEGFR)
17
Стабилизация заболевания - 4
Бевацизумаб + капацетабин
Ингибитор VEGF-сигнального пути + цитотоксический препарат
10
Отсутствие ответа
Ерлотиниб + гемцитабин
Ингибитор EGFR-сигнального пути + цитотоксический препарат
10
Стабилизация заболевания - 1
Сорафениб + паклитаксел
Мультикиназный ингибитор (BRAF, VEGFR, c-kit, PDGFR!) + цитотоксический препарат
9
Отсутствие ответа
Иматиниб
Мультикиназный ингибитор (c-KIT and PDGF)
4
Отсутствие ответа
Эверолимус
Ингибитор mTOR-киназы
4
Отсутствие ответа
