Решение Комиссии Таможенного союза от 17.08.2010 N 341
ЕВРАЗИЙСКОЕ ЭКОНОМИЧЕСКОЕ СООБЩЕСТВО
КОМИССИЯ ТАМОЖЕННОГО СОЮЗА
РЕШЕНИЕ
от 17 августа 2010 г. N 341
О ВОПРОСАХ ПРИМЕНЕНИЯ САНИТАРНЫХ МЕР В ТАМОЖЕННОМ СОЮЗЕ
Комиссия Таможенного союза решила:
1. Утвердить:
1.1. Изменения в следующие правовые акты Таможенного союза:
Единый перечень товаров, подлежащих санитарно-эпидемиологическому надзору (контролю) на таможенной границе и таможенной территории таможенного союза (прилагается);
Единая форма документа, подтверждающего безопасность продукции (товаров) (прилагается);
Положение о порядке осуществления государственного санитарно-эпидемиологического надзора (контроля) за лицами и транспортными средствами, пересекающими таможенную границу Таможенного союза, подконтрольными товарами, перемещаемыми через таможенную границу Таможенного союза и на таможенной территории Таможенного союза (прилагается);
Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю) (прилагаются).
1.2. Технические условия по формату и регламенту передачи данных из Национальных реестров свидетельств о государственной регистрации в Единый реестр свидетельств о государственной регистрации (далее - Технические условия) (прилагаются).
2. Секретариату Комиссии Таможенного союза в срок до 1 октября 2010 года отработать и предоставить Сторонам механизм обмена информации в рамках Технических условий между Национальными реестрами свидетельств о государственной регистрации Сторон и Единым реестром свидетельств о государственной регистрации, обеспечив при этом безопасность и авторизацию передаваемых данных к 1 января 2011 года.
3. Предоставить право уполномоченным органам Сторон давать официальные разъяснения методического характера по применению положений документов, утвержденных Комиссией Таможенного союза Решением от 28.05.2010 N 299.
4. Экспертной группе "Техническое регулирование, применение санитарных, ветеринарных и фитосанитарных мер в Таможенном союзе" совместно с рабочей группой по направлению "Санитарные меры" в срок до 1 сентября 2010 года:
4.1. уточнить перечень документов изготовителя (производителя), удостоверяющих качество и безопасность продукции;
4.2. проработать вопрос о применении документов, подтверждающих безопасность продукции (товаров), в области технического регулирования и санитарных мер.
5. Сторонам представить в Секретариат Комиссии Таможенного союза в срок до 25 августа 2010 года копии действующих двусторонних соглашений о взаимном признании документов, подтверждающих безопасность продукции (товаров).
6. Секретариату Комиссии Таможенного союза в срок до 15 сентября 2010 года проанализировать представленные соглашения, определить возможность дальнейших действий по их реализации и внести соответствующие предложения на очередное заседание Комиссии Таможенного союза.
7. Пункт 1 настоящего Решения вступает в силу через 30 календарных дней после его официального опубликования Комиссией Таможенного союза.
Члены Комиссии Таможенного союза:
Утверждены
Решением Комиссии
Таможенного союза
от 17 августа 2010 г. N 341
ИЗМЕНЕНИЯ
В ЕДИНЫЕ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ
И ГИГИЕНИЧЕСКИЕ ТРЕБОВАНИЯ К ТОВАРАМ, ПОДЛЕЖАЩИМ
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОМУ НАДЗОРУ (КОНТРОЛЮ)
Внести следующие изменения в Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю).
1. В раздел 1 "Требования к безопасности и пищевой ценности продуктов питания" Главы II:
1.1. ПУНКТ 18 РАЗДЕЛА 1.4 "ОБЩИЕ ТРЕБОВАНИЯ К МАРКИРОВКЕ ПИЩЕВЫХ ПРОДУКТОВ" В ЧАСТИ "ОРГАНИЧЕСКИЙ ПРОДУКТ"
"- для пищевых продуктов, произведенных с использованием технологий, обеспечивающих их изготовление из сырья, полученного без применения пестицидов и других средств защиты растений, химических удобрений, стимуляторов роста и откорма животных, антибиотиков, гормональных и ветеринарных препаратов, ГМО, не подвергнутого обработке с использованием ионизирующего излучения и в соответствии с законодательством государств - членов Таможенного союза, указывается информация: "органический продукт".
1.2. ПУНКТ 25 РАЗДЕЛА 1.5 "ГИГИЕНИЧЕСКИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ И ПИЩЕВОЙ ЦЕННОСТИ ПИЩЕВЫХ ПРОДУКТОВ" ИЗЛОЖИТЬ В СЛЕДУЮЩЕЙ РЕДАКЦИИ:
"25. При изготовлении продовольственного сырья растительного происхождения не допускается использование пестицидов, запрещенных к использованию в соответствии с законодательством государств - членов Таможенного союза".
1.3. Пункт 1.1 таблицы в части "Антибиотики" изложить в следующей редакции:
1.4. Пункт 1.2 таблицы в части "Антибиотики" изложить в следующей редакции:
1.5. Пункт 1.4 таблицы в части "Антибиотики" изложить в следующей редакции:
1.6. Пункт 1.5 таблицы в части "Антибиотики" изложить в следующей редакции:
1.7. Пункт 1.6 таблицы по строке "хром" и "сумма НДМА и НДЭА" изложить в следующей редакции:
1.8. Пункт 1.7 таблицы в части "Антибиотики" изложить в следующей редакции:
1.9. Пункт 1.8 таблицы в части "Антибиотики" изложить в следующей редакции:
1.10. Пункт 1.9 таблицы в части "Антибиотики" изложить в следующей редакции:
1.11. Пункт 1.10 таблицы в части "Антибиотики" изложить в следующей редакции:
1.12. Пункт 1.11 таблицы в части "Антибиотики" изложить в следующей редакции:
1.13. Пункт 1.9 таблицы в части "Антибиотики" изложить в следующей редакции:
1.14. Пункт 1.13 таблицы по строке "хром" и в части "Антибиотики" изложить в следующей редакции:
1.15. Пункт 1.14 таблицы в части "Антибиотики" изложить в следующей редакции:
1.16. Пункт 1.15 таблицы в части "Антибиотики" изложить в следующей редакции:
1.17. Пункт 1.16 таблицы в части "Антибиотики" изложить в следующей редакции:
1.18. Пункт 1.17 таблицы в части "Антибиотики" изложить в следующей редакции:
1.19. Наименование продукции пункта 2.1 таблицы дополнить категорией "сырое обезжиренное молоко" и изложить в следующей редакции: "2.1. Сырое молоко, сырое обезжиренное молоко, сырые сливки".
1.20. Пункт 2.1 таблицы в части "Антибиотики" изложить в следующей редакции:
1.21. В пункте 2.1 таблицы по подпункту "- молоко сырое высший сорт" показатель "Содержание соматических клеток в 1 см3 (г), не более" изложить в следующей редакции:
1.22. Пункт 2.1 таблицы дополнить в следующей редакции:
1.23. Пункт 2.1 таблицы по подпунктам "Сливки сырые высший сорт" и "Сливки сырые 1 сорт" изложить в следующей редакции:
1.24. Пункт 2.2 таблицы в части "Антибиотики" изложить в следующей редакции:
1.25. Пункт 2.2.1 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.2.1. Питьевое молоко, питьевые сливки, молочные напитки, молочная сыворотка, пахта, продукты на их основе, термически обработанные, в том числе: молоко питьевое в потребительской таре, в том числе пастеризованное".
1.26. Пункт 2.2.12 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.2.12. Напитки, коктейли, кисели желе, соусы, кремы, пудинги, муссы, пасты, суфле произведенные на основе молока, сливок, пахты, сыворотки пастеризованные".
1.27. Пункт 2.2.13 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.2.13. Продукты кисломолочные, продукты на их основе, продукты кисломолочные жидкие, в т.ч.".
1.28. Пункт 2.2.14 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.2.14. Продукты кисломолочные, обогащенные бифидобактериями и другими пробиотическими микроорганизмами".
1.29. Пункт 2.2.15 таблицы в части "Дрожжи" и "Плесени" изложить в следующей редакции:
1.30. Пункт 2.2 таблицы дополнить подпунктом 2.2.17 и изложить в следующей редакции:
1.31. Пункт 2.3 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.3. Творог, творожная масса, зерненный творог, сырок, творожные продукты, молочные составные продукты на их основе, альбумин и молочный и продукты на его основе, продукты пастообразные молочные белковые, в т.ч. термически обработанные после сквашивания".
1.32. Пункт 2.3 таблицы в части "Антибиотики" изложить в следующей редакции:
1.33. Пункт 2.3.1 дополнить подпунктами 2.3.1.1, 2.3.1.2, 2.3.1.3 и 2.3.1.4 и изложить в следующей редакции:
1.34. Пункт 2.3.3 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.3.3. Альбумин молочный, продукты на его основе, кроме вырабатываемых путем сквашивания".
1.35. Пункт 2.4 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.4. Молоко, сливки, пахта, сыворотка, молочные продукты, молочные составные продукты на их основе, концентрированные и сгущенные с сахаром, молоко сгущенное стерилизованное, молочные консервы и молочные составные консервы".
1.36. Пункт 2.4 таблицы в части "Антибиотики" изложить в следующей редакции:
1.37. Пункт 2.4.1 изложить в следующей редакции:
1.38. Пункт 2.5 таблицы в части "Антибиотики" изложить в следующей редакции:
1.39. Пункт 2.5.7 таблицы дополнить показателем: "L. monocytogenes в 25 г/см3 - не допускаются" с примечанием "Для мягкого мороженого".
1.40. Пункт 2.5.9 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.5.9. Пахта, заменители цельного молока (сухие)".
1.41. Пункт 2.6 таблицы в части "Антибиотики" изложить в следующей редакции:
1.42. Пункт 2.6.1 таблицы дополнить показателем:
"сульфитредуцирующие клостридии в 0,01 г/см3 - не допускаются".
1.43. Пункт 2.6.3 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.6.3. Концентрат казеина".
1.44. Пункт 2.7 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.7. Сыры, сырные продукты (сверхтвердые, твердые, полутвердые, мягкие, рассольные), плавленые, сывороточно-альбуминные, сухие, сырные пасты, соусы".
1.45. Пункт 2.7 таблицы в части "Антибиотики" изложить в следующей редакции:
1.46. Пункт 2.7 таблицы дополнить показателем:
"Стафилококковые энтеротоксины не допускаются" с примечанием "В 5-ти образцах массой по 25 г каждый при обнаружении стафилококков в нормируемой массе продукта (в сырах всех типов со сроком созревания не более 45 суток и продуктах на их основе)".
1.47. Пункт 2.7.1 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.7.1. Сыры, сырные продукты (сверхтвердые, твердые, полутвердые, мягкие, рассольные), сывороточно-альбуминные, копченые".
1.48. Пункт 2.7.1 таблицы внести изменения в примечание по показателю "листерии L. monocytogenes в 25 г/см3" и изложить в следующей редакции:
1.49. Пункт 2.7.2 таблицы изложить в следующей редакции:
1.50. Пункт 2.7 таблицы дополнить подпунктом 2.7.7 и изложить в следующей редакции:
1.51. Пункт 2.8 таблицы по показателям "свинец" и "кадмий" изложить в следующей редакции:
1.52. Пункт 2.8 таблицы в части "Антибиотики" изложить в следующей редакции:
1.53. Пункт 2.8.2 таблицы дополнить показателем: "стафилококки S. aureus в 1,0 г/см3 - не допускаются".
1.54. Пункт 2.9 таблицы по показателям "свинец" и "кадмий" изложить в следующей редакции:
1.55. Пункт 2.9 таблицы в части "Антибиотики" изложить в следующей редакции:
1.56. Пункт 2.9.1 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.9.1. Сливочно-растительный спред".
1.57. Пункт 2.9 таблицы дополнить подпунктом 2.9.2 и изложить в следующей редакции:
1.58. Пункт 2.10 таблицы графу "Наименование продукции" изложить в следующей редакции:
"2.10. Мороженое молочное, сливочное, пломбир, с растительным жиром, торты, пирожные, десерты из мороженого".
1.59. Пункт 2.10 таблицы в части "Антибиотики" изложить в следующей редакции:
1.60. Пункт 2.10 таблицы дополнить подпунктом 2.10.4 и изложить в следующей редакции:
1.61. Пункт 2.11 таблицы исключить из перечня нормируемых показателей "микотоксины" и "антибиотики".
1.62. Пункт 2.11.1 таблицы по подпункту "- закваски для кефира симбиотические (жидкие)" дополнить показателем "дрожжи" в следующей редакции: "дрожжи, КОЕ/см3(г), не менее - ![]() ".
".
1.63. Пункт 2.12 таблицы в части "Антибиотики" изложить в следующей редакции:
1.64. Пункт 2.13 таблицы изложить в следующей редакции:
1.65. Строки 1 - 5 подпункта 3.3.10 изложить в следующей редакции:
1.66. Пункт 3.4.4 таблицы "- икра осетровых рыб зернистая пастеризованная" по показателям "дрожжи" и "плесени" изложить в следующей редакции:
"плесени в 0,1 г - не допускаются";
"дрожжи в 0,1 г - не допускаются".
1.67. Пункт 3.4.6 таблицы "- икра других видов рыб пастеризованная" по показателям "дрожжи" и "плесени" изложить в следующей редакции:
"плесени в 0,1 г - не допускаются";
"дрожжи в 0,1 г - не допускаются".
1.68. Пункт 3.7.9 таблицы исключить подраздел "- агар пищевой, агароид, фурцелярин и альгинат натрия пищевой".
1.69. Пункт 5.2.2 таблицы изменить наименование продукции "- из цукатов, взорванных зерен, ликерными, желейными" и изложить в следующей редакции: "- из цукатов, взорванных зерен, ликерными, желейными, на основе кокосовой стружки".
1.70. Пункт 6.1 таблицы дополнить показателями по содержанию нитратов для салата латук в следующей редакции:
1.71. Пункт 6.4 таблицы в части "Пестициды" изложить в следующей редакции:
1.72. Пункт 6.7 таблицы графу "Наименование продукции" изложить в следующей редакции:
"6.7. Специи и пряности, пряные травы".
1.73. Пункт 6.11 таблицы графу "Наименование продукции" изложить в следующей редакции:
"6.11. Соки, в том числе концентрированные соки, фруктовые и (или) овощные нектары, морсы, в том числе концентрированные морсы, фруктовые и (или) овощные сокосодержащие напитки, фруктовые и (или) овощные пюре, в том числе концентрированные фруктовые и (или) овощные пюре, мороженое плодово-ягодное, ароматизированное и пищевые льды".
1.74. В пункте 6.11 таблицы допустимые уровни по показателям "свинец" и "мышьяк" изложить в следующей редакции:
1.75. Пункт 6.11.2 таблицы изложить в следующей редакции:
1.76. Пункт 6.11.3 таблицы изложить в следующей редакции:
1.77. Пункт 6.11 таблицы дополнить подпунктами 6.11.7 и 6.11.8 и и изложить в следующей редакции:
1.78. Пункт 7.3 таблицы в части "Антибиотики" изложить в следующей редакции:
1.79. Пункт 7.3.2 таблицы дополнить показателем: "КМАФАнМ, КОЕ/г, не более - ![]() ".
".
1.80. Пункт 7.3.3 таблицы изложить в следующей редакции:
1.81. Пункт 7.4 таблицы графу "Наименование продукции" изложить в следующей редакции:
"Семена масличных культур (подсолнечника, сои, хлопчатника, кукурузы, льна, горчицы, рапса, арахиса, пищевого мака и др.)."
1.82. Пункт 7.5 таблицы в части "Антибиотики" изложить в следующей редакции:
1.83. Пункт 7.6 таблицы в части "Антибиотики" изложить в следующей редакции:
1.84. Пункт 10.8 таблицы в части "Антибиотики" изложить в следующей редакции:
1.85. Пункт 11.1, "2) Показатели безопасности (в готовом к употреблению продукте)" таблицы в части "Антибиотики" изложить в следующей редакции:
1.86. Пункт 11.2, "2) Показатели безопасности" таблицы в части "Антибиотики" изложить в следующей редакции:
1.87. Пункт 12.1.1 таблицы графу "Наименование таблицы" изложить в следующей редакции:
"12.1.1. Адаптированные молочные смеси (сухие, жидкие, пресные и кисломолочные) и продукты на основе частично гидролизованных белков".
1.88. Пункт 12.1.1, раздел "1) Пищевая ценность (в готовом к употреблению продукте)" исключить строки таблицы:
"казеин", "Энергетическая ценность", "калий/натрий".
1.89. Пункт 12.1.1, раздел "1) Пищевая ценность (в готовом к употреблению продукте)" таблицы изменить по следующим строкам:
"1) Пищевая ценность (в готовом к употреблению продукте)"
--------------------------------
<*> За исключением адаптированных казеиндоминирующих смесей (молочных смесей с содержанием казеина более 50 процентов от общего количества белка).
<**> За исключением адаптированных казеиндоминирующих смесей (молочных смесей с содержанием казеина более 65 процентов от общего количества белка).
<3> Помимо лактозы могут быть использованы мальтодекстрин и частично гидролизованный безглютеновый крахмал; сахароза и фруктоза - только в начальных и последующих смесях на основе частично гидролизованных белков и в последующих частично адаптированных смесях; содержание сахарозы и (или) фруктозы или их сумма не должны быть выше 20 процентов от общего содержания углеводов; глюкоза и глюкозный сироп - только в начальных и последующих смесях на основе частично гидролизованных белков в количестве не более 14 г/л; углеводный компонент может включать пребиотики - галактоолигосахариды и фруктоолигосахариды (в сумме не более 0.8 процента от массы продукта) и лактулозу.
1.90. Пункт 12.1.1, раздел "2) Показатели безопасности (в готовом к употреблению продукте)" таблицы в части "Антибиотики" изложить в следующей редакции:
1.91. Пункт 12.1.1, раздел "2) Показатели безопасности (в готовом к употреблению продукте)" по продукции "Сухие молочные смеси моментального приготовления (пресные, кисломолочные)" таблицы внести изменения по строкам "патогенные, в т.ч. сальмонеллы и L. monocytogenes" и "молочнокислые микроорганизмы":
--------------------------------
<*> При контроле на E. coli и патогенные микроорганизмы, в том числе сальмонеллы, и обнаружении в нормируемой массе продукта бактерий Enterobacteriaceae, не относящихся к E. coli и сальмонеллам, контролируется отсутствие патогенного микроорганизма E. sakazakii в 300 г продукта.
1.92. Пункт 12.1.1 по продукции "Сухие молочные смеси моментального приготовления (пресные, кисломолочные)" и "Смеси, требующие термической обработки" таблицы в части микробиологических показателей дополнить примечанием в следующей редакции:
"Примечание: Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта.".
1.93. Пункт 12.1.2 таблицы графу "Наименование таблицы" изложить в следующей редакции:
"Частично адаптированные молочные смеси (сухие, жидкие, пресные и кисломолочные) для питания детей в возрасте старше 6 месяцев".
1.94. Пункт 12.1.2, раздел "1) Пищевая ценность (в готовом к употреблению продукте)" таблицы изменить по следующим строкам: натрий, марганец, хлориды, йод, зола, ретинол (A), кальциферол (D), тиамин (B1), рибофлавин (B2), пантотеновая кислота, пиридоксин (B6), фолиевая кислота (Bc), кислотность, осмоляльность:
1) Пищевая ценность (в готовом к употреблению продукте)
1.95. Пункт 12.1.2, раздел "2) Показатели безопасности (в готовом к употреблению продукте)" таблицы внести изменения в микробиологические показатели продукции "Смеси моментального приготовления по строке "патогенные, в т.ч. сальмонеллы и L. monocytogenes" и изложить в следующей редакции:
--------------------------------
<*> При контроле на E. coli и патогенные микроорганизмы, в том числе сальмонеллы, и обнаружении в нормируемой массе продукта бактерий Enterobacteriaceae, не относящихся к E. coli и сальмонеллам, контролируется отсутствие патогенного микроорганизма E. sakazakii в 300 г продукта.
1.96. Пункт 12.1.2 по продукции по продукции "Смеси моментального приготовления" и "Смеси, требующие термической обработки" таблицы в части микробиологических показателей дополнить примечанием в следующей редакции:
"Примечание: Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта.".
1.97. Пункт 12.1.3 таблицы графу "Наименование таблицы" изложить в следующей редакции:
"Молоко пастеризованное <*>, стерилизованное, ультрапастеризованное питьевое, в том числе обогащенное, сливки стерилизованные питьевые".
1.98. Пункт 12.1.3, раздел "1) Пищевая ценность (в готовом к употреблению продукте)" таблицы внести изменения по строкам: белок, жир, зола, кальций:
1.99. Пункт 12.1.3 "Молоко пастеризованное <*>, стерилизованное, ультрапастеризованное питьевое, в том числе обогащенное, сливки стерилизованные питьевые", раздел "2) Показатели безопасности (в готовом к употреблению продукте)" внести изменения по микробиологическим показателям для продукции "Пастеризованное, в т.ч. со сроком годности более 72 часов" по строке "B. cereus":
1. 100. Подраздел 12.1.3 дополнить ссылкой в следующей редакции:
"<*> Для детей первого года жизни только после термической обработки.".
1.101. Пункт 12.1.4 таблицы графу "Наименование таблицы" изложить в следующей редакции:
"Кисломолочные продукты, в том числе с фруктовыми и (или) овощными компонентами".
1.102. Пункт 12.1.4, раздел "1) Пищевая ценность (в 100 мл готового к употреблению продукта)" таблицы изменить по следующим строкам:
а) исключить показатель "Энергетическая ценность".
1.103. Пункт 12.1.4, раздел "1) Пищевая ценность (в 100 мл готового к употреблению продукта)" таблицы внести изменения по строкам: жир, углеводы, кальций:
--------------------------------
<*> Допускается замена сахарозы на фруктозу в количестве не более 5 граммов.
1.104. Пункт 12.1.5 таблицы графу "Наименование таблицы" изложить в следующей редакции:
"Творог и продукты на его основе, пастообразные молочные продукты, в том числе с фруктовыми и (или) овощными компонентами".
1.105. Пункт 12.1.5, раздел "1) Пищевая ценность (в 100 г продукта)" изменить по следующим строкам:
а) исключить показатель "Энергетическая ценность".
1.106. Пункт 12.1.5, раздел "1) Пищевая ценность (в 100 г продукта)" таблицы внести изменения по строкам: жир, углеводы, кальций:
--------------------------------
<*> Допускается замена сахарозы на фруктозу в количестве не более 5 граммов.
1.107. Пункт 12.1.5, раздел "2) Показатели безопасности" таблицы внести изменение по строке "свинец" и дополнить новой строкой микробиологические показатели:
2) Показатели безопасности
1.108. Пункт 12.1.6, раздел "1) Пищевая ценность (в 100 г готового к употреблению продукта)" таблицы внести изменения по строкам: белок, жир, кальций:
1.109. Пункт 12.1.6, раздел "2) Показатели безопасности" таблицы в части микробиологических показателей дополнить примечанием:
"Примечание: Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта.".
1.110. Пункт 12.1.7 таблицы графу "Наименование таблицы" изложить в следующей редакции:
"Сухие и жидкие молочные, молочные составные и молокосодержащие напитки для детей старше 6 месяцев".
1.111. Пункт 12.1.7, раздел "1) Пищевая ценность (в 100 г готового к употреблению продукта)" таблицы внести изменения по строкам: белок, углеводы, кальций:
--------------------------------
<*> Допускается замена сахарозы на фруктозу в количестве не более 3 граммов.
<**> Контроль по фактической закладке.
1.112. Пункт 12.1.7, раздел "2) Показатели безопасности" таблицы в микробиологические показатели продукции "Жидкие напитки" дополнить строкой B. cereus в следующей редакции:
1.113. Пункт 12.1.7, раздел "2) Показатели безопасности" таблицы в части микробиологических показателей дополнить примечанием:
"Примечание: Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта".
1.114. Пункт 12.2.2, раздел "1) Пищевая ценность (в 100 г продукта)" по строке "углеводы" и изложить в следующей редакции:
--------------------------------
<*> Допускается замена сахарозы на фруктозу в количестве не более 15 граммов.
<**> Контроль по фактической закладке.
1.115. Пункт 12.2.3 таблицы графу "Наименование таблицы" изложить в следующей редакции:
"Каши сухие на молочной основе, требующие варки".
1.116. Пункт 12.2.3, раздел "1) Пищевая ценность (в 100 г продукта)" по строке "углеводы" и изложить в следующей редакции:
--------------------------------
<*> Допускается замена сахарозы на фруктозу в количестве не более 10 граммов.
<**> Контроль по фактической закладке.
1.117. Пункт 12.2.3, раздел "2) Показатели безопасности" таблицы изменить наименование разделы и изложить в следующей редакции:
"Показатели безопасности в сухом продукте".
1.118. Пункт 12.2.3, раздел "2) Показатели безопасности" таблицы внести изменения по строкам "свинец", "мышьяк", "кадмий", "ртуть", "дезоксиниваленол", "зеараленон", "антибиотики", "пестициды" и изложить в следующей редакции:
2) Показатели безопасности в сухом продукте
1.119. Пункт 12.2.4, раздел "1) Пищевая ценность (в 100 г продукта)" по строке "углеводы" и изложить в следующей редакции:
--------------------------------
<*> Допускается замена сахарозы на фруктозу в количестве не более 10 граммов.
<**> Контроль по фактической закладке.
1.120. Пункт 12.2.4, раздел "2) Показатели безопасности" таблицы исключить строку "Микробиологические показатели каш молочных готовых к употреблению стерилизованных...".
1.121. Пункт 12.2.4, раздел "2) Показатели безопасности" таблицы дополнить показателями безопасности для продукции "Каши молочные, готовые к употреблению, стерилизованные, каши молочные готовые, произведенные на молочных кухнях" и изложить в следующей редакции:
б) для группы продукции "Каши сухие молочные быстрорастворимые (моментального приготовления)" внести изменения по строке "патогенные, в т.ч. сальмонеллы и L. monocytogenes", дополнить примечанием к сноске "<*>" и изложить в следующей редакции:
--------------------------------
<*> При контроле каш, предназначенных для питания детей с 4-х месяцев на патогенные микроорганизмы, в том числе сальмонеллы, и обнаружении в нормируемой массе продукта бактерий Enterobacteriaceae, не относящихся к сальмонеллам, контролируется отсутствие патогенного микроорганизма E. sakazakii в 300 г продукта.
1.122. Пункт 12.2.5, раздел "2) Показатели безопасности" таблицы в части "Антибиотики" изложить в следующей редакции:
1.123. Пункт 12.3, раздел "1) Пищевая ценность (в 100 г продукта)" таблицы внести изменения по строке "массовая доля титруемых кислот" и изложить в следующей редакции:
1.124. Пункт 12.3, раздел "1) Пищевая ценность (в 100 г продукта)" таблицы внести изменения по строке "калий":
1.125. Пункт 12.3, раздел "2) Показатели безопасности" таблицы внести изменения по строке "5-оксиметилфурфурол":
1.126. Пункты 13.1.2, 13.1.3 и 13.1.4 раздел "1) Пищевая ценность (в 100 г продукта)" таблицы исключить показатель "Энергетическая ценность".
1.127. Пункт 13.4.1 таблицы графу "Наименование пункта" изложить в следующей редакции:
"Молоко питьевое; сливки питьевые; кисломолочные продукты <*>; напитки на молочной основе (сухие и жидкие), в том числе обогащенные".
1.128. Пункт 13.4.1, раздел "1) Пищевая ценность (в 100 г готового к употреблению продукта)" внести изменения по строкам "Белок", "Жир" и "Углеводы" и изложить в следующей редакции:
--------------------------------
<*> Для составных кисломолочных продуктов допускается регламентировать их пищевую ценность установлением нормативными и (или) техническими документами, в соответствии с которыми производятся эти продукты.
<**> Допускается замена сахарозы на фруктозу в количестве не более 5 граммов.
<***> Контроль по фактической закладке.
1.129. Пункт 13.4.1, раздел "2) Показатели безопасности" (в готовом к употреблению продукте) внести изменения по строке "Антибиотики" и изложить в редакции:
1.130. Пункт 13.4.1, раздел "2) Показатели безопасности" таблицы в части микробиологических показателей внести изменения и дополнения:
1.131. Пункт 13.4.1 дополнить примечанием в следующей редакции:
"Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта".
1.132. Пункт 13.4.2 таблицы графу "Наименование пункта" изложить в следующей редакции:
"Творог и продукты на его основе, в том числе с фруктовыми и (или) овощными компонентами".
1.133. Пункт 13.4.2, раздел "1) Пищевая ценность (в 100 г продукта)" исключить показатель "Энергетическая ценность".
1.134. Пункт 13.4.2, раздел "1) Пищевая ценность (в 100 г продукта)" внести изменения по строкам "Белок", "Жир" и "Углеводы" и изложить в следующей редакции:
--------------------------------
<*> Допускается замена сахарозы на фруктозу в количестве не более 5 граммов.
<**> Контроль по фактической закладке.
1.135. Пункт 13.4.2, раздел "2) Показатели безопасности" внести изменения по строке "ртуть":
1.136. Пункт 13.4.3 таблицы графу "Наименование пункта" изложить в следующей редакции:
"Сыры (твердые, полутвердые, мягкие, плавленные, творожные) и сырные пасты".
1.137. Пункт 13.4.3, раздел "1) Пищевая ценность (в 100 г продукта)" внести изменения по строкам "Массовая доля влаги" и "Массовая доля жира в сухом веществе" и изложить в следующей редакции:
1.138. Пункт 13.5, раздел "2) Показатели безопасности" таблицы внести изменения по строке "5-оксиметилфурфурол":
1.139. Пункт 14.1 "Низколактозные и безлактозные продукты для детей 1 года жизни", раздел "1) Пищевая ценность (в готовом к употреблению продукте)" исключить показатели "Дестрин-мальтоза" и "Энергетическая ценность".
1.140. Пункт 14.1 "Низколактозные и безлактозные продукты для детей 1 года жизни", раздел "1) Пищевая ценность (в готовом к употреблению продукте)" внести изменения по строкам: "Белок", "Таурин" и "L-карнитин":
1.141. Пункт 14.1, раздел "2) Показатели безопасности (в готовом к употреблению продукте)" таблицы в части "Антибиотики" изложить в следующей редакции:
1.142. Пункт 14.1 таблицы в части микробиологических показателй внести дополнение в следующей редакции:
"Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта".
1.143. Пункт 14.3, раздел "2) Показатели безопасности (в готовом к употреблению продукте)" таблицы в части "Антибиотики" изложить в следующей редакции:
1.144. Пункт 14.3, раздел "2) Показатели безопасности" таблицы в части микробиологические показатели внести изменения по строке "патогенные, в т.ч. сальмонеллы и L. monocytogenes", дополнить примечанием к сноске "<*>" и изложить в следующей редакции:
--------------------------------
<*> При контроле на патогенные микроорганизмы, в том числе сальмонеллы, и обнаружении в нормируемой массе продукта бактерий Enterobacteriaceae, не относящихся к сальмонеллам, контролируется отсутствие патогенного микроорганизма E. sakazakii в 300 г продукта.
1.145. Пункт 14.3 таблицы в части микробиологических показателей внести дополнение в следующей редакции:
"Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта".
1.146. Пункт 14.5 таблицы графу "Наименование пункта" изложить в следующей редакции:
"Продукты на основе полных гидролизатов белка".
1.147. Пункт 15.1 таблицы в части микробиологических показателей внести дополнение в следующей редакции:
"Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта".
1.148. Пункт 16, раздел "2) Показатели безопасности (в готовом к употреблению продукте)" таблицы в части "Антибиотики" изложить в следующей редакции:
1.149. Пункт 16, раздел "2) Показатели безопасности" таблицы в части микробиологические показатели внести изменения по строке "патогенные, в т.ч. сальмонеллы и L. monocytogenes" и примечанием к сноске "<*>" и изложить в следующей редакции:
--------------------------------
<*> При контроле на E. coli и патогенные микроорганизмы, в том числе сальмонеллы, и обнаружении в нормируемой массе продукта бактерий Enterobacteriacea, не относящихся к E. coli и сальмонеллам, контролируется отсутствие патогенного микроорганизма E. sakazakii в 300 г продукта.
1.150. Пункт 16 таблицы в части микробиологических показателей внести дополнение и изложить в следующей редакции:
"Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта".
1.151. Пункт 17 Таблицы "Микробиологические показатели для молочных продуктов детского питания, изготовленных на молочных кухнях системы здравоохранения" внести изменения в столбец "Патогенные, в том числе сальмонеллы и L. monocytogenes" и дополнить пункт примечанием к ссылке "<**>":
------------------------------------
<1> Микроорганизмы заквасочной микрофлоры ![]() КОЕ/г, не менее;
КОЕ/г, не менее;
микроскопический препарат по жидким кисломолочным продуктам.
<**> При контроле на E. coli и патогенные микроорганизмы, в том числе сальмонеллы, и обнаружении в нормируемой массе продукта бактерий Enterobacteriaceae, не относящихся к E. coli и сальмонеллам, контролируется отсутствие патогенного микроорганизма E. sakazakii в 300 г продукта.
1.152. Пункт 18.1 таблицы дополнить примечанием в следующей редакции:
"Во всех детских сухих продуктах на молочной основе контролируется отсутствие стафилококковых энтеротоксинов, анализ проводится в пяти образцах массой 25 г каждый - при обнаружении стафилококков S. aureus в нормируемой массе продукта".
1.153. Пункт 18.7 таблицы графу "Наименование пункта" изложить в следующей редакции:
"Масло растительное".
1.154. Пункт 18.7 таблицы внести изменения в строку "перекисное число" и изложить в следующей редакции:
1.155. Пункт 18.8 таблицы дополнить строкой "Кислотность жировой фазы" и изложить в следующей редакции:
1.156. Пункт 18.9.1 таблицы графу "Наименование пункта" изложить в следующей редакции:
"Сахарный песок".
2. В раздел 2 "Требования безопасности к товарам детского ассортимента" Главы II:
2.1. Исключить из названия Подраздела 3 слова "спортивный инвентарь", так как далее по тексту требования безопасности на спортивный инвентарь не распространяются. Изложить название Подраздела 3 в следующей редакции: "Игрушки, игры, их части и принадлежности, пасты для лепки"
2.2. Изменить номер Подраздела 4 "Обувь" на номер "5. Обувь";
2.3. Изменить номер Подраздела 5 "Коляски детские" на номер "6. Коляски детские".
3. В раздел 4 "Требования к парфюмерно-косметическим средствам и средствам гигиены полости рта" подраздел 1 "Требования к парфюмерно-косметической продукции" Главы II:
3.1. В таблице 1 по группе товаров "Средства для ухода за волосами" показатель "Водородный показатель" по товарам "Шампуни" изложить в редакции "3,5 - 8,5", по товарам "Бальзамы-ополаскиватели, кондиционеры, ополаскиватели" - "3,0 - 7,5";
3.2. В таблице 1 по группе товаров "Изделия косметические гигиенические моющие" по товарам "Пена для ванн, гель, крем, крем-гель для душа или умывания, жидкое мыло" показатель "Водородный показатель" изложить в редакции "3,5 - 8,5";
3.3. В таблице 1 по группе товаров "Изделия косметические порошкообразные и компактные" по товарам "Детская присыпка, тальк, пудра (до 3 лет) в графе "Примечание" указать "15%-ный водный раствор".
4. В раздел 4 "Требования к парфюмерно-косметическим средствам и средствам гигиены полости рта" подраздел 2 "Требования к средствам гигиены полости рта" Главы II:
4.1. В таблице 1 Приложения 4.1 п. 6 "Вид продукции" изложить в следующей редакции "Вспомогательные средства (зубные нити (флоссы), флоссодержатели, ирригаторы, стимуляторы, ершики, зубочистки, скребки для языка и т.п.);
4.2. В таблице 1 Приложения 4.1 п. 6 столбец "характеристика и нормы" уточнить виды продукции и изложить в следующей редакции "Вощеные/невощеные (для зубных нитей), с ароматизаторами и фторидами (для зубных нитей и зубочисток)".
5. В раздел 5 "Требования к товарам бытовой химии и лакокрасочным материалам" подраздел 1 "Товары бытовой химии" Главы II:
5.1. Исключить последний абзац подраздела 1.1;
5.2. В п. 1.3.5 "биоразлагаемость (полная, первичная)..." изложить в следующей редакции - "биоразлагаемость (полная, первичная) *) **)"; дополнить пункт 1.3.5 следующим примечанием: **) - допускается проводить оценку биоразлагаемости средств по их компонентам;
5.3. П. 1.4.1 и п. 2.4 изложить в следующей редакции "масса нетто грамм, килограмм (г, кг) или объем сантиметры кубические, дециметры кубические, миллилитры, литры (см3, дм3, мл, л)";
5.4. Изложить первое предложение п. 1.4.2 в следующей редакции "В потребительскую маркировку включается перечень ингредиентов, входящих в состав товаров бытовой химии с указанием их содержания в процентах (далее по тексту)" и дополнить п. 1.4.2 следующим "В информацию для потребителя обязательному включению подлежат ингредиенты, поименованные в таблице 1. При указании состава допускается общепринятых математических символов сравнения";
5.5. Изложить п. 1.4.6 в следующей редакции "Потребительская маркировка должна содержать обязательные указания по мерам защиты пользователя от неблагоприятного воздействия товаров бытовой химии, мерам предосторожности и правилам хранения и применения и предупредительные надписи в зависимости от вида продукции (например, "Беречь от детей!" или "Хранить в недоступном для детей месте" или "Не разбирать и не давать детям" (в сочетании с пиктограммой); "Продукт обладает раздражающим действием на кожу", "Использование средств защиты кожи рук обязательно" и т.п.);
5.6. В таблице 1 приложения 5.1 по пунктам 5.1, 5.2, 5.2.1, 5.3, 5.4, 5.5, 5.5.1, 5.6, 5.6.1, 5.8 по критерию ингаляционной опасности заменить слова "наличие клинических..." на "допускается наличие клинических... (далее по тексту)";
5.7. В таблице 1 приложения 5.1 по пунктам 5.1, 5.2, 5.2.1, 5.3, 5.4, 5.5, 5.5.1, 5.6, 5.6.1, 5.8 по критерию ингаляционной опасности раздел "Примечание" дополнить следующим "для средств 3 класса опасности обязательна маркировка потребительской упаковки (пиктограмма и текст, использование СИЗ при необходимости);
5.8. В таблице 1 приложения 5А по п. 5.5 и 5.5.1 в разделе "санитарно-химические показатели" показатель "смываемость с посуды средств для мытья посуды" изложить в следующей редакции "смываемость с обрабатываемого изделия";
5.9. В таблице 1 приложения 5А по п. 5.2.1, 5.4, 5.5 в графе "показатель" по показатель "биоразлагаемость, полная" дополнить "первичная"; графу "допустимые уровни" по показателю "биоразлагаемость полная, первичная" изложить в следующей редакции "биоразлагаемость при полном биологическом разложении средств должна составлять не менее 60% (по двуокиси углерода), или не менее 70% (по общему органическому углероду), при их первичном биологическом разложении - не менее 80%";
6. В раздел 7 "Требования к продукции машиностроения, приборостроения и электротехники" Глава II:
6.1. Абзац 6 подраздела 3 изложить в следующей редакции: "Конструкция изделий должна, по возможности, исключать воздействие повышенных уровней физических факторов на обслуживающий персонал и пользователя с помощью организации и использования блокировок, ограждений, экранов, фильтров, защитных кожухов и укрытий, световых сигнальных устройств, таймеров, средств дистанционного управления и т.п.). Конструкция шумящего и вибрирующего оборудования должна предусматривать меры по минимизации шума и вибрации. Электрические изделия должны обеспечивать электробезопасность в условиях эксплуатации....(далее по тексту)";
6.2. В последнем абзаце подраздела 3 заменить слова "области применения продукции" на "назначение продукции";
6.3. Абзац 5 подраздела 5 изложить в следующей редакции: "Маркировка, наносимая непосредственно на изделие, должна содержать: наименование изготовителя и (или) его товарный знак; наименование изделия; габариты, масса, электропитание (при необходимости), заводской номер, дату (год) изготовления; нормативный документ, требованиям которого соответствует изделие; Знак обращения; другую информацию в соответствии с технической документацией изготовителя";
6.4. Первое предложение абзаца 7 подраздела 5 изложить в следующей редакции: "Маркировка должна быть хорошо читаема и долговечна. Способ выбирает изготовитель в соответствии со своим технологическим процессом изготовления изделия;
6.5. В приложении 7.1:
- в строке 4 заменить значения, указанные в столбцах 10, 11 и 12, в строке "с 7 до 23 часов" "30" на "32", "28" на "30" и "40" на "28", в строке с "23 до 7 часов" - "20" на "22", "18" на "20" и "30" на "18";
6.6. П. 1.6.3 подраздела 1.6 закончить словами: "принимаются по таблице 1.3";
6.7. В таблице раздела 2.1 "Предельно допустимые значения вибрации рабочих мест категории 3 - технологической типа "в", в последней строке "Корректированные и эквивалентные корректированные значения и их уровни" в 5-ом столбце ("1/1 октавы"), значение показателя вместо "92" указать "83";
6.8. В Примечании 2 к таблице 2.2 заменить "приведенным в таблице 9" на "приведенным в настоящей таблице";
6.9. Из названия раздела 4 исключить слово "воздушного";
6.10. Название таблицы 4.2 изложить в следующей редакции "Допустимые уровни воздушного ультразвука, создаваемого товарами народного потребления";
6.11. Во 2-ом столбце табл. 4.2 вместо значения "1265" указать "12,5";
6.12. В разделе 5.1.1 пояснение к формуле изложить в следующей редакции "где 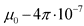 Гн/м - магнитная постоянная (далее по тексту)";
Гн/м - магнитная постоянная (далее по тексту)";
6.13. В разделе 5.4 после п. 5.4.1 включить п. 5.4.2 "Предельно допустимые уровни напряженности электрического поля 50 Гц" (далее по тексту);
6.15. В п. 5.4.2.1 вместо "Допустимый" указать "Предельно допустимый";
6.16. Название подраздела 5.5 изложить в следующей редакции: "Предельно допустимые уровни напряженности периодических (синусоидальных) МП частотой 50 Гц... (далее по тексту)";
6.17. В формуле п. 5.8.3 вместо знаков "тире" поставить знаки умножения;
6.18. П. 5.15.9 закончить словами: "... с допустимой относительной погрешностью не более 30%";
6.19. П. 5.15.10 закончить словами: "... с допустимой относительной погрешностью не более 40%".
7. В раздел 8 "Требований безопасности к печатным книгам и другим изделиям полиграфической промышленности":
7.1. Изложить абзац 3 в следующей редакции "Издательская продукция независимо от вида и возраста пользователя должна соответствовать следующим требованиям:
- для изготовления издательской продукции не допускается применение газетной бумаги, кроме издательской продукции, не предназначенной для повторного использования (экзаменационные билеты, карточки с заданиями, тестовые задачи, кроссворды);
- в издательской продукции не допускается применение узкого начертания шрифта;
- при оформлении буквенных, числовых и химических формул кегль шрифта основных элементов формул может быть на 2 пункта меньше кегля шрифта основного текста, кегль шрифта вспомогательных элементов формул должен быть не менее 6 пунктов;
- корешковые поля на развороте издания должны быть не менее 26 мм;
- на полях страницы допускается размещать условные обозначения, наглядные изображения и текст объемом не более 50 знаков на расстоянии не менее 5 мм от полосы;
- при печати текста с использованием черной краски интервал оптических плотностей элементов изображения текста и бумаги в издательской продукции должен быть не менее 0,7;
- не допускается печать текста с нечеткими штрихами знаков;
- пробел между словами в издательской продукции для дошкольного и младшего школьного возраста должен быть равен кеглю шрифта.
В изданиях литературно-художественных, развивающего обучения, для дополнительного образования и научно-популярных для текста не рекомендуется применять цветные краски и выворотку шрифта.
В изданиях при печати цветными красками на цветном фоне кегль шрифта должен быть не менее 20 пунктов, объем текста - не более 200 знаков.
Параметры шрифтового оформления издательской продукции даются в типометрической системе ДИДО (1 пункт равен 0,376 мм)".
7.2. В п. 3 "Гигиенические требования безопасности", пп. 3.2 после слов "Для детей дошкольного..." добавить "и младшего школьного".
8. В раздел 10. Требования к материалам для изделий (изделиям), контактирующим с кожей человека, одежде, обуви:
8.1. Дополнить название раздела 10 после слова "одежде" словом "обуви" и изложить название раздела 10 в следующей редакции "Требования к материалам для изделий (изделиям), контактирующим с кожей человека, одежде, обуви";
8.2. Дополнить название подраздела 1 после слова "одежда" словом "обуви" и изложить название подраздела 1 в следующей редакции "Материалы для изготовления изделий, контактирующих с кожей человека, одежде, обуви";
8.3. Добавить коды ТН ВЭД, относящиеся к материалам для изготовления обуви "из 3920";
8.4. Добавить в Таблицу 1, строка 8 (Материалы Поливинилацетатные) следующие определяемые вещества: Диоктилфталат - 2,0 мг/дм3; - 0,02 мг/м3 и Дибутилфталат - 0,2 мг/дм3; - 0,1 мг/м3;
8.5. Добавить в Таблицу 1 после строки 12 (Кожа, мех) строку "Материалы Резиновые" со следующими определяемыми веществами: Тиурам Е - 0,5 мг/дм3; Цинк - 1,0 мг/дм3; Диоктилфталат - 2,0 мг/дм3; - 0,02 мг/м3 и Дибутилфталат - 0,2 мг/дм3; - 0,1 мг/м3;
8.6. Изложить Таблицу 1 в следующей редакции:
Требования к санитарно-химическим показателям изделий
в зависимости от состава материала
--------------------------------
<*> Массовая доля свободного формальдегида определяется во всех видах материалов и составляет: не более 75 мкг/г для бельевых и бельевых постельных изделий; не более 300 мкг/г для остальных изделий.
<**> Норматив указан без учета фонового загрязнения окружающего воздуха.
8.7. Дополнить Раздел 10 Подразделом 6. Обувь (Коды ТН ВЭД: из 6401, из 6402, из 6403, из 6404, из 6405);
8.8. Изложить Подраздел 6. Обувь (Коды ТН ВЭД: из 6401, из 6402, из 6403, из 6404, из 6405) в следующей редакции:
6.1. Требования к органолептическим показателям: Интенсивность запаха образца изделия в естественных условиях не должна превышать 2 баллов.
6.2. Требования к санитарно-химическим показателям
Требования к санитарно-химическим показателям представлены в таблице 1
6.3. Токсиколого-гигиенические требования
6.3.1. Обувь, контактирующая с кожей человека, не должна оказывать местное кожно-раздражающее действие.
6.3.2. Значение индекса токсичности, определяемого в водной среде, должно быть в пределах от 70 до 120%; в воздушной среде - от 80 до 120% включительно.
Значение индекса токсичности, определяемого с помощью люминесцентного бактериального теста, должно быть меньше 20%.
9. В раздел 13 "Требования к сигаретам и табачному сырью" Главы II:
9.1. Пункт 3.6 изложить в следующей редакции: "Предельно допустимые уровни содержания пестицидов в табачном сырье изложены в разделе 15 "Требования к пестицидам и агрохимикатам" главы II "Единых санитарно-эпидемиологических и гигиенических требований к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)".
10. В раздел 14. Требования к средствам индивидуальной защиты
10.1. В первом абзаце раздела после слова "документы" исключить слово "принимается" и вставить слова "устанавливает единые санитарно-эпидемиологические и гигиенические требования к средствам индивидуальной защиты" (и далее по тексту).
10.2. В разделе 4.4 слово "волонтеров" заменить на "испытателей".
10.3. Раздел 5 до начала таблицы "Перечень средств индивидуальной защиты и материалов для их изготовления с кодами ТНВЭД" изложить в редакции:
Маркировка средств индивидуальной защиты должна соответствовать следующим требованиям:
Каждая единица средств индивидуальной защиты, включая сменные составные компоненты, должна иметь маркировку. Маркировка наносится непосредственно на изделие и на его упаковку. Если маркировку невозможно нанести непосредственно на изделие, она наносится на этикетку, прикрепленную к изделию, или на его индивидуальную упаковку;
Маркировка наносится непосредственно на изделие и комплектующие следующих средств индивидуальной защиты: костюмы изолирующие; СИЗОД; одежду специальную и фильтрующую защитную одежду; СИЗ головы; СИЗ глаз; СИЗ лица; СИЗ органа слуха, кроме берушей; перчатки из эластомерных материалов.
Маркировка, наносимая непосредственно на изделие или на этикетку, прикрепленную к изделию, должна содержать:
наименование изделия (для обуви - наименование модели, кода, артикула);
наименование изготовителя и (или) его товарный знак;
защитные свойства;
размер (при наличии);
наименование нормативного правового акта, документов в области стандартизации, и (или) сводов правил, и (или) технических условий, требованиям которых соответствует средство индивидуальной защиты;
знак обращения на рынке;
сведения о наличии сертификата соответствия или декларации соответствия;
дату изготовления или дату окончания срока годности, если она установлена;
сведения о климатическом поясе, в котором могут применяться средства индивидуальной защиты (при необходимости);
сведения о способах ухода и утилизации средства индивидуальной защиты;
другую информацию в соответствии с технической документацией изготовителя;
Информация должна наноситься любым рельефным способом (тиснение, гравировка, литье, штамповка) либо трудноудаляемой краской непосредственно на изделие или этикетку, прикрепленную к изделию. Допускается нанесение информации в форме пиктограмм, которые могут использоваться в качестве указателей опасности или области применения средств индивидуальной защиты. Информация должна быть четко читаемой и стойкой при хранении, перевозке, реализации и использовании продукции по назначению в течение всего срока службы и (или) гарантийного срока хранения.
Маркировка, наносимая на упаковку изделия, должна содержать:
наименование изделия (для обуви - наименование модели, кода, артикула);
наименование страны-изготовителя;
наименование, юридический адрес и торговую марку изготовителя;
наименование нормативно-правового акта, документов в области стандартизации, и (или) сводов правил, и (или) технических условий, требованиям которых соответствует средство индивидуальной защиты;
размер (при наличии);
защитные свойства изделия;
способы ухода за изделием (при необходимости);
год изготовления и, если установлены, срок годности или дату истечения срока годности;
гарантийный срок для средств индивидуальной защиты, теряющих защитные свойства в процессе хранения и (или) эксплуатации;
знак обращения на рынке, сведения о наличии сертификата соответствия или декларации соответствия;
величину опасного или вредного фактора, ограничивающего использование средства индивидуальной защиты (при наличии);
ограничения по использованию, обусловленные возрастом, состоянием здоровья и другими физиологическими особенностями пользователей;
сведения о климатическом поясе, в котором могут применяться средства индивидуальной защиты (при необходимости);
другую информацию в соответствии с документацией изготовителя.
Маркировка должна быть изложена на русском языке.
Маркировка средств индивидуальной защиты должна быть разборчивой, легкочитаемой и нанесена на поверхность продукции (этикетки, упаковки), доступную для осмотра без разборки или применения инструмента.
Указания по эксплуатации средств индивидуальной защиты содержатся в эксплуатационной документации на средства индивидуальной защиты и должны включать в себя:
1) область применения;
2) ограничения применения средств индивидуальной защиты по факторам воздействия, а также по возрастным категориям и состоянию здоровья пользователей (при наличии);
3) порядок использования средств индивидуальной защиты (для средств индивидуальной защиты сложной конструкции);
4) требования к квалификации пользователя, порядок допуска к применению средств индивидуальной защиты (при наличии);
5) вид средства индивидуальной защиты;
6) наименование средства индивидуальной защиты;
7) показатели защитных и эксплуатационных свойств средства индивидуальной защиты согласно требованиям к информации для приобретателя и условия, при которых эти требования достигаются;
8) сведения о способах безопасного применения средства индивидуальной защиты;
9) порядок проведения обслуживания и периодических проверок средства индивидуальной защиты (при необходимости);
10) информацию о размере (росте) средства индивидуальной защиты в единицах измерения, применяемых в странах ЕврАзЭС (при наличии);
11) правила, условия и сроки безопасного хранения средства индивидуальной защиты;
12) требования к безопасной транспортировке средств индивидуальной защиты (при наличии таких требований);
13) требования по утилизации средства индивидуальной защиты (при наличии таких требований);
14) наименование нормативного правового акта, документов в области стандартизации, и (или) сводов правил, и (или) технических условий, требованиям которых соответствует средство индивидуальной защиты";
15) наименование страны-изготовителя и наименование изготовителя, его юридический адрес;
16) срок годности или дату истечения срока годности;
17) гарантийный срок для средств индивидуальной защиты, теряющих защитные свойства в процессе хранения и (или) эксплуатации;
18) гарантии изготовителя;
19) сведения о наличии сертификата соответствия или декларации соответствия.
11. В раздел 15 "Требования к пестицидам и агрохимикатам":
11.1. Приложение 15.1 изложить в следующей редакции:
ГИГИЕНИЧЕСКИЕ НОРМАТИВЫ
СОДЕРЖАНИЯ ДЕЙСТВУЮЩИХ ВЕЩЕСТВ ПЕСТИЦИДОВ В ОБЪЕКТАХ
ОКРУЖАЮЩЕЙ СРЕДЫ, ПРОДОВОЛЬСТВЕННОМ СЫРЬЕ, ПИЩЕВЫХ
ПРОДУКТАХ <1>
--------------------------------
<1> Представлены допустимые величины: ДСД - допустимая суточная доза, ВДСД - временная допустимая суточная доза (помечена звездочкой *);
ПДК - предельно допустимая концентрация; (м.р.) - максимально-разовая концентрация; (с.-с.) - среднесуточная концентрация / ОДК - ориентировочная допустимая концентрация (для почвы), ОДУ - ориентировочный допустимый уровень(для воды), ОБУВ - ориентировочный безопасный уровень воздействия (для воздуха);
МДУ - максимально допустимый уровень, ВМДУ - временный максимально допустимый уровень помечен звездочкой (*), МДУ для импортируемой продукции помечен двумя звездочками (**).
Сокращения и условные обозначения: нн - вещество не нормировано в данной среде; нт - нормирование вещества не требуется в данной среде; (с.-т.) - санитарно-токсикологический; (общ.) - общесанитарный; (тр.) - транслокационный; (орг.) - органолептический; (м.-в.) - миграционно-водный; (м.-вз.) - миграционно-воздушный; (фит.) - фитосанитарный; (А) - аллерген; (а) - аэрозоль; (п + а) - пары + аэрозоль; (+) - опасен при попадании на кожу; (++) - вещества, при работе с которыми должен быть исключен контакт с органами дыхания и кожей при обязательном контроле воздуха рабочей зоны утвержденным методом на уровне чувствительности не менее 0,001 мг/м3.
12. В раздел 16 "Требования к материалам и изделиям, изготовленным из полимерных и других материалов, предназначенных для контакта с пищевыми продуктами и средами":
12.1. Последний абзац раздела 3 "Общие положения" изложить в следующей редакции: "Раздел содержит основные виды материалов (полимерных, синтетических, сталей, сплавов и других), предназначенных для использования в контакте с продуктами питания и основные химические вещества, присущие каждому виду материалов, которые следует контролировать при проведении санитарно-химических исследований. Гигиенические показатели безопасности и нормативы веществ представлены в таблицах 2, 3. Органолептические показатели при исследовании материалов и изделий, предназначенных для контакта с пищевыми продуктами, и их нормативы представлены в таблицах 4, 5.
После первого абзаца раздела 3 добавить "Органолептические показатели при исследовании материалов и изделий, предназначенных для контакта с пищевыми продуктами и средами, должны соответствовать требованиям, представленным в таблицах 4, 5.
Добавить таблицу 4 "Органолептические показатели водных вытяжек при исследовании материалов и изделий, предназначенных для контакта с пищевыми продуктами с влажностью более 15%
Добавить таблицу 5 "Органолептические показатели при исследовании материалов и изделий, предназначенных для контакта с пищевыми продуктами с влажностью не более 15%
12. В раздел 18 "Требования к изделиям медицинского назначения и медицинской техники":
12.1. Из абзаца 5 подраздела 1 исключить женские гигиенические прокладки, пеленки и памперсы для детей, женские гигиенические тампоны (из кодов ТН ВЭД исключить 4818 40 110 0, 4818 40 130 0, 5601 10, 5601 10 100 0, 5601 10 900 0);
12.2. В абзац "Положения настоящего документа не распространяются на:" дополнить следующим "средства женской гигиены (женские гигиенические прокладки, женские гигиенические, пеленки и памперсы для детей), за исключением тех изделий, которые специально предназначены изготовителем для использования в медицинских целях";
12.3. Из подраздела 2 определения "изделия медицинского назначения" исключить "стоматологические материалы";
12.4. Предпоследний абзац подраздела 3 дополнить предложением "При отсутствии необходимости принятия мер безопасности изготовитель указывает: "Соблюдения мер безопасности не требуется";
12.5. В подразделе 4 "оценка УФ-поглощения в диапазоне длин волн 220-36 нм" изложить в редакции "оценка УФ-поглощения в диапазоне длин волн 220-360 нм";
12.6. Последний абзац подраздела 4 изложить в следующей редакции - "клинические испытания (для женских гигиенических прокладок, подгузников, пеленок, предназначенных изготовителем исключительно для медицинских целей)";
12.7. Абзац 2 подраздела 5 изложить в следующей редакции - "Маркировка наносится непосредственно на изделие и/или на упаковку. Для изделия, вводимого в обращение в стерильном виде, маркировка должна наноситься и на стерильную упаковку. Маркировка на изделие не наносится, если оно имеет слишком малые размеры, или этого не допускают его специфические свойства";
12.8. Абзац 5 подраздела 5 изложить в следующей редакции - "Маркировка, наносимая непосредственно на изделие, должна содержать: наименование изготовителя и/или его товарный знак; наименование изделия; габариты, массу, электропитание, заводской номер (при необходимости), дату (год) изготовления (для ИМТ), срок годности или дату окончания срока годности, нормативный документ, требованиям которого соответствует изделие, знак обращения; другую информацию в соответствии с технической документацией изготовителя";
12.9. Абзац 6 подраздела 5 изложить в следующей редакции - "Маркировка, наносимая на упаковку изделия, должна содержать: наименование страны-изготовителя, наименование, юридический адрес и торговую марку изготовителя, наименование изделия, нормативный документ, требованиям которого соответствует изделие, габариты, массу (при необходимости), способы ухода за изделием, год изготовления (для ИМТ), срок годности или дату окончания срока годности (для ИМН), знак обращения, другую информацию в соответствии с документацией изготовителя";
12.10. Абзац 7 подраздела 5 изложить в следующей редакции - "Информация на ИМТ должна наноситься рельефным способом (тиснение, гравировка, литье, штамповка)" (далее по тексту).
Утверждены
Решением Комиссии
Таможенного союза
от 17 августа 2010 г. N 341
ИЗМЕНЕНИЯ
В ЕДИНЫЕ ФОРМЫ ДОКУМЕНТОВ, ПОДТВЕРЖДАЮЩИХ БЕЗОПАСНОСТЬ
ПРОДУКЦИИ (ТОВАРОВ)
Внести в Единые формы документов, подтверждающих безопасность продукции (товаров), следующие изменения:
1. Дополнить Приложение N 1 к Единой форме свидетельства о государственной регистрации продукции пунктом 18 следующего содержания: "Информация, которая не может быть размещена в бланке свидетельства о государственной регистрации по причинам ограничений объема, выносится в приложение к свидетельству о государственной регистрации, оформляемое в соответствии с Приложением N 3.
Допускается объединение в одном свидетельстве нескольких наименований товаров одного изготовителя, изготовленных по единым техническим требованиям, имеющих единый компонентный (ингредиентный) состав, гигиеническую характеристику, область применения, но с незначительными различиями, не имеющими гигиенического значения (например: различная форма или объем товара, процентный состав, различный цвет или аромат, обусловленный внесением красителей, ароматизаторов).".
Изменить нумерацию пунктов 18 и 19 на 19 и 20 соответственно.
2. Дополнить Единые формы документов приложением N 3 к Единой форме свидетельства о государственной регистрации продукции:
Приложение N 3
к Единой форме свидетельства
о государственной регистрации
Утверждены
Решением Комиссии
Таможенного союза
от 17 августа 2010 г. N 341
ИЗМЕНЕНИЯ
В ЕДИНЫЙ ПЕРЕЧЕНЬ ТОВАРОВ, ПОДЛЕЖАЩИХ
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОМУ НАДЗОРУ (КОНТРОЛЮ)
НА ТАМОЖЕННОЙ ГРАНИЦЕ И ТАМОЖЕННОЙ ТЕРРИТОРИИ
ТАМОЖЕННОГО СОЮЗА
Внести в Единый перечень товаров, подлежащих санитарно-эпидемиологическому надзору (контролю) на таможенной границе и таможенной территории Таможенного союза (далее - Единый перечень), следующие изменения:
1. В разделе II:
1.1. Тринадцатый абзац изложить в редакции: "Государственной регистрации подлежат товары, указанные в пунктах 1 - 11 настоящего раздела, включенные в следующие исчерпывающие позиции ТН ВЭД ТС, впервые изготавливаемые на таможенной территории Таможенного союза, а также впервые ввозимые на таможенную территорию Таможенного союза:".
1.2. В таблице:
1.2.1. товарные позиции по кодам ТН ВЭД ТС: из 2934, 3201, из 3505 исключить;
1.2.2. товарную позицию по коду ТН ВЭД ТС "3203" изложить в редакции:
1.2.3. товарную позицию по коду ТН ВЭД ТС "Из 3507" изложить в редакции:
1.2.4. дополнить сноской следующего содержания:
"<**> В соответствии с Перечнем государственной регистрации подлежит только та продукция, которая указана в группах продукции, перечисленных в начале Раздела II единого перечня, и одновременно находится в описаниях товарных позиций ТН ВЭД ТС с соответствующими изъятиями и оговорками.
Так, не подлежат государственной регистрации перечисленные в товарной номенклатуре внешнеэкономической деятельности Таможенного союза соли и сложные эфиры из позиций 2915, 2916, 2917, 2918 следующих подсубпозиций:
2915 12 000 0, 2915 13 000 0, 2915 24 000 0, соли и сложные эфиры из 2915 29 000 0, 2915 31 000 0, 2915 32 000 0, 2915 33 000 0, 2915 36 000 0, соли и сложные эфиры из 2915 39, 2915 39 100 0, 2915 39 300 0, 2915 39 500 0, 2915 39 800 0, 2915, соли и эфиры из 2915 40 000 0, соли и сложные эфиры из 2915 50 000 0, соли и сложные эфиры из 2915 60 110 0, 2915 60 190 0, соли и сложные эфиры из 2915 60 900 0, соли и сложные эфиры из 2915 70: 2915 70 200 0, 2915 70 300 0, 2915 70 800 0, соли и сложные эфиры из 2915 90, соли и сложные эфиры из 2915 90 800 0;
соли акриловой кислоты из 2916 11 000 0, 2916 12 сложные эфиры акриловой кислоты (2916 12 100 0, 2916 12 200 0, 2916 12 900 0), соли из 2916 13 000; 2916 14, соли и сложные эфиры из 2916 15 000 0, соли и сложные эфиры из 2916 19 100, соли и сложные эфиры из 2916 31 000 0, соли из 2916 34 000 0, 2916 35 000 0, соли и сложные эфиры из 2916 39 000 0;
соли и сложные эфиры из 2917 11 000 0, 2917 12: соли из 2917 12 100 0, 2917 12 900 0, соли и сложные эфиры из 2917 13 900 0, соли и сложные эфиры из 2917 19 (соли и сложные эфиры из 2917 19 100 и из 2917 19 900 0), 2917 31 000 0, 2917 32 000 0, 2917 33 000 0, 2917 34 000 0, соли из 2917 36 000, 2917 37 000, соли и сложные эфиры из 2917 39 (2917 39 110 0, соли и эфиры из 2917 39 190 0, соли и сложные эфиры из 2917 39 800 0);
соли и сложные эфиры из 2918 11 000 0, соли и сложные эфиры из 2918 13 000 0, соли и сложные эфиры из 2918 15 000 0, соли и сложные эфиры из 2918 16 000 0, соли и сложные эфиры из 2918 19 (соли и сложные эфиры из 2918 19 300 0, соли и сложные эфиры из 2918 19 850 0), соли из 2918 21 000 0, соли и сложные эфиры из 2918 22 000 0, 2918 23, соли и сложные эфиры из 2918 29 (соли и сложные эфиры из 2918 29 100 0, соли и сложные эфиры из 2918 29 300 0, соли и сложные эфиры из 2918 29 800 0); соли и сложные эфиры из 2918 30 000 0, соли и сложные эфиры из 2918 91 000 0, соли и сложные эфиры из 2918 99.
Из товарной позиции 3202 10 подлежат государственной регистрации душистые вещества и их смеси, используемые в пищевой промышленности или для производства напитков, что следует из наименования группы, иные вещества из указанной позиции государственной регистрации не подлежат.
Из товарной позиции 3403 государственной регистрации подлежат исключительно средства, предназначенные для масляной или жировой обработки текстильных материалов, кожи и меха.".
2. В разделе III:
2.1. название раздела дополнить сноской следующего содержания: "Действие настоящего перечня распространяется на товары, внесенные в раздел II Единого перечня товаров, подлежащих санитарно-эпидемиологическому надзору (контролю) на таможенной границе и таможенной территории Таможенного союза";
2.2. второй абзац изложить в редакции:
"- нетабачное сырье, нетабачные материалы и ингредиенты, используемые для производства табачных изделий;";
2.3. пятый абзац изложить в редакции:
"- запасные части техники, оборудования для использования в различных отраслях промышленности;".
8. Шестой абзац раздела III Единого перечня товаров исключить.
9. Седьмой абзац раздела III Единого перечня товаров изложить в редакции: "- сувенирная продукция, косметические аксессуары;".
10. Раздел III Единого перечня товаров дополнить абзацем следующего содержания: "припасы, превышающие нормы, установленные в соответствии с частью первой пункта 4 статьи 363 таможенного кодекса Таможенного союза, подлежащие помещению под таможенные процедуры.".
Утверждены
Решением Комиссии
Таможенного союза
от 17 августа 2010 г. N 341
ИЗМЕНЕНИЯ
В ПОЛОЖЕНИЕ О ПОРЯДКЕ ОСУЩЕСТВЛЕНИЯ ГОСУДАРСТВЕННОГО
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОГО НАДЗОРА (КОНТРОЛЯ) ЗА ЛИЦАМИ
И ТРАНСПОРТНЫМИ СРЕДСТВАМИ, ПЕРЕСЕКАЮЩИМИ ТАМОЖЕННУЮ
ГРАНИЦУ ТАМОЖЕННОГО СОЮЗА, ПОДКОНТРОЛЬНЫМИ ТОВАРАМИ,
ПЕРЕМЕЩАЕМЫМИ ЧЕРЕЗ ТАМОЖЕННУЮ ГРАНИЦУ ТАМОЖЕННОГО
СОЮЗА И НА ТАМОЖЕННОЙ ТЕРРИТОРИИ ТАМОЖЕННОГО СОЮЗА
Внести в Положение о порядке осуществления государственного санитарно-эпидемиологического надзора (контроля) за лицами и транспортными средствами, пересекающими таможенную границу Таможенного союза, подконтрольными товарами, перемещаемыми через таможенную границу Таможенного союза и на таможенной территории Таможенного союза (далее - Положение), следующие изменения:
1. В пункте 14 Положения изложить второй абзац в редакции: "контроль документов, подтверждающих безопасность продукции (товаров), содержащейся в разделе II Единого перечня товаров, и их соответствие транспортным (перевозочным) и (или) коммерческим документам;".
2. Внести изменения в пункт 17 Положения:
2.1. изложить четвертый абзац в редакции: "или выписка из Реестра свидетельств о государственной регистрации на товары, подлежащие санитарно-эпидемиологическому надзору (контролю) на таможенной границе и таможенной территории Таможенного союза (далее - Единый реестр) с указанием реквизитов документа, подтверждающего безопасность продукции (товаров), наименований продукции (товаров), изготовителя, получателя и органа, выдавшего документ, подтверждающий безопасность продукции (товаров);
2.2. дополнить абзацем: "или сведения электронной базы данных Единого реестра свидетельств о государственной регистрации на специализированном поисковом сервере сайта Таможенного союза в сети Интернет.".
3. Внести изменения в пункт 23 Положения, дополнив его первый абзац после слов "в письменной форме" словами "согласно Приложению N 5.".
4. Дополнить Положение приложением N 5 по форме, прилагаемой к настоящему Приложению.
5. Внести изменения в пункт 30 Положения:
5.1. Четвертый абзац изложить в новой редакции: "или выписка из Единого реестра с указанием реквизитов документа, подтверждающего безопасность продукции (товаров), наименований продукции (товаров), изготовителя, получателя и органа, выдавшего документ, подтверждающий безопасность продукции (товаров);";
5.2. дополнить абзацем: "или сведения электронной базы данных Единого реестра свидетельств о государственной регистрации на специализированном поисковом сервере сайта Таможенного союза в сети Интернет.".
"Приложение N 5
--------------------------------
<1> Пункт 17 Положения.
<2> Пункт 19 Положения.
<3> Пункт 19 Положения.
<4> Статья 9 "Соглашения таможенного союза по санитарным мерам".
Утверждены
Решением Комиссии
Таможенного союза
от 17 августа 2010 г. N 341
ТЕХНИЧЕСКИЕ УСЛОВИЯ
ПО ФОРМАТУ И РЕГЛАМЕНТУ ПЕРЕДАЧИ ДАННЫХ
ИЗ НАЦИОНАЛЬНЫХ РЕЕСТРОВ СВИДЕТЕЛЬСТВ О ГОСУДАРСТВЕННОЙ
РЕГИСТРАЦИИ В ЕДИНЫЙ РЕЕСТР СВИДЕТЕЛЬСТВ
О ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ
Единый реестр свидетельств о государственной регистрации (далее - Реестр) ведется Комиссией Таможенного союза согласно Положению о Реестре свидетельств о государственной регистрации.
Уполномоченные органы государств - членов Таможенного союза, ответственные за ведение Национальных реестров свидетельств о государственной регистрации (далее - Национальные реестры), передают данные о выданных свидетельствах о государственной регистрации в Реестр в следующем XML-формате.
Тип данных "строка" - строка переменной длины до 255 символов (если не указано иное); тип данных "текст" - текст размером до 64 килобайт.
Порядок передачи данных о выданных свидетельствах о государственной регистрации из Национальных реестров в Реестр:
1. Национальные реестры государств - членов Таможенного союза формируют пакеты для внесения изменений и добавления данных в Реестр. Пакет является архивом ZIP, в который помещаются xml файл(ы). Каждый xml-файл содержит информацию не более чем о 100 документах, у которых в Национальных реестрах отсутствует признак "Передано".
Имя пакета формируется в следующем порядке:
Позиция 1: двухсимвольный код страны ALPHA2 (BY - Беларусь, KZ - Казахстан, RU - Россия).
Позиция 2: четырехзначный цифровой код года формирования пакета.
Позиция 3: двухзначный цифровой код месяца формирования пакета.
Позиция 4: двухзначный цифровой код дня месяца формирования пакета.
Позиция 5: двухзначный порядковый номер пакета в этот день (нумерация с 01).
Позиция 6: постоянный трехсимвольный код расширения имени пакета.
Имя xml-файла формируется в следующем порядке:
Позиция 1: двухсимвольный код страны ALPHA2 (BY - Беларусь, KZ - Казахстан, RU - Россия).
Позиция 2: шестизначный цифровой код, который изменяется от 000001 до 999999.
2. Осуществляется передача пакета.
3. Реестр обрабатывает полученные пакеты следующим образом:
- данные о документах из обрабатываемого пакета добавляются в Реестр. В случае совпадения значения поля N UMB_DOC в документе из обрабатываемого пакета и в Реестре происходит полная замена данных Реестра данными о документе из пакета;
- по результатам обработки Реестр формирует пакет подтверждения. Пакет является архивом ZIP, в который помещается xml-файл (имя xml-файла совпадает с именем пакета, а расширение - xml), содержащий информацию по каждому обработанному документу.
Имя пакета формируется в следующем порядке:
Позиция 1: имя обработанного icu-пакета (без расширения).
Позиция 2: четырехзначный цифровой код года обработки icu-пакета.
Позиция 3: двухзначный цифровой код месяца обработки icu-пакета.
Позиция 4: двухзначный цифровой код дня месяца обработки icu-пакета.
Позиция 5: постоянный трехсимвольный код расширения имени пакета.
4. Национальные реестры государств - членов Таможенного союза обрабатывают пакеты подтверждения. Успешно переданные документы помечаются в Национальных реестрах признаком "Передано".
