"Клинические рекомендации "Плазмоклеточный лейкоз"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПЛАЗМОКЛЕТОЧНЫЙ ЛЕЙКОЗ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C90.1
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 808
Разработчик клинической рекомендации
- Национальное гематологическое общество
- Региональная общественная организация "Общество онкогематологов"
- Ассоциация онкологов России
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
CRAB - совокупность органных повреждений при симптоматической множественной миеломе: гиперкальциемия, дисфункция почек, анемия, повреждения костей
Dara-CVRd - режим иммунохимиотерапии, включающий #даратумумаб**, #циклофосфамид**, #бортезомиб**, #леналидомид** и #дексаметазон**
Dara-KRd - режим иммунохимиотерапии, включающий #даратумумаб**, #карфилзомиб**, #леналидомид** и #дексаметазон**
Ig - иммуноглобулин
IMWG - Международная группа по изучению множественной миеломы
Isa-KRd - режим иммунохимиотерапии, включающий #изатуксимаб**, #карфилзомиб**, #леналидомид** и #дексаметазон**
ISS - международная система стадирования (International Staging System - ISS)
KRd - режим иммунохимиотерапии, включающий #карфилзомиб**, #леналидомид** и #дексаметазон**
PAD - режим иммунохимиотерапии, включающий #доксорубицин**, #бортезомиб** и #дексаметазон**
Rd - режим иммунохимиотерапии, включающий #леналидомид** и #дексаметазон**
R-ISS - пересмотренная (revised) международная система стадирования
R2-ISS - второй пересмотр (revised 2) международной системы стадирования
SLiM - маркеры опухолевой активности
VCD - режим иммунохимиотерапии, включающий #циклофосфамид**, #бортезомиб** и #дексаметазон**
VRD - режим иммунохимиотерапии, включающий #леналидомид**, #бортезомиб** и #дексаметазон**
Алло-ТГСК - трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК - трансплантация аутологичных гемопоэтических стволовых клеток
ВБП - выживаемость без прогрессирования
в/в - внутривенно
ВДП - выживаемость до прогрессии
ВДХТ - высокодозная химиотерапия
ВОЗ - Всемирная организация здравоохранения
ВТЭО - венозные тромбоэмболические осложнения
ГКС - глюкокортикоиды
рчГ-КСФ** - рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор** (L03AA Колониестимулирующие факторы по АТХ классификации)
ГСК - гемопоэтические стволовые клетки
КМ - костный мозг
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
ММ - множественная миелома
МНО - международное нормализованное отношение
МОБ - минимальная остаточная болезнь
МРТ - магнитно-резонансная томография
ОВ - общая выживаемость
ОХЧР - очень хорошая частичная ремиссия
п/к - подкожно
ПК - плазматические клетки
ПКЛ - плазмоклеточный лейкоз
ПР - полная ремиссия
ПЭТ - позитронно-эмиссионная томография
СКК - стволовые клетки крови
СЛЦ - свободные легкие цепи (иммуноглобулинов)
СОЭ - скорость оседания эритроцитов
ТГСК - трансплантация гемопоэтических стволовых клеток
ХБП - хроническая болезнь почек
ЦНС - центральная нервная система
ЧР - частичная ремиссия
ЭКГ - электрокардиограмма
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Плазмоклеточный лейкоз - B-клеточное злокачественное новообразование, морфологическим субстратом которого являются плазматические клетки, циркулирующие в периферической крови в количестве 5% и более. Согласно классификации опухолей гематологической и лимфоидной тканей ВОЗ 5-го пересмотра плазмоклеточный лейкоз рассматривается в качестве одного из клинических вариантов множественной миеломы.
Множественная миелома - B-клеточная злокачественная опухоль, морфологическим субстратом которой являются плазматические клетки, продуцирующие моноклональный иммуноглобулин. Согласно последней версии классификации Всемирной организации здравоохранения (ВОЗ) 2017 г. термин "множественная миелома" заменен на термин "плазмоклеточная миелома" - заболевание, характеризующееся мультифокальной пролиферацией неопластических плазматических клеток, в большинстве случаев ассоциированное с секрецией моноклонального иммуноглобулина.
Плазматическая клетка - конечный этап дифференцировки B-лимфоцита. Функциональная активность - участие в формировании гуморального иммунитета, продукция антител.
Моноклональный иммуноглобулин - иммуноглобулин одного класса, который синтезируется в избыточном количестве опухолевой плазматической клеткой. Структура иммуноглобулина при этом не нарушена, но синтез иммуноглобулина или отдельных компонентов превосходит уровень физиологической потребности.
Моноклональная гаммапатия - состояние, характеризующиеся присутствием иммуноглобулина одного класса.
M-градиент - узкая, четко очерченная полоса на электрофореграмме, которую образуют моноклональные иммуноглобулины.
Ремиссия - период течения заболевания, который характеризуется значительным ослаблением или полным исчезновением симптомов заболевания, в том числе по данным выполненных лабораторных и инструментальных методов исследования.
Рецидив - возврат клиники заболевания, в том числе и по данным лабораторных и инструментальных методов исследований.
Общая выживаемость - рассчитывается от даты начала лечения до смерти от любой причины или до даты последней явки пациента.
Выживаемость без прогрессирования - рассчитывается от даты начала лечения до прогрессирования болезни или смерти от любой причины.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Плазмоклеточный лейкоз - агрессивное B-клеточное лимфопролиферативное заболевание с экстрамедуллярной диссеминацией и неблагоприятным прогнозом. Согласно классификации опухолей гематологической и лимфоидной тканей ВОЗ 5-го пересмотра плазмоклеточный лейкоз рассматривается в качестве одного из клинических вариантов множественной миеломы [1]. Вместе с тем, в международной классификации болезней 10 и 11 пересмотров плазмоклеточный лейкоз выделен в отдельную нозологическую единицу.
В 2021 г. консенсусом экспертов международной рабочей группы по изучению множественной миеломы (IMWG) были пересмотрены критерии установления диагноза первичный плазмоклеточный лейкоз. В настоящее время этот термин включает в себя состояние, при котором в дебюте заболевания у больных ММ в периферической крови выявляется циркуляция 5% и более плазматических клеток, вместо утвержденных ранее 20%. Важно отметить, что пациенты с первичным плазмоклеточным лейкозом не должны иметь продолжительного анамнеза ММ, в отличие от пациентов со вторичным плазмоклеточным лейкозом [2]. Вторичный плазмоклеточный лейкоз развивается в терминальной стадии заболевания вследствие избыточного опухолевого роста. Первичный плазмоклеточный лейкоз диагностируется в 2 - 2,5 раза чаще чем вторичный [3].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
До настоящего времени доподлинно не определена причина возникновения плазмоклеточного лейкоза. Подобно другим видам злокачественных новообразований, плазмоклеточный лейкоз развивается из-за ряда генетических событий, формирующих патологический клон плазматических клеток, которые хаотично и бесконтрольно растут и делятся. Биологические и клинические особенности ПКЛ связаны с широким спектром генетичесских нарушений, наиболее изученными из которых являются гиподиплоидный кариотип, перестройка локусов генов тяжелой цепи иммуноглобулина (чаще - t(11; 14) и t(14; 16)), а также del(17p) [3 - 5].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Заболеваемость плазмоклеточным лейкозом составляет приблизительно 0,5 - 2% от всех случаев ММ ежегодно, чаще диагностируется у пациентов молодого возраста [4].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C90.1 - плазмоклеточный лейкоз
В настоящей клинической рекомендации приводятся сведения о диагностике, методах терапии и прогнозе при первичном плазмоклеточном лейкозе.
Вторичный плазмоклеточный лейкоз по мнению экспертного сообщества следует рассматривать как проявление ММ в терминальной стадии вследствие избыточного опухолевого роста. Терапия вторичного плазмоклеточного лейкоза осуществляется в соответствии с принципами лечения рецидивов и рефрактерных форм множественной миеломы.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
До настоящего времени не разработаны классификационные критерии стадирования первичного плазмоклеточного лейкоза.
Поскольку ПКЛ рассматривается исследовательскими группами как один из клинических вариантов ММ рекомендуется применять системы стадирования, утвержденные для оценки множественной миеломы.
Распространенной системой стадирования является классификация B. Durie и S. Salmon, предложенная в 1975 г. (табл. 1) [6], которая была заменена на международную систему стадирования (International Staging System - ISS) [7], пересмотренную в 2014 г. [8].
Таблица 1. Стадирование ММ по системе B. Durie, S. Salmon
Стадия
Признаки
Клеточная масса, 1012/м2
I
Совокупность следующих признаков:
1. Уровень гемоглобина > 10 г/дл
2. Нормальный уровень кальция сыворотки
3. Рентгенологически нормальная структура костей или одиночный очаг поражения
4. Низкий уровень M-протеина:
а) IgG < 50 г/л;
б) IgA < 30 г/л
5. Белок Бенс-Джонса < 4 г/сут
< 0,6
(низкая)
II
Показатели, не соответствующие ни I, ни III стадиям
0,6 - 1,2
(средняя)
III
Один или более из следующих признаков:
- Уровень гемоглобина < 8,5 г/дл
- Уровень кальция сыворотки превышает нормальные значения
- Множественные поражения костей (> 3 литических очагов)
- Высокий уровень M-протеина:
- IgG > 70 г/л;
- IgA > 50 г/л
- Белок Бенс-Джонса > 12 г/сут
> 1,2
(высокая)
Дополнительным признаком, определяющим подстадию, является состояние функции почек:
- A - нормальная (креатинин сыворотки < 177 мкмоль/л или 2 мг/дл).
- B - сниженная (креатинин сыворотки >= 177 мкмоль/л или 2 мг/дл).
Классификация ISS основана на важном прогностическом значении сочетания ![]() -микроглобулина и альбумина сыворотки крови (табл. 2) [7].
-микроглобулина и альбумина сыворотки крови (табл. 2) [7].
Таблица 2. Стадирование множественной миеломы по системе ISS
Стадия
Показатели
Медиана ОВ, мес
I
![]() -микроглобулин сыворотки < 3,5 мг/л
-микроглобулин сыворотки < 3,5 мг/л
Альбумин >= 3,5 г/дл
62
II
![]() -микроглобулин сыворотки < 3,5 мг/л
-микроглобулин сыворотки < 3,5 мг/л
Альбумин < 3,5 г/дл
или
![]() -микроглобулин сыворотки 3,5 - 5,5 мг/л
-микроглобулин сыворотки 3,5 - 5,5 мг/л
44
III
![]() -микроглобулин >= 5,5 мг/л
-микроглобулин >= 5,5 мг/л
29
В 2014 г. ISS была пересмотрена (revised ISS; R-ISS). Кроме показателей ![]() -микроглобулина и альбумина сыворотки R-ISS учитывает наличие неблагоприятных хромосомных аномалий и высокий уровень лактатдегидрогеназы (ЛДГ) (табл. 3) [8].
-микроглобулина и альбумина сыворотки R-ISS учитывает наличие неблагоприятных хромосомных аномалий и высокий уровень лактатдегидрогеназы (ЛДГ) (табл. 3) [8].
Таблица 3. Пересмотренная международная система стадирования ММ
Прогностический фактор
Критерии
Стадии ISS
I
II
III
![]() микроглобулин сыворотки < 3,5 мг/л, альбумин >= 3,5 г/дл
микроглобулин сыворотки < 3,5 мг/л, альбумин >= 3,5 г/дл
Критерии не соответствуют I или III стадиям
![]() -микроглобулин >= 5,5 мг/л
-микроглобулин >= 5,5 мг/л
Цитогенетические аномалии по FISH
Высокий риск
Стандартный риск
Наличие del 17p и/или транслокации t(4; 14) и/или транслокации t(14; 16)
Отсутствие цитогенетических аномалий высокого риска
ЛДГ
Норма
Высокий уровень
ЛДГ сыворотки ниже верхней границы нормального уровня
ЛДГ сыворотки выше верхней границы нормального уровня
Новая модель стратификационного риска ММ
Стадии R-ISS
I
II
III
ISS-стадия I, цитогенетические аномалии стандартного риска по FISH и нормальный уровень ЛДГ
Критерии не соответствуют I или III стадиям R-ISS
ISS стадия III + цитогенетические аномалии высокого риска по FISH или высокий уровень ЛДГ
Второй пересмотр международной системы стадирования проведен в 2022 году (R2-ISS). Учитывая результаты проведенного многоцентрового исследования, авторы выделили основные факторы риска, совокупность которых влияла на продолжительность выживаемости больных ММ. Система стадирования основана на оценке таких параметров как стадия ISS, активность ЛДГ, цитогенетические аномалии, включая del(17p), t(4; 14) 1q+ (таблица 4). При этом каждому из представленных факторов присваиваются соответствующие баллы, которые суммируются и по их совокупности определяется стадия заболевания или группа риска [9].
Таблица 4. Второй пересмотр международной системы стадирования ММ (R2-ISS, 2022 г.)
Стадия по R2-ISS (риск)
Сумма баллов
Факторы прогноза и соответствующие баллы
Пятилетняя ВБП, %
Пятилетняя ОВ, %
I (низкий риск)
0
ISS II - 1 балл
ISS III - 1,5 балла
del(17p) - 1 балла
![]() ЛДГ - 1 балл
ЛДГ - 1 балл
t(4; 14) - 1 балл
1q - 0,5 балла
55
88
II (низкий промежуточный)
0,5 - 1
40
75
III (промежуточный высокий)
1,5 - 2,5
25
56
IV (высокий)
3 - 5
17
37
ВБП - выживаемость без прогрессирования, ОВ - общая выживаемость.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления ПКЛ чрезвычайно разнообразны, но в значительной мере определяются инфильтрацией костного мозга ПК и органными повреждениями. Клинические признаки проявляются симптомами, обусловленными костными повреждениями (боли в костях, переломы костей скелета, компрессия спинного мозга, радикулярные боли), гиперкальциемией (полиурия, полидипсия, тошнота, рвота), почечной недостаточностью (тошнота, рвота, недомогание, слабость), инфильтрацией миеломными клетками костного мозга (анемия, геморрагический синдром), снижением уровня нормальных иммуноглобулинов (частые инфекции, пневмонии), криоглобулинемией (синдром Рейно, акроцианоз), синдромом гипервязкости (одышка, транзиторные ишемические атаки, тромбоз глубоких вен, кровоизлияния в сетчатку глаза, тромбоз центральной вены сетчатки или ее ветвей, носовые кровотечения), органомегалией (гепатомегалия и спленомегалия), наличием экстрамедулярных новообразований [3, 10, 11].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
В настоящее время диагноз первичный плазмоклеточный лейкоз согласно рекомендациям IMWG 2021 устанавливают при наличии 5% или более циркулирующих плазматических клеток в мазках периферической крови у пациентов с симптоматической ММ [2].
Тщательное исследование периферической крови с помощью традиционной микроскопии должно проводиться всем пациентам с ММ. Необходимо проанализировать минимум 100 - 200 ядросодержащих клеток в мазке периферической крови.
При установлении диагноза симптоматической ММ должны быть обнаружены 10% и более плазматических клеток в костном мозге и/или плазмоклеточная инфильтрация в биопсийном материале пораженной ткани при обязательном наличии как минимум одного критерия CRAB и/или SLiM, в том числе [12]:
1. Один или более следующих признаков поражения органов или тканей, связанных с плазмоклеточной пролиферацией (критерии CRAB):
- гиперкальциемия (сывороточный кальций на 0,25 ммоль/л или на 1 мг/дл превышающий верхнюю границу нормальных значений, или > 2,75 ммоль/л, или > 11 мг/дл);
- почечная недостаточность (клиренс креатинина < 40 мл/мин или креатинин сыворотки > 177 мкмоль/л, или > 2 мг/дл);
- анемия (гемоглобин на 20 г/л ниже нормальных значений или ниже 100 г/л);
- поражение костей (один или более остеолитический очаг, выявленный при рентгенографии, КТ или ПЭТ/КТ; при плазмоклеточной инфильтрации костного мозга менее 10% должно выявляться более 1 очага поражения костей для проведения дифференциальной диагностики с солитарной плазмоцитомой с минимальным вовлечением костного мозга).
2. При отсутствии симптомов комплекса "CRAB" - наличие как минимум одного маркера опухолевой активности (критерии SLiM):
- более 60% плазматических клеток в костном мозге;
- соотношение вовлеченных/невовлеченных СЛЦ сыворотки более 100;
- более 1 очага инфильтрации костного мозга по результатам МРТ: каждый очаг должен быть в диаметре не менее 5 мм.
2.1 Жалобы и анамнез
- У всех пациентов с подозрением на ПКЛ или выявленным ПКЛ при первичном приеме рекомендуется тщательный сбор жалоб и анамнеза при заболеваниях органов кроветворения и крови для верификации диагноза [3, 5, 13 - 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.2 Физикальное обследование
- У всех пациентов с подозрением на ПКЛ или выявленным ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической, определение общего состояния по шкале ECOG, а также осмотр миндалин и полости рта для уточнения распространенности и тяжести течения заболевания [3, 5, 13 - 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при осмотре необходимо оценить общее состояние пациента по шкале ECOG (см. приложение Г1), а также осмотреть миндалины и полость рта; пальпация должна включать в себя оценку доступных групп периферических лимфатических узлов, печени, селезенки.
2.3 Лабораторные диагностические исследования
- Всем пациентам с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания рекомендуется для уточнения состояния пациента, выработки адекватной терапевтической тактики и/или (в случае ранее проведенной терапии) при развитии нежелательных явлений лечения выполнить следующие лабораторные исследования:
§ Общий (клинический) анализ крови развернутый с определением уровней гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов, СОЭ [2, 3, 19, 5, 12 - 18];
§ общий (клинический) анализ мочи [3, 5, 12 - 19];
§ определение количества белка в суточной моче [3, 5, 12 - 19];
§ анализ крови биохимический общетерапевтический (общий белок, альбумин, ЛДГ, мочевина, креатинин, билирубин, аспартатаминотрансфераза, аланинаминотрансфераза, щелочная фосфатаза, кальций, калий) [3, 5, 12 - 19];
§ коагулограмму (ориентировочное исследование системы гемостаза) с включением следующих параметров: протромбин, международное нормализованное отношение, активированное частичное тромбопластиновое время, фибриноген, тромбиновое время [3, 5, 20, 12 - 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания рекомендуется определить скорость клубочковой фильтрации расчетным методом для уточнения состояния функции почек и определения необходимости модификации терапии или доз препаратов при наличии почечной недостаточности и/или определения показаний к назначению гемодиализа [3, 5, 12 - 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания рекомендуется для уточнения активности основного заболевания или для оценки ответа на терапию выполнить следующие обследования:
§ определить соотношение белковых фракций в крови (кроме пациентов с несекретирующей, вялотекущей миеломой и миеломой легких цепей) и моче методом электрофореза с количественным исследованием моноклональности иммуноглобулинов в крови методом иммунофиксации и поликлональных иммуноглобулинов [3, 5, 21, 22, 12 - 19];
§ исследование уровня бета-2-микроглобулина в крови при диагностике для стадирования согласно международной классификации и оценки факторов риска [3, 5, 21, 22, 12 - 19];
§ исследование моноклональности иммуноглобулинов в крови и суточной моче методом иммунофиксации с количественным определением концентрации M-градиента [3, 5, 22, 12 - 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с несекретирующей, олигосекретирующей, а также при диализзависимой почечной недостаточности, при подозрении на заболевание, при первичном или повторном приеме по поводу выявленного заболевания, при контрольных обследованиях и подозрении на рецидив заболевания рекомендуется определение содержания свободных легких цепей (СЛЦ) каппа и лямбда в крови для уточнения активности основного заболевания или для оценки ответа на терапию [3, 5, 23, 12 - 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на ПКЛ или выявленном ПКЛ при первичном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания рекомендуется выполнить получение цитологического препарата КМ путем пункции (стернальная пункция), с последующим цитологическим (миелограмма) исследованием, а при необходимости исследованием биологического материала (костный мозг) методом проточной цитофлуориметрии для подтверждения и формулирования диагноза [3, 5, 13 - 19, 24].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Всем пациентам с подозрением на ПКЛ или выявленном ПКЛ при первичном приеме, а также для оценки костномозгового кроветворения перед сбором СКК или при подозрении на рецидив заболевания рекомендуется выполнить получение гистологического препарата костного мозга (КМ) (трепанобиопсию) и паталогоанатомическое исследование биопсийного (операционного) материала костного мозга (при необходимости с применением иммуногистохимических методов) для подтверждения и формулирования диагноза [3, 5, 13 - 19, 24].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Всем пациентам с впервые выявленным ПКЛ рекомендуется выполнить молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом для выявления наиболее прогностически важных цитогенетических аномалий: t(4; 14), t(14; 16), t(6; 14), del 17p13, t(11; 14), плоидности и изменений хромосомы 1 [3, 5, 8, 13 - 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с впервые выявленным ПКЛ рекомендуется выполнить спинномозговую пункцию с последующим цитологическим исследованием клеток спинномозговой жидкости [19, 25].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.4 Инструментальные диагностические исследования
- Всем пациентам при установке диагноза ПКЛ/перед началом терапии, при оценке эффекта терапии, а также при подозрении на рецидив заболевания рекомендуется выполнить КТ всех отделов позвоночника, органов грудной клетки, таза (предпочтение отдается низкодозной КТ всего скелета) для уточнения наличия и распространенности поражения костей, выявления костных и экстрамедуллярных плазмоцитом с определением их размеров [18, 19, 26].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам при установке диагноза ПКЛ перед началом терапии, при оценке эффекта терапии, а также при подозрении на рецидив заболевания в качестве альтернативы КТ всего скелета для уточнения наличия и распространенности поражения костей, выявления костных и экстрамедуллярных плазмоцитом с определением их размеров рекомендуется выполнить ПЭТ/КТ [3, 5, 27, 12 - 19]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.5 Иные диагностические исследования
Не применяются.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинических рекомендациях, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Учитывая редкую частоту выявления плазмоклеточного лейкоза, пересмотр критериев диагностики в 2021 году, данные по эффективности и безопасности терапии, основанные на результатах проспективных клинических исследований, носят ограниченный характер. На территории Российской Федерации, среди зарегистрированных лекарственных средств, обладающих противоопухолевой активностью в отношении плазматических клеток в разделе показания к применению отсутствует ПКЛ.
Настоящие клинические рекомендации основываются на результатах когортных исследований, описании клинических наблюдений и мнении экспертного сообщества по оптимальным подходам к терапии ПКЛ.
3.1 Показания к началу терапии и определение стратегии лечения
- Пациентам с первичным ПКЛ рекомендуется начало специфической противоопухолевой терапии [3 - 5, 10, 13 - 15, 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: тактика ведения пациентов моложе 65 - 70 лет и пожилых пациентов отличается. Для лечения пациентов молодого возраста без серьезной сопутствующей патологии в программу терапии рекомендуется включать высокодозную химиотерапию (ВДХТ) с трансплантацией ауто-ТГСК, ряд исследовательских групп считает целесообразным рассмотреть возможность выполнения трансплантации аллогенных стволовых клеток крови (алло-ТГСК), однако консенсус по этому вопросу не достигнут.
Пациентам старше 65 лет или молодым лицам с клинически значимыми сопутствующими заболеваниями следует рекомендовать комбинации на основе новых лекарственных препаратов без этапа ВДХТ с ауто-ТГСК или алло-ТГСК.
При выборе схемы индукционной терапии необходимо также учитывать сопутствующие заболевания пациента и осложнения ПКЛ. При наличии клинически значимой кардиальной патологии целесообразно исключить из терапии антрациклины и родственные соединения.
При наличии жизнеугрожающих состояний (клинически значимое кровотечение, некомпенсированный сахарный диабет тяжелого течения) противоопухолевая терапия проводится сразу после купирования указанных осложнений.
3.2 Лечение пациентов с впервые диагностированным ПКЛ
Рекомендации по лечению первичного плазмоклеточного лейкоза основаны на результатах:
- нескольких рандомизированных исследований, включающих немногочисленную когорту пациентов, диагноз которым был установлен на основании критериев 1974 г. или 2013 г.;
- когортных сравнительных исследований, ограничивающихся десятками случаев наблюдений, включающих как кандидатов на ауто-ТГСК, так и пациентов старшей возрастной группы с сопутсвующей патологией;
- описании эффективности противоопухолевого воздействия в отдельных клинических наблюдениях или серии случаев;
- анализа механизма действия лекарственных препаратов на опухолевую плазматическую клетку, мнении экспертного сообщества.
3.2.1 Индукционный этап терапии
- Пациентам с впервые выявленным ПКЛ в качестве индукционной терапии рекомендуется применять один из следующих режимов терапии на основе #бортезомиба** (описание режимов - см. приложение А3.1.) [28 - 32]:
#бортезомиб**/#леналидомид ** /#дексаметазон** (VRd) [19, 31, 33]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 4)
#бортезомиб**/#циклофосфамид**/#дексаметазон** (VCd) [29]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 4)
#бортезомиб**/#доксорубицин**/#дексаметазон** (PAd) [29, 34]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 4)
Комментарий: Во всех представленных схемах оптимальным является подкожное введение #бортезомиба**.
- Пациентам с впервые диагностированным ПКЛ рекомендуется проведение терапии #леналидомидом** и #дексаметазоном** (описание режимов - см. приложение А3.1.) [35]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Пациентам с впервые диагностированным ПКЛ рекомендуется проведение терапии #карфилзомибом**, #леналидомидом** и #дексаметазоном** (описание режимов - см. приложение А3.1.) [36]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Пациентам с впервые выявленным ПКЛ в качестве индукционной терапии рекомендуется применять один из следующих режимов многокомпонентной терапии, включающей как минимум два - три таргетных препарата [31, 35, 36] (описание режимов - см. приложение А3.1.):
#даратумумаб**/#циклофосфамид**/#бортезомиб**/#леналидомид**/#дексаметазон** (Dara-CVRd) [35, 37]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
#даратумумаб**/#карфилзомиб**/#леналидомид**/#дексаметазон** (Dara-KRd) [38, 39]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
#изатуксимаб**/#карфилзомиб**/#леналидомид**/#дексаметазон** (Isa-KRd) [41 - 43]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Пациентам, которым планируется выполнение ауто-ТГСК, мобилизацию гемопоэтических стволовых клеток рекомендуется проводить после 4 циклов терапии при достижении ремиссии.
- Пациентам с впервые выявленным ПКЛ в возрасте до 65 лет, а также пациентам 65 - 70 лет с хорошим соматическим статусом без тяжелых сопутствующих заболеваний рекомендуется выполнение индукционного лечения с последующей высокодозной терапией, включающей ауто-ТГСК [19, 31, 49, 50, 32, 33, 43 - 48]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: Возрастные ограничения обусловлены тем, что у пожилых пациентов возрастает риск летальности, ассоциированной с трансплантацией.
- Пациентам, имеющим по крайней мере 1 неблагоприятный фактор (возраст >= 75 лет, сопутствующие заболевания с нарушением функции органов), рекомендуется назначать лекарственные препараты с учетом наличия сопутствующих заболеваний (табл. 5) [18, 19, 51].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.2.2 Трансплантационный этап
- Пациентам с впервые выявленным ПКЛ в возрасте до 65 лет, а также пациентам 65 - 70 лет с хорошим соматическим статусом без тяжелых сопутствующих заболеваний, достигшим ПР, ОХЧР или ЧР после индукционной терапии, рекомендуется выполнение мобилизации и сбора ГСК крови под лабораторным контролем количества стволовых кроветворных клеток в периферической крови и аферезном продукте методом проточной цитометрии для последующего выполнения ауто-ТГСК [19, 31, 49, 50, 32, 33, 43 - 48].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
При наличии возможности рекомендуется собирать ауто-ГСК в количестве, достаточном для выполнения двух трансплантаций.
- Пациентам с впервые выявленным ПКЛ в возрасте до 65 лет, а также пациентам 65 - 70 лет с хорошим соматическим статусом без тяжелых сопутствующих заболеваний, достигшим ПР, ОХЧР или ЧР после индукционной терапии, в случае успешного сбора ГСК крови рекомендуется выполнение ВДХТ #мелфаланом** и последующей трансплантации ауто-ГСК [19, 31, 49, 50, 32, 33, 43 - 48].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: пациенты, достигшие ПР или ОЧХР после индукционной терапии, должны рассматриваться в качестве кандидатов на выполнение ауто-ТГСК, поскольку именно в этих случаях возможно достижение максимального эффекта от консолидации высокодозным #мелфаланом** (140 - 200 мг/м2) и увеличения выживаемости пациентов без признаков прогрессирования заболевания [19, 31, 49, 50, 32, 33, 43 - 48].
Интервал от мобилизации и сбора СКК до начала предтрансплантационного кондиционирования должен составлять от 2 до 4 нед. При выраженном нарушении функции почек (скорость клубочковой фильтрации < 30 мл/мин), не требующем проведения гемодиализа, а также пациентам старшего возраста (65 - 70 лет) целесообразно снижать дозу #мелфалана** до 140 мг/м2. Для пациентов, находящихся на программном гемодиализе, рекомендуемая доза мелфалана** составляет 140 мг/м2. Гемодиализ проводится в -4-й, -2-й (перед введением мелфалана**) и в 0-й день (перед трансфузией лейкоконцентрата) [19, 31, 49, 50, 32, 33, 43 - 48].
- Пациентам с впервые выявленным ПКЛ молодого возраста без тяжелых сопутствующих заболеваний рекомендуется рассмотреть возможность выполнения алло-ТГСК [3, 13, 14, 36, 54 - 56]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: Результаты ретроспективного исследования, включающего анализ данных 751 пациента с первичным ПКЛ за период 1998 - 2014 гг., показали, что выполнение трансплантации алло-ТГСК без предшествующей ауто-ТГСК характеризовалась высокой частотой трансплантационной смертности. При выполнении ауто-ТГСК в ПР последующая вторая ауто-ТГСК (тандемный подход) характеризовалась улучшением показателей ВБП и ОВ, что сопоставимо с результатами последовательной ауто/алло-ТГСК. При отсутствии полного ответа перед первой ауто-ТГСК целесообразно рекомендовать выполнение последовательной алло-ТГСК.
Исследователи сходятся в едином мнении, что кандидатами для алло-ТГСК могут являться пациенты молодого возраста, достигшие значимого противоопухолевого ответа после многокомпонентной терапии. Однако следует тщательно отбирать кандидатов на алло-ТГСК вследствие высокой летальности, ассоциированной с ранним посттрансплантационным периодом.
3.2.3 Этап консолидирующего лечения
- Для пациентов с ПКЛ в возрасте до 65 лет, а также пациентам 65 - 70 лет с хорошим соматическим статусом без тяжелых сопутствующих заболеваний после выполнения ВДХТ и ауто-ТГСК рекомендуется проведение консолидирующей терапии для повышения качества противоопухолевого ответа, достигнутого на предыдущих этапах лечения [34, 35, 38, 40 - 42, 56].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: консолидирующую терапию целесообразно начинать через 3 мес. после ауто-ТГСК, после получения результатов контрольного обследования, подтвердившего отсутствие прогрессии заболевания.
3.3.4 Этап поддерживающей терапии
Целесообразно проводить поддерживающее лечение всем больным ПКЛ, независимо от интеграции ауто-ТГСК в программу противоопухолевой терапии. Приоритетное внимание следует уделять возможности назначения многокомпонентной таргетной поддерживающей терапии. Однако рандомизированных исследований, демонстрирующих значимость такой рекомендации, нет.
- Для пациентов ПКЛ в возрасте до 65 лет, а также пациентам 65 - 70 лет с хорошим соматическим статусом без тяжелых сопутствующих заболеваний после выполнения ВДХТ, одной или тандемной ауто-ТГСК и консолидирующей терапии (если она проводилась), а также не кандидатам на ауто-ТГСК после завершения индукционного этапа терапии рекомендуется проведение поддерживающей терапии [32, 38, 39] [36] [37] [41 - 43]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
3.4 Лечение рецидивов ПКЛ
Рецидивы при ПКЛ неизбежно наступают у большинства пациентов. Выбор программы лечения рецидивов зависит от эффективности предшествующей терапии, длительности ремиссии, состояния и возраста пациента, сопутствующей патологии и осложнений, сопровождавших первоначальную терапию. При поздних рецидивах (спустя 12 мес. после окончания предшествующего лечения) возможно возобновление первичной терапии. При ранних рецидивах и рефрактерном ПКЛ необходима смена программы лечения с включением препаратов с другим механизмом действия. Повторную ВДХТ с ауто-ТГСК при рецидиве целесообразно проводить только в тех случаях, когда ремиссия после первой ауто-ТГСК продолжалась более 3 лет.
- Пациентам с признаками клинического рецидива, а также при быстром нарастании парапротеина (удвоение содержания M-градиента в течение 2 мес.) рекомендуется противорецидивная терапия [18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: признаками клинического рецидива являются CRAB-симптомы:
- Гиперкальциемия (содержание кальция крови > 2,75 ммоль/л)
- Почечная недостаточность, объясняемая миеломой
- Анемия (гемоглобин < 100 г/л)
- Костные поражения (литические повреждения или остеопороз с компрессионными переломами)
- Пациентам с рецидивом ПКЛ противоопухолевую терапию следует осуществлять по принципам лечения рефрактерных и рецидивирующих форм множественной миеломы (см. соответствующие клинические рекомендации) [13, 14, 47]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Лечение рецидивов первичного ПКЛ следует осуществлять исходя из эффективности предшествующей терапии, ее продолжительности, наличия нежелательных явлений. Спланированных клинических исследований по оценке эффективности протиопухолевой терапии рецидивов ПКЛ до настоящего времени не проведено. Учитывая редкость патологии и общий субстрат опухоли при ПКЛ и ММ, экспертное сообщество сходится во мнении, что лечение ПКЛ, в том числе рецидивов, должно проводиться по принципам терапии ММ высокого риска, предпочтение следует отдавать многокомпонентным схемам с интеграцией препаратов таргетной направленности.
3.5 Сопутствующая и сопроводительная терапия
Пациентам с ПКЛ сопроводительную и сопутсвующую терапию проводят согласно клиническим рекомендациям по диагностике и лечению множественной миеломы [19]
Обезболивание
- Пациентам с ПКЛ при возникновении острого или хронического болевого синдрома рекомендуется уточнение этиологии боли; при выявлении очага воспаления - проведение необходимых мероприятий по лечению очага воспаления согласно соответствующим клиническим рекомендациям (включая при необходимости хирургическое лечение); при исключении инфекционно-воспалительной природы болевого синдрома рекомендуется проведение обезболивающей терапии согласно существующим протоколам обезболивания, с учетом возможных противопоказаний, связанных с цитопенией, иными клиническими ситуациями [19, 59, 61]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Диетотерапия
Не применяется
3.7 Определение эффективности лечения
- Оценку эффекта противоопухолевой терапии у пациентов с ПКЛ рекомендуется проводить согласно международным критериям, предложенным в 2013 г. (см. раздел 7 данных рекомендаций) [58].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам с ПКЛ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация [59].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: специальных методов реабилитации при ПКЛ не существует. Реабилитация пациентов с ПКЛ должна носить комплексный характер, охватывая медицинские и социально-психологические аспекты адаптации пациента к нормальной жизни. Объем медицинской реабилитации разрабатывается индивидуально для каждого пациента врачом-реабилитологом при участии врача-гематолога и зависит от течения и проявлений заболевания (нарушения мобильности в связи с патологическими переломами, анемический синдром, болевой синдром, нарушения питания и др.) и проведенных вмешательств (ТГСК, гемодиализ). Кроме того, программа реабилитации должна учитывать социальные и психологические проблемы пациента и требует кроме медицинской помощи обязательного участия социальных работников и психологов. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Методов профилактики ПКЛ в настоящее время не существует, поскольку неизвестен этиологический(е) фактор(ы), ведущий(е) к развитию заболевания.
Пациенты с ПКЛ на протяжении всей жизни, как в период лечения, так и вне лечения ПКЛ, находятся на диспансерном наблюдении у врача-гематолога.
Контроль за течением заболевания и эффективностью терапии должен выполняться регулярно врачом-гематологом или врачом-онкологом по месту жительства пациента. В процессе проводимой терапии иммунохимическое исследование белков сыворотки крови и мочи следует выполнять каждые 2 - 3 мес. У пациентов олиго- или несекретирующей формой заболевания следует проводить исследование свободных легких цепей иммуноглобулинов. После окончания лечения иммунохимические исследования крови и мочи выполняют каждые 3 мес.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "гематология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ПКЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь пациентам с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении ПКЛ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь пациентам с ПКЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ПКЛ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости - с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "гематология", определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
Наличие диагноза ПКЛ для выполнения:
1. планового курса специфической терапии, включающей химиотерапевтические препараты, таргетные препараты биологического механизма действия, требующей круглосуточного наблюдения за пациентом (в том числе при наличии тяжелой коморбидности, цитопенического синдрома),
2. курса высокодозной химиотерапии,
3. мобилизации и сбора аутологичных стволовых гемопоэтических клеток крови,
4. трансплантации аутологичных (аллогенных) стволовых гемопоэтических клеток,
5. эксфузии аутологичного костного мозга для последующей трансплантации.
Показания для экстренной госпитализации:
Наличие диагноза ПКЛ, осложненного:
1. острым почечным повреждением,
2. тяжелым оссалгическим синдромом (в том числе с угрозой переломов, повреждения позвоночника, сдавления спинного мозга),
3. тромботическими/геморрагическими осложнениями на фоне специфической терапии,
4. тяжелыми инфекционными осложнениями на фоне специфической терапии,
5. кардиальной патологией на фоне специфической терапии,
6. глубокой цитопенией.
Показания к выписке пациента из стационара:
1. Завершение курса специфической терапии.
2. Купирование осложнений, возникших на фоне специфической терапии
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Оценка эффективности лечения плазмоклеточного лейкоза
Оценка эффективности лечения ПКЛ проводится согласно международным критериям, предложенным в 2013 г. (представлены в таблице 6) [58].
При оценке любое исследование нужно провести не менее 2 раз для подтверждения результатов.
Таблица 6. Критерии противоопухолевого ответа и рецидива при плазмоклеточном лейкозе согласно консенсусу IMWG 2013 г.
Категория ответа
Доля ПК в костном мозге <1>
Доля ПК в периферической крови <1>
Моноклональная секреция парапротеина <2>
Иные данные
Строгий полный ответ/ремиссия (сПо/сПР)
ПК в костном мозге < 5% и отсутствуют аберрантные ПК по данным проточной цитометрии
Отсутствие ПК в периферической крови по данным проточной цитометрии
Отсутствие парапротеина в сыворотке и моче по данным иммунофиксации и нормальное соотношение СЛЦ в сыворотке
Отсутствие экстрамедуллярного компонента
Полный ответ/ремиссия (ПО/ПР)
ПК в костном мозге < 5%
Отсутствие ПК в периферической крови
Отсутствие парапротеина в сыворотке и моче по данным иммунофиксации <3>
Отсутствие экстрамедуллярного компонента
Очень хороший частичный ответ/ремиссия (ОХЧО/ОХЧР)
ПК в костном мозге < 5%
Отсутствие ПК в периферической крови
Снижение уровня M-белка в сыворотке крови на >= 90% и
M-белок в моче в < 100 мг/сутки <4>
Отсутствие экстрамедуллярного компонента
Частичный ответ/ремиссия (ЧР/ЧО)
ПК в костном мозге - от 5 до 25%
ПК в периферической крови от 1 - 5%
Снижение концентрации M-белка в сыворотке крови на >= 50% и
снижение суточного содержания M-белка в моче на >= 90% и < 200 мг/сутки <5>
>= 50% уменьшение размера экстрамедуллярного компонента
Стабилизация
Несоответствие критериям ответа или прогрессии
Прогрессия
Увеличение доли ПК в аспирате костного мозга > 25% или абсолютное увеличение >= 10%
Абсолютное увеличение доли ПК в периферической крови > 5%
Повышение содержания M-белка в сыворотке > 25% при абсолютном повышении >= 5 г/л,
увеличение экскреции парапротеина > 25% с абсолютным увеличением >= 200 мг/сутки
Гиперкальциемия
Увеличение литических поражений костей.
Увеличение размера или количества экстрамедуллярных компонентов.
Рецидив после полной ремисси
Увеличение доли ПК в костном мозге более чем на 10%.
Повторное появление ПК в периферической крови в любом количестве
Повторное появление M-белка в сыворотке и/или моче.
Появление новых очагов деструкции и/или экстрамедуллярных компонентов
Сокращения: ПК - плазматические клетки, СЛЦ - свободная легкая цепь.
<1> - рекомендуется провести анализ не менее 200 лейкоцитов в мазках периферической крови и 500 ядросодержащих клеток в мазках костного мозга.
<2> - продолжительность сохранения ответа не менее 6 недель, в случае несоответствия или неопределяемости серологического показателя - необходимо определять ответ по остальным критериям.
<3> - если содержание M-белка в сыворотке и моче не поддается измерению, учитывается нормализация соотношения каппа/лямбда СЛЦ в сыворотке.
<4> - если M-белок в сыворотке и моче не поддается измерению, вместо M-белка требуется уменьшение разницы между вовлеченными и невлеченными СЛЦ на 90%.
<5> - если M-белок в сыворотке и моче не поддается измерению, вместо m-белка требуется уменьшение разницы между вовлеченными и невовлеченными СЛЦ на >= 50%.
Оценка эффекта по уровню моноклонального белка в сыворотке крови и моче применима для пациентов с "измеряемой" болезнью. Заболевание считают "измеряемым" при концентрации M-протеина в сыворотке >= 10 г/л или в суточной моче >= 200 г. При отсутствии моноклонального белка в сыворотке крови и моче по данным электрофореза и иммунофиксации (несекретирующей миеломе), но при его выявлении, "измеряемым" считают уровень "вовлеченных" СЛЦ иммуноглобулинов >= 100 мг/л. Соотношение ![]() СЛЦ иммуноглобулинов также должно быть аномальным.
СЛЦ иммуноглобулинов также должно быть аномальным.
Нормальное соотношение ![]() СЛЦ иммуноглобулинов составляет 0,26 - 1,65. У пациентов с почечной недостаточностью нормальным соотношением
СЛЦ иммуноглобулинов составляет 0,26 - 1,65. У пациентов с почечной недостаточностью нормальным соотношением ![]() СЛЦ иммуноглобулинов считается 0,37 - 3,1.
СЛЦ иммуноглобулинов считается 0,37 - 3,1.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Пациенту с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания выполнен общий (клинический) анализ крови развернутый с определением уровней гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы
да/нет
2
Пациенту с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания выполнен общий (клинический) анализ мочи
да/нет
3
Пациенту с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания выполнен анализ крови биохимический общетерапевтический с определением показателей ЛДГ, мочевины, креатинина, общего белка, альбумина, билирубина, аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, кальция, калия
да/нет
4
Пациенту с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания выполнено определение соотношения белковых фракций в крови и моче методом электрофореза с количественным определением моноклонального и поликлональных иммуноглобулинов (кроме пациентов с несекретирующей, вялотекущей миеломой и миеломой легких цепей)
да/нет
5
Пациенту с подозрением на ПКЛ или выявленном ПКЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив заболевания выполнено исследование моноклональности иммуноглобулинов в крови и моче методом иммунофиксации с количественным определением уровня M-градиента
да/нет
6
Пациенту с подозрением на ПКЛ или выявленном ПКЛ при первичном приеме, выполнено цитологическое исследование костного мозга или патологоанатомическое исследование биопсийного (операционного) материала костного мозга (при необходимости с применением иммуногистохимических методов) для подтверждения и формулирования диагноза
Оценка выполнения
7
Пациенту с подозрением на ПКЛ или выявленном ПКЛ перед началом терапии, при оценке эффекта терапии, а также при подозрении на рецидив заболевания выполнена КТ всех отделов позвоночника, грудной клетки, таза (низкодозная КТ всего скелета или ПЭТ/КТ)
да/нет
8
Пациенту с ПКЛ начато проведение специфической противопухолевой терапии
да/нет
9
Пациенту с признаками клинического рецидива, а также при быстром нарастании парапротеина (удвоение содержания M-градиента в течение 2 мес.) начато проведение противорецидивной терапии
да/нет
10
Пациенту, завершившему запланированное лечение по поводу ПКЛ, выполнена оценка эффекта лечения согласно международным критериям, предложенным в 2013 г.
да/нет
Список литературы
1. Alaggio R. et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms//Leuk. 2022 367. Nature Publishing Group, 2022. Vol. 36, N 7. P. 1720 - 1748.
2.  de Larrea C. et al. Primary plasma cell leukemia: consensus definition by the International Myeloma Working Group according to peripheral blood plasma cell percentage//Blood Cancer J. Nature Publishing Group, 2021. Vol. 11, N 12.
de Larrea C. et al. Primary plasma cell leukemia: consensus definition by the International Myeloma Working Group according to peripheral blood plasma cell percentage//Blood Cancer J. Nature Publishing Group, 2021. Vol. 11, N 12.
3. Jung S.-H., Lee J.-J. Update on primary plasma cell leukemia. 2022.
4. Tveden Gundesen M. et al. Plasma Cell Leukemia: Definition, Presentation, and Treatment. 1912.
5. Van De Donk N.W.C.J. et al. How I treat plasma cell leukemia. 2012.
6. Durie B.G.M., Salmon S.E. A clinical staging system for multiple myeloma correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival//Cancer. 1975. Vol. 36, N 3. P. 842 - 854.
7. Greipp P.R. et al. International staging system for multiple myeloma//J. Clin. Oncol. 2005. Vol. 23, N 15. P. 3412 - 3420.
8. Palumbo A. et al. Revised international staging system for multiple myeloma: A report from international myeloma working group//J. Clin. Oncol. 2015.
9. D'agostino M. et al. Second Revision of the International Staging System (R2-ISS) for Overall Survival in Multiple Myeloma: A European Myeloma Network (EMN) Report Within the HARMONY Project//J. Clin. Oncol. Lippincott Williams and Wilkins, 2022. Vol. 364.
10. Papadhimitriou S.I. et al. The Cytogenetic Profile of Primary and Secondary Plasma Cell Leukemia: Etiopathogenetic Perspectives, Prognostic Impact and Clinical Relevance to Newly Diagnosed Multiple Myeloma with Differential Circulating Clonal Plasma Cells//Biomedicines. Biomedicines, 2022. Vol. 10, N 2.
11. Бессмельцев С.С. Множественная миелома//Вестник гематологии. 2014. Vol. 10, N 3. P. 6 - 39.
12. Rajkumar S.V. et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma//Lancet Oncol. Elsevier Ltd, 2014. Vol. 15, N 12. P. e538 - e548.
13. Musto P. et al. An update on biology, diagnosis and treatment of primary plasma cell leukemia//Expert Rev. Hematol. Taylor & Francis, 2019. Vol. 12, N 4. P. 245 - 253.
14. Visram A. et al. Practical management and assessment of primary plasma cell leukemia in the novel agent era//Cancer Treat. Res. Commun. Elsevier, 2021. Vol. 28. P. 100414.
15. Chaulagain C.P. et al. Management of Primary Plasma Cell Leukemia Remains Challenging Even in the Era of Novel Agents//Clin. Med. Insights Blood Disord. SAGE Publications, 2021. Vol. 14.
16. Kyle R.A., Rajkumar S. V. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma.//Leukemia. 2009. Vol. 23, N 1. P. 3 - 9.
17. Moreau P. et al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up//Ann. Oncol. 2017. Vol. 28, N suppl_4. P. iv52 - iv61.
18. Менделеева Л.П., Вотякова О.М., Рехтина И.Г. Множественная миелома. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний./ed. Поддубной И.В., Савченко В.Г. Москва, 2018. 213 - 241 p.
19. Gavriatopoulou M. et al. European myeloma network recommendations on diagnosis and management of patients with rare plasma cell dyscrasias//Leukemia. 2018. Vol. 32. P. 1883 - 1898.
20. Coppola A. et al. Bleeding and thrombosis in multiple myeloma and related plasma cell disorders.//Semin. Thromb. Hemost. 2011. Vol. 37, N 8. P. 929 - 945.
21. Tripathy S. The role of serum protein electrophoresis in the detection of multiple myeloma: An experience of a corporate hospital//J. Clin. Diagnostic Res. 2012. Vol. 6, N 9. P. 1458 - 1461.
22. Misra A. et al. Old but Still Relevant: High Resolution Electrophoresis and Immunofixation in Multiple Myeloma//Indian Journal of Hematology and Blood Transfusion. Springer India, 2016. Vol. 32, N 1. P. 10 - 17.
23. Любимова Н.В. et al. Свободные легкие цепи иммуноглобулинов в диагностике и прогнозе множественной миеломы.//Альманах клинической медицины. 2017. Vol. 45, N 2. P. 102 - 108.
24. Julie D. et al. Comparison of Bone marrow Aspirate and Bone marrow Biopsy in the workup of Patients with Multiple Myeloma//Clin. Lymphoma Myeloma Leuk. Elsevier BV, 2015. Vol. 15. P. e117.
25. van de Donk N.W.C.J. et al. How I treat plasma cell leukemia//Blood. 2012. Vol. 120, N 12. P. 2376 - 2389.
26. Pianko M.J. et al. Whole-body low-dose computed tomography and advanced imaging techniques for multiple myeloma bone disease//Clinical Cancer Research. American Association for Cancer Research Inc., 2014. Vol. 20, N 23. P. 5888 - 5897.
27. Cavo M. et al. Role of 18F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a consensus statement by the International Myeloma Working Group.//Lancet. Oncol. 2017. Vol. 18, N 4. P. e206 - e217.
28. Katodritou E. et al. Treatment with bortezomib-based regimens improves overall response and predicts for survival in patients with primary or secondary plasma cell leukemia: Analysis of the Greek myeloma study group//Am. J. Hematol. Am J Hematol, 2014. Vol. 89, N 2. P. 145 - 150.
29. Royer B. et al. Bortezomib, Doxorubicin, Cyclophosphamide, Dexamethasone Induction Followed by Stem Cell Transplantation for Primary Plasma Cell Leukemia: A Prospective Phase II Study of the Intergroupe Francophone du  //J. Clin. Oncol. J Clin Oncol, 2016. Vol. 34, N 18. P. 2125 - 2132.
//J. Clin. Oncol. J Clin Oncol, 2016. Vol. 34, N 18. P. 2125 - 2132.
30. D'Arena G. et al. Frontline chemotherapy with bortezomib-containing combinations improves response rate and survival in primary plasma cell leukemia: a retrospective study from GIMEMA Multiple Myeloma Working Party//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. Ann Oncol, 2012. Vol. 23, N 6. P. 1499 - 1502.
31. Katodritou E. et al. Improved survival of patients with primary plasma cell leukemia with VRd or daratumumab-based quadruplets: A multicenter study by the Greek myeloma study group//Am. J. Hematol. John Wiley and Sons Inc, 2023. Vol. 98, N 5. P. 730 - 738.
32. Royer B. et al. Long Term Follow-up of Hematopoietic Stem Cell Transplantation (HSCT) for Primary Plasma Cell Leukemia (pPCL): Final Results of a Prospective Study of IFM Group//Blood. American Society of Hematology, 2016. Vol. 128, N 22. P. 4612 - 4612.
33. Usmani S.Z. et al. Bortezomib, lenalidomide, and dexamethasone with or without elotuzumab in patients with untreated, high-risk multiple myeloma (SWOG-1211): primary analysis of a randomised, phase 2 trial//Lancet. Haematol. NIH Public Access, 2021. Vol. 8, N 1. P. e45.
34. Telek B. et al. Effective PAD (bortezomib, doxorubicine, dexamethasone) treatment of a patient with plasma cell leukaemia developed after autologous stem cell transplantation//Orv. Hetil. 
![]() , 2008. Vol. 149, N 41. P. 1957 - 1959.
, 2008. Vol. 149, N 41. P. 1957 - 1959.
35. Musto P. et al. Lenalidomide and low-dose dexamethasone for newly diagnosed primary plasma cell leukemia//Leuk. 2014 281. Nature Publishing Group, 2013. Vol. 28, N 1. P. 222 - 225.
36. van de Donk N.W.C.J. et al. Treatment of primary plasma cell leukaemia with carfilzomib and lenalidomide-based therapy (EMN12/HOVON-129): final analysis of a non-randomised, multicentre, phase 2 study//Lancet Oncol. Elsevier Ltd, 2023. Vol. 24, N 10. P. 1119 - 1133.
37. Kaiser M.F. et al. Daratumumab, Cyclophosphamide, Bortezomib, Lenalidomide, and Dexamethasone as Induction and Extended Consolidation Improves Outcome in Ultra-High-Risk Multiple Myeloma//J. Clin. Oncol. Lippincott Williams and Wilkins, 2023. Vol. 41, N 23. P. 3945 - 3955.
38. Lawless S. et al. Comparison of autologous and allogeneic hematopoietic cell transplantation strategies in patients with primary plasma cell leukemia, with dynamic prediction modeling//Haematologica. Ferrata Storti Foundation, 2023. Vol. 108, N 4. P. 1105 - 1114.
39. Costa L.J. et al. Minimal residual disease response-adapted therapy in newly diagnosed multiple myeloma (MASTER): final report of the multicentre, single-arm, phase 2 trial//Lancet Haematol. Elsevier, 2023. Vol. 10, N 11. P. e890 - e901.
40. Derman B.A. et al. Final analysis of a phase II trial of daratumumab, carfilzomib, lenalidomide, and dexamethasone in newly diagnosed multiple myeloma without transplant//Blood Cancer J. Nature Publishing Group, 2024. Vol. 14, N 1.
41. Leypoldt L.B. et al. Isatuximab, carfilzomib, lenalidomide, and dexamethasone (Isa-KRd) in front-line treatment of high-risk multiple myeloma: interim analysis of the GMMG-CONCEPT trial//Leukemia. Leukemia, 2022. Vol. 36, N 3. P. 885 - 888.
42. Leypoldt L.B. et al. Isatuximab, Carfilzomib, Lenalidomide, and Dexamethasone for the Treatment of High-Risk Newly Diagnosed Multiple Myeloma//J. Clin. Oncol. J Clin Oncol, 2024. Vol. 42, N 1. P. 26 - 37.
43. O'Donnell E. et al. Isatuximab, carfilzomib, lenalidomide, and dexamethasone in patients with newly diagnosed, transplantation-eligible multiple myeloma (SKylaRk): a single-arm, phase 2 trial//Lancet. Haematol. Lancet Haematol, 2024. Vol. 11, N 6. P. e415 - e424.
44. Mahindra A. et al. Hematopoietic Cell Transplantation for Primary Plasma Cell Leukemia: Results from the Center for International Blood and Marrow Transplant Research//Leukemia. NIH Public Access, 2012. Vol. 26, N 5. P. 1091.
45. Dhakal B. et al. Hematopoietic Cell Transplantation Utilization and Outcomes for Primary Plasma Cell Leukemia in the Current Era//Leukemia. NIH Public Access, 2020. Vol. 34, N 12. P. 3338.
46. Gowda L. et al. Primary Plasma Cell Leukemia: Autologous Stem Cell Transplant in an Era of Novel Induction Drugs//Bone Marrow Transplant. NIH Public Access, 2019. Vol. 54, N 7. P. 1089.
47. Lemieux C. et al. Outcomes with Autologous or Allogeneic Stem Cell Transplantation in Patients with Plasma Cell Leukemia in the Era of Novel Agents//Biol. Blood Marrow Transplant. NIH Public Access, 2020. Vol. 26, N 12. P. e328.
48. Mahindra A. et al. Hematopoietic Cell Transplantation for Primary Plasma Cell Leukemia: Results from the Center for International Blood and Marrow Transplant Research HHS Public Access//Leukemia. 2012. Vol. 26, N 5. P. 1091 - 1097.
49. Dhakal B. et al. Hematopoietic Cell Transplantation Utilization and Outcomes for Primary Plasma Cell Leukemia in the Current Era HHS Public Access//Leukemia. 2020. Vol. 34, N 12. P. 3338 - 3347.
50. Tveden Gundesen M. et al. Plasma Cell Leukemia: Definition, Presentation, and Treatment. 1912.
51. Drake M. et al. Primary plasma cell leukemia and autologous stem cell transplantation on behalf of the European Group for Blood and Marrow Transplantation and the European Leukemia Net//Haematologica. 2010. Vol. 95. P. 804 - 809.
52. Larocca A. et al. Patient-centered practice in elderly myeloma patients: an overview and consensus from the European Myeloma Network (EMN)//Leukemia. 2018. Vol. 32. P. 1697 - 1712.
53. Dampmann M. et al. Single-Center Experience of Patients with Plasma Cell Leukemia in the Era of New Therapeutics//Acta Haematol. S. Karger AG, 2024. P. 1 - 8.
54. Nakaya A. et al. Retrospective analysis of primary plasma cell leukemia in Kansai Myeloma Forum registry//Leuk. Res. Reports. Elsevier, 2018. Vol. 10. P. 7.
55. Tang A.S.O. et al. Plasma Cell Leukemia with Successful Upfront Venetoclax in Combination with Allogeneic Transplantation//Am. J. Case Rep. International Scientific Information, Inc., 2023. Vol. 24. P. e938868 - 1.
56. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
57. Соловьев М.В., Соловьева М.В., Менделеева Л.П. Сопроводительная терапия при множественной миеломе: практические рекомендации//Клиническая онкогематология. 2023. Vol. 16, N 4. P. 426 - 448.
58.  De Larrea C. et al. Plasma cell leukemia: consensus statement on diagnostic requirements, response criteria and treatment recommendations by the International Myeloma Working Group//Leukemia. Leukemia, 2013. Vol. 27, N 4. P. 780 - 791.
De Larrea C. et al. Plasma cell leukemia: consensus statement on diagnostic requirements, response criteria and treatment recommendations by the International Myeloma Working Group//Leukemia. Leukemia, 2013. Vol. 27, N 4. P. 780 - 791.
59. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
60. Attal M. et al. Lenalidomide, Bortezomib, and Dexamethasone with Transplantation for Myeloma//N. Engl. J. Med. New England Journal of Medicine (NEJM/MMS), 2017. Vol. 376, N 14. P. 1311 - 1320.
61.  L. et al. Bortezomib, lenalidomide, and dexamethasone as induction therapy prior to autologous transplant in multiple myeloma//Blood. American Society of Hematology, 2019. Vol. 134, N 16. P. 1337 - 1345.
L. et al. Bortezomib, lenalidomide, and dexamethasone as induction therapy prior to autologous transplant in multiple myeloma//Blood. American Society of Hematology, 2019. Vol. 134, N 16. P. 1337 - 1345.
62. Leiba M. et al. Bortezomib-Cyclophosphamide-Dexamethasone (VCD) versus Bortezomib-Thalidomide-Dexamethasone (VTD) - based regimens as induction therapies in newly diagnosed transplant eligible patients with multiple myeloma: A meta-analysis//Br. J. Haematol. Blackwell Publishing Ltd, 2014. Vol. 166, N 5. P. 702 - 710.
63. Popat R. et al. Bortezomib, doxorubicin and dexamethasone (PAD) front-line treatment of multiple myeloma: updated results after long-term follow-up//Br. J. Haematol. John Wiley & Sons, Ltd, 2008. Vol. 141, N 4. P. 512 - 516.
64. Nooka A.K. et al. Bortezomib-containing induction regimens in transplant-eligible myeloma patients//Cancer. 2013. Vol. 119, N 23. P. 4119 - 4128.
65. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Менделеева Лариса Павловна - д.м.н., профессор, руководитель управления по научной и образовательной работе, зав. отделом химиотерапии парапротеинемических гемобластозов ФГБУ "НМИЦ гематологии" Минздрава России, член Наблюдательного совета Ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество, член Российского профессионального общества онкогематологов.
2. Соловьев Максим Валерьевич - к.м.н., заведующий отделением гематологии и химиотерапии химиотерапии парапротеинемических гемобластозов с блоком трансплантации костного мозга и гемопоэтических стволовых клеток, старший научный сотрудник, ФГБУ "НМИЦ гематологии" Минздрава России, член Ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
3. Рехтина Ирина Германовна - д.м.н., зав. отделением химиотерапии плазмоклеточных дискразий ФГБУ "НМИЦ гематологии" Минздрава России, член Ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество", член Ассоциации нефрологов.
4. Соловьева Майя Валерьевна - к.м.н., старший научный сотрудник отдела химиотерапии парапротеинемических гемобластозов ФГБУ "НМИЦ гематологии" Минздрава России, член Ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
5. Семочкин Сергей Вячеславович - д.м.н., г.н.с. отделения высокодозной химиотерапии с блоком трансплантации костного мозга МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, профессор кафедры онкологии, гематологии и лучевой терапии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член член Ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество", Российского общества онкогематологов и European Association for Cancer Research (EACR).
6. Поддубная Ирина Владимировна - академик РАН, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского профессионального общества онкогематологов.
7. Поспелова Татьяна Ивановна - д.м.н., профессор, проректор по научной работе, заведующая кафедрой терапии, гематологии и трансфузиологии ФГБОУ ВО Новосибирский государственный медицинский университет Минздрава России, член Ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество", председатель МОО "Ассоциация врачей-гематологов Сибири".
8. Ковригина Алла Михайловна - д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением "НМИЦ гематологии" Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов, член Ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- Врачи-гематологи.
- Врачи-онкологи.
- Студенты медицинских вузов.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0,3;
Поиск в электронных базах данных
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составила 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных метаанализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А2.1. - А2.3.).
В настоящих клинических рекомендациях приведены уровни доказательности рекомендаций в соответствии с проектом методических рекомендаций по оценке достоверности доказательств и убедительности рекомендаций ФГБУ "Центр экспертизы и контроля качества медицинской помощи" Минздрава России.
В соответствии с данным проектом рекомендаций отдельным общепринятым методикам диагностики на основании консенсуса экспертов придан уровень GPP (сложившаяся клиническая практика).
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2.2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования случай-контроль
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание методики валидизации рекомендаций
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров России и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2024 г., ежегодной Российской конференции с международным участием "Злокачественные лимфомы 2024", а также в рамках Конгресса гематологов России.
Порядок обновления клинических рекомендаций
Актуализация проводится не реже чем один раз в два года или ранее с учетом появившейся новой информации о диагностике и тактике ведения пациентов, страдающих ПКЛ. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
СХЕМЫ
ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ ПЕРВИЧНОГО ПЛАЗМОКЛЕТОЧНОГО ЛЕЙКОЗА
VRD [19, 31, 33]
- #Бортезомиб** 1,3 мг/м2 п/к в 1, 4, 8 и 11-й дни.
- #Леналидомид** 25 мг внутрь, с 1 по 14 день.
- #Дексаметазон** 20 мг в дни 1, 2, 4, 5, 8, 9, 11 и 12 каждого цикла.
Лечение возобновляется на 22-й день.
VCD [29] #Бортезомиб** 1,3 мг/м2 п/к или в/в, дни 1, 4, 8, 11-й
- #Циклофосфамид** 300 мг/м2, в/в капельно, дни 1, 8-й
- #Дексаметазон** 40 мг в/в капельно или внутрь, дни 1, 4, 8, 11-й. Лечение возобновляется на 22-й день.
PAD [29, 34]
- #Бортезомиб** 1,3 мг/м2 п/к или в/в, дни 1, 4, 8, 11-й
- #Доксорубицин пегилированный** 30 мг/м2 в день 4
- #Дексаметазон** 40 мг в/в капельно или внутрь, дни 1, 4, 8, 11-й Лечение возобновляется на 22-й день.
Dara-CVRd [35, 37]
- #Даратумумаб** 16 мг/кг в/в в дни 1,8,15 первые 2 курса, затем в 1-й день с 3 по 6-й курс.
- #Циклофосфамид** 500 мг, внутрь дни 1, 8.
- #Бортезомиб** 1,3 мг/м2 п/к в 1, 4, 8 и 11-й дни.
- #Леналидомид** 25 мг внутрь, с 1 по 14 день.
- #Дексаметазон** 40 мг в дни 1, 4, 8, 11.
Лечение возобновляется на 22-й день.
Rd [35]
- #Леналидомид** 25 мг внутрь, дни 1 - 21-й
- #Дексаметазон** 40 мг внутрь, дни 1, 8, 15, 22-й
Лечение возобновляется на 29-й день.
KRd [36]
- #Карфилзомиб** 36 мг/м2 в/в, дни 1, 2, 8, 9, 15, 16.
- #Леналидомид** 25 мг внутрь, дни 1 - 21-й
- #Дексаметазон** 20 мг внутрь, дни 1, 2, 8, 9, 15, 16, 22, 23
Лечение возобновляется на 29-й день.
Dara-KRd [39, 40]
- #Даратумумаб** 16 мг/кг в/в
- 1 раз в неделю курс в 1-ый и 2-ой курс
- 1 раз в 2 недели с 3-го по 8-ой курс
- 1 раз в 4 недели с 9-го по 24-й курс
- #Карфилзомиб** 20 мг/м2 в/в, дни 1, 2-й, далее в дозе 36 мг/м2, дни 8, 9, 15, 16-й только в 1-м курсе, в дозе 36 мг/м2 в дни 1, 2, 8, 9, 15, 16-й в курсах 2 - 8, начиная с 9-го до 24-го курса в дозе 36 мг/м2 в дни 1, 2, 15 и 16.
- #Леналидомид** 25 мг внутрь, дни 1 - 21-й, суммарно 24 курса.
- #Дексаметазон** 40 мг внутрь, дни 1, 8, 15, 22 в курсах с 1 по 8, затем 20 мг в те же дни в курсах 9 - 24.
Лечение возобновляется на 29-й день.
Isa-KRd [41 - 43]
- #Изатуксимаб** 10 мг/кг в/в
- в 1, 8, 15, 22 дни 1-го курса
- в 1 и 15 дни последующих курсов
- 1 вариант введения #Карфилзомиба** 20 мг/м2 в/в, дни 1, 2-й, далее в дозе 36 мг/м2, дни 8, 9, 15, 16-й только в 1-м курсе, в дозе 36 мг/м2 в дни 1, 2, 8, 9, 15, 16-й в последующих курсах
- 2 вариант введения #Карфилзомиба** 20 мг/м2 в/в, день 1, далее в дозе 56 мг/м2 в дни 8, 15 только в 1-м курсе, в дозе 56 мг/м2 в дни 1, 8, 15 в последующих курсах.
- #Леналидомид** 25 мг внутрь, дни 1 - 21-й.
- #Дексаметазон** 40 мг внутрь или в/в, дни 1, 8, 15, 22
Лечение возобновляется на 29-й день.
Приложение А3.2
РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ПКЛ В ПЕРИОД БЕРЕМЕННОСТИ
Учитывая ограниченные данные по ведению беременности при манифестации ПКЛ, решение о сроках начала и схеме лечения определяется индивидуально с привлечением междисциплинарной команды и проведением телемедицинской консультации со специалистами федеральных медицинских учреждений. В случае диагностирования ПКЛ в первом триместре (до 12 недель) беременности целесообразно рассмотреть возможность ее прерывания.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
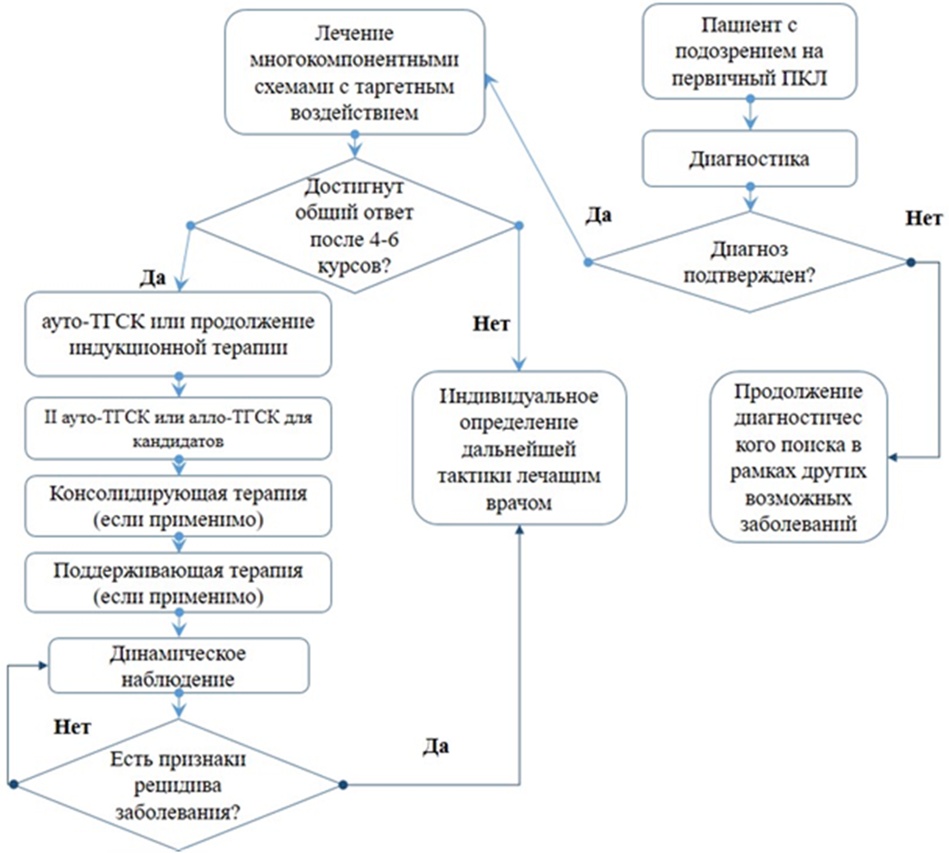
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
ПКЛ - заболевание опухолевой природы и в настоящее время является неизлечимым. Однако современные инновационные лекарственные препараты и трансплантационные методики позволяют достичь значимого противоопухолевого эффекта - так называемой ремиссии.
Ремиссия - это состояние, при котором минимизирована опухолевая масса, купированы основные клинические проявления заболевания (костные боли, почечная недостаточность, инфекционные осложнения). Современные лечебные мероприятия, включающие препараты биологического механизма действия, традиционные химиотерапевтические препараты обеспечивают контроль за опухолевым процессом, сохраняя качество жизни пациентов.
Лечение ПКЛ длительное. Первичная терапия в большинстве случаев проводится в стационарных условиях. По мере купирования клинических симптомов продолжение лечения возможно в условиях дневных стационаров или амбулаторно-поликлинических и даже домашних условиях.
Однако хорошо известно, что лекарственные препараты обладают побочными эффектами. В связи с этим пациенты должны сразу сообщать лечащему врачу обо всех нежелательных явлениях, возникающих на фоне лечения.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1.1
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ECOG
Клиническая оценка общего состояния пациента с ПКЛ проводится по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) [65]:
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 65 [65]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Пациент мертв
