"Клинические рекомендации "Рак яичников/рак маточной трубы/первичный рак брюшины"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК ЯИЧНИКОВ/РАК МАТОЧНОЙ ТРУБЫ/ПЕРВИЧНЫЙ РАК БРЮШИНЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C48, C56, C57, D39.1, D39.7, D39.9
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 547
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Общероссийская общественная организация "Российское общество клинической онкологии"
- Общероссийская общественная организация "Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АФП - альфа-фетопротеин
БДУ - без дополнительных уточнений
в/в - внутривенно(ый)
ВОЗ - Всемирная организация здравоохранения
ЖКТ - желудочно-кишечный тракт
ЗНО - злокачественные новообразования
ИГХ - иммуногистохимия
КТ - компьютерная томография
ЛТ - лучевая терапия (радиотерапия)
МКБ-10 - Международная классификация болезней 10-го пересмотра
МРТ - магнитно-резонансная томография
ПЭТ - позитронно-эмиссионная томография
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией с туморотропным радиофармпрепаратом
РЭА - раковый эмбриональный антиген
РЯ - рак яичников
УЗИ - ультразвуковое исследование
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
ХТ - химиотерапия
ЭГДС - эзофагогастродуоденоскопия
ЭКГ - электрокардиография
CA19.9 - опухолевый антиген 19.9
CA125 - опухолевый антиген 125
CTCAE - Common Terminology Criteria for Adverse Events (шкала оценки выраженности нежелательных явлений)
ECOG - Eastern Cooperative Oncology Group (Восточная объединенная группа онкологов)
HE4 - человеческий эпидермальный протеин 4
HRD - homologous recombination deficiency (дефицит гомологичной рекомбинации)
MSI - microsatellite instability (микросателлитная нестабильность)
PARP - поли(АДФ-рибоза)полимераза
PCI - Peritoneal cancer index (индекс перитонеального канцероматоза)
RECIST - Response Evaluation Criteria In Solid Tumors (критерии оценки эффекта при солидных опухолях)
ROMA - Risk of Ovarian Malignancy Algorithm (индекс расчета риска наличия злокачественной опухоли яичника)
TRG - Tumor Regression Grade (шкала оценки регресса опухоли)
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (off-label, офф-лейбл)
Термины и определения
Адъювантная химиотерапия - вид химиотерапии, проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
Неоадъювантная химиотерапия - вид химиотерапии, проводимый непосредственно перед хирургическим удалением первичной опухоли для улучшения результатов операции/лучевой терапии и для предотвращения образования метастазов.
Неоптимальная циторедуктивная операция - экстирпации матки с придатками, удаление большого сальника, проявлений опухолевого процесса с макроскопически определяемыми остаточными узлами, из которых хотя бы один более 10 мм в диаметре.
Оптимальная циторедуктивная операция - выполнение экстирпации матки с придатками, удаление большого сальника, а также видимых проявлений опухолевого процесса с макроскопически определяемыми остаточными опухолевыми узлами, каждый из которых имеет диаметр не более 10 мм.
Полная циторедуктивная операция - выполнение экстирпации матки с придатками, удаление большого сальника, а также всех видимых проявлений опухолевого процесса без макроскопически определяемых остаточных опухолевых масс.
Пререабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания;
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в т.ч. в условиях санаторно-курортных организаций).
Таргетная терапия - вид противоопухолевой терапии, которая блокирует рост раковых клеток с помощью вмешательства в механизм действия конкретных целевых (таргетных) молекул, необходимых для канцерогенеза и роста опухоли.
Уровни достоверности доказательств - отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам достоверность доказательств определяется по 3 основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций - в отличие от уровней достоверности доказательств отражают степень уверенности не только в достоверности эффекта вмешательства, но и в том, что следование рекомендациям принесет в конкретной ситуации больше пользы, чем негативных последствий.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Рак яичников, маточной трубы и первичный рак брюшины - группа злокачественных опухолей, исходящая из эпителия соответствующих органов. Клиническое течение и методы лечения первичного рака брюшины и маточных труб практически аналогичны раку яичников, поэтому нозологии рассматриваются в данных рекомендациях вместе. Далее по тексту будет использоваться термин "рак яичников" (РЯ).
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
У 10% пациенток с диагнозом РЯ развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространенный синдром наследования рака молочной железы и РЯ связан с мутациями генов BRCA [1]. У большинства пациенток РЯ имеет спорадический характер. В качестве факторов риска развития данной патологии рассматриваются: отсутствие беременностей, курение, избыточная масса тела, частое использование препаратов от бесплодия (исследования не дают четкого суждения по этому фактору риска), использование гормональной заместительной терапии, содержащей только эстрогены, в течение не менее чем 10 лет (исследования не дают четкого суждения по этому фактору риска) [2].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В структуре онкологических заболеваний среди женского населения России РЯ занимает 9-е место, что соответствовало 4,2% в 2021 году. "Грубый" показатель заболеваемости РЯ в России в 2021 году составил 17,05 на 100 тысяч женского населения, что в абсолютном выражении составило 13315 новых случаев заболевания. Средний возраст женщин на момент установления диагноза - 59,1 года. Стандартизированный по возрасту показатель заболеваемости РЯ составил 10,46 случаев на 100 тысяч женского населения. Прирост показателя заболеваемости РЯ за предшествующие 10 лет (с 2011 года) составил -1,85% [3].
В 2021 году в России от РЯ умерли 7213 женщин. В структуре причин онкологической смертности среди женщин РЯ в России занимает 7-е место (5,6%). "Грубый" показатель смертности от РЯ в России в 2021 году составил 9,23 на 100 тыс. женского населения. Стандартизированный по возрасту показатель смертности от РЯ в России в 2021 году составили 4,65 на 100 тысяч населения [3].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Рак брюшины, рак яичников, рак маточной трубы имеют гистологически одинаковую природу. Лечение данных патологических процессов идентично, в связи с чем эти нозологии объединены в один раздел.
Злокачественное новообразование забрюшинного пространства и брюшины (C48):
C48.0 - забрюшинного пространства
C48.1 - уточненных частей брюшины
C48.2 - брюшины неуточненной части
Злокачественное новообразование яичника (C56)
Злокачественное новообразование других и неуточненных женских половых органов (C57)
C57.0 - фаллопиевой трубы
C57.1 - широкой связки
C57.2 - круглой связки
C57.3 - параметрия
C57.4 - придатков матки неуточненных
C57.7 - других уточненных женских половых органов
C57.8 - поражение женских половых органов, выходящее за пределы одной и более вышеуказанных локализаций
C57.9 - женских половых органов неуточненной локализации.
Новообразования неопределенного или неизвестного характера женских половых органов (D39)
D39.1 - яичника
D39.7 - других женских половых органов
D39.9 - женских половых органов неуточненных
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Международная гистологическая классификация (классификация ВОЗ, 5-е издание, 2020 г.):
- 8441/3 серозная карцинома:
- 8460/3 низкой степени злокачественности (low grade),
- 8461/3 высокой степени злокачественности (high grade);
- 8380/3 эндометриоидная карцинома;
- 8474/3 серозно-муцинозная карцинома;
- 8480/3 муцинозная карцинома;
- 8310/3 светлоклеточная карцинома;
- 9000/3 злокачественная опухоль Бреннера;
- 8020/3 недифференцированная карцинома;
- 8323/3 смешанная эпителиальная карцинома.
1.5.2. Стадирование
В настоящее время определение стадии производится на основании классификации FIGO (2014) и TNM (8-е издание, 2016) (табл. 1).
Таблица 1. Стадирование рака яичников по TNM (8-е издание, 2016) и FIGO (2014).
TNM
FIGO
Характеристика
T1
I
Опухоль ограничена яичниками
T1a
IA
Опухоль ограничена одним яичником, капсула не повреждена, нет опухолевых разрастаний на поверхности яичника, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости
T1b
IB
Опухоль ограничена двумя яичниками, их капсулы не повреждены, нет опухолевых разрастаний на поверхности яичников, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости
T1c
IC
Опухоль ограничена одним или двумя яичниками и сопровождается любым из следующих факторов:
T1c1
IC1
Повреждение капсулы во время операции
T1c2
IC2
Повреждение капсулы до операции или опухоль на поверхности яичника/маточной трубы
T1c3
IC3
Злокачественные клетки в асцитической жидкости или смывах с брюшины
T2
II
Опухоль поражает один или два яичника с распространением на малый таз
T2a
IIA
Врастание и/или метастазирование в матку и/или в одну или обе маточные трубы
T2b
IIB
Распространение на другие ткани таза
T3 и/или N1
III
Опухоль поражает один или оба яичника с гистологически подтвержденными внутрибрюшинными метастазами за пределами таза и/или метастазами в регионарных лимфатических узлах (внутренних, наружных и общих подвздошных, запирательных, крестцовых или поясничных лимфоузлах)
N1
IIIA1
Метастазы только в забрюшинных лимфатических узлах
IIIA1(i)
Метастазы в лимфатических узлах размерами до 10 мм
IIIA(ii)
Метастазы в лимфатических узлах размерами более 10 мм
T3a
IIIA2
Микроскопические, гистологически подтвержденные внутрибрюшинные метастазы за пределами таза с метастазами/без метастазов в забрюшинных лимфатических узлах
T3b
IIIB
Макроскопические внутрибрюшинные метастазы за пределами таза до 2 см включительно в наибольшем измерении с метастазами/без метастазов в забрюшинных лимфатических узлах
T3c
IIIC
Внутрибрюшинные метастазы за пределами таза более 2 см в наибольшем измерении с метастазами/без метастазов в забрюшинных лимфатических узлах (включая распространение опухоли на капсулу печени и селезенки без поражения паренхимы органов)
M1
IV
Отдаленные метастазы (исключая внутрибрюшинные метастазы)
IVA
Плевральный выпот со злокачественными клетками
IVB
Метастазы в паренхиматозных органах и других органах вне брюшной полости (в том числе паховых лимфатических узлах и лимфатических узлах за пределами брюшной полости)
1.5.3. Оценка распространенности опухолевого процесса и степени выраженности перитонеального канцероматоза.
Оценка распространенности опухолевого процесса и степени выраженности перитонеального канцероматоза (PCI - Peritoneal cancer index) с использованием лучевых методов диагностики и видеоэндоскопической визуализации может использоваться для планирования лечения пациенток с распространенным РЯ, позволяя сократить частоту выполнения неоптимальных хирургических вмешательств.
Для подсчета PCI используется классификация, предложенная в 1998 г. P.H. Sugarbaker [202] и включенная в оценку распространенности при диссеминированном РЯ Европейским обществом онкогинекологов (ESGO) 2017 г., согласно которой брюшная полость делится на 13 зон:
- 0 - центральная зона: средний отдел брюшной полости, весь большой сальник, поперечно-ободочная кишка;
- 1 - правое подреберье: капсула правой доли печени, поверхность правой половины диафрагмы, правое подпеченочное пространство;
- 2 - эпигастральная область: левая доля печени, серповидная связка печени, малый сальник;
- 3 - левое подреберье: поверхность левой половины диафрагмы, хвост поджелудочной железы, желудок;
- 4 - левый фланг: нисходящая ободочная кишка, левый боковой канал;
- 5 - левая подвздошная область: левая стенка таза, сигмовидная кишка;
- 6 - малый таз: матка, яичники, маточные трубы, мочевой пузырь, дугласово пространство, прямая кишка;
- 7 - правая подвздошная область: правая стенка таза, слепая кишка, аппендикс;
- 8 - правый фланг: восходящая ободочная кишка, правый боковой канал;
- 9 - начальные отделы тощей кишки;
- 10 - дистальные отделы тощей кишки;
- 11 - начальные отделы подвздошной кишки;
- 12 - дистальные отделы подвздошной кишки.
Каждой зоне в зависимости от размера опухолевых очагов присваивается определенное количество баллов (0 - нет опухоли, 1 - очаги до 5 мм, 2 - очаги от 5 мм до 5 см, 3 - очаги > 5 см или сливающиеся инвазивные инфильтраты), и PCI суммарно может быть равен от 0 до 39 баллов. При наличии инфильтративных изменений вне зависимости от размера очага присваивается 3 балла.
Пример интраоперационного протокола для расчета PCI см. в Приложении Г6.
Определение высокой суммы баллов при оценке PCI являются прогностическими факторами невозможности выполнения оптимальной циторедуктивной операции.
При интраоперационной ревизии, при сумме баллов от 0 до 15 частота выполнения оптимальных операций составляла от 62 до 99%, при этом при индексе > 16 баллов она не превышает 35%. [203].
Комментарий:
- В оценке перитонеального карциноматоза не существует общепринятого эталонного метода обследования, а результаты магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) и совмещенной с КТ позитронно-эмиссионной томографии (ПЭТ-КТ) демонстрируют схожую эффективность при наличии определенных недостатков.
- При выполнении МРТ органов малого таза и КТ органов брюшной полости происходит наслоение пересечения зон 7 и 8, 0 и 6, 4 и 5. При оценке окончательного индекса пересекающиеся зоны не суммируются, а учитывается наибольший балл в каждой наслаивающейся зоне.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
На ранних стадиях болезнь может протекать бессимптомно или с незначительными явлениями дискомфорта. При распространенном процессе заболевание манифестирует неспецифическими симптомами: увеличение живота в объеме, диспепсические явления, потеря массы тела, аппетита, болевой синдром в животе или области таза, одышка, общая слабость.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза заболевания или состояния:
1) данные анамнеза;
2) данные физикального обследования;
3) данные методов лучевой диагностики;
4) морфологическая верификация
5) Лабораторные методы
Гистологическая верификация новообразования является обязательной для установления клинического диагноза. Диагноз РЯ устанавливается на основании гистологического исследования материала, полученного во время операции или при биопсии на дооперационном этапе. При невозможности выполнения на первом этапе оперативного вмешательства или биопсии лечение начинается с предоперационной ХТ, в этом случае диагноз может быть установлен на основании данных цитологического исследования, уровня CA125 и клинической картины (например, при массивной распространенности опухолевого процесса, требующей незамедлительного начала химиотерапии). <3> Выпот в плевральных полостях рекомендовано верифицировать с помощью трансторакальной пункции с последующим цитологическим исследованием полученного материала.
2.1 Жалобы и анамнез
- Всем пациенткам рекомендуется тщательный сбор жалоб и анамнеза (в т.ч. семейного онкологического анамнеза). На ранних стадиях РЯ может протекать бессимптомно или с незначительными явлениями дискомфорта. При распространенном процессе заболевание манифестирует неспецифическими симптомами: увеличение живота в объеме, диспепсические явления, потеря массы тела, аппетита, болевой синдром в животе или области таза, одышка, общая слабость [1, 4].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарий: Сбор информации о жалобах и деталях анамнеза, в том числе семейного анамнеза, проводится с целью выявления факторов, которые могут повлиять на выбор тактики лечения.
2.2 Физикальное обследование
- Рекомендуется тщательное физикальное обследование. Физикальное обследование включает в себя ректовагинальное исследование, пальпацию органов брюшной полости и всех групп периферических лимфатических узлов, аускультацию и перкуссию легких, пальпацию молочных желез [4, 5].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарий: Особого внимания требуют оценка состояния тяжести пациента по версии ВОЗ/ECOG и/или шкале Карновского (см. Приложение Г1 - Г2), оценка алиментарного статуса, наличия болевого синдрома, температуры тела, гемодинамики, увеличения периферических лимфоузлов, наличие плеврита и асцита.
2.3 Лабораторные диагностические исследования
- Рекомендуется выполнять общий (клинический) анализ крови развернутый, анализ крови биохимический общетерапевтический с оценкой показателей функции печени, почек, общий (клинический) анализ мочи, коагулограмма (ориентировочное исследование системы гемостаза) всем пациенткам с РЯ в целях оценки состояния пациента, определения тактики и алгоритма лечения пациента, оценки прогноза заболевания [5 - 12].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Клинический анализ крови выполняется (повторяется) не более чем за 5 дней до начала очередного курса ХТ [5, 6 - 12]. В общем (клиническом) анализе крови целесообразна оценка следующих параметров - исследование уровня общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов в крови, оценка гематокрита, определение среднего содержания и средней концентрации гемоглобина в эритроцитах, дифференциальный подсчет лейкоцитов (лейкоцитарная формула), исследование скорости оседания эритроцитов; в анализе крови биохимическом общетерапевтическом с оценкой показателей функции печени, почек - исследование уровня общего белка, глюкозы, общего билирубина, креатинина, мочевины в крови, исследование уровня железа сыворотки крови, определение активности аланинаминотрасферазы (АЛТ), аспартатаминотрансферазы (АСТ), лактатдегидрогеназы (ЛДГ) и щелочной фосфатазы (ЩФ) в крови, исследование уровня общего билирубина в крови; в некоторых случаях - электролитов плазмы (исследование уровня калия, натрия хлоридов в крови)); в общем (клиническом) анализе мочи - визуальное исследование мочи (определение цвета, прозрачности мочи), определение удельного веса (относительной плотности) мочи, определение белка в моче, определение концентрации водородных ионов (pH) мочи, определение уровня глюкозы в моче, обнаружение кетоновых тел в моче; микроскопическое исследование осадка мочи.
В рамках исследования свертывающей системы крови оценивается коагулограмма (ориентировочное исследование системы гемостаза) (исследование уровня фибриногена в крови, протромбина (по Квику), определение международного нормализованного отношения (МНО), определение протромбинового (тромбопластинового) времени (ПТВ) в крови, активированного частичного тромбопластинового времени (АЧТВ), определение тромбинового времени (ТВ) в крови. По показаниям дополнительно - определение концентрации D-димера в крови, определение активности антитромбина III в крови.
- Рекомендуется выполнить всем пациентам исследование уровня антигена аденогенных раков CA125 в крови в целях выявления РЯ и его рецидивов [5, 13 - 14].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- При подозрении на РЯ рекомендуется всем пациентам определение секреторного белка эпидидимиса человека 4 (HE4) в крови и определение индекса ROMA в целях оценки вероятности РЯ [15 - 17].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: Определение HE4 в крови и индекса ROMA не заменяет необходимость морфологической верификации диагноза, однако повышенный уровень HE4 увеличивает специфичность диагностики РЯ.
- При подозрении на муцинозную карциному рекомендуется помимо исследования уровня антигена аденогенных раков CA125 в крови исследование уровня антигена аденогенных раков CA19.9 в крови и исследование уровня ракового эмбрионального антигена в крови (РЭА) в сыворотке крови в целях дифференциальной диагностики [18].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: РЭА и CA19.9 могут повышаться при муцинозном РЯ, что позволяет в последующем контролировать эффективность проводимого лечения. Кроме того, повышенная концентрация этих маркеров может свидетельствовать о первичной опухоли желудочно-кишечного тракта.
- Для женщин до 40 лет, у которых вероятность неэпителиальных опухолей высока, рекомендуется на диагностическом этапе выполнять исследование уровня альфа-фетопротеина (АФП) в сыворотке крови, исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови. [19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Неэпителиальные опухоли яичников преобладают в молодом возрасте (подробная информация представлена в разделе "Неэпителиальные опухоли яичников").
- Всем пациенткам с серозными и эндометриоидными карциномами высокой степени злокачественности рекомендовано молекулярно-генетическое исследование мутаций в генах BRCA1 и BRCA2 в крови или взятием соскоба слизистой оболочки ротовой полости и/или в биопсийном (операционном) материале, как предикторов исхода заболевания и выбора алгоритма лечения пациента [1, 20, 21].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: Частота мутаций генов BRCA1 и BRCA2 при указанных гистологических типах опухоли составляет около 15%. Информация о наличии мутации BRCA полезна с целью определения более высокой чувствительности опухоли к терапии алкилирующими средствами, препаратами платины (соединения платины) и ингибиторами поли (АДФ-рибозы) полимеразы (PARP). При отрицательном результате по данным ПЦР-метода рекомендуется выполнение полного геномного секвенирования опухолевого образца для выявления редких герминальных и соматических мутаций в генах BRCA1/2. У пациентов с герминальными мутациями желательно проведение последующего генетического консультирования для определения необходимости ДНК-диагностики кровных родственников.
При эндометриоидных и светлоклеточных опухолях яичников возможно определение микросателлитной нестабильности (MSI) в биопсийном (операционном) материале) методом иммуногистохимии (ИГХ) и/или методом ПЦР и другими для определения показаний к иммунотерапии <1>.
Выполнение комплексного геномного профилирования не рекомендуется в связи с крайне низкой вероятностью обнаружения терапевтически значимых мутаций.
2.4 Инструментальные диагностические исследования
- Всем пациенткам с клинически заподозренным образованием яичника рекомендуется выполнение УЗИ органов малого таза комплексное (трансвагинальное и трансабдоминальное) в качестве метода первой линии для дифференциальной диагностики и оценки риска злокачественности. [167, 168]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Трансвагинальное УЗИ - доступный и высокоинформативный метод выбора первой линии визуальной диагностики при подозрении на образование яичников, при этом рекомендовано выполнять оценку с использованием систем стратификации риска злокачественности, среди которых следует отдать предпочтение O-RADS, что позволяет корректно охарактеризовать до 80 - 93% образований.
- При подозрении на РЯ всем пациенткам рекомендуется выполнить магнитно-резонансную томографию (МРТ) органов малого таза с в/в контрастированием с целью уточняющей диагностики (в т.ч. при неодназначной интерпретации выявленного по данным УЗИ образования в проекции придатков) для оценки органопринадлежности, уточнения риска злокачественности, определения распространенности опухолевого процесса на уровне малого таза для планирования лечения [169].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: Информативность МРТ в дифференциальной диагностики образований яичника составляет 94 - 100%, специфичность варьирует в пределах 91% - 93%, является золотым стандартом уточняющей диагностики образований яичников в соответствии с рекомендациями ESUR, ACR, NCCN. [169, 170, 171]
При наличии противопоказаний к использованию гадолиний-содержащих КС допустимо выполнение МРТ без контрастирования.
- Всем пациенткам с установленным РЯ или подозрением на РЯ по данным УЗИ рекомендуется выполнить компьютерную томографию (КТ) органов грудной полости и брюшной полости с внутривенным болюсным контрастированием с целью оценки распространенности опухолевого процесса при планирования тактики лечения. [172, 173, 174]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий:
- При противопоказаниях к использованию рентгено-контрастных средств, содержащих йод (КС), КТ органов грудной полости допустимо проводить без контрастирования.
- При невозможности выполнения КТ органов грудной полости рекомендуется выполнить прицельную рентгенографию органов грудной клетки. КТ органов грудной полости большей чувствительностью и специфичностью в выявлении метастатического поражения легких, плевры и внутригрудных лимфатических узлов (ЛУ).
- При невозможности проведения КТ органов брюшной полости с в/в контрастированием (противопоказания к использованию йод-растворимых КС, беременность и др.), рекомендуется выполнить МРТ органов брюшной полости с в/в контрастированием.
- МРТ органов брюшной полости с в/в контрастированием может быть также использована в качестве альтернативы КТ или как дополнение при неоднозначных результатах КТ, для оценки распространенности перитонеального карциноматоза и резектабельности процесса: метод обладает более высокой информативностью по сравнению с КТ, чувствительность которой существенно снижается для мелких поражений размером < 1 см, а также в определенных анатомических областях (правое поддиафрагмальное пространство, брыжейка и серозная оболочка тонкой кишки) до 22 - 50% по сравнению с МРТ (75 - 90%), что определяет более высокую чувствительность МРТ в прогнозировании субоптимальной циторедукции (91%), по сравнению с 50% для КТ при сходной специфичности: 100% и 97% для МРТ и КТ, соответственно. [175, 176, 177]
- Возможно выполнение позитронно-эмиссионной томографии всего тела совмещенной с компьютерной томографией с туморотропным РФП (ПЭТ-КТ) для оценки распространенности опухолевого процесса (поражение надключичных, внутригрудных лимфатических узлов, плевры) при неоднозначных результатах КТ/МРТ, в особенности если они могут повлиять на выбор тактики лечения, а также у пациенток с IVст РЯ (FIGO) [178, 179, 180].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарий: Информативность ПЭТ-КТ в выявлении метастатического поражения лимфатических узлов и очагов отдаленного метастазирования выше в сравнении с КТ и составляет - чувствительность 69,4%, специфичность 97,5% и диагностическая точность 94,0% [181]
- При недоступности томографических методов (КТ, МРТ, ПЭТ-КТ) всем пациенткам с РЯ или подозрением на РЯ рекомендуется выполнить УЗИ л/у шейно-надключичных, подключичных, подмышечных и паховых областей, брюшной полости, забрюшинного пространства [206, 207, 208].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: УЗИ - наиболее простой и доступный метод для оценки органов и структур брюшной полости и забрюшинного пространства, малого таза, статуса регионарных и периферических ЛУ. Однако этот метод имеет ограничения и не может заменить КТ/МРТ/ПЭТ-КТ при оценке распространенности опухоли на этапе принятия клинического решения при выборе тактики лечения. Оценка эффекта химиотерапии по критериям RECIST 1.1 также невозможна по результатам УЗИ, т.к. требует использования томографических методик.
- Всем пациентам с РЯ или подозрением на РЯ рекомендуется выполнить эзофагогастродуоденоскопию (ЭГДС) в целях исключения первичной опухоли желудочно-кишечного тракта (ЖКТ) и оценки наличия сопутствующих заболеваний ЖКТ [22].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: ЭГДС - обязательный метод исследования пациентов с подозрением на РЯ, позволяющий исключить вторичное (метастатическое) поражение яичников при злокачественных новообразованиях (ЗНО) ЖКТ.
- Всем пациентам с РЯ или подозрением на РЯ рекомендуется выполнить колоноскопию в целях дифференциальной диагностики с ЗНО ЖКТ и оценки наличия сопутствующих заболеваний ЖКТ [22, 23].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: Колоноскопия - обязательный метод исследования пациентов с подозрением на РЯ, позволяющий исключить вторичное (метастатическое) поражение яичников при ЗНО ЖКТ. При невозможности выполнения колоноскопии следует выполнить рентгенологическое исследования толстой кишки.
- Всем пациенткам при подозрении на РЯ и с установленным РЯ рекомендуется обследование молочных желез, с целью исключения опухолевого поражения вторичного (метастатического) характера и первично-множественных ЗНО [27, 28 - 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Женщинам моложе 40 лет проводится УЗИ молочных желез в первую фазу менструального цикла при его наличии, женщинам старше 40 лет рекомендуется выполнить маммографию в первую фазу менструального цикла при его наличии, консультация врача-маммолога проводится при необходимости по результатам проведенных исследований. Обследование молочных желез проводится в соответствии с принципами, изложенными в клинических рекомендациях по злокачественным новообразованиям молочных желез.
- При диагностированном РЯ/подозрении на РЯ во время беременности, всем пациенткам рекомендуется выполнение УЗИ и/или МРТ органов брюшной полости и малого таза (без парамагнитного контрастного средства) для оценки распространенности опухолевого процесса и планирования тактики лечения [182]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3)
Комментарий: В первом триместре беременности предпочтительным методом диагностики является УЗИ органов брюшной полости (комплексное) и малого таза комплексное (трансвагинальное и трансабдоминальное). При назначении МРТ органов брюшной полости и малого таза необходимо оценить соотношение риск/клиническая необходимость. При выполнении МРТ во втором и третьем триместрах беременности риски для плода отсутствуют, введение парамагнитного контрастного средства при проведении МРТ не рекомендовано.
- Всем пациенткам с установленным РЯ после проведенной неоадъювантной химиотерапии (ХТ), в процессе адъювантной и изолированной ХТ рекомендуется выполнить КТ органов грудной полости, КТ/МРТ органов брюшной полости и малого таза с внутривенным контрастированием с целью оценки эффективности лечения. При неоднозначных результатах КТ/МРТ, в качестве вспомогательного метода рекомендуется выполнение ПЭТ-КТ. [183]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: для стандартизации оценки эффективности системного лечения эффективно использование критериев RECIST - Response Evaluation Criteria In Solid Tumors (критерии оценки эффекта при солидных опухолях).
- После проведенного противоопухолевого лечения для оценки в динамике рекомендуется выполнение КТ органов грудной полости, КТ/МРТ органов брюшной полости и малого таза с внутривенным контрастированием при наличии подозрений на рецидив по результатам клинического обследования/в т.ч. "маркерного" рецидива. При неоднозначных результатах КТ/МРТ у пациенток с рецидивом РЯ и подозрением на него в качестве дополнительного метода визуализации рекомендовано выполнение позитронной эмиссионной томографии, совмещенной с компьютерной томографией с туморотропным РФП (ПЭТ-КТ). [184, 185, 186]]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий:
- при динамическом наблюдении после противоопухолевого лечения, методы визуализации назначаются по клиническим показаниям. Рутинное использование МСКТ, МРТ у бессимптомных пациенток не рекомендуется, при наличии клинических показаний выбор методики аналогичен таковому на диагностическом этапе.
- Проспективное многоцентровое когортное исследование показало, что применение ПЭТ-КТ при рецидивирующем течении РЯ (повышение уровня CA-125, наличие клинических симптомов) может повлиять на тактику лечения примерно у 60% пациенток, обнаружить дополнительные очаги, неопределяемые при традиционных методах визуализации, у 68% больных. При этом 77% очагов локализовалось ниже уровня диафрагмы с проявлением картины перитонеального карциноматоза в большинстве очагов. Однако рутинное выполнение ПЭТ-КТ у бессимптомных пациенток не рекомендуется. Выявление рецидива РЯ ограничено у пациенток с опухолями низкой степени злокачественности.
- Пациентам с установленным РЯ и подозрением на него может быть рекомендована диагностическая лапароскопия с целью морфологической верификации диагноза (если менее инвазивные способы представляются неэффективными), для уточнения распространенности опухолевого процесса или наличия рецидивной опухоли, стадирования и оценки резектабельности, [20, 31].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий:
- Гистологическая верификация является обязательной для установления клинического диагноза РЯ.
- Исключение составляют пациентки с клинической картиной распространенного РЯ (с асцитом, канцероматозом брюшины, высоким уровнем Ca-125 и HE-4, а РЭА в пределах нормы или незначительно его превышающим, при отсутствии данных за первичную злокачественную опухоль другой нозологии, в т.ч. ЖКТ, молочной железы и др.), которым, ввиду тяжести их состояния, требуется срочное начало химиотерапии; в этом случае морфологическая верификация новообразования может быть осуществлена с использованием цитологических методов исследования материала, полученного от пациента путем малоинвазивных методик (пункции брюшной полости и др.).
2.5 Иные диагностические исследования
- Настоятельно рекомендуется морфологическая верификация диагноза у всех пациенток с подозрением на РЯ до начала лечения. Забор материала для исследования может быть осуществлен в ходе диагностической лапароскопии или во время лапаротомии со срочным интраоперационным патолого-анатомическим исследованием биопсийного (операционного) материала [20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий:
Гистологическая верификация новообразования является обязательной для установления клинического диагноза и назначения консервативного лечения в большинстве случаев исключение составляют пациентки с клинической картиной распространенного РЯ (с асцитом, канцероматозом брюшины, высоким уровнем Ca-125 и HE-4, а РЭА в пределах нормы или незначительно его превышающим, при отсутствии данных за первичную злокачественную опухоль другой нозологии, в т.ч. ЖКТ, молочной железы и др.), которым, ввиду тяжести их состояния, требуется срочное начало химиотерапии; в этом случае верификация новообразования может быть осуществлена с использованием цитологических методов исследования материала, полученного от пациента путем малоинвазивных методик (пункции брюшной полости и др.).
Хирургическое вмешательство в ряде случаев может быть выполнено без морфологической верификации.
Выпот в плевральных полостях рекомендовано верифицировать с помощью трансторакальной пункции с последующим цитологическим исследованием полученного материала.
Выпот в плевральных полостях необходимо верифицировать с помощью трансторакальной пункции с последующим цитологическим исследованием полученного материала.
- Рекомендуется проводить патолого-анатомическое исследование операционного (биопсийного) материала с отражением в заключении следующих параметров [19, 20, 32, 33]:
1) Размеры первичной опухоли, повреждение капсулы или распространение опухоли на капсулу;
2) гистологическое строение опухоли;
3) степень злокачественности опухоли;
4) наличие злокачественных клеток в каждом отдельно взятом биоптате брюшины, а также в большом сальнике;
5) указание общего числа исследованных и пораженных лимфоузлов;
6) степень лечебного патоморфоза в случае предоперационной терапии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: При сомнительных или отрицательных результатах биопсии новообразования по результатам патологоанатомического исследования пациенткам с подозрением на РЯ показано проведение хирургического вмешательства со срочным интраоперационным патологоанатомическим исследованием биопсийного (операционного) материала;
- при необходимости морфологической верификации диагноза РЯ патологоанатомическое исследование биопсийного (операционного) материала может дополняться ИГХ-типированием;
7) степень лечебного патоморфоза в случае предоперационной терапии оценивается в соответствии с международными рекомендациями по шкале оценки регресса опухоли TRG (Tumor Regression Grade) [34, 35]: TRG 0 - полный ответ, TGR 1 - почти полный ответ, TGR 2 - частичный ответ, TGR 3 - плохой морфологический ответ; нет ответа на лечение (см. Приложение Г3).
- Рекомендуется всем пациенткам с РЯ цитологическое исследование перитонеальной и плевральной жидкости, экссудатов/аспиратов/пунктатов/смывов с брюшины, с целью уточнения стадии заболевания [32, 209, 210, 211, 212].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется цитологическое исследование мазков с шейки матки и цервикального канала, забор аспирата из полости матки на диагностическом этапе всем пациенткам с РЯ и подозрением на РЯ [2, 4].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинических рекомендациях, направлено на обеспечение пациента эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в клинической практике определяется в соответствии с конкретной клинической ситуацией, соблюдением мер предосторожности при их применении, а также возможна коррекция доз с учетом состояния пациента.
- При распространенности опухоли и состоянии пациентки, позволяющих выполнить оптимальную циторедуктивную операцию на первом этапе, рекомендуется проведение хирургического вмешательства в объеме полной или оптимальной циторедукции [1, 36 - 38].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: Определение полной и оптимальной циторедукции см. в разделе "Термины и определения".
3.1. Хирургическое лечение I - II стадий рака яичников
- При I - II стадиях заболевания при ревизии органов брюшной полости настоятельно рекомендуется выполнить все процедуры хирургического стадирования [32, 33, 39 - 41].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: Для хирургического стадирования РЯ выполняют следующие манипуляции:
1. Срединная лапаротомия для полноценной ревизии органов брюшной полости и малого таза и обеспечения адекватного доступа к большому сальнику. Лапароскопическая хирургия при ранних стадиях (I стадия) с целью стадирования может быть использована в крупных онкологических центрах при наличии подготовленных специалистов и соответствующего уровня технической оснащенности [5].
2. Если морфологической верификации диагноза нет, лапаротомию следует проводить со срочным интраоперационным патологоанатомическим исследованием биопсийного (операционного) материала.
3. Если обнаружен асцит, жидкость аспирируют для цитологического исследования. При отсутствии асцита выполняют цитологическое исследование смывов с брюшины (в том числе с ее диафрагмальной поверхности, латеральных каналов и малого таза).
4. Все отделы брюшной полости, малого таза, включая поддиафрагмальное пространство, большой и малый сальник, тонкую и толстую кишку и их брыжейки, поверхность париетальной и висцеральной брюшины, забрюшинное пространство, тщательно и методично осматривают; все участки брюшины и спайки, подозрительные в отношении метастазов, подвергают биопсии. Вся поверхность брюшины должна быть осмотрена. Спаечный процесс, препятствующий ревизии, должен быть отмечен.
5. Если проведенная ревизия не подтвердила наличие метастазов, выполняют биопсию случайно выбранных участков брюшины стенок малого таза, прямокишечно-маточного углубления, мочевого пузыря, латеральных каналов, а также правого и левого куполов диафрагмы (может быть выполнен соскоб с поверхностей диафрагмы).
6. Резекция (удаление) большого сальника является обязательным и выполняется на уровне большой кривизны желудка при РЯ.
7. Тотальная тазовая и поясничная лимфаденэктомия до уровня почечных сосудов обязательна при I стадии РЯ (кроме муцинозной и эндометриоидной аденокарциномы) для решения вопроса о необходимости адъювантной химиотерапии, во всех остальных случаях решается индивидуально. [217]
8. Аппендэктомия (удаление аппендикса) целесообразна в случае подозрения на его поражение.
Органосохраняющее хирургическое вмешательство (односторонняя аднексэктомия с резекцией второго яичника, резекция большого сальника (оментэктомия, тазовая и поясничная лимфаденэктомия и выполнение процедур стадирования) в виде исключения возможно у молодых больных, желающих сохранить фертильность, при серозной карциноме низкой степени злокачественности, эндометриоидной или муцинозной карциноме IA и IC1 стадий при наличии возможности тщательного диспансерного наблюдения и доказанном отсутствии наследственного характера заболевания. При эндометриоидном гистологическом варианте опухоли следует выполнить биопсию тканей матки (эндометрия) для исключения синхронного рака эндометрия.
Малоинвазивные хирургические вмешательства, в частности лапароскопические, могут быть использованы только для морфологической верификации диагноза, определения стадии или для прогнозирования объема циторедуктивной операции.
При невыполнении процедур стадирования, во время первой операции целесообразно выполнение повторного хирургического вмешательства с целью рестадирования [42 - 44].
3.2. Хирургическое лечение III - IV стадий рака яичников
- При распространенности опухоли и состоянии пациентки, позволяющих выполнить оптимальную циторедуктивную операцию на первом этапе, рекомендуется проведение хирургического вмешательства в объеме полной или оптимальной циторедукции, т.е. удаление всех видимых проявлений болезни [1, 45].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: Определение полной и оптимальной циторедукции см. в разделе "Термины и определения".
- При невозможности выполнения циторедуктивной операции на первом этапе рекомендуется начинать лечение с химиотерапии (ХТ) [46 - 48].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: К пациенткам, которым показана предоперационная ХТ, могут относиться пациентки с тяжелым соматическим статусом, а также пациентки с крайне выраженной распространенностью опухолевого процесса, делающей невозможным выполнение оптимальной циторедукции. Эти пациентки нуждаются в промежуточной циторедуктивной операции в максимально короткие сроки (после 2 - 3 курсов неоадъювантной ХТ). В случае отсутствия условий для выполнения полной циторедукции после 3 курсов химиотерапии индивидуально принимается решение о проведении еще 3 курсов химиотерапии с последующей оценкой возможности выполнения полной циторедуктивной операции. В случае прогрессирования после 3 курсов неоадъювантной ХТ пациентка переводится на 2 линию ХТ.
Этапы выполнения хирургического лечения и процедуры стадирования указаны в пункте 3.1.
- Выполнение лимфаденэктомии при III - IV стадии РЯ рекомендуется при полной циторедукции при увеличенных, подозрительных на метастатическое поражение лимфоузлах по данным предоперационного обследования или интраоперационной ревизии [49, 50].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: Удалению подлежат внутренние, наружные, общие подвздошные, запирательные, пре- и парааортальные, аортокавальные, пре- и паракавальные лимфоузлы до уровня почечных сосудов.
3.3. Адъювантная и первая линия химиотерапии
Степень лечебного патоморфоза по результатам патолого-анатомического исследования операционного (биопсийного) материала после предоперационной ХТ не является основанием для смены линии ХТ [51].
- Рекомендуется отказаться от проведения адъювантной ХТ при соблюдении всех следующих условий:
1) Ia - Ib стадия;
2) карцинома низкой степени злокачественности (low grade);
3) несветлоклеточный гистологический тип опухоли;
4) полностью выполнены процедуры хирургического стадирования [42 - 44, 51].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- Пациенткам с IA, IB стадиями с карциномами высокой степени злокачественности или светлоклеточным гистологическим типом, а также тем, кому не выполнены процедуры хирургического стадирования, рекомендуется провести 4 - 6 курсов платиносодержащей ХТ (табл. 2) [42 - 44, 51].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: Оптимальный срок начала ХТ до 25 дней от момента хирургического вмешательства пациенткам с РЯ. До 8 - 10% пациенток могут испытывать реакции гиперчувствительности в процессе терапии платиновыми агентами. Использование протоколов десенсибилизации может улучшать выживаемость пациенток. В настоящее время отсутствуют данные, демонстрирующие преимущество какого-либо конкретного протокола перед другими возможными схемами десенсибилизации.
При лечении пациенток с анамнезом аллергических реакций (реакций гиперчувствительности) на платиновые агенты рекомендуется оценить возможность продолжения терапии платиновыми препаратами (по АТХ L01XA: Соединения платины):
1. Оценить выраженность аллергической реакции. В случае развития аллергической реакции степени 1 - 3 по шкале CTCAE (Common Terminology Criteria for Adverse Events) следует рассмотреть возможность продолжения терапии с использованием десенсибилизирующей схемы введения препарата. В случае развития аллергической реакции 4 степени (жизнеугрожающая реакция гиперчувствительности) по международной шкале оценки выраженности нежелательных явлений (CTCAE) препарат, вызвавший ее развитие, должен быть отменен и не назначаться в последующем до консультации специалиста, имеющего опыт в проведении десенсибилизирующей терапии (врач-аллерголог-иммунолог или врач-онколог (химиотерапевт)).
2. При выборе протокола десенсибилизации следует руководствоваться данными специальной литературы. Протокол десенсибилизации должен включать дробное введение препарата, вызвавшего аллергическую реакцию и профилактическое применение препаратов, снижающих риск гиперчувствительности (антигистаминные средства системного действия (блокаторы H1-гистаминовых рецепторов), глюкокортикоиды). При лечении пациенток с реакциями гиперчувствительности обязательно следование выбранному протоколу десенсибилизации при проведении каждого последующего курса лечения.
3. Перед проведением терапии с использованием десенсибилизирующей схемы следует убедиться, что персонал медицинской организации знаком с симптомами аллергических реакций, порядком действий в случае их возникновения. Должен быть обеспечен быстрый доступ к необходимым препаратам (антигистаминные средства системного действия (блокаторы H1-гистаминовых рецепторов), глюкокортикоиды, эпинефрин**) и/или к реанимационной службе.
4. В случае, если было отмечено повторное развитие реакций гиперчувствительности, несмотря на следование протоколу десенсибилизации, дальнейшие решения по тактике лечения следует принимать индивидуально, с учетом соотношения риска и пользы от продолжения терапии, а также выраженности реакции гиперчувствительности;
5. В некоторых случаях может быть целесообразной замена платинового агента, вызвавшего реакцию гиперчувствительности, на другой препарат того же класса (например, цисплатина** на карбоплатин** или оксалиплатин**). При замене препарата следует учитывать спектр его токсичности и эффективности в составе используемого режима лечения.
В таблице 2 представлены режимы адъювантной/первой линии ХТ. [187]
Комбинация СР (соединения платины и циклофосфамид**) не рекомендуется к использованию у пациенток с РЯ в связи с меньшей клинической эффективностью.
Таблица 2. Химиотерапия первичного рака яичников
Показания
Режим химиотерапии
Пациентки с IA, IB стадиями при наличии факторов риска, все пациентки с IC - IV стадиями, а также пациентки, которым не выполнена циторедуктивная операция
1. Паклитаксел** 175 мг/м2 в/в 3 часа в 1-й день, карбоплатин** AUC 6 в/в 1 час в 1-й день 21-дневного курса, 6 курсов <1> [188]
2. Паклитаксел** 175 мг/м2 в/в 3 часа в 1-й день, цисплатин** 75 мг/м2 в/в 2 часа в 1-й день 21-дневного курса, 6 курсов <1>. [190]
3. #Паклитаксел** 80 мг/м2 в/в 1 час в 1-й, 8-й, 15-й дни, карбоплатин** AUC 6 в/в 1 час в 1-й день 28-дневного курса, 6 курсов [52, 191, 192, 193].
4. #Доцетаксел** 75 мг/м2 в/в 1 час в 1-й день, цисплатин** 75 мг/м2 в/в 2 часа в 1-й день 21-дневного курса, 6 курсов. [194, 195]
5. #Паклитаксел** 60 мг/м2 в/в 1 час день 1, 8, 15, #карбоплатин** AUC 2 в/в 1 час еженедельно день 1, 8, 15 - каждые 21 день, 6 курсов [53, 196].
6. Паклитаксел** 135 мг/м2 в/в 3 часа в 1-й день, #цисплатин** 75 мг/м2 внутрибрюшинно во 2-й день, #паклитаксел** 60 мг/м2 внутрибрюшинно в 8-й день 21-дневного курса, 6 курсов (допустима замена #цисплатина** на #карбоплатин** AUC 6 внутрибрюшинно во 2-й день) [54, 131, 197, 198].
7. Карбоплатин** AUC 6 в/в 1 час в 1-й день 21-дневного курса, 6 курсов. [199]
--------------------------------
<1> Проводить при первичной или вторичной профилактики нейтропении #филграстимом** по 5 мкг/кг (возможно округление разовой дозы до 300 мкг) подкожно через 24 - 72 часа после завершения режима терапии и до восстановления нормального числа нейтрофилов после максимального их падения, либо #эмпэгфилграстимом** 7,5 мг подкожно однократно, не менее чем через 24 часа после завершения введения химиопрепаратов. [214, 215]
- Внутрибрюшинная ХТ рекомендована при II - IV стадии в случае выполнения первичной циторедуктивной операции с максимальным размером остаточных опухолевых узлов не более 1 см и требует предварительной имплантации внутрибрюшинного порта [42 - 44, 51, 213]
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендовано добавление к химиотерапии #бевацизумаба** при наличии после циторедуктивной операции остаточных опухолевых узлов более 1 см (или если циторедуктивная операция не выполнена и не планируется в ближайшем будущем) или при IV стадии [56]. #Бевацизумаб** используется в дозе 7,5 мг/кг в/в или 15 мг/кг в/в с интервалом в 3 недели в течение суммарно 18 - 22 курсов (или до прогрессирования, если оно наступит раньше), начиная с первого или второго курса ХТ [57].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендовано пациенткам с III - IV стадией РЯ, с высокой степенью злокачественности и с мутациями в генах BRCA1/2, ответивших (полный* или частичный ответ) на платиносодержащую ХТ 1 линии проведение поддерживающей терапии олапарибом** (таблетки) в дозе 300 мг (2 таблетки по 150 мг) 2 раза в сутки (суточная доза 600 мг), в течение 2 лет, до прогрессирования заболевания или непереносимой токсичности - в зависимости от того, что наступит раньше [200].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендовано в рамках поддерживащей терапии пациенток РЯ при наличии известного результата HRD-положительного статуса без мутации генов BRCA1/2, ответивших (полный или частичный ответ) на платиносодержащую ХТ с #бевацизумабом** рассматривать вопрос о добавлении олапариба** (внутрь) в дозе 300 мг (2 таблетки по 150 мг) 2 раза в сутки (суточная доза 600 мг) в течение 2 лет или до прогрессирования. #Бевацизумаб** используется в дозе 15 мг/кг в месте с ХТ и далее до 15 мес. в поддерживающем режиме или до прогрессирования, если оно наступит раньше [58].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: У пациенток, получающих поддерживающую терапию олапарибом в комбинации с #бевацизумабом**, в случае возникновения признаков непереносимой токсичности, связанной с #бевацизумабом**, необходимо отменить #бевацизумаб** и продолжить терапию олапарибом** в монорежиме.
Добавление олапариба** в поддерживающем режиме в монотерапии или в комбинации с #бевацизумабом** возможно при достижении полного или частичного ответа при выполнении неоптимальной циторедукции, в случае выполнения полной/оптимальной циторедукции (т.е. при отсутствии контрольных очагов), назначение ингибитора поли(АДФ-рибозы) полимеразы (PARP) возможно при исключении прогрессирования заболевания после окончания ХТ. Ранее выполненная полная циторедукция не должна рассматриваться как противопоказание к назначению олапариба**.
- Всем пациенткам с РЯ, начиная с IC стадии, при отсутствии противопоказаний рекомендована лечебная (первая линия) платиносодержащая ХТ в количестве 6 курсов (см. табл. 2) [12, 33].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- В случае серозного РЯ низкой степени злокачественности после окончания ХТ рекомендуется поддерживающая эндокринная терапия [59, 60].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарий: В качестве препаратов рекомендованы ингибиторы ароматазы [60] или #тамоксифен** (20 мг 2 раза в день, 28-дневный цикл) [60] до прогрессирования или в течение трех лет. Необходимость иммуногистохимического типирования для определения экспрессии рецепторов эстрогенов и прогестерона при выполнении патолого-анатомического исследования операционного (биопсийного) материала с целью определения чувствительности к эндокринной терапии не доказана и является опциональной.
- Рекомендовано прекратить лечение после проведения 6 (максимум 8) курсов ХТ и перейти к проведению динамического наблюдения до признаков прогрессирования заболевания. [61].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: В случае прогрессирования опухолевого процесса на фоне ХТ первой линии (платинорефрактерный рак) возможна попытка назначения монохимиотерапии одним из неплатиновых препаратов (табл. 3). Во всех других случаях, в том числе при неполном эффекте проведенного лечения и наличии остаточной опухоли, рекомендуется динамическое наблюдение до прогрессирования. Поддерживающая терапия, за исключением бевацизумаба** и эндокринной терапии, является неэффективной. Операция "second-look" также не рекомендуется.
3.4. Лечение рецидивов рака яичников
Прогрессированием РЯ считается наличие любого из следующих критериев [62]:
(а) клинически или радиологически подтвержденное прогрессирование; (б) рост CA125 в 2 раза выше верхней границы нормы (если ранее он находился в пределах нормы) или рост CA125 в 2 раза выше наименьшего значения, зарегистрированного во время проводимого лечения (если во время лечения нормализации CA125 не зафиксировано), подтвержденный повторным анализом с интервалом не менее 1 нед [63].
Критерии прогрессирования РЯ не являются абсолютным показанием для начала новой линии ХТ, а служат для оценки эффективности предыдущего лечения, например для оценки длительности бесплатинового интервала.
- ХТ 2-й и последующих линий, и/или таргетную терапию, и/или гормонотерапию рекомендуется начинать у пациенток с рецидивом РЯ при наличии показаний (рост опухолевых очагов и наличие жалоб со стороны пациентки, связанных с прогрессированием опухолевого процесса или наличие опухолевых очагов, чей рост может привести к развитию осложнений опухолевого процесса) и отсутствии медицинских противопоказаний [32, 62, 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется рассматривать хирургическое лечение рецидивов РЯ как одну из опций лечения при соблюдении следующих условий:
1) длительность бесплатинового интервала более 6 мес.;
2) наличие одной или нескольких рецидивных опухолей в отсутствие распространенного канцероматоза и асцита > 500 мл;
3) общее состояние по шкале оценки тяжести состояния пациента по версии ВОЗ/ECOG 0 баллов и по шкале Карновского - 80 - 100 баллов (см. Приложение Г1 - Г2). [65 - 67].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: Отдельные пациентки с рецидивами РЯ могут рассматриваться как кандидаты для повторных циторедуктивных вмешательств. Повторная циторедукция целесообразна только в том случае, если может быть выполнена без макроскопически определяемой остаточной опухоли. Хирургическое вмешательство следует планировать до начала ХТ по поводу рецидива.
- Рекомендуется основывать выбор ХТ рецидивов РЯ на длительности бесплатинового интервала (рассчитывается от даты последнего введения соединений платины до даты прогрессирования), эффективности и токсичности ранее проведенной платиносодержащей химиотерапии и выраженности симптомов опухолевого процесса [32, 20, 62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: В таблице 3 суммированы рекомендуемые для лечения рецидивов РЯ режимы ХТ.
- При рецидиве заболевания с длительностью бесплатинового интервала от 6 до 24 мес. рекомендуется назначение комбинации соединений платины (цисплатина** или карбоплатина**) в сочетании с другим противоопухолевым препаратом, ранее не использованным для лечения данной пациентки (см. табл. 3) [68 - 70].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендовано при длительности бесплатинового интервала более 24 мес. рассмотреть возможность повторного назначения комбинации соединения (производного) платины и таксанов для лечения рецидива РЯ [70, 71].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Таблица 3. Допустимые режимы ХТ 2-й и последующих линий (средняя продолжительность ХТ 2-й линии составляет 4 - 6 курсов) [187]
Вид терапии
Режим химиотерапии
Комбинированная химиотерапия
<2> <1> карбоплатин** AUC 5 - 6 1 час в/в в 1-й день 21-дневного курса в сочетании с одним из нижеследующих препаратов:
- #доксорубицин** (пегилированный липосомальный) 30 мг/м2 в/в 1 час 1-й день 28-дневного курса (доза карбоплатина** в составе данного режима не превышает AUC 5) [216];
- #паклитаксел** 175 мг/м2 в/в 3 часа в 1-й день 21 дневного курса (или 60 или 80 мг/м2 в/в 1 час в 1-й, 8-й, 15-й дни 21-дневного курса) [216];
- гемцитабин** 1000 мг/м2 в/в 30 мин в 1-й, 8-й дни 21-дневного курса (в случае комбинации с карбоплатином** (доза карбоплатина** не превышает AUC 4) [205]
#Оксалиплатин** 100 - 130 мг/м2 в/в 2 часа в 1-й день в сочетании с одним из следующих препаратов:
- #гемцитабин** 1000 мг/м2 в/в 30 мин в 1-й, 8-й дни 21-дневного курса [74, 76, 216];
- #капецитабин** 2000 мг/м2 в 1 - 14-й дни 21-дневного курса (приоритетный режим для муцинозного рака после таксансодержащей химиотерапии) [216].
Цисплатин** 60 мг/м2 в/в 2 часа в 1-й день, #иринотекан** 60 мг/м2 в/в 30 - 90 мин в 1-й, 8-й, 15-й дни 28-дневного курса [78] (приоритетный режим для светлоклеточного рака после таксансодержащей химиотерапии).
#Оксалиплатин** 85 мг/м2 в/в 2 часа в 1-й день, #кальция фолинат ** 200 мг/м2 в/в в 1-й день, #фторурацил** 400 мг/м2 в/в болюсно в 1-й день, с последующей 22-часовой инфузией 600 мг/м2 #фторурацила** в течение 48 часов каждого 21-дневного курса (приоритетный режим для муцинозного рака после таксансодержащей химиотерапии) [79].
Монохимиотерапия и метрономная химиотерапия
#Этопозид** 100 мг внутрь в 1 - 10-й дни 21-дневного курса [80].
#Винорелбин** 20 - 25 мг/м2 в/в 6 - 10 мин в в еженедельном режиме [73].
#Топотекан 1,25 мг/м2 1 - 5-й дни 21-дневного курса или #топотекан 4 мг/м2 в 1, 8, 15 дни 21-дневного курса [82, 83].
доксорубицин** (пегилированный липосомальный) 50 мг/м2 в/в 1 час в 1-й день 28-дневного курса. [72]
Гемцитабин** 1000 мг/м2 в/в 30 мин 1-й, 8-й, 15-й дни 28-дневного курса [204]
#Паклитаксел** 80 мг/м2 в/в 1 час еженедельно [84].
#Пеметрексед** 500 мг/м2 в/в 10 мин в 1-й день 21-дневного курса [85].
Метрономная химиотерапия: #циклофосфамид** 50 мг внутрь ежедневно без перерыва +/- #метотрексат** 2,5 мг внутрь 2 раза в день 2 дня в неделю [86].
Эндокринотерапия
#Летрозол 2,5 мг в сутки внутрь ежедневно [87].
#Анастрозол** 1 мг в сутки внутрь ежедневно [87].
#Тамоксифен** 20 - 40 мг в сутки внутрь ежедневно [87].
--------------------------------
<2> возможно альтернативное использование Цисплатин** 75 мг/м2/карбоплатина** AUC 5 - 6 в зависимости от медицинских показаний.
<1> Проводить при при первичной или вторичной профилактике #филграстимом** по 5 мкг/кг (возможно округление разовой дозы до 300 мкг) подкожно через 24 - 72 часа после завершения режима терапии и до восстановления нормального числа нейтрофилов после максимального их падения либо #эмпэгфилграстимом** 7,5 мг подкожно однократно, не менее чем через 24 часа после завершения введения химиопрепаратов [214, 215]
- Рекомендовано добавление #бевацизумаба** (в дозе 7,5 или 15 мг/кг в/в 1 раз в 3 недели до прогрессирования) к ХТ для всех пациенток с рецидивами РЯ [88 - 90, 216]. #Бевацизумаб** следует продолжать до прогрессирования заболевания или неприемлемой токсичности [57]. При выявлении прогрессирования на фоне проводимой терапии #бевацизумабом** возможно дальнейшее использование этого препарата в составе режимов последующей терапии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2).
- Для пациенток с рецидивами РЯ вне зависимости от мутационного статуса генов BRCA1/2, когда течение заболевания свидетельствует о повышенной чувствительности опухолевых клеток к ДНК-повреждающим агентам (например, у больных серозной и эндометриоидной аденокарциномой high grade с длительным бесплатиновым интервалом и/или высокой чувствительностью к соединениям платины) рекомендуется проведение поддерживающей монотерапии олапарибом** (таблетки) <1> в дозе 300 мг (2 таблетки по 150 мг) 2 раза в сутки (суточная доза 600 мг) до прогрессирования заболевания. [20, 92, 216].
--------------------------------
<1> возможно повторное назначение после применения в поддерживающей терапии предшествующих линий [93].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- При рецидиве с длительностью бесплатинового интервала менее 6 мес., если не было прогрессирования в период проведения платиносодержащей ХТ, рекомендуется бесплатиновая монохимиотерапия и повторное назначение платиносодержащей ХТ в качестве возможной опции в будущем (см. табл. 3) [68, 69].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарий: При длительности бесплатинового интервала менее 6 месяцев и при невыраженных симптомах онкологического процесса рекомендуется бесплатиновая монохимиотерапия. При прогрессировании опухоли в дальнейшем повторное применение платиносодержащей ХТ является предпочтительным, если ранее не было зарегистрировано прогрессирования опухоли во время ХТ соединениями платины. При выраженных симптомах, связанных с прогрессированием опухолевого процесса или при наличии мутации в генах BRCA1/2 целесообразно сразу возобновить платиносодержащую ХТ, если ранее не было зарегистрировано прогрессирования опухоли во время ХТ соединениями платины.
- В случае неэффективности 2-х подряд режимов ХТ дальнейшее ее проведение сомнительно ввиду прогнозируемой низкой эффективности, рекомендуются либо симптоматическая терапия, либо включение в клинические исследования [28, 99].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При использовании в качестве ХТ 1-й линии бестаксановой комбинации рекомендуется включение таксанов в качестве ХТ 2-й линии [71].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- В рамках поддерживающей терапии для пациенток с патогенными герминальными или соматическими мутациями генов BRCA1/2 рекомендуется рассматривать вопрос о назначении препарата олапариб** при соблюдении всех следующих условий:
1) серозная карцинома высокой степени злокачественности;
2) объективный ответ после последней платиносодержащей ХТ, назначенной по поводу платиночувствительного рецидива [97, 98].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: Прием олапариба** в дозе 300 мг (2 капсул по 150 мг) 2 раза в сутки (суточная доза 600 мг) [92, 19 - 20] должен быть начат в течение 8 нед после окончания платиносодержащей ХТ и продолжен до прогрессирования заболевания или непереносимой токсичности [20, 92].
- В отдельных клинических ситуациях у больных с рецидивами заболевания рекомендовано рассмотреть возможность применения лучевой терапии по индивидуальным показаниям с паллиативной целью [99, 100].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Некоторые несерозные гистологические типы опухоли, например светлоклеточный, муцинозный или эндометриоидный, во многих случаях локализованы в тазу, а метастазирование может быть ограничено регионарными лимфатическими узлами. В условиях резистентности несерозных гистотипов к лекарственной терапии возможно применение лучевой терапии на рецидивные очаги и метастазы.
3.5. Профилактика и лечение осложнений злокачественных опухолей и противоопухолевой лекарственной терапии
- При проведении противоопухолевой лекарственной терапии препаратами с эметогенным побочным действием пациентам рекомендуется проведение профилактики и лечения тошноты и рвоты [1, 2].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы диагностики, профилактики и лечения тошноты и рвоты при проведении противоопухолевой лекарственной терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Владимирова Л.Ю. и соавт. Тошнота и рвота [3].
https://rosoncoweb.ru/standarts/?chapter=nausea_vomiting
- У пациентов с метастатическим поражением костей рекомендуется профилактика и лечение костных осложнений [4].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы диагностики, профилактики и лечения костных осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Багрова С.Г. и соавт. Патология костной ткани [5].
https://rosoncoweb.ru/standarts/?chapter=bone_pathology
- Пациентам рекомендуется профилактика и лечение венозных тромбоэмболических осложнений [6 - 8].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы диагностики, профилактики и лечения венозных тромбоэмболических осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сомонова О.В. и соавт. Тромбоэмболические осложнения [9].
https://rosoncoweb.ru/standarts/?chapter=thromboembolism
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение фебрильной нейтропении и инфекционных осложнений [10 - 12].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения фебрильной нейтропении и инфекционных осложнений, принципы антибактериальной терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сакаева Д.Д. и соавт. Практические рекомендации по диагностике и лечению фебрильной нейтропении [13].
https://rosoncoweb.ru/standarts/?chapter=febrile_neutropenia
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется коррекция гепатотоксичности [14, 15].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарии. Принципы диагностики, профилактики и лечения гепатотоксичности изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Ткаченко П.Е. и соавт. Гепатотоксичность [16].
https://rosoncoweb.ru/standarts/?chapter=hepatotoxicity
- При проведении пациентам противоопухолевой лекарственной терапии рекомендуется профилактика и лечения кардиоваскулярных осложнений [17 - 20].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы диагностики, профилактики и лечения сердечно-сосудистых осложнений при проведении противоопухолевой терапии изложены в Практических Рекомендациях Российского общества по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Виценя М.В. И соавт. Кардиоваскулярная токсичность [21].
https://rosoncoweb.ru/standarts/?chapter=cardiovascular_toxicity
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение дерматологических реакций [22].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы диагностики, профилактики и лечения кожных осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Королева И.А. и соавт. Дерматологические реакции [23].
https://rosoncoweb.ru/standarts/?chapter=dermatological_reactions
- Для поддержания метаболических резервов организма онкологического пациента и повышения его устойчивости к лечению (хирургическому, лекарственному, лучевому) рекомендована нутритивная поддержка. Выбор метода нутритивной поддержки определяется различными видами нарушений питания у пациента. Может быть рекомендована установка назогастральной, назоинтестинальной, чрескожной, эндоскопической, лапароскопической, лапаротомной стомы, эндоскопическое стентирование при опухолевом стенозе, паллиативная лучевая терапия [24, 25].
Уровень убедительности рекомендаций - 1 (уровень достоверности доказательств - 1).
Комментарии. Принципы проведения нутритивной поддержки представлены в Практических рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сытов А.В. и соавт. Нутритивная поддержка [26].
https://rosoncoweb.ru/standarts/?chapter=nutritional_support
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение нефротоксичности [27 - 29].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения нефротоксичности представлен в Практических рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Громова Е.Г. и соавт. Нефротоксичность [30].
https://rosoncoweb.ru/standarts/?chapter=nephrotoxicity
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение иммуноопосредованных нежелательных явлений [31 - 34].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения иммуноопосредованных нежелательных явлений изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Проценко С.А. и соавт. Иммуноопосредованные нежелательные явления [35]. https://rosoncoweb.ru/standarts/?chapter=immunerelated_adverse_events
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение мукозитов [36, 37].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения мукозитов изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Семиглазова Т.Ю. и соавт. Мукозиты [38].
https://rosoncoweb.ru/standarts/?chapter=mucositis
- Пациентам рекомендуется лечение анемии, которая возникает как симптом злокачественного новообразования и как нежелательное явление при проведении противоопухолевой лекарственной терапии [39, 40].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Порядок и принципы профилактики и лечения анемии соответствуют принципам, изложенным в клинических рекомендациях "Анемия при злокачественных новообразованиях" (ID: КР624, год утверждения 2020, www.cr.rosminzdrav.ru) и в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Орлова Р.В. и соавт. Анемия [41].
- При проведении лечения пациентам рекомендуется лечение синдрома анорексии-кахексии [42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарии. Детальный алгоритм диагностики и лечения синдрома анорексии-кахексии изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сытов А.В. и соавт. Практические рекомендации по лечению синдрома анорексии-кахексии у онкологических больных [43].
https://rosoncoweb.ru/standarts/?chapter=anorexia-cachexia
- При проведении пациентам цикловой противоопухолевой лекарственной терапии с включением непрерывных длительных (свыше 6 часов) инфузий противоопухолевых препаратов (фторурацила, доксорубицина и т.д.) или при неудовлетворительном состоянии периферических вен рекомендуется использование центрального венозного доступа и инфузионных помп [44].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии. Выбор варианта центрального доступа определяется запланированной длительностью всего курса лечения, предпочтениями пациента, анатомическими особенностями. При длительных (свыше 3 месяцев) курсах терапии наиболее удобным является имплантация подкожной венозной порт-системы. При меньших сроках альтернативой может служить периферически имплантируемый центральный венозный катетер. Принципы использования центрального венозного доступа изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Исянгулова А.З. и соавт. Центральный венозный доступ [45].
https://rosoncoweb.ru/standarts/?chapter=central_venous_access
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение экстравазатов противоопухолевых препаратов. При планировании противоопухолевой лекарственной терапии важен выбор сосудистого доступа для профилактики экстравазации противоопухолевых препаратов [46].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарии. Алгоритмы выбора сосудистого доступа, профилактики, диагностики и лечения эксравазации изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Буйденок Ю.В. и соавт. Экстравазация противоопухолевых препаратов [47].
https://rosoncoweb.ru/standarts/?chapter=extravasation_antitumor_drugs
- При проведении противоопухолевого лечения пациентам рекомендуется лечение хронического болевого синдрома [48].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Алгоритмы диагностики и лечения хронического болевого синдрома у онкологических больных изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Когония Л.М. и соавт. Хронический болевой синдром [49].
https://rosoncoweb.ru/standarts/?chapter=chronic_pain_syndrome
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение инфузионных реакций [50].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарии. Алгоритмы профилактики, диагностики и лечения инфузионных реакций изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Орлова Р.В. и соавт. Инфузионные реакции [51].
https://rosoncoweb.ru/standarts/?chapter=infusion_reactions
- При проведении терапии пациентам рекомендуется мониторинг и лечение реактивации/обострения хронических вирусных гепатитов [52].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии. Принципы мониторинга и лечебной тактики у онкологических пациентов с хроническим вирусным гепатитом изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Феоктистова П.С. и соавт. Хронические вирусные гепатиты [53].
https://rosoncoweb.ru/standarts/?chapter=chronic_viral_hepatitis
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение неврологических осложнений [54].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии. Принципы диагностики, профилактики и лечения неврологических осложнений противоопухолевой терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Латипова Д.Х. и соавт. Неврологические осложнения [55].
https://rosoncoweb.ru/standarts/?chapter=neurological_complication
- При проведении противоопухолевой гормональной терапии пациентам рекомендуется профилактика и лечение гормоноопосредованных побочных явлений [56].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии. Принципы диагностики, профилактики и лечения гормоноопосредованных побочных явлений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Стенина М.Б. и соавт. Гормоноопосредованные побочные явления [57].
https://rosoncoweb.ru/standarts/?chapter=hormone-mediated_side_events
- Пациентам при раке поджелудочной железы рекомендуется заместительная ферментная терапия в случае секреторной недостаточности [58].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Алгоритмы диагностики и лечения внешнесекреторной недостаточности при раке поджелудочной железы изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сытов А.В. и соавт. Заместительная ферментная терапия при раке поджелудочной железы [59].
https://rosoncoweb.ru/standarts/?chapter=pancreatic_enzyme_replacement_therapy
3.6. Обезболивание
Порядок и рекомендации по обезболиванию при РЯ соответствуют рекомендациям, представленным в рубрикаторе "Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи" [121].
3.7. Диетотерапия
- К настоящему моменту имеются данные о повышенном риске развития онкологических заболеваний у пациенток с избыточной массой тела (ожирением), в этой связи рекомендованы мероприятия, направленные на снижение избыточной массы тела пациенток до нормальных значений. Коррекция привычного рациона питания у таких пациенток будет способствовать профилактике осложнений проводимого лечения (хирургического, лекарственного или лучевого). [2]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
4.1. Пререабилитация
Проведение пререабилитации значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкологического заболевания. Пререабилитация включает в себя физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование больных [122].
Физическая пререабилитация состоит из комбинации аэробной и анаэробной нагрузки. Подобная комбинация улучшает толерантность к физическим нагрузкам, улучшает качество жизни и увеличивает тонус мышц.
Увеличение физической активности за 2 нед до операции улучшает качество жизни в послеоперационном периоде, позволяя вернуться к полноценной повседневной активности уже через 3 недели после операции [123].
Повышенный уровень физической активности значительно улучшает качество жизни и выживаемость пациенток с РЯ [124].
- Рекомендуется проведение ЛФК на предоперационном этапе с целью уменьшения частоты и вероятности развития послеоперационных осложнений [125].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 3).
- Рекомендуется тренировка дыхательных мышц пациентам в ходе пререабилитации в целях снижения послеоперационных легочных осложнений и продолжительности пребывания в стационаре [126].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется психологическая поддержка пациентов в рамках пререабилитации, так как она улучшает настроение, снижает уровень тревоги и депрессии у пациентов. Пациентки, прошедшие курс психологической пререабилитации, лучше адаптируются к повседневной жизни после хирургического лечения [125].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 3).
- Рекомендуется в психологической пререабилитации и поддержки пациенток использовать методики, направленные на работу со стрессом (методики релаксации, формирование позитивного настроя), в течение 40 - 60 мин 6 дней в неделю, которая начинается за 5 дней до операции и продолжается 30 дней после, что значительно улучшает качество жизни пациенток [127].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
4.2. I этап реабилитации при хирургическом лечении
- В целях уменьшения длительности пребывания пациенток в стационаре и частоты послеоперационных осложнений рекомендуется проводить реабилитацию пациентов при хирургическом лечении по программе fast track rehabilitation ("быстрый путь") и ERAS ("early rehabilitation after surgery" - "ранняя реабилитация после операции"), включающую в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, ранняя мобилизация (активизация и вертикализация) пациентов уже с 1 - 2 сут после операции не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций [128, 129].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется в рамках ранней реабилитации пациенток раннее начало выполнения комплекса ЛФК с включением в программу аэробной, силовой нагрузок и упражнений на растяжку в целях повышения физической выносливости пациентов. Раннее начало ЛФК не увеличивает частоту послеоперационных осложнений, улучшая качество жизни [130].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендуется применение побудительной спирометрии, подъем головного конца кровати более чем на 30°, раннее начало дыхательной гимнастики, гигиена полости рта 2 раза в день и ранняя активизация пациенток в целях профилактики застойных явлений в легких и послеоперационной пневмонии в послеоперационном периоде [131].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Рекомендуется профилактика венозной тромбоэмболии (ранняя активизация, назначение антитромботических средств с профилактической целью и ношение компрессионного трикотажа) у всех пациенток в послеоперационном периоде - более чем у 75% пациенток она выявляется более чем через 7 дней после операции. Кроме того, пациентки с РЯ, длительной госпитализацией и наличием венозной тромбоэмболии в анамнезе имеют повышенный риск ее развития [132].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется купирование болевого синдрома в послеоперационном периоде осуществлять с использованием междисциплинарного подхода, а также помимо медикаментозной коррекции использовать следующие методы - физическую реабилитацию (ЛФК), лечение положением, психологические методы коррекции боли (релаксация), чрескожную электростимуляцию, акупунктуру [133].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется проведение сеансов массажа медицинского, начиная со 2-х суток после операции в целях уменьшения интенсивности болевого синдрома, беспокойства, напряжения, улучшения качества жизни пациентки [134].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендовано проведение психологической коррекции и методик релаксации в послеоперационном периоде, что позволяет снизить тревожность, напряжения пациентов, кратность обезболивания и улучшить качество жизни онкогинекологических пациентов [135].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
4.3. II этап реабилитации при хирургическом лечении
- Рекомендуется активный образ жизни пациенток после завершения лечения - ожирение и малоподвижный образ жизни после комплексного лечения РЯ являются самостоятельными факторами, ухудшающими качество жизни пациенток, приводя к дистрессу [136].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациенткам рекомендуется физическая активность - сочетание силовых нагрузок, аэробных, упражнений на растяжку, что значительно улучшает качество жизни пациенток, позволяет контролировать массу тела [137].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется при возникновении лимфедемы нижних конечностей у пациентки проводить полную противоотечную терапию, включающую в себя мануальный лимфодренаж, ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [138, 139].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется при возникновении лимфедемы нижних конечностей у пациентки также назначить:
- перемежающую пневмокомпрессию конечностей в сочетании с полной противоотечной терапией [139];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- низкоинтенсивную лазеротерапию в сочетании с полной противоотечной терапией [140];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- электротерапию в сочетании с полной противоотечной терапией [141];
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- низкочастотную магнитотерапию в сочетании с полной противоотечной терапией [142];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- глубокую осцилляцию (массаж переменным электрическим полем) в сочетании с полной противоотечной терапией [143].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
- Всем пациенткам рекомендованы сеансы акупунктуры, так как она значительно уменьшает слабость и улучшает качество жизни [144].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
4.4. III этап реабилитации при хирургическом лечении
Функциональные нарушения органов малого таза в значительной степени затрудняют социальную адаптацию пациенток с опухолями женской репродуктивной системы, приводя их к физической и психологической инвалидизации [145].
Здоровый образ жизни, ежедневная физическая нагрузка позволяет контролировать такие клинические проявления менопаузы, как депрессия, слабость, а также проводить профилактику сердечно-сосудистых осложнений и осложнений, связанных с остеопорозом, у пациенток после комбинированного лечения злокачественных новообразований [63, 64]. Повышение уровня физической активности положительно влияет на сексуальную функцию у пациенток с РЯ [148].
- Рекомендованы психологическая поддержка и информирование пациенток: они позволяют улучшить качество жизни на фоне менопаузы у пациенток с РЯ [147].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендовано проведение периодических курсов медицинского массажа, так как они значительно улучшают качество жизни у онкогинекологических пациенток, уменьшая слабость, депрессию, клинические проявления менопаузы [149].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
4.5. Реабилитация при химиотерапии
- Рекомендовано всем пациенткам ежедневное выполнение комплекса ЛФК в процессе комбинированного лечения и после его окончания. Ежедневная физическая активность увеличивает мышечную силу, улучшает работу сердечно-сосудистой системы, уменьшает опасность развития тревоги и депрессии, уменьшает слабость, тошноту, рвоту, болевой синдром, улучшает настроение [150, 151].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарий: Дозированная, постепенно нарастающая физическая нагрузка улучшает переносимость химиотерапии у пациенток с онкогинекологическими заболеваниями [151].
- Рекомендовано пациенткам с анемией применение аэробной нагрузки, так как аэробная нагрузка положительно влияет на уровень гемоглобина и эритроцитов и снижает длительность лейко- и тромбоцитопении [152].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Для уменьшения усталости, слабости и депрессии на фоне химиотерапии рекомендовано проведение ЛФК. Сочетание ЛФК с психологической поддержкой в лечении слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [153].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендовано для уменьшения усталости, слабости и депрессии проведение курса массажа медицинского пациенткам в течение 6 нед на фоне комбинированного лечения [154].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: данная рекомендация сделана на основании результатов исследования влияния массажа на состояние пациентов с раком молочной железы; нет оснований предполагать, что данная терапия не будет эффективна у пациенток с РЯ.
- Рекомендованы упражнения на тренировку баланса для коррекции полинейропатии, так как они более эффективны, чем сочетание упражнений на выносливость и силовые упражнения [155].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Пациентам, получающим ХТ, рекомендован курс терренного лечения (лечения ходьбой) длительностью 6 нед в целях контроля клинических проявлений полинейропатии [156].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендуется применение низкоинтенсивной лазеротерапии в лечении периферической полинейропатии на фоне химиотерапии [157].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендована низкочастотная магнитотерапия для лечения периферической полинейропатии, возникшей на фоне ХТ [157].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендована чрескожная электростимуляция в течение 20 мин в день 4 нед в дополнение к стандартной противорвотной терапии для контроля тошноты и рвоты пациентам, получающих ХТ на основе цисплатина** [158, 159].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендована низкоинтенсивная лазеротерапия в целях профилактики мукозитов полости рта на фоне ХТ пациенту [160].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендуется применение системы охлаждения головы при проведении ХТ (аппарата для профилактики алопеции при ХТ) в целях профилактики алопеции [161, 162].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
- Всем пациентам рекомендуется выполнение комплекса ЛФК в целях снижения частоты развития кардиальных осложнений на фоне ХТ [163].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется динамическое наблюдение пациента после окончания лечения, подразумевающее обследование пациента каждые 12 - 16 нед в течение первых 2 лет, каждые 6 мес. в последующем [2, 5, 20, 164].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: Принципы наблюдения за пациентами после первичного лечения до конца не определены. Результаты крупного международного исследования MRC OV-05 [64] продемонстрировали отсутствие необходимости тщательного инструментального обследования с целью максимально раннего выявления рецидива. ХТ 2-й линии целесообразно начинать при появлении клинических симптомов. Раннее начало ХТ второй линии, например при маркерном рецидиве, не увеличивает продолжительность жизни, но ухудшает ее качество за счет побочных эффектов лечения.
Вместе с тем повторные циторедуктивные вмешательства оптимального объема могут улучшить отдаленные результаты лечения у пациентов, которым ранее была выполнена оптимальная циторедуктивная операция и длительность бесплатинового интервала после окончания химиотерапии составила > 6 мес. По этой причине члены рабочей группы предлагают следующий алгоритм наблюдения за пациентами:
- исследование уровня антигена аденогенных раков CA125 в крови, осмотр врача-гинеколога и УЗИ органов брюшной полости (комплексное) и малого таза комплексное (трансвагинальное или трансабдоминальное) 1 раз в 3 мес. в течение первых 2 лет, 1 раз в 4 мес. в течение 3-го года, далее - каждые 6 мес.;
- углубленное обследование (КТ или МРТ брюшной полости и малого таза, прицельная рентгенография органов грудной клетки/КТ органов грудной полости, ПЭТ-КТ) при повышении CA125, появлении жалоб или выявлении патологии при гинекологическом осмотре или УЗИ малого таза комплексное (трансвагинальное и трансабдоминальоне).
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 C81 - C96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее - федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики C37, C38, C40 - C41, C45 - C49, C58, D39, C62, C69 - C70, C72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней - онкология (МКБ-О), 3 издания 8936, 906 - 909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка - национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) [1] путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее - онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация отсутствует.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1
Выполнено исследование уровня антигена аденогенных раков CA125 в крови (при установлении диагноза)
1
A
2
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и забрюшинного пространства, и/или компьютерная томография органов брюшной полости, и/или магнитно-резонансная томография органов брюшной полости (при установлении диагноза).
2
B
3
Выполнено ультразвуковое исследование органов малого таза комплексное (трансвагинальное или трансабдоминальное), и/или компьютерная томография органов малого таза, и/или магнитно-резонансная томография органов малого таза (при установлении диагноза)
2
B
4
Выполнена компьютерная томография органов грудной полости и/или приицельная рентгенография органов грудной клетки и/или ПЭТ-КТ (при установлении диагноза)
2
B
5
Выполнено эндоскопическое обследование ЖКТ (эзофагогастродуоденоскопия и колоноскопия) (при установлении диагноза)
2
B
6
Выполнено обследование молочных желез всем пациенткам при установлении диагноза
2
B
7
Выполнено цитологическое исследование мазков с шейки матки и цервикального канала (при установлении диагноза)
2
B
8
Выполнено цитологическое исследование жидкости из брюшной полости (и/или плевральной полости) при ее наличии, полученной путем пункции/аспирата или интраоперационно (при установлении диагноза)
2
B
9
Выполнено патологоанатомическое исследование операционного (биопсийного) материала для верификации диагноза на диагностическом этапе (если это не представляется возможным, то получено цитологическое подтверждение) и при хирургическом вмешательстве.
1
A
10
Проведена с учетом показаний, стадии РЯ и морфологической верификации диагноза химиотерапия, и/или гормонотерапия, и/или таргетная терапия, и/или лучевая терапия.
1
A
11
12
Выполнен общий (клинический) анализ крови развернутый до начала курса химиотерапии, и/или таргетной терапии, и/или лучевой терапии
2
B
13
Выполнена адъювантная химиотерапия при наличии медицинских показаний и отсутствии медицинских противопоказаний)
2
B
14
Начат курс химиотерапии, и/или таргетной терапии, и/или гормонотерапии при выявлении клинических симптомов прогрессирования (при наличии медицинских показаний и отсутствии медицинских противопоказаний)
1
A
Список литературы
1. Pal T., Permuth-Wey J., Betts J.A. et al. BRCA1 and BRCA2 mutations account for a large proportion of ovarian carcinoma cases//Cancer. - 2005. - V. 104. - N 12. - P. 2807 - 16.
2. Rooth C. Ovarian cancer: risk factors, treatment and management//Br J Nurs. - 2013. - V. 22. - N 17. - P. S23 - 30.
3. Каприн А.Д., Старинский В.В., Шахзадова А.О. ред. Злокачественные новообразования в России в 2021 г. (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2022. 252 с.
4. Ebell M.H., Culp M.B., Radke T.J. A Systematic Review of Symptoms for the Diagnosis of Ovarian Cancer//Am J Prev Med. - 2016. - V. 50. - N 3. - P. 384 - 94.
5. NCCN guidelines panel. Epithelial Ovarian Cancer (including Fallopian Tube Cancer and Primary Peritoneal Cancer). Version 1.2016//published online: https://www.nccn.org/professionals/physician_gls/f_guidelines.asp#ovarian. - 2016. - P. OV1.
6. Zhou Q., et al. Clinicopathological and prognostic significance of platelet count in patients with ovarian cancer//Climacteric. - 2018. - Т. 21. - N. 1. - С. 60 - 68.
7. Nomelini R.S. et al. Parameters of blood count and tumor markers: a retrospective analysis and relation to prognostic factors in ovarian cancer//Eur J Gynaecol Oncol. - 2017. - Т. 38. - С. 364 - 67.
8. Ma X., et al. Prognostic significance of thrombocytosis, platelet parameters and aggregation rates in epithelial ovarian cancer//Journal of Obstetrics and Gynaecology Research. - 2014. - Т. 40. - N. 1. - С. 178 - 183.
9. Qin Y., et al. The value of red cell distribution width in patients with ovarian cancer//Medicine. - 2017. - Т. 96. - N. 17.
10. Slabuszewska-Jozwiak A., et al. The prognostic significance of thrombocytosis in ovarian cancer//Annals of Agricultural and Environmental Medicine. - 2015. - Т. 22. - N. 4.
11. Yang Z., et al. Preoperative neutrophil-to-lymphocyte ratio is a predictor of survival of epithelial ovarian cancer: a systematic review and meta-analysis of observational studies//Oncotarget. - 2017. - Т. 8. - N. 28. - С. 46414.
12. Schneider D., et al. Peritoneal fluid lactate dehydrogenase in ovarian cancer//Gynecologic oncology. - 1997. - Т. 66. - N. 3. - С. 399 - 404. DOI: 10.1006/gyno.1997.4792
13. Gu P., et al. CA 125, PET alone, PET-CT, CT and MRI in diagnosing recurrent ovari-an carcinoma: a systematic review and meta-analysis//European journal of radiology. - 2009. - Т. 71. - N. 1. - С. 164 - 174.
14. Ferraro S., et al. Serum human epididymis protein 4 vs carbohydrate antigen 125 for ovarian cancer diagnosis: a systematic review//Journal of clinical pathology. - 2013. - Т. 66. - N. 4. - С. 273 - 281.
15. Stiekema A., Boldingh Q.J., Korse C.M., et al. Serum human epididymal protein 4 (HE4) as biomarker for the differentiation between epithelial ovarian cancer and ovarian metastases of gastrointestinal origin//Gynecol Oncol. - 2015. - V. 136. - N 3. - P. 562 - 6.
16. Cui, Ranliang, et al. Clinical value of ROMA index in diagnosis of ovarian cancer: meta-analysis. Cancer management and research 28 Mar 2019; vol. 11: 2545 - 2551. doi: 10.2147/CMAR.S199400
17. Dochez V., Caillon H., Vaucel E., et al. Biomarkers and algorithms for diagnosis of ovarian cancer: CA125, HE4, RMI and ROMA, a review. J Ovarian Res 12, 28 (2019) doi: 10.1186/s13048-019-0503-7
18. Santotoribio J.D., Garcia-de la Torre A., Canavate-Solano C., et al. Cancer antigens 19.9 and 125 as tumor markers in patients with mucinous ovarian tumors//Eur J Gynaecol Oncol. - 2016. - V. 37. - N 1. - P. 26 - 9.
19. Colombo N., Peiretti M., Garbi A., et al. Non-Epithelial Ovarian Cancer: ESMO Clinical Practice Guidelines//Ann Oncol. - 2012. - V. 23 (Suppl 7). - P. vii20 - vii26.
20. Ledermann J.A., Raja F.A., Fotopoulou C., et al. Newly Diagnosed and Relapsed Epithelial Ovarian Carcinoma: ESMO Clinical Practice Guidelines//Ann Oncol. - 2013. - V. 24 (Suppl 6). - P. vi24 - vi32. doi: 10.1093/annonc/mdt333.
21. Zhong Q., et al. Effects of BRCA1-and BRCA2-related mutations on ovarian and breast cancer survival: a meta-analysis//Clinical Cancer Research. - 2015. - Т. 21. - N. 1. - P. 211 - 220.
22. Sankaranarayanan R. Screening for cancer in low- and middle-income countries//Ann Glob Health. - 2014. - V. 80. - N 5. - P. 412 - 7.
23. Holme ![]() ., et al. Effectiveness of flexible sigmoidoscopy screening in men and women and different age groups: pooled analysis of randomised trials//BMJ. - 2017. - Т. 356. - P. i6673.
., et al. Effectiveness of flexible sigmoidoscopy screening in men and women and different age groups: pooled analysis of randomised trials//BMJ. - 2017. - Т. 356. - P. i6673.
24. Roze J.F., et al. Positron emission tomography (PET) and magnetic resonance imaging (MRI) for assessing tumour resectability in advanced epithelial ovarian/fallopian tube/primary peritoneal cancer//Cochrane Database of Systematic Reviews. - 2018. - N 10.
25. Nam E.J., et al. Diagnosis and staging of primary ovarian cancer: correlation between PET/CT, Doppler US, and CT or MRI//Gynecologic oncology. - 2010. - Т. 116. - N. 3. - С. 389 - 394.
26. Fischerova D., et al. Ultrasound in preoperative assessment of pelvic and abdominal spread in patients with ovarian cancer: a prospective study//Ultrasound in Obstetrics & Gynecology. - 2017. - Т. 49. - N. 2. - P. 263 - 274.
27. Yadav B.S., Sharma S.C., Robin T.P. Synchronous primary carcinoma of breast and ovary versus ovarian metastases.//Semin Oncol. - 2015. - V. 42. - N 2. - P. e13 - 24.
28.  P.C.,
P.C.,  K.J. Screening for breast cancer with mammography//Cochrane database of systematic reviews. - 2013. - N. 6.
K.J. Screening for breast cancer with mammography//Cochrane database of systematic reviews. - 2013. - N. 6.
29. Wubulihasimu M., Maimaitusun M., Xu X.-L., Liu X.-D., Luo B.-M. The added value of contrast-enhanced ultrasound to conventional ultrasound in differentiating benign and malignant solid breast lesions: a systematic review and meta-analysis. Clinical Radiology 2018. doi: 10.1016/j.crad.2018.06.004
30. Hu Q., Wang X.Y., Zhu, S.Y., Kang L.K., Xiao Y.J., Zheng H.Y. Meta-analysis of contrast-enhanced ultrasound for the differentiation of benign and malignant breast lesions. Acta Radiologica 2015; 56 (1): 25 - 33. doi: 10.1177/0284185113517115
31. van de Vrie R., Rutten M.J., Asseler J., Leeflang M.M.G., Kenter G.G., Mol B.J., Buist M. Laparoscopy for diagnosing resectability of disease in women with advanced ovarian cancer. Cochrane Database of Systematic Reviews 2019, Issue 3. Art. No.: CD009786. doi: 10.1002/14651858.CD009786.pub3
32. Stuart G., Kitchener H., Bacon M. et al. 2010 Gynecologic Cancer InterGroup (GCIG) Consensus Statement on Clinical Trials in Ovarian Cancer Int J Gynecol Cancer 2011; 21: 750Y755.
33. Trimbos J.B., Parmar M., Vergote I.. et al. International Collaborative Ovarian Neoplasm trial I and Adjuvant ChemoTherapy In Ovarian Neoplasm trial: two parallel randomized phase III trials of adjuvant chemotherapy in patients with early-stage ovarian carcinoma. Journal of the National Cancer Institute, Volume 95, Issue 2, 15 January 2003, Pages 105 - 112, https://doi.org/10.1093/jnci/95.2.105
34. Zhou M., et al. Tumor regression grading after neoadjuvant chemotherapy predicts long-term outcome of stage IIIC epithelial ovarian cancer//J Clin Oncol 2018 36: 15_suppl, 5547 - 5547.
35. AJCC. PART III: digestive systems. In: Edge S.B., Byrd D.R., Compton C.C., Fritz A.G., Greene F.L., Trotti A. III, eds. AJCC cancer staging manual. 7th ed. New York: Springer; 2010. P. 103 - 26.
36. Elattar A., et al. Optimal primary surgical treatment for advanced epithelial ovarian cancer//Cochrane database of systematic reviews. - 2011. - N 8. 2A.
37. Huo Y.R., et al. Hyperthermic intraperitoneal chemotherapy (HIPEC) and cytoreductive surgery (CRS) in ovarian cancer: a systematic review and meta-analysis//European Journal of Surgical Oncology (EJSO). - 2015. - Т. 41. - N. 12. - С. 1578 - 1589.
38. Cardenas-Goicoechea J., et al. Minimally invasive interval cytoreductive surgery in ovarian cancer: systematic review and meta-analysis//Journal of robotic surgery. - 2019. - Т. 13. - N. 1. - P. 23 - 33.
39. Elattar A., et al. Optimal primary surgical treatment for advanced epithelial ovarian cancer//Cochrane database of systematic reviews. - 2011. - N 8. 2A.
40. Huo Y.R., et al. Hyperthermic intraperitoneal chemotherapy (HIPEC) and cytoreductive surgery (CRS) in ovarian cancer: a systematic review and meta-analysis//European Journal of Surgical Oncology (EJSO). - 2015. - Т. 41. - N. 12. - С. 1578 - 1589.
41. Cardenas-Goicoechea J., et al. Minimally invasive interval cytoreductive surgery in ovarian cancer: systematic review and meta-analysis//Journal of robotic surgery. - 2019. - Т. 13. - N. 1. - С. 23 - 33.
42. Young R.C., Walton L.A., Ellenberg S.S., et al. Adjuvant therapy in stage I and stage II epithelial ovarian cancer//N Engl J Med. - 1990. - V. 322. - P. 1021 - 7.
43. Young R.C., Brady M.F., Nieberg R.M., et al. Adjuvant treatment for early ovarian cancer: a randomized phase III trial of intraperitoneal 32P or intravenous cyclophosphamide and cisplatin - A Gynecologic Oncology Group study//J Clin Oncol 2003. - V 21. - N 23. P. 4350 - 5.
44. Bolis G., Colombo N., Pecorelli S., et al. Adjuvant treatment for early epithelial ovarian cancer: results of two randomized clinical trials comparing cisplatin to no further treatment or chromic phosphate (32P). GICOG: Gruppo Interregionale Collaborativo in Ginecologia Oncologica//Ann Oncol. - 1995. - V. 6, N 9. - P. 887 - 93.
45. Elattar A., et al. Optimal primary surgical treatment for advanced epithelial ovarian cancer//Cochrane database of systematic reviews. - 2011. - N. 8. 2A.
46. Vergote I., Trope C.G., Amant F., et al. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer//N Engl J Med. - 2010. - V. 363. - P. 943 - 53.
47. Yang L., et al. Neoadjuvant chemotherapy versus primary debulking surgery in advanced epithelial ovarian cancer: A meta-analysis of peri-operative outcome//PloS One. - 2017. - Т. 12. - N. 10. - С. e0186725.
48. Xiao Y., et al. Platinum-Based Neoadjuvant Chemotherapy versus Primary Surgery in Ovarian Carcinoma International Federation of Gynecology and Obstetrics Stages IIIc and IV: A Systematic Review and Meta-Analysis//Gynecologic and obstetric investigation. - 2018. - Т. 83. - N. 3. - С. 209 - 219.
49. Harter P., Sehouli J., Lorusso D., et al. A Randomized Trial of Lymphadenectomy in Patients with Advanced Ovarian Neoplasms//N Engl J Med. - 2019. - V. 380. - P. 822 - 832.
50. Zhou J., Shan G., Chen Y. The effect of lymphadenectomy on survival and recurrence in patients with ovarian cancer: a systematic review and meta-analysis//Japanese journal of clinical oncology. - 2016. - Т. 46. - N. 8. - С. 718 - 726.
51. Lawrie T.A., et al. Adjuvant (post-surgery) chemotherapy for early stage epithelial ovarian cancer//Cochrane Database of Systematic Reviews. - 2015. - N 12.
52. Katsumata N., et al. Dose-dense paclitaxel once a week in combination with carboplatin every 3 weeks for advanced ovarian cancer: a phase 3, open-label, randomised controlled trial. Lancet. 2009 Oct 17; 374 (9698): 1331 - 8. doi: 10.1016/S0140-6736(09)61157-0. Epub 2009 Sep 18.
53. Kurman A., Hoskins P.J., Tinker A.V. Clinical oncology (Royal College of Radiologists (Great Britain)), 2015. Vol. 27, Issue 1, P. 40 - 7. doi: https://doi.org/10.1016/j.clon.2014.10.001.
54. Armstrong D.K., et al. Intraperitoneal Cisplatin and Paclitaxel in Ovarian Cancer//N Engl J Med 2006; 354: 34 - 43 doi: 10.1056/NEJMoa052985
55. Gorodnova T.V., Kotiv K.B., Ivantsov A.O., Mikheyeva O.N., Mikhailiuk G.I., Lisyanskaya A.S., et al. Efficacy of Neoadjuvant Therapy With Cisplatin Plus Mitomycin C in BRCA1-Mutated Ovarian Cancer. Int J Gynecol Cancer. 2018; 28 (8): 1498 - 1506.
56. Oza A.M., Cook A.D., Pfisterer J., et al. Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase 3 randomised trial//The Lancet Oncology. 2015. - V. 16, N 8. - P. 928 - 936.
57. Li J., Zhou L., Chen X., Ba Y. Addition of bevacizumab to chemotherapy in patients with ovarian cancer: a systematic review and meta-analysis of randomized trials. Clinical and Translational Oncology 2015; 17 (9): 673 - 683. doi: 10.1007/s12094-015-1293 - z. 58. версия 1.
58. версия 2 Ray-Coquard I, Leary A, Pignata S, Cropet C,  A, Marth C, Nagao S, Vergote I, Colombo N,
A, Marth C, Nagao S, Vergote I, Colombo N,  J, Selle F, Sehouli J, Lorusso D, Guerra Alia EM, Bogner G, Yoshida H, Lefeuvre-Plesse C, Buderath P, Mosconi AM, Lortholary A, Burges A, Medioni J, El-Balat A, Rodrigues M, Park-Simon TW, Dubot C, Denschlag D, You B, Pujade-Lauraine E, Harter P; PAOLA-1/ENGOT-ov25 investigators. Olaparib plus bevacizumab first-line maintenance in ovarian cancer: final overall survival results from the PAOLA-1/ENGOT-ov25 trial. Ann Oncol. 2023 Aug; 34 (8): 681 - 692. doi: 10.1016/j.annonc.2023.05.005. Epub 2023 May 19. PMID: 37211045.
J, Selle F, Sehouli J, Lorusso D, Guerra Alia EM, Bogner G, Yoshida H, Lefeuvre-Plesse C, Buderath P, Mosconi AM, Lortholary A, Burges A, Medioni J, El-Balat A, Rodrigues M, Park-Simon TW, Dubot C, Denschlag D, You B, Pujade-Lauraine E, Harter P; PAOLA-1/ENGOT-ov25 investigators. Olaparib plus bevacizumab first-line maintenance in ovarian cancer: final overall survival results from the PAOLA-1/ENGOT-ov25 trial. Ann Oncol. 2023 Aug; 34 (8): 681 - 692. doi: 10.1016/j.annonc.2023.05.005. Epub 2023 May 19. PMID: 37211045.
59. Gershenson D., Bodurka D., Coleman R. et al. Hormonal Maintenance Therapy for Women With Low-Grade Serous Cancer of the Ovary or Peritoneum//J Clin Oncol. - 2017. In print.
60. Langdon S. P. et al. Endocrine therapy in epithelial ovarian cancer//Expert review of anticancer therapy. - 2017. - Т. 17. - N. 2. - С. 109 - 117.
61. Chen H., et al. Maintenance chemotherapy for ovarian cancer//Cochrane database of systematic reviews. - 2013. - N. 6.
62. Rustin G.J., Vergote I., Eisenhauer E., et al. Definitions for Response and Progression in Ovarian Cancer Clinical Trials Incorporating RECIST 1.1 and CA 125 Agreed by the Gynecological Cancer Intergroup (GCIG)//Int J Gynecol Cancer. - 2011. - V 21, N 2. - P. 419 - 23.
63. Al Rawahi T., et al. Surgical cytoreduction for recurrent epithelial ovarian cancer//Cochrane Database of Systematic Reviews. - 2013. - N. 2.
64. Rustin G.J., van der Burg M.E., Griffin C.L., et al. Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955): a randomised trial//Lancet. - 2010. - V. 376, N 9747. - P. 1155 - 63.
65. Harter P., du Bois A., Hahmann M., et al. Surgery in recurrent ovarian cancer: the Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) DESKTOP OVAR trial//Ann Surg Oncol. - 2006. - V. 13, N 12. - P. 1702 - 10.
66. Harter P., Sehouli J., Reuss A., et al. Prospective validation study of a predictive score for operability of recurrent ovarian cancer: the Multicenter Intergroup Study DESKTOP II. A project of the AGO Kommission OVAR, AGO Study Group, NOGGO, AGO-Austria, and MITO//Int J Gynecol Cancer. - 2011. - V. 21, N 2. - P. 289 - 95.
67. Al Rawahi T., et al. Surgical cytoreduction for recurrent epithelial ovarian cancer//Cochrane Database of Systematic Reviews. - 2013. - N. 2.
68. Markman M., Rothman R., Hakes T., et al. Second-line platinum therapy in patients with ovarian cancer previously treated with cisplatin. J Clin Oncol 1991; 9: 389 - 393.
69. Gore M., Fryatt I., Wiltshaw E., Dawson T. Treatment of relapsed carcinoma of the ovary with cisplatin or carboplatin following initial treatment with these components. Gynecol Oncol 36: 207 - 211, 1990.
70. Mahner S., Meier W., du Bois A., et al. Carboplatin and pegylated liposomal doxo-rubicin versus carboplatin and paclitaxel in very platinum-sensitive ovarian cancer patients: results from a subset analysis of the CALYPSO phase III trial. Eur J Cancer. 2015; 51 (3): 352 - 8.
71. The ICON and AGO Collaborators Paclitaxel plus platinum-based chemotherapy versus conventional platinum-based chemotherapy in women with relapsed ovarian cancer: the ICON4/AGO-OVAR-2.2 trial//Lancet. - 2003. - V. 361. - P. 2099 - 106.
72. Lawrie TA, Bryant A, Cameron A, Gray E, Morrison J. Pegylated liposomal doxorubicin for relapsed epithelial ovarian cancer. Cochrane Database Syst Rev. 2013 Jul 9; 2013 (7): CD006910. doi: 10.1002/14651858.CD006910.pub2.
73. Gershenson D.M., et al. A phase I study of a dailyx 3 schedule of intravenous vi-norelbine for refractory epithelial ovarian cancer//Gynecologic oncology. - 1998. - Т. 70. - N. 3. - С. 404 - 409.
74. Ray-Coquard I., et al. Gemcitabine-oxaliplatin combination for ovarian cancer resistant to taxane-platinum treatment: a phase II study from the GINECO group. Brit J Cancer 2009; 100 (4): 601 - 7. doi: 10.1038/sj.bjc.6604878
75. Recchia F., et al. Phase I study of liposomal doxorubicin and oxaliplatin as salvage chemotherapy in advanced ovarian cancer/Anticancer Drugs. 2003 Sep; 14 (8): 633-8/DOI: 10.1097/00001813-200309000-00008.
76. Harnett P., et al. Phase II study of gemcitabine and oxaliplatin in patients with recurrent ovarian cancer: an Australian and New Zealand Gynaecological Oncology Group study/Int J Gynecol Cancer. 2007 Mar - Apr; 17 (2): 359 - 66. doi: 10.1111/j.1525-1438.2007.00763.x
77. Wolf J.K., et al. A phase II trial of oral capecitabine in patients with platinum-and taxane-refractory ovarian, fallopian tube, or peritoneal cancer//Gynecol Oncol. - 2006. - Т. 102. - N. 3. - Р. 468 - 474. doi: 10.1016/j.ygyno.2005.12.040.
78. Sugiyama T., et al. Irinotecan (CPT-11) combined with cisplatin in patients with refrac-tory or recurrent ovarian cancer/Cancer Lett. 1998 Jun 19; 128 (2): 211 - 8. doi: 10.1016/s0304-3835(98)00065-2.
79. Conteduca V., Gurioli G., Rossi L., et al. Oxaliplatin plus leucovorin and 5-fluorouracil (FOLFOX-4) as a salvage chemotherapy in heavily-pretreated platinum-resistant ovarian cancer. BMC Cancer; 2018: 1267.
80. Kumar A., et al. Chemotherapy is of Value in Second Line and Beyond, Relapsed High-grade, Serous Epithelial Ovarian Cancer: An Analysis of Outcomes Obtained With Oral Etoposide/Am J Clin Oncol. 2018 Apr; 41 (4): 379 - 384. doi: 10.1097/COC.0000000000000281.
81. Bajetta E., et al. Phase II study of vinorelbine in patients with pretreated advanced ovarian cancer: activity in platinum-resistant disease./J Clin Oncol. 1996 Sep; 14 (9): 2546 - 51. DOI: 10.1200/JCO.1996.14.9.2546
82. Sehouli J., et al. Topotecan Weekly Versus Conventional 5-Day Schedule in Patients With Platinum-Resistant Ovarian Cancer: a randomized multicenter phase II trial of the North-Eastern German Society of Gynecological Oncology Ovarian Cancer Study Group//J Clin Oncol. 2011 Jan 10; 29 (2): 242 - 8. doi: 10.1200/JCO.2009.27.8911. Epub 2010 Nov 29. doi: 10.1200/JCO.2009.27.8911
83. Poveda A., et al. Phase II randomized study of PM01183 versus topotecan in patients with platinum-resistant/refractory advanced ovarian cancer. Ann Oncol 2017; 28 (6): 1280 - 1287. doi: 10.1093/annonc/mdx111
84. Gynecologic Oncology Group, Markman M, Blessing J et al. Phase II trial of weekly paclitaxel (80 mg/m2) in platinum and paclitaxel-resistant ovarian and primary peritoneal cancers: a Gynecologic Oncology Group study. Gynecol Oncol. 2006 Jun; 101 (3): 436 - 40. doi: 10.1016/j.ygyno.2005.10.036
85. Vergote I., et al. A randomised, double-blind, phase II study of two doses of pemetrexed in the treatment of platinum-resistant, epithelial ovarian or primary peritoneal cancer. Eur J Cancer. 2009; 45 (8): 1415 - 23. doi: 10.1016/j.ejca.2008.12.013.
86. El-Husseiny K., et al. Continuous Low-Dose Oral Cyclophosphamide and Methotrexate as Maintenance Therapy in Patients With Advanced Ovarian Carcinoma After Complete Clinical Response to Platinum and Paclitaxel Chemotherapy. Int J Gynecol Cancer. 2016; 26 (3): 437 - 42. doi: 10.1097/IGC.0000000000000647
87. Langdon S.P., et al. Endocrine therapy in epithelial ovarian cancer./Expert Rev Anti-cancer Ther. 2017 Feb; 17 (2): 109 - 117. doi: 10.1080/14737140.2017.1272414. Epub 2016 Dec 24./DOI:10.1080/14737140.2017.12724
88. Aghajanian C., Goff B., Nycum L.R., et al. Final overall survival and safety analy-sis of OCEANS, a phase 3 trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent ovarian cancer//Gynecol Oncol. - 2015. - V. 139, N 1. - P. 10 - 6. doi: 10.1016/j.ygyno.2015.08.004
89. Pujade-Lauraine E., Hilpert F. Weber B. et al. Bevacizumab Combined With Chemotherapy for Platinum-Resistant Recurrent Ovarian Cancer: The AURELIA Open-Label Randomized Phase III Trial//J Clin Oncol. - 2014. - 32 (13): 1302 - 8. doi: 10.1200/JCO.2013.51.4489
90. Oza A.M., et al. Standart chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase3 randomised trial. V 16(8). P. 928 - 936. doi: 10.1016/S1470-2045(15)00086-8
91. Gorodnova T.V., Sokolenko A.P., Kondratiev S.V., Kotiv K.B., Belyaev A.M., Berlev I.V., Imyanitov E.N. Mitomycin C plus cisplatin for systemic treatment of recurrent BRCA1-associated ovarian cancer. Invest New Drugs. 2020; 38(6): 1872 - 1878.
92. Pujade-Lauraine E. et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial//The lancet oncology. - 2017. - Т. 18. - N. 9. - С. 1274 - 1284. doi: 10.1016/S1470-2045(17)30469-2.
93. Pujade-Lauraine, et al. Presented at ESMO Virtual Congress 2021; 16 - 21 September (Oreo).
94. Wagner, U., et al. Final overall survival results of phase III GCIG CALYPSO trial of pegylated liposomal doxorubicin and carboplatin vs paclitaxel and carboplatin in platinum-sensitive ovarian cancer patients. Brit J Cancer vol. 2012; 107 (4): 588 - 91. doi: 10.1038/bjc.2012.307
95. Colombo N., et al. INOVATYON study: Randomized phase III international study compar-ing trabectedin/PLD followed by platinum at progression vs carboplatin/PLD in patients with recurrent ovarian cancer progressing within 6 - 12 months after last platinum line. Ann Oncol 2020; 31 (suppl_4): S1142 - S1215.
96. Hoskins P.J., Le N. Identifying patients unlikely to benefit from further chemotherapy: A descriptive study of outcome at each relapse in ovarian cancer//Gynecol Oncol 2005. - V. 97. - P. 862 - 869.
97. Ledermann J., Harter P., Gourley C., et al. Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol. 2014 Jul; 15 (8): 852 - 61.
98. Wiggans A.J., et al. Poly (ADP-ribose) polymerase (PARP) inhibitors for the treatment of ovarian cancer//Cochrane Database of Systematic Reviews. - 2015. - N. 5.
99. Swenerton K.D., Santos J.L., Gilks C.B. et al. Histotype predicts the curative potential of radiotherapy: the example of ovarian cancers//Ann Oncol - 2011. - V. 22. - P. 341 - 347.
100. Einhorn N. Ovarian Cancer. Acta Oncol 1996; 35 (sup7): 86 - 92. doi: 10.3109/02841869609101668
101. Navari RM, Gray SE, Kerr AC. Olanzapine versus aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a randomized phase III trial. J Support Oncol 2011; 9 (5): 188 - 95.
102. Владимирова Л.Ю., Гладков О.А., Королева И.А., Румянцев А.А., Семиглазова Т.Ю., Трякин А.А. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 (том 11). 37. https://www.rosoncoweb.ru/standarts/RUSSCO/2021/2021-37.pdf.
103. Sonal Krishan, Nalinda Panditaratne, Rajeev Verma, Roderick Robertson. Incremental value of CT venography combined with pulmonary CT angiography for the detection of thromboembolic disease: systematic review and meta-analysis. AJR Am J Roentgenol 2011; 196 (5): 1065 - 72.
104. Wendy Lim, Gregoire Le Gal, Shannon M. Bates, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: diagnosis of venous thromboembolism. Blood Adv 2018; 2 (22): 3226 - 3256.
105. Lyman G.H., Carrier M., Cihan A., et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv 2021; 5 (4): 927 - 974.
106. Сомонова О.В., Антух Э.А., Долгушин Б.И., Елизарова А.Л., Сакаева Д.Д., Сельчук В.Ю., Трякин А.А., Черкасов В.А. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021; (том 11): 47.
107. NCCN Guidelines. Prevention and Treatment of Cancer-Related Infections. v.1, 2021. https://www.nccn.org/professionals/physician_gls/pdf/infections.pdf.
108. Yoshimasa K., Yoshiaki R., Norikazu M., et al. Phase III placebo-controlled, double-blind, randomized trial of pegfilgrastim to reduce the risk of febrile neutropenia in breast cancer patients receiving docetaxel/cyclophosphamide chemotherapy. Support Care Cancer 2015; 23 (4): 1137 - 43.
109. Paul M., Yahav D., Fraser A., Leibovici L. Empirical antibiotic monotherapy for febrile neutropenia: systematic review and meta-analysis of randomized controlled trials. Journal of Antimicrobial Chemotherapy, Vol 57, Issue 2, Feb 2006, P. 176 - 189.
110. Сакаева Д.Д., Курмуков И.А., Орлова Р.В., Шабаева М.М. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021; (том 11): 39. https://www.rosoncoweb.ru/standarts/RUSSCO/2021/2021-39.pdf.
111. Vincenzi B., Russo A., Terenzio A., et al. The use of SAMe in chemotherapy-induced liver injury. Crit Rev Oncol Hematol 2018 Oct; 130: 70 - 77.
112. Remash D., Prince D.S., McKenzie C., et al. Immune checkpoint inhibitor-related hepatotoxicity: A review. World J Gastroenterol 2021; 27 (32): 5376 - 5391.
113. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021; (том 11): 40. https://www.rosoncoweb.ru/standarts/RUSSCO/2021/2021-40.pdf
114. Mao Z., Shen K., Zhu L., et al. Comparisons of Cardiotoxicity and Efficacy of Anthracycline-Based Therapies in Breast Cancer: A Network Meta-Analysis of Randomized Clinical Trials. Oncol Res Treat 2019; 42 (7 - 8): 405 - 413.
115. Albakri A. Systolic heart failure: A review of clinical status and metaanalysis of diagnosis and clinical management methods. Trends in Res, 2018, 1(4), doi: 10.15761/TR.1000124.
116. Tromp J., Ouwerkerk W., van Veldhuisen D.J., et al. A Systematic Review and Network-Meta-Analysis of Pharmacological Treatment of Heart Failure With Reduced Ejection Fraction. J Am Coll Cardiol HF. Dec 08, 2021.
117. Kashif Kalam, Thomas H.Marwick. Role of cardioprotective therapy for prevention of cardiotoxicity with chemotherapy: A systematic review and meta-analysis. Eur J Cancer 2013; 49 (13): 2900 - 9.
118. Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021; (том 11): 41. https://www.rosoncoweb.ru/standarts/RUSSCO/2021/2021-41.pdf
119. Li J., Yan H. Skin toxicity with anti-EGFR monoclonal antibody in cancer patients: a meta-analysis of 65 randomized controlled trials. Cancer Chemother Pharmacol 2018; 82 (4): 571 - 583.
120. Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В. и соавт. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021; (том 11): 42. https://www.rosoncoweb.ru/standarts/RUSSCO/2021/2021-42.pdf.
121. http://cr.rosminzdrav.ru/#!/recomend/708.
122. Silver J.A., Baima J. Cancer prehabilitation: an opportunity to decrease treatmentrelated morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2103; 92: 715 - 727.
123. Nilsson H., Angeras U., Bock D.,  M., Onerup A., Fagevik Olsen M., et al. Is preoperative physical activity related to post-surgery recovery? BMJ Open. 2016; 6 (1): e007997. doi: 10.1136/bmjopen-2015-007997
M., Onerup A., Fagevik Olsen M., et al. Is preoperative physical activity related to post-surgery recovery? BMJ Open. 2016; 6 (1): e007997. doi: 10.1136/bmjopen-2015-007997
124. Zhou Y., et al. Body mass index, physical activity, and mortality in women diagnosed with ovarian cancer: results from the Women"s Health Initiative. Gynecol Oncol 2014; 133 (1): 4 - 10.
125. Hijazi Y., Gondal U., Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery. Int J Surg. 2017 Mar; 39: 156 - 162. doi: 10.1016/j.ijsu.2017.01.111. Epub 2017 Feb 2.
126. Silver J.K., Baima J. Cancer prehabilitation: An opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil. 2013; 92: 715 - 27.
127. Tsimopoulou I., Pasquali S., Howard R., Desai A., Gourevitch D., Tolosa I., Vohra R. Psychological Prehabilitation Before Cancer Surgery: A Systematic Review. Ann Surg Oncol. 2015 Dec; 22 (13): 4117 - 23. DOI: 10.1245/s10434-015-4550-z. Epub 2015 Apr 14.
128. Carter J. Fast-Track Surgery in Gynaecology and Gynaecologic Oncology: A Review of a Rolling Clinical Audit. ISRN Surgery. Vol. 2012, Article ID 368014, 19 p., 2012.
129. Nelson G., Bakkum-Gamez J., Kalogera E., et al Guidelines for perioperative care in gynecologic/oncology: Enhanced Recovery After Surgery (ERAS) Society recommendations - 2019 update International Journal of Gynecologic Cancer Published Online First: 15 March 2019. doi: 10.1136/ijgc-2019-000356
130. De Almeida E.P.M., De Almeida J.P., Landoni G., Galas F.R.B.G., Fukushima J.T., Fominskiy E., et al. Early mobilization programme improves functional capacity after major abdominal cancer surgery: A randomized controlled trial. Brit J Anaesth 2017; 119 (5): 900 - 907.
131. Wren S.M., Martin M., Yoon J.K., Bech F. Postoperative pneumonia-prevention program for the inpatient surgical ward//Journal of the American College of Surgeons. - 2010. - Vol. 210, No. 4 - Pp. 491 - 495.
132. Peedicayil A., Weaver A., Li X., Carey E., Cliby W., Mariani A. Incidence and timing of venous thromboembolism after surgery for gynecological cancer//Gynecol Oncol. - 2011. - Vol. 121, No. 1. - Pp. 64 - 69.
133. Swarm R., Abernethy A.P., Anghelescu D.L. et al. NCCN Adult Cancer Pain. Adult cancer pain. J Natl Compr Canc Netw. 2010; 8: 1046 - 1086.
134. Ben-Arye E., Samuels N., Lavie O. Integrative Medicine for Female Patients with Gynecologic Cancer//The Journal of Alternative and Complementary Medicine. - Vol. 24, No. 9 - 10.
135. Goerling U., Jaeger C., Walz A., et al. The efficacy of psychooncological interventions for women with gynaecological cancer: A randomized study//Oncology. 2014; 87: 114 - 124. Crossref, Medline.
136. Smits A., Lopes A., Bekkers R., et al. Body mass index and the quality of life of endometrial cancer survivors - a systematic review and meta-analysis//Gynecol Oncol 2015; 137: 180 - 7. doi: 10.1016/j.ygyno.2015.01.540
137. Schmitz K.H., Courneya K.S., Matthews C., et al. American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports Exerc 2010; 42: 1409 - 26.
138. Biglia N., Zanfagnin V., Daniele A., Robba E., Bounous V.E. Lower Body Lymphedema in Patients with Gynecologic Cancer. Anticancer Res. 2017; 37 (8): 4005 - 15.
139. Shaitelman S.F., Cromwell K.D., Rasmussen J.C., Stout N.L., Armer J.M., Lasinski B.B., Cormier J.N. Recent progress in the treatment and prevention of cancer-related lymphedema. CA Cancer J Clin. 2015 Jan - Feb; 65 (1): 55 - 81. doi: 10.3322/caac.21253. Epub 2014 Nov 19. Erratum in: CA Cancer J Clin. 2015 May - Jun; 65 (3): 252. PMID: 25410402.
140. Borman P. Lymphedema diagnosis, treatment, and follow-up from the view point of physical medicine and rehabilitation specialists. Turk J Phys Med Rehab 2018; 64 (3): 179 - 197.
141. Piller N., Douglass J., Heidenreich B., Moseley A. Placebo controlled trial of mild electrical stimulation. Journal of Lymphoedema. - 2010. - Vol 5, No 1. - P. 15 - 25.
142. Грушина Т.И. Реабилитация в онкологии: физиотерапия. - М.: ГЭОТАР-Медиа, 2006. - 240 с.
143. McNeely M.L., Peddle C.J., Yurick J.L., Dayes I.S., Mackey J.R. Conservative and dietary interventions for cancer-related lymphedema: A Systematic review and meta-analysis. Cancer. 2011 Mar 15; 117 (6): 1136 - 48.
144. Zhang Y.L., Huiling L., Yan L., Li H., Tian В. Effects of acupuncture on cancer-related fatigue: a meta-analysis//Supportive Care in Cancer. - 2018. - V. 26, Issue 2. - P. 415 - 425.
145. Huffman L.B., Hartenbach E.M., Carter J., Rash J.K., Kushner D.M. Maintaining sexual health throughout gynecologic cancer survivorship: A comprehensive review and clinical guide. Gynecol Oncol. 2016 Feb; 140 (2): 359 - 68. doi: 10.1016/j.ygyno.2015.11.010. Epub 2015 Nov 7. PubMed PMID: 26556768; PubMed Central PMCID: PMC4835814.
146. Carmody J.F., Crawford S., Salmoirago-Blotcher E., Leung K., Churchill L., Olendzki N. Mindfulness training for coping with hot flashes: results of a randomized trial. Menopause. 2011 June; 18 (6): 611 - 20. DOI: 10.1097/gme.0b013e318204a05c.
147. Ferrandina G., Petrillo M., Mantegna G., Fuoco G., Terzano S., Venditti L., et al. Evaluation of quality of life and emotional distress in endometrial cancer patients: a 2-year prospective, longitudinal study. Gynecol Oncol. 2014 Jun; 133 (3): 518 - 25. doi: 10.1016/j.ygyno.2014.03.015.
148. Armbruster S.D., Song J., Bradford A. et al. Sexual health of endometrial cancer survivors before and after a physical activity intervention: A retrospective cohort analysis. Gynecol Oncol 2016; 143: 589 - 595. Crossref, Medline, Google Scholar.
149. Lawvere, Silvana. (2002). The effect of massage therapy in ovarian cancer patients. doi: 10.1016/B978-0-7234-3217-3.50009-0
150. Hu H., Xie Z.G., Qin W.L. Effect of electroacupuncture intervention at different phases of post-operation on bladder function in patients undergoing cervical cancer operation. Zhen Ci Yan Jiu 2013; 38: 64 - 67, 77. Medline, Google Scholar.
151. Cannioto R.A., Moysich K.B. Epithelial ovarian cancer and recreational physical activity: A review of the epidemiological literature and implications for exercise prescription. Gynecol Oncol, 2015. 137 (3): P. 559 - 73.
152. Hu M., Lin W. Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol. 2012; 127 (3): 156 - 64. Epub 2012 Jan 31.
153. Mustian K.M., Alfano C.M., Heckler C.. et al. Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017; 3: 961 - 968.
154. Kinkead B., Schettler P.J., Larson E.R., Carroll D., Sharenko M., Nettles J., et al. Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. Cancer. 2018 Feb 1; 124 (3): 546 - 554. DOI: 10.1002/cncr.31064.
155. Streckmann F., Zopf E.M., Lehmann H.C. et al: Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014; 44: 1289 - 1304.
156. Kleckner I.R., Kamen C., Gewandter J.S., et al. Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support Care Cancer 2018; 26: 1019 - 1028.
157. Rick O., von Hehn U., Mikus E., Dertinger H., Geiger G. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. Bioelectromagnetics 2016; 38 (2): 85 - 94.
158. ![]() M.,
M.,  A.,
A.,  S.A., Tan E. Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med. 2014 May; 46 (5): 454 - 60. doi: 10.2340/16501977-1271
S.A., Tan E. Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med. 2014 May; 46 (5): 454 - 60. doi: 10.2340/16501977-1271
159. Pearl M.L., et al. Transcutaneous electrical nerve stimulation as an adjunct for controlling chemotherapy-induced nausea and vomiting in gynecologic oncology patients//Cancer nursing. - 1999. - Т. 22. - N. 4. - С. 307 - 311.
160. Oberoi S., Zamperlini-Netto G., Beyene J., Treister N.S., Sung L. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. Send to PLoS One. 2014 Sep 8; 9 (9): e107418. DOI: 10.1371/journal.pone.0107418. eCollec-tion 2014.
161. Ross M., Fischer-Cartlidge E. Scalp Cooling: A Literature Review of Efficacy, Safety, and Tolerability for Chemotherapy-Induced Alopecia. Clin J Oncol Nurs. 2017 Apr 1; 21 (2): 226 - 233. doi: 10.1188/17.CJON.226-233
162. Avci P., Gupta G.K., Clark J., Wikonkal N., Hamblin M.R. Low-level laser (light) therapy (LLLT) for treatment of hair loss. Lasers in surgery and medicine 2013; 46 (2): 144 - 51.
163. Spence R.R., et al. Exercise and cancer rehabilitation: A systematic review. Cancer Treatment Reviews. - V. 36, Issue 2. - P. 185 - 194.
164. Kew F., et al. Evaluation of follow-up strategies for patients with epithelial ovarian cancer following completion of primary treatment//Cochrane Database of Systematic Reviews. - 2011. - N. 6.
165. Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5 (6): 649 - 55.
166. Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949:191 - 205.
167. Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45 (2): 228 - 47. doi: 10.1016/j.ejca.2008.10.026
168. Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken) 2011; 63 (Suppl 11): S240 - 52.
167. ESUR guidelines: ovarian cancer staging and follow-up. Forstner R, Sala E, Kinkel K, Spencer JA; European Society of Urogenital Radiology. Eur Radiol. 2010 Dec; 20 (12): 2773 - 80. doi: 10.1007/s00330-010-1886-4. Epub 2010 Sep 14. PMID: 20839002
168. O-RADS US Risk Stratification and Management System: A Consensus Guideline from the ACR Ovarian-Adnexal Reporting and Data System Committee//R. F. Andreotti et al., Radiology, 2019 (https://www.acr.org/Clinical-Resources/Reporting-and-Data-Systems/O-RADS)
169. Wang WH, Zheng CB, Gao JN, Ren SS, Nie GY, Li ZQ. Systematic review and meta-analysis of imaging differential diagnosis of benign and malignant ovarian tumors. Gland Surg. 2022 Feb; 11 (2): 330 - 340. doi: 10.21037/gs-21-889. PMID: 35284306; PMCID: PMC8899432.
170. American College of Radiology. ACR Appropriateness  : Clinically Suspected Adnexal Mass. Available at: https://acsearch.acr.org/docs/69466/Narrative/. Accessed March 30, 3018.
: Clinically Suspected Adnexal Mass. Available at: https://acsearch.acr.org/docs/69466/Narrative/. Accessed March 30, 3018.
171. ESUR recommendations for MR imaging of the sonographically indeterminate adnexal mass: an update. Forstner R, Thomassin-Naggara I, Cunha TM, Kinkel K, Masselli G, Kubik-Huch R, Spencer JA, Rockall A. Eur Radiol. 2017 Jun; 27 (6): 2248 - 2257. doi: 10.1007/s00330-016-4600-3. Oct 21. PMID: 27770228
172. Michielsen K, Dresen R, Vanslembrouck R, et al. Diagnostic value of whole body diffusion-weighted MRI compared to computed tomography for pre-operative assessment of patients suspected for ovarian cancer. Eur J Cancer 2017; 83: 88 - 98.;
173. Vandecaveye V, Dresen R, De Keyzer F. Novel imaging techniques in gynaecological cancer. Curr Opin Oncol 2017; 29: 335 - 42;
174. ACR Appropriateness  Staging and Follow-Up of Ovarian Cancer. Expert Panel on Women's Imaging:; Kang SK, Reinhold C, Atri M, Benson CB, Bhosale PR, Jhingran A, Lakhman Y, Maturen KE, Nicola R, Pandharipande PV, Salazar GM, Shipp TD, Simpson L, Small W Jr, Sussman BL, Uyeda JW, Wall DJ, Whitcomb BP, Zelop CM, Glanc P.J Am Coll Radiol. 2018 May; 15 (5S): S198 - S207. doi: 10.1016/j.jacr.2018.03.015. PMID: 29724422
Staging and Follow-Up of Ovarian Cancer. Expert Panel on Women's Imaging:; Kang SK, Reinhold C, Atri M, Benson CB, Bhosale PR, Jhingran A, Lakhman Y, Maturen KE, Nicola R, Pandharipande PV, Salazar GM, Shipp TD, Simpson L, Small W Jr, Sussman BL, Uyeda JW, Wall DJ, Whitcomb BP, Zelop CM, Glanc P.J Am Coll Radiol. 2018 May; 15 (5S): S198 - S207. doi: 10.1016/j.jacr.2018.03.015. PMID: 29724422
175. Lee E.Y.P., An H., Tse K.Y., Khong P.-L. Molecular Imaging of Peritoneal Carcinomatosis in Ovarian Carcinoma. Am. J. Roentgenol. 2020; 215: 305 - 312. doi: 10.2214/AJR.19.22621.
176. Prado J.G., Hernando C.G., Delgado D.V., Martinez R.S., Bhosale P., Sanchez J.B., Chiva L. Diffusion-weighted magnetic resonance imaging in peritoneal carcinomatosis from suspected ovarian cancer: Diagnostic performance in correlation with surgical findings. Eur. J. Radiol. 2019; 121: 108696. doi: 10.1016/j.ejrad.2019.108696.
177. Rizzo S., De Piano F., Buscarino V., Pagan E., Bagnardi V., Zanagnolo V., Colombo N., Maggioni A., Del Grande M., Del Grande F., et al. Pre-operative evaluation of epithelial ovarian cancer patients: Role of whole body diffusion weighted imaging MR and CT scans in the selection of patients suitable for primary debulking surgery. A single-centre study. Eur. J. Radiol. 2020; 123: 108786. doi: 10.1016/j.ejrad.2019.108786.
178. Yoshida Y, Kurokawa T, Tsuchida T et al (2004) The incremental benefits of FDG positron emission tomography over CT alone for the preoperative staging of ovarian cancer. AJR Am J Roentgenol 182: 227 - 233 2779;
179. Kitajima K, Murakami K, Yamasaki E et al (2008) Diagnostic accuracy of integrated FDG-PET/contrast enhanced CT in staging ovarian cancer: comparison with enhanced CT. Eur J Nucl Med Mol Imaging 35: 1912 - 1920;
180. Expert Panel on Women"s Imaging, Kang SK, Reinhold C, et al. ACR Appropriateness  ) Staging and Follow-Up of Ovarian Cancer. J Am Coll Radiol 2018; 15: S198 - S207]
) Staging and Follow-Up of Ovarian Cancer. J Am Coll Radiol 2018; 15: S198 - S207]
181. Kitajima K, Murakami K, Yamasaki E et al (2008) Diagnostic accuracy of integrated FDG-PET/contrast enhanced CT in staging ovarian cancer: comparison with enhanced CT. Eur J Nucl Med Mol Imaging 35: 1912 - 1920]
182. Franciszek ![]() , D.;
, D.;  , R.;
, R.;  , E.;
, E.;  , B. Ovarian Cancer and Pregnancy-A Current Problem in Perinatal Medicine: A Comprehensive Review. Cancers 2020, 12, 3795. https://doi.org/10.3390/cancers12123795
, B. Ovarian Cancer and Pregnancy-A Current Problem in Perinatal Medicine: A Comprehensive Review. Cancers 2020, 12, 3795. https://doi.org/10.3390/cancers12123795
183. NCCN Clinical Practice Guidelines in Oncology (NCCN  ) Ovarian Cancer Continue Including Fallopian Tube Cancer and Primary Peritoneal Cancer Version 1.2023, nccn.org)
) Ovarian Cancer Continue Including Fallopian Tube Cancer and Primary Peritoneal Cancer Version 1.2023, nccn.org)
184. ACR Appropriateness  Staging and Follow-Up of Ovarian Cancer. Expert Panel on Women's Imaging:; Kang SK, Reinhold C, Atri M, Benson CB, Bhosale PR, Jhingran A, Lakhman Y, Maturen KE, Nicola R, Pandharipande PV, Salazar GM, Shipp TD, Simpson L, Small W Jr, Sussman BL, Uyeda JW, Wall DJ, Whitcomb BP, Zelop CM, Glanc P.J Am Coll Radiol. 2018 May; 15 (5S): S198 - S207. doi: 10.1016/j.jacr.2018.03.015.PMID: 29724422;
Staging and Follow-Up of Ovarian Cancer. Expert Panel on Women's Imaging:; Kang SK, Reinhold C, Atri M, Benson CB, Bhosale PR, Jhingran A, Lakhman Y, Maturen KE, Nicola R, Pandharipande PV, Salazar GM, Shipp TD, Simpson L, Small W Jr, Sussman BL, Uyeda JW, Wall DJ, Whitcomb BP, Zelop CM, Glanc P.J Am Coll Radiol. 2018 May; 15 (5S): S198 - S207. doi: 10.1016/j.jacr.2018.03.015.PMID: 29724422;
185. Cengiz A, ![]() ZP,
ZP, ![]() Kara P,
Kara P,  Y. The Role of 18F-FDG PET/CT in Detecting Ovarian Cancer Recurrence in Patients with Elevated CA-125 Levels. Mol Imaging Radionucl Ther. 2019 Mar 19; 28 (1): 8 - 14. doi: 10.4274/mirt.galenos.2018.00710. PMID: 30942056; PMCID: PMC6455098;
Y. The Role of 18F-FDG PET/CT in Detecting Ovarian Cancer Recurrence in Patients with Elevated CA-125 Levels. Mol Imaging Radionucl Ther. 2019 Mar 19; 28 (1): 8 - 14. doi: 10.4274/mirt.galenos.2018.00710. PMID: 30942056; PMCID: PMC6455098;
186. Gu P, Pan LL, Wu SQ et al (2009) CA125, PET alone, PET-CT. CT and MRI in diagnosing recurrent ovarian carcinoma A systematic review Eur J Radiol 71: 164 - 174.
187. Тюляндина А.С. и др. Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб//Злокачественные опухоли. - 2021. - Т. 11. - N. 3S2-1. - С. 158 - 171. DOI: 10.18027/2224-5057-2021-11-3s2-10
188. Bamias A. et al. Prognostic factors for early-stage epithelial ovarian cancer, treated with adjuvant carboplatin/paclitaxel chemotherapy: a single institution experience//Gynecologic Oncology. - 2011. - Т. 123. - N. 1. - С. 37 - 42. doi: 10.1016/j.ygyno.2011.06.033
189. Lavoue V. et al. Management of epithelial cancer of the ovary, fallopian tube, primary peritoneum. Long text of the joint French clinical practice guidelines issued by FRANCOGYN, CNGOF, SFOG, GINECO-ARCAGY, endorsed by INCa. (Part 2: Systemic, intraperitoneal treatment, elderly patients, fertility preservation, follow-up)//Journal of Gynecology Obstetrics and Human Reproduction. - 2019. - Т. 48. - N. 6. - С. 379 - 386. doi: 10.1016/j.jogoh.2019.03.018
190. Chi D.S. et al. Primary intravenous paclitaxel and platinum chemotherapy for high-risk Stage I epithelial ovarian carcinoma//European journal of gynaecological oncology. - 1999. - Т. 20. - N. 4. - С. 277 - 280.
191. Bookman M.A. Optimal primary therapy of ovarian cancer//Annals of Oncology. - 2016. - Т. 27. - N S1. - pp. i58 - i62. DOI:https://doi.org/10.1093/annonc/mdw088
192. Katsumata N. et al. Long-term follow-up of a randomized trial comparing conventional paclitaxel and carboplatin with dose-dense weekly paclitaxel and carboplatin in women with advanced epithelial ovarian, fallopian tube, or primary peritoneal cancer: JGOG 3016 trial. - 2012. DOI: 10.1200/jco.2012.30.15_suppl.2 Journal of Clinical Oncology 30, no. 15_suppl (May 20, 2012) 2 - 2.
193. Katsumata N. et al. Long-term results of dose-dense paclitaxel and carboplatin versus conventional paclitaxel and carboplatin for treatment of advanced epithelial ovarian, fallopian tube, or primary peritoneal cancer (JGOG 3016): a randomised, controlled, open-label trial//The Lancet Oncology. - 2013. - Т. 14. - N. 10. - С. 1020 - 1026. doi: 10.1016/S1470-2045(13) 70363-2
194. Vasey P.A. et al. Docetaxel and cisplatin in combination as first-line chemotherapy for advanced epithelial ovarian cancer//Journal of clinical oncology. - 1999. - Т. 17. - N. 7. - С. 2069 - 2069. doi: 10.1200/JCO.1999.17.7.2069
195. ![]() V. et al. A multicenter phase II study of cisplatin and docetaxel (Taxotere) in the first-line treatment of advanced ovarian cancer: a GINECO study//Cancer chemotherapy and pharmacology. - 2004. - Т. 53. - С. 489 - 495. doi: 10.1007/s00280-004-0762-9
V. et al. A multicenter phase II study of cisplatin and docetaxel (Taxotere) in the first-line treatment of advanced ovarian cancer: a GINECO study//Cancer chemotherapy and pharmacology. - 2004. - Т. 53. - С. 489 - 495. doi: 10.1007/s00280-004-0762-9
196. Pignata S. et al. Carboplatin plus paclitaxel once a week versus every 3 weeks in patients with advanced ovarian cancer (MITO-7): a randomised, multicentre, open-label, phase 3 trial //The lancet oncology. - 2014. - Т. 15. - N. 4. - С. 396 - 405. doi: 10.1016/S1470-2045(14)70049-X.
197. Barlin J.N. et al. Progression-free and overall survival of a modified outpatient regimen of primary intravenous/intraperitoneal paclitaxel and intraperitoneal cisplatin in ovarian, fallopian tube, and primary peritoneal cancer//Gynecologic oncology. - 2012. - Т. 125. - N. 3. - С. 621 - 624. doi: 10.1016/j.ygyno.2012.03.027
198. Fujiwara K. et al. Principle and evolving role of intraperitoneal chemotherapy in ovarian cancer//Expert opinion on pharmacotherapy. - 2013. - Т. 14. - N. 13. - С. 1797 - 1806. doi: 10.1517/14656566.2013.820705
199. Kehoe S. et al. Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (CHORUS): an open-label, randomised, controlled, non-inferiority trial//The Lancet. - 2015. - Т. 386. - N. 9990. - С. 249 - 257. doi: 10.1016/S0140-6736(14)62223-6.
200. Ma J. et al. Efficacy and safety of olaparib maintenance therapy in platinum-sensitive ovarian cancer patients with BRCA mutations: a meta-analysis on randomized controlled trials//Cancer Management and Research. - 2019; 11: 3061 - 3078. doi: 10.2147/CMAR.S191107
201. Monk B.J. et al. Trabectedin plus pegylated liposomal doxorubicin (PLD) versus PLD in recurrent ovarian cancer: overall survival analysis//European journal of cancer. - 2012. - Т. 48. - N. 15. - С. 2361 - 2368
202. Sugarbaker P.H. Management of peritoneal surface malignancy: The surgeon's role. Langenbeck's Arch Surg 1999; 384: 576 - 87. DOI: 10.1007/s004230050246
203. Яковлева М.Г., Городнова Т.В., Котив Х.Б. и др. Прогнозирование исхода циторедуктивной операции у пациенток с распространенным раком яичника. Опухоли женской репродуктивной системы 2023; 19 (1): 99 - 111. DOI: 10.17650/1994-4098-2023-18-1-99-111
204. Silver DF, Piver MS. Gemcitabine salvage chemotherapy patients with gynecologic malignancies of the ovary, fallopian tube, and peritoneum. Am J Clin Oncol 1999; 22: 450 - 2.
205. J. Pfisterer, M. Plante, I. Vergote, et al. Gemcitabine plus carboplatin compared with carboplatin in patients with platinum-sensitive recurrent ovarian cancer: an intergroup trial of the AGO-OVAR, the NCIC CTG, and the EORTC GCG J Clin Oncol, 24 (2006), pp. 4699 - 4707
206. Fischerova D. Ultrasound scanning of the pelvis and abdomen for staging of gynecological tumors: a review//Ultrasound in obstetrics & gynecology. - 2011. - Т. 38. - N. 3. - С. 246 - 266.
207.  J.L. et al. Pre-operative assessment of intra-abdominal disease spread in epithelial ovarian cancer: A comparative study between ultrasound and computed tomography//International Journal of Gynecologic Cancer. - 2019. - Т. 29. - N. 2.
J.L. et al. Pre-operative assessment of intra-abdominal disease spread in epithelial ovarian cancer: A comparative study between ultrasound and computed tomography//International Journal of Gynecologic Cancer. - 2019. - Т. 29. - N. 2.
208. Fischerova D. et al. Preoperative staging of ovarian cancer: comparison between ultrasound, CT and whole-body diffusion-weighted MRI (ISAAC study)//Ultrasound in Obstetrics & Gynecology. - 2022. - Т. 59. - N. 2. - С. 248 - 262.
209. Anastasiadis P.G. et al. The contribution of rapid intraoperative cytology to the improvement of ovarian cancer staging//Gynecologic Oncology. - 2002. - Т. 86. - N. 3. - С. 244 - 249.
210. Naz S. et al. Role of peritoneal washing cytology in ovarian malignancies: correlation with histopathological parameters//World journal of surgical oncology. - 2015. - Т. 13. - N. 1. - С. 1 - 5.
211. Yoshimura S. et al. Peritoneal fluid cytology in patients with ovarian cancer//Gynecologic oncology. - 1984. - Т. 17. - N. 2. - С. 161 - 167.
212. Porcel J.M., Diaz J.P., Chi D.S. Clinical implications of pleural effusions in ovarian cancer//Respirology. - 2012. - Т. 17. - N. 7. - С. 1060 - 1067.
213. Jaaback K., Johnson N., Lawrie T.A. Intraperitoneal chemotherapy for the initial management of primary epithelial ovarian cancer//Cochrane database of systematic reviews. - 2016. - N. 1.
214. Трякин А.А., Бесова Н.С., Волков Н.М., Гладков О.А., Карасева В.В., Сакаева Д.Д. и соавт. Практические рекомендации по общим принципам проведения противоопухолевой лекарственной терапии. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2022 (том 12). 27 - 40
215. Ларионова В.Б., Кагония Л.М., Лунин В.В., Снеговой А.В. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НАЗНАЧЕНИЮ Г-КСФ С ЦЕЛЬЮ ПРОФИЛАКТИКИ РАЗВИТИЯ ФЕБРИЛЬНОЙ НЕЙТРОПЕНИИ. Злокачественные опухоли: Практические рекомендации RUSSCO, 2013. 322 - 327. Электронный доступ [https://rosoncoweb.ru/standarts/RUSSCO/2013/2-04.pdf] от 07.11.2023
216. Тюляндина А.С., Коломиец Л.А., Морхов К.Ю., Нечушкина В.М., Покатаев И.А., Румянцев А.А. и соавт. Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2022 (том 12). 198 - 211. DOI: 10.18027/2224-5057-2022-12-3s2-198-211
217. N. Bizzarri, M. Imterat, R. Fruscio et al. Lymph node staging in grade 1 - 2 endometrioid ovarian carcinoma apparently confined to the ovary: Is it worth?/EJC. V.196.10.2023/DOI:https://doi.org/10.1016/j.ejca.2023.113398
СПИСОК ЛИТЕРАТУРЫ РАЗДЕЛА "Профилактика и лечение осложнений злокачественных опухолей и противоопухолевой лекарственной терапии":
1. Navari R.M., Gray S.E., Kerr A.C. Olanzapine versus aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a randomized phase III trial. J Support Oncol 2011; 9(5): 188 - 95
2. Vanessa Piechotta, Anne Adams, Madhuri Haque, Benjamin Scheckel, Nina Kreuzberger, Ina Monsef, Karin Jordan, Kathrin Kuhr, Nicole Skoetz. Antiemetics for adults for prevention of nausea and vomiting caused by moderately or highly emetogenic chemotherapy: a network meta-analysis. Cochrane Database Syst Rev, 2021 Nov 16; 11(11): CD012775
3. Владимирова Л.Ю., Гладков О.А., Королева И.А., Румянцев А.А., Семиглазова Т.Ю., Трякин А.А., Кутукова С.И., Овчинникова Е.Г., Новикова О.Ю., Корниецкая А.Л. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=nausea_vomiting
4. Chaoyang Chen, Ruoming Li, Ting Yang. Denosumab Versus Zoledronic Acid in the Prevention of Skeletal-related Events in Vulnerable Cancer Patients: A Meta-analysis of Randomized, Controlled Trials. Clinical Therapeutics 2020, 42(8): 1494 - 1507.e1.
5. Багрова С.Г., Басин Е.М., Борзов К.А., Бычкова Н.М., Деньгина Н.В., Копп М.В., Крылов В.В., Кочетова Т.Ю., Семиглазова Т.Ю. Профилактика и лечение патологии костной ткани при злокачественных новообразованиях. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=bone_pathology
6. Sonal Krishan, Nalinda Panditaratne, Rajeev Verma, Roderick Robertson. Incremental value of CT venography combined with pulmonary CT angiography for the detection of thromboembolic disease: systematic review and meta-analysis. AJR Am J Roentgenol 2011; 196(5): 1065 - 72.
7. Chinthaka B Samaranayake, James Anderson, Colm McCabe, Syeda Farah Zahir, John W Upham, Gregory Keir, Direct oral anticoagulants for cancer-associated venous thromboembolisms: a systematic review and network meta-analysis, Intern Med J, 2022 Feb; 52(2): 272 - 281.
8. William Knoll, Nathan Fergusson, Victoria Ivankovic, Tzu-Fei Wang, Lucia Caiano, Rebecca Auer, Marc Carrier, Extended thromboprophylaxis following major abdominal/pelvic cancer-related surgery: A systematic review and meta-analysis of the literature, Thromb Res, 2021 Aug: 204: 114 - 122.
9. Сомонова О.В., Антух Э.А., Варданян А.В., Громова Е.Г., Долгушин Б.И., Елизарова А.Л., Сакаева Д.Д., Сельчук В.Ю., Трякин А.А., Черкасов В.А. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=thromboembolism
10. NCCN Guidelines. Prevention and Treatment of Cancer-Related Infections. v. 1, 2021. https://www.nccn.org/professionals/physician_gls/pdf/infections.pdf.
11. Yoshimasa Kosaka, Yoshiaki Rai, Norikazu Masuda, et al. Phase III placebo-controlled, double-blind, randomized trial of pegfilgrastim to reduce the risk of febrile neutropenia in breast cancer patients receiving docetaxel/cyclophosphamide chemotherapy. Support Care Cancer 2015 Apr; 23(4): 1137 - 43.
12. Mical Paul, Dafna Yahav, Abigail Fraser, Leonard Leibovici. Empirical antibiotic monotherapy for febrile neutropenia: systematic review and meta-analysis of randomized controlled trials. Journal of Antimicrobial Chemotherapy, Volume 57, Issue 2, February 2006, Pages 176 - 189.
13. Сакаева Д.Д., Борисов К.Е., Булавина И.С., Когония Л.М., Курмуков И.А., Орлова Р.В., Шабаева М.М. Практические рекомендации по диагностике и лечению фебрильной нейтропении. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=febrile_neutropenia
14. B Vincenzi, A Russo, A Terenzio, et al. The use of SAMe in chemotherapy-induced liver injury. Crit Rev Oncol Hematol 2018 Oct; 130: 70 - 77.
15. Devika Remash, David S Prince, Catriona McKenzie, et al. Immune checkpoint inhibitor-related hepatotoxicity: A review. World J Gastroenterol 2021 Aug 28; 27(32): 5376 - 5391.
16. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Практические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=hepatotoxicity
17. Zhujun Mao, Keping Shen, Limin Zhu, et al. Comparisons of Cardiotoxicity and Efficacy of Anthracycline-Based Therapies in Breast Cancer: A Network Meta-Analysis of Randomized Clinical Trials. Oncol Res Treat 2019; 42(7 - 8): 405 - 413.
18. Albakri, Aref. Systolic heart failure: A review of clinical status and metaanalysis of diagnosis and clinical management methods. Trends in Res, 2018, 1(4), doi: 10.15761/TR.1000124.
19. Jasper Tromp, Wouter Ouwerkerk, Dirk J. van Veldhuisen, et al. A Systematic Review and Network-Meta-Analysis of Pharmacological Treatment of Heart Failure With Reduced Ejection Fraction. J Am Coll Cardiol HF. Dec 08, 2021.
20. Kashif Kalam, Thomas H. Marwick. Role of cardioprotective therapy for prevention of cardiotoxicity with chemotherapy: A systematic review and meta-analysis. Eur J Cancer 2013 Sep; 49(13): 2900 - 9.
21. Виценя М.В., Агеев Ф.Т., Орлова Р.В., Полтавская М.Г., Потиевская В.И. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 2 https://rosoncoweb.ru/standarts/?chapter=cardiovascular_toxicity
22. Jing Li, Hengxiu Yan. Skin toxicity with anti-EGFR monoclonal antibody in cancer patients: a meta-analysis of 65 randomized controlled trials. Cancer Chemother Pharmacol 2018 Oct; 82(4): 571 - 583.
23. Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Когония Л.М., Круглова Л.С., Орлова Е.В., Орлова Р.В. Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=dermatological_reactions
24. Emily J Martin, Andrew R Bruggeman, Vinit V Nalawade, et al. Palliative Radiotherapy Versus Esophageal Stent Placement in the Management of Patients With Metastatic Esophageal Cancer. J Natl Compr Canc Netw 2020 May; 18(5): 569 - 574.
25. M A E de van der Schueren, A Laviano, H Blanchard, et al. Systematic review and meta-analysis of the evidence for oral nutritional intervention on nutritional and clinical outcomes during chemo(radio)therapy: current evidence and guidance for design of future trials. Ann Oncol. 2018 May; 29(5): 1141 - 1153.
26. Сытов А.В., Зузов С.А., Кукош М.Ю., Лейдерман И.Н., Обухова О.А., Потапов А.Л., Хотеев А.Ж. Практические рекомендации по нутритивной поддержке онкологических больных. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=nutritional_support
27. Perazella, Mark A. Onco-Nephrology. Renal Toxicities of Chemotherapeutic Agents Clinical Journal of the American Society of Nephrology, 2012 October, 7(10): p 1713 - 1721.
28. Han Li, Jinsheng Xu, Yaling Bai, Shenglei Zhang, Meijuan Cheng, Jingjing Jin. Nephrotoxicity in patients with solid tumors treated with anti-PD-1/PD-L1 monoclonal antibodies: a systematic review and meta-analysis. Investigational New Drugs, 2021, Volume 39, pages 860 - 870.
29. Songtao Li, Xiuyun He, Linjie Ruan, Ting Ye, Yulong Wen, Zhihua Song, Siying Hu, Yu Chen, Bo Peng, Shijie Li. Protective Effect of Mannitol on Cisplatin-Induced Nephrotoxicity: A Systematic Review and Meta-Analysis. Front Oncol. 2021; 11, Published online 2021 Dec 16.
30. Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=nephrotoxicity
31. NCCN guidelines. Management of Immunotherapy-Related Toxicities. Version 4, 2021. https://www.nccn.org/professionals/physician_gls/pdf/immunotherapy.pdf.
32. Daniel H Johnson, Chrystia M Zobniw, Van A Trinh, et al. Infliximab associated with faster symptom resolution compared with corticosteroids alone for the management of immune-related enterocolitis. Journal for ImmunoTherapy of Cancer, 2018, article number: 103.
33. Guillermo De Velasco, Youjin Je, Dominick ![]() , Mark M. Awad, Patrick A. Ott, Raphael B. Moreira, Fabio Schutz, Joaquim Bellmunt, Guru P. Sonpavde, F. Stephen Hodi, Toni K. Choueiri. Comprehensive Meta-analysis of Key Immune-Related Adverse Events from CTLA-4 and PD-1/PD-L1 Inhibitors in Cancer Patients. Cancer Immunol Res, 2017, 5 (4): 312 - 318
, Mark M. Awad, Patrick A. Ott, Raphael B. Moreira, Fabio Schutz, Joaquim Bellmunt, Guru P. Sonpavde, F. Stephen Hodi, Toni K. Choueiri. Comprehensive Meta-analysis of Key Immune-Related Adverse Events from CTLA-4 and PD-1/PD-L1 Inhibitors in Cancer Patients. Cancer Immunol Res, 2017, 5 (4): 312 - 318
34. Hongchuan Zhang MD, Xuemei Li MD, Xingliang Huang MD, Junfeng Li MD, Hong Ma MD, Rui Zeng MD, Impact of corticosteroid use on outcomes of non-small-cell lung cancer patients treated with immune checkpoint inhibitors: A systematic review and meta-analysis. Journal of Clinical Pharmacy and Therapeutics, Volume 46, Issue 4, August 2021, Pages 927 - 935
35. Проценко С.А., Баллюзек М.Ф., Васильев Д.А., Жукова Н.В., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Харкевич Г.Ю., Юдин Д.И. Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=immunerelated_adverse_events
36. P. Bossi, A. Antonuzzo, N.I. Cherny, et al. Diarrhoea in adult cancer patients: ESMO Clinical Practice Guidelines. Annals of Oncology, 2018, 29(4): pages iv126 - iv142.
37. D.E. Peterson, R.-J. Bensadoun, F. Roila. Management of oral and gastrointestinal mucositis: ESMO Clinical Practice Guidelines. Annals of Oncology 21 (Supplement 5): v261 - v265, 2010.
38. Семиглазова Т.Ю., Беляк Н.П., Владимирова Л.Ю., Корниецкая А.Л., Королева И.А., Нечаева М.Н., Раджабова З.А., Телетаева Г.М., Ткаченко Е.В. Практические рекомендации по лечению и профилактике мукозитов. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=mucositis
39. Yasuo Ohashi, Yukari Uemura, Yasuhito Fujisaka, et al. Meta-analysis of epoetin beta and darbepoetin alfa treatment for chemotherapy-induced anemia and mortality: Inpidual patient data from Japanese randomized, placebo-controlled trials. Cancer Sci 2013 Apr; 104(4): 481 - 5.
40. Anat Gafter-Gvili 1, Benaya Rozen-Zvi, Liat Vidal, et al. Intravenous iron supplementation for the treatment of chemotherapy-induced anaemia - systematic review and meta-analysis of randomised controlled trials. Acta Oncol 2013 Jan; 52(1): 18 - 29.
41. Орлова Р.В., Гладков О.А., Кутукова С.И., Копп М.В., Королева И.А., Ларионова В.Б., Моисеенко В.М., Поддубная И.В., Птушкин В.В. Практические рекомендации по лечению анемии при злокачественных новообразованиях. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=anemia
42. Fangyuan Zhang, Aomei Shen, Yinghui Jin, Wanmin Qiang. The management strategies of cancer-associated anorexia: a critical appraisal of systematic reviews. BMC Complement Altern Med. 2018; 18: 236.
43. Сытов А.В., Зузов С.А., Кукош М.Ю., Лейдерман И.Н., Потапов А.Л., Хотеев А.Ж. Практические рекомендации по лечению синдрома анорексии-кахексии у онкологических больных. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=anorexia-cachexia
44. Marcus Yeow, Shauna Soh, Ryan Yap, Serene Si Ning Goh, Charleen Shanwen Yeo, Zhiwen Joseph Lo. A systematic review and network meta-analysis of randomized controlled trials on choice of central venous access device for delivery of chemotherapy. Journal of Vascular Surgery_Venous and limphatic disorders. V 10, issue 4, p 1184 - 1191
45. Исянгулова А.З., Шин А.Р., Петкау В.В. Центральный венозный доступ. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=central_venous_access
46. Firas Y Kreidieh, Hiba A Moukadem, and Nagi S El Saghir Overview, prevention and management of chemotherapy extravasation World J Clin Oncol. 2016 Feb 10; 7(1): 87 - 97.
47. Буйденок Ю.В., Обухова О.А. Рекомендации по профилактике и лечению последствий экстравазации противоопухолевых препаратов. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=extravasation_antitumor_drugs
48. Margaux Evenepoel, Vincent Haenen, Tom De Baerdemaecker, Mira Meeus, Nele Devoogdt, Lore Dams, Sophie Van Dijck, Elien Van der Gucht, An De Groef. Pain Prevalence During Cancer Treatment: A Systematic Review and Meta-Analysis. Pain Symptom Manage, 2022 Mar; 63(3): e317 - e335
49. Когония Л.М., Новиков Г.А., Орлова Р.В., Сидоров А.В., Королева И.А., Сакаева Д.Д. Практические рекомендации по лечению хронического болевого синдрома у взрослых онкологических больных. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=chronic_pain_syndrome
50. S. Rosello, I. Blasco, L. ![]() Fabregat, A. Cervantes, K. Jordan. Management of infusion reactions to systemic anticancer therapy: ESMO Clinical Practice Guidelines. Annals of Oncology 28 (Supplement 4): iv100 - iv118, 2017
Fabregat, A. Cervantes, K. Jordan. Management of infusion reactions to systemic anticancer therapy: ESMO Clinical Practice Guidelines. Annals of Oncology 28 (Supplement 4): iv100 - iv118, 2017
51. Орлова Р.В., Жабина А.С., Иванова А.К., Наталенко К.Е., Телетаева Г.М. Практические рекомендации по лечению инфузионных реакций при проведении противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=infusion_reactions
52. Khalis Mustafayev, Harrys Torres. Narrative review. Hepatitis B virus and hepatitis C virus reactivation in cancer patients receiving novel anticancer therapies. Clinical Microbiology and Infection. Volume 28, Issue 10, October 2022, Pages 1321 - 1327
53. Феоктистова П.С., Винницкая Е.В., Нурмухаметова Е.А., Тихонов И.Н. Практические рекомендации по профилактике и лечению реактивации/обострения хронических вирусных гепатитов у пациентов, получающих противоопухолевую терапию. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=chronic_viral_hepatitis
54. Paola Alberti, Alessandro Salvalaggio, Andreas A. Argyriou, Jordi Bruna, Andrea Visentin, Guido Cavaletti, and Chiara Briani. Neurological Complications of Conventional and Novel Anticancer Treatments. Cancers (Basel). 2022 Dec; 14(24): 6088.
55. Латипова Д.Х., Андреев В.В., Маслова Д.А., Новик А.В., Проценко С.А. Неврологические осложнения противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=neurological_complication
56. Y. Andreu, A. Soto-Rubio, M. Ramos-Campos, A. Escriche-Saura, M.  , and J.
, and J. ![]() . Impact of hormone therapy side effects on health-related quality of life, distress, and well-being of breast cancer survivors. Scientific Reports, 2022; 12: 18673.
. Impact of hormone therapy side effects on health-related quality of life, distress, and well-being of breast cancer survivors. Scientific Reports, 2022; 12: 18673.
57. Стенина М.Б., Протасова А.Э., Самушия М.А., Юренева С.В. Практические рекомендации по коррекции гормоноопосредованных побочных явлений противоопухолевой терапии. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=hormone-mediated_side_events
58. Daniel de la Iglesia, Bartu Avci, Mariia Kiriukova, Nikola Panic, Maryana Bozhychko, Vasile Sandru, Enrique de-Madaria. Pancreatic exocrine insufficiency and pancreatic enzyme replacement therapy in patients with advanced pancreatic cancer: A systematic review and meta-analysis. United European Gastroenterol J, 2020 Nov; 8(9): 1115 - 1125.
59. Сытов А.В., Зузов С.А., Кукош М.Ю., Лейдерман И.Н., Потапов А.Л., Хотеев А.Ж., Кучерявый Ю.А. Практические рекомендации по заместительной ферментной терапии при раке поджелудочной железы. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=pancreatic_enzyme_replacement_therapy
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Ашрафян Л.А., академик РАН, д.м.н., профессор, заместитель директора ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, директор института онкогинекологии и маммологии.
2. Новикова Е.Г., д.м.н., профессор, начальник отделения онкогинекологии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
3. Хохлова С.В., д.м.н., заведующая онкологическим отделением противоопухолевой лекарственной терапии ФГБУ "НМИЦ АГиП им. академика В.И. Кулакова" Минздрава РФ.
4. Урманчеева А.Ф., д.м.н., профессор, ведущий научный сотрудник отделения онкогинекологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
5. Берлев И.В., д.м.н., профессор, заведующий научным отделением онкогинекологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
6. Антонова И.Б., д.м.н., заведующая лабораторией профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний ФГБУ "Российский научный центр рентгенорадиологии" Минздрава России.
7. Бабаева Н.А. д.м.н., ведущий научный сотрудник Института онкогинекологии и маммологии, врач-онколог онкологического отделения хирургических методов лечения ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России.
8. Алешикова О.И., к.м.н., старший научный сотрудник Института онкогинекологии и маммологии, врач-онколог онкологического отделения хирургических методов лечения ФГБУ "НМИЦ АГиП им. академика В.И. Кулакова" Минздрава РФ.
9. Мухтаруллина С.В., д.м.н., заведующая отделением онкогинекологии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
10. Вереникина Е.В., к.м.н., заведующая отделением онкогинекологии ФГБУ "Ростовский научно-исследовательский онкологический институт" Минздрава России.
11. Демидова Л.В., д.м.н., ведущий научный сотрудник отдела лучевой терапии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
12. Жорданиа К.И., д.м.н., профессор, ведущий научный сотрудник отделения онкогинекологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
13. Шевчук А.С., к.м.н., заведующий отделением комбинированных и лучевых методов лечения онкогинекологических заболеваний НИИ клинической онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
14. Ульрих Е.А., д.м.н., профессор, главный научный сотрудник научно-исследовательской лаборатории репродуктивных технологий, руководитель центра компетенций "Онкофертильность" НМИЦ им. В.А. Алмазова.
15. Красильников С.Э., д.м.н. профессор, директор института онкологии и нейрохирургии, врач-онколог ФГБУ "НМИЦ имени академика Е.Н. Мешалкина" Минздрава России
16. Давыдова И.Ю., д.м.н., ведущий научный сотрудник отдела онкохирургии тазового дна ГБУЗ МКНЦ имени А.С. Логинова ДЗМ
17. Крикунова Л.И., д.м.н., профессор, заведующая отделения лучевых и комбинированных методов лечения гинекологических заболеваний ФГБУ "НМИЦ радиологии" Минздрава России.
18. Коломиец Л.А., д.м.н., профессор, заведующая гинекологическим отделением НИИ онкологии ФГБНУ "Томский НИМЦ РАН".
19. Кравец О.А., д.м.н., Зав. отделением брахитерапии (кабинет) АО Медицина (клиника академика Ройтберга).
20. Крейнина Ю.М., д.м.н., ведущий научный сотрудник лаборатории инновационных технологий радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ "Российский научный центр рентгенорадиологии" Минздрава России.
21. Мещерякова Л.А., д.м.н., ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
22. Дубинина А.В., К.м.н., старший научный сотрудник отделения радиотерапии, ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
23. Карселадзе А.И., профессор, д.м.н., ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России.
24. Румянцев А.А., к.м.н., заведующий отделением противоопухолевой лекарственной терапии N 4 отдела лекарственного лечения ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России, Москва
25. Имянитов Е.Н., д.м.н., профессор, член-корреспондент российской академии наук, заведующий научным отделом биологии опухолевого роста ФГБУ "НМИЦ онкологии им Н.Н. Петрова" Минздрава России, Санкт-Петербург
26. Трякин А.А., д.м.н., профессор, заместитель директора (НИИ КО) по научной работе, заведующий отделением противоопухолевой лекарственной терапии N 2 отдела лекарственного лечения, ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
27. Рубцова Н.А., д.м.н., заведующая отделом лучевой диагностики, врач-рентгенолог МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
28. Быченко В.Г., к.м.н., заведующий отделением лучевой диагностики ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России.
29. Солопова А.Е., д.м.н., доцент, врач-рентгенолог отделение лучевой диагностики ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России.
30. Рыжкова Д.В., д.м.н., профессор РАН, заведующая кафедрой ядерной медицины и радиационных технологий с клиникой, главный научный сотрудник НИО ядерной медицины и тераностики ФГБУ "НМИЦ им В.А. Алмазова" Минздрава России
31. Оводенко Д.Л., д.м.н., отделение инновационной онкологии и гинекологии ФГБУ "НМИЦ "НМИЦ АГиП им. академика В.И. Кулакова" Минздрава РФ.
32. Гриневич В.Н., к.м.н., заведующий отделением онкопатологии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
33. Снеговой А.В., д.м.н., заведующий отделом лекарственного лечения опухолей "НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина" Минздрава России.
34. Герфанова Е.В., к.м.н. врач-онкогинеколог, институт онкогинекологии и маммологии, отделение инновационной онкологии и гинекологии ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
35. Маслиев К.С., к.м.н., зав. кафедрой превентивной медицины с курсом биохакинга Медицинского института РУДН
Блок по медицинской реабилитации:
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением МасЛФК и клинической биомеханики ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
3. Гильмутдинова И.Р., к.м.н., заведующая отделом биомедицинских технологий и лаборатория клеточных технологий, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
4. Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, врач-онколог.
5. Бутенко А.В., д.м.н., профессор, заместитель директора по клинической работе ФГБНУ РНЦХ им. акад. Б.В. Петровского.
6. Назаренко А.В., к.м.н., врач высшей квалификационной категории, заведующий отделением радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Российской ассоциации терапевтических радиационных онкологов (РАТРО), European Society for Radiotherapy & Oncology (ESTRO), Российско-американского альянса по изучению рака (ARCA), представитель России в МАГАТЭ.
7. Обухова О.А., к.м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN).
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
9. Ткаченко Г.А., психолог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
10. Петрова Т.А., логопед-педагог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
11. Семиглазова Т.Ю., д.м.н., в.н.с. научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент кафедры онкологии ФГБОУ ВО "СЗГМУ им. И.И. Мечникова" Минздрава России.
12. Пономаренко Г.Н., д.м.н., профессор, заслуженный деятель науки РФ, генеральный директор ФГБУ "ФНЦРИ им. Г.А. Альбрехта" Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Минобороны России.
13. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Минобороны России.
14. Каспаров Б.С., к.м.н., заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
15. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
16. Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
17. Кондратьева К.О., медицинский психолог ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
18. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России.
19. Романов А.И., академик РАН, д.м.н., профессор, главный врач ФГБУ "Центр реабилитации" Управления делами Президента РФ.
20. Степанова А.М., заместитель директора по науке, заведующая отделением реабилитации частного многопрофильного диагностического и реабилитационного центра "Восстановление".
Конфликта интересов нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1) врачи-радиотерапевты;
2) врачи-онкологи;
3) врачи-рентгенологи;
4) врачи-радиологи;
5) врачи-хирурги;
6) врачи - анестезиологи-реаниматологи;
7) врачи-терапевты;
8) врачи общей практики (семейной медицины);
9) врачи-генетики;
10) врачи-патологоанатомы;
11) врачи организации здравоохранения и общественного здоровья;
12) врачи-реабилитологи (специалисты по медицинской реабилитации);
13) врачи - клинические фармакологи;
14) студенты медицинских ВУЗов, ординаторы и аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РЯ в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Индикаторы доброкачественной клинической практики (Good Practice Points - GPPs): доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка:
Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Федеральный закон от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации".
2. Приказ Минздрава России от 13.10.2017 N 804н (ред. от 16.04.2019) "Об утверждении номенклатуры медицинских услуг" (Зарегистрировано в Минюсте России 07.11.2017 N 48808).
3. Письмо Федерального фонда обязательного медицинского страхования от 23.04.2019 N 5071/26-2/и. http://www.ffoms.ru/documents/the-orders-oms/.
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти в Государственном реестре лекарственных средств, размещенном на сайте Минздрава России: http://grls.rosminzdrav.ru.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
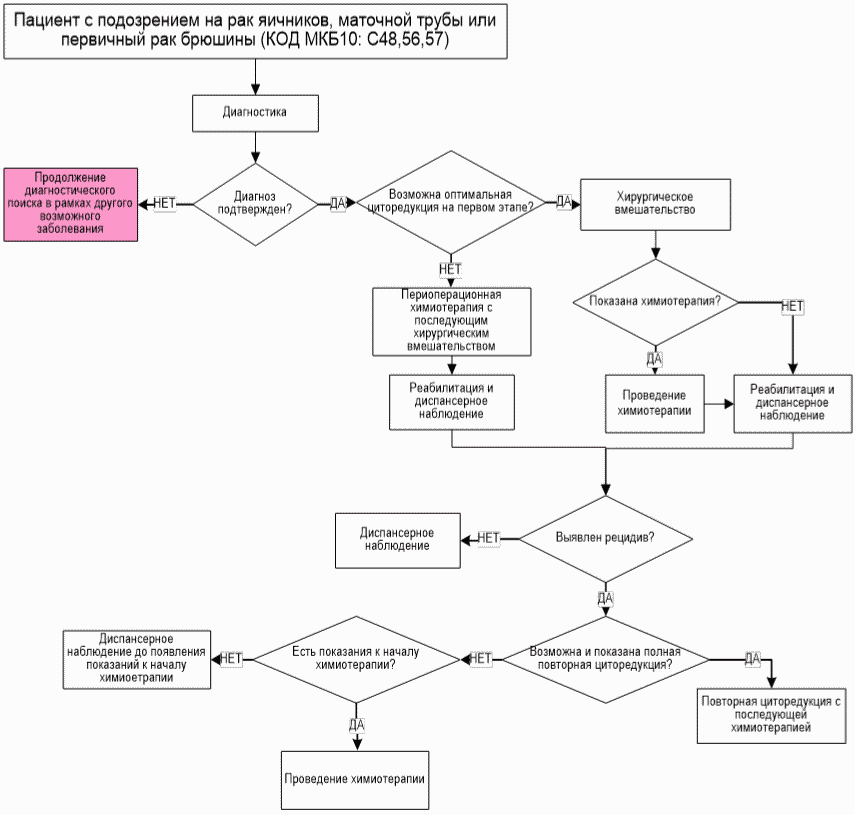
Схема 1. Блок-схема диагностики и лечения пациента
с диагнозом "рак яичников"
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Пациентку информируют о клинической картине и методах диагностики/стадирования РЯ, знакомят с различными методами лечения и их потенциальными результатами/осложнениями. Выбор метода лечения следует выполнять в результате такого собеседования после того, как пациентка имела возможность задать все интересующие ее вопросы.
Необходимо убедить пациентку не испытывать психологического дискомфорта в связи с заболеванием и ознакомиться с научно-популярной литературой о РЯ.
Следует информировать пациентку о характере последующего наблюдения после лечения РЯ, о важности регулярного обследования.
Пациенток следует также информировать о проводимых в Российской Федерации клинических исследованиях у пациентов с соответствующей нозологической формой.
Самостоятельный контроль за течением заболевания со стороны пациентки невозможен; частота посещения врача определяется в индивидуальном порядке в каждом конкретном случае.
Преимущества отказа от табакокурения и потребления алкоголя:
- Более высокие показатели выживаемости
-  эффективность лечения
эффективность лечения
- Меньшее количество и выраженность побочных эффектов противоопухолевого лечения (сердечно-легочные осложнения, утомляемость, снижение массы тела, мукозиты, потеря вкуса)
- Ускоренное восстановление общего состояния после лечения
- Ниже риск рецидива
- Меньший риск вторых опухолей
- Меньший риск инфекций
- Выше качество жизни
Рекомендации при осложнениях химиотерапии/лучевой терапии - связаться с онкологом/химиотерапевтом/лучевым терапевтом!
1) При повышении температуры тела 38 °C и выше:
- Рекомендовано применение противомикробной терапии по рекомендации врача-онколога/химиотерапевта.
2) При стоматите:
- Диета - механическое, термическое щажение;
- Частое полоскание полости рта (каждый час) - ромашки аптечной цветки, дуба кора, шалфея лекарственного препарата; смазывать слизистую полости рта облепиховым (персиковым) маслом;
- Обрабатывать полость рта по рекомендации врача-онколога/химиотерапевта.
3) При диарее:
- Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- Принимать препараты по рекомендации врача-онколога/химиотерапевта.
4) При тошноте:
- Принимать препараты по рекомендации врача-онколога/химиотерапевта.
Приложение Г1 - ГN
ШКАЛЫ
ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG. Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status.
Оригинальная публикация: Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5(6): 649 - 55 [165].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Пациент не способен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу (70 - 80% по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
5
Смерть
Ключ (интерпретация): приведен в самой шкале.
Приложение Г2
ШКАЛА КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название (если есть): Karnofsky Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949: 191 - 205 [166].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Балл
Шкала Карновского
100
Состояние нормальное, жалоб нет
90
Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80
Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70
Обсуживает себя самостоятельно, неспособен к нормальной деятельности или активной работе
60
Нуждается периодически в помощи, но способен сам удовлетворять  часть своих потребностей
часть своих потребностей
50
Нуждается в значительной помощи и медицинском обслуживании
40
Инвалид, нуждается в специальной помощи, в том числе медицинской
30
Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20
Тяжелый больной. Необходимы госпитализация и активное лечение
10
Умирающий
0
Смерть
Ключ (интерпретация): приведен в самой шкале.
Приложение Г3
ШКАЛА
ОЦЕНКИ СТЕПЕНИ ТЕРАПЕВТИЧЕСКОГО ПАТОМОРФОЗА ОПУХОЛИ (TUMOR
REGRESSION GRADING (TRG))
Название на русском языке: Шкала оценки степени терапевтического патоморфоза опухоли. Оригинальное название (если есть): Tumor regression grading
Источник (официальный сайт разработчиков, публикация с валидацией): AJCC. PART III. In: Edge S.B., Byrd D.R., Compton C.C., Fritz A.G., Greene FL., Trotti A. III, eds. AJCC cancer staging manual. 7th ed. New York: Springer; 2010. P. 103 - 26 [35].
Тип: шкала оценки.
Назначение: описать уровень терапевтического патоморфоза опухоли.
Содержание (шаблон):
Шкала оценки степени терапевтического патоморфоза опухоли (Tumor regression grading)
TRG 0
Полный ответ
TRG 1
Почти полный ответ
TRG 2
Частичный ответ
TRG 3
Плохой ответ (нет ответа на лечение)
Ключ (интерпретация): приведен в самой шкале.
Приложение Г4
КРИТЕРИИ
ОЦЕНКИ ОТВЕТА СОЛИДНЫХ ОПУХОЛЕЙ НА ЛЕЧЕНИЕ RECIST 1.1
(RESPONSE EVALUATION CRITERIA IN SOLID TUMORS 1.1)
Название на русском языке: Критерии оценки ответа солидных опухолей на лечение 1.1.
Оригинальное название (если есть): Response Evaluation Criteria In Solid Tumors 1.1 (RECIST).
Источник (официальный сайт разработчиков, публикация с валидацией): Eisenhau-er E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2): 228 - 47. doi: 10.1016/j.ejca.2008.10.026 [167]. Тип: шкала оценки.
Назначение: унификация оценки ответа солидных опухолей на лечение.
Содержание (шаблон):
Ответ на лечение
RECIST 1.1
Полный ответ
Отсутствие всех целевых образований или лимфоузлов >= 10 мм по короткой оси
Частичный ответ
Уменьшение сумм наибольших диаметров целевых очагов на >= 30%
Прогрессирование
Увеличение сумм наибольших диаметров целевых очагов на >= 20% с абсолютным приростом >= 5 мм
Появление новых очагов
Стабилизация
Ничего из перечисленного
Ключ (интерпретация): приведен в самой шкале.
Приложение Г5
ВИЗУАЛЬНО-АНАЛОГОВАЯ ШКАЛА ОЦЕНКИ ИНТЕНСИВНОСТИ БОЛИ
Название на русском языке: Визуально-аналоговая шкала оценки болевого синдрома.
Оригинальное название: Visual Analog Scale for Pain (VAS Pain).
Источник (официальный сайт разработчиков, публикация с валидацией): Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken) 2011; 63 (Suppl 11): S240 - 52 [168].
Тип: шкала оценки.
Назначение: предназначена для количественной оценки болевого синдрома с учетом субъективных ощущений больного и подбора анальгезирующей терапии.
Содержание (шаблон):
"Оцените по шкале выраженность боли, где 0 - отсутствие боли, а 10 - нестерпимая боль максимальной выраженности".
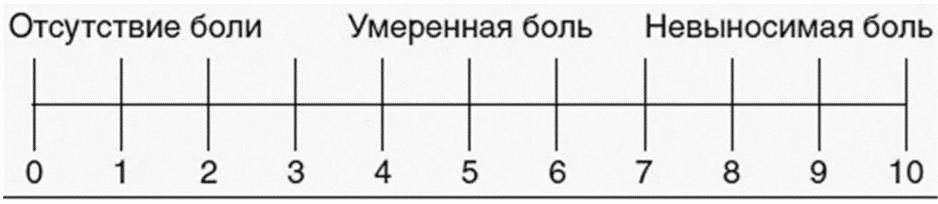
Инструкция: больному на 10-сантиметровой линии предлагается отметить степень выраженности боли по шкале от 0 до 10.
Ключ: 1 - 3 балла - слабая боль; 4 - 7 баллов - умеренная боль; 8 и более баллов - сильная боль.
Приложение Г6
ОЦЕНКА
РАСПРОСТРАНЕННОСТИ ОПУХОЛЕВОГО ПРОЦЕССА И СТЕПЕНИ
ВЫРАЖЕННОСТИ ПЕРИТОНЕАЛЬНОГО КАНЦЕРОМАТОЗА
Название на русском языке: Степень выраженности перитонеального канцероматоза, распространенности опухолевого процесса.
Оригинальное название: Peritoneal cancer index (PCI) Источник (официальный сайт разработчиков, публикация с валидацией): ESGO Guidelines, Recommendations and Assurance Quality Committee, ESGO, 2022. Электронный доступ https://www.esgo.org/media/2016/10/ESGO-Operative-Report.pdf
Тип: шкала оценки.
Назначение: предназначена для оценки распространенности опухолевого процесса и степени выраженности перитонеального канцероматоза как с использованием лучевых методов диагностики, так и видеоэндоскопической визуализации играет ведущую роль в планировании лечения пациенток с распространенным РЯ, позволяя сократить частоту выполнения неоптимальных хирургических вмешательств.
Содержание (шаблон Г6):
Инструкция: Для подсчета PCI используется классификация, предложенная в 1998 г. P.H. Sugarbaker [202] и включенная в оценку распространенности при диссеминированном РЯ Европейским обществом онкогинекологов (ESGO) 2017 г., согласно которой брюшная полость делится на 13 зон:
- 0 - центральная зона: средний отдел брюшной полости, весь большой сальник, поперечно-ободочная кишка;
- 1 - правое подреберье: капсула правой доли печени, поверхность правой половины диафрагмы, правое подпеченочное пространство;
- 2 - эпигастральная область: левая доля печени, серповидная связка печени, малый сальник;
- 3 - левое подреберье: поверхность левой половины диафрагмы, хвост поджелудочной железы, желудок;
- 4 - левый фланг: нисходящая ободочная кишка, левый боковой канал;
- 5 - левая подвздошная область: левая стенка таза, сигмовидная кишка;
- 6 - малый таз: матка, яичники, маточные трубы, мочевой пузырь, дугласово пространство, прямая кишка;
- 7 - правая подвздошная область: правая стенка таза, слепая кишка, аппендикс;
- 8 - правый фланг: восходящая ободочная кишка, правый боковой канал;
- 9 - начальные отделы тощей кишки;
- 10 - дистальные отделы тощей кишки;
- 11 - начальные отделы подвздошной кишки;
- 12 - дистальные отделы подвздошной кишки.
Каждой зоне в зависимости от размера опухолевых очагов присваивается определенное количество баллов (0 - нет опухоли, 1 - очаги до 5 мм, 2 - очаги от 5 мм до 5 см, 3 - очаги > 5 см или сливающиеся инвазивные инфильтраты), и PCI суммарно может быть равен от 0 до 39 баллов. При наличии инфильтративных изменений вне зависимости от размера очага присваивается 3 балла.
- В оценке перитонеального карциноматоза не существует общепринятого эталонного метода обследования, а результаты магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) и совмещенной с КТ позитронно-эмиссионной томографии демонстрируют схожую эффективность при наличии определенных недостатков.
- При выполнении МРТ органов малого таза и КТ органов брюшной полости происходит наслоение пересечения зон 7 и 8, 0 и 6, 4 и 5. При оценке окончательного индекса пересекающиеся зоны не суммируются, а учитывается наибольший балл в каждой наслаивающейся зоне.
Ключ: Определение высокой суммы баллов при оценке PCI являются прогностическими факторами невозможности выполнения оптимальной циторедуктивной операции.
По данным ряда авторов, при интраоперационной ревизии, при сумме баллов от 0 до 15 частота выполнения оптимальных операций составляет от 62 до 99%, при этом при индексе > 16 баллов она не превышает 35%. При сумме баллов > 20 выполнение оптимальной циторедукции практически исключено [203].
Продолжение на следующей странице
Приложение Г6. Оценка распространенности опухолевого процесса и степени выраженности перитонеального канцероматоза
Протокол операции при распространенном раке яичников с расчетом индекса перитонеального канцероматоза (ESGO 2018)
стр. 1
Ф.И.О. пациента, N истории болезни:
Дата рождения:
Дата операции:
Оператор:
Ассистент:
Тип опухоли: первичная, рецидивная
Тип операции: диагностическая, циторедуктивная, стадирующая, паллиативная
Уровень Ca-125:
Предполагается ли IV стадия? Если да, выберите: плевра, легкое, кожа, экстраабдоминальные лифматические узлы
брюшная стенка, паренхима печени, селезенки. Другое поражение:
Статус ECOG:
Хирургический доступ:
Тип операции: первичная циторедукция, интервальная циторедукция после НХТ, повторная циторедукция после первичной, первичная стадирующая, рестадирование (после нерадикальных операций в др. ЛПУ), диагностическая операция (биопсия), 3-я циторедукция, 4-я циторедукция, операция по неотложным показаниям
Объем асцита:
Срочное гистологическое исследование: да/нет
Заключение срочного исследования:
Диссеминация опухолевого процесса
Правый яичник
Матка
Правый карман
Брыжейка тонкой кишки
Паренхима печени
л/у чревного ствола
Левый яичник
Мочевой пузырь/мочеточник
Левый карман
Брыжейка толстой кишки
Малый сальник
Брюшная стенка
Правая маточная труба
Ректосигмоидальный отдел
Тонкая кишка
Парааортальные л/у
Желудок
кожа
Левая маточная труба
Ректовагинальная перегородка
Большой сальник
Диафрагма справа
Поджелудочная
Кардиодиафрагмальные л/у
Дугласово пространство
Стенки таза
Толстая кишка
Диафрагма слева
Селезенка
Паховые л/у
Вагина
Тазовые л/у
Аппендикс
Поверхность печени
л/у ворот печени
Другое:
До
После
+
R+
R0
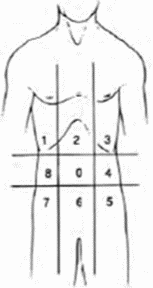
Перитонеальный индекс канцероматоза (PCI)
Баллы
Поражение
0 мезагастрий
Ретроперитонеальное распространение
0 Преаортальные
0
Нет опухоли
1 Правое подреберье
1 л/у ворот печени
1
Опухоль < 0,5 см
2 Эпигастрий
2 л/у чревного ствола
2
Опухоль 0,5 - 5,0 см
3 Левое подреберье
3 л/у селезенки
3
Опухоль > 5,0 см
4 Левый фланг
4 Левые парааортальные
5 Левая подвздошная обл.
5 Общие подвздошные слева
6 Таз
6 Наружные подвздошные слева
7 Правая подвздошная обл.
7 Левые паховые
+: Подозрение/позитивный
R+: остаточная опухоль
R0: без остаточной опухоли
8 Правый фланг
8 Правые паховые
9 Верхний отдел тощей кишки
9 Наружные подвздошные справа
10 Нижний отдел тощей кишки
10 Общие подвздошные справа
11 Верхний отдел подвздошной кишки
11 Пре-паракавальные
12 Нижний отдел подвздошной кишки
12 Кардиодиафрагмальные л/у справа
PCI
13 Кардиодиафрагмальные л/у слева
Объем операции
стр. 2
Гистерэктомия
Тазовые л/у
Резекция сальниковой сумки
Резекция капсулы печени
Унилатеральная аднексэктомия
Парааортальные л/у
Резекция желудка
Атипичная резекция печени
Билатеральная аднексэктомия
Перитонеэктомия флангов
л/у чревного ствола
Резекция печени
Резекция брыжейки тонкой кишки
Резекция тонкой кишки
л/у ворот печени
Холецистэктомия
Резекция мочеточника
Резекция толстой кишки
Стриппинг диафрагмы
Перитонеуэктомия кармана Моррисона
Резекция колоректального отдела
Аппендэктомия
Резекция диафрагмы
Паховые л/у
Резекция мочевого пузыря
Оментэктомия на уровне поперечной ободочной кишки
Спленэктомия
Кардиодиафрагмальные л/у
Тазовая перитонеумэктомия
Экстирпация большого сальника
Резекция поджелудочной железы
Другое:
Число анастомозов (N)
Длина тонкой кишки (см)
Формирование стомы да/нет,
превентивная/постоянная
Другие процедуры: установка интраперитонеального порта, HIPEC, торакоскопия, установка сетки, резекция брюшной стенки
Остаточная опухоль интраабдоминально; нет макроскопически определяемой; 0,1 - 0,5 см; 0,6 см - 10 см; более 1,0 см
Остаточная опухоль экстраабдоминально; нет макроскопически определяемой; 0,1 - 0,5 см; 0,6 см - 10 см; более 1,0 см
Локализация, размер остаточной опухоли:
Причина неоптимальной операции: диффузное поражение брюшины, печень, л/у ворот печени, поджелудочная, наддиафрагмальное поражение, паховые лимфоузлы, другое:
Особенности операции:
Длительность операции:
Кровопотеря:
Трансфузия Эр. Взвеси (N):
СЗП (N):
Интраоперационные осложнения:
Пациент переведен в ОАРИТ с: эндотрахеальной трубкой, катетером Фолея, эпидуральным катетером
Дата составления протокола:
Протокол составил (Ф.И.О.)
