"Клинические рекомендации "Остеопороз"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОСТЕОПОРОЗ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: M81.0, M81.8
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023
ID: 87
Разработчик клинической рекомендации
- Российская ассоциация эндокринологов
- Общественная организация "Российская ассоциация по остеопорозу"
- Ассоциация ревматологов России
- Ассоциация травматологов-ортопедов России
- Ассоциация гинекологов - эндокринологов России
- Общероссийская общественная организация "Российская ассоциация геронтологов и гериатров"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
БФ - бифосфонат
ВОЗ - Всемирная организация здравоохранения
ГКО - глюкокортикоидный остеопороз
ГнРГ - гонадотропин-рилизинг гормон
ДИ - доверительный интервал
ИБС - ишемическая болезнь сердца
ККТ - количественная компьютерная томография
КТ - компьютерная томография
КЭЭ - конъюгированные эквинные эстрогены
МГТ - менопаузальная гормональная терапия
МПК - минеральная плотность кости
МРТ - магнитно-резонансная томография
ОР - относительный риск
ОРИТ - отделение реанимации и интенсивной терапии
ПТГ - паратиреоидный гормон
РКИ - рандомизированное клиническое исследование
СД - сахарный диабет
СКФ - скорость клубочковой фильтрации
СОЭ - скорость оседания эритроцитов
СППП - служба профилактики повторных переломов
ТКИ (TBS) - трабекулярный костный индекс (trabecular bone score)
ТЭЛА - тромбоэмболия легочной артерии
BMC - костный минеральный компонент
BUA - широкополосное ослабление ультразвука
CTX - C-концевой телопептид коллагена 1 типа
DXA - двухэнергетическая рентгеновская абсорбциометрия
FRAX - алгоритм оценки индивидуальной 10-летней вероятности переломов
ISCD - международное общество по клинической денситометрии
P1NP - N-терминальный пропептид проколлагена 1-го типа
QUS - количественная ультразвуковая денситометрия
RANKL - рецептор лиганда ядерного фактора капа-бета
SD - стандартное отклонение
SOS - скорость ультразвука
SPEP - электрофорез белков в сыворотке крови
UPEP - электрофорез белков
WHI - The Woman's Health Initiative (наименование исследования)
** - препарат введен в список жизненно-важных средств
Термины и определения
Вторичный остеопороз - это остеопороз, который развивается вследствие серьезной сопутствующей соматической патологии (в том числе, эндокринных заболеваний) или приема лекарственных средств [1 - 3].
Минимальная травма - падение с высоты собственного роста на ту же поверхность или еще меньшая травма [4, 5].
Патологический или низкотравматический (низкоэнергетический), или остеопоротический перелом - перелом, произошедший при минимальной травме, в подавляющем большинстве случаев вследствие остеопороза. Термин патологический перелом также используется для описания перелома вследствие заболевания, а не травматического воздействия, например, перелом у пациентов с метастатическим поражением скелета, перелом вследствие болезни Педжета и т.д. Перелом вследствие остеопороза можно отнести к патологическому перелому, и этот термин используется в МКБ 10 и 11 пересмотров, поэтому далее для унификации будет использоваться термин "патологический перелом" [6].
Первичный остеопороз - это остеопороз, который развивается как самостоятельное заболевание [1, 2].
Тяжелый остеопороз - это остеопороз с уже имеющимся в анамнезе патологическим переломом: тела позвонка(ов), переломом бедренной кости или множественными переломами независимо от степени снижения минеральной плотности кости (МПК) по данным рентгеноденситометрии.
Остеопороз, осложненный патологическим переломом, - это остеопороз, осложненный патологическим переломом любой локализации, исключая переломы фаланг пальцев и костей черепа, которые не являются следствием остеопороза [3].
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Остеопороз - метаболическое заболевание скелета, характеризующееся снижением костной массы, нарушением микроархитектоники костной ткани и, как следствие, переломами при минимальной травме [6, 7].
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Остеопороз является полиэтиологическим заболеванием, развитие которого зависит от генетической предрасположенности, образа жизни, физической активности, эндокринологического статуса, наличия сопутствующих заболеваний, приема лекарственных препаратов, старения человека и индивидуальной продолжительности жизни [1 - 3]. Набор массы костной ткани происходит в детском и подростковом возрасте, достигая максимума к 20 - 30 годам. После достижения пика до 35 - 40 лет костная масса остается практически неизменной, после чего начинает постепенно уменьшаться. У женщин темпы снижения МПК значительно выше, чем у мужчин, что обусловлено дефицитом эстрогенов в период пери- и постменопаузы.
Костная ткань находится в состоянии постоянного изменения. Одновременно происходят два противоположных процесса: костеобразование и костная резорбция, от баланса которых зависит МПК, качество и прочность кости. В условиях дефицита эстрогенов данный баланс смещается в сторону потери костной массы. Однако дефицит эстрогенов не является единственной причиной потери МПК, как считали раньше. Ремоделирование костной ткани зависит от состояния фосфорно-кальциевого обмена, паратиреоидного гормона, витамина D, гормона роста, кальцитонина, тиреодных гормонов, глюкокортикоидов, старения и ассоциированного с ним секреторного фенотипа и т.д. В целом, все эффекты на состояние метаболизма костной ткани реализуются через основные регуляторные системы остеобластогенеза (канонический wnt-сигнальный путь) и остеокластогенеза (RANKL/RANK/OPG). Изменения экспрессии молекул-регуляторов остеобластогенеза и остеокластогенеза с возрастом и вследствие негативного влияния других факторов приводят к снижению прочности кости, что может проявляться нарушением внутренней микроархитектоники, снижением костной массы, МПК и, как следствие, переломами при минимальной травме [2]. Так, патологические переломы на фоне остеопороза могут возникнуть при падении с высоты собственного роста, неловком движении, кашле, чихании и вообще без видимого травматического вмешательства.
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В России среди лиц в возрасте 50 лет и старше остеопороз выявляется у 34% женщин и 27% мужчин, а частота остеопении составляет 43% и 44%, соответственно. Частота остеопороза увеличивается с возрастом [8]. В целом, остеопорозом страдают около 14 млн. человек и еще 20 млн. людей имеют снижение МПК, соответствующее остеопении [9]. Аналогичные показатели распространенности остеопороза у женщин отмечены среди белого населения Северной Америки и ряда стран Западной Европы [2, 3].
Социальная значимость остеопороза определяется его последствиями - переломами тел позвонков и костей периферического скелета, приводя к большим материальным затратам в области здравоохранения и обусловливающими высокий уровень нетрудоспособности, включая инвалидность и смертность.
Наиболее типичными переломами вследствие остеопороза считаются переломы проксимального отдела бедренной кости, лучевой кости и переломы тел позвонков, но также распространены переломы других крупных костей скелета (таза, ребер, грудины, голени, плечевой кости и т.д.) [10]. Одномоментное эпидемиологическое исследование среди городского населения России показало, что 24% женщин и 13% мужчин в возрасте 50 лет и старше ранее уже имели, по крайней мере, один патологический перелом, при этом наиболее распространены переломы тел позвонков [11]. Распространенность патологических переломов тел позвонков составляет около 10% у мужчин и 12,7% у женщин [9]. Частота переломов шейки бедренной кости, по данным эпидемиологического исследования, проведенного в 16 городах России (общая численность населения в возрасте 50 лет и старше составила 1 749 274 человек) в 1992 - 1997 гг., составила 100,9/100 000 населения, при этом достоверно чаще эти переломы зафиксированы среди женщин (115,5/100000) по сравнению с мужчинами (77,0/100000), p < 0,0001 [8]. Частота переломов была наиболее низкой у лиц обоего пола в возрасте 50 - 54 года и увеличивалась плавно до возраста 65 лет, а затем был отмечен ее экспоненциальный рост, особенно выраженный у женщин. За пятилетний период регистрации переломов отмечалось увеличение частоты переломов бедренной кости как у женщин, так и мужчин [8]. Аналогичное исследование было проведено через 11 лет (2008 - 2009 гг.) в четырех городах России. Оно показало, что частота переломов проксимального отдела бедренной кости уже составляет 239 случаев на 100 000 населения (276 и 175 случаев у женщин и мужчин, соответственно). При этом у мужчин в возрасте 50 - 64 года она была в 2 раза выше, чем у женщин, а в возрасте 75 лет и старше эта тенденция была диаметрально противоположной [11].
Показатели смертности в течение первого года после перелома бедренной кости составляют от 12 до 40%, причем данный показатель выше у мужчин [10]. Особенно высока летальность в течение первых 6 месяцев после перелома, которая на 5 - 20% выше по сравнению с этим показателем у лиц того же возраста без переломов, а в некоторых городах России летальность в 8 раз превышала общегородские показатели смертности у лиц того же возраста [12]. У пациентов, перенесших патологические переломы, достоверно снижается качество жизни, которое лишь частично восстанавливается в среднем через 12 - 24 месяца в зависимости от локализации перелома [12]. Так, среди лиц, выживших после перелома бедренной кости, каждый третий утрачивает способность к самообслуживанию и нуждается в длительном постоянном уходе. Восстановление качества жизни у выживших пациентов, перенесших перелом проксимального отдела бедренной кости, происходит в среднем через 2 года и зависит от того, было ли проведено оперативное лечение.
Перелом дистального отдела предплечья - один из наиболее распространенных переломов при падении с высоты собственного роста. По данным эпидемиологического исследования в России частота его составляла 426/100000 населения, превышая частоту перелома бедренной кости в 3 - 7 раз у мужчин и 4 - 8 раз у женщин и достоверно превалируя у женщин.
При этом за пятилетний период отмечалось достоверное увеличение частоты переломов любой локализации, особенно у пациентов, которые уже перенесли перелом [8].
Усредненная стоимость 1 года лечения остеопороза, осложненного переломом, составляла 61151 рублей, при этом наиболее дорогостоящим является лечение пациентов с переломом проксимального отдела бедренной кости, а наименее затратным - при переломе дистального отдела предплечья [13]. С учетом эпидемиологических данных о частоте патологических переломов пересчет на население России в возрасте 50 лет и старше показал, что только прямые медицинские затраты на лечение патологических переломов пяти основных локализаций за один год могут достигать около 25 млрд. рублей, при этом затраты на лечение пациентов с переломами тел позвонков, которые в популяции встречаются примерно у 10% населения в возрасте 50 лет и старше, почти в два раза превышают стоимость лечения пациентов с переломом бедренной кости в масштабах страны [13].
Сравнительное исследование социальных и экономических последствий перелома шейки бедренной кости и инфаркта миокарда [14] показало, что при одинаковых затратах на лечение этих двух заболеваний пациенты с переломом имеют существенно более низкое качество жизни, обусловленное, в первую очередь, отсутствием оперативного лечения или плохой реабилитацией, и, как следствие - хроническим болевым синдромом и двигательными нарушениями.
С учетом прогнозируемого роста продолжительности жизни в России в ближайшие годы будет наблюдаться рост случаев патологических переломов. Так, например, к 2035 году у мужчин число случаев перелома проксимального отдела бедренной кости вырастет на 36%, у женщин - на 43% [15].
Таким образом, высокая и постоянно растущая распространенность остеопороза, значительная стоимость лечения как самого заболевания, так и его прямых осложнений - переломов, развитие болевого синдрома, деформаций и потери трудоспособности и способности к самообслуживанию, определяют важность данной проблемы для здравоохранения Российской Федерации.
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
M81.0 - Постменопаузный остеопороз.
M81.8 - Другие остеопорозы.
1.5. Классификация заболевания или состояния (группы заболеваний или состояний)
Первичный остеопороз развивается как самостоятельное заболевание без выявленной другой причины снижения прочности скелета, занимает 95% в структуре остеопороза у женщин в постменопаузе (постменопаузальный остеопороз) и 80% в структуре остеопороза у мужчин старше 50 лет [1 - 3, 16]. К первичному остеопорозу также относится идиопатический остеопороз, который развивается у женщин до менопаузы, мужчин до 50 лет и ювенильный остеопороз, который диагностируется у детей (до 18 лет). Идиопатические и ювенильные формы первичного остеопороза крайне редки.
Вторичный остеопороз развивается вследствие различных заболеваний или состояний, а также приема лекарственных средств, то есть имеется конкретная причина, приводящая к остеопорозу (Таблица 1). В структуре остеопороза вторичный остеопороз занимает 5% у женщин и 20% у мужчин [16].
Таблица 1. Состояния, заболевания и препараты, способные приводить к развитию вторичного остеопороза [1, 2, 16]
Факторы образа жизни
Избыток витамина A
Выраженный дефицит массы тела, резкая потеря массы тела
Нарушения питания:
- низкое потребление кальция
- дефицит витамина D
- переизбыток соли в рационе
Генетические заболевания
Муковисцидоз
Синдром Элерса-Данло
Болезнь Гоше
Болезни накопления гликогена
Гемохроматоз
Гомоцистинурия
Гипофосфатазия <*>
Синдром Марфана
Болезнь "стальных волос" (болезнь Менкеса) - нарушение транспорта меди
Несовершенный остеогенез <*>
Семейная дизавтономия (синдром Рейли-Дея)
Порфирия
Гипогонадные состояния
Нечувствительность к андрогенам
Нервная анорексия
Аменорея атлетов
Гиперпролактинемия
Пангипопитуитаризм
Преждевременная менопауза (< 40 лет)
Синдромы Тернера и Клайнфельтера
Эндокринные нарушения
Акромегалия
Эндогенный гиперкортицизм
Сахарный диабет (СД) 1 и 2 типа
Гиперпаратиреоз <*>
Тиреотоксикоз
Желудочно-кишечные нарушения
Целиакия
Желудочный шунт
Хирургические вмешательства на ЖКТ
Воспалительные заболевания кишечника (болезнь Крона и неспецифический язвенный колит (НЯК))
Мальабсорбция
Панкреатит
Первичный билиарный цирроз
Гематологические нарушения
Гемофилия
Лейкемия и лимфомы
Моноклональные гаммапатии
Множественная миелома
Серповидноклеточная анемия
Системный мастоцитоз
Талассемия
Ревматологические и аутоиммунные заболевания
Анкилозирующий спондилит
Другие ревматические и аутоиммунные заболевания
Ревматоидный артрит
Системная красная волчанка
Неврологические и костно-мышечные факторы риска
Эпилепсия
Множественный склероз
Мышечная дистрофия
Болезнь Паркинсона
Повреждение спинного мозга
Инсульт
Другие состояния и заболевания
СПИД/ВИЧ-инфекция
Хроническая обструктивная болезнь легких
Амилоидоз
Хронический метаболический ацидоз
Застойная сердечная недостаточность
Иммобилизация
Алкоголизм
Терминальная почечная недостаточность
Гиперкальциурия
Идиопатический сколиоз
Посттрансплантационная костная болезнь
Саркоидоз
Лекарственные средства
Алюминий (в составе антацидов)
Антикоагулянты (гепарин натрия**)
Противоэпилептические препараты
Противоопухолевое средство - гонадотропин-рилизинг гормона аналог
Барбитураты
Противоопухолевые гормональные препараты - ингибиторы ароматазы
Медроксипрогестерон** (пременопаузальная контрацепция)
Глюкокортикостероид (>= 5 мг/сут преднизолона** или эквивалентной дозы в течение >= 3 месяца)
Лития карбонат циклоспорин** и такролимус**
Метотрексат**
Парентеральное питание
Ингибиторы протонового насоса
Антидепрессанты
Пиоглитазон и росиглитазон
Гормоны щитовидной железы (супрессивные дозы, длительно)
--------------------------------
<*> Несовершенный остеогенез, гиперпаратиреоз, гипофосфатазия относятся к метаболическим заболеваниям с преимущественным поражением скелета и поэтому они могут рассматриваться как самостоятельные заболевания.
Возможно развитие смешанного характера остеопороза. Например, при приеме глюкокортикоидов у женщин в постменопаузе вследствие серьезного соматического заболевания, которое само по себе может приводить к развитию вторичного остеопороза. В данном случае очень сложно выделить первопричину снижения прочности костей скелета.
1.6. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Остеопороз до развития патологического перелома не имеет клинических проявлений. В отличие от остеопороза, патологический перелом в остром периоде часто имеет яркую клиническую картину. Перелом сопряжен с болью, нарушением функции, и диагностируется рентгенологически врачом-травматологом, который в зависимости от характера предшествующей травмы может заподозрить остеопороз.
Отдельного внимания заслуживают клинические проявления патологических переломов тел позвонков, которые длительно могут оставаться не диагностированными. Компрессионные переломы тел позвонков сопровождаются болью или чувством усталости в спине, снижением роста, а также в случае развития множественных компрессионных деформаций целым рядом клинических проявлений, представленных на Рисунке 1.
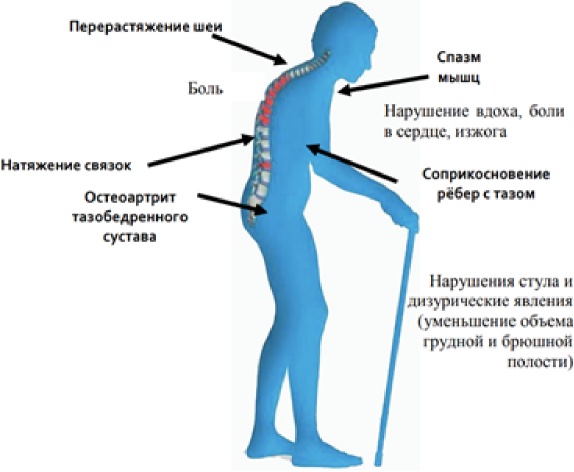
Рисунок 1. Клинические проявления множественных компрессионных деформаций тел позвонков
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Введение
Критерии установления диагноза остеопороз:
1. Наличие патологических переломов крупных костей скелета (бедренной кости, тел(а) позвонков(а), множественных переломов) в анамнезе или, выявленных при обследовании, независимо от результатов рентгеноденситометрии или FRAX (при условии исключения других заболеваний скелета).
2. Наличие высокой индивидуальной 10-летней вероятности основных патологических переломов (результат оценки FRAX соответствует Российскому порогу вмешательства и/или превышает его) независимо от показателя рентгеноденситометрии.
3. Снижение МПК на 2,5 и более стандартных отклонений (SD) по T-критерию в шейке бедренной кости и/или в целом в проксимальном отделе бедренной кости и/или в поясничных позвонках (L1 - L4, L2 - L4), измеренной двухэнергетической рентгеноденситометрией (DXA), у женщин в постменопаузе и мужчин старше 50 лет.
2.1. Жалобы и анамнез
До развития патологического перелома остеопороз не имеет клинических проявлений. В связи с этим, на этапе сбора жалоб и анамнеза, в первую очередь, необходимо оценить индивидуальную 10-летнюю вероятность патологического перелома с использованием алгоритма FRAX (fracture risk assessment tool).
- Скрининг для выявления групп с высокой вероятностью переломов рекомендован с использованием алгоритма FRAX среди всех женщин в постменопаузе и мужчин старше 50 лет [15, 17 - 24].
Уровень убедительности рекомендации A (уровень достоверности доказательств 1)
Комментарии: Ввиду высокой распространенности остеопороза и патологических переломов в старших возрастных группах [1 - 3], тяжелых инвалидизирующих последствиях патологических переломов, высокими затратами на лечение перелома и последующую реабилитацию [9 - 13] оправданно проводить скрининг для выявления пациентов с высоким риском переломов среди всего населения старше 50 лет. Для подтверждения эффективности алгоритма FRAX в качестве инструмента скрининга было проведено рандомизированное контролируемое исследование с включением когорты 11580 женщин в постменопаузе, проживающих самостоятельно. Пациенты были рандомизированы на тех пациентов, среди кого проводился скрининг с использованием алгоритма FRAX (n = 6233) и в группе высокого риска назначалась терапии и тех, кто традиционно наблюдался у своего лечащего врача (n = 6250). Наблюдение за включенными когортами в течение 5 лет показало, что активный скрининг с применением алгоритма FRAX позволяет сократить частоту переломов бедра на 28% (ОР 0,72 - 0,89) p = 0,0002 по сравнению с традиционным наблюдением [17].
Факторы риска для основных патологических переломов и для перелома бедренной кости, включенные в алгоритм FRAX, были выявлены по результатам 12 проспективных когортных исследований во многих географических регионах с использованием первичных баз данных [6, 25], что определяет высокую степень доказательности применения алгоритма. Наблюдение составило приблизительно 250 000 пациентов-лет среди 60 000 мужчин и женщин, в ходе которых было зарегистрировано более 5000 переломов [25]. Каждый включенный в алгоритм FRAX фактор риска повышает вероятность переломов независимо от МПК, но может быть совмещен с измерением МПК у индивидуального пациента [3, 6, 25]. Ключевые факторы риска патологических переломов, доказавшие свой независимый вклад, сведены в Приложении Г1.
В настоящее время, нет рандомизированного исследования использования инструмента скрининга у мужчин. Однако риск переломов, как и лечение остеопороза у мужчин определяется так же, как и у женщин, на основании исследований, подтверждающих эффективность по суррогатному критерию. Валидизация алгоритма FRAX у мужчин осуществлялась в частности в проспективном исследовании CaMos [21]. Средняя предсказанная вероятность переломов с включением МПК у мужчин для основных патологических переломов не отличалась значимо от полученной в ходе исследования (предсказанная 5.4%, полученная 6.4% (95% ДИ 5.2 - 7.5%). Схожие результаты были получены в большом Канадском исследовании в провинции Манитоба [22], в Великобритании [19] и Норвегии [20]. Таким образом, алгоритм FRAX откалиброванный на основании национальных исследований переломов бедра предсказывает риск сопоставимый с частотой переломов при учете различных групп риска. При калибровании алгоритма FRAX учитываются данные перелома бедра у мужчин и женщин, а также частота летальных исходов в стране, поэтому любая страна при калибровке алгоритма включает мужчин и женщин.
В ходе опроса с использованием алгоритма FRAX наряду с другими факторами риска врач уточняет наличие перелома в анамнезе. При положительном ответе на этот вопрос необходимо уточнить локализацию перелома и характер травмы [6].
- При наличии патологических переломов крупных костей скелета (бедренной кости, тел(а) позвонков(а), множественных переломов) в анамнезе рекомендовано устанавливать диагноз остеопороза и назначать лечение независимо от результатов рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости или FRAX (при условии исключения других заболеваний скелета) [2, 3, 6, 26 - 37].
Уровень убедительности рекомендации B (уровень достоверности доказательств 2)
Комментарии: Патологический перелом является ключевым осложнением остеопороза, который объединяет снижение костной массы и нарушение микроархитектоники, в то время как рентгеновская денситометрия отражает только снижение МПК и является одним из факторов риска переломов. Независимо от МПК, возраста и других клинических факторов риска, рентгенологически подтвержденные переломы тел позвонков (даже если они совершенно бессимптомны), переломы бедренной кости и других крупных костей скелета являются признаком изменения структуры и снижения прочности кости, и значимым предиктором новых переломов тел позвонков и других костей скелета [3, 9, 26 - 28], поэтому наличие перелома при минимальной травме достаточно для установления диагноза "остеопороз" и назначения лечения в международных клинических рекомендациях по остеопорозу [2, 3, 6]. Назначение препаратов для лечения остеопороза во многих исследованиях было основано на данных о снижении МПК. Многие исследования, в том числе мета-анализы, показали, что противопереломная эффективность у лиц с предшествующими переломами не зависит от исходной МПК [29 - 34]. Однако необходимым условием установки диагноза "остеопороз" является исключение других метаболических заболеваний скелета [2].
2.2. Физикальное обследование
- Всем пациентам (женщины в постменопаузе и мужчины старше 50 лет) рекомендуется проводить физикальное обследование, включающее измерение роста, оценку формы грудной клетки и осанки, наличия складок кожи на задней поверхности спины для выявления клинических признаков компрессионных переломов тел позвонков [1 - 3].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5)
Комментарии: При фиксации результатов роста необходимо уточнить максимальный рост в молодом возрасте (25 лет) и/или при последнем предыдущем измерении роста. При снижении роста на 2 см и более за 1 - 3 года или на 4 см и более за жизнь необходимо заподозрить компрессионный(ые) перелом(ы) тела позвонка.
Наличие складок кожи на спине и боках (симптом "лишней кожи"), уменьшение расстояния между реберными дугами и гребнями подвздошных костей меньше ширины 2 пальцев являются физикальными признаками компрессионных переломов тел позвонков. Эти физикальные признаки не отличаются у мужчин и женщин
При измерении роста следует обратить внимание на невозможность полностью распрямиться, появление расстояния от стены до затылка, что является симптомом компрессионных переломов тел позвонков.
Характерная кифотическая деформация грудной клетки, относительное увеличение живота в объеме ("выпячивание" передней брюшной стенки), относительное удлинение конечностей и укорочение грудной клетки представлены на рисунке 1 и являются симптомами множественных компрессионных деформаций тел позвонков.
Кроме того, при физикальном обследовании следует обращать внимание на наличие симптомов заболеваний, приводящих к вторичному остеопорозу (Табл. 1), которые достаточно специфичны для каждой патологии.
2.3. Лабораторные диагностические исследования
- Исследование уровня биохимических параметров крови: исследование уровня общего кальция в крови, исследование уровня креатинина в крови (с подсчетом скорости клубочковой фильтрации (СКФ)), исследование уровня неорганического фосфора в крови, определение активности щелочной фосфатазы в крови, исследование уровня глюкозы в крови рекомендуется проводить всем пациентам с впервые установленным диагнозом остеопороз, а также при неэффективности ранее назначенной терапии с целью дифференциальной диагностики с другими причинами повышенной хрупкости скелета [38 - 43].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
Комментарии: Результаты лабораторного исследования позволяют установить другую причину повышенной хрупкости скелета и уточнить противопоказания к назначению той или иной терапии (например, гипокальциемия является противопоказанием к назначению БФ и деносумаба**, гиперкальциемия и повышение щелочной фосфатазы являются противопоказанием для назначения терипаратида** и т.д.). Когортные исследования показывают, что до 15 - 30% пациентов могут иметь другие заболевания, приводящие к остеопорозу или усугубляющие его течение [40 - 42]. Лабораторные исследования следует повторять при неэффективности терапии ввиду возможности развития сочетанных заболеваний или дефицита витамина D, как причины недостаточного ответа на лечение [2, 43].
Общие и более специфические лабораторные методы для дифференциальной диагностики остеопороза и других метаболических заболеваний скелета сведены в Приложении А3.2. [1 - 3, 16]. Например, выявление синдрома гиперкальциемии предполагает целый ряд обследований для уточнения причины этого состояния. Наиболее часто диагностируется гиперпаратиреоз, но синдром гиперкальциемии может наблюдаться и при тиреотоксикозе, множественной миеломе, болезни Педжета, метастатическом поражении скелета и т.д.
- Общий (клинический) анализ крови рекомендуется проводить всем пациентам с впервые установленным диагнозом остеопороз, а также при неэффективности ранее назначенной терапии с целью дифференциальной диагностики с другими причинами повышенной хрупкости скелета [38 - 42].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
Комментарии: При первичном остеопорозе общий (клинический) анализ крови не имеет специфических изменений. Выявление анемии и повышенного СОЭ позволяет заподозрить другие заболевания, приводящие к снижению прочности скелета или причину вторичного остеопороза (Табл. 1 и Приложение А3.2).
- Рекомендуется определение C-концевого телопептида в крови, и/или исследование уровня N-терминального пропептида проколлагена 1-го типа (P1NP) в крови (маркера резорбции при назначении антирезорбтивной терапии и костеобразования при назначении анаболической терапии, соответственно) пациентам, получающим лечение остеопороза самостоятельно, исходно и через 3 месяца от начала терапии с целью ранней оценки эффективности лечения и приверженности к терапии. Достаточно оценивать один маркер, но в одной и той же лаборатории [44 - 51].
Уровень убедительности рекомендации A (уровень достоверности доказательств 2)
Комментарии: Костное ремоделирование происходит в течение всей жизни человека с целью адаптации костной ткани, репарации повреждений, а также для поддержания минерального гомеостаза. Основные биохимические маркеры костного ремоделирования, которые наиболее оправдано определять в клинической практике, сведены в Таблице 2.
Таблица 2. Биохимические маркеры костного ремоделирования
Маркеры костеобразования
Маркеры костной резорбции
Костно-специфическая щелочная фосфатаза в крови
Пиридинолин и дезоксипиридинолин в моче
Остеокальцин в крови
*C-концевой телопептид коллагена 1 типа (![]() - cross laps, СТХ) в крови
- cross laps, СТХ) в крови
*N-терминальный пропептид проколлагена 1-го типа (P1NP) в крови
N-концевой телопептид в моче
Примечание: *N-терминальный пропептид проколлагена 1 типа и C-концевой телопептид коллагена 1 типа считаются наиболее стабильными, с хорошей воспроизводимостью и рекомендуются для определения большинству пациентов [48 - 50].
До 50% случаев неэффективности терапии обусловлено недостаточной приверженностью пациентов, что включает в себя не только отказ от приема препарата, но и несоблюдение режима и правил приема таблетированных бифосфонатов (БФ) или ежедневных инъекций терипаратида**. Снижение маркеров костной резорбции у пациентов, получающих БФ, коррелировало с прибавкой МПК и в ряде случае независимо определяло снижение риска переломов [52 - 56]. Также повышение P1NP в ответ на терапию терипаратидом** является предиктором прироста МПК [57]. Исследование маркеров в ходе терапии позволяет отследить приверженности к лечению. Мета-анализ 171063 пациентов, которые наблюдались в течение 1 - 2,5 лет показал 46% снижение риска переломов у пациентов с хорошей комплаентностью по сравнению с теми, кто не в полной мере выполнял рекомендацию врача [58]. Оправдано исследовать уровень маркеров костного ремоделирования исходно и затем через 3 месяца терапии, ожидая как минимум 30% изменение [59]. Неадекватный ответ маркеров костного ремоделирования является ранним сигналом о необходимости дополнительного обучения или смены терапии. В условиях отсутствия возможности проведения рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости маркеры костного ремоделирования могут служить суррогатным критерием эффективности терапии. Ввиду биологической вариабильности оптимально исследовать маркеры костного ремоделирования в одно и тоже время на одинаковом анализаторе, используя наборы одного и того же производителя [60]. Необходимо отметить, что маркеры костного ремоделирования, в том числе костеобразования, повышаются после перелома и их повышение может сохраняться до 6 месяцев, при этом может не наблюдаться их дальнейшего повышения при терапии анаболическим агентом.
- Определение C-концевого телопептида коллагена в крови и/или исследование уровня N-терминального пропептида проколлагена 1-го типа (P1NP) в крови в верхней четверти референсного интервала рекомендуется оценивать как дополнительный фактор риска для инициации терапии остеопороза у женщин в постменопаузе с остеопенией [50, 61 - 66].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Имеются убедительные доказательства, что высокие показатели маркеров костного ремоделирования предсказывают более быструю потерю костной ткани [61 - 64, 67], хотя не существует точки вмешательства для индивидуального пациента. Фармакоэкономическое исследование с применением модели Маркова показало, что лечение алендроновой кислотой** у женщин с остеопенией с уровнем маркеров костного ремоделирования в верхней четверти референтного интервала экономически эффективно [66]. Некоторые специалисты считают обоснованным использовать маркеры для мониторинга состояния пациента после отмены терапии. Хотя наблюдение пациентов после отмены алендроновой кислоты**, ризедроновой кислоты и золедроновой кислоты** не выявило зависимости между повышением маркеров ремоделирования и повышением риска переломов [68 - 70], мониторинг маркеров костного ремоделирования после отмены терапии дает представление о присутствии терапевтического агента в костной ткани, механизме его действия. Необходимо отметить, что ни одно из исследований отмены препарата не обладало достаточной статистической мощностью, чтобы выявить связь между повышением маркеров костного ремоделирования и риском переломов.
- Не рекомендуется использовать маркеры костного ремоделирования для прогнозирования риска переломов у индивидуального пациента, а также выбора типа терапии (антирезорбтивной или анаболической) [71 - 73].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: На сегодняшний день, не существует отработанной точки вмешательства для одного лабораторного набора и/или одного маркера костного ремоделирования для определения риска перелома у женщин в постменопаузе, хотя известно, что уровень маркеров костного ремоделирования повышается в постменопаузе, и это отражает потерю костной массы [61 - 65]. По результатам исследований не было выявлено зависимости между уровнем маркеров костного ремоделирования исходно и степенью эффективности алендроновой кислоты** для предупреждения переломов или прибавки МПК [71]. Близкий результат был получен в исследовании ризедроновой кислоты [72]. Эффективность препаратов не определяется исходным уровнем маркеров. Например, при глюкокортикоидном остеопорозе (ГКО), несмотря на снижение маркеров костеобразования, лечение БФ является эффективным для предупреждения переломов; при постменопаузальном остеопорозе, особенно после перелома, уровень маркеров может быть повышен, тем не менее терипаратид** эффективен для предупреждения новых переломов. Таким образом, маркеры костного метаболизма являются только дополнительным фактором риска при принятии решения о терапии и не могут влиять на выбор терапии по механизму действия. Практическим специалистам не рекомендуется устанавливать первичный диагноз остеопороза на основании любых лабораторных исследований [2, 3]. Первичный остеопороз диагностируется только на основании патологического перелома, снижения МПК или совокупности факторов риска [2, 3, 6]. На основании лабораторных обследований исключаются другие метаболические заболевания скелета, приводящие к симптомокомплексу повышенной хрупкости скелета и потери МПК, то есть лабораторные исследования проводятся с целью дифференциального диагноза. При нормальных результатах первых тестов, более детальное исследование, как правило, не требуется, и повторный диагностический поиск проводится в случае появления новых симптомов или неэффективности лечения.
2.4. Инструментальные диагностические исследования
Наличие единственного перелома тела позвонка повышает риск последующих переломов позвонков в 3 - 5 раз, а риск переломов бедренной кости и другой локализации в 2 - 3 раза [29]. Выявление компрессионного перелома тела позвонка является показанием к медикаментозному лечению остеопороза с целью уменьшения риска последующих переломов [74].
- Рекомендовано проведение стандартной рентгенографии позвоночника грудного и поясничного отделов (Th4 - L5) в боковой проекции для выявления компрессионных переломов тел позвонков у следующих категорий пациентов:
- с болевым синдромом в спине [75];
- пациентам с длительно некомпенсированным сахарным диабетом (СД) 2 типа или на инсулинотерапии [76];
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
- снижением роста на 4 см в течение жизни или на 2 см при регулярном медицинском контроле [77];
- принимающим глюкокортикоиды [78];
- с диагностированными переломами другой локализации [29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Компрессионные переломы тел позвонков могут протекать без выраженного болевого синдрома. Кроме того, клинические проявления перелома неспецифичны и могут быть расценены как другая причина боли в спине. Вместе с тем, до 20% пациентов, испытавших патологический перелом тела позвонка, перенесут второй перелом уже в течение следующего года [71, 72]. Поэтому необходимо активное выявление компрессионных переломов тел позвонков с направлением на исследование пациентов, у которых вероятность наличия перелома высока. Клинические симптомы компрессионных переломов тел позвонков описаны в разделе физикального обследования. Применение глюкокортикоидов более 3-х месяцев и длительно некомпенсированный СД 2 типа являются наиболее значимыми факторами риска развития компрессионных переломов тел позвонков [37, 76, 79], поэтому пациенты с вышеуказанными состояниями должны быть активно обследованы. После проведения первого исследования, динамический контроль необходимо проводить лишь в случаях документально подтвержденного проспективного снижения роста или при возникновении/возобновлении боли в спине или изменения осанки [37, 80 - 83]. Повторное рентгенологическое исследование позвоночника также рекомендовано у пациентов при принятии решения об отмене медикаментозного лечения остеопороза, так как у пациентов со свежими переломами тел позвонков прекращение приема препаратов нежелательно.
Измененные позвонки часто чередуются с малоизмененными или неизмененными позвонками (симптом "клавиш") или располагаются среди тел позвонков с близкими по значению линейными размерами их передних краев (симптом "выравнивания") [1, 84]. При первичном остеопорозе никогда не наблюдается деструктивных изменений, внутрикостных уплотнений, прерывов контуров или увеличения в объеме тел позвонков, выраженных сужений межпозвонковых дисков. В отдельных случаях, при однократном обследовании нельзя точно дать оценку той или иной деформации, что требует динамического наблюдения за пациентом или более детального исследования области перелома с помощью компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) [85, 86]. В качестве альтернативы рентгенологическому исследованию исходно может быть выполнена компьютерная томография или магнитно-резонансная томография позвоночника Th4 - L5.
Применение рентгенологических методов визуализации позвоночника
Оценка состояния позвонков проводится с использованием рентгенографии грудного и поясничного отделов позвоночника в боковой проекции или с применением рентгеновской морфометрии в рамках рутинной рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости [83, 87]. Для выполнения рентгенографии применяется стандартное рентгенологическое оборудование. Получение боковых рентгенограмм грудного (Th4 - Th12) и поясничного (L1 - L5) отделов позвоночника требует соблюдения ряда правил [84, 88]:
- положение пациента на левом боку;
- обязательное выпрямление сколиотического искривления позвоночника специальными поролоновыми валиками так, чтобы линия, проведенная по остистым отросткам, шла параллельно столу;
- использование при рентгенографии грудного отдела позвоночника специального режима дыхания; снимок поясничного отдела делается при задержке дыхания;
- желательно использование рентгеновских кассет со специальными выравнивающими экранами для рентгенографии позвоночника.
Методы оценки переломов тел позвонков.
Компрессионный перелом тела позвонка - это снижение высоты тела позвонка (компрессионная деформация) в переднем, среднем или заднем отделах на 20% и более по сравнению с другими отделами этого же позвонка [83].
Классификация переломов 0, 1, 2 и 3 степени схематически показаны в Приложении А3.3.
Практическим специалистам не рекомендуется устанавливать диагноз остеопороза на основании косвенных признаков повышенной прозрачности костей скелета на стандартных рентгенограммах у пациентов без компрессионных переломов тел позвонков. В ряде случаев, в заключении рентгенолога указаны признаки остеопороза при рентгенографии различных участков скелета. Основной рентгенологический симптом остеопороза - повышение рентгенопрозрачности костной ткани неспецифичен и в значительной степени зависит от технических условий съемки и качества проявления рентгенограмм [1]. При отсутствии характерных компрессионных деформаций тел позвонков (компрессионных переломов) установление диагноза остеопороз на основании данных рентгенографии неправомочно [1]. КТ, МРТ и сцинтиграфия скелета могут рассматриваться в качестве дополнительных методов дифференциальной диагностики [85, 89 - 92].
- Рекомендовано устанавливать диагноз остеопороза и назначать лечение пациентам (женщинам в постменопаузе и мужчинам старше 50 лет) с высокой индивидуальной 10-летней вероятностью основных патологических переломов (результат оценки FRAX соответствует российскому порогу вмешательства (Рисунок 2) и/или превышает "высокую вероятность переломов" (Таблица 3)) независимо от показателя рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости [15, 17, 18, 93 - 95].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Если в ходе оценки жалоб, анамнеза, физикального обследования и рентгенографии позвоночника патологические переломы не выявлены, решение о необходимости назначения терапии остеопороза принимается на основании 10-летней вероятности развития патологического перелома [3].
В результате расчета FRAX врач получает индивидуальную 10-летнюю вероятность перелома бедренной кости (%) и основных патологических переломов (%). Термин основные патологические переломы, в данном случае, объединяет клинически значимые переломы тел позвонков (то есть переломы, которые сопровождаются болью), переломы бедренной, плечевой и лучевой костей [3, 6, 16, 96].
При расчете индивидуальной 10-летней вероятности перелома, алгоритм FRAX учитывает вероятность летального исхода от других причин [6]. Вероятность патологического перелома и смертность заметно различается в разных регионах мира [97], поэтому алгоритм FRAX откалиброван для тех стран, где эпидемиология патологических переломов бедренной кости и уровень смертности известны [98 - 101].
Построенная на основании российских данных точка вмешательства [15], нижний порог вмешательства и верхний порог вмешательства сведены в Таблице 3.
Таблица 3. Точка вмешательства FRAX по 10-летней вероятности (в процентах) основных патологических переломов эквивалентных вероятности переломов у женщин с патологическим переломом в анамнезе без других факторов риска (ИМТ = 24 кг/м2), без данных по МПК [15]
Возраст (годы)
10-летняя вероятность переломов (%)
Точка терапевтического вмешательства <1>
Низкая вероятность переломов <2>
Высокая вероятность переломов <3>
40
10,75
4,87
12,9
41
11,05
5,04
13,26
42
11,34
5,21
13,61
43
11,61
5,37
13,93
44
11,9
5,53
14,28
45
12,2
5,71
14,64
46
12,5
5,89
15
47
12,79
6,06
15,35
48
13,07
6,23
15,68
49
13,35
6,4
16,02
50
13,61
6,55
16,33
51
13,89
6,72
16,67
52
14,14
6,88
16,97
53
14,43
7,06
17,32
54
14,73
7,25
17,68
55
15,03
7,44
18,04
56
15,34
7,65
18,41
57
15,69
7,87
18,83
58
16,02
8,09
19,22
59
16,39
8,33
19,67
60
16,77
8,58
20,12
61
17,03
8,76
20,44
62
17,32
8,96
20,78
63
17,56
9,14
21,07
64
17,79
9,31
21,35
65
18,04
9,5
21,65
66
18,28
9,69
21,94
67
18,55
9,9
22,26
68
18,81
10,1
22,57
69
19,09
10,33
22,91
70
19,3
10,53
23,16
71
19,69
10,84
23,63
72
20,16
11,22
24,19
73
20,69
11,65
24,83
74
21,2
12,09
25,44
75
21,71
12,54
26,05
76
22,07
12,92
26,48
77
22,4
13,3
26,88
78
22,73
13,7
27,28
79
22,84
13,97
27,41
80
22,85
14,18
27,42
81
22,9
14,26
27,48
82
22,74
14,21
27,29
83
22,37
14,01
26,84
84
21,84
13,69
26,21
85
21,11
13,25
25,33
86
20,36
12,78
24,43
87
19,32
12,12
23,18
88
18,08
11,32
21,70
89
16,84
10,53
20,21
90
15,73
9,82
18,88
Примечания:
<1> Точка терапевтического вмешательства - значение индивидуальной 10-летней вероятности основных патологических переломов, при котором пациенту соответствующего возраста на основании совокупности факторов риска показано начинать терапию остеопороза. (Рентгеноденситометрия поясничного отдела позвоночника и проксимального отдела бедренной кости может быть проведена только для динамической оценки эффективности лечения.)
<2> Низкая вероятность переломов - значение индивидуальной 10-летней вероятности основных патологических переломов, при котором (и при более низких значениях) пациенту соответствующего возраста на основании совокупности факторов риска не показано проведение рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости, и пациент не нуждается в лечении остеопороза.
<3> Высокая вероятность переломов - значение индивидуальной 10-летней вероятности основных патологических переломов, при котором (и при более высоких значениях) пациенту соответствующего возраста на основании совокупности факторов риска не показано проведение рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости, и пациент однозначно нуждается в лечении остеопороза.
Точка вмешательства была предложена Российской ассоциацией по остеопорозу (РАОП) на основании статистических данных, полученных из травматологических клиник в городе Ярославле и городе Первоуральске [15, 102], которая затем была доработана с предложением нижней и верхней границ точки вмешательства (Рисунок 2). Необходимо отметить, что как эпидемиологические исследования, положенные в основу разработки FRAX, так и данные проспективной когорты, на которой российская точка вмешательства оценивалась [103], не обладают достаточной статистической мощностью, соответствующей таковой в Великобритании или в европейских странах с эпидемиологическими исследованиями на уровне страны [3]. В этой связи, лицам, у которых было рекомендовано исследование рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости по результатам FRAX (оранжевая зона) и был выявлен остеопороз по критериям ВОЗ (T-критерий <= -2,5) должно быть рекомендовано лечение остеопороза без переоценки FRAX. Точка вмешательства одинаково определяет необходимость терапии как для женщин, так и для мужчин.
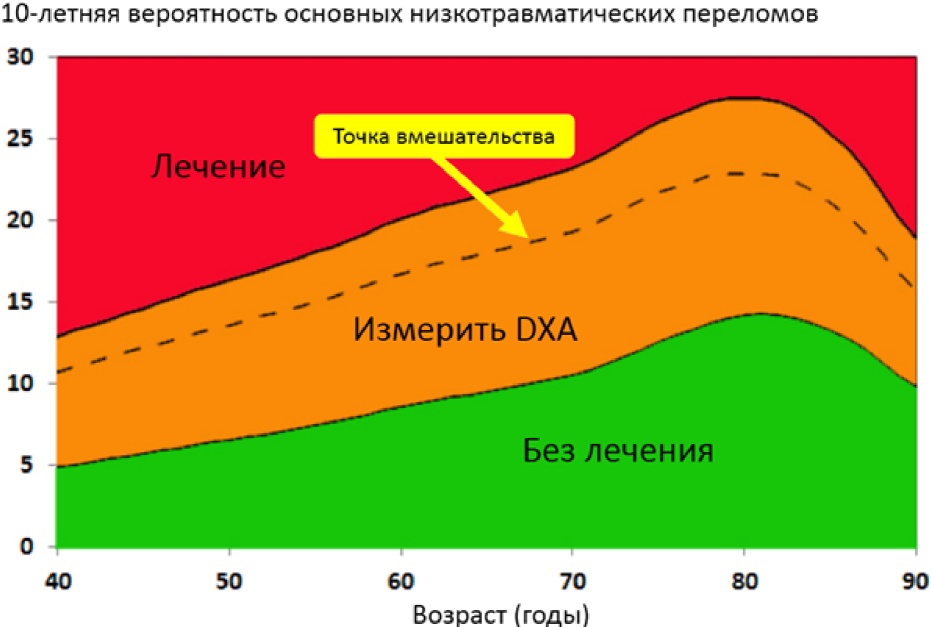
Рисунок 2. Точка вмешательства FRAX, предложенная для российской популяции по данным исследований в Ярославле и Первоуральске (ИМТ 24 кг/м2) без данных по МПК.
Ограничения FRAX.
Необходимо учитывать, что FRAX не показан для использования у молодых людей и детей. Инструмент FRAX не был валидизирован у пациентов, ранее получавших или получающих на момент обращения фармакотерапию по поводу остеопороза. Однако пациенты, прекратившие прием препаратов 2 и более года назад, могут считаться нелечеными [104]. FRAX может быть рассчитан с включением МПК/T-критерия в шейке бедренной кости, и не учитывает МПК поясничного отдела позвоночника. ВОЗ определила, что для многих вторичных причин остеопороза риск переломов был обусловлен, прежде всего, влиянием основного заболевания на МПК [25]. По этой причине при включении МПК в шейке бедра в онлайн-расчет FRAX отмеченные значения "вторичные причины остеопороза" автоматически инактивируются. Алгоритм оценки 10-летней вероятности переломов имеет ограничения, требующее клинического суждения врача. Так, при наличии у пациента множественных переломов риск последующих переломов будет занижен инструментом FRAX. Таким пациентам лечение остеопороза назначается независимо от показателя FRAX. FRAX не учитывает дозу глюкокортикоидов, количество сигарет и количество алкоголя, а также не учитывает влияние СД 2 типа на риск переломов.
- Рекомендуется увеличить индивидуальную 10-летнюю вероятность основных патологических переломов (FRAX) на 15% у пациентов, принимающих глюкокортикоиды в течение 3-х месяцев и более в дозе 7,5 мг/сут и более в перерасчете на преднизолон** с целью коррекции вероятности перелома [6, 105 - 107].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
Комментарий: Перерасчет индивидуальной 10-летней вероятности переломов в зависимости от дозы глюкокортикоидов сведен в Таблице 4 [3].
Таблица 4. Средний перерасчет 10-летней вероятности перелома бедренной кости и основных патологических переломов у женщин в постменопаузе и у мужчин в зависимости от дозы глюкокортикоидов [3]
Доза
Доза в перерасчете на преднизолон** (мг/день)
Средний перерасчет вероятности основных патологических переломов (FRAX) на любой возраст
Переломы бедренной кости
Средние дозы
5 - 7,5
Без перерасчета
Высокие дозы
>= 7,5
1,20 (увеличение на 20%)
Основные патологические переломы (плечо, луч, клинически значимые переломы тел позвонков, переломы бедренной кости)
Средние дозы
5 - 7,5
Без перерасчета
Высокие дозы
>= 7,5
1,15 (увеличение на 15%)
- При проведении оценки индивидуальной 10-летней вероятности FRAX у лиц с сахарным диабетом 2 типа рекомендуется провести коррекцию полученного результата, добавив дополнительный риск, ассоциированный с ревматоидным артритом (поставить "да" для данного фактора риска) или ввести результаты исследования трабекулярного костного индекса (ТКИ) [108 - 110].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
Комментарий: На основании ректроспективного исследования в провинции Манитоба и позиции рабочей группы по СД международного фонда остеопороза были предложены поправки для применения FRAX: при наличии у пациентов СД 2 типа рекомендуется отметить "да" для ревматоидного артрита, а также ввести значение ТКИ, который лучше, чем МПК отражает снижение качества костной ткани при СД [108, 109]. Рассматривались и другие возможности улучшения чувствительности FRAX для выявления популяции высокого риска переломов среди пациентов с СД 2 типа, в частности уменьшение T-критерия в шейке бедренной кости на 0,5 стандартных отклонения при введении показателя рентгеноденситометрии и увеличение возраста пациента на 10 лет. Однако было принято решение, в первую очередь, использовать введение дополнительного риска сопоставимого с ревматоидным артритом или суррогатного маркера качества кости [110].
- Проведение двухэнергетической рентгеноденситометрии (DXA) поясничного отдела позвоночника и проксимального отдела бедренной кости рекомендовано лицам с индивидуальной 10-летней вероятностью основных патологических переломов (FRAX) в интервале между низкой и высокой вероятностью переломов (Табл. 3 или оранжевая зона Рисунок 2) для диагностики остеопороза [111 - 117].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Рентгеноденситометрия проксимального отдела бедренной кости и поясничного отдела позвоночника может быть использована для следующих целей:
- Для установки или подтверждения диагноза остеопороза, согласно рекомендациям ВОЗ 1994 года (Таблица 5);
Таблица 5. Диагностика остеопороза на основании снижения МПК согласно критериям ВОЗ [6] для женщин в постменопаузе и мужчин старше 50 лет
Определение остеопороза на основании МПК (ВОЗ) 1994 год
Классификация
МПК
T-критерий
Норма
В пределах 1 SD от среднего значения у молодых представителей здоровой популяции
T-критерий -1,0 и выше
Остеопения
От 1,0 до 2,5 SD ниже среднего значения у молодых представителей здоровой популяции
T-критерий от -1,0 до -2,5
Остеопороз
На 2,5 SD или ниже среднего значения у молодых представителей здоровой популяции
T-критерий -2,5 и ниже
<*> Тяжелый остеопороз
На 2,5 SD или ниже среднего значения у молодых представителей здоровой популяции
T-критерий -2,5 и ниже с наличием одного или более переломов
--------------------------------
<*> В настоящее время к тяжелому остеопорозу относится остеопороз с патологическим переломом бедра, тела позвонка или множественными переломами независимо от снижения МПК.
- прогнозирования/расчета риска переломов в зависимости от степени снижения МПК;
- наблюдения за динамикой состояния пациентов на фоне терапии или без лечения.
Скрининг всех женщин, находящихся в периоде постменопаузы, с использованием рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости экономически нецелесообразен, поскольку в 2 - 10 раз превышает стоимость лечения всех патологических переломов, поэтому единственной разумной стратегией является селективный скрининг в группах риска [81]. Ранее существовал широкий спектр показаний для проведения рентгеновской денситометрии аксиального скелета. Однако, в настоящее время, ключевые факторы риска переломов сведены в алгоритм FRAX и могут быть оценены через ресурс доступный в Интернете. Ввиду отсутствия достаточного количества денситометров в РФ рентгеноденситометрию поясничного отдела позвоночника и проксимального отдела бедренной кости рекомендуется проводить лицам со средней индивидуальной вероятностью перелома (оранжевая зона FRAX Рисунок 2), то есть, когда назначение лечения сомнительно. Использование значений МПК в сочетании с клиническими факторами риска улучшает прогнозирование переломов бедренной кости и патологических переломов в целом как у женщин, так и у мужчин. [92] Данная последовательность применения алгоритма FRAX и проведения рентгеноденситометрии была валидизирована [25, 111, 113, 118], а стратегия терапевтического вмешательства продемонстрировала экономическую эффективность. [119, 120]
- Проведение двухэнергетической рентгеноденситометрии (DXA) поясничного отдела позвоночника и проксимального отдела бедренной кости рекомендовано для оценки эффективности проводимой терапии, а также динамики состояния МПК у пациентов с ранее установленным остеопорозом и перерывом в лечении с временным интервалом не менее 12 месяцев от первого исследования [111, 121, 122].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Согласно всем проведенным исследованиям, рентгеновская денситометрия является наиболее точным методом мониторинга терапии, доказавшим связь изменений на фоне терапии со снижением риска переломов при применении зарегистрированных препаратов для лечения остеопороза, поэтому этот метод используется для динамического контроля, но не чаще 1 раза в 12 месяцев [123].
- Рекомендовано устанавливать диагноз остеопороз и назначать терапию при снижении МПК на 2,5 и более стандартных отклонения по T-критерию в шейке бедренной кости и/или в целом в проксимальном отделе бедренной кости и/или в поясничных позвонках (L1 - L4, L2 - L4), измеренной двухэнергетической рентгеноденситометрией (DXA) у женщин в постменопаузе и мужчин старше 50 лет [1 - 3, 6, 104, 124 - 132].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Основными показателями минерализации костной ткани при обследовании методом DXA являются [123, 132 - 134]:
- Костный минеральный компонент (bone mineral content, BMC) - показывает количество минерализованной ткани (г) при сканировании костей, обычно определяется длиной сканирующего пути (г/см);
- МПК (или bone mineral density, BMD) - оценивается количество минерализованной костной ткани в сканируемой площади - (г/см2).
В современной клинической практике индивидуальная МПК сравнивается с референсной базой данных. Из-за разницы в методах измерения МПК в зависимости от различий в диагностическом оборудовании, наиболее приемлемым методом оценки МПК является использование T- и Z- критериев [124].
- T-критерий представляет собой стандартное отклонение выше или ниже среднего показателя от пика костной массы молодых женщин в возрасте 20 - 29 лет. Рекомендуемый референсный интервал получен из базы данных третьего исследования национального здоровья и питания (NHANES III). Хотя существуют отдельные нормативные базы для мужчин и женщин, рекомендуется использовать единую базу данных для лиц обоих полов (NHANES III), так как при одном и том же T-критерии риск переломов не отличается. T-критерий, как упоминалось выше, используется для женщин в постменопаузе и мужчин старше 50 лет. Классификация ВОЗ по денситометрической диагностике остеопороза, предложенная в 1994 году, не пересмотрена до настоящего времени [125], последние изменения и дополнения были внесены в 2013 году [127] (Таблица 5).
- Z-критерий представляет собой стандартное отклонение выше или ниже среднего показателя МПК у здоровых мужчин и женщин аналогичного возраста.
У женщин до менопаузы, мужчин моложе 50 лет и детей диагностическая классификация по T-критерию не может быть применима. В этих группах диагностика остеопороза не должна проводиться лишь на основании денситометрических критериев. Международное общество по клинической денситометрии (ISCD) рекомендует вместо T-критерия использовать скорректированные по этническому и расовому признаку Z-критерий, при значениях которого -2,0 и ниже следует давать определение "низкая МПК для хронологического возраста" или "ниже ожидаемых по возрасту значений", а выше - 2,0 - "в пределах ожидаемых по возрасту значений" [132, 134].
Показатели денситометрии служили критерием включения в подавляющее большинство клинических исследований эффективности препаратов для лечения остеопороза, и именно в этих популяциях продемонстрирована противопереломная эффективность терапии на фоне улучшения МПК, поэтому при выявленном снижении МПК, соответствующему остеопорозу, оправданно рекомендовать существующую терапию.
- Результат трабекулярного костного индекса (ТКИ), или trabecular bone score (TBS), полученный в ходе стандартной рентгеноденситометрии поясничного отдела позвоночника, рекомендуется использовать для одномоментного включения в алгоритм FRAX у пациентов, проходящих скрининг по поводу остеопороза с целью повышения чувствительности метода выявления пациентов с повышенным риском переломов [135].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: По результатам мета-анализа, ТКИ показал независимый вклад в предсказание риска переломов и, на сегодняшний день, этот показатель введен в алгоритм FRAX для повышения чувствительности метода [109]. ТКИ - тканевой показатель, оценивающий пиксельные отклонения по шкале градаций серого на денситометрических изображениях поясничного отдела позвоночника, другими словами - непрямой показатель трабекулярной микроархитектоники [136]. Отдельной точки вмешательства в отличие от DXA для этого показателя не существует. Однако введение параметра позволяет улучшить чувствительность FRAX и учитывает недостающие данные МПК поясничного отдела позвоночника. Для женщин в постменопаузе была также разработана градация ТКИ по степени нарушения микроархитектоники: деградированная микроархитектоника ТКИ <= 1,23; частично деградированная микроархитектоника > 1,23, но < 1,31 и нормальная микроархитектоника >= 1,31 [135 - 137]. Однако данная классификация используется в исследовательских целях и пока не может служить основанием для лечения.
Практическим специалистам не следует устанавливать диагноз остеопороза на основании данных ультразвуковой денситометрии, измерения МПК не аксиального скелета (например, МПК пяточной кости, лучевой кости и т.д.), а также использовать нестандартные, неодобренные производителем денситометров способы укладки пациентов (например, денситометрия лежа на боку) и другие локализации исследования МПК, измеренные при рентгеноденситометрии (например, треугольник Варда). Эти методы исследования не были валидизированы подобно стандартной двухэнергетической рентгенденситометрии и никогда не служили основанием для включения в исследование. Кроме того, вариабельность ультразвуковых методов исследования достаточно высока [137].
Все расчеты и градации риска переломов построены на относительных показателях: стандартных отклонениях от рефренсной базы данных молодых здоровых женщин (пика костной массы). Референсные данные были получены для определенных зон скелета с применением установленной укладки [104, 124, 133 - 135]. Эти нормы не являются референсными для других зон скелета и других укладок.
2.5. Иные диагностические исследования
В Таблице 6 приведены иные диагностические техники, которые точны и высоко воспроизводимы [137]. Трехмерное измерение МПК, производимое при количественной КТ, определяет количество минерализованной костной ткани на объем кости (г/см3). Вместе с тем, T-критерии, получаемые при применении этих технологий, не могут быть достоверно использованы в целях диагностической классификации, так как они не эквивалентны T-критериям, полученным при DXA.
Таблица 6. Дополнительные остеоденситометрические технологии [129]
Количественная компьютерная томография (ККТ) измеряет общую МПК: трабекулярной кости в позвоночнике и суммарную проекционную (кортикальной слой и губчатое вещество) в бедренной кости (г/см2) и может быть использована для определения прочности кости, в то время как периферическая ККТ (пККТ, pQCT) измеряет то же самое в предплечье или большеберцовой кости. пККТ высокого разрешения (пККТ-ВР, HR-pQCT) в лучевой и большеберцовой костях обеспечивает измерение объемной плотности, костной структуры и микроархитектоники. У женщин в постменопаузе измерение трабекулярной МПК в позвоночнике при ККТ может применяться для прогнозирования переломов тел позвонков, в то время как пККТ предплечья в дистальной трети лучевой кости возможно использовать для прогнозирования переломов бедренной кости, но не тел позвонков. Недостаточно доказательств прогностической способности в отношении переломов у мужчин. ККТ и пККТ ассоциированы с высокой лучевой нагрузкой, по сравнению с традиционной денситометрией.
Периферическая DXA измеряет МПК предплечья, пальца или пяточной кости, что может быть использовано для оценки риска переломов позвонков и в целом у женщин в постменопаузе. Однако нет оснований для установления диагноза остеопороза, пациенты должны направляться на аксиальную денситометрию. Недостаточно доказательств прогностической способности в отношении переломов у мужчин. Периферическая DXA ассоциирована с незначительной лучевой нагрузкой; не является подходящим методом мониторинга МПК после лечения.
Количественная ультразвуковая денситометрия (КУЗД, QUS) не измеряет напрямую МПК, определяя скорость звука (SOS) и/или широкополосное ослабление ультразвука (BUA) в пяточной кости, большеберцовой кости, надколеннике и других периферических локусах скелета. Сложносоставные параметры, включающие в себя SOS и BUA, могут быть использованы в клинической практике. Валидизированные КУЗД-приборы для пяточной кости позволяют прогнозировать переломы у женщин в постменопаузе (риск переломов позвонков, бедренной кости) и у мужчин в возрасте 65 лет и старше (переломы бедренной кости и внепозвоночные переломы). QUS не ассоциирована с какой-либо лучевой нагрузкой.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Консервативное лечение
Препараты для лечения остеопороза можно условно разделить на антирезорбтивную терапию (БФ, деносумаб**), преимущественно подавляющие костную резорбцию, действуя на остеокласт и анаболические (терипаратид**), которые преимущественно усиливают костеобразование [10]. Ввиду сопряженности костного обмена, как правило, при уменьшении костного разрушения снижается и костеобразование, а при увеличении костеобразования постепенно увеличивается костная резорбция. Клиническая эффективность медикаментозной терапии остеопороза оценивается по снижению количества переломов и косвенно по ряду суррогатных критериев, таких как, изменение МПК или маркеров костного ремоделирования. Основные эффекты препаратов для лечения остеопороза, разделенные по популяциям с различным риском патологического перелома сведены в Приложении А3.1.
- БФ рекомендованы для предупреждения патологических переломов и повышения МПК у пациентов с постменопаузальным остеопорозом (алендроновая кислота**, ризедроновая кислота, ибандроновая кислота, золедроновая кислота**), остеопорозом у мужчин (алендроновая кислота**, ризедроновая кислота, золедроновая кислота**), глюкокортикоидным остеопорозом (ГКО) (алендроновая кислота**, ризедроновая кислота, золедроновая кислота**) [138 - 151].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Детальные результаты регистрационных исследований сведены в Приложении А3.1. Алендроновая кислота** снижает частоту переломов позвонков и бедренной кости в течение 3-х лет лечения у пациентов с предшествующим переломом позвонков или у пациентов с остеопорозом (T-критерий <= -2,5) в области бедренной кости [138, 139]. Алендроновая кислота** также повышает МПК при остеопорозе у мужчин и ГКО у женщин и мужчин. [140, 141]. Похожие результаты и спектр показаний у ризедроновой кислоты [142 - 144], однако, следует отметить, что у неоригинальных препаратов, доступных в РФ, может отсутствовать показание ГКО согласно официальной инструкции. Ибандроновая кислота снижает частоту развития переломов тел позвонков в течение 3-х лет, но не влияет на снижение риска внепозвоночных переломов при первичном анализе данных исследования BONE [145]. Другие дозы ибандроновой кислоты (150 мг 1 раз в месяц и 3 мг 1 раз в 3 месяца внутривенно) подтвердили свою сходную эффективность [146, 147]. Эффективность ибандроновой кислоты для предупреждения внепозвоночных переломов была показана по данным мета-анализа [148]. Ибандроновая кислота 150 мг 1 раз в месяц исследовалась при ГКО (n = 140; T-критерий > -2,0) [152] и у мужчин (n = 132; T критерий <= -2,0 в шейке бедренной кости) [153] и была эффективна для повышения МПК и снижения маркеров костного ремоделирования. Однако официально эти показания не зарегистрированы и назначение ибандроновой кислоты при ГКО и остеопорозе у мужчин не прописано в инструкции. Золедроновая кислота** снижает частоту переломов тел позвонков (со значительным снижением риска уже за 1 год лечения), переломов бедренной кости и внепозвоночных переломов в течение 3-х лет у пациентов с предшествующим переломом тела позвонка или снижением МПК в области бедренной кости, соответствующее остеопорозу [149]. Препарат продемонстрировал противопереломную эффективность для лечения остеопороза у мужчин [150], а также для повышения МПК при ГКО [151].
- Золедроновую кислоту** в дозе 5 мг 1 раз в год дополнительно рекомендуется назначать после хирургического лечения по поводу патологического перелома проксимального отдела бедренной кости (минимум через две недели после операции) для предупреждения новых переломов и улучшения выживаемости пациентов [152].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Инфузии золедроновой кислоты** через минимум две недели после хирургического вмешательства по поводу перелома бедренной кости у мужчин и женщин в течение 3-х лет, продемонстрировали лучшую выживаемость и снижение риска новых переломов по сравнению с теми, кто получил плацебо [152].
- Золедроновая кислота** в дозе 5 мг 1 раз в 24 месяца рекомендуется для предупреждения потери МПК у женщин в постменопаузе с остеопенией и 1 раз в 18 месяцев для предупреждения переломов в группе женщин старше 65 лет [153, 154].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарий: Золедроновая кислота** продемонстрировала эффективность для повышения МПК у женщин с остеопенией, назначенная в режиме 1 инфузии 5 мг на 2 года терапии [153]. Кроме того, в результате 6-летнего двойного слепого исследования с участием 2000 женщин старше 65 лет с остеопенией в бедренной кости (Total Hip и Neck T-критерий от -1,0 SD до -2,5 SD) было показано снижение риска переломов тел позвонков (отношение рисков 0,63; 95% ДИ 0,50 до 0,79; P < 0,001) и внепозвоночных переломов (отношение рисков 0,66; P = 0,001) у пациенток, получавших золедроновую кислоту** 5 мг внутривенно капельно 1 раз в 18 месяцев по сравнению с приемом плацебо [154].
- Деносумаб** 60 мг 1 раз в 6 месяцев рекомендован для предупреждения патологических переломов и повышения МПК у женщин с постменопаузальным остеопорозом, у мужчин с повышенным риском переломов, при глюкокортикоидном остеопорозе, а также для предупреждения потери МПК и переломов при отсутствии костных метастазов у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин с раком предстательной железы, получающим гормон-депривационную терапию [155 - 164].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Эффективность деносумаба** по данным РКИ суммирована в Приложении А3.1 (снижение риска переломов тел позвонков на 68%, бедренной кости на 40% и внепозвоночных переломов на 20% по сравнению с плацебо) [155]. В ходе исследования была обнаружена дополнительная польза препарата для предупреждения падений: 175 (4,5%) в группе лечения по сравнению с 219 (5,7%) в группе плацебо p = 0,02 и видимо, как следствие, уменьшение случаев ушибов 1 - в группе лечения (< 1%) по сравнению с 11 (0,3%) в группе плацебо. Повышение МПК, сходное с полученным у женщин, наблюдалось у мужчин со сниженной костной массой (+8% в L1 - L4 и +3,4% в шейке бедренной кости за 2 года лечения) [156, 157]. Исследование по эффективности деносумаба** по сравнению с ризедроновой кислотой у лиц с ГКО включало 795 мужчин и женщин в возрасте >= 18 лет, получавших >= 7,5 мг преднизолона**. Все включенные пациенты моложе 50 лет уже имели патологический перелом в анамнезе, среди лиц старше 50 лет были пациенты со снижением МПК <= -2,0 по T-критерию или перелом независимо от МПК. Пациенты были рандомизированы для получения инъекций деносумаба** 60 мг 1 раз в 6 месяцев или ризедроновой кислоты 5 мг ежедневно. По результатам лечения в течение 24 месяцев деносумаб** превосходил ризедроновую кислоту в отношении увеличения МПК поясничного отдела позвоночника и МПК бедренной кости во всех измеренных зонах (за 24-месяца поясничный отдел позвоночника: деносумаб** +6,2% против ризедроновой кислоты + 1,7%, p < 0,001; Total Hip: деносумаб** + 3,1% против ризедроновой кислоты 0,0%, p < 0,001) [158].
Деносумаб** позволял предупредить новые переломы тел позвонков у женщин, получающих терапию по поводу гормонально-зависимого рака молочной железы без метастатического поражения скелета [159]. Кроме того, деносумаб** был эффективен для предупреждения переломов у мужчин, получающих андроген-депривационную терапию по поводу рака предстательной железы в течение 36 месяцев без метастатического поражения костей скелета (ОР 0,38 (95% ДИ 0,19 - 0,78)) [160].
- Деносумаб** 60 мг 1 раз в 6 месяцев дополнительно рекомендуется назначать пациентам с остеопорозом с большей потерей МПК в кортикальной кости (шейке бедренной кости, лучевой кости), пациентам с компрометированной функцией почек, а также пациентам, у которых лечение БФ было неэффективно или не удалось достичь желаемой прибавки МПК [165 - 173].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Распределение деносумаба** в костной ткани в отличие от БФ не зависит от активности костного ремоделирования в момент введения препарата, что позволяет добиться сопоставимой концентрации деносумаба** в трабекулярной и кортикальной кости и постоянного присутствия препарата в любой зоне кровоснабжения костной ткани [167, 174, 175]. Кроме того, клиренс деносумаба**, как белковой молекулы, не зависит от функции почек [174, 175]. Деносумаб** был более эффективен для прироста МПК при прямом сравнении со всеми БФ [166 - 168] и эффективно повышал МПК будучи назначенный как после БФ [169], так и после терипаратида** [170].
- Терипаратид** в дозе 20 мкг 1 раз в сутки рекомендован для предупреждения патологических переломов и прибавки МПК у женщин в постменопаузе с компрессионными переломами тел позвонков, для лечения остеопороза у мужчин; для лечения ГКО [30, 176 - 179].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Клиническая эффективность терипаратида** в дозе 20 мкг 1 раз в сутки была доказана у женщин в постменопаузе с патологическими переломами тел позвонков в анамнезе независимо от исходного снижения МПК, предшествующих переломов и возраста (Приложение A3) [30, 31, 176], у мужчин со снижением МПК [177], в том числе вследствие гипогонадизма и у пациентов с ГКО [178]. Увеличение МПК и изменения костного обмена у мужчин (437 пациентов 30 - 85 лет средний T-критерий в шейке бедренной кости -2,7 SD) соответствовали увеличению МПК и изменениям маркеров костного метаболизма у женщин, что позволяет предположить аналогичное влияние терипаратида** на снижение риска переломов у мужчин [177]. Наиболее серьезное исследование эффективности терипаратида** для лечения ГКО было проведено с участием 428 женщин и мужчин в возрасте от 22 до 89 лет [178]. Пациенты были рандомизированы на тех, кто принимал терипаратид** в дозе 20 мкг (n = 214) и алендроновую кислоту** 70 мг (n = 214). Лечение терипаратидом** в течение 18 месяцев оказалось более эффективным для предупреждения переломов тел позвонков по сравнению с алендроновой кислотой** (0,6% новых переломов позвонков в группе терипаратида** по сравнению с 6,1% в группе алендроновой кислоты** p = 0,004). Лучший прирост МПК был зарегистрирован на фоне применения терипаратида** по сравнению с алендроновой кислотой** (+7,2% терипаратид** vs +3,4% алендроновая кислота** в позвонках p < 0,001; +3,8% терипаратид** vs +2,4% алендроновая кислота** p = 0,005 в целом в бедренной кости) [178]. Применение терипаратида** при ГКО было пролонгировано на 3 года, что продемонстрировало хорошую эффективность и безопасность при более длительном использовании [179].
- Терипаратид** в дозе 20 мкг 1 раз в сутки рекомендуется использовать в качестве первой линии терапии у пациентов с остеопорозом с двумя и более компрессионными переломами тел позвонков, а также при неэффективности предшествующей терапии [179 - 185].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Терипаратид** был более эффективен для предупреждения переломов тел позвонков по сравнению с ризедроновой кислотой в рандомизированном контролируемом исследовании у женщин в постменопаузе с двумя компрессионными переломами тел позвонков в анамнезе [182]. Через 24 месяца лечения новые переломы позвонков произошли у 28 (5,4%) из 680 пациентов в группе терипаратида** и у 64 (12,0%) из 680 пациентов в группе ризедроновой кислоты (соотношение риска 0 44, 95% ДИ 0,29 - 0,68; p < 0,0001). Клинические переломы произошли у 30 (4,8%) из 680 пациентов в группе терипаратида** по сравнению с 61 (9,8%) из 680 в группе ризедроновой кислоты (отношение рисков 0,48, 95% ДИ 0,32 - 0,74; p = 0,0009) [183]. Терипаратид** также был более эффективен по сравнению с алендроновой кислотой** для предупреждения переломов тел позвонков у лиц с ГКО [178]. Ранее была показана лучшая эффективность терипаратида для прибавки МПК и для снижения болевого синдрома в спине по сравнению с другими БФ [183 - 185].
В мировой практике терипаратид** считается экономически оправданным использовать преимущественно у лиц с тяжелым остеопорозом (у пациентов с уже имеющимися переломами тел позвонков, независимо от степени снижения МПК), при неэффективности или непереносимости другой терапии остеопороза, а также лицам с высоким риском переломов и непереносимостью альтернативной терапии [2, 3]. В Российской Федерации терипаратид** введен в список ЖВНЛП и ОНЛС и назначается по врачебной комиссии как дорогостоящее лечение на 24 месяца.
- Не рекомендуется использовать стронция ранелат** в рутинной практике для лечения остеопороза ввиду высокого риска сердечно-сосудистых осложнений и тромбоэмболии [186 - 189].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: В 2007, 2013 - 2014 гг. Европейским Медицинским Агентством в связи с появлением новой информации о нежелательных явлениях были введены ограничения на применение стронция ранелата** [186 - 188]. Этот препарат не рекомендован пациентам с ишемической болезнью сердца (ИБС), цереброваскулярной болезнью, патологией периферических артерий, плохо контролируемой гипертензией и должен быть отменен при развитии сердечно-сосудистой патологии, что обусловлено повышением риска нежелательных явлений со стороны сердечно-сосудистой системы, в частности повышения риска инфаркта миокарда на 60% (ОР 1,6 95% ДИ 1,07 - 2,38). Стронция ранелат** противопоказан у пациентов с тромбозами и тромбоэмболиями, в том числе в анамнезе, а также у пациентов с факторами риска тромбообразования: постоянной или временной иммобилизацией; не рекомендуется применение стронция ранелата** у пациентов старше 80 лет, так как в этой возрастной группе риск тромбозов и тромбоэмболий значительно возрастает.
Кроме того, редкие, но тяжелые кожные реакции гиперчувствительности, в некоторых случаях с летальным исходом, были связаны с применением стронция ранелата** [188].
Согласно официальной позиции регуляторных органов, решение о назначении стронция ранелата** может быть принято только у пациентов с тяжелым остеопорозом, когда ни один другой препарат для лечения остеопороза не подходит с учетом всех указанных выше ограничений. Если принято решение о назначении стронция ранелата** необходимо мониторировать риск развития сердечно-сосудистой патологии в течение всего времени лечения и отменять препарат в случае появления симптомов сердечно-сосудистых заболеваний, кожных реакций и вероятности развития тромбоза [186 - 189].
Продолжительность лечения остеопороза. Последовательная и комбинированная терапия остеопороза
- Пациентам с остеопорозом без патологических переломов при достижении клинического эффекта терапии (МПК до -2,0 SD по T-критерию в шейке бедренной кости и отсутствием новых переломов) рекомендовано на 1 - 2 года прекратить терапию БФ с последующим динамическим наблюдением [190 - 192].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Снижение МПК до -2.5 SD по T-критерию является традиционным основанием для начала терапии остеопороза, и этот показатель сохраняется для возобновления терапии БФ или начала альтернативной терапии. Терапия может быть возобновлена при появлении нового принципиального фактора риска [190]. По последним данным в ходе систематического анализа было показано, что уже через 1 - 2 года после отмены БФ частота переломов начинает возрастать [193], поэтому перерыв в лечении рассматривается с большей осторожностью особенно в популяции пациентов с высоким риском переломов, у пациентов с уже имеющимися переломами в анамнезе. Если лечение остеопороза было начато в связи со снижением МПК в поясничных позвонках без снижения МПК в бедре оправданно добиваться сопоставимого T-критерия (-2,0 SD и лучше) в поясничных позвонках.
- Пациентам с переломами тел позвонков, бедренной кости или множественными переломами в анамнезе рекомендуется продолжать непрерывное длительное лечение остеопороза [46, 192 - 197].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Средняя продолжительность непрерывного лечения остеопороза с целью предупреждения переломов и повышения МПК таблетированными БФ составляет 5 лет, внутривенными БФ - 3 года [190]. Максимальный период применения БФ в условиях клинических исследований составляет 10 лет (алендроновая кислота**) [46]. Средние и максимальные периоды лечения БФ были определены на основании систематического анализа доказательных данных американского общество исследований костей и минералов (American Society for Bone and Mineral Research) [190]. При применении деносумаба** [194] стойкий ежегодный прирост МПК сохраняется в течение 10 лет во всех отделах скелета, что дает преимущество перед БФ, на фоне которых прирост МПК в шейке бедренной кости наблюдается в течение первых 2 - 3 лет [46, 191, 192].
- Пациентам с остеопорозом без переломов в анамнезе рекомендуется лечение деносумабом** до достижения МПК -2,0 SD по T-критерию и выше в шейке бедренной кости, а также поясничных позвонках; во всех случаях отмены деносумаба** необходим перевод на терапию БФ [174, 175, 195 - 203].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Стойкий ежегодный прирост МПК сохраняется в течение 10 лет применения деносумаба** [194] во всех отделах скелета, что дает преимущество перед БФ, на фоне которых прирост МПК в шейке бедренной кости наблюдается в течение первых 2 - 3 лет [46, 192].
При отмене деносумаба** через 1 - 3 года лечения маркеры костного обмена и МПК возвращаются к исходному состоянию через 12 месяцев, а при возобновлении лечения прибавка МПК и подавление маркеров костного ремоделирования восстанавливаются вновь [195, 196]. Данные о повышении риска переломов после отмены деносумаба** противоречивы. С одной стороны, при наблюдении пациентов в течение двух лет после отмены деносумаба** не наблюдалось повышения количества переломов по сравнению с группой ранее леченных плацебо [196]. С другой стороны, были описаны клинические случаи спонтанных переломов тел позвонков, гиперкальциемии после отмены деносумаба** [199, 200, 204]. Есть основания полагать, что назначения БФ после длительного применения деносумаба** позволяет нивелировать нежелательные эффекты отмены [197, 198]. Было проведено несколько систематических анализов и опубликованы позиции ведущих международных обществ, признавших обратимость терапевтического эффекта деносумаба**, который в отличие от БФ не накапливается в костной ткани [197, 198]. Так как остеопороз является хроническим заболеванием, пациенты нуждаются в непрерывном лечении деносумабом** или в переводе на альтернативную терапию в случае принятия решения о необходимости прекратить лечение этим препаратом.
Таким образом, ввиду лучшей эффективности деносумаба** для прибавки МПК по сравнению с БФ у лиц с тяжелым остеопорозом, с уже имеющимися переломами оправдано длительное лечение деносумабом** до 10 лет [194], что является эффективным и безопасным. Если решение о начале терапии остеопороза было принято только на основании снижения МПК, то по достижении терапевтического эффекта (T-критерий -2,0 SD и более) ввиду отсутствия значительного снижения риска переломов при последующем лечении возможен перевод на терапию БФ. При этом таблетированные БФ могут быть рекомендованы сразу через 6 месяцев после последней инъекции деносумаба**, а введение золедроновой кислоты** оправдано примерно через 8 месяцев после последней инъекции деносумаба** [196].
- После окончания лечения терипаратидом** рекомендуется перевод на антирезорбтивную терапию деносумабом** для дальнейшего прироста МПК или БФ для сохранения терапевтического эффекта [205 - 207].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Максимально разрешенная продолжительность лечения остеопороза терипаратидом** составляет 24 месяца. После окончания терапии терипаратидом** обязательно назначение антирезорбтивной терапии, так как терипаратид** не накапливается в костной ткани и его эффекты обратимы [1 - 3]. Комбинированную терапию терипаратидом** и деносумабом** можно рассматривать при тяжелом остеопорозе и значительной потере МПК, поскольку единственным препаратом с антирезорбтивным действием, показавшим более выраженную прибавку МПК в комбинации с терипаратидом** по сравнению с терипаратидом** в монотерапии, был деносумаб** [205]. В рандомизированном исследовании назначения деносумаба** или БФ после терипаратида** было показано более выраженное повышение МПК на фоне назначения деносумаба** по сравнению с БФ** [206], поэтому для лиц с недостаточным приростом МПК оправдано дальнейшее лечение деносумабом** до достижения терапевтического эффекта и уже затем перевод пациента на БФ. Назначение терипаратида** после деносумаба** сопряжено с потерей МПК, данные по переломам неизвестны [205], поэтому при неэффективности деносумаба** будет более оправдано добавить к лечению терипаратид, а не производить замену деносумаба** на терипаратид**.
- При неэффективности проводимой терапии остеопороза: развитии 2 и более патологических переломов за время лечения; потере МПК на 4% в бедренной кости и 5% в позвонках за два последовательных измерения; изменении маркеров костного обмена на фоне лечения менее, чем на 30%, в сочетании с потерей МПК рекомендуется переоценка приверженности пациента к лечению, исключение вторичных причин остеопороза и других метаболических заболеваний скелета и смена терапии остеопороза [208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Согласно разработанному консенсусу смена терапии производится в случае неэффективности предшествующего лечения: от таблетированных к парентеральным БФ и анаболической терапии [208]. Вместе с тем, терапия остеопороза может назначаться в любой последовательности (за исключением замены деносумаба** на терипаратид**) на усмотрение врача и с учетом пожеланий пациента по режиму дозирования. Как ранее было рекомендовано, у пациентов с впервые диагностированным тяжелым остеопорозом наиболее предпочтительно начинать лечение с анаболической терапии и затем переходить на антирезорбтивную [182 - 185].
Выбор таблетированных или парентеральных форм антирезорбтивной терапии как при первом назначении препарата, так и после анаболической терапии решается индивидуально [1 - 3]. Нет оснований начинать лечение остеопороза именно с таблетированных форм, но преимущественное назначение парентеральных препаратов рекомендуется пациентам с патологией верхних отделов желудочно-кишечного тракта. Деносумаб** может иметь дополнительное преимущество в качестве первой линии терапии при потере МПК в кортикальной кости и снижении функции почек. В случае исключения вторичных причин остеопороза, тяжелого дефицита витамина D, низкой приверженности пациента к лечению, оправдан перевод пациента с таблетированных БФ на парентеральные и/или с антирезорбтивной терапии на анаболическую терапию терипаратидом** [208]. В редких случаях крайне низкой МПК, тяжелого течения остеопороза возможна комбинация терипаратида** и деносумаба** по решению врачебной комиссии.
- Все препараты для лечения остеопороза рекомендуется назначать в сочетании с препаратами кальция и колекальциферола** [138 - 147, 149 - 152, 155 - 158, 176 - 182].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Все препараты для терапии остеопороза должны назначаться в сочетании с препаратами кальция (500 - 1000 мг в сутки) и колекальциферола** (минимум 800 МЕ в сутки), так как доказанная эффективность по результатам РКИ была продемонстрирована именно в такой комбинации [138 - 147, 149 - 152, 155 - 158, 176 - 182]. Имеются небольшие исследования, доказывающие, что вместо нативного витамина D (колекальциферола**) в комбинации с БФ можно использовать альфакальцидол** в дозе 1 мкг, и это позволяет добиться положительного эффекта даже при предшествующей потере до 3% МПК при терапии в сочетании с колекальциферолом** [209].
Данные по эффективности препаратов для лечения остеопороза, полученные на основании регистрационных исследований детально изложены в приложении А3.1 [143, 147, 155, 210, 211]. Показания, противопоказания и потенциальные нежелательные явления задокументированы в инструкциях к препаратам. Риски редких нежелательных явлений (атипичные переломы, остеонекроз челюсти) на фоне антирезорбтивной терапии значительно уступают потенциальной пользе на фоне лечения у пациентов с повышенным риском переломов [211].
3.2. Хирургическое лечение
- Всем пациентам с патологическим переломом проксимального отдела бедренной кости рекомендуется госпитализация и хирургическое лечение у врача-травматолога-ортопеда в течение 48 часов с последующей активизацией пациента для повышения выживаемости [213 - 216].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Единственной возможностью для пожилого пациента вернуться к прежнему уровню активности после перелома проксимального отдела бедренной кости является его оперативное лечение [213, 214]. Выбор метода хирургического лечения изложен в клинических рекомендациях и методических рекомендациях ассоциации травматологов-ортопедов [215].
Для оказания полноценной специализированной помощи данной группе пациентов необходимо руководствоваться следующими принципами [213].
- Все пациенты с переломом проксимального отдела бедренной кости должны быть госпитализированы в специализированное отделение не позднее 4 часов с момента поступления в стационар;
- Все пациенты с переломом шейки бедренной кости должны быть оперированы в течение 48 часов; с чрезвертельным переломом бедренной кости - в течение 72 часов;
- Все пациенты с переломом проксимального отдела бедренной кости должны получать соответствующий уход для профилактики образования пролежней;
- Все пациенты с переломом бедренной кости на фоне остеопороза должны быть осмотрены врачом-терапевтом при поступлении;
- Всем пациентам с патологическим переломом бедренной кости должна в последующем быть назначена специфическая терапия остеопороза;
- Всем пациентам с переломом бедренной кости на фоне остеопороза должны быть рекомендованы мероприятия по профилактике падений.
Все операции у данной категории пациентов должны проводиться в срочном порядке по жизненным показаниям, что должно быть отражено в предоперационном эпикризе [213, 214].
Противопоказаниями к проведению срочного хирургического лечения (остеосинтеза перелома или артропластики) являются [216, 217]:
- Острый инфаркт миокарда или острое нарушение мозгового кровообращения;
- Пневмония с необходимостью перевода пациента на ИВЛ;
- Острое хирургическое заболевание, требующее немедленного хирургического лечения;
- СД с декомпенсацией углеводного обмена (требуется срочный перевод на инсулинотерапию или контроль инсулинотерапии медперсоналом для подготовки к хирургическому лечению);
- Кома любой этиологии;
- Хроническая или острая гнойная инфекция в зоне предполагаемого разреза;
- Терминальная стадия заболевания, приведшая к невозможности передвигаться пациенту еще до перелома;
- Выраженные когнитивные нарушения или психическое заболевание пациента, приведшее к невозможности передвигаться до наступления перелома.
Все остальные сопутствующие заболевания в стадии декомпенсации могут расцениваться как противопоказания только в том случае, если их невозможно перевести в стадию субкомпенсации в течение 24 - 48 часов интенсивной терапии. Отказ от операции в обязательном порядке должен быть оформлен консилиумом в составе врача-травматолога, врача-анестезиолога-реаниматолога и врача-терапевта. В случае однозначного отказа от операции пациента целесообразно перевести в соматическое отделение для лечения заболевания, по поводу которого было решение консилиума.
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- После хирургического лечения перелома рекомендована ранняя активизация пациентов (желательно уже на 1 - 2 сутки после операции) и лечение остеопороза или другого заболевания скелета, приведшего к перелому для предупреждения новых переломов и улучшения прогноза реабилитации [213, 214, 216].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: После оперативного лечения перелома проксимального отдела бедренной кости перевод пациента из отделения ОРИТ должен осуществляться на 1 - 2 сутки. Оперативное пособие должно быть выполнено так, чтобы пожилой пациент смог с первых шагов нагружать оперированную ногу в полном объеме, опираясь на дополнительную опору ("ходунки") [213, 214]. В послеоперационном периоде необходим тот же самый командный подход, как и в предоперационном периоде [217]. Важная роль в этой команде принадлежит специалисту по лечебной физкультуре (специалисту по физической и реабилитационной медицине), от активности которого во многом зависит успех всего предыдущего лечения. Оптимальным считается выписка пациента в реабилитационный центр на 5 - 7 день после операции и активизации пациента при помощи дополнительных средств опоры. При отсутствии такой возможности правильным будет выписать пожилого пациента после снятия послеоперационных швов на 12 - 14 день после операции. Основным критерием для выписки может считаться активизация пациента в пределах палаты с опорой на "ходунки" [217].
Обязательным в программе лечения пожилых пациентов с патологическими переломами проксимального отдела бедренной кости является профилактика повторных переломов и оценка риска падений. Профилактика повторных переломов заключается в лечении заболевания, наиболее часто остеопороза, сопровождающего патологические переломы у пожилых пациентов. Выбор препарата для лечения остеопороза после патологического перелома осуществляется индивидуально среди зарегистрированных препаратов. Назначение антирезорбтивной терапии (БФ, деносумаб**) не влияет на длительность сращения перелома [218]. В экспериментальных исследованиях отмечено, что назначение терипаратида** ведет к значительному улучшению формирования костной мозоли и положительно влияет на сращение перелома, но эти данные не были официально подтверждены у человека [218]. Все препараты назначаются в комбинации с препаратами кальция и колекальциферола**. Кроме того, необходимо уделить внимание факторам риска падений и устранить потенциально модифицируемые факторы риска падений. Факторы риска падения сведены в Таблице 7 [219].
Таблица 7. Факторы риска падений [219]
Медицинские факторы риска
Старческий возраст
Плохое зрение
Саркопения
Тревога и возбуждение
Ортостатическая гипотензия
Аритмии
Прием некоторых лекарственных препаратов (наркотические анальгетики, противоэпилептические средства, психотропные средства, антигипертензивные препараты)
Депрессия
Падения в анамнезе
Плохое питание
Дефицит витамина D
Стрессовое недержание мочи
Неврологические
Энцефалопатия
Болезнь Паркинсона
Кифоз
Нарушения баланса
Головокружения
Снижение чувствительности ног
Эпилепсия
Двигательные нарушения (перенесенный инсульт, мышечные заболевания и др.)
Факторы окружающей среды
Отсутствие удобных поручней/держателей в ванных комнатах, туалетных комнатах
Отсутствие помощи при ходьбе ("ходунки", трости)
Скользкий пол
Половики и другие препятствия на полу
Плохое освещение
Протянутые провода
В работе с пожилым пациентом необходимо влиять на модифицируемые факторы риска, такие как коррекция сниженной остроты зрения, уменьшение потребления лекарственных препаратов, которые снижают концентрацию внимания и негативно влияют на равновесие, а также повышение безопасности домашней обстановки (устранение скользких полов, препятствий, недостаточного освещения, неудобных/отсутствующих поручней) [218].
- Пациентам с болевым синдромом в спине на фоне клинического компрессионного перелома позвонка, болях, возникающих при осевой нагрузке, и при нарушении статики позвоночника рекомендовано применение ортезов для уменьшения болевого синдрома [219 - 225].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: Ортезы улучшают качество жизни, осанку и предотвращают увеличение угла кифоза [220, 221]. Ношение ортезов или корректоров осанки рекомендуется в постоянном или прерывистом режиме с обязательным освобождением от них в ночное время [222]. При множественных переломах возможно использование торако-люмбальных ортезов [223]. По индивидуальным показаниям, возможно, ношение корсетов-гиперэкстензоров [224, 225]. Однако следует понимать, что ортезы не являются методом лечения остеопороза, и в первую очередь необходимы для уменьшения болевого синдрома и более быстрой активизации пациента. Не следует рекомендовать ортез, если это не приносит облегчения боли пациенту и увеличения двигательной активности [221, 222]. Длительное ношение корсетов может привести к мышечной дистрофии, поэтому использование корсетов дольше 8 - 12 недель нежелательно [223 - 225]. При стабильном компрессионном переломе позвонка рекомендованы легкие конструкции, в менее тяжелых случаях - более эластичные ортезы, которые минимизируют риск развития слабости мышц спины [224].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактика остеопороза включает мероприятия, направленные на максимальный набор пика костной массы у детей и молодых людей, поддержание костной массы и предупреждение падений у здоровых людей старшей возрастной группы и профилактику падений и переломов у лиц с диагностированным переломом в анамнезе и с остеопорозом.
Физические нагрузки
- Физические упражнения с осевыми нагрузками (ходьба, бег, танцы, подвижные игры) рекомендованы для оптимального набора пика костной массы в юности и поддержания МПК у здоровых пожилых людей [226, 227].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 2)
Комментарии: Механическая нагрузка стимулирует анаболические процессы, характеризуемые повышением активности остеобластов и снижением костной резорбции остеокластами [228]. При наборе пика костной массы оправданы осевые нагрузки, в то время как в пожилом возрасте предпочтительно использовать охранительный режим, избегать значительных осевых нагрузок, чтобы избежать патологических переломов тел позвонков
Недостаток физической активности, а также избыточная физическая нагрузка в подростковом возрасте приводят к более низкому набору пиковой костной массы [226]. Дети и молодые люди, ведущие активный образ жизни, имеющие более высокие показатели мышечной силы, достигают более высокого пика костной массы [226, 227].
- Умеренные силовые тренировки (пилатес, тай-чи, плавание и т.д.) рекомендуются для укрепления мышечного корсета, улучшения координации у пожилых пациентов с переломом в анамнезе или с диагностированным остеопорозом [229].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Исследования с участием женщин с ранним наступлением менопаузы показали, что силовые тренировки приводили к небольшим, но значимым изменениям МПК [227]. Мета-анализ 16 исследований и 699 испытуемых показал улучшение на 2% МПК в поясничном отделе позвоночника в группе, где осуществлялись силовые упражнения, по сравнению с группой без значимой физической активности [230, 231].
Таким образом, в постменопаузе благоприятное влияние упражнений на МПК значительно меньше, чем у молодых, но физические нагрузки улучшают другие важные показатели, такие как равновесие и мышечная сила, что в конечном итоге благоприятно для уменьшения риска падений и снижения риска переломов. [232 - 234].
Иммобилизация является важной причиной потери костной массы. При обездвиженности пациенты могут потерять больше костной массы в неделю, чем за год при обычной физической активности [235].
Пациентам с патологическими переломами тел позвонков следует избегать сгибаний туловища вперед и вбок, поднятия тяжелого веса, а также выполнения упражнений, оказывающих силовое воздействие на позвонки (например, бег, прыжки, езда на лошади). У пациентов пожилого возраста с тяжелым кифозом, дискомфортом в спине, и нестабильностью походки, план физической реабилитации должен фокусироваться на упражнениях без дополнительного отягощения, укрепления мышечного корсета спины и тренировки равновесия. Важным также может быть использование ортопедических приспособлений (ортезы, трости, ходунки), что способно уменьшить дискомфорт, предотвратить падения и переломы и повысить качество жизни [234]. Наиболее оптимальным являются занятия под контролем опытного специалиста по лечебной физкультуре.
С целью профилактики падений, улучшения координации и укрепления мышц можно включать силовые тренировки и другие упражнения с сопротивлением, такие как йога, пилатес, тай-чи, плавание. Физиотерапия, например, электромиостимуляция, также может являться важным компонентом реабилитации после перелома. [232]. Эти же мероприятия целесообразно рассматривать для лиц с установленным остеопорозом, высоким риском перелома, однако без перелома в анамнезе.
Витамин D и кальций
Витамин D важен для абсорбции кальция в кишечнике и для минерализации костной ткани. Основным источником витамина D в организме является его синтез в коже под действием ультрафиолетового облучения. Получение данного витамина из пищи в необходимом объеме затруднительно ввиду ограниченного числа продуктов, которые его содержат в значимом количестве [236, 237].
При этом исследования показывают, что особенности образа жизни с ограничением пребывания на солнце и использование активной защиты от его излучения (солнцезащитные крема), являются одной из важных причин высокой мировой распространенности дефицита витамина D у населения. Подробно вопросы, касающиеся витамина D, изложены в соответствующих клинических рекомендациях [237].
- Лечение дефицита витамина D рекомендуется препаратом колекальциферола** при установленном его дефиците (Табл. 8) и назначается курсом в лечебных дозах с последующим переводом на профилактическую терапию (Табл. 9) [237 - 244].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии: Длительно существующие низкие уровни витамина D могут приводить к субоптимальной абсорбции кальция в кишечнике, в результате чего развивается вторичный гиперпаратиреоз с повышением мобилизации кальция из костей, снижением МПК и развитием остеопороза в ряде случаев в сочетании с остеомаляцией. Витамин D поддерживает формирование и обменные процессы в мышечной ткани, особенно на уровне быстрых мышечных волокон, что обуславливает предрасположенность к падениям лиц с дефицитом этого витамина [245 - 247]. Концентрация 25(OH)D в сыворотке крови является лучшим индикатором для мониторинга статуса витамина D ввиду того, что это основная форма витамина D в циркуляции, имеет длительное время полужизни порядка 2 - 3 недель, отражает как поступление витамина D с пищей, приемом колекальциферола** и эргокальциферола, так и синтезированного в коже под воздействием ультрафиолетового облучения [246, 248].
Таблица 8. Интерпретация концентраций 25(OH)D, принятая Российской ассоциацией эндокринологов [245]
Классификация
Уровни 25(OH)D в крови нг/мл (нмоль/л)
Клинические проявления
Выраженный дефицит витамина D
< 10 нг/мл
Повышенный риск рахита, остеомаляции, вторичного гиперпаратиреоза, миопатии, падений и переломов
(< 25 нмоль/л)
Дефицит витамина D
< 20 нг/мл
Повышенный риск потери костной ткани, вторичного гиперпаратиреоза, падений и переломов
(< 50 нмоль/л)
Недостаточность витамина D
>= 20 и <30 нг/мл
Низкий риск потери костной ткани и вторичного гиперпаратиреоза, нейтральный эффект на падения и переломы
(>= 50 и <75 нмоль/л)
Адекватные уровни витамина D
>= 30 нг/мл*
Оптимальное подавление паратиреоидного гормона и потери костной ткани, снижение риска падений и переломов на 20%
(>= 75 нмоль/л)
Уровни с возможным проявлением токсичности витамина D
> 150 нг/мл
Гиперкальциемия, гиперкальциурия, нефрокальциноз, кальцифилаксия
(> 375 нмоль/л)
В связи с меньшей метаболической деградацией колекальциферола** (D3) он общепризнан препаратом выбора при коррекции низких уровней витамина D [245].
Таблица 9. Схемы лечения дефицита и недостаточности витамина D [245]
Доза колекальциферола**
Дефицит витамина D (25(OH)D менее 20 нг/мл) - суммарная насыщающая доза колекальциферола** - 400 000 МЕ
1
50 000 МЕ еженедельно в течение 8 недель внутрь
2
200 000 МЕ ежемесячно в течение 2 месяцев внутрь
3
150 000 МЕ ежемесячно в течение 3 месяцев внутрь
4
7 000 МЕ в день - 8 недель внутрь
Недостаточность витамина D (25(OH)D от 20 до 30 нг/мл) - суммарная насыщающая доза колекальциферола** - 200 000 МЕ
1
50 000 МЕ еженедельно в течение 4 недель внутрь
2
200 000 МЕ однократно внутрь
3
150 000 МЕ однократно внутрь
4
7 000 МЕ в день - 4 недель внутрь
Поддержание уровней витамина D > 30 нг/мл
1
1000 - 2000 МЕ ежедневно внутрь
2
7000 - 14 000 МЕ однократно в неделю внутрь
Дозы для поддержания уровня 25(OH)D более 30 нг/мл, у лиц с ранее диагностированными низкими уровнями витамина D, как правило, выше профилактических и составляют не менее 1500 - 2000 МЕ колекальциферола** в сутки [245].
- Пациентам рекомендуется достаточное потребление кальция с продуктами питания (Табл. 10) или прием препаратов кальция при его недостаточном содержании в пищевом рационе [245, 249 - 251].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1).
Комментарии: Витамин D способен активировать абсорбцию кальция в кишечнике и минерализацию скелета только при наличии адекватного поступления самого кальция. Назначение антирезорбтивной терапии может резко повысить потребность в кальции, необходимом для восстановления костной ткани, поэтому очень важно для профилактики/лечения патологии скелета наряду с предварительной коррекцией уровня витамина D обеспечить адекватное поступление кальция с пищей [250].
При проведении рентгеноденситометрии в отчете рассчитывается показатель BMC, который отражает содержание кальция в костной ткани. Недостаточное поступление кальция может способствовать нарушению минерализации. Содержание кальция в продуктах питания сведено в Приложении А3.4.
Нормы потребления кальция для различных возрастных групп сведены в Таблице 10.
Таблица 10. Возрастные нормы потребления кальция [243]
Возрастная группа
Норма потребления кальция (мг)
Дети до 3 лет
700
Дети от 4 до 10 лет
1000
Дети от 10 до 13 лет
1300
Подростки от 13 до 16 лет
1300
Лица старше 16 лет и до 50
1000
Женщины в постменопаузе или старше 50 лет
1000 - 1200
Беременные и кормящие грудью женщины
1000 - 1300
Для здорового населения нормы потребления кальция учитывают все источники: кальций с пищей и с добавками/препаратами кальция.
Кальций, обладая слабым антирезорбтивным действием, потенцирует эффект основных препаратов для лечения остеопороза, предотвращает гипокальциемию и рекомендуется при любых терапевтических режимах и схемах [251].
В некоторых странах проводится обогащение часто используемых продуктов кальцием (круп, соков, хлеба). В России подобная практика не распространена. Достаточным суточным потреблением кальция с продуктами питания считается присутствие в рационе не менее трех порций молочных продуктов в день. К одной порции можно отнести 30 г сыра, 100 г творога, 150 г йогурта, 200 мл молока [249]. Использование пищевых добавок кальция рекомендуется в случаях, когда невозможно достичь необходимого потребления кальция с пищевыми продуктами.
В мета-анализе 17 исследований, продолжавшихся до трех лет, более 50 000 пациентов получали монотерапию препаратами кальция или в сочетании с колекальциферолом**. В результате изолированного приема кальция было отмечено снижение риска переломов разных локализаций, включая позвонки, бедренную кость и предплечье, на 12% (ОР - 0,88, 95% ДИ, 0,83 - 0,95). Добавление колекальциферола** не приводило к существенному снижению риска переломов: на фоне приема кальция риск снижался на 10%, в комбинации с колекальциферолом** - на 13%. Примечательно, что в исследованиях с хорошим комплаенсом (> 80%) отмечалось наибольшее снижение риска переломов, достигающее 24% [232]. Другой объединенный анализ 68 500 пациентов, получавших только колекальциферола**, не показал снижения риска переломов. Но комбинация препаратов кальция с колекальциферолом** снижала риск переломов на 12% (p = 0,025) всех переломов и переломов бедренной кости - на 26% (p = 0,005) [239].
- Активные метаболиты витамина D (альфакальцидол**, кальцитриол**) рекомендованы в группах пациентов с относительными или абсолютными показаниями для их назначения (Табл. 11), а также могут быть рекомендованы у пожилых пациентов с высоким риском падений как монотерапия или в комбинации с антирезорбтивной терапией для улучшения МПК [252].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Абсолютные и относительные показания для назначения активных метаболитов витамина D сведены в Таблице 12.
Таблица 11. Абсолютные и относительные показания для назначения активных метаболитов витамина D [252]
Абсолютные
Относительные
Терминальная хроническая почечная недостаточность
Хроническая болезнь почек с СКФ менее 60 мл/мин
Возраст старше 65 лет
Гипопаратиреоз
Высокий риск падений у пожилых пациентов
Псевдогипопаратиреоз
Прием препаратов, нарушающих метаболизм витамина D
Выраженная гипокальциемия
В комбинированной терапии остеопороза, если предшествующее лечение БФ или деносумабом** в сочетании с колекальциферолом** не было достаточно эффективным
Активные метаболиты витамина D и их аналоги продемонстрировали большую эффективность по сравнению с колекальциферолом** для снижения риска падений, особенно у пациентов со сниженной СКФ [252]. Вместе с тем, при установленном дефиците 25(OH)D, компенсация дефицита нативного витамина D является обязательным этапом лечения и проводится, в том числе, пациентам с терминальной стадией почечной недостаточности [253], и диабетической нефропатией [254]. Необходимо помнить, что активные метаболиты витамина D и их аналоги не определяются в значимых количествах при исследовании концентрации витамина D в сыворотке крови ввиду их структурных отличий от колекальциферола**, а также их быстрой деградации. Поэтому для контроля эффективности назначаемых доз активных метаболитов витамина D и их аналогов необходимо использовать концентрацию общего и/или ионизированного кальция, паратгормона в крови. Кроме того, эти препараты ввиду потенциальной возможности развития гиперкальциемии/гиперкальциурии могут назначаться только под врачебным контролем уровней кальция в крови и в ряде случаев в моче (при нормальной скорости клубочковой фильтрации). С осторожностью также следует назначать активные метаболиты витамина D и их аналоги одновременно с препаратами нативного витамина D, содержащими дозу колекальциферола** выше профилактической (более 800 - 1000 МЕ в сутки) [245].
Менопаузальная гормональная терапия (МГТ)
МГТ одобрена для профилактики постменопаузального остеопороза, облегчения вазомоторных симптомов и вульвовагинальной атрофии, ассоциированных с менопаузой [255]. Женщины, у которых не было гистерэктомии, нуждаются в МГТ, содержащей прогестагены для протекции эндометрия.
- МГТ рекомендована для профилактики остеопороза у женщин в возрасте до 60 лет с длительностью постменопаузы до 10 лет. Рекомендуется использовать наименьшие эффективные дозы МГТ: по мере увеличения возраста женщины снижать дозу препарата и проводить ежегодную оценку соотношения польза/риск в каждом конкретном случае [255 - 258].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии: Доказательства профилактики переломов при назначении МГТ ограничены данными по пероральному применению стандартных доз конъюгированных эквинных эстрогенов (КЭЭ) и медроксипрогестерона**. В исследовании "The Woman's Health Initiative (WHI)" выявили, что применение МГТ в течение пяти лет снижает риск развития переломов тел позвонков и переломов бедренной кости на 34%, а внепозвоночных переломов на 23% [255].
Хотя МГТ предотвращает переломы в любом возрасте после наступления менопаузы, важен возраст начала МГТ. В возрасте 50 - 60 лет, или в течение 10 лет после наступления менопаузы, преимущества МГТ с наибольшей вероятностью превосходят какой-либо риск, МГТ может рассматриваться в качестве терапии первой линии. Не следует начинать МГТ в возрасте после 60 лет. Однако отсутствуют обязательные ограничения продолжительности применения МГТ при условии, что она соответствует целям лечения [255, 257].
Имеются фактические данные о предотвращении потери МПК при пероральном (КЭЭ) и трансдермальном применении доз, которые ниже стандартных [258].
Нежелательные явления, ассоциированные с применением МГТ
Глобальное исследование МГТ (WHI) продемонстрировало повышение риска ИБС, инсульта, инвазивного рака молочной железы, ТЭЛА и тромбоза глубоких вен нижних конечностей в течение 5-ти лет лечения стандартными дозами КЭЭ и медроксипрогестерона** [256]. Однако последующий ре-анализ этих данных не подтвердил увеличения риска ИБС у женщин в возрасте до 60 лет, начавших лечение в первые 10 лет постменопаузы, в то время как повышенные риски рака молочной железы, инсульта и тромбоэмболии сохранялись, однако не были столь драматичными. Абсолютный риск инсульта, рака молочной железы у женщин моложе 60 лет был низким. В подгруппе женщин после гистерэктомии, получавших монотерапию КЭЭ в дозе 0,625 мг в сутки в возрасте до 60 лет с длительностью менопаузы до 10 лет в WHI, было отмечено снижение риска рака молочной железы (РМЖ), ИБС и общей смертности в течение 7 лет лечения [256]. Мета-анализ и данные наблюдательных исследований свидетельствуют о меньшем риске тромбоэмболии и ишемического инсульта при использовании трансдермальной МГТ [258].
Служба профилактики повторных переломов
- С целью своевременного назначения терапии остеопороза и обеспечения длительного наблюдения за пациентами 50 лет и старше с патологическими переломами для снижения риска повторных переломов рекомендуется создавать Службы профилактики повторных переломов (СППП). [35, 36, 259 - 266]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии: После возникновения низкоэнергетического перелома риск последующих увеличивается в 2 - 3 раза [267, 268]. Около 50% переломов проксимального отдела бедра происходит у лиц, получивших ранее перелом из-за остеопороза [268, 269]. При этом антиостеопоротическое лечение в рутинной практике назначается менее чем у 20% пациентов [264, 270]. В случае наблюдения таких пациентов в рамках СППП в проведенных исследованиях было показано снижение числа повторных переломов до 40% [35, 36, 259], а также снижение летальности [259, 260] и высокая экономическая эффективность [261, 262].
Для организации эффективно работающей СППП нужно учитывать следующие аспекты: 1) Клиническая и экономическая эффективность была показана только при наличии в штате СППП выделенного координатора-медсестры, обеспечивающего маршрутизацию пациентов с переломами [263]. 2) Необходимо организовать систему систематического и активного выявления всех пациентов 50 лет и старше с новыми низкоэнергетическими переломами. 3) Должно быть организовано обследование пациента (или направление на это обследование в другие медицинские учреждения) для оценки риска повторных переломов с целью выявления пациентов с высоким риском. Для этого рекомендуется использовать оценку 10-летнего абсолютного риска переломов FRAX и/или остеоденситометрию. Также требуется обеспечить обследование для поиска вторичных причин остеопороза и для оценки риска падений. Так как риск получения повторного перелома наибольший в первые месяцы после случившегося перелома, обследование рекомендуется проводиться в первые 3 месяца. 4) Обучение пациентов проводится для повышения приверженности к лечению и снижения риска падений. 5) После проведения оценок должны быть применяться медикаментозные и немедикаментозные мероприятия, включая меры по снижению риска падений. 6) Следует обеспечить длительное наблюдение за пациентом в СППП или направление для этого к врачам первичного звена или врачам-специалистам. 7) Данные обо всех пациентах, выявленных в СППП, должны поступать в базу данных. Для оптимизации оказания помощи необходимо обеспечить качество работы СППП, что включает в себя сбор данных и контроль.
6. Организация оказания медицинской помощи
Остеопороз является системным хроническим заболеванием, поэтому, как правило, ведение таких пациентов осуществляется в амбулаторном порядке. Однако в некоторых случаях показана плановая госпитализация для проведения дифференциальной диагностики остеопороза и подбора терапии при тяжелом течении заболевания с множественными переломами, развитии новых патологических переломов на фоне проводимой терапии, а также при наличии костной патологии у пациентов молодого возраста.
Показания для плановой госпитализации в медицинскую организацию:
1. Наличие двух и более компрессионных переломов тел позвонков;
2. Наличие одного и более компрессионных переломов тел позвонков в сочетании внепозвоночными патологическими переломами в анамнезе;
3. Наличие патологического перелома у пациентов молодого возраста (менее 50 лет).
Показания к выписке пациента из медицинской организации:
1. Установления типа остеопороза: первичный или вторичный;
2. Оценка состояния фосфорно-кальциевого обмена, МПК и исключение других переломов;
4. Выбор тактики лечения пациента.
Одним из осложнений остеопороза является патологический перелом бедренной кости, который требует экстренной госпитализации и хирургического лечения у врача-травматолога-ортопеда в течение 48 часов с последующей активизацией пациента.
Показания для экстренной госпитализации в медицинскую организацию:
1. Патологический перелом бедренной кости.
Показания к выписке пациента из медицинской организации:
1. Проведение хирургического лечения перелома бедренной кости;
2. Активизация пациента в пределах палаты с опорой на "ходунки".
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Наибольшее влияние на течение и исход остеопороза, профилактику переломов оказывает приверженность пациента медикаментозной терапии. Лекарственные препараты для лечения остеопороза снижают риск развития переломов только при их регулярном приеме в сочетании с добавками препаратов кальция и препаратов витамина D и его аналогов. Продолжительность и последовательность терапии, преемственность между врачами хирургического и терапевтического профилей изложены в разделе "Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения".
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Выполнен скрининг для выявления групп с высокой вероятностью переломов с использованием алгоритма FRAX среди впервые обратившихся женщин в постменопаузе и мужчин старше 50 лет
Да/Нет
2
Выполнена стандартная рентгенография позвоночника грудного и поясничного отделов (Th4 - L5) в боковой проекции пациентов:
Да/Нет
- с болевым синдромом в спине;
- пациентам с длительно некомпенсированным СД 2 типа или на инсулинотерапии;
- снижением роста на 4 см в течение жизни или на 2 см при регулярном медицинском контроле;
- принимающим глюкокортикоиды;
- с диагностированными переломами другой локализации;
3
Проведена двухэнергетическая рентгеноденситометрия поясничного отдела позвоночника и проксимального отдела бедренной кости лицам с индивидуальной 10-летней вероятностью основных патологических переломов (FRAX) в интервале между низкой и высокой вероятностью переломов для диагностики остеопороза
Да/Нет
4
Выполнен общий (клинический) анализ крови при впервые установленном диагнозе остеопороз или при неэффективности терапии остеопороза
Да/Нет
5
Выполнен биохимический анализ крови: исследование уровня общего кальция в крови, исследование уровня креатинина в крови (с подсчетом скорости клубочковой фильтрации (СКФ)), исследование уровня неорганического фосфора в крови, определение активности щелочной фосфатазы в крови, исследование уровня глюкозы при впервые установленном диагнозе остеопороз или при неэффективности терапии остеопороза
Да/Нет
6
Назначено патогенетическое лечение остеопороза (БФ или деносумаб** или терипаратид**) в сочетании с препаратами кальция и колекальциферолом** всем лицам с установленным диагнозом остеопороз
Да/Нет
7
Проведена двухэнергетическая рентгеноденситометрия поясничного отдела позвоночника и проксимального отдела бедренной кости для оценки эффективности проводимой терапии, а также динамики состояния МПК у пациентов с ранее установленным остеопорозом с временным интервалом не менее 12 месяцев от первого исследования ИЛИ определение C-концевого телопептида в крови, и/или исследование уровня N-терминального пропептида проколлагена 1-го типа (P1NP) в крови (маркера резорбции при назначении антирезорбтивной терапии и костеобразования при назначении анаболической терапии, соответственно) пациентам, получающим лечение остеопороза исходно и через 3 месяца от начала терапии с целью ранней оценки эффективности лечения и приверженности к терапии.
Да/Нет
Список литературы
1. Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я., Торопцова Н.В., Алексеева Л.И., Бирюкова Е.В., Гребенникова Т.А., Дзеранова Л.К., Древаль А.В., Загородний Н.В., Ильин А.В., Крюкова И.В., Лесняк О.М., Мамедова Е.О., Никитинская О.А., Пигарова Е.А., Родионова С.С., Скрипникова И.А., Тарбаева Н.В., Фарба Л.Я., Цориев Т.Т., Чернова Т.О., Юренева С.В., Якушевская О.В., Дедов И.И. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза. Проблемы Эндокринологии, 2017, Том 63, N 6, стр. 392 - 426.
2. Camacho P.M., Petak S.M., Binkley N., Clarke B.L., Harris S.T., Hurley D.L., Kleerekoper M., Lewiecki E.M., Miller P.D., Narula H.S., Pessah-Pollack R., Tangpricha V., Wimalawansa S.J., Watts N.B.: American association of clinical endocrinologists and American college of endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis - 2016. Endocr Pract. 2016 Sep 2; 22 (Suppl 4): 1 - 42.
3. Kanis J.A., Cooper C., Rizzoli R., Reginster J.Y.; Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2019 Jan; 30(1): 3 - 44. doi: 10.1007/s00198-018-4704-5.
4. Raman-Wilms L. Book Review: Guidelines for Preclinical Evaluation and Clinical Trials in Osteoporosis. Annals of Pharmacotherapy. 1999; 33(12): 1377 - 1378. doi: 10.1177/106002809903301207.
5. American Association of Orthopedic Surgeon Position Statement, 1159, December 2009.
6. Kanis J.A., on behalf of the WHO Scientific Group. Assessment of osteoporosis at the primary health-care level. Technical Report. WHO Collaboraiting Centre, University of Sheffield, UK, 2008.
7. Consensus development conference: diagnosis, prophylaxis, and treatment of osteoporosis. Am J Med. 1993 Jun; 94(6): 646 - 50. DOI: 10.1016/0002-9343(93)90218-e.
8. Михайлов Е.Е., Беневоленская Л.И. Руководство по остеопорозу. М.: БИНОМ. Лаборатория знаний; 2003.
9. Лесняк О.М., Ершова О.Б. Аудит состояния проблемы остеопороза в странах Восточной Европы и Центральной Азии 2010. Naturaprint; 2011.
10. Дедов И.И., Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я.: "Остеопороз - от редкого симптома эндокринных болезней до безмолвной эпидемии 20 - 21 века" Ж. Проблемы Эндокринологии, 2011, том 57, стр. 35 - 45.
11. Ершова О.Б., Белова К.Ю., Белов М.В., Ганерт О.А., Гладкова Е.Н., Ходырев В.Н., Лесняк О.М., Давтян В.Г., Пилюкова Р.И., Романова М.А., Синицина О.С. Эпидемиология переломов проксимального отдела бедренной кости у городского населения Российской Федерации: результаты многоцентрового исследования. Форум остеопороза, 23 - 25 сентября, 2012; Санкт-Петербург. Материалы научно-практической конференции "Остеопороз - важнейшая мультидисциплинарная проблема здравоохранения XXI века"; 23 - 27.
12. Меньшикова Л.В., Храмцова Н.А., Ершова О.Б. Ближайшие и отдаленные исходы переломов проксимального отдела бедра у лиц пожилого возраста и их медико-социальные последствия (по данным многоцентрового исследования). Остеопороз и остеопатии. 2002; 1: 8 - 11.
13. Добровольская О.В., Торопцова Н.В., Лесняк О.М. Экономические аспекты осложненного остеопороза: стоимость лечения в течение первого года после перелома. Современная ревматология. 2016;. т. 10. N 3. с. 29 - 34.
14. Бахтиярова С.А., Бортник С.Б., Лесняк О.М., Кузнецова Н.Л. Сравнительная оценка социальных последствий перелома проксимального отдела бедра и инфаркта миокарда у пациентов старшего возраста. Остеопороз и остеопатии. 2003; Приложение. Научная программа и тезисы Росс. Конгресса по остеопорозу, Москва, 20 - 22 октября 2003 г. - С. 45.
15. Lesnyak O., Ershova O., Belova K. et al. Epidemiology of fracture in the Russian Federation and the development of a FRAX model. Arch Osteoporos. 2012; 7(1-2): 67 - 73. doi: 10.1007/s11657-012-0082-3.
16. Cosman F., de Beur S., LeBoff M., de Beur S.J., Tanner B. Clinician's Guide to Prevention and Treatment of Osteoporosis. National Osteoporosis Foundation. 1150 17th St., NW, Suite 850, Washington, DC 20036, Release Date: April 1, 2014.
17. Shepstone L., Lenaghan E., Cooper C., et al. SCOOP Study Team. Screening in the community to reduce fractures in older women (SCOOP): a randomised controlled trial. Lancet. 2018 Feb 24; 391(10122): 741 - 747. doi: 10.1016/S0140-6736(17)32640-5.
18. Turner D.A., Khioe R.F.S., Shepstone L., et al. SCOOP Study Team. The Cost-Effectiveness of Screening in the Community to Reduce Osteoporotic Fractures in Older Women in the UK: Economic Evaluation of the SCOOP Study. J Bone Miner Res. 2018 May; 33(5): 845 - 851. doi: 10.1002/jbmr.3381.
19. Hippisley-Cox J., Coupland C. (2009) Predicting risk of osteoporotic fracture in men and women in England and Wales: prospective derivation and validation of QFractures Scores. Br Med J 339: b4229.
20. Hoff M., Meyer H.E., Skurtveit S. et al (2017) Validation of FRAX and the impact of self-reported falls among elderly in a general population: the HUNT study, Norway. Osteoporos Int 28: 2935 - 2944.
21. Fraser L-A, Langsetmo L., Berger C. et al (2011) Fracture prediction and calibration of a Canadian FRAX(R) tool: a population-based report from CaMos. Osteoporos Int 22: 829 - 837.
22. Leslie W.D., Lix L.M., Johansson H. et al (2010) Manitoba bone density program. Independent clinical validation of a Canadian FRAX((R)) tool: fracture prediction and model calibration. J Bone Miner Res 25: 2350 - 2358.
23. Jiang X., Gruner M., Tremollieres F., Pluskiewicz W., Sornay-Rendu E., Adamczyk P., Schnatz P.F. Diagnostic accuracy of FRAX in predicting the 10-year risk of osteoporotic fractures using the USA treatment thresholds: A systematic review and meta-analysis. Bone. 2017 Jun; 99: 20 - 25. doi: 10.1016/j.bone.2017.02.008.
24. Marques A., Ferreira R.J., Santos E., Loza E., Carmona L., da Silva J.A. The accuracy of osteoporotic fracture risk prediction tools: a systematic review and meta-analysis. Ann Rheum Dis. 2015 Nov; 74(11): 1958 - 67. doi: 10.1136/annrheumdis-2015-207907.
25. Kanis J., Johnell O., Oden A., Johansson H., McCloskey E. FRAXTM and the assessment of fracture probability in men and women from the UK. Osteoporosis International. 2008; 19(4): 385 - 397. doi: 10.1007/s00198-007-0543-5.
26. Lindsay R., Silverman S.L., Cooper C., Hanley D.A., Barton I., Broy S.B., et al. Risk of new vertebral fracture in the year following a fracture. JAMA. 2001; 285: 320 - 323.
27. Gehlbach S., Saag K.G., Adachi J.D., Hooven F.H., Flahive J., Boonen S., et al. Previous fractures at multiple sites increase the risk for subsequent fractures: the Global Longitudinal Study of Osteoporosis in Women. J Bone Miner Res. 2012; 27: 645 - 653.
28. Edwards B.J., Bunta A.D., Simonelli C., Bolander M., Fitzpatrick L.A. Prior fractures are common in patients with subsequent hip fractures. Clin Orthop Relat Res. 2007; 461: 226 - 230.
29. Ross P. Pre-Existing Fractures and Bone Mass Predict Vertebral Fracture Incidence in Women. Annals of Internal Medicine. 1991; 114(11): 919. doi: 10.7326/0003-4819-114-11-919.
30. Gallagher J., Genant H., Crans G., Vargas S., Krege J. Teriparatide Reduces the Fracture Risk Associated with Increasing Number and Severity of Osteoporotic Fractures. The Journal of Clinical Endocrinology & Metabolism. 2005; 90(3): 1583 - 1587. doi: 10.1210/jc.2004-0826.
31. Marcus R., Wang O., Satterwhite J, Mitlak B. The Skeletal Response to Teriparatide Is Largely Independent of Age, Initial Bone Mineral Density, and Prevalent Vertebral Fractures in Postmenopausal Women With Osteoporosis. J Bone Miner Res. 2003; 18(1): 18 - 23. doi: 10.1359/jbmr.2003.18.1.18.
32. Kanis J.A., Barton I., Johnell O. Risedronate decreases fracture risk in patients selected solely on the basis of prior vertebral fracture. Osteoporos Int 2005; 16: 475 - 82.
33. Johnell O., Kanis J.A., Black D.M., et al. Association between baseline risk factors and vertebral fracture risk in the Multiple Outcomes of Raloxifene Evaluation (MORE) study. J Bone Miner Res 2004; 19: 64 - 72.
34. Kanis J.A., Jonsson B., Oden A., McCloskey E.V. A metaanalysis of the effect of strontium ranelate on the risk of vertebral and non-vertebral fracture in postmenopausal osteoporosis and the interaction with FRAX. Osteoporos Int 2011; 22: 2347 - 55.
35. Kanis J.A., Johnell O., De Laet C., et al. A meta-analysis of previous fracture and subsequent fracture risk. Bone 2004; 35(2): 375 - 82.
36. Klotzbuecher C.M., Ross P.D., Landsman P.B., et al. Patients with prior fractures have an increased risk of future fractures: a summary of the literature and statistical synthesis. J Bone Mineral Research 2000; 15(4): 721 - 39.
37. Schousboe J., Ensrud K., Nyman J., Kane R., Melton L. Potential cost-effective use of spine radiographs to detect vertebral deformity and select osteopenic post-menopausal women for amino-bisphosphonate therapy. Osteoporosis International. 2005; 16(12): 1883 - 1893. doi: 10.1007/s00198-005-1956-7.
38. Gallagher J.C., Sai A.J. Bone: Is screening for secondary causes of osteoporosis worthwhile? Nat Rev Endocrinol. 2010; 6: 360 - 362.
39. Barzel U.S. Recommended testing in patients with low bone density. J Clin Endocrinol Metab. 2003; 88: 1404 - 1405.
40. Tannenbaum C., Clark J., Schwartzman K., Wallenstein S., Lapinski R., Meier D., et al. Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab. 2002; 87: 4431 - 4437.
41. Cerda Gabaroi, D. et al. search for hidden secondary causes in postmenopausal women with osteoporosis. Menopause 17, 135 - 139 (2010).
42. Deutschmann, H.A. et al. search for occult secondary osteoporosis: impact of identified possible risk factors on bone mineral density. J. Intern. Med. 252, 389 - 397 (2002).
43. Priemel, M. et al. Bone mineralization defects and vitamin D deficiency: histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients. J. Bone Miner. Res. 25, 305 - 312 (2009).
44. Eastell R., Barton I., Hannon R.A., Chines A., Garnero P., Delmas P.D. Relationship of early changes in bone resorption to the reduction in fracture risk with risedronate. J Bone Miner Res. 2003; 18: 1051 - 1056.
45. Hochberg M.C., Greenspan S., Wasnich R.D. et al. Changes in bone density and turnover explain the reductions in incidence of nonvertebral fractures that occur during treatment with antiresorptive agents. J. Clin. Endocrinol. Metabol. 2002; 87(4): 1586 - 1592. doi: 10.1210/jcem.87.4.8415.
46. Bone H.G., Hosking D., Devogelaer J.P. et al. Ten years' experience with alendronate for osteoporosis in postmenopausal women. New Engl. J. Med. 2004; 350(12): 1189 - 99. doi: 10.1056/NEJMoa030897.
47. Black D.M., Schwartz A.V., Ensrud K.E. et al. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized tri-al. J. Am. Med. Association. 2006; 296(24): 2927 - 38. doi: 10.1001/jama.296.24.2927.
48. Delmas P.D., Eastell R., Garnero P., Seibel M.J., Stepan J. (2000) The use of biochemical markers of bone turnover in osteoporosis. Committee of Scientific Advisors of the International Osteoporosis Foundation. Osteoporos Int 11 (Suppl 6): S2-17.
49. Vasikaran S., Eastell R., Bruyere O., Foldes A.J., Garnero P., Griesmacher A., McClung M., Morris H.A., Silverman S., Trenti T., Wahl D.A., Cooper C., Kanis J.A. (2011) Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards. Osteoporos Int 22: 391 - 420.
50. Johansson H., Oden A., Kanis J.A., McCloskey E.V., Morris H.A., Cooper C., Vasikaran S. (2014) A meta-analysis of reference markers of bone turnover for prediction of fracture. Calcif Tissue Int 94: 560 - 567.
51. Bauer D.C., Black D.M., Bouxsein M.L., Lui L.Y., Cauley J.A., de Papp A.E., Grauer A., Khosla S., McCulloch C.E., Eastell R.; Foundation for the National Institutes of Health (FNIH) Bone Quality Project. Treatment-Related Changes in Bone Turnover and Fracture Risk Reduction in Clinical Trials of Anti-Resorptive Drugs: A Meta-Regression. J Bone Miner Res. 2018 Apr; 33(4): 634 - 642. doi: 10.1002/jbmr.3355. Epub 2018 Jan 10.
52. Ravn P., Hosking D., Thompson D. et al. Monitoring of Alendronate Treatment and Prediction of Effect on Bone Mass by Biochemical Markers in the Early Postmenopausal Intervention Cohort Study1. The Journal of Clinical Endocrinology & Metabolism. 1999; 84(7): 2363 - 2368. doi: 10.1210/jcem.84.7.5847.
53. Fink E., Cormier C., Steinmetz P., Kindermans C., Le Bouc Y., Souberbielle J. Differences in the Capacity of Several Biochemical Bone Markers to Assess High Bone Turnover in Early Menopause and Response to Alendronate Therapy. Osteoporosis International. 2000; 11(4): 295 - 303. doi: 10.1007/pl00004183.
54. Bauer D., Black D., Garnero P. et al. Change in Bone Turnover and Hip, Non-Spine, and Vertebral Fracture in Alendronate-Treated Women: The Fracture Intervention Trial. J Bone Miner Res. 2004; 19(8): 1250 - 1258. doi: 10.1359/jbmr.040512.
55. Delmas P., Recker R., Chesnut C. et al. Daily and intermittent oral ibandronate normalize bone turnover and provide significant reduction in vertebral fracture risk: results from the BONE study. Osteoporosis International. 2004; 15(10). doi: 10.1007/s00198-004-1602-9.
56. Reginster J., Gieschke R. Clinical Utility of a Pharmacostatistical Model for Ibandronate in Postmenopausal Osteoporosis. CDM. 2006; 7(7): 827 - 836. doi: 10.2174/138920006778520624.
57. Krege J., Lane N., Harris J., Miller P. PINP as a biological response marker during teriparatide treatment for osteoporosis. Osteoporosis International. 2014; 25(9): 2159 - 2171. doi: 10.1007/s00198-014-2646-0.
58. Imaz I., Zegarra P., Gonzalez-Enriquez J., Rubio B., Alcazar R., Amate J. Poor bisphosphonate adherence for treatment of osteoporosis increases fracture risk: systematic review and meta-analysis. Osteoporosis International. 2009; 21(11): 1943 - 1951. doi: 10.1007/s00198-009-1134-4.
59. Bergmann P., Body J., Boonen S. et al. Evidence-based guidelines for the use of biochemical markers of bone turnover in the selection and monitoring of bisphosphonate treatment in osteoporosis: a consensus document of the Belgian Bone Club. International Journal of Clinical Practice. 2009; 63(1): 19 - 26. doi: 10.1111/j.1742-1241.2008.01911.x.
60. Burch J., Rice S., Yang H. et al. Systematic review of the use of bone turnover markers for monitoring the response to osteoporosis treatment: the secondary prevention of fractures, and primary prevention of fractures in high-risk groups. Health Technology Assessment. 2014; 18(11). doi: 10.3310/hta18110.
61. Dresner-Pollak R., Parker R., Poku M., Thompson J., Seibel M., Greenspan S. Biochemical Markers of Bone Turnover Reflect Femoral Bone Loss in Elderly Women. Calcified Tissue International. 1996; 59(5): 328 - 333. doi: 10.1007/s002239900135.
62. Ross PKnowlton W. Rapid Bone Loss Is Associated with Increased Levels of Biochemical Markers. J Bone Miner Res. 1998; 13(2): 297 - 302. doi: 10.1359/jbmr.1998.13.2.297.
63. Hansen M.A., Overgaard K., Riis B.J. et al. Role of peak bone mass and bone loss in postmenopausal osteoporosis: 12 year study. BMJ 1991; 303: 961 - 4.
64. Garnero P., Sornay-Rendu E., Duboeuf F., Delmas P. Markers of Bone Turnover Predict Postmenopausal Forearm Bone Loss Over 4 Years: The OFELY Study. J Bone Miner Res. 1999; 14(9): 1614 - 1621. doi: 10.1359/jbmr.1999.14.9.1614.
65. Tian, A., Ma, J., Feng, K. et al. Reference markers of bone turnover for prediction of fracture: a meta-analysis. J Orthop Surg Res 14, 68 (2019). https://doi.org/10.1186/s13018-019-1100-6.
66. Schousboe J., Bauer D., Nyman J., Kane R., Melton L., Ensrud K. Potential for bone turnover markers to cost-effectively identify and select post-menopausal osteopenic women at high risk of fracture for bisphosphonate therapy. Osteoporosis International. 2006; 18(2): 201 - 210. doi: 10.1007/s00198-006-0218-7.
67. Boonen S., Body J., Boutsen Y. et al. Evidence-based guidelines for the treatment of postmenopausal osteoporosis: a consensus document of the Belgian Bone Club. Osteoporosis International. 2005; 16(3): 239 - 254. doi: 10.1007/s00198-004-1812-1.
68. McNabb B., Vittinghoff E., Schwartz A. et al. BMD changes and predictors of increased bone loss in postmenopausal women after a 5-year course of alendronate. J Bone Miner Res. 2013; 28(6): 1319 - 1327. doi: 10.1002/jbmr.1864.
69. Bauer D., Schwartz A., Palermo L. et al. Fracture Prediction After Discontinuation of 4 to 5 Years of Alendronate Therapy. JAMA Internal Medicine. 2014; 174(7): 1126.
70. Cosman F., Cauley J., Eastell R. et al. Reassessment of Fracture Risk in Women After 3 Years of Treatment With Zoledronic Acid: When is it Reasonable to Discontinue Treatment?. The Journal of Clinical Endocrinology & Metabolism. 2014; 99(12): 4546 - 4554. doi: 10.1210/jc.2014-1971.
71. Bauer D., Garnero P., Hochberg M. et al. Pretreatment Levels of Bone Turnover and the Antifracture Efficacy of Alendronate: The Fracture Intervention Trial. J Bone Miner Res. 2005; 21(2): 292 - 299. doi: 10.1359/jbmr.051018.
72. Seibel M., Naganathan V., Barton I., Grauer A. Relationship Between Pretreatment Bone Resorption and Vertebral Fracture Incidence in Postmenopausal Osteoporotic Women Treated With Risedronate. J Bone Miner Res. 2003; 19(2): 323 - 329. doi: 10.1359/jbmr.0301231.
73. Yamamoto T., Tsujimoto M., Hamaya E., Sowa H. Assessing the effect of baseline status of serum bone turnover markers and vitamin D levels on efficacy of teriparatide 20 mg/day administered subcutaneously in Japanese patients with osteoporosis. J. Bone Miner. Metab. 2013; 31: 199 - 205. doi: 10.1007/s00774-012-0403-z
74. Kanis J., Melton L., Christiansen C., Johnston C., Khaltaev N. The diagnosis of osteoporosis. J Bone Miner Res. 2009; 9(8): 1137 - 1141. doi: 10.1002/jbmr.5650090802.
75. Nevitt M.C., Ettinger B., Black D.M., Stone K., Jamal S.A., Ensrud K., Segal M., Genant H.K., Cummings S.R. The association of radiographically detected vertebral fractures with back pain and function: a prospective study. Ann Intern Med. 1998 May 15; 128(10): 793 - 800. doi: 10.7326/0003-4819-128-10-199805150-00001.
76. Yamamoto M., Yamaguchi T., Yamauchi M., Kaji H., Sugimoto T. Diabetic patients have an increased risk of vertebral fractures independent of BMD or diabetic complications. J Bone Miner Res. 2009 Apr; 24(4): 702 - 9. doi: 10.1359/jbmr.081207.
77. Siminoski K., Jiang G., Adachi J.D., Hanley D.A., Cline G., Ioannidis G., Hodsman A., Josse R.G., Kendler D., Olszynski W.P., Ste Marie L.G., Eastell R. Accuracy of height loss during prospective monitoring for detection of incident vertebral fractures. Osteoporos Int. 2005 Apr; 16(4): 403 - 10. doi: 10.1007/s00198-004-1709-z. Epub 2004 Aug 11.
78. T.P. van Staa, H.G.M. Leufkens, L. Abenhaim, B. Zhang, C. Cooper, Oral corticosteroids and fracture risk: relationship to daily and cumulative doses, Rheumatology, Volume 39, Issue 12, December 2000, Pages 1383 - 1389, https://doi.org/10.1093/rheumatology/39.12.1383
79. Dede A.D., Tournis S., Dontas I., Trovas G. Type 2 diabetes mellitus and fracture risk. Metabolism. 2014 Dec; 63(12): 1480 - 90. doi: 10.1016/j.metabol.2014.09.002.
80. Xu W., Perera S., Medich D., Fiorito G., Wagner J., Berger L.K., Greenspan S.L. Height loss, vertebral fractures, and the misclassification of osteoporosis. Bone. 2011 Feb; 48(2): 307 - 11. doi: 10.1016/j.bone.2010.09.027. Epub 2010 Sep 24.
81. Kamimura, M., Nakamura, Y., Sugino, N. et al. Associations of self-reported height loss and kyphosis with vertebral fractures in Japanese women 60 years and older: a cross-sectional survey. Sci Rep 6, 29199 (2016). https://doi.org/10.1038/srep29199.
82. Mikula, A.L., Hetzel, S.J., Binkley, N. et al. Validity of height loss as a predictor for prevalent vertebral fractures, low bone mineral density, and vitamin D deficiency. Osteoporos Int 28, 1659 - 1665 (2017). https://doi.org/10.1007/s00198-017-3937-z.
83. Genant H., Wu C., van Kuijk C., Nevitt M. Vertebral fracture assessment using a semiquantitative technique. J Bone Miner Res. 1993; 8(9): 1137 - 1148. doi: 10.1002/jbmr.5650080915.
84. Genant H.K., Jergas M. Assessment of prevalent and incident vertebral fractures in osteoporosis research. Osteoporosis Int. 2003; 14(3): 43 - 55.
85. Kazawa N. T2WI MRI and MRI-MDCT correlations of the osteoporotic vertebral compressive fractures. European Journal of Radiology. 2012; 81(7): 1630 - 1636. doi: 10.1016/j.ejrad.2011.04.052.
86. Baum T., Karampinos D., Liebl H., Rummeny E., Waldt S., Bauer J. High-Resolution Bone Imaging for Osteoporosis Diagnostics and Therapy Monitoring Using Clinical MDCT and MRI. CMC. 2013; 20(38): 4844 - 4852. doi: 10.2174/09298673113206660279.
87. Lenchik L., Rogers L., Delmas P., Genant H. Diagnosis of Osteoporotic Vertebral Fractures: Importance of Recognition and Description by Radiologists. American Journal of Roentgenology. 2004; 183(4): 949 - 958. doi: 10.2214/ajr.183.4.1830949.
88. Grigoryan M., Guermazi A., Roemer F., Delmas P., Genant H. Recognizing and reporting osteoporotic vertebral fractures. European Spine Journal. 2003; 12(0): S104 - S112. doi: 10.1007/s00586-003-0613-0.
89. Papadakis A., Karantanas A., Papadokostakis G., Petinellis E., Damilakis J. Can abdominal multi-detector CT diagnose spinal osteoporosis?. Eur Radiol. 2008; 19(1): 172 - 176. doi: 10.1007/s00330-008-1099-2.
90. Papadakis A., Karantanas A., Papadokostakis G., Damilakis J. Assessment of the morpho-densitometric parameters of the lumbar pedicles in osteoporotic and control women undergoing routine abdominal MDCT examinations. J Bone Miner Metab. 2010; 29(3): 352 - 358. doi: 10.1007/s00774-010-0227-7.
91. Baum T., Grande Garcia E., Burgkart R. et al. Osteoporosis imaging: effects of bone preservation on MDCT-based trabecular bone microstructure parameters and finite element models. BMC Medical Imaging. 2015; 15(1). doi: 10.1186/s12880-015-0066-z.
92. Damilakis J., Adams J., Guglielmi G., Link T. Radiation exposure in X-ray-based imaging techniques used in osteoporosis. Eur Radiol. 2010; 20(11): 2707 - 2714. doi: 10.1007/s00330-010-1845-0.
93. Kanis J.A., Harvey N.C., Cooper C. et al. A systematic review of intervention thresholds based on FRAX: A report prepared for the National Osteoporosis Guideline Group and the International Osteoporosis Foundation. Arch Osteoporos. 2016 Dec; 11(1): 25. doi: 10.1007/s11657-016-0278-z.
94. Merlijn T., Swart KMA, van der Horst H.E., Netelenbos J.C., Elders PJM (2020) Fracture prevention by screening for high fracture risk: a systematic review and meta-analysis. Osteoporos Int 31: 251 - 257.
95. Rubin K.H., Rothmann M.J., Holmberg T., Hoiberg M., Moller S., Barkmann R., Gluer C.C., Hermann A.P., Bech M., Gram J., Brixen K. (2018) Effectiveness of a two-step population-based osteoporosis screening program using FRAX: the randomized Risk-stratified Osteoporosis Strategy Evaluation (ROSE) study. Osteoporos Int 29: 567 - 578.
96. Kanis J.A., McCloskey E.V., Johansson H., Strom O., Borgstrom F., Oden A.; National Osteoporosis Guideline Group. Case finding for the management of osteoporosis with FRAX--assessment and intervention thresholds for the UK. Osteoporos Int. 2008 Oct; 19(10): 1395 - 408. doi: 10.1007/s00198-008-0712-1.
97. Kanis J., Johnell O., De Laet C., Jonsson B., Oden A., Ogelsby A. International Variations in Hip Fracture Probabilities: Implications for Risk Assessment. J Bone Miner Res. 2002; 17(7): 1237 - 1244. doi: 10.1359/jbmr.2002.17.7.1237.
98. De Laet C., Van Hout B., Burger H., Weel A., Hofman A., Pols H. Hip Fracture Prediction in Elderly Men and Women: Validation in the Rotterdam Study. J Bone Miner Res. 2009; 13(10): 1587 - 1593. doi: 10.1359/jbmr.1998.13.10.1587.
99. Kanis J.A., Delmas P., Burckhardt P., Cooper C., Torgerson D. Guidelines for diagnosis and management of osteoporosis. The European Foundation for Osteoporosis and Bone Disease. Osteoporos Int. 1997; 7(4): 390 - 406. DOI: 10.1007/bf01623782.
100. Kanis J.A., McCloskey E.V., Johansson H., Cooper C., Rizzoli R., Reginster J-Y, on behalf of the Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) and the Committee of Scientific Advisors of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2013 Jan; 24(1): 23 - 57. doi: 10.1007/s00198-012-2074-y.
101. Lekamwasam S., Adachi J.D., Agnusdei D., Bilezikian J., Boonen S., Borgstrom F., Cooper C., Diez Perez A., Eastell R., Hofbauer L., Kanis J.A., Langdahl B.L., Lesnyak O., Lorenc R., McCloskey E., Messina O.D., Napoli N., Obermayer-Pietsch B., Ralston S.H., Sambrook P.N., Silverman S., Sosa M., Stepan J., Suppan G., Wahl D.A., Compston J.E. for the Joint IOF-ECTS GIO Guidelines Working Group. A framework for the development of guidelines for the management of glucocorticoid-induced osteoporosis. Osteoporos Int. 2012 Sep; 23(9): 2257 - 76. doi: 10.1007/s00198-012-1958-1.
102. Алексеева Л.И., Баранова И.А., Белова К.Ю., Ершова О.Б., Зазерская И.Е., Зоткин Е.Г., Лесняк О.М., Никитинская О.А., Рожинская Л.Я., Скрипникова И.А., Смирнов А.В., Щеплягина Л.А.: Клинические рекомендации по профилактике и ведению больных с остеопорозом. Литера; 2012: 23.
103. Никитинская О.А., Торопцова Н.В. Оценка риска переломов с использованием модели FRAX(R) (ретроспективное десятилетнее исследование) Альманах клинической медицины. 2014; 43: 50 - 55.
104. National Osteoporosis Foundation (NOF) and International Society for Clinical Densitometry (ISCD). Recommendations to DXA Manufacturers for FRAX(R) Implementation. Available http://www.nof.org/files/nof/public/content/resource/862/files/392.pdf. Accessed January 28, 2013
105. Kanis J.A., Johansson H., Oden A., McCloskey E.V. Guidance for the adjustment of FRAX according to the dose of glucocorticoids. Osteoporos Int 2011: 22: 809 - 816.
106. Kanis J.A., Johansson H., Oden A. et al. A meta-analysis of prior corticosteroid use and fracture risk. J Bone Miner Res. 2004 Jun; 19(6): 893 - 9. DOI: 10.1359/JBMR.040134.
107. Van Staa T.P., Leufkens H.G.M., Cooper C. The epidemiology of corticosteroid-induced osteoporosis: a meta-analysis. Osteoporos Int. 2002 Oct; 13(10): 777 - 87.
108. Ferrari S.L., Abrahamsen B., Napoli N., et al; Bone and Diabetes Working Group of IOF. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporos Int. 2018 Dec; 29(12): 2585 - 2596. doi: 10.1007/s00198-018-4650-2.
109. Leslie W.D., Johansson H., McCloskey E.V., Harvey N.C., Kanis J.A., Hans D. Comparison of Methods for Improving Fracture Risk Assessment in Diabetes: The Manitoba BMD Registry. J Bone Miner Res. 2018 Nov; 33(11): 1923 - 1930. doi: 10.1002/jbmr.3538.
110. Baleanu F., Bergmann P., Hambye A.S., Dekelver C., Iconaru L., Cappelle S.I., Moreau M., Paesmans M., Karmali R., Body J.J. Assessment of bone quality with trabecular bone score in type 2 diabetes mellitus: A study from the FRISBEE cohort. Int J Clin Pract. 2019 Mar 26: e13347. doi: 10.1111/ijcp.13347.
111. Johansson H., Oden A., Johnell O., Jonsson B., de Laet C., Oglesby A., McCloskey E.V., Kayan K., Jalava T., Kanis J.A. (2004) Optimization of BMD measurements to identify high risk groups for treatment-a test analysis. J Bone Miner Res 19: 906 - 913.
112. Tosteson A.N., Melton L.J., 3rd, Dawson-Hughes B., Baim S., Favus M.J., Khosla S., Lindsay RL (2008) Cost-effective osteoporosis treatment thresholds: the United States perspective. Osteoporos Int 19: 437 - 447.
113. Leslie W.D., Morin S., Lix L.M., Johansson H., Oden A., McCloskey E., Kanis J..A (2012) Fracture risk assessment without bone density measurement in routine clinical practice. Osteoporos Int 23: 75 - 85.
114. Leslie W.D., Majumdar S.R., Lix L.M., Johansson H., Oden A., McCloskey E., Kanis J.A. (2012) High fracture probability with FRAX usually indicates densitometric osteoporosis: implications for clinical practice. Osteoporos Int 23: 391 - 397.
115. Kanis J.A., Oden A., Johnell O., et al. The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women. Osteoporos Int (2007) 18: 1033 - 1046.
116. Kyriakos G., Vidal-Casariego A., Fernandez-Martinez M.N. et al. Impact of the NOGG and NOF guidelines on the indication of bone mineral density in routine clinical practice. J Clin Densitom. 2015 Oct - Dec; 18(4): 533 - 8. doi: 10.1016/j.jocd.2015.08.001.
117. Kanis J.A., McCloskey E.V., Johansson H., Strom O., Borgstrom F., Oden A. Case finding for the management of osteoporosis with FRAX - assessment and intervention thresholds for the UK. Osteoporos Int. 2008; 19: 1395 - 1408.
118. Johansson H., Kanis J.A., Oden A., Johnell O., McCloskey E. BMD, clinical risk factors and their combination for hip fracture prevention. Osteoporos Int (2009) 20: 1675 - 1682.
119. Johansson H., Kanis J.A., Oden A., Compston J., McCloskey E. A comparison of case-finding strategies in the UK for the management of hip fractures. Osteoporos Int (2012) 23: 907 - 915.
120. Kanis J.A., Adams J., Borgstrom F. et al. The cost-effectiveness of alendronate in the management of osteoporosis. Bone (2008) 42: 4 - 15.
121. Cummings S.R., Karpf D.B., Harris F., Genant H.K., Ensrud K., LaCroix A.Z., Black D.M. Improvement in spine bone density and reduction in risk of vertebral fractures during treatment with antiresorptive drugs. Am J Med. 2002; 112: 281 - 289.
122. Chen P., Miller P.D., Delmas P.D., Misurski D.A., Krege J.H. Change in lumbar spine BMD and vertebral fracture risk reduction in teriparatide-treated postmenopausal women with osteoporosis. J Bone Miner Res. 2006; 21: 1785 - 1790.
123. Management of postmenopausal osteoporosis: position statement of The North American Menopause Society. Menopause. 2002: 84 - 101. doi: 10.1097/00042192-200203000-00003.
124. ISCD positions. Journal of Clinical Densitometry. 2004; 7(1).
125. Official Positions of the International Society for Clinical Densitometry. Copyright ISCD, October 2007.
126. Shepherd J.A., Blake G.M. T-scores and Z-scores. J Clin Densitom. 2007 Oct-Dec; 10(4): 349 - 50. DOI: 10.1016/j.jocd.2007.08.006.
127. Watts N.B., Leslie W.D., Foldes A.J., Miller P.D. International Society for Clinical Densitometry Position Development Conference: Task Force on Normative Databases. J Clin Densitom. 2013 Oct - Dec; 16(4): 472 - 81. doi: 10.1016/j.jocd.2013.08.001.
128. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. World Health Organization, Geneva. World Health Organ Tech Rep Ser. 1994; 843: 1 - 129.
129. Kelly T.L. Bone mineral density reference databases for American men and women. J Bone Miner Res 1990, 5 (Suppl 2): S249.
130. Hanson J. Standardization of femur BMD. J Bone Miner Res 1997, 12: 1316 e1317.
131. Kanis J.A., McCloskey E.V., Johansson H., Oden A., Melton L.J. 3rd, Khaltaev N. A reference standard for the description of osteoporosis. Bone. 2008 Mar; 42(3): 467 - 75. doi: 10.1016/j.bone.2007.11.001.
132. Nelson H.D., Haney E.M., Chou R., Dana T., Fu R., Bougatsos C. Screening for Osteoporosis: Systematic Review to Update the 2002 US Preventive Services Task Force Recommendation. Rockville (MD): Agency for Healthcare Research and Quality (US); 2010 Jul. Report No.: 10-05145-EF-1.
133. Melton L.J. Chrischilles E.A., Cooper C., Lane A.W., Riggs B.L. How many women have osteoporosis. J Bone Miner Res 1993: 7: 1005 - 1010.
134. Bonnick S. Bone Densitometry in Clinical Practice. Humana Press Inc. 2004: 411.
135. McCloskey E.V., Oden A., Harvey N.C., et al. A Meta-Analysis of Trabecular Bone Score in Fracture Risk Prediction and its Relationship to FRAX. J Bone Miner Res. 2016 May; 31(5): 940 - 8. doi: 10.1002/jbmr.2734.
136. Bousson V., Bergot C., Sutter B., Levitz P., Cortet B. Trabecular bone score (TBS): available knowledge, clinical relevance, and future prospects. Osteoporosis International. 2011; 23(5): 1489 - 1501. doi: 10.1007/s00198-011-1824-6.
137. International Society for Clinical Densitometry. 2013 Official Positions - Adult. http://www.iscd.org/official-positions/2013-iscd-official-positions-adult. Ссылка активна на 12.05.2019.
138. Black D.M., Cummings S.R., Karpf D.B. et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet. 1996; 348: 1535 - 1541.
139. Cummings S.R., Black D.M., Thompson D.E. et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA. 1998; 280: 2077 - 2082. doi: 10.1001/jama.280.24.2077.
140. Orwoll E., Ettinger M., Weiss S., Miller P., Kendler D., Graham J., Adami S., Weber K., Lorenc R., Pietschmann P., Vandormael K., Lombardi A. Alendronate for the treatment of osteoporosis in men. N Engl J Med. 2000 Aug 31; 343(9): 604 - 10. DOI: 10.1056/NEJM200008313430902.
141. Saag K., Emkey R., Schnitzer T. et al. Alendronate for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. Obstetrical & Gynecological Survey. 1999; 54(1): 39 - 40. doi: 10.1097/00006254-199901000-00021.
142. McClung M.R., Geusens P., Miller P.D., et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group.N Engl J Med. 2001; 344: 333 - 340.
143. Boonen S., Orwoll E., Wenderoth D., Stoner K., Eusebio R., Delmas P. Once-Weekly Risedronate in Men With Osteoporosis: Results of a 2-Year, Placebo-Controlled, Double-Blind, Multicenter Study. Journal of Bone and Mineral Research. 2009; 24(4): 719 - 725. doi: 10.1359/jbmr.081214.
144. Eastell R., Devogelaer J., Peel N. et al. Prevention of Bone Loss with Risedronate in Glucocorticoid-Treated Rheumatoid Arthritis Patients. Osteoporosis International. 2000; 11(4): 331 - 337. doi: 10.1007/s001980070122.
145. Chesnut C.H. 3rd, Skag A., Christiansen C., Recker R., Stakkestad J.A., Hoiseth A., Felsenberg D., Huss H., Gilbride J., Schimmer R.C., Delmas P.D.; Oral Ibandronate Osteoporosis Vertebral Fracture Trial in North America and Europe (BONE). Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res. 2004 Aug; 19(8): 1241 - 9. Epub 2004 Mar 29.
146. Miller P.D., McClung M.R., Macovei L., Stakkestad J.A., Luckey M., Bonvoisin B., Reginster J.Y., Recker R.R., Hughes C., Lewiecki E.M., Felsenberg D., Delmas P.D., Kendler D.L., Bolognese M.A., Mairon N., Cooper C. Monthly oral ibandronate therapy in postmenopausal osteoporosis: 1-year results from the MOBILE study J Bone Miner Res. 2005 Aug; 20(8): 1315 - 22. Epub 2005 Mar 14.
147. Recker R.R., Ste-Marie L.G., Langdahl B., Czerwinski E., Bonvoisin B., Masanauskaite D., Rowell L., Felsenberg D. Effects of intermittent intravenous ibandronate injections on bone quality and micro-architecture in women with postmenopausal osteoporosis: the DIVA study. Bone. 2010 Mar; 46(3): 660 - 5. doi: 10.1016/j.bone.2009.11.004. Epub 2009 Nov 10.
148. Harris S., Blumentals W., Miller P. Ibandronate and the risk of non-vertebral and clinical fractures in women with postmenopausal osteoporosis: results of a meta-analysis of phase III studies. Current Medical Research and Opinion. 2007; 24(1): 237 - 245. doi: 10.1185/030079908x253717.
149. Black D., Delmas P., Eastell R. et al. Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. N Engl J Med. 2007 May 3; 356(18): 1809 - 22 DOI: 10.1056/NEJMoa067312.
150. Boonen S., Reginster J., Kaufman J. et al. Fracture Risk and Zoledronic Acid Therapy in Men with Osteoporosis. New England Journal of Medicine. 2012; 367(18): 1714 - 1723.
151. Reid D.M., Devogelaer J.P., Saag K., Roux C., Lau C.S., Reginster J.Y., Papanastasiou P., Ferreira A., Hartl F., Fashola T., Mesenbrink P., Sambrook P.N.; HORIZON investigators. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2009 Apr 11; 373(9671): 1253 - 63. doi: 10.1016/S0140-6736(09)60250-6.
152. Kenneth W. Lyles, Cathleen S. Colon-Emeric, M.H.Sc., Jay S. Magaziner, et al for the HORIZON Recurrent Fracture Trial* Zoledronic Acid and Clinical Fractures and Mortality after Hip Fracture. N Engl J Med. 2007; 357: 1799 - 1809.
153. McClung M., Miller P., Recknor C., Mesenbrink P., Bucci-Rechtweg C., Benhamou C. Zoledronic Acid for the Prevention of Bone Loss in Postmenopausal Women With Low Bone Mass. Obstetrics & Gynecology. 2009; 114(5): 999 - 1007. doi: 10.1097/aog.0b013e3181bdce0a.
154. Reid I.R., Horne A.M., Mihov B., Stewart A., Garratt E., Wong S., Wiessing K.R., Bolland M.J., Bastin S., Gamble G.D. Fracture Prevention with Zoledronate in Older Women with Osteopenia. N Engl J Med. 2018 Dec 20; 379(25): 2407 - 2416. doi: 10.1056/NEJMoa1808082.
155. Cummings S., Martin J., McClung M. et al. Denosumab for Prevention of Fractures in Postmenopausal Women With Osteoporosis. N Engl J Med. 2009 Aug 20; 361(8): 756 - 65. doi: 10.1056/NEJMoa0809493. Epub 2009 Aug 11.
156. Langdahl B., Teglbjarg C., Ho P. et al. A 24-Month Study Evaluating the Efficacy and Safety of Denosumab for the Treatment of Men With Low Bone Mineral Density: Results From the ADAMO Trial. The Journal of Clinical Endocrinology & Metabolism. 2015; 100(4): 1335 - 1342. doi: 10.1210/jc.2014-4079.
157. Orwoll E., Teglbjarg C., Langdahl B. et al. A Randomized, Placebo-Controlled Study of the Effects of Denosumab for the Treatment of Men with Low Bone Mineral Density. The Journal of Clinical Endocrinology & Metabolism. 2012; 97(9): 3161 - 3169. doi: 10.1210/jc.2012-1569.
158. Saag K.G., Pannacciulli N., Geusens P., Adachi J.D., Messina O.D., Morales-Torres J., Emkey R., Butler P.W., Yin X., Lems W.F. Denosumab vs risedronate in glucocorticoid-induced osteoporosis: final results of a 24-month randomized, double-blind, double-dummy trial. Arthritis Rheumatol. 2019 Feb 28. doi: 10.1002/art.40874.
159. Gnant M., Pfeiler G., Dubsky P. et al. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomised, double-blind, placebo-controlled trial. The Lancet. 2015; 386(9992): 433 - 443. doi: 10.1016/s0140-6736(15)60995-3.
160. Smith M.R., Egerdie B., Hernandez Toriz N., Feldman R., Tammela T.L., Saad F., Heracek J., Szwedowski M., Ke C., Kupic A., Leder B.Z., Goessl C.; DenosumabHALT Prostate Cancer Study Group. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009 Aug 20; 361(8): 745 - 55. doi: 10.1056/NEJMoa0809003. Epub 2009 Aug 11.
161. Amiche M.A., Albaum J.M., Tadrous M., et al. Efficacy of osteoporosis pharmacotherapies in preventing fracture among oral glucocorticoid users: a network. Osteoporos Int. 2016 Jun; 27(6): 1989 - 98. doi: 10.1007/s00198-015-3476-4.
162. Benlidayi I.C. Denosumab in the treatment of glucocorticoid-induced osteoporosis. Rheumatol Int. 2018 Nov; 38(11): 1975 - 1984. doi: 10.1007/s00296-018-4106-1.
163. Yamaguchi Y., Morita T., Kumanogoh A. The therapeutic efficacy of denosumab for the loss of bone mineral density in glucocorticoid-induced osteoporosis: a meta-analysis. Rheumatol Adv Pract. 2020 Mar 13; 4(1): rkaa008. doi: 10.1093/rap/rkaa008.
164. Yanbeiy Z.A., Hansen K.E. Denosumab in the treatment of glucocorticoid-induced osteoporosis: a systematic review and meta-analysis. Drug Des Devel Ther. 2019 Aug 14; 13: 2843 - 2852. doi: 10.2147/DDDT.S148654.
165. Miller P., Bolognese M., Lewiecki E. et al. Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term continued, discontinued, and restarting of therapy: A randomized blinded phase 2 clinical trial. Bone. 2008; 43(2): 222 - 229. doi: 10.1016/j.bone.2008.04.007.
166. Mandema JW1, Zheng J., Libanati C., Perez Ruixo J.J. Time course of bone mineral density changes with denosumab compared with other drugs in postmenopausal osteoporosis: a dose-response-based meta-analysis. J Clin Endocrinol Metab. 2014 Oct; 99(10): 3746 - 55. doi: 10.1210/jc.2013-3795. Epub 2014 Jun 10.
167. Brown J., Prince R., Deal C. et al. Comparison of the Effect of Denosumab and Alendronate on BMD and Biochemical Markers of Bone Turnover in Postmenopausal Women With Low Bone Mass: A Randomized, Blinded, Phase 3 Trial*. Journal of Bone and Mineral Research. 2009; 24(1): 153 - 161. doi: 10.1359/jbmr.0809010.
168. Choi N.K., Solomon D.H., Tsacogianis T.N., Landon J.E., Song H.J., Kim S.C. Comparative Safety and Effectiveness of Denosumab Versus Zoledronic Acid in Patients With Osteoporosis: A Cohort Study. J Bone Miner Res. 2016 Oct 13. doi: 10.1002/jbmr.3019.
169. Kendler D., Roux C., Benhamou C. et al. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women transitioning from alendronate therapy. J Bone Miner Res. 2009; 25(1): 72 - 81. doi: 10.1359/jbmr.090716.
170. Tsai J., Uihlein A., Burnett-Bowie S. et al. Comparative Effects of Teriparatide, Denosumab, and Combination Therapy on Peripheral Compartmental Bone Density, Microarchitecture, and Estimated Strength: the DATA-HRpQCT Study. J Bone Miner Res. 2014; 30(1): 39 - 45. doi: 10.1002/jbmr.2315.
171. Broadwell A., Chines A., Ebeling P.R., Franek E., Huang S., Smith S., Kendler D., Messina O., Miller P.D. Denosumab Safety and Efficacy Among Participants in the FREEDOM Extension Study With Mild to Moderate Chronic Kidney Disease. J Clin Endocrinol Metab. 2021 Jan 23; 106(2): 397 - 409. doi: 10.1210/clinem/dgaa851. PMID: 33211870; PMCID: PMC7823314.
172. Meier C., Uebelhart B., Aubry-Rozier B., Birkhauser M., Bischoff-Ferrari H.A., Frey D., Kressig R.W., Lamy O., Lippuner K., Stute P., Suhm N., Ferrari S. Osteoporosis drug treatment: duration and management after discontinuation. A position statement from the SVGO/ASCO. Swiss Med Wkly. 2017 Aug 16; 147: w14484. doi: 10.4414/smw.2017.14484.
173. Miller P.D., Pannacciulli N., Brown J.P., Czerwinski E., Nedergaard B.S., Bolognese M.A., Malouf J., Bone H.G., Reginster J.Y., Singer A., Wang C., Wagman R.B., Cummings S.R. Denosumab or Zoledronic Acid in Postmenopausal Women With Osteoporosis Previously Treated With Oral Bisphosphonates. J Clin Endocrinol Metab. 2016 Aug; 101(8): 3163 - 70. doi: 10.1210/jc.2016-1801.
174. McClung M. Inhibition of RANKL as a treatment for osteoporosis: Preclinical and early clinical studies. Current Osteoporosis Reports. 2006; 4(1): 28 - 33. doi: 10.1007/s11914-006-0012-7.
175. Белая Ж.Е., Рожинская Л.Я. Новые направления в терапии остеопороза - применение моноклональных человеческих антител к RANKL (Деносумаб). Остеопороз и Остеопатии. 2011; 2: 19 - 22.
176. Neer R., Arnaud C., Zanchetta J. et al. Effect of Parathyroid Hormone (1-34) on Fractures and Bone Mineral Density in Postmenopausal Women With Osteoporosis. N Engl J Med. 2001 May 10; 344(19): 1434 - 41 DOI: 10.1056/NEJM200105103441904.
177. Orwoll E., Scheele W., Paul S. et al. The Effect of Teriparatide [Human Parathyroid Hormone (1-34)] Therapy on Bone Density in Men With Osteoporosis. J Bone Miner Res. 2003; 18(1): 9 - 17. doi: 10.1359/jbmr.2003.18.1.9.
178. Saag K., Shane E., Boonen S. et al. Teriparatide or Alendronate in Glucocorticoid-Induced Osteoporosis. N Engl J Med. 2007 Nov 15; 357(20): 2028 - 39 DOI: 10.1056/NEJMoa071408.
179. Saag K., Zanchetta J., Devogelaer J. et al. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: Thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis & Rheumatism. 2009; 60(11): 3346 - 3355. doi: 10.1002/art.24879.
180. Liu C.L., Lee H.C., Chen C.C., Cho D.Y. Head-to-head comparisons of bisphosphonates and teriparatide in osteoporosis: a meta-analysis. Clin Invest Med. 2017; 40(3): E146 - E157. doi: 10.25011/cim.v40i3.28394.
181. Wang Y.K., Qin S.Q., Ma T., Song W., Jiang R.Q., Guo J.B., Li K., Zhang Y.M. Effects of teriparatide versus alendronate for treatment of postmenopausal osteoporosis: A meta-analysis of randomized controlled trials. Medicine (Baltimore). 2017; 96(21): e6970. doi: 10.1097/MD.0000000000006970.
182. Kendler D.L., Marin F., Zerbini CAF, et al. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018 Jan 20; 391(10117): 230 - 240. doi: 10.1016/S0140-6736(17) 32137-2
183. Body J., Gaich G., Scheele W. et al. A Randomized Double-Blind Trial to Compare the Efficacy of Teriparatide [Recombinant Human Parathyroid Hormone (1-34)] with Alendronate in Postmenopausal Women with Osteoporosis. The Journal of Clinical Endocrinology & Metabolism. 2002; 87(10): 4528 - 4535. doi: 10.1210/jc.2002-020334.
184. Hadji P., Zanchetta J., Russo L. et al. Effect of teriparatide compared with risedronate on back pain and incident vertebral fractures in postmenopausal women with osteoporotic vertebral fractures. Bone. 2011; 48: S82 - S83. doi: 10.1016/j.bone.2011.03.108.
185. Miller P.D., Shergy W.J., Body J., Chen P., Rohe M.E., Krege J.H.: Longterm reduction of back pain risk in women with osteoporosis treated with teriparatide compared with alendronate.
186. European Medicines Agency Press Office. EMEA recommends changes in the product Information for Protelos/Osseor due to the risk of severe hypersensitivity reactions. EMEA/417458/2007.
187. European Medicines Agency: Recommendation to restrict the use of Protelos/Osseor (strontium ranelate) 25 April 2013 EMA/258269/2013.
188. European Medicines Agency: Protelos/Osseor (strontium ranelate) to remain available but with futher restrictions 15 April 2014 EMA 235924/2014. J Rheumatology. 2005; 32: 1556 - 1562.
189. O'Donnel S., Cranney A., Wells G.A., Adachi J., Reginster J.Y. (2008) Strontium ranelate for preventing and treating osteoporosis. The Cochrane Library, Issue 4.
190. Adler R., El-Hajj Fuleihan G., Bauer D. et al. Managing Osteoporosis in Patients on Long-Term Bisphosphonate Treatment: Report of a Task Force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2016; 31(1): 16 - 35. doi: 10.1002/jbmr.2708.
191. Black D.M., Boonen S., Cauley J.A., Cummings S.R., Lippuner K., Leung P.C., Martinez RLM, Ruzycky M.E., Eastell R. (2012a) Erratum: The effect of 3 versus 6 years of Zoledronic acid treatment of osteoporosis: A randomized extension to the horizon-pivotal fracture trial (PFT). J Bone Miner Res 27(12): 2612.
192. Black D.M., Reid I.R., Cauley J.A., Cosman F., Leung P.C., Lakatos P., Lippuner K., Cummings S.R., Hue T.F., Mukhopadhyay A., Tan M., Aftring R.P., Eastell R. (2015) The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis: A randomized second extension to the HORIZON-pivotal fracture trial (PFT). J Bone Miner Res 30(5): 934 - 944.
193. Dennison E.M., Cooper C., Kanis J.A., Bruyere O., Silverman S., McCloskey E., Abrahamsen B., Prieto-Alhambra D., Ferrari S.; IOF Epidemiology/Quality of Life Working Group. Fracture risk following intermission of osteoporosis therapy. Osteoporos Int. 2019 Jun 7. doi: 10.1007/s00198-019-05002-w.
194. Bone H.G., Wagman R.B., Brandi M.L., Brown J.P., Chapurlat R., Cummings S.R., Czerwinski E., Fahrleitner-Pammer A., Kendler D.L., Lippuner K., Reginster J.Y., Roux C., Malouf J., Bradley M.N., Daizadeh N.S., Wang A., Dakin P., Pannacciulli N., Dempster D.W., Papapoulos S. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol 2017 5(7): 513 - 23.
195. Bone H.G., Bolognese M.A., Yuenn C.K., Kendler D.L., Miller P.D., Yang Y.C., Grazette L., Martin J.S., Gallagher J.C. (2011) Effects of denosumab treatment and discontinuation on bone mineral density and bone turnover markers in postmenopausal women with low bone mass. J Clin Endocrinol Metab 96(4): 972 - 980.
196. Bone H.G., Chapurlat R., Brandi M.L., et al. (2013) The effect of three or six years of denosumab exposure in women with postmenopausal osteoporosis: Results from the FREEDOM extension. J Clin Endocrinol Metab 98(11): 4483 - 4492.
197. Anagnostis P., Paschou S.A., Mintziori G., Ceausu I., Depypere H., Lambrinoudaki I., Mueck A., Perez-Lopez F.R., Rees M., Senturk L.M., Simoncini T., Stevenson J.C., Stute P., Tremollieres F.A., Goulis DG Drug holidays from bisphosphonates and denosumab in postmenopausal osteoporosis: EMAS position statement. Maturitas, 2017, 101; 23030.
198. Белая Ж.Е., Bilezikian J.P., Ершова О.Б., и др. Возможности длительной терапии постменопаузального остеопороза: обзор результатов клинических исследований деносумаба и резолюция совета экспертов российской ассоциации по остеопорозу (РАОП). Ж. Остеопороз и Остеопатии, 2018, Том 21, стр. 4 - 9.
199. Brown J., Roux C., Torring O. et al. Discontinuation of denosumab and associated fracture incidence: Analysis from the Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months (FREEDOM) Trial. J Bone Miner Res. 2013; 28(4): 746 - 752. doi: 10.1002/jbmr.1808.
200. Popp A., Zysset P., Lippuner K. Rebound-associated vertebral fractures after discontinuation of denosumab - from clinic and biomechanics. Osteoporosis International. 2015; 27(5): 1917 - 1921. doi: 10.1007/s00198-015-3458-6.
201. Tsourdi E., Langdahl B., Cohen-Solal M., Aubry-Rozier B., Eriksen E.F., Guanabens N., Obermayer-Pietsch B., Ralston S.H., Eastell R., Zillikens M.C. Discontinuation of denosumab therapy for osteoporosis: a systematic review and position statement by ECTS. Bone. 2017; 105: 11 - 17.
202. Tsourdi Elena, Bente Langdahl, Martine Cohen-Solal, Berengere Aubry-Rozier, Erik Fink Eriksen, Nuria Guanabens, Barbara Obermayer-Pietsch, Stuart H Ralston, Richard Eastell, M Carola Zillikens. Discontinuation of Denosumab therapy for osteoporosis: A systematic review and position statement by ECTS Review. Bone, 2017 Dec; 105: 11 - 17. doi: 10.1016/j.bone.2017.08.003. Epub 2017 Aug 5.
203. Tsourdi E., Zillikens M.C., Meier C., Body J.J., Rodriguez E.G., Anastasilakis A.D., Abrahamsen B., McCloskey E., Hofbauer L.C., Guanabens N., Obermayer-Pietsch B., Ralston S.H., Eastell R., Pepe J., Palermo A., Langdahl B. Fracture risk and management of discontinuation of denosumab therapy: a systematic review and position statement by ECTS. J Clin Endocrinol Metab. 2020 Oct 26: dgaa756. doi: 10.1210/clinem/dgaa756. Online ahead of print.PMID: 33103722.
204. Koldkjar Solling A., Harslof T., Kaal A., Rejnmark L., Langdahl B. Hypercalcemia after discontinuation of long-term denosumab treatment. Osteoporosis International. 2016. doi: 10.1007/s00198-016-3535-5.
205. Leder B.Z., Tsai J.N., Uihlein A.V., Wallace P.M., Lee H., Neer R.M., Burnett-Bowie SAM (2015) Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): Extension of a randomised controlled trial. Lancet 386(9999): 1147 - 1155.
206. Ebina K., Hashimoto J., Kashii M., Hirao M., Kaneshiro S., Noguchi T., Tsukamoto Y., Yoshikawa H. The effects of switching daily teriparatide to oral bisphosphonates or denosumab in patients with primary osteoporosis. J Bone Miner Metab. 2017 Jan; 35(1): 91 - 98. doi: 10.1007/s00774-015-0731-x.
207. Rittmaster R.S., Bolognese M., Ettinger M.P., Hanley D.A., Hodsman A.B., Kendler D.L., Rosen C.J. Enhancement of bone mass in osteoporotic women with parathyroid hormone followed by alendronate. J Clin Endocrinol Metab. 2000 Jun; 85(6): 2129 - 34. doi: 10.1210/jcem.85.6.6614.
208. Diez-Perez A., Adachi J.D., Agnusdei D., Bilezikian J.P., Compston J.E., Cummings S.R., Eastell R., Eriksen E.F., Gonzales-Macies J., Liberman U.A., Wahl D.A., Seeman E., Kanis J.A., Cooper C.: Treatment failure in osteoporosis. Osteoporosis Int. 2012; (23): 2769 - 2774.
209. Gaal J., Bender T., Varga J. et al. Overcoming resistance to bisphosphonates through the administration of alfacalcidol: results of a 1-year, open follow-up study. Rheumatol Int. 2009; 30(1): 25 - 31. doi: 10.1007/s00296-009-0892-9.
210. Harris S.T., Watts N.B., Genant H.K. et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy With Risedronate Therapy (VERT) Study Group. JAMA. 1999; 282: 1344 - 1352.
211. Reginster J., Minne H., Sorensen O. et al. Randomized Trial of the Effects of Risedronate on Vertebral Fractures in Women with Established Postmenopausal Osteoporosis. Osteoporosis International. 2000; 11(1): 83 - 91. doi: 10.1007/s001980050010.
212. Meunier P., Roux C., Seeman E. et al. The Effects of Strontium Ranelate on the Risk of Vertebral Fracture in Women With Postmenopausal Osteoporosis. N Engl J Med. 2004 Jan 29; 350(5): 459 - 68 DOI: 10.1056/NEJMoa022436.
213. British Orthopaedic Association and British Geriatrics Society. The care of patients with fragility fracture. 2007: 15 - 50.
214. Griffiths R., Alper J., Beckingsale A. et al. Management of proximal femoral fractures 2011. Anaesthesia. 2011; 67(1): 85 - 98. doi: 10.1111/j.1365-2044.2011.06957.x.
215. Загородний Н.В., Голухов Г.Н., Волна А.А. и др. Диагностика и лечение переломов проксимального отдела бедра у лиц пожилого и старческого возраста. Метод. Рекомендации. Москва, РУДН, 2012.
216. Roche J. Effect of comorbidities and postoperative complications on mortality after hip fracture in elderly people: prospective observational cohort study. BMJ. 2005; 331(7529) 1374-0. doi: 10.1136/bmj.38643.663843.55.
217. Kates S., Mendelson D., Friedman S. Co-managed care for fragility hip fractures (Rochester model). Osteoporosis International. 2010; 21(S4): 621 - 625. doi: 10.1007/s00198-010-1417-9.
218. Silverman S.L., Kupperman E.S., Bukata S.V., Members of IOF Fracture Working Group Fracture healing: a consensus report from the International Osteoporosis Foundation Fracture Working Group Osteoporos Int (2016) 27: 2197 - 2206 DOI 10.1007/s00198-016-3513-y.
219. Oliver D., Connelly J., Victor C. et al. Strategies to prevent falls and fractures in hospitals and care homes and effect of cognitive impairment: systematic review and meta-analyses. BMJ. 2007; 334(7584): 82 - 82. doi: 10.1136/bmj.39049.706493.55.
220. Schmidt K., Hubscher M., Vogt L., et al. Influence of spinal orthosis on gait and physical functioning in women with postmenopausal osteoporosis // Der Orthopade. - 2012. - Vol. 41. - No 3. - P 200 - 205.
221. Pfeifer M., Begerow B., Minne H.W. Effects of a new spinal orthosis on posture, trunk strength, and quality of life in women with postmenopausal osteoporosis: a randomized trial. Am J Phys Med Rehabil. 2004; 83: 177 - 186.
222. Yuan Zhe Jin, Jae Hyup Lee Effect of Brace to Osteoporotic Vertebral Fracture: A Meta-Analysis // J Korean Med Sci 2016; 31: 1641 - 1649.
223. Valentin G.H., Pedersen L.N. Maribo T. Wearing an active spinal orthosis improves back extensor strength in women with osteoporotic vertebral fractures // Prosthetics and orthotics international. - 2014. - Vol. 38. - No 3. - P. 232 - 238.
224. Matussek J., Boluki D., Fussel S., Grifka. Orthotic methods for osteoporosis and osteoporotic vertebral fracture. J. Orthopade. 2010 Apr 39(4): 387 - 96. [Article in German] doi: 10.1007/s00132-010-1596-2.
225. Shariatzadeh H., Modaghegh B.S., M.D., Mirzaei A. The Effect of Dynamic Hyperextension Brace on Osteoporosis and Hyperkyphosis Reduction in Postmenopausal Osteoporotic Women. Arch Bone Jt Surg. 2017 May; 5(3): 181 - 185.
226. Snow-Harter C., Bouxsein M.L., Lewis B.T., Carter D.R., Marcus R. Effects of resistance and endurance exercise on bone mineral status of young women: a randomized exercise intervention trial. J Bone Miner Res. 1992; 7: 761 - 769.
227. Vainionpaa A., Korpelainen R., Leppaluoto J., Jamsa T. Effects of high-impact exercise on bone mineral density: a randomized controlled trial in premenopausal women. Osteoporos Int. 2005; 16(2): 191 - 7.
228. Yu H.S., Kim J.J., Kim H.W., Lewis M.P., Wall I. Impact of mechanical stretch on the cell behaviors of bone and surrounding tissues. J Tissue Eng. 2016; 7: 2041731415618342. doi: 10.1177/2041731415618342.
229. Kelley G., Kelley K., Tran Z. Exercise and Lumbar Spine Bone Mineral Density in Postmenopausal Women: A Meta-Analysis of Inpidual Patient Data. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 2002; 57(9): M599 - M604. doi: 10.1093/gerona/57.9.m599.
230. Michael Y., Whitlock E., Lin J., Fu R., O'Connor E., Gold R. Primary Care-Relevant Interventions to Prevent Falling in Older Adults: A Systematic Evidence Review for the U.S. Preventive Services Task Force. Annals of Internal Medicine. 2010; 153(12): 815. doi: 10.7326/0003-4819-153-12-201012210-00008.
231. Howe T.E., Shea B., Dawson L.J., Downie F., Murray A., Ross C., Harbour R.T., Caldwell L.M., Creed G. (2011) Exercise for preventing and treating osteoporosis in postmenopausal women. Cochrane Database Syst Rev. 2011; (7): CD000333. doi: 10.1002/14651858.CD000333.pub2.
232. Sherrington C., Whitney J., Lord S., Herbert R., Cumming R., Close J. Effective Exercise for the Prevention of Falls: A Systematic Review and Meta-Analysis. Journal of the American Geriatrics Society. 2008; 56(12): 2234 - 2243. doi: 10.1111/j.1532-5415.2008.02014.x.
233. Howe T.E., Rochester L., Neil F., Skelton D.A., Ballinger C. (2011) Exercise for improving balance in older people. Cochrane Database Syst Rev. 2011 Nov 9; (11): CD004963. doi: 10.1002/14651858.CD004963.pub3.
234. Li W., Chen Y., Yang R., Tsauo J. Effects of exercise programmes on quality of life in osteoporotic and osteopenic postmenopausal women: a systematic review and meta-analysis. Clinical Rehabilitation. 2009; 23(10): 888 - 896. doi: 10.1177/0269215509339002.
235. Smith E., Carroll A. Bone mineral density in adults disabled through acquired neurological conditions: a review. J Clin Densitom. 2011; 14(2): 85 - 94. doi: 10.1016/j.jocd.2010.12.002
236. Dawson-Hughes B., Mithal A., Bonjour J. et al. IOF position statement: vitamin D recommendations for older adults. Osteoporosis International. 2010; 21(7): 1151 - 1154. doi: 10.1007/s00198-010-1285-3.
237. The DIPART Group. Patient level pooled analysis of 68500 patients from seven major vitamin D fracture prevention in US and Europe. BMJ. 2010; 340: b5463.
238. Tripkovic L., Lambert H., Hart K., Smith C.P., Bucca G., Penson S., Chope G., Hypponen E., Berry J., Vieth R., Lanham-New S. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am J Clin Nutr. 2012 Jun; 95(6): 1357 - 64. doi: 10.3945/ajcn.111.031070. Epub 2012 May 2. PMID: 22552031; PMCID: PMC3349454.
239. Hassan A.B., Hozayen R.F., Alotaibi R.A., Tayem Y.I. Therapeutic and maintenance regimens of vitamin D3 supplementation in healthy adults: A systematic review. Cell Mol Biol (Noisy-le-grand). 2018 Nov 30; 64(14): 8 - 14. PMID: 30511630.
240. Kearns M.D., Alvarez J.A., Tangpricha V. Large, single-dose, oral vitamin D supplementation in adult populations: a systematic review. Endocr Pract. 2014 Apr; 20(4): 341 - 51. doi: 10.4158/EP13265.RA. PMID: 24246341; PMCID: PMC4128480.
241. Tabatabaeizadeh S.A., Avan A., Bahrami A., Khodashenas E., Esmaeili H., Ferns G.A., Abdizadeh M.F., Ghayour-Mobarhan M. High Dose Supplementation of Vitamin D Affects Measures of Systemic Inflammation: Reductions in High Sensitivity C-Reactive Protein Level and Neutrophil to Lymphocyte Ratio (NLR) Distribution. J Cell Biochem. 2017 Dec; 118(12): 4317 - 4322. doi: 10.1002/jcb.26084. Epub 2017 Jun 9. PMID: 28425575.
242. Esfandiari A., Pourghassem Gargari B., Noshad H., Sarbakhsh P., Mobasseri M., Barzegari M., Arzhang P. The effects of vitamin D3 supplementation on some metabolic and inflammatory markers in diabetic nephropathy patients with marginal status of vitamin D: A randomized double blind placebo controlled clinical trial. Diabetes Metab Syndr. 2019 Jan - Feb; 13(1): 278 - 283. doi: 10.1016/j.dsx.2018.09.013. Epub 2018 Sep 12. PMID: 30641712.
243. Dalle Carbonare L., Valenti M.T., Del Forno F., Piacentini G., Pietrobelli A. Vitamin D Daily versus Monthly Administration: Bone Turnover and Adipose Tissue Influences. Nutrients. 2018 Dec 6; 10(12): 1934. doi: 10.3390/nu10121934. PMID: 30563215; PMCID: PMC6315364.
244. Venugopal Y., Hatta SFWM, Musa N., Rahman S.A., Ratnasingam J., Paramasivam S.S., Lim L.L., Ibrahim L., Choong K., Tan A.T., Chinna K., Chan S.P., Vethakkan S.R. Maintenance vitamin D3 dosage requirements in Chinese women with post menopausal osteoporosis living in the tropics. Asia Pac J Clin Nutr. 2017 May; 26(3): 412 - 420. doi: 10.6133/apjcn.042016.10. PMID: 28429905.
245. Пигарова Е.А., Рожинская Л.Я., Белая Ж.Е., Дзеранова Л.К., Каронова Т.Л., Ильин А.В., Мельниченко Г.А., Дедов И.И. Клинические рекомендации Российской Ассоциации Эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых. Проблемы эндокринологии. 2016. Т. 62. N 4. С. 60 - 84
246. Heaney R.P., Davies K.M., Chen T.C., Holick M.F., Barger-Lux M.J.: Human serum 25-hydroxychole-calciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr. 2003; 77(1): 204 - 10.
247. Broe K., Chen T., Weinberg J., Bischoff-Ferrari H., Holick M., Kiel D. A Higher Dose of Vitamin D Reduces the Risk of Falls in Nursing Home Residents: A Randomized, Multiple-Dose Study. Journal of the American Geriatrics Society. 2007; 55(2): 234 - 239. doi: 10.1111/j.1532-5415.2007.01048.x.
248. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: National Academy Press, 2010.
249. Химический состав пищевых продуктов, используемых в Российской Федерации доступен по ссылке: http://web.ion.ru. Ссылка активна на 05.05.2016.
250. Boonen S., Bischoff-Ferrari H., Cooper C. et al. Addressing the Musculoskeletal Components of Fracture Risk with Calcium and Vitamin D: A Review of the Evidence. Calcified Tissue International. 2006; 78(5): 257 - 270. doi: 10.1007/s00223-005-0009-8.
251. Tang B.M., Eslick C.D., Nowson C., et al. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older; a meta-analysis. Lancet. 2007; 370: 657 - 66.
252. Richy F., Dukas L., Schacht E. Differential Effects of D-Hormone Analogs and Native Vitamin D on the Risk of Falls: A Comparative Meta-Analysis. Calcified Tissue International. 2008; 82(2): 102 - 107. doi: 10.1007/s00223-008-9102-0.
253. Del Valle E., Negri A.L., Fradinger E., Canalis M., Bevione P., Curcelegui M., Bravo M., Puddu M., Marini A., Ryba J., Peri P., Rosa Diez G., Sintado L., Gottlieb E. Weekly high-dose ergocalciferol to correct vitamin D deficiency/insufficiency in hemodialysis patients: A pilot trial. Hemodial Int. 2014. doi: 10.1111/hdi.12209.
254. Mager D.R., Jackson S.T., Hoffmann M.R., Jindal K., Senior P.A. "Vitamin D supplementation and bone health in adults with diabetic nephropathy: the protocol for a randomized controlled trial". BMC Endocr Disord. 2014; 14: 66. doi: 10.1186/1472-6823-14-66.
255. Baber R., Panay N., Fenton A. 2016 IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric. 2016; 19(2): 109 - 150. doi: 10.3109/13697137.2015.1129166.
256. Rossouw J.E., Anderson G.L., Prentice R.L., et al. Writing Group for the Women's Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principle results from the Women's Health Initiative randomized controlled trial. JAMA. 2002; 288(3): 321 - 333.
257. Ettinger B., Ensrud K., Wallace R. et al. Effects of Ultralow-Dose Transdermal Estradiol on Bone Mineral Density: A Randomized Clinical Trial. Obstetrics & Gynecology. 2004; 104(3): 443 - 451. doi: 10.1097/01.aog.0000137833.43248.79.
258. T.J. de Villiers, J.E. Hall, J.V. Pinkerton, S. Cerdas Perez, M. Rees, C. Yang, D.D. Pierroz Revised global Consensus Statement on Menopausal Hormone Therapy. J. Climacteric 2016 19: 4; 313 - 315.
259. McLellan A., Reid D., Forbes K., et al. Effectiveness of strategies for the secondary prevention of osteoporotic fractures in Scotland (CEPS 99/03): NHS Quality Improvement Scotland. 2004.
260. Akesson K., Marsh D., Mitchell P.J. et al. Capture the Fracture: a Best Practice Framework and global campaign to break the fragility fracture cycle. Osteoporos Int 2013; 24 (8): 2135 - 2152.
261. Hagino H., Sawaguchi T., Endo N., et al. The risk of a second hip fracture in patients after their first hip fracture. Calcif Tissue Int 2012; 90: 14 - 21.
262. Dell R. Fracture prevention in Kaiser Permanente Southern California. Osteoporos Int. 2011; 22 Suppl 3: 457 - 60.
263. Nakayama A., Major G., Holliday E., Attia J., Bogduk N. Evidence of effectiveness of a fracture liaison service to reduce the re-fracture rate. Osteoporos Int. 2016; 27(3): 873 - 9.
264. Marsh D., Akesson K., Beaton D.E. et al. Coordinator-based systems for secondary prevention in fragility fracture patients. Osteoporos Int. 2011; 22: 2051 - 2065.
265. Ganda K., Mitchell P.J., Seibel M.J. Chapter 3 - Models of Secondary Fracture Prevention: Systematic Review and Metaanalysis of Outcomes. Secondary Fracture Prevention. An International Perspective. 2019. P. 33 - 62.
266. Ganda K., Puech M., Chen J.S., Speerin R., Bleasel J., Center J.R., et al. Models of care for the secondary prevention of osteoporotic fractures: a systematic review and meta-analysis. OsteoporosInt 2013; 24(2): 393 - 406.
267. Huntjens K.M., van Geel T.A., van den Bergh J.P., et al. Fracture liaison service: impact on subsequent nonvertebral fracture incidence and mortality. J Bone Joint Surg Am. 2014; 96(4): e29.
268. Hawley S., Javaid M.K., Prieto-Alhambra D., et al. Clinical effectiveness of orthogeriatric and fracture liaison service models of care for hip fracture patients: population-based longitudinal study. Age Ageing. 2016; 45(2): 236 - 42.
269. Majumdar S.R., Lier D.A., Rowe B.H. et al. Cost-effectiveness of a multifaceted intervention to improve quality of osteoporosis care after wrist fracture. Osteoporos Int. 2011; 22 (6): 1799 - 1808.
270. McLellan A.R., Wolowacz S.E., Zimovetz E.A. et al. Fracture liaison services for the evaluation and management of patients with osteoporotic fracture: a cost-effectiveness evaluation based on data collected over 8 years of service provision. Osteoporos Int. 2011; 22: 2083 - 2098.
271. Reginster J.Y., Seeman E., De Vernejoul M.C. et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab. 2005; 90: 2816 - 2822.
272. Thompson K. Cytosolic Entry of Bisphosphonate Drugs Requires Acidification of Vesicles after Fluid-Phase Endocytosis. Molecular Pharmacology. 2006; 69(5): 1624 - 1632. doi: 10.1124/mol.105.020776.
273. Dunford J., Rogers M., Ebetino F., Phipps R., Coxon F. Inhibition of Protein Prenylation by Bisphosphonates Causes Sustained Activation of Rac, Cdc42, and Rho GTPases. J Bone Miner Res. 2006; 21(5): 684 - 694. doi: 10.1359/jbmr.060118.
274. U.S. Food and Drug Administration. Reclast (zoledronic acid): Drug Safety Communication - New Contraindication and Updated Warning on Kidney Impairment. Posted 09/01/2011. Доступно по http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm270464.htm. Ссылка активна на 12.05.2019.
275. Khosla S., Burr D., Cauley J. et al. Bisphosphonate-Associated Osteonecrosis of the Jaw: Report of a Task Force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2007; 22(10): 1479 - 1491. doi: 10.1359/jbmr.0707onj.
276. Marie P. Signaling Pathways Affecting Skeletal Health. Current Osteoporosis Reports. 2012; 10(3): 190 - 198. doi: 10.1007/s11914-012-0109-0.
277. Tashjian AChabner B. Commentary on Clinical Safety of Recombinant Human Parathyroid Hormone 1-34 in the Treatment of Osteoporosis in Men and Postmenopausal Women. J Bone Miner Res. 2002; 17(7): 1151 - 1161. doi: 10.1359/jbmr.2002.17.7.1151.
278. Vahle J., Sato M., Long G. et al. Skeletal Changes in Rats Given Daily Subcutaneous Injections of Recombinant Human Parathyroid Hormone (1-34) for 2 Years and Relevance to Human Safety. Toxicologic Pathology. 2002; 30(3): 312 - 321. doi: 10.1080/01926230252929882.
279. Miller P., Schwartz E., Chen P., Misurski D., Krege J. Teriparatide in postmenopausal women with osteoporosis and mild or moderate renal impairment. Osteoporosis International. 2006; 18(1): 59 - 68. doi: 10.1007/s00198-006-0189-8.
280. Nielsen S., Slosman D., Sorensen O. et al. Influence of Strontium on Bone Mineral Density and Bone Mineral Content Measurements by Dual X-Ray Absorptiometry. Journal of Clinical Densitometry. 1999; 2(4): 371 - 379. doi: 10.1016/s1094-6950(06) 60402-2.
281. Recker R., Marin F., Ish-Shalom S. et al. Comparative Effects of Teriparatide and Strontium Ranelate on Bone Biopsies and Biochemical Markers of Bone Turnover in Postmenopausal Women With Osteoporosis*. Journal of Bone and Mineral Research. 2009; 24(8): 1358 - 1368. doi: 10.1359/jbmr.090315.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Белая Ж.Е., д.м.н., заведующая отделением нейроэндокринологии и остеопатий ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; член общественной организации "Российская ассоциация эндокринологов", член общественной организации "Российская ассоциация по остеопорозу"
Белова К.Ю. д.м.н., заведующая областным лечебно-диагностическим центром остеопороза и остеоартроза ГАУЗ ЯО "Клиническая больница скорой медицинской помощи им. Н.В. Соловьева"; доцент кафедры терапии имени профессора Е.Н. Дормидонтова Ярославского государственного медицинского университета, член общества пациентов с остеопорозом "Остеорус", член президиума общественной организации "Российская ассоциация по остеопорозу", член общероссийской общественной организации "Ассоциация ревматологов России".
Бирюкова Е.В., д.м.н., профессор кафедры эндокринологии и диабетологии лечебного факультета ФГБОУ ВО "МГМСУ им. А.И. Евдокимова" Минздрава России; член общественной организации "Российская ассоциация эндокринологов"
Дедов И.И., д.м.н., академик РАН, президент ФГБУ "НМИЦ эндокринологии" Минздрава России, президент общественной организации "Российская ассоциация эндокринологов", главный внештатный специалист-эксперт эндокринолог Министерства здравоохранения России
Дзеранова Л.К., д.м.н., главный научный сотрудник отделения нейроэндокринологии и остеопатий ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; член общественной организации "Российская ассоциация эндокринологов"
Драпкина О.М., д.м.н., профессор, член-корреспондент РАН, директор ФГБУ "Национальный медицинский исследовательский центр профилактической медицины" Минздрава России, президент Российского общества профилактики неинфекционных заболеваний, президент Национального общества усовершенствования врачей им. С.П. Боткина, президент Ассоциации врачей общей практики (семейных врачей) России, президент Национальной ассоциации биобанков
Древаль А.В., д.м.н. профессор, доктор медицинских наук, заведующий кафедрой клинической эндокринологии ФУВ МОНИКИ, руководитель отделения терапевтической эндокринологии Московского областного научно-исследовательского клинического института (МОНИКИ) им. М.Ф. Владимирского, главный эндокринолог Московской области
Дубовицкая Т.А., к.м.н., старший научный сотрудник отделения нейроэндокринологии и остеопатий ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; не является членом профессиональной ассоциации
Дудинская Е.Н., к.м.н., заведующая лаборатории возрастных метаболических и эндокринных нарушений обособленного структурного подразделения - Российский геронтологический научно-клинический центр федерального государственного автономного образовательного учреждения высшего образования "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации; член общественной организации "Российская ассоциация эндокринологов", член общественной организации "Российская ассоциация по остеопорозу"
Ершова О.Б., д.м.н., профессор кафедры терапии имени профессора Е.Н. Дормидонтова Ярославского государственного медицинского университета; руководитель общества пациентов с остеопорозом "Остеорус", вице-президент общественной организации "Российская ассоциация по остеопорозу", член общероссийской общественной организации "Ассоциация ревматологов России".
Загородний Н.В., д.м.н, профессор, член-корр. РАН, и.о. директора ФГБУ "НМИЦ ТО им. Н.Н. Приорова" Минздрава России, Москва; член общероссийской общественной организации "Ассоциация травматологов-ортопедов России"
Илюхина О.Б., главный внештатный эндокринолог Оренбургской области, заведующая отделением эндокринологии ГАУЗ Оренбургская областная клиническая больница N 2, Оренбург; член общественной организации "Российская ассоциация эндокринологов"
Kanis J.A., международный консультант, профессор, директор Центра метаболических заболеваний костей Университета Шеффилд, Великобритания, профессор Католического университета Австралии (Мельбурн), почетный президент Международного фонда остеопороза (президент IOF с 2008 по 2017 год), член его научного комитета IOF, председатель рабочей группы IOF по эпидемиологии и качеству жизни.
Крюкова И.В., к.м.н., доцент кафедры эндокринологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва; не является членом профессиональной ассоциации
Лесняк О.М., д.м.н., президент Российской Ассоциации по остеопорозу, профессор кафедры семейной медицины ГБОУ ВПО "Северо-Западный государственный медицинский университет имени И.И. Мечникова" Минздрава России, Санкт-Петербург; президент общественной организации "Российская ассоциация по остеопорозу"; член общероссийской общественной организации "Ассоциация ревматологов России"
Мамедова Е.О., к.м.н., старший научный сотрудник отделения нейроэндокринологии и остеопатий ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; не является членом профессиональной ассоциации
Марченкова Л.А., к.м.н., ведущий научный сотрудник, заведующая отделением реабилитации пациентов с соматическими заболеваниями, заведующая отделом соматической реабилитации, репродуктивного здоровья и активного долголетия ФГБУ "НМИЦ РК" Минздрава РФ, член президиума общественной организации "Российская ассоциация по остеопорозу", член общественной организации "Российская ассоциация эндокринологов"
Мельниченко Г.А., д.м.н., академик РАН, директор Института клинической эндокринологии ФГБУ "НМИЦ эндокринологии" Минздрава России, председатель Московской ассоциации эндокринологов, вице-президент общественной организации "Российская ассоциация эндокринологов"
Никанкина Л.В., к.м.н., и.о. заведующей Клинико-диагностической лабораторией ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; не является членом профессиональной ассоциации
Никитинская О.А., к.м.н., старший научный сотрудник лаборатории остеопороза отдела метаболических заболеваний костей и суставов ФГБНУ НИИ Ревматологии им. В.А. Насоновой, Москва; генеральный секретарь общественной организации "Российская ассоциация по остеопорозу"; член общероссийской общественной организации "Ассоциация ревматологов России"
Петряйкин А.В., к.м.н., доцент, старший научный сотрудник ГБУЗ города Москвы "Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы", член "Российского общества рентгенологов и радиологов"
Пигарова Е.А., к.м.н., ведущий научный сотрудник отделения нейроэндокринологии и остеопатий ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; член общественной организации "Российская ассоциация эндокринологов"
Родионова С.С., д.м.н., профессор, руководитель научно-клинического центра остеопороза ФГБУ "НМИЦ ТО им. Н.Н. Приорова" Минздрава России, Москва; член президиума общественной организации "Российская ассоциация по остеопорозу"
Рожинская Л.Я., д.м.н., профессор, главный научный сотрудник отделения нейроэндокринологии и остеопатий ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; член президиума общественной организации "Российская ассоциация по остеопорозу", член общественной организации "Российская ассоциация эндокринологов"
Скрипникова И.А., д.м.н., руководитель отдела профилактики остеопороза ФГБУ "Национальный медицинский исследовательский центр профилактической медицины" Минздрава России, Москва; член президиума общественной организации "Российская ассоциация по остеопорозу"
Тарбаева Н.В., к.м.н., врач-рентгенолог отдела лучевой диагностики ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; не является членом профессиональной ассоциации
Ткачева О.Н., д.м.н., профессор, директор обособленного структурного подразделения - Российский геронтологический научно-клинический центр федерального государственного автономного образовательного учреждения высшего образования "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации, главный внештатный гериатр Минздрава России; президент общероссийской общественной организации "Российская ассоциация геронтологов и гериатров"
Торопцова Н.В., д.м.н., заведующая лабораторией остеопороза отдела метаболических заболеваний костей и суставов ФГБНУ НИИ Ревматологии им. В.А. Насоновой, Москва; член президиума общественной организации "Российская ассоциация по остеопорозу", член общероссийской общественной организации "Ассоциация ревматологов России"
Фарба Л.Я., врач-травматолог-ортопед ГБУЗ "Городская клиническая больница N 13 Департамента здравоохранения города Москвы", Москва; заместитель председателя член общероссийской общественной организации "Ассоциация травматологов-ортопедов России"
Цориев Т.Т., научный сотрудник отделения нейроэндокринологии и остеопатий ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; не является членом профессиональной ассоциации
Чернова Т.О., к.м.н., ведущий научный сотрудник отдела лучевой диагностики ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва; не является членом профессиональной ассоциации
Юренева С.В., д.м.н., ведущий научный сотрудник отделения гинекологической эндокринологии ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, Москва; член президиума общественной организации "Российская ассоциация по остеопорозу"; член общественной организации "Российская ассоциация по менопаузе"
Якушевская О.В., к.м.н., научный сотрудник отделения гинекологической эндокринологии ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, Москва; член общественной организации "Российская ассоциация по менопаузе"
Конфликт интересов: авторы, эксперты и рецензенты не имели конфликта интересов при разработке данных клинических рекомендаций.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Клинические рекомендации по оказанию медицинской помощи пациентам с остеопорозом составлены в соответствии с требованиями о разработке клинических рекомендаций медицинскими профессиональными некоммерческими организациями, часть 2 статьи 76 Федерального закона от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", приказом Министерства здравоохранения Российской Федерации N 103н от 28.02.2019 "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации". Клинические рекомендации основаны на доказательном клиническом опыте, описывающем действия врача, по диагностике, дифференциальной диагностике, лечению, реабилитации и профилактике остеопороза у женщин в постменопаузе и у мужчин старше 50 лет.
Целевая аудитория данных клинических рекомендаций:
- Врачи-эндокринологи;
- Врачи-ревматологи;
- Врачи-травматологи-ортопеды;
- Врачи-терапевты;
- Врачи общей практики (семейные врачи);
- Врачи-нефрологи;
- Врачи-акушеры-гинекологи;
- Врачи-неврологи;
- Врачи других специальностей, занимающихся диагностикой и ведением пациентов с остеопорозом.
Медицинским работникам следует придерживаться данных рекомендаций в процессе принятия клинических решений. В то же время, рекомендации не заменяют личную ответственность медицинских работников при принятии клинических решений с учетом индивидуальных особенностей пациентов и их пожеланий. Настоящие рекомендации учитывают накопленный российский и международный опыт ведения пациентов с остеопорозом и базируются на клинических рекомендациях, опубликованных Российской Ассоциацией Остеопороза [1] 2010, клинических рекомендациях Американской Ассоциации клинических эндокринологов 2016 [2], Европейских клинических рекомендациях по диагностике и лечению остеопороза у женщин в менопаузе, международного фонда остеопороза IOF 2013 [3] и Клинических рекомендациях национального фонда остеопороза США, 2014 [16].
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами. Экспертов просили прокомментировать, в том числе, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций. Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения регистрировались в рекомендациях.
Проект клинических рекомендаций был представлен на обсуждение широкому кругу специалистов в рамках Bone Health Tele Echo 27 ноября 2018 года и Всероссийского конгресса эндокринологов 25 мая 2019 года.
Таким образом, проект клинических рекомендаций обсуждался среди специалистов профессорско-преподавательского состава, организаторов здравоохранения в области эндокринологии и практических врачей, занимающихся проблемами остеопороза.
Шкалы оценки уровней достоверности доказательств (УДД) для методов диагностики, профилактики, лечения и реабилитации (диагностических, профилактических, лечебных, реабилитационных вмешательств) и шкала оценки уровней убедительности рекомендаций (УРР) для методов профилактики, диагностики, лечения и реабилитации (диагностических, профилактических, лечебных, реабилитационных вмешательств) представлены в Приложении А2-1, А2-2 и А2-3, соответственно.
Приложение А2-1
ШКАЛА ОЦЕНКИ УРОВНЕЙ ДОСТОВЕРНОСТИ ДОКАЗАТЕЛЬСТВ (УДД)
ДЛЯ МЕТОДОВ ДИАГНОСТИКИ (ДИАГНОСТИЧЕСКИХ ВМЕШАТЕЛЬСТВ)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Приложение А2-2
ШКАЛА ОЦЕНКИ УРОВНЕЙ ДОСТОВЕРНОСТИ ДОКАЗАТЕЛЬСТВ (УДД)
ДЛЯ МЕТОДОВ ПРОФИЛАКТИКИ, ЛЕЧЕНИЯ И РЕАБИЛИТАЦИИ
(ПРОФИЛАКТИЧЕСКИХ, ЛЕЧЕБНЫХ, РЕАБИЛИТАЦИОННЫХ ВМЕШАТЕЛЬСТВ)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Приложение А2-3
ШКАЛА ОЦЕНКИ УРОВНЕЙ УБЕДИТЕЛЬНОСТИ РЕКОМЕНДАЦИЙ
(УУР) ДЛЯ МЕТОДОВ ПРОФИЛАКТИКИ, ДИАГНОСТИКИ, ЛЕЧЕНИЯ
И РЕАБИЛИТАЦИИ (ПРОФИЛАКТИЧЕСКИХ, ДИАГНОСТИЧЕСКИХ,
ЛЕЧЕБНЫХ, РЕАБИЛИТАЦИОННЫХ ВМЕШАТЕЛЬСТВ)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ
К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
ДЛЯ ЛЕЧЕНИЯ ОСТЕОПОРОЗА
Препарат
Исследование
Показания
Средний возраст (лет)
Число включенных пациентов в условиях рандомизации
Частота переломов (% через 3 года) <*>
ОР (95% ДИ)
Плацебо
Лекарство
Снижение риска переломов тел позвонков в популяциях высокого риска (с переломами в анамнезе)
Алендроновая кислота**, 70 мг <1>
[138]
Переломы тел позвонков, МПК <= 0,68 г/м2
71
2027
15,0
8,0
0,53 (0,41 - 0,68)
-47%
Ризедроновая кислота, 35 мг <1>
[210]
Переломы тел 2-х позвонков или перелом 1 позвонка с T-критерием <= -2,0
69
2458
16,3
11,3
0,59 (0,43 - 0,82)
-41%
Ризедроновая кислота, 35 мг <1>
[211]
Переломы тел 2-х и более позвонков без указания МПК
71
1226
29,0
18,0
0,51 (0,36 - 0,73)
-49%
Терипаратид**, 20 мкг <4>
[176]
Переломы тел позвонков и T-критерий в L1 - L4 или Neck <= -1, если меньше 2 умеренных переломов
69
1637
14,0
5,0
0,35 (0,22 - 0,55)
-65%
Ибандроновая кислота, 150 мг <1>
[145]
Переломы тел позвонков и L1 - L4 T-критерий от -2,0 до -5
69
2946
9,6
4,7
0,38 (0,25 - 0,59)
-62%
Ибандроновая кислота, 3 мг <1>
[55]
Переломы тел позвонков и T-критерий в L1 - L4 от -2,0 до -5
70
708
9,6
4,9
0,50 (0,34 - 0,74)
-50%
Стронция ранелат**, 2 г
[212]
Переломы тел позвонков, МПК в L1 - L4 <= 0,840 г/м2
69
1649
32,8
20,9
0,59 (0,48 - 0,73)
-41%
Золедроновая кислота**, 5 мг
[149]
T-критерий в ШБ <= -2,5 +/- переломы тел позвонков или T-критерий <= -1,5 и не менее 2 средних или 1 легкий перелом тел позвонков
73
7765
10,9
3,3
0,30 (0,24 - 0,38)
-70%
Снижение риска переломов тел позвонков в популяциях среднего или низкого риска (без переломов в анамнезе)
Алендроновая кислота**, 70 мг <1>
[139]
T-критерий в Neck <= -2 SD
68
4432
3,8
2,1
0,56 (0,39 - 0,80)
-44%
Алендроновая кислота**, 70 мг <1>
[139]
Подгруппа женщин, T-критерий <= -2,5 SD
Данные отсутствуют (недоступны)
1631
4,0
2,0
0,50 (0,31 - 0,82)
-50%
Деносумаб**, 60 мг
[155]
T-критерий в L1 - L4 или бедренной кости от -2,5 SD до -4 SD; 60 - 90 лет
72
7868
7,2
2,3
0,32 (0,26 - 0,41)
-68%
Снижение риска переломов бедренной кости
Алендроновая кислота**, 70 мг <1>
[138]
Переломы позвонков с МПК <= 0,68 г/м2
71
2027
2,2
1,1
0,49 (0,23 - 0,99)
-51%
Алендроновая кислота**, 70 мг <1>, <2>
[139]
T-критерий в ШБ <= -2 <3>
68
4432
0,8
0,7
0,79 (0,43 - 1,44)
недостоверно
Алендроновая кислота, 70 мг <1>, <2>
[139]
T-критерий в ШБ <= -2,5 <3> (анализ в подгруппе)
Данные отсутствуют (недоступны)
1631
1,6
0,7
0,44 (0,18 - 1,97)
недостоверно
Стронция ранелат**, 2 г
[271]
Остеопороз (T-критерий <- 2,5) с или без предшествующих переломов
4932
3,4
2,9
0,85 (0,61 - 1,19)
Недостоверно
Стронция ранелат**, 2 г
[271]
Возраст >= 74 лет с T-критерием <= -2,4 (анализ в подгруппе)
80
1977
6,4
4,3
0,64 (0,412 - 0,997)
-36%
Золедроновая кислота**, 5 мг
[149]
T-критерий в Neck <= -2,5 или менее +/- переломы позвонков или T-критерий <= -1,5 и не менее 2 мягких или 1 умеренный перелом позвонков
73
7765
2,5
1,4
0,59 (0,42 - 0,83)
-41%
Деносумаб**, 60 мг
[155]
T-критерий в L1 - L4 или бедренной кости от -2,5 SD до -4 SD; 60 - 90 лет
72
7868
1,2
0,7
0,60 (0,37 - 0,97)
-40%
Примечания: L1 - L4 - поясничный отдел позвоночника, Neck - шейка бедренной кости
<*> - кроме случаев, оговоренных/указанных в столбце 1
<1> - Историческая справка, в первоначальных регистрационных исследованиях использовались алендроновая кислота в дозе 5 - 10 мг для ежедневного применения, ризендроновая кислота 5 мг для ежедневного применения, ибандроновая кислота 2,5 мг для ежедневного применения и ибандроновая кислота 20 мг внутривенно через день по 12 доз каждые 3 месяца
<2> - 4,2-летнее исследование
<3> - МПК скорректирована по популяции NHANES, для препаратов входит в список ЖНВЛП
<4> - 20-месячное исследование
Бифосфонаты (БФ)
Механизм действия
БФ представляют собой аналоги неорганических пирофосфатов, в которых атом кислорода заменен на атом углерода, что делает молекулу более стабильной. Химическая связь P-C-P не разлагается энзиматически, вследствие чего в организме человека не образуется промежуточных метаболитов, молекула выводится неизмененной почками, поэтому важно учитывать скорость клубочковой фильтрации. При костной резорбции остеокласт захватывает БФ, наиболее вероятно, вместе с кальцием и костным матриксом [272]. Нитроген-содержащий БФ связывается с ферментом фарнезилпирофосфат-синтазой, что блокирует синтез фарнезилдифосфата, необходимого для образования гераннил-геранил-дифосфата. Вследствие этого останавливается модификация сигнальных белков важных для нормальной функции остеокласта. Таким образом, ухудшается работа остеокласта, уменьшается резорбтивная поверхность, что в дальнейшем может приводить к апоптозу [273].
Алендроновая кислота**
Показания к применению: постменопаузальный остеопороз, остеопороз у мужчин, ГКО.
Противопоказания к применению: стриктура пищевода, ахалазия, неспособность больного стоять или сидеть прямо по крайней мере 30 мин после приема препарата, гипокальциемия, повышенная чувствительность к алендроновой кислоте.
Режим назначения: Препарат выпускается в таблетках по 70 мг. Принимается перорально 1 раз в 7 дней перорально. Алендроновая кислота** должна быть принята утром натощак за 30 мин до еды, их необходимо запивать стаканом простой воды. После приема таблетки важно сохранять вертикальное положение тела в течение 30 - 40 минут для предупреждения гастроэзофагеального рефлюкса, нельзя принимать пищу или жидкость, кроме простой воды.
Ибандроновая кислота
Показания к применению: постменопаузальный остеопороз.
Противопоказания к применению. Для всех лекарственных форм: повышенная чувствительность к ибандроновой кислоте или другим компонентам препарата; гипокальциемия. Для раствора для в/в введения: беременность; период кормления грудью, тяжелое нарушение функции почек (креатинин сыворотки крови > 200 мкмоль/л (2,3 мг/дл) или клиренс креатинина < 30 мл/мин). С осторожностью (для таблеток) - тяжелое нарушение функции почек (клиренс креатинина < 30 мл/мин).
Режим назначения: Препарат выпускается в таблетках по 150 мг и растворах для инъекции 3 мг в 3 мл. Таблетированную ибандроновую кислоту следует принимать с частотой 1 раз в месяц, утром натощак, запивая стаканом простой воды. После приема препарата необходимо сохранять вертикальное положение тела и воздержаться от приема пищи и других лекарственных препаратов в течение 60 мин. Ибандроновая кислота в форме 3 мг в 3 мл шприце вводится внутривенно в течение 15 - 30 секунд с частотой 1 раза в 3 месяца.
Ризедроновая кислота
Показания к применению: постменопаузальный остеопороз, остеопороз у мужчин, ГКО.
Противопоказания к применению: стриктура пищевода, ахалазия, неспособность больного стоять или сидеть прямо по крайней мере 30 мин после приема препарата, гипокальциемия, повышенная чувствительность к ризедроновой кислоте.
Режим назначения: Препарат выпускается в таблетках по 35 мг. Принимается перорально 1 раз в 7 дней перорально. Ризедроновая кислота должна быть принята утром натощак за 30 мин до еды, их необходимо запивать стаканом простой воды. После приема таблетки важно сохранять вертикальное положение тела в течение 30 - 40 минут для предупреждения гастроэзофагеального рефлюкса, нельзя принимать пищу или жидкость, кроме простой воды.
Золедроновая кислота**
Показания к применению: постменопаузальный остеопороз, остеопороз у мужчин, ГКО, профилактика постменопаузального остеопороза (у пациенток с остеопенией), профилактика новых переломов у мужчин и женщин с переломами проксимального отдела бедренной кости.
Противопоказания к применению: повышенная чувствительность к золедроновой кислоте, другим БФ и другим компонентам препарата, беременность, период лактации, детский и подростковый возраст до 18 лет, тяжелые нарушения минерального обмена, включая гипокальциемию; тяжелые нарушения функции почек (клиренс креатинина < 30 мл/мин).
Режим назначения: Препарат выпускается во флаконах 5 мг/100 мл. Вводится внутривенно с помощью клапанной инфузионной системы, обеспечивающей постоянную скорость инфузии, в течение не менее 15 мин. Для лечения остеопороза частота введения - 1 раз в год, для профилактики - 1 раз в 2 года.
Безопасность лечения БФ
Нежелательные явления со стороны желудочного тракта (трудности при глотании, эзофагит и гастрит) встречаются при применении пероральных препаратов из группы БФ, внутривенные БФ не оказывают влияния на желудочно-кишечный тракт. Все БФ выводятся в неизмененном виде почками и противопоказаны пациентам с СКФ ниже 30 - 35 мл/мин. Для выявления пациентов группы риска необходимо контролировать уровень креатинина крови до начала лечения [274]. Для внутривенных БФ характерна гриппоподобная реакция (возможно развитие реакции и при приеме таблетированных препаратов, но реже) в ответ на введение препарата. Так, по данным клинического исследования гриппоподобная реакция (повышение температуры тела, артралгии, миалгии, слабость и т.д.) наблюдалась в 32% случаев после первого введения золедроновой кислоты**, в 7% после второй инфузии и в 2% после третьего введения. Данные симптомы, как правило, исчезают спустя 3 дня после введения БФ [274]. Прием нестероидных противовоспалительных средств (ибупрофена, парацетамола) облегчает симптомы гриппоподобной реакции.
На фоне длительного применения БФ для лечения остеопороза были зарегистрированы случаи остеонекроза челюсти. Данное осложнение более распространено при лечении онкологических заболеваний, при введении высоких доз БФ. Риск развития остеонекроза челюсти при лечении остеопороза увеличивается, если продолжительность терапии БФ составляет более пяти лет [275]. К редким осложнениям при длительном лечении БФ (более пяти лет) относятся патологические атипичные переломы бедренной кости. Часто таким переломам предшествует боль в области бедра и паха, которая может быть двусторонней. При подозрении на атипичный перелом бедренной кости необходимо выполнить рентгенографическое исследование обеих бедренных костей, при необходимости МРТ [190]. В некоторых случаях при атипичном переломе бедренной кости требуется хирургическое вмешательство, но чаще придерживаются консервативной тактики. При возникновении таких переломов необходимо прекратить лечение БФ.
Моноклональное антитело к лиганду рецептора ядерного фактора каппа-бета (RANKL) - деносумаб**.
Деносумаб** - человеческое антитело к RANKL [155, 156]. Препарат вмешивается в механизм привлечения активного остеокласта действуя по аналогии с остеопротегерином, который в естественных условиях, блокируя RANKL, препятствует его взаимодействию с рецептором ядерного фактора каппа-бета (RANK) и, таким образом, уменьшает привлечение зрелых остеокластов.
В отличие от БФ - деносумаб** уменьшает образование остеокластов, а не нарушает функцию зрелых клеток. Кроме того, будучи биологическим препаратом деносумаб** не накапливается в костной ткани и не оказывает отсроченного влияния с полным обратным развитием эффекта после отмены лечения [157].
Показания к применению:
- постменопаузальный остеопороз;
- остеопороз у мужчин;
- ГКО;
- предупреждение потери костной массы и переломов при отсутствии костных метастазов у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы и у мужчин с раком предстательной железы, получающим гормон-депривационную терапию [153 - 158].
Безопасность применения деносумаба**
По результатам трехлетнего исследования с участием 7868 человек препарат продемонстрировал хороший профиль безопасности. Статистически значимо чаще у пациентов, получавших деносумаб**, наблюдалась экзема (118 чел. - 3% по сравнению с 65 чел. - 1,7% в группе плацебо), метеоризм (84 чел. - 2,2% по сравнению с 53 чел. 1,4% плацебо), воспаление подкожной жировой клетчатки (в том числе рожистое воспаление) 12 человек (0,3%) по сравнению 1 человеком (< 0,1%) в группе плацебо [155]. Деносумаб** может способствовать развитию гипокальцемии, поэтому важно компенсировать дефицит витамина D до начала лечения и обеспечить достаточное поступление кальция.
Остеонекроз нижней челюсти на фоне терапии деносумабом** развивается крайне редко и встречается при лечении пациентов, страдающих онкологическими заболеваниями с метастатическим поражением скелета (при более высоких дозах препарата). Атипичные переломы бедренной кости редко ассоциированы с применением деносумаба**.
Польза от лечения деносумабом** значимо превосходит риски редких нежелательных эффектов.
Противопоказания и ограничения терапии деносумабом**
Гипокальциемия, повышенная чувствительность к препарату. Беременность или кормление грудью.
Режим назначения деносумаба**
Для лечения остеопороза деносумаб** вводится подкожно в дозе 60 мг каждые 6 месяцев. Препарат выпускается в шприце с предварительно набранной дозой.
Терипаратид**
Терипаратид** (генно-инженерный фрагмента молекулы паратгормона (1-34 ПТГ)) относится к анаболической терапии остеопороза. Под анаболическим эффектом, в данном случае, понимается преимущественное действие на остеобласт, повышение продолжительности жизни костеобразующих клеток, уменьшение их апоптоза, увеличение дифференцировки мезенхимальной стволовой клетки по направлению к остеобласту (через Wnt сигнал), и, таким образом, усиление костеобразования в каждом цикле костного ремоделирования, а также активации моделирования в отдельных участках скелета, что доказано у человека по результатам костных биопсий [276, 277].
Режим назначения
Подкожные инъекции в дозе 20 мкг 1 раз в сутки, ежедневно. Терипаратид** выпускается в стеклянном картридже, который укреплен в одноразовую ручку, рассчитанную для введения 28 доз. Хранить препарат необходимо в холодильнике, однако в течение несколько часов (до 36 часов), возможно, пребывание при комнатной температуре.
Показания к применению:
- постменопаузальный остеопороз;
- остеопороз у мужчин;
- ГКО.
Нежелательные явления
Наиболее частые нежелательные явления (менее 10% испытуемых) были головокружение и судороги в ногах [176, 278]. Умеренная транзиторная гиперкальциемия (менее 2,8 ммоль/л) была зарегистрирована у 2% группы контроля после инъекции, 11% - у пациентов, получавших 20 мкг терипаратида** [176]. Увеличение уровня кальция обычно наблюдалось через 4 - 6 часов после инъекции и полностью нормализовалось через 24 часа. Увеличение кальциурии отличалось недостоверно от группы контроля и не ассоциировалось с увеличением риска мочекаменной болезни. Антитела к терипаратиду** были обнаружены у 3 - 8% женщин, но со временем их содержание уменьшилось, и они не оказали никакого эффекта на МПК или уровень кальция.
Применение терипаратида** у пациентов с умеренным снижением скорости клубочковой фильтрации (30 - 49 мл/мин) приводило к увеличению мочевой кислоты в сыворотке крови, но это не сочеталось с увеличением риска подагры, артралгией или камнеобразования в почках [279].
Противопоказания и ограничения
Гиперкальциемия, первичный гиперпаратиреоз, болезнь Педжета, необъяснимое повышение щелочной фосфатазы, остеогенная саркома, незакрытые зоны роста, облучение скелета в анамнезе, беременность или кормление грудью, злокачественные новообразования костной ткани или метастатическое поражение кости, аллергическая реакция к терипаратиду или компонентам растворителя.
Стронция ранелат**
Стронция ранелат** 2 г в саше для приема ежедневно в ходе клинических исследований демонстрировал умеренную противопереломную эффективность (Приложение А3.1). Снижение риска переломов бедренной кости наблюдалось только в субпопуляции пациентов старше 74 лет с остеопорозом в шейке бедренной кости. "Двойной", или слабый анаболический эффект на костную ткань при применении стронция ранелата** [212] не подтвердился в дальнейших исследованиях [280]. Уплотнение и утяжеление кости за счет содержания стронция в кристаллической решетке гидроксиапатита было предложено в качестве объяснения механизма действия препарата [280, 281].
Приложение А3.2
ВОЗМОЖНОСТИ ЛАБОРАТОРНЫХ МЕТОДОВ ИССЛЕДОВАНИЯ
ДЛЯ ИСКЛЮЧЕНИЯ ВТОРИЧНЫХ ПРИЧИН ОСТЕОПОРОЗА И ДРУГИХ
МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ СКЕЛЕТА
ПЛАЗМА или СЫВОРОТКА
Обязательный набор исследований при впервые установленном остеопорозе
Полный общеклинический анализ крови (анемии, повышение скорости оседания эритроцитов (СОЭ) - симптомы онкологической (в том числе множественной миеломы), ревматической и др. патологии)
Биохимический анализ (общий кальций, ионизированный кальций, креатинин (с подсчетом скорости клубочковой фильтрации (СКФ)), неорганический фосфор, общий магний, щелочная фосфатаза, аланинаминотрансфераза, аспартатаминотрансфераза, глюкоза) - исключение вторичного остеопороза, исключение ограничений для назначения терапии
ПО ПОКАЗАНИЯМ (при наличие клинической картины, по мнению врача)
Тиреотропный гормон (ТТГ) +/- свободный T4 (патология щитовидной железы)
25(OH)-витамин D (диагностика нарушений минерализации скелета)
Паратиреоидный гормон (ПТГ) (диагностика гипер- и гипопаратиреоза)
Общий тестостерон и гонадотропины у молодых мужчин/женщин (исключение гипогонадизма)
Проведение у отдельных групп пациентов (редко)
- Электрофорез белков в сыворотке крови (SPEP), иммунофиксация белков сыворотки крови, определение свободных легких цепей иммуноглобулинов (диагностика злокачественных моноклональных гаммапатий: множественная миелома и др.)
- Антитела к тканевой трансглютаминазе (IgA и IgG) (диагностика глютеновой энтеропатии)
- Железо и ферритин (нарушения всасывания, анемии)
- Гомоцистеин (наследственный синдром гомоцистинурии)
- Пролактин (гиперпролактинемия как причина гипогонадизма у мужчин и женщин)
- Триптаза (для диагностики костного поражения при системном мастоцитозе)
МОЧА
(при условии скорости клубочковой фильтрации выше 60 мл/мин)
Проведение у отдельных групп пациентов (редко)
- Электрофорез белков (UPEP) (диагностика множественной миеломы и др. моноклональных гаммапатий)
Определение кальция, фосфора в суточной или разовой порции мочи (с коррекцией по креатинину) (в ряде случаев при диагностике гиперпаратиреоза, фосфопенических форм остеомаляции)
- Свободный кортизол в суточной моче (эндогенный гиперкортицизм)
- Гистамин в моче (системный мастоцитоз, некоторые гормонально-активные карциноидные опухоли)
Приложение А3.3
МЕТОД ОЦЕНКИ
КОМПРЕССИОННЫХ ДЕФОРМАЦИЙ ТЕЛ ПОЗВОНКОВ [83, 84]
Норма
(0 степень)
Передняя деформация
Средняя деформация
Задняя деформация

Перелом 1 степени
(начальная деформация, снижение высоты тела на 20%)



Перелом 2 степени
(средняя деформация, снижение высоты тела на 20 - 40%)



Перелом 3 степени
(выраженная деформация, снижение высоты тела позвонка более 40%)



Приложение А3.4
СОДЕРЖАНИЕ КАЛЬЦИЯ В МОЛОЧНЫХ ПРОДУКТАХ НА 100 Г [249]
Продукт
Кальций (мг)
Молоко и кисломолочные продукты
Молоко 1,5% - 3,5%
120
Молоко топленое 4%
124
Сливки
90
Кефир 1% - 3,2%
120
Ацидофилин
126
Напиток "Снежок", "Плодово-ягодный"
109
Простокваша 1% - 3,2%
118
Ряженка 1% - 6%
124
Варенец 2,5%
118
Йогурт
124
Творог нежирный, 2%
120
Творог 9%
164
Творог 18%
150
Сыр домашний нежирный
166
Масса творожная "Московская"
135
Масса творожная "Особая"
120
Сырок ванильный глазированный
105
Сметана
90
Мороженое пломбир
156
Сыры
Сусанинский, Костромской, Латвийский, Российский
900
Пошехонский, Углический, Голландский, Чеддер, Советский, Швейцарский
1000
Адыгейский, Камамбер
520
Брынза, сулугуни, колбасный (копченый)
630
Сыры плавленые
300
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
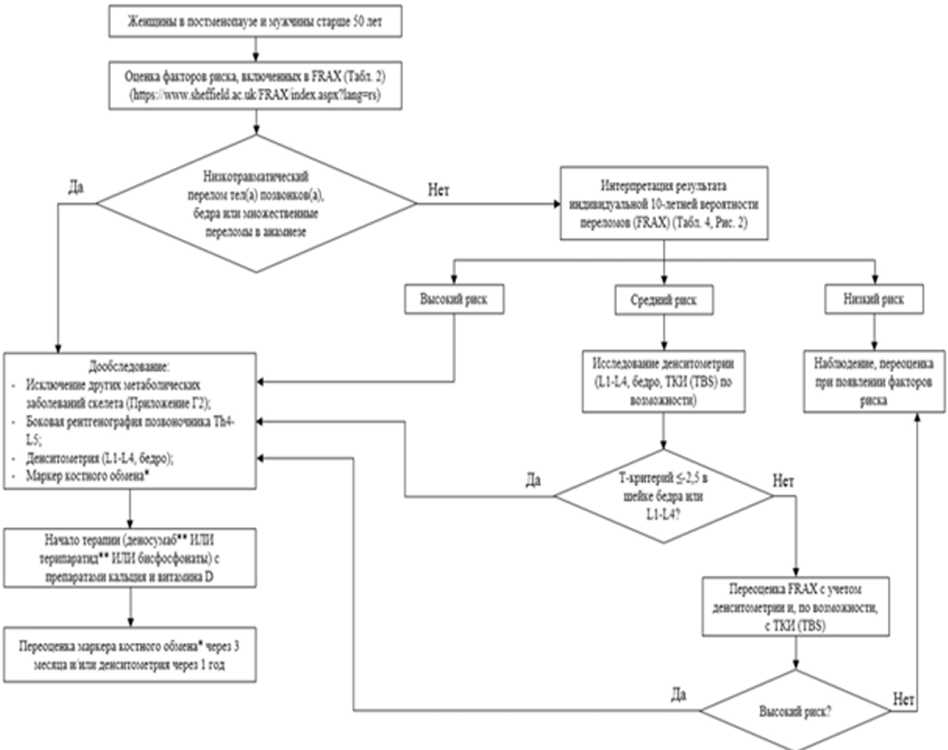
--------------------------------
<*> Исследование маркера костного обмена (костеобразования при назначении анаболической терапии или костной резорбции при назначении антирезорбтивной терапии (Табл. 3)) является дополнительным методом раннего контроля эффективности терапии, который можно использовать вместе с денситометрией или вместо денситометрии, если последняя недоступна.
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое остеопороз?
Остеопороз - это заболевание, при котором кости становятся хрупкими и могут легко ломаться. В норме кость имеет пористое строение, при остеопорозе уменьшается костная масса и нарушается структура кости
Кто болеет Остеопорозом?
Согласно данным международного общества остеопороза, каждая третья, а в странах с высокой продолжительностью жизни каждая вторая женщина старше 50 лет имеет перелом, связанный с остеопорозом. Поэтому 80% среди пациентов с остеопорозом - это женщины в постменопаузе (после прекращения менструаций).
Болеют остеопорозом и мужчины старшей возрастной группы (после 50 лет), а также пациенты любого возраста и пола, страдающие некоторыми эндокринными, ревматическими заболеваниями, тяжелыми поражениями кишечника (болезнь Крона, неспецифический язвенный колит), пациенты после пересадок внутренних органов, люди с ограниченной подвижностью, вследствие любых причин, а также пациенты, длительно принимающие некоторые медикаменты (противосудорожные препараты, глюкокортикоидные гормоны, средства снижающие кислотность желудка и т.д.)
Чем опасен Остеопороз?
У пациентов с остеопорозом переломы происходят при минимальной травме (падение с высоты собственного роста, чихании, кашле, подъеме тяжестей и т.д.) или даже без травматического воздействия.
Самые опасные переломы, связанные с высокой смертностью - это переломы бедренной кости. Если такой перелом случился, необходимо хирургическое лечение.
Кроме того, остеопороз становится причиной патологических переломов рук (лучевой, плечевой костей), костей голени, таза, ключицы, ребер при падении с высоты собственного роста.
Самые частые патологические переломы - это переломы тел позвонков. Перелом тела позвонка может сопровождаться болью в спине. Наличие одного перелома значительно увеличивают вероятность последующих переломов позвонков. Множественные переломы тел позвонков приводят к изменению осанки, снижению роста на 4 - 5 см и более.
Как заподозрить Остеопороз?
Некоторые называют остеопороз "безмолвной эпидемией". Пациента с остеопорозом без переломов обычно ничего не беспокоит. Вместе с тем, существуют факторы риска переломов, которые позволяют сориентироваться пациенту и врачу. Даже пациенту под силу оценить свою индивидуальную 10-летнюю вероятность основных переломов (FRAX).
Как диагностировать Остеопороз?
Для врача важно знать были ли у Вас переломы, развившиеся при минимальной травме в возрасте после 45 лет. Иногда наличие такого перелома достаточно, чтобы диагностировать остеопороз.
Для ранней диагностики остеопороза (когда переломов еще нет) наиболее точный метод - двухэнергетческая рентгеноденситометрия поясничного отдела позвоночника и проксимального отдела бедренной кости. Это безболезненный и безопасный метод для оценки минеральной плотности кости. Плотность костной ткани измеряется в поясничных позвонках, бедренной кости и иногда при необходимости в лучевой кости. Этого достаточно, чтобы сориентироваться о состоянии всего скелета. Уровень лучевой нагрузки при проведении исследования в 10 раз меньше, чем при стандартной рентгенографии легких. До проведения исследования желательно избегать использования контрастных препаратов. Вас попросят снять все металлические предметы с тех зон, где будут проводить исследование (нижняя треть туловища, бедра, предплечье). Ультразвуковые приборы (исследование костной плотности по пяточной кости, фаланге пальца и т.д.) являются методом скрининга, а не постановки диагноза.
Для определения причины остеопороза, выбора оптимального препарата для лечения и динамического наблюдения врачу могут потребоваться анализы крови, мочи, а также боковая рентгенография грудного и поясничного отделов позвоночника, иногда компьютерная томография позвоночника или магниторезонансное исследование.
Существуют ли методы лечения остеопороза?
На сегодняшний день, медикаментозное лечение остеопороза позволяет значительно уменьшить риск переломов и повысить костную плотность. Первые результаты лечения можно увидеть через 1 год, если ориентироваться на прибавку минеральной плотности кости по данным рентгеноденситометрии. Минимальная продолжительность непрерывного лечения остеопороза в большинстве случаев составляет 3 года. Однако у некоторых пациентов непрерывное лечение продолжается до 5 и более лет. Иногда врач может прекратить лечение и затем вновь возобновить терапию. Вместе с тем, выполнение рекомендаций специалиста позволяет предупредить переломы, сохранить осанку и, таким образом, значительно улучшить качество жизни. Новые препараты обладают высокой эффективностью в сочетании с все более редким и удобным приемом. Появление препаратов-копий позволяет сделать лечение остеопороза все более доступным.
Внимание! Препараты отличаются по эффективности, показаниям, противопоказаниям и их применение требует наблюдения врача.
Можно ли предупредить остеопороз?
Заботиться о здоровье костей нужно с детского возраста. Особенно важно вести здоровый образ жизни в период набора пика костной массы (до 25 - 30 лет). Чем больше наш "пик костной массы", тем позже снижение костной массы достигнет того "порога", за которым стоит перелом.
Для профилактики остеопороза рекомендуется:
1. Потреблять достаточное количество кальция и витамина D в течение всей жизни
Источники кальция в пище:
- 100 г нежирных молочных продуктов (молоко, кефир, йогурт, мороженое, творог) содержат 100 - 120 мг кальция;
- 100 г твердого сыра могут содержать до 1000 мг кальция;
- кальций также содержится в шпинате, брокколи, рыбных консервах с костями и продуктах, обогащенных кальцием (апельсиновый сок, каши - если указано, что продукт обогащен кальцием).
Витамин D играет важную роль для усвоения кальция и здоровья костей и мышц. У молодых людей витамин D синтезируется в коже под воздействием ультрафиолетовых лучей. Достаточно гулять 15 - 30 минут с открытым лицом и кистями, чтобы получить адекватный уровень витамина D. Однако, у пожилых людей возможности кожи синтезировать витамин D снижаются.
2. В течение всей жизни заниматься любительским спортом:
Физические упражнения, которые выполняются на ногах (ходьба, бег, теннис, танцы, занятия на тренажерах) благоприятны для лучшего набора пика костной массы и улучшения качества кости у молодых людей. Эти упражнения менее эффективны у женщин в постменопаузе для увеличения костной массы. Вместе с тем, упражнения, направленные на увеличение мышечной массы и улучшение равновесия благоприятны для предупреждения падений.
Истощающие физические нагрузки, напротив, могут приводить к преждевременной потере минеральной плотности кости.
3. Избегать вредных привычек (курение, злоупотребление алкоголем):
Курение негативно влияет на кости. Курящие женщины имеют более низкий уровень эстрогенов, раньше вступают в климакс. Курение влечет худшее усвоение кальция из продуктов питания. Люди, которые выкуривают пачку сигарет ежедневно обычно имеют на 5 - 10% меньше костной массы к 50 годам, по сравнению с некурящими.
Злоупотребление алкоголем (более 2 - 3 установленных единиц алкоголя ежедневно, регулярно - соответствует стандартному бокалу пива (285 мл), одной стандартной порции крепкого спиртного (30 мл), бокалу вина средних размеров (120 мл) или одной порции аперитива (60 мл)) приводит к снижению костной плотности даже у молодых мужчин и женщин. Алкоголизм увеличивает риск переломов из-за потери костной массы, недостатка питательных веществ и увеличению частоты падений.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ОЦЕНКА РИСКА ПЕРЕЛОМА ПО ШКАЛЕ FRAX [3]
Название на русском языке: ФРАКС - Инструмент оценки риска перелома
Оригинальное название (если есть): FRAX (R)
Источник (официальный сайт разработчиков, публикация с валидацией):
https://www.sheffield.ac.uk/FRAX/tool.aspx?lang=rs
Тип: шкала оценки
Назначение: оценка риска перелома
Содержание: Для подсчета 10-летней вероятности перелома с использованием минеральной плотности кости ответьте на следующие вопросы.
Анкета:
1. Возраст (от 40 до 90 лет) или дата рождения
Возраст: ![]() Дата рождения: год:
Дата рождения: год: ![]() месяц:
месяц: ![]() день:
день: ![]()
2. Пол ![]() Мужской
Мужской ![]() женский
женский
3. Вес (кг) ![]()
4. Рост (см) ![]()
5. Предшествующий перелом ![]() нет
нет ![]() да
да
6. Перелом бедра у родителей ![]() нет
нет ![]() да
да
7. Курение в настоящее время ![]() нет
нет ![]() да
да
8. Глюкокортикостероиды ![]() нет
нет ![]() да
да
9. Ревматоидный артрит ![]() нет
нет ![]() да
да
10. Вторичный остеопороз ![]() нет
нет ![]() да
да
11. Алкоголь от 3 единиц и более в день ![]() нет
нет ![]() да
да
12. Минеральная плотность кости (МПК) ![]()
Ключ (интерпретация): Результат оценки риска перелома в оранжевой зоне: рекомендовано проведение двухэнергетической рентгеноденситометрии (DXA) поясничного отдела позвоночника и проксимального отдела бедренной кости. При выявлении остеопороза (T-критерий <= -2,5) показано назначение антиостеопоротической терапии без повторной оценки риска перелома.
