"Национальные клинические рекомендации "Трансплантация сердца и механическая поддержка кровообращения"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ТРАНСПЛАНТАЦИЯ СЕРДЦА
И МЕХАНИЧЕСКАЯ ПОДДЕРЖКА КРОВООБРАЩЕНИЯ
Кодирование по МКБ: I42/O90.3/I25.3/I25.5/I34/I35/I36/I50/R57.0/T86.2/I97.1/Z94.1
Профессиональная ассоциация: Общероссийская общественная организация трансплантологов "Российское трансплантологическое общество"
Год переутверждения (частота пересмотра): 2016 (каждые 3 года)
ID:
URL:
Ключевые слова
Трансплантация сердца, трансплантация органов, механическая поддержка кровообращения, критическая сердечная недостаточность, иммуносупрессивная терапия.
Список сокращений
АВК - аппарат вспомогательного кровообращения
АГ - артериальная гипертония
АД - артериальное давление
БКАПС - болезнь коронарных артерий пересаженного сердца
БРА - блокатор рецепторов к ангиотензину
ВА ЭКМО - вено-артериальная экстракорпоральная мембранная оксигенация
ДЗЛК - давление заклинивания легочной артерии
ИАПФ - ингибитор ангиотензин превращающего фермента
КАГ - коронароангиография
КДО - конечный диастолический объем
КСО - конечный систолический объем
КТ - компьютерная томография
ЛЖ - левый желудочек
МАО - моноаминоксидаза
МРТ - магнитнорезонансная томография
ОРИТ - отделение реанимации и интенсивной терапии
СД - сахарный диабет
СИ - сердечный индекс
СКФ - скорость клубочковой фильтрации
ТПГ - транспульмонарный градиент
ТС - трансплантация сердца
ФВ - фракция выброса
ФВЛЖ - фракция выброса левого желудочка
ФК - функциональный класс
ФНЦТИО - Федеральный научный центр трансплантологии и искусственных органов
ЦНС - центральная нервная система
CYP3A4 - цитохром P3A4
ESC - Европейское общество кардиологов
ISHLT - Международное общество трансплантации сердца и легких
NYHA - Нью-Йоркская ассоциация сердца
Термины и определения
Трансплантация сердца - кардиохирургическая операция, в результате которой патологически измененное сердце реципиента заменяется на удовлетворительно функционирующее сердце донора.
Отторжение трансплантированного сердца - патологический процесс, при котором иммунная система реципиента распознает сердечный трансплантат как чужеродный объект, и активируется система гуморального и/или клеточного воспалительного ответа, что может привести к выраженной дисфункции органа.
Механическая поддержки кровообращения - хирургический метод лечения тяжелой сердечной недостаточности, при котором центральная гемодинамика поддерживается благодаря работе имплантируемого или внешнего электрического насоса.
Реципиент трансплантированного сердца - пациент, у которого была выполнена трансплантация сердца.
Потенциальный реципиент сердца - пациент с показаниями к трансплантации сердца, включенный в лист ожидания.
Сердечная недостаточность - синдром, характеризующийся совокупностью симптомов, обусловленных неспособностью сердечно-сосудистой системы обеспечить ткани и органы пациента адекватным количеством крови. При первичной сердечной недостаточности причиной патологического состояния является нарушение функции миокарда или структурные изменения в сердце.
1. Краткая информация
В настоящее время, несмотря на достижения в области фармакотерапии сердечно-сосудистых заболеваний, операция ортотопической трансплантации сердца (ОТТС) является общепризнанным золотым стандартом лечения терминальной СН, существенно улучшающим прогноз и качество жизни [1, 2, 3]. Ежегодно в мире выполняется более 4000 трансплантаций сердца, подавляющее большинство вмешательств - в странах Европы и Северной Америки [4]. В России на протяжении последних лет отмечается значительный рост числа трансплантации сердца и других органов. По данным Регистра Российского трансплантологического общества, в 2015 году количество количество трансплантаций сердца, выполняемых в 10 трансплантологических центрах России, увеличилось на 35.6% по сравнению с 2012 годом и составило 179 операций. При этом, четыре пятых всех операций (78.2%) были выполнены в в Московском ФНЦ ТИО им. ак. В.И. Шумакова (n = 103), Санкт-Петербургском Северо-Западном федеральном медицинском исследовательском центре (n = 20) и Краснодарской "Краевой клинической больнице им. проф. С.В. Очаповского (n = 17) [6].
Недостаток донорских органов на фоне возросшего количества больных с терминальной и декомпенсированной сердечной недостаточностью явился стимулом к развитию и широкому использованию различных методов вспомогательного кровообращения. В настоящее время у потенциальных реципиентов сердца с острой и быстро прогрессирующей сердечной недостаточностью, рефрактерной к медикаментозной терапии, используются имплантируемые системы длительного левожелудочкого (осевые и центрифужные насосы) и бивентрикулярного обхода (искусственное сердце), а также устройства временной механической поддержки кровообращения, позволяющие обеспечить сохранение жизнеспособности организма и подготовить больного к трансплантации сердца [14].
Имплантируемые устройства механической поддержки кровообращения у больных терминальной сердечной недостаточностью могут использоваться в качестве "моста" при двухэтапной трансплантации сердца, либо в качестве альтернативы трансплантации сердца у больных с противопоказаниями (возраст, сопутствующие заболевания) или у больных с потенциально обратимыми заболеваниями миокарда (например, послеродовая кардиомиопатия) с высокой вероятностью обратного ремоделирования сердца с восстановлением сократительной способности миокарда [18].
Результаты клинического применения устройств левожелудочкового обхода (ЛЖО) в последние годы значительно улучшились с применением насосов постоянного потока (центробежных и осевых). Выживаемость пациентов с ЛЖО постоянного потока составляет в среднем 80% в первый год после имплантации и 70% во второй год. Для систем с использованием пульсирующих насосов аналогичные показатели составляют 60 и 40% соответственно [19]. Несмотря на утрату нашей страной передовых позиций, достигнутых на начальном этапе разработки систем механической поддержки кровообращения в 70 - 80-е годы 20-го века, ФНЦ ТИО им. ак. В.И. Шумакова совместно с МИЭТ, ЗИТЦ, ООО "ДОНА-М" и ООО "БИОСОФТ-М" был разработан и испытан отечественный аппарат вспомогательного кровообращения на базе имплантируемого осевого насоса (АВК-Н). Первый случай имплантации отечественного аппарата вспомогательного кровообращения АВК-Н был описан в 2013 году [20]. К концу 2015 года было имплантировано 17 устройств вспомогательного кровообращения АВК-Н с хорошим клиническим результатом.
Настоящие рекомендации предназначены для врачей трансплантологов и врачей широкого профиля; созданы под эгидой Российского трансплантологического общества, находятся в соответствии и не противоречат основным положениям рекомендаций Международного общества по трансплантации сердца и легких (ISHLT - International Society for Heart and Lung Transplantion), а также рекомендациям Европейского общества кардиологов и Российского кардиологического общества, рекомендациям по количественной оценке структуры и функции камер сердца, рекомендациям по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза, рекомендациям по функциональному состоянию почек и прогнозированию сердечно-сосудистого риска, рекомендациям по кардиоваскулярной профилактике, рекомендациям по прогнозированию и профилактике кардиальных осложнений внесердечных хирургических вмешательств у кардиологических больных, рекомендациям по эффективности и безопасности лекарственной терапии при первичной и вторичной профилактике сердечно-сосудистых заболеваний.
1.1 Определение
В данных рекомендациях представлено описание технологий оказания медицинской помощи, предполагающей проведение обследований с целью выбора тактики ведения больных сердечной недостаточностью в терминальной стадии, определения показаний для трансплантации сердца или имплантации устройств механической поддержки кровообращения, определения периоперационного риска и статуса очередности для включения больных в лист ожидания трансплантации сердца, а также стабилизацию клинического состояния и оценку возможности восстановления/реабилитации больного после проведения операции ортотопической трансплантации сердца.
Категория возрастная: взрослые, дети
Пол: любой
Фаза: компенсация/декомпенсация, острая
Стадия: терминальная (Стражеско-Василенко IIБ - III ст.)
Осложнения: Сердечная недостаточность III - IV классов по функциональной классификации Нью-Йоркской ассоциации сердца (NYHA)
Вид медицинской помощи:
Условия оказания медицинской помощи: стационарно
Форма оказания медицинской помощи: плановая; неотложная; экстренная
1.2 Этиология и патогенез
Основным показанием к трансплантации сердца и имплантации устройств механической поддержки кровообращения является критическая острая или декомпенсированная хроническая сердечная недостаточность, развившаяся у больных кардиомиопатией, ишемической болезнью сердца, тяжелыми декомпенсированными заболеваниями клапанов сердца (при невозможности выполнения иных методов хирургического лечения), миокардитами, врожденными пороками сердца, а также другими заболеваниями сердца, которые существенно ограничивают физическую активность и сопровождаются риском смерти в течение года, превышающим 50%.
1.3 Эпидемиология
В настоящее время, несмотря на достижения в области фармакотерапии сердечно-сосудистых заболеваний, операция ортотопической трансплантации сердца (ОТТС) является общепризнанным золотым стандартом лечения терминальной СН, существенно улучшающим прогноз и качество жизни [1, 2, 3]. Ежегодно в мире выполняется более 4000 трансплантаций сердца, подавляющее большинство вмешательств - в странах Европы и Северной Америки [4]. В России на протяжении последних лет отмечается значительный рост числа трансплантации сердца и других органов, хотя еще в "Национальных рекомендация ВНОК И ОССН по диагностике и лечению ХСН", принятых на конференции ОССН в декабре 2009 года [5] указано, что "трансплантация сердца не имеет серьезного будущего". По данным Регистра Российского трансплантологического общества, в 2015 году количество количество трансплантаций сердца, выполняемых в 10 трансплантологических центрах России, увеличилось на 35.6% по сравнению с 2012 годом и составило 179 операций. При этом, четыре пятых всех операций (78.2%) были выполнены в Московском ФНЦТИО им. ак. В.И. Шумакова (n = 103), Санкт-Петербургском Северо-Западном федеральном медицинском исследовательском центре (n = 20) и Краснодарской "Краевой клинической больнице им. проф. С.В. Очаповского (n = 17). На фоне увеличения общего количества трансплантаций сердца в нашей стране отмечается существенное снижение периоперационной смертности и улучшение выживаемости в отдаленном периоде. Так, согласно опубликованным данным регистра ФНЦТИО им. В.И. Шумакова, где в период с 1986 по 2015 гг. было выполнено 615 трансплантаций сердца, относительная выживаемость больных в раннем послеоперационном периоде (18 суток) в 2013 - 2014 годах улучшилась в 4.4 раза по сравнению с периодом 2010 - 2012 гг. и в 8.6 раз по сравнению с периодом 1986 - 2009 гг. Сравнительный анализ долгосрочного прогноза показал, что 5-летняя выживаемость оперированных больных увеличилась с 0.34 +/- 0.08 и 0.51 +/- 0.08 в 1986 - 1991 гг. и 1992 - 2006 гг., соответственно, до 0.85 +/- 0.12 в 2010 - 2012, что соответствует относительному снижению пятилетней смертности в 3.9 раза [7]. Достигнутое увеличение выживаемости в ранние сроки после операции ОТТС обусловлено, в первую очередь, совершенствованием организации программы донорства и трансплантации сердца, качеством оперативного лечения, применением современных методов механической поддержки кровообращения, а также улучшением анестезиологического пособия и протоколов иммуносупрессии.
1.4 Кодирование по МКБ 10
Данные рекомендации применимы для больных с первичным или вторичным поражением сердца, определяющим прогноз жизни при отсутствии сопутствующих заболеваний, которые могут повлиять на риск развития периоперационных осложнений или значимо ухудшить прогноз выживаемости в послеоперационном периоде.
Коды диагнозов заболеваний по МКБ-10, на фоне которых может развиться критическая сердечная недостаточность, требующая хирургических методов лечения:
I42 Кардиомиопатия;
O90.3 Кардиомиопатия в послеродовом периоде;
I25.3 Аневризма сердца;
I25.5 Ишемическая кардиомиопатия;
I34 Неревматические поражения митрального клапана;
I35 Неревматические поражения аортального клапана;
I36 Неревматические поражения трехстворчатого клапана;
I50 Сердечная недостаточность;
R57.0 Кардиогенный шок;
T86.2 Отмирание и отторжение трансплантата сердца;
I97.1 Другие функциональные нарушения после операций на сердце;
Z94.1 Наличие трансплантированного сердца.
1.5 Классификация
Классификация недостаточности кровообращения
Критическая сердечная недостаточность может быть следствием острой или хронической недостаточности кровообращения.
Для классификации хронической недостаточности кровообращения в Российской Федерации используются функционально-морфологическая классификация Стражеско-Василенко, отражающая степень прогрессирования заболевания сердца, и Нью-Йоркская классификация функционального состояния (NYHA).
Согласно классификации Стражеско-Василенко выделяют три стадии прогрессирования заболевания: I (А и Б), II (А и Б) и III (А и Б). Для I-й стадии характерно появление симптомов сердечной недостаточности только на фоне физической нагрузки и исчезновение в покое. При IIА отмечаются умеренные признаки недостаточности кровообращения в покое лишь в одном из отделов сердечно-сосудистой системы - в малом или большом круге кровообращения, которые купируются на фоне медикаментозной терапии, включающей диуретики, ингибиторы ангиотензинпревращающего фермента или блокаторы ангиотензиновых рецепторов, бета-адреноблокаторы и антагонисты минералкортикоидных рецепторов. Стадия IIБ характеризуется наличием признаков недостаточности кровообращения как в малом, так и большом кругах кровообращения, в той или иной степени сохраняющиеся, несмотря на прием медикаментозной терапии. У больных с III-й стадией имеют место выраженные нарушения гемодинамики и признаки венозного застоя в обоих кругах кровообращения, а также значительные нарушения перфузии и метаболизма органов и тканей.
Функциональная классификация хронической сердечной недостаточности Нью-Йоркской кардиологической ассоциации (NYHA, 1964) основана исключительно на функциональной оценке тяжести и включает четыре функциональных класса: I ф.к. - ограничение в выполнении тяжелой физической нагрузки, обычная физическая нагрузка не сопровождается утомлением, слабостью, одышкой или сердцебиением; II ф.к. - умеренное ограничение физической активности, в покое симптомы отсутствуют, повседневная физическая нагрузка вызывает слабость, утомляемость, тахикардию, одышку и пр.; III ф.к. - выраженное ограничение физической активности, симптомы отсутствуют в покое, но появляются при физической нагрузке небольшой интенсивности; IV ф.к. - невозможность выполнять какую-либо нагрузку без появления дискомфорта, симптомы сердечной недостаточности имеются в покое.
Острая сердечная недостаточность - клинический синдром, характеризующийся быстрым развитием или утяжелением симптомов и признаков недостаточности кровообращения. Острая сердечная недостаточность предполагает необходимость незамедлительного оказания больному медицинской помощи.
В основе острой сердечной недостаточности могут лежать многочисленные сердечно-сосудистые и несердечные заболевания заболевания с вовлечением различных механизмов патогенеза, что следует учитывать при диагностике, стратификации риска и выборе подходов к лечению.
Острая сердечная недостаточность может быть, как впервые выявлена у лиц без диагносцированных сердечно-сосудистых заболеваний, так и развиваться на фоне декомпенсации. В настоящее время под эгидой Европейского общества кардиологов (ESC) создана классификация, в которой выделено 6 типов острой сердечной недостаточности:
- ESC-1. Острая декомпенсация ХСН:
- Впервые выявленная СН или декомпенсированная ХСН;
- Клинические признаки кардиогенного шока, отека легких и гипертонического криза отсутствуют.
- ESC-2. Острая недостаточность кровообращения на фоне гипертонического криза:
- Клинические признаки СН на фоне высокого АД при на фоне сохранной систолической функции левого желудочка сердца.
- ESC-3. Отек легких:
- Клинические признаки отека легких.
- ESC-4. Кардиогенный шок:
- Признаки гипоперфузии органов и тканей, артериальная гипотония, олиго/анурия и изменение уровня сознания.
- ESC-5. СН с высоким СВ:
- Характеризуется высоким сердечным выбросом, обычно сопровождающийся тахикардией, теплыми конечностями, застоем в малом круге кровообращения, как правило носит вторичный характер (развивается на фоне инфекционно-токсического шока, тиреотоксикоза, анемии, передозировке катехоламинов и др.).
- ESC-6. Правожелудочковая СН:
- Характеризуется синдромом низкого выброса на фоне повышенного центрального венозного давления, артериальной гипотонией, увеличением размеров печени.
Для описания степени тяжести острой сердечной недостаточности используют классификацию Киллипа (Таблица 1) или классификацию Форрестера (Таблица 2), первая основана на клинических проявлениях заболевания, вторая - на определении гемодинамических показателей.
Таблица 1. Классификация тяжести острой недостаточности кровообращения по Киллипу (Killip)
Класс
Признаки
I
Нет признаков сердечной недостаточности
II
Влажные хрипы, занимающие < 50% легочных полей, III тон, венозная гипертензия
III
Отек легких (влажные хрипы, занимающие > 50% легочных полей)
IV
Кардиогенный шок
Таблица 2. Классификация тяжести острой недостаточности кровообращения по Форрестеру (Forrester).
Класс
ДЗЛА (мм рт.ст.)
СИ (мм рт.ст.)
Клинические проявления
1
< 18
> 2,2
Норма
2
> 18
> 2,2
Застой в легких
3
< 18
< 2,2
Гиповолемия Недостаточность ПЖ
Дилатация артериол
4
> 18
< 2,2
Недостаточность ЛЖ Кардиогенный шок
Критическая недостаточность кровообращения как правило предполагает наличие хронической недостаточности кровообращения IIБ - III стадии (Стражеско-Василенко) и III - IV ф.к. (NYHA), либо острой сердечной недостаточности 3 - 4 классов (по Киллипу или Форрестеру).
Классификация хирургических методик ортотопической трансплантации сердца
В настоящее время при проведении операции ортотопической трансплантации сердца используются три метода: предсердный (Lower R.R., Stofer R.S., Shumway N.N. 1961 г.), кава-кавальный (Yacoub M. 1990, Dreyfus C. 1991 г.) и комбинированный.
Класс I:
Предсердная методика трансплантации сердца
Выполняют срединную стернотомию и перикардиотомию. Перед началом искусственного кровообращения (ИК) разделяют аорту и основной ствол легочной артерии. После начала ИК накладывают зажим на восходящую аорту.
Начинают иссечение сердца. Отсекают правый желудочек от предсердия от верхнего до нижнего края межпредсердной перегородки на 1 - 2 мм выше предсердно-желудочковой борозды. Правое ушко отсекают для профилактики тромбообразования. Как можно ближе к устьям пересекают аорту и легочную артерию. Левый желудочек отсекают от левого предсердия от верхнего до нижнего края межпредсердной перегородки с иссечением ушка левого предсердия. Пересекают межпредсердную перегородку. Производят осмотр области овальной ямки. При наличии вторичного межпредсердного дефекта или незаращения овального окна их тщательно ушивают.
Перед пришиванием трансплантата накладывают 2 шва держалки на верхний и нижний стыки левого и правого предсердия с межпредсердной перегородкой.
Первый шов накладывают на левые предсердия в области отсеченного ушка сердца реципиента и левого ушка трансплантата. Одним из концов этой нити выполняют обвивной непрерывный шов нижних краев предсердий изнутри их полостей до нижней держалки на межпредсердной перегородке, при этом нить выкалывают наружу и связывают с держалкой. Затем другим концом нити шва, наложенного в области ушек левых предсердий, сшивают верхние края левых предсердий. Эту линию шва выполняют снаружи от полостей предсердий. При достижении верхнего шва на межпредсердной перегородке нити связывают. При наличии рыхлых тканей изнутри в обратном направлении накладывают второй ряд обвивного шва. Концом одной из связанных нитей сшивают стенку левого предсердия трансплантата с межпредсердной перегородкой сердца реципиента.
Перед анастомозированием правых предсердий оценивают соответствие их периметров (длина разреза правого предсердия трансплантата должна соответствовать периметру краев правого предсердия сердца реципиента). Сшивают край правого предсердия трансплантата с межпредсердной перегородкой сердца реципиента.
Перед анастомозированием аорты трансплантата и реципиента также оценивают соответствие их диаметров. При соотношении 1:2 выполняют клиновидное иссечение участка верхней стенки аорты большего диаметра с наложением на края разреза обвивного непрерывного шва или рассечение верхней стенки меньшего диаметра на протяжении 1,5 - 2 см.
После наложения 2 швов-держалок на боковые края срезов аорты сшивают задние стенки аорты донора и реципиента изнутри их просветов. Передние стенки аорты трансплантата и реципиента сшивают снаружи от их просвета. После окончания анастомозирования аорты донора и реципиента выше линии шва для профилактики воздушной эмболии в просвет аорты вводят иглу Дюфо.
Сшивание легочной артерии донора с легочной артерий реципиента выполняют аналогично анастомозированию аорты. Сначала накладывают 2 шва держалки, затем изнутри сшивают задние стенки, после чего снаружи - передние стенки легочных артерий.
После окончания трансплантации переходят на параллельное кровообращение, которое должно продолжаться из расчета каждые 20 минут на каждый час пережатия аорты.
Через несколько минут после восстановления самостоятельных сокращений катетер, введенный через верхушку ушка левого предсердия в левый желудочек, трансплантата удаляют. Ушко у основания перевязывают. Прекращают искусственное кровообращение и удаляют венозные и аортальную канюли. Перикард не зашивают. Выполняют послойное ушивание раны с оставлением дренажей под задней поверхностью сердца и в переднем средостении.
Степень доказанности: C.
Кава-кавальная методика выполнения ортотопической трансплантации сердца
Отличие этой методики заключается в анастомозировании верхней и нижней полой вены, без рассечения правого предсердия.
Использование этой техники позволяет значительно снизить частоту регургитации на трехстворчатом клапане и дисфункции синусового узла пересаженного сердца.
Степень доказанности: C.
Комбинированная методика выполнения ортотопической трансплантации сердца
В отличие от описанных выше методик анастомозируется либо узкий "мостик" между полыми венами реципиента с правым предсердием донора, либо латеральный край разреза нижней полой вены донорского сердца с задней стенкой правого предсердия реципиента латеральнее овальной ямки, а противоположный край разреза нижней полой вены донорского сердца с краем реципиента.
Степень доказанности: C.
Классификация способов механической поддержки кровообращения
Для кратковременной механической поддержки кровообращения в настоящее время используют методы:
1. внутриаортальной баллонной контрпульсации (ВАБК);
2. внутриаортального левожелудочкового обхода с помощью осевого насоса;
3. экстракорпоральной мембранной оксигенации (ЭКМО);
4. экстракорпорального левожелудочкового обхода.
В то время как ВАБК улучшает лишь коронарный кровоток, остальные методы позволяют увеличить системную гемодинамику. К преимуществам первых двух методов относится относительная простота имплантации, к недостаткам - ограниченное время применения до 1 недели. Неоспоримым достоинством экстракорпоральной механической поддержки с использованием ЭКМО является возможность применения у больных с дыхательной недостаточностью.
Вено-артериальная экстракорпоральная мембранная оксигенация (ВА ЭКМО) может использоваться у больных с нарушениями системной гемодинамики, развившимися после кардиохирургических вмешательств, на фоне острого миокардита, в качестве средства сердечно-легочной реанимации, а также у больных терминальной сердечной недостаточностью, ожидающих трансплантацию сердца или у больных с дисфункцией сердечного трансплантата [15]. Кроме того, опубликованы данные о применении ВА ЭКМО с целью гемодинамической поддержки при кондиционировании мультиорганных доноров, включая и наблюдения, где производился забор донорского сердца [16].
Периферическая ВА ЭКМО, преимуществами которой являются меньшая травматичность процедуры имплантации, относительно низкие риски геморрагических и инфекционных осложнений, а также сохранение целостности грудной клетки и возможность ранней активизации пациентов в послеоперационном периоде, может рассматриваться в качестве метода предтрансплантационной механической поддержки кровообращения у потенциальных реципиентов сердца с быстро прогрессирующей, жизнеугрожающей декомпенсацией сердечной деятельности при необходимости неотложного выполнения им пересадки сердца.
Классификация отторжения сердечного трансплантата
Отторжение сердечного трансплантата на сегодняшний день является наиболее значимым фактором, определяющим прогноз больных после трансплантации сердца. Являясь проявлением защитной реакции организма донора против чужеродных клеток, реакция отторжения включает механизмы врожденного, клеточного и антителоопосредованного гуморального иммунного ответа. Выделяют сверхострое отторжение, острое клеточное отторжение, острое гуморальное отторжение и хроническое отторжение, проявляющееся васкулопатией трансплантата, или болезнью коронарных артерий пересаженного сердца (БКАПС).
1. Острое клеточное отторжение
Острое клеточное отторжение чаще всего развивается в течение первых месяцев после трансплантации сердца и обусловлено, в основном, активированными T-лимфоцитами. По данным Patel JK и соавт. [5], в течение первого года после трансплантации сердца острое клеточное отторжение развивается у 20 - 40% реципиентов.
Классификация острого клеточного отторжения:
Степень 1R - мононуклеарная инфильтрация миокарда с наличием или отсутствием единичного очага повреждения кардиомиоцитов;
Степень 2R - мононуклеарная инфильтрация миокарда с множественными очагами повреждения кардиомиоцитов;
Степень 3R - мононуклеарная инфильтрация с диффузным повреждением кардиомиоцитов и/или признаками отека, кровоизлияний или васкулита.
2. Острое гуморальное отторжение
Острое гуморальное (антителозависимое) отторжение трансплантата встречается реже, чем острое клеточное отторжение, примерно у 10% больных, сопровождаясь, как правило, признаками гемодинамической нестабильности (симптомами сердечной недостаточности). Острое гуморальное отторжение сердечного трансплантата в первую очередь обусловлено действием антител реципиента против антигенов сосудистого эндотелия донорского органа. Кроме этого, активированные T-лимфоциты могут стимулировать B-лимфоциты, способствуя их активации, пролиферации и дифференциации в плазмациты, продуцирующие антитела.
Иммуногистохимический диагноз острого гуморального отторжения основывается на выявлении иммуноглобулинов (IgG, IgM или IgA), фрагментов системы комплемента (C3d, C4d, C1q), макрофагов (CD 68 - позитивных клеток), а также новых циркулирующих антител против донорских молекул главного комплекса гистосовместимости HLA.
3. Бессимптомное гуморальное отторжение
Признаки гуморального отторжения могут быть обнаружены при гистологическом исследовании материала плановой эндомикардиальной биопсии при отсутствии каких-либо клинических симптомов. Бессимптомное гуморальное отторжение способствует прогрессированию васкулопатии трансплантата и является фактором риска смерти. При выявлении признаков бессимптомного гуморального отторжения у больных следует оценить эффективность поддерживающей иммуносупрессивной терапии и при необходимости скорректировать дозы лекарственных препаратов.
4. Смешанное отторжение
Термин "смешанное отторжение" используется в случаях, когда при гистологическом исследовании эндомиокардиального биоптата одновременно выявляются признаки клеточного и гуморального отторжения. При наличии признаков гемодинамических нарушений используется агрессивная тактика лечения, включающая внутривенное введение кортикостероидов и цитолитических средств. При легких формах смешанного отторжения без гемодинамических нарушений лечение такое же, как и при остром клеточном отторжении.
5. Позднее острое отторжение сердечного трансплантата
Частота и периодичность плановых биопсий миокарда трансплантата сердца в разных центрах трансплантации могут отличаться. В связи с этим, частота выявления позднего острого отторжения может быть различной. В то же время, как показали результаты проведенных исследований, более частое проведение плановых биопсий миокарда и связанное с этим более частое выявление бессимптомного острого отторжения аллотрансплантата не сопровождаются увеличением выживаемости больных в течение первых 5 лет после трансплантации сердца. В некоторых исследованиях было показано, что бессимптомное позднее острое отторжение может купироваться самостоятельно без дополнительного лечения.
Факторы риска позднего острого отторжения включают молодой возраст, наличие в анамнезе эпизодов острого отторжения, сенсибилизацию к HLA-антигенам, женский пол, эпизоды отторжения, развившиеся спустя более месяцев после трансплантации сердца. Недостаточные доза иммуносупрессантов и несоблюдение больными режима назначения лекарственных средств также способствуют развитию позднего острого отторжения.
Классификация васкулопатии сердечного трансплантата Международного общества трансплантации сердца и легких (ISHLT):
- ISHLT CAV0 (васкулопатия сердечного трансплантата не значимая): ангиографических изменений не выявлено;
- ISHLT CAV1 (легкая): стеноз ствола ЛКА < 50%, основных ветвей < 70%, или любой ветви < 70% (включая диффузное сужение) без дисфункции трансплантата;
- ISHLT CAV2 (умеренная): стеноз ствола ЛКА > 50%, основных ветвей > 70%, или любой ветви второго порядка > 70% без дисфункции трансплантата;
- ISHLT CAV3 (выраженная): стеноз ствола ЛКА > 50%, двух и более основных ветвей > 70%, или любой ветви второго порядка > 70% во всех трех основных бассейнах; или ISHLT CAV1, или ISHLT CAV2 в сочетании с дисфункцией трансплантата (определяемая как ФИЛЖ < 45%, обычно в сочетании с нарушением локальной сократимости ЛЖ), или признаки значимой рестриктивной диастолической дисфункции.
2. Диагностика
Обследование больных критической сердечной недостаточностью в качестве потенциальных реципиентов трансплантированного сердца или устройства механической поддержки кровообращения.
2.1 Жалобы и анамнез
Класс I (абсолютные показания):
1. Окончательное решение о выборе метода лечения терминальной сердечной недостаточности (медикаментозная терапия, включение в лист ожидания трансплантации сердца, имплантация устройств механической поддержки кровообращения, иные методы лечения) принимается консилиумом врачей-специалистов клинического центра, в котором планируется выполнение хирургического лечение;
Степень доказанности: C.
2. Больные - кандидаты для имплантации устройств механической поддержки кровообращения должны быть обследованы для выявления возможных обратимых причин декомпенсации сердечной недостаточности, а также должны быть обследованы по программе потенциального реципиента сердца (Приложение 1);
Степень доказательности C.
2.2 Физикальное обследование
Класс I (абсолютные показания):
1. Консультации врачей-специалистов в стационаре: кардиолога, анестезиолога-реаниматолога, сердечно-сосудистого хирурга, радиолога, стоматолога.
Степень доказанности: C.
Класс IIa (относительные показания):
1 Консультации врачей-специалистов: эндокринолога, нефролога, инфекциониста, уролога.
Степень доказанности: C.
2.3 Лабораторная диагностика
Класс I (абсолютные показания):
1. Лабораторные клинические обследования: общий анализ крови, общий анализ мочи, биохимический анализ крови (Креатинин, Мочевина, Билирубин, АЛТ, АСТ, Холестерин, ЛПВП, ЛПНП, Триглицериды, Щелочная фосфатаза, ГГТ, C-реактивный белок, альбумин, глюкоза, общий белок), электролиты крови (Калий, Натрий, Магний), коагулограмма (агрегация тромбоцитов, АЧТВ, ПТИ, Фибриноген, Фибринолитическая активность плазмы), гормоны щитовидной железы (ТТГ, T4 своб., T3), антитела к Гепатитам B, C, реакция Вассермана, антитела к ВИЧ, вирусологическое исследование (ПЦР ДНК цитомегаловируса, вируса Эпштейн-Барр, вируса простого герпеса), группа крови и резус фактор.
Степень доказанности: C.
2.4 Инструментальная диагностика
Класс I (абсолютные показания):
1. ЭКГ в 12-ти отведениях;
Степень доказанности: C.
2. Эхокардиографическое исследование;
Степень доказанности: C.
3. Комплексное исследование функции внешнего дыхания (исследование кривой "поток-объем", определение объема закрытия, остаточного объема легких, легочной диффузии, внутригрудного объема и фракций общей емкости легких, сопротивления дыхательных путей);
Степень доказанности: C.
4. МРТ головного мозга;
Степень доказанности: C.
5. Рентгеновская спиральная компьютерная томография органов грудной клетки с внутривенным контрастированием;
Степень доказанности: C.
6. Рентгеновская спиральная компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным контрастирование;
Степень доказанности: C.
7. Рентгенография грудной клетки непосредственно перед переводом больного в операционную;
Степень доказанности: C.
8. Эзофагогастродуоденоскопия;
Степень доказанности: C.
9. Пробы с физической нагрузкой: максимальное потребление кислорода VO2max, тест 6-ти минутной ходьбы;
Степень доказанности: C.
10. Эндомиокардиальная биопсия у реципиентов трансплантированного сердца выполняется в рамках обязательного планового обследования и у больных с клиническими признаками дисфункции сердечного трансплантата;
Степень доказанности: C.
11. Коронароангиографическое исследование у больных с клиническими признаками ишемической кардиопатии с целью выявления возможностей реваскуляризации миокарда как способа лечения сердечной недостаточности, а также у реципиентов трансплантированного сердца в рамках обязательного планового обследования и у больных с клиническими признаками дисфункции сердечного трансплантата;
Степень доказанности: C.
12. Катетеризация правых отделов сердца и исследование показателей центральной гемодинамики с определением показателей сердечного выброса, сердечного индекса, давления в полостях сердца, давления в легочной артерии, центрального венозного давления, сопротивления легочных сосудов, транспульмонарного градиента давления);
Степень доказанности: C.
Класс IIa (относительные показания)
1 Медикаментозные пробы при ЭКГ (дополнительно к основной ЭКГ);
Степень доказанности: C.
2 Ортостатическая проба при ЭКГ (дополнительно к основной ЭКГ);
Степень доказанности: C.
3 Пульсоксиметрия;
Степень доказанности: C.
4 Ультразвуковое исследование брюшной полости и почек;
Степень доказанности: C.
5 Перфузионная сцинтиграфия миокарда с Tc-99м-тетрофосмином синхронизированная с ЭКГ;
Степень доказанности: C.
6 Регистрация ЭКГ в одном отведении для оценки ритма (дополнительно к основной ЭКГ);
Степень доказанности: C.
7 Холтеровское мониторирование при длительности мониторирования до 24 часов;
8 Исследование поздних потенциалов сердца;
Степень доказанности: C.
9 УЗ-допплерография в импульсном режиме парных сосудов (артерий или вен);
Степень доказанности: C.
10 УЗ-допплерография в дуплексном режиме парных сосудов (артерий или вен);
Степень доказанности: C.
11 УЗИ брюшной аорты или нижней полой вены;
Степень доказанности: C.
12 Транскраниальная УЗ-допплерография;
Степень доказанности: C.
13 УЗ-допплерография магистральных сосудов внутренних органов;
Степень доказанности: C.
14 Рентгеновская спиральная компьютерная томография головного мозга;
Степень доказанности: C.
Катетеризация правых отделов сердца у потенциальных реципиентов сердечного трансплантата.
Катетеризация правых отделов сердца выполняется с целью верификации снижения насосной функции миокарда, проведения дифференциального диагноза и определения показателей гемодинамики и сосудистого сопротивления в малом круге кровообращения. Исследование проводится всем больным перед включением в лист ожидания трансплантации сердца.
Рекомендации для диагностической катетеризации правых отделов сердца
Всем потенциальным реципиентам сердечного трансплантата следует выполнять зондирование правых отделов сердца. Периодичность выполнения зондирования определяется индивидуально с учетом клинических показателей. У больных с механической поддержкой кровообращения и легочной гипертензией зондирование правых отделов сердца выполняется каждые 3 - 6 месяцев. Высокое значение показателя легочного сосудистого сопротивления, рефрактерного к медикаментозной терапии, является противопоказанием для трансплантации сердца. У таких больных используются устройства механической поддержки кровообращения. Исследования [8, 9] показали, что имплантация устройств механической поддержки кровообращения может сопровождаться снижением показателя сосудистого легочного сопротивления через 3 - 6 месяцев, однако в некоторых случаях эффективное снижение значений этого показателя может наблюдаться уже в течение первого месяца.
Класс I:
1. Катетеризация правых отделов сердца должна быть проведена всем кандидатам при включении в лист ожидания трансплантации сердца;
Степень доказанности: C.
2. Катетеризация правых отделов сердца должна проводиться с интервалом от 3 до 6 месяцев для больных, поставленных в лист ожидания, с обратимой легочной гипертензией или прогрессирующей сердечной недостаточностью;
Степень доказанности: C.
3. При выявлении показателей систолического давления в легочной артерии > 50 мм рт.ст., транспульмонарного градиента (ТПГ) > 15 мм рт.ст., показателя легочного сосудистого сопротивления (ЛСС) > 5 единиц Вуда, необходимо повторить измерения на фоне действия легочных вазодилятаторов (оксид азота, силденафил и др.);
Степень доказанности: C.
4. Катетеризация правых отделов сердца выполняется у больных с необходимостью мониторирования эффективности и безопасности медикаментозной терапии вазодилятаторами, диуретиками и средствами с инотропным действием.
Степень доказанности: C.
Диагностические критерии периоперационной дисфункции сердечного трансплантата
Класс I:
1. Критерии удовлетворительной сократительной функции сердечного трансплантата: ДПП 8 - 12 мм рт.ст., ДЗЛА 12 - 15 мм рт.ст., СИ >= 2,5 л/мин/м2 на фоне применения допамина и/или добутамина в дозировке 5 мкг/кг/мин ФИПЖ >= 30%, индексированный конечно-диастолический объем (ИКДОПЖ) <= 130 мл/м2 (термодилюционная волюметрия); фракция изгнания левого желудочка (ФИЛЖ) >= 55%; отсутствие гипокинезии свободной стенки правого желудочка (ПЖ), амплитуда движения фиброзного кольца трикуспидального клапана в направлении верхушки ПЖ >= 2,0 см (по данным транспищеводного или трансторакального ЭХОКГ исследования);
Степень доказанности: C.
2. Критерии нарушения сократительной функции сердечного трансплантата: ДПП > 12 мм рт.ст. и/или ДЗЛА > 15 мм рт.ст., необходимость применения допамина и/или добутамина в дозировке более 5 мкг/кг/мин и/или адреналина (независимо от величины дозировки) с целью поддержания СИ > 2,5 л/мин/м2. Умеренно выраженные нарушения насосной функции (дисфункции) сердечного трансплантата: потребность в допамине и/или добутамине в дозировках от 5 до 10 мкг/кг/мин без или в комбинации с адреналином (< 75 нг/кг/мин); Значимое нарушение - необходимость применения допамина и/или добутамина в дозировках 10 - 20 мкг/кг/мин и адреналина в дозировках 75 - 200 нг/кг/мин; Выраженное нарушение - дозировка вводимого допамина и/или добутамина > 20 мкг/кг/мин и адреналина > 200 нг/кг/мин и необходимость применения различных методов вспомогательного кровообращения;
Степень доказанности: C.
3. Критерии бивентрикулярного нарушения сократительной функции сердечного трансплантата: ДПП > 12 мм рт.ст., ДЗЛА > 15 мм рт.ст., необходимость применения допамина и/или добутамина в дозировке более 5 мкг/кг/мин и/или адреналина (независимо от величины дозировки) с целью поддержания СИ > 2,5 л/мин/м2, ДПП/ДЗЛА 0,8 - 1,0; ФИЛЖ < 55% (транспищеводное или трансторакальное ЭХОКГ исследование); ФИПЖ < 30%, ИКДОПЖ > 130 мл/м2 (термодилюционная волюметрия); гипокинезия свободной стенки ПЖ, уменьшение амплитуды движения фиброзного кольца трикуспидального клапана (менее 2,0 см) в направлении верхушки ПЖ (транспищеводное или трансторакальное ЭХОКГ исследование);
Степень доказанности: C.
4. Критерии нарушения сократительной функции сердечного трансплантата по правожелудочковому типу: ДПП > 12 мм рт.ст., ДЗЛА < 15 мм рт.ст., ДПП/ДЗЛА > 1,0, необходимость применения допамина и/или добутамина в дозировке более 5 мкг/кг/мин и/или адреналина (независимо от величины дозировки) с целью поддержания СИ > 2,5 л/мин/м2; ФИЛЖ >= 55% (транспищеводное или трансторакальное ЭХОКГ исследование); ФИПЖ < 30%, ИКДОПЖ > 130 мл/м2; гипокинезия свободной стенки ПЖ, уменьшение амплитуды движения фиброзного кольца трикуспидального клапана (менее 2,0 см) в направлении верхушки ПЖ (транспищеводное или трансторакальное ЭХОКГ исследование);
Степень доказанности: C.
5. Критерии сократительной функции сердечного трансплантата по левожелудочковому типу: ДПП < 12 мм рт.ст., ДЗЛА > 15 мм рт.ст., ДПП/ДЗЛА < 0,8, необходимость применения допамина и/или добутамина в дозировке более 5 мкг/кг/мин и/или адреналина (независимо от величины дозировки) с целью поддержания СИ > 2,5 л/мин/м2; ФИЛЖ < 55% (транспищеводное или трансторакальное ЭХОКГ исследование); ФИПЖ > 30%, ИКДОПЖ < 130 мл/м2; отсутствие гипокинезии свободной стенки ПЖ, амплитуда движения фиброзного кольца трикуспидального клапана в направлении верхушки ПЖ >= 2,0 см (транспищеводное или трансторакальное ЭХОКГ исследование);
Степень доказанности: C.
6. При диагностике гемодинамических вариантов дисфункции сердечного трансплантата необходимо исключать возможные механические причины, приводящие к нарушению функционирования правого и/или левого желудочков сердца и вызывающие стенозирование (сужение) в области анастомозов верхней и нижней полых вен (при бикавальной методике выполнения ТС), легочной артерии, левого предсердия или аорты. В связи с этим при проведении дифференциальной диагностики патогенеза нарушений функционирования сердечного трансплантата необходимо полноценное интраоперационное чреспищеводное эхокардиографическое исследование для выявления возможных анатомических дефектов;
Степень доказанности: C.
Рекомендации по послеоперационному мониторингу реципиентов пересаженного сердца
Класс I:
1. Периоперационный мониторинг реципиентов сердца должен включать в себя непрерывный мониторинг ЭКГ, послеоперационные ЭКГ в 12 отведениях, инвазивный мониторинг антериального давления, давления в правом предсердии или центрального венозного давления; давления заклинивания легочной артерии, периодическое измерение сердечного выброса, измерение сатурации O2; интраоперационная чреспищеводная эхокардиография, постоянная оценка диуреза.
Степень доказанности: C.
Регулярные клинические обследования и консультации больных после трансплантации сердца
Класс I:
1. Пожизненное наблюдение центром трансплантации всех больных после трансплантации сердца необходимо в связи; 1) с наличием риска острого или хронического отторжения трансплантанта; 2) необходимостью в подборе дозировок, мониторировании эффективности и безопасности иммуносупрессивной терапии; 3) высоким риском развития инфекционных осложнений и новообразований 4) развитием сопутствующих заболеваний и осложнений, требующих вмешательства или коррекции терапии;
Степень доказанности: C.
2. При длительном наблюдении больных после трансплантации сердца требуется мультидисциплинарный подход с участием врачей-хирургов, кардиологов, физиологов, диетологов, психотерапевтов и др. Сами больные и лечащие врачи должны сознавать, что после трансплантации сердца требуется пожизненное наблюдение специалистов;
Степень доказанности: C.
3. Частота повторных визитов зависит от особенностей послеоперационного периода и количества времени, прошедшего после вмешательства;
Степень доказанности: C.
4. При неосложненном течении послеоперационного периода повторные посещения врача следует выполнять через каждые 10 дней (раз в неделю) в течение первого месяца, каждые 2 недели в течение 2-го месяца, ежемесячно в течение 1-го года и каждые 3 - 6 месяцев в последующее время после трансплантации;
Степень доказанности: C.
5. Повторные консультации и обследования могут проводиться чаще в случае развития осложнений или при наличии особенностей клинического или психосоциального статуса больного;
Степень доказанности: C.
6. Наблюдение больных в отдаленном периоде после трансплантации сердца осуществляется специалистами центра трансплантации в сотрудничестве с местными органами здравоохранения и социальной поддержки;
Степень доказанности: C.
7. Местные органы здравоохранения должны проинформировать центр трансплантации в случаях:
- любой госпитализации больного в лечебное учреждение;
- изменений медикаментозной терапии, включая назначение любых антибактериальных, противогрибковых или противовирусных лекарственных средств;
- развития артериальной гипотонии или снижения уровней систолического АД более чем на 20 мм рт.ст. по сравнению с прежними уровнями
- увеличения ЧСС более чем на 10 мин-1;
- подъема температуры до 38 °C в течение 2 суток;
- снижения веса более чем на 0.9 - 1.0 кг в неделю или на 2 - 2.5 кг в течение неопределенного периода времени;
- выполнения любых хирургических вмешательств;
- появления жалоб на одышку;
- пневмонии или любых инфекционных заболеваний органов дыхания;
- появления болей в грудной клетке;
- снижения показателя объема форсированного выдоха за 1 сек более чем на 10%
- боли в животе;
- появления тошноты, рвоты или диареи;
- клинических признаков нарушения мозгового кровообращения, обморока или изменений когнитивного (ментального) статуса.
Степень доказанности: C.
Класс IIa:
1. Помимо плановых амбулаторных визитов реципиенты донорского сердца должны быть в плановом порядке госпитализированы для проведения детального клинического обследования каждые 1 - 2 года (Таблица 3);
Степень доказанности: B.
2. Основными задачами регулярной плановой госпитализации больных после трансплантации сердца являются выявление признаков отторжения трансплантата и возможных нежелательных событий. План обследования должен включать:
- полное физикальное обследование;
- анализ изменений в клинических назначениях и выявление возможной связи изменений в назначениях с изменением клинического статуса больного;
- общий и биохимический анализы крови;
- эхокардиографическое исследование;
- коронароангиографическое исследование с внутрикоронарным ультразвуковым исследованием (каждые 1 - 2 года);
- проведение эндомиокардиальной биопсии согласно графику, представленному в таблице;
- проведение обучения в рамках образовательных программ для больных, их родственников и медицинских работников разных специальностей, работающих с пациентом;
Степень доказанности: B.
3. Помимо плановых обследований, больным настоятельно рекомендуется обращаться в центр трансплантации по всем вопросам, связанным с состоянием здоровья;
Степень доказанности: C.
Таблица 3. Примерный план проведения эндомиокардиальной биопсии у пациентов после трансплантации сердца
Исследование
Периодичность
Биопсии NN 1, 2, 3, 4, 5
Еженедельно
Биопсии NN 6, 7, 8
Каждые 14 дней
Биопсии NN 9, 10
Каждые 3 недели
Биопсии NN 11, 12, 13
Каждые 4 недели
Последующие биопсии в течение 1-го года
Каждые 5 - 6 недель
Биопсии спустя более года после трансплантации
Ежегодно, либо по показаниям <*>
--------------------------------
<*> Использование неинвазивных методов оценки позволяет сократить количество биопсий, в ряде случае больше ориентироваться на показания при их проведении.
Клинические признаки отторжения сердечного трансплантата
У большинства больных отторжение трансплантата на ранних стадиях не имеет клинических проявлений. Это обуславливает необходимость проведения регулярных плановых биопсий миокарда с целью раннего выявления признаков отторжения и своевременного начала лечения.
Воспаление и гибель клеток, сопровождающие острое отторжение трансплантата, вначале приводят к интерстициальному отеку и снижению эластичности миокарда, что в свою очередь проявляется нарушением диастолической функции. В дальнейшем, при отсутствии адекватного лечения и прогрессировании патологического процесса развивается нарушение систолической функции и развитие сердечной недостаточности со снижением фракции выброса.
Вначале острое отторжение может проявляться неспецифическими симптомами - общим недомоганием, утомляемостью, слабостью, тошнотой, рвотой, повышением температуры. В дальнейшем появляются признаки, патогномоничные для сердечной недостаточности. Правожелудочковая недостаточность может развиваться как вторично, на фоне левожелудочковой недостаточности, так и являться следствием острого клеточного или гуморального отторжения.
Синкопальные состояния у больных с острым отторжением трансплантата могут быть следствием артериальной гипотонии, развивающейся на фоне нарушений ритма сердца (фибрилляция желудочков) или на фоне острой ишемии миокарда. У ряда больных первым клиническим проявлением отторжения может быть внезапная смерть.
Острое отторжение трансплантата может также проявляться развитием брадиаритмий и атриовентрикулярной блокады. При развитии перикардита может выслушиваться шум трения перикарда, в полости перикарда может выявляться жидкость.
На фоне прогрессирования отторжения появляются клинические признаки низкого сердечного выброса или истинного кардиогенного шока.
Диагностика васкулопатии сердечного трансплантата
Васкулопатия трансплантата сердца является одним из основных факторов, оказывающих влияние на отдаленный прогноз. На фоне улучшения эффективности цитостатической медикаментозной терапии и снижения частоты отторжения сердечного трансплантата, отмечающихся в последние годы, вероятность развития васкулопатии трансплантата остается неизменной. Вследствие того, что сердечный трансплантат является денервированным органом, ишемия миокарда не сопровождается болезненными ощущениями, и больные самостоятельно обращаются за помощью лишь в тех случаях, когда ишемия миокарда приводит к сердечной недостаточности, и это бывает, как правило, уже при значительных изменениях в коронарных артериях пересаженного сердца. В связи с этим, раннее выявление изменений в сосудах трансплантата имеет важное значение. Неинвазивные методы диагностики обладают низкими чувствительностью и специфичностью и в связи с этим, имеют ограниченное применение. Тем не менее при наличии отрицательной динамики показателей диастолической функции ЛЖ, как одного из чувствительных критериев наличия ишемии миокарда, они могут использоваться для назначения внеплановой коронароангиографии.
Основным методом скринингового обследования для выявления изменений в коронарных артериях пересаженного сердца является ангиографическое исследование. Первое коронароангиографическое исследование, как правило, проводят в течение короткого времени после операции трансплантации сердца с целью выявления возможных патологических изменений в донорском сердце, что особенно важно, если возраст донора > 35 лет. В дальнейшем, повторные коронароангиографические исследования проводятся с частотой 1 - 2 раза в год.
В связи с тем, что изменения в коронарных артериях при васкулопатии трансплантата характеризуются развитием диффузных, протяженных, концентрических стенозов, ангиографическая диагностика может быть затруднена в связи с отсутствием "референсных", неизмененных сегментов. Выявление "неровностей" внутреннего просвета коронарных артерий, использование компьютерных программ для количественного анализа изображений и сравнение с результатами предыдущих исследований позволяют улучшить чувствительность метода. При этом, пораженные сегменты с компенсаторной вазодилятацией (негативное ремоделирование артериальной стенки), как правило, не выявляются при коронароангиографическом исследовании.
Дополнительное внутрисосудистое ультразвуковое исследование (ВСУЗИ) коронарных артерий повышает чувствительность и специфичность рентгеноангиографического исследования как в выявлении исходных изменений в донорском сердце, так и для ранней диагностики васкулопатии трансплантата. Выявление увеличения толщины интимы коронарных артерий > 0.5 мм в течение 1-го года после трансплантации сердца свидетельствует о высоком риске смерти или развитии гемодинамически значимых сужений просвета артерий трансплантата в течение следующих 5 лет. Недостатками метода ВСУЗИ коронарных артерий являются высокая стоимость, возможность развития перипроцедурных осложнений и необходимость в дополнительной специальной подготовке персонала.
При отсутствии прогрессирования изменений в коронарных артериях трансплантата в течение 5 лет после операции, особенно у больных с почечной недостаточностью, повторные коронароангиографические исследования можно выполнять реже.
Учитывая высокую частоту развития рестенозов и вероятность развития новых очагов поражения у реципиентов сердца, особенно после проведения баллонной ангиопластики, повторное коронароангиографическое исследование следует проводить не позже, чем через месяцев после процедуры ангиопластики.
Дисфункция эндотелия является ранним проявлением васкулопатии сердечного трансплантата и может быть диагносцирована при помощи измерения резерва коронарного кровотока и эндотелий-зависимой вазодилятации. Метод оценки резерва коронарного кровотока позволяет диагностировать ранние нарушения в микроциркуляторном русле, даже при отсутствии изменений в крупных эпикардиальных артериях. Показано, что выявление сниженного резерва коронарного кровотока является предиктором развития васкулопатии трансплантата и нарушения сократительной функции желудочков трансплантата в течение последующих 2-х лет.
Сопутствующие заболевания (например, почечная недостаточность) и ряд трудностей технического характера могут затруднить проведение инвазивного ангиографического исследования. Среди неинвазивных методов ранней диагностики васкулопатии трансплантата наиболее информативными радиоизотопные методы оценки перфузии миокарда, стресс-эхокардиографическое исследование с добутамином и тканевое допплеровское исследование сократительной функции миокарда.
Лечение
Показания к трансплантации сердца.
Класс I (абсолютные показания к трансплантации сердца):
1. Трансплантация сердца выполняется у больных кардиомиопатией, ишемической болезнью сердца, тяжелыми декомпенсированными заболеваниями клапанов сердца (при невозможности выполнения иных методов хирургического лечения), миокардитами, врожденными пороками сердца, а также другими заболеваниями сердца, которые существенно ограничивают физическую активность и сопровождаются риском смерти в течение года, превышающим 50%;
Степень доказанности: C.
2. Трансплантация сердца показана больным с конечной стадией сердечной недостаточности (IIБ - III стадии по классификации Василенко-Стражеско) с выраженным ограничением физической активности (III - IV функциональный класс по NYHA) при неэффективности медикаментозной терапии или методов механической поддержки кровообращения, а также невозможности проведения иных методов хирургического лечения, но обладающим потенциалом для достижения ремиссии после трансплантации донорского сердца;
Степень доказанности: C.
3. Больные, госпитализированные с острой или декомпенсированной сердечной недостаточностью, требующие непрерывной инфузии катехоламинов или находящиеся на механической поддержке кровообращения, находятся в приоритетном листе ожидания трансплантации сердца. Больные, включенные в лист ожидания, и не нуждающиеся в постоянной медикаментозной инотропной или механической поддержке кровообращения, наблюдаемые амбулаторно, должны проходить регулярные обследования для оценки статуса (рекомендуемая ФНЦ ТИО периодичность - 1 раз в 3 месяца);
Степень доказанности: C.
4. Объективные критерии неблагоприятного прогноза у больных сердечной недостаточностью:
- фракция выброса левого желудочка менее 20%;
- давление заклинивания в легочной артерии > 20 мм рт.ст.;
- содержание норадреналина в плазме крови > 600 пкг/мл;
- снижение максимального VO2 < 12 мл/кг/мин у больных, не получающих бета-адреноблокаторы и VO2 < 14 мл/кг/мин на фоне приема максимально переносимой дозы бета-адреноблокаторов;
- ретрансплантация, обусловленная выраженной дисфункцией трансплантата;
- признаки тяжелой ишемии миокарда у больных с ишемической болезнью сердца, которые значительно ограничивают повседневную деятельность при невозможности проведения реваскуляризации методами коронарного шунтирования или чрескожной ангиопластики коронарных артерий;
- рецидивирующие жизнеугрожающие нарушения ритма, рефрактерные к медикаментозной терапии, а также к электрофизиологическим методам лечения (катетерная абляция и и (или) имплантация кардиовертера-дефибриллятора).
Степень доказанности: C.
Класс IIb (относительные противопоказания):
1. Возраст > 65 лет при отсутствии значимых сопутствующих заболеваний, повышающих риск развития нежелательных событий в периоперационном периоде. В настоящее время фактором, определяющим возможность выполнения трансплантации сердца, является не столько возраст, сколько наличие сопутствующих заболеваний и способность больного к достижению ремиссии после перенесенного оперативного вмешательства. Имеются сообщения о выполнении трансплантации сердца лицам старше 80 лет [10]). У лиц старшего возраста используются расширенные критерии для органного донорства;
Степень доказанности: C.
2. Ожирение, характеризующееся значениями показателя индекса массы тела 30 - 35 кг/м2, является фактором риска неблагоприятных исходов после трансплантации сердца [11, 12], в связи с чем в настоящее время расценивается как относительное противопоказание для трансплантации сердца;
Степень доказанности: C.
3. Сопутствующие заболевания, повышающие риск развития периоперационных осложнений:
- язвенная болезнь в стадии обострения;
- сахарный диабет с повреждением органов-мишеней (нейропатия, нефропатия или ретинопатия). Относительными противопоказаниями для трансплантации сердца у больных сахарным диабетом являются наличие поражения органов-мишеней (за исключением непролиферативной ретинопатии) и невозможность достижения адекватного контроля гликемии (уровни гликозилированного гемоглобина > 7.5% или 58 ммоль/л);
- наличие гемодинамически значимого атеросклероза артерий головы и шеи, артерий нижних конечностей, почечных артерий, значимый атеросклероз и кальциноз восходящего отдела аорты являются относительными противопоказаниями для трансплантации сердца и имплантации устройств механической поддержки кровообращения;
- острые инфекционные заболевания (за исключением инфекционных осложнений, связанных с устройствами механической поддержки кровообращения);
- ожирение (ИМТ > 35 кг/м2) или кахексия (ИМТ < 18 кг/м2);
- хроническая почечная недостаточность с уровнем креатинина > 2,5 мг/дл или клиренсом креатинина < 30 мл/мин/1.73 м2 расценивается как относительное противопоказание для трансплантации сердца [13]. Однако, в настоящее время имеется опыт сочетанной трансплантации сердца и почки, в том числе и в России;
- печеночная недостаточность с уровнем билирубина > 2,5 мг/дл, повышение уровня трансаминаз более, чем в 3 раза, МНО > 1,5 без варфарина;
- нарушение функции внешнего дыхания, характеризующееся величиной показателя ОФВ1 < 40%;
- коагулопатии;
- перенесенная инфарктная пневмония в течение предыдущих 6 - 8 недель;
- тяжелые неврологические или нервно-мышечные расстройства;
- истощение, или кахексия, у больных сердечной недостаточностью является неблагоприятным фактором, связанным с более высоким риском развития нежелательных событий и летальностью. Это может быть обусловлено более почтенным возрастом, большей длительностью и более выраженной тяжестью заболевания, что также может оказывать влияние на риск развития периоперационных осложнений и способность к восстановлению в послеоперационном периоде. Критериями диагноза кахексии является потеря в весе более 5% в течение последнего года или индекс массы тела при первичном осмотре больного < 20 кг/м2 и наличие 3 из 5 признаков: снижение мышечной силы, слабость, анорексия, астеническое телосложение, лабораторные показатели (высокие уровни C-реактивного белка или ИЛ-6, анемия, гипоальбуминемия).
Степень доказанности: C.
4. Состояния и заболевания, которые могут сопровождаться нарушением режима приема лекарственных средств в послеоперационном периоде:
- неблагоприятный социальный статус или психические заболевания при которых возможно достижение ремиссии;
- перенесенное острое нарушение мозгового кровообращения;
- эпизоды злоупотребления наркотиками или алкоголем в течение последних 6 месяцев;
- неспособность отказаться от курения табака.
Степень доказанности: C.
5. Хронические инфекционные заболевания:
- вирус иммунодефицита человека. Трансплантация сердца может быть выполнена у больных с наличием антител к ВИЧ в крови в случае отсутствия оппортунистических инфекций (в течение > 1 месяца), получающих комбинированную этиотропную противовирусную терапию (в течение > 3 месяцев), при отсутствии определяемой в крови ДНК ВИЧ (в течение > 3 месяцев) и при отсутствии лимфопении (содержание в крови CD4-положительных клеток > 200 клеток/мкл в течение > 3 месяцев). Больные с первичной лимфомой центральной нервной системы или висцеральной саркомой Капоши не рассматриваются в качестве потенциальных реципиентов сердечного трансплатата;
Степень доказанности: C.
- вирусы гепатитов B и C. Больные с разрешившейся или неактивной инфекцией ВГВ и ВГС могут быть включены в лист ожидания ТС. Больным с хронической инфекцией ВГВ и ВГС для решения вопроса о возможности выполнения трансплантации сердца показано проведение биопсии печени. Разрешившаяся инфекция ВГС характеризуется наличием в крови антител в ВГС, отсутствием РНК ВГС, определяемой методом ПЦР и сохранной синтетической функцией печени. Хроническая инфекция ВГС характеризуется наличием РНК вируса в крови или активным приемом противовирусных лекарственных средств. Неактивная перенесенная инфекция вирусного гепатита B характеризуется наличием HBc-антигена и/или HBs-антител и отсутствием HBs-антигена. Хроническая инфекция ВГВ характеризуется наличием в крови поверхностного HB-антигена;
Степень доказанности: C.
Класс III (абсолютные противопоказания):
1. Возраст старше 80 лет при наличии сопутствующих заболеваний, повышающих периоперационный риск и ограничивающих отдаленный прогноз;
Степень доказанности: C.
2. Сопутствующие заболевания, повышающие риск развития периоперационных осложнений:
- выраженные нарушения функции внешнего дыхания (напр., тяжелая обструктивная болезнь легких с ОФВ1 < 1 л/мин);
- легочная гипертензия с транспульмональным градиентом > 15 мм рт.ст. или легочно-сосудистым сопротивлением > 5 единиц Вуда, рефрактерная к медикаментозной терапии (NO, силденафил) и/или механической поддержке кровообращения;
- выраженные нарушения функции печени и/или почек;
- аутоиммунные заболевания (системная красная волчанка, саркоидоз или системный амилоидоз);
- выраженное ожирение (ИМТ > 35 кг/м2);
- выраженный атеросклероз сонных, мозговых и периферических артерий, сопровождающийся ишемией органов и тканей при невозможности хирургического лечения;
- наличие острой вирусной инфекции, в том числе фульминантных форм гепатитов B и C является противопоказанием для трансплантации сердца. Наличие клинических, радиологических, биохимических или морфологических признаков цирроза печени, портальной гипертензии или гепатоцеллюлярной карциномы является противопоказанием для трансплантации сердца;
Степень доказанности: C.
3. Сопутствующие заболевания, сопровождающиеся риском смерти в течение 5 лет, превышающим 50% (напр., онкологические заболевания с неблагоприятным прогнозом жизни).
Степень доказанности: C.
Рекомендации по клиническому применению устройств механической поддержки кровообращения.
Декомпенсированная/острая сердечная недостаточность.
Наличие острой декомпенсированной сердечной недостаточности при неэффективности медикаментозной терапии, включающей постоянную инотропную поддержку, является показанием для использования кратковременной механической поддержки кровообращения, в том числе устройства экстракорпоральной мембранной оксигенации.
(Класс I, степень доказательности C)
Наличие признаков полиорганной недостаточности, неврологического дефицита сепсиса или необходимость в искусственной вентиляции легких предполагает использование механической поддержки кровообращения в течение длительного времени с целью стабилизации состояния больного и подготовки к трансплантации сердца или имплантации постоянного устройства механической поддержки кровообращения.
(Класс I, степень доказательности C)
Наличие правожелудочковой недостаточности предполагает интенсивное лечение с использованием диуретиков, экстракорпоральной ультрафильтрации, инотропных лекарственных средств, применения внутриаортальной баллонной контрпульсации или других видов кратковременной механической поддержки кровообращения.
(Класс IIa, степень доказательности C)
Лечение правожелудочковой сердечной недостаточности, развившейся после имплантации УМПК, включает назначение диуретиков, инотропных лекарственных средств, легочных вазодилятаторов (ингаляция оксида азота, препаратов простациклина, прием ингибиторов фосфодиэстеразы V). Развитие правожелудочковой недостаточности предполагает кратковременную или постоянную имплантацию устройства механической поддержки правого желудочка сердца.
(Класс IIa, степень доказательности C)
Показания для имплантации устройств механической поддержки кровообращения у больных с острым кардиогенным шоком:
1. Показания (класс IIa, степень доказательности C):
- Наличие сердечной недостаточности вследствие необратимых изменений в сердце, предполагающих длительную механическую поддержку;
- Отсутствие перспектив восстановления адекватной сердечной функции при использовании устройств краткосрочной механической поддержки кровообращения или медикаментозной терапии (инотропные средства);
- Отсутствие необратимых изменений в экстракардиальных органах;
- Возможность восстановления функции других органов и улучшения качества жизни после имплантации УМПК;
- Больные на медикаментозной инотропной поддержке с высоким риском смерти;
2. Относительные показания (Класс IIb, степень доказательности C):
- Больные с показаниями для трансплантации сердца в период ожидания донорского органа (в качестве "моста" для трансплантации сердца);
3. Противопоказания (Класс III, степень доказательности C):
- У больных острым инфарктом миокарда с вовлечением в инфарктную зону верхушки сердца имплантация УМПК в остром периоде нецелесообразна.
Механическая поддержка кровообращения как мост к трансплантации сердца.
Механическая поддержка кровообращения применяется у больных с потенциально обратимыми или поддающимися лечению сопутствующими синдромами и заболеваниями, такими как ожирение, рак, почечная недостаточность, легочная гипертензия, резистентная к медикаментозной терапии. Основная задача механической поддержки кровообращения - поддержание адекватной гемодинамики и предупреждение развития органных изменений, а также подготовка больного к трансплантации сердца.
Класс IIb, Степень доказательности: C.
У больных с легочной гипертензией медикаментозная терапия с использованием препаратов синденафила или милренона не всегда позволяет добиться эффективного снижения сопротивления легочных сосудов.
Класс IIb, Степень доказательности: C.
Применение устройств механической поддержки кровообращения у больных с врожденными и приобретенными пороками клапанов сердца.
При имплантации УМПК больным с наличием механического аортального клапана показана замена его на биополимерный клапан. Наличие других протезированных клапанов сердца не является противопоказанием для имплантации УМПК.
Класс IIa, Степень доказательности: C.
Наличие аортальной регургитации или выраженного аортального стеноза предполагает одновременное с имплантацией УМПК протезирование аортального клапана.
Класс IIb, Степень доказательности: C.
Выраженная недостаточность митрального клапана сердца не является противопоказанием для имплантации УМПК, хирургическое лечение митральной недостаточности при имплантации УМПК не требуется.
Класс IIb, Степень доказательности: C.
Наличие митрального стеноза средней или тяжелой степени предполагает протезирование митрального клапана с использованием биопротезов одномоментно с имплантацией УМПК
Класс IIb, Степень доказательности: C.
При наличие удовлетворительно функционирующего механического протеза митрального клапана его замена не требуется.
Класс IIb, Степень доказательности: C.
Наличие трикуспидальной регургитации II - III степени является показанием к хирургической коррекции порока трикуспидального клапана одномоментно с имплантацией УМПК.
Класс IIb, Степень доказательности: C.
Применение устройств механической поддержки кровообращения у больных с инфекционным эндокардитом.
Имплантация УМПК больным, больным, перенесшим инфекционный эндокардит, возможна не ранее, чем через неделю после элиминации бактериемии на фоне адекватной антибиотикотерапии.
Класс IIa, Степень доказательности: C.
Острый эндокардит с бактериемией, признаками вовлечения в патологический процесс клапанов сердца, а также инфекции, ассоциированные с электродами или ложем кардиостимулятора являются абсолютным противопоказанием для имплантации УМПК.
Класс III, Степень доказательности: C.
Устройства механической поддержки кровообращения у больных с дефектами внутрисердечных перегородок.
Дефекты межпредсердной перегородки или незаращенное овальное окно должны быть корригированы хирургическим путем одномоментно с имплантацией УМПК.
Класс IIa, Степень доказательности: C.
Изолированная имплантация УМП ЛЖ при наличии сохраняющегося дефекта межжелудочковой перегородки или разрыва свободной стенки левого или правого желудочков сердца не показана.
Класс III, Степень доказательности: C.
Применение устройств механической поддержки кровообращения у больных с нарушениями ритма сердца.
1. Мерцательная аритмия.
Трепетания или фибрилляция предсердий не являются противопоказаниями для имплантации УМПК.
Класс IIa, Степень доказательности: C.
У больных с рефрактеной к медикаментозной терапии предсердной тахиаритмией целесообразно выполнить аблацию проводящих путей имплантацию водителя ритма до имплантации УМПК.
Класс IIb, Степень доказательности: C.
2. Желудочковые нарушения ритма.
Наличие рефрактерных к медикаментозной терапии и неустранимых хирургическим путем эпизодов желудочковой тахикардии или фибрилляции желудочков является противопоказанием для имплантации изолированного устройства механической поддержки левого желудочка. В этом случае рассматривается вопрос об имплантации системы бивентрикулярного обхода или трансплантации сердца.
Класс IIb, Степень доказательности: C.
Применение устройств механической поддержки кровообращения у больных с сопутствующими заболеваниями.
1. Полиорганная недостаточность
Наличие необратимой полиорганной недостаточности или неустранимых заболеваний экстракардиальных органов, определяющих прогноз, является противопоказанием для ТС и имплантации УМПК.
Класс IIb, Степень доказательности: C.
2. Ожидаемая продолжительность жизни менее 2-х лет, ограниченная экстракардиальной патологией, исключает возможность имплантации УМПК и включения больного в лист ожидания ТС
Класс III, Степень доказательности: C.
3. Заболевания периферических артерий.
Наличие заболевания периферических артерий является относительным противопоказанием для имплантации УМПК.
Класс IIb, Степень доказательности: C.
4. Заболевания ЦНС.
Недавно перенесенный инсульт - противопоказание для имплантации УМПК. Наличие органических заболеваний ЦНС или нарушение когнитивной функции, не позволяющие больному адекватно поддерживать и контролировать работу УМПК, является относительным противопоказанием для его имплантации.
Класс III, Степень доказательности: C.
5. Онкологические заболевания.
Наличие успешно вылеченных онкологических заболеваний с низким риском рецидива и ожидаемой продолжительностью жизни в отсутствие заболевания сердца более 2 лет не является противопоказанием для имплантации УМПК.
Класс IIa, Степень доказательности: C.
6. Сахарный диабет.
Сахарный диабет с неконтролируемой гиликемией и клинически значимыми признаками поражения органов-мишеней (диабетическая пролиферативная ретинопатия, нейропатия, нефропатия или васкулопатия) является противопоказанием для имплантации УМПК.
Класс III, Степень доказательности: C.
7. Хроническая почечная недостаточность.
Имплантация устройств механической поддержки кровообращения может сопровождаться улучшением почечной функции у больных со снижением скорости клубочковой фильтрации. В настоящее время изолированная почечная недостаточность не является абсолютным противопоказанием ни для выполнения трансплантации сердца, ни для имплантации устройств механической поддержки кровообращения. Факторами риска развития значимого снижения клубочковой фильтрации, предполагающего необходимость в программном гемодиализе, являются низкая клубочковая фильтрация в предоперационном периоде, длительность заболевания, выраженность венозного застоя и высокое центральное венозное давление, а также продолжительность искусственного кровообращения во время операции.
Класс IIa, Степень доказательности: C.
Необходимость в проведении программного гемодиализа у больных с показанием к трансплантации сердца не является противопоказанием к использованию устройств механической поддержки кровообращения в качестве "моста" к трансплантации сердца.
Класс IIa, Степень доказательности: C.
8. Беременность.
У больным с имплантированными устройствами механической поддержки кровообращения рекомендовано использование противозачаточных средств.
Класс IIa, Степень доказательности: C.
Беременность является противопоказанием для имплантации УМПК.
Класс III, Степень доказательности: C.
9. Факторы риска, обусловленные образом жизни
Ожирение связано с высоким риском нежелательных событий после трансплантации сердца в силу ряда причин. С одной стороны, у больных с ожирением повышено содержание в крови ряда адипоцитокинов, предрасполагающих к развитию тромбозов, активации системы воспалительного ответа и нарушения обмена углеводного и липидного обмена. С другой стороны, риск развития таких послеоперационных осложнений, как диастаз грудины инфекционные осложнения. Использование устройств механической поддержки кровообращения у лиц с ожирением также может быть сопряжено с развитием послеоперационных осложнений. У тщательно отобранных больных возможно рассмотрение вопроса об имплантации устройств механической поддержки кровообращения и одновременном участии в программе снижения веса [21].
Класс IIb, Степень доказательности: C.
Курение является противопоказанием для трансплантации сердца и имплантации УМПК, включение больных в лист ожидания ТС или рассмотрение вопроса об имплантации УМПК возможно не раньше, чем через 6 месяцев после отказа от курения.
Класс IIb, Степень доказательности: C.
После имплантации УМПК употребление алкоголя запрещено. Неспособность отказаться от употребления алкоголя является противопоказанием для имплантации УМПК или включения в лист ожидания трансплантации сердца.
Класс III, Степень доказательности: C.
9. Социальный статус и личностные особенности пациента.
Реципиенты трансплантированного сердца и больные с имплантированными устройствами механической поддержки кровообращения, особенно в течение первых месяцев после оперативного лечения, нуждаются в поддержке близких людей. Учитывая необходимость строго соблюдения лекарственных назначений и обслуживания механического устройства поддержки кровообращения, больные с выраженными когнитивными нарушениями, десоциализированные лица и пациенты, по тем или иным причинам неспособные к сотрудничеству с медицинским персоналом и выполнению рекомендаций, могут не рассматриваться в качестве реципиентов сердца или кандидатов для имплантации устройств механической поддержки. Наркомания, табакокурение и неспособность отказаться от употребления алкоголя являются относительными противопоказаниями для трансплантации сердца и имплантации устройств механической поддержки кровообращения.
Класс IIa, Степень доказательности: C.
Госпитальный послеоперационный период у реципиентов трансплантированного сердца.
Существенное влияние на результат операции имеет выбор оптимальной схемы интенсивной терапии при различных вариантах дисфункции сердечного трансплантата. В тщательном подборе кардиотропной и вазоактивной терапии нуждаются те пациенты, которые имеют исходно повышенный уровень легочного сосудистого сопротивления, что традиционно считается фактором риска, отягощающим течение раннего периода после ТС.
Основной задачей раннего периода после ТС является восстановление адекватной, соответствующей метаболическим потребностям организма реципиента насосной функции сердечного трансплантата. На этом этапе интенсивной терапии необходима комбинация всех современных методов коррекции функций донорского сердца (как медикаментозных, так и с использованием возможностей современных методик вспомогательного кровообращения) на основе постоянного мониторинга параметров центральной гемодинамики, показателей метаболизма, газообменной и кислородтранспортной функции крови, тщательного контроля за состоянием других жизненно важных органов (центральной нервной системы, почек, печени, легких и др.).
Резко выраженная степень нарушения насосной функции трансплантата отмечается у 10% реципиентов, в этом случае поддержание системной гемодинамики обеспечивается интенсивной медикаментозной терапией и применением различных методов вспомогательного кровообращения (внутриаортальная баллонная контрпульсация, одно- или бивентрикулярный обход сердца, вено-артериальная экстракорпоральная мембранная оксигенация). В крайних случаях при отсутствии восстановления функции пересаженного сердца требуется повторная трансплантация.
Медикаментозная терапия в перитрансплантационном периоде.
Основными направлениями медикаментозного лечения миокардиальной недостаточности сердечного трансплантата являются: инотропная терапия; легочная и/или системная вазодилатирующая терапия, направленная на снижение повышенного тонуса сосудов малого и/или большого круга кровообращения; метаболическая терапия; коррекция сосудистой недостаточности с целью повышения коронарного перфузионного давления и улучшения коронарного кровотока.
Выбор схемы кардитонической терапии определяется тяжестью нарушения насосной функции сердца, состоянием легочной и системной гемодинамики, частотой сердечных сокращений, характером сердечного ритма, наличием сопутствующей сосудистой недостаточности и другими факторами. Традиционными препаратами для коррекции нарушений насосной функции трансплантата являются симпатомиметические кардиотоники. (Табл. 4). Агонисты бета-адренорецепторов приводят к увеличению содержания циклического аденозинмонофосфата (цАМФ) и кальция внутри клетки за счет стимуляции этих рецепторных структур. Кроме 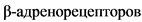 в сердца, симпатомиметические кардиотоники стимулируют и другие адренорецепторы симпатической нервной системы. При назначении симпатомиметических препаратов необходимо учитывать их влияние на ЧСС (положительное хронотропное действие), также необходимо принимать в расчет гемодинамические эффекты, связанные с их вазоконстрикторным или вазодилатирующим действием, и проаритмогенное влияние.
в сердца, симпатомиметические кардиотоники стимулируют и другие адренорецепторы симпатической нервной системы. При назначении симпатомиметических препаратов необходимо учитывать их влияние на ЧСС (положительное хронотропное действие), также необходимо принимать в расчет гемодинамические эффекты, связанные с их вазоконстрикторным или вазодилатирующим действием, и проаритмогенное влияние.
Таблица 4. Кардитонические и вазоактивные препараты, применяемые при трансплантации сердца
Вазоконстрикция
Сократимость
Вазодилатация
Хронотропизм
Аритмогенность
Изопротеренол
0
++++
+++
++++
++++
Добутамин
0
+++
++
+
+
Допамин
++
+++
+
+
+
Адреналин
+++
++++
+
++
+++
Милринон
0
+++
++
++
++
Норадреналин
++++
+++
0
+
+
Мезатон
++++
0
0
0
0
Вазопрессин
++++
0
0
0
0
Рекомендации по проведению инотропной терапии в перитрансплантационном периоде
Класс I:
1. При умеренно выраженных нарушениях сократительной функции миокарда сердечного трансплантата и нормальных значениях показателей, характеризующих состояние сосудистого тонуса, основным препаратом является добутамин, при низком общем периферическом сосудистом сопротивлении - допамин. При гемодинамически значимом нарушении насосной функции сердечного трансплантата базовым препаратом является адреналин (изолированно или в комбинации с другими кардиотониками). Потребность в использовании адреналина возрастает после ТС с длительным сроком ишемии сердечного трансплантата. При использовании адреналина необходимо учитывать потенциальное сосудосуживающее действие на малый круг, что может оказаться нежелательным у реципиентов с преимущественно правожелудочковой недостаточностью сердечного трансплантата.
Степень доказанности: C.
2. При нарушениях сократительной функции миокарда сердечного трансплантата по правожелудочковому типу рекомендуется использование добутамина - 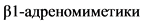 , ингибиторы фосфодиэстеразы-3 (милринон и др.). Терапия симпатомиметическими аминами прекращается после стабилизации сердечного выброса.
, ингибиторы фосфодиэстеразы-3 (милринон и др.). Терапия симпатомиметическими аминами прекращается после стабилизации сердечного выброса.
Степень доказанности: C.
3. Назначение вазодилататоров является одним из основных направлений медикаментозной коррекции нарушений насосной функции сердечного трансплантата, системной и легочной гемодинамики. Рекомендуется использование изосорбида динитрата, нитропруссида натрия и простагландин E1, а также ингаляционного оксида азота (иNO) при трансплантации сердца.
Степень доказанности: C.
4. С целью улучшения сократительной функции миокарда сердечного трансплантата и уменьшения доз инотропных лекарственных средств возможно применение сенситизаторов кальция (левосимендан). Гемодинамическими показаниями для терапии левосименданом являются: ДПП > 12 мм рт.ст., ДЗЛА > 15 мм рт.ст., СИ < 2,5 л/мин/м2 при необходимости в кардиотонической терапии допамином и/или добутамином > 15 мкг/кг/мин и адреналином > 100 нг/кг/мин. С учетом возможного системного вазодилатирующего действия рекомендуется введение левосимендана методом постоянной инфузии (100 нг/кг/мин) без предварительного болюсного введения нагрузочной дозы.
Степень доказанности: C.
Механическая поддержка кровообращения в периоперациононном периоде трансплантации сердца
У 5 - 20% и более реципиентов в раннем периоде после трансплантации развивается тяжелая дисфункция сердечного трансплантата, рефрактерная к комбинированной медикаментозной терапии (кардиотоники, вазодилататоры, метаболическая терапия) и требующая применения различных методов вспомогательного кровообращения (внутриаортальной баллонной контрпульсации, механического обхода левого и/или правого желудочка, экстракорпоральной мембранной оксигенации).
Основными причинами применения механической поддержки кровообращения в посттрансплантационном периоде являются: первичная или отсроченная дисфункция сердечного трансплантата, не связанная с иммунологическим повреждением миокарда; острое или хроническое отторжение сердечного трансплантата; нарушение насосной функции вследствие предсуществующей патологии коронарных сосудов донорского сердца.
Особенности механической поддержки кровообращения при бивентрикулярной дисфункции сердечного трансплантата
Ранняя бивентрикулярная дисфункция сердечного трансплантата, требующая применения механической поддержки кровообращения, чаще всего является следствием повреждения миокарда, развившегося либо до момента возникновения смерти головного мозга, либо вследствие гемодинамических, микроциркуляторных и метаболических расстройств в миокарде, обусловленных самой смертью головного мозга, длительными сроками холодовой и/или тепловой ишемии миокарда, а также различными периоперационными причинами, способными негативно повлиять на морфофункциональное состояние миокарда пересаженного сердца. Отдельно следует выделить иммунологическое повреждение миокарда, вызванное реакцией сверхострого или острого клеточного или гуморального отторжения миокарда, сопровождающееся тяжелыми гемодинамическими нарушениями. Значимыми факторами возникновения тяжелой бивентрикулярной дисфункции сердечного трансплантата считаются длительные сроки (более 4 ч) ишемии сердечного трансплантата, а также использование сердец от доноров с расширенными критериями. Одной из важных причин развития ранней бивентрикулярной дисфункции может явиться наличие недиагностированной коронарной патологии трансплантата (трансмиссивный атеросклероз).
Выраженная бивентрикулярная недостаточность сердечного трансплантата развивается в среднем у 20 - 25% реципиентов в раннем периоде после трансплантации. При этом только у одной трети этих пациентов требуется применение механической бивентрикулярной поддержки кровообращения. При наличии морфологических и функциональных резервов для восстановления сократительной способности миокарда бивентрикулярная дисфункция сердечного трансплантата является обратимой. В этих условиях адекватная кардиотоническая и вазоактивная терапия без или в сочетании со вспомогательным кровообращением обеспечивают поддержание системной гемодинамики на этапе ее разрешения. При отсутствии возможности восстановления сердечного трансплантата прогноз неблагоприятен, если не будет во время и успешно произведены ретрансплантация сердца или имплантация системы длительной поддержки кровообращения, прежде всего искусственного сердца.
Рекомендации по применению механической поддержки кровообращения в периоперационном периоде трансплантации сердца
Класс I:
1. Показаниями для бивентрикулярной поддержки кровообращения в раннем посттрансплантационном периоде являются первичное отсутствие функции траснплантата или выраженные гемодинамические проявления нарушения насосной функции правого и левого желудочков пересаженного сердца, сопровождающиеся неэффективностью кардиотонической терапии или невозможностью отключения от искусственного кровообращения, метаболическими, полиорганными и другими нарушениями: АД сист. < 90 мм рт.ст., АД среднее < 60 мм рт.ст., ДПП > 14 мм рт.ст., ДЗЛА > 18 мм рт.ст., СИ < 2,0 л/мин/м2, допамин/добутамин > 20 мкг/кг/мин, адреналин > 200, ВЕа > - 5 ммоль/л, лактат крови > 5 ммоль/л, олиго/анурия. Показания могут быть расширены, если прогнозируется дальнейшее ухудшение насосной функции пересаженного сердца;
Степень доказанности: B.
2. Показанием к прекращению механической поддержки является восстановление функции трансплантата. Если функция трансплантата не восстанавливается в течение 3 - 4 дней, при отсутствии сверхострой реакции отторжения, возможна повторная трансплантация сердца;
Степень доказанности: C.
3. Запаздывание с началом механической поддержки кровообращения может вызвать развитие грубых и необратимых органных нарушений, что приведет к последующей гибели реципиента от полиорганных расстройств, несмотря на восстановление системного кровообращения;
Степень доказанности: C.
4. Использование малоинвазивных (чрескожных) методов вспомогательного кровообращения может уменьшить риск возникновения различных осложнений и улучшить результативность бивентрикулярного обхода у реципиентов с выраженной дисфункции сердечного трансплантата. Одним из гибридных методов механической поддержки трансплантированного сердца является сочетанное применение катетерного осевого насоса Impella 2,5 целью обхода левого желудочка и системы вспомогательного кровообращения TandemHeart для обхода правого желудочка. Одномоментное применение катетерных осевых насосов Impella 2,5 (обход левого желудочка) и Impella Recovery RD (обход правого желудочка) (Abiomed), устанавливаемых пункционным, чрезкожным методом, может сделать проведение бивентрикулярной механической поддержки целиком малоинвазивной и малотравматичной методикой вспомогательного кровообращения при выраженной дисфункции сердечного трансплантата;
Степень доказанности: C.
Эффективность применения механической поддержки кровообращения трансплантата предопределяется тяжестью предтрансплантационного состояния реципиента, выраженностью развивающихся полиорганных расстройств и временным интервалом между возникновением гемодинамических нарушений и началом экстракорпорального кровообращения.
Рекомендации по использованию экстракорпоральной мембранной оксигенации
Класс I:
1. Вено-артериальная экстракорпоральная мембранная оксигенация (ВА ЭКМО) должна применяться при тяжелых проявлениях расстройств системной гемодинамики, обусловленных бивентрикулярной дисфункцией сердечного трансплантата, резистентной к медикаментозной терапии. Предлагается использование ВА ЭКМО не только при бивентрикулярной, но и при преимущественно правожелудочковой дисфункции сердечного трансплантата. По сравнению с бивентрикулярным обходом применение ВА ЭКМО при тяжелой дисфункции сердечного трансплантата представляется менее травматичным методом циркуляторной поддержки. В случаях ее интраоперационного развития, при невозможности прекращения ИК, предпочтение отдается центральной методике канюляции, при начале проявлений дисфункции сердечного трансплантата в послеоперационном периоде (в ОРИТ) - периферической методике. Периферическая методика ВА ЭКМО позволяет у многих больных произвести окончательное закрытие грудной клетки, уменьшить периоперационную кровопотерю, объем трансфузионной терапии, успешно прекратить использование механической поддержки без необходимости повторного открытия грудной клетки, что существенно уменьшает травматичность манипуляций, риск возможных инфекционных и других осложнений;
Степень доказанности: C.
2. При проведении ВА ЭКМО у реципиентов сердца через периферический доступ принципиальным является обеспечение профилактики ишемии нижней конечности, что достигается ее изолированной перфузией;
Степень доказанности: C.
3. Отсутствие стойкого регресса тяжелой дисфункции сердечного трансплантата в течение 4 суток считают фактором неблагоприятного прогноза при ВА ЭКМО;
Степень доказанности: C.
Особенности механической поддержки кровообращения при правожелудочковом типе дисфункции сердечного трансплантата
При выраженных гемодинамических расстройствах, когда значимая кардиотоническая терапия не обеспечивают должного улучшения насосной функции правого желудочка и сердечного трансплантата в целом, показано применение: обход правого желудочка (ОПЖ), бивентрикулярный обход (БВО) или вено-артериальная экстракорпоральная мембранная оксигенация (ВА ЭКМО).
Класс I:
1. Гемодинамическими показаниями для ОПЖ при правожелудочковой дисфункции сердечного трансплантата являются: визуальные и эхокардиографические признаки выраженного нарушения сократительной способности правого желудочка (гипоакинез свободной стенки, увеличение объемных характеристик правого желудочка, отсутствие или низкая амплитуда движения фиброзного кольца трикуспидального клапана, наличие трикуспидальной регургитации, ФИПЖ < 15%); АДср. < 60 мм рт.ст., ДПП > 18 - 20 мм рт.ст., ДЗЛК < 15 мм рт.ст., СИ < 1,8 - 2,0 л/мин/м2 несмотря на применение допамина/добутамина > 15 - 20 мкг/кг/мин и/или адреналина > 150 - 200 нг/кг/мин, неэффективность ингаляционного оксида азота (иNO) и внутриаортальной баллонной контрпульсации (ВАБК). Показания к ОПЖ могут быть расширены, если прогнозируется дальнейшее усугубление насосной функции правого желудочка;
Степень доказанности: C.
2. В случае наличия сопутствующего нарушения насосной функции левого желудочка применение ОПЖ может привести к ее усугублению (увеличение притока крови к левым отделам сердца), что может потребовать перехода на бивентрикулярную механическую поддержку кровообращения методом бивентрикулярного обхода или ВА ЭКМО;
Степень доказанности: C.
3. Возможно сочетанное использование обхода правого желудочка и ВАБК, применение которой направлено на улучшение кровоснабжения правого желудочка и ускорение разрешения правожелудочковой недостаточности. Кроме того, после прекращения использования обхода правого желудочка ВАБК обеспечивает поддержку кровообращения на этапе окончательного восстановления насосной функции правого желудочка;
Степень доказанности: C.
4. Для осуществления обхода правого желудочка у реципиентов сердца возможно использование осевого насоса Impella Recovere RD (Abiomed) обеспечивающего нагнетание крови из дренажной канюли, установленной в правое предсердие, через канюлю в легочную артерию. При этом снижается риск инфекционных осложнений со стороны операционный раны (полости перикарда, средостения, грудины), отсутствие в необходимости системной гепаринизации уменьшает периоперационную кровопотерю. Недостатком является необходимость проведения повторного оперативного вмешательства по извлечению устройства из полости перикарда;
Степень доказанности: C.
5. Возможно применение ВА ЭКМО вместо ОПЖ при острой правожелудочковой недостаточности сердечного трансплантата, что обеспечивает более качественную поддержку кровообращению и может способствовать улучшению результатов лечения реципиентов с тяжелой дисфункцией сердечного трансплантата;
Степень доказанности: C.
6. Основными причинами неблагоприятного исхода у реципиентов сердца с правожелудочковым обходом являются: развитие синдрома полиорганной недостаточности, сепсиса, коагулопатии; трансформация изолированной или преимущественно правожелудочковой недостаточности в бивентрикулярную. Запаздывание с началом применения вспомогательного кровообращения при выраженной недостаточности сердечного трансплантата рассматривается в качестве одного из ведущих факторов неудовлетворительных результатов;
Степень доказанности: C.
Ранний послеоперационный период после трансплантации сердца
Рекомендации по послеоперационному мониторингу реципиентов пересаженного сердца
Класс I:
1. Периоперационный мониторинг реципиентов сердца должен включать в себя непрерывный мониторинг ЭКГ, послеоперационные ЭКГ в 12 отведениях, инвазивный мониторинг артериального давления, давления в правом предсердии или центрального венозного давления; давления заклинивания легочной артерии, периодическое измерение сердечного выброса, измерение сатурации O2; интраоперационная чреспищеводная эхокардиография, постоянная оценка диуреза.
Степень доказанности: C.
Рекомендации по лечению нарушений ритма в периоперационном периоде
Класс I:
1. Для увеличения ЧСС рекомендовано применение хронотропных препаратов (изопротеренол, теофиллин и др.) в периоперационном периоде;
Степень доказанности: B.
2. Предсердная или желудочковая временная стимуляция должна быть налажена интраоперационно даже при наличии собственного синусового ритма;
Степень доказанности: B.
3. После трансплантации сердца, временная стимуляция должна быть начата при ЧСС менее 90 уд/мин;
Степень доказанности: B.
4. Имплантация постоянного водителя ритма возможна при неэффективности хронотропной терапии в течение 3 недель после ТС;
Степень доказанности: C.
5. Лечение нарушений ритма должно проводиться под строгим контролем СС и мониторированием нарушений ритма;
Степень доказанности: B.
6. В случае наличия стойких или персистирующих предсердных либо желудочковых тахиаритмий показано проведение эндомиокардиальной биопсии, в случае отсутствия отторжения - проведение электрофизиологического исследования;
Степень доказанности: B.
7. При наличии стойкой желудочковой тахикардии показано проведение эндомиокардиальной биопсии и ангиографии;
Степень доказанности: B.
Класс IIa:
1. Соталол и амиодарон могут быть безопасно использованы после ТС;
Степень доказанности: C.
2. Недигидропиридиновые антагонисты кальция и бета-адреноблокаторы блокаторы могут приняться для контроля ЧСС;
Степень доказанности: B.
Рекомендации для лечения гипергликемии в периоперационном периоде
Класс I:
1. Пероральные сахароснижающие препараты должны быть отменены до операции.
Степень доказанности: C.
Класс IIa:
1. Продленная инфузия инсулина должна проводиться с целью поддержания уровня глюкозы крови ниже 5,2 ммоль/л (200 мг/дл).
Степень доказанности: B.
Рекомендации по лечению больных с недостаточностью трикуспидального клапана сердечного трансплантата
Класс I:
1. Регургитация 2 и более степени на трехстворчатом клапане, выявленная во время операции, должны быть повторна оценена с помощью трансторакальной или чреспищеводной эхокардиографии в течение 24 часов после ТС. В дальнейшем необходимо руководствоваться клиническими и гемодинамическими проявлениями.
Степень доказанности: C.
Класс IIa:
1. Возможно выполнение аннулопластики трикуспидального клапана по методу Де-Вега для нормализации размеров фиброзного кольца.
Степень доказанности: C.
Иммуносупрессивная терапия
Протокол иммуносупрессивной терапии у реципиентов трансплантата сердца претерпел ряд изменений за последние два десятилетия. Успех трансплантации сердца во многом зависит от развития эффективных стратегий иммуносупрессивной терапии. Внедрение в клиническую практику ингибиторов кальциневрина было ключевым моментом в снижении частоты острого отторжения трансплантата сердца и улучшении показателей ранней выживаемости. Препараты микофеноловой кислоты и ингибиторы пролиферативного сигнала продемонстрировали возможность еще большего снижения частоты эпизодов острого отторжения, а также снижения заболеваемости васкулопатией трансплантата сердца, которая считается основным фактором, лимитирующим отдаленную выживаемость реципиентов сердца. Комбинированная терапия современными иммуносупрессантами с одновременным применением тактики минимизации дозы ингибиторов кальциневрина позволили уменьшить негативное влияние длительной медикаментозной иммуносупрессии на прогноз и качество жизни реципиентов сердца. К настоящему времени наиболее безопасным и эффективным протоколом иммуносупрессии у реципиентов сердца, по данным рандомизированных клинических научных исследований, является терапия такролимусом и препаратами микофеноловой кислоты, которая по сравнению с другими протоколами сопровождается меньшей частотой и числом осложнений. Дополнительное применение статинов также позволило улучшить результаты выживания реципиентов сердца, благодаря их метаболическим и иммуномодулирующим свойствам. Тем не менее, остаются актуальными проблемы лечения гуморального отторжения и болезни коронарных сосудов пересаженного сердца.
Целью комбинированной иммуносупрессивной медикаментозной терапии у больных после трансплантации сердца является профилактика острого отторжения трансплантата, васкулопатии, инфекционных и неинфекционных осложнений послеоперационного периода. Современный трехкомпонентный подход к иммуносупрессивной терапии вошел в клиническую практику с появлением в 80-х годах прошлого столетия циклоспорина.
В настоящее время при ТС используются те же иммунодепрессанты, что и при трансплантациях других солидных органов:
- глюкокортикостероиды (преднизолон, метилпреднизолон);
- ингибиторы кальциневрина (циклоспорин, такролимус);
- цитостатики (азатиоприн, микофенолатамофетил, микофеноловая кислота);
- антилимфоцитарные моно- и поликлональные антитела (муромонаб, антилимфоцитарный, антитимоцитарный глобулин);
- антитела к рецептору интерлейкина-2 (даклизумаб, базиликсимаб);
- ингибиторы пролиферативного сигнала (сиролимус, эверолимус).
Протокол индукционной иммуносупрессивной терапии, применяемый в ФНЦ трансплантологии и искусственных органов им. ак. В.И. ШУМАКОВА
Класс I
1. В операционной больному вводится базиликсимаб внутривенно болюсно или в виде 20 - 30-минутной инфузии. Первое введение: 20 мг за 2 ч до трансплантации сердца. Второе введение: 20 мг через 4 суток после операции;
Степень доказанности: C.
2. Интраоперационно назначается метилпреднизолон 1000 мг внутривенно перед снятием зажима с аорты;
Степень доказанности: C.
3. В течение первых суток назначается метилпреднизолон по 125 мг внутривенно через каждые 8 часов. После экстубации продолжается пероральный прием метилпреднизолона начиная с 0,5 мг/кг с постепенным снижением к концу 6-й недели после ТС до 0,05 - 0,1 мг/кг. Доза преднизолона снижается до 0,2 мг/кг/сутки с последующим снижением до 0,05 мг/кг к 4 неделе после ТС. Прием такролимуса начинают со 2 - 3-го дня после операции. В течение 1-й недели, контролируя под контролем клиренса креатинина, дозу такролимуса повышают с 0.05 до 0.1 - 0.2 мг/кг сутки поддерживая в последующем концентрацию такролимуса в крови 10 - 15 нг/мл в течение первого года после операции. Через год после трансплантации сердца дозу такролимуса подбирают таким образом, чтобы концентрация препарата в крови составляла 5 - 10 нг/мл. Такролимус назначается в сочетании с препаратами микофеноловой кислоты (микофенолата мофетил в дозе 2000 мг/сут, или натрия микофенолат в дозе 1440 мг/сут).
Степень доказанности: C.
Лечение отторжения сердечного трансплантата.
Рекомендации по лечению острого клеточного отторжения
Класс I:
1. При подозрении на острое отторжение трансплантата эндомиокардиальная биопсия должна быть выполнена как можно раньше;
Степень доказанности: C.
2. Больные с клинической картиной криза отторжения должны быть госпитализированы, а при наличии сопутствующих гемодинамических нарушений должны быть переведены в отделение интенсивной терапии;
Степень доказанности: C.
3. Внутривенная пульс-терапия кортикостероидами в высоких дозах является средством первого выбора при наличии клинических симптомов острого клеточного отторжения независимо от степени тяжести отторжения (1R, 2R или 3R);
Степень доказанности: C.
4. Цитолитическая терапия антитимоцитарными антителами должна быть добавлена к пульс-терапии кортикостероидами, если сохраняются гемодинамические нарушения или отсутствует улучшение через 12 - 24 часа от начала внутривенного введения кортикостероидов;
Степень доказанности: C.
5. Внутривенная терапия инотропными препаратами и вазопрессорами должна проводиться для поддержания адекватного сердечного выброса и системного артериального давления до восстановления адекватной сократительной функции трансплантата сердца;
Степень доказанности: C.
6. Одновременно с пульс-терапией кортикостероидами и цитолитической терапией должна проводиться профилактическая антибактериальная терапия;
Степень доказанности: C.
7. С целью снижения риска рецидива отторжения должна быть назначена адекватная поддерживающая иммуносупрессивная терапия. Возможные варианты коррекции поддерживающей иммуносупрессивной терапии включают увеличение доз принимаемых иммуносупрессантов, добавление нового компонента или замену одного препарата на другой. Также необходимо оценить соблюдение больным режима приема лекарственных средств;
Степень доказанности: C.
8. Следующая эндомиокардиальная биопсия должна быть выполнена через 1 - 2 недели от начала лечения острого клеточного отторжения;
Степень доказанности: C.
9. Для оценки эффективности терапии у больных с острым отторжением может быть использовано трансторакальное эхокардиографическое исследование сократительной функции трансплантата сердца;
Степень доказанности: C.
10. У пациентов с клиническими признаками сердечной недостаточности и легкой степенью острого клеточного отторжения, оцененного по результатам гистологического исследования, следует подозревать острое гуморальное (антителозависимое) отторжение;
Степень доказанности: C.
11. Антагонисты рецептора интерлейкина-2 не следует применять для лечения острого клеточного отторжения трансплантата сердца;
Степень доказанности: C.
Рекомендации по лечению бессимптомного острого клеточного отторжения.
Лечение бессимптомного острого клеточного отторжения умеренной степени (2R) может включать либо внутривенную пульс-терапию кортикостероидами (метилпреднизолон 125 - 1000 мг/сут в течение 3 дней) или пероральную пульс-терапию кортикостероидами (преднизолон 1 - 3 мг/кг/сутки в течение 3 - 5 дней, с последующим быстрым или медленным снижением дозы). Необходимость лечения бессимптомного острого клеточного отторжения легкой степени (1R) определяется риском прогрессирования патологических изменений. Большинство эпизодов бессимптомного острого клеточного отторжения легкой степени, развившихся в течение первого года после трансплантации сердца, могут самостоятельно регрессировать. Бессимптомное отторжение 1R степени с более выраженной диффузной инфильтрацией может потребовать коррекции поддерживающей иммуносупрессивной терапии и целевых уровней концентрации иммуносупрессантов в крови. Повторную биопсию после выявления острого клеточного отторжения следует проводить спустя 2 - 4 недели.
Класс I:
1. При выявлении во время проведения плановой биопсии гистологических признаков тяжелого острого клеточного отторжения (3R) лечение требуется, несмотря на отсутствие симптомов отторжения или дисфункции трансплантата;
Степень доказанности: C.
2. При тяжелом бессимптомном остром клеточном отторжении (3R) следует проводить внутривенную пульс-терапию кортикостероидами;
Степень доказанности: C.
3. При бессимптомном остром клеточном отторжении средней тяжести (2R) возможен выбор между внутривенной или пероральной пульс-терапией кортикостероидами;
Степень доказанности: C.
4. При тяжелом и умеренном бессимптомном остром клеточном отторжении (3R и 2R) необходима коррекция поддерживающей иммуносупрессивной терапии (увеличение дозы принимаемых иммуносупрессантов, добавление нового компонента или замена на другой лекарственный препарат);
Степень доказанности: C.
5. Медикаментозная терапия при лечении отторжения должна включать профилактическое назначение антимикробных лекарственных средств.
Степень доказанности: C.
Класс IIa:
1. Повторную эндомиокардиальную биопсию следует выполнять через 2 - 4 недели от начала лечения тяжелого или умеренного бессимптомного острого клеточного отторжения;
Степень доказанности: C.
2. Цитолитическая иммуносупрессивная терапия может быть назначена при отсутствии гистологического регресса острого клеточного отторжения;
Степень доказанности: C.
3. Бессимптомное острое клеточное отторжение легкой степени (1R) в большинстве случаев не требует лечения;
Степень доказанности: C.
Класс IIb:
Бессимптомное острое клеточное отторжение умеренной степени (1R) в сроки более года после ТС также может самостоятельно регрессировать без лечения, но в таком случае необходим тщательный мониторинг, включающий оценку клинической картины, эхокардиографию, повторные эндомиокардиальные биопсии.
Степень доказанности: C.
Возвратное/резистентное клеточное отторжение
Проведение повторной пульс-терапии метилпреднизолоном показано, если после первого трехдневного курса в суммарной дозе 3 г, по результатам контрольной биопсии на 5 сутки острое отторжение остается прежней степени или усиливается. Отторжение классифицируется как стероидорезистентное, если второй курс пульс-терапии кортикостероидами не дает положительного эффекта. Острое отторжение, выявляемое по результатам двух или более последовательных эндомиокардиальных биопсий, несмотря на проводимое лечение, расценивается как возвратное, или персистирующее отторжение. В этом случае возможно дополнение средств терапии с учетом представленных ниже положений:
- Назначение дополнительного курса цитолитической терапии. Поликлональные анти-тимоцитоарные антитела предпочтительнее ОКТ3 в связи с тем, что появление антител против ОКТ-3 может усиливать прогрессирование острого отторжения трансплантата;
- Результаты исследований свидетельствуют о том, что применение фотофереза может сопровождаться снижением риска развития гемодинамических нарушений у больных с возвратным или резистентным отторжением трансплантата. Фотоферез назначается 2 раза в неделю с повторением курса через 1 - 3 недели;
- В связи с появлением новых эффективных и безопасных методов медикаментозной терапии тотальная лимфоидная иррадиация в последние годы используется гораздо реже, чем ранее;
- Пульс-терапия метотрексатом в дозе 2.5 - 20 мг один раз в неделю может способствовать ремиссии отторжения у больных, резистентных к получаемой терапии.
Рекомендации по лечению возвратного/резистентного клеточного отторжения сердечного трансплантата.
Класс I:
1. При возвратном или стероидорезистентном остром клеточном отторжении рекомендуется проводить цитолитическую терапию анти-тимоцитарными антителами;
Степень доказанности: C.
2. При развитии у больного возвратного или стероидорезистентного криза клеточного отторжения схему поддерживающей иммуносупрессивной терапии следует пересмотреть;
Степень доказанности: C.
3. Независимо от наличия и выраженности клинических признаков недостаточности трансплантата сердца, больным с возвратным или резистентным к терапии клеточным отторжением показано проведение регулярных повторных эхокардиографических исследований с целью мониторирования сократительной функции трансплантата;
Степень доказанности: C.
Класс IIb:
1. Дополнительные методы лечения при развитии возвратного или стероидорезистентного отторжения могут включать пульс-терапию метотрексатом, а также фотоферез или тотальное лимфоидное облучение;
Степень доказанности: B.
2. Рекомендуется проводить дополнительное гистологическое исследование на наличие гуморального компонента отторжения и определять наличие в крови реципиента анти-HLA антител;
Степень доказанности: C.
Сверхострое отторжение сердечного трансплантата
Сверхострое отторжение трансплантированного сердца развивается в течение первых минут и до нескольких часов после реперфузии трансплантата. Причиной этого вида отторжения является наличие у донора анти-АВО антител в случае несоответствия донорского органа по группе крови, а также антител против антигенов главного комплекса гистосовместимости HLA 1-го класса, которые экспрессированы на поверхности эндотелиоцитов сосудов донорского органа.
Сверхострое отторжение инициируется связыванием большого количества антител, присутствующих в крови реципиента, с антигенами донора, что ведет к привлечению и фиксации комплемента на поверхности клеток сосудистой стенки донорского органа, в результате чего наступает гибель клеток, инфильтрация воспалительными клетками, активация тромбоцитов и развитие тромбоза. В результате в течение короткого времени развиваются диффузная ишемия и некроз трансплантата, имеющие фатальные последствия.
Тактика лечения сверхострого отторжения сердечного трансплантата
Лечение, которое должно быть начато немедленно при сверхостром клеточном отторжении, включает поддержку насосной функции сердца внутривенными инотропными препаратами и вазопрессорами, внутривенную пульс-терапию кортикостероидами, курс сеансов плазмафереза, цитолитическую терапию антителами. Ингибиторы кальциневрина и антиметаболические препараты (микофенолаты, циклофосфамид) должны быть назначены как можно раньше. Может потребоваться временная механическая поддержка насосной функции сердца (бивентрикулярный обход с помощью искусственных желудочков), поскольку положительный эффект от проводимой иммуносупрессивной терапии может наступить не ранее, чем через несколько часов или дней. Если вышеперечисленные меры оказываются недостаточными, требуется срочное принятие решения об экстренной ретрансплантации сердца (при этом следует помнить о крайне высокой летальности при ретрансплантации сердца, выполняемой ранее чем через 1 год после первой трансплантации).
Рекомендации по лечению сверхострого отторжения
Класс I:
1. Лечение сверхострого отторжения должно быть начато незамедлительно с момента выявления, желательно, еще в операционной. Лечение может включать: 1) внутривенную пульс-терапию кортикостероидами, 2) плазмаферез, 3) внутривенное введение иммуноглобулина, 4) цитолитическую терапию, 5) внутривенное введение ингибиторов кальциневрина (циклоспорина, такролимуса и микофенолатов), внутривенное введение инотропных препаратов и вазопрессоров, 6) механическую поддержку кровообращения;
Степень доказанности: C.
2. Для подтверждения диагноза сверхострого отторжения должна быть выполнена интраоперационная биопсия миокарда;
Степень доказанности: C.
Класс IIb:
1. При неэффективности вышеуказанных методов лечения, показана экстренная ретрансплантация сердца. При этом следует учитывать, что летальность у больных со сверхострым отторжением трансплантата достаточно высока.
Степень доказанности: C.
Лечение острого гуморального отторжения
Риск развития острого гуморального отторжения можно снизить при помощи мер профилактики. Сенсибилизация, или контакт с аллоантигенами больного, ожидающего трансплантацию сердца, должен быть сведен к минимуму. Следует избегать неоправданных переливаний крови, а при необходимости их проведения следует использовать только очищенную эритроцитарную массу, не содержащую маркеров цитомегаловирусной инфекции. Обязательно проводить перекрестную лимфоцитотоксическую пробу.
Лечение острого гуморального отторжения предполагает удаление циркулирующих антител и подавление образования новых антител к антигенам системы HLA и другим антигенам реципиента.
Независимо от природы антител, индуцирующих повреждение трансплантата, тактика лечения острого гуморального отторжения подразумевает следующее:
- Подавление T-клеточного звена (глюкокортикоиды, антилимфоцитарные антитела, микофенолаты, ингибиторы кальциневрина);
- Удаление циркулирующих анти-HLA антител (плазмаферез, плазмаферез с диафильтрацией и плазмаферез с иммунноадсорбцией);
- Связывание/опсонизация аутоантител (внутривенно иммуноглобулин);
- Подавление или лизис B-клеток (анти-CD20 моноклональные антитела - ритуксимаб). Выбор средств лечения острого гуморального лечения и продолжительности их применения зависит от степени выраженности клинических проявлений отторжения. У больных с острым гуморальным отторжением и клиническими признаками сердечной недостаточности отмечается наиболее неблагоприятный прогноз, им требуется проведение незамедлительного лечения. Лечение острого гуморального отторжения, особенно при наличии гемодинамических нарушений, следует начинать с пульс-терапии кортикостероидами (метилпреднизолон внутривенно 1000 мг/сут в течение 3 дней) и цитолитической терапии поликлональным антителами (применение ОКТ3 нежелательно в связи с тем, что появление антител против ОКТ-3 может усиливать прогрессирование острого отторжения трансплантата). Плазмаферез, иммуноадсобция и внутривенное введение препаратов иммуноглобулинов уменьшают повреждающее действие циркулирующих в крови антител. Как правило, проводится от 1 до 5 сеансов плазмафереза в неделю в течение 1 - 4 недель. Плазмаферез остается в настоящее время самым быстрым и эффективным методом удаления антидонорских антител. Иммуноадсорбция является более селективным методом, чем плазмаферез, при котором используются специальные адсорбирующие мембраны для удаления антител с помощью гидрофобных и электростатических реакций, или реакций антиген-антитело. По сравнению с плазмаферезом, иммуноадсорбция менее эффективно удаляет циркулирующие цитокины, но она связана с меньшим риском гемодинамических нарушений. Для лечения острого гуморального отторжения трансплантата сердца также используется внутривенное введение препаратов иммуноглобулина, действие которого сопровождается уменьшением образования новых антител и снижением активности циркулирующих антител.
Ритуксимаб является препаратом моноклональных анти-CD20 антител и в настоящее время также применяется для лечения острого гуморального отторжения. Ритуксимаб назначается в комбинации с внутривенным введением иммуноглобулина, кортикостероидов и плазмаферезом (Табл. 5).
Таблица 5. Медикаментозная терапия острого гуморального отторжения трансплантата сердца
Средство лечения
Режим назначения
Частота применения
Продолжительность назначения
Плазмаферез
Замещение 1 - 2 объемов циркулирующей плазмы
Ежедневно
Через день 3 раза в неделю
Один раз в неделю
3 - 5 дней
1 - 2 недели
1 - 4 недели
1 - 4 недели
Внутривенный иммуноглобулин
100 - 1000 мг/кг
1 - 3 раза в неделю, как правило, после сеансов плазмафереза
1 - 4 недели
Ритуксимаб
375 мг/м2
Один раз в неделю
1 - 4 недели
Введение поли- или моноклональных антилимфоцитарных антител, внутривенного иммуноглобулина или ритуксимаба не следует проводить перед сеансом плазмафереза или иммуноадсобции, т.к. последние удаляют вышеперечисленные препараты из плазмы реципиента. Если острое гуморальное отторжение осложняется гемодинамическими нарушениями, может потребоваться поддержка внутривенными инотропными препаратами и вазопрессорами, временная механическая поддержка сократительной функции трансплантата сердца. С целью предотвращения развития тромбоза коронарных артерий трансплантата во время острого гуморального отторжения назначаются антикоагулянты.
Эффективность методов профилактики рецидивов острого гуморального отторжения путем коррекции поддерживающей иммуносупрессивной терапии изучена недостаточно. Тем не менее, целесообразным считается усиление поддерживающей иммуносупрессивной терапии у реципиентов сердца, перенесших эпизод острого гуморального отторжения (увеличение дозы принимаемых иммуносупрессантов, добавление дополнительного иммуносупрессанта или конверсия одного на другой).
Эффективность терапии острого гуморального отторжения трансплантата оценивается при помощи повторной биопсии миокарда, которая проводится через 2 - 4 недели после начала лечения, а также мониторинга содержания в крови донор-специфических антител.
Рекомендации по лечению острого гуморального отторжения сердечного трансплантата
Класс IIa:
1. С целью уменьшения повреждающего действия антител на трансплантат сердца используются:
- внутривенное введение кортикостероидов в высоких дозах;
- цитолитическая иммуносупрессивная терапия;
Степень доказанности: C.
2. Для удаления циркулирующих анти-HLA антител или снижения их активности используются:
- плазмаферез;
- иммуноадсобция;
- внутривенное введение препаратов иммуноглобулина.
Степень доказанности: C.
3. Для поддержания адекватного сердечного выброса и артериального давления назначают:
- инотропные и вазопрессорные лекарственные средства, 2) используют вспомогательное кровообращение
Степень доказанности: C.
4. При подозрении на гуморальное отторжение гистологическое исследование биоптатов миокарда должно дополнительно включать иммуногистохимические методы для выявления компонентов системы комплемента и специфических антител
Степень доказанности: C.
5. Необходимо провести исследование на наличие в крови реципиента анти-HLA антител, определить их количество и специфичность в отношении антигенов донора
Степень доказанности: C.
6. Повторную эндомиокардиальную биопсию с иммуногистохимическим исследованием следует проводить через 1 - 4 недели после начала лечения гуморального отторжения.
Степень доказанности: C.
7. При необходимости следует провести коррекцию поддерживающей иммуносупрессивной терапии: увеличить дозу принимаемых лекарственных препаратов, добавить новый или заменить один препарат на другой.
Степень доказанности: C.
Класс IIb:
1. Антикоагулянтная терапия назначается с целью снижения риска развития тромбоза сосудов трансплантата сердца.
Степень доказанности: C.
2. При неэффективности терапии у больных с острым гуморальным отторжением решается вопрос об экстренной ретрансплантации.
Степень доказанности: C.
Лечение позднего острого гуморального отторжения трансплантата.
Тактика лечения позднего острого отторжения практически не отличается от таковой при остром отторжении трансплантата сердца в ранние сроки после операции. В данном случае следует принимать во внимание следующие особенности:
- развитие позднего острого отторжения трансплантата сердца может протекать бессимптомно; при проведении биопсии миокарда могут быть ложноотрицательные результаты;
- эхокардиографическое исследование, дополненное методами тканевого допплеровского исследования и оценкой сократительной функции правого желудочка и диастолической функции миокарда левого желудочка, может способствовать улучшению диагностики острого отторжения трансплантата;
- васкулопатия трансплантата может приводить к развитию симптомов застойной или острой сердечной недостаточности или инфаркта миокарда, при этом, поскольку трансплантат сердца является денервированным органом, больные могут не ощущать дискомфорта или болезненности в области сердца, - характерных симптомов стенокардии;
- диагноз инфаркта миокарда у больных после трансплантации сердца подтверждается результатами электрокардографии, выявлением в крови повышенных уровней маркеров повреждения миокарда (в первую очередь - тропонинов), выявлении зон гипокинеза миокарда по данным неинвазивных методов исследования, а также на основании результатов коронароангиографического исследования.
Рекомендации по лечению позднего острого отторжения трансплантата
Класс I:
1. При выявлении признаков острого отторжения сердечного трансплантата следует оценить адекватность назначений и соблюдение больным режима приема иммуносупрессивных лекарственных средств.
Степень доказанности: C.
Класс IIa:
1. У больных с высоким риском развития острого отторжения трансплантата сердца в отдаленные сроки после операции следует составить индивидуальный график проведении плановой биопсии миокарда;
Степень доказанности: C.
2. Обучение больных выявлению у себя клинических признаков отторжения трансплантата и разъяснение необходимости тщательного соблюдения режима назначений лекарственной терапии и образа жизни способствуют снижению риска нежелательных событий и улучшению отдаленного прогноза;
Степень доказанности: C.
3. Частое проведение повторных биопсий миокарда у больных с низким риском отторжения не способствует улучшению прогноза; следует учитывать риск осложнений при проведении биопсии миокарда;
Степень доказанности: C.
4. У больных с низким риском развития отторжения трансплантата применение неинвазивных функциональных методов диагностики в отдаленном периоде после трансплантации сердца может быть альтернативой частым повторным биопсиям миокарда.
Степень доказанности: C.
Тактика лечения васкулопатии сердечного трансплантата.
В настоящее время возможности медикаментозной терапии в лечении васкулопатии трансплантата ограничены. Результаты небольших пилотных исследований, показавших, что сиролимус эффективен в лечении васкулопатии трансплантата, не были подтверждены в контролируемых исследованиях.
При непротяженных, фокальных поражениях, эффективным методом лечения является ангиопластика коронарных артерий трансплантата, однако, даже при использовании стентов с антипролиферативным лекарственным покрытием частота рестенозов и необходимость в повторных вмешательствах остаются довольно высокими. Сравнение использования стентов с лекарственным покрытием и стентов без лекарственного покрытия показало, что несмотря на меньшую частоту развития рестеноза после имплантации стентов с лекарственным антипролиферативным покрытием, смертность в течение года после ангиопластики не отличается и составляет 32%.
Коронарное шунтирование может быть эффективным методом лечения васкулопатии трансплантата у некоторых больных, однако диффузный характер поражения артерий ограничивает возможности широкого использования хирургических методов реваскуляризации.
Наиболее эффективным способом лечения васкулопатии трансплантата при невозможности выполнения ангиопластики коронарных артерий, особенно у больных с признаками нарушения сократительной функции трансплантата сердца, является ретрансплантация, несмотря на то, что выживаемость больных после ретрансплантации несколько хуже, чем после первичной трансплантации.
Рекомендации по диагностике и лечению болезни коронарных артерий пересаженного сердца.
Класс I:
1. Первичная профилактика БКАПС у больных после пересадки сердца должна включать строгий контроль факторов риска сердечно-сосудистых заболеваний (артериальная гипертония, сахарный диабет, гиперлипидемия, курение, ожирение), а также профилактику цитомегаловирусной инфекции.
Степень доказанности: C.
2. У больных после трансплантации сердца прием статинов снижает риск развития БКАПС и улучшает выживаемость без нежелательных событий, включая снижение риска развития злокачественных новообразований и улучшение общей выживаемости. Статины показаны всем больным после трансплантации сердца (взрослым и детям).
Степень доказанности: A.
3. Проведение коронароангиографического исследования один или два раза в год позволяет оценить состояние коронарных артерий пересаженного сердца и на ранних этапах выявить БКАПС. При отсутствии БКАПС спустя 3 - 5 лет после трансплантации сердца, особенно у больных с признаками почечной недостаточности, коронароангиография может выполняться реже.
Степень доказанности: C.
4. Повторное коронароангиографическое исследование показано больным, перенесшим трансплантацию сердца, через полгода после ангиопластики коронарных артерий в связи с более высоким риском развития рестенозов.
Степень доказанности: C.
5. Селективная коронарная ангиография у детей после трансплантации сердца так же как и взрослых должна выполняться ежегодно или раз в два года.
Степень доказанности: C.
Класс IIa:
1. Для выявления возможного атеросклеротического поражения коронарных артерий донорского сердца, через 4 недели после трансплантации сердца должна выполняться ангиография коронарных артерий;
Степень доказанности: C.
2. Внутрисосудистое ультразвуковое исследование коронарных артерий спустя 4 - 6 недель после трансплантации сердца и через год после трансплантации сердца позволяет оценить отдаленный прогноз, выявить наличие атеросклеротического поражения донорского сердца и диагносцировать быстропрогрессирующую БКАПС;
Степень доказанности: B.
3. У больных после трансплантации сердца с БКАПС вместо микофенолата мофетила или азатиоприна следует назначить ингибиторы сигнала пролиферации;
Степень доказанности: B.
4. Ингибиторы сигнала пролиферации назначаются детям с БКАПС, однако их влияние на дальнейшее прогрессирование БКАПС не известно;
Степень доказанности: C.
5. Оценка фракционного резерва коронарного кровотока при проведении коронароангиографического исследования может позволить выявить микрососудистое поражение коронарных артерий, которое является проявлением БКАПС;
Степень доказанности: C.
6. Неинвазивные методы выявления ишемии миокарда - проба с физической нагрузкой, стресс-эхокардиографическое исследование или изотопные неинвазивные методы оценки перфузии миокарда могут быть использованы для выявления БКАПС с целью определения показаний для проведения коронароангиографического исследования;
Степень доказанности: B.
7. Ангиопластика коронарных артерий с использованием стентов с антипролиферативным покрытием может выполняться как у детей, так и взрослых с БКАПС. Этот метод лечения позволяет добиться кратковременного улучшения состояния у больных с непротяженными стенозами коронарных артерий;
Степень доказанности: C.
8. Хирургическая реваскуляризация (коронарное шунтирование) у больных после трансплантации сердца является методом выбора для лечения БКАПС при наличии технической возможности выполнения реваскуляризации;
Степень доказанности: C.
9. Больным с выраженной (тяжелой) БКАПС при отсутствии противопоказаний может быть выполнена повторная трансплантация сердца;
Степень доказанности: C.
Класс IIb:
1. Оценка коронарного кальциевого индекса при помощи методов компьютерной томографии является неинвазивным методом диагностики БКАПС, однако по своей диагностической значимости уступает неинвазивной ангиографии коронарных артерий при помощи ультраскоростной компьютерной томографии;
Степень доказанности: C.
2. Неинвазивная визуализация коронарных артерий при помощи методов компьютерной томографии может быть использована для диагностики БКАПС, однако применение этого метода диагностики на сегодняшний день ограничено необходимостью урежать сердечный ритм.
Степень доказанности: C.
Повторная трансплантация сердца (ретрансплантация)
Согласно данным различных регистров, частота повторных трансплантаций сердца составляет примерно 3%. Наиболее частые показания для ретрансплантации включают васкулопатию сердечного трансплантата, а также первичную дисфункцию и острое отторжение. Выживаемость больных после ретрансплантации ниже чем после первичной трансплантации сердца и составляет примерно 5% в течение 1-го года и 38% в течение 5 лет. Более благоприятный прогноз после ретрансплантации сердца отмечается у больных, которым повторная трансплантация была выполнена в связи с васкулопатией первичного трансплантата, менее благоприятный - у больных с острым отторжением или первичной дисфункцией трансплантата.
Факторы риска смерти после ретрансплантации сердца включают:
- нарушения сократительной функции сердечного трансплантата, развившиеся в течение 6 месяцев после операции трансплантации;
- длительность периода времени, прошедшего после первичной трансплантации (выживаемость в течение года не превышает 50%, если после первичной трансплантации прошло не более 6 месяцев и 75%, если более 2 лет);
- острое отторжение первичного трансплантата;
- небольшое количество трансплантаций, выполняемых в транспланталогическом центре. Тактика ведения больных после ретрансплантации сердца не имеет особенностей по сравнению с первичной трансплантацией сердца.
Рекомендации по повторной трансплантации сердца.
Класс IIa:
1. Вопрос о ретрансплантации рассматривается у взрослых реципиентов с признаками выраженной БКАПС и невозможностью выполнения реваскуляризации миокарда, недостаточной эффективностью медикаментозной терапии, на фоне которой отмечаются клинические признаки сердечной недостаточности или ишемии миокарда;
Степень доказанности: C.
2. Ретрансплантация у больных с клиническими проявлениями сердечной недостаточности в отсутствие признаков острого отторжения трансплантата;
Степень доказанности: C.
Класс IIb:
1. Больные с выраженными изменениями в коронарных артериях трансплантата при отсутствии либо с небольшими/умеренными признаками сердечной недостаточности.
Степень доказанности: C.
Класс III:
1. Пациенты с сердечной недостаточностью, развившейся на фоне острого отторжения трансплантата в течение первых месяцев после первой трансплантации сердца.
Степень доказанности: C.
Профилактика инфекционного эндокардита после трансплантации сердца.
Инфекционный эндокардит развивается редко у больных после трансплантации сердца, однако сопровождается высокой смертностью (до 80%). Наибольший риск развития инфекционного эндокардита отмечается у больных с дефектами клапанов. Основными возбудителями инфекционного эндокардита являются Staphylococus aureus и Aspergillus fumigatus. Staphylococus aureus может быть занесен с катетерами для гемодиализа, а также при воспалении кожи и подкожной клетчатки или при контаминации донорского органа. Эндокардит, вызванный Aspergillus fumigatus, нередко развивается на фоне цитомегаловирусной инфекции и может протекать на фоне диссеминированного аспергилеза, и сопровождаться аспергилезным эндофтальмитом.
Чаще всего при эндокардите поражаются митральный и трикуспидальный клапаны.
Несмотря на отсутствие клинических доказательств, с целью профилактики инфекционного эндокардита, при всех стоматологических вмешательствах показана антибиотикопрофилактика.
Рекомендации по профилактике инфекционного эндокардита после трансплантации сердца.
Класс IIa:
1. Специфических рекомендация по профилактике инфекционного эндокардита у больных после трансплантации сердца нет. С учетом высокого риска развития у таких больных приобретенной клапанной недостаточности и крайне неблагоприятного прогноза в случае развития инфекционного эндокардита, все стоматологические манипуляции у больных с вальвулопатиями должны проводиться на фоне профилактического назначения антибиотиков.
Степень доказанности: C.
Реабилитация
Больные после трансплантации сердца находятся под постоянным наблюдением центра трансплантации и получают необходимую медицинскую помощь по месту жительства.
Особенности ведения больных после трансплантации сердца определяются рядом специфических факторов, которые включают взаимодействие организма реципиента и сердечного трансплантата, необходимость в пожизненном приеме иммуносупрессивной терапии, особенность течения основного заболевания, приведшего к терминальной сердечной недостаточности в дотрансплантационном периоде, а также специфические аспекты психологической, физической и социальной адаптации. При этом, следует учитывать и особенности физиологии трансплантированного сердца, являющегося денервированным органом, а именно отсутствие болезненных ощущений при развитии ишемии миокарда, отсутствие вагусного влияния и зависимость сократительной функции левого желудочка от объема притекающей крови (преднагрузки).
Отдаленный прогноз больных после трансплантации сердца в первую очередь определяется особенностями взаимодействия организма реципиента и трансплантированного органа, проявляющимися отторжением трансплантата. Будучи максимальным в первые месяцы и снижаясь спустя и более год после операции трансплантации, риск развития отторжения трансплантата сердца сохраняется пожизненно, что определяет необходимость в постоянном приеме иммуносупрессивной терапии. Побочные эффекты действия иммуносупрессивной терапии оказывают негативное влияние на прогноз и качество жизни. Наиболее значимыми побочными действиями являются развитие злокачественных новообразований, риск инфекционных осложнений, нефропатия, сахарный диабет, артериальная гипертония, неврологические нарушения, остеопороз, влияние на репродуктивное здоровье и др. Для поддержания баланса между адекватной иммуносупрессией и профилактикой побочных действий необходим тщательный мониторинг иммуносупрессивной терапии, включающий измерение концентрации лекарственных препаратов в крови. У больных, получающих иммуносупрессивную терапию, следует учитывать особенности взаимодействий лекарств, опасность которых заключается как в вероятности развития побочных действий, так и в уменьшении эффективности иммуносупресии. В связи с этим, любые изменения в назначениях лекарственных средств должны согласовываться с центром трансплантации, к которому прикреплен больной.
Больные, перенесшие трансплантацию сердца, нуждаются в психологической, физической и социальной реабилитации, направленной на лечение и профилактику депрессивных расстройств, социализацию, развитие дисциплинированности в соблюдении врачебных рекомендаций по приему лекарственных средств и образу жизни, а также стимулирование самостоятельности и независимости.
Физические тренировки и реабилитация после трансплантации сердца.
Рекомендации по применению программ лечебной физкультуры и физической реабилитации у больных после трансплантации сердца.
Класс I:
1. Всем больным после трансплантации сердца показаны физические тренировки с аэробной нагрузкой. Физические тренировки улучшают адаптацию к физическим нагрузкам и способствуют модификации факторов риска сердечно-сосудистых заболеваний, таких как ожирение, нарушение толерантности к глюкозе и артериальная гипертония. Влияние физических тренировок на отдаленный прогноз и смертность у больных после трансплантации сердца не изучено;
Степень доказанности: B.
2. Тренировки с утяжелениями показаны больным с признаками снижения минеральной плотности костной ткани, а также с целью профилактики остеопороза и нежелательного действия на мышечную ткань препаратов кортикостероидов и ингибиторов кальциневрина. Тренировки с утяжелениями являются частью комплексной терапии по профилактике потери минеральной плотности костной ткани и атрофии скелетной мускулатуры.
Степень доказанности: B.
Проведение хирургических вмешательств у больных с трансплантированным сердцем.
Рекомендации по проведению хирургических вмешательств у больных с трансплантированным сердцем.
Класс I:
1. Подготовка к операции и анестезиологическому реципиентов пересаженного сердца осуществляется совместно и под контролем врача трансплантолога;
Степень доказанности: C.
2. Профилактическое назначение антибиотиков перед проведении оперативного вмешательства обязательно. При этом, следует избегать антибактериальных лекарственных средств из группы аминогликозидов и эритромицина в связи с возможным прогрессированием почечной недостаточности на фоне применения циклоспорина A и такролимуса;
Степень доказанности: C.
3. При необходимости переливания крови следует использовать препараты с низким содержанием лейкоцитов;
Степень доказанности: C.
4. При проведении анестезиологического пособия следует учитывать, что трансплантат сердца денервирован. ЧСС в покое у реципиентов пересаженного сердца выше, чем у остальных лиц: нормальная ЧСС составляет 90 мин-1, увеличение ЧСС до 130 мин-1 не требует медикаментозной терапии;
Степень доказанности: C.
5. Лечение брадиаритмий. Атропин у больных с пересаженным сердцем не увеличивает ЧСС в связи с тем, что трансплантат денервирован. Брадиаритмии купируются введением изопротеренола или при помощи электрокардиостиуляции;
Степень доказанности: A.
6. Самый частый вид нарушений ритма сердца у реципиентов - мерцание предсердий. Учитывая повышенную чувствительность денервированного сердца к аденозину, введение препарата в обычной дозе может сопровождаться развитием асистолии. Препаратом выбора для лечения мерцательной тахиаритмии у больных после пересадки сердца является амиодарон;
Степень доказанности: C.
7. Поддержание нормального объема циркулирующей крови имеет важное значение у больных после трансплантации сердца. Снижение объема циркулирующей крови повышает риск развития почечной недостаточности. Увеличение объема циркулирующей жидкости плохо переносится этими больными. При проведении хирургических вмешательств обязательно постоянное мониторирование центрального венозного давления;
Степень доказанности: C.
8. Назначение иммуносупрессивных препаратов не должно меняться без согласования с врачами-трансплантологами. Отмена ингибиторов кальциневрина возможна в утро перед оперативным вмешательством в связи с повышенным риском развития почечной недостаточности на фоне периоперационной дегидратации. Впоследствии назначение иммуносупрессивных препаратов должно быть продолжено. При отсутствии возможности назначения циклоспорина A перорально, препарат может назначаться внутривенно (как правило, в виде 6-часовой инфузии каждые 12 часов или постоянная инфузия в течение 24 часов). Доза циклоспорина A при внутривенном введении составляет 1/3 подобранной суточной дозы. Такролимус может назначаться внутривенно в количестве, составляющем 1/5 подобранной для перорального введения суточной дозы. Микофенолата мофетил и азатиоприн вводятся внутривенно в тех же дозах, что были подобраны для перорального приема.
Степень доказанности: C.
Социальная реабилитация больных после трансплантации сердца.
Рекомендации по социальной реабилитации больных после трансплантации сердца.
Класс IIа:
1. Возобновление трудовой деятельности больными после трансплантации сердца возможно при поддержке органов социальных служб;
Степень доказанности: C.
2. Возобновление социальной активности и трудовой деятельности после трансплантации сердца является основной задачей программ реабилитации;
Степень доказанности: C.
3. В программах социальной реабилитации больных после трансплантации сердца должны, помимо врачей, принимать участие работники социальных служб.
Степень доказанности: C.
Вождение автомобиля и управление транспортными средствами.
Рекомендации по вождению автомобиля и управлению транспортными средствами у больных после трансплантации сердца.
Класс I:
1. Вопросы возможности управления транспортным средством должны обсуждаться с больными на раннем послеоперационном этапе;
Степень доказанности: C.
2. Вопрос о возможности управления транспортным средством решается на основании неврологического осмотра больного (исключаются тремор, устойчивость осанки, функции зрения);
Степень доказанности: C.
3. У больных с брадикардией допуск к управлению автомобилем разрешается при наличии искусственного водителя ритма;
Степень доказанности: C.
4. Больные после трансплантации сердца, получающие лекарственные средства с выраженным гипогликемческим действием, к вождению транспортного средства не допускаются;
Степень доказанности: C.
5. Профессиональное управление транспортным средством возможно при условии соответствия клинического состояния больного условиям местного законодательства;
Степень доказанности: C.
6. При управлении летательными аппаратами следует соблюдать особую осторожность в связи с высоким риском внезапной смерти у больных с БКАПС.
Степень доказанности: C.
Психологическая адаптация. Лечение депрессий.
Рекомендации по профилактике и лечению депрессивных состояний у больных после трансплантации сердца.
Класс I:
1. Ингибиторы обратного захвата серотонина, особенно циталопрам и антидепрессанты нового поколения, такие как митразапин, не оказывающие существенного влияния на уровни артериального давления, частоту сердечных сокращений, внутрисердечную проводимость и ритм сердца - препараты выбора для медикаментозной терапии депрессии у больных после трансплантации сердца;
Степень доказанности: B.
2. Во избежание лекарственного взаимодействия с циклоспорином A и такролимусом, следует по возможности избегать назначения лекарственных средств, метаболизирующихся с участием системы цитохрома P-450 (например, таких как флувоксамин, нефазодон);
Степень доказанности: B.
3. Трициклические антидепрессанты (такие как имипрамин, дезипрамин, амитриптилин, комипрамин) могут оказывать нежелательные побочные действия на сердечно-сосудистую систему и цитотоксическое действие на миокард (замедление внутрисердечной проводимости, ортостатическая гипотензия, антихолинергическое действие), связи с чем их следует назначать только больным с признаками тяжелой депрессии, рефрактерной к другим лекарственным средствам;
Степень доказанности: B.
4. Ингибиторы моноаминоксидазы (МАО) не назначаются больным после трансплантации сердца в связи с их гипотензивным действием, лекарственными взаимодействиями с анестетиками и вазопрессорными лекарственными средствами, а также необходимостью соблюдать диету (при употреблении продуктов, содержащих моноамины и, в частности, тирамин, может произойти значительное повышение уровней катехоламинов в крови, сопровождающееся гипертоническим кризом);
Степень доказанности: B.
5. Лекарственные средства растительного происхождения (отвары, настойки, микстуры) не показаны вследствие их сложного состава и возможного лекарственного взаимодействия с циклоспорином A;
Степень доказанности: B.
Класс IIa:
1. При каждом визите больного следует оценить правильность выполнения им рекомендаций по приему лекарственных средств и образу жизни;
Степень доказанности: C.
2. Правильность выполнения рекомендаций можно оценивать любыми способами, включая сбор анамнеза, анализ дневниковых записей и информации, полученной от близких родственников и наблюдающего больного медицинского персонала;
Степень доказанности: C.
3. Следует оценивать соответствие приема назначениям не только иммуносупрессивных лекарственных средств, но также всей медикаментозной терапии и немедикаментозных методов профилактики нежелательных событий;
Степень доказанности: C.
4. Сложности, возникающие при соблюдении приема лекарственных средств, следует обсуждать вместе с больным;
Степень доказанности: C.
5. Наблюдение и ведение больного следует осуществлять в контакте с близкими больному людьми, вовлекая их в образовательные программы;
Степень доказанности: C.
6. Следует стимулировать стремление больного к независимости и самообслуживанию;
Степень доказанности: C.
7. Медицинский персонал (врачи и медсестры), наблюдающие больного по месту жительства, должны быть обучены всем аспектам ведения больных после трансплантации сердца;
Степень доказанности: C.
8. Следует регулярно обследовать больного доступными методами для выявления у него признаков депрессии;
Степень доказанности: C.
9. Среди специалистов, занимающихся ведением больного после трансплантации сердца, должен быть врач-психолог, специализирующийся в выявлении и лечении депрессивных состояний;
Степень доказанности: C.
Мультидисциплинарный подход в наблюдении за больными после трансплантации сердца.
Принципы мультидисциплинарного подхода в ведении больных после трансплантации сердца.
Класс I:
1. Врачи-трансплантологи должны предоставить необходимую контактную информацию врачам, наблюдающим реципиента трансплантированного сердца по месту жительства, позволяющую связаться с центром трансплантологии в любое время и гарантировать адекватную помощь, связанную с наблюдаемым больным;
Степень доказанности: C.
2. Врачи, наблюдающие больного по месту жительства должны иметь полную информацию о необходимых плановых консультациях и госпитализациях в центр трансплантологии;
Степень доказанности: C.
3. Врачам, наблюдающим реципиента донорского сердца, необходимо предоставлять информацию о результатах обследования больного и дальнейших планах по наблюдению и лечению;
Степень доказанности: C.
Профилактика и диспансерное наблюдение
Факторы, определяющие прогноз после трансплантации сердца.
По данным регистра Международного общества трансплантации сердца и легких (ISHLT), 50%-ная выживаемость больных после трансплантации сердца составляет 10 лет, а для больных, переживших первый год после операции - 13 лет. У больных, переживших 1-й год после трансплантации сердца, вероятность прожить 10 лет составляет 63%, 20 лет - 27%. По данным Федерального научного центра трансплантологии и искусственных органов им. ак. В.И. Шумакова, 5-летняя выживаемость больных, у которых трансплантация сердца была выполнена в 2006 - 2013 годах (n = 223), составила 80%.
Основные причины смерти после трансплантации сердца - острое отторжение трансплантата, сердечная недостаточность, болезнь коронарных артерий пересаженного сердца (васкулопатия трансплантата), инфекции, почечная недостаточность, онкологические заболевания. Отторжение трансплантата и инфекции являются ведущими причинами смерти в течение первых трех лет после трансплантации сердца, в то время как злокачественные новообразования и БКАПС - в последующем периоде.
Факторы риска нежелательных событий в течение первого года после трансплантации сердца:
- возраст и вес донора;
- причина сердечной недостаточности реципиента (у больных неишемической кардиомиопатией прогноз лучше);
- длительность ишемии трансплантата;
- ретрансплантация;
- необходимость механической поддержки кровообращения в предоперационном и периоперационном периодах;
- возраст реципиента (отмечается - образная зависимость, наименьший риск у 40-летних реципиентов);
- индекс массы тела реципиента;
- уровни билирубина и креатинина в крови;
- легочная гипертензия;
- почечная недостаточность;
- инфекции.
Факторы риска нежелательных событий в течение 5 лет после трансплантации сердца, помимо указанных выше, включают:
- количество трансплантаций, выполняемых трансплантологическим центром;
- впервые выявленный сахарный диабет;
- наличие беременностей в анамнезе;
- несовместимость трансплантата по HLA антигенам и группе крови.
Анализ выполненных в ФНЦТИО им. акад. В.И. Шумакова трансплантаций сердца за период с 1987 по 2006 г. (n = 71), показал, что степень совместимости по HLA-A-B-DR не оказывает достоверного негативного влияния на прогноз отдаленной выживаемости. Наилучший прогноз отдаленной выживаемости ассоциируется с мужским полом реципиентов и принадлежностью к возрастной группе старше 40 лет. Принадлежность реципиентов к возрастной группе менее 40 лет обусловливает более раннее развитие васкулопатии трансплантата, в патогенезе которой важную роль играет хроническое гуморальное отторжение.
При анализе влияния предтрансплантационной патологии на частоту развития эпизодов острого отторжения у реципиентов с дилатационной кардиомиопатией, ишемической кардиомиопатией, активным миокардитом получены неблагоприятные результаты только при активном миокардите, что проявляется возможностью развития в посттрансплантационном периоде персистирующего острого отторжения.
Мониторирование безопасности иммуносупрессивной терапии.
Рекомендации по выявлению побочных действий иммуносупрессивной терапии.
Класс I:
1. У больных после трансплантации сердца целесообразно проводить мониторинг эффективности и безопасности иммуносупрессивной терапии. При развитии специфических побочных действий целесообразно производить снижение дозы (замену) лекарственных средств при поддержании адекватного уровня иммуносупрессии.
Степень доказанности: C.
Значимые лекарственные взаимодействия иммуносупрессивных лекарственных средств.
Ферментная система цитохрома CYP3A и гастроинтестинального гликопротеина P играют ключевую роль в метаболизме многих иммуносупрессантов, таких как циклоспорин, такролимус, сиролимус и эверолимус. Таким образом, лекарственные средства изменяющие активность цитохрома или P-гликопротеина могут приводить к повышению или снижению концентрации иммуносупрессантов в крови.
Наиболее серьезным побочным эффектов статинов у реципиентов трансплантата сердца является миозит, который может перейти в рабдомиолиз и привести к такому осложнению как почечная недостаточность. Риск этого побочного эффекта выше у липофильных, чем у гидрофильных статинов за счет большей пенетрации в мышцы.
Опасное для жизни неблагоприятное событие - рабдомиолиз - может развиться при одновременном приеме циклоспорина и ингибиторов 3-гидрокси-3-метилглутарил-коэнзим-А-редуктазы (ГМГ-КоА-редуктазы), ловастатина или симвастатина, так как при таком сочетании повышается концентрация статинов в крови. Этот эффект может быть усилен при одновременном приеме клопидогреля или гемфиброзила, так как препараты всех этих трех групп метаболизируются с помощью ферментов цитохрома P450. Добавление клопидогреля к переносимой комбинации циклоспорина и статинов может привести к повышению концентрации статинов в плазме из-за конкурентного связывания свободных рецепторов-мишеней. Подобный эффект не развивается при комбинации циклоспорина, клопидогреля и правастатина, так как последний препарат метаболизируется иным путем, без участия цитохрома P450. В отличие от статинов, фибраты сами по себе ассоциируются с высоким риском рабдомиолиза на фоне иммуносупрессии циклоспорином, частота которого значительно возрастает при добавлении к фибратам статинов или других препаратов с возможным опасным лекарственным взаимодействием (Табл. 6).
Таблица 6. Лекарственные средства, оказывающие влияние на систему цитохрома P450
Действие
Лекарственные средства
Подавление активности P450
Аторвастатин, симвастатин, ловастатин, амиодарон, верапамил, дилтиазем, кетоконазол, флюконазол, итраконазол, эритромицин, кларитромицин, трициклические антидепрессанты, циклоспорин, такролимус, мибефрадил, кортикостероиды, грейпфрутовый сок
Повышение активности P450
Рифампицин, фенобарбитал, фенитоин, дексаметазон, циклофосфамид, карбамазепин, омепразол
Минимизация иммуносупрессивной терапии.
Стратегии минимизации иммуносупрессии.
Снижение дозы кортикостероидов.
Минимизация кортикостероидов и их отмена рассматривается как благоприятный фактор для увеличения продолжительности и улучшения качества жизни пациентов за счет исключения побочных эффектов длительной терапии кортикостероидами.
Прием кортикостероидов может сопровождаться:
- нарушениями углеводного обмена (развития толерантности к глюкозе, сахарного диабета 2-го типа);
- дислипидемией;
- артериальная гипертония;
- остеопороз;
- повышение риска развития инфекционных заболеваний. В связи с тем, что на фоне приема кортикостероидов может отмечаться ряд нежелательных побочных действий, уменьшение дозы принимаемых препаратов было бы желательным, если это снижение не приведет к отторжению трансплантата (если безопасно). Уменьшение дозы кортикостероидов в первую очередь возможно у больных с низким риском развития отторжения трансплантата.
Больные с низким риском развития отторжения трансплантата:
- отсутствие циркулирующих антилейкоцитарных антигенов человека (HLA);
- нерожавшие женщины;
- отсутствие эпизодов отторжения в анамнезе;
- лица старшего возраста.
Лицам с низким риском развития отторжения трансплантата возможно более раннее снижение дозировки и отмена кортикостероидных препаратов. У больных после трансплантации сердца (ТС) большее количество несовпадений по HLA антигенам является важным фактором риска нежелательных событий в случае снижения дозы кортикостероидов. Таким образом, при выборе индивидуальной тактики лечения кортикостероидами, необходимо учитывать степень иммунологического несоответствия между донорским органом и реципиентом. По данным ранняя отмена преднизолона в течение первого месяца после трансплантации сердца была успешна у 49 - 70% больных. В связи с тем, что чаще всего острое отторжение трансплантата развивается в течение первых месяцев после трансплантации сердца, отмена кортикостероидов по прошествии месяцев может быть успешно проведена у 80% больных, даже при отсутствии предшествующей индукционной терапии. Согласно данным регистра Международного общества трансплантации сердца и легких (ISHLT), более 40% больных могли успешно обходиться без кортикостероидов на протяжении 5-летнего периода. Обычно, при отмене кортикостероидов руководствуются стандартизированным протоколом и под контролем результатов серийной биопсии миокарда. Результаты рандомизированных сравнительных исследований свидетельствуют, что у лиц с низким риском отторжения трансплантата отмена кортикостероидов не повышает риск отторжения трансплантата, но сопровождается снижением смертности в раннем периоде.
Уменьшение дозы ингибиторов кальциневрина.
Ингибиторы кальциневрина, циклоспорин и такролимус, - являются базовым компонентом иммуносупрессивной терапии после ТС. Одним из нежелательных действий ингибиторов кальциневрина является развитие почечной недостаточности. Вероятность развития хронической почечной недостаточности у больных после трансплантации сердца превышает 10% в течение 5 лет и в основном развитие почечной недостаточности связывают именно с длительным приемом этой группы лекарственных средств. В раннем периода после трансплантации сердца, когда риск отторжения наибольший, ингибиторы кальциневрина назначаются в высоких дозах, которые впоследствии снижаются. В ряде клинических исследований изучалась возможность снижения дозы или прекращения приема ингибиторов кальциневрина.
Назначение микофенолата мофетила, но не азатиоприна, позволило успешно добиться снижения дозы ингибиторов кальциневрина и сопровождалось более низким риском развития отторжения трансплантата, почечной недостаточности и возможностью полной отмены кортикостероидов.
В проспективном многоцентровом исследовании замена азатиоприна на микофенолата мофетил до начала снижения дозы циклоспорина сопровождалось существенным снижением уровней сывороточного креатинина, в то время как в контрольной группе (лица, продолжающие принимать азатиоприн) отмечалось некоторое повышение уровней креатинина в крови.
Снижение дозы циклоспорина также сопровождалось достоверным снижением уровней артериального давления. Похожие результаты были также получены в ряде небольших исследований.
В то же время, позднее снижение дозы циклоспорина без дополнительной терапии не сопровождалось улучшением почечной функции. Замена сиролимусом азатиоприна также обладала ограниченными преимуществами в плане минимизации дозы ингибиторов кальциневрина в связи с тем, что лекарственные средства из группы ингибиторов сигнала пролиферации, к которым относится сиролимус, могут усиливать нефротоксичность ингибиторов кальциневрина. На сегодняшний день отношение к использованию ингибиторов сигнала пролиферации с целью уменьшения дозы ингибиторов кальциневрина для снижения нефротоксичности последних является противоречивым (нецелесообразным, нет однозначного мнения).
Отмена ингибиторов кальциневрина.
В отдаленном периоде после трансплантации сердца замена ингибиторов кальциневрина или микофенолата мофетила на сиролимус и целенаправленное снижение дозы ингибиторов кальциневрина способствует улучшению почечной функции и снижению риска васкулопатии, не сопровождаясь повышением риска развития отторжения трансплантата.
Таким образом, в то время как назначение сиролимуса без ингибиторов кальциневрина на ранних сроках после оперативного вмешательства, является нежелательным, в связи с тем, что в этот период риск отторжения трансплантата является наивысшим и иммуносупрессивная терапия при помощи ингибиторов кальциневрина имеет важное значение, в отдаленном периоде после трансплантации сердца у стабильных больных (у больных с низким риском) ингибиторы кальциневрина могут быть заменены на сиролимус и замена ингибиторов кальциневрина может сопровождаться улучшением почечной функции.
Назначение ингибиторов кальциневрина в монотерапии.
Очень небольшое количество исследований было посвящено эффективности и безопасности назначения ингибиторов кальциневрина больным после пересадки сердца в монотерапии. В одном небольшом исследовании была показана возможность первоначального назначения такролимуса в комбинации с преднизолоном, в последующем у 5% больных было прекращено назначение преднизолона, которое сопровождалось приемлемым уровнем отторжения трансплантата и отдаленной выживаемости. В последующем рандомизированном исследовании без индукционной терапии и с ранней отменой кортикостероидов были выявлены сравнимые уровни отторжения трансплантата в группах больных, получавших тройную комбинацию и ингибитор кальциневрина в монотерапии в течение 1-го года после трансплантации сердца. Однако, необходимы дополнительные исследования для оценки влияния такого подхода на риск смерти, отторжения трансплантата, почечной недостаточности, васкулопатии трансплантата и новообразований.
Мониторирование терапии ингибиторами кальциневрина.
Чаще всего для мониторирования уровней ингибиторов кальциневрина в крови используются фазы плато насыщения препарата в крови или уровни препарата перед следующей дозой. Однако, имеются свидетельства того, что концентрация циклоспорина в крови, определенная через 2 часа после приема препарата, может быть более точным показателем иммуносупрессивной эффективности по сравнению с уровнями фазы плато нахождения препарата в крови и позволяет использовать препарат в более низких дозах, что способствует меньшему риску развития побочных действий и сохранению функции почек.
Экспозиция микофенолата мофетила может быть оценена путем определения уровней микофеноловой кислоты в фазу плато распределения препарата в крови. Однако, четкой связи между уровнями микофеноловой кислоты в крови и риском отторжения трансплантированного сердца на сегодняшний день не выявлено.
Уровни активных антител, определенные у больного до трансплантации сердца, коррелируют с риском нежелательных событий после трансплантации сердца. Двукратное определение уровней анти-HLA антител при помощи метода проточной цитометрии (цитофлоуметрии) до и после трансплантации сердца более эффективно более эффективно свидетельствует (лучше предсказывает) о риске отторжения трансплантата по сравнению с методами лабораторной оценки комплемент-зависимой цитотоксичности. Уровни анти-HLA антител антител являются маркером, который может быть использован при мониторировании безопасности снижения доз иммуносупрессивной терапии. Регулярное определение дважды. Выявление в посттрансплантационном периоде специфичных донорских антител в крови также является маркером развития васкулопатии коронарный артерий трансплантированного сердца.
Рекомендации по минимизации иммуносупрессивной терапии.
Класс I:
1. Отмена кортикостероидов может быть успешно достигнута в течение 3 - 6 месяцев после трансплантации сердца у больных с низким риском отторжения трансплантата (больные без циркулирующих анти-HLA антител, нерожавшие женщины, больные без отторжения в анамнезе, больные старшего возраста);
Степень доказанности B.
2. Использование ингибиторов кальциневрина в комбинации с микофенолата мофетилом, в отличие от комбинации с азатиоприном, позволяет использовать более низкие дозы ингибиторов кальциневрина. Данная комбинация безопасна, на фоне ее применения отмечается низкий риск развития отторжения сердца, меньше страдает почечная функция.
Степень доказанности B.
Класс IIa:
1. С целью снижения риска развития нежелательного нефротоксического действия и васкулопатии коронарных артерий пересаженного сердца спустя 6 месяцев после операции трансплантации сердца могут быть заменены на ингибиторы пролиферативного сигнала.
Степень доказанности C.
Класс IIb:
1. У отдельных больных с низким риском развития отторжения трансплантата возможна ранняя отмена кортикостероидов и назначение ингибиторов кальциневрина в монотерапии.
Степень доказанности B.
Класс III:
1. Лекарственные средства, относящиеся к группе ингибиторов пролиферативного сигнала, могут потенцировать нефротоксическое действие ингибиторов кальциневрина, в связи с чем замена микофенолата мофетила на ингибиторы пролиферативного ответа с целью уменьшения дозы ингибиторов кальциневрина для профилактики нефротоксического действия последних не показана;
Степень доказанности C.
2. Замена микофенолата мофетила ингибиторами пролиферативного сигнала ранее, чем спустя 3 месяца после пересадки сердца, не рекомендована вследствие более высокого риска развития отторжения трансплантата и замедления заживления операционной раны.
Степень доказанности B.
Факторы риска и профилактика васкулопатии сердечного трансплантата.
Ранняя профилактика является наиболее эффективным предупреждения развития нежелательных сердечно-сосудистых обусловленных васкулопатией трансплантата.
Профилактика васкулопатии трансплантата включает предупреждение повреждения эндотелия донорского сердца при его заборе и имплантации, профилактику острого отторжения и цитомегаловирусной инфекции, а также уменьшение воздействия "традиционных" факторов риска сердечно-сосудистых заболеваний. Курение у больных после трансплантации сердца является фактором риска развития не только васкулопатии транспалантата, но и онкологических осложнений иммуносупрессивной терапии, и в связи с этим отказ от курения имеет важное значение у этих больных.
В общей популяции ожирение является фактором риска развития сахарного диабета и сердечно-сосудистых заболеваний. Данные о влиянии ожирения на выживаемость больных после трансплантации сердца неоднозначны. С одной стороны, тяжелая застойная сердечная недостаточность, являющаяся основным показанием для трансплантации сердца, сопровождается кахексией и снижением веса тела; в крупных исследованиях было показано, что у больных сердечной недостаточностью корреляция между весом тела и выживаемостью прямая. С другой стороны, у больных после трансплантации сердца ожирение развивается на фоне приема кортикостероидов, в меньшей степени - вследствие гиподинамии и избыточного употребления легкоусвояемых углеводов с пищей. В этих случаях доказана связь ожирением с риском развития сахарного диабета, артериальной гипертонии и дислипидемии, которые в свою очередь, могут негативно влиять на прогноз. Несмотря на отсутствие доказательств того, что снижение избыточного веса сопровождается снижением риска развития васкулопатии трансплантата, больным после пересадки сердца показаны физические тренировки и диета с низким содержанием животных жиров и легкоусвояемых углеводов.
Вирусные инфекции, особенно цитомегаловирусная инфекция, является фактором риска развития васкулопатии трансплантата. Несмотря на то, что специфические противовирусные средства (антицитомегаловирусный иммуноглобулин, ганцикловир и валганцикловир) обладают высокой эффективностью против циомегаловируса, нет убедительных данных о том, что их применение снижает риск развития васкулопатии трансплантата.
Вероятность развития сахарного диабета у больных после трансплантации сердца достаточно высока и достигает 30% в течение 1-го года после операции. Факторами риска развития сахарного диабета являются нарушенная толерантность к глюкозе в предоперационном периоде, семейная предрасположенность, ожирение, а также прием ингибиторов кальциневрина и кортикостероидов в качестве иммуносупрессивной терапии. По сравнении с циклоспорином, такролимус в большей степени повышает риск развития сахарного диабета. В исследованиях показано, что между уровнями гликозилированного гемоглобина в крови и выраженностью васкулопатии в коронарных артериях пересаженного сердца существует положительная корреляция. В связи с этим, строгий контроль уровней глюкозы в крови является важным фактором профилактики развития васкулопатии трансплантата.
Артериальная гипертония повышает риск развития васкулопатии трансплантата. Назначение антагонистов кальция эффективно снижает вероятность развития васкулопатии трансплантата. Совместное назначение с антагонистами кальция ингибиторов ангиотензинпревращающего фермента позволяет более эффективно контролировать уровни артериального давления и улучшать отдаленный прогноз после пересадки сердца.
Новообразования.
Факторы риска развития новообразований после трансплантации сердца.
Опухолевые новообразования весьма часто развиваются у больных после трансплантации солидных органов. У больных после трансплантации сердца самыми частыми опухолями являются новообразования кожи, лимфомы, а также раки простаты, легких и груди. Согласно данным регистра ISHLT, факторами риска развития новообразований в течение 5 лет после трансплантации сердца являются длительность периода времени, прошедшего после трансплантации сердца, мужской пол и возраст реципиента (> 60 лет).
Основным этиологическим фактором развития новообразований после трансплантации солидных органов является длительная иммуносупрессия. Показано, что по сравнению с азатиоприном, назначение микофенолата мофетила сопровождается более низким риском развития новообразования.
Неходжкинская лимфома, также называемая посттрансплантационным лимфопролиферативным заболеванием, редко встречается у лиц без нарушений иммунной системы, но является одним из неблагоприятных осложнений длительной иммуносупрессивной терапии у больных после трансплантации сердца. В большинстве случаев пострансплантационные лимфопролиферативные заболевания являются B-клеточными опухолями и связаны с вирусом Эпштейн-Барра.
Скрининговые обследования и лечение.
Регулярное исследование крови на содержание вируса Эпштейн-Барр (методом полимеразной цепной реакции, ПЦР) позволяет выявить больных с высоким риском развития лимфопролиферативных новообразований. Одним из наиболее эффективных средств профилактики новообразований является индивидуализация и минимизация иммуносупрессивной терапии.
В связи с тем, что раки кожи при их раннем выявлении хорошо поддаются лечению, они редко являются причиной смерти. Больные должны быть предупреждены о вреде инсоляции и обучены способам применения солнцезащитных средств, а также знать признаки рака кожи и методы самодиагностики. Скрининговые методы обследования для выявления новообразований, как то: маммография, цитологический мазок по Папаниколау (Пап-тест), колоноскопия, определение уровней простата-специфического антигена (ПСА), пальпация лимфатических узлов, рентгенография грудной клетки и дерматологические обследования должны проводиться регулярно.
Лечение новообразований, в особенности лимфом, у больных после трансплантации сердца имеет ряд особенностей и должно осуществляться под контролем трансплантационного центра. Тактика лечения таких больных включает минимизацию иммуносупрессивной терапии. Несмотря на отсутствие доказательств эффективности, больным часто назначаются противовирусные средства.
Ритуксимаб является эффективным средством для лечения неходжкинских лимфом, однако данных о том, как он влияет на выживаемость больных, в настоящее время нет.
Результаты исследований, опубликованных в последние годы свидетельствуют о том, что назначение статинов, помимо снижения риска развития васкулопатии трансплантата, может сопровождаться снижением риска развития злокачественных новообразований.
Рекомендации по профилактике, диагностике и лечению новообразований у больных после трансплантации сердца.
Класс I:
1. Рекомендации по раннему выявлению (скринингу) новообразований молочных желез, толстой кишки и простаты у больных после трансплантации сердца не отличаются от таковых в общей популяции;
Степень доказанности: C.
2. У больных после трансплантации сердца отмечается высокий риск развития кожных новообразований, в связи с чем им показано проведение профилактических мероприятий, включая участие в образовательных программах и ежегодный осмотр дерматолога;
Степень доказанности: C.
3. Больные после трансплантации сердца должны пройти первичное обследование и в дальнейшем наблюдаться у специалиста с целью раннего выявления и профилактики посттрансплантационных лимфопролиферативных заболеваний;
Степень доказанности: C.
4. У больных после трансплантации сердца с солидными новообразованиями (солидным раком), не связанными с лимфоидной системой, необходимости в уменьшении дозы иммуносупрессивных лекарственных средств нет. Такие больные должны получать адекватную иммуносупрессивную терапию в полном объеме за исключением случаев, когда имеется необходимость коррекции дозы или отмены отдельных лекарственных средств, обусловленных сопутствующими заболеваниями, например, при развитии лейкопении следует отменить или уменьшить дозы лекарственных средств, подавляющих кроветворную функцию красного костного мозга.
Степень доказанности: C.
Класс IIa:
1. В отдаленном периоде после трансплантации сердца целесообразно по возможности уменьшить дозы иммуносупрессивных лекарственных средств.
Степень доказанности: C.
Функция почек. Профилактика и лечение посттрансплантационной нефропатии.
Распространенность, факторы риска и тактика лечения нефропатии у реципиентов трансплантированного сердца.
Нарушение выделительной функции почек часто выявляется у больных после трансплантации сердца и оказывает влияние на прогноз. Выделительная функция почек характеризуется величиной показателя скорости клубочковой фильтрации (СКФ), рассчитываемого с учетом содержания креатинина в крови, веса, возраста и пола больного. Снижение выделительной функции почек характеризуется значениями показателя СКФ ниже 30 мл/мин/1.7 2 м и спустя 5 лет после трансплантации сердца выявляется примерно у 10% больных, сопровождаясь четырехкратным повышением риска смерти.
Ухудшение выделительной функции почек, характеризующееся снижением величины показателя СКФ на 30 - 50% развивается, как правило, спустя первые 6 месяцев после трансплантации сердца. Затем значение показателя СКФ стабилизируется или снижается более медленно.
Факторы риска развития почечной недостаточности после трансплантации сердца включают:
- "Традиционные" факторы риска нефропатии;
- Артериальная гипертония;
- Атеросклероз коронарных и/или периферических артерий;
- Сахарный диабет;
- Старший возраст;
- Женский пол;
- Назначение высоких доз ингибиторов кальциневрина;
- Сниженная функция почек у реципиента до операции трансплантации сердца.
Почечная недостаточность у больных после трансплантации сердца приводит к таким же последствиям, что и в общей популяции: развитию прогрессированию атеросклероза коронарных и периферических артерий, артериальной гипертонии, анемии и остеопорозу.
Наиболее эффективным методом лечения тяжелой почечной недостаточности у больных после пересадки сердца является трансплантации почки, после которой отдаленный прогноз существенно лучше, чем на фоне гемодиализа.
Рекомендации по профилактике, диагностике и лечению почечной недостаточности у больных после трансплантации сердца.
Класс I:
1. Оценка скорости клубочковой фильтрации, рассчитанной по формуле, общий анализ мочи и оценка соотношения [альбумин в моче]/[креатинин сыворотки крови] должны выполняться всем больным после трансплантации сердца не реже 1 раза в год. Оценка клиренса креатинина SCr для расчета СКФ должна выполняться чаще у больных с СКФ < 60 22 мл/мин/1.7 3 м или при быстром снижении показателя СКФ (> 4 мл/мин/1.7 3 м в год);
Степень доказанности: C.
2. Реципиентам после трансплантации сердца со значениями показателя СКФ < 30 мл/мин/1.7 3 м или протеинурией > 500 мг/сут, или с быстрым снижением значения показателя СКФ > 4 мл/мин/1.7 3 м в год показано обследование и лечение под наблюдением нефролога с целью коррекции метаболических нарушений и других осложнений почечной недостаточности. При выраженной почечной недостаточности рассмотреть вопрос о трансплантации почки;
Степень доказанности: C.
3. У всех реципиентов донорского сердца с признаками почечной недостаточности следует снизить дозы ингибиторов кальциневрина до минимального уровня, необходимого для поддержания адекватной иммуносупрессии. У больных, принимающих азатиоприн, это может быть достигнуто путем замены азатиоприна на микофенолата мофетил;
Степень доказанности: C.
4. Если на фоне снижения дозировки или отмены ингибиторов кальциневрина явления почечной недостаточности не уменьшаются, назначение этих лекарственных средств следует возобновить или продолжить в связи с более высокой эффективностью в профилактике отторжения трансплантата;
Степень доказанности: C.
5. У больных после трансплантации сердца применимы клинические рекомендации по профилактике и лечению ХПН, которые включают контроль гликемии, нормализация артериального давления, использование ингибиторов АПФ или блокаторов ангиотензиновых рецепторов. У больных сахарным диабетом тактика лечения должна соответствовать имеющимся рекомендациям по профилактике и лечению сахарного диабета. Целевые уровни артериального давления должны соответствовать принятым клиническим рекомендациям;
Степень доказанности: C.
6. Общий анализ крови и оценка содержания гемоглобина у больных ХПН после трансплантации сердца должны выполняться не реже 1 раза в год. У больных анемией (уровни гемоглобина в крови Hg < 13.5 г/дл у мужчин и Hg < 12 г/дл у женщин) следует оценить содержанием железа в крови и назначить лекарственные средства, стимулирующие гемопоэз для поддержания целевых уровней гемоглобина в крови в пределах 11 - 13 г/дл;
Степень доказанности: C.
7. У больных после трансплантации сердца при развитии тяжелой почечной недостаточности следует рассмотреть вопрос о трансплантации почки, предпочтительно от живого донора;
Степень доказанности: C.
8. У больных с признаками почечной недостаточности предпочтительными гипотензивными средствами являются ингибиторы АПФ или БРА; при их непереносимости или противопоказаниях целесообразно использовать антагонисты кальция.
Степень доказанности: C.
Артериальная гипертония после трансплантации сердца.
Распространенность и факторы риска АГ после трансплантации сердца.
Распространенность артериальной гипертонии (АГ) спустя 5 лет после трансплантации сердца может достигать 95%. Развитие АГ после трансплантации сердца в первую очередь связано с приемом ингибиторов кальциневрина, при этом, прием циклоспорина A в большей степени связан с развитие АГ, чем такролимус. Длительный прием кортикостероидов также сопровождается повышением уровней артериального давления (АД). Помимо иммуносупрессивной терапии, причинами развития АГ после трансплантации сердца являются нарушение барорефлексов (повышение активности) и прогрессирование ригидности аорты и периферических артерий.
У больных после трансплантации сердца чаще отмечается так называемая "скрытая артериальная гипертония" (синоним - "изолированная амбулаторная гипертония"), характеризующаяся тем, что при измерении на приеме у врача уровни АД ниже, чем при измерении в домашних условиях или при суточном мониторировании АД.
Чаще всего при суточном мониторировании АД у больных после трансплантации сердца выявляют повышение систолического АД в ночное время и постоянное повышение уровней диастолического АД.
Рекомендации по лечению артериальной гипертонии после трансплантации сердца.
Класс I:
1. Адекватная гипотензивная терапия у больных после трансплантации сердца эффективно снижает риск развития нежелательных сердечно-сосудистых событий, включая смерть, мозговой инсульт, инфаркт миокарда, сердечную недостаточность, нарушения ритма;
Степень доказанности: C.
2. Целевые уровни для медикаментозной терапии: 140/90 мм рт.ст.;
Степень доказанности: C.
3. Модификация факторов образа жизни обязательна (нормализация веса, снижение потребления NaCl, адекватная физическая активность);
Степень доказанности: C.
4. Выбор лекарственных средств: ингибиторы ангиотензинпревращающего фермента (ИАПФ) или при их непереносимости - блокаторы рецепторов к ангиотензину (БРА) и антагонисты кальция;
Степень доказанности: C.
5. Комбинированная гипотензивная терапия позволяет использовать низкие дозы гипотензивных средств и более эффективна, чем монотерапия;
Степень доказанности: C.
6. Лечение сахарного диабета и контроль уровней липидов у всех больных АГ;
Степень доказанности: C.
7. У больных после трансплантации сердца уменьшение дозы или отмена кортикостероидов может сопровождаться снижением/нормализацией уровней АД.
Степень доказанности: C.
Класс IIa:
1. Регулярное измерение АД, суточное мониторирование позволяет выявить гипертонию у больных после трансплантации сердца;
Степень доказанности: C.
2. При непереносимости или недостаточной эффективности антагонистов кальция назначаются диуретики: тиазидовые у больных с сохранной функцией почек, петлевые - при снижении скорости клубочковой фильтрации.
Степень доказанности: C.
Неврологические нарушения после трансплантации сердца.
Распространенность и факторы риска неврологических нарушений после трансплантации сердца.
У больных, перенесших трансплантацию сердца, нередко могут развиваться неврологические осложнения, которые оказывают неблагоприятное влияние на прогноз больного и существенно ухудшают качество жизни. Как правило неврологические осложнения не являются основной причиной смерти больных, перенесших трансплантацию сердца. Самые частые неврологические осложнения самой операции по пересадке сердца включают:
- ишемический мозговой инсульт;
- геморрагический мозговой инсульт;
- преходящие судорожные припадки;
- развитие энцефалопатии;
- инфекции центральной нервной системы;
- периферические нейропатии.
Самыми частыми побочными действиями ингибиторов кальциневрина со стороны нервной системы являются:
- головные боли;
- тремор;
- нарушения сна.
Побочные действия ингибиторов кальциневрина зависят от дозы, и уменьшаются при снижении дозы лекарственного средства. На фоне общей тенденции неврологических осложнений трансплантации сердца к снижению, вероятность их развития в раннем периоперационном периоде остается неизменной. Частота очаговых нарушений мозгового кровообращения у больных, перенесших трансплантацию сердца, составляет примерно 9%, в то время как риск этих осложнений при проведении других хирургических вмешательств составляет по данным разных авторов 1 - 5%. Повышенный периоперационный риск развития неврологических осложнений при пересадке сердца может быть обусловлен использованием средств механической поддержки кровообращения. Имеются данные о безопасности назначения аспирина после операции трансплантации сердца, однако влияние такого назначения на риск развития ишемического мозгового инсульта неизвестна. Эпилептические припадки могут развиваться у 15% пациентов, они развиваются, как правило, в периоперационном периоде вследствие локального ишемического повреждения головного мозга во время операции (аноксической энцефалопатии), токсического побочного действия ингибиторов кальциневрина или метаболических нарушений. Эпилептические припадки, развивающиеся в течение первого месяца после оперативного вмешательства, как правило, являются следствием токсического воздействия на ЦНС или оппортунистической инфекции ЦНС. Гипомагнезиемия, гипонатриемия и артериальная гипотония могут повышать риск развития эпилептических припадков, в то время как отмена ингибиторов кальциневрина или уменьшение их дозы может снижать риск их развития. Длительное назначение противосудорожной терапии используется редко. В случае показаний к противосудорожной терапии, следует учитывать, что определенные противосудорожные лекарственные средства, такие как карбамазепин, фосфенитоин, фенитоин и фенобарбитал могут повышать метаболизм ингибиторов кальциневрина, скорее всего, вследствие индукции ферментов, относящихся к системе печеночного цитохрома p-450 (CUP-450). В случае назначения вышеперечисленных лекарственных средств, необходимо проводить мониторирование содержания ингибиторов кальциневрина в крови и коррекцию их дозы.
Энцефалопатии, развивающиеся в ранний постоперационный период, как правило, имеют множественные причины, в то время как энцефалопатии, развивающиеся в позднем периоде, являются следствием какого-то определенного неврологического нарушения. Циклоспорин и, возможно, такролимус, могут вызывать так называемый, обратимый лейкоэнцефалопатический синдром с поражением задних отделов мозга (PRES-синдром). Этот синдром проявляется головными болями, нарушениями зрения и обмороками и характеризуется появлением очаговых повреждений в кортикальном и субкортикальном слое головного мозга, выявляемых при помощи методов магнито-резонансной томографии. Уменьшение дозы или отмена ингибиторов кальциневрина (или замена на другое лекарственное средство) в большинстве случаев сопровождается купированием этого синдрома, однако, следует иметь в виду, что недостаточной и неадекватной иммуносупрессии следует избегать.
Частоту развития интракраниальных инфекций удалось снизить на фоне снижения доз иммуносупрессивных лекарственных средств (уменьшения иммуносупрессивной терапии). Инфекционные агенты, вызывающие эти инфекции, различаются в зависимости от периода времени, прошедшего после трансплантации сердца.
Заболевания периферической нервной системы могут развиваться как в раннем, так и в позднем периоде после трансплантации сердца. Брахиальная плексопатия вследствие особенности положения больного во время операционного вмешательства или повреждение малоберцового нерва (peroneal nerve injury), вызванное установкой внутриаортального баллона, являются интраоперационными осложнениями. Сенсорная полинейропатия может развиваться у больных после трансплантации сердца на фоне сахарного диабета, почечной недостаточности или амилоидоза. Габапентин и трициклические антидепрессанты в данном случае назначаются достаточно часто, однако их влияние на отдаленный прогноз изучено недостаточно.
Рекомендации по лечению неврологических осложнений после трансплантации сердца.
Класс I:
1. Лечение эпилептоидных припадков/обмороков у больных после трансплантации сердца включает уменьшение дозы или отмену ингибиторов кальциневрина (при сохранении адекватной иммуносупрессии) и коррекцию гипомагнезиемии (если таковая выявлена);
Степень доказанности: C.
2. Развитие энцефалопатии в отдаленном периоде после трансплантации сердца предполагает консультацию невролога и проведение методов интракраниальной визуализации (КТ, МРТ) для выявления возможных причин;
Степень доказанности: C.
3. При развитии обратимого лейкоэнцефалопатического синдрома с поражением задних отделов мозга (PRES-синдрома) показано уменьшение дозы ингибиторов кальциневрина или их замена на другие лекарственные средства;
Степень доказанности: C.
Класс IIb:
1. При сохранении эпизодов эпилептических припадков/обмороков на фоне уменьшения доз ингибиторов кальциневрина, ингибиторы кальциневрина могут быть отменены и заменены на ингибиторы сигнала пролиферации (сиролимус, эверолимус).
Степень доказанности: C.
Сахарный диабет после трансплантации сердца.
Распространенность и факторы риска развития сахарного диабета после трансплантации сердца.
Сахарный диабет (СД) достаточно распространен у больных, перенесших трансплантацию сердца (32% через 5 лет после трансплантации), и приводит к развитию и прогрессированию болезни коронарных артерий пересаженного сердца, повышает риск инфекционных осложнений и дисфункции сердечного трансплантата.
Факторами риска развития СД после трансплантации сердца являются:
1. "Дотрансплантационные" факторы:
- наследственная предрасположенность к СД;
- нарушенная толерантность к глюкозе;
- ожирение и метаболический синдром;
2. "Посттрансплантационные" факторы:
иммуносупрессивная терапия:
- кортикостероиды
- ингибиторы кальциневрина (на фоне приема такролимуса СД может развиваться чаще, чем на фоне приема циклоспорина A).
Рекомендации по диагностике, профилактике и лечению сахарного диабета у больных после трансплантации сердца.
Класс I:
1. Учитывая высокий риск развития сахарного диабета, оказывающего неблагоприятное влияние на прогноз и качество жизни, программа ведения больных после трансплантации сердца должна включать мероприятия по профилактике и ранней диагностике этого заболевания; больные сахарным диабетом должны получать адекватную терапию;
Степень доказанности: C.
2. Скрининговые исследования для выявления сахарного диабета включают определение уровней гликозилированного гемоглобина, определение уровней глюкозы в крови натощак и тест на толерантность к глюкозе. Периодичность этих измерений определяется индивидуальными факторами риска больного и особенностями иммуносупрессивной терапии;
Степень доказанности: C.
3. Медикаментозная терапия сахарного диабета должна проводиться совместно с врачом-эндокринологом и в соответствии с современными рекомендациями по лечению сахарного диабета;
Степень доказанности: C.
4. Немедикаментозная терапия для профилактики и лечения сахарного диабета у реципиентов сердечного трансплантата включает поддержание нормального веса тела, соблюдение диеты и физические тренировки;
Степень доказанности: C.
5. При выявлении факторов риска или установке диагноза сахарного диабета следует пересмотреть режим иммуносупрессии и по возможности снизить дозировку или исключить лекарственные средства, обладающие диабетогенным действием, но только в том случае, если изменения в медикаментозной терапии не будут ухудшать эффективности иммуносупрессии;
Степень доказанности: C.
6. Кортикостероиды и ингибиторы кальциневрина повышают толерантность к глюкозе и обладают диабетогенным действием, в связи с этим у реципиентов сердечного трансплантата с сахарным диабетом и высоким риском развития сахарного диабета указанные лекарственные средства назначаются в невысоких дозах или заменяются на альтернативные;
Степень доказанности: C.
7. Артериальная гипертония и дислипидемия существенно ухудшают прогноз у больных сахарным диабетом и повышают риск развития осложнений; адекватная гипотензивная терапия, прием статинов и немедикаментозные методы профилактики позволяют снизить риск нежелательных событий у реципиентов сердечного трансплантата с сахарным диабетом;
Степень доказанности: C.
8. Больным после трансплантации сердца с сахарным диабетом не реже одного раза в год показано проведение обследования с целью выявления возможных осложнений сахарного диабета.
Степень доказанности: C.
Класс IIa:
1. Больным после трансплантации сердца при выявлении в скрининговых анализах крови повышенных уровней глюкозы или гликозилированного гемоглобина показана консультация эндокринолога.
Степень доказанности: C.
Остеопороз.
Факторы риска развития остеопороза после трансплантации сердца.
Остеопороз часто выявляется у больных, ожидающих трансплантацию сердца. Факторами риска развития остеопороза у больных сердечной недостаточностью, ожидающих трансплантацию сердца, являются кахексия, связанная с сердечной недостаточностью, сниженная подвижность/физическая активность, низкие уровни 25-гидроксивитамина D в плазме крови, гипогонадизм, длительное назначения гепарина, длительный прием диуретиков, почечная недостаточность, вторичный гиперпаратиреоидизм.
Бисфосфанаты являются лекарственными средствами первой линии для лечения постменопаузального остеопороза, остеопороза у мужчин, остеопороза, развившегося на фоне приема кортикостероидов. У этих больных назначение бисфосфанатов существенно повышает минеральную плотность кости и снижает риск развития переломов.
Рекомендации по профилактике остеопороза при трансплантации сердца.
Класс I:
1. У всех больных, ожидающих трансплантацию сердца, следует проводить первичный скрининг/обследование с целью выявления существующих заболеваний костной ткани. Целесообразно выполнять денситометрическое исследование с оценкой минеральной плотности костной ткани в области поясничного отдела позвоночника и шейки бедренной кости;
Степень доказанности: C.
2. Выявление снижения минеральной плотности костной ткани или компрессионного перелома позвонков предполагает тщательное клиническое обследование и выявление вероятных причин. Лечение остеопороза следует начинать до трансплантации сердца. Бисфосфанаты являются наиболее эффективными лекарственными средствами для лечения остеопороза;
Степень доказанности: C.
3. Все больные, ожидающие трансплантацию сердца, и реципиенты должны потреблять адекватное количество кальция (1000 - 1500 мг/сут в зависимости от возраста и наличия менопаузы) и витамина D (400 - 1000 МЕ/сут для поддержания концентрации 25-гидроксивитамина D в крови выше 30 нг/мл или 75 нмоль/л);
Степень доказанности: C.
4. Больным после трансплантации сердца целесообразно назначить физические тренировки с отягощениями, которые способствуют укреплению мышечной и костной ткани и снижают риск падений и переломов;
Степень доказанности: B.
5. Всем пациентам после трансплантации сердца в течение года показан профилактический прием бисфосфанатов на протяжении, как минимум, первого года после трансплантации сердца;
Степень доказанности: B.
6. Лекарственные препараты бисфосфанатов в комбинации с препаратами кальция и витамина D предотвращают потерю костной ткани и снижают риск развития переломов у больных после трансплантации сердца.
Степень доказанности: C.
Класс IIa:
1. Рентгеновское исследование позвоночника показано всем взрослым больным, ожидающим трансплантацию сердца с целью выявления травматических переломов костей конечностей и компрессионных переломов позвоночника;
Степень доказанности: C.
2. Если через год после трансплантации сердца кортикостероиды отменены, минеральная плотность костной ткани в пределах нормальных значений (значение показателя T > 1.5), препараты бисфосфанатов могут быть отменены;
Степень доказанности: C.
3. Длительность непрерывного приема препаратов бисфосфанатов не должна превышать 5 лет;
Степень доказанности: C.
4. Денситометрия минеральной плотности костной ткани показана всем реципиентам донорского сердца через год после трансплантации. Дальнейшее ежегодное обследование с оценкой минеральной плотности костной ткани показано больным, получающим кортикостероиды, имеющими признаки остеопороза и принимающим бисфосфанаты. В дальнейшем, денситометрическое исследование следует повторять через каждые два-три года.
Степень доказанности: C.
Класс IIb:
1. Назначение лекарственных препаратов активных метаболитов витамина D (кальцидиол, альфакальцидиол и кальцитриол) в качестве средства первой линии у больных со сниженной минеральной плотностью костной ткани. В случае назначения эти лекарственных средств показано регулярное измерение содержания уровней кальция в крови и моче (кальциемия, кальциурия - побочное действие этой группы лекарственных средств).
Степень доказанности: B.
Класс III:
1. Препараты кальцитонина в качестве средства для профилактики остеопороза не показаны больным после трансплантации сердца.
Степень доказанности: B.
Репродуктивное здоровье после трансплантации сердца.
Беременность.
Рекомендации по беременности у больных после трансплантации сердца.
Класс I:
1. Для ведения и наблюдения беременности у больных, перенесших трансплантацию сердца, используется мультидисциплинарный подход с привлечением врачей-специалистов: гинекологов, акушеров, неонатологов, кардиологов, трансплантологов, психологов и генетиков;
Степень доказанности: C.
2. Тактика ведения беременности и разрешения родов разрабатывается с учетом индивидуальных особенностей матери и состояния трансплантированного органа. Госпитализация и родоразрешение производится в центре трансплантологии;
Степень доказанности: C.
3. При планировании беременности учитываются индивидуальные факторы: риск отторжения трансплантата, риск развития инфекционных осложнений, особенности назначаемых лекарственных средств, которые могут обладать токсическим или тератогенным действием, а также особенности пересаженного органа. При выявлении риска неблагоприятного исхода или осложнения предстоящей беременности, ее следует предотвратить;
Степень доказанности: C.
4. Беременность не следует планировать в течение 1-го года после трансплантации сердца в связи с повышенным риском отторжения трансплантата;
Степень доказанности: C.
5. У потенциальной матери, планирующей беременность, план обследования должен включать электрокардиографическое, эхокардиографическое и коронароангиографическое (если не было выполнено в предыдущие месяцев) исследования, а в случае клинических показаний - эндомиокардиальную биопсию;
Степень доказанности: C.
6. У беременных реципиенток пересаженного сердца следует осуществлять регулярный мониторинг функции печени и почек, измерение уровней артериального давления, посевы мочи, а также необходимые диагностические мероприятия для выявления ранних признаков преэклампсии и гестационного диабета;
Степень доказанности: C.
7. Прием лекарственных препаратов ингибиторов кальциневрина и кортикостероидов беременным реципиенткам должен быть продолжен, препараты микофенолата мофетила следует отменить;
Степень доказанности: C.
8. В течение беременности должен проводиться тщательный мониторинг уровней ингибиторов кальциневрина в крови в связи с высокой вариабельности фармакодинамики этих лекарственных средств на фоне обусловленных беременностью изменений объема плазмы крови и интерстициальной жидкости, а также функции печени и почек;
Степень доказанности: C.
9. Частые обследования для выявления возможного отторжения трансплантата у беременных необходимы. При этом следует избегать проведения эндомиокардиальной биопсии под рентгеновским контролем. При проведении эндомиокардиальной биопсии предпочтение отдается ультразвуковому контролю, при необходимости рентгеновского контроля необходимо тщательное экранирование всех участков тела для защиты плода от рентгеновского облучения.
Степень доказанности: C.
Класс IIb:
1. Данные о безопасности азатиоприна у беременных в качестве альтернативы микофенолата мофетилу противоречивые. При назначении как микофенолата мофетила, так и азатиоприна следует учитывать как риск отторжения трансплантата у матери, так и неблагоприятное воздействие этих лекарственных средств на плод.
Степень доказанности: C.
Класс III:
1. Грудное вскармливание младенцев не показано в связи с тем, что безопасность применяемых препаратов не изучена.
Степень доказанности: C.
Рекомендации по контрацепции у больных после трансплантации сердца.
Класс I:
1. Комбинированные гормональные контрацептивы назначаются после оценки факторов риска возможных тромботических осложнений (тромбоэмболии в анамнезе или у близких родственников);
Степень доказанности: C.
2. Мониторирование концентрации препаратов иммуносупрессивной терапии в крови необходимо у больных, получающих комбинированную иммуносупрессивную терапию в связи с тем, что комбинированные пероральные контрацептивы оказывают ингибирующее действие на CYP3A4;
Степень доказанности: C.
3. Барьерные методы контрацепции не обеспечивают адекватного уровня предохранения от нежелательной беременности. Вместе с тем, они рекомендованы всем больным после пересадки сердца, ведущих активную сексуальную жизнь как средство профилактики заражения инфекциями, передающимися половым путем.
Степень доказанности: C.
Класс IIb:
1. Внутриматочные средства контрацепции не рекомендованы для использования у больных после трансплантации сердца, особенно у нерожавших женщин в связи с возможным риском воспалительных и инфекционных осложнений и бесплодия.
Степень доказанности: C.
Класс III:
1. Использование депонированной формы медроксипрогестерона ацетата может сопровождаться уменьшением минеральной плотности костной ткани, и в связи с этим, не рекомендуется у больных после трансплантации сердца;
Степень доказанности: C.
2. Пероральные гормональные контрацептивы противопоказаны больным после трансплантации сердца с артериальной гипертонией, БКАПС, эстроген-зависимыми опухолями или заболеваниями печени.
Степень доказанности: C.
Рекомендации по профилактике и лечению болезней, передающихся половым путем.
Класс I:
1. Врачи, наблюдающие больных после трансплантации сердца, должны обладать полной информацией о сексуальной жизни больных и, в том числе, перенесенных половых инфекциях;
Степень доказанности: C.
2. У взрослых больных после трансплантации сердца, ведущих активную половую жизнь и имеющие нескольких сексуальных партнеров следует регулярно проводить исследование на наличие инфекций, передающихся половым путем, включающее аногенитальное исследование с целью выявления кондилом, моллюсков, или признаков заболевания вирусом простого герпеса;
Степень доказанности: C.
3. При выявлении типичных урогенитальных симптомов болезней, передающихся половым путем, следует начинать эмпирическую антимикробную терапию до получения результатов анализов;
Степень доказанности: C.
4. Вакцинирование при помощи квадривалентной вакцины против вируса папиломы человека может снизить риск заражения вирусом простого герпеса и генитальных кондилом. Женщинам показано введение всех трех доз вакцины до трансплантации сердца. Противопоказаний к назначению вакцины после трансплантации сердца нет, однако доказательств ее эффективности при таком введении получено не было.
Степень доказанности: C.
Рекомендации по лечению эректильной дисфункции у больных после трансплантации сердца.
Класс I:
1. Эректильная дисфункция после трансплантации сердца может быть вызвана ятрогенными причинами. У больных с эректильной дисфункцией целесообразно рассмотреть вопрос о замене лекарственных средств с учетом их эффективности и побочных действий;
Степень доказанности: C.
2. Ингибиторы фософодиэстеразы могут быть использованы в качестве лекарственных средств для лечения эректильной дисфункции у больных после трансплантации сердца. При этом, следует избегать сочетанного назначения ингибиторов фосфодиэстеразы с нитратами (потенцирование гипотензивного действия).
Степень доказанности: C.
1. Дополнительная информация
Отбор доноров для трансплантации сердца.
Критерии отбора оптимальных доноров для трансплантации сердца.
Класс I:
1. Сердца от доноров моложе 45 лет обладают достаточным резервом для адекватного восстановления даже при условии длительной ишемии. Сердца от доноров в возрасте от 45 до 55 лет следует использовать, когда прогнозируемое время ишемии составляет <= 4 часов и реципиент не имеет сопутствующих заболеваний. Использование сердец от доноров > 55 лет следует рассматривать только в ургентных случаях;
Степень доказанности: B.
2. Использование сердец от доноров, принимавших или продолжающих принимать кокаин, возможно при условии нормальной функции миокарда и отсутствии гипертрофии левого желудочка;
Степень доказанности: C.
3. Использование сердец от доноров, причиной смерти которых была интоксикация окисью углерода, может быть рекомендовано с осторожностью. При этом должны быть удовлетворительные показатели ЭКГ и эхокардиографии, минимальные показатели концентрации сердечных маркеров и невысокая инотропная поддержка, относительно короткое время ишемии, хорошее соотношение веса донора и реципиента и нормальные показатели легочно-сосудистого сопротивления.
Степень доказанности: B.
Использование донорских сердец с нарушениями сокращения и проводимости.
Класс I:
1. Не должны использоваться сердца от доноров: в присутствии неразрешимыми желудочковых аритмий, необходимости в чрезмерной инотропной поддержке (допамин в дозе 20 мкг/кг/мин или аналогичных дозах другими адренергическими препаратами несмотря на агрессивную оптимизацию пред- и постнагрузки), нарушений сократимости по данным эхокардиографии или фракцией выброса левого желудочка (ФВ ЛЖ) < 40%, несмотря на оптимизацию гемодинамики инотропными препаратами;
Степень доказанности: B.
2. Сердце донора с нормально функционирующим двустворчатым аортальным клапаном могут быть использованы при трансплантации. При анатомических и гемодинамических нарушениях функции митрального или аортального клапанов возможно выполнение пластики или полной замены клапана с последующей трансплантацией.
Степень доказанности: C.
Класс IIa:
1. Использование донорского сердца с поражением коронарных артерий следует избегать, если сердце не рассматривается для кандидата, с ургентными показаниями к ТС;
Степень доказанности: C.
2. Представляется возможным использовать сердца от доноров с гипертрофией левого желудочка (ГЛЖ) при отсутствии выраженных изменений на ЭКГ и толщине стенки ЛЖ < 14 мм;
Степень доказанности: C.
Рекомендации по подбору пары донор-реципиент по массе тела.
Класс I:
1. Рекомендуется использование сердца от доноров, чей вес отличается от веса реципиента не более, чем на 30%. Кроме того, мужчин-доноров со средним весом (70 кг) можно безопасно использовать для реципиентов практически любого веса. К использованию сердец от доноров-женщин, вес которых отличается от веса реципиентов-мужчин более чем на 20%, следует отнестись с большой осторожностью.
Степень доказанности: C.
Рекомендации по оптимальному времени ишемии трансплантата.
Класс I:
Оптимальное время ишемии трансплантата - менее 4 часов. В ситуации, когда предполагаемое время ишемии может превысить 4 часа, необходимо использование сердец от доноров молодого возраста, с нормальной функцией, и небольшой инотропной поддержкой.
Степень доказанности: C.
Критерии оценки качества медицинской помощи
Критерии оценки качества медицинской помощи больным с критической сердечной недостаточностью, реципиентам трансплантированного сердца и реципиентам трансплантированного сердца с клиническими признаками отторжения/дисфункции сердечного трансплантата представлены в Табл. 7 - 9.
Таблица 7. Критерии оценки качества медицинской помощи больным с критической сердечной недостаточностью
N пп.
Критерий
Класс рекомендаций
Уровень достоверности доказательств
1
Осмотр (консультация) лечащего врача - ежедневно в стационаре
I
C
2
Клинические (инструментальные, лабораторные) обследования, необходимые для выявления показаний и оценки периоперационного риска у потенциальных реципиентов сердца
I
C
3
Консультация ведущего специалиста (профессора)
I
C
4
Определение тактики лечения больного критической сердечной недостаточностью: включение в лист ожидания трансплантации сердца/имплантация устройства механической поддержки кровоообращения в качестве временного или постоянного средства лечения/медикаментозная терапия
I
C
5
Выполнение ортотопической трансплантации сердца больным, включенным в лист ожидания/имплантация устройства механической поддержки кровообращения в качестве временного или постоянного средства лечения
I
C
6
Индивидуальный подбор комбинированной иммуносупрессивной терапии, а также лекарственных средств для профилактики инфекционных осложнений, побочных действий лекарственных средств с узким терапевтическим диапазоном и средств, улучшающих отдаленный прогноз
I
C
Таблица 8. Критерии оценки качества медицинской помощи реципиентам трансплантированного сердца
N пп.
Критерий
Вид критерия
Этап мед. помощи
1
Осмотр (консультация) лечащего врача - ежедневно в стационаре
I
C
2
Клинические (инструментальные, лабораторные) обследования, необходимые для неинвазивной оценки функции сердечного трансплантата
I
C
3
Консультация ведущего специалиста (профессора)
I
C
4
Коронароангиографическое исследование в течение первых 30 дней после выполнения трансплантации сердца, ежегодно при плановых обследованиях, а также при необходимости лечения и контроля у больных с признаками болезни коронарных артерий пересаженного сердца
I
C
5
Определение концентрации такролимуса или циклоспорина в крови не реже 2 раз в неделю в течение первого месяца после операции трансплантации сердца
I
C
6
Эндомиокардиальная биопсия (ЭМБ) в течение первых 10 дней после операции трансплатации сердца, повторная ЭМБ не позднее двух последующих недель, последующие ЭМБ через 3, 6, 12 месяцев, далее ежегодно
I
C
6
Индивидуальный подбор комбинированной иммуносупрессивной терапии, а также лекарственных средств для профилактики инфекционных осложнений, побочных действий лекарственных средств с узким терапевтическим диапазоном и средств, улучшающих отдаленный прогноз
I
C
Таблица 9. Критерии оценки качества медицинской помощи реципиентам трансплантированного сердца с клиническими признаками отторжения/дисфункции сердечного трансплантата
N пп.
Критерий
Вид критерия
Этап мед. помощи
1
Осмотр (консультация) лечащего врача - ежедневно в стационаре
I
C
2
Клинические (инструментальные, лабораторные) обследования, необходимые для неинвазивной оценки функции сердечного трансплантата
I
C
3
Консультация ведущего специалиста (профессора)
I
C
4
Коронароангиографическое исследование в течение первой недели после поступления больного в стационар
I
C
5
Определение концентрации такролимуса или циклоспорина в крови не реже 2 раз в неделю
I
C
6
Эндомиокардиальная биопсия (ЭМБ) в течение первых 5 дней после после поступления больного в стационар
I
C
7
Назначение этиотропной терапии в течение первого часа после поступления больного в стационар
I
C
6
Индивидуальный подбор комбинированной иммуносупрессивной терапии, а также лекарственных средств для профилактики инфекционных осложнений, побочных действий лекарственных средств с узким терапевтическим диапазоном и средств, улучшающих отдаленный прогноз
I
C
Список литературы
1 Yancy C.W., Jessup M., Bozkurt B., Butler J., Casey D.E. Jr., Drazner M.H., Fonarow G.C., Geraci S.A., Horwich T., Januzzi J.L., Johnson M.R., Kasper E.K., Levy W.C., Masoudi F.A., McBride P.E., McMurray J.J.V., Mitchell J.E., Peterson P.N., Riegel B., Sam F., Stevenson L.W., Tang W.H.W., Tsai E.J., Wilkoff B.L. ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013; 128: e240 - e327.
2 McMurray J.J., Adamopoulos S., Anker S.D. et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2012; 14 (8): 803 - 869.
3 Готье С.В., Шевченко А.О., Кормер А.Я., Попцов В.Н., Саитгареев Р.Ш., Шумаков Д.В., Захаревич В.М. Три десятилетия трансплантации сердца в ФНЦ ТИО имени академика В.И. Шумакова: отдаленные результаты. Вестник трансплантологии и искусственных органов. 2015. Т. 15. N 2. С. 70 - 73.
4 Lund et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Heart Transplantation Report - 2015. J Heart Lung Transplant 2015; 34: 1244 - 1254.
5 Мареев В.Я., Агеев Ф.Т., Арутюнов Г.П., Коротеев А.В., Ревишвили А.Ш. Национальные рекомендации ВНОК И ОССН по диагностике и лечению ХСН (третий пересмотр). Журнал Сердечная Недостаточность. Том 11, N 1 (57), 2010 г.
6 Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2015 году. VIII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2016 XVIII; (2): 5 - 23.
7 Готье С.В., Шевченко А.О., Кормер А.Я., Попцов В.Н., Шевченко О.П. Перспективы улучшения отдаленных результатов трансплантации сердца. Вестник трансплантологии и искусственных органов. 2014. Т. XVI. N 3. С. 23 - 30.
8 Mikus E., Stepanenko A., Krabatsch T. et al. Reversibility of fixed pulmonary hypertension in left ventricular assist device support recipients. Eur J Cardiothorac Surg 2011; 40: 971 - 7.
9 Kutty R.S., Parameshwar J., Lewis C., et al. Use of centrifugal left ventricular assist device as a bridge to candidacy in severe heart failure with secondary pulmonary hypertension. Eur J Cardiothorac Surg 2013; 43: 1237 - 42.
10 Goldstein D.J., Bello R., Shin J.J. et al. Outcomes of cardiac transplantation in septuagenarians. J Heart Lung Transplant 2012; 31: 679 - 85.
11 Weiss E.S., Allen J.G., Russell S.D., Shah A.S., Conte J.V. Impact of recipient body mass index on organ allocation and mortality in orthotopic heart transplantation. J Heart Lung Transplant 2009; 28: 1150 - 7.
12 Russo M.J., Hong K.N., Davies R.R. et al. The effect of body mass index on survival following heart transplantation: do outcomes support consensus guidelines? Ann Surg 2010; 251: 144 - 52.
13 Mehra M.R. et al. The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. January 2016 Volume 35, Issue 1, Pages 1 - 23.
14 Feldman D. et al. The 2013 International Society for Heart and Lung Transplantation Guidelines for mechanical circulatory support. The Journal of Heart and Lung Transplantation, 2013 Vol. 32, Issue 2, p157 - 187.
15 Sharing the Care of Kiernan M.S. et al. for the Evolving Mechanical Support Research Group (EMERG) Investigators. Mechanical Circulatory Support: Collaborative Efforts of Patients/Caregivers, Shared-Care Sites, and Left Ventricular Assist Device Implanting Centers. Circ Heart Fail. 2015; 8: 629 - 635.
16 Gurbanov E., Meng X., Cui Y. Evaluation ECMO in adult cardiac transplantation: can outcomes of marginal donor hearts be improved?//J. Cardiovasc. Surg. (Torino). 2011; 52 (3): 419 - 427.
17 Готье С.В., Попцов В.Н. Новая практика организации лечения критической сердечной недостаточности. Вестник трансплантологии и искусственных органов. 2015. Т. 15. N 2. С. 74 - 76.
18 Иткин Г.П., Попцов В.Н. Механизмы правожелудочковой недостаточности в условиях левожелудочкового вспомогательного кровообращения и методы бивентрикулярного обхода сердца. Вестник трансплантологии и искусственных органов. 2013. Т. XV. N 4. С. 126 - 135.
19 Kirklin J.K., Naftel D.C., Pagani F.D., et al. Seventh INTERMACS annual report: 15,000 patients and counting. J. Heart Lung Transplant. 2015; 34: 1495 - 1504.
20 Готье С.В., Иткин Г.П., Шемакин С.Ю., Саитгареев Р.Ш., Попцов В.Н., Захаревич В.М., Акопов Г.А., Кормер А.Я., Халилулин Т.А., Шевченко О.П., Невзоров А.М., Филатов И.А., Селищев С.В. Первый опыт клинического применения отечественного аппарата вспомогательного кровообращения на базе имплантируемого осевого насоса для двухэтапной трансплантации сердца. Вестник трансплантологии и искусственных органов. 2013. Т. XV. N 3. С. 92 - 101.
21 Gill R.S., Karmali S., Nagandran J., Frazier H.O., Sherman V. Combined ventricular assist device placement with adjustable gastric band (VAD-BAND): a promising new technique for morbidly obese patients awaiting potential cardiac transplantation. J Clin Med Res 2012; 4: 127 - 9.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
N пп
ФИО
Ученая степень
Ученое звание
Почетные звания и награды
Профессиональная ассоциация
1
Бельских Леонид Владиславович
к.м.н.
ОООТ "Российское трансплантологическое общество"
2
Гичкун Ольга Евгеньевна
к.м.н.
3
Гордеев Михаил Леонидович
д.м.н.
проф.
4
Готье Сергей Владимирович
д.м.н.
проф.,
акад.
РАН
ЗВ, пр. Прав. РФ 2008, 2014
5
Захаревич Вячеслав Мефодьевич
д.м.н.
пр. Прав. РФ 2014
6
Климушева Наталья Федоровна
к.м.н.
7
Минина Марина Геннадьевна
д.м.н.
пр. Прав. РФ 2014
8
Миронков Борис Леонтьевич
д.м.н.
проф.
9
Николаев Герман Викторович
к.м.н.
10
Платонов Вадим Сергеевич
к.м.н.
11
Попцов Виталий Николаевич
д.м.н.
проф.
пр. Прав. РФ 2014
12
Порханов Владимир Алексеевич
д.м.н.
проф., чл. кор. РАН
ЗВ, пр. Прав. РФ 2014
13
Саитгареев Ренат Шакирьянович
д.м.н.
проф.
ЗВ, пр. Прав. РФ 2014
14
Столяревич Екатерина Сергеевна
д.м.н.
15
Хомяков Сергей Михайлович
к.м.н.
16
Чернявский Александр Михайлович
д.м.н.
проф.
пр. Прав. РФ 2014
17
Шевченко Алексей Олегович
д.м.н.
проф. РАН
18
Шевченко Ольга Павловна
д.м.н.
проф.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
Врачи следующих специальностей:
1. Кардиология;
2. Терапия;
3. Анестезиология-реаниматология;
4. Детская кардиология;
5. Общая врачебная практика;
6. Патологоанатомия;
7. Сердечно-сосудистая хирургия;
8. Рентгенэндоваскулярные диагностика и лечение.
Классификация рекомендаций и степени доказанности
При создании данных клинических рекомендаций использовались приведенные ниже классификация рекомендаций и уровни достоверности доказательств (степени доказанности) - таблицы П1 и П2). Следует отметить, что с учетом специфики контингента больных критической сердечной недостаточностью и относительно небольшого количества клинических центров, в которых выполняются операции трансплантации сердца и имплантация систем для механической поддержки кровообращения, возможность проведения мультицентровых и рандомизированных исследований ограничена и большинство рекомендации имеет степень доказанности "C".
Таблица П1. Классы рекомендаций
Класс I: по данным клинических исследований и/или по общему мнению данный метод лечения или вмешательство полезны и эффективны
Класс II: противоречивые данные и/или расхождение мнений по поводу пользы/эффективности предлагаемого метода лечения или вмешательства
Класс IIa: имеющиеся данные свидетельствуют в пользу эффективности метода лечения или вмешательства
Класс IIb: польза/эффективность метода лечения или вмешательства установлены менее убедительно
Класс III: по данным клинических исследований или общему мнению метод лечения или вмешательство бесполезны/неэффективны и в некоторых случаях могут быть вредны
Таблица П2. Уровни достоверности доказательств (степени доказанности)
Степень A: доказательства получены в многочисленных рандомизированных клинических исследованиях или мета-анализах
Степень B: доказательства получены в единственном рандомизированном клиническом исследовании или крупных нерандомизированных исследованиях
Степень C: в основе рекомендации лежит общее мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Порядок обновления клинических рекомендаций
Национальные рекомендации по Трансплантации сердца и механической поддержке кровообращения обновляются не реже одного раза в два года, утверждаются решением Координационного Совета общероссийской общественной организации трансплантологов "Российское трансплантологическое общество", рассматриваются и рекомендуются к утверждению Профильной комиссией по трансплантологии Минздрава России.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Лечение больных критической сердечной недостаточностью осуществляется в рамках законодательства Российской Федерации и представлен в следующих нормативных документах:
1. Федеральные законы РФ
- Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 26.04.2016) "Об основах охраны здоровья граждан в Российской Федерации", Статья 47. Донорство органов и тканей человека и их трансплантация (пересадка)
- "О донорстве органов, частей органов человека и их трансплантации" (проект федерального закона)
2. Постановления Правительства РФ
- "Об утверждении Правил определения момента смерти человека, в том числе критериев и процедуры установления смерти человека, Правил прекращения реанимационных мероприятий и формы протокола установления смерти человека" от 20 сентября 2012 г. N 950
- "О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра "Сколково")" от 16 апреля 2012 г. N 291
- "О порядке финансового обеспечения медицинской деятельности, связанной с донорством органов человека в целях трансплантации (пересадки), за счет бюджетных ассигнований федерального бюджета" от 23 января 2016 г. N 33.
3. Приказы Минздрава (Минздравсоцразвития) России
- "Об утверждении Порядка оказания медицинской помощи по профилю "хирургия (трансплантация органов и (или) тканей человека)" от 31 октября 2012 г. N 567н
- "Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю "анестезиология и реаниматология" от 15 ноября 2012 г. N 919н
- "Об утверждении Порядка оказания медицинской помощи больным с острыми нарушениями мозгового кровообращения" от 15 ноября 2012 г. N 928н
- "Об утверждении Инструкции по констатации смерти человека на основании диагноза смерти мозга" от 20 декабря 2001 г. N 460
- "О Порядке установления диагноза смерти мозга человека" от 25 декабря 2014 г. N 908н (вступил в силу с 1 января 2016 г.)
- "Об утверждении Инструкции по определению критериев и порядка определения момента смерти человека, прекращения реанимационных мероприятий" от 4 марта 2003 г. N 73
- "Об утверждении перечня учреждений здравоохранения, осуществляющих забор, заготовку и трансплантацию органов и (или) тканей человека" от 4 июня 2015 г. N 307н/4
- "Об утверждении перечня объектов трансплантации" от 4 июня 2015 г. N 306н/3.
- "О медицинском заключении о необходимости трансплантации органов и (или) тканей человека" от 25 мая 2007 г. N 358
- "Об утверждении перечня видов высокотехнологичной медицинской помощи" от 29 декабря 2012 г. N 1629н
4. Международные акты
- Руководящие принципы ВОЗ по трансплантации человеческих клеток, тканей и органов (WHA 63.22)
- Стамбульская декларация о трансплантационном туризме и торговле органами, 2008 г.
Приложение Б
АЛГОРИТМЫ
ВЫБОРА ТАКТИКИ ЛЕЧЕНИЯ У БОЛЬНОГО
С КРИТИЧЕСКОЙ/ДЕКОМПЕНСИРОВАННОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
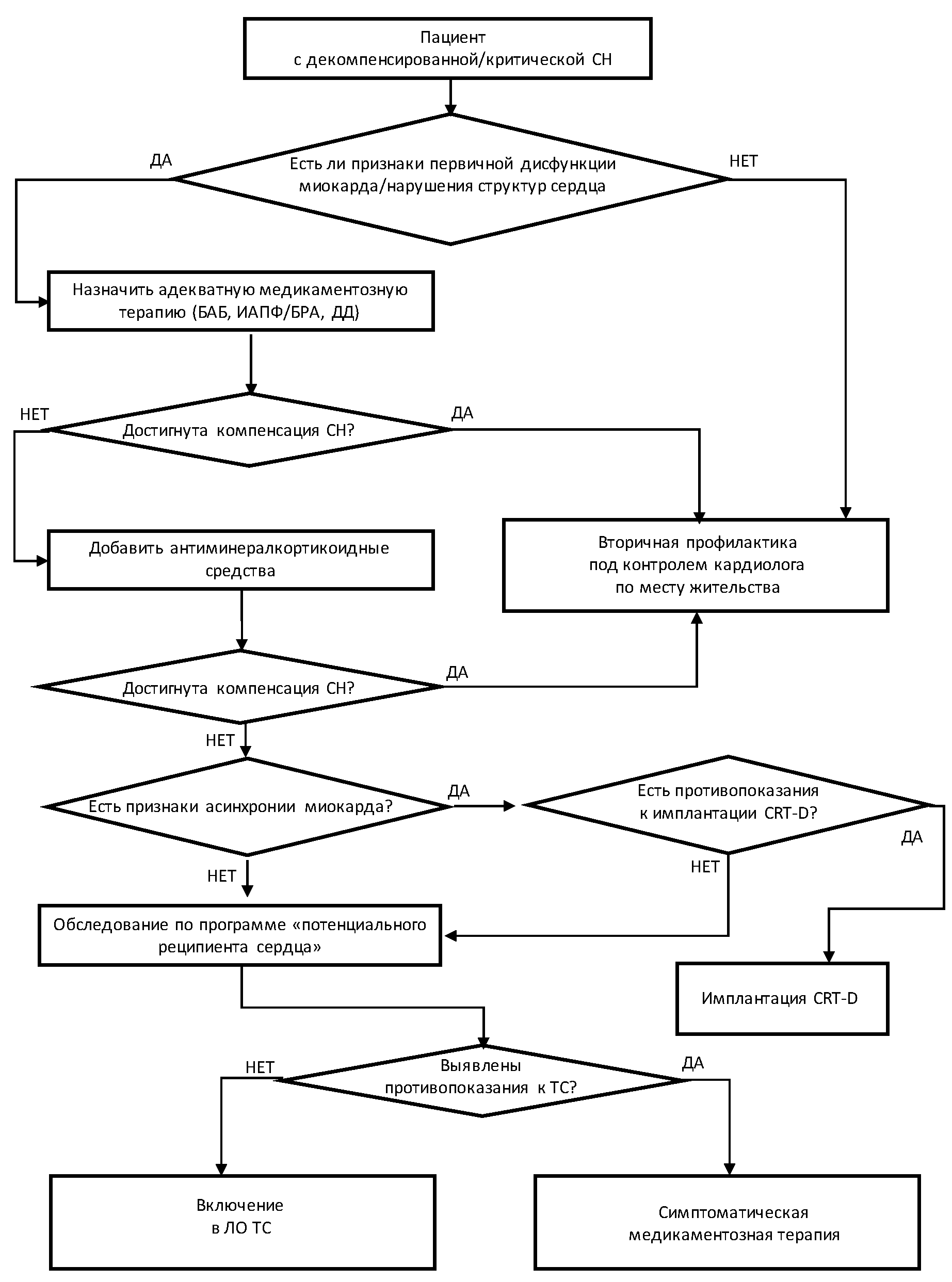
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое трансплантация сердца?
Операция ортотопической трансплантации сердца (ОТТС) является общепризнанным золотым стандартом лечения терминальной сердечной недостаточности, существенно улучшающим прогноз и качество жизни. Суть операции заключается в замене пораженного нежизнеспособного органа пациента донорским органом. В нашей стране подобные операции выполняются на протяжении трех десятилетий в ФГБУ ФНЦ Трансплантологии и искусственных органов им. ак. В.И. Шумакова, а также, на протяжении последнего десятилетия подобные операции стали выполняться и в других российских трансплантационных центрах.
Имплантируемый аппарат вспомогательного кровообращения может быть эффективной альтернативой у ряда пациентов, или использоваться в качестве "моста" у пациентов, ожидающих трансплантацию сердца.
Как проходит пересадка сердца?
На основании комплексного обследования врачи выбирают наиболее оптимальную тактику лечения заболевания, и если принимается решение о необходимости выполнения трансплантации сердца, пациент включается в лист ожидания, ему даются рекомендации по лечению и образу жизни в период ожидания операции.
Как проходит операция?
Операция трансплантации сердца совершенно безболезненна для пациента. Несмотря на то, что сама операция может длиться много часов, пациент не ощущает ни боли, ни дискомфорта, поскольку он спит, находясь под действием комбинации лекарственных препаратов.
После пробуждения в течение нескольких дней пациент находится в отделении реанимации, и, как только позволит его состояние - переводится в отделение кардиологии и кардиохирургии, где будет находиться еще две-три недели.
В течение раннего послеоперационного периода пациент под наблюдением врачей восстанавливается, проходит необходимые обследования, позволяющие оценить функцию трансплантата и предупредить возможные послеоперационные осложнения. Тогда же происходит подбор иммуносупрессивной терапии.
Сколько живут пациенты с пересаженным сердцем?
Анализ регистра ФНЦ Трансплантологии и искусственных органов им. ак. В.И. Шумакова, где наблюдается подавляющее большинство реципиентов пересаженного сердца свидетельствует о том, что средняя продолжительность жизни пациентов, оперированных в 2010 - 2016 года должна составить 25 лет. Здесь следует принять во внимание тот факт, что трансплантация сердца выполняется лишь пациентам, чья ожидаемая продолжительность жизни, по причине болезни, не превышает 1 - 2 лет. Также, необходимо понимать, что дисфункция сердечного трансплантата - это не приговор. Существует целый ряд методов, вплоть до повторной трансплантации сердца, позволяющий не только сохранить жизнь пациенту, но и поддержать его физическую активность и трудоспособность.
Как жить с трансплантированным сердцем?
Трансплантация сердца позволяет восстановить физическую и социальную активность пациента. При этом, пациенты должны постоянно принимать назначенные лекарственные средства и регулярно проходить профилактические обследования по индивидуальному плану, что, впрочем, не оказывает существенного влияния на трудоспособность и возможность жить полноценной активной жизнью.
