Постановление Правительства РФ от 15.09.2015 N 979
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОСТАНОВЛЕНИЕ
от 15 сентября 2015 г. N 979
О ВНЕСЕНИИ ИЗМЕНЕНИЙ
В ПОСТАНОВЛЕНИЕ ПРАВИТЕЛЬСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
ОТ 29 ОКТЯБРЯ 2010 Г. N 865 И ОБ УТВЕРЖДЕНИИ МЕТОДИКИ
РАСЧЕТА ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ
НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ВКЛЮЧЕННЫЕ В ПЕРЕЧЕНЬ ЖИЗНЕННО
НЕОБХОДИМЫХ И ВАЖНЕЙШИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Правительство Российской Федерации постановляет:
1. Утвердить прилагаемые:
изменения, которые вносятся в постановление Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" (Собрание законодательства Российской Федерации, 2010, N 45, ст. 5851; 2011, N 50, ст. 7390; 2012, N 37, ст. 5002);
методику расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов.
1(1). Министерству здравоохранения Российской Федерации и Федеральной антимонопольной службе давать при необходимости разъяснения по применению методики расчета устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при их государственной регистрации и перерегистрации, утвержденной настоящим постановлением.
2. Настоящее постановление вступает в силу с 1 октября 2015 г.
Председатель Правительства
Российской Федерации
Д.МЕДВЕДЕВ
Утверждены
постановлением Правительства
Российской Федерации
от 15 сентября 2015 г. N 979
ИЗМЕНЕНИЯ,
КОТОРЫЕ ВНОСЯТСЯ В ПОСТАНОВЛЕНИЕ ПРАВИТЕЛЬСТВА РОССИЙСКОЙ
ФЕДЕРАЦИИ ОТ 29 ОКТЯБРЯ 2010 Г. N 865
1. Абзац второй пункта 1 изложить в следующей редакции:
"Правила государственной регистрации и перерегистрации устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов;".
2. Правила государственной регистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденные указанным постановлением, изложить в следующей редакции:
"Утверждены
постановлением Правительства
Российской Федерации
от 29 октября 2010 г. N 865
(в редакции постановления
Правительства Российской Федерации
от 15 сентября 2015 г. N 979)
ПРАВИЛА
ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ И ПЕРЕРЕГИСТРАЦИИ
УСТАНАВЛИВАЕМЫХ ПРОИЗВОДИТЕЛЯМИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ,
ВКЛЮЧЕННЫЕ В ПЕРЕЧЕНЬ ЖИЗНЕННО НЕОБХОДИМЫХ
И ВАЖНЕЙШИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
1. Настоящие Правила устанавливают порядок осуществления государственной регистрации и перерегистрации устанавливаемых производителями государств - членов Евразийского экономического союза и иностранными производителями лекарственных препаратов (далее - производители) предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, ежегодно утверждаемый Правительством Российской Федерации (далее - лекарственные препараты).
2. Государственная регистрация и перерегистрация предельных отпускных цен производителей на лекарственные препараты осуществляется в рублях.
3. Министерство здравоохранения Российской Федерации осуществляет регистрацию предельной отпускной цены производителя на лекарственный препарат, ее перерегистрацию, внесение указанной зарегистрированной (перерегистрированной) предельной отпускной цены в государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов (далее - государственный реестр), выдачу держателю или владельцу регистрационного удостоверения лекарственного препарата (уполномоченному им лицу) выписки из приказа Министерства здравоохранения Российской Федерации о государственной регистрации (перерегистрации) предельной отпускной цены производителя на лекарственный препарат.
4. Для государственной регистрации и перерегистрации предельной отпускной цены производителя на лекарственный препарат в Министерство здравоохранения Российской Федерации представляются следующие документы (на бумажном носителе в 2 экземплярах и в электронном виде):
а) заявление о регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат по форме, утверждаемой Министерством здравоохранения Российской Федерации, содержащее следующие сведения:
наименование держателя или владельца регистрационного удостоверения лекарственного препарата, адрес электронной почты, наименование производителя, место нахождения производственных площадок, участвующих в процессе производства лекарственного препарата, с указанием стадии процесса производства;
наименование лекарственного препарата (международное непатентованное, или группировочное, или химическое и торговое наименования);
номер регистрационного удостоверения лекарственного препарата;
лекарственная форма с указанием дозировки лекарственного препарата и его количества во вторичной (потребительской) упаковке, а также комплектность;
штриховой код, нанесенный на вторичную (потребительскую) упаковку лекарственного препарата;
код лекарственного препарата по анатомо-терапевтическо-химической классификации, рекомендованной Всемирной организацией здравоохранения;
код лекарственного препарата в соответствии с Общероссийским классификатором продукции и (или) единой Товарной номенклатурой внешнеэкономической деятельности Евразийского экономического союза;
предельная отпускная цена производителя на лекарственный препарат, рассчитанная в соответствии с методикой расчета устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при их государственной регистрации и перерегистрации, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979 "О внесении изменений в постановление Правительства Российской Федерации от 29 октября 2010 г. N 865 и об утверждении методики расчета устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при их государственной регистрации и перерегистрации" (далее - методика);
подпись и расшифровка подписи уполномоченного лица, должность, контактные телефоны;
б) копия лицензии на производство лекарственных средств;
в) копия регистрационного удостоверения лекарственного препарата;
г) следующие документы, представляемые с учетом требований методики:
сведения об объемах и ценах отпуска находящихся в обращении в Российской Федерации лекарственных препаратов производства государств - членов Евразийского экономического союза;
расчет предельных отпускных цен на лекарственные препараты производства государств - членов Евразийского экономического союза, представляемых на государственную регистрацию;
расчет предельных отпускных цен на лекарственные препараты производства государств - членов Евразийского экономического союза, представляемых на государственную перерегистрацию;
обоснование предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, представляемых на государственную регистрацию или перерегистрацию;
сведения об объемах и ценах ввоза лекарственных препаратов иностранного производства, находящихся в обращении на территории Российской Федерации;
расчет предельных отпускных цен на лекарственные препараты иностранного производства, представляемых на государственную регистрацию.
5. Министерство здравоохранения Российской Федерации не вправе требовать у держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица) представления копий документов, предусмотренных подпунктами "б" и "в" пункта 4 настоящих Правил. Держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) вправе представить копии указанных документов по собственной инициативе.
6. В случае представления держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) заявления о регистрации предельной отпускной цены производителя на лекарственный препарат до истечения 3 лет со дня принятия решения об исключении предельной отпускной цены на заявляемый лекарственный препарат из государственного реестра, принятого на основании заявления этого держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица), заявленная предельная отпускная цена не может превышать ранее исключенную.
7. Министерство здравоохранения Российской Федерации в течение 15 рабочих дней со дня обращения держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица):
а) осуществляет проверку полноты представленных в соответствии с пунктом 4 настоящих Правил документов (далее - документы) и содержащихся в них сведений;
б) в случае если держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) не представил:
копию регистрационного удостоверения на лекарственный препарат, - проверяет сведения о государственной регистрации лекарственного препарата на основании данных государственного реестра лекарственных средств;
копию лицензии на производство лекарственных средств, - запрашивает и получает в порядке межведомственного информационного взаимодействия от Министерства промышленности и торговли Российской Федерации информацию о наличии по данным реестра лицензий на производство лекарственных средств для медицинского применения соответствующей лицензии у производителя (в отношении российского производителя);
в) проводит в соответствии с методикой проверку предельной отпускной цены производителя на лекарственный препарат для решения вопроса о направлении 1 экземпляра документов в Федеральную антимонопольную службу;
г) принимает решение об отказе в государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат в случае отсутствия в представленных документах необходимых сведений, выявления содержащихся в них недостоверных сведений или превышения заявленной предельной отпускной цены при подаче заявления с учетом требований пункта 6 настоящих Правил, а также в случае непредставления сведений в соответствии с пунктом 10 настоящих Правил.
8. Федеральная антимонопольная служба в течение 15 рабочих дней со дня получения документов проводит в соответствии с методикой экономический анализ предельной отпускной цены производителя на лекарственный препарат, а также принимает и направляет в Министерство здравоохранения Российской Федерации решение о согласовании указанной предельной отпускной цены или об отказе в ее согласовании (с изложением причин отказа).
9. Министерство здравоохранения Российской Федерации в течение 5 рабочих дней со дня получения решения Федеральной антимонопольной службы о согласовании предельной отпускной цены производителя на лекарственный препарат или об отказе в ее согласовании принимает решение о государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат или об отказе в государственной регистрации указанной цены с учетом решения, принятого Федеральной антимонопольной службой.
10. В случае необходимости уточнения сведений, содержащихся в представленных документах, получения дополнительной необходимой информации держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) представляет по запросу Министерства здравоохранения Российской Федерации соответствующую документально оформленную информацию. При этом срок рассмотрения документов, предусмотренный пунктом 7 настоящих Правил, увеличивается не более чем на 10 рабочих дней.
В случае необходимости уточнения сведений, содержащихся в представленных документах, получения дополнительной необходимой информации держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо), юридические лица, осуществляющие деятельность при обращении лекарственных средств, органы исполнительной власти в пределах их компетенции представляют по запросу Федеральной антимонопольной службы соответствующую документально оформленную информацию. При этом срок рассмотрения документов, предусмотренный пунктом 8 настоящих Правил, увеличивается не более чем на 10 рабочих дней.
При непоступлении от держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица) в пределах установленного срока запрошенной документально оформленной информации Федеральная антимонопольная служба в течение 5 рабочих дней со дня истечения срока ее представления принимает решение об отказе в согласовании предельной отпускной цены производителя на лекарственный препарат и направляет его в Министерство здравоохранения Российской Федерации, которое в течение 5 рабочих дней со дня получения этого решения принимает решение об отказе в государственной регистрации или перерегистрации указанной цены, о чем в письменной форме уведомляет держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченное им лицо).
11. В случае принятия решения о государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат Министерство здравоохранения Российской Федерации вносит соответствующие данные в государственный реестр, выдает держателю или владельцу регистрационного удостоверения лекарственного препарата (уполномоченному им лицу) выписку из приказа о государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат и размещает соответствующую информацию на своем официальном сайте в информационно-телекоммуникационной сети "Интернет".
12. В случае принятия решения об отказе в государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат Министерство здравоохранения Российской Федерации уведомляет держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) в письменной форме о принятом решении (с изложением причин отказа).
13. Основанием для отказа в согласовании Федеральной антимонопольной службой государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат, отказа в государственной регистрации или перерегистрации Министерством здравоохранения Российской Федерации предельной отпускной цены производителя на лекарственный препарат с учетом решения, принятого Федеральной антимонопольной службой, является:
а) представление недостоверных сведений;
б) представление документов в неполном объеме и (или) неполнота содержащихся в них сведений;
в) превышение представленной для государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат над ценой, рассчитанной в соответствии с методикой.
14. Решение об отказе в государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат может быть обжаловано в судебном порядке.
15. Для государственной регистрации предельных отпускных цен производителей на лекарственные препараты, не поступавшие в обращение на территории Российской Федерации, кроме документов, представляются:
а) производителями государств - членов Евразийского экономического союза:
расчет расходов, связанных с разработкой, производством и реализацией лекарственного препарата, с представлением необходимых документов;
данные об учетной политике предприятия в части способа учета и распределения общепроизводственных и общехозяйственных расходов на себестоимость лекарственных препаратов;
данные, документально подтверждающие сумму общепроизводственных и общехозяйственных расходов;
информация о способе отнесения общепроизводственных и общехозяйственных расходов на себестоимость конкретного лекарственного препарата;
данные об объемах выпуска лекарственного препарата, его удельном весе в общем объеме производимых лекарственных препаратов;
документальное подтверждение и расшифровка затрат, занимающих наибольший удельный вес в себестоимости препаратов;
расшифровка расходов на производство лекарственного препарата по статьям "Сырье" и "Материалы", а также документальное подтверждение расходов по указанным статьям;
б) производителями государств - членов Евразийского экономического союза, планирующими осуществлять первичную и (или) вторичную упаковку лекарственного препарата в Российской Федерации, держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) в случае отсутствия зарегистрированной предельной отпускной цены иностранного производителя на этот лекарственный препарат - размер минимальной отпускной цены производителя (без учета наименования производственных площадок, участвующих в процессе производства) на лекарственный препарат в странах, указанных в приложении N 4 к методике, с учетом расходов, связанных с таможенным оформлением (таможенных пошлин и сборов за таможенное оформление), а также сведения (по выбору держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица), подтверждающие представленную минимальную отпускную цену производителя на лекарственный препарат (на бумажном носителе с заверенным в установленном порядке переводом на русский язык);
в) иностранными производителями - размер минимальной отпускной цены иностранного производителя (без учета наименования производственных площадок, участвующих в процессе производства) на лекарственный препарат в странах, указанных в приложении N 4 к методике, с учетом расходов, связанных с таможенным оформлением (таможенных пошлин и сборов за таможенное оформление), а также сведения (по выбору держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица), подтверждающие представленную минимальную отпускную цену иностранного производителя на лекарственный препарат (на бумажном носителе с заверенным в установленном порядке переводом на русский язык).
16. Держатель или владелец регистрационного удостоверения (уполномоченное им лицо) воспроизведенного лекарственного препарата иностранного производства или воспроизведенного лекарственного препарата производства государств - членов Евразийского экономического союза, не находящегося в обращении в Российской Федерации, представляет для государственной регистрации предельную отпускную цену производителя на лекарственный препарат, не превышающую 80 процентов средней зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат, рассчитанной за период 3 лет до представления держателем или владельцем регистрационного удостоверения (уполномоченным им лицом) указанного воспроизведенного лекарственного препарата предельной отпускной цены, рассчитанной исходя из стоимости одной лекарственной формы, а в случае его отсутствия - предельную отпускную цену, не превышающую 80 процентов максимальной зарегистрированной предельной отпускной цены производителя на аналогичный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия), рассчитанной исходя из максимальной стоимости одной лекарственной формы. В случае если с момента государственной регистрации цены на референтный лекарственный препарат прошло менее 3 лет, расчет производится исходя из фактического периода государственной регистрации цены на референтный лекарственный препарат.
Держатель или владелец регистрационного удостоверения (уполномоченное им лицо) второго и последующих воспроизведенных лекарственных препаратов иностранного производства, не находящихся в обращении в Российской Федерации, представляет для государственной регистрации предельную отпускную цену производителя на лекарственный препарат ниже на 5 процентов последней зарегистрированной предельной отпускной цены производителя на аналогичный воспроизведенный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме, дозировке (концентрации, активности в единицах действия), рассчитанной исходя из максимальной стоимости одной лекарственной формы.
При снижении от максимальной зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат, а в случае его отсутствия - от максимальной зарегистрированной цены на аналогичный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия), рассчитанной исходя из максимальной стоимости одной лекарственной формы, на 40 процентов предельная отпускная цена производителя на воспроизведенный лекарственный препарат иностранного производства не может превышать 60 процентов максимальной зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат, а в случае его отсутствия - максимальной зарегистрированной предельной отпускной цены производителя на аналогичный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия), рассчитанной исходя из максимальной стоимости одной лекарственной формы.
17. Держатель или владелец регистрационного удостоверения (уполномоченное им лицо) биоаналогового (биоподобного) лекарственного препарата иностранного производства или биоаналогового (биоподобного) лекарственного препарата производства государств - членов Евразийского экономического союза, не находящегося в обращении в Российской Федерации, представляет для государственной регистрации предельную отпускную цену производителя на лекарственный препарат, не превышающую 90 процентов средней зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат, рассчитанной за период 3 лет до представления держателем или владельцем регистрационного удостоверения (уполномоченным им лицом) указанного биоаналогового (биоподобного) лекарственного препарата предельной отпускной цены, рассчитанной исходя из стоимости одной лекарственной формы, а в случае его отсутствия - предельную отпускную цену, не превышающую 90 процентов максимальной зарегистрированной предельной отпускной цены на аналогичный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия), рассчитанной исходя из максимальной стоимости одной лекарственной формы. В случае если с момента государственной регистрации цены на референтный лекарственный препарат прошло менее 3 лет, расчет производится исходя из фактического периода государственной регистрации цены на референтный лекарственный препарат.
Держатель или владелец регистрационного удостоверения (уполномоченное им лицо) второго и последующих биоаналоговых (биоподобных) лекарственных препаратов иностранного производства, не находящихся в обращении в Российской Федерации, представляет для государственной регистрации предельную отпускную цену производителя на лекарственный препарат ниже на 5 процентов последней зарегистрированной предельной отпускной цены производителя на аналогичный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия), рассчитанной исходя из стоимости одной лекарственной формы.
При снижении от максимальной зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат, а в случае его отсутствия - от максимальной зарегистрированной предельной отпускной цены производителя на аналогичный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия), рассчитанной исходя из максимальной стоимости одной лекарственной формы, на 40 процентов предельная отпускная цена производителя на биоаналоговый (биоподобный) лекарственный препарат иностранного производства не может превышать 60 процентов максимальной зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат, а в случае его отсутствия - максимальной зарегистрированной предельной отпускной цены производителя на аналогичный лекарственный препарат (по международному непатентованному наименованию или при его отсутствии - химическому или группировочному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия), рассчитанной исходя из стоимости одной лекарственной формы.
18. Зарегистрированная предельная отпускная цена производителя на лекарственный препарат может быть перерегистрирована на основании заявления и документов, поданных держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченного им лица) до 1 октября каждого года. Государственная перерегистрация осуществляется исходя из расчета, предусмотренного методикой, не чаще 1 раза в календарном году.
19. Зарегистрированная предельная отпускная цена на лекарственный препарат производства государств - членов Евразийского экономического союза может быть перерегистрирована:
а) для лекарственных препаратов нижнесреднего ценового сегмента до 500 рублей (включительно) - в случае увеличения цен на сырье и материалы, используемые при производстве конкретного лекарственного препарата, а также накладных расходов, которые в равной степени влияют на уровень зарегистрированных цен на все лекарственные препараты, отнесенные к одному международному непатентованному наименованию (колебания валютных курсов, повышение ставок налогов, рост тарифов на электроэнергию, теплоснабжение, водоснабжение, тарифов на перевозки, цен на топливо, форс-мажорные обстоятельства, возникшие у поставщиков сырья и материалов), но не выше уровня фактической инфляции предшествующего календарного года с учетом прогнозируемого уровня инфляции текущего года, установленного федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период;
б) в случае изменения цен на сырье и материалы, а также изменения накладных расходов, но не выше прогнозируемого уровня инфляции текущего года, установленного федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период;
в) в случае если средневзвешенная фактическая отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) предельной отпускной цены, была ниже зарегистрированной на этот период цены не более чем на прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, но не выше разницы между прогнозируемым уровнем инфляции текущего года, установленного федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, и разницей, рассчитанной в процентах от зарегистрированной цены, между зарегистрированной предельной отпускной ценой производителя на лекарственный препарат и средневзвешенной фактической отпускной ценой на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) предельной отпускной цены.
20. При государственной перерегистрации предельных отпускных цен производителей государств - членов Евразийского экономического союза документы на иностранном языке представляются на бумажном носителе с заверенным в установленном порядке переводом на русский язык.
Данные в отношении всех фактических цен в валюте государства - члена Евразийского экономического союза представляются с учетом пересчета на рубли по курсу, установленному Центральным банком Российской Федерации на дату, когда производителем была осуществлена фактическая реализация лекарственных препаратов организации оптовой торговли и (или) аптечной организации либо индивидуальному предпринимателю, имеющим лицензию на фармацевтическую деятельность.
21. Зарегистрированная предельная отпускная цена на лекарственный препарат иностранного производителя может быть перерегистрирована в случае, если рост курса национальной валюты государства-производителя к рублю за период со дня государственной регистрации (последней перерегистрации) предельной отпускной цены производителя на лекарственный препарат до дня подачи документов на очередную ее перерегистрацию превышает прогнозируемый уровень инфляции текущего года, установленный федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период.
Государственная перерегистрация предельной отпускной цены для иностранных производителей осуществляется с учетом прогнозируемого уровня инфляции текущего года, установленного федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, но не выше разницы между прогнозируемым уровнем инфляции текущего года, установленным федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, и разницей, рассчитанной в процентах от зарегистрированной цены, между зарегистрированной предельной отпускной ценой производителя на лекарственный препарат и средневзвешенной фактической ценой ввоза лекарственного препарата за период, истекший со дня государственной регистрации (последней перерегистрации) предельной отпускной цены, с учетом минимальной отпускной цены производителя (без учета наименования производственных площадок, участвующих в процессе производства) на такой лекарственный препарат в странах, указанных в приложении N 4 к методике, с представлением сведений (по выбору держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица), подтверждающих представленную минимальную отпускную цену производителя на лекарственный препарат (на бумажном носителе с заверенным в установленном порядке переводом на русский язык).
22. При государственной перерегистрации предельных отпускных цен производителей государств - членов Евразийского экономического союза, в том числе осуществляющих первичную и (или) вторичную упаковку лекарственного препарата в Российской Федерации, на лекарственные препараты в случаях, предусмотренных подпунктами "а" и "б" пункта 19 настоящих Правил, предельный уровень рентабельности не может превышать 30 процентов.
23. На основании заявления держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица) о снижении зарегистрированной предельной отпускной цены производителя Министерством здравоохранения Российской Федерации рассматривается вопрос о внесении соответствующих изменений в реестровую запись государственного реестра.
В случае снижения зарегистрированной предельной отпускной цены производителя на основании заявления держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица) цена на такой препарат не может быть заявлена держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) на перерегистрацию в течение года со дня принятия решения о снижении предельной отпускной цены.
Министерство здравоохранения Российской Федерации по результатам внесения соответствующих изменений в государственный реестр выдает держателю или владельцу регистрационного удостоверения лекарственного препарата (уполномоченному им лицу) выписку из государственного реестра.
24. Государственная регистрация и перерегистрация предельных отпускных цен производителей на лекарственные препараты осуществляется для производителей бесплатно.
25. Федеральная антимонопольная служба отменяет решение о согласовании предельной отпускной цены производителя на лекарственный препарат, если после принятия такого решения установлено, что держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) были представлены повлиявшие на результат решения недостоверные сведения.
Министерство здравоохранения Российской Федерации отменяет решение о государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат в случае, если после принятия такого решения установлено, что держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) были представлены недостоверные сведения, повлиявшие на результат принятого Министерством решения, а также в случае, если Федеральная антимонопольная служба отменила решение о согласовании предельной отпускной цены производителя на лекарственный препарат. Министерство здравоохранения Российской Федерации в указанных случаях исключает зарегистрированную (перерегистрированную) предельную отпускную цену из государственного реестра.".
3. В Правилах ведения государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных указанным постановлением:
а) пункт 5 изложить в следующей редакции:
"5. Реестровая запись содержит следующие сведения:
а) наименование держателя или владельца регистрационного удостоверения лекарственного препарата, наименование производителя лекарственного препарата, место нахождения производственных площадок, участвующих в процессе производства лекарственного препарата, с указанием стадии процесса производства;
б) наименование лекарственного препарата (международное непатентованное, или группировочное, или химическое и торговое наименования);
в) номер регистрационного удостоверения лекарственного препарата;
г) лекарственная форма с указанием дозировки лекарственного препарата и его количества во вторичной (потребительской) упаковке, а также комплектность;
д) зарегистрированная предельная отпускная цена производителя на лекарственный препарат в рублях;
е) дата и номер приказа Министерства здравоохранения Российской Федерации о государственной регистрации, перерегистрации предельной отпускной цены производителя на лекарственный препарат;
ж) штриховой код, нанесенный на вторичную (потребительскую) упаковку лекарственного препарата;
з) код лекарственного препарата по анатомо-терапевтическо-химической классификации, рекомендованной Всемирной организацией здравоохранения.";
б) дополнить пунктом 6(1) следующего содержания:
"6(1). Внесение изменений в реестровую запись о государственной регистрации предельной отпускной цены производителя на лекарственный препарат в части изменения наименования лекарственного препарата (международного непатентованного, или группировочного, или химического и торгового наименования), написания лекарственной формы, написания дозировки лекарственного препарата, изменения держателя или владельца регистрационного удостоверения лекарственного препарата, изменения производителя лекарственного препарата, наименования производственных площадок, участвующих в процессе производства лекарственного препарата, номера регистрационного удостоверения лекарственного препарата, штрихового кода, нанесенного на вторичную (потребительскую) упаковку лекарственного препарата, комплектности лекарственного препарата (при условии отсутствия изменения его количества во вторичной (потребительской) упаковке) осуществляется на основании заявления держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица) Министерством здравоохранения Российской Федерации без согласования с Федеральной антимонопольной службой с сохранением последней зарегистрированной цены на лекарственный препарат. Министерство здравоохранения Российской Федерации по результатам внесения изменений в реестровую запись выдает держателю или владельцу регистрационного удостоверения лекарственного препарата (уполномоченному им лицу) выписку из реестра.";
в) пункт 7 дополнить подпунктом "г" следующего содержания:
"г) отмены решения о государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат.".
Утверждена
постановлением Правительства
Российской Федерации
от 15 сентября 2015 г. N 979
МЕТОДИКА
РАСЧЕТА ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ
НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ВКЛЮЧЕННЫЕ В ПЕРЕЧЕНЬ ЖИЗНЕННО
НЕОБХОДИМЫХ И ВАЖНЕЙШИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
I. Общие положения
1. Настоящая методика устанавливает порядок расчета предельных отпускных цен производителей лекарственных препаратов (далее - производители) на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов (далее - лекарственные препараты), при их государственной регистрации и перерегистрации.
II. Расчет предельной отпускной цены на референтный
лекарственный препарат при ее государственной регистрации
2. Предельная отпускная цена на референтный лекарственный препарат устанавливается для каждого производителя в рамках регистрационного удостоверения референтного лекарственного препарата в соответствии с требованиями пунктов 24 и 25 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" (далее - Правила), на основании данных, рассчитанных в соответствии с настоящей методикой.
3. Предлагаемая к государственной регистрации предельная отпускная цена производителя государства - члена Евразийского экономического союза на референтный лекарственный препарат не может превышать:
а) средневзвешенную фактическую отпускную цену на референтный лекарственный препарат за отчетный период, рассчитанную в соответствии с разделом IV настоящей методики на основании сведений об объемах и отпускных ценах находящихся в обращении в Российской Федерации лекарственных препаратов производителя государства - члена Евразийского экономического союза и лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, согласно приложению N 1;
б) в случае если лекарственный препарат иностранного производства или производителя государства - члена Евразийского экономического союза реализуется в иностранных государствах, в отношении которых представляется информация об уровне минимальных отпускных цен на лекарственные препараты согласно приложению N 2, - минимальную отпускную цену производителя (без учета производственных площадок) на лекарственный препарат в указанных государствах, рассчитанную в соответствии с разделом VII настоящей методики на основании расчета предельной отпускной цены производителя на лекарственный препарат, представляемой на государственную регистрацию (перерегистрацию), согласно приложению N 3 с учетом расходов, связанных с таможенным оформлением.
4. Предлагаемая к государственной регистрации предельная отпускная цена на референтный лекарственный препарат иностранного производства не может превышать:
а) средневзвешенную фактическую цену ввоза референтного лекарственного препарата за отчетный период с учетом расходов, связанных с таможенным оформлением, рассчитанную в соответствии с разделом VI настоящей методики на основании сведений об объемах и о ценах ввоза лекарственного препарата иностранного производства, находящегося в обращении на территории Российской Федерации, за отчетный период согласно приложению N 4;
б) минимальную отпускную цену на референтный лекарственный препарат иностранного производства (без учета производственных площадок) в иностранных государствах, указанных в приложении N 2 к настоящей методике, определенную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением N 3 к настоящей методике, с учетом расходов, связанных с таможенным оформлением.
5. Предлагаемая к государственной регистрации предельная отпускная цена на референтный лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, не может превышать:
а) средневзвешенную фактическую отпускную цену на референтный лекарственный препарат за отчетный период, рассчитанную в соответствии с разделом IV настоящей методики на основании сведений, предусмотренных приложением N 1 к настоящей методике;
б) минимальную отпускную цену на референтный лекарственный препарат иностранного производства (без учета производственных площадок), рассчитанную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением N 3 к настоящей методике, и сведений об уровне минимальных цен лекарственного препарата в иностранных государствах, указанных в приложении N 2 к настоящей методике, с учетом расходов, связанных с таможенным оформлением.
6. При государственной регистрации предельная отпускная цена на референтный лекарственный препарат для всех производителей в рамках регистрационного удостоверения лекарственного препарата с учетом требований пункта 24 Правил не может превышать уровень минимальной из цен, рассчитанных с учетом требований пунктов 3 - 5 настоящей методики.
7. Предлагаемая к государственной регистрации предельная отпускная цена на референтный лекарственный препарат для всех производителей лекарственного препарата без учета формы выпуска лекарственного препарата, за исключением случаев, предусмотренных пунктом 25 Правил, не может превышать:
а) в случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрированы предельные отпускные цены на референтный лекарственный препарат с такой же лекарственной формой и дозировкой (концентрацией, активностью в единицах действия), - стоимость одной лекарственной формы референтного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата и умноженную на количество лекарственных форм во вторичной потребительской упаковке заявляемого референтного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата согласно приложению N 5;
б) в случае если не зарегистрированы предельные отпускные цены на заявляемый референтный лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия), - стоимость единицы действующего вещества референтного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные дозировки заявляемого лекарственного препарата и умноженную на количество единиц действующего вещества заявляемого референтного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата, предусмотренных приложением N 5 к настоящей методике.
8. В случае если по состоянию на дату представления заявления о государственной регистрации предельной отпускной цены производителя на референтный лекарственный препарат в Министерство здравоохранения Российской Федерации в рамках международного непатентованного наименования и лекарственной формы зарегистрированы предельные отпускные цены производителей на соответствующие воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, при этом предельная отпускная цена производителя на референтный лекарственный препарат не зарегистрирована, то предлагаемая к государственной регистрации предельная отпускная цена на референтный лекарственный препарат не может превышать максимальную зарегистрированную предельную отпускную цену на соответствующий воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат.
III. Расчет предельной отпускной цены
на воспроизведенный, биоаналоговый (биоподобный)
лекарственный препарат при ее государственной регистрации
9. Предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат (далее - воспроизведенный лекарственный препарат) устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 24 и 25 Правил, на основании данных, рассчитанных в соответствии с настоящей методикой для каждой группы производителей лекарственных препаратов.
10. Предлагаемая к государственной регистрации предельная отпускная цена производителя государства - члена Евразийского экономического союза на воспроизведенный лекарственный препарат не может превышать:
а) отпускную цену, рассчитанную с учетом требований пунктов 26 - 28 Правил и в соответствии с разделом VIII настоящей методики на основании данных расчета предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, представляемой на государственную регистрацию, согласно приложению N 6;
б) средневзвешенную фактическую отпускную цену на воспроизведенный лекарственный препарат за отчетный период, рассчитанную в соответствии с разделом IV настоящей методики на основании сведений, предусмотренных приложением N 1 к настоящей методике;
в) в случае если лекарственный препарат иностранного производства или производителя государства - члена Евразийского экономического союза реализуется в иностранных государствах, в отношении которых представляется информация об уровне минимальных отпускных цен на лекарственные препараты, указанных в приложение N 2 к настоящей методике, - минимальную отпускную цену производителя (без учета производственных площадок) на лекарственный препарат в указанных государствах, рассчитанную в соответствии с разделом VII настоящей методики на основании расчета предельной отпускной цены производителя на лекарственный препарат, представляемой на государственную регистрацию (перерегистрацию), предусмотренного приложением N 3 к настоящей методике, с учетом расходов, связанных с таможенным оформлением.
11. Предлагаемая к государственной регистрации предельная отпускная цена на воспроизведенный лекарственный препарат иностранного производства не может превышать:
а) отпускную цену, рассчитанную с учетом требований пунктов 26 - 28 Правил и в соответствии с разделом VIII настоящей методики на основании расчета, предусмотренного приложением N 6 к настоящей методике;
б) средневзвешенную фактическую цену ввоза лекарственного препарата за отчетный период с учетом расходов, связанных с таможенным оформлением, рассчитанную в соответствии с разделом VI настоящей методики на основании сведений, предусмотренных приложением N 4 к настоящей методике;
в) минимальную отпускную цену иностранного производителя (без учета производственных площадок) на воспроизведенный лекарственный препарат, рассчитанную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением N 3 к настоящей методике, с учетом расходов, связанных с таможенным оформлением.
12. Предлагаемая к государственной регистрации предельная отпускная цена на воспроизведенный лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, не может превышать:
а) отпускную цену, рассчитанную с учетом требований пунктов 26 - 28 Правил и в соответствии с разделом VIII настоящей методики на основании расчета, предусмотренного приложением N 6 к настоящей методике;
б) средневзвешенную фактическую отпускную цену на воспроизведенный лекарственный препарат за отчетный период, рассчитанную в соответствии с разделом IV настоящей методики на основании сведений, предусмотренных приложением N 1 к настоящей методике;
в) минимальную отпускную цену на воспроизведенный лекарственный препарат иностранного производства (без учета производственных площадок) в иностранных государствах, указанных в приложении N 2 к настоящей методике, рассчитанную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением N 3 к настоящей методике, с учетом расходов, связанных с таможенным оформлением.
13. При государственной регистрации предельная отпускная цена на воспроизведенный лекарственный препарат для всех производителей государств - членов Евразийского экономического союза в рамках регистрационного удостоверения лекарственного препарата с учетом требований пункта 24 Правил не может превышать уровень минимальной из цен, рассчитанных с учетом требований пункта 10 настоящей методики.
При государственной регистрации предельная отпускная цена на воспроизведенный лекарственный препарат для всех иностранных производителей, в том числе осуществляющих или планирующих осуществлять первичную и (или) вторичную упаковку лекарственного препарата в Российской Федерации, в рамках регистрационного удостоверения лекарственного препарата с учетом требований пункта 24 Правил не может превышать уровень минимальной из цен, рассчитанных с учетом требований пунктов 11 и 12 настоящей методики.
14. Предлагаемая к государственной регистрации предельная отпускная цена на воспроизведенный лекарственный препарат для всех производителей лекарственного препарата без учета формы выпуска лекарственного препарата, за исключением случаев, предусмотренных пунктом 25 Правил, не может превышать:
а) в случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрированы предельные отпускные цены на воспроизведенный лекарственный препарат с такой же лекарственной формой и дозировкой (концентрацией, активностью в единицах действия), - стоимость одной лекарственной формы воспроизведенного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата и умноженную на количество лекарственных форм во вторичной потребительской упаковке заявляемого воспроизведенного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата, предусмотренных приложением N 5 к настоящей методике;
б) в случае если не зарегистрированы предельные отпускные цены на заявляемый воспроизведенный лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия), - стоимость единицы действующего вещества воспроизведенного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные дозировки заявляемого лекарственного препарата и умноженную на количество единиц действующего вещества заявляемого воспроизведенного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата, предусмотренных приложением N 5 к настоящей методике.
15. При государственной регистрации предельной отпускной цены производителя на воспроизведенный лекарственный препарат в случае, если в рамках международного непатентованного наименования и лекарственной формы не зарегистрирована предельная отпускная цена на соответствующий референтный лекарственный препарат и не зарегистрированы предельные отпускные цены производителей на воспроизведенные лекарственные препараты, расчет цены осуществляется Федеральной антимонопольной службой на основании минимальной отпускной цены производителя (без учета производственных площадок, с учетом расходов, связанных с таможенным оформлением) на соответствующий референтный лекарственный препарат в иностранных государствах, указанных в приложении N 2 к настоящей методике, с применением понижающего коэффициента, значения которого определяются в соответствии с разделом VIII настоящей методики.
IV. Расчет средневзвешенной фактической отпускной цены
на лекарственный препарат производителя государства - члена
Евразийского экономического союза и лекарственный препарат
иностранного производства, первичная и (или) вторичная
упаковка которого осуществляется или планируется
осуществляться в Российской Федерации
16. Расчет средневзвешенной фактической отпускной цены на конкретный лекарственный препарат производителя государства - члена Евразийского экономического союза и (или) лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, производится за отчетный период на основании сведений, предусмотренных приложением N 1 к настоящей методике.
При расчете такой средневзвешенной фактической отпускной цены учитываются сведения об объемах и отпускных ценах на лекарственный препарат за отчетный период по каждому производителю в рамках одного регистрационного удостоверения лекарственного препарата.
Расчет средневзвешенной фактической отпускной цены на лекарственный препарат осуществляется с учетом всех форм выпуска (упаковки, комплектности) лекарственного препарата, за исключением случаев, предусмотренных пунктом 25 Правил.
17. Средневзвешенная фактическая отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) в рамках регистрационного удостоверения лекарственного препарата, отпущенный за отчетный период (цена срвзвпр отпп) (рублей), определяется по формуле:

где:
цена фактического отпуска - фактическая отпускная цена производителя государства - члена Евразийского экономического союза на одну потребительскую упаковку лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) (рублей);
количество отп - количество упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) производителя государства - члена Евразийского экономического союза, отгруженного за отчетный период по одной цене (штук);
количество общее отп - общее количество упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) производителей государств - членов Евразийского экономического союза в рамках регистрационного удостоверения лекарственного препарата, произведенного и отгруженного за отчетный период (штук). Из общего количества исключаются экспортные поставки, поставки, осуществленные в рамках различных видов гуманитарной помощи, и поставки лекарственных препаратов в рамках благотворительности, а также поставки лекарственных препаратов с остаточным сроком годности менее 5 процентов.
18. Средневзвешенная фактическая отпускная цена лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) в рамках регистрационного удостоверения лекарственного препарата, отпущенного за отчетный период (рублей) (цена срвзвпр отпп), определяется по формуле, приведенной в пункте 17 настоящей методики.
V. Расчет рентабельности для лекарственного
препарата производителя государства - члена Евразийского
экономического союза при перерегистрации предельной
отпускной цены на лекарственный препарат
19. Расчет расходов, связанных с разработкой, производством и реализацией лекарственного препарата производителя государства - члена Евразийского экономического союза, представляемой на перерегистрацию предельной отпускной цены на лекарственный препарат, осуществляется согласно приложению N 7.
20. Расчет рентабельности лекарственного препарата за отчетный период осуществляется по каждому производителю государства - члена Евразийского экономического союза в рамках одного регистрационного удостоверения лекарственного препарата.
21. При перерегистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат, находившийся в обращении на территории Российской Федерации, фактический уровень рентабельности продукции Rф) (процентов) определяется по формуле:
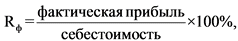
где:
фактическая прибыль - прибыль от реализации производителем конкретного лекарственного препарата за отчетный период, приведенная в приложении N 7 к настоящей методике (рублей);
себестоимость - сумма прямых, общепроизводственных и общехозяйственных расходов, приведенных в приложении N 7 к настоящей методике (рублей).
22. При перерегистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат, не поступавший в обращение на территории Российской Федерации в течение отчетного периода, прогнозируемый уровень рентабельности продукции (Rп) (процентов) определяется по формуле:
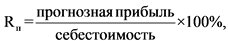
где:
прогнозная прибыль - прибыль от реализации производителем конкретного лекарственного препарата за год, которая приведена в приложении N 7 к настоящей методике (рублей);
себестоимость - сумма прямых, общепроизводственных и общехозяйственных расходов, приведенных в приложении N 7 к настоящей методике (рублей).
23. При перерегистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случаях, предусмотренных подпунктами "а" - "в" пункта 32 Правил, если фактический уровень рентабельности за отчетный период превысит 30 процентов, заявляемая к перерегистрации предельная отпускная цена на лекарственный препарат подлежит снижению с учетом данного ограничения.
VI. Расчет средневзвешенной фактической цены ввоза
лекарственного препарата иностранного производства
в Российскую Федерацию
24. Расчет средневзвешенной фактической цены ввоза конкретного лекарственного препарата иностранного производства в Российскую Федерацию производится на основании сведений, предусмотренных приложением N 4 к настоящей методике.
При расчете средневзвешенной фактической цены ввоза лекарственного препарата учитываются сведения об объемах и о ценах ввоза лекарственного препарата за отчетный период по каждому иностранному производителю в рамках одного регистрационного удостоверения лекарственного препарата.
Расчет средневзвешенной фактической цены ввоза лекарственного препарата осуществляется с учетом формы выпуска (упаковки, комплектности) лекарственного препарата, за исключением случаев, предусмотренных пунктом 25 Правил.
25. Средневзвешенная фактическая цена ввоза лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) иностранных производителей, указанных в регистрационном удостоверении лекарственного препарата, ввезенного за отчетный период на территорию Российской Федерации (цена срвзвпр ввп) (рублей), определяется по формуле:

где:
цена фактического ввоза - фактическая цена ввоза одной потребительской упаковки лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) иностранного производства (рублей);
количество вв - количество упаковок лекарственного препарата иностранного производства (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему), ввезенного иностранным производителем (импортером) за отчетный период по одной цене (штук);
количество общее вв - общее количество упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) иностранных производителей в рамках регистрационного удостоверения лекарственного препарата, ввезенного за отчетный период (штук).
Из общего количества исключаются поставки, осуществленные в рамках различных видов гуманитарной помощи, и поставки лекарственных препаратов в рамках благотворительности, поставки лекарственных препаратов с остаточным сроком годности менее 5 процентов, а также поставки лекарственных препаратов с фактической ценой ввоза, превышающей зарегистрированную предельную отпускную цену производителя.
VII. Расчет минимальной цены производителя
на лекарственный препарат в иностранных государствах,
указанных в приложении N 2 к настоящей методике
26. Расчет отпускной цены производителя на лекарственный препарат (по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственных форм в потребительской упаковке (количеству доз в упаковке, объему) производится на основании сведений об уровне минимальных цен лекарственного препарата (без учета производственных площадок) в иностранных государствах, указанных в приложении N 2 к настоящей методике, и на основании сведений, предусмотренных таблицей 1 приложения N 3 к настоящей методике.
27. В таблице 1 приложения N 3 к настоящей методике минимальные цены производителя на лекарственный препарат в иностранных государствах, указанных в приложении N 2 к настоящей методике, указываются в рублях. Пересчет цены в иностранной валюте в рубли осуществляется по среднему курсу соответствующей иностранной валюты к рублю Российской Федерации, установленному Центральным банком Российской Федерации за 3 календарных месяца, предшествующие месяцу даты подачи заявления о государственной регистрации (перерегистрации) предельной отпускной цены производителя на лекарственный препарат, который (курс валютного пересчета) указывается в таблице 2 приложения N 3 к настоящей методике.
28. В случае если лекарственный препарат реализуется в иностранных государствах, указанных в приложении N 2 к настоящей методике, под другим торговым наименованием, в таблице 1 приложения N 3 к настоящей методике указываются соответствующее торговое наименование и минимальные цены производителя на лекарственный препарат.
29. В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены на лекарственный препарат с количеством лекарственных форм в потребительской упаковке (количеством доз в упаковке, объемом), отсутствующим в одном или нескольких иностранных государствах, указанных в приложении N 2 к настоящей методике, в таблице 1 приложения N 3 к настоящей методике указываются минимальные цены на заявляемый лекарственный препарат с ближайшими смежными количествами лекарственных форм во вторичной потребительской упаковке (вне зависимости от наличия их государственной регистрации на территории Российской Федерации), которые реализуются в иностранных государствах, указанных в приложении N 2 к настоящей методике.
При этом минимальная цена производителя на заявляемый лекарственный препарат определяется как среднее арифметическое значение стоимости одной лекарственной формы лекарственных препаратов, имеющих ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке, умноженное на количество лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата в каждом из иностранных государств (графа 6 таблицы 1 приложения N 3 к настоящей методике).
В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены лекарственного препарата с дозировкой, отсутствующей в одном или нескольких иностранных государствах, указанных в приложении N 2 к настоящей методике, в таблице 1 приложения N 3 к настоящей методике указываются минимальные цены на заявляемый лекарственный препарат с ближайшими смежными дозировками (вне зависимости от наличия их регистрации на территории Российской Федерации), которые реализуются в иностранных государствах, указанных в приложении N 2 к настоящей методике.
При этом минимальная цена производителя на заявляемый лекарственный препарат определяется как среднее арифметическое значение стоимости одной единицы действующего вещества лекарственных препаратов, имеющих ближайшие смежные дозировки, умноженное на количество единиц действующего вещества заявляемого лекарственного препарата в каждом из иностранных государств (графа 7 таблицы 1 приложения N 3 к настоящей методике). В расчете не учитываются ближайшие смежные дозировки, превышающие дозировку заявленного лекарственного препарата, предназначенного для применения в педиатрической практике (на основании сведений инструкции по медицинскому применению), более чем в 2 раза.
30. В случае если лекарственный препарат иностранного производства, в том числе производство готовой лекарственной формы, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, производится только для продажи в Российской Федерации (не реализуется в иностранных государствах, указанных в приложении N 2 к настоящей методике), для расчета отпускной цены на лекарственный препарат представляется информация о минимальных ценах других иностранных производителей на лекарственные препараты, совпадающие по международному непатентованному наименованию (при его отсутствии по группировочному или химическому), лекарственной форме, дозировке (концентрации, активности в единицах действия), обращающиеся в государстве производителя лекарственного препарата, на основании данных из открытых общедоступных источников, соответствующих требованиям пункта 17 Правил. При этом заявленная к государственной регистрации цена на такой лекарственный препарат не должна превышать минимальную цену других иностранных производителей (с учетом расходов, связанных с таможенным оформлением), рассчитанную на основании таблицы 1 приложения N 3 к настоящей методике.
VIII. Расчет предельной отпускной цены производителя
на воспроизведенный лекарственный препарат
31. Держатель или владелец регистрационного удостоверения (уполномоченное им лицо) воспроизведенного лекарственного препарата в случае, если предельная отпускная цена на соответствующий референтный лекарственный препарат зарегистрирована, представляет для государственной регистрации предельную отпускную цену на лекарственный препарат, не превышающую цену (Цпр) (рублей), рассчитанную по формуле:

где:
Цреф - зарегистрированная на дату подачи заявления о государственной регистрации предельной отпускной цены держателем или владельцем регистрационного удостоверения воспроизведенного лекарственного препарата (или уполномоченным им лицом) предельная отпускная цена за потребительскую упаковку референтного лекарственного препарата (далее - цена референтного лекарственного препарата);
Кп - понижающий коэффициент, значения которого при государственной регистрации рассчитываются в соответствии пунктом 33 настоящей методики и пунктом 26 Правил (далее - понижающий коэффициент) (процентов), с округлением до сотых;
Кф - коэффициент пересчета фасовки, определяемый как соотношение между количеством лекарственных форм в упаковке воспроизведенного лекарственного препарата и референтного лекарственного препарата;
Кд - коэффициент пересчета дозировки, определяемый как соотношение между количеством единиц активного вещества в дозировке воспроизведенного лекарственного препарата и количеством единиц активного вещества в дозировке референтного лекарственного препарата.
32. Цена на референтный лекарственный препарат определяется как минимальная зарегистрированная предельная отпускная цена на референтный лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия) и таким же количеством лекарственных форм во вторичной потребительской упаковке, что и воспроизведенный лекарственный препарат, с учетом случаев, предусмотренных пунктом 25 Правил.
В случае если не зарегистрированы предельные отпускные цены на референтный лекарственный препарат с таким же количеством лекарственных форм во вторичной потребительской упаковке, что и заявляемый воспроизведенный лекарственный препарат, цена на воспроизведенный лекарственный препарат определяется как стоимость одной лекарственной формы референтного лекарственного препарата, рассчитанная исходя из среднего арифметического значения зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке референтного лекарственного препарата и умноженная на количество лекарственных форм во вторичной потребительской упаковке заявляемого воспроизведенного лекарственного препарата, при этом Кф соответственно равен 1.
В случае если не зарегистрированы предельные отпускные цены на референтный лекарственный препарат с такой же дозировкой, что и заявляемый воспроизведенный лекарственный препарат, цена на воспроизведенный лекарственный препарат определяется как стоимость одной единицы действующего вещества референтного лекарственного препарата, рассчитанная исходя из среднего арифметического значения зарегистрированных цен на ближайшие смежные дозировки референтного лекарственного препарата и умноженная на количество единиц действующего вещества заявляемого воспроизведенного лекарственного препарата, при этом Кд соответственно равен 1.
В случае если предельная отпускная цена производителя на референтный лекарственный препарат была перерегистрирована, то учитывается последняя зарегистрированная предельная отпускная цена на референтный лекарственный препарат.
33. В случаях, при которых в рамках международного непатентованного наименования (при его отсутствии - группировочного или химического) и лекарственной формы на референтный лекарственный препарат зарегистрированы различные предельные отпускные цены, применяется среднее арифметическое значение понижающего коэффициента, рассчитанное на основании зарегистрированных предельных отпускных цен на референтный лекарственный препарат, за исключением случаев, при которых понижающий коэффициент равен нулю.
В случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат не зарегистрирована предельная отпускная цена на воспроизведенный лекарственный препарат производителя государства - члена Евразийского экономического союза, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме, понижающий коэффициент определяется по формулам понижающих коэффициентов, применяемых при расчете предельной отпускной цены производителя на первый воспроизведенный лекарственный препарат, представляемой на государственную регистрацию, согласно приложению N 8.
В случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, не зарегистрирована предельная отпускная цена на воспроизведенный лекарственный препарат, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме, понижающий коэффициент определяется по формулам расчета, предусмотренным приложением N 8 к настоящей методике.
В случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат зарегистрирована предельная отпускная цена на воспроизведенный лекарственный препарат производителя государства - члена Евразийского экономического союза, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме, понижающий коэффициент определяется по формулам расчета понижающих коэффициентов, применяемых при расчете предельной отпускной цены производителя на воспроизведенный лекарственный препарат, представляемой на государственную регистрацию, согласно приложению N 9.
В случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, зарегистрирована предельная отпускная цена на воспроизведенный лекарственный препарат, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме, понижающий коэффициент определяется по формулам расчета, предусмотренным приложением N 9 к настоящей методике.
В отношении воспроизведенного, биоаналогового (биоподобного) орфанного лекарственного препарата понижающий коэффициент определяется по формулам расчета, предусмотренным приложением N 8 к настоящей методике, для воспроизведенного, биоаналогового (биоподобного) орфанного лекарственного препарата.
34. В случае если предельная отпускная цена на референтный лекарственный препарат в рамках международного непатентованного наименования и лекарственной формы не зарегистрирована или если в рамках международного непатентованного наименования и лекарственной формы референтный лекарственный препарат отсутствует, держатель или владелец регистрационного удостоверения (уполномоченное им лицо) воспроизведенного лекарственного препарата представляет для государственной регистрации предельную отпускную цену на лекарственный препарат, не превышающую цену (Цпр) (рублей), рассчитанную по формуле:
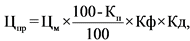
где:
Цм - зарегистрированная предельная отпускная цена на потребительскую упаковку лекарственного препарата, совпадающего по международному непатентованному наименованию (при его отсутствии по группировочному или химическому) и лекарственной форме, определенная в соответствии с пунктом 35 настоящей методики (далее - максимальная цена) (рублей);
Кп - понижающий коэффициент, значения которого при государственной регистрации рассчитываются в соответствии пунктом 36 настоящей методики и пунктом 28 Правил (процентов), с округлением до сотых.
Для расчета предельной отпускной цены производителя на иммунобиологический лекарственный препарат (вакцину) в соответствии с национальным календарем профилактических прививок понижающий коэффициент не применяется.
В случае если в рамках международного непатентованного наименования и лекарственной формы предельная отпускная цена на референтный лекарственный препарат не зарегистрирована и зарегистрирована предельная отпускная цена производителя на воспроизведенный лекарственный препарат с учетом требований пункта 15 настоящей методики, для расчета предельных отпускных цен производителей на вторые и последующие воспроизведенные лекарственные препараты понижающий коэффициент не применяется;
Кф - соотношение между количеством лекарственных форм во вторичной упаковке воспроизведенного лекарственного препарата и количеством лекарственных форм во вторичной упаковке лекарственного препарата, совпадающего по международному непатентованному наименованию (при его отсутствии по группировочному или химическому) и лекарственной форме;
Кд - соотношение между количеством единиц активного вещества в дозировке воспроизведенного лекарственного препарата и количеством единиц активного вещества в дозировке лекарственного препарата, совпадающего по международному непатентованному наименованию (при его отсутствии по группировочному или химическому) и лекарственной форме.
35. Максимальная цена определяется как зарегистрированная (перерегистрированная) предельная отпускная цена за потребительскую упаковку лекарственного препарата, совпадающего с заявляемым воспроизведенным лекарственным препаратом по международному непатентованному наименованию (при его отсутствии по химическому или группировочному наименованию), лекарственной форме и дозировке с максимальной стоимостью одной лекарственной формы:
в случае если зарегистрирована (перерегистрирована) предельная отпускная цена на такой лекарственный препарат, совпадающий по количеству во вторичной потребительской упаковке с заявляемым воспроизведенным лекарственным препаратом, максимальная цена определяется как последняя зарегистрированная (перерегистрированная) предельная отпускная цена на такой лекарственный препарат;
в случае если на такой лекарственный препарат в рамках регистрационного удостоверения лекарственного препарата зарегистрировано (перерегистрировано) несколько предельных отпускных цен на лекарственные препараты, отличных по количеству во вторичной потребительской упаковке от заявляемого воспроизведенного лекарственного препарата, максимальная цена определяется как среднее арифметическое значение последних зарегистрированных (перерегистрированных) предельных отпускных цен на такие лекарственные препараты исходя из стоимости одной лекарственной формы, умноженное на количество лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата, при этом Кф соответственно равен 1;
в случае отсутствия зарегистрированных предельных отпускных цен на лекарственный препарат, совпадающий по международному непатентованному наименованию (при его отсутствии по химическому или группировочному наименованию), лекарственной форме и дозировке, максимальная цена определяется как зарегистрированная предельная отпускная цена за потребительскую упаковку лекарственного препарата, совпадающего с заявляемым воспроизведенным лекарственным препаратом по международному непатентованному наименованию (при его отсутствии по химическому или группировочному наименованию) и лекарственной форме с максимальной стоимостью единицы действующего вещества;
в случае если на такой лекарственный препарат в рамках регистрационного удостоверения лекарственного препарата зарегистрировано (перерегистрировано) несколько предельных отпускных цен на лекарственные препараты, отличных по дозировке с заявляемым воспроизведенным лекарственным препаратом, максимальная цена определяется как среднее арифметическое значение последних зарегистрированных (перерегистрированных) предельных отпускных цен на такие лекарственные препараты исходя из стоимости единицы действующего вещества, умноженное на количество единиц действующего вещества заявляемого лекарственного препарата, при этом Кд соответственно равен 1.
36. Понижающий коэффициент для расчета предельных отпускных цен на воспроизведенные лекарственные препараты определяется в соответствии с максимальной ценой и рассчитывается в соответствии с пунктом 33 настоящей методики.
В случаях, при которых на лекарственный препарат, определенный в соответствии с требованиями пункта 35 настоящей методики, зарегистрированы различные предельные отпускные цены, применяется среднее арифметическое значение понижающего коэффициента, рассчитанное на основании последних зарегистрированных (перерегистрированных) предельных отпускных цен на такой лекарственный препарат, за исключением случаев, при которых понижающий коэффициент равен 0.
IX. Расчет предельной отпускной цены производителей
на лекарственный препарат производителя государства - члена
Евразийского экономического союза при ее перерегистрации
37. Предельная отпускная цена на лекарственный препарат при ее перерегистрации устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 24 и 25 Правил и не может превышать минимальную цену, рассчитанную в соответствии с настоящим разделом.
38. Перерегистрация предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случаях, предусмотренных подпунктами "а" - "в" пункта 32 Правил, осуществляется исходя:
а) из расчета, предусмотренного приложением N 7 к настоящей методике;
б) из обоснования расчета предельной отпускной цены на лекарственный препарат производителя государства - члена Евразийского экономического союза, представляемой на перерегистрацию, согласно приложению N 10.
39. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случаях, указанных в подпунктах "а" и "в" пункта 32 Правил, подлежит увеличению:
а) на величину удорожания сырья и материалов;
б) на величину изменения накладных расходов.
40. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случае, указанном в подпункте "б" пункта 32 Правил, подлежит увеличению в части цен на сырье и материалы, используемые при производстве конкретного лекарственного препарата, пропорционально величине удорожания стоимости сырья и материалов в структуре затрат на производство и реализацию лекарственного препарата, которое в равной степени влияет на зарегистрированные цены на все лекарственные препараты, отнесенные к одному международному непатентованному наименованию и имеющие одинаковый путь введения.
41. Величина увеличения зарегистрированной предельной отпускной цены на лекарственный препарат производителя государства - члена Евразийского экономического союза при ее перерегистрации в случаях, указанных в подпунктах "а" и "б" пункта 32 Правил, не должна превышать уровень фактической инфляции предшествующего календарного года с учетом прогнозируемого уровня инфляции текущего года, установленного федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (И) (процентов), определяемый по формуле:
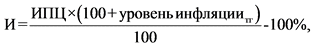
где:
ИПЦ - индекс потребительских цен на товары и услуги предшествующего календарного года (процентов);
уровень инфляцииТГ - прогнозируемый уровень инфляции текущего года, установленный федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (процентов).
42. При расчете предельной отпускной цены на лекарственный препарат при ее перерегистрации в случаях, указанных в подпунктах "а" - "в" пункта 32 Правил, не учитывается увеличение накладных расходов при изменении способа отнесения общепроизводственных и общехозяйственных расходов на себестоимость лекарственного препарата, а также при изменении значений показателей, используемых в соответствии с учетной политикой производителя государства - члена Евразийского экономического союза для отнесения общепроизводственных и общехозяйственных расходов на себестоимость лекарственного препарата.
43. Перерегистрация предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случае, предусмотренном подпунктом "г" пункта 32 Правил, осуществляется на основании сведений, предусмотренных приложением N 1 к настоящей методике.
44. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат подлежит перерегистрации в случае, указанном в подпункте "г" пункта 32 Правил, если средневзвешенная фактическая отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) предельной отпускной цены, была ниже зарегистрированной на этот период цены не более чем на прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период.
45. Величина увеличения зарегистрированной предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случае, указанном в подпункте "г" пункта 32 Правил (Уе) (процентов), определяется по формуле:

где:
Уп - прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (процентов);
Ип - коэффициент ценовой группы, определяемый в соответствии со значениями коэффициента ценовой группы, применяемого при расчете предельных отпускных цен производителей на лекарственные препараты, представляемых на перерегистрацию, согласно приложению N 11.
Ценовая группа определяется исходя из зарегистрированной предельной отпускной цены на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации);
цена зарег - зарегистрированная предельная отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) (рублей);
цена срвзв отпп - средневзвешенная фактическая отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат, отпущенный за отчетный период, рассчитанная в соответствии с разделом IV настоящей методики (рублей).
46. Предлагаемая к перерегистрации предельная отпускная цена на воспроизведенный лекарственный препарат не может превышать отпускную цену, рассчитанную в соответствии с настоящей методикой с учетом требований пункта 31 Правил.
X. Расчет предельной отпускной цены на лекарственный
препарат иностранного производства, в том числе первичная
и (или) вторичная упаковка которого осуществляется
или планируется осуществляться в Российской Федерации,
при ее перерегистрации
47. Предельная отпускная цена на лекарственный препарат иностранного производства при ее перерегистрации устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 24 и 25 Правил и не может превышать минимальную цену, рассчитанную в соответствии с настоящим разделом.
48. Перерегистрация предельной отпускной цены на лекарственный препарат иностранного производства осуществляется на основании:
а) сведений, предусмотренных приложением N 4 к настоящей методике;
б) обоснования расчета предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, представляемой на перерегистрацию, согласно приложению N 12.
49. Перерегистрация предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, на лекарственный препарат осуществляется на основании:
а) сведений, предусмотренных приложением N 1 к настоящей методике;
б) обоснования расчета, предусмотренного приложением N 12 к настоящей методике.
50. Предельная отпускная цена на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, на лекарственный препарат при ее перерегистрации подлежит увеличению при соблюдении следующих условий:
а) если рост курса национальной валюты государства - производителя лекарственного препарата к рублю со дня государственной регистрации (последней перерегистрации) предельной отпускной цены производителя на лекарственный препарат по отношению к курсу национальной валюты до даты подачи документов на ее очередную перерегистрацию превышает прогнозируемый уровень инфляции текущего года, установленный федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период;
б) если средневзвешенная фактическая цена ввоза лекарственного препарата (для лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, применяется средневзвешенная цена отпуска) за отчетный период была ниже зарегистрированной на этот период цены не более чем на прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период;
в) если предельная отпускная цена на лекарственный препарат иностранного производства при ее перерегистрации не превышает минимальную отпускную цену на лекарственный препарат иностранного производства в иностранных государствах, указанных в приложении N 2 к настоящей методике, определенную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением N 3 к настоящей методике, с учетом расходов, связанных с таможенным оформлением.
51. Предлагаемая к перерегистрации предельная отпускная цена на воспроизведенный лекарственный препарат не может превышать отпускную цену, рассчитанную в соответствии с настоящей методикой с учетом требований пункта 31 Правил.
52. Величина увеличения зарегистрированной предельной отпускной цены на лекарственный препарат иностранного производства при ее перерегистрации (Уи) (процентов) с округлением до сотых определяется по формуле:

где:
Уп - прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (процентов);
Ип - коэффициент ценовой группы, определяемый в соответствии со значениями коэффициентов ценовой группы, предусмотренными приложением N 11 к настоящей методике.
Ценовая группа определяется исходя из зарегистрированной предельной отпускной цены на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации);
цена зарег - зарегистрированная предельная отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) (рублей);
цена срвзв ввп - средневзвешенная фактическая цена ввоза лекарственного препарата иностранного производства, ввезенного за отчетный период, рассчитанная в соответствии с разделом VI настоящей методики (рублей).
53. Величина увеличения зарегистрированной предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, при ее перерегистрации определяется по формуле, приведенной в пункте 45 настоящей методики.
54. В случае если за отчетный период лекарственный препарат в рамках одного регистрационного удостоверения ввозился на территорию Российской Федерации иностранным производителем (импортером) и отгружался иностранным производителем, осуществлявшим первичную и (или) вторичную упаковку лекарственного препарата в Российской Федерации, расчет предельной отпускной цены производителя при перерегистрации осуществляется с применением общей средневзвешенной цены ввоза и отпуска лекарственного препарата.
Общая средневзвешенная цена ввоза и отпуска лекарственного препарата применяется вместо средневзвешенной фактической цены ввоза лекарственного препарата (цена срвзвпр ввп) и средневзвешенной фактической отпускной цены лекарственного препарата (цена срвзвпр отпп) при перерегистрации предельной отпускной цены производителя на лекарственный препарат в случаях, предусмотренных пунктом 34 Правил, для расчетов в соответствии с подпунктом "б" пункта 50, пунктами 52 и 53 настоящей методики.
XI. Расчет предельной отпускной цены производителя
на лекарственный препарат при ее перерегистрации
в целях снижения
55. Перерегистрация в целях снижения предельной отпускной цены производителя на лекарственный препарат проводится в случаях, предусмотренных подпунктом "а" пункта 42 Правил, в связи со снижением цены в национальной валюте на лекарственный препарат в иностранных государствах, указанных в приложении N 2 к настоящей методике, на основании расчета, предусмотренного приложением N 3 к настоящей методике, в случае, если рассчитанная в соответствии с разделом VII настоящей методики минимальная отпускная цена производителя на лекарственный препарат с учетом расходов, связанных с таможенным оформлением, ниже, чем зарегистрированная предельная отпускная цена на лекарственный препарат.
56. Перерегистрация предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата проводится в случаях, предусмотренных подпунктом "б" пункта 42 Правил, в связи со снижением предельной отпускной цены референтного лекарственного препарата в случаях, предусмотренных подпунктом "а" пункта 42 Правил.
Перерегистрация в целях снижения предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата осуществляется в случае, если зарегистрированная предельная отпускная цена воспроизведенного, биоаналогового (биоподобного) лекарственного препарата превышает цену референтного лекарственного препарата, перерегистрированную в целях снижения в соответствии с пунктом 55 настоящей методики. При этом предельная отпускная цена воспроизведенного, биоаналогового (биоподобного) лекарственного препарата не может превышать цену референтного лекарственного препарата, перерегистрированную в целях снижения в соответствии с пунктом 55 настоящей методики.
57. Перерегистрация предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, проводится в случаях, предусмотренных подпунктом "в" пункта 42 Правил, на основании данных расчета предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, представляемых на государственную регистрацию в соответствии с приложением N 9 к настоящей методике в связи с государственной регистрацией второй цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме и дозировке.
Перерегистрация в целях снижения предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, осуществляется в случае, если зарегистрированная предельная отпускная цена превышает цену, рассчитанную в качестве проекта предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат в соответствии с разделом VIII настоящей методики.
58. Перерегистрация предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата производителя государства - члена Евразийского экономического союза проводится в случаях, предусмотренных подпунктом "г" пункта 42 Правил, на основании данных расчета предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, представляемых на государственную регистрацию в соответствии с приложением N 9 к настоящей методике в связи с государственной регистрацией второй цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме и дозировке.
Перерегистрация в целях снижения предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата производителя государства - члена Евразийского экономического союза осуществляется в случае, если зарегистрированная предельная отпускная цена превышает цену, рассчитанную в качестве проекта предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза в соответствии с разделом VIII настоящей методики.
59. Предельная отпускная цена на лекарственный препарат при перерегистрации в целях снижения устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 24 и 25 Правил.
Приложение N 1
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Количество отпущенного лекарственного препарата
Средневзвешенная фактическая отпускная цена лекарственного препарата за потребительскую упаковку (без НДС), рублей
Зарегистрированная предельная отпускная цена лекарственного препарата за потребительскую упаковку (без НДС), рублей <**>
Проект предельной отпускной цены за потребительскую упаковку, предложенной на перерегистрацию (без НДС), рублей <**>
Прогнозируемый уровень инфляции, установленный на текущий год, процентов <**>
Увеличение предельной отпускной цены, процентов <**>
тыс. упаковок
тыс. рублей
1
2
3
4
5
6
7
8
N п/п
Торговое название (лекарственная форма, дозировка, количество во вторичной (потребительской) упаковке)
Производитель
Наименование поставщика
Номер товарной накладной
Дата товарной накладной
Количество отпущенного товара, упаковок
Цена отпуска за одну упаковку (без НДС), рублей
Объем реализации лекарственного препарата (без НДС), тыс. рублей
Остаточный срок годности отпущенного лекарственного препарата, процентов
1
2
3
4
5
6
7
8
9
10
Итого
![]()
![]()
Средневзвешенная фактическая отпускная цена лекарственного препарата за потребительскую упаковку (без НДС), рублей
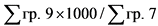
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
Приложение N 2
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
ПЕРЕЧЕНЬ
ИНОСТРАННЫХ ГОСУДАРСТВ, В ОТНОШЕНИИ КОТОРЫХ ПРЕДСТАВЛЯЕТСЯ
ИНФОРМАЦИЯ ОБ УРОВНЕ МИНИМАЛЬНЫХ ОТПУСКНЫХ ЦЕН
НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
1. Венгрия
2. Греческая Республика
3. Королевство Бельгия
4. Королевство Испания
5. Королевство Нидерландов
6. Республика Польша
7. Румыния
8. Словацкая Республика
9. Турецкая Республика
10. Французская Республика
11. Чешская Республика
12. Страна производителя
Приложение N 3
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Код ТН ВЭД ЕАЭС
Минимальная отпускная цена производителя на лекарственный препарат в стране производителя и в других иностранных государствах в соответствии с таблицей 1 <*>
Проект отпускной цены "поставка без оплаты таможенной пошлины и сборов за таможенное оформление", рублей <**>
Действующая ставка таможенной пошлины <**>
Сборы за таможенное оформление, рублей <**>
Проект расчетной отпускной цены производителя с учетом таможенных расходов (без НДС), рублей
наименование иностранного государства
Цена, рублей
процентов
рублей
1
2
3
4
5
6
7
8
9
N п/п
Торговое наименование лекарственного препарата
Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
Количество в потребительской упаковке
Минимальная отпускная цена по графам 8 - 19, рублей
Минимальная отпускная цена производителя на лекарственный препарат, рублей <*>
за упаковку
расчет за одну лекарственную форму
расчет за единицу действующего вещества
Венгрия
Греческая Республика
Королевство Бельгия
Королевство Испания
Королевство Нидерландов
Республика Польша
Румыния
Словацкая Республика
Турецкая Республика
Французская Республика
Чешская Республика
Страна производителя
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
Минимальная расчетная отпускная цена производителя за одну лекарственную форму, рублей <**>
Минимальная расчетная отпускная цена производителя за единицу действующего вещества лекарственного препарата <***>, рублей
Минимальная отпускная цена производителя на лекарственный препарат в стране производителя и в других странах (с учетом пересчета), рублей
Название страны с минимальной отпускной ценой на лекарственный препарат <****>
Особенности <*****>
1
Страна
Наименование валюты
Средний курс валюты <*>
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
Приложение N 4
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Наименование производителя
Номер таможенной декларации
Дата таможенной декларации
Серия
Количество упаковок
Номер декларации
Дата декларации
Цена ввоза одной потребительской упаковки (без НДС), рублей
Таможенная пошлина и таможенное оформление, рублей
Цена ввоза одной упаковки с учетом таможенной пошлины и таможенного оформления (без НДС), рублей
Стоимость ввозимого товара (без НДС), тыс. рублей
1
2
3
4
5
6
7
8
9
10
11
12
Итого
![]()
![]()
Итого: средневзвешенная фактическая цена ввоза лекарственного препарата за потребительскую упаковку (без НДС), рублей
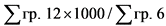
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Отчетный период при государственной регистрации предельной отпускной цены производителя на лекарственный препарат определяется в соответствии с пунктом 23 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов".
Отчетный период при перерегистрации предельной отпускной цены производителя на лекарственный препарат определяется в соответствии с пунктом 37 указанных Правил.
Примечание. Дополнительно представляются в электронной форме (Excel) данные об объемах ввоза лекарственных препаратов по всем фактическим случаям ввоза за отчетный период.
Приложение N 5
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Владелец регистрационного удостоверения, производитель, упаковщик, выпускающий контроль
Лекарственная форма, дозировка
Количество в потребительской упаковке
Номер приказа и дата приказа о государственной регистрации (перерегистрации) предельной отпускной цены
Зарегистрированная предельная отпускная цена производителя на лекарственный препарат (без НДС), рублей
за потребительскую упаковку
расчет за одну лекарственную форму
расчет за единицу действующего вещества
1
2
3
4
5
6
7
8
Значение, рассчитанное исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата, умноженное на количество лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата (без НДС), рублей. <**>
Значение
Значение, рассчитанное исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные дозировки заявляемого лекарственного препарата, умноженное на количество единиц действующего вещества заявляемого лекарственного препарата (без НДС), рублей. <***>
Значение
Расчетная предельная отпускная цена заявляемого лекарственного препарата за потребительскую упаковку (без НДС), рублей. <****>
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Указываются сведения обо всех регистрационных удостоверениях, лекарственных формах, дозировках (концентрациях, активности в единицах действия), упаковках, на которые зарегистрированы предельные отпускные цены заявляемого лекарственного препарата в нумерации, соответствующей разделу II настоящего приложения.
<**> Рассчитывается в случаях, указанных в подпункте "а" пункта 7 и в подпункте "а" пункта 14 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
<***> Рассчитывается в случаях, указанных в подпункте "б" пункта 7 и в подпункте "б" пункта 14 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
<****> Указывается расчетная предельная отпускная цена для дозировки и общего количества в потребительской упаковке, представленных в пунктах 4 и 5 раздела I настоящего приложения.
Приложение N 6
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Производитель
Зарегистрированная предельная отпускная цена на референтный лекарственный препарат (Цреф) или на лекарственный препарат с максимальной зарегистрированной предельной отпускной ценой (Цм)
Коэффициент пересчета дозировки, Кд <*>
Коэффициент пересчета фасовки, Кф <*>
Понижающий коэффициент пересчета, Кп <*>
Расчетная предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат (без НДС), рублей (Цпр)
производитель
наименование лекарственного препарата
лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
количество в потребительской упаковке
зарегистрированная предельная отпускная цена (без НДС), рублей (Цреф/Цм) <*>
1
2
3
4
5
6
7
8
9
10
11
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Цены на лекарственные препараты Цреф и Цм, а также коэффициенты пересчета Кд, Кф и Кп определяются в соответствии с разделом VIII методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Приложение N 7
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Производитель
Прямые расходы
Общепроизводственные расходы
Общехозяйственные расходы
Прибыль
Рентабельность, процентов
Фактическая цена отпуска за потребительскую упаковку (без НДС), рублей <**>
Проект отпускной цены на лекарственный препарат за потребительскую упаковку (без НДС), рублей
материалы
сырье
заработная плата
заработная плата общепроизводственного и вспомогательного персонала
электроэнергия, теплоснабжение, водоснабжение и топливо
амортизация основных средств, используемых для производства
прочие <*>
разработка
реализация
прочие <*>
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Относятся на общепроизводственные и общехозяйственные расходы.
<**> Заполняется для лекарственных препаратов, находившихся в обращении на территории Российской Федерации.
Таблица 1. Планируемый объем выпуска лекарственного
препарата, его удельный вес в общем объеме производимых
лекарственных препаратов, в натуральном
и стоимостном выражении
N п/п
Наименование лекарственного препарата, дозировка и количество в потребительской упаковке, производитель
Единица измерения
Планируемый объем выпуска, в натуральном выражении (количество единиц измерения)
Планируемый объем выпуска, в стоимостном выражении (без НДС), рублей
Удельный вес лекарственного препарата в общем объеме производимых лекарственных препаратов, в натуральном выражении, процентов
Удельный вес лекарственного препарата в общем объеме производимых лекарственных препаратов, в стоимостном выражении (без НДС), рублей
1
2
3
4
5
6
7
Таблица 2. Калькуляция затрат материалов
по производству одной потребительской упаковки
(графа 3 раздела II настоящего приложения)
__________________________________________________________
(наименование препарата, дозировка и количество
в потребительской упаковке)
N п/п
Расходы на материалы
Единица измерения
Норма расхода (согласно техническому регламенту предприятия)
Цена фактической закупки (без НДС), рублей <**>
Сумма затрат на одну потребительскую упаковку (без НДС), рублей
1
2
3
4
5
6
Итого <*>
--------------------------------
<*> В расчете на одну потребительскую упаковку.
<**> В случае отсутствия закупки материалов, необходимых для производства конкретного лекарственного препарата, представляются сведения по аналогичным по своим характеристикам материалам, закупаемым для производства иных жизненно необходимых и важнейших лекарственных препаратов, цены на которые ранее зарегистрированы.
Таблица 3. Опись документального
подтверждения расходов на материалы
(графа 3 раздела II настоящего приложения)
N п/п
Наименование материала
Наименование поставщика
Номер и дата товарной накладной, или грузовой таможенной декларации, или иного вида документального подтверждения
1
2
3
4
Таблица 4. Калькуляция затрат сырья
по производству одной потребительской упаковки
(графа 4 раздела II настоящего приложения)
___________________________________________________________
(наименование препарата, дозировка и количество
в потребительской упаковке)
N п/п
Статьи расходов на сырье
Единица измерения
Норма расхода (согласно техническому регламенту предприятия)
Цена фактической закупки (без НДС), рублей <**>
Сумма затрат на одну потребительскую упаковку (без НДС), рублей
1
2
3
4
5
6
Активная фармацевтическая субстанция
Вспомогательные вещества
Итого <*>
--------------------------------
<*> В расчете на одну потребительскую упаковку.
<**> В случае отсутствия закупки вспомогательных веществ, используемых при производстве конкретного лекарственного препарата, представляются сведения по этим же вспомогательным веществам, закупаемым для производства иных жизненно необходимых и важнейших лекарственных препаратов, цены на которые ранее зарегистрированы.
Таблица 5. Информация
об активной фармацевтической субстанции
(графа 4 раздела II настоящего приложения)
N п/п
Наименование активной фармацевтической субстанции
Удельный вес активной фармацевтической субстанции в статье "Сырье" за отчетный период, в натуральном выражении, процентов
Производитель активной фармацевтической субстанции
Страна производства активной фармацевтической субстанции
Поставщик активной фармацевтической субстанции
Единица измерения активной фармацевтической субстанции
Цена активной фармацевтической субстанции (включая таможенные расходы), без НДС
в валюте (указывается вид валюты)
в рублях (в пересчете на дату таможенной декларации, или товарной накладной, или иного вида документального подтверждения)
1
2
3
4
5
6
7
8
9
Таблица 6. Опись
документального подтверждения расходов на сырье
(графа 4 раздела II настоящего приложения)
N п/п
Наименование фармацевтической субстанции или вспомогательного вещества
Наименование поставщика
Номер и дата товарной накладной или грузовой таможенной декларации
1
2
3
4
Таблица 7. Расшифровка затрат по статье "Заработная плата"
(графа 5 раздела II настоящего приложения)
N п/п
Структурные подразделения
Оплата труда по 20 счету, рублей
Страховые взносы по 20 счету, рублей <*>
Страховые взносы на обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний по 20 счету, рублей
Итого (без НДС), рублей
1
2
3
4
5
6
Заработная плата работников, занятых непосредственно на производстве лекарственного препарата
Итого
В расчете на одну потребительскую упаковку <**>
--------------------------------
<*> Учитываются страховые взносы на обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное пенсионное страхование, обязательное медицинское страхование.
<**> Рассчитывается по формуле "Итоговое значение (в рублях)"/"Планируемый или фактический объем выпуска препарата" в соответствии с разделом V методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Таблица 8. Расшифровка затрат
по статье "Общепроизводственные расходы"
(графы 6 - 9 раздела II настоящего приложения)
8.1. Расшифровка затрат по статье "Заработная плата
общепроизводственного и вспомогательного персонала"
(графа 6 раздела II настоящего приложения)
N п/п
Структурные подразделения
Оплата труда по 25 счету, рублей
Страховые взносы по 25 счету, рублей <*>
Страховые взносы на обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний по 25 счету, рублей
Итого (без НДС), рублей
1
2
3
4
5
6
Итого
В расчете на одну потребительскую упаковку <**>
--------------------------------
<*> Учитываются страховые взносы на обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное пенсионное страхование, обязательное медицинское страхование.
<**> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
8.2. Расшифровка затрат по статье
"Электроэнергия, теплоснабжение, водоснабжение и топливо"
(графа 7 раздела II настоящего приложения)
N п/п
Статья затрат
Поставщик
Стоимость услуг (без НДС), рублей
1
2
3
4
1.
Электроэнергия
2.
Теплоснабжение
3.
Водоснабжение
4.
Топливо
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
8.3. Расшифровка затрат по статье "Амортизация
основных средств, используемых для производства"
(графа 8 раздела II настоящего приложения)
N п/п
Основные средства
Амортизация (без НДС), рублей
1
2
3
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
8.4. Расшифровка затрат
по статье "Прочие общепроизводственные расходы"
(графа 9 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуги
Стоимость услуг (без НДС), рублей
1
2
3
4
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
Таблица 9. Расшифровка
затрат по статье "Общехозяйственные расходы"
(графы 10 - 12 раздела II настоящего приложения)
9.1. Расшифровка затрат по статье "Разработка"
(графа 10 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуги
Стоимость услуг (без НДС), рублей
1
2
3
4
1.
Разработка конкретного лекарственного препарата, в том числе собственные расходы предприятия
2.
Регистрационные процедуры, в том числе доклинические исследования лекарственных средств и клинические исследования лекарственного препарата
3.
Прочие расходы
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
9.2. Расшифровка затрат по статье "Реализация"
(графа 11 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуг
Стоимость услуг (без НДС), рублей
1
2
3
4
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
9.3. Расшифровка затрат
по статье "Прочие общехозяйственные расходы"
(графа 12 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуги
Стоимость услуг (без НДС), рублей
1
2
3
4
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
Прибыль и рентабельность продукции (графы 13 и 14 раздела II настоящего приложения) определяются в соответствии с разделом V методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Примечание. Таблица 9 является типовой, допускается включение в нее дополнительных сведений, учитывающих способ отнесения общепроизводственных и общехозяйственных расходов в соответствии с учетной политикой организации.
Приложение N 8
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
ФОРМУЛЫ
РАСЧЕТА ПОНИЖАЮЩИХ КОЭФФИЦИЕНТОВ, ПРИМЕНЯЕМЫХ ПРИ РАСЧЕТЕ
ПРЕДЕЛЬНОЙ ОТПУСКНОЙ ЦЕНЫ ПРОИЗВОДИТЕЛЯ НА ПЕРВЫЙ
ВОСПРОИЗВЕДЕННЫЙ, БИОАНАЛОГОВЫЙ (БИОПОДОБНЫЙ) ЛЕКАРСТВЕННЫЙ
ПРЕПАРАТ, А ТАКЖЕ ВОСПРОИЗВЕДЕННЫЙ, БИОАНАЛОГОВЫЙ
(БИОПОДОБНЫЙ) ОРФАННЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ,
ПРЕДСТАВЛЯЕМОЙ НА ГОСУДАРСТВЕННУЮ РЕГИСТРАЦИЮ
Зарегистрированная предельная отпускная цена за потребительскую упаковку референтного лекарственного препарата, рублей (Цреф)
Понижающий коэффициент для расчета цены на первый воспроизведенный лекарственный препарат (Кп)
Понижающий коэффициент для расчета цены на первый биоаналоговый (биоподобный) лекарственный препарат, а также воспроизведенный, биоаналоговый (биоподобный) орфанный лекарственный препарат (Кп)
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
1
2
3
4
5
до 100 рублей (включительно)
0
0
0
0
от 100 рублей
до 500 рублей (включительно)
0
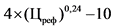
0
0
от 500 рублей
до 100000 рублей (включительно)
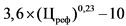


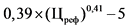
свыше 100000 рублей
40
55
25
40
--------------------------------
<*> Лекарственные препараты иностранного производства, в том числе первичная и (или) вторичная упаковка которых осуществляется или планируется осуществляться в Российской Федерации.
Приложение N 9
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
ФОРМУЛЫ
РАСЧЕТА ПОНИЖАЮЩИХ КОЭФФИЦИЕНТОВ, ПРИМЕНЯЕМЫХ
ПРИ РАСЧЕТЕ ПРЕДЕЛЬНОЙ ОТПУСКНОЙ ЦЕНЫ ПРОИЗВОДИТЕЛЯ
НА ВОСПРОИЗВЕДЕННЫЙ, БИОАНАЛОГОВЫЙ (БИОПОДОБНЫЙ)
ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, ПРЕДСТАВЛЯЕМОЙ
НА ГОСУДАРСТВЕННУЮ РЕГИСТРАЦИЮ
Зарегистрированная предельная отпускная цена за потребительскую упаковку референтного лекарственного препарата, рублей (Цреф)
Понижающий коэффициент для расчета цены на воспроизведенный лекарственный препарат (Кп)
Понижающий коэффициент для расчета цены на биоаналоговый (биоподобный) лекарственный препарат (Кп)
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
1
2
3
4
5
до 100 рублей (включительно)
0
0
0
0
от 100 рублей
до 500 рублей (включительно)
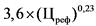

0
0
от 500 рублей
до 100 000 рублей (включительно)
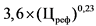

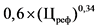
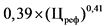
свыше
100000 рублей
50
65
30
45
--------------------------------
<*> Лекарственные препараты иностранного производства, в том числе первичная и (или) вторичная упаковка которых осуществляется или планируется осуществляться в Российской Федерации.
Приложение N 10
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Прямые расходы
Общепроизводственные расходы <*>
Прогнозируемый уровень инфляции, процентов (И) <**>
Фактический уровень инфляции с учетом прогнозируемого уровня, процентов <***>
Предельная отпускная цена за потребительскую упаковку (без НДС), рублей
материалы
сырье
электроэнергия, теплоснабжение, водоснабжение и топливо
амортизация основных средств, используемых для производства
факт.
план.
процентов увеличения
факт.
план.
процентов увеличения
факт.
план.
процентов увеличения
факт.
план.
процентов увеличения
зарегистрированная
заявленная
процентов увеличения
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Информация по накладным расходам заполняется при перерегистрации предельных отпускных цен производителей на лекарственные препараты в случаях, предусмотренных подпунктами "а" и "в" пункта 32 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов".
<**> Прогнозируемый уровень инфляции текущего года, установленный федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период.
<***> Фактический уровень инфляции предшествующего календарного года с учетом прогнозируемого уровня инфляции текущего года, установленного федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, рассчитываемый в соответствии с пунктом 41 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Приложение N 11
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
ЗНАЧЕНИЯ
КОЭФФИЦИЕНТА ЦЕНОВОЙ ГРУППЫ, ПРИМЕНЯЕМОГО ПРИ РАСЧЕТЕ
ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ НА ЛЕКАРСТВЕННЫЕ
ПРЕПАРАТЫ, ПРЕДСТАВЛЯЕМЫХ НА ПЕРЕРЕГИСТРАЦИЮ
Ценовая группа
Коэффициент ценовой группы, процентов (Ип)
1
2
до 100 рублей (включительно)
100
от 100 рублей до 500 рублей (включительно)
90
от 500 рублей до 1000 рублей (включительно)
85
от 1000 рублей до 3000 рублей (включительно)
80
от 3000 рублей до 5000 рублей (включительно)
75
от 5000 рублей до 10000 рублей (включительно)
70
от 10000 рублей до 20000 рублей (включительно)
60
от 20000 рублей до 40000 рублей (включительно)
50
от 40000 рублей до 100000 рублей (включительно)
40
свыше 100000 рублей
30
Приложение N 12
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Производитель (с указанием стадии производства)
Наименование национальной валюты государства-производителя
Курс национальной валюты государства-производителя к рублю (рублей)
Средневзвешенная фактическая цена ввоза (отпуска) лекарственного препарата, рублей <*>
Величина увеличения предельной отпускной цены, процентов <**>
Предельная отпускная цена за потребительскую упаковку (без НДС), рублей
курс при государственной регистрации (последней регистрации)
курс при перерегистрации
процентов увеличения
зарегистрированная <***>
заявленная <****>
процентов увеличения
1
2
3
4
5
6
7
8
9
10
11
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> При перерегистрации предельной отпускной цены на лекарственный препарат иностранного производства указывается средневзвешенная фактическая цена ввоза лекарственного препарата. При перерегистрации предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, указывается средневзвешенная фактическая цена отпуска лекарственного препарата.
<**> Рассчитывается в соответствии с пунктами 52 - 54 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
<***> Предельная отпускная цена производителя на лекарственный препарат, зарегистрированная по состоянию на дату подачи заявления о перерегистрации предельной отпускной цены.
<****> Заявленная к перерегистрации предельная отпускная цена производителя на лекарственный препарат.
