Постановление Правительства РФ от 16.12.2019 N 1683
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОСТАНОВЛЕНИЕ
от 16 декабря 2019 г. N 1683
О ВНЕСЕНИИ ИЗМЕНЕНИЙ
В НЕКОТОРЫЕ АКТЫ ПРАВИТЕЛЬСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ В ЧАСТИ
ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ И ПЕРЕРЕГИСТРАЦИИ ПРЕДЕЛЬНЫХ
ОТПУСКНЫХ ЦЕН НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ВКЛЮЧЕННЫЕ
В ПЕРЕЧЕНЬ ЖИЗНЕННО НЕОБХОДИМЫХ И ВАЖНЕЙШИХ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Правительство Российской Федерации постановляет:
1. Утвердить прилагаемые изменения, которые вносятся в акты Правительства Российской Федерации в части государственной регистрации и перерегистрации предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов.
2. Предельные отпускные цены производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов (далее - предельные отпускные цены), которые зарегистрированы до вступления в силу настоящего постановления и перерегистрированы в обязательном порядке в 2019 - 2020 годах в соответствии с Правилами обязательной перерегистрации в 2019 - 2020 годах зарегистрированных предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденными постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" (в редакции настоящего постановления) (далее - Правила обязательной перерегистрации), могут быть перерегистрированы в соответствии с пунктами 32 и 34 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" (в редакции настоящего постановления) (далее - Правила регистрации).
3. Установить, что:
к предельным отпускным ценам на лекарственные препараты, перерегистрированным в 2019 - 2020 годах в соответствии с Правилами обязательной перерегистрации, не применяются подпункты "в" и "г" пункта 42 Правил регистрации;
с 1 января 2021 г. не допускается реализация производителями лекарственных препаратов, предельные отпускные цены на которые не перерегистрированы в 2019 - 2020 годах в соответствии с Правилами обязательной перерегистрации.
4. Лекарственные препараты, реализованные их производителями на территории Российской Федерации до дня вступления в силу приказа Министерства здравоохранения Российской Федерации об обязательной перерегистрации в 2019 - 2020 годах предельной отпускной цены производителя, могут находиться в обращении до истечения срока их годности с учетом фактической отпускной цены производителя, не превышающей предельную отпускную цену, применявшуюся на дату их реализации.
5. Со дня вступления в силу настоящего постановления государственная регистрация и перерегистрация предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты в соответствии с Правилами регистрации может осуществляться после принятия решения об обязательной перерегистрации в 2019 - 2020 годах предельных отпускных цен на соответствующие им референтные лекарственные препараты.
6. Настоящее постановление вступает в силу со дня его официального опубликования.
Председатель Правительства
Российской Федерации
Д.МЕДВЕДЕВ
Утверждены
постановлением Правительства
Российской Федерации
от 16 декабря 2019 г. N 1683
ИЗМЕНЕНИЯ,
КОТОРЫЕ ВНОСЯТСЯ В АКТЫ ПРАВИТЕЛЬСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
В ЧАСТИ ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ И ПЕРЕРЕГИСТРАЦИИ
ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ,
ВКЛЮЧЕННЫЕ В ПЕРЕЧЕНЬ ЖИЗНЕННО НЕОБХОДИМЫХ И ВАЖНЕЙШИХ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
1. В постановлении Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" (Собрание законодательства Российской Федерации, 2010, N 45, ст. 5851; 2011, N 50, ст. 7390; 2012, N 37, ст. 5002; 2015, N 37, ст. 5153; N 38, ст. 5302; 2016, N 6, ст. 853; 2018, N 43, ст. 6597):
а) в пункте 1:
абзац второй изложить в следующей редакции:
"Правила государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов;";
после абзаца второго дополнить абзацем следующего содержания:
"Правила обязательной перерегистрации в 2019 - 2020 годах зарегистрированных предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов;";
б) в Правилах государственной регистрации и перерегистрации устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных указанным постановлением:
наименование изложить в следующей редакции:
"Правила государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов";
пункт 1 изложить в следующей редакции:
"1. Настоящие Правила устанавливают порядок осуществления государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, ежегодно утверждаемый Правительством Российской Федерации (далее - лекарственные препараты).";
в пункте 5:
подпункт "а" изложить в следующей редакции:
"а) заявление о государственной регистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, по форме согласно приложению N 1 (далее - заявление о государственной регистрации) или заявление о перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, по форме согласно приложению N 2 (далее - заявление о перерегистрации);";
в подпункте "г":
абзацы первый и второй изложить в следующей редакции:
"г) документы, представляемые с учетом требований методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979 "О внесении изменений в постановление Правительства Российской Федерации от 29 октября 2010 г. N 865 и об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" (далее - методика), включающие в себя:
сведения об объемах и о ценах отпуска находящегося в обращении на территории Российской Федерации лекарственного препарата производителя государства - члена Евразийского экономического союза и лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации;";
в абзацах седьмом и восьмом слова "производителей государств - членов" заменить словами "производителя государства - члена";
в абзаце девятом слова "на лекарственный препарат иностранных производителей, осуществляющих в том числе первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
пункт 7 после слов "копию регистрационного удостоверения лекарственного препарата" дополнить словами ", а также копию формы N 2-ЛЕК (пром) "Сведения о производстве, отгрузке и ценах на лекарственные средства";
в пункте 22:
абзац первый подпункта "а" изложить в следующей редакции:
"а) для лекарственного препарата производителя государства - члена Евразийского экономического союза, а также лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации:";
в подпункте "б" слова "иностранными производителями" заменить словами "для лекарственного препарата иностранного производства";
в пункте 24:
в абзаце втором слова "производителей государства - члена" заменить словами "производителя государства - члена", слова "государств - членов" заменить словами "государства - члена";
в абзаце третьем слова "иностранного производителя" заменить словами "иностранного производства";
в абзаце первом пункта 25 слова "в иностранных государствах, указанных" заменить словами "в одном из иностранных государств, указанном";
пункт 27 изложить в следующей редакции:
"27. В случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрирован воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза и иностранного производства, цена для такого лекарственного препарата рассчитывается как для лекарственного препарата производства государства - члена Евразийского экономического союза или лекарственного препарата иностранного производства с учетом соответствующего понижающего коэффициента в соответствии с методикой.";
в пункте 29:
слова "в соответствии с национальным календарем профилактических прививок" исключить;
дополнить абзацем следующего содержания:
"В случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации на лекарственный препарат, применяемый в педиатрической практике (на основании сведений инструкции по медицинскому применению лекарственного препарата), не зарегистрирована предельная отпускная цена на лекарственный препарат в дозировках, применяемых в педиатрической практике, в рамках одного международного непатентованного наименования (при его отсутствии химического или группировочного наименования) и лекарственной формы, расчет осуществляется в соответствии с требованиями, установленными для референтных лекарственных препаратов. При этом максимальная разница между минимальной зарегистрированной предельной отпускной ценой на лекарственный препарат и представленной для государственной регистрации предельной отпускной ценой на лекарственный препарат, рассчитанная исходя из стоимости единицы действующего вещества, не может превышать 90 процентов.";
в пункте 32:
в абзаце первом слова "производителей государств - членов" заменить словами "производителя государства - члена";
в подпункте "а" слова "до 50 рублей" заменить словами "до 100 рублей";
в подпунктах "б" и "в" слова "от 50 рублей" заменить словами "от 100 рублей";
в абзаце первом пункта 33 слова "производителей государств - членов" заменить словами "производителя государства - члена";
в абзацах первом и втором пункта 34 слова "на лекарственный препарат иностранного производителя, осуществляющего в том числе первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется";
в пункте 35:
в абзаце первом подпункта "а" и в абзаце первом подпункта "б" слова "производителями из государств - членов" заменить словами "для лекарственного препарата производителя государства - члена";
в подпункте "в":
слова "производителями государств - членов" заменить словами "для лекарственного препарата производителя государства - члена";
после слов "подпунктом "г" пункта 32 настоящих Правил, -" дополнить словами "копия формы N 2-ЛЕК (пром) "Сведения о производстве, отгрузке и ценах на лекарственные средства" (для отечественных производителей), а также";
в абзаце первом подпункта "г" слова "иностранными производителями, осуществляющими первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "для лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
в абзаце первом подпункта "д" слова "иностранными производителями" заменить словами "для лекарственного препарата иностранного производства";
в пункте 36 слова "производителей государств - членов" заменить словами "производителя государства - члена";
в пункте 41 слова "пункта 40" заменить словами "пунктов 40 и 45";
дополнить пунктами 42 - 45 следующего содержания:
"42. Держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) обязан представить заявление о перерегистрации в сторону снижения при наступлении следующих случаев:
а) если в результате снижения производителем отпускной цены в иностранной валюте на указанный лекарственный препарат в иностранных государствах, указанных в приложении N 2 к методике, отпускная цена производителя на лекарственный препарат в рублях, рассчитанная в соответствии с методикой (с учетом расходов на таможенное оформление), ниже зарегистрированной предельной отпускной цены производителя на указанный лекарственный препарат, - в течение 30 календарных дней со дня, когда решение о снижении цен уполномоченных органов в иностранных государствах, указанных в приложении N 2 к методике, вступило в силу;
б) если предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат выше предельной отпускной цены на соответствующий референтный лекарственный препарат в связи со снижением, предусмотренным подпунктом "а" настоящего пункта, - в течение 30 календарных дней со дня принятия решения о перерегистрации в сторону снижения зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат;
в) если зарегистрированная предельная отпускная цена на первый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, выше предельной отпускной цены производителя, рассчитанной с учетом понижающего коэффициента, указанного в приложении N 9 к методике, после государственной регистрации предельной отпускной цены производителя на второй воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому наименованию), лекарственной форме и дозировке, - в течение 30 календарных дней со дня принятия решения о государственной регистрации предельной отпускной цены производителя на второй воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат;
г) если зарегистрированная предельная отпускная цена на первый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза выше предельной отпускной цены производителя государства - члена Евразийского экономического союза, рассчитанной с учетом понижающего коэффициента, указанного в приложении N 9 к методике, после государственной регистрации предельной отпускной цены на второй воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме и дозировке, - в течение 30 календарных дней со дня принятия решения о государственной регистрации предельной отпускной цены производителя на второй воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза.
43. Перерегистрация зарегистрированной предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата в сторону снижения в случаях, предусмотренных подпунктами "в" и "г" пункта 42 настоящих Правил, осуществляется, если в рамках международного непатентованного наименования (при его отсутствии - группировочного или химического наименования) и лекарственной формы зарегистрирована предельная отпускная цена производителя на соответствующий референтный лекарственный препарат.
44. В случае перерегистрации зарегистрированной предельной отпускной цены производителя в сторону снижения на основании заявления держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица), представленного в соответствии с пунктом 42 настоящих Правил, цена на такой лекарственный препарат не может быть заявлена в течение календарного года на перерегистрацию в сторону увеличения в соответствии с пунктами 32 и 34 настоящих Правил.
45. Федеральная антимонопольная служба в письменной форме уведомляет держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) о необходимости перерегистрации зарегистрированной предельной отпускной цены на лекарственный препарат в сторону снижения, если держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) не представил заявление о перерегистрации в сторону снижения в соответствии с пунктом 42 настоящих Правил.
Держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) в течение 20 рабочих дней после получения уведомления Федеральной антимонопольной службы приводит зарегистрированную предельную отпускную цену в соответствие с ценой, рассчитанной в соответствии с настоящими Правилами и методикой, с учетом информации, указанной в уведомлении Федеральной антимонопольной службы.
Федеральная антимонопольная служба в течение 5 рабочих дней после истечения срока, указанного в абзаце втором настоящего пункта, отменяет решение о согласовании предельной отпускной цены производителя на лекарственный препарат в случае неприведения держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) зарегистрированной предельной отпускной цены в соответствие с настоящими Правилами и методикой с учетом информации, указанной в уведомлении Федеральной антимонопольной службы, в течение одного месяца со дня получения уведомления Федеральной антимонопольной службы.";
приложения N 1 и 2 к указанным Правилам изложить в следующей редакции:
"Приложение N 1
к Правилам государственной регистрации
и перерегистрации предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
(форма)
N п/п
Стадия производства
Производитель (наименование)
Адрес
Страна
Для российских юридических лиц - идентификационный номер налогоплательщика, для иностранных юридических лиц - код налогоплательщика в стране регистрации (инкорпорации) или его аналог
Наименование регистрирующего органа
Регистрационный номер
N п/п
Номер регистрационного удостоверения
Международное непатентованное, или группировочное, или химическое наименование <*>
Торговое наименование
Лекарственная форма, дозировка, комплектность <**>
Общее количество во вторичной (потребительской) упаковке
Предельная отпускная цена производителя за потребительскую упаковку <**> без НДС (рублей)
Штриховой код, нанесенный на вторичную (потребительскую) упаковку
Код АТХ
Код ТН ВЭД ЕАЭС
1
2
3
4
5
6
7
8
9
10
Уполномоченное
лицо
(ф.и.о.)
(должность)
(подпись)
М.П. (при наличии)
Контактные
телефоны
Адрес электронной
почты
--------------------------------
<*> В случае отсутствия международного непатентованного наименования в регистрационном удостоверении лекарственного препарата указывается наименование лекарственного препарата, предусмотренное перечнем жизненно необходимых и важнейших лекарственных препаратов.
<**> В случаях, предусмотренных пунктом 25 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов", дополнительно указывается форма выпуска лекарственного препарата, с учетом которой рассчитывается предельная отпускная цена производителя за потребительскую упаковку лекарственного препарата.
Приложение N 2
к Правилам государственной регистрации
и перерегистрации предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
(форма)
N п/п
Стадия производства
Производитель (наименование)
Адрес
Страна
Для российских юридических лиц - идентификационный номер налогоплательщика, для иностранных юридических лиц - код налогоплательщика в стране регистрации (инкорпорации) или его аналог
Наименование регистрирующего органа
Регистрационный номер
N п/п
Номер регистрационного удостоверения
Международное непатентованное, или группировочное, или химическое наименование <**>
Торговое наименование
Лекарственная форма, дозировка, комплектность <*>
Общее количество во вторичной (потребительской) упаковке
Предельная отпускная цена производителя за потребительскую упаковку <**> без НДС (рублей)
Штриховой код, нанесенный на вторичную (потребительскую) упаковку
Код АТХ
Код ТН ВЭД ЕАЭС
1
2
3
4
5
6
7
8
9
10
Уполномоченное
лицо
(ф.и.о.)
(должность)
(подпись)
М.П. (при наличии)
Контактные
телефоны
Адрес электронной
почты
--------------------------------
<*> В случае отсутствия международного непатентованного наименования в регистрационном удостоверении лекарственного препарата указывается наименование лекарственного препарата, предусмотренное перечнем жизненно необходимых и важнейших лекарственных препаратов.
<**> В случаях, предусмотренных пунктом 25 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов", дополнительно указывается форма выпуска лекарственного препарата, с учетом которой рассчитывается предельная отпускная цена производителя за потребительскую упаковку лекарственного препарата.";
в) дополнить Правилами обязательной перерегистрации в 2019 - 2020 годах зарегистрированных предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов следующего содержания:
"Утверждены
постановлением Правительства
Российской Федерации
от 29 октября 2010 г. N 865
ПРАВИЛА
ОБЯЗАТЕЛЬНОЙ ПЕРЕРЕГИСТРАЦИИ В 2019 - 2020 ГОДАХ
ЗАРЕГИСТРИРОВАННЫХ ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ
НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ВКЛЮЧЕННЫЕ В ПЕРЕЧЕНЬ ЖИЗНЕННО
НЕОБХОДИМЫХ И ВАЖНЕЙШИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
1. Настоящие Правила устанавливают порядок осуществления в 2019 - 2020 годах обязательной перерегистрации зарегистрированных предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов (далее соответственно - предельные отпускные цены, лекарственные препараты, обязательная перерегистрация).
Обязательная перерегистрация предельных отпускных цен на лекарственные препараты осуществляется с сохранением последних зарегистрированных (перерегистрированных) предельных отпускных цен на иммунобиологические лекарственные препараты, лекарственные препараты, содержащие наркотические средства и психотропные вещества, производства государств - членов Евразийского экономического союза, а также на лекарственные препараты в ценовом сегменте до 100 рублей, не превышающих предельных отпускных цен, определенных с учетом положений части 4 статьи 61 Федерального закона "Об обращении лекарственных средств".
2. Зарегистрированные до вступления в силу Федерального закона "О внесении изменений в Федеральный закон "Об обращении лекарственных средств" в части государственного регулирования цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" предельные отпускные цены на референтные лекарственные препараты подлежат обязательной перерегистрации на основании заявлений владельцев или держателей регистрационных удостоверений таких лекарственных препаратов (уполномоченных ими лиц), поданных в соответствии с настоящими Правилами.
3. Министерство здравоохранения Российской Федерации в течение 10 рабочих дней со дня вступления в силу постановления Правительства Российской Федерации от 16 декабря 2019 г. N 1683 "О внесении изменений в некоторые акты Правительства Российской Федерации в части государственной регистрации и перерегистрации предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов", размещает на своем официальном сайте в информационно-телекоммуникационной сети "Интернет" (далее - сеть "Интернет") обращение к владельцам или держателям регистрационных удостоверений референтных лекарственных препаратов (уполномоченным ими лицам) о необходимости представления документов и информации, предусмотренных настоящими Правилами.
4. Держатель или владелец регистрационного удостоверения референтного лекарственного препарата (уполномоченное им лицо) в течение 40 рабочих дней со дня вступления в силу постановления Правительства Российской Федерации, указанного в пункте 3 настоящих Правил, представляет в Министерство здравоохранения Российской Федерации следующие документы (на бумажном носителе в 2 экземплярах и в электронном виде):
заявление об обязательной перерегистрации в 2019 - 2020 годах зарегистрированной предельной отпускной цены производителя на референтный лекарственный препарат, включенный в перечень жизненно необходимых и важнейших лекарственных препаратов, по форме согласно приложению N 1 (далее - заявление);
сведения о лицензии на производство лекарственных средств;
сведения о регистрационном удостоверении лекарственного препарата;
расчет предельной отпускной цены производителя на референтный лекарственный препарат, представляемой для обязательной перерегистрации в 2019 - 2020 годах, по форме согласно приложению N 2;
информацию о минимальных отпускных ценах на лекарственный препарат в иностранных государствах по форме согласно приложению N 3. Пересчет цены в иностранной валюте на лекарственные препараты в иностранных государствах, указанных в приложении N 3 к настоящим Правилам, в рубли осуществляется по среднему курсу соответствующей иностранной валюты к рублю Российской Федерации, установленному Центральным банком Российской Федерации за 2018 год.
Дополнительно на бумажном носителе представляются:
сведения (по выбору держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченного им лица), подтверждающие отпускные цены производителя на лекарственный препарат в иностранных государствах, указанных в приложении N 3 к настоящим Правилам (в 2 экземплярах, с переводом на русский язык);
документ, подтверждающий полномочия уполномоченного лица.
5. Сведения, предусмотренные пунктом 4 настоящих Правил, указываются в соответствии с действующим на дату подачи заявления регистрационным удостоверением лекарственного препарата.
6. Держатель или владелец регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) в течение 40 рабочих дней со дня вступления в силу постановления Правительства Российской Федерации, указанного в пункте 3 настоящих Правил, обязан указать в личном кабинете заявителя на портале по ведению государственного реестра лекарственных средств реестровые записи государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов (далее - реестр), подлежащие исключению из реестра, содержащие номер регистрационного удостоверения лекарственного препарата, наименование владельца или держателя регистрационного удостоверения лекарственного препарата, наименования производителей (производственных площадок производителя), международное непатентованное наименование (при его отсутствии - химическое или группировочное наименование), торговое наименование, лекарственную форму, дозировку (концентрацию, объем, активность в единицах действия), форму выпуска, количество в потребительской упаковке, зарегистрированную предельную отпускную цену с указанием даты и номера приказа Министерства здравоохранения Российской Федерации о государственной регистрации или перерегистрации предельной отпускной цены и (или) даты и номера выписки из реестра, выданной владельцу или держателю регистрационного удостоверения лекарственного препарата по результатам внесения изменений в реестровую запись реестра или по результатам снижения зарегистрированной предельной отпускной цены производителя на лекарственный препарат, штриховой код, нанесенный на вторичную (потребительскую) упаковку лекарственного препарата).
7. При обязательной перерегистрации предельной отпускной цены на конкретный референтный лекарственный препарат сведения по всем указанным в рамках одного регистрационного удостоверения лекарственного препарата производственным площадкам производителя и формам выпуска лекарственного препарата представляются одновременно.
8. Министерство здравоохранения Российской Федерации в течение 15 рабочих дней со дня получения указанных в пункте 4 настоящих Правил документов и сведений осуществляет проверку их полноты и направляет один экземпляр документов и сведений в Федеральную антимонопольную службу или принимает решение об отказе в обязательной перерегистрации предельной отпускной цены на референтный лекарственный препарат.
9. Федеральная антимонопольная служба в течение 70 рабочих дней со дня получения документов и сведений проводит в соответствии с настоящими Правилами экономический анализ предельных отпускных цен на референтные лекарственные препараты, принимает и направляет в Министерство здравоохранения Российской Федерации решение о согласовании предельной отпускной цены или об отказе в ее согласовании с указанием причин отказа, публикует данные о согласованной цене референтного лекарственного препарата на своем официальном сайте в сети "Интернет".
10. В случае необходимости уточнения сведений, содержащихся в представленных документах, и (или) получения дополнительной необходимой информации Министерство здравоохранения Российской Федерации и Федеральная антимонопольная служба запрашивают соответствующие документы и сведения в порядке, предусмотренном пунктами 12 и 14 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов" (далее - Правила регистрации).
11. Основаниями для отказа в обязательной перерегистрации Министерством здравоохранения Российской Федерации предельной отпускной цены на референтный лекарственный препарат являются:
а) отсутствие в представленных в соответствии с пунктом 4 настоящих Правил документах сведений, предусмотренных настоящими Правилами;
б) непредставление сведений в соответствии с пунктами 4 и 10 настоящих Правил;
в) решение Федеральной антимонопольной службы об отказе в согласовании предельной отпускной цены на референтный лекарственный препарат.
12. Основаниями для принятия Федеральной антимонопольной службой решения об отказе в согласовании предельной отпускной цены на референтный лекарственный препарат являются:
а) представление недостоверных сведений;
б) представление документов в неполном объеме и (или) неполнота содержащихся в них сведений;
в) непредставление сведений в соответствии с пунктом 10 настоящих Правил;
г) превышение представленной к обязательной перерегистрации предельной отпускной цены на референтный лекарственный препарат над ценой, рассчитанной в соответствии с настоящими Правилами.
13. Федеральная антимонопольная служба при проверке сведений, представленных владельцем или держателем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) в соответствии с настоящими Правилами, использует источники, содержащие цены на лекарственные препараты в иностранных государствах согласно приложению N 3, соответствующие требованиям, предусмотренным пунктом 17 Правил регистрации.
14. Министерство здравоохранения Российской Федерации принимает решение об обязательной перерегистрации предельной отпускной цены на референтный лекарственный препарат в зависимости от решения о согласовании предельной отпускной цены, принятого Федеральной антимонопольной службой, одновременно с решением об обязательной перерегистрации предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты в зависимости от решения, принятого Федеральной антимонопольной службой.
15. Министерство здравоохранения Российской Федерации в течение 20 рабочих дней со дня получения решения Федеральной антимонопольной службы о согласовании предельной отпускной цены производителя на референтный лекарственный препарат направляет в Федеральную антимонопольную службу в отношении этого референтного лекарственного препарата по состоянию на день принятия указанного решения перечень зарегистрированных в Российской Федерации воспроизведенных, биоаналоговых (биоподобных) лекарственных препаратов, предельные отпускные цены на которые зарегистрированы и включены в реестр, содержащий необходимое для применения понижающего коэффициента описание воспроизведенных, биоаналоговых (биоподобных) лекарственных препаратов (номер регистрационного удостоверения лекарственного препарата, наименование владельца или держателя регистрационного удостоверения лекарственного препарата, наименования производителей (производственных площадок производителя), международное непатентованное наименование (при его отсутствии - химическое или группировочное наименование), торговое наименование, лекарственная форма, дозировка (концентрация, объем, активность в единицах действия), выраженная в соответствующих единицах измерения, форма выпуска, количество в потребительской упаковке, последняя предельная отпускная цена с указанием даты и номера приказа Министерства здравоохранения Российской Федерации о регистрации или перерегистрации предельной отпускной цены и (или) даты и номера выписки из реестра, выданной владельцу или держателю регистрационного удостоверения лекарственного препарата по результатам внесения изменений в реестровую запись реестра или по результатам снижения зарегистрированной предельной отпускной цены на лекарственный препарат, штриховой код, нанесенный на вторичную (потребительскую) упаковку лекарственного препарата), на бумажном носителе и в электронном виде в табличном формате.
16. Министерство здравоохранения Российской Федерации в течение 15 рабочих дней со дня получения решения Федеральной антимонопольной службы об отказе в согласовании предельной отпускной цены на референтный лекарственный препарат принимает соответствующее решение об отказе в обязательной перерегистрации предельной отпускной цены на референтный лекарственный препарат.
При принятии решения об отказе в обязательной перерегистрации предельной отпускной цены на лекарственный препарат Министерство здравоохранения Российской Федерации в срок, не превышающий 5 рабочих дней со дня получения решения Федеральной антимонопольной службы, уведомляет держателя или владельца регистрационного удостоверения лекарственного препарата (уполномоченное им лицо) в письменной форме о принятом решении (с изложением причин отказа).
17. В случае если держателем или владельцем регистрационного удостоверения референтного лекарственного препарата (уполномоченным им лицом) в течение 15 рабочих дней со дня принятия Министерством здравоохранения Российской Федерации решения об отказе в обязательной перерегистрации предельной отпускной цены на референтный лекарственный препарат повторно представлены в Министерство здравоохранения Российской Федерации документы в соответствии с пунктом 4 настоящих Правил, сроки рассмотрения повторно поданных документов определяются в соответствии с пунктами 10 и 13 Правил регистрации.
18. При обязательной перерегистрации предельная отпускная цена на референтный лекарственный препарат для каждой лекарственной формы, дозировки (концентрации, активности в единицах действия) и общего количества во вторичной (потребительской) упаковке без учета формы выпуска, за исключением случая, предусмотренного пунктом 21 настоящих Правил, не может превышать:
а) размер минимальной отпускной цены производителя (без учета производственных площадок производителя) на такой лекарственный препарат в иностранных государствах, указанных в приложении N 3 к настоящим Правилам (с учетом расходов, связанных с таможенным оформлением), рассчитанный на основании данных, указанных в приложении N 2 к настоящим Правилам;
б) ранее зарегистрированную (последнюю перерегистрированную) предельную отпускную цену на этот лекарственный препарат;
в) предельную отпускную цену на лекарственный препарат, определенную с учетом пункта 8 Правил регистрации, за исключением случаев, предусмотренных пунктом 6 настоящих Правил.
19. При обязательной перерегистрации с учетом пункта 18 настоящих Правил в рамках одного торгового наименования лекарственного препарата с учетом изменения торгового наименования лекарственного препарата для всех подлежащих снижению зарегистрированных (перерегистрированных) предельных отпускных цен на референтный лекарственный препарат производителей (производственных площадок производителя), указанных в рамках одного регистрационного удостоверения, по результатам обязательной перерегистрации в реестре устанавливается единая предельная отпускная цена на лекарственный препарат для каждой лекарственной формы, дозировки (концентрации, активности в единицах действия) и общего количества во вторичной (потребительской) упаковке без учета формы выпуска, за исключением случая, предусмотренного пунктом 21 настоящих Правил.
20. В случае если в рамках одного торгового наименования референтного лекарственного препарата с учетом изменения торгового наименования лекарственного препарата зарегистрированная (перерегистрированная) предельная отпускная цена для одного или нескольких производителей (производственных площадок производителя), указанных в рамках одного регистрационного удостоверения, ниже, чем предельная отпускная цена, рассчитанная в соответствии с пунктом 18 настоящих Правил, эта цена подлежит сохранению в реестре.
В случае если для референтного лекарственного препарата с одной лекарственной формой, дозировкой и общим количеством во вторичной (потребительской) упаковке зарегистрировано несколько предельных отпускных цен, предельная отпускная цена на лекарственный препарат не может превышать минимальную из зарегистрированных предельных отпускных цен (с учетом последней перерегистрированной цены, без учета производственных площадок производителя) с учетом сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата согласно приложению N 4.
21. В случае если минимальный уровень цен референтного лекарственного препарата на различные формы выпуска (шприц-ручки, картриджи либо иные формы выпуска, совместимые с устройствами введения (применения) или являющиеся устройствами введения (применения) в одном из государств, указанных в приложении N 3 к настоящим Правилам, различается более чем на 10 процентов, при обязательной перерегистрации предельных отпускных цен на указанный референтный лекарственный препарат допускается устанавливать предельную отпускную цену на каждую из таких форм выпуска лекарственного препарата.
22. Предельная отпускная цена на референтный лекарственный препарат в случае, предусмотренном пунктом 21 настоящих Правил, устанавливается на основании минимальной отпускной цены производителя (без учета производственных площадок производителя) на соответствующие формы выпуска такого лекарственного препарата в государствах, указанных в приложении N 3 к настоящим Правилам (с учетом расходов, связанных с таможенным оформлением).
При этом максимальная разница между предельными отпускными ценами на такой референтный лекарственный препарат в различных формах выпуска, сопоставимых по лекарственной форме, дозировке (концентрации, активности в единицах действия) и общему количеству во вторичной (потребительской) упаковке, не может превышать 90 процентов.
23. Обязательная перерегистрация предельных отпускных цен на иммунобиологические лекарственные препараты (вакцины) осуществляется в соответствии с требованиями, установленными для референтных лекарственных препаратов.
24. Зарегистрированные предельные отпускные цены на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты подлежат обязательной перерегистрации без представления заявления владельцами или держателями регистрационных удостоверений таких лекарственных препаратов (уполномоченными ими лицами).
25. При обязательной перерегистрации предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат для каждой лекарственной формы, дозировки (концентрации, активности в единицах действия) и общего количества во вторичной (потребительской) упаковке без учета формы выпуска, за исключением случая, предусмотренного пунктом 21 настоящих Правил, не может превышать:
а) ранее зарегистрированную (последнюю перерегистрированную) предельную отпускную цену производителя на этот лекарственный препарат;
б) предельную отпускную цену на этот лекарственный препарат, определенную с учетом требований пункта 8 Правил регистрации без учета предельных отпускных цен, исключенных в соответствии с пунктом 6 настоящих Правил;
в) для лекарственного препарата (за исключением орфанного лекарственного препарата), - цену, рассчитанную в соответствии с разделом VIII методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979 "О внесении изменений в постановление Правительства Российской Федерации от 29 октября 2010 г. N 865 и об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при их государственной регистрации и перерегистрации" (далее - методика), с применением понижающего коэффициента в отношении перерегистрированной в обязательном порядке в соответствии с настоящими Правилами предельной отпускной цены на соответствующий референтный лекарственный препарат. Значения понижающего коэффициента, применяемого при обязательной перерегистрации в 2019 - 2020 годах предельных отпускных цен производителей на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, определяются по формулам расчета согласно приложению N 5;
г) для орфанного лекарственного препарата - предельную отпускную цену на соответствующий референтный лекарственный препарат, перерегистрированную в обязательном порядке в соответствии с настоящими Правилами.
26. При обязательной перерегистрации с учетом пункта 25 настоящих Правил в рамках одного торгового наименования лекарственного препарата с учетом изменения торгового наименования лекарственного препарата для всех подлежащих снижению предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты производителей (производственных площадок производителя), указанных в рамках одного регистрационного удостоверения, по результатам обязательной перерегистрации с учетом пункта 29 настоящих Правил в реестре устанавливаются единые предельные отпускные цены на лекарственные препараты для каждой лекарственной формы, дозировки (концентрации, активности в единицах действия) и общего количества во вторичной (потребительской) упаковке без учета формы выпуска, за исключением случая, предусмотренного пунктом 30 настоящих Правил.
27. В случае если в рамках одного торгового наименования воспроизведенного, биоаналогового (биоподобного) лекарственного препарата с учетом изменения торгового наименования лекарственного препарата зарегистрированная (перерегистрированная) предельная отпускная цена для одного или нескольких производителей (производственных площадок производителя), указанных в рамках одного регистрационного удостоверения, ниже, чем предельная отпускная цена, рассчитанная в соответствии с пунктом 25 настоящих Правил, эта цена подлежит сохранению в реестре.
В случае если для воспроизведенного, биоаналогового (биоподобного) лекарственного препарата с одной лекарственной формой, дозировкой и общим количеством во вторичной (потребительской) упаковке зарегистрировано несколько предельных отпускных цен, предельная отпускная цена производителя на лекарственный препарат в рамках одного регистрационного удостоверения не может превышать минимальную из зарегистрированных предельных отпускных цен с учетом их перерегистрации, за исключением предельных отпускных цен, исключенных в соответствии с пунктом 6 настоящих Правил.
В случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрированы цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза и иностранного производства, минимальная из зарегистрированных предельных отпускных цен определяется с сохранением принадлежности производителя к государству - члену Евразийского экономического союза или иностранному производителю.
28. В случае если по результатам обязательной перерегистрации в рамках международного непатентованного наименования (при его отсутствии - группировочного или химического) и лекарственной формы на соответствующий референтный лекарственный препарат установлены различные предельные отпускные цены, применяется среднее арифметическое значение понижающего коэффициента, рассчитанное на основании установленных по результатам обязательной перерегистрации предельных отпускных цен на референтный лекарственный препарат.
29. В случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрирован воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза и иностранного производства, цены для указанного лекарственного препарата рассчитываются в соответствии с разделом VIII методики с применением понижающих коэффициентов, значения которых определяются в соответствии с приложением N 5 к настоящим Правилам.
30. В случае если предельная отпускная цена на референтный лекарственный препарат установлена в соответствии с пунктами 21 и 22 настоящих Правил, расчет предельных отпускных цен на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат осуществляется в соответствии с пунктами 24 - 27 настоящих Правил для каждой формы выпуска исходя из предельных отпускных цен на соответствующие формы выпуска референтного лекарственного препарата.
31. Федеральная антимонопольная служба в течение 60 рабочих дней со дня получения от Министерства здравоохранения Российской Федерации сведений, предусмотренных пунктом 15 настоящих Правил, проводит в соответствии с настоящими Правилами и методикой расчет предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, а также публикует на своем официальном сайте в сети "Интернет" и одновременно направляет в Министерство здравоохранения Российской Федерации указанный расчет предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, содержащий номер регистрационного удостоверения лекарственного препарата, наименование владельца или держателя регистрационного удостоверения лекарственного препарата, наименования производителей (производственных площадок производителя), международное непатентованное наименование (при его отсутствии - химическое или группировочное наименование), торговое наименование, лекарственную форму, дозировку (концентрацию, объем, активность в единицах действия), форму выпуска, количество в потребительской упаковке, предельную отпускную цену, рассчитанную Федеральной антимонопольной службой, штриховой код, нанесенный на вторичную (потребительскую) упаковку лекарственного препарата) (на бумажном носителе и в электронном виде в табличном формате).
32. При необходимости уточнения информации, требуемой для проведения расчета предельных отпускных цен на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, соответствующие сведения запрашиваются в порядке, предусмотренном пунктом 14 Правил регистрации.
33. Министерство здравоохранения Российской Федерации в течение 20 рабочих дней со дня получения от Федеральной антимонопольной службы решения об утверждении расчета предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты в соответствии с пунктом 31 настоящих Правил принимает решение об обязательной перерегистрации предельной отпускной цены на лекарственный препарат, вносит соответствующие данные в реестр в срок, предусмотренный пунктом 6 Правил ведения государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов", выдает держателю или владельцу регистрационного удостоверения лекарственного препарата (уполномоченному им лицу) выписку из приказа Министерства здравоохранения Российской Федерации об обязательной перерегистрации предельной отпускной цены на лекарственный препарат и размещает соответствующую информацию на своем официальном сайте в сети "Интернет".
34. Приказ Министерства здравоохранения Российской Федерации об обязательной перерегистрации предельной отпускной цены производителя на лекарственный препарат вступает в силу по истечении 5 месяцев со дня его принятия.
35. Министерство здравоохранения Российской Федерации в целях соблюдения нормы части 2 статьи 63 Федерального закона "Об обращении лекарственных средств" отмечает в реестре соответствующую информацию обо всех ранее зарегистрированных (перерегистрированных) предельных отпускных ценах производителей на референтный и соответствующие ему воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты.
36. При несогласии с произведенным Федеральной антимонопольной службой расчетом предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты держатели или владельцы регистрационных удостоверений воспроизведенных, биоаналоговых (биоподобных) лекарственных препаратов (уполномоченные ими лица) вправе в течение одного календарного месяца со дня принятия Министерством здравоохранения Российской Федерации решения об обязательной перерегистрации предельной отпускной цены на лекарственный препарат обратиться в Федеральную антимонопольную службу с заявлениями о пересмотре расчета зарегистрированных предельных отпускных цен на лекарственные препараты, в том числе в рамках одного международного непатентованного наименования.
Заявления о пересмотре расчета зарегистрированных предельных отпускных цен на лекарственные препараты с приложением (по выбору держателей или владельцев регистрационных удостоверений лекарственных препаратов, уполномоченных ими лиц) мотивированного документального подтверждения расчета указанной цены представляются в Федеральную антимонопольную службу на бумажном носителе.
37. Федеральная антимонопольная служба в течение одного месяца со дня поступления заявлений и документов, указанных в пункте 36 настоящих Правил, проверяет расчет предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, при необходимости пересматривает расчет предельных отпускных цен на указанные лекарственные препараты, отменяет ранее принятые решения и направляет в Министерство здравоохранения Российской Федерации новые решения об утверждении расчета предельных отпускных цен производителя на указанные лекарственные препараты или направляет заявителям решение об отказе в пересмотре расчета предельных отпускных цен на указанные лекарственные препараты (с указанием причин отказа).
38. В случае отмены Федеральной антимонопольной службой решения об утверждении расчета предельных отпускных цен на лекарственные препараты Министерство здравоохранения Российской Федерации отменяет решение об обязательной перерегистрации предельных отпускных цен на эти лекарственные препараты, исключает перерегистрированные в обязательном порядке предельные отпускные цены на указанные лекарственные препараты из реестра и принимает новые решения об обязательной перерегистрации предельных отпускных цен на эти лекарственные препараты в зависимости от решений, принятых Федеральной антимонопольной службой.
39. В случае если в рамках международного непатентованного наименования и лекарственной формы отсутствует референтный лекарственный препарат или цена на него не зарегистрирована, зарегистрированная до дня вступления в силу постановления Правительства Российской Федерации, указанного в пункте 3 настоящих Правил, предельная отпускная цена в отношении соответствующего воспроизведенного, биоаналогового (биоподобного) лекарственного препарата ценового сегмента свыше 100 рублей подлежит обязательной перерегистрации и не может превышать ранее зарегистрированную (перерегистрированную) предельную отпускную цену воспроизведенного, биоаналогового (биоподобного) лекарственного препарата (без учета формы выпуска).
В случае если в рамках одного торгового наименования воспроизведенного, биоаналогового (биоподобного) лекарственного препарата ценового сегмента свыше 100 рублей с учетом изменения торгового наименования лекарственного препарата с одной лекарственной формой, дозировкой и общим количеством во вторичной (потребительской) упаковке зарегистрировано несколько предельных отпускных цен, предельная отпускная цена не может превышать минимальную из последних зарегистрированных предельных отпускных цен (с учетом их перерегистрации).
В случае если в рамках одного регистрационного удостоверения лекарственного препарата воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производится в государстве - члене Евразийского экономического союза и иностранным производителем, минимальная из зарегистрированных предельных отпускных цен определяется с сохранением принадлежности лекарственного препарата к государству - члену Евразийского экономического союза или иностранному производителю.
40. В случае если предельная отпускная цена на референтный лекарственный препарат не перерегистрирована в обязательном порядке, расчет цены на соответствующие воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты при ее обязательной перерегистрации осуществляется Федеральной антимонопольной службой с учетом требований пунктов 25 - 27 настоящих Правил, а также на основании минимальной отпускной цены производителя (без учета производственных площадок производителя, но с учетом расходов, связанных с таможенным оформлением) на соответствующий референтный лекарственный препарат в иностранных государствах, указанных в приложении N 2 к методике, с применением понижающего коэффициента, значения которого определяются в соответствии с приложением N 5 к настоящим Правилам.
В случае отсутствия цен на референтный лекарственный препарат в иностранных государствах, указанных в приложении N 2 к методике, расчет цены на соответствующие воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты осуществляется Федеральной антимонопольной службой на основании минимальной отпускной цены производителя на этот воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат (без учета производственных площадок производителя) по международному непатентованному наименованию, лекарственной форме и дозировке в иностранных государствах, указанных в приложении N 2 к методике.
41. Министерство здравоохранения Российской Федерации по истечении 70 рабочих дней со дня вступления в силу постановления Правительства Российской Федерации, указанного в пункте 3 настоящих Правил, направляет в Федеральную антимонопольную службу список референтных лекарственных препаратов, предельные отпускные цены на которые зарегистрированы и включены в реестр, но не заявлены к обязательной перерегистрации или в обязательной перерегистрации которых отказано дважды в соответствии с пунктами 11 и 12 настоящих Правил, а также перечень соответствующих им воспроизведенных, биоаналоговых (биоподобных) лекарственных препаратов, предельные отпускные цены на которые зарегистрированы и включены в реестр, содержащий необходимое для применения понижающего коэффициента описание воспроизведенных, биоаналоговых (биоподобных) лекарственных препаратов (номер регистрационного удостоверения лекарственного препарата, наименование владельца или держателя регистрационного удостоверения лекарственного препарата, наименования производителей (производственных площадок производителя), международное непатентованное наименование (при его отсутствии - химическое или группировочное наименование), торговое наименование, лекарственная форма, дозировка (концентрация, объем, активность в единицах действия), выраженная в соответствующих единицах измерения, форма выпуска, количество в потребительской упаковке, последняя предельная отпускная цена с указанием даты и номера приказа Министерства здравоохранения Российской Федерации о регистрации или перерегистрации предельной отпускной цены на лекарственный препарат и (или) даты и номера выписки из реестра, выданной владельцу или держателю регистрационного удостоверения лекарственного препарата по результатам внесения изменений в реестровую запись реестра, штриховой код, нанесенный на вторичную (потребительскую) упаковку лекарственного препарата), на бумажном носителе и в электронном виде в табличном формате.
42. Федеральная антимонопольная служба в течение 60 рабочих дней со дня получения от Министерства здравоохранения Российской Федерации сведений, предусмотренных пунктом 41 настоящих Правил, проводит в соответствии с настоящими Правилами и методикой расчет предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, содержащий информацию о номере регистрационного удостоверения лекарственного препарата, наименовании владельца или держателя регистрационного удостоверения лекарственного препарата, наименованиях производителей (производственных площадок производителя), международном непатентованном наименовании (при его отсутствии - химическом или группировочном наименовании), торговом наименовании, лекарственной форме, дозировке (концентрации, объеме, активности в единицах действия), форме выпуска, количестве в потребительской упаковке, предельной отпускной цене, рассчитанной Федеральной антимонопольной службой, штриховом коде, нанесенном на вторичную (потребительскую) упаковку лекарственного препарата. Одновременно Федеральная антимонопольная служба публикует указанный расчет на своем официальном сайте в сети "Интернет" и направляет его в Министерство здравоохранения Российской Федерации на бумажном носителе и в электронном виде в табличном формате.
43. При представлении держателем или владельцем регистрационного удостоверения референтного лекарственного препарата (уполномоченным им лицом) в Министерство здравоохранения Российской Федерации документов в соответствии с пунктом 4 настоящих Правил после направления Министерством здравоохранения Российской Федерации документов в Федеральную антимонопольную службу в соответствии с пунктом 41 настоящих Правил, за исключением случая, предусмотренного пунктом 16 настоящих Правил, заявленная к обязательной перерегистрации предельная отпускная цена на референтный лекарственный препарат не может превышать максимальную перерегистрированную в обязательном порядке предельную отпускную цену на соответствующий воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат.
Приложение N 1
к Правилам обязательной перерегистрации
в 2019 - 2020 годах зарегистрированных
предельных отпускных цен производителей
на лекарственные препараты, включенные
в перечень жизненно необходимых
и важнейших лекарственных препаратов
(форма)
N п/п
Стадия производства
Производитель (наименование)
Адрес
Страна
Для российских юридических лиц - идентификационный номер налогоплательщика, для иностранных юридических лиц - код налогоплательщика в стране регистрации (инкорпорации) или его аналог
Наименование регистрирующего органа
Регистрационный номер
N п/п
Номер регистрационного удостоверения
Международное непатентованное, или группировочное, или химическое наименование <**>
Торговое наименование
Лекарственная форма, дозировка, комплектность <*>
Общее количество во вторичной (потребительской) упаковке
Предельная отпускная цена производителя за потребительскую упаковку <**> без НДС (рублей)
Штриховой код, нанесенный на вторичную (потребительскую) упаковку
Код АТХ
Код ТН ВЭД ЕАЭС
1
2
3
4
5
6
7
8
9
10
Уполномоченное
лицо
(ф.и.о.)
(должность)
(подпись)
Контактные
телефоны
Адрес электронной
почты
М.П. (при наличии)
--------------------------------
<*> В случае отсутствия международного непатентованного наименования в регистрационном удостоверении лекарственного препарата указывается наименование лекарственного препарата, предусмотренное перечнем жизненно необходимых и важнейших лекарственных препаратов.
<**> В случаях, предусмотренных пунктом 25 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов", дополнительно указывается форма выпуска лекарственного препарата, с учетом которой рассчитывается предельная отпускная цена производителя за потребительскую упаковку лекарственного препарата.
Приложение N 2
к Правилам обязательной перерегистрации
в 2019 - 2020 годах зарегистрированных
предельных отпускных цен производителей
на лекарственные препараты, включенные
в перечень жизненно необходимых
и важнейших лекарственных препаратов
(форма)
1.1.
Номер регистрационного удостоверения
1.2.
Международное непатентованное, или группировочное, или химическое наименование
1.3.
Торговое наименование
1.4.
Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
1.5.
Общее количество во вторичной (потребительской) упаковке
N п/п
Код ТН ВЭД ЕАЭС
Минимальная отпускная цена производителя на лекарственный препарат в государстве производителя и в других государствах в соответствии с приложением N 3 <*>
Проект отпускной цены "поставка без оплаты пошлины" (рублей) <**>
Действующая ставка таможенной пошлины <**>
Сборы за таможенное оформление (рублей) <**>
Проект расчетной отпускной цены производителя с учетом таможенных расходов, рублей (без НДС)
наименование страны
цена (рублей)
процентов
рублей
1
2
3
4
5
6
7
8
9
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
Приложение N 3
к Правилам обязательной перерегистрации
в 2019 - 2020 годах зарегистрированных
предельных отпускных цен производителей
на лекарственные препараты, включенные
в перечень жизненно необходимых
и важнейших лекарственных препаратов
(форма)
1.1.
Номер регистрационного удостоверения
1.2.
Международное непатентованное, или группировочное, или химическое наименование
1.3.
Торговое наименование
1.4.
Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
1.5.
Общее количество во вторичной (потребительской) упаковке
Государства
Отпускная цена производителя на лекарственный препарат за упаковку (в иностранной валюте)
Отпускная цена производителя на лекарственный препарат за 1 лекарственную форму (в иностранной валюте) <*>
Отпускная цена производителя на лекарственный препарат за единицу действующего вещества (в иностранной валюте) <**>
Наименование иностранной валюты
Расчет отпускной цены в рублях <***>
Венгрия
Греческая Республика
Королевство Бельгия
Королевство Испания
Королевство Нидерландов
Республика Польша
Румыния
Словацкая Республика
Турецкая Республика
Французская Республика
Чешская Республика
Страна производителя
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
Приложение N 4
к Правилам обязательной перерегистрации
в 2019 - 2020 годах зарегистрированных
предельных отпускных цен производителей
на лекарственные препараты, включенные
в перечень жизненно необходимых
и важнейших лекарственных препаратов
1.1.
Номер регистрационного удостоверения
1.2.
Международное непатентованное, или группировочное, или химическое наименование
1.3.
Торговое наименование
1.4.
Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
1.5.
Общее количество во вторичной (потребительской) упаковке
N п/п
Владелец регистрационного удостоверения лекарственного препарата (производитель, упаковщик, организация, осуществляющая выпускающий контроль)
Лекарственная форма, дозировка
Количество в потребительской упаковке
Номер и дата приказа о государственной регистрации (перерегистрации) предельной отпускной цены
Зарегистрированная предельная отпускная цена производителя на лекарственный препарат (без НДС), рублей
за потребительскую упаковку
расчет за одну лекарственную форму
расчет за единицу действующего вещества
1
2
3
4
5
6
7
8
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
Приложение N 5
к Правилам обязательной перерегистрации
в 2019 - 2020 годах зарегистрированных
предельных отпускных цен производителей
на лекарственные препараты, включенные
в перечень жизненно необходимых
и важнейших лекарственных препаратов
ФОРМУЛЫ
РАСЧЕТА ПОНИЖАЮЩИХ КОЭФФИЦИЕНТОВ, ПРИМЕНЯЕМЫХ
ПРИ ОБЯЗАТЕЛЬНОЙ ПЕРЕРЕГИСТРАЦИИ В 2019 - 2020 ГОДАХ
ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ
НА ВОСПРОИЗВЕДЕННЫЕ, БИОАНАЛОГОВЫЕ
(БИОПОДОБНЫЕ) ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
Зарегистрированная предельная отпускная цена за потребительскую упаковку референтного лекарственного препарата, Цреф (рублей)
Понижающий коэффициент для расчета цены на воспроизведенный лекарственный препарат, Кп
Понижающий коэффициент для расчета цены на биоаналоговый (биоподобный) лекарственный препарат, Кп
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства <*>, процентов
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства <*>, процентов
до 100 рублей (включительно)
0
0
0
0
от 100 рублей до 500 рублей (включительно)
0
4 x (Цреф)0,24 - 10
0
0
от 500 рублей до 100000 рублей (включительно)
3,6 x (Цреф)0,23 - 10
4 x (Цреф)0,24 - 10
0,6 x (Цреф)0,34 - 5
0,39 x (Цреф)0,41 - 5
свыше 100000 рублей
40
55
25
40
--------------------------------
<*> Лекарственные препараты иностранного производства, в том числе первичная и (или) вторичная упаковка которых осуществляется или планируется осуществляться в Российской Федерации.";
г) в Правилах ведения государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных указанным постановлением:
в пункте 5:
абзац первый после слова "(перерегистрации)" дополнить словами ", обязательной перерегистрации в 2019 - 2020 годах";
подпункт "е" после слова "(перерегистрации)" дополнить словами ", обязательной перерегистрации в 2019 - 2020 годах";
в пункте 6:
абзац первый после слов "регистрации (перерегистрации)" дополнить словами ", обязательной перерегистрации в 2019 - 2020 годах";
после абзаца третьего дополнить абзацем следующего содержания:
"принятия решения об обязательной перерегистрации в 2019 - 2020 годах предельной отпускной цены производителя на лекарственный препарат.";
абзац пятый после слов "решения о перерегистрации" дополнить словами ", обязательной перерегистрации в 2019 - 2020 годах";
в пункте 7:
после абзаца первого дополнить абзацами следующего содержания:
"изменения сведений о регистрации держателя или владельца регистрационного удостоверения лекарственного препарата в качестве налогоплательщика (для российских юридических лиц - идентификационный номер налогоплательщика (ИНН), для иностранных юридических лиц - страна регистрации, наименование регистрирующего органа, регистрационный номер, код налогоплательщика в стране регистрации (инкорпорации) или его аналог);
изменения сведений о регистрации производителя лекарственного препарата для медицинского применения в качестве налогоплательщика в стране регистрации (для российских юридических лиц - идентификационный номер налогоплательщика (ИНН), для иностранных юридических лиц - страна регистрации, наименование регистрирующего органа, регистрационный номер, код налогоплательщика в стране регистрации (инкорпорации) или его аналог);";
абзац пятнадцатый изложить в следующей редакции:
"Допускается внесение изменений в реестр без согласования с Федеральной антимонопольной службой с сохранением последней зарегистрированной цены на лекарственный препарат иностранного производства при внесении изменения в реестровую запись в части изменения иностранного производителя на производителя государства - члена Евразийского экономического союза.";
в пункте 9:
абзац первый после слова "(перерегистрации)" дополнить словами ", обязательной перерегистрации в 2019 - 2020 годах";
подпункт "д" после слова "перерегистрации" дополнить словами ", обязательной перерегистрации в 2019 - 2020 годах";
приложение к указанным Правилам изложить в следующей редакции:
"Приложение
к Правилам ведения
государственного реестра предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
(форма)
N п/п
Стадия производства
Производитель (наименование)
Адрес
Страна
Для российских юридических лиц - идентификационный номер налогоплательщика, для иностранных юридических лиц - код налогоплательщика в стране регистрации (инкорпорации) или его аналог
Наименование регистрирующего органа
Регистрационный номер
1
2
3
4
5
6
7
8
N п/п
Номер регистрационного удостоверения
Международное непатентованное, или группировочное, или химическое наименование <*>
Торговое наименование
Лекарственная форма, дозировка, комплектность <**>
Общее количество во вторичной (потребительской) упаковке
Предельная отпускная цена производителя за потребительскую упаковку <**> без НДС (рублей)
Штриховой код, нанесенный на вторичную (потребительскую) упаковку
Код АТХ
Код ТН ВЭД ЕАЭС
1
2
3
4
5
6
7
8
9
10
Уполномоченное
лицо
(ф.и.о.)
(должность)
(подпись)
Контактные
телефоны
Адрес электронной
почты
М.П. (при наличии)
--------------------------------
<*> В случае отсутствия международного непатентованного наименования в регистрационном удостоверении лекарственного препарата указывается наименование лекарственного препарата, предусмотренное перечнем жизненно необходимых и важнейших лекарственных препаратов.
<**> В случаях, предусмотренных пунктом 25 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов", дополнительно указывается форма выпуска лекарственного препарата, с учетом которой рассчитывается предельная отпускная цена производителя за потребительскую упаковку лекарственного препарата.";
д) в Правилах установления предельных размеров оптовых и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, в субъектах Российской Федерации, утвержденных указанным постановлением:
в пункте 7:
в абзаце первом слова "зарегистрированную цену" заменить словами "зарегистрированную или перерегистрированную предельную отпускную цену производителя";
абзацы второй и третий после слова "зарегистрированную" дополнить словами "или перерегистрированную";
приложение к указанным Правилам изложить в следующей редакции:
"Приложение
к Правилам установления предельных
размеров оптовых и предельных
размеров розничных надбавок
к фактическим отпускным ценам,
установленным производителями
лекарственных препаратов, включенных
в перечень жизненно необходимых
и важнейших лекарственных
препаратов, в субъектах
Российской Федерации
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
(форма)
Международное непатентованное наименование (химическое или группировочное)
Торговое наименование, лекарственная форма, дозировка, количество в потребительской упаковке, штриховой код
Серия
Производитель
Зарегистрированная предельная отпускная цена производителя (рублей) <1>
Фактическая отпускная цена, установленная производителем (рублей) <2>
Дата реализации производителем <3>
Отпускная цена организации оптовой торговли <4>, <5>
Размер оптовой надбавки организации оптовой торговли <7>, <8>
Отпускная цена организации оптовой торговли <7>
Суммарный размер оптовых надбавок организаций оптовой торговли <6>, <9>
Размер розничной надбавки организации розничной торговли
Фактическая отпускная цена организации розничной торговли без НДС (рублей)
без НДС (рублей)
с НДС (рублей)
УСН <10>/ЕНВД <11> (рублей)
без НДС (рублей)
с НДС (рублей)
в процентах
в рублях
УСН <10>/ЕНВД <11> (рублей)
без НДС (рублей)
с НДС (рублей)
в процентах
в рублях
в процентах
в рублях
УСН <10>/ЕНВД <11> (рублей)
без НДС (рублей)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
(подпись уполномоченного лица поставщика - организации оптовой торговли)
ф.и.о.
(подпись уполномоченного лица получателя - организации оптовой торговли или организации розничной торговли - указать нужное)
ф.и.о.
"__" ____________ 20__ г.
"__" ___________ 20__ г.
М.П. (при наличии)
М.П. (при наличии)
--------------------------------
<1> Зарегистрированная предельная отпускная цена производителя на лекарственный препарат на дату реализации лекарственного препарата производителем на территории Российской Федерации.
<2> При установлении цены иностранным производителем фактическая отпускная цена на лекарственный препарат указывается с учетом таможенной пошлины и сборов за таможенное оформление.
<3> Дата реализации лекарственного препарата производителем на территории Российской Федерации.
<4> При заполнении организацией оптовой торговли, которая приобрела лекарственный препарат у производителя, указывается цена реализации лекарственного препарата организацией оптовой торговли.
<5> При заполнении организацией оптовой торговли, которая приобрела лекарственный препарат у другой организации оптовой торговли, указывается цена приобретения лекарственного препарата.
<6> Заполняется каждой организацией оптовой торговли, которая реализует лекарственный препарат.
<7> Заполняется организацией оптовой торговли, которая приобрела лекарственный препарат у другой организации оптовой торговли.
<8> В случае реализации организацией оптовой торговли лекарственного препарата по цене ниже цены его приобретения указывается прочерк.
<9> В случае реализации организацией оптовой торговли лекарственного препарата по цене ниже фактической отпускной цены производителя указывается прочерк.
<10> Упрощенная система налогообложения.
<11> Единый налог на вмененный доход.
Примечание. Графы 1 - 8 заполняются организацией оптовой торговли, которая приобрела лекарственный препарат у производителя.
Информация, указанная в графах 1 - 8 организацией оптовой торговли, которая приобрела лекарственный препарат у производителя, указывается без изменений всеми оптовыми организациями, участвующими в реализации лекарственного препарата, в обязательном порядке.".
2. В постановлении Правительства Российской Федерации от 15 сентября 2015 г. N 979 "О внесении изменений в постановление Правительства Российской Федерации от 29 октября 2010 г. N 865 и об утверждении методики расчета устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при их государственной регистрации и перерегистрации" (Собрание законодательства Российской Федерации, 2015, N 38, ст. 5302; 2018, N 43, ст. 6597):
а) в наименовании слова "методики расчета устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при их государственной регистрации и перерегистрации" заменить словами "методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов";
б) абзац третий пункта 1 изложить в следующей редакции:
"методику расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов.";
в) в методике расчета устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при их государственной регистрации и перерегистрации, утвержденной указанным постановлением:
наименование изложить в следующей редакции:
"Методика расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов";
в пункте 2 слова "устанавливаемых производителями лекарственных препаратов предельных отпускных цен" заменить словами "предельных отпускных цен производителей";
в пункте 3:
в абзаце первом слова "производителей государств - членов" заменить словами "производителя государства - члена";
в подпункте "а" слова "производителей государств - членов" заменить словами "производителя государства - члена", слова "иностранных производителей, осуществляющих первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
в подпункте "б" слова "государств - членов" заменить словами "государства - члена";
в пункте 4:
в абзаце первом слова "иностранных производителей на референтный лекарственный препарат" заменить словами "на референтный лекарственный препарат иностранного производства";
в подпункте "б":
слова "иностранного производителя" заменить словами "на референтный лекарственный препарат иностранного производства";
слова "на референтный лекарственный препарат" исключить;
в пункте 5:
абзац первый изложить в следующей редакции:
"5. Предлагаемая к государственной регистрации предельная отпускная цена на референтный лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, не может превышать:";
в подпункте "б":
слова "иностранного производителя" заменить словами "на референтный лекарственный препарат иностранного производства";
слова "на референтный лекарственный препарат" исключить;
подпункты "а" и "б" пункта 7 изложить в следующей редакции:
"а) в случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрированы предельные отпускные цены на референтный лекарственный препарат с такой же лекарственной формой и дозировкой (концентрацией, активностью в единицах действия), - стоимость одной лекарственной формы референтного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата и умноженную на количество лекарственных форм во вторичной потребительской упаковке заявляемого референтного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата согласно приложению N 5;
б) в случае если не зарегистрированы предельные отпускные цены на заявляемый референтный лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия), - стоимость единицы действующего вещества референтного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные дозировки заявляемого лекарственного препарата и умноженную на количество единиц действующего вещества заявляемого референтного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата, предусмотренных приложением N 5 к настоящей методике.";
в пункте 10:
в абзаце первом слова "производителей государств - членов" заменить словами "производителя государства - члена";
в подпункте "в" слова "производителей государств - членов" заменить словами "производителя государства - члена";
в абзаце первом пункта 11 слова "иностранных производителей на воспроизведенный лекарственный препарат" заменить словами "на воспроизведенный лекарственный препарат иностранного производства";
в пункте 12:
абзац первый изложить в следующей редакции:
"12. Предлагаемая к государственной регистрации предельная отпускная цена на воспроизведенный лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, не может превышать:";
в подпункте "в" слова "иностранного производителя (без учета производственных площадок) на воспроизведенный лекарственный препарат" заменить словами "на воспроизведенный лекарственный препарат иностранного производства (без учета производственных площадок)";
подпункты "а" и "б" пункта 14 изложить в следующей редакции:
"а) в случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрированы предельные отпускные цены на воспроизведенный лекарственный препарат с такой же лекарственной формой и дозировкой (концентрацией, активностью в единицах действия), - стоимость одной лекарственной формы воспроизведенного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата и умноженную на количество лекарственных форм во вторичной потребительской упаковке заявляемого воспроизведенного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата, предусмотренных приложением N 5 к настоящей методике;
б) в случае если не зарегистрированы предельные отпускные цены на заявляемый воспроизведенный лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия), - стоимость единицы действующего вещества воспроизведенного лекарственного препарата, рассчитанную исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные дозировки заявляемого лекарственного препарата и умноженную на количество единиц действующего вещества заявляемого воспроизведенного лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата, предусмотренных приложением N 5 к настоящей методике.";
наименование раздела IV изложить в следующей редакции:
"IV. Расчет средневзвешенной фактической отпускной цены на лекарственный препарат производителя государства - члена Евразийского экономического союза и лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации";
абзац первый пункта 16 изложить в следующей редакции:
"16. Расчет средневзвешенной фактической отпускной цены на конкретный лекарственный препарат производителя государства - члена Евразийского экономического союза и (или) лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, производится за отчетный период на основании сведений, предусмотренных приложением N 1 к настоящей методике."
в абзаце первом пункта 17 слова "производителей государств - членов" заменить словами "производителя государства - члена";
в пункте 18 слова "иностранных производителей, осуществляющих первичную и (или) вторичную упаковку лекарственных препаратов в Российской Федерации, на лекарственный препарат" заменить словами "лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации", слово "отпущенный" заменить словом "отпущенного";
в наименовании раздела V слова "государств - членов" заменить словами "государства - члена";
в пункте 19 слова "государств - членов" заменить словами "государства - члена";
в абзаце первом пункта 22 слово "производителей" заменить словом "производителя";
в наименовании раздела VI слово "производителя" заменить словом "производства";
в абзаце первом пункта 24 слово "производителя" заменить словом "производства";
в абзацах четвертом и пятом пункта 25 слово "производителя" заменить словом "производства";
пункт 29 изложить в следующей редакции:
"29. В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены на лекарственный препарат с количеством лекарственных форм в потребительской упаковке (количеством доз в упаковке, объемом), отсутствующим в одном или нескольких иностранных государствах, указанных в приложении N 2 к настоящей методике, в таблице 1 приложения N 3 к настоящей методике указываются минимальные цены на заявляемый лекарственный препарат с ближайшими смежными количествами лекарственных форм во вторичной потребительской упаковке (вне зависимости от наличия их государственной регистрации на территории Российской Федерации), которые реализуются в иностранных государствах, указанных в приложении N 2 к настоящей методике.
При этом минимальная цена производителя на заявляемый лекарственный препарат определяется как среднее арифметическое значение стоимости одной лекарственной формы лекарственных препаратов, имеющих ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке, умноженное на количество лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата в каждом из иностранных государств (графа 6 таблицы 1 приложения N 3 к настоящей методике).
В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены лекарственного препарата с дозировкой, отсутствующей в одном или нескольких иностранных государствах, указанных в приложении N 2 к настоящей методике, в таблице 1 приложения N 3 к настоящей методике указываются минимальные цены на заявляемый лекарственный препарат с ближайшими смежными дозировками (вне зависимости от наличия их регистрации на территории Российской Федерации), которые реализуются в иностранных государствах, указанных в приложении N 2 к настоящей методике.
При этом минимальная цена производителя на заявляемый лекарственный препарат определяется как среднее арифметическое значение стоимости одной единицы действующего вещества лекарственных препаратов, имеющих ближайшие смежные дозировки, умноженное на количество единиц действующего вещества заявляемого лекарственного препарата в каждом из иностранных государств (графа 7 таблицы 1 приложения N 3 к настоящей методике). В расчете не учитываются ближайшие смежные дозировки, превышающие дозировку заявленного лекарственного препарата, предназначенного для применения в педиатрической практике (на основании сведений инструкции по медицинскому применению), более чем в 2 раза.";
в пункте 30:
в предложении первом слова "иностранного производителя" заменить словами "иностранного производства, в том числе производство готовой лекарственной формы, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации,";
в предложении втором слова "иностранного производителя на" заменить словами "на такой";
абзацы второй и третий пункта 32 изложить в следующей редакции:
"В случае если не зарегистрированы предельные отпускные цены на референтный лекарственный препарат с таким же количеством лекарственных форм во вторичной потребительской упаковке, что и заявляемый воспроизведенный лекарственный препарат, цена на воспроизведенный лекарственный препарат определяется как стоимость одной лекарственной формы референтного лекарственного препарата, рассчитанная исходя из среднего арифметического значения зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке референтного лекарственного препарата и умноженная на количество лекарственных форм во вторичной потребительской упаковке заявляемого воспроизведенного лекарственного препарата, при этом Кф соответственно равен 1.
В случае если не зарегистрированы предельные отпускные цены на референтный лекарственный препарат с такой же дозировкой, что и заявляемый воспроизведенный лекарственный препарат, цена на воспроизведенный лекарственный препарат определяется как стоимость одной единицы действующего вещества референтного лекарственного препарата, рассчитанная исходя из среднего арифметического значения зарегистрированных цен на ближайшие смежные дозировки референтного лекарственного препарата и умноженная на количество единиц действующего вещества заявляемого воспроизведенного лекарственного препарата, при этом Кд соответственно равен 1.";
в пункте 33:
в абзаце втором слова "и дозировке" исключить;
в абзаце третьем:
слова "на лекарственный препарат иностранного производителя, в том числе осуществляющего первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
слова "и дозировке" исключить;
в абзаце четвертом слова "и дозировке" исключить;
в абзаце пятом:
слова "на лекарственный препарат иностранного производителя, в том числе осуществляющего первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
слова "и дозировке" исключить;
дополнить абзацем следующего содержания:
"В отношении воспроизведенного, биоаналогового (биоподобного) орфанного лекарственного препарата понижающий коэффициент определяется по формулам расчета, предусмотренным приложением N 8 к настоящей методике, для воспроизведенного, биоаналогового (биоподобного) орфанного лекарственного препарата."
в пункте 34:
абзац седьмой после слов "предельных отпускных цен производителей на" дополнить словами "вторые и последующие";
в абзаце восьмом:
слово "(единиц)" исключить;
слово "качеством" заменить словами "количеством лекарственных форм во вторичной упаковке";
пункт 35 изложить в следующей редакции:
"35. Максимальная цена определяется как зарегистрированная (перерегистрированная) предельная отпускная цена за потребительскую упаковку лекарственного препарата, совпадающего с заявляемым воспроизведенным лекарственным препаратом по международному непатентованному наименованию (при его отсутствии по химическому или группировочному наименованию), лекарственной форме и дозировке с максимальной стоимостью одной лекарственной формы:
в случае если зарегистрирована (перерегистрирована) предельная отпускная цена на такой лекарственный препарат, совпадающий по количеству во вторичной потребительской упаковке с заявляемым воспроизведенным лекарственным препаратом, максимальная цена определяется как последняя зарегистрированная (перерегистрированная) предельная отпускная цена на такой лекарственный препарат;
в случае если на такой лекарственный препарат в рамках регистрационного удостоверения лекарственного препарата зарегистрировано (перерегистрировано) несколько предельных отпускных цен на лекарственные препараты, отличных по количеству во вторичной потребительской упаковке от заявляемого воспроизведенного лекарственного препарата, максимальная цена определяется как среднее арифметическое значение последних зарегистрированных (перерегистрированных) предельных отпускных цен на такие лекарственные препараты исходя из стоимости одной лекарственной формы, умноженное на количество лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата, при этом Кф соответственно равен 1;
в случае отсутствия зарегистрированных предельных отпускных цен на лекарственный препарат, совпадающий по международному непатентованному наименованию (при его отсутствии по химическому или группировочному наименованию), лекарственной форме и дозировке, максимальная цена определяется как зарегистрированная предельная отпускная цена за потребительскую упаковку лекарственного препарата, совпадающего с заявляемым воспроизведенным лекарственным препаратом по международному непатентованному наименованию (при его отсутствии по химическому или группировочному наименованию) и лекарственной форме с максимальной стоимостью единицы действующего вещества;
в случае если на такой лекарственный препарат в рамках регистрационного удостоверения лекарственного препарата зарегистрировано (перерегистрировано) несколько предельных отпускных цен на лекарственные препараты, отличных по дозировке с заявляемым воспроизведенным лекарственным препаратом, максимальная цена определяется как среднее арифметическое значение последних зарегистрированных (перерегистрированных) предельных отпускных цен на такие лекарственные препараты исходя из стоимости единицы действующего вещества, умноженное на количество единиц действующего вещества заявляемого лекарственного препарата, при этом Кд соответственно равен 1.";
пункт 36 дополнить абзацем следующего содержания:
"В случаях, при которых на лекарственный препарат, определенный в соответствии с требованиями пункта 35 настоящей методики, зарегистрированы различные предельные отпускные цены, применяется среднее арифметическое значение понижающего коэффициента, рассчитанное на основании последних зарегистрированных (перерегистрированных) предельных отпускных цен на такой лекарственный препарат, за исключением случаев, при которых понижающий коэффициент равен 0.";
наименование раздела IX изложить в следующей редакции:
"IX. Расчет предельной отпускной цены производителей на лекарственный препарат производителя государства - члена Евразийского экономического союза при ее перерегистрации";
в пункте 37 слова "настоящей методикой" заменить словами "настоящим разделом";
в абзаце первом и подпункте "б" пункта 38, в абзаце первом пункта 39, пункте 40 и абзаце первом пункта 41 слова "государств - членов" заменить словами "государства - члена";
в пунктах 43, 44 и в абзаце первом пункта 45 слова "производителей государств - членов" заменить словами "производителя государства - члена";
наименование раздела X изложить в следующей редакции:
"X. Расчет предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, при ее перерегистрации";
в пункте 47 слова "иностранных производителей" заменить словами "иностранного производства", слова "настоящей методикой" заменить словами "настоящим разделом";
в пункте 48:
в абзаце первом слова "иностранных производителей на лекарственный препарат" заменить словами "на лекарственный препарат иностранного производства";
в подпункте "б" слова "иностранных производителей, в том числе осуществляющих первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
в абзаце первом пункта 49 слова "иностранных производителей, осуществляющих первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
в пункте 50:
в абзаце первом слова "иностранных производителей, в том числе осуществляющих первичную и (или) вторичную упаковку лекарственного препарата" заменить словами "на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
в подпункте "б" слова "иностранного производителя, осуществляющего первичную и (или) вторичную упаковку" заменить словами "иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться";
в подпункте "в" слова "иностранного производителя на лекарственный препарат" заменить словами "на лекарственный препарат иностранного производства";
в пункте 52:
в абзаце первом слова "иностранного производителя на лекарственный препарат" заменить словами "на лекарственный препарат иностранного производства";
в абзаце восьмом слово "производителя" заменить словом "производства";
в пункте 53 слова "иностранных производителей, осуществляющих первичную и (или) вторичную упаковку в Российской Федерации, на лекарственный препарат" заменить словами "на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации,";
дополнить разделом XI следующего содержания:
"XI. Расчет предельной отпускной цены производителя
на лекарственный препарат при ее перерегистрации
в целях снижения
55. Перерегистрация в целях снижения предельной отпускной цены производителя на лекарственный препарат проводится в случаях, предусмотренных подпунктом "а" пункта 42 Правил, в связи со снижением цены в национальной валюте на лекарственный препарат в иностранных государствах, указанных в приложении N 2 к настоящей методике, на основании расчета, предусмотренного приложением N 3 к настоящей методике, в случае, если рассчитанная в соответствии с разделом VII настоящей методики минимальная отпускная цена производителя на лекарственный препарат с учетом расходов, связанных с таможенным оформлением, ниже, чем зарегистрированная предельная отпускная цена на лекарственный препарат.
56. Перерегистрация предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата проводится в случаях, предусмотренных подпунктом "б" пункта 42 Правил, в связи со снижением предельной отпускной цены референтного лекарственного препарата в случаях, предусмотренных подпунктом "а" пункта 42 Правил.
Перерегистрация в целях снижения предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата осуществляется в случае, если зарегистрированная предельная отпускная цена воспроизведенного, биоаналогового (биоподобного) лекарственного препарата превышает цену референтного лекарственного препарата, перерегистрированную в целях снижения в соответствии с пунктом 55 настоящей методики. При этом предельная отпускная цена воспроизведенного, биоаналогового (биоподобного) лекарственного препарата не может превышать цену референтного лекарственного препарата, перерегистрированную в целях снижения в соответствии с пунктом 55 настоящей методики.
57. Перерегистрация предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, проводится в случаях, предусмотренных подпунктом "в" пункта 42 Правил, на основании данных расчета предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, представляемых на государственную регистрацию в соответствии с приложением N 9 к настоящей методике в связи с государственной регистрацией второй цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме и дозировке.
Перерегистрация в целях снижения предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, осуществляется в случае, если зарегистрированная предельная отпускная цена превышает цену, рассчитанную в качестве проекта предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат в соответствии с разделом VIII настоящей методики.
58. Перерегистрация предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата производителя государства - члена Евразийского экономического союза проводится в случаях, предусмотренных подпунктом "г" пункта 42 Правил, на основании данных расчета предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, представляемых на государственную регистрацию в соответствии с приложением N 9 к настоящей методике в связи с государственной регистрацией второй цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза, совпадающий по международному непатентованному наименованию (при его отсутствии - группировочному или химическому), лекарственной форме и дозировке.
Перерегистрация в целях снижения предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата производителя государства - члена Евразийского экономического союза осуществляется в случае, если зарегистрированная предельная отпускная цена превышает цену, рассчитанную в качестве проекта предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза в соответствии с разделом VIII настоящей методики.
59. Предельная отпускная цена на лекарственный препарат при перерегистрации в целях снижения устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 24 и 25 Правил.";
приложения N 1 - 12 к указанной методике изложить в следующей редакции:
"Приложение N 1
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Количество отпущенного лекарственного препарата
Средневзвешенная фактическая отпускная цена лекарственного препарата за потребительскую упаковку (без НДС), рублей
Зарегистрированная предельная отпускная цена лекарственного препарата за потребительскую упаковку (без НДС), рублей <**>
Проект предельной отпускной цены за потребительскую упаковку, предложенной на перерегистрацию (без НДС), рублей <**>
Прогнозируемый уровень инфляции, установленный на текущий год, процентов <**>
Увеличение предельной отпускной цены, процентов <**>
тыс. упаковок
тыс. рублей
1
2
3
4
5
6
7
8
N п/п
Торговое название (лекарственная форма, дозировка, количество во вторичной (потребительской) упаковке)
Производитель
Наименование поставщика
Номер товарной накладной
Дата товарной накладной
Количество отпущенного товара, упаковок
Цена отпуска за одну упаковку (без НДС), рублей
Объем реализации лекарственного препарата (без НДС), тыс. рублей
Остаточный срок годности отпущенного лекарственного препарата, процентов
1
2
3
4
5
6
7
8
9
10
Итого
![]()
![]()
Средневзвешенная фактическая отпускная цена лекарственного препарата за потребительскую упаковку (без НДС), рублей
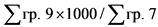
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
Приложение N 2
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
ПЕРЕЧЕНЬ
ИНОСТРАННЫХ ГОСУДАРСТВ, В ОТНОШЕНИИ КОТОРЫХ ПРЕДСТАВЛЯЕТСЯ
ИНФОРМАЦИЯ ОБ УРОВНЕ МИНИМАЛЬНЫХ ОТПУСКНЫХ ЦЕН
НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
1. Венгрия
2. Греческая Республика
3. Королевство Бельгия
4. Королевство Испания
5. Королевство Нидерландов
6. Республика Польша
7. Румыния
8. Словацкая Республика
9. Турецкая Республика
10. Французская Республика
11. Чешская Республика
12. Страна производителя
Приложение N 3
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Код ТН ВЭД ЕАЭС
Минимальная отпускная цена производителя на лекарственный препарат в стране производителя и в других иностранных государствах в соответствии с таблицей 1 <*>
Проект отпускной цены "поставка без оплаты таможенной пошлины и сборов за таможенное оформление", рублей <**>
Действующая ставка таможенной пошлины <**>
Сборы за таможенное оформление, рублей <**>
Проект расчетной отпускной цены производителя с учетом таможенных расходов (без НДС), рублей
наименование иностранного государства
Цена, рублей
процентов
рублей
1
2
3
4
5
6
7
8
9
N п/п
Торговое наименование лекарственного препарата
Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
Количество в потребительской упаковке
Минимальная отпускная цена по графам 8 - 19, рублей
Минимальная отпускная цена производителя на лекарственный препарат, рублей <*>
за упаковку
расчет за одну лекарственную форму
расчет за единицу действующего вещества
Венгрия
Греческая Республика
Королевство Бельгия
Королевство Испания
Королевство Нидерландов
Республика Польша
Румыния
Словацкая Республика
Турецкая Республика
Французская Республика
Чешская Республика
Страна производителя
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
Минимальная расчетная отпускная цена производителя за одну лекарственную форму, рублей <**>
Минимальная расчетная отпускная цена производителя за единицу действующего вещества лекарственного препарата <***>, рублей
Минимальная отпускная цена производителя на лекарственный препарат в стране производителя и в других странах (с учетом пересчета), рублей
Название страны с минимальной отпускной ценой на лекарственный препарат <****>
Особенности <*****>
1
Страна
Наименование валюты
Средний курс валюты <*>
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
Приложение N 4
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Наименование производителя
Номер таможенной декларации
Дата таможенной декларации
Серия
Количество упаковок
Номер декларации
Дата декларации
Цена ввоза одной потребительской упаковки (без НДС), рублей
Таможенная пошлина и таможенное оформление, рублей
Цена ввоза одной упаковки с учетом таможенной пошлины и таможенного оформления (без НДС), рублей
Стоимость ввозимого товара (без НДС), тыс. рублей
1
2
3
4
5
6
7
8
9
10
11
12
Итого
![]()
![]()
Итого: средневзвешенная фактическая цена ввоза лекарственного препарата за потребительскую упаковку (без НДС), рублей
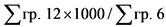
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Отчетный период при государственной регистрации предельной отпускной цены производителя на лекарственный препарат определяется в соответствии с пунктом 23 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов".
Отчетный период при перерегистрации предельной отпускной цены производителя на лекарственный препарат определяется в соответствии с пунктом 37 указанных Правил.
Примечание. Дополнительно представляются в электронной форме (Excel) данные об объемах ввоза лекарственных препаратов по всем фактическим случаям ввоза за отчетный период.
Приложение N 5
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Владелец регистрационного удостоверения, производитель, упаковщик, выпускающий контроль
Лекарственная форма, дозировка
Количество в потребительской упаковке
Номер приказа и дата приказа о государственной регистрации (перерегистрации) предельной отпускной цены
Зарегистрированная предельная отпускная цена производителя на лекарственный препарат (без НДС), рублей
за потребительскую упаковку
расчет за одну лекарственную форму
расчет за единицу действующего вещества
1
2
3
4
5
6
7
8
Значение, рассчитанное исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные количества лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата, умноженное на количество лекарственных форм во вторичной потребительской упаковке заявляемого лекарственного препарата (без НДС), рублей. <**>
Значение
Значение, рассчитанное исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие смежные дозировки заявляемого лекарственного препарата, умноженное на количество единиц действующего вещества заявляемого лекарственного препарата (без НДС), рублей. <***>
Значение
Расчетная предельная отпускная цена заявляемого лекарственного препарата за потребительскую упаковку (без НДС), рублей. <****>
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Указываются сведения обо всех регистрационных удостоверениях, лекарственных формах, дозировках (концентрациях, активности в единицах действия), упаковках, на которые зарегистрированы предельные отпускные цены заявляемого лекарственного препарата в нумерации, соответствующей разделу II настоящего приложения.
<**> Рассчитывается в случаях, указанных в подпункте "а" пункта 7 и в подпункте "а" пункта 14 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
<***> Рассчитывается в случаях, указанных в подпункте "б" пункта 7 и в подпункте "б" пункта 14 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
<****> Указывается расчетная предельная отпускная цена для дозировки и общего количества в потребительской упаковке, представленных в пунктах 4 и 5 раздела I настоящего приложения.
Приложение N 6
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Производитель
Зарегистрированная предельная отпускная цена на референтный лекарственный препарат (Цреф) или на лекарственный препарат с максимальной зарегистрированной предельной отпускной ценой (Цм)
Коэффициент пересчета дозировки, Кд <*>
Коэффициент пересчета фасовки, Кф <*>
Понижающий коэффициент пересчета, Кп <*>
Расчетная предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат (без НДС), рублей (Цпр)
производитель
наименование лекарственного препарата
лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
количество в потребительской упаковке
зарегистрированная предельная отпускная цена (без НДС), рублей (Цреф/Цм) <*>
1
2
3
4
5
6
7
8
9
10
11
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Цены на лекарственные препараты Цреф и Цм, а также коэффициенты пересчета Кд, Кф и Кп определяются в соответствии с разделом VIII методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Приложение N 7
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Производитель
Прямые расходы
Общепроизводственные расходы
Общехозяйственные расходы
Прибыль
Рентабельность, процентов
Фактическая цена отпуска за потребительскую упаковку (без НДС), рублей <**>
Проект отпускной цены на лекарственный препарат за потребительскую упаковку (без НДС), рублей
материалы
сырье
заработная плата
заработная плата общепроизводственного и вспомогательного персонала
электроэнергия, теплоснабжение, водоснабжение и топливо
амортизация основных средств, используемых для производства
прочие <*>
разработка
реализация
прочие <*>
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Относятся на общепроизводственные и общехозяйственные расходы.
<**> Заполняется для лекарственных препаратов, находившихся в обращении на территории Российской Федерации.
Таблица 1. Планируемый объем выпуска лекарственного
препарата, его удельный вес в общем объеме производимых
лекарственных препаратов, в натуральном
и стоимостном выражении
N п/п
Наименование лекарственного препарата, дозировка и количество в потребительской упаковке, производитель
Единица измерения
Планируемый объем выпуска, в натуральном выражении (количество единиц измерения)
Планируемый объем выпуска, в стоимостном выражении (без НДС), рублей
Удельный вес лекарственного препарата в общем объеме производимых лекарственных препаратов, в натуральном выражении, процентов
Удельный вес лекарственного препарата в общем объеме производимых лекарственных препаратов, в стоимостном выражении (без НДС), рублей
1
2
3
4
5
6
7
Таблица 2. Калькуляция затрат материалов
по производству одной потребительской упаковки
(графа 3 раздела II настоящего приложения)
__________________________________________________________
(наименование препарата, дозировка и количество
в потребительской упаковке)
N п/п
Расходы на материалы
Единица измерения
Норма расхода (согласно техническому регламенту предприятия)
Цена фактической закупки (без НДС), рублей <**>
Сумма затрат на одну потребительскую упаковку (без НДС), рублей
1
2
3
4
5
6
Итого <*>
--------------------------------
<*> В расчете на одну потребительскую упаковку.
<**> В случае отсутствия закупки материалов, необходимых для производства конкретного лекарственного препарата, представляются сведения по аналогичным по своим характеристикам материалам, закупаемым для производства иных жизненно необходимых и важнейших лекарственных препаратов, цены на которые ранее зарегистрированы.
Таблица 3. Опись документального
подтверждения расходов на материалы
(графа 3 раздела II настоящего приложения)
N п/п
Наименование материала
Наименование поставщика
Номер и дата товарной накладной, или грузовой таможенной декларации, или иного вида документального подтверждения
1
2
3
4
Таблица 4. Калькуляция затрат сырья
по производству одной потребительской упаковки
(графа 4 раздела II настоящего приложения)
___________________________________________________________
(наименование препарата, дозировка и количество
в потребительской упаковке)
N п/п
Статьи расходов на сырье
Единица измерения
Норма расхода (согласно техническому регламенту предприятия)
Цена фактической закупки (без НДС), рублей <**>
Сумма затрат на одну потребительскую упаковку (без НДС), рублей
1
2
3
4
5
6
Активная фармацевтическая субстанция
Вспомогательные вещества
Итого <*>
--------------------------------
<*> В расчете на одну потребительскую упаковку.
<**> В случае отсутствия закупки вспомогательных веществ, используемых при производстве конкретного лекарственного препарата, представляются сведения по этим же вспомогательным веществам, закупаемым для производства иных жизненно необходимых и важнейших лекарственных препаратов, цены на которые ранее зарегистрированы.
Таблица 5. Информация
об активной фармацевтической субстанции
(графа 4 раздела II настоящего приложения)
N п/п
Наименование активной фармацевтической субстанции
Удельный вес активной фармацевтической субстанции в статье "Сырье" за отчетный период, в натуральном выражении, процентов
Производитель активной фармацевтической субстанции
Страна производства активной фармацевтической субстанции
Поставщик активной фармацевтической субстанции
Единица измерения активной фармацевтической субстанции
Цена активной фармацевтической субстанции (включая таможенные расходы), без НДС
в валюте (указывается вид валюты)
в рублях (в пересчете на дату таможенной декларации, или товарной накладной, или иного вида документального подтверждения)
1
2
3
4
5
6
7
8
9
Таблица 6. Опись
документального подтверждения расходов на сырье
(графа 4 раздела II настоящего приложения)
N п/п
Наименование фармацевтической субстанции или вспомогательного вещества
Наименование поставщика
Номер и дата товарной накладной или грузовой таможенной декларации
1
2
3
4
Таблица 7. Расшифровка затрат по статье "Заработная плата"
(графа 5 раздела II настоящего приложения)
N п/п
Структурные подразделения
Оплата труда по 20 счету, рублей
Страховые взносы по 20 счету, рублей <*>
Страховые взносы на обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний по 20 счету, рублей
Итого (без НДС), рублей
1
2
3
4
5
6
Заработная плата работников, занятых непосредственно на производстве лекарственного препарата
Итого
В расчете на одну потребительскую упаковку <**>
--------------------------------
<*> Учитываются страховые взносы на обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное пенсионное страхование, обязательное медицинское страхование.
<**> Рассчитывается по формуле "Итоговое значение (в рублях)"/"Планируемый или фактический объем выпуска препарата" в соответствии с разделом V методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Таблица 8. Расшифровка затрат
по статье "Общепроизводственные расходы"
(графы 6 - 9 раздела II настоящего приложения)
8.1. Расшифровка затрат по статье "Заработная плата
общепроизводственного и вспомогательного персонала"
(графа 6 раздела II настоящего приложения)
N п/п
Структурные подразделения
Оплата труда по 25 счету, рублей
Страховые взносы по 25 счету, рублей <*>
Страховые взносы на обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний по 25 счету, рублей
Итого (без НДС), рублей
1
2
3
4
5
6
Итого
В расчете на одну потребительскую упаковку <**>
--------------------------------
<*> Учитываются страховые взносы на обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное пенсионное страхование, обязательное медицинское страхование.
<**> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
8.2. Расшифровка затрат по статье
"Электроэнергия, теплоснабжение, водоснабжение и топливо"
(графа 7 раздела II настоящего приложения)
N п/п
Статья затрат
Поставщик
Стоимость услуг (без НДС), рублей
1
2
3
4
1.
Электроэнергия
2.
Теплоснабжение
3.
Водоснабжение
4.
Топливо
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
8.3. Расшифровка затрат по статье "Амортизация
основных средств, используемых для производства"
(графа 8 раздела II настоящего приложения)
N п/п
Основные средства
Амортизация (без НДС), рублей
1
2
3
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
8.4. Расшифровка затрат
по статье "Прочие общепроизводственные расходы"
(графа 9 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуги
Стоимость услуг (без НДС), рублей
1
2
3
4
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
Таблица 9. Расшифровка
затрат по статье "Общехозяйственные расходы"
(графы 10 - 12 раздела II настоящего приложения)
9.1. Расшифровка затрат по статье "Разработка"
(графа 10 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуги
Стоимость услуг (без НДС), рублей
1
2
3
4
1.
Разработка конкретного лекарственного препарата, в том числе собственные расходы предприятия
2.
Регистрационные процедуры, в том числе доклинические исследования лекарственных средств и клинические исследования лекарственного препарата
3.
Прочие расходы
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
9.2. Расшифровка затрат по статье "Реализация"
(графа 11 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуг
Стоимость услуг (без НДС), рублей
1
2
3
4
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
9.3. Расшифровка затрат
по статье "Прочие общехозяйственные расходы"
(графа 12 раздела II настоящего приложения)
N п/п
Статья расходов
Поставщик услуги
Стоимость услуг (без НДС), рублей
1
2
3
4
Итого
В расчете на одну потребительскую упаковку <*>
--------------------------------
<*> Указывается формула, в соответствии с которой рассчитывается цена на одну потребительскую упаковку.
Прибыль и рентабельность продукции (графы 13 и 14 раздела II настоящего приложения) определяются в соответствии с разделом V методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Примечание. Таблица 9 является типовой, допускается включение в нее дополнительных сведений, учитывающих способ отнесения общепроизводственных и общехозяйственных расходов в соответствии с учетной политикой организации.
Приложение N 8
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
ФОРМУЛЫ
РАСЧЕТА ПОНИЖАЮЩИХ КОЭФФИЦИЕНТОВ, ПРИМЕНЯЕМЫХ ПРИ РАСЧЕТЕ
ПРЕДЕЛЬНОЙ ОТПУСКНОЙ ЦЕНЫ ПРОИЗВОДИТЕЛЯ НА ПЕРВЫЙ
ВОСПРОИЗВЕДЕННЫЙ, БИОАНАЛОГОВЫЙ (БИОПОДОБНЫЙ) ЛЕКАРСТВЕННЫЙ
ПРЕПАРАТ, А ТАКЖЕ ВОСПРОИЗВЕДЕННЫЙ, БИОАНАЛОГОВЫЙ
(БИОПОДОБНЫЙ) ОРФАННЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ,
ПРЕДСТАВЛЯЕМОЙ НА ГОСУДАРСТВЕННУЮ РЕГИСТРАЦИЮ
Зарегистрированная предельная отпускная цена за потребительскую упаковку референтного лекарственного препарата, рублей (Цреф)
Понижающий коэффициент для расчета цены на первый воспроизведенный лекарственный препарат (Кп)
Понижающий коэффициент для расчета цены на первый биоаналоговый (биоподобный) лекарственный препарат, а также воспроизведенный, биоаналоговый (биоподобный) орфанный лекарственный препарат (Кп)
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
1
2
3
4
5
до 100 рублей (включительно)
0
0
0
0
от 100 рублей
до 500 рублей (включительно)
0
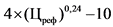
0
0
от 500 рублей
до 100000 рублей (включительно)
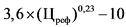
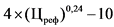
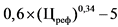
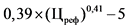
свыше 100000 рублей
40
55
25
40
--------------------------------
<*> Лекарственные препараты иностранного производства, в том числе первичная и (или) вторичная упаковка которых осуществляется или планируется осуществляться в Российской Федерации.
Приложение N 9
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
ФОРМУЛЫ
РАСЧЕТА ПОНИЖАЮЩИХ КОЭФФИЦИЕНТОВ, ПРИМЕНЯЕМЫХ
ПРИ РАСЧЕТЕ ПРЕДЕЛЬНОЙ ОТПУСКНОЙ ЦЕНЫ ПРОИЗВОДИТЕЛЯ
НА ВОСПРОИЗВЕДЕННЫЙ, БИОАНАЛОГОВЫЙ (БИОПОДОБНЫЙ)
ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, ПРЕДСТАВЛЯЕМОЙ
НА ГОСУДАРСТВЕННУЮ РЕГИСТРАЦИЮ
Зарегистрированная предельная отпускная цена за потребительскую упаковку референтного лекарственного препарата, рублей (Цреф)
Понижающий коэффициент для расчета цены на воспроизведенный лекарственный препарат (Кп)
Понижающий коэффициент для расчета цены на биоаналоговый (биоподобный) лекарственный препарат (Кп)
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
производителя государства - члена Евразийского экономического союза, процентов
иностранного производства, процентов <*>
1
2
3
4
5
до 100 рублей (включительно)
0
0
0
0
от 100 рублей
до 500 рублей (включительно)
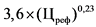
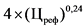
0
0
от 500 рублей
до 100 000 рублей (включительно)
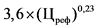
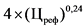
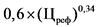
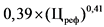
свыше
100000 рублей
50
65
30
45
--------------------------------
<*> Лекарственные препараты иностранного производства, в том числе первичная и (или) вторичная упаковка которых осуществляется или планируется осуществляться в Российской Федерации.
Приложение N 10
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Прямые расходы
Общепроизводственные расходы <*>
Прогнозируемый уровень инфляции, процентов (И) <**>
Фактический уровень инфляции с учетом прогнозируемого уровня, процентов <***>
Предельная отпускная цена за потребительскую упаковку (без НДС), рублей
материалы
сырье
электроэнергия, теплоснабжение, водоснабжение и топливо
амортизация основных средств, используемых для производства
факт.
план.
процентов увеличения
факт.
план.
процентов увеличения
факт.
план.
процентов увеличения
факт.
план.
процентов увеличения
зарегистрированная
заявленная
процентов увеличения
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> Информация по накладным расходам заполняется при перерегистрации предельных отпускных цен производителей на лекарственные препараты в случаях, предусмотренных подпунктами "а" и "в" пункта 32 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденных постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов".
<**> Прогнозируемый уровень инфляции текущего года, установленный федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период.
<***> Фактический уровень инфляции предшествующего календарного года с учетом прогнозируемого уровня инфляции текущего года, установленного федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, рассчитываемый в соответствии с пунктом 41 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
Приложение N 11
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
ЗНАЧЕНИЯ
КОЭФФИЦИЕНТА ЦЕНОВОЙ ГРУППЫ, ПРИМЕНЯЕМОГО ПРИ РАСЧЕТЕ
ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ НА ЛЕКАРСТВЕННЫЕ
ПРЕПАРАТЫ, ПРЕДСТАВЛЯЕМЫХ НА ПЕРЕРЕГИСТРАЦИЮ
Ценовая группа
Коэффициент ценовой группы, процентов (Ип)
1
2
до 100 рублей (включительно)
100
от 100 рублей до 500 рублей (включительно)
90
от 500 рублей до 1000 рублей (включительно)
85
от 1000 рублей до 3000 рублей (включительно)
80
от 3000 рублей до 5000 рублей (включительно)
75
от 5000 рублей до 10000 рублей (включительно)
70
от 10000 рублей до 20000 рублей (включительно)
60
от 20000 рублей до 40000 рублей (включительно)
50
от 40000 рублей до 100000 рублей (включительно)
40
свыше 100000 рублей
30
Приложение N 12
к методике расчета предельных
отпускных цен производителей
на лекарственные препараты,
включенные в перечень жизненно
необходимых и важнейших
лекарственных препаратов
(в редакции постановления
Правительства Российской Федерации
от 16 декабря 2019 г. N 1683)
1. Номер регистрационного удостоверения
2. Международное непатентованное, или группировочное, или химическое наименование
3. Торговое наименование
4. Лекарственная форма, дозировка или концентрация, объем, активность в единицах действия
5. Общее количество во вторичной (потребительской) упаковке
N п/п
Производитель (с указанием стадии производства)
Наименование национальной валюты государства-производителя
Курс национальной валюты государства-производителя к рублю (рублей)
Средневзвешенная фактическая цена ввоза (отпуска) лекарственного препарата, рублей <*>
Величина увеличения предельной отпускной цены, процентов <**>
Предельная отпускная цена за потребительскую упаковку (без НДС), рублей
курс при государственной регистрации (последней регистрации)
курс при перерегистрации
процентов увеличения
зарегистрированная <***>
заявленная <****>
процентов увеличения
1
2
3
4
5
6
7
8
9
10
11
Руководитель организации-заявителя
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
М.П. (при наличии)
Исполнитель
(подпись)
(ф.и.о.)
(телефон, адрес электронной почты)
--------------------------------
<*> При перерегистрации предельной отпускной цены на лекарственный препарат иностранного производства указывается средневзвешенная фактическая цена ввоза лекарственного препарата. При перерегистрации предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или планируется осуществляться в Российской Федерации, указывается средневзвешенная фактическая цена отпуска лекарственного препарата.
<**> Рассчитывается в соответствии с пунктами 52 - 54 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, утвержденной постановлением Правительства Российской Федерации от 15 сентября 2015 г. N 979.
<***> Предельная отпускная цена производителя на лекарственный препарат, зарегистрированная по состоянию на дату подачи заявления о перерегистрации предельной отпускной цены.
<****> Заявленная к перерегистрации предельная отпускная цена производителя на лекарственный препарат.".
