Постановление Правительства РФ от 01.10.2015 N 1045
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОСТАНОВЛЕНИЕ
от 1 октября 2015 г. N 1045
ОБ УТВЕРЖДЕНИИ ПРАВИЛ
ПРЕДОСТАВЛЕНИЯ СУБСИДИЙ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА
РОССИЙСКИМ ОРГАНИЗАЦИЯМ НА ВОЗМЕЩЕНИЕ ЧАСТИ ЗАТРАТ
НА РЕАЛИЗАЦИЮ ПРОЕКТОВ ПО ОРГАНИЗАЦИИ И ПРОВЕДЕНИЮ
КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В РАМКАХ
ПОДПРОГРАММЫ "РАЗВИТИЕ ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ"
ГОСУДАРСТВЕННОЙ ПРОГРАММЫ РОССИЙСКОЙ ФЕДЕРАЦИИ "РАЗВИТИЕ
ФАРМАЦЕВТИЧЕСКОЙ И МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ"
НА 2013 - 2020 ГОДЫ
Правительство Российской Федерации постановляет:
Утвердить прилагаемые Правила предоставления субсидий из федерального бюджета российским организациям на возмещение части затрат на реализацию проектов по организации и проведению клинических исследований лекарственных препаратов в рамках подпрограммы "Развитие производства лекарственных средств" государственной программы Российской Федерации "Развитие фармацевтической и медицинской промышленности" на 2013 - 2020 годы.
Председатель Правительства
Российской Федерации
Д.МЕДВЕДЕВ
Утверждены
постановлением Правительства
Российской Федерации
от 1 октября 2015 г. N 1045
ПРАВИЛА
ПРЕДОСТАВЛЕНИЯ СУБСИДИЙ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА
РОССИЙСКИМ ОРГАНИЗАЦИЯМ НА ВОЗМЕЩЕНИЕ ЧАСТИ ЗАТРАТ
НА РЕАЛИЗАЦИЮ ПРОЕКТОВ ПО ОРГАНИЗАЦИИ И ПРОВЕДЕНИЮ
КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В РАМКАХ
ПОДПРОГРАММЫ "РАЗВИТИЕ ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ"
ГОСУДАРСТВЕННОЙ ПРОГРАММЫ РОССИЙСКОЙ ФЕДЕРАЦИИ "РАЗВИТИЕ
ФАРМАЦЕВТИЧЕСКОЙ И МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ"
НА 2013 - 2020 ГОДЫ
1. Настоящие Правила устанавливают порядок и условия предоставления субсидий из федерального бюджета российским организациям на возмещение части затрат на реализацию проектов по организации и проведению клинических исследований лекарственных препаратов в рамках подпрограммы "Развитие производства лекарственных средств" государственной программы Российской Федерации "Развитие фармацевтической и медицинской промышленности" на 2013 - 2020 годы (далее соответственно - проект, субсидия).
2. Субсидии предоставляются в целях развития инновационного потенциала фармацевтической промышленности в соответствии с приоритетными направлениями научных исследований в области инновационного развития здравоохранения, а также в целях достижения значений следующих целевых показателей подпрограммы "Развитие производства лекарственных средств" государственной программы Российской Федерации "Развитие фармацевтической и медицинской промышленности" на 2013 - 2020 годы:
а) доля лекарственных средств отечественного производства в общем объеме потребления (в денежном выражении);
б) объем инвестиций в научные исследования, разработки, технологические инновации и перевооружение производства лекарственных средств.
3. Под приоритетными направлениями научных исследований в области инновационного развития здравоохранения в настоящих Правилах понимаются:
а) разработка противоопухолевых препаратов, совершенствование подходов ранней диагностики опухолевых заболеваний, выявление нового поколения онкомаркеров;
б) разработка лекарственных средств в области регенеративных технологий;
в) разработка лекарственных средств для ранней диагностики и лечения аутоиммунных и нейродегенеративных заболеваний;
г) разработка лекарственных средств для ранней диагностики и лечения эндокринных заболеваний, заболеваний пищеварительного тракта и нарушения обмена веществ, в том числе сахарного диабета;
д) разработка лекарственных средств для ранней диагностики и лечения сердечно-сосудистых заболеваний;
е) разработка лекарственных средств и средств диагностики для предупреждения, лечения и выявления инфекционных заболеваний;
ж) разработка лекарственных средств для профилактики, диагностики и лечения туберкулеза;
з) разработка лекарственных средств для вакцинопрофилактики и лечения особо опасных вирусных заболеваний, в том числе ВИЧ-инфекции и вирусных гепатитов;
и) разработка лекарственных средств для терапии гематологических, онкогематологических и врожденных наследственных заболеваний;
к) разработка лекарственных средств, применяемых в трансплантологии;
л) разработка лекарственных средств для ранней диагностики и лечения заболеваний дыхательных путей;
м) разработка лекарственных средств, применяемых в терапии болевого синдрома;
н) разработка лекарственных средств для лечения редких (орфанных) заболеваний.
4. Под проектом понимается комплекс взаимосвязанных мероприятий и процессов по организации и проведению клинического исследования одного лекарственного препарата (с одним международным непатентованным наименованием или при отсутствии такого наименования соответствующим химическим или группировочным наименованием), ограниченный по времени и ресурсам, в том числе с привлечением третьих лиц.
5. Субсидии предоставляются в пределах бюджетных ассигнований, предусмотренных федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, и лимитов бюджетных обязательств, утвержденных в установленном порядке Министерству промышленности и торговли Российской Федерации на цели, указанные в пункте 1 настоящих Правил.
6. Субсидии предоставляются российской организации, зарегистрированной в Российской Федерации.
7. Субсидии предоставляются российской организации на следующих условиях:
а) бизнес-план проекта предусматривает начало выпуска в гражданский оборот лекарственного препарата, разработанного в рамках проекта, не позднее 4 лет с даты заключения договора о предоставлении субсидии;
б) бизнес-план проекта предусматривает получение российской организацией выручки от реализации разработанного в рамках проекта лекарственного препарата суммарно за 3 года со дня начала его выпуска в размере, не менее чем в 3 раза превышающем размер предоставленной субсидии;
в) российская организация имеет разрешение на проведение клинического исследования заявленного лекарственного препарата, выданное уполномоченным федеральным органом исполнительной власти в установленном порядке;
г) наработка образцов заявленного лекарственного препарата для проведения клинических исследований осуществляется на производственной площадке на территории Российской Федерации;
д) проект не предполагает организацию и проведение клинических исследований лекарственного препарата при наличии в государственном реестре лекарственных средств для медицинского применения сведений о трех или более зарегистрированных российских лекарственных препаратах различных производителей с идентичным международным непатентованным наименованием (или при отсутствии такого наименования - с соответствующим химическим или группировочным наименованием), идентичной лекарственной формой и показаниями к применению на день подачи документов в соответствии с пунктом 10 настоящих Правил;
е) проведение клинических исследований лекарственного препарата осуществляется на территории Российской Федерации в клинических исследовательских центрах, аккредитованных Министерством здравоохранения Российской Федерации;
ж) проект не предполагает финансирование из бюджетов бюджетной системы Российской Федерации в соответствии с иными нормативными правовыми актами;
з) проект направлен на достижение целей, предусмотренных пунктом 2 настоящих Правил.
8. Субсидии предоставляются на возмещение фактически осуществленных не ранее 1 января 2015 г. и документально подтвержденных следующих затрат российской организации, связанных с реализацией проекта, предусмотренных бизнес-планом проекта:
а) на приобретение сырья, расходных материалов для наработки образцов разрабатываемого лекарственного препарата;
б) на приобретение лекарственных препаратов сравнения;
в) на оплату услуг сторонних организаций по проведению лабораторных, клинико-диагностических исследований, обработке полученных клинических данных, а также по транспортировке клинических образцов;
г) на страховые взносы по страхованию жизни и здоровья пациентов, участвующих в клинических исследованиях лекарственного препарата;
д) на заработную плату работников российской организации, имеющих высшее фармацевтическое, медицинское, биологическое или химическое образование и (или) ученую степень кандидата или доктора наук и стаж работы не менее 3 лет в области разработки лекарственных средств, включая компенсационные и стимулирующие выплаты, а также на вознаграждения по договорам гражданско-правового характера, заключенным с физическими лицами и индивидуальными предпринимателями, уплату страховых взносов на обязательное пенсионное страхование, обязательное медицинское страхование, обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний. При этом для расчета размера возмещения соответствующих затрат учитывается сумма средней заработной платы и (или) указанных вознаграждений, не превышающих размер среднемесячной номинальной начисленной заработной платы в Российской Федерации по виду экономической деятельности "Производство фармацевтической продукции" (код 24.4 по ОКВЭД) или по виду экономической деятельности "Производство лекарственных препаратов" (код 21.20.1 по ОКВЭД2) (объем таких расходов не может превышать 20 процентов общего размера затрат по проекту).
9. Субсидии предоставляются на основании договора о предоставлении субсидии, заключенного между Министерством промышленности и торговли Российской Федерации и российской организацией. Договор о предоставлении субсидии предусматривает:
а) цели, условия и порядок предоставления субсидии;
б) сроки перечисления субсидии;
в) обязанность Министерства промышленности и торговли Российской Федерации и органов государственного финансового контроля проводить проверки соблюдения российской организацией условий, целей и порядка предоставления субсидии, которые установлены договором о предоставлении субсидии и настоящими Правилами, и согласие этой организации на проведение таких проверок;
г) ответственность российской организации за неисполнение или ненадлежащее исполнение принятых обязательств, в том числе по достижению значений показателей (индикаторов) эффективности реализации проекта;
д) порядок возврата сумм, использованных российской организацией, в случае установления по итогам проверок, проведенных Министерством промышленности и торговли Российской Федерации и (или) органами государственного финансового контроля, факта нарушения условий, целей и порядка предоставления субсидии, которые определены настоящими Правилами и договором о предоставлении субсидии, а также порядок применения в случае недостижения установленных количественных значений показателей (индикаторов) эффективности реализации проекта, предусмотренных подпунктом "з" настоящего пункта, штрафных санкций, расчет размера которых осуществляется согласно приложению N 1. Размер штрафных санкций пропорционален степени недостижения значений целевых показателей реализации проекта, указанных в договоре о предоставлении субсидии;
е) условия расторжения договора о предоставлении субсидии, включая условие одностороннего расторжения Министерством промышленности и торговли Российской Федерации указанного договора в случае неисполнения российской организацией в течение 12 месяцев реализации проекта контрольных событий, предусмотренных планом-графиком реализации проекта;
ж) порядок, форма и сроки представления отчетности о достижении значений целевых показателей реализации проекта, предусмотренных договором о предоставлении субсидии, и об осуществлении затрат, источником финансового обеспечения которых является субсидия, в том числе порядок осуществления фактической проверки достижения заявленных значений показателей (индикаторов) эффективности реализации проектов после их завершения;
з) количественные значения следующих показателей (индикаторов) эффективности реализации проекта по годам в течение срока реализации проекта:
увеличение доли лекарственных средств отечественного производства в общем объеме потребления (в денежном выражении);
увеличение объема инвестиций в научные исследования, разработки, технологические инновации и перевооружение производства лекарственных средств;
начало выпуска в гражданский оборот лекарственного препарата, разработанного в рамках проекта, не позднее 4 лет с даты заключения договора о предоставлении субсидии;
получение российской организацией выручки от реализации разработанного в рамках проекта лекарственного препарата суммарно за 3 года со дня начала его выпуска в размере, не менее чем в 3 раза превышающем размер предоставленной субсидии;
и) сведения о целевых показателях реализации проекта, в том числе:
план-график реализации проекта, включая контрольные события и динамику достижения значений целевых показателей по годам его реализации;
итоги реализации проекта;
к) требование ведения российской организацией раздельного учета затрат, источником финансового обеспечения которых является субсидия;
л) порядок и случаи возврата в текущем финансовом году российской организацией остатков субсидии, не использованных в отчетном финансовом году;
м) запрет конвертации в иностранную валюту полученных из федерального бюджета средств.
10. Для заключения договора о предоставлении субсидии российская организация представляет в Министерство промышленности и торговли Российской Федерации следующие документы:
а) сопроводительное письмо с указанием реквизитов российской организации;
б) копии учредительных документов, заверенные руководителем российской организации;
в) копия бизнес-плана проекта с планом-графиком реализации проекта, содержащим контрольные события, в том числе по выпуску в гражданский оборот лекарственного препарата, и динамику достижения значений целевых показателей по годам его реализации, включающим смету затрат на реализацию проекта по годам, заверенная руководителем российской организации;
г) копия выписки из Единого государственного реестра юридических лиц, выданной не ранее 2 месяцев до дня представления документов, заверенная в установленном порядке (в случае непредставления российской организацией такого документа Министерство промышленности и торговли Российской Федерации запрашивает его самостоятельно);
д) справка, подписанная руководителем организации (иным уполномоченным лицом), подтверждающая отсутствие у организации просроченной задолженности по уплате налогов, сборов и иных обязательных платежей, подлежащих уплате в бюджеты бюджетной системы Российской Федерации, на 1 число месяца, предшествующего месяцу, в котором планируется заключение договора о предоставлении субсидии;
е) копия разрешения на проведение клинического исследования лекарственного препарата, выданного уполномоченным федеральным органом исполнительной власти.
11. Министерство промышленности и торговли Российской Федерации регистрирует документы, указанные в пункте 10 настоящих Правил, в порядке их поступления.
12. Министерство промышленности и торговли Российской Федерации рассматривает в порядке поступления документы, указанные в пункте 10 настоящих Правил, и в течение 15 календарных дней со дня их поступления заключает с российской организацией договор о предоставлении субсидии либо отказывает ей (в письменной форме) в заключении такого договора в случае несоответствия представленных документов положениям пункта 10 настоящих Правил.
13. Субсидия предоставляется на возмещение не более 50 процентов затрат российской организации, указанных в пункте 8 настоящих Правил. Максимальный размер субсидии, выдаваемой одной российской организации, не может превышать 400 млн. рублей по совокупности всех договоров о предоставлении субсидий, заключенных с российской организацией в соответствии с настоящими Правилами, за весь срок их действия.
14. Для получения субсидии российская организация, с которой заключен договор о предоставлении субсидии, не чаще одного раза в месяц и не позднее 5 декабря текущего календарного года представляет в Министерство промышленности и торговли Российской Федерации заявление о предоставлении субсидии, составленное в произвольной форме и подписанное руководителем организации, с приложением следующих документов:
а) копии договоров и первичных учетных документов (счетов-фактур, актов сдачи-приемки выполненных работ, товарных накладных, платежных ведомостей), подтверждающих осуществление затрат по направлениям, указанным в пункте 8 настоящих Правил, заверенные в установленном порядке;
б) справка, подписанная руководителем и главным бухгалтером российской организации, о том, что эта организация не находится в стадии реорганизации, банкротства, ликвидации и не имеет ограничений на осуществление хозяйственной деятельности;
в) справка налогового органа, подтверждающая отсутствие у российской организации просроченной задолженности по уплате налогов, сборов и иных обязательных платежей, подлежащих уплате в бюджеты бюджетной системы Российской Федерации в соответствии с законодательством Российской Федерации, на 1-е число месяца, предшествующего месяцу, в котором планируется принятие решения о предоставлении субсидии, заверенная в установленном порядке (в случае непредставления этой организацией такого документа Министерство промышленности и торговли Российской Федерации запрашивает его самостоятельно);
г) справка, подписанная руководителем и главным бухгалтером и скрепленная печатью российской организации (при наличии), с указанием банковских реквизитов расчетных счетов этой организации, на которые в случае принятия положительного решения будет перечислена субсидия;
д) справка, подписанная руководителем и главным бухгалтером и скрепленная печатью российской организации (при наличии), подтверждающая неполучение этой организацией из бюджетов бюджетной системы Российской Федерации компенсации затрат по заявленным согласно настоящим Правилам направлениям в соответствии с иными актами Правительства Российской Федерации за один и тот же период;
е) утратил силу. - Постановление Правительства РФ от 30.08.2016 N 861;
ж) расчет субсидии на возмещение затрат российской организации на приобретение сырья, расходных материалов для наработки образцов разрабатываемого лекарственного препарата в рамках реализации проекта по форме согласно приложению N 2, и (или) расчет субсидии на возмещение затрат российской организации на приобретение лекарственных препаратов сравнения в рамках реализации проекта по форме согласно приложению N 3, и (или) расчет субсидии на возмещение затрат российской организации на оплату услуг сторонних организаций по проведению лабораторных, клинико-диагностических исследований, обработке полученных клинических данных, а также по транспортировке клинических образцов в рамках реализации проекта по форме согласно приложению N 4, и (или) расчет субсидии на возмещение затрат российской организации на страховые взносы по страхованию жизни и здоровья пациентов, участвующих в клинических исследованиях лекарственного препарата в рамках реализации проекта, по форме согласно приложению N 5, и (или) расчет субсидии на возмещение связанных с реализацией проекта затрат российской организации на заработную плату работников российской организации, имеющих высшее фармацевтическое, медицинское, биологическое или химическое образование и (или) ученую степень кандидата или доктора наук и стаж работы не менее 3 лет в области разработки лекарственных средств, включая компенсационные и стимулирующие выплаты, а также на вознаграждения по договорам гражданско-правового характера, заключенным с физическими лицами и индивидуальными предпринимателями, уплату страховых взносов на обязательное пенсионное страхование, обязательное медицинское страхование, обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний по форме согласно приложению N 6;
з) утратил силу. - Постановление Правительства РФ от 30.08.2016 N 861.
14(1). Российская организация представляет не позднее 5 апреля и 5 октября текущего календарного года в Министерство промышленности и торговли Российской Федерации:
а) отчет об осуществлении затрат в рамках реализации проекта, источником возмещения которых является субсидия, по форме согласно приложению N 7;
б) справку о ходе достижения плановых показателей (индикаторов) эффективности реализации проекта, подписанную руководителем организации;
в) иные отчеты, предусмотренные договором о предоставлении субсидии.
15. Министерство промышленности и торговли Российской Федерации регистрирует заявление о предоставлении субсидии и документы, представленные в соответствии с пунктом 14 настоящих Правил, в порядке их поступления.
Заявления о предоставлении субсидии рассматриваются в порядке поступления.
16. Министерство промышленности и торговли Российской Федерации проверяет полноту и достоверность сведений, содержащихся в представленных российской организацией документах, их соответствие положениям пункта 14 настоящих Правил и условиям договора о предоставлении субсидий и в течение 10 календарных дней принимает решение о предоставлении субсидии либо об отказе в предоставлении субсидии.
17. Основаниями для отказа в предоставлении субсидии являются:
а) несоответствие представленных документов положениям пункта 14 настоящих Правил и условиям договора о предоставлении субсидии;
б) наличие в документах неполных и недостоверных сведений;
в) недостаток лимитов бюджетных обязательств, утвержденных в установленном порядке Министерству промышленности и торговли Российской Федерации на цели, предусмотренные пунктом 2 настоящих Правил;
г) превышение максимального размера субсидии, выдаваемой одной российской организации, указанного в пункте 13 настоящих Правил;
д) установление факта неисполнения российской организацией бизнес-плана и (или) плана-графика реализации проекта, включая контрольные события его реализации.
18. Министерство промышленности и торговли Российской Федерации в течение 10 календарных дней со дня принятия решения о предоставлении субсидии или об отказе в предоставлении субсидии уведомляет (в письменной форме) о принятом решении российскую организацию, подавшую заявление о предоставлении субсидии.
19. Перечисление субсидии осуществляется в установленном порядке на расчетный счет российской организации, открытый в российской кредитной организации.
20. В случае установления фактов нарушения условий предоставления субсидии российская организация обязана возвратить соответствующие денежные средства в доход федерального бюджета в течение 10 рабочих дней со дня получения соответствующего требования Министерства промышленности и торговли Российской Федерации, направленного заказным почтовым отправлением.
В случае если по итогам реализации проекта хотя бы одно из значений показателей (индикаторов) эффективности реализации проекта, указанных в договоре о предоставлении субсидии, составляет менее 100 процентов значения, заявленного в проекте и определенного договором о предоставлении субсидии, к российской организации применяются штрафные санкции, расчет размера которых осуществляется согласно приложению N 1 к настоящим Правилам.
При установлении фактов наличия в текущем финансовом году остатков субсидий, не использованных в отчетном финансовом году, российская организация обязана возвратить соответствующие денежные средства в доход федерального бюджета в течение 10 рабочих дней со дня получения соответствующего требования Министерства промышленности и торговли Российской Федерации, направленного заказным почтовым отправлением.
21. Информация о размерах и сроках перечисления субсидий учитывается Министерством промышленности и торговли Российской Федерации при формировании прогноза кассовых выплат из федерального бюджета, необходимого для составления в установленном порядке кассового плана исполнения федерального бюджета.
22. Контроль за соблюдением российской организацией условий, целей и порядка предоставления субсидий осуществляют Министерство промышленности и торговли Российской Федерации и федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в финансово-бюджетной сфере, в установленном порядке.
Приложение N 1
к Правилам предоставления
субсидий из федерального
бюджета российским организациям
на возмещение части затрат
на реализацию проектов
по организации и проведению
клинических исследований
лекарственных препаратов
в рамках подпрограммы "Развитие
производства лекарственных
средств" государственной
программы Российской Федерации
"Развитие фармацевтической
и медицинской промышленности"
на 2013 - 2020 годы
РАСЧЕТ РАЗМЕРА ШТРАФНЫХ САНКЦИЙ
Размер штрафных санкций (тыс. рублей) (A) определяется по формуле:
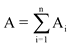 ,
,
для 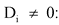
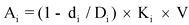 при
при 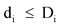
![]() при
при 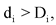
для ![]()
(или если не предусмотрено значение индикатора на отчетный период)
![]() ,
,
где:
A - общая сумма штрафных санкций за отчетный период (тыс. рублей);
![]() - вклад i-го индикатора в общую сумму штрафных санкций за отчетный период (тыс. рублей);
- вклад i-го индикатора в общую сумму штрафных санкций за отчетный период (тыс. рублей);
![]() - достигнутое значение i-го целевого показателя, указанного в договоре о предоставлении субсидии, на дату окончания срока реализации проекта;
- достигнутое значение i-го целевого показателя, указанного в договоре о предоставлении субсидии, на дату окончания срока реализации проекта;
![]() - плановое значение i-го показателя, указанного в договоре о предоставлении субсидии;
- плановое значение i-го показателя, указанного в договоре о предоставлении субсидии;
V - объем средств федерального бюджета, использованных организацией - получателем субсидии в рамках реализации проекта на дату окончания срока реализации проекта (тыс. рублей);
![]() - весовой коэффициент значения i-го показателя, указанный договоре о предоставлении субсидии;
- весовой коэффициент значения i-го показателя, указанный договоре о предоставлении субсидии;
n - количество индикаторов, указанное в договоре о предоставлении субсидии.
Приложение N 2
к Правилам предоставления
субсидий из федерального
бюджета российским организациям
на возмещение части затрат
на реализацию проектов
по организации и проведению
клинических исследований
лекарственных препаратов
в рамках подпрограммы "Развитие
производства лекарственных
средств" государственной
программы Российской Федерации
"Развитие фармацевтической
и медицинской промышленности"
на 2013 - 2020 годы
(форма)
Номер и дата договора
Сумма договора
Предмет договора
Наименование расходных материалов, реактивов
Сумма платежей по договору за расчетный период
Размер субсидии (гр. 5 x 0,5)
1
2
3
4
5
6
ИТОГО
Приложение N 3
к Правилам предоставления
субсидий из федерального
бюджета российским организациям
на возмещение части затрат
на реализацию проектов
по организации и проведению
клинических исследований
лекарственных препаратов
в рамках подпрограммы "Развитие
производства лекарственных
средств" государственной
программы Российской Федерации
"Развитие фармацевтической
и медицинской промышленности"
на 2013 - 2020 годы
(форма)
Номер и дата договора
Сумма договора
Предмет договора
Наименование лекарственного препарата
Сумма платежей по договору за расчетный период
Размер субсидии (гр. 5 x 0,5)
1
2
3
4
5
6
ИТОГО
Приложение N 4
к Правилам предоставления
субсидий из федерального
бюджета российским организациям
на возмещение части затрат
на реализацию проектов
по организации и проведению
клинических исследований
лекарственных препаратов
в рамках подпрограммы "Развитие
производства лекарственных
средств" государственной
программы Российской Федерации
"Развитие фармацевтической
и медицинской промышленности"
на 2013 - 2020 годы
(форма)
Номер и дата договора
Наименование подрядной организации
Сумма договора
Предмет договора
Наименование услуги (целевое назначение услуги)
Сумма платежей по договору за расчетный период
Размер субсидии (гр. 6 x 0,5)
1
2
3
4
5
6
7
ИТОГО
Приложение N 5
к Правилам предоставления
субсидий из федерального
бюджета российским организациям
на возмещение части затрат
на реализацию проектов
по организации и проведению
клинических исследований
лекарственных препаратов
в рамках подпрограммы "Развитие
производства лекарственных
средств" государственной
программы Российской Федерации
"Развитие фармацевтической
и медицинской промышленности"
на 2013 - 2020 годы
(форма)
Номер и дата договора
Наименование страховой компании
Сумма договора
Предмет договора
Размер страховой премии по договору
Размер субсидии (гр. 5 x 0,5)
1
2
3
4
5
6
ИТОГО
Приложение N 6
к Правилам предоставления
субсидий из федерального
бюджета российским организациям
на возмещение части затрат
на реализацию проектов
по организации и проведению
клинических исследований
лекарственных препаратов
в рамках подпрограммы "Развитие
производства лекарственных
средств" государственной
программы Российской Федерации
"Развитие фармацевтической
и медицинской промышленности"
на 2013 - 2020 годы
(форма)
Должность работника
Отработанный период (месяцев)
Заработная плата по должности за расчетный период <*>,
вознаграждения по договорам гражданско-правового характера за расчетный период
Коэффициент использования рабочего времени для работы по проекту (единиц)
Расходы на заработную плату и вознаграждения по договорам гражданско-правового характера (гр. 3 x гр. 4)
Страховые взносы (процентов)
Страховые взносы
(гр. 5 x гр. 6)
Размер субсидии
(0,5 x (гр. 5 + гр. 7)
Размер субсидии (расчет исходя из размера среднемесячной номинальной заработной платы (код 24.4 по ОКВЭД, код 21.20.1 по ОКВЭД2)
(0,5 x (стр. 1 x гр. 2 x гр. 4 x (1 + гр. 6 / 100%)
1
2
3
4
5
6
7
8
9
ИТОГО
Приложение N 7
к Правилам предоставления
субсидий из федерального
бюджета российским организациям
на возмещение части затрат
на реализацию проектов
по организации и проведению
клинических исследований
лекарственных препаратов
в рамках подпрограммы "Развитие
производства лекарственных
средств" государственной
программы Российской Федерации
"Развитие фармацевтической
и медицинской промышленности"
на 2013 - 2020 годы
(форма)
Наименование статьи расходов
Объем фактически произведенных расходов
Наименования организаций, с которыми заключены договоры, даты и номера таких договоров
Предмет договора
Реквизиты документа, являющегося основанием для перечисления средств
Реквизиты платежного поручения
Фактически оплачено
1
2
3
4
5
6
7
Всего
в том числе:
