"МУ 4.3.3939-23. 4.3. Методы контроля. Физические факторы. Методические указания по определению предельно допустимых уровней микроволновых излучений для населения. Методические указания"
Утверждаю
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный
санитарный врач
Российской Федерации
А.Ю.ПОПОВА
4 июля 2023 г.
4.3. МЕТОДЫ КОНТРОЛЯ. ФИЗИЧЕСКИЕ ФАКТОРЫ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ОПРЕДЕЛЕНИЮ ПРЕДЕЛЬНО ДОПУСТИМЫХ УРОВНЕЙ МИКРОВОЛНОВЫХ
ИЗЛУЧЕНИЙ ДЛЯ НАСЕЛЕНИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
МУ 4.3.3939-23
I. Общие положения и область применения
1.1. Настоящие методические указания (далее - МУ) определяют принципы проведения научно-исследовательских работ (далее - НИР) по обоснованию предельно допустимых уровней (далее - ПДУ) электромагнитных полей (далее - ЭМП) микроволнового диапазона (300 МГц - 300 ГГц), создаваемых антеннами радиоэлектронных средств (далее - РЭС) на селитебных территориях <1>.
--------------------------------
<1> Федеральный закон от 30.03.1999 N 52-ФЗ "О санитарно-эпидемиологическом благополучии населения".
1.2. МУ разработаны с целью унификации подходов к постановке и проведению исследований по научному обоснованию гигиенических нормативов ЭМП.
1.3. Научное обоснование гигиенических нормативов ЭМП осуществляется на основании экспериментальных исследований по изучению биологического действия ЭМП.
1.4. ПДУ микроволнового излучения устанавливаются в значениях плотности потока энергии (далее - ППЭ), мкВт/см2.
1.5. Отдельные гигиенические нормативы разрабатываются для различных групп РЭС, создающих ЭМП в дальней зоне излучения: радиолокационных станций (далее - РЛС), средств радиосвязи, средств телевидения в зависимости от особенностей радиочастотного сигнала.
II. Планирование исследований
2.1. При проведении НИР по обоснованию гигиенических нормативов ЭМП рекомендуется осуществлять междисциплинарное взаимодействие представителей различных областей науки.
2.2. При планировании НИР формулируются цель и задачи исследования, разрабатываются этапы НИР.
2.3. НИР включает следующие этапы:
- изучение режимов работы и технических характеристик РЭС (сведения об эффективной излучаемой мощности, частоте, типе модуляции и ширине полосы излучения, длительности и частоте следования импульсов, типах антенн, архитектуре построения сетей радиосвязи);
- разработка модели экспериментального исследования;
- создание стендовой базы для проведения экспериментального исследования на животных;
- выбор методов экспериментального исследования на лабораторных животных и методик статистической обработки данных;
- проведение экспериментальных исследований на животных по изучению биологических эффектов ЭМП;
- проведение исследований по моделированию процессов распределения и поглощения энергии ЭМП в теле животных и человека;
- обработка данных;
- экстраполяция результатов экспериментальных исследований с животных на человека;
- обобщение и оценка результатов экспериментальных исследований;
- формирование предложений по гигиенической регламентации ЭМП.
III. Постановка экспериментальных исследований на животных
3.1. Научное обоснование гигиенических нормативов ЭМП включает в том числе экспериментальные исследования на животных. Основными биологическими объектами экспериментальных исследований являются линейные белые крысы и мыши.
3.2. Исследования биологического действия ЭМП на животных одобряются этическим комитетом организации.
3.3. При планировании и постановке экспериментальных исследований определяются цели, задачи, разрабатывается схема эксперимента, определяются параметры ЭМП, осуществляется выбор видов животных, определяются массив регистрируемых показателей, методы их исследования и частота регистрации. По результатам исследования оформляется протокол. Рекомендуемая информация, указываемая в протоколе проведения экспериментальных исследований по оценке биологического действия микроволновых излучений, представлена в приложении 1 к настоящим МУ.
3.4. Стендовая база для проведения экспериментальных исследований разрабатывается в соответствии с целью и задачами и обеспечивает параметры ЭМП, близкие к натурным условиям по частоте ЭМП, модуляции сигнала, длительности и частоте следования импульса и другим характеристикам ЭМП, создаваемым РЭС на селитебной территории.
3.5. Животные для экспериментальных исследований размещаются в зоне сформированного ЭМП (дальняя зона излучения).
3.6. В зоне размещения животных неравномерность ППЭ ЭМП не превышает 10%. Стабильность уровней ППЭ обеспечивает источник излучения. Токопроводящие элементы в зоне облучения животных не размещаются.
3.7. Облучение животных проводится в условиях, исключающих воздействие ЭМП от внешних источников, отражение электромагнитной энергии, позволяющих моделировать распространение и взаимодействие плоской электромагнитной волны с биологическим объектом в зоне сформированного поля.
3.8. Контрольная группа животных, не подвергающихся воздействию ЭМП, находится в аналогичных условиях с животными основной группы, в том числе идентичных по показателям освещенности и микроклимата.
3.9. Опытные и контрольные группы животных имеют одинаковые вид, пол, линию, показатели ориентировочно-исследовательской активности (например, показатель энтропии), однородны по возрасту, массе тела (отклонение индивидуального значения не более чем на 10%).
3.10. Изучение биологического действия ЭМП в целях научного обоснования гигиенических нормативов проводится в условиях подострых и хронических воздействий.
3.11. В подострых экспериментах (продолжительность воздействия может составлять 2 - 4 недели) исследования выполняются не менее чем на трех уровнях ППЭ, один из которых является действующим. Показатели, характеризующие состояние различных систем и органов животных, регистрируются с периодичностью 1 раз в неделю. По результатам экспериментальных исследований определяется интенсивность ЭМП для постановки хронического эксперимента.
3.12. В исследованиях по изучению биологического действия хронических экспозиций ЭМП общая длительность облучения животных составляет от 4 до 12 месяцев. Регистрация показателей состояния животных проводится не реже 1 раза в месяц с обязательным определением этих показателей через 1 и 2 месяца после завершения облучения.
3.13. В хронических экспериментах рекомендуется облучение с групповым размещением животных для предотвращения развития стресса вследствие вынужденного нахождения в индивидуальных клетках и длительной изоляции.
3.14. Для учета особенностей поглощенной энергии ЭМП в разных биологических объектах рекомендуется использовать расчеты удельной поглощенной мощности (приложение 2 к настоящим МУ).
3.15. В экспериментальных исследованиях используется двойной слепой метод регистрации показателей, сбора и обработки данных.
3.16. Проводится проверка достоверности результатов экспериментальных исследований.
3.17. Выбор показателей биологического действия ЭМП основывается на имеющихся современных научных данных об изменениях в организме и наиболее чувствительных органах и системах.
3.18. В исследованиях используются методики, позволяющие регистрировать показатели, характеризующие структурные и функциональные изменения в организме.
3.19. Для изучения функциональных изменений применяется комплекс физиологических, биохимических, иммунологических показателей. Структурные изменения изучаются с помощью комплекса морфологических, в том числе эмбриологических и генетических, исследований (приложение 3 к настоящим МУ).
3.20. Статистическая обработка и анализ результатов экспериментальных исследований осуществляются согласно общим принципам математической статистики (приложение 4 к настоящим МУ).
IV. Оценка биоэффектов и расчеты ПДУ
4.1. При оценке результатов исследования и определении ПДУ ЭМП определяется тип реакции организма животных.
4.2. Значимые различия в оцениваемых показателях животных основной и контрольной группы в ходе хронического эксперимента и в период последействия (через 1 и 2 месяца после облучения), находящиеся в пределах физиологической нормы, могут оцениваться как отсутствие биологического эффекта или как адаптационно-компенсаторные изменения, которые учитываются при установлении ПДУ.
4.3. При установлении ПДУ может быть использован метод экстраполяции данных с животных на человека, представленный в приложении 5.
Приложение 1
к МУ 4.3.3939-23
РЕКОМЕНДУЕМАЯ ИНФОРМАЦИЯ,
УКАЗЫВАЕМАЯ В ПРОТОКОЛЕ ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТАЛЬНЫХ
ИССЛЕДОВАНИЙ ПО ОЦЕНКЕ БИОЛОГИЧЕСКОГО
ДЕЙСТВИЯ МИКРОВОЛНОВЫХ ИЗЛУЧЕНИЙ
1. В протоколе проведения экспериментальных исследований по оценке биологического действия микроволновых излучений (далее - протокол) указываются:
1.1. Цель, задачи и обоснование исследований, вид и длительность экспериментальных исследований (дата, время, сроки проведения), ответственный специалист.
1.2. Методология и дизайн исследований: выбор модели эксперимента, перечень регистрируемых показателей, частота и периодичность их мониторинга и методов их оценки.
1.3. Нормативные правовые акты, стандарты и иные документы, определяющие этические принципы проведения экспериментальных исследований с использованием животных, правила ухода и условий содержания животных.
1.4. Характеристика биологических объектов, включающая указание вида (породы), возраста, пола, веса животного, источника поставки.
1.5. Содержание объектов исследований: размещение животных, соответствие содержания и питания стандартным условиям и установленным нормам в виварии и при проведении экспериментальных исследований (например, параметры микроклимата, освещения).
1.6. Количество экспериментальных групп и количество животных указывается для каждого вида исследования.
1.7. Описание плана эксперимента, включая методы контроля систематической ошибки.
1.8. Методы статистической обработки результатов.
1.9. Первичные данные проведения исследований и результаты их обработки.
1.10. Схема (блок-схема) размещения животных основной и контрольной групп. Расстояние до излучающей антенны.
1.11. Описание и состав лабораторного стенда воздействия микроволнового излучения на животных. Сведения об источнике и характеристиках ЭМП (частота, форма сигнала, модуляция, ширина полосы сигнала, мощность передатчика, характеристики антенны, мощность, подаваемая на антенну, и значения ППЭ в зоне размещения животных). При использовании в эксперименте РЛС дополнительно: длительность импульса, частота следования, скважность, частота вращения антенны.
1.12. Система управления стендом. Периодичность контроля уровней ППЭ в зоне размещения животных.
1.13. Средства измерений, используемые для экспериментальных исследований, погрешность и свидетельства о государственной поверке.
1.14. Перечень используемого оборудования, включая сведения о государственной регистрации (поверке, калибровке), погрешности.
2. К протоколу прилагается:
2.1. Заключение этического комитета организации, в которой проводились исследования;
2.2. Гарантийное обязательство руководителя (ответственного исполнителя) работ на соблюдение процедур контроля за состоянием объектов, находящихся в исследовании, обеспечение условий содержания, кормления и квалифицированного ухода, выполнение правил проведения исследовательских работ.
3. Протокол подписывается руководителем (исполнителем), ответственным за его формирование и за проведение исследований с указанием должности.
4. Все изменения и пересмотры подписанного протокола и их причины фиксируются, подписываются руководителем исследования, датируются и хранятся вместе с протоколом.
Приложение 2
к МУ 4.3.3939-23
ОЦЕНКА
ОБЩЕЙ ПОГЛОЩЕННОЙ ЭНЕРГИИ ЭМП МИКРОВОЛНОВОГО ДИАПАЗОНА
В БИОЛОГИЧЕСКИХ ОБЪЕКТАХ
1.1. Оценка общей поглощенной электромагнитной энергии в биологических объектах осуществляется посредством дозиметрии ЭМП, где используются два дополняющих метода - теоретический и экспериментальный.
1.2. При теоретической дозиметрии используются вычислительные методы, которые позволяют определить величину энергии ЭМП, поглощенную объектом, и структуру ее распределения с учетом формы самого объекта, расстояния от источника, расположения относительно E-, H- и k-векторов электромагнитной волны, диэлектрических свойств.
При экспериментальной дозиметрии используются инструментальные методы оценки поглощения энергии ЭМП биологическими объектами и их моделями.
1.3. Единицей измерения поглощенной энергии является величина удельной поглощенной мощности (далее - УПМ), которая характеризует количество энергии ЭМП, поглощенной единицей объема или массы тела (ткани) в единицу времени, выражается в Вт/кг и определяется по формуле (1):
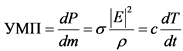 , где (1)
, где (1)
![]() - удельная электрическая проводимость ткани, См/м;
- удельная электрическая проводимость ткани, См/м;
![]() - плотность ткани, кг/м3;
- плотность ткани, кг/м3;
c - теплоемкость ткани Дж/кг·К;
T - среднеквадратичное значение вектора электрической составляющей ЭМП, В/м;
dT/dt - временная производная температуры, К/с.
1.4. Для оценки величины УПМобщ для тела массой m и объемом V используется формула (2):
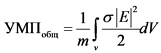 (2)
(2)
1.5. Область применения величины УПМ как количественного показателя воздействия ЭМП РЧ ограничена диапазоном частот 300 МГц - 6 ГГц.
1.6. Значение УПМ может использоваться для тепловых уровней экспозиции (оценка величины УПМ происходит по изменению температуры объекта за определенное время) и для уровней излучения ниже тепловых (УПМ определяется на основании величины среднеквадратичного значения вектора электрической составляющей ЭМП).
2. Теоретическая дозиметрия биологических объектов.
2.1. При теоретической дозиметрии используются уравнения электромагнетизма Максвелла - закон Фарадея и закон Ампера и различные методы расчета, ориентированные на конкретные условия и объекты облучения.
2.2. Рекомендуемые методы теоретической дозиметрии: аналитические методы с использованием длинноволновых приближений, расширенный метод граничных условий, повторяющийся расширенный метод граничных условий, метод моментов для решения системы линейных уравнений в частных производных, обобщенный многополюсный метод, метод конечных разностей скалярного потенциала, трехкоординатный метод импеданса, метод конечных элементов и метод конечных разностей во временной области.
2.3. Максимальная погрешность численных методов расчета УПМ - не более 30%.
3. Экспериментальная дозиметрия биологических объектов.
3.1. При экспериментальной дозиметрии оцениваются величины энергии ЭМП объекта экспозиции, при этом величина УПМ определяется параметрами электромагнитной волны, расстоянием от источника излучений и диэлектрическими свойствами объекта облучения.
3.2. Рекомендуемые методы экспериментальной дозиметрии: измерение с помощью термисторных зондов; измерение с помощью температурных зондов, основанное на оптических эффектах в виде изменения флюоресценции, лучепреломления или отражающих свойств жидких кристаллов под действием энергии ЭМП; термография; радиотермометрия; методы закрытых систем облучения, включающие линии передачи и резонаторы с исследуемым объектом; методы измерения E- или H-составляющих ЭМП с использованием миниатюрных изотропных имплантируемых зондов.
3.3. Максимальная погрешность экспериментальных методов оценки УПМ - не более 60%.
3.4. При оценке удельной поглощенной мощности гомогенного или гетерогенного объекта рекомендуется для каждой биологической ткани, учитывая частоту/центральную частоту воздействующего электромагнитного излучения, использовать международную базу данных диэлектрических свойств биологических тканей.
Приложение 3
к МУ 4.3.3939-23
ИССЛЕДОВАНИЕ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ ЭМП В ЭКСПЕРИМЕНТЕ
1. Физиологические исследования.
1.1. Физиологические исследования включают комплекс методов, позволяющих оценить функциональное состояние центральной нервной системы в соответствии с современными методическими разработками.
1.2. Состояние центральной нервной системы оценивается по поведенческим тестам, основанным на изучении ориентировочно-исследовательских реакций, и по оценке условно-рефлекторной деятельности на положительном подкреплении.
1.3. Исследование двигательного компонента ориентировочной реакции и эмоциональной реактивности животных проводится, например, с использованием методик "открытое поле", "крестообразный лабиринт".
2. Биохимические и эндокринологические исследования.
2.1. Оценка функционального состояния нейроэндокринной системы осуществляется путем применения современных сертифицированных методов исследования.
2.2. Биохимические исследования включают показатели, характеризующие развитие окислительного стресса в организме животных. Например, содержание SS- и SH-групп в белковой и небелковой фракциях крови, активность антиоксидантных ферментов, таких как глютатионредуктаза, супероксиддисмутаза, каталаза, глютатионпероксидаза; содержание некоторых низкомолекулярных веществ: мочевая, аскорбиновая (витамин C), липоевая кислоты, глутатион, убихинол, токоферол (витамин E), флавоноиды.
2.3. К биохимическим показателям, характеризующим развитие метаболических механизмов ответных реакций организма, относится активность ферментов энергетического обмена - гликолиза, цикла Кребса и дыхательной цепи.
2.4. При исследовании состояния эндокринной системы проводится определение в сыворотке крови прогестерона, тестостерона, лютеинизирующего и фолликулостимулирующих гормонов.
2.5. Исследование липидного обмена веществ включает определение холестерина, холестерина липопротеинов высокой плотности (ЛПВП), холестерина липопротеинов низкой плотности (ЛПНП), триглицеридов, общих липидов в сыворотке крови, а также определение индекса атерогенности.
2.6. В исследованиях электролитного обмена веществ определяется содержание калия, натрия, ионизированного кальция, магния, железа.
3. Исследование иммунной системы и состояния крови.
3.1. Для характеристики состояния иммунной системы проводятся исследования показателей: реакции завершения фагоцитоза, реакции связывания комплимента на холоде, реакции дегрануляции базофилов периферической крови или показателей повреждения нейтрофилов, реакции бластной трансформации лимфоцитов.
3.2. В иммунологических исследованиях рекомендуется применять комплекс следующих показателей: общее количество лейкоцитов, абсолютный и относительный уровень лимфоцитов и нейтрофилов, относительное и абсолютное количество T- и B-лимфоцитов, фагоцитарную активность нейтрофилов, комплементарную активность сыворотки крови, реакции дегрануляции базофилов в периферической крови.
3.3. Для оценки системы крови, в особенности структурно-функциональных характеристик форменных элементов крови и кроветворных органов, рекомендуется исследовать следующие показатели: общее количество лейкоцитов, общее количество эритроцитов, содержание гемоглобина, дифференциальный морфологический анализ клеток периферической крови и костного мозга, тимуса, селезенки.
4. Исследования гонадотропных, тератогенных и цитогенетических эффектов.
4.1. Для изучения влияния на андрогенную функцию и другие показатели репродуктивной системы используются морфологические, биохимические, молекулярные, генетические показатели.
4.2. Функциональное состояние семенников, других органов репродуктивной системы самцов (эпидидимис, простата, семенные пузырьки) оценивается по их массе и весовым индексам (относительная масса органов).
4.3. Используются показатели, характеризующие процесс воспроизводства клеточных популяций сперматогенных клеток, эндокринной регуляции функции семенников, изменения свойств эпидидимальных сперматозоидов.
4.4. При гистологических исследованиях семенников проводится количественный анализ сперматогенных клеток различных стадий дифференцировки.
4.5. При изучении репродуктивной функция самок определяются способности к зачатию и плодовитости с дальнейшим анализом микроструктуры яичников и матки, эмбрионального развития потомства.
4.6. Тератогенный эффект при воздействии микроволн в период беременности учитывается на внутриутробных плодах незадолго до рождения (у крыс на 20-й день, у мышей на 19-й день беременности). Определяется пред-, постимплантационная и общая эмбриональная смертность.
4.7. Для оценки изменений в постнатальном развитии у животных регистрируются время и характер течения родов, количество живых и мертвых плодов, наличие уродств у новорожденных.
4.8. Развитие потомства прослеживается до 21-го дня после рождения или вплоть до полового созревания. Контролируются вес, линейные размеры животных, время открытия ушей и глаз, отрастание шерсти, развитие центральной нервной и сердечно-сосудистой систем, органов зрения.
4.9. Проводятся определение частоты хромосомных аббераций в лимфоцитах периферической крови, исследование хромосомного набора клеток костного мозга, определение доминантных леталей, указывающее на поражение клеток генеративных тканей.
Приложение 4
к МУ 4.3.3939-23
СТАТИСТИЧЕСКАЯ ОБРАБОТКА
РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
1. Статистическая обработка данных экспериментальных исследований направлена на выявление статистически значимых отличий между группами лабораторных животных в эксперименте по исследуемым параметрам, на выявление зависимости эффектов ЭМП.
2. Статистический анализ отражает цель исследования, план эксперимента, выявляет закономерности, позволяет провести проверку одной или нескольких гипотез. Выбор используемых статистических критериев, тестов и методов определяется исходя из задач исследования, оцениваемых параметров (количественные, качественные), характера распределения параметров, количества экспериментальных животных в группе, количества групп.
3. На первом этапе статистической обработки данных проводится оценка характера распределения параметров наблюдения и степень его отличия от нормального распределения в каждой выборке. Для данной цели могут быть использованы тест Шапиро-Уилка, критерий Колмогорова-Смирнова (рекомендуется при количестве наблюдений в выборке более 50).
4. Описательные статистики.
4.1. В случае анализа количественных данных и нормального распределения в выборке описательная статистика включает расчет среднего арифметического (M) и его 95%-го доверительного интервала (95% ДИ) или стандартного (среднеквадратического) отклонения (SD). Если отсутствует необходимость показать вариабельность данных, подчиняющихся нормальному распределению, и необходимо осуществить точечную оценку и оценить показатель точности среднего арифметического, допускается указывать стандартную ошибку среднего арифметического (m).
4.2. При анализе количественных данных и распределении в выборке, отличающемся от нормального, в качестве меры центральной тенденции используют медиану (Me), а в качестве мер рассеяния - нижний (Q1) и верхний (Q3) квартили (25-й и 75-й процентили), а также размах вариации (межквартильный диапазон). Кроме медианы для описания центральных тенденций используют моду (Mo).
4.3. Выборки с категориальными признаками (номинальными или ранговыми) считаются не обладающими нормальным распределением. Данные атрибуты могут быть описаны как "номинальные", когда они не имеют естественного порядка (например, род или порода животных). При наличии только двух категорий данные называются бинарными (дихотомическими). Данные описываются как "порядковые", когда они имеют естественный порядок (например, баллы, низкие, средние и высокие уровни дозы) и могут быть определены численно. Номинальные и ранговые признаки представляются в виде долей (процентов) с указанием 95% ДИ, рассчитанного по методам Вальда, Уилсона. Допускается представление ранговых признаков как количественных данных, которые не подчиняются закону нормального распределения, то есть с помощью медианы и квартилей или процентилей.
5. При нормальности распределения параметра для сравнения групп рекомендуется использовать параметрические критерии. При распределении в одной сравниваемой выборке, отличающемся от нормального, рекомендуется использовать непараметрические критерии.
6. Параметрические методы.
6.1. Количественные данные, имеющие нормальное распределение, можно анализировать с помощью параметрических методов: одновыборочный t-критерий, t-критерий для двух независимых или парных выборок, а также однофакторного дисперсионного анализа ANOVA и ANOVA для повторных измерений при сравнении трех и более групп.
6.2. Параметрические тесты более универсальны, чем непараметрические, но зависят от допущений о том, что дисперсии примерно одинаковы в каждой группе, поэтому в дополнение к проверке нормальности распределения рекомендуется использовать критерий Ливеня для проверки равенства дисперсий.
6.3. Общепринятый критический уровень значимости нулевой гипотезы равен 0,05, и при p < 0,05 различия мер центральной тенденции признаются статистически значимыми. При проведении дисперсионного анализа подобный результат не дает ответа на вопрос, между какими из трех (или более) выборок будут статистически значимые отличия.
Для изучения различий между отдельными средними значениями можно использовать апостериорные сравнения, которые представляют собой попарные сравнения изучаемых групп для обнаружения различий между ними, а также ортогональные контрасты. Критический уровень значимости нулевой гипотезы при попарном сравнении выборок рекомендуется снижать (например, с использованием поправки Бонферрони).
7. Непараметрические методы.
7.1. Для проверки различий между двумя выборками парных или независимых измерений по уровню какого-либо количественного или рангового (порядкового) признака используют критерий Манна - Уитни (для 2 независимых выборок) и критерий Уилкоксона (для двух парных выборок). Для сравнения 3 и более независимых групп применяется критерий Краскела - Уоллиса, а для определения статистически значимых отличий в трех и более парных выборках используется критерий Фридмана. При уровне значимости критериев Краскела - Уоллиса или Фридмана менее 0,05 необходимо попарное сравнение выборок с помощью критериев Манна - Уитни или Уилкоксона. Рекомендуется корректировать критический уровень значимости нулевой гипотезы.
7.2. Для анализа различий между выборками с номинальными, а в отдельных случаях также и ранговыми данными, используются статистики на основе критерия хи-квадрат. Метод неточен, если числа в некоторых ячейках очень низкие. В таких случаях можно использовать критерий хи-квадрат с поправкой Йейтса (если количество ожидаемых наблюдений хотя бы в одной из ячеек менее 10). Если ожидаемое число наблюдений в любой из ячеек четырехпольной таблицы 2 x 2 будет меньше 5, то следует применять точный критерий Фишера. Для сравнения долей в двух зависимых выборках используется критерий Мак-Немара. Критерий хи-квадрат Пирсона также может быть применен для сравнения качественных данных в трех и более независимых группах, а для сравнения качественных данных в трех и более зависимых группах используется Q-критерий Кокрена. При обнаружении статистически значимых различий с помощью критерия Кокрена можно провести попарные сравнения с помощью критерия Мак-Немара с поправкой Бонферрони.
8. Вне зависимости от типа распределения и характера данных следует учитывать, что выраженное (захватывающее среднее или медиану соседней выборки) пересечение 95% ДИ или межквартильного диапазона будет свидетельствовать о незначимых отличиях массивов данных даже при статистически значимых отличиях мер центральной тенденции.
9. Статистически значимые отличия не исключают отсутствия практической (клинической) значимости отличий. Отсутствие статистически значимых отличий, полученное при исследовании небольших выборок, как правило, не позволяет однозначно интерпретировать результат, и одновременно результат исследования может быть значим с практической (клинической) точки зрения.
10. Корреляция.
10.1. Направление корреляционной связи может быть прямое (положительное) или обратное (отрицательное). Виды корреляции по силе связи:
а) отсутствует: 0,00;
б) слабая: 0,01 - 0,29;
в) средняя: 0,30 - 0,69;
г) сильная: 0,70 - 0,99;
д) полная: 1,00.
10.2. Наиболее распространенный коэффициент корреляции - корреляция Пирсона, используется для оценки прочности линейной связи между двумя числовыми переменными A и B в выборках, обладающих нормальным распределением.
10.3. Существуют другие формы коэффициента корреляции в зависимости от того, являются ли переменные измерениями рангами или дихотомическими значениями. Для выборок количественных данных, не обладающих нормальным распределением, вычисляют коэффициент корреляции Спирмена.
10.4. Помимо расчета коэффициента корреляции определяют также статистическую значимость корреляции. Корреляция признается статистически значимой при p < 0,05.
10.5. Кросс-корреляция является мерой сходства двух рядов в зависимости от перемещения одного ряда относительно другого. Кросс-корреляция рассчитывается для двух переменных, одна из которых берется с определенным запаздыванием ("лагом").
10.6. Корреляция определяет силу и направление связи (взаимосвязи) между переменными, но не определяет причинно-следственную связь.
11. Регрессия.
11.1. Регрессионный анализ используют для количественной оценки связи между двумя непрерывными переменными X и Y, где предполагается, что изменение X вызывает изменение Y. Таким образом, регрессия является асимметричной по отношению к X и Y. Предполагается, что переменная X измеряется без ошибок. Линейную регрессию можно использовать для подбора прямой линии формы y = a + b · x, где a и b - константы, которые обычно определяются на основе данных с использованием метода наименьших квадратов. В этом случае "a" (отрезок) представляет значение Y, когда X равно нулю, а "b" - это наклон линии регрессии. Положительное значение b означает, что наклон увеличивается слева направо, а отрицательное значение означает, что он уменьшается. Доверительные интервалы могут быть получены для наклона и могут быть установлены вокруг линии регрессии, чтобы получить, например, 2, что интерпретируется как доля изменчивости данных, объясняемая регрессией. Данное значение может быть низким, если переменная X не имеет достаточно большого диапазона.
11.2. Одновременное влияние нескольких независимых переменных X на фактор Y можно оценить с помощью множественной регрессии. Данный анализ носит исследовательский характер с целью определения того, какие переменные оказывают влияние. Логистическую регрессию используют для изучения взаимосвязи между одной или несколькими переменными-предикторами и бинарным результатом.
11.3. Регрессия и дисперсионный анализ связаны, поэтому регрессия, например, реакции на уровень дозы, может быть включена как часть дисперсионного анализа с использованием ортогональных контрастов. Обычный статистический тест в регрессионном анализе состоит в проверке нулевой гипотезы об отсутствии линейной зависимости между X и Y. Другие тесты касаются того, имеют ли две линии регрессии одинаковый наклон b и/или одинаковую точку пересечения a. Тестом для определения наличия квадратичного отношения будет тест того, дает ли квадратичная кривая значительно лучшее соответствие, чем прямая линия.
Приложение 5
к МУ 4.3.3939-23
ЭКСТРАПОЛЯЦИЯ ДАННЫХ С ЖИВОТНЫХ (КРЫСЫ, МЫШИ) НА ЧЕЛОВЕКА
1. Экстраполяция данных изучения эффектов воздействия ЭМП в эксперименте осуществляется на основании количественного сопоставления и определения эквивалентных условий облучения для человека и лабораторных животных. При экстраполяции данных учитываются характеристики поглощения энергии ЭМП - энергетический подход и представления о биологически эквивалентных временах для различных видов млекопитающих (например, человека, крыс, мышей) - временной подход.
2. Энергетический подход оценки эквивалентности условий облучения биологических объектов отражает физические закономерности поглощения электромагнитной энергии.
3. Временной подход позволяет учесть особенности биологического действия фактора, связанные с различиями в видовой чувствительности организмов к воздействию ЭМП.
4. Энергетический подход к подбору эквивалентных условий облучения различных биологических объектов основан на экстраполяции по частоте и по интенсивности падающего ЭМП.
5. Экстраполяция по частоте ЭМП основана на обеспечении равенства средних значений и подобия пространственного распределения УПМ в теле биологических объектов за счет сохранения постоянного соотношения длин волн к размеру объекта.
6. Частота ЭМП для человека, эквивалентная условиям облучения животных, определяется по формуле (3):
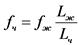 , где (3)
, где (3)
fч - частота эквивалентных условий облучения человека;
fж - частота условий облучения животного;
Lч - длина тела человека;
Lж - длина тела животного.
7. Экстраполяция по интенсивности ЭМП основана на определении уровня внешнего ЭМП, обеспечивающего заданную величину УПМ в теле биологических объектов на фиксированной частоте.
8. Уровень ППЭ внешнего ЭМП на частоте fч, обеспечивающий в теле человека такую же величину УПМ, как и в теле животного, определяется по формуле (4):
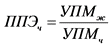 , где (4)
, где (4)
ППЭЧ - эквивалентная интенсивность облучения человека, мВт/см2;
УПМж - средняя величина УПМ в теле животного, Вт/кг;
УПМч - нормированная средняя величина УПМ в теле человека на частоте fч, 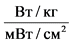 .
.
9. Экстраполяцию по интенсивности внешнего ЭМП рекомендуется применять при исследовании частотно-зависимых биологических эффектов, учитывая, что подобие структуры распределения поглощенной энергии внутри различных биологических объектов не обеспечивается.
10. При экстраполяции экспериментальных данных для учета различий в скорости проявления реакций животных и человека на воздействие фактора используется шкала биологически эквивалентных времен для различных видов млекопитающих. Например: биологически эквивалентное время воздействия фактора на крысу и человека связаны соотношением (5):
lg tч = 0,47 + 1,18 · lg tкр, где (5)
tч - эквивалентное время воздействия фактора на человека, сутки;
tкр - эквивалентное время воздействия фактора на крысу, сутки.
БИБЛИОГРАФИЧЕСКИЕ ССЫЛКИ
1. Федеральный закон от 30.03.1999 N 52-ФЗ "О санитарно-эпидемиологическом благополучии населения".
2. Федеральный закон от 07.07.2003 N 126-ФЗ "О связи".
3. Постановление Правительства Российской Федерации от 24.07.2000 N 554 "Об утверждении Положения о Государственной санитарно-эпидемиологической службе Российской Федерации и Положения о государственном санитарно-эпидемиологическом нормировании".
4. ГОСТ 24375 "Радиосвязь. Термины и определения".
5. ГОСТ 23611 "Совместимость радиоэлектронных средств. Термины и определения".
6. ГОСТ 33216 "Межгосударственный стандарт. Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами".
7. СП 323.1325800.2017 "Территории селитебные. Правила проектирования наружного освещения".
8. Методические рекомендации "Оценка биологического действия микроволн в целях их гигиенической регламентации", 1990 г.
9. Приложение А к Европейской конвенции об охране позвоночных животных, используемых для экспериментов и в других научных целях (ETS N 123) Руководство по содержанию и уходу за лабораторными животными (статья N 5 конвенции).
10. Директива Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22.09.2010 о защите животных, использующихся для научных целей.
11. Руководство по содержанию и использованию лабораторных животных. Восьмое издание./Пер. с англ, под ред. И.В. Белозерцевой, Д.В. Блинова, М.С. Красильщиковой. М.: ИРБИС, 2017. 336 с.
12. Справочник. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных. Под редакцией д.м.н., проф. Макарова В.Г., д.м.н. Макаровой М.Н. СПБ.: Изд-во "ЛЕМА", 2013. 116 с.
13. Попов В.И., Карпов В.Н., Ушаков И.Б., Чубирко М.И., Федоров В.П. Многофакторное планирование и анализ в медико-биологических исследованиях. Воронеж: Изд-во "Воронежский государственный университет", 2000. 68 с.
14. Иванов И.В., Ушаков И.Б. Основные подходы к экстраполяции данных с животных на человека в радиобиологическом эксперименте//Медицинская радиология и радиационная безопасность. 2020. Т. 65. N 3. С. 5 - 12.
15. Durney C. H. Radiofrequency Radiation Dosimetry Handbook, 4th Edition (Report TR-85-73)/C. H. Dumey, H. Massoudi, M. F. Iskander//Brooks Air Force Base, TX: USAF School of Aerospace Medicine. - 1986. (http://www.dtic.mil/dtic/tr/fulltext/u2/al80678.pdf).
16. European convention for the protection of vertebrate animals used for experimental and scientific purposes. Strasbourg, 18.III.1986. - European Treaty Series. N 123. (https://rm.coe.int/168007a6a8).
17. ICNIRP Guidelines for limiting exposure to electromagnetic fields (100 kHz to 300 GHz) Health Phys. 2020; 118: 483 - 524. doi: 10.1097/HP.0000000000001210. (https://www.icnirp.org/cms/upload/publications/ICNIRPrfgdl2020.pdf)
18. IEEE C95.1-2005. IEEE Standard for Safety Levels with Respect to Human Exposure to Radio Frequency Electromagnetic Fields, 3 kHz to 300 GHz. New York 2006, The Institute of Electrical and Electronics Engineers, Inc. 238 p. (https://emfguide.itu.int/pdfs/ C95.1-2005.pdf).
19. Henschenmacher, B., Bitsch, A., de Las Heras Gala, T., Forman, H. J., Fragoulis, A., Ghezzi, P., Kellner, R., Koch, W., Kuhne, J., Sachno, D., Schmid, G., Tsaioun, K., Verbeek, J., & Wright, R. (2022). The effect of radiofrequency electromagnetic fields (RF-EMF) on biomarkers of oxidative stress in vivo and in vitro: A protocol for a systematic review. Environment international, 158, 106932. (https://doi.org/10.1016/j.envint.2021.106932).
20. Mevissen M., Ward J.M., Kopp-Schneider A., McNamee J.P., Wood A.W., Rivero T.M., Thayer K., Straif K. Effects of radiofrequency electromagnetic fields (RF EMF) on cancer in laboratory animal studies/Environment International 161 (2022) 107106. 3 - 9 (https://pubmed.ncbi.nlm.nih.gov/35091376/).
21. C.Gabriel, S.Gabriel, E.Corthout: The dielectric properties of biological tissues: I. Literature survey//Phys. Med. Biol. 41 (1996), 2231 - 2249.
22. S.Gabriel, R.W.Lau, C.Gabriel: The dielectric properties of biological tissues: II. Measurements in the frequency range 10 Hz to 20 GHz//Phys. Med. Biol. 41 (1996), 2251 - 2269.
23. S.Gabriel, R.W.Lau, C.Gabriel: The dielectric properties of biological tissues: III. Parametric models for the dielectric spectrum of tissues//Phys. Med. Biol. 41 (1996), 2271 - 2293.
Методические указания разработаны ФБУН "Северо-Западный научный центр гигиены и общественного здоровья" (В.Н. Никитина, Г.Г. Ляшко, Н.И. Калинина, В.П. Плеханов, Е.Н. Дубровская, А.А. Ковшов, А.Н. Кубит) при участии ФГБНУ "Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова" (Н.Б. Рубцова, Ю.П. Пальцев, Л.В. Походзей).
