"Клинические рекомендации "Критическая ишемия нижних конечностей (КИНК)"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
КРИТИЧЕСКАЯ ИШЕМИЯ НИЖНИХ КОНЕЧНОСТЕЙ (КИНК)
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I70.0, I70.8, I73.8, I79.2, I79.8, E14.5, E13.5
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 1016_1
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Ассоциация сердечно-сосудистых хирургов России, России ское общество ангиологов и сосудистых хирургов, Общероссийская общественная организация "Российское общество хирургов", Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
КИНК Критическая ишемия нижней конечности
ПХ Перемежающаяся хромота
СДС Синдром диабетической стопы
УДД Уровень достоверности доказательств
УУР Уровень убедительности рекомендаций
IDSA Американское общество инфекционных заболеваний
ОБА Общая бедренная артерия
ПкА Подколенная артерия
АТС Артерия тыла стопы
ЗББА Задняя большеберцовая артерия
СД Сахарный диабет
ДС Дуплексное сканирование
КТАГ Компьютерно-томографическая ангиография (Компьютерно-томографическая ангиография одной анатомической области)
МРАГ Магнитно-резонансная ангиография (Магнитно-резонансная ангиография с контрастированием (одна область))
АГ Ангиография (Ангиография артерий нижней конечности прямая)
ПАД Пальцевое артериальное давление (Измерение артериального давления на периферических артериях)
ТКО Транскутанная оксиметрия (Определение парциального давления кислорода в мягких тканях (оксиметрия))
ЧНК Чрескожное напряжение кислорода (Чрескожный мониторинг парциального давления кислорода)
ХБП Хроническая болезнь почек
VQI Vascular Quality Initiative (Инициатива по контролю качества сосудистых вмешательств)
ИБС Ишемическая болезнь сердца
КТК-ФРК Компьютерно-томографическая коронарография + измерение фракционного резерва коронарного кровотока
ГДС Гастродуоденоскопия (Эзофагогастродуоденоскопия)
ЖКК Желудочно-кишечное кровотечение
ЖКТ Желудочно-кишечный тракт
ВСА Внутренняя сонная артерия
ОНМК Острое нарушение мозгового кровообращения
БЦА Брахиоцефальные артерии
ASA Американское общество анестезиологов
NSQIP Национальная программа повышения качества хирургической помощи в США
ESC Европейское общество кардиологов
ESA Европейское общество анестезиологов
АБШ Аортобедренное шунтирование (Аорто-глубокобедренное шунтирование)
АББШ Аортобедренное бифуркационное шунтирование (Аорто-бедренное бифуркационное шунтирование)
ОПА Общая подвздошная артерия
TASC Трансатлантический консенсус по лечению ишемии нижних конечностей
БВЛ Баллонный катетер, выделяющий лекарство (катетер дилатационный баллонный с лекарственным покрытием)
ПБА Поверхностная бедренная артерия
ПкА Подколенная артерия
БПС Бедренно-подколенный сегмент
БПШ Бедренно-подколенное шунтирование (A16.12.038.006)
ПТФЭ Политетрафторэтилен (протезы кровеносных сосудов из политетрафторэтилена, протез кровеносного сосуда синтетический***)
ПЭАЭ Полузакрытая эндартерэктомия (A16.12.008 эндартерэктомия)
GLASS Единая анатомическая классификация поражения артерий конечности
НИСК Нежелательные ишемические события со стороны конечности
МА Механическая атеротромбэктомия (Эндоваскулярная тромбэктомия аспирационная)
ЛА Лазерная атерэктомия (Эндоваскулярная тромбэктомия аспирационная)
МБА Малоберцовая артерия
СВЛ Стент, выделяющий лекарство (стенты периферические с лекарственным покрытием)
ртАП Рекомбинантный тканевой активатор плазминогена (Ферментные препараты, код по АТХ B01AD)
ХО Хирургическая обработка (хирургическая обработка раны или инфицированной ткани)
ПСЭ Симпатэктомия поясничная
СНС Спинальная нейростимуляция (имплантация временных электродов для нейростимуляции спинного мозга и периферических нервов)
ПГЕ1 Простагландин Е1
ПГИ2 Простагландин И2
АСК Ацетилсалициловая кислота**
ДААТ Двойная антиагрегантная терапия
АВК Антагонисты витамина К
МНО Международное нормализованное отношение
ЛПИ Лодыжечно-плечевой индекс (Скрининг-исследование риска заболеваний артерий нижних конечностей с помощью системы с автоматическим измерением систолического артериального давления и расчетом лодыжечно-плечевого индекса)
Термины и определения
Критическая ишемия нижней конечности - длительно существующее клиническое состояние, характеризующееся нарушением проходимости магистральных артерий нижней конечности при наличии болей в нижней конечности в состоянии покоя и/или трофического дефекта тканей конечности.
Доказательная медицина - надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в процессе принятия решений о состоянии здоровья и лечении пациента.
Заболевание - возникающее в связи с воздействием патогенных факторов нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма.
Инструментальная диагностика - диагностика с использованием различных приборов, аппаратов и инструментов.
Исход - любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства.
Клиническое исследование - любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов и/или выявления нежелательных
реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность. Термины "клиническое испытание" и "клиническое исследование" являются синонимами.
Лабораторная диагностика - совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
Лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности.
Пациент - физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния.
Рабочая группа по разработке/актуализации клинических рекомендаций - коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций, и несущих общую ответственность за результаты данной работы.
Состояние - изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи.
Симптом - признак какого-либо заболевания, статистически значимое отклонение того или иного показателя от границ его нормальных величин или возникновение качественно нового, не свойственного здоровому организму явления.
Синдром - устойчивая совокупность ряда симптомов с единым патогенезом.
Стент, выделяющий лекарство (стенты периферические с лекарственным покрытием, стент для бедренной артерии выделяющий лекарственное средство***) - стент для периферических артерий, из структур которого в течение определенного времени после установки выделяется антипролиферативное вещество, препятствующее образованию неоинтимы и за счет этого способствующее профилактике/замедлению повторного стенозирования.
Тезис-рекомендация - положение, отражающее порядок и правильность выполнения того или иного медицинского вмешательства, имеющего доказанную эффективность и безопасность.
Уровень достоверности доказательств (УДД) - степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
Уровень убедительности рекомендаций (УУР) - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
Хирургическая (открытая) реваскуляризация (Формирование сосудистого анастомоза магистральной артерии) - метод коррекции гемодинамических значимых изменений артериального сегмента конечности, при котором обязательным является разъединение и соединение тканей в ходе хирургической операции.
Рентгенэндоваскулярная реваскуляризация (Эндоваскулярная реконструкция стенки сосуда) - восстановление кровотока в стенозированном участке артериального русла конечности с использованием чрескожного введения необходимых для этого устройств. Включает транслюминальную баллонную ангиопластику, стентирование и современные инновационные технологии.
Гибридное вмешательство (формирование сосудистого анастомоза магистральной артерии + эндоваскулярная реконструкция стенки сосуда) - сочетание хирургического и рентенэндоваскулярного методов с целью реваскуляризации различных сегментов артериального русла конечности пациента в рамках одного клинического эпизода.
Условно-радикальная хирургическая обработка (Хирургическая обработка раны или инфицированной ткани) - первичное хирургическое вмешательство в зоне трофических и инфекционно-воспалительных изменений, целью которого является купирование острого инфекционного воспаления в тканях конечности и/или удаление основной массы некротизированных тканей на всю глубину поражения (вскрытие и дренирование гнойно-некротического очага, некрэктомия, малая ампутация).
Дебридмент (Хирургическая обработка раны или инфицированной ткани) - удаление поверхностно расположенных мертвых тканей в краях язвы или ампутационной раны, ее очищение от плотного эксудата и гиперкератоза с целью ускорения эпителизации трофического или ампутационного дефекта.
Первичная антитромботическая профилактика - предотвращение развития атеротромботических осложнений, протекающих в форме острой ишемии или хронической критической ишемии конечности, у пациентов с хроническими облитерирующими заболеваниями артерий нижних конечностей без клинических симптомов артериальной ишемии или в стадии перемежающейся хромоты.
Вторичная антитромботическая профилактика - предотвращение развития артериальных тромботических осложнений в зоне артериальной реконструкции в раннем и отдаленном послеоперационном периоде.
Сосудистая (мультидисциплинарная) команда - совокупность специалистов различного профиля, участвующих в принятии решений относительно тактики ведения пациента с критической ишемией нижней конечности, в рамках одного клинического эпизода.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Критическая ишемия нижней конечности - длительно существующее (более 2 недель) клиническое состояние, характеризующееся нарушением проходимости магистральных артерий нижней конечности при наличии болей в нижней конечности в состоянии покоя и/или трофического дефекта тканей нижней конечности.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Спектр возможных причин развития КИНК включает в себя заболевания и патологические состояния, приводящие к нарушению проходимости артерий нижних конечностей: атеросклероз, тромбоэмболию, тромбоз, артериит, аневризматическое расширение артерии, а также рестеноз и тромботические осложнения реконструкций, выполняемых на артериях конечности по поводу артериальной недостаточности.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По данным крупнейших национальных регистров [1, 2], заболеваемость КИНК достигает 150 новых случаев на 100.000 населения в год. Altin S. с соавт. проанализировали результаты 1.276.745 госпитализаций по поводу КИНК в США в период с 2012 по 2015 год. Доля пациентов мужского пола составила 61%. В 29% наблюдений возраст пациентов составил менее 66 лет, в 56% случаев 66 - 85 лет, еще 15% пациентов были старше 85 лет. Сопутствующая патологи у 79% больных была представлена артериальной гипертензией (АГ), у 69% - сахарным диабетом (СД), у 46% - ишемической болезнью сердца (ИБС). Курение в анамнезе выявлено у 36% [1]. Поскольку в структуре причин развития КИНК доминирующее место занимает облитерирующий атеросклероз сосудов нижних конечностей (ОАСНК), основные статистически значимые факторы риска КИНК соответствуют таковым для ОАСНК и включают в себя курение, СД, АГ и гиперхолестеринемию [3].
Среди возможных причин КИНК есть и другие, гораздо более редкие облитерирующие заболевания артерий нижних конечностей, факторы риска развития которых отличаются от таковых при атеросклеротическом поражении. Так, основным фактором риска облитерирующего тромбоангиита (болезни Бюргера) считают курение [4].
Облитерирующий аорто-артериит (болезнь Такаясу) - аутоиммунное воспалительное заболевание крупных и средних артерий, чаще возникающее у женщин (82,9 - 87,5% наблюдений) в возрасте 16 - 40 лет (медианный возраст развития болезни 30,2 - 40,1) [5, 6]. По данным Ortiz-Fernandez с соавт., некоторые аллели человеческого лейкоцитарного антигена (HLA) статистически связаны с повышенным риском развития данной болезни.
Помимо облитерирующих заболеваний, к развитию КИНК приводят и тромботические артериальные осложнения. Клинически они чаще всего манифестируют как острая ишемия конечности, однако у ряда пациентов с течением времени трансформируются в хроническую артериальную недостаточность. К ним относят артериальную эмболию вследствие фибрилляции предсердий, тромбоз ранее выполненной артериальной реконструкции, а также парадоксальную эмболию через дефект межпредсердной перегородки при флеботромбозах [7]. К редким причинам тромботической окклюзии артерий нижних конечностей относят также тромбоз аневризмы подколенной артерии, которая чаще формируется у курильщиков, пациентов с артериальной гипертензией и аневризматическим расширением артерий других бассейнов [8].
Наконец, некоторые виды коагулопатий, в частности коагулопатия при новой коронавирусной инфекции COVID19, также входят в эту группу механизмов развития КИНК [9].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Синдром КИНК имеет в своей основе широкий спектр заболеваний и медицинских состояний. Ниже перечислены возможные варианты кодирования этих нозологических форм согласно Международной классификации болезней (версия 10):
I70.0 - Атеросклероз аорты
I70.8 - Атеросклероз других артерий
I73.8 - Другие уточненные болезни периферических сосудов
I79.2 - Периферическая ангиопатия при болезнях, классифицированных в других рубриках
I79.8 - Другие поражения артерий, артериол и капилляров при болезнях, классифицированных в других рубриках
E13.5 - Другие уточненные формы сахарного диабета с нарушениями периферического кровообращения
E14.5 - Сахарный диабет неуточненный с нарушениями периферического кровообращения
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Понятие КИНК соответствует 3 и 4 стадиям хронической артериальной недостаточности нижних конечностей по классификации Покровского-Фонтейна и включает в себя пациентов с болями покоя, а также больных с трофическими или инфекционно-воспалительными изменениями тканей конечности. При этом трофические и инфекционно-воспалительные изменения могут носить спровоцированный характер, т.е. возникать в результате микротравматизации с прогрессирующей инфекцией стопы [3, 10, 11]. Важно отметить, что в клиническом отношении КИНК редко является финальной частью единого континуума нарушений артериального кровообращения в конечности и изначально формируется как отдельная нозологическая форма. Так, развитию КИНК редко предшествует продолжительный анамнез перемежающейся хромоты (ПХ) [12]. В отличие от пациентов с ПХ, больные КИНК даже при условии успешной реваскуляризации конечности (переключение магистральных артерий) имеют гораздо более тяжелый прогноз в отношении периоперационных осложнений и отдаленной выживаемости, чем пациенты с ПХ [12, 13]. Напротив, при ПХ жалобы обычно имеют стабильный характер в течение многих лет и лишь в отдельных случаях заболевание прогрессируют до КИНК [14]. Пациенты с ПХ имеют значительно более благоприятный профиль периоперационных осложнений, а также отдаленных результатов, чем больные КИНК [12 - 14].
В лечении КИНК (в отличие от ПХ) существует целый пласт проблем, связанных с наличием инфекционно-некротических изменений на конечности, необходимостью выполнения малых и высоких ампутаций (ампутация нижней конечности), применением реконструктивно-пластических операций (переключение магистральных артерий) с целью закрытия трофического дефекта тканей. В связи с этим, целесообразно в практических целях отделить классификацию КИНК от перемежающейся хромоты.
Удобной в практическом отношении представляется простая бинарная клиническая классификация, основанная на классификации Фонтейна-Покровского (см. приложение Г1) и включающая в себя две стадии КИНК:
1. Хроническая артериальная недостаточность (ХАН) 3 стадии: постоянный болевой синдром в конечности без трофических нарушений (дефектов тканей);
2. Хроническая артериальная недостаточность 4 стадии: КИНК с трофическими нарушениями тканей пораженной конечности.
Также может использоваться классификация Rutherford, в которой ХАН 3 стадии соответствует II степени или 4 категории ишемии, а ХАН 3 стадии - III - IV степени и 5 - 6 категории ишемии (см. приложение Г1).
Для количественной оценки риска высокой ампутации (ампутация нижней конечности) и срочности реваскуляризации конечности (переключение магистральных артерий) может использоваться классификация WIfI (см. приложение Г4). В практическом отношении ее использование позволяет выработать диверсифицированный подход к маршрутизации больных КИНК в ситуациях, когда подобный подход может быть реализован.
Безусловно, каждая из этих клинических категорий заключает в себе большое число вариантов поражения артерий, трофических дефектов конечности, уровней периоперационного риска, а, следовательно, и алгоритмов действия сосудистой команды. Однако, с позиции регулирования и материального обеспечения медицинской помощи эти группы больных предстают двумя отдельными множествами. Ведь именно появление трофических расстройств статистически сопряжено с увеличением тяжести сопутствующих заболеваний, рисков осложнений, стоимости лечения и влечет за собой целый комплекс изменений в медицинской тактике, являясь тем фактором, который наиболее кардинально влияет на всю совокупность лечебных мероприятий при КИНК [15 - 17].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В соответствии с определением, этиопатогенезом и предложенной классификацией КИНК, ее ключевыми клиническими проявлениями являются боли покоя и/или наличие трофического дефекта тканей дистальнее уровня нарушения проходимости магистральных артерий конечности.
Классические характеристики болевого синдрома при КИНК - боль возникает в состоянии покоя, чаще имеет постоянный характер, обычно локализована в области пальцев или плюсны (либо в области трофического дефекта при его наличии), усиливается при придании конечности горизонтального или возвышенного положения, а также в ночное время, заметно ослабевает (но не исчезает) при опускании стопы вниз [12, 18, 19]. При КИНК без трофических изменений ишемическая боль покоя является основным симптомом и присутствует в 100% случаев. В этой же стадии могут возникать и другие характерные симптомы КИНК: похолодание и онемение стопы, а также гиперемия стопы, которая может иметь оттенок цианоза, уменьшается или исчезает при придании конечности возвышенного положения (т.н. позиционная гиперемия) [19].
Трофические изменения при КИНК в подавляющем большинстве случаев расположены дистальнее уровня голеностопного сустава [19, 20], могут быть множественными, чаще всего возникают в области пальцев и плюсны [17, 21], имеют поверхностный (язва) или глубокий (некроз, гангрена, абсцесс, флегмона, остеомиелит) характер, сопровождаются более или менее выраженным перифокальным инфекционным воспалением, в тяжелых случаях присоединяются признаки системной воспалительной реакции.
Важно отметить, что наличие КИНК с трофическими изменениями не всегда сочетается с заметной болью покоя, в особенности при синдроме диабетической стопы (СДС) [21]. В этой же подгруппе пациентов дефект тканей нередко носит спровоцированный характер, т.е. является следствием микротравмы (краем ногтевой пластины, плохо подобранной обувью, инородным телом, например, швейной иглой, воздействием высокой температуры и пр.), которая остается незамеченной из-за снижения тактильной, болевой и температурной чувствительности стопы на фоне диабетической нейропатии [22].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
Диагноз устанавливается на основании жалоб, анамнестических данных, физикального обследования и инструментальных методов обследований (ультразвуковая допплерография артерий нижних конечностей, прямая ангиография артерий нижних конечностей).
2.1 Жалобы и анамнез
- Рекомендуется проводить подробный опрос пациента для уточнения жалоб, анамнеза, наличия факторов риска (сбор анамнеза и жалоб при сосудистой патологии) у всех пациентов с КИНК [7, 10, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: основными жалобами при КИНК являются боли и наличие трофических изменений в дистальных отделах конечности, особенности которых подробно описаны выше (глава V, п. 6). Важно отметить, что, при отсутствии своевременной квалифицированной помощи, время от момента возникновения первых симптомов КИНК до начала хирургического лечения обычно не превышает 6 месяцев [23].
При сборе анамнеза и жалоб при сосудистой патологии важно обратить внимание на наличие типичных для КИНК факторов риска и сопутствующих заболеваний (см. главу V, п. 3), выполнявшиеся ранее артериальные реконструкции (переключение магистральных артерий), сопутствующую медикаментозную терапию, в особенности антиагрегантами и антикоагулянтами (антитромботические средства, код по АТХ: B01A).
В остальных аспектах опрос пациента с КИНК проводится по общим принципам клинической медицины.
2.2 Физикальное обследование
- Рекомендуется проводить общий осмотр (визуальное исследование при сосудистой патологии) и физикальное обследование каждого пациента с КИНК в соответствии с принципами клинической медицины [12, 20, 44, 172].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: в литературе отсутствуют качественные научные данные, касающиеся методологии общего клинического осмотра пациентов с КИНК. В связи с этим рекомендуется проводить осмотр (визуальное исследование при сосудистой патологии) и обследование в соответствии с общими принципами клинической медицины.
- Рекомендуется оценивать местный статус конечности, включая ее осмотр и пальпацию (визуальное исследование при сосудистой патологии, пальпация при сосудистой патологии) [3, 12, 24 - 26].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: оценка местного статуса должна включать в себя осмотр и пальпацию конечности (визуальное исследование при сосудистой патологии, пальпация при сосудистой патологии). При осмотре оценивают цвет кожных покровов, наличие трофических изменений, позиционной гиперемии, отека. При пальпации определяют температуру конечности, пульсацию артерий, оценивают признаки наличия гнойно-некротического очага [3, 12, 24 - 26].
2.3 Лабораторные диагностические исследования
- Рекомендуется формировать план лабораторной диагностики в соответствии с общими принципами клинической медицины и индивидуальными особенностями пациента с КИНК [7, 10, 31, 44, 172].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5)
Комментарии: в литературе отсутствуют качественные научные данные, касающиеся методологии лабораторной диагностики пациентов с КИНК. В связи с этим рекомендуется формировать план лабораторной диагностики в соответствии с общими принципами клинической медицины и индивидуальными особенностями пациента с КИНК.
2.4 Инструментальные диагностические исследования
- Рекомендуется рассмотреть возможность выполнения ультразвукового дуплексного сканирования (ультразвуковая допплерография сосудов (артерий и вен) нижних конечностей) в качестве первичного метода сосудистой визуализации у пациентов с клиническими признаками КИНК [3, 10, 31, 44].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: дуплексное сканирование (ультразвуковая допплерография сосудов (артерий и вен) нижних конечностей, дуплексное сканирование сосудов (артерий и вен) нижних конечностей) является неинвазивным и наиболее доступным из всех существующих методов визуализации артерий конечности при КИНК с целью выявления в них гемодинамически значимых изменений [3]. Для подтверждения диагноза КИНК целесообразно провести измерение лодыжечного давления [3, 10].
- Рекомендуется рассмотреть возможность использования альтернативных методов диагностики нарушений артериального кровообращения (транскутанная оксиметрия - определение парциального давления кислорода в мягких тканях (оксиметрия), измерение пальцевого артериального давления (измерение артериального давления на периферических артериях) в конечности в сомнительных ситуациях (отсутствие соответствия данных визуального исследования при сосудистой патологии и пальпации при сосудистой патологии с данными ультразвуковой допплерографии сосудов (артерий и вен) нижних конечностей) [3, 10, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: подтвердить диагноз КИНК в сомнительных случаях помогает измерение пальцевого артериального давления (ПАД, измерение артериального давления на периферических артериях) и транскутанная оксиметрия (ТКО, определение парциального давления кислорода в мягких тканях (оксиметрия)) [27]. При этом признаками ишемического характера болей считают уровень ПАД ниже 30 мм рт. ст. и чрескожного напряжения кислорода (ЧНК) также менее 30 мм рт. ст. [3]. При КИНК с трофическими изменениями даже более высокие показатели ЛАД, ПАД и ЧНК не исключают наличие угрозы потери конечности [10].
- Рекомендуется рассмотреть возможность выполнения неинвазивных (ДС, КТАГ, МРАГ) (ультразвуковая допплерография артерий нижних конечностей, компьютерно-томографическая ангиография сосудов нижних конечностей, магнитно-резонансная ангиография с контрастированием (одна область)), а при их отсутствии - инвазивных (АГ) (ангиография артерий нижней конечности прямая) исследований артерий при планировании реваскуляризации конечности у пациентов с подтвержденным диагнозом КИНК [28 - 33].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: существующие методы сосудистой визуализации при КИНК - ультразвуковое дуплексное сканирование (ДС), компьютерно-томографическая ангиография (КТАГ), прямая контрастная ангиография (АГ) и магнито-резонансная ангиография (МРАГ) (ультразвуковая допплерография артерий нижних конечностей, дуплексное сканирование сосудов (артерий и вен) нижних конечностей, компьютерно-томографическая ангиография сосудов нижних конечностей, магнитно-резонансная ангиография с контрастированием (одна область)) - обладают высокой чувствительностью и специфичностью [28 - 33].
- Перед выполнением шунтирующей реконструкции бедренно-подколенного сегмента (бедренно-подколенное шунтирование) с использованием аутовенозного кондуита рекомендуется выполнить маркировку подкожных вен, (ультразвуковая допплерография вен нижних конечностей) которые предполагается использовать в ходе операции [3, 34, 35].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: для оценки качества и диаметра подкожных вен перед шунтирующим вмешательством (бедренно-подколенное шунтирование) авторы рекомендуют выполнять ультразвуковое сканирование (ультразвуковая допплерография вен нижних конечностей) с маркировкой хода вены на поверхности кожи [3, 34]. По данным регистра VQI, маркировка вены перед шунтирующей реконструкцией (бедренно-подколенное шунтирование) при КИНК выполнялась в 40 - 84% наблюдений [35].
- У пациентов с КИНК рекомендуется определять показания к обследованию других артериальных бассейнов (коронарного, мозгового), (A04.10.002.003 Эхокардиография с фармакологической нагрузкой, A04.10.002.004 Эхокардиография с физической нагрузкой, A06.10.006 Коронарография, A06.12.004 Ангиография сонной артерии избирательная) к функциональному исследованию сердечно-сосудистой системы, а также других органов и системы в соответствии с общими принципами клинической медицины, рекомендациями профильных сообществ и с учетом экспертного мнения соответствующих специалистов мультидисциплинарной сосудистой команды [3, 44, 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Не рекомендуется рутинное выполнение коронарной визуализации (A06.10.006 Коронарография) всем пациентам при отсутствии показаний (симптомов ишемии миокарда) перед реваскуляризацией нижних конечностей по поводу КИНК [3, 44, 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: сопутствующее поражение коронарных артерий часто встречается у пациентов с КИНК [36, 37]. Превентивная реваскуляризация коронарных артерий (транслюминальная баллонная ангиопластика и стентирование коронарных артерий, коронарное шунтирование в условиях искусственного кровообращения, коронарное шунтирование на работающем сердце без использования искусственного кровообращения) у пациентов с КИНК, по некоторым данным, улучшает выживаемость в отдаленном периоде, но не влияет на периоперационный риск тяжелых осложнений [36, 38, 39].
- Не рекомендуется рутинный скрининг эрозивно-язвенного поражения (эзофагогастродуоденоскопия) слизистой желудка и двенадцатиперстной кишки у пациентов с КИНК при отсутствии показаний согласно рекомендациям профильного гастроэнтерологического сообщества [44, 47, 235].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: данные о частоте эрозивно-язвенного поражения слизистой верхних отделов ЖКТ ограничены. Их возможная роль в развитии периоперационных геморрагических осложнений не подтверждается исследованиями [40, 41].
- Не рекомендуется рутинный скрининг стеноокклюзирующего поражения БЦА (дуплексное сканирование экстракраниальных отделов брахиоцефальных артерий) у пациентов с КИНК [3, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: у пациентов с КИНК часто находят сопутствующее ассимптомное атеросклеротическое поражение сонных артерий [42, 43]. В литературе отсутствуют данные, подтверждающих эффективность предоперационного скрининга атеросклероза (дуплексное сканирование экстракраниальных отделов брахиоцефальных артерий) сонных артерий и обоснованность превентивной реваскуляризации каротидного бассейна (эндартерэктомия каротидная, транслюминальная баллонная ангиопластика внутренней сонной артерии со стентированием) у пациентов обсуждаемой категории.
2.5 Иные диагностические исследования
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Хирургическое лечение
Хирургическое лечение пациентов с КИНК должно преследовать одну или несколько целей:
1. Купирование или постепенный регресс основных клинических проявлений КИНК - болей покоя и трофического дефекта тканей конечности;
2. Сохранение максимально опороспособной и функционально полноценной конечности с учетом возможного протезирования ее сегментов;
3. Устранение угрозы жизни пациента, обусловленной наличием инфекционно-воспалительного очага в тканях пораженной конечности.
Основным методом лечения КИНК сегодня остается хирургический [3, 44]. В зависимости от клинической ситуации, это лечение может преследовать одну или несколько целей:
1. Купирование или постепенный регресс основных клинических проявлений КИНК - болей покоя и трофического дефекта тканей конечности.
2. Сохранение максимально опороспособной и функционально полноценной конечности с учетом возможного протезирования ее сегментов;
3. Устранение угрозы жизни пациента, обусловленной наличием инфекционно-воспалительного очага в тканях пораженной конечности.
Спектр хирургических вмешательств, направленных на достижение этих целей, можно разделить на четыре группы:
1. Реваскуляризация (тромбэндартерэктомия, бедренно-подколенное шунтирование, баллонная ангиопластика подколенной артерии и магистральных артерий голени, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени);
2. Хирургическая обработка зоны трофических и инфекционно-воспалительных изменений в ишемизированном сегменте конечности (хирургическая обработка раны или инфицированной ткани) - вскрытие и дренирование гнойно-некротического очага (вскрытие флегмоны (абсцесса) стопы (голени), некрэктомия, малая ампутация (экзартикуляция пальца стопы), "туалет раны" (дебридмент), мероприятия по разгрузке стопы;
3. Реконструктивно-пластические вмешательства, направленные на закрытие дефекта тканей конечности (аутодермопластика);
4. Высокая ампутация конечности (ампутация нижней конечности).
- Рекомендуется вопрос о срочности хирургического лечения решать с привлечением врачей-специалистов (врач-сердечно-сосудистый хирург, врач-хирург) с учетом особенностей клинической картины заболевания согласно классификации тяжести хронической ишемии нижней конечности (см. приложение Г1) [47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: у значительной части пациентов с КИНК увеличение продолжительности догоспитального и внутригоспитального предоперационного периода может нести угрозу потери конечности [45, 46]. Опубликованные исследования не позволяют установить какие-либо универсальные временные рамки для оказания хирургической помощи при КИНК.
- Решение о выполнении хирургического вмешательства (тромбэндартерэктомия, бедренно-подколенное шунтирование, баллонная ангиопластика подколенной артерии и магистральных артерий голени, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) при КИНК рекомендуется принимать индивидуально, с учетом клинической картины, наличия ограничений к проведению различных хирургических манипуляций, а также интересов пациента на основании концепции информированного согласия [3, 12, 44, 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: по данным международных согласительных документов, наличие у пациента клинических признаков КИНК или рестеноза/реокклюзии в зоне артериальной реконструкции, выполненной ранее по поводу КИНК, являются показанием к хирургическому лечению (тромбэндартерэктомии, бедренно-подколенному шунтированию, баллонной ангиопластики подколенной артерии и магистральных артерий голени, баллонной ангиопластики со стентированием подколенной артерии и магистральных артерий голени, механической реканализации, баллонной ангиопластики со стентированием подколенной артерии и магистральных артерий голени) [3]. Доступные в литературе международные рекомендации и согласительные документы, касающиеся лечения КИНК, никак не определяют возможные противопоказания к хирургическому вмешательству [3, 12, 44, 47].
- Пациентам со стеноокклюзирующим поражением аорты и подвздошных артерий рекомендуется выполнение артериальной реконструкции аорто-подвздошного сегмента открытым или эндоваскулярным методом (тромбэндартерэктомия, бедренно-подколенное шунтирование, баллонная ангиопластика подколенной артерии и магистральных артерий голени, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени). Выбор метода вмешательства осуществляется с учетом клинической стадии хронической ишемии нижней конечности по классификациям Fontaine, A.B. Покровского и Rutherford (Приложение Г1), а также анатомического характера поражения по классификациям TASC II (Приложение Г2) и GLASS (Приложение Г3) [3, 12, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: открытые реконструкции аорто-подвздошного сегмента (тромбэндартерэктомия, бедренно-подколенное шунтирование) изучены наиболее детально и характеризуются высокой проходимостью в отдаленном послеоперационном периоде при низком уровне периоперационной летальности [48, 49]. Эндоваскулярные вмешательства обеспечивают более низкую периоперационную летальность и оптимальный отдаленный результат при относительно коротких и неокклюзирующих поражениях данной области артериального русла [50]. В международных согласительных документах открытые реконструкции (тромбэндартерэктомия, бедренно-подколенное шунтирование) рассматриваются как метод выбора при протяженных и окклюзирующих поражениях, в том числе с вовлечением брюшной аорты и общей бедренной артерии, в то время как эндоваскулярным вмешательствам (баллонная ангиопластика подколенной артерии и магистральных артерий голени, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) отдается предпочтение при относительно локальных, чаще неокклюзирующих изменениях данного артериального сегмента (см. классификации TASC II и GLASS в приложении Г2) [12]. Качественных сравнительных исследований открытых и эндоваскулярных методик (тромбэндартерэктомия, бедренно-подколенное шунтирование, баллонная ангиопластика подколенной артерии и магистральных артерий голени, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) реконструкции аорто-подвздошного сегмента в литературе найти не удается [51 - 55].
- При выполнении эндоваскулярной реконструкции аорто-подвздошного сегмента (баллонная ангиопластика подколенной артерии и магистральных артерий голени, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) у пациентов с тромботической окклюзией подвздошных артерий, аорто-бедренного, подвздошно-бедренного или экстранатомического шунта рекомендуется рассмотреть возможность использования устройств механической ротационной тромбэктомии/атерэктомии (катетер для эмболэктомии/система для тромбэктомии) с целью эффективной реваскуляризации пораженного сегмента [51 - 53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: по данным ретроспективных когортных исследований, механическая ротационная тромбэктомия/атерэктомия (механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) - эффективный и безопасный метод внутрисосудистой реваскуляризации окклюзий подвздошных артерий при остром или подостром тромбозе. В большинстве случаев применяется в сочетании с другими эндоваскулярными методиками (баллонная ангиопластика, стентирование) (баллонная ангиопластика подвздошной артерии) [51 - 53].
- У пациентов со стеноокклюзирующим поражением общей бедренной артерии без гемодинамически значимых изменений подвздошных артерий рекомендуется рассмотреть открытую эндартерэктомию как предпочтительный метод реконструкции (тромбэмболэктомия из подвздошных и бедренных артерий) [56 - 62].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: у пациентов с КИНК нередко встречается гемодинамически значимое поражение общей бедренной артерии (ОБА), требующее реконструкции [54, 55]. Открытая эндартерэктомия (тромбэмболэктомия из подвздошных и бедренных артерий) из ОБА обеспечивает высокую отдаленную проходимость (более 90%) даже через 5 - 7 лет [56 - 58]. Отдаленные результаты эндоваскулярных вмешательств на ОБА (баллонная ангиопластика со стентированием поверхностной бедренной артерии) практически не изучены на таких сроках, при этом подавляющее большинство пациентов в опубликованных исследованиях эндоваскулярных вмешательств на этом сегменте имели не окклюзирующее, а стенотическое поражение [59 - 62].
- При наличии противопоказаний или ограничений к выполнению открытой реконструкции общей бедренной артерии (тромбэмболэктомия из подвздошных и бедренных артерий) рекомендуется рассмотреть возможность использования эндоваскулярных методов: баллонной ангиопластики (в том числе баллонным катетером, выделяющим лекарство), стентирования, направленной атерэктомии (баллонная ангиопластика со стентированием поверхностной бедренной артерии, в том числе с катетером баллонным дилатационным с лекарственным покрытием для чрескожной транслюминальной ангиопластики периферических сосудов) [3, 12, 59 - 63].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: эндоваскулярная коррекция гемодинамически значимых поражений общей бедренной артерии (ОБА) (баллонная ангиопластика со стентированием поверхностной бедренной артерии) активно применяется многими коллективами как альтернативна открытой реконструкции (тромбэмболэктомия из подвздошных и бедренных артерий, бедренно-подколенное шунтирование) [63]. Подавляющее большинство пациентов в опубликованных исследованиях эндоваскулярных вмешательств на этом сегменте имели не окклюзирующее, а стенотическое поражение [59 - 62]. Результаты рандомизированных сравнительных исследований эндоваскулярных и открытых вмешательств (баллонная ангиопластика со стентированием поверхностной бедренной артерии, тромбэмболэктомия из подвздошных и бедренных артерий, бедренно-подколенное шунтирование) на ОБА противоречивы, использованные в них виды эндоваскулярных устройств недоступны сегодня в клинической практике [61, 62]. В международных согласительных документах предпочтение эндоваскулярному методу (баллонная ангиопластика со стентированием поверхностной бедренной артерии) отдается при наличии противопоказаний или ограничений к выполнению открытой реконструкции (тромбэмболэктомия из подвздошных и бедренных артерий, бедренно-подколенное шунтирование) [3, 12].
- При поражениях бедренно-подколенного сегмента рекомендуется выполнять открытые или эндоваскулярные реконструкции (тромбэмболэктомия из подвздошных и бедренных артерий, бедренно-подколенное шунтирование или баллонная ангиопластика со стентированием поверхностной бедренной артерии) с выбором вида реваскуляризации членами сосудистой команды в зависимости от клинической ситуации согласно классификации поражений артерий нижних конечностей TASC II (см. приложение Г2) [35, 63 - 78].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарий: открытые реконструкции (тромбэндартерэктомия, бедренно-подколенное шунтирование) чаще применяются при протяженных и окклюзирующих поражениях бедренно-подколенного сегмента (БПС), эндоваскулярные (баллонная ангиопластика со стентированием поверхностной бедренной артерии) - при относительно коротких, чаще неокклюзирующих изменениях [35, 63 - 66]. К основным факторам, негативно влияющим на отдаленный результат эндоваскулярных интервенций (баллонная ангиопластика со стентированием поверхностной бедренной артерии) в этой зоне, относят изменения путей оттока, тип поражения (при лечении окклюзий и диффузных поражений результаты хуже, чем при устранении локальных стенозов), степень кальциноза артерии и стадию ишемии (КИНК или ПХ) [67 - 72]. В международных согласительных документах открытые реконструкции (тромбэндартерэктомия, бедренно-подколенное шунтирование) рассматриваются как метод выбора при протяженных и окклюзирующих поражениях, в том числе с вовлечением трифуркации подколенной артерии, в то время как эндоваскулярным вмешательствам (баллонная ангиопластика со стентированием поверхностной бедренной артерии) отдается предпочтение при относительно коротких, локальных, чаще неокклюзирующих изменениях данного артериального сегмента (см. классификацию TASC II в приложении Г2). Данные рандомизированных сравнительных исследований открытых и эндовазальных вмешательств (тромбэндартерэктомия, бедренно-подколенное шунтирование, баллонная ангиопластика со стентированием поверхностной бедренной артерии) у пациентов с гемодинамически значимыми изменениями БПС противоречивы, доля пациентов с КИНК в них неоднородна, критерии выбора в пользу того или иного подхода к реваскуляризации не определены [73 - 78].
- При выборе кондуита для шунтирующего вмешательства (бедренно-подколенное шунтирование) на бедренно-подколенном сегменте рекомендуется отдавать предпочтение аутовенозному шунту из большой подкожной вены, при ее отсутствии или непригодности для использования в качестве кондуита рекомендуется использовать альтернативные аутологичные подкожные вены (малая подкожная вена, вены верхних конечностей), синтетический сосудистый протез (протез кровеносного сосуда синтетический***), полузакрытую эндартерэктомию (эндартерэктомия с пластикой магистральных сосудов) или сосудистый аллотрансплантат [35, 64, 76 - 78].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: результаты качественных сравнительных исследований свидетельствуют о том, что отдаленная проходимость аутовенозных БПШ выше, чем синтетических (протез кровеносного сосуда синтетический***) [79, 80]. При отсутствии у пациента большой подкожной вены применяют альтернативные аутовенозные кондуиты - малую подкожную вену, вены верхней конечности, в том числе с формированием шунта из нескольких - двух, трех, иногда четырех - аутовенозных фрагментов [81 - 85]. По данным рандомизированного исследования BEST-CLI, большая подкожная вена адекватного диаметра является более предпочтительным кондуитом при инфраингвинальном шунтировании (бедренно-подколенное шунтирование) при КИНК, чем альтернативные кондуиты (аутовенозные или синтетические (протез кровеносного сосуда синтетический***)) [78]. Ряд авторов в качестве альтернативы аутологичному венозному кондуиту успешно используют сосудистый аллотрансплантат [86, 87].
Некоторые авторы при отсутствии аутовенозного материала выполняют реконструкцию БПС с помощью полузакрытой эндартерэктомии (тромбэндартерэктомия) (ПЭАЭ). В рандомизированном исследовании в смешанной группе пациентов (23% КИНК, 77% ПХ) тромбэндартерэктомия не уступала по отдаленным результатам шунтирующим реконструкциям (бедренно-подколенное шунтирование). Суб-анализ в подгруппе КИНК не проводился [88]. По данным рандомизированного исследования Saaya с соавт., ПЭАЭ (тромбэндартерэктомия) и стентирование (баллонная ангиопластика со стентированием поверхностной бедренной артерии) при окклюзиях ПБА обеспечивали практически одинаковую проходимость через 1 год после вмешательства (82% и 83%, p > 0,05), однако через 4 года этот показатель был достоверно выше в группе ПЭАЭ (тромбэндартерэктомия) (46% и 28%, p = 0,04) [89].
- При эндоваскулярной реконструкции бедренно-подколенного сегмента (баллонная ангиопластика со стентированием поверхностной бедренной артерии) рекомендуется рассмотреть возможность выполнения баллонной ангиопластики (баллонная ангиопластика периферической артерии) со стентированием или без имплантации стента, с использованием баллонов и/или стентов, выделяющих лекарство (катетер баллонный дилатационный с лекарственным покрытием для чрескожной транслюминальной ангиопластики периферических сосудов, стенты периферические с лекарственным покрытием), стент-графтов (протезы-стенты сосудистые), эндоваскулярной атеротромбэктомии (механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) [55, 65, 90, 91, 92, 93].
Для баллонной ангиопластики со стентированием поверхностной бедренной артерии, баллонной ангиопластики периферической артерии Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2)
Для механической реканализации, баллонной ангиопластики со стентированием подколенной артерии и магистральных артерий голени Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: баллонная ангиопластика (баллонная ангиопластика периферической артерии) при поражениях БПС эффективно применяется как изолированный способ реваскуляризации, так и в сочетании с имплантацией внутрисосудистых устройств - стентов, стент-графтов (стенты периферические с лекарственным покрытием, протезы-стенты сосудистые) [35, 55, 65, 90]. При относительно коротких стенозах и окклюзиях ПБА и ПкА отдаленные результаты баллонной ангиопластики (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) не уступают результатам стентирования (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) при условии получения удовлетворительного ангиографического результата [91, 92]. При протяженных поражениях БПС использование стент-графтов (протезы-стенты сосудистые) обеспечивает более высокую проходимость реконструкции по сравнению со стентированием обычными стентами (стенты периферические с лекарственным покрытием) [93].
Баллонные катетеры и стенты, выделяющие лекарство (цитостатик), (катетер дилятационный баллонный с лекарственным покрытием, стенты периферические с лекарственным покрытием) широко применяются при эндовазальных вмешательствах, ангиопластике (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) на БПС и обеспечивают более высокую отдаленную проходимость в сравнении с баллонами без покрытия (катетер баллонный дилатационный для чрескожной транслюминальной ангиопластики) при относительно коротких поражениях [90, 94 - 98]. Механическая или лазерная атеротромбэктомия (механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) используется при лечении поражений БПС как самостоятельный метод, так и в сочетании с баллонной ангиопластикой и стентированием (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени). По данным качественных сравнительных исследований, данная методика улучшает отдаленные результаты эндовазальных вмешательств на ПБА и ПкА [99, 100].
- При эндоваскулярной реконструкции подколенной артерии (баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) имплантация стента (стенты периферические с лекарственным покрытием рекомендована лишь в случае неоптимального результата баллонной ангиопластики (баллонная ангиопластика периферической артерии) [44, 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: по данным рандомизированного исследования ETAP, отказ от имплантации стента (стенты периферические с лекарственным покрытием) в ПкА при получении удовлетворительного результата баллонной ангиопластики (баллонная ангиопластика периферической артерии) не приводил к ухудшению отдаленной проходимости по сравнению с первичным стентированием (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) [91].
- При поражениях подколенно-берцового сегмента рекомендуется выполнять открытые или эндоваскулярные реконструкции (тромбэндартерэктомия, бедренно-подколенное шунтирование, баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) с выбором вида реваскуляризации членами сосудистой команды в зависимости от клинической ситуации согласно глобальной системе оценки тяжести поражения артерий конечности (GLASS) (см приложение Г3) [13, 35, 63, 65, 101 - 107].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: реваскуляризация стеноокклюзирующих поражений подколенно-берцового сегмента (тромбэндартерэктомия, бедренно-подколенное шунтирование, баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) (ПБС) при КИНК выполняется открытым и эндоваскулярным способами [13, 35, 63, 65, 101 - 106]. По данным мета-анализа ретроспективных когортных исследований, эндоваскулярные вмешательства уступают открытым шунтирующим реконструкциям (открытые - тромбэндартерэктомия, бедренно-подколенное шунтирование; эндоваскулярные - баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) ПБС по отдаленной проходимости, но при этом эффективно обеспечивают высокий процент сохранения конечности [105]. В рандомизированном исследовании BASIL-2 вероятность достижения комбинированной конечной точки высокая ампутация/смерть в течение 2 лет составила 63% после аутовенозного шунтирования (бедренно-подколенное шунтирование) и 53% после эндоваскулярного вмешательства (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) (ОР 1,35; 95% ДИ 1,02 - 1,80; p = 0,037). Стратификация по сложности стеноокклюзирующего поражения артерий ПБС не проводилась [107].
- При выборе кондуита для шунтирующего вмешательства (бедренно-подколенное шунтирование) на подколенно-берцовом сегменте рекомендуется отдавать предпочтение аутовенозному шунту из большой подкожной вены, при ее отсутствии или непригодности для использования в качестве кондуита рекомендуется использовать альтернативные аутологичные подкожные вены (малая подкожная вена, вены верхних конечностей), при их отсутствии или непригодности - синтетический сосудистый протез (протез кровеносного сосуда синтетический***) или сосудистый аллотрансплантат [44, 47, 78, 108].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: по данным рандомизированного исследования BEST-CLI, большая подкожная вена адекватного диаметра является более предпочтительным кондуитом при инфраингвинальном (в том числе инфрапоплитеальном) шунтировании (бедренно-подколенном шунтировании) при КИНК, чем альтернативные кондуиты (аутовенозные или синтетические (протез кровеносного сосуда синтетический***) [78]. Ретроспективный анализ сосудистого регистра VQI продемонстрировал, что наиболее высокая проходимость шунтирующих реконструкций подколенно-берцового сегмента (бедренно-подколенное шунтирование) достигается при использовании кондуита из большой подкожной вены [108]. В качестве альтернативных кондуитов применяют также составные аутовенозные шунты из нескольких венозных фрагментов, в том числе с использованием альтернативных подкожных вен - малой подкожной, вен верхних конечностей; синтетические сосудистые протезы (протез кровеносного сосуда синтетический***), композитные кондуиты (протез кровеносного сосуда синтетический***, соединенный с аутовеной), сосудистые аллотрансплантаты [86, 108 - 110].
- При эндоваскулярной реконструкции подколенно-берцового сегмента, рекомендуется рассмотреть возможность выполнения баллонной ангиопластики без стентирования (баллонная ангиопластика периферической артерии), либо баллонной ангиопластики с имплантацией стента (баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени с имплантацией стента для периферических артерий, непокрытого металлического***) [65, 105, 111].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: в лечении стеноокклюзирующих поражений артерий голени среди эндоваскулярных методик самой распространенной является баллонная ангиопластика без стентирования (баллонная ангиопластика периферической артерии) [65, 105]. Проходимость и частота сохранения конечности после баллонной ангиопластики артерий голени (баллонная ангиопластика периферической артерии) ниже у пациентов с протяженными и окклюзирующими поражениями по сравнению с больными, у которых вмешательство проводят по поводу коротких стенозов ПБС [111]. В отдаленном периоде баллонная ангиопластика артерий (баллонная ангиопластика периферической артерии) обеспечивает первичную проходимость на уровне 48,6% через 3 года [105].
Стентирование артерий голени (баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) выполняют при неудовлетворительном результате баллонной дилатации. По данным регистра VQI, доля стентирования (баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) среди всех эндоваскулярных вмешательств на артериях голени составляет 9% [65]. Мета-анализ семи рандомизированных исследований не выявил преимуществ стентирования ПБС (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) перед баллонной ангиопластикой (баллонная ангиопластика периферической артерии) по частоте периоперационных осложнений, первичной проходимости через 6 месяцев, частоте высоких ампутаций (ампутаций нижней конечности) и летальности через 12 месяцев [112].
- При эндоваскулярной реконструкции подколенно-берцового сегмента (баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) рекомендуется рассмотреть возможность использования баллонных катетеров, выделяющих лекарство (катетер дилатационный баллонный с лекарственным покрытием) [113 - 115].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: по данным мета-анализа 9 рандомизированных исследований, включавших пациентов с КИНК, ангиопластика с помощью баллонного катетера, выделяющего лекарство (баллонная ангиопластика периферической артерии, катетер дилатационный баллонный с лекарственным покрытием), не отличалась от обычной баллонной ангиопластики (баллонная ангиопластика периферической артерии) по частоте повторных реваскуляризаций (14,6% и 22,1%; p = 0,15), риску развития рестеноза (33,3% и 62,9%; p = 0,42) и серьезных нежелательных событий (29,0% и 38,8%; p = 0,48) [113].
В мире существует определенный опыт применения эндоваскулярной механической атеротромбэктомии (МА) (эндоваскулярная тромбэктомия аспирационная, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) при атеросклеротическом поражении артерий голени. По данным ретроспективного исследования, статистически достоверных различий между МА и баллонной ангиопластикой (механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) по частоте осложнений в течение 30 дней, первичной проходимости на сроках до 18 месяцев, общей смертности, частоте ампутаций нижней конечности и скорости эпителизации трофического дефекта через 1 год выявлено не было [114].
В ретроспективном одноцентровом исследовании с псевдорандомизацией были изучены результаты лазерной атеротромбэктомии (эндоваскулярная тромбэктомия аспирационная, механическая реканализация, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) в сравнении с обычной баллонной ангиопластикой (баллонная ангиопластика периферической артерии) у пациентов с КИНК. Авторы не нашли статистически достоверных различий между группами по частоте реинтервенций, высоких ампутаций (ампутация нижней конечности) и серьезных нежелательных событий через 1 и 2 года [115].
- При критической ишемии, обусловленной поражениями подколенной артерии и артерий голеней, после баллонной дилатации артерий подколенно-берцового сегмента (баллонная ангиопластика периферической артерии) рекомендуется рассмотреть возможность использования стента (стент для периферических артерий, непокрытый металлический***, стенты периферические с лекарственным покрытием), выделяющего лекарство, в том числе стента, используемого для лечения ИБС (стенты коронарные с принадлежностями) [65, 116].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: по данным регистра VQI, доля стентирования (баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) среди всех эндоваскулярных вмешательств на артериях голени составляет 9% [65]. Применение стентов, выделяющих лекарство (стенты периферические с лекарственным покрытием), по результатам мета-анализа 9 рандомизированных исследований, в течение года после реваскуляризации (баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) приводило к достоверному снижению частоты реинтервенций, рестенозов и высоких ампутаций (ампутации нижней конечности) по сравнению с баллонной ангиопластикой или стентированием обычными баллонами (баллонная ангиопластика периферической артерии) и стентами без лекарственного покрытия (стент для периферических артерий, непокрытый металлический***). В этих исследованиях использовали стенты, сертифицированные для лечения атеросклероза коронарных артерий (стенты коронарные с принадлежностями***) [116].
- В случаях критической ишемии с поражением артерий стопы реваскуляризацию инфрамаллеолярного сегмента рекомендуется выполнять открытым или эндоваскулярным способом к крупным ветвям этих сосудов в области плюсны или голеностопного сустава - плантарным артериям, лодыжечным ветвям малоберцовой артерии, тарзальным ветвям артерии тыла стопы, плантарной артериальной дуг (шунтирование, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) с выбором вида реконструкции врачом-специалистом (врач сердечно-сосудистый хирург) или членами сосудистой команды, исходя из клинической ситуации согласно глобальной системе оценки тяжести поражения артерий конечности (GLASS) (приложение Г3) [117 - 123].
Для баллонной ангиопластики со стентированием подколенной артерии и магистральных артерий голени Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Для шунтирования к крупным ветвям сосудов в области плюсны или голеностопного сустава Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4)
Комментарии: вариантом открытой реваскуляризации конечности при значимых поражениях инфрамаллеолярных магистралей является шунтирование к крупным ветвям этих сосудов в области плюсны или голеностопного сустава - плантарным артериям, лодыжечным ветвям малоберцовой артерии, тарзальным ветвям артерии тыла стопы, плантарной артериальной дуге [117 - 119]. По данным Hughes с соавт., в течение 30 дней после вмешательства частота окклюзии шунта (шунт аутовенозный) составляет 11%, летальность - 1%. Первичная проходимость и частота сохранения конечности через 1 год достигает, соответственно, 67% и 75%, через 5 лет - 41% и 69% [118].
По данным ретроспективных исследований, эндоваскулярные вмешательства на артериях стопы (баллонная ангиопластика периферической артерии) по своим непосредственным и отдаленным результатам не уступают баллонной ангиопластике артерий голени (баллонная ангиопластика периферической артерии) [120 - 123]. Влияние инфрамаллеолярной ангиопластики (баллонная ангиопластика периферической артерии) на скорость и частоту эпителизации трофического дефекта стопы было изучено в одном ретроспективном сравнительном исследовании, где данный метод обеспечивал статистически достоверное увеличение частоты (59,3% и 38,1%, p < 0,05) и времени (211 дней и 365 дней, p = 0,008) заживления стопы по сравнению с баллонной ангиопластикой на уровне артерий голени (баллонная ангиопластика периферической артерии) [123].
- У пациентов с критической ишемией, обусловленной поражением артерий стоп, при выборе кондуита для шунтирующего вмешательства на инфрамаллеолярном сегменте (бедренно-подколенное шунтирование) рекомендуется отдавать предпочтение аутовенозному шунту из большой подкожной вены, при ее отсутствии или непригодности для использования в качестве кондуита рекомендуется использовать альтернативные аутологичные подкожные вены (малая подкожная вена, вены верхних конечностей) [118].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: в крупнейшем ретроспективном исследовании ультрадистальных шунтов (шунт аутовенозный) к ветвям плантарных магистралей были проанализированы результаты лечения 90 пациентов, которым выполнены 98 вмешательств. У 98% показанием к операции была КИНК, еще у 2% - рестеноз в зоне ранее выполненной открытой реконструкции. Во всех наблюдениях за исключением одного был использован аутовенозный кондуит. В течение 30 дней тромбоз шунта (шунт аутовенозный) развился у 11%, зарегистрирован один летальный исход (1%). Первичная проходимость и частота сохранения конечности через 1 год составили, соответственно, 67% и 75%, через 5 лет - 41% и 69% [118].
- Пациентам с тотальным поражением магистрального артериального русла стопы либо при неудачных попытках инфрамаллеолярной реваскуляризации (тромбэндартерэктомия, бедренно-подколенное шунтирование), рекомендуется рассмотреть возможность выполнения артериализации вен стопы открытым, гибридным или эндоваскулярным способом [124 - 128].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: при невозможности восстановить кровообращение в магистральных артериях на инфрамаллеолярном уровне вследствие их тотального поражения или в связи с технически неудачной попыткой реканализации (т.н. "синдром пустой стопы" или "безвариантная" КИНК) некоторыми авторами применяется артериализация венозного русла стопы открытым, эндоваскулярным или гибридным способом [124 - 128]. По данным мета-анализа, опубликованного Schreve с соавт. в 2017 году, артериализация вен стопы обеспечивала сохранение конечности у 75% пациентов (95% ДИ 0,70 - 0,81) в течение 1 года. Ранняя или 30-дневная летальность составила 0 - 10%, общая выживаемость 54 - 100% при среднем сроке наблюдения 5 - 60 месяцев. Первичная проходимость реконструкции в течение 12 месяцев колебалась в интервале 59 - 71% [127].
- У пациентов с критической ишемией, обсуловленной поражением подколенно-берцово-маллеолярного сегментов, при эндоваскулярных вмешательствах на подколенно-берцовом и стопном сегменте, (баллонная ангиопластика периферической артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) в том числе в рамках коррекции многоуровневых поражений, рекомендуется рассмотреть возможность прямой реваскуляризации пораженной ангиосомы, в особенности при глубоких трофических дефектах, расположенных в среднем или заднем отделах стопы, а также при поражении нескольких ангиосом, с целью улучшения показателей заживления трофического дефекта конечности [116, 129 - 136].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: данные о влиянии прямой (ангиосомной) реваскуляризации на отдаленный исход эндоваскулярного лечения КИНК получены в ретроспективных исследованиях низкого и среднего качества [116, 129 - 136]. В целом, в значительной части исследований ангиосомная реваскуляризация приводила к уменьшению времени эпителизации трофического дефекта [130, 132 - 135, 137]. Некоторые авторы также зарегистрировали снижение частоты высоких ампутаций (ампутация нижней конечности) при реализации такого подхода [130, 133]. Международный согласительный документ по лечению КИНК, опубликованный Conte с соавт., рекомендует рассмотреть возможность прямой реваскуляризации пораженной ангиосомы, в особенности при глубоких трофических дефектах, расположенных в среднем или заднем отделах стопы [3].
- При многоуровневом поражении артериального русла конечности, в том числе при поражении аорто-подвздошного сегмента с вовлечением общей бедренной артерии, рекомендуется рассмотреть возможность выполнения гибридной реваскуляризации [138, 140 - 142].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: по данным национального регистра госпитализаций США (NIS), в период с 2000 по 2004 годы количество гибридных вмешательств, ежегодно выполняемых при многоуровневом стеноокклюзирующем поражении артерий нижних конечностей, варьировало от 2312 до 2655, из них 28,3 - 29,8% были двухэтапными (открытый и эндоваскулярный этап выполняли с интервалом более 1 суток), (открытый этап - тромбэндартерэктомия, бедренно-подколенное шунтирование, эндоваскулярный этап - баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) [138]. По данным регистра VQI, в период с 2010 по 2017 годы доля гибридных реконструкций, при поражении БПС выросла с 6,1% до 32% [139]. При распространении стеноокклюзирующих изменений аорто-подвздошного сегмента на общую бедренную артерию (ОБА) эффективны гибридные вмешательства - сочетание открытой эндартерэктомии (тромбэндартерэктомии) из ОБА и эндоваскулярной коррекции артериального сегмента (стентирование артерий нижних конечностей) выше уровня паховой связи [140 - 142]. В крупном ретроспективном исследовании Zavatta с соавт. 30-дневная летальность после гибридных реконструкций подвздошно-бедренного сегмента была достоверно ниже, чем после открытой реваскуляризации (тромбэндартерэктомия, бедренно-подколенное шунтирование) [142]. В рандомизированном исследовании Starodoubtsev с соавт. у пациентов с поражениями подвздошных артерий и ОБА частота ранних послеоперационных осложнений была существенно и статистически достоверно ниже при выполнении гибридных реконструкцией по сравнению с открытой реваскуляризацией, (тромбэндартерэктомия, бедренно-подколенное шунтирование) (8,8% и 21%, соответственно; p = 0,03). При этом по первичной проходимости и частоте сохранения конечности в отдаленном периоде группы не различались [143].
- При сочетанных поражениях аорто-подвздошного и бедренно-подколенного сегментов у пациентов с КИНК без трофических изменений рекомендуется рассмотреть возможность выполнения реконструкции аорто-подвздошного сегмента с восстановлением прямого кровотока (аорто-глубокобедренное шунтирование) в бассейн глубокой бедренной артерии с последующей оценкой необходимости дальнейшей реваскуляризации конечности (бедренно-подколенное шунтирование) [144-147].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: у пациентов с КИНК и сочетанным стеноокклюзирующим поражением аорто-подвздошного и бедренно-подколенного сегментов в ряде случаев эффективна реваскуляризация бассейна глубокой бедренной артерии (ГБА) (Аорто-глубокобедренное шунтирование) без восстановления прямого кровообращения в нижележащих отделах артериального русла [144 - 147]. Факторами риска недостаточной эффективности изолированной реконструкции ГБА (Пластика глубокой бедренной артерии) были: гемодинамически значимые изменения ГБА или ПкА, наличие на уровне голени не более одной магистральной артерии оттока [147].
- При отсутствии аутовенозного кондуита достаточной длины у пациентов с КИНК и многоуровневыми поражениями инфраингвинального сегмента, рекомендуется рассмотреть возможность шунтирования (бедренно-подколенного шунтирования) к немагистральным ветвям поверхностной бедренной или подколенной артерий с целью купирования КИНК [119, 148 - 150].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: у пациентов с протяженными окклюзиями БПС, при отсутствии аутовенозного кондуита достаточной длины, некоторые авторы выполняют шунтирование к немагистральным ветвям (бедренно-подколенное шунтирование) поверхностной бедренной и подколенной артерий в области коленного сустава. При этом дистальный анастомоз формируют с нисходящей артерией колена или с одной из суральных артерий, в качестве кондуита в большинстве случаев используют аутовену. По данным ретроспективных исследований без контрольной группы, частота ранних тромбозов шунта (шунт аутовенозный) составляет 0-9%, первичная проходимость через 3 года составляет 56 - 77%, частота сохранения конечности через 1 год - 77%, через 3 года - 73,5 - 90% [119, 148 - 150].
- Рекомендуется рассмотреть возможность хирургической или эндоваскулярной коррекции (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) гемодинамически значимого рестеноза у пациентов, которым ранее выполнена артериальная реконструкция (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) по поводу КИНК [151 - 156, 236].
Для баллонной ангиопластики периферической артерии Уровень убедительности рекомендаций В (уровень достоверности доказательств - 1)
Для тромбэндартерэктомии, аорто-глубокобедренного шунтирования, бедренно-подколенного шунтирования, стентирования артерий нижних конечностей Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: одним из показаний к реконструктивному вмешательству на артериях конечности (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) является выявление рестеноза после ранее выполненной реваскуляризации (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) [3]. По данным ретроспективных и рандомизированных исследований, для лечения гемодинамически значимых рестенозов после реконструкций аорто-подвздошного и инфраингвинального сегментов (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии), помимо традиционных открытых методов, применяются баллонная ангиопластика (баллонная ангиопластика периферической артерии), в том числе с использованием режущих баллонных катетеров и баллонных катетеров, выделяющих лекарство (катетер баллонный дилатационный для чрескожной транслюминальной ангиопластики, катетер дилятационный баллонный с лекарственным покрытием) [151 - 156].
- Рекомендуется рассмотреть возможность превентивной реваскуляризации (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) у пациентов с остеоартропатией Шарко и гемодинамически значимыми изменениями конечности (КИНК) перед проведением ортопедической реконструкции стопы (пластика сухожильно-связочного аппарата стопы) [159, 160].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: доля пациентов с остеоартропатией Шарко, у которых при обследовании находят гемодинамически значимые изменения магистральных артерий конечности, по некоторым данным достигает 40 - 66,1% [157, 158]. Как правило эти изменения носят ассимптомный характер, а частота выявления КИНК в этой клинической группе на 82% ниже, чем при СДС с трофическими нарушениями [158, 159]. Однако при выполнении ортопедической реконструкции стопы (пластика сухожильно-связочного аппарата стопы) хирургическая травма способствует переходу фоновой ишемии конечности в критическую. По данным ретроспективного исследования Elmarsafi с соавт., наличие стеноокклюзирующих изменений в артериях у таких пациентов увеличивает риск высокой ампутации конечности (ампутация нижней конечности) в послеоперационном периоде в 4,3 раза (95% ДИ 1,7 - 11,0; p = 0,002). В связи с этим некоторые авторы считают обоснованным превентивную реваскуляризацию конечности (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) при "фоновой" ишемии стопы у больных с остеоартропатией Шарко [159, 160].
- Пациентам с тромботической окклюзией нативного артериального русла или зоны ранее выполненной реконструкции (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) на уровне аорто-подвздошного или инфраингвинального сегмента конечности рекомендуется рассмотреть возможность проведения катетерного тромболизиса (локальный эндоваскулярный трансартериальный тромболизис) [161 - 166].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: при лечении КИНК, вызванной тромботической окклюзией нативных артерий нижних конечностей или зоны ранее выполненной реконструкции, (эндоваскулярная реконструкция стенки сосуда) применяется также методика катетерного тромболизиса (локальный эндоваскулярный трансартериальный тромболизис) [161 - 166]. Чаще всего в качестве тромболитика (антитромботические средства B01A) используют рекомбинантный тканевой активатор плазминогена (ртАП) (ферментные препараты, код по АТХ B01AD) [167, 168].
- У пациентов с КИНК рекомендуется рассмотреть возможность проведения интраоперационной инструментальной визуализации зоны открытой артериальной реконструкции (ангиография артерий нижней конечности прямая) артериального русла нижней конечности с целью выявления возможных гемодинамически значимых изменений и их последующей коррекции [169, 170].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: интраоперационная визуализация (ультразвуковое сканирование, ангиография или обе методики одновременно) (дуплексное сканирование сосудов (артерий и вен) нижних конечностей, ангиография артерий нижней конечности прямая) широко применяется при выполнении шунтирующих вмешательств на артериях нижних конечностей (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование) [169, 170]. При этом дефекты, требующие ревизии реконструкции, находят в 10 - 27% случаев [171].
- Рекомендуется рассмотреть возможность проведения срочной и первоочередной по отношению к реваскуляризации (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование) условно-радикальной хирургической обработки зоны трофических и инфекционно-воспалительных изменений (хирургическая обработка раны или инфицированной ткани) в ишемизированном сегменте конечности при наличии у пациента с КИНК и синдромом диабетической стопы признаков системной воспалительной реакции (4 степень по IDSA, 3 степень по WIfI) [46, 172, 173].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: доступные в литературе исследования и международные согласительные документы рекомендуют рассмотреть возможность проведения срочной условно-радикальной ХО (хирургическая обработка раны или инфицированной ткани) при тяжелой инфекции стопы с явлениями системной воспалительной реакции (т.н. синдром "острой стопы", англ. foot attack) первым этапом хирургического лечения при КИНК с трофическими изменениями [46, 172, 173]. В ретроспективных исследованиях у пациентов с выраженными инфекционно-некротическими изменениями стопы ранняя условно-радикальная ХО (хирургическая обработка раны или инфицированной ткани) (выполненная в день госпитализации или в течение 72 часов) была статистически связана с более высокой частотой сохранения конечности, чем отсроченная ХО [174, 175].
- У пациента с КИНК и синдромом диабетической стопы при отсутствии убедительных признаков системной воспалительной реакции (4 степень инфекции по IDSA, 3 степень по WIfI) врачу сердечно-сосудистому хирургу или сосудистой команде, ответственной за лечение пациента с КИНК с целью улучшения результатов реваскулязизации рекомендуется принять решение о срочности и кратности проведения условно-радикальной хирургической обработки (хирургическая обработка раны или инфицированной ткани) зоны трофических и инфекционно-воспалительных изменений в ишемизированном сегменте конечности, а также о ее этапности по отношению к реваскуляризации (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) на основании клинического опыта и общих принципов клинической медицины систематизированных в классификации тяжести поражения конечности WIfI (Приложение Г4) [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: по данным ретроспективного исследования регистра ACS-NSQIP, выполнение ХО (хирургическая обработка раны или инфицированной ткани) одновременно с реваскуляризацией (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) конечности по поводу КИНК не приводило к увеличению периоперационной летальности и частоты ранних осложнений (включая высокую ампутацию) (ампутация нижней конечности) по сравнению с двухэтапным лечением, когда ХО проводили после артериальной реконструкции (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии). Тяжесть инфекционного воспаления в этой работе не оценивали [176].
- Рекомендуется обеспечить преемственность лечения пациента с КИНК и трофическими и/или инфекционно-воспалительными изменениями нижней конечности при синдроме диабетической стопы при выполнении хирургической обработки зоны трофических и/или инфекционно-воспалительных (хирургическая обработка раны или инфицированной ткани) изменений на базе другого отделения (медицинского учреждения) после реваскуляризации конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) [175 - 176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: продолжительность заживления трофического дефекта после реваскуляризации конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) часто превышает 6 месяцев [177]. Перенос этапа хирургической обработки (хирургическая обработка раны или инфицированной ткани) трофического дефекта в другое подразделение при условии сохранения преемственности лечения может достоверно повысить эффективность борьбы за конечность у пациентов с КИНК [178].
- У пациентов с КИНК и синдромом диабетической стопы после адекватной хирургической обработки (хирургическая обработка раны или инфицированной ткани) зоны инфекционно-воспалительных и некротических изменений рекомендуется рассмотреть возможность закрытия дефекта тканей конечности (аутодермопластика) с помощью лоскутной пластики аутотрансплантатом и/или в случае терапии осложненного заживления ран области хирургического вмешательства терапии отрицательным давлением (вакуум-терапии, вакуумное воздействие) [179 - 183, 237].
Для аутодермопластики Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Для терапии осложненного заживления ран области хирургического вмешательства отрицательным давлением (вакуумным воздействием) у пациентов с КИНК Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: лоскутная пластика трофического дефекта свободным аутотрансплантатом (аутодермопластика) на сосудистой ножке широко применяется после реваскуляризации конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) у пациентов с КИНК [179]. Данная методика обеспечивает высокие показатели скорости эпителизации дефекта и выживаемости без ампутации (ампутация нижней конечности) в отдаленном периоде [180 - 182]. Терапия отрицательным давлением (вакуум-терапия, вакуумное воздействие) как самостоятельный способ закрытия трофического дефекта конечности, по данным ретроспективных исследований, обеспечивает статистически достоверное снижение частоты высоких ампутаций (ампутация нижней конечности) и увеличение вероятности заживления трофического дефекта по сравнению с использованием гидрогелевых и альгинатных повязок (повязки гелевые на текстильной основе для лечения ожогов и инфицированных ран) [183].
- Выбор способа закрытия дефекта тканей конечности, продолжительности и кратности его применения, этапности по отношению к реваскуляризации (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии), рекомендуется принимать врачу-специалисту (врач сердечно-сосудистый хирург) или сосудистой команде, ответственной за лечение пациента с КИНК [180, 182, 184 - 191].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: совокупность литературных данных, посвященных проблеме выбора способа закрытия дефекта тканей конечности после реваскуляризации (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) по поводу КИНК, представлена главным образом небольшими ретроспективными исследованиями без группы сравнения либо рандомизированными исследованиями низкого качества, которые в основном включают в себя пациентов с дефектами тканей конечности неишемического генеза [180, 182, 184 - 191].
- Пациентам с КИНК рекомендуется прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный для определения показаний к выполнению высокой ампутации нижней конечности после рассмотрения всех возможных вариантов открытой и эндоваскулярной реваскуляризации (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) согласно системе классификации тяжести поражения конечности WIfI (приложение Г4) [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Пациентам с КИНК рекомендуется прием (осмотр, консультация) врача-хирурга первичный для рассмотрения возможности выполнения высокой ампутации нижней конечности при наличии выраженных инфекционно-воспалительных изменений, требующих экстренной или срочной радикальной хирургической обработки (хирургическая обработка раны или инфицированной ткани) с пересечением костных структур проксимальнее голеностопного сустава или в тесной близости от него [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: одним из методов хирургического лечения КИНК является высокая ампутация конечности (ампутация нижней конечности), которую выполняют в следующих ситуациях [3].
После консультации специалиста (Прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный, прием (осмотр, консультация) врача-хирурга первичный) медицинской организации, оказывающей специализированную помощь по профилям ССХ и РХМДИЛ после рассмотрения всех возможных вариантов открытой и эндоваскулярной реваскуляризации:
1. Когда выполненная реваскуляризация, хирургическая обработка и мероприятия, направленные на эпителизацию ампутационного/трофического дефекта (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) (хирургическая обработка раны или инфицированной ткани) (аутодеромопластика), не позволяют сохранить функциональную и опороспособную часть стопы в виду обширного и нереконструктабельного дефекта ее тканей.
2. При отсутствии перспектив сохранения функциональной и опороспособной части стопы/голени вследствие распространенных некротических изменений и/или технической возможности выполнить реваскуляризацию конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) в виду особенностей поражения ее артериального русла.
3. В ситуации, когда ишемизированная конечность необратимо утратила опороспособность в виду неврологических расстройств, нейромышечных и костно-суставных заболеваний.
4. При чрезмерно высоком операционном риске, обусловленном состоянием пациента и тяжестью сопутствующей патологии, а также при низкой ожидаемой продолжительности жизни.
Двухэтапный подход к выполнению высоких ампутаций нижней конечности при КИНК применяется многими авторами с целью улучшения заживления культи голени (реже бедра) и сохранения более протяженного и функционального сегмента конечности, как правило, у пациентов с обширными некрозами без четкой демаркации, тяжелой инфекцией и признаками остеомиелита [192 - 196]. В рандомизированном исследовании Fisher с соавт. частота раневых осложнений в группе первичной высокой ампутации нижней конечности составила 21% против 0% при двухэтапном подходе (p = 0,05) [195]. По данным ретроспективных исследований, двухэтапная высокая ампутация нижней конечности повышала частоту успешного заживления культи и снижала периоперационную летальность по сравнению с одномоментной ампутацией нижней конечности [192, 194].
- У пациентов с КИНК при определении уровня высокой ампутации нижней конечности рекомендуется рассмотреть возможность сохранения как можно более функционального сегмента конечности с целью повышения вероятности ее успешного протезирования [197].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: по данным ретроспективных исследований, у пациентов после высоких ампутаций конечности (ампутация нижней конечности) ниже уровня коленного сустава функциональный статус конечности достоверно лучше по сравнению с больными, которым выполнена ампутация бедра (ампутация бедра) [197, 198].
- У пациентов с КИНК при определении уровня высокой ампутации нижней конечности рекомендуется ориентироваться на клинические признаки и рассмотреть возможность использования транскутанной оксиметрии (определение парциального давления кислорода в мягких тканях - оксиметрия) для оценки вероятности успешного заживления культи на предполагаемом уровне усечения конечности [199 - 201].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: при определении уровня ампутации (ампутация нижней конечности) следует ориентироваться на клинические признаки (внешний вид конечности на уровне различных сегментов, наличие отека, гиперемии, цианоза, трофических изменений, суставной контрактуры). Степень кровоточивости тканей на уровне ампутации (ампутация нижней конечности) не является надежным предиктором заживления культи [199]. Из инструментальных методов оценки вероятности успешного заживления культи конечности наиболее распространенным является измерение чрескожного напряжения кислорода (определение парциального давления кислорода в мягких тканях - оксиметрия) на уровне предполагаемой ампутации (ампутация нижней конечности). Значение этого показателя выше 35 - 40 мм рт. ст. по данным нескольких ретроспективных исследований было статистически сопряжено с высокой вероятностью заживления культи голени [199-201]. Примечательно, что определение уровня высокой ампутации (ампутация нижней конечности) по уровню окклюзии магистральных артерий не подтвердило свою эффективность в клинических исследованиях и не фигурирует в научной литературе последних лет [199].
- У пациентов с КИНК для повышения вероятности успешного заживления культи конечности рекомендуется рассмотреть возможность ее превентивной или отсроченной реваскуляризации (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) [202 - 205].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: для повышения вероятности заживления или купирования ишемии тканей на уровне ампутации (ампутация нижней конечности) некоторые коллективы прибегают к реваскуляризации культи конечности открытым или эндоваскулярным способом (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) [202 - 205].
- Не рекомендуется выполнять симпатэктомию поясничную пациентам с КИНК с целью сохранения конечности [206].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: по данным систематического обзора Sanni с соавт., эффективность симпатэктомии поясничной (ПСЭ) при КИНК изучена в двух рандомизированных исследованиях, при этом лишь в одном из них симпатэктомию поясничную использовали как отдельный метод лечения. Авторам не удалось выявить достоверных преимуществ симпатэктомии поясничной по сравнению с консервативным лечением по таким показателям, как частота сохранения конечности, частота и время заживления трофических дефектов [206].
- Рекомендуется рассмотреть возможность проведения спинальной нейростимуляции (имплантация временных электродов для нейростимуляции спинного мозга и периферических нервов) пациентам с КИНК без трофических нарушений либо с поверхностными, ограниченными и неинфицированными трофическими нарушениями с целью уменьшения болевого синдрома и снижения риска высокой ампутации (ампутация нижней конечности) при нереконструктабельном поражении артерий конечности [207].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: по данным мета-анализа 6 рандомизированных исследований спинальной нейростимуляции (СНС, имплантация временных электродов для нейростимуляции спинного мозга и периферических нервов) у пациентов с КИНК и нереконструктабельным поражением артерий, частота высоких ампутаций нижней конечности через 12 месяцев после начала лечения была достоверно ниже (ОР 0,71; 95% ДИ 0,56 - 0,90), а процент пациентов с существенным уменьшением болей покоя - выше в группе СНС (имплантация временных электродов для нейростимуляции спинного мозга и периферических нервов) по сравнению с консервативным лечением. Доля пациентов без трофических нарушений составила 24 - 49%. Выраженная инфекция в зоне трофических изменений была критерием исключения в 5 исследованиях, распространенный или глубокий некроз - в 3 исследованиях из 6 [207].
3.2. Консервативное лечение
- Терапия препаратами группы простаноидов (Простогландины G02AD) не рекомендована пациентам с КИНК [208].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: по данным мета-анализа 33 рандомизированных исследований простаноидов (Простогландины G02AD) при КИНК, в том числе 21 плацебо-контролируемых, простаноиды (Простогландины G02AD) не влияли на частоту высоких ампутаций (ампутация нижней конечности) однако чаще приводили к побочным эффектам (головная боль, тошнота, рвота, диарея, приливы жара, гипотензия) по сравнению с плацебо [208].
- Терапия пентоксифиллином** не рекомендована пациентам с КИНК [210, 213].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: в рандомизированном исследовании Dawson с соавт. отмечено статистически достоверное снижение интенсивности болей покоя на фоне внутривенного введения препарата (пентоксифиллин**) по сравнению с группой плацебо (28% и 15%, соответственно; p = 0,026). При этом у пациентов, получавших пентоксифиллин**, частота побочных явлений со стороны ЖКТ была достоверно выше (37,6% и 11,5%; p < 0,0001) [209]. В Норвежском исследовании не было зарегистрировано достоверных различий по интенсивности болей покоя при продолжительности внутривенного применения пентоксифиллина** 7 дней [210].
- Генная терапия факторами роста (группа C05XX Прочие вазопротекторы) не рекомендована пациентам с КИНК [211].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: по данным мета-анализа 17 качественных рандомизированных исследований генной терапии, у пациентов с КИНК данный вид лечения не вызывает статистически достоверных изменений частоты высоких ампутаций (ампутация нижней конечности) и общей выживаемости по сравнению с плацебо [211].
- При наличии показаний к плановой высокой ампутации (ампутация нижней конечности) у пациентов с КИНК рекомендовано рассмотреть возможность паллиативного лечения и воздержаться от хирургического лечения при крайне высоком хирургическом риске, обусловленном тяжелой сопутствующей патологией и/или тяжелым общим состоянием больного при условии малой выраженности и непрогрессирующего характера инфекционного процесса в зоне некротических изменений конечности [212 - 214].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: значительная часть пациентов с КИНК имеют тяжелую сопутствующую патологию, которая резко повышает риск развития периоперационных осложнений и ухудшает отдаленные результаты лечения. При наличии крайне высокого риска операционного риска у пациентов с показаниями к плановой высокой ампутации (ампутация нижней конечности) по поводу КИНК ряд авторов воздерживаются от хирургического лечения в пользу паллиативного лечения (обезболивание, контроль инфекции в зоне некротических изменений, лечение сопутствующей патологии) при условии малой выраженности и непрогрессирующего характера инфекционного процесса в зоне некротических изменений конечности [212 - 214].
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- При определении уровня высокой ампутации конечности (ампутация нижней конечности) у пациентов с КИНК рекомендуется учитывать перспективы последующего протезирования [197, 216].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- После высокой ампутации (ампутация нижней конечности) по поводу КИНК рекомендуется рассмотреть возможность направления пациента в специализированный центр протезирования конечности [197, 215, 216].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4)
Комментарии: литературные данные, касающиеся реабилитации пациентов с КИНК, представлены единичными исследованиями отдаленных результатов протезирования нижних конечностей после высокой ампутации нижней конечности. Целью реабилитации, таким образом, является обеспечение максимальной мобильности пациентов, которым не удалость сохранить конечность.
Доля пациентов, способных самостоятельно передвигаться с помощью протеза, достоверно выше при ампутациях голени по сравнению с ампутациями бедра [197, 215].
По данным Webster с соавт., возраст пациентов старше 55 лет, наличие таких тяжелых сопутствующих заболеваний, как хроническая обструктивная болезнь легких и гемодиализ, снижали эффективность протезирования конечности [216].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется рассмотреть возможность применения монотерапии ацетилсалициловой кислотой** в дозе 100 мг/сутки или двухкомпонентной антитромботической терапии ацетилсалициловой кислотой** в дозе 100 мг/сутки (первичная профилактика острого инфаркта миокарда) и ривароксабаном** в дозе 2,5 мг 2 раза в сутки (профилактика инсульта, инфаркта миокарда и смерти вследствие сердечно-сосудистых причин, а также профилактика острой ишемии конечностей и общей смертности у пациентов с ишемической болезнью сердца (ИБС) или заболеванием периферических артерий (ЗПА) в комбинированной терапии с ацетилсалициловой кислотой) [217 - 219].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: в рандомизированном исследовании CLIPS терапия ацетилсалициловой кислотой** (АСК) у пациентов с асимптомным течением ХОЗАНК в течение 2 лет привела к достоверному снижению риска достижения комбинированной
конечной точки развития КИНК или тяжелых нежелательных сосудистых событий по сравнению с плацебо (снижение риска на 58%, p = 0,014). По частоте развития КИНК как изолированной конечной точки группы достоверно не различались [217].
Суб-анализ результатов рандомизированного исследования COMPASS включал в себя пациентов с асимптомным или симптомным поражением артерий нижних конечностей (у 32% в анамнезе реваскуляризация конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии)). Пациенты получали двойную антитромботическую терапию ацетилсалициловой кислотой** (АСК) в дозе 100 мг/сутки в сочетании с ривароксабаном** (код по АТХ: B01AF, прямые ингибиторы фактора Ха) в дозе 2,5 мг 2 раза в сутки. По сравнению с монотерапией ацетилсалициловой кислотой** двойная антитромботическая терапия статистически достоверно снижала риск достижения комбинированной конечной точки сердечно-сосудистая смерть/инфаркт миокарда/инсульт на 28%; риск тяжелых нежелательных событий со стороны конечности на 46%, риск высокой ампутации (ампутация нижней конечности) конечности на 70%, риск незапланированных сосудистых вмешательств по поводу ишемии конечности на 43%. В то же время, риск больших геморрагических событий по модифированным критериям Международного общества тромбоза и гемостаза (ISTH) в группе двойной терапии был достоверно выше, чем при монотерапии ацетилсалициловой кислотой** (3,1% и 1,9%; p = 0,0089). По частоте фатальных, внутричерепных кровотечений и кровотечений в критически важный орган группы достоверно не различались [218, 219].
- Рекомендуется рассмотреть возможность применения двухкомпонентной антитромботической терапии ацетилсалициловой кислотой** в дозе 100 мг/сутки (первичная профилактика острого инфаркта миокарда) и ривароксабаном** в дозе 2,5 мг 2 раза в сутки (профилактика инсульта, инфаркта миокарда и смерти вследствие сердечно-сосудистых причин, а также профилактика острой ишемии конечностей и общей смертности у пациентов с ишемической болезнью сердца (ИБС) или заболеванием периферических артерий (ЗПА) в комбинированной терапии с ацетилсалициловой кислотой) у пациентов после реваскуляризации нижних конечностей по поводу КИНК [219, 220].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: в рандомизированном двойном слепом многоцентровом исследовании VOYAGER PAD участвовали пациенты после реконструктивных вмешательств на артериях нижних конечностей (35% оперированы открытым способом, 65% эндоваскулярным), которые в послеоперационном периоде получали двойную антитромботическую терапию (ривароксабан** 2,5 мг 2 раза в сутки в сочетании с ацетилсалициловой кислотой** 100 мг/сутки) либо монотерапию ацетилсалициловой кислотой** 100 мг/сутки. В течение 3 лет двойная антитромботическая терапия приводила к статистически достоверному снижению частоты повторных реваскуляризаций (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) на 12%, частоты госпитализаций в связи с тромботическими событиями на 28%, риска достижения комбинированной конечной точки острая ишемия конечности/ампутация нижней конечности/инфаркт миокарда/ишемический инсульт/смерть от ИБС на 20%. Эти преимущества сохранялись в подгруппе больных с КИНК.
По частоте больших геморрагических событий, интракраниальных и фатальных кровотечений (использована шкала тромбоза и инфаркта миокарда - TIMI) группы двойной антитромботической терапии и ацетилсалициловой кислоты** достоверно не различались. По более строгим критериям Международного общества тромбоза и гемостаза (ISTH) в группе двойной антитромботической терапии частота больших геморрагических событий составила 5,94% против 4,06% в группе ацетилсалициловой кислоты** (p = 0,007) [219, 220].
- У пациентов без высокого риска кровотечения рекомендуется рассмотреть возможность применения двухкомпонентной антитромботической терапии ацетилсалициловой кислотой** в дозе 100 мг/сутки (первичная профилактика острого инфаркта миокарда) и ривароксабаном** 2,5 мг 2 р/сутки (профилактика инсульта, инфаркта миокарда и смерти вследствие сердечно-сосудистых причин, а также профилактика острой ишемии конечностей и общей смертности у пациентов с ишемической болезнью сердца (ИБС) или заболеванием периферических артерий (ЗПА) в комбинированной терапии с ацетилсалициловой кислотой) в сочетании с краткосрочным применением клопидогрела** сроком до 1 месяца у пациентов после эндоваскулярной реваскуляризации нижних конечностей (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) по поводу КИНК [221].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: около половины пациентов в исследовании дополнительно принимали клопидогрел** (код по АТХ: B01AC, Антиагреганты кроме гепарина), т.е. получали тройную антитромботическую терапию. Медианная продолжительность тройной терапии составила 30 дней. При продолжительности сопутствующего приема клопидогрела** ![]() 30 дней частота больших геморрагических событий по классификации ISTH в группе двойной антитромботической терапии не отличалась от таковой в контрольной группе. При продолжительности сопутствующего приема клопидогрела** более 30 дней отмечено увеличение частоты больших геморрагических событий по классификации ISTH на 2,71% в группе тройной антитромботической терапии по сравнению с двойной терапией ривароксабан** + ацетилсалициловая кислота** (ОР 3,20; 95% ДИ 1,44 - 7,13). В то же время, преимущества двухкомпонентной антитромботической терапии по частоте достижения первичной конечной точки по сравнению с терапией ацетилсалициловая кислота** + плацебо не зависели от сопутствующего приема клопидогрела** (р для взаимодействия 0,92) [221].
30 дней частота больших геморрагических событий по классификации ISTH в группе двойной антитромботической терапии не отличалась от таковой в контрольной группе. При продолжительности сопутствующего приема клопидогрела** более 30 дней отмечено увеличение частоты больших геморрагических событий по классификации ISTH на 2,71% в группе тройной антитромботической терапии по сравнению с двойной терапией ривароксабан** + ацетилсалициловая кислота** (ОР 3,20; 95% ДИ 1,44 - 7,13). В то же время, преимущества двухкомпонентной антитромботической терапии по частоте достижения первичной конечной точки по сравнению с терапией ацетилсалициловая кислота** + плацебо не зависели от сопутствующего приема клопидогрела** (р для взаимодействия 0,92) [221].
- Рекомендуется в качестве стратегии интраоперационной антитромботической профилактики использовать введение антитромботических средств (B01A) в зависимости от показателей коагулограммы (ориентировочного исследования гемостаза), в том числе активированного частичного тромбопластинового времени, и наличия противопоказаний или ограничений к применению различных антитромботических средств [238].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: в литературе отсутствуют качественные данные о сравнительной эффективности различных стратегий интраоперационной антитромботической профилактики при выполнении артериальных реконструкций (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) пациентам с КИНК [210, 212 - 224].
- Рекомендуется рассмотреть возможность применения двойной антиагрегантной терапии ацетилсалициловой кислотой** в дозе 100 мг/сутки (профилактика тромбоэмболии после операций и инвазивных вмешательств на сосудах) и клопидогрелом** в дозе 75 мг/сутки (при диагностированном заболевании периферических артерий) у пациентов с КИНК после эндоваскулярных вмешательств (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) на артериях нижних конечностей [222].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: в рандомизированном исследовании MIRROR участвовали пациенты после эндоваскулярных вмешательств (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) на артериях бедренно-подколенного сегмента, получавшие ДААТ или монотерапию ацетилсалициловой кислоты** на протяжении 6 месяцев. Операцию (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) выполняли по поводу КИНК у 33,8% больных. Первичной конечной точкой в исследовании была активность маркеров активации тромбоцитов. К концу срока наблюдения частота повторных реваскуляризаций (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) оперированного сегмента (вторичная конечная точка) по клиническим показаниям была достоверно ниже при использовании ДААТ по сравнению с ацетилсалициловой кислотой**. У 30% больных в группе ДААТ отмечена резистентность к действию клопидогрела** вследствие высокой остаточной активности тромбоцитов [222]. Основной целью назначения данных препаратов является снижение риска повторной реваскуляризации (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии).
- Рекомендуется рассмотреть возможность назначения двойной антиагрегантной терапии ацетилсалициловой кислотой** (профилактика тромбоэмболии после операций и инвазивных вмешательств на сосудах) в дозе 100 мг/сутки и клопидогрелом** в дозе 75 мг/сутки (при диагностированном заболевании периферических артерий) с целью снижения риска окклюзии шунта после инфраингвинального шунтирования (бедренно-подколенное шунтирование) синтетическим протезом (протез кровеносного сосуда синтетический***) на срок от 6 месяцев до 2 лет у пациентов с КИНК [223].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: в двойном слепом рандомизированном исследовании CASPAR пациенты после инфраингвинальных шунтирующих реконструкций (бедренно-подколенное шунтирование) получали ДААТ или монотерапию ацетилсалициловой кислотой**. Наблюдалась значимая статистическая взаимосвязь между эффектом лечения и типом трансплантата (p = 0,008) (шунт аутовенозный, протез кровеносного сосуда синтетический***). В подгруппе синтетических кондуитов (протез кровеносного сосуда синтетический***) риск окклюзии шунта (протез кровеносного сосуда синтетический***) в течение всего срока наблюдения был достоверно ниже при использовании ДААТ по сравнению с ацетилсалициловой кислотой** (ОР 0,65; 95% ДИ 0,45 - 0,95) [223].
- Не рекомендуется рутинно применять антагонисты витамина К (как в режиме монотерапии, так и в комбинации с другими антитромботическими средствами) с целью снижения риска повторной реваскуляризации после артериальных реконструкций (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) у пациентов с КИНК [224 - 226].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 2)
Комментарии: качественные научные данные об эффективности антагонистами витамина К (АВК) после открытых реконструктивных вмешательств (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, тромбэндартерэктомия) по поводу КИНК представлены тремя рандомизированными исследованиями с открытой маркировкой. В двух из них антагонисты витамина К применялись в режиме монотерапии, целевые показатели МНО существенно отличались от принятых сегодня в клинической практике. Анализ геморрагических осложнений представлен не полностью. Эти обстоятельства затрудняют однозначную интерпретацию результатов этих работ с точки зрения практических рекомендаций [224 - 226].
- Рекомендуется настоятельно рекомендовать отказ от курения всем пациентам с КИНК, которым выполнена реваскуляризация нижней конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование) [227].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: по данным мета-анализа 29 исследований (в том числе 4 рандомизированных), отказ от курения после шунтирующих сосудистых вмешательств (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование) на артериях нижних конечностей приводил к снижению риска потери проходимости реконструкции в отдаленном периоде в 3,09 раза (95% ДИ 2,34 - 4,08; р < 0,00001) [227].
- Рекомендуется рассмотреть возможность назначения терапии статинами (ингибиторы ГМГ-КоА-редуктазы C10AA) для снижения общей и сердечно-сосудистой смертности, а также для улучшения показателей сохранения конечности всем пациентам с КИНК [228 - 230].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: по данным ретроспективных исследований, терапия статинами (Ингибиторы ГМГ-КоА-редуктазы) способствовала повышению проходимости зоны реконструкции, снижению частоты повторных реваскуляризаций (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование) и общей летальности у пациентов после реваскуляризации нижних конечностей (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование) [198, 228 - 230].
5.1 Диспансерное наблюдение
- Пациентам после хирургического лечения КИНК рекомендуется периодическое клиническое (визуальное исследование при сосудистой патологии, пальпация при сосудистой патологии) и/или ультразвуковое обследование (ультразвуковая допплерография артерий нижних конечностей, дуплексное сканирование сосудов (артерий и вен) нижних конечностей) с целью контроля состояния конечности, оценки функции выполненной артериальной реконструкции, выявления признаков рестеноза и клинического рецидива КИНК [231 - 234].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 2)
Комментарии: по данным качественных сравнительных исследований, послеоперационное наблюдение, включающее в себя периодический клинический осмотр (визуальное исследование при сосудистой патологии, пальпация при сосудистой патологии) и/или ультразвуковое исследование (ультразвуковая допплерография артерий нижних конечностей, дуплексное сканирование сосудов (артерий и вен) нижних конечностей), позволяет эффективно выявлять признаки рестеноза в зоне реконструкции и рецидива ишемии конечности [231 - 234]. В течение первого года после реваскуляризации конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) более частое проведение контрольного осмотра повышает эффективность диспансеризации [232].
6. Организация оказания медицинской помощи
Целью медицинской помощи при КИНК является снижение приведенного показателя частоты высоких ампутаций нижней конечности в популяции (число высоких ампутаций нижней конечности на 100000 населения в год).
Основным видом медицинской помощи при КИНК является специализированная, в том числе высокотехнологичная, медицинская помощь (хирургическая помощь) в условиях стационара. Виды хирургических вмешательств, выполняемых при КИНК, перечислены в разделе 3.1 настоящих рекомендаций.
Этапы медицинской помощи при КИНК включают в себя квалифицированную и специализированную помощь в условиях стационара или амбулаторного лечебного учреждения (первичной медико-санитарной помощи).
Возможными показаниями к госпитализации пациентов с КИНК являются:
- необходимость оказания специализированной, в том числе высокотехнологичной, медицинской помощи - хирургической помощи (см. раздел 3.1);
- развитие у пациента с КИНК тяжелой сопутствующей патологии при отсутствии показаний или наличии противопоказаний к хирургическому лечению КИНК.
Основаниями для выписки из стационара являются:
- стабильное и удовлетворительное состояние пациента:
а. после проведенного хирургического лечения;
б. при выявлении противопоказаний к хирургическому лечению;
в. при отказе пациента от предложенного хирургического лечения;
г. при технической невозможности выполнения хирургического вмешательства в условиях данного стационара;
- другие законные основания, предусмотренные федеральными и региональными нормативными актами, а также правилами внутреннего распорядка лечебного учреждения.
Ключевые принципы организации медицинской помощи при КИНК включают в себя:
- уменьшение продолжительности догоспитального этапа (время от момента начала симптомов КИНК до поступления пациента в стационар с целью оказания специализированной, в том числе высокотехнологичной, медицинской помощи - хирургической помощи);
- уменьшение продолжительности предоперационной подготовки и обследования в условиях стационара;
- обеспечение мультидисциплинарного подхода к лечению пациента в стационаре;
- обеспечение преемственности в лечении пациента между стационарными подразделениями и на амбулаторном этапе после выписки из специализированного стационара.
С целью уменьшения продолжительности догоспитального этапа при первичном обращении пациента за консультативной помощью в амбулаторное учреждение здравоохранения целесообразно максимально сократить алгоритм обследования. При наличии клинически обоснованных подозрений на КИНК, даже если инструментальные данные о наличии стеноокклюзирующих изменений в артериях конечности (ультразвуковая допплерография артерий нижних конечностей, дуплексное сканирование сосудов (артерий и вен) нижних конечностей) на момент осмотра отсутствуют, следует в кратчайшие сроки направить пациента в специализированный стационар для решения вопроса о необходимости и срочности хирургического вмешательства. Не рекомендуется инициировать какие-либо лечебные мероприятия у пациентов с КИНК в условиях учреждения амбулаторной помощи без предварительного осмотра врача-специалиста (врача сердечно-сосудистого хирурга) в специализированном стационаре.
При поступлении в специализированный стационар (по направлению из амбулаторного учреждения, а также в экстренном порядке из дома или переводом из другого стационара) проводится ускоренное предоперационное обследование пациента с целью решения вопроса о необходимости и возможности оказания хирургической помощи, определения спектра планируемых вмешательств и последовательности их выполнения, объема предоперационной подготовки. Из алгоритма предоперационной диагностики следует исключить все нерелевантные исследования, результаты которых не влияют на выбор тактики хирургического лечения КИНК (см. раздел 2). При необходимости дополнительное обследование в связи с имеющимися у пациента хроническими сопутствующими заболеваниями может быть проведено в послеоперационном периоде.
Реализация мультидисциплинарного подхода к лечению КИНК в стационаре предполагает участие специалистов различного профиля в принятии решений относительно тактики ведения пациента и разумное распределение этапов лечения между этими специалистами, что повышает эффективность принимаемых мер и снижает риск неудачи (в частности, риск высокой ампутации нижней конечности). В международных согласительных документах совокупность этих специалистов называют сосудистой командой. Она может включать в себя врача-хирурга, врача-сердечно-сосудистого хирурга, эндоваскулярного хирурга, (врач по рентгенэндоваскулярным диагностике и лечению), врача-анестезиолога-реаниматолога, врача-кардиолога, врача-травматолога-ортопеда, врача-эндокринолога. В реальных условиях сосудистая команда может быть представлена различными комбинациями этих специалистов в зависимости от особенностей организационно-штатной структуры стационара. При отсутствии в стационаре сосудистой команды либо при отсутствии в сосудистой команде специалиста соответствующего профиля консультативная помощь может быть организована с использованием технологий телемедицины. При отсутствии в стационаре условий для выполнения вмешательства рекомендуется обсудить возможность перевода пациента в другой стационар, располагающий необходимыми для этого специалистами и техническими ресурсами.
Обеспечению преемственности в лечении пациента с КИНК после выписки из стационара способствуют:
- активное использование технологий телемедицины;
- создание единого регистра пациентов с КИНК;
- разработка документов, регламентирующих порядок оказания помощи пациентам с КИНК, с учетом организационно-штатной структуры отделений сердечно-сосудистой и рентгенэндоваскулярной хирургии в каждом регионе;
- объединение амбулаторных и стационарных отделений, участвующих в лечении больных обсуждаемой категории, в организационно единую структуру;
- разработка новых тарифов в рамках системы обязательного медицинского страхования, обеспечивающих выполнение хирургической обработки трофических изменений конечности и реконструктивно-пластических вмешательств (хирургическая обработка раны или инфицированной ткани, аутодермопластика) на стопе на базе амбулаторных учреждений и дневных стационаров.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Нет.
Критерии оценки качества медицинской помощи
N п/п
Критерии качества
Оценка выполнения
1
Пациентам с подтвержденным диагнозом КИНК при планировании реваскуляризации конечности (тромбэндартерэктомия аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирвание, стентирование артерий нижних конечнотей балонная ангиопластика периферической артерии) выполнены неинвазивные методы исследования (ультразвуковая допплерография артерий нижних конечностей, компьютерно-томаграфическая ангиография сосудов нижних конечностей, магнитно-резонансная ангиография с контрастированием (одна область)), а при их отсутствии - инвазивный метод исследования артерий (ангиография артерий нижней конечности прямая)
Да/Нет
2.
Пациентам с КИНК при стенооклюзирующих поражениях аорто-подвздошного, подколенно-берцового или инфрамаллеолярного сегмента выполнена открытая или эндоваскулярная реконструкция (тромбэндартерэктомия аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирвание, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии)
Да/Нет
3.
У пациентов с КИЕЖ и синдромом диабетической стопы выполнена срочная и первоочередная по отношению к реваскуляризации (аорто-глебокобедренное шунтирование, бедренно-подколенное шунтирование) условно-радикальная хирургическая обработка зоны трофических и инфекционно-воспалительных изменений (хирургическая обработка раны или инфицированной ткани) в ишемизированном сегменте конечности при наличии у пациента признаков системной воспалительной реакции (4 степень по IDSA, 3 степень по WIfI)
Да/Нет
4.
Пациентам с КИНК выполнен прием (осмотр, консультация) врача-хирурга первичный для рассмотрения выполнения высокой ампутации нижней конечности при наличии выраженных инфекционно-воспалительных изменений, требующих экстренной или срочной радикальной хирургической обработки (хирургическая обработка раны или инфицированной ткани) с пересечением костных структур проксимальнее голеностопного сустава или в тесной близости от него
Да/Нет
5
У пациентов с КИНК обеспечена преемственность лечения пациента при выполнении хирургической обработки зоны трофических и/или инфекционно-воспалнительных (хирургическая обработка раны или инфицированной ткани) изменений на базе другого отделения (медицинского учреждения) после реваскуляризации конечности (аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии)
Да/Нет
6.
Всем пациентам с КИНК назначена терапия статинами (ингибиторы ГМГ-КоА-C10AA)
Да/Нет
7.
Пациентам с КИНК после эндоваскулярных вмешательств (баллонная ангиопластика со стенитированием поверхностной бедренной артерии, баллонная ангиопластика со стенитированием подколенной артерии и магистральных артерий голени) назначена двойная антиагрегантная терапия ацетилсалициловой кислотой** и клопидогрелом**
Да/Нет
8.
У пациентов без высокого риска кровотечения после эндоваскулярной реваскуляризации нижних конечностей (баллонная ангиопластика со стентированием поверхностной бедренной артерии, баллонная ангиопластика со стентированием подколенной артерии и магистральных артерий голени) по поводу КИНК назначена двухкомпонентная терапия ацетилсалициловой кислотой** и ривароксабаном** в сочетании с краткосрочным применением клопидогрела** сроком до 1 месяца
Да/Нет
9.
У пациентов с подтвержденным диагнозом облитерирующего атеросклероза артерий нижних конечностей назначена монотерапия ацетилсалициловой кислотой** или двухкомпонентная ацетилсалициловой кислотой** и ривароксабаном**
Да/Нет
Список литературы
1. Altin S.E. et al. Seasonal variation in U.S. hospitalizations for chronic limb-threatening ischemia//Catheterization and Cardiovascular Interventions. John Wiley and Sons Inc, 2020. Vol. 96, N 7. P. 1473 - 1480.
2. Agarwal S., Sud K., Shishehbor M.H. Nationwide Trends of Hospital Admission and Outcomes among Critical Limb Ischemia Patients from 2003 - 2011//J Am Coll Cardiol. Elsevier USA, 2016. Vol. 67, N 16. P. 1901 - 1913.
3. Conte M.S. et al. Global vascular guidelines on the management of chronic limb-threatening ischemia//J Vasc Surg. Mosby Inc., 2019. Vol. 69, N 6. P. 3S - 125S.e40.
4. Lazarides M.K. et al. Diagnostic criteria and treatment of Buerger's disease: A review//International Journal of Lower Extremity Wounds. 2006. Vol. 5, N 2. P. 89 - 95.
5. Vanoli M. et al. Takayasu's arteritis: A study of 104 Italian patients//Arthritis Care Res (Hoboken). 2005. Vol. 53, N 1. P. 100 - 107.
6. Arnaud L. et al. Takayasu arteritis in France: A single-center retrospective study of 82 cases comparing white, North African, and black patients//Medicine. Lippincott Williams and Wilkins, 2010. Vol. 89, N 1. P. 1 - 17.
7. ![]() M. et al. Editor's Choice - European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2020. Vol. 59, N 2. P. 173 - 218.
M. et al. Editor's Choice - European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2020. Vol. 59, N 2. P. 173 - 218.
8. Magee R. et al. Growth and Risk Factors for Expansion of Dilated Popliteal Arteries//European Journal of Vascular and Endovascular Surgery. 2010. Vol. 39, N 5. P. 606 - 611.
9. Putko R.M. et al. SARS-CoV-2 and limb ischemia: A systematic review//Journal of Clinical Orthopaedics and Trauma. Elsevier B.V., 2021. Vol. 12, N 1. P. 194 - 199.
10. Mills J.L. et al. The society for vascular surgery lower extremity threatened limb classification system: Risk stratification based on Wound, Ischemia, and foot Infection (WIfI)//J Vasc Surg. Mosby Inc., 2014. Vol. 59, N 1.
11. Tyrrell M.R., Wolfe J.H.N. Critical leg ischaemia: an appraisal of clinical definitions. Joint Vascular Research Group//Br J Surg. Br J Surg, 1993. Vol. 80, N 2. P. 177 - 180.
12. Norgren L. et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II)//European Journal of Vascular and Endovascular Surgery. 2007. Vol. 33, N 1 SUPPL.
13. Lees T. et al. International variations in infrainguinal bypass surgery - A VASCUNET Report//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2012. Vol. 44, N 2. P. 185 - 192.
14. Kannel W.B. et al. Intermittent claudication. Incidence in the Framingham Study//Circulation. Circulation, 1970. Vol. 41, N 5. P. 875 - 883.
15. Brahmandam A. et al. Discrepancy in Outcomes after Revascularization for Chronic Limb-Threatening Ischemia Warrants Separate Reporting of Rest Pain and Tissue Loss//Ann Vasc Surg. Elsevier Inc., 2021. Vol. 70. P. 237 - 244.
16. Tsai F.W. et al. Skin perfusion pressure of the foot is a good substitute for toe pressure in the assessment of limb ischemia//J Vasc Surg. 2000. Vol. 32, N 1. P. 32 - 36.
17. Meloni M. et al. Prevalence, clinical aspects and outcomes in a large cohort of persons with diabetic foot disease: Comparison between neuropathic and ischemic ulcers//J Clin Med. MDPI, 2020. Vol. 9, N 6. P. 1 - 11.
18. Cranley J.J. Ischemic rest pain//Arch Surg. Arch Surg, 1969. Vol. 98, N 2. P. 187 - 188.
19. Provan. Pitfalls in the diagnosis of leg pain - PubMed [Electronic resource]. URL: https://pubmed.ncbi.nlm.nih.gov/229951/ (accessed: 23.02.2022).
20. Darling J.D. et al. Predictive ability of the Society for Vascular Surgery Wound, Ischemia, and foot Infection (WIfI) classification system following infrapopliteal endovascular interventions for critical limb ischemia//Journal of Vascular Surgery. Mosby Inc., 2016. Vol. 64, N 3. P. 616 - 622.
21. Yotsu R.R. et al. Comparison of characteristics and healing course of diabetic foot ulcers by etiological classification: Neuropathic, ischemic, and neuro-ischemic type//J Diabetes Complications. Elsevier Inc., 2014. Vol. 28, N 4. P. 528 - 535.
22. Gardner S.E., Frantz R.A. Wound bioburden and infection-related complications in diabetic foot ulcers//Biological Research for Nursing. 2008. Vol. 10, N 1. P. 44 - 53.
23. Dormandy J. et al. Prospective study of 713 below-knee amputations for ischaemia and the effect of a prostacyclin analogue on healing//British Journal of Surgery. 1994. Vol. 81. 33 - 37 p.
24. Criqui M.H. et al. The sensitivity, specificity, and predictive value of traditional clinical evaluation of peripheral arterial disease: results from noninvasive testing in a defined population//Circulation. Circulation, 1985. Vol. 71, N 3. P. 516 - 522.
25. Milne W.K., Worster A. Does the Clinical Examination Predict Lower Extremity Peripheral Arterial Disease?//Annals of Emergency Medicine. 2009. Vol. 54, N 5. P. 748 - 750.
26. Mcgee S.R., Boyko E.J. Physical Examination and Chronic Lower-Extremity Ischemia A Critical Review//Arch Intern Med. 1998. Vol. 158. 1357 - 1364 p.
27. Salaun P. et al. Comparison of Ankle Pressure, Systolic Toe Pressure, and Transcutaneous Oxygen Pressure to Predict Major Amputation After 1 Year in the COPART Cohort//Angiology. SAGE Publications Inc., 2019. Vol. 70, N 3. P. 229 - 236.
28. Met R. et al. Diagnostic performance of computed tomography angiography in peripheral arterial disease: a systematic review and meta-analysis//JAMA. JAMA, 2009. Vol. 301, N 4. P. 415 - 424.
29. Collins R. et al. A systematic review of duplex ultrasound, magnetic resonance angiography and computed tomography angiography for the diagnosis and assessment of symptomatic, lower limb peripheral arterial disease HTA Health Technology Assessment NHS R&D HTA Programme www.hta.ac.uk//Health Technol Assess (Rockv). 2007. Vol. 11, N 20.
30. Lapeyre M. et al. Assessment of critical limb ischemia in patients with diabetes: Comparison of MR angiography and digital subtraction angiography//American Journal of Roentgenology. 2005. Vol. 185, N 6. P. 1641 - 1650.
31. Sultan S., Tawfick W., Hynes N. Ten-year technical and clinical outcomes in TransAtlantic Inter-Society Consensus II infrainguinal C/D lesions using duplex ultrasound arterial mapping as the sole imaging modality for critical lower limb ischemia//J Vasc Surg. 2013. Vol. 57, N 4. P. 1038 - 1045.
32. Menke J., Larsen J. Meta-analysis: Accuracy of contrast-enhanced magnetic resonance angiography for assessing steno-occlusions in peripheral arterial disease//Ann Intern Med. Ann Intern Med, 2010. Vol. 153, N 5. P. 325 - 334.
33. Heijenbrok-Kal M.H., Kock M.C.J.M., Hunink M.G.M. Lower extremity arterial disease: Multidetector CT angiography - Meta-analysis//Radiology. 2007. Vol. 245, N 2. P. 433 - 439.
34. Seeger J.M., Schmidt J.H., Flynn T.C. Preoperative saphenous and cephalic vein mapping as an adjunct to reconstructive arterial surgery//Ann Surg. Ann Surg, 1987. Vol. 205, N 6. P. 733 - 739.
35. Soden P.A. et al. Regional variation in patient selection and treatment for lower extremity vascular disease in the Vascular Quality Initiative//Journal of Vascular Surgery. Mosby Inc., 2017. Vol. 65, N 1. P. 108 - 118.
36. Lee M.S. et al. Clinical Outcomes of Patients With Critical Limb Ischemia who Undergo Routine Coronary Angiography and Subsequent Percutaneous Coronary Intervention//J INVASIVE CARDIOL. 2015. Vol. 27, N 4. 213 - 217 p.
37. Nishijima A. et al. Coronary Artery Disease in Patients with Critical Limb Ischemia Undergoing Major Amputation or Not//Plast Reconstr Surg Glob Open. Lippincott Williams and Wilkins, 2017. Vol. 5, N 6.
38. Krievins D. et al. Diagnosis of silent coronary ischemia with selective coronary revascularization might improve 2-year survival of patients with critical limb-threatening ischemia//Journal of Vascular Surgery. Elsevier Inc., 2021. Vol. 74, N 4. P. 1261 - 1271.
39. Choi B.G. et al. Long-term outcomes of peripheral arterial disease patients with significant coronary artery disease undergoing percutaneous coronary intervention//PLoS One. Public Library of Science, 2021. Vol. 16, N 5 May.
40. Polyantsev A.A. et al. Vstrechaemost' erozivno-yazvennykh porazhenii zheludochno-kishechnogo trakta i krovotechenii u bol'nykh, operirovannykh na arteriyakh nizhnikh konechnostei po povodu kriticheskoi ishemii//Khirurgiia (Sofiia). NLM (Medline), 2021. N 7. P. 57 - 64.
41. Velescu A. et al. Anemia Increases Mortality after Open or Endovascular Treatment in Patients with Critical Limb Ischemia: A Retrospective Analysis//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2016. Vol. 51, N 4. P. 543 - 549.
42. Yun W.S. et al. Prevalence of asymptomatic critical carotid artery stenosis in korean patients with chronic atherosclerotic lower extremity ischemia: Is a screening carotid duplex ultrasonography worthwhile?//J Korean Med Sci. 2010. Vol. 25, N 8. P. 1167 - 1170.
43. Li Z. et al. Prevalence of asymptomatic carotid artery stenosis in Chinese patients with lower extremity peripheral arterial disease: A cross-sectional study on 653 patients//BMJ Open. BMJ Publishing Group, 2021. Vol. 11, N 4.
44. Aboyans V. et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS)//European Heart Journal. Oxford University Press, 2018. Vol. 39, N 9. P. 763 - 816.
45. Nickinson A.T.O. et al. A systematic review investigating the identification, causes, and outcomes of delays in the management of chronic limb-threatening ischemia and diabetic foot ulceration//Journal of Vascular Surgery. Mosby Inc., 2020. Vol. 71, N 2. P. 669 - 681.e2.
46. Hinchliffe R.J. et al. IWGDF guidance on the diagnosis, prognosis and management of peripheral artery disease in patients with foot ulcers in diabetes//Diabetes Metab Res Rev. John Wiley and Sons Ltd, 2016. Vol. 32. P. 37 - 44.
47. Hertzer N.R., Block P.C. PAD guidelines: ACC/AHA guidelines for the management of patients with peripheral arterial disease (lower extremity, renal mesenteric, and abdominal aortic)//ACC Cardiosource Review Journal. 2006. Vol. 15, N 5. P. 14 - 17.
48. Crawford. Aortoiliac occlusive disease: factors influencing survival and function following reconstructive operation over a twenty-five-year period - PubMed [Electronic resource]. URL: https://pubmed.ncbi.nlm.nih.gov/7313940/ (accessed: 23.02.2022).
49. Chiu K.W.H. et al. Review of Direct Anatomical Open Surgical Management of Atherosclerotic Aorto-Iliac Occlusive Disease//European Journal of Vascular and Endovascular Surgery. 2010. Vol. 39, N 4. P. 460 - 471.
50. Bosch J.L., Hunink M.G.M. Meta-analysis of the results of percutaneous transluminal angioplasty and stent placement for aortoiliac occlusive disease//Radiology. Radiology, 1997. Vol. 204, N 1. P. 87 - 96.
51.  . et al. Ricanalizzazione delle occlusioni trombotiche arteriose mediante trombectomia rotazionale//Radiologia Medica. 2011. Vol. 116, N 6. P. 932 - 944.
. et al. Ricanalizzazione delle occlusioni trombotiche arteriose mediante trombectomia rotazionale//Radiologia Medica. 2011. Vol. 116, N 6. P. 932 - 944.
52. Wissgott C., Kamusella P., Andresen R. Treatment of chronic occlusions of the iliac or femoropopliteal arteries with mechanical rotational catheters//RoFo Fortschritte auf dem Gebiet der Rontgenstrahlen und der Bildgebenden Verfahren. 2011. Vol. 183, N 10. P. 945 - 951.
53. Silingardi R. et al. Mechanical thrombectomy in in-stent restenosis: preliminary experience at the iliac and femoropopliteal arteries with the Rotarex System//J Cardiovasc Surg. 2010. Vol. 51, N 4. 543 - 50 p.
54. Nguyen B.N. et al. Postoperative complications after common femoral endarterectomy//Journal of Vascular Surgery. Mosby Inc., 2015. Vol. 61, N 6. P. 1489 - 1494.e1.
55. Siracuse J.J. et al. Endovascular treatment of the common femoral artery in the Vascular Quality Initiative//Journal of Vascular Surgery. Mosby Inc., 2017. Vol. 65, N 4. P. 1039 - 1046.
56. Malgor R.D. et al. Common femoral artery endarterectomy for lower-extremity ischemia: Evaluating the need for additional distal limb revascularization//Ann Vasc Surg. 2012. Vol. 26, N 7. P. 946 - 956.
57. Ballotta E. et al. Common femoral artery endarterectomy for occlusive disease: An 8-year single- center prospective study//Surgery. 2010. Vol. 147, N 2. P. 268 - 274.
58. Kang J.L. et al. Common femoral artery occlusive disease: Contemporary results following surgical endarterectomy//J Vasc Surg. Mosby Inc., 2008. Vol. 48, N 4.
59. Bonvini R.F. et al. Angioplasty and provisional stent treatment of common femoral artery lesions//Journal of Vascular and Interventional Radiology. 2013. Vol. 24, N 2. P. 175 - 183.
60. Deloose K. et al. Endovascular treatment for the common femoral artery: Is there a challenger to open surgery?//Journal of Cardiovascular Surgery. Edizioni Minerva Medica, 2019. Vol. 60, N P. 8 - 13.
61.  Y. et al. Stenting or Surgery for De Novo Common Femoral Artery Stenosis//JACC Cardiovasc Interv. Elsevier Inc., 2017. Vol. 10, N 13. P. 1344 - 1354.
Y. et al. Stenting or Surgery for De Novo Common Femoral Artery Stenosis//JACC Cardiovasc Interv. Elsevier Inc., 2017. Vol. 10, N 13. P. 1344 - 1354.
62. Linni K. et al. Bioabsorbable stent implantation vs. common femoral artery endarterectomy: Early results of a randomized trial//Journal of Endovascular Therapy. Allen Press Publishing Services, 2014. Vol. 21, N 4. P. 493 - 502.
63. Siracuse J.J. et al. Comparison of open and endovascular treatment of patients with critical limb ischemia in the Vascular Quality Initiative//Journal of Vascular Surgery. Mosby Inc., 2016. Vol. 63, N 4. P. 958 - 965.e1.
64. Humbarger O. et al. Broad variation in prosthetic conduit use for femoral-popliteal bypass is not justified on the basis of contemporary outcomes favoring autologous great saphenous vein//Journal of Vascular Surgery. Mosby Inc., 2019. Vol. 70, N 5. P. 1514 - 1523.e2.
65. SVS VQI 2016. SVS PSO PATIENT SAFETY ORGANIZATION 2016 Detailed Annual Report VASCULAR QUALITY INITIATIVE.
66. Swedvasc 2020. Nationella kvalitetsregistret  .
.
67. Davies M.G. et al. Impact of runoff on superficial femoral artery endoluminal interventions for rest pain and tissue loss//J Vasc Surg. Mosby Inc., 2008. Vol. 48, N 3.
68. Lee H.Y. et al. The effect of severe femoropopliteal arterial calcification on the treatment outcome of femoropopliteal intervention in patients with ischemic tissue loss//Vasc Specialist Int. Korean Society for Vascular Surgery, 2020. Vol. 36, N 2. P. 96 - 104.
69. Park U.J., Kim H.T., Roh Y.N. Impact of Tibial Runoff on Outcomes of Endovascular Treatment for Femoropopliteal Atherosclerotic Lesions//Vasc Endovascular Surg. SAGE Publications Inc., 2018. Vol. 52, N 7. P. 498 - 504.
70. Hiramori S. et al. Impact of runoff grade after endovascular therapy for femoropopliteal lesions//J Vasc Surg. 2014. Vol. 59, N 3. P. 720 - 727.
71. Tokuda T. et al. The Impact of Femoropopliteal Artery Calcium Score after Endovascular Treatment//Ann Vasc Surg. Elsevier Inc., 2020. Vol. 66. P. 543 - 553.
72. Smith B.M. et al. Subintimal angioplasty for superficial femoral artery occlusion: poor patency in critical ischaemia//Ann R Coll Surg Engl. Ann R Coll Surg Engl, 2005. Vol. 87, N 5. P. 361 - 365.
73. Bradbury A.W. et al. Multicentre randomised controlled trial of the clinical and cost-effectiveness of a bypass-surgery-first versus a balloon-angioplasty-first revascularisation strategy for severe limb ischaemia due to infrainguinal disease. The Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial//Health Technol Assess (Rockv). 2010. Vol. 14, N 14. P. 1 - 236.
74. Bradbury A.W. et al. Bypass versus angioplasty in severe ischaemia of the leg (BASIL): Multicentre, randomised controlled trial//Lancet. Elsevier B.V., 2005. Vol. 366, N 9501. P. 1925 - 1934.
75. Kodama A. et al. Editor's Choice - Relationship Between Global Limb Anatomic Staging System (GLASS) and Clinical Outcomes Following Revascularisation for Chronic Limb Threatening Ischaemia in the Bypass Versus Angioplasty in Severe Ischaemia of the Leg (BASIL)-1 Trial//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2020. Vol. 60, N 5. P. 687 - 695.
76. Bosiers M. et al. ZILVERPASS Study: ZILVER PTX Stent vs Bypass Surgery in Femoropopliteal Lesions//Journal of Endovascular Therapy. SAGE Publications Inc., 2020. Vol. 27, N 2. P. 287 - 295.
77. Enzmann F.K. et al. Nitinol Stent Versus Bypass in Long Femoropopliteal Lesions: 2-Year Results of a Randomized Controlled Trial//JACC Cardiovasc Interv. Elsevier Inc., 2019. Vol. 12, N 24. P. 2541 - 2549.
78. Farber A. et al. Surgery or Endovascular Therapy for Chronic Limb-Threatening Ischemia//N Engl J Med. N Engl J Med, 2022.
79. Ambler G.K., Twine C.P. Graft type for femoro-popliteal bypass surgery//Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2018. Vol. 2018, N 2.
80. Klinkert P. et al. Saphenous vein versus PTFE for above-knee femoropopliteal bypass. A review of the literature//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2004. Vol. 27, N 4. P. 357 - 362.
81. Nierlich P. et al. Alternative Venous Conduits for Below Knee Bypass in the Absence of Ipsilateral Great Saphenous Vein//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2020. Vol. 60, N 3. P. 403 - 409.
82. Nierlich P. et al. Arm Vein versus Small Saphenous Vein for Lower Extremity Bypass in the Absence of Both Great Saphenous Veins//Ann Vasc Surg. Elsevier Inc., 2021. Vol. 70. P. 341 - 348.
83. Faries P.L. et al. The use of arm vein in lower-extremity revascularization: results of 520 procedures performed in eight years//J Vasc Surg. J Vasc Surg, 2000. Vol. 31, N 1 Pt 1. P. 50 - 59.
84. Chew D.K.W. et al. Autogenous composite vein bypass graft for infrainguinal arterial reconstruction//J Vasc Surg. J Vasc Surg, 2001. Vol. 33, N 2. P. 259 - 265.
85. Chang B.B. et al. The use of spliced vein bypasses for infrainguinal arterial reconstruction//J Vasc Surg. J Vasc Surg, 1995. Vol. 21, N 3. P. 403 - 412.
86. Albers M. et al. Meta-analysis of allograft bypass grafting to infrapopliteal arteries//European Journal of Vascular and Endovascular Surgery. 2004. Vol. 28, N 5. P. 462 - 472.
87. Guevara-Noriega K.A., Lucar-Lopez G.A., Pomar J.L. Cryopreserved Allografts for Treatment of Chronic Limb-Threatening Ischemia in Patients Without Autologous Saphenous Veins//Ann Vasc Surg. Elsevier Inc., 2019. Vol. 60. P. 379 - 387.
88. Gisbertz S.S. et al. Remote endarterectomy versus supragenicular bypass surgery for long occlusions of the superficial femoral artery: Medium-term results of a randomized controlled trial (The REVAS trial)//Ann Vasc Surg. 2010. Vol. 24, N 8. P. 1015 - 1023.
89. Saaya S. et al. A prospective randomized trial on endovascular recanalization with stenting versus remote endarterectomy for the superficial femoral artery total occlusive lesions//J Vasc Surg. Elsevier Inc., 2022. Vol. 76, N 1. P. 158 - 164.
90. Mohapatra A. et al. Nationwide trends in drug-coated balloon and drug-eluting stent utilization in the femoropopliteal arteries//Journal of Vascular Surgery. Mosby Inc., 2020. Vol. 71, N 2. P. 560 - 566.
91. Rastan A. et al. Stent placement vs. balloon angioplasty for popliteal artery treatment: Two-year results of a prospective, multicenter, randomized trial//Journal of Endovascular Therapy. Allen Press Inc., 2015. Vol. 22, N 1. P. 22 - 27.
92. Laird J.R. et al. Nitinol stent implantation versus balloon angioplasty for lesions in the superficial femoral artery and proximal popliteal artery: Twelve-month results from the RESILIENT randomized trial//Circ Cardiovasc Interv. 2010. Vol. 3, N 3. P. 267 - 276.
93. Lammer J. et al. Sustained Benefit at 2 Years for Covered Stents Versus Bare-Metal Stents in Long SFA Lesions: The VIASTAR Trial//Cardiovasc Intervent Radiol. Springer New York LLC, 2015. Vol. 38, N 1. P. 25 - 32.
94. Bertges D.J. et al. Registry Assessment of Peripheral Interventional Devices objective performance goals for superficial femoral and popliteal artery peripheral vascular interventions//J Vasc Surg. Mosby Inc., 2021. Vol. 73, N 5. P. 1702 - 1714.e11.
95. Giannopoulos S. et al. Safety and Efficacy of Drug-Coated Balloon Angioplasty for the Treatment of Chronic Limb-Threatening Ischemia: A Systematic Review and Meta-Analysis//Journal of Endovascular Therapy. SAGE Publications Inc., 2020. Vol. 27, N 4. P. 647 - 657.
96. Dake M.D. et al. Durable Clinical Effectiveness with Paclitaxel-Eluting Stents in the Femoropopliteal Artery: 5-Year Results of the Zilver PTX Randomized Trial//Circulation. Lippincott Williams and Wilkins, 2016. Vol. 133, N 15. P. 1472 - 1483.
97. Gray W.A. et al. A polymer-coated, paclitaxel-eluting stent (Eluvia) versus a polymer-free, paclitaxel-coated stent (Zilver PTX) for endovascular femoropopliteal intervention (IMPERIAL): a randomised, non-inferiority trial//The Lancet. Lancet Publishing Group, 2018. Vol. 392, N 10157. P. 1541 - 1551.
98.  Y. et al. Efficacy of a Drug-Eluting Stent Versus Bare Metal Stents for Symptomatic Femoropopliteal Peripheral Artery Disease: Primary Results of the EMINENT Randomized Trial.//Circulation. 2022. P. 101161CIRCULATIONAHA122059606.
Y. et al. Efficacy of a Drug-Eluting Stent Versus Bare Metal Stents for Symptomatic Femoropopliteal Peripheral Artery Disease: Primary Results of the EMINENT Randomized Trial.//Circulation. 2022. P. 101161CIRCULATIONAHA122059606.
99. Bai H. et al. Comparison of Atherectomy to Balloon Angioplasty and Stenting for Isolated Femoropopliteal Revascularization//Ann Vasc Surg. Elsevier Inc., 2020. Vol. 69. P. 261 - 273.
100. Dippel E.J. et al. Randomized controlled study of excimer laser atherectomy for treatment of femoropopliteal in-stent restenosis: Initial results from the EXCITE ISR Trial (EXCImer laser randomized controlled study for treatment of FemoropopliTEal in-stent restenosis)//JACC Cardiovasc Interv. Elsevier Inc., 2015. Vol. 8, N 1. P. 92 - 101.
101. Moxey P.W. et al. Trends and outcomes after surgical lower limb revascularization in England//British Journal of Surgery. 2011. Vol. 98, N 10. P. 1373 - 1382.
102. Bluemn E.G. et al. Analysis of Thirty-Day Readmission after Infrainguinal Bypass//Ann Vasc Surg. Elsevier Inc., 2019. Vol. 61. P. 34 - 47.
103. Razavi M.K., Mustapha J.A., Miller L.E. Contemporary systematic review and meta-analysis of early outcomes with percutaneous treatment for infrapopliteal atherosclerotic disease//Journal of Vascular and Interventional Radiology. Elsevier Inc., 2014. Vol. 25, N 10. P. 1489 - 1496.e3.
104. Albers M. et al. Meta-analysis of popliteal-to-distal vein bypass grafts for critical ischemia//J Vasc Surg. Mosby Inc., 2006. Vol. 43, N 3.
105. Romiti M. et al. Meta-analysis of infrapopliteal angioplasty for chronic critical limb ischemia//J Vasc Surg. Mosby Inc., 2008. Vol. 47, N 5.
106. Kurianov P. et al. Popliteal Artery Angioplasty for Chronic Total Occlusions with versus without the Distal Landing Zone//Ann Vasc Surg. Ann Vasc Surg, 2020. Vol. 68. P. 417 - 425.
107. Bradbury A.W. et al. A vein bypass first versus a best endovascular treatment first revascularisation strategy for patients with chronic limb threatening ischaemia who required an infra-popliteal, with or without an additional more proximal infra-inguinal revascularisation procedure to restore limb perfusion (BASIL-2): an open-label, randomised, multicentre, phase 3 trial//Lancet. Lancet, 2023. Vol. 401, N 10390. P. 1798 - 1809.
108. Dalmia V. et al. Impact of tibial bypass conduit on long-term amputation-free survival and primary patency in the Vascular Quality Initiative//J Vasc Surg. Elsevier BV, 2021.
109. Albers M. et al. Meta-analysis of allograft bypass grafting to infrapopliteal arteries//European Journal of Vascular and Endovascular Surgery. 2004. Vol. 28, N 5. P. 462 - 472.
110. Albers M. et al. Meta-analysis of polytetrafluoroethylene bypass grafts to infrapopliteal arteries//J Vasc Surg. Mosby Inc., 2003. Vol. 37, N 6. P. 1263 - 1269.
111. Sigala F. et al. Long-term outcomes following 282 consecutive cases of infrapopliteal PTA and association of risk factors with primary patency and limb salvage//Vasc Endovascular Surg. 2012. Vol. 46, N 2. P. 123 - 130.
112. Hsu C.C.T. et al. Angioplasty versus stenting for infrapopliteal arterial lesions in chronic limb-threatening ischaemia//Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2018. Vol. 2018, N 12.
113. Wu R. et al. Drug-eluting balloon versus standard percutaneous transluminal angioplasty in infrapopliteal arterial disease: A meta-analysis of randomized trials//International Journal of Surgery. Elsevier Ltd, 2016. Vol. 35. P. 88 - 94.
114. Zia S. et al. Contemporary outcomes of infrapopliteal atherectomy with angioplasty versus balloon angioplasty alone for critical limb ischemia//Journal of Vascular Surgery. Mosby Inc., 2020. Vol. 71, N 6. P. 2056 - 2064.
115. Kokkinidis D.G. et al. Laser Atherectomy for Infrapopliteal Lesions in Patients With Critical Limb Ischemia//Cardiovascular Revascularization Medicine. Elsevier Inc., 2021. Vol. 23. P. 79 - 83.
116. Zhang J. et al. Systematic Review and Meta-Analysis of Drug-Eluting Balloon and Stent for Infrapopliteal Artery Revascularization//Vascular and Endovascular Surgery. SAGE Publications Inc., 2017. Vol. 51, N 2. P. 72 - 83.
117. Ascer E., Veith F.J., Affiliations G. Bypasses to plantar arteries and other tibial branches: an extended approach to limb salvage//J Vasc Surg![]() . 1988. Vol. 8, N 4. 434 - 475 p.
. 1988. Vol. 8, N 4. 434 - 475 p.
118. Hughes K. et al. Bypass to plantar and tarsal arteries: An acceptable approach to limb salvage//J Vasc Surg. 2004. Vol. 40, N 6. P. 1149 - 1157.
119. Brochado-Neto F.C. et al. Vein bypasses to branches of pedal arteries//J Vasc Surg. 2012. Vol. 55, N 3. P. 746 - 752.
120. Machin M. et al. Systematic review of inframalleolar endovascular interventions and rates of limb salvage, wound healing, restenosis, rest pain, reintervention and complications//Vascular. SAGE Publications Ltd, 2021.
121. Jung H.W. et al. Editor's Choice - Impact of Endovascular Pedal Artery Revascularisation on Wound Healing in Patients With Critical Limb Ischaemia//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2019. Vol. 58, N 6. P. 854 - 863.
122. Teymen B.,  S. Comparison of drug eluting balloon angioplasty to infrapopliteal artery critical lesions with or without additional pedal artery angioplasty in patients with diabetes mellitus and critical limb ischemia//J Interv Cardiol. Blackwell Publishing Inc., 2018. Vol. 31, N 3. P. 400 - 406.
S. Comparison of drug eluting balloon angioplasty to infrapopliteal artery critical lesions with or without additional pedal artery angioplasty in patients with diabetes mellitus and critical limb ischemia//J Interv Cardiol. Blackwell Publishing Inc., 2018. Vol. 31, N 3. P. 400 - 406.
123. Nakama T. et al. Clinical Outcomes of Pedal Artery Angioplasty for Patients With Ischemic Wounds: Results From the Multicenter RENDEZVOUS Registry//JACC Cardiovasc Interv. Elsevier Inc., 2017. Vol. 10, N 1. P. 79 - 90.
124. Ho V.T. et al. Open, percutaneous, and hybrid deep venous arterialization technique for no-option foot salvage//Journal of Vascular Surgery. Mosby Inc., 2020. Vol. 71, N 6. P. 2152 - 2160.
125. Lu X.W. et al. Meta-analysis of the Clinical Effectiveness of Venous Arterialization for Salvage of Critically Ischaemic Limbs//European Journal of Vascular and Endovascular Surgery. 2006. Vol. 31, N 5. P. 493 - 499.
126. Schmidt A. et al. Midterm Outcomes of Percutaneous Deep Venous Arterialization With a Dedicated System for Patients With No-Option Chronic Limb-Threatening Ischemia: The ALPS Multicenter Study//Journal of Endovascular Therapy. SAGE Publications Inc., 2020. Vol. 27, N 4. P. 658 - 665.
127. Schreve M.A. et al. Venous Arterialisation for Salvage of Critically Ischaemic Limbs: A Systematic Review and Meta-Analysis//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2017. Vol. 53, N 3. P. 387 - 402.
128. Pokrovskii A et al. Arterialization of venous blood flow in the foot in the treatment of severe ischemia in patients with crural arterial occlusions and non-functioning plantar arch [Electronic resource]//Khirurgia (Mosk). 1990. P. 35 - 42. URL: https://pubmed.ncbi.nlm.nih.gov/2391935/ (accessed: 10.03.2023).
129. Acin F. et al. Primary nitinol stenting in femoropopliteal occlusive disease: a meta-analysis of randomized controlled trials//J Endovasc Ther. J Endovasc Ther, 2012. Vol. 19, N 5. P. 585 - 595.
130. Alexandrescu V.A. et al. Healing of Diabetic Neuroischemic Foot Wounds With vs Without Wound-Targeted Revascularization: Preliminary Observations From an 8-Year Prospective Dual-Center Registry//Journal of Endovascular Therapy. SAGE Publications Inc., 2020. Vol. 27, N 1. P. 20 - 30.
131. Fossaceca R. et al. Endovascular treatment of diabetic foot in a selected population of patients with below-the-knee disease: Is the angiosome model effective?//Cardiovasc Intervent Radiol. 2013. Vol. 36, N 3. P. 637 - 644.
132. Jeon E.Y. et al. Clinical outcome of angiosome-oriented infrapopliteal percutaneous transluminal angioplasty for isolated infrapopliteal lesions in patients with critical limb ischemia//Diagnostic and Interventional Radiology. AVES Ibrahim Kara, 2016. Vol. 22, N 1. P. 52 - 58.
133. Iida O. et al. Importance of the angiosome concept for endovascular therapy in patients with critical limb ischemia//Catheterization and Cardiovascular Interventions. 2010. Vol. 75, N 6. P. 830 - 836.
134. de Athayde Soares R. et al. Concept of Angiosome Does Not Affect Limb Salvage in Infrapopliteal Angioplasty//Ann Vasc Surg. Elsevier Inc., 2016. Vol. 32. P. 34 - 40.
135.  M. et al. Angiosome-targeted infrapopliteal endovascular revascularization for treatment of diabetic foot ulcers//J Vasc Surg. 2013. Vol. 57, N 2. P. 427 - 435.
M. et al. Angiosome-targeted infrapopliteal endovascular revascularization for treatment of diabetic foot ulcers//J Vasc Surg. 2013. Vol. 57, N 2. P. 427 - 435.
136. Kurianov P. et al. Propensity-matched analysis does not support angiosome-guided revascularization of multilevel peripheral artery disease (PAD)//Vasc Med. Vasc Med, 2022. Vol. 27, N 1. P. 47 - 54.
137. ![]() F. et al. Results of infrapopliteal endovascular procedures performed in diabetic patients with critical limb ischemia and tissue loss from the perspective of an angiosome-oriented revascularization strategy//Int J Vasc Med. 2014. Vol. 2014.
F. et al. Results of infrapopliteal endovascular procedures performed in diabetic patients with critical limb ischemia and tissue loss from the perspective of an angiosome-oriented revascularization strategy//Int J Vasc Med. 2014. Vol. 2014.
138. Ebaugh J.L. et al. Comparison of costs of staged versus simultaneous lower extremity arterial hybrid procedures//Am J Surg. 2008. Vol. 196, N 5. P. 634 - 640.
139. Fereydooni A. et al. Rapid increase in hybrid surgery for the treatment of peripheral artery disease in the Vascular Quality Initiative database//J Vasc Surg. Mosby Inc., 2020. Vol. 72, N 3. P. 977 - 986.e1.
140. Ray F.S. et al. Femoropopliteal saphenous vein bypass grafts. Analysis of 150 cases//Am J Surg. Am J Surg, 1970. Vol. 119, N 4. P. 385 - 391.
141. Chang R.W. et al. Long-term results of combined common femoral endarterectomy and iliac stenting/stent grafting for occlusive disease//J Vasc Surg. 2008. Vol. 48, N 2. P. 362 - 367.
142. Zavatta M., Mell M.W. A national Vascular Quality Initiative database comparison of hybrid and open repair for aortoiliac-femoral occlusive disease//J Vasc Surg. Mosby Inc., 2018. Vol. 67, N P. 199 - 205.e1.
143. Starodubtsev V. et al. Better treatment option in chronic superficial femoral artery occlusive disease: comparison of methods (meta-analysis)//J Cardiovasc Thorac Res. Maad Rayan Publishing Company, 2019. Vol. 11, N 3. P. 224 - 229.
144. Mccoy D.M. et al. The role of isolated profundaplasty for the treatment of rest pain//Arch Surg. Arch Surg, 1989. Vol. 124, N 4. P. 441 - 444.
145. Fugger R. et al. The Place of Profundaplasty in the Surgical Treatment of Superficial Femoral Artery Occlusion//EurJ Vasc Surg. 1987. Vol. 1. 187 - 191 p.
146. Jamil Z. et al. Revascularization of the profunda femoris artery for limb salvage//Am Surg. Am Surg, 1984. Vol. 50, N 2. P. 109 - 111.
147. Akamatsu D. et al. Efficacy of iliac inflow repair in patients with concomitant iliac and superficial femoral artery occlusive disease//Asian J Surg. Elsevier (Singapore) Pte Ltd, 2017. Vol. 40, N 6. P. 475 - 480.
148. Barral X. et al. Bypass to the perigeniculate collateral vessels. A useful technique for limb salvage: preliminary report on 22 patients//J Vasc Surg. J Vasc Surg, 1998. Vol. 27, N 5. P. 928 - 935.
149. de Latour B. et al. Bypass to the Perigeniculate Collateral Arteries: Mid-term Results//European Journal of Vascular and Endovascular Surgery. 2008. Vol. 35, N 4. P. 473 - 479.
150. de Luccia N. et al. Limb salvage using bypass to the perigeniculate arteries//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2011. Vol. 42, N 3. P. 374 - 378.
151. Kang G. Endovascular approach to iliac artery stenosis and restenosis//Indian Heart Journal. Elsevier B.V., 2015. Vol. 67, N 6. P. 514 - 517.
152. Bekken J.A. et al. Covered Stents vs. Angioplasty for Common Iliac Artery In Stent Restenosis: A Retrospective Comparison//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2021.
153. Tsetis D. et al. Preliminary Experience With Cutting Balloon Angioplasty for Iliac Artery In-Stent Restenosis//J Endovasc Ther. 2008. Vol. 15. 193 - 202 p.
154. Stahlhoff S. et al. Drug-eluting vs standard balloon angioplasty for iliac stent restenosis: Midterm results//Journal of Endovascular Therapy. Allen Press Inc., 2015. Vol. 22, N 3. P. 314 - 318.
155. Cassese S. et al. Drug-coated balloon angioplasty for femoropopliteal in-stent restenosis: The repair cooperation: A meta-analysis of inpidual participant data from 3 randomized trials//Circ Cardiovasc Interv. Lippincott Williams and Wilkins, 2018. Vol. 11, N 12.
156.  P. et al. Drug-Coated versus Plain Balloon Angioplasty in Bypass Vein Grafts (the DRECOREST I-Study)//Ann Vasc Surg. Elsevier Inc., 2019. Vol. 55. P. 36 - 44.
P. et al. Drug-Coated versus Plain Balloon Angioplasty in Bypass Vein Grafts (the DRECOREST I-Study)//Ann Vasc Surg. Elsevier Inc., 2019. Vol. 55. P. 36 - 44.
157. Orioli L. et al. Prevalence, Characteristics, and Prognosis of Peripheral Arterial Disease in Patients With Diabetic Charcot Foot//Journal of Foot and Ankle Surgery. Academic Press Inc., 2021. Vol. 60, N 6. P. 1158 - 1163.
158. Wukich D.K., Raspovic K.M., Suder N.C. Prevalence of Peripheral Arterial Disease in Patients With Diabetic Charcot Neuroarthropathy//Journal of Foot and Ankle Surgery. Academic Press Inc., 2016. Vol. 55, N 4. P. 727 - 731.
159. Waibel F.W. et al. Treatment Failures in Diabetic Foot Osteomyelitis Associated with Concomitant Charcot Arthropathy: The Role of Underlying Arteriopathy//International Journal of Infectious Diseases. Elsevier B.V., 2022. Vol. 114. P. 15 - 20.
160. Cates N.K. et al. Peripheral Vascular Disease Diagnostic Related Outcomes in Diabetic Charcot Reconstruction//Journal of Foot and Ankle Surgery. Academic Press Inc., 2019. Vol. 58, N 6. P. 1058 - 1063.
161.  , Sincer., Erdal E. Catheter-directed intra-arterial thrombolysis for lower extremity arterial occlusions//Anatolian Journal of Cardiology. Turkish Society of Cardiology, 2019. Vol. 22, N 2. P. 54 - 59.
, Sincer., Erdal E. Catheter-directed intra-arterial thrombolysis for lower extremity arterial occlusions//Anatolian Journal of Cardiology. Turkish Society of Cardiology, 2019. Vol. 22, N 2. P. 54 - 59.
162. Vanheer R. et al. A comprehensive report of long-term outcomes after catheter-directed thrombolysis for occluded infrainguinal bypass grafts//J Vasc Surg. Mosby Inc., 2019. Vol. 70, N 4. P. 1205 - 1216.
163. Schrijver A.M. et al. Long-Term Outcomes of Catheter-Directed Thrombolysis for Acute Lower Extremity Occlusions of Native Arteries and Prosthetic Bypass Grafts//Ann Vasc Surg. Elsevier Inc., 2016. Vol. 31. P. 134 - 142.
164. Kuoppala M.,  , Acosta S. Outcome after thrombolysis for occluded endoprosthesis, bypasses and native arteries in patients with lower limb ischemia//Thromb Res. Elsevier Ltd, 2014. Vol. 134, N 1. P. 23 - 28.
, Acosta S. Outcome after thrombolysis for occluded endoprosthesis, bypasses and native arteries in patients with lower limb ischemia//Thromb Res. Elsevier Ltd, 2014. Vol. 134, N 1. P. 23 - 28.
165. Comerota A.J. et al. Results of a prospective, randomized trial of surgery versus thrombolysis for occluded lower extremity bypass grafts//Am J Surg. Am J Surg, 1996. Vol. 172, N 2. P. 105 - 112.
166. Weaver F.A. et al. Surgical revascularization versus thrombolysis for nonembolic lower extremity native artery occlusions: results of a prospective randomized trial. The STILE Investigators. Surgery versus Thrombolysis for Ischemia of the Lower Extremity//J Vasc Surg. J Vasc Surg, 1996. Vol. 24, N 4. P. 513 - 523.
167. Consensus on thrombolysis. Thrombolysis in the Management of Lower Limb Peripheral Arterial Occlusion-A Consensus Document* Working Party on Thrombolysis in the Management of Limb Ischemia ![]() DEFINITION AND OBJECTIVE OF THROMBOLYTIC TREATMENT.
DEFINITION AND OBJECTIVE OF THROMBOLYTIC TREATMENT.
168. Giannakakis S. et al. Thrombolysis in peripheral artery disease//Therapeutic Advances in Cardiovascular Disease. SAGE Publications Ltd, 2017. Vol. 11, N 4. P. 125 - 132.
169. Woo K. et al. Use of completion imaging during infrainguinal bypass in the Vascular Quality Initiative//J Vasc Surg. Mosby Inc., 2015. Vol. 61, N 5. P. 1258 - 1263.
170. Woo K. et al. Outcomes of completion imaging for lower extremity bypass in the Vascular Quality Initiative//Journal of Vascular Surgery. Mosby Inc., 2015. Vol. 62, N 2. P. 412 - 416.
171. Normahani P. et al. Applications of intraoperative Duplex ultrasound in vascular surgery: a systematic review//Ultrasound Journal. Springer-Verlag Italia s.r.l., 2021. Vol. 13, N 1.
172. Lipsky B.A. et al. 2012 infectious diseases society of America clinical practice guideline for the diagnosis and treatment of diabetic foot infections//Clinical Infectious Diseases. 2012. Vol. 54, N 12.
173. Vas P.R.J. et al. The Diabetic Foot Attack: "'Tis Too Late to Retreat!"//International Journal of Lower Extremity Wounds. SAGE Publications Inc., 2018. Vol. 17, N 1. P. 7 - 13.
174. Tan J.S. et al. Can Aggressive Treatment of Diabetic Foot Infections Reduce the Need for Above-Ankle Amputation?//Clinical Infectious Diseases. 1996. Vol. 23. 286-91 p.
175. Faglia E. et al. The Role of Early Surgical Debridement and Revascularization in Patients With Diabetes and Deep Foot Space Abscess: Retrospective Review of 106 Patients With Diabetes//Journal of Foot and Ankle Surgery. 2006. Vol. 45, N 4. P. 220 - 226.
176. Shannon A.H. et al. Impact of the Timing of Foot Tissue Resection on Outcomes in Patients Undergoing Revascularization for Chronic Limb-Threatening Ischemia//Angiology. SAGE Publications Inc., 2021. Vol. 72, N 2. P. 159 - 165.
177. Shiraki T. et al. Predictors of delayed wound healing after endovascular therapy of isolated infrapopliteal lesions underlying critical limb ischemia in patients with high prevalence of diabetes mellitus and hemodialysis//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2015. Vol. 49, N 5. P. 565 - 573.
178. Flores A.M. et al. Benefit of multidisciplinary wound care center on the volume and outcomes of a vascular surgery practice//Journal of Vascular Surgery. Mosby Inc., 2019. Vol. 70, N 5. P. 1612 - 1619.
179. Haug V. et al. Combined (endo-)vascular intervention and microsurgical lower extremity free flap reconstruction-A propensity score matching analysis in 5386 ACS-NSQIP patients//Journal of Plastic, Reconstructive and Aesthetic Surgery. Churchill Livingstone, 2021. Vol. 74, N 5. P. 1031 - 1040.
180. Randon C. et al. A 15-Year Experience with Combined Vascular Reconstruction and Free Flap Transfer for Limb-Salvage//European Journal of Vascular and Endovascular Surgery. 2009. Vol. 38, N 3. P. 338 - 345.
181. Baumeister S. et al. Stellenwert der plastischen chirurgie im interdisziplin ren therapiekonzept diabetischer ulzera am fu//Deutsche Medizinische Wochenschrift. 2004. Vol. 129, N 13. P. 676 - 680.
182. Clerici G. et al. The use of a dermal substitute to preserve maximal foot length in diabetic foot wounds with tendon and bone exposure following urgent surgical debridement for acute infection Dermal substitute for diabetic foot wounds//International Wound Journal -. 2010. Vol. 7, N 3. 176 - 183 p.
183. Blume P.A. et al. Comparison of Negative Pressure Wound Therapy Using Vacuum-Assisted Closure With Advanced Moist Wound Therapy in the Treatment of Diabetic Foot Ulcers A multicenter randomized controlled trial. 2008.
184. Attinger C.E. et al. The role of intrinsic muscle flaps of the foot for bone coverage in foot and ankle defects in diabetic and nondiabetic patients//Plast Reconstr Surg. Plast Reconstr Surg, 2002. Vol. 110, N 4. P. 1047 - 1054.
185. Gkotsoulias E. Split Thickness Skin Graft of the Foot and Ankle Bolstered With Negative Pressure Wound Therapy in a Diabetic Population: The Results of a Retrospective Review and Review of the Literature//Foot Ankle Spec. SAGE Publications Ltd, 2020. Vol. 13, N 5. P. 383 - 391.
186. OHTAS-NPWT. Negative Pressure Wound Therapy An EvidenceBased Analysis. 2006.
187. Tukiainen E., Biancari F., Lep ntalo M. Lower limb revascularization and free flap transfer for major ischemic tissue loss//World J Surg. 2000. Vol. 24, N 12. P. 1531 - 1536.
188. Igari K. et al. Combined Arterial Reconstruction and Free Tissue Transfer for Patients with Critical Limb Ischemia//Ann Vasc Dis. The Editorial Committee of Annals of Vascular Diseases, 2013. Vol. 6, N 4. P. 706 - 710.
189. Li X. et al. Reconstruction of the foot and ankle using pedicled or free flaps: Perioperative flap survival analysis//PLoS One. Public Library of Science, 2016. Vol. 11, N 12.
190. Kallio M. et al. Strategies for Free Flap Transfer and Revascularisation with Long-term Outcome in the Treatment of Large Diabetic Foot Lesions//European Journal of Vascular and Endovascular Surgery. W.B. Saunders Ltd, 2015. Vol. 50, N 2. P. 223 - 230.
191. Oh T.S., Lee H.S., Hong J.P. Diabetic foot reconstruction using free flaps increases 5-year-survival rate//Journal of Plastic, Reconstructive and Aesthetic Surgery. 2013. Vol. 66, N 2. P. 243 - 250.
192. Silva L.R. et al. Results of One-Stage or Staged Amputations of Lower Limbs Consequent to Critical Limb Ischemia and Infection//Ann Vasc Surg. Elsevier Inc., 2018. Vol. 46. P. 218 - 225.
193. Cheun T.J. et al. Short-term contemporary outcomes for staged versus primary lower limb amputation in diabetic foot disease//Journal of Vascular Surgery. Mosby Inc., 2020. Vol. 72, N P. 658 - 666.e2.
194. Tsvetkov V.O. et al. Two-phase amputation among critically ill patients with ischemic gangrene of lower limbs as a way to improve treatment outcome. Cohort study//Annals of Medicine and Surgery. Elsevier Ltd, 2020. Vol. 60. P. 587 - 591.
195. Fisher D.F. et al. One-stage versus two-stage amputation for wet gangrene of the lower extremity: A randomized study//J Vasc Surg. Elsevier BV, 1988. Vol. 8, N 4. P. 428 - 433.
196. Mcintyre K.E. et al. Guillotine Amputation in the Treatment of Nonsalvageable Lower-Extremity Infections. 1983.
197. Chopra A. et al. Ambulation and functional outcome after major lower extremity amputation//J Vasc Surg. Mosby Inc., 2018. Vol. 67, N 5. P. 1521 - 1529.
198. Suckow B.D. et al. Comparison of graft patency, limb salvage, and antithrombotic therapy between prosthetic and autogenous below-knee bypass for critical limb ischemia//Annals of Vascular Surgery. Elsevier Inc., 2013. Vol. 27, N 8. P. 1134 - 1145.
199. J rgensen H.R.I. et al. Selection of amputation level in ischemia: Skin blood flow and perfusion pressure equally predictive//Acta Orthop. Informa Healthcare, 1990. Vol. 61, N 1. P. 62 - 65.
200. Dowd. Predicting stump healing following amputation for peripheral vascular disease using the transcutaneous oxygen monitor - PubMed [Electronic resource]. URL: https://pubmed.ncbi.nlm.nih.gov/3566115/ (accessed: 23.02.2022).
201.  , Rakovec S.,
, Rakovec S.,  . Determination of amputation level in ischaemic limbs using tcPO2 measurement//Vasa - Journal of Vascular Diseases. 2005. Vol. 34, N 2. P. 108 - 112.
. Determination of amputation level in ischaemic limbs using tcPO2 measurement//Vasa - Journal of Vascular Diseases. 2005. Vol. 34, N 2. P. 108 - 112.
202. Karkos C.D. et al. Subintimal recanalization of the femoropopliteal segment to promote healing of an ulcerated below-knee amputation stump//J Endovasc Ther. J Endovasc Ther, 2006. Vol. 13, N P. 420 - 423.
203. Ichihashi S. et al. Percutaneous deep venous arterialization at femoropopliteal segment for unhealed amputated stump ulcer after below the knee amputation//Catheterization and Cardiovascular Interventions. John Wiley and Sons Inc, 2021. Vol. 98, N 1. P. E124 - E126.
204. Poi M.J. et al. Percutaneous profunda femoris artery revascularization to prevent hip disarticulation: case series and review of the literature//Am J Surg. Am J Surg, 2012. Vol. 204, N 5. P. 649 - 654.
205. Manouguian S. [Revascularization of the profunda femoris artery in ischemia of the stump after above knee amputation]//Zentralbl Chir. Zentralbl Chir, 2001. Vol. 126, N 2. P. 157 - 160.
206. Sanni A., Hamid A., Dunning J. Is sympathectomy of benefit in critical leg ischaemia not amenable to revascularisation?//Interact Cardiovasc Thorac Surg. 2005. Vol. 4, N 5. P. 478 - 483.
207. Ubbink D.T., Vermeulen H. Spinal cord stimulation for non-reconstructable chronic critical leg ischaemia//Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2013. Vol. 2013, N 2.
208. Vietto V. et al. Prostanoids for critical limb ischaemia//Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2018. Vol. 2018, N 1.
209. Brande. Intravenous pentoxifylline for the treatment of chronic critical limb ischaemia. The European Study Group//Eur J Vasc Endovasc Surg. Eur J Vasc Endovasc Surg, 1995. Vol. 9, N P. 426 - 436.
210. Myhre H.O. et al. Efficacy and clinical tolerance of parenteral pentoxifylline in the treatment of critical lower limb ischemia. A placebo controlled multicenter study. Norwegian Pentoxifylline Multicenter Trial Group//Int Angiol. Int Angiol, 1996. Vol. 15, N 1. P. 75 - 80.
211. Forster R. et al. Gene therapy for peripheral arterial disease//Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2018. Vol. 2018, N 10.
212. Houghton J.S. et al. Associations of Clinical Frailty with Severity of Limb Threat and Outcomes in Chronic Limb-threatening Ischaemia//Ann Vasc Surg. Elsevier Inc., 2021. Vol. 76. P. 406 - 416.
213. Ruemenapf G., Morbach S., Sigl M. Therapeutic Alternatives in Diabetic Foot Patients without an Option for Revascularization: A Narrative Review//Journal of Clinical Medicine. MDPI, 2022. Vol. 11, N 8.
214. Sibona A. et al. A single center's 15-year experience with palliative limb care for chronic limb threatening ischemia in frail patients//Journal of Vascular Surgery. Elsevier Inc., 2022. Vol. 75, N 3. P. 1014 - 1020.e1.
215. Suckow B.D. et al. Predicting functional status following amputation after lower extremity bypass//Annals of Vascular Surgery. 2012. Vol. 26, N 1. P. 67 - 78.
216. Webster J.B. et al. Prosthetic fitting, use, and satisfaction following lower-limb amputation: A prospective study//J Rehabil Res Dev. 2012. Vol. 49, N 10. P. 1493 - 1504.
217. Catalano M. et al. Prevention of serious vascular events by aspirin amongst patients with peripheral arterial disease: randomized, double-blind trial//J Intern Med. J Intern Med, 2007. Vol. 261, N 3. P. 276 - 284.
218. Anand S.S. et al. Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease: an international, randomised, double-blind, placebo-controlled trial//The Lancet. Lancet Publishing Group, 2018. Vol. 391, N 10117. P. 219 - 229.
219. Willems L.H. et al. Antithrombotic Therapy for Symptomatic Peripheral Arterial Disease: A Systematic Review and Network Meta-Analysis//Drugs. Drugs, 2022. Vol. 82, N 12. P. 1287 - 1302.
220. Bonaca M.P. et al. Rivaroxaban in Peripheral Artery Disease after Revascularization//New England Journal of Medicine. Massachusetts Medical Society, 2020. Vol. 382, N 21. P. 1994 - 2004.
221. Hiatt W.R. et al. Rivaroxaban and Aspirin in Peripheral Artery Disease Lower Extremity Revascularization: Impact of Concomitant Clopidogrel on Efficacy and Safety//Circulation. Circulation, 2020. Vol. 142, N 23. P. 2219 - 2230.
222. Tepe G. et al. Management of peripheral arterial interventions with mono or dual antiplatelet therapy--the MIRROR study: a randomised and double-blinded clinical trial//Eur Radiol. Eur Radiol, 2012. Vol. 22, N 9. P. 1998 - 2006.
223. Belch J.J.F., Dormandy J. Results of the randomized, placebo-controlled clopidogrel and acetylsalicylic acid in bypass surgery for peripheral arterial disease (CASPAR) trial//J Vasc Surg. Mosby Inc., 2010. Vol. 52, N 4. P. 825 - 833.e2.
224. Tangelder M.J.D. et al. Efficacy of oral anticoagulants compared with aspirin after infrainguinal bypass surgery (The Dutch Bypass Oral anticoagulants or Aspirin study): A randomised trial//Lancet. Elsevier B.V., 2000. Vol. 355, N 9201. P. 346 - 351.
225. Johnson W.C., Williford W.O. Benefits, morbidity, and mortality associated with long-term administration of oral anticoagulant therapy to patients peripheral arterial bypass procedures: A prospective randomized study//J Vasc Surg. Mosby Inc., 2002. Vol. 35, N 3. P. 413 - 421.
226. Sarac T.P. et al. Warfarin improves the outcome of infrainguinal vein bypass grafting at high risk for failure//J Vasc Surg. J Vasc Surg, 1998. Vol. 28, N 3. P. 446 - 457.
227. Willigendael E.M. et al. Smoking and the patency of lower extremity bypass grafts: A meta-analysis//J Vasc Surg. Mosby Inc., 2005. Vol. 42, N 1. P. 67 - 74.
228. Henke P.K. et al. Patients undergoing infrainguinal bypass to treat atherosclerotic vascular disease are underprescribed cardioprotective medications: Effect on graft patency, limb salvage, and mortality//J Vasc Surg. Mosby Inc., 2004. Vol. 39, N 2. P. 357 - 365.
229. Abbruzzese T.A. et al. Statin therapy is associated with improved patency of autogenous infrainguinal bypass grafts//J Vasc Surg. 2004. Vol. 39, N 6. P. 1178 - 1185.
230. Tomoi Y. et al. Efficacy of statin treatment after endovascular therapy for isolated below-the-knee disease in patients with critical limb ischemia//Cardiovasc Interv Ther. 2013. Vol. 28, N 4. P. 374 - 382.
231. Davies A.H. et al. Is duplex surveillance of value after leg vein bypass grafting? Principal results of the vein graft surveillance randomised trial (VGST)//Circulation. 2005. Vol. 112, N 13. P. 1985 - 1991.
232. Lundell A. et al. Femoropopliteal-crural graft patency is improved by an intensive surveillance program: A prospective randomized study//Swedish Medical Research Council. Vol. 00759.
233. Ihlberg L. et al. The utility of duplex scanning in infrainguinal vein graft surveillance: results from a randomised controlled study//Eur J Vasc Endovasc Surg. Eur J Vasc Endovasc Surg, 1998. Vol. 16, N 1. P. 19 - 27.
234. Abu Dabrh A.M. et al. The natural history of untreated severe or critical limb ischemia//Journal of Vascular Surgery. Mosby Inc., 2015. Vol. 62, N 6. P. 1642 - 1651.e3.
235. Leal C, Almeida N, Silva M, Santos A, Vasconcelos H, Figueiredo P. Appropriateness of Endoscopic Procedures: A Prospective, Multicenter Study. GE Port J Gastroenterol. 2021 May 25; 29(1): 5 - 12. doi: 10.1159/000515839. PMID: 35111959; PMCID: PMC8787496.
236. D'Oria M, Berchiolli R, Gargiulo M, Antonello M, Pratesi G, Michelagnoli S, Silingardi R, Isernia G, Veraldi GF, Tinelli G, Giudice R, Ippoliti A, Cappiello P, Martelli M, Lepidi S, Troisi N; OUTSTEPP2 Collaborative Study Group. Bypass vs endovascular treatment for occluded femoro-popliteal stents in patients with critical limb-threatening ischemia. J Vasc Surg. 2023 Nov; 78(5): 1270 - 1277. doi: 10.1016/j.jvs.2023.07.053. Epub 2023 Jul 31. PMID: 37532160.
237. Pleger SP, Nink N, Elzien M, Kunold A, Koshty A,  Reduction of groin wound complications in vascular surgery patients using closed incision negative pressure therapy (ciNPT): a prospective, randomised, single-institution study. Int Wound J. 2018 Feb; 15(1): 75 - 83. doi: 10.1111/iwj.12836. Epub 2017 Oct 25. PMID: 29068153; PMCID: PMC7950196.
Reduction of groin wound complications in vascular surgery patients using closed incision negative pressure therapy (ciNPT): a prospective, randomised, single-institution study. Int Wound J. 2018 Feb; 15(1): 75 - 83. doi: 10.1111/iwj.12836. Epub 2017 Oct 25. PMID: 29068153; PMCID: PMC7950196.
238. European Society for Vascular Surgery (ESVS) 2023 Clinical Practice Guidelines on Antithrombotic Therapy for Vascular Diseases
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Акчурин Р.С. - академик РАН, руководитель отдела сердечно-сосудистой хирургии, заместитель генерального директора по хирургии "НМИЦ кардиологии", Почетный президент Российского Общества ангиологов и сосудистых хирургов;
Абугов С.А. - д.м.н., профессор, заведующий отделением РХМДЛ "Российский научный центр хирургии им. академика Б.В. Петровского";
Алекян Б.Г. - академик РАН, д.м.н., профессор, заместитель директора по науке "НМИЦ хирургии им. А.В. Вишневского"; Председатель Российского научного общества специалистов по рентгенэнэндоваскулярной диагностике и лечению;
Аракелян В.С. - д.м.н., профессор, руководитель отдела сосудистой хирургии и ангиологии "НМИЦ сердечно-сосудистой хирургии им. А.Н. Бакулева"; Член Российского Общества ангиологов и сосудистых хирургов;
Вачев А.Н. - д.м.н., профессор, заведующий кафедрой факультетской хирургии Самарского государственного медицинского университета; Член Правления Российского Общества ангиологов и сосудистых хирургов;
Барышников А.А. - заведующий отделениями сосудистой хирургии и рентгенэндоваскулярной диагностики и лечения клиники ЮУГМУ, главный сосудистый хирург Челябинской области;
Белов Ю.В. - академик РАН, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов;
Бородулин А.В. - к.м.н., заведующий отделением Елизаветинской больницы, Санкт-Петербург;
Бредихин Р.А. - д.м.н., ведущий научный сотрудник отделения сосудистой хирургии МКДЦ и МКДЦ, Казань, Член Правления Российского Общества ангиологов и сосудистых хирургов;
Варава А.Б. - "НМИЦ хирургии им. А.В. Вишневского" Минздрава России; врач рентген-эндоваскулярный хирург;
Виноградов Р.А. - д.м.н. заведующий отделения сосудистой хирургии "НИИ краевой клинической больницы N 1 им. С.В. Очаповского". Член Правления Российского Общества ангиологов и сосудистых хирургов;
Гавриленко А.В. - академик РАН, д.м.н., профессор, заведующий отделением хирургии сосудов "Российский научный центр хирургии им. академика Б.В. Петровского"; Член Правления Российского Общества ангиологов и сосудистых хирургов;
Галстян Г.Р. - д.м.н., профессор, заведующий отделением диабетической стопы, главный научный сотрудник ГНЦ РФ ФГБУ "НМИЦ эндокринологии им. академика И.И. Дедова" Минздрава России;
Жолковский А.В. - заведующий отделением сосудистой хирургии Ростовской клинической больницы Южного окружного медицинского центра ФМБА России;
Завацкий В.В. - к.м.н., заведующий отделением сосудистой хирургии СПбГБУЗ "Городская Александровская больница";
Затевахин И.И. - президент РОХ, академик РАН, заведующий кафедрой факультетской хирургии педиатрического факультета "РНИМУ им. Н.И. Пирогова";
Ерошенко А.В. - к.м.н., руководитель направления эндоваскулярных вмешательств клиники К+31; Член Правления Российского Общества ангиологов и сосудистых хирургов;
Ерошкин И.А. - д.м.н., заведующий научным отделением рентгенохирургических методов диагностики и лечения "НИИ СП им. Н.В. Склифосовского ДЗМ", профессор кафедры эндоваскулярной и сосудистой хирургии ФГБОУ ВО "Российский университет медицины" Минздрава России; Член Российского Общества ангиологов и сосудистых хирургов;
Имаев Т.Э. - д.м.н., руководитель лаборатории гибридных методов лечения сердечно-сосудистых заболеваний "НМИЦ кардиологии им. Е.И. Чазова", Член Российского Общества ангиологов и сосудистых хирургов;
Казаков Ю.И. - д.м.н., профессор, заведующий кафедрой сердечно-сосудистой хирургии ТГМУ, Член Российского Общества ангиологов и сосудистых хирургов
Кавтеладзе З.А. - д.м.н., проф., руководитель центра сердечно-сосудистой и эндоваскулярной хирургии РГНКЦ, врач рентген-эндоваскулярный хирург;
Калашников В.Ю. - член-корреспондент РАН, д.м.н., профессор, заведующий отделом кардиологии, эндоваскулярной и сосудистой хирургии ГНЦ РФ ФГБУ "НМИЦ эндокринологии им. академика И.И. Дедова" Минздрава России;
Калинин Р.Е. - д.м.н., профессор, ректор, заведующий кафедрой сердечно-сосудистой, рентгенэндоваскулярной хирургии и лучевой диагностики РязГМУ им. акад. И.П. Павлова; Член Правления Российского Общества ангиологов и сосудистых хирургов;
Калитко И.М. - к.м.н., ведущий сосудистый хирург ООО "Клиника инновационной хирургии";
Карпенко А.А. - д.м.н., руководитель Центра сосудистой и гибридной хирургии "НМИЦ им. акад. Е.Н. Мешалкина"; Член Правления Российского Общества ангиологов и сосудистых хирургов;
Курьянов П.С. - к.м.н., заведующий отделением РХМДЛ больницы Святого Георгия, Санкт-Петербург Член Российского Общества ангиологов и сосудистых хирургов;
Лепилин П.М. - к.м.н. с.н.с. лаборатории гибридных методов лечения сердечно-сосудистых заболеваний "НМИЦ кардиологии им. Е.И. Чазова" Член Российского Общества ангиологов и сосудистых хирургов;
Литвинюк Н.В. - "НИИ комплексных проблем сердечно-сосудистых заболеваний", Красноярск; врач рентген-эндоваскулярный хирург;
Липин А.Н. - д.м.н., профессор кафедры Военно-морской хирургии "ВМА им. С.М. Кирова", руководитель Центра спасения конечностей (СПбГБУЗ Городская больница N 14);
Матюшкин А.В. - д.м.н., профессор кафедры факультетской хирургии педиатрического факультета "РНИМУ им. Н.И. Пирогова", руководитель отделения сосудистой хирургии; Член Правления Российского Общества ангиологов и сосудистых хирургов;
Мухамадеев И.С. - д.м.н., заведующий отделением сердечно-сосудистой хирургии "Пермская краевая клиническая больница";
Нохрин С.П. - д.м.н., ведущий научный сотрудник отдела неотложной сердечно-сосудистой хирургии "Санкт-Петербургского НИИ скорой помощи им. И.И. Джанелидзе";
Платонов С.А. - к.м.н., руководитель отдела сердечно-сосудистой и эндоваскулярной хирургии ГБУ "СПб НИИ СП им. И.И. Джанелидзе" Член Российского Общества ангиологов и сосудистых хирургов;
Плотников М.В. - к.м.н., доцент кафедры кардиологии, рентгенэндоваскулярной и сердечно-сосудистой хирургии КГМА;
Сапелкин С.В. - д.м.н., ведущий научный сотрудник отделения сосудистой хирургии "НМИЦ хирургии им. А.В. Вишневского"; Член Российского Общества ангиологов и сосудистых хирургов;
Светликов А.В. - д.м.н., руководитель Центра сосудистой хирургии КБ N 122, Санкт-Петербург; Вице-президент Российского Общества ангиологов и сосудистых хирургов;
Ситкин И.И. - д.м.н., ведущий научный сотрудник отделения диабетической стопы ГНЦ РФ ФГБУ "НМИЦ эндокринологии им. академика И.И. Дедова" Минздрава России;
Сокуренко Г.Ю. - д.м.н., профессор кафедры сердечно-сосудистой хирургии "СЗГМУ им. И.И. Мечникова"; Член Правления Российского Общества ангиологов и сосудистых хирургов;
Сорока В.В. - д.м.н., профессор, руководитель отдела неотложной сердечно-сосудистой хирургии "Санкт-Петербургского НИИ скорой помощи им. И.И. Джанелидзе"; Член Российского Общества ангиологов и сосудистых хирургов;
Сучков И.А. - д.м.н., профессор, профессор кафедры сердечно-сосудистой, рентгенэндоваскулярной хирургии и лучевой диагностики "РязГМУ им. акад. И.П. Павлова"; Вице-президент Российского Общества ангиологов и сосудистых хирургов, член Правления Российкого общества хирургов;
Троицкий А.В. - д.м.н., профессор, руководитель Центра сосудистой хирургии и генеральный директор, ФНКЦ ФМБА; Член Российского Общества ангиологов и сосудистых хирургов;
Фокин А.А. - д.м.н., профессор, заведующий кафедрой хирургии института дополнительного профессионального образования ЮУГМУ; Вице-президент Российского Общества ангиологов и сосудистых хирургов;
Харазов А.Ф. - к.м.н., старший научный сотрудник отделения сосудистой хирургии "НМИЦ хирургии им. А.В. Вишневского"; Член Российского Общества ангиологов и сосудистых хирургов;
Чернявский М.А. - д.м.н., заведующий научно-исследовательским отделом сосудистой и интервенционной хирургии "НМИЦ имени В.А. Алмазова"; Член Российского Общества ангиологов и сосудистых хирургов;
Чупин А.В. - д.м.н., заведующий отделением сосудистой хирургии "НМИЦ хирургии им. А.В. Вишневского". Вице-президент Российского Общества ангиологов и сосудистых хирургов.
У всех участников разработки клинической рекомендации конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врач-сердечно-сосудистый хирург
2. Врач-хирург
3. Врач по рентгенэндоваскулярным диагностике и лечению;
4. Врач-кардиолог
5. Врач ультразвуковой диагностики
В основу данных рекомендаций положен основной принцип доказательной медицины, согласно которому принятие решений о применении тех или иных медицинских технологий должно быть основано на комплексном анализе всех имеющихся научных доказательств их эффективности и безопасности, а не на мнении экспертов и личном клиническом опыте врачей.
Оценка научной обоснованности информации, включаемой в клинические рекомендации (КР), проводится посредством оценки уровней достоверности доказательств (УДД) и уровней убедительности (УУР) тезис-рекомендаций (таблицы 1, 2, 3).
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в
том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследование "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
По каждой тезис-рекомендации проводится систематический поиск и отбор публикаций несколькими членами рабочей группы в нескольких в электронных библиографических базах данных в соответствии с определенными критериями.
Определение УДД и УУР проводится на основании найденных по итогам систематического поиска клинических исследований наиболее высокого дизайна (дизайна, обеспечивающего наиболее достоверные доказательства).
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Настоящие рекомендации разработаны в соответствии с:
- Приказ Минздрава России от 28.02.2019 г. N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации";
- Методические рекомендации по проведению оценки научной обоснованности включаемой в клинические рекомендации информации. ФГБУ "Центр экспертизы и контроля качества медицинской помощи" Минздрава России, 2019 г.;
- Приказ Минздрава России от 15.11.2012 г. N 918н "Об утверждении порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями";
- Методические рекомендации по разработке клинических рекомендаций (протоколов лечения) по вопросам оказания медицинской помощи.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Приложение Б1
АЛГОРИТМ
ПРИНЯТИЯ РЕШЕНИЙ У ПАЦИЕНТА С ПОДОЗРЕНИЕМ НА КРИТИЧЕСКУЮ
ИШЕМИЮ НИЖНЕЙ КОНЕЧНОСТИ
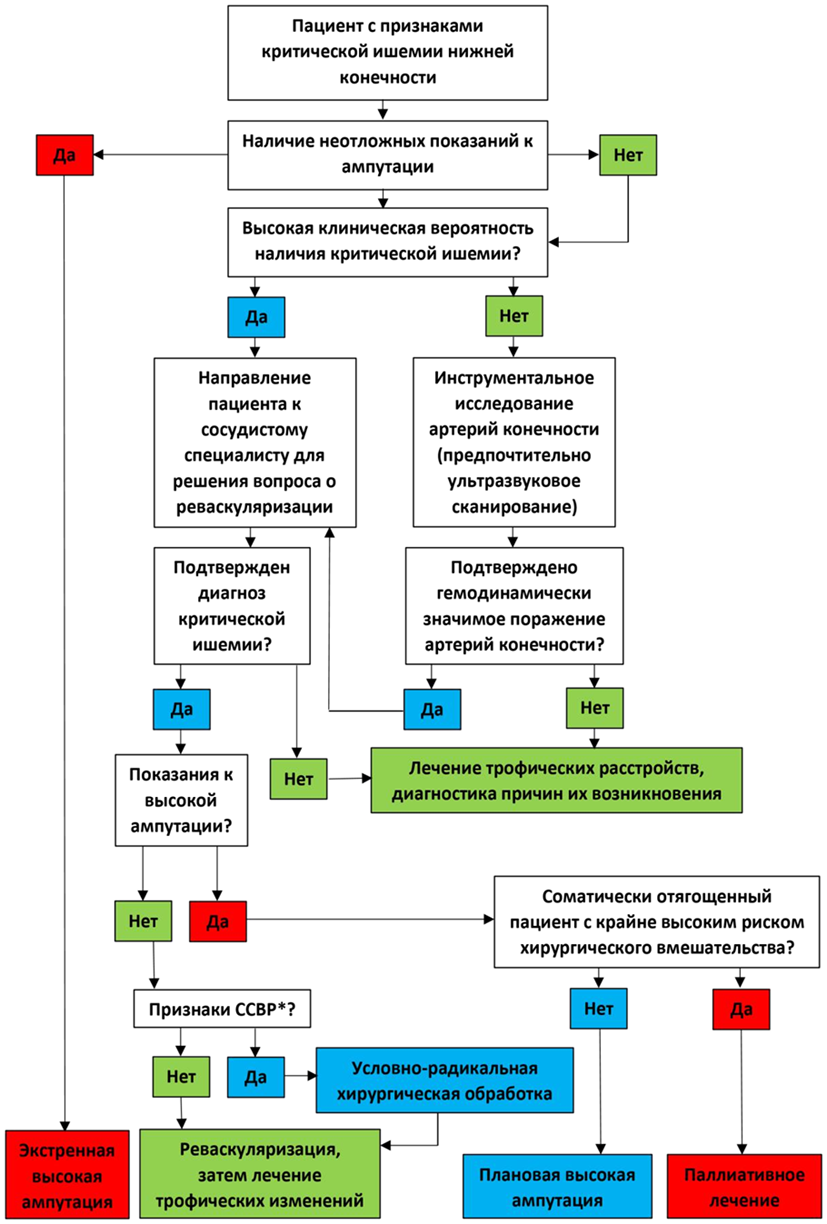
*ССВР - синдром системной воспалительной реакции
Приложение Б2
КЛИНИЧЕСКИЙ АЛГОРИТМ
ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ИШЕМИЧЕСКИХ И НЕИШЕМИЧЕСКИХ
БОЛЕЙ И ТРОФИЧЕСКИХ ИЗМЕНЕНИЙ НИЖНЕЙ КОНЕЧНОСТИ
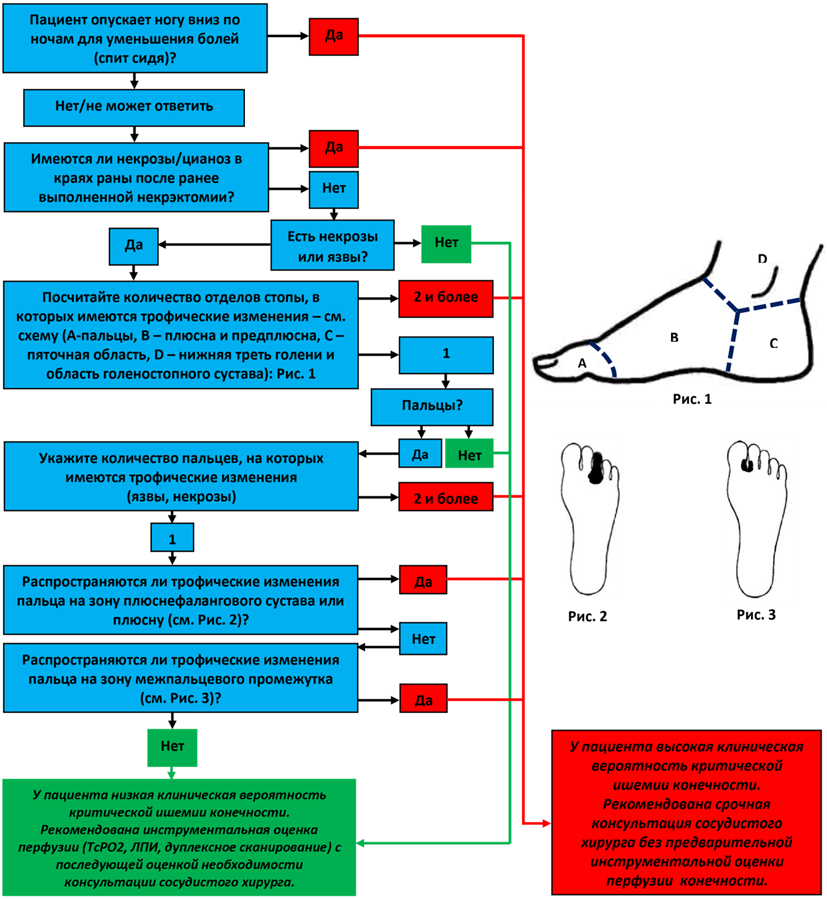
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Ишемия - состояние, при котором резко снижается приток крови к какой-либо области тела, в результате чего происходит нарушение функции клеток, а в тяжелых случаях их гибель. Причиной ишемии является сужение или закупорка артерий, несущих кровь от сердца к органам.
Ишемия нижней конечности на ранних стадиях проявляется нарушением ее функции, а именно ограничением дистанции ходьбы.
Критическая ишемия - крайнее проявление нарушения проходимости артерий нижней конечности, которое проявляется интенсивными болями или омертвением тканей конечности в результате критического снижения притока крови. Омертвение тканей может проявляться как длительно незаживающая язва или гангрена (при гангрене кожа приобретает черный цвет).
Основные факторы риска, повышающие вероятность развития ишемии нижней конечности, включают в себя курение, сахарный диабет, пожилой возраст, нарушения липидного обмена, повышенное артериальное давление.
Тревожные симптомы, которые могут свидетельствовать о развитии критической ишемии нижней конечности:
- потертости или язвы на стопе, которые не заживают или заживают слишком медленно;
- сильная боль или чувство онемения в конечности в состоянии покоя;
- гангрена (почернение частей стопы).
При появлении любого из этих симптомов необходимо срочно обратиться за медицинской помощью.
Помимо осмотра специалиста, диагностика критической ишемии нижней конечности может включать в себя:
- ультразвуковое исследование (дуплексное либо триплексное сканирование артерий нижних конечностей) (ультразвуковая допплерография артерий нижних конечностей, дуплексное сканирование сосудов (артерий и вен) нижних конечностей);
- магниторезонансную томографию, компьютерную томографию (магнитно-резонансная ангиография с контрастированием (одна область), компьютерно-томографическая ангиография одной анатомической области);
- прямую ангиографию (ангиография артерий нижней конечности прямая) (процедуру, при которой непосредственно в артериальную систему нижних конечностей вводят специальное контрастное вещество).
Лечение критической ишемии нижней конечности должно начинаться как можно раньше. В связи с этим очень важно при первых симптомах заболевания обратиться за консультацией к специалисту (врачу-сердечно-сосудистому хирургу), а при отсутствии такой возможности - к врачу-хирургу поликлиники.
Основным методом лечения критической ишемии является хирургический. Чаще всего он представлен одним или несколькими из следующих вмешательств:
- реваскуляризацией (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование, стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) (улучшением или полным восстановлением притока крови к конечности);
- некрэктомией (хирургическая обработка раны или инфицированной ткани) (удалением мертвых и/или инфицированных тканей) или малой ампутацией нижней конечности (удалением мертвых и/или инфицированных тканей с пересечением костных структур на уровне стопы);
- высокой ампутацией нижней конечности (удаление мертвых и/или инфицированных тканей с пересечением костных структур на уровне голени или бедра).
После хирургического лечения необходимо принимать медикаменты, снижающие риск тромбообразования (антитромботические средства). Их выбор осуществляет лечащий врач в зависимости от клинических показаний и противопоказаний.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
КЛАССИФИКАЦИИ ТЯЖЕСТИ ХРОНИЧЕСКОЙ ИШЕМИИ НИЖНЕЙ КОНЕЧНОСТИ
Название на русском языке: Классификации тяжести хронической ишемии нижней конечности.
Оригинальное название (если есть): (нет)
Источник (официальный сайт разработчиков, публикация с валидацией): 1. Покровский А.В. Заболевания аорты и ее ветвей - М., "Медицина", 1979, стр. 199 - 234;
1. Fontaine R., Kim M., Kieny R. Die chirurgische Behandlung der peripheren Durchblutungsst rungen.//Helv Chir Acta. 1954. Vol. 21, N 5 - 6. P. 499 - 533.
2. Rutherford RB, Baker JD, Ernst C, Johnston KW, Porter JM Ahn S, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997; 26: 517 - 538.
3. European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia. Eur J Vasc Endovasc Surg. 2020; 59:, 173 - 218. https://doi.org/10.1016/j.ejvs.2019.09.006.
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить): Клиническая классификация
Назначение: Определение тактики лечения пациента.
Содержание (шаблон): Таблица, отражающая степень ишемии нижних конечностей по стадии заболевания и по выраженности ишемических нарушений со стороны мягких тканей нижних конечностей.
Ключ (интерпретация): Бальная шкала оценки.
Пояснения: В зависимости от стадии заболевания и степени ишемии нижних конечностей определяются показания к хирургическому лечению, хирургической обработке раны или инфицированной ткани и ампутации нижних конечностей. Показания к хирургическому лечению рассматриваются при II - III стадии по классификации Fontaine, IIа - III стадии по классификации А.В. Покровского и при 2 - 4 категориях поражения по Rutherford. Реваскуляризация с хирургической обработкой раны или инфицированной ткани показаны при сочетании III - IV стадий с трофическими нарушениями по классификациям Fontaine и А.В. Покровского и 5 - 6 категорий Rutherford. Показания к ампутации нижней конечности рассматриваются при IV стадии по классификациям Fontaine и А.В. Покровского и 6 категории Rutherford.
Стадия болезни
Классификации
Fontaine A.B. Покровского
Rutherford Степень
Категория
Асимптомная
I
I
0
0
Легкая ПХ
IIa
IIa (200 - 1000 м)
I
1
Умеренная ПХ
Выраженная ПХ
IIb
IIb (< 200 м)
I
2
III
I
3
Боль в покое
III
II
4
Начальные трофические
IV
IV
III
5
Язва или гангрена
IV
6
Приложение Г2
КЛАССИФИКАЦИЯ ПОРАЖЕНИЙ АРТЕРИЙ НИЖНИХ КОНЕЧНОСТЕЙ TASC II
Название на русском языке: Классификация поражений артерий нижних конечностей TASC II.
Оригинальное название (если есть): Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II).
Источник (официальный сайт разработчиков, публикация с валидацией): Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FGR. on behalf of the TASC II Working Group. Inter-society consensus for the management of peripheral arterial disease (TASC II). J Vasc Surg. 2007 Jan; 45(1 Suppl): S5 - S67. https://doi.org/10.1016/j.ejvs.2019.09.006.
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить): Клинико-анатомическая классификация
Назначение: Определение тактики лечения пациента в зависимости от локализации и протяженности поражения артерий.
Содержание (шаблон): Таблица классифицирующая и отражающая анатомическую локализацию поражения артерий нижних конечностей по степени и протяженности поражения.
Ключ (интерпретация): Визуальная шкала оценки.
Пояснения: В зависимости от локализации и протяженности поражения делается вывод о показаниях к открытым реконструктивным (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование) или эндоваскулярным (стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) операциям. При классах поражений A и B рекомендуются эндоваскулярные операции (стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии), при классах поражений C и D - открытые операции (тромбэндартерэктомия, аорто-глубокобедренное шунтирование, бедренно-подколенное шунтирование).
Класс поражения по TACS II
Аорто-подвздошный сегмент
Бедренно-подколенный сегмент
A
Односторонний или двусторонний стеноз общей бедренной артерии
Единичный стеноз < 10 см
![]()
Односторонний или двусторонний стеноз наружной подвзодшной артерии
Единичная окклюзия < 5 см
![]()
B
Стеноз инфраренального отдела аорты < 3 см
Множественные поражения (стеноз или окклюзия) каждое из которых < 5 см
![]()
Односторонняя окклюзия общей подвздошной артерии
Единичный стеноз или окклюзия < 15 см, не затрагивающий подколенною артерию
![]()
Единичный или множественный стеноз наружной подвздошной артерии от 3 до 10 см. не затрагивающий общую бедренную артерию
Единичные или множественные поражения с отсутствием дистального кровотока
![]()
окклюзия наружной подвздошной артерии, не затрагивающая устье внутренней подвздошной или общей бедренной артерии
Единичная окклюзия <5 см с выраженным единичный стеноз подколенной артерии
![]()
C
Двусторонняя окклюзия общей подвздошной артерии
Множественные поражения (стеноз или окклюзия) общая длина которых > 15 см с выраженным или без него
![]()
Двусторонний стеноз наружной подвздошной артерии без вовлечения общей бедренной артерии
Односторонний стеноз наружной подвздошной артерии с вовлечением общей бедренной артерии
Односторонняя окклюзия наружной подвздошной артерии с вовлечением внутренней подвздошной или общей бедренной артерии

Рестеноз или реокклюзия после двух эндоваскулярных реконструкций
Односторонняя окклюзия наружной подвздошной артерии с выраженным

D
Окклюзия инфраренального отдела аорты и общей бедренной артерии
Хроническая окклюзия общей или поверхностной бедренной артерии > 20 см с вовлечением подколенной артерии
Диффузное поражение с вовлечением отдела аорты и подвздошных артерий

Одностороннее диффузное поражение общей, наружной подвздошной и общей бедренной артерии
Односторонняя окклюзия общей и наружной подвздошных артерий

Хроническая окклюзия подколенной артерии и проксимального сегмента трифуркации подколенной артерии

Двусторонняя окклюзия наружных подвздошных артерий

Стеноз подвздошной артерии у пациентов с аневризмой брюшной аорты, не подлежащей или с другими поражениями аорты, требующими открытого хирургического вмешательства
Приложение Г3
ГЛОБАЛЬНАЯ СИСТЕМА
ОЦЕНКИ ТЯЖЕСТИ ПОРАЖЕНИЯ АРТЕРИЙ КОНЕЧНОСТИ (GLASS)
Название на русском языке: Глобальная система оценки тяжести поражения артерий конечности (GLASS).
Оригинальное название (если есть): The Global Limb Anatomic Staging System (GLASS) for CLTI: Improving Inter-Observer Agreement.
Источник (официальный сайт разработчиков, публикация с валидацией): Wijnand JGJ, Zarkowsky D, Wu B, van Haelst STW, Vonken EPA, Sorrentino TA, Pallister Z, Chung J, Mills JL, Teraa M, Verhaar MC, de Borst GJ, Conte MS. The Global Limb Anatomic Staging System (GLASS) for CLTI: Improving Inter-Observer Agreement. J Clin Med. 2021 Aug 4; 10(16): 3454. doi: 10.3390/jcm10163454. PMID: 34441757; PMCID: PMC8396876.
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить): Клинио-анатомическая классификация
Назначение: Определение тактики лечения пациента в зависимости от локализации, протяженности и сочетанного характера поражения артерий нижних конечностей.
Содержание (шаблон): Таблица классифицирующая и отражающая анатомическую локализацию поражения артерий нижних конечностей по степени, протяженности и сочетанного характера поражения артерий нижних конечностей.
Ключ (интерпретация): Бальная шкала оценки.
Пояснения: В зависимости от локализации, протяженности и сочетанности поражения артерий нижних конечностей делается вывод о показаниях к открытым реконструктивным (тромбэндартерэктомия, бедренно-подколенное шунтирование) или эндоваскулярным (стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) операциям. Показания к конкретному виду операций предполагает сопоставление данных классификации GLASS с данными, полученными по классификации Wifi (подробно приведена ниже).
Аорто-подвздошный сегмент
I
Стеноз общей и/или наружной подвздошной артерии, окклюзия общей или
наружной подвздошной артерии (но не одновременно), стеноз инфраренального отдела аорты; любая комбинация этих состояний.
II
Окклюзия аорты; окклюзия общей и наружной подвздошной артерии; тяжелое диффузное поражение и/или малый диаметр (< 6 мм) общей и наружной подвздошной артерии; сопутствующая аневризма; тяжелый диффузный рестеноз в сегменте аорто-подвздошного сегмента
A
Значительное поражение ОБА отсутствует
B
Наличие значительного поражения ОБА (стеноз > 50%)
Бедренно-подколенный сегмент
0
Умеренное или незначительное (< 50%) поражение
1
- Общая длина поражения ПБА < 1/3 (< 10 см)
- Может присутствовать единичная фокальная окклюзия
- Умеренное или незначительное поражение подколенной артерии
2
- Общая длина поражения ПБА 1/3 - 2/3 (10 - 20 см)
- Может присутствовать окклюзия ПБА < 1/3 (10 см), кроме флаш-окклюзии
- Фокальный стеноз подколенной артерии < 2 см, без вовлечения трифуркации
3
- Общая длина поражения ПБА > 2/3 (20 см)
- Может присутствовать флаш-окклюзия ПБА < 20 см или окклюзия ПБА 10 - 20 см
- Короткий стеноз подколенной артерии 2 - 5 см, без вовлечения трифуркации
4
- Окклюзия ПБА длиной > 20 см
- Поражение подколенной артерии > 5 см или с вовлечением трифуркации
- Любая окклюзия подколенной артерии
Инфрапоплитеальный (берцовый) сегмент
0
Умеренное или незначительное поражение целевого пути реваскуляризации
1
- Фокальный стеноз артерии голени < 3 см
2
- Стеноз на 1/3 длины артерии
- Может присутствовать фокальная окклюзия (< 3 см)
- Нет поражения тибиоперонеального ствола и устьев берцовых артерий
3
- Поражение на 2/3 длины артерии
- Окклюзия до 1/3 длины (может включать устья берцовых артерий, но не тибиоперонеальный ствол)
4
- Диффузный стеноз > 2/3 длины артерии
- Окклюзия > 1/3 длины артерии
- Любой тип окклюзии тибиоперонеального ствола, если ПББА не является целевой артерией
Варианты поражения артерий стопы
P0
Целевая артерия пересекает лодыжку и спускается к стопе, артериальная дуга стопы не затронута
P1
Целевая артерия пересекает лодыжку и спускается к стопе, артериальная дуга стопы отсутствует или существенно поражена
P2
Целевая артерия, пересекающая лодыжку и спускающаяся к стопе, отсутствует
Приложение Г4
СИСТЕМА КЛАССИФИКАЦИИ ТЯЖЕСТИ ПОРАЖЕНИЯ КОНЕЧНОСТИ WIFI
Название на русском языке: Система классификации тяжести поражения конечности WIfI.
Оригинальное название (если есть): WIfI classification: the Society for Vascular Surgery lower extremity threatened limb classification system, a literature review.
Источник (официальный сайт разработчиков, публикация с валидацией): Cerqueira LO, Duarte EG, Barros ALS, Cerqueira JR, de Ara jo WJB. WIfI classification: the Society for Vascular Surgery lower extremity threatened limb classification system, a literature review. J Vasc Bras. 2020 May 8; 19:e20190070. doi: 10.1590/1677-5449.190070. PMID: 34178056; PMCID: PMC8202158.
Тип (подчеркнуть):
- шкала оценки степени тяжести ишемии, выраженности инфекции мягких тканей, и степени трофических нарушений
- индекс
- вопросник
- другое (уточнить):
Назначение: Определение тактики лечения пациента в зависимости от степени ишемии нижних конечностей, выраженности инфекционных процессов в мягких тканях и степени трофических нарушений вследствие ишемии нижних конечностей.
Содержание (шаблон): Таблица классифицирующая и отражающая оценку степени тяжести раны, ишемии нижних конечностей и тяжести инфекционного процесса в мягких тканях и костях нижних конечностей.
Ключ (интерпретация): Бальная шкала оценки.
Пояснения: В зависимости от локализации, протяженности и сочетанности поражения артерий нижних конечностей, выраженности трофических нарушений и характеристик имеющейся вследствие ишемии тканей раны и выраженности воспаления мягких тканей делается вывод о показаниях к открытым реконструктивным (тромбэндартерэктомия, бедренно-подколенное шунтирование) или эндоваскулярным (стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии) операциям в сочетании с хирургической
обработкой раны или инфицированной ткани или ампутации нижних конечностей. Согласно данной классификационной системе при сочетании I стадии изменений со стороны нижней конечности по классификации WiFi c любой стадией поражений по GLASS (I, II или III) реваскуляризация не рекомендуется. При II стадии поражения артерий нижних конечностей по классификации GLASS реваскуляризация не рекомендуется не зависимо от степени изменений по классификации Wifi, за исключением Wifi-2, когда рекомендуются эндоваскулярные вмешательства (стентирование артерий нижних конечностей, баллонная ангиопластика периферических артерий). При сочетании 2 - 4 стадий поражения по классификации Wifi с 1 стадией поражений по GLASS рекомендуется эндоваскулярная операция (стентирование артерий нижних конечностей, баллонная ангиопластика периферической артерии), а при 3 - 4 стадии по Wifi в сочетании с 3 стадией по GlASS рекомнедуется открытое хирургическое лечение (тромбэндартерэктомия, бедренно-подколенное шунтирование).
W - Оценка степени тяжести раны
Степень тяжести
Язва
Гангрена
0
Язва отсутствует
Гангрена отсутствует
Клиническое описание: ишемическая боль в состоянии покоя (обычные симптомы + ишемия 3 степени); раны отсутствуют.
1
Небольшая неглубокая язва дистального отдела конечности или стопы; кость не обнажена, если язва не ограничена дистальной фалангой.
Гангрена отсутствует
Клиническое описание: незначительная потеря ткани. Конечность можно сохранить с ампутацией 1 или 2 пальцев или проведением кожной пластикой.
2
Более глубокая рана с обнаженной костью, суставом или сухожилием; пятка обычно не затронута; неглубокая язва пятки, пяточная кость не затронута.
Гангренозные изменения пальцев стопы
Клиническое описание: значительная потеря ткани, возможность сохранения конечности с ампутацией (> 3) пальцев стопы или стандартная трансметатарзальная ампутация ![]() кожная пластика.
кожная пластика.
3
Обширная глубокая язва, затрагивающая передний отдел стопы или средний отдел стопы; глубокая язва пятки на всю толщину ![]() затрагивающая пяточную кость
затрагивающая пяточную кость
Обширная гангрена, затрагивающая передний отдел стопы и/или средний отдел стопы; некроз пятки на всю толщину ![]() затрагивающая пяточную кость
затрагивающая пяточную кость
Клиническое описание: обширная потеря ткани, сохранить конечность возможно только при сложной реконструкции стопы (нетрадиционная ампутация,
ампутация по Шопару или Лисфранку);
при больших дефектах мягких тканей необходима кожная пластика или комплексное лечение раны.
I - Оценка степени тяжести ишемии <*>
Степень
ЛПИ
Систолическое давление на уровне лодыжки
ПД, ТсРО2
0
> 0,80
> 100 мм рт. ст.
> 60 мм рт. ст.
1
0,6 - 0,79
70 - 100 мм рт. ст.
50 - 59 мм рт. ст.
2
0,4 - 0,59
50 - 70 мм рт. ст.
30 - 39 мм рт. ст.
3
< 0,39
< 50 мм рт. ст.
< 30 мм рт. ст.
--------------------------------
<*> Плоская или минимально пульсирующая форма волны пульсового объема соответствует 3 степени. Следует измерить ПАД (измерение артериального давления на периферических артериях) или TcPo2 (определение парциального давления кислорода в мягких тканях (оксиметрия)), если ЛПИ не определяется из-за несжимаемости (> 1.3). Пациентам с диабетом необходимо измерять ПАД. Если кальцификация артерий препятствует получению надежных значений ЛПИ и ПАД, то ишемия документируется на основании значений TcPo2 (определения парциального давления кислорода в мягких тканях (оксиметрия)), давления кожной перфузии или записями пульсового наполнения. Если значения ПАД и ЛПИ указывают на разные степени ишемии, первостепенное значение будет иметь показатель ПАД.
fI - Оценка степени тяжести инфекции
Клиническое проявление инфекции
SVS
Степень тяжести по классификации IDSA/PEDIS
Симптомы или признаки инфекции отсутствуют Инфекция присутствует, если отмечается не менее 2 признаков:
- Локальный отек или уплотнение
- Покраснение вокруг язвы размером от > 0,5 см до < 2,0 см
- Локальная чувствительность при нажатии или боль - Локальная гиперемия
- Гнойное отделяемое (густое, непрозрачное или белое отделяемое с кровью)
0
Инфекция отсутствует
Локальная инфекция, распространяющаяся только на кожу и подкожную клетчатку (не затрагивает более глубокие ткани, систематические признаки, описанные ниже, отсутствуют) Необходимо исключить другие причины воспалительной реакции кожи (например, травма, подагра, острая диабетическая трещина, тромбоз, венозный застой)
1
Умеренная
Локальная инфекция (см. описание выше) с покраснением размером > 2 см или средняя инфекция, затрагивающая более глубокие, чем кожа и подкожные ткани, структуры (например, абсцесс, остеомиелит, септический артрит. Отсутствие признаков системной воспалительной реакции (см. описание ниже)
2
Средняя инфекция
Локальная инфекция (см. описание выше) с подозрением на синдром системной воспалительной реакции при наличии двух и более признаков:
- Температура > 3 8 °C или <3 6 °C
- ЧСС > 90 ударов е минуту
- ЧДД > 20 дыхательных движений в минуту или PaCO2 > 32 мм рт. ст.
- Лейкоциты > 12 000 или < 4 000 клеток/мм3 или 10% незрелых форм
3
Тяжелая инфекция <a>
--------------------------------
<a> Ишемия может усложнять или повышать степень тяжести любой инфекции. Системная инфекция иногда может проявляться вместе с другими клиническими признаками, такими как гипертензия, спутанность сознания, рвота или метаболические нарушения, например, ацидоз, тяжелая гипергликемия и впервые выявленная азотемия.
Риск высокой ампутации конечности в течение 1 года
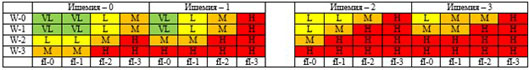
Вероятная польза (необходимость) реваскуляризации (после купирования инфекционного процесса)
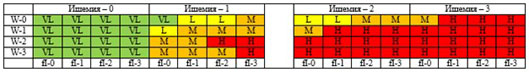
VL - очень низкий риск ампутации/польза реваскуляризации; L - умеренный риск ампутации/польза реваскуляризации; M - средний риск ампутации/польза реваскуляризации; H - высокий риск ампутации/польза реваскуляризации.
Приложение Г5
КЛАССИФИКАЦИОННАЯ СИСТЕМА
ДЛЯ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ И ТЯЖЕСТИ ИНФЕКЦИИ СТОПЫ,
РАЗРАБОТАННАЯ АМЕРИКАНСКИМ ОБЩЕСТВОМ ИНФЕКЦИОНИСТОВ (IDSA)
И МЕЖДУНАРОДНОЙ РАБОЧЕЙ ГРУППОЙ ПО ДИАБЕТИЧЕСКОЙ СТОПЕ
Название на русском языке: Классификационная система для определения наличия и тяжести инфекции стопы, разработанная Американским обществом инфекционистов (IDSA) и Международной рабочей группой по диабетической стопе.
Оригинальное название (если есть): _ IWGDF/IDSA Guidelines on the Diagnosis and Treatment of Diabetes-related Foot Infections (IWGDF/IDSA 2023).
Источник (официальный сайт разработчиков, публикация с валидацией): ric Senneville, Zaina Albalawi, Suzanne A van Asten, Zulfiqarali G Abbas, Geneve Allison, Javier Arag n-S nchez, John M Embil, Lawrence A Lavery, Majdi Alhasan, Orhan Oz, Ilker U kay, Vilma Urban i -Rovan, Zhang-Rong Xu, Edgar J G Peters, IWGDF/IDSA Guidelines on the Diagnosis and Treatment of Diabetes-related Foot Infections (IWGDF/IDSA 2023), Clinical Infectious Diseases, 2023;, ciad527, https://doi.org/10.1093/cid/ciad527
Тип (подчеркнуть):
- шкала оценки степени тяжести инфекции при диабетической стопе.
- индекс
- вопросник
- другое (уточнить):
Назначение: Определение тактики лечения пациента_в зависимости от степени тяжести воспалительных и инфекционных изменений в мягких тканях и костях стопы.
Содержание (шаблон): Таблица классифицирующая и отражающая оценку степени тяжести раневой инфекции при диабетической стопе.
Ключ (интерпретация): Бальная шкала оценки.
Пояснения: В зависимости от степени выраженности трофических нарушений и тяжести имеющихся инфекционных и воспалительных процессов в ране определяются показания к хирургической обработке раны или инфицированной ткани (при легкой и средней степени инфицированности) или ампутации нижних конечностей (при тяжелой степени инфекции стопы).
Нейнфилированная рана: отсутствие системных или местных признаков инфекции
1 (Отсутствие инфекции)
Инфицированная рана
- Наличие 2 и более признаков инфекции:
- местный отек или уплотнение
- гиперемия > 0,5 см2 вокруг раневого дефекта
- боль или болезненность при пальпации
- местное повышение температуры
- гнойные выделения
- Следует исключить другие причины воспаления кожных покровов (например. травму, подагру. острую Шарко, перелом, тромбоз, венозный застой)
- Инфекция охватывает только кажный покров или подкожную ткань (без вовлечения глубоких тканей и без системных проявлений, как описано ниже)
- Гиперемия не превышает 2 см* вокруг раневого дефекта
- Отсутствие местных осложнений и системных прихнаков инфекции (см. ниже)
2 (Легкая степень)
- В инфекционный процесс вовлечены более глубокие анатомические структуры (например, кости, суставы, сухожилия, мыщцы) или эртема распространяется > 2 см2 от края раны
- Отсутствие системных признаков или симптомов инфекции (см. ниже)
3 (Легкая степень)
- Всякая инфекция стопы с синдромом системной воспалительной реакции (ССВР), как о том свидетельствуют >= 2 нижеследующих признаков:
- температура тела > 38 °C
- пульс > 90 уд/мин
- частота респирации > 20 вздохов/мин или парциальное давление CO2 < 4,3 кПА (32 мм рт. ст.)
- уровень лейкоцитов в крови > 12 000 или < 4 000/мм3 или > 10% нейтрофильных лейкоцитов
4 (Легкая степень)
Примечание. *В любом направлении от края раны. Наличие клинически значимой ишемии стопы существенно затрудняет как диагноз, так и лечение инфекции.
