"Клинические рекомендации "Желудочковые нарушения ритма сердца. Внезапная сердечная смерть"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЖЕЛУДОЧКОВЫЕ НАРУШЕНИЯ
РИТМА СЕРДЦА. ВНЕЗАПНАЯ СЕРДЕЧНАЯ СМЕРТЬ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I47.0, I47.2, I46, I46.1, I46.9, I47.0, I47.9, I49.0, I49.3, I49.4, I49.8, I49.9, I46.0
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 569_2
Возрастная категория: Взрослые, Дети
Специальность:
Разработчик клинической рекомендации
Общероссийская общественная организация "Российское кардиологическое общество", Всероссийская общественная организация "Ассоциация детских кардиологов России", Всероссийское научное общество специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции, Российское общество холтеровского мониторирования и неинвазивной электрофизиологии, Общероссийская общественная организация "Российское общество скорой медицинской помощи"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
ААТ - антиаритмическая терапия
ААП - антиаритмические препараты (С01В Антиаритмические препараты, классы I и III)
(ААП класс IA - АТХ C01BA Антиаритмические препараты, класс IА
ААП класс IB - АТХ C01BB Антиаритмические препараты, класс IB
ААП класс IC - АТХ C01BC Антиаритмические препараты, класс IC
ААП класс III - АТХ C01BD Антиаритмические препараты, класс III)
АВ - атриовентрикулярный
АГ - артериальная гипертония
АД - артериальное давление
АКПЖ - аритмогенная кардиомиопатия правого желудочка
АРА - антагонист рецепторов ангиотензина II (АТХ С09СА Антагонисты ангиотензина II)
АРНИ - антагонисты рецепторов ангиотензина II в комбинации с другими средствами (АТХ C09DX04 валсартан + сакубитрил**)
АТХ - Анатомо-Терапевтически-Химическая система классификации
ВОС - внезапная остановка сердца
ВПС - врожденный порок сердца
ВСС - внезапная сердечная смерть
ВСЭФИ - внутрисердечное электрофизиологическое исследование
ВТЛЖ - выходной тракт левого желудочка
ВТПЖ - выходной тракт правого желудочка
ГКМП - гипертрофическая кардиомиопатия
ДКМП - дилатационная кардиомиопатия
ЕОК - Европейское кардиологическое общество
ДПП - дополнительный путь проведения
ИМ - инфаркт миокарда
ИМпST - ИМ с подъемом сегмента ST
ЖА - желудочковая аритмия
ЖНР - желудочковые нарушения ритма
ЖТА - желудочковая тахиаритмия
ЖТ - желудочковая тахикардия
ЖЭ - желудочковая экстрасистолия
иАПФ - ингибитор ангиотензин-превращающего фермента (АТХ C09A Ингибиторы АПФ)
ИБС - ишемическая болезнь сердца
ИКД - имплантируемый кардиовертер-дефибриллятор***
иНГЛТ-2 - ингибитор натрий-глюкозного ко-транспортера 2 типа (АТХ A10BK Ингибиторы натрийзависимого переносчика глюкозы 2 типа)
КА - катетерная абляция (радиочастотная абляция аритмогенных зон; радиочастотная абляция аритмогенных зон роботассистированная, криоабляция аритмогенных зон)
КАА - кардиомиопатия, ассоциированная с аритмией
КАГ - коронарография
КПЖТ - катехоламинергическая полиморфная желудочковая тахикардия
ЛЖ - левый желудочек
ЛНПГ - левая ножка пучка Гиса
МРТ - магнитно-резонансная томография
НЖТ - наджелудочковая тахикардия
НУЖТ - неустойчивая желудочковая тахикардия
ОКС - острый коронарный синдром
ОМТ - оптимальная медикаментозная терапия
ПЖ - правый желудочек
ПСЖ - программируемая стимуляция желудочков (электрокардиостимуляция)
РКИ - рандомизированное контролируемое исследование
СКИQT - синдром короткого интервала QТ
СЛР - сердечно-легочная реанимация
СН - сердечная недостаточность
СПС - структурная патология сердца СРТ - сердечная ресинхронизирующая терапия (имплантация трехкамерного электрокардиостимулятора (ресинхронизирующая терапия))
CРТ-устройство - имплантируемое устройство для сердечной ресинхронизирующей терапии (трехкамерный электрокардиостимулятор, он же - кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***)
ССЗ - сердечно-сосудистые заболевания
СУИQT - синдром удлиненного интервала QT
УДД - уровень достоверности доказательств
УЖТ - устойчивая желудочковая тахикардия
УМЖТ - устойчивая мономорфная желудочковая тахикардия
УУР - уровень убедительности рекомендаций
ФВ - фракция выброса
ФЖ - фибрилляция желудочков
ФК - функциональный класс
ХМЭКГ - Холтеровское мониторирование электрокардиограммы (холтеровское мониторирование сердечного ритма)
ХСН - хроническая сердечная недостаточность
ЧКВ - чрескожное коронарное вмешательство (транслюминальная баллонная ангиопластика и стентирование коронарных артерий)
ЧСС - частота сердечных сокращений
ЭКВ - электрическая кардиоверсия (наружная электрическая кардиоверсия (дефибрилляция))
ЭКГ - электрокардиография
ЭКМО - экстракорпоральная мембранная оксигенация
ЭХОКГ - эхокардиография
NYHA - Нью-Йоркская кардиологическая ассоциация
QTc - корригированный интервал QT
** - препарат включен в перечень жизненно необходимых и важнейших лекарственных препаратов
*** - медицинское изделие, имплантируемое при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи
# - лекарственный препарат для медицинского применения, используемого в несоответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата
Термины и определения
Инструментальная диагностика - диагностика с использованием для обследования пациента различных приборов, аппаратов и инструментов [1, 2].
Исход - любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [3].
Конфликт интересов - ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [2].
Медицинское вмешательство - выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности [2].
Медицинский работник - физическое лицо, которое имеет медицинское или иное образование, работает в медицинской организации и в трудовые (должностные) обязанности которого входит осуществление медицинской деятельности, либо физическое лицо, которое является индивидуальным предпринимателем, непосредственно осуществляющим медицинскую деятельность [2].
Пациент - физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [2].
Рабочая группа по разработке/актуализации клинических рекомендаций - это коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций, и несущих общую ответственность за результаты данной работы.
Состояние - изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи [2].
Синдром - устойчивая совокупность ряда симптомов с единым патогенезом [4]. Термин "синдром" традиционно используется для ряда состояний, когда этиология и патогенез уже известны, хотя термин "болезнь" был бы более подходящим. Например, синдром Бругада, синдром удлиненного интервала QT и некоторые другие.
Структурная патология сердца - данный термин применяется к взрослой и детской популяции и включает ИБС, все виды кардиомиопатий (ДКМП, ГКМП, рестриктивную кардиомиопатию, АКПЖ), клапанные и врожденные пороки сердца [5], а также наличие выраженной гипертрофии ЛЖ (по некоторым данным, выраженная гипертрофия характеризуется толщиной боковой стенки ЛЖ или межжелудочковой перегородки ![]() 14 мм у взрослых, или более 2 z-score у детей [6] по данным ЭХОКГ и/или МРТ сердца; однако члены рабочей группы клинических рекомендаций считают целесообразным выраженную степень гипертрофии миокарда левого желудочка трактовать лечащим врачом самостоятельно ввиду отсутствия убедительных научных данных).
14 мм у взрослых, или более 2 z-score у детей [6] по данным ЭХОКГ и/или МРТ сердца; однако члены рабочей группы клинических рекомендаций считают целесообразным выраженную степень гипертрофии миокарда левого желудочка трактовать лечащим врачом самостоятельно ввиду отсутствия убедительных научных данных).
Тезис-рекомендация - положение, отражающее порядок и правильность выполнения того или иного медицинского вмешательства, имеющего доказанную эффективность и безопасность.
Уровень достоверности доказательств (УДД) - степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным [7].
Уровень убедительности рекомендаций (УУР) - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [7].
Интервенционное лечение - метод лечения заболеваний путем малоинвазивного вмешательства, без разрезов и соединения тканей или с минимальным повреждением тканей. Применительно к лечению нарушений ритма сердца чаще всего к интервенционному лечению относят катетерную деструкцию (аблацию) субстрата/очага аритмии, установку эндокардиальных электродов для электрокардиостимуляции.
Хирургическое лечение - метод лечения заболеваний путем разъединения и соединения тканей в ходе хирургической операции.
ЕОК - Европейское общество кардиологов. В тексте настоящих клинических рекомендаций дополнительно указаны показания к тезисам в соответствии с рекомендациями ЕОК. В соответствии с международным документом, выделяются классы рекомендаций и уровни доказательности.
РКО - Российское кардиологическое общество.
Кардиовертер-дефибриллятор имплантируемый*** (ИКД) - электронный имплантируемый прибор, предназначенный для электротерапии (электрокардиостимуляция и разряды высокой энергии) угрожающих жизни аритмий и предотвращения остановки сердца.
Программирование ИКД (подбор параметров работы постоянного имплантируемого антиаритмического устройства; программирование постоянного имплантируемого антиаритмического устройства; тестирование состояния постоянного имплантируемого антиаритмического устройства) - опрос ИКД с извлечением из его памяти сохраненных электрических сигналов сердца, иной информации о ритмах сердца, проверка и настройка параметров кардиостимуляции и дефибрилляции, а также иных параметров, предусмотренных в конкретном устройстве. Специалист, выполняющий программирование постоянного имплантированного антиаритмического устройства (ЭКС, ИКД, СРТ и другие), должен иметь специфические знания о работе таких устройств и иметь опыт их настройки (программирования).
Мотивированный шок ИКД - высокоэнергетическая электротерапия (разряд) ИКД для купирования истинно желудочковой тахикардии (ЖТ) и фибрилляции желудочков (ФЖ).
Немотивированный шок ИКД - высокоэнергетическая электротерапия (разряд) ИКД, когда алгоритмы устройства дискриминировали (идентифицировали) сигналы электрограмм как ЖТ, однако истинной причиной детектированных сигналов является иная причина, например, НЖТ, помехи электрических сигналов в связи с поломкой электрода, двойной сенсинг за счет детекции зубцов Т наряду с QRS и т.п. Термин не является идеальным, поскольку, с точки зрения алгоритмов работы ИКД, нанесение разряда (шока) является мотивированным получаемыми сигналами. Треть экспертов, участвовавших в подготовке данных рекомендаций считают, что более адекватным термином был бы "неуместный шок", однако термин "немотивированный" является устоявшимся в русскоязычной литературе и применяется ниже в данном документе. Следует выделять другой термин "ненужный шок ИКД" - ситуация, когда купирование ЖТ могло произойти спонтанно, но установленный алгоритм в ИКД наносит шок раньше спонтанного купирования ЖТ; также относится к ситуации, когда ЖТ может быть купирована безболевой стимуляцией, однако программа работы ИКД наносит шок вместо этого.
Сердечная ресинхронизирующая терапия (СРТ) (имплантация трехкамерного электрокардиостимулятора (ресинхронизирующая терапия)) - метод лечения ХСН при наличии нарушений внутрижелудочкового проведения (чаще при блокаде левой ножки пучка Гиса), который осуществляется путем ресинхронизации сердечных сокращений с помощью кардиовертера-дефибриллятора имплантируемого трехкамерного (бивентрикулярного)***. Такие системы обычно включают правопредсердный электрод, правожелудочковый электрод и левожелудочковый электрод. Электроды могут имплантироваться трансвенозным или хирургическим способом, а также посредством торакотомии.
Холтеровское мониторирование ЭКГ (холтеровское мониторирование сердечного ритма) - метод исследования, который позволяет производить непрерывную регистрацию ЭКГ с помощью портативного устройства (монитора), отслеживать изменения в работе сердца в течение длительного периода (от 18 часов и более) в условиях его активности.
Катетерная абляция (КА) аритмии (радиочастотная абляция аритмогенных зон; радиочастотная абляция аритмогенных зон роботассистированная; криоабляция аритмогенных зон) - интервенционное катетерное вмешательство с использованием специальных катетеров, введенных в полость сердца через сосуды или введенных в сердечную сумку (перикард), и заключающееся в подаче энергии на участок миокарда для устранения нарушений сердечного ритма (аритмии). Наиболее часто для КА используется радиочастотная энергия - радиочастотная абляция, но могут применяться иные виды энергии - лазерная, ультразвуковая и др.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Желудочковые нарушения ритма (ЖНР) или желудочковые аритмии (ЖА) - обобщенное название расстройств сердечного ритма, при которых источник эктопической активности или круга риентри находится ниже пучка Гиса, т.е. в его ветвях, сети Пуркинье или в миокарде желудочков.
Желудочковая экстрасистола (ЖЭ) - преждевременная (по отношению к основному ритму) электрическая активация сердца с уширенным комплексом QRS (продолжительность комплекса QRS ![]() 120 мс), дискордантной волной Т по отношению к основному зубцу желудочкового комплекса и отсутствием волны Р перед желудочковым комплексом.
120 мс), дискордантной волной Т по отношению к основному зубцу желудочкового комплекса и отсутствием волны Р перед желудочковым комплексом.
Монофокусные или мономорфные ЖЭ - ЖЭ с одной морфологией комплекса QRS.
Мультифокусные или полиморфные ЖЭ - ЖЭ с разной морфологией комплекса QRS.
ЖЭ с коротким интервалом сцепления - ЖЭ, которые накладываются на T-волну предшествующего проведенного сокращения.
Желудочковая тахикардия - ![]() 3 последовательных сокращения с частотой более 100 ударов в мин, исходящие из желудочков, независимо от предсердного и АВ-узлового проведения [8].
3 последовательных сокращения с частотой более 100 ударов в мин, исходящие из желудочков, независимо от предсердного и АВ-узлового проведения [8].
Ускоренный желудочковый ритм - ![]() 3 последовательных комплекса с частотой > 40 ударов и < 100 ударов в мин, исходящие из желудочков.
3 последовательных комплекса с частотой > 40 ударов и < 100 ударов в мин, исходящие из желудочков.
Неустойчивая желудочковая тахикардия (НУЖТ) - желудочковая тахикардия продолжительностью менее 30 сек, прекращающаяся спонтанно.
Устойчивая желудочковая тахикардия - ЖТ продолжительностью ![]() 30 сек или требующая вмешательства для купирования.
30 сек или требующая вмешательства для купирования.
Мономорфная ЖТ - ЖТ при наличии одинаковой конфигурации QRS-комплексов.
Полиморфная ЖТ - ЖТ с нестабильной, меняющейся конфигурацией QRS-комплексов.
Двунаправленная ЖТ - альтернация фронтальной оси комплекса QRS от сокращения к сокращению (встречается при катехоламинергической полиморфной ЖТ, синдроме Андерсена-Тавила, дигоксиновой интоксикации, остром миокардите).
Желудочковая тахикардия типа "пируэт" - тахикардия типа "пируэт" (тахикардия типа torsades de pointes), подтип полиморфной ЖТ, связанный с удлинением продолжительности интервала QT, с постоянно изменяющимися комплексами QRS, которые имеют вид синусоиды вокруг базовой изолинии ЭКГ.
Электрический шторм - три или более эпизода ЖТ в течение 24 ч, при интервале времени между эпизодами не менее 5 мин, требующих либо антитахикардической электрокардиостимуляции, либо электрической кардиоверсии/дефибрилляции.
Трепетание желудочков - ритмичные, высокоамплитудные, уширенные электрические отклонения желудочков с частотой более 250 в мин., волны Т не определяются.
Фибрилляция желудочков - хаотическая электрическая активность в виде полиморфных осцилляций, постоянно изменяющихся по своей конфигурации, амплитуде, продолжительности и частоте, диапазон которой составляет от 300 и выше в 1 мин.
Частые желудочковые экстрасистолы - доля эктопических комплексов > 10% от сокращений сердца по данным холтеровского мониторирования ЭКГ (ХМЭКГ), что важно при прогнозировании риска развития кардиомиопатии, ассоциированной с аритмией (КАА). Для пациентов с острым инфарктом миокарда "частыми" считаются экстрасистолы > 10 в час, что важно с точки зрения прогноза жизнеугрожающих желудочковых тахиаритмий.
Внезапная смерть - непредвиденное смертельное событие, не связанное с травмой и возникающее в течение 1 ч с момента появления симптомов у практически здорового человека. Если смерть произошла без свидетелей, о внезапной смерти говорят в том случае, если погибший находился в удовлетворительном состоянии за 24 часов до смерти.
Внезапная сердечная смерть (ВСС) - термин применяется, если внезапная смерть возникла у субъекта с известным при жизни врожденным или приобретенным потенциально фатальным заболеванием сердца, или патология сердечно-сосудистой системы была выявлена на аутопсии и могла быть причиной смерти, или если очевидные экстракардиальные причины смерти по данным аутопсии не выявлены, и нарушение ритма служит наиболее вероятной причиной смерти.
Внезапная остановка сердца (ВОС) - непредвиденная остановка кровообращения, возникающая в течение 1 часа с момента появления острых симптомов, которая была устранена с помощью успешных реанимационных мероприятий (например, дефибрилляции). В Международной классификации болезней-10 обозначается I.46 "Остановка сердца" и I.46.0 "Остановка сердца с успешным восстановлением сердечной деятельности".
Внезапная необъяснимая смерть - необъяснимая внезапная смерть, возникшая у человека старше 1 года.
Синдром внезапной смерти младенцев - неожиданная ненасильственная смерть считающегося ранее здорового ребенка первого года жизни, при которой отсутствуют адекватные для объяснения причины смерти данные анамнеза и получены отрицательные результаты токсикологического и патоморфологического исследования.
Синдром внезапной аритмической смерти - необъяснимая внезапная смерть, возникшая у человека старше 1 года, при которой получены отрицательные результаты токсикологического и патоморфологического исследования.
Идиопатическая желудочковая аритмия - когда клиническое обследование пациента не позволило выявить заболевания, потенциально ассоциированные с желудочковой аритмией.
Первичная профилактика ВСС - мероприятия, направленные на снижение риска ВСС у лиц, имеющих повышенный риск ВСС, но без анамнеза угрожающих жизни аритмий или предотвращенной остановки сердца.
Вторичная профилактика ВСС - мероприятия, направленные на снижение риска ВСС у лиц, имеющих анамнез угрожающих жизни аритмий или предотвращенной остановки сердца.
Синдром Бругада - наследственный синдром из группы каналопатий, с типичной ЭКГ-картиной и высоким риском развития ФЖ и ВСС.
Катехоламинергическая полиморфная желудочковая тахикардия (КПЖТ) - редкая наследственная каналопатия, характеризующаяся злокачественным течением адренергически-индуцируемой двунаправленной и полиморфной ЖТ.
Нейромышечные заболевания - группа наследственных заболеваний, характеризующихся прогрессирующим первичным поражением нервных волокон (нейропатии) или скелетной мускулатуры (миопатии и миодистрофии). Вовлечение сердечной мышцы и проводящих путей вариабельно, и не коррелирует с выраженностью неврологической и миопатической симптоматики.
Некомпактный миокард - особый вид кардиомиопатии, который характеризуется выраженной трабекулярностью и глубокими межтрабекулярными углублениями левого и/или правого желудочка, а также часто сочетается с тонким компактным эпикардиальным слоем миокарда. Диагноз ставится на основании эхографических и/или МРТ-критериев (при сооотношении толщины некомпактного слоя к компактному > 2). Многие пациенты с некомпактным миокардом ЛЖ абсолютно бессимптомны, но возможны сочетания со всеми известными видами кардиомиопатий, с прогрессией до ХСН, тромбоэмболии, аритмии или ВСС в анамнезе.
Интервал QT - отражает электрическую систолу желудочков (время в миллисекундах от начала комплекса QRS до конца зубца Т). Его продолжительность зависит от пола (у женщин QT длиннее), возраста (с возрастом QT удлиняется) и частоты сердечных сокращений (ЧСС) (обратно пропорционально). Для объективной оценки интервала QT в настоящее время пользуются корригированным (с поправкой на ЧСС) интервалом QT (QTc), определяемым по формулам Базетта и Фредерика. В норме QTc составляет 340 - 480 мс для женщин и 340 - 460 мс для мужчин. Патологическим считается при значении более 500 мс.
Синдром удлиненного интервала QT (СУИQT) - самый частый наследственный синдром из группы каналопатий (частота 1:3000 - 1:2500 населения), характеризующийся удлинением интервала QT и жизнеугрожающими желудочковыми аритмиями, в основном провоцируемыми адренергической активацией.
Синдром короткого интервала QT (СКИQT) - редкая наследственная каналопатия, характеризующаяся укорочением интервала QT и повышенным риском развития жизнеугрожающих аритмий.
Опытный центр (в контексте интервенционных вмешательств) - медицинское учреждение или подразделение учреждения, где штатные специалисты имеют значительный опыт ведения пациентов с нарушениями ритма сердца, на регулярной основе выполняются катетерные аблации тахиаритмий, таких как фибрилляция предсердий, атипичное трепетание предсердий, постинфарктные желудочковые тахикардии, желудочковые тахикардии при аритмогенной кардиомиопатии правого желудочка (АКПЖ), дилатационной кардиомиопатии (ДКМП) и другие.
Опытный специалист (в контексте интервенционных вмешательств) - врач-специалист, имеющий значительный опыт ведения пациентов с нарушениями ритма сердца, такими как фибрилляция предсердий, атипичное трепетание предсердий, желудочковые тахикардии, на регулярной основе выполняющий катетерные аблации субстрата тахиаритмий, таких как фибрилляция предсердий, атипичное трепетание предсердий, постинфарктные ЖТ, ЖТ при АКПЖ, ДКМП и другие.
Патогенный и вероятно патогенный генетический вариант - Американская коллегия медицинской генетики и геномики (ACMG) предложила порядок интерпретации связи генетических вариантов с причиной заболевания путем стандартизации их по классам. Генетические варианты, являющиеся доказанной причиной заболевания, имеют V класс патогенности (Общепринятые формы записи - Патогенный, Пат, P). Генетические варианты, с высокой вероятностью являющиеся причиной заболевания, имеют IV класс патогенности (Общепринятые формы записи - Вероятно патогенный, ВерПат, LP).
Мутации - термин используется в данном документе для обозначения вариантов IV и V классов патогенности.
Генетический вариант неизвестной клинической значимости - изменение в генной дезоксирибонуклеотидной (ДНК) последовательности, у которого не известен эффект на здоровье человека, вариант III класса патогенности согласно критериям ACMG (2015) [9].
Кардиомиопатия, ассоциированная с аритмией (КАА) - дилатация полостей желудочка(ов) и снижение систолической функции желудочка(ов), наиболее вероятно возникшие или усугубившиеся на фоне нарушения ритма сердца, например, частой ЖЭ, непрерывно-рецидивирующей ЖТ, фибрилляции предсердий, предсердной тахикардии и др. Во многих случаях КАА обратима частично или полностью после купирования аритмии. Помимо частоты ритма, доли эктопических сокращений сердца также имеет значение ширина эктопических комплексов QRS в риске развития КАА.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основными механизмами ЖА являются:
- механизм повторного входа волны возбуждения (риентри);
- аномальный автоматизм;
- триггерная активность, индуцированная ранней или поздней постдеполяризацией;
- ускоренный нормальный автоматизм.
Формирование условий для возникновения феномена риентри в миокарде желудочков в виде зон замедленного проведения возбуждения, участков мышцы сердца с разными по величине рефрактерными периодами, обычно связано с патологическими изменениями в миокарде. Поэтому пароксизмальная ЖТ в подавляющем большинстве случаев осложняет течение тяжелых заболеваний сердца, таких как ИБС, особенно при наличии постинфарктных рубцов и хронической аневризмы левого желудочка, воспалительные заболевания миокарда, кардиомиопатии (ДКМП, ГКМП, АКПЖ и др.), инфильтративные заболевания миокарда. Остановка кровообращения, как механизм ВСС, в абсолютном большинстве случаев (более 80%) возникает в результате ФЖ или ЖТ, существенно реже (менее 20%) - в результате асистолии [10].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
1.3.1. Частота возникновения внезапной сердечной смерти
На долю ВСС приходится около 50% всех сердечно-сосудистых смертей, причем в половине случаев ВСС является первым проявлением заболевания; наиболее частый механизм ВСС - желудочковая тахиаритмия [11, 12, 13, 14, 15, 16].
В идеале, случаи, подозрительные на ВСС, должны регистрироваться и всем должна проводиться аутопсия, что позволит достоверно исключить внесердечные причины внезапной смерти. ВСС как необратимый исход и результат внезапной остановки сердца достигает 50% среди других исходов у лиц 35 - 50 лет, преимущественно мужского пола, однако в последнее время наблюдается тенденция к увеличению доли лиц женского пола, а также лиц подросткового и юношеского возраста. Риск ВСС выше у мужчин и увеличивается с возрастом в связи с большей распространенностью ИБС среди пожилых людей [17].
ВСС составляет половину от всех смертей при сердечно-сосудистых заболеваниях, по расчетам около 7 миллионов человек умирает внезапно во всем мире [18, 19].
Данные о распространенности ВСС в России ограничены, в том числе особенностями регистрации ВСС в разных странах. Доля ВСС во всех возрастных группах составила 49,1% (15420 из 31428 вскрытий, или 123,3 на 100 тыс. населения в год). При этом распространенность ВСС в возрасте от 1 до 45 лет составила 27,5% (2790 из 10132 вскрытий) [20]. Однако более близкими к реальности представляются значения 200 - 250 тыс. человек в год [21].
1.3.2. Причины внезапной смерти в разных возрастных группах
Количество случаев ВСС увеличивается с возрастом. В младенческом и детском возрасте ВСС составляет 1 на 100 000 человеко-лет. В среднем возрасте (5 - 6-й декады жизни) частота ВСС составляет около 50 на 100 тыс. человеко-лет [22, 23, 24], достигая к 8-й декаде жизни частоты 200 на 100 тыс. человеко-лет [12].
В любом возрасте среди мужчин частота ВСС выше, чем среди женщин, даже при поправке на такой фактор риска как ИБС [16, 25, 26, 27].
В Европе на ВСС приходится около 10 - 20% всех смертей [28, 29]. Эпидемиология ВСС в Европе тесно связана с ИБС, на долю которой приходится 75 - 80% случаев ВСС [30]. Хотя распространенность ИБС не уменьшилась, произошло значительное снижение смертности от ИБС. Статистически частота ВСС снижается [30], но доля ВСС от общего числа смертей от сердечно-сосудистых заболеваний, вероятно, увеличивается [31, 32].
Регулярная физическая активность имеет неоспоримую пользу для сердечно-сосудистой системы. В отдельных группах населения (особенно среди мужчин среднего возраста) ВСС может возникать во время или сразу после сверхинтенсивных спортивных нагрузок [33], что предполагает роль ИБС в качестве наиболее распространенной причины ВСС [34].
Заболевания сердца, ассоциированные с ВСС, варьируют в зависимости от возраста. В год у 300000 человек в Европе происходит остановка сердца вне медицинского учреждения [17, 35]. У молодых преобладают первичные электрические болезни и кардиомиопатии, а также миокардиты и аномалии коронарных артерий [17, 34, 35].
В течение четвертого десятилетия жизни половина случаев ВСС связана с ИБС, особенно с острым коронарным синдромом [36, 37].
У пожилых людей преобладают хронические структурные заболевания (острые и хронические формы ИБС, пороки сердца, сердечная недостаточность), в то время как у людей в возрасте до 50 лет более 50% ВСС могут вызывать наследственные электрические заболевания или структурные неишемические заболевания [34].
1.3.3. Популяционный и индивидуальный прогноз риска
Общую оценку риска при сердечно-сосудистых заболеваниях следует проводить в соответствии с рекомендациями по кардиоваскулярной профилактике 2017 [38]. В ряде исследований показано, что существует генетическая предрасположенность к внезапной смерти во время острой ишемии [39, 40]. Важно идентифицировать в общей популяции лиц с риском ВСС относительно небольшие подгруппы высокого риска, у которых ВСС может стать первым проявлением заболевания. Недавно учеными США были предложены модели новой стратификации риска ВСС среди населения в целом [41]. Нет четких данных, подтверждающих пользу программ массового скрининга среди населения в целом для предотвращения ВСС [42].
На протяжении десятилетий исследователи предполагали широкий спектр "индикаторов", "маркеров" ВСС, особенно при наличии ИБС. Было предложено несколько неинвазивных маркеров риска (включая поздние потенциалы, вариабельность сердечного ритма, динамику реполяризации и чувствительность барорефлекса) [43]. Однако, несмотря на многообещающие результаты первоначальных исследований, эти "предикторы" еще не повлияли на клиническую практику. Фракция выброса левого желудочка (ФВ ЛЖ) используется в сочетании с классом сердечной недостаточности по Нью-Йоркской классификации (NYHA) только для определения показаний к ИКД для первичной профилактики ВСС при хронической ИБС и ДКМП. Схемы и калькуляторы стратификации риска были разработаны для наследственных аритмогенных заболеваний, таких как ГКМП, АКПЖ и ламин-А/С (LMNA) кардиомиопатия [44, 45].
Калькуляторы риска внезапной сердечной смерти
Предложено множество калькуляторов риска ВСС для взрослых и детей [46, 47]. Развитие прогнозирования ВСС на протяжении последних десятилетий включало установление стандартов для разработки моделей, их валидизацию (внутреннюю и внешнюю) с последующим опубликованием статей о моделях прогнозирования ВСС [48, 49]. Типичными недостатками в разработке и проверке калькуляторов риска являются, помимо прочего, использование исторических выборок, не репрезентативных по отношению к современным когортам пациентов, пропущенные значения, композитные исходы с композитными событиями различной клинической значимости, отсутствие внешней валидизации и отсутствие калибровки.
Калькуляторы риска рекомендованы для применения Европейским обществом кардиологов (прошли валидацию на европейской популяции пациентов) и в России могут быть использованы для информационной поддержки врачей.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I46. Остановка сердца
I46.0. Остановка сердца с успешным восстановлением сердечной деятельности
I46.1. Внезапная сердечная смерть, так описанная
I46.9. Остановка сердца неуточненная
I47.0. Возвратная желудочковая аритмия
I47.2. Желудочковая тахикардия
I47.9. Пароксизмальная тахикардия неуточненная
I49.0. Фибрилляция и трепетание желудочков
I49.3. Преждевременная деполяризация желудочков
I49.4. Другая и неуточненная деполяризация
I49.8. Другие уточненные нарушения сердечного ритма
I49.9. Нарушение сердечного ритма неуточненное
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Классификации ЖНР, основанные на типе и количестве ЖНР, были сформулированы более 40 - 50 лет назад. Однако в связи с существенным развитием за последние два десятилетия методов лечения ЖНР, внедрением персонализированных подходов к пациентам на основании современных методов обследований, усовершенствованием оценки прогноза жизни и развития осложнений, необходима более актуальная систематизация данных о ЖНР для практических врачей. Многие параметры ЖНР (например, симптомность аритмии, бремя (нагрузка) аритмии, электрофизиологический механизм и локализация очага аритмии) практически никогда не отражаются в клинических диагнозах, но имеют колоссальное значение в определении стратегии лечения и методов подавления аритмии.
В текущей версии рекомендаций предлагается новая расширенная версия классификации ЖНР, систематизирующая важные характеристики аритмии, оказывающие влияние на прогноз и лечение. При этом, обозначены характеристики ЖНР, которые следует указывать в диагнозе или в описании диагноза в медицинской документации (обозначены как "ключевая характеристика"); а также характеристики ЖНР, которые не являются обязательными в диагнозе, но желательны после дополнительного обследования пациента или выполнения электрофизиологического исследования.
Данная классификация единогласно одобрена всеми членами рабочей группы данных клинических рекомендаций, одобрена Комитетом по клиническим рекомендациям Российского кардиологического общества от 23.03.2023 и может быть рекомендована для применения в ежедневной клинической практике.
Таблица 1. Классификация желудочковых аритмий Российского кардиологического общества 2023 г. (ЖА-РКО-23)
Характеристика
Клиническая значимость и целесообразность вынесения в диагноз
Типы ЖА
Желудочковая экстрасистолия (ЖЭ): одиночная, парная
Ключевая характеристика. Выносится в диагноз.
Желудочковая тахикардия (ЖТ)
Фибрилляция желудочков (ФЖ)
Трепетание желудочков: быстрая ЖТ с неразличимыми зубцами Т (обычно частотой > 250 уд/мин)
По длительности и повторяемости ЖТ
Устойчивая (длительность ![]() 30 секунд)
30 секунд)
Ключевая характеристика.
Выносится в диагноз.
Неустойчивая (длительность менее 30 секунд)
Непрерывно-рецидивирующая (ЖТ, которая рецидивирует в течение нескольких часов, несмотря на повторные попытки купирования)
Электрический шторм
По морфологии QRS
Мономорфная (все QRS похожи друг на друга)
Ключевая характеристика.
Выносится в диагноз.
Полиморфная (QRS отличаются)
Плеоморфная (более одной определенной морфологии QRS во время одного эпизода ЖТ, но морфология QRS не является постоянно изменяющейся)
По характеру основного заболевания
Желудочковые аритмии при отсутствии структурного заболевания сердца и каналопатий
Ключевая характеристика.
Выносится в диагноз.
Необходимо вынесение в диагноз конкретного заболевания. В случае идиопатической артитмии необходимо указание на это.
Желудочковые аритмии при отсутствии явного структурного заболевания сердца при наличии врожденных синдромов или т.н. каналопатий: СУИQT, синдром Бругада, катехоламинзависимая полиморфная желудочковая тахикардия, синдром короткого интервала QT, синдром ранней реполяризации желудочков
Желудочковые аритмии при отсутствии явного структурного заболевания сердца при наличии обратимых метаболических или лекарственных причин (например, вторичный синдром удлиненного интервала QT)
Желудочковые аритмии при наличии структурного заболевания сердца
Симптомность аритмии
Симптомная
Ключевая характеристика.
Выносится в диагноз.
Бессимптомная
Бремя (нагрузка) желудочковой аритмии (для ЖЭ и желудочковых ритмов)
< 10% от всех желудочковых комплексов в течение периода наблюдения при проведении ХМЭКГ
Дополнительная характеристика.
Необязательна в диагнозе до проведения дополнительного обследования.
![]() 10% от всех желудочковых комплексов в течение периода наблюдения при проведении ХМЭКГ (как правило, является значимым для профилактики или лечения кардиомиопатии, ассоциированной с аритмией)
10% от всех желудочковых комплексов в течение периода наблюдения при проведении ХМЭКГ (как правило, является значимым для профилактики или лечения кардиомиопатии, ассоциированной с аритмией)
Целесообразно вынесение в диагноз с формулировками "частая" и "нечастая" после дополнительного обследования.
По механизму возникновения
Очаг повышенного автоматизма
Дополнительная характеристика.
Необязательна в диагнозе.
Дифференцировка важна для инвазивного лечения, а также подбора терапии при некоторых видах (фасцикулярная ЖЭ или ЖТ), риентри по ножкам пучка Гиса.
Вынесение в диагноз довольно затруднительно в большинстве случаев без электрофизиологического исследования.
Триггерная ЖТ (ранние или поздние постдеполяризации)
Риентри (с участием измененной ткани миокарда или с участием волокон проводящей системы Гиса-Пуркинье)
По частоте (циклу) ЖТ
Ускоренный желудочковый ритм, частота < 100 уд/мин (цикл > 600 мс)
Дополнительная характеристика.
Необязательна в диагнозе.
Важно для оценки прогноза, настройки ИКД, планирования катетерной аблации.
Целесообразно вынесение в диагноз после уточнения при дополнительном обследовании.
Медленная ЖТ, < 150 уд/мин (цикл > 400 мс)
Быстрая ЖТ, ![]() 150 уд/мин (цикл
150 уд/мин (цикл ![]() 400 мс)
400 мс)
По локализации
Камера сердца: из правого желудочка, из левого желудочка
Дополнительная характеристика.
Необязательна в диагнозе.
Отдел желудочка: проводящая система сердца (фасцикулярные), выходной тракт (правого или левого желудочка), септальные, из папиллярных мышц, периклапанные и т.д.
Дифференцировать локализацию ЖА в некоторых случаях довольно несложно по стандартной ЭКГ в 12 отведениях (например, выходной тракт правого желудочка). В других случаях только тщательное электрофизиологическое картирование позволяет точно определить локализацию выхода аритмии.
Целесообразно вынесение в диагноз после дообследования при возможности достаточно достоверного определения локализации.
Локализация в толще миокарда: субэндокардиальная, субэпикардиальная, интрамуральная
Примеры формулировки диагноза:
1. Диагноз по МКБ-10: I49.3. Преждевременная деполяризация желудочков.
Описание диагноза аритмии: Идиопатическая симптомная частая (> 10% желудочковых сокращений) мономорфная одиночная желудочковая экстрасистолия из выходного тракта правого желудочка.
2. Диагноз по МКБ-10: I25. Хроническая ишемическая болезнь сердца. I25.2 Перенесенный в прошлом инфаркт миокарда. I47.2. Желудочковая тахикардия. I46.1. Внезапная сердечная смерть, так описанная.
Описание диагноза аритмии: Пароксизмальная симптомная (остановка кровообращения от 01.02.2023) быстрая устойчивая мономорфная левожелудочковая тахикардия на фоне постинфарктного кардиосклероза.
Классификации желудочковой аритмии Lown B./Wolf M. и Ryan M. остаются актуальными для стратификации риска в раннем и отсроченном периодах после инфаркта миокарда [50, 51].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления ЖТА могут существенно различаться - от абсолютной бессимптомности до сердцебиения, дискомфорта в груди, загрудинной боли, удушья, головокружения, синкопальных состояний, ВОК. Учащенное сердцебиение, предобморочное состояние и обмороки - три наиболее важных симптома, которые требуют тщательного сбора анамнеза и дополнительного обследования для исключения ЖТА.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установки диагноза
Желудочковые нарушения ритма (ЖНР) или желудочковые аритмии (ЖА) - обобщенное название расстройств сердечного ритма, при которых источник эктопической активности или круга риентри находится ниже пучка Гиса, т.е. в его ветвях, сети Пуркинье или в миокарде желудочков.
Основными методами диагностики ЖНР являются ЭКГ и ХМЭКГ; однако в ряде случаев для постановки и уточнения диагноза, а также для дифференциальной диагностики тахикардий с широкими комплексами QRS, проводится ВСЭФИ.
Общими ЭКГ-признаками для всех ЖНР являются: 1) широкий деформированный комплекс QRS (![]() 120 мс), который чаще бывает преждевременным, реже - своевременным или выскальзывающим; 2) отсутствие предшествующего зубца P; 3) дискордантность зубца Т по отношению к основному зубцу желудочкового комплекса; 4) наличие сливных комплексов. Разновидности ЖНР и критерии их диагностики на ЭКГ подробно изложены в разделе 1.1.
120 мс), который чаще бывает преждевременным, реже - своевременным или выскальзывающим; 2) отсутствие предшествующего зубца P; 3) дискордантность зубца Т по отношению к основному зубцу желудочкового комплекса; 4) наличие сливных комплексов. Разновидности ЖНР и критерии их диагностики на ЭКГ подробно изложены в разделе 1.1.
Диагностическое обследование при подозрении на желудочковые нарушения ритма включает следующие этапы:
- тщательное изучение жалоб, истории заболевания и семейного анамнеза;
- осмотр и физикальное обследование;
- лабораторно-инструментальные методы исследования: более простые на первом этапе и сложные - на втором этапе обследования (по показаниям);
- патологоанатомическое исследование и молекулярный анализ жертв внезапной сердечной смерти;
- генетическое тестирование;
- визуализирующие методики и морфологические исследования.
2.1 Жалобы и анамнез
- Рекомендуется при опросе пациента с ЖЭ оценить симптомы для определения тяжести клинических проявлений ЖЭ [50, 51].
ЕОК IC (УУР C, УДД 5)
Комментарий. Характер клинической симптоматики ЖЭ, а также ее значение для прогноза здоровья и жизни пациентов зависят от форм проявления самой экстрасистолии, но в еще большей степени - от основного заболевания, как причины ее возникновения. Редкая одиночная ЖЭ у лиц без признаков органической патологии сердца может протекать бессимптомно или малосимптомно, проявляясь лишь ощущением перебоев в работе сердца. Частая экстрасистолия с периодами бигеминии, особенно у пациентов со сниженными показателями сократительной функции сердца (ИБС, кардиомиопатии, другие формы поражения миокарда), помимо перебоев, может приводить к снижению АД, появлению чувства слабости, головокружению, появлению и нарастанию одышки.
- При опросе пациента со структурным заболеванием сердца, имеющего высокий риск ЖА, рекомендуется целенаправленно выяснять наличие жалоб для выявления пароксизмальных ЖА в связи с высокой вероятностью их развития [50, 51].
ЕОК IC (УУР C, УДД 5)
Комментарий. Тяжесть клинических проявлений зависит от ЧСС во время пароксизма, наличия или отсутствия СПС и сопутствующей патологии (например, атеросклероз брахиоцефальных артерий).
- С целью выявления жизнеугрожающих состояний у пациентов со СПС, особенно перенесших ИМ со сниженной ФВ ЛЖ, рекомендуется рассматривать ЖА в качестве одной из вероятных причин синкопальных состояний [50, 51].
ЕОК IC (УУР C, УДД 5)
- С целью выявления жизнеугрожающих состояний при опросе пациента рекомендуется рассматривать СУИQT и КПЖТ в качестве возможных причин кардиогенных синкопальных состояний, возникающих на высоте физической или эмоциональной нагрузки, особенно у молодых пациентов без СПС. Кроме того, следует учитывать такие специфические для СУИQT триггеры синкопе как резкий звук, плавание, пробуждение [52, 53].
ЕОК IB (УУР B, УДД 3)
Комментарий. При сборе анамнеза пациентов с СУИQT рекомендуется уделять внимание принимаемым пациентом лекарственным препаратам, поскольку удлинение интервала QT могут вызывать многие некардиологические лекарственные средства (постоянно обновляемый перечень представлен на сайте https://crediblemeds.org/; актуальная информация о побочных эффектах медикаментозных препаратов представлена на сайте https://www.drugs.com/).
- У пациентов, у которых предполагается или имеется ЖТА, рекомендован сбор семейного анамнеза, нацеленный на выявление случаев внезапных и необъяснимых смертей (например, утопление) среди родственников I - II степеней родства в молодом возрасте с целью оценки вероятности генетически детерминированных желудочковых нарушений ритма сердца [50, 51].
ЕОК IC (УУР C, УДД 5)
2.2 Физикальное обследование
- Всем обследуемым пациентам для установления диагноза основной и сопутствующей патологии или исключения возможных триггеров ЖНР рекомендуется проводить следующие стандартные измерения [50, 54]:
- антропометрические показатели (измерение роста, массы тела, индекс массы тела, определение окружности талии);
- термометрия общая и оценка состояния кожных покровов;
- оценка наличия отеков и их распространенности;
- измерение артериального давления на периферических артериях;
- исследование пульса на периферических артериях с оценкой частоты и регулярности ритма;
- оценка набухания и пульсации шейных вен, что может свидетельствовать о наличии венозного застоя;
- аускультация сердца, сонных, почечных и бедренных артерий для выявления патологических шумов;
- пальпация щитовидной железы: размеры, болезненность, подвижность.
ЕОК IC (УУР C, УДД 5)
Комментарий. В дополнение к основным показателям рекомендовано оценивать специфические изменения с целью исключения обратимых причин, которые потенциально могут быть ассоциированы с ЖА. Важным является скрининг кожных проявлений редких системных воспалительных (склеродермия, саркоидоз) и инфекционных заболеваний (болезнь Чагаса, боррелиоз и др.) [55]. Пациентов с СУИQT и КПЖТ характеризует брадикардия. В редких случаях при обследовании пациентов с врожденным СУИQT или АКПЖ возможно обнаружение аномалий органов чувств (врожденная глухота) и костно-суставной системы (синдактилия).
- При физикальном обследовании пациентов с пароксизмальными нарушениями ритма сердца рекомендуется выявление признаков гемодинамической нестабильности (снижение АД) с целью определения порядка оказания медицинской помощи [56, 57].
ЕОК IC (УУР C, УДД 5)
Комментарий. При подавляющем большинстве ЖА сердца при физикальном обследовании пациентов вне пароксизма какие-либо изменения не отмечаются. Внеочередные сердечные сокращения (экстрасистолы) могут быть отмечены при подсчете пульса, измерении АД или аускультации сердца пациента.
2.3 Лабораторные диагностические исследования
В рамках обследования целесообразно проведение стандартного лабораторного минимума, включающего общий (клинический) анализ крови и анализ крови биохимический общетерапевтический для определения уровня общего сердечно-сосудистого риска, с контролем дополнительных параметров, позволяющих подтвердить или исключить преходящие корригируемые нарушения, потенциально значимые для возникновения желудочковых нарушений ритма сердца.
Всем пациентам с ЖТА в рамках первичного обследования и в процессе динамического наблюдения для исключения сопутствующих заболеваний и определения тактики лечения целесообразно проведение биохимического анализа крови, включающего: исследование уровней натрия и калия, уровня креатинина, уровня глюкозы, уровня общего белка, уровня общего билирубина, уровня мочевой кислоты, уровня C-реактивного белка, активности аспартатаминотрансферазы и аланинаминотрансферазы, уровня холестерина и липопротеидов в крови, уровня триглицеридов [58, 59, 60, 61, 62].
- Рекомендуется проведение общего (клинического) анализа крови в рамках первичного обследования и в процессе динамического наблюдения у всех пациентов с желудочковыми тахиаритмиями для исключения сопутствующих заболеваний [58, 59].
РКО IIaC (УУР C, УДД 5)
- Во всех случаях у взрослых пациентов с ЖТА рекомендовано обследование для подтверждения или исключения преходящих (модифицируемых) факторов, значимых для возникновения ЖА (прием сердечных гликозидов, ААП (C01B Антиаритмические препараты I и III классов), уровень калия и магния в сыворотке крови, признаки острого ИМ, гипертиреоз и др.) [59, 63, 64].
ЕОК IC (УУР C, УДД 5)
- Пациентам со значимым удлинением интервала QT на ЭКГ рекомендовано проведение комплекса анализов для выявления преходящих причин: исследование тиреотропного гормона в крови у взрослых для выявления гипотиреоза и гипертиреоза, гипокалемии, гипокальциемии, приема лекарственных препаратов, метаболических нарушений, применения разнообразных диет и др.) [61, 62, 63, 64, 65].
ЕОК IC (УУР C, УДД 4 - для взрослых, УУР С, УДД 5 - для детей)
- Пациентам, у которых на ЭКГ регистрируется Бругада-паттерн, рекомендовано исключение преходящих причин, приводящих к подобным изменениям на ЭКГ (например, острого коронарного синдрома, тромбоэмболии легочной артерии, перикардита и др.) [50, 51].
УУР C, УДД 5
2.4 Инструментальные диагностические исследования
Скрининг пациентов с предполагаемыми или доказанными ЖТА
Стандартная ЭКГ в 12-ти отведениях может способствовать выявлению признаков наследственных заболеваний, связанных с ЖА и ВСС, таких как каналопатии (СУИQT и СКИQT, синдром Бругада, КПЖТ) и кардиомиопатии (АКПЖ и ГКМП). На СПС указывают такие ЭКГ-признаки, как блокада пучка Гиса, АВ блокада, гипертрофия желудочка и зубец Q, характерный для ИБС или инфильтративной кардиомиопатии. Электролитные нарушения и эффекты различных лекарственных препаратов могут привести к нарушению реполяризации и/или удлинению комплекса QRS.
Из инструментальных методов диагностики чаще всего используют ЭХОКГ, которая в сравнении с МРТ и КТ сердца, является менее дорогостоящей, более доступной и позволяет с высокой точностью диагностировать заболевания миокарда, клапанов сердца или врожденные пороки сердца, связанные с ЖА и ВСС [66]. Кроме того, у большинства пациентов она позволяет оценить систолическую функцию ЛЖ и региональное движение сердечной стенки.
- Регистрация ЭКГ в 12 отведениях рекомендована всем пациентам с сердечно-сосудистыми заболеваниями при прохождении обследования для выявления ЖА [50, 740].
ЕОК IA (УУР C, УДД 5)
- Регистрация ЭКГ в 12 отведениях и мониторирование электрокардиографических данных рекомендованы всем пациентам при подозрении на наличие ЖА для их подтверждения или исключения [50, 740].
РКО IC (УУР C, УДД 5)
Комментарий. Мониторирование электрокардиографических данных целесообразно с целью выявления ЖА, оценки результатов медикаментозного и хирургического лечения. С помощью мониторирования электрокардиографических данных возможно сопоставить симптомы у пациента с регистрируемыми нарушениями ритма, оценить клинико-электрокардиографиеские характеристики ЖА (типы, бремя, морфологию аритмии, длительность и повторяемость ЖТ, частоту сокращений желудочков при ЖТ, связь с провоцирующими факторами).
- Электрокардиография с физической нагрузкой рекомендована пациентам, если известно или предполагается, что ЖА провоцируются физической нагрузкой, для установки диагноза, определения прогноза, оценки результатов медикаментозной терапии или аблации [67].
ЕОК IA (УУР C, УДД 5)
Комментарий. Данное обследование должно проводиться квалифицированным персоналом в оснащенном согласно требованиям помещении.
- ЭХОКГ для оценки функции ЛЖ и ПЖ и выявления СПС рекомендована всем пациентам с предполагаемыми или доказанными ЖТА или имеющим высокий риск развития тяжелых ЖА или ВСС [68, 69, 741].
ЕОК IA (УУР C, УДД 5)
Комментарий. ЭХОКГ следует выполнять всем пациентам при наличии ЖА и подозрении на СПС, а также у пациентов с высоким риском развития ЖА или ВСС, например, при дилатационной, гипертрофической или правожелудочковой кардиомиопатии, а также у пациентов, переживших острый ИМ, или у родственников пациентов с наследственными заболеваниями с высоким риском ВСС.
- Нагрузочный стресс-тест (ЭКГ/ЭХОКГ/Однофотонная эмиссионная компьютерная томография миокарда перфузионная с функциональными пробами) рекомендован взрослым пациентам с ЖА, имеющим среднюю или высокую вероятность ИБС, исходя из возраста или симптомов, с целью провокации ишемических изменений или ЖА, а также для уточнения диагноза и прогноза при наличии ЖТА, идуцированных физической нагрузкой, или подозрении на данную патологию, включая КПЖТ [67, 68, 69]
ЕОК IB (УУР C, УДД 5)
Комментарий. Некоторым пациентам показана ЭХОКГ с фармакологической или физической нагрузкой ("стресс-ЭХО"), в том числе пациентам, у которых ЖА может быть спровоцирована ишемией, а также тем, кто не переносит физические нагрузки или имеет изменения ЭКГ в покое, что ограничивает точность ЭКГ для определения ишемии.
- Выполнение МРТ сердца с контрастированием или спиральной компьютерной томографии сердца с ЭКГ-синхронизацией у пациентов с ЖА рекомендовано для уточнения информации о функции ЛЖ и ПЖ и/или о структурных изменениях сердца в случаях, когда ЭХОКГ не дает точной информации [8, 51].
ЕОК IIa B (УУР С, УДД 5)
Комментарий. На качество почти всех видов изображения влияет наличие частых ЖЭ. Синхронизация ЭКГ, дополнительные последовательные задержки дыхания и применение 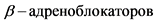 для снижения ЧСС способны улучшить качество визуализации [8].
для снижения ЧСС способны улучшить качество визуализации [8].
- При редких симптомах (к примеру, синкопальные состояния) и невозможности регистрации эпизода в процессе мониторирования ЭКГ рекомендовано использование кардиомонитора имплантируемого*** с целью выявления возможных транзиторных аритмий, способных вызывать такие симптомы [70, 71].
ЕОК IA (УУР C, УДД 4)
Комментарий. Тип прибора мониторирования ЭКГ и длительность записи должны соответствовать частоте клинических событий. Холтеровское мониторирование сердечного ритма в течение 24 - 72 часов подходит при почти ежедневных аритмиях, а при редких событиях целесообразна более длительная запись ЭКГ: еженедельно - 5 - 7 суточное мониторирование электрокардиографических данных, несколько раз в год или реже - применение кардиомонитора имплантируемого***.
Инвазивные методы диагностики
- Рекомендуется провести коронарографию для подтверждения или исключения наличия гемодинамически значимых стенозов коронарных артерий у взрослых пациентов с жизнеугрожающими ЖА или переживших ВСС, которые имеют среднюю или высокую вероятность ИБС с учетом возраста и симптомов [72, 73].
ЕОК IIaC (УУР C, УДД 4)
- Рекомендуется позитивная контрастная вентрикулография сердца и/или биопсия миокарда правого желудочка для исключения или подтверждения диагноза АКПЖ или миокардита, если эти заболевания не могут быть установлены или исключены на основании результатов других неинвазивных исследований и сохраняются подозрения на наличие одного из этих заболеваний [51, 73].
ЕОК IIaC (УУР C, УДД 5)
Внутрисердечное электрофизиологическое исследование (ВСЭФИ) с ПСЖ используется для оценки индукции ЖТ, картирования потенциальной области аблации, оценки рисков повторных эпизодов ЖТ или ВСС, а также для выявления причин потери сознания, возможно, связанных с нарушениями ритма, и для определения показаний к применению кардиовертера-дефибриллятора имплантируемого*** (ИКД).
- Пациентам, имеющим характерные клинические проявления, но не имеющим ЭКГ, зарегистрированных во время приступов, а также в случаях, когда диагноз не может быть однозначно поставлен на основании ЭКГ, зарегистрированной во время пароксизма, для индукции ЖТ и верификации диагноза рекомендуется проведение ВСЭФИ [50, 51].
ЕОК IB (УУР C, УДД 5)
- ВСЭФИ рекомендуется взрослым пациентам при жалобах на обмороки и при подозрении на брадиаритмию или тахиаритмию с учетом симптоматики (например, учащенное сердцебиение) или результатов неинвазивного обследования, особенно для пациентов со СПС, для стратификации риска ВСС и выбора лечебной тактики [74, 75].
ЕОК IB (УУР C, УДД 4)
Комментарий. Обмороки являются неблагоприятным признаком у пациентов со СПС, особенно при выраженной дисфункции ЛЖ. Наличие у пациента неустойчивой ЖТ (НУЖТ) по данным ХМЭКГ, обмороков и СПС с большой долей вероятности указывает на присутствие индуцируемой ЖТ. При сочетании синкопальных состояний, заболевания сердца и сниженной ФВ ЛЖ отмечается высокая частота повторных эпизодов аритмии и смертельных случаев, даже когда ВСЭФИ дает отрицательные результаты. ВСЭФИ целесообразно выполнять у пациентов с дисфункцией ЛЖ после перенесенного ИМ (ФВ ЛЖ < 40%), но данное исследование не является чувствительным методом для пациентов с неишемической кардиомиопатией; при этом индукция полиморфной ЖТ или ФЖ, особенно при агрессивной стимуляции, не является специфичным маркером. При ИБС ценность (предсказательная точность) диагностической информации, полученной при ВСЭФИ, может достигать 50%.
- ВСЭФИ рекомендовано для стратификации риска ВСС у взрослых пациентов с синдромом Бругада, с АКПЖ, однако интерпретация результатов исследования требует осторожности [76, 77, 78].
ЕОК IB (УУР C, УДД 4 для взрослых; УУР C, УДД 3 для детей)
Комментарий. Отсутствие индукции ЖТ или ФЖ в ходе исследования указывает на благоприятный прогноз, однако, прогностическая значимость индукции ЖТ или ФЖ в настоящее время не определена.
- ВСЭФИ не рекомендуется для стратификации риска ВСС у взрослых пациентов с СКИQT (синдромом короткого интервала QT) и при КПЖТ [76, 77, 79, 80, 81].
ЕОК III (УУР C, УДД 4)
Комментарий. Объем ценной диагностической информации, полученной с помощью ВСЭФИ, существенно варьирует в зависимости от типа и тяжести основного заболевания сердца, наличия или отсутствия спонтанной ЖТ, принимаемых лекарственных препаратов, протокола стимуляции и области стимуляции. Наибольшая частота индукции и воспроизводимость метода отмечена у пациентов, перенесших ИМ. Диагностическая информативность отличается в разных группах пациентов и обычно довольно мала при отсутствии СПС и изменений на ЭКГ [75, 77] и часто дает ложноотрицательные результаты [77]. У пациентов с нормальной функцией ЛЖ и без СПС ВСЭФИ может спровоцировать неспецифическую тахиаритмию.
Провокационные пробы в диагностике ЖТА
Активная ортостатическая проба. Оценка динамики интервала QT при регистрации ЭКГ в ходе ортостатической пробы обладает диагностической значимостью, позволяя в ряде случаев выявить лиц, больных СУИQT. После перехода в вертикальное положение отмечается умеренное увеличение частоты синусового ритма, при этом у здоровых пациентов длительность интервала QT уменьшается, а у больных СУИQT продолжительность интервала QT уменьшается менее существенно, не изменяется или увеличивается (максимально это выражено у пациентов с СУИQT 1-го типа). Удлинение корригированного интервала QT (QTс) в ортостазе более 499 - 500 мс является одним из диагностических критериев [80, 81, 82].
Проба с дозированной физической нагрузкой на велоэргометре или тредмиле. Наиболее информативна оценка длительности интервала QT в период восстановления. Оценивается динамика показателя корригированного интервала QT в исходе, на пике нагрузки и 4-й минуте восстановительного периода. Величина интервала QTc ![]() 480 мс на 4-й минуте восстановления после стресс-теста считается одним из критериев диагностики врожденного СУИQT (критерий, по значимости сопоставимый с наличием альтернации зубца Т) [81, 82].
480 мс на 4-й минуте восстановления после стресс-теста считается одним из критериев диагностики врожденного СУИQT (критерий, по значимости сопоставимый с наличием альтернации зубца Т) [81, 82].
2.5 Иные диагностические исследования
Методы молекулярно-генетического исследования
Медико-генетическое консультирование в учреждениях с опытом генетического обследования и динамического наблюдения необходимо всем пациентам с первичными электрическими заболеваниями сердца (каналопатиями) и их родственникам, и должно включать обсуждение пользы, рисков и ограничений генетического тестирования. Пациенты должны быть полноценно осведомлены о смысле и значимости скрининга, возможных его результатах, их клиническом значении, а также в целом о вопросах наследственности ССЗ. Стратегия лечения не должна базироваться только на результатах генетического тестирования, но должна опираться на результаты всестороннего клинического, инструментального и генетического обследования [81, 83, 84].
Целесообразно выполнять генетическое исследование у пациентов с потенциальным первичным электрическим заболеванием сердца (каналопатией) только в сочетании с надлежащим медико-генетическим консультированием [81, 82, 83, 84].
Синдром удлиненного интервала QT (СУИQT)
- Молекулярно-генетическое исследование мутаций в генах, имеющих доказанный причинный характер в отношении СУИQT (KCNQ1, KCNH2, SCN5A, CALM1, CALM2, CALM3), рекомендуется с целью диагностики всем пациентам с высокой вероятностью клинического диагноза СУИQT, основанного на данных персонального и семейного анамнеза и данных ЭКГ покоя, ХМЭКГ и нагрузочного теста (шкала Шварца в Приложении Г1 [83, 84, 85].
РКО IB (УУР В, УДД 3)
Комментарий. У пациентов с удлинением интервала QT и специфическим фенотипом, характерным для наследственных синдромов, следует проводить поиск мутаций в соответствующих генах (например, гены KCNQ1 и KCNE1 при синдроме Джервелла-Ланге-Нильсена; ген CACN1C при синдроме Тимоти; ген KCNJ2 при синдроме Андерсена; ген TRDN, если предполагается синдром недостаточности триадина; ген NAA10 при синдроме Огдена) [84, 85, 86].
- Проведение комплексного молекулярно-генетического исследования на выявление возможных мутаций в генах KCNQ1, KCNH2, SCN5A, CALM1, CALM2, CALM3 (СУИQT 1, 2 и 3-го типов - наиболее распространенные формы заболевания) рекомендовано с целью диагностики СУИQT всем пациентам с клиническими проявлениями СУИQT и удлинением интервала QTc, зарегистрированным на ЭКГ в покое или при проведении провокационных диагностических проб, а также всем пациентам, не имеющим характерных для СУИQT клинических симптомов, при регистрации на ЭКГ удлинения интервала QTc > 480 мс в препубертатном возрасте и QTc > 500 мс у взрослых при отсутствии других возможных причин удлинения интервала QT [82, 83, 86].
ЕОК IA (УУР B, УДД 3)
Комментарий. Методы молекулярно-генетического исследования имеют существенное значение в диагностике СУИQT и определении прогноза пациентов. При проведении комплексных генетических анализов мутации удается обнаружить приблизительно у 75% пациентов, поэтому отрицательный результат генетического анализа не позволяет полностью исключить диагноз СУИQT. В случае отрицательного анализа на мутации в первой линии диагностики, может быть рассмотрена возможность проведения экзомного секвенирования для поиска каузативного варианта у пробанда.
- Проведение комплексного молекулярно-генетического исследования на выявление возможных мутаций в генах KCNQ1, KCNH2 и SCN5A рекомендовано пациентам, не имеющим характерных СУИQT-симптомов, при регистрации на ЭКГ удлинения интервала QTc > 480 мс в препубертатном возрасте и QTc > 500 мс у взрослых при отсутствии других возможных причин удлинения интервала QT, с целью диагностики СУИQT [82, 83, 86].
ЕОК IA (УУР B, УДД 3)
- В случае обнаружения у пациента с СУИQT генетической мутации, проведение скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них характерных для этого заболевания клинических проявлений и изменений ЭКГ для оценки индивидуального прогноза [82, 83].
ЕОК IIaB (УУР B, УДД 3)
- Рекомендуется рассмотреть возможность молекулярно-генетического исследования генов KCNQ1, KCNH2, SCN5A, KCNE1 и KCNE2 у пациентов с анамнезом лекарственно-индуцированного удлинения интервала QT в возрасте < 40 лет при наличии базового QTc > 440 мс (у мужчин) и QTc > 450 мс (у женщин) (в отсутствие провоцирующего препарата) для потенциального выявления врожденного СУИQT [81, 83].
РКО IIb C (УУР C, УДД 5)
- Для оценки индивидуального прогноза рекомендуется вариант-специфический каскадный семейный скрининг родственникам пробанда с СУИQT, даже при отсутствии у них характерных для этого заболевания клинических проявлений и изменений ЭКГ [81, 83].
РКО IC (УУР C, УДД 5)
Комментарий. генетическое тестирование для оценки прогноза у детей - родственников пробанда с выявленной мутацией рекомендуется, начиная с рождения (в любом возрасте).
Синдром Бругада
Единственным геном с доказанной каузативностью при синдроме Бругада является ген SCN5A, однако на долю мутаций в этом гене приходится лишь около 20% случаев заболевания. Известные фенокопии синдрома Бругада, такие, как ишемия миокарда, электролитные расстройства, тромбоэмболия легочной артерии, лекарственная интоксикация, должны быть исключены до выполнения тестирования.
- Поиск мутаций в гене SCN5A рекомендуется пациентам с Бругада-паттерном 1 типа на ЭКГ, проявляющимся спонтанно или на фоне применения блокаторов натриевых каналов, в сочетании с клиническими проявлениями и/или отягощенным семейным анамнезом, с целью диагностики синдрома Бругада [85, 86].
РКО IC (УУР B, УДД 3)
- Вариант-специфический каскадный семейный скрининг рекомендуется членам семьи пробанда с выявленными редкими генетическими вариантами IV - V классов патогенности с целью риск-стратификации ВСС [85, 86].
РКО IIa C (УУР B, УДД 3)
- Не рекомендуется проведение молекулярно-генетических исследований лицам для диагностики, если наблюдаются бругадаподобные ЭКГ-изменения только 2-го и 3-го типов, при отсутствии у них клинических проявлений и отягощенного по ВСС семейного анамнеза [85, 86].
ЕОК IIIC (УУР B, УДД 3)
Катехоламинергическая полиморфная желудочковая тахикардия (КПЖТ)
- Всем пациентам с КПЖТ и пациентам, клинические проявления которых с большой вероятностью могут быть обусловлены этим заболеванием, рекомендуется молекулярно-генетическое исследование мутаций в генах RYR2, CASQ2, CALM1-3, TRDN, TECRL, KCNJ2 с целью диагностики и уточнения индивидуального прогноза [82, 87].
ЕОК IC (УУР C, УДД 5)
Комментарий. Клинические проявления синдрома Пуркинье-ассоциированных полиморфных желудочковых аритмий (мутации в гене SCN5A) и синдрома Андерсена (мутации в гене KCNJ2) также могут перекрываться с КПЖТ, однако частота ЖЭ в покое (вне катехоламинергической стимуляции) у таких пациентов довольно высока, что отличает эти синдромы от истинной КПЖТ. Поэтому для ряда пациентов включение в диагностическую панель гена SCN5A также может быть оправдано.
- В случае обнаружения у пациента патогномоничной генетической мутации при молекулярно-генетическом исследовании, направленном на выявление этой мутации, всем близким родственникам пациента рекомендовано проведение молекулярно-генетического скрининга, даже при отсутствии у них клинических проявлений заболевания, с целью диагностики и уточнения индивидуального прогноза [82, 84].
ЕОК IC (УУР C, УДД 5)
Синдром короткого интервала QT
- Пациентам с клиническим подозрением на СКИQT рекомендуется рассмотреть возможность комплексного поиска мутаций в генах KCNH2, KCNQ1, KCNJ2 и SLC4A3, для выявления и оценки персональных рисков [82].
ЕОК IC (УУР C, УДД 5)
Комментарий. Следует учитывать низкую чувствительность методов в диагностике заболевания.
- Для оценки индивидуального прогноза рекомендуется вариант-специфический каскадный семейный скрининг родственникам пробанда с СКИQT, даже при отсутствии у них характерных для этого заболевания клинических проявлений и изменений ЭКГ [82].
РКО IIaB (УУР C, УДД 5)
Аритмогенная кардиомиопатия
Аритмогенная кардиомиопатия характеризуется, как правило, фиброзным или фиброзно-жировым замещением миокарда, что ведет к прогрессирующему нарушению сократительной способности (очаговой/глобальной) и высокой частоте желудочковых аритмий. Структурные изменения могут поражать как правый, так и левый желудочек, также известны бивентрикулярные формы. Выделяют три основных фенотипа: преимущественно правожелудочковый вариант ("классическая" аритмогенная кардиомиопатия правого желудочка - АКПЖ (ARVC)), бивентрикулярный вариант и преимущественно левожелудочковый вариант (также известный как "аритмогенная левожелудочковая кардиомиопатия" - ALVC). Идентификация генетического варианта высоких классов патогенности (Патогенный/Вероятно патогенный) является большим диагностическим критерием для всех типов аритмогенной кардиомиопатии, а для постановки диагноза левожелудочкового варианта аритмогенной кардиомиопатии может быть необходимым условием. Самым частым типом наследования аритмогенной кардиомиопатии является аутосомно-доминантный, но известно небольшое число и аутосомно-рецессивных форм [81, 88, 89, 90].
- Всем пациентам с достоверным диагнозом аритмогенной кардиомиопатии, поставленным на основании современных диагностических критериев, рекомендуется поиск мутаций в генах PP2, DSP, DSG2, DSC2, JUP, TMEM43, PLN, FLNC, DES, LMNA. В случае выявления вариантов с высоким классом патогенности проведение каскадного семейного скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них клинических проявлений заболевания, с целью диагностики и уточнения индивидуального прогноза [81, 82, 84].
УУР C, УДД 5
- Всем пациентам с вероятным и возможным диагнозом аритмогенной кардиомиопатии, поставленным на основании современных диагностических критериев, рекомендуется поиск мутаций в генах PKP2, DSP, DSG2, DSC2, JUP, TMEM43, PLN, FLNC, DES, LMNA, с целью диагностики и уточнения индивидуального прогноза [81, 82, 83, 88, 90].
РКО IIaB (УУР C, УДД 5)
Комментарий. В случае выявления вариантов с высоким классом патогенности целесообразно проведение каскадного семейного скрининга, направленного на выявление этой мутации, у всех близких родственников пробанда, даже при отсутствии у них клинических проявлений заболевания.
Патологоанатомическое исследование и молекулярно-генетический анализ у жертв внезапной сердечной смерти
- Аутопсия (A08.30.019 Патологоанатомическое вскрытие) рекомендована для установления причин внезапной смерти и выяснения фактов, является ли ВСС следствием нарушений ритма или других механизмов (к примеру, разрыв аневризмы аорты) [82, 91].
ЕОК IC (УУР C, УДД 5)
- Независимо от сроков проведения аутопсии, наряду с патологоанатомическим исследованием, рекомендовано выполнение патолого-анатомического исследования биопсийного (операционного) материала миокарда с применением электронно-микроскопических методов, включая исследование меченых блоков поперечных срезов миокарда обоих желудочков, обладающих достаточной репрезентативностью, с целью установления причин внезапной смерти [82, 91].
ЕОК IC (УУР C, УДД 5)
- Посмертное исследование образцов крови и других биологических жидкостей жертв ВСС (иммуноцитохимическое исследование биологического материала; исследования биологических жидкостей, с помощью которых исследуются концентрации веществ и активность ферментов в жидких средах организма; судебно-химическая экспертиза (исследование) биологического объекта на наличие химических веществ) и молекулярно-генетическое исследование мутаций в генах, ассоциированных с риском ВСС, рекомендовано во всех случаях необъяснимой ВСС с целью установления причин внезапной смерти [82, 91].
ЕОК IC (УУР C, УДД 5)
- Посмертное молекулярно-генетическое исследование для возможной идентификации генов, потенциально ассоциированных с развитием врожденной патологии сердца, следует рассматривать у всех жертв ВСС, для которых вероятно наличие каналопатий или кардиомиопатий, с целью установления причин внезапной смерти [82, 91].
ЕОК IIaC (УУР C, УДД 4)
Диагностические исследования в отдельных клинических ситуациях манифестации ЖТ и/или ВСС
Наиболее часто встречаются следующие варианты манифестации ЖТ и/или ВСС:
- впервые выявленная НУЖТ и/или ЖЭ (варианты: выявленная случайно при обследовании по поводу иного состояния, выявленная направленно при обследовании пациента с характерными жалобами или риском ВСС);
- впервые возникшая устойчивая ЖТ;
- выживший после внезапной остановки сердца (ВОС);
- умерший вследствие ВОС.
Случайное выявление неустойчивой желудочковой тахикардии
У пациентов с впервые документированной ЖА (частые ЖЭ, НУЖТ, УМЖТ) необходима регистрация исходной ЭКГ в 12 отведениях, регистрация ЖА на ЭКГ в 12 отведениях, когда это возможно, и выполнение ЭХОКГ. При случайном выявлении НУЖТ необходимо дополнительное ЭКГ-обследование, в частности, проведение Холтеровское мониторирование сердечного ритма (ХМЭКГ) продолжительностью ![]() 24 ч.
24 ч.
Впервые выявленная устойчивая мономорфная желудочковая тахикардия
У пациентов с первым эпизодом УМЖТ для выявления этиологической причины могут быть выполнены следующие исследования: ВСЭФИ, электроанатомическое картирование и биопсия под контролем картирования.
Выживший после ВОС
У электрически нестабильных пациентов после ВОС с подозрением на продолжающуюся ишемию миокарда показана КАГ. Всем выжившим после ВОС целесообразно выполнение ЭХОКГ для оценки структуры и функции сердца. Обследование пациента, выжившего после ВОС без очевидной экстракардиальной причины, следует проводить многопрофильной командой специалистов. У пациентов, выживших после ВОС, следует провести КТ головного мозга/грудной клетки, если результаты ЭКГ и ЭХОКГ не позволяют выявить сосудистую причину ВОС. При поступлении в стационар выжившего после ВОС целесообразно проводить анализ крови на токсикологическое тестирование (иммуноцитохимическое исследование биологического материала; исследования биологических жидкостей, с помощью которых исследуются концентрации веществ и активность ферментов в жидких средах организма; судебно-химическая экспертиза (исследование) биологического объекта на наличие химических веществ) и сбор образца крови на молекулярное-генетическое исследование мутаций в генах, ассоциированных с риском ВСС, (скрининг каналопатий). Всем выжившим после ВОС без ясной причины необходимы визуализация коронарных артерий и МРТ с отсроченным контрастированием гадолинием (АТХ V08CA Парамагнитные контрастные средства) для оценки структуры и функции сердца и сердечных сосудов.
Жертва внезапной смерти (ВС)
В случаях ВС необходимо выяснить подробности обстоятельств смерти, симптомов, предшествовавших смерти, семейный анамнез и изучить предыдущие медицинские документы. Следует стремиться к проведению комплексного патолого-анатомического вскрытия во всех случаях неожиданной ВС, особенно в возрасте до 50 лет. В случаях ВС рекомендуется сохранить биообразцы, подходящие для выделения ДНК, и проконсультироваться с врачом-кардиологом при подозрении на наследственную причину или невыясненной причине смерти. После внезапной аритмической смерти (ВАС) целесообразно проведение посмертного молекулярно-генетического исследования, нацеленного на выявление первичного электрического заболевания сердца, когда умерший молод (![]() 50 лет) и/или обстоятельства и/или семейный анамнез подтверждают первичное электрическое заболевание.
50 лет) и/или обстоятельства и/или семейный анамнез подтверждают первичное электрическое заболевание.
Родственники умерших от ВАС
Обследование членов семьи умерших от ВАС целесообразно: для ближайших родственников; для родственников, которые должны быть носителями мутации на основе анализа семейного анамнеза; для родственников с подозрительными симптомами; когда умершему < 50 лет или если есть другие данные, предполагающие наследственное заболевание. Обследование семьи умершего ВАС должно включать в себя генетическое тестирование, если посмертное генетическое тестирование умершего выявило патогенную мутацию.
- У пациентов с недавно подтвержденной ЖА (частые ЖЭ, НУЖТ, УМЖТ) и подозрением на СПС (кроме ИБС) после первоначальной оценки рекомендовано выполнение МРТ сердца для исключения СПС [92].
ЕОК IIaB (УУР C, УДД 4)
- Опрос (программирование) имеющегося постоянного имплантируемого антиаритмического устройства (ЭКС***, ИКД*** или иного) или носимого устройства (например, монитора) с анализом записей внутрисердечных электрограмм и/или ЭКГ рекомендуется у всех выживших после ВОС для диагностики вероятного нарушения ритма сердца, приводящего к ВОС [8].
ЕОК IB (УУР C, УДД 5)
- Пациентам, выжившим после ВОС, рекомендуется повторная регистрация ЭКГ в 12 отведениях при стабильном ритме (включая ЭКГ в высоких прекордиальных отведениях), а также непрерывное мониторирование ЭКГ (например, ХМЭКГ), для обнаружения признаков изменений в миокарде и/или нарушений ритма и проводимости [90, 92, 740].
ЕОК IB (УУР C, УДД 5)
- Фармакологическая проба с блокаторами натриевых каналов (ААП классов IA, IC) (для возможного выявления синдрома Бругада или иных электрофизиологических отклонений) и нагрузочная проба рекомендуются выжившим после ВОС без явной основной причины [93].
ЕОК IB (УУР C, УДД 4)
- Токсикологическое исследование (исследования биологических жидкостей, с помощью которых исследуются концентрации веществ и активность ферментов в жидких средах организма) рекомендуется в случаях ВС с неопределенной причиной смерти для исключения воздействия вредных веществ в качестве причины ВС [94].
ЕОК IB (УУР C, УДД 4)
- Если при аутопсии подозревается наследственное заболевание сердца, рекомендуется направить родственников первой степени родства для обследования в клинику с имеющимися компетенциями и возможностью расширенного обследования с целью стратификации риска ВС [95].
ЕОК IB (УУР C, УДД 4)
- В неаутопсийных случаях ВС, когда подозревается наследственное заболевание сердца, рекомендуется направлять родственников первой линии родства для оценки состояния сердца в клинику с имеющимися компетенциями и возможностью расширенного обследования с целью стратификации риска ВС [96].
ЕОК IB (УУР C, УДД 4)
- Рекомендуется минимальное обследование членов семьи умершего ВАС, включающее сбор анамнеза и проведение физикального осмотра, регистрацию стандартной ЭКГ с высоким расположением прекордиальных отведений (V1 - V2), ЭХОКГ и пробу с физической нагрузкой с целью стратификации риска ВС [97, 740, 741].
ЕОК IB (УУР C, УДД 4)
- В семьях с ВАС без определенного диагноза после клинического обследования рекомендуется наблюдение за детьми умерших до достижения ими совершеннолетия с целью стратификации риска ВС [98].
ЕОК IC (УУР C, УДД 4)
- Фармакологическая проба с блокаторами натриевых каналов (ААП классов IA, IC) рекомендуется у родственников умерших от ВАС в возрасте 16 лет и старше, если исходное обследование у них и/или результаты обследования пробанда вызывают подозрение на синдром Бругада [82, 98].
ЕОК IIaB (УУР C, УДД 4)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Общие принципы ведения пациентов в момент желудочковой тахиаритмии
3.1.1. Устранение обратимых причин
Обратимые причины развития ЖА могут составлять до 50% ВСС [98]. Однако в большинстве случаев трудно определить основную причину ВСС и является ли она обратимой. Кроме того, крайне важно понимать, что для устранения обратимой причины желудочковых нарушений ритма сердца может требоваться достаточно продолжительное время. Комплексное обследование пациентов с ВСС является обязательным, если заболевание сердца ранее не диагностировалось или подозревается его прогрессирование.
- При подозрении на индуцированные лекарственными препаратами ЖА рекомендуется отмена этих препаратов [99, 100, 101].
ЕОК IB (УУР B, УДД 3)
Комментарий. Аритмогенное действие препаратов следует заподозрить у пациентов, принимающих лекарственные средства, которые могут изменять электрические свойства сердца (например, вызывают уширение комплекса QRS или удлинение интервала QT), способствуют нарушению электролитного баланса (например, тиазидные и "петлевые" диуретики). В таких случаях необходима отмена этих препаратов и восстановление электролитного баланса; кроме того, следует избегать применения препаратов, удлиняющих интервал QT (например, ААП, класс III) [100, 101, 102]. Рефрактерные, рецидивирующие пароксизмы ЖТ типа "пируэт" на фоне медикаментозного удлинения интервала QT, могут быть купированы учащающей трансвенозной желудочковой стимуляцией.
- Пациентам с ЖА рекомендуется диагностика обратимых причин с последующей их коррекцией (например, дисбаланс электролитов, ишемия, гипоксемия, лихорадка) [100, 101].
ЕОК IC (УУР C, УДД 4)
Комментарий. Дисбаланс электролитов, в частности гипокалиемия, может спровоцировать ЖА, а быстро нарастающая гиперкалиемия может вызвать асистолию [103]. Такие факторы, как брадикардия, ишемия, спазм коронарных артерий, тромбоз, лихорадка, голодание и диета, могут также способствовать возникновению ЖА [102]. Рекомендуется экстренная коррекция этих обратимых нарушений. Гипомагниемия и/или гипокалиемия могут быть причиной возникновения полиморфной ЖТ типа ТdP. В/в введение #магния сульфата** является эффективным лечением ТdP даже при отсутствии гипомагниемии [8, 104, 105, 106, 107, 108]. Дозы для взрослых: 2 - 4 г в/в струйно медленно под контролем АД. Доза может быть увеличена до 6 - 10 г при отсутствии гипотонии. Дозы для детей: 12,5% раствор #магния сульфата** внутривенно медленно 25 - 50 мг/кг (не более 2 гр) [65, 105, 106, 107, 108].
(См. Приложение А, таблицы А3.4).
Пациенты, пережившие ВСС с предполагаемой обратимой причиной, имеют высокий уровень смертности [109]. В недавнем крупном наблюдательном исследовании [110] у выживших после ВСС, связанной с обратимой и корректируемой причиной, последующая имплантация ИКД*** была ассоциирована с более низкой смертностью от всех причин, за исключением ВСС при остром ИМ. Таким образом, возможна профилактическая имплантация ИКД*** с учетом основного заболевания сердца и индивидуальной оценки риска развития жизнеугрожающих ЖА.
- Если после тщательной оценки индивидуального риска развития ЖА/ВСС рецидив ЖТ/ВСС считается высоким, пациентам старше 16 лет с устранимой причиной развития ЖА, несмотря на возможность ее коррекции, рекомендована имплантация ИКД*** [109, 110, 111].
ЕОК IIaC (УУР C, УДД 4)
3.1.2. Реанимационные мероприятия
- При ВОС (ЖТ с отсутствием пульса или ФЖ) необходимо (т.е., однозначно рекомендуется) незамедлительное проведение комплекса сердечно-легочных реанимационных мероприятий (СЛР) [66, 109, 111, 112, 113].
ЕОК IC (УУР C, УДД 4)
- При ВОС (ЖТ с отсутствием пульса или ФЖ) ключевым элементом СЛР (т.е. однозначно рекомендованным) является экстренная электрическая дефибрилляция сердца [112, 113, 114, 115, 116, 117].
ЕОК IC (УУР C, УДД 5)
- При ФЖ/ЖТ с отсутствием пульса после трех неэффективных шоков кардиовертера-дефибриллятора рекомендовано внутривенное болюсное введение амиодарона** для взрослых 300 мг на фоне продолжения СЛР с целью повышения эффективности проводимых реанимационных мероприятий и предупреждения немедленных рецидивов ЖТ/ФЖ [111, 118, 119, 120].
ЕОК IA (УУР B, УДД 2)
Комментарий. Введение дополнительных 150 мг амиодарона** рекомендовано после 5 неэффективных шоков кардиовертера-дефибриллятора. Дозы #амиодарона** для детей [118]: в/в струйно 5 мг/кг в течение 15 - 20 мин., далее в/в капельно: 1 мг/мин. - 6 ч., 0,5 мг/мин. - 18 ч. (до 1200 мг в сутки) (См. Приложение А, таблицы А3.2 и А3.4).
- Внутривенное (в/в) введение лидокаина** на фоне продолжения СЛР рекомендуется в случае неэффективности дефибрилляции или непрерывного рецидивирования аритмии для повышения шансов купирования ФЖ и предупреждения немедленных рецидивов ЖТ/ФЖ в случае, если амиодарон** недоступен [102, 117, 119, 120, 121].
ЕОК IIaB (УУР B, УДД 2 для взрослых; УУР C, УДД 5 для детей)
Комментарий. Дозы препарата для взрослых и детей указаны в Приложении А3, табл. А3.2 и A3.4].
- Рекомендуется рассмотреть возможность в/в введения #эпинефрина** 1 мг каждые 3 - 5 мин после введения первой дозы в ходе СЛР до восстановления эффективного кровообращения, независимо от ритма, сопровождающего остановку кровообращения, с целью повышения эффективности проводимых реанимационных мероприятий [112, 122, 123, 124, 125].
ЕОК IIbA (УУР B, УДД 2 для взрослых; УУР C, УДД 5 для детей)
Комментарий. Препарат вводится с целью стимуляции периферической вазоконстрикции, централизации кровообращения и улучшения перфузии головного мозга и сердца. По данным клинических исследований, применение более высоких доз препарата не обладает преимуществом по сравнению со стандартной дозой 1 мг. Время введения первой дозы #эпинефрина** зависит от сердечного ритма, сопровождающего остановку кровообращения:
- при ритмах, подлежащих дефибрилляции или кардиоверсии, первая доза #эпинефрина** вводится после трех неэффективных шоков кардиовертера-дефибриллятора;
- при ритмах, не подлежащих лечению шоком кардиовертера-дефибриллятора (электромеханическая диссоциация и асистолия) первая доза #эпинефрина** вводится немедленно после установки внутривенного доступа. Введение лекарств не должно прерывать СЛР и задерживать такие вмешательства, как дефибрилляция или кардиоверсия.
- Экстренная электрическая кардиоверсия рекомендована при ЖТ, сопровождающейся острыми нарушениями гемодинамики (симптомная артериальная гипотензия, синкопальное/пресинкопальное состояние, признаки острой ишемии миокарда, отек легких/острая СН) [8, 126, 127].
ЕОК IA (УУР C, УДД 5)
3.1.3. Купирование устойчивой мономорфной желудочковой тахикардии
Лечение пациентов с устойчивой ЖТ должно проводиться в соответствии с ее этиологией и клинической картиной. В Приложении Б на рисунке 1 представлен алгоритм неотложной помощи при регулярной (ритмичной) тахикардии с широкими комплексами QRS. Дозы препаратов для купирования пароксизмов ЖТ для взрослых и детей представлены в Приложении А3, таблицы А3.2 и А3.4.
- Пациентам с устойчивой мономорфной ЖТ (УМЖТ) и нестабильной гемодинамикой в качестве первоначальной терапии рекомендуется использовать наружную электрическую кардиоверсию (дефибрилляцию) (ЭКВ) [8, 67, 102, 106, 108, 127].
ЕОК IB (УУР C, УДД 5)
Комментарий. ЭКВ не показана пациентам с рецидивирующей НУЖТ.
У пациентов со стабильной гемодинамикой важное значение имеет регистрация 12-ти канальной ЭКГ при любой тахикардии с широкими QRS-комплексами.
- При оказании неотложной медицинской помощи пароксизмы тахикардии с широкими комплексами QRS рекомендуется расценивать как ЖТ за исключением ситуаций, когда диагноз НЖТ не вызывает сомнения [8, 127, 128, 129, 130, 131].
ЕОК IC (УУР C, УДД 5)
Комментарий. Интерпретация тахикардии с широкими комплексами QRS как НЖТ только на основании отсутствия острых нарушений гемодинамики является распространенной клинической ошибкой. Препараты, используемые для купирования ЖТ, эффективны и при НЖТ, в то время как препараты, применяемые для купирования НЖТ (#верапамил**) могут вызывать снижение АД и приводить к острым нарушениям гемодинамики у пациентов с ЖТ.
- Пациентам с регулярной тахикардией с широкими комплексами QRS без нарушения гемодинамики и подозрением на НЖТ, рекомендовано применение вагусных проб [131, 132, 133, 134].
ЕОК IIaC (УУР C, УДД 5)
- При неэффективности вагусных проб у взрослых пациентов с регулярной тахикардией с широкими комплексами QRS без нарушения гемодинамики и подозрением на НЖТ, рекомендовано в/в введение #трифосаденина [108, 135, 136].
ЕОК IiaC (УУР C, УДД 3)
Комментарии. Некоторые виды ЖТ, механизм которых связан с цАМФ-опосредованной триггерной активностью, могут быть купированы в/в введением #трифосаденина [136]. Дозы препарата для взрослых указаны в Приложении А3, табл. А3.2
ФП при наличии ДПП может быть диагностирована по ЭКГ-паттерну "БШН" ("быстрая, широкая, нерегулярная"). Она может имитировать ЖТ, поэтому следует избегать в/в введения препаратов, которые замедляют AB-проводимость (#трифосаденин, бета-адреноблокаторы, верапамил**, дигоксин** и амиодарон**) [137].
Незамедлительное купирование УМЖТ рекомендуется даже при стабильной гемодинамике, так как у пациента может произойти быстрое ухудшение состояния. Купирование ЖТ может быть достигнуто ЭКВ, использованием ААП или электрической кардиостимуляцией. Все ААП могут вызвать гипотонию. Кроме того, следует учитывать индивидуальный риск анестезии/седации при проведении ЭКВ.
- Пациентам с УМЖТ без нарушения гемодинамики ЭКВ рекомендуется в качестве первоначального лечения при условии, что риск анестезии/седации низок [8].
ЕОК IC (УУР C, УДД 5)
Пациентам с УМЖТ и установленной или вероятной СПС без нарушения гемодинамики, рекомендовано в/в введение #прокаинамида** [108, 138].
ЕОК IiaB (УУР B, УДД 2)
Комментарий. В исследовании PROCAMIO [140] введение прокаинамида** ассоциировалось с более высокой частотой купирования ЖТ и меньшим количеством серьезных побочных эффектов, по сравнению с амиодароном**. В/в введение #прокаинамида** не следует применять взрослым пациентам с тяжелой сердечной недостаточностью, острым ИМ и терминальной стадией почечной недостаточности. У пациентов с ИКД*** трансвенозная катетерная опережающая (учащающая) стимуляция желудочков по типу "овердрайв" может привести к купированию ЖТ с длиной цикла ЖТ ниже запрограммированной в ИКД***.
Дозы препарата для взрослых указаны в Приложении А3, табл. А3.2. Дозы #прокаинамида** для детей: 0,15 - 0,2 мл/кг [102, 108].
- Пациентам с УМЖТ без нарушения гемодинамики, при отсутствии установленного диагноза, рекомендуется рассмотреть возможность в/в введения #амиодарона** [65, 67, 102, 108, 138].
ЕОК IIbB (УУР B, УДД 2 для взрослых; УУР C, УДД 5 для детей)
Комментарий. Дозы препарата для детей указаны в Приложении А3, табл. А3.4.
- Пациентам с установленной идиопатической ЖТ без нарушения гемодинамики рекомендуется в/в введение бета-адреноблокатора (при ЖТ из ВТПЖ) или #верапамила** или #трифосаденина (при фасцикулярной ЖТ, при ЖТ из ВТПЖ) [67, 139, 140, 141, 142, 143, 144].
ЕОК IC (УУР C, УДД 4)
Комментарий. Дозы препарата для детей указаны в Приложении А3, табл. А3.4.
- В/в введение #верапамила** не рекомендуется для купирования тахикардии с широкими комплексами QRS неизвестной этиологии у взрослых [141, 142].
ЕОК IIIB (УУР C, УДД 4)
Комментарий. #Верапамил** эффективен для купирования фасцикулярной ЖТ [140], но может вызвать тяжелую гипотензию.
Всестороннее обследование пациентов с устойчивой ЖТ является обязательным, если основное сердечное заболевание неизвестно или высоковероятно его прогрессирование. Алгоритм действий врача в отношении пациента с первичным эпизодом УМЖТ представлен в Приложении Б (рисунок 3).
3.1.4. Ведение пациентов с электрическим штормом и непрерывной желудочковой тахикардией
Электрический шторм нередко встречается у пациентов с ИКД*** [116, 144, 145]. У пациентов, перенесших электрический шторм, наблюдаются психологические расстройства, декомпенсация СН и повышается риск смерти [146, 147]. Тяжесть электрического шторма может варьировать от рецидивирующих бессимптомных эпизодов ЖТ, купирующихся #трифосаденином, до жизнеугрожающей электрической нестабильности с рецидивами ЖА после частых множественных шоков. Частые шоки ИКД могут быть немотивированными. В Приложении Б на рисунках 2А, 2Б, 2В представлен алгоритм ведения пациентов с электрическим штормом или повторными шоками ИКД.
У пациентов при частых немотивированных разрядах ИКД*** (например, из-за НЖТ или дислокации внутрисердечных электродов, при НУЖТ или постоянно рецидивирующей ЖТ, которая прекращается и возобновляется спонтанно) целесообразно отключить функцию дефибрилляции ИКД***.
Если специалист по настройке имплантируемых антиаритмических устройств (ИАУ) недоступен, ИКД*** можно отключить, поместив магнит над устройством.
При нестабильной гемодинамике необходимо использовать расширенную СЛР [148]. Требуют коррекции обратимые состояния, способствующие возникновению и поддержанию ЖТ (см. раздел 3.1.1). Дальнейшее лечение зависит от вида и этиологии ЖА [145, 148]. Для лечения часто требуется комплексный подход, включающий перепрограммирование ИКД*** при необходимости, введение ААТ, седацию, КА, модуляцию автономной нервной активности (нейромодуляцию) и использование средств механической поддержки кровообращения.
- Легкая и умеренная седация рекомендуется пациентам с электрическим штормом для уменьшения психологического стресса и снижения проаритмогенного симпатического тонуса [8].
ЕОК IC (УУД C, УДД 5)
- Пациентам со СПС и электрическим штормом при отсутствии противопоказаний рекомендовано назначение бета-адреноблокаторов (предпочтительно неселективных) в сочетании с в/в введением #амиодарона** [149, 150].
ЕОК IB (УУР C, УДД 5)
Комментарий. Наиболее часто применяются неселективные бета-адреноблокаторы, такие как #пропранолол**, который превосходит по эффективности метопролол** [150], в комбинации с #амиодароном** [151]. Дозы препаратов указаны в Приложении А3, табл. А3.2 и А3.4.
Использование таких препаратов, как #прокаинамид** [148] или лидокаин** [149, 152, 153], зависит от конкретной клинической ситуации, вида и этиологии ЖА.
- Глубокая седация с интубацией рекомендована взрослым пациентам с резистентным к медикаментозной терапии электрическим штормом [154].
ЕОК IIaC (УУР C, УДД 4)
Комментарий. Отсутствует подтверждение у детей.
- В/в введение #магния сульфата** с добавлением #калия хлорида** рекомендуется пациентам с ЖТ типа "пируэт" [106, 107, 108, 117].
ЕОК IB (УУР C, УДД 5)
Комментарий. Дозы препаратов указаны в Приложении А3, табл. А3.2 и А3.4.
- Трансвенозная учащающая желудочковая электрокардиостимуляция рекомендуется взрослым пациентам с приобретенным СУИQT и рецидивирующей ЖТ типа "пируэт", наряду с коррекцией сопутствующей патологии и в/в введением #магния сульфата** [102, 105, 106, 107, 124].
ЕОК IC (УУР C, УДД 5)
Комментарий. Дозы препарата указаны в Приложении А3, табл. А3.2 и А3.4.
- КА рекомендуется пациентам старше 16 лет с непрерывной ЖТ или электрическим штормом при отсутствии эффекта от ААП [155, 156].
ЕОК IВ (УУР B, УДД 3)
- Выполнение КА рекомендовано взрослым пациентам с рецидивирующими эпизодами ЖТ/ФЖ, вызванными аналогичными по морфологии комплекса QRS ЖЭ, резистентными к медикаментозной терапии или без эффекта от коронарной реваскуляризации [157, 158, 159, 160].
ЕОК IIaC (УУР C, УДД 4)
Комментарий. Наиболее распространенной аритмией, лежащей в основе электрического шторма, является УМЖТ, связанная со СПС, которая хорошо устраняется КА [146]. Ретроспективный анализ показал, что успешная аблация ассоциируется со значительным снижением частоты рецидивов ЖТ, электрического шторма и улучшением долгосрочной выживаемости [155]. У пациентов с непрекращающейся медленной мономорфной ЖТ КА предпочтительнее терапии ААП, которые могут вызвать еще большее замедление ЖТ.
Если лечение бета-адреноблокаторами для снижения симпатического тонуса недостаточно или плохо переносимо, некоторым пациентам может помочь автономная модуляция, например, чрескожная блокада звездчатых ганглиев [161], торакальная эпидуральная анестезия, [162] или левосторонняя симпатическая денервация сердца [163].
- Взрослым пациентам с электрическим штормом, рефрактерным к медикаментозному лечению и при неэффективности или невозможности КА, рекомендуется рассмотрение возможности воздействия на автономную нервную регуляцию (нейромодуляция) [157, 162, 163].
ЕОК IIbC (УУР C, УДД 4)
- При электрическом шторме, рефрактерном к ААТ, сопровождающимся кардиогенным шоком, рекомендуется рассмотреть возможность применения механической поддержки кровообращения у пациентов старше 18 лет [164, 165].
ЕОК IIbC (УУР C, УДД 4)
Комментарии. Применение средств механической поддержки кровообращения может быть применено для стабилизации гемодинамики, когда традиционная терапия неэффективна, и для обеспечения поддержки кровообращения в процессе абляции [165]. В недавно опубликованном метаанализе [166], включающем 2465 пациентов, наблюдалась значительно более низкая смертность при профилактическом применении механической поддержки кровообращения среди пациентов, страдающих электрическим штормом или имеющих высокий риск [167]. Напротив, экстренное использование механической поддержки кровообращения в процессе аблации было связано с высокой частотой смерти [168].
У пациентов с электрическим штормом, вызванным рецидивирующей пароксизмальной ЖТ или ФЖ, дальнейшая лечебная тактика определяется основной причиной, вызвавшей ЖА.
3.2. Общие принципы лечения, направленного на профилактику эпизодов желудочковой аритмии
3.2.1. Медикаментозное лечение
Важнейшим условием успешного лечения ЖА и предотвращения ВСС является эффективное лечение основного заболевания сердца и сопутствующих заболеваний. ИБС является основной патологией сердца, являющейся причиной ЖТА и ВСС. Лечение основного заболевания, являющегося причиной возникновения ЖТА и ВСС, должно осуществляться в соответствии с действующими клиническими рекомендациями по рассматриваемым заболеваниям/состояниям.
Оптимальное медикаментозное лечение основного заболевания сердца, включая максимально переносимые дозы лекарств по поводу ХСН, является обязательным [169].
- У пациентов с ХСН со сниженной ФВ ЛЖ рекомендуется применение иАПФ/АРА/АРНИ, антагонистов минералокортикоидных рецепторов (АТХ C03DA Антагонисты альдостерона), бета-адреноблокаторов и иНГЛТ-2 для снижения смертности от СН и ВСС [170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182].
ЕОК IA (УУР C, УДД 5)
Медикаментозные средства лечения нарушений ритма сердца играют важную роль в качестве дополнительной терапии при лечении ЖА, особенно у симптомных пациентов. До сих пор ни один из лекарственных средств для лечения нарушений ритма сердца за исключением бета-адреноблокаторов, не продемонстрировал снижения смертности от всех причин. Каждый препарат обладает значительным потенциалом возникновения побочных эффектов, включая проаритмию. Например, большое количество препаратов с другими терапевтическими показаниями, могут удлинять интервал QT (http://www.crediblemeds.org) и провоцировать возникновение ЖТ типа "пируэт". Некоторые препараты способны оказывать отрицательные инотропный и хронотропный эффекты, усугубляя СН, и вызывая брадикардию. ААП, классов IA и IC, а также некоторые другие препараты, блокирующие натриевые каналы, повышают риск ЖА у пациентов с синдромом Бругада (http://www.brugadadrugs.org).
Выбор лечебного подхода при ЖА основывается на наличии либо отсутствии у пациента признаков СПС или/и дисфункции ЛЖ. Перечень основных ААП, показания к назначению, дозы и побочные эффекты приведены в Приложении А3.
Медикаментозная антиаритмическая терапия (ААТ) желудочковой эктопической активности у пациентов без СПС/дисфункции ЛЖ
- У пациентов без СПС рекомендовано лекарственное подавление частой ЖЭ, если аритмия сопровождается клинической симптоматикой, либо ее количество превышает 10% от общего количества сердечных сокращений по данным ХМЭКГ и приводит к ремоделированию ЛЖ и снижению сократительной способности миокарда [183, 184, 185, 186, 187, 188, 189].
ЕОК IC (УУР C, УДД 5)
Комментарий. Перед назначением любых лекарственных препаратов для лечения нарушений ритма сердца важно убедиться, что ЖЭ не является следствием обратимых причин (см. раздел 3.1.1). В отсутствие СПС/дисфункции ЛЖ, так называемая "идиопатическая" желудочковая эктопическая активность может быть представлена в виде одиночной, парной ЖЭ, НУЖТ, а также аналогичных проявлений желудочковой парасистолии. Пациенты без СПС/дисфункции ЛЖ имеют благоприятный прогноз вне зависимости от вида желудочковой эктопической активности, общего количества ЖЭ в сутки и величины интервала сцепления ЖЭ и не нуждаются в профилактике ВСС [183, 184]. Особенности назначения лекарственных препаратов для лечения нарушений ритма сердца у детей в данной клинической ситуации см. в разделе 3.5
- Для подавления частой, симптомной желудочковой эктопической активности у пациентов без СПС/дисфункции ЛЖ рекомендовано назначение бета-адреноблокаторов, ААП I класса (по классификации E.M. VaughanWilliams в модификации B.N. Singh и D.C. Harrison) (АТХ C01B Антиаритмические препараты, классы I и III), блокаторов "медленных" кальциевых каналов с прямым влиянием на сердце (АТХ C08D Селективные блокаторы кальциевых каналов с прямым действием на сердце) (#верапамила**), #соталола** и #амиодарона** (см. Приложение А3, таблицы А3.1 и А3.2) [108, 183, 184, 185].
ЕОК IIaB (УУР B, УДД 3 - для взрослых, УУР C, УДД 5 - для детей)
Комментарий. Наиболее эффективными средствами подавления ЖЭ являются Антиаритмические препараты, класс IC (пропафенон**, диэтиламинопропионилэтоксикарбониламинофенотиазин [203, 204, 206, 207], лаппаконитина гидробромид** и флекаинид у взрослых), а также ААП III класса (АТХ C01B Антиаритмические препараты, классы I и III) (#соталол** и #амиодарон**). При частой, симптомной мономорфной ЖЭ, исходящей из области ВТПЖ или фасцикулярной ЖЭ из ЛЖ, КА рекомендуется как метод лечения первого выбора [190, 191].
Перечень препаратов, рекомендованных для лечения ЖА у взрослых и детей, с указанием их стандартных терапевтических доз, представлен в Приложении А3, табл. А3.1 и А3.2.
- Учитывая высокую вероятность развития серьезных экстракардиальных побочных эффектов при длительном применении #амиодарона**, у пациентов с "идиопатическими" ЖА данный препарат не рекомендуется в качестве первой линии ААТ, и может быть рассмотрен только при симптомной аритмии или при снижении ФВЛЖ и условии неэффективности или непереносимости других лекарственных средств лечения нарушений ритма сердца [192].
EOK IIIC (УУР C, УДД 5)
Комментарий. Дозы препарата для взрослых и детей указаны в Приложении А3, табл. А3.1 и А3.3.
- При наличии приступов УМЖТ у пациентов без СПС/дисфункции ЛЖ, для профилактики повторного возникновения аритмии рекомендовано назначение бета-адреноблокаторов, #верапамила**, а также ААП, классы I и III [66, 185, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205].
ЕОК IIaB (УУР B, УДД 3)
Комментарий. С позиции риска ВСС, в большинстве случаев пациенты с идиопатическими ЖТ имеют благоприятный прогноз жизни, однако данные аритмии могут сопровождаться выраженными нарушениями системной гемодинамики (обморок, отек легких), а при длительно персистирующем течении - приводить к прогрессирующему снижению сократимости миокарда и развитию тахикардиомиопатии. Эти состояния при отсутствии эффективной ААТ могут значительно ухудшать качество жизни пациентов. Выбор препарата для ААТ с целью профилактики рецидивов ЖТ должен осуществляться с учетом индивидуальных провоцирующих факторов и характерных для разных форм ЖТ изменений ЭКГ. Бета-адреноблокаторы являются препаратами выбора при идиопатических ЖТ, провоцируемых физической нагрузкой или эмоциональным стрессом. Профилактический прием #верапамила** целесообразен для лечения непароксизмальной ЖТ из ВТПЖ и предупреждения пароксизмов фасцикулярной левожелудочковой тахикардии. Наиболее эффективными средствами предупреждения рецидивов пароксизмальной мономорфной ЖТ, в том числе не связанной с ВТПЖ/ФЛЖТ, у взрослых являются ААП, класс IC и амиодарон**. #Соталол**, ввиду недостаточной его эффективности и потенциальной опасности проаритмии, связанной с блокадой калиевых каналов (TdP), не должен назначаться в качестве препарата первого выбора. Необходимо учитывать возможность развития экстракардиальных побочных эффектов при применении амиодарона**, в связи с чем у пациентов с идопатическими ЖА данный препарат должен назначаться только при условии неэффективности либо невозможности использования других ААП, класс Ic и недоступности интервенционных методов лечения.
Особенности назначения лекарственных препаратов для лечения нарушений ритма сердца у детей в данной клинической ситуации см. в разделе 3.5.
Перечень препаратов для взрослых и детей представлен в Приложении А3, таблицах А3.1 и А3.3 [65, 186, 194, 205].
В качестве альтернативы лекарственной ААТ при любой идиопатической мономорфной ЖТ, следует рассмотреть возможность проведения КА источника аритмии [184, 190].
Медикаментозная ААТ желудочковой эктопической активности у пациентов со СПС/дисфункцией ЛЖ
- При наличии желудочковой эктопической активности у пациентов со СПС/дисфункцией ЛЖ повышен риск ВСС и рекомендуется проведение ААТ для ее профилактики [206, 207, 208, 209, 210, 211, 212, 213].
ЕОК IA (УУР C, УДД 5)
Комментарий. У пациентов со СПС риск ВСС зависит от характера желудочковой эктопической активности и выраженности дисфункции ЛЖ. Наличие у пациентов со СПС частой ЖЭ (> 10 ЖЭ в час), множественных форм желудочковой эктопической активности (парной ЖЭ, НУЖТ) и/или сниженной сократительной функции ЛЖ (ФВЛЖ < 40% по данным ЭХОКГ) сопряжено с повышенным риском ВСС [206, 207].
- Для лечения пациентов со СПС/дисфункцией ЛЖ, имеющих повышенный риск ВСС и нуждающихся в ее первичной или вторичной профилактике, рекомендовано назначение бета-адреноблокаторов [211, 213, 214, 215, 216, 217].
ЕОК IA (УУР C, УДД 5)
Комментарий. Бета-адреноблокаторы (предпочтительно селективные липофильные) должны назначаться с учетом противопоказаний к их применению и возможных побочных эффектов [211, 214].
- Лекарственная ААТ рекомендована взрослым пациентам со СПС/дисфункцией ЛЖ с целью подавления частой симптомной ЖЭ, либо если количество желудочковой эктопической активности > 10% от общего количества сердечных сокращений в сутки по данным ХМЭКГ и ассоциировано с дилатацией полостей сердца и снижением сократимости миокарда ЛЖ [191, 218, 219, 220].
ЕОК IC (УУР B, УДД 2)
- У пациентов старше 18 лет с имплантированными медицинскими устройствами, например, электрокардиостимулятором имплантируемым трехкамерным (бивентрикулярным)***, кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)*** (для сердечной ресинхронизирующей терапии; далее - имплантируемое СРТ-устройство), применение лекарственной ААТ рекомендовано для подавления частой ЖЭ в случаях, когда она приводит к уменьшению доли навязанного бивентрикулярного ритма ниже рекомендованного уровня [221, 222, 223].
ЕОК IIaB (УУР C, УДД 4)
Комментарий. Для достижения наилучшего эффекта СРТ необходимо стремиться к максимально высокому проценту навязанного бивентрикулярного ритма (97 - 100%). Оптимальным для проведения СРТ считается наличие не менее 93% бивентрикулярных навязанных комплексов (по данным из имплантированных СРТ-устройств или полученным при ХМЭКГ) [224].
У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
- В качестве средств антиаритмического лечения ЖЭ у взрослых пациентов со СПС/дисфункцией ЛЖ рекомендовано назначение бета-адреноблокаторов, соталола**, амиодарона**, либо комбинации бета-адреноблокаторов и амиодарона** [102, 219, 220, 225, 226].
ЕОК IA (УУР B, УДД 2)
Комментарий. Бета-адреноблокаторы необходимо рассматривать в качестве основы ААТ ЖА. Соталол** эффективнее, чем бета-адреноблокаторы, подавляет желудочковую эктопическую активность, однако его применение не рекомендовано пациентам с ФВ ЛЖ < 40% по данным ЭХОКГ, а также признаками ХСН, почечной недостаточностью. Амиодарон** в качестве монотерапии и в комбинации с бета-адреноблокаторами представляет собой наиболее эффективный ААП для лечения ЖА у пациентов со СПС/дисфункцией ЛЖ. В то же время, его применение сопряжено с наиболее высоким риском развития тяжелых экстракардиальных побочных эффектов. Вследствие этого, амиодарон** целесообразно назначать при неэффективности или невозможности применения бета-адреноблокаторов/соталола** и отсутствии возможности применения интервенционных методов лечения ЖА. Перечень препаратов, рекомендованных для лечения ЖА, с указанием их стандартных терапевтических доз, представлен в Приложении А3, таблицах А3.1 и А3.3 [219].
- Не рекомендовано применение ААП, классов IA и IC и селективных блокаторов кальциевых каналов с прямым влиянием на сердце для подавления ЖЭ у пациентов со СПС/дисфункцией ЛЖ [221, 222, 227, 228, 229, 230].
ЕОК IIIA (УУР C, УДД 5)
Комментарий. ААП, классы IA и IC не должны применяться для подавления ЖЭ у пациентов с ИБС, в т.ч. переживших ИМ, а также у пациентов с другими формами сердечной патологии, приводящими к снижению сократительной функции ЛЖ (значения ФВ ЛЖ < 40% по данным ЭХОКГ) и/или проявлениям ХСН. Назначение ААП, классы A и IC также противопоказано пациентам, имеющим выраженную гипертрофию миокарда ЛЖ. Селективные блокаторы кальциевых каналов с прямым влиянием на сердце (#верапамил** и #дилтиазем) малоэффективны в лечении ЖА у пациентов со СПС и могут ухудшать прогноз пациентов с дисфункцией ЛЖ и СН.
- Оценку эффективности и безопасности подавления желудочковой эктопической активности у пациентов со СПС/дисфункцией ЛЖ рекомендовано проводить под контролем повторного ХМЭКГ, выполненного на фоне приема лекарственных средств для лечения нарушений ритма сердца в терапевтической дозе в течение времени, достаточного для наступления его антиаритмического эффекта [207, 231, 232].
ЕОК IIaC (УУР C, УДД 5)
Комментарий. Оценку антиаритмического эффекта бета-адреноблокаторов целесообразно проводить на 3 - 5 сутки их приема, #соталола** - на 5 - 7 сутки, #амиодарона** - с учетом особенностей фармакокинетики, полный терапевтический эффект оценивается через 4 - 6 недель от начала приема. Назначение каждого последующего лекарственного препарата для лечения нарушений ритма сердца должно проводиться не ранее чем через 5 периодов полувыведения предыдущего, а для #амиодарона** - не ранее чем через 1,5 месяца после его отмены. Для оценки эффективности тестируемых препаратов для лечения нарушений ритма сердца рекомендуется использовать следующие критерии: при приеме препаратов для лечения нарушений ритма сердца в терапевтической дозе регистрируется снижение общего количества ЖЭ более чем на 50% и/или уменьшение количества часов в сутки, в течение которых регистрировалась ЖЭ более чем в 2 раза от такового, проводившегося в отсутствии ААТ. Параллельно с этим у пациентов должно регистрироваться уменьшение количества парных ЖЭ в 10 раз и более, а также полное устранение НУЖТ. Для оценки длительной эффективности и безопасности приема препаратов для лечения нарушений ритма сердца целесообразна регулярная регистрация ЭКГ и применение других методов обследования в зависимости от индивидуальных особенностей пациентов [207].
- Назначение #амиодарона** или комбинации #амиодарона** с бета-адреноблокаторами (исключая #соталол**) рекомендовано для профилактики пароксизмальной ЖТ/ФЖ у пациентов со СПС или дисфункцией ЛЖ как альтернатива ИКД***, если имплантация ИКД не может быть выполнена по каким-либо причинам, либо пациенты отказываются от имплантации ИКД*** [213, 233, 234].
ЕОК IA (УУР C, УДД 5)
Комментарий. У пациентов, нуждающихся в первичной и вторичной профилактике ВСС, #амиодарон** или его комбинированное применение с бета-адреноблокаторами являются единственной лекарственной альтернативой ИКД***, способной предупреждать возникновение ЖТ/ФЖ и увеличивать продолжительность жизни пациентов. В качестве альтернативы лекарственной ААТ при повторных приступах ЖТ/ФЖ следует рассмотреть возможность проведения КА источника аритмии. У детей целесообразно придерживаться такого же подхода, несмотря на отсутствие достаточной доказательной базы. Перечень препаратов, рекомендованных для лечения ЖА, с указанием их стандартных терапевтических доз, представлен в Приложении А3, таблицах А3.1 и А3.3.
- Назначение профилактической ААТ #амиодароном** рекомендовано пациентам со СПС или дисфункцией ЛЖ при наличии повторных приступов ЖТ/ФЖ, требующих срабатывания ИКД*** вопреки терапии бета-адреноблокаторами [65, 213, 233, 234].
ЕОК IIaC (УУР C, УДД 5)
Комментарий. Препаратами "первого выбора" для профилактики повторных приступов ЖТ/ФЖ у пациентов со СПС или дисфункцией ЛЖ являются #соталол**, #амиодарон** и комбинация #амиодарона** с бета-адреноблокаторами. ААП, класс IB, #фенитоин** рекомендован в качестве средства "второй линии" при частых рецидивах ЖТ/ФЖ у пациентов старше 18 лет со СПС и имплантированными ИКД***, при недостаточной эффективности бета-адреноблокаторов, #соталола** и #амиодарона**, а также при невозможности их приема в связи с абсолютными противопоказаниями или тяжелыми побочными эффектами лечения. #Фенитоин** рекомендуется для длительного приема у пациентов старше 18 лет внутрь в дозах 400 - 600 мг/сутки. Комбинированное применение ААП, класс IB, #фенитоина** и ААП, класс III (#соталола** и #амиодарона**) рекомендовано взрослым пациентам со СПС/дисфункцией ЛЖ и имплантированным ИКД*** в случаях, когда другие варианты лечения (монотерапия и/или КА) оказались безуспешными в устранении рецидивов ЖТ и ФЖ. В качестве альтернативы лекарственной ААТ при повторных приступах ЖТ/ФЖ и адекватных срабатываниях ИКД*** следует рассмотреть возможность проведения КА источника аритмии. Перечень препаратов для взрослых пациентов и детей представлен в Приложении А3, таблицах А3.1 и А3.3. [65, 148, 202, 231, 232, 233, 234, 235, 236, 237, 238].
- Лечение пациентов с пароксизмами ЖТ/ФЖ рекомендуется проводить параллельно с выявлением и устранением индивидуальных патогенетических факторов, лежащих в основе возникновения аритмии [142, 188, 239, 240].
ЕОК IC (УУР C, УДД 5)
Комментарий. Потенциальными патогенетическими факторами, провоцирующими возникновение ЖТ, являются аритмогенное действие лекарственных препаратов, электролитные нарушения (гипокалиемия, гипомагниемия), повышенный тонус симпатической нервной системы, гипертиреоз, гиповолемия, воспаление, перегрузка миокарда объемом и давлением, синдром обструктивного апноэ сна, гипоксия и острая ишемия миокарда. Пациенты с СН со сниженной ФВ ЛЖ должны находиться на оптимальной медикаментозной терапии, включающей иАПФ/АРА/АРНИ, бета-адреноблокаторы, антагонисты альдостерона иНГЛТ-2 [171, 172].
3.2.2 Антиаритмические устройства
Кардиовертер-дефибриллятор имплантируемый***
Кардиовертер-дефибриллятор имплантируемый*** (ИКД***) - устройство, предназначенное для прерывания жизнеугрожающих аритмий с целью предотвращения ВСС [51].
Имплантация ИКД*** обычно проводится под местной анестезией. Применение ИКД*** в профилактике ВСС основано на аритмическом механизме развития ВСС. Восстановление синусового (или подлежащего) ритма происходит с помощью нанесения электрического разряда в несколько десятков джоулей, либо пачек электрических стимулов, которые являются безболезненными для пациента и энергетически менее затратными. ИКД*** следует рассматривать как основное средство первичной и вторичной профилактики ВСС [227, 245].
ИКД с целью вторичной профилактики ВСС
- Имплантация ИКД*** рекомендована пациентам с документированной ФЖ или ЖТ с выраженными изменениями гемодинамики при условии отсутствия преходящих причин их развития и после 48 ч от момента развития инфаркта миокарда. Пациенты должны получать оптимальную медикаментозную терапию (ОМТ) и иметь ожидаемую продолжительность жизни не менее года в удовлетворительном клиническом статусе [8, 51, 246].
ЕОК IA (УУР C, УДД 5)
- Рекомендуется рассмотреть возможность имплантации ИКД*** в течение 40 дней после ИМ у отдельных взрослых пациентов (при неполной реваскуляризации, предшествующей дисфункции и снижении ФВ ЛЖ, появлении аритмий после 48 ч от возникновения острого коронарного синдрома, полиморфной ЖТ или ФЖ) [216, 217].
ЕОК IIbC (УУР B, УДД 2)
- Имплантация ИКД*** рекомендована пациентам старше 18 лет с устойчивой ЖТ при умеренно выраженной дисфункции левого желудочка (ФВ ЛЖ менее 45%), вне зависимости от возможности выполнения КА и результатов процедуры [223, 224, 225].
РКО IIaC (УУР B, УДД 2)
Комментарий. Имплантация ИКД*** пациентам с устойчивой ЖТ сопровождается увеличением выживаемости по сравнению с ААТ. На сегодняшний день нет исследований, в которых бы сравнивали результаты ИКД***-терапии и КА без ИКД*** у пациентов с устойчивой ЖТ. Учитывая небольшой объем данных и высокую частоту рецидивов устойчивой ЖТ после КА, установка ИКД*** целесообразна всем пациентам с дисфункцией ЛЖ (ФВ ЛЖ < 45%) и устойчивой ЖТ.
- Имплантация ИКД*** рекомендована пациентам старше 18 лет с НУЖТ с дисфункцией ЛЖ (ФВ ЛЖ менее 40%) вследствие перенесенного ИМ и индуцируемой устойчивой ЖТ или ФЖ при проведении ВСЭФИ [223, 224, 225].
РКО IIaC (УУР B, УДД 2)
ИКД с целью первичной профилактики ВСС
В рандомизированных исследованиях и метаанализах было продемонстрировано, что риск ВСС связан с нарушением функции ЛЖ, а использование ИКД*** в качестве средства первичной профилактики ВСС значимо влияет на уровень смертности данной категории пациентов как с ишемической, так и с неишемической ее природой [225, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257].
Для всех показаний к применению ИКД*** решение в пользу последних принимается только в случае, когда прогнозируемая продолжительность жизни пациента превышает 1 год. Необходимость в адекватной реваскуляризации миокарда, наряду со стремлением радикального устранения аритмии, являются приоритетными по отношению к применению ИКД***-терапии.
Пациенты с СН со сниженной ФВ ЛЖ должны находиться на ОМТ, включающей иАПФ/АРА/АРНИ, бета-адреноблокаторы, антагонисты альдостерона, иНГЛТ-2 с повторной оценкой ФВ ЛЖ на фоне терапии перед принятием решения об имплантации ИКД*** для первичной профилактики ВСС, если прогнозируемая продолжительность жизни > 1 года.
- Имплантация ИКД*** для первичной профилактики ВСС не рекомендована в течение 40 дней после ИМ [247, 248].
ЕОК IIIA (УУР B, УДД 2)
- Имплантация ИКД*** рекомендована для уменьшения риска ВСС пациентам с дисфункцией ЛЖ (ФВ ЛЖ 35% и менее) и ХСН (II или III ФК по NYHA) на фоне ОМТ, не ранее чем через 40 дней после перенесенного ИМ и 90 дней после реваскуляризации миокарда [225, 247].
ЕОК IA (УУР B, УДД 2)
- Имплантация ИКД*** рекомендована у пациентов с дисфункцией ЛЖ (ФВ ЛЖ - 35% и менее) неишемического генеза и ХСН II или III ФК по NYHA на фоне ОМТ [5, 111, 225, 254, 255, 256, 257, 258].
ЕОК IB (УУР C, УДД 5)
- Имплантация ИКД*** рекомендована для профилактики ВСС у пациентов старше 18 лет, ожидающих трансплантацию сердца вне лечебного учреждения [236, 237, 259, 260].
ЕОК IIaC (УУР B, УДД 3)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
Состояния, при которых ИКД-терапия не показана или противопоказана:
- прогнозируемый срок жизни пациентов с удовлетворительным функциональным статусом не превышает 1 год, даже если они имеют показания, соответствующие 1 - 5 УДД;
- пациентам, страдающим непрерывно-рецидивирующими ЖТ или ФЖ;
- пациентам с выраженными психическими заболеваниями, которые могут быть усугублены имплантацией прибора или препятствовать систематическому наблюдению;
- пациентам с ХСН IV ФК (NYHA), рефрактерной к лекарственной терапии, когда они не являются кандидатами на трансплантацию сердца;
- пациентам с обмороками неясного генеза без индуцируемых ЖТА и без СПС;
- в случаях, когда ЖТ или ФЖ являются устранимыми радикально, хирургически или с помощью КА;
- аритмии, связанные с синдромом WPW, тахикардии из выходного тракта желудочков, фасцикулярные и идиопатические ЖТ, при отсутствии СПС;
- пациентам, у которых эпизод ЖТА возник вследствие преходящих или обратимых расстройств (например, острый ИМ, нарушение электролитного баланса, побочные эффекты медикаментов, травма), когда коррекция расстройства возможна и может значительно снизить риск повторного возникновения аритмии.
Сердечная ресинхронизирующая терапия у пациентов с ХСН для снижения риска ВСС. Комбинированные СРТ-Д устройства (Кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***)
Эффективность СРТ продемонстрирована в многочисленных клинических исследованиях и метаанализах при кардиомиопатии как ишемического, так и неишемического генеза [261, 262, 263, 264, 265]. Данные европейского регистра свидетельствуют о более низкой смертности у пациентов с комбинированными устройствами СРТ-Д*** (с функцией дефибриллятора) (Кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный***) [266].
- Имплантация СРТ-устройства (Электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) рекомендована у симптомных пациентов старше 18 лет с ХСН, синусовым ритмом и морфологией QRS по типу блокады левой ножки пучка Гиса (БЛНПГ), длительностью QRS ![]() 150 мс, ФВ ЛЖ
150 мс, ФВ ЛЖ ![]() 35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [261, 267, 268, 269, 270, 271].
35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [261, 267, 268, 269, 270, 271].
ЕОК IA (УУР B, УДД 2)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) рекомендована у симптомных пациентов старше 18 лет с ХСН, синусовым ритмом и QRS-морфологией БЛНПГ, длительностью QRS 130 - 149 мс, ФВ ЛЖ ![]() 35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [268, 269, 270, 271].
35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [268, 269, 270, 271].
ЕОК IB (УУР B, УДД 2)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) рекомендована у симптомных пациентов старше 18 лет с ХСН, синусовым ритмом и QRS-морфологией, не соответствующей БЛНПГ, длительностью QRS ![]() 150 мс, ФВ ЛЖ
150 мс, ФВ ЛЖ ![]() 35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [269, 270, 271].
35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [269, 270, 271].
ЕОК IIaB (УУР B, УДД 2)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) рекомендована у симптомных пациентов старше 18 лет с ХСН, синусовым ритмом и QRS-морфологией, не соответствующей БЛНПГ, длительностью QRS 130 - 149 мс, ФВ ЛЖ ![]() 35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [269, 270, 271].
35%, на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти [269, 270, 271].
ЕОК IIbB (УУР B, УДД 2)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) не рекомендована у пациентов с ХСН и длительностью QRS менее 130 мс [272, 273].
ЕОК IIIA (УУР B, УДД 2)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) рекомендована у пациентов старше 18 лет с ХСН, III - IV ФК по NYHA, длительностью QRS ![]() 130 мс, ФВ ЛЖ
130 мс, ФВ ЛЖ ![]() 35%, с ФП на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти. Пациентам должна быть обеспечена постоянная бивентрикулярная стимуляция с эффективным захватом желудочков [274, 275, 276, 277, 278].
35%, с ФП на фоне ОМТ, с целью уменьшения симптоматики, снижения морбидности и риска смерти. Пациентам должна быть обеспечена постоянная бивентрикулярная стимуляция с эффективным захватом желудочков [274, 275, 276, 277, 278].
ЕОК IIaB (УУР B, УДД 2)
- Пациентам старше 18 лет с СРТ-устройством (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) и ФП, в случае неэффективной бивентрикулярной стимуляции, рекомендовано создание блокады сердца с помощью КА АВ узла [279, 280].
ЕОК IIaB (УУР C, УДД 4)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) рекомендована у пациентов старше 18 лет с ФП, неконтролируемой частотой желудочкового ритма, кандидатов на создание блокады сердца с помощью КА АВ узла [21, 281, 282, 283, 284].
ЕОК IIaВ (УУР B, УДД 2)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***) рекомендована у симптомных пациентов старше 18 лет с ХСН, ФВ ЛЖ < 40%, которые имеют показания к постоянной желудочковой стимуляции вследствие брадикардии, с целью уменьшения симптоматики и снижения морбидности [285, 286, 287, 288].
ЕОК IA (УУР B, УДД 2)
- Имплантация СРТ-устройств (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный))*** рекомендована в качестве замены имеющегося ЭКС*** или ИКД*** для взрослых пациентов с ФВ ЛЖ < 40%, которые нуждаются в постоянной желудочковой стимуляции, с прогрессивным ухудшением состояния вследствие прогрессирования ХСН, несмотря на ОМТ [259, 288, 289, 290, 291, 292].
ЕОК IA (УУР B, УДД 2)
Комментарий. Решение вопроса о выборе типа устройства для ресинхронизирующей терапии (электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)*** или кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный))*** должно основываться на существующих показаниях для проведения ИКД***-терапии и детальном обсуждении данного вопроса с пациентом и его родственниками, с учетом пользы от имплантации устройства для СРТ с функцией дефибрилляции и возможных осложнений, последствий, связанных с необходимостью изменения жизненного уклада, ситуаций, требующих деактивации такого устройства, а также возможности наблюдения за пациентом в течение длительного периода времени.
Имплантируемый кардиовертер-дефибриллятор*** (подкожный)
Сложности применения эндокардиальных электродов (отведение дефибриллятора) у некоторых пациентов привели к появлению подкожного ИКД*** с одним или двумя электродами, которые имплантируются подкожно, вне грудной полости. Результаты исследований показывают, что подкожные дефибрилляторы могут предотвращать ВСС. Подкожные ИКД*** можно использовать для первичной профилактики ВСС, однако на сегодняшний день нет долгосрочных исследований с большой выборкой таких пациентов и соответствующие эффекты применения подкожных ИКД** еще не описаны. К настоящему времени продолжаются проспективные рандомизированные исследования, в которых проводится сравнение эффективности и осложнений у пациентов с подкожными и стандартными ИКД***.
- Имплантация кардиовертера-дефибриллятора*** (подкожного) рекомендована в качестве альтернативы кардиовертеру-дефибриллятору с эндокардиальными отведениями (Отведение дефибриллятора эндокардиальное***) у пациентов с показаниями к ИКД в тех случаях, когда не требуются антибрадикардическая стимуляция, СРТ и антитахикардическая стимуляция [293, 294, 295, 296, 297, 298].
ЕОК IIA С (УУР C, УДД 4)
- Имплантация кардиовертера-дефибриллятора*** (подкожного) рекомендована в качестве альтернативы дефибриллятору с эндокардиальными электродами (Отведение дефибриллятора эндокардиальное***) при осложненном венозном доступе, при инфекционных осложнениях, связанных с предыдущим устройством, во всех случаях, когда применение эндокардиальных электродов невозможно, нецелесообразно или потенциально опасно [293, 294, 295, 296, 297, 298].
ЕОК IIbC (УУР C, УДД 4)
Ведение пациентов с имплантированным кардиовертером-дефибриллятором***
Целесообразно отметить, что методика программирование ИКД*** у взрослых и детей не имеет принципиальных различий. Отдельных публикаций, касающихся особенностей программирования ИКД*** у детей нет.
- Обсуждение возможного изменения уклада жизни в связи с имплантацией ИКД*** рекомендовано для всех пациентов, кому показана ИКД***-терапия [299, 300, 301, 302].
ЕОК IC (УУР B, УДД 3)
- Оценка психического состояния и лечение психических расстройств рекомендовано всем пациентам с частыми срабатываниями ИКД*** [300, 301, 302].
ЕОК IC (УУР B, УДД 3)
- Необходимость в деактивации ИКД*** рекомендуется коллективно рассмотреть при значительном ухудшении состояния пациента и в терминальной стадии заболевания при участии пациента или его представителей [303, 304].
РКО IC (УУР C, УДД 5)
Комментарий: при принятии решения об имплантации ИКД*** первостепенное значение имеет учет ожидаемой продолжительности жизни пациента, качества жизни и сопутствующих заболеваний, а также оценка и обсуждение этих вопросов с пациентом в процессе замены ИКД***.
Отдельные аспекты лечения с помощью устройств
Оптимизация программирования ИКД***.
- Рекомендуется осуществлять оптимизацию программирования ИКД*** таким образом, чтобы свести к минимуму вероятность необоснованных и ненужных срабатываний ИКД*** с целью снижения смертности [305, 306, 307].
ЕОК IA (УУР B, УДД 1)
- Рекомендуется осуществлять программирование ИКД*** таким образом, чтобы по возможности заменить высоковольтные разряды (шоки) на антитахикардитическую стимуляцию для купирования аритмий без ущерба для безопасности пациента [308, 309, 310, 311].
РКО IC (УУР C, УДД 5)
- Рекомендуется минимизация желудочковой стимуляции в однокамерных или двухкамерных ИКД*** у пациентов без показаний к антибрадикардитической стимуляции [111, 177, 308, 309, 310].
ЕОК IA (УУР C, УДД 5)
- Рекомендуется программирование в ИКД*** пролонгированного интервала детекции (критерии длительности не менее 6 - 12 секунд или 30 интервалов) [301, 311, 316].
ЕОК IA (УУР C, УДД 5)
- Рекомендуется программировать предел зоны терапии самой медленной тахикардии ![]() 188 ударов в минуту взрослым пациентам с ИКД*** для первичной профилактики ВСС [315, 316].
188 ударов в минуту взрослым пациентам с ИКД*** для первичной профилактики ВСС [315, 316].
ЕОК IA (УУР B, УДД 2)
- Рекомендуется программирование хотя бы одной электротерапии в виде антитахикардитической стимуляции во всех зонах тахиаритмий в ИКД*** у взрослых пациентов со СПС [307, 308, 313, 317, 318].
ЕОК IA (УУР B, УДД 2)
- Рекомендуется программировать в ИКД*** алгоритмы дискриминации НЖТ и ЖТ для тахикардий с частотой до 230 уд/мин у взрослых [317].
ЕОК IB (УУР B, УДД 3)
- Рекомендуется в любых ИКД*** активировать оповещения об отказе электрода [318, 319, 320].
ЕОК IB (УУР C, УДД 4)
- Рекомендуется применение удаленного мониторинга в ИКД*** для снижения частоты неуместных шоков у взрослых пациентов [321].
ЕОК IB (УУР B, УДД 2)
- Рекомендуется программирование в любых ИКД*** антитахикардитической стимуляции типа залповой с постоянным интервалом между стимулами (burst) в качестве первой электротерапии вместо учащающей с последовательно сокращающимся интервалом между стимулами (ramp) стимуляции [322, 327].
ЕОК IB (УУР C, УДД 5)
- У взрослых пациентов с подкожными кардиовертерами-дефибрилляторами*** рекомендуется программирование двойной зоны обнаружения с активацией алгоритма дискриминации в нижней зоне [323, 324, 325].
ЕОК IB (УУР B, УДД 3)
- Для рутинного программирования ИКД*** рекомендуется активация более одной зоны обнаружения тахикардии [316, 326].
ЕОК IIA (УУР C, УДД 4)
- Перепрограммирование ранее установленного ИКД*** рекомендовано в случае повторных необоснованных срабатываний устройства [5, 51, 309].
РКО IC (УУР C, УДД 5)
Аспекты ведения пациентов в конце жизни
В конце жизни пациента основным подходом в лечении становится паллиативная медицинская помощь, а принятая ранее стратегия лечения может быть изменена. Паллиативная медицинская помощь представляет собой комплекс мероприятий, включающих медицинские вмешательства, мероприятия психологического характера и уход, осуществляемые в целях улучшения качества жизни неизлечимо больных граждан и направленные на облегчение боли, других тяжелых проявлений заболевания [328]. В настоящее время с пациентами редко проводятся беседы об индивидуальных целях лечения, даже в период конечной стадии заболевания [329]. Начало паллиативной помощи больным не означает отказ от стандартных подходов лечения, отсутствие шансов на стабилизацию и/или улучшение их состояния. Паллиативная помощь проводится для улучшения качества жизни (КЖ) пациента и членов его семьи и продолжается совместно со стандартной терапией заболевания больного [330].
Согласно опубликованным данным, в последние 30 дней жизни от 21% до 27% пациентов с имлантированными электродами для дефибрилляции испытывали разряд терапии (шок) [331, 332], что сопровождалось чувством страдания [332]. При анализе 130 устройств ИКД, полученных после смерти пациентов, было выявлено, что 31% больных испытал шок в последние 24 часа жизни: 55% из них получили 3 разряда, 32% - более 10 разрядов. Присутствовавший рядом медицинский персонал или члены семьи отмечали у умирающего стресс и боль [333, 334].
В последние 10 лет деактивация дефибрилляции ИКД** у пациентов с терминальной стадией хронического заболевания вошла в рекомендации по лечению этих заболеваний в структуре стратегии паллиативного лечения больных [169, 335, 336].
- Рекомендуется перед имплантацией и в случае значительного ухудшения состояния здоровья обсуждение с пациентом и его семьей возможности деактивации дефибрилляции ИКД**, с совместным принятием решения об этом [8, 337].
РКО IC (УУР C, УДД 5)
Для отключения функции дефибрилляции необходимо наличие всех следующих критериев:
- совместно с профильным специалистом по основному заболеванию пациента определение терминальной стадии заболевания или выраженной тяжести заболевания, некорректируемого известными в настоящее время методами воздействия и определения паллиативной фазы лечения;
- не предполагается для лечения пациента трансплантация органа и/или имплантация систем механической поддержки кровообращения;
- имеется желание самого пациента (в случае его вменяемости) на отключение функции дефибрилляции (выбор пациента ориентирован на КЖ и общий комфорт);
- подписанное пациентом или его родственниками (при его невменяемости или отсутствии сознания) информированного согласия на отключение функции дефибрилляции ИКД.
Комментарии. Решение об ургентном отключении функции дефибрилляции (для предотвращения непрерывного срабатывания ИКД***) может принять и осуществить (например, наложением магнита на область ИКД***) консилиум врачей в момент умирания пациента, пребывающего в терминальной стадии своего заболевания. Решение об отключении функции дефибрилляции принимается пациентом и консилиумом врачей с фиксацией его в истории болезни или амбулаторной карте больного и информировании об этом решении родственников пациента (при согласии пациента). Отключение функции дефибрилляции может проводиться в амбулаторных, стационарных условиях или в хосписе. Важно помнить, что решение пациента об отключении функции дефибрилляции или его включении может изменяться с течением времени, и это решение следует считать определяющим для выполнения и фиксации этого в медицинской документации [338].
- Обсуждение предварительного планирования лечения, цель которого - донесение врачом или командой врачей пациенту и членам его семьи информации о течении заболевания, вариантах лечения и паллиативной помощи, рекомендуется проводить до того, как пациенту станет трудно принимать собственные решения [330, 339].
ЕОК IB (УУР C, УДД 5)
Комментарии: цели лечения могут изменяться в зависимости от стадии заболевания, тяжести сопутствующей патологии и решения пациента. Учитывая непредсказуемость течения заболевания, эволюцию отношения пациента к лечению и возможность расхождения мнения больного с мнением членов его семьи о заболевании и объеме лечения, необходимо информировать пациента и его родственников о течении заболевания, прогнозе, возможностях лечения и совместно определять цели и задачи терапии [340].
3.2.3. Катетерная абляция (радиочастотная абляция аритмогенных зон; радиочастотная абляция аритмогенных зон роботассистированная; криоабляция аритмогенных зон)
- Выполнение процедуры КА для лечения ЖТ/ЖЭ рекомендуется с использованием систем трехмерной навигации (система картирования сердца с возможностью отображения трехмерных результатов картирования) для повышения безопасности и эффективности процедуры [341].
РКО IIaC (УУР C, УДД 5)
Комментарии. У детей целесообразно придерживаться такой же рекомендации, как и у взрослых, несмотря на отсутствие достаточной доказательной базы.
- У пациентов с повторяющейся УМЖТ или устойчивой полиморфной ЖТ/ФЖ, когда ЖНР индуцируются повторяющимися ЖЭ идентичной морфологии, рекомендуется рассмотреть возможность КА [51, 342].
РКО IIaC (УУР C, УДД 5)
Комментарии. У детей целесообразно придерживаться такой же рекомендации, как и у взрослых, несмотря на отсутствие достаточной доказательной базы.
Катетерная абляция (КА) (радиочастотная абляция аритмогенных зон; криоабляция аритмогенных зон) у пациентов без структурной патологии сердца
Область выходного тракта правого и левого желудочков часто является источником идиопатических ЖТ и ЖЭ. В 70% случаев это выходной тракт ПЖ (ВТПЖ), в остальных случаях - синусы Вальсальвы, выходной тракт ЛЖ (ВТЛЖ), большая вена сердца, эпикардиальные зоны, аорто-митральное соединение, реже - проксимальный отдел легочной артерии непосредственно над пульмональным клапаном. Идиопатическая очаговая ЖТ из выходного тракта (ЖТ-ВТ) обычно возникает у пациентов без СПС, однако у некоторых пациентов были выявлены незначительные изменения по данным МРТ.
Желудочковая тахикардия из выходного отдела сердца
- Выполнение КА желудочковых аритмий предположительно из области ВТПЖ рекомендовано при наличии симптомов и/или в случае неэффективности ААТ (к примеру, бета-адреноблокаторов), а также у пациентов с нарушением систолической функции ЛЖ на фоне частой ЖТ/ЖЭ [51, 116, 342, 343].
ЕОК IB (УУР C, УДД 5)
Комментарий. Пациентам с ЖТ/ЖЭ предположительно из ВТПЖ рекомендована КА в качестве метода первого выбора, тогда как при ЖТ/ЖЭ из ВТЛЖ ее выполнение следует рассматривать только при отсутствии эффекта ААТ.
- Выполнение КА опытными специалистами для лечения ЖТ/ЖЭ предположительно из ВТЛЖ, области аортального клапана или эпикардиальной ЖТ/ЖЭ рекомендовано у симптомных пациентов при неэффективности приема 1 и более ААП класс IC, а также при нежелании пациентов находиться на долгосрочной ААТ [186, 344].
ЕОК IIaB (УУР C, УДД 5)
- Катетерная абляция для лечения ЖТ/ЖЭ предположительно из синусов Вальсальвы рекомендована только при неэффективности терапии ААП класс IC [344].
ЕОК IC (УУР C, УДД 5)
- Эпикардиальный подход для абляции ЖТ/ЖЭ рекомендован только после неэффективной эндокардиальной абляции ЖТ/ЖЭ из выходных трактов [345].
ЕОК IC (УУР C, УДД 4)
Комментарий. Большинство очаговых эпикардиальных ЖТ возникают в непосредственной близости от крупных сердечных вен или коронарных артерий, и главным риском такой процедуры является повреждение коронарной артерии.
Более подробная информация о проведении КА у пациентов детского возраста без структурной патологии сердца в п. 3.5
Идиопатическая левожелудочковая тахикардия
Чаще всего встречается фасцикулярная ЖТ с локализацией цепи риентри в области разветвлений задней ветви левой ножки пучка Гиса (> 90%), изредка - передней ветви, которая развивается главным образом у молодых людей без СПС. Методом первого выбора для лечения таких пациентов в опытных центрах является КА, поскольку заболевание встречается в основном у лиц молодого возраста, и длительное медикаментозное лечение в этом случае неэффективно.
Желудочковая тахикардия из папиллярных мышц, области кольца митрального или трехстворчатого клапана
- При отсутствии эффекта от лечения ЖТ/ЖЭ из папиллярных мышц, области кольца митрального или трехстворчатого клапана Антиаритмическими препаратами, класс IC и/или бета-адреноблокаторами рекомендована КА [51, 346].
ЕОК IC (УУР C, УДД 5)
Комментарий. При картировании и выполнении абляции в зоне папиллярных мышц достаточно сложно достичь стабильного положения катетера, в связи с чем рекомендуется транссептальный доступ в ряде случаев и контроль с помощью внутрисердечной ЭХОКГ. Успешная абляция может крайне редко осложняться митральной регургитацией.
Катетерная абляция (КА) (радиочастотная абляция аритмогенных зон; криоабляция аритмогенных зон) у пациентов со структурной патологией сердца/дисфункцией левого желудочка
У пациентов с дисфункцией ЛЖ и устойчивой ЖТ патофизиологический механизм аритмии во многих случаях заключается в формировании круга риентри на фоне рубцовых изменений, и целью абляции является критический перешеек в области этого круга. ЖТ у таких пациентов чаще всего имеет мономорфный характер. Предпочтительной конечной точкой процедуры является отсутствие любых индуцируемых ЖТ. В случае развития электрического шторма выполнение КА может способствовать его прекращению, а также снизить частоту повторных эпизодов по сравнению с медикаментозной терапией.
- Выполнение неотложной КА в опытных центрах рекомендовано у пациентов с непрерывной ЖТ или электрическим штормом, приводящим к повторному нанесению шоков ИКД*** [51, 155, 156].
ЕОК IB (УУР C, УДД 5)
Комментарий. У детей целесообразно придерживаться такой же рекомендации, как и у взрослых, несмотря на отсутствие достаточной доказательной базы.
- Назначение #амиодарона** или КА рекомендованы пациентам с повторными шоками ИКД*** вследствие устойчивой ЖТ [102, 108, 236].
ЕОК IB (УУР C, УДД 5)
Комментарий. Дозы амиодарона** для взрослых пациентов и #амиодарона** для детей представлены в Приложении А3 (таблицы А3.1-А3.4)
- Выполнение КА рекомендовано после регистрации первого эпизода устойчивой ЖТ у некоторых пациентов старше 18 лет с ИКД*** для снижения риска последующих срабатываний устройства [237, 238, 240].
РКО IIaB (УУР B, УДД 2)
Комментарий. Для принятия подобного решения необходимо коллективное обсуждение врача-кардиолога и специалиста, выполняющего катетерные вмешательства. Выполнение КА целесообразно в медицинском учреждении, обладающим опытом подобных процедур (опытном центре). При невозможности выполнения КА у таких пациентов целесообразно назначение амиодарона**. Дозы амиодарона** для взрослых пациентов представлены в Приложении А3 (таблица А3.1).
- У пациентов с дисфункцией ЛЖ, направленных на катетерную абляцию ЖА, препроцедурная или внутрипроцедурная визуализация рекомендуется для исключения тромбоза полостей сердца [347, 348, 349].
ЕОК IB (УУР B, УДД 2)
- У взрослых пациентов с неишемической или ишемической кардиомиопатиями, направленных на катетерную абляцию ЖТ, рекомендована МРТ-визуализация миокарда для повышения эффективности вмешательства и снижения вероятности рецидивов ЖТ [350, 351].
ЕОК IIaB (УУР B, УДД 2)
- У пациентов старше 18 лет с рубец-ассоциированной ЖТ рекомендована абляция субстрата для повышения эффективности вмешательства и снижения вероятности рецидивов ЖТ [352, 353].
ЕОК IB (УУР B, УДД 2)
- Рекомендовано мультиэлектродное картирование высокой плотности для более полной характеристики аритмогенной ткани в процессе КА рубец-ассоциированной ЖТ для повышения эффективности вмешательства и снижения вероятности рецидивов ЖТ [51, 342, 354, 355, 356].
ЕОК IIaB (УУР C, УДД 5)
Желудочковая экстрасистолия у пациентов со структурной патологией сердца/дисфункцией левого желудочка
- У пациентов со СПС/дисфункцией ЛЖ с частой симптомной ЖЭ или повторяющейся НУЖТ рекомендовано выполнение КА [51, 342, 357, 358].
ЕОК IIaB (УУР C, УДД 5)
- При наличии дисфункции ЛЖ, ассоциированной с ЖЭ, рекомендовано проведение КА [51, 342, 358].
ЕОК IIaB (УУР C, УДД 5)
3.2.4. Модуляция автономной нервной активности (нейромодуляция)
Общепризнана роль автономной нервной системы в развитии аритмий [360]. Ранее было продемонстрировано, что симпатическая активация играет ключевую роль в индукции ЖА, особенно при некоторых наследственных заболеваниях, таких как врожденный СУИQT и КПЖТ [361, 362], а левосторонняя симпатическая денервация сердца снижает частоту аритмических обмороков при врожденном СУИQT [363]. Доказана эффективность симпатической блокады сердца с помощью различных подходов (торакальной эпидуральной анестезии, чрескожной блокады звездчатого узла или хирургической резекции звездчатого ганглия) в снижении тяжести аритмии при рефрактерной ЖТ/ФЖ [161, 164]. Необходимы дальнейшие исследования для выявления когорты пациентов с наибольшей эффективностью нейромодуляции для купирования и профилактики ЖТ/ФЖ.
- У взрослых пациентов с ЖТ/ФЖ и неэффективной терапией бета-адреноблокаторами и/или другими лекарственными препаратами для лечения нарушений ритма сердца, когда КА неэффективна, противопоказана или невозможна, рекомендуется рассмотреть возможность симпатической денервации сердца [163].
РКО IIaB (УУР С, УДД 4)
3.3. Ведение пациентов с отдельными видами нозологий
3.3.1. Идиопатические желудочковые аритмии
Идиопатическими называют ЖА без СПС и каналопатий [8].
- Лицам с бессимптомной ЖЭ без СПС и/или наследственной каналопатии, когда доля эктопических комплексов более 10% от общего количества сердечных сокращений по данным ХМЭКГ, или при наличии НУЖТ, рекомендуется динамическое наблюдение для возможного выявления заболевания сердечно-сосудистой системы [51, 363, 364, 365, 366].
ЕОК IС (УУР C, УДД 5)
- Пациентам с ЖЭ/ЖТ с морфологией QRS комплексов, не типичной для идиопатических аритмий даже при нормальных результатах ЭХОКГ, рекомендовано выполнение МРТ сердца для диагностики структурной патологии [66, 186].
ЕОК IIaC (УУР C, УДД 5)
- Рекомендовано проведение МРТ сердца при подозрении на кардиомиопатию, индуцированную ЖЭ (дилатация полостей сердца и снижение сократимости миокарда ЛЖ) [66, 370, 371, 372].
ЕОК IIaВ (УУР B, УДД 3)
- У пациентов без СПС/дисфункции ЛЖ медикаментозное лечение бессимптомной нечастой ЖЭ/НУЖТ не рекомендовано, так как у этих пациентов низкий риск ВСС и не требуется ее профилактика [207, 368, 369, 370].
РКО IIIC (УУР C, УДД 5)
Комментарий. С позиции риска ВСС пациенты без СПС имеют благоприятный прогноз вне зависимости от вида желудочковой эктопической активности и общего количества ЖЭ в сутки [183, 184, 186].
- Бета-адреноблокаторы, антиаритмические препараты, класс IC или селективные блокаторы кальциевых каналов с прямым действием на сердце (#верапамил**) рекомендованы у пациентов с ЖЭ/ЖТ из ВТПЖ и при идиопатической левожелудочковой (фасцикулярной) тахикардии при наличии симптомов в случае отказа пациента от проведения КА, а также если ее проведение невозможно или ассоциировано с высоким риском [51, 185, 371, 372].
ЕОК IIaB (УУР C, УДД 4)
Комментарий. Перечень препаратов с указанием доз для взрослых пациентов и детей представлен в Приложении А3, таблицы А3.1 и А3.3)
Методом выбора лечения ЖЭ/ЖТ из ВТПЖ и идиопатической левожелудочковой (фасцикулярной) тахикардии является КА.
- Пациентам с идиопатической ЖЭ/ЖТ с локализацией вне ВТПЖ при наличии симптомов рекомендовано использование бета-адреноблокаторов или селективных блокаторов кальциевых каналов с прямым действием на сердце (#верапамила**) [51, 102, 185, 343, 371].
ЕОК IC (УУР C, УДД 5)
Комментарий. Перечень препаратов с указанием доз для взрослых пациентов и детей представлен в Приложении А3, таблицы А3.1, А3.2, А3,3, А3.4).
- Антиаритмические препараты, класс IC, при наличии симптомов рекомендованы у пациентов с идиопатической ЖЭ/ЖТ с локализаций вне ВТПЖ [343, 372, 373].
ЕОК IIaС (УУР С, УДД 4)
- Амиодарон** не рекомендован в качестве терапии первой линии у пациентов с идиопатическими ЖЭ/ЖТ [8, 184].
ЕОК IIIC (УУР С, УДД 5)
Комментарий. Наиболее эффективными средствами лечения ЖЭ/НУЖТ у взрослых лиц без СПС являются антиаритмические препараты, класс IC (пропафенон**, диэтиламинопропионилэтоксикарбониламинофенотиазин, лаппаконитина гидробромид**, флекаинид) [185, 192, 193, 197, 200, 201, 202, 203, 204, 372], а также амиодарон**. Применение амиодарона** у данной группы пациентов ограничено внекардиальными побочными эффектами [192] и целесообразно лишь при наличии СПС, включая кардиомиопатию на фоне частой ЖЭ (см ниже) [188, 190]. Перечень препаратов представлен в Приложении А3, таблицах А3.1 и А3.3.
- У взрослых пациентов с кардиомиопатией на фоне частой мономорфной ЖЭ медикаментозная ААТ, включая амиодарон**, рекомендована в случае отказа пациента от проведения КА, а также если ее проведение невозможно, ассоциировано с высоким риском или было неэффективным [189, 374, 375, 376].
ЕОК IIaC (УУР B, УДД 2)
Область выходного тракта правого и левого желудочков часто является источником идиопатических ЖТ и ЖЭ [343, 377]. В 70% случаев это ВТПЖ, в остальных случаях - синусы Вальсальвы, выходной тракт ЛЖ, большая вена сердца, эпикардиальные зоны, аорто-митральное соединение, реже проксимальный отдел легочной артерии непосредственно над пульмональным клапаном [344, 345, 376, 377].
Идиопатическая ЖТ из выходного тракта обычно возникает у пациентов без СПС, однако у некоторых пациентов были выявлены незначительные изменения по данным МРТ. Идиопатическая ЖТ обычно имеет доброкачественный характер, но в некоторых случаях возможна злокачественная ЖТ [343, 375, 376, 378, 379].
- КА рекомендуется пациентам с симптомной ЖЭ/ЖТ из ВТПЖ в качестве терапии первой линии [8, 51, 190, 382].
ЕОК IB (УУР C, УДД 5)
- КА рекомендуется пациентам с идиопатической симптомной левожелудочковой (фасцикулярной) тахикардией в качестве терапии первой линии [8, 191, 382].
ЕОК IB (УУР C, УДД 5)
- КА рекомендуется у пациентов старше 18 лет с идиопатической симптомной ЖЭ/ЖТ с локализаций вне ВТПЖ [51, 191, 382].
ЕОК IIaС (УУР C, УДД 4)
Комментарий. Катетерная абляция ЖЭ/ЖТ вне ВТПЖ (ВТЛЖ, эпикардиальная локализация, папиллярные мышцы, кольца митрального и трикуспидального клапанов) нередко сопряжена с техническими трудностями и более высоким риском вмешательства, поэтому рекомендована как альтернатива антиаритмическим препаратам, класс IC при неэффективности бета-адреноблокаторов.
- У асимптомных пациентов старше 18 лет с целью профилактики систолической дисфункции ЛЖ вследствие кардиомиопатии, индуированной ЖЭ, рекомендуется рассмотреть возможность выполнения КА идиопатических ЖЭ, когда доля эктопических комплексов составляет более 20% от общего количества сердечных сокращений в сутки по данным ХМЭКГ [191, 218, 383].
ЕОК IIB (УУР B, УДД 3)
- Выполнение КА рекомендуется пациентам с кардиомиопатией, развившейся вследствие частой мономорфной ЖЭ [51, 191, 218, 384, 385, 386].
ЕОК IC (УУР C, УДД 5)
3.3.2. Ишемическая болезнь сердца
3.3.2.1. Острый коронарный синдром и острый инфаркт миокарда у взрослых пациентов
Частота ЖА при ОКС на госпитальном этапе снизилась за счет ранней и активной реваскуляризации и своевременной адекватной фармакотерапии. Тем не менее, у 4 - 12% пациентов с ИМ с подъемом сегмента ST (ИМпST) в первые 48 часов с момента появления симптомов развиваются ЖА [387, 388, 389].
Дореперфузионные ЖА встречаются чаще, чем реперфузионно-индуцированные или постреперфузионные аритмии при ИМпST [390]. Гемодинамическая нестабильность, кардиогенный шок, ФВЛЖ менее 40%, а также сумма отклонений сегмента ST во всех отведениях, являются независимыми предикторами ЖА как при ИМпST, так и без него [387, 391]. Кроме того, ранняя реполяризация связана с повышенным риском ЖА и ВСС при ОКС [392].
Профилактика желудочковых аритмий при инфаркте ИМпST
Срочная реперфузия является наиболее важной терапией [393, 394], так как острая ишемия вызывает аритмии. Лечение бета-адреноблокаторами также целесообразно для предотвращения ЖА [395, 396].
В случае ОКС и повторной стойкой и/или гемодинамически значимой ЖТ или ФЖ быстрая и успешная реваскуляризация имеет ключевое значение для профилактики последующих аритмий и должна выполняться без промедления [397, 398, 399].
- Рекомендуется рассмотреть возможность экстренной КАГ, при необходимости с реваскуляризацией, у пациентов с повторными эпизодами ЖТ или ФЖ, когда не удается исключить ишемию миокарда [5, 51, 400].
ЕОК IIbC (УУР C, УДД 5)
- Экстренная реперфузия рекомендована при ИМпST для уменьшения ишемического повреждения и электрической нестабильности миокарда [401, 402, 403].
ЕОК IA (УУР B, УДД 1)
- Рекомендуется рассмотреть возможность выполнения КАГ и, при необходимости, коронарной ангиопластики в течение 2 ч после поступления у пациентов с ИМ без подъема сегмента ST из группы высокого риска, в том числе с угрожающими жизни ЖА, для уменьшения ишемического повреждения и электрической нестабильности миокарда [397, 398].
ЕОК IIbC (УУР C, УДД 5)
- Рекомендуется рассмотреть возможность экстренной реваскуляризации коронарных артерий у пациентов с повторными эпизодами ЖТ или ФЖ для устранения ишемии миокарда [393, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406].
ЕОК IIbC (УУР B УДД 1)
- Поступление в отделение интенсивной терапии рекомендовано пациентам, выжившим после остановки сердца вне стен лечебного учреждения и находящимся в состоянии комы, без ЭКГ-признаков ИМпST на ЭКГ после реанимации [5, 51, 393, 406].
ЕОК IIaB (УУР C, УДД 5)
- Срочное выполнение КАГ (< 2 ч) рекомендовано пациентам, выжившим после остановки сердца вне стен лечебного учреждения и находящихся в коматозном состоянии, при отсутствии данных за некоронарные причины, особенно у пациентов с нестабильной гемодинамикой [393, 406, 407].
ЕОК IIaB (УУР C, УДД 4)
Комментарий. Острая ишемия является причиной электрической нестабильности и провоцирует возникновение ЖА при ОКС [408]. Для уменьшения вероятности ЖТ/ФЖ при ОКС рекомендуется назначение бета-адреноблокаторов в раннем периоде [407, 409, 410]. В некоторых случаях помогает компенсация гипомагниемии и гипокалиемии. Ингибиторы ГМГ-КоА-редуктазы уменьшают смертность среди пациентов с ИБС, главным образом за счет предотвращения повторных коронарных событий, и являются частью стандартного лечения таких пациентов [400, 401]. Возникновение ФЖ в раннем периоде (т.е. в течение 48 часов) при ОКС сопровождается пятикратным повышением риска госпитальной смертности [411].
- Внутривенное (в/в) введение бета-адреноблокаторов рекомендовано пациентам с рецидивирующим ЖТ/ФЖ во время ИМпST, если нет противопоказаний [407, 409].
ЕОК IB (УУР C, УДД 5)
- В/в введение амиодарона** рекомендовано пациентам с рецидивирующим ЖТ/ФЖ во время острой фазы ОКС [128, 410, 411, 412].
ЕОК IIaC (УУР B, УДД 3)
- Рекомендуется рассмотреть возможность в/в введения лидокаина** для лечения рецидивирующих ЖТ/ФЖ, не поддающихся лечению бета-адреноблокаторами или амиодароном**, или если амиодарон** противопоказан во время острой фазы ОКС [153].
ЕОК IIbC (УУР A, УДД 1)
- Профилактическое назначение лекарственных препаратов для лечения нарушений ритма сердца (кроме бета-адреноблокаторов) не рекомендуется пациентам с ОКС, не имеющих документированных пароксизмов ЖТ/ФЖ [216, 256, 389, 396, 418].
ЕОК IIIB (УУР C, УДД 4)
- Имплантация ИКД*** рекомендована у выживших после ВОС вследствие спазма коронарных артерий [413, 414, 415].
ЕОК IIaC (УУР C, УДД 4)
Стратификация риска ВСС в острый период (первые 10 дней) ИМ
Большинство исследований, в которых оценивали целесообразность неинвазивных способов стратификации риска, проводились на пациентах с выраженным снижением ФВ ЛЖ (< 40%) или в смешанных группах. Результаты для пациентов с ФВ ЛЖ > 40% либо не сообщались, либо подгруппы таких пациентов были настолько малы, что не позволяли выполнить достоверный анализ и интерпретировать полученные данные. В настоящий момент нет достаточно специфичных и чувствительных неинвазивных методов стратификации риска у пациентов, перенесших ИМ и имеющих нормальную ФВ ЛЖ.
Есть ограниченные данные, полученные в подгруппах больших исследований, что программируемая стимуляция желудочков (ПСЖ) может применяться для стратификации риска после ИМ у пациентов с ФВ ЛЖ > 40% [416, 417, 418]. Этот метод сейчас оценивают в рамках продолжающегося исследования PRESERVE-EF по стратификации риска у пациентов с сохраненной ФВЛЖ.
- Неинвазивные методы (например, оценка альтернации зубца T, дисфункции вегетативной системы или сигнал-усредненной ЭКГ) не рекомендуются для стратификации риска в ранний период после ИМ [417, 418, 419].
ЕОК IIIB (УУР B, УДД 2)
- Ранняя (до выписки из стационара) оценка ФВ ЛЖ рекомендована всем пациентам, перенесшим ИМ [5, 51, 78, 401, 420].
ЕОК IB (УУР B, УДД 3)
- Повторная оценка сниженной ФВ ЛЖ (< 35%) рекомендуется через 6 - 12 недель после ИМ с целью определения необходимости имплантации ИКД*** для первичной профилактики ВСС [5, 51, 418, 419].
ЕОК IC (УУР B, УДД 2)
Комментарий. В особых случаях, например, при неполной реваскуляризации, предшествующем нарушении ФВ ЛЖ и появлении аритмии спустя 48 часов от развития ОКС, можно рассмотреть раннюю (< 40 дней) установку ИКД***. При этом следует учитывать тип ЖА (мономорфная, полиморфная, плеоморфная ЖТ или ФЖ), а также длину цикла ЖТ (нестойкие короткие циклы и нестойкие длинные циклы). Если выполняется программируемая стимуляция, дополнительно оценивают индукцию и тип индуцируемой аритмии (мономорфная ЖТ, полиморфная ЖТ, ФЖ) [248].
- Реваскуляризация коронарных артерий рекомендована пациентам со сниженной ФВ ЛЖ и предшествующими ей признаками ишемии миокарда для снижения риска ВСС [5, 51].
ЕОК IB (УУР C, УДД 5)
3.3.2.2. Хроническая ИБС у взрослых пациентов
Первичная профилактика ВСС у больных со сниженной ФВ ЛЖ
Через 40 дней после ИМпST примерно у 5% пациентов ФВ ЛЖ становится менее 35%, что увеличивает риск ВСС [418, 419, 420]. Пациентам с ФВЛЖ ![]() 35% и симптомами ХСН ФК класса II и III по NYHA рекомендуется первичная профилактика ВСС методом имплантации ИКД*** [225]. Имплантация ИКД*** также должна рассматриваться у бессимптомных пациентов с ФВ
35% и симптомами ХСН ФК класса II и III по NYHA рекомендуется первичная профилактика ВСС методом имплантации ИКД*** [225]. Имплантация ИКД*** также должна рассматриваться у бессимптомных пациентов с ФВ ![]() 30% [251]. В этой группе пациентов снижение смертности с помощью ИКД*** было продемонстрировано в четырех рандомизированных клинических исследованиях [225, 249, 250, 251]. Пациентам с ИБС со сниженной ФВ ЛЖ (
30% [251]. В этой группе пациентов снижение смертности с помощью ИКД*** было продемонстрировано в четырех рандомизированных клинических исследованиях [225, 249, 250, 251]. Пациентам с ИБС со сниженной ФВ ЛЖ (![]() 40%) и бессимптомной ЖТ, индуцируемой с помощью ПСЖ, рекомендована имплантация ИКД*** независимо от класса NYHA [250].
40%) и бессимптомной ЖТ, индуцируемой с помощью ПСЖ, рекомендована имплантация ИКД*** независимо от класса NYHA [250].
С момента публикации вышеупомянутых исследований расширилось применение ранней реваскуляризации и были внедрены новые препараты для терапии СН, что снизило общий риск ВСС у пациентов с СН [421, 422].
- Пациентам с обмороком и перенесенным ИМпST рекомендована ПСЖ, если обморок остается необъяснимым после неинвазивного обследования [421, 422].
ЕОК IB (УУР C, УДД 5)
- Имплантация ИКД*** рекомендуется пациентам с ИБС, симптомами ХСН (II-III класс по NYHA) и ФВ ЛЖ ![]() 35% на фоне ОМТ, продолжающейся более 3 месяцев [225, 251].
35% на фоне ОМТ, продолжающейся более 3 месяцев [225, 251].
ЕОК IA (УУР B, УДД 2)
- Имплантация ИКД*** рекомендована пациентам с ИБС, симптомами ХСН функционального класса I по NYHA и ФВ ЛЖ ![]() 30% на фоне ОМТ, продолжающейся более 3 месяцев [251].
30% на фоне ОМТ, продолжающейся более 3 месяцев [251].
ЕОК IIaB (УУР B, УДД 2)
- Имплантация ИКД*** рекомендована пациентам с ИБС, ФВ ЛЖ ![]() 40%, на фоне ОМТ, продолжающейся более 3 месяцев, и УМЖТ, если она индуцируется с помощью ПСЖ [250].
40%, на фоне ОМТ, продолжающейся более 3 месяцев, и УМЖТ, если она индуцируется с помощью ПСЖ [250].
ЕОК IIaB (УУР B, УДД 2)
- Пациентам с ИБС, не имеющим документированных устойчивых пароксизмов ЖТ/ФЖ, не рекомендуется профилактическая ААТ, кроме бета-адреноблокаторов [220, 221, 222].
ЕОК IIIA (УУР B, УДД 2)
Вторичная профилактика ВСС и лечение ЖА
- Имплантация ИКД*** рекомендуется пациентам без продолжающейся ишемии с подтвержденной ФЖ или гемодинамически значимой ЖТ, возникающей позднее чем через 48 ч после ИМ [227, 250, 423, 424, 425].
ЕОК IA (УУР B, УДД 2)
- КА рекомендована пациентам с ИБС и рецидивирующей симптомной УМЖТ и/или шоками ИКД*** при УМЖТ, несмотря на постоянную терапию амиодароном**, вместо усиления ААТ [155, 158, 160, 246, 347, 427].
ЕОК IB (УУР B, УДД 2)
- Добавление перорального амиодарона** или замена бета-адреноблокаторов соталолом** рекомендованы пациентам с ИБС с рецидивирующей симптомной УМЖТ и/или шоками ИКД*** для купирования УМЖТ во время лечения бета-адреноблокаторами [151, 425].
ЕОК IIaB (УУР В, УДД 2)
- Имплантация ИКД*** рекомендована пациентам с гемодинамически значимой УМЖТ и ФВЛЖ ![]() 40%, если катетерная абляция ЖТ неэффективна, недоступна или нежелательна [8].
40%, если катетерная абляция ЖТ неэффективна, недоступна или нежелательна [8].
ЕОК IIaC (УУР C, УДД 5)
- КА рекомендована пациентам с ИБС и рецидивирующей симптомной УМЖТ или шоками ИКД*** при УМЖТ, несмотря на лечение бета-адреноблокаторами или соталолом** [237].
ЕОК IIaC (УУР В, УДД 2)
- Рекомендуется рассмотреть возможность КА у пациентов с ИБС, которым показана имплантация ИКД***, непосредственно перед или сразу после имплантации ИКД***, чтобы уменьшить количество возможных последующих эпизодов ЖТ и шоков ИКД*** [350, 425, 426, 427].
ЕОК IIbB (УУР B, УДД 2)
- У пациентов с ИБС и гемодинамически стабильной УМЖТ и ФВ ЛЖ ![]() 40% КА в опытных центрах рекомендуется как альтернатива ИКД*** при условии достижения неиндуцируемости ЖТ и элиминации всех поздних и фрагментированных электрограмм миокарда желудочков [425, 426, 427].
40% КА в опытных центрах рекомендуется как альтернатива ИКД*** при условии достижения неиндуцируемости ЖТ и элиминации всех поздних и фрагментированных электрограмм миокарда желудочков [425, 426, 427].
ЕОК IIaC (УУР B, УДД 2)
Аневризма левого желудочка. Ишемическая кардиомиопатия. Хроническая сердечная недостаточность.
- Частота развития и тяжесть ЖА возрастают по мере утяжеления СН, однако прогностическое значение ЖА для оценки риска ВСС пока неясно. Оптимальная медикаментозная терапия иАПФ (или АРА при непереносимости иАПФ), бета-адреноблокаторами или антагонистами альдостерона рекомендована пациентам с ХСН и систолической дисфункцией ЛЖ (ФВ ЛЖ ![]() 35 - 40%) для снижения общей смертности и риска ВСС [171, 428, 429, 430, 431].
35 - 40%) для снижения общей смертности и риска ВСС [171, 428, 429, 430, 431].
УУР B, УДД 1
- Хирургическая реконструкция левого желудочка во время коронарного шунтирования рекомендована у пациентов с ХСН III - IV класса по NYHA, у пациентов с большой аневризмой ЛЖ, большим тромбом, эпизодами тромбоэмболии в анамнезе или в случае аритмии вследствие аневризмы [432, 433, 434, 435].
ЕОК IIaA (УУР B, УДД 2)
Комментарий. Цель хирургической реконструкции ЛЖ - удаление рубцовой ткани при помощи резекции эндокарда и эндовентрикулярной пластики с нормализацией формы и объема ЛЖ для улучшения диастолической и концентрической систолической функций, исключение зоны риентри, устранение ишемии миокарда, исправление дилатации кольца митрального клапана [431, 432, 433, 435].
Хирургическое лечение желудочковой тахикардии
К хирургическим методам лечения ЖА относятся аблация и резекция эндокарда. Хирургическая аблация может выполняться эндокардиально и эпикардиально радиочастотным током высокой частоты (радиочастотная абляция аритмогенных зон) или с помощью замораживания миокарда (криоабляция аритмогенных зон). Локализация зон ЖА должна быть выявлена с помощью ВСЭФИ до операции и уточнена при проведении картирования во время операции на открытом сердце.
- Хирургическая аблация в опытных центрах с обязательным электрофизиологическим контролем (индукцией) после операции, рекомендована пациентам с рефрактерной к терапии ЖТ, при неуспешной или невозможной попытке КА для купирования и профилактики рецидива ЖТ/ФЖ [5, 434, 435, 436].
ЕОК IB (УУР C, УДД 4)
- Эндокардэктомия во время хирургической реконструкции ЛЖ рекомендована пациентам с ЖТ на фоне постинфарктной аневризмы ЛЖ для купирования и профилактики рецидива ЖТ/ФЖ [434, 435, 436, 437, 438, 439]
ЕОК IIaA (УУР C, УДД 4)
Комментарий. Резекция эндокарда может быть выполнена и у пациентов с аневризмой ЛЖ без документированной ЖТ, поскольку риск развития ЖТ при наличии постинфарктной аневризмы ЛЖ составляет 50%.
- Имплантация ИКД*** рекомендована пациентам после операции хирургической реконструкции ЛЖ с индуцируемой ЖТ в раннем послеоперационном периоде для купирования эпизодов ЖТ/ФЖ после операции [433, 434, 439, 440].
ЕОК IIaB (УУР B, УДД 3)
Аномальное отхождение коронарных артерий
Аномальное отхождение коронарных артерий ассоциировано с повышенным риском ВСС, особенно у лиц моложе 35 лет в процессе или после интенсивных физических упражнений [440]. Факторами риска ВСС являются расположение коронарной артерии между аортой и легочной артерией, щелевидное устье, высокое устье, отхождение коронарной артерии под острым углом, интрамуральное расположение коронарной артерии и длина интрамурального хода [441].
Показаниями к хирургическому вмешательству, особенно у бессимптомных пациентов, являются наличие анатомического варианта высокого риска (визуализация с помощью КТ ангиографии) и ишемия миокарда (проба с физической нагрузкой) [441].
- Стресс-ЭХОКГ с физической нагрузкой рекомендована пациентам старше 18 лет с аномальным отхождением коронарной артерии в дополнение к кардиореспираторному тесту для подтверждения/исключения ишемии миокарда [36, 67, 69, 442].
ЕОК IC (УУР C, УДД 4)
- Стресс-ЭХОКГ с физической нагрузкой рекомендована пациентам старше 18 лет с аномальным отхождением коронарной артерии с остановкой сердца в анамнезе после хирургического лечения в дополнение к кардиореспираторному тесту [36, 67, 69, 442].
ЕОК IC (УУР C, УДД 4)
- Хирургическая коррекция аномалии коронарной артерии рекомендована пациентам с аномальным отхождением коронарной артерии с остановкой сердца, обмороком, предположительно вызванным ЖА, или со стенокардией, когда другие причины были исключены [440, 441, 442, 443, 444].
ЕОК IC (УУР C, УДД 4)
- Хирургическая коррекция аномалии коронарной артерии рекомендована у бессимптомных пациентов с аномальным отхождением коронарной артерии и признаками ишемии миокарда или аномальным отхождением левой коронарной артерии с анатомией высокого риска [440, 441, 442, 443].
ЕОК IIaC (УУР B, УДД 3)
3.3.3. Дилатационная кардиомиопатия
Дилатационная кардиомиопатия (ДКМП) характеризуется дилатацией ЛЖ и систолической дисфункцией, не связанной с ИБС и/или гемодинамической перегрузкой [444]. Причины ДКМП могут быть генетическими или приобретенными. Возможно также взаимодействие генетической предрасположенности и внешних факторов, такими как алкоголь, химиотерапия, родовой период. Фенотип ДКМП, в частности, при генетической этиологии, может изменяться со временем и может не соответствовать стандартным критериям заболевания в момент манифестации и постановки диагноза.
Основными причинами сердечно-сосудистой смертности при ДКМП являются прогрессирующая ХСН и ВСС на фоне ЖА или реже брадиаритмии. Показано, что 5-летняя смертность у пациентов с ДКМП при наличии СН на фоне ОМТ составляет 21 - 28%. ВСС встречается у 12% больных с ДКМП и составляет 25 - 35% всех смертей [225].
Стратификация риска и ведение пациентов с ДКМП
- Генетическое тестирование с определением мутаций, как минимум, в генах LMNA, PLN, RBM20, FLNC рекомендовано пациентам с ДКМП/НКМП в возрасте менее 50 лет при замедлении АВ проводимости или с семейным анамнезом ДКМП либо ВСС у родственников первой степени родства в возрасте моложе 50 лет [111, 445, 446, 450].
ЕОК IB УУР C, УДД 4
Комментарий. Ген LMNA кодирует ядерные ламиновые белки; ген PLN кодирует фосфоламбан; ген RBM20 кодирует белок RBM20, являющийся одним из активаторов сплайсинга; ген FLNC кодирует ламин С. Мутации в указанных генах сопряжены с высоким риском ЖА и ВСС, независимо от степени снижения ФВЛЖ.
- Генетическое тестирование с определением мутаций как минимум в генах LMNA, PLN, RBM20, FLNC рекомендовано для стратификации риска при спорадической ДКМП пациентам молодого возраста или с признаками заболевания, характерными для наследственной этиологии [111, 445, 446, 447, 448, 449, 450].
ЕОК IIaC (УУР B, УДД 2)
- Пациентам с кардиомиопатией неишемического генеза рекомендовано проведение МРТ с гадолинием (АТХ V08CA Парамагнитные контрастные средства) для возможного определения этиологии заболевания, риска ЖА и ВСС [451, 452, 453].
ЕОК IIaB (УУР C, УДД 5)
Комментарий. Позднее накопление гадолиния (АТХ V08CA Парамагнитные контрастные средства) в миокарде при МРТ ассоциировано с высоким риском ЖА и ВСС, в том числе при ФВ ЛЖ более 35%.
- Взрослым пациентам с ДКМП и синкопальными состояниями рекомендовано проведение ВСЭФИ, если после обследования с использованием неинвазивных методов диагностики причина обморока остается неясной [453, 454, 455].
ЕОК IIaC (УУР B, УДД 2)
Первичная профилактика ВСС у больных с ДКМП
- Пациентам старше 18 лет с ДКМП рекомендована оптимальная медикаментозная терапия (ОМТ) (иАПФ, бета-адреноблокаторы, антагонисты альдостерона, АРНИ, ингибиторы натрийзависимого переносчика глюкозы 2 типа) для уменьшения риска ВСС и прогрессирующей сердечной недостаточности [170, 454].
ЕОК IA (УУР C, УДД 5)
- Интенсивные физические нагрузки, включая участие в спортивных соревнованиях, не рекомендованы пациентам с ДКМП и мутацией в гене LMNA [463, 464].
ЕОК IIIC (УУР C, УДД 4)
- Не рекомендуется назначать #амиодарон** с целью подавления бессимптомной неустойчивой ЖТ пациентов с ДКМП [102, 193, 225, 256].
ЕОК IIIA (УУР B, УДД 2 - взрослые, УУР C, УДД 5 - дети)
- Не рекомендуется назначать ААП, класс 1, для лечения ЖА у взрослых пациентов с ДКМП [457, 458, 459, 460].
ЕОК IIIA (УУР B УДД 1)
- Имплантация ИКД*** рекомендована пациентам с ДКМП, симптомами ХСН (II - III функционального класса по NYHA) и ФВ ЛЖ ![]() 35% на фоне ОМТ
35% на фоне ОМТ ![]() 3 месяцев при ожидаемой продолжительности жизни > 1 года [177, 254, 257, 459, 460, 461].
3 месяцев при ожидаемой продолжительности жизни > 1 года [177, 254, 257, 459, 460, 461].
ЕОК IIaА (УУР В, УДД 3 для взрослых; УУР С, УДД 5 для детей)
- Имплантация ИКД*** рекомендована пациентам с ДКМП и подтвержденной патогенной мутацией LMNA с предполагаемым пятилетним риском возникновения жизнеугрожающих ЖА ![]() 10% и при наличии НУЖТ, или ФВ ЛЖ менее 50%, или нарушений АВ проводимости [46, 462, 463].
10% и при наличии НУЖТ, или ФВ ЛЖ менее 50%, или нарушений АВ проводимости [46, 462, 463].
ЕОК IIaВ (УУР С, УДД 5)
Комментарий. Мутации в гене LMNA ассоциированы с ранним развитием ЖА, нарушений проводимости, высоким риском ВСС и прогрессирующей ХСН. Для оценки пятилетнего риска жизнеугрожающих аритмий рекомендуется использовать калькулятор (не валидирован на российской популяции): https://lmna-riskvta.fr [46].
- Имплантация ИКД*** рекомендована пациентам с ДКМП и ФВ ЛЖ менее 50% и двумя или более факторами риска: обмороки, позднее накопления гадолиния в миокарде при МРТ, индуцируемая при программированной стимуляции УМЖТ, патогенные мутации в генах LMNA, PLN, FLNC и RBM20 [116, 170, 447, 449, 451, 463, 464, 465, 466, 467].
ЕОК IIaC (УУР C, УДД 5)
Вторичная профилактика ВСС у больных с ДКМП
- Имплантация ИКД*** рекомендована пациентам с ДКМП и анамнезом остановки кровообращения в следствие ФЖ или ЖТ, или при наличии ЖТ, сопровождающейся нарушениями гемодинамики [51, 111, 227, 245, 424, 469, 470].
ЕОК IB (УУР C, УДД 5)
- Имплантация ИКД*** рекомендована взрослым пациентам с ДКМП и устойчивой пароксизмальной ЖТ без гемодинамических расстройств [8].
ЕОК IIaC (УУР C, УДД 5)
- Пациентам старше 18 лет с ДКМП и ИКД с рецидивирующими симптомными пароксизмами ЖТ, сохраняющимися, несмотря на прием бета-адреноблокаторов и оптимальное программирование ИКД***, рекомендовано добавление к терапии амиодарона** или замена бета-адреноблокаторов на соталол** [8, 151, 192, 219, 245].
ЕОК IIaB (УУР C, УДД 5)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
- Пациентам с ДКМП и рецидивирующей симптомной УМЖТ или шоками ИКД*** для купирования мономорфной ЖТ в случае, если ААТ неэффективна, противопоказана или не переносится, рекомендовано проведение КА в опытных центрах [51, 182, 471, 472, 473].
ЕОК IIaC (УУР C, УДД 5)
3.3.4. Аритмогенная кардиомиопатия правого желудочка
Аритмогенная кардиомиопатия правого желудочка (АКПЖ) - наследственное заболевание, характеризующееся фиброзно-жировым замещением миокарда с характерными проявлениями в виде ЖА, ХСН и ВСС [474].
Стратификация риска и ведение пациентов с аритмогенной кардиомиопатией
- Пациентам с подозрением на АКПЖ рекомендовано проведение МРТ сердца [475, 476, 477, 478].
ЕОК IB (УУР B, УДД 3)
- Пациентам с предполагаемым или установленным диагнозом АКПЖ рекомендовано проведение генетического обследования [479, 480].
ЕОК IB (УУР C, УДД 4)
- Для стратификации риска ВСС у пациентов старше 18 лет с АКПЖ при наличии симптомов, подозрительных на ЖА, рекомендуется рассмотреть возможность проведения ВСЭФИ [481, 482].
ЕОК IIbC (УУР B, УДД 3)
- У родственников первой линии родства пациентов с АКПЖ рекомендовано выполнение ЭКГ и ЭХОКГ [8, 483, 740, 741].
ЕОК IC (УУР C, УДД 4)
Первичная профилактика внезапной сердечной смерти у больных с АКПЖ
- Пациентам с АКПЖ для профилактики ВСС рекомендовано воздерживаться от интенсивных физических нагрузок [483, 484, 485].
ЕОК IB (УУР B, УДД 3)
- Рекомендуется рассмотреть возможность ограничения физических нагрузок у носителей патогенных мутаций, связанных с АКПЖ, без фенотипических проявлений заболевания [484, 485, 486, 487].
ЕОК IIbC (УУР B, УДД 3)
- Пациентам с устойчивой ЖТ или НУЖТ рекомендована терапия бета-адреноблокаторами [488, 489, 490].
ЕОК IC (УУР C, УДД 3 для взрослых; УУР C, УДД 5 для детей)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря на отсутствие достаточной доказательной базы.
- Рекомендуется рассмотреть возможность терапии бета-адреноблокаторами у всех пациентов с установленным диагнозом АКПЖ [486, 487, 488, 491].
ЕОК IIbC (УУР C, УДД 5)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря на отсутствие достаточной доказательной базы.
- Имплантация ИКД*** рекомендована пациентам с установленным диагнозом АКПЖ и аритмическими обмороками [488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498].
ЕОК IIaB (УУР B, УДД 3)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря на отсутствие достаточной доказательной базы.
- Имплантация ИКД*** рекомендована пациентам с установленным диагнозом АКПЖ и тяжелой систолической дисфункцией правого или левого желудочка [111, 481, 493, 495, 498].
ЕОК IIaC (УУР B, УДД 3)
Комментарий. Под тяжелой систолической дисфункцией ПЖ понимают изменение фракционной площади FAC (fractional area change) ![]() 17% или снижение фракции выброса ПЖ (ФВ ПЖ)
17% или снижение фракции выброса ПЖ (ФВ ПЖ) ![]() 35%, под тяжелой систолической дисфункцией ЛЖ - ФВ ЛЖ
35%, под тяжелой систолической дисфункцией ЛЖ - ФВ ЛЖ ![]() 35%.
35%.
- Имплантация ИКД*** рекомендована пациентам с установленным диагнозом АКПЖ с наличием симптомов, умеренной систолической дисфункцией ПЖ (ФВ ПЖ ![]() 40%) или ЛЖ (ФВ ЛЖ
40%) или ЛЖ (ФВ ЛЖ ![]() 45%) в сочетании с НУЖТ либо с устойчивой ЖТ, индуцированной при ВСЭФИ [111, 482, 493, 498].
45%) в сочетании с НУЖТ либо с устойчивой ЖТ, индуцированной при ВСЭФИ [111, 482, 493, 498].
ЕОК IIaC (УУР B, УДД 3)
Вторичная профилактика ВСС у больных с АКПЖ
- Имплантация ИКД*** рекомендована пациентам с ФЖ или ЖТ, сопровождающейся гемодинамическими нарушениями [51, 495, 496, 498].
ЕОК IC (УУР C, УДД 4)
- Имплантация ИКД*** рекомендована пациентам с АКПЖ и устойчивой ЖТ, протекающей без гемодинамических расстройств [111, 496, 498].
ЕОК IIaC (УУР C, УДД 4)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря на отсутствие достаточной доказательной базы.
- Пациентам с АКПЖ с показаниями к ИКД-терапии*** рекомендована имплантация устройств с возможностью программирования антитахикардитической стимуляции желудочков с целью купирования пароксизмов ЖТ и минимизации количества шоков [8, 498].
ЕОК IIaB (УУР C, УДД 5)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря на отсутствие достаточной доказательной базы.
- Пациентам с АКПЖ и рецидивирующей симптомной УМЖТ или шоками ИКД*** вследствие ЖТ, несмотря на прием бета-адреноблокаторов, рекомендовано выполнение КА в опытном центре [51, 491, 499, 500, 501, 502].
ЕОК IIaC (УУР C, УДД 5)
- Пациентам с АКПЖ и рецидивирующими симптомными пароксизмами ЖТ при неэффективности бета-адреноблокаторов рекомендовано назначение лекарственных препаратов для купирования нарушений ритма сердца [478, 488, 491, 500].
ЕОК IIaC (УУР C, УДД 4 - взрослые, УУР C, УДД 5 - дети)
Комментарий. Лекарственные средства для лечения аритмий при АКПЖ имеют ограниченную эффективность. Целесообразно применение #амиодарона, который в единичных исследованиях продемонстрировал более высокую эффективность по сравнению с соталолом** (** у взрослых пациентов) [12, 17, 491, 500]. Эффективность ААП, класс I, зарегистрированных в Российской Федерации, у пациентов с АКПЖ не изучена.
3.3.5. Гипертрофическая кардиомиопатия
Смерть от аритмии и частота обоснованных срабатываний ИКД в связи с ЖТА в общей популяции пациентов с ГКМП составляет 1 - 2% и 0,8% в год, соответственно [498]. ВСС преобладает как причина смерти у пациентов в возрасте моложе 60 лет, тогда как в старшей возрастной группе основное значение имеют инсульты и ХСН [501, 502, 503, 504, 505, 506]. Калькулятор риска ВСС в течение 5 лет (HCM risk-SCD) представлен по ссылке: http://doc2do.com/hcm/webHCM.html (Приложение Г3) [507].
Стратификация риска и ведение пациентов с ГКМП
- Пациентам с ГКМП рекомендовано проведение МРТ сердца с гадолинием (АТХ V08CA Парамагнитные контрастные средства) с целью дополнительной стратификации риска ВСС [508, 509, 510].
ЕОК IB (УУР C, УДД 4)
Комментарий. Накопление парамагнитного контрастного средства ![]() 15% от массы миокарда ЛЖ является предиктором ВСС у взрослых.
15% от массы миокарда ЛЖ является предиктором ВСС у взрослых.
- Пациентам с ГКМП рекомендовано проведение генетического обследования и прием (осмотр, консультация) врача-генетика первичный [503, 511, 512, 513, 514, 515, 516, 517].
ЕОК IB (УУР C, УДД 5)
Комментарий. Одна или множественные саркомерные мутации являются дополнительным фактором риска ВСС.
- Пациентам с ГКМП ввиду высокого риска ВСС не рекомендуется участие в соревновательных видах спорта [503, 518, 519].
ЕОК IC (УУР C, УДД 5)
Комментарий. Под соревновательными видами спорта подразумевают любительскую или профессиональную спортивную деятельность на регулярной основе с участием в организованных соревнованиях.
- У родственников первой линии родства пациентов с ГКМП рекомендованы регистрация ЭКГ и ЭХОКГ [29, 740, 741].
ЕОК IC (УУР C, УДД 4)
- Пятилетний риск внезапной смерти рекомендуется оценивать при первоначальном обследовании пациента, а также каждые 1 - 3 года или при изменении клинического статуса [8].
ЕОК IC (УУР C, УДД 5)
Первичная профилактика ВСС у больных с ГКМП
Расчет риска ВСС в течение 5 лет, предлагаемый ЕОК (HCM risk-SCD), представлен в Приложении Г3 (ссылка: http://doc2do.com/hcm/webHCM.html) (не валидирован на российской популяции); результат оценивается в % вероятности ВСС [507].
- Имплантация ИКД*** рекомендована пациентам с ГКМП при расчетном пятилетнем риске ВСС ![]() 6% [507, 520, 521, 522, 523].
6% [507, 520, 521, 522, 523].
ЕОК IIaB (УУР C, УДД 4)
- Имплантация ИКД*** рекомендована пациентам с ГКМП в возрасте ![]() 16 лет при расчетном пятилетнем риске ВСС от
16 лет при расчетном пятилетнем риске ВСС от ![]() 4 до < 6% и при наличии как минимум одного из следующих факторов риска:
4 до < 6% и при наличии как минимум одного из следующих факторов риска:
а) значительное накопление парамагнитного контрастного средства в миокарде при МРТ сердца (![]() 15% от массы ЛЖ);
15% от массы ЛЖ);
б) ФВ ЛЖ менее 50%;
в) аномальная реакция АД при выполнении пробы с физической нагрузкой (прирост АД на пике нагрузки менее 20 мм рт. ст. или снижение более 20 мм рт. ст.);
г) верхушечная аневризма ЛЖ;
д) наличие патогенной саркомерной мутации [512, 513, 515, 524, 525, 526, 527].
ЕОК IIaB (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность имплантации ИКД*** пациентам с ГКМП в возрасте ![]() 16 лет при расчетном пятилетнем риске ВСС от
16 лет при расчетном пятилетнем риске ВСС от ![]() 4 до < 6% [507, 511, 528].
4 до < 6% [507, 511, 528].
ЕОК IIbB (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность имплантации ИКД*** пациентам с ГКМП в возрасте ![]() 16 лет при расчетном пятилетнем риске ВСС от < 4% при наличии как минимум одного из следующих факторов риска:
16 лет при расчетном пятилетнем риске ВСС от < 4% при наличии как минимум одного из следующих факторов риска:
а) значительное накопление парамагнитного контрастного средства в миокарде при МРТ сердца (![]() 15% от массы ЛЖ);
15% от массы ЛЖ);
б) ФВ ЛЖ менее 50%;
в) верхушечная аневризма ЛЖ [512, 513, 515, 524, 525, 526, 527].
ЕОК IIbB (УУР C, УДД 4)
Вторичная профилактика ВСС у больных с ГКМП
- Имплантация ИКД*** рекомендована пациентам с ГКМП со спонтанной устойчивой ЖТ, протекающей с нарушением гемодинамики, или устойчивой ФЖ [111, 528, 529, 530, 531].
ЕОК IB (УУР C, УДД 4)
- Имплантация ИКД*** рекомендована пациентам с ГКМП со спонтанной устойчивой ЖТ, протекающей без нарушений гемодинамики [8].
ЕОК IIaC (УУР C, УДД 5)
- Пациентам с ГКМП и рецидивирующей симптомной ЖТА или повторными шоками ИКД *** вследствие ЖТ/ФЖ рекомендовано назначение ААТ [8].
ЕОК IIaC (УУР C, УДД 5)
Комментарий. В нерандомизированных исследованиях продемонстрирована эффективность амиодарона** в подавлении ЖТА у взрослых пациентов с ГКМП [529, 530]. Бета-адреноблокаторы также могут быть использованы с антиаритмической целью у данной группы пациентов, учитывая их благоприятное влияние на симптомы и снижение обструкции в ВТЛЖ [6, 505]. Вместе с тем отсутствуют доказательства влияния ААТ на снижение риска ВСС.
- Рекомендуется рассмотреть возможность выполнения КА в опытном центре пациентам старше 18 лет с ГКМП и рецидивирующей симптомной УМЖТ при неэффективности, непереносимости или противопоказаниях к приему ААП [531, 532].
ЕОК IIbC (УУР C, УДД 4)
- У детей в возрасте до 16 лет с ГКМП и предполагаемым 5-летним риском ВСС ![]() 6% (на основе оценки HCM Risk-Kids) следует рассмотреть вопрос об имплантации ИКД*** [520] (Приложение Г4).
6% (на основе оценки HCM Risk-Kids) следует рассмотреть вопрос об имплантации ИКД*** [520] (Приложение Г4).
ЕОК IIaB (УУР C, УДД 4)
Комментарий: До недавнего времени у детей с ГКМП было мало данных о первичной профилактике ВСС. К настоящему времени разработана шкала и калькулятор риска ВСС, включающие оценку таких факторов, как необъяснимый обморок, максимальная толщина стенки ЛЖ, значимое увеличение левого предсердия, градиент давления в ВТЛЖ и НУЖТ. В отличие от взрослых, возраст и семейный анамнез ВСС не улучшали показатели прогностической ценности модели у детей. Калькулятор риска ВСС у детей 1 - 16 лет с ГКМП представлен по ссылке (валидирован на внешних данных, но не проходил валидацию на российской популяции): https://hcmriskkids.org
3.3.6. Рестриктивная кардиомиопатия
- Имплантация ИКД*** рекомендована пациентам с транстиретиновым (TTR) амилоидозом или амилоидозом легких цепей (AL) при наличии пароксизмальных ЖТА, протекающих с нарушением гемодинамики, после обсуждения рисков ВСС, неаритмической сердечно-сосудистой и некардиальной смерти [8, 533].
EОК IIaC (УУР C, УДД 5)
3.3.7. Нейромышечные заболевания
Аритмии часто встречаются при нейромышечных заболеваниях и могут быть первым проявлением заболевания. Миотоническая дистрофия и дистрофия Дюшенна наиболее распространены, при этом большинство пациентов умирают в возрасте до 20 лет. При большинстве нейромышечных заболеваний встречаются нарушения проводимости и ритма сердца.
Имплантация электрокардиостимулятора*** может быть предпочтительной у пациентов с синдромами Кернса-Сейра, Эмери-Дрейффуса или поясно-конечностной мышечной дистрофией с любой степенью АВ блокады, поскольку у них имеется значительный риск быстрого прогрессирования до полной АВ блокады [534].
Имплантация ИКД***, а не электрокардиостимулятора***, может быть предпочтительней у пациентов с болезнью Дюшенна/Беккера, когда на МРТ имеется значительное позднее контрастирование гадолинием (АТХ V08CA Парамагнитные контрастные средства). Польза от имплантации ИКД*** должна быть сбалансирована с общим прогнозом для некоторых подтипов заболеваний, таких как дистрофия Дюшенна.
- Пациентам с мышечными дистрофиями рекомендуется ежегодное динамическое наблюдение с регистрацией ЭКГ не менее чем в 12 отведениях, даже в скрытой фазе заболевания [535, 536, 537, 538, 740].
ЕОК IC (УУР C, УДД 4)
- Взрослым пациентам с нейромышечными расстройствами и ЖА или дисфункцией ЛЖ рекомендуется лечение аритмий так же, как и у пациентов без нейромышечных заболеваний [539, 540].
ЕОК IC (УУР C, УДД 4)
- ВСЭФИ рекомендуется пациентам старше 18 лет с миотонической дистрофией и приступами сердцебиения или обмороками, свидетельствующими о ЖА, а также пациентам после ВОС [541].
ЕОК IC (УУР C, УДД 4)
- Имплантация ИКД*** рекомендуется пациентам старше 18 лет с миотонической дистрофией и УМЖТ или купированной ВОС, не вызванной ЖТ в виде риентри с участием ножек пучка Гиса [542, 543].
ЕОК IC (УУР C, УДД 4)
- ВСЭФИ рекомендуется пациентам старше 18 лет с миотонической дистрофией и внезапным удлинением интервала PR или расширением комплекса QRS [483, 543, 544].
ЕОК IIaB (УУР C, УДД 4)
- ВСЭФИ рекомендуется пациентам старше 18 лет с миотонической дистрофией и интервалом PR ![]() 240 мс или продолжительностью QRS
240 мс или продолжительностью QRS ![]() 120 мс, а также пациентам старше 40 лет с наджелудочковой аритмией или старше 40 лет со значительным поздним контрастированием гадолинием по данным МРТ [543, 544].
120 мс, а также пациентам старше 40 лет с наджелудочковой аритмией или старше 40 лет со значительным поздним контрастированием гадолинием по данным МРТ [543, 544].
ЕОК IIaB (УУР C, УДД 4)
- Пациентам старше 18 лет с миотонической дистрофией без замедления АВ проведения и обмороков, предположительно ассоциированных с ЖА, рекомендуется имплантация ИКД*** [543, 544, 545].
ЕОК IIaC (УУР C, УДД 5)
- Пациентам с миотонической дистрофией и приступами сердцебиения, крайне подозрительного на ЖА, и индукцией ЖТ без участия ножек пучка Гиса рекомендуется имплантация ИКД*** [543, 544, 545].
ЕОК IIaC (УУР C, УДД 5)
- Пациентам с поясно-конечностной мышечной дистрофией типа 1В или Эмери-Дрейфуса и показанием к кардиостимуляции рекомендуется имплантация ИКД*** [542, 545].
ЕОК IIaC (УУР C, УДД 5)
- Рекомендуется рассмотреть возможность имплантации ИКД*** у пациентов с мышечной дистрофией Дюшенна/Беккера и значительным поздним контрастированием гадолинием (АТХ V08CA Парамагнитные контрастные средства) при МРТ сердца [537, 538, 543].
ЕОК IIbC (УУР C, УДД 5)
- Рекомендуется рассмотреть возможность имплантации ИКД*** вместо постоянного ЭКС у пациентов с миотонической дистрофией с дополнительными факторами риска ЖА и ВСС [538, 539, 540, 541, 543].
ЕОК IIbC (УУР C, УДД 4)
- Повторная оценка АВ проводимости и индукции ЖА с помощью ВСЭФИ не рекомендуется у пациентов старше 18 лет с миотонической дистрофией без подозрения на аритмию или прогрессирование нарушений проводимости [541].
ЕОК IIIC (УУР C, УДД 4)
- Пациентам старше 18 лет с симптомной ЖТ с участием ножек пучка Гиса рекомендуется проведение КА [540, 543].
ЕОК IC (УУР C, УДД 4)
- Пациентам с миотонической дистрофией старше 18 лет, которым выполняется аблация ЖТ с участием ножек пучка Гиса, рекомендуется имплантация кардиостимулятора*** [540, 543].
ЕОК IC (УУР C, УДД 4)
3.3.8. Миокардит
- Пациентов с подтвержденным острым миокардитом или при подозрении на острый миокардит с жизнеопасными ЖА рекомендуется направлять в медицинское учреждение с соответствующими компетенциями и опытом лечения подобных пациентов [8, 546].
ЕОК IC (УУР C, УДД 5)
- Пациентам с гемодинамически значимой УМЖТ, возникающей в хронической фазе миокардита, рекомендуется имплантация ИКД*** [8, 111, 547].
ЕОК IC (УУР C, УДД 5)
- У пациентов с ЖТ или ФЖ, сопровождающимися нестабильной гемодинамической, на фоне острой фазы миокардита рекомендуется рассмотреть возможность имплантации ИКД*** до выписки из стационара [8, 111, 547].
ЕОК IIaC (УУР C, УДД 5)
- Пациентам старше 18 лет с симптомной неустойчивой или устойчивой ЖА в острой фазе миокардита рекомендуется ААТ (предпочтительно амиодарон** и бета-адреноблокаторы) [8].
ЕОК IIaC (УУР C, УДД 5)
- Пациентам старше 18 лет с рецидивирующей симптомной ЖТ, перенесшим миокардит, рекомендуется ААТ [8].
ЕОК IIaC (УУР C, УДД 5)
- У пациентов после миокардита с симптомной рецидивирующей УМЖТ или шоками ИКД*** для купирования УМЖТ, когда неэффективны, непереносимы или нежелательны ААП, рекомендуется КА в опытных центрах [8, 51].
ЕОК IIaC (УУР C, УДД 5)
- У пациентов с хроническим миокардитом и гемодинамически значимой УМЖТ рекомендуется имплантация ИКД*** [8, 111, 548].
ЕОК IIaC (УУР C, УДД 5)
- У пациентов старше 18 лет с гемодинамически малозначимой УМЖТ, возникающей в хронической фазе миокардита, при сохранной функции ЛЖ и наличии ограниченного рубца, рекомендуется рассмотреть возможность КА как альтернативы имплантации ИКД***, при условии обсуждения данной тактики с пациентом, а также достижения неиндуцируемости ЖТ и элиминации локальных электрограмм, характеризующих замедление проведения, в конце процедуры абляции [8, 548].
ЕОК IIbC (УУР C, УДД 4)
3.3.9. Саркоидоз
Проявления поражения сердца встречаются примерно у 5% пациентов с саркоидозом. Обычно саркоидоз сердца манифестирует в трех формах: дисфункция ЛЖ, нарушения АВ проведения и ЖНР. Терапия глюкокортикоидами является основой лечения саркоидоза сердца, но ее эффект на ЖНР описан только в наблюдательных исследованиях.
- Пациентам старше 18 лет с саркоидозом сердца рекомендуется имплантация ИКД*** при ФВ ЛЖ < 35% [8, 549].
ЕОК IB (УДД 5, УУР 4)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
- Пациентам старше 18 лет с саркоидозом сердца и показаниями к кардиостимуляции вследствие АВ блокады 2 - 3 степени рекомендуется имплантация ИКД*** независимо от ФВ ЛЖ [8, 550].
ЕОК IIaC (УУР C, УДД 4)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
- Пациентам старше 18 лет с саркоидозом сердца, ФВ ЛЖ > 35%, но значимым накоплением контрастного средства по данным МРТ, рекомендуется имплантация ИКД*** после разрешения активной фазы воспаления [8, 551].
ЕОК IIaB (УУР C, УДД 4)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
- Пациентам старше 18 лет с саркоидозом сердца, ФВ ЛЖ 35 - 50% и незначимым накоплением контрастного средства по данным МРТ, после разрешения активной фазы воспаления, рекомендовано ВСЭФИ с целью попытки индукции ЖТ и стратификации риска [8, 551].
ЕОК IIaC (УУР C, УДД 4)
- Пациентам старше 18 лет с саркоидозом сердца, ФВ ЛЖ 35 - 50% и индуцированной мономорфной ЖТ рекомендуется имплантация ИКД*** [8, 552].
ЕОК IIaC (УУР C, УДД 4)
3.3.10. Болезнь Лайма и болезнь Чагаса
Болезнь Лайма (боррелиоз) - инфекционное заболевание, вызываемое спирохетой Borrelia burgdorferi. Переносчиками являются иксодовые клещи. Наряду с кожными проявлениями, воспалительным поражением нервной системы и суставов, в патологический процесс могут вовлекаться миокард и перикард. Характерными являются нарушения проводимости вплоть до полной АВ блокады, описаны жизнеопасные ЖА [553, 554, 555, 556]. Лечение жизнеопасных ЖА при миокардите описано в разделе 3.3.8, что актуально и при болезни Лайма.
Болезнь Чагаса (Шагаса) - инфекционное паразитарное заболевание, вызываемое Trypanosoma cruzi. Переносчиками являются триатомовые клопы. Распространена в Южной и Центральной Америке. Поражаются в основном желудочно-кишечный тракт и сердце. В острую фазу заболевания поражение сердца представляет собой острый миокардит, в хроническую формируется кардиомиопатия с ХСН. Для заболевания характерны как нарушения проводимости, вплоть до полной АВ блокады, так и жизнеопасные ЖА. Имплантация ИКД*** может быть оправдана для вторичной профилактики ВСС у пациентов с болезнью Чагаса, однако существуют противоречивые исследования о преимуществах и рисках применения ИКД*** у этих пациентов.
- У пациентов старше 18 лет с болезнью Чагаса рекомендуется назначение амиодарона** для снижения эпизодов аритмии при наличии симптомных ЖЭ или ЖТ [557].
ЕОК IIaC (УУР B, УДД 3)
- У пациентов старше 18 лет с болезнью Чагаса и рецидивирующей симптомной УМЖТ или шоками ИКД*** при мономорфной ЖТ, у которых ААТ неэффективна, противопоказана или не переносится, рекомендуется КА в опытных центрах [558].
ЕОК IIaC (УУР C, УДД 4)
- У пациентов старше 18 лет с болезнью Чагаса и симптомной ЖТ, когда неэффективна или непереносима ААТ (амиодарон** и бета-адреноблокаторы), рекомендуется рассмотреть возможность имплантации ИКД*** [559].
ЕОК IIbC (УУР B, УДД 2)
3.3.11. Патология клапанов сердца
Клапанные пороки сердца предрасполагают к ВСС как в предоперационном периоде, так и после операций на клапанах. Пациенты с поражением клапанов сердца и остаточной дисфункцией ЛЖ после операции на клапане, которым был установлен ИКД*** для первичной профилактики ВСС, с учетом индивидуальных особенностей, имеют такую же частоту смерти и частоту срабатывания ИКД***, как и пациенты после ИМ и с ДКМП.
- ВСЭФИ и КА рекомендуется у пациентов старше 18 лет с патологией аортального клапана и УМЖТ с целью выявления и абляции ЖТ, вовлекающей ножки пучка Гиса, особенно при возникновении ЖТ после коррекции аортального порока [560].
ЕОК IC (УДД 4, УУР C)
- Пациентам старше 18 лет с поражением клапанов сердца и дисфункцией ЛЖ, в том числе после хирургической коррекции, рекомендуется имплантация ИКД*** с целью первичной профилактики ВСС аналогично показаниям при ДКМП [111, 561].
ЕОК IC (УДД 4, УУР C)
3.3.12. Идиопатическая фибрилляция желудочков
Диагноз идиопатической ФЖ выставляется у перенесших ВСС, предпочтительно с подтвержденной ФЖ, после исключения структурной, метаболической, токсикологической этиологии и каналопатий. Дополнительную информацию дает клиническое обследование (анамнез, регистрация ЭКГ и ЭКГ в высоких прекордиальных отведениях, тест с физической нагрузкой, ЭХОКГ) родственников первой степени родства пациентов с идиопатической ФЖ. Пациентам оправдано проведение генетического тестирования для выявления мутаций генов, ассоциированных с каналопатиями и кардиомиопатиями.
- Имплантация ИКД*** рекомендована при идиопатической ФЖ у пациентов старше 18 лет [8, 111].
ЕОК IB (УДД 5, УУР C)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
- Пациентам старше 18 лет при рецидивирующих эпизодах ФЖ, индуцируемых повторяющимися сходными между собой по морфологии ЖЭ, рефрактерными к медикаментозной терапии, рекомендована КА опытными специалистами [8].
ЕОК IIaC (УУР C, УДД 5)
3.3.13. Синдром удлиненного интервала QT (в т.ч. приобретенный)
Средний возраст манифестации клинических проявлений - 14 лет. Годовой показатель ВСС у пациентов с нелеченным СУИQT составляет от 0,3 до 0,9%, тогда как синкопе возникают у 5% в год [363]. Были выявлены мутации в 17 генах, ассоциированные с СУИQT, большинство из которых кодируют субъединицы электрически активируемых ионных каналов: калиевых, натриевых или кальциевых. Генетический скрининг выявляет патологические мутации в 75% случаев СУИQT в трех основных генах (KCNQ1, KCNH2 и SCN5A - типы СУИQT 1, 2 и 3 соответственно), что составляет 90% положительно генотипированных случаев.
Выделяют следующие подтипы СУИQT:
1. Аутосомно-доминантный СУИQT (распространенность 1 случай на 2500) без внесердечных проявлений.
2. Аутосомно-доминантные СУИQT с внесердечными проявлениями, включающие:
а) синдром Андерсена-Тавила, который все чаще рассматривается как самостоятельное заболевание [573, 574, 575].
б) синдром Тимоти, характеризующийся удлинением интервала QT, синдактилией, пороками развития сердца, расстройством аутистического спектра и дисморфизмом [565].
3. Аутосомно-рецессивный СУИQT (синдром Джервелла-Ланге-Нильсена), сочетающий экстремальное удлинение интервала QT с врожденной глухотой [566].
Группа экспертов ЕОК, разрабатывающая клинические рекомендации по лечению ЖА 2022 г., подтвердила диагностические критерии для установления клинического диагноза СУИQT [8]: QTc ![]() 480 мс или наличие > 3 баллов по шкале оценки риска для СУИQT (Приложение Г1) [567]. При наличии аритмогенного обморока или сердечного ареста QTc
480 мс или наличие > 3 баллов по шкале оценки риска для СУИQT (Приложение Г1) [567]. При наличии аритмогенного обморока или сердечного ареста QTc ![]() 460 мс достаточно для постановки диагноза СУИQT.
460 мс достаточно для постановки диагноза СУИQT.
Стратификация индивидуального риска осуществляется с учетом клинических, ЭКГ- и генетических параметров [567, 568]. К профилактическому применению ИКД*** следует подходить индивидуально у всех пациентов группы высокого риска, в частности у женщин с генотипом СУИQT 2 типа и QTc > 500 мс, у пациентов с QTc > 500 мс и признаками электрической нестабильности, а также у пациентов с генетическим профилем высокого риска (синдрома Тимоти, синдрома Джервелла-Ланге-Нильсена, носительство двух и более мутаций). Надо также учитывать, что тяжесть фенотипа может определяться не только каузативной мутацией, но и всем генетическим ландшафтом.
На сегодняшний день нет данных, свидетельствующих о прогностической значимости ВСЭФИ с ПСЖ у пациентов с СУИQT [53].
- Следующие мероприятия по коррекции образа жизни рекомендованы всем пациентам с диагностированным синдромом удлиненного интервала QT:
a. Избегать приема медикаментов, способствующих удлинению интервала QT (перечень на сайте www.crediblemeds.org).
b. Корректировать нарушения электролитного баланса (гипокалиемию, гипомагниемию, гипокальциемию), которые могут развиваться на фоне диареи, рвоты или метаболических нарушений.
c. Избегать специфических триггеров аритмии (активное плавание, особенно при 1-м типе СУИQT, и воздействие громких звуков при 2-м типе заболевания) [569, 570].
УУР C, УДД 4
- Выявление и устранение причин удлинения интервала QT (прежде всего отмена любых лекарственных средств, способных удлинять интервал QT, если таковые применяются, коррекция электролитных нарушений, устранение брадикардии) рекомендовано пациентам с полиморфной ЖТ типа "пируэт" [53, 568, 571, 572, 573].
ЕОК IIaC (УУР C, УДД 4)
- Пациентам с СУИQT для профилактики ВСС рекомендован прием бета-адреноблокаторов [8, 569, 570, 573].
ЕОК IB (УУР C, УДД 4)
Комментарий. Предпочтение отдается неселективным бета-адреноблокаторам (пропранолол**) [8, 574].
- Назначение бета-адреноблокаторов для профилактики ВСС рекомендовано у носителей генетической мутации СУИQT с нормальным QT-интервалом [573, 575, 576, 577].
ЕОК IIaB (УУР B, УДД 2)
- Взрослым пациентам с врожденным СУИQT 3-го типа и выраженным удлинением интервала QT рекомендуется рассмотреть назначение #ранолазина (АТХ C01EB Другие препараты для лечения заболеваний сердца) в дополнение к бета-адреноблокаторам для предупреждения рецидивов ЖТ и внезапной смерти при условии, что во время острого лекарственного теста с этим препаратом интервал QTс укорачивается более чем на 40 мс [8, 101, 578, 579, 580, 581, 582, 583].
РКО IIaC (УУР C, УДД 3)
- Взрослым пациентам с врожденным СУИQT 3-го типа и выраженным удлинением интервала QT рекомендуется рассмотреть назначение блокатора натриевых каналов (АТХ C01BC Антиаритмические препараты, класс IC) #флекаинида в дополнение к бета-адреноблокаторам для предупреждения рецидивов ЖТ и внезапной смерти при условии, что во время острого лекарственного теста с этим препаратом интервал QTс укорачивается более чем на 40 мс [8, 101, 579, 580, 581, 582, 583, 584, 585].
РКО IIaC (УУР C, УДД 4)
Комментарий: дозы для взрослых указаны в Приложении А3, таблицы А3.2 и А3.4.
- Временная электрокардиостимуляция с частотой 100 и более в минуту рекомендуется пациентам старше 18 лет для укорочения интервала QT и предупреждения рецидивов полиморфной ЖТ типа "пируэт" при отсутствии эффекта от введения магния сульфата** [586, 587].
ЕОК IC (УУР C, УДД 4)
- С целью купирования полиморфной ЖТ типа "пируэт" применение ААП, класс IA и ААП, класс III, не рекомендовано [52, 102].
ЕОК IIIC (УУР C, УДД 4 - взрослые, УУР C, УДД 5 - дети)
Комментарий. У детей целесообразно придерживаться такого же подхода, несмотря не отсутствие достаточной доказательной базы.
- В/в введение #магния сульфата** рекомендовано для предупреждения рецидивов полиморфной ЖТ типа "пируэт" [52, 102].
ЕОК IC (УУР C, УДД 4 для взрослых; УУР C, УДД 5 для детей)
Комментарий. Введение #магния сульфата** нередко оказывается эффективным, в том числе и у пациентов с исходно нормальным уровнем магния в крови. Дозы для взрослых и детей указаны в Приложении А3, таблицы А3.2 и А3.4.
- Имплантация ИКД*** в сочетании с приемом бета-адреноблокаторов рекомендована пациентам с СУИQT, пережившим остановку сердца [8, 111, 588].
ЕОК IB (УУР C, УДД 4)
- Имплантация ИКД*** в сочетании с приемом бета-адреноблокаторов рекомендована пациентам с СУИQT и синкопальными состояниями и/или ЖТ на фоне приема адекватной дозы бета-адреноблокаторов [8, 111, 588].
ЕОК IIaC (УУР C, УДД 4)
- Выполнение грудной левосторонней симпатической денервации сердца рекомендовано у симптомных пациентов с СУИQT в следующих случаях:
a. Прием бета-адреноблокаторов неэффективен, плохо переносится, либо имеются противопоказания.
b. ИКД***-терапия противопоказана или имеется отказ пациента.
c. Пациенты с имплантированным ИКД*** на фоне приема бета-адреноблокаторов продолжают испытывать множественные шоки ИКД*** [163, 361, 589, 590, 591].
ЕОК IIaC (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность имплантации ИКД*** в дополнение к терапии бета-адреноблокаторами у асимптомных носителей патологической мутации в генах KCNH2 или SCN5A при увеличении QTc > 500 мс [569, 570].
ЕОК IIbC (УУР C, УДД 4)
3.3.14. Синдром короткого интервала QT (СКИQT)
Синдром характеризуется уменьшением продолжительности потенциала действия кардиомиоцитов как предсердий, так и желудочков, уменьшением эффективного рефрактерного периода предсердий и желудочков, вследствие чего создает условиядля развития жизнеугрожающих аритмий по механизму риентри. Идентифицированы пять генов, связанных с СКИQT: KCNH2, KCNQ1, KCNJ2, CACNA1C и CACNB2b. Но положительный результат генетического скрининга остается невысоким (всего 20%). Заболевание является летальным во всех возрастных группах, включая детей в первые месяцы жизни, и вероятность первой остановки сердца к возрасту 40 лет составляет 40%. Весьма вероятно, что СКИQT является недодиагностированным состоянием в общей популяции. Диагноз у взрослых устанавливается по критериям, предложенным Gollob M. с соавт. [592] (Приложение Г2).
У детей и подростков до 20 лет уточненными критериями СКИQT являются значения QTc < 316 мс, корригированного J-Tpeak < 181 мс и наличие ранней реполяризации желудочков [593].
Показания к применению ИКД*** в каждом случае рассматривают индивидуально, учитывая семейный анамнез и наличие укороченного QTc, однако для общих рекомендаций на данный момент данных недостаточно [594, 595].
На сегодняшний день нет данных о том, что ПСЖ позволяет прогнозировать аритмические события у пациентов с СКИQT.
- Имплантация ИКД*** для профилактики ВСС рекомендована пациентам с СКИQT, которые:
a. Пережили остановку сердца и/или
b. Имеют документированную спонтанную устойчивую ЖТ [594, 595, 596, 597, 597].
ЕОК IC (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность назначения соталола** для профилактики ВСС у пациентов cтарше 18 лет с диагностированным СКИQT, имеющих показания к ИКД***-терапии, в случае, когда ИКД*** противопоказан или пациент отказался от устройства [594, 595].
ЕОК IIbC (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность назначения соталола** для профилактики ВСС у асимптомных пациентов старше 18 лет с диагностированным СКИQT и семейным анамнезом ВСС [101, 594, 595].
ЕОК IIbC (УУР C, УДД 4)
Комментарий. Дозы препарата для взрослых и детей указаны в Приложении А3, таблицах А3.1 и А3.3
3.3.15. Синдром Бругада
Синдром Бругада - каналопатия с доминантным наследованием и различной пенетрантностью, зависимой от возраста и пола: клинические проявления заболевания, встречаются чаще у взрослых и в 8 раз чаще у мужчин, чем у женщин. ФЖ встречается в среднем возрасте (пик манифестации приходится на 40 лет), но может возникать в любом возрасте, обычно во время отдыха или сна.
Психотропные средства (АТХ Н05), некоторые ААП, анестетики, кокаин, чрезмерное употребление алкоголя и лихорадка являются потенциальными триггерами появления бругада-подобного паттерна ЭКГ 1 типа и запуска ФЖ. Синдром Бругада диагностируется у пациентов с подъемом сегмента ST с морфологией 1-го типа ![]() 2 мм в одном или нескольких правых прекордиальных отведениях V1 и/или V2, расположенных во втором, третьем или четвертом межреберье, возникающих либо спонтанно, либо после провокационного лекарственного теста с в/в введением антиаритмического препарата, класс IA (такого как прокаинамид**), или при регистрации ЭКГ в верхних прекордиальных отведениях (межреберных промежутках на 1 - 2 ребра выше положений электродов в V1 и V2.
2 мм в одном или нескольких правых прекордиальных отведениях V1 и/или V2, расположенных во втором, третьем или четвертом межреберье, возникающих либо спонтанно, либо после провокационного лекарственного теста с в/в введением антиаритмического препарата, класс IA (такого как прокаинамид**), или при регистрации ЭКГ в верхних прекордиальных отведениях (межреберных промежутках на 1 - 2 ребра выше положений электродов в V1 и V2.
- Следующие мероприятия по коррекции образа жизни рекомендованы всем пациентам с диагностированным синдромом Бругада:
a. Избегать приема медикаментов, которые могут провоцировать элевацию сегмента ST в правых грудных отведениях (www.brugadadrugs.org).
b. Избегать употребления кокаина, каннабиса, и значительного употребления алкоголя.
с. Немедленно принять меры для снижения температуры тела при возникновении лихорадки любого генеза [600, 601, 602, 603].
ЕОК IC (УУР C, УДД 4)
- Имплантация ИКД*** рекомендована пациентам с диагностированным синдромом Бругада, которые: пережили остановку сердца и/или имеют документированную спонтанную устойчивую ЖТ [600, 601, 602, 603, 604].
ЕОК IC (УУР C, УДД 4)
- Имплантация ИКД*** рекомендована у пациентов со спонтанными ЭКГ-проявлениями 1-го типа синдрома Бругада и синкопальными состояниями (вероятно, аритмического генеза) в анамнезе [601, 602, 603, 604, 605].
ЕОК IIaC (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность имплантации ИКД*** у пациентов с диагностированным синдромом Бругада, у которых индуцируется ФЖ в процессе ВСЭФИ с ПСЖ до 2-х экстрастимулов [601, 602, 603, 604, 605].
ЕОК IIbC (УУР C, УДД 4)
- КА очага ЖЭ, являющихся триггером ФЖ/ЖТ, и/или эпикардиального субстрата ВТПЖ рекомендуется у пациентов с синдромом Бругада с повторяющимися шоками ИКД***, рефрактерными к медикаментозной терапии [605, 606].
ЕОК IIaC (УУР C, УДД 4)
3.3.16. Катехоламинергическая полиморфная желудочковая тахикардия
Редкое наследственное аритмогенное заболевание, характеризующееся адренергически-индуцируемой двунаправленной и полиморфной ЖТ (предполагаемая распространенность 1 на 10 000). Идентифицировано два генетических типа КПЖТ: доминантный вариант из-за мутаций в гене, кодирующем ген рецептора кардиального рианодина (RyR2), и редкий рецессивный вариант, вызванный мутацией в гене кардиального кальсеквестрина (CASQ2). Для пациентов с КПЖТ характерен выраженный полиморфизм нарушений ритма - от брадикардии, укорочения интервала PR, АВ диссоциации, наджелудочковых тахикардий до политопных и полиморфных тахиаритмий, что нередко является причиной несвоевременной диагностики КПЖТ при неправильной интерпретации причин синкопе [607, 608, 609].
Независимыми прогностическими факторами для аритмических событий в случае КПЖТ являются выявление заболевания в детском возрасте, отсутствие терапии 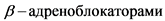 и персистирующие сложные аритмии. Первая линия терапии КПЖТ включает неселективные бета-адреноблокаторы (без внутренней симпатомиметической активности) и модификацию образа жизни с ограничением физических нагрузок.
и персистирующие сложные аритмии. Первая линия терапии КПЖТ включает неселективные бета-адреноблокаторы (без внутренней симпатомиметической активности) и модификацию образа жизни с ограничением физических нагрузок.
Левосторонняя симпатическая денервация сердца оказывает определенный эффект при КПЖТ у пациентов, которые не переносят бета-адреноблокаторы, однако необходимы дополнительные данные и более длительное наблюдение для количественной оценки этого эффекта. Пациентам, пережившим остановку сердца, рекомендованы прием бета-адреноблокаторов и ИКД***-терапия; если такое лечение по результатам стресс-теста не позволяет достичь полного контроля аритмии, следует рассмотреть комбинированную ААТ.
Имплантация ИКД*** возможна у пациентов с КПЖТ, которые не отвечают на лечение бета-адреноблокаторами. При программировании ИКД*** увеличивают продолжительность детекции ЖТ, поскольку нанесение шоков может быть болезненным и способствовать повышению симпатического тонуса и провоцировать повторные эпизоды аритмии, что в конечном итоге ведет к возникновению порочного круга с рецидивирующими ЖА, вплоть до смертельного исхода.
- Всем пациентам с диагностированной КПЖТ рекомендуется избегать соревновательных видов спорта, силовых тренировок и стрессовых ситуаций [610, 611].
ЕОК IC (УУР C, УДД 4)
- Прием бета-адреноблокаторов рекомендован для лечения аритмии и профилактики ВСС всем пациентам с диагностированной КПЖТ, учитывая наличие документированной спонтанной или стресс-индуцированной ЖА [611].
ЕОК IC (УУР C, УДД 4)
- Имплантация ИКД*** дополнительно к приему бета-адреноблокаторов в сочетании или без антиаритмических препаратов, классы I и III рекомендована для лечения аритмии и профилактики ВСС пациентам с диагностированной КПЖТ, пережившим остановку сердца, имеющим в анамнезе повторные синкопальные состояния или эпизоды полиморфной/двунаправленной ЖТ, несмотря на ОМТ [610, 611, 612].
ЕОК IC (УУР C, УДД 4)
- Терапия бета-адреноблокаторами рекомендована родственникам пациента для профилактики ВСС при выявлении генетических мутаций, даже при отсутствии симптомов или манифестации ЖТ [610, 611].
ЕОК IIaC (УУР C, УДД 4)
- Терапия #флекаинидом рекомендована при рецидивах обмороков, полиморфной/двунаправленной ЖТ или сохраняющихся нагрузочных ЖЭ у пациентов с КПЖТ на фоне приема бета-адреноблокаторов в максимальной переносимой дозе [111, 580, 606, 612].
ЕОК IIaC (УУР C, УДД 4)
Комментарий. Дозы для детей: #Флекаинид (от 2 до 3 мг/кг).
- Рекомендуется рассмотреть возможность выполнения грудной левосторонней симпатической денервации сердца у пациентов с диагностированной КПЖТ и повторными синкопальными состояниями, полиморфной/двунаправленной ЖТ, несколькими мотивированными срабатываниями ИКД*** с нанесением шоков на фоне изолированного приема бета-адреноблокаторов или в сочетании с антиаритмическими препаратами, классы I и III, а также при наличии непереносимости или противопоказаний к их приему [591, 611].
ЕОК IIbC (УУР C, УДД 4)
3.3.17. Врожденные пороки сердца
Стратификация риска и первичная профилактика ВСС
Вне зависимости от типа ВПС
- Применение ИКД*** рекомендовано у пациентов с ВПС и обмороками неизвестного происхождения в сочетании с тяжелой дисфункцией желудочков и/или индуцируемой устойчивой ЖТ/ФЖ при проведении ВСЭФИ [51, 614, 615, 616].
ЕОК IIaB (УУР C, УДД 4)
- Имплантация ИКД*** рекомендована взрослым пациентам с ВПС с бивентрикулярной физиологией и дисфункцией системного желудочка (ФВ < 35%), симптомной ХСН на фоне ОМТ с II или III ФК по NYHA [51, 617, 618, 619].
ЕОК IC (УУР C, УДД 4)
- Имплантации ИКД*** рекомендована пациентам с ВПC и предполагаемыми аритмогенными синкопе, имеющими либо дисфункцию ЛЖ, либо индуцируемую устойчивую ЖТ при ПСЖ [51, 614, 618, 619, 620].
ЕОК IIaB (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность имплантации ИКД*** у пациентов с тяжелой дисфункцией единственного желудочка или системного ПЖ при наличии других факторов риска, включая НУЖТ, ХСН II или III ФК по NYHA, выраженную регургитацию на системном АВ клапане, широкий QRS ![]() 140 мс [51, 621, 622, 623, 624].
140 мс [51, 621, 622, 623, 624].
ЕОК IIbB (УУР C, УДД 4)
У пациентов после хирургической коррекции тетрады Фалло
- У пациентов после коррекции тетрады Фалло с симптомами аритмии и НУЖТ рекомендовано проведение ВСЭФИ, включая ПСЖ [616, 621, 623, 624].
ЕОК IIaC (УУР C, УДД 4)
- У пациентов после коррекции тетрады Фалло с симптомами аритмии и положительным результатом ПСЖ, или с сочетанием других факторов риска и положительной ПСЖ, рекомендована имплантация ИКД*** [614, 618, 619, 622].
ЕОК IIaC (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность проведения ВСЭФИ, в том числе ПСЖ, у пациентов после коррекции тетрады Фалло без симптомов аритмии, но в сочетании с другими факторами риска [620].
ЕОК IIbC (УУР C, УДД 4)
- У пациентов с оперированной тетрадой Фалло, идущих на повторную операцию на открытом сердце или чрескожную замену клапана легочной артерии, рекомендуется рассмотреть возможность проведения дооперационного электрофизиологического картирования и аблации/хирургического пересечения анатомических перешейков, ассоциированных с ЖТ, до или во время вмешательства [625].
ЕОК IIbC (УУР C, УДД 4)
Комментарий. Использование трансаннулярной заплаты у пациентов с тетрадой Фалло связано с более низким риском ЖА [625].
Вторичная профилактика ВСС и лечение ЖА при ВПС
Вне зависимости от типа ВПС
- У пациентов с ВПС с устойчивыми ЖА рекомендована оценка резидуальных и/или новых анатомических аномалий как субстрата для развития ЖА [626, 627].
УУР C, УДД 4
У пациентов после хирургической коррекции тетрады Фалло
- У пациентов с оперированной тетрадой Фалло, у которых имеется УМЖТ или повторные срабатывания ИКД по поводу УМЖТ, рекомендовано проведение КА в опытных центрах [628, 629, 630].
ЕОК IC (УУР C, УДД 4)
- Пациентам с оперированной тетрадой Фалло, которым предстоит повторное кардиохирургическое вмешательство, и у которых подтверждено наличие УМЖТ, рекомендовано проведение предоперационного катетерного картирования и абляция/хирургическое пересечение анатомических перешейков, ассоциированных с ЖТ, до или во время вмешательства [625, 627, 631].
ЕОК IIaC (УУР C, УДД 4)
- У пациентов с оперированной тетрадой Фалло с сохраненной бивентрикулярной функцией, у которых имеется симптомная УМЖТ, рекомендуется рассмотреть возможность проведения КА или хирургической абляции в опытных центрах как альтернативу терапии ИКД*** [623, 628, 630].
ЕОК IIbC (УУР C, УДД 4)
Катетерная аблация ЖТ у пациентов с ВПС
- У пациентов с ВПС и рецидивирующими эпизодами УМЖТ или срабатываниями ИКД***, которые не могут быть корректированы программированием ИКД*** или ААТ, рекомендовано проведение КА в опытных центрах [102, 632, 633, 634].
ЕОК IIaC (УУР C, УДД 4)
- Выполнение КА рекомендовано в качестве альтернативы медикаментозной терапии при симптомной УМЖТ у пациентов с ВПС и ИКД*** [102, 632, 633, 634].
ЕОК IIaB (УУР C, УДД 4)
- КА и профилактическое применение терапии для лечения нарушений ритма сердца не рекомендованы в случае бессимптомных, редких ЖЭ у пациентов с ВПС и стабильной функцией желудочков [51].
ЕОК IIIC (УУР C, УДД 5)
- У пациентов с определенными вариантами ВПС (включая пластику предсердной перегородки при транспозиции магистральных артерий, операцию Фонтена и аномалию Эбштейна) с ВОС рекомендовано выявлять и проводить лечение НЖТ с быстрым проведением на желудочки [619, 635].
ЕОК IIaC (УУР C, УДД 4)
3.4. Аспекты ведения в особенных группах пациентов
3.4.1. Беременные и перипартальная кардиомиопатия
Лечение ЖТ во время беременности
- Лечение бета-адреноблокаторами рекомендуется во время беременности и в послеродовом периоде пациенткам с СУИQT или КПЖТ [636, 637, 638, 639].
ЕОК IC (УУР C, УДД 4)
- Лечение бета-адреноблокаторами рекомендуется во время беременности пациенткам с АКПЖ [640, 641, 642].
ЕОК IIaC (УУР C, УДД 4)
- Назначение метопролола**, #пропранолола** или #верапамила** во время беременности внутрь рекомендуется для длительной терапии идиопатической устойчивой ЖТ [643].
ЕОК IIaC (УУР C, УДД 5)
Комментарий: дозы препаратов во время беременности указаны в Приложении А3, таблице А3.1 и не отличаются от общей популяции
- В случае неэффективности других антиаритмических препаратов, для профилактики рецидивов устойчивой ЖТ во время беременности рекомендуются пропафенон**, флекаинид**, соталол** (дозы препаратов указаны в Приложении А3, таблице А3.1.) [185, 643, 645].
ЕОК IIaC (УУР C, УДД 5)
- Экстренная электрическая кардиоверсия во время беременности рекомендуется для купирования аритмии при устойчивой ЖТ, особенно с нарушением гемодинамики [644].
ЕОК IC (УУР C, УДД 4)
- В/в введение бета-адреноблокаторов, прокаинамида** или применение опережающей (овердрайв) стимуляции для подавления ЖТ во время беременности рекомендовано для экстренной конверсии УМЖТ без нарушений гемодинамики [643].
ЕОК IIaC (УУР C, УДД 5)
- У беременных пациенток без СПС рекомендуется назначение бета-адреноблокаторов, антиаритмических препаратов, класс IC, или селективных блокаторов кальциевых каналов с прямым действием на сердце или соталола**, когда количество ЖЭ превышает 10% от общего количества сердечных сокращений по данным ХМЭКГ, или/и при симптомной ЖЭ с плохой переносимостью, или/и с гемодинамическими нарушениями [643, 645].
РКО IC (УУР C, УДД 5)
- Рекомендуется назначение бета-адреноблокаторов, или селективных блокаторов кальциевых каналов с прямым действием на сердце (#верапамил** - до 240 мг в сутки при беременности [646]) или соталола** при отсутствии абсолютных противопоказаний (дозы препаратов указаны в Приложении А3, таблице А3.1.) во время беременности при симптомной ЖЭ с плохой переносимостью, гемодинамическими нарушениями и/или систолической дисфункцией ЛЖ [643, 645, 646].
РКО IC (УУР C, УДД 4)
Комментарий. В большинстве случаев ЖЭ не является противопоказанием к естественным родам и не требует медикаментозного лечения [645].
- При наличии соответствующих показаний выполнение имплантации ИКД*** рекомендуется во время беременности с оптимальной защитой от ионизирующего излучения [647, 648].
ЕОК IC (УУР C, УДД 4)
- Рекомендуется рассмотреть возможность выполнения КА во время беременности с оптимальной защитой от облучения для лечения рефрактерных к медикаментозной терапии и плохо переносимых ЖА [649].
ЕОК IIaC (УУР B, УДД 3)
Комментарий. Впервые возникшая ЖТ может проявляться во время беременности и риск рецидива аритмии выше у пациенток с уже имеющейся ЖТ и ВПС [650].
Наружная электрическая кардиоверсия (дефибрилляция) является безопасной на всех этапах беременности, нет доказательств нарушения кровообращения у плода или инициации преждевременных родов [644]. ЧСС плода должна регулярно контролироваться на всех этапах наружной электрической кардиоверсии (дефибрилляции) [651].
При наличии показаний, имплантация ИКД*** должна быть выполнена после 8 недель беременности с минимизацией использования флюорографии легких с применением рентген-защиты и опытным оператором [652]. Применение ультразвукового контроля и/или систем 3D-навигации позволяет снизить длительность флюорографии легких [647, 653].
У беременных с ИКД*** перед родами рекомендуется рутинный опрос устройства.
Фармакологическое лечение аритмий и СН у беременных женщин может быть аналогичным, как и у небеременных, но следует избегать применения препаратов, противопоказанных при беременности, таких как иАПФ, АРА/АРНИ и ингибиторы ренина [643, 654, 655, 656]. Первый триместр связан с наибольшим тератогенным риском. Фармакологическую терапию рекомендуется начинать в самый поздний срок беременности и с наименьшей эффективной дозы. Воздействие препарата во втором и третьем триместре может оказывать неблагоприятное воздействие на рост и развитие плода, а также повышать риск проаритмии. Рекомендуется проверять препараты и данные о безопасности перед началом приема нового препарата во время беременности [611]. К хорошо переносимым относятся соталол**, #верапамил** (доза препарата указана в Приложении А3, таблице А3.1.). Применение оправдано в том случае, если потенциальная польза превышает потенциальный риск: метопролол**, бисопролол**, #карведилол**, #лидокаин**, #пропранолол**, #верапамил** внутривенно [643]. Недостаточно данных: #ивабрадин**, пропафенон** (дозы препаратов указаны в Приложении А3, таблице А3.1.) Противопоказаны: #амиодарон**, #атенолол**, #дилтиазем [643].
При СУИQT (в частности, при 2 типе СУИQT) риск сердечно-сосудистых событий существенно возрастает в послеродовом периоде (вплоть до одного года после родов) [583]. Поэтому важно продолжать терапию бета-адреноблокаторами во время беременности и после родов [636, 637, 638]. Продолжение лечения бета-адреноблокаторами рекомендуется при СУИQT и КПЖТ и должно рассматриваться при АКПЖ [639]. Дополнительный риск при беременности у женщин с синдромом Бругада неизвестен [577, 657].
Симптомную тахиаритмию следует лечить КА до наступления планируемой беременности. Если КА показана беременной пациентке, следует избегать процедуры в первом триместре, и следует отдавать предпочтение процедурам под контролем электроанатомического картирования [649, 658].
Аритмии, связанные с перипартальной кардиомиопатией
Перипартальная кардиомиопатия (ПКМП) характеризуется развитием впервые систолической дисфункции ЛЖ и СН, может сопровождаться развитием ЖТ; развивается в течение последних месяцев беременности или первых 5 месяцев после родов и проявляется СН вследствие развития идиопатической систолической дисфункции ЛЖ (ФВ обычно < 45%) [643, 654]. Генетическая предрасположенность к ПКМП может быть у 20% пациенток [650].
У пациенток с ПКМП к ранней имплантации ИКД*** с целью профилактики ВСС следует относиться крайне взвешенно, поскольку зачастую происходит спонтанное выздоровление после родов [652].
У пациенток с ПКМП использование бромокриптина** в качестве специфической терапии в дополнение к стандартной терапии СН показало многообещающие результаты в двух клинических исследованиях [659, 660, 661, 662].
3.4.2. Трансплантация сердца
- Пациентам старше 18 лет, ожидающим трансплантацию сердца (ТС), рекомендована имплантация ИКД*** для первичной профилактики ВСС [663, 664].
ЕОК IIaC (УУР C, УДД 4)
Комментарий. Пациенты, включенные в лист ожидания трансплантации сердца (ЛОТС), подвержены риску ВСС и имеют высокую частоту развития ЖА. Особенно это важно при длительном нахождении в ЛОТС, средняя продолжительность ожидания трансплантации в мире составляет 8 - 16 месяцев.
У детей целесообразно придерживаться такого же подхода, несмотря на отсутствие достаточной доказательной базы.
- Пациентам старше 18 лет, ожидающим ТС, рекомендовано рассмотреть возможность использования дефибриллятора носимой системы длительной регистрации сердечного ритма с функцией дефибрилляции (носимый дефибриллятор) [665].
ЕОК IIbC (УУР C, УДД 4)
- Реципиентам сердца с ЖНР старше 18 лет в качестве первой линии лечения рекомендована медикаментозная терапия с использованием ААП [198, 202, 203, 204, 664, 679]: Антиаритмические препараты, класс IC (пропафенон**, диэтиламинопропионилэтоксикарбониламинофенотиазин, лаппаконитина гидробромид**, флекаинид), бета-адреноблокаторы.
(УУР C, УДД 4)
Антиаритмические препараты, класс III (амиодарон**, соталол**)
(УУР C, УДД 5)
и Блокаторы кальциевых каналов (верапамил**)
(УУР C, УДД 4)
РКО IIaC
Комментарий. Использование ААТ у пациентов с трансплантированным сердцем требует специального рассмотрения и персонифицированного подхода из-за лекарственного взаимодействия с иммунодепрессантами и требует дополнительного контроля концентрации иммунодепрессантов в крови и коррекции их дозы в случае отклонения их концентрации от целевого уровня. Наиболее часто используемые иммунодепрессанты, такие как циклоспорин**, такролимус** и сиролимус, активно метаболизируются системой цитохрома Р450 (CYP3A4) и переносчиком Р-гликопротеина. Ингибиторы или индукторы этих ферментов могут влиять на концентрацию лекарств. Амиодарон**, дилтиазем, верапамил**, блокаторы натриевых каналов (АТХ C01BA, АТХ C01BB, АТХ C01BC), такие как лидокаин** (при в\в введении), пропафенон** и другие препараты, могут ингибировать эти ферменты и приводить к повышению концентрации иммунодепрессантов. Иммунодепрессанты могут влиять на удлинение интервала QT, поэтому рекомендуется соблюдать осторожность при их использовании с соталолом**. Циклоспорин**, эверолимус** и азатиоприн** более значительно увеличивали QTc по сравнению с такролимусом**. Бета-адреноблокаторы не обладают лекарственным взаимодействием с иммуносупрессивной терапией, а за счет контроля ЧСС в условиях симпатической реиннервации по данным ретроспективного исследования обладают дополнительным эффектом в снижении смертности и сердечно-сосудистой заболеваемости [663].
- Реципиентам сердца с устойчивой ЖТ рекомендовано выполнение КАГ и эндомиокардиальной биопсии для исключения криза острого отторжения и болезни коронарных артерий пересаженного сердца [666].
РКО IIaC (УУР C, УДД 5)
- Пациентам после ТС с развитием болезни коронарных артерий пересаженного сердца или купированным кризом отторжения трансплантата, осложненным остановкой сердечного трансплантата, сохраняющейся систолической дисфункцией ЛЖ, рекомендуется рассмотреть возможность имплантации ИКД*** [8, 667].
ЕОК IIbC (УУР B, УДД 2)
Комментарии. У пациентов после ТС риск развития ВСС в 3 раза выше по сравнению с нетрансплантированными пациентами, что может быть ассоциировано с активацией симпатической нервной системы и дисбалансом между симпатической и парасимпатической иннервацией [664]. Развитие ВСС является причиной смерти после ТС в 10% случаев [667, 668], и может быть ассоциировано с кризом отторжения трансплантата и болезнью коронарных артерий пересаженного сердца [8, 65, 667], поэтому имплантация ИКД может быть уместна у отдельных пациентов из группы высокого риска [8].
3.4.3. Внезапная сердечная смерть у спортсменов
Частота ВСС у спортсменов увеличивается с возрастом [669, 670].
У практически здоровых спортсменов среднего и старшего возраста (> 35 лет) она колеблется от 2 до 6,3 на 100 000 человеко-лет. У юных и молодых спортсменов, принимающих участие в соревнованиях (![]() 35 лет), частота летальных исходов значительно ниже, чем в старшей возрастной группе, и составляет 0,4 - 3 на 100 000 участников в год [34, 670, 671]. Предварительное обследование сердечно-сосудистой системы дает возможность ранней диагностики ССЗ у спортсменов до появления первых симптомов [652]. У спортсменов среднего/старшего возраста наиболее частой причиной смерти является ИБС [672, 673].
35 лет), частота летальных исходов значительно ниже, чем в старшей возрастной группе, и составляет 0,4 - 3 на 100 000 участников в год [34, 670, 671]. Предварительное обследование сердечно-сосудистой системы дает возможность ранней диагностики ССЗ у спортсменов до появления первых симптомов [652]. У спортсменов среднего/старшего возраста наиболее частой причиной смерти является ИБС [672, 673].
Отличные показатели выживаемости с благоприятным неврологическим исходом имеются при использовании устройств наружной электрической кардиоверсии (дефибрилляции). Важно, что они должны быть использованы в первые 10 минут от момента развития фатальной ЖА [673, 674]. Необходимо размещать устройства наружной электрической кардиоверсии (дефибрилляции) в спортивных залах, на спортивных аренах в доступных местах.
Спортсменам с установленным диагнозом CCЗ, ассоциированного с риском ВСС, необходима оценка возможности продолжения занятий в соответствии с текущими положениями о допуске.
- Спортсменам с анамнезом сердечно-сосудистой патологии, отклонениями от нормы при медицинском осмотре или при изменениях на ЭКГ рекомендуется проведение более глубокого обследования, включая ЭХОКГ и/или МРТ сердца, для подтверждения (или исключения) основного заболевания [34, 675, 676, 741].
УУР C, УДД 5
- С целью проведения обследования сердечно-сосудистой системы у молодых спортсменов (до 35 лет) рекомендовано выполнять сбор анамнеза, медицинский осмотр и регистрация ЭКГ в 12 отведениях [34, 675, 740].
УУР C, УДД 4
- У лиц среднего и старшего спортивного возраста (старше 35 лет) рекомендована оценка сердечно-сосудистого риска до участия в высокоинтенсивных физических нагрузках [34].
УУР C, УДД 4
Под соревновательными видами спорта подразумевают любительскую или профессиональную спортивную деятельность на регулярной основе с участием в организованных соревнованиях. При выявлении клинически значимых ЖА целесообразно, как минимум временно, отстранение от физических нагрузок. Оправдан период детренинга в течение 30 - 90 дней с повторным обследованием сердечно-сосудистой системы. Нарушения, не являющиеся генетически детерминированными, связанные исключительно с высокими нагрузками, в большинстве случаев нивелируются.
Целесообразно обучение персонала спортивных сооружений сердечно-легочной реанимации и использованию устройства наружной электрической кардиоверсии (дефибрилляции)*** [674].
- Перед участием в соревнованиях спортсменам рекомендовано обследование сердечно-сосудистой системы [34].
ЕОК IIaC (УУР C, УДД 4)
3.4.4. Синдром Вольфа-Паркинсона-Уайта
У пациентов с синдромом Вольфа-Паркинсона-Уайта (WPW) наиболее частой аритмией является АВ риентри тахикардия (АВРТ, 80%), за которой следует фибрилляция предсердий (ФП) (20 - 30%). ФП с проведением по дополнительному АВ пути может привести к индукции ФЖ и ВСС, что является наиболее опасным проявлением синдрома WPW. Риск ФЖ/ВСС у нелеченых пациентов с синдромом WPW составляет 0,9 - 2,4 на 1000 человеко-лет. Подход к стратификации риска при НЖТ и рекомендации по профилактике ВСС изложены в национальных рекомендациях по наджелудочковым тахикардиям 2020 г. и с пересмотром в 2023 г.
КА дополнительного пути АВ проведения при синдроме WPW является наиболее эффективным лечением заболевания и профилактики ВСС.
- У детей с бессимптомными дополнительными проводящими путями стратификация риска не рекомендуется до 8 лет [678].
УУР C, УДД 5
3.4.5. Профилактика внезапной смерти у пожилых
Биологический возраст может частично варьироваться в зависимости от сопутствующих заболеваний. Сопутствующие заболевания значительно влияют на выживаемость пациентов с показаниями к ИКД***, а высокий индекс коморбидности связан с меньшим эффектом имплантации ИКД*** для первичной или вторичной профилактики ВСС. Показания к применению ИКД*** у пожилых пациентов должны основываться на индивидуальной оценке общего состояния и сопутствующих заболеваний.
- У пожилых пациентов с наличием показаний к первичной профилактике ВСС, но малой ожидаемой остаточной продолжительностью жизни, рекомендуется рассмотреть возможность отказа от имплантации ИКД*** [680].
ЕОК IIbB (УУР C, УДД 4)
3.5. Желудочковые аритмии и риск внезапной смерти у детей
3.5.1. Лечение желудочковых аритмий у детей без структурного заболевания сердца
- Детям с редкой, бессимптомной ЖТ, у которых предполагается крайне низкий риск ВСС и доброкачественный характер течения заболевания, в большинстве случаев не рекомендовано назначение ААТ [51, 613].
ЕОК IB (УУР C, УДД 4)
Комментарий. Такие дети нуждаются в амбулаторном наблюдении с целью раннего выявления развития симптомов и профилактики возможных осложнений. Лечение ЖТ может быть медикаментозным (ААТ) и хирургическим (интервенционным). В свою очередь, медикаментозное лечение состоит из двух направлений: терапии, направленной на экстренное купирование приступа ЖТ, и протекторной терапии для предупреждения возникновения приступов. Схема медикаментозного лечения ЖТ зависит от выраженности клинических проявлений (частота, длительность и тяжесть пароксизмов ЖТ), наличия или отсутствия СПС, факторов риска ВСС, возраста, локализации субстрата аритмии, эффективности используемых ранее препаратов. На сегодняшний день нет данных, подтверждающих пользу лечения аритмии у бессимптомных пациентов с сохраненной функцией желудочков. Кроме того, с течением времени, особенно у детей, количество ЖЭ часто спонтанно уменьшается. У отдельных групп пациентов, например, тех, которые не хотят продолжать наблюдение, можно рассмотреть возможность КА. У пациентов с плотностью желудочковой эктопической активности менее 10% (доля ЖЭ в структуре всех сокращений сердца за сутки, по данным ХМЭКГ) повторное обследование может быть целесообразным в случае развития новых симптомов или изменения состояния пациента.
- Медикаментозная терапия или КА рекомендованы детям с частыми ЖЭ или ЖТ, которые могут вызвать дисфункцию желудочков [51, 373, 613, 633, 634, 681, 682].
ЕОК IC (УУР C, УДД 4)
Комментарий. В целом лечение детей должно быть таким же, как и взрослых лиц. Тем не менее, КА следует отложить у детей раннего и младшего возраста из-за риска развития осложнений и относительно большего размера аблационного поражения по сравнению с детьми более старшего возраста [655, 656].
- Детям с непрерывно-рецидивирующей ЖТ в отсутствие нарушений центральной гемодинамики, но с наличием начальных проявлений аритмогенной дисфункции миокарда, рекомендовано проведение терапии антиаритмическими препаратами, классы I и III, бета-адреноблокаторами и селективными блокаторами кальциевых каналов с прямым действием на сердце [65, 66, 102, 343, 373, 633, 634, 679, 681, 682, 685, 686].
РКО IIaC (УУР C, УДД 4)
- Рекомендовано применение антиаритмических препаратов, класс IC в качестве альтернативы бета-адреноблокаторам или #верапамилу** у детей с ЖТ из выходного тракта [51, 373].
ЕОК IIaC (УУР С, УДД 5)
- Лечение ЖТ/ЖЭ #верапамилом** не рекомендовано детям в возрасте до 1 года, в особенности если у них есть признаки СН, либо пациенты уже принимают другие лекарственные средства для лечения нарушений ритма сердца [51, 687, 688].
ЕОК IIIC (УУР C, УДД 5)
Комментарий. Описаны случаи развития гипотонии, связанные с приемом #верапамила**. Следует отметить, что во всех этих случаях у пациентов имелись либо признаки СН, либо передозировка #верапамила**, либо прием других лекарственных средств для лечения нарушений ритма сердца в комбинации с #верапамилом** [687, 688].
- Выполнение КА у детей с симптомной идиопатической ЖТ/ЖЭ из области ВТПЖ или левожелудочковой фасцикулярной тахикардией, чувствительной к #верапамилу**, рекомендовано в случае, если медикаментозная терапия оказалась неэффективной или нежелательной [51, 373, 634, 681, 687].
ЕОК IIaB (УУР C, УДД 4)
- Выполнение КА в опытном центре у детей с симптомной идиопатической ЖТ-ВТЛЖ, области аортального клапана или эпикардиальной ЖТ/ЖЭ рекомендовано в случае, если медикаментозная терапия оказалась неэффективной, или в качестве альтернативы пожизненной медикаментозной терапии [51, 373, 613].
ЕОК IIaB (УУР C, УДД 4)
- Катетерная аблация ЖТ/ЖЭ не рекомендована детям младше 5 лет, или весом менее 10 кг, за исключением случаев неэффективности медикаментозной терапии и ЖТ с тяжелыми нарушениями гемодинамики [51, 683].
ЕОК IIIC (УУР C, УДД 5)
3.5.2. Применение ИКД*** у детей
- Имплантация ИКД*** рекомендуется с целью вторичной профилактики ВСС у детей, выживших после ВОС в том случае, если тщательно выполненное обследование исключает возможность устранения ее причин как среди пациентов без СПС, так и при наличии ВПС, КМП или врожденной каналопатии [51, 614, 615, 616, 621].
ЕОК IB (УУР C, УДД 5)
Комментарий. Пациентам должно быть выполнено инвазивное исследование гемодинамики и ВСЭФИ. Необходимо рассмотреть возможность применения альтернативных методов лечения, таких как КА или хирургическое вмешательство, для устранения ЖТ. В случаях невозможности устранения ЖТ данными методами показана имплантация ИКД*** [51, 614, 615, 616, 621].
Стратификация риска ВСС у детей с ГКМП в возрасте от 1 до 16 лет включительно проводится с использованием недавно предложенного и валидированного калькулятора риска. Показания к имплантации ИКД*** у детей с ГКМП представлены в разделе 3.3.5.
3.5.3. Катетерная аблация ЖТ у детей
- Проведение КА субстрата ЖТ (как первая линия лечения или при неэффективности ААТ) рекомендовано у детей с гемодинамически значимой ЖТ или наличием аритмогенной дисфункции миокарда [51, 343, 373, 609, 633, 634, 681, 682, 689].
РКО IIaC (УУР C, УДД 4)
- Рекомендовано проведение КА (как первая линия лечения или при неэффективности ААТ) у детей при наличии фасцикулярной, #верапамил**-чувствительной ЖТ [51, 343, 373, 633, 634, 682, 690].
ЕОК IIaB (УУР C, УДД 5)
- Проведение КА рекомендовано у детей с симптомной ЖТ из ВТПЖ [51, 343, 373, 634, 681, 682, 690].
ЕОК IIaB (УУР C, УДД 5)
Комментарий. КА может проводиться у детей с полиморфной ЖА в случае доминирования одной из морфологий, или, когда известен триггер, на который будет направлена абляция. КА ЖТ не рекомендуется у детей с бессимптомной ЖТ, когда не ожидается развитие аритмогенной дисфункции миокарда. КА ЖТ не рекомендуется в тех случаях, когда ЖТ обусловлена преходящими причинами, такими как острый миокардит, токсическое влияние медикаментов и т.д. [343].
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Кардиологическая реабилитация предполагает собой комплексные долговременные программы, включающие медицинское наблюдение, дозированные физические нагрузки, модификацию факторов риска, обучение и консультирование. Программы направлены на ограничение негативных физиологических и психологических проявлений сердечного заболевания, снижают риск ВСС и коронарных катастроф, позволяют контролировать симптомы заболевания, улучшать физический и профессиональный статус пациента [691]. Пациентами, исходы у которых улучшаются при включении в программы реабилитации, являются: пациенты с ОКС, перенесшие аортокоронарное шунтирование, ЧКВ, коррекцию клапанного поражения, пересадку сердца, а также пациенты со стенокардией [692]. Программы реабилитации для пациентов с ЖНР как таковой в настоящее время не существует. Реабилитационные мероприятия должны осуществляться в соответствии с основным заболеванием, являющимся причиной аритмии, если таковое имеется [693].
Ограничение физических нагрузок рекомендовано пациентам в соответствии с имеющимся заболеванием сердечно-сосудистой системы [693], в том числе, в соответствии со стадией, тяжестью и степенью компенсации основного заболевания.
- Пациентам старше 18 лет после успешной КА рекомендовано рассмотреть возможность ограничения физической активности в пределах бытовых нагрузок в течение 1 недели - 1 месяца; длительность ограничения должна быть обоснована клиническим состоянием пациента и вероятностью рецидива нарушения ритма [694, 695, 696, 697].
РКО IIbC (УУР C, УДД 4)
Комментарий. Ограничение физической активности не должно противоречить ограничениям по поводу основной сердечно-сосудистой патологии. При отсутствии осложнений КА проведения специальных реабилитационных мероприятий не требуется, программы реабилитации базируются на рекомендациях по лечению основного заболевания.
- Пациентам с серьезным осложнением КА рекомендована скорейшая госпитализация в стационар [246, 698, 699, 700].
РКО IIaC (УУР C, УДД 4)
Комментарий. В случаях возникновения любых осложнений после КА, в том числе отсроченных, показана скорейшая госпитализация в кардиологический/кардиохирургический стационар (срочная консультация в стационаре) для проведения необходимых лечебно-диагностических мероприятий.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактика ВСС - это комплекс мероприятий, проводимых с целью предупреждения или уменьшения вероятности развития ВСС, который осуществляется у лиц, переживших ВОС (вторичная профилактика) или у пациентов без эпизодов ВОС в анамнезе, но имеющих факторы риска развития ВСС (первичная профилактика). Профилактика риска ВСС должна включать в себя модификацию факторов риска заболеваний, а также проведение адекватного медикаментозного лечения основной и сопутствующей патологии [519]. Возможные лечебные медикаментозные и немедикаментозные мероприятия изложены в разделе 3 данных рекомендаций и рассматриваются как профилактика ВСС.
Стратификация риска
Бдительность по отношению к ЭКГ- и ЭХОКГ-признакам наследственных аритмологических заболеваний является важной частью клинической практики и позволяет своевременно выявить лиц с высоким риском ВСС. Однако до сих пор нет единого мнения о том, должен ли такой тщательный подход распространяться на массовый скрининг населения на наличие риска ВСС. В Италии и Японии введены системы ЭКГ-скрининга в целях выявления лиц с наследственными аритмологическими заболеваниями, не имеющими какой-либо симптоматики [554, 693, 701].
В Европе и США обязательным является скрининг спортсменов перед соревнованиями, согласно требованиям Международного олимпийского комитета, хотя последнее исследование в Израиле показало отсутствие изменений в частоте случаев ВСС у профессиональных спортсменов после введения скрининга [702, 703, 704, 705].
Регистрация и анализ ЭКГ выполняются всем лицам с высоким риском ВСС, а также при плановых диспансеризациях взрослого населения. В соответствии с приказом Министерства здравоохранения Российской Федерации, регистрация ЭКГ в 12-ти отведениях предусмотрена при плановых диспансеризациях взрослого населения:
- для мужчин старше 36 лет и женщин старше 45 лет при каждом прохождении диспансеризации (то есть 1 раз в 3 года);
- для мужчин в возрасте до 36 лет и женщин в возрасте до 45 лет при первичном прохождении диспансеризации [706].
- В настоящее время не рекомендовано проведение общепопуляционного ЭКГ-скрининга в связи с недостатком информации о его экономической эффективности и неизвестном количестве ложноположительных и ложноотрицательных результатов [42, 707].
РКО IIIC (УУР C, УДД 4)
- Ближайшим родственникам жертв внезапной смерти рекомендуется сообщить о существующем для них риске и необходимости обследования у врача-кардиолога в том случае, если патологоанатомическое исследование и анализ не выявили очевидных аномалий. Контакт с родственниками жертв внезапной смерти должен происходить с учетом их психосоциальных потребностей и с использованием междисциплинарного подхода [582, 708, 709, 710, 711].
РКО IIaC (УУР C, УДД 3)
Комментарий. Примерно в половине случаев у родственников жертв ВСС устанавливают диагноз наследственных аритмологических заболеваний, прежде всего, каналопатий (например, СУИQT, синдрома Бругада или КПЖТ), реже - начальных проявлений кардиомиопатий [прежде всего ГКМП и АКПЖ], а также семейной гиперхолестеринемии). Если при синдроме внезапной необъяснимой смерти (СВНС), а также при внезапной аритмической смерти или синдроме внезапной смерти новорожденного (СВСН) патологоанатомическое исследование погибшего невозможно, или когда патологоанатомическое исследование не выявляет структурных аномалий, а результаты токсикологического анализа в норме, ближайшим родственникам следует сообщить о существующем для них риске внезапной смерти и необходимости обследования у врача-кардиолога. Семейный анамнез повторных случаев СВНС в молодом возрасте (до 40 лет) или при наличии наследственных заболеваний сердца является неопровержимым доводом в пользу обследования всех членов семьи.
- Скрининг родственников жертв внезапной смерти рекомендуется вести по представленному протоколу (см. комментарий), учитывая экономическую и информационную целесообразность каждого метода [87, 88, 710].
РКО IIaC (УУР C, УДД 4)
Комментарий. Предложено несколько разных протоколов для скрининга родственников жертв внезапной смерти. В основе всех этих протоколов лежит пошаговый подход, когда в первую очередь используют наименее дорогостоящие методы обследования, дающие максимальный объем ценной информации, после чего на основании полученных результатов и с учетом данных семейного анамнеза переходят к дополнительному обследованию. Если в ходе обследования выявляются структурные или электрические изменения, свидетельствующие в пользу конкретного диагноза, необходимо следовать стандартному протоколу обследования по соответствующему диагнозу. Первым шагом в постановке посмертного диагноза, до начала обследования родственников погибшего, является тщательный сбор анамнеза. В случае ВСС молодых лиц до 40 лет, у ближайших родственников в первую очередь, следует исключить кардиомиопатии и каналопатии. Рекомендуется оценка предшествовавших сердечных симптомов (в том числе обмороков или судорожных припадков) и тщательное изучение обстоятельств смерти, а также сбор и анализ прижизненных кардиологических заключений. У лиц старше 40 лет, в первую очередь, исключают факторы риска ИБС (например, активное или пассивное курение, дислипопротеинемию, АГ или сахарный диабет). Необходимо составить родословную погибшего в трех поколениях, в которой должны быть отражены все случаи внезапной смерти и родственники с сердечными заболеваниями. Следует, по возможности, получить архивные медицинские карты и/или результаты патологоанатомического исследования. В первую очередь обследованию подлежат родственники с признаками заболеваний сердца, такими как обмороки, учащенное сердцебиение или боли за грудиной. Если в семье отсутствует диагноз сердечных заболеваний, следует провести скрининг маленьких детей хотя бы с помощью ЭКГ и ЭХОКГ.
Выполнение ЭХОКГ целесообразно в качестве метода скрининга пациентов при наличии подтвержденного диагноза или подозрения на ЖА. ЭХОКГ следует рассматривать у всех пациентов с ЖА, у которых предполагается или имеется СПС, а также в группах пациентов с высоким риском развития ЖА или ВСС - например, у пациентов с ДКМП, ГКМП и АКПЖ, а также у пациентов, переживших острый ИМ, и у родственников пациентов с наследственными заболеваниями с высоким риском ВСС [65].
Диспансерное наблюдение
Диспансеризация пациентов с ЖА и повышенным риском ВСС проводится в соответствии с порядком диспансерного наблюдения за взрослыми (приказ МЗ РФ N 168н от 15.03.2022 г.) не реже двух раз в год с оценкой следующих показателей: Измерение массы тела (ИМТ); Определение окружности талии; Статус курения; Измерение артериального давления на периферических артериях; Измерение частоты сердцебиения; скорость клубочковой фильтрации (не реже 1 раза в год); Исследование уровня холестерина липопротеинов низкой плотности в крови (не реже 2 раз в год, по показаниям); регистрация ЭКГ (не реже 1 раза в год); ЭХОКГ (не реже 1 раза в год); Холтеровское мониторирование сердечного ритма (не реже 1 раза в год, по показаниям).
Больные с высоким риском сердечно-сосудистых осложнений или при возобновлении и/или учащении эпизодов нарушений ритма сердца, появлении пресинкопальных и/или синкопальных состояний наблюдаются врачом-кардиологом поликлиники, кардиодиспансера, учреждения с имеющимися компетенциями по диагностике и лечению нарушений ритма и проводимости сердца 4 раза в год [712]. Наблюдение пациентов с ИКД осуществляется в учреждениях с имеющимися возможностями или отделениях по диагностике и лечению нарушений ритма и проводимости сердца в течение первых 6 месяцев после имплантации, далее - не реже 1 раза в год, а также после срабатывания ИКД***.
Целесообразно рассмотреть возможность диспансерного наблюдения не реже двух раз в год пациентов с ЖА и повышенным риском ВСС.
6. Организация оказания медицинской помощи
Вид помощи и порядок ее оказания зависит от этиологии ЖТ и сопутствующей патологии. Структурная или функциональная патология сердца, особенно при ее прогрессировании, может являться основным показанием для госпитализации.
Возможности амбулаторной помощи пациентам с ЖТА ограничиваются следующими случаями:
1) Пациенты с хроническими стабильными аритмиями без нарушений гемодинамики: ЖЭ, НУЖТ, редкие приступы медленных ЖТ;
2) Обследование у пациентов без СПС для выявления скрытой патологии сердца, критериев риска ВСС;
3) Подготовка к госпитализации при стабильном состоянии пациента;
4) Наблюдение после хирургических и интервенционных вмешательств, имплантации электронных устройств (ЭКС***, ИКД***, электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)***/кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***).
Показания для плановой госпитализации:
1) Впервые возникшая симптомная ЖЭ, сопровождающаяся развитием или значительным усугублением СН;
2) Впервые возникшие или рецидивирующие эпизоды устойчивой ЖТ без ВОС, требующей специлизированного лечения в плановом порядке;
3) Прогрессирование основного заболевания в случаях, когда аритмия не является гемодинамически значимой;
4) При неэффективности догоспитального лечения симптомных хронических стабильных ЖЭ, НУЖТ, медленных ЖТ.
Показания для экстренной госпитализации
Обязательной госпитализации подлежат пациенты, у которых на фоне ЖТА имеются признаки артериальной гипотонии, острой левожелудочковой недостаточности, ангинозного синдрома, ухудшения мозгового кровообращения. При подозрении на ИМ необходимо экстренно доставить пациента в медицинское учреждение.
- Ведение пациента после реанимационных мероприятий рекомендуется в медицинских учреждениях с мультидисциплинарным подходом к интенсивной терапии и возможностью выполнения первичных коронарных вмешательств, ВСЭФИ, имплантации вспомогательных желудочковых систем для механической поддержки кровообращения, в том числе экстракорпоральной мембранной оксигенации (ЭКМО), хирургических вмешательств на сердце и сосудах и терапевтической гипотермии [115, 713, 714].
ЕОК IB (УУР C, УДД 5)
Комментарий: Как правило, такими возможностями обладают стационары 3 уровня.
- КАГ с возможной последующей ангиопластикой в течение первых 2 часов госпитализации рекомендована пациентам высокого риска с ИМпST, в том числе с жизнеугрожающими ЖА [398].
ЕОК IC (УУР C, УДД 5)
При остановке кровообращения госпитализация требуется сразу же после купирования приступа и восстановления нормальной сердечной деятельности. Если реанимационные мероприятия не принесли необходимого эффекта, пациента транспортируют в стационар без сознания. При этом по дороге непрерывно выполняют искусственную вентиляцию легких и непрямой массаж сердца.
Пациентов с приступами пароксизмальной ЖТ следует госпитализировать в случае отсутствия эффекта от неотложной терапии, а также при наличии признаков острой левожелудочковой недостаточности, ухудшения мозгового кровообращения, артериальной гипотонии, ангинозного синдрома.
Госпитализации подлежат лица, перенесшие приступ ЖТ, успешно купированный на догоспитальном этапе при наличии СПС или при отсутствии результатов кардиологического обследования, при наличии сопутствующих заболеваний, высоком риске развития осложнений.
При рефрактерной остановке спонтанного кровообращения и неэффективности мероприятий расширенной сердечно-легочной реанимации (СЛР) целесообразно рассмотреть возможность применения технологии вено-артериальной ЭКМО в комплексе расширенной СЛР (ЭСЛР).
Рефрактерной остановкой кровообращения в настоящее время считают отсутствие восстановления спонтанного кровообращения в течение 30 минут расширенной сердечно-легочной реанимации. С точки зрения клинической своевременности применения ЭСЛР рефрактерной остановкой кровообращения следует признать в случае безуспешности реанимационных усилий в течение 20 минут и/или после завершения 3 полных циклов СЛР с применением амиодарона**. Применение ЭСЛР возможно только в медицинской организации, имеющей в своем составе подразделение с опытом работы с ЭКМО.
Решение об ЭСЛР должно быть принято в месте оказания медицинской помощи, включая этап медицинской эвакуации, если предполагаемый срок с момента принятия решения до установки системы не превышает 20 - 30 минут. Таким образом, с момента остановки кровообращения до момента экстракорпоральной перфузии с помощью ЭКМО должно пройти не более 60 минут. Превышение этого времени приводит к неудовлетворительным результатам применения технологии в виде неблагоприятных исходов и необратимых постгипоксических изменений со стороны центральной нервной системы. строгое соблюдение критериев применения вено-артериальной ЭКМО при проведении СЛР (приложение А3).
Оказание помощи пациентам с внезапной остановкой кровообращения в стационарном отделении скорой медицинской помощи
Порядок представлен в приложении А3.
Показания к выписке пациента из стационара
Целесообразность дальнейшего пребывания в стационаре и возможность амбулаторного лечения определяются по итогам обследования.
- Ранняя (перед выпиской из стационара) оценка ФВ ЛЖ рекомендована всем пациентам после ИМ [251, 399, 715].
ЕОК IC (УУР C, УДД 5)
Пациенты могут быть выписаны из стационара в следующих случаях:
1) Выполнение радикального или паллиативного хирургического и интервенционного лечения;
2) Имплантация кардиовертера-дефибриллятора***, если не требуется продолжение терапии в условиях стационара по основному заболеванию;
3) Эффективный подбор ААТ и терапии основного заболевания;
4) Установление диагноза и прогностического значения ЖТА, не требующее срочной коррекции ААТ, хирургического или интервенционного вмешательства, имплантации ИКД***.
Иные организационные подходы
У несовершеннолетних целесообразна регистрация ЭКГ при профилактических медицинских осмотрах в 1 год, 6, 15, 17 лет, а также при предварительных медицинских осмотрах перед приемом в средние и высшие образовательные учреждения, выполнение ЭХОКГ в 6 лет [42, 706, 707, 716]. Имеется утвержденный порядок прохождения медицинских осмотров несовершеннолетними. Особенно важен генеалогический метод анализа у лиц молодого возраста, страдающих рецидивирующими приступами потери сознания или имеющих аномалии на ЭКГ [716, 717].
Автоматические наружные дефибрилляторы в местах скопления людей
- Автоматические наружные дефибрилляторы рекомендуется устанавливать в общественных местах, где существует значительная концентрация людей, что существенно повышает вероятность возникновения ситуации с ВОС (например, в школах, аэропортах, на вокзалах и стадионах), или в местах, где нет иной возможности дефибрилляции (например, в поездах, на круизных лайнерах, в самолетах и т.д.) [718, 719].
ЕОК IB (УУР C, УДД 4)
Комментарий. В большинстве случаев остановка сердца происходит вне стен лечебного учреждения. При экстренной дефибрилляции шансы на восстановление нормального ритма и стабильного сердечного выброса намного выше, чем при отсроченной дефибрилляции [718, 719, 720].
- Рекомендуется рассмотреть возможность обучения основным принципам реанимации родственников пациентов с высоким риском ВСС [719].
ЕОК IIbC (УУР C, УДД 4)
Могут быть использованы:
- Телемедицинское консультирование пациентов.
- Удаленный мониторинг амбулаторных пациентов с имплантируемыми устройствами.
В оказании помощи пациентам с ЖТ и ВСС целесообразно выделение уровней оказания помощи с различными возможностями оказания помощи. Учитывая жизнеопасный характер ЖТ, при экстренной госпитализации целесообразно направление пациентов в центры более высокого уровня (приложение А3).
Этап первичной медико-санитарной помощи:
- реанимационная помощь
- кардиоверсия/дефибрилляция
Этап специализированной помощи:
- антиаритмическая терапия
- коронарография/реваскуляризация
- ВСЭФИ
- катетерная аблация ЖТ
- имплантация кардиовертера-дефибриллятора***
- имплантация электрокардиостимулятора имплантируемого трехкамерного (бивентрикулярного)***/кардиовертера-дефибриллятора имплантируемого трехкамерного (бивентрикулярного)***
Экспертные центры:
- коронарография/реваскуляризация
- эндомиокардиальная биопсия
- генетическое тестирование
- ВСЭФИ
- катетерная аблация ЖТ
- имплантация кардиовертера-дефибриллятора***
- имплантация электрокардиостимулятора имплантируемого трехкамерного (бивентрикулярного)***/ кардиовертера-дефибриллятора имплантируемого трехкамерного (бивентрикулярного)***
- вспомогательное кровообращение
- трансплантация сердца
В отдельных субъектах РФ могут быть сформированы отдельные дорожные карты оказания помощи пациентам с ЖТА и созданы региональные центры/регистры жизнеопасных тахиаритмий и внезапной смерти.
- Рекомендовано рассмотреть возможность создания региональных сетей по экстренной помощи при остановке сердца, чтобы улучшить показатели выживаемости и результаты лечения среди спасенных лиц [5, 51, 401].
ЕОК IIaB (УУР C, УДД 5)
При определении показаний к интервенционному или хирургическому лечению нарушения ритма или проводимости сердца, а также в сложных случаях, необходимо обсуждение тактики ведения со специалистом, имеющим достаточный опыт лечения нарушений ритма. Таким специалистом может быть врач-кардиолог, врач-сердечно-сосудистый хирург [744].
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Совместное принятие решений
Важно учитывать предпочтения пациента для диагностики ЖА и принятия решения о ведении. Предпочтения пациентов в отношении инвазивной терапии и принятие риска ВСС варьируются и могут изменяться на протяжении всей болезни. Подход к совместному принятию решений может быть частью общей стратегии ведения пациентов с ЖА и риском ВСС. Общепринятое определение совместного принятия решений включает в себя 4 компонента [720]: 1) минимум 2 участника: врач и пациент; 2) обе стороны делятся информацией; 3) обе стороны предпринимают шаги для формирования общего подхода к предпочтительному лечению; 4) соглашение о реализации лечения. Поделиться решением - не значит предоставить пациенту список рисков и преимуществ лечения и предложить принять решение (такой подход некоторые авторы назвали "оставлением" [696]. Рекомендация, основанная как на научных доказательствах, так и на понимании цели лечения, предпочтений и ценностей пациента, важна для истинного совместного принятия решений. Также, возможность деактивации имеющегося ИКД*** следует обсудить с пациентами в терминальной стадии заболевания.
ИКД*** продлевают жизнь, как подчеркивается во многих разделах настоящих рекомендаций. Тем не менее, пациент с ХСН или тяжелым некардиальным заболеванием может отказаться от замены ИКД*** при столкновении с перспективой постоянного ухудшения здоровья и функционального статуса. К сожалению, результаты исследований показывают, что пациенты плохо информированы, когда сталкиваются с пониманием риска, пользы и последующего бремени имплантированного ИКД***. У пациентов с ИКД*** отмечается тенденция к переоценке его пользы и недооценка ассоциированных рисков [50, 721, 722]. Аналогичным образом, пациенты, которые отказываются от ИКД***, также часто недооценивают личный риск ВСС [75, 76]. Исследования принятия клинических решений показывают, что врачи часто переоценивают преимущества и в то же время преуменьшают потенциальный вред [722]. В момент, когда определяются показания к замене ИКД***, пациент и врач должны вместе обсудить, по-прежнему ли соответствует замена ИКД*** цели лечения. Что имело смысл в 70 лет, может не иметь смысла в 80 лет. Пациенты могут иметь прогрессирующее заболевание или низкое качество жизни. Все эти факторы могут изменить соотношение риск/польза от ИКД*** и повлиять на предпочтение пациентов.
Рекомендации по принятию общего решения
- У пациентов с ЖА или повышенным риском ВСС клиницистам рекомендуется принять подход к совместному принятию решения, при котором решение о лечении основано не только на наилучших доступных научных данных, но и на цели пациента в отношении собственного здоровья, предпочтениях и его ценностях [720, 723, 724].
ЕОК IB (УУР C, УДД 5)
- В случае рассмотрения имплантации нового ИКД*** или замены имеющегося ИКД*** в связи с разрядом батареи у пациента, рекомендуется информировать его/ее об индивидуальном риске ВСС и риске невнезапной смерти от ХСН или несердечных заболеваний, а также об эффективности, безопасности и потенциальных осложнениях ИКД*** в свете цели самого пациента в отношении его здоровья, предпочтений и ценностей [720, 723, 725].
ЕОК IB (УУР C, УДД 5)
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи при желудочковых нарушениях ритма или внезапной остановке сердца (коды по МКБ - 10: I46, I46.0, I46.1, I46.9, I47.0, I47.2, I47.9, I49, I49.0, I49.3, I49.4, I49.8, I49.9)
N п/п
Критерий качества (текст)
Оценка выполнения (Да/Нет)
1.
Выполнена регистрация электрокардиограммы в покое в 12-ти отведениях и/или холтеровское мониторирование сердечного ритма (ХМ-ЭКГ) пациентам при прохождении обследования на предмет выявления желудочковых аритмий (ЖА)
Да/Нет
2.
Выполнена эхокардиография для оценки функции ЛЖ и выявления структурной патологии сердца у пациента с ЖА
Да/Нет
3.
Назначено лечение бета-адреноблокаторами пациента со структурной патологией сердца/дисфункцией левого желудочка, имеющего повышенный риск внезапной сердечной смерти и нуждающегося в ее первичной или вторичной профилактике (при отсутствии противопоказаний)
Да/Нет
Критерии оценки качества специализированной медицинской помощи взрослым при желудочковых нарушениях ритма или внезапной остановке сердца (коды по МКБ - 10: I46, I46.0, I46.1, I46.9, I47.0, I47.2, I47.9, I49, I49.0, I49.3, I49.4, I49.8, I49.9)
N п/п
Критерий качества
Оценка выполнения (Да/Нет)
1.
Выполнено направление на консультацию к врачу, специализирующемуся на диагностике и лечении нарушений ритма сердца (врачу-кардиологу, врачу-сердечно-сосудистому хирургу) для решения вопроса о необходимости выполнения катетерной аблации пациентам с ИБС и рецидивирующей симптомной устойчивой мономорфной желудочковой тахикардией или шоками ИКД*** при устойчивой мономорфной желудочковой тахикардии, несмотря на лечение бета-адреноблокаторами или соталолом**
Да/Нет
2.
Выполнено направление на консультацию к врачу, специализирующемуся на диагностике и лечении нарушений ритма сердца (врачу-кардиологу, врачу-сердечно-сосудистому хирургу) или в специализированный кардиологический центр для решения вопроса о необходимости имплантации ИКД при сохраняющейся дисфункции левого желудочка (ФВЛЖ - 35% и менее) и сердечной недостаточности (II или III ФК по NYHA), по истечении 40 дней после инфаркта миокарда
Да/Нет
Список литературы
1. Sackett DL., Rosenberg WM., Gray JA., Haynes RB., Richardson WS. Evidence based medicine: what it is and what it isn't. BMJ 1996; 312(7023): 71 - 2. Doi: 10.1136/bmj.312.7023.71.
2. Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 03.04.2017) "Об основах охраны здоровья граждан в Российской Федерации".
3. Эпидемиологический словарь, 4-е издание. Под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. М., 2009. 316 с.
4. Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТ Р 52379-2005. Надлежащая клиническая практика. Москва, 2005.
5. Al-Khatib SM., Stevenson WG., Ackerman MJ., Bryant WJ., Callans DJ., Curtis AB., Deal BJ., Dickfeld T., Field ME., Fonarow GC., et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation 2018; 138(13): e272 - e391. Doi: 10.1161/CIR.0000000000000549.
6. Elliot P., Zamorano JL., Anastasakis A., Borger MA., Borggrefe M., Cecchi F., Charron P., Hagege AA., Lafont A., Limongelli G., et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: The task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39): 2733 - 79. Doi: 10.1093/eurheartj/ehu284.
7. Андреева Н.С., Реброва О.Ю., Зорин Н.А., Авксентьева М.В., Омельяновский В.В. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор 2012; 4: 10 - 24.
8. Zeppenfeld K., Tfelt-Hansen J., de Riva M., Winkel BG., Behr ER., Blom NA., Charron P., Corrado D., Dagres N., de Chillou C., et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J 2022; 43(40): 3997 - 4126. Doi: 10.1093/eurheartj/ehac262.
9. Рыжкова О.П., Кардымон О.Л., Прохорчук Е.Б., Коновалов Ф.А., Масленников А.Б., Степанов В.А., Афанасьев А.А., Заклязьминская Е.В., Ребриков Д.В., Савостьянов К.В. и др. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2). Медицинская генетика 2019; 18(2): 3 - 23.
10. Ревишвили А.Ш., Шляхто Е.В., Попов С.В. и др. Российские клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств. - Москва: ВНОА, 2017. - 701 с.
11. Myerburg RJ., Junttila MJ. Sudden cardiac death caused by coronary heart disease. Circulation 2012; 125(8): 1043 - 52. Doi: 10.1161/CIRCULATIONAHA.111.023846.
12. Stecker EC., Reinier K., Marijon E., Narayanan K., Teodorescu C., Uy-Evanado A., Gunson K, Jui J., Chugh SS. Public health burden of sudden cardiac death in the United States. Circ Arrhythm Electrophysiol 2014; 7(2): 212 - 17.
13. Chen LY., Sotoodehnia N.,  , Lopez FL., Yee LM., Heckbert SR., Prineas R., Soliman EZ., Adabag S., Konety S., et al. Atrial fibrillation and the risk of sudden cardiac death: the atherosclerosis risk in communities study and cardiovascular health study. JAMA Intern Med 2013; 173(1): 29 - 35. Doi: 10.1001/2013.jamainternmed.744.
, Lopez FL., Yee LM., Heckbert SR., Prineas R., Soliman EZ., Adabag S., Konety S., et al. Atrial fibrillation and the risk of sudden cardiac death: the atherosclerosis risk in communities study and cardiovascular health study. JAMA Intern Med 2013; 173(1): 29 - 35. Doi: 10.1001/2013.jamainternmed.744.
14. Marijon E., Uy-Evanado A., Dumas F., Karam N., Reinier K., Teodorescu C., Narayanan K., Gunson K., Jui J., Jouven X., Chugh SS. Warning Symptoms Are Associated With Survival From Sudden Cardiac Arrest. Ann Intern Med 2016; 164(1): 23 - 9. Doi: 10.7326/M14-2342.
15. Glinge C., Jabbari R., Risgaard B., Lynge TH.,  , Albert CM.,
, Albert CM.,  , Winkel BG., Tfelt-Hansen J. Symptoms Before Sudden Arrhythmic Death Syndrome: A Nationwide Study Among the Young in Denmark. J Cardiovasc Electrophysiol 2015; 26(7): 761 - 67. Doi: 10.1111/jce.12674.
, Winkel BG., Tfelt-Hansen J. Symptoms Before Sudden Arrhythmic Death Syndrome: A Nationwide Study Among the Young in Denmark. J Cardiovasc Electrophysiol 2015; 26(7): 761 - 67. Doi: 10.1111/jce.12674.
16.  , Lynge TH., Blanche P., Banner J., Prescott E., Jabbari R., Tfelt-Hansen J. Temporal trends and sex differences in sudden cardiac death in the Copenhagen City Heart Study. Heart 2021; 107(16): 1303 - 1309. Doi: 10.1136/heartjnl-2020-318881.
, Lynge TH., Blanche P., Banner J., Prescott E., Jabbari R., Tfelt-Hansen J. Temporal trends and sex differences in sudden cardiac death in the Copenhagen City Heart Study. Heart 2021; 107(16): 1303 - 1309. Doi: 10.1136/heartjnl-2020-318881.
17. Eckart RE., Shry EA., Burke AP., McNear JA., Appel DA., Castillo-Rojas LM., Avedissian L., Pearse LA., Potter RN., Tremaine L., et al. Sudden death in young adults: an autopsy-based series of a population undergoing active surveillance. J Am Coll Cardiol 2011; 58(12): 1254 - 61. Doi: 10.1016/j.jacc.2011.01.049.
18. Van der Werf C., Hendrix A., Birnie E., Bots ML., Vink A., Bardai A., Blom MT., Bosch J., Bruins W., Das CK., et al. Improving usual care after sudden death in the young with focus on inherited cardiac diseases (the CAREFUL study): a community-based intervention study. Europace 2016; 18(4): 592 - 601. Doi: 10.1093/europace/euv059.
19. United Nations Economic Commission for Europe. UNECE statistical database.
20. Л.М. Макаров, В.Н. Комолатова, И.И. Киселева. Распространенность внезапной сердечной смерти у лиц молодого возраста в крупном мегаполисе. Медицинский алфавит 2014. 3: 35 - 40.
21. Бокерия Л.А., Неминущий Н.М., Постол А.С. Сердечная ресинхронизирующая терапия. Формирование показаний и современных подходов к методу повышения эффективности. Комплексные проблемы сердечно-сосудистых заболеваний 2018; 7(3): 102 - 116. Doi: 10.17802/2306-1278-2018-7-3-102-116.
22. Fishman GI., Chugh SS., Dimarco JP., Albert CM., Anderson ME., Bonow RO., Buxton AE., Chen PS., Estes M., Jouven X., et al. Sudden cardiac death prediction and prevention: report from a National Heart, Lung, and Blood Institute and Heart Rhythm Society Workshop. Circulation 2010; 122(22): 2335 - 48. Doi: 10.1161/CIRCULATIONAHA.110.976092.
23. Wong CX., Brown A., Lau DH., Chugh SS., Albert CM., Kalman JM., Sanders P. Epidemiology of Sudden Cardiac Death: Global and Regional Perspectives. Heart Lung Circ 2019; 28(1): 6 - 14. Doi: 10.1016/j.hlc.2018.08.026.
24. Bougouin W., Lamhaut L., Marijon E., Jost D., Dumas F., Deye N., Beganton F., Empana JP., Chazelle E., Cariou A., et al. SDEC Co-Investigators. Characteristics and prognosis of sudden cardiac death in Greater Paris: population-based approach from the Paris Sudden Death Expertise Center (Paris-SDEC). Intensive Care Med 2014. 40(6): 846 - 54. Doi: 10.1007/s00134-014-3252-5.
25. Deo R., Albert CM. Epidemiology and genetics of sudden cardiac death. Circulation 2012; 125(4): 620 - 37. Doi: 10.1161/CIRCULATIONAHA.111.023838.
26. Gerber Y., Jacobsen SJ., Frye RL., Weston SA., Killian JM., Roger VL. Secular trends in deaths from cardiovascular diseases: a 25-year community study. Circulation 2006; 113(19): 2285 - 92. Doi: 10.1161/CIRCULATIONAHA.105.590463.
27. Krahn AD., Connolly SJ., Roberts RS., Gent M. ATMA Investigators. Diminishing proportional risk of sudden death with advancing age: implications for prevention of sudden death. Am Heart J 2004; 147(5): 837 - 40. Doi: 10.1016/j.ahj.2003.12.017.
28. Becker LB., Han BH., Meyer PM., Wright FA., Rhodes KV., Smith DW., Barrett J. Racial differences in the incidence of cardiac arrest and subsequent survival. The CPR Chicago Project. N Engl J Med 1993; 329(9): 600 - 6. Doi: 10.1056/NEJM199308263290902.
29. Zhao D., Post WS., Blasco-Colmenares E., Cheng A., Zhang Y., Deo R., Pastor-Barriuso R., Michos ED., Sotoodehnia N., Guallar E. Racial Differences in Sudden Cardiac Death. Circulation 2019; 139(14): 1688 - 1697. Doi: 10.1161/CIRCULATIONAHA.118.036553. Erratum in: Circulation 2019; 139(14): e837. Doi: 10.1161/CIR.0000000000000672.
30. Fox CS., Evans JC., Larson MG., Kannel WB., Levy D. Temporal trends in coronary heart disease mortality and sudden cardiac death from 1950 to 1999: the Framingham Heart Study. Circulation 2004; 110(5): 522 - 7. Doi: 10.1161/01.CIR.0000136993.34344.41.
31. Zheng ZJ., Croft JB., Giles WH., Mensah GA. Sudden cardiac death in the United States, 1989 to 1998. Circulation 2001; 104(18): 2158 - 63. Doi: 10.1161/hc4301.098254.
32. Dudas K., Lappas G., Stewart S., Rosengren A. Trends in out-of-hospital deaths due to coronary heart disease in Sweden (1991 to 2006). Circulation 2011; 123(1): 46 - 52. Doi: 10.1161/CIRCULATIONAHA.110.964999.
33. Heidbuchel H., Willems R., Jordaens L., Olshansky B., Carre F., Lozano IF., Wilhelm M.,  , Huybrechts W., Morgan J., et al. Intensive recreational athletes in the prospective multinational ICD Sports Safety Registry: Results from the European cohort. Eur J Prev Cardiol 2019; 26(7): 764 - 775. Doi: 10.1177/2047487319834852.
, Huybrechts W., Morgan J., et al. Intensive recreational athletes in the prospective multinational ICD Sports Safety Registry: Results from the European cohort. Eur J Prev Cardiol 2019; 26(7): 764 - 775. Doi: 10.1177/2047487319834852.
34. Risgaard B., Winkel BG., Jabbari R., Glinge C., Ingemann-Hansen O., Thomsen JL., Ottesen GL.,  , Holst AG., Tfelt-Hansen J. Sports-related sudden cardiac death in a competitive and a noncompetitive athlete population aged 12 to 49 years: data from an unselected nationwide study in Denmark. Heart Rhythm 2014; 11(10): 1673 - 81. Doi: 10.1016/j.hrthm.2014.05.026.
, Holst AG., Tfelt-Hansen J. Sports-related sudden cardiac death in a competitive and a noncompetitive athlete population aged 12 to 49 years: data from an unselected nationwide study in Denmark. Heart Rhythm 2014; 11(10): 1673 - 81. Doi: 10.1016/j.hrthm.2014.05.026.
35. Byrne R., Constant O., Smyth Y., et al. Multiple source surveillance incidence and aetiology of out-of-hospital sudden cardiac death in a rural population in the West of Ireland. European Heart Journal 2008; 29(11): 1418 - 1423. Doi: 10.1093/eurheartj/ehn155. Epub 2008 Apr 17.
36. Waldmann V., Karam N., Bougouin W., et al. Burden of coronary artery disease as a cause of sudden cardiac arrest in the young. Journal of the American College of Cardiology 2019; 73(16): 2118 - 2120. Doi: 10.1016/j.jacc.2019.01.064.
37. Waldmann V., Karam N., Rischard J., et al. Low rates of immediate coronary angiography among young adults resuscitated from sudden cardiac arrest. Resuscitation 2020; 147: 34 - 42. Doi: 10.1016/j.resuscitation.2019.12.005.
38. Бойцов С.А., Погосова Н.В., Бубнова М.Г. и др. Кардиоваскулярная профилактика 2017. Российские национальные рекомендации. Российский кардиологический журнал 2018; 7 - 122. https://doi.org/10.15829/1560-4071-2018-6-7-122.
39. Jouven X., Desnos M., Guerot C.,  Predicting sudden death in the population: the Paris Prospective Study I. Circulation 1999; 99(15): 1978 - 1983. Doi: 10.1161/01.cir.99.15.1978.
Predicting sudden death in the population: the Paris Prospective Study I. Circulation 1999; 99(15): 1978 - 1983. Doi: 10.1161/01.cir.99.15.1978.
40. Dekker LRC., Bezzina CR., Henriques JPS., et al. Familial sudden death is an important risk factor for primary ventricular fibrillation: a case-control study in acute myocardial infarction patients. Circulation 2006; 114(11): 1140 - 1145. Doi: 10.1161/CIRCULATIONAHA.105.606145.
41. Deo R., Norby FL., Katz R., et al. Development and validation of a sudden cardiac death prediction model for the general population. Circulation 2016; 134(11): 806 - 816. Doi: 10.1161/CIRCULATIONAHA.116.023042.
42. Yoshinaga M., Ushinohama H., Sato S., et al. Etectrocardiographic screening of 1-month-old infants for identifying prolonged QT intervals. Circulation: Arrhythmia and Electrophysiology 2013; 6(5): 932 - 938. Doi: 10.1161/CIRCEP.113.000619.
43. Boas R., Sappler N., von  , et al Periodic repolarization dynamics identifies ICD-responders in non-ischemic cardiomyopathy: a DANISH substudy. Circulation 2022; 145(10): 754 - 764. Doi: 10.1161/CIRCULATIONAHA.121.056464.
, et al Periodic repolarization dynamics identifies ICD-responders in non-ischemic cardiomyopathy: a DANISH substudy. Circulation 2022; 145(10): 754 - 764. Doi: 10.1161/CIRCULATIONAHA.121.056464.
44. Spirito P., Bellone P., Harris K.M., et al. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. The New England Journal of Medicine 2000; 342(24): 1778 - 1785. Doi: 10.1056/NEJM200006153422403.
45. Barsheshet A., Goldenberg I., O-Uchi J., et al. Mutations in cytoplasmic loops of the KCNQ1 channel and the risk of life-threatening events: implications for mutation-specific response to  therapy in type 1 long-QT syndrome. Circulation 2012; 125(16): 1988 - 1996. Doi: 10.1161/CIRCULATIONAHA.111.048041.
therapy in type 1 long-QT syndrome. Circulation 2012; 125(16): 1988 - 1996. Doi: 10.1161/CIRCULATIONAHA.111.048041.
46. Wahbi K., Ben Yaou R., Gandjbakhch E., et al. Development and validation of a new risk prediction score for life-threatening ventricular tachyarrhythmias in laminopathies / // Circulation. 2019; 140(4): 293 - 302. Doi: 10.1161/CIRCULATIONAHA.118.039410.
47. Cadrin-Tourigny J., Bosman L.P., Nozza A., et al. A new prediction model for ventricular arrhythmias in arrhythmogenic right ventricular cardiomyopathy. European Heart Journal 2019; 40(23): 1850 - 1858. Doi: 10.1093/eurheartj/ehz103.
48. Steyerberg E.W., Vergouwe Y. Steyerberg E.W. Towards better clinical prediction models: seven steps for development and an ABCD for validation. European Heart Journal 2014; 35(29): 1925 - 1931. Doi: 10.1093/eurheartj/ehu207.
49. Collins G.S., Reitsma J.B., Altman D.G., et al. TRIPOD Group. Transparent reporting of a multivariable prediction model for inpidual prognosis or diagnosis (TRIPOD): the TRIPOD statement. Circulation 2015; 350: g7594. Doi: 10.1136/bmj.g7594.
50. Zipes D.P., Camm A.J., Borggrefe M., et al. ACC/AHA/ЕОК 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Circulation 2006; 114(10): e385 - 484. Doi: 10.1161/CIRCULATIONAHA.106.178233.
51. Priori SG.,  , Mazzanti A., Blom N., Borggrefe M., Camm J., Elliott PM., Fitzsimons D., Hatala R., Hindricks G., et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015; 36(41): 2793 - 2867. Doi: 10.1093/eurheartj/ehv316.
, Mazzanti A., Blom N., Borggrefe M., Camm J., Elliott PM., Fitzsimons D., Hatala R., Hindricks G., et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015; 36(41): 2793 - 2867. Doi: 10.1093/eurheartj/ehv316.
52. Keren A, Tzivoni D., Gavish D., Levi J., Gottlieb S., Benhorin J., Stern S. Etiology, warning signs and therapy of torsade de pointes. A study of 10 patients. Circulation 1981; 64(6): 1167 - 74. Doi: 10.1161/01.cir.64.6.1167.
53. Bhandari AK., Shapiro WA., Morady F., Shen EN., Mason J., Scheinman MM. Electrophysiologic testing in patients with the long QT syndrome. Circulation 1985; 71(1): 63 - 71. Doi: 10.1161/01.cir.71.1.63.
54. Piepoli MF., Hoes AW., Agewall S., Albus C., Brotons C., Catapano AL., Cooney MT.,  , Cosyns B., Deaton C., et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016; 37(29): 2315 - 81. Doi: 10.1093/eurheartj/ehw106.
, Cosyns B., Deaton C., et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016; 37(29): 2315 - 81. Doi: 10.1093/eurheartj/ehw106.
55. Casella M., Carbucicchio C., Russo E., Pizzamiglio F., Golia P., Conti S., Costa F., Dello Russo A., Tondo C. Electrical storm in systemic sclerosis: Inside the electroanatomic substrate. World J Cardiol 2014; 6(10): 1127 - 30. Doi: 10.4330/wjc.v6.i10.1127.
56. Apshtein A.E., Ideker R.E. Ventricular Fibrillation in "Cardiac Electrophysiology. From Cell to Bedside". Saunders Company 2000: 677 - 684.
57. Epstein AE., Dimarco JP., Ellenbogen KA., Estes NA 3rd., Freedman RA., Gettes LS., Gillinov AM., Gregoratos G., Hammill SC., Hayes DL., Hlatky MA., et al. ACC/AHA/HRS 2008 Guidelines for device-based therapy of cardiac rhythm abnormalities. Heart Rhythm 2008; 5(6): 1 - 62. Doi: 10.1016/j.hrthm.2008.04.014.
58. Avanzas P., Arroyo-Espliguero R.,  , Quiles J., Zouridakis E., Kaski JC. Multiple complex stenoses, high neutrophil count and C-reactive protein levels in patients with chronic stable angina. Atherosclerosis; 175(1): 151 - 57. Doi: 10.1016/j.atherosclerosis.2004.03.013.
, Quiles J., Zouridakis E., Kaski JC. Multiple complex stenoses, high neutrophil count and C-reactive protein levels in patients with chronic stable angina. Atherosclerosis; 175(1): 151 - 57. Doi: 10.1016/j.atherosclerosis.2004.03.013.
59.  ,
,  ,
,  ,
,  , Sanchis J., Husser O.,
, Sanchis J., Husser O.,  Low lymphocyte count and cardiovascular diseases. Curr Med Chem 2011; 18(21): 3226 - 33. Doi: 10.2174/092986711796391633.
Low lymphocyte count and cardiovascular diseases. Curr Med Chem 2011; 18(21): 3226 - 33. Doi: 10.2174/092986711796391633.
60. Suh S., Cho YR., Park MK., Kim DK., Cho NH., Lee MK. Relationship between serum bilirubin levels and cardiovascular disease. PLoS One 2018; 13(2). Doi: 10.1371/journal.pone.0193041. eCollection 2018.
61. Alexander CM., Landsman PB., Teutsch SM. Diabetes mellitus, impaired fasting glucose, atherosclerotic risk factors, and prevalence of coronary heart disease. Am J Cardiol 2000; 86(9): 897 - 902. Doi: 10.1016/s0002-9149(00) 01118-8.
62. Pilarczyk K., Carstens H., Heckmann J., Canbay A., Koch A., Pizanis N., Jakob H., Kamler M. The aspartate transaminase/alanine transaminase (DeRitis) ratio predicts mid-term mortality and renal and respiratory dysfunction after left ventricular assist device implantation. Eur J Cardiothorac Surg 2017; 52(4): 781 - 88. Doi: 10.1093/ejcts/ezx247.
63. Narita K., Ureshino H., Hashimoto S. Sustained ventricular tachycardia caused by subacute thyroiditis. Intern Med J 2018; 48(9): 1160 - 62. Doi: 10.1111/imj.14018.
64. Tsai IH., Su YJ. Thyrotoxic periodic paralysis with ventricular tachycardia. Electrocardiol 2019; 54: 93 - 5. Doi: 10.1016/j.jelectrocard.2019.04.001.
65. Лебедев Д.С., Васичкина Е.С., Татарский Р.Б. Желудочковые тахиаритмии у детей. Р.Б. - СПб.: 2018. - 120 с.
66. Cheitlin MD., Armstrong WF., Aurigemma GP., Beller GA., Bierman FZ., Davis JL., Douglas PS., Faxon DP., Gillam LD., Kimball TR., et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography - summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation 2003; 108(9): 1146 - 62. Doi: 10.1161/01.CIR.0000073597.57414.A9.
67. Podrid PJ., Graboys TB. Exercise stress testing in the management of cardiac rhythm disorders. Med Clin North Am 1984; 68(5): 1139 - 52. Doi: 10.1016/s0025-7125(16) 31089-6.
68. Prastaro M., D'Amore C., Paolillo S., Losi M., Marciano C., Perrino C., Ruggiero D., Gargiulo P., Savarese G., Trimarco B., et al. Prognostic role of transthoracic echocardiography in patients affected by heart failure and reduced ejection fraction. Heart Fail Rev 2015; 20(3): 305 - 16. Doi: 10.1007/s10741-014-9461-8.
69. Zellweger MJ., Hachamovitch R., Kang X., Hayes SW., Friedman JD., Germano G., Berman DS. Threshold, incidence, and predictors of prognostically high-risk silent ischemia in asymptomatic patients without prior diagnosis of coronary artery disease. J Nucl Cardiol 2009; 16(2): 193 - 200. Doi: 10.1007/s12350-008-9016-2.
70. Volosin K., Stadler RW., Wyszynski R., Kirchhof P. Tachycardia detection performance of implantable loop recorders: results from a large 'real-life' patient cohort and patients with induced ventricular arrhythmias. Europace 2013; 15(8): 1215 - 22. Doi: 10.1093/europace/eut036.
71. de Asmundis C., Conte G., Sieira J., Chierchia GB., Rodriguez-Manero M., Di Giovanni G., Ciconte G., Levinstein M., Baltogiannis G., Saitoh Y., et al. Comparison of the patient-activated event recording system vs. traditional 24 h Holter electrocardiography in inpiduals with paroxysmal palpitations or dizziness. Europace 2014; 16(8): 1231 - 5. Doi: 10.1093/europace/eut411.
72. Kang X., Berman DS., Lewin H., Miranda R., Erel J., Friedman JD., Amanullah AM. Comparative ability of myocardial perfusion single-photon emission computed tomography to detect coronary artery disease in patients with and without diabetes mellitus. Am Heart J 1999; 137(5): 949 - 57. Doi: 10.1016/s0002-8703(99) 70421-7.
73.  ,
,  , Andres J.,
, Andres J.,  , Sadowski J.,
, Sadowski J.,  Ten-year experience of an invasive cardiology centre with out-of-hospital cardiac arrest patients admitted for urgent coronary angiography. Kardiol Pol 2014; 72(8): 687 - 99. Doi: 10.5603/KP. a2014.0088.
Ten-year experience of an invasive cardiology centre with out-of-hospital cardiac arrest patients admitted for urgent coronary angiography. Kardiol Pol 2014; 72(8): 687 - 99. Doi: 10.5603/KP. a2014.0088.
74. Zaman S., Narayan A., Thiagalingam A., Sivagangabalan G., Thomas S., Ross DL., Kovoor P. Significance of repeat programmed ventricular stimulation at electrophysiology study for arrhythmia prediction after acute myocardial infarction. Pacing Clin Electrophysiol 2014; 37(7): 795 - 802. Doi: 10.1111/pace.12391.
75. Denes P., Uretz E., Ezri MD., Borbola J. Clinical predictors of electrophysiologic findings in patients with syncope of unknown origin. Arch Intern Med 1988; 148(9): 1922 - 8.
76. Speranzon A., Chicco D., Bonazza P., D'Alfonso R., Bobbo M., D'Agata Mottolese B., Barbi E., Caiffa T. Brugada Syndrome: Focus for the General Pediatrician. Children (Basel) 2024; 11(3): 281. Doi: 10.3390/children11030281.
77. Brignole M., Menozzi C., Moya A., Garcia-Civera R., Mont L., Alvarez M., Errazquin F., Beiras J., Bottoni N., Donateo P. International Study on Syncope of Uncertain Etiology (ISSUE) Investigators. Mechanism of syncope in patients with bundle branch block and negative electrophysiological test. Circulation 2001; 104(17): 2045 - 50. Doi: 10.1161/hc4201.097837.
78. Yuhas J., Mattocks K., Gravelin L., Remetz M., Foley J., Fazio R., Lampert R. Patients' attitudes and perceptions of implantable cardioverter-defibrillators: potential barriers to appropriate primary prophylaxis. Pacing Clin Electrophysiol 2012; 35(10): 1179 - 87. Doi: 10.1111/j.1540-8159.2012.03497.x.
79. St John Sutton M., Pfeffer MA., Plappert T., Rouleau JL.,  , Dagenais GR., Lamas GA., Klein M., Sussex B., Goldman S., et al. Quantitative two-dimensional echocardiographic measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation 1994; 89(1): 68 - 75. Doi: 10.1161/01.cir.89.1.68.
, Dagenais GR., Lamas GA., Klein M., Sussex B., Goldman S., et al. Quantitative two-dimensional echocardiographic measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation 1994; 89(1): 68 - 75. Doi: 10.1161/01.cir.89.1.68.
80. Adler A., van der Werf C., Postema PG., Rosso R., Bhuiyan ZA., Kalman JM., Vohra JK., Guevara-Valpia ME., Marquez MF., Halkin A., et al. The phenomenon of "QT stunning": the abnormal QT prolongation provoked by standing persists even as the heart rate returns to normal in patients with long QT syndrome. Heart Rhythm 2012; 9(6): 901 - 8. Doi: 10.1016/j.hrthm.2012.01.026.
81. Ackerman MJ., Priori SG., Willems S., Berul C., Brugada R., Calkins H., Camm AJ., Ellinor PT., Gollob M., Hamilton R., et al. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Heart Rhythm 2011; 8(8): 1308 - 39. Doi: 10.1016/j.hrthm.2011.05.020.
82. Wilde AAM., Semsarian C.,  , Shamloo AS., Ackerman MJ., Ashley EA., Sternick EB., Barajas-Martinez H., Behr ER., Bezzina CR., et al. Developed in partnership with and endorsed by the European Heart Rhythm Association (EHRA), a branch of the European Society of Cardiology (ESC), the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), and the Latin American Heart Rhythm Society (LAHRS). European Heart Rhythm Association (EHRA)/Heart Rhythm Society (HRS)/Asia Pacific Heart Rhythm Society (APHRS)/Latin American Heart Rhythm Society (LAHRS) Expert Consensus Statement on the state of genetic testing for cardiac diseases. Europace 2022; 24(8): 1307 - 1367. Doi: 10.1093/europace/euac030.
, Shamloo AS., Ackerman MJ., Ashley EA., Sternick EB., Barajas-Martinez H., Behr ER., Bezzina CR., et al. Developed in partnership with and endorsed by the European Heart Rhythm Association (EHRA), a branch of the European Society of Cardiology (ESC), the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), and the Latin American Heart Rhythm Society (LAHRS). European Heart Rhythm Association (EHRA)/Heart Rhythm Society (HRS)/Asia Pacific Heart Rhythm Society (APHRS)/Latin American Heart Rhythm Society (LAHRS) Expert Consensus Statement on the state of genetic testing for cardiac diseases. Europace 2022; 24(8): 1307 - 1367. Doi: 10.1093/europace/euac030.
83. Adler A., Novelli V., Amin AS., Abiusi E., Care M., Nannenberg EA., Feilotter H., Amenta S., Mazza D., Bikker H., et al. An International, Multicentered, Evidence-Based Reappraisal of Genes Reported to Cause Congenital Long QT Syndrome. Circulation 2020; 141(6): 418 - 428. Doi: 10.1161/CIRCULATIONAHA.119.043132.
84. Casey JP.,  , McGorrian C., Galvin J., Blenski M., Dunne A., Ennis S., Brett F., King MD., Arnesen T., et al. NAA10 mutation causing a novel intellectual disability syndrome with Long QT due to N-terminal acetyltransferase impairment. Sci Rep 2015; 5: 16022. Doi: 10.1038/srep16022.
, McGorrian C., Galvin J., Blenski M., Dunne A., Ennis S., Brett F., King MD., Arnesen T., et al. NAA10 mutation causing a novel intellectual disability syndrome with Long QT due to N-terminal acetyltransferase impairment. Sci Rep 2015; 5: 16022. Doi: 10.1038/srep16022.
85. Hosseini SM., Kim R., Costain G., et al. Reappraisal of reported genes for sudden arrhythmic death: evidence-based evaluation of gene validity for Brugada syndrome. Circulation 2018; 138(12): 1195 - 1205. Doi: 10.1161/CIRCULATIONAHA.118.035070.
86. Yamagata K., Horie M., Aiba T., et al. Genotype-Phenotype Correlation of SCN5A Mutation for the Clinical and Electrocardiographic Characteristics of Probands With Brugada Syndrome A Japanese Multicenter Registry. Circulation 2017; 135(23): 2255 - 2270. Doi: 10.1161/CIRCULATIONAHA.117.027983.
87. Giudicessi JR., Ackerman MJ. Exercise testing oversights underlie missed and delayed diagnosis of catecholaminergic polymorphic ventricular tachycardia in young sudden cardiac arrest survivors. Heart Rhythm 2019; 16(8): 1232 - 1239. Doi: 10.1016/j.hrthm.2019.02.012.
88. Corrado D., Perazzolo Marra M., Zorzi A., et al. Diagnosis of arrhythmogenic cardiomyopathy: the Padua criteria. International Journal Cardiology 2020; 319(15): 106 - 114. Doi: 10.1016/j.ijcard.2020.06.005.
89. Walsh R., Thomson KL., Ware JS., et al. Reassessment of Mendelian gene pathogenicity using 7,855 cardiomyopathy cases and 60,706 reference samples. Genetics in Medicine 2017; 19(2): 192 - 203. Doi: 10.1038/gim.2016.90.
90. Corrado D., van Tintelen PJ., McKenna WJ., Hauer RNW., et al. Arrhythmogenic right ventricular cardiomyopathy: evaluation of the current diagnostic criteria and differential diagnosis. European Heart Journal 2020; 41(14): 1414 - 1429. Doi: 10.1093/eurheartj/ehz669.
91. Tester DJ., Medeiros-Domingo A., Will ML., Haglund CM., et al. Cardiac channel molecular autopsy: insights from 173 consecutive cases of autopsynegative sudden unexplained death referred for postmortem genetic testing. Mayo Clinic Proceedings 2012 Jun; 87(6): 524 - 39. Doi: 10.1016/j.mayocp.2012.02.017.
92. Nucifora G., Muser D., Masci PG., et al. Prevalence and prognostic value of concealed structural abnormalities in patients with apparently idiopathic ventricular arrhythmias of left versus right ventricular origin: a magnetic resonance imaging study. Circulation: Arrhythmia and Electrophysiology 2014; 7(3): 456 - 62. Doi: 10.1161/CIRCEP.113.001172.
93. Curcio A., Mazzanti A., Bloise R., et al. Clinical presentation and outcome of Brugada syndrome diagnosed with the new 2013 criteria. Journal of Cardiovascular Electrophysiology 2016; 27(8): 937 - 943. Doi: 10.1111/jce.12997.
94. Bjune T., Risgaard B., Kruckow L., Glinge C., et al. Post-mortem toxicology in young sudden cardiac death victims: a nationwide co- hort study. Europace 2018; 20(4): 614 - 621. Doi: 10.1093/europace/euw435.
95. Papadakis M., Raju H., Behr ER., et al. Sudden cardiac death with autopsy findings of uncertain significance: potential for erroneous interpretation. Circulation: Arrhythmia and Electrophysiology 2013; 6(3): 588 - 96. Doi: 10.1161/CIRCEP.113.000111.
96. Van der Werf C., Hofman N., Tan HL., et al. Diagnostic yield in sudden unexplained death and aborted cardiac arrest in the young: the experience of a tertiary referral center in The Netherlands. Heart Rhythm 2010; 7(10): 1383 - 1389. Doi: 10.1016/j.hrthm.2010.05.036.
97. Wong LCH., Roses-Noguer F., Till JA., et al. Cardiac evaluation of pediatric relatives in sudden arrhythmic death syndrome: a 2-center experience. Circulation: Arrhythmia and Electrophysiology 2014; 7(5): 800 - 806. Doi: 10.1161/CIRCEP.114.001818.
98. Behr ER., Dalageorgou C., Christiansen M., Syrris P., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. European Heart Journal 2008; 29(13): 1670 - 1680. Doi: 10.1093/eurheartj/ehn219.
99. Madhavan M., Friedman PA., Lennon RJ., et al. Implantable cardioverter-defibrillator therapy in patients with ventricular fibrillation out of hospital cardiac arrest secondary to acute coronary syndrome. Journal of the American Heart Association 2015; 4(2): e001255. Doi: 10.1161/JAHA.114.001255.
100. Gibbs C., Thalamus J., Heldal K.,  , Haugaa KH., Hysing J. Predictors of mortality in high-risk patients with QT prolongation in a community hospital. Europace 2018; 20(FI1): 99 - 107. Doi: 10.1093/europace/eux286.
, Haugaa KH., Hysing J. Predictors of mortality in high-risk patients with QT prolongation in a community hospital. Europace 2018; 20(FI1): 99 - 107. Doi: 10.1093/europace/eux286.
101. Simpson TF., Salazar JW., Vittinghoff E., Probert J., Iwahashi A., Olgin JE., Ursell P., Hart A., Moffatt E., Tseng ZH. Association of QT-Prolonging Medications With Risk of Autopsy-Defined Causes of Sudden Death. JAMA Intern Med 2020; 180(5): 698 - 706. Doi: 10.1001/jamainternmed.2020.0148.
102. Brugada J., Blom N., Sarquella-Brugada G., Blomstrom-Lundqvist C., Deanfield J., Janousek J., Abrams D., Bauersfeld U., Brugada R., Drago F., et al. Pharmacological and non-pharmacological therapy for arrhythmias in the pediatric population: EHRA and AEPC-Arrhythmia Working Group joint consensus statement. Europace 2013; 15(9): 1337 - 82. Doi: 10.1093/europace/eut082.
103. Schupp T., Behnes M., Zworowsky MV., Kim SH., Weidner K., Rusnak J., Kuche P.,  , Barth C., Reiser L., et al. Hypokalemia but not Hyperkalemia is Associated with Recurrences of Ventricular Tachyarrhythmias in ICD Recipients. Clin Lab 2020; 66(3). Doi: 10.7754/Clin.Lab.2019.190645.
, Barth C., Reiser L., et al. Hypokalemia but not Hyperkalemia is Associated with Recurrences of Ventricular Tachyarrhythmias in ICD Recipients. Clin Lab 2020; 66(3). Doi: 10.7754/Clin.Lab.2019.190645.
104. Goyal A., Spertus JA., Gosch K., Venkitachalam L., Jones PG., Van den Berghe G., Kosiborod M. Serum potassium levels and mortality in acute myocardial infarction. JAMA 2012; 307(2): 157 - 64. Doi: 10.1001/jama.2011.1967.
105. Tzivoni D., Banai S., Schuger C., Benhorin J., Keren A., Gottlieb S., Stern S. Treatment of torsade de pointes with magnesium sulfate. Circulation 1988; 77(2): 392 - 7. Doi: 10.1161/01.cir.77.2.392.
106. Van de Voorde P., Turner NM., Djakow J., de Lucas N., Martinez-Mejias A., Biarent D., Bingham R., Brissaud O., Hoffmann F., Johannesdottir GB., et al. European Resuscitation Council Guidelines 2021: Paediatric Life Support. Resuscitation 2021; 161: 327 - 387. Doi: 10.1016/j.resuscitation.2021.02.015.
107. Soar J., Perkins GD., Maconochie I.,  , Deakin CD., Sandroni C., Olasveengen TM., Wyllie J., Greif R., Lockey A., et al. European Resuscitation Council Guidelines for Resuscitation: 2018 Update - Antiarrhythmic drugs for cardiac arrest. Resuscitation 2019; 134: 99 - 103. Doi: 10.1016/j.resuscitation.2018.11.018.
, Deakin CD., Sandroni C., Olasveengen TM., Wyllie J., Greif R., Lockey A., et al. European Resuscitation Council Guidelines for Resuscitation: 2018 Update - Antiarrhythmic drugs for cardiac arrest. Resuscitation 2019; 134: 99 - 103. Doi: 10.1016/j.resuscitation.2018.11.018.
108. Балыкова Л.А., Назарова И.С., Тишина А.Н. Лечение аритмий сердца у детей. Практическая медицина 2011; 53: 30 - 37.
109. Wyse DG., Friedman PL., Brodsky MA., Beckman KJ., Carlson MD., Curtis AB., Hallstrom AP., Raitt MH., Wilkoff BL., Greene HL.; AVID Investigators. Life-threatening ventricular arrhythmias due to transient or correctable causes: high risk for death in follow-up. J Am Coll Cardiol 2001; 38(6): 1718 - 24. Doi: 10.1016/s0735-1097(01) 01597-2.
110. Ladejobi A., Pasupula DK., Adhikari S., Javed A., Durrani AF., Patil S., Qin D., Ahmad S., Munir MB., Rijal S., et al. Implantable Defibrillator Therapy in Cardiac Arrest Survivors With a Reversible Cause. Circ Arrhythm Electrophysiol 2018; 11(3): e005940. doi: 10.1161/CIRCEP.117.005940.
111. Silvetti, M.S.; Colonna, D.; Gabbarini, F.; Porcedda, G.; Rimini, A.; D'Onofrio, A.; Leoni, L. New Guidelines of Pediatric Cardiac Implantable Electronic Devices: What Is Changing in Clinical Practice? J. Cardiovasc. Dev. Dis 2024, 11(4): 99. Doi: 10.3390/jcdd11040099.
112. Link MS., Berkow LC., Kudenchuk PJ., Halperin HR., Hess EP., Moitra VK., Neumar RW., O'Neil BJ., Paxton JH., Silvers SM., et al. Part 7: Adult Advanced Cardiovascular Life Support: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2015; 132(18 Suppl 2): S444 - 64. Doi: 10.1161/CIR.0000000000000261.
113. Stiell IG., Wells GA., Field B., Spaite DW., Nesbitt LP., De Maio VJ., Nichol G., Cousineau D., Blackburn J., Munkley D., et al. Advanced cardiac life support in out-of-hospital cardiac arrest. N Engl J Med 2004; 351(7): 647 - 56. Doi: 10.1056/NEJMoa040325.
114. Sasson C., Rogers MA., Dahl J., Kellermann AL. Predictors of survival from out-of-hospital cardiac arrest: a systematic review and meta-analysis. Circ Cardiovasc Qual Outcomes 2010; 3(1): 63 - 81. Doi: 10.1161/CIRCOUTCOMES.109.889576.
115. Cobb LA., Fahrenbruch CE., Walsh TR., Copass MK., Olsufka M., Breskin M., Hallstrom AP. Influence of cardiopulmonary resuscitation prior to defibrillation in patients with out-of-hospital ventricular fibrillation. JAMA 1999; 281(13): 1182 - 8. Doi: 10.1001/jama.281.13.1182.
116. Cronin EM., Bogun FM., Maury P., Peichl P., et al. 2019 HRS/EHRA/APHRS/LAHRS expert consensus statement on catheter ablation of ventricular arrhythmias. Europace 2019; 21(8): 1143 - 1144. Doi: 10.1093/europace/euz132.
117. Van de Voorde P, Turner NM, Djakow J, de Lucas N, Martinez-Mejias A, Biarent D, Bingham R, Brissaud O, Hoffmann F, Johannesdottir GB, Lauritsen T, Maconochie I. European Resuscitation Council Guidelines 2021: Paediatric Life Support. Resuscitation. 2021 Apr; 161: 327 - 387.
118. Carolina Ornelas-Dorian, Kevin R., William B., Amal M., Jeffrey T. Assessment and Management of a Child With Wide Complex Tachycardia. Annals of Emergency Medicine 2024. 83: 42 - 45. Doi: 10.1016/j.annemergmed.2023.08.007.
119. Dorian P., Cass D., Schwartz B., Cooper R., Gelaznikas R., Barr A. Amiodarone as compared with lidocaine for shock-resistant ventricular fibrillation. N Engl J Med 2002; 346(12): 884 - 90. Doi: 10.1056/NEJMoa013029.
120. Kudenchuk PJ., Brown SP., Daya M., Rea T., Nichol G., Morrison LJ., Leroux B., Vaillancourt C., Wittwer L., Callaway CW., et al. Resuscitation Outcomes Consortium Investigators. Amiodarone, Lidocaine, or Placebo in Out-of-Hospital Cardiac Arrest. N Engl J Med 2016; 374(18): 1711 - 22. Doi: 10.1056/NEJMoa1514204.
121. Herlitz J.,  , Wennerblom B., Axelsson A.,
, Wennerblom B., Axelsson A.,  , Lindkvist J., Persson NG., Holmberg S. Lidocaine in out-of-hospital ventricular fibrillation. Does it improve survival? Resuscitation 1997; 33(3): 199 - 205. Doi: 10.1016/s0300-9572(96) 01018-0.
, Lindkvist J., Persson NG., Holmberg S. Lidocaine in out-of-hospital ventricular fibrillation. Does it improve survival? Resuscitation 1997; 33(3): 199 - 205. Doi: 10.1016/s0300-9572(96) 01018-0.
122. Gueugniaud PY., Mols P., Goldstein P., Pham E., Dubien PY., Deweerdt C., Vergnion M., Petit P., Carli P. A comparison of repeated high doses and repeated standard doses of epinephrine for cardiac arrest outside the hospital. European Epinephrine Study Group. N Engl J Med 1998; 339(22): 1595 - 601. Doi: 10.1056/NEJM199811263392204.
123. Hagihara A., Hasegawa M., Abe T., Nagata T., Wakata Y., Miyazaki S. Prehospital epinephrine use and survival among patients with out-of-hospital cardiac arrest. JAMA 2012; 307(11): 1161 - 8. Doi: 10.1001/jama.2012.294.
124. Maconochie IK., Aickin R., Hazinski MF., Atkins DL., Bingham R., Couto TB., Guerguerian AM., Nadkarni VM., Ng KC., Nuthall GA., et al. Pediatric Life Support Collaborators. Pediatric Life Support: 2020 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations. Resuscitation 2020; 156: A120-A155. Doi: 10.1016/j.resuscitation.2020.09.013.
125. Topjian AA., Raymond TT., Atkins D., Chan M., Duff JP., Joyner BL Jr., Lasa JJ., Lavonas EJ., Levy A., Mahgoub M., et al. Pediatric Basic and Advanced Life Support Collaborators. Part 4: Pediatric Basic and Advanced Life Support: 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2020; 142(16_suppl_2): S469-S523. Doi: 10.1161/CIR.0000000000000901.
126. Long B., Koyfman A. Best Clinical Practice: Emergency Medicine Management of Stable Monomorphic Ventricular Tachycardia. J Emerg Med 2017; 52(4): 484 - 492. Doi: 10.1016/j.jemermed.2016.09.010.
127. Tang PT., Do DH., Li A., Boyle NG. Team Management of the Ventricular Tachycardia Patient. Arrhythm Electrophysiol Rev 2018; 7(4): 238 - 246. Doi: 10.15420/aer.2018.37.2.
128. Ohlow MA., Beierlein A.,  , von Korn H., Geller JC., Yu J., Lauer B. Stable tachycardia with wide QRS complex in pre-hospital emergency medicine. Dtsch Med Wochenschr 2005; 130(47): 2694 - 8. Doi: 10.1055/s-2005-922056.
, von Korn H., Geller JC., Yu J., Lauer B. Stable tachycardia with wide QRS complex in pre-hospital emergency medicine. Dtsch Med Wochenschr 2005; 130(47): 2694 - 8. Doi: 10.1055/s-2005-922056.
129. Patel KK., Spertus JA., Khariton Y., Tang Y., Curtis LH., Chan PS. American Heart Association's Get With the Guidelines-Resuscitation Investigators. Association Between Prompt Defibrillation and Epinephrine Treatment With Long-Term Survival After In-Hospital Cardiac Arrest. Circulation 2018; 137(19): 2041 - 2051. Doi: 10.1161/CIRCULATIONAHA.117.030488.
130. Eckardt L., Breithardt G., Kirchhof P. Approach to wide complex tachycardias in patients without structural heart disease. Heart 2006; 92(5): 704 - 11. Doi: 10.1136/hrt.2005.063792.
131. Hudson KB., Brady WJ., Chan TC., Pollack M., Harrigan RA. Electrocardiographic manifestations: ventricular tachycardia. J Emerg Med 2003; 25(3): 303 - 14. Doi: 10.1016/s0736-4679(03) 00207-5.
132. Miller JM., Das MK., Yadav AV., Bhakta D., Nair G, Alberte C. Value of the 12-lead ECG in wide QRS tachycardia. Cardiol Clin 2006; 24(3): 439 - 51. Doi: 10.1016/j.ccl.2006.03.003.
133. Goldberger ZD., Rho RW., Page RL. Approach to the diagnosis and initial management of the stable adult patient with a wide complex tachycardia. Am J Cardiol 2008; 101(10): 1456 - 66. Doi: 10.1016/j.amjcard.2008.01.024.
134. Abedin Z. Differential diagnosis of wide QRS tachycardia: A review. J Arrhythm 2021; 37(5): 1162 - 1172. Doi: 10.1002/joa3.12599.
135. Marill KA., Wolfram S., Desouza IS., Nishijima DK., Kay D., Setnik GS., Stair TO., Ellinor PT. Adenosine for wide-complex tachycardia: efficacy and safety. Crit Care Med 2009; 37(9): 2512 - 8. Doi: 10.1097/CCM.0b013e3181a93661.
136. Sharma AD, Klein GJ, Yee R. Intravenous adenosine triphosphate during wide QRS complex tachycardia: safety, therapeutic efficacy, and diagnostic utility. Am J Med. 1990 Apr; 88(4): 337 - 43.
137. Brugada J., Katritsis D.G., Arbelo E., et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardia. The task force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). European Heart Journal 2020; 41(5): 655 - 720. Doi: 10.1093/eurheartj/ehz467.
138. Ortiz M.,  , Arribas F., Coll-Vinent B., Del Arco C., Peinado R., Almendral J. PROCAMIO Study Investigators. Randomized comparison of intravenous vs. intravenous for the acute treatment of tolerated wide QRS tachycardia: the PROCAMIO study. Eur Heart J 2017; 38(17): 1329 - 1335. Doi: 10.1093/eurheartj/ehw230.
, Arribas F., Coll-Vinent B., Del Arco C., Peinado R., Almendral J. PROCAMIO Study Investigators. Randomized comparison of intravenous vs. intravenous for the acute treatment of tolerated wide QRS tachycardia: the PROCAMIO study. Eur Heart J 2017; 38(17): 1329 - 1335. Doi: 10.1093/eurheartj/ehw230.
139. Buxton AE., Marchlinski FE., Doherty JU., et al. Repetitive, monomorphic ventricular tachycardia: clinical and electrophysiologic characteristics in patients with and patients without organic heart disease. American Journal of Cardiology 1984; 54(8): 997 - 1002. Doi: 10.1016/s0002-9149(84) 80133-2.
140. Griffith MJ., Garratt CJ., Rowland E., et al. Effects of intravenous adenosine on verapamil-sensitive 'idiopathic' ventricular tachycardia. American Journal of Cardiology 1994; 73(11): 759 - 64. Doi: 10.1016/0002-9149(94) 90877-x.
141. Buxton AE., Marchlinski FE., Doherty JU., et. al. Hazards of intravenous verapamil for sustained ventricular tachycardia. American Journal of Cardiology 1987; 59(12): 1107 - 1110. Doi: 10.1016/0002-9149(87) 90857-5.
142. Rankin AC., Rae A.P., Cobbe SM. Misuse of intravenous verapamil in patients with ventricular tachycardia. Lancet 1987; 2(8557): 472 - 474. Doi: 10.1016/s0140-6736(87) 91790-9.
143. Kehr J, Binfield A, Maxwell F, Hornung T, Skinner JR. Fascicular tachycardiain infancy and the use of verapamil: a case series and literature review. Arch Dis Child 2019; 104(8): 789 - 792. Doi: 10.1136/archdischild-2018-315617.
144. Pedersen CT., Kay GN., Kalman J., Borggrefe M., et al. EHRA/HRS/APHRS expert consensus on ventricular arrhythmias. Europace 2014; 16(9): 1257 - 1283. Doi: 10.1093/europace/euu194.
145. Kowlgi GN., Cha Y-M. Management of ventricular electrical storm: a contemporary appraisal. Europace 2020; 22(12): 1768 - 1780. Doi: 10.1093/europace/euaa232.
146. Guerra F., Shkoza M., Scappini L., Flori M., et al. Role of electrical storm as a mortality and morbidity risk factor and its clinical predictors: a meta-analysis. Europacen 2014; 16(3): 347 - 353. Doi: 10.1093/europace/eut304.
147. Noda T., Kurita T., Nitta T., Chiba Y., et al. Significant impact of electrical storm on mortality in patients with structural heart disease and an implantable cardiac defibrillator. International Journal of Cardiology 2018; 255(15): 85 - 91. Doi: 10.1016/j.ijcard.2017.11.077.
148. Soar J., Maconochie I., Wyckoff MH., Olasveengen TM., et al. 2019 International consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations: summary from the basic life support; advanced life support; pediatric life support; neonatal life support; education, implementation, and teams; and first aid task force. Circulation 2019; 140(24): e826-e880. Doi: 10.1161/CIR.0000000000000734.
149. Eifling M., Razavi M., Massumi A. The evaluation and management of electrical storm. Texas Heart Institute Journal 2011; 38(2): 111 - 21.
150. Chatzidou S., Kontogiannis C., Tsilimigras DI., et al. Propranolol versus metoprolol for treatment of electrical storm in patients with implantable cardioverter-defibrillator. Journal of the American College of Cardiology 2018; 71(17): 1897 - 1906. Doi: 10.1016/j.jacc.2018.02.056.
151. Connolly SJ., Dorian P., Roberts RS., Gent M., et al. Comparison of beta-blockers, amiodarone plus beta-blockers, or sotalol for prevention of shocks from implantable cardioverter defibrillators: the OPTIC Study: a randomized trial. JAMA 2006; 295(2): 165 - 71. Doi: 10.1001/jama.295.2.165.
152. Gorgels AP., van den Dool A., Hofs A., Mulleneers R., Smeets JL., Vos MA., Wellens HJ. Comparison of procainamide and lidocaine in terminating sustained monomorphic ventricular tachycardia. Am J Cardiol 1996; 78(1): 43 - 6. Doi: 10.1016/s0002-9149(96) 00224-x.
153.  , Simancas-Racines D., Anand V., Bangdiwala S. Prophylactic lidocaine for myocardial infarction. Cochrane Database Syst Rev 2015; 2015(8): CD008553. Doi: 10.1002/14651858.CD008553.pub2.
, Simancas-Racines D., Anand V., Bangdiwala S. Prophylactic lidocaine for myocardial infarction. Cochrane Database Syst Rev 2015; 2015(8): CD008553. Doi: 10.1002/14651858.CD008553.pub2.
154. Martins RP, Urien JM, Barbarot N, Rieul G, Sellal JM, Borella L, Clementy N, Bisson A, Guenancia C, Sagnard A, Schumacher S, Gandjbakhch E, Duchateau J, Tixier R, Goepp A, Hamon D, Lellouche N, Champ-Rigot L, Milliez P, Marijon E, Varlet E, Garcia R, Degand B, Bouju P, Mabo P, Leclercq C, Behar N, Pavin D, de Chillou C, Sacher F, Galand V. Effectiveness of Deep Sedation for Patients With Intractable Electrical Storm Refractory to Antiarrhythmic Drugs. Circulation 2020; 142(16): 1599 - 1601. Doi: 10.1161/CIRCULATIONAHA.120.047468.
155. Carbucicchio C., Santamaria M., Trevisi N., Maccabelli G., Giraldi F., Fassini G., Riva S., Moltrasio M., Cireddu M., Veglia F., et al. Catheter ablation for the treatment of electrical storm in patients with implantable cardioverter-defibrillators: short- and long-term outcomes in a prospective single-center study. Circulation 2008; 117(4): 462 - 9. Doi: 10.1161/CIRCULATIONAHA.106.686534.
156. Vergara P., Tung R., Vaseghi M., Brombin C., Frankel DS., Di Biase L., Nagashima K., Tedrow U., Tzou WS., Sauer WH., et al. Successful ventricular tachycardia ablation in patients with electrical storm reduces recurrences and improves survival. Heart Rhythm 2018; 15(1): 48 - 55. Doi: 10.1016/j.hrthm.2017.08.022. Epub 2017 Aug 24. Erratum in: Heart Rhythm. 2018 Mar; 15(3): 472. doi: 10.1016/j.hrthm.2018.02.002.
157.  , Shah DC.,
, Shah DC., ![]() , Shoda M., Kautzner J., Arentz T., Kalushe D., Kadish A., Griffith M.,
, Shoda M., Kautzner J., Arentz T., Kalushe D., Kadish A., Griffith M.,  , et al. Role of Purkinje conducting system in triggering of idiopathic ventricular fibrillation. Lancet 2002; 359(9307): 677 - 8. Doi: 10.1016/S0140-6736(02)07807-8.
, et al. Role of Purkinje conducting system in triggering of idiopathic ventricular fibrillation. Lancet 2002; 359(9307): 677 - 8. Doi: 10.1016/S0140-6736(02)07807-8.
158. Komatsu Y., Hocini M., Nogami A., Maury P., Peichl P., Iwasaki YK., Masuda K., Denis A., Voglimacci-Stephanopoli Q., Wichterle D., et al. Catheter Ablation of Refractory Ventricular Fibrillation Storm After Myocardial Infarction. Circulation 2019; 139(20): 2315 - 2325. Doi: 10.1161/CIRCULATIONAHA.118.037997.
159. Knecht S., Sacher F., Wright M., Hocini M., Nogami A., Arentz T., Petit B., Franck R., De Chillou C., Lamaison D., et al. Long-term follow-up of idiopathic ventricular fibrillation ablation: a multicenter study. J Am Coll Cardiol 2009; 54(6): 522 - 8. Doi: 10.1016/j.jacc.2009.03.065.
160. Peichl P.,  ,
,  , Wichterle D., Vancura V., Kautzner J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. J Interv Card Electrophysiol 2010; 27(1): 51 - 9. Doi: 10.1007/s10840-009-9443-2.
, Wichterle D., Vancura V., Kautzner J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. J Interv Card Electrophysiol 2010; 27(1): 51 - 9. Doi: 10.1007/s10840-009-9443-2.
161. Fudim M., Boortz-Marx R., Ganesh A., Waldron NH., Qadri YJ., Patel CB., Milano CA., Sun AY, Mathew JP., Piccini JP. Stellate ganglion blockade for the treatment of refractory ventricular arrhythmias: A systematic review and meta-analysis. J Cardiovasc Electrophysiol 2017; 28(12): 1460 - 1467. Doi: 10.1111/jce.13324.
162. Do DH., Bradfield J., Ajijola OA., Vaseghi M., Le J, Rahman S., Mahajan A., Nogami A., Boyle NG., Shivkumar K. Thoracic Epidural Anesthesia Can Be Effective for the Short-Term Management of Ventricular Tachycardia Storm. J Am Heart Assoc 2017; 6(11): e007080. Doi: 10.1161/JAHA.117.007080. PMID: 29079570; PMCID: PMC5721785.
163. Vaseghi M., Barwad P., Malavassi Corrales FJ., Tandri H., Mathuria N., Shah R., Sorg JM., Gima J., Mandal K.,  , et al. Cardiac Sympathetic Denervation for Refractory Ventricular Arrhythmias. J Am Coll Cardiol 2017; 69(25): 3070 - 3080. Doi: 10.1016/j.jacc.2017.04.035.
, et al. Cardiac Sympathetic Denervation for Refractory Ventricular Arrhythmias. J Am Coll Cardiol 2017; 69(25): 3070 - 3080. Doi: 10.1016/j.jacc.2017.04.035.
164. Vaseghi M., Gima J., Kanaan C., Ajijola OA., Marmureanu A., Mahajan A., Shivkumar K. Cardiac sympathetic denervation in patients with refractory ventricular arrhythmias or electrical storm: intermediate and long-term follow-up. Heart Rhythm 2014; 11(3): 360 - 6. Doi: 10.1016/j.hrthm.2013.11.028.
165. Le Pennec-Prigent S., Flecher E., Auffret V., Leurent G., Daubert JC., Leclercq C., Mabo P., Verhoye JP., Martins RP. Effectiveness of Extracorporeal Life Support for Patients With Cardiogenic Shock Due To Intractable Arrhythmic Storm. Crit Care Med 2017; 45(3): e281-e289. Doi: 10.1097/CCM.0000000000002089.
166. Mariani S., Napp LC., Lo Coco V., Delnoij TSR., Luermans JGLM., Ter Bekke RMA., Timmermans C., Li T., Dogan G., Schmitto JD., et al. Mechanical circulatory support for life-threatening arrhythmia: A systematic review. Int J Cardiol 2020; 308: 42 - 49. Doi: 10.1016/j.ijcard.2020.03.045.
167. Muser D., Liang JJ., Castro SA., Hayashi T., Enriquez A., Troutman GS., McNaughton NW., Supple G., Birati EY., Schaller R., et al. Outcomes with prophylactic use of percutaneous left ventricular assist devices in high-risk patients undergoing catheter ablation of scar-related ventricular tachycardia: A propensity-score matched analysis. Heart Rhythm 2018; 15(10): 1500 - 1506. Doi: 10.1016/j.hrthm.2018.04.028.
168. Mathuria N., Wu G., Rojas-Delgado F., Shuraih M., Razavi M., Civitello A., Simpson L., Silva G., Wang S., Elayda M., Kantharia B., et al. Outcomes of pre-emptive and rescue use of percutaneous left ventricular assist device in patients with structural heart disease undergoing catheter ablation of ventricular tachycardia. J Interv Card Electrophysiol 2017; 48(1): 27 - 34. Doi: 10.1007/s10840-016-0168-8.
169. Ponikowski P., Voors AA., Anker SD., Bueno H., Cleland JGF., Coats AJS., Falk V.,  , Harjola VP., Jankowska EA., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129 - 2200. Doi: 10.1093/eurheartj/ehw128.
, Harjola VP., Jankowska EA., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129 - 2200. Doi: 10.1093/eurheartj/ehw128.
170. McDonagh TA., Metra M., Adamo M., Gardner RS., Baumbach A.,  , Burri H., Butler J.,
, Burri H., Butler J.,  , Chioncel O., et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42(36): 3599 - 3726. Doi: 10.1093/eurheartj/ehab368.
, Chioncel O., et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42(36): 3599 - 3726. Doi: 10.1093/eurheartj/ehab368.
171. AlJaroudi WA., Refaat MM., Habib RH., Al-Shaar L., Singh M., Gutmann R., Bloom HL., Dudley SC., Ellinor PT., Saba SF., et al. Genetic Risk Assessment of Defibrillator Events Investigators. Effect of angiotensin-converting enzyme inhibitors and receptor blockers on appropriate implantable cardiac defibrillator shock in patients with severe systolic heart failure (from the GRADE Multicenter Study). Am J Cardiol 2015; 115(7): 924 - 31. Doi: 10.1016/j.amjcard.2015.01.020.
172. Pitt B., Remme W., Zannad F., Neaton J., Martinez F., Roniker B., Bittman R., Hurley S., Kleiman J., Gatlin M; Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study Investigators. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348(14): 1309 - 21. Doi: 10.1056/NEJMoa030207.
173. McMurray JJ., Packer M., Desai AS., Gong J., Lefkowitz MP., Rizkala AR., Rouleau JL., Shi VC., Solomon SD., Swedberg K., et al. PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371(11): 993 - 1004. Doi: 10.1056/NEJMoa1409077.
174. Packer M., Anker SD., Butler J., Filippatos G., Pocock SJ., Carson P., Januzzi J., Verma S., Tsutsui H., Brueckmann M., et al. EMPEROR-Reduced Trial Investigators. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med 2020; 383(15): 1413 - 1424. Doi: 10.1056/NEJMoa2022190.
175. Desai AS., McMurray JJ., Packer M., Swedberg K., Rouleau JL., Chen F., Gong J., Rizkala AR., Brahimi A., Claggett B., et al. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J 2015; 36(30): 1990 - 7. Doi: 10.1093/eurheartj/ehv186.
176. Жарова О.П., Басаргина Е.Н., Фисенко А.П., Гандаева Л.А., Деревнина Ю.В., Эффективность медикаментозной терапии хронической сердечной недостаточности у детей раннего возраста с дилатационной кардиомиопатией. Российский педиатрический журнал 2019; 22(4): 219 - 225. DoI: 10.18821/1560-9561-2019-22-4-219-225.
177. Kirk R., Dipchand AI., Rosenthal DN., Addonizio L., Burch M., Chrisant M., Dubin A., Everitt M., Gajarski R., Mertens L., et al. The International Society for Heart and Lung Transplantation Guidelines for the management of pediatric heart failure: Executive summary. J Heart Lung Transplant 2014; 33(9): 888 - 909. Doi: 10.1016/j.healun.2014.06.002.
178. Das BB. A Review of Contemporary and Future Pharmacotherapy for Chronic Heart Failure in Children. Children (Basel) 202; 11(7): 859. Doi: 10.3390/children11070859.
179. Rupp S., Apitz C., Tholen L., Latus H., Ostermayer SH., Schmidt D., Bauer J., Schranz D. Upgraded heart failure therapy leads to an improved outcome of dilated cardiomyopathy in infants and toddlers. Cardiol Young 2015; 25(7): 1300 - 5. Doi: 10.1017/S1047951114002406.
180. Chavey WE., Hogikyan RV., Van Harrison R., Nicklas JM. Heart Failure Due to Reduced Ejection Fraction: Medical Management. Am Fam Physician 2017; 95(1): 13 - 20.
181. Castro  , Khalil F., Schwender H., Dalinghaus M., Jovanovic I., Makowski N., Male C., Bajcetic M., van der Meulen M., de Wildt SN., et al. Pharmacotherapeutic management of paediatric heart failure and ACE-I use patterns: a European survey. BMJ Paediatr Open 2019; 3(1): e000365. Doi: 10.1136/bmjpo-2018-000365.
, Khalil F., Schwender H., Dalinghaus M., Jovanovic I., Makowski N., Male C., Bajcetic M., van der Meulen M., de Wildt SN., et al. Pharmacotherapeutic management of paediatric heart failure and ACE-I use patterns: a European survey. BMJ Paediatr Open 2019; 3(1): e000365. Doi: 10.1136/bmjpo-2018-000365.
182. Bogle C., Colan SD., Miyamoto SD., Choudhry S., Baez-Hernandez N., Brickler MM., Feingold B., Lal AK., Lee TM., Canter CE., et al. American Heart Association Young Hearts Pediatric Heart Failure and Transplantation Committee of the Council on Lifelong Congenital Heart Disease and Heart Health in the Young (Young Hearts). Treatment Strategies for Cardiomyopathy in Children: A Scientific Statement From the American Heart Association. Circulation 2023; 148(2): 174 - 195. Doi: 10.1161/CIR.0000000000001151.
183. Nguyen KT., Vittinghoff E., Dewland TA., Dukes JW., Soliman EZ., Stein PK., Gottdiener JS., Alonso A., Chen LY., Psaty BM., et al. Ectopy on a Single 12-Lead ECG, Incident Cardiac Myopathy, and Death in the Community. J Am Heart Assoc 2017; 6(8): e006028. Doi: 10.1161/JAHA.117.006028.
184. Dukes JW., Dewland TA., Vittinghoff E., Mandyam MC., Heckbert SR., Siscovick DS., Stein PK., Psaty BM., Sotoodehnia N., Gottdiener JS., et al. Ventricular Ectopy as a Predictor of Heart Failure and Death. J Am Coll Cardiol 2015; 66(2): 101 - 9. Doi: 10.1016/j.jacc.2015.04.062.
185. Gill JS., Mehta D., Ward DE., Camm AJ. Efficacy of flecainide, sotalol, and verapamil in the treatment of right ventricular tachycardia in patients without overt cardiac abnormality. Br Heart J 1992; 68(4): 392 - 7. Doi: 10.1136/hrt.68.10.392.
186. Shimizu W. Arrhythmias originating from the right ventricular outflow tract: how to distinguish "malignant" from "benign"? Heart Rhythm 2009; 6(10): 1507 - 11. Doi: 10.1016/j.hrthm.2009.06.017.
187. Jamil HA., Mohammed SA., Gierula J., Paton MF., Lowry JE., Cubbon RM., Kearney MT., Witte KKA. Prognostic Significance of Incidental Nonsustained Ventricular Tachycardia Detected on Pacemaker Interrogation. Am J Cardiol 2019; 123(3): 409 - 413. Doi: 10.1016/j.amjcard.2018.10.040.
188. Dabbagh GS., Bogun F. Predictors and Therapy of Cardiomyopathy Caused by Frequent Ventricular Ectopy. Curr Cardiol Rep 2017; 19(9): 80. Doi: 10.1007/s11886-017-0887-1.
189. Hyman MC., Mustin D., Supple G., Schaller RD., Santangeli P., Arkles J., Lin D., Muser D., Dixit S., Nazarian S., et al. Class IC antiarrhythmic drugs for suspected premature ventricular contraction-induced cardiomyopathy. Heart Rhythm 2018; 15(2): 159 - 163. Doi: 10.1016/j.hrthm.2017.12.018.
190. Ling Z., Liu Z., Su L. et al. Radiofrequency ablation versus antiarrhythmic medication for treatment of ventricular premature beats from the right ventricular outflow tract: prospective randomized study. Circulation: Arrhythmia and Electrophysiology 2014; 7(2): 237 - 243. Doi: 10.1161/CIRCEP.113.000805.
191. Latchamsetty R., Yokokawa M., Morady F., et al. Multicenter outcomes for catheter ablation of idiopathic premature ventricular complexes. JACC Clinical Electrophysiology 2015; 1(3): 116 - 123. Doi: 10.1016/j.jacep.2015.04.005.
192. Primeau R., Agha A., Giorgi C., Shenasa M. Long term efficacy and toxicity of amiodarone in the treatment of refractory cardiac arrhythmias. Canadian Journal of Cardiology 1989; 5(2): 98 - 104.
193. R. A. Bertels, Janneke A. E. Kammeraad, A. M. Zeelenberg, et al. The Efcacy of Anti Arrhythmic Drugs in Children With Idiopathic Frequent Symptomatic or Asymptomatic Premature Ventricular Complexes With or Without Asymptomatic Ventricular Tachycardia: a Retrospective Multi Center Study. Pediatr Cardiol. 2021; 42(4): 883 - 890. Doi: 10.1007/s00246-021-02556-7.
194. Mont L., Seixas T., Brugada P., Brugada J., et al. Clinical and electrophysiologic characteristics of exercise-related idiopathic ventricular tachycardia. The American Journal of Cardiology 1991; 68(9): 897 - 900. Doi: 10.1016/0002-9149(91) 90405-a.
195. Toivonen L., Nieminen M. Persistent ventricular tachycardia resulting in left ventricular dilatation treated with verapamil. International Journal of Cardiology 1986; 13(3): 361 - 365. Doi: 10.1016/0167-5273(86) 90120-8.
196. Singh B., Kaul U., Talwar KK., Wasir H.S. Reversibility of tachycardia induced cardiomyopathy following the cure of idiopathic left ventricular tachycardia using radiofrequency energy. Pacing Clinical Electrophysiology 1996; 19(9): 1391 - 1392. Doi: 10.1111/j.1540-8159.1996.tb04222.x.
197. Stec S., et al. Benign symptomatic premature ventricular complexes: short- and long- term efficacy of antiarrhythmic drugs and radiofrequency ablation. Polish Heart Journal (Kardiologia Polska) 2012; 70(4): 351 - 358.
198. Krittayaphong R., Bhuripanyo K., Punlee K., Kangkagate C., Chaithiraphan S. Effect of atenolol on symptomatic ventricular arrhythmia without structural heart disease: a randomized placebo-controlled study. Am Heart J 2002; 144(6): e10. Doi: 10.1067/mhj.2002.125516.
199. Kuhlkamp V., Mewis C., Mermi J., et al. Suppression of sustained ventricular tachyarrhythmias: a comparison of d,l-sotalol with no antiarrhythmic drug treatment. J Am Coll Cardiol 1999; 33(1): 46 - 52. Doi: 10.1016/s0735-1097(98) 00521-x.
200. Capucci A, Di Pasquale G, Boriani G. A double-blind crossover comparison of flecainide and slow-release mexiletine in the treatment of stable premature ventricular complexes. Int J Clin Pharmacol Res 1991; 11(1): 23 - 33.
201. Лоскутов Н.С. Этацизин в коррекции доброкачественных желудочковых нарушений ритма у больных ИБС и гипертонической болезнью / Н.С. Лоскутов, М.Б. Нагорный // Известия Российской военно-медицинской академии. - 2022. - Т. 41, N S2. - С. 272 - 276.
202. Соколов С.Ф., Бакалов С.А., Миронова Н.А., Рогова М.М., Малкина Т.А., Голицын С.П. Эффективность и безопасность аллапинина при краткосрочном и длительном лечении больных с доброкачественной желудочковой экстрасистолией. Кардиология 2014; 1: 20 - 26.
203. Влияние этацизина и атенолола на аритмии у больных с различными заболеваниями сердца / А. Макарова, А. Евдокименко, Т. М. Ибрагимова, Э.Оморова // Здравоохранение Кыргызстана. - 2009. - N 1. - С. 72 - 74.
204. Новые возможности применения неинвазивных электрофизиологических предикторов внезапной сердечной смерти: прогнозирование эффективности и безопасности антиаритмической терапии / Д.А. Царегородцев, А.В. Седов, Н.В. Мельник [и др.] // Кардиология и сердечно-сосудистая хирургия. - 2015. - Т. 8, N 6. - С. 114 - 121.
205. Oeffl N., Schober L., Faudon P., Schweintzger S., Manninger M.,  , Sallmon H., Scherr D., Kurath-Koller S. Antiarrhythmic Drug Dosing in Children-Review of the Literature. Children (Basel) 2023; 10(5): 847. Doi: 10.3390/children10050847.
, Sallmon H., Scherr D., Kurath-Koller S. Antiarrhythmic Drug Dosing in Children-Review of the Literature. Children (Basel) 2023; 10(5): 847. Doi: 10.3390/children10050847.
206. Ruberman W., Weinblatt E., Goldberg JD., et al. Ventricular premature beats and mortality after myocardial infarction. The New England Journal of Medicine 1977; 297(14): 750 - 757. Doi: 10.1056/NEJM197710062971404.
207.  , Hedblad B., Janzon L.,
, Hedblad B., Janzon L.,  Ventricular arrhythmias during 24-h ambulatory ECG recording: incidence, risk factors and prognosis in men with and without a history of cardiovascular disease. J Intern Med 1999; 246(4): 363 - 72. Doi: 10.1046/j.1365-2796.1999.00509.x.
Ventricular arrhythmias during 24-h ambulatory ECG recording: incidence, risk factors and prognosis in men with and without a history of cardiovascular disease. J Intern Med 1999; 246(4): 363 - 72. Doi: 10.1046/j.1365-2796.1999.00509.x.
208. Hoffmann A.,  , Burckhardt D. High-grade ventricular ectopic activity and 5-year survival in patients with chronic heart disease and in healthy subjects. Cardiology 1983; 70 Suppl 1: 82 - 7. Doi: 10.1159/000173635.
, Burckhardt D. High-grade ventricular ectopic activity and 5-year survival in patients with chronic heart disease and in healthy subjects. Cardiology 1983; 70 Suppl 1: 82 - 7. Doi: 10.1159/000173635.
209. Bikkina M., Larson MG., Levy D. Asymptomatic ventricular arrhythmias and mortality risk in subjects with left ventricular hypertrophy. J Am Coll Cardiol 1993; 22(4): 1111 - 6. Doi: 10.1016/0735-1097(93) 90424-y.
210. Adabag AS., Casey SA., Kuskowski MA., Zenovich AG., Maron BJ. Spectrum and prognostic significance of arrhythmias on ambulatory Holter electrocardiogram in hypertrophic cardiomyopathy. J Am Coll Cardiol 2005; 45(5): 697 - 704. Doi: 10.1016/j.jacc.2004.11.043.
211. Freemantle N., Cleland J., Young P., Mason J., Harrison J. beta Blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999; 318(7200): 1730 - 7. Doi: 10.1136/bmj.318.7200.1730.
212. Magalie Ladouceur, Victor Waldmann, Stefano Bartoletti, Marie-A Chaix, Paul Khairy, Ventricular arrhythmia in congenital heart diseases with a systemic right ventricle, International Journal of Cardiology Congenital Heart Disease, Volume 13, 2023, 100463, ISSN 2666-6685, https://doi.org/10.1016/j.ijcchd.2023.100463.
213. Ono K., Iwasaki YK., Akao M., Ikeda T., Ishii K., Inden Y., Kusano K., Kobayashi Y., Koretsune Y., Sasano T., et al. J Arrhythm 2022; 38(6): 833 - 973. Doi: 10.1002/joa3.12714.
214. Al-Gobari M., El Khatib C., Pillon F., Gueyffier F. 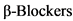 for the prevention of sudden cardiac death in heart failure patients: a meta-analysis of randomized controlled trials. BMC Cardiovasc Disord 2013; 13: 52. Doi: 10.1186/1471-2261-13-52.
for the prevention of sudden cardiac death in heart failure patients: a meta-analysis of randomized controlled trials. BMC Cardiovasc Disord 2013; 13: 52. Doi: 10.1186/1471-2261-13-52.
215. Cleophas TJ., Zwinderman AH. Beta-blockers and heart failure: meta-analysis of mortality trials. Int J Clin Pharmacol Ther 2001; 39(9): 383 - 8. Doi: 10.5414/cpp39383.
216. Hjalmarson A. Effects of beta blockade on sudden cardiac death during acute myocardial infarction and the postinfarction period. Am J Cardiol. 1997; 80(9B): 35J-39J. Doi: 10.1016/s0002-9149(97) 00837-0.
217. Al-Gobari M., Al-Aqeel S., Gueyffier F., Burnand B. Effectiveness of drug interventions to prevent sudden cardiac death in patients with heart failure and reduced ejection fraction: an overview of systematic reviews. BMJ Open 2018; 8(7): e021108. Doi: 10.1136/bmjopen-2017-021108.
218. Baman TS., Lange DC., Ilg KJ., Gupta SK., Liu TY., Alguire C., Armstrong W., Good E., Chugh A., Jongnarangsin K., Pelosi F Jr., et al. Relationship between burden of premature ventricular complexes and left ventricular function. Heart Rhythm 2010; 7(7): 865 - 9. Doi: 10.1016/j.hrthm.2010.03.036.
219. Julian DG., Camm AJ., Frangin G., Janse MJ., Munoz A., Schwartz PJ., Simon P. Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarct Amiodarone Trial Investigators. Lancet 1997; 349(9053): 667 - 74. Doi: 10.1016/s0140-6736(96) 09145-3.
220. Cairns JA., Connolly SJ., Roberts R., Gent M. Randomised trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators. Lancet 1997; 349(9053): 675 - 82. Doi: 10.1016/s0140-6736(96) 08171-8.
221. Echt DS., Liebson PR., Mitchell LB., Peters RW., Obias-Manno D., Barker AH., Arensberg D., Baker A., Friedman L., Greene HL., et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med 1991; 324(12): 781 - 8. Doi: 10.1056/NEJM199103213241201.
222. Cardiac Arrhythmia Suppression Trial II Investigators. Effect of the antiarrhythmic agent moricizine on survival after myocardial infarction. N Engl J Med 1992; 327(4): 227 - 33. Doi: 10.1056/NEJM199207233270403.
223. Ho AT., Pai SM., Timothy P., Pai RG. Effect of concomitant antiarrhythmic therapy on survival in patients with implantable cardioverter defibrillators. Pacing Clin Electrophysiol 2005; 28(7): 647 - 53. Doi: 10.1111/j.1540-8159.2005.00164.x.
224. Hayes DL., Boehmer JP., Day JD., Gilliam FR. 3rd, Heidenreich PA., Seth M., Jones PW., Saxon LA. Cardiac resynchronization therapy and the relationship of percent biventricular pacing to symptoms and survival. Heart Rhythm 2011; 8(9): 1469 - 75. Doi: 10.1016/j.hrthm.2011.04.015.
225. Bardy GH., Lee KL., Mark DB., Poole JE., Packer DL., Boineau R., Domanski M., Troutman C., Anderson J., Johnson G., et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005; 352(3): 225 - 37. Doi: 10.1056/NEJMoa043399.
226. Vorperian VR., Havighurst TC., Miller S., January CT. Adverse effects of low dose amiodarone: a meta-analysis. J Am Coll Cardiol 1997; 30(3): 791 - 8. Doi: 10.1016/s0735-1097(97) 00220-9.
227. Kuck KH., Cappato R., Siebels J.,  Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation 2000; 102(7): 748 - 54. Doi: 10.1161/01.cir.102.7.748.
Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation 2000; 102(7): 748 - 54. Doi: 10.1161/01.cir.102.7.748.
228. Furberg CD., Yusuf S. Effect of drug therapy on survival in chronic congestive heart failure. Am J Cardiol 1988; 62(2): 41A-45A. Doi: 10.1016/s0002-9149(88) 80084-5.
229.  , Chassany O., Grenard AS., Caulin C., Bergmann JF. Defining the role of calcium channel antagonists in heart failure due to systolic dysfunction. Am J Cardiovasc Drugs 2003; 3(1): 33 - 41. Doi: 10.2165/00129784-200303010-00004.
, Chassany O., Grenard AS., Caulin C., Bergmann JF. Defining the role of calcium channel antagonists in heart failure due to systolic dysfunction. Am J Cardiovasc Drugs 2003; 3(1): 33 - 41. Doi: 10.2165/00129784-200303010-00004.
230. Masarone D., Limongelli G., Rubino M., Valente F., Vastarella R., Ammendola E., Gravino R., Verrengia M., Salerno G., Pacileo G. Management of Arrhythmias in Heart Failure. J Cardiovasc Dev Dis 2017; 4(1): 3. Doi: 10.3390/jcdd4010003.
231. Podrid P., Lown B. Selection of an antiarrhythmic drug to protect against ventricular fibrillation. In Proceedings of the first US-USSR Symposium on Sudden Death. DHEW publ. no. (NIH) 1978. 259 - 278.
232. Mason JW. A comparison of seven antiarrhythmic drugs in patients with ventricular tachyarrhythmias. Electrophysiologic Study versus Electrocardiographic Monitoring Investigators. N Engl J Med 1993; 329(7): 452 - 8. Doi: 10.1056/NEJM199308123290702.
233. Aiba T., Kurita T., Taguchi A., Shimizu W., Suyama K., Aihara N., Kamakura S.. Long-term efficacy of empirical chronic amiodarone therapy in patients with sustained ventricular tachyarrhythmia and structural heart disease. Circ J 2002; 66(4): 367 - 71. Doi: 10.1253/circj.66.367.
234. Bokhari F., Newman D., Greene M., Korley V., Mangat I., Dorian P. Long-term comparison of the implantable cardioverter defibrillator versus amiodarone: eleven-year follow-up of a subset of patients in the Canadian Implantable Defibrillator Study (CIDS). Circulation 2004; 110(2): 112 - 6. Doi: 10.1161/01.CIR.0000134957.51747.6E.
235. Sobiech M., Lewandowski M.,  ,
,  , Syska P.,
, Syska P.,  , Kowalik I.,
, Kowalik I.,  , Szwed H., Pytkowski M. Efficacy and tolerability of mexiletine treatment in patients with recurrent ventricular tachyarrhythmias and implantable cardioverter-defibrillator shocks. Kardiol Pol 2017; 75(10): 1027 - 1032. Doi: 10.5603/KP.2017.0189.
, Szwed H., Pytkowski M. Efficacy and tolerability of mexiletine treatment in patients with recurrent ventricular tachyarrhythmias and implantable cardioverter-defibrillator shocks. Kardiol Pol 2017; 75(10): 1027 - 1032. Doi: 10.5603/KP.2017.0189.
236. AbdelWahab A., Sapp J. Ventricular Tachycardia with ICD Shocks: When to Medicate and When to Ablate. Curr Cardiol Rep 2017; 19(11): 105. Doi: 10.1007/s11886-017-0924-0.
237. Sapp JL., Wells GA., Parkash R., Stevenson WG., Blier L., Sarrazin JF., Thibault B., Rivard L., Gula L., Leong-Sit P., et al. Ventricular Tachycardia Ablation versus Escalation of Antiarrhythmic Drugs. N Engl J Med 2016; 375(2): 111 - 21. Doi: 10.1056/NEJMoa1513614.
238. Deyell MW., Steinberg C., Doucette S., Parkash R., Nault I., Gray C., Essebag V., Gardner M., Sterns LD., Healey JS., et al. Mexiletine or catheter ablation after amiodarone failure in the VANISH trial. J Cardiovasc Electrophysiol 2018; 29(4): 603 - 608. Doi: 10.1111/jce.13431.
239. Gao D., Van Herendael H., Alshengeiti L., Dorian P., Mangat I., Korley V., Ahmad K., Golovchiner G., Aves T., Pinter A. Mexiletine as an adjunctive therapy to amiodarone reduces the frequency of ventricular tachyarrhythmia events in patients with an implantable defibrillator. J Cardiovasc Pharmacol 2013; 62(2): 199 - 204. Doi: 10.1097/FJC.0b013e31829651fe.
240. Kavey RE., Blackman MS., Sondheimer HM. Phenytoin therapy for ventricular arrhythmias occurring late after surgery for congenital heart disease. Am Heart J 1982;104(4 Pt 1): 794 - 8. Doi: 10.1016/0002-8703(82) 90013-8.
241. Epstein A. E., Plumb VJ., Henthorn RW., Waldo AL. Phenytoin in the treatment of inducible ventricular tachycardia: results of electrophysiologic testing and long-term follow-up. Pacing Clin Electrophysiol 1987; 10(5): 1049 - 57. Doi: 10.1111/j.1540-8159.1987.tb06124.x.
242. Fogoros RN., Fiedler SB., Elson JJ. Efficacy of phenytoin in suppressing inducible ventricular tachyarrhythmias. Cardiovasc Drugs Ther 1988; 2(2): 171 - 176. Doi: 10.1007/BF00051232.
243. Ruwald MH., Solomon SD., Foster E., Kutyifa V., et al. Left ventricular ejection fraction normalization in cardiac resynchronization therapy and risk of ventricular arrhythmias and clinical outcomes: results from the Multicenter Automatic Defibrillator Implantation Trial with Cardiac Resynchronization Therapy (MADIT-CRT) trial. Circulation 2014; 130(25): 2278 - 86. Doi: 10.1161/CIRCULATIONAHA.114.011283.
244. El-Sherif N., Turitto G. Electrolyte disorders and arrhythmogenesis. Journal of Cardiology 2011; 18(3): 233 - 45.
245. Conolly SJ., Gent M., Roberts RS., et al. Canadian Implantable Defibrillator Study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000; 101(11): 1297 - 1302. Doi: 10.1161/01.cir.101.11.1297.
246. Tanner H., Hindricks G., Volkmer M., et al. Catheter ablation of recurrent scar-related ventricular tachycardia using electroanatomical mapping and irrigated ablation technology: results of the prospective multicenter Euro-VT-study. Journal of Cardiovascular Electrophysiology 2010; 21(1): 47 - 53. Doi: 10.1111/j.1540-8167.2009.01563.x.
247. Hohnloser SH., Kuck KH., Dorian P., et al. On behalf of the DINAMIT investigators. Prophylactic use of an implantable cardioverter-defibrillator after acute myocardial infarction. The New England Journal of Medicine 2004; 351(24): 2481 - 2488. Doi: 10.1056/NEJMoa041489.
248. Steinbeck G., Andresen D., Seidl K. Defibrillator Implantation Early after Myocardial Infarction. Immediate Risk-Stratification Improves Survival (IRIS). The New England Journal of Medicine 2009; 361: 1427 - 1436. Doi: 10.1056/NEJMoa0901889.
249. Moss AJ., Hall WJ., Cannom DS., et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. The New England Journal of Medicine 1996; 335(26): 1933 - 1940. Doi: 10.1056/NEJM199612263352601.
250. Buxton AE., Lee KL., Fisher JD., et al. A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. The New England Journal of Medicine 1999; 341(25): 1882 - 1890. Doi: 10.1056/NEJM199912163412503.
251. Moss AJ., Zareba W., Hall WJ., et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. The New England Journal of Medicine 2002; 346(12): 877 - 883. Doi: 10.1056/NEJMoa013474.
252. Bristow MR., Saxon LA., Boehmer J., et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. The New England Journal of Medicine 2004; 350(21): 2140 - 2150. Doi: 10.1056/NEJMoa032423.
253. Bigger JT. Prophylactic use of implanted cardiac defibrillators in patients at risk for ventricular arrhythmias after coronary artery bypass graft surgery (Coronary Artery Bypass Graft (CABG) Patch Trial Investigators). The New England Journal of Medicine 1997; 337(22): 1569 - 1575. Doi: 10.1056/NEJM199711273372201.
254.  , Thune JJ., Nielsen JC., et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. Danish Study to Assess the Efficacy of ICDs in Patients with Non-ischemic Systolic Heart Failure on Mortality (DANISH). The New England Journal of Medicine 2016; 375(13): 1221 - 1230. Doi: 10.1056/NEJMoa1608029.
, Thune JJ., Nielsen JC., et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. Danish Study to Assess the Efficacy of ICDs in Patients with Non-ischemic Systolic Heart Failure on Mortality (DANISH). The New England Journal of Medicine 2016; 375(13): 1221 - 1230. Doi: 10.1056/NEJMoa1608029.
255.  , Antz M., Boczor S., et al. Primary Prevention of Sudden Cardiac Death in Idiopathic Dilated Cardiomyopathy The Cardiomyopathy Trial (CAT). Circulation 2002; 105(12): 1453 - 1458. Doi: 10.1161/01.cir.0000012350.99718.ad.
, Antz M., Boczor S., et al. Primary Prevention of Sudden Cardiac Death in Idiopathic Dilated Cardiomyopathy The Cardiomyopathy Trial (CAT). Circulation 2002; 105(12): 1453 - 1458. Doi: 10.1161/01.cir.0000012350.99718.ad.
256. Strickberger SA., Hummel JD., Bartlett TG., et al. Amiodarone Versus Implantable Cardioverter-Defibrillator: Randomized Trial in Patients With Nonischemic Dilated Cardiomyopathy and Asymptomatic Nonsustained Ventricular Tachycardia-AMIOVIRT. Journal of the American College of Cardiology 2003; 41(10): 1707 - 1712. Doi: 10.1016/s0735-1097(03) 00297-3.
257. Kadish A., Dyer A., Daubert JP., Quigg R., Estes NA., Anderson KP., Calkins H., Hoch D., Goldberger J., Shalaby A., et al. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med 2004; 350(21): 2151 - 8. Doi: 10.1056/NEJMoa033088.
258. Desai AS., Fang JC., Maisel WH., Baughman KL. Implantable defibrillators for the prevention of mortality in patients with nonischemic cardiomyopathy: a meta-analysis of randomized controlled trials. JAMA 2004; 292(23): 2874 - 9. Doi: 10.1001/jama.292.23.2874.
259. Algalarrondo V., Perault R., Bories MC., Narayanan K., Garcia R., Combes N., Perier MC., Defaye P., Sadoul N., Gras D., et al. Prophylactic implantable cardioverter defibrillators for primary prevention: From implantation to heart transplantation. Arch Cardiovasc Dis 2018; 111(12): 758 - 765. Doi: 10.1016/j.acvd.2018.05.004.
260. Sandner SE., Wieselthaler G., Zuckermann A., Taghavi S., Schmidinger H., Pacher R., Ploner M., Laufer G., Wolner E., Grimm M. Survival benefit of the implantable cardioverter-defibrillator in patients on the waiting list for cardiac transplantation. Circulation 2001; 104(12 Suppl 1): I171-6. Doi: 10.1161/hc37t1.094916.
261. Cleland JG., Daubert JC., Erdmann E., Freemantle N., Gras D., Kappenberger L., Klein W., Tavazzi L.; CARE-HF study Steering Committee and Investigators. The CARE-HF study (CArdiac REsynchronisation in Heart Failure study): rationale, design and end-points. Eur J Heart Fail 2001; 3(4): 481 - 9. Doi: 10.1016/s1388-9842(01) 00176-3.
262. Tang AS., Wells GA., Talajic M., Arnold MO., Sheldon R., Connolly S., Hohnloser SH., Nichol G., Birnie DH., Sapp JL., et al. Cardiac-resynchronization therapy for mild-to-moderate heart failure. N Engl J Med 2010;363(25): 2385 - 95. Doi: 10.1056/NEJMoa1009540.
263. Eickholt C., Siekiera M., Kirmanoglou K., Rodenbeck A., Heussen N., Schauerte P., Lichtenberg A., Balzer J., Rassaf T., Perings S., Kelm M., et al. Improvement of left ventricular function under cardiac resynchronization therapy goes along with a reduced incidence of ventricular arrhythmia. PLoS One 2012; 7(11): e48926. Doi: 10.1371/journal.pone.0048926.
264. Young JB., Abraham WT., Smith AL., Leon AR., Lieberman R., Wilkoff B., Canby RC., Schroeder JS., Liem LB., Hall S., et al. Combined cardiac resynchronization and implantable cardioversion defibrillation in advanced chronic heart failure: the MIRACLE ICD Trial. JAMA 2003; 289(20): 2685 - 94. Doi: 10.1001/jama.289.20.2685.
265. Bradley DJ., Bradley EA., Baughman KL., Berger RD., Calkins H., Goodman SN., Kass DA., Powe NR. Cardiac resynchronization and death from progressive heart failure: a meta-analysis of randomized controlled trials. JAMA 2003; 289(6): 730 - 40. Doi: 10.1001/jama.289.6.730.
266. McAlister FA., Ezekowitz JA., Wiebe N., Rowe B., Spooner C., Crumley E., Hartling L., Klassen T., Abraham W. Systematic review: cardiac resynchronization in patients with symptomatic heart failure. Ann Intern Med 2004; 141(5): 381 - 90. Doi: 10.7326/0003-4819-141-5-200409070-00101.
267. Cleland JG., Coletta AP., Lammiman M., Witte KK., Loh H., Nasir M., Clark AL. Clinical trials update from the European Society of Cardiology meeting 2005: CARE-HF extension study, ESSENTIAL, CIBIS-III, S-ICD, ISSUE-2, STRIDE-2, SOFA, IMAGINE, PREAMI, SIRIUS-II and ACTIVE. Eur J Heart Fail 2005; 7(6): 1070 - 5. Doi: 10.1016/j.ejheart.2005.09.006.
268. Cleland JG., Daubert JC., Erdmann E., Freemantle N., Gras D., Kappenberger L., Tavazzi L. Longer-term effects of cardiac resynchronization therapy on mortality in heart failure [the CArdiac REsynchronization-Heart Failure (CARE-HF) trial extension phase]. Eur Heart J 2006; 27(16): 1928 - 32. Doi: 10.1093/eurheartj/ehl099.
269. Daubert C., Gold MR., Abraham WT., Ghio S., Hassager C., Goode G.,  , Linde C.; REVERSE Study Group. Prevention of disease progression by cardiac resynchronization therapy in patients with asymptomatic or mildly symptomatic left ventricular dysfunction: insights from the European cohort of the REVERSE (Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction) trial. J Am Coll Cardiol 2009; 54(20): 1837 - 46. Doi: 10.1016/j.jacc.2009.08.011.
, Linde C.; REVERSE Study Group. Prevention of disease progression by cardiac resynchronization therapy in patients with asymptomatic or mildly symptomatic left ventricular dysfunction: insights from the European cohort of the REVERSE (Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction) trial. J Am Coll Cardiol 2009; 54(20): 1837 - 46. Doi: 10.1016/j.jacc.2009.08.011.
270. Linde C., Gold MR., Abraham WT., St John Sutton M., Ghio S., Cerkvenik J., Daubert C; REsynchronization reVErses Remodeling in Systolic left vEntricular dysfunction Study Group. Long-term impact of cardiac resynchronization therapy in mild heart failure: 5-year results from the REsynchronization reVErses Remodeling in Systolic left vEntricular dysfunction (REVERSE) study. Eur Heart J 2013; 34(33): 2592 - 9. Doi: 10.1093/eurheartj/eht160.
271. Cleland JG., Abraham WT., Linde C., Gold MR., Young JB., Claude Daubert J., Sherfesee L., Wells GA., Tang AS. An inpidual patient meta-analysis of five randomized trials assessing the effects of cardiac resynchronization therapy on morbidity and mortality in patients with symptomatic heart failure. Eur Heart J 2013; 34(46): 3547 - 56. Doi: 10.1093/eurheartj/eht290.
272. Woods B., Hawkins N., Mealing S., Sutton A., Abraham WT., Beshai JF., Klein H., Sculpher M., Plummer CJ., Cowie MR. Inpidual patient data network meta-analysis of mortality effects of implantable cardiac devices. Heart 2015; 101(22): 1800 - 6. Doi: 10.1136/heartjnl-2015-307634.
273. Steffel J., Robertson M., Singh JP., Abraham WT., Bax JJ., Borer JS., Dickstein K., Ford I., Gorcsan J 3rd., Gras D., et al. The effect of QRS duration on cardiac resynchronization therapy in patients with a narrow QRS complex: a subgroup analysis of the EchoCRT trial. Eur Heart J 2015; 36(30): 1983 - 9. Doi: 10.1093/eurheartj/ehv242.
274. Jacobsson J., Reitan C., Carlson J., Borgquist R., Platonov PG. Atrial fibrillation incidence and impact of biventricular pacing on long-term outcome in patients with heart failure treated with cardiac resynchronization therapy. BMC Cardiovasc Disord 2019; 19(1): 195. Doi: 10.1186/s12872-019-1169-1.
275. Healey JS., Hohnloser SH., Exner DV., Birnie DH., Parkash R., Connolly SJ., Krahn AD., Simpson CS., Thibault B., Basta M., et al. RAFT Investigators. Cardiac resynchronization therapy in patients with permanent atrial fibrillation: results from the Resynchronization for Ambulatory Heart Failure Trial (RAFT). Circ Heart Fail 2012; 5(5): 566 - 70. Doi: 10.1161/CIRCHEARTFAILURE.
276. Lopes C., Pereira T., Barra S. Cardiac resynchronization therapy in patients with atrial fibrillation: a meta-analysis. Rev Port Cardiol 2014; 33(11): 717 - 25. Doi: 10.1016/j.repc.2014.05.008.
277. Gasparini M., Leclercq C., Lunati M., Landolina M., Auricchio A., Santini M., Boriani G., Lamp B., Proclemer A., Curnis A., et al. Cardiac resynchronization therapy in patients with atrial fibrillation: the CERTIFY study (Cardiac Resynchronization Therapy in Atrial Fibrillation Patients Multinational Registry). JACC Heart Fail 2013; 1(6): 500 - 7. Doi: 10.1016/j.jchf.2013.06.003.
278. Upadhyay GA., Choudhry NK., Auricchio A., Ruskin J., Singh JP. Cardiac resynchronization in patients with atrial fibrillation: a meta-analysis of prospective cohort studies. J Am Coll Cardiol 2008; 52(15): 1239 - 46. Doi: 10.1016/j.jacc.2008.06.043.
279. Gasparini M., Auricchio A., Regoli F., Fantoni C., Kawabata M., Galimberti P., Pini D., Ceriotti C., Gronda E., Klersy C., et al. Four-year efficacy of cardiac resynchronization therapy on exercise tolerance and disease progression: the importance of performing atrioventricular junction ablation in patients with atrial fibrillation. J Am Coll Cardiol 2006; 48(4): 734 - 43. Doi: 10.1016/j.jacc.2006.03.056.
280. Ferreira AM.,  , Cavaco DM., Candeias R., Morgado FB., Santos KR., Santos E., Silva JA. Benefit of cardiac resynchronization therapy in atrial fibrillation patients vs. patients in sinus rhythm: the role of atrioventricular junction ablation. Europace 2008; 10(7): 809 - 15. Doi: 10.1093/europace/eun135.
, Cavaco DM., Candeias R., Morgado FB., Santos KR., Santos E., Silva JA. Benefit of cardiac resynchronization therapy in atrial fibrillation patients vs. patients in sinus rhythm: the role of atrioventricular junction ablation. Europace 2008; 10(7): 809 - 15. Doi: 10.1093/europace/eun135.
281. Orlov MV., Gardin JM., Slawsky M., Bess RL., Cohen G., Bailey W., Plumb V., Flathmann H., de Metz K. Biventricular pacing improves cardiac function and prevents further left atrial remodeling in patients with symptomatic atrial fibrillation after atrioventricular node ablation. Am Heart J 2010; 159(2): 264 - 70. Doi: 10.1016/j.ahj.2009.11.012.
282. Doshi RN., Daoud EG., Fellows C., Turk K., Duran A., Hamdan MH., Pires LA. PAVE Study Group. Left ventricular-based cardiac stimulation post AV nodal ablation evaluation (the PAVE study). J Cardiovasc Electrophysiol 2005; 16(11): 1160 - 5. Doi: 10.1111/j.1540-8167.2005.50062.x.
283. Brignole M., Gammage M., Puggioni E., Alboni P., Raviele A., Sutton R., Vardas P., Bongiorni MG., Bergfeldt L., Menozzi C., Musso G. Optimal Pacing SITE (OPSITE) Study Investigators. Comparative assessment of right, left, and biventricular pacing in patients with permanent atrial fibrillation. Eur Heart J 2005; 26(7): 712 - 22. Doi: 10.1093/eurheartj/ehi069.
284. Brignole M., Botto GL., Mont L., Oddone D., Iacopino S., De Marchi G., Campoli M., Sebastiani V., Vincenti A., Garcia Medina D., et al. Predictors of clinical efficacy of 'Ablate and Pace' therapy in patients with permanent atrial fibrillation. Heart 2012; 98(4): 297 - 302. Doi: 10.1136/heartjnl-2011-301069.
285. Leclercq C., Cazeau S., Lellouche D., Fossati F., Anselme F., Davy JM., Sadoul N., Klug D., Mollo L., Daubert JC. Upgrading from single chamber right ventricular to biventricular pacing in permanently paced patients with worsening heart failure: The RD-CHF Study. Pacing Clin Electrophysiol 2007; 30 Suppl 1: S23 - 30. Doi: 10.1111/j.1540-8159.2007.00598.x.
286.  , Meurling C., Brandt J. Upgrade to biventricular pacing in patients with conventional pacemakers and heart failure: a double-blind, randomized crossover study. Europace 2006; 8(1): 51 - 5. Doi: 10.1093/europace/euj014.
, Meurling C., Brandt J. Upgrade to biventricular pacing in patients with conventional pacemakers and heart failure: a double-blind, randomized crossover study. Europace 2006; 8(1): 51 - 5. Doi: 10.1093/europace/euj014.
287. van Geldorp IE., Vernooy K., Delhaas T., Prins MH., Crijns HJ., Prinzen FW., Dijkman B. Beneficial effects of biventricular pacing in chronically right ventricular paced patients with mild cardiomyopathy. Europace 2010; 12(2): 223 - 9. Doi: 10.1093/europace/eup378.
288. Laurenzi F., Achilli A., Avella A., Peraldo C., Orazi S., Perego GB., Cesario A., Valsecchi S., De Santo T., Puglisi A., et al. Biventricular upgrading in patients with conventional pacing system and congestive heart failure: results and response predictors. Pacing Clin Electrophysiol 2007; 30(9): 1096 - 104. Doi: 10.1111/j.1540-8159.2007.00819.x.
289. Vatankulu MA., Goktekin O., Kaya MG., Ayhan S., Kucukdurmaz Z., Sutton R., Henein M. Effect of long-term resynchronization therapy on left ventricular remodeling in pacemaker patients upgraded to biventricular devices. Am J Cardiol 2009; 103(9): 1280 - 4. Doi: 10.1016/j.amjcard.2009.01.023.
290. Foley PW., Muhyaldeen SA., Chalil S., Smith RE., Sanderson JE., Leyva F. Long-term effects of upgrading from right ventricular pacing to cardiac resynchronization therapy in patients with heart failure. Europace 2009; 11(4): 495 - 501. Doi: 10.1093/europace/eup037.
291. Paparella G., Sciarra L., Capulzini L., Francesconi A., et al. Long-term effects of upgrading to biventricular pacing: differences with cardiac resynchronization therapy as primary indicationю Pacing Clinical Electrophysiology 2010; 33(7): 841 - 849. Doi: 10.1111/j.1540-8159.2010.02701.x.
292. Gage RM., Burns KV., Bank AJ. Echocardiographic and clinical response to cardiac resynchronization therapy in heart failure patients with and without previous right ventricular pacing. European Journal of Heart Failure 2014; 16(11): 1199 - 1205. Doi: 10.1002/ejhf.143.
293. Bardy G.H., Smith WM., Hood MA. et al. An entirely subcutaneous implantable cardioverter-defibrillator. The New England Journal of Medicine 2010; 363(1): 36 - 44. Doi: 10.1056/NEJMoa0909545.
294. Weiss R., Knight BP., Gold MR., Leon AR., et al. Safety and efficacy of a totally subcutaneous implantable-cardioverter defibrillator. Circulation 2013; 128(9): 944 - 953. Doi: 10.1161/CIRCULATIONAHA.113.003042.
295. Jarman JW., Lascelles K., Wong T., et al. Clinical experience of entirely subcutaneous implantable cardioverter-defibrillators in children and adults: cause for caution. European Heart Journal 2012; 33(11): 1351 - 1359. Doi: 10.1093/eurheartj/ehs017.
296. Dabiri Abkenari L., Theuns DA., Valk SD., et al. Clinical experience with a novel subcutaneous implantable defibrillator system in a single center. Clinical Research in Cardiology 2011; 100(9): 737 - 44. Doi: 10.1007/s00392-011-0303-6.
297. Burke MC., Gold MR., Knight BP., et al. Safety and efficacy of the totally subcutaneous implantable defibrillator: 2-year results from a pooled analysis of the IDE Study and EFFORTLESS Registry. Journal of the American College of Cardiology 2015; 65(16): 1605 - 1615. Doi: 10.1016/j.jacc.2015.02.047.
298. Lambiase PD., Barr C., Theuns DA. et al. Worldwide experience with a totally subcutaneous implantable defibrillator: early results from the EFFORTLESS S-ICD Registry. European Heart Journal 2014; 35(25): 1657 - 1665. Doi: 10.1093/eurheartj/ehu112.
299. Irvine J., Dorian P., Baker B., et al. Quality of life in the Canadian Implantable Defibrillator Study (CIDS). American Heart Journal 2002 Aug; 144(2): 282 - 9. Doi: 10.1067/mhj.2002.124049.
300. Tomzik J., Koltermann KC., Zabel M., et. Al. Quality of Life in Patients with an Implantable Cardioverter Defibrillator: A Systematic Review. Frontiers in Cardiovascular Medicine 2015; 2: 34. Doi: 10.3389/fcvm.2015.00034.
301. Schron EB., Exner DV., Yao Q., et. Al. Quality of life in the antiarrhythmics versus implantable defibrillators trial impact of therapy and influence of adverse symptoms and defibrillator shocks. Circulation 2002; 105(5): 589 - 594. Doi: 10.1161/hc0502.103330.
302. Koopman HM., Vrijmoet-Wiersma CM., Langius JN., et al. Psychological functioning and disease-related quality of life in pediatric patients with an implantable cardioverter defibrillator. Pediatric Cardiology 2012; 33(4): 569 - 575. Doi: 10.1007/s00246-012-0175-1.
303. Padeletti L., Arnar DO., Boncinelli L. et al. EHRA Expert Consensus Statement on the management of cardiovascular implantable electronic devices in patients nearing end of life or requesting withdrawal of therapy. Europace 2010; 12(10): 1480 - 1489. Doi: 10.1093/europace/euq275.
304. Jaarsma T., Beattie JM., Ryder M., Rutten FH., et al. Palliative care in heart failure: a position statement from the palliative care workshop of the Heart Failure Association of the European Society of Cardiology. European Journal of Heart Failure 2009; 11(5): 433 - 443. Doi: 10.1093/eurjhf/hfp041.
305. Scott PA., Silberbauer J., McDonagh TA., Murgatroyd FD. Impact of prolonged implantable cardioverter-defibrillator arrhythmia detection times on outcomes: a meta-analysis. Heart Rhythm 2014; 11(5): 828 - 835. Doi: 10.1016/j.hrthm.2014.02.009.
306. Tan VH., Wilton SB., Kuriachan V., et al. Impact of programming strategies aimed at reducing nonessential implantable cardioverter defibrillator therapies on mortality: a systematic review and meta-analysis. Circulation: Arrhythmia and Electrophysiology 2014; 7(1): 164 - 170. Doi: 10.1161/CIRCEP.113.001217.
307. Saeed M., Hanna I., Robotis D., Styperek R., Polosajian L., Khan A., Alonso J., Nabutovsky Y., Neason C. Programming implantable cardioverter-defibrillators in patients with primary prevention indication to prolong time to first shock: results from the PROVIDE study. J Cardiovasc Electrophysiol 2014; 25(1): 52 - 9. Doi: 10.1111/jce.12273.
308. Wathen MS., DeGroot PJ., Sweeney MO., Stark AJ., Otterness MF., Adkisson WO., Canby RC., Khalighi K., Machado C., Rubenstein DS., et al. Prospective randomized multicenter trial of empirical antitachycardia pacing versus shocks for spontaneous rapid ventricular tachycardia in patients with implantable cardioverter-defibrillators: Pacing Fast Ventricular Tachycardia Reduces Shock Therapies (PainFREE Rx II) trial results. Circulation 2004; 110(17): 2591 - 6. Doi: 10.1161/01.CIR.0000145610.64014.E4.
309. Sweeney MO., Wathen MS., Volosin K., Abdalla I., DeGroot PJ., Otterness MF., Stark AJ. Appropriate and inappropriate ventricular therapies, quality of life, and mortality among primary and secondary prevention implantable cardioverter defibrillator patients: results from the Pacing Fast VT REduces Shock ThErapies (PainFREE Rx II) trial. Circulation 2005; 111(22): 2898 - 905. Doi: 10.1161/CIRCULATIONAHA.104.526673.
310. Borne RT., Varosy PD., Masoudi FA. Implantable cardioverter-defibrillator shocks: epidemiology, outcomes, and therapeutic approaches. JAMA Intern Med 2013; 173(10): 859 - 65. Doi: 10.1001/jamainternmed.2013.428.
311. Berg SK., Higgins M., Reilly CM., Langberg JJ., Dunbar SB. Sleep quality and sleepiness in persons with implantable cardioverter defibrillators: outcome from a clinical randomized longitudinal trial. Pacing Clin Electrophysiol 2012; 35(4): 431 - 43. Doi: 10.1111/j.1540-8159.2011.03328.x.
312. Barsheshet A., Moss AJ., McNitt S., Jons C., Glikson M., Klein HU., Huang DT., Steinberg JS., Brown MW., Zareba W., et al. Long-term implications of cumulative right ventricular pacing among patients with an implantable cardioverter-defibrillator. Heart Rhythm 2011; 8(2): 212 - 8. Doi: 10.1016/j.hrthm.2010.10.035.
313. Wilkoff BL., Cook JR., Epstein AE., Greene HL., Hallstrom AP., Hsia H., Kutalek SP., Sharma A.; Dual Chamber and VVI Implantable Defibrillator Trial Investigators. Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA 2002; 288(24): 3115 - 23. Doi: 10.1001/jama.288.24.3115.
314. Olshansky B., Day JD., Moore S., Gering L., Rosenbaum M., McGuire M., Brown S., Lerew DR. Is dual-chamber programming inferior to single-chamber programming in an implantable cardioverter-defibrillator? Results of the INTRINSIC RV (Inhibition of Unnecessary RV Pacing With AVSH in ICDs) study. Circulation 2007; 115(1): 9 - 16. Doi: 10.1161/CIRCULATIONAHA.106.629428.
315. Gasparini M., Proclemer A., Klersy C., Kloppe A., Lunati M., Ferrer JB., Hersi A., Gulaj M., Wijfels MC., Santi E., et al. Effect of long-detection interval vs standard-detection interval for implantable cardioverter-defibrillators on antitachycardia pacing and shock delivery: the ADVANCE III randomized clinical trial. JAMA 2013; 309(18): 1903 - 11. Doi: 10.1001/jama.2013.4598.
316. Moss AJ., Schuger C., Beck CA., Brown MW., Cannom DS., Daubert JP., Estes NA 3rd., Greenberg H., Hall WJ., Huang DT., et al. Reduction in inappropriate therapy and mortality through ICD programming. N Engl J Med. 2012 Dec 13; 367(24): 2275 - 83. Doi: 10.1056/NEJMoa1211107.
317. Wilkoff BL., Williamson BD., Stern RS., Moore SL., Lu F., Lee SW., Birgersdotter-Green UM., Wathen MS., Van Gelder IC., Heubner BM., et al. Strategic programming of detection and therapy parameters in implantable cardioverter-defibrillators reduces shocks in primary prevention patients: results from the PREPARE (Primary Prevention Parameters Evaluation) study. J Am Coll Cardiol 2008; 52(7): 541 - 50. Doi: 10.1016/j.jacc.2008.05.011.
318. Ploux S., Swerdlow CD., Strik M., Welte N., Klotz N., Ritter P.,  , Bordachar P. Towards eradication of inappropriate therapies for ICD lead failure by combining comprehensive remote monitoring and lead noise alerts. J Cardiovasc Electrophysiol 2018; 29(8): 1125 - 1134. Doi: 10.1111/jce.13653.
, Bordachar P. Towards eradication of inappropriate therapies for ICD lead failure by combining comprehensive remote monitoring and lead noise alerts. J Cardiovasc Electrophysiol 2018; 29(8): 1125 - 1134. Doi: 10.1111/jce.13653.
319. Ellenbogen KA., Gunderson BD., Stromberg KD., Swerdlow CD. Performance of Lead Integrity Alert to assist in the clinical diagnosis of implantable cardioverter defibrillator lead failures: analysis of different implantable cardioverter defibrillator leads. Circ Arrhythm Electrophysiol 2013; 6(6): 1169 - 77. Doi: 10.1161/CIRCEP.113.000744.
320. Swerdlow CD., Gunderson BD., Ousdigian KT., Abeyratne A., Sachanandani H., Ellenbogen KA. Downloadable software algorithm reduces inappropriate shocks caused by implantable cardioverter-defibrillator lead fractures: a prospective study. Circulation 2010; 122(15): 1449 - 55. Doi: 10.1161/CIRCULATIONAHA.110.962407.
321.  , Kouakam C., Klug D.,
, Kouakam C., Klug D.,  , Brigadeau F.,
, Brigadeau F.,  , Blangy H., Lacroix D.,
, Blangy H., Lacroix D.,  , Sadoul N., et al. Decreased delivery of inappropriate shocks achieved by remote monitoring of ICD: a substudy of the ECOST trial. J Cardiovasc Electrophysiol 2014; 25(7): 763 - 70. Doi: 10.1111/jce.12405.
, Sadoul N., et al. Decreased delivery of inappropriate shocks achieved by remote monitoring of ICD: a substudy of the ECOST trial. J Cardiovasc Electrophysiol 2014; 25(7): 763 - 70. Doi: 10.1111/jce.12405.
322. Gulizia MM., Piraino L., Scherillo M., Puntrello C., Vasco C, Scianaro MC., Mascia F., Pensabene O., Giglia S.,  , et al. A randomized study to compare ramp versus burst antitachycardia pacing therapies to treat fast ventricular tachyarrhythmias in patients with implantable cardioverter defibrillators: the PITAGORA ICD trial. Circ Arrhythm Electrophysiol 2009; 2(2): 146 - 53. Doi: 10.1161/CIRCEP.108.804211.
, et al. A randomized study to compare ramp versus burst antitachycardia pacing therapies to treat fast ventricular tachyarrhythmias in patients with implantable cardioverter defibrillators: the PITAGORA ICD trial. Circ Arrhythm Electrophysiol 2009; 2(2): 146 - 53. Doi: 10.1161/CIRCEP.108.804211.
323. Gold MR., Weiss R., Theuns DA., Smith W., Leon A., Knight BP., Carter N., Husby M., Burke MC. Use of a discrimination algorithm to reduce inappropriate shocks with a subcutaneous implantable cardioverter-defibrillator. Heart Rhythm 2014; 11(8): 1352 - 8. Doi: 10.1016/j.hrthm.2014.04.012.
324. Mesquita J., Cavaco D., Ferreira A., Lopes N., Santos PG., Carvalho MS., Haas A., Costa F., Carmo P., Morgado F., et al. Effectiveness of subcutaneous implantable cardioverter-defibrillators and determinants of inappropriate shock delivery. Int J Cardiol 2017; 232: 176 - 180. Doi: 10.1016/j.ijcard.2017.01.034.
325. Gold MR., Lambiase PD., El-Chami MF., Knops RE., Aasbo JD., Bongiorni MG., Russo AM., Deharo JC., Burke MC., Dinerman J., et al. Primary Results From the Understanding Outcomes With the S-ICD in Primary Prevention Patients With Low Ejection Fraction (UNTOUCHED) Trial. Circulation 2021; 143(1): 7 - 17. Doi: 10.1161/CIRCULATIONAHA.120.048728.
326. Gilliam FR., Hayes DL., Boehmer JP., Day J., Heidenreich PA., Seth M., Jones PW., Stein KM., Saxon LA. Real world evaluation of dual-zone ICD and CRT-D programming compared to single-zone programming: the ALTITUDE REDUCES study. J Cardiovasc Electrophysiol 2011; 22(9): 1023 - 9. Doi: 10.1111/j.1540-8167.2011.02086.x.
327. Silka MJ., Shah MJ., Silva JNA., Balaji S., Beach CM., Benjamin MN., Berul CI., Cannon B., Cecchin F., Cohen MI., et al. 2021 PACES Expert Consensus Statement on the Indications and Management of Cardiovascular Implantable Electronic Devices in Pediatric Patients: Executive Summary. Heart Rhythm; 18(11): 1925 - 1950. Doi: 10.1016/j.hrthm.2021.07.051.
328. Приложение к приказу об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья, утвержденному приказом Министерства здравоохранения Российской Федерации и Министерства труда и социальной защиты Российской Федерации от 31 мая 2019 г.: N 345н/372н.
329. Hupcey JE., Kitko L., Alonso W. Patients' Perceptions of Illness Severity in Advanced Heart Failure. J Hosp Palliat Nurs 2016; 18(2): 110 - 114. Doi: 10.1097/NJH.0000000000000229.
330. Tsutsui H., Isobe M., Ito H., Ito H., Okumura K., Ono M., Kitakaze M., Kinugawa K., Kihara Y., Goto Y., et al. Japanese Circulation Society and the Japanese Heart Failure Society Joint Working Group. JCS 2017/JHFS 2017 Guideline on Diagnosis and Treatment of Acute and Chronic Heart Failure - Digest Version. Circ J 2019; 83(10): 2084 - 2184. Doi: 10.1253/circj.CJ-19-0342.
331. Lewis WR., Luebke DL., Johnson NJ., Harrington MD., Costantini O., Aulisio MP. Withdrawing implantable defibrillator shock therapy in terminally ill patients. Am J Med 2006; 119(10): 892 - 6. Doi: 10.1016/j.amjmed.2006.01.017.
332. Goldstein NE., Lampert R., Bradley E., Lynn J., Krumholz HM. Management of implantable cardioverter defibrillators in end-of-life care. Ann Intern Med 2004; 141(11): 835 - 8. Doi: 10.7326/0003-4819-141-11-200412070-00006.
333. Kinch Westerdahl A.,  , Mattiasson AC., Rosenqvist M., Frykman V. Implantable cardioverter-defibrillator therapy before death: high risk for painful shocks at end of life. Circulation 2014; 129(4): 422 - 9. Doi: 10.1161/CIRCULATIONAHA.113.002648.
, Mattiasson AC., Rosenqvist M., Frykman V. Implantable cardioverter-defibrillator therapy before death: high risk for painful shocks at end of life. Circulation 2014; 129(4): 422 - 9. Doi: 10.1161/CIRCULATIONAHA.113.002648.
334. Brady DR. Planning for Deactivation of Implantable Cardioverter Defibrillators at the End of Life in Patients With Heart Failure. Crit Care Nurse 2016; 36(6): 24 - 31. Doi: 10.4037/ccn2016362.
335. Ferrell BR, Twaddle ML, Melnick A, Meier DE. National Consensus Project Clinical Practice Guidelines for Quality Palliative Care Guidelines, 4th Edition. J Palliat Med. 2018 Dec; 21(12): 1684 - 1689.
336. Greater Manchester and Eastern Cheshire Strategic Clinical Networks. Palliative care pain & symptom control guidelines for adults. 5th ed. [Manchester]: Greater Manchester and Eastern Cheshire Strategic Clinical Networks; 2019.
337. Stoevelaar R., Brinkman-Stoppelenburg A., van Driel AG., Theuns DA., Bhagwandien RE., van Bruchem-Visser RL., Lokker IE., van der Heide A., Rietjens JA. Trends in time in the management of the implantable cardioverter defibrillator in the last phase of life: a retrospective study of medical records. Eur J Cardiovasc Nurs 2019; 18(6): 449 - 457. Doi: 10.1177/1474515119844660.
338. Crespo-Leiro MG., Metra M., Lund LH., Milicic D., Costanzo MR., Filippatos G., Gustafsson F., Tsui S., Barge-Caballero E., De Jonge N., et al. Advanced heart failure: a position statement of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2018; 20(11): 1505 - 1535. Doi: 10.1002/ejhf.1236.
339. Kida K., Doi S., Suzuki N. Palliative Care in Patients with Advanced Heart Failure. Heart Fail Clin 2020; 16(2): 243 - 254. Doi: 10.1016/j.hfc.2019.12.006.
340. Lowey SE. Palliative Care in the Management of Patients with Advanced Heart Failure. Adv Exp Med Biol 2018; 1067: 295 - 311. Doi: 10.1007/5584_2017_115.
341. Гасымова Н.З., Шабанов В.В., Сафонов Н.В., Рзаев Ф.Г., Филатов А.Г., Рогалев П.В., Кропоткин Е.Б., Михайлов Е.Н. Многоконтактное картирование в лечении различных нарушений ритма сердца. Вестник аритмологии 2024; 31(1): 110 - 122. Doi: 10.35336/VA-1297.
342. Philip Saul J., et al. PACES/HRS expert consensus statement on the use of catheter ablation in children and patients with congenital heart disease. Heart Rhythm 2016; 13(6): e251 - 89. Doi: 10.1016/j.hrthm.2016.02.009.
343. Crosson JE., Callans DJ., Bradley DJ., Dubin A., Epstein M., Etheridge S., Papez A., Phillips JR., Rhodes LA., Saul P., Stephenson E., Stevenson W., Zimmerman F. PACES/HRS expert consensus statement on the evaluation and management of ventricular arrhythmias in the child with a structurally normal heart. Heart Rhythm. 2014; 11(9): e55 - 78. Doi: 10.1016/j.hrthm.2014.05.010.
344. Latchamsetty R., Bogun F. Premature Ventricular Complexes and Premature Ventricular Complex Induced Cardiomyopathy. Current Problems in Cardiology 2015; 40(9): 379 - 422. Doi: 10.1016/j.cpcardiol.2015.03.002.
345. Daniels DV., Lu YY., Morton JB., Santucci PA., et al Idiopathic epicardial left ventricular tachycardia originating remote from the sinus of Valsalva: electrophysiological characteristics, catheter ablation, and identification from the 12-1ead electrocardiogram. Circulation. 2006; 113(13): 1659 - 1666. Doi: 10.1161/CIRCULATIONAHA.105.611640.
346. Doppalapudi H., Yamada T., McElderry HT., Plumb VJ., et al. Ventricular tachycardia originating from the posterior papillary muscle in the left ventricle: a distinct clinical syndrome. Circulation: Arrhythmia and Electrophysiology 2008; 1(1): 23 - 29. Doi: 10.1161/CIRCEP.107.742940.
347. Sapp JL., Tang ASL., Parkash R., Stevenson WG., Healey JS., Wells G. A randomized clinical trial of catheter ablation and antiarrhythmic drug therapy for suppression of ventricular tachycardia in ischemic cardiomyopathy: The VANISH2 trial. Am. Heart J. 2024; 274: 1 - 10. Doi: 10.1016/j.ahj.2024.04.009.
348. Visser CA., Kan G., David GK., Lie KI., et al. Two dimensional echocardiography in the diagnosis of left ventricular thrombus: a prospective study of 67 patients with anatomic validation. Chest 1983; 83(2): 228 - 232. Doi: 10.1378/chest.83.2.228.
349. Weinsaft JW., Kim RJ., Ross M., et al. Contrast-enhanced anatomic imaging as compared to contrast-enhanced tissue characterization for detection of left ventricular thrombus. JACC Cardiovascular Imaging 2009; 2(8): 969 - 979. Doi: 10.1016/j.jcmg.2009.03.017.
350. Soto-Iglesias D., Acosta J., Penela D., et al. Image-based criteria to identify the presence of epicardial arrhythmogenic substrate in patients with transmural myocardial infarction. Heart Rhythm 2018; 15(6): 814 - 821. Doi: 10.1016/j.hrthm.2018.02.007.
351. Reddy VY., Reynolds MR., Neuzil P., et al. Prophylactic catheter ablation for the prevention of defibrillator therapy. The New England Journal of Medicine 2007; 357(26): 2657 - 2665. Doi: 10.1056/NEJMoa065457.
352. Kumar S., Baldinger SH., Romero J., et al. Substrate-based ablation versus ablation guided by activation and entrainment mapping for ventricular tachycardia: a systematic review and meta-analysis. Journal of Cardiovascular Electrophysiology 2016; 27(12): 1437 - 1447. Doi: 10.1111/jce.13088.
353. Acosta J., Penela D., Andreu D., et al. Multielectrode vs. point-by-point mapping for ventricular tachycardia substrate ablation: a randomized study. Europace 2018; 20(3): 512 - 519. Doi: 10.1093/europace/euw406.
354. Berte B., Relan J., Sacher F., et al. Impact of electrode type on mapping of scar-related VT. Journal of Cardiovascular Electrophysiology 2015; 26(11): 1213 - 1223. Doi: 10.1111/jce.12761.
355. Yamashita S., Cochet H., Sacher F., et al. Impact of new technologies and approaches for post-myocardial infarction ventricular tachycardia ablation during long-term follow-up. Circulation: Arrhythmia and Electrophysiology 2016; 9(7): e003901. Doi: 10.1161/CIRCEP.116.003901.
356. Desjardins B., Yokokawa M., Good E., et al. Characteristics of intramural scar in patients with nonischemic cardiomyopathy and relation to intramural ventricular arrhythmias. Circulation: Arrhythmia and Electrophysiology 2013; 6(5): 891 - 897. Doi: 10.1161/CIRCEP.113.000073.
357. Deyell MW., Park KM., Han Y., Frankel DS., Dixit S., Cooper JM., Hutchinson MD., Lin D., Garcia F., Bala R., et al. Predictors of recovery of left ventricular dysfunction after ablation of frequent ventricular premature depolarizations. Heart Rhythm 2012; 9(9): 1465 - 72. Doi: 10.1016/j.hrthm.2012.05.019.
358.  , Wellens HJ. Philippe Coumel: a founding father of modern arrhythmology. Europace 2004; 6(5): 464 - 5. Doi: 10.1016/j.eupc.2004.06.001.
, Wellens HJ. Philippe Coumel: a founding father of modern arrhythmology. Europace 2004; 6(5): 464 - 5. Doi: 10.1016/j.eupc.2004.06.001.
359. Neira V., Enriquez A., Simpson C., Baranchuk A. Update on long QT syndrome. J Cardiovasc Electrophysiol 2019; 30(12): 3068 - 3078. Doi: 10.1111/jce.14227.
360. Winbo A., Paterson DJ. The Brain-Heart Connection in Sympathetically Triggered Inherited Arrhythmia Syndromes. Heart Lung Circ 2020; 29(4): 529 - 537. Doi: 10.1016/j.hlc.2019.11.002.
361. Schwartz PJ., Priori SG., Cerrone M., Spazzolini C., Odero A., Napolitano C., Bloise R., De Ferrari GM., Klersy C., Moss AJ., et al. Left cardiac sympathetic denervation in the management of high-risk patients affected by the long-QT syndrome. Circulation 2004; 109(15): 1826 - 33. Doi: 10.1161/01.CIR.0000125523.14403.1E.
362. Ataklte F., Erqou S., Laukkanen J., Kaptoge S. Meta-analysis of ventricular premature complexes and their relation to cardiac mortality in general populations. Am J Cardiol 2013; 112(8): 1263 - 70. Doi: 10.1016/j.amjcard.2013.05.065.
363. Arnar DO., Mairesse GH., Boriani G., Calkins H., Chin A., Coats A., Deharo JC., Svendsen JH.,  , Isa R., et al. Management of asymptomatic arrhythmias: a European Heart Rhythm Association (EHRA) consensus document, endorsed by the Heart Failure Association (HFA), Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), Cardiac Arrhythmia Society of Southern Africa (CASSA), and Latin America Heart Rhythm Society (LAHRS). Europace 2019; 21(6): 844 - 845. Doi: 10.1093/europace/euz046.
, Isa R., et al. Management of asymptomatic arrhythmias: a European Heart Rhythm Association (EHRA) consensus document, endorsed by the Heart Failure Association (HFA), Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), Cardiac Arrhythmia Society of Southern Africa (CASSA), and Latin America Heart Rhythm Society (LAHRS). Europace 2019; 21(6): 844 - 845. Doi: 10.1093/europace/euz046.
364. Lee V., Perera D., Lambiase P. Prognostic significance of exercise-induced premature ventricular complexes: a systematic review and meta-analysis of observational studies. Heart Asia 2017; 9(1): 14 - 24. Doi: 10.1136/heartasia-2016-010854.
365. Lin CY., Chang SL., Chung FP., Chen YY., Lin YJ., Lo LW., Hu YF., Tuan TC., Chao TF., Liao JN., Chang YT., et al. Long-Term Outcome of Non-Sustained Ventricular Tachycardia in Structurally Normal Hearts. PLoS One 2016; 11(8): e0160181. Doi: 10.1371/journal.pone.0160181.
366. Muser D., Nucifora G., Muser D., Nucifora G., Pieroni M., Castro SA., Casado Arroyo R., Maeda S., Benhayon DA., Liuba I., et al. Prognostic Value of Nonischemic Ringlike Left Ventricular Scar in Patients With Apparently Idiopathic Nonsustained Ventricular Arrhythmias. Circulation 2021; 143(14): 1359 - 1373. Doi: 10.1161/CIRCULATIONAHA.120.047640.
367. Aquaro GD., Pingitore A., Strata E., Di Bella G., Molinaro S., Lombardi M. Cardiac magnetic resonance predicts outcome in patients with premature ventricular complexes of left bundle branch block morphology. J Am Coll Cardiol 2010; 56(15): 1235 - 43. Doi: 10.1016/j.jacc.2010.03.087.
368. Чуева К.А., Татарский Р.Б., Ковальчук Т.С., Первунина Т.М., Труфанов Г.Е., Рыжков А.В., Фокин В.А., Лебедев Д.С., Васичкина Е.С. Возможности магнитно-резонансной томографии в поиске субстрата "идиопатических" желудочковых аритмий у детей. Вестник аритмологии. 2021; 28(4): 9 - 14.
369. Prystowsky EN., Padanilam BJ., Joshi S., Fogel RI. Ventricular arrhythmias in the absence of structural heart disease. J Am Coll Cardiol 2012; 59(20): 1733 - 44. Doi: 10.1016/j.jacc.2012.01.036.
370. Niwano S., Wakisaka Y., Niwano H., Fukaya H., Kurokawa S., Kiryu M., Hatakeyama Y., Izumi T. Prognostic significance of frequent premature ventricular contractions originating from the ventricular outflow tract in patients with normal left ventricular function. Heart 2009; 95(15): 1230 - 7. Doi: 10.1136/hrt.2008.159558.
371. Sharma N., Cortez D., Imundo JR. High burden of premature ventricular contractions in structurally normal hearts: To worry or not in pediatric patients? Ann Noninvasive Electrocardiol 2019; 24(6): e12663. Doi: 10.1111/anec.12663.
372. Hamon D., Swid MA., Rajendran PS., Liu A., Boyle NG., Shivkumar K., Bradfield JS. Premature ventricular contraction diurnal profiles predict distinct clinical characteristics and beta-blocker responses. J Cardiovasc Electrophysiol 2019; 30(6): 836 - 843. Doi: 10.1111/jce.13944.
373. Pfammatter JP., Paul T. Idiopathic ventricular tachycardia in infancy and childhood: a multicenter study on clinical profile and outcome. Working Group on Dysrhythmias and Electrophysiology of the Association for European Pediatric Cardiology. J Am Coll Cardiol 1999; 33(7): 2067 - 72. Doi: 10.1016/s0735-1097(99) 00105-9.
374. Kjekshus J., Bathen J., Orning OM., Storstein L. A double-blind, crossover comparison of flecainide acetate and disopyramide phosphate in the treatment of ventricular premature complexes. Am J Cardiol 1984; 53(5): 72B-78B. Doi: 10.1016/0002-9149(84) 90506-x.
375. Krittayaphong R., Sriratanasathavorn C., Dumavibhat C., Pumprueg S., Boonyapisit W., Pooranawattanakul S., Phrudprisan S., Kangkagate C. Electrocardiographic predictors of long-term outcomes after radiofrequency ablation in patients with right-ventricular outflow tract tachycardia. Europace 2006; 8(8): 601 - 6. Doi: 10.1093/europace/eul067.
376. Komatsu Y., Nogami A., Kurosaki K., Morishima I., Masuda K., Ozawa T., Kaneshiro T., Hanaki Y., Shinoda Y., Talib AK., et al. Fascicular Ventricular Tachycardia Originating From Papillary Muscles: Purkinje Network Involvement in the Reentrant Circuit. Circ Arrhythm Electrophysiol 2017; 10(3): e004549. Doi: 10.1161/CIRCEP.116.004549.
377. Singh SN., Fletcher RD., Fisher SG., Singh BN., Lewis HD., Deedwania PC., Massie BM., Colling C., Lazzeri D. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N Engl J Med 1995; 333(2): 77 - 82. Doi: 10.1056/NEJM199507133330201.
378. Callans DJ., Menz V., Schwartzman D., Gottlieb CD., Marchlinski FE. Repetitive monomorphic tachycardia from the left ventricular outflow tract: electrocardiographic patterns consistent with a left ventricular site of origin. J Am Coll Cardiol 1997; 29(5): 1023 - 7. Doi: 10.1016/s0735-1097(97) 00004-1.
379. Kanagaratnam L., Tomassoni G., Schweikert R., Pavia S., Bash D., Beheiry S., Neibauer M., Saliba W., Chung M., Tchou P., et al. Ventricular tachycardias arising from the aortic sinus of valsalva: an under-recognized variant of left outflow tract ventricular tachycardia. J Am Coll Cardiol 2001; 37(5): 1408 - 14. Doi: 10.1016/s0735-1097(01) 01127-5.
380. Lerman BB. Response of nonreentrant catecholamine-mediated ventricular tachycardia to endogenous adenosine and acetylcholine. Evidence for myocardial receptor-mediated effects. Circulation 1993; 87(2): 382 - 90. Doi: 10.1161/01.cir.87.2.382.
381. Baksiene D., Sileikiene R., Sileikis V., Kazakevicius T., Zabiela V., Zebiene M., Puodziukynas A. Idiopathic ventricular tachycardia in children: curative therapy with radiofrequency ablation. Medicina (Kaunas) 2007; 43(10): 803 - 7.
382. van Huls van Taxis CF., Piers SR., de Riva Silva M., Dekkers OM., Pijnappels DA., Schalij MJ., Wijnmaalen AP., Zeppenfeld K. Fatigue as Presenting Symptom and a High Burden of Premature Ventricular Contractions Are Independently Associated With Increased Ventricular Wall Stress in Patients With Normal Left Ventricular Function. Circ Arrhythm Electrophysiol 2015; 8(6): 1452 - 9. Doi: 10.1161/CIRCEP.115.003091.
383. Bogun F., Crawford T., Reich S., Koelling TM., Armstrong W., Good E., Jongnarangsin K., Marine JE., Chugh A., Pelosi F., et al. Radiofrequency ablation of frequent, idiopathic premature ventricular complexes: comparison with a control group without intervention. Heart Rhythm 2007; 4(7): 863 - 7. Doi: 10.1016/j.hrthm.2007.03.003.
384. Lee A., Denman R., Haqqani HM. Ventricular Ectopy in the Context of Left Ventricular Systolic Dysfunction: Risk Factors and Outcomes Following Catheter Ablation. Heart Lung Circ 2019; 28(3): 379 - 388. Doi: 10.1016/j.hlc.2018.01.012.
385. Mountantonakis SE., Frankel DS., Gerstenfeld EP., Dixit S., Lin D., Hutchinson MD., Riley M., Bala R., Cooper J., Callans D., et al. Reversal of outflow tract ventricular premature depolarization-induced cardiomyopathy with ablation: effect of residual arrhythmia burden and preexisting cardiomyopathy on outcome. Heart Rhythm 2011; 8(10): 1608 - 14. Doi: 10.1016/j.hrthm.2011.04.026.
386. Penela D., Van Huls Van Taxis C., Van Huls Vans Taxis C., Aguinaga L.,  , Mont L., Castel MA., Heras M., Tolosana JM., Sitges M., et al. Neurohormonal, structural, and functional recovery pattern after premature ventricular complex ablation is independent of structural heart disease status in patients with depressed left ventricular ejection fraction: a prospective multicenter study. J Am Coll Cardiol 2013; 62(13): 1195 - 202. Doi: 10.1016/j.jacc.2013.06.012.
, Mont L., Castel MA., Heras M., Tolosana JM., Sitges M., et al. Neurohormonal, structural, and functional recovery pattern after premature ventricular complex ablation is independent of structural heart disease status in patients with depressed left ventricular ejection fraction: a prospective multicenter study. J Am Coll Cardiol 2013; 62(13): 1195 - 202. Doi: 10.1016/j.jacc.2013.06.012.
387. Zang M., Zhang T., Mao J., Zhou S., He B. Beneficial effects of catheter ablation of frequent premature ventricular complexes on left ventricular function. Heart 2014; 100(10): 787 - 93. Doi: 10.1136/heartjnl-2013-305175.
388. Jabbari R.,  , Glinge C., Risgaard B., Jabbari J., Winkel BG., Terkelsen CJ., Tilsted HH., Jensen LO., Hougaard M., et al. Incidence and risk factors of ventricular fibrillation before primary angioplasty in patients with first ST-elevation myocardial infarction: a nationwide study in Denmark. J Am Heart Assoc 2015; 4(1): e001399. Doi: 10.1161/JAHA.114.001399.
, Glinge C., Risgaard B., Jabbari J., Winkel BG., Terkelsen CJ., Tilsted HH., Jensen LO., Hougaard M., et al. Incidence and risk factors of ventricular fibrillation before primary angioplasty in patients with first ST-elevation myocardial infarction: a nationwide study in Denmark. J Am Heart Assoc 2015; 4(1): e001399. Doi: 10.1161/JAHA.114.001399.
389. Orvin K., Eisen A., Goldenberg I., Gottlieb S., Kornowski R., Matetzky S., Golovchiner G., Kuznietz J., Gavrielov-Yusim N., Segev A., et al. Outcome of contemporary acute coronary syndrome complicated by ventricular tachyarrhythmias. Europace 2016; 18(2): 219 - 26. Doi: 10.1093/europace/euv027.
390. Demirel F., Rasoul S., Elvan A., Ottervanger JP., Dambrink JH., Gosselink AT., Hoorntje JC., Ramdat Misier AR., van 't Hof AW. Impact of out-of-hospital cardiac arrest due to ventricular fibrillation in patients with ST-elevation myocardial infarction admitted for primary percutaneous coronary intervention: Impact of ventricular fibrillation in STEMI patients. Eur Heart J Acute Cardiovasc Care 2015; 4(1): 16 - 23. Doi: 10.1177/2048872614547448.
391. Mehta RH., Starr AZ., Lopes RD., Hochman JS., et al. Incidence of and outcomes associated with ventricular tachycardia or fibrillation in patients undergoing primary percutaneous coronary intervention. JAMA 2009; 301(17): 1779 - 1789. Doi: 10.1001/jama.2009.600.
392. Demidova MM., Carlson J., Erlinge D., Platonov PG. Predictors of ventricular fibrillation at reperfusion in patients with acute ST-elevation myocardial infarction treated by primary percutaneous coronary intervention. The American Journal of Cardiology 2015; 115(4): 417 - 422. Doi: 10.1016/j.amjcard.2014.11.025.
393. Dumas F., Cariou A., Manzo-Silberman S., Grimaldi D., Vivien B., Rosencher J., Empana JP., Carli P., Mira JP., Jouven X., et al. Immediate percutaneous coronary intervention is associated with better survival after out-of-hospital cardiac arrest: insights from the PROCAT (Parisian Region Out of hospital Cardiac ArresT) registry. Circ Cardiovasc Interv 2010; 3(3): 200 - 7. Doi: 10.1161/CIRCINTERVENTIONS.109.913665.
394. Cheng Y.-J., Li Z.-Y., Yao F.-J., Xu X.-J., et al. Early repolarization is associated with a significantly increased risk of ventricular arrhythmias and sudden cardiac death in patients with structural heart disease. Heart Rhythm 2017; 14(8): 1157 - 1164. Doi: 10.1016/j.hrthm.2017.04.022.
395. Dumas F., Bougouin W., Geri G., Lamhaut L., et al. Emergency percutaneous coronary intervention in post-cardiac arrest patients without ST-segment elevation pattern: insights from the PROCAT II registry. JACC 2016; 9(10): 1011 - 1018. Doi: 10.1016/j.jcin.2016.02.001.
396. Ibanez B., James S., Agewall S., Antunes MJ., Bucciarelli-Ducci C., et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal 2018; 39(2): 119 - 177. Doi: 10.1093/eurheartj/ehx393.
397. Chatterjee S., Chaudhuri D., Vedanthan R., Fuster V., et al. Early intravenous beta-blockers in patients with acute coronary syndrome-a meta-analysis of randomized trials. International Journal of Cardiology 2013; 168(2): 915 - 921. Doi: 10.1016/j.ijcard.2012.10.050.
398. Windecker S., Koth P., Alfonso F., et al. 2014 ЕОК/EACTS Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ЕОК) and the European Association for Cardio-Thoracic Surgery (EACTS) developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). European Heart Journal 2014; 35(37): 2541 - 619. Doi: 10.1093/eurheartj/ehu278.
399. Roffi M., Patrono C., Cotter J.P., et al. 2015 ЕОК Guidelines for the Management of Acute Coronary Syndromes in Patients Presenting Without Persistent ST-Segment Elevation. European Heart Journal 2016; 37(3): 267 - 315. Doi: 10.1093/eurheartj/ehv320.
400. Steg PG., James SK., Atar D., et al. ЕОК Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. European Heart Journal 2012; 33(20): 2569 - 2619. Doi: 10.1093/eurheartj/ehs215.
401. Soholm H., Wachte UK., Nietsen SL., et al. Tertiary centres have improved survival compared to other hospitals in the Copenhagen area after out-of-hospital cardiac arrest. Resuscitation 2013; 84(2): 162 - 167. Doi: 10.1016/j.resuscitation.2012.06.029.
402. Boersma E., Maas AC., Deckers JW., Simoons ML. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet 1996; 348(9030): 771 - 775. Doi: 10.1016/S0140-6736(96) 02514-7.
403. Boersma E. Primary Coronary Angioplasty vs. Thrombolysis Group. Does time matter? A pooled analysis of randomized clinical trials comparing primary percutaneous coronary intervention and in-hospital fibrinolysis in acute myocardial infarction patients. European Heart Journal 2006; 27(7): 779 - 788. Doi: 10.1093/eurheartj/ehi810.
404. Keeley EC., Boura JA., Grines CL. Comparison of primary and facilitated percutaneous coronary interventions for ST-etevation myocardial infarction: quantitative review of randomised trials. Lancet 2006; 367(9510): 5 79 - 88. Doi: 10.1016/S0140-6736(06) 68148-8.
405. Spaulding CM., Joly LM., Rosenberg A., et al. Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. The New England Journal of Medicine 1997; 336(23): 1629 - 33. Doi: 10.1056/NEJM199706053362302.
406. Bowers TR., O'Neitt WW., Grines C., et al. Effect of reperfusion on biventricular function and survival after right ventricular infarction. The New England Journal of Medicine 1998; 338(14): 933 - 940. Doi: 10.1056/NEJM199804023381401.
407. Gorenek B., Blomstrom Lundqvist C., Brugada P., Terradetlas J., et al. Cardiac arrhythmias in acute coronary syndromes: position paper from the joint EH RA, ACCA, and EAPCI task force. Europace 2015; 4(4): 386. Doi: 10.1177/2048872614550583.
408. Piccini JP., Hranitzky PM., Kilaru R., Rouleau JL., White HD., Aylward PE., Van de Werf F., Solomon SD., Califf RM., Velazquez EJ. Relation of mortality to failure to prescribe beta blockers acutely in patients with sustained ventricular tachycardia and ventricular fibrillation following acute myocardial infarction (from the VALsartan In Acute myocardial iNfarcTion trial [VALIANT] Registry). Am J Cardiol 2008; 102(11): 1427 - 32. Doi: 10.1016/j.amjcard.2008.07.033.
409. Huikuri HV., Castellanos A., Myerburg RJ. Sudden death due to cardiac arrhythmias. N Engl J Med 2001; 345(20): 1473 - 82. Doi: 10.1056/NEJMra000650.
410. Bougouin W., Marijon E., Puymirat E., Defaye P., Celermajer DS., Le Heuzey JY., Boveda S., Kacet S., Mabo P., Barnay C., Det al. Incidence of sudden cardiac death after ventricular fibrillation complicating acute myocardial infarction: a 5-year cause-of-death analysis of the FAST-MI 2005 registry. Eur Heart J 2014; 35(2): 116 - 22. Doi: 10.1093/eurheartj/eht453.
411. Nademanee K., Taylor R., Bailey WE., Rieders DE., Kosar EM. Treating electrical storm: sympathetic blockade versus advanced cardiac life support-guided therapy. Circulation 2000; 102(7): 742 - 7. Doi: 10.1161/01.cir.102.7.742.
412. Piccini JP., Schulte PJ., Pieper KS., Mehta RH., White HD., Van de Werf F., Ardissino D., Califf RM., Granger CB., Ohman EM., et al. Antiarrhythmic drug therapy for sustained ventricular arrhythmias complicating acute myocardial infarction. Crit Care Med 2011; 39(1): 78 - 83. Doi: 10.1097/CCM.0b013e3181fd6ad7.
413. Ahn JM., Lee KH., Yoo SY., Cho YR., Suh J., Shin ES., Lee JH., Shin DI., Kim SH., Baek SH., et al. Prognosis of Variant Angina Manifesting as Aborted Sudden Cardiac Death. J Am Coll Cardiol 2016; 68(2): 137 - 45. Doi: 10.1016/j.jacc.2016.04.050. P.
414. Sueda S., Kohno H. Optimal Medications and Appropriate Implantable Cardioverter-defibrillator Shocks in Aborted Sudden Cardiac Death Due to Coronary Spasm. Intern Med 2018; 57(10): 1361 - 1369. Doi: 10.2169/internalmedicine.8796-17.
415.  , Oloriz T., le Polain de Waroux JB., Burri H., Kreidieh B., de Asmundis C., Arias MA., Arbelo E.,
, Oloriz T., le Polain de Waroux JB., Burri H., Kreidieh B., de Asmundis C., Arias MA., Arbelo E.,  ,
,  , et al. Long-term prognosis of patients with life-threatening ventricular arrhythmias induced by coronary artery spasm. Europace 2018; 20(5): 851 - 858. Doi: 10.1093/europace/eux052.
, et al. Long-term prognosis of patients with life-threatening ventricular arrhythmias induced by coronary artery spasm. Europace 2018; 20(5): 851 - 858. Doi: 10.1093/europace/eux052.
416. Buxton AE., Lee KL., DiCarlo L., Gold MR., Greer GS., Prystowsky EN., O'Toole MF., Tang A., Fisher JD., Coromilas J., et al. Electrophysiologic testing to identify patients with coronary artery disease who are at risk for sudden death. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med 2000; 342(26): 1937 - 45. Doi: 10.1056/NEJM200006293422602.
417. Exner DV., Kavanagh KM., Slawnych MP., Mitchell LB., Ramadan D., Aggarwal SG., Noullett C., Van Schaik A., Mitchell RT., Shibata MA., et al. Noninvasive risk assessment early after a myocardial infarction the REFINE study. J Am Coll Cardiol 2007; 50(24): 2275 - 84. Doi: 10.1016/j.jacc.2007.08.042.
418. Malik M., Camm AJ., Janse MJ., Julian DG., Frangin GA., Schwartz PJ. Depressed heart rate variability identifies postinfarction patients who might benefit from prophylactic treatment with amiodarone: a substudy of EMIAT (The European Myocardial Infarct Amiodarone Trial). J Am Coll Cardiol 2000; 35(5): 1263 - 75. Doi: 10.1016/s0735-1097(00) 00571-4.
419. Allman KC., Shaw LJ., Hachamovitch R., Udelson JE. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002; 39(7): 1151 - 8. Doi: 10.1016/s0735-1097(02) 01726-6.
420. Altmann DR., Mutschelknauss M., Ehl N., Koller M., Schaer B., ![]() , Ammann P.,
, Ammann P.,  , Rickli H., Osswald S., et al. Prevalence of severely impaired left ventricular ejection fraction after reperfused ST-elevation myocardial infarction. Swiss Med Wkly 2013; 143: w13869. Doi: 10.4414/smw.2013.13869.
, Rickli H., Osswald S., et al. Prevalence of severely impaired left ventricular ejection fraction after reperfused ST-elevation myocardial infarction. Swiss Med Wkly 2013; 143: w13869. Doi: 10.4414/smw.2013.13869.
421. Shen L., Jhund PS., Petrie MC., Claggett BL., Barlera S., Cleland JGF., Dargie HJ., Granger CB., Kjekshus J.,  , et al. Declining Risk of Sudden Death in Heart Failure. N Engl J Med 2017; 377(1): 41 - 51. Doi: 10.1056/NEJMoa1609758.
, et al. Declining Risk of Sudden Death in Heart Failure. N Engl J Med 2017; 377(1): 41 - 51. Doi: 10.1056/NEJMoa1609758.
422. Gatzoulis KA., Tsiachris D., Arsenos P., Archontakis S., Dilaveris P., Vouliotis A., Sideris S., Skiadas I., Kallikazaros I., Stefanadis C. Prognostic value of programmed ventricular stimulation for sudden death in selected high risk patients with structural heart disease and preserved systolic function. Int J Cardiol 2014; 176(3): 1449 - 51. Doi: 10.1016/j.ijcard.2014.08.068.
423. Olshansky B., Hahn EA., Hartz VL., Prater SP., Mason JW. Clinical significance of syncope in the electrophysiologic study versus electrocardiographic monitoring (ESVEM) trial. The ESVEM Investigators. Am Heart J 1999; 137(5): 878 - 86. Doi: 10.1016/s0002-8703(99) 70412-6.
424. Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med 1997; 337(22): 1576 - 83. Doi: 10.1056/NEJM199711273372202.
425. Pacifico A., Hohnloser SH., Williams JH., Tao B., Saksena S., Henry PD., Prystowsky EN. Prevention of implantable-defibrillator shocks by treatment with sotalol. d,l-Sotalol Implantable Cardioverter-Defibrillator Study Group. N Engl J Med 1999; 340(24): 1855 - 62. Doi: 10.1056/NEJM199906173402402.
426. Willems S., Tilz RR., Steven D.,  , Wegscheider K.,
, Wegscheider K.,  , Meyer C., Heeger CH., Metzner A., Sinner MF., et al. BERLIN VT Investigators. Preventive or Deferred Ablation of Ventricular Tachycardia in Patients With Ischemic Cardiomyopathy and Implantable Defibrillator (BERLIN VT): A Multicenter Randomized Trial. Circulation 2020; 141(13): 1057 - 1067. Doi: 10.1161/CIRCULATIONAHA.119.043400.
, Meyer C., Heeger CH., Metzner A., Sinner MF., et al. BERLIN VT Investigators. Preventive or Deferred Ablation of Ventricular Tachycardia in Patients With Ischemic Cardiomyopathy and Implantable Defibrillator (BERLIN VT): A Multicenter Randomized Trial. Circulation 2020; 141(13): 1057 - 1067. Doi: 10.1161/CIRCULATIONAHA.119.043400.
427. Kuck KH., Schaumann A., Eckardt L., Willems S., Ventura R.,  , Pitschner HF., Kautzner J., Schumacher B., Hansen PS. VTACH study group. Catheter ablation of stable ventricular tachycardia before defibrillator implantation in patients with coronary heart disease (VTACH): a multicentre randomised controlled trial. Lancet 2010; 375(9708): 31 - 40. Doi: 10.1016/S0140-6736(09) 61755-4.
, Pitschner HF., Kautzner J., Schumacher B., Hansen PS. VTACH study group. Catheter ablation of stable ventricular tachycardia before defibrillator implantation in patients with coronary heart disease (VTACH): a multicentre randomised controlled trial. Lancet 2010; 375(9708): 31 - 40. Doi: 10.1016/S0140-6736(09) 61755-4.
428. Kuck KH., Tilz RR., Deneke T., Hoffmann BA., Ventura R., Hansen PS., Zarse M., Hohnloser SH., Kautzner J., Willems S. SMS Investigators. Impact of Substrate Modification by Catheter Ablation on Implantable Cardioverter-Defibrillator Interventions in Patients With Unstable Ventricular Arrhythmias and Coronary Artery Disease: Results From the Multicenter Randomized Controlled SMS (Substrate Modification Study). Circ Arrhythm Electrophysiol 2017; 10(3): e004422. Doi: 10.1161/CIRCEP.116.004422.
429. Pitt B., White H., Nicolau J., Martinez F., Gheorghiade M., Aschermann M., van Veldhuisen DJ., Zannad F., Krum H., Mukherjee R., et al. EPHESUS Investigators. Eplerenone reduces mortality 30 days after randomization following acute myocardial infarction in patients with left ventricular systolic dysfunction and heart failure. J Am Coll Cardiol 2005; 46(3): 425 - 31. Doi: 10.1016/j.jacc.2005.04.038.
430. Peck KY., Lim YZ., Hopper I., Krum H. Medical therapy versus implantable cardioverter - defibrillator in preventing sudden cardiac death in patients with left ventricular systolic dysfunction and heart failure: a meta-analysis of > 35,000 patients. Int J Cardiol 2014; 173(2): 197 - 203. Doi: 10.1016/j.ijcard.2014.02.014.
431. Chatterjee S., Udell JA., Sardar P., Lichstein E., Ryan JJ. Comparable benefit of  therapy in heart failure across regions of the world: meta-analysis of randomized clinical trials. Can J Cardiol 2014; 30(8): 898 - 903. Doi: 10.1016/j.cjca.2014.03.012.
therapy in heart failure across regions of the world: meta-analysis of randomized clinical trials. Can J Cardiol 2014; 30(8): 898 - 903. Doi: 10.1016/j.cjca.2014.03.012.
432. Neumann FJ., Sousa-Uva M., Ahlsson A., Alfonso F., Banning AP., Benedetto U., Byrne RA., Collet JP., Falk V., Head SJ., et al. ESC Scientific Document Group. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019; 40(2): 87 - 165. Doi: 10.1093/eurheartj/ehy394.
433. Dor V., Civaia F., Alexandrescu C., Sabatier M., Montiglio F. Favorable effects of left ventricular reconstruction in patients excluded from the Surgical Treatments for Ischemic Heart Failure (STICH) trial. J Thorac Cardiovasc Surg 2011; 141(4): 905 - 16, 916.e1-4. Doi: 10.1016/j.jtcvs.2010.10.026.
434. Jones RH., Velazquez EJ., Michler RE., Sopko G., Oh JK., O'Connor CM., Hill JA., Menicanti L., Sadowski Z., Desvigne-Nickens P., et al. STICH Hypothesis 2 Investigators. Coronary bypass surgery with or without surgical ventricular reconstruction. N Engl J Med 2009; 360(17): 1705 - 17. Doi: 10.1056/NEJMoa0900559.
435. Babokin V., Shipulin V., Batalov R., Popov S. Surgical ventricular reconstruction with endocardectomy along radiofrequency ablation-induced markings. J Thorac Cardiovasc Surg 2013; 146(5): 1133 - 8. Doi: 10.1016/j.jtcvs.2012.08.067.
436. Sartipy U.,  , Insulander P., Lindblom D. Surgery for ventricular tachycardia in patients undergoing surgical ventricular restoration: the Karolinska approach. J Interv Card Electrophysiol 2007; 19(3): 171 - 8. Doi: 10.1007/s10840-007-9152-7.
, Insulander P., Lindblom D. Surgery for ventricular tachycardia in patients undergoing surgical ventricular restoration: the Karolinska approach. J Interv Card Electrophysiol 2007; 19(3): 171 - 8. Doi: 10.1007/s10840-007-9152-7.
437. ![]() de Luna A., Coumel P., Leclercq JF. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am Heart J 1989; 117(1): 151 - 9. Doi: 10.1016/0002-8703(89) 90670-4.
de Luna A., Coumel P., Leclercq JF. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am Heart J 1989; 117(1): 151 - 9. Doi: 10.1016/0002-8703(89) 90670-4.
438. Josephson ME., Harken AH., Horowitz LN. Endocardial excision: a new surgical technique for the treatment of recurrent ventricular tachycardia. Circulation 1979; 60(7): 1430 - 9. Doi: 10.1161/01.cir.60.7.1430.
439. Reddy YM., Chinitz L., Mansour M., Bunch TJ., Mahapatra S., Swarup V., Di Biase L., Bommana S., Atkins D., Tung R., et al. Percutaneous left ventricular assist devices in ventricular tachycardia ablation: multicenter experience. Circ Arrhythm Electrophysiol 2014; 7(2): 244 - 50. Doi: 10.1161/CIRCEP.113.000548.
440. Dor V., Sabatier M., Montiglio F., Rossi P., Toso A., Di Donato M. Results of nonguided subtotal endocardiectomy associated with left ventricular reconstruction in patients with ischemic ventricular arrhythmias. J Thorac Cardiovasc Surg 1994; 107(5): 1301 - 7.
441. Molossi S., Agrawal H., Mery CM., Krishnamurthy R., et al. Outcomes in anomalous aortic origin of a coronary artery following a prospective standardized approach. Circulation: Cardiovascular Interventions 2020; 13(2): e008445. Doi: 10.1161/CIRCINTERVENTIONS.119.008445.
442. Krasuski RA., Magyar D., Hart S., Kalahasti V., et al. Long-term outcome and impact of surgery on adults with coronary arteries originating from the opposite coronary cusp. Circulation 2011; 123(2): 154 - 62. Doi: 10.1161/CIRCULATIONAHA.109.921106.
443. Jegatheeswaran A., Devlin PJ., McCrindle BW., Williams WG., et al. Features associated with myocardial ischemia in anomalous aortic origin of a coronary artery: a congenital heart surgeons' society study. The Journal of Thoracic and Cardiovascular Surgery 2019; 158(3): 822-834.e3. Doi: 10.1016/j.jtcvs.2019.02.122.
444. Jegatheeswaran A., Devlin PJ., Williams WG., et al. Outcomes after anomalous aortic origin of a coronary artery repair: a congenital heart surgeons' society study. The Journal of Thoracic and Cardiovascular Surgery 2020 Sep; 160(3): 757 - 771. e5. Doi: 10.1016/j.jtcvs.2020.01.114.
445. Elliott P., Andersson B., Arbustini E., et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. European Heart Journal 2008; 29(2): 270 - 276. Doi: 10.1093/eurheartj/ehm342.
446. Ader F., De Groote P.,  , Rooryck-Thambo C., et al. FLNC pathogenic variants in patients with cardiomyopathies: prevalence and genotype-phenotype correlations. Clinical Genetics 2019; 96(4): 317 - 329. Doi: 10.1111/cge.13594.
, Rooryck-Thambo C., et al. FLNC pathogenic variants in patients with cardiomyopathies: prevalence and genotype-phenotype correlations. Clinical Genetics 2019; 96(4): 317 - 329. Doi: 10.1111/cge.13594.
447. Gigli M., Merlo M., Graw SL., Barbati G., et al. Genetic risk of arrhythmic phenotypes in patients with dilated cardiomyopathy. JACC 2019; 74(11): 1480 - 1490. Doi: 10.1016/j.jacc.2019.06.072.
448. Van den Hoogenhof MMG., Beqqali A., Amin AS., van der Made I., et al. RBM20 mutations induce an arrhythmogenic dilated cardiomyopathy related to disturbed calcium handling. Circulation 2018; 138(13): 1330 - 1342. Doi: 10.1161/CIRCULATIONAHA.117.031947.
449. Kayvanpour E., Sedaghat-Hamedani F., Amr A., Lai A., Haas J., Holzer DB., et al. Genotype-phenotype associations in dilated cardiomyopathy: meta-analysis on more than 8000 inpiduals. Clinical Research in Cardiology 2017; 106(2): 127 - 139. Doi: 10.1007/s00392-016-1033-6.
450. Ortiz-Genga MF., Cuenca S., Dal Ferro M., Zorio E., et al. Truncating FLNC mutations are associated with high-risk dilated and arrhythmogenic cardiomyopathies. JACC 2016; 68(22): 2440 - 2451. Doi: 10.1016/j.jacc.2016.09.927.
451. Di Marco A., Anguera I., Schmitt M., Klem I., et al. Late gadolinium enhancement and the risk for ventricular arrhythmias or sudden death in dilated cardiomyopathy: systematic review and meta-analysis. JACC 2017; 5(1): 28 - 38. Doi: 10.1016/j.jchf.2016.09.017.
452. Francone M. Role of cardiac magnetic resonance in the evaluation of dilated cardiomyopathy: diagnostic contribution and prognostic significance. ISRN Radiology 2014; 365404. Doi: 10.1155/2014/365404. УДД 5 УУР С.
453. Klem I., Klein M., Khan M., Yang E.Y., et al. Relationship of LVEF and myocardial scar to long-term mortality risk and mode of death in patients with nonischemic cardiomyopathy. Circulation 2021; 143(14): 1343 - 1358. Doi: 10.1161/CIRCULATIONAHA.120.048477.
454. Goldberger JJ.,  , Patel T., et al. Sudden cardiac death risk stratification in patients with nonischemic dilated cardiomyopathy. JACC 2014; 63(18): 1879 - 1889. Doi: 10.1016/j.jacc.2013.12.021.
, Patel T., et al. Sudden cardiac death risk stratification in patients with nonischemic dilated cardiomyopathy. JACC 2014; 63(18): 1879 - 1889. Doi: 10.1016/j.jacc.2013.12.021.
455. Link MS., Costeas XF., Griffith JL., Colburn CD., et al. High incidence of appropriate implantable cardioverter-defibrillator therapy in patients with syncope of unknown etiology and inducible ventricular arrhythmias. JACC 1997; 29(2): 370 - 375. Doi: 10.1016/s0735-1097(96) 00477-9.
456. Pasotti M., Klersy C., Pilotto A., Marziliano N., Rapezzi C., Serio A., Mannarino S., Gambarin F., Favalli V., Grasso M., et al. Long-term outcome and risk stratification in dilated cardiolaminopathies. J Am Coll Cardiol 2008; 52(15): 1250 - 60. Doi: 10.1016/j.jacc.2008.06.044.
457.  , Hasselberg NE., Dejgaard LA.,
, Hasselberg NE., Dejgaard LA.,  , Andersen K., Holm T., Edvardsen T., Haugaa KH. Exercise is Associated With Impaired Left Ventricular Systolic Function in Patients With Lamin A/C Genotype. J Am Heart Assoc 2020; 9(2): e012937. Doi: 10.1161/JAHA.119.012937.
, Andersen K., Holm T., Edvardsen T., Haugaa KH. Exercise is Associated With Impaired Left Ventricular Systolic Function in Patients With Lamin A/C Genotype. J Am Heart Assoc 2020; 9(2): e012937. Doi: 10.1161/JAHA.119.012937.
458. Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989; 321(6): 406 - 12. Doi: 10.1056/NEJM198908103210629.
459. Connolly SJ., Camm AJ., Halperin JL., Joyner C., Alings M., Amerena J., Atar D.,  ,
,  , Borggrefe M., et al. Dronedarone in high-risk permanent atrial fibrillation. N Engl J Med 2011; 365(24): 2268 - 76. Doi: 10.1056/NEJMoa1109867.
, Borggrefe M., et al. Dronedarone in high-risk permanent atrial fibrillation. N Engl J Med 2011; 365(24): 2268 - 76. Doi: 10.1056/NEJMoa1109867.
460. Beggs SAS., Jhund PS., Jackson CE., McMurray JJV., Gardner RS. Non-ischaemic cardiomyopathy, sudden death and implantable defibrillators: a review and meta-analysis. Heart 2018; 104(2): 144 - 150. Doi: 10.1136/heartjnl-2016-310850.
461. Zabel M., Willems R., Lubinski A., Bauer A., Brugada J., Conen D., Flevari P.,  , Svetlosak M., Huikuri HV., et al. Clinical effectiveness of primary prevention implantable cardioverter-defibrillators: results of the EU-CERT-ICD controlled multicentre cohort study. Eur Heart J 2020; 41(36): 3437 - 3447. Doi: 10.1093/eurheartj/ehaa226.
, Svetlosak M., Huikuri HV., et al. Clinical effectiveness of primary prevention implantable cardioverter-defibrillators: results of the EU-CERT-ICD controlled multicentre cohort study. Eur Heart J 2020; 41(36): 3437 - 3447. Doi: 10.1093/eurheartj/ehaa226.
462. van Rijsingen IA., Arbustini E., Elliott PM., Mogensen J., Hermans-van Ast JF., van der Kooi AJ., van Tintelen JP., van den Berg MP., Pilotto A., Pasotti M., et al. Risk factors for malignant ventricular arrhythmias in lamin a/c mutation carriers a European cohort study. J Am Coll Cardiol 2012; 59(5): 493 - 500. Doi: 10.1016/j.jacc.2011.08.078.
463. Thuillot M., Maupain C., Gandjbakhch E., Waintraub X., Hidden-Lucet F., Isnard R., Ader F., Rouanet S., Richard P., Charron P. External validation of risk factors for malignant ventricular arrhythmias in lamin A/C mutation carriers. Eur J Heart Fail 2019; 21(2): 253 - 254. Doi: 10.1002/ejhf.1384.
464. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of inpidual data from 6500 patients in randomised trials. Amiodarone Trials Meta-Analysis Investigators. Lancet 1997; 350(9089): 1417 - 24.
465. Di Marco A., Brown PF., Bradley J., Nucifora G., Claver E., de Frutos F., Dallaglio PD., Comin-Colet J., Anguera I., Miller CA., et al. Improved Risk Stratification for Ventricular Arrhythmias and Sudden Death in Patients With Nonischemic Dilated Cardiomyopathy. J Am Coll Cardiol 2021; 77(23): 2890 - 2905. Doi: 10.1016/j.jacc.2021.04.030.
466. Merlo M., Gentile P., Artico J.,  , Paldino A., De Angelis G., Barbati G., Alonge M., Gigli M., Pinamonti B., et al. Arrhythmic risk stratification in patients with dilated cardiomyopathy and intermediate left ventricular dysfunction. J Cardiovasc Med (Hagerstown) 2019; 20(5): 343 - 350. Doi: 10.2459/JCM.0000000000000792.
, Paldino A., De Angelis G., Barbati G., Alonge M., Gigli M., Pinamonti B., et al. Arrhythmic risk stratification in patients with dilated cardiomyopathy and intermediate left ventricular dysfunction. J Cardiovasc Med (Hagerstown) 2019; 20(5): 343 - 350. Doi: 10.2459/JCM.0000000000000792.
467. Mariani M.V., Pierucci N., Fanisio F. Inherited Arrhythmias in the Pediatric Population: An Updated Overview. Medicina (Kaunas) 2024; 60(1): 94. Doi: 10.3390/medicina60010094.
468. Zecchin M., Di Lenarda A., Gregori D., Merlo M., Pivetta A., Vitrella G., Sabbadini G., Mestroni L., Sinagra G. Are nonsustained ventricular tachycardias predictive of major arrhythmias in patients with dilated cardiomyopathy on optimal medical treatment? Pacing Clin Electrophysiol 2008; 31(3): 290 - 9. Doi: 10.1111/j.1540-8159.2008.00988.x.
469. Connolly SJ., Hallstrom AP., Cappato R., Schron EB., Kuck KH., Zipes DP., Greene HL., Boczor S., Domanski M., Follmann D., et al. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg. Canadian Implantable Defibrillator Study. Eur Heart J 2000; 21(24): 2071 - 8. Doi: 10.1053/euhj.2000.2476.
470. Dinov B., Fiedler L.,  , Bollmann A., Rolf S., Piorkowski C., Hindricks G., Arya A. Outcomes in catheter ablation of ventricular tachycardia in dilated nonischemic cardiomyopathy compared with ischemic cardiomyopathy: results from the Prospective Heart Centre of Leipzig VT (HELP-VT) Study. Circulation 2014; 129(7): 728 - 36. Doi: 10.1161/CIRCULATIONAHA.113.003063.
, Bollmann A., Rolf S., Piorkowski C., Hindricks G., Arya A. Outcomes in catheter ablation of ventricular tachycardia in dilated nonischemic cardiomyopathy compared with ischemic cardiomyopathy: results from the Prospective Heart Centre of Leipzig VT (HELP-VT) Study. Circulation 2014; 129(7): 728 - 36. Doi: 10.1161/CIRCULATIONAHA.113.003063.
471. Ebert M., Wijnmaalen AP., de Riva M., Trines SA., Androulakis AFA., Glashan CA., Schalij MJ., Peter van Tintelen J., Jongbloed JDH., Zeppenfeld K. Prevalence and Prognostic Impact of Pathogenic Variants in Patients With Dilated Cardiomyopathy Referred for Ventricular Tachycardia Ablation. JACC Clin Electrophysiol 2020; 6(9): 1103 - 1114. Doi: 10.1016/j.jacep.2020.04.025.
472. Muser D., Santangeli P., Castro SA., Pathak RK., Liang JJ., Hayashi T., Magnani S., Garcia FC., Hutchinson MD., Supple GG., et al. Long-Term Outcome After Catheter Ablation of Ventricular Tachycardia in Patients With Nonischemic Dilated Cardiomyopathy. Circ Arrhythm Electrophysiol 2016; 9(10): e004328. Doi: 10.1161/CIRCEP.116.004328.
473. Tung R., Vaseghi M., Frankel DS., Vergara P., Di Biase L., Nagashima K., Yu R., Vangala S., Tseng CH., Choi EK., et al. Freedom from recurrent ventricular tachycardia after catheter ablation is associated with improved survival in patients with structural heart disease: An International VT Ablation Center Collaborative Group study. Heart Rhythm 2015; 12(9): 1997 - 2007. Doi: 10.1016/j.hrthm.2015.05.036.
474. Corrado D., Link MS., Calkins H. Arrhythmogenic Right Ventricular Cardiomyopathy. N Engl J Med 2017; 376(15): 1489 - 90. Doi: 10.1056/NEJMc1701400.
475. Aquaro GD., Barison A., Todiere G., Grigoratos C., Ait Ali L., Di Bella G., Emdin M., Festa P. Usefulness of Combined Functional Assessment by Cardiac Magnetic Resonance and Tissue Characterization Versus Task Force Criteria for Diagnosis of Arrhythmogenic Right Ventricular Cardiomyopathy. Am J Cardiol 2016; 118(11): 1730 - 1736. Doi: 10.1016/j.amjcard.2016.08.056.
476. Rastegar N., Te Riele AS., James CA., Bhonsale A., Murray B., Tichnell C., Calkins H., Tandri H., Bluemke DA., Kamel IR., et al. Fibrofatty Changes: Incidence at Cardiac MR Imaging in Patients with Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy. Radiology 2016; 280(2): 405 - 12. Doi: 10.1148/radiol.2016150988.
477. te Riele AS., Bhonsale A., James CA., Rastegar N., Murray B., Burt JR., Tichnell C., Madhavan S., Judge DP., Bluemke DA., et al. Incremental value of cardiac magnetic resonance imaging in arrhythmic risk stratification of arrhythmogenic right ventricular dysplasia/cardiomyopathy-associated desmosomal mutation carriers. J Am Coll Cardiol 2013; 62(19): 1761 - 9. Doi: 10.1016/j.jacc.2012.11.087.
478. Cicenia M., Drago F. Arrhythmogenic Cardiomyopathy: Diagnosis, Evolution, Risk Stratification and Pediatric Population-Where Are We? J Cardiovasc Dev Dis 2022; 9(4): 98. Doi: 10.3390/jcdd9040098.
479. Bhonsale A., Groeneweg JA., James CA., Dooijes D., Tichnell C., Jongbloed JD., Murray B., te Riele AS., van den Berg MP., Bikker H., et al. Impact of genotype on clinical course in arrhythmogenic right ventricular dysplasia/cardiomyopathy-associated mutation carriers. Eur Heart J 2015; 36(14): 847 - 55. Doi: 10.1093/eurheartj/ehu509.
480. Rigato I., Bauce B., Rampazzo A., Zorzi A., Pilichou K., Mazzotti E., Migliore F., Marra MP., Lorenzon A., De Bortoli M., et al. Compound and digenic heterozygosity predicts lifetime arrhythmic outcome and sudden cardiac death in desmosomal gene-related arrhythmogenic right ventricular cardiomyopathy. Circ Cardiovasc Genet 2013; 6(6): 533 - 42. Doi: 10.1161/CIRCGENETICS.113.000288.
481. Bhonsale A., James CA., Tichnell C., Murray B., Gagarin D., Philips B., Dalal D., Tedford R., Russell SD., Abraham T., et al. Incidence and predictors of implantable cardioverter-defibrillator therapy in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy undergoing implantable cardioverter-defibrillator implantation for primary prevention. J Am Coll Cardiol 2011; 58(14): 1485 - 96. Doi: 10.1016/j.jacc.2011.06.043.
482. Saguner AM., Medeiros-Domingo A., Schwyzer MA., On CJ., Haegeli LM., Wolber T.,  , Steffel J., Krasniqi N.,
, Steffel J., Krasniqi N.,  , et al. Usefulness of inducible ventricular tachycardia to predict long-term adverse outcomes in arrhythmogenic right ventricular cardiomyopathy. Am J Cardiol 2013; 111(2): 250 - 7. Doi: 10.1016/j.amjcard.2012.09.025.
, et al. Usefulness of inducible ventricular tachycardia to predict long-term adverse outcomes in arrhythmogenic right ventricular cardiomyopathy. Am J Cardiol 2013; 111(2): 250 - 7. Doi: 10.1016/j.amjcard.2012.09.025.
483. Chivulescu M.,  , Popescu BA., Skulstad H., Edvardsen T., Jurcut RO., Haugaa KH. High penetrance and similar disease progression in probands and in family members with arrhythmogenic cardiomyopathy. Eur Heart J 2020; 41(14): 1401 - 1410. Doi: 10.1093/eurheartj/ehz570.
, Popescu BA., Skulstad H., Edvardsen T., Jurcut RO., Haugaa KH. High penetrance and similar disease progression in probands and in family members with arrhythmogenic cardiomyopathy. Eur Heart J 2020; 41(14): 1401 - 1410. Doi: 10.1093/eurheartj/ehz570.
484. James CA., Bhonsale A., Tichnell C., Murray B., Russell SD., Tandri H., Tedford RJ., Judge DP., Calkins H. Exercise increases age-related penetrance and arrhythmic risk in arrhythmogenic right ventricular dysplasia/cardiomyopathy-associated desmosomal mutation carriers. J Am Coll Cardiol 2013; 62(14): 1290 - 1297. Doi: 10.1016/j.jacc.2013.06.033.
485.  , Dejgaard LA., Saberniak J., Rootwelt C., Stokke MK., Edvardsen T., Haugaa KH. Harmful Effects of Exercise Intensity and Exercise Duration in Patients With Arrhythmogenic Cardiomyopathy. JACC Clin Electrophysiol 2018; 4(6): 744 - 753. Doi: 10.1016/j.jacep.2018.01.010.
, Dejgaard LA., Saberniak J., Rootwelt C., Stokke MK., Edvardsen T., Haugaa KH. Harmful Effects of Exercise Intensity and Exercise Duration in Patients With Arrhythmogenic Cardiomyopathy. JACC Clin Electrophysiol 2018; 4(6): 744 - 753. Doi: 10.1016/j.jacep.2018.01.010.
486. Saberniak J., Hasselberg NE., Borgquist R., Platonov PG., Sarvari SI., Smith HJ., Ribe M., Holst AG., Edvardsen T., Haugaa KH. Vigorous physical activity impairs myocardial function in patients with arrhythmogenic right ventricular cardiomyopathy and in mutation positive family members. Eur J Heart Fail 2014; 16(12): 1337 - 44. Doi: 10.1002/ejhf.181.
487. Towbin JA., McKenna WJ., Abrams DJ., Ackerman MJ., Calkins H., Darrieux FCC., Daubert JP., de Chillou C., DePasquale EC., Desai MY., et al. 2019 HRS expert consensus statement on evaluation, risk stratification, and management of arrhythmogenic cardiomyopathy. Heart Rhythm 2019; 16(11): e301-e372. Doi: 10.1016/j.hrthm.2019.05.007.
488. Te Riele ASJM., James CA., Calkins H., Tsatsopoulou A. Arrhythmogenic Right Ventricular Cardiomyopathy in Pediatric Patients: An Important but Underrecognized Clinical Entity. Front Pediatr 2021; 9: 750916. Doi: 10.3389/fped.2021.750916.
489. Sawant AC., Te Riele AS., Tichnell C., Murray B., Bhonsale A., Tandri H., Judge DP., Calkins H., James CA. Safety of American Heart Association-recommended minimum exercise for desmosomal mutation carriers. Heart Rhythm 2016; 13(1): 199 - 207. Doi: 10.1016/j.hrthm.2015.08.035.
490. Denis A., Sacher F., Derval N., Lim HS., Cochet H., Shah AJ., Daly M., Pillois X., Ramoul K., Komatsu Y., et al. Diagnostic value of isoproterenol testing in arrhythmogenic right ventricular cardiomyopathy. Circ Arrhythm Electrophysiol 2014; 7(4): 590 - 7. Doi: 10.1161/CIRCEP.113.001224.
491. Marcus GM., Glidden DV., Polonsky B., et al. Efficacy of antiarrhythmic drugs in arrhythmogenic right ventricular cardiomyopathy: a report from the North American ARVC Registry. JACC 2009; 54(7): 609 - 615. Doi: 10.1016/j.jacc.2009.04.052.
492. Canpolat U., Aytemir K., Dural M., et al. Fragmented QRS complex predicts the arrhythmic events in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia: frQRS and outcomes in ARVC/D / Journal of Cardiovascular Electrophysiology 2013; 24(11): 1260 - 1266. Doi: 10.1111/jce.12202.
493. Corrado D., Calkins H., Link M.S., et al. Prophylactic implantable defibrillator in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia and no prior ventricular fibrillation or sustained ventricular tachycardia. Circulation 2010; 122(12): 1144 - 1152. Doi: 10.1161/CIRCULATIONAHA.109.913871.
494. Martin A., Crawford J., Skinner JR., Smith W. High arrhythmic burden but low mortality during long-term follow-up in arrhythmogenic right ventricular cardiomyopathy. Heart, Lung and Circulation 2016; 25(3): 275 - 281. Doi: 10.1016/j.hlc.2015.08.019.
495. Mazzanti A., Ng K., Faragli A., Maragna R., et al. Arrhythmogenic right ventricular cardiomyopathy: clinical course and predictors of arrhythmic risk / JACC 2016; 68(23): 2540 - 2550. Doi: 10.1016/j.jacc.2016.09.951.
496. Santangeli P., Dello Russo A., Pieroni M., et al. Fragmented and delayed electrograms within fibrofatty scar predict arrhythmic events in arrhythmogenic right ventricular cardiomyopathy: Results from a prospective risk stratification study. Heart Rhythm 2012; 9(8): 1200 - 1206. Doi: 10.1016/j.hrthm.2012.03.057.
497. Hulot J.-S., Jouven X., Empana J.-P., et al. Natural history and risk stratification of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circulation 2004; 110(14): 1879 - 1884. Doi: 10.1161/01.CIR.0000143375.93288.82.
498. Corrado D., Leoni L., Link MS., et al. Implantable cardioverter-defibrillator therapy for prevention of sudden death in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia. Circulation 2003; 108(25): 3084 - 3091. Doi: 10.1161/01.CIR.0000103130.33451.D2.
499. Wang W., Cadrin-Tourigny J., Bhonsale A., et al. Arrhythmic outcome of arrhythmogenic right ventricular cardiomyopathy patients without implantable defibrillators. Journal of Cardiovascular Electrophysiology 2018; 29(10): 1396 - 1402. Doi: 10.1111/jce.13668.
500. Link MS., Laidlaw D., Polonsky B., et al. Ventricular arrhythmias in the North American multidisciplinary study of ARVC: predictors, characteristics, and treatment. JACC 2014; 64(2): 119 - 125. Doi: 10.1016/j.jacc.2014.04.035.
501. Mahida S., Venlet J., Saguner A.M., et al. Ablation compared with drug therapy for recurrent ventricular tachycardia in arrhythmogenic right ventricular cardiomyopathy: results from a multicenter study. Heart Rhythm 2019; 16(4): 536 - 543. Doi: 10.1016/j.hrthm.2018.10.016.
502. Santangeli P., Zado E.S., Supple G.E., et al. Long-term outcome with catheter ablation of ventricular tachycardia in patients with arrhythmogenic right ventricular cardiomyopathy. Circ: Arrhythmia and Electrophysiology 2015; 8(6): 1413 - 1421. Doi: 10.1161/CIRCEP.115.003562.
503. Ommen SR., Mital S., Burke MA., et al. 2020 AHA/ACC guideline for the diagnosis and treatment of patients with hypertrophic сardiomyopathy: executive summary: a report of the American College of Cardiology. American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2020; 142(25): e533-e557. Doi: 10.1161/CIR.0000000000000938.
504. Lorenzini M., Anastasiou Z., O'Mahony C., et al. Mortality among referral patients with hypertrophic cardiomyopathy vs the general European population. JAMA Cardiology 2020; 5(1): 73 - 80. Doi: 10.1001/jamacardio.2019.4534.
505. O'Mahony C., Jichi F., Ommen SR,. et al. International External Validation Study of the 2014 European Society of Cardiology Guidelines on Sudden Cardiac Death Prevention in Hypertrophic Cardiomyopathy (EVIDENCE-HCM). Circulation 2018; 137(10): 1015 - 1023. Doi: 10.1161/CIRCULATIONAHA.117.030437.
506. Vriesendorp PA., Schinkel AF., Liebregts M., Theuns DA., van Cleemput J., Ten Cate FJ., Willems R., Michels M. Validation of the 2014 European Society of Cardiology guidelines risk prediction model for the primary prevention of sudden cardiac death in hypertrophic cardiomyopathy. Circ Arrhythm Electrophysiol 2015; 8(4): 829 - 35. Doi: 10.1161/CIRCEP.114.002553.
507. O'Mahony C., Jichi F., Pavlou M., Monserrat L., Anastasakis A., Rapezzi C., Biagini E., Gimeno JR., Limongelli G., McKenna WJ., et al. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J 2014; 35(30): 2010 - 20. Doi: 10.1093/eurheartj/eht439.
508. Chan RH., Maron BJ., Olivotto I., Pencina MJ., Assenza GE., Haas T., Lesser JR., Gruner C., Crean AM., Rakowski H., et al. Prognostic value of quantitative contrast-enhanced cardiovascular magnetic resonance for the evaluation of sudden death risk in patients with hypertrophic cardiomyopathy. Circulation 2014; 130(6): 484 - 95. Doi: 10.1161/CIRCULATIONAHA.113.007094.
509. Smith BM., Dorfman AL., Yu S., Russell MW., Agarwal PP., Mahani MG., Lu JC. Clinical significance of late gadolinium enhancement in patients <20 years of age with hypertrophic cardiomyopathy. Am J Cardiol 2014; 113(7): 1234 - 9. Doi: 10.1016/j.amjcard.2013.12.034.
510. Miron A., Lafreniere-Roula M., Steve Fan CP., Armstrong KR., Dragulescu A., Papaz T., Manlhiot C., Kaufman B., Butts RJ., Gardin L., et al. A Validated Model for Sudden Cardiac Death Risk Prediction in Pediatric Hypertrophic Cardiomyopathy. Circulation 2020; 142(3): 217 - 229. Doi: 10.1161/CIRCULATIONAHA.
511. He D., Ye M., Zhang L., Jiang B. Prognostic significance of late gadolinium enhancement on cardiac magnetic resonance in patients with hypertrophic cardiomyopathy. Heart Lung 2018; 47(2): 122 - 126. Doi: 10.1016/j.hrtlng.2017.10.008.
512. Weissler-Snir A., Dorian P., Rakowski H., Care M., Spears D. Primary prevention implantable cardioverter-defibrillators in hypertrophic cardiomyopathy-Are there predictors of appropriate therapy? Heart Rhythm 2021; 18(1): 63 - 70. Doi: 10.1016/j.hrthm.2020.08.009.
513. Ho CY., Day SM., Ashley EA., Michels M., Pereira AC., Jacoby D., Cirino AL., Fox JC., Lakdawala NK., Ware JS., et al. Genotype and Lifetime Burden of Disease in Hypertrophic Cardiomyopathy: Insights from the Sarcomeric Human Cardiomyopathy Registry (SHaRe). Circulation 2018; 138(14): 1387 - 1398. Doi: 10.1161/CIRCULATIONAHA.117.033200.
514. Kim HY., Park JE., Lee SC., Jeon ES., On YK., Kim SM., Choe YH., Ki CS., Kim JW., Kim KH. Genotype-Related Clinical Characteristics and Myocardial Fibrosis and their Association with Prognosis in Hypertrophic Cardiomyopathy. J Clin Med 2020; 9(6): 1671. Doi: 10.3390/jcm9061671.
515. Maron BJ., Maron MS., Semsarian C. Double or compound sarcomere mutations in hypertrophic cardiomyopathy: a potential link to sudden death in the absence of conventional risk factors. Heart Rhythm 2012; 9(1): 57 - 63. Doi: 10.1016/j.hrthm.2011.08.009.
516. Rosmini S., Biagini E., O'Mahony C., Bulluck H., Ruozi N., Lopes LR., Guttmann O., Reant P., Quarta CC., Pantazis A., et al. Relationship between aetiology and left ventricular systolic dysfunction in hypertrophic cardiomyopathy. Heart 2017; 103(4): 300 - 306. Doi: 10.1136/heartjnl-2016-310138.
517. Wang J., Wang Y., Zou Y., Sun K., Wang Z., Ding H., Yuan J., Wei W., Hou Q., Wang H., et al. Malignant effects of multiple rare variants in sarcomere genes on the prognosis of patients with hypertrophic cardiomyopathy. Eur J Heart Fail 2014; 16(9): 950 - 7. Doi: 10.1002/ejhf.144.
518. Pelliccia A., Fagard R.,  , Anastassakis A., Arbustini E., Assanelli D., Biffi A., Borjesson M.,
, Anastassakis A., Arbustini E., Assanelli D., Biffi A., Borjesson M.,  , Corrado D., et al. Recommendations for competitive sports participation in athletes with cardiovascular disease: a consensus document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2005; 26(14): 1422 - 45. Doi: 10.1093/eurheartj/ehi325.
, Corrado D., et al. Recommendations for competitive sports participation in athletes with cardiovascular disease: a consensus document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2005; 26(14): 1422 - 45. Doi: 10.1093/eurheartj/ehi325.
519. Национальные Рекомендации по определению риска и профилактике внезапной сердечной смерти / Шляхто Е.В. и др. - Москва, 2008. - 167 с.
520. Norrish G., Ding T., Field E.,  , Olivotto I., Limongelli G., Anastasakis A., Weintraub R., Biagini E., Ragni L., et al. Development of a Novel Risk Prediction Model for Sudden Cardiac Death in Childhood Hypertrophic Cardiomyopathy (HCM Risk-Kids). JAMA Cardiol 2019; 4(9): 918 - 927. Doi: 10.1001/jamacardio.2019.2861.
, Olivotto I., Limongelli G., Anastasakis A., Weintraub R., Biagini E., Ragni L., et al. Development of a Novel Risk Prediction Model for Sudden Cardiac Death in Childhood Hypertrophic Cardiomyopathy (HCM Risk-Kids). JAMA Cardiol 2019; 4(9): 918 - 927. Doi: 10.1001/jamacardio.2019.2861.
521. Norrish G., Qu C., Field E., Cervi E., Khraiche D., Klaassen S., Ojala TH., Sinagra G., Yamazawa H., Marrone C., et al. External validation of the HCM Risk-Kids model for predicting sudden cardiac death in childhood hypertrophic cardiomyopathy. Eur J Prev Cardiol 2022; 29(4): 678 - 686. Doi: 10.1093/eurjpc/zwab181.
522. Elliott PM., Poloniecki J., Dickie S., Sharma S., Monserrat L., Varnava A., Mahon NG., McKenna WJ. Sudden death in hypertrophic cardiomyopathy: identification of high risk patients. J Am Coll Cardiol 2000; 36(7): 2212 - 8. Doi: 10.1016/s0735-1097(00) 01003-2.
523. Rowin EJ., Maron BJ., Carrick RT., Patel PP., Koethe B., Wells S., Maron MS. Outcomes in Patients With Hypertrophic Cardiomyopathy and Left Ventricular Systolic Dysfunction. J Am Coll Cardiol 2020; 75(24): 3033 - 3043. Doi: 10.1016/j.jacc.2020.04.045.
524. Rowin EJ., Maron BJ., Haas TS., Garberich RF., Wang W., Link MS., Maron MS. Hypertrophic Cardiomyopathy With Left Ventricular Apical Aneurysm: Implications for Risk Stratification and Management. J Am Coll Cardiol. 2017 Feb 21; 69(7): 761 - 773. doi: 10.1016/j.jacc.2016.11.063. Erratum in: J Am Coll Cardiol 2017; 69(12): 1652. Doi: 10.1016/j.jacc.2017.02.014.
525. Sadoul N., Prasad K., Elliott PM., Bannerjee S., Frenneaux MP., McKenna WJ. Prospective prognostic assessment of blood pressure response during exercise in patients with hypertrophic cardiomyopathy. Circulation 1997; 96(9): 2987 - 91. Doi: 10.1161/01.cir.96.9.2987.
526. Cecchi F., Maron BJ., Epstein SE. Long-term outcome of patients with hypertrophic cardiomyopathy successfully resuscitated after cardiac arrest. J Am Coll Cardiol 1989; 13(6): 1283 - 8. Doi: 10.1016/0735-1097(89) 90302-1.
527. Elliott PM., Sharma S., Varnava A., Poloniecki J., Rowland E., McKenna WJ. Survival after cardiac arrest or sustained ventricular tachycardia in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 1999; 33(6): 1596 - 601. Doi: 10.1016/s0735-1097(99) 00056-x.
528. Maron BJ., Spirito P., Shen WK., Haas TS., Formisano F., Link MS., Epstein AE., Almquist AK., Daubert JP., Lawrenz T., et al. Implantable cardioverter-defibrillators and prevention of sudden cardiac death in hypertrophic cardiomyopathy. JAMA 2007; 298(4): 405 - 12. Doi: 10.1001/jama.298.4.405.
529. McKenna WJ., Oakley CM., Krikler DM., Goodwin JF. Improved survival with amiodarone in patients with hypertrophic cardiomyopathy and ventricular tachycardia. Br Heart J 1985; 53(4): 412 - 6. Doi: 10.1136/hrt.53.4.412.
530. Melacini P., Maron BJ., Bobbo F., Basso C., Tokajuk B., Zucchetto M., Thiene G., Iliceto S. Evidence that pharmacological strategies lack efficacy for the prevention of sudden death in hypertrophic cardiomyopathy. Heart 2007; 93(6): 708 - 10. Doi: 10.1136/hrt.2006.099416.
531. Dukkipati SR., d'Avila A., Soejima K., Bala R., Inada K., Singh S., Stevenson WG., Marchlinski FE., Reddy VY. Long-term outcomes of combined epicardial and endocardial ablation of monomorphic ventricular tachycardia related to hypertrophic cardiomyopathy. Circ Arrhythm Electrophysiol 2011; 4(2): 185 - 94. Doi: 10.1161/CIRCEP.110.957290.
532. Igarashi M., Nogami A., Kurosaki K., Hanaki Y., Komatsu Y., Fukamizu S., Morishima I., Kaitani K., Nishiuchi S., Talib AK., et al. Radiofrequency Catheter Ablation of Ventricular Tachycardia in Patients With Hypertrophic Cardiomyopathy and Apical Aneurysm. JACC Clin Electrophysiol 2018; 4(3): 339 - 350. Doi: 10.1016/j.jacep.2017.12.020.
533. Kristen AV., Dengler TJ., Hegenbart U., Schonland SO., Goldschmidt H., Sack FU., Voss F., Becker R., Katus HA., Bauer A. Prophylactic implantation of cardioverter-defibrillator in patients with severe cardiac amyloidosis and high risk for sudden cardiac death. Heart Rhythm 2008; 5(2): 235 - 40. Doi: 10.1016/j.hrthm.2007.10.016.
534. Shah MJ., Silka MJ., Silva JNA., Balaji S., Beach CM., Benjamin MN., Berul CI., Cannon B., Cecchin F., Cohen MI., et al. 2021 PACES expert consensus statement on the indications and management of cardiovascular implantable electronic devices in pediatric patients: Developed in collaboration with and endorsed by the Heart Rhythm Society (HRS), the American College of Cardiology (ACC), the American Heart Association (AHA), and the Association for European Paediatric and Congenital Cardiology (AEPC). Endorsed by the Asia Pacific Heart Rhythm Society (APHRS), the Indian Heart Rhythm Society (IHRS), and the Latin American Heart Rhythm Society (LAHRS). Cardiology in the Young 2021; 31(11): 1738 - 1769. Doi: 10.1017/S1047951121003413.
535. Bucci E., Testa M., Licchelli L., Frattari A., El Halabieh NA., Gabriele E., Pignatelli G., De Santis T., Fionda L., Vanoli F., et al. A 34-year longitudinal study on long-term cardiac outcomes in DM1 patients with normal ECG at baseline at an Italian clinical centre. J Neurol 2018; 265(4): 885 - 895. Doi: 10.1007/s00415-018-8773-3.
536. Breton R., Mathieu J. Usefulness of clinical and electrocardiographic data for predicting adverse cardiac events in patients with myotonic dystrophy. Can J Cardiol 2009; 25(2): e23 - 7. Doi: 10.1016/s0828-282x(09) 70479-9.
537. Fayssoil A., Abasse S., Silverston K. Cardiac Involvement Classification and Therapeutic Management in Patients with Duchenne Muscular Dystrophy. J Neuromuscul Dis 2017; 4(1): 17 - 23. Doi: 10.3233/JND-160194.
538. Клинические рекомендации. Прогрессирующая мышечная дистрофия Дюшенна. Прогрессирующая мышечная дистрофия Беккера. Категория Дети. 2024.
539. Bhakta D., Groh MR., Shen C., Pascuzzi RM., Groh WJ. Increased mortality with left ventricular systolic dysfunction and heart failure in adults with myotonic dystrophy type 1. Am Heart J 2010; 160(6): 1137 - 41, 1141.e1. Doi: 10.1016/j.ahj.2010.07.032.
540. Merino JL., Carmona JR.,  , Peinado R., Basterra N., Sobrino JA. Mechanisms of sustained ventricular tachycardia in myotonic dystrophy: implications for catheter ablation. Circulation 1998; 98(6): 541 - 6. Doi: 10.1161/01.cir.98.6.541.
, Peinado R., Basterra N., Sobrino JA. Mechanisms of sustained ventricular tachycardia in myotonic dystrophy: implications for catheter ablation. Circulation 1998; 98(6): 541 - 6. Doi: 10.1161/01.cir.98.6.541.
541. Wahbi K., Meune C., Porcher R.,  , Lazarus A.,
, Lazarus A.,  , Stojkovic T.,
, Stojkovic T.,  , Radvanyi-Hoffmann H., Eymard B., et al. Electrophysiological study with prophylactic pacing and survival in adults with myotonic dystrophy and conduction system disease. JAMA 2012; 307(12): 1292 - 301. Doi: 10.1001/jama.2012.346.
, Radvanyi-Hoffmann H., Eymard B., et al. Electrophysiological study with prophylactic pacing and survival in adults with myotonic dystrophy and conduction system disease. JAMA 2012; 307(12): 1292 - 301. Doi: 10.1001/jama.2012.346.
542. Sanna T., Dello Russo A., Toniolo D., Vytopil M., Pelargonio G., De Martino G., Ricci E., Silvestri G., Giglio V., Messano L., et al. Cardiac features of Emery-Dreifuss muscular dystrophy caused by lamin A/C gene mutations. Eur Heart J 2003; 24(24): 2227 - 36. Doi: 10.1016/j.ehj.2003.09.020.
543. Menon SC., Etheridge SP., Liesemer KN., Williams RV., Bardsley T., Heywood MC., Puchalski MD. Predictive value of myocardial delayed enhancement in Duchenne muscular dystrophy. Pediatr Cardiol 2014; 35(7): 1279 - 85. Doi: 10.1007/s00246-014-0929-z.
544. Prystowsky EN., Pritchett EL., Roses AD., Gallagher J. The natural history of conduction system disease in myotonic muscular dystrophy as determined by serial electrophysiologic studies. Circulation 1979; 60(6): 1360 - 4. Doi: 10.1161/01.cir.60.6.1360.
545. Rajdev A., Groh WJ. Arrhythmias in the muscular dystrophies. Card Electrophysiol Clin 2015; 7(2): 303 - 8. Doi: 10.1016/j.ccep.2015.03.011.
546. Shah Z, Mohammed M., Vuddanda V., Ansari M.W. National trends, gender, management, and outcomes of patients hospitalized for myocarditis. The American Journal of Cardiology 2019; 124(1): 131 - 136. Doi: 10.1016/j.amjcard.2019.03.036.
547. Rosier L., Zouaghi A.,  , Martins R., et al. High risk of sustained ventricular arrhythmia recurrence after acute myocarditis. Journal of Clinical Medicine 2020; 9(3): 848. Doi: 10.3390/jcm9030848.
, Martins R., et al. High risk of sustained ventricular arrhythmia recurrence after acute myocarditis. Journal of Clinical Medicine 2020; 9(3): 848. Doi: 10.3390/jcm9030848.
548. Vaseghi M., Hu T.Y., Tung R., Vergara P., et al. Outcomes of catheter ablation of ventricular tachycardia based on etiology in nonischemic heart disease: an international ventricular tachycardia ablation center collaborative study. JACC 2018; 4(9): 1141 - 1150. Doi: 10.1016/j.jacep.2018.05.007.
549. Kandolin R., Lehtonen J., Airaksinen J., et al. Cardiac sarcoidosis: epidemiology, characteristics, and outcome over 25 years in a nationwide study. Circulation 2015; 131(7): 624 - 632. Doi: 10.1161/CIRCULATIONAHA.114.011522.
550. Nordenswan H.-K., Lehtonen J.,  , Kandolin R., et al. Outcome of cardiac sarcoidosis presenting with high-grade atrioventricular block. Circulation: Arrhythmia and Electrophysiology 2018; 11(8): e006145. Doi: 10.1161/CIRCEP.117.006145.
, Kandolin R., et al. Outcome of cardiac sarcoidosis presenting with high-grade atrioventricular block. Circulation: Arrhythmia and Electrophysiology 2018; 11(8): e006145. Doi: 10.1161/CIRCEP.117.006145.
551. Greulich S., Deluigi CC., Gloekler S., et al. CMR imaging predicts death and other adverse events in suspected cardiac sarcoidosis. JACC 2013; 6(4): 501 - 511. Doi: 10.1016/j.jcmg.2012.10.021.
552. Mehta D., Mori N., Goldbarg S.H., et al. Primary prevention of sudden cardiac death in silent cardiac sarcoidosis: role of programmed ventricular stimulation. Circ: Arrhythmia and Electrophysiology 2011; 4(1): 43 - 48. Doi: 10.1161/CIRCEP.110.958322.
553. Robinson M.L., Kobayashi T., Higgins Y., et al. Lyme carditis. Infectious Disease Clinics of North America 2015; 29(2): 255 - 268. Doi: 10.1016/j.idc.2015.02.003.
554.  ,
,  ,
,  , et al. Manifestations of Lyme carditis. International Journal of Cardiology 2017; 232: 24 - 32. Doi: 10.1016/j.ijcard.2016.12.169.
, et al. Manifestations of Lyme carditis. International Journal of Cardiology 2017; 232: 24 - 32. Doi: 10.1016/j.ijcard.2016.12.169.
555. Nagi K.S., Joshi R., Thakur R.K. Cardiac manifestations of Lyme disease: a review. Canadian Journal of Cardiology 1996; 12(5): 503 - 506.
556. Esfandiar N., Beebe-Peat T., Quinlan A., et al. Lyme carditis complicated by polymorphic ventricular tachycardia and cardiac arrest: a case report. Journal of Investigative Medicine High Impact Case Reports 2022; 10: 23247096221098333. Doi: 10.1177/23247096221098333.
557. Stein C., Migliavaca C.B., Colpani V., et al. Amiodarone for arrhythmia in patients with chagas disease: a systematic review and inpidual patient data meta-analysis. PLOS Neglected Tropical Diseases 2018; 12(8): e0006742. Doi: 10.1371/journal.pntd.0006742.
558. Soto-Becerra R., Bazan V., Bautista W., et al. Ventricular tachycardia in the setting of chagasic cardiomyopathy: use of voltage mapping to characterize endoepicardial nonischemic scar distribution. Circulation: Arrhythmia and Electrophysiology 2017; 10(11): e004950. Doi: 10.1161/CIRCEP.116.004950.
559. Rassi FM, Minohara L., Rassi A., et al. Systematic review and meta-analysis of clinical outcome after implantable cardioverter-defibrillator therapy in patients with chagas heart disease. JACC: Clinical Electrophysiology 2019; 5(10): 1213 - 1223. Doi: 10.1016/j.jacep.2019.07.003.
560. Eckart RE, Hruczkowski TW, Tedrow UB., et al. Sustained ventricular tachycardia associated with corrective valve surgery. Circulation 2007; 116(18): 2005 - 2011. Doi: 10.1161/CIRCULATIONAHA.107.703157.
561.  ,
,  , Assi EA., et al. Primary prevention of sudden death in patients with valvular cardiomyopathy. Revista Espa ola de Cardiolog a (Engl Ed) 2016; 69(3): 272 - 278. Doi: 10.1016/j.rec.2015.05.016.
, Assi EA., et al. Primary prevention of sudden death in patients with valvular cardiomyopathy. Revista Espa ola de Cardiolog a (Engl Ed) 2016; 69(3): 272 - 278. Doi: 10.1016/j.rec.2015.05.016.
562. Sadek MM., Benhayon D., Sureddi R., Chik W., Santangeli P., Supple GE., Hutchinson MD., Bala R., Carballeira L., Zado ES., et al. Idiopathic ventricular arrhythmias originating from the moderator band: Electrocardiographic characteristics and treatment by catheter ablation. Heart Rhythm 2015; 12(1): 67 - 75. Doi: 10.1016/j.hrthm.2014.08.029.
563. Andersen ED., Krasilnikoff PA., Overvad H. Intermittent muscular weakness, extrasystoles, and multiple developmental anomalies. A new syndrome? Acta Paediatr Scand 1971; 60(5): 559 - 64. Doi: 10.1111/j.1651-2227.1971.tb06990.x.
564. Tawil R., Ptacek LJ., Pavlakis SG., DeVivo DC., Penn AS., Ozdemir C., Griggs RC. Andersen's syndrome: potassium-sensitive periodic paralysis, ventricular ectopy, and dysmorphic features. Ann Neurol 1994; 35(3): 326 - 30. Doi: 10.1002/ana.410350313.
565. Splawski I., Timothy KW., Decher N., Kumar P., Sachse FB., Beggs AH., Sanguinetti MC., Keating MT. Severe arrhythmia disorder caused by cardiac L-type calcium channel mutations. Proc Natl Acad Sci U S A 2005; 102(23): 8089 - 96; discussion 8086-8. Doi: 10.1073/pnas.0502506102.
566. JERVELL A., LANGE-NIELSEN F. Congenital deaf-mutism, functional heart disease with prolongation of the Q-T interval and sudden death. Am Heart J 1957; 54(1): 59 - 68. Doi: 10.1016/0002-8703(57) 90079-0.
567. Schwartz PJ., Moss AJ., Vincent GM., Crampton RS. Diagnostic criteria for the long QT syndrome. An update. Circulation 1993; 88(2): 782 - 4. Doi: 10.1161/01.cir.88.2.782.
568. Schwartz PJ., Crotti L. QTc behavior during exercise and genetic testing for the long-QT syndrome. Circulation 2011; 124(20): 2181 - 4. Doi: 10.1161/CIRCULATIONAHA.111.062182.
569. Jons C., Moss AJ., Goldenberg I., Liu J., McNitt S., Zareba W., Qi M., Robinson JL. Risk of fatal arrhythmic events in long QT syndrome patients after syncope. J Am Coll Cardiol 2010; 55(8): 783 - 8. Doi: 10.1016/j.jacc.2009.11.042.
570. Schwartz PJ., Priori SG., Spazzolini C., Moss AJ., Vincent GM., Napolitano C., Denjoy I., Guicheney P., Breithardt G., Keating MT., et al. Genotype-phenotype correlation in the long-QT syndrome: gene-specific triggers for life-threatening arrhythmias. Circulation 2001; 103(1): 89 - 95. Doi: 10.1161/01.cir.103.1.89.
571. Priori SG., Napolitano C., Schwartz PJ., Grillo M., Bloise R., Ronchetti E., Moncalvo C., Tulipani C., Veia A., Bottelli G., et al. Association of long QT syndrome loci and cardiac events among patients treated with beta-blockers. JAMA 2004; 292(11): 1341 - 4. Doi: 10.1001/jama.292.11.1341.
572. Schwartz PJ., Woosley RL. Predicting the Unpredictable: Drug-Induced QT Prolongation and Torsades de Pointes. J Am Coll Cardiol 2016; 67(13): 1639 - 1650. Doi: 10.1016/j.jacc.2015.12.063.
573. Kannankeril P., Roden DM., Darbar D. Drug-induced long QT syndrome. Pharmacol Rev 2010; 62(4): 760 - 81. Doi: 10.1124/pr.110.003723.
574. Ahn J., Kim HJ., Choi JI., Lee KN., Shim J., Ahn HS., Kim YH. Effectiveness of beta-blockers depending on the genotype of congenital long-QT syndrome: A meta-analysis. PLoS One 2017; 12(10): e0185680. Doi: 10.1371/journal.pone.0185680.
575. Went TR., Sultan W., Sapkota A., Khurshid H., Qureshi IA., Jahan N., Tara A., Win M., Wiltshire DA., Kannan A., et al. A Systematic Review on the Role of eta-Blockers in Reducing Cardiac Arrhythmias in Long QT Syndrome Subtypes 1 - 3. Cureus 2021; 13(9): e17632. Doi: 10.7759/cureus.17632.
576. Yoshinaga M., Kucho Y., Sarantuya J., Ninomiya Y., Horigome H., Ushinohama H., Shimizu W., Horie M. Genetic characteristics of children and adolescents with long-QT syndrome diagnosed by school-based electrocardiographic screening programs. Circ Arrhythm Electrophysiol 2014; 7(1): 107 - 12. Doi: 10.1161/CIRCEP.113.000426.
577.  , Casado-Arroyo R., Sarkozy A., Leysen E., et al. The clinical significance of pregnancy in Brugada syndrome. Revista
, Casado-Arroyo R., Sarkozy A., Leysen E., et al. The clinical significance of pregnancy in Brugada syndrome. Revista  de
de  (Engl Ed) 2014; 67(3): 176 - 180. Doi: 10.1016/j.rec.2013.06.023.
(Engl Ed) 2014; 67(3): 176 - 180. Doi: 10.1016/j.rec.2013.06.023.
578. 578 Gupta T., Khera S., Kolte D., Aronow WS., Iwai S. Antiarrhythmic properties of ranolazine: A review of the current evidence. Int J Cardiol 2015; 187: 66 - 74. Doi: 10.1016/j.ijcard.2015.03.324.
579. 579 Bunch TJ., Mahapatra S., Murdock D., Molden J., Weiss JP., May HT., Bair TL., Mader KM., Crandall BG., Day JD., et al. Ranolazine reduces ventricular tachycardia burden and ICD shocks in patients with drug-refractory ICD shocks. Pacing Clin Electrophysiol 2011; 34(12): 1600 - 6. Doi: 10.1111/j.1540-8159.2011.03208.x.
580. Zareba W, Daubert JP, Beck CA, Huang DT, Alexis JD, Brown MW, Pyykkonen K, McNitt S, Oakes D, Feng C, Aktas MK, Ayala-Parades F, Baranchuk A, Dubuc M, Haigney M, Mazur A, McPherson CA, Mitchell LB, Natale A, Piccini JP, Raitt M, Rashtian MY, Schuger C, Winters S, Worley SJ, Ziv O, Moss AJ; RAID Trial Investigators. Ranolazine in High-Risk Patients With Implanted Cardioverter-Defibrillators: The RAID Trial. J Am Coll Cardiol. 2018 Aug 7; 72(6): 636 - 645.
581. Ruan Y., Liu N., Bloise R., Napolitano C., Priori SG. Gating properties of SCN5A mutations and the response to mexiletine in long-QT syndrome type 3 patients. Circulation 2007; 116(10): 1137 - 44. Doi: 10.1161/CIRCULATIONAHA.107.707877.
582. Moss AJ., Zareba W., Schwarz KQ., Rosero S., McNitt S., Robinson JL. Ranolazine shortens repolarization in patients with sustained inward sodium current due to type-3 long-QT syndrome. J Cardiovasc Electrophysiol 2008; 19(12): 1289 - 93. Doi: 10.1111/j.1540-8167.2008.01246.x.
583. Chorin E., Hu D., Antzelevitch C., Hochstadt A., Belardinelli L., Zeltser D., Barajas-Martinez H., Rozovski U., Rosso R., Adler A., et al. Ranolazine for Congenital Long-QT Syndrome Type III: Experimental and Long-Term Clinical Data. Circ Arrhythm Electrophysiol 2016; 9(10): e004370. Doi: 10.1161/CIRCEP.116.004370.
584. Chorin E., Taub R., Medina A., Flint N., Viskin S., Benhorin J. Long-term flecainide therapy in type 3 long QT syndrome. Europace 2018; 20(2): 370 - 376. Doi: 10.1093/europace/euw439.
585. Windle JR., Geletka RC., Moss AJ., Zareba W., Atkins DL. Normalization of ventricular repolarization with flecainide in long QT syndrome patients with SCN5A: DeltaKPQ mutation. Ann Noninvasive Electrocardiol 2001; 6(2): 153 - 8. Doi: 10.1111/j.1542-474x.2001.tb00100.x.
586. Umeda M., Morimoto A., Yokoyama K., Tateishi E., Makino K., Yamamoto K., Nakagawa Y., Fukuhara S., Takase E. [Despite medication, overdrive pacing is required to stabilize the electrical storm associated with acute coronary syndrome: a case report]. J Cardiol 2007; 50(4): 263 - 9.
587. Yoshida T., Naito Y., Nishimura K. Temporary ventricular overdrive pacing for electrical storm after coronary artery bypass grafting. Gen Thorac Cardiovasc Surg 2011; 59(11): 756 - 9. Doi: 10.1007/s11748-010-0771-z.
588. Schwartz PJ., Spazzolini C., Priori SG., Crotti L., Vicentini A., Landolina M., Gasparini M., Wilde AA., Knops RE., Denjoy I., et al. Who are the long-QT syndrome patients who receive an implantable cardioverter-defibrillator and what happens to them?: data from the European Long-QT Syndrome Implantable Cardioverter-Defibrillator (LQTS ICD) Registry. Circulation 2010; 122(13): 1272 - 82. Doi: 10.1161/CIRCULATIONAHA.110.950147.
589. Ajijola OA., Lellouche N., Bourke T., Tung R., Ahn S., Mahajan A., Shivkumar K. Bilateral cardiac sympathetic denervation for the management of electrical storm. J Am Coll Cardiol 2012; 59(1): 91 - 2. Doi: 10.1016/j.jacc.2011.09.043.
590. Schwartz PJ., Priori SG., Locati EH., Napolitano C., Cant F., Towbin JA., Keating MT., Hammoude H., Brown AM., Chen LS., et al. Long QT syndrome patients with mutations of the SCN5A and HERG genes have differential responses to Na+ channel blockade and to increases in heart rate. Implications for gene-specific therapy. Circulation 1995; 92(12): 3381 - 6. Doi: 10.1161/01.cir.92.12.3381.
591. Hofferberth SC., Cecchin F., Loberman D., Fynn-Thompson F. Left thoracoscopic sympathectomy for cardiac denervation in patients with life-threatening ventricular arrhythmias. J Thorac Cardiovasc Surg 2014; 147(1): 404 - 9. Doi: 10.1016/j.jtcvs.2013.07.064.
592. Gollob MH., Redpath CJ., Roberts JD. The short QT syndrome: proposed diagnostic criteria. J Am Coll Cardiol 2011; 57(7): 802 - 12. Doi: 10.1016/j.jacc.2010.09.048.
593. Suzuki H., Horie M., Ozawa J., Sumitomo N., Ohno S., Hoshino K., Ehara E., Takahashi K., Maeda Y., Yoshinaga M., et al. Novel electrocardiographic criteria for short QT syndrome in children and adolescents. Europace 2021; 23(12): 2029 - 2038. Doi: 10.1093/europace/euab097.
594. Giustetto C., Schimpf R., Mazzanti A., Scrocco C., Maury P., Anttonen O., Probst V., Blanc JJ., Sbragia P., Dalmasso P., et al. Long-term follow-up of patients with short QT syndrome. J Am Coll Cardiol 2011; 58(6): 587 - 95. Doi: 10.1016/j.jacc.2011.03.038.
595. Dewi IP., Dharmadjati BB. Short QT syndrome: The current evidences of diagnosis and management. J Arrhythm 2020; 36(6): 962 - 966. Doi: 10.1002/joa3.12439.
596. Mazzanti A., Kanthan A., Monteforte N., Memmi M., Bloise R., Novelli V., Miceli C., O'Rourke S., Borio G., Zienciuk-Krajka A., et al. Novel insight into the natural history of short QT syndrome. J Am Coll Cardiol 2014; 63(13): 1300 - 1308. Doi: 10.1016/j.jacc.2013.09.078.
597. Gaita F., Giustetto C., Bianchi F., Wolpert C., et al. Short QT syndrome: a familial cause of sudden death. Circulation 2003; 108(8): 965 - 970. Doi: 10.1161/01.CIR.0000085071.28695.C4.
598. Gaita F., Giustetto C., Bianchi F., et al. Short QT syndrome: pharmacological treatment. JACC 2004; 43(8): 1494 - 1499. Doi: 10.1016/j.jacc.2004.02.034.
599. Priori SG., Napolitano C., Gasparini M., et al. Natural history of Brugada syndrome: insights for risk stratification and management. Circulation 2002; 105(11): 1342 - 1347. Doi: 10.1161/hc1102.105288.
600. Maury P., Hocini M., Haissaguerre M. Electrical storms in Brugada syndrome: review of pharmacologic and ablative therapeutic options. Indian Pacing Electrophysiology. 2005; 5(1): 25 - 34.
601. Marquez MF., Bonny A., Hemandez-Castillo E., et al. Long-term efficacy of low doses of quinidine on malignant arrhythmias in Brugada syndrome with an implantable cardioverter-defibrillator: a case series and literature review. Heart Rhythm 2012; 9(12): 1995 - 2000. Doi: 10.1016/j.hrthm.2012.08.027.
602. Brugada J., Brugada R., Brugada P. Determinants of sudden cardiac death in inpiduals with the electrocardiographic pattern of Brugada syndrome and no previous cardiac arrest. Circulation 2003; 108(25): 3092 - 3096. Doi: 10.1161/01.CIR.0000104568.13957.4F.
603. Nademanee K., Veerakul G., Chandanamattha P., et al. Prevention of ventricular fibrillation episodes in Brugada syndrome by catheter ablation over the anterior right ventricular outflow tract epicardium. Circulation 2011; 123(12): 1270 - 1279. Doi: 10.1161/CIRCULATIONAHA.110.972612.
604. Argenziano M., Antzelevitch C. Recent advances in the treatment of Brugada syndrome. Expert Review of Cardiovascular Therapy 2018; 16(6): 387 - 404. Doi: 10.1080/14779072.2018.1475230.
605. Haissaguerre M., Extramiana F., Hocini M., et al. Mapping and ablation of ventricular fibrillation associated with Long-QT and Brugada syndromes. Circulation 2003; 108(8): 925 - 928. Doi: 10.1161/01.CIR.0000088781.99943.95.
606. Nademanee K., Haissaguerre M., Hocini M., et al. Mapping and ablation of ventricular fibrillation associated with early repolarization syndrome. Circulation 2019; 140(18): 1477 - 1490. Doi: 10.1161/CIRCULATIONAHA.118.039022.
607. Leenhardt A., Lucet V., Denjoy I., et al. Catecholaminergic Polymorphic Ventricular Tachycardia in Children A 7-Year Follow-up of 21 Patients. Circulation 1995; 91(5): 1512 - 1519. Doi: 10.1161/01.cir.91.5.1512.
608. Макаров Л.М., Курылева Т.А., Чупрова С.Н. Укорочение интервала PR, брадикардия и полиморфная желудочковая тахикардия. Клинико-электрокардиографический синдром с высоким риском внезапной смерти у детей. Кардиология 2003; 7: 34 - 37.
609. Makarov L., Kyrileva T., Komoliatova T., et al. New ECG pattern in young patients with polymorphic catecholaminergic ventricular tachycardia. JACC 2007; 49 (9): 916 - 242.
610. Priori SG., Napolitano C., Memmi M., et al. Clinical and molecular characterization of patients with catecholaminergic polymorphic ventricular tachycardia/Priori S.G., Napolitano C., Memmi M. et al. Circulation 2002; 106(1): 69 - 74. Doi: 10.1161/01.cir.0000020013.73106.d8.
611. Hayashi M., Denjoy I., Extramiana F., et al Incidence and risk factors of arrhythmic events in catecholaminergic polymorphic ventricutar tachycardia. Circulation 2009; 119(18): 2426 - 2434. Doi: 10.1161/CIRCULATIONAHA.108.829267.
612. Watanabe H., Chopra N., Laver D., Hwang HS., Davies SS., Roach DE., Duff HJ., Roden DM., Wilde AA., Knollmann BC. Flecainide prevents catecholaminergic polymorphic ventricular tachycardia in mice and humans. Nat Med 2009; 15(4): 380 - 3. Doi: 10.1038/nm.1942.
613. Beaufort-Krol GC., Dijkstra SS., Bink-Boelkens MT. Natural history of ventricular premature contractions in children with a structurally normal heart: does origin matter? Europace 2008; 10(8): 998 - 1003. Doi: 10.1093/europace/eun121.
614. Khairy P., Harris L., Landzberg MJ., Viswanathan S., Barlow A., Gatzoulis MA., Fernandes SM., Beauchesne L., Therrien J., Chetaille P., et al. Implantable cardioverter-defibrillators in tetralogy of Fallot. Circulation 2008; 117(3): 363 - 70. Doi: 10.1161/CIRCULATIONAHA.107.726372.
615. Berul CI., Van Hare GF., Kertesz NJ., Dubin AM., Cecchin F., Collins KK., Cannon BC., Alexander ME., Triedman JK., Walsh EP., et al. Results of a multicenter retrospective implantable cardioverter-defibrillator registry of pediatric and congenital heart disease patients. J Am Coll Cardiol 2008; 51(17): 1685 - 91. Doi: 10.1016/j.jacc.2008.01.033.
616. Koyak Z., de Groot JR., Van Gelder IC., Bouma BJ., van Dessel PF., Budts W., van Erven L., van Dijk AP., Wilde AA., Pieper PG., et al. Implantable cardioverter defibrillator therapy in adults with congenital heart disease: who is at risk of shocks? Circ Arrhythm Electrophysiol 2012; 5(1): 101 - 10. Doi: 10.1161/CIRCEP.111.966754.
617. Gallego P., Gonzalez AE., Sanchez-Recalde A., Peinado R., Polo L., Gomez-Rubin C., Lopez-Sendon JL., Oliver JM. Incidence and predictors of sudden cardiac arrest in adults with congenital heart defects repaired before adult life. Am J Cardiol 2012; 110(1): 109 - 17. Doi: 10.1016/j.amjcard.2012.02.057.
618. Ghai A., Silversides C., Harris L., Webb GD., Siu SC., Therrien J. Left ventricular dysfunction is a risk factor for sudden cardiac death in adults late after repair of tetralogy of Fallot. J Am Coll Cardiol 2002; 40(9): 1675 - 80. Doi: 10.1016/s0735-1097(02) 02344-6.
619. Gatzoulis MA., Balaji S., Webber SA., Siu SC., Hokanson JS., Poile C., Rosenthal M., Nakazawa M., Moller JH., Gillette PC., et al. Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000; 356(9234): 975 - 81. Doi: 10.1016/S0140-6736(00) 02714-8.
620. Khairy P., Landzberg MJ., Gatzoulis MA., Lucron H., Lambert J.,  , Alexander ME., Walsh EP. Value of programmed ventricular stimulation after tetralogy of fallot repair: a multicenter study. Circulation 2004; 109(16): 1994 - 2000. Doi: 10.1161/01.CIR.0000126495.11040.BD.
, Alexander ME., Walsh EP. Value of programmed ventricular stimulation after tetralogy of fallot repair: a multicenter study. Circulation 2004; 109(16): 1994 - 2000. Doi: 10.1161/01.CIR.0000126495.11040.BD.
621. Khairy P., Harris L., Landzberg MJ., Fernandes SM., Barlow A., Mercier LA., Viswanathan S., Chetaille P., Gordon E., Dore A., et al. Sudden death and defibrillators in transposition of the great arteries with intra-atrial baffles: a multicenter study. Circ Arrhythm Electrophysiol 2008; 1(4): 250 - 7. Doi: 10.1161/CIRCEP.108.776120.
622. Koyak Z., Harris L., de Groot JR., Silversides CK., Oechslin EN., Bouma BJ., Budts W., Zwinderman AH., Van Gelder IC., Mulder BJ. Sudden cardiac death in adult congenital heart disease. Circulation 2012; 126(16): 1944 - 54. Doi: 10.1161/CIRCULATIONAHA.112.104786.
623. Atallah J., Gonzalez Corcia MC., Walsh EP.; Participating Members of the Pediatric and Congenital Electrophysiology Society. Ventricular Arrhythmia and Life-Threatening Events in Patients With Repaired Tetralogy of Fallot. Am J Cardiol 2020; 132: 126 - 132. Doi: 10.1016/j.amjcard.2020.07.012.
624. Koyak Z., de Groot JR., Bouma BJ., Van Gelder IC., Budts W., Zwinderman AH., Mulder BJ. Symptomatic but not asymptomatic non-sustained ventricular tachycardia is associated with appropriate implantable cardioverter therapy in tetralogy of Fallot. Int J Cardiol 2013; 167(4): 1532 - 5. Doi: 10.1016/j.ijcard.2012.04.103.
625. Sabate Rotes A., Connolly HM., Warnes CA., Ammash NM., Phillips SD., Dearani JA., Schaff HV., Burkhart HM., Hodge DO., Asirvatham SJ., et al. Ventricular arrhythmia risk stratification in patients with tetralogy of Fallot at the time of pulmonary valve replacement. Circ Arrhythm Electrophysiol 2015; 8(1): 110 - 6. Doi: 10.1161/CIRCEP.114.001975.
626. Miyazaki A., Sakaguchi H., Ohuchi H., Matsuoka M., Komori A., Yamamoto T., Yasuda K., Satomi K., Hoashi T., Kamakura S., Yamada O. Efficacy of hemodynamic-based management of tachyarrhythmia after repair of tetralogy of Fallot. Circ J 2012; 76(12): 2855 - 62. Doi: 10.1253/circj.cj-12-0208.
627. Harrison DA., Harris L., Siu SC., MacLoghlin CJ., Connelly MS., Webb GD., Downar E., McLaughlin PR., Williams WG. Sustained ventricular tachycardia in adult patients late after repair of tetralogy of Fallot. J Am Coll Cardiol 1997; 30(5): 1368 - 73. Doi: 10.1016/s0735-1097(97) 00316-1.
628. van Zyl M., Kapa S., Padmanabhan D., Chen FC., Mulpuru SK., Packer DL., Munger TM., Asirvatham SJ., McLeod CJ. Mechanism and outcomes of catheter ablation for ventricular tachycardia in adults with repaired congenital heart disease. Heart Rhythm 2016; 13(7): 1449 - 54. Doi: 10.1016/j.hrthm.2016.03.002.
629. Laredo M., Frank R., Waintraub X., Gandjbakhch E., Iserin L., Hasco t S., Himbert C., Gallais Y., Hidden-Lucet F., Duthoit G. Ten-year outcomes of monomorphic ventricular tachycardia catheter ablation in repaired tetralogy of Fallot. Arch Cardiovasc Dis 2017; 110(5): 292 - 302. Doi: 10.1016/j.acvd.2017.01.009.
630. Kapel GF., Reichlin T., Wijnmaalen AP., Piers SR., Holman ER., Tedrow UB., Schalij MJ., Stevenson WG., Zeppenfeld K. Re-entry using anatomically determined isthmuses: a curable ventricular tachycardia in repaired congenital heart disease. Circ Arrhythm Electrophysiol 2015; 8(1): 102 - 9. Doi: 10.1161/CIRCEP.114.001929.
631. Kapel GF., Sacher F., Dekkers OM., Watanabe M., Blom NA., Thambo JB., Derval N., Schalij MJ., Jalal Z., Wijnmaalen AP., et al. Arrhythmogenic anatomical isthmuses identified by electroanatomical mapping are the substrate for ventricular tachycardia in repaired Tetralogy of Fallot. Eur Heart J 2017; 38(4): 268 - 276. Doi: 10.1093/eurheartj/ehw202.
632. Zeppenfeld K., Schalij MJ., Bartelings MM., Tedrow UB., Koplan BA., Soejima K., Stevenson WG. Catheter ablation of ventricular tachycardia after repair of congenital heart disease: electroanatomic identification of the critical right ventricular isthmus. Circulation 2007; 116(20): 2241 - 52. Doi: 10.1161/CIRCULATIONAHA.
633. Collins KK., Schaffer MS., Liberman L., Saarel E., Knecht M., Tanel RE., Bradley D., Dubin AM., Paul T., Salerno J., et al. Pediatric and Congenital Electrophysiology Society. Fascicular and nonfascicular left ventricular tachycardias in the young: an international multicenter study. J Cardiovasc Electrophysiol 2013; 24(6): 640 - 8. Doi: 10.1111/jce.12105.
634. Schneider HE., Kriebel T., Jung K., Gravenhorst VD., Paul T. Catheter ablation of idiopathic left and right ventricular tachycardias in the pediatric population using noncontact mapping. Heart Rhythm 2010; 7(6): 731 - 9. Doi: 10.1016/j.hrthm.2010.02.031.
635. Kammeraad JA., van Deurzen CH., Sreeram N., Bink-Boelkens MT., Ottenkamp J., Helbing WA., Lam J., Sobotka-Plojhar MA., Daniels O., Balaji S. Predictors of sudden cardiac death after Mustard or Senning repair for transposition of the great arteries. J Am Coll Cardiol 2004; 44(5): 1095 - 102. Doi: 10.1016/j.jacc.2004.05.073.
636. Seth R., Moss AJ., McNitt S., Zareba W., Andrews ML., Qi M., Robinson JL., Goldenberg I., Ackerman MJ., Benhorin J., et al. Long QT syndrome and pregnancy. J Am Coll Cardiol 2007; 49(10): 1092 - 8. Doi: 10.1016/j.jacc.2006.09.054.
637. Rashba EJ., Zareba W., Moss AJ., Hall WJ., Robinson J., Locati EH., Schwartz PJ., Andrews M. Influence of pregnancy on the risk for cardiac events in patients with hereditary long QT syndrome. LQTS Investigators. Circulation 1998; 97(5): 451 - 6. Doi: 10.1161/01.cir.97.5.451.
638. Ishibashi K., Aiba T., Kamiya C., Miyazaki A., Sakaguchi H., Wada M., Nakajima I., Miyamoto K., Okamura H., Noda T., et al. Arrhythmia risk and ![]() -blocker therapy in pregnant women with long QT syndrome. Heart 2017; 103(17): 1374 - 1379. Doi: 10.1136/heartjnl-2016-310617.
-blocker therapy in pregnant women with long QT syndrome. Heart 2017; 103(17): 1374 - 1379. Doi: 10.1136/heartjnl-2016-310617.
639. Cheung CC., Lieve KV., Roston TM., van der Ree MH., Deyell MW., Andrade JG., Laksman ZW., Nannenberg EA., Tadros R., Pang B., et al. Pregnancy in Catecholaminergic Polymorphic Ventricular Tachycardia. JACC Clin Electrophysiol 2019; 5(3): 387 - 394. Doi: 10.1016/j.jacep.2018.10.019.
640. Wu L., Liang E., Fan S., Zheng L., Hu F., Liu S., Liu L., Hu Z., Li G., Yao Y. Effect of Pregnancy in Arrhythmogenic Right Ventricular Cardiomyopathy. Am J Cardiol 2020; 125(4): 613 - 617. Doi: 10.1016/j.amjcard.2019.11.008.
641. Bauce B., Daliento L., Frigo G., Russo G., Nava A. Pregnancy in women with arrhythmogenic right ventricular cardiomyopathy/dysplasia. Eur J Obstet Gynecol Reprod Biol 2006; 127(2): 186 - 9. Doi: 10.1016/j.ejogrb.2005.10.011.
642. Gandjbakhch E., Varlet E., Duthoit G., Fressart V., Charron P., Himbert C., Maupain C., Bordet C., Hidden-Lucet F., Nizard J. Pregnancy and newborn outcomes in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Int J Cardiol 2018; 258: 172 - 178. Doi: 10.1016/j.ijcard.2017.11.067.
643. Regitz-Zagrosek V., Roos-Hesselink JW., Bauersachs J.,  ,
,  , De Bonis M., Iung B., Johnson MR., Kintscher U., Kranke P., et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J 2018; 39(34): 3165 - 3241. Doi: 10.1093/eurheartj/ehy340.
, De Bonis M., Iung B., Johnson MR., Kintscher U., Kranke P., et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J 2018; 39(34): 3165 - 3241. Doi: 10.1093/eurheartj/ehy340.
644. Wang YC., Chen CH., Su HY., Yu MH. The impact of maternal cardioversion on fetal haemodynamics. Eur J Obstet Gynecol Reprod Biol 2006; 126(2): 268 - 9. Doi: 10.1016/j.ejogrb.2005.11.021.
645. И. Стрюк, Ю.А. Бунин, В.М. Гурьева, О.Б. Иртюга, Л.С. Коков, О.Е. Коломацкая, О.М. Моисеева, С.Р. Мравян, А.И. Чесникова, В.С. Чулков, и др. Диагностика и лечение сердечно-сосудистых заболеваний при беременности 2018. Национальные рекомендации. Российский кардиологический журнал 2018; (3): 91 - 134. Doi: 10.15829/1560-4071-2018-3-91-134.
646. Cleary-Goldman J, Salva CR, Infeld JI, Robinson JN. Verapamil-sensitive idiopathic left ventricular tachycardia in pregnancy. J Matern Fetal Neonatal Med. 2003 Aug; 14(2): 132 - 5.
647. Abello M., Peinado R., Merino JL., Gnoatto M., Mateos M., Silvestre J., Dominguez JL. Cardioverter defibrillator implantation in a pregnant woman guided with transesophageal echocardiography. Pacing Clin Electrophysiol 2003; 26(9): 1913 - 4. Doi: 10.1046/j.1460-9592.2003.00293.x.
648. Tuzcu V., Kilinc OU. Implantable cardioverter defibrillator implantation without using fluoroscopy in a pregnant patient. Pacing Clin Electrophysiol 2012; 35(9): e265 - 6. Doi: 10.1111/j.1540-8159.2011.03221.x.
649. Driver K., Chisholm CA, Darby AE., et al. Catheter ablation of arrhythmia during pregnancy. Journal of Cardiovascular Electrophysiology 2015; 26(6): 698 - 702. Doi: 10.1111/jce.1267.
650. Silversides CK., Harris L., Haberer K., Sermer M., et al. Recurrence rates of arrhythmias during pregnancy in women with previous tachyarrhythmia and impact on fetal and neonatal outcomes. The American Journal of Cardiology 2006; 97(8): 1206 - 1212. Doi: 10.1016/j.amjcard.2005.11.041.
651. Barnes E.J., Eben F., Patterson D. Direct current cardioversion during pregnancy should be performed with facilities available for fetal monitoring and emergency caesarean section. BJOG 2002; 109(12): 1406 - 1407. Doi: 10.1046/j.1471-0528.2002.02113.x.
652. Miyoshi T., Kamiya CA., Katsuragi S., Ueda H., et al. Safety and effcacy of implantable cardioverter-defibrillator during pregnancy and after delivery. Circulaton 2013; 77(5): 1166 - 1170. Doi: 10.1253/circj.cj-12-1275.
653. Hartz J., Clark BC., Ito S., Sherwin ED., Berul CI. Transvenous nonfluoroscopic pace maker implantation during pregnancy guided by 3-dimensional electroanatomic mapping. HeartRhythm Case Reports 2017; 3(10): 490 - 492. Doi: 10.1016/j.hrcr.2017.07.020.
654. Sliwa K., Mebazaa A., Hilfiker-Kleiner D., Petrie MC,. et al. Clinical characteristics of patients from the worldwide registry on peripartum cardiomyopathy (PPCM): EURObservational Research Programme in conjunction with the Heart Failure Association of the European Society of Cardiology Study Group on PPCM. European Journal of Heart Failure 2017; 19(9): 1131 - 1141. Doi: 10.1002/ejhf.780.
655. Jeejeebhoy FM., Zelop CM., Lipman S., et al. Cardiac arrest in pregnancy: a scientific statement from the American heart association. Circulation 2015; 132(18): 1747 - 1773. Doi: 10.1161/CIR.0000000000000300.
656. European Society of Gynecology (ESG), Association for European Paediatric Cardiology (AEPC), German Society for Gender Medicine (DGesGM), Regitz-Zagrosek V., Blomstrom Lundqvist C., Borghi C., et al. ESC Guidelines on the management of cardiovascular diseases during pregnancy: the task force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). European Heart Journal 2011; 32(24): 3147 - 3197. Doi: 10.1093/eurheartj/ehr218.
657. Benito B., Berruezo A. Brugada syndrome and pregnancy: delving into the role of sex hormones in ion channelopathies. Revista  (Engl Ed) 2014; 67(3): 165 - 167. Doi: 10.1016/j.rec.2013.09.021.
(Engl Ed) 2014; 67(3): 165 - 167. Doi: 10.1016/j.rec.2013.09.021.
658. Wang Z., Chen YW., Jiang YH., et al. Electrophysiological characteristics and therapeutic efficacy of radiofrequency ablation of focal atrial tachycardia originating from the right atrial appendage during pregnancy. Zhonghua Xin Xue Guan Bing Za Zhi 2020; 48(10): 859 - 865. Doi: 10.3760/cma.j.cn112148-20191104-00683.
659. Ware JS, Li J., Mazaika E., Yasso CM., et al. Shared genetic predisposition in peripartum and dilated cardiomyopathies. The New England Journal of Medicine 2016; 374(3): 233 - 241. Doi: 10.1056/NEJMoa1505517.
660. Bauersachs J.,  , van der Meer P., Petrie MC., et al. Pathophysiology, diagnosis and management of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Study Group on peripartum cardiomyopathy. European Journal of Heart Failure 2019; 21(7): 827 - 843. Doi: 10.1002/ejhf.1493.
, van der Meer P., Petrie MC., et al. Pathophysiology, diagnosis and management of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Study Group on peripartum cardiomyopathy. European Journal of Heart Failure 2019; 21(7): 827 - 843. Doi: 10.1002/ejhf.1493.
661. Sliwa K., Blauwet L., Tibazarwa K., Libhaber E., et al. Evaluation of bromocriptine in the treatment of acute severe peripartum cardiomyopathy: a proof-of-concept pilot study. Circulation 2010; 121(13): 1465 - 1473. Doi: 10.1161/CIRCULATIONAHA.109.901496.
662. Hilfiker-Kleiner D., Haghikia A., Berliner D., Vogel-Claussen J., et al. Bromocriptine for the treatment of peripartum cardiomyopathy: a multicentre randomized study. European Heart Journal 2017; 38(35): 2671 - 2679. Doi: 10.1093/eurheartj/ehx355.
663.  , Holzmeister J.,
, Holzmeister J.,  , et al. Prophylactic implantable cardioverter defibrillator treatment in patients with end-stage heart failure awaiting heart transplantation. Heart 2013; 99(16): 1158 - 1165. Doi: 10.1136/heartjnl-2013-304185.
, et al. Prophylactic implantable cardioverter defibrillator treatment in patients with end-stage heart failure awaiting heart transplantation. Heart 2013; 99(16): 1158 - 1165. Doi: 10.1136/heartjnl-2013-304185.
664. Joglar JA., Wan EY., Chung MK., Gutierrez A., Slaughter MS., Bateson BP., Loguidice M., Drazner M., Kistler PM., Saour B., et al. Management of Arrhythmias After Heart Transplant: Current State and Considerations for Future Research. Circ Arrhythm Electrophysiol 2021; 14(3): e007954. Doi: 10.1161/CIRCEP.120.007954.
665. Garcia R., Combes N., Defaye P., Narayanan K., Guedon-Moreau L., Boveda S., Blangy H., Bouet J., Briand F., Chevalier P., et al. Wearable cardioverter-defibrillator in patients with a transient risk of sudden cardiac death: the WEARIT-France cohort study. Europace 2021; 23(1): 73 - 81. Doi: 10.1093/europace/euaa268.
666. Costanzo MR., Dipchand A., Starling R., Anderson A., Chan M., Desai S., Fedson S., Fisher P., Gonzales-Stawinski G., Martinelli L., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2010; 29(8): 914 - 56. Doi: 10.1016/j.healun.2010.05.034.
667. Alba AC., Foroutan F., Ng Fat Hing NKV., Fan CS., Manlhiot C., Ross HJ. Incidence and predictors of sudden cardiac death after heart transplantation: A systematic review and meta-analysis. Clin Transplant 2018; 32(3): e13206. Doi: 10.1111/ctr.13206.
668. Vakil K., Taimeh Z., Sharma A., Abidi KS., Colvin M., Luepker R., Levy WC., Adabag S. Incidence, predictors, and temporal trends of sudden cardiac death after heart transplantation. Heart Rhythm 2014; 11(10): 1684 - 90. Doi: 10.1016/j.hrthm.2014.07.016.
669. Pelliccia A., Sharma S., Gati S.,  ,
,  , Caselli S., Collet JP., Corrado D., Drezner JA., Halle M., et al. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J. 2021 Jan 1; 42(1): 17 - 96. doi: 10.1093/eurheartj/ehaa605. Erratum in: Eur Heart J 2021; 42(5): 548 - 549. Doi: 10.1093/eurheartj/ehaa835.
, Caselli S., Collet JP., Corrado D., Drezner JA., Halle M., et al. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J. 2021 Jan 1; 42(1): 17 - 96. doi: 10.1093/eurheartj/ehaa605. Erratum in: Eur Heart J 2021; 42(5): 548 - 549. Doi: 10.1093/eurheartj/ehaa835.
670. Corrado D., Zorzi A. Sudden death in athletes. Int J Cardiol 2017; 237: 67 - 70. Doi: 10.1016/j.ijcard.2017.03.034.
671. Holst AG., Winkel BG., Theilade J., Kristensen IB., Thomsen JL., Ottesen GL., Svendsen JH.,  , Prescott E., Tfelt-Hansen J. Incidence and etiology of sports-related sudden cardiac death in Denmark--implications for preparticipation screening. Heart Rhythm 2010; 7(10): 1365 - 71. Doi: 10.1016/j.hrthm.2010.05.021.
, Prescott E., Tfelt-Hansen J. Incidence and etiology of sports-related sudden cardiac death in Denmark--implications for preparticipation screening. Heart Rhythm 2010; 7(10): 1365 - 71. Doi: 10.1016/j.hrthm.2010.05.021.
672. Corrado D., Schmied C., Basso C., Borjesson M., Schiavon M., Pelliccia A., Vanhees L., Thiene G. Risk of sports: do we need a pre-participation screening for competitive and leisure athletes? Eur Heart J 2011; 32(8): 934 - 44. Doi: 10.1093/eurheartj/ehq482.
673. Drezner JA., Peterson DF., Siebert DM., Thomas LC., Lopez-Anderson M., Suchsland MZ., Harmon KG., Kucera KL. Survival After Exercise-Related Sudden Cardiac Arrest in Young Athletes: Can We Do Better? Sports Health 2019; 11(1): 91 - 98. Doi: 10.1177/1941738118799084.
674. Drezner JA., Rogers KJ., Horneff JG. Automated external defibrillator use at NCAA Division II and III universities. Br J Sports Med 2011; 45(15): 1174 - 8. Doi: 10.1136/bjsm.2009.070052.
675. Malhotra A., Dhutia H., Finocchiaro G., Gati S., Beasley I., Clift P., Cowie C., Kenny A., Mayet J., Oxborough D., et al. Outcomes of Cardiac Screening in Adolescent Soccer Players. N Engl J Med 2018; 379(6): 524 - 534. Doi: 10.1056/NEJMoa1714719.
676. Maestrini V, Torlasco C, Hughes R, Moon JC. Cardiovascular Magnetic Resonance and Sport Cardiology: a Growing Role in Clinical Dilemmas. J Cardiovasc Transl Res. 2020 Jun; 13(3): 296 - 305.
677. Kragholm K., Wissenberg M., Mortensen RN., Hansen SM., Malta Hansen C., Thorsteinsson K., Rajan S., Lippert F., Folke F., Gislason G., et al. Bystander Efforts and 1-Year Outcomes in Out-of-Hospital Cardiac Arrest. N Engl J Med 2017; 376(18): 1737 - 1747. Doi: 10.1056/NEJMoa1601891.
678. Pediatric and Congenital Electrophysiology Society (PACES); Heart Rhythm Society (HRS); American College of Cardiology Foundation (ACCF); American Heart Association (AHA); American Academy of Pediatrics (AAP); Canadian Heart Rhythm Society (CHRS); Cohen MI., Triedman JK., Cannon BC., Davis AM., et al. PACES/HRS expert consensus statement on the management of the asymptomatic young patient with a Wolff-Parkinson-White (WPW, ventricular preexcitation) electrocardiographic pattern: developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology Foundation (ACCF), the American Heart Association (AHA), the American Academy of Pediatrics (AAP), and the Canadian Heart Rhythm Society (CHRS). Heart Rhyth. 2012; 9(6): 1006 - 24. Doi: 10.1016/j.hrthm.2012.03.050.
679. Gill JS., Ward DE., Camm AJ. Comparison of verapamil and diltiazem in the suppression of idiopathic ventricular tachycardia. Pacing Clin Electrophysiol 1992; 15(11 Pt 2): 2122 - 6. Doi: 10.1111/j.1540-8159.1992.tb03033.x.
680. Elming MB., Nielsen JC., Haarbo J.,  , Korup E., Signorovitch J., Olesen LL., Hildebrandt P., Steffensen FH., Bruun NE., et al. Age and Outcomes of Primary Prevention Implantable Cardioverter-Defibrillators in Patients With Nonischemic Systolic Heart Failure. Circulation 2017; 136(19): 1772 - 1780. Doi: 10.1161/CIRCULATIONAHA.117.028829.
, Korup E., Signorovitch J., Olesen LL., Hildebrandt P., Steffensen FH., Bruun NE., et al. Age and Outcomes of Primary Prevention Implantable Cardioverter-Defibrillators in Patients With Nonischemic Systolic Heart Failure. Circulation 2017; 136(19): 1772 - 1780. Doi: 10.1161/CIRCULATIONAHA.117.028829.
681. Wang S., Zhu W., Hamilton RM., Kirsh JA., Stephenson EA., Gross GJ. Diagnosis-specific characteristics of ventricular tachycardia in children with structurally normal hearts. Heart Rhythm 2010; 7(12): 1725 - 31. Doi: 10.1016/j.hrthm.2010.07.037.
682. М.А. Школьникова, В.В. Березницкая. Желудочковые аритмии. Клинические рекомендации по детской кардиологии и ревматологии 2011. 5: 133 - 159.
683. Blaufox AD., Felix GL., Saul JP. Pediatric Catheter Ablation Registry. Radiofrequency catheter ablation in infants </= 18 months old: when is it done and how do they fare?: short-term data from the pediatric ablation registry. Circulation 2001; 104(23): 2803 - 8. Doi: 10.1161/hc4801.100028.
684. Li G., Zhang L. The role of mexiletine in the management of long QT syndrome. J Electrocardiol 2018; 51(6): 1061 - 1065. Doi: 10.1016/j.jelectrocard.2018.08.035.
685. Yeh SJ., Kou HC., Lin FC., Hung JS., Wu D. Effects of oral diltiazem in paroxysmal supraventricular tachycardia. Am J Cardiol 1983; 52(3): 271 - 8. Doi: 10.1016/0002-9149(83) 90121-2.
686. Buckley MM., Grant SM., Goa KL., McTavish D., Sorkin EM. Diltiazem. A reappraisal of its pharmacological properties and therapeutic use. Drugs 1990; 39(5): 757 - 806. Doi: 10.2165/00003495-199039050-00009.
687. Lapage MJ., Bradley DJ., Dick M. 2nd. Verapamil in infants: an exaggerated fear? Pediatr Cardiol 2013; 34(7): 1532 - 4. Doi: 10.1007/s00246-013-0739-8.
688. Kirk CR., Gibbs JL., Thomas R., Radley-Smith R., Qureshi SA. Cardiovascular collapse after verapamil in supraventricular tachycardia. Arch Dis Child 1987; 62(12): 1265 - 6. Doi: 10.1136/adc.62.12.1265.
689. Surman TL., Stuklis RG., Chan JC. Thoracoscopic Sympathectomy for Long QT Syndrome. Literature Review and Case Study. Heart Lung Circ 2019; 28(3): 486 - 494. Doi: 10.1016/j.hlc.2018.02.005.
690. А.Ш. Ревишвили. Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств. Всероссийское научное общество специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции 2013; 595: 16.
691. Wenger NK., Froelicher ES., Smith LK., Ades PA., Berra K., Blumenthal JA., Certo CM., Dattilo AM., Davis D., DeBusk RF., et al. Cardiac rehabilitation as secondary prevention. Agency for Health Care Policy and Research and National Heart, Lung, and Blood Institute. Clin Pract Guidel Quick Ref Guide Clin 1995; (17): 1 - 23.
692. Thomas R. J., et al. AACVPR/ACC/AHA 2007 performance measures on cardiac rehabilitation for referral to and delivery of cardiac rehabilitation/secondary prevention services endorsed by the American College of Chest Physicians, American College of Sports Medicine, American Physical Therapy Association, Canadian Association of Cardiac Rehabilitation, European Association for Cardiovascular Prevention and Rehabilitation, Inter-American Heart Foundation, National Association of Clinical Nurse Specialists, Preventive Cardiovascular Nurses Association, and the Society of Thoracic Surgeons. JACC 2007; 50(14): 1400 - 33.
693. Клинические рекомендации "Желудочковые аритмии" МЗ РФ, ФГБУ "ННПЦССХ им. А.Н. Бакулева" МЗ РФ Центр хирургической и интервенционной аритмологии. - Москва, 2017. - 38 с.
694. Morady F., Kadish AH., DiCarlo L., Kou WH., et al. Long term results of catheter ablation of idiopathic right ventricular tachycardia. Circulation 1990; 82(6): 2093 - 2099. Doi: 10.1161/01.cir.82.6.2093.
695. Tada H., Hiratsuji T., Naito S., Kurosaki K., et al. Prevalence and characteristics of idiopathic outflow tract tachycardia with QRS alteration following catheter ablation requiring additional radiofrequency ablation at a different point in the outflow tract. Pacing Clinical Electrophysiology 2004; 27(9): 1240 - 1249. Doi: 10.1111/j.1540-8159.2004.00615.x.
696. Klein LS., Shih HT., Hackett FK., Zipes DP., et al. Radiofrequency catheter ablation of ventricular tachycardia in patients without structural heart disease. Circulation 1992; 85(5): 1666 - 1674. Doi: 10.1161/01.cir.85.5.1666.
697. Della Bella P., Baratto F., Tsiachris D., et al. Management of ventricular tachycardia in the setting of a dedicated unit for the treatment of complex ventricular arrhythmias: long-term outcome after ablation. Circulation 2013; 127(13): 1359 - 1368. Doi: 10.1161/CIRCULATIONAHA.112.000872.
698. Koruth JS., Aryana A., Dukkipati SR., et al. Unusual complications of percutaneous epicardial access and epicardial mapping and ablation of cardiac arrhythmias. Circulation: Arrhythmia and Electrophysiology 2011; 4(6): 882 - 888. Doi: 10.1161/CIRCEP.111.965731.
699. Roberts-Thomson KC., Steven D., Seller J., et al. Coronary artery injury due to catheter ablation in adults: presentations and outcomes. Circulation 2009; 120(15): 1465 - 1473. Doi: 10.1161/CIRCULATIONAHA.109.870790.
700. Makimoto H., Zhang Q., Tilz RR. et al. Aborted sudden cardiac death due to radiofrequency ablation within the coronary sinus and subsequent total occlusion of the circumflex artery. Journal of Cardiovascular Electrophysiology 2013; 24(8): 929 - 932. Doi: 10.1111/jce.12083.
701. Schwartz PJ., Stramba-Badiate M., Crotti L., et al. Prevalence of the congenital long QT syndrome. Circulation 2009; 120(18): 1761 - 1767. Doi: 10.1161/CIRCULATIONAHA.109.863209.
702. Corrado D., Petticcia A., Bjornstad HH., et al. Cardiovascular pre-participation screening of young competitive athletes for prevention of sudden death: proposal for a common European protocol. Consensus Statement of the Study Group of Sport Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. European Heart Journal 2005; 26(5): 516 - 524. Doi: 10.1093/eurheartj/ehi108.
703. Maron BJ., Thompson PD., Ackerman MJ., et al. Recommendations and considerations related to preparticipation screening for cardiovascutar abnormalities in competitive athletes: 2007 update: a scientific statement from the American Heart Association Council on Nutrition, Physical Activity, and Metabolism: endorsed by the American College of Cardiology Foundation. Circulation 2007; 115(12): 1643 - 1455. Doi: 10.1161/CIRCULATIONAHA.107.181423.
704. Ljungqvist A., Jenoure P., Engebretsen L., et al. The International Olympic Committee (IOC) consensus statement on periodic health evaluation of elite athletes, March 2009. British Journal of Sports Medicine 2009; 43(9): 631 - 643. Doi: 10.1136/bjsm.2009.064394.
705. Steinvil A., Chundadze T., Zeltser D., et al. Mandatory etectrocardiographic screening of athletes to reduce their risk for sudden death: proven fact or wishful thinking? JACC 2011; 57(11): 1291 - 1296. Doi: 10.1016/j.jacc.2010.10.037.
706. Kaltman JR., Thompson PD., Lantos J., Berul CI., Botkin J., Cohen JT., Cook NR., Corrado D., Drezner J., Frick KD., et al. Screening for sudden cardiac death in the young: report from a national heart, lung, and blood institute working group. Circulation 2011; 123(17): 1911 - 8. Doi: 10.1161/CIRCULATIONAHA.110.017228.
707. Narain R., Mayers J., Dhutia H., Malhotra A., Merghani A., Millar L., Sheikh N., Paradakis M., Sharma S. Preventing sudden cardiac death in the young: results from a population-based screening program in the UK. European Journal of Preventive Cardiology 2014; 21: S1-S6. DOI: 10.1016/j.ihj.2014.10.194 УДД 4 УУР С (взрослые, дети).
708. Charron P., Arad M., Arbustini E., Basso C., Bilinska Z., Elliott P., Helio T., Keren A., McKenna WJ., Monserrat L., et al. Genetic counselling and testing in cardiomyopathies: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2010; 31(22): 2715 - 26. Doi: 10.1093/eurheartj/ehq271.
709. Ormondroyd E., Oates S., Parker M., Blair E., Watkins H. Pre-symptomatic genetic testing for inherited cardiac conditions: a qualitative exploration of psychosocial and ethical implications. Eur J Hum Genet 2014; 22(1): 88 - 93. Doi: 10.1038/ejhg.2013.81.
710. Ingles J., Yeates L., Hunt L., McGaughran J., Scuffham PA., Atherton J., Semsarian C. Health status of cardiac genetic disease patients and their at-risk relatives. Int J Cardiol 2013; 165(3): 448 - 53. Doi: 10.1016/j.ijcard.2011.08.083.
711. Battista RN., Blancquaert I., Laberge AM., van Schendel N., Leduc N. Genetics in health care: an overview of current and emerging models. Public Health Genomics 2012; 15(1): 34 - 45. Doi: 10.1159/000328846.
712. Чазов Е.И., Агеев Ф.Т., Акчурин Р.С., Буза В.В., Власова Э.Е., Голицин С.П., Ефремова Ю.Е., Карпов Ю.А., Кухарчук В.В., Малкина Т.А., Мартынюк Т.В. и др. Рекомендации по диспансерному наблюдению больных с сердечно-сосудистыми заболеваниями. - Москва, 2014. - 28 с.
713. Nolan JP., Soar J., Zideman DA., Biarent D., Bossaert LL., Deakin C., Koster RW., Wyllie J.,  ; ERC Guidelines Writing Group. European Resuscitation Council Guidelines for Resuscitation 2010 Section 1. Executive summary. Resuscitation 2010; 81(10): 1219 - 76. Doi: 10.1016/j.resuscitation.2010.08.021.
; ERC Guidelines Writing Group. European Resuscitation Council Guidelines for Resuscitation 2010 Section 1. Executive summary. Resuscitation 2010; 81(10): 1219 - 76. Doi: 10.1016/j.resuscitation.2010.08.021.
714. Monsieurs KG., Nolan JP., Bossaert LL., Greif R., Maconochie IK., Nikolaou NI., Perkins GD., Soar J.,  , Wyllie J., et al. European Resuscitation Council Guidelines for Resuscitation 2015: Section 1. Executive summary. Resuscitation 2015; 95: 1 - 80. Doi: 10.1016/j.resuscitation.2015.07.038.
, Wyllie J., et al. European Resuscitation Council Guidelines for Resuscitation 2015: Section 1. Executive summary. Resuscitation 2015; 95: 1 - 80. Doi: 10.1016/j.resuscitation.2015.07.038.
715. Chiu DT., Shapiro NI., Sun BC., Mottley JL., Grossman SA. Are echocardiography, telemetry, ambulatory electrocardiography monitoring, and cardiac enzymes in emergency department patients presenting with syncope useful tests? A preliminary investigation. J Emerg Med 2014; 47(1): 113 - 8. Doi: 10.1016/j.jemermed.2014.01.018.
716. Приказ Министерства здравоохранения Российской Федерации от 10.08.2017 N 514н "О порядке прохождения несовершеннолетними медицинских осмотров, в том числе при поступлении в образовательные учреждения и в период обучения в них": Приложение N 1.
717. Школьникова М.А., Харлап М.С., Ильдарова Р.А. Генетически детерминированные нарушения ритма сердца. Российский кардиологический журнал 2011; 1 (87): 8 - 25.
718. Adler A., Halkin A., Viskin S. Wearable cardioverter-defibrillators. Circulation 2013; 127(7): 854 - 60. Doi: 10.1161/CIRCULATIONAHA.112.146530.
719. Hallstrom AP., Ornato JP., Weisfeldt M., Travers A., Christenson J., McBurnie MA., Zalenski R., Becker LB., Schron EB., Proschan M.; Public Access Defibrillation Trial Investigators. Public-access defibrillation and survival after out-of-hospital cardiac arrest. N Engl J Med 2004; 351(7): 637 - 46. Doi: 10.1056/NEJMoa040566.
720. Quill TE., Brody H. Physician recommendations and patient autonomy: finding a balance between physician power and patient choice. Ann Intern Med 1996; 125(9): 763 - 9. Doi: 10.7326/0003-4819-125-9-199611010-00010.
721. Stewart GC., Weintraub JR., Pratibhu PP., Semigran MJ., Camuso JM., Brooks K., Tsang SW., Anello MS., Nguyen VT., Lewis EF., et al. Patient expectations from implantable defibrillators to prevent death in heart failure. J Card Fail 2010; 16(2): 106 - 13. Doi: 10.1016/j.cardfail.2009.09.003.
722. Ottenberg AL., Mueller PS., Topazian RJ., Kaufman S., Swetz KM. "It's not broke, so let's not try to fix it": why patients decline a cardiovascular implantable electronic device. Pacing Clin Electrophysiol 2014; 37(10): 1306 - 14. Doi: 10.1111/pace.12433.
723. Sherazi S., Zareba W., Daubert JP., McNitt S., Shah AH., Aktas MK., Block RC. Physicians' knowledge and attitudes regarding implantable cardioverter-defibrillators. Cardiol J 2010; 17(3): 267 - 73.
724. Charles C., Gafni A., Whelan T. Shared decision-making in the medical encounter: what does it mean? (or it takes at least two to tango). Soc Sci Med 1997; 44(5): 681 - 92. Doi: 10.1016/s0277-9536(96) 00221-3.
725. Lewis KB., Stacey D., Matlock DD. Making decisions about implantable cardioverter-defibrillators from implantation to end of life: an integrative review of patients' perspectives. Patient 2014; 7(3): 243 - 60. Doi: 10.1007/s40271-014-0055-2.
726. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999; 353(9146): 9 - 13.
727. Packer M., Bristow MR., Cohn JN., Colucci WS., Fowler MB., Gilbert EM., Shusterman NH. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med 1996; 334(21): 1349 - 55. Doi: 10.1056/NEJM199605233342101.
728. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999; 353(9169): 2001 - 7.
729. A randomized trial of propranolol in patients with acute myocardial infarction. I. Mortality results. JAMA 1982; 247(12): 1707 - 14. Doi: 10.1001/jama.1982.03320370021023.
730. Hirsowitz G., Podrid PJ., Lampert S., Stein J., Lown B. The role of beta blocking agents as adjunct therapy to membrane stabilizing drugs in malignant ventricular arrhythmia. Am Heart J 1986; 111(5): 852 - 60. Doi: 10.1016/0002-8703(86) 90633-2.
731. Peltenburg PJ., Kallas D., Bos JM., Lieve KVV., Franciosi S., Roston TM., et al. An international multicenter cohort study on ![]() -blockers for the treatment of symptomatic children with catecholaminergic polymorphic ventricular tachycardia. Circulation 2022; 145(5): 333 - 344. Doi: 10.1161/CIRCULATIONAHA.121.056018.
-blockers for the treatment of symptomatic children with catecholaminergic polymorphic ventricular tachycardia. Circulation 2022; 145(5): 333 - 344. Doi: 10.1161/CIRCULATIONAHA.121.056018.
732. Yager N., Wang K., Keshwani N., Torosoff M. Phenytoin as an effective treatment for polymorphic ventricular tachycardia due to QT prolongation in a patient with multiple drug intolerances. BMJ Case Rep 2015; 2015: bcr2015209521. Doi:10.1136/bcr-2015-209521.
733. Ito M., Maeda Y., Arita M., Ito S., Saikawa T., Omura I., et al. Effects of oral 784 diltiazem on ventricular premature contractions. J Electrocardiol 1986; 19(1): 59 - 66. Doi: 10.1016/s0022-0736(86) 80008-5.
734. Garson AJr., Gillette PC., McVey P., Hesslein PS., Porter CJ., Angell LK., Kaldis LC., Hittner HM. Amiodarone treatment of critical arrhythmias in children and young adults. J Am Coll Cardiol 1984; 4(4): 749 - 755. Doi: 10.1016/s0735-1097(84) 80402-7.
735. Yu Y., Liting T., Xiaoqin W. et al. Clinical and genetic profiles of chinese pediatric patients with catecholaminergic polymorphic ventricular tachycardia. Orphanet J Rare Dis 2023; 18(1): 380. Doi: 10.1186/s13023-023-02991-0.
736. Ильдарова Р.А., Щербакова Н.В., Березницкая В.В., Школьникова М.А. Сердечные и внесердечные проявления синдрома Джервелла-Ланге-Нильсена. Вестник аритмологии. 2021; 28(3): 37 - 44. https://doi.org/10.35336/VA-2021-3-37-44. УДД 4 УУР С (дети).
737. Wang Y., Yang Y., Xu N., Xiao Y., Zuo C., Chen Z. Clinical characteristics and follow-up of complex arrhythmias associated with RYR2 gene mutations in children. Front Genet 2024; 15: 1405437. Doi: 10.3389/fgene.2024.1405437.
738. Schupp T, Behnes M, Abumayyaleh M, Weidner K, Rusnak J, Mashayekhi K, Bertsch T, Akin I. Carvedilol versus Metoprolol in Patients with Ventricular Tachyarrhythmias. J Cardiovasc Dev Dis. 2022 Aug 16; 9(8): 274.
739. Joglar JA, Kapa S, Saarel EV, Dubin AM, Gorenek B, Hameed AB, Lara de Melo S, Leal MA,  , Pacheco LD, Robinson MR, Sarkozy A, Silversides CK, Spears D, Srinivas SK, Strasburger JF, Tedrow UB, Wright JM, Zelop CM, Zentner D. 2023 HRS expert consensus statement on the management of arrhythmias during pregnancy. Heart Rhythm. 2023 Oct; 20(10): e175-e264.
, Pacheco LD, Robinson MR, Sarkozy A, Silversides CK, Spears D, Srinivas SK, Strasburger JF, Tedrow UB, Wright JM, Zelop CM, Zentner D. 2023 HRS expert consensus statement on the management of arrhythmias during pregnancy. Heart Rhythm. 2023 Oct; 20(10): e175-e264.
740. Дроздов Д.В., Макаров Л.М., Баркан В.С., Газашвили Т.М., Ефимова В.П., Жук М.Ю., Иртюга О.Б., Калинин Л.А., Ковалев И.А., Комолятова В.Н., Пармон Е.В., Рогоза А.Н., Стручков П.В., Татаринова А.А., Терегулов Ю.Э., Трешкур Т.В., Шутов Д.В. Регистрация электрокардиограммы покоя в 12 общепринятых отведениях взрослым и детям 2023 Методические рекомендации. Российский кардиологический журнал. 2023; 28(10): 5631. doi: 10.15829/1560-4071-2023-5631.
741. Мацкеплишвили С.Т., Саидова М.А., Мироненко М.Ю., Сафарова А.Ф., Павлюкова Е.Н., Бощенко А.А., Ярославская Е.И., Ахунова С.Ю., Скидан В.И., Иртюга О.Б., Козленок А.В., Федорова Д.Н. Выполнение стандартной трансторакальной эхокардиографии. Методические рекомендации 2024 Российский кардиологический журнал. 2025; 30(2): 6271. https://doi.org/10.15829/1560-4071-2025-6271.
742. Bratton S, Taylor MK, Cortez P, Schiattarella A, Fochesato C, Sisti G. Does atenolol use during pregnancy cause small for gestational age neonates? A meta-analysis. J Perinat Med. 2024 Aug 8; 52(8): 858 - 862. doi: 10.1515/jpm-2024-0114. PMID: 39115600.
743. Регистр лекарственных средств России РЛС Энциклопедия лекарств. - 16-й вып./Гл. ред. Г.Л. Вышковский. - М.: "РЛС - 2008", 2007. - 1456 с.
744. Приказ Минздрава России от 15.11.2012 N 918н "Об утверждении порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями" (Зарегистрировано в Минюсте России 29.12.2012 N 26483).
745. Yeh SJ, Wen MS, Wang CC, Lin FC, Wu D. Adenosine-sensitive ventricular tachycardia from the anterobasal left ventricle. J Am Coll Cardiol. 1997 Nov 1; 30(5): 1339 - 45. doi: 10.1016/s0735-1097(97) 00291-x. PMID: 9350937.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Президиум рабочей группы:
Михайлов Евгений Николаевич (Санкт-Петербург)
Гизатулина Татьяна Прокопьевна (Тюмень)
Лебедев Дмитрий Сергеевич (Санкт-Петербург)
Члены рабочей группы:
Голухова Елена Зеликовна (Москва)
Харлап Мария Сергеевна (Москва)
Лебедева Виктория Кимовна (Санкт-Петербург)
Багненко Сергей Федорович (Санкт-Петербург)
Артюхина Елена Александровна (Москва)
Бабокин Вадим Егорович (Москва)
Баталов Роман Ефимович (Томск)
Березницкая Вера Васильевна (Москва)
Бондарев Сергей Анатольевич (Москва)
Васичкина Елена Сергеевна (Санкт-Петербург)
Гарькина Светлана Витальевна (Санкт-Петербург)
Голицын Сергей Павлович (Москва)
Давтян Карапет Воваевич (Москва)
Дупляков Дмитрий Викторович (Самара)
Заклязьминская Елена Валерьевна (Москва)
Зенин Сергей Анатольевич (Новосибирск)
Иваницкий Эдуард Алексеевич (Красноярск)
Ильдарова Рукижат Абдул-Гафуровна (Москва)
Иртюга Ольга Борисовна (Санкт-Петербург)
Комолятова Вера Николаевна (Москва)
Костарева Анна Александровна (Санкт-Петербург)
Кучинская Елена Андреевна (Москва)
Лайович Лада Юрьевна (Москва)
Любимцева Тамара Алексеевна (Санкт-Петербург)
Макаров Леонид Михайлович (Москва)
Мамчур Сергей Евгеньевич (Кемерово)
Медведев Михаил Маркович (Санкт-Петербург)
Миннуллин Ильдар Пулатович (Санкт-Петербург)
Миронов Николай Юрьевич (Москва)
Митрофанова Любовь Борисовна (Санкт-Петербург)
Неминущий Николай Михайлович (Москва)
Попов Сергей Валентинович (Томск)
Прасол Денис Михайлович (Санкт-Петербург)
Ревишвили Амиран Шотаевич (Москва)
Рзаев Фархад Гусейнович (Москва)
Романов Александр Борисович (Новосибирск)
Ситникова Мария Юрьевна (Санкт-Петербург)
Татарский Роман Борисович (Санкт-Петербург)
Термосесов Сергей Артурович (Москва)
Тодосийчук Виктор Викторович (Тюмень)
Уцумуева Мадина Джаватовна (Москва)
Федотов Петр Алексеевич (Санкт-Петербург)
Хоменко Егор Александрович (Кемерово)
Царегородцев Дмитрий Александрович (Москва)
Школьникова Мария Александровна (Москва)
Шлевков Николай Борисович (Москва)
Шляхто Евгений Владимирович (Санкт-Петербург)
Шубик Юрий Викторович (Санкт-Петербург)
Яшин Сергей Михайлович (Санкт-Петербург)
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов, член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Представленные Рекомендации разработаны на основе предыдущей версии документа "Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть" 2020 года, одобренного на заседании Научно-практического совета Министерства здравоохранения Российской Федерации (заседание от 16.10.2020 г. протокол N 38/2-3-4), Рекомендаций Европейского общества кардиологов по лечению больных с желудочковыми нарушениями ритма и профилактике внезапной смерти 2022 года, а также с учетом клинических рекомендаций по проведению электрофизиологических исследований, катетерной аблации и применению имплантируемых антиаритмических устройств Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции (ВНОА) 2017 года, рекомендаций общества специалистов по неотложной кардиологии "Желудочковые аритмии у взрослых" 2015 года, Всероссийских клинических рекомендаций по контролю над риском внезапной остановки сердца и внезапной сердечной смерти, профилактике и оказанию первой помощи 2018 года, созданных, в свою очередь, на основе анализа имеющегося более чем 20-летнего опыта различных по целям, протоколам и объемам крупных исследований, проведенных по различным аспектам диагностики и лечения желудочковых тахиаритмий.
В Рекомендациях изложены основные принципы диагностики, стратификации риска внезапной смерти и лечения пациентов, в том числе и в ряде клинических ситуаций, которые были получены в рандомизированных контролируемых исследованиях. Используется комплексный подход с учетом этиопатогенеза, индивидуальных особенностей механизмов развития и течения заболевания, использования медикаментозных, интервенционных и хирургических методов лечения.
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог
2. Врач-сердечно-сосудистый хирург
3. Врач по рентгенэндоваскулярным диагностике и лечению
4. Врач функциональной диагностики
5. Врач-терапевт
6. Врач общей практики (семейный врач)
ЕОК - в тексте настоящих клинических рекомендаций дополнительно указаны показания к тезисам в соответствии с рекомендациями Европейского кардиологического общества (ЕОК).
Вследствие того, что Российское кардиологическое общество (РКО) входит в состав Европейского общества кардиологов (ЕОК), и члены РКО также являются членами ЕОК, все европейские рекомендации формируются с участием российских экспертов, которые являются соавторами рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских врачей-кардиологов.
В связи с этим, формирование национальных рекомендаций проводилось на основе рекомендаций ЕОК с учетом национальной специфики, особенностей обследования, лечения, доступности той или иной медицинской помощи. По этой причине в ходе разработки российских клинических рекомендаций РКО использованы международные классы показаний рекомендаций, позволяющие оценить необходимость выполнения тезиса рекомендаций и уровни достоверности доказательств данных классов (Таблицы А2.1 и А2.2).
В тех случаях, когда в европейских рекомендациях отсутствовали классы и уровни доказательности, но по мнению экспертов РКО данные тезисы являлись крайне необходимыми для выполнения или, наоборот, абсолютно не рекомендованы к применению, эксперты РКО, основываясь на правилах формирования классов показаний согласно рекомендациям Европейского общества кардиологов, сами проставляли классы и уровни. В данной ситуации обозначение ЕОК заменено на РКО-классы и уровни, проставленные экспертами РКО.
Кроме того, добавлена новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы А2.3, А2.4 и А2.5), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Таким образом, в тексте клинических рекомендаций, разрабатываемых экспертами РКО, одновременно использованы две шкалы (Таблицы А2.1, А2.2, А2.3, А2.4, А2.5).
Таблица А2.1. Классы показаний согласно рекомендациям Европейского Общества Кардиологов (ЕОК)
Класс рекомендаций (ЕОК)
Определение
Предлагаемая формулировка для использования
I
Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными
Рекомендовано/показано
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
Целесообразно
Применять
Можно применять
IIa
IIb
III
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/не эффективны, а в ряде случаев могут приносить вред
Не рекомендуется применять
Таблица А2.2. Уровни достоверности доказательств согласно рекомендациям Европейского Общества Кардиологов (ЕОК)
Уровни достоверности доказательств (ЕОК)
A
Данные многочисленных рандомизированных клинических исследований или метаанализов
B
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
C
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Таблица А2.3. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2.4. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А2.5. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Связанные документы
1. Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. N 918н "Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями".
2. Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. N 710н "Об утверждении стандарта специализированной медицинской помощи при желудочковой тахикардии".
3. Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. N 520н "Об утверждении критериев оценки качества медицинской помощи".
4. Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации" (зарегистрирован 08.05.2019 N 54588).
Лекарственные средства для профилактики желудочковых аритмий
В настоящее время принята классификация противоаритмических препаратов по E.M. Vaughan Williams в модификации B.N. Singh и D.C. Harrison.
Эта классификация позволяет разделить все известные в настоящее время противоаритмические препараты на 4 класса, в зависимости от их способности:
1. угнетать деполяризацию (фазу 0 потенциала действия) в тканях с "быстрым" ответом;
2. блокировать симпатические влияния на сердце;
3. увеличивать продолжительность потенциала действия, замедляя процессы реполяризации;
4. замедлять деполяризацию в тканях с "медленным" ответом.
Каждый из известных противоаритмических препаратов обладает одним из представленных выше эффектов в качестве доминирующего, что позволяет отнести его к тому или иному классу.
1. Антиаритмические препараты, классы I и III (препараты, блокирующие натриевые каналы) (АТХ: C01BA - ААП, класс IA, C01BB - ААП, класс IB, C01BC - ААП, класс IC)
2. Бета-адреноблокаторы: антиаритмические препараты II класса (АТХ С07А - Бета-адреноблокаторы)
3. Антиаритмические препараты, класс III: препараты, блокирующие калиевые каналы (АТХ C01BD - Антиаритмические препараты, класс III)
Примечание: По классификации E.M. Vaughan Williams в модификации B.N. Singh и D.C. Harrison соталол** яваляется антиаритмическим препаратом, класс III с сопутствующей неселективной бета-блокирующей активностью. А в соответствии с классификацией АТХ отнесен к неселективным бета-адреноблокаторам (C07AA). В тексте настоящих рекомендаций соталол** рассматривается как антиаритмический препарат, класс III, как единственный представитель бета-адреноблокаторов, удлиняющих интервал QT, что принципиально важно с позиции эффективности, а главное, безопасности его применения.
4. Блокаторы "медленных" кальциевых каналов: антиаритмические препараты IV класса (АТХ C08D Селективные блокаторы кальциевых каналов с прямым действием на сердце)
Таблица А3.1 Лекарственные препараты для длительной терапии с целью подавления ЖЭ и профилактики рецидивов ЖТ у взрослых
Препарат (класс <1>)
Группа АТХ
Доза для длительного перорального применения
Показания
Частые побочные эффекты
Протнвопока з ання
Амиодарон** (III)
C01BD
200 мг 3 раза в сутки - 1 неделя, затем 200 мг 2 раза в сутки - 1 - 2 недели, затем поддерживающая доза 200 мг в сутки
ЖЭ, ЖТ, ФЖ, в том числе у пациентов с ХСН, выраженной ГЛЖ, пике
Кардиальные:
Гипотензия, брадикардия, АВ-блокада.
ЖТ типа "пируэт", замедление ритма ЖТ ниже порога детекции ИКД***, возрастание порога дефибрилляции
Некардиальные:
кератопатия, гипо- и гнпертиреоз, рвота, запор, фотосенсибилизация, атаксия, головокружение, периферическая нейропатия, тремор, лекарственный гепатит, цирроз печени, фиброз легких, пневмонит
QT > 480 мс до начала терапин
Сердечная недостаточность III - IV ФК NYHA
Синусовая брадикардия, СА-блокада II - III ст.
АВ-блокада II III ст. при отсутствии имплантированного ЭКС***
Нарушение функции щитовидной железы, за исключением случаев его коррекции.
Бета-адреноблокаторы (II)
#Атенолол** (1) гбнсопролол** (2) #карведнлол** (3) #Метопролол** (4) Шропранолол** (5)
C07A
Разные дозы
ЖЭ, ЖТ, в том числе у пациентов с ХСН, выраженой ГЛЖ, ПИКС, Врожденный СУИQT, КПЖТ, с целью первичной и вторичной профилактики ВСС у пациентов с СПС
Кардиальные:
Брадикардия,
гипотензия, АВ-блокада, усугубление ХСН.
Некардиатьные:
Головокружение, усталость, бронхообструктивный синдром, тревожные расстройства, депрессия, диарея, сексуальные расстройства, гипогликемия при инсулинзависимом СД
СА-блокада II - III ст., АВ-блокада II - III ст.,
сину совая брадикардия (в отсутствии ЭКС***), артериальная гипотония, ХСН IV ФК, бронхообструктивный синдром.
Имеются указания на повышенный риск преждевременных родов, связанный с применением атенолола по сравнению с другими бета-адреноблокаторами, в частности, пропрано лолом**, бисопрололом** и метопрололом [742].
25 - 100 мг 1 - 2 р/сут. (1) [198, 574 742]
2,5 - 10 мг 1 р/сут. (2) [726]
3,125 - 25 мг 2 р/сут. (3) [727, 738] 50 - 200 мг в сут. в два приема (4) [728, 739]
10 - 40 мг 4 р/сут. (5) [150, 574, 729, 730, 731]
Соталол** (III)
CQ7AA
80 - 120 мг 2 р/сут
Макс, доза 320 мг/сут. [185]
ЖЭ, ЖТ
Кардиальные:
брадикардия, гипотензия, усугубление ХСН, ЖТ тина "пируэт"
Некарднальные: как у бета-адреноблокаторов
СА-блокада II - III ст., АВ-блокада II - III ст., LQT, синусовая брадикардия (в отсутствии ЭКС***), артериальная гипотония, ФВ < 40%, ХСН III - IV ФК, в остром периоде ИМ, бронхообструктивный синдром, ХБП III Б ст. (КК < 45 мл/мин)
Пропафенон** (IC)
C01BC
150 - 300 мг 3 р/сут.
ЖЭ, ЖТ
(без структурно го поражения сердца)
Кардиальные:
СА-блокада, АВ-блокада, расширение комплекса QRS до 25%, отрицательный инотропный эффект, усугубление ХСН, увеличение порогов стимуляции и дефибрилляции сердца.
Аритмогенное действие - мономорфная ЖТ, ФЖ.
Некарднальные:
головокружение, утомляемость, сухость во рту, тошнота, диарея, тремор, нечеткость зрения, нарушения функции печени
СА-блокада II - III ст., АВ-блокада II - III ст..
синусовая брадикардия (в отсутствии ЭКС***),
тяжелые нарушения внутрижелудочкового проведения (QRS > 140 мс), ТП (при отсутствии терапии препаратами.. блокирующими АВ-проведение), ИБС, ПИКС, ГЛЖ (> 1,4 см), сниженная
ФВЛЖ, болезни клапанного аппарата сердца с нарушением гемодинамики, синдром Бругада, наследственный СУИQТ (кроме 3 типа - для флекаинида), серьезные заболевания печени, почек.
Лаппаконитина гидробромид** (IC)
2
2
Лаппаконитина гидробромид таблетки с пролонгированным высвобождением (IC)
C01BC
25 мг 3 - 4 р/сут.
или
50 мг 2 р/сут.
Диэтнламннопропнон илэтоксикарбонилами нофенотиазин (IC)
C01BC
50 от 3 р/сут. [201, 203, 204, 235, 239]
Флекаинид (IC)
C01BC
50 - 200 мг 2 р/сут. [185]
#фенитоин** (IB)
C01BB
200 - 400 мг/сут [240, 242, 732]
ЖЭ, ЖТ при дигиталисной интоксикации, комбинации с амнодароном** или соталолом** при неэффектиости монотерапии ЖНРС у пациентов с СПС и ИКД
Кардиальные:
артериальная гипотония
Некарднальные:
головокружение, д1нзартрия, летаргия, гингивит, макроцитарная анемия, волчаночноподобный синдром, легочные инфильтраты
СА-блокада II - III ст., АВ-блокада II - III ст., синусовая брадикардия (в отсутствие ЭКС***), тяжелые нарушения внутрижелудочкового проведения (QRS > 140 мс), ХСН III - IV ФК
#верапамил** (IV)
COSD
240 - 360 мг/сут. [185, 679]
ЖЭ, фасцикулярная ЖТ из лж, ЛЖ из выносящего тракта ПЖ
Кардиальные:
гипотензия, отеки, АВ-блокада, синусовая брадикардия, усугубление ХСН у пациентов со сниженнойФВЛЖ
Некардиальные:
головная боль, сыпь, гиперплазия десен, запор, диспепсия
СА-блокада II - III ст., АВ-блокада II - III ст., синусовая брадикардия (в отсутствие ЭКС***),
ХСН, снижение ФВЛЖ
ФП/ТП у пациентов с синдромом WPW
#дилтиазеы (IV)
COSD
90 - 180 мг/сут. [679, 733]
--------------------------------
Примечания: <1> согласно классификации E. Vaughan Williams в модификации D. Harrison.
Сут. - сутки, мг/сут. - миллиграмм в сутки, ЖЭ - желудочковая экстрасистолия, ЖТ - желудочковая тахикардия, ФЖ - фибрилляция желудочков, ФП - фибрилляция предсердий, ТП - трепетание предсердий, СА - синоатриальный, АВ - атриовентрикулярный, СУИQT - синдром удлиненного интервала QT, КПЖТ - катехоламинергическая полиморфная желудочковая тахикардия, ПЖ - правый желудочек, ГЛЖ - гипертрофия левого желудочка, ПИКС - постинфарктный кардиосклероз, ФВЛЖ - фракция выброса левого желудочка, ХСН - хроническая сердечная недостаточность, ФК - функциональный класс, СД - сахарный диабет, TdP - ЖТ типа "пируэт" (torsades de pointes). АТХ - Анатомо-Терапевтически-Химическая система классификации лекарственных средств
Таблица А3.2 Лекарственные препараты для купирования пароксизмов ЖТ у взрослых
Препарат (класс <1>)
Группа АТХ
Дозы и схемы
Применение
Параметры ЭКГ, требующие внимания
Частые побочные эффекты
Амиодарон** (III)
C01BD
в/в струйно
5 мг/кг в течение
15 - 20 мин.,
далее в/в капельно:
1 мг/мин. - 6 ч.,
0,5 мг/мин. - 18 ч. (до 1200 мг в сутки)
ЖТ у пациентов со структурным поражением сердца, после перенесенного ИМ, в том числе при выраженной ГЛЖ, ХСН, ЖТ после кардиологических операций, ЖТ у пациентов с ИКД***
Синусовая брадикардия ![]() 50 уд/мин.
50 уд/мин.
Угнетение АВ-проведения (блокады II - III ст.),
QRS > 160 мс,
QT ![]() 500 мс
500 мс
Артериальная гипотония, брадикардия, нарушения АВ-проводимости, возрастание порога дефибрилляции, ЖТ типа "пируэт" (редко)
Лидокаин** (I(B))
C01BB
1 мг/кг в/в в течение 2 - 4 мин., при необходимости далее в/в капельно 1 - 4 мг/мин в течение 12 - 24 ч. Максимальная доза 2000 мг/сут
ЖТ у пациентов в остром периоде ИМ, ЖТ вследствие интоксикации сердечными гликозидами, после кардиохирургических операций
Значимо не влияет на интервалы ЭКГ. Может сокращать QTc
Делирий, психоз, эпилептические припадки, тремор, дизартрия (при дозах капельного введения 1 г/сут. и более)
Прокаинамид** (IA)
С01ВА
В/в медленно 100 мг каждые 5 мин до купирования ЖТ или достижения дозы 500 мг, затем в/в капельно 20 мг/мин в течение 25 минут (макс. нагрузочная доза 1000 мг).
При необходимости поддержания концентрации длительное в/в капельное введение 2 - 6 мг/мин
Купирование УМЖТ при отсутствии выраженной СН, гипотензии, острого ИМ, терминальной почечной недостаточности, признаков
синдрома Бругада
Синусовая брадикардия ![]() 50 уд/мин.
50 уд/мин.
угнетение АВ-проведения (блокады II - III ст.),
QRS > 160 мс,
QT ![]() 500 мс
500 мс
Артериальная гипотония, брадикардия, нарушения АВ-проводимости, нарушения внутрижелудочковой проводимости, возрастание порога дефибрилляции, ЖТ типа "пируэт"
#Верапамил** (IV)
C08D
В/в струйно 5 - 10 мг (до 0,145 мг/кг) медленно болюсом [8, 743]
"Идиопатические" ЖТ:
Из выходного тракта ПЖ, ЛЖ.
Фасцикулярная ЛЖТ
Синусовая брадикардия ![]() 50 уд/мин.
50 уд/мин.
Угнетение АВ-проведения (блокады II - III ст.)
Артериальная гипотония, брадикардия, нарушения АВ-проводимости, острая СН.
Противопоказаны при синдроме WPW и любых формах ХСН
#Трифосаденин
C01EB
В/в струйно 20 мг
в течение 2 сек.
Через 2 мин. возможно повторное введение
20 мг
в течение 2 сек. [136, 745]
ЖТ из выходного тракта ПЖ, ЛЖ.
Фасцикулярная ЛЖТ
Арест синусового узла или АВ-блокада II - III ст. (кратковременно).
Возможно развитие пароксизма ФП.
Одышка, бронхоспазм.
#Магния сульфат**
B05XA
2 г в/в струйно медленно под контролем АД. При неэффективности - повторное введение в течение 5 - 15 мин [105]
ЖТ типа TdP при CУИQT различной этиологии
Артериальная гипотония
--------------------------------
Примечание: <1> согласно классификации E. Vaughan Williams в модификации D. Harrison.
Сокращения: АВ - атриовентрикулярный, АД - артериальное давление, в/в - внутривенное введение, ГЛЖ - гипертрофия левого желудочка, ЖТ - желудочковая тахикардия, ИКД - имплантируемый кардиовертер-дефибриллятор, ИМ - инфаркт миокарда, ЛЖ - левый желудочек, ПЖ - правый желудочек, СУИQT - синдром удлиненного интервала QT, СН - сердечная недостаточность, УМЖТ - устойчивая мономорфная ЖТ, ФП - фибрилляция предсердий, ХСН - хроническая сердечная недостаточность, ЭКГ - электрокардиограмма, TdP - torsades de pointes, WPW - синдром Вольфа-Паркинсона-Уайта. АТХ - Анатомо-Терапевтически-Химическая система классификации лекарственных средств
Таблица А3.3 Лекарственные препараты для длительной терапии с целью профилактики рецидивов ЖТ у детей
Код АТХ
Наименование лекарственного препарата (МНН)
Путь введения
Тип лек. формы по агрегатному состоянию на момент потребления
Суточная доза (мг/кг/сутки)
Среднее количество приемов в день
Комментарий
Ссылки на литературу
C01BD01
#Амнодарон**
Пероральный
Твердая
Доза насыщения - 5 - 10 мг/кг в течение 60 мин. затем поддерживающая инфузия 10 мг/кг/сутки (5 - 15 мг/кг/мин)
2
- Офф-лейбл по оказаниям; по возрасту
[65, 102, 108, 734]
C07AB03
#Агенолол**
Пероральный
Твердая
0,3 - 1,3 мг/кг/сутки
1 - 2
- Офф-лейбл по показаниям: по Еозраслу
[102, 205]
C07AB07
#Бисопролол**
Пероральный
Твердая
0,3 - 0,4 мг/кг/суткн (не более 10 мг/сут)
1
- Офф-лейбл по показаниям: по возрасту
[205]
C08DA01
#Верапамнл**
Пероральный
Твердая
2 - 9 мг/кг/сугки
3
- Офф-лейбл по оказаниям; по возрасту
[102, 205]
Код АТХ
Наименование лекарственного препарата (МНН)
Путь введения
Тип лек. формы по агрегатному состоянию на момент потребления
Суточная лоза (мг/кг/сутки)
Среднее количество приемов в день
Комментарий
Ссылки на литературу
C07AB02
#Метопролол**
Пероральный
Твердая
1 - 2 мг/кг/сутки
2
- Офф-лейбл по показаниям; по возраст)
[735, 731, 736]
C01BC03
#Пропафенон**
Пероральный
Твердая
10 - 15 мг/кг/сутки
3
- Офф-лейбл по показаниям; по возраст)
[108]
C07AA05
Шропранолол**
Пероральный
Твердая
1 - 4 мг/кг/сутки
4
- Офф-лейбл по показаниям; по возраст)
[191, 731, 736, 737]
C07AA07
#Соталол**
Пероральный
Твердая
1 - 3 мг/кг/сутки в 2 приема.
При "нагрузочной" симпатнкозависимой экстрасистолии используют соталол (0,5 - 3,0 мг/кг/сут).
3
- Офф-лейбл по показаниям; по возраст)
[108]
C01BC04
#Флеканнид
Пероральный
Твердая
1 - 3 мг/кг/сутки
3
- Офф-лейбл по показаниям; по возраст)
[102, 205, 737]
Таблица А3.4 Лекарственные препараты для купирования пароксизмов ЖТ у детей
Код АТХ
Наименование лекарственного препарата (МНН)
Путь введения
Тип лек. формы по агрегатному состоянию на момент потребления
Доза и схема введения (мг/кг/сутки)
Комментарий
Ссылки на литературу
C01BD01
#Амиодарон**
Внутривенно, внутрикостно
Жидкая
Нагрузочная доза: 5 - 10 мг/кг за 60 минут.
Поддерживающая инфузия:
5 - 15 мкг/кг/мин
5 - 10 мг/кг,
максимально 300 мг
- Офф-лейбл по показаниям; по возрасту
[102, 108, 723, 724]
C01BA02
#Прокаинамид**
Внутривенно
Жидкая
0,15 - 0,2 мл/кг
- Офф-лейбл по показаниям; по возрасту
[102, 108]
C01CA24
#Эпинефрин**
Внутривенный, внутрикостно
Жидкая
0,01 мг/кг, максимальная разовая доза для ребенка 6 - 12 лет - 0,3 мг, до 6 лет - 0,15 мг
- Офф-лейбл по показаниям; по возрасту
[125]
C01BB01
#Лидокаин**
Внутривенно
Жидкая
1 мг/кг (внутривенно болюсно, допустимо 3х кратное введение данной дозы с интервалом 10 мин);
с последующей непрерывной инфузией со скоростью 20 - 50 мкг/кг/мин.
Офф-лейбл по показаниям; по возрасту
[102, 107]
B05XA05
#Магния сульфат**
Внутривенно 12,5% раствор
Жидкая
25 - 50 мг/кг
(не более 2 гр.)
Внутривенное введение в течение 1 - 2 минуты для купирования приступа тахикардии типа "пируэт", при неэффективности повторное введение той же дозы через 5 - 10 минут
Офф-лейбл по показаниям; по возрасту
[106, 108]
C08DA01
#Верапамил**
Внутривенно
Жидкая
0,1 мг/кг в течение 2 мин.
Офф-лейбл по показаниям; по возрасту
[143]
Порядок оказания экстренной медицинской помощи на догоспитальном этапе: Применения ЭКМО при СЛР
Критерии применения венозно-артериальной ЭКМО при проведении СЛР
Рисунок (не приводится)
1. Наличие свидетеля внезапной остановки кровообращения (факт остановки кровообращения произошел в присутствии лица, который способен это распознать и вызвать помощь).
2. Немедленное начало базового комплекса СЛР (Не позднее 5 минут от момента предполагаемой остановки сердца должен быть начат непрямой массаж сердца);
3. Предполагаемый интервал от остановки кровообращения до запуска ЭКМО менее 60 минут;
4. Предполагаемый возраст пациента не более 70 лет;
5. Возможность применения устройств автоматической наружной компрессии грудной клетки (подходящее телосложение, отсутствие видимых противопоказаний, наличие устройства на оснащении медицинской бригады или в медицинской организации);
6. Отсутствие ранее известных сопутствующих заболеваний, ограничивающих продолжительность жизни (терминальная стадия сердечной недостаточности у не кандидатов на трансплантацию сердца, хроническая обструктивная болезнь легких, терминальная стадия почечной или печеночной недостаточности, полиорганная недостаточность при оценке по шкале SOFA более 14 баллов (приложение Г5), терминальная стадия онкологического заболевания);
7. Отсутствие достоверных данных о средней и тяжелой недостаточности аортального клапана;
8. Отсутствие травм и продолжающегося кровотечения;
9. Наличие любой электрической активности сердца (фибрилляция желудочков, желудочковая тахикардия, электрическая активность без пульса, повторяющиеся остановки кровообращения);
10. Лактат артериальной крови менее 18 ммоль/л;
11. EtCO2 более 10 мм рт. ст.;
12. PaO2 более 50 мм рт. ст.;
13. SaO2 более 85%;
14. Техническая возможность канюляции;
15. Потенциально обратимая причина остановки кровообращения (кардиогенный шок любого типа и происхождения, гипотермия, отравление кардиотоксичными препаратами, острые электролитные нарушения, не связанные с хроническим заболеванием).
Пример чек-листа проверки критериев применения ЭКМО при проведении СЛР:
Критерий
Оценка критерия
Качественная
Количественная
Возраст до 70 лет
Да
Нет
Свидетель остановки кровообращения
Да
Нет
Начало СЛР < 5 мин
Да
Нет
Начало ЭСЛР < 60 мин
Да
Нет
Электрическая активность сердца
Да
Нет
ETCO2/PaCO2 > 10 mm Hg
Да
Нет
Признаки жизни - хотя бы один (отсутствие двустороннего мидриаза, наличие фотореакций зрачков, рефлексов, реакции на боль, спонтанных движений)
Да
Нет
Отсутствие неизлечимых заболеваний и осложнений
Да
Нет
Критерии исключения применения ЭКМО при СЛР:
Тяжелая хроническая сердечная недостаточность (у не кандидатов на трансплантацию сердца)
Да
Нет
Терминальная почечная/печеночная недостаточность (SOFA более 14 баллов)
Да
Нет
Хроническая обструктивная болезнь легких
Да
Нет
Онкологический анамнез вне ремиссии
Да
Нет
Техническая невозможность канюляции
Да
Нет
Порядок оказания помощи пациентам с внезапной остановкой кровообращения в стационарном отделении скорой медицинской помощи.
При поступлении в стационарное отделение скорой медицинской помощи пациента в состоянии клинической смерти, развившейся вне медицинской организации осуществляются:
- Осмотр врача анестезиолога-реаниматолога стационарного отделения скорой медицинской помощи;
- Регистрация ЭКГ.
Лабораторное обследование:
- Исследование кислотно-основного состояния и газов крови (B03.016.011);
- Общий (клинический) анализ крови (B03.016.002);
- Исследование уровня калия в крови (A09.05.031); Исследование уровня натрия в крови (A09.05.030); Исследование уровня креатинина в крови (A09.05.020); Исследование уровня мочевины в крови (A09.05.017); Определение активности аланинаминотрансферазы в крови (A09.05.042); Определение активности аспартатаминотрансферазы в крови (A09.05.041); Исследование уровня общего билирубина в крови (A09.05.021); Исследование уровня глюкозы в крови (A09.05.023);
- Активированное частичное тромбопластиновое время (A12.05.039); Определение международного нормализованного отношения (МНО) (A12.30.014);
- Исследование уровня тропонинов I, T в крови (A09.05.193);
- Молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus) (A26.05.019), молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) (A26.05.020), Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови (A26.06.048) и Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови (A26.06.049) или Исследование уровня антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1/2 и антигена p24 (Human immunodeficiency virus HIV 1/2 + Agp24) в крови (A26.06.049.001), Определение антител к бледной трепонеме (Treponema pallidum) в крови (A26.06.082);
- Определение группы крови и резус-фактора: Определение основных групп по системе AB0 (A12.05.005), Определение антигена D системы Резус (резус-фактор) (A12.05.006).
Инструментальная диагностика
- Ультразвуковой скрининг (FAST-протокол): Эхокардиография (A04.10.002), Ультразвуковое определение жидкости в брюшной полости (A04.30.004), Ультразвуковое исследование плевральной полости (A04.09.001), Ультразвуковое исследование забрюшинного пространства (A04.30.003), Ультразвуковое исследование органов малого таза комплексное (трансвагинальное и трансабдоминальное) (A04.30.010);
- Компьютерная томография головного мозга (A06.23.004);
- Компьютерная томография органов грудной полости с внутривенным болюсным контрастированием (A06.09.005.002);
- Компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием (A06.30.005.003);
- Коронарография (A06.10.006).
Консультации специалистов: по показаниям.
Лечение:
- продолжение расширенных мероприятий сердечно-легочной реанимации в полном объеме; в случае выявления причины, приведшей к остановке кровообращения, проводится патогенетическая терапия, направленная на ее устранение;
- решение о применении вено-артериальной экстракорпоральной мембранной оксигенации (ВА ЭКМО) в комплексе сердечно-легочной реанимации (ЭСЛР).
Алгоритм принятия решения бригадой скорой медицинской помощи по эвакуации пациента с внезапной остановкой кровообращения
Рисунок (не приводится)
СРЛ - сердечно-легочная реанимация;
ЭКМО - экстракорпоральная мембранная оксигенация; СМП - скорая медицинская помощь.
Дополнительные интернет-ресурсы
- Обновляемый перечень лекарственных средств, влияющих на длительность интервала QT: https://crediblemeds.org/
- Актуальная информация о побочных эффектах медикаментозных препаратов: https://www.drugs.com/
- Препараты, повышающие риск желудочковых аритмий у пациентов с синдромом Бругада: http://www.brugadadrugs.org; на русском языке: https://www.brugadadrugs.org/upload-dir/Drugs%20in%20Brugada%20syndrome%20letter%20RUSSIAN.pdf
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Рисунок 1. Алгоритм купирования пароксизма регулярной тахикардии с широкими комплексами QRS.
Рисунок (не приводится)
Примечание: НЖТ - наджелудочковая тахикардия, ЖТ - желудочковая тахикардия, ВТПЖ - выводной тракт правого желудочка (адаптировано из [8]).
#прокаинамид** применяется при отсутствии выраженной сердечной недостаточности, гипотензии, острого ИМ, терминальной почечной недостаточности, признаков синдрома Бругада (дозы для взрослых и детей см. в Приложении А, таблицы А3.2 и А3.4).
Рисунок 2А. Алгоритм ведения пациентов с электрическим штормом или повторными разрядами ИКД.
Рисунок (не приводится)
Примечание: ИКД - кардиовертер-дефибриллятор имплантируемый***, ФП - фибрилляция предсердий, СВТ - суправентрикулярная тахикардия, ЖА - желудочковая аритмия, ЖТ - желудочковая тахикардия (адаптировано из [8]).
Рисунок 2Б. Алгоритм ведения пациентов с электрическим штормом или повторными разрядами ИКД (продолжение рисунка 2А).
Рисунок (не приводится)
Примечание: ЖА - желудочковая аритмия, СУИQT - синдром удлиненного интервала QT, ФЖ - фибрилляция желудочков, КПЖТ - катехоламинергическая полиморфная желудочковая тахикардия, ОКС - острый коронарный синдром, ИМ - инфаркт миокарда, ЖЭ - желудочковая экстрасистолия, в/в - внутривенно, ААТ - антиаритмическая терапия (адаптировано из [8]).
Рисунок 2В. Алгоритм ведения пациентов с электрическим штормом или повторными разрядами ИКД (продолжение рисунка 2А).
Рисунок (не приводится)
Примечание: ЖА - желудочковая аритмия, ИКД - кардиовертер-дефибриллятор имплантируемый***, ААП - антиаритмические препараты (адаптировано из [8]).
Бремя ЖА (для ЖЭ и желудочковых ритмов): доля желудочковой эктопический активности от общего числа сердечных сокращений в течение периода наблюдения при проведении холтеровского мониторирования сердечного ритма или по данным имплантируемого антиаритмического устройства.
Рисунок 3. Алгоритм действий врача при первичном эпизоде устойчивой мономорфной желудочковой тахикардии.
Рисунок (не приводится)
Примечание: ЖТ - желудочковая тахикардия, ССЗ - сердечно-сосудистые заболевания, ВСС - внезапная сердечная смерть, ТТГ - тиреотропный гормон, ЭХОКГ - эхокардиография, КАГ - коронароангиография, СПС - структурная патология сердца, ИБС - ишемическая болезнь сердца, МРТ - магнитно-резонансная томография сердца, АКПЖ - аритмогенная кардиомиопатия правого желудочка, ПЭТ КТ - позитронно-эмиссионная компьютерная томография, ЭФИ - электрофизиологическое исследование, ЭАК ПЖ - электроанатомическое картирование правого желудочка (адаптировано из [8]).
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Желудочковые нарушения ритма. Внезапная сердечная смерть.
Основная терминология
Желудочковые нарушения ритма или желудочковые тахиаритмии - обобщенное название расстройств сердечного ритма, при которых источник патологической электрической активности находится в ткани желудочков сердца.
Внезапная смерть - непредвиденное смертельное событие, не связанное с травмой и возникающее в течение 1 часа с момента появления симптомов у практически здорового человека. Если смерть произошла без свидетелей, о внезапной смерти говорят в том случае, если погибший находился в удовлетворительном состоянии за 24 часа до смерти.
Внезапная сердечная смерть (ВСС) - термин применяется, если внезапная смерть возникла у пациента с известным при жизни врожденным или приобретенным потенциально фатальным заболеванием сердца, или патология сердечно-сосудистой системы была выявлена посмертно и могла быть причиной смерти, или если очевидные внесердечные причины смерти не были выявлены, и нарушение ритма служит наиболее вероятной причиной смерти.
Социальная значимость
Внезапная сердечная смерть как необратимый исход и результат внезапной остановки сердца достигает 50% среди других исходов у лиц 35 - 50 лет, преимущественно мужского пола, однако в последнее время наблюдается тенденция к увеличению доли лиц женского пола, а также подросткового и юношеского возраста.
Почти в половине случаев остановка сердца у лиц старше 40 лет происходит без известных заболеваний сердца, однако большинство из них при этом имеют недиагностированную ишемическую болезнь сердца (ИБС). Снижение заболеваемости ИБС и другими видами сердечной патологии привело к уменьшению количества случаев ВСС почти на 40%. Существует генетическая предрасположенность к внезапной смерти. Описано прогностическое значение семейного анамнеза внезапной смерти - при наличии одного случая внезапной смерти в семье относительный ее риск возрастает практически вдвое, а при двух случаях внезапной смерти в семье риск увеличивается в 9 раз.
Бдительность по отношению к электрокардиографическим (ЭКГ) и эхокардиографическим признакам наследственных аритмогенных заболеваний является важной частью клинической практики и позволяет своевременно выявить лиц с высоким риском ВСС. Скрининг ближайших родственников жертв внезапной смерти позволяет выявить лица в зоне риска, назначить соответствующее лечение и тем самым предотвратить другие случаи внезапной смерти в этой семье.
Клинические проявления
Клинические проявления желудочковых тахиаритмий могут существенно различаться - от абсолютной бессимптомности до сердцебиения, дискомфорта в груди, загрудинной боли, удушья, головокружения, пресинкопальных и синкопальных состояний. Учащенное сердцебиение, предобморочное состояние и обмороки - три наиболее важных симптома, которые требуют визита к врачу и дополнительного обследования.
Коррекция сердечно-сосудистых факторов риска неблагоприятных исходов
Пациент должен знать об имеющихся у него и членов его семьи сердечно-сосудистых факторах риска - курении, избыточной массе тела, психоэмоциональном стрессе, малоподвижном образе жизни, повышенном уровне холестерина. Влияние указанных факторов риска может быть снижено. Особенно важна коррекция изменяемых факторов риска при наличии у пациента и членов его семьи некорригируемых факторов риска, к которым относятся: наличие в семейном анамнезе внезапной сердечной смерти, ранних мозговых инсультов, инфарктов миокарда, сахарного диабета; также к данным факторам относят мужской пол, пожилой возраст, физиологическую или хирургическую менопаузу у женщин.
Коррекцию факторов риска требуется проводить не только пациенту, но и членам его семьи. Она осуществляется путем реализации программ семейной первичной профилактики и воспитания, составленных лечащим врачом:
- Индекс массы тела (Кетле) = масса тела в килограммах/(рост в м2);
- Индекс талия/бедра (ИТБ): ИТБ = ОТ/ОБ, где ОТ (окружность талии) - наименьшая окружность, измеренная над пупком; ОБ (окружность бедер) - наибольшая окружность, измеренная на уровне ягодиц;
Базовые советы пациенту и его семье
1. Достаточным считается сон не менее 7 часов в сутки;
2. Масса тела должна приближаться к идеальной (ИМТ менее 25 кг/м2). Для этого суточная калорийность пищи в зависимости от массы тела и характера работы должна составлять от 1500 до 2000 ккал. Потребление белка - 1 г/кг массы тела в сутки, углеводов - до 50 г/сут, жиров - до 80 г/сут.
3. Желательно вести дневник питания; пациенту настоятельно рекомендуется избегать жирных, сладких блюд, отдавать предпочтение овощам, фруктам, злаковым и хлебу грубого помола;
4. Ограничение потребления соли до 5 г/сутки;
5. Следует употреблять в пищу продукты, богатые калием (свежие фрукты, овощи, курага, печеный картофель);
6. Необходимо прекратить или ограничить курение;
7. Потребление алкоголя следует ограничить, с максимальным потреблением не более 30 мл/сут. в пересчете на абсолютныи этанол;
8. Согласование с лечащим врачом индивидуально приемлемых для пациента нагрузок: пешие прогулки, езда на велосипеде, ходьба на лыжах, работа в саду;
9. Психоэмоциональный стресс на производстве и в быту контролируется правильным образом жизни. Следует ограничить продолжительность рабочего дня и домашних нагрузок, избегать ночных смен, командировок;
10. Юношам, занимающимся спортом, нельзя злоупотреблять пищевыми добавками для наращивания мышечной массы и исключить прием анаболических стероидов.
Советы пациенту с имплантированным кардиовертером-дефибриллятором*** и/или устройством сердечной ресинхронизирующей терапии
- Запрещается подвергаться воздействию мощных магнитных и электромагнитных полей, а также непосредственному воздействию любых магнитов вблизи места имплантации;
- Запрещается подвергаться воздействию электрического тока;
- Выполнение магнитно-резонансной томографии (МРТ) запрещено; исключение составляют системы ИКД и СРТ-Д (электроды и устройство), имеющие отметку о МРТ-совместимости;
- Запрещается наносить удары в грудь в область имплантации ИКД/СРТ-Д, пытаться смещать аппарат под кожей;
- Запрещается садиться за руль транспортного средства в первые 3 месяца после имплантации ИКД/СРТ-Д, а также в течение 3 месяцев после обоснованного срабатывания ИКД;
- Запрещается применять монополярную электрокоагуляцию при хирургических вмешательствах (в т.ч. эндоскопических), применение биполярной коагуляции должно быть максимально ограничено;
- Следует ограничить применение перфораторов и электродрелей, а также газонокосилок; косить вручную и колоть дрова необходимо с осторожностью, по возможности лучше отказаться от данного вида деятельности;
- Нежелательны большие нагрузки на плечевой пояс;
- Можно пользоваться компьютером и подобными ему устройствами, в том числе портативными;
- Можно выполнять любые рентгеновские исследования, в том числе компьютерную томографию;
- Можно работать по дому или на земельном участке, использовать электроинструмент, при условии его исправности;
- Можно заниматься спортом, избегая контактно-травматических видов;
- Пациент с ИКД***/СРТ-Д должен своевременно являться к врачу для проверки устройства с использованием соответствующего программатора;
- Пациент с ИКД***/СРТ-Д должен знать название, модель имплантированного устройства; крайне желательно всегда иметь при себе паспорт, информационные данные об ИКД***/СРТ-Д.
Советы пациенту после проведения интервенционного лечения желудочковых нарушений ритма
- Ограничение среднетяжелых, тяжелых физических нагрузок в течение от одного до трех месяцев после интервенционного лечения желудочковых нарушений ритма;
- Строгое соблюдение двигательного режима, рекомендаций по приему медикаментозных препаратов;
- Регулярное посещение лечащего врача с оценкой состояния здоровья, ЭКГ-контролем не реже 1 раза в 6 месяцев;
- При возникновении приступа аритмии, сопровождающегося головокружением, слабостью, потерей сознания, учащенным сердцебиением, - вызов скорой медицинской помощи; желательна ЭКГ-фиксация нарушений ритма;
- По показаниям, рекомендациям лечащего врача может быть необходимо проведение контрольного эхокардиографического исследования, холтеровского мониторирования сердечного ритма.
Принципы наблюдения пациента у лечащего врача
- Плановые визиты к лечащему врачу для контроля состояния здоровья показаны в среднем 1 раз в полгода;
- Пациенту желательно знать названия и дозировки принимаемых препаратов;
- Целесообразно проведение ЭКГ-контроля при визите к лечащему врачу;
- При ухудшении самочувствия рекомендован внеплановый осмотр лечащего врача.
Неотложные состояния, требующие вызова скорой медицинской помощи
- При возникновении эпизода аритмии, сопровождающегося головокружением, слабостью, предобморочным состоянием, потерей сознания, учащенным сердцебиением показан вызов скорой медицинской помощи для контроля и стабилизации состояния, определения показаний к возможной госпитализации в стационар;
- При возникновении эпизодов предобморочных состояний, потери сознания рекомендован вызов скорой медицинской помощи для контроля и стабилизации состояния, определения показаний к возможной госпитализации в стационар;
- При возникновении срабатываний ИКД***/СРТ-Д рекомендован вызов скорой медицинской помощи для контроля и стабилизации состояния, определения показаний к возможной госпитализации в стационар;
- Пациентам с возникшими осложнениями после катетерной аблации рекомендована скорейшая госпитализация в специализированный стационар для проведения необходимых лечебно-диагностических мероприятий.
Медицинская документация
Пациентам рекомендуется хранить все выписные эпикризы из стационаров, электрокардиограммы (особенно зарегистрированные в момент нарушений ритма), копии лабораторных анализов и протоколов инструментальных исследований, заключения от врачей-консультантов не кардиологического профиля с назначениями лекарственных препаратов. Во время планового визита в поликлинику, при госпитализации, при вызове "Скорой помощи" обязательно покажите эти документы врачу. Сравнение Ваших данных с предыдущими показателями очень важно и может иметь решающее значение для правильного диагноза и лечения.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
МОДИФИЦИРОВАННАЯ ШКАЛА
ДЛЯ ДИАГНОСТИКИ СИНДРОМА УДЛИНЕННОГО ИНТЕРВАЛА QT (СУИQT)
(ШКАЛА ШВАРЦА)
Группа экспертов ЕОК, разрабатывающая клинические рекомендации по лечению ЖА 2022 г., подтвердила применение шкалы Шварца для установления клинического диагноза СУИQT [8]. Для диагностики врожденного СУИQT используются критерии Шварца, разработанные в 1985 г., измененные в 1993 г. и обновленные в 2006 и 2011 гг. [567, 568].
Название на русском языке: Модифицированная шкала для диагностики CУИQT (Шкала Шварца).
Оригинальное название: Modified long QT syndrome diagnostic score.
Источник (официальный сайт разработчиков, публикация с валидацией): 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death / Zeppenfeld K., Tfelt-Hansen J., de Riva M., et al. // European Heart Journal. - 2022. - Vol. 21. - Is. 43(40). - P. 3997 - 4126; Diagnostic criteria for the long QT syndrome. An update / Schwartz P.J, Moss A.J, Vincent G.M, Crampton R.S. // Circulation. - 1993. - V. 88. - P. 782 - 784.
Тип (подчеркнуть):
- шкала оценки
Назначение: клинический инструмент для оценки вероятности диагноза СУИQT.
Содержание (шаблон):
Признаки
Баллы
![]() 480 мс
480 мс
3,5
ЭКГ
QTc
460 - 479 мс
2
450 - 459 мс
(для мужского пола)
1
![]() 480 мс в течение 4-х минут восстановительного периода после пробы с физической нагрузкой
480 мс в течение 4-х минут восстановительного периода после пробы с физической нагрузкой
1
ЖТ по типу "пируэт"
2
Альтернация волны Т
1
Зазубрины на волне Т в 3-х отведениях
1
Сниженная ЧСС для возраста
0,5
Клинический анамнез
Синкопальные состояния
При нагрузке
2
Без нагрузки
1
Семейный анамнез
Члены семьи с определенным СУИQT
1
Необъяснимая ВСС в возрасте < 30 лет у родственников 1-й степени родства
0,5
Генетические находки
Патогенная мутация
3,5
Ключ (интерпретация): Диагноз СУИQT правомочен при наличии > 3 баллов.
Пояснения: в шкале представлены 4 группы критериев для установления диагноза CУИQT, включая ЭКГ, клинические данные, семейный анамнез и результаты генетических исследований. Каждому из критериев соответствует определенное количество баллов, которые суммируются. При сумме баллов более 3 диагноз СУИQT правомочен.
Приложение Г2
ШКАЛА
ДЛЯ ДИАГНОСТИКИ СИНДРОМА КОРОТКОГО ИНТЕРВАЛА QТ (СКИQT)
Название на русском языке: Критерии диагностики СКИQT.
Оригинальное название: SQTS Diagnostic Criteria.
Источник (официальный сайт разработчиков, публикация с валидацией): Gollob M. The Short QT Syndrome Proposed Diagnostic Criteria / Gollob M, Redpath C, Roberts J. // JACC. - 2011. - V. 57(7). - P. 802 - 12.
Тип (подчеркнуть):
- шкала оценки
Назначение: клинический инструмент для оценки вероятности диагноза СКИQT.
Содержание (шаблон):
Критерии диагностики СКИQT
Баллы
Интервал QTc < 370 мс
1
Интервал QTc < 350 мс
2
Интервал QTc < 330 мс
3
Интервал J point - T peak < 120 мс
1
Остановка сердца
2
Полиморфная ЖТ/ФЖ
2
Необъяснимые синкопе
1
Фибрилляция предсердий
1
Семейная история СКИQT
2
Семейная история ВСС
1
Семейная история синдрома ВС младенцев
1
Позитивный генотип
2
Мутации неопределенного значения в генах-кандидатах
1
Ключ (интерпретация): при наличии 4 баллов и более - высокая вероятность СКИQT, при наличии 3 баллов - средняя вероятность, при наличии ![]() 2 баллов - низкая.
2 баллов - низкая.
Пояснения: ЭКГ должна быть записана в отсутствие факторов, вызывающих укорочение интервала QT. Интервал J point - T peak должен быть измерен в прекордиальном отведении с наибольшей амплитудой зубца Т. Клинический анамнез: события должны происходить в отсутствие причины, включая структурные заболевания сердца. Баллы могут быть начислены только за 1 остановку сердца, документально подтвержденную полиморфную ЖТ или необъяснимый обморок. Семейный анамнез: баллы в этом разделе можно получить только один раз. * Для установления диагноза в разделе ЭКГ необходимо набрать как минимум 1 балл, остальные баллы являются дополнительными к ЭКГ-критерию.
Приложение Г3
HCM RISK-SCD. ШКАЛА ОЦЕНКИ РИСКА ВСС У ПАЦИЕНТОВ С ГКМП
Название на русском языке: Шкала оценки риска ВСС у пациентов с ГКМП.
Оригинальное название: HCM risk-SCD.
Источник (официальный сайт разработчиков, публикация с валидацией): O'Mahony C., Jihchi F., Pavlou M. et al. // European Heart Journal. - 2014. - V. 35. - P. 2010 - 2020.
Калькулятор на сайте: http://doc2do.com/hcm/webHCM.html
Тип (подчеркнуть): - шкала оценки.
Назначение: клинический инструмент для прогнозирования риска ВСС у пациентов с ГКМП.
Содержание (шаблон):
Шкала риска ВСС HCM risk-SCD
Показывает лучшие результаты у пациентов с ГКМП с высоким риском ВСС
Калькулятор 5-летнего риска ВСС на основе модели, в которой учитываются следующие параметры:
1. Семейная история ВСС
2. Синкопы
3. Неустойчивая ЖТ
4. Максимальная толщина стенки ЛЖ
5. Возраст
6. Диаметр ЛП
7. Градиент давления в ВТЛЖ
Параметры вносятся в калькулятор на сайте: http://doc2do.com/hcm/webHCM.html
Ключ-интерпретация:
ИКД*** показан, если риск ![]() 6%
6%
ИКД*** может быть рассмотрен, если риск ![]() 4%, но < 6%
4%, но < 6%
ИКД***, как правило, не показан, если риск < 4%
Приложение Г4
HCM RISK-KIDS. КАЛЬКУЛЯТОР
РИСКА ВСС У ДЕТЕЙ 1 - 16 ЛЕТ С ГКМП
До недавнего времени у детей с ГКМП было мало данных о первичной профилактике ВСС. К настоящему времени разработана шкала и калькулятор риска ВСС, включающие оценку таких факторов, как необъяснимый обморок, максимальная толщина стенки ЛЖ, значимое увеличение левого предсердия, градиент давления в ВТЛЖ и НУЖТ. Калькулятор риска ВСС у детей 1 - 16 лет с ГКМП представлен по ссылке (валидирован на внешних данных, но не проходил валидацию на российской популяции): https://hcmriskkids.org
Модель валидирована только для детей в возрасте 1 - 16 лет.
Название на русском языке: Шкала оценки риска ВСС у детей 1 - 16 лет с ГКМП.
Оригинальное название: HCM Risk-Kids.
Источник (официальный сайт разработчиков, публикация с валидацией): Development of a novel risk prediction model for sudden cardiac death in childhood hypertrophic cardiomyopathy (HCM risk-kids) / Norrish G., Ding T., Field E. et al. // JAMA Cardiology. - 2019. - V. 4. - P. 918 - 927. УДД 4 УУР
Калькулятор на сайте: https://hcmriskkids.org
Тип (подчеркнуть): - шкала оценки.
Назначение: клинический инструмент для прогнозирования риска ВСС у детей 1 - 16 лет с ГКМП.
Содержание (шаблон):
Шкала риска ВСС HCM Risk-Kids
Калькулятор 5-летнего риска ВСС на основе модели, в которой учитываются следующие параметры:
1. Пол
2. Вес (кг)
3. Максимальная толщина стенки ЛЖ (мм)
4. Диаметр ЛП
5. Градиент давления в ВТЛЖ
6. Неустойчивая ЖТ
7. Необъяснимые синкопэ
Параметры вносятся в калькулятор на сайте: https://hcmriskkids.org
Ключ-интерпретация:
Если риск ![]() 6%, следует рассмотреть вопрос об имплантации ИКД***
6%, следует рассмотреть вопрос об имплантации ИКД***
Приложение Г5
ШКАЛА ОЦЕНКИ ВЫРАЖЕННОСТИ ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ SOFA
Шкала SOFA (Sequential Organ Failure Assessment) предназначена для объективной оценки степени дисфункции шести основных органов и систем (дыхательной, сердечно-сосудистой, печеночной, коагуляционной, почечной и центральной нервной системы) у пациентов с подозрением на полиорганную недостаточность, особенно в условиях интенсивной терапии. Каждая система оценивается по балльной шкале от 0 (норма) до 4 (тяжелая дисфункция), итоговая сумма баллов отражает выраженность полиорганной недостаточности и коррелирует с прогнозом летальности: чем выше суммарный балл, тем выше риск неблагоприятного исхода. SOFA применяется для динамического наблюдения за состоянием пациента, а также для стратификации риска при сепсисе и других критических состояниях.
Название на русском языке: Шкала оценки органной недостаточности.
Оригинальное название: SOFA (Sequential Organ Failure Assessment).
Источник (официальный сайт разработчиков, публикация с валидацией): Vincent J.L., Moreno R., Takala J. et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. Intensive Care Med. 1996; 22(7): 707 - 710. УДД 4 УУР
Калькулятор на сайте: https://medsoftpro.ru/kalkulyatory/sofa-scores.html
Тип (подчеркнуть): - шкала оценки.
Назначение: клинический инструмент для объективной оценки степени дисфункции шести основных органов и систем (дыхательной, сердечно-сосудистой, печеночной, коагуляционной, почечной и центральной нервной системы) у пациентов с подозрением на полиорганную недостаточность.
Содержание (шаблон):
Градации оценок органной недостаточности по шкале SOFA:
Оценка
Показатель
0 балл
1 балл
2 балла
3 балла
4 балла
Дыхание
PaO2/FiO2, мм рт. ст.
![]() 400
400
< 400
< 300
< 200
< 100
Сердечно-Сосудистая Система
Среднее АД, мм рт. ст. или вазопрессоры, мкг/кг/мин.
![]() 70
70
< 70
Дофамин < 5 или добутамин (любая доза)
Дофамин 5 - 15 или адреналин < 0,1 норадреналин < 0.1
Дофамин > 15 или адреналин > 0,1 или норадреналин > 0,1
Коагуляция
Тромбоциты, 10 3/мкл
![]() 150
150
< 150
< 100
< 50
< 20
Печень
Билирубин, ммоль/л, мг/дл
< 20
20 - 32
33 - 101
102 - 201
> 204
< 1,2
1.2 - 1.9
2.0 - 5.9
6.0 - 11.9
![]() 12.0
12.0
Почки
Креатинин, мкмоль/л, мг/дл
< 110
110 - 170
171 - 299
300 - 440
> 440
< 1,2
1,2 - 1,9
2,0 - 3,4
3,5 - 4,9
> 4,9
ЦНС
Шкала Глазго, баллы
15
13 - 14
10 - 12
6 - 9
< 6
Примечания:
- Дисфункция каждого органа оценивается отдельно в динамике.
- PaO2 в mm Hg и FIO2 в % 0.21 - 1.00.
- Адренергические препараты назначены как минимум на 1 час в дозе мкг на кг в минуту.
- Среднее АД в mm Hg = ((систолическое АД в mm Hg) + (2 * (диастолическое АД в mm Hg))) / 3.
- 0 баллов - норма; 4 балла - наибольшее отклонение от нормального значения
- Общий балл SOFA = Сумма баллов всех 6 параметров.
Интерпретация:
- минимальный общий балл: 0
- максимальный общий балл: 24
- чем выше балл, тем больше дисфункция органа.
- чем больше общий балл, тем сильнее мультиорганная дисфункция.
