"Клинические рекомендации "Расслоение аорты"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАССЛОЕНИЕ АОРТЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I71.0, I72.1
Год утверждения (частота пересмотра): 2025 Пересмотр не позднее: 2027
ID: 946_1
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации Ассоциация сердечно-сосудистых хирургов России, Российское общество ангиологов и сосудистых хирургов, Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АБА - аневризма брюшной аорты
АГ - артериальная гипертензия
АГА - аневризма грудной аорты
АД - артериальное давление
АОС - аневризмо-остеоартритический синдром
АРГА - аневризма и расслоение грудной аорты
ВСУЗИ - внутрисосудистое ультразвуковое исследование
ГКА - гигантоклеточный (или височный) артериит
ГМК - гладкомышечные клетки
ДАК - двустворчатый аортальный клапан
ДИ - доверительный интервал
иАПФ - ингибиторы ангиотензин превращающего фермента
ИМГ - интрамуральная гематома
ИП - истинный просвет
КоА - коарктация аорты
КТ - компьютерная томография
КТА - компьютерно-томографическая ангиография аорты
КФК - креатинфосфокиназа
ЛКС - левая коронарная створка
ЛП - ложный просвет
МРТ - магнитно-резонансная томография
МСКТ - мультиспиральная компьютерная томография
НКС - некоронарная створка
нсАРГА - несиндромные формы АРГА
ОАС - острый аортальный синдром
ОР - относительный риск (RR - (англ.) relative risk)
ПАЯ - пенетрирующая атеросклеротическая язва
ПКС - правая коронарная створка
ПЭТ - позитронно-эмиссионная томография
РА - расслоение аорты
РКИ - рандомизированное клиническое исследование
САИ - синдром артериальной извитости
СТ - синдром Тернера
ТПА - травматическое повреждение аорты
ТТ-ЭхоКГ - трансторакальная эхокардиография
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
УЗДГ - ультразвуковая допплерография
УЗИ - ультразвуковое исследование
ФДГ - Флудезоксиглюкоза [18F]
ЧП-ЭхоКГ - чреспищеводная эхокардиография
ЭКГ - электрокардиограмма
ЯРА - ятрогенное РА
BSA - площадь поверхности тела
EDS - синдром Элерса-Данло
EVAR - эндоваскулярное лечение заболеваний аорты
HR - отношение рисков (англ.: hazard ratio)
LDS - синдром Лойеса-Дитца
MIP - проекция максимальной интенсивности
MPR - парасагиттальная многоплоскостная реконструкция (multiplanar reconstruction) TEVAR - эндоваскулярное лечение заболеваний грудной аорты
TGF - трансформирующий фактор роста
ULP - проекция, похожая на язву (ulcer-like projection)
Термины и определения
Аневризма - выпячивание стенки артерии (реже вены) вследствие ее истончения или растяжения.
Интрамуральная гематома - состояние, при котором кровь подтекает в средний слой аорты на фоне низкого давления, образуя тромб, который выталкивает наружную стенку аорту кнаружи, при этом оставляя просвет аорты относительно нормальным (отсутствует ложный просвет).
Истинная аневризма - аневризма, стенками которой являются структурные элементы сосудистой стенки.
Истинный просвет аорты - просвет аорты, формирующийся при расслоении аорты и имеющий антеградный кровоток.
Ложная аневризма - наполненная кровью полость, лежащая в тканях вне артерии, но сообщающейся с ней через отверстие в стенке.
Ложный просвет аорты - просвет аорты, формирующийся при расслоении аорты и имеющий ретроградный кровоток или тромбоз.
Острое расслоение аорты - время от момента начала появления симптомов расслоения аорты до 14 суток.
Острый аортальный синдром - это внезапно возникшие ситуации с похожими клиническими характеристиками, сопровождающиеся поражением аорты. В основе различных проявлений ОАС лежит разрушение интимы и медии аорты, что может приводить к образованию интрамуральной гематомы, пенетрирующей аортальной язвы, расслоению или разрыву аорты.
Отграниченный разрыв аорты - состояние, когда у пациента с острой болью (как правило, гемодинамически стабильного) при инструментальном исследовании обнаруживается аневризма аорты с сохранной стенкой (в отличие от разрушения всех слоев стенки как при разрыве) и периваскулярная гематома с/без образования ложной аневризмы.
Пенетрирующая аортальная язва - это язва атеросклеротической бляшки аорты, проникающая через внутреннюю эластическую пластинку в медию.
Подострое расслоение аорты - период от 15 суток с момента возникновения симптомов расслоения аорты до 90 суток.
Расслоение аорты - разрушение среднего слоя ее стенки, вызванного внутристеночным попаданием крови, с последующим разделением/расслоением слоев стенки аорты и формированием ИП и ЛП с/без сообщения между ними.
Синдром мальперфузии - нарушение кровоснабжения органов и/или частей тела (миокардиальная, церебральная, спинальная, мезентериальная, ренальная ишемия, ишемия конечностей), возникшее вследствие расслоения аорты и ее ветвей.
Фенестрация - сообщение между истинным и ложным просветом расслоенной аорты
Хроническое расслоение аорты - время более 90 суток от момента начала появления симптомов расслоения аорты, а также у ранее оперированных пациентов с РА типа A и сохраняющимся расслоением нисходящей аорты.
Эндолик - неполное выключение аневризматического мешка с постоянным притоком крови в мешок после endovascular aneurysm repair (EVAR).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Острый аортальный синдром (ОАС) - это опасные для жизни состояния, при которых происходит нарушение целостности стенки аорты. ОАС включает в себя расслоение аорты (РА), интрамуральную гематому (ИМГ) и пенетрирующую атеросклеротическую язву (ПАЯ), которые могут привести к разрыву аорты.
Расслоение аорты - определяется как разрушение среднего слоя ее стенки, вызванного внутристеночным попаданием крови, с последующим разделением/расслоением слоев стенки аорты и формированием ИП и ЛП с/без сообщения между ними. В большинстве случаев причиной РА является разрыв интимы, вследствие чего кровь попадает в плоскость расслоения - в среднюю оболочку аорты. Далее следует либо разрыв аорты в случае разрушения адвентиции, либо повторное попадание крови в просвет аорты через второй участок разрыва интимы. РА может быть антеградным или ретроградным. Расслоение аорты может также распространяться на ее основные ветви. Другие осложнения включают тампонаду сердца, недостаточность аортального клапана и синдром мальперфузии органов. Воспалительная реакция на процессы тромбоза в медии способна инициировать дальнейший некроз и апоптоз ГМК и дегенерацию эластической ткани, что увеличивает риск разрыва медии.
Интрамуральная гематома - это наличие крови в медиальном слое стенки аорты при отсутствии явного разрыва интимы или явного ложного просвета. Кровь может появиться либо из-за разрыва vasa vasorum, вызывающий кровотечение в медии, либо из-за небольших разрывов интимы, которые не визуализируются при помощи стандартных методов визуализации. ИМГ диагностируется с помощью компьютерно-томографической ангиографии аорты (КТА), магнитно-резонансной ангиографии с контрастированием (МРТ) и трансторакальной эхокардиографии по наличию утолщения стенки аорты в форме круглого или серповидного утолщения стенки > 5 мм без признаков кровотока.
Пенетрирующая аортальная язва - это изъязвления атеросклеротической бляшки, приводящая к локальному дефекту в интиме аорты, что позволяет крови проникать в медиальный слой и часто ассоциируется с ИМГ различного размера. ПАУ чаще всего возникают в средней или дистальной части нисходящей грудной аорты, реже в дуге аорты и брюшной аорте и редко в восходящей аорте.
Тупое травматическое повреждение аорты (ТПА) - это нарушение целостности стенки аорты, которое наиболее часто встречается вследствие резкого замедления из-за лобового или бокового столкновения, как правило, при высокоскоростных дорожно-транспортных происшествиях или падении с большой высоты. После травмы головного мозга, травма грудной аорты является второй наиболее распространенной причиной смерти у пациентов с тупой травмой, ранняя летальность может превышать 80%. При улучшении оказания помощи и быстром обнаружении ТПА выжившие пациенты с большей вероятностью перенесут успешную хирургическую коррекцию.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
1.2.1 Расслоение аорты
Считается, что этиология расслоения аорты связана с основной слабостью в средней оболочке (медии) аорты, усугубленной разрывом внутренней оболочки (интимы), разрывом vasa vasorum (интрамуральной гематомой) или разрывом атеросклеротической бляшки/язвы. Расположение первичного входного разрыва и степень аортального распространения определяют клиническое течение острого расслоения аорты. После первоначального повреждения стенки аорты на уровне интимы/медии распространение может происходить проксимально и/или дистально. Хотя первичный входной разрыв обычно может быть отнесен к сегменту аорты, проксимальное/дистальное распространение и степень поражения аорты определяют классификацию заболевания (будь то Стэнфорд или ДеБейки), клиническое течение и лечение.
Мальперфузия возникает, когда расслоение нарушает приток крови к органу-мишени. Дистальное распространение ложного просвета в нисходящей аорте может вызвать коллапс истинного просвета, что приводит к мальперфузии внутренних органов, почек, позвоночника и/или конечностей. "Синдром мальперфузии" относится к ишемии органов-мишеней: внутренних органов, почек, сосудов нижних конечностей, головного или спинного мозга, проявляющейся клинически распознаваемыми патофизиологическими изменениями (например, ишемия кишечника с сопутствующим лактоацидозом). "Мальперфузия", определяется как просто уменьшение кровотока к артериальному руслу жизненно важного органа путем клинического или инструментального обследования (например, уменьшение/асимметричный пульс конечности).
1.2.2 Травматическое повреждение аорты
Следствием быстрого замедления является воздействие скручивающих и сдвигающих сил на относительно неподвижные отделы аорты, такие, как корень аорты, область рядом с артериальной связкой или диафрагмой. Сочетание сжатия и смещения средостения кпереди, резкий подъем АД и растяжение аорты вдоль позвоночника также может объяснить патогенез ТПА. Соответственно, при ТПА повреждение находится у перешейка аорты в 90% случаев.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
1.3.1 Расслоение аорты
Актуальных данных по эпидемиологии РА мало. По данным Oxford Vascular Study, заболеваемость РА оценивается в 6 случаях на 100 000 человек в год. Заболеваемость выше среди мужчин и увеличивается с возрастом. Прогноз хуже у женщин из-за атипичных проявлений и поздней диагностики. Наиболее распространенным фактором риска, связанным с РА, является АГ, которая наблюдается у 65 - 75% лиц. По данным регистра IRAD, средний возраст больных составляет 63 года, мужчины составляют 65%. Другими факторами риска являются патология аорты или аортального клапана в анамнезе, семейный анамнез заболеваний аорты, перенесенные операции на сердце, курение, тупые травмы грудной клетки и использование наркотических средств. По данным аутопсий, погибших в ДТП, примерно у 20% погибших был разрыв аорты.
1.3.2 Интрамуральная гематома
Исследования показывают, что от 5% до 25% пациентов с предполагаемым ААС имеют ИМГ. При естественном течении ИМГ, менее чем в 10% случаев ИМГ проходит самопроизвольно. От 16% до 47% случаев ИМГ прогрессирует до расслоения аорты, если интима разрывается и образуется сообщение с просветом аорты.
1.3.3 Пенетрирующая атеросклеротическая язва
Истинная частота ПАУ неизвестна, но, по оценкам, составляет от 2% до 7% всех случаев ОАС. Как правило, пациенты с ПАУ старше 70 лет, чем пациенты с классическим расслоением аорты, и у них чаще наблюдается мультифокальный атеросклероз. Сопутствующими заболеваниями являются: гипертония, употребление табака, хроническую обструктивную болезнь легких и почечную недостаточность. ПАУ может возникать у более молодых пациентов, но часто на фоне заболевания соединительной ткани, причем мужчины страдают чаще, чем женщины. Естественное течение ПАУ четко не определено, поскольку они могут оставаться стабильными, увеличиваться или прогрессировать либо до ИМГ, расслоения, псевдоаневризмы, либо разрыва аорты. Риск разрыва достигает 40%. Оптимальная стратегия ведения должна подбираться индивидуально с учетом клинической картины, особенностей визуализации ПАУ и сопутствующих заболеваний пациента.
1.3.4 Травматическое повреждение аорты
ТПА представляет собой редкое травматическое образование, встречающееся у < 1% пациентов с тупой травмой. Пациенты с ТПА часто имеют сопутствующие травмы, такие как переломы ребер, повреждения внутренних органов брюшной полости и сердечные осложнения, которые влияют на решение о лечении. Подобно ТПА, повреждения брюшной аорты классифицируются на основе дефектов контура аорты, и эта классификация может быть использована для обеспечения основы для лечения и определения риска серьезной заболеваемости и смерти от травм. Поскольку ТПА встречается редко, а симптомы разнообразны, лечение пациентов должно осуществляться на индивидуальной основе. В целом, пациентам с повреждениями аорты 1 степени, вероятно, можно назначать антигипертензивную терапию, бета-адреноблокаторы и антитромботические средства, если нет противопоказаний, с повторной компьютерно-томографической ангиографией аорты через 24 - 48 часов. Травмы 2-й степени также можно лечить неоперабельно, но они могут прогрессировать и включать тромбоз или разрыв сосудов конечных органов. При травмах 3-й степени может быть полезно эндоваскулярное лечение, если оно анатомически приемлемо. Травмы 4-й степени чаще сопровождаются рефрактерной гипотензией, что требует быстрый контроль кровотечения, что может быть сделано в отделении неотложной помощи (например, переднебоковая торакотомия с поперечным пережатием аорты) или операционной. Будут ли использоваться открытые или эндоваскулярные средства для восстановления ТПА, будет зависеть от клинического статуса пациента, ресурсов больницы и опыта практикующего врача.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I71.0 - Расслоение аорты (любой части)
I72.1 - Аневризма и расслоение артерии верхней конечности
Примеры оформления диагнозов:
Основной: Расслоение аорты 1(3) типа с формированием аневризмы торакоабдоминального отдела аорты.
Осложнения: Острая почечная недостаточность. Хроническая ишемия нижних конечностей 2Б степени.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1 Расслоение аорты
В соответствии с классификацией DeBakey, различают три типа РА. Тип I (около 50% от всех диссекций) - диссекции, начинающиеся в восходящем отделе аорты и распространяющиеся как минимум на дугу аорты или дистальнее, II тип (35%) - начинаются и ограничиваются восходящим отделом аорты (проксимальнее брахиоцефального ствола), III тип - начинающийся ниже места отхождения левой подключичной артерии и распространяющиеся дистальнее.
Расслоение аорты типа A по Стэнфордской классификации вовлекает восходящую аорту (проксимальнее брахиоцефального ствола) вне зависимости от расположения первичной фенестрации, что также рассматривается как РА тип I/тип II (в зависимости от дистальной протяженности расслоения) по DeBakey.
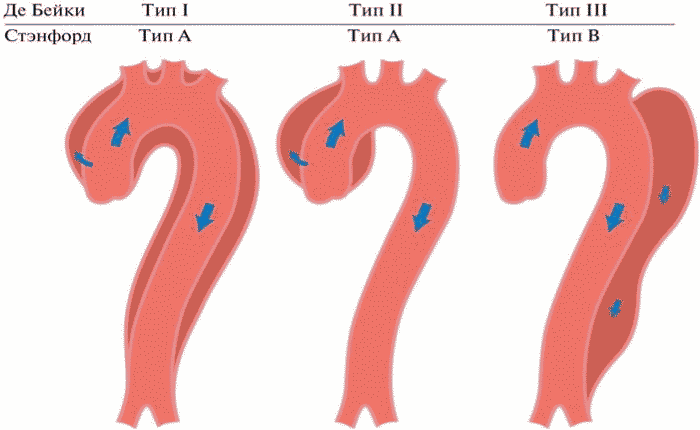
Во временном аспекте различают следующие виды РА: острое РА (< 14 дней), подострое РА (15 - 90 дней) и хроническое РА (> 90 дней).
1.5.2 Интрамуральная гематома
- Интрамуральная гематома типа A
- Интрамуральная гематома типа B
1.5.3 Пенетрирующая атеросклеротическая язва
- Пенетрирующая атеросклеротическая язва с интрамуральной гематомой (с разрывом и без разрыва)
- Изолированная пенетрирующая атеросклеротическая язва
1.5.4 Травматическое повреждение аорты
Классификация ТПА (см. приложение А3):
- Тип I - разрыв интимы,
- Тип II - ИМГ,
- Тип III - псевдоаневризма,
- Тип IV - разрыв.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Боль в грудной клетке является наиболее частым симптомом острого РА. Резко начавшаяся сильная боль в груди и/или в спине является наиболее типичной. Боль может быть острой, разрывающей, похожей на удар ножом и, как правило, отличается от других причин боли в груди, резкость ее начала является наиболее специфической характеристикой. Наиболее частой локализацией боли является грудная клетка (80%), в то время как боль в спине или в животе встречается в 40 и 25% случаев соответственно. Боль в передней части грудной клетки чаще ассоциируется с РА типа A, в то время как у пациентов с расслоением типа B чаще отмечается боль в спине или животе. Клинические проявления двух типов РА часто могут пересекаться.
Дефицит пульса может встречаться у 30% пациентов с РА типа A и 15% при типе B. Тяжелая ишемия нижних конечностей встречается редко. Также может отмечаться разница АД на правой и левой плечевой артериях при распространении расслоения на ветви дуги.
Аортальная недостаточность может сопровождать 40 - 75% случаев РА типа. После острого разрыва аорты недостаточность аортального клапана является второй наиболее распространенной причиной смерти у больных с РА. У пациентов с острой тяжелой аортальной недостаточностью обычно развивается сердечная недостаточность и кардиогенный шок.
Аортальная регургитация при РА является следствием расширения корня аорты и фиброзного кольца аортального клапана, разрыва фиброзного кольца или створок клапана, смещения одной из створок ниже линии закрытия клапана, отсутствия коаптации створок и физического воздействия отслоенной интимы на закрытие аортального клапана. Тампонада сердца наблюдается у 20% пациентов с острым РА типа A и сопровождается удвоением летальности.
Ишемия и инфаркт миокарда могут развиваться у 10 - 15% пациентов с РА и являются следствием расширения ЛП аорты с последующим сдавлением или закрытием устьев коронарных артерий или распространением расслоения на коронарные артерии.
Хроническая сердечная недостаточность в условиях РА обычно связана с аортальной недостаточностью. Чаще выявляемая при РА типа A сердечная недостаточность может также встречаться у пациентов с РА типа B, причиной которой является ишемия миокарда, ранее существовавшая диастолическая дисфункция или неконтролируемая артериальная гипертензия.
Массивный гемоторакс вследствие кровотечения из аорты в средостение и плевральную полость встречается относительно редко, ибо эти пациенты, как правило, не доживают до прибытия в больницу. Небольшой гемоторакс может обнаруживаться у 15 - 20% пациентов с РА, при этом имеется почти равное распределение между РА типа A и B. Считается, что гемоторакс является преимущественно следствием воспалительного процесса.
Легочные осложнения острого РА редки и включают в себя сдавление легочной артерии и формирование аортолегочного свища, что приводит к одышке или одностороннему отеку легких, а также к острому прорыву аорты в легкое с массивным кровохарканьем.
Обморок является важным начальным симптомом РА, возникающим примерно у 15% пациентов с РА типа A и у 5% с типом B. Этот симптом связан с повышенным риском госпитальной смертности, ибо он часто сопровождается опасными для жизни осложнениями такими, как тампонада сердца или расслоение ветвей дуги аорты. Следовательно, у пациентов с подозрением на РА и синкопальными состояниями клиницисты должны активно искать эти осложнения.
Неврологическая симптоматика часто может быть драматичной и доминировать в клинической картине, маскируя основное заболевание. Причиной ее может быть церебральная мальперфузия, гипотония, тромбоэмболия, а также сдавление периферических нервов. Частота развития неврологической симптоматики при РА находится в диапазоне 15 - 40%, и в половине случаев она носит транзиторный характер. Острая параплегия, обусловленная ишемией спинного мозга, вызванной окклюзией спинномозговых артерий, наблюдается нечасто, может быть безболезненной и приводить к ошибочной постановке диагноза синдрома Лериша. Осиплость голоса из-за сдавления левого возвратного гортанного нерва наблюдается редко.
Мезентериальная ишемия возникает у < 5% пациентов с РА типа A. Клинические проявления заболевания бывают разнообразными вследствие того, что боли в животе часто неспецифичны, а отсутствие болевого синдрома встречается в 40% случаев. В результате диагноз, дающий возможность проведения своевременных корректных лечебных мероприятий для спасения жизни пациента, часто устанавливается с запозданием. Госпитальная летальность у пациентов с мезентериальной мальперфузией почти в 3 раза выше, чем у больных без этого осложнения (63% против 24%). Желудочно-кишечное кровотечение является редким, но потенциально смертельным осложнением. Кровотечение может быть ограниченным вследствие инфаркта брыжейки, или массивным, вызванным аорто-пищеводным свищом, или прорывом ЛП в тонкую кишку.
Почечная недостаточность может встречаться в дебюте заболевания либо манифестировать на госпитальном этапе с частотой до 20% при остром РА типа A и примерно у 10% пациентов с РА типа B. Она может быть следствием почечной гипоперфузии или инфаркта почки из-за вовлечения в процесс расслоения почечных артерий, или развиваться из-за длительной гипотонии. Для раннего выявления этого состояния требуется последовательное исследование уровня креатинина в крови и определение объема мочи.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления заболевания или состояния.
Диагноз расслоение аорты предполагают при кардиологическом обследовании, прицельной рентгенографии органов грудной клетки, регистрации электрокардиограммы и подтверждают с помощью компьютерно-томографической ангиографии аорты.
2.1 Жалобы и анамнез
- Всем пациентам с подозрением на РА рекомендуется сбор жалоб и анамнеза для верификации диагноза и выбора оптимальной тактики лечения [1].
(УУР C, УДД 4).
Комментарии. Хотя классическим хрестоматийным описанием ОАС является острая или "рвущая" боль, пациенты чаще сообщают о резком возникновении сильной "острой" или "колющей" боли в груди или спине (а иногда и животе), максимальной в начале, которая иногда иррадиирует. В зависимости от протяженности вовлечения аорты, пациенты могут испытывать различные дополнительные симптомы. Для постановки диагноза очень важен тщательный детализированный сбор жалоб и анамнеза, в том числе семейного (наличие аневризм аорты, генетических аортопатий, РА или случаев внезапной смерти).
Несмотря на то, что во многих случаях заболевания аорты могут не сопровождаться клиническими проявлениями, с различными поражениями аорты потенциально могут быть связаны широкие спектры симптомов:
- острая резкая, ломящая или пульсирующая боль в груди или животе, которая может распространяться на спину, ягодицы, пах или ноги и наводить на мысль о РА или другом ОАС, лучше всего описывается как "ощущение разрыва";
- кашель, одышка, или затрудненное или болезненное глотание при больших АГА;
- постоянная или перемежающаяся боль в животе или дискомфорт, чувство пульсации в животе, или чувство "переполнения" после минимального приема пищи при больших АБА;
- инсульт, транзиторная ишемическая атака, или хромота вследствие атеросклероза аорты;
- осиплость из-за паралича левого гортанного нерва при быстро прогрессирующих поражениях.
Оценка анамнеза должна быть направлена на оптимальное понимание жалоб пациента, выявление персональных факторов риска сердечно-сосудистых заболеваний, а также семейного анамнеза заболеваний артерий, и особенно наличия аневризм и случаев РА, либо внезапной смерти.
2.2 Физикальное обследование
- Рекомендуется физикальное обследование всех пациентов с подозрением на РА для установления диагноза [1, 3, 5].
(УУР C, УДД 4).
Комментарии: В некоторых случаях физикальное обследование может выявить патологическую пульсацию артерий или турбулентный кровоток, перитонеальные симптомы из-за мезентериальной ишемии. Также необходимо сравнивать АД на обеих верхних конечностях, оценивать пульсацию на БЦА, нижних конечностях.
АД должно измеряться на обеих руках и обеих нижних конечностях, чтобы выявить или исключить разницу АД, возникающую в результате ОАС. При аускультации (аускультация при патологии сердца и перикарда) можно услышать характерный для аортального стеноза шум, возможно, указывающий на лежащий в основе ДАК, или аортальную регургитацию, которая часто сопровождает РА типа A.
2.3 Лабораторные диагностические исследования
- Рекомендуется проведение общего (клинического) анализа мочи и общего (клинического) анализа крови, в том числе развернутого с исследованием уровня общего гемоглобина в крови и оценкой гематокрита, исследованием уровня эритроцитов, лейкоцитов, тромбоцитов в крови, исследованием скорости оседания эритроцитов у всех пациентов с РА в рамках первичного обследования при поступлении в стационар, в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде, в процессе динамического амбулаторного наблюдения не менее 1 раза в год [168 - 170].
(УУР C, УДД 5).
- Рекомендуется всем пациентам с РА, поступающим в стационар для оперативного лечения исследование кислотно-основного состояния и газов крови (pH, BE, pCO2, PO2, Lac - анализ капиллярной/артериальной/венозной проб) с целью оценки тяжести гипоксемии и степени выраженности метаболических нарушений, выполнение коагулограммы (ориентировочное исследование системы гемостаза) (активированное частичное тромбопластиновое время, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение концентрации Д-димера в крови, исследование уровня фибриногена в крови, определение активности антитромбина III в крови), определение международного нормализованного отношения (МНО) для прогноза риска периоперационных кровотечений и величины кровопотери, определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител, определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови для исключения ассоциации с ВИЧ-инфекцией, гепатитом, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде [168 - 170].
(УУР C, УДД 5).
- Рекомендуется проведение анализа крови биохимического общетерапевтического (исследование уровня калия, натрия, глюкозы, креатинина, общего белка, мочевины, общего билирубина в крови, определение активности аспартатаминотрансферазы и аланинаминотрансферазы в крови, исследование уровня свободного трийодтиронина (СТ3) в крови, исследование уровня свободного тироксина (СТ4) сыворотки крови и тиреотропного гормона (ТТГ) в крови, исследование уровня C-реактивного белка в сыворотке крови, исследование уровня прокальцитонина в крови для оценки почечной и печеночной функции, исключения воспаления. Биохимическая экспертиза (исследование) крови на миоглобин для оценки реперфузионного повреждения, рабдомиолиза. Исследование уровня тропонинов I, T в крови для дифференциальной диагностики с инфарктом миокарда. Определение соотношения белковых фракций методом электрофореза. Исследование уровня холестерина крови, исследование уровня холестерина липопротеидов низкой плотности (ХсЛНП) и исследование уровня триглицеридов в крови (ТГ), с целью выявления фактора риска сопутствующего атеросклероза и, при необходимости, коррекции терапии, у всех пациентов с РА в рамках первичного обследования, при поступлении в стационар, не менее 1 раз в год на контрольном визите при динамическом амбулаторном наблюдении, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде [168 - 170].
(УУР C, УДД 5).
2.4 Инструментальные диагностические исследования
- Пациентам с РА рекомендуется регистрация электрокардиограммы (ЭКГ) в покое, расшифровка, описание и интерпретация электрокардиографических данных (12-канальной ЭКГ) для оценки сердечного ритма, выявления изменений комплекса QRS, нарушений сердечного ритма и проводимости, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде [34].
(УУР C, УДД 4).
- Пациентам с подозрением на расслоение аорты рекомендуется проведение эхокардиографии для предварительного визуализирующего исследования [2 - 3].
(УУР C, УДД 5).
Комментарии: для обнаружения острой ИМГ аорты трансторакальной эхокардиографии недостаточно из-за ее низкой чувствительности. Пограничным пределом для ИМГ является значение 5 мм, чувствительность трансторакальной эхокардиографии для ее обнаружения составляет менее 40%. Следовательно, трансторакальноая эхокардиография не может быть использована в качестве единственного метода визуализации у пациентов с подозрением на ОАС. Компьютерно-томографическая ангиография аорты и магнитно-резонансная ангиография с контрастированием являются ведущими методами для диагностики и классификации интрамуральной гематомы. При оценке состояния аорты по компьютерно-томографической ангиографии аорты, определяющее значение для диагностики ИМГ имеют изображения без контрастного усиления. Высокоплотное серповидное утолщение аорты, распространяющееся в продольной, неспиралевидной плоскости, является отличительной чертой данной патологии. В отличие от РА, просвет аорты редко сужается при наличии ИМГ, а после введения контрастного средства не визуализируются фрагменты интимы, не усиливается контрастирование стенки аорты. Использование компьютерно-томографической ангиографии аорты с комбинацией нативных изображений и изображений с контрастным усилением при диагностике ИМГ обеспечивает чувствительность до 96%. Иногда при компьютерно-томографической ангиографии аорты бывает трудно дифференцировать ИМГ от атеросклеротического утолщения аорты, тромботических масс или тромбированного расслоения. При этих обстоятельствах ценным методом, разрешающим эти проблемы, может стать магнитно-резонансная ангиография с контрастированием, с помощью которой также возможно определение сроков развития гематомы на основе сигнальных характеристик различных продуктов распада гемоглобина. При острой ИМГ типов A и B необходимо тщательно анализировать изображения и попытаться локализовать первичную фенестрацию, которая очень часто присутствует и, следовательно, может помочь в выборе метода лечения, особенно при обсуждении возможности TEVAR.
При нативной компьютерно-томографической ангиографии аорты ПАЯ напоминает ИМ. Компьютерно-томографическая ангиография аорты, в том числе с использованием аксиальных и многоплоскостных преобразований, является методом выбора для диагностики ПАЯ. Характерным признаком является локализованное изъязвление, проникающее через интиму аорты в стенку в средней и дистальной трети нисходящей грудной аорты. Локальное утолщение или выраженное снижение интенсивности сигнала от прилежащей соседней стенки аорты предполагает наличие ассоциированной ИМГ. В данном аспекте потенциальным недостатком магнитно-резонансной ангиографии с контрастированием является его неспособность выявить смещение кальцинатов интимы, что часто сопровождает ПАЯ.
- Рекомендуется выполнение прицельной рентгенографии органов грудной клетки пациентам с подозрением РА для дифференциальной диагностики [168].
(УУР C, УДД 5).
В случае изначально отрицательного результата инструментального исследования у пациентов с сохраняющимся подозрением на ОАС рекомендуется проведение повторной компьютерно-томографической ангиографии аорты для уменьшения возможных осложнений через 6 месяцев [168].
- У пациентов с подозрением на РА для первоначальной диагностической визуализации рекомендуется проведение компьютерно-томографической ангиографии аорты, компьютерно-томографической ангиографии брахиоцефальных артерий, компьютерно-томографической ангиографии сосудов нижних конечностей для верификации диагноза [2 - 6].
(УУР C, УДД 5).
Комментарии: При панаортографии диагноз РА основывается на "прямых" ангиографических признаках, таких, как визуализация фрагмента интимы (негативное, часто мобильное линейное изображение) или выявление двух отдельных просветов в аорте. "Косвенные" признаки включают неровности контура аорты, жесткость или сдавление, аномалии ветвей аорты, утолщение стенки аорты и аортальную недостаточность. Панаортография больше не используется для диагностики РА, за исключением коронарографии или эндоваскулярного вмешательства.
- Для начальной диагностической визуализации у пациентов с подозрением на ОАС в качестве альтернативного исследования с учетом рисков рекомендуется выполнить чреспищеводную эхокардиографию и магнитно-резонансную ангиографию с контрастированием [2 - 7].
(УУР C, УДД 5).
Комментарии: Хотя чувствительность и специфичность компьютерно-томографической ангиографии аорты, магнитно-резонансной ангиографии с контрастированием и чреспищеводной эхокардиографии являются вполне высокими, именно компьютерно-томографическая ангиография аорты стала предпочтительным методом оценки большинства пациентов с подозрением на ОАС. "Золотым стандартом" является МСКТ-панаортография с ЭКГ-синхронизацией, с захватом в область сканирования брахиоцефальных и общих бедренных артерий.
(УУР C, УДД 5).
- Пациентам с РА типа B и консервативном лечении рекомендуется выполнение повторных визуализирующих исследований (компьютерно-томографической ангиографии аорты или магнитно-резонансной ангиографии с контрастированием) в течение 24 - 48 часов после первого исследования для уменьшения возможных осложнений [171, 173].
(УУР C, УДД 5).
- Пациентам с подозрением на ТПА рекомендуется выполнение компьютерно-томографической ангиографии аорты для определения дальнейшей хирургической тактики [117].
(УУР C, УДД 4).
- Пациентам с подозрением на ТПА в случае недоступности компьютерно-томографической ангиографии аорты рекомендуется выполнить чреспищеводную эхокардиографию для дифференциальной диагностики ТПА [118 - 119].
(УУР C, УДД 2).
- Рекомендуется выполнение ультразвукового исследования органов брюшной полости (комплексное) пациентам с РА с целью получения информации о сопутствующей патологии, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде [168].
(УУР C, УДД 5).
- Рекомендуется выполнение инвазивной коронарографии у пациентов с РА при планировании хирургического вмешательства для выявления гемодинамически значимых стенозов коронарных артерий, врожденных аномалий коронарных артерий, а также для уточнения анатомических характеристик коронарных артерий перед хирургическим вмешательством [63].
(УУР C, УДД 4).
2.5 Иные диагностические исследования
Нет.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
3.1.1 Медикаментозная терапия в острой стадии расслоения
- У всех пациентов с ОАС рекомендуется проведение медикаментозной терапии, включающей обезболивание (внутривенное введение морфина** (группа N 02AA - природные алкалоиды опия; син.: наркотические анальгетики)) и стабилизацию АД для проведения антиимпульсной терапии (внутривенное введение бета-адреноблокатора (преимущественно метопролола**)) [172, 173].
(УУР C, УДД 5).
Комментарии: Помимо обезболивания, морфин** способствует уменьшению страха, возбуждения, снижает симпатическую активность, увеличивает тонус блуждающего нерва, уменьшает работу дыхания, вызывает расширение периферических артерий и вен (последнее особенно важно при отеке легких). Доза, необходимая для адекватного обезболивания, зависит от индивидуальной чувствительности, возраста, размеров тела. Перед использованием 10 мг морфина** разводят как минимум в 10 мл 0,9% раствора натрия хлорида** (группа B05BB - растворы, влияющие на водно-электролитный баланс). Первоначально следует ввести в/в медленно 2 - 4 мг лекарственного вещества. При необходимости введение повторяют каждые 5 - 15 мин по 2 - 4 мг до купирования боли или возникновения побочных эффектов, не позволяющих увеличить дозу.
При использовании морфина** возможны следующие осложнения:
- выраженная артериальная гипотензия; устраняется в горизонтальном положении в сочетании с поднятием ног (если нет отека легких). Если этого недостаточно, в/в капельно вводится 0,9% раствор натрия хлорида**. В редких случаях - адрено- и допаминстимуляторы (группа C01CA - адренергические и дофаминергические средства);
- выраженная брадикардия в сочетании с артериальной гипотензией; устраняется атропином** (в/в 0,5 - 1,0 мг);
- тошнота, рвота; устраняются производными фенотиазина, в частности, метоклопрамидом** (в/в однократно 10 мг);
- выраженное угнетение дыхания; устраняется налоксоном** (в/в 0,1 - 0,2 мг, при необходимости повторно каждые 15 мин), при этом уменьшается и анальгезирующее действие препарата.
Опиаты могут ослаблять перистальтику кишечника и приводить к запорам. Препараты этой группы снижают тонус мочевого пузыря и затрудняют мочевыведение, особенно у мужчин с гипертрофией предстательной железы.
Метопролол необходимо вводить в/в медленно под контролем ЭКГ и АД по 5 мг каждые 2 мин. до максимальной дозы 15 мг; при хорошей переносимости через 15 мин. после последнего в/в введения прием внутрь до 50 мг каждые 6 ч. в течение 48 ч.
- Пациентам при неосложненном РА типа B всегда должно рекомендоваться проведение медикаментозной терапии (обезболивающая и антиимпульсная терапия) для уменьшения возможных осложнений [3].
(УУР C, УДД 4).
Комментарии: Схема лекарственной терапии описана в первой рекомендации раздела 3.1.1.
- У пациентов, поступающих в стационар с ОАС, в качестве начальных лечебных мероприятий, направленных на снижение нагрузки на стенку аорты, рекомендуется в первые часы поступления в отделение интенсивной терапии назначение антиимпульсной терапии и измерение артериального давления на периферических артериях при помощи артериального катетера для снижения прогрессирования ОАС [2 - 6].
(УУР C, УДД 4).
Комментарии: Схема лекарственной терапии описана в первой рекомендации раздела 3.1.1.
- У пациентов с ОАС рекомендуется в начальное лечение включать внутривенное введение бета-адреноблокаторов (за исключением тех пациентов, кому они противопоказаны), чтобы снизить ЧСС и САД (целевые значения САД 100 - 120 мм рт.ст., целевые значения ЧСС менее 60 уд./мин) [172].
(УУР C, УДД 5).
Комментарии: Схема лекарственной терапии описана в первой рекомендации раздела 3.1.1.
- У пациентов с противопоказаниями к применению бета-адреноблокаторов или их непереносимостью, рекомендуется начать лечение с внутривенного введения блокаторов кальциевых каналов (верапамил** (при наличии АГ может быть использован дилтиазем)) для достижения контроля над частотой сердечных сокращений [172].
(УУР C, УДД 5).
Комментарии: Верапамил**, дилтиазем (группа C08DA - производные фенилалкиламина) или амлодипин** (группа C08CA - производные дигидропиридина) могут применяться при невозможности контролировать АГ другими средствами. Дилтиазем или верапамил** могут быть рассмотрены для контроля сердечного ритма при невозможности использовать бета-адреноблокаторы, реже - для купирования суправентрикулярных тахиаритмий. У пациентов с сохраняющейся ишемией миокарда при недостаточной эффективности бета-адреноблокаторов, противопоказаниях к бета-адреноблокаторам или их неприемлемых осложнениях можно рассмотреть добавление длительно действующих дигидропиридиновых производных. Совместный прием верапамила** и дилтиазема с бета-адреноблокаторами в целом нежелателен из-за суммирования рисков побочных эффектов.
- Если у пациентов с ОАС после начала внутривенной терапии бета-адреноблокаторами сохраняется неудовлетворительный контроль АД, рекомендуется к начальному лечению добавить внутривенное введение периферических вазодилататоров (нитроглицерина**) для нормализации АД [173].
(УУР C, УДД 5).
Комментарии: Нитроглицерин: внутривенная инфузия 5 - 166 мкг/мин; обычно сначала инфузия 10 - 20 мкг/мин с возможным увеличением на 5 - 10 мкг/мин каждые 5 - 10 мин до уменьшения симптомов и/или снижения систолического АД на 10 - 15% при исходно нормальном АД и на 25 - 30% при АГ (но не ниже 95 мм рт. ст.).
Критерий адекватно подобранной скорости введения (дозы) при в/в инфузии нитратов - уровень систолического АД, который должен быть снижен на 10 - 15% у нормотоников и на 25 - 30% - у лиц с АГ, но не ниже 100 мм рт. ст. Обычная начальная скорость введения нитроглицерина** 10 мкг/мин. При ее неэффективности скорость инфузии увеличивается на 10 - 15 мкг/мин каждые 5 - 10 мин, пока не будет достигнут желаемый эффект. Если достичь целевого уровня снижения АД не удается, даже увеличив скорость инфузии нитроглицерина до 166 мкг/мин, то дальнейшее увеличение дозы не имеет смысла. Оптимальная продолжительность инфузии нитратов - не более 24 - 48 ч, т.к. в дальнейшем часто развивается толерантность. При развитии гипотонии обычно достаточно прекратить инфузию нитроглицерина**, так как у препарата короткий период полувыведения. Реже приходится проводить стандартные мероприятия по увеличению притока крови к сердцу (приподнять нижние конечности; возможно в/в введение 0,9% раствора натрия хлорида**, применение адрено- и допамин-стимуляторов). Органические нитраты не рекомендуются при артериальной гипотонии, ИМ правого желудочка, а также после приема силденафила или варденафила в предыдущие 24 ч, тадалафила - в предыдущие 48 ч из-за высокого риска осложнений. При появлении головной боли могут использоваться анальгетики и кофеинсодержащие препараты.
- При наличии гипотензии у пациентов с ОАС рекомендуется проводить восполнение обьема циркулирующей крови до достижения САД = 90 мм рт.ст. для уменьшения риска неврологических осложнений и летального исхода [172].
(УУР C, УДД 5).
Комментарии: У пациентов с ОАС и политравмой важное значение имеет междисциплинарный подход для правильного установления сроков вмешательств и приоритетов лечения. Следует избегать агрессивного введения жидкости, поскольку это может усугубить кровотечение, коагулопатию и гипертензию, для снижения риска разрыва аорты среднее АД не должно превышать 90 мм. рт.ст.
- Для улучшения контроля гемодинамики у пациентов с ОАС рекомендуется проводить адекватное обезболивание по мере необходимости [5].
(УУР C, УДД 5).
Комментарии: Схема лекарственной терапии описана в первой рекомендации раздела 3.1.1.
- Оптимальная медикаментозная терапия рекомендуется для снижения риска возможных осложнений (разрыв аорты, мальперфузия внутренних органов, острое нарушение мозгового кровообращения, критическая ишемия нижних конечностей, острая почечная недостаточность, острый инфаркт миокарда) пациентам с неосложненным РА типа B и ретроградным расслоением от разрыва на уровне или дистальнее ЛПклА при условии, что ретроградное расслоение ограничено дугой аорты [30].
(УУР C, УДД 4).
Комментарии: Схема лекарственной терапии описана в первой рекомендации раздела 3.1.1.
- У пациентов при гемоперикарде вследствие ОРА типа A и неминуемой остановкой сердца, может быть рекомендован перикардиоцентез в первый час после выявления для купирования тампонады и восстановления достаточной перфузии органов [36].
(УУР C, УДД 4).
3.1.2 Медикаментозная терапия в отдаленные сроки
- Пациентам с РА рекомендуется пожизненное лечение бета-адреноблокаторами (если нет противопоказаний) для обеспечения контроля частоты сердечных сокращений и АД с целью уменьшения вероятности развития долгосрочных нежелательных явлений, связанных с поражением аорты [173].
(УУР C, УДД 5).
3.1.3 Интрамуральная гематома
- У пациентов с неосложненной острой ИМГ типа B в качестве начальной стратегии лечения рекомендуется консервативная терапия для уменьшения риска прогрессирования заболевания [9, 158, 73, 162].
(УУР C, УДД 4).
3.1.4 Травматическое повреждение аорты
- У пациентов с ТПА типа 1 рекомендовано консервативное лечение с динамическим наблюдением и обследованием для улучшения отдаленной выживаемости [114, 121].
(УУР C, УДД 5).
Комментарии: Консервативное лечение включает в себя обезболивание и антиимпульсную терапию с/без введением периферических вазодиллататоров (см. раздел 3.1.1). Динамическое наблюдение и обследование: повторная компьютерно-томографическая ангиография аорты в течение 24 - 48 часов после первоначального сканирования, исследование уровня общего гемоглобина в крови, анализ крови биохимический общетерапевтический, определение объема мочи.
- Пациентам с ТПА типа 2 без высокого аортального риска может быть рекомендовано консервативное лечение с динамическим наблюдением и обследованием для профилактики последующих осложнений [122, 123].
(УУР C, УДД 4).
Комментарии: Режим динамического наблюдения и консервативного лечения см. предыдущей рекомендации.
- У пациентов с ТПА 1 - 2 степени без нарушения перфузии рекомендуется гипотензивная терапия (см. раздел 3.1.1), если она клинически переносима, и повторная компьютерно-томографическая ангиография аорты в течение 24 - 48 часов после первоначального сканирования, чтобы снизить риск прогрессирования травмы [166].
(УУР C, УДД 4).
3.2 Хирургическое лечение
3.2.1 Острое расслоение аорты типа A (см. приложение Б):
- Пациентам с ОАС, требующим срочного оперативного вмешательства (в течение 24 часов с момента установления диагноза), рекомендуется принимать решение "Мультидисциплинарной аортальной командой" для выбора метода и тактики лечения [37 - 40].
(УУР C, УДД 4).
Комментарии: Пациенты с РАА, для лечения которых могут быть применены как хирургические так и эндоваскулярные методы лечения, а также пациенты с сопутствующей коморбидной патологией должны быть направлены в экспертные Центры, выполняющим не менее 30 - 40 операций в год. Мультидисциплинарная аортальная команда может включать в себя кардиолога, сердечно-сосудистого хирурга, анестезиолога, реаниматолога.
- Пациентам с ОРА типа A рекомендовано в короткий срок решение вопроса о хирургическом вмешательстве для снижения риска возможных осложнении летальности [37 - 40].
(УУР C, УДД 4).
Комментарии: Хирургическая сортировка основана на клинических результатах и данных компьютерно-томографической ангиографии аорты и/или трансторакальной эхокардиографии во время которых ориентируются на:
1) Выявление РА или ИМГ,
2) Расположение первичной фенестрации,
3) Распространение ложного просвета проксимально и дистально,
4) Радиологические признаки мальперфузии или разрыва.
Клинические признаки сопоставляют с данными инструментальных исследований для верификации осложнений ОРА типа A, таких как тампонада, аортальная регургитация, синдром мальперфузии или шок. Традиционная стратегия лечения ОРА типа A с синдромом мальперфузии подразумевает вмешательство на грудной аорте в течение 24 часов с целью восстановить истинный просвет и нормализовать кровоток по истинному просвету ветвей аорты, а периферическая реваскуляризация откладывается на следующий этап на случай сохранения ишемии конечных органов (через 3 месяца и не позднее 1 года). Альтернативная стратегия у стабильных пациентов с ОРА типа A и синдромом мальперфузии предполагает обратный порядок действий и заключается в поэтапной эндоваскулярной или хирургической реваскуляризацией с последующим хирургическим вмешательством на грудной аорте [60 - 65]. Данный подход направлен на устранение синдрома мальперфузии, снижение оперативного риска при последующем хирургическом вмешательстве на грудной аорте и улучшение общей выживаемости. Тем не менее, эта стратегия имеет риск разрыва аорты, потому что восстановление проксимальной аорты вынужденно отложено, поэтому важное значение имеет индивидуальный подход. Гибридные стратегии позволяют проводить лечение висцеральной мальперфузии и замену проксимальной аорты одновременно [70].
- У пациентов с ОРА типа A и церебральной мальперфузией рекомендуется хирургическое лечение для улучшения отдаленной выживаемости [50 - 56].
(УУР C, УДД 4).
- Консервативное ведение может быть рекомендовано пациентам с катетер-индуцированном ОРА типа A, если оно не распространяется за пределы корня аорты, с целью уменьшения вероятности развития долгосрочных нежелательных явлений [57 - 59].
(УУР C, УДД 4).
Комментарии. Ятрогенное расслоение аорты (ЯРА) может произойти в условиях эндоваскулярных вмешательств на коронарных артериях, операций на сердце, а также в результате эндоваскулярного лечения коарктации аорты [132, 133], эндопротезирования аорты [134], периферических вмешательств, баллонной внутриаортальной контрпульсации и транскатетерной эндоваскулярной имплантации аортального клапана [135]. ЯРА является редким осложнением, встречающимся менее чем в 4 случаях на 10 000 коронарографий и менее чем в 2 на 1000 чрескожных коронарных вмешательств [135 - 139]. Как правило, ЯРА легко выявляется в ходе коронарографии и характеризуется застоем контрастного средства на уровне корня аорты или в восходящей аорте.
Ведение пациентов с катетер-индуцированным ЯРА не стандартизовано. Часто применяется консервативный подход, особенно при катетер-индуцированном расслоении брюшной аорты или подвздошных артерий, а также в тех случаях, когда расслоение располагается на уровне створок АК. Несмотря на то, что ЯРА устья правой коронарной артерии может вызвать нарушения кровотока в этой артерии и потребовать неотложного ЧКВ, исход доброкачественный в случаях быстрого выявления осложнения и отказа от дальнейшего введения контрастного средства. Ведение пациентов консервативное, в большинстве случаев с полным спонтанным излечением. Разрывы аорты чрезвычайно редки, но в отдельных сообщениях об обширных вторичных расслоениях типа A требуется тщательное наблюдение за этими пациентами.
Расслоение, распространяющееся на несколько сантиметров в восходящую аорту или далее, вероятно, потребует экстренной хирургической операции.
- У ряда пациентов с ретроградным ОРА типа A рекомендуется рассмотреть выполнение изолированного эндопротезирования нисходящей аорты (TEVAR) с целью уменьшения вероятности развития осложнений [60 - 61].
(УУР C, УДД 4).
- У пациентов с ОРА типа A, осложнившимся мезентериальной мальперфузией, рекомендуется отложить хирургическое вмешательство на грудной аорте для определения совместимости с жизнью ишемических изменений в висцеральных органах [60 - 65].
(УУР C, УДД 4).
- У пациентов с ОРА типа A, осложнившимся мезентериальной мальперфузией, рекомендуется рассмотреть возможность выполнения эндопротезирования нисходящей аорты с фенестрацией стент-графта и стентированием ветвей брюшной аорты для уменьшения вероятности развития нежелательных осложнений со стороны ЖКТ [63, 66].
(УУР C, УДД 4).
- Перед хирургическим вмешательством на грудной аорте у пациентов с ОРА типа A рекомендуется рассмотреть возможность восстановления кровотока в ишемизированной конечности до вмешательства на проксимальной аорте при стабильном состоянии больного или принять меры к сохранению кровотока (перфузия конечности во время ИК, фенестрация, стентирование и т.д.) во время вмешательства по жизненным показаниям (тампонада, острая аортальная недостаточность и т.д.) для снижения риска развития острой ишемии конечности и последующих осложнений [67 - 69].
(УУР C, УДД 4).
- Пациентам с ОРА типа A с частично расслоенным корнем без значимой патологии аортального клапана, рекомендуется пластика аортального клапана в условиях искусственного кровообращения (ресуспензия клапана) нежели замена клапана для улучшения отдаленной выживаемости [75 - 79].
(УУР B, УДД 2).
- Пациентам с ОРА типа A со значительным вовлечением корня в расслоение, аневризмой корня или при аортальной дисплазии рекомендована замена корня с целью уменьшения вероятности летального исхода [80 - 83].
(УУР C, УДД 4).
- У стабильных пациентов с ОРА типа A рекомендуется рассмотреть реконструкцию восходящего отдела аорты с сохранением аортального клапана при выполнении опытными хирургами в мультидисциплинарной аортальной команде для улучшения отдаленной выживаемости [84 - 85].
(УУР B, УДД 2).
- При протезировании восходящей аорты пациентам с ОРА типа A рекомендовано наложение "открытого" дистального анастомоза для улучшения отдаленных результатов (выживаемость, тромбоз ложного просвета) [86 - 89].
(УУР C, УДД 4).
- Пациентам с ОРА типа A без разрывов интимы в дуге и без значимого расширения аорты рекомендуется отдать предпочтение частичной замене дуги вместо полной для улучшения отдаленных результатов [90 - 92].
(УУР B, УДД 2).
- При распространении расслоения в нисходящую аорту у пациентов с ОРА типа A, рекомендуется рассмотреть возможность расширенной резекции аорты с протезированием с антеградным эндопротезированием проксимальной части НГА для снижения мальперфузии и уменьшения риска поздних осложнений со стороны дистальных отделов аорты [93 - 94].
(УУР C, УДД 4).
3.2.1.1 Стратегии перфузии и канюляции при ОРА типа A
- Пациентам с ОРА типа A, подвергающимся хирургическому вмешательству, при наличии возможности, рекомендуется аксиллярная канюляция, чем бедренная, с целью снижения риска церебральных осложнений или ретроградной мальперфузии [101 - 102].
(УУР B, УДД 2).
- Пациентам с ОРА типа A, подвергающимся хирургическому вмешательству, которым требуется циркуляторный арест, рекомендуется проведение чрескожного мониторинга парциального давления кислорода головного мозга для улучшения неврологических результатов [103 - 105].
(УУР C, УДД 4).
- Пациентам с ОРА типа A, альтернативой аксиллярной или бедренной канюляции может быть рекомендована канюляция истинного просвета аорты или БЦС для поддержания принципа максимальной безопасности [106 - 111].
(УУР C, УДД 4).
Комментарии: Стратегия канюляции должна исходить из принципа максимальной безопасности при учете варианта расслоения. Могут применяться различные комбинации методов.
3.2.2 Острое расслоение типа B (осложненное) (см. приложение Б):
- TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) рекомендуется пациентам при осложненных сверхострых, острых или подострых состояниях с разрывом и/или мальперфузией и благоприятной анатомией для TEVAR, для уменьшения возникших осложнений [6].
(УУР C, УДД 5).
- Рекомендуется открытое хирургическое реконструктивное вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) при осложненных сверхострых, острых или подострых РА для пациентов, у которых анатомия не подходит для TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) для устранения возникших осложнений [10, 11].
(УУР B, УДД 2).
- Фенестрация (транслюминальная баллонная ангиопластика аорты) может быть рекомендована пациентам с осложненным сверхострым, острым или подострым РА для уменьшения последствий возникших осложнений [4 - 8].
(УУР C, УДД 4).
3.2.3 Острое расслоение типа B (неосложненное) (см. приложение Б):
- У пациентов с острым неосложненным РА типа B и признаками высокого риска рекомендуется рассмотреть возможность лечения (от 24 часов до 90 дней) с помощью TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [18 - 21].
(УУР C, УДД 4).
Комментарии: Естественное течение РА типа B часто неосложненное, поэтому в отсутствие мальперфузии или ранних признаков прогрессирования заболевания состояние пациента можно стабилизировать путем изолированной медикаментозной терапии, контролируя болевой синдром и АД.
- Рекомендуется профилактическое TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) для уменьшения поздних нежелательных явлений, связанных с аортой и смерти у пациентов с неосложненным РА типа B [5 - 6].
(УУР C, УДД 5).
3.2.4 Хроническое расслоение типа B (см. приложение Б):
- Рекомендуется открытое хирургическое вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) для пациентов с хроническим РА типа B, при отсутствии противопоказаний со стороны сопутствующих заболеваний для устранения возникших осложнений [8 - 10].
(УУР B, УДД 2).
Комментарии: Пациенты с хроническим РА типа B, осложненным прогрессивным расширением грудной аорты (> 10 мм/год), ЛП аневризмы (с общим диаметром аорты > 60 мм), синдромом мальперфузии или рецидивирующим болевым синдромом, требуют проведения TEVAR или открытого хирургического лечения (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой). Оптимальное лечение у пациентов с хроническим РА остается неясным. Отсутствуют рандомизированные сравнения TEVAR и обычного хирургического лечения (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой). Эндоваскулярное вмешательство на грудной аорте может быть использовано для изоляции аневризмы, которая обычно расположена в дистальном отделе дуги аорты, и предотвращения ее разрыва, однако ожидать ремоделирования аорты нельзя из-за утолщенной, неподвижной интимы. В небольших сериях случаев было показано, что TEVAR возможна у пациентов с аневризмой нисходящей грудной аорты, вторичной по отношению к хроническому РА, с приемлемыми среднесрочными результатами. Полное ремоделирование аорты наблюдалось только у 36% пациентов после TEVAR. Хирургия нисходящей аорты сопряжена с высоким операционным риском. Распространяющееся в последнее время открытое протезирование дуги аорты с антеградным стентированием нисходящей грудной аорты ("замороженный хобот слона") может стать оптимальной альтернативой для выбранных пациентов.
- TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) рекомендуется для пациентов с хроническим РА типа B с подходящей анатомией (адекватная зона имплантации, отсутствие аневризмы восходящего отдела аорты или дуги аорты) и высокими риском осложнений при выполнении открытого реконструктивного хирургического вмешательства (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) из-за сопутствующих заболеваний для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [12 - 13].
(УУР C, УДД 4).
- Изолированное TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) в качестве единственной терапии не рекомендуется пациентам с хроническим РА типа B, у которых аневризма брюшной аорты большого размера, недостаточная дистальная зона имплантации и/или дистальные фенестрации большого размера с целью снижения ранних нежелательных явлений [14 - 17].
(УУР C, УДД 4).
- Для пациентов с заболеваниями соединительной ткани и РА типа B, у которых, несмотря на оптимальную консервативную терапию, наблюдается прогрессирование заболевания, рекомендуется открытое хирургическое вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) для улучшения отдаленной выживаемости [171].
(УУР C, УДД 5).
- TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) рекомендуется для пациентов с заболеваниями соединительной ткани с острым осложненным РА типа B и анатомией, благоприятной для TEVAR в качестве моста к отсроченному открытому реконструктивному хирургическому вмешательству (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) для улучшения отдаленной выживаемости [171].
(УУР C, УДД 5).
- Для снижения риска ишемического повреждения спинного мозга у пациентов с РА при использовании TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом), препятствующего антеградному кровотоку ЛПклА, рекомендуется предварительная реваскуляризация ЛПклА (сонно-подключичное шунтирование, стентирование подключичной артерии) [171].
(УУР C, УДД 5).
- Рекомендуется установить дренаж спиномозговой жидкости (люмбальный дренаж наружный) у пациентов с РА типа B, которым выполняется TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом), для снижения риска развития ишемии спинного мозга (длина стент-графта (стент-графт аортальный эндоваскулярный универсальный) более 20 см, установка стент-графта (стент-графт аортальный эндоваскулярный универсальный) в пределах 2 см от устья чревного ствола или другие факторы риска) [171].
(УУР C, УДД 5).
- Рекомендуется установить дренаж спинномозговой жидкости (люмбальный дренаж наружный) в течение 3 суток у пациентов с расслоением типа B, у которых развиваются симптомы парапареза/параплегии для улучшения перфузии спинного мозга [171].
(УУР C, УДД 5).
3.2.5 Интрамуральная гематома
- У пациентов с осложненной острой ИМГ аорты типа A или B рекомендуется срочное оперативное вмешательство (в течение 24 часов) для снижения вероятности летального исхода [9, 158, 73].
(УУР C, УДД 4).
Комментарии: Признаки осложненной ИМГ: мальперфузия, периаортальная гематома, перикардиальный выпот с тампонадой сердца, персистирующий, рефрактерный или рецидивирующий болевой синдром, разрыв.
- У пациентов с неосложненной острой ИМГ типа A рекомендуется немедленное проведение открытого оперативного вмешательства в сроки до 3 суток (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием) для снижения вероятности развития нежелательных осложнений [9, 159 - 161].
(УУР B, УДД 3).
- Экстренное хирургическое вмешательство рекомендовано пациентам с ИМГ типа A при наличии факторов риска (диаметр аорты более 50 мм, толщина гематомы более 11 мм, гемоперикард, аортальная регургитация, изъязвление стенки аорты) для снижения вероятности летального исхода [43 - 44].
(УУР C, УДД 4).
Комментарии: Экстренное хирургическое лечение показано в осложненных случаях при наличии выпота в перикард, периаортальной гематомы или большой аневризмы, а неотложная операция (< 24 ч после установления диагноза) требуется при большинстве ИМГ типа A. У пожилых пациентов с наличием серьезных сопутствующих заболеваний, разумным вариантом может быть начальное консервативное лечение "ожидать и наблюдать" (оптимальная медикаментозная терапия с контролем АД, болевого синдрома и повторными визуализирующими исследованиями), особенно при отсутствии дилатации аорты (< 50 мм) и толщины ИМГ < 11 мм.
- Выжидательная тактика рекомендована для пациентов с ИМГ типа A и значимой коморбидной патологией в отсутствие факторов риска со стороны аорты для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [45 - 49].
(УУР C, УДД 4).
- У пациентов с ИМГ типа B, нуждающихся в хирургическом лечении дистального отдела дуги аорты или нисходящей части грудной аорты (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) и имеющих подходящую анатомию, использование TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) рекомендуется в том случае, если ее выполняют врачи-хирурги, у которых есть практический опыт в эндоваскулярной хирургии для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [158, 163].
(УУР B, УДД 2).
Комментарии: Первичным подходом при ИМГ типа B является медикаментозная терапия. Показания к эндоваскулярному лечению или открытой операции такие же, как при РА типа B. Подгруппа пациентов с расширением аорты или ULP должна тщательно оцениваться, и при сохраняющейся или рецидивирующей симптоматике, либо при прогрессивном расширении аорты, показано хирургическое лечение. Показаниями для вмешательства в острой фазе являются расширение ИМГ, несмотря на медикаментозное лечение и разрыв интимы, по данным компьютерно-томографической ангиографии аорты, при этом TEVAR более предпочтительно, чем открытая операция.
- У пациентов с ИМГ типа B, нуждающихся в хирургическом лечении дистального отдела дуги аорты или нисходящей части грудной аорты и имеющих неблагоприятные для эндоваскулярной хирургии анатомические особенности, рекомендуется проведение открытой хирургической операции (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием) для улучшения отдаленных результатов [73, 158].
(УУР C, УДД 4).
- У пациентов с неосложненной ИМГ типа B, имеющих признаки высокого риска по данным визуализации, рекомендуется проведение TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [162, 165].
(УУР C, УДД 2).
3.2.6 Пенетрирующая атеросклеротическая язва
- Пациентам с ПАЯ с надрывом аорты или с ПАЯ восходящей аорты с ИМГ, рекомендовано в короткий срок (до 3 суток после установления диагноза) решение вопроса о хирургическом вмешательстве (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, эндопротезирование аорты) для уменьшения вероятности летального исхода [71 - 73, 173].
(УУР C, УДД 4).
- У пациентов с ПАЯ восходящей аорты, при наличии ассоциации с ИМГ, рекомендуется срочное оперативное вмешательство для уменьшения риска летального исхода [9, 73, 158, 173].
(УУР C, УДД 4).
- Пациентам с ПАЯ дуги аорты или НГА при наличии ИМГ, рекомендовано в короткий срок (до 3 суток после установления диагноза) решение вопроса о хирургическом вмешательстве для уменьшения вероятности развития нежелательных осложнений [71 - 73, 173].
(УУР C, УДД 4).
- У пациентов с ПАЯ брюшной аорты, при наличии ассоциации с ИМГ, может быть рекомендовано срочное оперативное вмешательство (до 3 суток после установления диагноза) (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, эндопротезирование аорты) для уменьшения риска летального исхода [159, 173].
(УУР B, УДД 3).
- Симптомным пациентам с изолированной ПАЯ с рецидивирующим болевым синдромом, коррелирующим с данными визуализирующих исследований, рекомендовано срочное оперативное вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, эндопротезирование аорты) для уменьшения вероятности развития нежелательных осложнений [71 - 73, 173].
(УУР C, УДД 4).
- Асимптомным пациентам с изолированной ПАЯ, но с высоким риском аортальных осложнений (максимальный диаметр ПАЯ равен или больше 13 - 20 мм, максимальная глубина равна или более 10 мм (см. приложение А3), значительное увеличение диаметра или глубины ПАЯ в динамике, сочетание ПАЯ с мешотчатой аневризмой или с нарастанием плеврального выпота), рекомендовано оперативное вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, эндопротезирование аорты) при отсутствии существенных коморбидных заболеваний для уменьшения вероятности развития нежелательных осложнений [71, 72, 74, 173].
(УУР C, УДД 4).
- Пациентам, которым показано хирургическое лечение по поводу ПАЯ, рекомендуется отдавать предпочтение открытому вмешательству над эндоваскулярным при расположении ПАЯ в восходящей аорте или проксимальной части дуги (зоны 0 - 1) для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [173].
(УУР C, УДД 5).
- Пациентам, которым показано хирургическое лечение по поводу ПАЯ, расположенной в дистальной части дуги (зоны 2 - 3), НГА или брюшной аорте, рекомендуется рассмотреть возможность как открытого, так и эндоваскулярного вмешательства, исходя из анатомических особенностей и состояния пациента для улучшения отдаленных результатов [173].
(УУР C, УДД 4).
- Пациентам с изолированной ПАЯ, которые имеют симптоматику и персистирующий болевой синдром, клинически коррелирующие с рентгенологическими данными, рекомендуется проведение хирургического лечения с целью снижения вероятности развития нежелательных осложнений [9, 73, 158, 173].
(УУР C, УДД 4).
- У бессимптомных пациентов с изолированной ПАЯ, которые имеют признаки высокого риска по данным визуализации, рекомендуется рассмотреть плановое хирургическое вмешательство для предотвращения вероятности развития нежелательных осложнений [9, 158, 159, 173].
(УУР C, УДД 4).
- Пациентам с ПАЯ, которым требуется восстановление восходящей аорты или проксимальной дуги аорты, рекомендуется открытое хирургическое вмешательство для улучшения отдаленных результатов [9, 73, 158, 173].
(УУР C, УДД 4).
У пациентов с ПАЯ, которым требуется восстановление в дистальном отделе дуги аорты, нисходящей грудной аорте или брюшной аорте, рекомендуется открытое или эндоваскулярное хирургическое вмешательство, показания к которым зависят от анатомии аорты и сопутствующих заболеваниях для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [159 - 161, 173].
(УУР B, УДД 3).
3.2.7 Травматическое повреждение аорты
- Лечение пациентов с ТПА рекомендуется осуществлять в многопрофильном стационаре, имеющий в своем составе специализированное травматологическое и сосудистое отделение с возможностями и опытом хирургических вмешательств на аорте для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [115, 120].
(УУР C, УДД 2).
Комментарии: Тип травмы аорты является критическим фактором для определения сроков вмешательства. Также стоит обратить внимание, что у пациентов с политравмой жизненно важное значение имеет междисциплинарный подход для правильного установления сроков вмешательств и приоритетов лечения. Лечение пациентов с ТПА возможно осуществлять в многопрофильном сосудистом центре, имеющий в своем составе специализированное травматологическое и сосудистое отделение с возможностями и опытом хирургических вмешательств на аорте.
- У пациентов с ТПА типа 3 и 4 без других жизнеугрожающих травм и противопоказаний по коморбидности рекомендовано хирургическое вмешательство на аорте для предотвращения развития нежелательных осложнений и летального исхода [121, 122].
(УУР C, УДД 4).
Комментарии: До настоящего времени отсутствует единое мнение относительно выбора оптимальных сроков лечения пациентов с ТПА. Полагают, что у гемодинамически стабильных пациентов большинство разрывов аорты, связанных с ТПА, происходит в течение 24 ч. По этой причине в течение многих лет стандартом лечения считалось немедленное лечение ТПА. Впоследствии в нескольких исследованиях было показано снижение показателей летальности и параплегии, ассоциированное с отсрочкой лечения у отдельных пациентов, когда требовалось проведение определенных процедур из-за других обширных повреждений. У таких пациентов вмешательство на аорте должно быть выполнено как можно скорее после первичной травмы (т.е. в течение 24 ч). Пациенты со свободным разрывом аорты или крупными периаортальными гематомами должны оперироваться в экстренном порядке. Во всех других случаях вмешательство может быть отложено на срок до 24 ч для стабилизации пациента и создания наилучших условий выполнением.
- Пациентам с ТПА типа 2 с высоким аортальным риском (гематома заднего средостения более 10 мм, соотношение аорты к нормальному диаметру составляет более 1,4, обширная гематома средостения, псевдокоарктация аорты, массивный левосторонний гемоторакс, вовлечение восходящей аорты, дуги или ветвей, гематома дуги аорты) рекомендуется выполнение хирургического вмешательства (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, эндопротезирование аорты) на аорте для предотвращения развития нежелательных осложнений и летального исхода [122 - 127].
(УУР C, УДД 4).
Комментарии: Открытая хирургическая реконструкция ТПА (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием) в классическом месте в области перешейка, как правило, требует выполнения левосторонней торакотомии в четвертом межреберье, а также однолегочной вентиляции легких. Аорта пережимается проксимальнее устья левой подключичной артерии и дистальнее поврежденного сегмента. До середины 80-х годов XX века большинство этих процедур выполнялись по принципу "пережимай и оперируй". По данным метаанализа этой методики, уровни летальности и параплегии составляют 16 - 31 и 5 - 19% соответственно. Для защиты спинного мозга используются различные методы перфузии дистального отдела аорты. Применение искусственного кровообращения было связано со снижением риска периоперационной смертности и параплегии. Метаанализ и большие когортные исследования активной и пассивной перфузии показали более низкую частоту послеоперационной параплегии (19% против 3%) и летальность (30% против 12%), связанные с активной перфузией.
- При ТПА, требующей оперативного вмешательства, рекомендуется отдать предпочтение TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) нежели открытой операции, при подходящих анатомических условиях для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [128 - 130].
(УУР B, УДД 2).
Комментарии: Имеющиеся данные показывают, что при подходящих анатомических условиях предпочтение должно отдаваться TEVAR при лечении ТПА. В обзоре 139 исследований (7768 пациентов), большинство из которых не содержат сравнительного анализа различных серий больных и являются ретроспективными и нерандомизированными, при TEVAR наблюдается меньшая летальность, чем при открытых операциях (9% против 19%; р < 0,01. Точно также в большинстве других систематических обзоров предполагаются преимущества TEVAR, с точки зрения выживаемости, а также снижения частоты параплегии по сравнению с открытой коррекцией. При TEVAR частота развития эндоликов составила 5,2%, сдавления стент-графта (стент-графт аортальный эндоваскулярный универсальный) - 2,5%, отдаленная летальность - 12,9%.
- У пациентов с ТПА 2 степени и сопутствующей мальперфузией рекомендуется рассмотреть возможность хирургического лечения с целью купирования ишемии внутренних органов [166].
(УУР C, УДД 4).
- У пациентов с ТПА не рекомендуется рутинное применение реанимационной эндоваскулярной баллонной окклюзии аорты (транслюминальная баллонная ангиопластика аорты) для контроля кровотечения для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [167].
(УУР C, УДД 3).
Комментарии: Эффективность неясна и в некоторых случаях может нанести вред.
3.2.8 Расслоение аорты и беременность
- Пациенткам с ОРА типа A в период по 27 неделю беременности рекомендовано в течение 2 суток решение вопроса о хирургическом вмешательстве на аорте с мониторингом состояния плода для уменьшения риска развития нежелательных явлений [140 - 142, 173].
(УУР C, УДД 4).
- Пациенткам с ОРА типа A в период с 28 недели беременности рекомендовано в течение 24 часов решение вопроса о родоразрешении путем кесарева сечения с последующим незамедлительным хирургическим вмешательством на аорте для предотвращения развития нежелательных осложнений и летального исхода [140 - 143, 173].
(УУР C, УДД 5).
- Пациенткам с прогрессирующим расширением аорты в период до 28 недели беременности рекомендуется рассмотреть целесообразность превентивного хирургического вмешательства на аорте с учетом индивидуальных особенностей во избежание аортальных осложнений. [140, 141, 143, 173].
(УУР C, УДД 5).
- Пациенткам с 28 недели беременности с хроническим расслоением аорты в анамнезе рекомендуется кесарево сечение для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [8, 173].
(УУР C, УДД 5).
- Пациенткам, перенесшим острое расслоение аорты типа B во время беременности, рекомендуется медикаментозная терапия (см. раздел 3.1.1) до и после родоразрешения, если только для лечения острых осложнений не требуется эндоваскулярная или хирургическая реконструкция (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, эндопротезирование аорты) для улучшения отдаленных результатов [141, 143, 173].
(УУР C, УДД 5).
- У беременных с аортопатией и диаметром аорты < 4,0 см рекомендуется вагинальное родоразрешение для уменьшения ранних нежелательных явлений и улучшения отдаленных результатов [140, 143, 173].
(УУР C, УДД 5).
- У беременных (с 28 недели) с диаметром корня аорты, восходящей аорты или обоих более 4,5 см рекомендуется кесарево сечение для улучшения отдаленных результатов [141, 143, 173].
(УУР C, УДД 5).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Пациентам с острым РА типа B после выписки из больницы рекомендуется тщательное неопределенно долгое наблюдение врачом-хирургом каждые 3 месяца по месту жительства (профилактический прием (осмотр, консультация) врача-хирурга) для мониторинга прогрессирования заболевания [4].
(УУР C, УДД 4).
Комментарии: Для мониторинга прогрессирования заболевания необходимо выполнять регистрацию электрокардиограммы, эхокардиографию, ультразвуковое исследование органов брюшной полости, прицельную рентгенографию органов грудной клетки, компьютерно-томографическую ангиографию аорты 1 раз в год или при признаках прогрессирования заболевания.
- Пациентам после открытого или эндоваскулярного хирургического лечения (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, эндопротезирование аорты) ОРА типа A или ИМГ с сохраняющейся патологией резидуальной аорты рекомендован динамический контроль через 1, 6 и 12 месяцев с возможным выполнением компьютерно-томографической ангиографии аорты, а затем, при стабильном состоянии, ежегодно с целью контроля возникших осложнений [144 - 149].
(УУР C, УДД 4).
Комментарии: то же касается и пациентов, получавших только консервативную терапию [150]. В дополнение к компьютерно-томографической ангиографии аорты, может быть полезным проведение трансторакальной эхокардиографии для динамического наблюдения за корнем аорты и аортальным клапаном.
- Пациентам после хирургического или медикаментозного лечения ОРА типа A или ИМГ с сохраняющейся резидуальной хронической патологией грудной аорты и ее аневризматическом расширении более 5,5 см, рекомендовано рассмотрение вопроса о хирургическом вмешательстве в зависимости от коморбидного состояния пациента и факторов риска для уменьшения нежелательных явлений и улучшения отдаленных результатов [145, 147, 151, 152].
(УУР C, УДД 4).
Комментарии: Оптимальное послеоперационное ведение пациентов после ОРА типа A включает в себя контроль АД и пожизненное наблюдение с применением визуализирующих методов исследования. При этом следует принимать во внимание несколько важных аспектов долгосрочного наблюдения. Во-первых, медикаментозная терапия, направленная на нормализацию АД и снижение нагрузки на стенку аорты, должна быть назначена и должным образом объяснена пациентам, чтобы обеспечить адекватное соблюдение приема лекарств. Во-вторых, визуализирующие исследования должны планироваться с соответствующими временными интервалами. Диагностические исследования должны быть направлены на оценку аортального клапана и функцию левого желудочка, а также ремоделирование аорты. Наконец, ближайшие родственники пациентов должны быть обследованы на эхокардиографиии, если она выявит клинические особенности, пациенту должно быть предложено генетическое тестирование для выявления наследственных заболеваний аорты (цитогенетическое исследование (кариотип).
- У пациентов с ТПА, которым не было выполнено оперативное вмешательство, рекомендована динамическая оценка состояния аорты по компьютерно-томографической ангиографии аорты через 1, 6 и 12 мес. от получения травмы, а также, при стабильном состоянии аорты, в последующем, с соответствующими интервалами в зависимости от типа и распространения поражения для контроля появления посттравматических осложнений [173].
(УУР C, УДД 5).
Комментарии: В настоящее время стандартным методом визуализации после успешного выполнения TEVAR считается компьютерно-томографическая ангиография аорты. Однако, учитывая часто молодой возраст пациентов с ТПА, есть определенные опасения относительно кумулятивного воздействия ионизирующего излучения и рентгеноконтрастных средств, содержащие йод. По этим причинам лучшей альтернативой для контроля в отдаленном периоде после использования МРТ-совместимых стент-графтов (стент-графт аортальный эндоваскулярный универсальный) является магнитно-резонансная ангиография с контрастированием. Представляется целесообразным использовать комбинацию мультипроекционной прицельной рентгенографии органов грудной клетки и магнитно-резонансной ангиографии с контрастированием, а не компьютерно-томографическую ангиографию аорты, с учетом металлического компонента стент-графта (стент-графт аортальный эндоваскулярный универсальный), для долгосрочного наблюдения за пациентами. При этих двух условиях могут быть обнаружены эндолики, псевдоаневризмы и осложнения, связанные с материалом стент-графта (стент-графт аортальный эндоваскулярный универсальный).
Классификация эндоликов: Тип I: затек в месте фиксации стент-графта (стент-графт аортальный эндоваскулярный универсальный) выше, ниже, или между компонентами графта (Ia: проксимальная зона фиксации; Ib: дистальная зона фиксации). Тип II: аневризматический мешок заполняется ретроградно через одну (IIa) или несколько боковых ветвей (IIb). Тип III: затек через механический дефект в графте, механическое повреждение стент-графта (стент-графт аортальный эндоваскулярный универсальный) в результате разделения модульных компонентов (IIIa), или переломы и отверстия в эндопротезе (IIIb). Тип IV: затек через ткани графта вследствие их пористости. Тип V: дальнейшее расширение аневризматического мешка без очевидного затека при визуализации (endotension).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Пациентам после медикаментозного лечения ПАЯ рекомендовано динамическое наблюдение компьютерно-томографической ангиографией аорты через 1 мес., далее каждые 6 мес. в течение 2 лет при стабильном состоянии, затем - с соответствующими интервалами, в зависимости от возраста и характеристик ПАЯ для мониторинга прогрессирования заболевания [153, 156].
(УУР C, УДД 4).
Комментарии: Показатели летальности при медикаментозном лечении в Европе и США высокие, в отличие от Азии. По данным IRAD, госпитальная летальность при ИМГ типа A аналогична таковой при РА типа A и обусловлена близостью поражения к аортальному клапану. С другой стороны, в ряде исследований было показано, что 30 - 40% ИМГ типа A трансформируются в РА с наибольшим риском в первые 8 дней после начала заболевания. При острой ИМГ типа B риск госпитальной летальности составляет < 10% аналогично РА типа B. Отдаленный прогноз у пациентов с ИМГ более благоприятен по сравнению с больными с РА. Однако 5-летняя выживаемость при ИМГ находится в диапазоне 43 - 90% в зависимости от особенностей пациентов. Локальное разрушение (ulcer-like projection - ULP) аорты может появиться в течение первых дней или через несколько месяцев после дебюта симптоматики и этим отличается от ПАЯ, которая связана с атеросклерозом стенки аорты. Несмотря на то что ULP восходящей аорты имеет неблагоприятный прогноз, при ИМГ типа B течение заболевания более доброкачественное.
- Пациентам после хирургического лечения ПАЯ рекомендовано динамическое наблюдение компьютерно-томографической ангиографией аорты с интервалами, соответствующими вмешательству при ОРА типа A для мониторинга прогрессирования заболевания [153 - 155].
(УУР C, УДД 3).
6. Организация оказания медицинской помощи
Показания для плановой госпитализации:
1) наличие симптомов мальперфузии головного мозга, внутренних органов, почек, нижних конечностей, аортальной регургитации, аневризмы аорты;
2) плановое оперативное лечение.
Показания для экстренной госпитализации:
1) острое расслоение аорты;
2) осложненное течение хронического расслоения.
Показания к выписке пациента из стационара:
1) стабилизации состояния пациента в подострой и хронической стадии расслоения аорты;
1) отсутствие показаний к экстренному оперативному вмешательству.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
Этап постановки диагноза
1
Выполнена трансторакальная эхокардиография пациенту с подозрением на ОАС в качестве предварительного визуализирующего исследования для определения диагноза РА
Да/Нет
2
Выполнена чреспищеводная эхокардиография и/или магнитно-резонансная ангиография с контрастированием для начальной диагностической визуализации у пациентов с подозрением на ОАС для дифференциальной диагностики
Да/Нет
3
Выполнена компьютерно-томографическая ангиография аорты для установления диагноза у пациента с подозрением на РА
Да/Нет
4
Выполнены повторные визуализирующие исследования (КТА или магнитно-резонансная ангиография с контрастированием) через 24 - 48 часов после первого исследования при сохраняющемся подозрении у пациента ОАС для уточнения диагноза
Да/Нет
Этап консервативного и хирургического лечения
1
Выполнена медикаментозная терапия, включающая обезболивание и стабилизацию АД для антиимпульсной терапии (см. раздел 3.1.1) у пациента с ОАС
Да/Нет
2
Назначена терапия для снижения АД и ЧСС (целевые значения САД 100 - 120 мм рт.ст., целевые значения ЧСС менее 60 уд./мин) у пациентов, поступающих в стационар с ОАС, в качестве начальных лечебных мероприятий, направленных на снижение нагрузки на стенку аорты, а также измерение артериального давления на периферических артериях при помощи артериального катетера (см. раздел 3.1.1)
Да/Нет
3
У пациентов с ОАС в начальном лечении назначено внутривенное введение бета-адреноблокаторов для контроля ЧСС (см. раздел 3.1.1)
Да/Нет
4
Пациентам с РА назначено длительное лечение бета-адреноблокаторами (если нет противопоказаний) для обеспечения контроля частоты сердечных сокращений и АД с целью уменьшения вероятности развития долгосрочных нежелательных явлений, связанных с поражением аорты (см. раздел 3.1.2)
Да/Нет
5
Выполнено профилактическое TEVAR для уменьшения поздних нежелательных явлений, связанных с аортой и смерти у пациентов с неосложненным РА типа B
Да/Нет
6
Выполнено открытое хирургическое реконструктивное вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) при осложненных сверхострых, острых или подострых РА для пациентов, у которых анатомия не подходит для TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом) с целью улучшения отдаленных результатов
Да/Нет
7
Выполнено TEVAR у пациентов с хроническим РА типа B с подходящей анатомией (адекватная зона имплантации, отсутствие аневризмы восходящего отдела аорты или дуги аорты) и высокими риском осложнений при выполнении открытого реконструктивного хирургического вмешательства (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, пластика аорты заплатой) из-за сопутствующих заболеваний для улучшения отдаленных результатов
Да/Нет
8
Для пациентов с заболеваниями соединительной ткани и РА типа B, у которых, несмотря на оптимальную консервативную терапию через 6 месяцев, наблюдается прогрессирование заболевания выполнено открытое хирургическое вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием) для улучшения отдаленных результатов
Да/Нет
9
Для снижения риска ишемического повреждения спинного мозга при использовании TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом), препятствующего антеградному кровотоку ЛПклА, выполнена реваскуляризация ЛПклА (открытая хирургическая или эндоваскулярная) у пациента с РА типа B
Да/Нет
10
Установлен дренаж спинномозговой жидкости (люмбальный дренаж наружный) у пациентов с РА типа B, которым выполняется TEVAR, если у них повышенный риск развития ишемии спинного мозга (длина стент-графта (стент-графт аортальный эндоваскулярный универсальный) более 20 см, установка стент-графта (стент-графт аортальный эндоваскулярный универсальный) в пределах 2 см от устья чревного ствола или другие факторы риска для улучшения перфузии спинного мозга
Да/Нет
11
Установлен дренаж спинномозговой жидкости (люмбальный дренаж наружный) у пациентов с расслоением типа B в течение 3 суток после постановки диагноза, у которых развиваются симптомы парапареза/параплегии для снижения отека спинного мозга
Да/Нет
12
Беременным пациенткам с 28 недели и хроническим расслоением аорты в анамнезе выполнено кесарево сечение для улучшения отдаленных результатов
Да/Нет
13
Пациентам с ОРА типа A/ПАЯ с ИМГ восходящего отдела или дуги в течении 24 часов решен вопрос о хирургическом вмешательстве (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, реконструкция восходящего отдела аорты с протезированием аортального клапана) для снижения риска нежелательных осложнений
Да/Нет
14
Пациентам с ИМГ типа A при наличии факторов риска со стороны аорты выполнено хирургическое вмешательство (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, реконструкция восходящего отдела аорты с протезированием аортального клапана) с целью уменьшения вероятности развития нежелательных явлений
Да/Нет
15
У пациентов с ОРА типа A, осложнившимся мезентериальной мальперфузией, выполнено эндопротезирование нисходящей аорты с фенестрацией стент-графта и стентированием ветвей брюшной аорты для уменьшения вероятности развития нежелательных осложнений со стороны ЖКТ
Да/Нет
16
У стабильных пациентов с ОРА типа A рассмотрена возможность восстановления кровотока в ишемизированной конечности (перекрестное бедренно-бедреное шунтирование, фенестрация (транслюминальная баллонная ангиопластика аорты)) до вмешательства на проксимальной аорте, у нестабильного пациента приняты меры к сохранению кровотока во время вмешательства для предотвращения развития острой ишемии конечности с последующими осложнениями
Да/Нет
17
Пациентам с ПАЯ с высоким риском аортальных осложнений без выраженных коморбидных факторов риска выполнено оперативное вмешательство с целью уменьшения вероятности развития нежелательных явлений (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, реконструкция восходящего отдела аорты с протезированием аортального клапана)
Да/Нет
18
У пациентов с ТПА, требующей хирургического лечения, выполнена TEVAR при подходящих анатомических условиях с целью улучшения отдаленных результатов
Да/Нет
19
Пациенткам с ОРА типа A в период до 27 недели беременности в течение 36 часов решен вопрос о хирургическом вмешательстве (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, реконструкция восходящего отдела аорты с протезированием аортального клапана, TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом)) на аорте с целью улучшения отдаленных результатов
Да/Нет
20
Пациенткам с ОРА типа A в период с 28 недели беременности в течение 24 часов выполнено кесарево сечение с последующим хирургическим вмешательством (резекция аорты с протезированием и пластикой ветвей, резекция аорты с протезированием, реконструкция восходящего отдела аорты с протезированием аортального клапана, TEVAR (эндопротезирование грудного отдела аорты эндоваскулярным доступом)) на аорте для улучшения отдаленных результатов
Да/Нет
Этап послеоперационного контроля
1
Пациентам с острым РА типа B после выписки из больницы тщательное наблюдение врачом-хирургом по месту жительства (профилактический прием (осмотр, консультация) врача-хирурга) для мониторинга прогрессирования заболевания (см. раздел 4)
Да/Нет
2
Пациентам после открытого или эндоваскулярного хирургического лечения ОРА типа A или ИМГ с сохраняющейся патологией резидуальной аорты проведен динамический контроль посредством компьютерно-томографической ангиографией аорты через 1, 6 и 12 мес., а затем, при стабильном состоянии, ежегодно для контроля прогрессирования заболевания
Да/Нет
Список литературы
1. Januzzi JL, Eagle KA, Cooper JV, Fang J, Sechtem U, Myrmel T, Evangelista A, Oh JK, Llovet A, O'Gara PT, Nienaber CA, Isselbacher EM. Acute aortic dissection presenting with congestive heart failure: results from the International Registry of Acute Aortic Dissection. J Am Coll Cardiol. 2005; 46: 733 - 735.
2. Clough RE, Nienaber CA. Management of acute aortic syndrome. Nat Rev Cardiol. 2015; 12: 103 - 114.
3. Booher AM, Isselbacher EM, Nienaber CA, et al. The IRAD classification system for characterizing survival after aortic dissection. Am J Med. 2013; 126: 730.e719 - 730.e724.
4. Tsai TT, Nienaber CA, Eagle KA. Acute aortic syndromes. Circulation. 2005; 112: 3802 - 3813.
5. Czerny M, Schmidli J, Adler S, et al. Current options and recommendations for the treatment of thoracic aortic pathologies involving the aortic arch: an expert consensus document of the European Association for Cardio-Thoracic surgery (EACTS) and the European Society for Vascular Surgery (ESVS). Eur J Cardiothorac Surg. 2019; 55: 133 - 162.
6. Lombardi JV, Hughes GC, Appoo JJ, et al. Society for Vascular Surgery (SVS) and Society of Thoracic Surgeons (STS) reporting standards for type B aortic dissections. Ann Thorac Surg. 2020; 109: 959 - 981.
7. Grewal S, Contrella BN, Sherk WM, et al. Endovascular management of malperfusion syndromes in aortic dissection. Tech Vasc Interv Radiol. 2021; 24: 100751.
8. Oderich GS,  JM, Reed NR, et al. Penetrating aortic ulcer and intramural hematoma. Cardiovasc Intervent Radiol. 2019; 42: 321 - 334.
JM, Reed NR, et al. Penetrating aortic ulcer and intramural hematoma. Cardiovasc Intervent Radiol. 2019; 42: 321 - 334.
9. Harris KM, Braverman AC, Eagle KA, et al. Acute aortic intramural hematoma: an analysis from the International Registry of Acute Aortic Dissection. Circulation. 2012; 126: S91 - S96.
10. Nienaber CA, Rousseau H, Eggebrecht H, Kische S, Fattori R, Rehders TC, Kundt G, Scheinert D, Czerny M, Kleinfeldt T, Zipfel B, Labrousse L, Ince H. Randomized comparison of strategies for type B aortic dissection: the INnvestigation of STEnt Grafts in Aortic Dissection (INSTEAD) trial. Circulation. 2009; 120: 2519 - 2528.
11. Nienaber CA, Kische S, Rousseau H, Eggebrecht H, Rehders TC, Kundt G, Glass A, Scheinert D, Czerny M, Kleinfeldt T, Zipfel B, Labrousse L, Fattori R, Ince H. Endovascular repair of type B aortic dissection: long-term results of the randomized investigation of stent grafts in aortic dissection trial. Circ Cardiovasc Interv. 2013; 6: 407 - 416.
12. Hirst AE Jr, Johns VJ Jr, Kime SW Jr. Dissecting aneurysm of the aorta: a review of 505 cases. Medicine (Baltimore). 1958; 37: 217 - 279.
13. Booher AM, Isselbacher EM, Nienaber CA, et al. Ascending thoracic aorta dimension and outcomes in acute type B dissection (from the international registry of Acute Aortic Dissection [IRAD]). Am J Cardiol. 2011; 107: 315 - 320.
14. Svensson LG, Kouchoukos NT, Miller DC, et al. Expert consensus document on the treatment of descending thoracic aortic disease using endovascular stent-grafts. Ann Thorac Surg. 2008; 85 (suppl): S1 - S41.
15. Zoli S, Etz CD, Roder F, et al. Long-term survival after open repair of chronic distal aortic dissection. Ann Thorac Surg. 2010; 89: 1458 - 1466.
16. Akin I, Kische S, Ince H, Nienaber CA. Indication, timing and results of endovascular treatment of type B dissection. Eur J Vasc Endovasc Surg. 2009; 37: 289 - 296.
17. Zafar MA, Chen JF, Wu J, et al. Natural history of descending thoracic and thoracoabdominal aortic aneurysms. J Thorac Cardiovasc Surg. 2021; 161: 498 - 511.e1.
18. Desai ND, Gottret JP, Szeto WY, et al. Impact of timing on major complications after thoracic endovascular aortic repair for acute type B aortic dissection. J Thorac Cardiovasc Surg. 2015; 149 (suppl): S151 - S156.
19. Steuer J, Bjorck M, Mayer D, Wanhainen A, Pfammatter T, Lachat M. Distinction between acute and chronic type B aortic dissection: is there a sub-acute phase? Eur J Vasc Endovasc Surg. 2013; 45: 627 - 631.
20. VIRTUE Registry Investigators. Mid-term outcomes and aortic remodelling after thoracic endovascular repair for acute, subacute, and chronic aortic dissection: the VIRTUE Registry. Eur J Vasc Endovasc Surg. 2014; 48: 363 - 371.
21. Miyairi T, Miyata H, Chiba K, et al. Influence of timing after thoracic endovascular aortic repair for acute type B aortic dissection. Ann Thorac Surg. 2018; 105: 1392 - 1396.
22. Loeys BL, Schwarze U, Holm T, et al. Aneurysm syndromes caused by mutations in the TGF-beta receptor. N Engl J Med. 2006; 355: 788 - 798.
23. Judge DP, Dietz HC. Marfan's syndrome. Lancet. 2005; 366: 1965 - 1976.
24. Pepin M, Schwarze U, Superti-Furga A, Byers PH. Clinical and genetic features of Ehlers-Danlos syndrome type IV, the vascular type. N Engl J Med. 2000; 342: 673 - 680.
25. Fletcher AJ, Syed MBJ, Aitman TJ, Newby DE, Walker NL. Inherited thoracic aortic disease: new insights and translational targets. Circulation. 2020; 141: 1570 - 1587.
26. Alhussaini M, Arnaoutakis GJ, Scali ST, et al. Impact of secondary aortic interventions after thoracic endovascular aortic repair on long-term survival. Ann Thorac Surg. 2020; 110: 27 - 38.
27. Dijkstra ML, Vainas T, Zeebregts CJ, Hooft L, van der Laan MJ. Editor's Choice-Spinal cord ischaemia in endovascular thoracic and thoraco-abdominal aortic repair: review of preventive strategies. Eur J Vasc Endovasc Surg. 2018; 55: 829 - 841.
28. Huang Q, Chen XM, Yang H, Lin QN, Qin X. Effect of left subclavian artery revascularisation in thoracic endovascular aortic repair: a systematic review and meta-analysis. Eur J Vasc Endovasc Surg. 2018; 56: 644 - 651.
29. Scali ST, Giles KA, Wang GJ, et al. National incidence, mortality outcomes, and predictors of spinal cord ischemia after thoracic endovascular aortic repair. J Vasc Surg. 2020; 72: 92 - 104.
30. Nauta FJ, Tolenaar JL, Patel HJ, et al. Impact of retrograde arch extension in acute type B aortic dissection on management and outcomes. Ann Thorac Surg. 2016; 102: 2036 - 2043
31. Sievers HH, Rylski B, Czerny M, Baier ALM, Kreibich M, Siepe M, et al. Aortic dissection reconsidered: type, entry site, malperfusion classification adding clarity and enabling outcome prediction. Interact Cardiovasc Thorac Surg. 2020; 30: 451 - 7.
32. Berretta P, Trimarchi S, Patel HJ, Gleason TG, Eagle KA, Di Eusanio M. Malperfusion syndromes in type A aortic dissection: what we have learned from IRAD. J Vis Surg 2018; 4: 65.
33. Akutsu K, Yoshino H, Shimokawa T, Ogino H, Kunihara T, Takahashi T, et al. Is systolic blood pressure high in patients with acute aortic dissection on first medical contact before hospital transfer? Heart Vessels. 2019; 34: 1748 - 57.
34. Bossone E, Gorla R, La Bounty TM, Suzuki T, Gilon D, Strauss C, et al. Presenting Systolic Blood Pressure and Outcomes in Patients With Acute Aortic Dissection. J Am Coll Cardiol. 2018; 71: 1432 - 40.
35. Tsai TT, Bossone E, Isselbacher EM, Nienaber CA, Evangelista A, Fang J, et al. Clinical characteristics of hypotension in patients with acute aortic dissection. Am J Cardiol. 2005; 95: 48 - 52.
36. Nakai C, Izumi S, Haraguchi T, Kikuta S, Nakayama S, Okita Y, et al. Acute type A aortic dissection with cardiopulmonary arrest at presentation. Ann Thorac Surg. 2020.
37. Evangelista A, Isselbacher EM, Bossone E, Gleason TG, Eusanio MD, Sechtem U, et al. Insights From the International Registry of Acute Aortic Dissection: A 20-Year Experience of Collaborative Clinical Research. Circulation. 2018; 137: 1846 - 60.
38. Hagan PG, Nienaber CA, Isselbacher EM, Bruckman D, Karavite DJ, Russman PL, et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA. 2000; 283: 897 - 903.
39. Pape LA, Awais M, Woznicki EM, Suzuki T, Trimarchi S, Evangelista A, et al. Presentation, Diagnosis, and Outcomes of Acute Aortic Dissection: 17-Year Trends From the International Registry of Acute Aortic Dissection. J Am Coll Cardiol. 2015; 66: 350 - 8.
40. Weigang E, Conzelmann LO, Kallenbach K, Dapunt O, Karck M. German registry for acute aortic dissection type A (GERAADA)-lessons learned from the registry. Thorac Cardiovasc Surg. 2010; 58: 154 - 8.
41. Chow SCY, Wong RHL, Lakhani I, Wong MV, Tse G, Yu PSY, et al. Management of acute type A intramural hematoma: upfront surgery or inpidualized approach? A retrospective analysis and meta-analysis. J Thorac Dis. 2020; 12: 680 - 9.
42. Kan CB, Chang RY, Chang JP. Optimal initial treatment and clinical outcome of type A aortic intramural hematoma: a clinical review. Eur J Cardiothorac Surg. 2008; 33: 1002 - 6.
43. Estrera A, Miller C 3rd, Lee TY, De Rango P, Abdullah S, Walkes JC, et al. Acute type A intramural hematoma: analysis of current management strategy. Circulation. 2009; 120: S287 - 291.
44. Kitai T, Kaji S, Yamamuro A, Tani T, Tamita K, Kinoshita M, et al. Clinical outcomes of medical therapy and timely operation in initially diagnosed type a aortic intramural hematoma: a 20-year experience. Circulation. 2009; 120: S292 - 298.
45. Song JK, Yim JH, Ahn JM, Kim DH, Kang JW, Lee TY, et al. Outcomes of patients with acute type a aortic intramural hematoma. Circulation. 2009; 120: 2046 - 52.
46. Song JM, Kim HS, Song JK, Kang DH, Hong MK, Kim JJ, et al. Usefulness of the initial noninvasive imaging study to predict the adverse outcomes in the medical treatment of acute type A aortic intramural hematoma. Circulation. 2003; 108 (Suppl 1): II324 - 328.
47. Zhou X, Krishnan A, Hsu J, Burns A, Mandal K. Delayed Surgical Management of Type A Intramural Hematoma Is Not Associated with Worse Outcomes Than Emergent Operation. Heart Surg Forum. 2019; 22: E103 - 6.
48. Estrera AL, Garami Z, Miller CC, Porat EE, Achouh PE, Dhareshwar J, et al. Acute type A aortic dissection complicated by stroke: can immediate repair be performed safely? J Thorac Cardiovasc Surg. 2006; 132: 1404 - 8.
49. Morimoto N, Okada K, Okita Y. Lack of neurologic improvement after aortic repair for acute type A aortic dissection complicated by cerebral malperfusion: predictors and association with survival. J Thorac Cardiovasc Surg. 2011; 142: 1540 - 4.
50. NakamuraY, Tagusari O, IchikawaY, Morita A. Impact of immediate aortic repair on early and midterm neurologic status in patients with acute type a aortic dissection complicated by cerebral malperfusion. Ann Thorac Surg. 2011; 92: 336 - 8.
51. Niclauss L, Delay D, Ferrari E, Pretre R. Impact of preoperative central neurologic dysfunction on patients undergoing emergency surgery for type A dissection. Ann Vasc Surg. 2014; 28: 1227 - 35.
52. Tsukube T, Haraguchi T, Okada Y, Matsukawa R, Kozawa S, Ogawa K, et al. Long-term outcomes after immediate aortic repair for acute type A aortic dissection complicated by coma. J Thorac Cardiovasc Surg. 2014; 148: 1013 - 8; discussion 1018 - 1019.
53. Di Eusanio M, Patel HJ, Nienaber CA, Montgomery DM, Korach A, Sundt TM, et al. Patients with type A acute aortic dissection presenting with major brain injury: should we operate on them? J Thorac Cardiovasc Surg. 2013; 145: S213 - 221 e211.
54. Most H, Reinhard B, Gahl B, Englberger L, Kadner A, Weber A, et al. Is surgery in acute aortic dissection type A still contraindicated in the presence of preoperative neurological symptoms? Eur J Cardiothorac Surg. 2015; 48: 945 - 50; discussion 950.
55. Huenges K, Dreyer J, Panholzer B, Grothusen C, Renner J, Schafer P, et al. Iatrogenic Catheter-Induced Acute Aortic Dissection Type A after Coronary Angiography - A Retrospective Consecutive Case Series. Thorac Cardiovasc Surg. 2017; 65: 85 - 9.
56.  IJ, Bautista D, Cerrato E, Salinas P, Varbella F, Omed_e P, et al. Incidence, Management, and Immediate- and Long-Term Outcomes After Iatrogenic Aortic Dissection During Diagnostic or Interventional Coronary Procedures. Circulation. 2015; 131: 2114 - 9.
IJ, Bautista D, Cerrato E, Salinas P, Varbella F, Omed_e P, et al. Incidence, Management, and Immediate- and Long-Term Outcomes After Iatrogenic Aortic Dissection During Diagnostic or Interventional Coronary Procedures. Circulation. 2015; 131: 2114 - 9.
57. Rylski B, Hoffmann I, Beyersdorf F, Suedkamp M, Siepe M, Nitsch B, et al. Iatrogenic acute aortic dissection type A: insight from the German Registry for Acute Aortic Dissection Type A (GERAADA). Eur J Cardiothorac Surg. 2013; 44: 353 - 9; discussion 359.
58. Omura A, Matsuda H, Matsuo J, Hori Y, Fukuda T, Inoue Y, et al. Thoracic endovascular repair for retrograde acute type A aortic dissection as an alternative choice. Gen Thorac Cardiovasc Surg. 2020.
59. Shu C, Wang T, Li QM, Li M, Jiang XH, Luo MY, et al. Thoracic endovascular aortic repair for retrograde type A aortic dissection with an entry tear in the descending aorta. J Vasc Interv Radiol. 2012; 23: 453 - 60. 460 e451.
60. Leshnower BG, Keeling WB, Duwayri YM, JordanWDJr, Chen EP. The "thoracic endovascular aortic repair-first" strategy for acute type A dissection with mesenteric malperfusion: Initial results compared with conventional algorithms. J Thorac Cardiovasc Surg. 2019; 158: 1516 - 24.
61. Uchida K, Karube N, Kasama K, Minami T, Yasuda S, Goda M, et al. Early reperfusion strategy improves the outcomes of surgery for type A acute aortic dissection with malperfusion. J Thorac Cardiovasc Surg. 2018; 156: 483 - 9.
62. Yang B, Norton EL, Rosati CM, Wu X, Kim KM, Khaja MS, et al. Managing patients with acute type A aortic dissection and mesenteric malperfusion syndrome: A 20-year experience. J Thorac Cardiovasc Surg. 2019; 158: 675 - 687 e674.
63. Yang B, Rosati CM, Norton EL, Kim KM, Khaja MS, Dasika N, et al. Endovascular Fenestration/Stenting First Followed by Delayed Open Aortic Repair for Acute Type A Aortic Dissection With Malperfusion Syndrome. Circulation. 2018; 138: 2091 - 103.
64. Deeb GM, Williams DM, Bolling SF, Quint LE, Monaghan H, Sievers J, et al. Surgical delay for acute type A dissection with malperfusion. Ann Thorac Surg. 1997; 64: 1669 - 75; discussion 1675 - 1667.
65. Sugiyama K, Watanuki H, Okada M, Futamura Y, Wakayama R, Matsuyama K. Revascularization-first strategy in acute aortic dissection with mesenteric malperfusion. J Card Surg. 2020; 35: 3004 - 9.
66. Leshnower BG, Veeraswamy RK, Duwayri YM, Chen EP. The "TEVAR-first" approach to DeBakey I aortic dissection with mesenteric malperfusion. Ann Thorac Surg. 2014; 97: 693 - 6.
67. Charlton-Ouw KM, Sandhu HK, Leake SS, Jeffress K, Miller CCR, Durham CA, et al. Need for Limb Revascularization in Patients with Acute Aortic Dissection is Associated with Mesenteric Ischemia. Ann Vasc Surg. 2016; 36: 112 - 20.
68. Charlton-Ouw KM, Sritharan K, Leake SS, Sandhu HK, Miller CC 3rd, Azizzadeh A, et al. Management of limb ischemia in acute proximal aortic dissection. J Vasc Surg. 2013; 57: 1023 - 9.
69. Long SM 3rd, Nair D, Halandras PM, Kasirajan K, Milner R, Chen EP. Ileofemoral malperfusion complicating type a dissection: revascularization prevents renal failure. Ann Thorac Surg. 2007; 84: 2099 - 101.
70. Perera NK, Galvin SD, Seevanayagam S, Matalanis G. Optimal management of acute type A aortic dissection with mesenteric malperfusion. Interact Cardiovasc Thorac Surg. 2014; 19: 290 - 4.
71. Ganaha F, Miller DC, Sugimoto K, et al. Prognosis of aortic intramural hematoma with and without penetrating atherosclerotic ulcer: a clinical and radiological analysis. Circulation. 2002; 106: 342 - 348.
72. Tittle SL, Lynch RJ, Cole PE, et al. Midterm follow-up of penetrating ulcer and intramural hematoma of the aorta. J Thorac Cardiovasc Surg. 2002; 123: 1051 - 1059.
73. Chou AS, Ziganshin BA, Charilaou P, et al. Long-term behavior of aortic intramural hematomas and penetrating ulcers. J Thorac Cardiovasc Surg. 2016; 151: 361 - 373. e1.
74. Yang L, Zhang QY, Wang XZ, et al. Long-term imaging evolution and clinical prognosis among patients with acute penetrating aortic ulcers: a retrospective observational study. J Am Heart Assoc. 2020; 9: e014505.
75. Hysi I, Juthier F, Fabre O, et al. Aortic root surgery improves long-term survival after acute type A aortic dissection. Int J Cardiol. 2015; 184: 285 - 290.
76. Peterss S, Dumfarth J, Rizzo JA, et al. Sparing the aortic root in acute aortic dissection type A: risk reduction and restored integrity of the untouched root. Eur J Cardiothorac Surg. 2016; 50: 232 - 239.
77. Chen SK, Qiu ZH, Fang GH, et al. Reported outcomes after aortic valve resuspension for acute type A aortic dissection: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg. 2019; 29: 331 - 338.
78. Saczkowski R, Malas T, Mesana T, et al. Aortic valve preservation and repair in acute type A aortic dissection. Eur J Cardiothorac Surg. 2014; 45: e220 - e226.
79. Qiu J, Wu J, Xie E, et al. Surgical management and outcomes of the aortic root in acute type A aortic dissection. Ann Thorac Surg. 2020; 110: 136 - 143.
80. Vendramin I, Lechiancole A, Piani D, et al. Type A acute aortic dissection with >= 40-mm aortic root: results of conservative and replacement strategies at long-term follow-up. Eur J Cardiothorac Surg. 2021; 59: 1115 - 1122.
81. Di Eusanio M, Trimarchi S, Peterson MD, et al. Root replacement surgery versus more conservative management during type A acute aortic dissection repair. Ann Thorac Surg. 2014; 98: 2078 - 2084.
82. Yang B, Norton EL, Hobbs R, et al. Short- and long-term outcomes of aortic root repair and replacement in patients undergoing acute type A aortic dissection repair: twenty-year experience. J Thorac Cardiovasc Surg. 2019; 157: 2125 - 2136.
83. Malaisrie SC, Szeto WY, Halas M, et al. 2021 The American Association for Thoracic Surgery expert consensus document: surgical treatment of acute type A aortic dissection. J Thorac Cardiovasc Surg. 2021; 162: 735 - 758. e2.
84. Beckmann E, Martens A, Pertz J, et al. Valve-sparing David I procedure in acute aortic type A dissection: a 20-year experience with more than 100 patients. Eur J Cardiothorac Surg. 2017; 52: 319 - 324.
85. Mosbahi S, Stak D, Gravestock I, et al. A systemic review and meta-analysis: Bentall versus David procedure in acute type A aortic dissection. Eur J Cardiothorac Surg. 2019; 55: 201 - 209.
86. Geirsson A, Shioda K, Olsson C, et al. Differential outcomes of open and clamp-on distal anastomosis techniques in acute type A aortic dissection. J Thorac Cardiovasc Surg. 2019; 157: 1750 - 1758.
87. Malvindi PG, Modi A, Miskolczi S, et al. Open and closed distal anastomosis for acute type A aortic dissection repair. Interact Cardiovasc Thorac Surg. 2016; 22: 776 - 783.
88. Lawton JS, Liu J, Kulshrestha K, et al. The impact of surgical strategy on survival after repair of type A aortic dissection. J Thorac Cardiovasc Surg. 2015; 150: 294 - 301. e291.
89. Rampoldi V, Trimarchi S, Eagle KA, et al. Simple risk models to predict surgical mortality in acute type A aortic dissection: the International Registry of Acute Aortic Dissection score. Ann Thorac Surg. 2007; 83: 55 - 61.
90. Hsieh WC, Kan CD, Yu HC, et al. Ascending aorta replacement vs. total aortic arch replacement in the treatment of acute type A dissection: a meta-analysis. Eur Rev Med Pharmacol Sci. 2019; 23: 9590 - 9611.
91. Poon SS, Theologou T, Harrington D, et al. Hemiarch versus total aortic arch replacement in acute type A dissection: a systematic review and meta-analysis. Ann Cardiothorac Surg. 2016; 5: 156 - 173.
92. Yan Y, Xu L, Zhang H, et al. Proximal aortic repair versus extensive aortic repair in the treatment of acute type A aortic dissection: a meta-analysis. Eur J Cardiothorac Surg. 2016; 49: 1392 - 1401.
93. Preventza O, Cervera R, Cooley DA, et al. Acute type I aortic dissection: traditional versus hybrid repair with antegrade stent delivery to the descending thoracic aorta. J Thorac Cardiovasc Surg. 2014; 148: 119 - 125.
94. Roselli EE, Idrees JJ, Bakaeen FG, et al. Evolution of simplified frozen elephant trunk repair for acute DeBakey type I dissection: midterm outcomes. Ann Thorac Surg. 2018; 105: 749 - 755.
95. Amis ES Jr, Butler PF, American College of Radiology. ACR white paper on radiation dose in medicine: three years later. J Am Coll Radiol. 2010; 7: 865 - 870.
96. Brenner DJ, Hall EJ. Computed tomography - an increasing source of radiation exposure. N Engl J Med. 2007; 357: 2277 - 2284.
97. Costello JE, Cecava ND, Tucker JE, et al. CT radiation dose: current controversies and dose reduction strategies. AJR Am J Roentgenol. 2013; 201: 1283 - 1290.
98. Georgiadis GS, Antoniou GA, Georgakarakos EI, et al. Surgical or endovascular therapy of abdominal penetrating aortic ulcers and their natural history: a systematic review. J Vasc Interv Radiol. 2013; 24: 1437 - 1449. e1433.
99. Georgiadis GS, Trellopoulos G, Antoniou GA, et al. Endovascular therapy for penetrating ulcers of the infrarenal aorta. ANZ J Surg. 2013; 83: 758 - 763.
100. Salim S, Locci R, Martin G, et al. Short- and long-term outcomes in isolated penetrating aortic ulcer disease. J Vasc Surg. 2020; 72: 84 - 91.
101. Benedetto U, Mohamed H, Vitulli P, et al. Axillary versus femoral arterial cannulation in type A acute aortic dissection: evidence from a meta-analysis of comparative studies and adjusted risk estimates. Eur J Cardiothorac Surg. 2015; 48: 953 - 959.
102. Ren Z, Wang Z, Hu R, et al. Which cannulation (axillary cannulation or femoral cannulation) is better for acute type A aortic dissection repair? A metaanalysis of nine clinical studies. Eur J Cardiothorac Surg. 2015; 47: 408 - 415.
103. Wiedemann D, Kocher A, Dorfmeister M, et al. Effect of cerebral protection strategy on outcome of patients with Stanford type A aortic dissection. J Thorac Cardiovasc Surg. 2013; 146: 647 - 655. e641.
104. Preventza O, Simpson KH, Cooley DA, et al. Unilateral versus bilateral cerebral perfusion for acute type A aortic dissection. Ann Thorac Surg. 2015; 99: 80 - 87.
105. Samanidis G, Kanakis M, Khoury M, et al. Antegrade and retrograde cerebral perfusion during acute type A aortic dissection repair in 290 patients. Heart Lung Circ. 2021; 30: 1075 - 1083.
106. Jormalainen M, Raivio P, Mustonen C, et al. Direct aortic versus peripheral arterial cannulation in surgery for type A aortic dissection. Ann Thorac Surg. 2020; 110: 1251 - 1258.
107. Kreibich M, Chen Z, Rylski B, et al. Outcome after aortic, axillary, or femoral cannulation for acute type A aortic dissection. J Thorac Cardiovasc Surg. 2019; 158: 27 - 34. e29.
108. Preventza O, Bakaeen FG, Stephens EH, et al. Innominate artery cannulation: an alternative to femoral or axillary cannulation for arterial inflow in proximal aortic surgery. J Thorac Cardiovasc Surg. 2013; 145: S191 - S196.
109. Reece TB, Tribble CG, Smith RL, et al. Central cannulation is safe in acute aortic dissection repair. J Thorac Cardiovasc Surg. 2007; 133: 428 - 434.
110. Khaladj N, Shrestha M, Peterss S, et al. Ascending aortic cannulation in acute aortic dissection type A: the Hannover experience. Eur J Cardiothorac Surg. 2008; 34: 792 - 796; discussion 796.
111. Frederick JR, Yang E, Trubelja A, et al. Ascending aortic cannulation in acute type A dissection repair. Ann Thorac Surg. 2013; 95: 1808 - 1811.
112. Richens D, Kotidis K, Neale M, Oakley C, Fails A. Rupture of the aorta following road traffic accidents in the United Kingdom 1992 - 1999. The results of the cooperative crash injury study. Eur J Cardiothorac Surg 2003; 23: 143 - 148.
113. Neschis DG, Scalea TM, Flinn WR, Griffith BP. Blunt aortic injury. N Engl J Med 2008; 359: 1708 - 1716.
114. Azizzadeh A, Keyhani K, Miller CC 3rd, Coogan SM, Safi HJ, Estrera AL. Blunt traumatic aortic injury: initial experience with endovascular repair. J Vasc Surg 2009; 49: 1403 - 1408.
115. Fabian TC, Davis KA, Gavant ML, Croce MA, Melton SM, Patton JH Jr., Haan CK, Weiman DS, Pate JW. Prospective study of blunt aortic injury: helical CT is diagnostic and antihypertensive therapy reduces rupture. Ann Surg 1998; 227: p666 - 676; discussion 676 - 677.
116. Fabian TC, Richardson JD, Croce MA, Smith JS Jr, Rodman G Jr, Kearney PA, Flynn W, Ney AL, Cone JB, Luchette FA, Wisner DH, Scholten DJ, Beaver BL, Conn AK, Coscia R, Hoyt DB, Morris JA Jr, Harviel JD, Peitzman AB, Bynoe RP, Diamond DL, Wall M, Gates JD, Asensio JA, McCarthy MC, Girotti MJ, Van Wijngaarden M, Cogbill TH, Levison MA, Aprahamian C, Sutton JE Jr., Allen CF, Hirsch EF, Nagy K, Bachulis BL, Bales CR, Shapiro MJ, Metzler MH, Conti VR, Baker CC, Bannon MP, Ochsner MG, Thomason MH, Hiatt JR, O'Malley K, Obeid FN, Gray P, Bankey PE, Knudson MM, Dyess DL, Enderson BL. Prospective study of blunt aortic injury: Multicenter Trial of the American Association for the Surgery of Trauma. J Trauma 1997; 42: p374 - 380; discussion 380 - 383.
117. Mosquera VX, Marini M, Muniz J, Asorey-Veiga V, Adrio-Nazar B, Boix R, Lopez-Perez JM, Pradas-Montilla G, Cuenca JJ. Traumatic aortic injury score (TRAINS): an easy and simple score for early detection of traumatic aortic injuries in major trauma patients with associated blunt chest trauma. Intensive Care Med 2012; 38: 1487 - 1496.
118. Smith MD, Cassidy JM, Souther S, Morris EJ, Sapin PM, Johnson SB, Kearney PA. Transesophageal echocardiography in the diagnosis of traumatic rupture of the aorta. N Engl J Med 1995; 332: 356 - 362.
119. Vignon P, Gueret P, Vedrinne JM, Lagrange P, Cornu E, Abrieu O, Gastinne H, Bensaid J, Lang RM. Role of transesophageal echocardiography in the diagnosis and management of traumatic aortic disruption. Circulation 1995; 92: 2959 - 2968.
120. Pate JW, Gavant ML, Weiman DS, et al. Traumatic rupture of the aortic isthmus: program of selective management. World J Surg. 1999; 23: 59 - 63.
121. Lee WA, Matsumura JS, Mitchell RS, et al. Endovascular repair of traumatic thoracic aortic injury: clinical practice guidelines of the Society for Vascular Surgery. J Vasc Surg. 2011; 53: 187 - 192.
122. DuBose JJ, Leake SS, Brenner M, et al. Contemporary management and outcomes of blunt thoracic aortic injury: a multicenter retrospective study. J Trauma Acute Care Surg. 2015; 78: 360 - 369.
123. Fortuna GR Jr, Perlick A, DuBose JJ, et al. Injury grade is a predictor of aortic-related death among patients with blunt thoracic aortic injury. J Vasc Surg. 2016; 63: 1225 - 1231.
124. Rabin J, DuBose J, Sliker CW, et al. Parameters for successful nonoperative management of traumatic aortic injury. J Thorac Cardiovasc Surg. 2014; 147: 143 - 149.
125. Starnes BW, Lundgren RS, Gunn M, et al. A new classification scheme for treating blunt aortic injury. J Vasc Surg. 2012; 55: 47 - 54.
126. Harris DG, Rabin J, Starnes BW, et al. Evolution of lesion-specific management of blunt thoracic aortic injury. J Vasc Surg. 2016; 64: 500 - 505.
127. Gavant ML. Helical CT grading of traumatic aortic injuries. Impact on clinical guidelines for medical and surgical management. Radiol Clin North Am. 1999; 37: 553 - 574, vi.
128. Xenos ES, Abedi NN, Davenport DL, et al. Metaanalysis of endovascular vs open repair for traumatic descending thoracic aortic rupture. J Vasc Surg. 2008; 48: 1343 - 1351.
129. Grigorian A, Spencer D, Donayre C, et al. National trends of thoracic endovascular aortic repair versus open repair in blunt thoracic aortic injury. Ann Vasc Surg. 2018; 52: 72 - 78.
130. Murad MH, Rizvi AZ, Malgor R, et al. Comparative effectiveness of the treatments for thoracic aortic transection [corrected]. J Vasc Surg. 2011; 53: 193 - 199. e1 - 21.
131. Jacob-Brassard J, Salata K, Kayssi A, et al. A systematic review of nonoperative management in blunt thoracic aortic injury. J Vasc Surg. 2019; 70: 1675 - 1681. e6.
132. Erbel R, Bednarczyk I, Pop T, Todt M, Henrichs KJ, Brunier A, Thelen M, Meyer J. Detection of dissection of the aortic intima and media after angioplasty of coarctation of the aorta. An angiographic, computer tomographic, and echocardiographic comparative study. Circulation. 1990; 81: 805 - 814.
133. Holzer R, Qureshi S, Ghasemi A, Vincent J, Sievert H, Gruenstein D, Weber H, Alday L, Peirone A, Zellers T, Cheatham J, Slack M, Rome J. Stenting of aortic coarctation: acute, intermediate, and long-term results of a prospective multi-institutional registry: Congenital Ardiovascular Interventional Study Consortium (CCISC). Catheter Cardiovasc Interv. 2010; 76: 553 - 563.
134. Piffaretti G, Mariscalco G, Tozzi M, Bruno VD, Sala A, Castelli P. Acute iatrogenic type A aortic dissection following thoracic aortic endografting. J Vasc Surg. 2010; 51: 993 - 999.
135. Gerber RT, Osborn M, Mikhail GW. Delayed mortality from aortic dissection post transcatheter aortic valve implantation (TAVI): the tip of the iceberg. Catheter Cardiovasc Interv. 2010; 76: 202 - 204.
136. Dunning DW, Kahn JK, Hawkins ET, O'Neill WW. Iatrogenic coronary artery dissections extending into involving the aortic root. Catheter Cardiovasc Interv. 2000; 51: 387 - 393.
137. Gomez-Moreno S, Sabate M, Jimenez-Quevedo P, Vazquez P, Alfonso F, Angiolillo DJ, Hernandez-Antolin R, Moreno R, Banuelos C, Escaned J, Macaya C. Iatrogenic dissection of the ascending aorta following heart catheterisation: incidence, management and outcome. Eur Intervention. 2006; 2: 197 - 202.
138. Yip HK, Wu CJ, Yeh KH, Hang CL, Fang CY, Hsieh KY, Fu M. Unusual complication of retrograde dissection to the coronary sinus of valsalva during percutaneous revascularization: a singlecenter experience and literature review. Chest. 2001; 119: 493 - 501.
139. Leontyev S, Borger MA, Legare JF, Merk D, Hahn J, Seeburger J, Lehmann S, Mohr FW. Iatrogenic type A aortic dissection during cardiac procedures: early and late outcome in 48 patients. Eur J Cardiothorac Surg. 2012; 41: 641 - 646.
140. Lansman SL, Goldberg JB, Kai M, et al. Aortic surgery in pregnancy. J Thorac Cardiovasc Surg. 2017; 153: S44 - S48.
141. Zhu JM, Ma WG, Peterss S, et al. Aortic dissection in pregnancy: management strategy and outcomes. Ann Thorac Surg. 2017; 103: 1199 - 1206.
142. Yates MT, Soppa G, Smelt J, et al. Perioperative management and outcomes of aortic surgery during pregnancy. J Thorac Cardiovasc Surg. 2015; 149: 607 - 610.
143. Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, et al. 2018 ESC guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J. 2018; 39: 3165 - 3241.
144. Aizawa K, Kawahito K, Misawa Y. Long-term outcomes of tear-oriented ascending/hemiarch replacements for acute type A aortic dissection. Gen Thorac Cardiovasc Surg. 2016; 64: 403 - 408.
145. Bajona P, Quintana E, Schaff HV, et al. Aortic arch surgery after previous type A dissection repair: results up to 5 years. Interact Cardiovasc Thorac Surg. 2015; 21: 81 - 85; discussion 85 - 86.
146. Kimura N, Itoh S, Yuri K, et al. Reoperation for enlargement of the distal aorta after initial surgery for acute type A aortic dissection. J Thorac Cardiovasc Surg. 2015; 149 (suppl 2): S91 - S98. e1.
147. Arafat A, Roselli EE, Idrees JJ, et al. Stent grafting acute aortic dissection: comparison of DeBakey extent IIIA versus IIIB. Ann Thorac Surg. 2016; 102: 1473 - 1481.
148. Stelzmueller ME, Nolz R, Mahr S, et al. Thoracic endovascular repair for acute complicated type B aortic dissections. J Vasc Surg. 2019; 69: 318 - 326.
149. Huang W, Yang F, Luo J, et al. Outcomes and morphologic changes of immediate type IA endoleak following endovascular repair of acute type B aortic dissection. Ann Vasc Surg. 2015; 29: 174 - 182.
150. Akin I, Kische S, Rehders TC, et al. Thoracic endovascular stent-graft therapy in aortic dissection. Curr Opin Cardiol. 2010; 25: 552 - 559.
151. Wang H, Wagner M, Benrashid E, et al. Outcomes of reoperation after acute type A aortic dissection: implications for index repair strategy. J Am Heart Assoc. 2017; 6: e006376.
152. Malvindi PG, van Putte BP, Sonker U, et al. Reoperation after acute type A aortic dissection repair: a series of 104 patients. Ann Thorac Surg. 2013; 95: 922 - 927.
153. Georgiadis GS, Antoniou GA, Georgakarakos EI, et al. Surgical or endovascular therapy of abdominal penetrating aortic ulcers and their natural history: a systematic review. J Vasc Interv Radiol. 2013; 24: 1437 - 1449. e1433.
154. Georgiadis GS, Trellopoulos G, Antoniou GA, et al. Endovascular therapy for penetrating ulcers of the infrarenal aorta. ANZ J Surg. 2013; 83: 758 - 763.
155. D'Annoville T, Ozdemir BA, Alric P, et al. Thoracic endovascular aortic repair for penetrating aortic ulcer: literature review. Ann Thorac Surg. 2016; 101: 2272 - 2278.
156. Yang L, Zhang QY, Wang XZ, et al. Long-term imaging evolution and clinical prognosis among patients with acute penetrating aortic ulcers: a retrospective observational study. J Am Heart Assoc. 2020; 9: e014505.
157. Gifford SM, Duncan AA, Greiten LE, et al. The natural history and outcomes for thoracic and abdominal penetrating aortic ulcers. J Vasc Surg. 2016; 63: 1182 - 1188.
158. Tollenaar JL, Harris KM, Upchurch GR Jr, et al. The differences and similarities between intramural hematoma of the descending aorta and acute type B dissection. J Vasc Surg. 2013; 58: 1498 - 1504.
159. Hata M, Hata H, Sezai A, et al. Optimal treatment strategy for type A acute aortic dissection with intra-mural hematoma. J Thorac Cardiovasc Surg. 2014; 147: 307 - 311.
160. Matsushita A, Fukui T, Tabata M, et al. Preoperative characteristics and surgical outcomes of acute intra-mural hematoma involving the ascending aorta: a propensity score-matched analysis. J Thorac Cardiovasc Surg. 2016; 151: 351 - 358.
161. Sandhu HK, Tanaka A, Charlton-Ouw KM, et al. Outcomes and management of type A intramural hematoma. Ann Cardiothorac Surg. 2016; 5: 317 - 327.
162. Schoenhoff FS, Zanchin C, Czerny M, et al. Aorta related and all-cause mortality in patients with aortic intramural haematoma. Eur J Vasc Endovasc Surg. 2017; 54: 447 - 453.
163. Chakos A, Twindyawardhani T, Evangelista A, et al. Endovascular versus medical management of type B intramural hematoma: a meta-analysis. Ann Cardiothorac Surg. 2019; 8: 447 - 455.
164. MoralS,  H, Avegliano G, et al. Clinical implications of focal intimal disruption in patients with type B intramural hematoma. J Am Coll Cardiol. 2017; 69: 28 - 39.
H, Avegliano G, et al. Clinical implications of focal intimal disruption in patients with type B intramural hematoma. J Am Coll Cardiol. 2017; 69: 28 - 39.
165. Moral S, Ballesteros E, Roque M, et al. Intimal disruption in type B aortic intramural hematoma. Does size matter? A systematic review and meta-analysis. Int J Cardiol. 2018; 269: 298 - 303.
166. Shalhoub S, Starnes BW, Brenner ML, et al. Blunt abdominal aortic injury: a Western Trauma Association multicenter study. J Trauma Acute Care Surg. 2014; 77: 879 - 885; discussion 885.
167. Norii T, Crandall C, Terasaka Y. Survival of severe blunt trauma patients treated with resuscitative endovascular balloon occlusion of the aorta compared with propensity score-adjusted untreated patients. J Trauma Acute Care Surg. 2015; 78: 721 - 728
168. Сосудистая хирургия по Хаймовичу. Руководство под редакцией. Ашер Э., Бином 2010.
169. Болезни сердечно-сосудистой системы: клиника, диагностика и лечение: учеб. пособие/Д. И. Трухан, С. Н. Филимонов. - Санкт-Петербург: СпецЛит, 2016. - 319 с.
170. Медицинская лабораторная диагностика: программы и алгоритмы [Электронныи ресурс]/под ред. А.И. Карпищенко - М.: ГЭОТАР-Медиа, 2014. - http://www.studentlibrary.ru/book/ISBN9785970429587.html
171. Thomas E. MacGillivray, MD, Thomas G. Gleason, MD, Himanshu J. Patel, MD et al. The Society of Thoracic Surgeons/American Association for Thoracic Surgery Clinical Practice Guidelines on the Management of Type B Aortic Dissection. Ann Thorac Surg 2022; 113: 1073 - 92
172. S. Christopher Malaisrie, MD,a Wilson Y. Szeto, MD,b Monika Halas, MD, a Leonard N. Girardi, MD,c Joseph S. Coselli et.al. 2021 The American Association for Thoracic Surgery expert consensus document: Surgical treatment of acute type A aortic dissection. The Journal of Thoracic and Cardiovascular Surgery c Volume 162, Number 3: 735 - 758
173. Eric M Isselbacher, Ourania Preventza, James Hamilton Black Iii, John G Augoustides, Adam W Beck, Michael A Bolen et.al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022 Dec 13; 80(24): e223 - e393.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Экспертная группа по подготовке рекомендаций:
Куратор рабочей группы: Аракелян В.С., д.м.н. (Москва).
Ответственные исполнители: Мироненко В.А., д.м.н., (Москва),
Папиташвили В.Г., к.м.н. (Москва).
Ответственный секретарь: Кокоев М.Б., к.м.н, Хон В.Л., к.м.н. (Москва).
Члены экспертной группы:
С.А. Абугов (Москва),
Т.Б. Аверина (Москва),
Б.А. Аксельрот (Москва),
Р.С. Акчурин (Москва)
Б.Г. Алекян (Москва),
В.С. Аракелян (Москва),
Ю.В. Белов (Москва),
А.Н. Вачев (Самара),
М.Л. Гордеев (Санкт-Петербург),
Р.К. Джорджикия (Казань),
А.А. Дюжиков (Ростов-на-Дону),
И.А. Ерошкин (Москва),
Т.Э. Имаев (Москва),
З.А. Кавтеладзе (Москва),
А.М. Караськов (Москва),
С.А. Ковалев (Воронеж),
Л.С. Локшин (Москва),
В.А. Мироненко (Москва),
К.В. Петросян (Москва),
Е.В. Росейкин (Пенза),
М.М. Рыбка (Москва),
В.В. Соколов (Москва),
А.В. Троицкий (Москва),
А.А. Фокин (Челябинск),
И.Е. Чазова (Москва),
Э.Р. Чарчян (Москва),
И.И. Чернов (Астрахань),
А.М. Чернявский (Новосибирск),
А.В. Чупин (Москва),
К.В. Шаталов (Москва),
В.Н. Шиповский (Москва),
Е.В. Шляхто (Санкт-Петербург),
Ю.А. Шнейдер (Калининград).
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория разработанных клинических рекомендаций:
1. Врач-сердечно-сосудистый хирург
2. Врач-торакальный хирург
3. Врач-хирург
4. Врач ультразвуковой диагностики
5. Врач-рентгенолог
Методы сбора/селекции доказательств: поиск в электронных базах данных
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой рекомендаций являются публикации, включенные в базы данных PubMed, Scopus, Google Scholar. Глубина поиска составила 30 лет.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
Уровни достоверности доказательств (УДД)
Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации" (зарегистрирован 08.05.2019 N 54588)
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендации (УРР)
Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации" (зарегистрирован 08.05.2019 N 54588)
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Связанные документы
1. Закон Об основах охраны здоровья граждан в Российской Федерации (ФЗ от 21.11.2011 N 323-ФЗ)
2. Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Минздрава России от 15.11.2012 N 918н)
3. Приказ Минтруда России от 26.07.2024 N 374н "Об утверждении классификаций и критериев, используемых при осуществлении медико-социальной экспертизы граждан федеральными учреждениями медико-социальной экспертизы" (Зарегистрировано в Минюсте России 23.08.2024 N 79273)
Порядок обновления клинических рекомендаций
Клинические рекомендации обновляются каждые 3 года.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Размеры ПАЯ
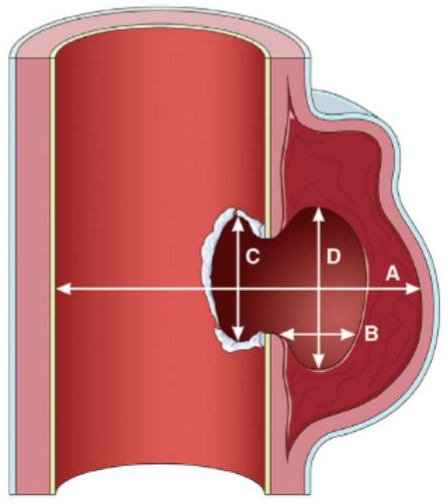
A - максимальный диаметр аорты в области язвы (от дна язвы до противоположной стенки), B - глубина язвы, C - протяженность дефекта интимы в области язвы, D - максимальная ширина язвы внутри аортальной стенки (адаптировано из [157])
Классификация ТПА
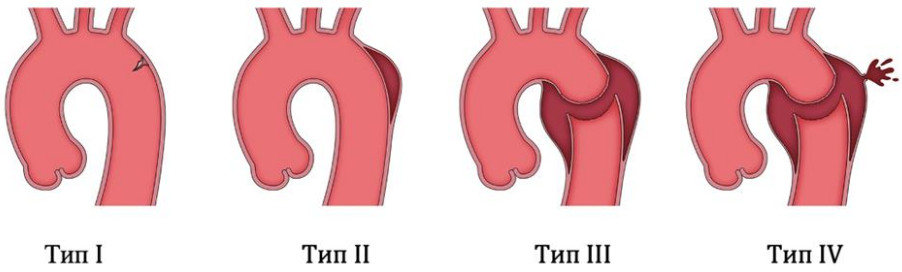
Травматическое повреждение аорты классифицируются на основании изменений, выявленных при диагностической визуализации: 1 - разрыв интимы и/или лоскут интимы, 2 - интрамуральная гематома, 3 - надрыв аортальной стенки с формированием псевдоаневризмы, 4 - свободный разрыв аортальной стенки (адаптировано из [114]).
Цели начальной медикаментозной терапии у пациентов с нормальным или повышенным артериальным давлением должны быть сосредоточены на снижении напряжения на стенки аорты, подавлении распространения ложного просвета и в конечном счете предотвращении разрыва. Силы, остро влияющие на процесс расслоения, включают частоту сердечных сокращений, артериальное давление и скорость сокращения желудочков. Эти параметры могут быть стабилизированы путем ранней блокады до целевых значений систолического артериального давления от 100 до 120 мм рт. ст. и частоты сердечных сокращений ниже 60 ударов в минуту. Благодаря уменьшению постнагрузки и снижению скорости потребления кислорода, антиимпульсной терапии (антигипертензивные средства) также обеспечивает улучшение перфузии миокарда. Типичными агентами являются внутривенные пропранолол, эсмолол, или метопролол**.
Эсмолол имеет уникально короткий период полувыведения, а бета-адреноблокатор с присущей ему частичной симпатомиметической активностью, дает мощное преимущество в достижении контроля частоты сердечных сокращений и артериального давления, потенциально снижая потребность в дополнительных препаратах. Некоторыми противопоказаниями к применению бета-адреноблокаторов являются астма, хроническая обструктивная болезнь легких или атриовентрикулярная блокада. Потенциальными альтернативами у пациентов с противопоказаниями или у тех, кто не может переносить бета-адреноблокаторы, являются недигидропиридиновые блокаторы кальциевых каналов (производные фенилалкиламина и бензотиазепина) - верапамил** или дилтиазем. Оба препарата следует применять с осторожностью в условиях тяжелой АН, поскольку они могут вызвать рефлекторную тахикардию.
Дополнительные препараты могут потребоваться, если артериальная гипертензия невосприимчива к одному препарату. Периферические вазодилататоры следует применять с осторожностью, предварительно установив хронотропный контроль с помощью бета-адреноблокаторов, чтобы избежать рефлекторной тахикардии. Внутривенное введение нитропруссида натрия дигидрата также эффективно применялось в условиях острого РА, однако токсичность его основных метаболитов (цианида и тиоционата) при длительном введении является серьезным побочным эффектом.
Ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы рецепторов ангиотензина также являются разумными вариантами, но их труднее титровать.
Внутривенное введение опиоидов следует начинать как можно раньше после постановки диагноза и быстро подбирать дозы для облегчения боли.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Алгоритмы ведения пациентов с ОРА типа A
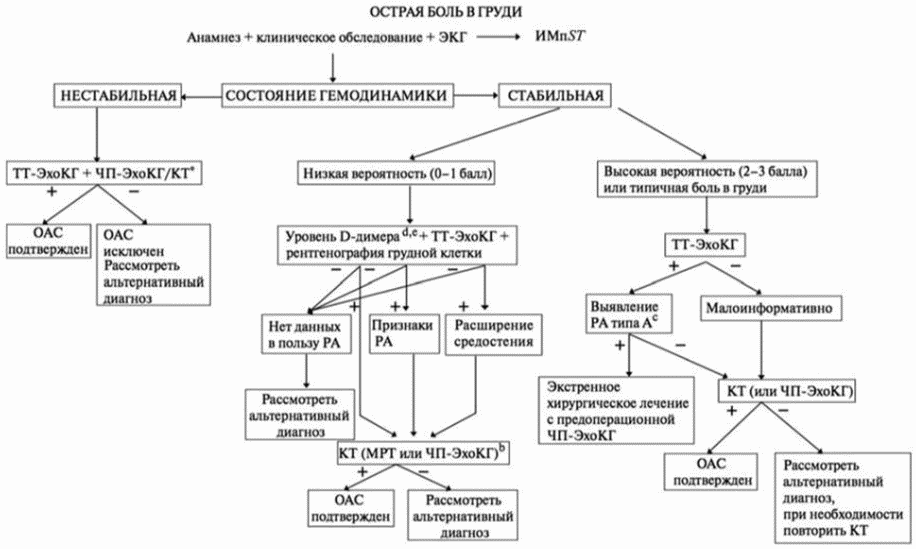
Алгоритмы ведения пациентов с РА типа B
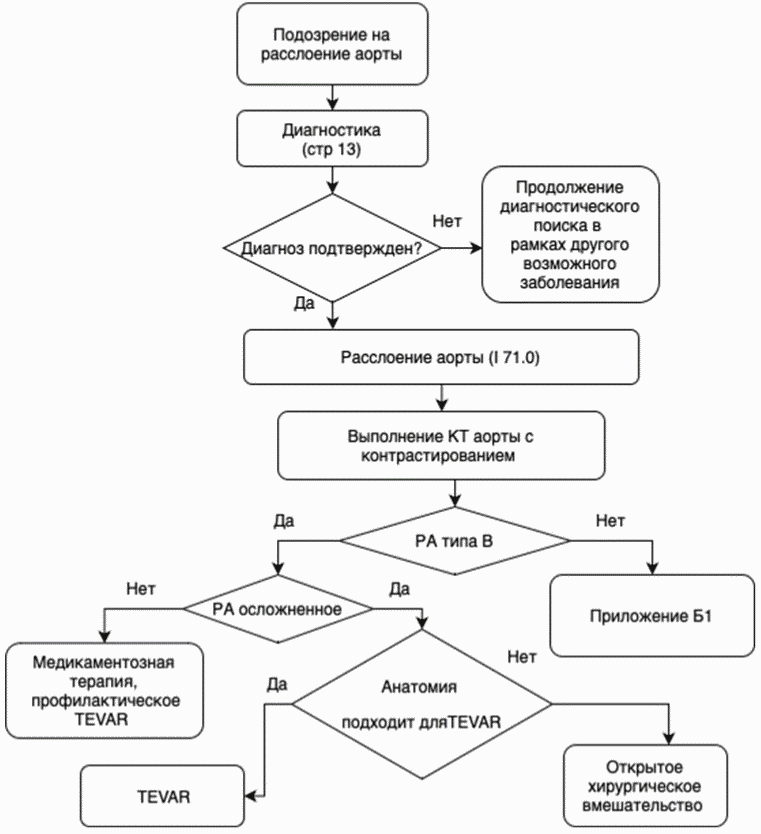
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое расслоение аорты и как он возникает?
Расслоение аорты - это разрушение среднего слоя стенки аорты, вызванного внутристеночным попаданием крови, с последующим разделением/расслоением слоев стенки аорты и формированием двух просветов с/без сообщения между ними.
Расслоение аорты может также распространяться на ветви внутренних органов. Другие осложнения включают тампонаду сердца, недостаточность аортального клапана и синдром недостаточного кровоснабжения органов.
Такие изменения чаще всего встречаются у курильщиков, больных сахарным диабетом, при повышенном артериальном давлении и при повышенном содержании в крови жиров.
Считается, что этиология расслоения аорты связана с основной слабостью в средней оболочке (медии) аорты, усугубленной разрывом внутренней оболочки (интимы), разрывом vaso vasorum (интрамуральной гематомой) или разрывом атеросклеротической бляшки/язвы.
Среди других причин может быть врожденная дисплазия соединительной ткани ("слабость") стенки сосуда.
Что может произойти без лечения?
Естественное течение этого заболевания связано с высоким риском возникновения грозных осложнений:
Прогрессирование нарушения кровообращения внутренних органов с развитием полиорганной недостаточности, вплоть до летального исхода
Развитие аневризмы аорты, стенки которой очень тонкие и может внезапно произойти ее разрыв, следствием чего является острое, почти всегда смертельное кровотечение;
Хирургическое лечение позволяет избежать этих опасностей.
Как проводится операция?
Оперативное вмешательство проводится под наркозом. Риск анестезии вам детально объяснит врач-анестезиолог. Целью операции является устранение симптомов недостаточности кровообращения внутренних органов (головной мозг, верхние и нижние конечности, почки, органы ЖКТ, сердце) и профилактика развития осложнений (развитие аневризмы аорты, прогрессирование расслоения, разрывы стенки аорты и др.). Для этого через разрез (по средней линии живота, боковым разрезом через живот, рассечение грудины) обнажается аорта, пережимается аорта, пришивается синтетический протез для устранения последствий расслоения аорты. Протезы аорты и артерий не отторгаются и верно служат в течение всей жизни больного. При малоинвазивном вмешательстве, через разрез на бедре в просвет аорты устанавливается специальный протез (стент-граф).
Для отсасывания раневого секрета в ране оставляются временные дренажи (трубочки). После завершения операции иногда проводится рентгенологическое исследование с контрастным веществом.
Может понадобиться увеличение объема операции.
Врач обсуждает с вами этапы оперативного вмешательства, однако во время операции может возникнуть необходимость в проведении дополнительных незапланированных этапов. На это также должно быть получено ваше согласие; в противном случае, операция будет остановлена. Повторная операция будет проводиться после дополнительного обсуждения с вами, что увеличит сроки лечения и повысит вероятность опасных осложнений и неблагоприятного исхода.
Какие могут быть осложнения?
В отдельных случаях при тяжелых операциях могут возникать осложнения.
Общие осложнения:
Послеоперационные кровотечения, крупные гематомы;
Инфекционные осложнения. Возникает нагноение раны, которое требует дальнейших лечебных мероприятий. При этом раны заживают долго, с образованием келоидных рубцов;
Образование тромбов в венах с возможной эмболией легочных артерий. При повышенном риске вы будете получать медикаментозные препараты с профилактической целью, которые понижают свертываемость крови. При применении этих препаратов может повыситься склонность к кровотечениям. При инъекции этих препаратов, так же как и при инъекции любых других, в единичных случаях могут возникать абсцессы;
Сдавление нервов и мягких тканей из-за необходимого при операции длительного неподвижного положения тела. Эти осложнения встречаются очень редко и, как правило, проходят в течение недели. В отдельных случаях могут оставаться жалобы (например, чувство онемения) и рубцы. Также может встречаться поражение кожи дезинфектантами;
Переливание крови или компонентов крови, которое может потребоваться при определенных обстоятельствах. Крайне редко может возникнуть заражение (например, вирусами гепатита, ВИЧ/СПИД);
Реакции гиперчувствительности (аллергии) на медикаменты, средства для наркоза и рентгенологического исследования, которые могут проявляться, например, зудом. Крайне редко встречаются сильно выраженные реакции, такие как коллапс, судороги и нарушение дыхания, которые требуют стационарного лечения и могут приводить к необратимым последствиям;
Избыточное рубцевание. При соответствующей предрасположенности могут, как и при другой операции, возникать толстые бугристые и/или болезненные рубцы (келоиды);
Специфические осложнения:
Повреждения соседних органов таких, как кишечник, мочеточник, мочевой пузырь и т.д., которое потребует соответствующего расширения операции;
Редко может возникнуть ишемия спинного мозга, временная или постоянная, причиной которой является ухудшение кровоснабжения спинного мозга при пережатии аорты;
Почечная недостаточность. Из-за пережатия аорты выше отхождения почечных артерий ограничивается кровоснабжение почек, следствием чего является почечная недостаточность. Может возникнуть необходимость в применении методов очистки крови (диализ);
Ухудшение кровоснабжения кишечника и печени из-за пережатия аорты во время операции. Иногда может потребоваться удаление участка кишки. В чрезвычайных ситуациях может потребоваться создание искусственного ануса (выведение кишки на переднюю брюшную стенку);
Закупорка (тромбоз), эмболия протеза, ниже и вышележащих участков сосуда. Следствием является уменьшение кровоснабжения органов и рецидив заболевания. В этом случае будет обсуждаться необходимость оперативного или консервативного лечения.
Инфицирование протеза, что может привести к кровотечению из швов протеза; при прогрессировании инфекции может потребоваться удаление протеза, следствием чего станет значительное ухудшение кровоснабжения органов.
Послеоперационное расширение аорты в месте прикрепления протеза к аорте; большое расширение должно быть удалено повторным оперативным вмешательством.
Все вышеназванные осложнения могут возникнуть после операции. Но серьезные осложнения встречаются редко: при повторных операциях (если возникает рецидив), при прогрессировании болезни, при избыточной массе тела или при наличии сопутствующих заболеваний, курении.
Каковы перспективы?
В большинстве случаев операция приводит к улучшению состояния и исчезновению жалоб.
Для сохранения положительного результата операции необходимо ваше активное участие. Требуется лечение и профилактика прогрессирования основного заболевания. Для этого вы должны полностью отказаться от курения, обсудить с вашим лечащим врачом специальную диету и возможность устранения факторов риска.
На что следует обратить внимание?
Особенно важными являются контрольные обследования после операции для своевременного выявления оценки состояния оперированного сосуда и выявлении возможных осложнений.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не предусмотрено.
