"Клинические рекомендации "Легочная гипертензия у детей"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ У ДЕТЕЙ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I27.0, I27.2, I27.8, I27.9
Год утверждения (частота пересмотра): 2025 Пересмотр не позднее: 2027
ID: 939_1
Возрастная категория: Дети
Специальность:
Разработчик клинической рекомендации Ассоциация сердечно-сосудистых хирургов России, Всероссийская общественная организация "Ассоциация детских кардиологов России", Союз педиатров России, Общероссийская общественная организация Педиатрическое респираторное общество
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
аЛАГ - ассоциированная легочная артериальная гипертензия
АРЭ - антагонист рецепторов эндотелина
АЛТ - аланинаминотрансфераза
АС - баллонная атрисептостомия
АСТ - аспартатаминотрансфераза
БКК - блокатор кальциевых каналов
БЛД - бронхолегочная дисплазия
ВИЧ - вирус иммунодефицита человека
ВПС - врожденный порок сердца
ВОБЛ - веноокклюзионная болезнь легких
ДЗЛА - давление заклинивания легочной артерии
ДН - дыхательная недостаточность
ДЛА - давление в легочной артерии
ЗСТ - заболевания соединительной ткани
иЛАГ - идиопатическая легочная артериальная гипертензия
ИЛСС - индекс легочного сосудистого сопротивления
иФДЭ-5 - ингибитор фосфодиэстеразы 5 типа
КТ - компьютерная томография высокого разрешения
ЛАГ - легочная артериальная гипертензия
ЛАГ-ВПС - ЛАГ, ассоциированная с врожденным пороком сердца
ЛАГ-ВПКШ - ЛАГ, ассоциированная с врожденным порто-кавальным шунтированием
ЛАГ-ЗСТ - ЛАГ, ассоциированная с заболеваниями соединительной ткани
ЛВОБ - легочная веноокклюзионная болезнь
ЛГ - легочная гипертензия
ЛСС - легочное сосудистое сопротивление
МКК - малый круг кровообращения
МРТ - магнитно-резонансная томография
МПЗ - миелопролиферативные заболевания
нЛАГ - наследственная легочная артериальная гипертензия
ПГСБЛ - педиатрическая гипертензионная сосудистая болезнь легких
ПЛГН - персистирующая легочная гипертензия новорожденных
ПСС - периферическое сосудистое сопротивление
ППГ - порто-пульмональная гипертензия
рГЦ - растворимая гуанилатциклаза
САД - системное артериальное давление
СД - синдром Дауна
СКА - серповидно-клеточная анемия
СрДЛА - среднее давление в легочной артерии
СИ - сердечный индекс
СЭ - синдром Эйзенменгера
Т6МХ - тест 6-минутной ходьбы
ТПГ - транспульмональный градиент
ХТЭЛГ - хроническая тромбоэмболическая легочная гипертензия
ТЭЛА - тромбоэмболия легочной артерии
ФВ - фракция выброса
ФК - функциональный класс
ХБП - хроническая болезнь почек
ХОБЛ - хроническая обструктивная болезнь легких
ХСН - хроническая сердечная недостаточность
цГМФ - циклический гуанозинмонофосфат
ЧСС - частота сердечных сокращений
ЭКГ - электрокардиография
ЭТ-1 - эндотелин-1
ЭХОКГ - эхокардиография
IP-рецепторы - подкласс мембранных белков, связывающихся с простаноидами
HbS - мутантная форма гемоглобина у больных серповидноклеточной анемией
NT-proBNP - N-терминальный фрагмент мозгового натрийуретического пептида
Qp/Qs - соотношение объемов легочного и системного кровотока
PaO2 - парциальной напряжение кислорода в артериальной крови
SaO2 - насыщение артериальной крови кислородом
TAPSE - систолическая экскурсия фиброзного кольца трикуспидального клапана (tricuspid annular plane systolic excursion)
Термины и определения
Давление заклинивания легочной артерии (ДЗЛА) - это давление, определяемое на конце катетера в момент окклюзии баллоном при катетеризации легочной артерии. В отсутствие препятствия между левым предсердием и левым желудочком ДЗЛА считается равным конечному диастолическому давлению в левом желудочке [1, 2].
Диастолический транспульмональный градиент (ДПГ) - это расчетный показатель, определяемый как разница между диастолическим давлением в легочной артерии и ДЗЛА [2, 3].
Легочная гипертензия (ЛГ) - это состояние, при котором выявляется локальное или диффузное повышение давления в системе малого круга кровообращения выше пороговых значений [1].
Легочная артериальная гипертензия - это прекапиллярная форма легочной гипертензии, при отсутствии заболеваний легких, тромбоэмболии в систему легочной артерии (ТЭЛА), других редких болезней (группа 5) в качестве возможных причин повышения давления в легочной артерии [1].
Легочная гипертензия венозная - это посткапиллярная форма легочной гипертензии [1].
Индекс легочного сосудистого сопротивления (иЛСС) - это расчетный показатель, определяемый по формуле: иЛСС = (срДЛА - ДЗЛА) / СИ МКК [2, 3, 4].
Стратификация риска - это оценка ключевых параметров при прогнозировании развития процесса, исходя из его прошлой истории, с целью принятия наилучшего из возможных решения для оптимизации параметров и влияния на прогноз заболевания [5].
Оценка риска ЛГ - это вероятность того, что в определенный период времени произойдет неблагоприятный исход [5 - 7].
Шкала риска ЛГ - это прогнозируемый риск летального исхода в течение 1 года, определяемый как низкий, средний или высокий [6, 7].
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Легочная гипертензия (ЛГ) у детей - это хроническое прогрессирующее заболевание, характеризующееся пролиферативными изменениями легочных сосудов, повышением легочного сосудистого сопротивления и присоединением правожелудочковой недостаточности.
За последние два десятилетия произошло существенное снижение смертности, ассоциированной с ЛГ у детей и взрослых, обусловленное накоплением знаний об этиологии, вероятных путях патогенеза и патофизиологии заболевания, более точной и своевременной диагностике, лучшей стратификации риска и раннему началу комбинированной фармакотерапии [6 - 9]. Однако 5-летняя выживаемость без трансплантации среди детей и взрослых с идиопатической и наследственной ЛАГ, у больных с синдром Эйзенменгера и персистирующей ЛАГ после коррекции врожденного порока сердца остается низкой и не превышает 80% [10 - 12]. Несмотря на то, что в настоящее время отсутствуют радикальные методы лечения ЛАГ, и заболевание остается неизлечимым, основной целью как общепризнанных, так и экспериментальных вариантов лечения является сдерживание прогрессирования заболевания и облегчение симптомов, снижение смертности и улучшение качества жизни пациентов.
ЛГ - патогенетически сложное, мультифакториальное состояние, в качестве определения имеет гемодинамические критерии. В 2018 г. Всемирный симпозиум по ЛГ модифицировал критерии ЛГ у детей и взрослых [1, 6 - 8]. Исходя из анализа течения болезни и клинических исходов нескольких сотен пациентов, включенных в несколько национальных и международных регистров ЛГ, нижняя граница нормы среднего давления в легочной артерии (СрДЛА) была снижена с 24 до 20 мм рт. ст. [1, 6 - 8, 13]. Установлено, что значения СрДЛА от 20 до 24 мм рт. ст. являются независимыми предикторами ухудшения выживаемости у взрослых лиц с ЛГ [14 - 18]. Поэтому критерием легочной гипертензии является состояние, при котором выявлено повышение СрДЛА более 20 мм рт. ст., определенное методом катетеризации сердца у детей старше 3 месяцев в состоянии покоя при проведении оценки на уровне моря [8, 13].
Прекапиллярная легочная гипертензия у детей - это состояние, соответствующее трем основным и одному дополнительному критериям, определяемым при катетеризации сердца [6, 8, 13]:
1. Среднее давление в легочной артерии составляет > 20 мм рт. ст.
2. Давление заклинивания легочной артерии <= 15 мм рт. ст.
3. Индекс легочного сосудистого сопротивления >= 3 ед. Вуда x м2
4. Диастолический транспульмональный градиент >= 7 мм рт. ст. - дополнительный критерий.
Изолированная посткапиллярная легочная гипертензия у детей [6, 8, 13] - состояние, при котором
1. Среднее давление в легочной артерии составляет > 20 мм рт. ст.
2. Давление заклинивания легочной артерии > 15 мм рт. ст.
3. Индекс легочного сосудистого сопротивления <= 3 ед. Вуда x м2
4. Диастолический транспульмональный градиент < 7 мм рт. ст. - дополнительный критерий.
Комбинированная пре- и посткапиллярная легочная гипертензия [6, 8, 13] - состояние, при котором
1. Среднее давление в легочной артерии составляет > 20 мм рт. ст.
2. Давление заклинивания легочной артерии > 15 мм рт. ст.
3. Индекс легочного сосудистого сопротивления >= 3 ед. Вуда x м2
4. Диастолический транспульмональный градиент >= 7 мм рт. ст. - дополнительный критерий.
Идиопатическая легочная артериальная гипертензия - это прекапиллярная форма ЛГ в отсутствии генетических, хромосомных аномалий или известных триггерных факторов, ассоциирующихся с развитием ЛАГ [9].
Наследственная легочная артериальная гипертензия (нЛАГ) - это прекапиллярная форма ЛГ при наличии у больного двух и более членов семьи с подтвержденным диагнозом ЛАГ или выявлении у больного генетической мутации, или хромосомной аномалии, ассоциирующейся с ЛАГ [9].
Ассоциированная легочная артериальная гипертензия (аЛАГ) - это прекапиллярная форма ЛГ, при которой установлена взаимосвязь с установленным пусковым или триггерным фактором, ассоциирующимся с развития ЛАГ.
Педиатрическая гипертензионная сосудистая болезнь легких - это заболевание, проявляющееся нарушением структуры и роста легочных сосудов, сопровождающееся прогрессирующим повышением легочного сосудистого сопротивления [8, 12, 13].
Гипертензионная сосудистая болезнь легких при бивентрикулярной гемодинамике [8, 12, 13]:
1. Повышении среднего давления в легочной артерии > 20 мм рт. ст.
2. Индекс легочного сосудистого сопротивления >= 3 ед. Вуда x м2
Прекапиллярная легочная гипертензия при ВПС с унивентрикулярной гемодинамикой [8, 12, 13]:
1. Среднее давление в легочной артерии >= 15 мм рт. ст.
2. Индекс легочного сосудистого сопротивления >= 3 ед. Вуда x м2
3. Средний транспульмональный градиент > 6 мм рт. ст. (определяемый как разница среднего ДЛА и давления заклинивания ЛА).
Посткапиллярная легочная гипертензия при ВПС с унивентрикулярной гемодинамикой [8, 12, 13]:
1. Среднее давление в легочной артерии >= 15 мм рт. ст.
2. Индекс легочного сосудистого сопротивления < 3 ед. Вуда x м2
3. Средний транспульмональный градиент <= 6 мм рт. ст.
Синдром Эйзенменгера - необратимая форма ЛАГ при больших интра- и экстракардиальных дефектах с соотношением СрДЛА >= среднему САД, сопровождается реверсивным или двунаправленным сбросом на уровне шунта, цианозом, вторичной компенсаторной полицитемией, гипоксемией и нарушениями функций печени, почек и др. органов и систем [19].
Легочно-гипертензионный криз - резкое повышение давления и сосудистого сопротивления легких у больных с ЛГ с высоким риском кардиоваскулярного коллапса и смерти [20].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Легочная гипертензия - группа тяжелых клинических состояний и заболеваний, объединяемых общим признаком: наличием обструктивного ремоделирования легочного сосудистого русла, в основе которого - морфологическое и структурное повреждение легочных сосудов, приводящее к повышению легочного сосудистого сопротивления, и замедлению перфузии. Увеличение постнагрузки и избыточное напряжение миокарда приводят к нарушению биоэнергетики кардиомиоцитов, запуская целый каскад нейрогормональных, биохимических и иммунологических реакций ремоделирования правого желудочка с последующим присоединением правожелудочковой, а в развернутой стадии - тяжелой бивентрикулярной недостаточности [8, 9, 21, 22]. Снижение легочной перфузии приводит к ухудшению процессов оксигенации, и, как следствие, гипоксемии. Замедленный венозный возврат в сочетании с нарушениями релаксации миокарда левого желудочка из-за его избыточного сдавления правым сопровождается уменьшением системного сердечного выброса и запускает каскад мультисистемных патологических реакций, характерных для хронической гипоперфузии по большому кругу кровообращения. Прогрессирующая правожелудочковая недостаточность в сочетании с хронической гипоксемией и синдромом малого сердечного выброса обуславливает клиническую симптоматику и может быть причиной преждевременной гибели больного [9].
В отличие от взрослых больных, у детей заболевание имеет патогенетические, гемодинамические и клинические особенности, в основе которых фундаментальные отличия растущего и уже сформированного организма. Легочный ангиогенез и органогенез находятся в строгой взаимосвязи. Любые нарушения формирования, роста и развития легочной ткани могут сопровождаться нарушением формирования легочной сосудистой стенки. Также изменения структуры и функции легочных сосудов неизменно сопровождаются периваскулярными нарушениями структуры альвеолярной ткани [22].
ЛГ у детей неразрывно связана с проблемами роста и развития легких, включая многочисленные пренатальные и ранние постнатальные факторы. Развитие ЛГ у новорожденных и младенцев первых месяцев жизни часто связано с нарушением функциональной и структурной адаптации легочного кровообращения во время перехода от внутриутробной жизни к жизни после рождения. Время развития повреждения легочных сосудов является критическим фактором, определяющим последующую реакцию развивающегося легкого на такие неблагоприятные стимулы как гипероксия, гипоксия, объемная перегрузка и гемодинамический стресс, воспалительное и аутоиммунное повреждение как в пре-, так и постнатальный период. Таким образом, для формирования нормальной структуры легких, поддержания должного уровня обмена веществ и газообмена, обеспечения способности переносить повышенные физические нагрузки, требуется адекватный ангиогенез для формирования нормального легочного сосудистого русла [8].
ЛГ может возникать у детей с рядом генетических и хромосомных аномалий (трисомией 13, 18, 21, синдромами CHARGE, Поланда, Адамса-Оливера, Дурсан, Билса, Канту, Ди Джорджи, Нунан, болезнью фон Реклингаузена, ассоциацией VACTERL, нейрофиброматозом I типа, аутоиммунным полиэндокринным синдромом, болезнью Гоше, гликогенозами, митохондриальными заболеваниями и др.) [9, 20 - 26]. Среди генетических синдромов, ассоциированных с ЛГ, наиболее частым является синдром Дауна (СД). Распространенность ЛГ среди детей с СД достигает 25%. Как правило, развитие ЛГ при СД имеет многофакторную этиологию и включает пороки развития, гипоплазию легких, диафрагмальные грыжи, обструктивные заболевания легких, синдром ночного апноэ, предрасположенность к эндотелиальной дисфункции, врожденные желудочно-кишечные заболевания и эндокринные нарушения. Наиболее частым пусковым фактором развития ЛГ при СД являются ВПС [26].
1.2.1. Группа 1. Легочная артериальная гипертензия
Легочная артериальная гипертензия (ЛАГ) является одной из форм "прекапиллярной" легочной гипертензии и включает изолированные формы (идиопатическую и наследственную) и ЛАГ, ассоциированную с системно-легочными шунтами, системными заболеваниями соединительной ткани, ВИЧ инфекцией, портальной гипертензией, шистосомозом, ЛАГ с явными признаками веноокклюзионной болезни/гемангиоматоза легочных капилляров, а также персистирующая легочная гипертензия новорожденных [1, 6, 8, 9, 27, 28].
Основным проявлением всех групп ЛАГ служит легочная васкулопатия, которая сопровождается типичным патоморфологическим паттерном в виде стойкой патологической вазоконстрикции, концентрического ремоделирования, вплоть до полной облитерации легочных сосудов, формированием плексиформных изменений и присоединением периваскулярных воспалительных реакций [21].
Патологические изменения затрагивают преимущественно дистальные легочные артерии (50 - 200 ![]() в диаметре) с вовлечением всех слоев сосудистой стенки, включая гиперплазию интимы, гипертрофию гладких мышечных клеток, фиброз адвентиции с формированием периваскулярных воспалительных инфильтратов и тромботические повреждения in situ, образованием межсосудистых анастомозов замыкающего и гломусного типов [21].
в диаметре) с вовлечением всех слоев сосудистой стенки, включая гиперплазию интимы, гипертрофию гладких мышечных клеток, фиброз адвентиции с формированием периваскулярных воспалительных инфильтратов и тромботические повреждения in situ, образованием межсосудистых анастомозов замыкающего и гломусного типов [21].
Патогенез легочной артериальной гипертензии включает целый каскад взаимосвязанных межмолекулярных и клеточных механизмов, имеющий общие с онкогенезом признаки:
1. Врожденное или приобретенное повреждение эндотелия легочных сосудов, сопровождаемое нарушением функции регуляции сосудистого тонуса в виде нарушения баланса между выработкой вазодилятирующих (оксид азота, вазоинтестинальный пептид, простациклин) и вазоконстрктивных веществ (эндотелин-1, серотонин, тромбоксан A2) с развитием стойкой патологической вазоконстрикции [21, 27 - 33].
2. Нарушение чувствительности эндотелиальных и гладкомышечных клеток к апоптозу под воздействием эндогенных факторов роста, избыточной продукции антиапоптозных протеинов нарушает баланс между клеточной пролиферацией и апоптозом. Избыточная пролиферация эндотелиальных и гладкомышечных клеток сопровождается нарушением их нормальной дифференциации. Трансдифференциация этих клеток в мезенхимильные клетки в сочетании с миграцией фибробластов адвентиции с проникновением в медию и интиму меняют структуру легочной сосудистой стенки [29 - 34].
3. Неоангиогенез с формированием vasa vasorum, неоинтимальной мальформацией с полной или частичной окклюзией сосудов менее чем 500 - 100 ![]() и выключение малых прекапиллярных артерий [35 - 36].
и выключение малых прекапиллярных артерий [35 - 36].
4. Иммунная дизрегуляция обеспечивает воспалительное повреждение эндотелия с активацией провоспалительных цитокинов, которые усиливают адгезию тромбоцитов и лейкоцитов, их субэндотелиальное проникновение в стенку сосуда с развитием всех стадий воспаления вплоть до образования фиброзной ткани и лимфоидным неогенезом [36 - 37].
5. Нарушение функции ионных каналов гладкомышечных клеток с развитием несвоевременной деполяризации участвует в формировании и поддержании патологической вазоконстрикции [38].
Группа ЛАГ включает изолированные, включая идиопатическую и наследственную, формы и ассоциированные формы ЛАГ.
Идиопатическая ЛАГ (иЛАГ) - прекапиллярная форма ЛГ в отсутствие известных или доказанных триггерных факторов, ассоциирующихся с развитием ЛАГ [9].
Идиопатическая ЛАГ является причиной более 50% всех случаев ЛАГ и является диагнозом исключения, требующего обширного диагностического поиска с исключением всех возможных пусковых факторов, состояний и заболеваний, которые могли бы быть причиной развития и/или оказывать существенное влияние на течение ЛАГ, включая генетические мутации и хромосомные аномалии [1, 8, 9, 21, 22, 39].
Наследственная легочная артериальная гипертензия (нЛАГ) - прекапиллярная форма ЛГ при наличии у больного двух и более членов семьи с подтвержденным диагнозом ЛАГ или выявлении у больного генетической мутации или хромосомной аномалии, ассоциирующейся с ЛАГ [1, 8, 9, 21, 22, 39].
У 70% случаев семейных форм и у 40% спорадических случаев иЛАГ у взрослых больных и у 50% и 10%, соответственно, педиатрических пациентов выявляются мутации в гене BMPR2, кодирующего рецептор типа II к протеину костного морфогенеза, относящегося к семейству трансформирующего фактора роста бета 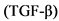 [40, 41]. Для данного вида мутаций характерен аутосомно-доминантный тип наследования с низкой (10 - 20%) пенетрантностью гена. В настоящее время описаны более 300 мутаций в этом гене. В гендерной структуре мутаций в данном гене преобладают мужчины (до 78%). Пораженные мутацией в гене BMPR2, как правило, моложе, и имеют более тяжелое клиническое течение и прогноз [40, 41].
[40, 41]. Для данного вида мутаций характерен аутосомно-доминантный тип наследования с низкой (10 - 20%) пенетрантностью гена. В настоящее время описаны более 300 мутаций в этом гене. В гендерной структуре мутаций в данном гене преобладают мужчины (до 78%). Пораженные мутацией в гене BMPR2, как правило, моложе, и имеют более тяжелое клиническое течение и прогноз [40, 41].
Второй основной мутацией, выявляемой у 7,7% детей с иЛАГ и 8% детей с нЛАГ, является мутация в гене TBX4, наиболее характерная для ЛАГ, манифестирующей в детском возрасте. Ген TBX4, расположенный на 17 хромосоме является членом семейства генов T-box, участвующих в кодировании факторов транскрипции, которые играют важную роль в эмбриогенезе, особенно в развитии и органогенезе легких и нижних конечностей [42, 43]. Мутации TBX4 у пациентов с ЛАГ фенотипически могут проявляться аномалиями скелета, с развитием болезни в широком возрастном диапазоне - от рождения до старческого возраста. Клиническое течение, как правило, тяжелое, обусловлено паренхиматозными заболеваниями легких и легочной гипертензией [42, 43].
Мутации de novo в нескольких генах могут объяснить до 19% педиатрической ЛАГ и обусловлены более редкими генетическими вариантами - в их числе другие гены сигнального пути 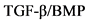 , гены наследственной геморрагической телеангиэктазии (HHT), гены активина A рецептора II типа 1 (ACVRL1) и эндоглина (ENG), эукариотического фактора инициации трансляции (EIF2AK4), ассоциированного с легочной веноокклюзионной болезнью/легочным капиллярным гемангиоматозом, кавеолин-1 (CAV1), гены, кодирующие рецепторы калиевых каналов гладко-мышечных клеток (KCNK3, KCNA5), член подсемейства АТФ-связывающих кассет 8 (ABCC8) [40 - 43].
, гены наследственной геморрагической телеангиэктазии (HHT), гены активина A рецептора II типа 1 (ACVRL1) и эндоглина (ENG), эукариотического фактора инициации трансляции (EIF2AK4), ассоциированного с легочной веноокклюзионной болезнью/легочным капиллярным гемангиоматозом, кавеолин-1 (CAV1), гены, кодирующие рецепторы калиевых каналов гладко-мышечных клеток (KCNK3, KCNA5), член подсемейства АТФ-связывающих кассет 8 (ABCC8) [40 - 43].
ЛАГ, ассоциированная с приемом лекарственных средств или токсическим воздействием
Развитие ЛАГ может быть спровоцировано приемом целого ряда лекарственных препаратов или быть вызвано токсическим воздействием, список которых приведен в таблице 1 [1]. В отсутствие генетической предрасположенности ЛАГ, ассоциированная с лекарственным воздействием, может быть обратима при отмене препарата, явившегося триггером [43, 44].
Таблица 1. Список лекарственных препаратов и токсинов, распределенных в зависимости от степени риска развития легочной артериальной гипертензии [1, 6]
Определенный риск
Вероятный риск
Аминорекс
Бенфлуорекс
Карфилзомиб
Дазатиниб
Дексфенфлурамин
Фенфлурамин
Метамфетамины
Митомицин C
Токсичное рапсовое масло
Алкилирующие средства
Амфетамины
Бевацизумаб
Бортезомиб
Босутиниб
Кокаин
Диазоксид
Противовирусные средства прямого действия против вируса гепатита C (софосбувир)
Indigo naturalis (китайская трава Циндай)
 и
и ![]()
Лефлуномид
l-триптофан
Фенилпропаноламин
Понатиниб
Растворители (трихлорэтилен)
Трава зверобоя продырявленного
Под термином ассоциированные формы ЛАГ (аЛАГ) подразумевают прекапиллярную форму ЛГ с доказанным триггерным фактором, ассоциирующимся с развития ЛАГ и включающую [1, 6, 8]:
1. ВПС (простые пре- и посттрикуспидальные дефекты с исходно артериовенозным сбросом);
2. аутоиммунные заболевания (системные) заболевания соединительной ткани: системная склеродермия, системная красная волчанка, некоторые аутовоспалительные синдромы - моногенная интерферонопатия I типа;
3. синдром приобретенного иммунодефицита при заражении вирусом иммунодефицита человека (ВИЧ);
4. портальную гипертензию;
5. паразитарные заболевания (шистосомоз).
Все группы ассоциированных форм строго различаются по этиологическим признакам, включая факторы, запускающие механизм развития васкулопатии, но патоморфологические признаки ремоделирования легочных сосудов идентичны изолированным формам ЛАГ, хотя различия в степени выраженности некоторых паттернов возможны [21]. Особенностью ассоциированных форм является их развитие на фоне предрасполагающего заболевания, клинические проявления которого "маскируют" проявления ассоциированной ЛАГ, которая вследствие этого диагностируется позже, что снижает эффективность лечения больных и ухудшает их прогноз.
ЛАГ, ассоциированная с ВПС
ВПС, гемодинамика которых может осложниться ЛГ, являются гетерогенной группой, куда входят и простые изолированные дефекты с артериовенозным сбросом, и сложные, комбинированные ВПС, врожденные аномалии, связанные с нарушениями путей притока и оттока левого желудочка, а также врожденные стенозы легочных артерий и ВПС с сегментарной ЛГ [19, 39, 45, 46].
В настоящее время к ЛАГ, ассоциированной с ВПС, относят только простые дефекты с артериовенозным сбросом на уровне перегородок сердца или артериальном уровне. Развитие ЛАГ в данной группе зависит от расположения дефекта (претрикуспидальный или посттрикуспидальный уровень), размера, типа или их комбинации. В основе анатомического разделения - существенные различия в гемодинамике пороков с артериовенозным сбросом между камерами сердца с низким или с высоким давлением соответственно, определяющие темпы развитие легочной васкулопатии и сроки достижения необратимой стадии заболевания [19, 39, 45, 46]. Наличие исходно артериовенозного шунта обеспечивает дополнительный объем, поступающий в правые камеры сердца и, соответственно, увеличивает объем выброса в легочную артерию. Гиперволемия малого круга кровообращения (МКК) является пусковым фактором, запускающим процесс концентрического ремоделирование легочных артерий и артериол. Сужение просвета и снижение податливости легочного сосудистого русла увеличивает легочное сосудистое сопротивление (ЛСС) и постнагрузку на правый желудочек [19, 39, 45, 46].
Претрикуспидальные дефекты с артериовенозным сбросом между камерами или сосудами с низким градиентом давления приводят лишь к объемной перегрузке МКК без немедленного или среднесрочного повышения давления в легочной артерии [45 - 47]. К ним относят частичный аномальный дренаж легочных вен с ДМПП или без него, тотальный аномальный дренаж легочных вен с ДМПП, все виды ДМПП. В отсутствие генетической предрасположенности развитие ЛАГ может начаться после 3 - 4 десятилетия жизни. Синдром Эйзенменгера (СЭ) встречается только у 2% взрослых пациентов [19]. При выявлении ЛАГ в детском возрасте необходимо исключить другие пусковые факторы и наследственный характер заболевания.
Гемодинамика при посттрикуспидальных дефектах имеет существенное отличие от претрикуспидальных, поскольку наличие артериовенозного сброса на уровне желудочков является причиной не только увеличения сердечного выброса с гипермолемией МКК, но и вызывает перегрузку значительным градиентом давлением, возникающим между камерами или сосудами с высоким и низким давлением соответственно [45 - 47]. Эта группа включает ДМЖП, открытый артериальный проток, дефект аорто-легочной перегородки. В зависимости от размеров дефекта ЛАГ развивается либо внутриутробно, либо в первые годы жизни.
Размер посттрикуспидального дефекта принято соотносить с диаметром аорты. Если первый равен диаметру аорты или более, его дефект определяется как "нерестриктивный", то есть не способный ограничить патологический сброс крови из левых камер сердца; при меньших, по сравнению с аортой размерах - как "рестриктивный" [45 - 47].
Артериовенозный сброс на посттрикуспидальном уровне с большим градиентом давления ускоряет развитие легочной васкулопатии с быстрым достижением уровня ЛСС равного или превышающего ПСС с формированием двунаправленного или право-левого сброса. Синдром Эйзенменгера - тяжелое осложнение ВПС с большим, исходно артериовенозным сбросом, сопровождающееся мультисистемным поражением, включая цианоз в покое, усиливающийся при нагрузке, вторичную к гипоксемии полицитемию и связанные с ней нарушения коагуляции, легочные и системные тромбозы, парадоксальные эмболии, легочные кровотечения, остеоартропатии и сколиоз, симптомы подагры с гиперурикемией, холелитиазом, нарушением функции почек [19, 45, 49 - 51].
Тяжесть ЛАГ-ВПС определяют по комбинации факторов, включая соотношение ДЛА к АД, соотношение ЛСС к ПСС, объем сброса (табл. 2).
Таблица 2. Гемодинамическая классификация ЛАГ при ВПС с дефектами перегородок сердца [48]
Гемодинамическая группа ЛАГ
ДЛА, % от системного АД
ЛСС/ПСС, %
Артериовенозный сброс крови, %
1А
1Б
Менее 30%
Менее 30%
Норма
Норма
Менее 30%
Более 30%
2
30 - 70%
Норма или несколько повышено
В среднем 50 - 60%
3А
3Б
Более 70%
Более 70%
Менее 60%
Более 60%
Более 40%
Менее 40%
4
100% и более
100% и более
Веноартериальный сброс
В отличие от других групп ЛАГ, ЛАГ-ВПС уникальна, поскольку она также имеет раннюю фазу, при которой среднее давление в легочной артерии повышено, но ЛСС еще нормально, отсутствуют признаки артериопатии, и своевременное закрытие дефекта может предотвратить ее развитие. В случае начальных проявлений артериопатии, при незначительном повышении ЛСС и обратимости ЛГ своевременная и адекватная оперативная коррекция предотвратит ее дальнейшее прогрессирование до необратимой стадии, нормализует легочную гемодинамику и морфологию сосудов, т.е. приведет к излечению заболевания [49 - 50]. Напротив, закрытие дефекта после наступления необратимой фазы ЛАГ может ускорить прогрессирование заболевания и значительно ухудшить прогноз [46 - 49]. В ряде случаев ЛАГ выявляется при дефектах, расположение и размеры которых не могут быть основной причиной ЛАГ, а являются лишь фоном заболевания, прогноз которого идентичен иЛАГ. Реже ЛАГ сохраняется сразу после коррекции ВПС или рецидивирует спустя месяцы или годы после нее при отсутствии значимых послеоперационных нарушений гемодинамики. В связи с чем выделяют 4 группы ЛАГ-ВПС, различных по патофизиологическим признакам, прогнозу и тактике ведения (табл. 3). Критерии операбельности и неоперабельности ВПС, осложненных ЛГ все еще остаются дискутабельными.
Таблица 3. Клиническая классификация ЛАГ, ассоциированной с ВПС у детей [45, 46]
1. Синдром Эйзенменгера
Большие интра- и экстракардиальные дефекты с исходным системно-легочным сбросом крови, дальнейшим прогрессирующим повышением ЛСС и реверсией сброса в легочно-системный или двунаправленный; цианоз, вторичный эритроцитоз, обычно имеются полиорганные нарушения
2. ЛАГ, ассоциированная с преимущественно системно-легочным сбросом
2.1. Операбельная
2.2. Неоперабельная
Средние и большие дефекты; ЛСС незначительно или умеренно повышено; преобладает системно-легочный сброс крови; цианоза в покое нет
3. ЛАГ при малых/сопутствующих дефектах
Выраженное повышение ЛСС при наличии малых дефектов, которые сами по себе не могут привести к повышению ЛСС; клиническая картина очень схожа с идиопатической ЛАГ. Закрытие дефектов противопоказано
4. ЛАГ после коррекции ВПС
ВПС корригирован, но ЛАГ сохраняется сразу после коррекции или рецидивирует спустя месяцы или годы после нее при отсутствии значимых послеоперационных нарушений гемодинамики
Данные о распространенности известных мутаций при ЛАГ-ВПС противоречивы, поскольку в нескольких исследованиях мутации, ассоциированные с ЛАГ, не были обнаружены, в то время как другие исследователи идентифицировали мутации BMPR2 у пациентов с ЛАГ-ВПС [11, 14]. Несколько вариантов мутаций гене SOX17 описаны у детей с ЛАГ-ВПС [39 - 41, 52].
ЛАГ, ассоциированная с портальной гипертензией
ЛАГ, ассоциированная с портальной гипертензией или портопульмональная гипертензия (ППГ) является тяжелым, жизнеугрожающим осложнением портальной гипертензии и/или портокавального шунтирования [53 - 55]. Согласно определению ВОЗ критерием ППГ является одновременное наличие ЛАГ и портальной гипертензии. Хронические заболевания печени, сопровождающиеся повышением внутрипеченочного сосудистого сопротивления, приводят к увеличению давления в портальной системе и постепенному формированию внутри- или внепеченочных порто-системных коллатеральных сосудов и шунтов, основным патофизиологическим последствием которых является шунтирование порто-мезентериальной крови в легочный, а затем системный кровоток [54]. Классическим критерием постановки диагноза портопульмональной ЛАГ (ППГ) является сочетание признаков портальной гипертензии и прекапиллярной ЛГ [53]. Патоморфология легочных сосудов, наблюдаемая при ППГ, идентична иЛАГ. Во взрослой популяции ППГ развивается у 1,1 - 6,3% пациентов с портальной гипертензией, в большинстве случаев обусловленной циррозом печени, хотя нецирротические причины ППГ, включая тромбоз воротной вены, гранулематозную болезнь, аутоиммунные заболевания, лекарственные реакции, инфекции (такие как гепатит C) возможны. У детей преобладают нецирротические причины на фоне врожденной мальформации сосудов печени или аномалий, пороков желчевыводящих путей [54 - 57]. Из них наиболее частой формой ППГ у детей является ЛАГ, ассоциированная с врожденным портокавальным шунтированием (ЛАГ-ВПКШ). Ключевым отличием ЛАГ-ВПКШ, от типичной ППГ является наличие врожденного портосистемного шунтирования в отсутствие первичного заболевания печени, при этом показатели давления в портальной системе могут быть нормальными [54]. В основе заболевания - врожденная сосудистая аномалия портальной системы, приводящая к формированию анатомического сообщения с патологическим частичным или полным шунтированием порто-мезентериальной венозной крови в систему нижней полой вены, минуя физиологический печеночный клиренс, в отсутствие первичного заболевания печени. В связи с этим, критериями ППГ предложено считать не сочетание ЛАГ и портальной гипертензии, а сочетание прекапиллярной ЛГ и портосистемного шунтирования (врожденного или приобретенного, в т.ч. хирургического) [54 - 58]. Ключевым патофизиологическим фактором ВПКШ является дренаж порто-мезентериальной венозной крови, содержащей эндогенные продукты метаболизма, вазоактиные токсины, аллергены, абсорбированные желудочно-кишечным трактом, которые, не подвергаясь физиологической инактивации и метаболизму в печени, напрямую поступают с правые камеры сердца, далее в легочный, а затем в системный кровоток, что вызывает тяжелые мультисистемные патофизиологические реакции [54, 58]. По сравнению с идиопатической ЛАГ пациенты с ППГ имеют худшую выживаемость. Прогноз, как правило, крайне неблагоприятный: заболевание отличается высокой и быстрой летальность [57 - 60]. Риск смерти более чем в три раза выше, чем у пациентов с иЛАГ [53, 56, 60]. Пятилетняя выживаемость интактных взрослых пациентов с ППГ составляет всего 14,2% [58]. У детей длительные наблюдения ППГ, включая ЛАГ-ВПКШ ограничены описаниями нескольких случаев, где 3-летняя летальность составила 6% [54 - 59].
Несколько подклассов ЛАГ связаны с воспалительным и иммунным повреждением, включая ЛАГ, ассоциированную с заболеваниями соединительной ткани, шистосомозом, ВИЧ-инфекцией.
ЛАГ, ассоциированная с заболеваниями соединительной ткани (ЛАГ-ЗСТ)
Легочная артериальная гипертензия является тяжелым и часто фатальным осложнением различных заболеваний соединительной ткани (ЗСТ), таких как системный склероз, смешанное заболевание соединительной ткани и системная красная волчанка [61]. По сравнению с иЛАГ, ЛАГ-ЗСТ, имеет уникальные клинические характеристики, такие как более неблагоприятный прогноз, возможное сочетанное поражение артериол и вен, вовлечение в системный процесс сердца, легких, почек, тромботические осложнения, связанный с васкулитом и/или тромбофилией и позитивный ответ на иммуносупрессию [61 - 64].
Патоморфологические исследования показали отличия васкулопатии при ЛАГ-ЗСТ, по сравнению с легочной артериопатией при иЛАГ. У 75% пациентов с ЗСТ-ЛАГ в целом и у 100% больных ЛАГ на фоне системного склероза, наблюдалось не только обструктивное ремоделирование артериол, обусловленное аутоиммунным воспалительным повреждением, но и ремоделирование венозной системы легких, не наблюдаемое при иЛАГ [61 - 64]. У части больных верифицированы признаки веноокклюзионной болезни.
Изменения миокарда при ЛАГ-ЗСТ отличаются от других вариантов ЛАГ формированием не только вторичного ремоделирования миокарда правого желудочка в ответ на повышение ЛСС, но и риском развития первичного поражения миокарда обоих желудочков, обусловленным течение системного процесса с отложением коллагена и последующими фиброзными изменениями миокарда [65]. В этом случае структурные изменения миокарда левого желудочка могут быть причиной развития диастолической, а в последующем систолической дисфункции миокарда и присоединения посткапиллярного компонента ЛГ с формированием комбинированной пре- и посткапиллярной ЛГ.
У больных с диффузной формой системного склероза ЛГ часто обусловлена интерстициальным поражением легких, тогда как у пациентов с его ограниченной формой ЛГ формируется вследствие поражения сосудов легких [64].
У детей клинические проявления тяжелой ЛАГ часто предшествуют диагностике ЗСТ в случаях бессимптомного течения или при минимальной выраженности клиники. Тогда диагностика заболевания строится на основании лабораторных данных, что делает обязательным проведение скрининга на ЗСТ при первичном обследовании больного с ЛГ. Отрицательные маркеры иммунологической панели при изолированных формах ЛАГ не исключают диагноз аЛАГ, рекомендуется регулярная повторная их оценка в динамике для ранней диагностики аутоиммунных заболеваний, поскольку иммуносупрессивная терапия улучшает течение основного заболевания, а в сочетании с ЛАГ-специфической терапией оптимизирует прогноз больного [65 - 67].
ЛАГ, ассоциированная с шистосомозом (Ш-ЛАГ)
Шистосомоз - это эндемическое, острое или хроническое паразитарное заболевание, вызываемое кровяными сосальщиками (трематодами) рода Schistosoma, паразитирующими внутри сосудов. Шистосомоз распространен в тропических и субтропических районах, особенно в популяциях с недостаточным доступом к безопасной питьевой воде и отсутствием надлежащей санитарии [68]. Ш-ЛАГ является опасным для жизни осложнением хронического гепатоселезеночного шистосомоза и является основной причиной ЛАГ во всем мире. Патогенез Ш-ЛАГ обусловлен эмболизацией яйцами шистосом легких с запуском развитием каскада иммуноаллергических реакций на антигены яиц шистосом, сопровождаемых высвобождением большого количества воспалительных цитокинов, что приводит к запуску концентрического ремоделирования сосудов. Патоморфологические исследования позволяют выявлять яйца шистосом, окруженные зоной инфильтрации иммунными клетками и эозинофилами, и микроинфаркты, которые впоследствии замещаются грануляциями и фиброзом [69 - 71]. Воспалительная васкулопатия при Ш-ЛАГ характеризуется плексогенной артериопатией и повышенной плотностью периартериальных Т-клеток и тучных клеток. Патоморфологические признаки этой легочной васкулопатии имеют большое сходство с иЛАГ, что свидетельствует об общих патогенетических механизмах, связанных с воспалением и сигнальным путем ![]() [70 - 71]. Как только сформировалась Ш-ЛАГ, эффект от антигельминтной терапии нивелируется; улучшить симптомы и продлить жизнь могут только ЛАГ специфические препараты. При этом ответ на терапию, включая гемодинамические показатели, у пациентов с Ш-ЛАГ может быть лучше по сравнению с пациентами с иЛАГ. На фоне адекватной терапии 1-, 2- и 3-летняя выживаемость при Ш-ЛАГ составляет 95,1%, 95,1% и 85,9%, соответственно [71 - 73].
[70 - 71]. Как только сформировалась Ш-ЛАГ, эффект от антигельминтной терапии нивелируется; улучшить симптомы и продлить жизнь могут только ЛАГ специфические препараты. При этом ответ на терапию, включая гемодинамические показатели, у пациентов с Ш-ЛАГ может быть лучше по сравнению с пациентами с иЛАГ. На фоне адекватной терапии 1-, 2- и 3-летняя выживаемость при Ш-ЛАГ составляет 95,1%, 95,1% и 85,9%, соответственно [71 - 73].
Легочная артериальная гипертензия, ассоциированная с инфекцией вируса иммунодефицита человека (ЛАГ-ВИЧ)
По оценке ВОЗ более 34 миллиона человек в мире инфицированы ВИЧ, из них 10% пациенты младше 15 лет [74]. ЛАГ является одним из тяжелых осложнений ВИЧ-инфекции. У детей заражение в основном происходит путем передачи от матери к ребенку в пре-, пери- или постнатальном периоде (через грудное молоко). Патофизиология ЛАГ-ВИЧ у детей является многофакторной и может включать в т.ч. генетические факторы. Вирус действует как триггер, поддерживая хроническое воспаление на фоне измененного иммунологического статуса [75]. Гистологические характеристики артериопатии при ЛАГ-ВИЧ подобны иЛАГ и включают концентрическое ремоделирование, обусловленное гиперплазией интимы и медии как с "плексиформными поражениями", так и без. Тромботические поражения также возможны. Присоединение рецидивирующих бактериологических, грибковых и паразитарных инфекций наносит второй удар и может служить причиной развития ХОБЛ или интерстициального поражения легких с присоединением к ЛАГ-ВИЧ и ЛГ 3 группы [76 - 79].
Антиретровирусная терапия не полностью снижает в последующем риск развития легочной гипертензии у ВИЧ-инфицированных детей. Показано, что даже получающие адекватную терапию ВИЧ-инфицированные дети должны на протяжении всей жизни регулярно проходить скрининг на ЛГ и должным образом наблюдаться [77, 80 - 82].
ЛАГ с устойчивым ответом на терапию блокаторами кальциевых каналов (БКК).
Патофизиология ЛАГ, как многофакторного состояния может включать множество молекулярных и клеточных механизмов. Формирование стойкой патологической вазоконстрикции играет в ней ключевую роль. Преобладание именно этого звена патогенеза ЛАГ показано у пациентов, которые имели положительным ответ на острый тест на введение вазодилататоров, а в последующем, хороший и устойчивый ответ на терапию БКК [83]. Долгосрочный ответ определяется как клиническое улучшение (достижение ФК I или II NYHA) с устойчивым улучшением гемодинамики по крайней мере через 1 год только на фоне терапии БКК [1, 6, 8, 83, 84]. Однако эффективность терапии БКК, как правило, прогрессивно снижается с возрастом и в последующем может потребоваться назначение специфической ЛАГ терапии. Напротив, пациенты с длительным и устойчивым положительным ответом на терапию БКК показали патофизиологические, фенотипические характеристики, характеризующиеся значительно лучшим прогнозом в отличии от других пациентов с ЛАГ. Выживаемость у детей с иЛАГ, отвечающих на терапию БКК составила 80% [85]. В связи с чем в 2018 г. предложено введение новой подгруппы ЛАГ [1, 6, 8].
Веноокклюзионная болезнь легких и легочный капиллярный гемангиоматоз
Легочная веноокклюзионная болезнь (ЛВОБ) - редкая форма легочной гипертензии, характеризующаяся преимущественным ремоделированием легочных венул [27]. Легочный капиллярный гемангиоматоз (ЛКГ) - редкое сосудистое заболевание легких, характеризующееся аномальным ангиогенезом легочных капилляров, инфильтрирующих перибронхиальный, периваскулярный интерстиций и легочную паренхиму. В современной классификации ЛГ ЛВОБ и ЛКГ считаются общим явлением и представляют различные проявления одного и того же заболевания [6, 8, 27, 86 - 87]. Гистологические признаки ЛВОБ/ЛКГ находили у пациентов артериитом Такаясу, синдром Картагенера, склеродермией и системной красной волчанки [86 - 87]. Открытие мутации EIF2AK4 подтвердило, что ЛВОБ и ЛКГ являются двумя клинико-патологическими проявлениями одного и того же заболевания [88 - 90]. Все пациенты, несущие биаллельные мутации в гене EIF2AK4, относят к наследственной группе ЛГ. Описаны случаи развития ЛВОБ на фоне высокодозной химиотерапии, особенно в условиях трансплантации гемопоэтических стволовых клеток [91]. Хотя ЛВОБ и ЛАГ имеют схожую клиническую картину с признаками тяжелой прекапиллярной ЛГ, важно различать эти два состояния, поскольку ЛВОБ имеет худший прогноз с очень ограниченным ответом на терапию ЛАГ и риском отека легких в случае лечения вазодилататорами. Возможен точный диагноз ЛВОБ на основе неинвазивных исследований с использованием оценки сатурации кислорода, выявления низкой диффузионной способности по окиси углерода и характерных признаков на компьютерной томографии грудной клетки с высоким разрешением. Биопсия легких - наиболее точный диагностический метод, однако сопряжена с риском осложнений. Компьютерная томография высокого разрешения грудной клетки - основной метод неинвазивной диагностики [27, 86 - 90].
Персистирующая легочная гипертензия новорожденных
Персистирующая легочная гипертензия новорожденных (ПЛГН) представляет собой синдром, в основе которого нарушение нормальной перестройки и адаптации сосудов легких новорожденного к постнатальной жизни. Состояние характеризуется устойчивым повышением ЛСС при нормальном или низком ПСС [8, 92 - 96]. ПЛГН обычно проявляется вскоре после рождения, вызывая тяжелую дыхательную недостаточность и гипоксемию, обусловленную недостаточной перфузией легких и персистированием фетальных коммуникаций с веноартериальным сбросом. Новорожденные с ПЛГН подвержены высокому риску тяжелой асфиксии и ее осложнений, включая неврологические повреждения, полиорганную дисфункцию и смерть [93 - 94].
Внутриутробно органом газообмена служит плацента. Высокий уровень ЛСС является обязательным условием нормального фетального кровообращения, он поддерживается низким парциальным напряжением кислорода (PaO2 30 - 40 мм рт. ст.), высоким уровнем циркулирующих вазоконстрикторов, включая эндотелин-1, серотонин и метаболиты простагландинов, а также механическим сдавлением сосудов нефункционирующей паренхимой легких [97]. Супрасистемные показатели ЛСС обеспечивают высокие уровни давления в правых камерах, поэтому 80 - 90% объема смешанной крови плода, поступающей в правые камеры, попадает в левые камеры через фетальные коммуникации, и только 10 - 20% - в легкие. После рождения и прекращения плацентарного кровообращения легкие расправляются, начало газообмена повышает насыщение крови кислородом, увеличивает легочную перфузию, соответственно снижается ЛСС и растет ОПС, фетальные коммуникации перестают функционировать. Успешная адаптация к внеутробной жизни требует быстрого увеличения легочного кровотока при рождении, чтобы легкие стали местом газообмена. Любые заболевания - от врожденных аномалий развития легких до их инфекционного поражения, а также комбинации этих заболеваний могут нарушить процесс физиологической перестройки гемодинамики у ребенка [94, 95]. Показана взаимосвязь развития ПЛГН с антенатальными факторами в виде преэклампсии, хориоамнионита, приемом матерью лекарственных средств (нестероидные противовоспалительные препараты, ингибиторы обратного захвата серотонина) и другими перинатальными событиями, приводящими к аномальному росту и функционированию легочных сосудов и, возможно, повышающими риск развития ЛАГ в более позднем возрасте [97 - 100].
1.2.2. Группа 2. Легочная гипертензия, ассоциированная с заболеваниями левых камер сердца (ЛГ-ЛК)
Заболевания левых камер сердца, сопровождающиеся повышением давления наполнения левого желудочка и левого предсердия, являются самой частой причиной развития легочной гипертензии в общей популяции и встречаются при широком спектре сердечно-сосудистых заболеваний [101 - 104]. Этиология ЛГ-ЛК у детей отличается от таковой у взрослых, что влияет на прогноз и выбор метода лечения. Развитие ЛГ является независимым предиктором неблагоприятного прогноза при заболеваниях левых камер сердца, в т.ч. левожелудочковой недостаточности любой этиологии [105 - 110]. Любые врожденные и приобретенные аномалии, сопровождающиеся затруднением путей притока и оттока левого желудочка, учитывая закрытость гемодинамической системы, приводит к увеличению давления в левом предсердии и ретроградно - в системе легочных вен. Врожденные и приобретенные стенозы легочных вен, обструкция путей притока левого желудочка объемным образованием, митральные и аортальные пороки, коарктация аорты, миокардиальная дисфункция любой этиологии как систолическая, так и диастолическая, сопровождающаяся увеличением конечно-диастолического давления в левом желудочке с последующим ретроградным повышением давления в левом предсердии и легочных венах могут осложняться легочной гипертензией [105 - 110]. Увеличение постнагрузки левого желудочка при системной артериальной гипертензии также ассоциируется с легочной гипертензией. В таблице 4 отражены основные причины развития легочной гипертензии, ассоциирующейся с болезнями левых камер сердца у детей.
Критерием постановки диагноза посткапиллярной легочной гипертензии является повышение давления заклинивания легочной артерии более 15 мм рт. ст. при среднем давлении в легочной артерии более 20 мм рт. ст. [1, 6, 8].
На ранних стадиях заболевания повышение давления в системе легочной циркуляции, обусловленное повышением тонуса артерий и артериол легких, может быть обратимым. Легочное сосудистое сопротивление остается нормальным. При прогрессировании заболевания на фоне венозного застоя запускается структурное ремоделирование легочного сосудистого русла, включая пролиферацию интимы и гипертрофию медии. К пассивной посткапиллярной присоединяется прекапиллярная легочная гипертензия, формируя комбинированную форму ЛГ. Диастолическое давление в легочной артерии у этих пациентов повышено непропорционально давлению в левом предсердии с повышением диастолического транспульмонального градиента (ТПГ) более 7 мм рт. ст. и иЛСС более 3 ед. Вуда x м2. Структурное ремоделирование сосудистого русла необратимо [107, 110, 111]. Присоединение прекапиллярного компонента увеличивает постнагрузку на правый желудочек с последующим развитием правожелудочковой недостаточности, что еще более неблагоприятно сказывается на прогнозе заболевания и является независимым предиктором летальности.
Таблица 4. Основные причины развития легочной гипертензии, ассоциирующейся с болезнями левых камер сердца у детей [1, 6, 8, 103, 110, 111]
Подгруппы ЛГ-ЛК
Ассоциированные заболевания
ЛГ вследствие ХСН со сниженной фракцией выброса
Дилатационная кардиомиопатия
Гипертрофическая кардиомиопатия
Аритмогенная кардиомиопатия с поражением левого желудочка
Некомпактный миокард
Фиброэластоз эндокарда
Снижение систолической функции системного желудочка при ВПС
ЛГ вследствие ХСН с нормальной фракцией выброса
Гипертрофическая кардиомиопатия
Рестриктивная кардиомиопатия
Некомпактный миокард
Вторичная гипертрофия системного желудочка при ВПС, АГ и др.
Синдром гипоплазии левого желудочка
Констриктивный перикардит
Клапанные пороки
Врожденные и приобретенные стенозы и недостаточности митрального, аортального клапанов, артериального АВ клапана
Другие ВПС с обструкцией путей притока и оттока левого желудочка
1. Стеноз и/или гипоплазия легочных вен
а) изолированные
б) ассоциированные с БЛД
2. Обструктивный аномальный дренаж легочных вен, в т.ч. стеноз коллектора легочных вен
3. Трехпредсердное сердце
4. Коарктация, гипоплазия или перерыв дуги аорты
Обструкция путей притока и оттока левого желудочка объемным образованием
Опухоли, кисты, вегетации, тромбы
Патологические изменения включают расширение легочных вен, утолщение их стенок, дилатацию капиллярного русла, интерстициальный отек, альвеолярные геморрагии, расширение лимфатических сосудов и увеличение лимфатических узлов. При прогрессировании заболевания развивается утолщение (фиброз) интимы и гипертрофия медии дистальных легочных артерий. Снижение венозного возврата левого желудочка приводит к прогрессирующему венозному застою, отеку легких, альвеолярным кровотечениям и может привести к преждевременной гибели больного [111].
1.2.3. Группа 3. Легочная гипертензия, ассоциированная с патологией легких и/или гипоксией (ЛГ-ЗЛ)
Легочная гипертензия в сочетании с заболеванием легких и/или гипоксией - представляет собой сложную, весьма гетерогенную группу. В общей популяции ЛГ может осложнить течение большинства хронических заболеваний легких, но чаще всего она осложняет хроническую обструктивную болезнь легких и/или эмфизему, интерстициальную болезнь легких, обструктивное апноэ сна и альвеолярную гиповентиляцию в условиях высокогорья [6, 8]. Пациенты данной группы обычно демонстрируют умеренную степень тяжести ЛГ со средним давлением в легочной артерии в диапазоне от 25 до 35 мм рт. ст. Однако во время обострений основного заболевания, при физической нагрузке и во время сна могут возникать транзиторные повышения давления в легочной артерии. При этом наличие даже умеренной легочной гипертензии при хронических заболеваниях легких связано с неблагоприятным прогнозом и увеличением смертности [112]. Механизм развития этой группы ЛГ многофакторный. Ключевым звеном патогенеза является хроническая или рецидивирующая системная гипоксемия, которая активирует чувствительный к кислороду фактор транскрипции (HIF), являющийся ядром метаболического ответа на гипоксическую стимуляцию, а также окислительный стресс, метаболизм металлов, ионные каналы, воспалительные цитокины, клеточный апоптоз и сосудистые факторы, которые запускают и поддерживают механизм ремоделирования легочных сосудов [113 - 114]. Начало формирования ЛГ-ЗЛ проходит две фазы: гипоксическая легочная вазоконстрикция и гипоксическое ремоделирование легочных сосудов. Заболевание поражает дистальные участки легочного сосудистого русла с формированием, как правило, прекапиллярной формы ЛГ [115].
Данная группа ЛГ является второй по распространенности формой ЛГ у детей после ЛАГ и ассоциируется, помимо низкой оксигенации, снижением функциональных показателей легких [1, 8, 111 - 115]. В отличие от взрослых пациентов 3-й группы ЛГ, у которых ЛГ чаще всего осложняет хроническую обструктивную болезнь легких и/или эмфизему, интерстициальную болезнь легких, обструктивное апноэ сна и альвеолярную гиповентиляцию в условиях высокогорья, у детей ведущей причиной этой группы ЛГ являются нарушения развития и врожденные аномалии легких, включая: бронхолегочную дисплазию, врожденную диафрагмальную грыжу, альвеолярно-капиллярную дисплазию, варианты гипоплазий легких, легочный интерстициальный гликогеноз, генетически обусловленные аномалии белка сурфактанта, комбинированные бронхо-легочные заболевания при синдроме Дауна [111 - 117]. Структурные и сосудистые аномалии легких у этой группы детей представлены в таблице 5. Степень функциональных нарушений и выраженность нарушений газообмена более значительны в этих группах. Развитие на фоне основного заболевания ЛГ, как правило от умеренной до крайне тяжелой, является одним из основных факторов, определяющих прогноз этих пациентов и ассоциируется с высоким уровнем летальности [117 - 123]. Основные усилия должны быть направлены на терапию основного заболевания легких, поскольку имеющиеся в настоящее легочные вазодилятаторы не обладают достаточной доказательной базой для лечения легочной гипертензии, ассоциированной с хроническими заболеванием легких.
Таблица 5. Пороки и аномалии развития легких, ассоциированные с ЛГ [115 - 137]
Дефект развития
Сосудистая патология
Интерстициальные заболевания легких
Интерстициальные заболевания легких, характеризующиеся нарушением газообмена, рестриктивной физиологией легких и диффузным поражением легких при визуализации. Включают гетерогенную группу состояний, связанных с нарушением развития альвеол и дистальных отделов дыхательных путей
Альвеолярно-капиллярная дисплазия с аномалиями вен или без него
Редкое, генетически детерминированное, фатальное заболевание легких у новорожденных и детей грудного возраста, связанное с аномальным развитием капиллярно-сосудистой системы вокруг альвеол легких. Уменьшение альвеолярных капилляров, утолщение ткани альвеолярной перегородки и неспособность капилляров контактировать с альвеолярным эпителием. Выявлены геномные и генетические делеции кластера генов фактора транскрипции FOX в 16p24.1 и инактивирующие точечные мутации FOXF1.
Бронхолегочная дисплазия
Тяжелое многофакторное заболевание морфологически незрелых легких, развивающееся у маловесных и глубоко недоношенных детей, которое обычно вызывается длительной вентиляцией легких.
Протекает с преимущественным поражением бронхиол и паренхимы легких, развитием эмфиземы, фиброза и/или нарушением репликации альвеол; проявляется зависимостью от кислорода в возрасте 28 сучок жизни и старше, бронхообструктивным синдромом и симптомами дыхательной недостаточности. Заболевание сопровождается снижением ветвления сосудов, измененным распределением сосудов в интерстнции легких и персистирующими внутрилегочными венозными анастамозами. Нарушение роста и развития сосудов приводит к снижению их плотности по всей микрокапиллярной сети легких и сопровождается изменением структуры сосудистой стенки с гиперплазией интимы и избыточной мускуляризацией мелких легочных артерий. Ремоделирование легочных сосудов, наряду с непропорциональностью сосудистой сети и легочной ткани, являются ключевыми звеньями патогенеза ЛГ при БЛД.
Врожденная диафрагмальная грыжа
Врожденный порок развития, включающий дефект развития диафрагмы и нарушение органогенеза легких, что приводит к их недоразвитию - легочной гипоплазии, нарушению развития сосудистой сети со снижением ее плотности и последующим концентрическим ремоделированием.
Гипоплазия легких (первичная и вторичная)
Врожденные генетические аномалии или серьезное снижение уровня амниотической жидкости, приводящее к нарушению пренатального развития альвеол и сосудов. Сопровождается уменьшением объема легких, тяжелой, рефрактерной дыхательной недостаточностью, которая не поддается агрессивному лечению (включая инсталляции сурфактанта/ингаляции оксида азота/механическую респираторную поддержку). Обычно несовместимо с жизнью.
Легочный интерстициальный гликогеноз
Редкая нелетальная педиатрическая форма интерстициального заболевания легких, возможно преобладание у мужчин. Младенцы с респираторным дистресс-синдромом. Гистологическими характеристиками являются накопление моночастиц гликогена в интерстициальных клетках и связанные с ними аномалии роста легких, затрагивающие все структуры легких.
Легочный альвеолярный протеиноз [115, 126]
Редкое заболевание легких, при котором происходит аномальное накопление сурфактанта в альвеолах, препятствующее газообмену и влияющее на рост легких. Возможная причина - аутоантитела против гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF).
Заболевание характеризуется аномальным накоплением сурфактанта в альвеолах, препятствующее газообмену и влияющее на рост легких. Недостаточная утилизация сурфактанта приводит к нарушению газообмена и дыхательной недостаточности, может осложняться воспалительными изменениями в легочной ткани, с последующим развитием интерстициального фиброза. Нарушение альвеолярной структуры, в частности, в виде примитивного типа строения альвеол и изменений пневмоцитов по типу регенеративной гиперплазии в сочетании с прогрессирующим фиброзом и вовлечением в процесс сосудов легких лежит в основе развития легочной гипертензии.
Легочная лимфангиэктазия
Редкое нарушение развития легких, характеризующееся субплевральной, междолевой, периваскулярной и перибронхиальной лимфангиэктазией.
Аномалии сурфактантного белка
Генетически обусловленный дефицит поверхностно-активного белка сурфактанта, приводящий к нарушению развития легких. Выделяют состояния, сопровождаемые дефицитом сурфактантного протеина B и сурфактантного протеина C. Может проявляться как интерстициальное заболевание легких. Вероятная причина - мутации в генах АБСА3, ТВХ4, ТТФ1/НКХ2-1.
Легочный интерстициальный гликогеноз
Обусловлен аномальным накоплением гликогена в интерстиции легкого, что приводит к его утолщению и затрудняет диффузию газов через альвеолокапиллярную мембрану. Гистологическими характеристиками являются накопление моночастичного гликогена в интерстициальных клетках и связанные с этим нарушения роста легких, влияющие на все структуры легких.
ЛГ при болезни Дауна
Многофакторное состояние, включающее рецидивирующие обструктивные заболевания верхних дыхательных путей, трахеобронхомаляцию, гастроэзофагальный рефлюкс, уменьшенный объем легких. При наличии ВПС с артерио-венозным сбросом ЛГ развивается в первые месяцы жизни. Но ЛГ при СД может манифестировать и в отсутствии ВПС.
1.2.4. Группа 4. Легочная гипертензия, обусловленная обструкцией легочных артерий
Региональное или диффузное повышение давления в системе легочной артерии может быть обусловлено множеством факторов, включая периферические стенозы легочных артерий (как врожденные, в т.ч. в составе комбинированного ВПС, так и приобретенные, например, в следствие перенесенного артериита), а также сдавление или обструкцию легочных артерий ангиосаркомой, другими внутрисосудистыми опухолями или кистам [1, 6, 8]. Например, легочный гидатидоз является доминирующей формой эхинококкоза в педиатрической популяции [138].
Наиболее частой причиной ЛГ, обусловленной обструкцией легочной артерии является хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) - редкое, но потенциально опасное для жизни состояние, наблюдающееся у небольшой части больных после острой тромбоэмболии легочной артерии [139]. Триггером заболевания является неразрешившаяся тромбоэмболия проксимальных и средних сегментов легочного артериального русла с последующей организацией тромботической массы с обструкцией, частичной или полной окклюзией просвета легочных артерий фиброзно-организованными тромбами. Механическая обструкция запускает процесс вторичной васкулопатии с концентрическим ремоделированием неокклюзированных дистальных отделов легочного сосудистого русла, формируя прекапиллярный тип ЛГ, по патоморфологическим признакам похожий на ЛАГ. Критерием постановки диагноза является наличие прекапиллярной ЛГ, подтвержденной при катетеризации правых отделов сердца в сочетании с верификацией организованных тромбов/эмболов в легочном стволе, долевых, сегментарных, субсегментарных легочных артериях по данными селективной ангиографии, многосрезовой компьютерная томографии, выявлении характерных дефектов перфузии дистальных участков легочного сосудистого русла при вентиляционно-перфузионной сцинтиграфии легких [6, 140, 141]. При доказанном эпизоде ТЭЛА диагностический поиск для исключения формирования ХТЭЛГ необходимо предпринять через 3 месяца адекватной терапии антикоагулянтами, но у пациентов с выраженной симптоматикой или у пациентов с ухудшением состояния может потребоваться более раннее обследование.
В отсутствие лечения, при прогрессирующей правожелудочковой недостаточности прогноз фатальный. Своевременная тромбэндартерэктомия является операцией выбора, приводящей к значительному улучшению функционального состояния, сердечно-легочной гемодинамики и выживаемости [142].
Более половины детей с ХТЭЛГ ни имеют в анамнезе указаний на ТЭЛА или венозные тромбозы. Около трети пациентов долгое время наблюдались с диагнозом иЛАГ, что говорит в чрезвычайной важности исключения ХТЭЛГ у таких пациентов [142]. При этом факторы риска тромбоэмболии выявляются у большинства детей с ХТЭЛГ, и, примерно, у трети пациентов имеется положительный семейный анамнез тромбоэмболии. Более 80% детей с ХТЭЛГ имеют указания на гиперкоагуляцию, в основе которой заболевания, сопровождаемые тромбофилией. Увеличенный уровень волчаночного антикоагулянта, антител к кардиолипину и дефицит протеина C и S - наиболее распространенные факторы, предрасполагающими к тромбофилии. Мутации, кодирующие белок антитромбина III, протромбина, плазминогена фактора V Лейдена или фактора VIII также могут быть фактором риска ХТЭЛГ.
В отсутствие признаков тромбофилии, факторами риска тромбоэмболии могут быть заболевания и состояния, ассоциирующиеся с риском тромбообразования, включая, вентрикуло-атриальный шунт, синдром Клиппеля-Треноне-Вебера, нефротический синдром, длительная иммобилизация конечности, гемоглобинопатии, состояние после спленэктомии, в т.ч. аутоспленэктомии, например при гомозиготных формах серповидно-клеточной анемии, длительные центральные венозные катетеры, электроды внутрисердечных имплантируемых устройств, злокачественные новообразования в анамнезе [140 - 142]. Такие пациенты должны проходить регулярный скрининг, поскольку своевременность лечения ТЭЛА имеет критическое значение. У детей с доказанной ТЭЛА на фоне гиперкоагуляции и/или других факторов риска тромбоэмболии рекомендуется тщательное обследование, включая проведение вентиляционно-перфузионного сканирования и адекватное лечение для обеспечения полного разрешения тромбообразования.
1.2.5. Группа 5. Легочная гипертензия с неясными и/или многофакторными механизмами
В эту группу включены заболевания, о которых известно, что они могут осложниться легочной гипертензией, но механизм ее развития еще до конца не изучен или включает несколько пусковых факторов, степень влияние которых также нуждается в изучении [1, 6, 8, 143].
Классификация заболеваний, вошедших в 5-ю группу ЛГ, представлена в таблице 6.
Таблица 6. Подклассы легочной гипертензии 5-й группы: ЛГ с неясными и/или многофакторными механизмами [1, 6, 8, 102, 143 - 160]
Группы заболеваний
Заболевания
5.1 Гематологические нарушения
5.1.1. Гемолитические анемии
5.1.2. Миелопролиферативные заболевания
5.2 Системные и метаболические заболевания
5.2.1. Лангергансо-клеточный гистиоцитоз легких
5.2.2. Болезнь Гоше
5.2.3. Гликогенозы
5.2.4. Нейрофиброматоз
5.2.5. Саркоидоз
5.3. Другие
5.3.1. Хроническая почечная недостаточность с гемодиализом или без него
5.3.2. Фиброзирующий медиастинит
5.4 Сложные врожденные пороки сердца
5.4.1. Сегментарная легочная гипертензия
-
Отхождение легочной артерии от открытого артериального протока
-
Атрезия легочной артерии
-
Атрезия легочной артерии с дефектом межжелудочковой перегородки и крупными аорто-легочными коллатеральными артериями
-
Гемитрункус
-
Другое
5.4.2. Единственный желудочек (неоперированный и оперированный)
5.4.3. Синдром ятагана
Гемоглобинопатии
ЛГ является редким, но фатальным осложнением у больных с гемоглобинопатиями [144 - 149]. При ЭХОКГ скрининге больных с серповидно-клеточными анемиями (СКА) регистрация скорости ТК регургитации более 2,5 м/с ассоциируется с 8 - 9 кратным увеличением риска ранней гибели [146, 147]. Несмотря на относительно небольшие показатели скорости ТК регургитации, 3-летняя летальность может достигать у таких больных 40% и коррелирует со степенью выраженности внутрисосудистого гемолиза. Основные эффекты СКА влияют на функцию всех органов и включают внутрисосудистый гемолиз и мультисистемную васкулопатию, обусловленную диффузной окклюзией мелких сосудов с ишемически-перфузионным повреждением соответствующих органов. Высвобождение свободного гемоглобина и аргиназы в кровоток приводит к состояниям хронической дезоксигенации [148]. При данной группе гемоглобинопатий патофизиология ЛГ, как правило, имеет признаки прекапиллярной ЛГ, но может быть посткапиллярной или комбинированной, если в патологический процесс вовлекается миокард и формируется диастолическая его дисфункция [149 - 151]. В ответ на состояние хронического гемолиза усиливается синтез эндотелина-1, снижается доступность молекул оксида азота, что приводит к повышенной адгезии сосудистых клеток. Нарушения баланса вазоактивных пептидов и опосредованная гемолизом гипоксемия поддерживают стойкую вазоконстрикцию легочных сосудов. Патогенетический каскад при СКА также может включать хроническое тромбоэмболическое повреждение и асептическое воспаление. Мультисистемная пролиферативная васкулопатия при СКА, проявляющаяся диастолической дисфункцией ЛЖ, ЛГ, аритмиями и хронической болезнью почек, проявляют себя на втором десятилетии жизни [148 - 151]. Диастолическая дисфункция, ЛГ и внезапная смерть являются основными причинами смертности от СКА [150 - 151].
Миелопролиферативные заболевания
Среди пациентов с миелопролиферативными заболеваниями (МПЗ) наибольшему риску развития ЛГ подвержены пациенты с хроническим миелоидным лейкозом, истинной полицитемией, эссенциальным тромбоцитозом и миелофиброзом. Развитие ЛГ ассоциируется у таких больных со значительным снижением выживаемости [152, 153]. Патогенез ЛГ при МПЗ имеет два основных фенотипа: хроническая тромбоэмболическая ЛГ (ХТЭЛГ) и пролиферативная легочная артериопатия. Тромботические явления (как венозные, так и артериальные) и микроциркуляторные нарушения характерны для больных истинной полицитемией и эссенциальным тромбоцитозом [154]. Легочная васкулопатия может осложнить течение МПЗ при часто сопутствующем поражении печени с присоединением портальной гипертензии у 13% больных с МПЗ [155].
Не менее важным фактором является лекарственно-индуцированная ЛГ при МПЗ. Ингибиторы тирозинкиназы, которые часто используются в терапии МПЗ, ассоциируются с прекапиллярными формами ЛГ [156]. При этом такие формы ЛАГ могут регрессировать после прекращения курса препарата. Трансплантация костного мозга также может увеличить риск легочной веноокклюзионной болезни у пациентов с МПЗ [157].
Хроническая почечная недостаточность
Легочная гипертензия (ЛГ) часто встречается у пациентов с хронической болезнью почек (ХБП) и с ассоциируется с высокой летальностью [158]. Большинство пациентов с ХБП имеют посткапиллярный или комбинированный пре- и посткапиллярный тип ЛГ, реже изолированный прекапиллярный тип ЛГ [159]. Механизм развития ЛГ при ХБП многофакторный и может включать: хроническую перегрузку объемом ЛЖ, ремоделирование легочных сосудов из-за дисбаланса уровня вазоактивных факторов (например, оксида азота, простациклина и эндотелина), воспалительное повреждение и сопутствующие заболевания легких (например, обструктивное апноэ во сне и хронический обструктивный синдром), которые обычно связаны с ХБП [160].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ЛГ - потенциально фатальное заболевание, которое встречается в любом возрасте. Распространенность значительно варьирует в зависимости от региона мира, причем различия определяются генетическими, географическими, экологическими и социально-экономическими факторами [6, 100, 161 - 165]. Значительный прогресс в диагностике и лечении ЛГ постепенно превратил это состояние из орфанного заболевания в серьезную глобальную проблему здравоохранения [161]. По оценкам, около 80% глобального бремени болезни приходится на страны с низким и средним уровнем дохода, где ЛГ чаще встречается у более молодых людей, по сравнению со странами с высоким уровнем дохода, где ЛГ преобладает у пожилых людей старше 65 лет [162]. При том, что наиболее распространенной причиной ЛГ во всем мире являются заболевание левых камер сердца, распространенность ЛГ на порядок выше в группах риска, таких как ВИЧ-инфицированные пациенты, больные шистосомозом, системным склерозом или серповидно-клеточной анемией [101, 104, 148, 161 - 164].
Истинная распространенность заболевания у детей достоверно неизвестна. По данным голландского национального эпидемиологического исследования, ежегодный уровень заболеваемости ЛГ среди детей составляет 63,7 на 1 000 000 детей [165]. Из них 82% имели транзиторную ЛАГ, включая персистирующую ЛГ новорожденного и ЛАГ при ВПС, разрешившуюся после своевременной коррекции. Группа прогрессирующих форм в 26,9% образована ЛАГ (из них 28% - иЛАГ, 72% - ЛАГ-ВПС), 27,8% - ЛГ при поражении левых отделов сердца, 44,2% - заболевания легких/гипоксемия, 0,9% - тромбоэмболическая болезнь.
По данным национальных регистров, заболеваемость всеми группами ЛГ у детей значительно варьирует - от 4 до 10 случаев на 1 000 000 детей в год в Европе и от 4,8 до 8,1 случаев на 1 000 000 детей в год в Северной Америке [101, 165 - 168].
Распространенность ЛГ варьирует от 20 - 40 случаев на 1 000 000 детей в Европе до 25,7 - 32,6 случаев на 1 000 000 детей в США [1011, 165 - 168].
Гендерные характеристики
У взрослых больных ЛАГ заболевание имеет хорошо установленный гендерный диморфизм, который касается не только эпидемиологии ЛАГ у женщин и мужчин, но и различия в клиническом течение заболевания, ответе на терапию и, соответственно, прогнозе заболевания [39, 164, 169 - 170]. Распространенность ЛАГ у женщин примерно в 1,7 - 4 раза выше, тогда как более неблагоприятный прогноз ассоциируются с мужским полом. Для мужчин с ЛАГ характерны более выражены нарушения функции правого желудочка и более низкая выживаемость. В патобиологии гендерных характеристик ЛАГ участвуют не только эндогенные половые гормоны, в частности 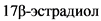 и его метаболиты, но различие в уровне окислительного стресса с меньшей активностью антиоксидантных ферментов у мужчин, различный тип клеточных реакций с преобладанием апоптоза для женщин и клеточного некроза у мужчин [1].
и его метаболиты, но различие в уровне окислительного стресса с меньшей активностью антиоксидантных ферментов у мужчин, различный тип клеточных реакций с преобладанием апоптоза для женщин и клеточного некроза у мужчин [1].
Характерное для взрослых преобладание лиц женского возраста в структуре ЛАГ с соотношением женщин и мужчин ~ 1,7:1 - 4,8:1 не наблюдается при дебюте заболевания в детском возрасте, при котором заболеваемость в целом одинакова для мальчиков и девочек. Выраженная возрастная и патогенетическая вариабельность ЛГ и ЛАГ, в частности, в педиатрической популяции определяют и различные гендерные характеристики возрастных групп. Во 2 - 5-й группах ЛГ соотношение мальчиков и девочек 1:1 - 1,5:1 с незначительным преобладанием лиц мужского пола [165 - 168].
Группа 1. Легочная артериальная гипертензия
Идиопатическая ЛАГ
Расчетные показатели заболеваемости идиопатическое иЛАГ варьируют от 0,47 до 1 - 2 случаев на 1 000 000 детей в зависимости от региона, с оцениваемыми показателями распространенности от 2,1 до 6,0 случаев на 1 00 0000 детского населения [101, 165 - 168].
Наследственная ЛАГ
Истинная распространенность наследственной ЛАГ (нЛАГ) не известна. Информация накапливается постепенно по мере изучения роли молекулярно-генетических и эпигенетических факторов в патогенезе ЛАГ [40 - 42, 52]. В гендерной структуре мутаций в гене BMPR2 преобладают мужчины (до 78%). Пораженные мутацией в гене BMPR2, как правило, моложе и имеют более тяжелое клиническое течение и прогноз [40].
ЛАГ, индуцированная лекарствами и токсинами
Распространенность этой группы ЛАГ у детей не известна.
Ассоциированные формы ЛАГ
Показатели заболеваемости ассоциированных форм ЛАГ (аЛАГ) варьируют от 4,3 до 7,3 случаев на 1 000 000 детей в зависимости от региона, с оцениваемыми показателями распространенности от 21,3 до 27,0 случаев на 1 000 000 детского населения [101, 165 - 168].
ЛАГ, ассоциированная с системными заболеваниями соединительной ткани (ЛАГ-ЗСТ)
У взрослых больных заболевания соединительной ткани являются одной из основных причин ЛАГ, составляя около 20% [61, 161 - 163]. У детей ЛАГ-ЗСТ встречается редко, по данным ряда национальных регистров эта группа составляет 0 - 4% пациентов с ЛАГ [101, 165 - 168]. Во многонациональной когорте из 389 детей с системным ювенильным артритом из регистра CARRA у 16 (4%) была диагностирована ЛАГ [171]. По данным ЭХОКГ скрининга ЛАГ была диагностирована у 2% когорты из 850 детей с системной красной волчанкой в течение первых 2 лет постановки диагноза [172].
ЛАГ, ассоциированная с ВИЧ-инфекцией
Точная распространенность легочной гипертензии у ВИЧ-инфицированных детей неизвестна. Оценки распространенности ЛАГ у взрослых ВИЧ инфицированных варьируют от 0,5% до 9,9%, что примерно в 1000 - 2500 раз выше, чем в общей, что определяет рекомендацию регулярного скрининга ВИЧ-инфицированных взрослых [74 - 76]. В эндемичных по ВИЧ регионах Азии, Африки и Южной Америки у вертикально инфицированных ВИЧ детей распространенность ЛАГ варьирует от 4,4% до 7%, частота комбинированных форм ЛГ достигает 40% [75 - 83]. При этом возраст заражения играет решающее значение. У зараженных ВИЧ в раннем возрасте распространенность ЛАГ-ВИЧ составляет 48 - 75%. За пределами эндемических регионов ЛАГ-ВИЧ у детей встречается редко: единичные случаи в каждом из регистров Испании, Нидерландов и Великобритании [165 - 166]. Такая редкая выявляемость может быть обусловлена отсутствием систематического сердечно-сосудистого скрининга у детей с ВИЧ инфекцией. Поскольку ЛАГ может проявляться только через годы или десятилетия после заражения, систематический скрининг следует рекомендовать ВИЧ-инфицированным детям.
ЛАГ, ассоциированная с портальной гипертензией
Во взрослой популяции ППГ развивается у 1,1 - 6,3% пациентов с портальной гипертензией, в большинстве случаев обусловленной циррозом печени [60]. У детей с портальной гипертензией распространенность ППГ колеблется от 1% до 5,2% [53 - 55]. Распространенность ЛАГ при у детей с ВПКШ может варьировать в зависимости от региона от 10 до 45%, что определяет ВПКШ как ведущую причину ППГ у детей [55 - 58].
ЛАГ, ассоциированная с ВПС
Транзиторная ЛАГ, преходящая после коррекции ВПС встречается в 21,9 случаев на 1 000 000 и является одной из самых распространенных форм ЛАГ у детей, уступая только персистирующей легочной гипертензии у новорожденных [165, 173, 174]. По данным национальных регистров Европы распространенность ЛАГ-ВПС у детей значительно варьирует от 7,8 до 15,0 на 1000 000 детей в зависимости от региона [101, 165 - 168, 173 - 174].
В странах с достаточно развитой сердечно-сосудистой хирургией распространенность ЛАГ у взрослых с ВПС составляет около 4,2%, представленность пациентов с синдромом Эйзенменгера минимальна и не превышает 1% [173, 174]. Простые претрикуспидальные ВПС с артериовенозным сбросом осложняются ЛАГ в 6 - 17% случаев, как правило, на 3 - 4 десятилетии жизни, из них СЭ развивают не более 2%. Напротив, посттрикуспидальные ВПС с артериовенозным сбросом осложняются ЛАГ уже на 1 году жизни, 50% из них разовьют синдром Эйзенменгера, что определяет необходимость хирургической коррекции данной группы ВПС в первые месяцы жизни [45, 48, 49, 174, 175].
ЛАГ, ассоциированная с шистосомозом
По оценкам ВОЗ, в мире более 230 миллионов человек поражено шистосомозом, из которых у 10% развивается гепатоселезеночная форма, которая, в свою очередь, осложняется ЛАГ в 5% [68]. Шистосомоз является эндемическим заболеванием и редко встречается в развитых странах, эпидемиология Ш-ЛАГ у детей не известна.
ЛАГ с устойчивым ответом на терапию блокаторами кальциевых каналов (БКК)
Эпидемиологию этой группы ЛАГ еще предстоит изучить. Основываясь на критериях Ситбона, эта подгруппа может включать около 8 - 15% детей с иЛАГ [13].
ЛАГ с признаками с признаками поражения вен/капилляров: веноокклюзионная болезнь легких/легочный капиллярный гемангиоматоз
По данным национальных регистров стран Европы и США, а также международного регистра ТОРР данный вид ЛАГ диагностировали в 0,7 - 2% случаев ЛАГ [164, 175].
Персистирующая ЛГ новорожденных (ПЛГН)
ПЛГН является наиболее частой причиной транзиторной ЛАГ, составляя около 30 случаев на миллион детей в год [165 - 167, 175]. В эпоху, предшествовавшую терапии ингаляционным оксидом азота, ПЛГН возникала примерно у 2 из 1000 рожденных живыми, при этом она была наиболее высока у доношенных и поздних недоношенных детей [176]. В период с 2003 по 2012 г. распространенность ПЛГН среди глубоко недоношенных детей составила 8,1%, причем тенденция ежегодно увеличивается, отчасти из-за увеличения выживаемости детей с крайне низкой массой тела при рождении. Доля новорожденных с ПЛГН обратно пропорциональна гестационному возрасту: заболеваемость составляет 15 - 22% у детей, родившихся на 22 - 24 неделе гестации, по сравнению с 3,8 - 5,2% у детей, родившихся на 27 недели гестации и позже [176, 177]. Несмотря на успехи в неонатальной кардиореспираторной помощи, ПЛГН по-прежнему остается одной из основных причин неонатальной заболеваемости и смертности с уровнем летальности 4 - 33% [95 - 98].
Группа 2. ЛГ, обусловленная заболеваниями левых камер сердца
У взрослых больных ЛГ при патологии левых камер сердца - одна из наиболее распространенных форм ЛГ, которая составляет 48 - 80% в структуре легочных гипертензий [101, 103, 104, 162, 178]. Эпидемиология ЛГ у детей с заболеваниями левых камер сердца неизвестна. По данным нескольких национальных педиатрических регистров ЛГ эта группа больных составила от 5 до 14% исследуемой популяции [165 - 168].
Группа 3. ЛГ, обусловленная заболеваниями легких и/или гипоксемией
Во взрослой популяции у 3 - 4% пациентов с хроническими заболеваниями легких регистрируется повышение среднего ДЛА более 40 мм рт. ст. T [6, 111].
У детей изолированная ЛГ, ассоциированная с заболеваниями легких, образует вторую по численности группу ЛГ после ЛАГ, составляя от 34 до 49% всех зарегистрированных случаев [101, 165 - 166, 175, 175]. Заболевания легких часто сопровождают другие группы ЛГ: 10 - 12% детей с ЛГ имеют сопутствующие заболевания легких, при этом БЛД является наиболее распространенным заболеванием, которое осложняется ЛГ в 25 - 30% случаев, формирую тяжелое сердечно-легочное заболевание с крайне неблагоприятным прогнозом [112 - 114]. До 47% детей с БЛД, осложненной ЛГ умирают через 2 года после постановки диагноза ЛГ. Тяжелая, часто суперсистемная форма ЛГ осложняет течение заболевания более 60% детей с врожденной диафрагмальной грыжей и гипоплазией легких, определяя высокий уровень смертности в этой группе в период новорожденности [112 - 117]. ЛГ осложняет течение 4,3% детей с синдромом ночного апноэ [121]
Группа 4. ЛГ, обусловленная обструкцией легочной артерии
Истинная распространенность ХТЭЛГ в популяции не известна, заболевание редко диагностируется у детей. По данным нескольких национальных регистров ЛГ у детей заболевание зарегистрировано в единичных случаях, составляя примерно в 0 - 1,4% случаев [111, 141, 165 - 168, 175].
Группа 5. Легочная гипертензия с неясными и многофакторными механизмами заболевания
ЛГ является серьезным осложнением и одной из основных причин гибели взрослых пациентов с хроническими гемолитическими анемиями [144]. При ЭХОКГ скрининге повышение ДЛА регистрируется у 30% взрослых с гемоглобином SS и у 10 - 25% с гемоглобином SC [145, 146]. В исследованиях, использующих инвазивную оценку, распространенность ЛГ при серповидно-клеточной анемии у взрослых варьирует от 6 до 11% [144, 145]. Выживаемость взрослых с гемоглобином SS в течение 40 месяцев даже при незначительном повышении ДЛА не превышает 40% [151].
У детей ЛГ осложняет течение заболевания у 10 - 20% детей с серповидно-клеточной анемией, также являясь основной причиной гибели [147 - 149].
ЛГ значительно ухудшает прогноз и выживаемость больных с миелопролиферативными заболеваниями. При ЭХОКГ скрининге данное осложнение выявляется в 35 - 40% случаев [152, 153]. Из-за тяжести основного заболевания инвазивная оценка параметров гемодинамики проводится не у всех пациентов. В исследованиях, использовавших инвазивную оценку, критерии ЛГ выявлялись у 7% больных [154 - 155].
ЛГ является частым осложнением у взрослых больных с хронической почечной недостаточностью - до 48,7% по данным ЭХОКГ скрининга. Распространенность легочной гипертензии зависит от стадии заболевания и колеблется от 9 до 39% у лиц с ХБП 5 стадии, от 18,8 до 68,8% у пациентов, находящихся на гемодиализе, и от 0 до 42% у пациентов, находящихся на перитонеальном диализе [158, 159]. При инвазивной оценке параметров гемодинамики показатели еще выше: до 68% пациентов с ХПН имеют ЛГ в качестве фатального осложнения. Преобладающим фенотипом ЛГ среди пациентов с ХБП является посткапиллярная ЛГ, выявляемая у 76% таких больных, реже (24%) выявляют прекапиллярную ЛГ [159]. При этом выживаемость в обеих группах одинаково низкая. При прекапиллярной ЛГ, ассоциированной с ХБП, до 75% больных составляют женщины [160].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I27.0 - Первичная легочная гипертензия
I27.2 - Другая вторичная легочная гипертензия
I28.8 - Другие уточненные болезни легочных сосудов
I28.9 - Болезнь легочных сосудов неуточненная
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Термин "легочная гипертензия" объединяет этиологически и патоморфологически различные заболевания и состояния, имеющие значительные клинические и прогностические различия. В настоящее время для определения и систематизации этого большого списка заболеваний используется несколько классификаций:
1. Гемодинамическая классификация ЛГ.
2. Клиническая классификацию ЛГ (общая).
3. Классификация педиатрической легочной гипертензионной сосудистой болезни.
4. Функциональная классификации ЛГ (ВОЗ).
5. Функциональная педиатрическая классификация педиатрической легочной гипертензионной сосудистой болезни.
6. Патоморфологическая классификация ЛГ.
1.5.1. Гемодинамическая классификация ЛГ
В зависимости от уровня поражения легочного сосудистого русла выделяют прекапиллярную, посткапиллярную и комбинированную пре- и посткапиллярные формы ЛГ [1, 6, 8]. Гемодинамические критерии этих форм и их различия, определяемые при катетеризации камер сердца, представлены в таблице 7.
Таблица 7. Гемодинамическая классификация легочной гипертензии у детей [1, 8, 13]
Гемодинамические типы ЛГ
Критерии
Ассоциация с клиническими группами ЛГ
Легочная гипертензия
(все формы)
Среднее давление в ЛА > 20 мм рт. ст.
1, 2, 3, 4 и 5
Прекапиллярная ЛГ
Среднее давление в ЛА > 20 мм рт. ст.
Давление заклинивания ЛА <= 15 мм рт. ст.
Индекс легочного сосудистого сопротивления >= 3 ед. Вуда x м2
1, 3, 4 и 5
Посткапиллярная изолированная
Среднее давление в ЛА > 20 мм рт. ст.
Давление заклинивания ЛА > 15 мм рт. ст Индекс легочного сосудистого сопротивления < 3 ед. Вуда x м2
2 и 5
Комбинированная пре- и посткапиллярная
Среднее давление в ЛА > 20 мм рт. ст.
Давление заклинивания ЛА > 15 мм рт. ст Индекс легочного сосудистого сопротивления >= 3 ед. Вуда x м2
2 и 5
1.5.2 Общая клиническая классификация ЛГ
ЛГ как синдром, ассоциируется с обширным спектром заболеваний, и только в двух формах (идиопатическая и наследственная ЛАГ) расценивается как самостоятельное (изолированное) заболевание. Первая клиническая классификация ЛГ, предложенная ВОЗ в 1973 г., включала только 2 категории: первичная и вторичная ЛГ. За прошедшие 50 лет произошли значительные изменения в понимании этиологии и патофизиологии, а также клинических различий разных вариантов ЛГ. В 2024 г. на основании материалов 7-го Всемирного симпозиума по ЛГ опубликована обновленная и пересмотренная классификация, включающая пять основных клинических групп ЛГ, объединяемых общими патоморфологическими, гемодинамическими, клиническими признаками и, соответственно, общей стратегией терапии (табл. 8) [1, 6]. Для соблюдения принципа преемственности данная классификация используется в качестве рабочего инструмента в ежедневной клинической практике у детей и взрослых, а также в различных эпидемиологических исследованиях, включая национальные и региональные регистры легочной гипертензии. Объединение различных вариантов ЛГ обусловлено общими для конкретной группы подходами к тактике ведения.
Таблица 8. Общая клиническая классификация легочной гипертензии [1]
Группа 1.
Легочная артериальная гипертензия
1.1. Идиопатическая ЛАГ
1.1.1 ЛАГ с устойчивым ответом на терапию БКК
1.2. Наследственная ЛАГ <1>
1.3 ЛАГ, индуцированная лекарственными препаратами и токсинами <2>
1.4. ЛАГ, ассоциированная с:
1.4.1. системными заболеваниями соединительной ткани
1.4.2. ВИЧ-инфекцией
1.4.3. портальной гипертензией
1.4.4. врожденными пороками сердца <3>
1.4.5. шистосомозом
1.5. ЛАГ с явными признаками веноокклюзионной болезни/гемангиоматоза легочных капилляров
1.6. Персистирующая ЛГ новорожденных
Группа 2.
ЛГ, обусловленная заболеваниями левых камер сердца
2.1. Сердечная недостаточность:
2.1.1 с сохраненной фракцией выброса
2.1.2 со сниженной или умеренно сниженной ФВ
2.1.3 кардиомиопатии со специфической этиологией
2.2. Пороки клапанов сердца:
2.2.1 поражение аортального клапана
2.2.2 поражение митрального клапана
2.2.3 смешанное поражение клапанов сердца
2.3. Врожденная/приобретенная сердечно-сосудистая патология, приводящая к посткапиллярной ЛГ
Группа 3.
ЛГ, обусловленная заболеваниями легких и/или гипоксемией
3.1. Хронические обструктивные заболевания легких или эмфизема
3.2. Интерстициальное заболевание легких
3.3. Сочетанный легочный фиброз и эмфизема
3.4 Другие паренхиматозные заболевания легких
3.5 Непаренхиматозные рестриктивные заболевания:
3.5.1 синдромы гиповентиляции
3.5.2 пневмонэктомия
3.6. Гипоксия без заболеваний легких (в т.ч. высокогорная)
3.7. Аномалии развития легких
Группа 4.
ЛГ, обусловленная обструкцией легочной артерии
4.1. Хроническая тромбоэмболическая ЛГ
4.2. Другие причины обструкции легочной артерии
Группа 5.
Легочная гипертензия с неясными и многофакторными механизмами заболевания
5.1. Гематологические заболевания
5.2. Системные заболевания
5.3. Метаболические заболевания
5.4. Хроническая почечная недостаточность с или без диализа
5.5. Тромботическая микроангиопатия опухоли легкого
5.6. Фиброзирующий медиастинит
5.7. Сложный врожденный порок сердца
--------------------------------
<1> мутации в генах BMPR2, ACVRL1*, TBX4, ENG, SOX17, KCNK3 и других
<2> амфетамины, метамфетамины, дазатиниб, рапсовое масло
<3> кроме: сложных ВПС, отнесенных к группе 5 и ВПС с обструкцией путей притока левого желудочка, отнесенных к группе 2
В классификацию ЛГ Nice 2018 года включены дополнительные причины неонатальной и детской ЛАГ, включая персистирующую легочную гипертензию новорожденного, ЛАГ с посткапиллярной обструкцией (обструктивное заболевание легочных вен и гемангиоматоз легочных капилляров), врожденные посткапиллярные обструктивные поражения (стеноз легочных вен и другая обструкция левого сердца), врожденные заболевания и пороки легких и новые генетические причины детской ЛАГ. Однако, данная классификация не отражает в полной мере особенности и выраженную гетерогенность ЛГ в детском возрасте.
1.5.3. Классификация педиатрической легочной гипертензионной сосудистой болезни
В 2011 г. Педиатрической целевой группой Научно-исследовательского института легочных сосудов на совещании в Панаме предложен термин "педиатрическая гипертензивная сосудистая болезнь легких" и представлена первая клиническая классификация, включающая десять основных групп и 109 подгрупп (табл. 9, 10) [102]. Данная классификация не ориентирована на выбор метода лечения. Нозологии объединены в группы на основании общих патогенетических и патофизиологических признаков. Цель ее - систематизировать выраженную гетерогенность легочной гипертензии во всех возрастных категориях от внутриутробного периода до подросткового возраста, улучшить понимание патогенеза и патофизиологии заболевания, тем самым облегчить сложную задачу диагностического поиска у ребенка с выявленной легочной гипертензией. Панамская классификация выделяет многофакторные причины детской легочной гипертензии, включая аномалии роста и развития легких, врожденные пороки сердца, хромосомные аномалии, нарушения дыхания во сне, хроническую аспирацию и пренатальные нарушения, которые способствуют развитию постнатальных заболеваний легких.
Таблица 9. Основные категории педиатрической гипертензионной сосудистой болезни легких [102]
Категория
Основные категории
1
Пренатальная или врожденная гипертензионная сосудистая болезнь легких
2
Перинатальная дезадаптация легочных сосудов (персистирующая легочная гипертензия новорожденных, ПЛГН)
3
Педиатрические сердечно-сосудистые заболевания
4
Бронхо-легочная дисплазия
5
Изолированная педиатрическая гипертензионная сосудистая болезнь легких (изолированная педиатрическая ЛАГ)
6
Многофакторная педиатрическая легочная гипертензия сосудистого происхождения в сочетании с врожденными пороками развития
7
Педиатрические заболевания легких
8
Педиатрические тромбоэмболические заболевания, обуславливающие сосудистую легочную гипертензию
9
Педиатрические гипобарические гипоксические состояния
10
Педиатрическая гипертензионная сосудистая болезнь легких, связанная с нарушением деятельности других систем
Полная классификация педиатрической гипертензивной сосудистой болезни представлена в таблице 10 (справочные материалы). Данная классификация полезна с клинической точки зрения, так как позволяет точно охарактеризовать состояние ребенка с учетом этиологии, особенно у детей, страдающих ЛГ, ассоциированной с врожденными пороками развития или хромосомными нарушениями. Некоторые заболевания или состояния могут осложняться легочной гипертензией, которую можно отнести к различным категориям.
1.5.4. Функциональная классификация легочной гипертензии по ВОЗ
Функциональный класс (ФК) пациента с ЛГ - один из важнейших параметров и прогностических факторов в определяющих тактику ведения таких больных [5, 7, 10, 11, 179, 180]. По рекомендациям экспертов ВОЗ в 1998 году, для больных с ЛГ адаптирована функциональная классификация Нью-йоркской ассоциации кардиологов (табл. 11, Приложение Г1 - ГN) [181].
1.5.5 Функциональная педиатрическая классификация педиатрической легочной гипертензионной сосудистой болезни
Функциональная классификация ЛГ по ВОЗ предназначена для лиц в возрасте 16 лет и старше. У детей существуют свои особенности оценки функционального статуса при ЛГ, которые зависят от возраста, роста и развития органов и систем, или могут быть связаны со свойственными возрасту поведенческими реакциями на внутренние и внешние стимулы. Оценка ФК зависит и от способности ребенка описывать симптомы. Поэтому у детей раннего возраста оценку ФК рекомендуется проводить с учетом нормативных параметров (рост, рефлексы, поведение). У маленьких детей особенно важно определить, можно ли считать нарушение какой-либо функции проявлением болезни, или это естественный процесс развития организма. Это следует принимать во внимание при оценке ФК у детей с ЛГ, развившейся на фоне генетических синдромов, влияющих на моторную и сенсорную сферу. С 6 лет ребенок, как правило, уже может сам рассказать о своем физическом состоянии, а также о самочувствии.
Члены педиатрической рабочей группы Института изучения заболеваний сосудов легких (PVRI) на ежегодной конференции PVRI в Панаме, в феврале 2011 г. представили консенсус по функциональной классификации легочной гипертензии у детей [182]. В ней предусмотрено 4 класса тяжести заболевания, класс III подразделен на подклассы А и Б. Классификация состоит из функциональных классов, разделенных на 5 возрастных групп (табл. 12 - 15, Приложение Г1 - ГN). Три группы предназначены для детей в возрасте младше 2 лет, когда происходят самые активные процессы развития и созревания организма. Учитывая тот факт, что дети в этом возрасте не могут рассказать о своем самочувствии, были использованы такие оценочные параметры как прибавка в весе, назначение дополнительного питания (с учетом тяжести заболевания). Количество учебных дней, пропущенных по состоянию здоровья, представляет собой важный критерий для оценки тяжести заболевания у детей школьного возраста. В связи с этим в классификацию были введены параметры (75%, 50% или ниже) посещаемости школы.
1.5.6 Патоморфологическая классификация ЛГ
В 1958 году Heath и Edwards предложили патоморфологическую классификацию легочной гипертензии для больных в ЛАГ-ВПС [182 - 183]. Впоследствии эту классификацию стали использовать для других форм ЛГ. Согласно авторам, морфологические изменения легочных сосудов развиваются последовательно и стереотипно.
Стадия 1. При большом ДМЖП и открытом артериальном протоке: медиальная гипертрофия артерий и артериол; изменений в интиме нет. При ДМПП: клеточная пролиферация интимы в мельчайших мышечных артериях и артериолах; фиброз интимы в легочных венах.
Стадия 2. Гипертрофия медии; клеточная пролиферация интимы.
Стадия 3. Гипертрофия медии; фиброз интимы; раннее генерализованное расширение сосудов в тяжелых случаях.
Стадия 4. Прогрессирующее генерализованное расширение сосудов и фиброз интимы с окклюзией просвета артерии, фиброэластоз. Появление плексиформных поражений, которые являются одной из форм сложных дилатационных поражений, возникающих в легочных артериолах и мелких мышечных легочных артериях.
Стадия 5. Появление других "поражений расширения", включая похожие на вены ветви гипертрофированных мышечных артерий, кавернозные поражения и ангиоматоидные поражения; сильно сосудистое легкое из-за похожих на вены артериальных ветвей; легочный гемосидероз.
Стадия 6. Некротизирующий артериит.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Симптомы ЛГ не специфичны и значительно варьируют в зависимости от возраста больных, их клинического и функционального статуса [179, 180, 185 - 187]. В младенчестве и раннем возрасте клинические проявления явной правожелудочковой недостаточности крайне редки и выявляются при очень запущенной стадии заболевания. У маленьких детей может наблюдаться отставание физическом развитии. Наиболее частыми жалобами у детей с ЛГ являются слабость и утомляемость, одышка в различной степени от минимальной в дебюте при значительной физической нагрузке, до одышки в покое и минимальной физической нагрузке в развернутой стадии. Одышка, как правило, носит инспираторный характер. Приступы удушья не характерны. В отсутствие внутрисердечных коммуникаций данные симптомы обусловлены недостаточным наполнением системного желудочка и низким сердечным выбросом во время физической нагрузки [8, 9]. По мере прогрессирования ЛГ появляются симптомы ПЖ недостаточности. Боли в грудной клетке при физической нагрузке обычно возникают из-за гипоперфузии миокарда, вызванной повышенным напряжением стенки ПЖ и потребностью миокарда в кислороде. Реже этот симптом может быть вызван сдавлением ствола левой коронарной артерии дилатированной ЛА. Недостаточное увеличение сердечного выброса во время физической активности может быть причиной пре- и синкопальных состояний. Периферические отеки, увеличение печени, асцит и набухание шейных вен возникают в развернуой стадии застойной правожелудочковой недостаточности и обусловлены нарушением биоэнергетики кардиомиоцитов в условиях избыточной пре- и постнагрузки, и неспособностью миокарда правого желудочка преодолеть повышенное легочное сосудистое сопротивление. Снижение аппетита и боли в правом подреберье могут возникать на фоне гепатомегалии, обусловленной застойными явлениями в печени. Ребенок или его родители могут отмечать увеличение обхвата живота из-за асцита. Реже пациенты отмечают кашель, кровохарканье и охриплость голоса. Последняя вызвана сдавлением левого возвратного гортанного нерва расширенным стволом легочной артерией (синдром Ортнера), что может приводить к нарушению иннервации голосовых связок.
"Визитной карточной" ЛАГ-ВПС с би- и унивентрикулярной гемодинамикой и массивным артериовенозным сбросом (ЛАГ с сохранением лево-правого сброса и ЛГ при сложных ВПС) служат частые бронхолегочные заболевания, связанные с переполнением малого круга кровообращения [45 - 48, 187]. Одышка, сердцебиение, утомляемость, слабость и плохая переносимость физической нагрузки у таких пациентов (в основном детей раннего возраста) связаны с застойной лево- и правожелудочковой недостаточностью и сопровождаются влажными хрипами в легких и увеличением печени [8, 45 - 50].
Часто диагноз ЛГ также может быть результатом случайных находок (например, увеличение кардиоторакального соотношения при рентгенографии, отклонения электрической оси сердца, признаки гипертрофии правых камер сердца при ЭКГ. В ряде случаев при жалобах на утомляемость, кашель, одышку у детей может быть ошибочно диагностирован бронхит или бронхиальная астма. У детей с обмороками, в т.ч. с судорожным компонентом, может быть выставлен ошибочный диагноз эпилепсии [9].
Жалобы на перебои в ритме сердца, учащенное сердцебиение - редкий, но опасный симптом у пациентов с ЛГ, который может быть обусловлен развитием жизнеугрожающих аритмий (например, фибрилляции или трепетания предсердий), ассоциирующихся с ухудшением прогноза заболевания и риском внезапной сердечной смерти.
При синдроме Эйзенменгера наблюдается цианоз и признаки его системных осложнений - эритроцитоз, деформация дистальных фаланг пальцев по типу "барабанных палочек" и "часовых стекол", нарушение осанки вследствие остеоартропатии и сколиоза, легочные и парадоксальные системные тромбозы, и эмболии, кровотечения, симптомы подагры и холелитиаза, нарушение функции почек и др. [19, 45 - 48].
Грозным осложнением длительно существующей ЛГ являются кровохарканье и легочные кровотечения, обусловленные разрывом патологических легочных коллатеральных артерий из БКК [46 - 48, 185]. Другая причина кровохарканья - инфаркты легкого вследствие тромбоза аневризматически расширенных легочных артерий при низкой скорости кровотока [47].
Легочно-гипертензионный криз у пациентов с ЛГ - быстрое и относительно длительное повышение ЛСС, как правило, обусловленное различными провоцирующими факторами - физической нагрузкой, стрессом, гиповолемией и др. Снижение легочного кровотока и сердечного выброса, нарастание гипоксемии, гипоперфузия и гипоксия тканей при легочно-гипертензионном кризе иногда сопровождается потерей сознания. Легочно-гипертензионный криз может длиться несколько часов и суток, купироваться самостоятельно, после лечения или привести к летальному исходу [20, 49 - 51, 186].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерием установления диагноза ЛГ является повышение среднего давления в легочной артерии более 20 мм рт. ст., определяемое у доношенных детей старше 3 месяцев жизни при катетеризации полостей сердца [1, 6, 8, 12, 13].
2.1 Жалобы и анамнез
- Рекомендуется детям с ЛГ всесторонний сбор анамнеза и жалоб для оценки клинического и функционального состояния [179 - 180, 186 - 188].
УДД 2 УУР A
Комментарий: при сборе анамнеза и жалоб рекомендуется расспросить ребенка и/или его родителей о наличии у него утомляемости, снижения переносимости физических нагрузок, отставания в физическом развитии, одышки как при физической нагрузке, так и в покое, приступов головокружений, обмороков, провоцируемых физической нагрузкой, кашля, кровохарканья, болей в грудной клетке, перебоев в ритме сердца, сердцебиения, болей в животе, отеков.
- Рекомендуется детям с ЛГ при оценке анамнестических данных уточнять наличие у ребенка факторов и заболеваний, ассоциирующихся с развитием ЛГ для уточнения этиологии заболевания [8, 45, 56, 61, 73, 75, 179 - 181].
УДД 2 УУР A
- Рекомендовано детям с ЛАГ-ВПС при сборе анамнестических данных выяснить проводилась ли оперативная коррекция порока, ее тип и модификацию, результаты, наличие или отсутствие осложнений, степень ЛГ до и после операции [45 - 48, 188].
УДД 3 УУР A
- Рекомендована детям с ЛГ оценка семейного анамнеза для определения ее семейной формы [40, 41].
УДД 3 УУР B
Комментарий: При сборе анамнеза рекомендовано расспросить родителей ребенка о наличии в семейном анамнезе указаний на ЛГ любой этиологии у родственников 1 - 2 степени родства, о близкородственном браке родителей ребенка.
2.2 Физикальное обследование
- Рекомендуется всем детям с подозрением или установленным диагнозом ЛГ при физикальном обследовании ребенка [8, 13, 45, 179 - 182, 187, 188]:
- провести общий осмотр,
- провести антропометрическое исследование ребенка согласно перцентильному распределению по возрасту и полу,
- оценить состояние кожных покровов, слизистых, подкожно-жировой клетчатки, лимфоузлов,
- определить тонус мышц,
- провести определение формы грудной клетки, исключить наличие костных деформаций,
- измерение частоты дыхания,
- определить характеристики верхушечного и сердечного толчка, провести терапевтические перкуссию и аускультацию сердца, провести измерение частоты сердцебиений, оценить ритм тонов сердца, наличие или отсутствие шумов,
- осмотреть, провести пальпацию шейных вен, оценить их наполнение в клино- и ортостазе,
- провести исследование пульса на периферических артериях верхних и нижних конечностей,
- провести измерение артериального давления на периферических артериях верхних и нижних конечностей,
- проведение пульсоксиметрии с определением сатурации кислорода на всех четырех конечностях (SpO2),
- оценить состояние передней брюшной стенки, размеры живота, провести терапевтические пальпацию и перкуссию живота,
- определить температуру конечностей, исключить периферические отеки,
- провести оценку выпитой и выделенной жидкости.
УДД 5 УУР C
Комментарий: При физикальном обследовании следует обратить внимание на отставание в физическом и психомоторном развитии, на цвет кожных покровов, наличие центрального, периферического или смешанного цианоза, изменение фаланг пальцев по типу "барабанных палочек" и ногтевых пластин в виде "часовых стекол"; на расширенные и наполненные вен шеи в клиноположении и ортостазе; на положительный венный пульс; на изменение формы грудной клетки ("бочкообразная" грудная клетка, сердечный горб); на усиленный, разлитой сердечный толчок, расширение границ относительной сердечной тупости; усиление, акцент II тона над легочной артерией; диастолический шум относительной недостаточности клапана легочной артерии (шум Грехема-Стилла); систолический шум трикуспидальной недостаточности; шум артерио-венозного сброса крови при системно-легочных шунтах; на увеличение печени, асцит, похолодание конечностей, периферические отеки.
- Рекомендовано детям с ЛГ проводить оценку функционального класса для оценки тяжести заболевания, стратификации риска ЛГ как при первичном обследовании, так и при динамически наблюдениях для оценки ответа на проводимую терапию (табл. 12 - 15 Приложение Г1 - ГN) [180 - 182, 187 - 189].
УДД 2 УУР A
2.3 Лабораторные диагностические исследования
- Рекомендовано детям с ЛГ проведение общего (клинического) анализа крови как при первичном обследовании, так и при динамическом наблюдении каждые 3 - 6 месяцев [8, 12, 187, 188, 190, 191].
УДД 5 УУР C
Комментарий: Помимо стандартной информации, получаемой при анализе гемограммы, необходимо обращать внимание на динамику уровней гемоглобина, эритроцитов, включая их ширину распределения по объему; у пациентов с синдромом Эйзенменгера - на наличие и степень полицитоза.
- Рекомендовано детям с ЛГ исследование кислотно-основного состояния и газов крови как при первичном обследовании, так и при динамическом обследовании каждые 3 - 6 месяцев для оценки эффективности терапии [8, 12, 187, 188, 190, 191].
УДД 5 УУР C
- Рекомендовано детям с ЛГ проведение анализа крови биохимического общетерапевтического с как при первичном обследовании, так и при динамических наблюдениях [8, 12, 187 - 191].
УДД 5 УУР C
Комментарий: Для пациентов, получающих постоянную терапию антагонистами рецепторов эндотелина оценка уровня АСТ и АЛТ должна проводиться регулярно, ежемесячно для своевременного выявления потенциального повреждения печени.
- Рекомендована детям с ЛГ оценка обмена железа, включая исследование уровней свободного железа и ферритина в крови и исследование железосвязывающей способности сыворотки, насыщения трансферрина железом, как при первичном обследовании, так и при динамическом наблюдении каждые 6 месяцев для своевременного выявления его дефицита и последующей коррекции железодефицитной анемии [192 - 194].
УДД 3 УУР A
- Рекомендовано детям с ЛГ исследование уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови для оценки тяжести заболевания, стратификации риска ЛГ как при первичном обследовании, так и при динамических наблюдениях для оценки ответа на проводимую у больных с ЛГ [195 - 200].
УДД 2 УУР A
Комментарий: Уровень NT-proBNP в сыворотке крови высоко коррелирует с показателями инвазивной гемодинамики, ФК, функцией правого желудочка и выживаемостью у детей. Оценка изменений уровня NT-proBNP в динамике также отражает изменения тяжести заболевания и используется в качестве прогностического биомаркера эффективности терапии и риска неблагоприятного исхода, включая летальность.
- Рекомендовано детям с ЛГ исследование уровней витамина B12 (цианокобаламина) и фолиевой кислоты в сыворотке крови, как фактора, влияющего на течение заболевания [201, 202].
УДД 4 УУР C
- Рекомендовано детям с ЛГ исследование уровней свободного трийодтиронина (СТ3), свободного тироксина (СТ4) и тиреотропного гормона (ТТГ) в крови всем больным с ЛГ при первичном обследовании и динамическом наблюдении для оценки функции щитовидной железы, как фактора, влияющего на течение ЛГ [203].
УДД 4 УУР C
- Рекомендовано детям с ЛАГ исследование на ВИЧ-инфекцию для исключения ассоциации с ВИЧ-инфекцией [75 - 83].
УДД 2 УУР A
Комментарии: 1. У детей с перинатальным контактом по ВИЧ-инфекции в возрасте младше 18 месяцев, а также у лиц, находящихся в инкубационном периоде, рекомендовано использовать молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1).
2. У детей с перинатальным контактом по ВИЧ-инфекции в возрасте старше 18 месяцев, а также у детей без перинатального контакта в качестве стандартного метода лабораторной диагностики ВИЧ-инфекции использовать тест-системы для одновременного определения антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) и антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови и антигена p24 вируса иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) в крови с последующим применением подтверждающих тестов (иммунный, линейный блот).
- Рекомендовано детям с ЛГ определение антигенов HbeAg, HbsAg, HbcAg вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, для исключения сопутствующей патологии [8, 187].
УДД 5 УУР C
- Рекомендовано детям с ЛГ проведение иммунологических тестов, включая исследование уровня C-реактивного белка в сыворотке крови, определение содержания ревматоидного фактора в крови, определение содержания антител к антигенам ядра клетки и ДНК в крови, определение содержания антител к экстрагируемым ядерным антигенам в крови, определение содержания антител к цитруллинированным белкам в крови, определение содержания антинейтрофильных цитоплазматических антител в крови, определение содержания антифосфолипидных антител в крови для исключения ассоциированных форм, включая системные заболевания соединительной ткани [62 - 68, 204].
УДД 5 УУР C
- Рекомендовано детям с ЛГ определение содержания антител IgG и, IgM к кардиолипину в крови, определение содержания антител к фосфолипидам в крови, включая волчаночный антикоагулянт, определение содержания антител к бета-2-гликопротеину в крови для выявления факторов риска ХТЭЛГ; у больных с вероятным или подтвержденным диагнозом ХТЭЛГ - для установления ее причины [141, 142, 204].
УДД 5 УУР C
- Рекомендована детям с ЛГ оценка системы коагуляции, включая определение активности протеина С в крови, определение активности протеина S в крови, определение активности антитромбина III в крови, определение активности фактора V в сыворотке крови", определение активности фактора VII в сыворотке крови", определение активности фактора VIII в сыворотке крови", исследование агрегации тромбоцитов всем пациентам с ЛГ для исключения наличия состояния гиперкоагуляции и определения вероятного риска ХТЭЛГ [140, 142, 205, 206].
УДД 5 УУР C
Генетическое обследование
- Рекомендован детям с ЛГ скрининг на наличие наследственных тромбофилий для выявления факторов риска ХТЭЛГ, у больных с вероятным или подтвержденным диагнозом ХТЭЛГ - для установления ее причины [141, 142, 200].
УДД 5 УУР C
- Рекомендована консультация врача-генетика с последующим проведением генетического исследование детям с ЛАГ неизвестной этиологии (идиопатической), семейной формой, ЛАГ-ВПС при малых/сопутствующих дефектах, ЛАГ-ВПС, сохраняющаяся после коррекции ВПС, ЛАГ, ассоциированной с лекарственным или токсическим воздействием для определения молекулярно-генетического варианта, проведения риск стратификации заболевания и выявления членов семьи с высоким риском ЛАГ [40 - 43, 207 - 210].
УДД 3 УУР A
Комментарий: Целесообразно включить в генетическое тестирование исследование генов, мутации в которых, доказано ассоциированы с ЛАГ: ACVRL1, ABCC8, BMPR2, CAV1, ENG, TBX4, KCNK3, EIF2AK4, а также в генах, вероятно ассоциированных с ЛАГ: NOTCH3, SMAD9, GDF2, AQP1, SMAD8, SOX17 и ATP13A3.
- Рекомендовано детям с отягощенным семейным анамнезом по ЛГ с наличием родственников 1 степени родства с моногенными формами нЛАГ, генетическое исследование для наиболее ранней диагностики заболевания ЛАГ [207 - 210].
УДД 3 УУР B
- Рекомендован регулярный неивазивный скрининг детей-бессимптомных носителей генетической мутации, ассоциированной с ЛАГ, на наличие критериев ЛГ включающий регистрацию электрокардиограммы (ЭКГ), трансторакальную эхокардиографию (ЭХОКГ), исследование уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови [207 - 210].
УДД 5 УУР C
2.4 Инструментальные диагностические исследования
- Рекомендовано детям с подозрением на наличие у них ЛГ на основании медицинского анамнеза, включая семейный, жалоб, физикального обследования провести как можно быстрее первичное обследования, включающие регистрацию ЭКГ, проведение ЭХОКГ и прицельной рентгенографии органов грудной клетки (рис. 1 Приложение Б) [8, 12, 13, 22, 45 - 48].
УДД 3 УУР A
2.4.1. Стандартная электрокардиография
- Рекомендована регистрация электрокардиограммы (ЭКГ) детям с подозрением на наличие ЛГ [211 - 214].
УДД 3 УУР A
Комментарий: ЭКГ является высокочувствительным, но не специфичным инструментом диагностики легочной гипертензии. Отсутствие изменений на ЭКГ не исключает ЛГ, поэтому ЭКГ не может служить методом скрининга ЛГ. Основными ЭКГ-маркерами ЛГ являются признаки гипертрофии правого желудочка и правого предсердия, с коррекцией на возраст ребенка, при этом наличие этих признаков не коррелирует с тяжестью заболевания. Из-за физиологической правограммы отклонение ЭОС как критерий ЛГ ненадежен у детей раннего возраста. ЭКГ у детей с ЛГ может выявить множество аномалий, включая нарушения ритма и проводимости, удлинение интервала QT, признаки ишемии миокарда. Желудочковые аритмии регистрируются при ЛГ реже, чем наджелудочковые тахикардии, возникновение которых ассоциируется с ухудшением состояния и прогрессированием правожелудочковой недостаточности. Персистирование трепетания или фибрилляции предсердий у таких больных являются фактором высокого риска смерти от правожелудочковой недостаточности (смертность до 82%) [214]. При этом стабильное восстановление синусового ритма ассоциируется с улучшение прогноза и снижением летальности до 6,3%.
- Рекомендована детям с ЛГ регистрация ЭКГ каждые 3 - 6 месяцев для динамического наблюдения [211 - 214].
УДД 3 УУР A
2.4.2. Рентгенография органов грудной клетки
- Рекомендована прицельная рентгенография органов грудной клетки детям с подозрением на ЛГ при первичном обследовании [12, 13, 22, 187, 188, 215, 216].
УДД 5 УУР C
Комментарий: При проведении рентгенографии следует обращать внимание на патологические изменения, включающие повышение прозрачности легочных полей на периферии за счет обеднения легочного рисунка; выбухание ствола и левой ветви легочной артерии, которые формируют в прямой проекции II дугу по левому контуру сердца; расширение корней легких; увеличение правых отделов сердца. Рентгенография грудной клетки обычно позволяет обоснованно исключить умеренное или тяжелое поражение легких или венозную легочную гипертензию, обусловленную болезнями левых камер сердца, приводящую к отеку легких. Однако степень ЛГ не обязательно коррелирует со степенью рентгенологических отклонений. У детей с подозрением на ЛГ рентгенография может дать исходную информацию о состоянии легких с учетом приемлемого риска/дозы облучения. Необходимость рентгенографии грудной клетки при повторных визитах определяется клинической ситуацией.
- Не рекомендовано детям с ЛГ проведение прицельной рентгенографии органов грудной клетки при каждом визите, если нет конкретных клинических показаний (например, изменение клинического статуса, наличие заболевания легких и др.) [215, 216].
УДД 5 УУР C
2.4.3. Эхокардиография
- Рекомендовано проведение трансторакальной эхокардиографии (ЭХОКГ) всем детям с подозрением на наличие легочной гипертензии [217 - 222].
УДД 2 УУР A
Комментарий: ЭХОКГ является основным методом скрининга на наличие признаков ЛГ. Чувствительность метода достигает 85%, специфичность - 74% при небольшом временном интервале (в идеале - 1 сутки) между ЭХОКГ и инвазивной оценкой параметров гемодинамики и снижается при увеличении этого промежутка [217 - 220]. Скрининг на наличие ЛГ должен обязательно проводиться всем детям с прогрессирующей одышкой, снижением толерантности к физической нагрузке, синкопе неустановленного генеза, физикальными признаками и симптомами, ассоциирующимися с ЛГ. При выявлении подобных симптомов необходимо исключить наличие врожденных пороков сердца и иных структурных аномалий сердца и сосудов. При проведении ЭХОКГ рекомендовано оценить форму, линейные размеры, объемы, толщину миокарда правого желудочка, размеры правого предсердия; оценить степень трикуспидальной и пульмональной регургитации. Показателями, свидетельствующими о наличии ЛГ, являются увеличение размеров и формы правого предсердия, увеличение объема, размеров, толщины миокарда правого желудочка, изменение формы правого и левого желудочков с отклонением межжелудочковой перегородки в полость левого желудочка и формирование его D-формы, расширение ствола легочной артерии и ее ветвей, изменение паттерна кровотока в легочной артерии, укорочение времени изгнания правого желудочка. Рекомендовано оценить систолическую и диастолическую функцию правого желудочка, рассчитать систолическое, диастолическое и среднее давления в легочной артерии с учетом давления в правом предсердии на основании размеров и степени коллабирования ВПВ. Эхокардиографические критерии легочной гипертензии представлены в таблице 16.
Таблица 16. Эхокардиографические критерии легочной гипертензии [1, 6, 8, 217]
Определение
Критерии
ЛГ маловероятна
Vтк регургитации <= 2,8 м/с,
СДЛА 1 <= 36 мм рт. ст.,
отсутствуют дополнительные ЭХОКГ критерии ЛГ
ЛГ возможна
1. Vтк регургитации <= 2,8 м/с,
СДЛА <= 36 мм рт. ст.,
есть дополнительные ЭХОКГ критерии ЛГ
2. Vтк регургитации >= 2,9 м/с,
СДЛА = 37 - 50 мм рт. ст.
ЛГ достоверна
Vтк регургитации > 3,4 м/с,
СДЛА > 50 мм рт. ст.
--------------------------------
<1> СДЛА - систолическое давление в легочной артерии
<2> Vтк регургитации - скорость кровотока трикуспидальной регургитации
- Рекомендован регулярный ЭХОКГ скрининг на наличие признаков легочной гипертензии детям с заболеваниями и состояниями, ассоциированными с развитием любых групп ЛГ, для своевременного выявления заболевания [8, 12, 13, 217 - 222].
УДД 3 УУР A
Комментарий: Регулярный скрининг на наличие ЛГ должен проводится всем пациентам с ВПС, системными заболеваниями соединительной ткани, портальной гипертензией, шистосомозом, ВИЧ-инфекцией, заболеваниями сердца, патологией легких, синдромом ночного апноэ, персистирующей ЛГ новорожденных в анамнезе, тромбоэмболиями, гемолитическими анемиями, миелопролиферативными заболеваниями, метаболическими заболеваниями и болезнями накопления, хронической почечной недостаточностью, а также генетическими и хромосомными заболеваниями, ассоциированными с ЛГ.
- Рекомендовано детям с вероятной ЛГ, выявленной при ЭХОКГ, подтвердить данными катетеризации сердца для верификации диагноза [8, 12, 13, 187, 217 - 228].
УДД 3 УУР A
- Рекомендованы детям с установленным диагнозом ЛГ регулярные повторные ЭХОКГ с использованием специализированных для ЛГ протоколов в среднем каждые 3 - 6 месяцев для мониторинга за состоянием внутрисердечной гемодинамики, контроля функции правого желудочка, стратификации риска и определения ответа на проводимую терапию [8, 12, 13, 187, 217 - 222].
УДД 3 УУР A
2.4.3.1. Расчет давления в легочной артерии при эхокардиографии
- Рекомендован детям с ЛГ расчет систолического давления в легочной артерии по пиковому систолическому транстрикуспидальному градиенту давления (PGтк) [217, 222 - 224, 226, 227].
УДД 3 УУР A
Комментарий: Оценка систолического PGтк должна проводится не менее чем в трех стандартных эхокардиографических позициях для выявления его максимальных значений. Расчет систолического PGТК производится с использованием модифицированного уравнения Bernoulli с коррекцией на расчетный показатель давления в правом предсердии и учетом градиента в выносящем тракте правого желудочка.
Наиболее частые ошибки, влияющие на достоверность при расчете СДЛА по скорости трикуспидальной регургитации:
1. значительное (более 20%) отклонение угла наклона сканирующего луча,
2. неправильный расчет давления в правом предсердии,
3. не принятие к расчетам градиента давления в выносящем тракте правого желудочка.
Минимальность или выраженность степени трикуспидальной недостаточности может затруднить адекватную оценку давления в ЛА и привести к недооценке и переоценке соответственно.
- Рекомендован детям с ЛГ расчет среднего давления в легочной артерии (срДЛА) для неинвазивной оценки уровня ЛА [217, 218, 226 - 228].
УДД 3 УУР B
Комментарий: Расчет возможен несколькими методами:
1. используя уравнение, где срДЛА = 0,61 x систолическое ДЛА + 2 мм рт. ст. или
2. определение срДЛА по сумме раннего (пикового) диастолического транспульмонального градиента и давления в правом предсердии.
- Рекомендовано детям с ЛГ определение диастолического давления в ЛА, используя сумму конечного диастолического транспульмонального градиента и расчетного давления в правом предсердии [217, 225, 227].
УДД 3 УУР A
2.4.3.2. Оценка морфологии и функции правых камер сердца
- Рекомендовано детям с ЛГ определение размеров и площади правого желудочка для оценки степени его ремоделирования [229, 230].
УДД 3 УУР B
Комментарий: Оценка стандартных размеров, площади правого желудочка и фракции укорочения площади производиться в B-режиме с учетом референтных значений по площади поверхности тела ребенка и расчетом Z-score [229 - 231].
- Рекомендовано детям с ЛГ определение конечно систолического индекса ремоделирования правого желудочка для стратификации риска ЛГ [231].
УДД 3 УУР B
- Рекомендовано детям с ЛГ определение систолической экскурсии фиброзного кольца трикуспидального клапана (TAPSE) для определение продольной систолической функции правого желудочка и стратификации риска [232 - 235].
УДД 3 УУР A
Комментарий: Оценка показателя у детей проводится строго с учетом референсных значений согласно возрасту и площади поверхности тела ребенка с расчетом Z-score [234, 235].
- Рекомендовано детям с ЛГ использовать показатель TAPSE для стратификации риска неблагоприятных событий при ЛГ как при первичном обследовании, так последующих динамических наблюдениях для оценки ответа на проводимую терапию [8, 217, 221, 232].
УДД 3 УУР A
- Рекомендована детям с ЛГ оценка деформации и скорости деформации миокарда правого желудочка методом speckle tracking для оценки его региональной и глобальной функции [236 - 237].
УДД 3 УУР B
- Рекомендовано определение объемов и фракции выброса правого желудочка методом 3D для оценки степени его ремоделирования и систолической функции [238 - 240].
УДД 3 УУР B
- Рекомендована детям с ЛГ оценка степени систолической экскурсии свободной стенки правого желудочка для определения его систолической функции [241 - 242].
УДД 3 УУР B
Комментарий: Снижение этого показателя относительно референсных значений у детей является высокочувствительным (100%) и высокоспецифичным (100%) маркером снижения глобальной систолической функции правого желудочка, коррелирующим с выживаемостью у детей с ЛГ.
- Рекомендовано детям с ЛГ определение соотношения продолжительности времени систолы и диастолы правого желудочка методом допплеровского исследования для стратификации риска ЛГ [243, 244].
УДД 3 УУР B
Комментарий: Увеличение отношения продолжительности систолы к диастоле > 1,4 коррелирует со снижением выживаемости у детей с ЛГ и является индикатором степени тяжести ЛГ и высокого риска.
- Рекомендована детям с ЛГ оценка систолической и диастолической функции правого желудочка методом тканевого допплеровского исследования для стратификации риска [245 - 247].
УДД 3 УУР B
Комментарий: Снижение пиковой систолической скорости (S') смещения фиброзного кольца трехстворчатого клапана у детей и молодых людей с ЛГ коррелирует с ФВ правого желудочка, ФК пациента и может служить прогностическим маркером [248].
- Рекомендовано детям с ЛГ определение времени ускорения систолического кровотока в стволе легочной артерии [248 - 250].
УДД 2 УУР A
Комментарий: Укорочение времени ускорения в выносящем тракте правого желудочка менее 100 мс является высоко чувствительным (84%), и специфичным (84%) признаком ЛГ у детей и взрослых. Показатель высоко коррелирует со степенью тяжести состояния. У детей данный показатель зависит от возраста и, соответственно, ЧСС, его оценка нуждается в определении Z-score.
- Рекомендовано детям с ЛГ определение размеров, 2D площади, объема и функции правого предсердия для определения преднагрузки правого желудочка [251 - 252].
УДД 3 УУР B
Комментарий: Систолический 2D индексированный объем правого предсердия, рассчитанный при ЭХОКГ, высоко коррелирует с уровнем давления в правом предсердии, определяемого при инвазивном исследовании.
2.4.3.3. Оценка межжелудочкового соотношения
- Рекомендован детям с ЛГ расчет соотношения линейных диаметров правого и левого желудочков в конце систолы для определения степени сдавления ЛЖ и стратификации риска ЛГ [253 - 257].
УДД 3 УУР A
Комментарий: Соотношения линейных диаметров правого и левого желудочков в конце систолы высоко коррелируют с показателями инвазивной гемодинамики и отражают степень тяжести ЛГ. Отношение ПЖ/ЛЖ >= 0,67 у детей старше 1 года с чувствительностью 100% и специфичность 95% ассоциируется с ЛГ [254]. Увеличение данного соотношения более 1,4 у детей старше 1 года соотносится с критериями высокого риска ЛГ [255, 256].
- Рекомендовано детям с ЛГ определение индексов эксцентричности левого желудочка в систолу и диастолу ПЖ/ЛЖ для определения степени сдавления ЛЖ и стратификации риска ЛГ [256 - 258].
УДД 3 УУР A
Комментарий: D-форма левого желудочка с увеличением индекса эксцентричности ЛЖ в систолу более 1,1 у детей старше 1 года с чувствительностью 100% и специфичность 97% ассоциируется с ЛГ [258].
- Рекомендовано детям с ЛГ определить диастолическую функцию левого желудочка для оценки степени компрессии ЛГ и тяжести заболевания [259 - 260].
УДД 4 УУР C
2.4.4. Чрезвенозная катетеризация сердца
Инвазивная регистрация параметров гемодинамики с помощью чрезвенозной катетеризации камер сердца является золотым стандартом диагностики ЛГ. При этом показания и алгоритм этого диагностического исследования различаются у пациентов с наличием сопутствующего ВПС или без.
- Рекомендовано выполнение процедуры чрезвенозной катеризации камер сердца детям с ЛГ в условиях специализированных детских кардиологических или кардиохирургических центров, имеющих достаточный опыт ведения детей с ЛГ и способных обеспечить лечение потенциальных осложнений, таких как легочный криз [261 - 264].
УДД 3 УУР A
- Рекомендовано проведение чрезвенозной катетеризации камер сердца у ребенка с подозрением на наличие ЛГ по данным предварительного обследования (физикальное обследование, ЭКГ, ЭХОКГ) [1 - 4, 265 - 270]:
а) для верификации диагноза ЛГ (выявления критериев ЛГ),
б) для определения гемодинамической группы (прекапиллярная, посткапиллярная, комбинированная пре- и посткапиллярная),
в) для стратификации риска неблагоприятных событий (низкий, промежуточный, высокий) до начала ЛАГ-терапии,
г) у пациентов с ЛАГ без ВПС для определения показаний к таргетной терапии,
д) у пациентов с ЛАГ-ВПС для определения показаний или противопоказаний к оперативному лечению ВПС.
УДД 3 УУР A
- Рекомендовано детям с впервые установленным диагнозом ЛАГ проведение полного протокола чрезвенозной катетеризации полостей сердца до назначения легочных вазодилятаторов для верификации прекапиллярной формы ЛГ, стратификации риска, определения метода и объема терапии [8, 9, 13, 46, 265 - 270].
УДД 3 УУР A
- Рекомендованы детям с установленным диагнозом ЛГ повторные процедуры чрезвенозной катетеризация камер сердца при [1 - 4, 8, 265 - 271]:
а) ухудшении клинического состояния,
б) необходимости оценки ответа на проводимую терапию,
в) выявлении ранних признаков прогрессирования заболевания,
г) появлении неинвазивных критериев промежуточного или высокого риска для более точной стратификации риска неблагоприятных событий и определения оснований для эскалации терапии,
д) оценке необходимости внесения в список ожидания трансплантации легких.
УДД 3 УУР A
Комментарий: Интервалы между повторными катетеризациями должны определяться на основании клинических данных, а решение о проведении процедуры катетеризации основывается, главным образом, на появлении признаков клинического ухудшения, требующего изменения терапии (комбинированной двойной-тройной терапии, смена препарата одного класса) или неудаче при достижении целей лечения.
- Не рекомендуется проводить чрезвенозную катетеризацию сердца детям с ЛГ и нестабильной гемодинамикой, в тяжелом состоянии, при которым требуется немедленное начало терапии [8, 262 - 270].
УДД 4 УУР C
Комментарий: При стабилизации состояния пациента следует вернуться к решению вопроса о проведении чрезвенозной катетеризации сердца, поскольку ее результаты могут повлиять на выбор метода и способа лечения.
- Не рекомендуется проводить чрезвенозную катетеризацию сердца из-за риска осложнений [8, 262 - 266]:
а) новорожденным с ЛГ и детям с массой тела менее 5 кг,
б) при типичной персистирующей легочной гипертензией новорожденных.
УДД 4 УУР C
- Рекомендовано детям с ЛГ включать в стандартный протокол катетеризации оценку и расчет параметров гемодинамики как правых, так и левых камер сердца [1 - 4, 8, 265 - 272]:
а) Среднее давление в правом предсердии, мм рт. ст.
б) Среднее давление в левом предсердии (при наличии межпредсердного сообщения), давление заклинивания легочной артерии или конечное диастолической давление левого желудочка, мм рт. ст.
в) Систолическое давление в правом желудочке, мм рт. ст.
г) Систолическое, диастолическое и среднее давление в легочной артерии, мм рт. ст.
д) Систолическое давление в левом желудочке, мм рт. ст.
е) Систолическое, диастолическое и средее давление в аорте, мм рт. ст.
ж) Сатурация крови в ЛА, аорте, левом предсердии и смешаной венозной крови, %.
з) Индекс легочного сосудистого сопротивления, ед. Вуда x м2.
и) Индекс периферического (системного) сосудистого сопротивления (ПСС), ед. Вуда x м2.
к) Сердечный индекс малого круга кровообращения (СИМКК), л/мин/м2.
л) Сердечный индекс большого круга кровобращения (СИБКК), л/мин/м2.
м) Сердечный индекс эффективного легочного кровотока (СИЭфКр), л/мин/м2.
н) Наличие и величина артериовенозного и веноартериального сброса крови, %.
УДД 3 УУР A
- Рекомендовано детям с подозрением на ЛГ определение среднего давления в легочной артерии для выявления критерия ЛГ [1 - 4, 6, 8, 265 - 270].
УДД 3 УУР A
Комментарий: Критерием наличия легочной гипертензии любой клинической группы и любого гемодинамического класса у детей является показатель среднего давления в легочной артерии выше 20 мм рт. ст.
- Рекомендован детям с ЛГ расчет среднего системного давления и его соотношения со средним давлением в легочной артерии для определения степени тяжести легочной гипертензии и стратификации риска неблагоприятных событий, включая летальность [1 - 4, 6, 8, 270].
УДД 5 УУР C
Комментарий: Соотношение среднего ДЛА к среднему АД менее 0,5 соответствует критерию низкого риска, значение данного соотношения более 0,5, но менее 0,75 - промежуточного риска и более 0,75 - высокому риску.
- Рекомендован расчет индекса легочного сосудистого сопротивления (иЛСС) при проведении катетеризации сердца детям с ЛГ для определения гемодинамического класса ЛГ, определения степени тяжести и стратификации риска с последующим решением вопроса о методе и тактике ведения, а также определения ответа на уже проводимую терапию [1 - 4, 8, 264 - 266, 270].
УДД 3 УУР A
Комментарий: Индекс ЛСС определяют с помощью следующей формулы: индекс ЛСС = (срДЛА - ДЗЛА) / СИМКК, где срДЛА - среднее давление в ЛА, ДЗЛА - давление заклинивания легочной артерии, а СИМКК - сердечный индекс малого круга кровообращения. Альтернативно давлению заклинивания легочной артерии могут использоваться давление в левом предсердии (измерение возможно при наличии межпредсердного сособщения) или конечное диастолическое давление левого желудочка (показатель может использоваться при отсутсвии митрального стеноза). Индекс ЛСС (иЛСС) >= 3 ед. Вуда x м2 поверхности тела ребенка является критерием прекапиллярного компонента легочной гипертензии и подтверждает наличие легочной гипертензионной сосудистой болезни как у детей с бивентрикулярной, так и с унивентрикулярного гемодинамикой. Выявление данного критерия у больного с исходно венозной легочной гипертензией свидетельствует о развитии комбинированной формы пре- и посткапиллярной легочной гипертензии (табл. 7). Значение иЛСС менее 10 ед. Вуда x м2 является критерием низкого риска ЛГ, от 10 до 15 ед. Вуда x м2 - промежуточного. Определение иЛСС более 15 ед. Вуда x м2 относит пациента к категории высокого риска ЛГ и ассоциируется с высокой летальностью.
- Рекомендовано определение давления заклинивания легочной артерии (ДЗЛА) детям с ЛГ для установления гемодинамического класса ЛГ (пре-, посткапиллярный или комбинировнный) [1 - 4, 6, 8, 265 - 270].
УДД 3 УУР A
Комментарий: ДЗЛА определяется при окклюзии легочной артерии баллоном катетера легочной артерии. В отсутствие препятствий путей притока левого предсердия ДЗЛА равно давлению в левом предсердии. В норме этот показатель не должен превышать 15 мм рт. ст., что позволяет дифференцировать прекапиллярную и посткапиллярную форму ЛГ. Увеличение ДЗЛА более 15 мм рт. ст. свидетельствует о наличии посткапиллярного компонента ЛГ и может наблюдаться как при изолированной венозной ЛГ, так и при комбинированной пре- и посткапиллярной форме ЛГ. При изолированной венозной (посткапиллярной) форме специфическая ЛАГ терапия противопоказана. Решение о назначении ЛАГ терапии при комбинированной (пре- и посткапиллярной) форме ЛГ должно быть чрезвычайно взвешенным и соблюдать баланс потенциальной пользы и вероятного вреда. Важно отметить, что посткапиллярная форма ЛГ, обусловленная стенозами легочных вен, часто связанными с врожденной диафрагмальной грыжей, другими ВПС или бронхолегочной дисплазией, должна быть исключена как потенциальная причина ЛГ.
- Рекомендовано определение давления в правом предсердии при проведении чрезвенозной катетеризации сердца детям с ЛГ для стратификации риска ЛГ и оценки степени тяжести и [1 - 4, 8, 264 - 271].
УДД 3 УУР A
Комментарий: Низкое (менее 10 мм рт. ст.) давление в правом предсердии свидетельствует о низком риске неблагоприятных событий, ассоциированных с ЛГ, показатели от 10 до 15 мм рт. ст. - о промежуточном риске, более 15 мм рт. ст. - о высоком риске. Давление в правом предсердии более 20 мм рт. ст. является маркером очень высокого риска и противопоказанием к процедуре атриосептостомии.
- Рекомендовано проведение чрезвенозной катетеризации сердца у детей с ЛГ на фоне самостоятельного дыхания пациента, либо под умеренной седацией, когда это только возможно [261 - 270].
УДД 3 УУР A
- Рекомендовано детям с ЛГ проведение первичной и повторных динамических чрезвенозных катетеризаций сердца при идентичных уровнях сознания пациента [261, 262, 267].
УДД 3 УУР A
- Рекомендовано детям с ЛГ продолжать назначенную таргетную терапию ЛАГ в день проведения катетеризации сердца для оценки ее эффективности [261, 262, 267 - 270].
УДД 3 УУР A
- Рекомендовано детям с ЛГ проведение острого теста на вазореактивность при катетеризации сердца для стратификации риска неблагоприятных событий [261, 266, 268, 273 - 276].
УДД 2 УУР A
- Рекомендовано детям с ЛГ проведение острого теста на вазореактивность в условиях специализированного кардиологического центра, имеющего опыт ведения данной группы пациентов и готового к потенциальным осложнениям, включая легочный криз [8, 261 - 264].
УДД 3 УУР A
- Рекомендовано детям с идиопатической, наследственной или медикаментозной ЛАГ проведение теста на вазореактивность для определения тактики медикаментозного лечения, стратификации риска и определения вероятного прогноза [261, 266 - 274].
УДД 2 УУР A
Комментарий: Тест состоит в определении основных показателей гемодинамики в ответ на введение короткодействующих вазодилататоров. После получения исходных параметров гемодинамики производится оценка реакции основных показателей на последовательное введение оксида азота, комбинации оксида азота и кислорода, #илопроста и комбинации оксида азота, кислорода и #илопроста. Тест на вазореактивность должен проводиться до начала ЛАГ-специфической терапии.
- Рекомендовано детям с ЛГ использование исходной комбинации оксида азота (20 - 80 ppm) и кислорода в высокой концентрации (FiO2 0,8 - 1,0) для сокращения времени обследования [8, 273 - 276].
УДД 2 УУР A
- Рекомендована детям с паренхиматозными/интерстициальными заболеваниями легких последовательная оценка параметров гемодинамики на фоне дыхание комнатным воздухом, затем кислородом (FiO2 1,0), затем кислородом (FiO2 1,0) и оксидом азота (60 - 80 ppm) [8, 273 - 276].
УДД 3 УУР A
- Рекомендовано детям с ЛГ при недоступности ингаляционного оксида азода рассмотреть ингаляционный #илопрост в качестве потенциальной его альтернативы для проведения теста на вазореактивность [277, 278].
УДД 4 УУР C
Комментарий: Дозы вводимых препаратов для вазореактивного теста представлены в таблице 17.
Таблица 17. Дозы препаратов, используемых для острого теста на вазореактивность у детей [273 - 277]
Препарат
Доза
Оксид азота
20 - 80 ppm
#Илопрост ингаляционный
0,3 - 0,5 мкг/кг
- Рекомендовано детям с ЛГ без признаков значимого артерио-венозного сброса крови (Qp / Qs = 1) критерием положительного острого теста на вазореактивность считать снижение более, чем на 20% среднего ДЛА и соотношения индексов ЛСС и ПСС при отсутствии снижения сердечного выброса [8, 261, 270, 273 - 275].
УДД 2 УУР B
- Рекомендовано детям с ЛГ до проведения острого лекарственного теста на вазореактивность исключить диагноз легочного веноокклюзионного заболевания, поскольку ингаляционное введение вазодилятаторов у этих пациентов может осложниться тяжелым, в т.ч. фатальным отеком легких [274 - 276].
УДД 4 УУР C
- Рекомендовано детям с ЛАГ-ВПС со значимым артериовенозным сбросом крови (Qp / Qs > 1,5:1) проведение острого теста на вазореактивность для определения показаний к хирургическому лечению ВПС и стратификации риска ЛГ [8, 45, 273, 277, 278, 282 - 284].
УДД 3 УУР A
- Рекомендовано детям с ЛАГ-ВПС со значимым артериовенозным сбросом крови (Qp / Qs > 1,5:1) в качестве критерия положительного теста на вазореактивность рассматривать снижение иЛСС и соотношения иЛСС/иПСС на 20% и более, при достижении иЛСС < 6 ед. Вуда x м2 и соотношение иЛСС/иПСС < 0,3 соответственно [8, 45, 273, 277, 278, 282 - 284].
УДД 3 УУР A
Комментарии:
1) У пациентов со значимым системно-легочным сбросом снижение иЛСС ниже 6 ед. Вуда x м2 и соотношения иЛСС/иПСС менее 0,3 свидетельствует, что закрытие шунта может быть выполнено безопасно с хорошим долгосрочным прогнозом.
2) При иЛСС от 6 до 8 ед. Вуда x м2, решение о закрытии дефекта (в ряде случаев с оставлением фенестрации межпредсердной перегородки) принимается с использованием другой доступной клинической информации.
- Не рекомендовано детям с ЛГ применение антагонистов кальциевых каналов и аденозина при остром тесте на вазореактивность [8, 274, 277, 285].
УДД 5 УУР C
2.4.5. Другие методы визуализации
- Рекомендуется детям с ЛГ использование дополнительных методов визуализации для исключения паренхиматозных заболеваний легких, веноокклюзионной болезни легких, хронической тромбоэмболической легочной гипертензии и анатомических обструкций, которые могут выходить за рамки того, что может быть диагностировано с помощью трансторакальной эхокардиографии [6, 8, 286, 287].
УДД 5 УУР C
2.4.5.1. Компьютерная томография с внутривенным болюсным контрастированием, мультипланарной и трехмерной реконструкцией
- Рекомендована компьютерная томография органов грудной полости с внутривенным болюсным контрастированием (КТ) всем детям с подозрением на наличие ЛГ для детальной оценки состояния паренхимы легких, для оценки структуры, анатомии бронхиального дерева и легочных сосудов, особенностей гемодинамики легочного сосудистого русла, а также морфологии органов средостения, сердца и сосудов [6, 8, 140, 210, 215, 286 - 292].
УДД 3 УУР A
Комментарий: КТ органов грудной полости - важный метод, позволяющий определить клинический класс ЛГ. Стандартизированные протоколы включают КТ-изображения паренхимы легких с высоким разрешением и КТ-ангиографию. Исследование необходимо при диагностике интерстициального заболевания легких, ВОБЛ, врожденных сосудистых мальформаций и аномалий, стенозов и обструкций легочных сосудов. Заподозрить наличие ЛГ при КТ-ангиографии позволяет изменение скорости распространения контрастного вещества и разница по времени между пиками контрастирования ЛА. При динамической КТ у пациентов с установленным диагнозом ЛГ скорость распространения контраста в ЛА снижается. Признаки ХТЭЛГ при КТ включают отсутствие или внезапный обрыв сосудов, заполненных контрастом, и "мозаичную перфузию", которая отражает неоднородность перфузии легких. Признаки ВОБЛ при КТ включают увеличение лимфатических узлов, центрилобулярные затемнения по типу матового стекла и утолщение перегородок с расширением легочной артерии. Напротив, признаки гемангиоматоза легочных капилляров при КТ включают гладкое утолщение междольковой перегородки, диффузные мультифокальные области затемнений по типу матового стекла, плевральный выпот и расширенные центральные легочные артерии. КТ-ангиография в настоящее время является золотым стандартом для выявления тромбоэмболии легочной артерии как у детей, так и у взрослых. Поскольку дети младшего возраста лучше переносят КТ-ангиографию органов грудной клетки, чем вентиляционно-перфузионное сканирование, многие центры предпочитают компьютерную томографию вместо исследований вентиляции/перфузии. Внедрение протоколов снижения дозы облучения при компьютерной томографии также является важным фактором. У взрослых вентиляционно-перфузионное сканирование более чувствительно для диагностики хронической тромбоэмболии легочной артерии, чем КТ-ангиография.
- Рекомендовано детям с подозрением на ЛГ измерение соотношения диаметров основного ствола легочной артерии к диаметру восходящей аорты при проведении КТ грудной клетки для выявления признаков ЛГ [290 - 293].
УДД 3 УУР B
Комментарий: Ряд исследований показал достоверную высокую корреляцию между параметрами, полученными из изображений КТ, включая диаметры легочной артерии и нисходящей аорты, сумму диаметров левой и правой легочных артерий, диаметр нисходящей аорты и их соотношение, и средним ДЛА в зависимости от возраста и роста ребенка. Увеличении соотношения диаметров основного ствола легочной артерии к диаметру восходящей аорты >= 1,4 является маркером ЛГ. Полученные с помощью регрессионного анализа формулы позволяют достоверно с высокой чувствительностью (88,9%) и специфичностью (72,2 - 77,8%) рассчитать среднее давление в легочной артерии. Такой неинвазивный мониторинг может быть использован для оценки ответа на проводимую терапии и необходимости ее коррекции.
- Рекомендовано детям с прекапиллярной ЛГ неясной этиологии проведение КТ грудной клетки с внутривенным болюсным контрастированием, в т.ч. с мультипланарной и трехмерной реконструкцией при наличии признаков гиперкоагуляции или факторов риска тромбоэмболии для диагностики ХТЭЛГ [89, 139, 140, 295].
УДД 2 УУР A
Комментарий: КТ легких является высокочувствительным (99%) и специфичным (97%) критерием диагностики как ТЭЛА, так ХТЭЛГ. При этом отрицательный результат КТ не исключает ХТЭЛГ, т.к. недостаточно хорошо оценивает дистальные сегменты легочного сосудистого русла. Для этой цели рекомендована вентиляционно-перфузионная сцинциграфия.
- Не рекомендована детям с ЛГ КТ грудной клетки при очевидной или установленной причине ЛГ (например, лево-правый системно-легочный шунт) [6, 8, 289 - 290].
УДД 4 УУР C
Комментарий: Если не исключены другие патологические анатомические состояния, ассоциированные с ЛГ, КТ органов грудной клетки может быть полезным.
- Рекомендовано проведение КТ высокого разрешения детям с ЛГ, которым планируется процедура трансплантации легких [6, 8, 87, 288].
УДД 3 УУР A
2.4.5.2. Планарная вентиляционно-перфузионная сцинтиграфия легких
- Рекомендовано детям с ЛГ проведение планарной вентиляционно-перфузионной сцинтиграфии легких, если диагноз остается неясен, несмотря на использование различных методов визуализации (катетеризация сердца, КТ грудной клетки с ангиографией) для исключения ХТЭЛГ [6, 8, 140, 143, 296, 297].
УДД 5 УУР C
Комментарий: Вентиляционно-перфузионная (V/Q) сцинтиграфия легких рекомендована в качестве скринингового теста первой линии для взрослых пациентов с ХТЭЛГ. Этот метод хорошо зарекомендовал себя и имеет превосходную диагностическую ценность, особенно при отсутствии заболеваний легких. Изображение перфузии включает воздействие ионизирующего излучения и требует инъекции макроагрегированного человеческого альбумина, меченного 99mTc (диаметром 10 - 90 мкм). Макроагрегированный альбумин задерживается в мелких легочных артериолах, и получается трехмерное изображение легочной перфузии. При ХТЭЛГ обычно выявляются периферические клиновидные дефекты разного размера. Несоответствие вентиляции можно подтвердить, сравнивая изображения вентиляции и перфузии. ХТЭЛГ может быть пропущена на КТ, так как истонченные дистальные сосуды и субсегментарный стеноз могут быть не оценены. Ранние исследования показали, что сцинтиграфия более чувствительна, чем КТ, для выявления ХТЭЛГ.
2.4.5.3. Магнитно-резонансная томография
- Рекомендована магнитно-резонансная томография сердца с контрастированием (МРТ) при первичном обследовании детей с подозрением на наличие ЛГ, а также в ходе последующего наблюдения для оценки анатомии и функции камер сердца [8, 215, 298 - 300].
УДД 2 УУР A
Комментарий: МРТ является золотым стандартом для оценки структуры, морфологии и функции сердца и сосудов. При ЛГ МРТ позволяет провести всестороннюю оценку сердца и подходит для мониторинга, т.к. часть параметров, включая параметры функции миокарда и гемодинамики ПЖ имеет прогностическое значение при ЛАГ. Результаты МРТ могут помочь определить причину ЛГ, особенно при заболеваниях левых отделов сердца и ХТЭЛГ.
- Рекомендовано детям с ЛГ при проведении МРТ сердца с контрастированием использовать следующие режимы визуализации [8, 215, 298, 301].
а) кино-МРТ для оценки массы, объема и функции обоих желудочков, с использованием пакета срезов вдоль длинной или короткой оси, покрывающих весь объем сердца;
б) фазово-контрастные МРТ измерения легочной артерии и ее ветвей, восходящей аорты;
в) стандартные 2D измерения потока (фазово-контрастное МРТ) в легочных венах при оценке легочного кровотока.
УДД 2 УУР A
- Рекомендовано при проведении МРТ сердца детям с ЛГ использовать контрастное усиление с гадолинием для выявления и количественной оценки фиброза миокарда [8, 215, 301].
УДД 3 УУР A
- Рекомендовано при проведении МРТ сердца детям с ЛГ провести оценку региональной функции миокарда ПЖ у больных с ЛГ [8, 298, 299].
УДД 4 УУР C
2.4.5.4. Ультразвуковое исследование органов брюшной полости (комплексное)
- Рекомендовано всем детям с ЛГ ультразвуковое исследование органов брюшной полости (комплексное) для исключения заболеваний печени, выявления признаков портальной гипертензии, аномалий и мальформаций сосудов печение, уточнения степени застойных явления по большому кругу кровообращения, в т.ч. признаков асцита [53 - 57].
УДД 3 УУР A
2.4.5.5. Легочные функциональные тесты
- Рекомендовано детям с ЛГ регулярное проведение пульсоксиметрии с определением сатурации кислорода отдельно на руках и ногах в состоянии покоя и после физической нагрузки для оценки наличия и степени гипоксемии как при первичном обследовании, так и при каждом динамическом наблюдении [6, 8, 12, 13, 45 - 47].
УДД 5 УУР C
- Рекомендовано детям с ЛГ старше 5 лет исследование легочной функции с проведением бодиплетизмографии и оценкой диффузионной способности легких (DLCO) при установлении диагноза ЛГ для определения клинического класса ЛГ и исключения любого сопутствующего бронхолегочного заболевания [6, 8, 12, 13, 306].
УДД 3 УУР A
Комментарий: Функциональные исследования системы дыхания обычно проводятся у детей старше 5 лет из-за необходимости следовать указаниям и делать сильный выдох в течение не менее четырех-шести секунд.
- Рекомендовано детям с ЛГ, которым планируется терапия ингаляционным #илопростом, функциональные исследования системы дыхания до начала терапии ингаляционными простаноидами [306, 307].
УДД 3 УУР A
Комментарий: #Илопрост для ингаляционного применения может вызывать бронхоспазм, что может служить причиной для отмены препарата.
- Рекомендовано проведение кардиореспираторного мониторинга детям с ЛГ, подверженным риску нарушения дыхания во сне, особенно пациентам с трисомией 21-й хромосомы, системными заболеваниями соединительной ткани и другой синдромальной патологией, у пациентов с уменьшенными размерами верхних дыхательных путей, в т.ч. с гиперплазией аденоидов, у пациентов с жалобами на значительную сонливость в дневное время, а также во всех случаях неадекватного ответа на проводимую ЛАГ терапию для выявления синдрома апноэ во сне или альвеолярной гиповентиляции [308 - 310].
УДД 2 УУР A
2.5 Иные диагностические исследования
- Не рекомендовано рутинное проведение биопсии легких у детей с ЛГ из-за выского риска возможных осложнений [8, 47, 63, 286].
УДД 4 УУР C
- Открытая биопсия легких может быть рекомендована при подозрении на наличие интерстициальных/паренхиматозных заболеваний легких, вено-окклюзионной болезни; капиллярного гемангиоматоза [8, 63, 286].
УДД 3 УУР C
- Открытая биопсия легких может быть рекомендована как дополнительная процедура при паллиативной коррекции врожденных пороков сердца [8, 45, 47, 50, 283].
УДД 3 УУР C
2.6. Особенности диагностики отдельных групп ЛАГ
- Рекомендовано детям с верифицированной прекапиллярной формой ЛГ неясной этиологии исключение всех возможных состояний и заболеваний, которые могли бы быть причиной развития прекапиллярной ЛГ, включая генетические мутации и хромосомные аномалии, ВПС со значимым системно-легочным шунтом, системные заболевания соединительной ткани, ВИЧ-инфекцию, состояния сопровождаемые портальной гипертензией, шистосомоз, заболевания и пороки развития легких, состояния, сопровождаемые стенозом или обструкцией легочных артерий, в т.ч. ХТЭЛГ [6, 8, 9, 12, 13, 45, 55, 61, 69, 78, 103, 111, 141].
УДД 2 УУР A
Комментарий: Алгоритм действий врача при диагностике ЛГ у детей представлен на рисунке 1.
- Рекомендовано детям и подросткам с ЛГ и ВПС провести полное диагностическое обследование, для определения причинно-следственной связи ЛГ, включая инвазивную оценку параметров гемодинамики для определения тактики лечения [8, 13, 22, 45 - 50].
УДД 2 УУР A
- Рекомендовано продолжить диагностический поиск другой возможной причины или пускового фактора детям с ЛГ и ВПС при отсутствии доказанной причинно-следственной связи ЛАГ с ВПС, когда ВПС рассматривается как фон, но не причина ЛАГ (рис. 1) [8, 13, 22, 45 - 50].
УДД 2 УУР A
2.7. Оценка функциональной способности
- Рекомендуется детям с ЛГ старше 7 лет проведение теста с 6-минутной ходьбой (Т6МХ) при первичном обследовании до начала терапии для определения функциональных способностей и стратификации риска ЛГ [311 - 315].
УДД 2 УУР A
Комментарий: Т6МХ должен включать оценку Z-score пройденной дистанции согласно нормативному распределения по возрасту, весу и полу ребенка, оценку одышки по шкале Борга, динамику ЧСС, частоты дыхания, АД, SpO2.
- Рекомендовано детям с ЛГ старше 7 лет проведение регулярных Т6МХ для определения ответа на проводимую терапию, включая динамику переносимости физических нагрузок, стратификацию риска неблагоприятных событий 1 раз в 3 - 6 месяцев [311 - 315].
УДД 2 УУР A
- Рекомендовано детям с ЛГ старше 7 лет, прошедшим дистанцию более 300 метров при Т6МХ, проведение кардиопульмонального нагрузочного теста (тредмил-тест или велоэргометрия) для дополнительной оценки переносимости физических нагрузок при первичном обследовании и при динамических наблюдениях 1 раз в 6 месяцев для определения ответа на терапию [316].
УДД 3 УУР A
- Рекомендуется детям с ЛГ определение функционального класса (ФК) на основании переносимости физических нагрузок, динамики роста и развития ребенка при первичном обследовании до начала терапии для стратификации риска, включая летальность, для определения объема терапии [8, 12, 180 - 182].
УДД 2 УУР A
- Рекомендованы регулярные оценки ФК ЛГ раз в 3 - 6 месяцев для определения ответа на проводимую терапию, включая динамику переносимости физических нагрузок, стратификации риска неблагоприятных событий, включая летальность, и для коррекции терапии [8, 12, 180 - 182].
УДД 2 УУР A
2.8. Определение степени тяжести заболевания
- Рекомендуется оценивать степень тяжести ЛГ у детей на основании комбинации клинических данных, включая прогрессирование симптомов, наличие признаков правожелудочковой недостаточности, функционального класса, уровня BNP/proBNP, комплекса измерений и расчетных показателей, полученных при эхокардиографии и инвазивной оценки гемодинамики, результатов теста на вазореактивность для назначения адекватной тяжести терапии (табл. 18) [5, 7, 8, 12, 180 - 182, 244, 249, 257 - 260, 266, 274, 313 - 319].
УДД 3 УУР A
Комментарий: Для каждого критерия устанавливаются значения для присвоения низкого, промежуточного или высокого риска расчетной смертности. Средний балл ряда критериев низкого и высокого риска на исходном уровне позволяет классифицировать пациентов как низкий, промежуточный или высокий риск предполагаемой летальности в течение 1 года. Изменения риска от первоначальной оценки до первого последующего наблюдения также предсказывают выживаемость и являются основанием для оптимизации/эскалации терапии.
- Рекомендовано в качестве оптимального ответа на терапию у пациентов с ЛГ использовать достижение или поддержание критериев низкого риска [180 - 182, 244, 249, 257 - 260, 266, 274, 313 - 319].
УДД 3 УУР C
- У стабильных пациентов рекомендуется выполнять регулярные оценки каждые 3 - 6 месяцев последующего наблюдения для своевременной эскалации терапии [180 - 182, 244, 249, 257 - 260, 266, 274, 315 - 319].
УДД 3 УУР C
Таблица 18. Стратификация риска неблагоприятных событий, включая летальность [8]
Критерии риска
Низкий риск
Высокий риск
Клинические проявления правожелудочковой недостаточности
Нет
Да
Симптомы прогрессируют
Нет
Да
Синкопе
Нет
Да
Отставание в физическом развитии
Нет
Да
ФК
I или II
III или IV
NTproBNP
Норма или минимальное повышение
Значительное повышение
> 1200 пг/мл (> 1 г)
ЭХОКГ, МРТ
Нормальные размеры или минимальная дилатация правых камер сердца, функция правого желудочка в норме.
ПЖ/ЛЖ < 1
TAPSE > -2 Z
AT > 100 мс
Систола/диастола ПЖ < 1,0
Отсутствует выпот в полости перикарда
Выраженная дилатация, снижение функции правого желудочка,
ПЖ/ЛЖ > 1,4
TAPSE < -3 Z
AT < 70 мс (> 1 г)
Систола/диастола ПЖ > 1,4
Выпот в полости перикарда
Гемодинамика по данным катетеризации сердца
СИ > 3,0 л/мин/м2
ДПП < 10 мм рт. ст.
срДЛА/срДАо < 0,5
Вазореактивность +
СИ < 2,5 л/мин/м2
ДПП > 15 мм рт. ст.
срДЛА/срДАо > 0,75
ИЛСС > 15 ед. Вуда/м2
АТ - время ускорения потока в легочной артерии
СИ - сердечный индекс
ДПП - давление в правом предсердии
срДЛА/срДАо - отношение среднего давления в легочной артерии к среднему системному артериальному давлению
ИЛСС - индекс легочного сосудистого сопротивления
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Основными целями терапии ЛГ, вне зависимости от ее этиологии, являются [27]:
1) уменьшение, облегчение симптомов заболевания;
2) улучшение качества жизни больных;
3) сдерживание прогрессирования заболевания;
4) улучшение выживаемости.
Важнейшие изменения в терапии ЛАГ, произошедшие за последние годы в результате появления новой генерации специфических препаратов, привели к улучшению клинической симптоматики, функциональных и гемодинамических показателей, замедлению прогрессирование заболевания, улучшению прогноза в этой сложной группе пациентов.
В нашей стране терапевтическая практика располагает лекарственными средствами, зарегистрированными для лечения ЛАГ у взрослых пациентов. Исходя из механизма действия, препараты относятся к трем фармакологическим группам и могут применяться перорально и ингаляционно. В ближайшем будущем ожидается появление новых групп ЛАГ-специфических лекарственных препаратов. Однако появляющиеся новые методики медикаментозного лечения для взрослых пациентов с ЛАГ недостаточно хорошо изучены у детей. Кроме того, многофакторный характер ЛАГ у детей существенно затрудняет выбор возможных средств лечения и не приемлет необдуманного назначения любых имеющихся в наличии ЛАГ-специфических препаратов. Алгоритм лечебной тактики ЛАГ у детей представляет собой комплексную стратегию, включающую оценку тяжести и прогноза заболевания в каждом конкретном случае, оценку эффективности различных лекарственных средств и их взаимодействия при возможных комбинациях, а также лекарственное взаимодействие с сопутствующими препаратами (рис. 2) [6, 8, 22, 27, 340]. С относительно недавнего времени в клиническую практику вошли новые хирургические и интервенционные методы паллиативного лечения детей с тяжелой ЛАГ, включающие атриосептостомию (АС) и анастомоз Поттса, позволяющие снизить избыточное давления в правом желудочке, уменьшить компрессию, улучшить релаксацию левого желудочка и увеличить системный выброс.
Выбор тактики лечения ЛГ у детей обусловлен тяжестью заболевания и ограниченным спектром препаратов, разрешенных к применению в детском возрасте. Основные цели терапии ЛГ у детей, как правило, зависят от реальной клинической ситуации, но среди них выделяют базовые стратегические задачи, требующие решения в конкретной ситуации [6, 8, 27, 318 - 319]:
1) подавление патологической вазоконстрикции;
2) сдерживание прогрессирования пролиферативного ремоделирования легочных сосудов;
3) поддержание функции правого желудочка;
4) коррекция гипоксемии;
5) профилактика и лечение тромбозов;
6) лечение основного заболевания при ассоциированных формах.
Достижение глобальных целей терапии ЛГ у конкретного пациента требует, как правило, комбинации тактических решений и включает:
1) общие рекомендации по коррекции образа жизни, методам физической и психологической реабилитации, предупреждению беременности, вакцинации;
2) поддерживающую медикаментозную терапию ЛГ (коррекцию гипоксемии, ацидоза, обезболивание, седацию, антикоагулянты, диуретики, сердечные гликозиды, инотропные препараты; меры, направленные на коррекцию ассоциированного заболевания);
3) специфическую терапию ЛГ, включая медикаментозную вазодилатирующую, антипролиферативную терапию;
4) хирургическое лечение.
Основная стратегия современной терапии легочной гипертензии у детей и взрослых с ЛГ - достижение и поддержание профиля низкого риска, используя регулярную многофакторную стратификацию факторов риска, включая клинические, функциональные, лабораторные, гемодинамические характеристики, для своевременного назначения адекватной состоянию пациента терапии [8, 315 - 318].
3.1. Общие рекомендации для больных с легочной гипертензией
Для всех больных с ЛГ актуальны общие рекомендации, соблюдение которых позволяет уменьшить риск возможного ухудшения течения заболевания:
- Рекомендуется наблюдение детей с ЛГ в специализированных центрах для определения персонифицированной программы мониторинга и своевременной коррекции терапии [6, 8, 10, 12, 187, 196, 219].
УДД 3 УУР A
- Рекомендуется всем детям с ЛГ ограничение интенсивности физических нагрузок, исключение соревновательных видов спорта [6, 8, 321].
УДД 2 УУР A
Комментарий: Легкие физические упражнения могут быть полезны, но их следует выполнять только после консультации врача и всестороннего обследования, включающего нагрузочные тесты.
- Рекомендуется детям с ЛГ низкого риска легкие, до умеренных аэробные физические нагрузки под контролем самочувствия [6, 8, 27, 321, 322].
УДД 2 УУР A
Комментарий: Пациентам следует позволить самостоятельно ограничивать свою активность по мере необходимости, но при этом избегать напряженных и изометрических упражнений, дегидратации, а также физических нагрузок на средней (1500 - 2500 м) или большой (> 2500 м) высоте.
- Детям с ЛГ не рекомендованы силовые виды спорта, анаэробные и изометрические нагрузки [6, 8, 27, 321, 322].
УДД 2 УУР A
- Рекомендовано детям с ЛГ устранение провоцирующих факторов (болевого синдрома, возбуждения, ацидоза, алкалоза, гиповолемии, гипертермии, гиперкоагуляции, анемии, аритмии, инфекций и др. для избегания дестабилизации состояния и возможной провокации легочного криза [6, 8, 10, 12, 22, 187, 196, 323, 325].
УДД 5 УУР C
Комментарий: беспокойные пациенты с ЛГ, дети с гипервозбудимостью при болевом синдроме могут нуждаться в дополнительной седации.
- Рекомендовано детям с ЛГ, которым планируются оперативные вмешательства под седацией или общей анестезией, наблюдение кардиоанестезиолога или кардиореаниматолога с учетом анестезиологического риска [8, 22, 323, 325].
УДД 5 УУР C
- Рекомендовано детям с ЛГ проведение плановой вакцинации (включая вакцинацию против пневмококковой инфекции и гриппа), а пациентам до 2 лет с ЛГ - проведение иммунизации против РС-инфекции при отсутствии противопоказаний, во избежание ухудшения состояния вследствие управляемых инфекций [8, 22, 325, 326].
УДД 5 УУР C
Комментарий: В случае возникновения респираторных заболеваний терапия должна быть достаточно активной с целью минимизировать или предупредить повышение реактивности легочных сосудов вследствие вентиляционно-перфузионных нарушений и/или гипоксемии. Активная жаропонижающая терапия в случае лихорадки должна предупредить развитие метаболических нарушений. Любое инфекционное заболевание должно рассматриваться как фактор риска легочного гипертензивного криза, специфическая терапия на этом фоне должна быть максимальной.
- Рекомендована своевременная консультация девочек подростков, больных ЛГ, о вероятных рисках, ассоциирующихся с беременностью и родами, а также о возможности безопасной контрацепции [327].
УДД 5 УУР C
- Рекомендовано детям с ЛГ путешествовать авиатранспортом только в стабильном и компенсированном состоянии [8, 13, 22].
УДД 5 УУР C
3.2. Поддерживающая терапия легочной гипертензии
Поддерживающая медикаментозная терапия ЛГ включает коррекцию гипоксемии, снижение преднагрузки на правый желудочек, поддержание функции миокарда обоих желудочков, коррекцию имеющейся сердечной недостаточности для обеспечения достаточного сердечного выброса, меры, направленные на коррекцию ассоциированного заболевания.
3.2.1. Оксигенотерапия
- Рекомендована детям с ЛГ оксигенотерапия при стойком снижении насыщения кислородом артериальной крови менее 92% или парциального давления кислорода артериальной крови менее 60 мм рт. ст. для поддержания целевого насыщения артериальной крови кислородом 93% и более [8, 13, 22, 312, 322].
УДД 2 УУР A
Комментарий: Использование постоянной оксигенотерапии следует рассматривать в тех случаях, когда она приводит к доказанному уменьшению степени гипоксемии и клиническому улучшению. Рекомендованная скорость введения потока 1 - 2 литра в минуту. Значительное увеличение скорости потока может высушить слизистые и вызвать носовое кровотечение или ринит. Отмена оксигенотерапии проводится постепенно, сначала отменяют кислород в дневное время и период бодрствования, затем в ночное время и во время сна под контролем пролонгированной пульсоксиметрии. Следует учитывать, что оксигенотерапия повышает риск легочных осложнений, таких как пневмония или даже обострение хронического заболевания легких.
- Рекомендована детям с синдромом Эйзенменгера и PaO2 < 60 мм рт. ст. оксигенотерапия для уменьшения симптомов заболевания [8, 19, 45 - 47, 327].
УДД 5 УУР C
- Рекомендована детям с ЛГ оксигенотерапия при пребывании в высокогорных районах или во время авиаперелетов [8].
УДД 5 УУР C
- Рекомендована оксигенотерапия детям с ЛГ при десатурации менее 92% на фоне интеркуррентных заболеваний, гипертермии, возбуждении, болевом синдроме, авиаперелетах и других потенциально опасных состояниях для профилактики клинического ухудшения [8, 13, 22, 312, 322].
УДД 2 УУР A
- Рекомендована детям с ЛГ оксигенотерапия для купирования острого легочного криза [8, 13, 20, 22, 312, 322].
УДД 2 УУР A
- Рекомендована детям с тяжелой ЛГ, выраженной гипоксемией и тяжелой сердечной и/или дыхательной недостаточностью процедура экстракорпоральной мембранной оксигенации при неэффективности медикаментозной терапии, для предупреждения необратимых изменений в органах и тканях [6, 8, 328, 329].
УДД 2 УУР A
3.2.2. Оксид азота
- Рекомендован ингаляционный оксид азота (NO) детям с персистирующей ЛГ при резком ухудшении с дестабилизацией показателей гемодинамики, при развитии легочного сосудистого криза, острой ЛГ на фоне респираторного дистресс-синдрома, паренхиматозного/интерстициального заболевания легких и/или ПЛГН [4, 8, 92, 120, 122, 176, 186, 330 - 335].
УДД 2 УУР A
Комментарий: NO - бесцветный газ без запаха, мало растворимый в воде. Оксид азота (NO) является ключевой молекулой в биологии человеческой жизни, участвует в физиологии жизнеспособности органов и систем. Эндотелиальная его форма (eNO), секретируемая эндотелием легочных сосудов, непосредственно участвует в регуляции сосудистого тонуса, локально контролируя перфузию органов в соответствии с изменениями кровотока. Действуя как мощный вазодилататор, он играет важную защитную роль в отношении эндотелия, поддерживая сосудистый гомеостаз, подавляет избыточную пролиферацию гладкомышечных клеток сосудов, агрегацию тромбоцитов и связывание лейкоцитов с эндотелием. NO ограничивает окислительное фосфорилирование в митохондриях - функцию, которая может участвовать в регуляции клеточной биоэнергетики и апоптоза. NO для ингаляции - это газообразная смесь окиси азота и азота в концентрации 0,08 и 99,92% для 800 ppm и 0,1 и 99,9% для 1000 ppm соответственно. Ингаляции NO, проводимые в течение нескольких часов после операции, снижают соотношение легочного и системного сопротивления, а также индекс оксигенации у больных с послеоперационной легочной гипертензией, но не влияют на оксигенацию при длительной терапии. Значительных различий в ранней послеоперационной смертности или в среднем давлении в легочной артерии у пациентов, получавших терапию NO и плацебо не получено. Однако ингаляции оксида азота в настоящее время по-прежнему являются терапией первой линии при острой легочной гипертензии, в т.ч. у послеоперационных больных, но не используются в качестве метода постоянной терапии легочной гипертензии. Ингаляции NO снижают потребность в процедуре экстракорпоральной мембранной оксигенации, особенно у недоношенных детей с дыхательной недостаточностью. В 1999 г. FDA одобрило iNO для новорожденных (> 34 недель гестации) у пациентов с гипоксической дыхательной недостаточностью и ЛГ. У послеоперационных больных терапию начинают с малых (3 - 10 ppm) доз. У больных с тяжелой ЛГ ингаляции NO начинают со стартовых доз 20 ppm. При отсутствии эффекта дозу увеличивают до 40 ppm. Если эффект не наступает в течение 30 минут, терапию ингаляционным NO прекращают. Использование высоких доз NO у недоношенных детей может привести к развитию метгемоглобинемии, что потребует быстрой отмены препарата.
3.2.3. Антикоагулянты и дезагреганты
- Рекомендована детям с ЛГ терапия антикоагулянтами (АТХ код B01 Антитромботические средства) при наличии признаков гиперкоагуляции, доказанных артериальных и венозных тромбозах, тромбоэмболии легочной артерии, ХТЭЛГ, состояниях, требующих длительной установки центрального венозного катетера, с низким сердечным выбросом [8, 13, 22, 336 - 338].
УДД 2 УУР A
Комментарий: Назначение антикоагулянтов детям требует тщательного анализа анамнестических данных, оценки показателей коагуляции, функции печени для адекватного расчета вероятных риска и пользы от антикоагулянтной терапии. Целевой уровень международного нормализованного отношения (МНО) составляет 2,0 - 2,5 при иЛАГ и иЛАГ. При наличии признаков гиперкоагуляции, доказанных тромбозах в анамнезе целевые показатели МНО могут быть увеличены. Дальнейший режим дозирования устанавливается индивидуально под контролем МНО.
- Не рекомендовано детям с иЛАГ рутинное назначение терапии непрямыми антикоагулянтами [191, 337, 338].
УДД 2 УУР A
Комментарий: Нет РКИ в поддержку использования антикоагулянтов при иЛАГ. Отсутствуют доказательства улучшения выживаемости пациентов. Напротив, у детей с умеренной и тяжелой легочной гипертензией существует риск геморрагических осложнений, ассоциированных со вторичным угнетением фактора Виллебранда, тромбоципатиями.
- Не рекомендовано детям с наследственной геморрагической телеангиэктазией, портопульмональной гипертензией и ЛАГ-ВИЧ применение антикоагулянтов [8, 54, 55].
УДД 3 УУР C
3.2.4. Препараты железа
- Рекомендована детям с ЛГ коррекция дефицита железа и терапия анемий (Код АТХ - B03AC Парентеральные препараты трехвалентного железа) для предупреждения прогрессирования заболевания [191 - 195].
УДД 3 УУР A
3.2.5. Антагонисты рецепторов альдостерона и диуретики
- Рекомендована детям с ЛГ и клиническими признаками правожелудочковой недостаточности и/или перегрузкой объемом ПЖ назначение терапии диуретиками [8, 13, 22, 339, 340].
УДД 3 УУР B
Комментарий: Рекомендовано тщательное титрование доз препаратов под контролем уровня электролитов, мочевины в сыворотке крови, креатинина и состояния диуреза во избежание электролитных нарушений, резкого падения сердечного выброса и снижения системного артериального давления.
- Рекомендована детям с ЛГ терапия антогонистами рецепторов минералокортикоидов (Код АТХ - C03D Калийсберегающие диуретики) для снижения преднагрузки, улучшения диастолической функции правого и левого желудочков [8, 13, 22, 339 - 343].
УДД 2 УУР A
3.2.6. Сердечные гликозиды и другие сердечно-сосудистые препараты
- Не рекомендовано рутинное применение сердечных гликозидов детям с ЛГ и изолированной правожелудочковой недостаточности [6, 8, 13, 22, 344].
УДД 4 УУР C
Комментарий: Хотя применение сердечных гликозидов может оказывать благоприятное гемодинамическое действие при острой правожелудочковой недостаточности, вторичной по отношению к ЛГ, его роль в хроническом ведении этих пациентов противоречива. Применение #дигоксина** при лечении легочной артериальной гипертензии у детей ограничено. Результаты исследований противоречивы. Некоторые исследования показывают увеличение сердечного выброса, но другие не находят положительного влияния на выживаемость. В ретроспективной нерандомизированной когорте лечение #дигоксином** было связано с большей смертностью от всех причин и госпитализациями по поводу ХСН [345].
- Не рекомендовано детям с ЛГ применения ингибиторов ангиотензин-превращающего фермента и блокаторов рецепторов ангиотензина II с ЛГ при изолированной правожелудочковой недостаточности из-за риска значительного снижения сердечного выброса и усугубления системной гипотонии [6, 8, 13, 22, 346, 347].
УДД 4 УУР C
- Рекомендована детям с ЛГ 2-й группы стандартная терапия левожелудочковой или бивентрикулярной сердечной недостаточности с применением 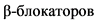 , ингибиторов ангиотензин-превращающего фермента или блокаторов рецепторов ангиотензина II, препаратов наперстянки, диуретиков и антагонистов рецептов альдостерона для лечения основного заболевания [108, 178, 347].
, ингибиторов ангиотензин-превращающего фермента или блокаторов рецепторов ангиотензина II, препаратов наперстянки, диуретиков и антагонистов рецептов альдостерона для лечения основного заболевания [108, 178, 347].
УДД 2 УУР A
- Рекомендовано использование тонической поддержки адрено- и допаминомиметиками (Код АТХ - C01CA Адренергические и дофаминергические средства) при прогрессировании или декомпенсации правожелудочковой недостаточности у больных ЛГ [6, 8, 13, 22, 346 - 348].
УДД 2 УУР A
3.3. Вазодилатирующая терапия легочной артериальной гипертензии
Назначение ЛАГ-специфических, патогенетически обоснованных препаратов с доказанным вазодилатирующим и антипролиферативным действием играет ключевую роль в терапии ЛАГ. Своевременность назначения и адекватность тяжести специфической терапии ЛАГ определяет прогноз заболевания. Решение о назначении ЛАГ-терапии принимаются с учетом комбинации факторов:
1. наличие критериев прекапиллярной ЛГ,
2. результаты теста на вазореактивность,
3. результаты многофакторной стратификации риска.
- Рекомендовано детям с ЛГ до начала лечения проведение многофакторной стратификации риска, включающей комбинацию клинических, гемодинамических и функциональных характеристик больного для определения критериев, соответствующих низкому, промежуточному или высокому риску неблагоприятных событий, включая летальность для выбора метода и объема терапии (табл. 18) [5, 7, 8, 12, 180 - 182, 244, 249, 257 - 260, 266, 274, 313 - 319].
УДД 3 УУР A
3.3.1. Неспецифическая вазодилатирующая терапия ЛАГ
Блокаторы кальциевых каналов
- Рекомендована детям старше 1 года с изолированной ЛАГ, резидуальной ЛАГ после радикальной бивентрикулярной коррекции ВПС и с ЛАГ при малых/сопутствующих дефектах монотерапия блокаторами кальциевых каналов (БКК) при соблюдении следующих критериев [8, 9, 13, 22, 45, 83, 84, 349, 350]:
1. тест на вазореактивность положительный;
2. сердечный индекс более 2,1 л/мин/м2;
3. SaO2 венозной крови более 63%;
4. давление в правом предсердии менее 10 мм рт. ст.;
5. критерии низкого риска ЛАГ.
УДД 5 УУР C
- Блокаторы кальциевых каналов не рекомендованы детям с ЛАГ при следующих условиях [8, 9, 13, 22, 45, 83 - 84, 349, 350]:
1) возраст пациента до 1 года;
2) отрицательный тест на вазореактивность;
3) пациентам не проводился тест на вазореактивность;
4) пациентам с правожелудочковой недостаточностью вне зависимости от ответа на вазореактивный тест;
5) пациентам с ЛАГ высокого риска вне зависимости от ответа на вазореактивный тест.
УДД 5 УУР C
- Рекомендуется детям с ЛАГ, получающим терапию БКК, оценивать эффективность терапии каждые 3 - 4 месяца на основании данных чрезвенозной катетеризации сердца с обязательным проведением теста на вазореактивность для своевременной коррекции терапии [8, 13, 83 - 84, 349].
УДД 5 УУР C
- Не рекомендовано детям с ЛАГ, получающим терапию БКК, ее продолжение в случае ее клинической не эффективности [8, 13, 83 - 84].
УДД 5 УУР C
Комментарий: использование БКК у пациентов, не отвечающих на лечение, может вызвать серьезные побочные эффекты, такие как гипотония, снижение сатурации кислорода и нарушение функции правого желудочка.
- Не рекомендовано детям с ЛАГ, получающим терапию БКК, ее продолжение при отрицательном тесте на вазореактивность при повторной катетеризации сердца [8, 22, 83 - 84, 349, 350].
УДД 5 УУР C
- Монотерапия БКК не рекомендована детям с синдромом Эйзенменгера и ВПС со значимым системно-легочным сбросом [8, 45, 349, 350].
УДД 5 УУР C
3.3.2. Специфическая вазодилатирующая терапия ЛАГ
Современная ЛАГ-специфическая терапия направленно воздействует на три основных звена патогенеза ЛАГ, включая путь эндотелина, путь оксида азота/циклического гуанозинмонофосфата и путь простациклина. В основе каждого патогенетического пути лежит эндотелиальная дисфункция, вызывающая нарушение существующего в норме равновесия между продукцией вазодилятирующих и вазоконстриктивных молекул, которое приводит к формированию стойкой, патологической вазоконстрикции [21].
ЛАГ-специфическая терапия включает пять групп препаратов, воздействующих на три основных пути патогенеза ЛАГ:
1) путь эндотелина: блокаторы рецепторов эндотелина-1 (бозентан**, #амбризентан**, #мацитентан**);
2) путь NO и циклического гуанозинмонофосфата (цГМФ): ингибиторы фосфодиэстеразы 5 типа (#силденафил, #тадалафил) и стимулятор растворимой гуанилат циклазы #риоцигуат**;
3) путь простациклина: синтетический аналог эндогенного простациклина #илопрост и агонист рецепторов простациклина #селексипаг** [6, 8, 21, 27 - 30].
- Рекомендовано назначение специфической терапии детям с верифицированным диагнозом ЛАГ при наличии одного и более условий [8, 13, 22, 85, 351 - 353]:
1. отрицательный тест на вазореактивность;
2. отсутствие ответа или неустойчивый ответ на ранее проводимую терапию БКК;
3. наличие противопоказаний к назначению БКК.
УДД 3 УУР A
- Рекомендована монотерапия специфическими вазодилятаторами детям с верифицированной ЛАГ при минимальном риске, отсутствии эффекта на терапию блокаторами кальциевых каналов или отрицательном тесте на вазореактивность [8, 13, 22, 85, 351 - 353]:
УДД 3 УУР A
Комментарий: Препаратами выбора для таких больных может быть антагонист рецепторов эндотелина (АРЭ), ингибитор фосфодиэстеразы 5 типа (иФД5) или агонист рецепторов простациклина (АРП).
- Рекомендована стартовая двойная терапия специфическими вазодилятаторами детям с ЛАГ низкого риска и отрицательным тестом на вазореактивность для облегчения симптомов заболевания и улучшения выживаемости [8, 11, 13, 22, 85, 351 - 354].
УДД 3 УУР A
Комментарий: Комбинированную терапию следует начинать с комбинации АРЭ и иФДЭ5. Альтернативными комбинациями могут быть сочетание АРП с любым из АРЭ или иФДЭ-5. При неэффективности комбинации рекомендуется рассмотреть возможность смены одного препарата на другой в рамках одного класса ЛАГ-специфических препаратов.
- Рекомендуется детям с ЛАГ, соответствующим критериям промежуточного риска, стартовая или последовательная двойная, или тройная терапия, включая АРЭ, иФДЭ5 и АРП для снижения выраженности симптомов, улучшения прогноза и достижения критериев низкого риска [8, 11, 13, 22, 85, 187, 351 - 354].
УДД 3 УУР A
- Рекомендуется детям с ЛАГ высокого риска незамедлительное начало тройной комбинированной ЛАГ терапии с применением простаноидов: ингаляционный #илопрост в сочетании с пероральными препаратами групп АРЭ и иФДЭ5 для уменьшения выраженности симптомов, улучшения прогноза и достижения критериев низкого риска [8, 13, 22, 187, 339, 340, 364 - 368].
УДД 3 УУР A
- Рекомендовано пациентам с ЛГ продолжать подобранную терапию с регулярной переоценкой многофакторной стратификации риска каждые 3 - 6 месяцев (табл. 18) для своевременного выявления возможного ухудшения, эскалации терапии и улучшения выживаемости [8, 13, 22, 187, 339, 340, 364 - 368].
УДД 3 УУР A
Комментарий: в случае, если статус низкого риска не достигается при плановых последующих оценках, требуется дальнейшая эскалация лечения. Достижение критериев промежуточного риска не является достаточным.
Бозентан**
Бозентан** (Код ATX - С02КХ01) является неселективным антагонистом эндотелиновых рецепторов со степенью селективности 20:1 к рецепторам эндотелина ETA и ETB и продолжительностью блокады рецепторов (t1/2) ~1 минута. Бозентан** подавляет синтез самого мощного из известных вазоконстрикторов эндотелина-1 (ЭТ), блокируя его основные эффекты, оказывает вазодилятирующее действие, подавляет клеточную пролиферацию, сдерживая ремоделирование миокарда, а также проявляет противовоспалительную активность. Результаты инвазивных исследований гемодинамики показали, что лечение бозентаном** приводит к значительному повышению сердечного индекса, а также существенному снижению давления в легочной артерии, легочного сосудистого сопротивления и среднего давления в правом предсердии [354]. Препарат является одновременно первым из группы АРЭ и первым пероральным ЛАГ-специфическим препаратом, достоверно улучшившим симптомы у детей и взрослых с ЛАГ. На протяжении двух десятилетий препарат занимал центральное место в терапии детей и взрослых с ЛАГ. Началу применения бозентана** в клинической практике у взрослых предшествовала целая серия клинических, контролируемых и неконтролируемых испытаний. Основные пять исследований: преклиническое пилотное, а также рандомизированные контролируемые клинические исследования BREATHE-1 и 2, EARLY, затем BREATHE-5, анализировавшие данные около 500 взрослых больных с идиопатической, наследственной и ассоциированной с ВПС ЛАГ, показали улучшение функциональных и гемодинамических показателей, увеличение времени до клинического ухудшения на фоне терапии бозентаном** в течение 12 - 24 недель [355 - 358]. Улучшение выживаемости и снижение риска прогрессирования заболевания на фоне приема бозентана** было выявлено и у больных ЛАГ, ассоциированной с системными заболеваниями [355, 359].
Исследования бозентана**, предшествовавшие регистрации показаний у детей, значительно менее многочисленны из-за трудностей и ограничений в проведении фармакологических испытаний в детском возрасте. Первое открытое рандомизированное, но неконтролируемое изучение фармакокинетики, эффективности и безопасности применения бозентана** у 19 детей с идиопатической ЛАГ и ЛАГ, ассоциированной с ВПС в возрасте 3 - 15 лет (BREATHE-3, 2003 г.), получавших бозентан** в форме нерастворимой таблетки в оболочке в дозе 2 мг/кг веса, показало улучшение показателей гемодинамики в обеих группах [360]. В неконтролируемое исследование фармакокинетического профиля, эффективности и безопасности диспергируемой формы бозентана** у детей FUTURE-1, 2 и 3 были включены суммарно 100 детей в возрасте от 1 до 12 лет для получения бозентана в дозе 2 мг/кг веса тела 2 раза в день, 2 мг/кг веса тела 3 раза в день и 4 мг/кг веса тела 2 раза в день. Наблюдения показали хорошую переносимость, улучшение параметров гемодинамики, стабилизацию или улучшение ФК больных. Выживаемость на 1-ом и 2-м году составили 98% и 94% соответственно [361 - 364]. При длительном применении бозентана** у детей в условиях реальной клинической практики получены противоречивый данные. Так в двухцентровое исследование в 2010 г. [365] были включены 86 детей (37 мальчики, 49 девочки) в возрасте 11 +/- 5 лет с иЛАГ, нЛАГ, ЛАГ-ВПС и ЛАГ, ассоциированной с системными заболеваниями соединительной ткани. За время наблюдения 40% пациентов потребовалось добавление простаноидов, 13% умерли. Расчетная 2-летняя выживаемость составила 91%. При проспективном наблюдении через 4 года у 54% пациентов отмечено прогрессирование заболевание. Четырехлетняя выживаемость составила уже 82%. Основными факторами риска прогрессирования заболевания и смертности являлись высокий функциональный класс и показатели легочного сосудистого сопротивления. Имеется достаточная доказательная база применения бозентана** у детей с ЛАГ при ВПС [356, 357].
В двух контролируемых исследованиях бозентана у новорожденных показана хорошая переносимость препарата и отсутствие серьезных угрожающих событий [366, 367]. В одном из них выявлено достоверное увеличение индекса оксигенации, снижение времени механической вентиляции легких, показана хорошая переносимость препарата, отсутствовали нежелательные явления. При этом не выявлено различий по уровню смертности по сравнению с плацебо. Как у взрослых больных, так и у детей с ЛАГ улучшение выживаемости и снижение риска прогрессирования заболевания у детей с ЛАГ на фоне приема бозентана** доказано только в составе комбинированной терапии с аналогами эндогенного простациклина [367].
На фоне приема бозентана** возможны нежелательные явлениями: боли в животе, конечностях, тошнота, рвота, головные боли, усталость, покраснение, отек и заложенность носа. Наиболее значимые побочные эффекты: увеличение уровня трансаминаз, отеки и анемия. Из всех побочных эффектов потенциальная гепатотоксичность бозентана** является наиболее значимой. Эффект, как правило, дозозависим и исчезает после отмены препарата. Несмотря на то, что в педиатрических исследованиях показано, что риски гепатотоксичности бозентана** у детей выражены гораздо меньше, ежемесячное определение активности АЛТ и АСТ в крови рекомендовано [370, 372]. Требуется соблюдать осторожность при одновременном применении бозентана** с индукторами и ингибиторами изофермента CYP3A4.
- Рекомендуется назначение Бозентана** детям с ЛАГ в возрасте от 3 месяцев и старше с минимальным риском в качестве монотерапии; при низком, промежуточном или высоком риске - только в составе комбинированной терапии для улучшения гемодинамических, функциональных показателей и удержания или достижения критериев низкого риска [6, 8, 12, 13, 22, 27, 354, 360 - 367].
УДД 2 УУР B
Комментарий: При применении педиатрической диспергируемой формы бозентана** у детей с ЛАГ в возрасте 1 года и старше рекомендуется применять начальную и поддерживающую дозу 4 мг/кг массы тела в сутки в 2 приема утром и вечером. Максимальная доза 250 мг в сутки. Оценка эффективности препарата должна осуществляться не ранее, чем через 4 недели приема препарата в постоянной поддерживающей дозе. С целью своевременного выявления нежелательных воздействий рекомендовано ежемесячное определение активности АЛТ и АСТ в крови у детей, получающих терапию бозентаном**.
- Рекомендовано детям с ЛАГ при отсутствии эффективности монотерапии бозентаном**, прогрессировании заболевания и наличии показаний к эскалации ЛАГ терапии с применением иФДЭ-5, принимая во внимание фармакодинамические эффекты бозентана** при комбинированной терапии, рекомендовано обсудить смену бозентана** на другой АРЭ [368 - 372].
УДД 2 УУР B
Комментарий: Комбинированная терапия бозентана** и иФДЭ5 не показала дополнительных преимуществ в переносимости физических нагрузок, параметров систолической функции миокарда и частоты нежелательных явлений [367 - 372]. При оценке фармакодинамики выявлено снижении концентрации #силденафила и #тадалафила на 62 и 43% соответственно в плазме крови при комбинированной терапии с бозентаном**, при этом концентрация самого бозентана** увеличивалась до 50% путем индукции изофермента цитохрома P450 3A4, что увеличивало риски его гепатотоксических эффектов [370].
- Рекомендован ежемесячный контроль активности аспартатаминотрансферазы и аланинаминотрансферазы, уровней гемоглобина и гематокрита в крови детям с ЛАГ на фоне терапии бозентаном** из-за потенциального риска осложнений [372, 373].
УУР 2, УДД A
#Амбризентан**
#Амбризентан** (код АТХ - C02KX02) - селективный антагонист эндотелина с селективностью к ETa и ETb рецепторам 100:1. Международное рандомизированное, двойное слепое, плацебо-контролируемое исследование III фазы с участием 383 взрослых пациентов с ЛАГ (ARIES) показало хорошую переносимость, улучшение клинической симптоматики и функциональных показателей, увеличение времени наступления ухудшения на фоне терапии #амбризентаном** [374]. Препарат показал хорошую переносимость и низкий уровень гепатотоксичнсти. С 2011 года препарат зарегистрирован в России для применения у взрослых больных с ЛАГ II - III функционального класса. #Амбризентан** - единственный из АРЭ, для которого в показания включено совместное назначение с #тадалафилом для снижения риска проводимой терапии. Рандомизированное, двойное слепое исследование комбинированной терапии #амбризентана** и #тадалафила (AMBITION) показало значительное (до 63%) снижение риска госпитализаций вследствие прогрессирования тяжести ЛАГ и смертности, улучшения прогноза по сравнению с монотерапией [375].
В небольшом ретроспективном исследовании с участием 38 детей с ЛАГ в возрасте от 2 до 18 лет (средний 10,1 +/- 4,1), получавших #амбризентан** в течение 3 месяцев в качестве дополнительной терапии или переведенных на терапию #амбризентаном** с терапии бозентаном**, показано снижение среднего давления в легочной артерии, улучшение функционального класса по ВОЗ в 31% случаев. Повышения уровней печеночных ферментов не наблюдалось, летальные исходы не зарегистрированы [376].
Рандомизированное не контролируемое исследование безопасности и эффективности (II фазы) двух доз #амбризентана** для лечения легочной артериальной гипертензии у 41 пациента в возрасте от 8 до 18 лет показало, что препарат переносился хорошо; профиль безопасности был идентичен таковому для взрослых [377]. Вопреки результатам исследования у взрослых с ЛАГ, получавшим #амбризентан**, не было зарегистрировано клинически значимых изменений гемоглобина, гематокрита, количества тромбоцитов, изменения уровня печеночных ферментов ни в одной из групп. Однако набор в исследование был отложен из-за результатов доклинических испытаний, показавших случаи уменьшения массы головного мозга у молодых крыс, получавших очень высокие дозы #амбризентана** 20 мг/кг в сутки. Несмотря на то, что дозы, применяемые у детей, были кратно меньше, набор в исследование ограничили пациентами старше 8 лет. Результаты исследования показали, что в целом эффективность препарата была аналогична данным, полученным у взрослых, однако степень снижение уровня NT-proBNP и улучшения ФК к 24-й неделе исследования было немного ниже, чем в исследовании #амбризентана** у взрослых [378].
В недавнем ретроспективном исследовании безопасность и переносимость комбинированной терапии #амбризентаном** и #тадалафилом при лечении легочной артериальной гипертензии у 43 детей старше 4 лет показано, что терапия хорошо переносилась с приемлемым профилем безопасности, ассоциировалась с улучшением переносимости физической нагрузки и гемодинамики у детей, которые ранее не получали лечения или получали монотерапию препаратами для лечения легочной гипертензии до начала применения #амбризентана** и #тадалафила [379].
- #Амбризентан** может быть рекомендован в качестве монотерапии детям старше 8 лет с ЛАГ, соответствующей критериям минимального риска при положительном остром тесте на вазореактивность и отсутствии эффекта от терапии антагонистами кальция; у детей с ЛАГ, соответствующей критериям низкого, промежуточного и высокого риска - в составе комбинированной терапии для улучшения гемодинамических, функциональных показателей и удержания или достижения критериев низкого риска [375 - 379].
УДД 2 УУР B
Комментарий: Стартовая доза #Амбризентана 2,5 мг на прием однократно в сутки, поддерживающая доза от 5 до 10 мг на прием однократно в сутки [376 - 379].
- Рекомендован детям с ЛАГ ежемесячный контроль активности аспартатаминотрансферазы и аланинаминотрансферазы, уровней гемоглобина и гематокрита в крови на фоне приема терапии #амбризентаном** для своевременного выявления потенциальных нежелательных явлений [372, 373].
УУР 2, УДД A
#Мацитентан**
#Мацитентан** (код АТХ - C02KX04) антагонист эндотелиновых рецепторов третьего поколения, разработан на основе молекулы бозентана** путем изменения структуры с целью повышения эффективности и безопасности с селективностью к ETa и ETb 50:1 [380]. Препарат обладает в 20 - 4000 раз большей липофильностью по сравнению с АРЭ первых поколений, в связи с чем лучше проникает в окружающие ткани. Медленная адсорбция #мацитентана** и медленное высвобождение активного метаболита ACT-132577, в сочетании с его лучшей пенетрантностью к тканям, обосновали применение более низкой дозы препарата и меньшую кратность применения - 1 раз в сутки - по сравнению с другими АРЭ. Помимо лучшей способности проникать в окружающие ткани основным отличием #мацитентана** от предыдущих АРЭ является его способность оказывать в 15 - 20 более продолжительную и выраженную блокаду рецепторов ETA и ETB, что приводит к большей клинической эффективности препарата по сравнению с АРЭ ранних генераций [381]. Вызывая длительную блокаду рецепторов эндотелина-1 способствует подавлению вазоконстрикции и препятствует пролиферации гладкомышечных клеток. В изучение профиля безопасности и эффективности #мацитентана** при длительной терапии ЛАГ в двойном слепом, плацебо контролируемом исследовании III фазы у пациентов с симптомной ЛАГ (SERAPHIN - Study with an Endothelin Receptor Antagonist in Pulmonary arterial Hypertension to Improve cliNical outcome) были вовлечены 151 центр из 39 стран мира. Итоговую когорту сформировали 742 пациента старше 12 лет, с идиопатической, наследственной ЛАГ, ЛАГ, ассоциированной с системными заболеваниями соединительной ткани, ВИЧ, после коррекции ВПС, ассоциированной с приемом препаратов или токсином [381]. Пациенты были рандомизированы в равном соотношении в группы для получения 3 мг или 10 мг #мацитентана** в сутки, или плацебо в течение 100 недель. Регрессионный анализ показал значительное, до 45%, снижения количества угрожающих событий, включая появление показаний к терапии внутривенными или подкожными простаноидами, АС или трансплантации легких в группе пациентов, принимавших 10 мг #мацитентана** по сравнению с плацебо. Смертность составила соответственно 14,0% и 17,6% в группе, получавшей препарат и плацебо. Прием #мацитентана** в дозе 10 мг значительно улучшал показатели сердечно-легочной гемодинамики, включая среднее давление в легочной артерии, показатель легочно-сосудистого сопротивления, сердечный индекс и уровень натрийуретического пептида по сравнению с плацебо. Улучшение гемодинамических характеристик сопровождалось повышением переносимости физических нагрузок и улучшало качество жизни пациентов. #Мацитентан** улучшал функциональные показатели, влиял на долгосрочные исходы, снижал прогрессирование заболевания и смертность вне зависимости от ранее проводимой терапии. Признаков токсического действия на печень не наблюдалось, однако, у 4,3% пациентов, получавших 10 мг #мацитентана**, было обнаружено снижение гемоглобина до уровня <= 8 г/дл. В отличие от бозентана**, #мацитентан**, по-видимому, не приводит к снижению уровня #силденафила в плазме, хотя данных, полученных в специальных исследованиях недостаточно.
В исследование SERAPHIN вошли 12 подростков в возрасте от 12 до 17 лет. Учитывая недостаточное количество респондентов, исследователи не смогли сделать вывод об эффективности применения #мацитентана** у детей с ЛАГ. При этом показана его хорошая переносимость и профиль безопасности, аналогичный взрослым пациентам.
Многоцентровое двойное, слепое, плацебо-контролируемое исследование III фазы (MAESTRO) для оценки эффективности и безопасности #мацитентана** у пациентов с синдромом Эйзенменгера в возрасте >= 12 лет показало неоднозначные результаты [382]. С одной стороны, через 16 недель терапии не получено достоверных различий по динамике функционального класса, шкале Борга, уровню сатурации. Произошло парадоксальное увеличение продолжительности дистанции при тесте с 6 минутной ходьбой в группе плацебо. С другой стороны, к моменту завершения исследования в группе пациентов, получавших #мацитентан**, произошло достоверное и значимое снижение уровня NT-proBNP, снижение индекса легочного сосудистого сопротивления по сравнению с плацебо. При этом исследование показало хорошую переносимость препарата, благоприятный профиль безопасности и переносимости по сравнению с другими АРЭ.
С 2016 г. по настоящее время проводится первое открытое международное многоцентровое рандомизированное исследование 3 фаз (TOMORROW), направленное на оценку эффективности, безопасности и фармакокинетики #мацитентана** по сравнению со стандартами лечения в замедлении прогрессирования заболевания у детей с ЛАГ. В исследование планируется привлечь детей в возрасте от 1 месяца до 17 лет.
Значительные успехи и благоприятный профиль безопасности применения #мацитентана** у взрослых, принимая во внимание недостаточную эффективность или побочные эффекты разрешенной терапии ЛАГ у детей, воодушевили педиатров и детских кардиологов для начала применения этого препарата в клинической практике off-label до получения данных контролируемого испытания #мацитентана** у детей, в т.ч. у детей грудного возраста [384 - 388]. Препарат показал хорошую переносимость, улучшение клинической симптоматики, функциональных и гемодинамических показателей.
Профиль безопасности #мацитентана** аналогичен бозентану**, однако риски их развития значительно меньше. Наиболее частые нежелательные явления: головная боль, назофарингит, анемия, отеки.
- #Мацитентан** рекомендован в качестве монотерапии детям с ЛАГ, соответствующей критериям минимального риска при положительном остром тесте на вазореактивность и отсутствие эффекта от терапии антагонистами кальция (код АТХ - C08 Блокаторы кальциевых каналов); у детей с ЛАГ, соответствующей критериям низкого, промежуточного и высокого риска - в составе комбинированной терапии для улучшения гемодинамических, функциональных показателей и удержания или достижения критериев низкого риска [384 - 388].
УДД 3 УУР B
Комментарий: Стартовая доза варьирует от 1 до 7,5 мг в зависимости от возраста, с постепенным увеличением ежедневно с шагом 1 мг до достижения максимальной дозы 5 - 10 мг однократно в сутки под контролем самочувствия и показателей гемодинамики (табл. 19) [389]. С осторожностью применять при одновременном назначении с индукторами и ингибиторами CYP3A4.
Таблица 19. Рекомендуемые дозы #мацитентана** у детей [387 - 388]
Вес ребенка
Суточная доза, мг
10 - 20 кг
5
20 - 40 кг
7,5
> 40 кг
10
- Рекомендован детям с ЛАГ ежемесячный контроль активности аспартатаминотрансферазы и аланинаминотрансферазы, уровней гемоглобина и гематокрита в крови на фоне приема терапии #мацитентаном** для своевременного выявления потенциальных нежелательных явлений [372, 373].
УДД 2 УУР A
#Силденафил
#Силденафил (код АТХ - G04BE03) - пероральный селективный ингибитор фосфодиэстеразы 5 типа, фармакологический эффект которого связан с повышением внутриклеточной концентрации цГМФ и повышением активности эндогенного оксида азота [389]. Увеличение концентрации этого нуклеотида оказывает релаксирующее и антипролиферативное действие на гладкомышечные клетки сосудов. Препарат увеличивает насыщение гемоглобина кислородом венозной и артериальной крови, улучшают показатели легочной гемодинамики и функциональные возможности больных ЛАГ. В многочисленных, в т.ч. рандомизированных, клинических исследованиях с участием взрослых пациентов показаны улучшение функциональных и гемодинамических показателей у пациентов с ЛАГ на фоне терапии #силденафилом [82, 389, 390].
В первом рандомизированном двойном слепом плацебо-контролируемом исследовании пероральной формы #силденафила у детей (STARTS-1) в 2011 году обследованы 235 детей с иЛАГ или ЛАГ, ассоциированной с ВПС в возрасте от 1 года до 17 лет и весом более 8 кг [391]. Дети были рандомизированы на 3 группы: получавшие низкую дозу (10 мг), среднюю дозу (10 - 40 мг) или высокую дозу (20 - 80 мг) #силденафила или плацебо перорально 3 раза в сутки на протяжении 16 недель. В результате исследования получено улучшение пикового потребления кислорода, функциональных показателей, снижение среднего давления в легочной артерии у пациентов, получавших средние и высокие дозы #силденафила по сравнению с плацебо. Низкие дозы оказались неэффективны. Последующее наблюдение в исследовании STARTS-2 этих же пациентов через 3 года после начала лечения показали, что смертность у этих пациентов составила 9% (5 из 55), 14% (10 из 74), и 20% (20 из 100) в группах, получавших низкие, средние и высокие дозы, соответственно [392]. При этом риск смертности был значительно выше у старших пациентов с иЛАГ, имевших исходно более высокие показатели давления в легочной артерии и легочного сосудистого сопротивления. Случаев смертности не отмечено у пациентов с весом < 20 кг и пациентов с ЛАГ, ассоциированной с ВПС.
В 2011 году #силденафил получил одобрение Европейского медицинского агентства для применения у детей в возрасте старше 1 года. В связи с более высокой смертностью в группе терапии высокими дозами #силденафила в 2013 году Европейское медицинское агентство выпустило предупреждение не использовать лекарственное средство в более высоких дозах. FDA в 2013 году даже выпустило предупреждение против длительного использования #силденафила у детей в возрасте 1 - 17 лет с ЛАГ, которое в 2014 году было уточнено (для применения #силденафила у детей "противопоказания отсутствуют"). #Силденафил при внутривенном применении может быть эффективен у детей с ПЛГН и в послеоперационном периоде после хирургического вмешательства по поводу ВПС [393].
Несколько систематических обзоров и метаанализов показали значительное снижение смертности у педиатрических пациентов с ЛГ на фоне терапии #силденафилом [393 - 395]. Было доказано, что препарат не только эффективен в снижении среднего и систолического давления в ЛА, но и в сокращении времени вентиляции легких в отделениях интенсивной терапии.
- #Силденафил рекомендован детям с ЛАГ с минимальным риском в качестве монотерапии; при низком, промежуточном или высоком риске - только в составе комбинированной терапии для улучшения гемодинамических, функциональных показателей и удержания или достижения критериев низкого риска [8, 12, 33, 390 - 393].
УДД 2, УУР B
Комментарий: Начальная доза: 0,3 - 0,5 мг/кг на прием 4 раза в сутки у детей до 1 года и 3 раза в сутки у детей старше 1 года перорально. Поддерживающая доза: 0,5 - 1 мг/кг на прием 4 раза в сутки у детей до 1 года и 3 раза в сутки у детей старше 1 года перорально.
Для детей от 8 до 20 кг рекомендована поддерживающая доза #силденафила 10 мг на прием 3 раза в сутки перорально. Для детей более 20 кг рекомендована поддерживающая доза #силденафила 20 мг на прием 3 раза в сутки перорально [8, 391 - 392]. Возможные побочные эффекты включают: гиперемию, возбудимость, гипотонию, нарушения зрения и слуха у недоношенных детей, приапизм. Поскольку #силденафил в основном метаболизируется ферментами цитохрома P450 (CYP) печени, следует избегать одновременного применения #силденафила с мощными индукторами или ингибиторами CYP3A, такими как кетоконазол или рифампин. При одновременном назначении #силденафила и бозентана** следует учитывать, что бозентан** снижает максимальную концентрацию (Cmax) #силденафила** в плазме крови на 55,4%, тогда как сам #силденафил увеличивает Cmax бозентана** на 42,0% [396]. Клинический эффект этого взаимодействия до конца неясен, однако вероятность гепатотоксического эффекта бозентана** увеличивается, что требует пристального мониторинга функции печени. Параллельное увеличение дозы #силденафила у детей не рассматривается.
#Тадалафил
#Тадалафил (код АТХ - G04BE08) - иФД5 нового поколения, показавший идентичный #силденафилу профиль эффективности и безопасности, но имеющий преимущества в виде однократного приема [394]. В международном рандомизированном плацебо-контролируемом исследовании фазы III эффективности и безопасности #тадалафила у 34 детей в возрасте от 6 до 18 лет с ЛАГ, получавших ранее терапию АРЭ (бозентан** или #мацитентан**) показана тенденция к улучшению гемодинамических, функциональных и лабораторных показателей через 24 недели приема [395]. При одновременном приеме #тадалафила и бозентана**, концентрация последнего в сыворотке крови пациентов увеличивалась, при этом концентрация #тадалафила снижалась [396]. В исследованиях, проводивших переход от #силденафила к #тадалафилу, показано снижение среднего давления в легочной артерии, что может свидетельствовать о лучшей эффективности #тадалафила [397, 398]. В ретроспективном, не контролируемом наблюдении 42 новорожденных и детей раннего возраст с ЛГ, ассоциированной с БЛД, было показано, что прием #тадалафила в дозе 1 мг на кг веса в сутки per os однократно хорошо переносится и коррелирует с улучшением давления в легочной артерии [399].
- #Тадалафил рекомендован детям с ЛАГ старше 2 лет с минимальным риском в качестве монотерапии; при низком, промежуточном или высоком риске - только в составе комбинированной терапии для улучшения гемодинамических, функциональных показателей и удержания или достижения критериев низкого риска [394 - 398].
УДД 2 УУР B
Комментарий: Доза #тадалафила у детей менее 25 кг - 1 мг на кг веса в сутки per os однократно, при весе ребенка от 25 до 40 кг - 20 мг #тадалафила один раз в сутки. При весе ребенка более 40 кг назначается доза аналогичная дозе у взрослых 40 мг однократна в сутки [8, 394 - 398]. При применении препарата в указанных дозировках значимых нежелательных явлений в контролируемых испытаниях не выявлено. #Тадалафил может быть рекомендован детям с ЛГ, ассоциированной с БЛД, для улучшения показателей легочной гемодинамики [399].
#Риоцигуат** (код АТХ - C02KX05) - пероральный стимулятор растворимой гуанилатциклазы, одобренный для лечения ЛАГ и хронической тромбоэмболической ЛГ у взрослых в РФ [400 - 402]. #Риоцигуат** обладает двойным механизмом действия: действуя в синергии с эндогенным NO, препарат напрямую стимулирует растворимую гуанилатциклазу (рГЦ) независимо от NO, тем самым увеличивая образование циклического гуанозинмонофосфата (цГМФ) [29]. Растворимая гуанилатциклаза экспрессируются в гладкомышечных клетках сосудов легких, тромбоцитах, кардиомиоцитах и других типах клеток. Связанная с NO, рГЦ катализирует превращение гуанозинтрифосфата в цГМФ, тем самым способствуя расширению сосудов и подавляя пролиферацию гладких мышц, рекрутирование лейкоцитов, воспаление, фиброз, агрегацию тромбоцитов и, возможно, ремоделирование легочных сосудов. В рандомизированном контролируем исследовании фазы III PATENT-1 (443 пациента с симптоматической ЛАГ) получено достоверное улучшение функциональных и гемодинамических показателей в группе получавших #риоцигуат** по сравнению с плацебо [400]. Было показано, что #риоцигуат** в индивидуально подобранной дозе до 2,5 мг три раза в день значительно улучшает переносимость физических нагрузок, снижает ЛСС и функцию правого желудочка, концентрацию NT-proBNP в сыворотке, улучшает ФК, время до клинического ухудшения, снижает оценку одышки по шкале Борга по сравнению с плацебо у взрослых с ЛАГ как в подгруппе монотерапии, так и в комбинации с другими ЛАГ-препаратами. Данные изменения были устойчивы при оценке отдаленных исходов у этих пациентов по данным открытого рандомизированного долгосрочного расширенного исследования PATENT-2 [401].
По результатам открытого рандомизированного долгосрочного расширенного исследования CHEST-2 отдаленных исходов у 237 пациентов, получавших #риоцигуат** по поводу ХТЭЛГ, 2-летняя общая выживаемость составила 93% (95% ДИ 89 - 96), а клиническая выживаемость без ухудшения - 82% (95% ДИ 77 - 87) [402]. ФК ВОЗ на исходном уровне и при последующем наблюдении не показал значимой связи с общей выживаемостью, но был связан с клинической выживаемостью без ухудшения. #Риоцигуат** хорошо переносился большинством пациентов, новых сигналов безопасности выявлено не было. Серьезные нежелательные явления наблюдались у 129 (54%) из 237 пациентов, и 14 (6%) пациентов прекратили терапию #риоцигуатом** из-за нежелательных явлений [416]. Возможные побочные эффекты включают системную артериальную гипотензию, головную боль, головокружения, диспепсию. Противопоказано одновременное применение с ингибиторами ФДЭ-5 (#силденафилом, #тадалафилом).
Первый опыт применение #риоцигуата** у 4-летнего ребенка с тяжелой супрасистемной иЛАГ опубликовано в 2018 году [403]. Безопасность, переносимость и фармакокинетика #риоцигуата** для перорального применения у детей с ЛАГ оценивалась в многоцентровом одногрупповом 24-недельном открытом исследовании фазы III PATENT-CHILD (NCT02562235). 24 пациента с ЛАГ ФК I - III ВОЗ в возрасте 6 - 17 лет, уже получавших терапию АРЭ и/или аналогами простациклина, получили #риоцигуат** в дозе 0,5 - 2,5 мг три раза в день в зависимости от массы тела. Первичными точками были безопасность, переносимость и фармакокинетика препарата.. Нежелательные явления (НЯ), в основном легкие или умеренные, были зарегистрированы у 20 пациентов (83%). У четырех пациентов (17%) наблюдалось серьезное НЯ; все проблемы разрешились к концу исследования, а два (8%) были расценены как связанные с приемом исследуемого препарата. Концентрации #риоцигуата** в плазме у педиатрических пациентов соответствовали концентрациям, опубликованным у взрослых пациентов. Через 24 недели применения исследование показало увеличение среднего +/- SD дистанции Т6МХ на 23 +/- 69 м (n = 19), а среднее снижение NT-proBNP составило - 66 +/- 585 пг/мл (n = 14). Никаких изменений в ВОЗ-ФК не произошло. У двух пациентов наблюдалось клиническое ухудшение состояния при госпитализации по поводу правожелудочковой сердечной недостаточности. Данные свидетельствуют о приемлемом профиле безопасности с потенциальными сигналами эффективности.
Опубликован первый опыт применения #риоцигуата** у 2 младенцев с тяжелой ЛАГ, при невозможности отлучиться от терапии ингаляционным NO в течение нескольких недель. Замена #силденафила на #риоцигуат** хорошо переносилась и позволила успешно отказаться от терапии NO [405].
- #Риоцигуат** может быть рекомендован детям с ЛАГ старше 6 лет в составе комбинированной двойной или тройной терапии при неэффективности иФД5 [8, 403 - 405].
УДД 2 УУР B
Комментарий: Рекомендованные дозы риоцигуата для применения у детей в возрасте 6 - 17 лет с ЛГ ФК I - III 0,5 - 2,5 мг три раза в день в зависимости от массы тела [403].
Ингаляционный #илопрост (код АТХ - B01AC11) - единственный зарегистрированный на территории РФ для применения у пациентов с ЛАГ синтетический аналог эндогенного простациклина. Основными эффектами #илопроста являются расширение легочных сосудов и, вероятно, противовоспалительный и сдерживающий ремоделирование эффекты, которые обычно не сопровождаются существенным влиянием на системное артериальное давление [330]. В многоцентровом рандомизированном плацебо-контролируемом исследовании AIR монотерапии терапии #илопростом у взрослых с ЛАГ показано увеличение дистанции Т6МХ и улучшении ФК (ВОЗ) без ухудшения или смерти по сравнению с пациентами, получавшими плацебо [406]. В многоцентровом, контролируемом исследовании STEP 67 пациентов с ЛАГ, получающих терапию бозентаном**, были рандомизированы для применения ингаляционного #илопроста или плацебо. Были отмечены значительные улучшения дистанции Т6МХ, ФК (ВОЗ), времени до клинического ухудшения и гемодинамическим параметрам. Комбинированная терапия оказалась безопасной и хорошо переносимой [407] в проспективном исследовании краткосрочных и долгосрочных эффектов ингаляционной терапии #илопростом у 22 детей с иЛАГ и ЛАГ-ВПС, в т.ч. при переходе от внутривенной терапии простаноидами, показано устойчивое функциональное улучшение у некоторых детей с ЛАГ, хотя иногда ингаляционный #илопрост вызывал бронхоконстрикцию [408]. Через 6 месяцев ФК улучшился у 35%, снизился у 15% и остался неизменным у 50% пациентов. 36% прекратили прием #илопроста из-за снижения реактивности дыхательных путей, клинического ухудшения или смерти. Острое введение ингаляционного #илопроста снижало срДЛА, эквивалентное ответу на ингаляцию оксида азота с кислородом. Острая ингаляция #илопроста снижала объем форсированного выдоха за 1 с и средний объем форсированного выдоха на 5% и 10% соответственно, что соответствует острой бронхоконстрикции. Побочные эффекты и несоблюдение режима лечения из-за частоты ингаляций могут ограничивать хроническое лечение детей.
Основная сфера применения ингаляционного #илопроста у детей - терапия острой легочной гипертензии и легочных кризов, в т.ч. в качестве альтернативы оксиду азота, а также применение в качестве агента при остром тесте на вазореактивность [409, 410]. При анализе острого эффекта ингаляционного #илопроста у 100 детей с ЛАГ-ВПС отмечено снижение срДЛА, увеличение Qp/Qs без изменения сердечного индекса, значительное снижение ЛСС [409].
Для хронического применения используется для терапии ЛАГ у детей только в составе комбинированной, как правило, тройной ЛАГ-терапии в комбинации с АРЭ и иФДЭ-5. Ретроспективный анализ показателей 20 детей с иЛАГ и аЛАГ показал, что своевременное назначение ингаляционного #илопроста в комбинации АРЭ и/или иФДЭ-5 необходимо и эффективно для облегчения клинической симптоматики [411]. В начале терапии #илопростом могут возникать головные боли, боль в челюсти и возможно развитие бронхоконстрикции, поэтому до начала терапии рекомендуется выполнить тесты для оценки функции легких.
- #Илопрост ингаляционный не рекомендован детям с ЛАГ в качестве постоянной монотерапии ЛАГ [408 - 410].
УДД 3 УУР A
- #Илопрост ингаляционный рекомендован детям с иЛАГ, нЛАГ, ЛАГ, ассоциированной с ВПС, системными заболеваниями соединительной ткани, лекарственными или токсическими воздействиями, ХТЭЛГ при установленном промежуточном или высоком риске ЛГ в составе комбинированной двойной или тройной ЛАГ-специфической терапии в комбинации с АРЭ и иФДЭ-5 для снижения выраженности симптомов и потенциального улучшения прогноза [8, 407 - 415].
УДД 3 УУР A
Комментарий: Средняя стартовая доза 1,25 мкг для детей раннего возраста и 2,5 мкг для детей старшего возраста. Средняя поддерживающая доза - 5 мкг на ингаляцию. Максимальная разовая доза, рекомендованная доза для детей 10 мкг. Ингаляции применяют от 6 (в случае стабильного состояния) и до 9 раз в сутки при дестабилизации [8, 407 - 411].
Не рекомендовано применение менее 6 и более 9 ингаляций в сутки.
Варианты дозировок в зависимости от веса ребенка:
Вес менее 10 кг - 7,5 мкг/сутки,
Вес 10 - 20 кг - 12,5 мкг/сутки,
Вес 20 - 30 кг - 17,5 мкг/сутки,
Вес 30 - 40 кг - 22,5 мкг/сутки,
Вес более 40 кг - 30 мкг/сутки.
У новорожденных с ПЛГН рекомендовано титрование дозы от 0,25 - 2 мкг/кг на одну ингаляцию, продолжительностью 5 - 10 минут, временные интервалы между дозами 2 - 8 часов. Указанные "альвеолярные дозы" применяются при введении с помощью лицевой маски, эндотрахеальной трубки или контура ИВЛ. При использовании мундштука в небулайзер вводится #илопрост в дозе, превышающей альвеолярную в 4 раза. Допускается использование различных устройств для проведения ингаляции, использующих сверхмалое дисперсное распыление лекарственного вещества, при условии, что размер капель составляет от 2,5 до 5 мкм. До начала первого введения препарата рекомендована оценка функции внешнего дыхания для исключения наличия тяжелых обструктивных нарушений. Появление признаков системной гипотензии, бронхоспазма на фоне ингаляций илопроста является ограничением для его дальнейшего использования (рассмотреть альтернативные варианты лечения).
- Перед началом ингаляционной терапии #илопростом целесообразно проведение исследование дыхательных объемов с применением лекарственных препаратов для исключения наличия тяжелых обструктивных нарушений [6, 8, 408, 410, 411].
УДД 3 УУР A
#Селексипаг** (АТХ - B01AC) - высокоселективный агонист рецепторов простациклина (IP) для перорального приема с выраженными вазодилатирующими и антипролиферативными свойствами [416]. Действие #селексипага** и его метаболита реализуется через активацию IP-рецепторов, вызывает вазодилатацию сосудов МКК и снижение ЛСС. Воздействуя посредством циклического аденозинмонофосфата, агонисты простациклина вызывают расслабление гладкомышечных клеток и, как следствие - расширение легочных сосудов; подавляя пролиферацию гладкомышечных клеток, снижают легочное сосудистое сопротивление; ингибируя агрегацию тромбоцитов, оказывают антитромботическое действие. Эффективность и безопасность показана в двойном слепом плацебо-контролируемом исследовании III фазы по оценке эффективности селексипага с учетом первого события заболеваемости и смертности (GRIPHON) с участием 1156 взрослых больных с ЛАГ, получавших препарат как мототерапию, так и в комбинации с антагонистом эндотелиновых рецепторов и ингибитором фосфодиэстеразы 5 типа [416, 417]. Эффективность #селексипага** доказана в отношении идиопатической и наследственной ЛАГ, а также ЛАГ, ассоциированной с заболеваниями соединительной ткани и ЛАГ, ассоциированной с врожденным пороком сердца. В этом масштабном, рандомизированном исследовании #селексипаг** показал снижение риска возникновения событий заболеваемости и смертности по сравнению с плацебо на 55% при назначении на ранней стадии заболевания (в первые 6 месяцев от момента постановки диагноза), на 40% в общей популяции больных ЛАГ, на 42% в популяции пациентов с ЛАГ-ВПС, на 42% при добавлении к монотерапии иФДЭ-5 и на 37% при добавлении к комбинации АРЭ и иФДЭ-5. Выживаемость пациентов на терапии с применением #селексипага** спустя 5 лет составляет 75,7%. [6, 417 - 420]. #Селексипаг** разрешен для длительного лечения ЛАГ II - IV ФК по классификации ВОЗ у взрослых с целью предотвращения прогрессирования заболевания.
В 2018 году стартовало международное (с участием центров РФ) исследование эффективности различных дозировок #селексипага** для сдерживания прогрессирования ЛАГ у детей. Учитывая значимые результаты испытаний препарата у взрослых больных, многие клиники инициировали применение #селексипага** у детей и подростков до завершения контролируемых испытаний у детей [422 - 428]. Препарат показал эффективность, сопоставимую с внутривенными простанидами. Мультицентровое исследование эффективности комбинированной ЛАГ-специфической терапии с добавлением #селексипага** у детей, выполненное в Германии в 2020 году, показало отсутствие смертности за 8 месяцев наблюдения, улучшения ключевых функциональных и гемодинамических показателей у 50% больных, снижения степени прогрессирования заболевания у 27% [429].
- #Селексипаг** рекомендован детям с иЛАГ, нЛАГ, ЛАГ-ВПС в качестве монотерапии при минимальном риске и отсутствие эффекта от терапии антагонистами кальция. У пациентов с низким, промежуточным и высоким риском - только в составе комбинированной терапии для улучшения симптомов, сдерживания прогрессирования заболевания и улучшения прогноза [8, 422 - 429].
УДД 3 УУР A
Комментарий: Стартовая доза при весе пациента >= 50 кг - 200 мкг, титруемая до максимально переносимой или до максимально допустимой дозы 1600 мкг. При весе пациента от 25 до 50 кг начальная доза 150 мкг, титруемая до максимально переносимой или до максимально допустимой дозы 1200 мкг. При весе пациента от 9 до 25 кг начальная доза 100 мкг, титруемая до максимально переносимой или до максимально допустимой дозы 800 мкг [8, 418, 424, 425, 429].
3.4. Лечение острой легочной гипертензии и легочного криза
- Рекомендовано детям с хронической ЛГ устранение провоцирующих факторов (болевого синдрома, возбуждения, ацидоза, алкалоза, гиповолемии, гипертермии, гиперкоагуляции, анемии, аритмии, инфекций) для избегания дестабилизации состояния и возможной провокации легочного криза [8, 20, 22, 324, 335, 339, 340].
УДД 3 УУР A
- Рекомендуется детям с острой ЛАГ и легочно-гипертензионным кризом устранение провоцирующих факторов (болевого синдрома, возбуждения, ацидоза, алкалоза, гиповолемии, гипертермии и др.) в сочетании с адекватной терапией легочными вазодилататорами, включая кислород, оксид азота, ингаляционный #илопрост и пероральные ЛАГ-специфические препараты [8, 20, 22, 324, 335, 339, 340, 430, 431].
УДД 3 УУР A
- Рекомендованы детям с острой ЛГ ингаляции увлажненного кислорода при нормальной анатомии сердца при сатурации O2 < 95%, определяемой чрескожным методом (пульсоксиметрией) [8, 22, 13, 312, 322].
УДД 3 УУР A
- Рекомендован ингаляционный оксид азота (iNO) для лечения послеоперационной ЛГ у пациентов, находящихся на искусственной вентиляции легких, с целью улучшения оксигенации и снижения риска легочного гипертензивного криза [122, 331 - 335].
УДД 3 УУР A
Комментарий: Сохранение или нарастание признаков легочной гипертензии на фоне начала отмены терапии iNO требует ее возобновления.
- Экстракорпоральная мембранная оксигенация (ЭКМО) рекомендована детям с острой ЛГ или декомпенсацией хронической ЛГ при наличии признаков снижения сердечного выброса или глубокой легочной недостаточности, несмотря на проводимую оптимальную и адекватную медикаментозную терапию [8, 430, 431].
УДД 3 УУР A
Комментарий: ЭКМО может рассматриваться как возможность поддержания жизненных процессов в качестве переходного этапа к трансплантации или выздоровлению. При этом смертность детей с ЛГ, нуждающихся в ЭКМО, выше, чем у детей без ЛГ. Факторами риска летальность при ЭКМО у детей являются: возраст менее 6 месяцев и более 5 лет; остановка сердца перед экстракорпоральной мембранной оксигенацией; преэкстракорпоральная мембранная оксигенация газами крови с pH менее 7,12, PaCO2 более 75, PaO2 менее 35 и сатурацией артериального кислорода менее 60%; продолжительность экстракорпоральной мембранной оксигенации более 280 часов; экстракорпоральная сердечно-легочная реанимация; осложнения экстракорпоральной мембранной оксигенации, включая сердечно-легочную реанимацию, инотропную поддержку, оглушение миокарда, тампонаду, легочное кровотечение, внутричерепное кровоизлияние, судороги, другие кровоизлияния, диссеминированное внутрисосудистое свертывание, заместительную почечную терапию и метаболический ацидоз [431].
3.5. Лечение персистирующей легочной гипертензии у новорожденных
- Рекомендована при подозрении/установлении диагноза ЛГ у новорожденного дотация кислорода и/или, вентиляционная поддержка для достижения предпротокового SpO2 от 91% до 95%, что способствует предотвращению ателектазов, коллапса легких и периодической десатурации [92, 432].
УДД 5 УУР C
- Рекомендовано новорожденным с персистирующей легочной гипертензией (ПЛГН) в первые часы после рождения в качестве целевых значений рассматривать PaCO2 от 45 до 60 мм рт. ст. и целевой pH > 7,25 с уровнем лактата < 5 ммоль/л [92, 432, 433].
УДД 5 УУР C
- Рекомендовано новорожденным с ПЛГН и нарушением диффузии в легких (за исключением пациентов с врожденной диафрагмальной грыжей!) интратрахеальное введение сурфактанта для оптимизации вентиляции и оксигенации [92, 432 - 435].
УДД 2 УУР A
- Ингаляционный оксид азота рекомендован для лечения детей с ПЛГН, находящихся на ИВЛ, для улучшения оксигенации и уменьшения потребности в ЭКМО, если они нуждаются в 100%-кислороде или если индекс оксигенации (OI = (FiO2 x Pmean) / PaO2) превышает 25 [92, 120, 122, 333, 335, 435].
УДД 3 УУР A
- Рекомендован пероральный прием #силденафила детям с ПЛГН для улучшения гемодинамических и респираторных показателей [92, 436 - 438].
УДД 2 УУР A
- Рекомендован прием бозентана** детям с ПЛГН как в качестве монотерапии, так и в комбинации с #силденафилом для улучшения симптомов и гемодинамических показателей [8, 366, 367, 440].
УДД 2 УУР A
- Рекомендован ингаляционный #илопрост детям с тяжелым течением ПЛГН в составе комбинированной ЛАГ-терапии для улучшения показателей оксигенации [441 - 443].
УДД 2 УУР A
- Рекомендовано использование ЭКМО в лечении тяжелой ПЛГН, если другие меры интенсивной терапии не увенчаются успехом [8, 444 - 445].
УДД 3 УУР B
- Не рекомендовано выполнение процедуры ЭКМО для недоношенных детей < 34 недель беременности (0/7 дней) и/или < 2000 г массы тела с тяжелой ПЛГН [8, 444 - 445].
УДД 3 УУР B
3.6. Терапия легочной гипертензии, ассоциированной с заболеваниями левых камер сердца
Своевременная и адекватная коррекция основного заболевания может предупредить развитие или уменьшить степень вторичной ЛГ. Присоединение посткапиллярной ЛГ у больных с заболеваниями левых камер сердца значительно ухудшает прогноз и увеличивает летальность. У детей с ХСН должна проводиться адекватная медикаментозная терапия, включающая ингибиторы ангиотензин-превращающего фермента, блокаторы рецепторов к ангиотензину II, ![]() -блокаторы, антагонисты альдостерона, диуретики, сердечные гликозиды, а при наличии показаний - кардиоресинхронизирующая терапия. У больных с врожденными и приобретенными пороками митрального и аортального клапана, атриовентрикулярных клапанов, врожденной или приобретенной обструкцией путей притока и оттока левого желудочка требуется своевременная оперативная коррекции.
-блокаторы, антагонисты альдостерона, диуретики, сердечные гликозиды, а при наличии показаний - кардиоресинхронизирующая терапия. У больных с врожденными и приобретенными пороками митрального и аортального клапана, атриовентрикулярных клапанов, врожденной или приобретенной обструкцией путей притока и оттока левого желудочка требуется своевременная оперативная коррекции.
- Рекомендована стандартная терапия левожелудочковой или бивентрикулярной сердечной недостаточности у пациентов с ЛГ 2 группы с применением ![]() -блокаторов, ингибиторов ангиотензин-превращающего фермента или блокаторов рецепторов ангиотензина II, препаратов наперстянки, диуретиков и антагонистов рецептов альдостерона, при необходимости механической поддержки для лечения основного заболевания [103 - 109, 345 - 347].
-блокаторов, ингибиторов ангиотензин-превращающего фермента или блокаторов рецепторов ангиотензина II, препаратов наперстянки, диуретиков и антагонистов рецептов альдостерона, при необходимости механической поддержки для лечения основного заболевания [103 - 109, 345 - 347].
УДД 2 УУР
- Не рекомендовано назначение вазодилятирующих ЛАГ-препаратов при изолированной посткапиллярной ЛГ [5, 8, 103 - 109].
УДД 5 УУР C
- #Силденафил может быть рекомендован детям с верифицированной комбинированной пре- и посткапиллярной ЛГ при ЛСС более 5 ед. Вуда x м2 для разгрузки и поддержания функции правого желудочка и облегчения симптомов [5, 8, 106 - 108, 446].
УДД 2 УУР B
Комментарий: Исследования применения #силденафила показали улучшение параметров гемодинамики, функции ПЖ и качества жизни у взрослых больных с комбинированной пре- и посткапиллярной ЛГ и значимым повышением ЛСС более 5 ед. Вуда x м2 [446].
3.7. Терапия легочной гипертензии, ассоциированной с заболеваниями легких и/или хронической гипоксемией
- Рекомендована детям с ЛГ 3-й группы максимальная оптимизации лечения основного заболевания легких [92, 447].
УДД 5 УУР C
- Рекомендована детям с ЛГ 3 группы и гипоксемией в покое PaO2 < 60 мм рт. ст. или SpO2 < 92% непрерывная оксигенотерапия не менее 18 часов в день [92, 448].
УДД 3 УУР B
- Рекомендована дополнительная оксигенотерапия детям с ЛГ 3 группы с симптомной нагрузочной десатурацией SpO2 < 92%, если доказано улучшение симптомов и SpO2 при использовании дополнительного кислорода [92, 447, 448].
УДД 3 УУР B
- Рекомендована ночная оксигенотерапия детям с ЛГ, ассоциированной с гипоксемией во сне, для снижение ЛСС, улучшения толерантности к физической нагрузке и улучшения выживаемости [92, 121, 447 - 451].
УДД 3 УУР B
- Рекомендован прием #силденафила детям с ЛГ, ассоциированной с БЛД, при отсутствии улучшения симптомов ЛГ на фоне оксигенотерапии при SpO2 > 92% [8, 92, 451 - 456].
УДД 2 УУР B
- Не рекомендован прием #амбризентана** детям с ЛГ, ассоциированной с интерстициальным заболеванием легких из-за риска ухудшения состояния [456 - 457].
УДД 2 УУР A
- Не рекомендован детям с ЛГ, ассоциированной с интерстициальным поражением легких, прием #риоцигуата** из-за риска серьезных побочных эффектов и смертности [458]
УДД 2 УУР B
3.8. Терапия легочной гипертензии, обусловленной обструкцией легочной артерии
- Рекомендованы детям с ХТЭЛГ меры по ликвидации причины и источника тромбов из-за риска ретромбозов [139, 141 - 142, 148, 154, 206].
УДД 3 УУР B
- Рекомендуется детям с ХТЭЛГ рассмотреть возможность проведения легочной тромбэндартерэктомии (ЛТЭ) в специализированном центре 139, 141 - 142, 154, 206, 459, 460].
УДД 2 УУР A
Комментарий: ЛТЭ является методом первой линии в лечении операбельной ХТЭЛГ. Это технически сложная операция, которая обеспечивает пациентам с ХТЭЛГ улучшение выживаемости и качества жизни. Метаанализ данных более 5000 публикаций, посвященных ЛТЭ, показал, что 30-дневная летальность значительно варьировала от 0,8% до 24,4% в разных исследованиях и напрямую зависела от объема ЛТЭ, проводимых в конкретном центре. Показатели летальности прогрессивно снижались через каждые 100 выполненных процедур. При этом периоперационная летальность зависела от возраста, ЛСС и ФК пациента. Высокие показателе ЛСС коррелировали с риском остаточной ЛГ после ЛТЭ [460].
- Рекомендуется прием непрямых антикоагулянтов (Код АТХ - B01AA03 Антитромботические средства) детям с ХТЭЛГ для профилактики рецидива острой тромбоэмболии легочной артерии [139, 141 - 142, 154, 206].
- #Риоцигуат** может быть рекомендован детям с неоперабельной ХТЭЛГ для улучшения функциональных и гемодинамических характеристик [402, 404].
УДД 2 УУР B
- #Илопрост может быть рекомендован детям с неоперабельной ХТЭЛГ для улучшения показателей гемодинамических характеристик [413].
УДД 3 УУР B
3.9. Хирургическое лечение врожденных пороков сердца с легочной артериальной гипертензией
- Рекомендовано детям с ЛАГ-ВПС обследование и лечение в специализированных центрах [8, 22, 45, 47, 48, 51, 52, 461 - 465].
УДД 2 УУР B
- Рекомендовано детям с ВПС и простыми посттрикуспидальными дефектами со значимым артериовенозным (Qp/Qs > 1,5) сбросом своевременное хирургическое/эндоваскулярное закрытие дефекта в первые 6 месяцев жизни для коррекции нарушений гемодинамики и профилактики развития легочной сосудистой болезни [8, 45, 47, 48, 51, 283 - 285].
УДД 3 УУР B
- Рекомендовано детям с ВПС и простыми претрикуспидальными дефектами со значимым артериовенозным сбросом (Qp/Qs > 1,5) своевременное хирургическое/эндоваскулярное закрытие дефекта с индивидуальным расчетом вероятного риска и пользы для принятия решения в каждом конкретном случае [8, 45, 47, 48, 51, 283 - 285].
УДД 3 УУР B
Комментарий: Как правило, хирургическое лечение простых претрикуспидальных дефектов со значимым артериовенозным сбросом (Qp/Qs > 1,5) проводится в возрасте старше 1 года.
- Рекомендуется детям с пре- или посттрикуспидальными дефектами в возрасте > 6 месяцев, имеющим клинические и инструментальные признаки высокой ЛГ (ЛГ > 70% по данным ЭХОКГ, цианоз, SpO2 < 95% и др.) проведение катетеризации правых и левых отделов сердца перед интервенционным/хирургическим лечением [8, 45 - 48, 270, 461].
УДД 3 УУР B
- Рекомендовано детям с ЛАГ-ВПС проведение катетеризации сердца до хирургического/интервенционного закрытия дефекта вне зависимости от возраста при наличии интеркуррентных заболеваний или синдромов, ассоциированных с повышенным риском ЛГ [8, 45, 47, 123, 136, 266 - 271, 461].
УДД 3 УУР A
- Рекомендовано детям с иЛСС < 6 ед. Вуда x м2 и соотношением иЛСС/иПСС < 0,3 хирургическое/интервенционное закрытие шунта при отсутствии дополнительных факторов риска [8, 45, 47, 283 - 285].
УДД 3 УУР A
- Рекомендовано детям с ЛАГ-ВПС и иЛСС >= 6 ед. Вуда x м2 и отношением иЛСС/иПСС >= 0,3 проведение острого теста на вазореактивность для определения критериев операбельности [8, 45, 47, 266 - 271, 283 - 285].
УДД 3 УУР A
- Рекомендовано детям с ЛАГ-ВПС хирургическое/интервенционное закрытие шунта с созданием фенестрации межпредсердной перегородки в случае, если при остром тесте на вазореактивность достигнуты иЛСС < 6 ед. Вуда x м2 и соотношение иЛСС/иПСС < 0,3 и отсутствуют дополнительные факторы риска [8, 45, 47, 266 - 271, 283 - 285].
- Рекомендован детям с ЛАГ-ВПС курс ЛАГ-специфической терапии продолжительностью 3 - 4 месяца (так называемый treat-and-repair подход) с последующей повторной оценкой гемодинамики и операбельности в случае, если при остром тесте на вазореактивность иЛСС >= 6 ед. Вуда x м2 и соотношение иЛСС/иПСС >= 0,3, [8, 45, 47, 266 - 271, 283 - 285, 462 - 464].
УДД 3 УУР A
- Рекомендовано детям с ЛАГ-ВПС и иЛСС и >= 6 ед. Вуда x м2 обследование в специализированном центре для разработки персонифицированного подхода с применением комбинированной медикаментозной и хирургической тактики [8, 45, 47, 266 - 271, 283 - 285].
УДД 3 УУР A
- Рекомендовано детям с ЛАГ-ВПС, большим посттрикуспидальным шунтом и тяжелой сопутствующей патологией (при невозможности или высоком риске операции с искусственным кровообращением) в качестве альтернативы первичному закрытию дефекта рассмотреть двухэтапное хирургическое лечение с суживанием легочной артерии на первом этапе [8, 45, 47, 281 - 283, 465].
УДД 3 УУР B
- Не рекомендовано детям и подросткам с ЛАГ-ВПС и иЛСС > 8 ед. Вуда x м2 и/или синдромом Эйзенменгера закрытие пре- и посттрикуспидальных дефектов из-за неблагоприятного прогноза [8, 45, 47, 281 - 284, 471 - 475].
УДД 3 УУР B
Комментарий: Неоперабельным больным с ЛАГ-ВПС, включая синдром Эйзенменгера, показана таргетная ЛАГ-терапия в объеме, соответствующем степени тяжести состояния (см. п. 3.3).
- Рекомендовано детям с ЛГ при сложных ВПС или сочетанием ВПС с систолической и диастолической дисфункцией системного желудочка проведение полного протокола катетеризации правых и левых отделов сердца для оценки параметров гемодинамики, определения типа ЛГ и ее тяжести [8, 45, 47, 266 - 271, 283 - 285].
УДД 2 УУР A
- Рекомендовано детям с ВПС и унивентрикулярной гемодинамикой показаниями к операциям "обхода" правых отделов сердца (операции Фонтена и двунаправленному кавапульмональному анастомозу) считать ср. ДЛА < 15 мм рт. ст. и иЛСС < 3 ед. Вуда x м2 [8, 45 - 47, 466, 467].
УДД 3 УУР B
3.10. Паллиативное хирургическое лечение ЛГ
- Рекомендовано детям с супрасистемной ЛАГ высокого риска, рефрактерной к комбинированной тройной таргетной терапии с применением простаноидов, в отсутствие значимого системно-легочного шунта рассмотреть возможность паллиативного хирургического лечения (АС, анастомоз Поттса) для улучшения функциональных показателей и увеличения выживаемости, в т.ч. на время ожидания трансплантации легких [8, 468 - 474].
УДД 3 УУР B
Комментарий: Данные паллиативные хирургические операции рассматриваются как в качестве самостоятельного метода лечения, показавшего свою эффективность в лечении ЛГ, так и в качестве "моста" к трансплантации легких. Суть процедуры АС со стентированием МПП или без состоит в создании рестриктивного межпредсердного сообщения с право-левым сбросом для снижения преднагрузки на правый желудочек, улучшения преднагрузки левого желудочка и увеличения сердечного выброса. В отсутствие противопоказаний к проведению процедуры АС основным условием ее успеха и, как следствие, улучшения состояния ребенка является стабильное превышение показателей давления в правом предсердии по сравнению с левым. Процедура сопровождается снижением общего системного насыщения кислородом. В отличие от посттрикуспидального шунтирования (анастомоза Поттса), создание рестриктивного претрикуспидального шунта имеет потенциальную пользу и допустима у больных с клиническими проявлениями умеренной правожелудочковой недостаточности. Напротив, создание сообщения между нисходящей аортой и левой легочной артерией в условия супрасистемной ЛГ потенциально должно снижать постнагрузку на правый желудочек до уровня системного. При этом формируется физиология синдрома Эйзенменгера со стабильным право-левым сбросом и цианозом. В отличие от АС, при которой снижается общая сатурация, анастомоз Поттса приводит к десатурация нижней половины тела при нормальном насыщении кислородом верхней половины и мозга в частности [8, 468 - 474].
- Строго рекомендовано детям с ЛАГ проведение процедур АС и наложения анастомоза Поттса в специализированных центрах, имеющих достаточный опыт проведения подобных операций [8, 468 - 474].
УДД 3 УУР A
- Строго рекомендовано детям с ЛАГ продолжение комбинированной ЛАГ терапии в оптимальных дозировках после процедуры АС или наложения анастомоза Поттса [8, 468, 474].
УДД 3 УУР A
- Не рекомендовано детям с ЛАГ проведение АС при наличии следующих факторов связи с высоким риском летального исхода [468 - 474]:
1) среднее давление в правом предсердии > 20 мм рт. ст.;
2) насыщение артериальной крови кислородом в покое < 90%;
3) тяжелая правожелудочковая недостаточность;
4) терминальное состояние пациента.
УДД 3 УУР A
3.11. Трансплантация легких
Несмотря на успехи медикаментозной терапии ЛГ, 5-летняя выживаемость остается низкой и варьирует в пределах 57 - 75% в зависимости от этиологии ЛГ. При прогрессировании заболевания трансплантация легких или комбинированная трансплантация сердца/легких остается единственным из возможных шансов на выживание этой тяжелой группы пациентов.
- Рекомендовано детям с ЛГ высокого риска, в отсутствие необратимых пороков и других структурных изменений сердца рассмотреть возможность проведения билатеральной трансплантации легких при соблюдении следующих критериев [8, 475, 476]:
1. быстрое прогрессирование симптомов;
2. сохранение критериев высокого риска на фоне комбинированной тройной таргетной терапии с применением ингаляционных или внутривенных простаноидов в максимально переносимых дозах;
3. ФК III - IV;
4. сердечный индекс < 2 л/мин/м2;
5. давление в правом предсердии > 15 мм рт. ст.
УДД 3 УУР B
Комментарий: Билатеральная трансплантация легкого при ЛГ имеет значительно более высокую краткосрочную и долгосрочную выживаемость по сравнению с унилатеральной. Решение о трансплантации следует рассматривать до наступления терминальной стадии ХСН и появления признаков другой органной недостаточности.
- Детям с ЛГ высокого риска, рефрактерной к максимальной медикаментозной терапии при наличии необратимых пороков и других структурных изменений сердца рекомендовано рассмотреть возможность комбинированной трансплантации комплекса сердца-легкие при соблюдении следующих критериев [8, 475, 478]:
1. быстрое прогрессирование симптомов;
2. сохранение критериев высокого риска на фоне комбинированной тройной таргетной терапии с применением ингаляционных или внутривенных простаноидов в максимально переносимых дозах;
3. ФК III - IV;
4. сердечный индекс < 2 л/мин/м2;
5. давление в правом предсердии > 15 мм рт. ст.
УДД 3 УУР B
- Не рекомендовано детям с ЛГ проведение процедуры трансплантации легких или комплекса сердце-легкие при наличии следующих критериев [8, 475, 478]:
1. злокачественные новообразования за последние 5 лет;
2. необратимые заболевания других органов (например, ХПН, нуждающаяся в диализе, тяжелый кардиальный фиброз или цирроз печени);
3. инкурабельные хронические внелегочные инфекции, включая активные гепатиты B, C и ВИЧ;
4. туберкулез;
5. значимые деформации грудной клетки и позвоночника;
6. отсутствие приверженности пациента и семьи следовать медицинским предписаниям;
7. не поддающееся лечению психическое и/или психологическое расстройства;
8. социальная дезадаптация;
9. курение, алкогольная и наркотическая зависимости.
УДД 3 УУР B
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Реабилитация - важная составная часть комплексной программы терапии больных с легочной гипертензией и представляет собой комплекс мер, включающих не только физические тренировки, но и коррекцию и поддержание адекватной базовой терапии, психологическую и информационную поддержку пациенту и его семье, направленные на улучшение физического и эмоционального состояний ребенка и формирующие поведенческие изменения для формирования здорового образа жизни [479]. Реабилитационные мероприятия разрабатываются и проводятся специалистами экспертного центра ЛГ строго в дополнение к медикаментозной терапии. При правильном проведении приводит к улучшению клинического состояния, толерантности к физическим нагрузкам.
Цели реабилитации у больных с ЛГ:
1. улучшение толерантности к физическим нагрузкам;
2. оптимизация психологического состояния;
3. улучшение симптомов;
4. улучшение качества жизни;
5. снижение частоты госпитализаций вследствие ухудшения состояния, в т.ч. с использованием БИТ;
6. снижение смертности.
Метаанализ клинических исследований, включая рандомизированные, изучавших влияние физической реабилитации и респираторного тренинга у больных с ЛАГ, показал улучшение переносимости физических нагрузок, увеличение уровня физической активности, уменьшение одышки, увеличение дистанции при Т6МХ, КПТ, снижение выраженности симптомов, улучшение качества жизни [479]. Исследования показали, что индивидуально разработанная физической реабилитации в сочетании с адекватной медикаментозной терапией у пациентов с ЛАГ способствует улучшению и предотвращает возможное ухудшение в контексте состояния здоровья в долгосрочной перспективе, наряду с улучшением толерантности к физической нагрузке и увеличением времени, затрачиваемого на физическую активность низкой или средней интенсивности [479, 480].
Реабилитационные мероприятия для пациентов с ЛГ включают:
1. определение индивидуальной переносимости нагрузок пациента,
2. комплекс физической реабилитации,
3. психологическую поддержку, повышение мотивации,
4. коррекцию диеты,
5. социальную поддержку.
Обязательное требования для начала реабилитационных мероприятий для больных с ЛАГ включают:
1. стабильное состояние пациента в течение 3 месяцев,
2. оптимальную индивидуально подобранную ЛАГ-специфическую терапию,
3. мультидисциплинарную команду специалистов, прошедших специальную подготовку: врач-кардиолог, врач-пульмонолог, врач-физиотерапевт, врач по лечебной физкультуре, специалист по физической реабилитации (кинезиоспециалист), врач-диетолог.
- Рекомендовано проведение комплекса индивидуально подобранных в условиях экспертного центра по ЛГ реабилитационных мероприятий пациентам с ЛГ, находящимся в стабильном состоянии не менее 3 месяцев, получающих адекватную тяжести терапию [479, 480].
УДД 2 УУР B
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Легочная гипертензия может быть самостоятельным заболеванием или синдромом, осложняющим целый спектр состояний. Специальных мер для профилактики идиопатической и наследственной формы не существует. Своевременное адекватное лечение основного заболевания является основным методом профилактики ассоциированных форм ЛГ. Регулярный ЭХОКГ скрининг в целевых группах, включая больных с системно-легочными шунтами, заболеваниями соединительной ткани, портальной гипертензией, гемолитическими анемиями, ВИЧ-инфекцией, заболеваниями легких, отягощенным семейным анамнезом по развитию ЛАГ, генетическими мутациями, ассоциированными с ЛАГ и т.д., позволяют выявить заболевания на ранней стадии и своевременно назначить лечение. Основным методом профилактики ЛАГ-ВПС, как наиболее частой формы ЛАГ у детей является своевременная коррекция порока сердца.
Рекомендованный план динамического наблюдения за больными с ЛГ представлен в таблице 20.
Таблица 20. Рекомендованный план динамического наблюдения за больными с ЛГ [8, 481]
Обследование
Первичное обследование до назначения специфической терапии
Через 3 - 4 мес. после начата специфической терапии
Каждые 3 - 6 месяцев
При ухудшении состояния
Оценка жалоб
V
V
V
V
Физикальное обследование
V
V
V
V
Общий (клинический) анализ крови
V
V
V
V
Пульсоксиметрия
V
V
V
V
Анализ крови биохимический общетерапевтический
V
V
V
V
Коагулограмма
V
V
V
V
Исследования уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови
V
V
V
V
Регистрация электрокардиограммы
V
V
V
V
Трансторакальная эхокардиография (протокол ЛГ)
V
V
V
V
Тест 6 минутной ходьбы (детям старше 7 лет)
V
V
V
V
Кардиопульмональный тест (детям старше 7 лет, прошедшим более 300 м при Т6МХ)
V
V
V
V
Оценка ФК
V
V
V
V
Чрезвенозная катетеризация сердца
V
V
Итоговая стратификация риска
V
V
V
V
6. Организация оказания медицинской помощи
Все пациенты с предполагаемой или установленной ЛГ должны быть обследованы в специализированных центрах, где помощь детям с ЛАГ оказывается в тесном сотрудничестве региональных специалистов, наблюдающих детей по месту жительства, и экспертов специализированных центров. Стратегия оказания помощи детям с ЛГ должна строиться путем скоординированных усилий врачей - детских кардиологов, врачей-пульмонологов, врачей-ревматологов, врачей-неонатологов, врачей - сердечно-сосудистых хирургов, врачей - торакальных хирургов, врачей-хирургов, врачей ультразвуковой диагностики", врачей функциональной диагностики", врачей-рентгенологов [8, 12, 13, 22, 45, 219, 481].
Показанием для плановой госпитализации в медицинскую организацию для оказания первичной медицинской помощи является подозрении на наличие ЛГ при проведение первичного (скринингового) обследования на амбулаторном уровне [219, 481 - 482].
Показаниями для плановой госпитализации в медицинскую организацию 2 или 3 уровня при подозрении на наличие ЛГ для оказания специализированной медицинской помощи по профилю "детская кардиология" [481, 482] являются:
1. верификация диагноза ЛГ;
2. определения гемодинамического класса ЛГ;
3. проведение острого теста на вазореактивность;
4. определение клинического класса ЛГ;
5. определение степени тяжести ЛГ на основании анализа комбинации клинических, функциональных, лабораторных, гемодинамических данных, показателей ЭХОКГ;
6. определение показаний к хирургическому лечению в случае наличия ВПС, ХТЭЛГ, порока развития легких;
7. определение показаний к терапии ЛАГ-специфическими антигипертензивными препаратами, ее состава и комбинации, поддерживающей терапии;
8. разработка индивидуальной программы мониторинга ЛГ.
Показаниями для плановой госпитализации в медицинскую организацию 2 или 3 уровня при установленном диагнозе ЛГ для оказания специализированной медицинской помощи по профилю "детская кардиология" являются [491, 492]:
1. неэффективность ЛАГ-специфической терапии (отсутствие улучшения);
2. мониторинг основных клинических, функциональных, лабораторных, гемодинамических данных, показателей ЭХОКГ для адекватной оценки степени тяжести ЛГ, своевременной оптимизации ЛАГ-специфической и поддерживающей терапии;
3. определение показаний к паллиативному хирургическому лечению ЛАГ;
4. определение показаний к трансплантации легких или комплекса сердце-легкие.
Показаниями к выписке пациента из медицинской организации является улучшение или стабилизация клинических и гемодинамических показателей [482, 483].
Показания для экстренной госпитализации детей с ЛГ [8]:
1. декомпенсация правожелудочковой или бивентрикулярной сердечной недостаточности;
2. легочный криз;
3. синкопальное состояние;
4. острая тромбоэмболия легочной артерии;
5. легочное кровотечение.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Основными модифицируемыми факторами, определяющими течение и прогноз заболевания, являются [5, 7, 8, 12, 114, 180 - 182, 244, 249, 257 - 260, 266, 274, 313 - 319]:
1. Результаты стратификации риска ЛГ, отражающими степень тяжести и прогноз заболевания.
2. Своевременность назначения базовой и поддерживающей терапии.
3. Своевременность обоснованной хирургической коррекции в случае ЛАГ-ВПС, ЛГ-заболевания легких (пороки, аномалии легких), ХТЭЛГ.
4. Регулярный мониторинг и оптимизация базовой и поддерживающей терапии для улучшения клинической симптоматики, сдерживания прогрессирования заболевания и улучшения прогноза.
Основными не модифицируемыми факторами риска неблагоприятного исхода ЛГ являются [114, 136, 151, 152, 158, 180, 189, 264, 431]:
1. Возраст (< 5 лет).
2. Этиология ЛГ.
3. Генетические и хромосомные аномалии.
4. Тяжелые коморбидные состояния (психоневрология, нервно-мышечные заболевания, деформации скелета, эндокринные расстройства, болезни обмена и др.).
5. Более, чем 1 сопутствующее заболевание.
6. Сочетание нескольких групп ЛГ у одного ребенка.
Дополнительными не модифицируемыми факторами риска ЛГ являются [114, 136, 151, 152, 158, 180, 189]:
1. Недоношенность в анамнезе <= 36 недели гестации.
2. Низкий вес при рождении, несоответствующий гестационному возрасту.
3. Наличие персистирующей ЛГ новорожденных в анамнезе.
4. Механическая респираторная поддержка/SPAP в период новорожденности.
5. ИВЛ с интубацией в период новорожденности.
6. Сепсис, в т.ч. неонатальный.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1.
Выполнен опрос ребенка с ЛГ и законных представителей ребенка о наличии у него одышки, утомляемости, снижения переносимости физических нагрузок, головокружений, обмороков, кашля, кровохарканья, болей в грудной клетке, перебоев в ритме сердца, сердцебиения, о наличии у ребенка заболеваний, ассоциирующихся с развитием ЛГ, есть ли в семье родственники, страдающие ЛГ.
2
A
2.
При физикальном обследовании дана оценка физического и психомоторного развития ребенка, подтверждены или исключены изменение цвета кожных покровов, наличие цианоза, изменение фаланг пальцев по типу "барабанных палочек" и ногтевых пластин в виде "часовых стекол"; на расширенные вены шеи в клиноположении и ортостазе; изменение формы грудной клетки; усиленный, разлитой сердечный толчок, расширение границ относительной сердечной тупости; усиление, акцент II тона над легочной артерией; шумы в сердце, увеличение печени, асцит, похолодание конечностей, периферические отеки.
2
A
3.
Выполнены общий (клинический) анализ крови, анализ крови биохимический общетерапевтический, исследование кислотно-основного состояния и газов крови, коагулограмма (ориентировочное исследование системы гемостаза), исследование уровня антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1/2 и антигена p24 (Human immunodeficiency virus HIV 1/2 + Agp24) в крови, определение антигена (HbeAg) вируса гепатита B (Hepatitis B virus) в крови.
2
A
4.
Выполнено исследования уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови.
2
A
5.
Выполнена пульсоксиметрия с определением сатурации кислорода отдельно на руках и ногах в состоянии покоя и после физической нагрузки.
4
A
6.
Выполнена регистрация электрокардиограммы.
2
A
7.
Выполнена трансторакальная эхокардиография.
2
A
8.
При проведении эхокардиографии выполнен расчет систолического давления в легочной артерии.
1
A
9.
При проведении эхокардиографии выполнено определение систолической функции правого желудочка.
1
B
10.
Выполнена прицельная рентгенография органов грудной клетки.
1
B
11.
Детям старше 7 лет выполнен тест 6-минутной ходьбы.
2
A
12.
Выполнен кардиопульмональный нагрузочный тест (тредмил-тест или велоэргометрия) детям старше 7 лет, прошедшим более 300 м при Т6МХ.
3
A
13.
Выполнена чрезвенозная катетеризация полостей сердца.
3
A
14.
При проведении катетеризации сердца проведено определение среднего давления в легочной артерии.
3
A
15.
При проведении катетеризации сердца выполнен расчет индекса легочного сосудистого сопротивления.
3
A
16.
При проведении катетеризации сердца выполнен расчет давления заклинивания легочной артерии.
3
A
17.
При проведении катетеризации сердца выполнен тест на вазореактивность.
2
A
18.
Выполнена компьютерная томография органов грудной полости с внутривенным болюсным контрастированием.
3
A
19.
Выполнена магнитно-резонансная томография сердца с контрастированием.
2
A
20.
Выполнено исследование легочной функции с проведением бодиплетизмографии и оценкой диффузионной способности легких детям старше 5 лет.
3
A
21.
Выполнено ультразвуковое исследование органов брюшной полости.
3
A
22.
Выполнена оценка степени тяжести ЛГ методом многофакторной стратификации риска неблагоприятных событий, включая летальность.
3
A
23.
Выполнена оксигенотерапия при снижении насыщения кислородом артериальной крови менее 92% или парциального давления кислорода артериальной крови менее 60 мм рт. ст.
2
A
24.
Выполнена коррекция дефицита железа (Код АТХ - B03AC Парентеральные препараты трехвалентного железа).
3
A
25.
Блокатор рецепторов минералокортикоидов назначен больным с ЛАГ и диастолической сердечной недостаточностью, в т.ч. при сохранной фракции выброса.
2
A
26.
Ребенку с ЛГ и клиническими проявлениями правожелудочковой недостаточности назначены диуретики.
4
A
27.
Назначена монотерапия специфическими вазодилятаторами детям с верифицированной ЛАГ при минимальном риске, отсутствии эффекта на терапию блокаторами кальциевых каналов или отрицательном тесте на вазореактивность.
3
A
28.
Назначена стартовая двойная терапия специфическими вазодилятаторами детям с ЛАГ низкого риска и отрицательным тестом на вазореактивность.
4
A
29.
Назначена детям с ЛАГ, соответствующим критериям промежуточного риска, стартовая или последовательная двойная или тройная терапия антагонистом рецепторов эндотелина, ингибитора фосфодиэстеразы 5 типа и агонистом рецепторов простациклина.
3
A
32.
Назначена детям с ЛАГ высокого риска тройная ЛАГ-терапия с применением простаноидов в сочетании с антагонистом рецепторов эндотелина и ингибитора фосфодиэстеразы 5 типа.
3
A
33.
Выполнено направление ребенка с ЛАГ высокого риска, рефрактерной к комбинированной тройной таргетной терапии с применением ингаляционных или внутривенных простаноидов, в отсутствие значимого системно-легочного шунта, на паллиативное хирургическое лечения.
3
B
Список литературы
1. Kovacs G, Bartolome S, Denton CP, et al. Definition, classification and diagnosis of pulmonary hypertension. Eur Respir J. 2024 Aug 29: 2401324. doi: 10.1183/13993003.01324-2024.
2. Rosenkranz S, Preston IR. Right heart catheterisation: best practice and pitfalls in pulmonary hypertension. Eur Respir Rev. 2015 Dec; 24(138): 642 - 52. doi: 10.1183/16000617.0062-2015.
3. Sorajja P, Borlaug BA, Dimas VV, et al. SCAI/HFSA clinical expert consensus document on the use of invasive hemodynamics for the diagnosis and management of cardiovascular disease. Catheter Cardiovasc Interv. 2017 Jun 1; 89(7): E233 - E247. doi: 10.1002/ccd.26888. Epub 2017 May 10.
4. Moustafa GA, Kolokythas A, Charitakis K, et al. Diagnostic Cardiac Catheterization in the Pediatric Population. Curr Cardiol Rev. 2016; 12(2): 155 - 162. doi: 10.2174/1573403x12666160301120955.
5. Girwar SM, Jabroer R, Fiocco M, et al. A systematic review of risk stratification tools internationally used in primary care settings. Health Sci Rep. 2021; 4(3): e329. Published 2021 Jul 23. doi:10.1002/hsr2.329.
6. Humbert M, Kovacs G, Hoeper MM, et al. ESC/ERS Scientific Document Group. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J. 2023 Jan 6; 61(1): 2200879. doi: 10.1183/13993003.00879-2022
7. ![]() N, Channick RN, Frantz RP, et al. Risk stratification and medical therapy of pulmonary arterial hypertension. Eur Respir J. 2019 Jan 24; 53(1): 1801889. doi: 10.1183/13993003.01889-2018
N, Channick RN, Frantz RP, et al. Risk stratification and medical therapy of pulmonary arterial hypertension. Eur Respir J. 2019 Jan 24; 53(1): 1801889. doi: 10.1183/13993003.01889-2018
8. Hansmann G, Koestenberger M, Alastalo TP, et al. 2019 updated consensus statement on the diagnosis and treatment of pediatric pulmonary hypertension: The European Pediatric Pulmonary Vascular Disease Network (EPPVDN), endorsed by AEPC, ESPR and ISHLT. J Heart Lung Transplant. 2019 Sep; 38(9): 879 - 901. doi: 10.1016/j.healun.2019.06.022. Epub 2019 Jun 21
9. Миклашевич, И.М. Идиопатическая легочная артериальная гипертензия/И.М. Миклашевич, С.В. Горбачевский//Легочная гипертензия у детей: Руководство. - Москва: Общество с ограниченной ответственностью "Актелион Фармасьютикалз", 2013. - С. 57 - 87. ISBN: 978-5-9905090-1-6.
10. Haworth SG, Hislop AA. Treatment and survival in children with pulmonary arterial hypertension: the UK Pulmonary Hypertension Service for Children 2001 - 2006. Heart. 2009 Feb; 95(4): 312 - 7. doi: 10.1136/hrt.2008.150086. Epub 2008 Oct 24
11. Zijlstra WMH, Douwes JM, Rosenzweig EB, et al. Survival differences in pediatric pulmonary arterial hypertension: clues to a better understanding of outcome and optimal treatment strategies. J Am Coll Cardiol. 2014 May 27; 63(20): 2159 - 2169. doi: 10.1016/j.jacc.2014.02.575. Epub 2014 Mar 26.
12. Frank BS, Ivy DD. Diagnosis, Evaluation and Treatment of Pulmonary Arterial Hypertension in Children. Children (Basel). 2018 Mar 23; 5(4): 44. doi: 10.3390/children5040044.
13. Rosenzweig EB, Abman SH, Adatia I, et al. Paediatric pulmonary arterial hypertension: updates on definition, classification, diagnostics and management. Eur Respir J. 2019 Jan 24; 53(1): 1801916. doi: 10.1183/13993003.01916-2018.
14. Maron BA, Wertheim BM, Gladwin MT. Under Pressure to Clarify Pulmonary Hypertension Clinical Risk. Am J Respir Crit Care Med. 2018 Feb 15; 197(4): 423 - 426. doi: 10.1164/rccm.201711-2306ED.
15. Douschan P, Kovacs G, Avian A, et al. Mild Elevation of Pulmonary Arterial Pressure as a Predictor of Mortality. Am J Respir Crit Care Med. 2018 Feb 15; 197(4): 509 - 516. doi: 10.1164/rccm.201706-1215OC.
16. Maron BA, Hess E, Maddox TM, et al. Association of borderline pulmonary hypertension with mortality and hospitalization in a large patient cohort: insights from the Veterans Affairs Clinical Assessment, Reporting, and Tracking Program. Circulation. 2016; 133: 1240 - 1248.
17. Assad TR, Maron BA, Robbins IM, et al. The prognostic impact of longitudinal hemodynamic assessment of borderline pulmonary hypertension. JAMA Cardiol. 2017; 2: 1361 - 1368.
18. Kolte D, Lakshmanan S, Jankowich MD, et al. Mild pulmonary hypertension is associated with increased mortality: a systematic review and meta-analysis. J Am Heart Assoc. 2018; 7e009729.
19. Шмальц А.А., Купряшов А.А., Черногривов И.Е. Патологическая физиология осложнений синдрома Эйзенменгера. Креативная кардиология. 2024; 18(1): 7 - 19. DOI: 10.24022/1997-3187-2024-18-1-7-19
20. Bernier ML, Romer LH, Bembea MM. Spectrum of Current Management of Pediatric Pulmonary Hypertensive Crisis. Crit Care Explor. 2019 Aug 9; 1(8): e0037. doi: 10.1097/CCE.0000000000000037.
21. Humbert M, Guignabert C, Bonnet S, et al. Pathology and pathobiology of pulmonary hypertension: state of the art and research perspectives. Eur Respir J. 2019 Jan 24; 53(1): 1801887. doi: 10.1183/13993003.01887-2018. PMID: 30545970; PMCID: PMC6351340.
22. Abman SH, Hansmann G, Archer SL, et al. Pediatric Pulmonary Hypertension: Guidelines From the American Heart Association and American Thoracic Society. Circulation. 2015 Nov 24; 132(21): 2037 - 99. doi: 10.1161/CIR.0000000000000329.
23. Stewart D., Cogan J. Kramer M. et al. Is pulmonary arterial hypertension in neurofibromatosis type 1 secondary to a plexogenic arteriopathy? Chest. 2007; 132: 798 - 808.
24. Lo S., Liu J., Chen F. et al. Pulmonary vascular disease in Gaucher disease: clinical spectrum, determinants of phenotype and long-term outcomes of therapy. J Inherit Metab Dis. 2011; 34: 643 - 650.
25. Alghamdi M., Steinraths M., Panagiotopoulos C. et al. Primary pulmonary arterial hypertension and autoimmune polyendocrine syndrome in a pediatric patient. Pediatr Cardiol. 2010; 31: 872 - 874.
26. Taksande A, Pujari D, Jameel PZ, et al. Prevalence of pulmonary hypertension among children with Down syndrome: A systematic review and meta-analysis. World J Clin Pediatr. 2021 Nov 9; 10 (6): 177 - 191. doi: 10.5409/wjcp.v10.i6.177.
27. Miklashevich IM, Shkolnikova МА, Gorbachevsky SV, et al. Contemporary strategy of pulmonary hypertension management in pediatrics. Cardiovascular Therapy and Prevention. 2018; 17(2): 101 - 124. (In Russ.) Миклашевич И.М., Школьникова М.А., Горбачевский С.В. и др. Современная стратегия терапии легочной гипертензии у детей. Кардиоваскулярная терапия и профилактика. 2018; 17 (2): 101 - 124. doi: 10.15829/1728-8800-2018-2-101-124
28. Montani D, Lau EM,  P, et al. Pulmonary veno-occlusive disease. Eur Respir J. 2016 May; 47(5): 1518 - 34. doi: 10.1183/13993003.00026-2016.
P, et al. Pulmonary veno-occlusive disease. Eur Respir J. 2016 May; 47(5): 1518 - 34. doi: 10.1183/13993003.00026-2016.
29. Emel'yanchik EYu, Vol'f NG, Vesemiller OA, et al. Functional State of Vascular Endothelium in Patients With Pulmonary Arterial Hypertension Associated With Congenital Heart Diseases. Kardiologiia. 2017; 57 (8): 40 - 46. (In Russ.) Емельянчик Е.Ю., Вольф Н.Г., Ваземиллер О.А., Салмина А.Б. Функциональное состояние эндотелия у больных легочной артериальной гипертензией, ассоциированной с врожденными пороками сердца. Кардиология. 2017; 57(8): 40 - 46. doi: https://doi.org/10.18087/cardio.2017.8.10016.
30. Guignabert C, Aman J, Bonnet S, et al. Pathology and pathobiology of pulmonary hypertension: current insights and future directions. Eur Respir J. 2024 Aug 29: 2401095. doi: 10.1183/13993003.01095-2024
31. He S, Zhu T, Fang Z. The Role and Regulation of Pulmonary Artery Smooth Muscle Cells in Pulmonary Hypertension. Int J Hypertens. 2020; 2020: 1478291. Published 2020 Aug 11. doi: 10.1155/2020/1478291.
32. Le Hiress M, Tu L, Ricard N, Phan C, et al. Proinflammatory Signature of the Dysfunctional Endothelium in Pulmonary Hypertension. Role of the Macrophage Migration Inhibitory Factor/CD74 Complex. Am J Respir Crit Care Med. 2015; 192(8): 983 - 97. doi: 10.1164/rccm.201402-0322OC.
33. Qian J, Tian W, Jiang X, et al. Leukotriene B4 Activates Pulmonary Artery Adventitial Fibroblasts in Pulmonary Hypertension. Hypertension. 2015 Dec; 66(6): 1227 - 1239. doi: 10.1161/HYPERTENSIONAHA.115.06370.
34. Aldabbous L, Abdul-Salam V, McKinnon T, et al.. Neutrophil Extracellular Traps Promote Angiogenesis: Evidence From Vascular Pathology in Pulmonary Hypertension. Arterioscler Thromb Vasc Biol. 2016; 36(10): 2078 - 87. doi: 10.1161/ATVBAHA.116.307634. Epub 2016 Jul 28.
35. Bhagwani A, Thompson AAR, Farkas L. When Innate Immunity Meets Angiogenesis-The Role of Toll-Like Receptors in Endothelial Cells and Pulmonary Hypertension. Front Med (Lausanne). 2020; 7: 352. doi: 10.3389/fmed.2020.00352.
36. Savai R, Al-Tamari HM, Sedding D, et al. Pro-proliferative and inflammatory signaling converge on FoxO1 transcription factor in pulmonary hypertension. Nat Med. 2014 Nov; 20(11): 1289 - 300. doi: 10.1038/nm.3695.
37. Hashimoto-Kataoka T, Hosen N, Sonobe T, et al. Interleukin-6/interleukin-21 signaling axis is critical in the pathogenesis of pulmonary arterial hypertension. Proc Natl Acad Sci USA. 2015 May 19; 112(20): E2677 - 86. doi: 10.1073/pnas.1424774112.
38. Ma L, Roman-Campos D, Austin ED, et al. A novel channelopathy in pulmonary arterial hypertension. N Engl J Med. 2013 Jul 25; 369(4): 351 - 361. doi: 10.1056/NEJMoa1211097.
39. Чазова И.Е., Мартынюк Т.В., Шмальц А.А., Грамович В.В., Данилов Н.М., Веселова Т.Н. и соавт. Евразийские рекомендации по диагностике и лечению легочной гипертензии (2023). Евразийский Кардиологический Журнал. 2024; (1): 6 - 85, https://doi.org/10.38109/2225-1685-2024-1-6-85
40. Zhu N, Pauciulo MW, Welch CL, et al. Novel risk genes and mechanisms implicated by exome sequencing of 2572 inpiduals with pulmonary arterial hypertension. Genome Med. 2019; 11(1): 69. Published 2019 Nov 14. doi:10.1186/s13073-019-0685-z
41. Zhu N, Gonzaga-Jauregui C, Welch CL, et al.. Exome Sequencing in Children With Pulmonary Arterial Hypertension Demonstrates Differences Compared With Adults. Circ Genom Precis Med. 2018 Apr; 11(4): e001887. doi: 10.1161/CIRCGEN.117.001887.
42. Kerstjens-Frederikse WS, Bongers EM, et al. TBX4 mutations (small patella syndrome) are associated with childhood-onset pulmonary arterial hypertension. J Med Genet. 2013 Aug; 50(8): 500 - 6. doi: 10.1136/jmedgenet-2012-101152. Epub 2013 Apr 16.
43. Hong JH, Lee SE, Choi SY, et al. Reversible Pulmonary Arterial Hypertension Associated with Dasatinib for Chronic Myeloid Leukemia. Cancer Res Treat. 2015 Oct; 47(4): 937 - 42. doi: 10.4143/crt.2013.155. Epub 2014 Nov 17.
44. Charoenpong P, Dhillon N, Murnane K, et al. Methamphetamine-associated pulmonary arterial hypertension: data from the national biological sample and data repository for pulmonary arterial hypertension (PAH Biobank). BMJ Open Respir Res. 2023; 10(1): e001917. Published 2023 Dec 7. doi: 10.1136/bmjresp-2023-001917
45. Kozlik-Feldmann R, Hansmann G, Bonnet D, et al. Pulmonary hypertension in children with congenital heart disease (PAH-CHD, PPHVD-CHD). Heart. 2016 May; 102 Suppl 2: ii42 - 8. doi: 10.1136/heartjnl-2015-308378.
46. Zijlstra WM, Douwes JM, Ploegstra MJ, et al. Clinical classification in pediatric pulmonary arterial hypertension associated with congenital heart disease. Pulm Circ; 6(3): 302 - 12. doi: 10.1086/687764.
47. Горбачевский С.В., Шмальц А.А., Черногривов И.Е. Легочная гипертензия и легочная сосудистая болезнь при врожденных пороках сердца: определение и классификация. В кн.: Горбачевский С.В., Шмальц А.А. (ред.) Диагностика легочной гипертензии при врожденных пороках сердца. М.: ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" МЗ РФ; 2023: 9 - 19
48. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. М.: Медицина; 1975
49. Van der Feen DE, Bartelds B, de Boer RA, et al. Pulmonary arterial hypertension in congenital heart disease: translational opportunities to study the reversibility of pulmonary vascular disease. Eur Heart J. 2017 Jul 7; 38(26): 2034 - 2041. doi: 10.1093/eurheartj/ehx034.
50. Manes A, Palazzini M, Leci E, et al. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. Eur Heart J. 2014 Mar; 35(11): 716 - 24. doi: 10.1093/eurheartj/eht072.
51. Thomaz AM, Kajita LJ, Aiello VD, et al. EXPRESS: Parameters associated with outcome in pediatric patients with congenital heart disease and pulmonary hypertension subjected to combined vasodilator and surgical treatments. Pulm Circ. Published online February 26, 2019. doi:10.1177/2045894019837885
52. Haarman MG, Kerstjens-Frederikse WS, Vissia-Kazemier TR, et al. The Genetic Epidemiology of Pediatric Pulmonary Arterial Hypertension. J Pediatr. 2020 Oct; 225: 65 - 73. e5. doi: 10.1016/j.jpeds.2020.05.051.
53. Ecochard-Dugelay E., Lambert V., Schleich J.M., et al. Portopulmonary Hypertension in Liver Disease Presenting in Childhood. J Pediatr Gastroenterol Nutr. 2015; 61(3): 346 - 54. doi: 10.1097/MPG.0000000000000821.
54. Miklashevich I.M., Potrokhova E.A., Morozov D.A. Pulmonary hypertension associated with congenital portosystemic shunts as a new form of portopulmonary hypertension in children and adults. Cardiovascular Therapy and Prevention. 2024; 23(3): 3753. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3753. Миклашевич И.М., Потрохова Е.А., Морозов Д.А. Легочная артериальная гипертензия, ассоциированная врожденными портокавальными шунтами - новая форма портопульмональной гипертензии у детей и взрослых. Кардиоваскулярная терапия и профилактика. 2024; 23(3): 3753.
55. Kawut SM, Taichman DB, Ahya VN, et al. Hemodynamics and survival of patients with portopulmonary hypertension. Liver Transpl. 2005 Sep; 11(9): 1107 - 11. doi: 10.1002/lt.20459.
56. Ridaura-Sanz C,  C,
C,  E. Portopulmonary hypertension in children. A study in pediatric autopsies. Arch Med Res. 2009 Oct; 40(7): 635 - 9. doi: 10.1016/j.arcmed.2009.08.006.
E. Portopulmonary hypertension in children. A study in pediatric autopsies. Arch Med Res. 2009 Oct; 40(7): 635 - 9. doi: 10.1016/j.arcmed.2009.08.006.
57. Tingo J, Rosenzweig EB, Lobritto S, et al. Portopulmonary hypertension in children: a rare but potentially lethal and under-recognized disease. Pulm Circ. 2017; 7(3): 712 - 718. doi:10.1177/2045893217723594.
58. Miklashevich I.M., Potrokhova E.A., Morozov D.A. et al. Pulmonary arterial hypertension associated with type II Abernethy malformation in an adolescent: a case report. Cardiovascular Therapy and Prevention. 2024; 23(2): 3754. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3754. Миклашевич И.М., Потрохова Е.А., Морозов Д.А., Исаева Ю.С. Легочная артериальная гипертензия, ассоциированная с аномалией Абернети II типа у подростка (клинический случай). Кардиоваскулярная терапия и профилактика. 2024; 23(2): 3754
59. Emelyanchik EYu, Volf NG, Cherkashina TV, et al. Management of a child with portopulmonal hypertension due to cavernous transformation of the portal vein and sple- norenal anastomosis. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2024; 69(1): 102 - 107. (In Russ.) Емельянчик Е.Ю., Вольф Н.Г., Черкашина Т.В. и др. Тактика ведения ребенка с портопульмональной гипертензией на фоне кавернозной трансформации воротной вены и спленоренального анастомоза. Российский вестник перинатологии и педиатрии. 2024; 69(1): 102 - 107. doi:https://doi.org/10.21508/1027-4065-2024-69-1-102-107
60. Takahashi Y., Yamamoto K., Sakao S., et al.. The clinical characteristics, treatment, and survival of portopulmonary hypertension in Japan. BMC Pulm Med. 2021; 21: 89. doi: 10.1186/s12890-021-01452-3.
61. Kato M, Atsumi T. Pulmonary arterial hypertension associated with connective tissue diseases: A review focusing on distinctive clinical aspects. Eur J Clin Invest. 2018 Feb; 48(2). doi: 10.1111/eci.12876.
62.  P, Humbert M, Perros F, et al. Fibrous remodeling of the pulmonary venous system in pulmonary arterial hypertension associated with connective tissue diseases. Hum Pathol. 2007; 38(6): 893 - 902. doi: 10.1016/j.humpath.2006.11.022.
P, Humbert M, Perros F, et al. Fibrous remodeling of the pulmonary venous system in pulmonary arterial hypertension associated with connective tissue diseases. Hum Pathol. 2007; 38(6): 893 - 902. doi: 10.1016/j.humpath.2006.11.022.
63. Fernandes F, Ramires FJ, Arteaga E, et al. Cardiac remodeling in patients with systemic sclerosis with no signs 102or symptoms of heart failure: an endomyocardial biopsy study. J Card Fail. 2003 Aug; 9(4): 311 - 7. doi: 10.1054/jcaf.2003.51.
64. Hsu VM, Chung L, Hummers LK. Development of pulmonary hypertension in a high-risk population with systemic sclerosis in the Pulmonary Hypertension Assessment and Recognition of Outcomes in Scleroderma (PHAROS) cohort study. Semin Arthritis Rheum. 2014; 44(1): 55 - 62.
65. Takatsuki S, Soep JB, Calderbank M, et al. Connective tissue disease presenting with signs and symptoms of pulmonary hypertension in children. Pediatr Cardiol. 2011; 32(6): 828 - 833. doi:10.1007/s00246-011-9950-7
66. Anuardo P, Verdier M, Gormezano NW, et al. Subclinical Pulmonary Hypertension in Childhood Systemic Lupus Erythematosus Associated with Minor Disease Manifestations. Pediatr Cardiol. 2017; 38(2): 234 - 239. doi: 10.1007/s00246-016-1504-6.
67. Avouac J, ![]() P, Meune C, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol. 2010 Nov; 37(11): 2290 - 8. doi: 10.3899/jrheum.100245. Epub 2010 Sep 1.
P, Meune C, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol. 2010 Nov; 37(11): 2290 - 8. doi: 10.3899/jrheum.100245. Epub 2010 Sep 1.
68. World Health Organization. Global update on implementation of preventive chemotherapy (PC) against neglected tropical diseases (NTDs) in 2022 and status of donated medicines for NTDs in 2022 - 2023 Implementation of PC: 2022 update//Geneva: WHO. - 2022. https://www.who.int/publications/i/item/who-wer9852-681-696.
69. Houlder EL, Costain AH, Cook PC, et al Schistosomes in the Lung: Immunobiology and Opportunity. Front Immunol. 2021; 12: 635513. Published 2021 Apr 19. doi: 10.3389/fimmu.2021.635513
70. Kumar R, Mickael C, Kassa B, et al. Th2 CD4+ T Cells Are Necessary and Sufficient for Schistosoma-Pulmonary Hypertension. J Am Heart Assoc. 2019; 8(15): e013111. doi:10.1161/JAHA.119.013111
71. Mauad T, Pozzan G, ![]() T, et al. Immunopathological aspects of schistosomiasis-associated pulmonary arterial hypertension. J Infect. 2014 Jan; 68(1): 90 - 8. doi: 10.1016/j.jinf.2013.08.004. Epub 2013 Aug 15.
T, et al. Immunopathological aspects of schistosomiasis-associated pulmonary arterial hypertension. J Infect. 2014 Jan; 68(1): 90 - 8. doi: 10.1016/j.jinf.2013.08.004. Epub 2013 Aug 15.
72. dos Santos Fernandes CJ, Jardim CV, et al. Survival in schistosomiasis-associated pulmonary arterial hypertension. J Am Coll Cardiol. 2010 Aug 24; 56(9): 715 - 20. doi: 10.1016/j.jacc.2010.03.065.
73. Knafl D, Gerges C, King CH, et al. Schistosomiasis-associated pulmonary arterial hypertension: a systematic review. Eur Respir Rev. 2020; 29(155): 190089. doi: 10.1183/16000617.0089-2019.
74. World Health Organization:. Progress report 2011: Global HIV/AIDS response//Geneva: WHO. - 2011.
75. L'Huillier AG, Posfay-Barbe KM, Pictet H, et al. Pulmonary Arterial Hypertension among HIV-Infected Children: Results of a National Survey and Review of the Literature. Front Pediatr. 2015; 3: 25. doi:10.3389/fped.2015.00025
76. Butrous G. Human immunodeficiency virus-associated pulmonary arterial hypertension: considerations for pulmonary vascular diseases in the developing world. Circulation. 2015 Apr 14; 131(15): 1361 - 70. doi: 10.1161/CIRCULATIONAHA.114.006978.
77. Bigna JJ, Nansseu JR, Noubiap JJ. Pulmonary hypertension in the global population of adolescents and adults living with HIV: a systematic review and meta-analysis. Sci Rep. 2019 May 24; 9(1): 7837. doi: 10.1038/s41598-019-44300-5.
78. Idris NS, Uiterwaal CSPM, Burgner DP, et al. Effects of HIV Infection on Pulmonary Artery Pressure in Children. Glob Heart. 2019 Dec; 14(4): 367 - 372. doi: 10.1016/j.gheart.2019.08.006.
79. Thienemann F, Katoto PDMC, Azibani F, et al. Long-Term Follow-up of Human Immunodeficiency Virus-Associated Pulmonary Hypertension: Clinical Features and Survival Outcomes of the Pan Africa Pulmonary Hypertension Cohort (PAPUCO). Open Forum Infect Dis. 2022; 9(12): ofac604
80. Ferrand RA, Desai SR, Hopkins C, et al.. Chronic lung disease in adolescents with delayed diagnosis of vertically acquired HIV infection. Clin Infect Dis. 2012 Jul; 55(1): 145 - 52. doi: 10.1093/cid/cis271.
81. Cunha Mdo C, Siqueira Filho AG, Santos SR, et al. AIDS in childhood: cardiac involvement with and without triple combination antiretroviral therapy. Arq Bras Cardiol. 2008 Jan; 90(1): 11 - 7. doi: 10.1590/s0066-782x2008000100003.
82. Wong AR, Rasool AH, Abidin NZ, et al. Sildenafil as treatment for Human Immunodeficiency Virus-related pulmonary hypertension in a child. J Paediatr Child Health. 2006 Mar; 42(3): 147 - 8. doi: 10.1111/j.1440-1754.2006.00816.x.
83. Sitbon O, Humbert M, ![]() X, et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation. 2005 Jun 14; 111(23): 3105 - 11. doi: 10.1161/CIRCULATIONAHA.104.488486.
X, et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation. 2005 Jun 14; 111(23): 3105 - 11. doi: 10.1161/CIRCULATIONAHA.104.488486.
84. Montani D, Savale L, Natali D, et al. Long-term response to calcium-channel blockers in non-idiopathic pulmonary arterial hypertension. Eur Heart J. 2010 Aug; 31(15): 1898 - 907. doi: 10.1093/eurheartj/ehq170.
85. Barst RJ, McGoon MD, Elliott CG, et al. Survival in childhood pulmonary arterial hypertension: insights from the registry to evaluate early and long-term pulmonary arterial hypertension disease management. Circulation. 2012 Jan 3; 125(1): 113 - 22. doi: 10.1161/CIRCULATIONAHA.111.026591.
86. Dhala A. Pulmonary arterial hypertension in systemic lupus erythematosus: current status and future direction. Clin Dev Immunol. 2012; 2012: 854941. doi: 10.1155/2012/854941.
87. Berteloot L, Proisy M, Jais JP, et al. Idiopathic, heritable and veno-occlusive pulmonary arterial hypertension in childhood: computed tomography angiography features in the initial assessment of the disease. Pediatr Radiol. 2019 May; 49(5): 575 - 585. doi: 10.1007/s00247-018-04331-y.
88. Best DH, Sumner KL, Austin ED, et al. EIF2AK4 mutations in pulmonary capillary hemangiomatosis. Chest. 2014 Feb; 145(2): 231 - 236. doi: 10.1378/chest.13-2366.
89. Eyries M, Montani D, Girerd B, et al. EIF2AK4 mutations cause pulmonary veno-occlusive disease, a recessive form of pulmonary hypertension. Nat Genet. 2014 Jan; 46(1): 65 - 9. doi: 10.1038/ng.2844.
90. Tenorio J, Navas P, Barrios E, et al. A founder EIF2AK4 mutation causes an aggressive form of pulmonary arterial hypertension in Iberian Gypsies. Clin Genet. 2015 Dec; 88(6): 579 - 83. doi: 10.1111/cge.12549. Epub 2015 Jan 7. PMID: 25512148.
91. Morin CE, McBee MP, Elbahlawan L, et al. Early pulmonary complications related to cancer treatment in children. Pediatr Radiol. 2022 Sep; 52(10): 2017 - 2028. doi: 10.1007/s00247-022-05403-w. Epub 2022 Jul 2.
92. Hilgendorff A, Apitz C, Bonnet D, et al. Pulmonary hypertension associated with acute or chronic lung diseases in the preterm and term neonate and infant. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and DGPK. Heart. 2016 May; 102 Suppl 2: ii49 - 56. doi: 10.1136/heartjnl-2015-308591.
93. Nakanishi H, Suenaga H, Uchiyama A, et al. Neonatal Research Network, Japan. Persistent pulmonary hypertension of the newborn in extremely preterm infants: a Japanese cohort study. Arch Dis Child Fetal Neonatal Ed. 2018 Nov; 103(6): F554 - F561. doi: 10.1136/archdischild-2017-313778.
94. Martinho S, ![]() R, Leite-Moreira AF, et al. Persistent Pulmonary Hypertension of the Newborn: Pathophysiological Mechanisms and Novel Therapeutic Approaches. Front Pediatr. 2020 Jul 24; 8:342. doi: 10.3389/fped.2020.00342.
R, Leite-Moreira AF, et al. Persistent Pulmonary Hypertension of the Newborn: Pathophysiological Mechanisms and Novel Therapeutic Approaches. Front Pediatr. 2020 Jul 24; 8:342. doi: 10.3389/fped.2020.00342.
95. Abman SH. Pulmonary Hypertension: The Hidden Danger for Newborns. Neonatology. 2021; 118(2): 211 - 217. doi: 10.1159/000516107.
96. Mourani PM, Mandell EW, Meier M, et al. Early Pulmonary Vascular Disease in Preterm Infants Is Associated with Late Respiratory Outcomes in Childhood. Am J Respir Crit Care Med. 2019 Apr 15; 199(8): 1020 - 1027. doi: 10.1164/rccm.201803-0428OC.
97. Hansen AR, ![]() CM, Folkman J, et al. Maternal preeclampsia predicts the development of bronchopulmonary dysplasia. J Pediatr. 2010 Apr; 156(4): 532 - 6. doi: 10.1016/j.jpeds.2009.10.018.
CM, Folkman J, et al. Maternal preeclampsia predicts the development of bronchopulmonary dysplasia. J Pediatr. 2010 Apr; 156(4): 532 - 6. doi: 10.1016/j.jpeds.2009.10.018.
98. Steurer MA, Jelliffe-Pawlowski LL, Baer RJ, et al. Persistent Pulmonary Hypertension of the Newborn in Late Preterm and Term Infants in California. Pediatrics. 2017 Jan; 139(1): e20161165. doi: 10.1542/peds.2016-1165.
99. Nair J, Lakshminrusimha S. Update on PPHN: mechanisms and treatment. Semin Perinatol. 2014 Mar; 38(2): 78 - 91. doi: 10.1053/j.semperi.2013.11.004.
100. Sallmon H, Koestenberger M, Avian A, et al. Extremely premature infants born at 23 - 25 weeks gestation are at substantial risk for pulmonary hypertension. J Perinatol. 2022 Apr 1. doi: 10.1038/s41372-022-01374-w. Epub ahead of print.
101. Li L, Jick S, Breitenstein S, et al. Pulmonary arterial hypertension in the USA: an epidemiological study in a large insured pediatric population. Pulm Circ. 2017 Feb 1; 7(1): 126 - 136. doi: 10.1086/690007
102. Cerro MJ, Abman S, Diaz G, et al. A consensus approach to the classification of pediatric pulmonary hypertensive vascular disease: Report from the PVRI Pediatric Taskforce, Panama 2011. Pulm Circ. 2011; 1(2): 286 - 298. doi: 10.4103/2045-8932.83456.
103. Миклашевич И.М. Легочная гипертензия, обусловленная болезнями левых камер сердца/И.М. Миклашевич, М.А. Школьникова//Легочная гипертензия у детей: Руководство. - Москва: Общество с ограниченной ответственностью "Актелион Фармасьютикалз", 2013. - С. 164 - 175.
104. Lin Y, Pang L, Huang S, et al. The prevalence and survival of pulmonary hypertension due to left heart failure: A retrospective analysis of a multicenter prospective cohort study. Front Cardiovasc Med. 2022 Aug 2; 9:908215. doi: 10.3389/fcvm.2022.908215.
105. Gerges C, Gerges M, Lang MB, et al. Diastolic pulmonary vascular pressure gradient: a predictor of prognosis in "out-of-proportion" pulmonary hypertension. Chest. 2013 Mar; 143(3): 758 - 766. doi: 10.1378/chest.12-1653.
106. Cam A, Goel SS, Agarwal S, et al. Prognostic implications of pulmonary hypertension in patients with severe aortic stenosis. J Thorac Cardiovasc Surg. 2011 Oct; 142(4): 800 - 8. doi: 10.1016/j.jtcvs.2010.12.024. Epub 2011 Feb 12.
107. Naeije R, D'Alto M. The Diagnostic Challenge of Group 2 Pulmonary Hypertension. Prog Cardiovasc Dis. 2016 Jul - Aug; 59(1): 22 - 9. doi: 10.1016/j.pcad.2016.05.003.
108. Nawaytou H, Fineman JR, Moledina S, et al. Practice patterns of pulmonary hypertension secondary to left heart disease among pediatric pulmonary hypertension providers. Pulm Circ. 2021 Feb 9; 11(1): 2045894021991446. doi: 10.1177/2045894021991446.
109. Fayyaz AU, Edwards WD, Maleszewski JJ, et al. Global Pulmonary Vascular Remodeling in Pulmonary Hypertension Associated With Heart Failure and Preserved or Reduced Ejection Fraction. Circulation. 2018 Apr 24; 137(17): 1796 - 1810. doi: 10.1161/CIRCULATIONAHA.117.031608.
110. Charalampopoulos A, Lewis R, Hickey P, et al. Pathophysiology and Diagnosis of Pulmonary Hypertension Due to Left Heart Disease. Front Med (Lausanne). 2018; 5: 174. doi: 10.3389/fmed.2018.00174
111. Klinger JR. Group III Pulmonary Hypertension: Pulmonary Hypertension Associated with Lung Disease: Epidemiology, Pathophysiology, and Treatments. Cardiol Clin. 2016 Aug; 34(3): 413 - 33. doi: 10.1016/j.ccl.2016.04.003.
112. Hansmann G, Sallmon H, Roehr CC, et al. European Pediatric Pulmonary Vascular Disease Network (EPPVDN). Pulmonary hypertension in bronchopulmonary dysplasia. Pediatr Res. 2021 Feb; 89(3): 446 - 455. doi: 10.1038/s41390-020-0993-4.
113. Al-Ghanem G, Shah P, Thomas S, et al. Bronchopulmonary dysplasia and pulmonary hypertension: a meta-analysis. J Perinatol. 2017 Apr; 37(4): 414 - 419. doi: 10.1038/jp.2016.250.
114. Kim YJ, Shin SH, Park HW, et al. Risk factors of early pulmonary hypertension and its clinical outcomes in preterm infants: a systematic review and meta-analysis. Sci Rep. 2022 Aug 19; 12(1): 14186. doi: 10.1038/s41598-022-18345-y.
115. Kurland G, Deterding RR, Hagood JS, et al. American Thoracic Society Committee on Childhood Interstitial Lung Disease (chILD) and the chILD Research Network. An official American Thoracic Society clinical practice guideline: classification, evaluation, and management of childhood interstitial lung disease in infancy. Am J Respir Crit Care Med. 2013 Aug 1; 188(3): 376 - 94. doi: 10.1164/rccm.201305-0923ST.
116. Bishop NB, Stankiewicz P, Steinhorn RH. Alveolar capillary dysplasia. Am J Respir Crit Care Med. 2011 Jul 15; 184(2): 172 - 9. doi: 10.1164/rccm.201010-1697CI. Epub 2011 Mar 11.
117. Hennelly M, Greenberg RG, Aleem S. An Update on the Prevention and Management of Bronchopulmonary Dysplasia. Pediatric Health Med Ther. 2021 Aug 11; 12: 405 - 419. doi: 10.2147/PHMT.S287693.
118. Principi N, Di Pietro GM, Esposito S. Bronchopulmonary dysplasia: clinical aspects and preventive and therapeutic strategies. J Transl Med. 2018 Feb 20; 16(1): 36. doi: 10.1186/s12967-018-1417-7.
119. Kirby E, Keijzer R. Congenital diaphragmatic hernia: current management strategies from antenatal diagnosis to long-term follow-up. Pediatr Surg Int. 2020 Apr; 36(4): 415 - 429. doi: 10.1007/s00383-020-04625-z.
120. Cochius-den Otter S, Schaible T, et al. CDH EURO Consortium. The CoDiNOS trial protocol: an international randomized controlled trial of intravenous sildenafil versus inhaled nitric oxide for the treatment of pulmonary hypertension in neonates with congenital diaphragmatic hernia. BMJ Open. 2019 Nov 5; 9(11): e032122. doi: 10.1136/bmjopen-2019-032122.
121. Milligan I, Shaw AK, Leu R, et al. Prevalence of pulmonary hypertension in obstructive sleep apnea and its relation to disease severity. J Clin Sleep Med. 2024; 20(5): 675 - 680. doi:10.5664/jcsm.10952
122. Ellsworth KR, Ellsworth MA, Weaver AL, et al. Association of Early Inhaled Nitric Oxide With the Survival of Preterm Neonates With Pulmonary Hypoplasia. JAMA Pediatr. 2018 Jul 2; 172(7): e180761. doi: 10.1001/jamapediatrics.2018.0761.
123. Bush D, Galambos C, Dunbar Ivy D. Pulmonary hypertension in children with Down syndrome Pediatr Pulmonol. 2021 Mar; 56(3): 621 - 629. doi: 10.1002/ppul.24687.
124.  O, Torrent-Vernetta A, Rovira-Amigo S, et al. AIsolated pulmonary interstitial glycogenosis associated with alveolar growth abnormalities: A long-term follow-up study. Pediatr Pulmonol 2019 Jun; 54(6): 837 - 846. Epub 2019 Mar 25 doi: 10.1002/ppul.24324.
O, Torrent-Vernetta A, Rovira-Amigo S, et al. AIsolated pulmonary interstitial glycogenosis associated with alveolar growth abnormalities: A long-term follow-up study. Pediatr Pulmonol 2019 Jun; 54(6): 837 - 846. Epub 2019 Mar 25 doi: 10.1002/ppul.24324.
125. Liptzin DR, Baker CD, Darst JR, et al. Pulmonary interstitial glycogenosis: Diagnostic evaluation and clinical course. Pediatr Pulmonol. 2018 Dec; 53(12): 1651 - 1658. doi: 10.1002/ppul.24123. Epub 2018 Jul 18.
126. Griese M. Pulmonary alveolar proteinosis: a comprehensive clinical perspective. Pediatrics 2017; 140(2). pii: e20170610. doi: 10.1542/peds.2017-0610.
127. Reiterer F, Grossauer K, Pfleger A, et al. Severe primary pulmonary lymphangiectasis in a premature infant: management and follow up to early childhood. Pediatr Int. 2015; 57(1): 166 - 9. doi: 10.1111/ped.12416.
128. Barker PM, Esther CR Jr, Fordham LA, et al. Primary pulmonary lymphangiectasia in infancy and childhood. Eur Respir J. 2004 Sep; 24(3): 413 - 9. doi: 10.1183/09031936.04.00014004.
129. Eldridge, W.B., et al., Outcomes of lung transplantation for infants and children with genetic disorders of surfactant metabolism. The Journal of pediatrics, 2017. 184: p. 157 - 164. e2.
130. Fan, L.L., et al., Diffuse lung disease in biopsied children 2 to 18 years of age. Application of the child classification scheme. Annals of the American Thoracic Society, 2015. 12 (10): p. 1498 - 1505.
131. Nogee LM. Genetic_causes_of_surfactant_protein_abnormalities Curr Opin Pediatr. 2019 Jun; 31(3): 330 - 339. doi: 10.1097/MOP.0000000000000751
132. Singh J, Jaffe A, Schultz A, et al. Surfactant protein disorders in childhood interstitial lung disease. Eur J Pediatr. 2021 Sep; 180(9): 2711 - 2721. doi: 10.1007/s00431-021-04066-3. Epub 2021 Apr 11.
133.  O, Torrent-Vernetta A, Rovira-Amigo S, et al. AIsolated pulmonary interstitial glycogenosis associated with alveolar growth abnormalities: A long-term follow-up study. Pediatr Pulmonol 2019 Jun; 54(6): 837 - 846. Epub 2019 Mar 25 doi: 10.1002/ppul.24324.
O, Torrent-Vernetta A, Rovira-Amigo S, et al. AIsolated pulmonary interstitial glycogenosis associated with alveolar growth abnormalities: A long-term follow-up study. Pediatr Pulmonol 2019 Jun; 54(6): 837 - 846. Epub 2019 Mar 25 doi: 10.1002/ppul.24324.
134. Liptzin DR, Baker CD, Darst JR, et al. Pulmonary interstitial glycogenosis: Diagnostic evaluation and clinical course. Pediatr Pulmonol 2018 Dec; 53(12): 1651 - 1658. Epub 2018 Jul 18 doi: 10.1002/ppul.
135. Seidl E, Carlens J, Reu S, et al. Pulmonary interstitial glycogenosis - A systematic analysis of new cases.Respir Med 2018 Jul; 140: 11 - 20. Epub 2018 May 17 doi: 10.1016/j.rmed.2018.05.009.
136. Bush D, Galambos C, Ivy DD, et al. Clinical characteristics and risk factors for developing pulmonary hypertension in children with Down syndrome. J Pediatr. 2018; 202: 212 - 219.
137. O'Leary L, Hughes-McCormack L, Dunn K, et al. Early death and causes of death of people with Down Syndrome: a systematic review. J Appl Res Intellect Disabil. 2018; 31(5): 687 - 708.
138. Mfingwana L, Goussard P, van Wyk L, et al. Pulmonary Echinococcus in children: A descriptive study in a LMIC. Pediatr Pulmonol. 2022 May; 57(5): 1173 - 1179. doi: 10.1002/ppul.25854. Epub 2022 Feb 14. PMID: 35122423
139. Delcroix M, Torbicki A, Gopalan D, et al. ERS statement on chronic thromboembolic pulmonary hypertension. Eur Respir J. 2021 Jun 17; 57(6): 2002828. doi: 10.1183/13993003.02828-2020.
140. Dong C, Zhou M, Liu D, et al. Diagnostic Accuracy of Computed Tomography for Chronic Thromboembolic Pulmonary Hypertension: A Systematic Review and Meta-Analysis. PLoS ONE 10(4): e0126985. https://doi.org/10.1371/journal.pone.0126985
141. Madani MM, Wittine LM, Auger WR, et al. Chronic thromboembolic pulmonary hypertension in pediatric patients. J Thorac Cardiovasc Surg. 2011 Mar; 141(3): 624 - 30. doi: 10.1016/j.jtcvs.2010.07.010. Epub 2010 Aug 30.
142. Spencer R, Valencia Villeda G, Takeda K, et al. Chronic Thromboembolic Pulmonary Hypertension in a Child With Sickle Cell Disease. Front Pediatr. 2020; 8: 363. doi: 10.3389/fped.2020.00363
143. Al-Qadi M, LeVarge B, Ford HJ. Epidemiology, Pathogenesis, and Clinical Approach in Group 5 Pulmonary Hypertension. Front Med (Lausanne). 2021; 7: 616720. doi: 10.3389/fmed.2020.616720.
144. Klings ES, Machado RF, Barst RJ, et al. American Thoracic Society Ad Hoc Committee on Pulmonary Hypertension of Sickle Cell Disease. An official American Thoracic Society clinical practice guideline: diagnosis, risk stratification, and management of pulmonary hypertension of sickle cell disease. Am J Respir Crit Care Med. 2014 Mar 15; 189(6): 727 - 40. doi: 10.1164/rccm.201401-0065ST.
145. Parent F, Bachir D, Inamo J, et al. A hemodynamic study of pulmonary hypertension in sickle cell disease. N Engl J Med. 2011 Jul 7; 365(1): 44 - 53. doi: 10.1056/NEJMoa1005565.
146. Gordeuk VR, Minniti CP, Nouraie M, et al.. Elevated tricuspid regurgitation velocity and decline in exercise capacity over 22 months of follow up in children and adolescents with sickle cell anemia. Haematologica. 2011 Jan; 96(1): 33 - 40. doi: 10.3324/haematol.2010.030767.
147. Rai P, Joshi VM, Goldberg JF, et al. Longitudinal effect of disease-modifying therapy on tricuspid regurgitant velocity in children with sickle cell anemia. Blood Adv. 2021; 5(1): 89 - 98. doi: 10.1182/bloodadvances.2020003197
148. Sheikh AB, Nasrullah A, Lopez ED, et al. Sickle Cell Disease-Induced Pulmonary Hypertension: A Review of Pathophysiology, Management, and Current Literature. Pulse (Basel). 2021; 9(3-4): 57 - 63. doi:10.1159/000519101
149. Mondal P, Midya V, Khokhar A, et al. Predictors of Diffusing Capacity in Children With Sickle Cell Disease: A Longitudinal Study. Front Pediatr. 2021; 9: 678174. doi:10.3389/fped.2021.678174
150. Wood KC, Gladwin MT, Straub AC. Sickle cell disease: at the crossroads of pulmonary hypertension and diastolic heart failure. Heart. 2020; 106(8): 562 - 568. doi: 10.1136/heartjnl-2019-314810
151. Nichols JS, Ernst I, Hunter LA, et al. Pulmonary hypertension as a risk factor for death in patients with sickle cell disease. N Engl J Med. 2004 Feb 26; 350(9): 886 - 95. doi: 10.1056/NEJMoa035477.
152. Ferrari A, Scandura J, Masciulli A, et al. Prevalence and risk factors for Pulmonary Hypertension associated with chronic Myeloproliferative Neoplasms. Eur J Haematol. 2021 Feb; 106(2): 250 - 259. doi: 10.1111/ejh.13543. Epub 2020 Nov 22.
153. Guilpain P, Montani D, Damaj G, et al. Pulmonary hypertension associated with myeloproliferative disorders: a retrospective study of ten cases. Respiration. 2008; 76(3): 295 - 302. doi: 10.1159/000112822. Epub 2007 Dec 21.
154. Eichstaedt CA, Verweyen J, Halank M, et al. Myeloproliferative Diseases as Possible Risk Factor for Development of Chronic Thromboembolic Pulmonary Hypertension-A Genetic Study. Int J Mol Sci. 2020; 21(9): 3339. Published 2020 May 8. doi:10.3390/ijms21093339
155. Toros AB, Gokcay S, Cetin G, et al. Portal hypertension and myeloproliferative neoplasms: a relationship revealed. ISRN Hematol. 2013; 2013: 673781. Published 2013 Sep 16. doi:10.1155/2013/673781.
156. Montani D, Bergot E,  S, et al. Pulmonary arterial hypertension in patients treated by dasatinib. Circulation. 2012 May 1; 125(17): 2128 - 37. doe: 10.1161/CIRCULATIONAHA.111.079921. Epub 2012 Mar 26.
S, et al. Pulmonary arterial hypertension in patients treated by dasatinib. Circulation. 2012 May 1; 125(17): 2128 - 37. doe: 10.1161/CIRCULATIONAHA.111.079921. Epub 2012 Mar 26.
157. Bunte MC, Patnaik MM, Pritzker MR, et al. Pulmonary veno-occlusive disease following hematopoietic stem cell transplantation: a rare model of endothelial dysfunction. Bone Marrow Transplant. 2008 Apr; 41(8): 677 - 86. doi: 10.1038/sj.bmt.1705990.
158. Nithiya N, Indhumathi E, Jagadeswaran D, et al. Pulmonary hypertension - prevalence, risk factors, and its association with vascular calcification in chronic kidney disease and hemodialysis patients. Saudi J Kidney Dis Transpl [serial online] 2020 [cited 2022 Feb 7]; 31: 380 - 7.
159. O'Leary JM, Assad TR, Xu M, et al. Pulmonary hypertension in patients with chronic kidney disease: invasive hemodynamic etiology and outcomes. Pulm Circ. 2017; 7(3): 674 - 683. doi:10.1177/2045893217716108
160. Tang, M., Batty, J. A., Lin, C., et al. Pulmonary Hypertension, Mortality, and Cardiovascular Disease in CKD and ESRD Patients: A Systematic Review and Meta-analysis. American Journal of Kidney Diseases, 72(1), 75 - 83. https://doi.org/10.1053/j.ajkd.2017.11.018
161. Mocumbi AO, Thienemann F, Sliwa K. A global perspective on the epidemiology of pulmonary hypertension. Can J Cardiol. 2015 Apr; 31(4): 375 - 81. doi: 10.1016/j.cjca.2015.01.030.
162. Dzudie A, Dzekem BS, Ojji DB, et al. Pulmonary hypertension in low- and middle-income countries with focus on sub-Saharan Africa. Cardiovasc Diagn Ther. 2020 Apr; 10(2): 316 - 324. doi: 10.21037/cdt.2019.07.06.
163. Wijeratne DT, Lajkosz K, Brogly SB, et al. Increasing Incidence and Prevalence of World Health Organization Groups 1 to 4 Pulmonary Hypertension: A Population-Based Cohort Study in Ontario, Canada. Circ Cardiovasc Qual Outcomes. 2018; 11(2): e003973. doi: 10.1161/CIRCOUTCOMES.117.003973
164. Чазова И.Е., Архипова О.А., Мартынюк Т.В. Легочная артериальная гипертензия в России: анализ шестилетнего наблюдения по данным Национального регистра. Терапевтический архив. 2019; 91 (1): 10 - 31.
165. van Loon RL, Roofthooft MT, Hillege HL, et al. Pediatric pulmonary hypertension in the Netherlands: epidemiology and characterization during the period 1991 to 2005. Circulation. 2011 Oct 18; 124(16): 1755 - 64. doi: 10.1161/CIRCULATIONAHA.110.969584.
166. del Cerro ![]() MJ,
MJ, ![]()
![]() A, Rodriguez Ogando A, et al. Assessing pulmonary hypertensive vascular disease in childhood. Data from the Spanish registry. Am J Respir Crit Care Med. 2014; 190(12): 1421 - 1429. doi: 10.1164/rccm.201406-1052OC
A, Rodriguez Ogando A, et al. Assessing pulmonary hypertensive vascular disease in childhood. Data from the Spanish registry. Am J Respir Crit Care Med. 2014; 190(12): 1421 - 1429. doi: 10.1164/rccm.201406-1052OC
167. Pektas A, Pektas BM, Kula S. An epidemiological study of paediatric pulmonary hypertension in Turkey. Cardiol Young 2016; 26: 693 - 697.
168. Kwiatkowska, J.; Zuk, M.; Migdal, A.; et al. Children and Adolescents with Pulmonary Arterial Hypertension: Baseline and Follow-Up Data from the Polish Registry of Pulmonary Hypertension (BNP-PL). J. Clin. Med. 2020, 9, 1717. https://doi.org/10.3390/jcm9061717
169. Mair KM, Johansen AK, Wright AF, et al. Pulmonary arterial hypertension: basis of sex differences in incidence and treatment response. Br J Pharmacol. 2014; 171(3): 567 - 579. doi: 10.1111/bph.12281
170. Rafikov R, James J, McClain N, et al. Role of Gender in Regulation of Redox Homeostasis in Pulmonary Arterial Hypertension. Antioxidants (Basel). 2019; 8(5): 135. Published 2019 May 16. doi: 10.3390/antiox8050135/
171. Kimura Y, Weiss JE, Haroldson KL, et al. Pulmonary hypertension and other potentially fatal pulmonary complications in systemic juvenile idiopathic arthritis. Arthritis Care Res 2013; 65: 745 - 752.
172. Anuardo P, Verdier M, Gormezano NW, et al. Subclinical pulmonary hypertension in childhood systemic lupus erythematosus associated with minor disease manifestations. Pediatr Cardiol 2017; 38: 234 - 239.
173. Duffels MG, Engelfriet PM, Berger RM, et al. Pulmonary arterial hypertension in congenital heart disease: an epidemiologic perspective from a Dutch registry. Int J Cardiol. 2007 Aug 21; 120(2): 198 - 204. doi: 10.1016/j.ijcard.2006.09.017.
174. Kaemmerer H, Mebus S, Schulze-Neick I, et al. The adult patient with Eisenmenger syndrome: a medical update after dana point part I: epidemiology, clinical aspects and diagnostic options. Curr Cardiol Rev. 2010 Nov; 6(4): 343 - 55. doi: 10.2174/157340310793566154.
175. Beghetti M, Berger RM, Schulze-Neick I, et al. TOPP Registry Investigators. Diagnostic evaluation of paediatric pulmonary hypertension in current clinical practice. Eur Respir J. 2013 Sep; 42(3): 689 - 700. doi: 10.1183/09031936.00140112.
176. Walsh-Sukys MC, Tyson JE, Wright LL, et al. Persistent pulmonary hypertension of the newborn in the era before nitric oxide: practice variation and outcomes. Pediatrics. 2000 Jan; 105(1 Pt 1): 14 - 20. doi: 10.1542/peds.105.1.14.
177. Nakanishi H, Suenaga H, Uchiyama A, et al. Persistent pulmonary hypertension of the newborn in extremely preterm infants: a Japanese cohort study. Arch Dis Child Fetal Neonatal Ed 2018; 106: F554 - F561.
178. Rosenkranz S, Lang IM, Blindt R, et al. Pulmonary hypertension associated with left heart disease: Updated Recommendations of the Cologne Consensus Conference 2018.Int J Cardiol. 2018; 272S: 53 - 62.
179. Berger RM, Beghetti M, Humpl T, et al. Clinical features of paediatric pulmonary hypertension: a registry study. Lancet. 2012 Feb 11; 379(9815): 537 - 46. doi: 10.1016/S0140-6736(11) 61621-8.
180. Ploegstra MJ, Zijlstra WMH, Douwes JM, et al. Prognostic factors in pediatric pulmonary arterial hypertension: A systematic review and meta-analysis. Int J Cardiol. 2015 Apr 1; 184: 198 - 207. doi: 10.1016/j.ijcard.2015.01.038.
181. Kubo SH, Schulman S, Starling RC, et al. Development and validation of a patient questionnaire to determine New York Heart Association classification. J Card Fail. 2004 Jun; 10(3): 228 - 35. doi: 10.1016/j.cardfail.2003.10.005.
182. Lammers AE, Adatia I, Cerro MJ et al. Functional classification of pulmonary hypertension in children: Report from the PVRI pediatric taskforce, Panama 2011. Pulm Circ. 2011 Aug 2; 1(2): 280 - 285. doi: 10.4103/2045-8932.83445.
183. Heath D, Edwards JE. The pathology of hypertensive pulmonary vascular disease; a description of six grades of structural changes in the pulmonary arteries with special reference to congenital cardiac septal defects. Circulation. 1958 Oct; 18(4 Part 1): 533 - 47. doi: 10.1161/01.cir.18.4.533.
184. Хугаев Г.А., Шмальц А.А. Морфологическая оценка легочной сосудистой болезни. В кн.: Горбачевский С.В., Шмальц А.А. (ред.) Диагностика легочной гипертензии при врожденных пороках сердца. М.: ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" МЗ РФ; 2023: 125 - 142.
185. Baroutidou A, Arvanitaki A, Hatzidakis A, et al. Haemoptysis in Pulmonary Arterial Hypertension Associated with Congenital Heart Disease: Insights on Pathophysiology, Diagnosis and Management. J Clin Med. 2022 Jan 26; 11(3): 633. doi: 10.3390/jcm11030633.
186. Kaestner M, Schranz D, Warnecke G, et al. Pulmonary hypertension in the intensive care unit. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and DGPK. Heart. 2016 May; 102 Suppl 2: ii57 - 66. doi: 10.1136/heartjnl-2015-307774.
187. Lamers AE, Apitz C, Zartner P, et al. Diagnostics, ex and outpatient care in children with suspected pulmonary hypertension/paediatric pulmonary hypertensive vascular disease. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. Heart. 2016 May; 102 Suppl 2: ii1 - 13. doi: 10.1136/heartjnl-2015-307792.
188. Горбачевский С.В., Шмальц А.А. Первичное обследование. В кн.: Горбачевский С.В., Шмальц А.А. (ред.) Диагностика легочной гипертензии при врожденных пороках сердца. М.: ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" МЗ РФ; 2023: 20 - 34
189. Sehgal M, Amritphale A, Vadayla S, et al. Demographics and Risk Factors of Pediatric Pulmonary Hypertension Readmissions. Cureus 13(10): e18994. doi: 10.7759/cureus.18994.
190. Liu J, Yang J, Xu S, et al. Prognostic impact of red blood cell distribution width in pulmonary hypertension patients: A systematic review and meta-analysis. Medicine (Baltimore). 2020 Apr; 99(16): e19089. doi: 10.1097/MD.0000000000019089.
191. Mathew R, Huang J, Wu JM, et al. Hematological disorders and pulmonary hypertension. World J Cardiol. 2016; 8(12): 703 - 718. doi: 10.4330/wjc.v8.i12.703.
192. Sonnweber, T., Pizzini, A., Tancevski, I. et al. Anaemia, iron homeostasis and pulmonary hypertension: a review. Intern Emerg Med 15, 573 - 585 (2020). [https://doi.org/10.1007/s11739-020-02288-1].
193. Rhodes CJ, Wharton J, Howard L, et al. Iron deficiency in pulmonary arterial hypertension: a potential therapeutic target. Eur Respir J. 2011 Dec; 38(6): 1453 - 60. doi: 10.1183/09031936.00037711. Epub 2011 Apr 8.
194. Tilea I, Petra DN, Serban RC, et al. Short-Term Impact of Iron Deficiency in Different Subsets of Patients with Precapillary Pulmonary Hypertension from an Eastern European Pulmonary Hypertension Referral Center. Int J Gen Med. 2021 Jul 12; 14: 3355 - 3366. doi: 10.2147/IJGM.S318343.
195. Takatsuki S, Wagner BD, Ivy DD. B-type natriuretic peptide and amino-terminal pro-B-type natriuretic peptide in pediatric patients with pulmonary arterial hypertension. Congenit Heart Dis. 2012 May - Jun; 7(3): 259 - 67. doi: 10.1111/j.1747-0803.2011.00620.x. Epub 2012 Feb 10.
196. Said F, Haarman MG, Roofthooft MTR, Hillege HL, Ploegstra MJ, Berger RMF. Serial Measurements of N-Terminal Pro-B-Type Natriuretic Peptide Serum Level for Monitoring Pulmonary Arterial Hypertension in Children. J Pediatr. 2020 May; 220: 139 - 145. doi: 10.1016/j.jpeds.2020.01.001.
197. Bernus A, Wagner BD, Accurso F, et al. Brain natriuretic peptide levels in managing pediatric patients with pulmonary arterial hypertension. Chest. 2009 Mar; 135(3): 745 - 751. doi: 10.1378/chest.08-0187. Epub 2008 Oct 10.
198. Gan CT, McCann GP, Marcus JT, van Wolferen SA, Twisk JW, Boonstra A, Postmus PE, Vonk-Noordegraaf A. NT-proBNP reflects right ventricular structure and function in pulmonary hypertension. Eur Respir J. 2006 Dec; 28(6): 1190 - 4. doi: 10.1183/09031936.00016006
199. Ten Kate CA, Tibboel D, Kraemer US. B-type natriuretic peptide as a parameter for pulmonary hypertension in children. A systematic review. Eur J Pediatr. 2015 Oct; 174(10): 1267 - 75. doi: 10.1007/s00431-015-2619-0. Epub 2015 Aug 23.
200. Pattathu J, Gorenflo M, Hilgendorff A, et al. Genetic testing and blood biomarkers in paediatric pulmonary hypertension. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and DGPK. Heart. 2016 May; 102 Suppl 2: ii36 - 41. doi: 10.1136/heartjnl-2014-307238.
201. Liu, J, Tang, X, Zhou, C, et al. Cobalamin C deficiency presenting with diffuse alveolar hemorrhage and pulmonary microangiopathy. Pediatric Pulmonology. 2020; 55: 1481 - 1486. https://doi.org/10.1002/ppul.24781.
202.  M, Roofthooft MT, Westra D, et al. Combined pulmonary hypertension and renal thrombotic microangiopathy in cobalamin C deficiency. Pediatrics. 2013; 132(2): e540 - e544. doi: 10.1542/peds.2012-2581
M, Roofthooft MT, Westra D, et al. Combined pulmonary hypertension and renal thrombotic microangiopathy in cobalamin C deficiency. Pediatrics. 2013; 132(2): e540 - e544. doi: 10.1542/peds.2012-2581
203. Chu JW, Kao PN, Faul JL, et al. High prevalence of autoimmune thyroid disease in pulmonary arterial hypertension. Chest 2002; 122: 1668 - 73.
204. Kato M, Sugimoto A, Atsumi T. Diagnostic and prognostic markers and treatment of connective tissue disease-associated pulmonary arterial hypertension: current recommendations and recent advances. Expert Rev Clin Immunol. 2020 Oct; 16(10): 993 - 1004. doi: 10.1080/1744666X.2021.1825940.
205. Mahajerin A, Betensky M, Goldenberg NA. Thrombosis in Children: Approach to Anatomic Risks, Thrombophilia, Prevention, and Treatment. Hematol Oncol Clin North Am. 2019 Jun; 33(3): 439 - 453. doi: 10.1016/j.hoc.2019.01.009.
206. Kerr KM, Elliott CG, Benza RL, et al. The United States Chronic Thromboembolic Pulmonary Hypertension Registry: Protocol for a Prospective, Longitudinal Study. JMIR Res Protoc. 2021 May 25; 10(5): e25397. doi: 10.2196/25397.
207. Evans JD, Girerd B, Montani D, et al. BMPR2 mutations and survival in pulmonary arterial hypertension: an inpidual participant data meta-analysis. Lancet Respir Med. 2016 Feb; 4(2): 129 - 37. (S7-4)
208. Morrell NW, Aldred MA, Chung WK, et al. Genetics and genomics of pulmonary arterial hypertension. Eur Respir J, Jan 2018, 1801899; DOI: 10.1183/13993003.01899-2018
209. Levy M, Eyries M, Szezepanski I, et al. Genetic analyses in a cohort of children with pulmonary hypertension. Eur Respir J 2016; 48: 1118 - 1126
210. Глушко Л.А., Шмальц А.А. Оценка состояния кардиреспираторной системы. В кн.: Горбачевский С.В., Шмальц А.А. (ред.) Диагностика легочной гипертензии при врожденных пороках сердца. М.: ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" МЗ РФ; 2023: 109 - 124.
211.  J, Kreuzer F, Kaestner M, et al. Impact of the Right Ventricular Sokolow-Lyon Index in Children with Idiopathic Pulmonary Arterial Hypertension. Pediatr Cardiol. 2018 Aug; 39(6): 1115 - 1122. doi: 10.1007/s00246-018-1862-3.
J, Kreuzer F, Kaestner M, et al. Impact of the Right Ventricular Sokolow-Lyon Index in Children with Idiopathic Pulmonary Arterial Hypertension. Pediatr Cardiol. 2018 Aug; 39(6): 1115 - 1122. doi: 10.1007/s00246-018-1862-3.
212. Sawada H, Mitani Y, Nakayama T, et al. Detection of Pediatric Pulmonary Arterial Hypertension by School Electrocardiography Mass Screening. Am J Respir Crit Care Med. 2019 Jun 1; 199(11): 1397 - 1406. doi: 10.1164/rccm.201802-0375OC.
213. Balieva I, Dzudie A, Thienemann F, et al. Prevalence and predictive value of electrocardiographic abnormalities in pulmonary hypertension: evidence from the Pan-African Pulmonary Hypertension Cohort (PAPUCO) study. Cardiovasc J Afr. 2017 Nov/Dec 23; 28(6): 370 - 376. doi: 10.5830/CVJA-2017-020.
214. Tongers J, Schwerdtfeger B, Klein G, et al. Incidence and clinical relevance of supraventricular tachyarrhythmias in pulmonary hypertension. Am Heart J. 2007 Jan; 153(1): 127 - 32. doi: 10.1016/j.ahj.2006.09.008.
215. Юрпольская Л.А., Шмальц А.А. Рентгенография, рентгеновская компьютерная и магнитно-резонансная томография при легочной гипертензии, ассоциированной с врожденными пороками сердца. Детские болезни сердца и сосудов. 2021; 18 (2): 83 - 93. DOI: 10.24022/1810-0686-2021-18-2-83-93
216. Goerne H, Batra K, Rajiah P. Imaging of pulmonary hypertension: an update. Cardiovasc Diagn Ther. 2018; 8(3): 279 - 296. doi: 10.21037/cdt.2018.01.10
217. Koestenberger M, Apitz C, Abdul-Khaliq H, et al. Transthoracic echocardiography for the evaluation of children and adolescents with suspected or confirmed pulmonary hypertension. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and D6PK. Heart. 2016 May; 102 Suppl 2: ii14 - 22. doi: 10.1136/heartjnl-2014-307200.
218. Ni JR, Yan PJ, Liu SD, et al. Diagnostic accuracy of transthoracic echocardiography for pulmonary hypertension: a systematic review and meta-analysis. BMJ Open. 2019 Dec 22; 9(12): e033084. doi: 10.1136/bmjopen-2019-033084.
219. Koestenberger M, Hansmann G, Apitz C, et al. Diagnostics in Children and Adolescents with Suspected or Confirmed Pulmonary Hypertension. Paediatr Respir Rev. 2017 Jun; 23: 3 - 15. doi: 10.1016/j.prrv.2016.10.006. Epub 2016 Oct 26.
220. Ploegstra MJ, Roofthooft MT, Douwes JM, et al. Echocardiography in pediatric pulmonary arterial hypertension: early study on assessing disease severity and predicting outcome. Circ Cardiovasc Imaging 2014; 8(1). pii: e000878.
221. Ploegstra MJ, Douwes JM, Roofthooft MT, et al. Identification of treatment goals in paediatric pulmonary arterial hypertension. Eur Respir J. 2014 Dec; 44(6): 1616 - 26. doi: 10.1183/09031936.00030414. Epub 2014 Jul 17.
222. Masuyama T, Kodama K, Kitabatake A, et al. Continuous-wave Doppler echocardiographic detection of pulmonary regurgitation and its application to noninvasive estimation of pulmonary artery pressure. Circulation. 1986 Sep; 74(3): 484 - 92. doi: 10.1161/01.cir.74.3.484.
223. Lammers AE, Apitz C, Michel-Behnke I, et al. A guide to echocardiographic assessment in children and adolescents with pulmonary hypertension. Cardiovasc Diagn Ther. 2021 Aug; 11(4): 1160 - 1177. doi: 10.21037/cdt-21-119.
224. Chen L, Larsen CM, Le RJ, et al. The prognostic significance of tricuspid valve regurgitation in pulmonary arterial hypertension. Clin Respir J. 2018 Apr; 12(4): 1572 - 1580. doi: 10.1111/crj.12713. Epub 2017 Nov 8.
225. Masuyama T, Uematsu M, Sato H, et al. Pulmonary arterial end-diastolic pressure noninvasively estimated by continuous wave Doppler echocardiography]. J Cardiogr. 1986 Sep; 16(3): 669 - 75. Japanese.
226. Greiner S, Jud A, Aurich M, et al. Reliability of noninvasive assessment of systolic pulmonary artery pressure by Doppler echocardiography compared to right heart catheterization: analysis in a large patient population. J Am Heart Assoc. 2014 Aug 21; 3(4): e001103. doi: 10.1161/JAHA.114.001103.
227. Parasuraman S, Walker S, Loudon BL, et al. Assessment of pulmonary artery pressure by echocardiography-A comprehensive review. Int J Cardiol Heart Vasc. 2016 Jul 4; 12: 45 - 51. doi: 10.1016/j.ijcha.2016.05.011.
228. Sohail A, Korejo HB, Shaikh AS, et al. Correlation between Echocardiography and Cardiac Catheterization for the Assessment of Pulmonary Hypertension in Pediatric Patients. Cureus. 2019 Aug 29; 11(8): e5511. doi: 10.7759/cureus.5511.
229. Koestenberger M, Avian A, Sallmon H, et al. The right ventricular outflow tract in pediatric pulmonary hypertension-Data from the European Pediatric Pulmonary Vascular Disease Network. Echocardiography. 2018 Jun; 35(6): 841 - 848. doi: 10.1111/echo.13852. Epub 2018 Mar 5.
230. Koestenberger M, Nagel B, Ravekes W, et al. Reference values and calculation of z-scores of echocardiographic measurements of the normal pediatric right ventricle. Am J Cardiol. 2014 Nov 15; 114(10): 1590 - 8. doi: 10.1016/j.amjcard.2014.08.028. Epub 2014 Aug 27. Erratum in: Am J Cardiol. 2016 Jan 15; 117(2): 317.
231. Koestenberger M, Avian A, Chouvarine P, et al. Right ventricular end-systolic remodeling index in the assessment of pediatric pulmonary arterial hypertension. The European Pediatric Pulmonary Vascular Disease Network (EPPVDN). Pediatr Res. 2020 Aug; 88(2): 285 - 292. doi: 10.1038/s41390-020-0748-2. Epub 2020 Jan 10.
232. Forfia PR, Fisher MR, Mathai SC, et al. Tricuspid annular displacement predicts survival in pulmonary hypertension. Am J Respir Crit Care Med 2006; 174: 1034 - 41.
233. Koestenberger M, Avian A, Cantinotti M, et al. Tricuspid annular plane systolic excursion (TAPSE) in pediatric pulmonary hypertension: Integrating right ventricular ejection efficiency (RVEe) into advanced multi-parametric imaging. Int J Cardiol. 2019 Jan 1; 274: 296 - 298. doi: 10.1016/j.ijcard.2018.07.013.
234. Koestenberger M, Ravekes W, Everett AD, et al. Right ventricular function in infants, children and adolescents: reference values of the tricuspid annular plane systolic excursion (TAPSE) in 640 healthy patients and calculation of z score values. J Am Soc Echocardiogr. 2009 Jun; 22(6): 715 - 9. doi: 10.1016/j.echo.2009.03.026.
235. Kurath-Koller S, Avian A, Cantinotti M, et al. Normal Pediatric Values of the Subcostal Tricuspid Annular Plane Systolic Excursion (S-TAPSE) and Its Value in Pediatric Pulmonary Hypertension. Can J Cardiol. 2019 Jul; 35(7): 899 - 906. doi: 10.1016/j.cjca.2019.01.019.
236. Hasan H, Chouvarine P, Diekmann F, et al. Validation of the new paediatric pulmonary hypertension risk score by CMR and speckle tracking echocardiography. Eur J Clin Invest. 2022 Jul 17: e13835. doi: 10.1111/eci.13835.
237. Puwanant S, Park M,  ZB, et al. Ventricular geometry, strain, and rotational mechanics in pulmonary hypertension. Circulation 2010; 121: 259 - 66.
ZB, et al. Ventricular geometry, strain, and rotational mechanics in pulmonary hypertension. Circulation 2010; 121: 259 - 66.
238. Grapsa J, O'Regan DP, Vitarelli A, et al. Three-dimensional echocardiography and 2D-3D speckle-tracking imaging in chronic pulmonary hypertension: diagnostic accuracy in detecting hemodynamic signs of right ventricular (RV) failure. J Am Heart Assoc. 2015 Mar 19; 4(3): e001584. doi: 10.1161/JAHA.114.001584.
239. Pavlopoulos H, et al. Right ventricular remodeling inpulmonary arterial hypertension with three-dimensional echocardiography: comparison with cardiac magnetic resonance imaging. Eur J Echocardiogr 2010; 11: 64 - 73.
240. Lu X, Nadvoretskiy V, Bu L, et al. Accuracy and reproducibility of real-time three-dimensional echocardiography for assessment of right ventricular volumes and ejection fraction in children. J Am Soc Echocardiogr 2008; 21: 84 - 9.
241. Alsoos F, Almobarak M, Shebli H. Right ventricular outflow tract systolic excursion: a useful method for determining right ventricular systolic function. J Echocardiogr. 2014 Dec; 12(4): 151 - 8. doi: 10.1007/s12574-014-0229-x. Epub 2014 Nov 6.
242. Koestenberger M, Ravekes W, Nagel B, et al. Reference values of the right ventricular outflow tract systolic excursion in 711 healthy children and calculation of z-score values. Eur Heart J Cardiovasc Imaging. 2014 Sep; 15(9): 980 - 6. doi: 10.1093/ehjci/jeu041. Epub 2014 Mar 23.
243. Sarnari R, Kamal RY, Friedberg MK, et al. Doppler assessment of the ratio of the systolic to diastolic duration in normal children: relation to heart rate, age and body surface area. J Am Soc Echocardiogr. 2009 Aug; 22(8): 928 - 32. doi: 10.1016/j.echo.2009.05.004. Epub 2009 Jun 23.
244. Alkon J, Humpl T, Manlhiot C, et al. Usefulness of the right ventricular systolic to diastolic duration ratio to predict functional capacity and survival in children with pulmonary arterial hypertension. Am J Cardiol. 2010 Aug 1; 106(3): 430 - 6. doi: 10.1016/j.amjcard.2010.03.048. Epub 2010 Jun 18.
245. Lammers AE, Haworth SG, Riley G, et al. Value of tissue Doppler echocardiography in children with pulmonary hypertension. J Am Soc Echocardiogr 2012; 25: 504 - 10.
246. Koestenberger M, Nagel B, Ravekes W, A et al. Tricuspid annular peak systolic velocity (S') in children and young adults with pulmonary artery hypertension secondary to congenital heart diseases, and in those with repaired tetralogy of Fallot: echocardiography and MRI data. J Am Soc Echocardiogr. 2012 Oct; 25(10): 1041 - 9. doi: 10.1016/j.echo.2012.06.004.
247. Takatsuki S, Nakayama T, Jone PN, et al. Tissue Doppler imaging predicts adverse outcome in children with idiopathic pulmonary arterial hypertension. J Pediatr 2012; 161: 1126 - 31.
248. Wang YC, Huang CH, Tu YK. Pulmonary Hypertension and Pulmonary Artery Acceleration Time: A Systematic Review and Meta-Analysis. J Am Soc Echocardiogr. 2018 Feb; 31(2): 201 - 210. e3. doi: 10.1016/j.echo.2017.10.016.
249. Gaulton JS, Mercer-Rosa LM, Glatz AC, et al. Relationship between pulmonary artery acceleration time and pulmonary artery pressures in infants. Echocardiography. 2019 Aug; 36(8): 1524 - 1531. doi: 10.1111/echo.14430. Epub 2019 Jul 1.
250. Levy PT, Patel MD, Groh G, Choudhry S, et al. Pulmonary Artery Acceleration Time Provides a Reliable Estimate of Invasive Pulmonary Hemodynamics in Children. J Am Soc Echocardiogr. 2016 Nov; 29(11): 1056 - 1065. doi: 10.1016/j.echo.2016.08.013.
251. Koestenberger M, Burmas A, Ravekes W, et al. Echocardiographic Reference Values for Right Atrial Size in Children with and without Atrial Septal Defects or Pulmonary Hypertension. Pediatr Cardiol. 2016 Apr; 37(4): 686 - 95. doi: 10.1007/s00246-015-1332-0. Epub 2015 Dec 26.
252. Patel SG, Woolman P, Li L, et al. Relation of Right Atrial Volume, Systemic Venous Dimensions, and Flow Patterns to Right Atrial Pressure in Infants and Children. Am J Cardiol. 2017 May 1; 119(9): 1473 - 1478. doi: 10.1016/j.amjcard.2017.01.013. Epub 2017 Feb 10.
253. Schweintzger S, Kurath-Koller S, Burmas A, et al. Normal Echocardiographic Reference Values of the Right Ventricular to Left Ventricular Endsystolic Diameter Ratio and the Left Ventricular Endsystolic Eccentricity Index in Healthy Children and in Children With Pulmonary Hypertension. Front Cardiovasc Med. 2022 Jul 14; 9: 950765. doi: 10.3389/fcvm.2022.950765.
254. Zeng WJ, Sun YJ, Xiong CM, et al. Prognostic value of echocardiographic right/left ventricular end-diastolic diameter ratio in idiopathic pulmonary arterial hypertension. Chin Med J (Engl). 2011 Jun; 124(11): 1672 - 7.
255. Jone PN, Hinzman J, Wagner BD, et al. Right ventricular to left ventricular diameter ratio at end-systole in evaluating outcomes in children with pulmonary hypertension. J Am Soc Echocardiogr 2014; 27: 172 - 8
256. Koestenberger M, Sallmon H, Avian A, et al. Ventricular-ventricular interaction variables correlate with surrogate variables of clinical outcome in children with pulmonary hypertension. Pulm Circ. 2019 Apr - Jun; 9(2): 2045894019854074. doi: 10.1177/2045894019854074.
257. Lammers AE, Marek J, Diller GP, et al. Prognostic Value of Transthoracic Echocardiography in Children With Pulmonary Arterial Hypertension. J Am Heart Assoc. 2023; 12(6): e023118.
258. Kim BS, Heo R, Shin J, et al. E/E' and D-shaped left ventricle severity in patients with increased pulmonary artery pressure. J Cardiovasc Imaging 2018; 26: 85 - 92.
259. Kassem E, Humpl T, Friedberg MK. Prognostic significance of 2-dimensional, M-mode, and Doppler echo indices of right ventricular function in children with pulmonary arterial hypertension. Am Heart J 2013; 165: 1024 - 1031.
260. Burkett DA, Slorach C, Patel SS, et al. Impact of Pulmonary Hemodynamics and Ventricular Interdependence on Left Ventricular Diastolic Function in Children With Pulmonary Hypertension. Circ Cardiovasc Imaging. 2016 Sep; 9(9): 10.1161/CIRCIMAGING.116.004612 e004612. doi: 10.1161/CIRCIMAGING.116.004612.
261. Apitz C, Hansmann G, Schranz D. Hemodynamic assessment and acute pulmonary vasoreactivity testing in the evaluation of children with pulmonary vascular disease. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and DGPK. Heart. 2016 May; 102 Suppl 2: ii23 - 9. doi: 10.1136/heartjnl-2014-307340.
262. Zuckerman WA, Turner ME, Kerstein J, et al. Safety of cardiac catheterization at a center specializing in the care of patients with pulmonary arterial hypertension. Pulm Circ. 2013 Dec; 3(4): 831 - 9
263. O'Byrne ML, Glatz AC, Shinohara RT, et al. Effect of center catheterization volume on risk of catastrophic adverse event after cardiac catheterization in children. Am Heart J. 2015 Jun; 169(6): 823 - 832.
264. O'Byrne ML, Kennedy KF, Kanter JP, et al. Risk Factors for Major Early Adverse Events Related to Cardiac Catheterization in Children and Young Adults With Pulmonary Hypertension: An Analysis of Data From the IMPACT (Improving Adult and Congenital Treatment) Registry. J Am Heart Assoc. 2018 Feb 28; 7(5).
265. Hansmann G, Apitz C. The Need for Comprehensive Cardiac Catheterization in Children With Pulmonary Hypertension. J Am Coll Cardiol. 2016 Mar 1; 67(8): 1009 - 10
266. Kaestner M, Apitz C, Lammers AE. Cardiac catheterization in pediatric pulmonary hypertension: a systematic and practical approach. Cardiovasc Diagn Ther. 2021 Aug; 11(4): 1102 - 1110. doi: 10.21037/cdt-20-395.
267. Соболев А.В., Шмальц А.А. Катетеризация сердца и ангиокардиография. В кн.: Горбачевский С.В., Шмальц А.А. (ред.) Диагностика легочной гипертензии при врожденных пороках сердца. М.: ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" МЗ РФ; 2023: 68 - 83.
268. Шмальц А.А., Мартынюк Т.В., Наконечников С.Н. Расчет гемодинамики методом Фика при легочной гипертензии, ассоциированной с врожденными пороками сердца. Евразийский кардиологический журнал. 2022; (2): 96 - 102, https://doi.org/10.38109/2225-1685-2022-2-96-102
269. Beghetti M, Schulze-Neick I, Berger RM, et al. TOPP Investigators. Haemodynamic characterisation and heart catheterisation complications in children with pulmonary hypertension: Insights from the Global TOPP Registry (tracking outcomes and practice in paediatric pulmonary hypertension). Int J Cardiol. 2016 Jan 15; 203: 325 - 30. doi: 10.1016/j.ijcard.2015.10.087.
270. Del Cerro MJ, Moledina S, Haworth SG, et al. Cardiac catheterization in children with pulmonary hypertensive vascular disease: consensus statement from the Pulmonary Vascular Research Institute, Pediatric and Congenital Heart Disease Task Forces. Pulm Circ. 2016 Mar; 6(1): 118 - 25. doi: 10.1086/685102.
271. Rosenzweig EB, Bates A, Mullen MP, et al. Cardiac Catheterization and Hemodynamics in a Multicenter Cohort of Children with Pulmonary Hypertension. Ann Am Thorac Soc. 2022 Jun; 19(6): 1000 - 1012. doi: 10.1513/AnnalsATS.202108-998OC.
272. Apitz C, Berger RMF, Ivy DD, et al. Hemodynamic and prognostic impact of the diastolic pulmonary arterial pressure in children with pulmonary arterial hypertension-a registry-based analysis. Cardiovasc Diagn Ther. 2021 Aug; 11(4): 1037 - 1047. doi: 10.21037/cdt-20-934.
273. Barst RJ. Pharmacologically induced pulmonary vasodilatation in children and young adults with primary pulmonary hypertension. Chest. 1986 Apr; 89(4): 497 - 503. doi: 10.1378/chest.89.4.497.
274. Caicedo L, Hopper RK, Garcia H. et al. EXPRESS: Acute Vasoreactivity Testing in Pediatric Idiopathic Pulmonary Arterial Hypertension: an international Survey on Current Practice. Pulm Circ. 2019 May 30; 9(4): 2045894019857533. doi: 10.1177/2045894019857533
275. Barst RJ, Agnoletti G, Fraisse A, Baldassarre J, Wessel DL, For the NO Diagnostic Study Group. Vasodilator Testing with Nitric Oxide and/or Oxygen in Pediatric Pulmonary Hypertension. Pediatr Cardiol. 2010 Jul 1; 31(5): 598 - 606.
276. Шмальц А.А., Горбачевский С.В. Тест на вазореактивность. В кн.: Горбачевский С.В., Шмальц А.А. (ред.) Диагностика легочной гипертензии при врожденных пороках сердца. М.: ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" МЗ РФ; 2023: 99 - 108.
277. Zhang D, Zhu X, Meng J, et al. Acute hemodynamic responses to adenosine and iloprost in patients with congenital heart defects and severe pulmonary arterial hypertension. Int J Cardiol. 2011 Mar 17; 147(3): 433 - 7.
278. Li Q, Dimopoulos K, Zhang C, et al. Acute Effect of Inhaled Iloprost in Children with Pulmonary Arterial Hypertension Associated with Simple Congenital Heart Defects. Pediatr Cardiol. 2018 Apr; 39(4): 757 - 762.
279.  A, Torrent-Vernetta A, de Mir Messa I, et al. Use of inhaled iloprost in children with pulmonary hypertension. Pediatr Pulmonol. 2015 Apr; 50(4): 370 - 9. doi: 10.1002/ppul.23044. Epub 2014 Apr 11.
A, Torrent-Vernetta A, de Mir Messa I, et al. Use of inhaled iloprost in children with pulmonary hypertension. Pediatr Pulmonol. 2015 Apr; 50(4): 370 - 9. doi: 10.1002/ppul.23044. Epub 2014 Apr 11.
280. Douwes JM, Humpl T, Bonnet D, et al. TOPP Investigators. Acute Vasodilator Response in Pediatric Pulmonary Arterial Hypertension: Current Clinical Practice From the TOPP Registry. J Am Coll Cardiol. 2016 Mar 22; 67(11): 1312 - 23. doi: 10.1016/j.jacc.2016.01.015.
281. Caicedo L, Hopper RK, Garcia H, et al. EXPRESS: Acute Vasoreactivity Testing in Pediatric Idiopathic Pulmonary Arterial Hypertension: an international Survey on Current Practice. Pulm Circ. 2019; 9(4): 2045894019857533. doi:10.1177/2045894019857533
282. Beghetti M, ![]() N, Bonnet D. Can "Inoperable" Congenital Heart Defects Become Operable in Patients with Pulmonary Arterial Hypertension? Dream or Reality? Congenit Heart Dis 2012; 7(1): 3 - 11.
N, Bonnet D. Can "Inoperable" Congenital Heart Defects Become Operable in Patients with Pulmonary Arterial Hypertension? Dream or Reality? Congenit Heart Dis 2012; 7(1): 3 - 11.
283. Lopes AA, Thomaz AM. When to Operate on Pediatric Patients with Congenital Heart Disease and Pulmonary Hypertension. Arq Bras Cardiol. 2017 Sep; 109(3): 183 - 184.
284. Lopes AA, Barst RJ, Haworth SG, et al. Repair of congenital heart disease with associated pulmonary hypertension in children: what are the minimal investigative procedures? Consensus statement from the Congenital Heart Disease and Pediatric Task Forces, Pulmonary Vascular Research Institute (PVRI). Pulm Circ. 2014 Jun; 4(2): 330 - 41. doi: 10.1086/675995.
285. Oliveira EC, Ribeiro ALP, Amaral CFS. Adenosine for vasoreactivity testing in pulmonary hypertension: A head-to-head comparison with inhaled nitric oxide. Respir Med. 2010 Apr 1; 104(4): 606 - 11.
286. Mullen MP. Diagnostic strategies for acute presentation of pulmonary hypertension in children: particular focus on use of echocardiography, cardiac catheterization, magnetic resonance imaging, chest computed tomography, and lung biopsy. Pediatr Crit Care Med. 2010; 11(2 Suppl): S23 - S26.
287. Beerbaum P, Apitz C, Hansmann G, et al. Cardiac MR and CT imaging in children with suspected or confirmed pulmonary hypertension/pulmonary hypertensive vascular disease. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and DGPK. Heart. 2016 May; 102 Suppl 2: ii30 - 5. doi: 10.1136/heartjnl-2015-308246.
288. Kiely DG, Levin D, Hassoun P, et al. XPRESS: Statement on imaging and pulmonary hypertension from the Pulmonary Vascular Research Institute (PVRI). Pulm Circ. 2019 Mar 18; 9(3): 2045894019841990. doi: 10.1177/2045894019841990
289. Chen SJ, Huang JH, Lee WJ, et al. Diagnosis of Pulmonary Arterial Hypertension in Children by Using Cardiac Computed Tomography. Korean J Radiol. 2019; 20(6): 976 - 984. doi: 10.3348/kjr.2018.0673.
290. Shih TT, Wu MH, Li YW. Trends in the utilization of computed tomography and cardiac catheterization among children with congenital heart disease. J Formos Med Assoc. 2015 Nov; 114(11): 1061 - 8. doi: 10.1016/j.jfma.2014.08.004. Epub 2014 Sep 18.
291. Oda S, Kidoh M, Nagayama Y, et al. Non-Invasive Imaging in Pulmonary Hypertension - Comprehensive Assessment Using Dual-Layer Spectral Computed Tomography. Circ J. 2021 Feb 25; 85(3): 316. doi: 10.1253/circj.CJ-20-1007. Epub 2021 Jan 30.
292. Corson N, Armato SG 3rd, Labby ZE, et al. CT-based pulmonary artery measurements for the assessment of pulmonary hypertension. Acad Radiol. 2014 Apr; 21(4): 523 - 30. doi: 10.1016/j.acra.2013.12.015.
293.  P, Compton G, Humpl T, et al. Pulmonary arterial hypertension in children: diagnosis using ratio of main pulmonary artery to ascending aorta diameter as determined by multi-detector computed tomography. Pediatr Radiol 2016; 46: 1378 - 83
P, Compton G, Humpl T, et al. Pulmonary arterial hypertension in children: diagnosis using ratio of main pulmonary artery to ascending aorta diameter as determined by multi-detector computed tomography. Pediatr Radiol 2016; 46: 1378 - 83
294. Compton GL, Florence J, MacDonald C, Yoo SJ, Humpl T, Manson D. Main pulmonary artery-to ascending aorta diameter ratio in healthy children on MDCT. AJR Am J Roentgenol 2015; 205
295. Lee EY, Tse SK, Zurakowski D, et al. Children suspected of having pulmonary embolism: multidetector CT pulmonary angiography: thromboembolic risk factors and implications for appropriate use. Radiology. 2012; 262: 242 - 251. doi: 10.1148/radiol.11111056.
296. Albricker ACL, Freire CMV, Santos SND, et al. Joint Guideline on Venous Thromboembolism - 2022. Arq Bras Cardiol. 2022 Jun 10; 118(6): 1153. doi: 10.36660/abc.20220213
297. Bajc M, Neilly JB, Miniati M, et al. EANM guidelines for ventilation/perfusion scintigraphy: Part 2. Algorithms and clinical considerations for diagnosis of pulmonary emboli with V/P(SPECT) and MDCT. Eur J Nucl Med Mol Imaging. 2009; 36(9): 1528 - 1538.
298. Alabed S, Shahin Y, Garg P, et al. Cardiac-MRI Predicts Clinical Worsening and Mortality in Pulmonary Arterial Hypertension: A Systematic Review and Meta-Analysis. JACC Cardiovasc Imaging. 2021 May; 14(5): 931 - 942. doi: 10.1016/j.jcmg.2020.08.013. Epub 2020 Sep 30. Erratum in: JACC Cardiovasc Imaging. 2021 Apr; 14(4): 884.
299.  M, Ivy DD, Barker AJ, Kheyfets V, Shandas R, Abman SH, Hunter KS, Truong U. Characterization of CMR-derived haemodynamic data in children with pulmonary arterial hypertension. Eur Heart J Cardiovasc Imaging 2017; 18: 424 - 431.
M, Ivy DD, Barker AJ, Kheyfets V, Shandas R, Abman SH, Hunter KS, Truong U. Characterization of CMR-derived haemodynamic data in children with pulmonary arterial hypertension. Eur Heart J Cardiovasc Imaging 2017; 18: 424 - 431.
300. Blalock S, Chan F, Rosenthal D, et al. Magnetic resonance imaging of the right ventricle in pediatric pulmonary arterial hypertension. Pulm Circ 2013; 3: 350 - 5.
301. Freed BH, Gomberg-Maitland M, Chandra S, et al. Late gadolinium enhancement cardiovascular magnetic resonance predicts clinical worsening in patients with pulmonary hypertension. J Cardiovasc Magn Reson 2012; 14:
302. Moledina S, Pandya B, Bartsota M, et al. Prognostic significance of cardiac magnetic resonance imaging in children with pulmonary hypertension. Circ Cardiovasc Imaging. 2013; 6(3): 407 - 414. doi:10.1161/CIRCIMAGING.112.000082
303. Truong U, Patel S, Kheyfets V, et al. Non-invasive determination by cardiovascular magnetic resonance of right ventricular-vascular coupling in children and adolescents with pulmonary hypertension. J Cardiovasc Magn Reson. 2015 Sep 16; 17(1): 81. doi: 10.1186/s12968-015-0186-1.
304.  M, Truong U, Browne LP, et al. Measuring flow hemodynamic indices and oxygen consumption in children with pulmonary hypertension: a comparison of catheterization and phase-contrast MRI. Pediatr Cardiol 2018; 39: 268 - 274.
M, Truong U, Browne LP, et al. Measuring flow hemodynamic indices and oxygen consumption in children with pulmonary hypertension: a comparison of catheterization and phase-contrast MRI. Pediatr Cardiol 2018; 39: 268 - 274.
305. Crowe LA, Genecand L, Hachulla AL, et al. Non-Invasive Cardiac Output Determination Using Magnetic Resonance Imaging and Thermodilution in Pulmonary Hypertension. J Clin Med. 2022 May 11; 11(10): 2717. doi: 10.3390/jcm11102717.
306. Ring AM, Carlens J, Bush A, et al. Pulmonary function testing in children's interstitial lung disease. Eur Respir Rev. 2020 Jul 21; 29(157): 200019. doi: 10.1183/16000617.0019-2020.
307. Ivy DD, Doran AK, Smith KJ, et al. Short- and long-term effects of inhaled iloprost therapy in children with pulmonary arterial hypertension. J Am Coll Cardiol. 2008; 51(2): 161 - 169. doi:10.1016/j.jacc.2007.09.031.
308. Sibarani CR, Walter LM, Davey MJ, et al. Sleep-disordered breathing and sleep macro-and micro-architecture in children with Down syndrome. Pediatr Res. 2022 Apr; 91(5): 1248 - 1256. doi: 10.1038/s41390-021-01642-z.
309. Wise MS, Nichols CD, Grigg-Damberger MM, et al. Executive summary of respiratory indications for polysomnography in children: an evidence-based review. Sleep. 2011; 34(3): 389 - 98AW. doi: 10.1093/sleep/34.3.389
310. Pogemiller JE, Kulik TJ, Casey AM, et al. Lung Pathology in Pediatric Pulmonary Vein Stenosis. Pediatr Dev Pathol. 2016 May - Jun; 19(3): 219 - 29. doi: 10.2350/15-07-1670-OA.1. Epub 2015 Oct 12.
311. Mylius CF, Paap D, Takken T. Reference value for the 6-minute walk test in children and adolescents: a systematic review. Expert Rev Respir Med. 2016 Dec; 10(12): 1335 - 1352. doi: 10.1080/17476348.2016.1258305
312. Douwes JM, Hegeman AK, van der Krieke MB, et al. Six-minute walking distance and decrease in oxygen saturation during the six-minute walk test in pediatric pulmonary arterial hypertension. Int J Cardiol. 2016; 202: 34 - 39. doi:10.1016/j.ijcard.2015.08.155
313. Atasayan V, Canbeyli F,  FS, et al. Prognostic value of oxygen saturation and heart rate during a six-minute walk test in pediatric pulmonary hypertension. Turk J Med Sci. 2021 Aug 30; 51(4): 1833 - 1840. doi: 10.3906/sag-2004-220.
FS, et al. Prognostic value of oxygen saturation and heart rate during a six-minute walk test in pediatric pulmonary hypertension. Turk J Med Sci. 2021 Aug 30; 51(4): 1833 - 1840. doi: 10.3906/sag-2004-220.
314. Patel SS, Fernie JC, Taylor AL, et al. Evaluation of predictive models for six minute walk test among children with pulmonary hypertension. Int J Cardiol. 2017 Jan 15; 227: 393 - 398. doi: 10.1016/j.ijcard.2016.11.042.
315. Lammers AE, Diller GP, Odendaal D, et al. Comparison of 6-min walk test distance and cardiopulmonary exercise test performance in children with pulmonary hypertension. Arch Dis Child 2011; 96: 141 - 147.
316. Ploegstra MJ, Berger RMF. Prognostic biomarkers in pediatric pulmonary arterial hypertension. Cardiovasc Diagn Ther. 2021 Aug; 11(4): 1089 - 1101. doi: 10.21037/cdt-20-374.
317. Balkin EM, Steurer MA, Delagnes EA, et al. Multicenter mortality and morbidity associated with pulmonary hypertension in the pediatric intensive care unit. Pulm Circ. 2018 Jan - Mar; 8(1): 2045893217745785. doi: 10.1177/2045893217745785. Epub 2017 Dec 18.
318. Ablonczy L, Ferenci T,  O, et al. Prognostic Value of Early Risk Stratification in Pediatric Pulmonary Arterial Hypertension. Transplant Proc. 2021 Jun; 53(5): 1439 - 1442. doi: 10.1016/j.transproceed.2021.01.047.
O, et al. Prognostic Value of Early Risk Stratification in Pediatric Pulmonary Arterial Hypertension. Transplant Proc. 2021 Jun; 53(5): 1439 - 1442. doi: 10.1016/j.transproceed.2021.01.047.
319. Haarman MG, Douwes JM, Ploegstra MJ, et al. The Clinical Value of Proposed Risk Stratification Tools in Pediatric Pulmonary Arterial Hypertension. Am J Respir Crit Care Med. 2019 Nov 15; 200(10): 1312 - 1315. doi: 10.1164/rccm.201902-0266LE.
320. Kam CW, Ruiz FE. Opportunities and challenges of pharmacotherapy for pulmonary arterial hypertension in children. Pediatr Pulmonol. 2021 Mar; 56(3): 593 - 613. doi: 10.1002/ppul.25101.
321.  E, Eichstaedt C,
E, Eichstaedt C,  JA, et al. ERS statement on exercise training and rehabilitation in patients with severe chronic pulmonary hypertension. Eur Respir J. 2019 Feb 28; 53(2): 1800332. doi: 10.1183/13993003.00332-2018.
JA, et al. ERS statement on exercise training and rehabilitation in patients with severe chronic pulmonary hypertension. Eur Respir J. 2019 Feb 28; 53(2): 1800332. doi: 10.1183/13993003.00332-2018.
322. Boutou AK, Dipla K, Zafeiridis A, Markopoulou A, Papadopoulos S, Kritikou S, Panagiotidou E, Stanopoulos I, Pitsiou G. A randomized placebo-control trial of the acute effects of oxygen supplementation on exercise hemodynamics, autonomic modulation, and brain oxygenation in patients with pulmonary hypertension. Respir Physiol Neurobiol. 2021 Aug; 290:103677. doi: 10.1016/j.resp.2021.103677.
323. Twite MD, Friesen RH. The anesthetic management of children with pulmonary hypertension in the cardiac catheterization laboratory. Anesthesiol Clin. 2014 Mar; 32(1): 157 - 73. doi: 10.1016/j.anclin.2013.10.005. Epub 2013 Dec 17.
324. Li Q, Zhang C, Wang R, et al. Pulmonary hypertensive crisis in children with pulmonary arterial hypertension undergoing cardiac catheterization. Pulm Circ. 2022 Apr 18; 12(2): e12067. doi: 10.1002/pul2.12067.
325. Mirsaeidi M, Ebrahimi G, Allen MB, et al. Pneumococcal vaccine and patients with pulmonary diseases. Am J Med. 2014 Sep; 127(9): 886.e1 - 8. doi: 10.1016/j.amjmed.2014.05.010.
326. Arif R, Pandey A, Zhao Y, et al. Treatment of pulmonary hypertension associated with COPD: a systematic review. ERJ Open Res. 2022 Feb 21; 8(1): 00348 - 2021. doi: 10.1183/23120541.00348-2021.
327. Шмальц А.А., Черногривов И.Е. Неспецифическая терапия синдрома Эйзенменгера. Евразийский кардиологический журнал. 2024; (2): 122 - 131. https://doi.org/10.38109/2225-1685-2024-2-122-131.
328. Rosenzweig EB, Gannon WD, Madahar P, et al. Extracorporeal life support bridge for pulmonary hypertension: A high-volume single-center experience. J Heart Lung Transplant. 2019 Dec; 38(12): 1275 - 1285. doi: 10.1016/j.healun.2019.09.004.
329. Furfaro D, Rosenzweig EB, Shah L, et al. Lung transplantation disparities based on diagnosis for patients bridging to transplant on extracorporeal membrane oxygenation. J Heart Lung Transplant. 2021 Dec; 40(12): 1641 - 1648. doi: 10.1016/j.healun.2021.08.005.
330. Chen SH, Chen LK, Teng TH, et al. Comparison of inhaled nitric oxide with aerosolized prostacyclin or analogues for the postoperative management of pulmonary hypertension: a systematic review and meta-analysis. Ann Med. 2020 May - Jun; 52(3-4): 120 - 130. doi: 10.1080/07853890.2020.1746826.
331. Signori D, Magliocca A, Hayashida K, et al. Inhaled nitric oxide: role in the pathophysiology of cardio-cerebrovascular and respiratory diseases. Intensive Care Med Exp. 2022 Jun 27; 10(1): 28. doi: 10.1186/s40635-022-00455-6.
332. Dillard J, Pavlek LR, Korada S, et al. Worsened short-term clinical outcomes in a cohort of patients with iNO-unresponsive PPHN: a case for improving iNO responsiveness. J Perinatol. 2022 Jan; 42(1): 37 - 44. doi: 10.1038/s41372-021-01228-x.
333. Barrington KJ, Finer N, Pennaforte T, et al. Nitric oxide for respiratory failure in infants born at or near term. Cochrane Database Syst Rev 2017; 1: CD000399
334. Baczynski M, Ginty S, Weisz DE, McNamara PJ, Kelly E, Shah P, Jain A. Short-term and long-term outcomes of preterm neonates with acute severe pulmonary hypertension following rescue treatment with inhaled nitric oxide. Arch Dis Child Fetal Neonatal Ed. 2017 Nov; 102(6): F508 - F514. doi: 10.1136/archdischild-2016-312409
335. Rallis D, Deierl A, Atreja G, et al. The efficacy of inhaled nitric oxide treatment in premature infants with acute pulmonary hypertension. Early Hum Dev. 2018; 127: 1-5. doi: 10.1016/j.earlhumdev.2018.09.004.
336. Khan MS, Usman MS, Siddiqi TJ, et al. Is Anticoagulation Beneficial in Pulmonary Arterial Hypertension? Circ Cardiovasc Qual Outcomes. 2018 Sep; 11(9): e004757. doi: 10.1161/CIRCOUTCOMES.118.004757.
337. Wang P, Hu L, Yin Y, et al. Can anticoagulants improve the survival rate for patients with idiopathic pulmonary arterial hypertension? A systematic review and meta-analysis. Thromb Res. 2020 Dec; 196: 251 - 256. doi: 10.1016/j.thromres.2020.08.024.
338. Pelland-Marcotte MC, Humpl T, James PD, et al. Idiopathic pulmonary arterial hypertension - a unrecognized cause of high-shear high-flow haemostatic defects (otherwise referred to as acquired von Willebrand syndrome) in children. Br J Haematol. 2018; 183(2): 267 - 275. doi:10.1111/bjh.15530
339. Hansen L, Burks M, Kingman M, et al. Volume Management in Pulmonary Arterial Hypertension Patients: An Expert Pulmonary Hypertension Clinician Perspective. Pulm Ther. 2018 Jun; 4(1): 13 - 27. doi: 10.1007/s41030-018-0052-z.
340. Yogeswaran A, Richter MJ, Husain-Syed F, et al. Estimated plasma volume status: association with congestion, cardiorenal syndrome and prognosis in precapillary pulmonary hypertension. Front Cardiovasc Med. 2023; 10: 1161041. doi:10.3389/fcvm.2023.1161041
341. Mamazhakypov A, Hein L, Lother A. Mineralocorticoid receptors in pulmonary hypertension and right heart failure: From molecular biology to therapeutic targeting. Pharmacol Ther. 2022 Mar; 231: 107987. doi: 10.1016/j.pharmthera.2021.107987.
342. Safdar Z, Cho E. Effect of spironolactone use in pulmonary arterial hypertension - analysis from pivotal trial databases. Pulm Circ. 2021 Nov 10; 11(4): 20458940211045618. doi: 10.1177/20458940211045618.
343. Maron BA, Waxman AB, Opotowsky AR, et al. Effectiveness of spironolactone plus ambrisentan for treatment of pulmonary arterial hypertension (from the [ARIES] study 1 and 2 trials). Am J Cardiol. 2013 Sep 1; 112(5): 720 - 5. doi: 10.1016/j.amjcard.2013.04.051.
344. Eshtehardi P, Mojadidi M, Khosraviani K, et al. Effect of digoxin on mortality in patients with isolated right ventricular dysfunction secondary to severe pulmonary hypertension. J Am Coll Cardiol. 2014 Apr, 63 (12_Supplement) A750. [https://doi.org/10.1016/S0735-1097(14) 60750-6]
345. Chang KY, Giorgio K, Schmitz K, et al. Effect of Chronic Digoxin Use on Mortality and Heart Failure Hospitalization in Pulmonary Arterial Hypertension. J Am Heart Assoc. 2023; 12(6): e027559. doi: 10.1161/JAHA.122.027559
346. Zelt JGE, Chaudhary KR, Cadete VJ, et al. Medical Therapy for Heart Failure Associated With Pulmonary Hypertension. Circ Res. 2019 May 24; 124(11): 1551 - 1567. doi: 10.1161/CIRCRESAHA.118.313650.
347. Kido K, Coons JC. Efficacy and Safety of the Use of Pulmonary Arterial Hypertension Pharmacotherapy in Patients with Pulmonary Hypertension Secondary to Left Heart Disease: A Systematic Review. Pharmacotherapy. 2019 Sep; 39(9): 929 - 945. doi: 10.1002/phar.2314.
348. Masarone D, Kittleson M, Pollesello P, et al. Use of Levosimendan in Patients with Pulmonary Hypertension: What is the Current Evidence?. Drugs. 2023; 83(3): 195 - 201. doi: 10.1007/s40265-022-01833-w
349. Hirakawa K, Asano R, Ueda J, et al. Calcium channel blockers in patients with pulmonary arterial hypertension receiving PAH-specific treatment. Int J Cardiol. 2024; 406: 132043. doi: 10.1016/j.ijcard.2024.132043
350. Gerhardt F, Fiessler E, Olsson KM, et al. Positive Vasoreactivity Testing in Pulmonary Arterial Hypertension: Therapeutic Consequences, Treatment Patterns, and Outcomes in the Modern Management Era. Circulation. Published online April 12, 2024. doi: 10.1161/CIRCULATIONAHA.122.063821
351. Steffes LC, Austin ED. Upfront Combination Therapy: Growing the Case to Get Ahead of Pediatric Pulmonary Arterial Hypertension. Ann Am Thorac Soc. 2022 Feb; 19(2): 163 - 165. doi: 10.1513/AnnalsATS.202108-975ED.
352. Bogaard HJ, Sitbon O. Initial triple therapy in pulmonary arterial hypertension: coming of age and rejuvenated. Eur Respir J. 2021 Jan 28; 57(1): 2004258. doi: 10.1183/13993003.04258-2020.
353. Zijlstra WMH, Douwes JM, Rosenzweig EB, et al. Survival differences in pediatric pulmonary arterial hypertension: clues to a better understanding of outcome and optimal treatment strategies. J Am Coll Cardiol. 2014 May 27; 63(20): 2159 - 2169. doi: 10.1016/j.jacc.2014.02.575. Epub 2014 Mar 26.
354. Miklashevich I.M., Groznova O.S. The role of endothelin receptor antagonists in the treatment of pulmonary arterial hypertension in children and adults. Pediatria n.a. G.N. Speransky. 2020; 99 (3): 143-155 (In Russ.) Миклашевич И.М., Грознова О.С.. Роль антагонистов рецепторов эндотелина в лечении легочной артериальной гипертензии у детей и взрослых. Педиатрия им. Г.Н. Сперанского. 2020; 99 (3): 143 - 155.
355. Rubin LJ, Badesch DB, Barst RJ, et al. Bosentan therapy for pulmonary arterial hypertension [published correction appears in N Engl J Med 2002 Apr 18; 346(16): 1258]. N Engl J Med. 2002; 346(12): 896 - 903. doi: 10.1056/NEJMoa012212
356. ![]() N, Beghetti M., Gatzoulis M.A., et al. Bosentan Randomized Trial of Endothelin Antagonist Therapy-5 (BREATHE-5) Investigators. Bosentan therapy in patients with Eisenmenger syndrome: a multicenter, double-blind, randomized, placebo-controlled study. Circulation. 2006; 114: 48 - 54. doi.org/10.1161/CIRCULATIONAHA.106.630715.
N, Beghetti M., Gatzoulis M.A., et al. Bosentan Randomized Trial of Endothelin Antagonist Therapy-5 (BREATHE-5) Investigators. Bosentan therapy in patients with Eisenmenger syndrome: a multicenter, double-blind, randomized, placebo-controlled study. Circulation. 2006; 114: 48 - 54. doi.org/10.1161/CIRCULATIONAHA.106.630715.
357. Шмальц А.А., Горбачевский С.В. Доказательная база специфических легочных вазодилататоров у детей с врожденными пороками сердца. Педиатрия. Журнал им. Г.Н. Сперанского. 2017: 96 (6): 126 - 139. doi.org/10.24110/0031-403x-2017-96-6-126-139
358. Simonneau G., ![]() N., Jansa P., et al. Long-term results from the EARLY study of bosentan in WHO functional class II pulmonary arterial hypertension patients. Int J Cardiol. 2014; 172(2): 332 - 9. doi: 10.1016/j.ijcard.2013.12.179.
N., Jansa P., et al. Long-term results from the EARLY study of bosentan in WHO functional class II pulmonary arterial hypertension patients. Int J Cardiol. 2014; 172(2): 332 - 9. doi: 10.1016/j.ijcard.2013.12.179.
359. Murdaca G., Lantieri F., Puppo F. et al. Beneficial effects of long-term treatment with bosentan on the development of pulmonary arterial hypertension in patients with systemic sclerosis. J Int Med Res. 2016; 44: 85 - 89. doi: 10.1177/0300060515593257
360. Barst RJ, Ivy D, Dingemanse J, et al. Pharmacokinetics, safety, and efficacy of bosentan in pediatric patients with pulmonary arterial hypertension. Clin Pharmacol Ther. 2003 Apr; 73(4): 372 - 82. doi: 10.1016/s0009-9236(03) 00005-5.
361. Beghetti M, Haworth SG, Bonnet D, et al. Pharmacokinetic and clinical profile of a novel formulation of bosentan in children with pulmonary arterial hypertension: the FUTURE-1 study. Br J Clin Pharmacol. 2009; 68(6): 948 - 955. doi: 10.1111/j.1365-2125.2009.03532.x.
362. Berger RM, Haworth SG, Bonnet D, et al. FUTURE-2: Results from an open-label, long-term safety and tolerability extension study using the pediatric FormUlation of bosenTan in pUlmonary arterial hypeRtEnsion [published correction appears in Int J Cardiol. 2016 Nov 15; 223: 1072 - 1073]. Int J Cardiol. 2016; 202: 52 - 58. doi: 10.1016/j.ijcard.2015.08.080
363. Berger RMF, Gehin M, Beghetti M, et al. A bosentan pharmacokinetic study to investigate dosing regimens in paediatric patients with pulmonary arterial hypertension: FUTURE-3. Br J Clin Pharmacol. 2017; 83(8): 1734 - 1744. doi: 10.1111/bcp.13267
364. Beghetti M, Hoeper MM, Kiely DG, et al. Safety experience with bosentan in 146 children 2 - 11 years old with pulmonary arterial hypertension: results from the European Postmarketing Surveillance program. Pediatr Res. 2008; 64(2): 200 - 204. doi: 10.1203/PDR.0b013e318179954c
365. Ivy DD, Rosenzweig EB,  JC, Brand M, Rosenberg D, Barst RJ. Long-term outcomes in children with pulmonary arterial hypertension treated with bosentan in real-world clinical settings. Am J Cardiol. 2010; 106(9): 1332 - 1338. doi: 10.1016/j.amjcard.2010.06.064
JC, Brand M, Rosenberg D, Barst RJ. Long-term outcomes in children with pulmonary arterial hypertension treated with bosentan in real-world clinical settings. Am J Cardiol. 2010; 106(9): 1332 - 1338. doi: 10.1016/j.amjcard.2010.06.064
366. Mohamed WA, Ismail M. A randomized, double-blind, placebo-controlled, prospective study of bosentan for the treatment of persistent pulmonary hypertension of the newborn. J Perinatol. 2012; 32(8): 608 - 613. doi: 10.1038/jp.2011.157
367. Steinhorn RH., Fineman J, Kusic-Pajic A, et al. Bosentan as adjunctive therapy for persistent pulmonary hypertension of the newborn: results of the randomized multicenter placebo-controlled exploratory trial. J Pediatr. 2016; 177: 90 - 96. doi: 10.1016/j.jpeds.2016.06.078. Epub 2016 Aug 5.
368. Iversen K., Jensen A. S., Jensen T.V., et al. Combination therapy with bosentan and sildenafil in Eisenmenger syndrome: a randomized, placebo-controlled, double-blinded trial, European Heart Journal. May 2010; 31: 1124 - 1131, https://doi.org/10.1093/eurheartj/ehq011.
369. McLaughlin V., Channick R.N., Ghofrani H.-A., et al. Bosentan added to sildenafil therapy in patients with pulmonary arterial hypertension European Respiratory Journal Aug. 2015; 46 (2): 405 - 413; DOI: 10.1183/13993003.02044-2014.
370. Anhua Wei, Zhichun Gu, Juan Li, et al. Clinical Adverse Effects of Endothelin Receptor Antagonists: Insights From the Meta-Analysis of 4894 Patients From 24 Randomized Double-Blind lacebo-Controlled Clinical Trials. J Am Heart Assoc. 2016; 5: e003896 doi: 10.1161/JAHA.116.003896.
371. Dang ZC, Tang B, Li B, et al. A meta-analysis of the safety and efficacy of bosentan therapy combined with prostacyclin analogues or phosphodiesterase type-5 inhibitors for pulmonary arterial hypertension. Exp Ther Med. 2019; 18(6): 47ff40-4746. doi: 10.3892/etm.2019.8142. Epub 2019 Oct 29.
372. Wei A, Gu Z, Li J, et al. Clinical Adverse Effects of Endothelin Receptor Antagonists: Insights From the Meta-Analysis of 4894 Patients From 24 Randomized Double-Blind Placebo-Controlled Clinical Trials. J Am Heart Assoc. 2016 Oct 26; 5(11): e003896. doi: 10.1161/JAHA.116.003896. - Controlled Clinical Trials. J Am Heart Assoc. 2016; 5: e003896 doi: 10.1161/JAHA.116.003896.
373. Shu T, Chen H, Wang L, et al. The Efficacy and Safety of Pulmonary Vasodilators in Pediatric Pulmonary Hypertension (PH): A Systematic Review and Meta-analysis. Front Pharmacol. 2021 Apr 23; 12: 668902. doi: 10.3389/fphar.2021.668902.
374. Galie N., Olschewski H., Oudiz R.J, et al.; Ambrisentan in Pulmonary Arterial Hypertension, Randomized, Double-Blind, Placebo-Controlled, Multicenter, Efficacy Studies (ARIES) Group. Ambrisentan for the treatment of pulmonary arterial hypertension: results of the Ambrisentan in Pulmonary Arterial Hypertension, Randomized, Double-Blind, Placebo-Controlled, Multicenter, Efficacy (ARIES) study 1 and 2. Circulation. 2008; 117: 3010 - 3019.
375.  JL,
JL, ![]() N,
N,  JA, et al. AMBITION Study Group. Initial combination therapy with ambrisentan + tadalafil on pulmonary arterial hypertension-related hospitalization in the AMBITION trial. J Heart Lung Transplant 2019; 38: 194 - 202; doi.org/10.1016/j.healun.2018.11.006
JA, et al. AMBITION Study Group. Initial combination therapy with ambrisentan + tadalafil on pulmonary arterial hypertension-related hospitalization in the AMBITION trial. J Heart Lung Transplant 2019; 38: 194 - 202; doi.org/10.1016/j.healun.2018.11.006
376. Takatsuki S, Rosenzweig EB, Zuckerman W, et al. Clinical safety, pharmacokinetics, and efficacy of ambrisentan therapy in children with pulmonary arterial hypertension. Pediatr Pulmonol. 2013 Jan; 48(1): 27 - 34. doi: 10.1002/ppul.22555. Epub 2012 Apr 17. Pediatr Pulmonol. 2013 Jan; 48(1): 27 - 34. doi: 10.1002/ppul.22555.
377. Ivy D, Beghetti M, Juaneda-Simian E, et al. A Randomized Study of Safety and Efficacy of Two Doses of Ambrisentan to Treat Pulmonary Arterial Hypertension in Pediatric Patients Aged 8 Years up to 18 Years. J Pediatr X. 2020; 5: 100055. doi: 10.1016/j.ympdx.2020.100055
378. Ivy D, Beghetti M, Juaneda-Simian E, et al. Long-term safety and tolerability of ambrisentan treatment for pediatric patients with pulmonary arterial hypertension: An open-label extension study. Eur J Pediatr. 2024; 183(5): 2141 - 2153. doi: 10.1007/s00431-024-05446-1
379. Issapour A, Frank B, Crook S, et al. Safety and tolerability of combination therapy with ambrisentan and tadalafil for the treatment of pulmonary arterial hypertension in children: Real-world experience. Pediatr Pulmonol. 2022 Mar; 57(3): 724 - 733. doi: 10.1002/ppul.25796.
380. Iglarz M, Binkert C, Morrison K, et al. Pharmacology of Macitentan, an Orally Active Tissue-Targeting Dual Endothelin Receptor Antagonist. Journal of Pharmacology and Experimental Therapeutics. 2008; 327: 736 - 745. doi.org/10.1124/jpet.108.142976.
381. Bolli MH, Boss C, Binker, et al. The discovery of N-[5-(4-bromophenyl)-6-[2-[(5-bromo-2-pyrimidinyl) oxy] ethoxy]-4-pyrimidinyl]-N0-propylsulfamide (macitentan), an orally active, potent dual endothelin receptor antagonist. J Med Chem. 2012; 55: 7849 - 7861. doi: 10.1021/jm3009103. Epub 2012 Aug 16.
382. Pulido T, Adzerikho I, Channick RN, et al. et al. SERAPHIN Investigators. Macitentan and morbidity and mortality in pulmonary arterial hypertension N Engl J Med. 2013 Aug 29; 369(9): 809 - 18. doi: 10.1056/NEJMoa1213917.
383. Gatzoulis MA, Landzberg M, Beghetti M, et al. Efficace M, Gesang S, He J, Papadakis K, Pulido T, ![]() N; MAESTRO Study Investigators. Evaluation of Macitentan in Patients With Eisenmenger Syndrome. Circulation. 2019 Jan 2; 139(1): 51 - 63. doi: 10.1161/CIRCULATIONAHA.118.033575.
N; MAESTRO Study Investigators. Evaluation of Macitentan in Patients With Eisenmenger Syndrome. Circulation. 2019 Jan 2; 139(1): 51 - 63. doi: 10.1161/CIRCULATIONAHA.118.033575.
384. Miklashevich I.М., Groznova O., Melnikova A. Switch from bosentan to macitentan in children and adolescents with pulmonary arterial hypertension during a hospitalization period. 53rd Annual Meeting of the Association for European Paediatric and Congenital Cardiology (AEPC) is organized by Association for European Paediatric and Congenital Cardiology (AEPC). May 15 - 18, 2019. Abstract P-64
385. Miklashevich I.M., Groznova O.S. The first experience with the use of non selective endothelin receptor antagonist macitentan in combination therapy for severe pulmonary arterial hypertension in children. Pediatria n.a. G.N. Speransky. 2020; 99 (3): 43 - 49. (In Russ.) Миклашевич И.М., Грознова О.С. Первый опыт применения неселективного антагониста рецепторов эндотелина мацитентана в комбинированной терапии тяжелой легочной артериальной гипертензии у детей. Педиатрия им. Г.Н. Сперанского. 2020; 99 (3): 43 - 49.
386. Flores M., Caro A.T., Mendoza A. Initial experience in children with the use of macitentan in pulmonary arterial hypertension after side effects with other endothelin receptor antagonists. Progress in Pediatric Cardiology, 2019; Vol. 52: 55 - 56. https://doi.org/10.1016/j.ppedcard.2018.11.004.
387. Aypar E, Alehan D, Karagoz T, et al. Clinical efficacy and safety of switch from bosentan to macitentan in children and young adults with pulmonary arterial hypertension. Cardiol Young. 2018; 28: 542 - 7. doi: 10.1017/S1047951117002542.
388. Albinni S, Heno J, Pavo I, et al. Macitentan in the Young-Mid-term Outcomes of Patients with Pulmonary Hypertensive Vascular Disease treated in a Pediatric Tertiary Care Center. Paediatr Drugs. 2023; 25(4): 467 - 481. doi: 10.1007/s40272-023-00573-y
389. Singh TP, Rohit M, Grover A, et al. A randomized, placebo-controlled, double-blind, crossover study to evaluate the efficacy of oral sildenafil therapy in severe pulmonary artery hypertension. Am Heart J. 2006 Apr; 151(4): 851.e1-5. doi: 10.1016/j.ahj.2005.09.006.
390. Wirostko BM, Tressler C, Hwang LJ, et al. Ocular safety of sildenafil citrate when administered chronically for pulmonary arterial hypertension: results from phase III, randomised, double masked, placebo controlled trial and open label extension. BMJ. 2012 Feb 21; 344: e554. doi: 10.1136/bmj.e554.
391. Barst RJ, Ivy DD, Gaitan G, et al. A randomized, double-blind, placebo-controlled, dose-ranging study of oral sildenafil citrate in treatment-naive children with pulmonary arterial hypertension. Circulation. 2012 Jan 17; 125(2): 324 - 34. doi: 10.1161/CIRCULATIONAHA.110.016667.
392. Barst RJ, Beghetti M, Pulido T, et al. STARTS-2: long-term survival with oral sildenafil monotherapy in treatment-naive pediatric pulmonary arterial hypertension. Circulation. 2014 May 13; 129(19): 1914 - 23. doi: 10.1161/CIRCULATIONAHA.113.005698.
393. Awad AK, Gad ER, Abdelgalil MS, et al. Sildenafil for congenital heart diseases induced pulmonary hypertension, a meta-analysis of randomized controlled trials. BMC Pediatr. 2023 Jul 20; 23(1): 372. doi: 10.1186/s12887-023-04180-1
394. Small D, Ferguson-Sells L, Dahdah N, et al. Pharmacokinetics and safety of tadalafil in a paediatric population with pulmonary arterial hypertension: A multiple ascending-dose study. Br J Clin Pharmacol. 2019 Oct; 85(10): 2302 - 2309. doi: 10.1111/bcp.14039
395. Ivy D, Bonnet D, Berger RMF, et al. Efficacy and safety of tadalafil in a pediatric population with pulmonary arterial hypertension: phase 3 randomized, double-blind placebo-controlled study. Pulm Circ. 2021 Jun 23; 11(3): 20458940211024955. doi: 10.1177/20458940211024955.
396.  E, Ohnesorge J, Benjamin N, et al. Plasma Drug Concentrations in Patients with Pulmonary Arterial Hypertension on Combination Treatment. Respiration. 2017; 94(1): 26 - 37. doi: 10.1159/000470916. Epub 2017 May 12.
E, Ohnesorge J, Benjamin N, et al. Plasma Drug Concentrations in Patients with Pulmonary Arterial Hypertension on Combination Treatment. Respiration. 2017; 94(1): 26 - 37. doi: 10.1159/000470916. Epub 2017 May 12.
397. Yamazaki H, Kobayashi N, Taketsuna M, et al. Safety and effectiveness of tadalafil in pediatric patients with pulmonary arterial hypertension: a sub-group analysis based on Japan post-marketing surveillance. Curr Med Res Opin. 2017 Dec; 33(12): 2241 - 2249. doi: 10.1080/03007995.2017.1354832.
398. Sabri, M., Bigdelian, H., Hosseinzadeh, M., et al. Comparison of the therapeutic effects and side effects of tadalafil and sildenafil after surgery in young infants with pulmonary arterial hypertension due to systemic-to-pulmonary shunts. Cardiology in the Young, 27(9), 1686 - 1693. doi: 10.1017/S1047951117000981
399. Kiskaddon A, Dang T, Mauriello D. Tadalafil in Neonates and Infants With Pulmonary Hypertension Secondary to Bronchopulmonary Dysplasia. J Pediatr Pharmacol Ther. 2024; 29(2): 140 - 143. doi: 10.5863/1551-6776-29.2.140
400. Ghofrani HA, ![]() N, Grimminger F, et al. Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med. 2013 Jul 25; 369(4): 330 - 40. doi: 10.1056/NEJMoa1209655.
N, Grimminger F, et al. Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med. 2013 Jul 25; 369(4): 330 - 40. doi: 10.1056/NEJMoa1209655.
401. Ghofrani HA, Grimminger F,  E, et al. Predictors of long-term outcomes in patients treated with riociguat for pulmonary arterial hypertension: data from the PATENT-2 open-label, randomised, long-term extension trial. Lancet Respir Med. 2016 May; 4(5): 361 - 71. doi: 10.1016/S2213-2600(16) 30019-4.
E, et al. Predictors of long-term outcomes in patients treated with riociguat for pulmonary arterial hypertension: data from the PATENT-2 open-label, randomised, long-term extension trial. Lancet Respir Med. 2016 May; 4(5): 361 - 71. doi: 10.1016/S2213-2600(16) 30019-4.
402. Simonneau G, D'Armini AM, Ghofrani HA, et al. Predictors of long-term outcomes in patients treated with riociguat for chronic thromboembolic pulmonary hypertension: data from the CHEST-2 open-label, randomised, long-term extension trial. Lancet Respir Med. 2016 May; 4(5): 372 - 80. doi: 10.1016/S2213-2600(16) 30022-4.
403. Spreemann T, Bertram H, Happel CM, et al. First-in-child use of the oral soluble guanylate cyclase stimulator riociguat in pulmonary arterial hypertension. Pulm Circ. 2018 Jan-Mar; 8(1): 2045893217743123. doi: 10.1177/2045893217743123.
404. Garcia Aguilar H, Gorenflo M, Ivy DD, et al. Riociguat in children with pulmonary arterial hypertension: The PATENT-CHILD study. Pulm Circ. 2022; 12(3): e12133. Published 2022 Jul 1. doi: 10.1002/pul2.12133.
405. Domingo LT, Ivy DD, Abman SH, et al. Novel use of riociguat in infants with severe pulmonary arterial hypertension unable to wean from inhaled nitric oxide. Front Pediatr. 2022; 10: 1014922. doi: 10.3389/fped.2022.1014922
406. Olschewski H, Simonneau G, ![]() N, et al. Aerosolized Iloprost Randomized Study Group. Inhaled iloprost for severe pulmonary hypertension. N Engl J Med. 2002 Aug 1; 347(5): 322 - 9. doi: 10.1056/NEJMoa020204.
N, et al. Aerosolized Iloprost Randomized Study Group. Inhaled iloprost for severe pulmonary hypertension. N Engl J Med. 2002 Aug 1; 347(5): 322 - 9. doi: 10.1056/NEJMoa020204.
407. McLaughlin VV, Oudiz RJ, Frost A, et al. Randomized study of adding inhaled iloprost to existing bosentan in pulmonary arterial hypertension. Am J Respir Crit Care Med. 2006 Dec 1; 174(11): 1257 - 63. doi: 10.1164/rccm.200603-358OC.
408. Ivy DD, Doran AK, Smith KJ, et al. Short- and long-term effects of inhaled iloprost therapy in children with pulmonary arterial hypertension. J Am Coll Cardiol. 2008 Jan 15; 51(2): 161 - 9. doi: 10.1016/j.jacc.2007.09.031.
409. Li Q, Dimopoulos K, Zhang C, et al. Acute Effect of Inhaled Iloprost in Children with Pulmonary Arterial Hypertension Associated with Simple Congenital Heart Defects. Pediatr Cardiol. 2018 Apr; 39(4): 757 - 762. doi: 10.1007/s00246-018-1818-7.
410. Tissot C, Beghetti M. Review of inhaled iloprost for the control of pulmonary artery hypertension in children. Vasc Health Risk Manag. 2009; 5(1): 325 - 31. doi: 10.2147/vhrm.s3222.
411. Alehan D,  I, Sahin M, et al. Long-term inhaled iloprost use in children with pulmonary arterial hypertension. Cardiol Young. 2012 Aug; 22(4): 396 - 403. doi: 10.1017/S1047951111001843.
I, Sahin M, et al. Long-term inhaled iloprost use in children with pulmonary arterial hypertension. Cardiol Young. 2012 Aug; 22(4): 396 - 403. doi: 10.1017/S1047951111001843.
412. Шмальц А.А., Горбачевский С.В. Возможности и ограничения для начальной комбинированной специфической терапии легочной артериальной гипертензии в Российской Федерации. Терапевтический архив. 2020; 92 (12): 80 - 85. DOI: 10.26442/00403660.2020.12.000840
413. Krug S, Hammerschmidt S, Pankau H, et al. Acute improved hemodynamics following inhaled iloprost in chronic thromboembolic pulmonary hypertension. Respiration. 2008; 76(2): 154 - 9. doi: 10.1159/000107977.
414. Yasuda K, Adachi S, Nishiyama I, et al. Inhaled iloprost induces long-term beneficial hemodynamic changes in patients with pulmonary arterial hypertension receiving combination therapy. Pulm Circ. 2022 Apr 14; 12(2): e12074. doi: 10.1002/pul2.12074.
415. Wu Y, Liu HM, Gu L, et al. Prostacyclins and pulmonary arterial hypertension in children. Eur Rev Med Pharmacol Sci. 2022 Jan; 26(1): 37 - 45. doi: 10.26355/eurrev_202201_27745.
416. Bruderer S, Hurst N, Remenova T, Dingemanse J. Clinical pharmacology, efficacy, and safety of selexipag for the treatment of pulmonary arterial hypertension. Expert Opin Drug Saf. 2017 Jun; 16(6): 743 - 751. doi: 10.1080/14740338.2017.1328052.
417. Sitbon O, Channick R, Chin KM, et al. et al.Selexipag for the Treatment of Pulmonary Arterial Hypertension. N Engl J Med. 2015 Dec 24; 373(26): 2522 - 33. doi: 10.1056/NEJMoa1503184.
418. ![]() N, Gaine S, Channick R, et al. Long-Term Survival, Safety and Tolerability with Selexipag in Patients with Pulmonary Arterial Hypertension: Results from GRIPHON and its Open-Label Extension. Adv Ther. 2022 Jan; 39(1): 796 - 810. doi: 10.1007/s12325-021-01898-1.
N, Gaine S, Channick R, et al. Long-Term Survival, Safety and Tolerability with Selexipag in Patients with Pulmonary Arterial Hypertension: Results from GRIPHON and its Open-Label Extension. Adv Ther. 2022 Jan; 39(1): 796 - 810. doi: 10.1007/s12325-021-01898-1.
419. Gaine S, Sitbon O, Channick RN, et al. Relationship Between Time From Diagnosis and Morbidity/Mortality in Pulmonary Arterial Hypertension: Results From the Phase III GRIPHON Study. Chest. 2021 Jul; 160(1): 277 - 286. doi: 10.1016/j.chest.2021.01.066.
420. Beghetti M, Channick RN, Chin KM, et al. Selexipag treatment for pulmonary arterial hypertension associated with congenital heart disease after defect correction: insights from the randomised controlled GRIPHON study. Eur J Heart Fail. 2019 Mar; 21(3): 352 - 359. doi: 10.1002/ejhf.1375.
421. Berlier C, Schwarz EI, Saxer S, et al. Real-Life Experience with Selexipag as an Add-On Therapy to Oral Combination Therapy in Patients with Pulmonary Arterial or Distal Chronic Thromboembolic Pulmonary Hypertension: A Retrospective Analysis. Lung. 2019 Jun; 197(3): 353 - 360. doi: 10.1007/s00408-019-00222-7.
422. Chida-Nagai A, Tsujioka T, Sasaki D, et al. An Adolescent Patient With Idiopathic Pulmonary Arterial Hypertension Weaned Off Intravenous Epoprostenol Following Treatment With Selexipag: A Case Report. Front Pediatr. 2022 Jun 17; 10: 909595. doi: 10.3389/fped.2022.909595.
423. Bravo-Valenzuela NJM, Navarro F, Silva SP. Use of selexipag in a teenage patient with pulmonary arterial hypertension. Ann Pediatr Cardiol. 2021 Jan-Mar; 14(1): 75 - 78. doi: 10.4103/apc.APC_63_19. Epub 2020 Sep 23.
424. Gallotti R, Drogalis-Kim DE, Satou G, et al. Single-Center Experience Using Selexipag in a Pediatric Population. Pediatr Cardiol. 2017 Oct; 38(7): 1405 - 1409. doi: 10.1007/s00246-017-1677-7. Epub 2017 Jul 13.
425. Grossman M, Walker S, Ramsey EZ. Selexipag Dosing Strategies for Pediatric Patients with Pulmonary Arterial Hypertension. Pediatr Cardiol. Published online May 10, 2024. doi: 10.1007/s00246-024-03513-w
426. Koo R, Lo J, Bock MJ. Transition from intravenous treprostinil to enteral selexipag in an infant with pulmonary arterial hypertension. Cardiol Young. 2019 Jun; 29(6): 849 - 851. doi: 10.1017/S1047951119001082.
427. Rothman A, Cruz G, Evans WN, Restrepo H. Hemodynamic and clinical effects of selexipag in children with pulmonary hypertension. Pulm Circ. 2020 Feb 17; 10(1): 2045894019876545. doi: 10.1177/2045894019876545.
428. Koestenberger M, Hansmann G. Should we use the oral selective IP receptor agonist selexipag off-label in children with pulmonary arterial hypertension? Pulm Circ. 2018 Jul-Sep; 8(3): 2045894018793580. doi: 10.1177/2045894018793580.
429. Hansmann G, Meinel K, Bukova M, et al. Selexipag for the treatment of children with pulmonary arterial hypertension: First multicenter experience in drug safety and efficacy. J Heart Lung Transplant. 2020 Jul; 39(7): 695 - 706. doi: 10.1016/j.healun.2020.03.029. Epub 2020 Apr 7.
430. Morell E, Rajagopal SK, Oishi P, et al. Extracorporeal Membrane Oxygenation in Pediatric Pulmonary Hypertension. Pediatr Crit Care Med. 2020 Mar; 21(3): 256 - 266. doi: 10.1097/PCC.0000000000002127.
431. Howard TS, Kalish BT, Rajagopal SK, et al. Factors Associated With Mortality in Children Who Successfully Wean From Extracorporeal Membrane Oxygenation. Pediatr Crit Care Med. 2018 Sep; 19(9): 875 - 883. doi: 10.1097/PCC.0000000000001642.
432. Chandrasekharan P, Rawat M, Lakshminrusimha S. How Do We Monitor Oxygenation during the Management of PPHN? Alveolar, Arterial, Mixed Venous Oxygen Tension or Peripheral Saturation? Children (Basel). 2020 Oct 13; 7(10): 180. doi: 10.3390/children7100180.
433. Lakshminrusimha S. Neonatal and Postneonatal Pulmonary Hypertension. Children (Basel). 2021 Feb 11; 8(2): 131. doi: 10.3390/children8020131.
434. Natarajan CK, Sankar MJ, Jain K, et al. Surfactant therapy and antibiotics in neonates with meconium aspiration syndrome: a systematic review and meta-analysis. J Perinatol. 2016 May; 36 Suppl 1(Suppl 1): S49 - 54. doi: 10.1038/jp.2016.32.
435. Jain A, Giesinger RE, Dakshinamurti S, et al. Care of the critically ill neonate with hypoxemic respiratory failure and acute pulmonary hypertension: framework for practice based on consensus opinion of neonatal hemodynamics working group. J Perinatol. 2022 Jan; 42(1): 3 - 13. doi: 10.1038/s41372-021-01296-z.
436. Kelly LE, Ohlsson A, Shah PS. Sildenafil for pulmonary hypertension in neonates. Cochrane Database Syst Rev 2017; 8: CD005494.
437. Chetan C, Suryawanshi P, Patnaik S, et al. Oral versus intravenous sildenafil for pulmonary hypertension in neonates: a randomized trial. BMC Pediatr. 2022 May 27; 22(1): 311. doi: 10.1186/s12887-022-03366-3.
438. Sun L, Wang C, Zhou Y, et al. Clinical Efficacy and Safety of Different Doses of Sildenafil in the Treatment of Persistent Pulmonary Hypertension of the Newborn: A Network Meta-analysis. Front Pharmacol. 2021 Sep 24; 12: 697287. doi: 10.3389/fphar.2021.697287
439. van der Graaf M, Rojer LA, Helbing W, et al. EXPRESS: Sildenafil for bronchopulmonary dysplasia and pulmonary hypertension: a meta-analysis. Pulm Circ. 2019 Feb 26; 9(3): 2045894019837875. doi: 10.1177/2045894019837875.
440. More K, Athalye-Jape GK, Rao SC, et al. Endothelin receptor antagonists for persistent pulmonary hypertension in term and late preterm infants. Cochrane Database Syst Rev. 2016 Aug 18; 2016(8): CD010531. doi: 10.1002/14651858.
441. Adnan M, Arshad MS, Anwar-Ul-Haq HM, et al. Persistent Pulmonary Hypertension of the Newborn: The Efficacy Comparison of Vasodilators Sildenafil Plus Bosentan Versus Sildenafil Plus Beraprost at a Tertiary Childcare Health Facility. Cureus. 2021 Nov 29; 13(11): e20020. doi: 10.7759/cureus.20020.
442. Shivanna B, Gowda S, Welty SE, Barrington KJ, Pammi M. Prostanoids and their analogues for the treatment of pulmonary hypertension in neonates. Cochrane Database Syst Rev. 2019 Oct 1; 10(10): CD012963. doi: 10.1002/14651858.
443. Kim SH, Lee HJ, Kim NS, et al. Inhaled Iloprost as a First-Line Therapy for Persistent Pulmonary Hypertension of the Newborn [Internet]. Vol. 26, Neonatal Medicine. The Korean Society of Neonatology 2019. p. 191 - 7. doi.org/10.5385/nm.2019.26.4.191
444. McMullan DM, Thiagarajan RR, Smith KM, Rycus PT, Brogan TV. Extracorporeal cardiopulmonary resuscitation outcomes in term and premature neonates*. Pediatr Crit Care Med. 2014 Jan; 15(1): e9 - e16. doi: 10.1097/PCC.0b013e3182a553f3.
445. Smith KM, McMullan DM, Bratton SL, et al. Is age at initiation of extracorporeal life support associated with mortality and intraventricular hemorrhage in neonates with respiratory failure? J Perinatol 2014; 34: 386 - 91
446. Kido K, Coons JC. Efficacy and Safety of the Use of Pulmonary Arterial Hypertension Pharmacotherapy in Patients with Pulmonary Hypertension Secondary to Left Heart Disease: A Systematic Review. Pharmacotherapy. 2019 Sep; 39(9): 929 - 945. doi: 10.1002/phar.2314.
447. Sugarman J, Weatherald J. Management of pulmonary hypertension due to chronic lung disease. Methodist Debakey Cardiovasc J. 2021; 17(2): 124 - 133. doi: 10.14797/zkut3813.
448. Farber HW, Badesch DB, Benza RL, et al. Use of supplemental oxygen in patients with pulmonary arterial hypertension in REVEAL. J Heart Lung Transplant. 2018; 37(8): 948 - 955. doi: 10.1016/j.healun.2018.03.010.
449. Adir Y, Humbert M, Chaouat A. Sleep-related breathing disorders and pulmonary hypertension. Eur Respir J. 2021; 57(1). 10.1183/13993003.02258 - 2020.
450. Ignatiuk D, Miles K, Gurbani N, et al. Occurrence of sleep-disordered breathing in children with pulmonary hypertension. Pediatr Pulmonol. 2023; 58(12): 3566 - 3573. doi: 10.1002/ppul.26693
451. Krishnan U, Krishnan S, Gewitz M. Treatment of pulmonary hypertension in children with chronic lung disease with newer oral therapies. Pediatr Cardiol. 2008; 29(6): 1082 - 1086. doi: 10.1007/s00246-008-9260-x.
452.  A,
A,  A, Ryciak E, et al. Children with Bronchopulmonary Dysplasia-Associated Pulmonary Hypertension Treated with Pulmonary Vasodilators - The Pediatric Cardiologist Point of View. Children (Basel). 2021; 8(5): 326. Published 2021 Apr 22. doi: 10.3390/children8050326
A, Ryciak E, et al. Children with Bronchopulmonary Dysplasia-Associated Pulmonary Hypertension Treated with Pulmonary Vasodilators - The Pediatric Cardiologist Point of View. Children (Basel). 2021; 8(5): 326. Published 2021 Apr 22. doi: 10.3390/children8050326
453. Hansmann G, Sallmon H, Roehr CC, et al. Pulmonary hypertension in bronchopulmonary dysplasia. Pediatr Res. 2021; 89(3): 446 - 455. doi: 10.1038/s41390-020-0993-4
454. Lang JE, Hornik CD, Martz K, et al. Safety of sildenafil in premature infants at risk of bronchopulmonary dysplasia: Rationale and methods of a phase II randomized trial. Contemp Clin Trials Commun. 2022; 30: 101025. Published 2022 Oct 31. doi: 10.1016/j.conctc.2022.101025.
455. Sun L, Wang C, Zhou Y, et al. Clinical Efficacy and Safety of Different Doses of Sildenafil in the Treatment of Persistent Pulmonary Hypertension of the Newborn: A Network Meta-analysis. Front Pharmacol. 2021 Sep 24; 12: 697287. doi: 10.3389/fphar.2021.697287
456. Fabyan KD, Chandel A, King CS. Pulmonary Hypertension in Interstitial Lung Disease: Management Options to Move Beyond Supportive Care. Curr Pulmonol Rep. Published online May 22, 2023. doi: 10.1007/s13665-023-00311-2.
457. Raghu G, Behr J, Brown KK, et al. Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial [published correction appears in Ann Intern Med. 2014 May 6; 160(9): 658]. Ann Intern Med. 2013; 158(9): 641 - 649. doi: 10.7326/0003-4819-158-9-201305070-00003.
458. Nathan SD, Behr J, Collard HR, et al. Riociguat for idiopathic interstitial pneumonia-associated pulmonary hypertension (RISE-IIP): a randomised, placebo-controlled phase 2b study. Lancet Respir Med. 2019; 7(9): 780 - 790. doi: 10.1016/S2213-2600(19) 30250-4
459. Kumbasar U, Aypar E,  T, Demircin M,
T, Demircin M, ![]() R. Pulmonary thromboendarterectomy in pediatric patients: Report of three cases. Turk J Pediatr. 2018; 60(5): 604 - 607. doi: 10.24953/turkjped.2018.05.023.
R. Pulmonary thromboendarterectomy in pediatric patients: Report of three cases. Turk J Pediatr. 2018; 60(5): 604 - 607. doi: 10.24953/turkjped.2018.05.023.
460. Brookes JDL, Li C, Chung STW, et al. Pulmonary thromboendarterectomy for chronic thromboembolic pulmonary hypertension: a systematic review. Ann Cardiothorac Surg. 2022; 11(2): 68 - 81. doi: 10.21037/acs-2021-pte-25
461. Latus H, Wagner I, Ostermayer S, et al. Hemodynamic Evaluation of Children with Persistent or Recurrent Pulmonary Arterial Hypertension Following Complete Repair of Congenital Heart Disease. Pediatr Cardiol. 2017 Oct; 38(7): 1342 - 1349. doi: 10.1007/s00246-017-1667-9.
462. Takaya Y, Akagi T, Sakamoto I, et al. Efficacy of treat-and-repair strategy for atrial septal defect with pulmonary arterial hypertension. Heart. 2022 Mar; 108(5): 382 - 387. doi: 10.1136/heartjnl-2021-319096.
463. Wang Z, Li X, Li M, et al. The efficacy of the treat-repair-treat strategy for severe pulmonary arterial hypertension associated with congenital heart disease: a meta-analysis. BMC Cardiovasc Disord. 2023; 23(1): 569. Published 2023 Nov 20. doi: 10.1186/s12872-023-03606-z
464. Myers PO, Tissot C, Beghetti M. Assessment of operability of patients with pulmonary arterial hypertension associated with congenital heart disease. Circ J. 2014; 78(1): 4 - 11. doi: 10.1253/circj.cj-13-1263. Epub 2013 Nov 13. Erratum in: Circ J. 2014; 78(7): 1774.
465. Шмальц А.А. Суживание легочной артерии при врожденных пороках сердца с легочной гипертензией и легочно-сосудистой болезнью. Детские болезни сердца и сосудов. 2019: 16 (3), 149 - 161.
466. Mazza GA, Gribaudo E, Agnoletti G. The pathophysiology and complications of Fontan circulation. Acta Biomed. 2021 Nov 3; 92(5): e2021260. doi: 10.23750/abm.v92i5.10893.
467. Gorbachevsky Sv., Shmalts A.A. What can cause pulmonary vascular disease in functionally single ventricle? Anatomy & Physiology: Current Research. 2016; 6 (1). doi.org/10.4172/2161-0940.1000e137.
468. Baruteau AE, Belli E, Boudjemline Y, et al. Palliative Potts shunt for the treatment of children with drug-refractory pulmonary arterial hypertension: updated data from the first 24 patients. Eur J Cardiothorac Surg. 2015 Mar; 47(3): e105-10. doi: 10.1093/ejcts/ezu445.
469. Gorbachevsky SV, Shmalts AA, Dadabaev GM, et al. Outcomes of Atrioseptostomy with Stenting in Patients with Pulmonary Arterial Hypertension from a Large Single-Institution Cohort. Diagnostics (Basel). 2020; 10(9): 725. doi: 10.3390/diagnostics10090725
470. Gorbachevsky SV, Shmalts AA, Barishnikova IY, et al. Potts shunt in children with pulmonary arterial hypertension: institutional experience. Interact Cardiovasc Thorac Surg. 2017; 25(4): 595 - 599. doi: 10.1093/icvts/ivx209.
471. Горбачевский С.В., Пурсанов М.Г., Шмальц А.А., и соавт. Результаты атриосептостомии со стентированием у больных с идиопатической и схожими формами легочной артериальной гипертензии. Грудная и сердечно-сосудистая хирургия. 2019; 61 (2): 100 - 113.doi.org/10.24022/0236-2791-2019-61-2-100-113.
472. Горбачевский С.В., Шмальц А.А., Белкина М.В., и соавт. Анастомоз Поттса у детей с легочной гипертензией: 7 операций в одной клинике и обзор мирового опыта. Детские болезни сердца и сосудов. 2016; 13 (4): 189 - 198.
473. Шмальц А.А., Нишонов Н.А. Атриосептостомия у больных с легочной гипертензией. Грудная и сердечно-сосудистая хирургия. 2015; 57 (5): 18 - 25.
474. Grady RM, Canter MW, Wan F, et al. International Registry Potts Shunt. Pulmonary-to-Systemic Arterial Shunt to Treat Children With Severe Pulmonary Hypertension. J Am Coll Cardiol. 2021 Aug 3; 78(5): 468 - 477. doi: 10.1016/j.jacc.2021.05.039.
475. Ploegstra MJ, Arjaans S, Zijlstra WMH, et al. Clinical Worsening as Composite Study End Point in Pediatric Pulmonary Arterial Hypertension. Chest. 2015 Sep; 148(3): 655 - 666. doi: 10.1378/chest.14-3066.
476. Hayes D, Jr, Cherikh WS, Chambers DC, et al. The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Twenty-second pediatric lung and heart-lung transplantation report-2019; Focus theme: Donor and recipient size match. J Heart Lung Transplant 2019; 38: 1015 - 27. 10.1016/j.healun.2019.08.003.
477.  E, Eichstaedt C,
E, Eichstaedt C,  JA, et al. ERS statement on exercise training and rehabilitation in patients with severe chronic pulmonary hypertension. Eur Respir J. 2019 Feb 28; 53(2): 1800332. doi: 10.1183/13993003.00332-2018.
JA, et al. ERS statement on exercise training and rehabilitation in patients with severe chronic pulmonary hypertension. Eur Respir J. 2019 Feb 28; 53(2): 1800332. doi: 10.1183/13993003.00332-2018.
478. Pandey A, Garg S, Khunger M, et al. Efficacy and Safety of Exercise Training in Chronic Pulmonary Hypertension: Systematic Review and Meta-Analysis. Circ Heart Fail. 2015 Nov; 8(6): 1032 - 43. doi: 10.1161/CIRCHEARTFAILURE.115.002130.
479. Karapolat H, ![]() ME,
ME,  G, et al. Effects of cardiopulmonary rehabilitation on pulmonary arterial hypertension: A prospective, randomized study. Turk J Phys Med Rehabil. 2019 May 8; 65(3): 278 - 286. doi: 10.5606/tftrd.2019.2758.
G, et al. Effects of cardiopulmonary rehabilitation on pulmonary arterial hypertension: A prospective, randomized study. Turk J Phys Med Rehabil. 2019 May 8; 65(3): 278 - 286. doi: 10.5606/tftrd.2019.2758.
480. Seo YG, Oh S, Park WH, et al. Optimal aerobic exercise intensity and its influence on the effectiveness of exercise therapy in patients with pulmonary arterial hypertension: a systematic review. J Thorac Dis. 2021 Jul; 13(7): 4530 - 4540. doi: 10.21037/jtd-20-3296.
481. Lammers AE, Apitz C, Zartner P, et al. Diagnostics, monitoring and outpatient care in children with suspected pulmonary hypertension/paediatric pulmonary hypertensive vascular disease. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and DGPK. Heart. 2016 May; 102 Suppl 2: ii1-13. doi: 10.1136/heartjnl-2015-307792
482. Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 03.04.2017) "Об основах охраны здоровья граждан в Российской Федерации".
483. Приказ Министерства здравоохранения РФ от 25 октября 2012 г. N 440н "Об утверждении Порядка оказания медицинской помощи по профилю "детская кардиология"
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Миклашевич Ирина Михайловна - председатель рабочей группы, к.м.н., заведующий детским кардиологическим отделением ОСП "Научно-исследовательский клинический институт педиатрии и детской хирургии имени академика Ю.Е. Вельтищева" ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член ВОО "Ассоциация детских кардиологов России".
1. Васичкина Елена Сергеевна - д.м.н., главный научный сотрудник НИО сердечно-сосудистых заболеваний у детей, научный руководитель отделения детской кардиологии и медицинской реабилитации, профессор кафедры детских болезней лечебного факультета Института медицинского образования Центра Алмазова, главный внештатный специалист - детский кардиолог Северо-Западного федерального округа МЗ РФ, первый вице-президент Ассоциации детских кардиологов России (Санкт-Петербург).
2. Грознова Ольга Сергеевна - д.м.н., главный научный сотрудник отдела детской кардиологии и аритмологии ОСП "Научно-исследовательский клинический институт педиатрии и детской хирургии имени академика Ю.Е. Вельтищева" ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член ВОО "Ассоциация детских кардиологов России".
3. Дьякова Светлана Эвальдовна - к.м.н., врач-пульмонолог, ОСП "Научно-исследовательский клинический институт педиатрии и детской хирургии имени академика Ю.Е. Вельтищева" ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Детского Респираторного Общества, доцент кафедры генетики болезней органов дыхания ФГБНУ "Медико-генетический научный центр Н.П. Бочкова".
4. Емельянчик Елена Юрьевна - д.м.н., профессор кафедры педиатрии Института последипомного образования ФГБОУ ВО "Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого" Минздрава России, член ВОО "Ассоциация детских кардиологов России".
5. Ковалев Игорь Александрович - д.м.н., профессор, советник директора ФГБУ "НМИЦ сердечно-сосудистой хирургии им. А.Н. Бакулева", Президент ВОО "Ассоциация детских кардиологов России".
6. Мизерницкий Юрий Леонидович - профессор, д.м.н., заведующий отделом хронических, воспалительных и аллергических болезней легких ОСП "Научно-исследовательский клинический институт педиатрии и детской хирургии имени академика Ю.Е. Вельтищева" ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
7. Мовсесян Рубен Рудольфович - д.м.н., профессор, член-корреспондент РАН, заведующий отделением кардиохирургии ГБУЗ "Детский городской многопрофильный клинический специализированный центр высоких медицинских технологий" (Детская городская больница N 1) (г. Санкт-Петербург), профессор кафедры педиатрии и детской кардиологии ФГБОУ ВО "Северо-Западный государственный медицинский университет им. И.И. Мечникова" Минздрава России, член Ассоциации сердечно-сосудистых хирургов России.
8. Сабирова Дина Рашидовна - к.м.н., доцент кафедры госпитальной педиатрии ФГБОУ ВО "Казанский государственный медицинский университет" Минздрава России, член ВОО "Ассоциация детских кардиологов России".
9. Садыкова Динара Ильгизаровна - д.м.н., профессор, заведующий кафедрой госпитальной педиатрии "Казанский государственный медицинский университет" Минздрава России, Генеральный директор ВОО "Ассоциация детских кардиологов России", член "Союза педиатров России".
10. Трунина Инна Игоревна - д.м.н., главный внештатный детский специалист-кардиолог ДЗМ, заведующая отделением кардиологии ГБУЗ "Детская городская клиническая больница им. З.А. Башляевой ДЗМ", профессор кафедры госпитальной педиатрии N 1 педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член ВОО "Ассоциация детских кардиологов России".
11. Шмальц Антон Алексеевич - д.м.н., ведущий научный сотрудник отдела хирургического лечения заболеваний сердца с прогрессирующей легочной гипертензией ФГБУ "НМИЦ сердечно-сосудистой хирургии им. А.Н. Бакулева" Минздрава России, доцент кафедры сердечно-сосудистой хирургии ФГБОУ ДПО "РМАНПО" МЗ РФ.
12. Черногривов Игорь Евгеньевич - д.м.н., заведующий кардиохирургическим отделением N 7 ФГБУ "НМИЦ сердечно-сосудистой хирургии им. А.Н. Бакулева" Минздрава России.
13. Яковлева Людмила Викторовна - д.м.н., профессор, заведующий кафедрой поликлинической и неотложной педиатрии ФГБОУ ВО "Башкирский государственный медицинский университет" Минздрава России, член ВОО "Ассоциации детских кардиологов России.
14. Янулевич Ольга Сергеевна - к.м.н., врач - детский кардиолог консультативно-поликлинического отделения ФГБУ "Федеральный центр высоких медицинских технологий" Минздрава России (г. Калининград).
Конфликт интересов
Конфликт интересов среди членов Рабочей группы, участвующих в разработке данных клинических рекомендаций, отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-педиатры;
2. Врачи - детские кардиологи;
3. Врачи-пульмонологи;
4. Врачи - сердечно-сосудистые хирурги;
5. Врачи-анестезиологи-реаниматологи;
6. Врачи ультразвуковой диагностики;
7. Врачи-рентгенологи.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация, отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Таблица 10. Полная классификация педиатрической гипертензионной сосудистой болезни легких (Panama, 2011) [102]
Категория
Описание
Примеры
1
Пренатальная или врожденная педиатрическая гипертензионная сосудистая болезнь легких
1.1. Связанная с патологией матери или плаценты
1.1.1 Преэклампсия
1.1.2 Хориоамнионит
1.1.3 Прием матерью лекарственных средств (нестероидные противовоспалительные препараты)
1.2. Связанная с фетальным нарушением развития сосудов легких
1.2.1. Связанная с фетальной гипоплазией легких
1.2.1 a. Идиопатическая гипоплазия легких
1.2.1 b. Семейная гипоплазия легких
1.2.1.c. Врожденная диафрагмальная грыжа
1.2.1.d. Гепатопульмональное сращение
1.2.1.e. Синдром "турецкой сабли" (аномальный дренаж легочных вен)
1.2.1.f. Связанная с фетальной компрессией легких: олигогидрамнион (маловодие), омфалоцеле/гастрошизис, кистозный аденоматоз легких, фетальные опухоли и опухолевидные образования
1.2.1.g. Связанная с фетальными пороками развития скелета
1.2.2. Связанная с фетальной задержкой роста легких/аномалией развития
1.2.2.a. Ацинозная дисплазия
1.2.2.b. Врожденная альвеолярная дисплазия
1.2.2.c. Дисплазия альвеолярных капилляров с аномалиями расположения легочных вен или без них
1.2.2.d. Лимфангиэктазия
1.2.2.e. Аномалии легочной артерии
1.2.2.f. Аномалии легочных вен
1.3. Связанная с фетальной аномалией развития сердца
1.3.1. Преждевременное закрытие овального отверстия или артериального протока
1.3.1.a. Идиопатическое
1.3.1.b. Лекарственное
1.3.2. Врожденные пороки сердца, связанные с болезнью легочных сосудов плода
1.3.2.a. Транспозиция крупных артерий (TGA) с интактной межжелудочковой перегородкой
1.3.2.b. Синдром гипоплазии левых отделов сердца с интактной межпредсердной перегородкой
1.3.2.c. Окклюзионный тотальный аномальный дренаж легочных вен
1.3.2.d. Атрезия общей легочной вены
2
Перинатальный дефект адаптации легочных сосудов (персистирующая легочная гипертензия новорожденных)
2.1. Идиопатическая ПЛГН
2.2. ПЛГН, вызванная или связанная с
2.2.1. Сепсисом
2.2.2. Аспирацией мекония
2.2.3. Врожденным пороком сердца
2.2.4. Врожденной диафрагмальной грыжей
2.2.5. Трисомией 13 (синдром Патау), 18 (синдром Эдвардса) или 21 (синдром Дауна) хромосомы
2.2.6. Лекарственными препаратами и токсинами
3
Педиатрические сердечно-сосудистые заболевания
3.1 Системно-легочные шунты
3.1.1. ЛАГ, связанная с системно-легочным шунтом с повышением PVRI без шунта со сбросом справа налево
3.1.1.1. Операбельная
3.1.1.2. Неоперабельная
3.1.2 Классический синдром Эйзенменгера
3.1.2.1. Эйзенменгер - простое поражение (дефект межпредсердной перегородки, дефект межжелудочковой перегородки, открытый артериальный проток)
3.1.2.2. Эйзенменгер - сложное поражение (ствол, ТМА/ДМЖП, единственный желудочек)
3.1.3. Небольшой дефект с повышением давления в легочной артерии/PVRI, несоизмеримо выше размеров дефекта
- В сочетании с легочной гипоплазией
- В сочетании с наследственной или идиопатической педиатрической гипертензивной сосудистой болезни легких
3.2 Послеоперационная легочная гипертензия после:
3.2.1. Закрытия шунта с
3.2.1.1 персистирующим повышением PVRI > 3 WU.м2
3.2.1.2 рецидивирующим повышением PVRI > 3 WU.м2
3.2.2. Операции артериального или предсердного переключения по поводу ТМА с интактной межжелудочковой перегородкой
3.2.3. Операции по поводу обструкции левых отделов сердца
3.2.4. Операции по поводу тетрады Фалло
3.2.5. Операции по поводу атрезии легочной артерии с ДМЖП и MAPCA (большие аорто-легочные коллатерали)
3.2.6. Аорто-пульмонального шунтирования
3.3. Сосудистая легочная болезнь после поэтапного лечения по поводу единственного желудочка
3.3.1. После стадии 1 (перевязка легочной артерии, модифицированная операция Норвуда, гибридные вмешательства, аортопульмональный или вентрикулярно-пульмональный шунт, стентирование PDA)
3.3.2. После наложения анастомоза SVC с PA (операция Гленна)
3.3.3. После тотального кавапульмонального анастомоза (операция Фонтена)
3.4. Педиатрическая гипертензионная сосудистая болезнь легких, связанная с врожденными дефектами легочных артерий/вен
3.4.1. ПГСБЛ, связанная с врожденными дефектами легочных артерий
3.4.1.1. Отхождение легочной артерии от аорты
3.4.1.2. Одностороннее расположение/отхождение от протока/"отсутствие" легочной артерии
3.4.2. ПГСБЛ, связанная с врожденными дефектами легочных вен
3.4.2.1. Синдром "турецкой сабли"
3.4.2.2. Стеноз легочных вен
3.4.2.3. Синдром Канту
3.5. Венозная легочная гипертензия
3.5.1. Венозная легочная гипертензия, обусловленная врожденной обструкцией путей притока или оттока левых отделов сердца:
3.5.1.1. стеноз аортального клапана,
3.5.1.2. недостаточность аортального клапана,
3.5.1.3. митральный стеноз,
3.5.1.4. митральная регургитация,
3.5.1.5. надклапанное кольцо митрального клапана,
3.5.1.6. окклюзия легочных вен,
3.5.1.7. трехпредсердное сердце,
3.5.1.8. фиброэластоз эндокарда,
3.5.1.9. гипоплазия левого желудочка/синдром Шона,
3.5.1.10. врожденная кардиомиопатия,
3.5.1.11. рестриктивный дефект межпредсердной перегородки при синдроме гипоплазии левых камер сердца
3.5.2. Венозная легочная гипертензия, обусловленная приобретенным заболеванием левых камер сердца
3.5.2.1. Заболевание клапанов (ревматизм/после эндокардита/при ревматоидном артрите)
3.5.2.2. Рестриктивная/дилатационная/гипертрофическая кардиомиопатия
3.5.2.3. Констриктивный перикардит
4
Бронхо-легочная дисплазия
4.1. С гипоплазией легочных сосудов
4.2. Со стенозом легочных вен
4.3. С диастолической дисфункцией левого желудочка
4.4. С системно-легочными шунтами:
4.4.1. аортолегочные коллатерали
4.4.1. дефект межпредсердной перегородки
4.4.1. открытый артериальный проток
4.4.1. дефект межжелудочковой перегородки
4.5. Со значительной гиперкапнией и/или гипоксией
5
Изолированная педиатрическая гипертензионная сосудистая болезнь легких или изолированная педиатрическая (ЛАГ) легочная гипертензия
5.1. Идиопатическая PPHVD/PAH
5.2. Наследственная PPHVD/PAH
5.2.1. Ген BMPR2 (рецептор 2 костного морфогенетического белка)
5.2.2. Ген Alk 1 (активин-рецептороподобная киназа 1), эндоглин
5.2.3. Неустановленная генетическая природа
5.3. Лекарственные средства и токсины
5.3.1. Конкретная связь:
5.3.1.1. синдром токсического масла
5.3.2. Вероятная связь:
5.3.2.1. Амфетамины
5.3.4. Возможная связь:
5.3.4.1. Кокаин
5.3.4.1. Метилфенидат
5.3.4.1. Диазоксид
5.3.4.1. Циклоспорин
5.3.4.1. Фенилпропаноламин
5.4. Легочная вено-окклюзионная болезнь (ЛВОБ) и/или легочный капиллярный гемангиоматоз
5.4.1 Идиопатическая ЛВОБ
5.4.2 Наследственная ЛВОБ
6
Многофакторная педиатрическая гипертензивная сосудистая болезнь легких в сочетании с врожденными пороками развития
6.1. Синдромы с врожденными пороками сердца
6.2. Синдромы без врожденных пороков сердца
Пункты 6.1 и 6.2 могут включать ассоциацию VACTERL, синдром CHARGE, синдром Поланда, синдром Адамса-Оливера, синдром "турецкой сабли", трисомию, синдром Ди Джорджи, синдром Нунана, болезнь фон Реклингаузена, синдром Dursun, синдром Канту
7
Педиатрические заболевания легких
7.1. Муковисцидоз
7.2. Интерстициальные поражения легких: сурфактантная белковая недостаточность и пр.
7.3. Нарушение дыхания во сне
7.4. Деформации грудной клетки и позвоночника
7.5. Рестриктивная болезнь легких
7.6. Хронические обструктивные заболевания легких
8
Педиатрические тромбо-эмболические заболевания, вызывающие педиатрическую гипертензивную сосудистую болезнь легких
8.1. Хронические тромбоэмболии, связанные с центральными венозными катетерами
8.2. Хронические тромбоэмболии, связанные с электродами эндокардиальными для кардиостимуляции
8.3. Желудочково-предсердный шунт при гидроцефалии
8.4. Серповидноклеточная анемия
8.5. Первичный эндокардиальный фиброэластоз
8.6. Антикардиолипиновый/антифосфолипидный синдром
8.7. Метилмалоновая ацидемия и гомоцистинурия
8.8. Злокачественные новообразования: остеосаркома, опухоль Вильмса
8.9. Состояние после спленэктомии
9
Гипобарическая гипоксия
9.1. Отек легких на большой высоте
9.2. Детская подострая горная болезнь
9.3. Болезнь Монже (горная болезнь Монже)
9.4. Гипобарическая гипоксия, связанная с:
9.4.1. ПЛГН
9.4.2. ВПС
9.4.3. изолированной идиопатической или наследственной педиатрической гипертензивной сосудистой болезнью легких
10
Педиатрическая гипертензивная сосудистая болезнь легких, связанная с нарушением деятельности других систем
10.1. Педиатрическая портальная гипертензия
10.1.1. Врожденный внепеченочный порто-кавальный/порто-системный шунт (например, синдром Абернети, левопредсердный изомеризм, трисомия, атрезия или тромбоз воротной вены)
10.1.2. Цирроз печени
10.2. Детские гематологические заболевания
10.2.1. Гемолитические анемии:
10.2.1.1. 
10.2.1.2. серповидноклеточная анемия
10.2.2. После спленэктомии
10.3. Педиатрические онкологические заболевания
10.3.1. Педиатрическая гипертензия легочной артерии, связанная со злокачественными заболеваниями
10.3.2. Легочная вено-окклюзионная болезнь после трансплантации костного мозга и химиотерапии
10.4. Педиатрические метаболические/эндокринные заболевания
10.4.1. Болезнь Гоше
10.4.2. Гликогенозы
10.4.3. Некетоновая гиперглицинемия
10.4.4. Синдром митохондриального истощения
10.4.5. Мукополисахаридозы
10.4.6. Гипотиреоз/гипертиреоз
10.5. Педиатрические аутоиммунные и аутовоспалительные заболевания
10.5.1. POEMS-синдром
10.5.2. Смешанные заболевания соединительной ткани
10.5.3. Склеродермия (ограниченная и диффузная)
10.5.4. Дерматомиозит
10.5.5. Системная красная волчанка (СКВ)
10.5.6. Антикардиолипиновый/антифосфолипидный синдром
10.5.7. Ювенильный артрит с системным началом
10.5.8 Легочная вено-окклюзионная болезнь и СКВ
10.6. Педиатрические инфекционные заболевания
10.6.1. Шистосоматоз
10.6.2. ВИЧ-инфекция
10.6.3. Туберкулез легких
10.7. Педиатрическая хроническая почечная недостаточность
10.7.1 Легочная гипертензия до начала диализа, а также в ходе гемодиализа или перитонеального диализа
10.7.2 Легочная вено-окклюзионная болезнь после трансплантации почки
Таблица 11. Функциональная классификация легочной гипертензии (ВОЗ) [181]
Класс
Описание
I ФК
Нет ограничений обычной физической активности, она не вызывает повышенной одышки, усталости, болей в груди или предсинкопальных состояний.
II ФК
Легкое ограничение физической активности. Дискомфорт в покое отсутствует, но обычная физическая активность вызывает повышенную одышку, слабость, боль в грудной клетке или пресинкопальные состояния.
III ФК
Значительное ограничение физической активности. В состоянии покоя дискомфорта нет, но физическая активность меньше обычной вызывает повышенную одышку, усталость, боль в груди или пресинкопальные состояния.
IV ФК
Одышка и/или усталость в состоянии покоя, усиливающиеся практически при минимальной физической активности. Могут быть признаки правожелудочковой недостаточности.
Таблица 12. Педиатрическая функциональная классификация для детей в возрасте 0,5 - 1 года [182]
Класс
Дети с легочной гипертензией
I
Отсутствие симптомов, рост согласно собственным процентилям, физическая активность не ограничена. Подвижность, сидение, хватательный рефлекс, стремление встать, ползание, игра.
II
Незначительное ограничение физической активности, чрезмерная одышка и утомляемость при игре. Отставание в физическом развитии. В покое - комфорт. Продолжение роста согласно собственным процентилям.
IIIa
Выраженное ограничение физической активности. Регресс физических навыков. Прекращение ползания. Тихое поведение и необходимость частого сна. Нерешительность. В покое - комфорт. Нагрузка ниже обычной вызывает чрезмерное утомление или обморок и/или предобморочное состояние. Рост замедлен. Аппетит снижен. Требуется тщательное медицинское наблюдение.
IIIb
Выраженное замедление роста. Аппетит снижен. Дополнительное питание. Нагрузка ниже обычной вызывает чрезмерное утомление или обморок. Плюс - характеристики класса IIIa.
IV
Невозможность переносить какие-либо нагрузки без чрезмерной одышки, утомляемости или обморока. Отсутствие общения с членами семьи. Обмороки и/или правожелудочковая недостаточность. Плюс - характеристики класса III.
Таблица 13. Педиатрическая функциональная классификация для детей в возрасте 1 - 2 лет [182]
Класс
Дети с легочной гипертензией
I
Отсутствие симптомов, рост согласно собственным процентилям, физическая активность не ограничена. Стояние, стремление к ходьбе/ходьба, лазание.
II
Незначительное ограничение физической активности, чрезмерная одышка и утомляемость при игре. Отставание в физическом развитии. В покое - комфорт. Продолжение роста согласно собственным процентилям.
IIIa
Выраженное ограничение физической активности. Регресс физических навыков. Нежелание играть. Тихое поведение и необходимость частого сна. Нерешительность. В покое - комфорт. Нагрузка ниже обычной вызывает чрезмерное утомление или обморок и/или предобморочное состояние. Рост замедлен. Аппетит снижен.
IIIb
Выраженное замедление роста. Аппетит снижен. Дополнительное питание. Нагрузка ниже обычной вызывает чрезмерное утомление или обморок. Плюс - характеристики класса IIIa.
IV
Невозможность переносить какие-либо нагрузки без чрезмерной одышки, утомляемости или обморока. Отсутствие общения с членами семьи. Обмороки и/или правожелудочковая недостаточность. Плюс - характеристики класса III.
Таблица 14. Педиатрическая функциональная классификация для детей в возрасте 2 - 5 лет [182]
Класс
Дети с легочной гипертензией
I
Отсутствие симптомов, рост нормальный, регулярное посещение детского сада (яслей)/школы, физическая активность не ограничена, занятия спортом с одноклассниками.
II
Незначительное ограничение физической активности, чрезмерная одышка и утомляемость при играх с одноклассниками. Посещаемость детского сада (яслей)/школы - 75%. Отставание в физическом развитии. В покое - комфорт. Продолжение роста согласно собственным процентилям. Боли в грудной клетке отсутствуют.
IIIa
Выраженное ограничение физической активности. Регресс физических навыков. Нежелание подниматься по лестнице и играть с друзьями. Нерешительность. В покое - комфорт. Нагрузка ниже обычной (одевание) вызывает чрезмерное утомление, одышку, обморок и/или предобморочное состояние или боли в грудной клетке. Посещаемость детского сада (яслей)/школы - 50%.
IIIb
Невозможность посещать ясли/школу, но хорошая подвижность в домашних условиях. Для передвижений вне дома требуется кресло-коляска. Замедление роста. Аппетит снижен. Дополнительное питание. Нагрузка ниже обычной вызывает чрезмерное утомление, обморок или боли в грудной клетке. Плюс - характеристики класса IIIa.
IV
Невозможность переносить какие-либо нагрузки без чрезмерной одышки, утомляемости, обморока или болей в грудной клетке. Невозможность посещать школу, зависимость от кресла-коляски, отсутствие общения с друзьями. Обмороки и/или правожелудочковая недостаточность. Плюс - характеристики класса III.
Таблица 15. Педиатрическая функциональная классификация для детей в возрасте 5 - 16 лет [182]
Класс
Дети с легочной гипертензией
I
Отсутствие симптомов, рост согласно собственным процентилям, регулярное посещение школы, физическая активность не ограничена, занятия спортом с одноклассниками.
II
Незначительное ограничение физической активности, чрезмерная одышка и утомляемость при играх с одноклассниками. Посещаемость школы - 75%. Отставание в физическом развитии. В покое - комфорт. Продолжение роста согласно собственных процентилей. Боли в грудной клетке отсутствуют.
IIIa
Выраженное ограничение физической активности. Нежелание заниматься спортом. В покое - комфорт. Нагрузка ниже обычной вызывает чрезмерное утомление, одышку, обморок или боли в грудной клетке. Посещаемость школы - 50%.
IIIb
Невозможность посещать школу, но хорошая подвижность в домашних условиях и при общении с друзьями. Для передвижений вне дома требуется кресло-коляска. Замедление роста. Аппетит снижен. Дополнительное питание. Нагрузка ниже обычной (одевание) вызывает чрезмерное утомление, обморок и/или предобморочное состояние или боли в грудной клетке. Плюс - характеристики класса IIIa.
IV
Невозможность переносить какие-либо нагрузки без чрезмерной одышки, утомляемости, обморока или болей в грудной клетке. Невозможность посещать школу, зависимость от кресла-коляски, отсутствие общения с друзьями. Обмороки и/или правожелудочковая недостаточность. Плюс - характеристики класса III.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
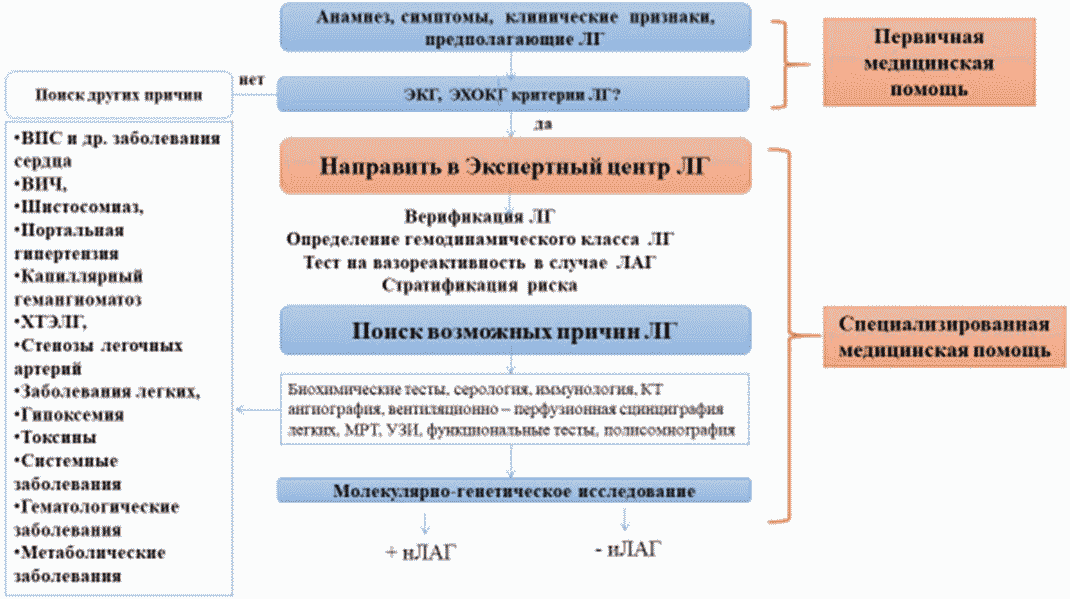
Рис. 1. Диагностический алгоритм для детей и подростков с подозрением на ЛГ
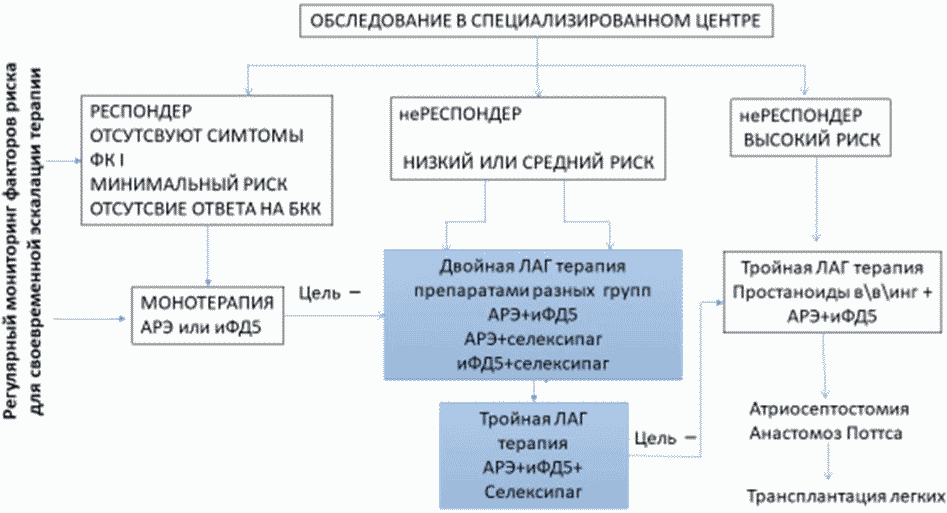
Рис. 2. Алгоритм терапии ЛАГ у детей
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Легочная гипертензия - угрожающее патологическое состояние, когда в легких ухудшается циркуляция крови и сердцу становится крайне трудно работать. Именно так происходит у детей, страдающих этим потенциально смертельным заболеванием, долгое время считавшимся неизлечимым.
Одышка, сердцебиение и повышенная утомляемость заставляют думать, что у ребенка болезнь сердца или астма. Но в ряде случаев эти симптомы могут быть вызваны патологическими изменениями кровеносных сосудов легких. Сосуды становятся все более и более узкими. В результате все меньше крови доходит до воздушных мешочков (альвеол) легких, затрудняя получение организмом ребенка кислорода. Ощущения страдающих легочной гипертензией подобны пребыванию на высоте нескольких тысяч метров. Сердце ведет все более ожесточенную борьбу с дополнительным сопротивлением, создаваемым суженными кровеносными сосудами, пока в конце концов не отказывает.
У некоторых детей повышен риск развития легочной гипертензии, например, при пороке сердца, аутоиммунных заболеваниях, бронхолегочной дисплазии или ВИЧ-инфекции. Правильный диагноз часто устанавливают слишком поздно. Поскольку легочная гипертензия развивается постепенно и на начальном этапе симптомы отсутствуют, ее часто диагностируют уже в тяжелой стадии. Как правило, требуется консультация нескольких врачей, прежде чем удается поставить диагноз легочной гипертензии. Важную информацию можно получить при эхокардиографическом исследовании. Полученные данные необходимо, если позволяет состояние пациента, подтвердить, напрямую измеряя давление в сердце и сосудах при чрезвенозной катетеризации сердца.
Если удается выявить заболевание на ранней стадии, можно стабилизировать состояние пациента и поддерживать более высокое качество жизни. Недавно единственной надеждой для пациентов с легочной гипертензией была пересадка легких. Однако уже сейчас имеется возможность эффективно лечить легочную гипертензию специальными лекарственными препаратами.
Каждый организм реагирует на методы лечения и лекарственные препараты по-разному. Поэтому сказать, какие из них окажутся наиболее действенными именно для Вашего ребенка, без специального обследования и последующего постоянного наблюдения не представляется возможным. Проконсультируйтесь у своего лечащего врача.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не применяются.
