"Клинические рекомендации "Цирроз и фиброз печени"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЦИРРОЗ И ФИБРОЗ ПЕЧЕНИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: K74.0, K74.6, K72, K76.7, K74.1, K74.2, K74.4, K74.5
Год утверждения (частота пересмотра): 2025 Пересмотр не позднее: 2027
ID: 715_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации Российская Гастроэнтерологическая Ассоциация, Общероссийская общественная организация "Российское научное медицинское общество терапевтов", Российское общество по изучению печени, Межрегиональная Общественная Организация "Научное сообщество по содействию клиническому изучению микробиома человека", Российское общество профилактики неинфекционных заболеваний
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
ВВ - варикозные вены
ВВПиЖ - варикозные вены пищевода и желудка
ГЦР - гепатоцеллюлярный рак
ГПС - гепатопульмональный синдром
ГРС - гепаторенальный синдром
ГРС-ОПП - гепаторенальный синдром с критериями острого повреждения почек
ДИ - доверительный интервал
ДРА - двухэнергетическая рентгеновская абсорбциометрия
ИМТ - индекс массы тела
ИПП - ингибиторы протонной помпы (насоса)
КУУЗИ - контраст-усиленное ультразвуковое исследование
КТ - компьютерная томографии (КТ) органов брюшной полости с внутривенным болюсным контрастированием
МАЖБП - метаболически ассоциированная жировая болезнь печени
МетАБП - метаболически ассоциированная жировая болезнь печени в сочетании с избыточным употреблением алкоголя
МНО - международное нормализованное отношение
МО - медицинская организация
МРТ - магнитно-резонансная томография органов брюшной полости с внутривенным введением гепатотропного контрастного препарата
НАЖБП - неалкогольная жировая болезнь печени
НПВП - нестероидные противовоспалительные и противоревматические препараты
НСББ - неселективные бета-адреноблокаторы
ОБП - острая болезнь почек
ОКН - острый канальцевый некроз
ОМП - окружность мышц плеча
ОПП - острое повреждение почек
ОР - относительный риск
ОЦК - объем циркулирующей крови
ПЛГ - портолегочная гипертензия
ПГ - портальная гипертензия
ПГГ - портальная гипертензионная гастропатия
ПЭ - печеночная энцефалопатия
РКИ - рандомизированное клиническое исследование
СААГ - сывороточно-асцитический альбуминовый градиент
СБП - спонтанный бактериальный перитонит
СИБР - синдромом избыточного бактериального роста
СМИ - скелетно-мышечный индекс
СМИ ВК - скелетно-мышечный индекс верхних конечностей
СКФ - скорость клубочковой фильтрации
ТП - трансплантация печени
УЗИ - ультразвуковое исследование
ХБП - хроническая болезнь почек
ЦП - цирроз печени
ЭГДС - эзофагогастродуоденоскопия
ЭХО - эхокардиография
ICA - International Club of Ascites (Международный клуб по изучению асцита)
KDIGO - Kidney Disease Improving Global Outcomes (Инициатива по улучшению глобальных исходов заболеваний почек)
LOLA - L-орнитин-L-аспартат
MELD - Model for End-stage Liver Disease (модель для оценки терминальной стадии заболеваний печени)
NOD2 - nucleotide-binding oligomerization domain containing 2 (нуклеотид-связывающий домен олигомеризации)
SIRS - systemic inflammatory response syndrome (синдром системного воспалительного ответа)
TIPS - transjugular intrahepatic portosystemic shunt (трансъюгулярный внутрипеченочный портосистемный шунт)
Термины и определения
Асцит - патологическое накопление жидкости в брюшной полости, встречается более чем у 50% больных с 10-летней историей заболевания печени и значительно ухудшает прогноз жизни пациентов с ЦП. В течение первого года от момента появления асцита выживает от 45 до 82% больных, в течение пяти лет - менее 50%.
Гепатопульмональный синдром - легочное осложнение, которое возникает у пациентов с хроническим заболеванием печени и (или) портальной гипертензией и характеризуется дилатацией легочных сосудов и гипоксемией при отсутствии кардиореспираторных заболеваний.
Гепаторенальный синдром с критериями острого повреждения почек - жизнеугрожающее и потенциально обратимое нарушение функции почек, вызванное системным воспалением и (или) спланхнической и системной вазодилатацией у пациентов с декомпенсированным циррозом печени, портальной гипертензией и асцитом, при котором наблюдается повышение креатинина до уровня, соответствующего критериям ОПП (на >= 26,5 мкмоль/л от исходного за 48 ч и (или) на >= 50% от исходного за 7 суток).
Гепатоцеллюлярный рак (гепатоцеллюлярная карцинома, печеночно-клеточный рак) - наиболее частая (около 85% случаев) злокачественная опухоль печени, исходящая из гепатоцитов.
Гиперволемическая гипонатриемия (дилюционная гипонатриемия или гипонатриемия разведения) - снижение уровня натрия сыворотки крови ниже 130 ммоль/л, которое развивается вследствие избытка внеклеточной жидкости из-за нарушения способности почек выводить воду, не содержащую растворенных в ней веществ вследствие неосмотической гиперсекреции антидиуретического гормона, что вторично по отношению к снижению эффективного артериального давления у пациентов с ЦП. Гиперволемическая гипонатриемия ассоциирована с увеличением летальности у пациентов с ЦП, а также с увеличением числа осложнений после трансплантации печени. Встречается у трети госпитализированных больных ЦП и асцитом.
Гипоаммониемические средства - препараты, уменьшающие концентрацию аммиака в крови и относящиеся к следующим группам в соответствии с АТХ: антибиотик - рифаксимин, препараты для лечения заболеваний печени (орнитин), осмотические слабительные средства - лактулоза**.
Гиповолемическая гипонатриемия - снижение уровня натрия сыворотки крови ниже 130 ммоль/л вследствие потери внеклеточной жидкости, например, из-за чрезмерной диуретической терапии. Гиповолемическая гипонатриемия составляет 10% от всех случаев гипонатриемии у пациентов с ЦП.
Жировая болезнь печени - наднозологическое понятие, объединяющее все заболевания печени, протекающие со стеатозом и стеатогепатитом.
Декомпенсация - нарушение деятельности органа, системы органов или всего организма вследствие истощения или срыва приспособительных механизмов.
Заболевание - состояние, возникающее в связи с воздействием патогенных факторов, нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма.
Исход - любой возможный результат, возникающий при воздействии причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства.
Изменение образа жизни - мероприятия, направленные на нормализацию массы тела, характера питания и двигательной активности, целью которых является профилактика и лечение заболеваний.
Индекс массы тела - показатель, который используется для диагностики избыточной массы тела и ожирения, а также оценки его степени (масса тела в килограммах, деленная на рост в метрах квадратных, кг/м2).
Корригированный ИМТ - индекс массы тела, который рассчитывается исходя из массы тела пациента путем вычитания доли свободной жидкости от измеренной массы тела: в зависимости от выраженности асцита вычитается 5% при легкой (1-й), 10% - при средней степени (2-й) и 15% - при напряженном асците (3-й степени). Если проводился лапароцентез, корригированный ИМТ вычислялся после процедуры. При наличии двустороннего отека нижних конечностей вычитается еще 5%.
Конфликт интересов - ситуация, при которой у медицинского или фармацевтического работника при осуществлении им профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского или фармацевтического работника и интересами пациента.
Клиническое исследование - любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и (или) фармакологических эффектов исследуемых продуктов и (или) выявления нежелательных реакций на исследуемые продукты и (или) изучения их всасывания, распределения, метаболизма и выведения с целью оценки их безопасности и (или) эффективности.
Кровотечения из варикозных вен пищевода и желудка - наиболее частое фатальное осложнение цирроза печени, которое возникает в результате натяжения и разрыва стенки варикозных вен в пищеводе и желудке из-за повышения давления в портальной системе.
Лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, сохранения, предотвращения или прерывания беременности.
Медицина, основанная на доказательствах - надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в сочетании с индивидуальным клиническим опытом и с учетом ценностей и предпочтений пациента в процессе принятия решений о состоянии здоровья и лечении пациента.
Медицинская реабилитация - комплекс мероприятий медицинского и психологического характера, направленных на полное или частичное восстановление нарушенных и (или) компенсацию утраченных функций пораженного органа либо системы организма, поддержание функций организма в процессе завершения остро развившегося патологического процесса или обострения хронического патологического процесса в организме, а также предупреждение, раннюю диагностику и коррекцию возможных нарушений функций поврежденных органов либо систем организма, предупреждение и снижение степени возможной инвалидности, улучшение качества жизни, сохранение работоспособности пациента и его социальную интеграцию в общество.
Медицинское вмешательство - выполняемые по отношению к пациенту медицинским и иным работником, имеющим право на осуществление медицинской деятельности, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности.
Острое повреждение почек - патологическое состояние, развивающееся в результате непосредственного острого воздействия ренальных и (или) экстраренальных повреждающих факторов, продолжающееся до 7 суток и характеризующееся быстрым (часы, дни) развитием признаков повреждения или дисфункции почек различной степени выраженности.
Острая печеночная недостаточность на фоне хронической (Acute-on-chronic liver failure, ACLF) согласно определению европейской ассоциации по изучению печени (European Association for the Study of the Liver) - тяжелая форма острой декомпенсации цирроза печени, которая характеризуется полиорганной недостаточностью и высоким риском краткосрочной смертности (> 20% в течение 28 дней). Острая декомпенсация определяется развитием асцита, печеночной энцефалопатии, желудочно-кишечного кровотечения и (или) бактериальных инфекций. Критерии: недостаточность одного или более из 6 основных органов и систем (печень, почки, головной мозг, система свертывания крови, система кровообращения, дыхательная система) в сочетании с системным воспалением, которое могло быть вызвано острым повреждением печени и (или) другого органа.
Пациент - физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния.
Печеночный венозный градиент давления (Hepatic venous pressure gradient, HVPG) - разница давления между воротной и интраабдоминальной частью нижней полой вены (печеночными венами), золотой стандарт определения портального давления. Используется для оценки наличия и степени выраженности портальной гипертензии.
Печеночная энцефалопатия - комплекс потенциально обратимых нервно-психических нарушений, возникающих в результате печеночной недостаточности и (или) портосистемного шунтирования крови.
Преабилитация - комплекс предшествующих операции мероприятий для повышения готовности пациента к хирургическому вмешательству и эффективности послеоперационного восстановления.
Портальная гипертензия - клинический синдром, развивающийся в результате повышения давления в воротной вене, когда градиент давления между воротной и печеночными венами (нижней полой веной), характеризующийся формированием портосистемных коллатералей, асцитом, спленомегалией, составляет > 5 мм рт.ст.
Клинически значимая портальная гипертензия - портальная гипертензия с градиентом печеночного венозного давления >= 10 мм рт.ст. В клиническом аспекте у таких пациентов повышается риск развития варикозного расширения вен пищевода и декомпенсации ЦП.
Портальная гипертензионная гастропатия - изменения слизистой оболочки желудка в виде характерного мозаичного рисунка с различной степенью выраженности внутрислизистых кровоизлияний в результате повышения портального давления, полнокровия подслизистых сосудов и расширения венул и капилляров слизистой.
Портолегочная гипертензия - легочная артериальная гипертензия, развивающаяся на фоне портальной гипертензии при отсутствии других причин.
Рабочая группа по разработке/актуализации клинических рекомендаций - коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы.
Рекомпенсация - разрешение асцита (без сопутствующего применения диуретиков), печеночной энцефалопатии (без медикаментозной профилактики), отсутствие рецидивирующего варикозного кровотечения в течение как минимум 12 месяцев; устранение или подавление этиологической причины заболевания печени, улучшение синтетической функции печени (сывороточный альбумин, международное нормализованное отношение (МНО), билирубин).
Саркопения - прогрессирующее и генерализованное заболевание скелетных мышц, которое ассоциируется с повышенной вероятностью неблагоприятных исходов, включая падения, переломы, физическую инвалидизацию и смертность.
Синдром - устойчивая совокупность ряда симптомов с единым патогенезом, выступающая как осложнение болезни или как важное звено патогенеза или как ее сущностное проявление.
Системное воспаление при циррозе печени - состояние, которое характеризуется повышенным уровнем белков острой фазы, маркеров активации эндотелия, провоспалительных цитокинов и их рецепторов, маркеров активации макрофагов, системного окислительного стресса и повышенной экспрессии поверхностных активирующих антигенов циркулирующими иммунными клетками; развивается в рамках иммунной дисфункции данного заболевания. Выделяют два фенотипа системного воспаления при циррозе печени: системное воспаление низкой степени выраженности (low-grade inflammation), которое не сопровождается тяжелой иммунной дисфункцией и органной недостаточностью и наблюдается преимущественно у пациентов с компенсированным циррозом печени; тяжелое системное воспаление (high-grade inflammation), которое сопровождается глубокими нарушениями со стороны иммунной системы, когда эффекторные клетки не способны реагировать на повторные стимулы патогенов, данный фенотип предшествует развитию острой печеночной недостаточности на фоне хронической.
Синдром системного воспалительного ответа (systemic inflammatory response syndrome, SIRS) - общая воспалительная реакция организма в ответ на тяжелое поражение вне зависимости от локализации очага при участии медиаторов воспаления с вовлечением практически всех систем организма. Диагноз синдрома системной воспалительного ответа правомочен при наличии как минимум двух следующих критериев: температура тела >= 38 °C или <= 36 °C; частота сердечных сокращений >= 90/мин; частота дыхательных движений >= 20/мин или парциальное давление двуокиси углерода в крови (CO2) <= 32 мм рт. ст.; лейкоцитоз >= 12 000/мкл или лейкопения <= 4000/мкл или сдвиг лейкоцитарной формулы влево или более 10% незрелых форм.
Состояние - изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи.
Спонтанный бактериальный перитонит - инфицирование асцитической жидкости в отсутствие какого-либо очевидного, локализованного в брюшной полости источника инфекции.
Уровень достоверности доказательств - степень уверенности в том, что полученный эффект от применения медицинского вмешательства является истинным.
Уровень убедительности рекомендаций - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
Хроническая болезнь почек - наднозологическое понятие, объединяющее всех пациентов с признаками повреждения почек и (или) снижением функции, оцениваемой по величине скорости клубочковой фильтрации, которые сохраняются в течение 3 месяцев и более.
Трансплантация печени - хирургическая операция, которая заключается в замене поврежденной печени целой и частью здоровой печени, полученной от другого человека, называемого донором.
Тромбоцитопения - снижение количества тромбоцитов в периферической крови < 150 x 109/л. Частота тромбоцитопении зависит от стадии цирроза, при декомпенсации заболевания достигает 86%.
Эффективное кровообращение - состояние системы кровообращения, при котором обеспечивается адекватная перфузия тканей и органов в соответствии с их метаболическими потребностями.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Цирроз печени (ЦП) - это диффузный процесс, характеризующийся фиброзом и трансформацией нормальной структуры печени с образованием узлов. ЦП представляет собой финальную стадию большинства хронических диффузных заболеваний печени. Естественное течение ЦП характеризуется бессимптомной стадией (компенсированный ЦП), которая сменяется стадией повышения давления в портальной системе и ухудшением функции печени, что приводит к появлению клинической картины в виде осложнений ЦП (стадия декомпенсации). В стадии компенсации у пациентов, как правило, хорошее качество жизни, и заболевание может протекать скрыто в течение нескольких лет. Стадия декомпенсации проявляется развитием выраженных клинических симптомов. К наиболее важным относятся следующие:
- асцит (с инфицированием асцитической жидкости или без него);
- кровотечение из варикозных вен (ВВ) пищевода и желудка (ВВПиЖ);
- печеночная энцефалопатия (ПЭ);
- гепаторенальный синдром с критериями острого повреждения почек (ГРС-ОПП);
- легочные осложнения (печеночный гидроторакс, гепатопульмональный синдром (ГПС), портолегочная гипертензия (ПЛГ));
- цирротическая кардиомиопатия;
- инфекционные осложнения (спонтанный бактериальный перитонит (СБП), мочевая инфекция, пневмония, инфекции мягких тканей и бактериемия) [1];
- саркопения.
Современные возможности по устранению/контролю над причиной повреждения печени привели к появлению нового термина - рекомпенсация ЦП, что предполагает нормальные печеночные тесты и отсутствие описанных выше клинических признаков декомпенсации в течение не менее 12 месяцев. Рекомпенсация ЦП - самый благоприятный исход заболевания [2].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Причинами развития ЦП являются вирусные гепатиты (B, C, D), алкоголь, метаболические нарушения (неалкогольный стеатогеатит, наследственный гемохроматоз, болезнь Вильсона, недостаточность 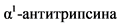 , муковисцидоз, галактоземия, гликогенозы, наследственная тирозинемия, наследственная непереносимость фруктозы, наследственная геморрагическая телеангиоэктазия, абеталипопротеинемия, порфирия и пр.), заболевания желчных путей (внепеченочная обструкция желчных путей, внутрипеченочная обструкция желчных путей: первичный билиарный холангит, первичный склерозирующий холангит, холангиопатия у детей), нарушение венозного оттока из печени: синдром Бадда-Киари, веноокклюзионная болезнь, тяжелая правожелудочковая недостаточность, влияние лекарств, токсинов, химикатов, обладающих гепатотоксическим эффектом, иммунные нарушения: аутоиммунный гепатит, болезнь "трансплантат против хозяина", другие редкие причины: сифилис, шистосоматоз, саркоидоз, гипервитаминоз витамином A. Если причину повреждения печени выявить не удалось, то ЦП называют криптогенным.
, муковисцидоз, галактоземия, гликогенозы, наследственная тирозинемия, наследственная непереносимость фруктозы, наследственная геморрагическая телеангиоэктазия, абеталипопротеинемия, порфирия и пр.), заболевания желчных путей (внепеченочная обструкция желчных путей, внутрипеченочная обструкция желчных путей: первичный билиарный холангит, первичный склерозирующий холангит, холангиопатия у детей), нарушение венозного оттока из печени: синдром Бадда-Киари, веноокклюзионная болезнь, тяжелая правожелудочковая недостаточность, влияние лекарств, токсинов, химикатов, обладающих гепатотоксическим эффектом, иммунные нарушения: аутоиммунный гепатит, болезнь "трансплантат против хозяина", другие редкие причины: сифилис, шистосоматоз, саркоидоз, гипервитаминоз витамином A. Если причину повреждения печени выявить не удалось, то ЦП называют криптогенным.
Формирование ЦП происходит в ответ на повреждение печеночной паренхимы и характеризуется избыточным отложением экстрацеллюлярного матрикса в результате увеличения синтеза его компонентов и уменьшения скорости их разрушения. Развитие фиброза сопровождается накоплением и отложением коллагена I, III, IV типов, ламинина, фибронектина, гликозамингликанов, протеогликанов, эластина и т.д. в пространстве Диссе, что приводит к потере фенестрации (капилляризации) эндотелиальных клеток синусоидов печени. Это вызывает нарушение процессов обмена между кровью, поступающей через систему воротной вены и гепатоцитами с развитием гипоксии и активацией фиброгенеза.
В результате активного сокращения синусоидальных звездчатых клеток и расширения пространства Диссе, заполненного коллагеновыми волокнами, увеличивается сопротивление току крови, поступающей по системе воротной вены, повышается давление в воротной вене, развивается синдром портальной гипертензии (ПГ) и формируются портокавальные шунты. При дальнейшем прогрессировании перечисленных изменений со временем происходит перестройка архитектоники печеночной ткани и развивается ЦП [3 - 7].
Прогноз жизни пациентов с ЦП во многом зависит от развития его осложнений, представленных выше [8].
Естественное течение ЦП включает две фазы, компенсации и декомпенсации. Компенсированный ЦП обычно характеризуется длительным бессимптомным течением. Декомпенсированный ЦП представляет собой быстро прогрессирующий патологический процесс, характеризующийся осложнениями ПГ и клиническими проявлениями нарушенной функции печени, у пациентов развивается асцит, кровотечение из варикозно расширенных вен, ПЭ и другие осложнения [8]. Пациенты становятся крайне восприимчивы к развитию бактериальных инфекций. Инфекционные осложнения в свою очередь утяжеляют течение ЦП, значительно повышают риск острой печеночной недостаточности на фоне хронической (ACLF) и сопровождаются высокой смертностью [9].
В качестве основной причины развития осложнений и декомпенсации ЦП рассматривается концепция артериальной вазодилатации. Гемодинамические нарушения, гипердинамический тип кровообращения, связанный с периферической артериальной вазодилатацией, приводят к периферической органной гипоперфузии с обязательным вовлечением почек и активацией ренин-ангиотензин-альдостероновой системы и задержкой натрия и воды [10].
В патогенезе ЦП и его осложнений важную роль играет системное воспаление, что подтверждается в первую очередь повышением уровня циркулирующих провоспалительных цитокинов и хемокинов на фоне бактериальной транслокации [11]. К бактериальной транслокации приводит нарушение синтеза белков плотных межклеточных контактов, локального иммунного ответа и собственно состава кишечного микробиома с экспансией микроорганизмов из толстой кишки в тонкую. Это предрасполагает к проникновению факультативных анаэробов и их продуктов - липополисахаридов во внутреннюю среду организма - в стенку кишечника, мезентериальные лимфатические узлы, портальный и системный кровоток. При ЦП наблюдается постоянное попадание патоген-ассоциированных молекулярных паттернов (Pathogen-associated molecular patterns, PAMPs) в системный кровоток и связывание их рецепторами иннатных иммунных клеток, что приводит к высвобождению провоспалительных молекул. При снижении барьерной функции кишечника, наблюдаемой при ЦП, факультативные анаэробы могут проникать в асцитическую жидкость, что влечет за собой развитие СБП. При ЦП снижается барьерная функция печени и данные микроорганизмы могут проникнуть в системный кровоток, вызывая развитие септицемии или септикопиемии [12].
Хронические заболевания печени на стадии ЦП служат основной причиной асцита (80% случаев). Кроме ЦП, другими причинами могут быть алкогольный гепатит тяжелого течения, синдром Бадда-Киари, гепатоцеллюлярная карцинома и канцероматоз брюшины, острый панкреатит. В патогенезе асцита при ЦП основную роль играют два звена: ПГ и спланхническая артериальная вазодилатация [13]. ПГ приводит к переполнению печеночных синусоидов, что сопровождается повышением давления во внутрипеченочных лимфатических сосудах и пропотеванию жидкости через капсулу печени в брюшную полость. Периферическая артериальная вазодилатация, возникающая преимущественно по спланхническому типу, обусловливает гипердинамический тип кровообращения у пациентов с ЦП и приводит к периферической органной гипоперфузии. В свою очередь, снижение эффективного кровообращения запускает активацию вазоконстрикторных механизмов (например, ренин-ангиотензин-альдостероновой системы, симпатической нервной системы и секреции вазопрессина) и задержку натрия и воды. Этому также способствует и нарушение катаболизма в печени гормонов и других биологически активных веществ, что обусловливает повышение сывороточных концентраций ренина, альдостерона, ангиотензина, вазопрессина. В результате происходит накопление свободной жидкости в брюшной полости, чему также способствует и гипоальбуминемия, снижающая онкотическое давление плазмы.
Кровотечение из ВВПиЖ - критическое состояние, возникающее при натяжении и разрыве стенки ВВ из-за повышения давления в портальной системе. При этом определяющим фактором в развитии кровотечения становится разница между давлением в воротной и нижней полой вене - печеночный венозный градиент давления. В норме он составляет 1 - 5 мм рт. ст. ПГ приводит к образованию портосистемных коллатералей, через которые часть кровотока из воротной вены шунтируется в системный кровоток в обход печени [14]. Клинически значимой ПГ становится при повышении портокавального градиента давления > 10 мм рт. ст. [15]. В настоящее время методика в большинстве центров в РФ не доступна.
В развитых странах около 90% случаев ПГ обусловлено ЦП. В развивающихся странах кроме ЦП частой причиной служит поражение мелких ветвей воротной вены при шистосомозе. Нецирротическая ПГ (вследствие воздействия других патогенетических факторов) составляет от 10 до 20% из всех случаев развития данного синдрома [7].
Варикозное кровотечение представляет собой грозное осложнение ЦП - второе по частоте после асцита, приводящее к декомпенсации заболевания и ассоциированное с высокой смертностью. Риск кровотечения из ВВПиЖ определяется степенью выраженности ВВ и наличием пятен васкулопатии при эзофагогастродуоденоскопии (ЭГДС). Васкуло- и гастропатия - это совокупность макроскопических проявлений, наблюдаемых в слизистой оболочке пищевода и желудка при ПГ, связанных с эктазией и дилатацией сосудов слизистого и подслизистого слоя без значительных воспалительных изменений [16 - 18].
Патофизиологической основой ПЭ служит некроз или функциональная недостаточность гепатоцитов, приводящая к снижению детоксицирующей функции печени и накоплению в системном кровотоке токсичных веществ, прежде всего аммиака, которые, проникая через гематоэнцефалический барьер в головной мозг, вызывают дисфункцию центральной нервной системы. Еще одним патофизиологическим механизмом развития ПЭ у пациентов с ЦП и клинически значимой ПГ служат естественные или хирургически сформированные портосистемные шунты, через которые токсины, образующиеся в желудочно-кишечном тракте, минуя печень, попадают в системный кровоток.
Основные причины гипераммониемии у пациентов с ЦП: потеря функционирующих перипортальных гепатоцитов, в которых происходит обезвреживание аммиака до конечного продукта - мочевины, выводимой из организма через почки; снижение способности перивенозных гепатоцитов связывать аммиак с образованием глутамина [19]. В ряде исследований установлена прямая корреляция между степенью гипераммониемии и тяжестью ПЭ, а снижение концентрации аммиака ассоциируется с клиническим улучшением [19, 20]. При этом у части пациентов с явной ПЭ концентрация аммиака может находиться в пределах референсных значений и диапазоны концентраций аммиака при разных стадиях ПЭ перекрываются [19, 21].
В патогенезе ПЭ, помимо ключевого фактора - гипераммониемии, рассматривается участие и других, таких как нейровоспаление, изменение нейротрансмиссии, передачи сигналов желчных кислот, микробиома, избыток марганца и некоторые другие [22].
Нарушение функции почек у пациентов с асцитом ассоциировано с высокой смертностью, а в ряде случаев сохраняется даже после успешной трансплантации печени (ТП) [23, 24]. Современные представления о повреждении почек при ЦП предполагают наличие признаков дисфункции почек, что выражается в повышении уровня креатинина в определенном временном контексте (на чем и основано определение острого повреждения почек (ОПП)), а также клинического фенотипа повреждения. К последнему как раз относится ГРС. Ранее существовавшей классификации, подразумевающей наличие 1-го и 2-го типа ГРС, в настоящее время на смену пришли понятия ГРС-ОПП и ГРС с критериями острой (ОБП) или хронической болезни почек (ХБП) (ГРС-неОПП) соответственно [25 - 27]. Чаще всего дифференциальный диагноз ОПП помимо ГРС проводится между преренальной азотемией, функциональным типом повреждения, полностью потенциально обратимым, и острым канальцевым некрозом (ОКН) - напротив, структурным типом повреждения с высоким риском трансформации в ХБП [28]. Так, например, для ГРС характерно отсутствие значительной протеинурии (не более 0,5 г/сут) и гематурии (не более 50 эритроцитов в поле зрения) в отличие от ОКН. Тем не менее на ранних этапах уровень протеинурии и гематурии может не позволить уверенно судить о том или ином клиническом фенотипе. Для преренальной азотемии наличие мочевого осадка вовсе не характерно [25]. Учитывая, что рутинное исследование молекулярных маркеров повреждения почек в РФ не доступно, при проведении дифференциального диагноза необходимо опираться на тщательный анализ клинической картины и данные анамнеза [29]. Таким образом, для диагноза ГРС-ОПП необходимо наличие критериев как ОПП, так и ГРС. К критериям ОПП относят повышение уровня сывороточного креатинина на >= 26,5 мкмоль/л от исходного за 48 ч и (или) на >= 50% от исходного за 7 суток и (или) снижение диуреза <= 0,5 мл/кг на протяжении >= 6 ч. Исходным уровнем креатинина в ряде случаев может считаться его наименьший уровень за последние 3 - 12 месяцев [30]. Главным образом это объясняется достаточно низким исходным уровнем креатинина у пациентов с ЦП ввиду наличия саркопении, усиления канальцевой секреции креатинина и увеличенным объемом внеклеточной жидкости на фоне отеков. Нередко и высокий уровень билирубина может влиять на лабораторную диагностику, искажая результаты исследования [31]. Поскольку ГРС представляет собой диагноз исключения, его критерии во многом связаны с отсутствием признаков других фенотипов повреждения:
1) наличие ЦП с асцитом;
2) отсутствие явных признаков других фенотипов ОПП (отсутствие шока, указаний на прием препаратов, связанных с нефротоксичностью (например, нестероидные противовоспалительные и противоревматические препараты (НПВП), рентгеноконтрастные средства, содержащие йод), отсутствие признаков структурных изменений паренхимы почек (нормальная картина по данным ультразвукового исследования (УЗИ) почек, протеинурия <= 0,5 г/сут, гематурия <= 50 эритроцитов в поле зрения). Однако важно отметить, что ГРС может развиваться на фоне предсуществующей нефропатии, ХБП, при которых наличие мочевого осадка не редкость.
3) отсутствие ответа или неполный ответ (снижения уровня креатинина) на отмену диуретиков и введение альбумина в достаточном объеме (1 г на 1 кг массы тела, не более 100 г/сут) на протяжении 2 суток; при этом трансфузии альбумина должны проводиться исключительно по показаниям (необходимость восполнения объема) и не должны выступать в качестве инструмента для диагноза ГРС [26, 30, 32 - 34].
Гипонатриемия разведения встречается в среднем у трети (30 - 35%) внутригоспитальных больных с ЦП и асцитом, ассоциирована с высокой смертностью, развитием неврологических осложнений и низкой выживаемостью после ТП. У пациентов с ЦП может развиваться как гипер-, так и гиповолемическая гипонатриемия. Чаще развивается гиперволемическая гипонатриемия (гиповолемия разведения, или дилюционная гипонатриемия), характеризующаяся увеличением объема внеклеточной жидкости, появлением асцита и периферических отеков. Она может возникать спонтанно, или в результате введения большого объема гипотонических растворов, или на фоне осложнений ЦП, сопровождающихся резким ухудшением эффективного кровообращения. Часто предрасполагающими факторами к развитию гиперволемической гипонатриемии считаются прием НПВП и выполнение объемного парацентеза без последующего введения высококонцентрированного альбумина [35 - 37]. В отличие от гиперволемической, гиповолемическая гипонатриемия развивается при уменьшении объема внеклеточной жидкости, чаще всего вследствие передозировки диуретиков [37, 38].
Хорошо изучена связь хронических заболеваний печени с дыхательными нарушениями и гипоксией. Основные легочные осложнения, возникающие у пациентов с хроническим заболеванием печени: печеночный гидроторакс, ГПС и портопульмональная гипертензия.
Печеночный гидроторакс (портоплевральный синдром) представляет собой скопление транссудата в плевральных полостях у пациентов с декомпенсированным ЦП в отсутствие заболевания сердца или легких. Асцитическая жидкость поступает из брюшной в плевральные полости (преимущественно справа) через расширенные поры в диафрагме в результате повышения внутрибрюшного давления и отрицательного внутригрудного давления на вдохе. Печеночный гидроторакс может приводить к тяжелой дыхательной недостаточности и может осложняться спонтанной бактериальной эмпиемой. Прогноз пациентов с портоплевральным синдромом плохой: их средняя выживаемость составляет около 8 - 12 месяцев [39].
Гепатопульмональный синдром (ГПС) определяют как нарушение легочной оксигенации, вызванное дилатацией сосудов легких и реже плевральными и внутрилегочными артериовенозными шунтами в рамках ПГ. ГПС чаще диагностируют у пациентов с ЦП и ПГ, иногда он возникает у пациентов с внепеченочной формой ПГ в отсутствие ЦП и даже у пациентов с острым гепатитом [40 - 42]. В основе ГПС лежат два механизма: а) дилатация прекапилляров/капилляров легких, уменьшение времени контакта крови с альвеолами (ускорение кровотока); б) формирование артериовенозных соединений и анатомического шунта, что приводит к недостаточной оксигенации крови.
Ключевые критерии ГПС:
- Печеночная недостаточность.
- ПГ, как внутри-, так и внепеченочная.
- Гипоксемия (PaO2 < 80 мм рт. ст. при дыхании воздухом, O2 21%).
- Повышенный альвеолярно-артериальный градиент кислорода (P(A-a)O2 > 15 мм рт. ст.).
- Подтверждение внутрилегочных шунтов с помощью эхокардиографии с контрастным усилением (появление микропузырьков воздуха в левых камерах сердца в течение 3 - 6 сердечных циклов указывает на дилатацию легочных сосудов).
Портопульмональная гипертензия (ППГ) может быть диагностирована у пациента с ПГ (в том числе нецирротической) в отсутствие других причин для повышения давления в легочных сосудах, в частности тромбоэмболии легочной артерии, хронического заболевания легких, хронической сердечной недостаточности. Согласно современной классификации легочной гипертензии ВОЗ, ППГ относится к 1-й группе [43]. Встречается у 2 - 5% пациентов с ПГ, выше - в группе пациентов, включенных в лист ожидания ТП, - до 8,5%. ППГ ассоциирована с плохим исходом после ТП: смертность пациентов со средним давлением в легочной артерии (ДЛА ср.) > 35 мм рт. ст. достигает 35%. Для диагностики используются результаты эхокардиографического исследования и чрезвенозной катетеризации правых отделов сердца [44].
Диагностические критерии ППГ:
- наличие клинически значимой ПГ;
- среднее давление в легочной артерии > 25 мм рт. ст. в покое;
- среднее давление заклинивания легочных капилляров < 15 мм рт. ст.
Подходы к лечению - такие же, как и при лечении легочной артериальной гипертензии [45].
К числу характерных инфекционных осложнений ЦП относится инфицированный асцит (как правило, СБП), выявляемый, по данным разных авторов, у 7 - 31% больных с асцитом. В случае поздней диагностики и отсроченного лечения смертность от СБП может превышать 90%. Большинство эпизодов инфицирования асцитической жидкости вызывается кишечными бактериями. В 70% возбудителями бактериального асцита служат грамотрицательные бактерии - Escherichia coli и Klebsiella spp., 10 - 20% составляют грамположительные кокки (Streptococcus pneumoniae), часто встречается Candida albicans. Анаэробную флору высевают у 3 - 4% пациентов. Описаны случаи, вызванные Listeria monocitogenes, а также микобактериями туберкулеза и грибами Cryptococcus neoformans. Развитие СБП всегда инициируется попаданием микроорганизмов в асцитическую жидкость. Бактерии проникают в брюшную полость двумя путями - транслокационным и гематогенным. В настоящее время большее значение придается пассажу микроорганизмов из кишечника, хотя патогенез возникновения СБП не до конца ясен. В патогенезе СБП существенную роль играет синдром избыточного бактериального роста (СИБР), часто встречающийся у больных ЦП. Этому может способствовать употребление алкоголя пациентами с алкогольным циррозом, снижение секреции соляной кислоты из-за назначения антисекреторных препаратов (препараты для лечения заболеваний связанных с нарушением кислотности), уменьшение секреции желчных кислот и увеличение времени кишечного пассажа [9, 46 - 48].
Риск бактериальных инфекций при ЦП обусловлен многими факторами, включающими нарушение функции печени, портосистемное шунтирование, СИБР в кишечнике и генетическую предрасположенность [33]. В основе последнего фактора лежит носительство мутаций в гене nucleotide-binding oligomerization domain containing 2 (NOD2). NOD2 экспрессируется в эпителиальных, а также в антигенпрезентирующих клетках, например, незрелых дендритных клетках, и в других мононуклеарах. NOD2-ассоциированные мутации могут вести к недостаточной активации ![]() (Nuclear Factor Kappa-Light-Chain-Enhancer of Activated B Cells), далее - к недостаточной элиминации транслоцирующихся бактерий и усилению бактериальной транслокации через множественные вторичные эффекты. Доказано, что СБП значительно чаще (p = 0,008) развивается у носителей мутаций NOD2 (OR 3,06) [49].
(Nuclear Factor Kappa-Light-Chain-Enhancer of Activated B Cells), далее - к недостаточной элиминации транслоцирующихся бактерий и усилению бактериальной транслокации через множественные вторичные эффекты. Доказано, что СБП значительно чаще (p = 0,008) развивается у носителей мутаций NOD2 (OR 3,06) [49].
К частым осложнениям ЦП относят саркопению. При ЦП нарушаются процессы поддержания мышечной массы в результате снижения синтеза белков и относительного преобладания их катаболизма (иными словами - гиперкатаболизма). Предрасполагающими факторами служат: нарушение белкового обмена, гипераммониемия, системное воспаление, снижение уровня тестостерона. Снижение детоксикационной функции печени при ЦП ведет к активации внепеченочной утилизации аммиака за счет синтеза глутамина в скелетных мышцах, субстратом для которого служат аминокислоты с разветвленной боковой цепью (BCAA - branched-chain amino acids). Соответственно, уменьшение мышечной массы происходит за счет снижения уровня аминокислот с разветвленной боковой цепью [50]. Миотоксическое действие аммиака реализуется через механизмы, включающие снижение синтеза белка, усиление аутофагии, протеолиза и митохондриальной окислительной дисфункции в скелетных мышцах, что ведет к нарушению сократительной функции мышц и потере мышечной массы [51, 52].
Снижение уровня тестостерона и одновременное увеличение соотношения эстрогенов и андрогенов при ЦП влияет на обмен мышечного белка, что приводит к подавлению дифференцировки миобластов в мышечные волокна, в результате чего развивается саркопения [50].
Кроме того, у пациентов с ЦП может наблюдаться дефицит питания, связанный с дисгевзией, анорексией хронических заболеваний, невкусной пищей из-за ограничения содержания соли, ПГ, которая способствует нарушению перистальтики кишечника, снижением всасывания питательных веществ и энтеропатией с потерей белка [53]. Дополнительные факторы, которые приводят к снижению потребления белка с пищей, включают снижение аппетита из-за асцита/метеоризма (механическое сдавление желудка), неадекватное ограничение потребления белка, госпитализацию с периодами голодания для диагностических и терапевтических процедур, ПЭ и желудочно-кишечные кровотечения [54]. Кроме того, на стадии декомпенсации ЦП наблюдается снижение физической активности пациента.
Тромбоцитопения - еще один серьезный симптом у пациентов с ЦП. Развитие данного осложнения связано в первую очередь с синдромом гиперспленизма, т.е. способностью, увеличенной вследствие ПГ селезенкой быстрее, чем это происходит в физиологических условиях, секвестрировать и депонировать клетки крови, в частности тромбоциты. Помимо секвестрации тромбоцитов увеличенной селезенкой, вклад в развитие тромбоцитопении вносит снижение выработки тромбопоэтина (ТПО) печенью. Дополнительно на снижение выработки ТПО могут влиять этиологические факторы заболевания печени, способные самостоятельно угнетать костномозговое кроветворение, например, вирус гепатита C, алкоголь и т.п.
Тромбоцитопения связана с повышенным риском кровотечений и смертности в данной группе пациентов. Ведение таких пациентов усложняется из-за нарушенного гемостаза и повышения риска кровотечений перед проведением инвазивных процедур или хирургических вмешательств. Риск кровотечений у пациентов с ЦП зависит от многих факторов: состояния системы гемостаза, степени тромбоцитопении, типа инвазивного вмешательства и т.д. [55].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ЦП служит одной из ведущих причин смерти во всем мире. По данным Всемирной организации здравоохранения (ВОЗ), в 2019 г. на долю ЦП пришлось 2,4% смертей в мире [56].
Согласно систематическому обзору 2017 г., предполагаемое число людей с компенсированным ЦП во всем мире составляет 112 млн, что соответствует глобальной распространенности данного заболевания: 1395 случаев на 100 тыс. чел. [57]. По данным того же обзора, число случаев декомпенсированного ЦП в мире увеличилось с 5,2 млн в 1990 г. до 10,6 млн в 2017 г. [57].
По некоторым оценкам, в 2019 г. число смертей, связанных с ЦП, во всем мире составило 1 472 000, что на 10% выше по сравнению с 2010 г. [58].
Основными причинами ЦП служат инфекции, вызванные вирусом гепатита B (HBV) и вирусом гепатита C (HCV), заболевания печени, связанные с употреблением алкоголя, и неалкогольная жировая болезнь печени (НАЖБП).
По данным систематического обзора (2017), доля случаев декомпенсированного ЦП, связанных с инфекцией HBV составила 28%, HCV - 25%, употреблением алкоголя - 23%, НАЖБП - 9% и другими причинами - 16% [57].
Распространенность инфекции HBV и HCV среди лиц с ЦП была оценена в большом систематическом обзоре и метаанализе 520 исследований (включая 1 376 503 исследования из 86 стран или территорий), опубликованных в период с 1993 по 2021 г. [59]. Во всем мире среди лиц с ЦП 42% были инфицированы HBV и 21% - HCV. Однако благодаря широкой программе вакцинаций HBV-инфекции и успешной противовирусной терапии HCV-инфекции наблюдается тенденция к снижению распространенности данных заболеваний в развитых странах.
Вероятнее всего, значительная часть пациентов с ЦП имеет более одной причины его развития, особенно учитывая растущую распространенность ожирения и увеличение потребления алкоголя на душу населения во многих странах мира. Необходимо учитывать новую концепцию множественной этиологии поражения печени и развития ЦП, которая в новой номенклатуре обозначается как метаболически ассоциированная жировая болезнь печени (МАЖБП) и МАЖБП в сочетании с избыточным употреблением алкоголя (МетАБП) [60].
В 2000 г. МАЖБП была определена как третья по частоте причина ЦП (14%), но в 2019 г. стала ведущей причиной ЦП (36%). Доля случаев ЦП, вызванных употреблением алкоголя, за период исследования увеличилась с 28 до 33%. Напротив, в 2000 г. HCV-инфекция была основной причиной ЦП (45%), но к 2019 г. этот показатель снизился (11%) [61].
Таким образом, в некоторых странах наблюдается тенденция к снижению доли пациентов с ЦП вирусной этиологии и рост числа пациентов с МАЖБП и МетАБП. Изменение доминирующей этиологии ЦП наблюдается преимущественно в европейских странах. Анализ данных по всем случаям госпитализации в Германии за период с 2005 по 2018 г. показал, что распространенность ЦП, ассоциированного с НАЖБП, увеличилась в четыре раза за исследуемый период [62]. Тем не менее в Германии потребление алкоголя оставалось основной причиной ЦП, на долю которого приходилось 52% случаев ЦП; на НАЖБП и НАСГ приходилось только 3 и 1% случаев соответственно [62].
Метаанализ 30 исследований показал, что глобальная распространенность острой печеночной недостаточности на фоне хронической среди пациентов, поступивших с декомпенсированным ЦП, составила 35% [63]. Употребление алкоголя было основной причиной хронических заболеваний печени у 45% людей с острой печеночной недостаточностью во всем мире.
По другим данным распространенность ЦП в Европе, ассоциированного с алкоголем, по-видимому, снижается, возможно, в ответ на меры общественного здравоохранения, такие как установление минимальной цены и повышение налогов на алкоголь, а вот распространенность ЦП, ассоциированного с НАЖБП/МАЖБП, в Европе растет [64].
Вклад в смертность от ЦП любой этиологии вносят его осложнения. Самое частое осложнение ЦП, асцит, приводит к снижению работоспособности пациента, социальной адаптации, часто ведет к госпитализации, к постоянной медикаментозной поддержке. Асцит часто служит причиной развития других осложнений, таких как СБП, рестриктивная дыхательная недостаточность и абдоминальные грыжи. Появление асцита значительно ухудшает прогноз жизни пациентов с ЦП. В течение первого года от момента появления асцита выживает от 45 до 82% больных, в течение пяти лет - менее 50% [65]. ВВПиЖ выявляются у 30 - 40% больных с компенсированным и у 60% - с декомпенсированным ЦП на момент диагностики ЦП, из них у каждого четвертого возникает кровотечение [1, 65, 66].
Заболеваемость и распространенность ПЭ зависят от тяжести печеночной недостаточности и наличия портосистемных шунтов [67, 68]. У пациентов с ЦП явная ПЭ, равно как и кровотечение из ВВПиЖ или асцит, служит признаком стадии декомпенсации заболевания [69]. Явная форма ПЭ на момент клинической манифестации ЦП диагностируется у 10 - 20% [70], в 10 - 50% случаев у пациентов с трансъюгулярным внутрипеченочным портосистемным шунтом (TIPS - transjugular intrahepatic portosystemic shunt) [71] у 30 - 40% развивается в течение заболевания и служит признаком декомпенсации. Скрытая форма диагностируется у 20 - 80% пациентов в зависимости от метода выявления [19, 72, 73, 74].
Риск развития СБП повышен у всех пациентов с ЦП и асцитом. Частота возникновения СБП варьирует в зависимости от исследуемой популяции: в течение 1 года у амбулаторных пациентов с декомпенсированным ЦП заболеваемость СБП достигает 3,5%, у госпитализированных пациентов с ЦП и асцитом она составляет 7 - 30%. По результатам многоцентрового межконтинентального исследования S. Piano et al. распространенность СБП составила 27% среди 1302 стационарных пациентов с ЦП и асцитом [75 - 77]. При этом половина случаев СБП приходится на только что госпитализированных пациентов, вторая половина развивается у пациентов во время госпитализации [78].
К другим инфекционным осложнениям ЦП относятся инфекции мочевыделительной системы, пневмония, инфекции кожи и мягких тканей, бактериемия. Они представляют собой гетерогенную группу по клиническому течению и прогнозу. Их частота составляет 25 - 30% среди госпитализированных пациентов с ЦП [12, 66, 79 - 81]. Развитие инфекционных осложнений у пациентов с ЦП ассоциировано с повышением смертности в течение месяца на 30% и в течение 12 месяцев - на 63% [80, 82].
Распространенность ГРС среди госпитализированных пациентов с ЦП варьирует от 16 до 29% по данным различных исследований и встречается чаще у пациентов с алкогольной этиологией заболевания [83].
Саркопения - частое осложнение ЦП, его общая распространенность при данном заболевании составляет 40,1% [84]. Саркопения служит независимым предиктором более длительного пребывания в стационаре, низкого качества жизни, повышенной заболеваемости и смертности у пациентов с ЦП. Помимо этого, саркопения - фактор риска развития других осложнений: асцита, ПЭ и т.д. [85, 86].
Среди пациентов с ЦП, страдающих саркопенией, примерно 20% имеют компенсированное заболевание, 80% декомпенсированных и до 100% кандидатов на ТП [87].
По данным отчета Европейской ассоциации по изучению печени, около 40% ТП в Европе проводится по поводу ЦП вирусной этиологии, 33% - алкогольной и еще 5% - вследствие сочетания этих этиологических факторов, при этом процентное соотношение может варьировать в зависимости от страны [65].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
K74.0 Фиброз печени.
K74.1 Склероз печени.
K74.2 Фиброз печени в сочетании со склерозом печени.
K74.4 Вторичный билиарный цирроз.
K74.5 Билиарный цирроз неуточненный.
K74.6 Другой и неуточненный цирроз печени.
K72 Печеночная недостаточность, не классифицированная в других рубриках.
K72.0 Острая и подострая печеночная недостаточность.
K72.1 Хроническая печеночная недостаточность.
K72.9 Печеночная недостаточность неуточненная.
K76.7 Гепаторенальный синдром.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Чаще всего для оценки тяжести состояния пациентов с ЦП применяется классификация по Child-Turcotte-Pugh (таблица 1, приложение Г).
Другая оценочная шкала - MELD (Model for End-stage Liver Disease) - изначально была разработана в 2002 г. для определения очередности ТП в листе ожидания (приложение Г), в настоящее время также используется для оценки тяжести ЦП.
Еще более точным методом оценки тяжести состояния больного ЦП и его очередности в листе ожидания пересадки печени является модификация этой шкалы - MELD-Na, где наряду с вышеуказанными показателями учитывается сывороточный уровень натрия. Учитывая, что пациенты с терминальной стадией хронического заболевания печени представляют крайне нестабильную категорию больных с частыми декомпенсациями и развитием тяжелых осложнений, возникает необходимость регулярного пересчета MELD [1, 65].
Портальная гипертензия может развиваться при различных патологических процессах, сопровождающихся повышением давления в системе воротной вены. В соответствии с анатомическим расположением препятствия кровотоку форма ПГ может быть классифицирована как подпеченочная (с вовлечением селезеночной, брыжеечной или воротной вены), внутрипеченочная (заболевания печени) и надпеченочная (заболевания, приводящие к нарушению венозного оттока от печени) [18, 88].
Классификация ПГ по уровню портального блока
1. Надпеченочная:
- тромбоз/сужение печеночных вен и обструкция нижней полой вены (синдром Бадда-Киари, инвазия опухолью, аномалия развития: мембрана в просвете нижней полой вены);
- заболевания сердечно-сосудистой системы (констриктивный перикардит, выраженная трикуспидальная регургитация).
2. Внутрипеченочная:
- пресинусоидальная:
- болезнь Рандю-Ослера;
- врожденный фиброз печени;
- тромбоз ветвей портальной вены (тяжелый бактериальный холангит, злокачественные новообразования);
- первичный склерозирующий холангит;
- гранулематозы (шистосоматоз, саркоидоз, туберкулез);
- хронический вирусный гепатит;
- первичный билиарный холангит;
- миелопролиферативные заболевания;
- нодулярная регенераторная гиперплазия;
- идиопатическая (нецирротическая) ПГ/портосинусоидальное сосудистое заболевание;
- болезнь Вильсона;
- гемохроматоз;
- поликистоз;
- амилоидоз;
- воздействие токсичных веществ (медь, мышьяк, 6-меркаптопурин);
- синусоидальная:
- все случаи ЦП;
- острый алкогольный гепатит;
- тяжелый вирусный гепатит;
- острая жировая печень беременных;
- интоксикация витамином A;
- системный мастоцитоз;
- печеночная пурпура;
- цитотоксичные лекарства.
- постсинусоидальная:
- веноооклюзионная болезнь;
- алкогольный центролобулярный гиалиновый склероз;
3. Подпеченочная:
- тромбоз воротной вены и кавернозная трансформация воротной вены;
- тромбоз селезеночной вены;
- висцеральная артериовенозная фистула;
- идиопатическая тропическая спленомегалия;
Классификация асцита
В практической работе очень удобна классификация, предложенная Международным клубом по изучению асцита (International Club of Ascites, ICA)), которая включает три степени в зависимости от его выраженности [1, 65, 66]:
- 1-я степень: жидкость в брюшной полости определяется только при ультразвуковом исследовании;
- 2-я степень проявляется симметричным увеличением живота;
- 3-я степень представляет собой напряженный асцит.
Если правильное назначение мочегонных препаратов не приводит к уменьшению асцита, то его называют резистентным, что встречается в 10% случаев среди пациентов с ЦП и асцитом. Выживаемость таких пациентов в течение 1 года не превышает 50%.
Диагностические критерии резистентного асцита
1. Длительность лечения: интенсивная терапия диуретическими препаратами (максимальные дозировки: спиронолактон 400 мг/сут, фуросемид** 160 мг/сут) в течение 1 недели при соблюдении диеты с содержанием соли до 5 г/сут);
2. Отсутствие ответа на лечение: снижение массы тела менее 0,8 кг каждые 4 дня;
3. Ранний рецидив асцита: возврат асцита 2 - 3-й степени в течение 4 недель от проведения лечебно-диагностического лапароцентеза;
4. Осложнения, связанные с приемом диуретических препаратов:
- ПЭ, развившаяся в отсутствие других провоцирующих факторов;
- почечная недостаточность вследствие диуретической терапии: повышение уровня сывороточного креатинина на 100% со значением > 2 мг/дл у пациентов, которые ответили на лечение диуретиками;
- гипонатриемия - снижение уровня сывороточного Na более чем на 10 ммоль/л до уровня менее 130 ммоль/л (ряд авторов указывают пороговое значение 135 ммоль/л),
- гипокалиемия - снижение уровня сывороточного К менее 3,5 ммоль/л;
- гиперкалиемия - повышение уровня сывороточного К более 5,5 ммоль/л [1, 65].
Классификация варикозных вен
Варикозные вены классифицируются по степени выраженности (таблица 1) и по наличию пятен васкулопатии (наиболее информативно для определения риска кровотечения), по локализации (для определения лечебной тактики).
Таблица 1. Классификация ВВ по степени выраженности по N. Soehendra [88].
Степень ВРВП
Годовой риск кровотечения в зависимости от диаметра ВРВП
Риск смертности при кровотечении
1 степень < 5 мм
5 - 7%
15 - 20%
2 степень - 5 - 10 мм
10 - 15%
20 - 30%
3 степень > 10 мм
30 - 50%
30 - 50% (до 60% без лечения)
Классификация варикозных вен по локализации [89, 90]
- I тип - гастроэзофагеальные ВВПиЖ с распространением на кардиальный и субкардиальный отделы малой кривизны желудка;
- II тип - гастроэзофагеальные ВВПиЖ от эзофагокардиального перехода по большой кривизне по направлению к дну желудка;
- III тип - изолированные ВВ желудка без ВВ пищевода, варикозная трансформация вен фундального отдела желудка;
- IV тип - эктопические узлы тела, антрального отдела желудка, двенадцатиперстной кишки [88 - 90].
Классификация васкулопатии
- легкая - небольшие участки розового цвета, окруженные белым контуром;
- средняя - плоские красные пятна в центре розовой ареолы;
- тяжелая - сочетание с точечными кровоизлияниями [89, 90].
В англоязычной литературе для описания ВВ желудка чаще всего используется классификация S.K. Sarin et al., согласно которой их разделяют по локализации и соотношению с пищеводом. По этому принципу выделяют гастроэзофагеальные (GOV - gastroesophageal varices) и изолированные ВВ желудка (IGV - isolated gastric varices). Среди гастроэзофагеальных ВВ дополнительно выделяют еще два подтипа: с расположением по малой кривизне желудка (GOV1) и по направлению к дну желудка (GOV2). Изолированные ВВ желудка также подразделяют на два подтипа: расположенные в области дна желудка (IGV1) и эктопические вариксы в любом отделе желудка (IGV2). Кровотечения из ВВ желудка встречаются реже, чем из ВВ пищевода, но протекают тяжелее [91].
Классификация ПЭ
Согласно существующей классификации, ПЭ подразделяют в зависимости от типа, длительности и клинических характеристик. Минимальную ПЭ рассматривают как отдельную форму.
Выделяют несколько типов ПЭ в зависимости от причин, которые привели к ее развитию:
- тип A - возникающий при острой печеночной недостаточности;
- тип B - обусловленный портосистемным шунтированием в отсутствие хронической печеночной недостаточности;
- тип C - наиболее распространенный, обусловленный ЦП [92].
По тяжести клинических проявлений ПЭ делится на две формы: скрытая (минимальная ПЭ и ПЭ 1-й степени) и явная ПЭ. Минимальная ПЭ (ранее носившая название латентной ПЭ) характеризуется отсутствием субъективной и объективной клинической симптоматики. Своевременное распознавание этой формы важно по следующим причинам:
1) служит независимым предиктором явной ПЭ, частота минимальной ПЭ достигает 32 - 85% вне зависимости от этиологии заболевания печени;
2) минимальная ПЭ опасна неадекватной реакцией пациента в экстремальных условиях, например, при вождении автомобиля, что сопряжено с повышенным риском создания аварийных ситуаций [92, 93];
3) минимальная ПЭ ухудшает физическое функционирование пациента и снижает качество его жизни [19];
В настоящее время стадирование ПЭ проводится согласно модифицированным критериям West Haven и ISHEN (International Society of Hepatic Encephalopathy and Nitrogen Metabolism), что представлено в таблице 2 [94]. Определение стадии ПЭ входит в систему оценки тяжести ЦП по классификации Child-Pugh и необходимо для оценки жизненного прогноза пациента. Необходимо помнить, что после появления клинически выраженной (явной) ПЭ в течение 1 года выживает 42% больных, а в течение 3 лет - всего 23% [1, 65, 74, 94].
Таблица 2. Стадии печеночной энцефалопатии согласно модифицированным критериям West Haven и ISHEN
Критерии West Haven, включая минимальную печеночную энцефалопатию
ISHEN
Описание
Предлагаемые оперативные критерии
Комментарий
Печеночной энцефалопатии нет
Нет симптомов и анамнеза печеночной энцефалопатии
Скорость психомоторных функций по результатам психометрического/нейропсихологического тестирования или результаты нейрофизиологического исследования в пределах референсных значений
Минимальная
Скрытая
Клинических признаков печеночной энцефалопатии нет. Снижена скорость психомоторных функций по результатам психометрического/нейропсихологического тестирования или выявлены изменения при проведении нейрофизиологического исследования.
Снижена скорость психомоторных функций по результатам психометрического/нейропсихологического тестирования или изменены результаты нейрофизиологического исследования
Нет универсальных критериев диагностики.
Требуются локальные стандарты и опытный оператор
1-я стадия
Дефицит понимания.
Эйфория или тревога.
Снижение концентрации внимания.
Нарушение сложения или вычитания.
Изменение ритма сна.
Ориентация во времени и пространстве сохранена (см. ниже). При клиническом обследовании или лицами, осуществляющим уход, обнаруживаются некоторые когнитивные/поведенческие нарушения по отношению к обычному состоянию пациента
Клинические данные обычно не воспроизводимы
2-я стадия
Явная
Вялость или апатия.
Дезориентация во времени.
Явное изменение личности.
Неадекватное поведение.
Диспраксия.
Астериксис.
Дезориентация во времени (неправильно названы как минимум три из следующих критериев: текущая дата, день недели, месяц, время года или год) +/- упомянутые симптомы предыдущей стадии
Клинические данные варьируют, но в некоторой степени воспроизводимы
3-я стадия
Сонливость до полуступора.
Сохранность реакции на раздражители.
Спутанность сознания.
Выраженная дезориентация. Неадекватное поведение.
Дополнительно к дезориентации во времени появляется дезориентация в пространстве (неправильно названы как минимум три из следующих признаков: страна, область (или регион), город или место)
Клинические данные в некоторой степени воспроизводимы
4-я стадия
Кома
Отсутствие реакции даже на болевые раздражители
Клинические данные обычно воспроизводимы
По времени развития ПЭ можно разделить на следующие формы:
- эпизодическая ПЭ, для которой характерны интермиттирующие нейропсихические нарушения;
- фульминантная (молниеносная) ПЭ, которая характеризуется быстро нарастающими клиническими проявлениями в условиях фульминантной печеночной недостаточности;
- персистирующая ПЭ, наблюдающаяся преимущественно у больных с выраженными портосистемными коллатералями, в том числе созданными в результате хирургического вмешательства. У пациентов с такой формой ПЭ помимо типичной психоневрологической симптоматики наблюдаются постепенно проявляющиеся симптомы миелопатии: атаксия, хореоатетоз, параплегия. Эти нарушения обычно необратимы и ведут к церебральной атрофии и деменции;
- рецидивирующая ПЭ, при которой рецидивы клинических проявлений происходят с интервалом в 6 месяцев или чаще.
В соответствии с наличием провоцирующих факторов ПЭ подразделяется:
- на спонтанную ПЭ, которая развивается в отсутствие какого-либо доказанного провоцирующего фактора;
- спровоцированную ПЭ - в этом случае следует указать провоцирующие факторы (таблица 3).
Таблица 3. Провоцирующие факторы ПЭ
Группа факторов
Характеристика
Повышение поступления белка
Богатая белком диета <*> (7 - 10%).
Желудочно-кишечное кровотечение (25 - 30%)
Повышение катаболизма белка
Дефицит альбумина, обширные гематомы, лихорадка, хирургические вмешательства, инфекции, гиперглюкагонемия
Факторы, снижающие детоксицирующую функцию печени
Алкоголь, лекарства, экзо- и эндотоксины, инфекция (10 - 18%), запор
Повышение уровня фактора некроза опухоли - ![]() (tumor necrosis factor alpha)
(tumor necrosis factor alpha)
Алкогольный гепатит тяжелого течения. Бактериальная транслокация
Связывание ГАМК-рецепторов
Производные бензодиазепина, барбитураты и их производные, пиперазиновые и пиперидиновые производные фенотиазина (10 - 15%)
Метаболические нарушения
Ацидоз, азотемия (25 - 30%), гипогликемия
Электролитные нарушения
Снижение концентрации калия, натрия, магния, повышение уровня марганца в сыворотке крови
Циркуляторные нарушения
Гиповолемия, гипоксия
Подавление синтеза мочевины
Диуретики (25 - 30%), снижение уровня цинка, ацидоз
--------------------------------
<*> Дефицит белка в рационе пациентов с ЦП также нежелателен, так как провоцирует прогрессирование саркопении, нарастание ПЭ и тем самым ухудшает прогноз пациентов. Оптимальным считается поступление 1,2 - 1,5 г белка на 1 кг массы тела в сутки [1, 19, 65, 95].
Классификация гипонатриемии при ЦП
1. По времени возникновения:
- острая (развитие признаков произошло в срок < 48 ч);
- хроническая (развитие признаков произошло в срок > 48 ч).
2. По уровню сывороточного натрия:
- легкая (уровень сывороточного Na 126 - 135 ммоль/л);
- средней степени тяжести (уровень сывороточного Na 120 - 125 ммоль/л);
- тяжелая (Na <= 120 ммоль/л).
3. По волемическому статусу:
- гиповолемичекая;
- гиперволемическая.
4. По выраженности клинических симптомов:
- бессимптомная/средней степени тяжести (общая слабость, головная боль, тошнота);
- тяжелая (кома, судороги, респираторный дистресс).
При ЦП встречаются различные варианты гипонатриемии, однако чаще всего - хроническая гиперволемическая гипонатриемия [96].
Классификация инфекционных осложнений ЦП
1. По времени возникновения выделяют:
- внебольничную инфекцию (community-acquired) - диагноз установлен в первые 48 - 72 ч от момента поступления пациента без его госпитализации в предшествующие 6 месяцев (30% госпитализированных больных). Чаще представлена СБП и мочевой инфекцией;
- связанную с оказанием медицинской помощи (healthcare-associated) - диагноз установлен в первые 48 - 72 ч от момента поступления пациента, имевшего не менее 2 дней госпитализации в предшествующие 6 месяцев (30% госпитализированных больных). Также чаще представлена СБП и мочевой инфекцией;
- нозокомиальную инфекцию - диагноз установлен после 48 - 72 ч от момента поступления пациента (40% госпитализированных). Преимущественно проявляется в виде мочевой и C. difficile ассоциированной инфекции [9, 66, 97].
2. По ответу на терапию выделяют бактерии со следующими видами антибиотикорезистентности:
- бактерии с широкой лекарственной устойчивостью (Extensive Drug Resistant) - резистентностью к одному препарату и более в двух и менее антимикробных категориях;
- бактерии с множественной лекарственной устойчивостью (Multiple Drug Resistance, MDR) - это приобретенная резистентность микроорганизма к одному препарату и более в трех и более антимикробных категориях. Факторы риска: наличие инфекции, вызванной MDR-штаммами в течение предыдущих 6 месяцев; применение бета-лактамных антибактериальных препаратов (пенициллины) и других бета-лактамных антибактериальных препаратов в течение предыдущих 3 месяцев; длительный профилактический прием фторхинолонов;
- бактерии с полирезистентностью - устойчивость ко всем антимикробным препаратам (антибактериальным препаратам системного действия) во всех категориях;
- энтеробактерии, продуцирующие бета-лактамазы расширенного спектра действия (ESBL, Extended spectrum beta-lactamase producing Enterobacteriaceae);
- ванкомицин-резистентные энтерококки (VRE, vancomycin-resistant enterococci) [47, 97, 98].
Инфицирование асцитической жидкости (см. таблицу 4) подразделяется на собственно СБП, при котором обязательно обнаружение нейтрофилов более 250 в 1 мм3 независимо от результата посева асцитической жидкости; бактериальный асцит, при котором количество нейтрофилов менее 250 в 1 мм3, но имеется положительный посев асцитической жидкости [1, 46, 65, 66]. Вторичный бактериальный перитонит (очаг инфекции локализован в брюшной полости) может быть заподозрен при получении полимикробной культуры посева асцитической жидкости в сочетании с нейтрофилами асцитической жидкости >= 250 в 1 мм3 [99]. Этот вариант инфицирования асцитической жидкости возникает в случае перфорации кишки, таким пациентам требуется срочное проведение рентгенологического исследования или КТ органов брюшной полости и при необходимости хирургическое вмешательство. Полимикробный бактериальный асцит - ятрогенное состояние, вызванное повреждением кишечника во время выполнения парацентеза. Результат посева положительный, но полимикробный бактериальный асцит обычно не вызывает увеличения содержания нейтрофилов и разрешается самостоятельно. Спонтанная бактериальная эмпиема плевры возникает у пациентов с гидротораксом в отсутствие пневмонии. Диагноз устанавливается при высевании микрофлоры и количестве нейтрофилов >= 250 в 1 мм3 в плевральной жидкости либо при негативном результате посева и количестве нейтрофилов >= 500 в 1 мм3. Дальнейшая тактика ведения этой группы пациентов такая же, как при СБП [99, 100].
Таблица 4. Варианты инфицированного асцита (по P. Gines)
Тип инфекции
Количество нейтрофилов в 1 мм3 асцитической жидкости
Результат посева асцитической жидкости
СБП
>= 250
Положительный/отрицательный
Бактериальный асцит
< 250
Положительный
Вторичный бактериальный перитонит
>= 250
Положительный (полимикробный)
Полимикробный бактериальный асцит
< 250
Положительный
Классификация нарушений функции почек
Острое повреждение почек (ОПП) - это повышение уровня сывороточного креатинина на >= 0,3 мг/дл (>= 26,5 мкмоль/л) от исходного уровня за 48 ч или на >= 50% (в 1,5 раза выше исходного уровня) за 7 дней и (или) снижение диуреза <= 0,5 мл/кг на протяжении >= 6 ч.
Исходным уровнем креатинина также в ряде случаев может считаться наименьший уровень за последние 3 - 12 месяцев. ОПП может возникать на фоне ОБП и ХБП [36].
Острая болезнь почек (ОБП) - этап патологического континуума повреждения почек, соответствующий ОПП, которое не разрешилось в течение одной недели. Помимо этого, к критериям ОБП относится снижение скорости клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2, или снижение СКФ на >= 35%, или повышение уровня креатинина на 50% от исходного на протяжении менее 3 месяцев [37].
ХБП - изменения функции и (или) структуры почек, сохраняющиеся на протяжении более 3 месяцев, которые влияют на состояние здоровья. Критериями ХБП служат снижение СКФ < 60 мл/мин/1,73 м2 и наличие маркеров повреждения почек (для диагноза должен быть один и более):
- альбуминурия;
- наличие мочевого осадка;
- персистирующая гематурия;
- электролитные и другие нарушения, связанные с тубулопатией;
- изменения паренхимы почек, обнаруженные при морфологическом исследовании;
- структурные изменения, выявленные при визуализирующих методах исследования;
- пересадка почки в анамнезе [101, 102].
Стадии ОПП
1A - увеличение креатинина >= 0,3 мг/дл (26,5 мкмоль/л) в пределах 1,5 мг/дл (133 мкмоль/л) по сравнению с исходным уровнем;
1B - то же, но >= 1,5 мг/дл (133 мкмоль/л);
2 - увеличение креатинина в 2 раза по сравнению с исходным;
3 - увеличение уровня креатинина в 3 раза и более исходного, либо на >= 4,0 мг/дл (353,6 мкмоль/л) и более, либо начало заместительной почечной терапии.
Варианты ОПП при ЦП
1. Преренальное ОПП - самая частая причина ОПП у госпитализированных пациентов с декомпенсированным ЦП (до 45% всех случаев). Основная причина - это гиповолемия на фоне острого желудочно-кишечного кровотечения, другой кровопотери, рвоты, диареи как инфекционного генеза, так и на фоне передозировки лактулозой**, передозировки мочегонными препаратами, проведения высокообъемного лапароцентеза (более 5 л) без адекватного замещения удаленной асцитической жидкости 20% раствором альбумина [103, 104].
2. Постренальное ОПП встречается очень редко у пациентов с ЦП (< 1% всех вариантов ОПП).
3. Ренальное ОПП наблюдается в 43% случаев и представлено, согласно критериям Консенсуса Международного клуба по изучению асцита (International Club of Ascites, ICA) (адаптация KDIGO - Kidney Disease: Improving Global Outcomes), двумя вариантами:
- ОКН (на фоне применения нефротоксичных препаратов, НПВП, рентгеноконтрастных средств, содержащих йод при компьютерной томографии, токсичного воздействия желчных кислот и др.);
- ГРС с критериями ОПП (ГРС по типу ОПП) [25, 103].
Классификация тромбоцитопении
- легкая: количество тромбоцитов < 150, но > 100 x 109/л;
- умеренно выраженная: количество тромбоцитов > 50, но < 100 x 109/л;
- тяжелая: количество тромбоцитов < 50 x 109/л [105].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
На стадии компенсации ЦП имеет неспецифическую клиническую картину и может проявляться астеническим синдромом, диспепсией.
Декомпенсированный ЦП характеризуется наличием одного или нескольких клинических признаков и синдромов: желтуха, отечно-асцитический синдром, ПЭ, геморрагический синдром, СБП, ГРС-ОПП, изменения со стороны сердечно-сосудистой, дыхательной системы, саркопения.
Отечно-асцитический синдром проявляется возникновением симметричных отеков нижних конечностей и наличием или отсутствием (при асците 1-й степени по ICA) видимого увеличения живота в объеме [106].
Кровотечения из ВВПиЖ при ЦП, как правило, массивные, и поэтому их клинические проявления достаточно яркие и складываются из общих симптомов, свойственных любой кровопотере (резкая слабость, головокружение, потеря сознания, выраженная бледность кожных покровов, частый пульс слабого наполнения и напряжения, снижение артериального давления и т.д.), и симптомов, характерных для кровотечения в просвете желудочно-кишечного тракта: рвота свежей или реже видоизмененной кровью ("кофейная гуща") и черный дегтеобразный стул (мелена) [106].
Печеночная энцефалопатия характеризуется широким спектром проявлений, начиная от клинически бессимптомных форм (минимальная ПЭ) до коматозного состояния. Ключевым маркером ПЭ служит изменение уровня и содержания (наполненность сознания различными элементами психической деятельности) сознания [106].
Гиперволемическая гипонатриемия. У больных ЦП гиперволемическая гипонатриемия, как правило, развивается в течение нескольких дней - недель, хотя возможны и острые состояния. У большинства пациентов уровень натрия сыворотки крови колеблется от 125 до 130 ммоль/л, однако у части больных этот показатель может снижаться до 110 - 125 ммоль/л. Клинически гипонатриемия проявляется тошнотой, рвотой, апатией, анорексией, летаргией, судорогами, дезориентацией, головной болью. Неврологические симптомы, возникающие при этом состоянии, бывают трудно отличимы от проявлений ПЭ [75].
СБП у пациентов с ЦП. Клиническая картина СБП включает боль в животе различной интенсивности без четкой локализации, болезненность при пальпации живота, лихорадку и нарастание ПЭ без видимых провоцирующих факторов. У 8 - 10% пациентов определяется положительный симптом раздражения брюшины. Ригидность брюшных мышц редко встречается при напряженном асците. Лихорадка отмечается у 50% больных с СБП и может быть связана с септическим шоком, нередко имеется повышение температуры тела только до субфебрильных цифр. У 10 - 15% пациентов возникают рвота, диарея, признаки пареза кишечника. У ряда больных заболевание манифестирует признаками септического шока с выраженной гипотензией, тахикардией, олигурией. Вместе с тем у 10 - 33% больных начальная симптоматика отсутствует и заболевание выявляют случайно при исследовании асцитической жидкости. Это может быть связано с тем, что обычно у таких больных преобладает клиника ПЭ, что маскирует другую симптоматику [66, 78, 93, 107]. Пациентам с ЦП необходима оценка признаков SIRS для исключения возможности инфекционного осложнения и уточнения жизненного прогноза [108].
Гепаторенальный синдром. Специфических симптомов ГРС нет. В то же время клинические признаки, которые позволяют рассматривать ГРС как основную причину ОПП, включают асцит (основные звенья патогенеза асцита и ГРС совпадают), в ряде случаев может встречаться олиго-/анурия, предвосхищающая повышение уровня креатинина [1, 36, 65, 66].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза. Диагноз ЦП устанавливается на основании клинических и лабораторно-инструментальных признаков внутрипеченочной ПГ с признаками печеночной недостаточности и без них. Характерная морфологическая картина - тяжелый фиброз с изменением архитектоники печени и формированием узлов. Однако в настоящее время чрескожная биопсия печени в диагностике ЦП уже не занимает прежнее ключевое место, она выполняется в единичных случаях по индивидуальным показаниям. Нередко биопсия печени проводится в рамках клинических исследований [109 - 111].
Определение жесткости ткани печени оказывает помощь в установлении диагноза компенсированного ЦП. С широким внедрением метода транзиентной эластографии в клиническую практику и разработкой других неинвазивных методов определения фиброза в консенсусе Baveno VII [2] международными экспертами была предложена концепция хронического компенсированного заболевания печени на продвинутой стадии (compensated Advanced Chronic Liver Disease, cACLD), куда отнесли пациентов с тяжелым фиброзом (F3) и компенсированным ЦП. Разграничение этих состояний в большинстве случаев не играет большой роли, поскольку прогноз таких пациентов одинаков. Принципиальное значение для диагностики cACLD имеет показатель жесткости ткани печени по данным транзиентной эластографии: значения от 10 до 15 кПа делают этот диагноз вероятным; значения > 15 кПа - высоко вероятным. Такой подход в оценке прогноза прост и удобен в клинической практике. Однако выполнение эластографии требует соблюдения целого ряда условии, в противном случае результат может быть искажен в сторону его завышения, как при асците, высоком уровне сывороточных трансаминаз; исследовании, выполненном не натощак, неопытным оператором и др.
Драйвером декомпенсации ЦП или хронического компенсированного заболевания печени на продвинутой стадии служит ПГ. Для ее точной оценки по-прежнему используется печеночный венозный градиент давления - инвазивная процедура, которая выполняется в отдельных случаях в высокоспециализированных учреждениях. Повышение печеночного венозного градиента давления > 5 мм рт. ст. служит индикатором синусоидальной ПГ. Повышение данного показателя > 10 мм рт. ст. отражает развитие клинически значимой ПГ, что ассоциируется с риском появления осложнений ЦП. В настоящее время предложены неинвазивные методы оценки печеночного венозного градиента давления, однако они еще не валидизированы для широкой клинической практики. Подробно познакомиться с ними можно в документе, который опубликован по итогам соглашения экспертов Baveno VII [2].
2.1 Жалобы и анамнез
Компенсированный ЦП, как правило, протекает бессимптомно. Пациенты могут предъявлять неспецифические жалобы: общая слабость, снижение или потеря аппетита, снижение массы тела и мышечной массы, ощущение тяжести в верхней половине живота.
При декомпенсированном ЦП появляются жалобы на увеличение в размерах живота, отеки ног, желтуху, легкое появление синяков на теле, носовые кровотечения, тремор рук, бессонницу ночью и сонливость в дневные часы, заторможенность, изменение сознания. Характерными клиническими проявлениями саркопении у пациентов с ЦП служат слабость (общая и мышечная), снижение работоспособности. В основе лежит уменьшение мышечной массы, силы и функции. Потеря массы тела также может быть одним из проявлений саркопении, но не относится к патогномоничным признакам, поскольку саркопения встречается и у пациентов с метаболической этиологией заболевания с избыточной массой тела и (или) ожирением. У женщин детородного возраста одним из первых клинических проявлений ЦП могут быть нарушения менструального цикла вплоть до аменореи, а у мужчин - эректильная дисфункция и снижение либидо. Кожный зуд - частый признак внутри- и внепеченочного холестаза, наиболее характерен для первичного билиарного холангита и первичного склерозирующего холангита (в настоящих рекомендациях не рассматриваются).
При сборе анамнеза у пациентов с ЦП необходимо активно расспрашивать о переливании крови (особенно до 1990 г.), внутривенном введении лекарств или наркотиков, пирсинге, татуировках, особенностях половой жизни, контактах с пациентами с вирусными гепатитами, профессиональных вредностях, характере потребления алкогольных напитков, недавней инсоляции, приеме лекарственных препаратов и биологически активных добавок, семейном анамнезе. Необходимо выявлять наличие сопутствующих и сочетанных заболеваний, которые так или иначе могут быть ассоциированы с повреждением печени: сахарный диабет, экзогенно-конституциональное ожирение, артериальная гипертензия, гиперлипидемия, (факторы риска жировой болезни печени). Следует уточнить наличие аутоиммунных заболеваний (аутоиммунный тиреоидит, воспалительные заболевания кишечника, витилиго, синдром Шегрена и суставной синдром), которые часто сочетаются с заболеванием печени аутоиммунной природы
Курение - доказанный фактор риска прогрессирования вирусного и алкогольного ЦП [1, 65].
2.2 Физикальное обследование
- Всем пациентам с подозрением на ЦП рекомендован прием (осмотр, консультация) врача-гастроэнтеролога первичный, а при его отсутствии - врача-терапевта, с целью верификации диагноза [1, 507, 510].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Физикальное исследование пациентов с ЦП проводится согласно общепринятому плану и включает общий осмотр, оценку общего состояния, сознания, кожных покровов и далее - основных органов и систем.
Пациенту с ЦП необходимо измерить температуру тела, которая может быть повышена в случае инфекционных осложнений. Правильная оценка массы тела имеет важное значение для пациентов с ЦП и задержкой жидкости, для этого целесообразно использовать корригированный индекс массы тела (ИМТ), который рассчитывается путем вычитания доли свободной жидкости от измеренной массы тела (см. раздел "Термины и определения") [112]. Общее состояние пациента может быть удовлетворительным, средней тяжести и тяжелым согласно стадии ЦП (компенсированный или декомпенсированный) и имеющимся осложнениям. Особого внимания требует оценка сознания на предмет явной или скрытой ПЭ, а также других осложнений, оказывающих влияние на нервно-психическую сферу. Если врач фиксирует у пациента измененное сознание, то необходимо применить модифицированные критерии шкалы West Haven и ISHEN, которые представлены в разделе 1.5, таблице 2. Всем пациентам с ЦП нужно исключать минимальную ПЭ с использованием психометрических тестов и теста "Назови животных" (см. раздел 2.5). Необходимо помнить о том, что к измененному сознанию у пациентов с ЦП может приводить гипонатриемия, симптомы которой сходны с симптомами ПЭ.
При осмотре кожных покровов можно обнаружить изменение их цвета: желтушность кожи, склер, уздечки языка; сосудистые звездочки (телеангиоэктазии), расположенные чаще всего в области плечевого пояса, зоны декольте: пальмарную эритему; петехии и экхимозы вследствие нарушений в системе коагуляции и тромбоцитопении; ксантомы и ксантелазмы, следы расчесов при холестазе; гинекомастию вследствие нарушения метаболизма эстрогенов в печени пациентов с ЦП или в результате нежелательных последствий длительного приема спиронолактона**; ломкость и изменение цвета ногтей (белые ногти) и (или) ногти в виде барабанных палочек. На алкогольную этиологию ЦП могут указывать стигмы систематического употребления алкоголя: facies alcoholica, контрактура Дюпюитрена, увеличение околоушных слюнных желез, ринофима, расширение сосудов носа и склер, гипергидроз кожи лица и ладоней. Также можно обнаружить расширенные вены передней брюшной стенки (иногда в форме "головы медузы"); асцит и отеки нижних конечностей, которые развиваются в рамках ПГ и (или) печеночной недостаточности.
При исследовании костно-мышечной системы необходимо обращать внимание на мышечную массу и проводить тесты для диагностики саркопении: краткая батарея тестов физической активности (short physical performance battery, SPPB), которая включает тест с подъемом со стула, проверку равновесия и скорости ходьбы в течение 2 - 3 мин; динамометрию для оценки мышечной силы у постели больного (см. раздел 2.5) [113].
При исследовании органов дыхания нужно клинически оценивать возможность таких осложнений ЦП, как гидроторакс, ГПС. К проявлениям ГПС относятся одышка, центральный цианоз, изменения фаланг пальцев по типу барабанных палочек. Одышка у пациентов с ГПС появляется в вертикальном положении и носит название платипноэ. Также в вертикальном положении у них снижается сатурация кислорода, что принято называть ортодеоксией [52, 114]. Гидроторакс можно диагностировать при наличии одышки в покое и при физической нагрузке, о чем свидетельствуют такие физикальные признаки, как асимметрия/отставание одной половины грудной клетки при дыхании, притупление перкуторного звука, ослабление/отсутствие голосового дрожания и бронхофонии, отсутствие дыхательных шумов. Диагностическая точность физикальных методов составляет примерно 60% (при большом выпоте достигает 88%) [1].
При исследовании сердечно-сосудистой системы нужно помнить о том, что у пациентов с декомпенсированным ЦП можно обнаружить проявления гипердинамического типа кровообращения, что проявляется тахикардией в покое и гипотонией [12].
Во время исследования органов пищеварения пациента с ЦП можно определить сладковатый запах изо рта, что связано с тяжелой печеночной недостаточностью. При осмотре ротовой полости можно обнаружить ярко-красный язык с атрофированными сосочками - "лакированный" язык (проявление гиповитаминоза группы B, что часто встречается при алкогольной этиологии ЦП). Живот может быть увеличен в объеме из-за асцита. Если асцит ненапряженный, то живот выглядит распластанным ("лягушачий живот"), при напряженном асците живот приобретает куполообразную форму. Перкуссия живота позволяет определить притупление перкуторного звука во фланках при асците. Нередко определяется вздутие живота и ослабление кишечной перистальтики (преходящий парез кишечника) вследствие СИБР в кишечнике и бактериальной транслокации, СБП. У 8 - 10% пациентов с СБП определяются положительные симптомы раздражения брюшины.
При пальпации живота можно обнаружить плотную, увеличенную в размерах печень с неровным краем и плотную, увеличенную в размерах вследствие ПГ селезенку. При напряженном асците пальпация внутренних органов затруднена, при этом печень и селезенка могут баллотировать (симптомы флуктуации и "плавающей льдинки"). На поздних стадиях ЦП печень может быть уменьшена в размерах и недоступна для пальпации [1, 18, 65, 114].
Диагностическая точность притупления перкуторного звука в диагностике асцита составляет 57,1%, симптома флуктуации - 20% [1, 19, 65]. У пациентов с рецидивирующим асцитом нередко формируется пупочная грыжа.
При исследовании органов мочеполовой системы необходимо обращать внимание на суточный диурез, поскольку нарушение функции почек нередко сопровождается олигурией.
Со стороны эндокринной системы у женщин с ЦП нередко наблюдается аменорея, у мужчин, особенно с алкогольной этиологией ЦП, - атрофия яичек и феминизация.
2.3 Лабораторные диагностические исследования
- Рекомендовано проведение общего (клинического) анализа крови пациентам с ЦП для оценки уровня гемоглобина, тромбоцитов, лейкоцитов [1, 65, 66, 115 - 118].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Чаще всего у пациентов отмечается цитопения (в большей степени - тромбоцитопения различной степени тяжести). Возможно наличие двухростковой цитопении (лейко- и тромбоцитопении), что отражает синдром гиперспленизма (секвестрационной и (или) иммунной цитопении). В случае впервые выявленной тромбоцитопении обязательно проведение ручного подсчета форменных элементов крови (дифференциальный диагноз с агрегацией тромбоцитов). У пациентов с алкогольным ЦП спленомегалия и гиперспленизм могут быть выражены минимально или отсутствовать вовсе, что не исключает стадию ЦП. Возможно наличие анемии различной природы и выраженности: вклад могут вносить оккультные кровотечения при портальной гастро- и колопатии, дефицит витаминов (фолиевой кислоты и B12 при хронической алкогольной интоксикации), постгеморрагическая анемия (после варикозных кровотечений), а также анемия хронических заболеваний.
- Рекомендовано пациентам с ЦП и тяжелой тромбоцитопенией (< 50 x 109/л) по результатам исследования общего (клинического) анализа крови на автоматическом гематологическом анализаторе взять образец крови в пробирку вакуумную с цитратом натрия и повторно провести исследование уровня тромбоцитов крови на автоматическом гематологическом анализаторе для исключения ложной тромбоцитопении [105].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В клинической практике при использовании автоматического гематологического анализатора врач может столкнуться с ложной или псевдотромбоцитопенией. Этот феномен возникает in vitro, когда в пробирке с кровью, стабилизированной калиевыми солями этилендиаминтетрауксусной кислоты (ЭДТА) (пробирка вакуумная с ЭДТА трикалиевая соль (КЗЭДТА)), формируются тромбоцитарные агрегаты под действием ЭДТА-зависимых антитромбоцитарных антител. Добавление в пробирку с венозной кровью 4% раствора цитрата натрия позволяет избежать этого феномена и определить истинную концентрацию тромбоцитов на автоматическом гематологическом анализаторе, при этом другие показатели гемограммы не оцениваются.
- Рекомендовано проведение анализа крови биохимического общетерапевтического, включая исследование уровней общего белка, альбумина, общего билирубина, билирубина связанного (конъюгированного) креатинина в крови, определение активности аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, гамма-глютамилтрансферазы в крови, исследование уровня глюкозы в крови, пациентам с ЦП для оценки некровоспалительной активности, холестаза, функции печени, почек [1, 65, 118 - 124].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Повышение активности аминотрансфераз по мере прогрессирования хронического заболевания печени теряет клиническое значение: при ЦП активность аспартатаминотрансферазы чаще выше активности аланинаминотрансферазы; сочетание высокой активности аспартатаминотрансферазы и гамма-глутамилтрансферазы (+ макроцитоз/гиперхромная анемия) могут указывать на алкоголизацию, при этом специфичность гамма-глутамилтрансферазы составляет около 60% и может отражать метаболические нарушения (коррелирует с избыточной массой тела). Обязательно исследование уровня альбумина в крови (прогностический маркер и ключевой показатель белоксинтетической недостаточности). В рамках печеночной недостаточности отмечается изолированное снижение уровня альбумина при нормальном/пограничном уровне общего белка. Высокий уровень белка может наблюдаться при активном аутоиммунном процессе (аутоиммунном ЦП), а также отражать патологическую секрецию: в таких случаях показано дополнительное обследование у врача-гематолога. Снижение уровня креатинина отражает дефицит мышечной ткани (саркопению) и является неблагоприятным прогностическим маркером. Помимо трансфузий раствора альбумина человека**, таким пациентам показано назначение соответствующей высокобелковой диеты и (или) энтерального питания для коррекции нутритивного статуса.
- Рекомендовано выполнение коагулограммы (ориентировочного исследования системы гемостаза), включая определение таких показателей, как международное нормализованное отношение (МНО), протромбиновый индекс, фибриноген, протромбин, протромбиновое (тромбопластиновое) время, концентрации Д-димера, активности антитромбина III в крови пациентам с ЦП для оценки коагуляционного статуса, функции печени [1, 65, 66, 117, 121, 125 - 126].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: В рамках печеночной недостаточности отмечается снижение синтеза всех плазменных факторов коагуляции - как про-, так и антикоагулянтов (коагулопатия). В большей степени при использовании стандартных тестов выявляют признаки гипокоагуляции: повышение МНО, снижение протромбинового индекса, уровня фибриногена. В ряде случаев показано исследование концентрации Д-димера (исключение активного тромбообразования и эффективности антикоагулянтной терапии), активированного частичного тромбопластинового времени (контроль эффективности терапии низкомолекулярными гепаринами (группа гепарина)), определение активности антитромбина III (при дефиците данного фактора эффект низкомолекулярных гепаринов (группы гепарина) может быть неполным или отсутствовать вовсе).
- Рекомендовано исследование общего (клинического) анализа мочи пациентам с ЦП для исключения мочевой инфекции, а также пациентам с ЦП с повышением уровня креатинина для изучения мочевого осадка в целях проведения дифференциального диагноза ОПП [30, 127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Исследование мочевого осадка - необходимый инструмент для проведения дифференциального диагноза между различными фенотипами ОПП. Преренальная азотемия, в основе которой лежит дисфункция почек без структурных изменений, характеризуется отсутствием мочевого осадка. При ГРС может встречаться либо отсутствие мочевого осадка, либо наличие маловыраженных изменений (протеинурия <= 0,5 г/сут, гематурия <= 50 эритроцитов в поле зрения), при ОКН изменения более значительные. Стоит отметить, что указанные характеристики справедливы для пациентов, у которых изначально не было изменений анализа мочи; в случае, когда они исходно фигурировали (особенно это касается ситуаций, когда ОПП развивается на фоне ХБП), необходимо ориентироваться на их динамику [30, 127 - 128]. Также появление протеинурии, гематурии может косвенно говорить о наличии мочевой инфекции. Даже латентная мочевая инфекция может провоцировать ПЭ и острую печеночную недостаточность на фоне хронической (и декомпенсацию ЦП в целом).
- Рекомендовано пациентам с ЦП исследование маркеров вирусных гепатитов (определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к вирусу гепатита D (Hepatitis D virus) в крови); определение соотношения белковых фракций методом электрофореза исследование электрофореза белков, уровня иммуноглобулинов в крови, уровня ферритина в крови, процента насыщения трансферрина железом, уровня церулоплазмина в крови в качестве скрининговых показателей для уточнения этиологии заболевания (в случае если причина ЦП неизвестна) [1, 65, 66].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с ЦП и подозрением на инфекционное осложнение рекомендовано микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы для уточнения инфекционного процесса, исключения бактериальной инфекции [129].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с ЦП с нарушениями стула, лихорадкой, а также пациентам с ЦП, неоднократно госпитализированным, получавшим антибактериальные препараты системного действия, рекомендовано иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile) для исключения инфекции C. difficile [130].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Лабораторное исследование асцитической жидкости
- Рекомендовано пациентам с ЦП и впервые развившимся асцитом проведение диагностического парацентеза (лапароцентеза) с последующим исследованием асцитической жидкости в целях дифференциального диагноза [1, 18, 30, 65, 131 - 137].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано проведение диагностического парацентеза (лапароцентеза) с последующим исследованием асцитической жидкости пациентам с ЦП и подозрением на инфицирование асцитической жидкости с целью выявления СБП [78, 138, 139].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Диагностический парацентез (лапароцентез) целесообразен для пациентов с желудочно-кишечным кровотечением, признаками шока, лихорадкой и другими критериями SIRS, при ухудшении функции печени и (или) почек, при ПЭ [78, 138], поскольку инфицированный асцит может провоцировать их развитие. В некоторых случаях СБП даже может протекать бессимптомно, особенно у амбулаторных пациентов [78, 139]. Асцитическая жидкость направляется на микроскопическое исследование перитонеальной (асцитической) жидкости, а также производится бактериологическое исследование перитонеальной жидкости на аэробные и факультативно анаэробные условно-патогенные микроорганизмы. Обычно асцитическая жидкость прозрачна и имеет соломенный цвет, примесь крови наблюдается при злокачественном процессе в брюшной полости либо малом тазу, недавно проведенном парацентезе или выполнении инвазивных процедур. Электролитный состав асцитической жидкости аналогичен другим внеклеточным жидкостям.
В систематическом обзоре и метаанализе для оценки исходов среди госпитализированных пациентов с ЦП и асцитом изучалось влияние времени выполнения диагностического лапароцентеза на госпитальную летальность. Показано, что суммарный риск госпитальной смертности был значительно ниже у пациентов, которым был выполнен ранний (<= 12 ч или <= 1 суток от момента госпитализации) парацентез по сравнению с отсроченным (> 12 ч или > 1 суток) (относительный риск (ОР)) 0,69; p < 0,00001), а также у пациентов, которым был выполнен парацентез в сравнении с отсутствием данной манипуляции (ОР 0,74; p < 0,00001) [139].
- Рекомендовано подсчитывать количество нейтрофилов в асцитической жидкости и производить бактериологическое исследование перитонеальной жидкости на аэробные и факультативно анаэробные условно-патогенные микроорганизмы пациентам с ЦП, асцитом и признаками шока, лихорадкой и другими критериями SIRS, при ухудшении функции печени и (или) почек, при ПЭ с целью выявления СБП [1, 65, 66, 78, 139 - 141].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Содержание нейтрофилов > 250 клеток/мм3 (0,25 x 109/л) является критерием СБП при отсутствии перфораций или воспаления органов брюшной полости [1, 65, 66, 78, 139]. Для бактериологического исследования перитонеальной жидкости на аэробные и факультативно анаэробные условно-патогенные микроорганизмы полученную асцитическую жидкость следует немедленно поместить во флаконы с питательной средой и отправить в лабораторию. В многочисленных исследованиях установлено, что немедленный посев асцитической жидкости на гемокультуру позволяет идентифицировать микроорганизм в 72 - 90% случаев СБП.
- Рекомендовано определять уровень общего белка и альбумина в асцитической жидкости, полученной при диагностическом парацентезе (лапароцентезе), пациентам с ЦП с асцитом с целью выявления пациентов с высоким риском развития СБП [1, 65, 66, 134, 135].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Уровень общего белка асцитической жидкости < 1,5 г/дл рассматривается как неблагоприятный фактор риска развития СБП [1, 65, 132, 133].
- Рекомендовано рассчитывать сывороточно-асцитический альбуминовый градиент (СААГ) пациентам с ЦП и асцитом в диагностически неясных случаях с целью уточнения природы выпота в брюшную полость [1, 65, 66, 132].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: СААГ рассчитывается по следующей формуле:
СААГ = альбумин сыворотки крови - альбумин асцитической жидкости.
Значения СААГ 1,1 г/дл и больше в 80% случаев свидетельствуют в пользу ПГ как причины развития асцита [135, 136]. Алгоритм диагностики причин асцита в зависимости от уровня белка асцитической жидкости и СААГ представлен на рисунке 1 (приложение Б).
- Рекомендовано пациентам с ЦП и асцитом исследовать в асцитической жидкости, полученной при диагностическом парацентезе (лапароцентезе), содержание эритроцитов для исключения геморрагического асцита [1, 65, 66].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: в асцитической жидкости при ЦП обычно количество эритроцитов не превышает 1 тыс. клеток/мм3. Геморрагический асцит (> 50 тыс. клеток/мм3) определяется у 2% пациентов с ЦП, из которых треть больных имеют гепатоцеллюлярный рак (ГЦР). У половины пациентов с геморрагическим асцитом причину его установить не удается.
- Рекомендовано пациентам с ЦП с асцитом также определение в асцитической жидкости концентрации глюкозы, амилазы, лактатдегидрогеназы, триглицеридов для уточнения этиологии асцита [1, 65, 66].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано пациентам с ЦП и асцитом проводить микроскопическое исследование перитонеальной (асцитической) жидкости для исключения опухолевого генеза асцита [66, 136].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Лабораторное исследование плевральной жидкости
- Рекомендовано проведение диагностического торакоцентеза пациентам с ЦП с гидротораксом с целью оценки характера плевральной жидкости и исключения ее инфицирования [1, 39, 65].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Диагноз печеночного гидроторакса требует исключения сердечной недостаточности и легочной патологии. С помощью диагностического торакоцентеза можно подтвердить инфицирование плевральной жидкости (критерии, аналогичные инфицированию асцитической жидкости), оценить содержание белка в плевральной жидкости (при неосложненном печеночном гидротораксе содержание белка низкое, градиент между содержанием альбумина в сыворотке и плевральной жидкости больше 1,1 г/дл) [1, 39, 65].
2.4 Инструментальные диагностические исследования
- Рекомендовано проведение ультразвукового исследования (УЗИ) органов брюшной полости (комплексное) пациентам с ЦП с целью определения размеров и ультразвуковых характеристик печени, диагностики ПГ (обнаружение асцита, измерение диаметра воротной и селезеночной вен, размеров селезенки), исключения очаговых образований печени, при возможности использовать ультразвуковую допплерографию для оценки проходимости печеночных и воротной вен, с целью обнаружения тромбоза сосудов портальной системы [1, 10, 142, 143].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: При проведении ультразвукового исследования признаками ПГ служат расширение воротной вены до 13 мм и более, снижение в ней скорости кровотока либо ретроградный кровоток, появление портокавальных коллатералей (параумбиликальная вена, варикозные расширения селезеночной вены и др.), спленомегалия.
- Рекомендована регистрация электрокардиограммы пациентам с ЦП для оценки сердечного ритма и проводимости [144 - 146].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Рекомендовано проведение ЭГДС пациентам с ЦП с целью оценки размера вен пищевода и желудка, пятен васкулопатии как стигм высокого риска кровотечения [18, 90, 147, 429].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Определение степени ВРВП служит одним из инструментов прогноза риска кровотечения и смертности. Так, при диаметре ВРВП > 10 мм риск кровотечения в течение года достигает 30 - 50% [2, 429]. Более подробно данные о годовом риске кровотечения и смертности после первого кровотечения с учетом степени ВРВП представлены в разделе 1.5. "Классификация заболевания или состояния (группы заболеваний или состояний)".
- Рекомендовано проведение ЭГДС в максимально короткие сроки (желательно в течение первых 12 ч) пациентам с ЦП и варикозным кровотечением с целью уточнения причины кровотечения и эндоскопического лечения [1, 2, 18, 65, 90, 148 - 150].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: ЭГДС проводится при поступлении пациента для определения генеза кровотечения, подтверждения варикозного характера кровотечения, локализации варикозной трансформации и исключения других источников кровотечения (язвенная болезнь желудка или двенадцатиперстной кишки, опухолевые поражения желудка, синдром Меллори-Вейсса, эрозивно-геморрагический гастрит и др.). Тем не менее при нестабильном состоянии пациента проведение ЭГДС должно быть отложено до момента его стабилизации [2, 148].
- Рекомендуется проведение компьютерной томографии (КТ) органов брюшной полости с внутривенным болюсным контрастированием и (или) магнитно-резонансную томографию (МРТ) органов брюшной полости с внутривенным контрастированием (в отсутствие противопоказаний для введения контрастного средства) пациентам с ЦП и подозрением на объемное образование с целью уточнения его природы [151].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: В систематическом обзоре и метаанализе диагностических характеристик компьютерной (КТ) и магнитно-резонансной томографии (МРТ) как неинвазивных методов оценки ГЦР у пациентов с хроническими заболеваниями печени было показано, что в сравнении с эталонным стандартом (гистопатологические данные и (или) результаты последующего наблюдения) общая чувствительность МРТ для каждого пациента составила 88% (95% доверительный интервал (ДИ) 83 - 92%), а специфичность - 94% (95% ДИ 85 - 98%). Общая чувствительность МРТ для каждого очага поражения была выше, чем у мультидетекторной КТ, когда были объединены парные данные из 11 доступных исследований (80 против 68%, P = 0,0023). МРТ показала более высокую чувствительность к каждому очагу поражения, чем мультидетекторная КТ, и должна быть предпочтительным методом визуализации для диагностики ГЦР у пациентов с хроническими заболеваниями печени. В другом метаанализе также была показана более высокая чувствительность и точность МРТ с контрастированием (применение внеклеточного контрастного средства) для диагностики ГЦР, особенно при размерах поражений < 20 мм, по сравнению с КТ с контрастированием (sAUCs = 0,96 против 0,93; P = 0,04). Инструментальная диагностика объемных образований печени проводится согласно КР "Рак печени (гепатоцеллюлярный)" [152].
Также КТ позволяет оценить портосистемные коллатерали с целью определения тактики лечения при варикозных кровотечениях и возможности применения эндоваскулярных методов лечения [2, 148].
Рационально пациентам с ЦП и клиническими признаками саркопении при выполнении им КТ или МРТ печени и органов брюшной полости количественно оценивать мышечную массу. Для этого при проведении КТ вычисляется скелетно-мышечный индекс (СМИ) на основании сканирования мышц на уровне третьего поясничного позвонка (L3). Было показано, что площадь скелетных мышц на уровне L3 линейно коррелирует с мышечной массой всего тела [153, 154].
МРТ без введения контрастного препарата также может применяться для количественной и качественной оценки мышц [155 - 158]. Эффективность КТ и МРТ для оценки состояния мышц сопоставима [159, 160].
- Рекомендуется использование МРТ органов брюшной полости с внутривенным введением гепатотропного контрастного препарата гадоксетовой кислоты** для выявления раннего ГЦР (до 2,0 см), описания сложных для интерпретации объемных образований печени у отдельных пациентов с ЦП любой этиологии [151].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: МРТ органов брюшной полости с внутривенным введением гепатотропного контрастного препарата (гадоксетовая кислота**) показала значительно более высокую чувствительность в выявлении ГЦР в сравнении с МРТ и применением других контрастных веществ (87 против 74%; P = 0,03). Чувствительность в выявлении очагов размером менее 1 см была ниже в сравнении с очагами размером более 1 см (P < 0,001 для КТ, P = 0,02 для МРТ и P = 0,04 для КТ, P < 0,001 для МРТ соответственно) [151]. Назначение МРТ органов брюшной полости с внутривенным введением гепатотропного контрастного препарата (гадоксетовая кислота**) проводится согласно КР "Рак печени (гепатоцеллюлярный)" [152].
- Рекомендовано проведение КТ органов брюшной полости с внутривенным болюсным контрастированием и (или) МРТ органов брюшной полости с внутривенным контрастированием (в отсутствие противопоказаний для введения контрастного средства) пациентам с ЦП и подозрением на тромбоз в венах портальной системы/печеночных венах [161, 162].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендуется пациентам с ЦП проведение контраст-усиленного ультразвукового исследования (КУУЗИ) для оценки объемных образований печени в тех случаях, когда имеются противопоказания для проведения КТ или МРТ органов брюшной полости с внутривенным контрастированием [163 - 165].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: КУУЗИ представляет собой современный метод ультразвуковой диагностики, при котором имеется возможность получить дополнительную информацию о характере кровоснабжения интересующего участка. КУУЗИ может применяться в качестве альтернативы лучевым и магнитно-резонансным методам диагностики при наличии соответствующих противопоказаний к их применению, в частности аллергия на рентгеноконтрастные средства, содержащие йод; нарушение работы почек, в том числе с высоким риском контраст-индуцированной нефропатии; наличие кардиостимуляторов и других металлосодержащих конструкций; клаустрофобия. В РФ для КУУЗИ используется контрастное средство для ультразвуковой диагностики - серы гексафторид в виде микропузырьков инертного газа, окруженных стабилизирующей оболочкой из фосфолипидов (дистеароилфосфатидилхолин, дипальмитоилфосфатидилглицерол натрия). Средний период полувыведения препарата - около 12 мин (2 - 33 мин), после разрушения микропузырьков газ выделяется с выдыхаемым воздухом, а оболочка метаболизируется по пути эндогенных фосфолипидов. КУУЗИ обладает достаточно высокой чувствительностью в диагностике ГЦР - 88% (95% ДИ 84 - 92%) [163 - 165], однако имеет ограничения, связанные с аппарато- и операторозависимостью, влиянием факторов пациента/опухоли на визуализацию (аналогично стандартному УЗИ), отсутствием полных данных о стадировании и недостаточным объемом информации для планирования лечения [166, 167].
- Рекомендуется пациентам с ЦП и множественными объемными образованиями печени с разным характером контрастирования (узлы регенерации, ГЦР) проведение КУУЗИ для выбора оптимального объемного образования печени для биопсии в целях ранней диагностики ГЦР, а также мониторирования этих образований согласно характеру их контрастирования [168].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: КУУЗИ имеет высокую диагностическую ценность и воспроизводимость для неинвазивной оценки гиперваскулярной гепатоцеллюлярной карциномы > 1 см у пациентов с ЦП. Это положение доказано в проспективном исследовании B. Boozari et al. [163]. Авторы проанализировали диагностическую точность КУУЗИ для неинвазивной оценки гиперваскулярной ГЦР при ЦП в сравнении с данными гистологического исследования объемных образований. Чувствительность, специфичность, положительная прогностическая ценность и отрицательная прогностическая ценность КУУЗИ для оценки ГЦР для всех пациентов составляли 94% (ДИ 72 - 99%), 95% (ДИ 88 - 99%), 81% и 99%, а для пациентов с опухолями < 5 см - 100% (95% ДИ 79 - 100), 96% (95% ДИ 80 - 99), 92% и 100% соответственно. Коэффициенты вероятности положительного и отрицательного диагноза составили 18 и 26 и 0,06 и 0 соответственно, k = 0,941 (p < 0,001).
- Рекомендовано проведение рентгеноденситометрии для оценки риска остеопении или степени остеопороза пациентам с ЦП, особенно холестатической или аутоиммунной (на фоне длительной терапии глюкокортикоидами) этиологии, а также при подготовке к ТП [169 - 174].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Термин "печеночная остеодистрофия", включающий остеопороз и остеомаляцию, используется для описания заболеваний костной системы у пациентов с повреждением печени [171]. Распространенность остеопороза у пациентов с хроническим заболеванием печени и ЦП зависит главным образом от способа отбора пациентов и диагностических критериев. По разным данным, около 30% пациентов страдают остеопорозом, причем более высокая распространенность наблюдается у пациентов с ЦП в исходе холестатических заболеваний печени (первичный билиарный холангит и первичный склерозирующий холангит), а также у пациентов, готовящимся к ТП [169, 172, 175].
Значительную роль в патогенезе остеопороза у пациентов с ЦП играют пищевые, гормональные, метаболические, генетические и воспалительные факторы, влияющие главным образом на снижение костеобразования. Диагноз остеопороза основывается на минеральной плотности костной ткани, которая обычно измеряется с помощью рентгеноденситометрии поясничного отдела позвоночника и (или) тазобедренного сустава.
При состояниях, связанных с быстрой потерей костной массы, таких как ЦП, а также при наличии более одного фактора риска развития остеопороза рентгеноденситометрию целесообразно проводить примерно один раз в год. Рентгеноденситометрию показано проводить перед ТП. Необходимо принимать во внимание неточности в измерениях минеральной плотности костной ткани и костных маркеров у пациентов с ЦП или хроническим холестазом [169, 172, 174, 175].
2.5 Иные диагностические исследования
- Пациентам с ЦП рекомендовано применять психометрические тесты (связи чисел, число - буква, линии, почерка, арифметический, пересказа) и тест "назови животных" (animal naming test) и другие с целью диагностики скрытой ПЭ [19, 176, 177].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: При выполнении теста связи чисел пациент соединяет линией цифры от 1 до 25, напечатанные вразброс на листе бумаги (приложение Г). Оценкой теста служит время, затраченное пациентом на его выполнение, включая время, необходимое для исправления ошибок. Чувствительность психометрических тестов в выявлении ПЭ составляет 70 - 80%. В диагностике скрытой ПЭ у постели больного используется упрощенный тест "назови животных" (animal naming test). Он универсален и быстро применим, занимает всего 60 сек, может выполняться врачами, медсестрами и лицами, осуществляющими уход за пациентом. Данный тест имеет ограниченную спонтанную вариабельность, что делает его полезным для последующего динамического наблюдения/мониторинга. В течение 60 сек пациенту предлагается абсолютно произвольно перечислять животных. Результат оценивается следующим образом: если в течение 60 сек пациент называет более 15 животных, то энцефалопатии нет (присваивается значение 0), если за этот период времени он называет от 10 до 15 животных - легкая степень ПЭ (присваивается значение 1), если пациент способен назвать менее 10 животных - более значимая ПЭ и присваивается значение 2. Эта оценка коррелировала как с результатами психометрических тестов (p < 0,0001), так и с данными электроэнцефалографии (p = 0,007). Более того, данная трехуровневая оценка показала прогностическую ценность в отношении годичного риска развития явной ПЭ и смерти [177]. Явная ПЭ диагностируется по критериям West Haven (см. таблицу 2) [1, 19, 176, 178].
- Рекомендовано пациентам с ЦП и диагностически неясной энцефалопатией проводить прием (осмотр, консультация) врача-невролога первичный и исследование уровня аммиака в крови с целью дифференциального диагноза измененного сознания [19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: У пациентов с ЦП причинами измененного сознания могут быть внепеченочные состояния, которые вызывают или усугубляют симптомы ПЭ - провоцирующие факторы (см. таблицу 3). К ним относятся инфекции (пневмония, мочевая инфекция, СБП, сепсис, острый гастроэнтерит и др.) [179], желудочно-кишечные кровотечения [180], запор, избыточное расщепление глутамина глутаминазами тонкой кишки [181], дегидратация, гипонатриемия [182], гипокалиемия [183], неконтролируемое использование диуретиков, употребление алкоголя, прием производных бензодиазепина, избыточное употребление белка [184] и факторы, роль которых в развитии ПЭ активно обсуждается в последние годы: потеря скелетной мышечной массы (саркопения) [185] и наложение трансъюгулярного внутрипеченочного портосистемного шунта [186]. Провоцирующие факторы ПЭ у пациента с ЦП могут встречаться изолированно или в различных сочетаниях и сопровождаются гипераммониемией. Таким пациентам проводится лечение гипоаммониемическими средствами, а провоцирующий фактор обязательно устраняется. В случаях неэффективности такого подхода целесообразно измерение концентрации аммиака: высокая концентрация требует модификации гипоаммониемической терапии (увеличения дозы, применения комбинированных схем лечения) и активного поиска неустраненных провоцирующих факторов; нормальная концентрация аммиака требует поиска альтернативных причин изменения сознания. Предпочтительным считается исследование уровня аммиака в крови с помощью экспресс-метода. Концентрация аммиака у пациентов с ЦП может измеряться в артериальной, венозной и капиллярной крови. Установлено, что скорость утилизации аммиака головным мозгом напрямую коррелирует с концентрацией аммиака в артериальной крови. Концентрация аммиака в капиллярной крови наиболее близко соответствует таковой в артериальной крови, поэтому капиллярная кровь может быть хорошей альтернативой более инвазивному забору артериальной крови. При исследовании капиллярной крови оптимальным местом забора крови служит мочка уха, которая не содержит потовых желез, более точно отражает истинную концентрацию аммиака [19].
- Рекомендовано пациентам с ЦП и клиническими признаками саркопении для оценки мышечной массы проводить измерение окружности мышц средней трети плеча [187].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Окружность мышц средней трети плеча определяется как окружность мышц плеча (ОМП), измеренная сантиметровой лентой минус толщина кожно-жировой складки трицепса, измеренная методом калиперометрии [188]. Данная оценка проста для исследования, и на нее не влияют отеки нижних конечностей и асцит, что важно для пациентов с ЦП. Данные ОМП коррелируют с показателями СМИ, измеренных методом биоимпедансного анализа [189], при этом определение ОМП выполняется у постели больного, не требует дополнительных экономических и временных затрат, на его значение не влияет задержка жидкости в организме при декомпенсированном ЦП.
- Рекомендовано пациентам с ЦП и клиническими признаками саркопении для оценки мышечной массы проводить следующие инструментальные методы исследования: определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансметра, рентгеноденситометрию (ДРА - двухэнергитическая рентгеновская абсорбциометрия, или DEXA в англоязычной литературе), ультразвуковое исследование мышц (ультразвуковое исследование мягких тканей (одна анатомическая зона)) [154].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Все эти инструментальные методы позволяют объективно оценить мышечную массу путем измерения отдельных мышц и расчета СМИ для оценки саркопении [154]. Они отличаются точностью, воспроизводимостью, доступностью, стоимостью исследования. Наиболее простыми, доступными и изученными методами оценки состава тела являются ДРА и биоимпедансный анализ [190, 191]. На точность данных методов влияет задержка жидкости у пациентов с заболеваниями печени [191, 192].
- Рекомендовано пациентам с ЦП и клиническими признаками саркопении для оценки мышечной силы проводить измерение силы мышц кисти (кистевую динамометрию) [193].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии: Кистевая динамометрия - доступный и экономически эффективный способ для определения мышечной силы пациента [193, 194]. Слабая сила сжатия кисти служит важной диагностической характеристикой саркопении.
- Рекомендовано пациентам с ЦП, асцитом и отеками с целью диагностики саркопении использовать ДРА с расчетом СМИ верхних конечностей (СМИ ВК) [195].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Среди инструментальных методов для оценки мышечной массы наиболее простым, дешевым и доступным методом, оказывающим меньшую лучевую нагрузку, является ДРА. Это исследование выполняется на стандартном денситометре и позволяет количественно определить три составляющие тела: костную, жировую и тощую массу (мышцы, кожа, сухожилия и соединительные ткани). К основным ограничениям метода относится неспособность отличить мышцы от воды, из-за чего показатель мышечной массы может быть завышен у пациентов с ЦП и отечно-асцитическим синдромом [192]. Для более точной оценки мышечной массы у пациентов с отечно-асцитическим синдромом было предложено использовать мышечную массу конечностей - аппендикулярного скелета с расчетом аппендикулярного СМИ (appendicular skeletal muscle index, ASMI) [191, 196, 197], значения которого сильно коррелируют со СМИ по данным КТ [191]. Однако этот индекс также имеет ограничения у пациентов с декомпенсированным ЦП и отеками нижних конечностей ввиду невозможности отличить мышечную ткань от жидкости. Для нивелирования этого влияния предложено использовать для оценки мышечной массы только СМИ ВК.
В недавно опубликованном исследовании у пациентов с декомпенсированным ЦП и отечно-асцитическим синдромом СМИ ВК статистически значимо различался в группе исследования и контроля и имел преимущество перед стандартным СМИ по чувствительности, специфичности и точности как для мужчин, так и для женщин. Качество модели оценки снижения мышечной массы для СМИ ВК у женщин было хорошим (AUC = 0,776), у мужчин - очень хорошим (AUC = 0,821) [195]. Сходные результаты получены в исследовании M. Sinclair et al. [198], в котором сообщалось, что низкая тощая масса рук была лучшим предиктором смертности, чем низкие показатели стандартного СМИ и тощей массы ног у мужчин, находящихся в листе ожидания ТП. В исследовании C.S. Eriksen et al. [199], включавшем 231 мужчину и 84 женщины с ЦП (все классы по Child-Pugh) и 315 здоровых контрольной группы, СМИ ВК показал более тесную ассоциацию, чем стандартный СМИ или СМИ нижних конечностей.
В настоящее время перспективным методом неинвазивной оценки клинически значимой ПГ и стратификации риска варикозных кровотечений у пациентов с ЦП служит измерение жесткости селезенки. Жесткость селезенки <= 40 кПа, измеренная с помощью транзиентной эластографии, может указывать на низкий риск варикозных кровотечений [2, 200 - 202].
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Немедикаментозное лечение
3.1.1. Особенности питания, принципы диетотерапии и нутритивной поддержки
Частым осложнением ЦП является трофологическая недостаточность (дефицит питания), которая ухудшает прогноз пациентов, повышает частоту развития осложнений ЦП, общую смертность (в 1,5 раза по сравнению с пациентами с нормальной массой тела) и снижает выживаемость после ТП. Наряду с саркопенией она ассоциирована с прогрессированием печеночной недостаточности и с более высокой частотой осложнений, включая инфекции, ПЭ и асцит [203].
Недостаточное питание при ЦП встречается часто: у 20% пациентов с компенсированным и у 75 - 90% с декомпенсированным заболеванием печени. По данным исследований, при ЦП мужчины чаще теряют мышечную массу, а женщины - в большей степени жировую [1, 65, 95, 204 - 207].
- Рекомендовано пациентам с ЦП любой этиологии, клиническими признаками саркопении и недостаточности питания (без ожирения) обеспечить суточное поступление 30 - 35 ккал/кг массы тела (с поправкой массы тела на отеки и асцит) с интервалами между приемами пищи не более 3 - 4 ч для предотвращения гиперкатаболизма, усугубления трофологической недостаточности и саркопении, развития и прогрессирования ПЭ, инфекционных осложнений и улучшения общей выживаемости [124, 206, 208, 209].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии: У пациентов с ЦП с сохранной физической активностью повышается потребность в энергии, которая еще больше возрастает при резистентном асците и развитии острых осложнений (например, СБП/инфекции, варикозное кровотечение и др.). Дефицит калорий (наряду с дефицитом белка) встречается очень часто - от 34 до 100% пациентов и приводит к развитию трофологической недостаточности. Это связано не только с повышенной потребностью организма, но и со снижением общего объема потребляемой пищи. Калорийность питания обеспечивается адекватным поступлением жиров и углеводов. Важно не делать большие перерывы между приемами пищи (более 6 ч), поскольку в этом случае значительно нарастают катаболические процессы, что может лишь усугубить трофологическую недостаточность, даже в случае поступления адекватного по калориям, но редкого питания. При отсутствии саркопении подсчет суточного калоража и гиперкалорийное питание не показаны [124, 206, 208, 209].
- Рекомендовано пациентам с ЦП любой этиологии обеспечить суточное поступление белка 1,2 - 1,5 г/кг массы тела для предотвращения гиперкатаболизма, развития и прогрессирования саркопении, снижения риска осложнений (инфекционных, ПЭ) и улучшения прогноза [1, 65, 95, 124, 205 - 207].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Ввиду усиленного катаболизма при ЦП повышается потребность не только в калориях, но и в белке. Дефицит поступающего белка приводит к усугублению саркопении, повышает риск осложнений и в целом снижает выживаемость. Дефицит белка встречается у 50 - 90% пациентов с ЦП, что повышает риск смерти, развития асцита, инфекционных осложнений и ГРС. Сбалансированная по белковому составу (с акцентом на растительный и молочный белок) пища может благоприятно влиять на прогноз, уменьшать смертность и риск ПЭ. В проспективных исследованиях показано, что богатая животным белком диета, наоборот, может быть ассоциирована с повышенной смертностью. Показано, что в сочетании с углеводами белок усваивается быстрее [210 - 213].
Поздний ночной перекус (late evening snack, LES) белково-углеводной пищей, которая содержит не менее 50 г сложных углеводов, или энтеральными питательными смесями может не только покрыть ночные потребности организма в энергии/белке, но и снизить риск энцефалопатии, саркопении и в целом смертность. В исследованиях показано, что у пациентов, которые ели на ночь, жизненный прогноз лучше. Углеводы способствуют уменьшению концентрации аммиака и триптофана в плазме, однако следует помнить, что пациентам с ЦП свойственно развитие нарушения толерантности к глюкозе, что иногда требует назначения инсулинов и их аналогов. Применение фруктозы, сорбитола и ксилитола нецелесообразно вследствие повышенного риска лактатацидоза [214, 215].
У пациентов с доказанной саркопенией и недостаточностью питания количество белка должно быть самым высоким - 1,5 г/кг/сут.
В случае ПЭ 2 - 3-й стадии количество поступающего белка следует ограничить до 60 г/сут (1,0 г/кг), поскольку его избыточное поступление приводит в этом случае к нарастанию уровня аммиака и повышает риск отека головного мозга. После купирования явной ПЭ суточное потребление белка может быть снова увеличено до 80 - 100 г/сут (1,2 - 1,5 г/кг). Пациент с ПЭ должен питаться естественным путем, если позволяет его соматический статус. Необходимо учитывать, что у каждого пациента с ЦП свой порог переносимости пищевого белка, и при белковой интолерантности (когда ПЭ развивается при употреблении небольшого количества животного белка) его дефицит нужно восполнять за счет растительного белка, лактальбумина и (или) аминокислот с разветвленной боковой цепью в дозе 0,20 - 0,25 г/кг/сутки (до 30 г). Длительный пероральный прием последних в указанной суточной дозе может улучшать выживаемость, уменьшает МПЭ, а также саркопению [124, 205 - 207, 216].
- Рекомендовано пациентам с компенсированным ЦП и ожирением (ИМТ > 30 кг/м2) постепенно снижать массу тела (более чем на 5 - 10%) для улучшения прогноза и исхода заболевания [217, 218].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Ожирение при компенсированном ЦП встречается так же часто, как и в общей популяции - в диапазоне от 20 до 35% независимо от этиологии заболевания печени, но чаще всего в исходе неалкогольного стеатогепатита. Более того, малоподвижный образ жизни широко распространен у пациентов с ЦП и может рассматриваться как кофактор, приводящий к увеличению массы тела. Ожирение дополнительно увеличивает риск прогрессирования ЦП независимо от его этиологии. Снижение массы тела более 10% дополнительно может приводить к уменьшению выраженности фиброза печени [204, 218, 219].
- Рекомендовано пациентам с ЦП и саркопеническим ожирением придерживаться индивидуальной диеты с умеренной гипокалорийностью (за вычетом 500 - 800 ккал/сут от расчетной суточной потребности), но сохраняющей достаточное потребление белка, с целью снижения массы тела [218, 219].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Особая форма, которая встречается у пациентов с ЦП (от 2 до 42%), - саркопеническое ожирение, при котором сочетается саркопения и избыток жировой ткани. Последнее ассоциировано с развитием миостеатоза (накопления жира в ткани скелетных мышц), что не только усугубляет саркопению, но и повышает риск осложнений и смерти в 1,5 - 2 раза. Целью служит уменьшение объема жировой ткани и сохранение/увеличение мышечной массы. Необходимо не допускать длительных периодов голодания (более 4 - 6 ч), что может только усугубить саркопению и риск осложнений ЦП, в частности ПЭ. Оценивать эффективность снижения массы тела следует по оценке состава тела соответствующими методами (см. раздел 2.5), а не по индексу массы тела. ИМТ не позволяет адекватно оценить, за счет чего снижается масса тела - жировой или мышечной массы [218, 219].
- Рекомендовано всем пациентам с ЦП и недостаточностью питания и (или) саркопенией дополнительное применение средств для перорального энтерального питания (сипинг) для достижения целевых показателей по суточной калорийности и содержанию белка в рационе и уменьшения процессов гиперкатаболизма в печени и мышцах, риска развития саркопении и улучшения выживаемости [124, 205, 220].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В РФ доступно множество средств для дополнительного перорального питания, объем и дозу которых рассчитывают исходя из суточной потребности пациента в белке и калориях. У пациентов с ЦП и нарушениями углеводного обмена следует учитывать содержание углеводов в конкретной питательной смеси. Показано, что средства, обогащенные аминокислотами с разветвленной боковой цепью, не имеют преимуществ перед обычными высокобелковыми смесями. Смеси с высоким содержанием пищевых волокон могут давать дополнительные положительные эффекты, учитывая их способность стимулировать рост бифидо- и лактобактерий, снижать проницаемость кишечной стенки, адсорбировать токсические субстанции, возможно их использование для уменьшения степени бактериальной транслокации у пациентов с ЦП, осложненным асцитом, и, соответственно, профилактики СБП [205, 220].
- Рекомендовано пациентам с ЦП и невозможностью адекватного перорального питания в течение более чем 5 - 7 дней назначение энтерального зондового или парентерального питания для предотвращения процессов гиперкатаболизма, покрытия потребности организма в макронутриентах и энергии, снижения риска энцефалопатии, инфекционных осложнений и смертности [124, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Принципы назначения парентерального питания аналогичны таковым у пациентов без ЦП. При этом следует не допускать перегрузку объемом при отечно-асцитическом синдроме. Наличие варикозно расширенных вен пищевода не служит противопоказанием к установке назогастрального зонда. Объем, калораж и количество белка рассчитываются, как и в случае диеты пациентов с ЦП без зондового или парентерального питания (см выше). Когда пациент снова будет способен принимать пищу самостоятельно, зондовое/парентеральное питание следует завершить [124, 208].
Дефицит витаминов и минералов характерен для пациентов с ЦП независимо от этиологии заболевания печени и особенно распространен при холестазе, алкогольной этиологии заболевания, острой на фоне хронической печеночной недостаточности (acute-on-chronic liver failure, ACLF) или при прогрессирующем течении заболевания [124, 154, 213, 221]. У пациентов с ЦП может развиться дефицит ряда микронутриентов, которые клинически проявляются симптомами гипо- и авитаминозов [154, 222 - 228]. Наиболее часто отмечается недостаток витаминов группы B, вызванный уменьшением их печеночных запасов.
Также наблюдается нарушение усвоения питательных веществ вследствие мальабсорбции, мальдигестии и изменения метаболизма макро- и микроэлементов. Факторы, способствующие мальабсорбции и мальдигестии у пациентов с ЦП, включают портосистемное шунтирование, дефицит ферментов поджелудочной железы, избыточный бактериальный рост, изменение кишечной флоры и энтеропатии [229].
В литературе у пациентов с ЦП описывают состояние гиперметаболизма, связанное с преобладанием катаболизма над анаболизмом. Данное состояние наблюдается по меньшей мере у 15% пациентов с ЦП без четкой корреляция гиперметаболизма с тяжестью заболевания или другими предикторами [230, 231]. Это косвенно может указывать на повышенную потребность у данной категории пациентов в макро- и микронутриентах.
Пациенты с ЦП, особенно алкогольной этиологии, подвержены дефициту водорастворимых витаминов, особенно тиамина (B1). При подозрении на энцефалопатию Вернике обязательным является обильное парентеральное введение тиамина**. Более подробно информация о режиме и дозировках использования препаратов витамина B1 при энцефалопатии Вернике описана в клинических рекомендациях по алкогольной болезни печени (2024) [232].
Обсуждается возможность применения у пациентов с ЦП и признаками остеопороза препаратов кальция, витамина D и его аналогов, золедроновой кислоты**, алендроновой кислоты**, заместительной гормональной терапии (тестостерон**, эстрогены), иммунотерапии человеческими моноклональными антителами IgG (деносумаб**).
Пациентам с хроническими заболеваниями печени может быть показано пероральное применение препаратов витамина D и его аналогов при его дефиците [217, 233], а также бисфосфонатов при ЦП и доказанном остеопорозе. Однако в настоящее время нет точных и убедительных данных, подтверждающих эффективность этих добавок в предотвращении потери костной массы у пациентов с ЦП. Главным образом это связано с ограниченным числом исследований и небольшой выборкой пациентов. Тем не менее бифосфонаты (этидроновая кислота, алендроновая кислота** и ибандроновая кислота) увеличивают костную массу у пациентов с первичным билиарным циррозом. При использовании этих препаратов серьезных побочных эффектов не наблюдалось, о потенциальной гепатотоксичности бисфосфонатов не сообщалось. Кроме того, у пациентов с ЦП, особенно холестатического происхождения, следует учитывать дефицит и других жирорастворимых витаминов, например K [234].
Пациентам необходимо уменьшить или полностью отказаться от употребления алкоголя и табака, так как это факторы, которые могут способствовать потере костной ткани.
3.1.2. Физическая активность
- Рекомендуется пациентам с ЦП избегать гиподинамии и выполнять физическую активность согласно их индивидуальной переносимости для предотвращения и (или) снижения степени саркопении [235 - 237].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Лечение пациентов с ЦП должно включать в себя физические упражнения, которые помогут улучшить мышечную массу, силу и функцию. Исследования показывают, что 8 - 14 недель тренировок с аэробными упражнениями под наблюдением врача приводят к улучшению аэробной выносливости, мышечной массы и силы, улучшению качества жизни, снижению утомляемости [235 - 238]. Физические упражнения должны выполняться пациентом регулярно, длительно, несколько раз в неделю с постепенным наращиванием интенсивности с учетом его индивидуальных особенностей [236, 239]. Для достижения лучших результатов целесообразно сочетать физические упражнения с соблюдением рекомендаций по питанию (см. раздел "3.1.1. Особенности питания, принципы диетотерапии и нутритивной поддержки").
3.2. Медикаментозное лечение
Медикаментозное лечение ЦП преследует две главные цели:
- лечение основного заболевания, приведшего к ЦП: устранение/контроль этиологического фактора (хронического вирусного гепатита B и C, аутоиммунного гепатита, ПБХ, ПСХ, алкогольной болезни печени, НАЖБП, МетАБП, болезни Вильсона, гемохроматоза и др.), что необходимо для профилактики развития осложнений и, как следствие, улучшения прогноза пациента. Лечение основного заболевания проводится в соответствии с актуальными нормативными документами (клиническими рекомендациями);
- лечение осложнений ЦП, чему посвящен текущий раздел клинических рекомендаций.
3.2.1. Лечение цирроза печени с асцитом
ЦП и асцит первой степени по ICA
- Рекомендовано пациентам с асцитом первой степени по ICA устранить/взять под контроль причину, которая привела к хроническому заболеванию печени на стадии ЦП, для улучшения прогноза пациента [240].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: В соответствии с рекомендациями Международного клуба по изучению асцита, пациенты с первой степенью асцита не нуждаются в лечении и (или) назначении диеты с ограничением соли, самым актуальным для прогноза заболевания на этой стадии служит устранение причины заболевания печени или контроль над ней (например, при аутоиммунных заболеваниях) [1, 65, 113, 230].
ЦП и асцит второй степени по ICA (умеренный асцит)
- Рекомендована диета с ограничением поступающего с пищей натрия пациентам с ЦП и асцитом второй степени по ICA для достижения отрицательного водного баланса [1, 65, 113, 217].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Ограничение поступления натрия с пищей может привести к разрешению асцита у 10% пациентов, особенно у пациентов с впервые возникшим асцитом. Целесообразно ограничивать поступающий с пищей натрий в первую очередь за счет исключения из пищевого рациона полуфабрикатов, консервов и т.д. [1, 65, 124]. Пациентам с ЦП и асцитом суточное потребление натрия не должно превышать более 80 ммоль в день - 2 г натрия, что соответствует 5 г соли. Однако потребление натрия не должно быть ниже 60 ммоль/сут, поскольку это может привести к гипонатриемии, а также сделать пищу невкусной, потенциально снижая потребление энергии и белка. Последнее приводит к мальнутриции, саркопении и ухудшению течения ЦП. Профилактировать наступление этих событий может проведение беседы с пациентом с разъяснением цели, длительности и нежелательных последствиях диеты с ограничением натрия, а также способах их предотвращения [217, 241].
- Рекомендовано назначение калийсберегающего диуретика - антагониста альдостерона спиронолактона** в начальной дозировке 100 мг/сут перорально в дополнение к диете с ограничением поступающего с пищей натрия пациентам с ЦП и впервые возникшим асцитом второй степени по ICA для достижения отрицательного водного баланса [1, 65, 113, 242, 243].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Так как вторичный гиперальдостеронизм играет ключевую роль в задержке натрия почками у пациентов с ЦП, диуретики с антиминералокортикоидным действием (спиронолактон**) составляют основу лечения асцита. Причем монотерапия спиронолактоном** демонстрирует схожую с комбинацией спиронолактона** и фуросемида** эффективность и безопасность в лечении умеренного асцита у пациентов с ЦП, а также требует меньше коррекции доз, в связи с чем лучше подходит для амбулаторного лечения [244].
- Рекомендовано пациентам с ЦП и асцитом второй степени по ICA пошагово увеличивать дозу спиронолактона** до максимальной дозы 400 мг перорально в день (не более 1 недели) при отсутствии ответа на более низкую дозу [1, 65, 124, 242, 245].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Спиронолактон** и его активные метаболиты имеют продолжительный период полувыведения, в связи с чем эффект от изменения дозы будет развиваться в течение 72 ч. Учитывая это, дозу спиронолактона** увеличивают на 100 мг не чаще, чем каждые 3 - 4 дня. Критерий эффективности проводимой терапии: уменьшение массы тела не менее, чем на 2 кг в неделю [89, 188].
- Рекомендовано добавлять к лечению петлевые диуретики (сульфонамиды) - фуросемид** или торасемид - в нарастающих дозах (по 40 или 5 мг перорально соответственно) пациентам с ЦП с асцитом второй степени по ICA при неэффективности монотерапии спиронолактоном** или развитии его побочного действия в виде гиперкалиемии с целью достижения отрицательного водного баланса [1, 65, 242, 245 - 247].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: В рандомизированном клиническом исследовании (РКИ) с участием 100 пациентов было продемонстрировано, что комбинированная терапия спиронолактоном** + фуросемидом**/торасемидом не уступает по эффективности монотерапии, а также имеет аналогичный профиль безопасности. Помимо ситуаций, когда развиваются побочные эффекты, комбинированная терапия имеет преимущества в эффективности над монотерапией при повторном развитии асцита и (или) длительном его течении, а также при необходимости ускорения процесса его купирования [244]. Начальная доза фуросемида** (40 мг/сут) постепенно увеличивается на 40 мг каждые 7 дней до максимальной дозы 160 мг/сут, доза торасемида - 5 мг до максимальной суточной дозы 30 мг [1, 65, 245]. На более продвинутых этапах ЦП, когда асцит уже ранее возникал, будет рационально сразу начинать с комбинации спиронолактона** и фуросемида** (в дозе 200 и 50 мг/сут) [243].
- Рекомендовано рассмотреть вопрос замены фуросемида** на торасемид пациентам с ЦП и асцитом второй степени по ICA с неудовлетворительным ответом на фуросемид** для достижения отрицательного водного баланса [1, 65, 247 - 257].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Эффект фуросемида** может быть ниже ожидаемого у пациентов с гипоальбуминемией, что связано с фармакокинетикой препарата: для реализации необходимого эффекта фуросемид** должен связываться с молекулой альбумина [251]. В нескольких небольших РКИ было продемонстрировано, что торасемид не уступает фуросемиду** в диуретической и натрийретической активности [247 - 250], подходит для продолжительного применения, при этом не зависит от уровня альбумина, что делает его хорошей альтернативой фуросемиду**. В то же время в некоторых случаях проблема неэффективности фуросемида** на фоне гипоальбуминемии (менее 25 г/л) может решаться путем трансфузий р-ра альбумина (в дозе не менее 30 г). Комбинация фуросемида** с альбумином оказывает более выраженный натрий- и диуретический эффект в сравнении с монотерапией фуросемидом** [252].
- Рекомендовано дозу диуретиков подбирать таким образом, чтобы максимальное уменьшение массы тела для пациентов с ЦП и асцитом без периферических отеков составляло 0,5 кг/день, а для пациентов с асцитом и периферическими отеками - 1 кг/день для профилактики развития ассоциированных осложнений [1, 65, 243].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Способность брюшины реабсорбировать асцитическую жидкость ограничена примерно 500 мл/сут, в связи с чем уменьшение массы тела более чем на 0,5 кг у пациентов без периферических отеков и на 1 кг у пациентов с периферическими отеками может грозить развитием ОПП и гипонатриемии. В связи с этим пациентам с ЦП и разрешающимся асцитом дозу диуретиков снижают до минимальной эффективной дозы во избежание развития побочных эффектов мочегонной терапии [253]. При разрешении асцита доза диуретиков должна уменьшаться до уровня, при котором асцит не возникает вновь/остается минимальным, либо отменена по усмотрению врача.
- Рекомендовано проводить регулярную оценку наличия осложнений/нежелательных лекарственных реакций, связанных с приемом мочегонной терапии, пациентам с ЦП и асцитом для их своевременной коррекции [253].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Помимо ожидаемых полезных эффектов, применение диуретиков у пациентов с ЦП выступает в качестве фактора риска целого ряда осложнений:
- ОПП, особенно при комбинации диуретиков;
- электролитных нарушений: гипонатриемии, гипокалиемии при применении петлевых диуретиков, гиперкалиемии на фоне приема антогонистов альдостерона;
- ПЭ (преимущественно ассоциирована с электролитными нарушениями и гиповолемией);
- гинекомастии на фоне терапии спиронолактоном** (часто болезненная при пальпации);
- мышечных судорог.
Основания для полной отмены диуретиков: снижение концентрации сывороточного натрия менее 125 ммоль/л, прогрессирующая почечная недостаточность, углубление ПЭ и развитие судорог. Если на фоне диуретической терапии развивается гиповолемия, то восполняется объем циркулирующей крови (ОЦК); при электролитных нарушениях отменяется провоцирующий диуретик и проводится коррекция электролитного баланса, при гинекомастии и эректильной дисфункции необходима замена спиронолактона** на #эплеренон в дозе, соответствующей половине дозы спиронолактона (т.е. 50 мг #эплеренона соответствует 100 мг спиронолактона) [253] При снижении уровня сывороточного калия менее 3,0 ммоль/л пациенту следует отменить фуросемид**; при повышении уровня калия выше 6 ммоль/л - отменить спиронолактон**. Следует избегать назначения максимальных доз диуретиков дольше 1 недели [1, 65, 253].
ЦП и асцит третьей степени по ICA (напряженный асцит)
- Рекомендовано пациентам с ЦП и асцитом третьей степени по ICA выполнять лечебный парацентез с регулируемым удалением перитонеального транссудата (лапароцентез) для облегчения их общего физического состояния, улучшения перфузии почек, уменьшения одышки [1, 65, 248, 254].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Процедура парацентеза безопасна, эффективна и имеет меньше побочных эффектов в случае напряженного асцита, чем диуретическая терапия. Парацентез проводится в стерильных условиях. Нежелательна эвакуация асцитической жидкости с использованием троакара. Процедура ассоциирована с очень низким риском местных осложнений (преимущественно локальное подкожное кровотечение) даже у пациентов с МНО > 1,5 и уровнем тромбоцитов < 30 000/л, профилактические трансфузии компонентов крови не требуются. Объемный парацентез не проводится при синдроме диссеминированного внутрисосудистого свертывания, инфекциях мягких тканей в месте предполагаемой пункции, выраженном парезе кишечника [105].
- Рекомендовано пациентам с ЦП и асцитом третьей степени по ICA после проведения парацентеза в объеме более 5 л асцитической жидкости вводить высокодозный альбумин человека** из расчета 8 г на каждый удаленный литр (но не более 100 г на 1 манипуляцию) асцитической жидкости в целях профилактики циркуляторных расстройств [1, 65, 248, 254].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Объемный лапароцентез (удаление более 5 л асцитической жидкости одномоментно) потенциально ассоциирован с последующим снижением эффективного объема крови - циркуляторной дисфункцией. Клинически она проявляется ОПП, дилюционной гипонатриемией, ПЭ и снижением выживаемости этих больных. Чтобы предотвратить развитие осложнений после парацентеза, необходимо возмещать объем циркулирующей жидкости. Следует назначать только 20, 25%-й раствор альбумина человека** [255]. Следует помнить, что введение 500 мл и более 20%-го раствора альбумина человека** (за одно введение) может привести к развитию респираторного дистресс-синдрома [1, 253]. Назначение декстрана** (B05AA кровезаменители и препараты плазмы крови) следует избегать ввиду отсутствия эффективности. В день проведения процедуры диуретики отменяют [1, 2, 253].
- Рекомендовано при проведении объемного парацентеза у пациентов с ЦП выполнять эвакуацию асцитической жидкости одномоментно (в течение 1 - 4 часов), без имплантации постоянных перитонеальных дренажных катетеров*** с целью снижения риска инфекционных осложнений и уменьшения смертности [133, 253; 137; 139].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Пациенты с декомпенсированным ЦП имеют высокий риск развития инфекционных осложнений по причине общего сниженного иммунного статуса, лейкопении, системного воспаления, гиперпродукции провоспалительных цитокинов, дефектных свойств молекулы альбумина. Повторные госпитализации и инвазивные процедуры, в частности установка перитонеальных дренажей (катетеров перитонеальных дренажных***), у пациентов с ЦП повышает риск развития инфицирования асцитической жидкости и инфекции мягких тканей, ассоциированных с микроорганизмами с множественной лекарственной резистентностью [9, 48, 75]. По этой причине при проведении лапароцентеза пациентам с ЦП желательно дренировать как можно большее количество асцитической жидкости за один сеанс, при условии введения соответствующего количества альбумина человека**. При этом следует помнить, что количество допустимого альбумина человека** не должно превышать 100 г/сут. При проведении лапароцентеза следует предпринять меры, снижающие риск подтекания асцитической жидкости из места выполнения парацентеза, которое повышает риск инфицирования: после процедуры пациенты должны лежать на противоположной стороне в течение 2 часов, на зону выполнения манипуляции возможно наложение мешка для стомы [253].
Алгоритм ведения пациента с асцитом представлен на рисунке 2 в приложении Б.
- Рекомендовано пациентам после проведения объемного парацентеза и возмещения объема удаленной асцитической жидкости введением высокодозного раствора альбумина человека** назначать диуретики в сочетании с диетой с ограничением пищевого натрия для профилактики рецидива асцита [1, 2, 253].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Лечение ЦП с резистентным асцитом
- Рекомендовано у пациентов с ЦП и резистентным асцитом без системных осложнений ЦП (кровотечение или бактериальные осложнения) оценивать приверженность к диуретической терапии и диетическим рекомендациям с целью своевременной диагностики резистентного асцита [1, 2, 253].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Критерии резистентного асцита представлены в разделе "1.5. Классификация заболевания или состояния (группы заболеваний или состояний)". Нередко асцит ошибочно расценивается как резистентный. Причинами неэффективности диуретической терапии может быть несоблюдение пациентом гипонатриемической диеты, прием НПВП, что приводит к задержке жидкости, назначение неадекватных доз диуретиков, низкий уровень альбумина (актуально для фуросемида**, эффективность которого реализуется при связывании с молекулой альбумина) [253, 256].
- Рекомендовано проведение повторных парацентезов в сочетании с введением высокодозного раствора альбумина человека** (из расчета 8 г на литр удаленной асцитической жидкости, но не более 100 г в течение одной манипуляции) пациентам с резистентным асцитом, находящимся в листе ожидания ТП, с целью улучшения их качества жизни [1, 65, 253].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано назначение #рифаксимина в дозе 800 мг/сут пациентам с ЦП и резистентным асцитом для улучшения выживаемости [65, 256].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Назначение #рифаксимина в дозе 200 мг 4 раза в сутки длительностью не менее двух недель пациентам с резистентным асцитом продемонстрировало повышение 6-месячной выживаемости (p < 0,048) в сравнении с группой контроля, которая получала базисную терапию ЦП без включения в нее #рифаксимина [256].
Хирургические аспекты лечения пациентов с ЦП и резистентным асцитом представлены в разделе "3.3.2. Хирургическое лечение пациентов с ЦП и резистентным асцитом".
3.2.2. Лечение цирроза печени с кровотечениями из варикозных вен пищевода и желудка
- Всем пациентам с ЦП с признаками острого кровотечения из верхних отделов желудочно-кишечного тракта рекомендован осмотр (консультация) врачом-анестезиологом-реаниматологом первичный и перевод или госпитализация в отделение интенсивной терапии и реанимации для мониторирования витальных функций [1, 65, 258, 259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Кровотечение как из ВВ, так и из других локализаций у пациентов с декомпенсированным ЦП сопряжено с высоким риском осложнений и смертности. Ургентную медикаментозную терапию необходимо начинать, не дожидаясь подтверждения кровотечения методом ЭГДС. Лечебная тактика основывается на оценке клинического состояния больного, тяжести течения заболевания и степени кровопотери, ведение пациента осуществляют мультидисциплинарной командой врачей-хирургов, врачей-анестезиологов-реаниматологов, врачей-эндоскопистов или врачей-гастроэнтерологов, а также специалистов смежных диагностических служб [65, 148, 259].
- Рекомендовано проводить трансфузии компонентов крови пациентам с ЦП и варикозным кровотечением для достижения целевого уровня гемоглобина 7 - 9 г/дл [18, 65, 260].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Показатели целевого уровня гемоглобина при назначении компонентов крови могут быть скорректированы и должны учитывать индивидуальные факторы у определенных групп больных (сердечно-сосудистые заболевания, возраст, гемодинамический статус, продолжающееся кровотечение и пр.) [2, 148, 258, 261].
- Не рекомендовано пациентам с ЦП и варикозным кровотечением проведение трансфузий свежезамороженной плазмы в качестве метода достижения гемостаза во избежание перегрузки объемом и усугубления ПГ [2, 262 - 266].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Причиной варикозного кровотечения служит повышенное давление в портальной системе. Поэтому лечение прежде всего должно быть сосредоточено на ликвидации источника кровотечения и снижении портального давления, а не на коррекции коагулопатических нарушений. Рутинные показатели коагулограммы (протромбиновое время, МНО, активизированное частичное тромбопластиновое время) не отражают должным образом коагуляционный статус у больных с ЦП. Также отсутствуют данные о том, что уровень тромбоцитов и фибриногена влияет на эффективность лечения (рецидива) кровотечения. Решение о коррекции гемостатических нарушений должно приниматься индивидуально в каждом конкретном случае [2, 262 - 268].
- Рекомендовано воздерживаться от применения рекомбинантного фактора свертывания крови VII** при варикозных кровотечениях у пациентов с ЦП с целью купирования эпизода кровотечения ввиду отсутствия доказательств его эффективности у пациентов данной категории [262, 269].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано воздерживаться от применения транексамовой кислоты** при варикозных кровотечениях у пациентов с ЦП с целью купирования эпизода кровотечения ввиду отсутствия доказательств ее эффективности у пациентов данной категории [2, 148, 262, 270].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
- Рекомендовано пациентам с ЦП и варикозным кровотечением назначать цефтриаксон** в дозе 1 г/сут на протяжении 7 суток с целью снижения риска инфекционных осложнений, улучшения выживаемости [2, 271 - 273].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Антибиотикопрофилактику необходимо начинать незамедлительно при возникновении варикозного кровотечения и продолжать в течение 7 дней. Цефтриаксон** в дозе 1 г/сут служит препаратом первой линии для пациентов с декомпенсированным ЦП, а также пациентов, уже получающих производные хинолона (фторхинолоны) либо пребывающих в стационарах с высокой частотой фторхинолон-устойчивых бактериальных штаммов. В остальных случаях могут применяться фторхинолоны (#норфлоксацин 400 мг дважды в день) [271 - 273]. Применение антибиотиков (антибактериальных препаратов системного действия) позволяет снизить частоту инфекционных осложнений, показателей смертности и уменьшить риск повторного кровотечения в течение первых 4 недель [273, 274].
- Рекомендовано у пациентов с ЦП и варикозным кровотечением удаление крови из желудочно-кишечного тракта (с использованием #лактулозы** 30 мл перорально 3 - 4 раза в сутки до прекращения мелены либо в виде клизм или высоких очистительных клизм) в максимально короткие сроки с целью профилактики ПЭ [1, 2, 15, 18, 19, 65, 90, 259, 275 - 278].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Водный раствор осмотических слабительных средств вводится через установленный с целью гемостаза зонд для остановки кровотечения пищевода "Блекмора" после промывания желудка до чистых вод. При остановленном кровотечении следует продолжить пероральное введение #лактулозы** (или с помощью клизм - при отсутствии возможности введения per os).
- Рекомендовано пациентам с ЦП и варикозным кровотечением после достижения гемостаза как можно раньше вернуться к пероральному питанию с целью профилактики развития и усугубления недостаточности питания и саркопении исходя из состояния пациента [2, 148, 279 - 281].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано пациентам с ЦП и варикозным кровотечением отменить ингибиторы протонного насоса, если таковые были назначены ранее и нет прямых показаний к их применению, после установления причины кровотечения с целью уменьшения риска инфекционных осложнений/ПЭ [2, 148, 282 - 284].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Как только установлено, что источником кровотечения являются ВВ, введение ИПП следует прекратить, если только нет прямых показаний к их дальнейшему применению (эрозивный эзофагит/ГЭРБ, эрозивно-язвенное поражение желудка и (или) двенадцатиперстной кишки), так как ряд исследований показал, что применение препаратов данной группы у пациентов с ЦП увеличивает риск развития инфекционных осложнений и (прогрессии) ПЭ [282 - 284].
- Рекомендовано пациентам с ЦП и варикозным кровотечением незамедлительное (до выполнения эндоскопии) назначение терлипрессина** или октреотида** с целью уменьшения кровопотери и снижения смертности [2, 18, 65, 90, 148, 259, 285 - 292].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Назначение терлипрессина** или октреотида** до проведения ЭГДС позволяет уменьшить объем кровопотери во время эндоскопического вмешательства и облегчить проведение эндоскопического лечения, тем самым улучшая прогноз этих пациентов. Терлипрессин** и октреотид** вызывают спланхническую вазоконстрикцию и, соответственно, уменьшают объем портальной крови, тем самым снижают риск раннего повторного кровотечения. Терлипрессин** - синтетический аналог гормона задней доли гипофиза (антидиуретический гормон). Этот препарат непосредственно воздействует на гладкомышечные клетки сосудов. Механизм действия октреотида** связан с подавлением активности эндогенных вазодилататоров (в частности, глюкагона). Рекомендуемая доза #терлипрессина** согласно инструкции - внутривенно 2 мг каждые 4 ч в течение 48 ч, затем 1 мг каждые каждые 4 - 6 ч. Рекомендуемая доза #октреотида** - болюсно 50 мкг, затем - путем постоянной инфузии 25 - 50 мкг/ч [285 - 291].
Продолжительность терапии вазоактивными препаратами (октреотид**, терлипрессин**) при варикозном кровотечении должна составлять от 2 до 5 дней [2, 148]. Во время терапии терлипрессином необходим контроль за развитием нежелательных лекарственных реакций (см. раздел "3.2.7. Лечение цирроза печени с гепаторенальным синдромом с критериями острого повреждения почек (ГРС-ОПП)"). После окончания терапии вазоактивными препаратами (октреотид, терлипрессин) необходимо возобновить прием неселективных бета-адреноблокаторов/#карведилола**, как только появится возможность перорального приема пищи [148].
В настоящее время отсутствуют рекомендации ведущих международных экспертов о применении органических нитратов при лечении варикозных кровотечений, а также их первичной и вторичной профилактики [2, 148].
- Рекомендовано введение #эритромицина в дозе 250 мг внутривенно за 30 - 120 мин до ЭГДС пациентам с варикозным кровотечением при отсутствии противопоказаний (удлинение QTc) с целью ускорения эвакуации содержимого из желудка и улучшения визуализации при эндоскопии [2, 148, 259, 272, 293 - 295].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Основные методы хирургического лечения кровотечений из варикозных вен пищевода и желудка представлены в разделе "3.3. Хирургическое лечение".
3.2.3. Лечение цирроза печени с печеночной энцефалопатией
Медикаментозная терапия ПЭ включает применение гипоаммониемических препаратов с различным механизмом действия: орнитин способствует связыванию аммиака, лактулоза** и невсасывающийся антибиотик рифаксимин подавляют рост аммониепродуцирующей флоры в кишечнике. Все три препарата применяются в качестве монотерапии или сочетаются друг с другом по усмотрению врача [21]. Сочетание рифаксимина с лактулозой**, орнитина с лактулозой** и рифаксимином позволяет получить дополнительный положительный эффект в разрешении ПЭ, улучшении физического функционирования пациента и исходах заболевания [296, 297]. Среди препаратов, подавляющих рост аммониепродуцирующей флоры кишечника, безопасность невсасывающегося антибиотика рифаксимина выше в сравнении с лактулозой** [298].
Лечение явной печеночной энцефалопатии
- Рекомендовано пациентам с ЦП с любыми клиническими вариантами явной ПЭ выявление и устранение провоцирующих факторов с целью ее быстрого и эффективного разрешения [1, 65, 97, 299, 300].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Устранение провоцирующих факторов ПЭ (остановка кровотечения, коррекция гиповолемии, поддержание кислотно-щелочного и электролитного баланса, ликвидация инфекции и т.д.) является основной задачей, поскольку позволяет в 90% случаев ее купировать [1, 19, 65, 299 - 303].
- Рекомендовано применение лактулозы** пациентам с явной ПЭ для уменьшения ее клинических симптомов и улучшения клинических исходов, а также снижения уровня аммиака в системном кровотоке за счет коррекции кишечного дисбиоза [1, 19, 65, 176, 304, 305].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Лактулоза выпускается в виде сиропа, который может вводиться перорально, ректально в виде клизм и через желудочный/назогастральный зонд. Путь введения лактулозы** выбирается врачом по индивидуальным показаниям, что определяется степенью ПЭ и тяжестью общего состояния пациента. Чаще всего сироп лактулозы** принимают перорально в индивидуальной дозе (как правило, начальная доза составляет 15 - 30 мл каждые 12 ч). В дальнейшем доза препарата подбирается индивидуально для появления/поддержания 2 - 3-кратного опорожнения кишечника в течение суток. Лактулоза** в сравнении с плацебо/отсутствием вмешательства эффективна в уменьшении симптомов явной ПЭ и выживаемости пациентов [21]. Показано, что эффективность лактулозы** аналогична эффективности другого невсасывающегося дисахарида - лактитола в лечении клинически явной ПЭ [176].
Прием высоких доз лактулозы** (60 мл/сут) может привести в ряде случаев к таким осложнениям, как дегидратация с усугублением ПЭ, развитием гипернатриемии и повышением концентрации креатинина в крови, происходит это на фоне в среднем 5 опорожнений кишечника в сутки [306].
- Рекомендовано применение рифаксимина в дозе 1100 мг/сут для лечения явной ПЭ II - III стадии у пациентов с ЦП с целью уменьшения симптомов ПЭ, снижения уровня аммиака в крови [21, 65, 298, 302, 303, 307].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Рифаксимин имеет широкий спектр антибактериальной активности, воздействуя на большинство грамположительных и грамотрицательных бактерий, как аэробных, так и анаэробных. Препарат практически не всасывается в желудочно-кишечном тракте (при пероральном приеме натощак в крови обнаруживается не более 0,4% от принятой дозы). Доказано положительное действие рифаксимина как на уровень аммония в крови, так и на динамику клинических проявлений ПЭ в условиях монотерапии, в комбинации с лактулозой**, при непереносимости лактулозы** [1, 21, 65, 298, 302, 303, 308]. Эффективность рифаксимина сопоставима с эффективностью невсасывающихся дисахаридов и других невсасывающихся антибиотиков (антибиотик-рифаксимин, лактулоза**), но профиль безопасности значительно лучше. Длительность применения рифаксимина при ПЭ II - III стадии варьирует от 5 - 7 дней до 6 месяцев в зависимости от клинической ситуации [19, 298, 307].
- Рекомендовано применение орнитина для лечения явной ПЭ II - IV стадии у пациентов с ЦП для уменьшения симптомов ПЭ, уровня аммиака крови, 28-дневной смертности [303, 308 - 313].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Орнитин и аспартат играют основную роль в превращении аммиака в мочевину. Орнитин включается в цикл мочевины в качестве субстрата и служит стимулятором для одного из основных ферментов в цикле мочевины; аспартат также включается в цикл превращения аммиака и служит субстратом для синтеза глутамина. Таким образом, прием орнитина усиливает метаболизм аммиака, что способствует уменьшению клинических проявлений и улучшению исходов ПЭ. Из препаратов орнитина наибольшей доказательной базой обладает орнитин (L-орнитина - L-аспартата) [13].
Эффективность применения орнитина у пациентов с явной ПЭ II - IV стадий по критериям West Haven показана в ряде метаанализов. По сравнению с плацебо/отсутствием вмешательства орнитин (суточная доза - 9 - 18 г per os или 20 г внутривенно, длительность лечения - от 3 до 14 дней) был эффективнее в уменьшении симптомов ПЭ, смертности, скорости и степени снижения как тощаковой, так и постпрандиальной гипераммониемии. При этом переносимость, частота побочных эффектов между орнитином и плацебо/отсутствием существенно не различались [311 - 313].
При сравнении орнитина с другими гипоаммониемическими средствами для лечения явной ПЭ показан либо одинаковый эффект [314], либо преимущество орнитина в отношении клинического улучшения, снижения концентрации аммиака и переносимости лечения [19, 21, 308, 314, 315].
В двойном слепом рандомизированном плацебо-контролируемом исследовании пациентов с ЦП и тяжелой ПЭ (III - IV стадии по критериям West Haven) терапия с применением орнитина в виде непрерывной внутривенной инфузии в дозе 30 г в течение 24 ч в течение 5 дней в комбинации с лактулозой** и рифаксимином демонстрировало достоверное улучшение в течение ПЭ, снижении 28-дневной летальности, уменьшении маркеров воспаления (IL-6 и ![]() ), снижении уровня аммиака в сравнении с плацебо в комбинации с лактулозой** и рифаксимином [297].
), снижении уровня аммиака в сравнении с плацебо в комбинации с лактулозой** и рифаксимином [297].
По результатам метаанализа, опубликованного в 2024 г., орнитин в сравнении с лактулозой** и рифаксимином обладает самым выраженным гипоаммониемическим действием [316].
Орнитин выпускается как в виде раствора для внутривенной инфузии, так и в форме гранул для приготовления раствора для перорального приема. Стандартная схема применения предусматривает внутривенное капельное введение до 40 г (обычно достаточно 20 - 30 г) препарата в сутки в течение 7 - 14 дней с последующим переходом на пероральный прием 9 - 18 г/сут [1, 311, 317]. Для достижения более быстрого и стойкого результата возможна комбинация внутривенного и перорального способа применения.
Применение орнитина ограничено при выраженном нарушении функции почек (креатинин более 266 мкмоль/л).
Лечение скрытой печеночной энцефалопатии
- Рекомендовано применение орнитина в суточной дозе 9 - 18 г в два или три приема перорально в течение 2 - 3 месяцев для лечения скрытой ПЭ (минимальной и I стадии по критериям West Haven) у пациентов с ЦП с целью ее разрешения и профилактики клинически явной ПЭ, улучшения качества жизни и физического функционирования пациентов [19, 313, 318 - 321].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: В клинических исследованиях, систематических обзорах и метаанализах показана эффективность орнитина (LOLA) в лечении скрытой ПЭ (минимальной и I стадии по критериям West Haven), что выражалось в улучшении показателей выполнения психометрических тестов, качества жизни и физического функционирования. Переносимость препарата была лучше, чем лактулозы** [19, 313, 314, 319, 320]. Помимо этого, по результатам ранее проведенного РКИ применение орнитина в течение 3 месяцев оказалось сравнимым по эффективности с лактулозой**, а также превзошло последнюю в аспекте снижения уровня аммиака (p < 0,0001) [320]. В систематическом обзоре шести РКИ с участием 292 пациентов с ЦП и минимальной ПЭ сравнивалась эффективность орнитина (LOLA) с плацебо или отсутствием вмешательства. Было показано, что как пероральная, так и внутривенная форма орнитина приводила к разрешению минимальной ПЭ и предупреждала ее прогрессирование в клинически явную форму (ОР 2,648; 95% ДИ 1,593 - 4,402; P = 0,000; I2 = 0,0% для пероральной формы; ОР 1,669; 95% ДИ 0,904 - 3,084; P = 0,102, I2 = 0,0% для внутривенной формы) в сравнении с плацебо/отсутствием вмешательства [318]. Согласно текущим научным данным, минимально эффективная доза орнитина для пациентов с ЦП и скрытой ПЭ составляет 9 г/сут [19].
- Рекомендовано применение рифаксимина в дозе не более 1200 мг/сут для лечения скрытой ПЭ (минимальной и I стадии по критериям West Haven) у пациентов с ЦП с целью ее разрешения, профилактики клинически явной ПЭ и уменьшения числа связанных с этим госпитализаций, улучшения качества жизни пациентов [296, 322].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: В рандомизированном двойном слепом плацебо-контролируемом исследовании с включением 299 пациентов с рецидивирующей ПЭ в фазе ремиссии рифаксимин в дозе 550 мг 2 раза в день значительно снижал риск развития повторного эпизода ПЭ в сравнении с плацебо (ОР при применении рифаксимина - 0,42; 95% ДИ 0,28 - 0,64; P < 0,001), что сопровождалось меньшим числом госпитализаций; курс лечения составил 6 месяцев. Более 90% пациентов получали сопутствующую терапию лактулозой**. Частота нежелательных явлений, о которых сообщалось в ходе исследования, была одинаковой в обеих группах [299].
Безопасность долгосрочного применения рифаксимина 550 мг 2 раза в сутки в течение 24 месяцев и его эффективность относительно профилактики случаев клинически явной ПЭ и снижения числа связанных с этим госпитализаций подтверждены в клиническом исследовании OLE RFHE3002 [323].
В систематическом обзоре группы Кокрейн [296] было показано, что применение рифаксимина в сравнении с плацебо/отсутствием вмешательства улучшает качество жизни у пациентов с ЦП и минимальной ПЭ. Рифаксимин в сочетании с неабсорбируемыми дисахаридами (лактулоза**), вероятно, снижает общий риск летальности, сокращает продолжительность пребывания пациента в больнице и предотвращает развитие явной ПЭ. Определенность доказательств этих исходов варьирует от очень низкой до умеренной; необходимы дальнейшие высококачественные исследования.
В другом систематическом обзоре и метаанализе [324] показано, что рифаксимин улучшал качество жизни, социальное функционирование и сон пациентов с ЦП и ПЭ.
В мультицентровом проспективном открытом исследовании NORMIND с включением 288 пациентов с ЦП и минимальной ПЭ была показана эффективность рифаксимина в дозе 1200 мг/сут в течение 12-месячного курса лечения в улучшении качества жизни, концентрации внимания, когнитивных функций, работоспособности [322].
Длительность применения рифаксимина: рифаксимин в дозе 1100 мг/сут - от 6 до 24 месяцев по усмотрению врача, рифаксимин в дозе 1200 мг/сут - до 12 месяцев по усмотрению врача.
- Рекомендовано применение лактулозы** в суточной дозе 30 - 60 мл пациентам ЦП со скрытой ПЭ для разрешения минимальной ПЭ, профилактики явной ПЭ, улучшения качества жизни и физического функционирования [316]. Длительность лечения определяет врач по индивидуальным показаниям пациента.
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
3.2.4. Лечение цирроза печени с гипонатриемией
Тактика лечения гипонатриемии при ЦП зависит от ее степени тяжести, причины, которая послужила триггером к ее развитию, а также от того, хроническая она или развивалась остро (в течение 48 ч). Как правило, чем быстрее развивается гипонатриемия, тем быстрее она должна быть ликвидирована. Для ЦП наиболее характерна хроническая, гиперволемическая гипонатриемия (или гипонатриемия разведения) [96].
- Пациентам с ЦП и гиповолемической гипонатриемией рекомендовано устранение причины потери ОЦК: отмена диуретиков, слабительных средств и введение растворов электролитов (0,9% изотонический раствор натрия хлорида**) или раствора альбумина с целью коррекции гипонатриемии/профилактики развития жизнеугрожающих осложнений [96, 325].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с ЦП и гиперволемической гипонатриемией легкой степени тяжести (126 - 135 ммоль/л) рекомендовано ограничение объема жидкости для предотвращения дальнейшего падения уровня натрия и развития жизнеугрожающих осложнений [1, 65, 253].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с ЦП и гиперволемической гипонатриемией средней и тяжелой степени (уровень Na 120 - 125 и <= 120 ммоль/л соответственно) рекомендовано ограничение объема жидкости до 1 л в день на протяжении 2 - 3 суток и отмена диуретиков, слабительных средств для предотвращения дальнейшего падения уровня натрия [1, 65, 253].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Ограничение питьевого режима - один из первых шагов к коррекции уровня натрия у пациента с ЦП. Главная цель - добиться отрицательного водного баланса (т.е. объем потребленной жидкости должен быть меньше суточного диуреза и неощутимых потерь воды). Индикатором эффективности метода выступает повышение уровня натрия в первые 24 - 48 ч. Следует учитывать, что настрой и комплаенс пациента могут играть решающую роль в успешности этого метода, поскольку рекомендованное ограничение питьевого режима может быть достаточно существенным (менее 750 мл/сут), что крайне сложно поддерживать в течение определенного времени и может приводить к снижению аппетита и сокращению потребления белка и других энергетических субстратов [37, 96]. В наблюдательном исследовании с участием 595 пациентов с ЦП и гипонатриемией проводилось сравнение различных терапевтических подходов к лечению гипонатриемии: ограничение питьевого режима приводило к повышению уровня натрия на >= 5 ммоль/л на третьи сутки только в 39% случаев, при этом рецидив гипонатриемии происходил в 55% случаев [324]. Таким образом, ограничение питьевого режима скорее рассматривается как мера по удержанию уровня натрия, а не лечению гипонатриемии, которая не должна применяться продолжительно и быть единственным методом коррекции состояния [253]. В случае гипонатриемии средней и тяжелой степени тяжести помимо ограничения питьевого режима и отмены диуретиков и слабительных средств может назначаться 20%-й раствор альбумина человека**, особенно при наличии независимых показаний для его применения (ГРС-ОПП с гиповолемией, сепсис и высокообъемный лапароцентез), что позволяет решить сразу несколько задач [96, 328, 329]. Применение гипертонических растворов для лечения гипонатриемии может приводить к усугублению отечно-асцитического синдрома и оправдано только в случае ее тяжелого течения, при наличии жизнеугрожающих осложнений (сердечно-легочные осложнения, судороги, угнетение сознания, риск развития отека мозга) у пациентов в листе ожидания ТП и только в течение короткого периода времени [46, 253]. Также стоит иметь в виду, что при слишком быстрой коррекции гипонатриемии (увеличение уровня натрия > 8 ммоль/сут для пациентов с выраженными электролитными нарушениями, помимо гипонатриемии, мальнутрицией, энцефалопатией в анамнезе, алкогольной этиологией заболевания) существует риск развития осмотического демиелинизирующего синдрома [325].
Для лечения гипонатриемии также применяются ваптаны - антагонисты рецепторов вазопрессина (V1 и V2). Взаимодействие ваптанов с V2R приводит к изменению сродства АДГ (антидиуретического гормона) к своему рецептору, в результате чего снижается реабсорбция воды, увеличивается экскреция низкоосмолярной мочи и повышается уровень натрия в сыворотке крови [330]. Ваптаны обладают высоким уровнем эффективности в отношении АДГ-зависимых форм гипонатриемии, однако при ЦП данные об эффективности гетерогенны: с одной стороны, их применение приводит к достоверно значимому повышению уровня натрия, способствует уменьшению частоты возникновения ПЭ и СБП, с другой - не имеет стойкого эффекта (отмечается рецидив гипонатриемии вскоре после отмены толваптана) и, самое главное, не уменьшает показатели смертности [331 - 333]. Однако в РФ препараты указанной фармакологической группы не зарегистрированы и не применяются.
3.2.5. Лечение цирроза печени, осложненного инфицированным асцитом
- Рекомендовано незамедлительно назначать пациентам с ЦП и признаками инфицирования асцитической жидкости эмпирическую внутривенную антибиотикотерапию для улучшения жизненного прогноза [1, 65, 66, 78].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано у пациентов с ЦП и признаками инфицирования асцитической жидкости оценивать условия возникновения инфекции, профиль бактериальной резистентности в данной МО (https://amrmap.ru) и тяжесть инфекционного осложнения с целью выбора эмпирической антибиотикотерапии [1, 65, 66, 253, 334].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Пациенты с декомпенсированным ЦП крайне восприимчивы к развитию инфекций, вызванных микроорганизмами с множественной лекарственной устойчивостью, так как эти пациенты нуждаются в повторных госпитализациях, часто подвергаются инвазивным процедурам, принимают разные группы антибактериальных препаратов системного действия в качестве профилактики и с терапевтической целью [1, 65, 66]. Распространенность MDR-штаммов среди пациентов с ЦП на стадии декомпенсации и с признаками острой печеночной недостаточности на фоне хронической возрастает по всему миру, представляет большую проблему для здравоохранения и существенным образом сказывается на жизненном прогнозе пациентов [335]. Развитие бактериальной резистентности увеличивает риск смертности от инфицированного асцита в 4 раза [66, 96].
- Рекомендовано применение антибактериальных препаратов системного действия из группы других бета-лактамных антибактериальных препаратов (цефалоспорины третьего поколения) в качестве препаратов первой линии лечения пациентов с ЦП с внебольничной инфекцией асцитической жидкости при низком риске бактериальной резистентности с целью улучшения прогноза заболевания и выживаемости [1, 65, 66, 336, 337].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Предпочтение следует отдавать цефотаксиму** или цефтриаксону** (другие бета-лактамные антибактериальные препараты: цефалоспорины третьего поколения). Цефотаксим** назначается в дозе 2 г каждые 12 ч парентерально (эффективен в 67,8% случаев), цефтриаксон** - в дозе 2 г однократно в день парентерально (эффективен в 77,0% случаев). Длительность терапии составляет 5 - 7 дней. В зависимости от эпидемических данных возможен подбор эмпирической терапии [1, 65, 66, 336 - 338].
- Рекомендовано применение пиперациллина + тазобактама или цефоперазона + сульбактама** в качестве препарата первой линии лечения пациентов с ЦП и внебольничным инфицированием асцитической жидкости при высоком риске бактериальной резистентности к цефалоспоринам с целью улучшения прогноза заболевания и выживаемости [1, 65, 66, 336, 339].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Учитывая рост резистентности к цефалоспоринам третьего поколения среди госпитализируемых пациентов с декомпенсированным ЦП [335], некоторые профессиональные медицинские сообщества рекомендуют начинать лечение с пиперациллина + тазобактама или цефоперазона + сульбактама** при внебольничном инфицировании асцитической жидкости в случае выявления факторов, ассоциированных с развитием MDR-штаммов [65, 253, 339].
Предпочтительный путь введения пиперациллина + тазобактама - внутривенно в дозе 16 г/2 г в день в форме непрерывной внутривенной инфузии в течение первых 48 - 72 ч с последующим переходом на дозу 4 г/0,5 г каждые 6 - 8 ч [340]. Цефоперазон/сульбактам** вводится внутривенно в дозе 1 г/1 г 2 раза в день.
Инфекции, ассоциированные с оказанием медицинской помощи, и нозокомиальные инфекции часто связаны с развитием бактериальной резистентности [341].
- Пациентам с ЦП и инфицированным асцитом, связанным с оказанием медицинской помощи, и нозокомиальной инфекцией с целью разрешения инфекции рекомендовано назначение пиперациллин + тазобактама, если имеются данные о низкой частоте мультирезистентных штаммов [342, 343].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Пиперациллин + тазобактам остается препаратом 1-й линии при лечении пациентов с нозокомиальным СБП. Однако необходимо помнить, что препарат может быть неэффективным у пациентов с жизнеугрожающими инфекциями, вызванными энтеробактериями, продуцирующими бета-лактамазы [344]. Схема назначения пиперациллина + тазобактама указана выше.
- Рекомендовано пациентам с ЦП и инфицированным асцитом, связанным с оказанием медицинской помощи, и нозокомиальной инфекцией с целью улучшения выживаемости и снижения риска развития ОПП назначение других бета-лактамных антибактериальных препаратов - карбапенемов, если имеются данные о высокой распространенности энтеробактерий - продуцентов бета-лактамаз расширенного спектра действия (ESBL), а также при рецидивах инфицирования асцитической жидкости [345].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Карбапенемы (меропенем**, эртапенем**, имипенем + [циластатин]**) обладают высокой бактериальной активностью против энтеробактерий, продуцирующих бета-лактамазы, но в то же время слабо активны по отношению к стафилококкам и энтерококкам. Проведенные ретроспективные исследования показали более высокую эффективность карбапенемов в отношении разрешения инфицирования АЖ и повышения краткосрочной выживаемости пациентов с нозокомиальной инфекцией, рецидивами инфекции АЖ, а также среди пациентов с декомпенсацией заболевания и полиорганной недостаточностью (CLIF-SOFA >= 7 баллов) по сравнению с цефалоспоринами третьего поколения. Препарат из этой группы меропенем** назначается парентерально в дозе 1 г каждые 8 ч [46, 346].
- Рекомендовано пациентам с ЦП и инфицированным асцитом, связанным с оказанием медицинской помощи, и нозокомиальной инфекцией в случае высокой распространенности грамположительных бактерий с множественной лекарственной устойчивостью с целью улучшения выживаемости применение других бета-лактамных антибактериальных препаратов (карбапенемов) в комбинации с антибиотиками гликопептидной структуры или #даптомицином** или #линезолидом** [1, 48, 65, 96, 343, 348].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: В последние годы отмечается увеличение частоты случаев инфицированного асцита, вызванного Staphylococcus aureus, среди пациентов с нозокомиальной инфекцией (19 - 48%) [348]. Если у таких пациентов имеются факторы риска для развития метициллин-резистентных штаммов (MRSA) или пациенту незадолго до развития инфекции АЖ проводились медицинские вмешательства, то необходимо добавлять в схемы терапии антибактериальные препараты системного действия, активные в отношении MRSA (например, ванкомицин**, #даптомицин**, #линезолид**).
Антибиотики гликопептидной группы (например, ванкомицин**, тейкопланин) активны против MDR-грампозитивных кокков. Препараты должны применяться с осторожностью из-за риска нефротоксичности [349]. #Ванкомицин** назначается в дозе 15 мг/кг каждые 8 часов [334].
#Даптомицин** - это липопептид, активный в отношении MDR-грампозитивных патогенов, включая метициллин-чувствительные S. aureus, MRSA и VRE [350]. Комбинацию #даптомицина** и бета-лактамов (бета-лактамные антибактериальные препараты, пенициллины и другие бета-лактамные антибактериальные препараты) следует применять в лечении инфекций, вызванных даптомицин-устойчивыми и MRSA-штаммами [351]. #Даптомицин** назначается в дозе 8 - 12 мг/кг каждые 12 ч. #Линезолид** вводится в дозе 600 мг внутривенно каждые 12 ч [352].
- Рекомендовано пациентам с ЦП со спонтанной бактериальной эмпиемой придерживаться алгоритма подбора антибактериальной терапии, аналогичного инфицированию асцитической жидкости с целью улучшения прогноза заболевания и выживаемости [66, 99].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано у пациентов с ЦП и инфицированным асцитом оценивать эффективность антибиотикотерапии посредством повторного диагностического парацентеза (лапароцентеза) с цитологическим исследованием перитонеальной жидкости через два дня от начала лечения с целью коррекции терапии [1, 65, 66, 78].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Эффективность антибиотикотерапии определяют по исчезновению клинической симптоматики и уменьшению количества нейтрофилов асцитической жидкости более чем на 25% через 48 ч от начала лечения. Если уменьшения количества нейтрофилов не наблюдается, то высока вероятность развития инфекции, вызванной бактериями, устойчивыми к антибактериальной терапии [1, 65, 66, 347]. Заменять препарат следует с учетом чувствительности выделенного микроорганизма. Также в случае неэффективности лечения необходимо помнить о возможности развития вторичного перитонита. Наиболее важным негативным предиктором выживаемости при СБП служит развитие ОПП во время инфекции. Международное общество по изучению асцита рекомендует повторить цитологическое исследование перитонеальной жидкости через 2 дня.
- Рекомендовано введение высокодозного альбумина человека** пациентам с инфицированным асцитом и ЦП с целью профилактики развития ГРС-ОПП и снижения смертности [9, 65, 66, 317, 347, 353].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: СБП может провоцировать усугубление дисциркуляторных нарушений с развитием тяжелого нарушения функции печени, ПЭ и ГРС-ОПП, что, несмотря на разрешение инфекции, сопряжено с повышением смертности до 20% за период госпитализации [66, 353]. Добавление к антибактериальной терапии альбумина человека** в дозе 1,5 г/кг массы тела (но не более 100 г сухого вещества) в день постановки диагноза инфицированного асцита и 1 г/кг на 3-й день позволяет снизить развитие ГРС-ОПП (с 30 до 10%) и смертность (с 29 до 10%) по сравнению с антибактериальной терапией без введения альбумина человека**. Наиболее эффективно данная схема лечения СБП показала себя в группах пациентов с уровнем сывороточного креатинина более 1 мг/дл и билирубина более 4 мг/дл [1, 65, 66, 353].
3.2.6. Лечение цирроза печени с другими инфекционными осложнениями
- Рекомендовано незамедлительное назначение эмпирической антибактериальной терапии пациентам с ЦП с подозрением на инфекционное осложнение с целью снижения внутрибольничной смертности [1, 66, 354].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Самые частые инфекционные осложнения у пациентов с ЦП - инфекции мочеполовой системы, инфицированный асцит, пневмония, бактериемия. Быстрое начало эмпирической антибактериальной терапии снижает внутрибольничную смертность этих пациентов до 6% по сравнению со стандартной терапией (25%) [1, 65, 66, 354].
- Рекомендовано с целью подбора эмпирической антибиотикотерапии пациентам с ЦП основываться на условиях возникновения инфекции (внебольничная или связанная с оказанием медицинской помощи или нозокомиальная), профиле бактериальной резистентности в данном МО, типе инфекционного осложнения и его тяжести [1, 65, 66, 355].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: С целью оптимизации эмпирической антибиотикотерапии крайне важно определять время и условия возникновения инфекционного осложнения. Показано, что смертность при развитии нозокомиальной инфекции намного выше (25 - 48%), чем при развитии внебольничной инфекции (7 - 21%).
Более подробная информация по подбору эмпирической антибактериальной терапии при инфекционных осложнениях (инфекции мочеполовой системы, пневмония, бактериемия) представлена в соответствующих нормативных документах.
Классические схемы антибактериальной терапии не всегда возможно применять при ЦП, поскольку ряд антибактериальных препаратов системного действия или обладают гепатотоксическим потенциалом (например, амоксициллин + [клавулановая кислота]**), или не так эффективны по сравнению с общей популяцией, особенно в случае нозокомиальной инфекции. В основе этого лежит общий сниженный иммунный статус у пациентов с ЦП, лейкопения (в рамках гиперспленического синдрома), гиперпродукция провоспалительных цитокинов, дефектные свойства молекулы альбумина, системное воспаление и др.
3.2.7. Лечение цирроза печени с гепаторенальным синдромом с критериями острого повреждения почек (ГРС-ОПП)
Развитие ГРС представляет собой достаточно сложную задачу для клинициста: на начальных этапах требуется как можно более оперативное проведение дифференциального диагноза между различными фенотипами ОПП, которые в свою очередь уже будут влиять на выбор лечения, требующего тщательного мониторинга эффективности и развития нежелательных лекарственных реакций. Важным инструментом, необходимым для решения этой задачи, выступает определение волемического статуса, поскольку позволяет среди прочих признаков определить тот или иной фенотип и своевременно и адекватно скорректировать проводимое лечение. Оценка волемического статуса состоит из комбинации анамнестических, физикальных данных и данных ультразвуковой диагностики (оценка диаметра НПВ, ее коллабирования, эхокардиография, POCUS) [356, 337]. Могут встречаться следующие варианты:
- гиповолемия: представляет собой "визитную карточку" преренальной азотемии. В то же время отсутствие ответа на восполнение дефицита ОЦК через 24 ч от начала лечения требует пересмотра диагноза в пользу ГРС (важнейший признак ГРС);
- эуволемия: может встречаться при ГРС и ОКН также, как и гиперволемия;
- гиперволемия: пациентам с эуволемией или гиперволемией назначение альбумина человека** не показано, так как ведет к перегрузке объемом и развитию соответствующих осложнений, а также к задержке назначения вазопрессоров (терлипрессин, октреотид, норэпинефрин);
- интерпретация волемического статуса бывает затруднена: в таком случае инфузионная терапия может быть оправдана. Назначение солевых растворов и (или) альбумина человека** поможет исключить преренальную азотемию, как причину ОПП [30, 357].
- Рекомендовано пациентам с ЦП и подозрением на ГРС-ОПП оценить волемический статус перед назначением лечения для определения показаний к инфузии солевых растворов и (или) трансфузии альбумина человека** [30].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано восполнение ОЦК при гиповолемии пациентам с ЦП и подозрением на ГРС-ОПП с целью проведения дифференциального диагноза фенотипа повреждения почек и улучшения функции почек [30, 66, 355].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Восполнение ОЦК при ОПП с признаками гиповолемии преследует сразу две цели: купировать эпизод ОПП и исходя из ответа на лечение сделать выводы о том, какой это клинический фенотип. При преренальной азотемии восполнение ОЦК будет способствовать снижению уровня креатинина в течение 24 - 48 ч. При ГРС полноценный ответ на лечение будет отсутствовать, поскольку одного достижения эуволемии недостаточно, необходимо и воздействие на тонус спланхнических сосудов, дилатация которых - главный драйвер патогенеза ГРС [358]. Необходимый объем вводимой жидкости должен регулярно корректироваться в процессе лечения в зависимости от текущего волемического статуса, стадии ОПП, диуреза, что позволит избежать ятрогенной гиперволемии [356]. Выбор раствора при гиповолемии чаще всего зависит от провоцирующего фактора: пациентам с диареей или интенсивным диурезом показана терапия растворами, влияющими на водно-электролитный баланс (солевые растворы). Пациентам с острым желудочно-кишечным кровотечением необходимы трансфузии эритроцитарной массы (эритроцитсодержащие компоненты донорской крови) для поддержания гемоглобина на уровне 70 - 90 г/л [97]. При ГРС-ОПП и (или) наличии СБП чаще всего используется 20%-й или 25%-й раствор альбумина человека** [253]. При этом назначение раствора альбумина человека** на 48 ч для установления диагноза ГРС всем пациентам не целесообразно. Решение о проведении трансфузии должно приниматься исходя из текущего волемического статуса [30].
- Рекомендована отмена инфузионной терапии и назначение диуретиков или инициация заместительной почечной терапии пациентам с ЦП и ГРС-ОПП с признаками перегрузки объемом с целью улучшения функции почек [30, 356].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В зависимости от волемического статуса при ОПП может назначаться не только инфузионная, но и диуретическая терапия. В случае если имеет место гиперволемия, сперва применяются диуретики. Если отсутствует эффект от максимально переносимых дозировок, возникает метаболический ацидоз, в индивидуальном порядке может рассматриваться проведение заместительной почечной терапии [354].
- Рекомендован поиск и устранение провоцирующего фактора ГРС-ОПП у пациентов с ЦП с целью улучшения функции почек [1, 30, 65, 101].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: ГРС может развиваться без явных провоцирующих факторов, однако таковые в большинстве случаев все же присутствуют. К ним относятся: резкое снижение ОЦК (кровотечение из ВРВПиЖ, передозировка диуретиками, диарея различного генеза, в том числе инфекционного); СБП, сепсис, инфекции различных локализаций; прием неселективных бета-блокаторов (НСББ), проведение высокообъемного лапароцентеза. В анамнезе также могут быть указания на прием НПВП, антагонистов рецепторов ангиотензина II (БРА) и ингибиторы АПФ (иАПФ), использование контрастных средств. Наличие этих фактов будет требовать в первую очередь исключения преренальной азотемии и ОКН как причин ОПП. После установления причины необходимо ее купировать, т.е. отменить нефротоксичные препараты, диуретики, НПВП [1, 26, 65, 66, 101], бета-адреноблокаторы [1, 7, 65], назначить лечение, направленное на восполнение дефицита ОЦК при его наличии, устранение бактериальной инфекции [358].
- Рекомендовано пациентам с ЦП и ГРС-ОПП с целью разрешения повреждения почек вводить #терлипрессин** внутривенно болюсно в начальной дозе 0,5 мг с постепенным увеличением каждые 4 - 6 ч (до дозы 1 мг каждые 4 - 6 ч) или внутривенно непрерывно в начальной дозировке 2 мг/сут в комбинации с альбумином человека** в дозе 1 мг/1 кг массы тела (не более 100 мг/сут) в качестве терапии первой линии под контролем уровня креатинина каждые 48 - 72 ч [1, 65, 66, 359 - 365].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Терлипрессин**, аналог вазопрессина, - самый частый вазоконстриктор, действие которого изучалось у пациентов с ГРС-ОПП. Клинический ответ (полный или частичный) на введение терлипрессина** составляет 45 - 76% по данным различных исследователей [18, 65, 361 - 366]. В двух метаанализах было показано, что комбинация терлипрессина** и альбумина человека** не только улучшает почечную функцию, но и повышает краткосрочную выживаемость этих пациентов [361, 362]. #Терлипрессин** можно вводить внутривенно болюсно, начиная с дозы 0,5 - 1 мг каждые 4 - 6 ч с увеличением дозы до 2 мг каждые 4 - 6 ч в случае неадекватного снижения уровня сывороточного креатинина (< 25%) [65, 362, 363, 366, 367]. Предпочтительнее введение препарата через инфузомат непрерывно, начиная с дозы 2 мг в день. По эффективности такой путь введения препарата аналогичен болюсному введению, а по профилю безопасности - лучше, учитывая необходимость введения меньшей дозы [365]. Добавление к терапии терлипрессином** альбумина человека** считается более эффективным, чем монотерапия вазоконстрикторами [359]. Это можно объяснить тем, что, увеличивая эффективный объем кровообращения, альбумин человека** препятствует снижению сердечного выброса, связанного с ГРС, а также с действием терлипрессина** [32, 65, 368]. Кроме того, альбумин человека** оказывает антиоксидантное и противовоспалительное действие [65, 369]. Терлипрессин** следует отменить в случаях, когда: 1) уровень креатинина вернулся к исходному; 2) функция почек не улучшилась на фоне лечения с использованием максимально переносимой дозировки препарата на протяжении 48 ч, в этом случае также имеет смысл пересмотреть диагноз, поскольку вазопрессоры (терлипрессин, октреотид, норэпинефрин) имеют эффективность только в отношении ГРС и не должны применяться при других фенотипах ОПП; 3) есть показания к инициации заместительной почечной терапии; 4) развивается серьезная нежелательная лекарственная реакция; 5) продолжительность терапии достигла 14 дней [30].
- Рекомендовано пациентам с ЦП и ГРС-ОПП с целью уменьшения спланхнической артериальной вазодилатации и улучшения почечной перфузии вводить #норэпинефрин** в начальной дозе 0,5 мг/ч (максимальная доза - 3 мг/ч) внутривенно болюсно или в виде продолжающейся инфузии в комбинации с альбумином человека** в дозе 1 г/1 кг массы тела (не более 100 мг/сут) при недоступности терлипрессина или наличии противопоказаний к его применению, под контролем уровня креатинина каждые 48 - 72 ч [33, 359, 370 - 372].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: В ряде метаанализов и систематических обзоров было продемонстрировано, что #норэпинефрин** и терлипрессин** схожи по эффективности в отношении разрешения эпизода ОПП, влиянии на показатели смертности и превосходят другие вазоактивные препараты в этих аспектах. #Норэпинефрин** уступает терлипрессину** только в случае развития повреждения почек на фоне ACLF [372 - 374]. В связи с этим когда терлипрессин** не доступен или имеются противопоказания к его применению, может применяться #норэпинефрин** [359, 375, 376]. Вводится #норэпинефрин** внутривенно болюсно в дозе 0,5 - 3 мг/ч, начиная с наименьшей дозы препарата и постепенно увеличивая каждые 4 ч до достижения целевого подъема среднего артериального давления (САД) > 10 мм рт. ст. [358, 377]. Стоит учитывать, что, в отличие от терлипрессина**, для введения #норэпинефрина** необходим центральный венозный доступ, а в некоторых странах - перевод пациента в отделение интенсивной терапии. Критерии отмены #норэпинефрина** полностью совпадают с таковыми при применении терлипрессина** [30].
- Рекомендована динамическая оценка волемического статуса всем пациентам с ЦП и ГРС-ОПП и регулярная коррекция доз альбумина человека** в соответствии с волемическим статусом во время лечения с целью избежание развития гиперволемии [30, 377].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: При ГРС-ОПП показано ежедневное введение 20% или 25% раствора альбумина человека**, тем не менее важно заметить, что универсальная дозировка и продолжительность применения не определены и зависят от появления признаков гиперволемии, в связи с чем подбор режима осуществляется в индивидуальном порядке. При развитии отека легких необходима незамедлительная отмена препарата [30, 377].
- Рекомендован тщательный мониторинг состояния всем пациентам с ЦП и ГРС-ОПП, получающим терлипрессин**, включая выяснение жалоб со стороны органов ЖКТ, лабораторный контроль электролитного баланса, регистрацию ЭКГ, оценку признаков дыхательной недостаточности с целью своевременного устранения осложнений, ассоциированных с приемом терлипрессина** [30, 378].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендован тщательный мониторинг состояния всем пациентам, получающим #норадреналин**, включая регистрацию ЭКГ, с целью своевременного устранения осложнений, ассоциированных с приемом #норадреналина** [30, 378].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Терлипрессин**, аналог вазопрессина, оказывает воздействие на гладкую мускулатуру сосудов и органов ЖКТ, с чем и связано большое число нежелательных лекарственных реакций. С приемом терлипрессина** чаще всего ассоциирована тошнота, боль в животе и диарея (14 - 80%). Нередко возникает электролитный дисбаланс - гипонатриемия (30 - 60%). Со стороны сердечно-сосудистой системы (11%) могут возникать достаточно серьезные осложнения в виде аритмий и риска ишемического повреждения миокарда. При приеме терлипрессина** также нередко может развиваться одышка и дыхательная недостаточность, причинами которой выступают прямое повышение гидростатического давления внутри сосудов за счет централизации кровотока (увеличение преднагрузки) и повышение сопротивления периферических сосудов (увеличение постнагрузки) под воздействием препарата. В совокупности с введением альбумина человека**, увеличивающими внутрисосудистый объем жидкости, риск респираторных осложнений (отека легких, в частности) возрастает еще больше [378 - 380]. Частота отмены терлипрессина** из-за осложнений, преимущественно сердечно-сосудистых, составляет около 20% [16, 18]. Как и в случае терлипрессина**, при применении #норадреналина** повышается риск ишемических событий, возникновения аритмий [30].
3.2.8. Лечение цирроза печени с легочными осложнениями
- Рекомендовано назначение диуретиков пациентам с ЦП с печеночным гидротораксом с целью уменьшения объема плевральной жидкости и уменьшения дыхательной недостаточности [1, 65, 381].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Подходы к назначению диуретиков и контролю терапии у пациентов с ЦП и печеночным гидротораксом схожи с таковыми при асците (см. раздел 3.2.1). Назначают бессолевую диету и начинают лечение с комбинации спиронолактона** 100 мг и фуросемида** 40 мг перорально с постепенным увеличением доз препаратов до максимально переносимых [381].
- Рекомендовано проведение лечебного торакоцентеза с последующим лабораторной оценки плевральной жидкости (цитологическим исследованием плевральной жидкости, исследованием уровня белка в плевральной жидкости, исследование физических свойств плевральной жидкости, микробиологическое (культуральное) исследование плевральной жидкости на аэробные и факультативно-анаэробные микроорганизмы) пациентам с ЦП с печеночным гидротораксом, не отвечающим на диуретики, с целью уменьшения дыхательной недостаточности [1, 39, 65, 381].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Лечебный торакоцентез необходим для уменьшения выраженности дыхательной недостаточности, в том числе одышки. Однако его эффективность при рефрактерном печеночном гидротораксе ограничена, в ряде случае требуется проведение неоднократного торакоцентеза, что увеличивает риск осложнений, таких как пневмоторакс, инфицирование плевральной жидкости и мягких тканей, кровотечение. Исключение составляют пациенты, находящиеся в листе ожидания ТП, а также те, которым невозможно установить TIPS. Для них повторный торакоцентез - оптимальная тактика купирования симптомов. Подходы к оценке плевральной жидкости такие же, как и при инфицировании асцитической жидкости (см. раздел 3.2.5).
- Рекомендована длительная кислородотерапия пациентам с ЦП и ГПС с тяжелой формой гипоксии (PaO2 < 60 мм рт. ст. или SatO2 < 88% без респираторной поддержки) или при наличии ночной десатурации или десатурации при нагрузке с целью уменьшения дыхательной недостаточности [41, 65, 382].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В настоящее время нет убедительных данных об эффективности применения того или иного средства в лечении ГПС, что во многом обусловлено отсутствием больших рандомизированных исследований. Результаты некоторых неконтролируемых исследований показали неэффективность таких препаратов, как неселективные бета-адреноблокаторы, ненаркотические анальгетики (другие анальгетики и антипиретики), включая НПВП и другие противовоспалительные средства (ингибиторы циклооксигеназы), кортикостероиды системного действия, циклофосфамид** [1, 39, 41, 65, 382].
Единственным методом терапии, способным улучшить прогноз пациентов с ГПС, является трансплантация печени (см. раздел 3.3.2). Парциальное давление PaO2 < 44 мм рт. ст. до операции - предиктор высокой летальности, поэтому пациентов с тяжелым ГПС необходимо включать в лист ожидания ТП, а саму операцию желательно выполнить до падения PaO2 < 50 мм рт. ст. Без проведения ТП около 50% пациентов погибают в течение 2,5 лет с момента постановки диагноза. Газообмен обычно восстанавливается в течение 6 - 12 месяцев у 80% пациентов, однако встречаются случаи рефрактерного ГПС [383, 384].
Предполагалось, что наложение TIPS должно уменьшить портальное давление у пациентов с ГПС, однако полученные данные не продемонстрировали достоверно значимую эффективность этого метода лечения [385, 386]. Кроме того, TIPS может усугубить легочную вазодилатацию посредством усиления гиперкинетического типа кровообращения. Поэтому длительная оксигенотерапия остается единственным консервативным методом лечения, который может быть рекомендован пациентам с тяжелой дыхательной недостаточностью, обусловленной ГПС. Необходимо, однако, оценить такие аспекты этого лечения, как эффективность, стоимость, приверженность терапии.
Наличие ПЛГ не служит самостоятельным показанием к ТП у пациентов с компенсированным ЦП, однако требуется обязательный поиск ее признаков у пациентов-кандидатов в рамках обследования перед проведением ТП (трансторакальная эхокардиография). Среднее давление в легочной артерии (ДЛА ср.) > 45 мм рт. ст. и (или) признаки дисфункции правого желудочка - абсолютные противопоказания к ТП. Значения ДЛА ср. > 35 мм рт. ст. и < 45 мм рт. ст. ассоциированы с более высоким риском смертности пациентов [387, 388], поэтому перед ТП таким пациентам необходимо назначение препаратов, направленных на снижение давления в легочной артерии [383]. Лечение ПЛГ проводится в соответствии с актуальными клиническими рекомендациями по ведению пациентов с легочной артериальной гипертензией (ЛАГ) [389, 390]. В случае если удается взять под контроль давление в легочной артерии (< 35 мм рт. ст.), на следующем этапе становится возможным и проведение ТП. Именно такая тактика (ЛАГ-специфическая терапия + ТП) в сравнении с ТП без лечения ПЛГ и лечением ПЛГ без последующей ТП оказалась наиболее эффективной и была ассоциирована с самым благоприятным прогнозом пациентов [391].
У пациентов с ПЛГ избегают назначения бета-адреноблокаторов и выполнения TIPS, так как они ухудшают функцию правого желудочка [383, 384, 388].
3.2.9. Коррекция тромбоцитопении у пациентов с циррозом печени
Тромбоцитопения той или иной степени тяжести встречается при ЦП в 70% случаев. Вклад в ее развитие вносят следующие факторы: секвестрация и депонирование тромбоцитов увеличенной вследствие ПГ селезенкой, снижение выработки тромбопоэтина (ТПО) цирротической печенью; способные самостоятельно угнетать костномозговое кроветворение этиологические факторы ЦП (например, вирус гепатита C, алкоголь и т.д.). Тромбоцитопения умеренной и тяжелой степени нередко служит причиной отказа пациентам с ЦП в выполнении инвазивных процедур или хирургических вмешательств, что нередко негативно влияет на их физическое функционирование и прогноз. Серьезное отношение к тромбоцитопении оправдано, поскольку, согласно ряду исследований, она служит фактором риска перипроцедурных/периоперационных геморрагических осложнений. Соответственно, возникает вопрос: кому, когда и как ее нужно корректировать. Помимо уровня тромбоцитов, на исход влияют другие условия: какого рода вмешательство должно быть выполнено - плановое или экстренное, высокого риска геморрагических осложнений или низкого (приложение Г), какова система плазменного гемостаза, есть ли необходимость в коррекции тромбоцитов. Коррекция тромбоцитопении может потребоваться либо в экстренном, либо в плановом порядке, что влияет на выбор тактики ведения пациентов с ЦП.
С вопросами диагностики и коррекции плазменного гемостаза можно ознакомиться в соответствующих публикациях [262, 392 - 394].
Как правило, тромбоцитопения при ЦП не требует коррекции из-за крайне низкого риска развития спонтанных кровотечений, если только уровень тромбоцитов не снизится < 20 x 109/л. Однако такая клиническая ситуация встречается крайне редко у больных ЦП и всегда требует тщательного дифференциального диагноза [394].
Следует отметить, что превентивная коррекция факторов плазменного гемостаза, согласно мнению экспертов, также не продемонстрировала своего влияния на риск развития геморрагических осложнений у пациентов с ЦП [262, 393].
- Рекомендовано пациентам с ЦП перед выполнением инвазивных процедур/хирургических вмешательств оценить риск развития перипроцедурных/периоперационных геморрагических осложнений с целью планирования мероприятий по их предотвращению [105, 396, 397].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: При выполнении инвазивных процедур/хирургических вмешательств у любой категории пациентов риск кровотечения оценивается в зависимости от характера вмешательства, техники его выполнения, опыта оператора, возможностей локального гемостаза при развитии кровотечения, области вмешательства и т.д. У пациентов с ЦП на риск периоперационного/перипроцедурного кровотечения оказывают влияние дополнительные факторы: нарушение синтетической функции печени (снижение продукции про- и антикоагулянтов), тромбоцитопения, ПГ; декомпенсация заболевания и развитие острой печеночной недостаточности на фоне хронической.
С целью предотвращения перипроцедурных/периоперационных геморрагических осложнений риск инвазивных вмешательств у всех пациентов, в том числе при ЦП, классифицируется на низкий и высокий. К процедурам с низким уровнем риска относятся те, при которых ожидается, что сильное кровотечение произойдет в <= 1,5% случаев, и (или) если оно произойдет, то его можно легко остановить. К процедурам высокого риска относят вмешательства с риском сильного кровотечения - > 1,5%, и (или) если кровотечение возникает, то оно может быть трудноконтролируемым или приводить к катастрофическим последствиям даже в небольших объемах (например, кровотечение в центральной нервной системе), см. приложение Г [105, 262, 396 - 399].
- Рекомендовано пациентам с ЦП при экстренных оперативных вмешательствах коррекцию тромбоцитопении проводить посредством трансфузий концентрата тромбоцитов в индивидуальных дозах, которые зависят от тяжести тромбоцитопении у пациента; объема, характера оперативного вмешательства и порогового значения тромбоцитов для его выполнения с целью уменьшения числа перипроцедурных/периоперационных кровотечений [105].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В настоящее время для коррекции тромбоцитопении в случае экстренного хирургического вмешательства или инвазивной процедуры высокого риска кровотечения единственным способом служит переливание концентрата тромбоцитов [55, 392]. Доза концентрата тромбоцитов и целевой уровень тромбоцитов зависят от порогового значения данного параметра согласно характеру планируемого вмешательства (см. приложение Г). Необходимо принимать во внимание, что перелитые тромбоциты имеют короткий срок жизни (3 - 4 дня), который при ЦП становится еще меньше за счет секвестрации перелитых тромбоцитов увеличенной селезенкой. Соответственно, данная манипуляция выполняется в том лечебном подразделении, где планируется дальнейшее лечение пациента.
- Рекомендовано пациентам с ЦП и тяжелой тромбоцитопенией (< 50 x 109/л) при подготовке к плановым инвазивным процедурам/оперативным вмешательствам назначать агонист рецептора тромбопоэтина (аТПО-р) (другие гемостатические средства системного действия) аватромбопаг для увеличения концентрации тромбоцитов, уменьшения числа перипроцедурных/периоперационных кровотечений и потребности в переливаниях концентрата тромбоцитов по поводу этих осложнений [105, 400, 401].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: В настоящее время в качестве альтернативы переливанию концентрата тромбоцитов для коррекции тяжелой (< 50 x 109/л) тромбоцитопении перед проведением плановых инвазивных/хирургических вмешательств у пациентов с ЦП используются агонисты рецептора ТПО (аТПО-р) (другие гемостатические средства системного действия), механизм действия которых основан на заместительном эффекте в условиях сниженной продукции ТПО [403]. Эффективность аТПО-р аватромбопага для коррекции тромбоцитопении у пациентов с хроническими заболеваниями печени перед плановыми инвазивными процедурами изучалась в рамках международной многоцентровой программы ADAPT, которая объединила идентичные по дизайну РКИ третьей фазы клинических испытаний ADAPT-1 и ADAPT-2. Анализ объединенных данных двух исследований ADAPT показал, что концентрация тромбоцитов в день процедуры составляла >= 50 x 109/л у большинства пациентов, получавших аватромбопаг, - 77,6% по сравнению с 15,8% из группы плацебо (p < 0,0001). Аватромбопаг был значительно эффективнее плацебо по снижению потребности в трансфузиях концентрата тромбоцитов - 75,8 vs 31,7% пациентов (p < 0,0001). Проведенный анализ в подгруппах позволил установить, что аватромбопаг был одинаково эффективен при инвазивных процедурах/оперативных вмешательствах как низкого, так и высокого риска геморрагических осложнений. Профиль безопасности был аналогичен плацебо: общая частота серьезных нежелательных явлений во время лечения составила 7,3% в группе получавших аватромбопаг и 9% - в группе плацебо (p > 0,05). На эффективность аватромбопага не влияли пол, возраст, этническая принадлежность пациента, этиология заболевания и степень тяжести ЦП по шкале Child-Pugh или MELD [402].
Полученные в исследованиях ADAPT результаты об эффективности и безопасности аватромбопага подтверждены данными реальной клинической практики и систематического обзора [403, 404]. Согласно вышеперечисленным исследованиям, аватромбопаг имеет преимущества перед назначением концентрата тромбоцитов, поскольку применяется перорально, не требует нахождения пациента в медицинском учреждении, повышает уровень тромбоцитов в крови пациента с ЦП на более длительный период, чем трансфузии концентрата тромбоцитов; обладает хорошим профилем безопасности (количество нежелательных явлений сопоставимо с плацебо) и не сопряжен с увеличением числа тромботических осложнений. Режим и длительность лечения аватромбопагом: при концентрации тромбоцитов от 40 до 50 x 109/л - 40 мг/сут в течение 5 дней, при концентрации тромбоцитов < 40 x 109/л - 60 мг/сут в течение 5 дней. Запланированная инвазивная процедура/оперативное вмешательство выполняется на 5 - 8-й день после последнего приема препарата.
Необходимы дополнительные исследования для оценки эффективности агонистов рецептора ТПО при обширных хирургических вмешательствах (операции в области головы и шеи, открытые операции на органах грудной клетки, лапаротомия, резекции/удаление/трансплантация органов).
3.2.10. Лечение цирроза печени с саркопенией
Комплексное лечение саркопении у пациентов с ЦП включает элиминацию его этиологического фактора, диетические рекомендации, средства для энтерального и парентерального питания, физическую активность (см. разделы 3.1.1, 3.1.2), а также назначение лекарственной терапии. Среди возможных лекарственных препаратов в комплексной терапии изучался #орнитин, также есть единичные исследования по применению #тестостерона** у пациентов мужского пола с ЦП с целью увеличения мышечной массы [405].
- Рекомендовано в комплексной терапии пациентов с ЦП и саркопенией применение #орнитина в дозе 3 г 3 раза в день продолжительностью не менее трех месяцев с целью улучшения параметров основных компонентов саркопении - мышечной силы, массы и функции [406, 407].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: L-орнитин - основной промежуточный продукт цикла мочевины, способный стимулировать превращение аммиака в мочевину остаточными перипортальными гепатоцитами [408]. Также трансаминирование L-орнитина способствует синтезу глутамата в скелетных мышцах, необходимого для синтеза глутаминсинтетазы. Оба эти процесса приводят к снижению уровня аммиака в мышцах и крови, тем самым ослабляя неблагоприятные воздействия аммиака на мышцы и способствуя улучшению фенотипа и функции скелетных мышц [409].
В исследованиях показано увеличение мышечной массы на фоне терапии орнитином [407].
Также в недавнем исследовании пациентов с декомпенсированным ЦП, саркопенией и гипреаммониемией показано положительное влияние орнитина в комплексной терапии ЦП на все основные параметры саркопении - функцию, массу и силу мышц [406].
В исследовании A. Horvath et al. описано снижение инсулиноподобного фактора роста 1 у пациентов с ЦП на фоне терапии орнитином и его потенциальный эффект в отношении саркопении [410].
3.3. Хирургическое лечение
3.3.1. Хирургическое лечение цирроза печени с кровотечением из варикозных вен пищевода и желудка
- Рекомендовано при подтверждении у пациентов с ЦП продолжающегося кровотечения из изолированных ВВ пищевода и вен желудка 1 типа (до 8 - 10 мм в диаметре) предпринять попытку лигирования источника кровотечения при условии его удовлетворительной визуализации с целью повышения выживаемости [1, 2, 18, 65, 148, 258, 259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендована комбинация терлипрессина** или октреотида** с эндоскопическим лигированием ВВ пищевода у пациентов с ЦП и кровотечением из вен пищевода для достижения максимальной эффективности гемостаза [1, 18, 65, 90, 259, 411 - 413].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Комбинация двух методов лечения наиболее эффективна, так как позволяет достичь местного гемостатического эффекта при эндоскопическом лечении и снизить портальное давление назначением терлипрессина** или октреотида** [259, 412 - 414].
- Рекомендована установка зонда-обтуратора (зонд-обтуратор резиновый пищеводно-желудочный для остановки кровотечения из расширенных вен пищевода и кардиального отдела желудка) или саморасправляющегося металлического стента Даниша (здесь и далее - стент для экстренной остановки кровотечений из варикозно расширенных вен пищевода) при невозможности лигирования источника кровотечения и продолжения интенсивной консервативной терапии с возмещением кровопотери, применением вазоактивных препаратов (терлипрессина** или октреотида**) пациентам с ЦП и неконтролируемым массивным варикозным кровотечением из вен пищевода с целью его остановки [2, 18, 65, 148, 259, 415 - 417].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Баллонная тампонада должна использоваться только при продолжающемся массивном кровотечении как временная мера в течение максимум 24 ч с периодическим распусканием пищеводной (через каждые 2 - 3 ч) и желудочной (через каждые 4 - 6 ч) манжеток для предотвращения образований пролежней на слизистой. Цель этого метода - в том, чтобы дать возможность применения методов достижения более стойкого гемостаза: эндоскопическое лечение, TIPS и пр. [2, 148, 259, 415 - 417].
- Рекомендовано пациентам с ЦП и продолжающимся варикозным кровотечением в сочетании с нарушениями сознания и (или) рвотой эндоскопическое исследование и (или) баллонную тампонаду предварять оротрахеальной интубацией с целью уменьшения риска аспирационного синдрома [2, 148].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В настоящее время основные экспертные сообщества сходятся на том, что из-за высокого риска аспирационного синдрома больным с нарушением сознания, а также продолжающимся кровотечением и рвотой эндоскопическое исследование и (или) баллонную тампонаду показано предварять оротрахеальной интубацией [2, 148]. При этом экстубацию следует выполнять после проведения эндоскопии и (или) баллонной тампонады как можно скорее, как только это становится возможным и безопасным [2, 148, 418].
Однако по поводу интубации существует и противоположное мнение. Так, метаанализ 2019 г. D. Chaudhuri et al. исследований риска интубации у больных с пищеводно-желудочными кровотечениями (с общим количеством клинических наблюдений более 5000) показал, что пациенты, которым выполнялась профилактическая интубация, в особенности у больных с ЦП при варикозных кровотечениях, была ассоциирована с повышенным уровнем смертности в стационаре, повышенным риском развития пневмонии и сердечно-сосудистых осложнений. Противоречивые мнения по этому поводу высказаны в работах D. Chaudhuri и et al. и R. Sasso et al. [418, 419].
Последующая повторная ЭГДС проводится через 12 - 24 ч в условиях остановленного кровотечения. Выбор дальнейшей тактики в отношении окончательного гемостаза строится на основе оценки тяжести состояния пациента, течения заболевания и данных дополнительных лабораторного и инструментального методов исследований (ЭГДС, УЗИ органов брюшной полости (комплексное) с доплерографией, КТ органов брюшной полости, эхокардиография и др.) [148].
- Рекомендовано раннее (в течение 72 ч, в идеале - в течение первых 24 ч) выполнение процедуры TIPS с использованием стент-графтов в ближайшие 24 - 72 ч пациентам с ЦП > 7 баллов, но менее 14 баллов по шкале Child-Pugh и продолжающимся варикозным кровотечением при ЭГДС при поступлении в стационар и (или) с градиентом печеночного венозного давления (HVPG) > 20 мм рт. ст. на момент кровотечения с целью достижения окончательного гемостаза и улучшения выживаемости [2, 148, 411, 418, 420 - 422].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: РКИ показали, что раннее выполнение процедуры TIPS с использованием покрытых стентов пациентам с ЦП и неконтролируемым варикозным кровотечением или высоким риском повторного кровотечения в течение 72 ч (в идеале - в течение первых 24 ч) позволяет добиться окончательного гемостаза и улучшает выживаемость [411, 418, 420 - 422]. В настоящее время данный метод лечения может быть рекомендован пациентам с ЦП класса B и C по шкале Child-Pugh с количеством баллов > 7 и < 14 соответственно. У пациентов с декомпенсированным ЦП (MELD > 19) сохраняется высокий уровень летальности, несмотря на раннее выполнение TIPS, тем не менее он все же ниже по сравнению со стандартной терапией [423, 424]. Однако критерии отбора пациентов в имеющихся исследованиях остаются неоднозначными, так как в них не учитывались пациенты пожилого возраста, больные с тотальным тромбозом воротной вены, ГЦК, тяжелой острой и хронической почечной недостаточностью, сердечной недостаточностью и пр. Требуются дополнительные исследования. Кроме того, повсеместное применение TIPS все еще ограничивается его доступностью.
У пациентов с ЦП и варикозным кровотечением, подходящих под критерии раннего выполнения процедуры TIPS, декомпенсация хронической печеночной недостаточности (ACLF), энцефалопатия, гипербилирубинемия на момент поступления в стационар не должны расцениваться как противопоказания к ее выполнению [2, 148, 421, 425]. Основным осложнением после наложения TIPS является развитие ПЭ (до 50% пациентов) [426]. Существенно снизить частоту развития ПЭ (до 18%) позволяет использование для TIPS стент-графтов, небольшого размера - 8 мм [15, 426].
- Рекомендовано воздержаться от выполнения процедуры TIPS с целью достижения гемостаза пациентам с ЦП класса C (> 14) по Child-Pugh, значением MELD > 30 и уровнем лактата в крови > 12 ммоль/л, если только в ближайший отрезок времени не планируется ТП. Решение в таких ситуациях должно приниматься индивидуально [2, 148, 426 - 428].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Рекомендовано при компенсированном течении заболевания и стабильном состоянии пациента рассмотреть альтернативные варианты окончательного гемостаза (эндоскопическое лечение, эндоваскулярные окклюзирующие вмешательства на ВВ и др.), кроме раннего выполнения процедуры TIPS [2, 148, 259, 411, 429].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Пациентам с ЦП и неконтролируемым варикозным кровотечением (в том числе его рецидиве) рекомендована баллонная тампонада или постановка стента Даниша (последний - при кровотечении из ВВ пищевода) в качестве метода временного гемостаза до появления возможности применения методов более стойкого гемостаза (TIPS и др.) [2, 146, 259, 415 - 417, 430].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано использование стентов для желудочно-кишечного тракта (стента Даниша) с покрытием пациентам с массивным кровотечением из вен пищевода (но не из желудка) как альтернативы баллонной тампонаде с целью снижения частоты осложнений [2, 66, 148, 259, 415, 416, 430].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано выполнение процедуры TIPS с использованием стент-графтов пациентам с ЦП и некупируемым варикозным кровотечением при неэффективности комбинации эндоскопической и медикаментозной терапии [65, 79, 259, 431].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано пациентам с ЦП и варикозным кровотечением после выполнения процедуры TIPS назначение терапии препаратами лактулозы** и рифаксимина с целью снижения риска (прогрессии) ПЭ [2, 148, 259, 432 - 434].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано пациентам с ЦП и варикозным кровотечением из вен желудка (тип 2 (GOV2) и тип 3 (IGV1)), а также из эктопических ВВ с целью достижения гемостаза в качестве альтернативы эндоскопическому и эндоваскулярному (TIPS) лечению рассмотрение вопроса о выполнении баллонной ретроградной трансвенозной облитерации (balloon-occluded retrograde transvenous obliteration - BRTO), баллонной антеградной трансвенозной облитерации (balloon-occluded antegrade transvenous obliteration - BATO), эмболизации вен желудка, а также их вариантов (здесь и далее - BRTO/BATO для обозначения эндоваскулярных процедур данного типа) [2, 148, 435 - 437].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Данные процедуры (BRTO/BATO) при наличии анатомических возможностей для их выполнения (наличие проходимых сосудов портальной системы и спонтанного портосистемного шунта минимально необходимого диаметра) показали свою эффективность и безопасность [435 - 437].
- Рекомендовано пациентам с ЦП при кровотечениях из эктопических ВВ с целью достижения гемостаза применять как эндоскопические, так и эндоваскулярные методы лечения [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано у пациентов с ЦП после выполнения процедуры TIPS при сохранении значительного портосистемного сброса по венозным коллатералям рассмотрение вопроса о сочетанном применении процедур TIPS и BRTO/BATO с целью снижения риска рецидива кровотечения из желудочных и эктопических ВВ [2, 148, 435 - 441].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: ВВ желудка встречаются у 17 - 25% больных ЦП. Риск возникновения кровотечений из них в течение 3 лет составляет 16 - 45%. Несмотря на меньшую частоту, кровотечения из ВВ желудка могут возникать при меньшем уровне портального давления (чем ВВ пищевода), и они, как правило, массивнее, тяжелее контролируются, чаще рецидивируют и ассоциированы с более высокой смертностью (до 45%) [442 - 444]. Эти вены чаще обнаруживают у пациентов с абдоминальным тромбозом. Кроме того, само их наличие повышает риск возникновения тромбоза в портальной системе, а также развития (прогрессии) ПЭ. Это объясняется тем, что кровоток по ним может конкурировать с кровотоком по воротной вене по типу синдрома обкрадывания, снижая скорость последнего и повышая риск наступления тромбоза [445].
При лечении кровотечений из вен желудка (тип 2 (GOV2) и тип 3 (IGV1)), а также из эктопических ВВ процедура BRTO/BATO зарекомендовала себя как эффективный и безопасный метод. Более того, у пациентов с декомпенсированным ЦП и MELD-Na > 20 процедура BRTO/BATO может считаться более предпочтительной по сравнению с TIPS, так как ассоциирована с меньшим риском ранних рецидивов кровотечения и (прогрессии) ПЭ [436, 437].
По этим же причинам у ряда пациентов (при наличии анатомических возможностей) оправдано сочетанное применение BRTO/BATO и TIPS [435 - 438].
У пациентов со значением MELD-Na < 20, особенно при наличии больших ВВП и (или) выраженного асцита, предпочтительно выполнение TIPS [427, 446 - 448]. Решение о применении той или иной методики должно приниматься индивидуально [148, 435].
- Пациентам с ЦП при рецидиве кровотечения из вен желудка и отсутствии анатомических возможностей выполнения операций TIPS и (или) BRTO/BATO (тромбоз воротной вены и ее внутрипеченочных разветвлений) рекомендована полостная операция. При сохранной печеночной функции и стабильном состоянии больного (ЦП класса A по Child-Pugh) рекомендовано выполнение шунтирующей операции для остановки кровотечения [65, 148, 259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: При отсутствии топографо-анатомических условий для наложения портокавального сосудистого анастомоза в группах больных с ЦП класса B по Child-Pugh и варикозным кровотечением целесообразно выполнение прямых вмешательств на варикозных венах желудка (операция М.Д. Пациоры - гастротомия, прошивание варикозно расширенных вен желудка и пищевода) для остановки кровотечения [18, 65, 259].
- Рекомендовано пациентам с ЦП и варикозным кровотечением или угрозой его возникновения при умеренной выраженности ВВ желудка I типа (ориентировочно до 8 - 10 мм) выполнение их лигирования нейлоновыми петлями с целью прекращения кровотока по ним [15, 18, 259]. Недопустимо для лигирования вен желудка использование латексных колец [2, 259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с компенсированным ЦП и кровотечением из варикозных гастроэзофагеальных вен II типа рекомендована шунтирующая операция с целью его остановки [15, 18, 259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано пациентам с ЦП и портальной гипертензионной гастропатией (ПГГ) эндоскопическое лечение (аргоноплазменная коагуляция кровоточащего сосуда или гемостатические средства для местного применения) с целью купирования активных кровотечений, обусловленных ПГГ, и их вторичной профилактики [2, 148, 449 - 452].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: ПГГ - часто встречающиеся при портальной гипертензии изменения слизистой оболочки желудка в виде характерного мозаичного рисунка с различной степенью выраженности внутрислизистых кровоизлияний в результате повышения портального давления, полнокровия подслизистых сосудов и расширения венул и капилляров слизистой [453].
ПГГ следует дифференцировать с эктазией вен антрального отдела желудка (GAVE-синдром - Gastric Antral Vascular Ectasia), так как подходы к лечению при этих патологических состояниях различаются.
ПГГ сама по себе (хотя и реже, чем ВВПиЖ) может являться источником как острой (2,5 - 5%), так и хронической (4 - 12%) кровопотери [143, 454].
Ряд исследований свидетельствуют об эффективности эндоскопического лечения (рецидивов) кровотечений при ПГГ и их вторичной профилактики (аргоноплазменная коагуляция, гемостатические средства для местного применения) [449 - 452]. Также существуют данные об эффективном применении октреотида** в качестве начальной терапии при активном кровотечении, обусловленном ПГГ [455].
Несмотря на медикаментозное и эндоскопическое лечение, при развитии трансфузионной зависимости у пациентов с кровотечениями, обусловленными ПГГ, должен быть рассмотрен вопрос о выполнении TIPS [2].
3.3.2. Хирургическое лечение пациентов с ЦП и резистентным асцитом
- Рекомендовано рассматривать вопрос о наложении TIPS (трансъюгулярного внутрипеченочного портосистемного шунта) пациентам с ЦП и резистентным асцитом с целью улучшения их физического функционирования в период ожидания ТП [359, 458, 459].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Наложение шунта между бассейнами воротной и печеночной вены способствует снижению портального давления, возвращению ОЦК из спланхнического в системный кровоток и повышению эффективного циркуляционного объема. Все это приводит к постепенной супрессии активированной ренин-ангиотензин-альдостероновой системы и симпатической нервной системы и в свою очередь к уменьшению ретенции натрия и воды, а вместе с ним и мобилизации асцитической жидкости из брюшной полости. Обычно этот процесс занимает от 3 до 6 месяцев [459]. В метаанализе A. Albillos et al. [459] было продемонстрировано, что TIPS превосходит высокообъемный лапароцентез в аспекте контроля над асцитом, однако имеет существенный недостаток в виде развития ПЭ и не улучшает показатели смертности. В то же время в другом метаанализе [460] показатели выживаемости без ТП были лучше после проведения TIPS (ОР 0,61; 95% ДИ 0,46 - 0,82; P < 0,001). Тем не менее чем старше пациенты и чем выше индекс MELD, тем хуже показатели выживаемости, что выступает в качестве аргумента в пользу того, что метод наложения шунта выступает скорее в качестве bridge-терапии перед ТП [461].
3.4. Трансплантация печени
ТП - единственный радикальный метод лечения ЦП на его терминальной стадии. Последнее время отмечается тенденция к более раннему определению показаний и уменьшению спектра противопоказаний к ТП, хотя возможности трансплантации от посмертного донора по-прежнему ограничены сохраняющимся дефицитом органов, а трансплантация от живого родственного донора - биологическими, медицинскими и этическими аспектами.
В основе определения показаний для ТП лежит принцип преимущества в выживаемости пациентов, которое они получают в результате операции. Прогнозируемая продолжительность жизни после трансплантации должна превышать продолжительность жизни пациентов без нее [1, 65, 66, 387, 462].
Основными показаниями для ТП при ЦП служат терминальная или фульминантная печеночная недостаточность и (или) развитие осложнений ЦП, которые не поддаются адекватной коррекции (перечислены ниже в отдельных положениях).
Абсолютные противопоказания к ТП включают следующие состояния [387, 463]:
- ВИЧ 4 - 5-й стадии при количестве CD4 менее 150 кл/мкл;
- внепеченочное распространение злокачественных опухолей печени, сосудистая инвазия;
- онкологические заболевания до достижения ремиссии;
- активная внепеченочная инфекция (туберкулез и др.);
- алкогольная, наркотическая зависимость;
- психические заболевания, исключающие соблюдение рекомендаций после ТП;
- тяжелая атеросклеротическая болезнь коронарных сосудов, не поддающихся реваскуляризации;
- тяжелые сопутствующие и конкурирующие заболевания других органов и систем при противопоказании к сопутствующей трансплантации по поводу заболевания этих органов (печень и почки, печень и сердце);
- давление в легочной артерии более 45 мм рт. ст., несмотря на ЛАГ-специфическую терапию.
Возраст старше 60 лет, ожирение с ИМТ более 35 кг/м2, дефицит питания не являются абсолютными противопоказаниями к трансплантации сами по себе, но обязывают провести расширенное обследование для исключения скрытых сердечно-сосудистых и (или) онкологических заболеваний. В случае выраженного дефицита питания требуется нутритивная поддержка и преабилитация до ТП [387, 463 - 472].
Тромбоз ствола и сосудов системы воротной вены (Yerdel 3 - 4), ранее считавшийся противопоказанием к ТП, требует индивидуального подхода. Тактика определяется анатомо-хирургическим особенностями пациента и владением хирургическими методиками восстановления портального кровотока специалистами центра трансплантации, поэтому пациента с тромбозом воротной вены любой распространенности следует направлять на прием (осмотр, консультация) врача-гастроэнтеролога или врача-терапевта первичный, занимающимися вопросами трансплантации печени [473, 474].
Пациентам с алкогольным циррозом ТП может быть проведена при условии соблюдения 6-месячной абстиненции [475].
Тщательно отобранные пациенты с первым эпизодом тяжелого алкогольного гепатита и плохим прогнозом (неэффективность глюкокортикоидов) могут быть направлены на ТП без соблюдения условия 6-месячной абстиненции при условии специализированной психо-наркологической реабилитации, лечения и профилактики возврата к употреблению алкоголя. К критериям отбора может относиться отсутствие представления у пациента о тяжести его заболевания печени, первая госпитализация с нарушением функции печени, отсутствие сопутствующих психиатрических заболеваний, поддержка семьи, окружения [476, 477].
Внепеченочные онкологические заболевания в ремиссии/cancer-free не являются противопоказанием к ТП. После лечения онкологического заболевания выполнимость и время наблюдения до ТП определяются специфическими характеристиками опухоли и ее лечения врачами-врачами-онкологами совместно с трансплантологами (прием (осмотр, консультация) врача-гастроэнтеролога или врача-терапевта первичный, занимающимися вопросами трансплантации печени) [475, 478, 479].
- Рекомендовано проведение ТП пациенту с ЦП и тяжелым нарушением функции печени (прогрессирующая печеночная недостаточность) с индексом MELD-Na >= 15 баллов для улучшения жизненного прогноза и уменьшения смертности от некорригируемых осложнений цирроза [462, 475, 480 - 483].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Пациентов с ЦП и нарушением функции печени (класса B и C по шкале Child-Pugh) при отсутствии противопоказаний следует направлять на консультацию для включения в лист ожидания ТП. Оценка по шкале MELD-Na >= 15 баллов является показанием к ТП, так как свидетельствует о повышенном риске смерти пациентов с ЦП без ТП. При индексе MELD-Na < 15 преимущество имеет консервативная терапия в отсутствие других осложнений ЦП, приведенных ниже [69, 481, 484].
- Рекомендовано направление на ТП пациентов с жизнеугрожающими осложнениями ЦП, несмотря на отсутствие тяжелых нарушений функции печени и (или) количество баллов по шкале MELD < 15 для улучшения жизненного прогноза и уменьшения смертности от некорригируемых осложнений ЦП [485 - 487].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: К осложнениям, которые являются показаниями к ТП при ЦП, помимо нарушения функции печени (MELD-Na >= 15), относятся:
- рефрактерные асцит и (или) гидроторакс;
- рецидивирующая или хроническая ПЭ;
- рецидивирующие варикозные кровотечения (если нет другой хирургической альтернативы лечения);
- рецидивирующие холангиты;
- ГПС с PaO2 < 60 мм рт. ст.;
- ГРС-ОПП независимо от ответа на терапию вазопрессорами (терлипрессином или октреотидом);
- СБП/инфицированный гидроторакс;
- ГЦР на некоторых стадиях согласно Барселонской классификации (BCLC) и при соответствии конкретным критериям, исходя из размеров и количества очагов, уровня альфа-фетопротеина, либо после down-staging (уменьшения размеров и (или) распространенности опухоли в результате лечения) [152];
- нестерпимый холестатический зуд, который значительно снижает качество жизни пациентов и повышает риск суицида.
- Рекомендовано пациентов с ЦП и резистентным асцитом рассматривать как кандидатов для ТП вне зависимости от баллов по шкале MELD с целью улучшения их жизненного прогноза [65, 256, 488 - 490].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: В настоящее время ТП остается радикальным методом лечения ЦП, осложненного резистентным (рефрактерным) асцитом. Резистентный асцит служит независимым прогностическим фактором снижения выживаемости пациентов с ЦП. Смертность в течение года среди пациентов с резистентным асцитом превосходит 20% [488, 489]. Использование шкалы MELD для определения приоритета пациента в листе ожидания ТП, не учитывает наличие асцита, в отличие от шкалы Child-Pugh, поэтому стоит рассматривать пациентов с резистентным асцитом в качестве кандидатов на ТП даже при низком MELD [490]. Наличие резистентного асцита эквивалентно добавлению дополнительно 4,5 балла к результату, полученному при расчете баллов по шкале MELD [489].
- Пациентам с ЦП и ГРС-ОПП вне зависимости от ответа на прием вазопрессоров (терлипрессином или октреотидом) рекомендована ТП с целью улучшения выживаемости [491 - 493].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Ответ на терапию терлипрессином** и альбумином человека** при ОПП-ГРС ассоциирован с меньшим риском развития ХБП после эпизода ОПП, меньшей необходимостью в ЗПТ до и после ТП, а также способствует улучшению показателей выживаемости пациентов после ТП [494, 495]. Однако даже это лечение ОПП-ГРС на общую выживаемость и выживаемость без ТП положительного влияния не оказывает, в связи с чем необходимо продолжить клинико-лабораторный мониторинг и направить пациента на ТП [491 - 493].
- Рекомендовано проведение ТП пациентам с ЦП и рефрактерным печеночным гидротораксом и при наличии противопоказаний или неэффективности TIPS с целью улучшения их выживаемости [65, 386, 496 - 498].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано регулярное (каждые 6 месяцев) исследование кислотно-основного состояния и газов крови (исследование газов артериальной крови) пациентам с ЦП с целью диагностики ГПС и установления показаний к ТП [388, 499].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В связи с тем, что тяжелая гипоксемия (PaO2 < 45 - 50 мм рт. ст.) ассоциирована с повышением смертности после ТП, необходимо регулярно оценивать газовый состав крови пациентов с ЦП, чтобы определить показания и противопоказания к трансплантации печени [499].
- Рекомендовано рассмотрение вопроса о ТП пациентам с ЦП и ГПС с PaO2 < 60 мм рт. ст. с целью улучшения их выживаемости [499 - 501].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Единственным на сегодняшний день рекомендованным методом лечения ГПС является трансплантация печени. ТП приводит к полному разрешению ГПС или значительному улучшению дыхательной недостаточности у более чем 85% пациентов с тяжелой гипоксемией [499 - 501].
- Рекомендован регулярный скрининг и оценка дефицита питания, признаков саркопении пациентам с ЦП, которым назначена плановая операция или которые включены в лист ожидания ТП, с целью уменьшения риска периоперационных осложнений и улучшения исходов оперативного лечения и выживаемости в целом [502 - 505].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: У пациентов с ЦП и недостаточным питанием после абдоминальной операции повышается риск послеоперационной заболеваемости и смертности. Пациентам с ЦП, которым назначена плановая операция, необходимо корректировать питание в соответствии с рекомендациями по питанию при ЦП (см. раздел 3.1.1).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Медицинская реабилитация больных ЦП в стадии компенсации подразумевает раннее выявление признаков начинающейся декомпенсации заболевания, присоединения новых осложнений, определение показателей нутритивной недостаточности.
- Рекомендовано пациентам с ЦП в амбулаторных условиях проводить восстановительное немедикаментозное и медикаментозное лечение, которое должно включать прекращение приема алкоголя; исключение воздействия гепатотоксичных веществ и приема лекарственных средств без назначения врача; физическую активность согласно индивидуальным особенностям пациента и правильное питание согласно нутритивному статусу пациента и характеру имевшихся у него осложнений, продолжение приема рекомендованных врачом лекарственных препаратов согласно имеющимся у пациента осложнениям ЦП [217, 367, 506, 507].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Общие принципы питания пациентов с ЦП без печеночной недостаточности: полноценное, сбалансированное по составу, высокобелковое, высококалорийное. Более подробно принципы питания у пациентов с ЦП описаны в разделе лечения 3.1.1. "Особенности питания, принципы диетотерапии и нутритивной поддержки".
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Диспансерное наблюдение
Диагноз ЦП предполагает увеличение показателей как ассоциированной с заболеванием печени, так и общей смертности. Стадия компенсированного ЦП характеризуется либо полным отсутствием, либо скудным количеством клинических признаков и симптомов, в связи с чем в клинической практике диагноз чаще всего устанавливается после эпизода декомпенсации. В зависимости от типа события (кровотечение из ВВПиЖ или др.), а также их количества (1 или 2 и более) риск смертности в течение 5 лет может составлять от 20 до 88% [508, 509]. Самым благоприятным сценарием для пациента выступает выявление ЦП еще на этапе компенсации функции и дальнейшая первичная профилактика развития осложнений. При вторичной же профилактике фокус внимания должен быть на недопущении последующих эпизодов декомпенсации. Полноценная профилактика заключается в контроле за проведением этиотропной терапии, выявлении осложнений, нежелательных лекарственных реакций и их купировании, повышении осведомленности пациентов и их родственников о заболевании, возможных осложнениях и мерах, направленных на предвосхищение их развития, важности динамического наблюдения. Выполнение этих ключевых задач во многом возложено на специалистов амбулаторного звена [510].
- Рекомендовано пациентам с ЦП выполнять диспансерный прием (осмотр, консультация) врача-гастроэнтеролога, а при его отсутствии - диспансерный прием (осмотр, консультация) врача-терапевта для динамического обследования и раннего выявления осложнений [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Режим диспансерного наблюдения определяется лечащим врачом индивидуально в зависимости от характера течения заболевания и его осложнений. Впервые выявленные пациенты с ЦП в течение первого года наблюдаются каждые 3 месяца, далее кратность наблюдения и обследования зависит от тяжести течения заболевания. В случае прогрессирующего течения необходимо наблюдение каждые 1 - 2 месяца с решением вопроса о ТП [1]. Диспансерное наблюдение не исключает активных визитов пациента при ухудшении состояния или развитии нежелательных явлений при проведении лечения.
Пациенты с ЦП любой этиологии на любой стадии (кроме тех, кто находится в листе ожидания ОТП) дважды в год должны проходить скрининговое обследование на ГЦР (УЗИ органов брюшной полости, анализ крови на АФП) [65, 152].
Эндоскопический контроль у пациентов с ЦП в рамках диспансерного наблюдения должен проводиться в следующем порядке (рисунки 3 и 4 в приложении Б):
- каждые 2 года при отсутствии ВВПиЖ при продолжающемся воздействии этиологического фактора (употребление алкоголя, наличие вирусной нагрузки и т.д.);
- каждые 3 года при отсутствии ВВПиЖ и без воздействия этиологического фактора (отказ от алкоголя, устойчивый вирусологический ответ на фоне противовирусной терапии и т.д.);
- каждый год при наличии противопоказаний к применению неселективных бета-адреноблокаторов и #карведилола** пациентам с компенсированным ЦП и клинически значимой ПГ (измеренной инвазивными и неинвазивными способами) и продолжающимся воздействием этиологического фактора;
- каждые 2 года при противопоказаниях к применению неселективных бета-адреноблокаторов и #карведилола** пациентам с компенсированным ЦП и клинически значимой ПГ (измеренной инвазивными и неинвазивными способами) без воздействия этиологического фактора;
- каждый год пациентам с компенсированным ЦП и наличием ВВПиЖ;
- каждый год пациентам с декомпенсированным ЦП вне зависимости от наличия ВВ желудка и пищевода [147, 148, 259, 511, 512].
Нередко пациенты с ЦП могут получать рекомендации воздержаться от приема статинов (ингибиторов ГМГ-КоА-редуктазы), ацетилсалициловой кислоты**, антикоагулянтов (антитромботических средств, в том числе прямых ингибиторов Xa фактора), что, как правило, мотивируется потенциальными рисками гепатотоксичности и геморрагических осложнений. Такая тактика не обоснована в случаях, когда польза от приема препаратов преобладает над риском развития потенциальных нежелательных явлений [2].
5.2. Профилактика развития и рецидива осложнений цирроза печени
Очень важен амбулаторный этап ведения пациента, именно от него зависит частота осложнений ЦП, риск его быстрой декомпенсации и повторных госпитализаций [514]. Альбумин человека** играет принципиальную роль в этом процессе.
- Рекомендовано длительное применение высокодозного раствора альбумина человека** в дозе 40 г 2 раза в неделю на протяжении первых 2 недель, затем 40 г 1 раз в неделю в амбулаторных условиях пациентам с декомпенсированным ЦП на протяжении не менее 3 месяцев для контроля над асцитом, снижения частоты инфекционных осложнений, эпизодов энцефалопатии [2, 514 - 518].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: В 2018 г. были опубликованы результаты многоцентрового рандомизированного открытого в параллельных группах исследования ANSWER (human Albumin for the treatmeNt of aScites in patients With hEpatic cirrhosis - "Применение альбумина человека** для лечения асцита у пациентов с ЦП"), организованного в Италии в условиях реальной клинической практики. Пациенты, получавшие терапию антагонистами альдостерона (>= 200 мг/сут) и фуросемидом** (>= 25 мг/сут), в результате рандомизации были определены в две группы: те, кто получал стандартную медикаментозную терапию и стандартную терапию в комбинации с раствором альбумина человека** в дозе 40 г 2 раза в неделю в течение 2 недель, затем 40 г 1 раз в неделю продолжительностью в общей сложности до 18 месяцев. Авторы продемонстрировали, что такая комбинация способствовала контролю над асцитом, приводила к уменьшению частоты повторных госпитализаций, уменьшению летальности, улучшению качества жизни, увеличению периода общей выживаемости [514]. Свойства высокодозного альбумина человека** (20% или 25%) в комплексной терапии указанных осложнений ЦП описаны в работе M.A. Heybe et al. [515, 518]. Режим введения раствора альбумина человека**: 20%-й или 25%-й раствор альбумина человека** в дозе 40 г 2 раза в неделю в течение первых 2 недель после выписки пациента из стационара или до достижения компенсации функции печени/ПГ в амбулаторных условиях, затем 40 г 1 раз в неделю продолжительностью до 18 месяцев [514, 516].
5.2.1. Профилактика инфицирования асцитической жидкости
Ввиду того, что большинство эпизодов инфицированного асцита возникает в результате транслокации грамотрицательных бактерий из кишечника, профилактика данного осложнения проводится антибиотиками системного (фторхинолоны) и локального (рифаксимин) действия. При этом необходимо учитывать риск развития резистентности кишечной микробиоты и подавление роста полезной микрофлоры (лакто- и бифидобактерий). Препаратом выбора для профилактики СБП должен стать препарат с хорошим профилем безопасности, чему соответствует локальный антибиотик рифаксимин [66, 519]. Профилактика антибактериальными препаратами системного действия должна проводиться пациентам, относящимся к группам риска: пациенты с желудочно-кишечным кровотечением, пациенты с низким содержанием белка в асцитической жидкости без предшествующего эпизода СБП (первичная профилактика) и пациенты с повторными эпизодами СБП (вторичная профилактика) [1, 7, 65, 519 - 522].
- Рекомендовано назначение рифаксимина в суточной дозе 1200 или рифаксимина в суточной дозе 1100 мг в течение 6 - 12 месяцев пациентам с ЦП для первичной и вторичной профилактики инфицированного асцита [138, 520, 523, 524].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Согласно метаанализу имеющихся исследований, назначение рифаксимина в суточной дозе 1200 мг или рифаксимина в суточной дозе 1100 мг в течение 6 - 12 месяцев показало более высокую эффективность рифаксимина для первичной профилактики инфицированного асцита при ЦП по сравнению с антибактериальными препаратами системного действия [138, 523]. В другом метаанализе продемонстрировано, что, помимо снижения риска инфицирования асцитической жидкости, у пациентов с ЦП применение рифаксимина сопровождается увеличением общей выживаемости, препарат обладает лучшим профилем безопасности, чем #норфлоксацин, при этом частота развития C. difficile ассоциированной диареи не превышает таковую для пациентов, получающих лактулозу** [516]. Достоверно уменьшается частота и повторных эпизодов СБП (вторичная профилактика) у пациентов с ЦП на фоне приема рифаксимина в дозе 550 мг 2 раза в день в сравнении с #норфлоксацином [520, 524].
- Рекомендовано назначение антибактериальных препаратов, производных хинолона (фторхинолоны: #норфлоксацин 400 мг/день, #ципрофлоксацин** 500 мг/день) пациентам с ЦП с прогрессирующей печеночной недостаточностью и низким содержанием белка в асцитической жидкости с целью первичной и вторичной профилактики СБП [66, 520, 521, 525].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Назначение #норфлоксацина (400 мг/день) или #ципрофлоксацина (500 мг/день) в течение 3 - 12 месяцев (в зависимости от клинического состояния пациента и разрешения асцита) значительно улучшает трехмесячную выживаемость пациентов с низким содержанием белка в асцитической жидкости (< 15 г/л) с прогрессирующей печеночной недостаточностью (сумма баллов по шкале Child-Pugh >= 9 и уровень сывороточного билирубина >= 3 мг/дл) или нарушением функции почек (уровень сывороточного креатинина >= 1,2 мг/дл, азота мочевины >= 25 мг/дл или сывороточная концентрация натрия <= 130 ммоль/л) по сравнению с пациентами, получающими плацебо (94 vs 62%; p = 0,03) [65, 66, 336, 524]. Согласно данным метаанализа всех исследований эффективности антибактериальных препаратов, производных хинолона (фторхинолонов) в качестве профилактики СБП у пациентов с ЦП, преимущество их длительного применения в отношении выживаемости особенно заметно в первые три месяца (94 vs 62%, p = 0,003), но снижается со временем и не прослеживается после 12 месяцев наблюдения (ОР 0,65; 95% ДИ 0,41 - 1,02) [1, 65, 66, 520]. После эпизода СБП вероятность возврата инфекции в течение года составляет около 70% [47, 66]. Назначение #норфлоксацина снижает вероятность развития повторного эпизода СБП с 68 до 20% [66, 521]. Целесообразно отменить терапию #норфлоксацином пациентам с ЦП при улучшении функции печени и разрешении асцита с целью профилактики развития резистентных к терапии штаммов [1, 65, 66].
- Рекомендовано ограничивать применение ИПП пациентам с ЦП и асцитом с целью профилактики развития СБП [522].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Очень часто ИПП применяются необоснованно у пациентов с ЦП. Показано, что их длительное применение существенно повышает риск развития СИБР в тонкой кишке, усиления патологической бактериальной транслокации и, как следствие, СБП и ПЭ, особенно у пациентов с асцитом. ПГГ не служит показанием для назначения ингибиторов протонового насоса, препараты выбора аналогичны таковым при лечении ПГ - неселективные бета-адреноблокаторы [15, 16, 18, 25, 65].
5.2.2. Профилактика варикозных кровотечений
Первичная профилактика варикозных кровотечений
- Рекомендовано пациентам с ЦП и отсутствием ВВПиЖ проведение регулярного эндоскопического контроля (эзофагогастродуоденоскопии) с целью их раннего обнаружения и начала применения методов первичной профилактики варикозных кровотечений [2, 147, 148, 259, 512, 513].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Сроки проведения эндоскопического контроля представлены в разделе "5.1. Диспансерное наблюдение".
- Рекомендовано пациентам с ЦП и наличием ВВПиЖ назначение неселективных бета-адреноблокаторов или #карведилола**, начиная с суточной дозы 6,25 мг и постепенно повышая ее до 12,5 мг (при необходимости до 25 мг) в зависимости от гемодинамических показателей и индивидуальной переносимости пациента, с целью первичной профилактики варикозных кровотечений [2, 148, 259, 526, 527].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
- Рекомендовано пациентам с ЦП и ПГГ применение неселективных бета-адреноблокаторов или #карведилола**, начиная с суточной дозы 6,25 мг и постепенно повышая ее до 12,5 мг (при необходимости до 25 мг) в зависимости от гемодинамических показателей и индивидуальной переносимости пациента, с целью первичной профилактики кровотечений, обусловленных ПГГ [2, 148, 528 - 530].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Влияние бета-адреноблокаторов (#пропранолол**)) и альфа- и бета-адреноблокатора #карведилола** на ПГ опосредуется за счет двух механизмов: а) снижение сердечного выброса и спланхнического кровотока через блокаду бета-рецепторов и б) спланхническая вазоконстрикция, приводящая к снижению портального давления, за счет блокады альфа-1-адренорецепторов. Препараты целесообразно назначать в дозе, снижающей частоту пульса в покое на 25%, либо при исходно низком пульсе до 55 ударов в минуту. Дозы #пропранолола** и #карведилола** необходимо титровать. Рекомендуемые дозы #пропранолола** могут варьировать от 20 мг/сут внутрь (начальная) до 320 мг/сут (максимальная) и подбираются индивидуально. #Карведилол** необходимо назначать, начиная с суточной дозы 6,25 мг и постепенно повышая ее до 12,5 мг (целевая доза в большинстве случаев). Максимальная суточная доза - 25 мг в день. Назначение #карведилола** ассоциировано с более существенным снижением портального давления по сравнению с неселективными бета-адреноблокаторами [65, 293, 531]. При достижении целевых дозировок неселективных бета-адреноблокаторов печеночный венозный градиент давления снижается < 10 мм рт. ст., что уменьшает риск кровотечения. Тем не менее целевые гемодинамические изменения отмечаются только у 46% пациентов, получающих неселективные бета-адреноблокаторы [15, 16, 18, 459, 531 - 533].
У больных с компенсированным ЦП следует отдавать предпочтение #карведилолу**, так как он более эффективен в качестве препарата, снижающего портальное давление. Данный препарат продемонстрировал больший позитивный эффект при профилактике декомпенсации, лучшую переносимость по сравнению с бета-адреноблокаторами и лучшие показатели выживаемости [2, 148, 527]. Помимо влияния на ВВПиЖ, неселективные бета-адреноблокаторы и #карведилол** способны в значительной степени уменьшать проявления ПГГ и являются препаратами выбора для первичной профилактики ассоциированных с ней кровотечений [528 - 530, 534, 535].
- Рекомендовано пациентам с ЦП и наличием противопоказаний/непереносимости/неэффективности неселективных бета-адреноблокаторов и (или) #карведилола** выполнять эндоскопическое лигирование варикозно расширенных вен пищевода с целью первичной профилактики варикозных кровотечений [2, 148, 259, 535 - 538].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: К абсолютным противопоказаниям неселективных бета-адреноблокаторов и (или) #карведилола** относятся бронхиальная астма, атриовентрикулярная блокада 2-й и 3-й степени (при отсутствии установленного водителя ритма), синдром слабости синусового узла и выраженная брадикардия (< 50 ударов в минуту). К относительным противопоказаниям относятся псориаз, заболевания периферических артерий и синдром Рейно, хроническая обструктивная болезнь легких, инсулинозависимый сахарный диабет.
При выполнении эндоскопического лигирования следует стремиться к достижению эрадикации ВВ.
Если для достижения эрадикации ВВ требуется несколько процедур эндоскопического лигирования, интервал между ними должен составлять 4 - 8 недель с целью обеспечения эпителизации постлигатурных эрозий слизистой и снижения риска эрозивных кровотечений. После эрадикации ВВ эндоскопический контроль следует осуществлять каждые 6 - 12 месяцев [2, 148, 259, 539, 540]. Также важно подчеркнуть, что у пациентов с компенсированным ЦП другие процедуры - TIPS и BRTO/BATO - не должны проводиться для первичной профилактики кровотечений. Причиной этого выступает недостаточность данных об их роли в качестве первичной профилактики: существующие исследования ограничены малым количеством наблюдений. Наряду с этим имеются данные о достаточно высоком риске развития связанных с ПГ осложнений после процедуры BRTO/BATO [2, 148, 435, 541].
- Рекомендовано пациентам с декомпенсированным ЦП и наличием ВВПиЖ 2-й или 3-й степени (и любой степени при наличии "красных маркеров" угрозы кровотечения) комбинировать назначение неселективных бета-адреноблокаторов или #карведилола**, начиная с суточной дозы 6,25 мг и постепенно повышая ее до 12,5 мг (при необходимости до 25 мг), с выполнением эндоскопического лигирования варикозно расширенных вен пищевода с целью первичной профилактики варикозных кровотечений [542, 543].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарии: В качестве способов первичной профилактики варикозных кровотечений применяются неселективные бета-адреноблокаторы или #карведилол** либо эндоскопическое лигирование варикозно расширенных вен пищевода. Согласно имеющимся данным, неселективные бета-адреноблокаторы и #карведилол** более предпочтительны, так как эндоскопическое лигирование ассоциировано с более высоким риском развития осложнений (таких как образование постлигатурных язв и кровотечение из них) и смертности [543, 544]. Кроме того, эндоскопическое лигирование варикозно расширенных вен пищевода не влияет на ПГ. Следует отметить, что разница в уровнях выживаемости может быть связана с тем, что длительное применение неселективных бета-адреноблокаторов и #карведилола** способно предотвращать последующую декомпенсацию основного заболевания [545, 546]. При ВВ 2-й и 3-й степени возможно применение обоих методов, особенно у пациентов с декомпенсированным ЦП. Так, по данным РКИ с включением 330 пациентов с ЦП классов B и C по Child-Pugh, комбинация #карведилола** с эндоскопическим лигированием варикозно расширенных вен пищевода позволила существенно снизить риск возникновения первого кровотечения и показатели смертности в течение 1-го года [542]. По современным данным, наличие декомпенсированного ЦП, выраженного и даже рефрактерного асцита не является противопоказанием к их применению [547 - 549], тем не менее стоит учитывать их потенциально негативное влияние на перфузию почек, что, как следствие, предрасполагает к развитию ГРС-ОПП [550 - 552].
Вторичная профилактика варикозных кровотечений (профилактика рецидива кровотечения)
- Рекомендовано пациентам с ЦП, перенесшим варикозное кровотечение и (или) получившим эндоскопическое, эндоваскулярное или хирургическое лечение, проводить эзофагогастродуоденоскопию через 3, 6 месяцев после вмешательства и далее - ежегодно с целью динамической оценки ВВПиЖ и определения показаний к дальнейшему лечению и вторичной профилактике варикозных кровотечений [147, 148, 259, 512, 553].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Рекомендовано пациентам с ЦП и кровотечением (кровотечениями) в анамнезе выполнение эндоскопического лигирования варикозно расширенных вен пищевода в сочетании с назначением неселективных бета-адреноблокаторов или #карведилола** (в дозе 6,25 - 25 мг в зависимости от индивидуальной переносимости пациента) с целью профилактики рецидива кровотечения [2, 148, 259, 554 - 556].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: При отсутствии вторичной профилактики до 60% пациентов с ЦП, перенесших ранее варикозное кровотечение, перенесут рецидив в течение ближайшего года после первого эпизода. Наиболее высокий риск рецидива - в течение первых 6 недель после предыдущего эпизода кровотечения [557, 558]. В случае если невозможна комбинация лигирования с назначением НСББ или #карведилола**, следует применять либо эндоскопический, либо консервативный метод в зависимости от того, что будет возможно в конкретной ситуации. При наличии резистентного асцита лучше отдать предпочтение TIPS [554 - 556].
- При неэффективности сочетанного применения эндоскопического лечения и неселективных бета-адреноблокаторов или #карведилола** рекомендовано выполнение процедуры TIPS пациентам с ЦП и кровотечениями в анамнезе с целью профилактики рецидива кровотечений [386, 559 - 561].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: В РКИ сравнительной оценки стандартной терапии (неселективные бета-адреноблокаторы/#карведилол** в сочетании с эндоскопическим лечением) и процедуры TIPS у больных с ЦП и рецидивирующими варикозными кровотечениями последняя показала свою высокую эффективность. При этом статистически значимой разницы в уровнях выживаемости получено не было. Однако у пациентов после выполнения TIPS закономерно повышался риск развития ПЭ [386, 559, 560].
- Рекомендовано пациентам с ЦП и кровотечением из ВВ 2-го (GOV2) и 3-го типа (IGV1) с целью вторичной профилактики кровотечений сочетанное применение неселективных бета-адреноблокаторов или #карведилола** и эндоскопического лечения (клеевой облитерации с применением медицинского клея сульфакрилата) либо проведение эндоваскулярного лечения (TIPS, BRTO/BATO или их комбинация) [443, 562 - 567].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Частота кровотечений из ВВ 2-го (GOV2) и 3-го типа (IGV1) составляет 17 - 25%. И хотя она ниже, чем при варикозе 1-го типа (GOV1), кровотечения ассоциированы с более высоким риском неэффективности гемостаза и повышенной смертностью [443, 444, 553, 562]. Риск рецидива кровотечения из вен данной локализации составляет, по разным данным, от 10 до 54% [563 - 567].
Выбор метода профилактики кровотечений из ВВ 2-го (GOV2) и 3-го типа (IGV1) должен осуществляться индивидуально в каждом конкретном случае и в зависимости от локального опыта применения и доступности той или иной технологии.
Процедура эндоскопической клеевой облитерации (склерозирования) ВВ желудка с помощью тканевых клеевых композиций (сульфакрилата) производится с помощью интравазальной инъекции препарата в ВВ желудка через эндоскопическую иглу. При контакте с кровью цианакрилат быстро полимеризуется, что приводит к окклюзии сосуда и прекращению кровотока по нему. Применение данной методики возможно и эффективно при варикозном расширении вен желудка 2-го типа (GOV2), при котором эндоскопическое лигирование выполнять нельзя ввиду высокого риска раннего рецидива кровотечения, возникающего вследствие соскальзывания лигатур со слизистой желудка и образования перфорации сосуда.
По имеющимся данным, выполнение процедуры BRTO/BATO снижает риск рецидива из ВВ желудка по сравнению с TIPS и ассоциировано с меньшим риском развития ПЭ [433, 434], при отсутствии различий в уровне выживаемости [562]. Комбинация TIPS и BRTO/BATO снижает как риск рецидива кровотечений, так и риск (прогрессии) ПЭ [435 - 438].
- Рекомендовано пациентам с ЦП при угрозе кровотечения из ВВПиЖ 2-го типа (GOV2) при отсутствии анатомических или технических возможностей выполнения процедуры TIPS и (или) BRTO/BATO (тромбоз воротной вены и ее внутрипеченочных разветвлений) с целью вторичной профилактики кровотечения выполнение полостной операции. При сохранной печеночной функции и стабильном состоянии больного (ЦП класса A по Child-Pugh) рекомендовано выполнение селективного спленоренального шунтирования [65, 148, 259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: При отсутствии анатомических или технических возможностей для эндоваскулярного лечения возможно выполнение гастротомии и прямого прошивания варикозно расширенных вен желудка и нижней трети пищевода (операция М.Д. Пациоры). При наличии ВВ желудка 3-го типа (IGV1) возможно выполнение спленэктомии [65, 148, 259].
- Рекомендовано пациентам с ЦП и ПГГ применение неселективных бета-адреноблокаторов или #карведилола** с целью вторичной профилактики кровотечений, обусловленных ПГГ [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано пациентам с ЦП и ПГГ эндоскопическое лечение (аргоноплазменная коагуляция или гемостатические средства для местного применения) с целью вторичной профилактики кровотечений, обусловленных ПГГ [2, 148, 449 - 452].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии: Ряд исследований свидетельствуют об эффективности эндоскопического лечения (аргоноплазменная коагуляция, гемостатические средства для местного применения) в качестве вторичной профилактики кровотечений при ПГГ [449 - 452].
5.2.3. Профилактика печеночной энцефалопатии
- Рекомендовано пациентам с ЦП раннее выявление и устранение провоцирующих развитие ПЭ факторов, элиминация/контроль этиологического фактора ЦП в целях первичной профилактики данного осложнения, а также образовательная работа с пациентом, медицинским персоналом об особенностях течения ЦП и развития его осложнений [568 - 570].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: К провоцирующим факторам ПЭ относят: желудочно-кишечное кровотечение, гиповолемию, нарушение кислотно-щелочного и электролитного баланса, инфекционные осложнения, крупные портосистемные шунты и т.д. Их своевременное выявление и коррекция, как правило, эффективны в первичной профилактике развития ПЭ. Так, например, острое варикозное кровотечение у пациентов с ЦП служит провоцирующим фактором ПЭ в 16 - 40% случаев, быстрое удаление крови из желудочно-кишечного тракта - эффективное средство ее профилактики [571]. Элиминация/контроль этиологического фактора ЦП и лечение его осложнений у ряда пациентов приводят к рекомпенсации заболевания, что предполагает отсутствие осложнений и нормальные клинико-лабораторные параметры, это сопровождается хорошим жизненным прогнозом [2].
- Рекомендовано пациентам с ЦП и эпизодами ПЭ в анамнезе назначение орнитина в дозе 6 г 3 раза в сутки перорально в три приема в течение 6 месяцев с целью вторичной профилактики эпизодов ПЭ [572].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: В ранее проведенном двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании с включением 150 пациентов с циррозом печени и эпизодами ПЭ в анамнезе было показано, что применение орнитина в дозе 18 г в течение 6 месяцев значимо снижает риск развития повторного эпизода ПЭ в сравнении с плацебо (p = 0,02) [572].
- Рекомендовано пациентам с ЦП и рецидивирующей ПЭ в анамнезе применение рифаксимина в дозе 1100 мг на протяжении 6 месяцев с целью вторичной профилактики повторных эпизодов ПЭ [299].
Уровень убедительности рекомендаций A (Уровень достоверности доказательств 2)
Комментарии: По данным двойного слепого плацебо-контролируемого РКИ с включением 299 пациентов с рецидивирующей ПЭ в фазе ремиссии было показано, что рифаксимин в дозе 1100 мг/сут значительно снижал риск развития повторного эпизода ПЭ в сравнении с плацебо (p < 0,001) [299].
- Рекомендовано пациентам с ЦП и эпизодами ПЭ в анамнезе назначение лактулозы** с целью профилактики повторных эпизодов ПЭ [573].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: По данным одного из ранее проведенных РКИ, куда были включены 140 пациентов с ЦП и ПЭ в анамнезе, было показано, что применение лактулозы** связано со значимо более низким риском повторного развития ПЭ [573].
- Рекомендуется пациентам с ЦП своевременная диагностика и лечение скрытой ПЭ (минимальной и ПЭ I стадии по критериям West Haven) с целью профилактики явной ПЭ [70, 571].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Лечение скрытой и явной ПЭ представлено в разделе 3.2.3. "Лечение печеночной энцефалопатии".
- Рекомендуется пациентам с ЦП и острым варикозным кровотечением проводить первичную профилактику ПЭ: орнитином (10 г в виде внутривенной инфузии), или рифаксимином (1200 мг/сут), или лактулозой** (в индивидуальной дозе до достижения 2 - 3 опорожнений кишечника в день) в течение минимум 7 дней с целью предотвращения развития данного осложнения [278, 574].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: В метаанализе РКИ была продемонстрирована эффективность лактулозы** в профилактике ПЭ у пациентов с гастроинтестинальными кровотечениями: 7% в группе лактулозы** vs 26% в группе контроля (p = 0,01). Лактулоза** назначалась в индивидуальной дозе до достижения 2 - 3 опорожнений кишечника в день. Серьезных побочных эффектов у пациентов, получавших лактулозу**, не отмечалось [278]. В двойном слепом плацебо-контролируемом РКИ 84 пациента с острым варикозным кровотечением без признаков минимальной или явной энцефалопатии на момент включения были разделены на 4 группы и получали следующие препараты: лактулозу** (начальная доза - 30 мл, далее - индивидуальная доза до достижения стула 2 - 3 раза в день), LOLA (орнитин) (10 г в виде внутривенной инфузии), рифаксимин (1200 мг/сут); 4-я группа получала плацебо. Длительность наблюдения - 28 дней. Все препараты были эффективны в предотвращении первого эпизода ПЭ. Наилучший профиль безопасности отмечался у орнитина (не зарегистрировано побочных эффектов, не наблюдалось летальных случаев от рецидива кровотечения или других осложнений ЦП), хороший профиль безопасности отмечен у рифаксимина (у 1 пациента, т.е. 4,8%, была тошнота и диспепсия, 1 пациент умер в течение периода наблюдения от повторного кровотечения). В группе пациентов, получавших лактулозу**, диарея наблюдалась в 54,5% случаев, метеоризм и дискомфорт в животе отметили 45,5%, у 2 пациентов (9,1%) развился СБП вторично к E. coli, 1 пациент умер от рецидива кровотечения [574].
- Рекомендовано пациентам с ЦП после установки TIPS назначение орнитина (в дозе 10 г в виде внутривенной инфузии в течение 7 дней) для первичной профилактики ПЭ с целью улучшения клинических исходов заболевания [319, 574].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: В систематическом обзоре с метаанализом было показано, что орнитин эффективен для первичной профилактики ПЭ после острого варикозного кровотечения (ОР 0,42; 95% ДИ 0,16 - 0,98; p < 0,03) и установки TIPS (ОР 0,30; 95% ДИ 0,03 - 2,66) в сравнении с плацебо/отсутствием вмешательства [319].
- Рекомендуется пациентам с ЦП с установленным TIPS с целью первичной профилактики ПЭ назначение рифаксимина в дозе 550 мг 2 раза в сутки в комбинации с лактулозой** в дозе 30 - 45 мл 3 - 4 раза в день с дальнейшим переходом на индивидуально подобранную поддерживающую дозу так, чтобы мягкий стул был максимально 2 - 3 раза в день [433, 575].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Развитие ПЭ после установки TIPS является частым (20 - 54%) и нередко тяжелым осложнением, что требует ее профилактики. В метаанализе A. Liang et al. [575] показано, что подавляющее большинство лекарственных препаратов (рифаксимин, лактулоза**, лактитол, орнитин, альбумин) не оказывают клинически значимого эффекта в первичной профилактике ПЭ после установки TIPS при их использовании в качестве монотерапии. Комбинация лактулозы** в индивидуальной дозе с целью достижения стула 2 - 3 раза в сутки и рифаксимина в дозе 550 мг 2 раза в день, которые назначали за 72 ч до установки TIPS и в течение 12 месяцев после данной процедуры, показали клинически значимый эффект в сравнении с пациентами, которые получали профилактическую терапию только лактулозой** или были без лечения: 28,1 vs 52,1%, p = 0,004. Результат оценивался по количеству случаев возникновения ПЭ: дополнительное назначение орнитина не приводило к усилению клинического эффекта (25 vs 29,7%, p = 0,780). Факторами риска развития ПЭ после установки TIPS служили более старший возраст и эпизоды ПЭ в прошлом.
Режим введения комбинации: рифаксимин в дозе 550 мг 2 раза в сут., лактулоза** в дозе 30 - 45 мл 3 - 4 раза в сутки с переходом на поддерживающую (доза может подбираться индивидуально с целью достижения стула 2 - 3 раза в день) в целях первичной профилактики ПЭ. Данная комбинация назначается за 72 ч до установки TIPS и в течение 12 месяцев после данной процедуры [433].
5.2.4. Профилактика гепаторенального синдрома с критериями острого повреждения почек
Основным принципом профилактики ГРС-ОПП служит устранение потенциальных провоцирующих факторов, к которым относят инфекции различных локализаций, желудочно-кишечные кровотечения (в частности, варикозные), проведение высокообъемного лапароцентеза без введения альбумина человека** и др. Помимо этого, в клинической практике существуют и отдельные случаи.
- Рекомендовано пациентам с ЦП и напряженным асцитом выполнение лечебного парацентеза с регулируемым удалением перитонеального транссудата (лапароцентеза) в сочетании с введением высокодозного раствора альбумина человека** с целью профилактики развития ГРС-ОПП. Доза и продолжительность лечения зависят от гемодинамических показателей и волемического статуса пациента [30, 369, 576, 577].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Известно, что назначение альбумина человека** при проведении высокообъемного лечебного лапароцентеза с регулируемым удалением перитонеального транссудата пациентам с напряженным асцитом ассоциировано с меньшей частотой развития гемодинамических нарушений, что является триггером ОПП в общем и ГРС в частности. По данным двух метаанализов с включением 17 [576] и 42 РКИ [577] применение альбумина человека** при лапароцентезе позволяло существенно сократить риск развития дисфункции почек.
- Рекомендовано пациентам с ЦП и СБП назначение высокодозного раствора альбумина человека** в дополнение к антибактериальной терапии с целью профилактики развития ГРС-ОПП. Доза и продолжительность лечения зависят от гемодинамических показателей и волемического статуса пациента [30, 347].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: По данным исследования P. Sort et al., назначение раствора альбумина человека** пациентам с СБП в дозе 1,5 г/кг массы тела в 1-е сутки и 1 г/кг массы тела на третьи сутки дополнительно к антибиотикам приводило к снижению частоты ОПП и показателей смертности [347]. При этом, по данным ретроспективного исследования M. Poca et al., применение альбумина человека** имело смысл только у пациентов с высокими показателями внутригоспитальной смертности и повреждения почек (такие пациенты имели уровень билирубина > 68 мкмоль/л и креатинина > 88,4 мкмоль/л) [578]. В то же время стоит отметить, что назначение альбумина человека** пациентам с инфекцией, отличной от СБП, не приносит ожидаемого положительного эффекта: хотя и замедляет наступление повреждения почек, при этом не улучшает их функцию и 3-месячную выживаемость [579]. Исключение составляют ситуации, когда развивается септический шок: в этом случае назначение альбумина человека** для профилактики развития ОПП играет ключевую роль [515].
6. Организация оказания медицинской помощи
Показания к госпитализации: желтуха, явная энцефалопатия (2-я стадия и выше), впервые возникший или медикаментозно неконтролируемый/напряженный асцит, отечный синдром, подозрение на кровотечение, появление/усиление астенического синдрома, олигурия/анурия, подозрение на развитие инфекционного осложнения, появление/усиление одышки, клинические признаки поражения почек (олиго-/анурия). Госпитализация при ЦП может быть плановой и экстренной, в терапевтический или хирургический блок, в отделение интенсивной терапии и реанимации.
Показания к выписке пациента: уменьшение выраженности клинических симптомов и улучшение качества жизни, отсутствие необходимости хирургического лечения, необходимости проведения интенсивной терапии, стабилизация функции жизненно важных органов: сердечно-сосудистой (гемодинамика) и дыхательной системы, почек, центральной нервной системы, печени.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация отсутствует.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Выполнен прием (осмотр, консультация) врача-гастроэнтеролога или врача-терапевта первичный
да/нет
2
Выполнено лечение в условиях стационара (при возникновении и/или усугублении признаков декомпенсации)
да/нет
3
Выполнен общий (клинический) анализ крови, анализ крови биохимический общетерапевтический (общий белок, альбумин, общий билирубин, прямой билирубин, креатинин, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, гаммаглутаминтранспептидаза, глюкоза), коагулограмма (ориентировочное исследование системы гемостаза) (МНО, протромбиновый индекс%, фибриноген, протромбин, протромбиновое время), общий (клинический) анализ мочи
да/нет
4
Выполнен диагностический парацентез с последующим исследованием асцитической жидкости (пациентам с ЦП с впервые возникшим асцитом для уточнения природы выпота и пациентам с ЦП с подозрением на инфицирование асцитической жидкости)
да/нет
5
Выполнено ультразвуковое исследование органов брюшной полости (комплексное)
да/нет
6
Выполнена эзофагогастродуоденоскопия
да/нет
7
Выполнена компьютерная томографии органов брюшной полости с внутривенным болюсным контрастированием (при наличии медицинских показаний и отсутствии противопоказаний) (пациентам с подозрением на тромбоз в венах портальной системы или с очаговыми изменениями печени на ультразвуковом исследовании)
да/нет
8
Выполнен лечебный объемный парацентез с регулируемым удалением перитонеального транссудата (лапароцентез) пациентам с напряженным асцитом, а также с асцитом, осложненным острым повреждением почек - гепаторенальным синдромом
да/нет
9
Выполнен лечебный торакоцентез пациентам с печеночным гидротораксом, признаками дыхательной недостаточности, при неэффективности диуретической терапии
да/нет
10
Выполнена трансфузия раствора альбумина человека ** (из расчета 8 г на каждый литр асцитической жидкости и не более 1 г/кг безотечной массы тела пациента) после проведения парацентеза с регулируемым удалением перитонеального транссудата
да/нет
11
Выполнено лечение диуретиками в сочетании с бессолевой диетой под контролем уровня калия и натрия крови пациентам с асцитом и/или печеночным гидротораксом при наличии показаний и отсутствии противопоказаний
да/нет
12
Выполнено лечение лактулозой** и/или рифаксимином и/или орнитином пациентам с печеночной энцефалопатией при наличии показаний и отсутствии противопоказаний
да/нет
13
Выполнено лечение антибактериальными препаратами системного действия (при наличии показаний и отсутствии противопоказаний)
да/нет
14
Выполнена трансфузия альбумина человека** в дозе 1,5 г/кг массы тела в 1-е сутки от установления диагноза и 1г/кг массы тела на 3 сутки от установления диагноза пациентам с циррозом печени и инфицированным асцитом
да/нет
15
Выполнено лечение #терлипрессином** или #норэпинефрином** и альбумином человека** пациентам с циррозом печени, осложненным острым повреждением почек - гепаторенальным синдромом под контролем уровня креатинина через 48 - 72 часа от начала терапии
да/нет
16
Выполнен осмотр (консультация) врачом-анестезиологом-реаниматологом первичный пациентам с циррозом печени с признаками острого кровотечения из верхних отделов желудочно-кишечного тракта
да/нет
17
Выполнено лигирование источника кровотечения при условии удовлетворительной визуализации в комбинации с введением терлипрессина** или октреотида** пациентам с продолжающимся кровотечением из изолированных варикозных вен пищевода и вен желудка 1 типа (до 8 - 10 мм в диаметре)
да/нет
18
Установлен зонд-обтуратор резиновый пищеводно-желудочный для остановки кровотечения из расширенных вен пищевода и кардиального отдела желудка при невозможности лигирования источника кровотечения
да/нет
19
Выполнено лечение цефтриаксоном** 1 г в день пациентам с циррозом печени и варикозным кровотечением (при наличии показаний и отсутствии противопоказаний)
да/нет
20
Выполнено направление на прием (осмотр, консультация) врача-гастроэнтеролога или врача-терапевта первичный, занимающимися вопросами трансплантации печени, пациентам с циррозом печени и тяжелым нарушением функции печени (индекс MELD-Na >= 15 баллов) или резистентным асцитом или острым повреждением почек - гепаторенальным синдромом или рефрактерным печеночным гидротораксом или гепатопульмональным синдромом с PaO2 < 60 мм. рт. ст.
да/нет
Список литературы
1. Ивашкин ВТ, Маевская МВ, Жаркова МС, Жигалова СБ, Киценко ЕА, Манукьян ГВ и др. Клинические рекомендации Российского общества по изучению печени и Российской гастроэнтерологической ассоциации по диагностике и лечению фиброза и цирроза печени и их осложнений. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021; 31(6): 56 - 102. Режим доступа: https://www.gastro-j.ru/jour/article/view/621/.
2. De Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C. Corrigendum to 'Baveno VII - Renewing consensus in portal hypertension' [J Hepatol (2022) 959 - 974]. J Hepatol. 2022; 77(1): 271. https://doi.org/10.1016/j.jhep.2022.03.024.
3. Guo J, Friedman SL. Hepatic fibrogenesis. Semin Liver Dis. 2007; 27(4): 413 - 426. https://doi.org/10.1055/s-2007-991517.
4. Das SK, Vasudevan DM. Genesis of hepatic fibrosis and its biochemical markers. Scand J Clin Lab Invest. 2008; 68(4): 260 - 269. https://doi.org/10.1080/00365510701668516.
5. Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Ann Hepatol. 2009; 8(4): 283 - 291. https://doi.org/10.1016/S1665-2681(19) 31740 - 5.
6. Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis. Annu Rev Pathol. 2011; 6: 425 - 456. https://doi.org/10.1146/annurev-pathol-011110-130246.
7. Bosch J, Groszmann RJ, Shah VH. Evolution in the understanding of the pathophysiological basis of portal hypertension: How changes in paradigm are leading to successful new treatments. J Hepatol. 2015; 62(Suppl. 1): S121 - 130. https://doi.org/10.1016/j.jhep.2015.01.003.
8. Bernardi M, Moreau R, Angeli P, Schnabl B, Arroyo V. Mechanisms of decompensation and organ failure in cirrhosis: From peripheral arterial vasodilation to systemic inflammation hypothesis. J Hepatol. 2015; 63(5): 1272 - 1284. https://doi.org/10.1016/j.jhep.2015.07.004.
9. Jalan R, Fernandez J, Wiest R, Schnabl B, Moreau R, Angeli P et al. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013. J Hepatol. 2014; 60(6): 1310 - 1324. https://doi.org/10.1016/j.jhep.2014.01.024.
10. Масленников РВ, Татаркина МА, Маевская МВ, Павлов ЧС, Жаркова МС, Ивашкин ВТ. Влияние синдрома избыточного бактериального роста и системного воспаления на абдоминальную гемодинамику у больных циррозом печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017; 27(4): 52 - 61. https://doi.org/10.22416/1382-4376-2017-27-4-52-61.
11. Kronsten VT, Shawcross DL. Clinical Implications of Inflammation in Patients With Cirrhosis. Am J Gastroenterol. 2025; 120(1): 65 - 74. https://doi.org/10.14309/ajg.0000000000003056.
12. Масленников РВ, Дрига АА, Ивашкин КВ, Жаркова МС, Маевская МВ, Павлов ЧС и др. Роль синдрома избыточного бактериального роста и системного воспаления в патогенезе гемодинамических изменений у больных циррозом печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017; 27(3): 45 - 56. https://doi.org/10.22416/1382-4376-2017-27-3-45-56.
13. Oliver JA, Verna EC. Afferent mechanisms of sodium retention in cirrhosis and hepatorenal syndrome. Kidney Int. 2010; 77(8): 669 - 680. https://doi.org/10.1038/ki.2010.4.
14. Ripoll C, Groszmann R, Garcia-Tsao G, Grace N, Burroughs A, Planas R et al. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology. 2007; 133(2): 481 - 488. https://doi.org/10.1053/j.gastro.2007.05.024.
15. Затевахин ИИ, Ивашкин ВТ, Киценко ЕА, Павлов ЧС, Шерцингер АГ, Чжао АВ и др. Национальные клинические рекомендации Минздрава России по лечению кровотечений из варикозно расширенных вен пищевода и желудка. Медицинская газета. 2015; 71 - 74. Режим доступа: https://mgzt.ru/content/лечение-кровотечений-из-варикозно-расширенных-вен-пищевода-и-желудка.
16. De Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol. 2010; 53(4): 762 - 768. https://doi.org/10.1016/j.jhep.2010.06.004.
17. D'Amico G, De Franchis R. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology. 2003; 38(3): 599 - 612. https://doi.org/10.1053/jhep.2003.50385.
18. De Franchis R. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and inpidualizing care for portal hypertension. J Hepatol. 2015; 63(3): 743 - 752. https://doi.org/10.1016/j.jhep.2015.05.022.
19. Надинская МЮ, Маевская МВ, Бакулин ИГ, Бессонова ЕН, Буеверов АО, Жаркова МС и др. Диагностическое и прогностическое значение гипераммониемии у пациентов с циррозом печени, печеночной энцефалопатией и саркопенией (соглашение специалистов). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2024; 34(1): 85 - 100. https://doi.org/10.22416/1382-4376-2024-34-1-85-100.
20. Lu K. Cellular Pathogenesis of Hepatic Encephalopathy: An Update. Biomolecules. 2023; 13(2): 396. https://doi.org/10.3390/biom13020396.
21. Butterworth RF, McPhail MJW. L-Ornithine L-Aspartate (LOLA) for Hepatic Encephalopathy in Cirrhosis: Results of Randomized Controlled Trials and Meta-Analyses. Drugs. 2019; 79(Suppl. 1): 31 - 37. https://doi.org/10.1007/s40265-018-1024-1.
22. Blaney H, DeMorrow S. Hepatic Encephalopathy: Thinking Beyond Ammonia. Clin Liver Dis (Hoboken). 2022; 19(1): 21 - 24. https://doi.org/10.1002/cld.1163.
23. Tariq R, Hadi Y, Chahal K, Reddy S, Salameh H, Singal AK. Incidence, Mortality and Predictors of Acute Kidney Injury in Patients with Cirrhosis: A Systematic Review and Meta-analysis. J Clin Transl Hepatol. 2020; 8(2): 135 - 142. https://doi.org/10.14218/JCTH.2019.00060.
24. Utako P, Emyoo T, Anothaisintawee T, Yamashiki N, Thakkinstian A, Sobhonslidsuk A. Clinical Outcomes after Liver Transplantation for Hepatorenal Syndrome: A Systematic Review and Meta-Analysis. Biomed Res Int. 2018: 5362810. https://doi.org/10.1155/2018/5362810.
25. Angeli P, Garcia-Tsao G, Nadim MK, Parikh CR. News in pathophysiology, definition and classification of hepatorenal syndrome: A step beyond the International Club of Ascites (ICA) consensus document. J Hepatol. 2019; 71(4): 811 - 822. https://doi.org/10.1016/j.jhep.2019.07.002.
26. Angeli P, ![]() P, Wong F, Bernardi M, Boyer TD, Gerbes A et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J Hepatol. 2015; 62(4): 968 - 974. https://doi.org/10.1016/j.jhep.2014.12.029.
P, Wong F, Bernardi M, Boyer TD, Gerbes A et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J Hepatol. 2015; 62(4): 968 - 974. https://doi.org/10.1016/j.jhep.2014.12.029.
27.  JM, Paradis V, Rautou PE, Francoz C, Escolano S, Sallee M et al. The spectrum of renal lesions in patients with cirrhosis: a clinicopathological study. Liver Int. 2010; 30(5): 725 - 732. https://doi.org/10.1111/j.1478-3231.2009.02182.x.
JM, Paradis V, Rautou PE, Francoz C, Escolano S, Sallee M et al. The spectrum of renal lesions in patients with cirrhosis: a clinicopathological study. Liver Int. 2010; 30(5): 725 - 732. https://doi.org/10.1111/j.1478-3231.2009.02182.x.
28. Velez JCQ, Therapondos G, Juncos LA. Reappraising the spectrum of AKI and hepatorenal syndrome in patients with cirrhosis. Nat Rev Nephrol. 2020; 16(3): 137 - 155. https://doi.org/10.1038/s41581-019-0218-4.
29. Lee HA, Seo YS. Current knowledge about biomarkers of acute kidney injury in liver cirrhosis. Clin Mol Hepatol. 2022; 28(1): 31 - 46. https://doi.org/10.3350/cmh.2021.0148.
30. Nadim MK, Kellum JA, Forni L, Francoz C, Asrani SK, Ostermann M et al. Acute kidney injury in patients with cirrhosis: Acute Disease Quality Initiative (ADQI) and International Club of Ascites (ICA) joint multidisciplinary consensus meeting. J Hepatol. 2024; 81(1): 163 - 183. https://doi.org/10.1016/j.jhep.2024.03.031.
31. Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012; 120(4): c179 - c184. https://doi.org/10.1159/000339789.
32. Krag A, Bendtsen F, Henriksen JH, ![]() S. Low cardiac output predicts development of hepatorenal syndrome and survival in patients with cirrhosis and ascites. Gut. 2010; 59(1): 105 - 110. https://doi.org/10.1136/gut.2009.180570.
S. Low cardiac output predicts development of hepatorenal syndrome and survival in patients with cirrhosis and ascites. Gut. 2010; 59(1): 105 - 110. https://doi.org/10.1136/gut.2009.180570.
33. Wiest R, Lawson M, Geuking M. Pathological bacterial translocation in liver cirrhosis. J Hepatol. 2014; 60(1): 197 - 209. https://doi.org/10.1016/j.jhep.2013.07.044.
34. Van Slambrouck CM, Salem F, Meehan SM, Chang A. Bile cast nephropathy is a common pathologic finding for kidney injury associated with severe liver dysfunction. Kidney Int. 2013; 84(1): 192 - 197. https://doi.org/10.1038/ki.2013.78.
35. Biggins SW, Rodriguez HJ, Bacchetti P, Bass NM, Roberts JP, Terrault NA. Serum sodium predicts mortality in patients listed for liver transplantation. Hepatology. 2005; 41(1): 32 - 39. https://doi.org/10.1002/hep.20517.
36. ![]() E,
E, ![]() P. Hypervolemic Hyponatremia (Liver). Front Horm Res. 2019; 52: 104 - 112. https://doi.org/10.1159/000493241.
P. Hypervolemic Hyponatremia (Liver). Front Horm Res. 2019; 52: 104 - 112. https://doi.org/10.1159/000493241.
37. John S, Thuluvath PJ. Hyponatremia in cirrhosis: pathophysiology and management. World J Gastroenterol. 2015; 21(11): 3197 - 3205. https://doi.org/10.3748/wjg.v21.i11.3197.
38. Guevara M, ![]() P. Hiponatremia en la cirrosis
P. Hiponatremia en la cirrosis  : patogenia y tratamiento. Endocrinol Nutr. 2010; 57(Suppl. 2): 15 - 21. https://doi.org/10.1016/S1575-0922(10)70018-8.
: patogenia y tratamiento. Endocrinol Nutr. 2010; 57(Suppl. 2): 15 - 21. https://doi.org/10.1016/S1575-0922(10)70018-8.
39. Badillo R, Rockey DC. Hepatic hydrothorax: clinical features, management, and outcomes in 77 patients and review of the literature. Medicine (Baltimore). 2014; 93(3): 135 - 142. https://doi.org/10.1097/MD.0000000000000025.
40. Garbuzenko DV, Arefyev NO. Hepatic hydrothorax: An update and review of the literature. World J Hepatol. 2017; 9(31): 1197 - 1204. https://doi.org/10.4254/wjh.v9.i31.1197.
41.  R, Krowka MJ,
R, Krowka MJ, ![]() P, Fallon MB. Pulmonary-Hepatic vascular Disorders (PHD). Eur Respir J. 2004; 24(5): 861 - 880. https://doi.org/10.1183/09031936.04.00010904.
P, Fallon MB. Pulmonary-Hepatic vascular Disorders (PHD). Eur Respir J. 2004; 24(5): 861 - 880. https://doi.org/10.1183/09031936.04.00010904.
42. Machicao VI, Balakrishnan M, Fallon MB. Pulmonary complications in chronic liver disease. Hepatology. 2014; 59(4): 1627 - 1637. https://doi.org/10.1002/hep.26745.
43. Jasso-Baltazar EA,  GA, Aguirre-Valadez J, Ruiz I, Papacristofilou-Riebeling B, Jimenez JV et al. Portopulmonary Hypertension: An Updated Review. Transplant Direct. 2023; 9(8): e1517. https://doi.org/10.1097/TXD.0000000000001517.
GA, Aguirre-Valadez J, Ruiz I, Papacristofilou-Riebeling B, Jimenez JV et al. Portopulmonary Hypertension: An Updated Review. Transplant Direct. 2023; 9(8): e1517. https://doi.org/10.1097/TXD.0000000000001517.
44. Saleemi S. Portopulmonary hypertension. Ann Thorac Med. 2010; 5(1): 5 - 9. https://doi.org/10.4103/1817-1737.58953.
45. Kaymakoglu S, Kahraman T, Kudat H, Demir K, Cakaloglu Y, Adalet I et al. Hepatopulmonary syndrome in noncirrhotic portal hypertensive patients. Dig Dis Sci. 2003; 48(3): 556 - 560. https://doi.org/10.1023/a:1022549018807.
46. Dever J.B., Sheikh M.Y. Review article: spontaneous bacterial peritonitis--bacteriology, diagnosis, treatment, risk factors and prevention. Aliment Pharmacol Ther. 2015; 41(11): 1116 - 31. https://doi.org/10.1111/apt.13172.
47. Piano S, Fasolato S, Salinas F, Romano A, Tonon M, Morando F et al. The empirical antibiotic treatment of nosocomial spontaneous bacterial peritonitis: Results of a randomized, controlled clinical trial. Hepatology. 2016; 63(4): 1299 - 1309. https://doi.org/10.1002/hep.27941.
48. Piano S, Brocca A, Mareso S, Angeli P. Infections complicating cirrhosis. Liver Int. 2018; 38(Suppl. 1): 126 - 133. https://doi.org/10.1111/liv.13645.
49. Appenrodt B,  F, Gentemann MG, Thyssen L, Sauerbruch T, Lammert F. Nucleotide-binding oligomerization domain containing 2 (NOD2) variants are genetic risk factors for death and spontaneous bacterial peritonitis in liver cirrhosis. Hepatology. 2010; 51(4): 1327 - 1333. https://doi.org/10.1002/hep.23440.
F, Gentemann MG, Thyssen L, Sauerbruch T, Lammert F. Nucleotide-binding oligomerization domain containing 2 (NOD2) variants are genetic risk factors for death and spontaneous bacterial peritonitis in liver cirrhosis. Hepatology. 2010; 51(4): 1327 - 1333. https://doi.org/10.1002/hep.23440.
50. Kamimura H, Sato T, Natsui K, Kobayashi T, Yoshida T, Kamimura K et al. Molecular Mechanisms and Treatment of Sarcopenia in Liver Disease: A Review of Current Knowledge. Int J Mol Sci. 2021; 22(3): 1425. https://doi.org/10.3390/ijms22031425.
51. Dasarathy S, Hatzoglou M. Hyperammonemia and proteostasis in cirrhosis. Curr Opin Clin Nutr Metab Care. 2018; 21(1): 30 - 36. https://doi.org/10.1097/MCO.0000000000000426.
52. Nasser M, Mokhtar A, Abbas N, Awad M, Ibrahim A. Nutritional status in cirrhosis; pathogenesis and management. Med J Vir Hepat. 2019; (3): 41 - 47.
53. Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y,  O, Cederholm T et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019; 48(1): 16 - 31. https://doi.org/10.1093/ageing/afy169.
O, Cederholm T et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019; 48(1): 16 - 31. https://doi.org/10.1093/ageing/afy169.
54. Xia Z, Cholewa J, Zhao Y, Shang HY, Yang YQ, ![]()
![]() K et al. Targeting Inflammation and Downstream Protein Metabolism in Sarcopenia: A Brief Up-Dated Description of Concurrent Exercise and Leucine-Based Multimodal Intervention. Front Physiol. 2017; 8: 434. https://doi.org/10.3389/fphys.2017.00434.
K et al. Targeting Inflammation and Downstream Protein Metabolism in Sarcopenia: A Brief Up-Dated Description of Concurrent Exercise and Leucine-Based Multimodal Intervention. Front Physiol. 2017; 8: 434. https://doi.org/10.3389/fphys.2017.00434.
55. Hayashi H, Beppu T, Shirabe K, Maehara Y, Baba H. Management of thrombocytopenia due to liver cirrhosis: a review. World J Gastroenterol. 2014; 20(10): 2595 - 2605. https://doi.org/10.3748/wjg.v20.i10.2595.
56. Global health estimates: Leading causes of death. Cause-specific mortality, 2000 - 2021. Available at: https://www.who.int/data/gho/data/themes/mortality-and-global-health-estimates/ghe-leading-causes-of-death.
57. GBD 2017 Cirrhosis Collaborators. The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990 - 2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol. 2020; 5(3): 245 - 266. https://doi.org/10.1016/S2468-1253(19)30349-8.
58. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990 - 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020; 396(10258): 1204 - 1222. https://doi.org/10.1016/S0140-6736(20)30925-9.
59. Alberts CJ, Clifford GM, Georges D, Negro F, Lesi OA, Hutin YJ, de Martel C. Worldwide prevalence of hepatitis B virus and hepatitis C virus among patients with cirrhosis at country, region, and global levels: a systematic review. Lancet Gastroenterol Hepatol. 2022; 7(8): 724 - 735. https://doi.org/10.1016/S2468-1253(22)00050-4.
60. Райхельсон КЛ, Маевская МВ, Жаркова МС, Гречишникова ВР, Оковитый СВ, Деева ТА и др. Жировая болезнь печени: новая номенклатура и ее адаптация в Российской Федерации. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2024; 34(2): 35 - 44. https://doi.org/10.22416/1382-4376-2024-961.
61. Gonzalez-Chagolla A, Olivas-Martinez A, Ruiz-Manriquez J,  M, Kauffman-Ortega E,
M, Kauffman-Ortega E,  LC et al. Cirrhosis etiology trends in developing countries: Transition from infectious to metabolic conditions. Report from a multicentric cohort in central Mexico. Lancet Reg Health Am. 2021; 7: 100151. https://doi.org/10.1016/j.lana.2021.100151.
LC et al. Cirrhosis etiology trends in developing countries: Transition from infectious to metabolic conditions. Report from a multicentric cohort in central Mexico. Lancet Reg Health Am. 2021; 7: 100151. https://doi.org/10.1016/j.lana.2021.100151.
62. Gu W, Hortlik H, Erasmus HP, Schaaf L, Zeleke Y, Uschner FE et al. Trends and the course of liver cirrhosis and its complications in Germany: Nationwide population-based study (2005 to 2018). Lancet Reg Health Eur. 2021; 12: 100240. https://doi.org/10.1016/j.lanepe.2021.100240.
63. Mezzano G, Juanola A, Cardenas A, Mezey E, Hamilton JP, Pose E et al. Global burden of disease: acute-on-chronic liver failure, a systematic review and meta-analysis. Gut. 2022; 71(1): 148 - 155. https://doi.org/10.1136/gutjnl-2020-322161.
64. European action plan to reduce the harmful use of alcohol 2012 - 2020. Available at: https://www.who.int/europe/publications/i/item/9789289002868.
65. European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018; 69(2): 406 - 460. https://doi.org/10.1016/j.jhep.2018.03.024.
66. European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010; 53(3): 397 - 417. https://doi.org/10.1016/j.jhep.2010.05.004.
67. Bajaj JS, Schubert CM, Heuman DM, Wade JB, Gibson DP, Topaz A et al. Persistence of cognitive impairment after resolution of overt hepatic encephalopathy. Gastroenterology. 2010; 138(7): 2332 - 2340. https://doi.org/10.1053/j.gastro.2010.02.015.
68. Riggio O, Ridola L, Pasquale C, Nardelli S, Pentassuglio I, Moscucci F, Merli M. Evidence of persistent cognitive impairment after resolution of overt hepatic encephalopathy. Clin Gastroenterol Hepatol. 2011; 9(2): 181 - 183. https://doi.org/10.1016/j.cgh.2010.10.002.
69. Zipprich A, Garcia-Tsao G, Rogowski S, Fleig WE, Seufferlein T, Dollinger MM. Prognostic indicators of survival in patients with compensated and decompensated cirrhosis. Liver Int. 2012; 32(9): 1407 - 1414. https://doi.org/10.1111/j.1478-3231.2012.02830.x.
70.  M, Boza F,
M, Boza F,  MS,
MS, ![]() E, Aguilar-Reina J. Subclinical hepatic encephalopathy predicts the development of overt hepatic encephalopathy. Am J Gastroenterol. 2001; 96(9): 2718 - 2723. https://doi.org/10.1111/j.1572-0241.2001.04130.x.
E, Aguilar-Reina J. Subclinical hepatic encephalopathy predicts the development of overt hepatic encephalopathy. Am J Gastroenterol. 2001; 96(9): 2718 - 2723. https://doi.org/10.1111/j.1572-0241.2001.04130.x.
71. Simonetti RG, Perricone G, Robbins HL, Battula NR, Weickert MO, Sutton R, Khan S. Portosystemic shunts versus endoscopic intervention with or without medical treatment for prevention of rebleeding in people with cirrhosis. Cochrane Database Syst Rev. 2020; (10): CD000553. https://doi.org/10.1002/14651858.CD000553.pub3.
72. Sharma P, Sharma BC, Puri V, Sarin SK. Critical flicker frequency: diagnostic tool for minimal hepatic encephalopathy. J Hepatol. 2007; 47(1): 67 - 73. https://doi.org/10.1016/j.jhep.2007.02.022.
73. Bajaj JS. Management options for minimal hepatic encephalopathy. Expert Rev Gastroenterol Hepatol. 2008; 2(6): 785 - 790. https://doi.org/10.1586/17474124.2.6.785.
74. Patidar KR, Bajaj JS. Covert and Overt Hepatic Encephalopathy: Diagnosis and Management. Clin Gastroenterol Hepatol. 2015; 13(12): 2048 - 2061. https://doi.org/10.1016/j.cgh.2015.06.039.
75. Piano S, Singh V, Caraceni P, Maiwall R, Alessandria C, Fernandez J et al. Epidemiology, predictors and outcomes of multi drug resistant (MDR) bacterial infections in patients with cirrhosis across the world. Final results of the "Global study". Dig Liver Dis. 2018; 50(Suppl. 1) 1: 2 - 3. https://doi.org/10.1016/j.dld.2018.01.007.
76. Marciano S, Diaz JM, Dirchwolf M, Gadano A. Spontaneous bacterial peritonitis in patients with cirrhosis: incidence, outcomes, and treatment strategies. Hepat Med. 2019; 11: 13 - 22. https://doi.org/10.2147/HMER.S164250.
77. Tay PWL, Xiao J, Tan DJH, Ng C, Lye YN, et al. An Epidemiological Meta-Analysis on the Worldwide Prevalence, Resistance, and Outcomes of Spontaneous Bacterial Peritonitis in Cirrhosis. Front Med (Lausanne). 2021 Aug 5; 8: 693652. doi: 10.3389/fmed.2021.693652
78. Jalan R, Fernandez J, Wiest R, Schnabl B, Moreau R, Angeli P et al. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013. J Hepatol. 2014; 60(6): 1310 - 1324. https://doi.org/10.1016/j.jhep.2014.01.024.
79. Fasolato S, Angeli P, Dallagnese L, Maresio G, Zola E, Mazza E et al. Renal failure and bacterial infections in patients with cirrhosis: epidemiology and clinical features. Hepatology. 2007; 45(1): 223 - 229. https://doi.org/10.1002/hep.21443.
80. Жаркова МС. Бактериальная транслокация в патогенезе инфекционных осложнений у больных циррозом печени: автореф. дис. ... канд. мед. наук. М., 2012.
81. Dibos M, Mayr U, Triebelhorn J, Schmid RM, Lahmer T. Infektionen und Leberzirrhose. Med Klin Intensivmed Notfmed. 2024; 119(6): 465 - 469. https://doi.org/10.1007/s00063-024-01168-2.
82. Arvaniti V, D'Amico G, Fede G, Manousou P, Tsochatzis E, Pleguezuelo M, Burroughs AK. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology. 2010; 139(4): 1246 - 1256. https://doi.org/10.1053/j.gastro.2010.06.019.
83. Frager SZ, Sigal SH. Editorial: The US burden of HRS-AKI-Putting numbers to the problem. Aliment Pharmacol Ther. 2023; 58(1): 120 - 121. https://doi.org/10.1111/apt.17541.
84. Tuo S, Yeo YH, Chang R, Wen Z, Ran Q, Yang L et al. Prevalence of and associated factors for sarcopenia in patients with liver cirrhosis: A systematic review and meta-analysis. Clin Nutr. 2024; 43(1): 84 - 94. https://doi.org/10.1016/j.clnu.2023.11.008.
85. El Khoury B, Khazaka S, Chalhoub N, Habib FA, Saba L, Sarkis Y et al. Myosteatosis and Frailty Factors associated with the occurrence of Complications in Cirrhotic patients: MYOFACC study. Ann Clin Gastroenterol Hepatol. 2023; 7: 019 - 027. https://doi.org/10.29328/journal.acgh.1001041.
86. Tantai X, Liu Y, Yeo YH, Praktiknjo M, Mauro E, Hamaguchi Y et al. Effect of sarcopenia on survival in patients with cirrhosis: A meta-analysis. J Hepatol. 2022; 76(3): 588 - 599. https://doi.org/10.1016/j.jhep.2021.11.006.
87. Fox R, Stenning K, Slee A, Macnaughtan J, Davies N. Sarcopenia in liver cirrhosis: Prevalence, pathophysiology and therapeutic strategies. Anal Biochem. 2022; 647: 114581. https://doi.org/10.1016/j.ab.2022.114581.
88. Oliver TI, Sharma B, John S. Portal Hypertension. [Updated 2023 Apr 7]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK507718/
89. Манукьян Г.В., Шерцингер А.Г., Жигалова С.Б., Семенова Т.С., Мартиросян Р.А. Первичная профилактика кровотечений из варикозно расширенных вен пищевода и желудка у больных портальной гипертензией, Аналы хирургической гепатологии. 2016; 21(2): 93 - 104; https://doi.org/10.16931/1995-5464.2016293-104.
90. Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 2007; 46(3): 922 - 938. https://doi.org/10.1002/hep.21907.
91. Sarin SK, Lahoti D. Management of gastric varices. Baillieres Clin Gastroenterol. 1992; 6(3): 527 - 548. https://doi.org/10.1016/0950-3528(92) 90037-f.
92. Павлов ЧС, Дамулин ИВ, Ивашкин ВТ. Печеночная энцефалопатия: патогенез, клиника, диагностика, терапия. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016; 26(1): 44 - 53. https://doi.org/10.22416/1382-4376-2016-26-1-44-5.
93. Mandiga P, Kommu S, Bollu PC. Hepatic Encephalopathy. [Updated 2025 Jan 20]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK430869/.
94. Vilstrup H, Amodio P, Bajaj J, Cordoba J, Ferenci P, Mullen KD et al. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology. 2014; 60(2): 715 - 735. https://doi.org/10.1002/hep.27210.
95. Les I, Doval E,  R, Planas M,
R, Planas M,  G,
G,  P et al. Effects of branched-chain amino acids supplementation in patients with cirrhosis and a previous episode of hepatic encephalopathy: a randomized study. Am J Gastroenterol. 2011; 106(6): 1081 - 1088. https://doi.org/10.1038/ajg.2011.9.
P et al. Effects of branched-chain amino acids supplementation in patients with cirrhosis and a previous episode of hepatic encephalopathy: a randomized study. Am J Gastroenterol. 2011; 106(6): 1081 - 1088. https://doi.org/10.1038/ajg.2011.9.
96. Alukal JJ, John S, Thuluvath PJ. Hyponatremia in Cirrhosis: An Update. Am J Gastroenterol. 2020; 115(11): 1775 - 1785. https://doi.org/10.14309/ajg.0000000000000786.
97.  J, Acevedo J, Castro M, Garcia O, de Lope CR, Roca D et al. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study. Hepatology. 2012; 55(5): 1551 - 1561. https://doi.org/10.1002/hep.25532.
J, Acevedo J, Castro M, Garcia O, de Lope CR, Roca D et al. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study. Hepatology. 2012; 55(5): 1551 - 1561. https://doi.org/10.1002/hep.25532.
98. Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012; 18(3): 268 - 281. https://doi.org/10.1111/j.1469-0691.2011.03570.x.
99. Soriano G, Castellote J, Alvarez C, Girbau A, Gordillo J, Baliellas C et al. Secondary bacterial peritonitis in cirrhosis: a retrospective study of clinical and analytical characteristics, diagnosis and management. J Hepatol. 2010; 52(1): 39 - 44. https://doi.org/10.1016/j.jhep.2009.10.012.
100. Chen CH, Shih CM, Chou JW, Liu YH, Hang LW, Hsia TC et al. Outcome predictors of cirrhotic patients with spontaneous bacterial empyema. Liver Int. 2011; 31(3): 417 - 424. https://doi.org/10.1111/j.1478-3231.2010.02447.x.
101. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024; 105(4S): S117-S314. https://doi.org/10.1016/j.kint.2023.10.018.
102. Flamm SL, Wong F, Ahn J, Kamath PS. AGA Clinical Practice Update on the Evaluation and Management of Acute Kidney Injury in Patients With Cirrhosis: Expert Review. Clin Gastroenterol Hepatol. 2022; 20(12): 2707 - 2716. https://doi.org/10.1016/j.cgh.2022.08.033.
103. Patidar KR, Belcher JM, Regner KR, St Hillien SA, Simonetto DA, Asrani SK et al. Incidence and outcomes of acute kidney injury including hepatorenal syndrome in hospitalized patients with cirrhosis in the US. J Hepatol. 2023; 79(6): 1408 - 1417. https://doi.org/10.1016/j.jhep.2023.07.010.
104. Regner KR, Kanduri SR, Velez JCQ. Management of AKI in Patients with Cirrhosis. Curr Treat Options Gastro. 2022; (20): 295 - 315. https://doi.org/10.1007/s11938-022-00398-7.
105. Маевская МВ, Надинская МЮ, Бессонова ЕН, Гейвандова НИ, Жаркова МС, Киценко ЕА и др. Коррекция тромбоцитопении у пациентов с циррозом печени перед плановыми хирургическими вмешательствами/инвазивными процедурами (соглашение специалистов). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2024; 34(3): 115 - 134. https://doi.org/10.22416/1382-4376-2024-1032-2784.
106. Ивашкин В.Т. Пропедевтика внутренних болезней: учебник. 2-е изд. М.: ГЭОТАР-Медиа, 2023. 936 с.
107. Bernardi M, Trevisani F, Gasbarrini A, Gasbarrini G. Hepatorenal disorders: role of the renin-angiotensin-aldosterone system. Semin Liver Dis. 1994; 14(1): 23 - 34.
108. Borgonovo A, Baldin C, Maggi DC, Victor L, Bansho ETO, Piedade J, et al. Systemic Inflammatory Response Syndrome in Patients Hospitalized for Acute Decompensation of Cirrhosis. Can J Gastroenterol Hepatol. 2021: 5581587. https://doi.org/10.1155/2021/5581587.
109. Neuberger J, Patel J, Caldwell H, Davies S, Hebditch V, Hollywood C et al. Guidelines on the use of liver biopsy in clinical practice from the British Society of Gastroenterology, the Royal College of Radiologists and the Royal College of Pathology. Gut. 2020; 69(8): 1382 - 1403. https://doi.org/10.1136/gutjnl-2020-321299.
110. Chowdhury AB, Mehta KJ. Liver biopsy for assessment of chronic liver diseases: a synopsis. Clin Exp Med. 2023; 23(2): 273 - 285. https://doi.org/10.1007/s10238-022-00799-z.
111. Amarapurkar D, Amarapurkar A. Indications of Liver Biopsy in the Era of Noninvasive Assessment of Liver Fibrosis. J Clin Exp Hepatol. 2015; 5(4): 314 - 319. https://doi.org/10.1016/j.jceh.2015.08.005.
112. Tandon P, Low G, Mourtzakis M, Zenith L, Myers RP, Abraldes JG et al. A Model to Identify Sarcopenia in Patients With Cirrhosis. Clin Gastroenterol Hepatol. 2016; 14(10): 1473 - 1480.e3. https://doi.org/10.1016/j.cgh.2016.04.040.
113. Островская АС, Маевская МВ. Саркопения и мальнутриция у пациентов с заболеваниями печени. Медицинский совет. 2023; (18): 35 - 42. https://doi.org/10.21518/ms2023-374.
114. Bloom S, Kemp W, Lubel J. Portal hypertension: pathophysiology, diagnosis and management. Intern Med J. 2015; 45(1): 16 - 26. https://doi.org/10.1111/imj.12590.
115. Abd-Elsalam S, Habba E, Elkhalawany W, Tawfeek S, Elbatea H, El-Kalla F et al. Correlation of platelets count with endoscopic findings in a cohort of Egyptian patients with liver cirrhosis. Medicine (Baltimore). 2016; 95(23): e3853. https://doi.org/10.1097/MD.0000000000003853.
116. Moreau R, Jalan R, Gines P, Pavesi M, Angeli P, Cordoba J et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology. 2013; 144(7): 1426 - 1437. https://doi.org/10.1053/j.gastro.2013.02.042.
117. Rios R, Sangro B, Herrero I, Quiroga J, Prieto J. The role of thrombopoietin in the thrombocytopenia of patients with liver cirrhosis. Am J Gastroenterol. 2005; 100(6): 1311 - 1316. https://doi.org/10.1111/j.1572-0241.2005.41543.x.
118. Sharma SK, Aggarwal R. Prediction of large esophageal varices in patients with cirrhosis of the liver using clinical, laboratory and imaging parameters. J Gastroenterol Hepatol. 2007; 22(11): 1909 - 1915. https://doi.org/10.1111/j.1440-1746.2006.04501.x.
119. Lammers WJ, van Buuren HR, Hirschfield GM, Janssen HL, Invernizzi P, Mason AL et al. Levels of alkaline phosphatase and bilirubin are surrogate end points of outcomes of patients with primary biliary cirrhosis: an international follow-up study. Gastroenterology. 2014; 147(6): 1338 - 1349.e5. https://doi.org/10.1053/j.gastro.2014.08.029.
120. Lee HA, Jung JY, Lee YS, Jung YK, Kim JH, An H et al. Direct Bilirubin Is More Valuable than Total Bilirubin for Predicting Prognosis in Patients with Liver Cirrhosis. Gut Liver. 2021; 15(4): 599 - 605. https://doi.org/10.5009/gnl20171.
121. Poynard T, Zourabichvili O, Hilpert G, Naveau S, Poitrine A, Benatar C, Chaput JC. Prognostic value of total serum bilirubin/gamma-glutamyl transpeptidase ratio in cirrhotic patients. Hepatology. 1984; 4(2): 324 - 327. https://doi.org/10.1002/hep.1840040224.
122. Agustanti N, Djumhana A, Abdurachman SA, Soetodjo NMN. Correlation between Serum Albumin and Fasting Blood Glucose Level in Patients with Liver Cirrhosis. The Indonesian Journal of Gastroenterology, Hepatology, and Digestive Endoscopy. 2014; 15(3): 143 - 146. https://doi.org/10.24871/1532014143-146.
123. Mammen EF. Coagulation abnormalities in liver disease. Hematol Oncol Clin North Am. 1992; 6(6): 1247 - 1257. https://doi.org/10.1016/S0889-8588(18)30273-9.
124. Bischoff SC, Bernal W, Dasarathy S, Merli M, Plank LD, ![]() T, Plauth M. ESPEN practical guideline: Clinical nutrition in liver disease. Clin Nutr. 2020; 39(12): 3533 - 3562. https://doi.org/10.1016/j.clnu.2020.09.001.
T, Plauth M. ESPEN practical guideline: Clinical nutrition in liver disease. Clin Nutr. 2020; 39(12): 3533 - 3562. https://doi.org/10.1016/j.clnu.2020.09.001.
125. Castera L, Pauwels A, ![]() VG. Indicateurs pronostiques chez les malades atteints de cirrhose admis en service de
VG. Indicateurs pronostiques chez les malades atteints de cirrhose admis en service de  . Gastroenterol Clin Biol. 1996; 20(3): 263 - 268.
. Gastroenterol Clin Biol. 1996; 20(3): 263 - 268.
126. Violi F, Ferro D, Basili S, Saliola M, Quintarelli C, Alessandri C, Cordova C. Association between low-grade disseminated intravascular coagulation and endotoxemia in patients with liver cirrhosis. Gastroenterology. 1995; 109(2): 531 - 539. https://doi.org/10.1016/0016-5085(95)90342-9.
127. Ariza X, ![]() E, Elia C, Barreto R, Moreira R, Morales-Ruiz M et al. Analysis of a urinary biomarker panel for clinical outcomes assessment in cirrhosis. PLoS ONE. 2015; 10(6): e0128145. https://doi.org/10.1371/journal.pone.0128145.
E, Elia C, Barreto R, Moreira R, Morales-Ruiz M et al. Analysis of a urinary biomarker panel for clinical outcomes assessment in cirrhosis. PLoS ONE. 2015; 10(6): e0128145. https://doi.org/10.1371/journal.pone.0128145.
128. Cullaro G, Kanduri SR, Velez JCQ. Acute Kidney Injury in Patients with Liver Disease. Clin J Am Soc Nephrol. 2022; 17(11): 1674 - 1684. https://doi.org/10.2215/CJN.03040322.
129. Han D, Wang R, Yu Y, Yang S, Mueller S, Romeiro F et al. Impact of elevated urine leukocyte and bacteria count per high-power field on the in-hospital outcome of patients with liver cirrhosis. J Public Health Emerg. 2017; 1(8). https://doi.org/10.21037/jphe.2017.08.02.
130. Trifan A, Stoica O, Stanciu C, Cojocariu C, Singeap AM, Girleanu I, Miftode E. Clostridium difficile infection in patients with liver disease: a review. Eur J Clin Microbiol Infect Dis. 2015; 34(12): 2313 - 2324. https://doi.org/10.1007/s10096-015-2501-z.
131. Jeong JH, Park IS, Kim DH, Kim SC, Kang C, Lee SH et al. CLIF-SOFA score and SIRS are independent prognostic factors in patients with hepatic encephalopathy due to alcoholic liver cirrhosis. Medicine (Baltimore). 2016; 95(26): e3935. https://doi.org/10.1097/MD.0000000000003935.
132. Huang LL, Xia HH, Zhu SL. Ascitic Fluid Analysis in the Differential Diagnosis of Ascites: Focus on Cirrhotic Ascites. J Clin Transl Hepatol. 2014; 2(1): 58 - 64. https://doi.org/10.14218/JCTH.2013.00010.
133. Moore KP, Wong F, Gines P, Bernardi M, Ochs A, Salerno F et al. The management of ascites in cirrhosis: report on the consensus conference of the International Ascites Club. Hepatology. 2003; 38(1): 258 - 266. https://doi.org/10.1053/jhep.2003.50315.
134. Bruns T, Lutz P, Stallmach A, Nischalke HD. Low ascitic fluid protein does not indicate an increased risk for spontaneous bacterial peritonitis in current cohorts. J Hepatol. 2015; 63(2): 527 - 528. https://doi.org/10.1016/j.jhep.2015.03.040.
135. Runyon BA, Montano AA, Akriviadis EA, Antillon MR, Irving MA, McHutchison JG. The serum-ascites albumin gradient is superior to the exudate-transudate concept in the differential diagnosis of ascites. Ann Intern Med. 1992; 117(3): 215 - 220. https://doi.org/10.7326/0003-4819-117-3-215.
136. Gerbes AL, ![]() D, Xie YN, Permanetter W, Paumgartner G. Ascitic fluid analysis for the differentiation of malignancy-related and nonmalignant ascites. Proposal of a diagnostic sequence. Cancer. 1991; 68(8): 1808 - 1814. https://doi.org/10.1002/1097-0142(19911015) 68: 8<1808:: aid-cncr2820680827>3.0.co; 2 - 6.
D, Xie YN, Permanetter W, Paumgartner G. Ascitic fluid analysis for the differentiation of malignancy-related and nonmalignant ascites. Proposal of a diagnostic sequence. Cancer. 1991; 68(8): 1808 - 1814. https://doi.org/10.1002/1097-0142(19911015) 68: 8<1808:: aid-cncr2820680827>3.0.co; 2 - 6.
137. McGibbon A, Chen GI, Peltekian KM, van Zanten SV. An evidence-based manual for abdominal paracentesis. Dig Dis Sci. 2007; 52(12): 3307 - 3315. https://doi.org/10.1007/s10620-007-9805-5.
138. Kimer N, Krag A, Moller S, Bendtsen F, Gluud LL. Systematic review with meta-analysis: the effects of rifaximin in hepatic encephalopathy. Aliment Pharmacol Ther. 2014; 40(2): 123 - 132. https://doi.org/10.1111/apt.12803.
139. Badal J, Badal B, Nawras M, Lee-Smith W, Stanley S, Hassan M, Ahmed Z. Diagnostic Paracentesis Within 1 Day Is Associated With Reduced Mortality and Length of Hospital Stay in Patients with Cirrhosis and Ascites. Dig Dis Sci. 2024; 69(4): 1454 - 1466. https://doi.org/10.1007/s10620-023-08249-w.
140. Mostafa MS, El-Seidi EA, Kassem AM, Shemis MA, Saber M, Michael MN. Detection of ascitic fluid infections in patients with liver cirrhosis and ascites. Arab J Gastroenterol. 2011; 12(1): 20 - 24. https://doi.org/10.1016/j.ajg.2011.01.004.
141. ![]() L, Rimola A,
L, Rimola A, ![]() P, Llach J, Arroyo V,
P, Llach J, Arroyo V, ![]() J. Recurrence of spontaneous bacterial peritonitis in cirrhosis: frequency and predictive factors. Hepatology. 1988; 8(1): 27 - 31. https://doi.org/10.1002/hep.1840080107.
J. Recurrence of spontaneous bacterial peritonitis in cirrhosis: frequency and predictive factors. Hepatology. 1988; 8(1): 27 - 31. https://doi.org/10.1002/hep.1840080107.
142. Kudo M, Zheng RQ, Kim SR, Okabe Y, Osaki Y, Iijima H et al. Diagnostic accuracy of imaging for liver cirrhosis compared to histologically proven liver cirrhosis. A multicenter collaborative study. Intervirology. 2008; 51(Suppl. 1): 17 - 26. https://doi.org/10.1159/000122595.
143. Primignani M, Carpinelli L, Preatoni P, Battaglia G, Carta A, Prada A et al. Natural history of portal hypertensive gastropathy in patients with liver cirrhosis. The New Italian Endoscopic Club for the study and treatment of esophageal varices (NIEC). Gastroenterology. 2000; 119(1): 181 - 187. https://doi.org/10.1053/gast.2000.8555.
144. Toma L, Stanciu AM, Zgura A, Bacalbasa N, Diaconu C, Iliescu L. Electrocardiographic Changes in Liver Cirrhosis-Clues for Cirrhotic Cardiomyopathy. Medicina (Kaunas). 2020; 56(2): 68. https://doi.org/10.3390/medicina56020068.
145. Al Hamoudi W, Lee SS. Cirrhotic cardiomyopathy. Ann Hepatol. 2006; 5(3): 132 - 139. https://doi.org/10.1016/S1665-2681(19)31996-9.
146. Lentine KL, Costa SP, Weir MR, Robb JF, Fleisher LA, Kasiske BL et al. Cardiac disease evaluation and management among kidney and liver transplantation candidates: a scientific statement from the American Heart Association and the American College of Cardiology Foundation: endorsed by the American Society of Transplant Surgeons, American Society of Transplantation, and National Kidney Foundation. Circulation. 2012; 126(5): 617 - 663. https://doi.org/10.1161/CIR.0b013e31823eb07a.
147. Merli M, Nicolini G, Angeloni S, Rinaldi V, De Santis A, Merkel C et al. Incidence and natural history of small esophageal varices in cirrhotic patients. J Hepatol. 2003; 38(3): 266 - 272. https://doi.org/10.1016/s0168-8278(02)00420-8.
148. Kaplan DE, Ripoll C, Thiele M, Fortune BE, Simonetto DA, Garcia-Tsao G, Bosch J. AASLD Practice Guidance on risk stratification and management of portal hypertension and varices in cirrhosis. Hepatology. 2024; 79(5): 1180 - 1211. https://doi.org/10.1097/HEP.0000000000000647.
149. Chen PH, Chen WC, Hou MC, Liu TT, Chang CJ, Liao WC et al. Delayed endoscopy increases re-bleeding and mortality in patients with hematemesis and active esophageal variceal bleeding: a cohort study. J Hepatol. 2012; 57(6): 1207 - 1213. https://doi.org/10.1016/j.jhep.2012.07.038.
150. Bai Z, Wang R, Cheng G, Ma D, Ibrahim M, Chawla S, Qi X. Outcomes of early versus delayed endoscopy in cirrhotic patients with acute variceal bleeding: a systematic review with meta-analysis. Eur J Gastroenterol Hepatol. 2021; 33(Suppl. 1): e868 - e876. https://doi.org/10.1097/MEG.0000000000002282.
151. Lee YJ, Lee JM, Lee JS, Lee HY, Park BH, Kim YH et al. Hepatocellular carcinoma: diagnostic performance of multidetector CT and MR imaging-a systematic review and meta-analysis. Radiology. 2015; 275(1): 97 - 109. https://doi.org/10.1148/radiol.14140690.
152. Абдурахманов ДТ, Алиева СБ, Балахнин ПВ, Базин ИС, Болотина ЛВ, Бредер ВВ и др. Рак печени (гепатоцеллюлярный): клинические рекомендации. М., 2022. Режим доступа: https://cr.minzdrav.gov.ru/preview-cr/1_3.
153. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, Boirie Y, Cederholm T, Landi F et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010; 39(4): 412 - 423. https://doi.org/10.1093/ageing/afq034.
154. Lai JC, Tandon P, Bernal W, Tapper EB, Ekong U, Dasarathy S, Carey EJ. Malnutrition, Frailty, and Sarcopenia in Patients With Cirrhosis: 2021 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2021; 74(3): 1611 - 1644. https://doi.org/10.1002/hep.32049.
155. Lee CM, Kang BK, Kim M. Radiologic Definition of Sarcopenia in Chronic Liver Disease. Life(Basel). 2021; 11(2): 86. https://doi.org/10.3390/life11020086.
156. Beer L, Bastati N, Ba-Ssalamah A,  S, Lampichler K, Bican Y et al. MRI-defined sarcopenia predicts mortality in patients with chronic liver disease. Liver Int. 2020; 40(11): 2797 - 2807. https://doi.org/10.1111/liv.14648.
S, Lampichler K, Bican Y et al. MRI-defined sarcopenia predicts mortality in patients with chronic liver disease. Liver Int. 2020; 40(11): 2797 - 2807. https://doi.org/10.1111/liv.14648.
157. Fischer MA, Pfirrmann CW, Espinosa N, Raptis DA, Buck FM. Dixon-based MRI for assessment of muscle-fat content in phantoms, healthy volunteers and patients with achillodynia: comparison to visual assessment of calf muscle quality. Eur Radiol. 2014; 24(6): 1366 - 1375. https://doi.org/10.1007/s00330-014-3121-1.
158. Nakamura A, Yoshimura T, Sato T, Ichikawa T. Diagnosis and Pathogenesis of Sarcopenia in Chronic Liver Disease Using Liver Magnetic Resonance Imaging. Cureus. 2022; 14(5): e24676. https://doi.org/10.7759/cureus.24676.
159. Khan AI, Reiter DA, Sekhar A, Sharma P, Safdar NM, Patil DH et al. MRI quantitation of abdominal skeletal muscle correlates with CT-based analysis: implications for sarcopenia measurement. Appl Physiol Nutr Metab. 2019; 44(8): 814 - 819. https://doi.org/10.1139/apnm-2018-0473.
160. Faron A, Sprinkart AM, Kuetting DLR, Feisst A, Isaak A, Endler C et al. Body composition analysis using CT and MRI: intra-inpidual intermodal comparison of muscle mass and myosteatosis. Sci Rep. 2020; 10(1): 11765. https://doi.org/10.1038/s41598-020-68797-3.
161. Elkrief L, Hernandez-Gea V, Senzolo M, Albillos A, Baiges A, Berzigotti A et al. Portal vein thrombosis: diagnosis, management, and endpoints for future clinical studies. Lancet Gastroenterol Hepatol. 2024; 9(9): 859 - 883. https://doi.org/10.1016/S2468-1253(24)00155-9.
162. DeLeve LD, Valla DC, Garcia-Tsao G; American Association for the Study Liver Diseases. Vascular disorders of the liver. Hepatology. 2009; 49(5): 1729 - 1764. https://doi.org/10.1002/hep.22772.
163. Friedrich-Rust M, Klopffleisch T, Nierhoff J, Herrmann E, Vermehren J, Schneider MD et al. Contrast-Enhanced Ultrasound for the differentiation of benign and malignant focal liver lesions: a meta-analysis. Liver Int. 2013; 33(5): 739 - 755. https://doi.org/10.1111/liv.12115.
164. Terzi E, Iavarone M, Pompili M, Veronese L, Cabibbo G, Fraquelli M et al. Contrast ultrasound LI-RADS LR-5 identifies hepatocellular carcinoma in cirrhosis in a multicenter restropective study of 1,006 nodules. J Hepatol. 2018; 68(3): 485 - 492. https://doi.org/10.1016/j.jhep.2017.11.007.
165. Li S, Zhou L, Chen R, Chen Y, Niu Z, Qian L et al. Diagnostic efficacy of contrast-enhanced ultrasound versus MRI Liver Imaging Reporting and Data System(LI-RADS) for categorising hepatic observations in patients at risk of hepatocellular carcinoma. Clin Radiol. 2021; 76(2): 161.e1 - 161.e10. https://doi.org/10.1016/j.crad.2020.10.009.
166. Zhou H, Zhang C, Du L, Jiang J, Zhao Q, Sun J et al. Contrast-Enhanced Ultrasound Liver Imaging Reporting and Data System in Diagnosing Hepatocellular Carcinoma: Diagnostic Performance and Interobserver Agreement. Ultraschall Med. 2022; 43(1): 64 - 71. https://doi.org/10.1055/a-1168-6321.
167. Bartolotta TV, Taibbi A, Midiri M, Lagalla R. Contrast-enhanced ultrasound of hepatocellular carcinoma: where do we stand? Ultrasonography. 2019; 38(3): 200 - 214. https://doi.org/10.14366/usg.18060.
168. Boozari B, Soudah B, Rifai K, Schneidewind S, Vogel A, Hecker H et al. Grading of hypervascular hepatocellular carcinoma using late phase of contrast enhanced sonography - a prospective study. Dig Liver Dis. 2011; 43(6): 484 - 490. https://doi.org/10.1016/j.dld.2011.01.001.
169. Mounach A, Ouzzif Z, Wariaghli G, Achemlal L, Benbaghdadi I, Aouragh A et al. Primary biliary cirrhosis and osteoporosis: a case-control study. J Bone Miner Metab. 2008; 26(4): 379 - 384. https://doi.org/10.1007/s00774-007-0833-1.
170. Nakchbandi IA, van der Merwe SW. Current understanding of osteoporosis associated with liver disease. Nat Rev Gastroenterol Hepatol. 2009; 6(11): 660 - 670. https://doi.org/10.1038/nrgastro.2009.166.
171.  G, Lucendo AJ,
G, Lucendo AJ,  S, Tenias JM. Hepatic osteodystrophy: An important matter for consideration in chronic liver disease. World J Hepatol. 2011; 3(12): 300 - 307. https://doi.org/10.4254/wjh.v3.i12.300.
S, Tenias JM. Hepatic osteodystrophy: An important matter for consideration in chronic liver disease. World J Hepatol. 2011; 3(12): 300 - 307. https://doi.org/10.4254/wjh.v3.i12.300.
172. Guichelaar MM, Kendall R, Malinchoc M, Hay JE. Bone mineral density before and after OLT: long-term follow-up and predictive factors. Liver Transpl. 2006; 12(9): 1390 - 1402. https://doi.org/10.1002/lt.20874.
173. Collier JD, Ninkovic M, Compston JE. Guidelines on the management of osteoporosis associated with chronic liver disease. Gut. 2002; 50(Suppl. 1): i1 - 9. https://doi.org/10.1136/gut.50.suppl_1.i1.
174.  N,
N, ![]() A. Liver and bone. Arch Biochem Biophys. 2010; 503(1): 84 - 94. https://doi.org/10.1016/j.abb.2010.05.030.
A. Liver and bone. Arch Biochem Biophys. 2010; 503(1): 84 - 94. https://doi.org/10.1016/j.abb.2010.05.030.
175. Monegal A, Navasa M, Peris P, Colmenero J, Cuervo A, ![]() A et al. Bone disease in patients awaiting liver transplantation. Has the situation improved in the last two decades? Calcif Tissue Int. 2013; 93(6): 571 - 576. https://doi.org/10.1007/s00223-013-9797-4.
A et al. Bone disease in patients awaiting liver transplantation. Has the situation improved in the last two decades? Calcif Tissue Int. 2013; 93(6): 571 - 576. https://doi.org/10.1007/s00223-013-9797-4.
176. Pisarek W. Minimal hepatic encephalopathy - diagnosis and treatment. Prz Gastroenterol. 2021; 16(4): 311 - 317. doi: 10.5114/pg.2021.111389.
177. Campagna F, Montagnese S, Ridola L, Senzolo M, Schiff S, De Rui M et al. The animal naming test: An easy tool for the assessment of hepatic encephalopathy. Hepatology. 2017; 66(1): 198 - 208. https://doi.org/10.1002/hep.29146.
178. Bernardi M, Laffi G, Salvagnini M, Azzena G, Bonato S, Marra F et al. Efficacy and safety of the stepped care medical treatment of ascites in liver cirrhosis: a randomized controlled clinical trial comparing two diets with different sodium content. Liver. 1993; 13(3): 156 - 162. https://doi.org/10.1111/j.1600-0676.1993.tb00624.x.
179. Wang QM, Ji Q, Duan ZJ, Zhang M, Chang QY. A study on the position and etiology of infection in cirrhotic patients: A potential precipitating factor contributing to hepatic encephalopathy. Exp Ther Med. 2013; 6(2): 584 - 590. https://doi.org/10.3892/etm.2013.1137.
180. Olde Damink SW, Dejong CH, Deutz NE, van Berlo CL, Soeters PB. Upper gastrointestinal bleeding: an ammoniagenic and catabolic event due to the total absence of isoleucine in the haemoglobin molecule. Med Hypotheses. 1999; 52(6): 515 - 519. https://doi.org/10.1054/mehy.1998.0026.
181.  M. Role of phosphate-activated glutaminase in the pathogenesis of hepatic encephalopathy. Metab Brain Dis. 2005; 20(4): 319 - 325. https://doi.org/10.1007/s11011-005-7913-5.
M. Role of phosphate-activated glutaminase in the pathogenesis of hepatic encephalopathy. Metab Brain Dis. 2005; 20(4): 319 - 325. https://doi.org/10.1007/s11011-005-7913-5.
182. Younas A, Riaz J, Chughtai T, Maqsood H, Saim M, Qazi S et al. Hyponatremia and Its Correlation With Hepatic Encephalopathy and Severity of Liver Disease. Cureus. 2021; 13(2): e13175. https://doi.org/10.7759/cureus.13175.
183. Gaduputi V, Chandrala C, Abbas N, Tariq H, Chilimuri S, Balar B. Prognostic significance of hypokalemia in hepatic encephalopathy. Hepatogastroenterology. 2014; 61(133): 1170 - 1174.
184. Ali MH, Kabir MA, Islam MS, Rahim CM, Hasan MK, Islam MK et al. Study on Precipitating Factor of Chronic Hepatic Encephalopathy. Mymensingh Med J. 2020; 29(4): 800 - 806.
185. Nardelli S, Lattanzi B, Merli M, Farcomeni A, Gioia S, Ridola L, Riggio O. Muscle Alterations Are Associated With Minimal and Overt Hepatic Encephalopathy in Patients With Liver Cirrhosis. Hepatology. 2019; 70(5): 1704 - 1713. https://doi.org/10.1002/hep.30692.
186. Schindler P, Heinzow H, Trebicka J, Wildgruber M. Shunt-Induced Hepatic Encephalopathy in TIPS: Current Approaches and Clinical Challenges. J Clin Med. 2020; 9(11): 3784. https://doi.org/10.3390/jcm9113784.
187. Gnanadeepam S, Janeela AM, Zachariah U, Eapen CE, Goel A. Sarcopenia is Closely Associated With Frailty in Decompensated Cirrhosis. J Clin Exp Hepatol. 2022; 12(1): 237 - 238. https://doi.org/10.1016/j.jceh.2021.09.021.
188. Гавриленко ДИ, Гавриленко ТЕ, Родина ЕВ. Нарушения питания при хронических заболеваниях печени. Часть 2. Оценка саркопении и коррекция нарушений питания. Вестник Витебского государственного медицинского университета. 2023; 22(2): 27 - 34. Режим доступа: https://elib.vsmu.by/handle/123/24831.
189. Gort-van Dijk D, Weerink LBM, Milovanovic M, Haveman JW, Hemmer PHJ, Dijkstra G et al. Bioelectrical Impedance Analysis and Mid-Upper Arm Muscle Circumference Can Be Used to Detect Low Muscle Mass in Clinical Practice. Nutrients. 2021; 13(7): 2350. https://doi.org/10.3390/nu13072350.
190. Bozic D, Grgurevic I, Mamic B, Capkun V, Bilandzic-Ivisic J, Ivanovic T et al. Detection of Sarcopenia in Patients with Liver Cirrhosis Using the Bioelectrical Impedance Analysis. Nutrients. 2023; 15(15): 3335. https://doi.org/10.3390/nu15153335.
191. Lindqvist C, Brismar TB, Majeed A, Wahlin S. Assessment of muscle mass depletion in chronic liver disease: Dual-energy x-ray absorptiometry compared with computed tomography. Nutrition. 2019; 61: 93 - 98. https://doi.org/10.1016/j.nut.2018.10.031.
192. Kallwitz ER. Sarcopenia and liver transplant: The relevance of too little muscle mass. World J Gastroenterol. 2015; 21(39): 10982 - 10993. https://doi.org/10.3748/wjg.v21.i39.10982.
193. Voulgaridou G, Tyrovolas S, Detopoulou P, Tsoumana D, Drakaki M, Apostolou T et al. Diagnostic Criteria and Measurement Techniques of Sarcopenia: A Critical Evaluation of the Up-to-Date Evidence. Nutrients. 2024; 16(3): 436. https://doi.org/10.3390/nu16030436.
194. Капустина АВ, Шальнова СА, Куценко ВА, Концевая АВ, Свинин ГЕ, Муромцева ГА и др. Оценка мышечной силы с помощью кистевой динамометрии в российской популяции среднего и пожилого возраста и ее ассоциации с показателями здоровья. Кардиоваскулярная терапия и профилактика. 2023; 22(8S): 3792. https://doi.org/10.15829/1728-8800-2023-3792.
195. Островская АС, Маевская МВ, Лобан КМ, Жаркова МС, Шапка МП, Надинская МЮ и др. Скелетно-мышечный индекс верхних конечностей для диагностики саркопении при циррозе печени. Медицинский совет. 2024; (15): 126 - 134. https://doi.org/10.21518/ms2024-382.
196. Belarmino G, Gonzalez MC, Sala P, Torrinhas RS, Andraus W, D'Albuquerque LAC et al. Diagnosing Sarcopenia in Male Patients With Cirrhosis by Dual-Energy X-Ray Absorptiometry Estimates of Appendicular Skeletal Muscle Mass. JPEN J Parenter Enteral Nutr. 2018; 42(1): 24 - 36. https://doi.org/10.1177/0148607117701400.
197. Belarmino G, Torrinhas RS,  NV, Heymsfield SB, Waitzberg DL. New anthropometric and biochemical models for estimating appendicular skeletal muscle mass in male patients with cirrhosis. Nutrition. 2021; 84: 111083. https://doi.org/10.1016/j.nut.2020.111083.
NV, Heymsfield SB, Waitzberg DL. New anthropometric and biochemical models for estimating appendicular skeletal muscle mass in male patients with cirrhosis. Nutrition. 2021; 84: 111083. https://doi.org/10.1016/j.nut.2020.111083.
198. Sinclair M, Hoermann R, Peterson A, Testro A, Angus PW, Hey P et al. Use of Dual X-ray Absorptiometry in men with advanced cirrhosis to predict sarcopenia-associated mortality risk. Liver Int. 2019; 39(6): 1089 - 1097. https://doi.org/10.1111/liv.14071.
199. Eriksen CS, Kimer N, Suetta C, ![]() S. Arm lean mass determined by dual-energy X-ray absorptiometry is superior to characterize skeletal muscle and predict sarcopenia-related mortality in cirrhosis. Am J Physiol Gastrointest Liver Physiol. 2021; 320(5): G729 - G740. https://doi.org/10.1152/ajpgi.00478.2020.
S. Arm lean mass determined by dual-energy X-ray absorptiometry is superior to characterize skeletal muscle and predict sarcopenia-related mortality in cirrhosis. Am J Physiol Gastrointest Liver Physiol. 2021; 320(5): G729 - G740. https://doi.org/10.1152/ajpgi.00478.2020.
200. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis - 2021 update. J Hepatol. 2021; 75(3): 659 - 689. https://doi.org/10.1016/j.jhep.2021.05.025.
201. Fernandes FF, Filho ECC,  RA, Silva LM, Terra C, Pereira G et al. Baveno's VI non-invasive approach for primary prophylaxis of variceal bleeding: Can spleen stiffness help? Hepatology. 2015; 62(S1): 251A - 254A.
RA, Silva LM, Terra C, Pereira G et al. Baveno's VI non-invasive approach for primary prophylaxis of variceal bleeding: Can spleen stiffness help? Hepatology. 2015; 62(S1): 251A - 254A.
202. Colecchia A, Ravaioli F, Marasco G, Colli A, Dajti E, Di Biase AR et al. A combined model based on spleen stiffness measurement and Baveno VI criteria to rule out high-risk varices in advanced chronic liver disease. J Hepatol. 2018; 69(2): 308 - 317. https://doi.org/10.1016/j.jhep.2018.04.023.
203. Traub J, Reiss L, Aliwa B, Stadlbauer V. Malnutrition in Patients with Liver Cirrhosis. Nutrients. 2021; 13(2): 540. https://doi.org/10.3390/nu13020540.
204. Yin Y, Li Y, Shao L, Yuan S, Liu B, Lin S et al. Effect of Body Mass Index on the Prognosis of Liver Cirrhosis. Front Nutr. 2021; 8: 700132. https://doi.org/10.3389/fnut.2021.700132.
205. Mendez-Guerrero O, Carranza-Carrasco A, Chi-Cervera LA, Torre A, Navarro-Alvarez N. Optimizing nutrition in hepatic cirrhosis: A comprehensive assessment and care approach. World J Gastroenterol. 2024; 30(10): 1313 - 1328. https://doi.org/10.3748/wjg.v30.i10.1313.
206. Elsebaie EM, Abdel-Fattah AN, Bakr NA, Attalah KM, Aweas AHA. Principles of Nutritional Management in Patients with Liver Dysfunction - A Narrative Review. Livers. 2023; 3(2): 190 - 218. https://doi.org/10.3390/livers3020013.
207. Merli M. Nutrition in cirrhosis: Dos and Don'ts. J Hepatol. 2020; 73(6): 1563 - 1565. https://doi.org/10.1016/j.jhep.2020.07.019.
208. Canillas L, Pelegrina A,  J,
J,  E, Salar A, Aguilera L et al. Clinical Guideline on Perioperative Management of Patients with Advanced Chronic Liver Disease. Life (Basel). 2023; 13(1): 132. https://doi.org/10.3390/life13010132.
E, Salar A, Aguilera L et al. Clinical Guideline on Perioperative Management of Patients with Advanced Chronic Liver Disease. Life (Basel). 2023; 13(1): 132. https://doi.org/10.3390/life13010132.
209. Hasse JM, DiCecco SR. Enteral Nutrition in Chronic Liver Disease: Translating Evidence Into Practice. Nutr Clin Pract. 2015; 30(4): 474 - 487. https://doi.org/10.1177/0884533615591058.
210. Daftari G, Tehrani AN, Pashayee-Khamene F, Karimi S, Ahmadzadeh S, Hekmatdoost A et al. Dietary protein intake and mortality among survivors of liver cirrhosis: a prospective cohort study. BMC Gastroenterol. 2023; 23(1): 227. https://doi.org/10.1186/s12876-023-02832-1.
211. Eghtesad S, Poustchi H, Malekzadeh R. Malnutrition in liver cirrhosis: the influence of protein and sodium. Middle East J Dig Dis. 2013; 5(2): 65 - 75.
212. Griffin JWD, Bradshaw PC. Effects of a high protein diet and liver disease in an in silico model of human ammonia metabolism. Theor Biol Med Model. 2019; 16(1): 11. https://doi.org/10.1186/s12976-019-0109-1.
213. Cheung K, Lee SS, Raman M. Prevalence and mechanisms of malnutrition in patients with advanced liver disease, and nutrition management strategies. Clin Gastroenterol Hepatol. 2012; 10(2): 117 - 125. https://doi.org/10.1016/j.cgh.2011.08.016.
214. Hanai T, Shiraki M, Imai K, Suetsugu A, Takai K, Shimizu M. Late Evening Snack with Branched-Chain Amino Acids Supplementation Improves Survival in Patients with Cirrhosis. J Clin Med. 2020; 9(4): 1013. https://doi.org/10.3390/jcm9041013.
215. Leoni L, Valoriani F, Barbieri R, Pambianco M, Vinciguerra M, Sicuro C et al. Unlocking the Power of Late-Evening Snacks: Practical Ready-to-Prescribe Chart Menu for Patients with Cirrhosis. Nutrients. 2023; 15(15): 3471. https://doi.org/10.3390/nu15153471.
216. Gluud LL, Dam G, Les I, Marchesini G, Borre M, Aagaard NK, Vilstrup H. Branched-chain amino acids for people with hepatic encephalopathy. Cochrane Database Syst Rev. 2017; 5(5): CD001939. https://doi.org/10.1002/14651858.CD001939.pub4.
217. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol. 2019; 70(1): 172 - 193. https://doi.org/10.1016/j.jhep.2018.06.024.
218. Nishikawa H, Enomoto H, Nishiguchi S, Iijima H. Sarcopenic Obesity in Liver Cirrhosis: Possible Mechanism and Clinical Impact. Int J Mol Sci. 2021; 22(4): 1917. https://doi.org/10.3390/ijms22041917.
219. Polyzos SA, Vachliotis ID, Mantzoros CS. Sarcopenia, sarcopenic obesity and nonalcoholic fatty liver disease. Metabolism. 2023; 147: 155676. https://doi.org/10.1016/j.metabol.2023.155676.
220. Amodio P, Bemeur C, Butterworth R, Cordoba J, Kato A, Montagnese S et al. The nutritional management of hepatic encephalopathy in patients with cirrhosis: International Society for Hepatic Encephalopathy and Nitrogen Metabolism Consensus. Hepatology. 2013; 58(1): 325 - 336. https://doi.org/10.1002/hep.26370.
221. Himoto T, Masaki T. Current Trends of Essential Trace Elements in Patients with Chronic Liver Diseases. Nutrients. 2020; 12(7): 2084. https://doi.org/10.3390/nu12072084.
222.  J,
J, ![]() E,
E,  E, Gerok W. Zinc and vitamin A deficiency in liver cirrhosis. Hepatogastroenterology. 1983; 30(4): 119 - 125.
E, Gerok W. Zinc and vitamin A deficiency in liver cirrhosis. Hepatogastroenterology. 1983; 30(4): 119 - 125.
223. Yang F, Ren H, Gao Y, Zhu Y, Huang W. The value of severe vitamin D deficiency in predicting the mortality risk of patients with liver cirrhosis: A meta-analysis. Clin Res Hepatol Gastroenterol. 2019; 43(6): 722 - 729. https://doi.org/10.1016/j.clinre.2019.03.001.
224. Thomson AD. Mechanisms of vitamin deficiency in chronic alcohol misusers and the development of the Wernicke-Korsakoff syndrome. Alcohol Alcohol Suppl. 2000; 35(1): 2 - 7. https://doi.org/10.1093/alcalc/35.supplement_1.2.
225. Levy C, Lindor KD. Management of osteoporosis, fat-soluble vitamin deficiencies, and hyperlipidemia in primary biliary cirrhosis. Clin Liver Dis. 2003; 7(4): 901 - 910. https://doi.org/10.1016/s1089-3261(03)00097-7.
226. Yang M, Wang D, Wang X, Mei J, Gong Q. Role of Folate in Liver Diseases. Nutrients. 2024; 16(12): 1872. https://doi.org/10.3390/nu16121872.
227. Malaguarnera G, Catania VE, Bertino G, Drago F, Madeddu R, Bonfiglio C, Malaguarnera M. Serum Folate deficiency in HCV related Hepatocellular Carcinoma. Sci Rep. 2022; 12(1): 5025. https://doi.org/10.1038/s41598-022-09030-1.
228. Halsted CH. B-Vitamin dependent methionine metabolism and alcoholic liver disease. Clin Chem Lab Med. 2013; 51(3): 457 - 465. https://doi.org/10.1515/cclm-2012-0308.
229. Bunchorntavakul C, Reddy KR. Review article: malnutrition/sarcopenia and frailty in patients with cirrhosis. Aliment Pharmacol Ther. 2020; 51(1): 64 - 77. https://doi.org/10.1111/apt.15571.
230. Peng S, Plank LD, McCall JL, Gillanders LK, McIlroy K, Gane EJ. Body composition, muscle function, and energy expenditure in patients with liver cirrhosis: a comprehensive study. Am J Clin Nutr. 2007; 85(5): 1257 - 1266. https://doi.org/10.1093/ajcn/85.5.1257.
231. Eslamparast T, Vandermeer B, Raman M, Gramlich L, Den Heyer V, Belland D et al. Are Predictive Energy Expenditure Equations Accurate in Cirrhosis? Nutrients. 2019; 11(2): 334. https://doi.org/10.3390/nu11020334.
232. Ивашкин ВТ, Лазебник ЛБ, Голованова ЕВ, Деева ТА, Драпкина ОМ, Еремина ЕЮ. Алкогольная болезнь печени: клинические рекомендации. М., 2022. Режим доступа: https://cr.minzdrav.gov.ru/preview-cr/711_2.
233. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96(7): 1911 - 1930. https://doi.org/10.1210/jc.2011-0385.
234. Assis DN. Chronic Complications of Cholestasis: Evaluation and Management. Clin Liver Dis. 2018; 22(3): 533 - 544. https://doi.org/10.1016/j.cld.2018.03.014.
235. Brustia R, Savier E, Scatton O. Physical exercise in cirrhotic patients: Towards prehabilitation on waiting list for liver transplantation. A systematic review and meta-analysis. Clin Res Hepatol Gastroenterol. 2018; 42(3): 205 - 215. https://doi.org/10.1016/j.clinre.2017.09.005.
236. Duarte-Rojo A,  A,
A,  AJ,
AJ,  RU, Ferrando A, Kim WR. Exercise and physical activity for patients with end-stage liver disease: Improving functional status and sarcopenia while on the transplant waiting list. Liver Transpl. 2018; 24(1): 122 - 139. https://doi.org/10.1002/lt.24958.
RU, Ferrando A, Kim WR. Exercise and physical activity for patients with end-stage liver disease: Improving functional status and sarcopenia while on the transplant waiting list. Liver Transpl. 2018; 24(1): 122 - 139. https://doi.org/10.1002/lt.24958.
237. Kruger C, McNeely ML, Bailey RJ, Yavari M, Abraldes JG, Carbonneau M et al. Home Exercise Training Improves Exercise Capacity in Cirrhosis Patients: Role of Exercise Adherence. Sci Rep. 2018; 8(1): 99. https://doi.org/10.1038/s41598-017-18320-y.
238. Jones JC, Coombes JS, Macdonald GA. Exercise capacity and muscle strength in patients with cirrhosis. Liver Transpl. 2012; 18(2): 146 - 151. https://doi.org/10.1002/lt.22472.
239. Moore G, Durstine JL, Painter P (eds.). ACSM's Exercise Management for Persons with Chronic Diseases and Disabilities. 4th ed. Human Kinetics, 2016. 416 p.
240. Tonon M, Balcar L, Semmler G, Calvino V, Scheiner B, Incicco S et al. Etiological cure prevents further decompensation and mortality in patients with cirrhosis with ascites as the single first decompensating event. Hepatology. 2023; 78(4): 1149 - 1158. https://doi.org/10.1097/HEP.0000000000000460.
241. Morando F, Rosi S, Gola E, Nardi M, Piano S, Fasolato S et al. Adherence to a moderate sodium restriction diet in outpatients with cirrhosis and ascites: a real-life cross-sectional study. Liver Int. 2015; 35(5): 1508 - 1515. https://doi.org/10.1111/liv.12583.
242. Bernardi M, Servadei D, Trevisani F, Rusticali AG, Gasbarrini G. Importance of plasma aldosterone concentration on the natriuretic effect of spironolactone in patients with liver cirrhosis and ascites. Digestion. 1985; 31(4): 189 - 193. https://doi.org/10.1159/000199198.
243. Angeli P, Fasolato S, Mazza E, Okolicsanyi L, Maresio G, Velo E et al. Combined versus sequential diuretic treatment of ascites in non-azotaemic patients with cirrhosis: results of an open randomised clinical trial. Gut. 2010; 59(1): 98 - 104. https://doi.org/10.1136/gut.2008.176495.
244. Fiaccadori F, Pedretti G, Pasetti G, Pizzaferri P, Elia G. Torasemide versus furosemide in cirrhosis: a long-term, double-blind, randomized clinical study. Clin Investig. 1993; 71(7): 579 - 584. https://doi.org/10.1007/BF00208486.
245. Santos J, Planas R, Pardo A,  R,
R, ![]() E, Morillas RM et al. Spironolactone alone or in combination with furosemide in the treatment of moderate ascites in nonazotemic cirrhosis. A randomized comparative study of efficacy and safety. J Hepatol. 2003; 39(2): 187 - 192. https://doi.org/10.1016/s0168-8278(03)00188-0.
E, Morillas RM et al. Spironolactone alone or in combination with furosemide in the treatment of moderate ascites in nonazotemic cirrhosis. A randomized comparative study of efficacy and safety. J Hepatol. 2003; 39(2): 187 - 192. https://doi.org/10.1016/s0168-8278(03)00188-0.
246. Guardiola J, Baliellas C, Xiol X, Fernandez Esparrach G, ![]() P, Ventura P, Vazquez S. External validation of a prognostic model for predicting survival of cirrhotic patients with refractory ascites. Am J Gastroenterol. 2002; 97(9): 2374 - 2378. https://doi.org/10.1111/j.1572-0241.2002.05928.x.
P, Ventura P, Vazquez S. External validation of a prognostic model for predicting survival of cirrhotic patients with refractory ascites. Am J Gastroenterol. 2002; 97(9): 2374 - 2378. https://doi.org/10.1111/j.1572-0241.2002.05928.x.
247. Abecasis R, Guevara M, Miguez C, Cobas S, Terg R. Long-term efficacy of torsemide compared with frusemide in cirrhotic patients with ascites. Scand J Gastroenterol. 2001; 36(3): 309 - 313. https://doi.org/10.1080/003655201750074672.
248. Elsabaawy MM, Abdelhamid SR, Alsebaey A, Abdelsamee E, Obada MA, Salman TA, Rewisha E. The impact of paracentesis flow rate in patients with liver cirrhosis on the development of paracentesis induced circulatory dysfunction. Clin Mol Hepatol. 2015; 21(4): 365 - 371. https://doi.org/10.3350/cmh.2015.21.4.365.
249. Laffi G, Marra F, Buzzelli G, Azzena G, Meacci E, De Feo ML et al. Comparison of the effects of torasemide and furosemide in nonazotemic cirrhotic patients with ascites: a randomized, double-blind study. Hepatology. 1991; 13(6): 1101 - 11005.
250. Gerbes AL, Bertheau-Reitha U, Falkner C, ![]() D, Paumgartner G. Advantages of the new loop diuretic torasemide over furosemide in patients with cirrhosis and ascites. A randomized, double blind cross-over trial. J Hepatol. 1993; 17(3): 353 - 358. https://doi.org/10.1016/s0168-8278(05)80217-x.
D, Paumgartner G. Advantages of the new loop diuretic torasemide over furosemide in patients with cirrhosis and ascites. A randomized, double blind cross-over trial. J Hepatol. 1993; 17(3): 353 - 358. https://doi.org/10.1016/s0168-8278(05)80217-x.
251. Inoue M, Okajima K, Itoh K, Ando Y, Watanabe N, Yasaka T et al. Mechanism of furosemide resistance in analbuminemic rats and hypoalbuminemic patients. Kidney Int. 1987; 32(2): 198 - 203. https://doi.org/10.1038/ki.1987.192.
252. Lee TH, Kuo G, Chang CH, Huang YT, Yen CL, Lee CC et al. Diuretic effect of co-administration of furosemide and albumin in comparison to furosemide therapy alone: An updated systematic review and meta-analysis. PLoS ONE. 2021; 16(12): e0260312. https://doi.org/10.1371/journal.pone.0260312.
253. Biggins SW, Angeli P, Garcia-Tsao G, ![]() P, Ling SC, Nadim MK et al. Diagnosis, Evaluation, and Management of Ascites, Spontaneous Bacterial Peritonitis and Hepatorenal Syndrome: 2021 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2021; 74(2): 1014 - 1048. https://doi.org/10.1002/hep.31884.
P, Ling SC, Nadim MK et al. Diagnosis, Evaluation, and Management of Ascites, Spontaneous Bacterial Peritonitis and Hepatorenal Syndrome: 2021 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2021; 74(2): 1014 - 1048. https://doi.org/10.1002/hep.31884.
254. Salerno F, Merli M, Riggio O, Cazzaniga M, Valeriano V, Pozzi M et al. Randomized controlled study of TIPS versus paracentesis plus albumin in cirrhosis with severe ascites. Hepatology. 2004; 40(3): 629 - 635. https://doi.org/10.1002/hep.20364.
255. Vila MC, Coll S, ![]() R, Andreu M, Gana J, Marquez J. Total paracentesis in cirrhotic patients with tense ascites and dilutional hyponatremia. Am J Gastroenterol. 1999; 94(8): 2219 - 2223. https://doi.org/10.1111/j.1572-0241.1999.01296.x.
R, Andreu M, Gana J, Marquez J. Total paracentesis in cirrhotic patients with tense ascites and dilutional hyponatremia. Am J Gastroenterol. 1999; 94(8): 2219 - 2223. https://doi.org/10.1111/j.1572-0241.1999.01296.x.
256. Lv XY, Ding HG, Zheng JF, Fan CL, Li L. Rifaximin improves survival in cirrhotic patients with refractory ascites: A real-world study. World J Gastroenterol. 2020; 26(2): 199 - 218. https://doi.org/10.3748/wjg.v26.i2.199.
257. Durand F, Graupera I, ![]() P, Olson JC, Nadim MK. Pathogenesis of Hepatorenal Syndrome: Implications for Therapy. Am J Kidney Dis. 2016; 67(2): 318 - 328. https://doi.org/10.1053/j.ajkd.2015.09.013.
P, Olson JC, Nadim MK. Pathogenesis of Hepatorenal Syndrome: Implications for Therapy. Am J Kidney Dis. 2016; 67(2): 318 - 328. https://doi.org/10.1053/j.ajkd.2015.09.013.
258. Villanueva C, Colomo A, Bosch A,  M, Hernandez-Gea V, Aracil C et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med. 2013; 368(1): 11 - 21. https://doi.org/10.1056/NEJMoa1211801.
M, Hernandez-Gea V, Aracil C et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med. 2013; 368(1): 11 - 21. https://doi.org/10.1056/NEJMoa1211801.
259. Анисимов АЮ, Верткин АЛ, Девятов АВ, Дзидзава ИИ, Ивашкин ВТ, Киценко ЕА и др. Практические рекомендации по лечению кровотечений из варикозно расширенных вен Пищевода и желудка Российское общество хирургов. Московский хирургический журнал. 2013; (6): 41 - 54.
260. Garcia-Tsao G, Bosch J. Management of varices and variceal hemorrhage in cirrhosis. N Engl J Med. 2010; 362(9): 823 - 832. https://doi.org/10.1056/NEJMra0901512.
261. Odutayo A, Desborough MJ, Trivella M, Stanley AJ, ![]() C, Collins GS et al. Restrictive versus liberal blood transfusion for gastrointestinal bleeding: a systematic review and meta-analysis of randomised controlled trials. Lancet Gastroenterol Hepatol. 2017; 2(5): 354 - 360. https://doi.org/10.1016/S2468-1253(17)30054-7.
C, Collins GS et al. Restrictive versus liberal blood transfusion for gastrointestinal bleeding: a systematic review and meta-analysis of randomised controlled trials. Lancet Gastroenterol Hepatol. 2017; 2(5): 354 - 360. https://doi.org/10.1016/S2468-1253(17)30054-7.
262. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on prevention and management of bleeding and thrombosis in patients with cirrhosis. J Hepatol. 2022; 76(5): 1151 - 1184. https://doi.org/10.1016/j.jhep.2021.09.003.
263. Lisman T, Procopet B. Fresh frozen plasma in treating acute variceal bleeding: Not effective and likely harmful. Liver Int. 2021; 41(8): 1710 - 1712. https://doi.org/10.1111/liv.14988.
264. Northup PG, Lisman T, Roberts LN. Treatment of bleeding in patients with liver disease. J Thromb Haemost. 2021; 19(7): 1644 - 1652. https://doi.org/10.1111/jth.15364.
265. O'Leary JG, Greenberg CS, Patton HM, Caldwell SH. AGA Clinical Practice Update: Coagulation in Cirrhosis. Gastroenterology. 2019; 157(1): 34 - 43. e1. https://doi.org/10.1053/j.gastro.2019.03.070.
266. Mohanty A, Kapuria D, Canakis A, Lin H, Amat MJ, Rangel Paniz G et al. Fresh frozen plasma transfusion in acute variceal haemorrhage: Results from a multicentre cohort study. Liver Int. 2021; 41(8): 1901 - 1908. https://doi.org/10.1111/liv.14936.
267. Rassi AB, d'Amico EA, Tripodi A, da Rocha TRF, Migita BY, Ferreira CM et al. Fresh frozen plasma transfusion in patients with cirrhosis and coagulopathy: Effect on conventional coagulation tests and thrombomodulin-modified thrombin generation. J Hepatol. 2020; 72(1): 85 - 94. https://doi.org/10.1016/j.jhep.2019.09.008.
268. Fu X, Yan D, Huang W, Xie X, Zhou Y, Li H et al. Efficacy of fresh frozen plasma transfusion in decompensated cirrhosis patients with coagulopathy admitted to ICU: a retrospective cohort study from MIMIC-IV database. Sci Rep. 2024; 14(1): 4925. https://doi.org/10.1038/s41598-024-54379-0.
269. Qi X, Ye C, Guo X. Recombinant factor VIIa for variceal bleeding in liver cirrhosis: still only a hope. Arch Med Sci. 2017; 13(2): 496 - 499. https://doi.org/10.5114/aoms.2017.65331.
270. O'Donnell O, Gallagher C, Davey MG, Coulter J, Regan M. A systematic review and meta-analysis assessing the use of tranexamic acid(TXA) in acute gastrointestinal bleeding. Ir J Med Sci. 2024; 193(2): 705 - 719. https://doi.org/10.1007/s11845-023-03517-0.
271. Tandon P, Abraldes JG, Keough A, Bastiampillai R, Jayakumar S, Carbonneau M et al. Risk of Bacterial Infection in Patients With Cirrhosis and Acute Variceal Hemorrhage, Based on Child-Pugh Class, and Effects of Antibiotics. Clin Gastroenterol Hepatol. 2015; 13(6): 1189 - 1196. e2. https://doi.org/10.1016/j.cgh.2014.11.019.
272.  J, Ruiz del Arbol L,
J, Ruiz del Arbol L,  C, Durandez R, Serradilla R, Guarner C, et al. Norfloxacin vs ceftriaxone in the prophylaxis of infections in patients with advanced cirrhosis and hemorrhage. Gastroenterology. 2006; 131(4): 1049 - 56; https://doi.org/10.1053/j.gastro.2006.07.010.
C, Durandez R, Serradilla R, Guarner C, et al. Norfloxacin vs ceftriaxone in the prophylaxis of infections in patients with advanced cirrhosis and hemorrhage. Gastroenterology. 2006; 131(4): 1049 - 56; https://doi.org/10.1053/j.gastro.2006.07.010.
273. Bernard B,  JD, Khac EN, Amiot X, Opolon P, Poynard T. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology. 1999; 29(6): 1655 - 61. https://doi.org/10.1002/hep.510290608.
JD, Khac EN, Amiot X, Opolon P, Poynard T. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology. 1999; 29(6): 1655 - 61. https://doi.org/10.1002/hep.510290608.
274. Wu CK, Yang SC, Liang CM, Li YC, Yeh WS, Tai WC et al. The role of antibiotics in upper gastrointestinal bleeding among cirrhotic patients without major complications after endoscopic hemostasis. J Gastroenterol Hepatol. 2020; 35(5): 777 - 787. https://doi.org/10.1111/jgh.14873.
275. Sharma P, Agrawal A, Sharma BC, Sarin SK. Prophylaxis of hepatic encephalopathy in acute variceal bleed: a randomized controlled trial of lactulose versus no lactulose. J Gastroenterol Hepatol. 2011; 26(6): 996 - 1003. https://doi.org/10.1111/j.1440-1746.2010.06596.x.
276. Rattanasupar A, Chang A, Akarapatima K, Chaojin T, Piratvisuth T. Role of lactulose for prophylaxis against hepatic encephalopathy in cirrhotic patients with upper gastrointestinal bleeding: A randomized trial. Indian J Gastroenterol. 2021; 40(6): 621 - 629. https://doi.org/10.1007/s12664-021-01150-2.
277. Wen J, Liu Q, Song J, Tong M, Peng L, Liang H. Lactulose is highly potential in prophylaxis of hepatic encephalopathy in patients with cirrhosis and upper gastrointestinal bleeding: results of a controlled randomized trial. Digestion. 2013; 87(2): 132 - 138. https://doi.org/10.1159/000346083.
278. Aires FT, Ramos PT, Bernardo WM. Efficacy of lactulose in the prophylaxis of hepatic encephalopathy in cirrhotic patients presenting gastrointestinal bleeding. Rev Assoc Med Bras (1992). 2016; 62(3): 243 - 247. https://doi.org/10.1590/1806-9282.62.03.243.
279. Tsai MH, Huang HC, Peng YS, Chen YC, Tian YC, Yang CW et al. Nutrition Risk Assessment Using the Modified NUTRIC Score in Cirrhotic Patients with Acute Gastroesophageal Variceal Bleeding: Prevalence of High Nutrition Risk and its Independent Prognostic Value. Nutrients. 2019; 11(9): 2152. https://doi.org/10.3390/nu11092152.
280. De  V, Beau P, Mannant PR, Borderie C, Ripault MP, Silvain C, Beauchant M. Early feeding or enteral nutrition in patients with cirrhosis after bleeding from esophageal varices? A randomized controlled study. Dig Dis Sci. 1997; 42(3): 536 - 541. https://doi.org/10.1023/a:1018838808396.
V, Beau P, Mannant PR, Borderie C, Ripault MP, Silvain C, Beauchant M. Early feeding or enteral nutrition in patients with cirrhosis after bleeding from esophageal varices? A randomized controlled study. Dig Dis Sci. 1997; 42(3): 536 - 541. https://doi.org/10.1023/a:1018838808396.
281. Sidhu SS, Goyal O, Singh S, Kishore H, Chhina RS, Sidhu SS. Early feeding after esophageal variceal band ligation in cirrhotics is safe: Randomized controlled trial. Dig Endosc. 2019; 31(6): 646 - 652. https://doi.org/10.1111/den.13423.
282. O'Leary JG, Reddy KR, Wong F, Kamath PS, Patton HM, Biggins SW et al. Long-term use of antibiotics and proton pump inhibitors predict development of infections in patients with cirrhosis. Clin Gastroenterol Hepatol. 2015; 13(4): 753 - 759.e1 - 2. https://doi.org/10.1016/j.cgh.2014.07.060.
283. Dam G, Vilstrup H, Andersen PK, Bossen L, Watson H, Jepsen P. Effect of proton pump inhibitors on the risk and prognosis of infections in patients with cirrhosis and ascites. Liver Int. 2019; 39(3): 514 - 521. https://doi.org/10.1111/liv.14012.
284. Thomson MJ, Lok ASF, Tapper EB. Appropriate and Potentially Inappropriate Medication Use in Decompensated Cirrhosis. Hepatology. 2021; 73(6): 2429 - 2440. https://doi.org/10.1002/hep.31548.
285. Feu F, Ruiz del Arbol L,  R, Planas R, Bosch J. Double-blind randomized controlled trial comparing terlipressin and somatostatin for acute variceal hemorrhage. Variceal Bleeding Study Group. Gastroenterology. 1996; 111(5): 1291 - 1299. https://doi.org/10.1053/gast.1996.v111.pm8898643.
R, Planas R, Bosch J. Double-blind randomized controlled trial comparing terlipressin and somatostatin for acute variceal hemorrhage. Variceal Bleeding Study Group. Gastroenterology. 1996; 111(5): 1291 - 1299. https://doi.org/10.1053/gast.1996.v111.pm8898643.
286. Abid S, Jafri W, Hamid S, Salih M, Azam Z, Mumtaz K et al. Terlipressin vs. octreotide in bleeding esophageal varices as an adjuvant therapy with endoscopic band ligation: a randomized double-blind placebo-controlled trial. Am J Gastroenterol. 2009; 104(3): 617 - 623. https://doi.org/10.1038/ajg.2008.147.
287. Freeman JG, Cobden I, Lishman AH, Record CO. Controlled trial of terlipressin ('Glypressin') versus vasopressin in the early treatment of oesophageal varices. Lancet. 1982; 2(8289): 66 - 68. https://doi.org/10.1016/s0140-6736(82)91689-0.
288. Walker S, Stiehl A, Raedsch R, Kommerell B. Terlipressin in bleeding esophageal varices: a placebo-controlled, double-blind study. Hepatology. 1986; 6(1): 112 - 115. https://doi.org/10.1002/hep.1840060121.
289. Hwang SJ, Lin HC, Chang CF, Lee FY, Lu CW, Hsia HC et al. A randomized controlled trial comparing octreotide and vasopressin in the control of acute esophageal variceal bleeding. J Hepatol. 1992; 16(3): 320 - 325. https://doi.org/10.1016/s0168-8278(05)80663-4.
290. Rengasamy S, Ali SM, Sistla SC, Lakshmi CP, Harichandra Kumar KT. Comparison of 2 days versus 5 days of octreotide infusion along with endoscopic therapy in preventing early rebleed from esophageal varices: a randomized clinical study. Eur J Gastroenterol Hepatol. 2015; 27(4): 386 - 392. https://doi.org/10.1097/MEG.0000000000000300.
291. Sung JJ, Chung SC, Yung MY, Lai CW, Lau JY, Lee YT et al. Prospective randomised study of effect of octreotide on rebleeding from oesophageal varices after endoscopic ligation. Lancet. 1995; 346(8991 - 8992): 1666 - 1669. https://doi.org/10.1016/s0140-6736(95)92840-5.
292. Avgerinos A, Nevens F, Raptis S, Fevery J. Early administration of somatostatin and efficacy of sclerotherapy in acute oesophageal variceal bleeds: the European Acute Bleeding Oesophageal Variceal Episodes (ABOVE) randomised trial. Lancet. 1997; 350(9090): 1495 - 1499. https://doi.org/10.1016/s0140-6736(97)05099-x.
293. Bai Y, Guo JF, Li ZS. Meta-analysis: erythromycin before endoscopy for acute upper gastrointestinal bleeding. Aliment Pharmacol Ther. 2011; 34(2): 166 - 171. https://doi.org/10.1111/j.1365-2036.2011.04708.x.
294. Theivanayagam S, Lim RG, Cobell WJ, Gowda JT, Matteson ML, Choudhary A, Bechtold ML. Administration of erythromycin before endoscopy in upper gastrointestinal bleeding: a meta-analysis of randomized controlled trials. Saudi J Gastroenterol. 2013; 19(5): 205 - 210. https://doi.org/10.4103/1319-3767.118120.
295. ![]() D, Gois AF, Pacheco RL, Pimentel CF, Riera R. Erythromycin prior to endoscopy for acute upper gastrointestinal haemorrhage. Cochrane Database Syst Rev. 2023; 2(2): CD013176. https://doi.org/10.1002/14651858.CD013176.pub2.
D, Gois AF, Pacheco RL, Pimentel CF, Riera R. Erythromycin prior to endoscopy for acute upper gastrointestinal haemorrhage. Cochrane Database Syst Rev. 2023; 2(2): CD013176. https://doi.org/10.1002/14651858.CD013176.pub2.
296. Zacharias HD, Kamel F, Tan J, Kimer N, Gluud LL, Morgan MY. Rifaximin for prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev. 2023; 7(7): CD011585. https://doi.org/10.1002/14651858.CD011585.pub2.
297. Jain A, Sharma BC, Mahajan B, Srivastava S, Kumar A, Sachdeva S et al. L-ornithine L-aspartate in acute treatment of severe hepatic encephalopathy: A double-blind randomized controlled trial. Hepatology. 2022; 75(5): 1194 - 1203. https://doi.org/10.1002/hep.32255.
298. Kimer N, Krag A, ![]() S, Bendtsen F, Gluud LL. Systematic review with meta-analysis: the effects of rifaximin in hepatic encephalopathy. Aliment Pharmacol Ther. 2014; 40(2): 123 - 132. https://doi.org/10.1111/apt.12803.
S, Bendtsen F, Gluud LL. Systematic review with meta-analysis: the effects of rifaximin in hepatic encephalopathy. Aliment Pharmacol Ther. 2014; 40(2): 123 - 132. https://doi.org/10.1111/apt.12803.
299. Bass NM, Mullen KD, Sanyal A, Poordad F, Neff G, Leevy CB et al. Rifaximin treatment in hepatic encephalopathy. N Engl J Med. 2010; 362(12): 1071 - 1081. https://doi.org/10.1056/NEJMoa0907893.
300. Zullo A, Hassan C, Ridola L, Lorenzetti R, Campo SM, Riggio O. Rifaximin therapy and hepatic encephalopathy: Pros and cons. World J Gastrointest Pharmacol Ther. 2012; 3(4): 62 - 67. https://doi.org/10.4292/wjgpt.v3.i4.62.
301. Kang SH, Lee YB, Lee JH, Nam JY, Chang Y, Cho H et al. Rifaximin treatment is associated with reduced risk of cirrhotic complications and prolonged overall survival in patients experiencing hepatic encephalopathy. Aliment Pharmacol Ther. 2017; 46(9): 845 - 855. https://doi.org/10.1111/apt.14275.
302. Hudson M, Schuchmann M. Long-term management of hepatic encephalopathy with lactulose and/or rifaximin: a review of the evidence. Eur J Gastroenterol Hepatol. 2019; 31(4): 434 - 450. https://doi.org/10.1097/MEG.0000000000001311.
303. Wu D, Wu SM, Lu J, Zhou YQ, Xu L, Guo CY. Rifaximin versus Nonabsorbable Disaccharides for the Treatment of Hepatic Encephalopathy: A Meta-Analysis. Gastroenterol Res Pract. 2013: 236963. https://doi.org/10.1155/2013/236963.
304. Simmons F, Goldstein H, Boyle JD. A controlled clinical trial of lactulose in hepatic encephalopathy. Gastroenterology. 1970; 59(6): 827 - 832.
305. Tapper EB, Finkelstein D, Mittleman MA, Piatkowski G, Chang M, Lai M. A Quality Improvement Initiative Reduces 30-Day Rate of Readmission for Patients With Cirrhosis. Clin Gastroenterol Hepatol. 2016; 14(5): 753 - 759. https://doi.org/10.1016/j.cgh.2015.08.041.
306. Bajaj JS, Sanyal AJ, Bell D, Gilles H, Heuman DM. Predictors of the recurrence of hepatic encephalopathy in lactulose-treated patients. Aliment Pharmacol Ther. 2010; 31(9): 1012 - 1017. https://doi.org/10.1111/j.1365-2036.2010.04257.x.
307. Eltawil KM, Laryea M, Peltekian K, Molinari M. Rifaximin vs. conventional oral therapy for hepatic encephalopathy: a meta-analysis. World J Gastroenterol. 2012; 18(8): 767 - 777. https://doi.org/10.3748/wjg.v18.i8.767.
308. Butterworth RF, Kircheis G, Hilger N, McPhail MJW. Efficacy of l-Ornithine l-Aspartate for the Treatment of Hepatic Encephalopathy and Hyperammonemia in Cirrhosis: Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Clin Exp Hepatol. 2018; 8(3): 301 - 313. https://doi.org/10.1016/j.jceh.2018.05.004.
309. Dhiman RK, Thumburu KK, Verma N, Chopra M, Rathi S, Dutta U et al. Comparative Efficacy of Treatment Options for Minimal Hepatic Encephalopathy: A Systematic Review and Network Meta-Analysis. Clin Gastroenterol Hepatol. 2020; 18(4): 800 - 812.e25. https://doi.org/10.1016/j.cgh.2019.08.047.
310. Rimola A,  JM, Clemente G, Rodrigo L, Obrador A, Miranda ML et al. Two different dosages of cefotaxime in the treatment of spontaneous bacterial peritonitis in cirrhosis: results of a prospective, randomized, multicenter study. Hepatology. 1995; 21(3): 674 - 679.
JM, Clemente G, Rodrigo L, Obrador A, Miranda ML et al. Two different dosages of cefotaxime in the treatment of spontaneous bacterial peritonitis in cirrhosis: results of a prospective, randomized, multicenter study. Hepatology. 1995; 21(3): 674 - 679.
311. Jiang Q, Jiang XH, Zheng MH, Chen YP. L-Ornithine-l-aspartate in the management of hepatic encephalopathy: a meta-analysis. J Gastroenterol Hepatol. 2009; 24(1): 9 - 14. https://doi.org/10.1111/j.1440-1746.2008.05582.x.
312. Bai M, Yang Z, Qi X, Fan D, Han G. l-ornithine-l-aspartate for hepatic encephalopathy in patients with cirrhosis: a meta-analysis of randomized controlled trials. J Gastroenterol Hepatol. 2013; 28(5): 783 - 792. https://doi.org/10.1111/jgh.12142.
313. Goh ET, Stokes CS, Sidhu SS, Vilstrup H, Gluud LL, Morgan MY. L-ornithine L-aspartate for prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev. 2018; 5(5): CD012410. https://doi.org/10.1002/14651858.CD012410.pub2.
314. Poo JL,  J,
J,  F, Aguilar-Castillo S,
F, Aguilar-Castillo S,  G,
G,  M et al. Efficacy of oral L-ornithine-L-aspartate in cirrhotic patients with hyperammonemic hepatic encephalopathy. Results of a randomized, lactulose-controlled study. Ann Hepatol. 2006; 5(4): 281 - 288.
M et al. Efficacy of oral L-ornithine-L-aspartate in cirrhotic patients with hyperammonemic hepatic encephalopathy. Results of a randomized, lactulose-controlled study. Ann Hepatol. 2006; 5(4): 281 - 288.
315. Zhu GQ, Shi KQ, Huang S, Wang LR, Lin YQ, Huang GQ et al. Systematic review with network meta-analysis: the comparative effectiveness and safety of interventions in patients with overt hepatic encephalopathy. Aliment Pharmacol Ther. 2015; 41(7): 624 - 635. https://doi.org/10.1111/apt.13122.
316. Hammd M, Elghezewi A, Abdulhadi A, Alabid A, Alabid A, Badi Y et al. Efficacy and Safety of Variable Treatment Options in the Prevention of Hepatic Encephalopathy: A Systematic Review and Network Meta-Analysis. Cureus. 2024; 16(1): e53341. https://doi.org/10.7759/cureus.53341.
317. Merli M, Lucidi C, Di Gregorio V, Lattanzi B, Giannelli V, Giusto M et al. An empirical broad spectrum antibiotic therapy in health-care-associated infections improves survival in patients with cirrhosis: A randomized trial. Hepatology. 2016; 63(5): 1632 - 1639. https://doi.org/10.1002/hep.28332.
318. He Q, Mao C, Chen Z, Zeng Y, Deng Y, Hu R. Efficacy of L-ornithine L-aspartate for minimal hepatic encephalopathy in patients with cirrhosis: A meta-analysis of randomized controlled trials. Arab J Gastroenterol. 2024; 25(2): 84 - 92. https://doi.org/10.1016/j.ajg.2024.01.006.
319. Butterworth RF. Beneficial effects of L-ornithine L-aspartate for prevention of overt hepatic encephalopathy in patients with cirrhosis: a systematic review with meta-analysis. Metab Brain Dis. 2020; 35(1): 75 - 81. https://doi.org/10.1007/s11011-019-00463-8.
320. Mittal VV, Sharma BC, Sharma P, Sarin SK. A randomized controlled trial comparing lactulose, probiotics, and L-ornithine L-aspartate in treatment of minimal hepatic encephalopathy. Eur J Gastroenterol Hepatol. 2011; 23(8): 725 - 732. https://doi.org/10.1097/MEG.0b013e32834696f5.
321. Sharma K, Pant S, Misra S, Dwivedi M, Misra A, Narang S et al. Effect of rifaximin, probiotics, and l-ornithine l-aspartate on minimal hepatic encephalopathy: a randomized controlled trial. Saudi J Gastroenterol. 2014; 20(4): 225 - 232. https://doi.org/10.4103/1319-3767.136975.
322. Bakulin IG, Ivanova KN, Eremina EY, Marchenko NV. Comparative Analysis of the Efficacy of Different Regimens of 12 Months Rifaximin-Alfa Therapy in Patients with Liver Cirrhosis and Minimal Hepatic Encephalopathy. Diagnostics(Basel). 2023; 13(20): 3239. https://doi.org/10.3390/diagnostics13203239.
323. Mullen KD, Sanyal AJ, Bass NM, Poordad FF, Sheikh MY, Frederick RT et al. Rifaximin is safe and well tolerated for long-term maintenance of remission from overt hepatic encephalopathy. Clin Gastroenterol Hepatol. 2014; 12(8): 1390 - 1397.e2. https://doi.org/10.1016/j.cgh.2013.12.021.
324. Moon AM, Kim HP, Jiang Y, Lupu G, Bissram JS, Barritt AS 4th, Tapper EB. Systematic Review and Meta-Analysis on the Effects of Lactulose and Rifaximin on Patient-Reported Outcomes in Hepatic Encephalopathy. Am J Gastroenterol. 2023; 118(2): 284 - 293. https://doi.org/10.14309/ajg.0000000000002008.
325. Verbalis JG, Goldsmith SR, Greenberg A, Korzelius C, Schrier RW, Sterns RH, Thompson CJ. Diagnosis, evaluation, and treatment of hyponatremia: expert panel recommendations. Am J Med. 2013; 126(10 Suppl. 1): S1 - 42. https://doi.org/10.1016/j.amjmed.2013.07.006.
326. Sigal SH, Amin A, Chiodo JA 3rd, Sanyal A. Management Strategies and Outcomes for Hyponatremia in Cirrhosis in the Hyponatremia Registry. Can J Gastroenterol Hepatol. 2018: 1579508. https://doi.org/10.1155/2018/1579508.
327. Bai Z, Wang L, Lin H, Tacke F, Cheng G, Qi X. Use of Human Albumin Administration for the Prevention and Treatment of Hyponatremia in Patients with Liver Cirrhosis: A Systematic Review and Meta-Analysis. J Clin Med. 2022; 11(19): 5928. https://doi.org/10.3390/jcm11195928.
328. Roy A, Giri S, Sharma S, Singh S, De A, Jalal P, Goenka M. Effectiveness of albumin infusion for the management of hyponatremia in decompensated cirrhosis: a systematic review. Egypt Liver Journal. 2024; 14: 41. https://doi.org/10.1186/s43066-024-00350-7.
329. Bajaj JS, Tandon P, O'Leary JG, Biggins SW, Wong F, Kamath PS et al. The Impact of Albumin Use on Resolution of Hyponatremia in Hospitalized Patients With Cirrhosis. Am J Gastroenterol. 2018; 113(9): 1339. https://doi.org/10.1038/s41395-018-0119-3.
330. Rondon-Berrios H, Velez JCQ. Hyponatremia in Cirrhosis. Clin Liver Dis. 2022; 26(2): 149 - 164. https://doi.org/10.1016/j.cld.2022.01.001.
331. Dahl E, Gluud LL, Kimer N, Krag A. Meta-analysis: the safety and efficacy of vaptans(tolvaptan, satavaptan and lixivaptan) in cirrhosis with ascites or hyponatraemia. Aliment Pharmacol Ther. 2012; 36(7): 619 - 626. https://doi.org/10.1111/apt.12025.
332. Li M, Bi Z, Huang Z. Impact of Vaptans on Clinical Outcomes in Cirrhosis Patients: A Meta-Analysis of Randomized Controlled Trials. Front Pharmacol. 2019; 10: 1365. https://doi.org/10.3389/fphar.2019.01365.
333.  A,
A, ![]() P, Marotta P, Czerwiec F, Oyuang J, Guevara M, Afdhal NH. Tolvaptan, an oral vasopressin antagonist, in the treatment of hyponatremia in cirrhosis. J Hepatol. 2012; 56(3): 571 - 578. https://doi.org/10.1016/j.jhep.2011.08.020.
P, Marotta P, Czerwiec F, Oyuang J, Guevara M, Afdhal NH. Tolvaptan, an oral vasopressin antagonist, in the treatment of hyponatremia in cirrhosis. J Hepatol. 2012; 56(3): 571 - 578. https://doi.org/10.1016/j.jhep.2011.08.020.
334. Bajaj JS, Kamath PS, Reddy KR. The Evolving Challenge of Infections in Cirrhosis. N Engl J Med. 2021; 384(24): 2317 - 2330. https://doi.org/10.1056/NEJMra2021808.
335.  J, Prado V, Trebicka J, Amoros A, Gustot T, Wiest R et al. Multidrug-resistant bacterial infections in patients with decompensated cirrhosis and with acute-on-chronic liver failure in Europe. J Hepatol. 2019; 70(3): 398 - 411. https://doi.org/10.1016/j.jhep.2018.10.027.
J, Prado V, Trebicka J, Amoros A, Gustot T, Wiest R et al. Multidrug-resistant bacterial infections in patients with decompensated cirrhosis and with acute-on-chronic liver failure in Europe. J Hepatol. 2019; 70(3): 398 - 411. https://doi.org/10.1016/j.jhep.2018.10.027.
336.  J, Piano S, Bartoletti M, Wey EQ. Management of bacterial and fungal infections in cirrhosis: The MDRO challenge. J Hepatol. 2021; 75(Suppl. 1): S101 - S117. https://doi.org/10.1016/j.jhep.2020.11.010.
J, Piano S, Bartoletti M, Wey EQ. Management of bacterial and fungal infections in cirrhosis: The MDRO challenge. J Hepatol. 2021; 75(Suppl. 1): S101 - S117. https://doi.org/10.1016/j.jhep.2020.11.010.
337. Yim HJ, Kim TH, Suh SJ, Yim SY, Jung YK, Seo YS et al. Response-Guided Therapy With Cefotaxime, Ceftriaxone, or Ciprofloxacin for Spontaneous Bacterial Peritonitis: A Randomized Trial: A Validation Study of 2021 AASLD Practice Guidance for SBP. Am J Gastroenterol. 2023; 118(4): 654 - 663. https://doi.org/10.14309/ajg.0000000000002126.
338. Lutz P, Nischalke HD,  B, Goeser F, Kaczmarek DJ, Schlabe S et al. Antibiotic resistance in healthcare-related and nosocomial spontaneous bacterial peritonitis. Eur J Clin Invest. 2017; 47(1): 44 - 52. https://doi.org/10.1111/eci.12701.
B, Goeser F, Kaczmarek DJ, Schlabe S et al. Antibiotic resistance in healthcare-related and nosocomial spontaneous bacterial peritonitis. Eur J Clin Invest. 2017; 47(1): 44 - 52. https://doi.org/10.1111/eci.12701.
339. Shi L, Wu D, Wei L, Liu S, Zhao P, Tu B et al. Nosocomial and Community-Acquired Spontaneous Bacterial Peritonitis in patients with liver cirrhosis in China: Comparative Microbiology and Therapeutic Implications. Sci Rep. 2017; 7: 46025. https://doi.org/10.1038/srep46025.
340. Bartoletti M, Giannella M, Lewis RE, Caraceni P, Tedeschi S, Paul M et al. Extended Infusion of  for Bloodstream Infection in Patients With Liver Cirrhosis: An Observational Multicenter Study. Clin Infect Dis. 2019; 69(10): 1731 - 1739. https://doi.org/10.1093/cid/ciz032.
for Bloodstream Infection in Patients With Liver Cirrhosis: An Observational Multicenter Study. Clin Infect Dis. 2019; 69(10): 1731 - 1739. https://doi.org/10.1093/cid/ciz032.
341. Iqbal A, Gangwani MK, Beran A, Dahiya DS, Sohail AH, Lee-Smith W et al. Nosocomial vs healthcare associated vs community acquired spontaneous bacterial peritonitis: Network meta-analysis. Am J Med Sci. 2023; 366(4): 305 - 313. https://doi.org/10.1016/j.amjms.2023.06.014.
342. Wieser A, Li H, Zhang J, Liss I, Markwardt D, Hornung R et al. Evaluating the best empirical antibiotic therapy in patients with acute-on-chronic liver failure and spontaneous bacterial peritonitis. Dig Liver Dis. 2019; 51(9): 1300 - 1307. https://doi.org/10.1016/j.dld.2019.02.015.
343. Quickert S,  S, Reuken PA, Hagel S, Schneider J, Schmid RM et al. Real-World Effectiveness of Piperacillin/Tazobactam with and without Linezolid for Spontaneous Bacterial Peritonitis. Dig Dis. 2022; 40(6): 777 - 786. https://doi.org/10.1159/000522259.
S, Reuken PA, Hagel S, Schneider J, Schmid RM et al. Real-World Effectiveness of Piperacillin/Tazobactam with and without Linezolid for Spontaneous Bacterial Peritonitis. Dig Dis. 2022; 40(6): 777 - 786. https://doi.org/10.1159/000522259.
344. Retamar P,  L, Muniain MA, Pascual
L, Muniain MA, Pascual ![]() ,
,  J. Impact of the MIC of piperacillin-tazobactam on the outcome of patients with bacteremia due to extended-spectrum-
J. Impact of the MIC of piperacillin-tazobactam on the outcome of patients with bacteremia due to extended-spectrum-![]() -lactamase-producing Escherichia coli. Antimicrob Agents Chemother. 2013; 57(7): 3402 - 3404. https://doi.org/10.1128/AAC.00135-13.
-lactamase-producing Escherichia coli. Antimicrob Agents Chemother. 2013; 57(7): 3402 - 3404. https://doi.org/10.1128/AAC.00135-13.
345. Sasidharan Nair GV, Mathen PG, Pillai MG, Gireesh Kumar KP, Velayudhan KK, Sreekrishnan TP. Initial choice of antibiotic in recurrent spontaneous bacterial peritonitis: A retrospective study. Int J Crit Illn Inj Sci. 2019; 9(4): 187 - 190. https://doi.org/10.4103/IJCIIS.IJCIIS_49_18.
346. Kim SW, Yoon JS, Park J, Jung YJ, Lee JS, Song J et al. Empirical Treatment With Carbapenem vs Third-generation Cephalosporin for Treatment of Spontaneous Bacterial Peritonitis. Clin Gastroenterol Hepatol. 2021; 19(5): 976 - 986.e5. https://doi.org/10.1016/j.cgh.2020.06.046.
347. Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz-del-Arbol L et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med. 1999; 341(6): 403 - 409. https://doi.org/10.1056/NEJM199908053410603.
348. Falcone M, Russo A, Pacini G, Merli M, Venditti M. Spontaneous Bacterial Peritonitis Due to Methicillin-Resistant Staphylococcus Aureus in a Patient with Cirrhosis: The Potential Role for Daptomycin and Review of the Literature. Infect Dis Rep. 2015; 7(3): 6127. https://doi.org/10.4081/idr.2015.6127.
349. Zoratti C, Moretti R, Rebuzzi L, Albergati IV, Di Somma A, Decorti G et al. Antibiotics and Liver Cirrhosis: What the Physicians Need to Know. Antibiotics(Basel). 2021; 11(1): 31. https://doi.org/10.3390/antibiotics11010031.
350. Eisenstein BI, Oleson FB Jr, Baltz RH. Daptomycin: from the mountain to the clinic, with essential help from Francis Tally, MD. Clin Infect Dis. 2010; 50(Suppl. 1): S10 - 5. https://doi.org/10.1086/647938. PMID: 20067387.
351. Renzoni A, Kelley WL, Rosato RR, Martinez MP, Roch M, Fatouraei M et al. Molecular Bases Determining Daptomycin Resistance-Mediated Resensitization to  (Seesaw Effect) in Methicillin-Resistant Staphylococcus aureus. Antimicrob Agents Chemother. 2016; 61(1): e01634 - 16. https://doi.org/10.1128/AAC.01634-16.
(Seesaw Effect) in Methicillin-Resistant Staphylococcus aureus. Antimicrob Agents Chemother. 2016; 61(1): e01634 - 16. https://doi.org/10.1128/AAC.01634-16.
352. Fiore M., Andreana L. The Possible Role of Anti-Methicillin-Resistant Staphylococcus Aureus Antimicrobial Agents in Spontaneous Bacterial Peritonitis. Infect Dis Rep. 2015 Dec 22; 7(4): 6286. doi: 10.4081/idr.2015.6286.
353. Salerno F, Navickis RJ, Wilkes MM. Albumin infusion improves outcomes of patients with spontaneous bacterial peritonitis: a meta-analysis of randomized trials. Clin Gastroenterol Hepatol. 2013; 11(2): 123 - 130.e1. https://doi.org/10.1016/j.cgh.2012.11.007.
354. Nadim MK, Durand F, Kellum JA, Levitsky J, O'Leary JG, Karvellas CJ et al. Management of the critically ill patient with cirrhosis: A multidisciplinary perspective. J Hepatol. 2016; 64(3): 717 - 735. https://doi.org/10.1016/j.jhep.2015.10.019.
355. Umgelter A, Reindl W, Wagner KS, Franzen M, Stock K, Schmid RM, Huber W. Effects of plasma expansion with albumin and paracentesis on haemodynamics and kidney function in critically ill cirrhotic patients with tense ascites and hepatorenal syndrome: a prospective uncontrolled trial. Crit Care. 2008; 12(1): R4. https://doi.org/10.1186/cc6765.
356. Durand F, Kellum JA, Nadim MK. Fluid resuscitation in patients with cirrhosis and sepsis: A multidisciplinary perspective. J Hepatol. 2023; 79(1): 240 - 246. https://doi.org/10.1016/j.jhep.2023.02.024.
357. Banegas-Deras EJ,  J,
J,  G, Ruiz-Cobo JC,
G, Ruiz-Cobo JC,  C, Serrano-Soto M et al. Acute kidney injury and point-of-care ultrasound in liver cirrhosis: redefining hepatorenal syndrome. Clin Kidney J. 2024; 17(5): sfae112. https://doi.org/10.1093/ckj/sfae112.
C, Serrano-Soto M et al. Acute kidney injury and point-of-care ultrasound in liver cirrhosis: redefining hepatorenal syndrome. Clin Kidney J. 2024; 17(5): sfae112. https://doi.org/10.1093/ckj/sfae112.
358. Nadim MK, Garcia-Tsao G. Acute Kidney Injury in Patients with Cirrhosis. N Engl J Med. 2023; 388(8): 733 - 745. https://doi.org/10.1056/NEJMra2215289.
359. Nanda A, Reddy R, Safraz H, Salameh H, Singal AK. Pharmacological Therapies for Hepatorenal Syndrome: A Systematic Review and Meta-Analysis. J Clin Gastroenterol. 2018; 52(4): 360 - 367. https://doi.org/10.1097/MCG.0000000000000913.
360. Albillos A,  R,
R,  M, Catalina MV, Molinero LM. A meta-analysis of transjugular intrahepatic portosystemic shunt versus paracentesis for refractory ascites. J Hepatol. 2005; 43(6): 990 - 996. https://doi.org/10.1016/j.jhep.2005.06.005.
M, Catalina MV, Molinero LM. A meta-analysis of transjugular intrahepatic portosystemic shunt versus paracentesis for refractory ascites. J Hepatol. 2005; 43(6): 990 - 996. https://doi.org/10.1016/j.jhep.2005.06.005.
361. Facciorusso A, Chandar AK, Murad MH, Prokop LJ, Muscatiello N, Kamath PS, Singh S. Comparative efficacy of pharmacological strategies for management of type 1 hepatorenal syndrome: a systematic review and network meta-analysis. Lancet Gastroenterol Hepatol. 2017; 2(2): 94 - 102. https://doi.org/10.1016/S2468-1253(16)30157-1.
362.  E, Elia C,
E, Elia C, ![]() E, Barreto R, Graupera I, Andrealli A et al. Terlipressin and albumin for type-1 hepatorenal syndrome associated with sepsis. J Hepatol. 2014; 60(5): 955 - 961. https://doi.org/10.1016/j.jhep.2013.12.032.
E, Barreto R, Graupera I, Andrealli A et al. Terlipressin and albumin for type-1 hepatorenal syndrome associated with sepsis. J Hepatol. 2014; 60(5): 955 - 961. https://doi.org/10.1016/j.jhep.2013.12.032.
363. Cavallin M, Kamath PS, Merli M, Fasolato S, Toniutto P, Salerno F et al. Terlipressin plus albumin versus midodrine and octreotide plus albumin in the treatment of hepatorenal syndrome: A randomized trial. Hepatology. 2015; 62(2): 567 - 574. https://doi.org/10.1002/hep.27709.
364. Cavallin M, Piano S, Romano A, Fasolato S, Frigo AC, Benetti G et al. Terlipressin given by continuous intravenous infusion versus intravenous boluses in the treatment of hepatorenal syndrome: A randomized controlled study. Hepatology. 2016; 63(3): 983 - 992. https://doi.org/10.1002/hep.28396.
365. Moreau R, Durand F, Poynard T, Duhamel C, Cervoni JP, ![]() P et al. Terlipressin in patients with cirrhosis and type 1 hepatorenal syndrome: a retrospective multicenter study. Gastroenterology. 2002; 122(4): 923 - 930. https://doi.org/10.1053/gast.2002.32364.
P et al. Terlipressin in patients with cirrhosis and type 1 hepatorenal syndrome: a retrospective multicenter study. Gastroenterology. 2002; 122(4): 923 - 930. https://doi.org/10.1053/gast.2002.32364.
366. Narahara Y, Kanazawa H, Taki Y, Kimura Y, Atsukawa M, Katakura T et al. Effects of terlipressin on systemic, hepatic and renal hemodynamics in patients with cirrhosis. J Gastroenterol Hepatol. 2009; 24(11): 1791 - 1797. https://doi.org/10.1111/j.1440-1746.2009.05873.x.
367. Andersen MM, Aunt S, Jensen NM, Homann C, Manniche J, Svendsen S et al. Rehabilitation for cirrhotic patients discharged after hepatic encephalopathy improves survival. Dan Med J. 2013; 60(8): A4683.
368. Garcia-Martinez R, Caraceni P, Bernardi M, Gines P, Arroyo V, Jalan R. Albumin: pathophysiologic basis of its role in the treatment of cirrhosis and its complications. Hepatology. 2013; 58(5): 1836 - 1846. https://doi.org/10.1002/hep.26338.
369. Alessandria C, Ottobrelli A, Debernardi-Venon W, Todros L, Cerenzia MT, Martini S et al. Noradrenalin vs terlipressin in patients with hepatorenal syndrome: a prospective, randomized, unblinded, pilot study. J Hepatol. 2007; 47(4): 499 - 505. https://doi.org/10.1016/j.jhep.2007.04.010.
370. Sharma P, Kumar A, Shrama BC, Sarin SK. An open label, pilot, randomized controlled trial of noradrenaline versus terlipressin in the treatment of type 1 hepatorenal syndrome and predictors of response. Am J Gastroenterol. 2008; 103(7): 1689 - 1697. https://doi.org/10.1111/j.1572-0241.2008.01828.x.
371. Piano S, Morando F, Fasolato S, Cavallin M, Boscato N, Boccagni P et al. Continuous recurrence of type 1 hepatorenal syndrome and long-term treatment with terlipressin and albumin: a new exception to MELD score in the allocation system to liver transplantation? J Hepatol. 2011; 55(2): 491 - 496. https://doi.org/10.1016/j.jhep.2011.02.002.
372. Malik A, Malik MI, Qureshi S, Nadir A. Efficacy and safety of terlipressin and albumin vs. noradrenaline and albumin in adult patients with hepatorenal syndrome: A systematic review and meta-analysis. Ann Hepatol. 2024; 29(4): 101495. https://doi.org/10.1016/j.aohep.2024.101495.
373. Arora V, Maiwall R, Rajan V, Jindal A, Muralikrishna Shasthry S, Kumar G et al. Terlipressin Is Superior to Noradrenaline in the Management of Acute Kidney Injury in Acute on Chronic Liver Failure. Hepatology. 2020; 71(2): 600 - 610. https://doi.org/10.1002/hep.30208.
374. Singal AK, Palmer G, Melick L, Abdallah M, Kwo P. Vasoconstrictor Therapy for Acute Kidney Injury Hepatorenal Syndrome: A Meta-Analysis of Randomized Studies. Gastro Hep Adv. 2023; 2(4): 455 - 464. https://doi.org/10.1016/j.gastha.2023.01.007.
375. Best LM, Freeman SC, Sutton AJ, Cooper NJ, Tng EL, Csenar M et al. Treatment for hepatorenal syndrome in people with decompensated liver cirrhosis: a network meta-analysis. Cochrane Database Syst Rev. 2019; 9(9): CD013103. https://doi.org/10.1002/14651858.CD013103.pub2.
376. Pitre T, Kiflen M, Helmeczi W, Dionne JC, Rewa O, Bagshaw SM et al. The Comparative Effectiveness of Vasoactive Treatments for Hepatorenal Syndrome: A Systematic Review and Network Meta-Analysis. Crit Care Med. 2022; 50(10): 1419 - 1429. https://doi.org/10.1097/CCM.0000000000005595.
377. Garcia-Tsao G, Abraldes JG, Rich NE, Wong VW. AGA Clinical Practice Update on the Use of Vasoactive Drugs and Intravenous Albumin in Cirrhosis: Expert Review. Gastroenterology. 2024; 166(1): 202 - 210. https://doi.org/10.1053/j.gastro.2023.10.016.
378. Qi X, Bai Z, Zhu Q, Cheng G, Chen Y, Dang X et al. Practice guidance for the use of terlipressin for liver cirrhosis-related complications. Therap Adv Gastroenterol. 2022; 15: 17562848221098253. https://doi.org/10.1177/17562848221098253.
379. Allegretti AS, Subramanian RM, Francoz C, Olson JC,  A. Respiratory events with terlipressin and albumin in hepatorenal syndrome: A review and clinical guidance. Liver Int. 2022; 42(10): 2124 - 2130. https://doi.org/10.1111/liv.15367.
A. Respiratory events with terlipressin and albumin in hepatorenal syndrome: A review and clinical guidance. Liver Int. 2022; 42(10): 2124 - 2130. https://doi.org/10.1111/liv.15367.
380. Allegretti AS, Israelsen M, Krag A, Jovani M, Goldin AH, Schulman AR et al. Terlipressin versus placebo or no intervention for people with cirrhosis and hepatorenal syndrome. Cochrane Database Syst Rev. 2017; 6(6): CD005162. https://doi.org/10.1002/14651858.CD005162.pub4.
381.  R, Krowka MJ. Hepatopulmonary syndrome - a liver-induced lung vascular disorder. N Engl J Med. 2008; 358(22): 2378 - 2387. https://doi.org/10.1056/NEJMra0707185.
R, Krowka MJ. Hepatopulmonary syndrome - a liver-induced lung vascular disorder. N Engl J Med. 2008; 358(22): 2378 - 2387. https://doi.org/10.1056/NEJMra0707185.
382. Tsauo J, Weng N, Ma H, Jiang M, Zhao H, Li X. Role of Transjugular Intrahepatic Portosystemic Shunts in the Management of Hepatopulmonary Syndrome: A Systemic Literature Review. J Vasc Interv Radiol. 2015; 26(9): 1266 - 1271. https://doi.org/10.1016/j.jvir.2015.04.017.
383. Soulaidopoulos S, Goulis I, Cholongitas E. Pulmonary manifestations of chronic liver disease: a comprehensive review. Ann Gastroenterol. 2020; 33(3): 237 - 249. https://doi.org/10.20524/aog.2020.0474.
384. Benz F, Mohr R, Tacke F, Roderburg C. Pulmonary Complications in Patients with Liver Cirrhosis. J Transl Int Med. 2020; 8(3): 150 - 158. https://doi.org/10.2478/jtim-2020-0024.
385. Ditah IC, Al Bawardy BF, Saberi B, Ditah C, Kamath PS. Transjugular intrahepatic portosystemic stent shunt for medically refractory hepatic hydrothorax: A systematic review and cumulative meta-analysis. World J Hepatol. 2015; 7(13): 1797 - 1806. https://doi.org/10.4254/wjh.v7.i13.1797.
386. Sauerbruch T, Mengel M, Dollinger M, Zipprich A, ![]() M, Panther E et al. Prevention of Rebleeding From Esophageal Varices in Patients With Cirrhosis Receiving Small-Diameter Stents Versus Hemodynamically Controlled Medical Therapy. Gastroenterology. 2015; 149(3): 660 - 668.e1. https://doi.org/10.1053/j.gastro.2015.05.011.
M, Panther E et al. Prevention of Rebleeding From Esophageal Varices in Patients With Cirrhosis Receiving Small-Diameter Stents Versus Hemodynamically Controlled Medical Therapy. Gastroenterology. 2015; 149(3): 660 - 668.e1. https://doi.org/10.1053/j.gastro.2015.05.011.
387. Raevens S, Boret M, De Pauw M, Fallon MB, Van Vlierberghe H. Pulmonary Abnormalities in Liver Disease: Relevance to Transplantation and Outcome. Hepatology. 2021; 74(3): 1674 - 1686. https://doi.org/10.1002/hep.31770.
388. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on liver transplantation. J Hepatol. 2024; 81(6): 1040 - 1086. https://doi.org/10.1016/j.jhep.2024.07.032.
389. Авдеев СН, Барбараш ОЛ, Валиева ЗС, Волков АВ, Веселова ТН, Галявич АС и др. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации 2024. Российский кардиологический журнал. 2024; 29(11): 6161. https://doi.org/10.15829/1560-4071-2024-6161.
390. Krowka MJ, Fallon MB, Kawut SM, Fuhrmann V, Heimbach JK, Ramsay MA et al. International Liver Transplant Society Practice Guidelines: Diagnosis and Management of Hepatopulmonary Syndrome and Portopulmonary Hypertension. Transplantation. 2016; 100(7): 1440 - 1452. https://doi.org/10.1097/TP.0000000000001229.
391. Deroo R, ![]() E, Holvoet T, De Pauw M, Geerts A, Verhelst X et alVasomodulators and Liver Transplantation for Portopulmonary Hypertension: Evidence From a Systematic Review and Meta-Analysis. Hepatology. 2020; 72(5): 1701 - 1716. https://doi.org/10.1002/hep.31164.
E, Holvoet T, De Pauw M, Geerts A, Verhelst X et alVasomodulators and Liver Transplantation for Portopulmonary Hypertension: Evidence From a Systematic Review and Meta-Analysis. Hepatology. 2020; 72(5): 1701 - 1716. https://doi.org/10.1002/hep.31164.
392. Заболотских ИБ, Синьков СВ, Лебединский КМ, Буланов АЮ, Ройтман ЕВ. Периоперационное ведение пациентов с нарушениями системы гемостаза. Анестезиология и реаниматология. 2018; (1): 58 - 81. https://doi.org/10.17116/anaesthesiology201801-02158.
393. Маевская МВ, Жаркова МС, Ивашкин ВТ, Бессонова ЕН, Гейвандова НИ, Киценко ЕА и др. Диагностика расстройств в системе коагуляции, оценка риска геморрагических осложнений при циррозе/заболеваниях печени тяжелого течения по глобальным скрининговым тестам системы гемостаза и принципы их коррекции: методические рекомендации. Медицинский совет. 2022; (15): 70 - 82. https://doi.org/10.21518/2079-701X-2022-16-15-70-82.
394. Бобовник СВ, Горобец ЕС, Заболотских ИБ, Киров МЮ, Кохно ВН, Кузьков ВВ и др. Периоперационная инфузионная терапия у взрослых: методические рекомендации. М., 2021. Режим доступа: https://apicr.minzdrav.gov.ru/Files/recomend/МР132.pdf.
395. Меликян АЛ, Птушкин ВВ, Пустовая ЕИ, Цветаева НВ, Егорова ЕК. Идиопатическая тромбоцитопеническая пурпура(ИТП) у взрослых. М., 2024. Режим доступа: https://cr.minzdrav.gov.ru/preview-cr/150_3.
396. Northup PG, Garcia-Pagan JC, Garcia-Tsao G, Intagliata NM, Superina RA, Roberts LN et al. Vascular Liver Disorders, Portal Vein Thrombosis, and Procedural Bleeding in Patients With Liver Disease: 2020 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2021; 73(1): 366 - 413. https://doi.org/10.1002/hep.31646.
397. Baron TH, Kamath PS, McBane RD. Management of antithrombotic therapy in patients undergoing invasive procedures. N Engl J Med. 2013; 368(22): 2113 - 2124. https://doi.org/10.1056/NEJMra1206531.
398. Patel IJ, Rahim S, Davidson JC, Hanks SE, Tam AL, Walker TG et al. Society of Interventional Radiology Consensus Guidelines for the Periprocedural Management of Thrombotic and Bleeding Risk in Patients Undergoing Percutaneous Image-Guided Interventions-Part II: Recommendations: Endorsed by the Canadian Association for Interventional Radiology and the Cardiovascular and Interventional Radiological Society of Europe. J Vasc Interv Radiol. 2019; 30(8): 1168 - 1184.e1. https://doi.org/10.1016/j.jvir.2019.04.017.
399. Seeff LB, Everson GT, Morgan TR, Curto TM, Lee WM, Ghany MG et al. Complication rate of percutaneous liver biopsies among persons with advanced chronic liver disease in the HALT-C trial. Clin Gastroenterol Hepatol. 2010; 8(10): 877 - 883. https://doi.org/10.1016/j.cgh.2010.03.025.
400. Terrault N, Chen YC, Izumi N, Kayali Z, Mitrut P, Tak WY et al. Avatrombopag Before Procedures Reduces Need for Platelet Transfusion in Patients With Chronic Liver Disease and Thrombocytopenia. Gastroenterology. 2018; 155(3): 705 - 718. https://doi.org/10.1053/j.gastro.2018.05.025.
401. Poordad F, Terrault NA, Alkhouri N, Tian W, Allen LF, Rabinovitz M. Avatrombopag, an Alternate Treatment Option to Reduce Platelet Transfusions in Patients with Thrombocytopenia and Chronic Liver Disease-Integrated Analyses of 2 Phase 3 Studies. Int J Hepatol. 2020: 5421632. https://doi.org/10.1155/2020/5421632.
402. Olson SR, Koprowski S, Hum J, McCarty OJT, DeLoughery TG, Shatzel JJ. Chronic liver disease, thrombocytopenia and procedural bleeding risk; are novel thrombopoietin mimetics the solution? Platelets. 2019; 30(6): 796 - 798. https://doi.org/10.1080/09537104.2018.1542125.
403. Satapathy SK, Sundaram V, Shiffman ML, Jamieson BD. Real-world use of avatrombopag in patients with chronic liver disease and thrombocytopenia undergoing a procedure. Medicine (Baltimore). 2023; 102(40): e35208. https://doi.org/10.1097/MD.0000000000035208.
404. Rose PD, Au M, Woodman RJ, Tee D, Chinnaratha MA. Pre-procedural use of thrombopoietin-receptor agonists in cirrhosis and severe thrombocytopenia: A systematic review and meta-analysis. Dig Liver Dis. 2021; 53(11): 1396 - 1403. https://doi.org/10.1016/j.dld.2021.07.015.
405. Sinclair M, Grossmann M, Hoermann R, Angus PW, Gow PJ. Testosterone therapy increases muscle mass in men with cirrhosis and low testosterone: A randomised controlled trial. J Hepatol. 2016; 65(5): 906 - 913. https://doi.org/10.1016/j.jhep.2016.06.007.
406. Островская АС, Маевская МВ, Лобан КМ, Жаркова МС, Шапка МП, Васильцова ЕА и др. Возможности лечения саркопении при циррозе печени гипоаммониемическими средствами. Медицинский совет. 2024; (15): 51 - 60. https://doi.org/10.21518/ms2024-383.
407. Pasha Y, Taylor-Robinson S, Leech R, Ribeiro I, Cook N, Crossey M, Marcinkowski H. PWE-091. L-ornithine L-aspartate in minimal hepatic encephalopathy: possible effects on the brain-muscle axis? Gut. 2018; 67: A117 - A118. https://doi.org/10.1136/gutjnl-2018-BSGAbstracts.233.
408. Rose C, Michalak A, Pannunzio P, Therrien G, Quack G, Kircheis G, Butterworth RF. L-ornithine-L-aspartate in experimental portal-systemic encephalopathy: therapeutic efficacy and mechanism of action. Metab Brain Dis. 1998; 13(2): 147 - 157. https://doi.org/10.1023/a:1020613314572.
409. Butterworth RF. L-Ornithine L-Aspartate for the Treatment of Sarcopenia in Chronic Liver Disease: The Taming of a Vicious Cycle. Can J Gastroenterol Hepatol. 2019: 8182195. https://doi.org/10.1155/2019/8182195.
410. Horvath A, Traub J, Aliwa B, Bourgeois B, Madl T, Stadlbauer V. Oral Intake of L-Ornithine-L-Aspartate Is Associated with Distinct Microbiome and Metabolome Changes in Cirrhosis. Nutrients. 2022; 14(4): 748. https://doi.org/10.3390/nu14040748.
411.  JC, Caca K, Bureau C, Laleman W, Appenrodt B, Luca A et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med. 2010; 362(25): 2370 - 2379. https://doi.org/10.1056/NEJMoa0910102.
JC, Caca K, Bureau C, Laleman W, Appenrodt B, Luca A et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med. 2010; 362(25): 2370 - 2379. https://doi.org/10.1056/NEJMoa0910102.
412. Chitapanarux T, Ritdamrongthum P, Leerapun A, Pisespongsa P, Thongsawat S. Three-day versus five-day somatostatin infusion combination with endoscopic variceal ligation in the prevention of early rebleeding following acute variceal hemorrhage: A randomized controlled trial. Hepatol Res. 2015; 45(13): 1276 - 1282. https://doi.org/10.1111/hepr.12503.
413.  R, Albillos A,
R, Albillos A,  D, Alonso S,
D, Alonso S,  M, Ruiz-del-Arbol L et al. Endoscopic treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding: a meta-analysis. Hepatology. 2002; 35(3): 609 - 615. https://doi.org/10.1053/jhep.2002.31354.
M, Ruiz-del-Arbol L et al. Endoscopic treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding: a meta-analysis. Hepatology. 2002; 35(3): 609 - 615. https://doi.org/10.1053/jhep.2002.31354.
414. Hung TH, Tsai CC, TsenK GC, Hsieh YH, Tseng CW. No mortality difference following treatment with terlipressin or somatostatin in cirrhotic patients with gastric variceal hemorrhage. Saudi J Gastroenterol. 2016; 22(3): 220 - 225. https://doi.org/10.4103/1319-3767.182458.
415. Escorsell ![]() , Pavel O,
, Pavel O,  A, Morillas R, Llop E, Villanueva C et al. Esophageal balloon tamponade versus esophageal stent in controlling acute refractory variceal bleeding: A multicenter randomized, controlled trial. Hepatology. 2016; 63(6): 1957 - 1967. https://doi.org/10.1002/hep.28360.
A, Morillas R, Llop E, Villanueva C et al. Esophageal balloon tamponade versus esophageal stent in controlling acute refractory variceal bleeding: A multicenter randomized, controlled trial. Hepatology. 2016; 63(6): 1957 - 1967. https://doi.org/10.1002/hep.28360.
416. McCarty TR, Njei B. Self-expanding metal stents for acute refractory esophageal variceal bleeding: A systematic review and meta-analysis. Dig Endosc. 2016; 28(5): 539 - 547. https://doi.org/10.1111/den.12626.
417. Rodrigues SG,  A, Escorsell
A, Escorsell ![]() , Bosch J. Balloon Tamponade and Esophageal Stenting for Esophageal Variceal Bleeding in Cirrhosis: A Systematic Review and Meta-analysis. Semin Liver Dis. 2019; 39(2): 178 - 194. https://doi.org/10.1055/s-0039-1678726.
, Bosch J. Balloon Tamponade and Esophageal Stenting for Esophageal Variceal Bleeding in Cirrhosis: A Systematic Review and Meta-analysis. Semin Liver Dis. 2019; 39(2): 178 - 194. https://doi.org/10.1055/s-0039-1678726.
418. Sasso R, Lauzon S, Rockey DC. Cirrhotic Patients on Mechanical Ventilation Have a Low Rate of Successful Extubation and Survival. Dig Dis Sci. 2020; 65(12): 3744 - 3752. https://doi.org/10.1007/s10620-020-06051-6.
419. Chaudhuri D, Bishay K, Tandon P, Trivedi V, James PD, Kelly EM et al. Prophylactic endotracheal intubation in critically ill patients with upper gastrointestinal bleed: A systematic review and meta-analysis. JGH Open. 2019; 4(1): 22 - 28. https://doi.org/10.1002/jgh3.12195.
420.  V, Procopet B,
V, Procopet B,  , Amitrano L, Villanueva C, Thabut D et al. Preemptive-TIPS Improves Outcome in High-Risk Variceal Bleeding: An Observational Study. Hepatology. 2019; 69(1): 282 - 293. https://doi.org/10.1002/hep.30182.
, Amitrano L, Villanueva C, Thabut D et al. Preemptive-TIPS Improves Outcome in High-Risk Variceal Bleeding: An Observational Study. Hepatology. 2019; 69(1): 282 - 293. https://doi.org/10.1002/hep.30182.
421. Trebicka J, Gu W,  L,
L,  V, Pitarch C, Garcia E et al. Rebleeding and mortality risk are increased by ACLF but reduced by pre-emptive TIPS. J Hepatol. 2020; 73(5): 1082 - 1091. https://doi.org/10.1016/j.jhep.2020.04.024.
V, Pitarch C, Garcia E et al. Rebleeding and mortality risk are increased by ACLF but reduced by pre-emptive TIPS. J Hepatol. 2020; 73(5): 1082 - 1091. https://doi.org/10.1016/j.jhep.2020.04.024.
422.  O, Han G, Rudler M, Angrisani D, Monescillo A, Torres F et al. Effects of Early Placement of Transjugular Portosystemic Shunts in Patients With High-Risk Acute Variceal Bleeding: a Meta-analysis of Inpidual Patient Data. Gastroenterology. 2021; 160(1): 193 - 205.e10. https://doi.org/10.1053/j.gastro.2020.09.026.
O, Han G, Rudler M, Angrisani D, Monescillo A, Torres F et al. Effects of Early Placement of Transjugular Portosystemic Shunts in Patients With High-Risk Acute Variceal Bleeding: a Meta-analysis of Inpidual Patient Data. Gastroenterology. 2021; 160(1): 193 - 205.e10. https://doi.org/10.1053/j.gastro.2020.09.026.
423. Hermie L, Dhondt E, Vanlangenhove P, Hoste E, Geerts A, Defreyne L. Model for end-stage liver disease score and hemodynamic instability as a predictor of poor outcome in early transjugular intrahepatic portosystemic shunt treatment for acute variceal hemorrhage. Eur J Gastroenterol Hepatol. 2018; 30(12): 1441 - 1446. https://doi.org/10.1097/MEG.0000000000001222.
424. Lv Y, Yang Z, Liu L, Li K, He C, Wang Z et al. Early TIPS with covered stents versus standard treatment for acute variceal bleeding in patients with advanced cirrhosis: a randomised controlled trial. Lancet Gastroenterol Hepatol. 2019; 4(8): 587 - 598. https://doi.org/10.1016/S2468-1253(19)30090-1.
425. Gu W, Kimmann M, Laleman W, Praktiknjo M, Trebicka J. To TIPS or Not to TIPS in High Risk of Variceal Rebleeding and Acute-on-Chronic Liver Failure. Semin Liver Dis. 2023; 43(2): 189 - 205. https://doi.org/10.1055/a-2107-0576.
426. Malinchoc M, Kamath PS, Gordon FD, Peine CJ, Rank J, ter Borg PC. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts. Hepatology. 2000; 31(4): 864 - 871. https://doi.org/10.1053/he.2000.5852.
427. Bettinger D, Sturm L, Pfaff L, Hahn F, Kloeckner R, Volkwein L et al. Refining prediction of survival after TIPS with the novel Freiburg index of post-TIPS survival. J Hepatol. 2021; 74(6): 1362 - 1372. https://doi.org/10.1016/j.jhep.2021.01.023.
428. Bureau C,  S, D'Amico M,
S, D'Amico M, ![]() JM, Otal P, Pagan JC et al. Serum bilirubin and platelet count: a simple predictive model for survival in patients with refractory ascites treated by TIPS. J Hepatol. 2011; 54(5): 901 - 907. https://doi.org/10.1016/j.jhep.2010.08.025.
JM, Otal P, Pagan JC et al. Serum bilirubin and platelet count: a simple predictive model for survival in patients with refractory ascites treated by TIPS. J Hepatol. 2011; 54(5): 901 - 907. https://doi.org/10.1016/j.jhep.2010.08.025.
429. Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J. Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. Hepatology. 2017; 65(1): 310 - 335. https://doi.org/10.1002/hep.28906.
430. Maimone S, Saffioti F, Filomia R, Alibrandi A, ![]() G, Calvaruso V et al. Predictors of Re-bleeding and Mortality Among Patients with Refractory Variceal Bleeding Undergoing Salvage Transjugular Intrahepatic Portosystemic Shunt(TIPS). Dig Dis Sci. 2019; 64(5): 1335 - 1345. https://doi.org/10.1007/s10620-018-5412-x.
G, Calvaruso V et al. Predictors of Re-bleeding and Mortality Among Patients with Refractory Variceal Bleeding Undergoing Salvage Transjugular Intrahepatic Portosystemic Shunt(TIPS). Dig Dis Sci. 2019; 64(5): 1335 - 1345. https://doi.org/10.1007/s10620-018-5412-x.
431. Rodge G.A., Goenka U., Goenka M.K. Management of Refractory Variceal Bleed in Cirrhosis. J Clin Exp Hepatol. 2022 Mar - Apr; 12(2): 595 - 602. doi: 10.1016/j.jceh.2021.08.030.
432. Ahmed Z., Hassan M., Arif S.F., Aziz M., Iqbal U., et al. Comparative Efficacy of Treatment Options for the Prevention of Post-TIPS Hepatic Encephalopathy: A Systematic Review and Network Meta-analysis. J Gastrointestin Liver Dis. 2023 Apr 1; 32(1): 70 - 76. doi: 10.15403/jgld-4508.
433. Seifert LL, Schindler P, Schoster M, Weller JF, Wilms C, Schmidt HH et al. Recurrence of Hepatic Encephalopathy after TIPS: Effective Prophylaxis with Combination of Lactulose and Rifaximin. J Clin Med. 2021; 10(20): 4763. https://doi.org/10.3390/jcm10204763.
434. Bureau C, Thabut D, Jezequel C, Archambeaud I, D'Alteroche L, Dharancy S et al. The Use of Rifaximin in the Prevention of Overt Hepatic Encephalopathy After Transjugular Intrahepatic Portosystemic Shunt: A Randomized Controlled Trial. Ann Intern Med. 2021; 174(5): 633 - 640. https://doi.org/10.7326/M20-0202.
435. Saad WE. Balloon-occluded retrograde transvenous obliteration of gastric varices: concept, basic techniques, and outcomes. Semin Intervent Radiol. 2012; 29(2): 118 - 128. https://doi.org/10.1055/s-0032-1312573.
436. Wang ZW, Liu JC, Zhao F, Zhang WG, Duan XH, Chen PF et al. Comparison of the Effects of TIPS versus BRTO on Bleeding Gastric Varices: A Meta-Analysis. Can J Gastroenterol Hepatol. 2020: 5143013. https://doi.org/10.1155/2020/5143013.
437. Paleti S., Nutalapati V., Fathallah J., Jeepalyam S., Rustagi T. Balloon-Occluded Retrograde Transvenous Obliteration (BRTO) Versus Transjugular Intrahepatic Portosystemic Shunt (TIPS) for Treatment of Gastric Varices Because of Portal Hypertension: A Systematic Review and Meta-Analysis. J Clin Gastroenterol. 2020 Aug; 54(7): 655 - 660. doi: 10.1097/MCG.0000000000001275.
438. Saad WE, Kitanosono T, Koizumi J. Balloon-occluded antegrade transvenous obliteration with or without balloon-occluded retrograde transvenous obliteration for the management of gastric varices: concept and technical applications. Tech Vasc Interv Radiol. 2012; 15(3): 203 - 225. https://doi.org/10.1053/j.tvir.2012.07.004.
439. Saad WE, Wagner CC, Lippert A, Al-Osaimi A, Davies MG, Matsumoto AH et al. Protective value of TIPS against the development of hydrothorax/ascites and upper gastrointestinal bleeding after balloon-occluded retrograde transvenous obliteration (BRTO). Am J Gastroenterol. 2013; 108(10): 1612 - 1619. https://doi.org/10.1038/ajg.2013.232.
440. Wang YB, Zhang JY, Gong JP, Zhang F, Zhao Y. Balloon-occluded retrograde transvenous obliteration versus transjugular intrahepatic portosystemic shunt for treatment of gastric varices due to portal hypertension: A meta-analysis. J Gastroenterol Hepatol. 2016; 31(4): 727 - 733. https://doi.org/10.1111/jgh.13248.
441. Saad WE, Darcy MD. Transjugular Intrahepatic Portosystemic Shunt (TIPS) versus Balloon-occluded Retrograde Transvenous Obliteration (BRTO) for the Management of Gastric Varices. Semin Intervent Radiol. 2011; 28(3): 339 - 349. https://doi.org/10.1055/s-0031-1284461.
442. Henry Z, Patel K, Patton H, Saad W. AGA Clinical Practice Update on Management of Bleeding Gastric Varices: Expert Review. Clin Gastroenterol Hepatol. 2021; 19(6): 1098 - 1107. e1. https://doi.org/10.1016/j.cgh.2021.01.027.
443. Mishra SR, Sharma BC, Kumar A, Sarin SK. Primary prophylaxis of gastric variceal bleeding comparing cyanoacrylate injection and beta-blockers: a randomized controlled trial. J Hepatol. 2011; 54(6): 1161 - 1167. https://doi.org/10.1016/j.jhep.2010.09.031.
444. Saad WE. Vascular anatomy and the morphologic and hemodynamic classifications of gastric varices and spontaneous portosystemic shunts relevant to the BRTO procedure. Tech Vasc Interv Radiol. 2013; 16(2): 60 - 100. https://doi.org/10.1053/j.tvir.2013.02.002.
445. Tripathi D, Therapondos G, Jackson E, Redhead DN, Hayes PC. The role of the transjugular intrahepatic portosystemic stent shunt (TIPSS) in the management of bleeding gastric varices: clinical and haemodynamic correlations. Gut. 2002; 51(2): 270 - 274. https://doi.org/10.1136/gut.51.2.270.
446. Boike JR, Mazumder NR, Kolli KP, Ge J, German M, Jest N et al. Outcomes After TIPS for Ascites and Variceal Bleeding in a Contemporary Era-An ALTA Group Study. Am J Gastroenterol. 2021; 116(10): 2079 - 2088. https://doi.org/10.14309/ajg.0000000000001357.
447. Chapin SE, Goldberg DS, Kaplan DE, Mahmud N. External Validation of the FIPS Score for Post-TIPS Mortality in a National Veterans Affairs Cohort. Dig Dis Sci. 2022; 67(9): 4581 - 4589. https://doi.org/10.1007/s10620-021-07307-5.
448. Chau TN, Patch D, Chan YW, Nagral A, Dick R, Burroughs AK. "Salvage" transjugular intrahepatic portosystemic shunts: gastric fundal compared with esophageal variceal bleeding. Gastroenterology. 1998; 114(5): 981 - 987. https://doi.org/10.1016/s0016-5085(98) 00640-4.
449. El Shahawy MS, Shady ZM, Gaafar A. The Efficacy of Argon Plasma Coagulation versus Carvedilol for Treatment of Portal Hypertensive Gastropathy. Digestion. 2020; 101(6): 651 - 658. https://doi.org/10.1159/000502814.
450. Hashim AE, Zaky S, Berengy MS. Effect of Endoscopic Argon Plasma Coagulation on Gastrointestinal Blood Loss Due to Portal Hypertensive Gastropathy. J Clin Gastroenterol Hepatol. 2017; 1(2): 1. https://doi.org/10.21767/2575-7733.1000009.
451. Herrera S, Bordas JM, Llach J, ![]() A,
A, ![]() M,
M,  G et al. The beneficial effects of argon plasma coagulation in the management of different types of gastric vascular ectasia lesions in patients admitted for GI hemorrhage. Gastrointest Endosc. 2008; 68(3): 440 - 446. https://doi.org/10.1016/j.gie.2008.02.009.
G et al. The beneficial effects of argon plasma coagulation in the management of different types of gastric vascular ectasia lesions in patients admitted for GI hemorrhage. Gastrointest Endosc. 2008; 68(3): 440 - 446. https://doi.org/10.1016/j.gie.2008.02.009.
452. Bansal RK, Gupta MK, Gupta VK, Kaur G, Seth AK et al. Endoscopic Treatment of Upper Gastrointestinal Bleeding Using Haemoseal Spray: A Retrospective, Observational Study from a Tertiary Center in North India. J Dig Endosc. 2020; 11(04): 279 - 282. https://doi.org/10.1055/s-0040-1722387.
453. ![]() J, Bordas JM,
J, Bordas JM, ![]() JM, Bosch J,
JM, Bosch J,  JC, Feu F et al. Increased gastric mucosal perfusion in cirrhotic patients with portal hypertensive gastropathy. Gastroenterology. 1992; 103(6): 1875 - 1882. https://doi.org/10.1016/0016-5085(92) 91447-c.
JC, Feu F et al. Increased gastric mucosal perfusion in cirrhotic patients with portal hypertensive gastropathy. Gastroenterology. 1992; 103(6): 1875 - 1882. https://doi.org/10.1016/0016-5085(92) 91447-c.
454. Merli M, Nicolini G, Angeloni S, Gentili F, Attili AF, Riggio O. The natural history of portal hypertensive gastropathy in patients with liver cirrhosis and mild portal hypertension. Am J Gastroenterol. 2004; 99(10): 1959 - 1965. https://doi.org/10.1111/j.1572-0241.2004.40246.x.
455. Zhou Y, Qiao L, Wu J, Hu H, Xu C. Comparison of the efficacy of octreotide, vasopressin, and omeprazole in the control of acute bleeding in patients with portal hypertensive gastropathy: a controlled study. J Gastroenterol Hepatol. 2002; 17(9): 973 - 979. https://doi.org/10.1046/j.1440-1746.2002.02775.x.
456. Kouroumalis EA, Koutroubakis IE, Manousos ON. Somatostatin for acute severe bleeding from portal hypertensive gastropathy. Eur J Gastroenterol Hepatol. 1998; 10(6): 509 - 512. https://doi.org/10.1097/00042737-199806000-00013.
457. Wong F. Management of refractory ascites. Clin Mol Hepatol. 2023; 29(1): 16 - 32. https://doi.org/10.3350/cmh.2022.0104.
458. Bai M, Qi XS, Yang ZP, Yang M, Fan DM, Han GH. TIPS improves liver transplantation-free survival in cirrhotic patients with refractory ascites: an updated meta-analysis. World J Gastroenterol. 2014; 20(10): 2704 - 2714. https://doi.org/10.3748/wjg.v20.i10.2704.
459. Albillos A,  R,
R,  M, Ripoll C, Gonzalez R, Catalina MV, Molinero LM. Value of the hepatic venous pressure gradient to monitor drug therapy for portal hypertension: a meta-analysis. Am J Gastroenterol. 2007; 102(5): 1116 - 1126. https://doi.org/10.1111/j.1572-0241.2007.01191.x.
M, Ripoll C, Gonzalez R, Catalina MV, Molinero LM. Value of the hepatic venous pressure gradient to monitor drug therapy for portal hypertension: a meta-analysis. Am J Gastroenterol. 2007; 102(5): 1116 - 1126. https://doi.org/10.1111/j.1572-0241.2007.01191.x.
460. Chen RP, Zhu Ge XJ, Huang ZM, Ye XH, Hu CY, Lu GR et al. Prophylactic use of transjugular intrahepatic portosystemic shunt aids in the treatment of refractory ascites: metaregression and trial sequential meta-analysis. J Clin Gastroenterol. 2014; 48(3): 290 - 299. https://doi.org/10.1097/MCG.0b013e3182a115e9.
461. Trebicka J. Does Transjugular Intrahepatic Portosystemic Shunt Stent Differentially Improve Survival in a Subset of Cirrhotic Patients? Semin Liver Dis. 2018; 38(1): 87 - 96. https://doi.org/10.1055/s-0038-1627457.
462. Durand F, Levitsky J, Cauchy F, Gilgenkrantz H, Soubrane O, Francoz C. Age and liver transplantation. J Hepatol. 2019; 70(4): 745 - 758. https://doi.org/10.1016/j.jhep.2018.12.009.
463. Martin P, DiMartini A, Feng S, Brown R Jr, Fallon M. Evaluation for liver transplantation in adults: 2013 practice guideline by the American Association for the Study of Liver Diseases and the American Society of Transplantation. Hepatology. 2014; 59(3): 1144 - 1165. https://doi.org/10.1002/hep.26972.
464. Sharpton SR, Feng S, Hameed B, Yao F, Lai JC. Combined effects of recipient age and model for end-stage liver disease score on liver transplantation outcomes. Transplantation. 2014; 98(5): 557 - 562. https://doi.org/10.1097/TP.0000000000000090.
465. Dolnikov S, Adam R, Cherqui D, Allard MA. Liver transplantation in elderly patients: what do we know at the beginning of 2020? Surg Today. 2020; 50(6): 533 - 539. https://doi.org/10.1007/s00595-020-01996-7.
466.  Gavara C, Esposito F, Gurusamy K, Salloum C, Lahat E, Feray C et al. Liver transplantation in elderly patients: a systematic review and first meta-analysis. HPB (Oxford). 2019; 21(1): 14 - 25. https://doi.org/10.1016/j.hpb.2018.07.025.
Gavara C, Esposito F, Gurusamy K, Salloum C, Lahat E, Feray C et al. Liver transplantation in elderly patients: a systematic review and first meta-analysis. HPB (Oxford). 2019; 21(1): 14 - 25. https://doi.org/10.1016/j.hpb.2018.07.025.
467. Schwartz J, Thiesset H, Box T, Hutson W, Sorensen J. Liver transplantation in septuagenarians receiving model for end-stage liver disease exception points for hepatocellular carcinoma: the national experience. Liver Transpl. 2012; 18(11): 1395 - 1396. https://doi.org/10.1002/lt.23513.
468. Adam R, Karam V, Delvart V, O'Grady J, Mirza D, Klempnauer J et al. Evolution of indications and results of liver transplantation in Europe. A report from the European Liver Transplant Registry (ELTR). J Hepatol. 2012; 57(3): 675 - 688. https://doi.org/10.1016/j.jhep.2012.04.015.
469. Diwan TS, Lee TC, Nagai S, Benedetti E, Posselt A, Bumgardner G et al. Obesity, transplantation, and bariatric surgery: An evolving solution for a growing epidemic. Am J Transplant. 2020; 20(8): 2143 - 2155. https://doi.org/10.1111/ajt.15784.
470. Bhanji RA, Takahashi N, Moynagh MR, Narayanan P, Angirekula M, Mara KC et al. The evolution and impact of sarcopenia pre- and post-liver transplantation. Aliment Pharmacol Ther. 2019; 49(6): 807 - 813. https://doi.org/10.1111/apt.15161.
471. Brown S, Richardson B, Bouquet E, Reid E, Mercer E, Goncalves M et al. Cirrhosis-related sarcopenia may not resolve after liver transplantation. JHEP Rep. 2023; 5(11): 100881. https://doi.org/10.1016/j.jhepr.2023.100881.
472. Lin FP, Visina JM, Bloomer PM, Dunn MA, Josbeno DA, Zhang X et al. Prehabilitation-Driven Changes in Frailty Metrics Predict Mortality in Patients With Advanced Liver Disease. Am J Gastroenterol. 2021; 116(10): 2105 - 2117. https://doi.org/10.14309/ajg.0000000000001376.
473. Bhangui P, Lim C, Levesque E, Salloum C, Lahat E, Feray C, Azoulay D. Novel classification of non-malignant portal vein thrombosis: A guide to surgical decision-making during liver transplantation. J Hepatol. 2019; 71(5): 1038 - 1050. https://doi.org/10.1016/j.jhep.2019.08.012.
474. Fundora Y, Hessheimer AJ, Del Prete L, Maroni L, Lanari J, Barrios O et al. Alternative forms of portal vein revascularization in liver transplant recipients with complex portal vein thrombosis. J Hepatol. 2023; 78(4): 794 - 804. https://doi.org/10.1016/j.jhep.2023.01.007.
475. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Liver transplantation. J Hepatol. 2016; 64(2): 433 - 485. https://doi.org/10.1016/j.jhep.2015.10.006.
476. Mathurin P. Early liver transplantation for acute alcoholic hepatitis: We can't say no. J Hepatol. 2021; 75(3): 718 - 722. https://doi.org/10.1016/j.jhep.2021.05.019.
477. Louvet A, Labreuche J, Artru F, Boursier J, Kim DJ, O'Grady J et al. Combining Data From Liver Disease Scoring Systems Better Predicts Outcomes of Patients With Alcoholic Hepatitis. Gastroenterology. 2015; 149(2): 398 - 406. e8. https://doi.org/10.1053/j.gastro.2015.04.044.
478. Acuna SA, Sutradhar R, Kim SJ, Baxter NN. Solid Organ Transplantation in Patients With Preexisting Malignancies in Remission: A Propensity Score Matched Cohort Study. Transplantation. 2018; 102(7): 1156 - 1164. https://doi.org/10.1097/TP.0000000000002178.
479. Al-Adra DP, Hammel L, Roberts J, Woodle ES, Levine D, Mandelbrot D et al. Pretransplant solid organ malignancy and organ transplant candidacy: A consensus expert opinion statement. Am J Transplant. 2021; 21(2): 460 - 474. https://doi.org/10.1111/ajt.16318.
480. Merion RM, Schaubel DE, Dykstra DM, Freeman RB, Port FK, Wolfe RA. The survival benefit of liver transplantation. Am J Transplant. 2005; 5(2): 307 - 313. https://doi.org/10.1111/j.1600-6143.2004.00703.x.
481. Kim WR, Biggins SW, Kremers WK, Wiesner RH, Kamath PS, Benson JT et al. Hyponatremia and mortality among patients on the liver-transplant waiting list. N Engl J Med. 2008; 359(10): 1018 - 1026. https://doi.org/10.1056/NEJMoa0801209.
482. Goudsmit BFJ, Putter H, Tushuizen ME, de Boer J, Vogelaar S, Alwayn IPJ et al. Validation of the Model for End-stage Liver Disease sodium (MELD-Na) score in the Eurotransplant region. Am J Transplant. 2021; 21(1): 229 - 240. https://doi.org/10.1111/ajt.16142.
483. Goudsmit BFJ, Ilaria Prosepe, Tushuizen ME, Mazzaferro V, Alwayn IPJ, van Hoek B et al. Survival benefit from liver transplantation for patients with and without hepatocellular carcinoma. JHEP Rep. 2023; 5(12): 100907. https://doi.org/10.1016/j.jhepr.2023.100907.
484.  MC,
MC,  A, Guevara M,
A, Guevara M, ![]() L, de Las Heras D, Navasa M et al. MELD score and serum sodium in the prediction of survival of patients with cirrhosis awaiting liver transplantation. Gut. 2007; 56(9): 1283 - 1290. https://doi.org/10.1136/gut.2006.102764.
L, de Las Heras D, Navasa M et al. MELD score and serum sodium in the prediction of survival of patients with cirrhosis awaiting liver transplantation. Gut. 2007; 56(9): 1283 - 1290. https://doi.org/10.1136/gut.2006.102764.
485. Freeman RB Jr, Gish RG, Harper A, Davis GL, Vierling J, Lieblein L et al. Model for end-stage liver disease (MELD) exception guidelines: results and recommendations from the MELD Exception Study Group and Conference (MESSAGE) for the approval of patients who need liver transplantation with diseases not considered by the standard MELD formula. Liver Transpl. 2006; 12(12 Suppl. 3): S128 - 136. https://doi.org/10.1002/lt.20979.
486. Dirchwolf M, Becchetti C, Gschwend SG, Toso C, Dutkowski P, Immer F et al. The MELD upgrade exception: a successful strategy to optimize access to liver transplantation for patients with high waiting list mortality. HPB (Oxford). 2022; 24(7): 1168 - 1176. https://doi.org/10.1016/j.hpb.2021.12.009.
487. Tschuor C, Ferrarese A, Kuemmerli C, Dutkowski P, Burra P, Clavien PA. Allocation of liver grafts worldwide - Is there a best system? J Hepatol. 2019; 71(4): 707 - 718. https://doi.org/10.1016/j.jhep.2019.05.025.
488. Jepsen P, Watson H, Macdonald S, Vilstrup H, Jalan R. MELD remains the best predictor of mortality in outpatients with cirrhosis and severe ascites. Aliment Pharmacol Ther. 2020; 52(3): 492 - 499. https://doi.org/10.1111/apt.15882.
489. Heuman DM, Abou-Assi SG, Habib A, Williams LM, Stravitz RT, Sanyal AJ et al. Persistent ascites and low serum sodium identify patients with cirrhosis and low MELD scores who are at high risk for early death. Hepatology. 2004; 40(4): 802 - 810. https://doi.org/10.1002/hep.20405.
490. Freeman RB Jr, Wiesner RH, Harper A, McDiarmid SV, Lake J, Edwards E et al. The new liver allocation system: moving toward evidence-based transplantation policy. Liver Transpl. 2002; 8(9): 851 - 858. https://doi.org/10.1053/jlts.2002.35927.
491. Wong F, Pappas SC, Curry MP, Reddy KR, Rubin RA, Porayko MK et al. Terlipressin plus Albumin for the Treatment of Type 1 Hepatorenal Syndrome. N Engl J Med. 2021; 384(9): 818 - 828. https://doi.org/10.1056/NEJMoa2008290.
492. Terbah R, Cao J, Wong D, Lim PCH, Gow P, Testro A, Sinclair M. Outcomes of patients with hepatorenal syndrome undergoing liver transplantation in the era of terlipressin. Eur J Gastroenterol Hepatol. 2023; 35(8): 881 - 888. https://doi.org/10.1097/MEG.0000000000002584.
493. Bera C, Wong F. Management of hepatorenal syndrome in liver cirrhosis: a recent update. Therap Adv Gastroenterol. 2022; 15: 17562848221102679. https://doi.org/10.1177/17562848221102679.
494. Piano S, Gambino C, Vettore E, Calvino V, Tonon M, Boccagni P et al. Response to Terlipressin and Albumin Is Associated With Improved Liver Transplant Outcomes in Patients With Hepatorenal Syndrome. Hepatology. 2021; 73(5): 1909 - 1919. https://doi.org/10.1002/hep.31529.
495. Curry MP, Vargas HE, Befeler AS, Pyrsopoulos NT, Patwardhan VR, Jamil K. Early treatment with terlipressin in patients with hepatorenal syndrome yields improved clinical outcomes in North American studies. Hepatol Commun. 2023; 7(1): e1307. https://doi.org/10.1097/01.HC9.0000897228.91307.0c.
496. ![]() T, Moreno C, Francoz C, Razek WA, Paugham C, Belghitti J et al. The impact of preoperative hepatic hydrothorax on the outcome of adult liver transplantation. Eur J Gastroenterol Hepatol. 2010; 22(2): 207 - 212. https://doi.org/10.1097/MEG.0b013e3283311140.
T, Moreno C, Francoz C, Razek WA, Paugham C, Belghitti J et al. The impact of preoperative hepatic hydrothorax on the outcome of adult liver transplantation. Eur J Gastroenterol Hepatol. 2010; 22(2): 207 - 212. https://doi.org/10.1097/MEG.0b013e3283311140.
497. Krowka MJ, Mandell MS, Ramsay MA, Kawut SM, Fallon MB, Manzarbeitia C et al. Hepatopulmonary syndrome and portopulmonary hypertension: a report of the multicenter liver transplant database. Liver Transpl. 2004; 10(2): 174 - 182. https://doi.org/10.1002/lt.20016.
498. Fathma S, Boateng S, Amatya A, Ameyaw P, Banini BA. The impact of MELD exception points for hydrothorax on posttransplant mortality: a propensity score-matched analysis. Eur J Gastroenterol Hepatol. 2024; 36(8): 1016 - 1021. https://doi.org/10.1097/MEG.0000000000002792.
499. Weinfurtner Kю, Forde K. Hepatopulmonary Syndrome and Portopulmonary Hypertension: Current Status and Implications for Liver Transplantation. Curr Hepatol Rep. 2020 Sep; 19(3): 174 - 185. doi: 10.1007/s11901-020-00532-y.
500. DuBrock H.M., Forde K., Krok K., Patel M., Al-Naamani N., et al. Cardiac index and hepatopulmonary syndrome in liver transplantation candidates: The pulmonary vascular complications of liver disease study. Liver Transpl. 2023 May 1; 29(5): 467 - 475. doi: 10.1097/LVT.0000000000000112.
501. Fallon MB, Krowka MJ, Brown RS, Trotter JF, Zacks S, Roberts KE et al. Impact of hepatopulmonary syndrome on quality of life and survival in liver transplant candidates. Gastroenterology. 2008; 135(4): 1168 - 1175. https://doi.org/10.1053/j.gastro.2008.06.038.
502. Masuda T, Shirabe K, Ikegami T, Harimoto N, Yoshizumi T, Soejima Y et al. Sarcopenia is a prognostic factor in living donor liver transplantation. Liver Transpl. 2014; 20(4): 401 - 407. https://doi.org/10.1002/lt.23811.
503. Merli M, Giusto M, Gentili F, Novelli G, Ferretti G, Riggio O et al. Nutritional status: its influence on the outcome of patients undergoing liver transplantation. Liver Int. 2010; 30(2): 208 - 214. https://doi.org/10.1111/j.1478-3231.2009.02135.x.
504. Reichelt S, Pratschke J, Engelmann C, Neumann UP, Lurje G, Czigany Z. Body composition and the skeletal muscle compartment in liver transplantation: Turning challenges into opportunities. Am J Transplant. 2022; 22(8): 1943 - 1957. https://doi.org/10.1111/ajt.17089.
505. Reichelt S, Merle U, Klauss M, Kahlert C, Lurje G, Mehrabi A, Czigany Z. Shining a spotlight on sarcopenia and myosteatosis in liver disease and liver transplantation: Potentially modifiable risk factors with major clinical impact. Liver Int. 2024; 44(7): 1483 - 1512. https://doi.org/10.1111/liv.15917.
506. Schmidt NP, Fernandes SA, Silveira AT, Rayn RG, Henz AC, Rossi D et al. Nutritional and functional rehabilitation in cirrhotic patients. J Gastroenterol Hepatol Res. 2021; 10(2). Available at: http://www.ghrnet.org/index.php/joghr/article/view/3075.
507. Mansour D, Masson S, Shawcross DL, Douds AC, Bonner E, Corless L et al. British Society of Gastroenterology Best Practice Guidance: outpatient management of cirrhosis - part 1: compensated cirrhosis. Frontline Gastroenterol. 2023; 14(6): 453 - 461. https://doi.org/10.1136/flgastro-2023-102430.
508. Tonon M, D'Ambrosio R, Calvino V, Tosetti G, Barone A, Incicco S et al. A new clinical and prognostic characterization of the patterns of decompensation of cirrhosis. J Hepatol. 2024; 80(4): 603 - 609. https://doi.org/10.1016/j.jhep.2023.12.005.
509. Shetty A, Jun Yum J, Saab S. The Gastroenterologist's Guide to Preventive Management of Compensated Cirrhosis. Gastroenterol Hepatol (N Y). 2019; 15(8): 423 - 430.
510. Grattagliano I, Ubaldi E, Bonfrate L, Portincasa P. Management of liver cirrhosis between primary care and specialists. World J Gastroenterol. 2011; 17(18): 2273 - 2282. https://doi.org/10.3748/wjg.v17.i18.2273.
511. D'Amico G, Morabito A, Pagliaro L, Marubini E. Survival and prognostic indicators in compensated and decompensated cirrhosis. Dig Dis Sci. 1986; 31(5): 468 - 475. https://doi.org/10.1007/BF01320309.
512. D'Amico G, Pagliaro L. The Clinical Course of Portal Hypertension in Liver Cirrhosis. In: Rossi P, Ricci P, Broglia L (eds.). Portal Hypertension. Medical Radiology. Berlin, Heidelberg: Springer, 2000, pp. 15 - 24. https://doi.org/10.1007/978-3-642-57116-9_2.
513. Pagliaro L, D'Amico G, Pasta L., et al. (1994) Portal Hypertension in Cirrhosis: Natural History. In: Bosch J., Groszmann RJ (eds.). Portal Hypertension. Pathophysiology and Treatment. Oxford, Boston: Blackwell Scientific, 1994, pp. 72 - 92.
514. Caraceni P. Riggio O., Angeli P., Alessandria C., Neri S., Foschi F.G., et al. ANSWER Study Investigators. Long-term albumin administration in decompensated cirrhosis (ANSWER): an open-label randomised trial. Lancet. 2018 Jun 16; 391(10138): 2417 - 2429. doi: 10.1016/S0140-6736(18)30840-7. Erratum in: Lancet. 2018 Aug 4; 392(10145): 386. doi: 10.1016/S0140-6736(18)31709-4.
515. Bai Z,  N, Romeiro FG, Mancuso A, Philips CA, Tacke F et al. Use of albumin infusion for cirrhosis-related complications: An international position statement. JHEP Rep. 2023; 5(8): 100785. https://doi.org/10.1016/j.jhepr.2023.100785.
N, Romeiro FG, Mancuso A, Philips CA, Tacke F et al. Use of albumin infusion for cirrhosis-related complications: An international position statement. JHEP Rep. 2023; 5(8): 100785. https://doi.org/10.1016/j.jhepr.2023.100785.
516. Turkina A, Maevskaya M, Zharkova M, Ivashkin V. The role of prolonged albumin replacement therapy in correction of its structure and functional properties and management of ascites. J Hepatol. 2023; 78(Suppl. 1): S260. https://doi.org/10.1016/S0168-8278(23)00827-9.
517. Туркина АА, Маевская МВ, Жаркова МС, Ивашкин ВТ. Роль заместительной терапии альбумином в лечении печеночной энцефалопатии у больных циррозом печени. Медицинский совет. 2023; (13): 102 - 107. https://doi.org/10.21518/ms2023-140.
518. Heybe MA, Mehta KJ. Role of albumin infusion in cirrhosis-associated complications. Clin Exp Med. 2024; 24(1): 58. https://doi.org/10.1007/s10238-024-01315-1.
519. Soni H, Kumar-M P, Sharma V, Bellam BL, Mishra S, Mahendru D et al. Antibiotics for prophylaxis of spontaneous bacterial peritonitis: systematic review & Bayesian network meta-analysis. Hepatol Int. 2020; 14(3): 399 - 413. https://doi.org/10.1007/s12072-020-10025-1.
520. Loomba R, Wesley R, Bain A, Csako G, Pucino F. Role of fluoroquinolones in the primary prophylaxis of spontaneous bacterial peritonitis: meta-analysis. Clin Gastroenterol Hepatol. 2009; 7(4): 487 - 493. https://doi.org/10.1016/j.cgh.2008.12.018.
521. Saab S, Hernandez JC, Chi AC, Tong MJ. Oral antibiotic prophylaxis reduces spontaneous bacterial peritonitis occurrence and improves short-term survival in cirrhosis: a meta-analysis. Am J Gastroenterol. 2009; 104(4): 993 - 1001. https://doi.org/10.1038/ajg.2009.3.
522. Min YW, Lim KS, Min BH, Gwak GY, Paik YH, Choi MS et al. Proton pump inhibitor use significantly increases the risk of spontaneous bacterial peritonitis in 1965 patients with cirrhosis and ascites: a propensity score matched cohort study. Aliment Pharmacol Ther. 2014; 40(6): 695 - 704. https://doi.org/10.1111/apt.12875.
523. Zhang SH, Zhu ZY, Chen Z, Li Y, Zou Y, Yan M et al. Population Pharmacokinetics and Dosage Optimization of Linezolid in Patients with Liver Dysfunction. Antimicrob Agents Chemother. 2020; 64(6): e00133 - 20. https://doi.org/10.1128/AAC.00133-20.
524. Praharaj DL, Premkumar M, Roy A, Verma N, Taneja S, Duseja A et al. Norfloxacin for Spontaneous Bacterial Peritonitis Prophylaxis: A Randomized Controlled Trial. J Clin Exp Hepatol. 2022; 12(2): 336 - 342. https://doi.org/10.1016/j.jceh.2021.08.010.
525. ![]() P, Rimola A, Planas R, Vargas V, Marco F, Almela M et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a double-blind, placebo-controlled trial. Hepatology. 1990; 12(4 Pt 1): 716 - 724. https://doi.org/10.1002/hep.1840120416.
P, Rimola A, Planas R, Vargas V, Marco F, Almela M et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a double-blind, placebo-controlled trial. Hepatology. 1990; 12(4 Pt 1): 716 - 724. https://doi.org/10.1002/hep.1840120416.
526. Rowe IA, Villanueva C, Shearer JE, Torres F, Albillos A,  J et al. Quantifying the benefit of nonselective beta-blockers in the prevention of hepatic decompensation: A Bayesian reanalysis of the PREDESCI trial. Hepatology. 2023; 78(2): 530 - 539. https://doi.org/10.1097/HEP.0000000000000342.
J et al. Quantifying the benefit of nonselective beta-blockers in the prevention of hepatic decompensation: A Bayesian reanalysis of the PREDESCI trial. Hepatology. 2023; 78(2): 530 - 539. https://doi.org/10.1097/HEP.0000000000000342.
527. Cheung KS, Mok CH, Lam LK, Mao XH, Mak LY, Seto WK, Yuen MF. Carvedilol Versus Other Nonselective Beta Blockers for Variceal Bleeding Prophylaxis and Death: A Network Meta-analysis. J Clin Transl Hepatol. 2023; 11(5): 1143 - 1149. https://doi.org/10.14218/JCTH.2022.00130S.
528. Lo GH, Lai KH, Cheng JS, Hsu PI, Chen TA, Wang EM et al. The effects of endoscopic variceal ligation and propranolol on portal hypertensive gastropathy: a prospective, controlled trial. Gastrointest Endosc. 2001; 53(6): 579 - 584. https://doi.org/10.1067/mge.2001.114062.
529. Hosking SW, Kennedy HJ, Seddon I, Triger DR. The role of propranolol in congestive gastropathy of portal hypertension. Hepatology. 1987; 7(3): 437 - 441. https://doi.org/10.1002/hep.1840070304.
530.  RM,
RM, ![]() JM, Bosch J,
JM, Bosch J, ![]() J,
J,  A,
A, ![]() R et al. Propranolol in prevention of recurrent bleeding from severe portal hypertensive gastropathy in cirrhosis. Lancet. 1991; 337(8755): 1431 - 1434. https://doi.org/10.1016/0140-6736(91) 93125-s.
R et al. Propranolol in prevention of recurrent bleeding from severe portal hypertensive gastropathy in cirrhosis. Lancet. 1991; 337(8755): 1431 - 1434. https://doi.org/10.1016/0140-6736(91) 93125-s.
531. Garcia-Pagan JC, De Gottardi A, Bosch J. Review article: the modern management of portal hypertension - primary and secondary prophylaxis of variceal bleeding in cirrhotic patients. Aliment Pharmacol Ther. 2008; 28(2): 178 - 186. https://doi.org/10.1111/j.1365-2036.2008.03729.x.
532. Li T, Ke W, Sun P, Chen X, Belgaumkar A, Huang Y et al. Carvedilol for portal hypertension in cirrhosis: systematic review with meta-analysis. BMJ Open. 2016; 6(5): e010902. https://doi.org/10.1136/bmjopen-2015-010902.
533. Kim SG, Kim TY, Sohn JH, Um SH, Seo YS, Baik SK et al. A Randomized, Multi-Center, Open-Label Study to Evaluate the Efficacy of Carvedilol vs. Propranolol to Reduce Portal Pressure in Patients With Liver Cirrhosis. Am J Gastroenterol. 2016; 111(11): 1582 - 1590. https://doi.org/10.1038/ajg.2016.327.
534. Conn HO, Grace ND, Bosch J, Groszmann RJ, ![]() J, Wright SC et al. Propranolol in the prevention of the first hemorrhage from esophagogastric varices: A multicenter, randomized clinical trial. The Boston-New Haven-Barcelona Portal Hypertension Study Group. Hepatology. 1991; 13(5): 902 - 912.
J, Wright SC et al. Propranolol in the prevention of the first hemorrhage from esophagogastric varices: A multicenter, randomized clinical trial. The Boston-New Haven-Barcelona Portal Hypertension Study Group. Hepatology. 1991; 13(5): 902 - 912.
535. Merkel C, Marin R, Sacerdoti D, Donada C, Cavallarin G, Torboli P et al. Long-term results of a clinical trial of nadolol with or without isosorbide mononitrate for primary prophylaxis of variceal bleeding in cirrhosis. Hepatology. 2000; 31(2): 324 - 329. https://doi.org/10.1002/hep.510310210.
536. Lay CS, Tsai YT, Lee FY, Lai YL, Yu CJ, Chen CB, Peng CY. Endoscopic variceal ligation versus propranolol in prophylaxis of first variceal bleeding in patients with cirrhosis. J Gastroenterol Hepatol. 2006; 21(2): 413 - 419. https://doi.org/10.1111/j.1440-1746.2005.04071.x.
537. Lo GH, Chen WC, Chen MH, Lin CP, Lo CC, Hsu PI et al. Endoscopic ligation vs. nadolol in the prevention of first variceal bleeding in patients with cirrhosis. Gastrointest Endosc. 2004; 59(3): 333 - 338. https://doi.org/10.1016/s0016-5107(03) 02819-0.
538. Sarin SK, Wadhawan M, Agarwal SR, Tyagi P, Sharma BC. Endoscopic variceal ligation plus propranolol versus endoscopic variceal ligation alone in primary prophylaxis of variceal bleeding. Am J Gastroenterol. 2005; 100(4): 797 - 804. https://doi.org/10.1111/j.1572-0241.2005.40468.x.
539. Yoshida H, Mamada Y, Taniai N, Yamamoto K, Kawano Y, Mizuguchi Y et al. A randomized control trial of bi-monthly versus bi-weekly endoscopic variceal ligation of esophageal varices. Am J Gastroenterol. 2005; 100(9): 2005 - 2009. https://doi.org/10.1111/j.1572-0241.2005.41864.x.
540. Sheibani S, Khemichian S, Kim JJ, Hou L, Yan AW, Buxbaum J et al. Randomized trial of 1-week versus 2-week intervals for endoscopic ligation in the treatment of patients with esophageal variceal bleeding. Hepatology. 2016; 64(2): 549 - 555. https://doi.org/10.1002/hep.28597.
541. Takuma Y, Nouso K, Makino Y, Saito S, Shiratori Y. Prophylactic balloon-occluded retrograde transvenous obliteration for gastric varices in compensated cirrhosis. Clin Gastroenterol Hepatol. 2005; 3(12): 1245 - 1252. https://doi.org/10.1016/s1542-3565(05)00744-5.
542. Tevethia HV, Pande A, Vijayaraghavan R, Kumar G, Sarin SK. Combination of carvedilol with variceal band ligation in prevention of first variceal bleed in Child-Turcotte-Pugh B and C cirrhosis with high-risk oesophageal varices: the 'CAVARLY TRIAL'. Gut. 2024; 73(11): 1844 - 1853. https://doi.org/10.1136/gutjnl-2023-331181.
543. Sharma M, Singh S, Desai V, Shah VH, Kamath PS, Murad MH, Simonetto DA. Comparison of Therapies for Primary Prevention of Esophageal Variceal Bleeding: A Systematic Review and Network Meta-analysis. Hepatology. 2019; 69(4): 1657 - 1675. https://doi.org/10.1002/hep.30220.
544. Tripathi D, Ferguson JW, Kochar N, Leithead JA, Therapondos G, McAvoy NC et al. Randomized controlled trial of carvedilol versus variceal band ligation for the prevention of the first variceal bleed. Hepatology. 2009; 50(3): 825 - 833. https://doi.org/10.1002/hep.23045.
545. Senzolo M, Cholongitas E, Burra P, Leandro G, Thalheimer U, Patch D, Burroughs AK. beta-Blockers protect against spontaneous bacterial peritonitis in cirrhotic patients: a meta-analysis. Liver Int. 2009; 29(8): 1189 - 1193. https://doi.org/10.1111/j.1478-3231.2009.02038.x.
546. Mookerjee RP, Pavesi M, Thomsen KL, Mehta G, Macnaughtan J, Bendtsen F et al. Treatment with non-selective beta blockers is associated with reduced severity of systemic inflammation and improved survival of patients with acute-on-chronic liver failure. J Hepatol. 2016; 64(3): 574 - 582. https://doi.org/10.1016/j.jhep.2015.10.018.
547. Leithead JA, Rajoriya N, Tehami N, Hodson J, Gunson BK, Tripathi D, Ferguson JW. Non-selective  are associated with improved survival in patients with ascites listed for liver transplantation. Gut. 2015; 64(7): 1111 - 1119. https://doi.org/10.1136/gutjnl-2013-306502.
are associated with improved survival in patients with ascites listed for liver transplantation. Gut. 2015; 64(7): 1111 - 1119. https://doi.org/10.1136/gutjnl-2013-306502.
548. Bossen L, Krag A, Vilstrup H, Watson H, Jepsen P. Nonselective  do not affect mortality in cirrhosis patients with ascites: Post Hoc analysis of three randomized controlled trials with 1198 patients. Hepatology. 2016; 63(6): 1968 - 1976. https://doi.org/10.1002/hep.28352.
do not affect mortality in cirrhosis patients with ascites: Post Hoc analysis of three randomized controlled trials with 1198 patients. Hepatology. 2016; 63(6): 1968 - 1976. https://doi.org/10.1002/hep.28352.
549. Wong RJ, Robinson A, Ginzberg D, Gomes C, Liu B, Bhuket T. Assessing the safety of beta-blocker therapy in cirrhosis patients with ascites: A meta-analysis. Liver Int. 2019; 39(6): 1080 - 1088. https://doi.org/10.1111/liv.14040.
550. Tergast TL, Kimmann M, Laser H, Gerbel S, Manns MP, Cornberg M, Maasoumy B. Systemic arterial blood pressure determines the therapeutic window of non-selective beta blockers in decompensated cirrhosis. Aliment Pharmacol Ther. 2019; 50(6): 696 - 706. https://doi.org/10.1111/apt.15439.
551. Bhutta AQ, Garcia-Tsao G, Reddy KR, Tandon P, Wong F, O'Leary JG et al. Beta-blockers in hospitalised patients with cirrhosis and ascites: mortality and factors determining discontinuation and reinitiation. Aliment Pharmacol Ther. 2018; 47(1): 78 - 85. https://doi.org/10.1111/apt.14366.
552. ![]() L,
L,  L,
L, ![]() Del Villar C, Yotti R,
Del Villar C, Yotti R,  J,
J,  L et al. Non-selective beta-blockers impair global circulatory homeostasis and renal function in cirrhotic patients with refractory ascites. J Hepatol. 2020; 73(6): 1404 - 1414. https://doi.org/10.1016/j.jhep.2020.05.011.
L et al. Non-selective beta-blockers impair global circulatory homeostasis and renal function in cirrhotic patients with refractory ascites. J Hepatol. 2020; 73(6): 1404 - 1414. https://doi.org/10.1016/j.jhep.2020.05.011.
553. Sarin SK, Lahoti D, Saxena SP, Murthy NS, Makwana UK. Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology. 1992; 16(6): 1343 - 1349. https://doi.org/10.1002/hep.1840160607.
554. Cheung J, Zeman M, van Zanten SV, Tandon P. Systematic review: secondary prevention with band ligation, pharmacotherapy or combination therapy after bleeding from oesophageal varices. Aliment Pharmacol Ther. 2009; 30(6): 577 - 588. https://doi.org/10.1111/j.1365-2036.2009.04075.x.
555. Gonzalez R, Zamora J, Gomez-Camarero J, Molinero LM,  R, Albillos A. Meta-analysis: Combination endoscopic and drug therapy to prevent variceal rebleeding in cirrhosis. Ann Intern Med. 2008; 149(2): 109 - 122. https://doi.org/10.7326/0003-4819-149-2-200807150-00007.
R, Albillos A. Meta-analysis: Combination endoscopic and drug therapy to prevent variceal rebleeding in cirrhosis. Ann Intern Med. 2008; 149(2): 109 - 122. https://doi.org/10.7326/0003-4819-149-2-200807150-00007.
556. Puente A,  V, Graupera I, Roque M, Colomo A, Poca M et al. Drugs plus ligation to prevent rebleeding in cirrhosis: an updated systematic review. Liver Int. 2014; 34(6): 823 - 833. https://doi.org/10.1111/liv.12452.
V, Graupera I, Roque M, Colomo A, Poca M et al. Drugs plus ligation to prevent rebleeding in cirrhosis: an updated systematic review. Liver Int. 2014; 34(6): 823 - 833. https://doi.org/10.1111/liv.12452.
557. D'Amico G, Pagliaro L, Bosch J. The treatment of portal hypertension: a meta-analytic review. Hepatology. 1995; 22(1): 332 - 354. https://doi.org/10.1002/hep.1840220145.
558. Graham DY, Smith JL. The course of patients after variceal hemorrhage. Gastroenterology. 1981; 80(4): 800 - 809.
559. Holster IL, Tjwa ET, Moelker A, Wils A, Hansen BE, Vermeijden JR et al. Covered transjugular intrahepatic portosystemic shunt versus endoscopic therapy +  for prevention of variceal rebleeding. Hepatology. 2016; 63(2): 581 - 589. https://doi.org/10.1002/hep.28318.
for prevention of variceal rebleeding. Hepatology. 2016; 63(2): 581 - 589. https://doi.org/10.1002/hep.28318.
560. Lv Y, Qi X, He C, Wang Z, Yin Z, Niu J et al. Covered TIPS versus endoscopic band ligation plus propranolol for the prevention of variceal rebleeding in cirrhotic patients with portal vein thrombosis: a randomised controlled trial. Gut. 2018; 67(12): 2156 - 2168. https://doi.org/10.1136/gutjnl-2017-314634.
561. Ardevol A, Alvarado-Tapias E, Garcia-Guix M, Brujats A, Gonzalez L,  V et al. Early rebleeding increases mortality of variecal bleeders on secondary prophylaxis with
V et al. Early rebleeding increases mortality of variecal bleeders on secondary prophylaxis with  and ligation. Dig Liver Dis. 2020; 52(9): 1017 - 1025. https://doi.org/10.1016/j.dld.2020.06.005.
and ligation. Dig Liver Dis. 2020; 52(9): 1017 - 1025. https://doi.org/10.1016/j.dld.2020.06.005.
562. Luo X, Xiang T, Wu J, Wang X, Zhu Y, Xi X et al. Endoscopic Cyanoacrylate Injection Versus Balloon-Occluded Retrograde Transvenous Obliteration for Prevention of Gastric Variceal Bleeding: A Randomized Controlled Trial. Hepatology. 2021; 74(4): 2074 - 2084. https://doi.org/10.1002/hep.31718.
563. Kim DJ, Darcy MD, Mani NB, Park AW, Akinwande O, Ramaswamy RS, Kim SK. Modified Balloon-Occluded Retrograde Transvenous Obliteration (BRTO) Techniques for the Treatment of Gastric Varices: Vascular Plug-Assisted Retrograde Transvenous Obliteration (PARTO)/Coil-Assisted Retrograde Transvenous Obliteration (CARTO)/Balloon-Occluded Antegrade Transvenous Obliteration (BATO). Cardiovasc Intervent Radiol. 2018; 41(6): 835 - 847. https://doi.org/10.1007/s00270-018-1896-1.
564. Imai Y, Nakazawa M, Ando S, Sugawara K, Mochida S. Long-term outcome of 154 patients receiving balloon-occluded retrograde transvenous obliteration for gastric fundal varices. J Gastroenterol Hepatol. 2016; 31(11): 1844 - 1850. https://doi.org/10.1111/jgh.13382.
565. Mishra SR, Chander Sharma B, Kumar A, Sarin SK. Endoscopic cyanoacrylate injection versus beta-blocker for secondary prophylaxis of gastric variceal bleed: a randomised controlled trial. Gut. 2010; 59(6): 729 - 735. https://doi.org/10.1136/gut.2009.192039.
566. Sabri SS, Abi-Jaoudeh N, Swee W, Saad WE, Turba UC, Caldwell SH et al. Short-term rebleeding rates for isolated gastric varices managed by transjugular intrahepatic portosystemic shunt versus balloon-occluded retrograde transvenous obliteration. J Vasc Interv Radiol. 2014; 25(3): 355 - 361. https://doi.org/10.1016/j.jvir.2013.12.001.
567. Hung HH, Chang CJ, Hou MC, Liao WC, Chan CC, Huang HC et al. Efficacy of non-selective  as adjunct to endoscopic prophylactic treatment for gastric variceal bleeding: a randomized controlled trial. J Hepatol. 2012; 56(5): 1025 - 1032. https://doi.org/10.1016/j.jhep.2011.12.021.
as adjunct to endoscopic prophylactic treatment for gastric variceal bleeding: a randomized controlled trial. J Hepatol. 2012; 56(5): 1025 - 1032. https://doi.org/10.1016/j.jhep.2011.12.021.
568. Faccioli J, Nardelli S, Gioia S, Riggio O, Ridola L. Primary Prophylaxis of Overt Hepatic Encephalopathy: Is It Time to Consider It? J Clin Med. 2023; 12(12): 3903. https://doi.org/10.3390/jcm12123903.
569. Maharshi S, Sharma BC. Prophylaxis of hepatic encephalopathy: current and future drug targets. Hepatol Int. 2024; 18(4): 1096 - 1109. https://doi.org/10.1007/s12072-024-10647-9.
570. Lapenna L, Di Cola S, Merli M. The crucial role of risk factors when dealing with hepatic Encephalopathy. Metab Brain Dis. 2024; 40(1): 29. https://doi.org/10.1007/s11011-024-01446-0.
571. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on the management of hepatic encephalopathy. J Hepatol. 2022; 77(3): 807 - 824. https://doi.org/10.1016/j.jhep.2022.06.001.
572. Varakanahalli S, Sharma BC, Srivastava S, Sachdeva S, Dahale AS. Secondary prophylaxis of hepatic encephalopathy in cirrhosis of liver: a double-blind randomized controlled trial of L-ornithine L-aspartate versus placebo. Eur J Gastroenterol Hepatol. 2018; 30(8): 951 - 958. https://doi.org/10.1097/MEG.0000000000001137.
573. Sharma BC, Sharma P, Agrawal A, Sarin SK. Secondary prophylaxis of hepatic encephalopathy: an open-label randomized controlled trial of lactulose versus placebo. Gastroenterology. 2009; 137(3): 885 - 891. https://doi.org/10.1053/j.gastro.2009.05.056.
574. Higuera-de-la-Tijera F,  AI, Salas-Gordillo F,
AI, Salas-Gordillo F,  JL, Abdo-Francis JM, Camacho-Aguilera J et al. Primary Prophylaxis to Prevent the Development of Hepatic Encephalopathy in Cirrhotic Patients with Acute Variceal Bleeding. Can J Gastroenterol Hepatol. 2018: 3015891. https://doi.org/10.1155/2018/3015891.
JL, Abdo-Francis JM, Camacho-Aguilera J et al. Primary Prophylaxis to Prevent the Development of Hepatic Encephalopathy in Cirrhotic Patients with Acute Variceal Bleeding. Can J Gastroenterol Hepatol. 2018: 3015891. https://doi.org/10.1155/2018/3015891.
575. Liang A, Brar S, Almaghrabi M, Khan MQ, Qumosani K, Teriaky A. Primary prevention of hepatic encephalopathy post-TIPS: A systematic review and meta-analysis. Medicine (Baltimore). 2023; 102(38): e35266. https://doi.org/10.1097/MD.0000000000035266.
576. Bernardi M, Caraceni P, Navickis RJ, Wilkes MM. Albumin infusion in patients undergoing large-volume paracentesis: a meta-analysis of randomized trials. Hepatology. 2012; 55(4): 1172 - 1181. https://doi.org/10.1002/hep.24786.
577. Bai Z, Wang L, Wang R, Zou M,  N, Romeiro FG et al. Use of human albumin infusion in cirrhotic patients: a systematic review and meta-analysis of randomized controlled trials. Hepatol Int. 2022; 16(6): 1468 - 1483. https://doi.org/10.1007/s12072-022-10374-z.
N, Romeiro FG et al. Use of human albumin infusion in cirrhotic patients: a systematic review and meta-analysis of randomized controlled trials. Hepatol Int. 2022; 16(6): 1468 - 1483. https://doi.org/10.1007/s12072-022-10374-z.
578. Poca M,  M, Casas M, Alvarez-Urturi C, Gordillo J,
M, Casas M, Alvarez-Urturi C, Gordillo J,  V et al. Role of albumin treatment in patients with spontaneous bacterial peritonitis. Clin Gastroenterol Hepatol. 2012; 10(3): 309 - 315. https://doi.org/10.1016/j.cgh.2011.11.012.
V et al. Role of albumin treatment in patients with spontaneous bacterial peritonitis. Clin Gastroenterol Hepatol. 2012; 10(3): 309 - 315. https://doi.org/10.1016/j.cgh.2011.11.012.
579.  T, Bureau C, Oberti F, Anty R, Louvet A, Plessier A et al. Effect of albumin in cirrhotic patients with infection other than spontaneous bacterial peritonitis. A randomized trial. J Hepatol. 2015; 62(4): 822 - 830. https://doi.org/10.1016/j.jhep.2014.11.017.
T, Bureau C, Oberti F, Anty R, Louvet A, Plessier A et al. Effect of albumin in cirrhotic patients with infection other than spontaneous bacterial peritonitis. A randomized trial. J Hepatol. 2015; 62(4): 822 - 830. https://doi.org/10.1016/j.jhep.2014.11.017.
580. Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet. 1974; 2(7872): 81 - 84. https://doi.org/10.1016/s0140-6736(74)91639-0.
581. Christidis C, Mal F, Ramos J, Senejoux A, Callard P, Navarro R et al. Worsening of hepatic dysfunction as a consequence of repeated hydroxyethylstarch infusions. J Hepatol. 2001; 35(6): 726 - 732. https://doi.org/10.1016/s0168-8278(01)00200-8.
582. Weissenborn K, Ennen JC, Schomerus H,  N, Hecker H. Neuropsychological characterization of hepatic encephalopathy. J Hepatol. 2001; 34(5): 768 - 773. https://doi.org/10.1016/s0168-8278(01)00026-5.
N, Hecker H. Neuropsychological characterization of hepatic encephalopathy. J Hepatol. 2001; 34(5): 768 - 773. https://doi.org/10.1016/s0168-8278(01)00026-5.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Ивашкин Владимир Трофимович - академик РАН, доктор медицинских наук, профессор, заведующий кафедрой пропедевтики внутренних болезней лечебного факультета ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" (Сеченовский университет) Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Драпкина Оксана Михайловна - академик РАН, доктор медицинских наук, профессор, директор ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России, президент Российского общества профилактики неинфекционных заболеваний. Конфликт интересов отсутствует.
Маевская Марина Викторовна - доктор медицинских наук, профессор ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Жаркова Мария Сергеевна - кандидат медицинских наук, заведующая отделением гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ФГАОУ ВО "Первый Московский государственный университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Гречишникова Василиса Романовна - ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО "Первый Московский государственный университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Винницкая Елена Владимировна - доктор медицинских наук, заведующая отделом гепатологии ГБУЗ ДЗМ "Московский клинический научно-практический центр имени А.С. Логинова" ДМЗ. Конфликт интересов отсутствует.
Деева Татьяна Андреевна - кандидат медицинских наук, доцент кафедры биологической химии Института цифрового биодизайна и моделирования живых систем, ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Жигалова Светлана Борисовна - доктор медицинских наук, лауреат премии Правительства РФ в области науки и техники в 2009 г., лауреат премии г. Москвы в области медицины в 2004 г., врач центра экстренной хирургии и портальной гипертензии ГБУЗ "Городская клиническая больница им. А.К. Ерамишанцева" ДЗМ. Конфликт интересов отсутствует.
Ивашкин Константин Владимирович - доктор медицинских наук, лауреат премии Правительства РФ в области науки и техники в 2017 г., член Российского общества по изучению печени. Конфликт интересов отсутствует.
Киценко Евгений Александрович - доктор медицинских наук, профессор, ведущий научный сотрудник центра экстренной хирургии и портальной гипертензии ГБУЗ "Городская клиническая больница им. А.К. Ерамишанцева" ДЗМ. Конфликт интересов отсутствует.
Малиновская Юлия Олеговна - кандидат медицинских наук, врач-гастроэнтеролог, старший научный сотрудник отделения хирургии и трансплантации печени ГБУЗ МО "Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского". Конфликт интересов отсутствует.
Манукьян Гарик Ваганович - доктор медицинских наук, профессор, руководитель центра экстренной хирургии и портальной гипертензии ГБУЗ "Городская клиническая больница им. А.К. Ерамишанцева" ДЗМ. Конфликт интересов отсутствует.
Малов Святослав Леонидович - врач по рентгенэндоваскулярным диагностике и лечению отделения экстренной хирургии и портальной гипертензии ФБГНУ РНЦХ им акад. Б.В. Петровского, ГБУЗ города Москвы "Городская клиническая больница имени А.К. Ерамишанцева" ДЗМ. Конфликт интересов отсутствует.
Надинская Мария Юрьевна - кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Островская Анна Сергеевна - врач отделения гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ФГАОУ ВО "Первый Московский государственный университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует. Конфликт интересов отсутствует.
Тихонов Игорь Николаевич - ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Института клинической медицины им. Н.В. Склифосовского, врач отделения гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ФГАОУ ВО "Первый Московский государственный университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Фандеев Евгений Евгеньевич - кандидат медицинских наук, старший научный сотрудник отделения экстренной хирургии и портальной гипертензии ФГБНУ "Российский научный центр хирургии им. акад. Б.В. Петровского". Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе ЦП, познакомить с применяющимся в настоящее время алгоритмами оценки тяжести заболевания, прогноза и лечения.
Целевая аудитория данных клинических рекомендации
1. Врачи-гастроэнтерологи.
2. Врачи общей практики (семейные врачи).
3. Врачи-терапевты.
4. Врачи-хирурги.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные
4
Несравнительные исследования, описание клинического случая или серии случаев, исследование "случай - контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение эксперта
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество, и (или) их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество, и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже, чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Минздрава России от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации" (зарегистрировано в Минюсте России 08.05.2019 N 54588).
2. Приказ Министерства здравоохранения Российской Федерации от 12.11.2012 N 906н "Об утверждении порядка оказания медицинской помощи населению по профилю "Гастроэнтерология" (зарегистрировано в Минюсте России 21.01.2013 N 2664).
3. Приказ Министерства здравоохранения Российской Федерации от 28.12.2022 N 810н "Об утверждении стандарта медицинской помощи взрослым при циррозе и фиброзе печени (диагностика и лечение)".
4. Приказ Министерства здравоохранения Российской Федерации от 10.05.2017 N 203н "Об утверждении критериев оценки качества медицинской помощи".
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Рисунок 1. Алгоритм диагностики причин асцита в зависимости от состава асцитической жидкости
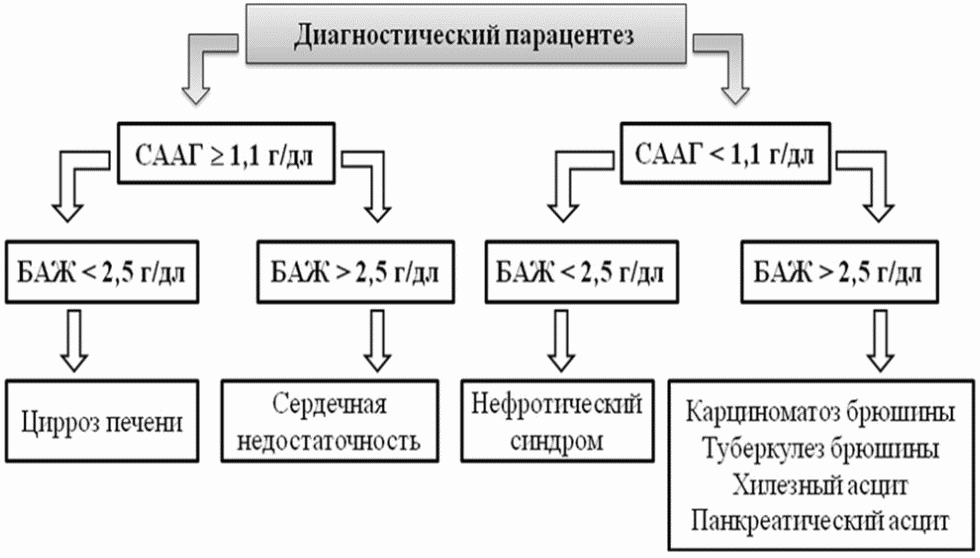
БАЖ - белок асцитической жидкости.
Рисунок 2. Алгоритм ведения пациентов с ЦП с асцитом
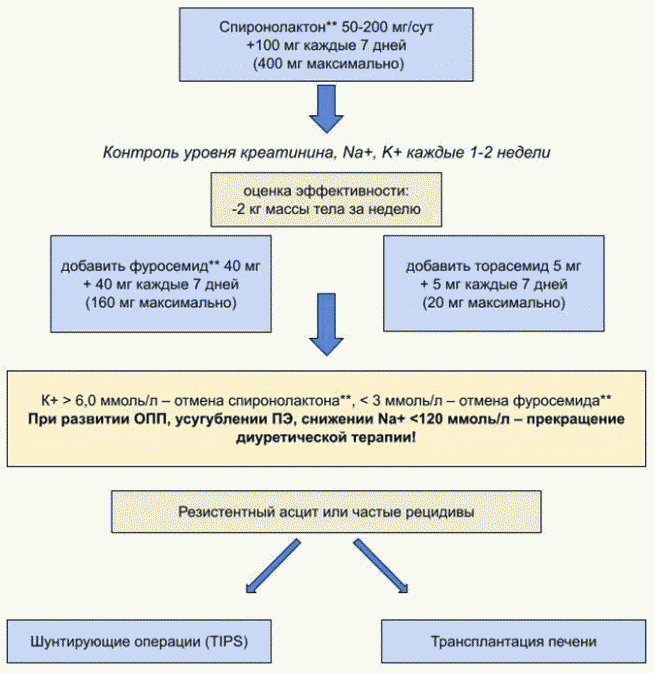
![]() Максимальное уменьшение массы тела для пациентов без периферических отеков - 0,5 кг в день, с периферическими отеками - 1 кг в день (риск почечной недостаточности и гипонатриемии!).
Максимальное уменьшение массы тела для пациентов без периферических отеков - 0,5 кг в день, с периферическими отеками - 1 кг в день (риск почечной недостаточности и гипонатриемии!).
![]() Спиронолактон** и петлевые диуретики обладают функциональным антагонизмом - следует назначать препараты с разницей в 3 ч.
Спиронолактон** и петлевые диуретики обладают функциональным антагонизмом - следует назначать препараты с разницей в 3 ч.
Рисунок 3. Диспансерное наблюдение и первичная профилактика варикозных кровотечений у пациентов с компенсированным циррозом
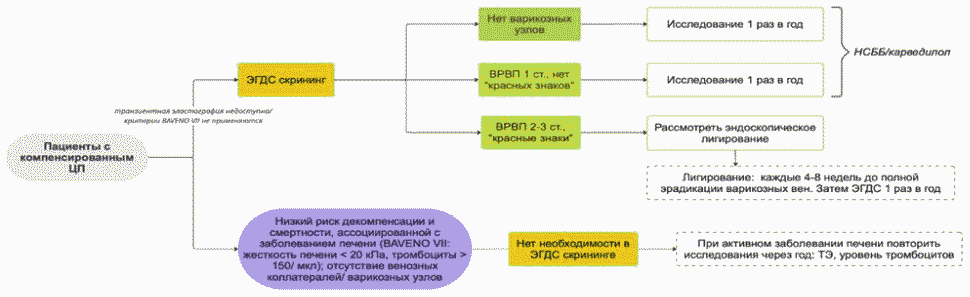
ВРВП - варикозно расширенные вены пищевода; НСББ - неселективные бета-адреноблокаторы; ТЭ - транзиентная эластография, ЭГДС - эзофагогастродуоденоскопия.
Рисунок 4. Диспансерное наблюдение и профилактика варикозных кровотечений у пациентов с декомпенсированным циррозом
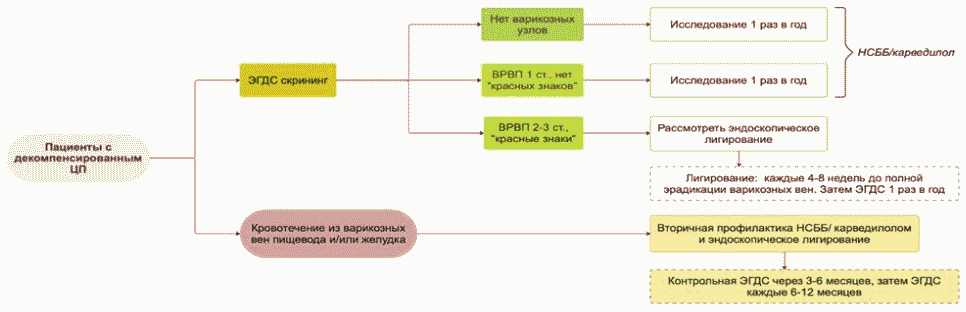
ВРВП - варикозно расширенные вены пищевода; НСББ - неселективные бета-блокаторы; ТЭ - транзиентная эластография; ЭГДС - эзофагогастродуоденоскопия.
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Уважаемый пациент! Цирроз печени развивается при формировании соединительной ткани в печени в результате различных хронических заболеваний, включая действие алкоголя, вирусные гепатиты, аутоиммунные заболевания печени, более редкие наследственные заболевания печени. По мере прогрессирования заболевания печень с трудом выполняет основные свои функции, что приводит к развитию таких осложнений, как желтуха, асцит (накопление жидкости в брюшной полости) и отеки, ПЭ (нарушение ориентации, заторможенность, сонливость). При наличии расширенных вен пищевода и желудка может развиться кровотечение, которое проявляется резкой слабостью, тошнотой, рвотой желудочным содержимым по типу кофейной гущи. В случае своевременной диагностики цирроза печени и лечения основного фактора, который привел к циррозу, можно избежать этих жизнеугрожающих осложнений, а в некоторых случаях даже обратить процесс вспять. Вам необходимо находиться под постоянным контролем врача, который определит перечень необходимых исследований и их периодичность, назначит необходимую терапию.
Важно!
- Большая часть информации, которую вы слышали/читали о взаимосвязи между пищей и печенью, имеет ограниченные научные доказательства. Как правило, всем пациентам рекомендуется здоровое, разнообразное, полноценное питание.
- Практически никакая пища, кроме алкоголя, на самом деле не повреждает печень и (или) не противопоказана пациентам с циррозом печени.
- Употребление достаточного количества калорий и белка гораздо важнее, чем отказ от определенных продуктов, поэтому важно, чтобы у вас была разнообразная еда, которая вам нравится.
- Вам следует постараться разделить свой рацион на 3 основных приема пищи (завтрак, обед и ужин) и 3 перекуса (в середине утра, в середине дня, поздним вечером). Поздний вечерний перекус является наиболее важным, так как он охватывает длительный промежуток между ужином и завтраком, он может быть как белковым, так и углеводным или смешанным.
- Вы должны стараться есть как можно больше фруктов и овощей. Если из-за этого у вас усиливается вздутие живота, пожалуйста, сообщите об этом своему врачу или диетологу.
- Вы должны стараться не добавлять слишком много соли в свою пищу. Может потребоваться некоторое время, чтобы приспособиться. Однако если вы продолжаете чувствовать, что из-за этого ваша пища становится невкусной, пресной и вы едите меньше, пожалуйста, сообщите об этом своему врачу или диетологу.
- У ограниченной доли пациентов с заболеваниями печени наблюдается осложнение, называемое печеночной энцефалопатии, из-за которого они могут плохо переносить животный белок (мясо). Прежде чем вносить какие-либо изменения в потребление белка, вам всегда следует проконсультироваться со своим врачом.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
КЛАССИФИКАЦИЯ
СТЕПЕНИ ТЯЖЕСТИ ЦИРРОЗА ПЕЧЕНИ ПО ЧАЙЛД-ТЮРКОТТ-ПЬЮ
(CHILD-TURCOTTE-PUGH) [580]
Название на русском языке: Классификация степени тяжести ЦП по Чайлд-Тюркотт-Пью (Child-Turcotte-Pugh).
Источник: Durand F, Valla D. Assessment of the prognosis of cirrhosis: Child-Pugh versus MELD. J Hepatol. 2005; 42(Suppl. 1): S100 - 107. https://doi.org/10.1016/j.jhep.2004.11.015.
Тип: шкала оценки.
Назначение: При выборе лечебной тактики у больных с ЦП необходимо оценить функциональное состояние печени. Шкала применяется для оценки тяжести состояния больных ЦП.
Содержание (шаблон):
Показатель
Баллы
1
2
3
Асцит
Нет
Небольшой
Умеренный/большой
Энцефалопатия
Нет
Небольшая/умеренная
Умеренная/выраженная
Уровень билирубина (мг/дл)
< 2,0
2 - 3
> 3,0
Уровень альбумина (мг/л)
> 3,5
2,8 - 3,5
< 2,8
Удлинение ПВ (сек)
1 - 3
4 - 6
> 6,0
Общее количество баллов
Класс
5 - 6
A
7 - 9
B
10 - 15
C
Ключ (интерпретация): 5 - 6 баллов - класс A (хорошо компенсированная функция печени), выживаемость в течение года - 100%; 7 - 9 баллов - класс B (выраженные нарушения функции печени), выживаемость в течение года - 80%; 10 - 15 баллов - класс C (декомпенсация заболевания и функции печени); выживаемость в течение года - 45%.
При сумме баллов менее 5 средняя продолжительность жизни пациентов составляет 6,4 года, а при сумме 12 и более - 2 месяца.
Приложение Г2
ИНДЕКС 1. ИНДЕКС MELD (MODEL FOR END-STAGE LIVER DISEASE)
Название на русском языке: Модель для оценки терминальной стадии заболеваний печени.
Источник: Durand F, Valla D. Assessment of the prognosis of cirrhosis: Child-Pugh versus MELD. J Hepatol. 2005; 42(Suppl. 1): S100 - 107. https://doi.org/10.1016/j.jhep.2004.11.015.
Тип: индекс.
Назначение: Данная числовая шкала принята для определения очередности трансплантации печени в листе ожидания (в связи с ограниченным количеством донорских органов).
Содержание: MELD = 9,57 Ln (уровень креатинина) + 3,78 Ln (уровень общего билирубина) + 11,2 (МНО) + 6,43. MELD-калькулятор (источник: https://www.mayoclinic.org/medical-professionals/transplant-medicine/calculators/meld-model/itt-20434705), где Ln - натуральный логарифм, МНО - международное нормализованное отношение.
Применяются следующие правила расчета: минимальное значение для любой из трех переменных - 1 мг/дл, максимальный возможный уровень креатинина - 4 мг/дл, максимальное значение для индекса MELD - 40. Неблагоприятый жизненный прогноз ассоциирован со значением MELD > 18.
Ключ (интерпретация): Чем выше значение индекса, тем тяжелее протекает заболевание печени. При использовании классификации MELD было выявлено, что она обладает большой достоверностью при прогнозировании летального исхода в течение трех месяцев у пациентов с декомпенсированным ЦП. Так, при MELD > 35 баллов летальный исход прогнозируется в 80% случаев, при MELD от 20 до 34 баллов - в 10 - 60%, при MELD < 8 баллов - пациент является амбулаторным и требует активного наблюдения. Также используется для оценки тяжести алкогольного гепатита (> 21 балла - тяжелый).
Приложение Г3
ШКАЛА КОМЫ ГЛАЗГО [581]
Название на русском языке: Шкала комы Глазго.
Источник: Sternbach GL. The Glasgow coma scale. J Emerg Med. 2000; 19(1): 67 - 71. https://doi.org/10.1016/s0736-4679(00)00182-7.
Назначение: Для оценки состояния пациентов с тяжелыми нарушениями сознания, шкала позволяет получить картину неврологических нарушений.
Содержание (шаблон): Шкала состоит из трех тестов, оценивающих реакцию открывания глаз, речевые и двигательные реакции.
Показатель
Баллы
1. Открывание глаз
-
спонтанное
4
-
на звук
3
-
на боль
2
-
нет ответа
1
2. Речь
-
связная
5
-
отдельные фразы
4
-
отдельные слова
3
-
бормотание
2
-
отсутствует
1
3. Движения
-
по команде
6
-
локализация боли
5
-
отдергивание конечности на боль
4
-
патологические сгибательные движения
3
-
патологические разгибательные движения
2
-
отсутствуют
1
Сумма
3 - 15
Ключ (интерпретация): Сумма баллов определяет сознание пациента от ясного (15 баллов) до атонической комы (3 балла).
Приложение Г4
ТЕСТ СВЯЗИ ЧИСЕЛ [582]
Название на русском языке: тест связи чисел.
Источник: Моисеева Е.О. Современные клинические и инструментальные методы диагностики печеночной энцефалопатии. Вестник Смоленской государственной медицинской академии. 2010; (1): 87 - 83.
Тип: шкала оценки.
Назначение: Для определения стадии ПЭ у пациентов с ЦП, в том числе латентной ПЭ, которая клинически не проявляется и характеризуется снижением быстроты познавательной деятельности и точности тонкой моторики; для оценки динамики психометрических тестов в процессе лечения.
Содержание:
Вариант 1
ФИО
Дата исследования
Время выполнения теста (сек.)
Образец почерка (имя и отчество)
Ключ (интерпретация):
Время, с
Баллы
Стадия ПЭ
< 40
0
Нет
41 - 60
1
0 - 1
61 - 90
2
1, 1 - 2
91 - 120
3
2
> 120
4
2 - 3
Приложение Г5
СТРАТИФИКАЦИЯ
РИСКА КРОВОТЕЧЕНИЙ ПРИ ИНВАЗИВНЫХ ПРОЦЕДУРАХ/ОПЕРАТИВНЫХ
ВМЕШАТЕЛЬСТВАХ У ПАЦИЕНТОВ С ЦИРРОЗОМ ПЕЧЕНИ
Название на русском языке: оценка риска кровотечений при инвазивных процедурах/оперативных вмешательствах у пациентов с ЦП.
Источник: Маевская М.В., Надинская М.Ю., Бессонова Е.Н., Гейвандова Н.И., Жаркова М.С., Киценко Е.А. и др. Коррекция тромбоцитопении у пациентов с циррозом печени перед плановыми хирургическими вмешательствами/инвазивными процедурами (соглашение специалистов). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2024; 34(3): 115 - 134. https://doi.org/10.22416/1382-4376-2024-1032-2784.
Тип: шкала оценки.
Назначение: При подготовке к оперативному вмешательству у больных с ЦП необходимо оценить степень риска кровотечения. Шкала применяется для оценки риска кровотечения в зависимости от типа хирургического вмешательства/инвазивной процедуры у больных ЦП.
Содержание (шаблон):
Таблица 4. Рекомендуемая минимальная пороговая концентрация тромбоцитов при проведении плановых хирургических вмешательств у пациентов с циррозом печени в зависимости от риска кровотечений
Анатомическая область
Примеры операций
Минимальная пороговая концентрация тромбоцитов, x 109/л
Высокий риск кровотечения (> 1,5%)
Голова и шея
-
Операции на центральной нервной системе и головном мозге
>= 100
-
Септопластика
-
Репозиция костей носа
-
Операции на щитовидной железе
-
Подслизистая вазотомия нижних носовых раковин
-
Все варианты шейной лимфодиссекции
-
Тонзиллэктомия
-
Офтальмологические операции
-
Гайморотомия открытого типа
Грудная клетка
-
Тимэктомия
-
Видеоассистированная медиастинальная лимфаденэктомия
-
Операции на легких
-
Операции при новообразованиях средостения
Живот, забрюшинное пространство, прямая кишка
-
Все виды вмешательств на печени, желчном пузыре, желчных протоках
-
Резекция желудка/гастростомия
-
Оперативное лечение паховых, бедренных и других грыж
-
Резекция тонкой/толстой кишки
-
Энтеростомия/колостомия
-
Низкая передняя резекция прямой кишки
-
Резекция поджелудочной железы
-
Экстирпация прямой кишки
-
Геморроидэктомия
-
Спленэктомия
-
Операции на надпочечнике
Почки, мочевыводящие пути, органы малого таза
-
Нефротомия/нефрэктомия/нефростомия
-
Цистостомия
-
Удаление кисты яичника
-
Резекция мочевого пузыря/цистэктомия
-
Искусственное прерывание беременности (аборт)
-
Сальпингэктомия/сальпингоофорэктомия
-
Кесарево сечение
Опорно-двигательный аппарат
-
Эндопротезирование межпозвоночных дисков, тазобедренного, коленного сустава
-
Остеосинтез титановой пластиной и других суставов
Челюстно-лицевая область
-
Имплантация зубов с остеопластикой (костная пластика, синус-лифтинг, костная аугментация)
-
Остеосинтез верхней/нижней челюсти
-
Сложная экстракция зуба
-
Операции на височно-нижнечелюстном суставе
Низкий риск кровотечения (<= 1,5%)
Живот, забрюшинное пространство, прямая кишка
-
Операции при свищах прямой кишки
>= 80
-
Лигирование геморроидальных узлов
-
Операции при трещинах прямой кишки
-
Иссечение эпителиального копчикового хода
Опорно-двигательный аппарат
-
Артроскопическая пластика связок коленного сустава
Челюстно-лицевая область
-
Простая экстракция зуба и другие малые стоматологические хирургические вмешательства
>= 50
Таблица 5. Рекомендуемая минимальная пороговая концентрация тромбоцитов при проведении плановых инвазивных процедур у пациентов с циррозом печени в зависимости от риска кровотечений
Процедура
Примеры инвазивных процедур
Минимальная пороговая концентрация тромбоцитов, x 109/л
Высокий риск кровотечения (> 1,5%)
Чрескожная/сосудистая
-
Нейроаксиальные методы аналгезии/анестезии (катетеризация эпидурального пространства, регионарная эпидуральная или спинальная анестезия и др.)
>= 100
Чрескожная/сосудистая
-
Внутриглазные процедуры/инъекции
>= 80
-
Внутрибрюшинная игольная биопсия солидных органов (включая печень)/новообразований под ультразвуковым контролем
-
Внутрисуставные инъекции
-
Пункционная декомпрессия межпозвоночных дисков
-
Лапароскопическая биопсия
-
Дренирование абсцессов различной локализации
-
Биопсия предстательной железы под ультразвуковым контролем
-
Радиочастотная катетерная/чрескожная аблация
Внутригрудная биопсия органов
Чрескожная/сосудистая
-
Трансъюгулярное внутрипеченочное портосистемное шунтирование
>= 50
-
Чреспеченочная артериальная химиоэмболизация или радиоэмболизация
Ангиография/коронарная ангиография/ венография с вмешательством
Эндоскопическая
-
Эндоскопическое удаление полипов из кишки, женских половых органов, бронхоскопия (> 2 полипов, размер >= 1 см)
>= 80
-
Эндоскопическое расширение стриктуры или резекция слизистой оболочки
-
Эндоскопическая ретроградная холангиопанкреатография с папиллосфинктеротомией
-
Эндоскопическое ультразвуковое исследование с тонкоигольной аспирацией
-
Чрескожная эндоскопическая установка гастростомы
-
Цистогастростомия
-
Эндоскопическая клеевая облитерация
-
Баллонная энтероскопия
-
Терапевтическая бронхоскопия
Низкий риск кровотечения (<= 1,5%)
Чрескожная/сосудистая
-
Люмбальная пункция
>= 50
-
Трансъюгулярное измерение печеночного венозного градиента давления (с биопсией печени)
-
Биопсия/удаление новообразований кожи
-
Установка/удаление центрального катетера
-
Диагностическая коронарная ангиография и катетеризация правых отделов сердца
Эндоскопическая
-
Диагностическая ЭГДС и стандартное лигирование варикозно расширенных вен пищевода, желудка
-
Капсульная эндоскопия
-
Эндоскопическая ретроградная холангиопанкреатография без папиллосфинктеротомии
-
Колоноскопия (с биопсией слизистой оболочки и (или) удаление 1 полипа < 1 см в диаметре)
-
Эндоскопическое ультразвуковое исследование
-
Трансэзофагеальная эхокардиография
-
Энтероскопия
Чрескожная/сосудистая
-
Лапароцентез
>= 30
-
Замена дренажного катетера
-
Торакоцентез
-
Катетеризация мочеточника
-
Дренирование плевральной, брюшной полости
-
Установка кава-фильтра
-
Диагностическая венография
Стоматологическая
-
Местная анестезия
-
Санация ротовой полости (лечение кариеса, удаление налета, глубокая очистка зубов и другие терапевтические процедуры)
