"Клинические рекомендации "Рак прямой кишки"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК ПРЯМОЙ КИШКИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C20, D01.2, D37.5
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 554_4
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Общероссийская общественная организация "Ассоциация колопроктологов России", Ассоциация онкологов России, Общероссийская общественная организация "Российское общество клинической онкологии", Российское общество специалистов по колоректальному раку
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
в/в - внутривенный(но)
ИГХ - иммуногистохимия
ЗНО - злокачественное новообразование
МКАТ - моноклональные антитела
КРР - колоректальный рак
КТ - компьютерная томография
ЛТ - лучевая терапия
ЛТ 5 x 5 Гр - лучевая терапия РОД 5 Гр, СОД 25 Гр
ЛФК - лечебная физкультура
МРТ - магнитно-резонансная томография
НАХТ - неоадъювантная химиотерапия
ПЦР - полимеразная цепная реакция
ПЭТ/КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией
РОД - разовая очаговая доза
РЧА - радиочастотная аблация
РЭА - раковый эмбриональный антиген
СНННН - смешанное нейроэндокринное-ненейроэндокринное новообразование
СОД - суммарная очаговая доза
УЗДГ - ультразвуковая допплерография
УЗИ - ультразвуковое исследование
ФУ - фторурацил
ХЛТ - химиолучевая терапия (курс дистанционной конформной лучевой терапии в комбинации с химиотерапией аналогами пиримидина с РОД 1, 8 - 2 Гр, СОД 44 Гр на зоны регионарного метастазирования, СОД 50 - 54 Гр на первичную опухоль.
ХТ - химиотерапия
ЦГР - циркулярная граница резекции
ЭКГ - электрокардиография
CTCAE - общие терминологические критерии неблагоприятных эффектов
ECOG - Восточная объединенная группа онкологов
EGFR - рецептор эпидермального фактора роста
IMRT (англ. intensity-modulated radiation therapy) - модулированная по интенсивности лучевая терапия
MSI - микросателлитная нестабильность
dMMR - дефицит белков системы репарации неспаренных оснований
МЕК - ген киназы митоген-активированной протеинкиназы (mitogen-activated protein kinase).
RAS - семейство генов NRAS и KRAS.
VMAT - объемно-модулированное облучение
3DCRT - трехмерная конформная лучевая терапия
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (англ. off-label, офф-лейбл)
Термины и определения
Адъювантная химиотерапия - вид химиотерапии, проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
Аналоги пиримидина - химиопрепараты из группы антиметаболитов.
Метастазэктомия - операция, предусматривающая хирургическое удаление метастаза.
Неоадъювантная химиотерапия - вид химиотерапии, проводимый непосредственно перед хирургическим удалением первичной опухоли для улучшения результатов операции/лучевой терапии и для предотвращения образования метастазов.
Предреабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Таргетная терапия - вид противоопухолевой терапии, которая блокирует рост раковых клеток с помощью вмешательства в механизм действия конкретных целевых (таргетных) молекул, необходимых для канцерогенеза и роста опухоли.
Уровни достоверности доказательств - отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам, достоверность доказательств определяется по 3 основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций - в отличие от уровней достоверности доказательств отражают степень уверенности не только в достоверности эффекта вмешательства, но и в том, что следование рекомендациям принесет в конкретной ситуации больше пользы, чем негативных последствий.
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в т.ч. в условиях санаторно-курортных организаций).
3DCRT - метод проведения лучевой терапии, трехмерная конформная лучевая терапия.
IMRT - метод проведения лучевой терапии, модулированная по интенсивности лучевая терапия.
Rapid Arc - технология проведения лучевой терапии под визуальным контролем.
BRAF - онкоген, который кодирует серин-треониновую протеинкиназу B-Raf.
FOLFIRI - режим химиотерапии: иринотекан** (180 мг/м2 в виде 90-минутной инфузии в 1-й день), кальция фолинат** (400 мг/м2 в/в в течение 2 ч) с последующим болюсным введением фторурацила** (400 мг/м2 в/в струйно) и 46-часовой инфузией фторурацила** (2400 мг/м2, по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день.
mFOLFOX6 (далее по тексту FOLFOX) - режим химиотерапии: оксалиплатин** (85 мг/м2 в виде 2-часовой инфузии в 1-й день), кальция фолинат** (400 мг/м2 в/в в течение 2 ч) с последующим болюсным введением фторурацила** (400 мг/м2 в/в струйно) и 46-часовой инфузией фторурацила** (2400 мг/м2, по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день.
FOLFOXIRI - режим химиотерапии: иринотекан** (165 мг/м2 в виде 90-минутной инфузии в 1-й день), оксалиплатин** (85 мг/м2 в виде 2-часовой инфузии в 1-й день), кальция фолинат** (200 мг/м2 в/в в течение 2 ч) с последующей 46-часовой инфузией фторурацила** (3200 мг/м2). Начало очередного курса - на 15-й день.
FLOX - режим химиотерапии: оксалиплатин** (85 мг/м2 в течение 2 ч в 1, 15 и 29-й дни каждого цикла), кальция фолинат** (250 мг/м2 в/в струйно) с последующим болюсным введением фторурацила** (500 мг/м2 еженедельно в течение 6 нед с последующим 2-недельным перерывом) или оксалиплатин** (85 мг/м2 в течение 2 ч в 1 день, кальция фолинат** (60 мг/м2 в/в струйно) с последующим болюсным введением фторурацила** (500 мг/м2) в 1 и во 2 день 1 раз в 2 недели.
МЕК - ген киназы митоген-активированной протеинкиназы (mitogen-activated protein kinase).
RAS - семейство генов NRAS и KRAS.
XELOX - режим химиотерапии: оксалиплатин** (130 мг/м2 внутривенно капельно в 1-й день), капецитабин** (825 мг/м2 2 раза в сутки в 1 - 14-й дни). Начало очередного курса - на 22-й день.
XELIRI - режим химиотерапии: #иринотекан** в виде 90-минутной инфузии (180 - 200 мг/м2 в 1-й день), #капецитабин** (1600 - 1800 мг/м2 в сутки внутрь в 1 - 14-й дни). Начало очередного курса - на 22-й день.
Дистанционная конформная лучевая терапия (ЛТ) - подразумевается одна или несколько медицинских услуг (A06.30.002.015, A06.30.021, A07.19.001, A07.19.001.001, A07.19.001.002, A07.19.001.003, A07.19.001.004, A07.19.001.005, A07.19.002, A07.19.003, A07.19.006, A07.19.007, A07.19.008, A07.30 020.082, A07.30.009, A07.30.009.001, A07.30.009.015, A07.30.009.077, A07.30.020, A07.30.020.004, A07.30.020.008, A07.30.020.009, A07.30.020.010, A07.30.020.013, A07.30.021, A07.30.044, A07.30.046, A07.30.047, A07.30.048, A07.30.049, A07.30.055, A23.30.043, A25.30.014.002, B01.027.004, B01.027.004.001, B01.027.005, B01.027.005.001, B01.027.009)
Хирургическое лечение (рака прямой кишки) - подразумевается одна из спектра услуг (A16.19.020 - A16.19.021.014)
Брюшно-промежностная экстирпация прямой кишки или обструктивная резекция прямой кишки - коды НМУ (A16.19.020 - A16.19.021.014)
Хирургическое вмешательство (при потенциально резектабельных метастазах рака прямой кишки) - коды НМУ в диапазоне (A16.14.036 - A16.14.036.011; A16.09.009 - A16.09.009.011, A16.09.013 - A16.09.015)
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Рак прямой кишки - гетерогенная группа злокачественных эпителиальных опухолей прямой кишки, различающихся по своему течению, прогнозу, а также лекарственной чувствительности и локализующихся в пределах 15 см от ануса при измерении ригидным ректоскопом. В клинической практике и при описании результатов научных исследований рак прямой кишки разделяют на нижнеампулярный (0 - 5.0 см от анокутанной линии), среднеампулярный (5.1 - 10.0 см от анокутанной линии), верхнеампулярный (10.1 - 15.0 см от анокутанной линии).
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
У 3 - 5% пациентов, страдающих раком прямой кишки, развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространенные - синдром Линча, семейный аденоматоз толстой кишки и MutYH-ассоциированный полипоз, редкие гамартомные полипозные синдромы. У оставшихся пациентов рак ободочной и прямой кишки имеет спорадический характер. В качестве факторов риска развития данного заболевания рассматриваются: хронические воспалительные заболевания толстой кишки (например, язвенный колит, болезнь Крона), курение, алкоголь, превалирование в рационе красного мяса, наличие сахарного диабета, ожирение или повышенный индекс массы тела, низкая физическая активность [1 - 5].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Рак прямой кишки занимает лидирующие позиции по заболеваемости и смертности от злокачественных опухолей. В 2022 г. в России зарегистрировано 29 724 новых случаев рака прямой кишки (C19 - C21) и умерли по этой причине 15 864 пациентов [6].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
D01.2 Карцинома in situ прямой кишки
D37.5 Новообразование неопределенного или неизвестного характера. Прямая кишка
C20 Злокачественное новообразование (ЗНО) прямой кишки
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Board W.C.o.T.E.WHO classification of tumours//Book WHO classification of tumours/EditorWorld Health Organization Lyon, France, 2019. [7]
Эпителиальные опухоли
I. Доброкачественные опухоли:
A. 8211/0 Тубулярная аденома.
B. 8261/0 Ворсинчатая аденома.
C. 8263/0 Тубулярно-ворсинчатая аденома.
D. 8220/0 Аденоматозный полип.
E. 8213/0 Зубчатая дисплазия.
II. Интраэпителиальная неоплазия (дисплазия), связанная с хроническими воспалительными заболеваниями кишечника:
A. 8148/2 Железистая интраэпителиальная неоплазия высокой степени.
B. 8148/0 Железистая интраэпителиальная неоплазия низкой степени.
III. Рак:
A. 8140/3 Аденокарцинома кишечного типа [1].
B. 8213/3 Муцинозная (слизистая) аденокарцинома [2].
C. 8262/3 Зубчатая аденокарцинома [3].
D. 8265/3 Микропапиллярная аденокарцинома.
E. 8480/3 Аденомоподобная аденокарцинома [4].
F. 8490/3 Медуллярный рак [5].
G. 8490/3 Перстневидноклеточный рак [6].
H. 8560/3 Железисто-плоскоклеточный рак.
I. 8510/3 Медуллярный рак [7].
J. 8220/3 Недифференцированный рак БДУ [8].
K. 8033/3 Рак с саркоматоидным компонентом [9].
L. 8240/3 Нейроэндокринная опухоль БДУ.
M. 8240/3 Нейроэндокринная опухоль G1.
N. 8249/3 Нейроэндокринная опухоль G2.
O. 8249/3 Нейроэндокринная опухоль G3.
P. 8246/3 Нейроэндокринный рак БДУ [10].
Q. 8041/3 Мелкоклеточный рак.
R. 8013/3 Крупноклеточный нейроэндокринный рак.
S. 8154/3 Смешанное нейроэндокринное-ненейроэндокринное новообразование [11].
Согласно Классификации ВОЗ (2019), гистологическая градация аденокарциномы толстой кишки становится двухступенчатой вместо ранее используемой 4-ступенчатой шкалы (G1 - G4):
- аденокарцинома низкой степени злокачественности (включает высоко- и умеренно дифференцированные карциномы G1 - G2),
- аденокарцинома высокой степени злокачественности (включает низкодифференцированные карциномы G3).
Гистологической градации подлежат только аденокарцинома кишечного типа и слизистая аденокарцинома. Гистологическая градация зубчатой аденокарциномы, микропапиллярной аденокарциномы, диффузного рака, перстневидноклеточного рака, саркоматоидного рака, недифференцированного рака не проводится в связи с тем, что данные опухоли всегда имеют высокую степень злокачественности.
Гистологическая градация аденомоподобной аденокарциномы и медуллярного рака не проводится в связи с тем, что данные опухоли отличаются благоприятным прогнозом.
[1] Аденокарцинома кишечного типа является самым частым гистологическим вариантом колоректального рака (75% случаев).
[2] Доля муцинозной аденокарциномы составляет 15% случаев колоректального рака. Опухоль ассоциирована с наличием микросателлитной нестабильности.
[3] Доля зубчатой аденокарциномы не превышает 10% случаев. Опухоль ассоциирована с наличием микросателлитной нестабильности.
[4] Нозологическая единица впервые введена комитетом МАИР/ВОЗ в МКБ-О в 2019 г. Доля аденомоподобной аденокарциномы не превышает 4% случаев.
[5] Доля медуллярного рака не превышает 4% случаев. Опухоль ассоциирована с наличием микросателлитной нестабильности.
[6] Устанавливается, если > 50% клеток опухоли представлено перстневидноклеточными элементами. Опухоль всегда соответствует G3. При правосторонней локализации опухоль часто ассоциирована с MSI.
[7] Опухоль всегда соответствует G3. При правосторонней локализации опухоль часто ассоциирована с MSI.
[8] Является диагнозом исключения - устанавливается только по результатам применения дополнительных методов исследования (иммуногистохимическое исследование при выполнении патолого-анатомического исследования, электронная микроскопия), соответствует G4.
[9] Нозологическая единица впервые введена комитетом IARC/WHO в МКБ-О в 2019 г. Является диагнозом исключения, соответствует G3 - G4.
[10] Диагноз устанавливается только по результатам применения дополнительных методов исследования (иммуногистохимия, электронная микроскопия), всегда соответствует G3.
[11] Диагноз устанавливается только по результатам применения дополнительных методов исследования: СНННН является диморфным раком, сочетающим компоненты аденокарциномы и нейроэндокринного рака/опухоли (доля любого компонента должна быть не менее 30%).
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
1.6.1. Стадирование рака прямой кишки по системе TNM-8 (2017)
Для рака ободочной и прямой кишки используется единая классификация.
Символ T содержит следующие градации:
Tx - недостаточно данных для оценки первичной опухоли.
Tis - преинвазивный рак (интраэпителиальная инвазия или инвазия собственной пластинки слизистой оболочки).
T1 - опухоль распространяется в подслизистый слой стенки кишки.
T2 - опухоль распространяется на мышечный слой.
T3 - врастание в субсерозу или неперитонизированную околокишечную клетчатку.
Для опухолей, расположенных в верхнеампулярном отделе прямой кишки и ректосигмоидном отделах толстой кишки (покрытых брюшиной), символ T3 характеризует распространение опухоли до субсерозной оболочки (не прорастают серозную оболочку).
T4 - опухоль прорастает в окружающие органы и ткани или серозную оболочку при локализации в верхнеампулярном отделе прямой кишки и ректосигмоидном отделах толстой кишки (покрытых брюшиной).
T4a - прорастание висцеральной брюшины.
T4b - прорастание в другие органы и структуры.
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах:
Nx - недостаточно данных для оценки регионарных лимфатических узлов.
N0 - поражения регионарных лимфатических узлов нет.
N1 - метастазы в 1 - 3 (включительно) регионарных лимфатических узлах.
N1a - метастазы в 1 регионарном лимфатическом узле.
N1b - 2 - 3 лимфатических узла.
N1c - диссеминаты в брыжейке без поражения регионарных лимфатических узлов.
N2 - метастазы в более чем 3-х регионарных лимфатических узлах.
N2a - поражено 4 - 6 лимфатических узлов.
N2b - поражено 7 и более лимфатических узлов.
Символ M характеризует наличие или отсутствие отдаленных метастазов:
M0 - отдаленных метастазов нет.
M1 - наличие отдаленных метастазов.
M1a - наличие отдаленных метастазов в одном органе.
M1b - наличие отдаленных метастазов более чем в одном органе.
M1c - метастазы по брюшине.
Группировка по стадиям представлена в таблице 1.
Таблица 1. Стадии рака толстой кишки
Стадия
T
N
M
0
is
0
0
I
1, 2
0
0
II
3, 4
0
0
IIA
3
0
0
IIB
4a
0
0
IIC
4b
0
0
III
Любая
1,2
0
IIIA
1, 2
1
0
1
2a
0
IIIB
3, 4a
1
0
2, 3
2a
0
IIIC
4b
1, 2a, 2b
0
4a
2a
0
3, 4a
2b
0
IV
Любая
Любая
1
IVa
Любая
Любая
1a
IVb
Любая
Любая
1b
IVc
Любая
Любая
1с
1.6.2. Стадирование по Kikuchi раннего рака прямой кишки
При планировании местного иссечения T1 рака прямой кишки предлагается детальное стадирование заболевания на основании данных МРТ и УЗ-колоноскопии по следующим критериям:
T1sm1 - глубина инвазии подслизистого слоя до 1/3.
T1sm2 - умеренная глубина инвазии подслизистого слоя - до 2/3.
T1sm3 - полная инвазия опухолью всего подслизистого слоя.
Окончательное стадирование проводится по результатам патолого-анатомического исследования операционного материала. Стадирование по Kikuchi возможно только при наличии в удаленном макропрепарате мышечного слоя кишечной стенки.
1.6.3. МРТ-подклассификация Т3 рака прямой кишки
Для персонализации показаний к предоперационному лечению T3 рака прямой кишки используется основанная на данных МРТ дополнительная классификация [8]:
T3a - инвазия в мезоректальную клетчатку менее 1 мм.
T3b - инвазия в мезоректальную клетчатку 1 - 5 мм.
T3c - инвазия в мезоректальную клетчатку 5 - 15 мм.
T3d - инвазия в мезоректальную клетчатку более 15 мм.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критериями постановки диагноза рака прямой кишки являются:
- локализация опухоли выше зубчатой линии и в пределах 15 см от анокутанной линии
- при гистологическом исследовании верифицирована злокачественная опухоль эпителиального происхождения
- Рекомендуется устанавливать диагноз рака прямой кишки на основании данных физикального, инструментального обследования и патологоанатомического изучения биопсийного материала [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.1 Жалобы и анамнез
- Рекомендуется у всех пациентов при выявлении рака прямой кишки проводить тщательный сбор жалоб и анамнеза у пациента с целью выявления факторов, которые могут повлиять на выбор тактики лечения [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: у 3 - 5% пациентов развитие рака прямой кишки связано с наличием известных наследственных синдромов. Наиболее распространенные - синдром Линча, семейный аденоматоз толстой кишки и MutYH-ассоциированный полипоз.
- У всех пациентов, страдающих раком прямой кишки, рекомендуется собрать семейный анамнез и проанализировать его на соответствие критериям Amsterdam II и рекомендациям Bethesda или критериев НМИЦ колопроктологии им. А.Н. Рыжих (Приложение Г) c целью выявления пациентов с наследственными формами заболевания [1, 12 - 14].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: При соответствии анамнеза пациента критериям Amsterdam II, НМИЦ колопроктологии им. А.Н. Рыжих или рекомендациям Bethesda целесообразно провести исследование его опухолевого образца на наличие дефицита белков системы репарации неспаренных оснований методом ИГХ (иммуногистохимии), а при обнаружении данного дефекта в дальнейшем провести секвенирование соответствующего (только одного) гена системы MMR для поиска наследственного патогенного варианта. Если же у пациента проводится поиск микросателлитной настабильности в образце опухоли, и она обнаруживается, а возможности провести исследование дефицита белков системы репарации неспаренных оснований методом ИГХ - нет, то необходимо провести секвенирование всех 4 генов системы MMR. Если при секвенировании генов MMR патогенный вариант не обнаружен, то желателен поиск крупных вставок/делеций методом MLPA.
В случае, когда пациент не соответствует указанным критериям, но в его образце обнаружена микросателлитная нестабильность/дефицит белков системы репарации неспаренных оснований, возможно рассмотреть дальнейшее исследование генов системы MMR.
2.2 Физикальное обследование
- Рекомендуется всем пациентам раком прямой кишки до начала лечения выполнять тщательный физикальное обследование, включающий пальцевое ректальное исследование, оценку нутритивного статуса с целью дальнейшего определения плана диагностики и лечения [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам с раком прямой кишки до начала лечения выполнять общий (клинический) анализ крови, анализ крови биохимический общетерапевтический, коагулограмму (ориентировочное исследование системы гемостаза) для определения дальнейшей тактики диагностики, лечения, оценки прогноза [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: коагулограмму (ориентировочное исследование системы гемостаза) обязательно выполнять перед хирургическим лечением, у остальных пациентов - при наличии клинических показаний. Конкретный набор параметров анализа крови биохимического общетерапевтического и коагулограммы (ориентировочного исследования системы гемостаза) должен определять лечащий врач индивидуально, с учетом особенностей конкретного пациента.
- Рекомендуется всем пациентам с раком прямой кишки до начала лечения исследование уровня ракового эмбрионального антигена в крови (РЭА) для определения дальнейшей тактики диагностики, лечения, оценки прогноза [9 - 11, 15].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: Выполнение исследования уровня ракового эмбрионального антигена в крови (РЭА) показано всем пациентам раком прямой кишки. Конкретный набор параметров биохимического анализа крови и коагулограммы должен определять лечащий врач индивидуально, с учетом особенностей конкретного пациента.
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам выполнять ректороманоскопию в качестве скрининга рака прямой кишки с определением локализации опухоли в прямой кишке и измерять расстояние от наружного края анального канала только ригидным ректоскопом для дальнейшего определения оптимальной тактики диагностики и лечения заболевания [16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: при определении локализации опухоли на основании данных исследований с использованием гибких эндоскопов возможно искусственное завышение расстояния от анокутанной линии за счет того, что эндоскопы могут дополнительно изгибаться в просвете кишки. Это может приводить к постановке некорректного диагноза и неверному выбору плана лечения. Определение расстояния от анокутанной линии на основании данных МРТ органов малого таза может быть точным, однако эта методика не стандартизована и значительно зависит от опыта специалиста-рентгенолога.
- Рекомендуется с целью установления диагноза всем пациентам с подозрением на рак прямой кишки выполнить колоноскопию с взятием биопсийного материала (Биопсия прямой кишки с помощью видеоэндоскопических технологий) - наиболее информативный метод исследования при раке прямой кишки, позволяющий непосредственно визуализировать опухоль, определить ее размеры, локализацию и макроскопический тип, оценить угрозу осложнений (кровотечение, перфорация), а также получить материал для морфологического исследования. Для получения достаточного количества материала требуется выполнить несколько (3 - 5) биопсий стандартными эндоскопическими щипцами [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: план лечения не следует составлять до получения данных биопсии. При подслизистом инфильтративном росте опухоли возможен ложноотрицательный результат, что требует повторной глубокой биопсии. Чувствительность и специфичность метода возрастает при использовании современных технологий эндоскопической визуализации (увеличительной эндоскопии, узкоспектральной эндоскопии, хромоэндоскопии, флуоресцентной диагностики). Если тотальная колоноскопия не была выполнена на дооперационном этапе, ее необходимо провести в течение 3 - 6 мес после хирургического лечения.
- Рекомендуется пациентам, у которых выполнение тотальной колоноскопии до начала лечения невозможно из-за выраженного опухолевого стеноза или других объективных причин, выполнить ирригоскопию [17] (Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4) или КТ с оценкой состояния толстой кишки (Компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием) до начала лечения [18 - 20] или тотальную колоноскопию в течение 3 - 6 мес после хирургического лечения для исключения наличия синхронных опухолей и полипов в ранее необследованных участках толстой кишки [21, 22].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
Комментарий: необходимость выполнения полного обследования толстой кишки диктуется высоким риском выявления синхронных полипов и рака вышележащих отделов толстой кишки. При выявлении рака прямой кишки и синхронных полипов толстой кишки при технической выполнимости предпочтительно их удаление до начала лечения рака прямой кишки, чтобы избежать риска их роста и малигнизации с учетом возможной отсрочки возможности эндоскопического удаления после противоопухолевого лечения и риска несоблюдения пациентом медицинских рекомендаций.
- Рекомендуется с целью стадирования выполнить МРТ органов малого таза на МР-томографах не менее 1,5T всем пациентам раком прямой кишки перед определением тактики лечения [23 - 26].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: МРТ органов малого таза позволяет определить локализацию, протяженность, глубину инвазии опухоли, оценить состояние регионарных лимфатических узлов. Внутривенное контрастирование при МРТ органов малого таза для оценки местного распространения не требуется. При направлении на МРТ необходимо четко сформулировать цель исследования и предполагаемую локализацию опухоли для выбора корректного протокола сканирования.
- Рекомендуется при оценке клинического ответа опухоли на неоадъювантную терапию проводить повторное МРТ органов малого таза через 8 - 12 недель после завершения ХЛТ [27].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: МРТ органов малого таза после окончания неоадъювантного лечения позволяет выявить 3 группы пациентов: с МРТ полным, почти полным и неполным ответами [28].
- Рекомендуется в протоколе заключения МРТ органов малого таза при раке прямой кишки у всех пациентов с целью оптимального составления плана лечения указывать следующую информацию: вертикальный размер опухоли, расстояние от нижнего полюса опухоли до наружного края анального канала, а также от пуборектальной петли, наличие и глубину опухолевой инвазии за пределы кишечной стенки, минимальное расстояние от края опухоли до мезоректальной фасции, наличие инвазии брюшины, наличие, количество и размеры лимфатических узлов параректальной клетчатки с МР-признаками злокачественного поражения, депозитов опухоли, наличие экстрамуральной сосудистой инвазии, количество и размеры экстрафасциальных лимфатических узлов с МР-признаками злокачественного поражения; для рака нижнеампулярного отдела прямой кишки - наличие инвазии внутреннего сфинктера/межсфинктерного пространства/наружного сфинктера/мышц, поднимающих задний проход [29].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: современные режимы МРТ с использованием диффузно-взвешенных изображений могут повысить информативность проводимого исследования. Внутривенное контрастирование не повышает информативность оценки распространенности опухоли [30]. Окончательное принятие решение о тактике лечения пациентов раком прямой кишки возможно только по результатам МРТ-исследования.
- Рекомендуется с целью исключения метастатического поражения органов брюшной полости всем пациентам до начала специфического противоопухолевого лечения выполнить КТ или МРТ органов брюшной полости с внутривенным контрастированием [9 - 11, 31].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- Рекомендуется с целью исключения метастатического поражения органов грудной клетки всем пациентам выполнить КТ органов грудной полости [9 - 11, 32].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется у пациентов с метастатическим поражением печени оценивать резектабельность метастазов в печени по данным МРТ органов брюшной полости с внутривенным контрастированием или КТ органов брюшной полости с внутривенным применением рентгеноконтрастных средств, содержащих йод. Рекомендуется выполнять МРТ органов брюшной полости с внутривенным контрастированием при планировании резекции печени в случаях, когда КТ органов брюшной полости с внутривенным контрастированием не позволяет в полной мере высказаться о распространенности процесса в печени [31, 33, 34].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: для оценки резектабельности метастазов колоректального рака (КРР) в печени предпочтительно использование МРТ органов брюшной полости с внутривенным контрастированием. Пациентам с противопоказанием к использованию внутривенного контрастирования возможно выполнение МРТ с режимом DWI. МРТ позволяет у 10 - 20% пациентов выявить не определяемые по данным УЗИ метастазы и сократить количество эксплоративных операций и операций в объеме R2. Пациентам с противопоказанием к выполнению МРТ рекомендуется выполнение КТ с внутривенным контрастированием с использованием рентгеноконтрастных средств, содержащих йод, или ПЭТ-КТ с 18-фтор-дезоксиглюкозой и внутривенным контрастированием. МРТ обладает наиболее высокой чувствительностью по сравнению с другими диагностическими методами, в особенности в отношении метастазов размерами менее 1 см [35], при этом предпочтение следует отдавать МРТ с гепатотропными контрастными средствами (гадоксетовой кислотой), так как они позволяют повысить чувствительность метода в отношении мелких метастазов в печени [36]. Не допускается планирование резекции метастазов на основании данных только УЗИ печени или КТ без внутривенного контрастирования.
- Рекомендуется всем пациентам выполнить электрокардиографию (ЭКГ) (Регистрация электрокардиограммы) с целью исключения сопутствующих заболеваний [9 - 11, 37].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: рекомендуется выполнение ЭКГ перед планированием любого вида лечения. У пациентов, получающих противоопухолевую лекарственную терапию, ЭКГ выполняется по клиническим показаниям.
- Рекомендуется пациентам, которым планируется местное иссечение по поводу раннего рака прямой кишки, выполнить эндоректальное ультразвуковое исследование (Ультразвуковое исследование прямой кишки трансректальное) с целью более детального стадирования и исключения наличия противопоказаний к этому виду лечения [38 - 40].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендуется выполнить остеосцинтиграфию (Сцинтиграфия костей всего тела) при подозрении на метастатическое поражение костей скелета с целью его исключения [9 - 11, 41].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется выполнить биопсию лимфатических узлов, подозрительных в отношении метастатических очагов, под контролем УЗИ/КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения [9 - 11, 42, 43].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется выполнить ПЭТ-КТ (Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения [43].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: метаанализ рандомизированных исследований по определению необходимости выполнения ПЭТ/КТ (Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) для исключения экстрапеченочных метастазов при решении вопроса о метастазэктомии в печени показал, что данный метод обследования меняет тактику лечения лишь у 8% пациентов и не влияет на общую выживаемость [43].
- Рекомендуется выполнить лапароскопию диагностическую при подозрении на диссеминацию опухоли по брюшине, когда их выявление принципиально меняет тактику лечения [44].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2).
- Рекомендуется выполнить МРТ головного мозга с контрастированием при подозрении на метастатическое поражение головного мозга, с целью его исключения [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.5 Иные диагностические исследования
- Рекомендуется пациентам при положительном результате биопсии (Биопсия прямой кишки с помощью видеоэндоскопических технологий) в заключении указывать гистологический тип опухоли и степень ее дифференцировки для определения оптимальной тактики лечения [32].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам с подозрением на рак прямой кишки при отрицательном результате биопсии (Биопсия прямой кишки с помощью видеоэндоскопических технологий) (диагноз новообразования не верифицирован) для определения тактики лечения принимать решение о необходимости выполнения повторной биопсии индивидуально, с учетом наличия признаков злокачественного роста по данным эндоскопических и рентгенологических методов обследования [32].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется при подготовке к хирургическому лечению в целях выбора алгоритма лечения пациента и оценки его функционального статуса выявлять сопутствующие заболевания у пациента с проведением необходимых диагностических исследований в соответствии с клиническими рекомендациями по данным заболеваниям, состояниям [9 - 11, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: проводятся эхокардиография, холтеровское мониторирование сердечного ритма, исследование функции внешнего дыхания (Флоуметрия дыхания), ультразвуковая допплерография (УЗДГ) сосудов шеи (Дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока) и нижних конечностей (Ультразвуковая допплерография вен нижних конечностей), приемы (осмотры, консультации) врача-кардиолога, врача-эндокринолога, врача-невролога и других профильных специалистов.
- Пациентам с диссеминированным или нерезектабельным местнораспространенным раком прямой кишки рекомендуется выполнять молекулярно-генетическое исследование биоптата опухоли на наличие соматической мутации генов семейства RAS (экзонов 2-4 гена KRAS и экзонов 2 - 3 гена NRAS) (Молекулярно-генетическое исследование мутаций в гене KRAS в биопсийном (операционном) материале, Молекулярно-генетическое исследование мутаций в гене NRAS в биопсийном (операционном) материале), с указанием мутации, гена BRAF, с указанием мутации, на микросателлитную нестабильность/дефицит белков системы репарации неспаренных оснований (Определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР), экспрессии или амплификации Her2 (при отсутствии мутаций в генах KRAS, NRAS, BRAF, MSS фенотипе), что может повлиять на выбор таргетного агента в лечении метастатического процесса [46 - 49]. Если мутации в генах KRAS, NRAS, BRAF определялись методом ПЦР и их не было обнаружено, то возможно рассмотреть проведение дальнейшего генетического поиска методом секвенирования, что может дополнительно выявить альтерации у 14 - 17% пациентов (приложение А3).
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: Молекулярно-генетический анализ возможно выполнять как на биопсийном материале опухоли, так и в циркулирующей опухолевой ДНК как методом ПЦР, так и секвенированием следующего поколения. При невозможности выполнения анализа на оптимальный спектр мутаций в генах RAS, необходимо рассмотреть возможность обращения в референсный центр. При метастатическом раке толстой кишки с микросателлитно нестабильным фенотипом возможно определение транслокаций генов NTRK, ROS1, ALK, RET в связи с относительно высоким шансом их наличия. В отсутствии микросателлитной нестабильности при метастатическом раке возможно рассмотреть определение соматических мутаций в генах POLD1 и POLE, при этом в заключении необходимо указывать только клинически значимые. Пациентам, которым планируется проведение химиотерапии с включением аналогов пиримидина, возможно рассмотреть определение 4 основных вариантов гена DPYD: c. 1905 + 1G > A (rs3918290), c. 2846A > T (rs67376798), c. 1679T > G (rs55886062) и c. 1236G > A (rs56038477), ассоциированных с токсичностью данного класса препаратов. При этом наличие гетерозиготных мутаций не всегда является отражением клинически значимого дефицита фермента дигидропиримидиндегидрогеназы [50 - 52]. Однако редкость гомозиготных вариантов данных полиморфизмов не позволяет назначать данный анализ в рутинной практике всем пациентам. Пациентам, которым планируется проведение химиотерапии с включением иринотекана**, возможно рассмотреть определение полиморфизма гена UGT1A1, ассоциированного с токсичностью данного класса препаратов [53]. При местнораспространенном раке прямой кишки до начала лечения желательно выполнять молекулярно-генетическое исследование биоптата опухоли на наличие микросателлитной нестабильности/дефицита белков системы репарации неспаренных оснований, что может повлиять на выбор тактики ведения пациента [54].
- Молекулярно-генетические исследования с целью исключения наследственных форм заболевания рекомендуются в следующих случаях:
1. Подозрение на синдром Линча - секвенирование генов MLH1, MSH2, MSH6 и PMS2 и поиск крупных делеций/вставок методом MLPA (Молекулярно-генетическое исследование мутаций в генах MLH1, MSH2, MSH6, PMS2 в крови):
- при соответствии пациента критериям Amsterdam II (приложение С), НМИЦ колопроктологии им. А.Н. Рыжих или рекомендациям Бетезда (приложение Г) и наличии в его опухолевом образце MSI/dMMR
2. Подозрение на семейный аденоматоз - секвенирование гена АРС и поиск крупных делеций/вставок методом MLPA:
- при наличии у пациента более 100 полипов кишечника или
- при наличии у пациента родственника 1 линии с установленным диагнозом семейного аденоматоза толстой кишки (при наличии родственника с выявленным патогенным вариантом гена APC).
3. Подозрение на наличие аттенуированной формы семейного аденоматоза (от 20 до 100 полипов) - секвенирование гена АРС. MUTYH-ассоциированный полипоз - секвенирование гена MUTYH - пациенты, у которых выявлено более 20 полипов толстой кишки, но с отрицательным анализом на патогенный вариант АРС:
- пациенты, у которых в семье прослеживается рецессивное наследование семейного аденоматоза;
- пациенты, у которых полипы выявляются в более позднем возрасте (34 - 44 лет) [13, 32, 55, 56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: за исключением MUTYH-ассоциированного полипоза и синдрома Блума, все наследственные синдромы, связанные с развитием колоректального рака, носят аутосомно-доминантный характер. При наличии яркого семейного анамнеза злокачественных заболеваний пациентам с исключенными семейным аденоматозным полипозом и синдромом Линча показана консультация генетика для потенциального выявления более редких заболеваний: синдромов Пейтца-Егерса, Ли-Фраумени, Блума, Коудена, ювенильного полипоза, олигодонтии и колоректального рака, NTHL1-ассоциированного полипоза, POLD1 и POLE-ассоциированных полипозов, PTEN-гамартомных опухолевых синдромов [2, 3]. Учитывая разнообразие наследственных синдромов и сложность их диагностики наиболее оптимальным является применение мультигенных панелей NGS или полноэкзомного секвенирования. При наличии сегментарного поражения толстой кишки множественными полипами необходимо проводить дифференциальную диагностику с воспалительными полипами на фоне язвенного колита.
- Рекомендуется проводить патологоанатомическое исследование операционного материала (Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки). В макроскопическом описании удаленного препарата следует отразить следующие параметры [7, 57 - 60]:
1) Длина удаленного отрезка кишки (см).
2) При наличии в макропрепарате первичной опухоли смежных органов перечислись их, указав размеры (см).
3) Оценить объем выполненной хирургом диссекции регионарной клетчатки в пределах мезоректальной фасции (по P. Quirke, TME-G1-G3).
4) Оценить объем выполненной хирургом диссекции мышц-леваторов в интерсфинктерной зоне (по P. Quirke, TME-G1-G3) в случае исследования препарата брюшно-промежностной экстирпации.
5) Расположение опухоли относительно нижней границы брюшины передней стенки кишки.
6) Размеры опухоли (см).
7) Наличие признаков перфорации серозной оболочки кишечной стенки вблизи опухоли.
8) Расстояние от опухоли до проксимального и дистального краев резекции (см).
9) При наличии двух и более первичных опухолей, отразить пункты 5 - 8 для каждого новообразования отдельно.
- В микроскопическом описании удаленного препарата следует отразить следующие параметры для определения прогноза заболевания и тактики дальнейшего лечения:
1) Гистологический тип инвазивной опухоли (Классификации ВОЗ, 2019 г.).
2) Степень злокачественности опухоли (если применимо).
3) Гистологические тип прединвазивной опухоли-предшественника (при наличии).
4) Глубина инвазии (pT).
5) Наличие микрососудистой инвазии (отрицательный результат также должен быть констатирован).
6) Наличие интрамуральной венозной инвазии (отрицательный результат также должен быть констатирован).
7) Наличие экстрамуральной венозной инвазии (отрицательный результат также должен быть констатирован).
8) Указать общее число исследованных лимфатических узлов.
9) Указать число лимфатических узлов с метастазами (pN+).
10) Указать число лимфатических узлов с микрометастазами [12] (pN+).
11) Указать число лимфатических узлов с изолированными опухолевыми клетками [13] (pN0).
12) Наличие периневральной инвазии (отрицательный результат также должен быть констатирован).
13) Гистологическая градация инвазивного фронта опухоли (tumor-budding) по 3-ступенчатой схеме International Tumor Budding Consensus Conference (2016).
14) Наличие в периколярной жировой ткани изолированных опухолевых депозитов без предсуществующих структур лимфатического узла (иначе следует относить к метастазу), сосудистых структур (иначе следует относить к сосудистой инвазии) или нервов (иначе следует относить к периневральной инвазии).
15) Наличие поражения проксимального края резекции (отрицательный результат также должен быть констатирован).
16) Наличие поражения дистального края резекции (отрицательный результат также должен быть констатирован).
17) Указать расстояние в миллиметрах от ближайшего фокуса опухоли (первичный очаг или депозит или метастаз) до маркированного красителем циркулярного края резекции (по P. Quirke).
18) Поражение наиболее удаленного от опухоли лимфатического узла вдоль сосудистого пучка - лимфатический узел маркирован хирургом (отрицательный результат также должен быть констатирован).
19) При наличии предшествующей неоадъювантной терапии указать степень регрессии опухоли и название использованной шкалы по оценки регрессии опухоли.
20) После проведения неоадъювантной терапии не выполняется оценка следующих параметров: степень злокачественности, tumor-budding.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: для оценки регрессии опухоли предпочтительно использование шкал Mandard или Ryan [61].
[12] Скопления опухолевых клеток в лимфатическом узле в наибольшем измерении 0,2 - 2 мм.
[13] Скопления опухолевых клеток в лимфатическом узле в наибольшем измерении менее 0,2 мм.
- Рекомендуется в макроскопическом описании при патолого-анатомическом исследовании операционного материала при трансанальном эндоскопическом удалении опухоли прямой кишки для определения прогноза заболевания и дальнейшей тактики лечения указывать следующие параметры [7, 57, 60, 62]:
1) Размеры удаленного фрагменты стенки кишки с опухолью (см).
2) Размеры опухоли (см).
3) Расстояние от опухоли до ближайших краев резекции (см).
В микроскопическом описании удаленного препарата следует отразить следующие параметры для определения прогноза заболевания и тактики дальнейшего лечения:
4) Гистологический тип инвазивной опухоли (Классификации ВОЗ, 2019 г.).
5) Степень злокачественности опухоли (если применимо).
1) Гистологические тип прединвазивной опухоли-предшественника (при наличии).
6) Глубина инвазии (pT):
2) Для малигнизированных полипов на широком основании при инвазии в пределах подслизистого слоя (pT1) дополнительно указывать глубину инвазии по Kikuchi.
3) Для малигнизированных полипов на ножке при инвазии в пределах подслизистого слоя (pT1) дополнительно указывать глубину инвазии по Haggitt.
4) В малигнизированных полипах при невозможности оценки инвазии по Haggitt и Kikuchi может быть указано только наличие или отсутствие поражения границ резекции.
7) Наличие микрососудистой инвазии (отрицательный результат также должен быть констатирован).
5) Наличие интрамуральной венозной инвазии (отрицательный результат также должен быть констатирован).
8) Наличие периневральной инвазии (отрицательный результат также должен быть констатирован).
6) Гистологическая градация инвазивного фронта опухоли (tumor-budding) по 3-ступенчатой схеме International Tumor Budding Consensus Conference (2016).
7) Расстояние в миллиметрах от опухоли до ближайшего латерального края резекции.
8) Указать расстояние в миллиметрах от ближайшего фокуса опухоли (первичный очаг, опухолевый эмбол, иное) до глубокого края резекции.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется в микроскопическом описании при патолого-анатомическом исследовании операционного материала указывать результаты дополнительных (иммуногистохимических) исследований:
1) Статус белков системы восстановления ДНК, дефицит/профицит MMR (антитела к белкам MLH1, PMS2, MSH2 и MSH6, интерпретация результатов в соответствие с рекомендациями производителя тест-системы [63, 64]).
2) Наличие в опухоли мутации BRAFV600E (рекомендовано к использованию антитело BRAFV600E клон VE1, интерпретация результатов в соответствие с рекомендациями производителя тест-системы [63]).
9) Наличие в опухоли экспрессии Her2 (рекомендовано к использованию антитело Her2, клон 4B5, интерпретация результатов может быть выполнена в соответствие с результатами валидационного исследования [65] или с применением шкалы для аденокарциномы желудка [66]).
3) Наличие в опухоли экспрессии NTRK (рекомендовано к использованию антитело pan-TRK, клон EPR17341, интерпретация результатов в соответствие с рекомендациями производителя тест-системы [67]).
4) Наличие в опухоли экспрессии ALK (рекомендовано к использованию антитело ALK, клон D5F3, интерпретация результатов в соответствие с рекомендациями производителя тест-системы [68]).
5) Наличие в опухоли экспрессии ROS1 (рекомендовано к использованию антитело ROS1, клон SP384, интерпретация результатов в соответствие с рекомендациями производителя тест-системы [69]).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинических рекомендациях, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.. Смена режимов противоопухолевой лекарственной терапии, изменение доз препаратов в схеме не подразумевает проведения для этого онкологического консилиума, а определяется лечащим врачом.
Лечение плоскоклеточного рака прямой кишки проводится в соответствии с принципами, описанными в клинических рекомендациях по лечению плоскоклеточного рака анального канала, с целью улучшения результатов лечения и повышения частоты проведения органосохраняющего лечения [70 - 72]. Лечение нейроэндокринных опухолей и нейроэндокринного рака прямой кишки также рассматривается в специализированном разделе клинических рекомендаций.
Порядок и рекомендации по обезболиванию при раке прямой кишки соответствуют рекомендациям, представленным в клинических рекомендациях "Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи" [73].
Специальных рекомендаций по диетотерапии, отличных от таковых при других формах злокачественных новообразований, не требуется. При наличии симптомов кишечной непроходимости врач индивидуально дает рекомендации по питанию и ограничению определенных продуктов.
- Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения пациентов раком прямой кишки, за исключением плоскоклеточного рака прямой кишки [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: по показаниям дополнительно проводится адъювантная/неоадъювантная химиотерапия, лучевая терапия, химиолучевая терапия.
3.1. Предоперационное лечение
Основными показаниями к проведению предоперационного лечения являются локализация опухоли ![]() 5 см от наружного края анального канала, поражение циркулярной границы резекции (по данным МРТ малого таза), поражение регионарных лимфатических узлов (по данным МРТ малого таза). Алгоритм выбора предоперационного лечения представлен в приложении Б (рисунок 2). Выбор предпочтительного режима лечения в различных клинических ситуациях разобран в отдельных тезисах ниже.
5 см от наружного края анального канала, поражение циркулярной границы резекции (по данным МРТ малого таза), поражение регионарных лимфатических узлов (по данным МРТ малого таза). Алгоритм выбора предоперационного лечения представлен в приложении Б (рисунок 2). Выбор предпочтительного режима лечения в различных клинических ситуациях разобран в отдельных тезисах ниже.
3.1.1. Общие принципы проведения предоперационного лечения.
- Рекомендуется использование следующих режимов лучевой и химиолучевой терапии пациентам раком прямой кишки, которым показан данный метод лечения:
1) курс дистанционной конформной лучевой терапии. РОД на первичную опухоль и зону регионарного метастазирования РОД 5 Гр, 5 фракций до СОД 25 Гр в течение 5 последовательных дней, или
2) курс дистанционной конформной лучевой терапии в комбинации с химиотерапией аналогами пиримидина (таблица 2). Лучевая терапия РОД 1, 8 - 2 Гр, СОД 44 Гр на зоны регионарного метастазирования. СОД 50 - 54 Гр на первичную опухоль. Лечение проводится ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ [74 - 76].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: в дальнейшем по тексту курс ЛТ РОД 5 Гр, СОД 25 Гр будет называться ЛТ 5 x 5 Гр, а курс ЛТ РОД 1, 8 - 2 Гр, СОД 50 - 54 Гр на фоне терапии фторпиримидинами - химиолучевой терапией (ХЛТ).
Незначительные вариации СОД возможны с учетом особенностей оборудования и конкретной клинической ситуации. Объем облучения на зону регионарного метастазирования должен включать параректальные, обтураторные, внутренние подвздошные, нижние брыжеечные лимфатические узлы. Начинается дистанционная лучевая терапия с объемного 3D-планирования и выполняется по технологии конформной лучевой терапии. Предлучевая топометрическая подготовка включает в себя выполнение КТ- и МРТ-исследований, на основании чего формируется план облучения. Точность воспроизведения условий лучевой терапии контролируется с помощью системы портальной визуализации. Возможно проведение лучевой терапии на протонных ускорителях энергией 70 - 250 МэВ с использованием протонных комплексов.
Таблица 2. Режимы аналогов пиримидина, применяемые в одновременной химиолучевой терапии рака прямой кишки
Схема химиотерапии
Препарат
Доза
Путь введения
Дни приема
Длительность цикла, дни
Количество циклов
1
Непрерывная инфузия #фторурацила**
225 мг/м2 в/в непрерывно
5 (в дни лучевой терапии) или 7 дней в неделю в зависимости от переноси-мости
На протяжении всей лучевой терапии
На протяжении всей лучевой терапии (50 - 50,4 Гр, РОД 1,8 - 2,0 Гр/ фракция)
2
#Капецитабин**
825 мг/м2
2 раза в сутки
Внутрь
3
Болюсная инфузия фторурацила**
400 мг/м2
Внутривенно
Дни 1 - 4, недели 1, 5
1 - 4 день
2 цикла
Болюсная инфузия кальция фолината**
20 мг/м2
Внутривенно
Дни 1 - 4, недели 1, 5
1 - 4 день
2 цикла
- Рекомендуется пациентам после пролонгированного курса ХЛТ с целью достижения максимального эффекта ХЛТ и снижения риска послеоперационных осложнений [77 - 79] соблюдать следующие сроки проведения хирургического лечения: в случае отсутствия консолидирующей ХТ - не ранее 7 и не позднее 12 недель после завершения, в случае проведения консолидирующей ХТ - не позднее 20 недель с момента ее завершения.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: ожидание более 8 нед после завершения химиолучевой терапии допустимо, однако по результатам рандомизированного исследования увеличение интервала до 11 недель не приводило к увеличению частоты полных патоморфологических ответов и улучшению выживаемости.
- Рекомендуется пациентам после курса лучевой терапии РОД 5 Гр, СОД 25 Гр с целью достижения максимального эффекта и снижения риска осложнений соблюдать следующие сроки проведения хирургического лечения: в случае отсутствия консолидирующей ХТ - не ранее 6 и не позднее 8 недель после завершения, в случае проведения консолидирующей ХТ - не позднее 20 недель с момента ее завершения [80 - 83].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: другие варианты тотальной неоадъювантной химиотерапии в сочетании с данным режимом ЛТ в проспективных исследованиях не изучены
- Рекомендуется использование следующих режимов неоадъювантной химиотерапии пациентам раком прямой кишки, которым показан данный метод лечения: проведение химиотерапии по схеме FOLFOX или XELOX, при этом продолжительность химиотерапии не должна превышать 12 недель [84 - 87].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: при проведении до ЛТ или ХЛТ неоадъювантную химиотерапию принято называть индукционной, при проведении после завершения ЛТ или ХЛТ - консолидирующей. По показаниям возможно проведение НАХТ без ЛТ или ХЛТ. Принципы ее проведения при этом не меняются.
- Пациентам с локализованным раком прямой кишки (Т1sm3-Т2-3bN0-1M0 рак нижне- и среднеампулярного отделов прямой кишки) в медицинских организациях, в которых имеется опыт проведения подобного лечения, рекомендуется рассматривать возможность проведения курса химиолучевой терапии (с возможным добавлением консолидирующей НАХТ) с дальнейшим использованием тактики "наблюдения и ожидания" с целью выполнения органосохраняющего лечения в случае полного клинического ответа на химиолучевую терапию [88, 89].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: пациентам с локализованным раком прямой кишки, которым показано выполнение операций в объеме низкой передней резекции прямой кишки или брюшно-промежностной экстирпации прямой кишки, потенциально связанных со значительным снижением качества жизни, возможно проведение радикального курса химиолучевой терапии (СОД не менее 50 Гр) с последующим наблюдением. Учитывая малый опыт учреждений в использовании подобной стратегии лечения, рекомендуется обсуждать случаи использования тактики "наблюдения и ожидания" с федеральными клиниками, имеющими компетенцию в данной области (оптимально использование телемедицины). У значительного числа пациентов возможно достичь стойкой полной регрессии опухоли. Условиями для проведения данной тактики лечения являются:
- полное информированное согласие пациента с указанием возможных осложнений химиолучевой терапии и альтернативных вариантов лечения;
- возможность явки пациента на контрольные обследования не реже 4 раз в год в течение не менее чем 3 лет после завершения химиолучевой терапии. Письменное согласие пациента на проведение контрольных обследований с необходимой регулярностью.
Данная стратегия применима только в медицинских организациях, в которых имеется опыт проведения подобного лечения, т.к. она связана с рядом дополнительных рисков для пациентов, требует наличия мультидисциплинарной команды специалистов, включающей врача-онколога, хирурга, врача-эндоскописта, радиолога, специализирующегося на МРТ диагностике опухолей малого таза, радиотерапевта, химиотерапевта, имеющих опыт ведения пациентов с тактикой "наблюдения и ожидания". Во время каждого контрольного обследования пациенту должны быть выполнены: пальцевое исследование прямой кишки (Трансректальное пальцевое исследование), МРТ органов малого таза, видеоректоскопия (Видеоколоноскопия).
При исходной возможности выполнения операции в объеме передней резекции прямой кишки с парциальной мезоректумэктомией, связанной с меньшим риском снижения качества жизни, использование тактики "наблюдения и ожидания" не оправдано и может рассматриваться только у пациентов с объективными противопоказаниями или крайне высоким риском проведения радикального хирургического лечения.
Критериями полного клинического ответа следует считать отсутствие достоверных признаков остаточной опухолевой ткани по данным МРТ органов малого таза (mrTRG1-2), отсутствие признаков остаточной опухоли или наличие только плоского белого рубца или плоской белой язвы при видеоректоскопии, отсутствие признаков остаточной опухоли при пальцевом ректальном исследовании. Диагноз "полного клинического ответа" невозможно поставить без выполнения всех 3 исследований (МРТ органов малого таза, видеоректоскопии (Видеоколоноскопия), пальцевого ректального исследования (Трансректальное пальцевое исследование)), также его невозможно поставить при mrTRG3-5, при выполнении простой ригидной ректоскопии (Ректороманоскопия).
3.1.2. Предоперационное лечение пациентов с неметастатическим раком нижнеампулярного отдела прямой кишки.
- Пациентам с нижнеампулярным раком прямой кишки cT2-4bN0M0 или сТлюбоеN1-2M0 рекомендуется проведение ХЛТ, при этом возможно увеличение СОД с учетом особенностей оборудования и конкретной клинической ситуации до 56 Гр [77, 90 - 92].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: альтернативные режимы лучевой терапии с меньшей вероятностью обеспечивают регрессию и повышение резектабельности опухоли.
- При отсутствии осложнений 3 - 4 степени пациентам с нижнеампулярным раком прямой кишки cT2-4bN0M0 или cTлюбоеN1-2M0 после завершения курса ХЛТ рекомендуется рассматривать проведение консолидирующей НАХТ [84].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: при этом сроки проведения хирургического лечения не должны превышать указанные в разделе 3.1.1 Проведение консолидирующей НАХТ является предпочтительным у пациентов, когда целью лечения является достижение максимальной регрессии опухоли или полного клинического ответа, у пациентов с поражением ЦГР.
- При раке прямой кишки (cT3-4N0-2M0, в нижнеампулярном отделе - cT2-4N0-2M0) с MSI с целью достижения полного клинического эффекта рекомендуется рассматривать проведение 6 месяцев терапии анти-PD-антителами (пембролизумаб**, ниволумаб**) в качестве альтернативы другим видам предоперационного лечения [93].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
3.1.3. Предоперационное лечение пациентов с неметастатическим раком среднеампулярного отдела прямой кишки.
- Пациентам со среднеампулярным раком прямой кишки с поражением ЦГР рекомендуется проведение ХЛТ, при этом возможно увеличение СОД с учетом особенностей оборудования и конкретной клинической ситуации до 56 Гр [77, 90, 92].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: альтернативные режимы лучевой терапии с меньшей вероятностью обеспечивают регрессию и повышение резектабельности опухоли. Также можно рассматривать проведение ХЛТ в качестве варианта лечения при среднеампулярном раке прямой кишки без поражения ЦГР, при стадиях сТ3с-Т4аN0M0, cT2-N4aN1-2M0.
- При отсутствии осложнений 3 - 4 степени пациентам со среднеампулярным раком прямой кишки с поражением ЦГР после завершения курса ХЛТ рекомендуется рассматривать проведение консолидирующей НАХТ [84].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
Комментарии: при этом сроки проведения хирургического лечения не должны превышать указанные в разделе 3.1.1 Проведение консолидирующей НАХТ является предпочтительным у пациентов, когда целью лечения является достижение максимальной регрессии опухоли или полного клинического ответа, у пациентов с поражением ЦГР. Также можно рассматривать проведение консолидирующей НАХТ в качестве варианта лечения при среднеампулярном раке прямой кишки без поражения ЦГР, при стадиях сТ3с-Т4аN0M0, cT2-N4aN1-2M0.
- Рекомендуется пациентам со среднеампулярным раком прямой кишки при стадии сT3c-T4а-N0-2M0, при отсутствии поражения ЦГР рассматривать проведение лучевой терапии РОД 5 Гр, СОД 25 Гр с консолидирующей НАХТ [80 - 83].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: Предпочтение отдается курсу ЛТ 5 x 5 Гр с консолидирующей химиотерапией, а не ХЛТ, учитывая более высокий риск системного, а не локального прогрессирования при отсутствии поражения ЦГР.
- Рекомендуется пациентам со среднеампулярным раком прямой кишки при стадии сT2-T4а-N1-2M0, сT3с-Т4аN0M0 при отсутствии поражения ЦГР рассматривать проведение НАХТ с последующим продолжением адъювантной химиотерапии суммарно до 6 месяцев лечения. При отсутствии ответа или росте первичной опухоли возможно рассмотреть проведение предоперационной ХЛТ [94, 95].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: Отказ от проведения ЛТ или ХЛТ при раке среднеампулярного отдела прямой кишки возможен только в специализированных клиниках с высоким потоком операций (не менее 20 резекций прямой кишки на хирурга в год).
- Рекомендуется пациентам со среднеампулярным раком прямой кишки при стадии сТ2-3bN0-1M0 и отсутствии поражения ЦГР рассматривать проведение хирургического лечения (A16.19.020 - A16.19.021.014) без предоперационной терапии [96, 97].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: Отказ от проведения предоперационного лечения при раке среднеампулярного отдела прямой кишки возможен только в специализированных клиниках с высоким потоком операций (не менее 20 резекций прямой кишки на хирурга в год). Рассматривать хирургическое лечение возможно только у пациентов с поражением не более 3 лимфатических узлов и их максимальным размером менее 8 мм по данным МРТ органов малого таза. Данная тактика менее предпочтительна у пациентов мужского пола в связи с близостью к мышцам тазового дна.
3.1.4. Предоперационное лечение пациентов с неметастатическим раком верхнеампулярного отдела прямой кишки.
- Рекомендуется пациентам с верхнеампулярным раком прямой кишки при стадии cT3c-T4b-N0-2M0, cTлюбоеN1-2M0 рассматривать проведение НАХТ, в случае решения онкологического консилиума о наличии факторов риска, делающих проведение хирургического лечения на 1 этапе нежелательным [98].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: Предпочтительным вариантом лечения для большинства пациентов с верхнеампулярным раком прямой кишки является проведение радикального хирургического вмешательства на 1 этапе. Анатомически верхнеампулярный отдел прямой кишки расположен преимущественно в брюшной полости, что позволяет экстраполировать результаты клинических исследований по лечению рака ободочной кишки [99, 100]. Проведение НАХТ возможно рассматривать у пациентов с распространенным поражением регионарных лимфатических узлов, наличием опухолевых депозитов или других индивидуально определяемых факторов негативного прогноза.
- Рекомендуется пациентам с верхнеампулярным раком прямой кишки при поражении ЦГР за счет первичной опухоли рассматривать проведение ЛТ или ХЛТ с консолидирующей НАХТ [84].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
3.1.5. Предоперационная лучевая терапия у пациентов с метастатическим раком прямой кишки.
- Рекомендуется пациентам с метастатическим нижнеампулярным раком прямой кишки или метастатическим раком прямой кишки с поражением ЦГР при планировании резекции первичной опухоли проводить предоперационную конформную ЛТ 5 x 5 Гр [101 - 103].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: в остальных ситуациях решение о проведении лучевой терапии пациентам с метастатическим раком прямой кишки принимается индивидуально, с учетом прогноза заболевания, наличия симптомов со стороны первичной опухоли. Проведение пролонгированного курса ХЛТ обычно не рекомендуется, учитывая высокий риск системного прогрессирования заболевания. Исключение могут составлять ситуации, когда у пациента исходно резектабельные метастазы, ограниченные одним органом, при этом проведение ХЛТ может принципиально повлиять на возможность проведения сфинктеросохраняющего лечения, а также когда у пациента метастатический рак прямой кишки cT4b с низкой вероятностью удаления первичной опухоли в объеме R0. Период ожидания после завершения курса ЛТ целесообразно использовать для дополнительного проведения лекарственного лечения или проведения резекции метастатических очагов.
- Рекомендуется пациентам с метастатическим раком прямой кишки при наличии отдаленных метастазов только в тазовых лимфатических узлах проводить предоперационную ХЛТ с включением пораженных лимфатических узлов в поля облучения [101 - 103].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при технической возможности лечение целесообразно дополнять индукционной и/или консолидирующей НАХТ.
3.1.6. Послеоперационная лучевая терапия
- Рекомендуется отказаться от проведения послеоперационной лучевой или химиолучевой терапии в пользу проведения адъювантной химиотерапии у больных раком прямой кишки 2 - 3 стадии [104, 105].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: в отличие от адъювантной химиотерапии, послеоперационная ЛТ и ХЛТ не оказывают достоверного влияния на выживаемость пациентов [104, 105]. Роль послеоперационной терапии в условиях выполнения тотальной мезоректумэктомии не установлена.
3.2. Общие принципы хирургического лечения. Хирургическое лечение неметастатического рака прямой кишки
- При технической доступности и при наличии квалифицированной хирургической бригады в специализированных клиниках рекомендуется выполнять хирургическое лечение рака прямой кишки лапароскопическим доступом (A16.19.020.002, A16.19.021.003, A16.19.021.012, A16.19.021.013) для ускорения периода реабилитации пациентов и снижения риска периоперационных осложнений [106 - 109].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: лапароскопические резекции прямой кишки имеют ряд преимуществ, включая раннюю реабилитацию пациентов, снижение частоты развития и выраженности спаечного процесса, меньшее использование опиоидных анальгетиков, снижение сроков госпитализации, меньший риск развития послеоперационных грыж и лучший косметический результат операции. По своей онкологической эффективности лапароскопические операции по поводу рака прямой кишки не уступают открытым вмешательствам, однако, требуют соответствующей подготовки хирургической бригады. Возможно использование роботического хирургического доступа, однако его преимущества перед лапароскопическим не доказаны.
- Рекомендуется при наличии противопоказаний к формированию первичного анастомоза с целью снижения риска послеоперационных осложнений выполнять обструктивную резекцию с формированием концевой колостомы (операция Гартмана) [110].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется при раке прямой кишки выполнять следующие стандартные объемы оперативных вмешательств у пациентов с раком прямой кишки: передняя резекция прямой кишки, низкая передняя резекция прямой кишки, брюшно-анальная резекция прямой кишки, операция Гартмана, брюшно-промежностная экстирпация прямой кишки (A16.19.020 - A16.19.021.014). Мобилизация прямой кишки должна выполняться только острым путем с соблюдением принципов тотальной или частичной мезоректумэктомии (необходимо удаление мезоректума не менее 5 см дистальнее опухоли) с сохранением тазовых вегетативных нервов [109, 111, 112].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: при распространении опухоли за пределы мезоректальной фасции показано экстрафасциальное удаление прямой кишки. При выполнении мультивисцеральных резекций для рассечения тканей предпочтительно использовать электрохирургические и ультразвуковые инструменты с целью уменьшения кровопотери. Дистальная граница резекции должна составлять не менее 2 см по стенке кишки и не менее 5 см по мезоректальной клетчатке из-за риска ретроградного лимфогенного метастазирования.
Нижняя брыжеечная артерия должна быть лигирована непосредственно у места отхождения от аорты либо непосредственно ниже уровня отхождения левой ободочной артерии, перевязка нижней брыжеечной вены - ниже тела поджелудочной железы, что позволяет мобилизовать левые отделы ободочной кишки (при необходимости с полной мобилизацией селезеночного изгиба) для формирования колоректального анастомоза без натяжения. Допустима перевязка нижней брыжеечной вены на том же уровне, что и нижней брыжеечной артерии. При этом следует при технической возможности сохранять преаортальное и нижнее брыжеечное вегетативные нервные сплетения. Мобилизацию прямой кишки следует производить в межфасциальном пространстве с сохранением (при отсутствии опухолевого поражения) правого и левого подчревных нервов, тазовых сплетений и внутренностных нервов. Рутинное выполнение расширенной аорто-подвздошно-тазовой лимфодиссекции не рекомендуется. При выполнении тотальной мезоректумэктомии (локализация опухоли ниже 10 см от наружного края анального канала) и формировании низкого колоректального анастомоза рекомендуется формировать превентивную коло- или илеостому. После тотальной мезоректумэктомии операция может завершаться формированием тазового толстокишечного резервуара или анастомоза "бок-в-конец" для улучшения функциональных результатов лечения.
Выполнение экстралеваторной экстирпации прямой кишки показано пациентам с подтвержденным МРТ врастанием опухоли в мышцы тазового дна.
При вовлечении в опухолевый процесс соседних органов и тканей возможно расширение объема хирургического вмешательства до передней экзентерации малого таза, задней экзентерации малого таза или тотальной экзентерации малого таза.
- Рекомендуется у пациентов с кишечной непроходимостью, а также со свищами, вызванными раком прямой кишки, ограничивать хирургическое лечение формированием двуствольной трансверзо- или сигмостомы (Колостомия) с целью проведения последующего комбинированного лечения и повышения вероятности выполнения хирургического лечения в объеме R0 [110, 113].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: у пациентов с не купируемым консервативно клинически значимым кровотечением и/или перфорацией с развитием перитонита, вызванными раком прямой кишки, показано на первом этапе выполнение хирургического лечения рака прямой кишки с соблюдением принципов тотальной мезоректумэктомии (A16.19.020 - A16.19.021.014). При других осложнениях опухолевого процесса предпочтение следует отдавать формированию временной или постоянной кишечной стомы. Выполнение на первом этапе хирургических вмешательств с удалением первичной опухоли возможно только в отдельных случаях по решению онкологического консилиума с участием хирурга-онколога, лучевого терапевта, химиотерапевта и документированным обоснованием невозможности проведения предоперационного лечения. В отдельных случаях, при условии наличия в клинике должного опыта и оборудования, разрешение непроходимости возможно путем стентирования с последующей подготовкой пациента к плановому хирургическому или комбинированному лечению. Выбор в пользу формирования трансверзо- или сигмостомы должен определяться планом последующего хирургического лечения. Если наиболее вероятный объем последующей операции - брюшно-промежностная экстирпация прямой кишки или обструктивная резекция прямой кишки (A16.19.020 - A16.19.021.014) (при локализации опухоли ниже 5 см от анокутанной линии и/или при вовлечении в опухолевый процесс мышц тазового дна и/или при исходной полной анальной инконтиненции) предпочтение следует отдавать формированию двухствольной сигмостомы. Во всех остальных ситуациях (при планировании любого вида сфинктеросохраняющих операций) предпочтение следует отдавать формированию трансверзостомы, которую в дальнейшем можно использовать как превентивную после формирования сигморектального анастомоза.
- Рекомендуется пациентам, которым выполнены операции по поводу рака прямой кишки с формированием временной кишечной стомы, с целью снижения риска послеоперационных осложнений выполнять закрытие стомы (закрытие колостомы или закрытие илеостомы) не ранее 12 нед после ее формирования [114, 115].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: у отдельных пациентов с низким риском послеоперационных осложнений по решению консилиума возможно закрытие превентивных коло- или илеостом в более ранние сроки, но только после эндоскопической (видеоколоноскопия) и рентгенологической (проктография) проверки состоятельности межкишечного анастомоза [116, 117]. В общей популяции риск осложнений при раннем закрытии стом выше [114]. Закрытие колостомы или илеостомы в процессе адъювантной химиотерапии возможно и не связано с повышенным риском послеоперационных осложнений [118, 119].
- При раннем раке прямой кишки 0 - I стадии (Tis-T1sm1-sm2N0M0) рекомендуется выполнять хирургическое лечение методом трансанального полнослойного эндоскопического удаления опухоли или эндоскопической подслизистой диссекции с целью сохранения органа [120 - 125].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: особенность - благоприятный прогноз (5-летняя выживаемость более 90%) и возможность применения органосохранных и функционально-щадящих способов лечения с высокой эффективностью. При отсутствии в клинике оборудования для выполнения трансанального эндоскопического удаления опухоли или опыта выполнения эндоскопической подслизистой диссекции показано направление пациента в специализированный центр, где возможно проведение необходимого лечения.
Показания к проведению органосохранного лечения:
умеренно- или высокодифференцированная аденокарцинома с инвазией ограниченной подслизистым слоем (основой) стенки прямой кишки без явных признаков поражение мезоректальных лимфоузлов по данным МРТ таза и/или эндоректального УЗИ.
При выявлении после морфологического исследования удаленной трансанально опухоли факторов негативного прогноза выполняется стандартная операция с тотальной мезоректумэктомией (TMЭ). Факторы негативного прогноза:
- стадия > pT1sm3;
- поражение краев резекции;
- лимфоваскулярная инвазия;
- низкодифференцированная или слизистая аденокарцинома;
- перстневидноклеточный рак;
- степень почкования опухоли (tumor budding) 2 - 3.
Адъювантная терапия не проводится.
- При раке прямой кишки, не требующем проведения предоперационного лечения (см. раздел 3.1), рекомендуется выполнение тотальной или частичной мезоректумэктомии без предоперационного лечения с целью снижения рисков побочных эффектов лечения [96, 126].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: В случае отсутствия предоперационного лечения при II - III стадии рака прямой кишки проведение адъювантной химиотерапии определяется правилами ее назначения как при раке ободочной кишки.
- Рекомендуется перед проведением предоперационной ЛТ или ХЛТ у женщин моложе 45 лет обсуждать с пациентками возможность проведения лапароскопической транспозиции яичников с целью сохранения гормональной функции [127].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2).
Комментарии: Проведение транспозиции яичников не влияет на онкологические результаты лечения и должно предлагаться исключительно с целью повышения качества жизни, наиболее обосновано проведение данного вмешательства у пациенток моложе 40 лет. При этом проведение транспозиции яичников позволяет сохранить гормональную функцию только у 60 - 70% пациенток.
3.3. Лечение пациентов с резектабельными метастазами
- Рекомендуется всех пациентов с изолированным метастатическим поражением печени/легких на долечебном этапе обсуждать совместно врачами-хирургами и врачами-онкологами, имеющими опыт выполнения резекций печени, легких с целью выработки оптимального плана лечения [9, 96].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- При генерализованном раке прямой кишки с потенциально резектабельными синхронными метастазами в печени и/или легких рекомендуется выполнять хирургическое вмешательство (A16.14.036 - A16.14.036.011; A16.09.009 - A16.09.009.011, A16.09.013 - A16.09.015), как только метастазы будут признаны резектабельными, с целью улучшения результатов лечения [128, 129].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: тактика лечения зависит от исходной резектабельности метастатических очагов. Наилучших результатов возможно добиться при достижении края резекции не менее 1 мм. При исходной возможности выполнения R0 резекции метастазов рака прямой кишки в печень или легкие, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения проведение хирургического лечения в объеме R0 может обеспечить 5-летнюю выживаемость у 30 - 50% пациентов. Пациентам, которые ранее получали химиотерапевтическое лечение, хирургическое вмешательство в объеме R0 необходимо выполнять, как только метастазы станут резектабельными. Пролонгация химиотерапии может приводить к повышению частоты токсических поражений печени, а также к "исчезновению" части метастазов, что затрудняет их идентификацию хирургом во время резекции. При наличии симптомной первичной опухоли (угрозе кишечной непроходимости/кровотечения) на первом этапе проводится хирургическое лечение в объеме удаления первичной опухоли с лимфодиссекцией (A16.19.020 - A16.19.021.014). Радиочастотная аблация (РЧА) (Чрескожная радиочастотная абляция опухолей печени под контролем ультразвукового исследования) метастазов в печень или стереотаксическое лучевое воздействие может применяться как дополнение к резекции для достижения радикальности вмешательства, так и самостоятельно при невозможности хирургического лечения. Альтернативой немедленному хирургическому лечению является проведение периоперационной системной химиотерапии (FOLFOX, XELOX). Данный вариант стратегии следует выбрать при высоком риске прогрессирования заболевания (например, при высоком риске по классификации Fong или любой другой). После 8-12 недель терапии выполняется одновременное или последовательное удаление метастазов и первичной опухоли (A16.14.036 - A16.14.036.011; A16.09.009 - A16.09.009.011, A16.09.013 - A16.09.015, A16.19.020 - A16.19.021.014), а после операции продолжается проводимая ранее химиотерапия до достижения суммарной продолжительности 6 мес. Добавление моноклональных антител к химиотерапии не показано при резектабельных метастазах, так как может ухудшать отдаленные результаты. Применение локальных методов лечения метастазов (хирургия, радиочастотная абляция, лучевая терапия и т.п.) может рассматриваться как при олигопрогрессировании, так и при олигометастатическом поражении органов и во второй и последующих линиях системного лечения.
- При генерализованном раке прямой кишки с нерезектабельными синхронными метастазами рекомендуется проведение максимально эффективной химиотерапии - применение двойных или тройных комбинаций (FOLFOX, XELOX или FOLFIRI, XELIRI, FOLFOXIRI) - задачей которой является достижение объективного эффекта и перевод нерезектабельных метастазов в резектабельные [9 - 11, 130]. При MSI - монотерапии анти-PD1 антителами - ниволумабом** или пембролизумабом** в монорежиме или комбинацией ниволумаба** и ипилимумаба** [131 - 133].
Уровень убедительности рекомендаций для пембролизумаба - A (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций для ниволумаба или комбинации ниволумаба и ипилимумаба - C (уровень достоверности доказательств - 4).
Комментарии: при левосторонней локализации первичной в опухоли в случае отсутствия мутации RAS, BRAF, гиперэкспрессии/амплификации Her2neu и MSS возможно добавление к режимам химиотерапии FOLFIRI или FOLFOX (но не XELOX/XELIRI или FLOX) анти-EGFR моноклональных антител (МКАТ), что позволяет увеличить частоту выполнения R0-резекций печени и увеличить продолжительность жизни. При правосторонней локализации первичной опухоли, наличии мутаций в генах KRAS, NRAS, BRAF, гиперэкспрессии/амплификации HER2neu или MSS рекомендуется добавление бевацизумаба к любому двойному режиму химиотерапии (вне зависимости от мутации RAS), что повышает частоту выраженного лекарственного патоморфоза по сравнению только с химиотерапией. Другой возможной опцией повышения резектабельности является применение "тройной" комбинации FOLFOXIRI, к которой возможно добавление МКАТ, однако более высокая токсичность режима требует осторожности при его назначении. Внутриартериальная химиотерапия остается экспериментальным методом и не рекомендуется к рутинному применению в первой линии терапии. Различные методы эмболизации печеночной артерии, внутриартериальная химиотерапия могут применяться у отдельных пациентов с изолированным или преобладающим метастатическим поражением печени при исчерпанности возможностей системной терапии. Пациенты, у которых ответ на лечение недостаточен для перевода опухоли в резектабельное состояние, подлежат паллиативному лекарственному лечению. Вопрос об удалении первичной опухоли решается индивидуально с учетом риска развития связанных с ней осложнений. При условии хорошего ответа на проводимую терапию проводится повторная оценка резектабельности метастатических очагов.
- При метахронных резектабельных метастазах рака прямой кишки в печени или легких рекомендуется проведение хирургического лечения с послеоперационной химиотерапией двойными (FOLFOX или XELOX) комбинациями препаратов или монотерапией фторпиримидинами [130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2).
Комментарии: при исходной возможности выполнения R0 резекции метастазов рака прямой кишки в печень или легкие, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения проведение хирургического лечения в объеме R0 может обеспечить 5-летнюю выживаемость у 30 - 50% пациентов. Альтернативой данному подходу при наличии неблагоприятных онкологических факторов (например, 3 - 5 балла по шкале Fong) является проведение периоперационной (около 3 мес терапии FOLFOX или XELOX до резекции печени и столько же после нее) химиотерапии.
- При исходно резектабельных метастатических очагах после успешного проведения R0- или R1-резекции для снижения риска прогрессирования заболевания рекомендуется проведение адъювантной химиотерапии [130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2).
Комментарии: при исходно резектабельных метастатических очагах альтернативой немедленному хирургическому лечению является проведение периоперационной системной химиотерапии (FOLFOX, XELOX). Данный вариант стратегии следует выбрать при высоком риске прогрессирования заболевания (например, при высоком риске по классификации Fong или любой другой). После 8 - 12 недель терапии выполняется одновременное или последовательное удаление метастазов и первичной опухоли, а после операции продолжается проводимая ранее химиотерапия до достижения суммарной продолжительности 6 мес. При низком риске прогрессирования заболевания (например, при низком риске по классификации Fong или любой другой, ранее проводимая химиотерапия), возможна опция и наблюдения, если хирургическое удаление метастазов выполнялось на первом этапе. Добавление моноклональных антител (МКА) к химиотерапии при резектабельных метастазах в печени не показано, так как оно может ухудшить отдаленные результаты.
- При потенциально резектабельных синхронных и метахронных метастатических очагах рекомендуется проведение максимально активной химиотерапии, задачи которой - достижение объективного эффекта и перевод нерезектабельных метастазов в резектабельные (FOLFOX, XELOX или FOLFIRI, XELIRI, FOLFOXIRI) [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При потенциально резектабельных метастатических очагах в случае отсутствия мутации RAS и BRAF, отсутствие гиперэкспрессии или амплификации Her/2, при MSS рекомендуется рассмотреть возможность добавления к химиотерапии (режимы FOLFIRI, FOLFOX, FOLFOXIRI) цетуксимаба** или панитумумаба** [130, 134].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: Комбинация FOLFOXIRI с анти-EGFR-антителами характеризуется большей токсичностью и, хотя не во всех исследованиях приводит к повышению частоты объективных ответов, может быть рассмотрена у отдельных пациентов в общем хорошем состоянии, левосторонней локализации первичной опухоли и с потенциально-операбельными метастазами.
- При потенциально резектабельных метастатических очагах при наличии мутации RAS или BRAF или MSI рекомендовано добавление бевацизумаба** к любому из указанных выше режимов химиотерапии (FOLFOX XELOX или FOLFIRI, XELIRI). Другой возможной опцией повышения резектабельности является применение "тройной" комбинации FOLFOXIRI, к которой возможно добавление бевацизумаба** [134, 135]. После 4 - 6 циклов выполняется повторная оценка резектабельности, при отсутствии прогрессирования - одновременное или последовательное удаление метастазов и первичной опухоли. Далее - адъювантная химиотерапия по программе FOLFOX или XELOX или монотерапией фторпиримидинами до суммарной продолжительности 6 мес. (с учетом предоперационной химиотерапии). В случае прогрессирования/невозможности удаления метастатических очагов лечение проводится по принципам, указанным в пункте лечения пациентов с нерезектабельными метастазами [136].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- При потенциально резектабельных метастатических очагах при наличии мутации BRAF с целью повышения вероятности ответа на лечение рекомендовано назначение режима химиотерапии FOLFOXIRI c МКАТ (бевацизумабом**) [9, 134 - 136].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: в случае назначения таргетных препаратов, после перевода метастазов в операбельное состояние и выполнения R0-резекции метастатических очагов, проводится химиотерапия до суммарной продолжительности 6 мес. Цетуксимаб**, панитумумаб**, бевацизумаб** и иринотекан** в послеоперационном периоде следует отменить.
При R1/2 резекции возможно продолжение предоперационной комбинации химиопрепаратов и МКА до суммарной продолжительности 6 мес.
- При потенциально резектабельных метастазах при MSI рекомендовано назначение в 1-й линии комбинации ниволумаба** и ипилимумаба** или, при отсутствии мутаций в генах RAS, пембролизумаба** в монорежиме до прогрессирования или перехода опухоли в резектабельное состояние. Также допустима комбинация режимов FOLFOX или XELOX с ниволумабом или пембролизумабом [137 - 139]. Оптимальная продолжительность иммунотерапии после выполнения R0-резекции точно не определена, но при удовлетворительной переносимости рекомендуется продолжать до 1 года с учетом предоперационного этапа [131 - 133].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2) для пембролизумаба и Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4) для комбинации ниволумаба и ипилимумаба.
3.4. Рак прямой кишки у функционально неоперабельного пациента
- При раке прямой кишки у функционально неоперабельного пациента (на фоне тяжелой сопутствующей патологии) рекомендуется проведение паллиативного лекарственного лечения либо симптоматической терапии для увеличения продолжительности жизни и контроля симптомов со стороны опухоли. Возможно стентирование опухоли или формировании разгрузочной кишечной стомы [9, 140].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: риск проведения операции превышает риск, связанный с прогрессированием онкологического заболевания. Решение о наличии противопоказаний к хирургическому лечению может приниматься только на консилиуме с участием врача-хирурга, врача-терапевта, врача-анестезиолога-реаниматолога.
3.5. Рецидивы рака прямой кишки
- При рецидиве рака прямой кишки рекомендовано проведение предоперационной дистанционной конформной лучевой терапии РОД 2 Гр, СОД 44 Гр на зону регионарного метастазирования, СОД 54 - 58 Гр на зону рецидива (в случае, если лучевая терапия не проводилась ранее), затем рассмотреть возможность повторного хирургического лечения, при невозможности проведения повторного хирургического лечения рекомендована системная химиотерапия [141 - 147].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: даже если пациенту ранее проводилась лучевая терапия, необходимо рассмотреть вопрос о возможности дополнительного облучения или локального стереотаксического лучевого воздействия. Хирургическое лечение (A16.19.020 - A16.19.021.014) выполняют через 10 - 12 нед после химиолучевой терапии. В случае невозможности проведения лучевой терапии и выполнения хирургического вмешательства проводят паллиативную химиотерапию.
Выбор лечебной тактики осуществляется на мультидисциплинарном консилиуме с участием врача-онколога, врача-хирурга, врача-радиотерапевта и врача-онколога (химиотерапевта) на основании результатов дооперационного обследования с определением клинической стадии заболевания.
- При рецидиве рака прямой кишки, если лучевая терапия проводилась ранее, с целью повышения вероятности выполнения хирургического лечения в объеме R0 рекомендованы прием (осмотр, консультация) врача-онколога (лучевого терапевта) на предмет возможности проведения повторного курса лучевой терапии и проведение повторного курса лучевой терапии при технической возможности [148].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: конкретная схема и дозы повторных курсов лучевой терапии определяются индивидуально, т.к. возможность проведения повторного лечения зависит от большого количества факторов, включая использованное во время первого курса лучевой терапии оборудование, особенности выбранного во время первичного лечения объема облучения и сроков после завершения последнего курса лучевой терапии. Не всем пациентам возможно проведение повторных курсов лучевой терапии. Проведение повторных курсов лучевой терапии с СОД менее 30 Гр нецелесообразно.
3.6. Адъювантная химиотерапия
- Рекомендовано назначать адъювантную химиотерапию пациентам после хирургического лечения рака прямой кишки с целью снижения риска прогрессирования заболевания в зависимости от проведения предоперационной химиолучевой терапии [130, 149 - 155].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: в случаях предоперационного химиолучевого лечения назначение адъювантной химиотерапии основано на результатах патолого-анатомического исследования операционного материала и исходного клинического стадирования. Рекомендованная ниже продолжительность адъювантной включает в себя проведенную на предоперационном этапе химиотерапию и химиолучевую терапию.
При исходной распространенности cT3c-T4 и (или) сN1-2 и (или) экстрамуральной инвазии после проведения предоперационного лечения рекомендуется:
при ypT3-4N0 или ypT1-3N1 - адъювантная химиотерапия по схеме XELOX суммарно до 3 - 6 мес или FOLFOX суммарно до 6 мес терапии (включая и длительность предоперационного лечения);
при ypT1-4N2 или ypT4N0-2 - адъювантная химиотерапия по схеме XELOX или FOLFOX суммарно до 6 мес терапии (включая и длительность предоперационного лечения);
при ypT1-2N0 - адъювантная химиотерапия аналогами пиримидина в монорежиме (в случае отсутствия MSI в опухоли) или 3 мес комбинацией XELOX или 3 - 6 мес FOLFOX; в случае, если ХЛТ проводилась при cT1-2N0M0, и патоморфологически опухоль также осталась стадируется в рамках I стадии, то от проведения адъювантной химиотерапии возможно воздержаться;
при ypT0N0 адъювантная химиотерапия не проводится или может быть проведена аналогами пиримидина в монорежиме;
При исходной распространенности cT1-3a/bN0-1 и отсутствии экстрамуральной инвазии после проведения предоперационного лечения рекомендуется:
при ypT0-2N0 - адъювантная химиотерапия не проводится;
при ypT3N0 - в зависимости от исходной стадии возможно наблюдение, адъювантная химиотерапия адъювантная химиотерапия аналогами пиримидина в монорежиме (в случае отсутствия MSI в опухоли) до 6 месяцев или 3 месяца комбинацией XELOX или 3 - 6 мес FOLFOX;
при ypT1-4N1-3 или ypT4N0-2 - адъювантная химиотерапия по схеме XELOX или FOLFOX суммарно до 6 мес терапии (включая и длительность предоперационного лечения);
В случае отсутствия предоперационного лечения:
при pT3-4N0 или pT1-4N1-2 адъювантная химиотерапия назначается по рекомендациям лечения рака ободочной кишки.
Общая продолжительность адъювантной химиотерапии составляет 6 мес. Принимая во внимание результаты исследования IDEA, несмотря на то что в анализ не включались пациенты, которым проводилась предоперационная ХЛТ, в ситуациях неудовлетворительной переносимости лечения, возможно при ypT0-3N0-1 ограничиться проведением 3 мес химиотерапевтического лечения режимом XELOX. Обнаруженная MSI опухоли при II стадии свидетельствует о хорошем прогнозе и проведение химиотерапии, как правило, не требуется при условии отсутствия pT4N0. Минимальный объем химиотерапии при III стадии включает в себя аналоги пиримидина, которые можно применять в различных вариантах: инфузионный (модифицированный режим de Gramont) или перорально (капецитабин**) (таблица 3). Оптимальный объем адъювантной химиотерапии при III стадии включает комбинацию оксалиплатина** с аналогами пиримидина в течение 6 мес. Оптимальными являются режимы FOLFOX или XELOX. Комбинация оксалиплатина** со струйным фторурацилом** (режим FLOX) обладает схожей эффективностью, но сопряжена с высокой токсичностью (является вариантом выбора при развитии кардиотоксичности при применении капецитабина** или длительных инфузий фторурацила**) (см. таблицу 3). При развитии в процессе химиотерапии симптомов полинейропатии 2 степени рекомендуется отмена оксалиплатина и продолжение монотерапии аналогами пиримидина. В адъювантной терапии рака прямой кишки не должны применяться иринотекан** и таргетные препараты, в частности, бевацизумаб** и цетуксимаб**, панитумумаб**, афлиберцепт**, рамуцирумаб, регорафениб** [156], нет данных и об эффективности иммунотерапии в адъювантном режиме. Если адъювантное лечение не было начато в течение 2 - 4 мес, при отсутствии признаков прогрессирования, пациент остается под динамическим наблюдением.
У пациентов 70 лет и старше, добавление оксалиплатина** к аналогам пиримидина не увеличивает значимо общую выживаемость [130, 157 - 159], тем не менее режим химиотерапии в данной группе пациентов определяется индивидуально. В связи с этим применение оксалиплатина** в этой возрастной группе решается индивидуально - в зависимости от стадии, сопутствующей патологии и ожидаемой продолжительности жизни. Для понимания рисков развития осложнений 3 - 5 степени при применении комбинаций препаратов и необходимости коррекции доз препаратов у лиц старше 70 лет, желательно проведение комплексной гериатрической оценки (mycarg.org), что позволит повысить качество жизни данных пациентов и преемственность проводимого лечения
Таблица 3. Режимы аналогов пиримидина, применяемые в лечении колоректального рака
Режим
Схема
Модифицированный LV5FU2
(модифицированный режим de Gramont)
Кальция фолинат** 200 мг/м2 в/в в течение 2 ч с последующим болюсом ФУ** 400 мг/м2 и с последующей 46-часовой инфузией ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки)
Начало очередного курса на 15-й день [160]
Капецитабин**
1650 - 2000 мг/м2 в сутки внутрь 1 - 14-й дни. Начало очередного курса на 22-й день [161]
Таблица 4. Режимы оксалиплатина** и аналогов пиримидина, применяемые в лечении колоректального рака
Модифицированный FOLFOX 6
Оксалиплатин** 85 мг/м2 2-часовая инфузия в 1-й день, кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсом ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день [160, 162]
XELOX
#Оксалиплатин** 130 мг/м2 в/в кап в 1-й день, капецитабин** 2000 мг/м2 внутрь в сутки с 1-го по 14-й день, каждые 3 нед, начало очередного курса на 22-й день [163]
FLOX
Оксалиплатин** 85 мг/м2 в/в кап в течение 2 ч (дни 1, 15 и 29 каждого цикла) + кальция фолинат** 250 мг/м2 в/в струйно и с последующим болюсом ФУ** 500 мг/м2 еженедельно в течение 6 нед с последующим 2-недельным перерывом
FLOX (Nordic)
Оксалиплатин** в дозе 85 мг/м2 в/в кап в течение 2 ч 1 день + кальция фолинат** в дозе 60 мг/м2 в/в струйно с последующим болюсным введением ФУ** в дозе 500 мг/м2 в 1 и 2 дни. Начало очередного курса - на 15 день [164, 165]
3.7. Паллиативная химиотерапия
- У пациентов с раком прямой кишки рекомендуется проведение противоопухолевой лекарственной терапии в соответствие с общими принципами, изложенными в "Практических рекомендациях по общим вопросам проведения противоопухолевой лекарственной терапии" Российского общества клинической онкологии [166].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- У пациентов с нерезектабельными метастазами и бессимптомной первичной опухолью с целью улучшения переносимости химиотерапии и качества жизни пациента рекомендуется не удалять первичную опухоль [167, 168].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: по результатам проспективных рандомизированных исследований удаление бессимптомной первичной опухоли при нерезектабельных метастазах не улучшает ни выживаемость без прогрессирования, ни общую выживаемость, однако ухудшает переносимость химиотерапии.
- Рекомендуется в качестве первой линии терапии у отдельных пациентов с малосимптомным (статус ECOG 0 - 1) метастатическим раком прямой кишки, при невозможности назначения в 1 линии иринотекана** или оксалиплатина**, назначать монотерапию аналогами пиримидина с или без добавления таргетных препаратов в зависимости от мутационного статуса (таблица 5) и локализации первичной опухоли. При прогрессировании заболевания рекомендуется рассмотреть возможность добавления к режиму оксалиплатина**, а в качестве 3 линии - иринотекана** в редуцированных дозах [136, 169 - 171]. Режимы дозирования указаны ниже.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Таблица 5. Режимы применения аналогов пиримидина в лечении колоректального рака
Режим
Схема
Модифицированный LV5FU2
(модифицированный режим de Gramont)
Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением ФУ** 400 мг/м2 и последующей 46-часовой инфузией #ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки)
Начало очередного курса на 15-й день [160]
Модифицированный LV5FU2
(модифицированный режим de Gramont) + #цетуксимаб**
Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением ФУ** 400 мг/м2 и последующей 46-часовой инфузией #ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки). Цетуксимаб** 400 мг/м2 в виде 1-часовой инфузии в 1-й день, далее по 250 мг/м2 еженедельно или #цетуксимаб** в режиме 500 мг/м2 в/в капельно 1 раз в 2 нед [172, 173]
Начало очередного курса на 15-й день
Модифицированный LV5FU2
(модифицированный режим de Gramont) + #панитумумаб**
Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** 400 мг/м2 и последующей 46-часовой инфузией #фторурацила** 2400 мг/м2 (по 1200 мг/м2 в сутки). #Панитумумаб** 6 мг/кг в виде 1-часовой инфузии 1 день [174]
Начало очередного курса на 15-й день [175]
Модифицированный LV5FU2
(модифицированный режим de Gramont) + бевацизумаб**
Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением ФУ** 400 мг/м2 и последующей 46-часовой инфузией #ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки). Бевацизумаб** 5 мг/кг в/в капельно 1 день
Начало очередного курса на 15-й день [176 - 178]
Модифицированный LV5FU2
(модифицированный режим de Gramont) + рамуцирумаб**
Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** 400 мг/м2 и последующей 46-часовой инфузией #ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки). Рамуцирумаб** 8 мг/кг в/в капельно 1 день
Начало очередного курса на 15-й день [178 - 180]
Модифицированный LV5FU2
(модифицированный режим de Gramont) + афлиберцепт**
Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** 400 мг/м2 и последующей 46-часовой инфузией ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки). Афлиберцепт** 4 мг/кг в/в капельно 1 день
Начало очередного курса на 15-й день [181 - 184]
Капецитабин**
Капецитабин 2000 мг/м2 в сутки внутрь в 1 - 14-й дни
Начало очередного курса на 22-й день [185, 186]
Капецитабин** + бевацизумаб**
2000 мг/м2 в сутки внутрь в 1 - 14-й дни. Бевацизумаб** 7,5 мг/кг в/в капельно 1 день
Начало очередного курса на 22-й день [187]
- Для подавляющего числа пациентов с метастатическим раком прямой кишки рекомендуются к применению в первой линии химиотерапии комбинации препаратов (mFOLFOX6, XELOX или XELIRI, FOLFIRI, FOLFOXIRI) на протяжении не менее 3 - 4 мес с последующей возможной поддерживающей терапией аналогами пиримидина до прогрессирования [169 - 171].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: оксалиплатин** в монотерапии малоэффективен и должен применяться в комбинации с аналогами пиримидина. С целью профилактики фебрильной нейтропении при применении режима FOLFOXIRI возможно назначение филграстима** в дозе 300 - 480 мкг п/к через 24 часа после завершения химиотерапии до восстановления показателей нейтрофилов или пэгфилграстима** 6 мг п/к или эмпэгфилграстим** 7,5 мг п/к и через 24 часа после окончания химиотерапии 1 раз в 15 дней [188 - 190]. В случае прогрессирования опухолевого процесса после первой линии терапии вторая линия может быть назначена пациентам с удовлетворительным общим статусом (ECOG <=2). При рефрактерности к режиму FOLFOX (XELOX) в качестве второй линии обычно назначают режим FOLFIRI/XELIRI или монотерапию иринотеканом**. При рефрактерности к иринотекану** в 1 линии в режиме FOLFIRI - mFOLFOX6/XELOX (см. таблицы 3, 4). В случае, если прогрессирование заболевания отмечено после или во время адъювантной химиотерапии, оптимальным вариантом первой линии будет являться иринотекан-содержащая химиотерапия (FOLFIRI/XELIRI), что по результатам поданализов рандомизированных исследований показывает наилучшие результаты в сравнении с режимом FOLFOX или FOLFOXIRI. При прогрессировании на фоне или после терапии 1 линии по схеме FOLFOXIRI, оптимальным режимом 2 линии является FOLFIRI. При хорошем соматическом статусе пациента возможно рассмотреть и повторное назначение режима FOLFOXIRI.
- Рекомендуется к вышеперечисленным режимам добавление МКА (бевацизумаб**, цетуксимаб** или панитумумаб**), что увеличивает продолжительность жизни [191, 192].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: режим дозирования определяется инструкциями по медицинскому применению конкретных лекарственных препаратов. В режиме монотерапии бевацизумаб** малоэффективен. Рекомендуется продолжение терапии бевацизумабом** с аналогами пиримидина до прогрессирования заболевания. В случае, когда результат мутационного анализа задерживается, возможно начинать химиотерапию, а в дальнейшем, при получении результата, добавлять таргетный препарат со 2 - 4-го курса. В случае прогрессирования возможно продолжение применения бевацизумаба** со сменой режима (ESMO-MCBS 1 балл - в соответствии со шкалой клинической пользы ESMO препараты делятся на высокий уровень эффективности - 4 - 5 баллов, умеренного уровня 2 - 3 балла, низкого уровня 0 - 1 балл). На сегодняшний день неизвестны клинические или молекулярные факторы, предсказывающие эффективность бевацизумаба**. Наибольшую активность бевацизумаб** демонстрирует в 1-й и 2-й линиях терапии (ESMO-MCBS 3 балла); добавление бевацизумаба** к режимам на основе оксалиплатина** или иринотекана** во 2-й линии лечения достоверно увеличивает продолжительность жизни. Во 2-й линии терапии возможно назначение других антиангиогенных МКА - афлиберцепта** (ESMO-MCBS 1 балл) или рамуцирумаба** (ESMO-MCBS 1 балл), которые применяются только в сочетании с режимом FOLFIRI. При развитии значимой токсичности возможно продолжать терапию афлиберцептом** или рамуцирумабом** или в сочетании с режимом de Gramont или иринотеканом**. Непрямое сравнение данных трех антиангиогенных моноклональных антител позволяют говорить об их схожей эффективности. В связи с чем, с финансовой точки зрения и уменьшения токсичности, рекомендуется рассмотреть преимущественное назначение бевацизумаба.
В отличие от бевацизумаба* при неоперабельных метастазах цетуксимаб* или панитумумаб** активны как в режиме монотерапии, так и в комбинации с химиотерапией, но лишь у пациентов с отсутствием мутации в генах RAS, BRAF, отсутствием гиперэкспрессии HER-2/neu, микросателлитно стабильным фенотипом и при локализации первичной опухоли в левых отделах толстой кишки. Цетуксимаб** и панитумумаб** не должны применяться с режимами на основе капецитабина* и струйного фторурацила. Самостоятельная активность цетуксимаба** и панитумумаба** позволяет их применять и в режиме монотерапии в 3 - 4-й линии (ESMO-MCBS 4 балла). На поздних линиях возможно применение панитумумаба** или цетуксимаба** и в случае правосторонней локализации первичной опухоли при отсутствии мутаций в генах RAS и BRAF. Совместное применение бевацизумаба** и цетуксимаба** или панитумумаба** ухудшает результаты лечения и не рекомендуется. При левосторонней локализации первичной опухоли предпочтение в комбинации с анти-EGFR-антителами в первой линии отдается режимам FOLFOX или FOLFIRI (ESMO-MCBS 4 балла при сравнении с химиотерапией и 3 балла при сравнении с комбинациями с бевацизумабом). При правосторонней локализации первичной опухоли предпочтение в комбинации с бевацизумабом в первой линии отдается режиму FOLFOXIRI (ESMO-MCBS 3 балла) независимо от мутационного статуса генов RAS, BRAF.
Цели паллиативной химиотерапии - увеличение продолжительности жизни, уменьшение выраженности симптомов болезни и улучшение качества жизни. Пациенты, получившие все 3 активных химиопрепарата (иринотекан**, оксалиплатин** и аналоги пиримидина), имеют достоверно большую продолжительность жизни. При этом неважно, за сколько линий терапии это удается реализовать. До сих пор неясна оптимальная продолжительность 1-й линии терапии. Возможные варианты:
1) непрерывная терапия до прогрессирования заболевания или развития неприемлемых токсических явлений;
2) проведение лечения на протяжении не менее чем 3 - 6 мес с последующим наблюдением;
3) применение двойной комбинации в течение не менее чем 3 - 4 мес с последующей поддержкой аналогами пиримидина (стратегия поддерживающей терапии имеет преимущества перед полным прекращением лечения в отношении выживаемости без прогрессирования, но не общей выживаемости). В случае применения комбинации химиотерапии с бевацизумабом** поддерживающая терапия бевацизумабом** совместно с аналогами пиримидина должна проводиться до появления признаков прогрессирования болезни или развития неприемлемых токсических явлений. При использовании комбинации химиотерапии с цетуксимабом** или панитумумабом** также рекомендуется поддерживающая терапия комбинацией инфузий кальция фолината**, фторурацила** и цетуксимаба** или панитумумаба** или монотерапия МКА до прогрессирования заболевания.
На выживаемость пациентов влияет и последовательность назначения таргетной терапии. Так, если в 1-й линии терапии был назначен бевацизумаб**, то во 2-й линии оптимально продолжать антиангиогенную терапию даже при отсутствии мутаций в генах RAS и BRAF, что дает преимущество в отношении выживаемости в сравнении с таковой у пациентов, которым во 2-й линии назначали цетуксимаб** или панитумумаб**. Если в 1-й линии был назначен цетуксимаб или панитумумаб, во 2-й линии оптимально использовать схемы с включением бевацизумаба** (предпочтительнее), или афлиберцепта**, или рамуцирумаба**. Продолжение применения цетуксимаба** или панитумумаба** при прогрессировании не улучшает показатели выживаемости пациентов даже при отсутствии мутаций в генах RAS и BRAF. Исключением являются ситуации, когда анти-EGFR антитела были прекращены в отсутствии прогрессирования болезни [193].
- У пациентов с MSI в 1-й линии рекомендуется назначить пембролизумаб** в монорежиме или комбинацию ипилимумамба** с ниволумабом**. Последняя опция более предпочтительна [194, 195].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2) для пембролизумаба
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4) для комбинации ниволумаба и ипилимумаба
Комментарии: у пациентов с мутацией в гене KRAS пембролизумаб** в монорежиме был менее эффективен в 1-й линии, чем у пациентов без мутаций; при применении ипилимумаба** с ниволумабом** данной тенденции отмечено не было. Ввиду риска раннего прогрессирования при монотерапии рака толстой кишки анти-PD1-антителами у пациентов с большим объемом опухолевого поражения следует рассмотреть возможность назначения комбинации режима FOLFOX/XELOX с пембролизумабом** или ниволумабом**. Эффективность комбинации FOLFOX/XELOX с анти-PD1-антителами в 1-й линии продемонстрирована в рандомизированных исследованиях III фазы при распространенном раке желудка, а также в ретроспективных работах [137, 196]. При отсутствии прогрессирования возможно прекратить лечение после 1 года терапии анти-PD1-атителами [114, 197].
- Рекомендуется у пациентов с прогрессированием или непереносимостью на оксалиплатине**, иринотекане** и аналогах фторпиримидинов, бевацизумабе** и анти-EGFR антителах (по показаниям) назначение препарата регорафениба** (ESMO-MCBS 1 балл). Рекомендуется начинать терапию #регорафенибом** в следующем режиме на первом курсе терапии: 80 мг/сут внутрь - 1-я неделя, 120 мг/сут внутрь - 2-я неделя, 160 мг/сут внутрь - 3-я неделя, затем - 1 нед перерыв. Эскалация дозы возможна только при удовлетворительной переносимости препарата. Второй и последующие курсы проводятся в ранее максимально переносимой дозе [198].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Не рекомендуется применение регорафениба** у пациентов с неблагоприятными прогностическими факторами [310].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: к неблагоприятному прогнозу относятся пациенты с суммой 4 и более баллов следующих прогностических факторов - длительность метастатической болезни менее 18 месяцев (2 балла), поражение более 2 органов метастазами (1 балл), метастатическое поражение печени (1 балл), функциональный статус по шкале ECOG 1 (1 балл), статус по шкале ECOG 2 и выше (4 балла).
- Рекомендуется в 3-й и последующих линиях терапии при гиперэкспрессии или амплификации гена Her-2/neu при отсутствии мутаций в генах RAS и BRAF назначение комбинаций #трастузумаба** и #лапатиниба** или #трастузумаба** и #пертузумаба** [51, 52], 1 [199].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: повторное применение в 3 и более подряд линиях бевацизумаба в комбинации с режимами на основе иринотекана, оксалиплатина и (или) фторпиримидинов не имеет достаточной доказательной базы, чтобы рекомендовать данный подход, особенно при мутации в генах RAS.
- Рекомендуется во 2-й и более поздних линиях терапии при наличии у пациента MSI назначение монотерапии анти-PD1 антитела - ниволумаба** или пембролизумаба** в монорежиме или комбинацией ниволумаба** и ипилимумаба** [131, 200, 201]. Последний вариант характеризуется большей частотой объективных ответов, однако данных по сравнению отдаленных параметров выживаемости не представлено.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: у пациентов с мутацией в генах RAS пембролизумаб** в монорежиме в рамках рандомизиированного исследования показал меньшую эффективность в первой линии в сравнении с пациентами без мутаций; при применении схемы ипилимумамаба** с ниволумабом** данных тенденций отмечено не было. Учитывая возможный риск раннего прогрессирования при применении монотерапии анти-PD-1-антителами при раке толстой кишки, у пациентов с большим объемом опухолевого поражения, возможно рассмотреть назначение комбинации режима FOLFOX/XELOX с пембролизумабом** или ниволумабом**. При отсутствии прогрессирования возможно прекратить лечение после 1 года терапии анти-PD1-антителами. Аналогичные подходы применения иммунотерапии, как при MSI, могут быть рассмотрены при выявлении патогенных мутаций в генах POLD1 и POLE при метастатическом раке толстой кишки.
- Ослабленным пациентам с ECOG > 2 в качестве первой линии рекомендуется малотоксичная монохимиотерапия аналогами пиримидина с или без таргетной терапии в зависимости от мутационного статуса и локализации первичной опухоли или симптоматическая терапия, а при наличии MSI - ниволумаба** или пембролизумаба** или комбинацию ипилимумаба** с ниволумабом** [9, 131, 202].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: пациентам старше 70 лет желательно проведение комплексной гериатрической оценки (mycarg.org), для понимания рисков развития осложнений 3 - 5 степени при применении комбинаций препаратов и необходимости коррекции доз препаратов, что позволит повысить качество жизни данных пациентов и преемственность проводимого лечения.
- В 3 и последующих линиях терапии рекомендовано повторное назначение режимов химиотерапии с или без таргетной терапии, которые были эффективны в ранее проведенных линиях лечения [203 - 205].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Рекомендуется при мутации в гене BRAF в качестве первой линии при удовлетворительном состоянии пациента и при отсутствии противопоказаний назначать режим FOLFOXIRI или FOLFOX с добавлением МКАТ бевацизумаба** [206, 207].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: применение режима FOLFOXIRI с бевацизумабом определяет большую частоту объективных эффектов, но не увеличивает выживаемость без прогрессирования и общую выживаемость в сравнении с двойными комбинациями с бевацизумабом. В некоторых ретроспективных работах отмечена его большая эффективность при правосторонней локализации и мутации в гене BRAF. При прогрессировании заболевания в ходе 1-й линии терапии при мутации в гене BRAF возможно назначение режима FOLFIRI с использованием афлиберцепта*/бевацизумаба*/рамуцирумаба** [109] или комбинации цетуксимаба** или панитумумаба** с энкорафенибом/#вемурафенибом**/#дабрафенибом** и #траметинибом** [110, 111] (табл. 6) (мутации в гене BRAF делятся на 3 класса, описываемый подход с таргетной терапией активен при I и II классе мутаций). В случае невозможности назначения химиотерапии в первой линии терапии при мутации в гене BRAF возможно рассмотреть терапию комбинацией цетуксимаба** или панитумумаба** с энкорафенибом/#вемурафенибом**/#дабрафенибом**, с #траметинибом** или без него. При невозможности назначения анти-EGFR антител, возможно, рассмотреть применение комбинации #вемурафениба** и #кобиметиниба**, что менее предпочтительно. В некоторых клинических ситуациях, требующих быстрого достижения объективного ответа, возможно назначение сочетания химиотерапии (иринотекан, FOLFOX, FOLFIRI) и анти-EGFR-антител с BRAF-ингибиторами. При мутации в гене BRAF 3 класса лечение проводится как при диком типе гена. При сочетании мутации в гене BRAF и MSI предпочтение отдается иммунотерапии - комбинации ипилимумаба** с ниволумабом** или пембролизумабу**/ниволумабу** в монорежиме (таблица 6).
Таблица 6. Режимы с иринотеканом** и моноклональные антитела, применяемые в лечении колоректального рака
Режим
Схема
FOLFIRI
Иринотекан** 180 мг/м2 в виде 90-минутной инфузии в 1-й день, кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией #ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки)
Начало очередного курса на 15-й день
FOLFOXIRI*
#Иринотекан** 165 мг/м2 в виде 90-минутной инфузии в 1-й день, оксалиплатин** 85 мг/м2 в виде 2-часовой инфузии в 1-й день, кальция фолинат** 200 мг/м2 в/в в течение 2 ч с последующей 48-часовой инфузией ФУ** 3200 мг/м2 [202]
Начало очередного курса на 15-й день
XELIRI*
Иринотекан** 180 - 200 мг/м2 в виде 90-минутной инфузии в 1-й день, капецитабин** 1600 - 1800 мг/м2 внутрь в сутки в 1 - 14-й дни
Начало очередного курса на 22-й день [206]
#Иринотекан**
#Иринотекан** 250 - 300 мг/м2 в виде 90-минутной инфузии в 1-й день
Начало очередного курса на 22-й день [201]
#Иринотекан**
#Иринотекан** 150 - 180 мг/м2 в виде 90-минутной инфузии в 1-й день
Начало очередного курса на 15-й день [208]
Бевацизумаб**
7,5 мг/кг в виде 90 - 60 - 30-минутной инфузии каждые 3 нед или 5 мг/кг каждые 2 нед (в зависимости от применяемого режима химиотерапии может применяться с любым режимом химиотерапии метастатического рака толстой кишки)
Афлиберцепт**
4 мг/кг в виде 1-часовой инфузии каждые 2 нед (вместе с режимом FOLFIRI или режимом de Gramount или иринотеканом во 2 и последующих линиях терапии)
Цетуксимаб**
400 мг/м2 в виде 1-часовой инфузии в 1-й день, далее по 250 мг/м2 еженедельно (может применяться в монорежиме, в комбинации с иринотеканом**, с режимами De Gramount, FOLFOX, FOLFIRI и FOLFOXIRI при метастатическом раке толстой кишки)
Возможно назначение #цетуксимаба** в режиме 500 мг/м2 в/в капельно 1 раз в 2 нед [209]
Панитумумаб**
6 мг/кг в виде 1-часовой инфузии каждые 2 нед (может применяться в монорежиме, в комбинации с иринотеканом**, с режимами de Gramont, FOLFOX, FOLFIRI и FOLFOXIRI при метастатическом раке толстой кишки)
Рамуцирумаб**
8 мг/кг в виде 1-часовой инфузии каждые 2 нед (вместе с режимом FOLFIRI или режимом De Gramont или иринотеканом во 2-й и последующих линиях терапии)
Регорафениб**
Регорафениб** 160 мг 1 раз в день внутрь в 1 - 21-й дни, 1 нед перерыва (соотв. инструкции) или #Регорафениб** 80 мг в сутки внутрь - 1-я неделя, 120 мг/сут внутрь - 2-я неделя, 160 мг/сут внутрь - 3-я неделя, затем - 1 нед перерыва. Эскалация дозы возможна только при удовлетворительной переносимости препарата. Последующие курсы терапии проводятся уже в переносимой по результатам первого курса дозе [210, 211]
Пембролизумаб**
#Пембролизумаб** 2 мг/кг или 200 мг в/в капельно 30 мин каждые 3 нед или 400 мг в/в каждые 6 нед (только при MSI) [212, 213]
Ниволумаб**
3 мг/кг в/в или 240 мг капельно 30 мин каждые 2 нед или 480 мг в/в каждые 4 нед (только при MSI) [131]
Ниволумаб** + ипилимумаб**
Ниволумаб** 3 мг/кг в/в капельно 30 мин каждые 3 нед и ипилимумаб** 1 мг/кг в/в капельно 30 мин 1 раз в 3 нед (4 введения, в дальнейшем через 3 недели после последнего введения ипилимумаба продолжается монотерапия ниволумабом** в дозе 240 мг или 3 мг/кг в/в капельно 1 раз в 2 нед или 480 мг в/в капельно 1 раз в 4 нед (в 1 и последующих линиях) (только при MSI) [133, 214]
или
#Ниволумаб** 3 мг/кг в/в капельно 30 мин каждые 2 нед и ипилимумаб** 1 мг/кг в/в капельно 30 мин 1 раз в 6 нед до прогрессирования, непереносимой токсичности или 12 месяцев [133]
#Трастузумаб** + #лапатиниб**
#Трастузумаб** 4 мг/кг в/в в первый день первого цикла, затем 2 мг/кг в/в - еженедельно. #Лапатиниб**# 1000 мг внутрь ежедневно (только при гиперэкспрессии или амплификации Her-2/neu) [52]
#Трастузумаб** + #пертузумаб**
#Трастузумаб** 8 мг/кг в/в - нагрузочная доза в первый день первого цикла, затем 6 мг/кг в/в - каждые 21 день. #Пертузумаб** - 840 мг в/в нагрузочная доза в первый день первого цикла, затем 420 мг в/в - каждые 21 день (только при гиперэкспрессии или амплификации Her-2/neu [51]
<*> Режим характеризуется более высокой, чем FOLFIRI, частотой развития диареи. Возможность проведения химиотерапии в сочетании с таргетной терапией в соответствии с рекомендациями определяется доступностью лекарственных препаратов.
В случае дефектуры фолиевой кислоты** возможно уменьшить дозу фолиевой кислоты** в режимах с инфузионным или струйным введением фторурацила** (например, FOLFOX, FOLFIRI, FOLFOXIRI) до фиксированной дозы 50 мг в 1 день, или же вообще исключить из схем без значимого влияния на их эффективность и переносимость.
Таблица 7. Режимы, применяемые в лечении колоректального рака с мутацией в гене BRAF во 2-й и последующих линиях лечения
Режим
Схема
FOLFIRI
Иринотекан** 180 мг/м2 в виде 90-минутной инфузии в 1-й день, кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день [215]
Возможно добавление бевацизумаба** 5 мг/кг, или афлиберцепта** 4 мг/кг, или рамуцирумаба** 8 мг/кг в/в капельно в 1-й день каждого курса
#Иринотекан** + BRAF ингибитор + #цетуксимаб**
#Иринотекан** 180 мг/м2 90-минутная инфузия в 1-й день, #цетуксимаб** 400 мг/м2 в/в капельно 1-й день, затем по 250 мг/м2 в/в капельно еженедельно с 8-го дня (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели), #вемурафениб** 960 мг внутрь 2 раза в день ежедневно [172, 210]
BRAF + МЕК ингибитор + панитумумаб** или #цетуксимаб**
#Дабрафениб** 150 мг 2 раза в сутки внутрь ежедневно, #Траметиниб** 2 мг 1 раз в день внутрь ежедневно, панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 нед или цетуксимаб** 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [216 - 218]
BRAF ингибитор + панитумумаб** или цетуксимаб**
#Дабрафениб 150 мг 2 раза в сутки внутрь ежедневно панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 нед или цетуксимаб** 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [216 - 218]
или
#вемурафениб**# 960 мг внутрь 2 раза в день ежедневно панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 нед или цетуксимаб** 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [216, 219, 220]
BRAF + МЕК ингибиторы#
#Дабрафениб** 150 мг 2 раза в сутки внутрь ежедневно, #Траметиниб** 2 мг 1 раз в день внутрь ежедневно [221]
или
#вемурафениб** 960 мг внутрь 2 раза в день ежедневно и #кобиметиниб** 60 мг внутрь 1 раз в день 1-21 дни 1 нед перерыв, каждые 28 дней [222]
#Иринотекан
+ BRAF ингибитор
+ МЕК ингибитор
+ анти-EGFR антитела
-
Иринотекан** 80 мг/м2 90-минутная инфузия в 1-й день еженедельно
-
#Дабрафениб** 150 мг 2 раза в сутки внутрь ежедневно
-
#Траметиниб** 2 мг 1 раз в день внутрь ежедневно
-
цетуксимаб** 400 мг/м2 в / в капельно 1 день, затем по 250 мг/м2 в / в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [223]
#BRAF ингибитор
+ МЕК ингибитор
+ анти-EGFR антитела
-
#Дабрафениб** 150 мг 2 раза в сутки внутрь ежедневно
-
#Траметиниб** 2 мг 1 раз в день внутрь ежедневно
-
Панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 недели или цетуксимаб** 400 мг/м2 в / в капельно 1 день, затем по 250 мг/м2 2 в/в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [216, 224, 320].
Или
#Энкорафениб 300 мг 1 раз в день внутрь ежедневно [225]
Биниметиниб** 45 мг 2 раза в день внутрь ежедневно [226, 227]
цетуксимаб* 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [228].
#BRAF ингибитор
+ анти-EGFR-антитела
-
#Дабрафениб** 150 мг 2 раза в сутки внутрь ежедневно
-
Панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 недели или цетуксимаб* 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [216]
или
-
#Вемурафениб* 960 мг внутрь 2 раза в день ежедневно
-
#Панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 недели [229, 230]
Или
-
Энкорафениб 300 мг 1 раз в день внутрь ежедневно
-
#Панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 недели или #цетуксимаб** 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели) [228, 231]
#BRAF ингибитор
+ анти-EGFR-антитела + mFOLFOX6
Оксалиплатин** 85 мг/м2 2-часовая инфузия в 1-й день, кальция фолинат** 400 мг/м2 в / в в течение 2 часов с последующим болюсом ФУ** 400 мг/м2 в / в струйно и 46-часовой инфузией ФУ** 2400 мг/м2 (по 1200 мг/м2 / сут.).
Энкорафениб 300 мг 1 раз в день внутрь ежедневно
#Панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 недели или цетуксимаб** 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или #цетуксимаб** 500 мг/м2 в/в каждые 2 недели)
Начало очередного курса на 15-й день [231, 232]
#BRAF ингибитор
+ анти-EGFR-антитела + FOLFIRI
Иринотекан 180 мг/м2 в виде 90-минутной инфузии в 1-й день
-
- Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки).
Энкорафениб 300 мг 1 раз в день внутрь ежедневно
#цетуксимаб** 500 мг/м2 в/в каждые 2 недели)
Начало очередного курса на 15-й день [232]
Иринотекан 180 мг/м2 в виде 90-минутной инфузии в 1-й день
-
Кальция фолинат** 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией ФУ** 2400 мг/м2 (по 1200 мг/м2 в сутки).
#вемурафениб**# 960 мг внутрь 2 раза в день ежедневно #цетуксимаб** 500 мг/м2 в/в каждые 2 недели
Начало очередного курса на 15-й день [232, 233]
Возможность проведения химиотерапии в сочетании с таргетной терапией в соответствии с рекомендациями определяется доступностью лекарственных препаратов
# режимы являются менее предпочтительным по сравнению с комбинациями с включением анти-EGFR антител и рекомендуются лишь при невозможности применения последних.
- Рекомендовано с целью снижения числа осложнений у пациентов, получающих длительные (свыше 6 часов) инфузии фторурацила**, выполнять их через центральный венозный доступ с применением инфузоматов [112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.8. Профилактика и лечение осложнений злокачественных опухолей и противоопухолевой лекарственной терапии. Симптоматическая терапия.
- Пациентам с острым кровотечением с целью его остановки рекомендуется выполнить срочное эндоскопическое исследование, системную гемостатическую терапию. В зависимости от результатов исследования производят эндоскопическую остановку кровотечения. При невозможности/неэффективности эндоскопического гемостаза проводится экстренное хирургическое вмешательство (A16.19.020 - A16.19.021.014) [9 - 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При опухолевом стенозе с развитием кишечной непроходимости с целью ее разрешения рекомендуется установка саморасправляющегося стента в зону опухолевого стеноза (Эндоскопическое стентирование при опухолевом стенозе) или оперативное лечение (колостомия/илеостомия) [234].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- В лечении болевого синдрома у пациентов с нерезектабельными метастазами рака прямой кишки рекомендуется проведение дистанционной лучевой терапии, медикаментозной терапии, локорегионарной анестезии (Анестезиологическое пособие (включая раннее послеоперационное ведение) в зависимости от причины болевого синдрома [101, 141, 235].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При лечении асцита у пациентов с нерезектабельными метастазами рака прямой кишки рекомендуется рассмотреть возможность применения диуретиков и лапароцентеза. При рефрактерном асците, обусловленном канцероматозом брюшины, рекомендовано рассмотреть вопрос о внутрибрюшинной химиотерапии [236].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: целями так называемой "наилучшей поддерживающей терапии" (best supportive care) являются профилактика и облегчение симптомов заболевания, а также поддержание качества жизни пациентов и их близких независимо от стадии заболевания и потребности в других видах терапии. В случае рака прямой кишки меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни.
- При проведении противоопухолевой лекарственной терапии препаратами с эметогенным побочным действием пациентам рекомендуется проведение профилактики и лечения тошноты и рвоты [237, 238].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Принципы диагностики, профилактики и лечения тошноты и рвоты при проведении противоопухолевой лекарственной терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Владимирова Л.Ю. и соавт. Тошнота и рвота [239].
- У пациентов с метастатическим поражением костей рекомендуется профилактика и лечение костных осложнений [232, 240, 241].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Принципы диагностики, профилактики и лечения костных осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Багрова С.Г. и соавт. Патология костной ткани [241].
- Пациентам рекомендуется профилактика и лечение венозных тромбоэмболических осложнений [236, 242 - 244].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Принципы диагностики, профилактики и лечения венозных тромбоэмболических осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сомонова О.В. и соавт. Тромбоэмболические осложнения [245].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение фебрильной нейтропении и инфекционных осложнений [246 - 248].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения фебрильной нейтропении и инфекционных осложнений, принципы антибактериальной терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сакаева Д.Д. и соавт. Практические рекомендации по диагностике и лечению фебрильной нейтропении [249].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется коррекция гепатотоксичности [250, 251].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Принципы диагностики, профилактики и лечения гепатотоксичности изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Ткаченко П.Е. и соавт. Гепатотоксичность [252].
- При проведении пациентам противоопухолевой лекарственной терапии рекомендуется профилактика и лечения кардиоваскулярных осложнений [253 - 256].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы диагностики, профилактики и лечения сердечно-сосудистых осложнений при проведении противоопухолевой терапии изложены в Практических Рекомендациях Российского общества по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Виценя М.В. И соавт. Кардиоваскулярная токсичность [257].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение дерматологических реакций [258].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы диагностики, профилактики и лечения кожных осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Королева И.А. и соавт. Дерматологические реакции [259].
- Для поддержания метаболических резервов организма онкологического пациента и повышения его устойчивости к лечению (хирургическому, лекарственному, лучевому) рекомендована нутритивная поддержка. Выбор метода нутритивной поддержки определяется различными видами нарушений питания у пациента. Может быть рекомендована установка назогастральной (A11.16.010), назоинтестинальной (A03.16.002), чрескожной, эндоскопической, лапароскопической, лапаротомной стомы, эндоскопическое стентирование при опухолевом стенозе, паллиативная лучевая терапия [260, 261].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Принципы проведения нутритивной поддержки представлены в Практических рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сытов А.В. и соавт. Нутритивная поддержка [262].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение нефротоксичности [263 - 265].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения нефротоксичности представлен в Практических рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Громова Е.Г. и соавт. Нефротоксичность [266].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение иммуноопосредованных нежелательных явлений [267-270].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения иммуноопосредованных нежелательных явлений изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Проценко С.А. и соавт. Иммуноопосредованные нежелательные явления [271].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение мукозитов [272, 273].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения мукозитов изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Семиглазова Т.Ю. и соавт. Мукозиты [274].
- Пациентам рекомендуется лечение анемии, которая возникает как симптом злокачественного новообразования и как нежелательное явление при проведении противоопухолевой лекарственной терапии [275, 276].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Порядок и принципы профилактики и лечения анемии соответствуют принципам, изложенным в клинических рекомендациях "Анемия при злокачественных новообразованиях" (ID: КР624, год утверждения 2020, www.cr.rosminzdrav.ru) и в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Орлова Р.В. и соавт. Анемия [277].
- При проведении лечения пациентам рекомендуется лечение синдрома анорексии-кахексии [278].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Детальный алгоритм диагностики и лечения синдрома анорексии-кахексии изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сытов А.В. и соавт. Практические рекомендации по лечению синдрома анорексии-кахексии у онкологических больных [279].
- При проведении пациентам цикловой противоопухолевой лекарственной терапии с включением непрерывных длительных (свыше 6 часов) инфузий противоопухолевых препаратов (фторурацила, доксорубицина и т.д.) или при неудовлетворительном состоянии периферических вен рекомендуется использование центрального венозного доступа и инфузионных помп [280].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Выбор варианта центрального доступа определяется запланированной длительностью всего курса лечения, предпочтениями пациента, анатомическими особенностями. При длительных (свыше 3 месяцев) курсах терапии наиболее удобным является имплантация подкожной венозной порт-системы. При меньших сроках альтернативой может служить периферически имплантируемый центральный венозный катетер. Принципы использования центрального венозного доступа изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Исянгулова А.З. и соавт. Центральный венозный доступ [281].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение экстравазатов противоопухолевых препаратов. При планировании противоопухолевой лекарственной терапии важен выбор сосудистого доступа для профилактики экстравазации противоопухолевых препаратов [282].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Алгоритмы выбора сосудистого доступа, профилактики, диагностики и лечения эксравазации изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Буйденок Ю.В. и соавт. Экстравазация противоопухолевых препаратов [283].
- При проведении противоопухолевого лечения пациентам рекомендуется лечение хронического болевого синдрома [284].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Алгоритмы диагностики и лечения хронического болевого синдрома у онкологических больных изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Когония Л.М. и соавт. Хронический болевой синдром [285].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение инфузионных реакций [286].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Алгоритмы профилактики, диагностики и лечения инфузионных реакций изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Орлова Р.В. и соавт. Инфузионные реакции [287].
- При проведении терапии пациентам рекомендуется мониторинг и лечение реактивации/обострения хронических вирусных гепатитов [288].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Принципы мониторинга и лечебной тактики у онкологических пациентов с хроническим вирусным гепатитом изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Феоктистова П.С. и соавт. Хронические вирусные гепатиты [289].
- При проведении противоопухолевой лекарственной терапии пациентам рекомендуется профилактика и лечение неврологических осложнений [290] [291].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Принципы диагностики, профилактики и лечения неврологических осложнений противоопухолевой терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Латипова Д.Х. и соавт. Неврологические осложнения [291].
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется при наличии показаний не отказывать пациентам, завершившим лечение по поводу рака прямой кишки в проведении заместительной гормональной терапии, использовании оральных контрацептивов, любых видов санаторно-курортного лечения, физиотерапии [292 - 298].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: отсутствуют доказательные данные или известные механизмы, которые могут привести к повышению риска прогрессирования рака прямой кишки при проведении заместительной гормональной терапии, любых видов санаторно-курортного лечения, физиотерапии. Данный тезис не отменяет возможных противопоказаний, связанных с наличием длительно незаживающих ран, очагов хронического воспаления, повышенного риска развития грыж и других факторов, которые могут быть связаны с перенесенным ранее лечением. Данные противопоказания являются общими для ран, очагов воспаления любой этиологии. Само наличие в анамнезе рака прямой кишки не является противопоказанием к проведению каких бы то ни было методов лекарственного лечения, физиотерапии, санаторно-курортного лечения. При оценке показаний к проведению любых видов неонкологического лечения и реабилитации следует ориентироваться только на имеющиеся у пациента проблемы со здоровьем, вне зависимости от их этиологии, но не на факт наличия онкологического анамнеза. Назначение санаторно-курортного лечения, физиотерапии, лекарственного лечения по поводу сопутствующих заболеваний, включая заместительную гормональную терапию и оральные контрацептивы, не требует консультации онколога.
4.1. Предреабилитация
- Рекомендуется рассматривать проведение предреабилитации всем пациентам с целью снижения риска осложнений лечения, что включает в себя физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование пациентов [299, 300].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: проведение предреабилитации значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкологического заболевания.
- Рекомендуется объяснять всем пациентам эффективность увеличения физической активности за 2 нед до операции с целью снижения риска осложнений лечения [194].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: увеличение физической активности улучшает качество жизни в послеоперационном периоде, позволяя быстрее вернуться к полноценной повседневной активности. Программа комплексной предреабилитации у пациентов с колоректальным раком, которая включает в себя занятия ЛФК в домашних условиях (комплекс физической нагрузки средней интенсивности, включающей в себя как аэробную, так и анаэробную нагрузку), консультирование по питанию (Прием (осмотр, консультация) врача-диетолога первичный), работу с медицинским психологом (Прием (тестирование, консультация) медицинского психолога первичный) на преодоление тревоги и депрессии (начинается за 28 дней до операции и продолжается в течение 8 нед после) значительно улучшает качество жизни в послеоперационном периоде [195].
Психологическая поддержка в плане предреабилитации улучшает настроение, снижает уровень тревоги и депрессии. Пациенты, прошедшие курс психологической предреабилитации лучше адаптируются к повседневной жизни после хирургического лечения. Психологическая предреабилитация, включающая методики, направленные на работу со стрессом (методики релаксации, формирование позитивного настроя) в течение 40-60 мин 6 дней в неделю, которая начинается за 5 дней до операции и продолжается 30 дней после значительно улучшает качество жизни [301].
4.2. Реабилитация при хирургическом лечении
4.2.1. I этап реабилитации при хирургическом лечении
- Рекомендуется пациентам, которым проводится хирургическое лечение по поводу рака прямой кишки, с целью снижения риска периоперационных осложнений использовать тактику fast track rehabilitation ("быстрый путь"/ERAS (early rehabilitation after surgery - ранняя реабилитация после операции)), включающую в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию (активизация и вертикализация) пациентов с 1 - 2 суток после операции [302].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: данная тактика не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций.
- Рекомендуется пациентам, которым проводится хирургическое лечение, с целью снижения риска послеоперационных осложнений применение побудительной спирометрии, подъем головного конца кровати на 30° и более, раннее начало дыхательной гимнастики и ранняя активизация пациентов [303].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: указанные меры помогают в профилактике осложнений со стороны дыхательной системы в послеоперационном периоде. Дыхательная гимнастика начинается сразу после нормализации сознания пациента после операции. Тактике дыхательной гимнастики в послеоперационном периоде пациент обучается до операции. После проведения оперативного лечения у пациентов с колоректальным раком рекомендовано выполнение диафрагмального дыхания, которое способствует улучшению циркуляции лимфы в организме и позволяет вентилировать нижние доли легких, которые при грудном типе дыхания обычно наполняются воздухом недостаточно [304].
4.2.2. II этап реабилитации при хирургическом лечении
- Рекомендуется у пациентов, у которых развился синдром низкой передней резекции, для оптимизации его лечения, тактику лечения синдрома низкой передней резекции определять после функционального обследования, включающего в себя методики аноректальной манометрии (Аноректальная манометрия) и сфинктерометрии (Исследование функций сфинктерного (запирательного) аппарата прямой кишки) [305, 306].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется при нарушении мочеиспускания и эректильной дисфункции рассмотреть назначение упражнений для укрепления мышц тазового дна, Biofeedback-терапии (Лечебная физкультура с биологической обратной связью при заболеваниях толстой кишки, Тренировка с биологической обратной связью по кинезиологическому образу при заболеваниях толстой кишки), тибиальной нейромодуляции, электростимуляции мышц тазового дна и промежности [305].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Рекомендовано при возникновении лимфедемы нижних конечностей для ее лечения проведение следующих реабилитационных мероприятий: проводить полную противоотечную терапию, включающую в себя мануальный лимфодренаж, ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [307].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
4.2.3. III этап реабилитации при хирургическом лечении
- Рекомендуется пациентам после хирургического лечения с целью ускорения реабилитации, снижения усталости, повышения качества сна давать рекомендации по выполнению комплекса ЛФК и повышению физической активности пациентам с метастатическим раком прямой кишки [308, 309].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: повышение физической активности уменьшает слабость, увеличивает мобильность, снижает уровень депрессии и улучшает качество жизни.
- Не рекомендуется ограничивать пациентам раком прямой кишки показания к химиотерапии, пребывание на солнце, учитывая отсутствие опубликованных данных о негативном влиянии данных факторов и возможном влиянии данных ограничений на психологическое состояние пациентов [310].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: отсутствуют данные о повышении риска прогрессирования опухолевого процесса при использовании данных методов реабилитации.
4.3. Реабилитация при химиотерапии
- Во время проведения химиотерапии с целью снижения риска побочных эффектов лечения, усталости рекомендуется выполнение комплекса ЛФК (Лечебная физкультура при заболеваниях толстой кишки), методики релаксации, включающие в себя диафрагмальное дыхание и прогрессирующую мышечную релаксацию [311, 312].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
Комментарии: объем и интенсивность ЛФК подбирается индивидуально исходя из степени слабости (легкая, средняя, тяжелая). При улучшении общего состояния возможно увеличить интенсивность ЛФК. Рекомендуется сочетание аэробной нагрузки и силовой.
- Во время проведения химиотерапии с целью снижения риска побочных эффектов лечения, усталости рекомендуется рассмотреть возможность назначения курса массажа (Массаж при заболеваниях толстой кишки, Общий массаж медицинский) [311, 312].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Во время третьего этапа реабилитации с целью ускорения восстановления пациента, снижения усталости рекомендовано ведение активного образа жизни, выполнение комплексов ЛФК (Лечебная физкультура при заболеваниях толстой кишки) после комбинированного лечения колоректального рака [194, 195].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: выполнение комплекса ЛФК пациентами с рецидивом рака, снижает риск общей смертности на 29%. Выполнение комплекса ЛФК и физическая активность пациентов с диссеминированным опухолевым процессом уменьшает слабость, увеличивает мобильность, снижает уровень депрессии и улучшает качество жизни.
4.4. Реабилитация при лучевой терапии
- Рекомендуется рассмотреть применение комплекса ЛФК (Лечебная физкультура при заболеваниях толстой кишки) (аэробной нагрузки в сочетании с силовой) на фоне лучевой терапии у пациентов раком прямой кишки с целью снижения побочных эффектов лечения [311, 312].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
Комментарии: проведение комплекса ЛФК увеличивает плотность костной ткани и выносливость пациента на фоне лучевой терапии.
- Рекомендуется для профилактики лучевого дерматита у пациентов с раком прямой кишки рассмотреть, получающим лучевую терапию, применение низкоинтенсивной лазеротерапии (внутривенного облучения крови). Низкоинтенсивная лазеротерапия (внутривенное облучение крови) применяется через 3 дня после начала лучевой терапии, 3 дня в неделю для профилактики лучевого дерматита [313].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется соблюдать следующую периодичность обследований пациентов после завершения лечения по поводу рака прямой кишки с целью своевременной диагностики прогрессирования заболевания при его развитии: в первые 2 года обследование рекомендуется проводить каждые 3 - 6 мес, на сроке 3 - 5 лет - 1 раз в 6 - 12 мес. После 5 лет с момента операции обследования проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен. Обследование пациента включает следующие мероприятия [314]:
- анамнез и физикальное обследование (пальцевое исследование прямой кишки);
- исследование уровня ракового эмбрионального антигена в крови, (если был повышен исходно) каждые 3 мес первые 2 года и далее каждые 6 мес в последующие 3 года;
- колоноскопия через 1 и 3 года после резекции первичной опухоли, далее каждые 5 лет с целью выявления метахронной опухоли или удаления обнаруженных полипов толстой кишки. При выявлении полипов размером более 1 см или зубчатых аденом колоноскопия выполняется ежегодно. В случае если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, она производится не позже 6 мес после ее резекции;
- УЗИ органов брюшной полости (комплексное) и органов малого таза каждые 3 - 6 мес в зависимости от риска прогрессирования;
- рентгенография органов грудной клетки каждые 12 мес;
- КТ органов грудной полости и органов брюшной полости с внутривенным контрастированием - однократно в сроки 12 - 18 мес после операции [9 - 11, 315].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей прямой кишки (см. Приложение А. План контрольных обследований пациента после завершения лечения). Отсутствуют данные о влиянии активного наблюдения на отдаленные результаты лечения. Тем не менее, у пациентов с высоким риском рецидива, а также при подозрении на рецидив, на усмотрение врача-онколога, возможно дополнение обследования проведением МРТ органов малого таза. Частота проведения МРТ органов малого таза при отсутствии подозрения на рецидив (данные пальцевого исследования, рост РЭА и т.д.) обычно не превышает 1 раза в год [316].
- Рекомендуется пациентам при проведении активной выжидательной тактики проведение МРТ органов малого таза, видеоректоскопии и трансректального пальцевого исследования в процессе динамического наблюдения каждые 3 месяца в течение первых 3 лет, далее - 1 раз в 6 месяцев в течение 2 лет [317 - 319].
Уровень убедительности рекомендаций - C (Уровень достоверности доказательств - 5).
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента рака прямой кишки врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации рака прямой кишки, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента рака прямой кишки в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам раком прямой кишки, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам раком прямой кишки, не должен превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданами медицинской помощи, утверждаемой Правительством Российской Федерации. 7 календарных дней с даты морфологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам раком прямой кишки, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам раком прямой кишки, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю "онкология" определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
1) наличии осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т.д.) онкологического заболевания.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Рекомендуется перед операцией у всех пациентов с раком прямой кишки получить информированное согласие на проведение хирургического вмешательства и формирование коло- или илеостомы (даже если это не предполагается в плане операции).
Показанием к выписке пациента из медицинской организации является:
1) завершение курса лечения, или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Известные прогностические факторы при раке прямой кишки, которые рекомендуется регистрировать, приведены в табл. 2.
Таблица 2. Прогностические факторы при раке прямой кишки
Категория факторов
Прогностические факторы
ассоциированные с опухолью
ассоциированные с пациентом
ассоциированные с окружающей средой
Необходимые для оценки
Критерии T, N, M (по классификации TNM, 8-я редакция)
Наличие язвенного колита, болезни Крона, диффузного аденоматоза (семейного полипоза) толстой кишки, синдрома Линча
Прием лекарственных препаратов, особенно иммунодепрессанты
Дополнительные
Лимфоваскулярная инвазия, периневральное распространение
Локализация первичной опухоли, семейный анамнез
-
Новые и перспективные
MSI, KRAS, NRAS, BRAF, Her-2-neu
-
-
Критерии оценки качества медицинской помощи
Критерии оценки качества специализированной медицинской помощи пациентам при раке прямой кишки указаны ниже.
N
Критерии качества
Выполнено
1
Выполнение патологоанатомического исследования биопсийного материала для морфологической верификации диагноза до начала лечения, за исключением случаев экстренной хирургии
да/нет
3
Наличие назначения теста опухоли на определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР у пациентов с диссеминированным или нерезектабельным местнораспространенным раком прямой кишки
да/нет
4
Выполнено молекулярно-генетическое исследование мутаций в гене KRAS, NRAS, BRAF в биопсийном (операционном) материале (при метастатической болезни)
да/нет
5
У пациента с изолированным метастатическим поражением печени/легких на долечебном этапе выполнен прием (осмотр, консультация) врача-онколога, имеющего опыт выполнения резекций печени
да/нет
6
Выполнено назначение обследования перед хирургическим лечением в соответствии с рекомендациями
да/нет
7
Выполнено патологоанатомическое исследование операционного материала (при хирургическом лечении)
да/нет
8
Пациентам раком прямой кишки со стадией cT3-4N0-2M0 или cT2N1-2M0 и локализацией опухоли до 5 см от переходной анальной складки включительно выполнена предоперационная лучевая или химиолучевая терапия
да/нет
9
Выполнена тотальная колоноскопия до операции или в течение 3 мес после операции
да/нет
11
Выполнена компьютерная томография органов брюшной полости и/или магнитно-резонансная томография органов брюшной полости (при установлении диагноза)
да/нет
12
Выполнена магнитно-резонансная томография органов малого таза (при установлении диагноза)
да/нет
13
Выполнена компьютерная томография органов грудной полости (при установлении диагноза)
да/нет
14
Выполнено исследование уровня раково-эмбрионального антигена в крови (при установлении диагноза)
да/нет
15
Выполнена дозиметрическая верификация рассчитанного плана (при лучевой терапии)
да/нет
Список литературы
1. Johns L.E., Houlston R.S. A systematic review and meta-analysis of familial colorectal cancer risk//Am J Gastroenterol. - 2001. - T. 96, N 10. - C. 2992 - 3003.
2. Tenesa A., Dunlop M. G. New insights into the aetiology of colorectal cancer from genome-wide association studies//Nat Rev Genet. - 2009. - T. 10, N 6. - C. 353-8.
3. Huxley R.R., Ansary-Moghaddam A., Clifton P., Czernichow S., Parr C.L., Woodward M. The impact of dietary and lifestyle risk factors on risk of colorectal cancer: a quantitative overview of the epidemiological evidence//Int J Cancer. - 2009. - T. 125, N 1. - C. 171-80.
4. Rasool S., Kadla S.A., Rasool V., Ganai B.A. A comparative overview of general risk factors associated with the incidence of colorectal cancer//Tumour Biol. - 2013. - T. 34, N 5. - C. 2469-76.
5. Raskov H., Pommergaard H.C., Burcharth J., Rosenberg J. Colorectal carcinogenesis--update and perspectives//World J Gastroenterol. - 2014. - T. 20, N 48. - C. 18151-64.
6. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой Злокачественные новообразования в России в 2021 году (заболеваемость и смертность) - М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, - 2022. - илл. - 252 с.//.
7. Board W.C.o.T.E. WHO classification of tumours//Book WHO classification of tumours/EditorWorld Health Organization Lyon, France, 2019.
8. Group M.S. Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: results of the MERCURY study//Radiology. - 2007. - T. 243, N 1. - C. 132-9.
9. Glynne-Jones R., Wyrwicz L., Tiret E., Brown G., Rodel C., Cervantes A., Arnold D., Committee E.G. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up//Ann Oncol. - 2018. - T. 29, N Suppl 4. - C. iv263.
10. Holland-Frei cancer medicine./Bast Jr R.C., Croce C.M., Hait W.N., Hong W.K., Kufe D.W., Piccart-Gebhart M., Pollock R.E., Weichselbaum R.R., Wang H., Holland J.F.: John Wiley&Sons, 2017.
11. Steele S.R., Hull T.L., Read T.E., Saclarides T.J., Senagore A.J., Whitlow C. B. Correction to: The ASCRS Textbook of Colon and Rectal Surgery//The ASCRS Textbook of Colon and Rectal Surgery. - 2016. - C. E1 - E1.
12. Malik S.S., Lythgoe M.P., McPhail M., Monahan K.J. Metachronous colorectal cancer following segmental or extended colectomy in Lynch syndrome: a systematic review and meta-analysis//Fam Cancer. - 2018. - T. 17, N 4. - C. 557 - 564.
13. van Erp S.J., Leicher L.W., Hennink S.D., Ghorbanoghli Z., Breg S.A., Morreau H., Nielsen M., Hardwick J.C., Roukema J.A., Langers A.M. Identification of familial colorectal cancer and hereditary colorectal cancer syndromes through the Dutch population-screening program: results ofa pilot study//Scandinavian Journal of Gastroenterology. - 2016. - T. 51, N 10. - C. 1227 - 1232.
14. Syngal S., Fox E.A., Eng C., Kolodner R.D., Garber J.E. Sensitivity and specificity of clinical criteria for hereditary non-polyposis colorectal cancer associated mutations in MSH2 and MLH1//J Med Genet. - 2000. - T. 37, N 9. - C. 641-5.
15. Liu Z., Zhang Y., Niu Y., Li K., Liu X., Chen H., Gao C. A systematic review and meta-analysis of diagnostic and prognostic serum biomarkers of colorectal cancer//PLoS One. - 2014. - T. 9, N 8. - C. e103910.
16. Tanaka A., Sadahiro S., Suzuki T., Okada K., Saito G. Comparisons of Rigid Proctoscopy, Flexible Colonoscopy, and Digital Rectal Examination for Determining the Localization of Rectal Cancers//Dis Colon Rectum. - 2018. - T. 61, N 2. - C. 202 - 206.
17. Chong A., Shah J.N., Levine M.S., Rubesin S.E., Laufer I., Ginsberg G.G., Long W.B., Kochman M.L. Diagnostic yield of barium enema examination after incomplete colonoscopy//Radiology. - 2002. - T. 223, N 3. - C. 620-4.
18. Pickhardt P.J., Hassan C., Halligan S., Marmo R. Colorectal cancer: CT colonography and colonoscopy for detection--systematic review and meta-analysis//Radiology. - 2011. - T. 259, N 2. - C. 393-405.
19. Kim J.H., Kim W.H., Kim T.I., Kim N.K., Lee K.Y., Kim M.J., Kim K.W. Incomplete colonoscopy in patients with occlusive colorectal cancer: usefulness of CT colonography according to tumor location//Yonsei Med J. - 2007. - T. 48, N 6. - C. 934-41.
20. Neri E., Giusti P., Battolla L., Vagli P., Boraschi P., Lencioni R., Caramella D., Bartolozzi C. Colorectal cancer: role of CT colonography in preoperative evaluation after incomplete colonoscopy//Radiology. - 2002. - T. 223, N 3. - C. 615-9.
21. Langevin J.M., Nivatvongs S. The true incidence of synchronous cancer of the large bowel. A prospective study//Am J Surg. - 1984. - T. 147, N 3. - C. 330-3.
22. Mulder S.A., Kranse R., Damhuis R.A., de Wilt J.H., Ouwendijk R.J., Kuipers E.J., van Leerdam M.E. Prevalence and prognosis of synchronous colorectal cancer: a Dutch population-based study//Cancer Epidemiol. - 2011. - T. 35, N 5. - C. 442-7.
23. Martling A., Holm T., Bremmer S., Lindholm J., Cedermark B., Blomqvist L. Prognostic value of preoperative magnetic resonance imaging of the pelvis in rectal cancer//Br J Surg. - 2003. - T. 90, N 11. - C. 1422-8.
24. Algebally A.M., Mohey N., Szmigielski W., Yousef R.R., Kohla S. The value of high-resolution MRI technique in patients with rectal carcinoma: pre-operative assessment of mesorectal fascia involvement, circumferential resection margin and local staging//Pol J Radiol. - 2015. - T. 80. - C. 115-21.
25. Norenberg D., Sommer W. H., Thasler W., D'Haese J., Rentsch M., Kolben T., Schreyer A., Rist C., Reiser M., Armbruster M. Structured Reporting of Rectal Magnetic Resonance Imaging in Suspected Primary Rectal Cancer: Potential Benefits for Surgical Planning and Interdisciplinary Communication//Invest Radiol. - 2017. - T. 52, N 4. - C. 232 - 239.
26. Battersby N.J., How P., Moran B., Stelzner S., West N.P., Branagan G., Strassburg J., Quirke P., Tekkis P., Pedersen B. G., Gudgeon M., Heald B., Brown G., Group M.I. S. Prospective Validation of a Low Rectal Cancer Magnetic Resonance Imaging Staging System and Development of a Local Recurrence Risk Stratification Model: The MERCURY II Study//Ann Surg. - 2016. - T. 263, N 4. - C. 751-60.
27. Maas M., Beets-Tan R.G., Lambregts D.M., Lammering G., Nelemans P.J., Engelen S.M., van Dam R.M., Jansen R.L., Sosef M., Leijtens J.W., Hulsewe K.W., Buijsen J., Beets G.L. Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer//J Clin Oncol. - 2011. - T. 29, N 35. - C. 4633-40.
28. Fokas E., Appelt A., Glynne-Jones R., Beets G., Perez R., Garcia-Aguilar J., Rullier E., Smith J.J., Marijnen C., Peters F.P., van der Valk M., Beets-Tan R., Myint A.S., Gerard J.P., Bach S.P., Ghadimi M., Hofheinz R. D., Bujko K., Gani C., Haustermans K., Minsky B.D., Ludmir E., West N.P., Gambacorta M.A., Valentini V., Buyse M., Renehan A. G., Gilbert A., Sebag-Montefiore D., Rodel C. International consensus recommendations on key outcome measures for organ preservation after (chemo)radiotherapy in patients with rectal cancer//Nat Rev Clin Oncol. - 2021. - T. 18, N 12. - C. 805 - 816.
29. Sahni V.A., Silveira P.C., Sainani N.I., Khorasani R. Impact of a Structured Report Template on the Quality of MRI Reports for Rectal Cancer Staging//AJR Am J Roentgenol. - 2015. - T. 205, N 3. - C. 584-8.
30. Vliegen R.F., Beets G.L., von Meyenfeldt M.F., Kessels A.G., Lemaire E.E., van Engelshoven J.M., Beets-Tan R.G. Rectal cancer: MR imaging in local staging--is gadolinium-based contrast material helpful?//Radiology. - 2005. - T. 234, N 1. - C. 179-88.
31. Floriani I., Torri V., Rulli E., Garavaglia D., Compagnoni A., Salvolini L., Giovagnoni A. Performance of imaging modalities in diagnosis of liver metastases from colorectal cancer: a systematic review and meta-analysis//J Magn Reson Imaging. - 2010. - T. 31, N 1. - C. 19 - 31.
32. Schmoll H.J., Van Cutsem E., Stein A., Valentini V., Glimelius B., Haustermans K., Nordlinger B., van de Velde C.J., Balmana J., Regula J., Nagtegaal I.D., Beets-Tan R.G., Arnold D., Ciardiello F., Hoff P., Kerr D., Kohne C.H., Labianca R., Price T., Scheithauer W., Sobrero A., Tabernero J., Aderka D., Barroso S., Bodoky G., Douillard J.Y., El Ghazaly H., Gallardo J., Garin A., Glynne-Jones R., Jordan K., Meshcheryakov A., Papamichail D., Pfeiffer P., Souglakos I., Turhal S., Cervantes A. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. a personalized approach to clinical decision making//Ann Oncol. - 2012. - T. 23, N 10. - C. 2479 - 2516.
33. Niekel M.C., Bipat S., Stoker J. Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment//Radiology. - 2010. - T. 257, N 3. - C. 674-84.
34. Choi S.H., Kim S.Y., Park S.H., Kim K.W., Lee J.Y., Lee S.S., Lee M.G. Diagnostic performance of CT, gadoxetate disodium-enhanced MRI, and PET/CT for the diagnosis of colorectal liver metastasis: Systematic review and meta-analysis//J Magn Reson Imaging. - 2018. - T. 47, N 5. - C. 1237 - 1250.
35. Ko Y., Kim J., Park J.K., Kim H., Cho J.Y., Kang S.B., Ahn S., Lee K.J., Lee K. H. Limited detection of small (</= 10 mm) colorectal liver metastasis at preoperative CT in patients undergoing liver resection//PLoS One. - 2017. - T. 12, N 12. - C. e0189797.
36. Zech C.J., Korpraphong P., Huppertz A., Denecke T., Kim M.J., Tanomkiat W., Jonas E., Ba-Ssalamah A., group V.s. Randomized multicentre trial of gadoxetic acid-enhanced MRI versus conventional MRI or CT in the staging of colorectal cancer liver metastases//Br J Surg. - 2014. - T. 101, N 6. - C. 613-21.
37. Herrmann J., Lerman A., Sandhu N.P., Villarraga H.R., Mulvagh S.L., Kohli M. Evaluation and management of patients with heart disease and cancer: cardio-oncology//Mayo Clin Proc. - 2014. - T. 89, N 9. - C. 1287-306.
38. Starck M., Bohe M., Simanaitis M., Valentin L. Rectal endosonography can distinguish benign rectal lesions from invasive early rectal cancers//Colorectal Dis. - 2003. - T. 5, N 3. - C. 246-50.
39. Santoro G.A., Gizzi G., Pellegrini L., Battistella G., Di Falco G. The value of high-resolution three-dimensional endorectal ultrasonography in the management of submucosal invasive rectal tumors//Dis Colon Rectum. - 2009. - T. 52, N 11. - C. 1837-43.
40. Zorcolo L., Fantola G., Cabras F., Marongiu L., D'Alia G., Casula G. Preoperative staging of patients with rectal tumors suitable for transanal endoscopic microsurgery (TEM): comparison of endorectal ultrasound and histopathologic findings//Surg Endosc. - 2009. - T. 23, N 6. - C. 1384-9.
41. Roth E.S., Fetzer D.T., Barron B.J., Joseph U.A., Gayed I. W., Wan D.Q. Does colon cancer ever metastasize to bone first? a temporal analysis of colorectal cancer progression//BMC Cancer. - 2009. - T. 9. - C. 274.
42. Augestad K.M., Bakaki P.M., Rose J., Crawshaw B.P., Lindsetmo R.O., Dorum L. M., Koroukian S.M., Delaney C.P. Metastatic spread pattern after curative colorectal cancer surgery. A retrospective, longitudinal analysis//Cancer Epidemiol. - 2015. - T. 39, N 5. - C. 734-44.
43. Daza J.F., Solis N.M., Parpia S., Gallinger S., Moulton C.A., Belley-Cote E.P., Levine M. N., Serrano P.E. A meta-analysis exploring the role of PET and PET-CT in the management of potentially resectable colorectal cancer liver metastases//Eur J Surg Oncol. - 2019. - T. 45, N 8. - C. 1341 - 1348.
44. Muntean V., Oniu T., Lungoci C., Fabian O., Munteanu D., Molnar G., Bintintan V. Staging laparoscopy in digestive cancers//J Gastrointestin Liver Dis. - 2009. - T. 18, N 4. - C. 461-7.
45. De Marco M.F., Janssen-Heijnen M.L., van der Heijden L.H., Coebergh J.W. Comorbidity and colorectal cancer according to subsite and stage: a population-based study//Eur J Cancer. - 2000. - T. 36, N 1. - C. 95-9.
46. Khattak M.A., Martin H., Davidson A., Phillips M. Role of first-line anti-epidermal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analysis of randomized clinical trials//Clin Colorectal Cancer. - 2015. - T. 14, N 2. - C. 81 - 90.
47. Pietrantonio F., Petrelli F., Coinu A., Di Bartolomeo M., Borgonovo K., Maggi C., Cabiddu M., Iacovelli R., Bossi I., Lonati V., Ghilardi M., de Braud F., Barni S. Predictive role of BRAF mutations in patients with advanced colorectal cancer receiving cetuximab and panitumumab: a meta-analysis//Eur J Cancer. - 2015. - T. 51, N 5. - C. 587 - 94.
48. Prasad V., Kaestner V., Mailankody S. Cancer Drugs Approved Based on Biomarkers and Not Tumor Type-FDA Approval of Pembrolizumab for Mismatch Repair-Deficient Solid Cancers//JAMA Oncol. - 2018. - T. 4, N 2. - C. 157 - 158.
49. Therkildsen C., Bergmann T. K., Henrichsen-Schnack T., Ladelund S., Nilbert M. The predictive value of KRAS, NRAS, BRAF, PIK3CA and PTEN for anti-EGFR treatment in metastatic colorectal cancer: A systematic review and meta-analysis//Acta Oncol. - 2014. - T. 53, N 7. - C. 852 - 64.
50. Wang X. Y., Zheng Z. X., Sun Y., Bai Y. H., Shi Y. F., Zhou L. X., Yao Y. F., Wu A. W., Cao D. F. Significance of HER2 protein expression and HER2 gene amplification in colorectal adenocarcinomas//World J Gastrointest Oncol. - 2019. - T. 11, N 4. - C. 335 - 347.
51. Meric-Bernstam F., Hurwitz H., Raghav K. P. S., McWilliams R. R., Fakih M., VanderWalde A., Swanton C., Kurzrock R., Burris H., Sweeney C., Bose R., Spigel D. R., Beattie M. S., Blotner S., Stone A., Schulze K., Cuchelkar V., Hainsworth J. Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study//Lancet Oncol. - 2019. - T. 20, N 4. - C. 518 - 530.
52. Sartore-Bianchi A., Trusolino L., Martino C., Bencardino K., Lonardi S., Bergamo F., Zagonel V., Leone F., Depetris I., Martinelli E., Troiani T., Ciardiello F., Racca P., Bertotti A., Siravegna G., Torri V., Amatu A., Ghezzi S., Marrapese G., Palmeri L., Valtorta E., Cassingena A., Lauricella C., Vanzulli A., Regge D., Veronese S., Comoglio P. M., Bardelli A., Marsoni S., Siena S. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial//Lancet Oncol. - 2016. - T. 17, N 6. - C. 738 - 746.
53. Li Q., Liu Y., Zhang H. M., Huang Y. P., Wang T. Y., Li D. S., Sun H. Z. Influence of DPYD Genetic Polymorphisms on 5-Fluorouracil Toxicities in Patients with Colorectal Cancer: A Meta-Analysis//Gastroenterol Res Pract. - 2014. - T. 2014. - C. 827989.
54. Vikas P., Messersmith H., Compton C., Sholl L., Broaddus R. R., Davis A., Estevez-Diz M., Garje R., Konstantinopoulos P. A., Leiser A., Mills A. M., Norquist B., Overman M. J., Sohal D., Turkington R. C., Johnson T. Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy: ASCO Endorsement of College of American Pathologists Guideline//J Clin Oncol. - 2023. - T. 41, N 10. - C. 1943 - 1948.
55. Jasperson K. W., Tuohy T. M., Neklason D. W., Burt R. W. Hereditary and familial colon cancer//Gastroenterology. - 2010. - T. 138, N 6. - C. 2044 - 58.
56. Pab n M. MA; Babiker, HM A Review Of Hereditary Colorectal Cancers//StatPearls; StatPearls Publishing LLC.: Treasure Island, FL, USA. - 2019.
57. Lugli A., Kirsch R., Ajioka Y., Bosman F., Cathomas G., Dawson H., El Zimaity H., Flejou J. F., Hansen T. P., Hartmann A., Kakar S., Langner C., Nagtegaal I., Puppa G., Riddell R., Ristimaki A., Sheahan K., Smyrk T., Sugihara K., Terris B., Ueno H., Vieth M., Zlobec I., Quirke P. Recommendations for reporting tumor budding in colorectal cancer based on the International Tumor Budding Consensus Conference (ITBCC) 2016//Mod Pathol. - 2017. - T. 30, N 9. - C. 1299 - 1311.
58. Loughrey M. B., Webster F., Arends M. J., Brown I., Burgart L. J., Cunningham C., Flejou J. F., Kakar S., Kirsch R., Kojima M., Lugli A., Rosty C., Sheahan K., West N. P., Wilson R. H., Nagtegaal I. D. Dataset for Pathology Reporting of Colorectal Cancer: Recommendations From the International Collaboration on Cancer Reporting (ICCR)//Ann Surg. - 2022. - T. 275, N 3. - C. e549 - e561.
59. Burgart L. J., Chopp W. V., Jain D. Protocol for the examination of resection specimens from patients with primary carcinoma of the colon and rectum//CAP Cancer and CAP Pathology Electronic Reporting Committees. - 2021. - C. 1 - 28.
60. Johncilla M., Yantiss R. K. Histology of Colorectal Carcinoma: Proven and Purported Prognostic Factors//Surg Pathol Clin. - 2020. - T. 13, N 3. - C. 503 - 520.
61. Trakarnsanga A., Gonen M., Shia J., Nash G. M., Temple L. K., Guillem J. G., Paty P. B., Goodman K. A., Wu A., Gollub M., Segal N., Saltz L., Garcia-Aguilar J., Weiser M. R. Comparison of tumor regression grade systems for locally advanced rectal cancer after multimodality treatment//J Natl Cancer Inst. - 2014. - T. 106, N 10.
62. Rosty C., Webster F., Nagtegaal I. D., Brown I., Cooper H. S., Dekker E., Driman D. K., Gonzalez R. S., Hewett D. G., Loughrey M. B. Pathology reporting of colorectal local excision specimens: recommendations from the international collaboration on cancer reporting (ICCR)//Gastroenterology. - 2021. - T. 161, N 2. - C. 382 - 387.
63. Ventana MMR IHC Panel. Interpretation Guide for Staining of Colorectal Tissue. Ventana Medical Systems, Inc. (2017), p. 1 - 51. //.
64. Bartley A. N., Mills A. M., Konnick E., Overman M., Ventura C. B., Souter L., Colasacco C., Stadler Z. K., Kerr S., Howitt B. E., Hampel H., Adams S. F., Johnson W., Magi-Galluzzi C., Sepulveda A. R., Broaddus R. R. Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy: Guideline From the College of American Pathologists in Collaboration With the Association for Molecular Pathology and Fight Colorectal Cancer//Arch Pathol Lab Med. - 2022. - T. 146, N 10. - C. 1194 - 1210.
65. Valtorta E., Martino C., Sartore-Bianchi A., Penaullt-Llorca F., Viale G., Risio M., Rugge M., Grigioni W., Bencardino K., Lonardi S., Zagonel V., Leone F., Noe J., Ciardiello F., Pinto C., Labianca R., Mosconi S., Graiff C., Aprile G., Frau B., Garufi C., Loupakis F., Racca P., Tonini G., Lauricella C., Veronese S., Truini M., Siena S., Marsoni S., Gambacorta M. Assessment of a HER2 scoring system for colorectal cancer: results from a validation study//Mod Pathol. - 2015. - T. 28, N 11. - C. 1481 - 91.
66. Bartley A. N., Washington M. K., Ventura C. B., Ismaila N., Colasacco C., Benson A. B., 3rd, Carrato A., Gulley M. L., Jain D., Kakar S., Mackay H. J., Streutker C., Tang L., Troxell M., Ajani J. A. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and American Society of Clinical Oncology//Arch Pathol Lab Med. - 2016. - T. 140, N 12. - C. 1345 - 1363.
67. Тест VENTANA pan-TRK (EPR17341). ООО "Рош Диагностика Рус" (2020), p. 1 - 4. www.med.roche.ru //.
68. Демидова И.А., Савелов Н.А., Гриневич В.Н. Руководство VENTANA по интерпретации иммуногистохимического окрашивания ALK при немелкоклеточном раке легкого (НМРЛ). Руководство по оценке ALK-статуса с использованием кроличьих моноклональных антител Ventana anti-ALK (D5F3) Rabbit Monoclonal Primary Antibody. Ventana Medical Systems, Inc. (2018), p. 1 - 52. www.med.roche.ru //.
69. Первичное кроличье моноклональное антитело VENTANA ROS1 (SP384) Rabbit Monoclonal Primary Antibodya. ООО "Рош Диагностика Рус" (2021), p. 1 - 4. www.med.roche.ru //.
70. Guerra G. R., Kong C. H., Warrier S. K., Lynch A. C., Heriot A. G., Ngan S. Y. Primary squamous cell carcinoma of the rectum: An update and implications for treatment//World J Gastrointest Surg. - 2016. - T. 8, N 3. - C. 252 - 65.
71. Vyas N., Ahmad S., Bhuiyan K., Catalano C., Alkhawam H., Sogomonian R., Nguyen J., Walfish A., Aron J. Primary squamous cell carcinoma of the rectum: a case report and literature review//J Community Hosp Intern Med Perspect. - 2016. - T. 6, N 3. - C. 31708.
72. Sturgeon J. D., Crane C. H., Krishnan S., Minsky B. D., Skibber J. M., Rodriguez-Bigas M. A., Chang G. J., You Y. N., Eng C., Das P. Definitive Chemoradiation for Squamous Cell Carcinoma of the Rectum//Am J Clin Oncol. - 2017. - T. 40, N 2. - C. 163 - 166.
73. Клинические рекомендации. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи. МЗ РФ. 2018. //.
74. Babaei M., Jansen L., Balavarca Y., Sjovall A., Bos A., van de Velde T., Moreau M., Liberale G., Goncalves A. F., Bento M. J., Ulrich C. M., Schrotz-King P., Lemmens V., Glimelius B., Brenner H. Neoadjuvant Therapy in Rectal Cancer Patients With Clinical Stage II to III Across European Countries: Variations and Outcomes//Clin Colorectal Cancer. - 2018. - T. 17, N 1. - C. e129 - e142.
75. Abraha I., Aristei C., Palumbo I., Lupattelli M., Trastulli S., Cirocchi R., De Florio R., Valentini V. Preoperative radiotherapy and curative surgery for the management of localised rectal carcinoma//Cochrane Database Syst Rev. - 2018. - T. 10, N 10. - C. CD002102.
76. De Caluwe L., Van Nieuwenhove Y., Ceelen W. P. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer//Cochrane Database Syst Rev. - 2013. - T. 2013, N 2. - C. CD006041.
77. Ngan S. Y., Burmeister B., Fisher R. J., Solomon M., Goldstein D., Joseph D., Ackland S. P., Schache D., McClure B., McLachlan S. A., McKendrick J., Leong T., Hartopeanu C., Zalcberg J., Mackay J. Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04//J Clin Oncol. - 2012. - T. 30, N 31. - C. 3827 - 33.
78. Du D., Su Z., Wang D., Liu W., Wei Z. Optimal Interval to Surgery After Neoadjuvant Chemoradiotherapy in Rectal Cancer: A Systematic Review and Meta-analysis//Clin Colorectal Cancer. - 2018. - T. 17, N 1. - C. 13 - 24.
79. Petrelli F., Sgroi G., Sarti E., Barni S. Increasing the Interval Between Neoadjuvant Chemoradiotherapy and Surgery in Rectal Cancer: A Meta-analysis of Published Studies//Ann Surg. - 2016. - T. 263, N 3. - C. 458 - 64.
80. Pettersson D., Cedermark B., Holm T., Radu C., Pahlman L., Glimelius B., Martling A. Interim analysis of the Stockholm III trial of preoperative radiotherapy regimens for rectal cancer//Br J Surg. - 2010. - T. 97, N 4. - C. 580 - 7.
81. Nilsson P. J., van Etten B., Hospers G. A., Pahlman L., van de Velde C. J., Beets-Tan R. G., Blomqvist L., Beukema J. C., Kapiteijn E., Marijnen C. A., Nagtegaal I. D., Wiggers T., Glimelius B. Short-course radiotherapy followed by neo-adjuvant chemotherapy in locally advanced rectal cancer--the RAPIDO trial//BMC Cancer. - 2013. - T. 13. - C. 279.
82. Jin J., Tang Y., Hu C., Jiang L. M., Jiang J., Li N., Liu W. Y., Chen S. L., Li S., Lu N. N., Cai Y., Li Y. H., Zhu Y., Cheng G. H., Zhang H. Y., Wang X., Zhu S. Y., Wang J., Li G. F., Yang J. L., Zhang K., Chi Y., Yang L., Zhou H. T., Zhou A. P., Zou S. M., Fang H., Wang S. L., Zhang H. Z., Wang X. S., Wei L. C., Wang W. L., Liu S. X., Gao Y. H., Li Y. X. Multicenter, Randomized, Phase III Trial of Short-Term Radiotherapy Plus Chemotherapy Versus Long-Term Chemoradiotherapy in Locally Advanced Rectal Cancer (STELLAR)//J Clin Oncol. - 2022. - T. 40, N 15. - C. 1681 - 1692.
83. Petrelli F., Trevisan F., Cabiddu M., Sgroi G., Bruschieri L., Rausa E., Ghidini M., Turati L. Total Neoadjuvant Therapy in Rectal Cancer: A Systematic Review and Meta-analysis of Treatment Outcomes//Ann Surg. - 2020. - T. 271, N 3. - C. 440-448.
84. Sychev S, Ponomarenko A, Chernyshov S, Alekseev M, Mamedli Z, Kuzmichev D, Polynovskiy A, Rybakov E. Total neoadjuvant therapy in rectal cancer: a network meta-analysis of randomized trials. Annals of Coloproctology. 2023 Aug; 39(4): 289 //.
85. Liao C. K., Kuo Y. T., Lin Y. C., Chern Y. J., Hsu Y. J., Yu Y. L., Chiang J. M., Hsieh P. S., Yeh C. Y., You J. F. Neoadjuvant Short-Course Radiotherapy Followed by Consolidation Chemotherapy before Surgery for Treating Locally Advanced Rectal Cancer: A Systematic Review and Meta-Analysis//Curr Oncol. - 2022. - T. 29, N 5. - C. 3708 - 3727.
86. Verheij F. S., Omer D. M. R., Williams H., Buckley J. T., Lin S. T., Qin L.-X., Thompson H. M., Yuval J. B., Gollub M. J., Wu A. J.-C. Sustained organ preservation in patients with rectal cancer treated with total neoadjuvant therapy: Long-term results of the OPRA trial//Book Sustained organ preservation in patients with rectal cancer treated with total neoadjuvant therapy: Long-term results of the OPRA trial / EditorAmerican Society of Clinical Oncology, 2023.
87. Romesser P. B., Park B. K., Nemirovsky D., Alvarez J., Omer D. M., Sarkar R., Verheij F. S., Yamner M., Reyngold M., Hajj C. Organ preservation and total neoadjuvant therapy for rectal cancer: Investigating long-course chemoradiation versus short-course radiation therapy//Book Organ preservation and total neoadjuvant therapy for rectal cancer: Investigating long-course chemoradiation versus short-course radiation therapy / EditorAmerican Society of Clinical Oncology, 2023.
88. van der Valk M. J. M., Hilling D. E., Bastiaannet E., Meershoek-Klein Kranenbarg E., Beets G. L., Figueiredo N. L., Habr-Gama A., Perez R. O., Renehan A. G., van de Velde C. J. H., Consortium I. Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicentre registry study//Lancet. - 2018. - T. 391, N 10139. - C. 2537 - 2545.
89. Dossa F., Chesney T. R., Acuna S. A., Baxter N. N. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis//Lancet Gastroenterol Hepatol. - 2017. - T. 2, N 7. - C. 501 - 513.
90. Latkauskas T., Pauzas H., Gineikiene I., Janciauskiene R., Juozaityte E., Saladzinskas Z., Tamelis A., Pavalkis D. Initial results of a randomized controlled trial comparing clinical and pathological downstaging of rectal cancer after preoperative short-course radiotherapy or long-term chemoradiotherapy, both with delayed surgery//Colorectal Dis. - 2012. - T. 14, N 3. - C. 294 - 8.
91. Cercek A., Roxburgh C. S. D., Strombom P., Smith J. J., Temple L. K. F., Nash G. M., Guillem J. G., Paty P. B., Yaeger R., Stadler Z. K., Seier K., Gonen M., Segal N. H., Reidy D. L., Varghese A., Shia J., Vakiani E., Wu A. J., Crane C. H., Gollub M. J., Garcia-Aguilar J., Saltz L. B., Weiser M. R. Adoption of Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer//JAMA Oncol. - 2018. - T. 4, N 6. - C. e180071.
92. McCarthy K., Pearson K., Fulton R., Hewitt J. Pre operative chemoradiation for non metastatic locally advanced rectal cancer//Cochrane database of systematic reviews. - 2012. N 12.
93. Lumish M. A., Cohen J. L., Stadler Z. K., Weiss J. A., Lamendola-Essel M. F., Yaeger R., Segal N. H., El Dika I. H., Saltz L. B., Shcherba M. PD-1 blockade alone for mismatch repair deficient (dMMR) locally advanced rectal cancer//Book PD-1 blockade alone for mismatch repair deficient (dMMR) locally advanced rectal cancer / EditorAmerican Society of Clinical Oncology, 2022.
94. Mei W. J., Wang X. Z., Li Y. F., Sun Y. M., Yang C. K., Lin J. Z., Wu Z. G., Zhang R., Wang W., Li Y., Zhuang Y. Z., Lei J., Wan X. B., Ren Y. K., Cheng Y., Li W. L., Wang Z. Q., Xu D. B., Mo X. W., Ju H. X., Ye S. W., Zhao J. L., Zhang H., Gao Y. H., Zeng Z. F., Xiao W. W., Zhang X. P., Zhang X., Xie E., Feng Y. F., Tang J. H., Wu X. J., Chen G., Li L. R., Lu Z. H., Wan D. S., Bei J. X., Pan Z. Z., Ding P. R. Neoadjuvant Chemotherapy With CAPOX Versus Chemoradiation for Locally Advanced Rectal Cancer With Uninvolved Mesorectal Fascia (CONVERT): Initial Results of a Phase III Trial//Ann Surg. - 2023. - T. 277, N 4. - C. 557 - 564.
95. Basch E., Dueck A. C., Mitchell S. A., Mamon H., Weiser M., Saltz L., Gollub M., Rogak L., Ginos B., Mazza G. L., Colgrove B., Chang G., Minasian L., Denicoff A., Thanarajasingam G., Musher B., George T., Venook A., Farma J., O'Reilly E., Meyerhardt J. A., Shi Q., Schrag D. Patient-Reported Outcomes During and After Treatment for Locally Advanced Rectal Cancer in the PROSPECT Trial (Alliance N 1048)//J Clin Oncol. - 2023. - T. 41, N 21. - C. 3724 - 3734.
96. Taylor F. G., Quirke P., Heald R. J., Moran B., Blomqvist L., Swift I., Sebag-Montefiore D. J., Tekkis P., Brown G., group M. s. Preoperative high-resolution magnetic resonance imaging can identify good prognosis stage I, II, and III rectal cancer best managed by surgery alone: a prospective, multicenter, European study//Ann Surg. - 2011. - T. 253, N 4. - C. 711 - 9.
97. Kennedy E. D., Simunovic M., Jhaveri K., Kirsch R., Brierley J., Drolet S., Brown C., Vos P. M., Xiong W., MacLean T., Kanthan S., Stotland P., Raphael S., Chow G., O'Brien C. A., Cho C., Streutker C., Wong R., Schmocker S., Liberman S., Reinhold C., Kopek N., Marcus V., Bouchard A., Lavoie C., Morin S., Perigny M., Wright A., Neumann K., Clarke S., Patil N. G., Arnason T., Williams L., McLeod R., Brown G., Mathieson A., Pooni A., Baxter N. N. Safety and Feasibility of Using Magnetic Resonance Imaging Criteria to Identify Patients With "Good Prognosis" Rectal Cancer Eligible for Primary Surgery: The Phase 2 Nonrandomized QuickSilver Clinical Trial//JAMA Oncol. - 2019. - T. 5, N 7. - C. 961 - 966.
98. Morton D., Seymour M., Magill L., Handley K., Glasbey J., Glimelius B., Palmer A., Seligmann J., Laurberg S., Murakami K., West N., Quirke P., Gray R., Group F. O. C. Preoperative Chemotherapy for Operable Colon Cancer: Mature Results of an International Randomized Controlled Trial//J Clin Oncol. - 2023. - T. 41, N 8. - C. 1541 - 1552.
99. Marinello F. G., Frasson M., Baguena G., Flor-Lorente B., Cervantes A., Rosello S., Espi A., Garcia-Granero E. Selective approach for upper rectal cancer treatment: total mesorectal excision and preoperative chemoradiation are seldom necessary//Dis Colon Rectum. - 2015. - T. 58, N 6. - C. 556-65.
100. Rosenberg R., Maak M., Schuster T., Becker K., Friess H., Gertler R. Does a rectal cancer of the upper third behave more like a colon or a rectal cancer?//Dis Colon Rectum. - 2010. - T. 53, N 5. - C. 761 - 70.
101. Sager O., Dincoglan F., Demiral S., Uysal B., Gamsiz H., Dirican B., Beyzadeoglu M. A Concise Review of Pelvic Radiation Therapy (RT) for Rectal Cancer with Synchronous Liver Metastases//Int J Surg Oncol. - 2019. - T. 2019. - C. 5239042.
102. Kim M. J., Kim S. J., Park S. C., Kim D. Y., Park J. W., Ryoo S. B., Jeong S. Y., Park K. J., Oh H. K., Kim D. W., Kang S. B., Joo J. N., Oh J. H., Group S. E. C. Adjuvant radiotherapy for the treatment of stage IV rectal cancer after curative resection: A propensity score-matched analysis and meta-analysis//Medicine (Baltimore). - 2016. - T. 95, N 47. - C. e4925.
103. Liu Q., Shan Z., Luo D., Cai S., Li Q., Li X. Palliative beam radiotherapy offered real-world survival benefit to metastatic rectal cancer: A large US population-based and propensity score-matched study//J Cancer. - 2019. - T. 10, N 5. - C. 1216 - 1225.
104. Chen J. H., Ye Q., Huang F. Determining the survival benefit of postoperative radiotherapy in patients with pT1-3N1M0 rectal cancer undergoing total mesorectal excision: a retrospective analysis//BMC Gastroenterol. - 2023. - T. 23, N 1. - C. 83.
105. Yu D., Wang Y., Song Y., Gao P., Sun J., Chen X., Hu Y., Wang Z. The efficacy of postoperative radiotherapy for locally advanced rectal cancer without neoadjuvant therapy//Translational Cancer Research. - 2018. - T. 7, N 4.
106. van der Pas M. H., Haglind E., Cuesta M. A., Furst A., Lacy A. M., Hop W. C., Bonjer H. J., Group C. O. c. L. o. O. R. I. S. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial//Lancet Oncol. - 2013. - T. 14, N 3. - C. 210 - 8.
107. Jeong S. Y., Park J. W., Nam B. H., Kim S., Kang S. B., Lim S. B., Choi H. S., Kim D. W., Chang H. J., Kim D. Y., Jung K. H., Kim T. Y., Kang G. H., Chie E. K., Kim S. Y., Sohn D. K., Kim D. H., Kim J. S., Lee H. S., Kim J. H., Oh J. H. Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label, non-inferiority, randomised controlled trial//Lancet Oncol. - 2014. - T. 15, N 7. - C. 767 - 74.
108. Green B. L., Marshall H. C., Collinson F., Quirke P., Guillou P., Jayne D. G., Brown J. M. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer//Br J Surg. - 2013. - T. 100, N 1. - C. 75 - 82.
109. Schwenk W., Haase O., Neudecker J., Muller J. M. Short term benefits for laparoscopic colorectal resection//Cochrane Database Syst Rev. - 2005. - T. 2005, N 3. - C. CD003145.
110. Ribas Y., Hotouras A., Wexner S. D., D'Hoore A. Shared decision-making and informed consent process in rectal cancer treatment: weighing up oncological and functional outcomes//Colorectal Dis. - 2016. - T. 18, N 1. - C. 9 - 12.
111. Breukink S., Pierie J., Wiggers T. Laparoscopic versus open total mesorectal excision for rectal cancer//Cochrane Database Syst Rev. - 2006.10.1002/14651858.CD005200.pub2 N 4. - C. CD005200.
112. Chude G. G., Rayate N. V., Patris V., Koshariya M., Jagad R., Kawamoto J., Lygidakis N. J. Defunctioning loop ileostomy with low anterior resection for distal rectal cancer: should we make an ileostomy as a routine procedure? A prospective randomized study//Hepatogastroenterology. - 2008. - T. 55, N 86 - 87. - C. 1562 - 7.
113. Гордеев С., Иванов В., Расулов А., Барсуков Ю., Ткачев С., Сураева Ю., Черных М., Кузьмичев Д., Козак Е., Малихов А. Химиолучевая терапия осложненного местнораспространенного и рецидивного рака прямой кишки. Медицинская радиология и радиационная безопасность 2016; 61(6): 57 - 63. //.
114. Wang L., Chen X., Liao C., Wu Q., Luo H., Yi F., Wei Y., Zhang W. Early versus late closure of temporary ileostomy after rectal cancer surgery: a meta-analysis//Surg Today. - 2021. - T. 51, N 4. - C. 463 - 471.
115. Elsner A. T., Brosi P., Walensi M., Uhlmann M., Egger B., Glaser C., Maurer C. A. Closure of Temporary Ileostomy 2 Versus 12 Weeks After Rectal Resection for Cancer: A Word of Caution From a Prospective, Randomized Controlled Multicenter Trial//Dis Colon Rectum. - 2021. - T. 64, N 11. - C. 1398 - 1406.
116. Park J., Angenete E., Bock D., Correa-Marinez A., Danielsen A. K., Gehrman J., Haglind E., Jansen J. E., Skullman S., Wedin A., Rosenberg J. Cost analysis in a randomized trial of early closure of a temporary ileostomy after rectal resection for cancer (EASY trial)//Surg Endosc. - 2020. - T. 34, N 1. - C. 69 - 76.
117. Danielsen A. K., Park J., Jansen J. E., Bock D., Skullman S., Wedin A., Marinez A. C., Haglind E., Angenete E., Rosenberg J. Early Closure of a Temporary Ileostomy in Patients With Rectal Cancer: A Multicenter Randomized Controlled Trial//Ann Surg. - 2017. - T. 265, N 2. - C. 284 - 290.
118. Kye B. H., Kim H. J., Kim J. G., Cho H. M. Is it safe the reversal of a perting stoma during adjuvant chemotherapy in elderly rectal cancer patients?//Int J Surg. - 2014. - T. 12, N 12. - C. 1337 - 41.
119. Hajibandeh S., Hajibandeh S., Sarma D. R., East J., Zaman S., Mankotia R., Thompson C. V., Torrance A. W., Peravali R. Meta-analysis of temporary loop ileostomy closure during or after adjuvant chemotherapy following rectal cancer resection: the dilemma remains//Int J Colorectal Dis. - 2019. - T. 34, N 7. - C. 1151 - 1159.
120. Nascimbeni R., Nivatvongs S., Larson D. R., Burgart L. J. Long-term survival after local excision for T1 carcinoma of the rectum//Dis Colon Rectum. - 2004. - T. 47, N 11. - C. 1773 - 9.
121. Sgourakis G., Lanitis S., Gockel I., Kontovounisios C., Karaliotas C., Tsiftsi K., Tsiamis A., Karaliotas C. C. Transanal endoscopic microsurgery for T1 and T2 rectal cancers: a meta-analysis and meta-regression analysis of outcomes//Am Surg. - 2011. - T. 77, N 6. - C. 761 - 72.
122. Doornebosch P. G., Tollenaar R. A., De Graaf E. J. Is the increasing role of Transanal Endoscopic Microsurgery in curation for T1 rectal cancer justified? A systematic review//Acta Oncol. - 2009. - T. 48, N 3. - C. 343 - 53.
123. Чернышов С.В., Нагудов М.А., Хомяков Е.А., Козырева С.Б., Майновская О.А., Рыбаков Е.Г. Результаты тотальной мезоректумэктомии и трансанальной эндомикрохирургии при аденокарциномах прямой кишки с инвазией в подслизистый слой. Хирургия. Журнал им. Н.И. Пирогова. 2022; (4): 34 41. //.
124. Maynovskaia O, Rybakov E, Chernyshov S, Khomyakov E, Achkasov S. Are the width, length, depth, and area of submucosal invasion predictive of lymph node metastasis in pT1 colorectal cancer? Ann Coloproctol. 2023; 39(6): 484 - 492. //.
125. Zwager L. W., Bastiaansen B. A. J., Montazeri N. S. M., Hompes R., Barresi V., Ichimasa K., Kawachi H., Machado I., Masaki T., Sheng W., Tanaka S., Togashi K., Yasue C., Fockens P., Moons L. M. G., Dekker E. Deep Submucosal Invasion Is Not an Independent Risk Factor for Lymph Node Metastasis in T1 Colorectal Cancer: A Meta-Analysis//Gastroenterology. - 2022. - T. 163, N 1. - C. 174 - 189.
126. Cho S. H., Choi G. S., Kim G. C., Seo A. N., Kim H. J., Kim W. H., Shin K. M., Lee S. M., Ryeom H., Kim S. H. Long-term outcomes of surgery alone versus surgery following preoperative chemoradiotherapy for early T3 rectal cancer: A propensity score analysis//Medicine (Baltimore). - 2017. - T. 96, N 12. - C. e6362.
127. Tessier L., McKechnie T., Lee Y., Park L. J., Gangam N., Eskicioglu C. Laparoscopic ovarian transposition prior to pelvic radiation in young women with anorectal malignancies: a systematic review and meta-analysis of prevalence//Colorectal Dis. - 2023. - T. 25, N 7. - C. 1336 - 1348.
128. Allard M. A., Adam R., Giuliante F., Lapointe R., Hubert C., Ijzermans J. N. M., Mirza D. F., Elias D., Laurent C., Gruenberger T., Poston G., Letoublon C., Isoniemi H., Lucidi V., Popescu I., Figueras J. Long-term outcomes of patients with 10 or more colorectal liver metastases//Br J Cancer. - 2017. - T. 117, N 5. - C. 604 - 611.
129. Adam R., Wicherts D. A., de Haas R. J., Ciacio O., Levi F., Paule B., Ducreux M., Azoulay D., Bismuth H., Castaing D. Patients with initially unresectable colorectal liver metastases: is there a possibility of cure?//J Clin Oncol. - 2009. - T. 27, N 11. - C. 1829 - 35.
130. Brandi G., De Lorenzo S., Nannini M., Curti S., Ottone M., Dall'Olio F. G., Barbera M. A., Pantaleo M. A., Biasco G. Adjuvant chemotherapy for resected colorectal cancer metastases: Literature review and meta-analysis//World J Gastroenterol. - 2016. - T. 22, N 2. - C. 519 - 33.
131. Overman M. J., McDermott R., Leach J. L., Lonardi S., Lenz H. J., Morse M. A., Desai J., Hill A., Axelson M., Moss R. A., Goldberg M. V., Cao Z. A., Ledeine J. M., Maglinte G. A., Kopetz S., Andre T. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study//Lancet Oncol. - 2017. - T. 18, N 9. - C. 1182 - 1191.
132. Andre T., Shiu K. K., Kim T. W., Jensen B. V., Jensen L. H., Punt C., Smith D., Garcia-Carbonero R., Benavides M., Gibbs P., de la Fouchardiere C., Rivera F., Elez E., Bendell J., Le D. T., Yoshino T., Van Cutsem E., Yang P., Farooqui M. Z. H., Marinello P., Diaz L. A., Jr., Investigators K.-. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer//N Engl J Med. - 2020. - T. 383, N 23. - C. 2207 - 2218.
133. Lenz H.-J., Lonardi S., Zagonel V., Van Cutsem E., Limon M. L., Wong K. Y. M., Hendlisz A., Aglietta M., Garcia-Alfonso P., Neyns B. Nivolumab (NIVO)+ low-dose ipilimumab (IPI) as first-line (1L) therapy in microsatellite instability-high/DNA mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Clinical update//Book Nivolumab (NIVO)+ low-dose ipilimumab (IPI) as first-line (1L) therapy in microsatellite instability-high/DNA mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Clinical update / EditorAmerican Society of Clinical Oncology, 2019.
134. Modest D. P., Martens U. M., Riera-Knorrenschild J., Greeve J., Florschutz A., Wessendorf S., Ettrich T., Kanzler S., Norenberg D., Ricke J., Seidensticker M., Held S., Buechner-Steudel P., Atzpodien J., Heinemann V., Seufferlein T., Tannapfel A., Reinacher-Schick A. C., Geissler M. FOLFOXIRI Plus Panitumumab As First-Line Treatment of RAS Wild-Type Metastatic Colorectal Cancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109)//J Clin Oncol. - 2019. - T. 37, N 35. - C. 3401 - 3411.
135. Федянин М., Трякин А., Тюляндин С. Потенциальные предикторы эффективности анти-EGFR-терапии при метастатическом раке толстой кишки. Онкологическая колопроктология 2013; 2. //.
136. Wang J., Luo L., Wang D., Guo B., Li J., Yang Z., Tang D. Combination adjuvant chemotherapy with targeted drugs for treatment of colorectal cancer: A network meta-analysis//J Cell Biochem. - 2018. - T. 119, N 2. - C. 1521 - 1537.
137. Chen M., Wang Z., Liu Z., Deng T., Wang X., Chang Z., Zhang Q., Yang W., Liu N., Ji Z., Zhang X., Wang X., Peng Z., Li Y., Cao Y., Jin X., Lu H., Qu H., Tang Y., Xu C., Fang W., Zhang H., Yan D., Wang L., Li J., Zhang J., Wang Q., Xue L., Yin F., Han G., Cheng Z., Liu Q., Jin Y., Zhang Y., Li L., Cao B., Yao Y., Chen Z., Zou J., Ying J., Wei Q., Tian T., Zhao W., Li L., Zhang T., Song F., Ba Y. E., Li N., Gao H., Ji Y., Bao L., Zhao X., Cai J., Yuan Z., Shen L., Li J. PD-1/PD-L1 Inhibitor Plus Chemotherapy Versus PD-1/PD-L1 Inhibitor in Microsatellite Instability Gastrointestinal Cancers: A Multicenter Retrospective Study//JCO Precis Oncol. - 2023. - T. 7. - C. e2200463.
138. Mutlu A. U., Aytac E., Gulmez M., Erdamar S., Ozer L. Case Report: Chemoimmunotherapy in microsatellite-instability-high advanced goblet cell carcinoma of the colon//Front Immunol. - 2023. - T. 14. - C. 1160586.
139. Ree A. H., Saltyte Benth J., Hamre H. M., Kersten C., Hofsli E., Guren M. G., Sorbye H., Johansen C., Negard A., Bjornetro T., Nilsen H. L., Berg J. P., Flatmark K., Meltzer S. First-line oxaliplatin-based chemotherapy and nivolumab for metastatic microsatellite-stable colorectal cancer-the randomised METIMMOX trial//Br J Cancer. - 2024. - T. 130, N 12. - C. 1921 - 1928.
140. Cetinkaya E., Dogrul A. B., Tirnaksiz M. B. Role of self expandable stents in management of colorectal cancers//World J Gastrointest Oncol. - 2016. - T. 8, N 1. - C. 113-20.
141. Nielsen M. B., Laurberg S., Holm T. Current management of locally recurrent rectal cancer//Colorectal Dis. - 2011. - T. 13, N 7. - C. 732-42.
142. Rahbari N. N., Ulrich A. B., Bruckner T., Munter M., Nickles A., Contin P., Loffler T., Reissfelder C., Koch M., Buchler M. W., Weitz J. Surgery for locally recurrent rectal cancer in the era of total mesorectal excision: is there still a chance for cure?//Ann Surg. - 2011. - T. 253, N 3. - C. 522-33.
143. Lee J. H., Kim D. Y., Kim S. Y., Park J. W., Choi H. S., Oh J. H., Chang H. J., Kim T. H., Park S. W. Clinical outcomes of chemoradiotherapy for locally recurrent rectal cancer//Radiat Oncol. - 2011. - T. 6. - C. 51.
144. Tanis P. J., Doeksen A., van Lanschot J. J. Intentionally curative treatment of locally recurrent rectal cancer: a systematic review//Can J Surg. - 2013. - T. 56, N 2. - C. 135-44.
145. Bird T. G., Ngan S. Y., Chu J., Kroon R., Lynch A. C., Heriot A. G. Outcomes and prognostic factors of multimodality treatment for locally recurrent rectal cancer with curative intent//Int J Colorectal Dis. - 2018. - T. 33, N 4. - C. 393 - 401.
146. Watanabe J., Shoji H., Hamaguchi T., Miyamoto T., Hirano H., Iwasa S., Honma Y., Takashima A., Kato K., Ito Y., Itami J., Kanemitsu Y., Boku N. Chemoradiotherapy for Local Recurrence of Rectal Cancer: A Single Center Study of 18 Patients//In Vivo. - 2019. - T. 33, N 4. - C. 1363 - 1368.
147. Yu S. K., Bhangu A., Tait D. M., Tekkis P., Wotherspoon A., Brown G. Chemoradiotherapy response in recurrent rectal cancer//Cancer Med. - 2014. - T. 3, N 1. - C. 111-7.
148. Guren M. G., Undseth C., Rekstad B. L., Braendengen M., Dueland S., Spindler K. L., Glynne-Jones R., Tveit K. M. Reirradiation of locally recurrent rectal cancer: a systematic review//Radiother Oncol. - 2014. - T. 113, N 2. - C. 151-7.
149. Petrelli F., Coinu A., Lonati V., Barni S. A systematic review and meta-analysis of adjuvant chemotherapy after neoadjuvant treatment and surgery for rectal cancer//Int J Colorectal Dis. - 2015. - T. 30, N 4. - C. 447-57.
150. Andre T., Colin P., Louvet C., Gamelin E., Bouche O., Achille E., Colbert N., Boaziz C., Piedbois P., Tubiana-Mathieu N., Boutan-Laroze A., Flesch M., Billiau V., Buyse M., Gramont A., Groupe d'Etude et de Recherche Clinique en Oncologie R. Randomized adjuvant study comparing two schemes of 5-fluorouracil and leucovorin in stage B2 and C colon adenocarcinoma: study design and preliminary safety results. Groupe d'Etude et de Recherche Clinique en Oncologie Radiotherapies//Semin Oncol. - 2001. - T. 28, N 1 Suppl 1. - C. 35 - 40.
151. Breugom A. J., van Gijn W., Muller E. W., Berglund A., van den Broek C. B. M., Fokstuen T., Gelderblom H., Kapiteijn E., Leer J. W. H., Marijnen C. A. M., Martijn H., Meershoek-Klein Kranenbarg E., Nagtegaal I. D., Pahlman L., Punt C. J. A., Putter H., Roodvoets A. G. H., Rutten H. J. T., Steup W. H., Glimelius B., van de Velde C. J. H. Adjuvant chemotherapy for rectal cancer patients treated with preoperative (chemo)radiotherapy and total mesorectal excision: a Dutch Colorectal Cancer Group (DCCG) randomized phase III trial//Ann Oncol. - 2015. - T. 26, N 4. - C. 696 - 701.
152. Guo Y., Xiong B. H., Zhang T., Cheng Y., Ma L. XELOX vs. FOLFOX in metastatic colorectal cancer: An updated meta-analysis//Cancer Invest. - 2016. - T. 34, N 2. - C. 94 - 104.
153. Kato T., Nagata N., Fujii M., Takemoto H., Kondo K., Okuyama Y., Tominaga H., Sakamoto J., Mishima H. Multi-center phase II study of FLOX for advanced colorectal cancer patients in Japan: SWIFT 3 study//Anticancer Res. - 2011. - T. 31, N 12. - C. 4657-64.
154. Andre T., Quinaux E., Louvet C., Colin P., Gamelin E., Bouche O., Achille E., Piedbois P., Tubiana-Mathieu N., Boutan-Laroze A., Flesch M., Lledo G., Raoul Y., Debrix I., Buyse M., de Gramont A. Phase III study comparing a semimonthly with a monthly regimen of fluorouracil and leucovorin as adjuvant treatment for stage II and III colon cancer patients: final results of GERCOR C96.1//J Clin Oncol. - 2007. - T. 25, N 24. - C. 3732-8.
155. Mizushima T., Ikeda M., Kato T., Ikeda A., Nishimura J., Hata T., Matsuda C., Satoh T., Mori M., Doki Y. Postoperative XELOX therapy for patients with curatively resected high-risk stage II and stage III rectal cancer without preoperative chemoradiation: a prospective, multicenter, open-label, single-arm phase II study//BMC Cancer. - 2019. - T. 19, N 1. - C. 929.
156. Федянин М., Трякин А., Тюляндин С. Адъювантная химиотерапия после химиолучевого лечения рака прямой кишки. Онкологическая колопроктология 2014; 2. //.
157. Andre T., Boni C., Navarro M., Tabernero J., Hickish T., Topham C., Bonetti A., Clingan P., Bridgewater J., Rivera F., de Gramont A. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial//J Clin Oncol. - 2009. - T. 27, N 19. - C. 3109-16.
158. Kuebler J. P., Wieand H. S., O'Connell M. J., Smith R. E., Colangelo L. H., Yothers G., Petrelli N. J., Findlay M. P., Seay T. E., Atkins J. N., Zapas J. L., Goodwin J. W., Fehrenbacher L., Ramanathan R. K., Conley B. A., Flynn P. J., Soori G., Colman L. K., Levine E. A., Lanier K. S., Wolmark N. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP C-07//J Clin Oncol. - 2007. - T. 25, N 16. - C. 2198-204.
159. McCleary N. J., Meyerhardt J. A., Green E., Yothers G., de Gramont A., Van Cutsem E., O'Connell M., Twelves C. J., Saltz L. B., Haller D. G., Sargent D. J. Impact of age on the efficacy of newer adjuvant therapies in patients with stage II/III colon cancer: findings from the ACCENT database//J Clin Oncol. - 2013. - T. 31, N 20. - C. 2600-6.
160. Cheeseman S. L., Joel S. P., Chester J. D., Wilson G., Dent J. T., Richards F. J., Seymour M. T. A 'modified de Gramont' regimen of fluorouracil, alone and with oxaliplatin, for advanced colorectal cancer//Br J Cancer. - 2002. - T. 87, N 4. - C. 393-9.
161. Hirsch B. R., Zafar S. Y. Capecitabine in the management of colorectal cancer//Cancer Manag Res. - 2011. - T. 3. - C. 79 - 89.
162. Matsumoto S., Nishimura T., Kanai M., Mori Y., Nagayama S., Kawamura J., Nomura A., Miyamoto S., Kitano T., Ishiguro H., Yanagihara K., Teramukai S., Sakai Y., Chiba T., Fukushima M. Safety and efficacy of modified FOLFOX6 for treatment of metastatic or locally advanced colorectal cancer. A single-institution outcome study//Chemotherapy. - 2008. - T. 54, N 5. - C. 395 - 403.
163. Cassidy J., Tabernero J., Twelves C., Brunet R., Butts C., Conroy T., Debraud F., Figer A., Grossmann J., Sawada N., Schoffski P., Sobrero A., Van Cutsem E., Diaz-Rubio E. XELOX (capecitabine plus oxaliplatin): active first-line therapy for patients with metastatic colorectal cancer//J Clin Oncol. - 2004. - T. 22, N 11. - C. 2084-91.
164. Demir L., Somali I., Oktay Tarhan M., Erten C., Ellidokuz H., Can A., Dirican A., Vedat Bayoglu I. The toxicity and efficacy of Nordic-FLOX regimen as adjuvant treatment of stage III colon cancer//J BUON. - 2011. - T. 16, N 4. - C. 682-8.
165. Sorbye H., Glimelius B., Berglund A., Fokstuen T., Tveit K. M., Braendengen M., Ogreid D., Dahl O. Multicenter phase II study of Nordic fluorouracil and folinic acid bolus schedule combined with oxaliplatin as first-line treatment of metastatic colorectal cancer//J Clin Oncol. - 2004. - T. 22, N 1. - C. 31-8.
166. Трякин А.А., Бесова Н.С., Волков Н.М., Гладков О.А., Карасева В.В., Сакаева Д.Д. и соавт. Общие принципы проведения противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 1. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 28 - 41. //.
167. Moritani K., Kanemitsu Y., Shida D., Shitara K., Mizusawa J., Katayama H., Hamaguchi T., Shimada Y., Colorectal Cancer Study Group of Japan Clinical Oncology G. A randomized controlled trial comparing primary tumour resection plus chemotherapy with chemotherapy alone in incurable stage IV colorectal cancer: JCOG1007 (iPACS study)//Jpn J Clin Oncol. - 2020. - T. 50, N 1. - C. 89 - 93.
168. Kanemitsu Y., Shitara K., Mizusawa J., Hamaguchi T., Shida D., Komori K., Ikeda S., Ojima H., Ike H., Shiomi A., Watanabe J., Takii Y., Yamaguchi T., Katsumata K., Ito M., Okuda J., Hyakudomi R., Shimada Y., Katayama H., Fukuda H., Group J. C. C. S. Primary Tumor Resection Plus Chemotherapy Versus Chemotherapy Alone for Colorectal Cancer Patients With Asymptomatic, Synchronous Unresectable Metastases (JCOG1007; iPACS): A Randomized Clinical Trial//J Clin Oncol. - 2021. - T. 39, N 10. - C. 1098 - 1107.
169. Seymour M. T., Maughan T. S., Ledermann J. A., Topham C., James R., Gwyther S. J., Smith D. B., Shepherd S., Maraveyas A., Ferry D. R., Meade A. M., Thompson L., Griffiths G. O., Parmar M. K., Stephens R. J., Investigators F. T., National Cancer Research Institute Colorectal Clinical Studies G. Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial//Lancet. - 2007. - T. 370, N 9582. - C. 143 - 152.
170. Cunningham D., Sirohi B., Pluzanska A., Utracka-Hutka B., Zaluski J., Glynne-Jones R., Koralewski P., Bridgewater J., Mainwaring P., Wasan H., Wang J. Y., Szczylik C., Clingan P., Chan R. T., Tabah-Fisch I., Cassidy J. Two different first-line 5-fluorouracil regimens with or without oxaliplatin in patients with metastatic colorectal cancer//Ann Oncol. - 2009. - T. 20, N 2. - C. 244-50.
171. Ackland S. P., Jones M., Tu D., Simes J., Yuen J., Sargeant A. M., Dhillon H., Goldberg R. M., Abdi E., Shepherd L., Moore M. J. A meta-analysis of two randomised trials of early chemotherapy in asymptomatic metastatic colorectal cancer//Br J Cancer. - 2005. - T. 93, N 11. - C. 1236-43.
172. Matsuda A., Yamada T., Jamjittrong S., Shinji S., Ohta R., Sonoda H., Kamonvarapitak T., Sekiguchi K., Miyashita M., Suzuki H., Yoshida H. Comparison Between Biweekly and Weekly Cetuximab in Patients With Metastatic Colorectal Cancer: A Meta-analysis//Anticancer Res. - 2020. - T. 40, N 6. - C. 3469 - 3476.
173. Munemoto Y., Nakamura M., Takahashi M., Kotaka M., Kuroda H., Kato T., Minagawa N., Noura S., Fukunaga M., Kuramochi H., Touyama T., Takahashi T., Miwa K., Satake H., Kurosawa S., Miura T., Mishima H., Sakamoto J., Oba K., Nagata N. SAPPHIRE: a randomised phase II study of planned discontinuation or continuous treatment of oxaliplatin after six cycles of modified FOLFOX6 plus panitumumab in patients with colorectal cancer//Eur J Cancer. - 2019. - T. 119. - C. 158 - 167.
174. Modest D. P., Karthaus M., Fruehauf S., Graeven U., Muller L., Konig A. O., Fischer von Weikersthal L., Caca K., Kretzschmar A., Goekkurt E., Haas S., Kurreck A., Stahler A., Held S., Jarosch A., Horst D., Reinacher-Schick A., Kasper S., Heinemann V., Stintzing S., Trarbach T. Panitumumab Plus Fluorouracil and Folinic Acid Versus Fluorouracil and Folinic Acid Alone as Maintenance Therapy in RAS Wild-Type Metastatic Colorectal Cancer: The Randomized PANAMA Trial (AIO KRK 0212)//J Clin Oncol. - 2022. - T. 40, N 1. - C. 72 - 82.
175. Hurwitz H. I., Fehrenbacher L., Hainsworth J. D., Heim W., Berlin J., Holmgren E., Hambleton J., Novotny W. F., Kabbinavar F. Bevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer//J Clin Oncol. - 2005. - T. 23, N 15. - C. 3502-8.
176. Bendell J. C., Tournigand C., Swieboda-Sadlej A., Barone C., Wainberg Z. A., Kim J. G., Pericay C., Pastorelli D., Tarazi J., Rosbrook B., Bloom J., Ricart A. D., Kim S., Sobrero A. F. Axitinib or bevacizumab plus FOLFIRI or modified FOLFOX-6 after failure of first-line therapy for metastatic colorectal cancer: a randomized phase II study//Clin Colorectal Cancer. - 2013. - T. 12, N 4. - C. 239-47.
177. Aparicio T., Bouche O., Taieb J., Maillard E., Kirscher S., Etienne P. L., Faroux R., Khemissa Akouz F., El Hajbi F., Locher C., Rinaldi Y., Lecomte T., Lavau-Denes S., Baconnier M., Oden-Gangloff A., Genet D., Paillaud E., Retornaz F., Francois E., Bedenne L., for P. I. Bevacizumab+chemotherapy versus chemotherapy alone in elderly patients with untreated metastatic colorectal cancer: a randomized phase II trial-PRODIGE 20 study results//Ann Oncol. - 2018. - T. 29, N 1. - C. 133 - 138.
178. Obermannova R., Van Cutsem E., Yoshino T., Bodoky G., Prausova J., Garcia-Carbonero R., Ciuleanu T., Garcia Alfonso P., Portnoy D., Cohn A., Yamazaki K., Clingan P., Lonardi S., Kim T. W., Yang L., Nasroulah F., Tabernero J. Subgroup analysis in RAISE: a randomized, double-blind phase III study of irinotecan, folinic acid, and 5-fluorouracil (FOLFIRI) plus ramucirumab or placebo in patients with metastatic colorectal carcinoma progression//Ann Oncol. - 2016. - T. 27, N 11. - C. 2082 - 2090.
179. Verdaguer H., Tabernero J., Macarulla T. Ramucirumab in metastatic colorectal cancer: evidence to date and place in therapy//Ther Adv Med Oncol. - 2016. - T. 8, N 3. - C. 230-42.
180. Tabernero J., Yoshino T., Cohn A. L., Obermannova R., Bodoky G., Garcia-Carbonero R., Ciuleanu T. E., Portnoy D. C., Van Cutsem E., Grothey A., Prausova J., Garcia-Alfonso P., Yamazaki K., Clingan P. R., Lonardi S., Kim T. W., Simms L., Chang S. C., Nasroulah F., Investigators R. S. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study//Lancet Oncol. - 2015. - T. 16, N 5. - C. 499 - 508.
181. Folprecht G., Pericay C., Saunders M. P., Thomas A., Lopez Lopez R., Roh J. K., Chistyakov V., Hohler T., Kim J. S., Hofheinz R. D., Ackland S. P., Swinson D., Kopp M., Udovitsa D., Hall M., Iveson T., Vogel A., Zalcberg J. R. Oxaliplatin and 5-FU/folinic acid (modified FOLFOX6) with or without aflibercept in first-line treatment of patients with metastatic colorectal cancer: the AFFIRM study//Ann Oncol. - 2016. - T. 27, N 7. - C. 1273-9.
182. Van Cutsem E., Tabernero J., Lakomy R., Prenen H., Prausova J., Macarulla T., Ruff P., van Hazel G. A., Moiseyenko V., Ferry D., McKendrick J., Polikoff J., Tellier A., Castan R., Allegra C. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen//J Clin Oncol. - 2012. - T. 30, N 28. - C. 3499-506.
183. Cunningham D., Lang I., Marcuello E., Lorusso V., Ocvirk J., Shin D. B., Jonker D., Osborne S., Andre N., Waterkamp D., Saunders M. P., investigators A. s. Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial//Lancet Oncol. - 2013. - T. 14, N 11. - C. 1077 - 1085.
184. Alfonso P. G., Fernandez M. E., Alsar J. S., Paez D., Montes A. F., Suarez B. G., Salud A., Esteban A. Y., Espa a M. G., Declara I. M. 560MO Maintenance with 5FU/LV-Aflibercept after induction with FOLFIRI-Aflibercept vs FOLFIRI-Aflibercept until progression in older patients (pts) in 2nd line metastatic colorectal cancer (mCRC): The randomized AFEMA trial//Annals of Oncology. - 2023. - T. 34. - C. S416 - S417.
185. Koukourakis G. V., Zacharias G., Tsalafoutas J., Theodoridis D., Kouloulias V. Capecitabine for locally advanced and metastatic colorectal cancer: A review//World J Gastrointest Oncol. - 2010. - T. 2, N 8. - C. 311-21.
186. Petrioli R., Paolelli L., Marsili S., Civitelli S., Francini E., Cioppa T., Roviello F., Nettuno R., Intrivici C., Tanzini G., Lorenzi M., Francini G. FOLFOX-4 stop and go and capecitabine maintenance chemotherapy in the treatment of metastatic colorectal cancer//Oncology. - 2006. - T. 70, N 5. - C. 345-50.
187. Feliu J., Safont M. J., Salud A., Losa F., Garcia-Giron C., Bosch C., Escudero P., Lopez R., Madronal C., Bolanos M., Gil M., Llombart A., Castro-Carpeno J., Gonzalez-Baron M. Capecitabine and bevacizumab as first-line treatment in elderly patients with metastatic colorectal cancer//Br J Cancer. - 2010. - T. 102, N 10. - C. 1468-73.
188. Динаева Э.А., и др. Значение эмпегфилграстима в интенсивных режимах терапии опухолей ЖКТ. Доклад на сессии отечественные исследования в онкологии, конференции "Опухоли ЖКТ" 15 апреля 2022 г. https://www.sciencedirect.com/science/article/pii/S2468294221001623. //.
189. Falandry C., Campone M., Cartron G., Guerin D., Freyer G. Trends in G-CSF use in 990 patients after EORTC and ASCO guidelines//Eur J Cancer. - 2010. - T. 46, N 13. - C. 2389-98.
190. Aghedo B. O., Gupta V. Filgrastim //. - 2020.
191. Baraniskin A., Buchberger B., Pox C., Graeven U., Holch J. W., Schmiegel W., Heinemann V. Efficacy of bevacizumab in first-line treatment of metastatic colorectal cancer: A systematic review and meta-analysis//Eur J Cancer. - 2019. - T. 106. - C. 37 - 44.
192. Rosa B., de Jesus J. P., de Mello E. L., Cesar D., Correia M. M. Effectiveness and safety of monoclonal antibodies for metastatic colorectal cancer treatment: systematic review and meta-analysis//Ecancermedicalscience. - 2015. - T. 9. - C. 582.
193. Avallone A., Giuliani F., Nasti G., Montesarchio V., Santabarbara G., Leo S., De Stefano A., Rosati G., Lolli I., Tamburini E. Randomized intermittent or continuous panitumumab plus FOLFIRI (FOLFIRI/PANI) for first-line treatment of patients (pts) with RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC): The IMPROVE study//Book Randomized intermittent or continuous panitumumab plus FOLFIRI (FOLFIRI/PANI) for first-line treatment of patients (pts) with RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC): The IMPROVE study / EditorAmerican Society of Clinical Oncology, 2022.
194. Hijazi Y., Gondal U., Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery//Int J Surg. - 2017. - T. 39. - C. 156 - 162.
195. Gillis C., Li C., Lee L., Awasthi R., Augustin B., Gamsa A., Liberman A. S., Stein B., Charlebois P., Feldman L. S., Carli F. Prehabilitation versus rehabilitation: a randomized control trial in patients undergoing colorectal resection for cancer//Anesthesiology. - 2014. - T. 121, N 5. - C. 937-47.
196. Shitara K., Ajani J. A., Moehler M., Garrido M., Gallardo C., Shen L., Yamaguchi K., Wyrwicz L., Skoczylas T., Bragagnoli A. C., Liu T., Tehfe M., Elimova E., Bruges R., Zander T., de Azevedo S., Kowalyszyn R., Pazo-Cid R., Schenker M., Cleary J. M., Yanez P., Feeney K., Karamouzis M. V., Poulart V., Lei M., Xiao H., Kondo K., Li M., Janjigian Y. Y. Nivolumab plus chemotherapy or ipilimumab in gastro-oesophageal cancer//Nature. - 2022. - T. 603, N 7903. - C. 942 - 948.
197. Cohen R., Meurisse A., Pudlarz T., Bennouna J., Tournigand C., De La Fouchardiere C., Tougeron D., Borg C., Mazard T., Chibaudel B. One-year duration of nivolumab plus ipilimumab in patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI/dMMR) metastatic colorectal cancer (mCRC): Long-term follow-up of the GERCOR NIPICOL phase II study//Book One-year duration of nivolumab plus ipilimumab in patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI/dMMR) metastatic colorectal cancer (mCRC): Long-term follow-up of the GERCOR NIPICOL phase II study / EditorAmerican Society of Clinical Oncology, 2022.
198. Федянин М.Ю., Полянская Е.М., Трякин А.А., и др. Влияние стартовой дозы регорафениба на общую выживаемость пациентов с метастатическим раком толстой кишки: систематический обзор и метаанализ. Современная онкология 2019. Т. 21. N 3. C. 10 - 15. doi: 10.26442/18151434.2019.3.190651 //.
199. Yoshino T., Di Bartolomeo M., Raghav K., Masuishi T., Loupakis F., Kawakami H., Yamaguchi K., Nishina T., Wainberg Z., Elez E., Rodriguez J., Fakih M., Ciardiello F., Saxena K., Kobayashi K., Bako E., Okuda Y., Meinhardt G., Grothey A., Siena S., investigators D.-C. Final results of DESTINY-CRC01 investigating trastuzumab deruxtecan in patients with HER2-expressing metastatic colorectal cancer//Nat Commun. - 2023. - T. 14, N 1. - C. 3332.
200. Le D. T., Uram J. N., Wang H., Bartlett B. R., Kemberling H., Eyring A. D., Skora A. D., Luber B. S., Azad N. S., Laheru D., Biedrzycki B., Donehower R. C., Zaheer A., Fisher G. A., Crocenzi T. S., Lee J. J., Duffy S. M., Goldberg R. M., de la Chapelle A., Koshiji M., Bhaijee F., Huebner T., Hruban R. H., Wood L. D., Cuka N., Pardoll D. M., Papadopoulos N., Kinzler K. W., Zhou S., Cornish T. C., Taube J. M., Anders R. A., Eshleman J. R., Vogelstein B., Diaz L. A., Jr. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency//N Engl J Med. - 2015. - T. 372, N 26. - C. 2509-20.
201. Overman M. J., Lonardi S., Wong K. Y. M., Lenz H. J., Gelsomino F., Aglietta M., Morse M. A., Van Cutsem E., McDermott R., Hill A., Sawyer M. B., Hendlisz A., Neyns B., Svrcek M., Moss R. A., Ledeine J. M., Cao Z. A., Kamble S., Kopetz S., Andre T. Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer//J Clin Oncol. - 2018. - T. 36, N 8. - C. 773 - 779.
202. Le D. T., Kim T. W., Van Cutsem E., Geva R., Jager D., Hara H., Burge M., O'Neil B., Kavan P., Yoshino T., Guimbaud R., Taniguchi H., Elez E., Al-Batran S. E., Boland P. M., Crocenzi T., Atreya C. E., Cui Y., Dai T., Marinello P., Diaz L. A., Jr., Andre T. Phase II Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: KEYNOTE-164//J Clin Oncol. - 2020. - T. 38, N 1. - C. 11 - 19.
203. Kostek O., Hacioglu M. B., Sakin A., Demir T., Sari M., Ozkul O., Araz M., Dogan A. F., Demircan N. C., Uzunoglu S., Cicin I., Erdogan B. Regorafenib or rechallenge chemotherapy: which is more effective in the third-line treatment of metastatic colorectal cancer?//Cancer Chemother Pharmacol. - 2019. - T. 83, N 1. - C. 115 - 122.
204. Gundgaard M. G., Soerensen J. B., Ehrnrooth E. Third-line therapy for metastatic colorectal cancer//Cancer Chemother Pharmacol. - 2008. - T. 61, N 1. - C. 1 - 13.
205. Walter T., Hawkins N. S., Pollock R. F., Colaone F., Shergill S., Ross P. J. Systematic review and network meta-analyses of third-line treatments for metastatic colorectal cancer//J Cancer Res Clin Oncol. - 2020. - T. 146, N 10. - C. 2575 - 2587.
206. Cremolini C., Loupakis F., Antoniotti C., Lupi C., Sensi E., Lonardi S., Mezi S., Tomasello G., Ronzoni M., Zaniboni A., Tonini G., Carlomagno C., Allegrini G., Chiara S., D'Amico M., Granetto C., Cazzaniga M., Boni L., Fontanini G., Falcone A. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study//Lancet Oncol. - 2015. - T. 16, N 13. - C. 1306-15.
207. Федянин М.Ю., Полянская Е.М., Эльснукаева Х.Х., Трякин А.А., Покатаев И.А., Буланов А.А., Тюляндин С.А. Метаанализ исследований по сравнению эффективности режимов FOLFOXIRI и FOLFOX или FOLFIRI с таргетной терапией при метастатическом раке толстой кишки с мутацией в гене BRAF. Медицинский Совет 2020; (20): 125-132. https://doi.org/10.21518/2079-701X-2020-20-125-132 //.
208. Guo W., Zhang X., Wang Y., Zhang W., Liu X., Shen W., He Y., Zhu X., Chen Z., Wang H. Q. FOLFIRI versus irinotecan monodrug as second-line treatment in metastatic colorectal cancer patients: An open, multicenter, prospective, randomized controlled phase III clinical study//Book FOLFIRI versus irinotecan monodrug as second-line treatment in metastatic colorectal cancer patients: An open, multicenter, prospective, randomized controlled phase III clinical study / EditorAmerican Society of Clinical Oncology, 2020.
209. Wirapati P., Pomella V., Vandenbosch B., Kerr P., Maiello E., Grahame M. J., Curca R.-O. D., Karthaus M., Bridgewater J. A., Mihailov A. C. Velour trial biomarkers update: Impact of RAS, BRAF, and sidedness on aflibercept activity//Annals of Oncology. - 2017. - T. 28. - C. iii151 - iii152.
210. Kopetz S., Guthrie K. A., Morris V. K., Lenz H. J., Magliocco A. M., Maru D., Yan Y., Lanman R., Manyam G., Hong D. S., Sorokin A., Atreya C. E., Diaz L. A., Allegra C., Raghav K. P., Wang S. E., Lieu C. H., McDonough S. L., Philip P. A., Hochster H. S. Randomized Trial of Irinotecan and Cetuximab With or Without Vemurafenib in BRAF-Mutant Metastatic Colorectal Cancer (SWOG S1406)//J Clin Oncol. - 2021. - T. 39, N 4. - C. 285 - 294.
211. Bekaii-Saab T. S., Ou F. S., Ahn D. H., Boland P. M., Ciombor K. K., Heying E. N., Dockter T. J., Jacobs N. L., Pasche B. C., Cleary J. M., Meyers J. P., Desnoyers R. J., McCune J. S., Pedersen K., Barzi A., Chiorean E. G., Sloan J., Lacouture M. E., Lenz H. J., Grothey A. Regorafenib dose-optimisation in patients with refractory metastatic colorectal cancer (ReDOS): a randomised, multicentre, open-label, phase 2 study//Lancet Oncol. - 2019. - T. 20, N 8. - C. 1070 - 1082.
212. Trullas A., Delgado J., Genazzani A., Mueller-Berghaus J., Migali C., Muller-Egert S., Zander H., Enzmann H., Pignatti F. The EMA assessment of pembrolizumab as monotherapy for the first-line treatment of adult patients with metastatic microsatellite instability-high or mismatch repair deficient colorectal cancer//ESMO Open. - 2021. - T. 6, N 3. - C. 100145.
213. Freshwater T., Kondic A., Ahamadi M., Li C. H., de Greef R., de Alwis D., Stone J. A. Evaluation of dosing strategy for pembrolizumab for oncology indications//J Immunother Cancer. - 2017. - T. 5. - C. 43.
214. Andre T., Elez E., Van Cutsem E., Jensen L. H., Bennouna J., Mendez G., Schenker M., De La Fouchardiere C., Limon M. L., Yoshino T. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): First results of the CheckMate 8HW study//Book Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): First results of the CheckMate 8HW study / EditorAmerican Society of Clinical Oncology, 2024.
215. Kanat O., Ertas H. Existing anti-angiogenic therapeutic strategies for patients with metastatic colorectal cancer progressing following first-line bevacizumab-based therapy//World J Clin Oncol. - 2019. - T. 10, N 2. - C. 52 - 61.
216. Corcoran R. B., Andre T., Atreya C. E., Schellens J. H. M., Yoshino T., Bendell J. C., Hollebecque A., McRee A. J., Siena S., Middleton G., Muro K., Gordon M. S., Tabernero J., Yaeger R., O'Dwyer P. J., Humblet Y., De Vos F., Jung A. S., Brase J. C., Jaeger S., Bettinger S., Mookerjee B., Rangwala F., Van Cutsem E. Combined BRAF, EGFR, and MEK Inhibition in Patients with BRAF(V600E)-Mutant Colorectal Cancer//Cancer Discov. - 2018. - T. 8, N 4. - C. 428 - 443.
217. Wu Z., Huang M., Gong Y., Lin C., Guo W. BRAF and EGFR inhibitors synergize to increase cytotoxic effects and decrease stem cell capacities in BRAF(V600E)-mutant colorectal cancer cells//Acta Biochim Biophys Sin (Shanghai). - 2018. - T. 50, N 4. - C. 355 - 361.
218. M. Fedyanin1, H. Elsnukaeva1, I. Demidova, et al. 448P - Efficacy of combinations of BRAF inhibitors and anti-EGFR antibodies in metastatic colorectal carcinoma (mCRC) patients with mBRAF in the real clinical practice. Annals of Oncology (2021) 32 (suppl_5): S530 - S582. doi: 10.1016/annonc/annonc698 //.
219. Yaeger R., Cercek A., O'Reilly E. M., Reidy D. L., Kemeny N., Wolinsky T., Capanu M., Gollub M. J., Rosen N., Berger M. F., Lacouture M. E., Vakiani E., Saltz L. B. Pilot trial of combined BRAF and EGFR inhibition in BRAF-mutant metastatic colorectal cancer patients//Clin Cancer Res. - 2015. - T. 21, N 6. - C. 1313-20.
220. Hyman D. M., Puzanov I., Subbiah V., Faris J. E., Chau I., Blay J. Y., Wolf J., Raje N. S., Diamond E. L., Hollebecque A., Gervais R., Elez-Fernandez M. E., Italiano A., Hofheinz R. D., Hidalgo M., Chan E., Schuler M., Lasserre S. F., Makrutzki M., Sirzen F., Veronese M. L., Tabernero J., Baselga J. Vemurafenib in Multiple Nonmelanoma Cancers with BRAF V600 Mutations//N Engl J Med. - 2015. - T. 373, N 8. - C. 726-36.
221. Corcoran R. B., Atreya C. E., Falchook G. S., Kwak E. L., Ryan D. P., Bendell J. C., Hamid O., Messersmith W. A., Daud A., Kurzrock R., Pierobon M., Sun P., Cunningham E., Little S., Orford K., Motwani M., Bai Y., Patel K., Venook A. P., Kopetz S. Combined BRAF and MEK Inhibition With Dabrafenib and Trametinib in BRAF V600-Mutant Colorectal Cancer//J Clin Oncol. - 2015. - T. 33, N 34. - C. 4023-31.
222. Klute K. A., Rothe M., Garrett-Mayer E., Mangat P. K., Nazemzadeh R., Yost K. J., Duvivier H. L., Ahn E. R., Cannon T. L., Alese O. B., Krauss J. C., Thota R., Calfa C. J., Denlinger C. S., O'Lone R., Halabi S., Grantham G. N., Schilsky R. L. Cobimetinib Plus Vemurafenib in Patients With Colorectal Cancer With BRAF Mutations: Results From the Targeted Agent and Profiling Utilization Registry (TAPUR) Study//JCO Precis Oncol. - 2022. - T. 6. - C. e2200191.
223. Chen Y., Li X., Yuxin M., Hu H., Wang L., Zhang Z., Chen P., Liu Y., Lu J., Lin T. Phase Ib study of dabrafenib, trametinib, irinotecan and cetuximab in BRAF V600E-mutated metastatic colorectal cancer//Book Phase Ib study of dabrafenib, trametinib, irinotecan and cetuximab in BRAF V600E-mutated metastatic colorectal cancer / EditorAmerican Society of Clinical Oncology, 2023.
224. Piringer G., Decker J., Trommet V., K hr T., Heibl S., D rfler K., Thaler J. Ongoing complete response after treatment cessation with dabrafenib, trametinib, and cetuximab as third-line treatment in a patient with advanced BRAFV600E mutated, microsatellite-stable colon cancer: a case report and literature review//Frontiers in Oncology. - 2023. - T. 13. - C. 1166545.
225. Messersmith W. A. NCCN Guidelines Updates: Management of Metastatic Colorectal Cancer//J Natl Compr Canc Netw. - 2019. - T. 17, N 5.5. - C. 599 - 601.
226. Zaanan A., Dabout V., Garinet S., Giraud D., Perkins G., Taieb J., Gallois C. Encorafenib, binimetinib and cetuximab in BRAF V600E-mutated advanced pancreatic adenocarcinoma//ESMO Open. - 2024. - T. 9, N 11. - C. 103975.
227. Van Cutsem E., Taieb J., Yaeger R., Yoshino T., Grothey A., Maiello E., Elez E., Dekervel J., Ross P., Ruiz-Casado A., Graham J., Kato T., Ruffinelli J. C., Andre T., Carriere Roussel E., Klauck I., Groc M., Vedovato J. C., Tabernero J. ANCHOR CRC: Results From a Single-Arm, Phase II Study of Encorafenib Plus Binimetinib and Cetuximab in Previously Untreated BRAF(V600E)-Mutant Metastatic Colorectal Cancer//J Clin Oncol. - 2023. - T. 41, N 14. - C. 2628 - 2637.
228. Kopetz S., Grothey A., Yaeger R., Van Cutsem E., Desai J., Yoshino T., Wasan H., Ciardiello F., Loupakis F., Hong Y. S. Encorafenib, binimetinib, and cetuximab in BRAF V600E-mutated colorectal cancer//New England Journal of Medicine. - 2019. - T. 381, N 17. - C. 1632 - 1643.
229. Capalbo C., Marchetti P., Coppa A., Calogero A., Anastasi E., Buffone A., Belardinilli F., Gulino M., Frati P., Catalano C., Cortesi E., Giannini G., Gulino A. Vemurafenib and panitumumab combination tailored therapy in BRAF-mutated metastatic colorectal cancer: a case report//Cancer Biol Ther. - 2014. - T. 15, N 7. - C. 826-31.
230. Fox D. A., Bhamidipati D., Kopetz S., Hong D. S. Durable Remission After Targeted Therapy in BRAF V600E-Mutant Metastatic Colorectal Cancer: Case Report//J Immunother Precis Oncol. - 2025. - T. 8, N 1. - C. 11 - 14.
231. Benson AB, Venook AP, Al-Hawary MM, Azad N, Chen YJ, Ciombor KK, Cohen S, Cooper HS, Deming D, Garrido-Laguna I, Grem JL. Rectal cancer, version 1.2025, NCCN clinical practice guidelines in oncology. https://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf //.
232. Tabernero J., Yoshino T., Kim T., Yaeger R., Desai J., Wasan H., Van Cutsem E., Ciardiello F., Maughan T., Eng C. LBA26 BREAKWATER safety lead-in (SLI): Encorafenib (E)+ cetuximab (C)+ chemotherapy (chemo) for BRAFV600E metastatic colorectal cancer (mCRC)//Annals of Oncology. - 2022. - T. 33. - C. S1392 - S1393.
233. Wang Z., Qin B. D., Ye C. Y., Wang M. M., Yuan L. Y., Dai W. P., Sun L., Liu K., Qin W. X., Jiao X. D., Li X. N., Zang Y. S. Cetuximab and vemurafenib plus FOLFIRI (5-fluorouracil/leucovorin/irinotecan) for BRAF V600E-mutated advanced colorectal cancer (IMPROVEMENT): An open-label, single-arm, phase II trial//Eur J Cancer. - 2022. - T. 163. - C. 152 - 162.
234. Bayraktar B., Ozemir I. A., Kefeli U., Demiral G., Sagiroglu J., Bayraktar O., Adali G., Ozcelik A., Tortum O. B. Colorectal stenting for palliation and as a bridge to surgery: A 5-year follow-up study//World J Gastroenterol. - 2015. - T. 21, N 31. - C. 9373-9.
235. Cameron M. G., Kersten C., Vistad I., Fossa S., Guren M. G. Palliative pelvic radiotherapy of symptomatic incurable rectal cancer - a systematic review//Acta Oncol. - 2014. - T. 53, N 2. - C. 164-73.
236. Costi R., Leonardi F., Zanoni D., Violi V., Roncoroni L. Palliative care and end-stage colorectal cancer management: the surgeon meets the oncologist//World J Gastroenterol. - 2014. - T. 20, N 24. - C. 7602-21.
237. Navari R. M., Qin R., Ruddy K. J., Liu H., Powell S. F., Bajaj M., Dietrich L., Biggs D., Lafky J. M., Loprinzi C. L. Olanzapine for the Prevention of Chemotherapy-Induced Nausea and Vomiting//N Engl J Med. - 2016. - T. 375, N 2. - C. 134-42.
238. Piechotta V., Adams A., Haque M., Scheckel B., Kreuzberger N., Monsef I., Jordan K., Kuhr K., Skoetz N. Antiemetics for adults for prevention of nausea and vomiting caused by moderately or highly emetogenic chemotherapy: a network meta-analysis//Cochrane Database Syst Rev. - 2021. - T. 11, N 11. - C. CD012775.
239. Владимирова Л.Ю., Гладков О.А., Королева И.А., Румянцев А.А., Семиглазова Т.Ю., Трякин А.А., Кутукова С.И., Овчинникова Е.Г., Новикова О.Ю., Корниецкая А.Л. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=nausea_vomiting //.
240. Chen C., Li R., Yang T., Ma L., Zhou S., Li M., Zhou Y., Cui Y. Denosumab Versus Zoledronic Acid in the Prevention of Skeletal-related Events in Vulnerable Cancer Patients: A Meta-analysis of Randomized, Controlled Trials//Clin Ther. - 2020. - T. 42, N 8. - C. 1494 - 1507 e1.
241. Багрова С.Г., Басин Е.М., Борзов К.А., Бычкова Н.М., Деньгина Н.В., Копп М.В., Крылов В.В., Кочетова Т.Ю., Семиглазова Т.Ю. Профилактика и лечение патологии костной ткани при злокачественных новообразованиях. Практические рекомендации RUSSCO, часть 2. //.
242. Krishan S., Panditaratne N., Verma R., Robertson R. Incremental value of CT venography combined with pulmonary CT angiography for the detection of thromboembolic disease: systematic review and meta-analysis//AJR Am J Roentgenol. - 2011. - T. 196, N 5. - C. 1065-72.
243. Samaranayake C. B., Anderson J., McCabe C., Zahir S. F., J W. U., Keir G. Direct oral anticoagulants for cancer-associated venous thromboembolisms: a systematic review and network meta-analysis//Intern Med J. - 2022. - T. 52, N 2. - C. 272 - 281.
244. Knoll W., Fergusson N., Ivankovic V., Wang T. F., Caiano L., Auer R., Carrier M. Extended thromboprophylaxis following major abdominal/pelvic cancer-related surgery: A systematic review and meta-analysis of the literature//Thromb Res. - 2021. - T. 204. - C. 114 - 122.
245. Сомонова О.В., Антух Э.А., Варданян А.В., Громова Е.Г., Долгушин Б.И., Елизарова А.Л., Сакаева Д.Д., Сельчук В.Ю., Трякин А.А., Черкасов В.А. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=thromboembolism //.
246. NCCN Guidelines. Prevention and Treatment of Cancer-Related Infections. v.1, 2021. https://www.nccn.org/professionals/physician_gls/pdf/infections.pdf. //.
247. Kosaka Y., Rai Y., Masuda N., Takano T., Saeki T., Nakamura S., Shimazaki R., Ito Y., Tokuda Y., Tamura K. Phase III placebo-controlled, double-blind, randomized trial of pegfilgrastim to reduce the risk of febrile neutropenia in breast cancer patients receiving docetaxel/cyclophosphamide chemotherapy//Support Care Cancer. - 2015. - T. 23, N 4. - C. 1137-43.
248. Paul M., Yahav D., Fraser A., Leibovici L. Empirical antibiotic monotherapy for febrile neutropenia: systematic review and meta-analysis of randomized controlled trials//J Antimicrob Chemother. - 2006. - T. 57, N 2. - C. 176-89.
249. Сакаева Д.Д., Борисов К.Е., Булавина И.С., Когония Л.М., Курмуков И.А., Орлова Р.В., Шабаева М.М. Практические рекомендации по диагностике и лечению фебрильной нейтропении. Практические рекомендации RUSSCO, часть 2. //.
250. Vincenzi B., Russo A., Terenzio A., Galvano A., Santini D., Vorini F., Antonelli-Incalzi R., Vespasiani-Gentilucci U., Tonini G. The use of SAMe in chemotherapy-induced liver injury//Crit Rev Oncol Hematol. - 2018. - T. 130. - C. 70 - 77.
251. Remash D., Prince D. S., McKenzie C., Strasser S. I., Kao S., Liu K. Immune checkpoint inhibitor-related hepatotoxicity: A review//World J Gastroenterol. - 2021. - T. 27, N 32. - C. 5376 - 5391.
252. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Практические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией. Практические рекомендации RUSSCO, часть 2. //.
253. Mao Z., Shen K., Zhu L., Xu M., Yu F., Xue D., Li H., Xue C. Comparisons of Cardiotoxicity and Efficacy of Anthracycline-Based Therapies in Breast Cancer: A Network Meta-Analysis of Randomized Clinical Trials//Oncol Res Treat. - 2019. - T. 42, N 7-8. - C. 405 - 413.
254. Albakri A. Systolic heart failure: A review of clinical status and meta-analysis of diagnosis and clinical management methods//Trends in Research. - 2018. - T. 1, N 4.
255. Tromp J., Ouwerkerk W., van Veldhuisen D. J., Hillege H. L., Richards A. M., van der Meer P., Anand I. S., Lam C. S. P., Voors A. A. A Systematic Review and Network Meta-Analysis of Pharmacological Treatment of Heart Failure With Reduced Ejection Fraction//JACC Heart Fail. - 2022. - T. 10, N 2. - C. 73 - 84.
256. Kalam K., Marwick T. H. Role of cardioprotective therapy for prevention of cardiotoxicity with chemotherapy: a systematic review and meta-analysis//Eur J Cancer. - 2013. - T. 49, N 13. - C. 2900-9.
257. Виценя М.В., Агеев Ф.Т., Орлова Р.В., Полтавская М.Г., Потиевская В.И. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 2 //.
258. Li J., Yan H. Skin toxicity with anti-EGFR monoclonal antibody in cancer patients: a meta-analysis of 65 randomized controlled trials//Cancer Chemother Pharmacol. - 2018. - T. 82, N 4. - C. 571 - 583.
259. Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Когония Л.М., Круглова Л.С., Орлова Е.В., Орлова Р.В. Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию. Практические рекомендации RUSSCO, часть 2. https://rosoncoweb.ru/standarts/?chapter=dermatological_reactions //.
260. Martin E. J., Bruggeman A. R., Nalawade V. V., Sarkar R. R., Qiao E. M., Rose B. S., Murphy J. D. Palliative Radiotherapy Versus Esophageal Stent Placement in the Management of Patients With Metastatic Esophageal Cancer//J Natl Compr Canc Netw. - 2020. - T. 18, N 5. - C. 569 - 574.
261. de van der Schueren M. A. E., Laviano A., Blanchard H., Jourdan M., Arends J., Baracos V. E. Systematic review and meta-analysis of the evidence for oral nutritional intervention on nutritional and clinical outcomes during chemo(radio)therapy: current evidence and guidance for design of future trials//Ann Oncol. - 2018. - T. 29, N 5. - C. 1141 - 1153.
262. Сытов А.В., Зузов С.А., Кукош М.Ю., Лейдерман И.Н., Обухова О.А., Потапов А.Л., Хотеев А.Ж. Практические рекомендации по нутритивной поддержке онкологических больных. Практические рекомендации RUSSCO, часть 2. //.
263. Perazella M. A. Onco-nephrology: renal toxicities of chemotherapeutic agents//Clin J Am Soc Nephrol. - 2012. - T. 7, N 10. - C. 1713-21.
264. Li H., Xu J., Bai Y., Zhang S., Cheng M., Jin J. Nephrotoxicity in patients with solid tumors treated with anti-PD-1/PD-L1 monoclonal antibodies: a systematic review and meta-analysis//Invest New Drugs. - 2021. - T. 39, N 3. - C. 860 - 870.
265. Li S., He X., Ruan L., Ye T., Wen Y., Song Z., Hu S., Chen Y., Peng B., Li S. Protective Effect of Mannitol on Cisplatin-Induced Nephrotoxicity: A Systematic Review and Meta-Analysis//Front Oncol. - 2021. - T. 11. - C. 804685.
266. Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Практические рекомендации RUSSCO, часть 2. //.
267. NCCN guidelines.. Management of Immunotherapy-Related Toxicities. Version 4, 2021. https://www.nccn.org/professionals/physician_gls/pdf/immunotherapy.pdf. //.
268. Johnson D. H., Zobniw C. M., Trinh V. A., Ma J., Bassett R. L., Jr., Abdel-Wahab N., Anderson J., Davis J. E., Joseph J., Uemura M., Noman A., Abu-Sbeih H., Yee C., Amaria R., Patel S., Tawbi H., Glitza I. C., Davies M. A., Wong M. K., Woodman S., Hwu W. J., Hwu P., Wang Y., Diab A. Infliximab associated with faster symptom resolution compared with corticosteroids alone for the management of immune-related enterocolitis//J Immunother Cancer. - 2018. - T. 6, N 1. - C. 103.
269. De Velasco G., Je Y., Bosse D., Awad M. M., Ott P. A., Moreira R. B., Schutz F., Bellmunt J., Sonpavde G. P., Hodi F. S., Choueiri T. K. Comprehensive Meta-analysis of Key Immune-Related Adverse Events from CTLA-4 and PD-1/PD-L1 Inhibitors in Cancer Patients//Cancer Immunol Res. - 2017. - T. 5, N 4. - C. 312 - 318.
270. Zhang H., Li X., Huang X., Li J., Ma H., Zeng R. Impact of corticosteroid use on outcomes of non-small-cell lung cancer patients treated with immune checkpoint inhibitors: A systematic review and meta-analysis//J Clin Pharm Ther. - 2021. - T. 46, N 4. - C. 927 - 935.
271. Проценко С.А., Баллюзек М.Ф., Васильев Д.А., Жукова Н.В., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Харкевич Г.Ю., Юдин Д.И. Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями. Практические рекомендации RUSSCO, часть 2. //.
272. Bossi P., Antonuzzo A., Cherny N. I., Rosengarten O., Pernot S., Trippa F., Schuler U., Snegovoy A., Jordan K., Ripamonti C. I., Committee E. G. Diarrhoea in adult cancer patients: ESMO Clinical Practice Guidelines//Ann Oncol. - 2018. - T. 29, N Suppl 4. - C. iv126 - iv142.
273. Peterson D. E., Bensadoun R. J., Roila F., Group E. G. W. Management of oral and gastrointestinal mucositis: ESMO Clinical Practice Guidelines//Ann Oncol. - 2010. - T. 21 Suppl 5. - C. v261-5.
274. Семиглазова Т.Ю., Беляк Н.П., Владимирова Л.Ю., Корниецкая А.Л., Королева И.А., Нечаева М.Н., Раджабова З.А., Телетаева Г.М., Ткаченко Е.В. Практические рекомендации по лечению и профилактике мукозитов. Практические рекомендации RUSSCO, часть 2. //.
275. Ohashi Y., Uemura Y., Fujisaka Y., Sugiyama T., Ohmatsu H., Katsumata N., Okamoto R., Saijo N., Hotta T. Meta-analysis of epoetin beta and darbepoetin alfa treatment for chemotherapy-induced anemia and mortality: Inpidual patient data from Japanese randomized, placebo-controlled trials//Cancer Sci. - 2013. - T. 104, N 4. - C. 481-5.
276. Gafter-Gvili A., Rozen-Zvi B., Vidal L., Leibovici L., Vansteenkiste J., Gafter U., Shpilberg O. Intravenous iron supplementation for the treatment of chemotherapy-induced anaemia - systematic review and meta-analysis of randomised controlled trials//Acta Oncol. - 2013. - T. 52, N 1. - C. 18 - 29.
277. Орлова Р.В., Гладков О.А., Кутукова С.И., Копп М.В., Королева И.А., Ларионова В.Б., Моисеенко В.М., Поддубная И.В., Птушкин В.В. Практические рекомендации по лечению анемии при злокачественных новообразованиях. Практические рекомендации RUSSCO, часть 2. //.
278. Zhang F., Shen A., Jin Y., Qiang W. The management strategies of cancer-associated anorexia: a critical appraisal of systematic reviews//BMC Complement Altern Med. - 2018. - T. 18, N 1. - C. 236.
279. Сытов А.В., Зузов С.А., Кукош М.Ю., Лейдерман И.Н., Потапов А.Л., Хотеев А.Ж. Практические рекомендации по лечению синдрома анорексии-кахексии у онкологических больных. Практические рекомендации RUSSCO, часть 2. //.
280. Yeow M., Soh S., Yap R., Tay D., Low Y. F., Goh S. S. N., Yeo C. S., Lo Z. J. A systematic review and network meta-analysis of randomized controlled trials on choice of central venous access device for delivery of chemotherapy//J Vasc Surg Venous Lymphat Disord. - 2022. - T. 10, N 5. - C. 1184 - 1191 e8.
281. Исянгулова А.З., Шин А.Р., Петкау В.В. Центральный венозный доступ. Практические рекомендации RUSSCO, часть 2. //.
282. Kreidieh F. Y., Moukadem H. A., El Saghir N. S. Overview, prevention and management of chemotherapy extravasation//World J Clin Oncol. - 2016. - T. 7, N 1. - C. 87 - 97.
283. Буйденок Ю.В., Обухова О.А. Рекомендации по профилактике и лечению последствий экстравазации противоопухолевых препаратов. Практические рекомендации RUSSCO, часть 2. //.
284. Zielinska A., Wlodarczyk M., Makaro A., Salaga M., Fichna J. Management of pain in colorectal cancer patients//Crit Rev Oncol Hematol. - 2021. - T. 157. - C. 103122.
285. Когония Л.М., Новиков Г.А., Орлова Р.В., Сидоров А.В., Королева И.А., Сакаева Д.Д. Практические рекомендации по лечению хронического болевого синдрома у взрослых онкологических больных. Практические рекомендации RUSSCO, часть 2. //.
286. Rosello S., Blasco I., Garcia Fabregat L., Cervantes A., Jordan K., Committee E. G. Management of infusion reactions to systemic anticancer therapy: ESMO Clinical Practice Guidelines//Ann Oncol. - 2017. - T. 28, N suppl_4. - C. iv100 - iv118.
287. Орлова Р.В., Жабина А.С., Иванова А.К., Наталенко К.Е., Телетаева Г.М. Практические рекомендации по лечению инфузионных реакций при проведении противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 2. //.
288. Mustafayev K., Torres H. Hepatitis B virus and hepatitis C virus reactivation in cancer patients receiving novel anticancer therapies//Clin Microbiol Infect. - 2022. - T. 28, N 10. - C. 1321 - 1327.
289. Феоктистова П.С., Винницкая Е.В., Нурмухаметова Е.А., Тихонов И.Н. Практические рекомендации по профилактике и лечению реактивации/обострения хронических вирусных гепатитов у пациентов, получающих противоопухолевую терапию. Практические рекомендации RUSSCO, часть 2. //.
290. Alberti P., Salvalaggio A., Argyriou A. A., Bruna J., Visentin A., Cavaletti G., Briani C. Neurological Complications of Conventional and Novel Anticancer Treatments//Cancers (Basel). - 2022. - T. 14, N 24.
291. Латипова Д.Х., Андреев В.В., Маслова Д.А., Новик А.В., Проценко С.А. Неврологические осложнения противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 2. //.
292. Deli T., Orosz M., Jakab A. Hormone Replacement Therapy in Cancer Survivors - Review of the Literature//Pathol Oncol Res. - 2020. - T. 26, N 1. - C. 63 - 78.
293. Hoel D. G., Berwick M., de Gruijl F. R., Holick M. F. The risks and benefits of sun exposure 2016//Dermatoendocrinol. - 2016. - T. 8, N 1. - C. e1248325.
294. Maltser S., Cristian A., Silver J. K., Morris G. S., Stout N. L. A Focused Review of Safety Considerations in Cancer Rehabilitation//PM R. - 2017. - T. 9, N 9S2. - C. S415 - S428.
295. Derksen J. W. G., Beijer S., Koopman M., Verkooijen H. M., van de Poll-Franse L. V., May A. M. Monitoring potentially modifiable lifestyle factors in cancer survivors: A narrative review on currently available methodologies and innovations for large-scale surveillance//Eur J Cancer. - 2018. - T. 103. - C. 327 - 340.
296. Arem H., Loftfield E. Cancer Epidemiology: A Survey of Modifiable Risk Factors for Prevention and Survivorship//Am J Lifestyle Med. - 2018. - T. 12, N 3. - C. 200 - 210.
297. Vijayvergia N., Denlinger C. S. Lifestyle Factors in Cancer Survivorship: Where We Are and Where We Are Headed//J Pers Med. - 2015. - T. 5, N 3. - C. 243-63.
298. Serfaty D. Update on the contraceptive contraindications//J Gynecol Obstet Hum Reprod. - 2019. - T. 48, N 5. - C. 297 - 307.
299. Silver J. K., Baima J. Cancer prehabilitation: an opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes//Am J Phys Med Rehabil. - 2013. - T. 92, N 8. - C. 715-27.
300. Greer N. L., Gunnar W. P., Dahm P., Lee A. E., MacDonald R., Shaukat A., Sultan S., Wilt T. J. Enhanced Recovery Protocols for Adults Undergoing Colorectal Surgery: A Systematic Review and Meta-analysis//Dis Colon Rectum. - 2018. - T. 61, N 9. - C. 1108 - 1118.
301. Tsimopoulou I., Pasquali S., Howard R., Desai A., Gourevitch D., Tolosa I., Vohra R. Psychological Prehabilitation Before Cancer Surgery: A Systematic Review//Ann Surg Oncol. - 2015. - T. 22, N 13. - C. 4117-23.
302. Li P., Fang F., Cai J. X., Tang D., Li Q. G., Wang D. R. Fast-track rehabilitation vs conventional care in laparoscopic colorectal resection for colorectal malignancy: a meta-analysis//World J Gastroenterol. - 2013. - T. 19, N 47. - C. 9119-26.
303. Wren S. M., Martin M., Yoon J. K., Bech F. Postoperative pneumonia-prevention program for the inpatient surgical ward//J Am Coll Surg. - 2010. - T. 210, N 4. - C. 491-5.
304. de Almeida E. P. M., de Almeida J. P., Landoni G., Galas F., Fukushima J. T., Fominskiy E., de Brito C. M. M., Cavichio L. B. L., de Almeida L. A. A., Ribeiro U., Jr., Osawa E. A., Diz M. P., Cecatto R. B., Battistella L. R., Hajjar L. A. Early mobilization programme improves functional capacity after major abdominal cancer surgery: a randomized controlled trial//Br J Anaesth. - 2017. - T. 119, N 5. - C. 900 - 907.
305. Visser W. S., Te Riele W. W., Boerma D., van Ramshorst B., van Westreenen H. L. Pelvic floor rehabilitation to improve functional outcome after a low anterior resection: a systematic review//Ann Coloproctol. - 2014. - T. 30, N 3. - C. 109-14.
306. Efthimiadis C., Basdanis G., Zatagias A., Tzeveleki I., Kosmidis C., Karamanlis E., Harlaftis N. Manometric and clinical evaluation of patients after low anterior resection for rectal cancer//Tech Coloproctol. - 2004. - T. 8 Suppl 1. - C. s205-7.
307. Finnane A., Janda M., Hayes S. C. Review of the evidence of lymphedema treatment effect//Am J Phys Med Rehabil. - 2015. - T. 94, N 6. - C. 483-98.
308. Cheville A. L., Kollasch J., Vandenberg J., Shen T., Grothey A., Gamble G., Basford J. R. A home-based exercise program to improve function, fatigue, and sleep quality in patients with Stage IV lung and colorectal cancer: a randomized controlled trial//J Pain Symptom Manage. - 2013. - T. 45, N 5. - C. 811-21.
309. Jeon J., Sato K., Niedzwiecki D., Ye X., Saltz L. B., Mayer R. J., Mowat R. B., Whittom R., Hantel A., Benson A., Wigler D. S., Atienza D., Messino M., Kindler H., Venook A., Fuchs C. S., Meyerhardt J. A. Impact of physical activity after cancer diagnosis on survival in patients with recurrent colon cancer: Findings from CALGB 89803/Alliance//Clin Colorectal Cancer. - 2013. - T. 12, N 4. - C. 233-8.
310. Mosher C. E., Winger J. G., Given B. A., Helft P. R., O'Neil B. H. Mental health outcomes during colorectal cancer survivorship: a review of the literature//Psychooncology. - 2016. - T. 25, N 11. - C. 1261 - 1270.
311. Mustian K. M., Alfano C. M., Heckler C., Kleckner A. S., Kleckner I. R., Leach C. R., Mohr D., Palesh O. G., Peppone L. J., Piper B. F., Scarpato J., Smith T., Sprod L. K., Miller S. M. Comparison of Pharmaceutical, Psychological, and Exercise Treatments for Cancer-Related Fatigue: A Meta-analysis//JAMA Oncol. - 2017. - T. 3, N 7. - C. 961 - 968.
312. Kinkead B., Schettler P. J., Larson E. R., Carroll D., Sharenko M., Nettles J., Edwards S. A., Miller A. H., Torres M. A., Dunlop B. W., Rakofsky J. J., Rapaport M. H. Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial//Cancer. - 2018. - T. 124, N 3. - C. 546 - 554.
313. Bensadoun R. J., Nair R. G. Low-Level Laser Therapy in the Management of Mucositis and Dermatitis Induced by Cancer Therapy//Photomed Laser Surg. - 2015. - T. 33, N 10. - C. 487-91.
314. Pita-Fernandez S., Alhayek-Ai M., Gonzalez-Martin C., Lopez-Calvino B., Seoane-Pillado T., Pertega-Diaz S. Intensive follow-up strategies improve outcomes in nonmetastatic colorectal cancer patients after curative surgery: a systematic review and meta-analysis//Ann Oncol. - 2015. - T. 26, N 4. - C. 644 - 656.
315. Jeffery M., Hickey B. E., Hider P. N. Follow-up strategies for patients treated for non-metastatic colorectal cancer//Cochrane Database Syst Rev. - 2007.10.1002/14651858.CD002200.pub2 N 1. - C. CD002200.
316. Lee S. L., Shin Y. R., Kim K. The added value of pelvic surveillance by MRI during postoperative follow-up of rectal cancer, with a focus on abbreviated MRI//Eur Radiol. - 2020. - T. 30, N 6. - C. 3113 - 3124.
317. Hupkens B. J. P., Maas M., Martens M. H., Deserno W., Leijtens J. W. A., Nelemans P. J., Bakers F. C. H., Lambregts D. M. J., Beets G. L., Beets-Tan R. G. H. MRI surveillance for the detection of local recurrence in rectal cancer after transanal endoscopic microsurgery//Eur Radiol. - 2017. - T. 27, N 12. - C. 4960 - 4969.
318. Jayaprakasam V. S., Alvarez J., Omer D. M., Gollub M. J., Smith J. J., Petkovska I. Watch-and-Wait Approach to Rectal Cancer: The Role of Imaging//Radiology. - 2023. - T. 307, N 1. - C. e221529.
319. Omer D. M. R., Williams H., Lin S. T., Thompson H. M., Verheij F. S., Yuval J. B., Buckley J. T., Qin L.-X., Gollub M. J., Garcia-Aguilar J. Diagnostic performance of endoscopy and MRI in identifying true response among patients with rectal cancer treated with total neoadjuvant therapy and selective watch and wait or TME//Book Diagnostic performance of endoscopy and MRI in identifying true response among patients with rectal cancer treated with total neoadjuvant therapy and selective watch and wait or TME / EditorAmerican Society of Clinical Oncology, 2024.
320. Федянин М.Ю., Гладков О.А., Гордеев С.С., Карачун А.М., Козлов Н.А., Мамедли З.З., Рыков И.В., Трякин А.А., Цуканов А.С., Черных М.В.. Рак ободочной кишки, ректосигмоидного соединения и прямой кишки. Практические рекомендации RUSSCO, часть 1.1. Злокачественные опухоли 2024; 14(3s2): 263-322. https://rosoncoweb.ru/standarts/RUSSCO/2024/2024-1_1-14.pdf
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Мамедли З.З., д.м.н., заведующий отделением хирургического отделения N 3 (колопроктологии) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
2. Гордеев С.С., д.м.н., доцент, ведущий научный сотрудник хирургического отделения N 3 (колопроктологии), заведующий отделом планирования и координации научных исследований ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
3. Федянин М.Ю., д.м.н., старший научный сотрудник отделения противоопухолевой лекарственной терапии N 2 отдела лекарственной терапии НИИ клинической онкологии им. академика РАН и РАМН Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России; руководитель службы химиотерапевтического лечения ГБУЗ "ММКЦ Коммунарка" ДЗ г. Москвы; заведующий кафедрой онкологии ФГБУ "Национальный медико-хирургический центр им. Н.И. Пирогова" Минздрава России.
4. Ачкасов С.И., д.м.н., профессор, директор ФГБУ "НМИЦ колопроктологии им. А.Н. Рыжих" Минздрава России.
5. Белохвостова А.С., к.м.н., заведующий отделением противоопухолевой лекарственной терапии МРНЦ им. А. Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России, доцент кафедры радионуклидной медицины ИАТЭ НИЯУ МИФИ.
6. Березовская Т.П., д.м.н., профессор, главный научный сотрудник отделения лучевой диагностики МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
7. Болотина Л.В., д.м.н., профессор РАН, заведующая отделением химиотерапии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
8. Геворкян Ю.А., д.м.н., профессор, заведующий отделением абдоминальной онкологии N 2 ФГБУ "НМИЦ онкологии" Минздрава России.
9. Карачун А.М., профессор, д.м.н. заведующий хирургическим отделением абдоминальной онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, сотрудник кафедры онкологии Северо-Западного государственного медицинского университета им. И.И. Мечникова.
10. Козлов Н.А., к.м.н., врач-патологоанатом патологоанатомического отделения отдела морфологической и молекулярно-генетической диагностики опухоли ФГБУ "НМИЦ Онкологии им. Н.Н. Блохина" Минздрава России.
11. Невольских А.А., д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
12. Петров К.С., к.м.н., врач-рентгенолог отделения рентгендиагностики ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
13. Рыбаков Е.Г., д.м.н., профессор РАН, руководитель отдела онкопроктологии, ФГБУ "НМИЦ колопроктологии имени А.Н. Рыжих" Минздрава России.
14. Снеговой А.В., д.м.н., заведующий отделом лекарственного лечения опухолей НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина.
15. Трякин А.А., д.м.н., профессор, зам. директора по научной работе, заведующий отделением противоопухолевой лекарственной терапии N 2 отдела лекарственной терапии НИИ клинической онкологии им. академика РАН и РАМН Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
16. Цуканов А.С., д.м.н., руководитель отдела лабораторной генетики, ФГБУ "НМИЦ колопроктологии имени А.Н. Рыжих" Минздрава России.
17. Черных М.В., к.м.н., заместитель директора по лечебной работе НИИ КиЭР, заведующий отделением радиотерапии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Блок по реабилитации
1. Мерзлякова А.М., к.м.н., врач-онколог отделения медицинской реабилитации МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ Радиологии" Минздрава России.
2. Обухова О.А., к.м.н., врач ФРМ отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Блок по организации медицинской помощи
1. Фоменко Ю.А., к.м.н., заместитель генерального директора по клинико-экспертной работе ФГБУ "НМИЦ онкологии" Минздрава России.
2. Иванов С.А., д.м.н., профессор, член-корреспондент РАН, заслуженный врач РФ, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России, главный внештатный специалист-онколог ЦФО Минздрава России.
3. Хайлова Ж.В., к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Геворкян Т.Г., заместитель директора ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
5. Комаров Ю.И., к.м.н., заместитель директора по организационно-методической работе ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
Блок по сопроводительной терапии
1. Гладков О.А., профессор, д.м.н., директор медицинского центра ООО "ЭВИМЕД".
2. Карасева В.В., д.м.н., доцент, профессор, кафедра онкологии ИНОПР ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Конфликта интересов нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1) врачи-онкологи;
2) врачи-радиологи;
3) врачи-радиотерапевты;
4) врачи-колопроктологи;
5) врачи-хирурги;
6) врачи-эндоскописты;
7) врачи-анестезиологи-реаниматологи;
8) врачи-терапевты;
9) врачи общей врачебной практики (семейной медицины);
10) врачи-генетики;
11) врачи-патологоанатомы;
12) врачи организации здравоохранения и общественного здоровья;
13) врачи-реабилитологи (специалисты по медицинской реабилитации);
14) врачи-клинические фармакологи;
15) студенты медицинских ВУЗов, ординаторы и аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме рака прямой кишки в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Индикаторы доброкачественной клинической практики (Good Practice Points - GPPs): доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей - детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка:
Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациентов раком прямой кишки.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1) клинические рекомендации Европейской ассоциации колопроктологов;
2) приказ Минздрава России от 2 апреля 2010 г. N 206н "Об утверждении Порядка оказания медицинской помощи населению с заболеваниями толстой кишки, анального канала и промежности колопроктологического профиля (с изменениями на 21 февраля 2020 г.);
3) приказ Минздрава России от 15 ноября 2012 г. N 915н "Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю "онкология".
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти в Государственном реестре лекарственных средств, размещенном на сайте Минздрава России: http://grls.rosminzdrav.ru, а также на сайте RUSSCO.
План контрольных обследований пациента после завершения лечения
Методы исследования
Сроки контрольных обследований пациента после завершения лечения
1 год
2 год
3 год
4-5 год
Далее
3 мес
6 мес
9 мес
12 мес
3 мес
6 мес
9 мес
12 мес
3 мес
6 мес
9 мес
12 мес
3 мес
6 мес
9 мес
12 мес
3 мес
6 мес
9 мес
12 мес
Прием (осмотр. консультация) врача-онколога
(сбор жалоб + физикальный осмотр)
x
x
x
x
x
x
x
x
x
x
x
x
x
Исследование уровня ракового эмбрионального антигена в крови
x
x
x
x
x
x
x
x
x
x
x
x
-
УЗИ органов брюшной полости (комплексное) и органов малого таза (комплексное)
x
x
x
x
x
x
x
x
Прицельная рентгенография органов грудной клетки
x
x
x
КТ органов грудной полости с в/в болюстным контрастированием и органов брюшной полости с в/в контрастированием
x
x
-
Колоноскопия [14]
x
x
каждые 5 лет
МРТ органов малого таза [2]
x
x
--------------------------------
[14] При выявлении полипов выполняется ежегодно; в случае если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, ее производят в течение 3 - 6 мес после резекции.
[2] МРТ малого таза может выполняться у пациентов с высоким риском рецидива, на усмотрение врача-онколога. Данное обследование не влияет на отдаленные результаты лечения
Примечание: у пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Критерии для генетического обследования пациентов с подозрением на синдром Линча
Критерии Amsterdam I
1. По крайней мере у 3 родственников присутствует гистологически верифицированный колоректальный рак, один из них - родственник первой линии.
2. Заболевание прослеживается по крайней мере в двух поколениях.
3. По крайней мере у 1 из родственников КРР диагностирован в возрасте до 50 лет.
4. Семейный аденоматозный полипоз исключен.
Критерии Amsterdam II
1. По крайней мере у 3 родственников развился рак, связанный с синдромом Линча (КРР, рак эндометрия, рак желудка, яичников, мочеточника/почечной лоханки, головного мозга, тонкой кишки, гепатобилиарного тракта и кожи (сальных желез)), один из них - родственник первой линии.
2. Заболевание прослеживается по крайней мере в двух поколениях.
3. По крайней мере у 1 из родственников связанный с синдромом Линча рак диагностирован в возрасте до 50 лет.
4. Семейный аденоматозный полипоз исключен в случаях наличия КРР.
5. Опухоли по возможности должны быть верифицированы.
Критерии Bethesda для тестирования на MSI
1. Колоректальный рак у пациента младше 50 лет.
2. Наличие синхронного, метахронного колоректального рака для другого рака, который может быть связан с синдромом Линча, вне зависимости от возраста.
3. Колоректальный рак с выявленным при гистологическом исследовании MSI у пациента в возрасте до 60 лет.
4. Колоректальный рак у одного или более родственников первой линии с заболеванием, которое может быть связано с синдромом Линча, по крайней мере один из случаев заболевания выявлен в возрасте до 50 лет.
5. Колоректальный рак у 2 или более родственников первой или второй линии с заболеваниями, которые могут быть связаны с синдромом Линча, вне зависимости от возраста.
Критерии отбора ФГБУ "ГНЦК имени А.Н. Рыжих" для российских пациентов
1. Пациент с колоректальным раком в возрасте до 43 лет.
2. Наряду с колоректальным раком еще 2 случая и более злокачественных опухолей любой локализации у самого пациента или у кровных родственников независимо от возраста.
Минимальный список мутаций генов RAS для тестирования при раке толстой кишки
Ген
Мутация
KRAS (2 экзон)
c.35G > A (p.Gly12Asp)
c.35G > T (p.Gly12Val)
c.35G > C (p.Gly12Ala)
c.34G > T (p.Gly12Cys)
c.34G > A (p.Gly12Ser)
c.34G > C (p.Gly12Arg)
c.37_38delins2 (p.Gly12Phe)
c.38G > A (p.Gly13Asp)
c.38G > C (p.Gly13Ala)
c.37G > T (p.Gly13Cys)
c.37G > A (p.Gly13Ser)
c.37G > C (p.Gly13Arg)
c.38G > T (p.Gly13Val)
KRAS (3 экзон)
c.176C > A (p.Ala59Glu)
c.176C > G p.Ala59Gly)
c.175G > T (p.Ala59Ser)
c.175G > A (p.Ala59Thr)
c.183A > C (p.Gln61His)
c.181C > G (p.Gln61Glu)
c.183A > T (p.Gln61His)
c.181C > A (p.Gln61Lys)
c.182A > T (p.Gln61Leu)
c.182A > C (p.Gln61Pro)
c.182A > G (p.Gln61Arg)
KRAS (4 экзон)
c.351A > C (p.Lys117Asn)
c.351A > T (p.Lys117Asn)
c.349A > G (p.Lys117Glu)
c.350A > G (p.Lys117Arg)
c.436G > C (p.Ala146Pro)
c.436G > A (p.Ala146Thr)
c.437C > T (p.Ala146Val)
NRAS (2 экзон)
c.34G > A (p.Gly12Ser)
c.34G > C (p.Gly12Arg)
c.34G > T (p.Gly12Cys)
c.35G > A (p.Gly12Asp)
c.35G > C (p.Gly12Ala)
c.35G > T (p.Gly12Val)
c.37G > A (p.Gly13Ser)
c.37G > C (p.Gly13Arg)
c.37G > T (p.Gly13Cys)
c.38G > A (p.Gly13Asp)
c.38G > C (p.Gly13Ala)
c.38G > T (p.Gly13Val)
NRAS (3 экзон)
c.175G > A (p.Ala59Thr)
c.176C > A (p.Ala59Asp)
c.176C > G (p.Ala59Gly)
c.175G > T (p.Ala59Ser)
c.181C > A (p.Gln61Lys)
c.181C > G (p.Gln61Glu)
c.182A > G (p.Gln61Arg)
c.182A > C (p.Gln61Pro)
c.183A > C (p.Gln61His)
c.183A > T (p.Gln61His)
c.182A > T (p.Gln61Leu)
Классификация мутаций в гене BRAF
Мутация
Класс мутации
V600 E/K/D/R/L
1
T599_V600TinsT
2
T599I/dup/V600insT
2
T599R
2
G464 A/E/V/R
2
G469 A/V/S/R/L/T170delinsAK
2
V471F
2
K499E
2
F595 L
2
L596 Q/R/S/V
2
L597 V/S/R/Q/P/K
2
I483S
2
L485 F/W
2
L485_P490delinsY
2
L505H/F
2
L525 R
2
E586K
2
Q257R
2
K601 E/N/Q/T
2
BRAF транслокации
2
A598 V/T599insV
2
N486_P490del
2
V487_P492delinsA
2
V600_K601del
2
V600_K601 D/E/N
2
V600_K602delinsE
2
V600_K602delinsDT
2
V600_S605delinsEISRWR
2
V600_W604delinsDQTDG
2
G466 E/V/R/A
3
G469 E
3
K483 M/E
3
N581 I/S/T/Y/K
3
D594 A/H/V/G/N/E/Y/F
3
G596 V/R/C
3
F595 L
3
F247 L
3
Q524 L
3
R558 Q
3
S467 L
3
T470 R
3
D287H
3
T599A
3
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
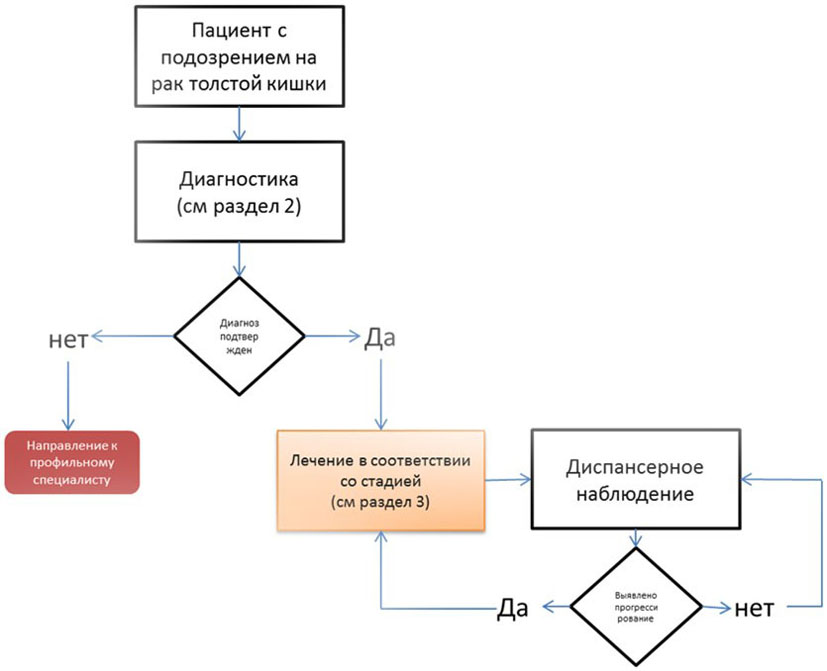
Рис. 1. Блок-схема диагностики и лечения пациента с раком толстой кишки
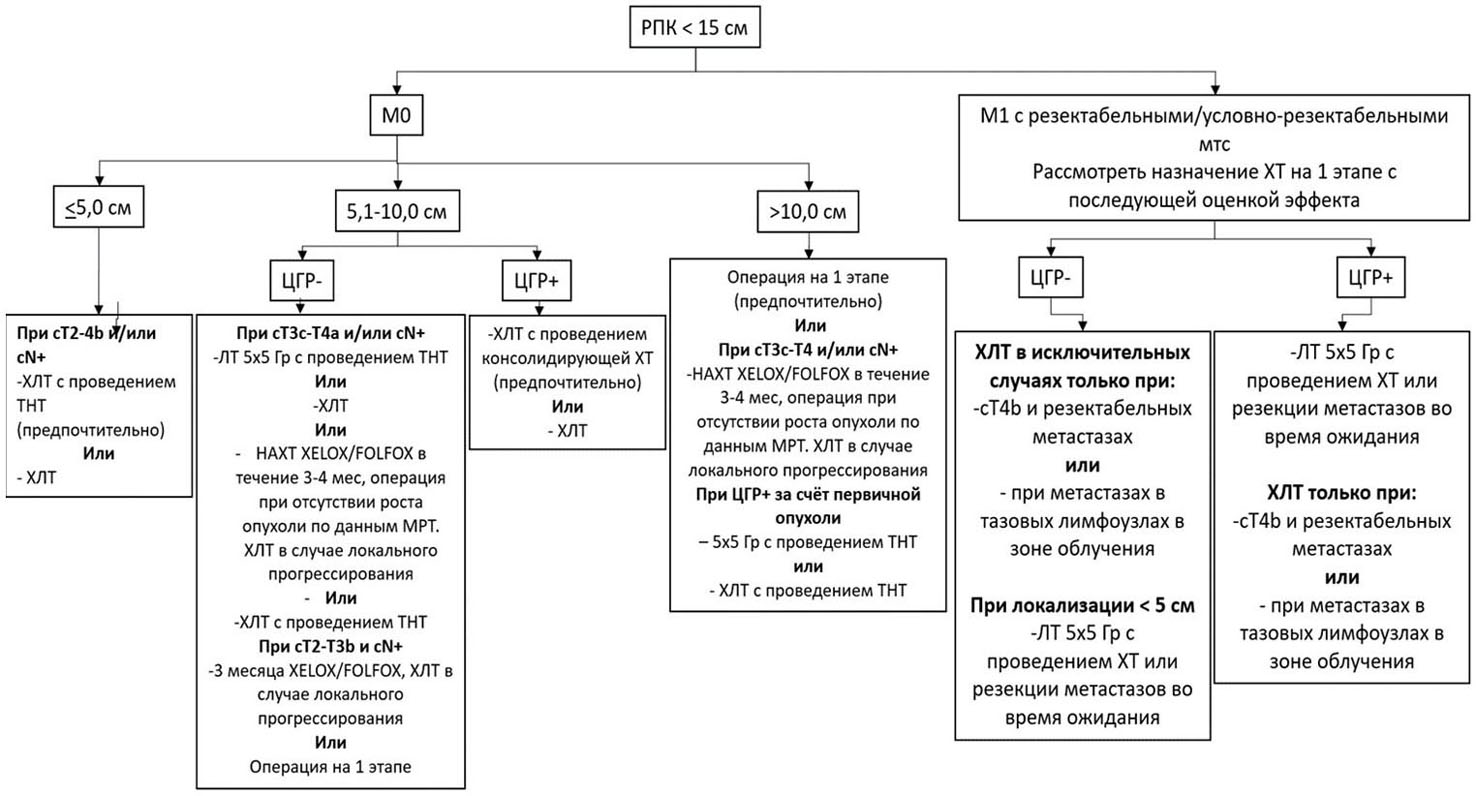
ПК - рак прямой кишки
ТНТ - тотальная неоадъювантная терапия (3 или более месяца ХТ по схеме XELOX или FOLFOX)
ЦГР - циркулярная граница резекции
ХЛТ - химиолучевая терапия (СОД 50-52 Гр)
ЛТ - лучевая терапия (РОД 5 Гр, СОД 25 Гр)
Рис. 2. Алгоритм выбора режима предоперационного лечения при раке прямой кишки
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Рекомендуется в качестве источника информации по диагностике, лечению и профилактике рака прямой кишки использовать одобренный профессиональными и пациентскими сообществами источник информации: http://www.russcpa.ru/patsientam/.
Рекомендации при осложнениях химиотерапии - связаться с врачом-онкологом.
1. При повышении температуры тела 38 °C и выше: начать прием антибиотиков: по назначению врача-онколога.
2. При стоматите:
-- диета - механическое, термическое щажение;
-- частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
-- обрабатывать полость рта по назначению врача-онколога.
3. При диарее:
-- Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
-- Принимать препараты по назначению врача-онколога.
4. При тошноте:
-- Принимать препараты по назначению врача-онколога.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status.
Оригинальная публикация: Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5(6): 649-55 [232].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Пациент не способен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу (70 - 80% по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
5
Смерть
Ключ (интерпретация): приведен в самой шкале.
Приложение Г2
ШКАЛА КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название (если есть): Karnofsky Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949: 191 - 205 [233].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Балл
Шкала Карновского
100
Состояние нормальное, жалоб нет
90
Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80
Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70
Обсуживает себя самостоятельно, неспособен к нормальной деятельности или активной работе
60
Нуждается периодически в помощи, но способен сам удовлетворять большую часть своих потребностей
50
Нуждается в значительной помощи и медицинском обслуживании
40
Инвалид, нуждается в специальной помощи, в том числе медицинской
30
Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20
Тяжелый больной. Необходимы госпитализация и активное лечение
10
Умирающий
0
Смерть
Ключ (интерпретация): приведен в самой шкале.
Приложение Г3
ВИЗУАЛЬНО-АНАЛОГОВАЯ ШКАЛА ОЦЕНКИ БОЛЕВОГО СИНДРОМА
Название на русском языке: Визуально-аналоговая шкала оценки болевого синдрома.
Оригинальное название: Visual Analog Scale for Pain (VAS Pain).
Источник (официальный сайт разработчиков, публикация с валидацией): Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken) 2011; 63(Suppl 11): S240-52 [234].
Тип: шкала оценки.
Назначение: предназначена для количественной оценки болевого синдрома с учетом субъективных ощущений больного и подбора анальгезирующей терапии.
Содержание (шаблон):
"Оцените по шкале выраженность боли, где 0 - отсутствие боли, а 10 - нестерпимая боль максимальной выраженности".
Инструкция: больному на 10-сантиметровой линии предлагается отметить степень выраженности боли по шкале от 0 до 10.
Ключ: 1 - 3 балла - слабая боль; 4 - 7 баллов - умеренная боль; 8 и более баллов - сильная боль.
Приложение Д
ТЕРМИНЫ,
ОПИСЫВАЮЩИЕ ПРОЦЕДУРЫ В КЛИНИЧЕСКОЙ РЕКОМЕНДАЦИИ И ВОЗМОЖНЫЕ
(НАИБОЛЕЕ БЛИЗКИЕ) ТЕРМИНЫ ИЗ ДЕЙСТВУЮЩЕЙ НОМЕНКЛАТУРЫ
МЕДИЦИНСКИХ УСЛУГ
Термин, встречающийся в клинической рекомендации
Виды и подвиды медицинских услуг, наиболее подходящих под термин клинической рекомендации (на основании номенклатуры медицинских услуг, утвержденной приказом от 13 октября 2017 г. N 804н МЗ РФ)
Прием (осмотр, консультация) врача-генетика первичный
B01.006.001
Прием (осмотр, консультация) врача-онколога первичный
B01.027.001
Патолого-анатомическое исследование биопсийного (операционного) материала лимфоузла
A08.06.002
Патолого-анатомическое исследование биопсийного (операционного) материала ободочной кишки
A08.19.002
Патолого-анатомическое исследование биопсийного (операционного) материала ободочной кишки с применением иммуногистохимических методов
A08.19.002.002
Патолого-анатомическое исследование белка к рецепторам HER2/neu с применением иммуногистохимических методов
A08.30.013.001
Определение амплификации гена HER2 методом флюоресцентной гибридизации in situ (FISH)
A08.30.036
Определение амплификации гена HER2 методом хромогенной гибридизации in situ (CISH)
A08.30.037
Определение мутаций в генах MLH1, MSH2, MSH6, PMS2 иммуногистохимическим методом
A08.30.040
Исследование уровня ракового эмбрионального антигена в крови
A09.05.195
Молекулярно-генетическое исследование мутаций в генах MLH1, MSH2, MSH6, PMS2 в крови
A27.05.049
Молекулярно-генетическое исследование мутаций в гене APC в крови
A27.05.050
Молекулярно-генетическое исследование мутаций в гене MYH в крови
A27.05.051
Определение микросателлитной нестабильности в биопсийном (операционном) материале методом ПЦР
A27.30.001
Молекулярно-генетическое исследование мутаций в гене KRAS в биопсийном (операционном) материале
A27.30.006
Молекулярно-генетическое исследование мутаций в гене NRAS в биопсийном (операционном) материале
A27.30.007
Молекулярно-генетическое исследование мутаций в гене BRAF в биопсийном (операционном) материале
A27.30.008
Определение полиморфизма гена DPYD методом ПЦР
A27.30.014
Определение полиморфизма гена UGT1A1
A27.30.015
Коагулограмма (ориентировочное исследование системы гемостаза)
B03.005.006
Общий (клинический) анализ крови
B03.016.002
Анализ крови биохимический общетерапевтический
B03.016.004
Видеоколоноскопия
A03.18.001.001
Ректороманоскопия
A03.19.002
Ультразвуковое исследование прямой кишки трансректальное
A04.19.001.00 1
Эндосонография толстой кишки
A03.18.001.004
Ультразвуковое исследование органов брюшной полости (комплексное)
A04.16.001
Ультразвуковое исследование забрюшинного пространства
A04.30.003
Регистрация электрокардиограммы
A05.10.006
Магнитно-резонансная томография головного мозга с контрастированием
A05.23.009.001
Магнитно-резонансная томография органов малого таза с внутривенным контрастированием
A05.30.004.001
Магнитно-резонансная томография органов малого таза
A05.30.004
Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием
A05.30.005.001
Компьютерная томография органов грудной полости
A06.09.005
Рентгенография легких
A06.09.007
Ирригоскопия
A06.18.001
Компьютерно-томографическая колоноскопия
A06.18.004
Компьютерная томография органов малого таза у женщин с контрастированием
A06.20.002.003
Компьютерная томография органов таза у мужчин с контрастированием
A06.21.003.003
Компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием
A06.30.005.003
Сцинтиграфия костей всего тела
A07.03.001.001
Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП
A07.30.043
Биопсия лимфатического узла под контролем ультразвукового исследования
A11.06.002.001
Биопсия прямой кишки эндоскопическая
A11.19.002
Суточное наблюдение врачом-анестезиологом-реаниматологом
B01.003.003
Прием (осмотр, консультация) врача-кардиолога первичный
B01.015.001
Прием (осмотр, консультация) врача-кардиолога повторный
B01.015.002
Прием (осмотр, консультация) врача-невролога первичный
B01.023.001
Прием (осмотр, консультация) врача-невролога повторный
B01.023.002
Прием (осмотр, консультация) врача-онколога повторный
B01.027.002
Ежедневный осмотр врачом-онкологом с наблюдением и уходом среднего и младшего медицинского персонала в отделении стационара
B01.027.003
Прием (осмотр, консультация) врача-эндокринолога первичный
B01.058.001
Прием (осмотр, консультация) врача-эндокринолога повторный
B01.058.002
Патолого-анатомическое исследование биопсийного (операционного) материала тканей легкого
A08.09.002
Патолого-анатомическое исследование биопсийного (операционного) материала тканей легкого с применением иммуногистохимических методов
A08.09.002.002
Патолого-анатомическое исследование биопсийного (операционного) материала печени
A08.14.001
Патолого-анатомическое исследование биопсийного (операционного) материала печени с применением иммуногистохимических методов
A08.14.001.002
Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки
A08.19.001
Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки с применением иммуногистохимических методов
A08.19.001.002
Патолого-анатомическое исследование биопсийного (операционного) материала брюшины
A08.30.012
Патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов
A08.30.013
Коагулограмма (ориентировочное исследование системы гемостаза)
B03.005.006
Общий (клинический) анализ крови
B03.016.002
Анализ крови биохимический общетерапевтический
B03.016.004
Эхокардиография
A04.10.002
Ультразвуковая допплерография вен нижних конечностей
A04.12.002.002
Регистрация электрокардиограммы
A05.10.006
Холтеровское мониторирование сердечного ритма
A05.10.008
Исследование неспровоцированных дыхательных объемов и потоков
A12.09.001
Эндоскопическая резекция слизистой толстой кишки
A03.18.002
Биопсия печени при помощи лапароскопии
A11.14.003
Биопсия брюшины
A11.30.007
Удаление новообразования легкого (атипичная резекция) видеоторакоскопическое
A16.09.013.006
Резекция печени атипичная
A16.14.030
Резекция сегмента (сегментов) печени
A16.14.034
Гемигепатэктомия
A16.14.036
Радиочастотная абляция, термоабляция, криодеструкция опухолей печени
A16.14.037
Илеостомия
A16.17.007
Колостомия
A16.18.007
Экстирпация прямой кишки
A16.19.020
Экстирпация прямой кишки с использованием видеоэндоскопических технологий
A16.19.020.002
Расширенная комбинированная брюшно-промежностная экстирпация прямой кишки
A16.19.020.003
Резекция прямой кишки
A16.19.021
Резекция прямой кишки передняя с использованием видеоэндоскопических технологий
A16.19.021.003
Резекция прямой кишки передняя низкая
A16.19.021.005
Комбинированная резекция прямой кишки с резекцией соседних органов
A16.19.021.01
Микрохирургия при новообразованиях прямой кишки эндоскопическая
A16.19.025
Эндоскопическое стентирование при опухолевом стенозе
A16.30.037
Лапароскопия диагностическая
A16.30.079
Диспансерный прием (осмотр, консультация) врача-онколога
B04.027.001
Дозиметрическое планирование лучевой терапии
A07.30.020
Топографическое и топометрическое планирование лучевой терапии
A07.30.044
Дистанционная лучевая терапия опухолей сигмовидной кишки и прямой кишки
A07.19.001
Конформная дистанционная лучевая терапия
A07.30.009
Конформная дистанционная лучевая терапия, в том числе IMRT, IGRT, ViMAT, стереотаксическая
A07.30.009.001
