"Клинические рекомендации "Тиреотоксикоз с диффузным зобом (болезнь Грейвса), узловым/многоузловым зобом"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ТИРЕОТОКСИКОЗ С ДИФФУЗНЫМ ЗОБОМ (БОЛЕЗНЬ ГРЕЙВСА),
УЗЛОВЫМ/МНОГОУЗЛОВЫМ ЗОБОМ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E05.0, E05.1, E05.2, E05.3, E05.4, E05.5, E05.8
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 270_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации Российская ассоциация эндокринологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АИТ
аутоиммунный тиреоидит
БГ
болезнь Грейвса
ДТЗ
диффузный токсический зоб
ИБС
ишемическая болезнь сердца
КТ
компьютерная томография
МРТ
магнитно-резонансная томография
МТЗ
многоузловой токсический зоб
РЙТ
радиойодтерапия: терапия натрия йодидом [131I]
рТТГ
рецептор тиреотропного гормона (Определение содержания антител к рецептору тиреотропного гормона (ТТГ) в крови)
рИРФ1
рецептор инсулиноподобного фактора роста 1
ДРФС
V09 диагностические радиофармацевтические средства
СТ3
свободный трийодтиронин (Исследование уровня свободного трийодтиронина (Т3) в крови)
СТ4
свободный тироксин (Исследование уровня свободного тироксина (СТ4) сыворотки крови)
ТГ
тиреоглобулин
ТК
тиреотоксический криз
ТПО
тиреопероксидаза
ТТГ
тиреотропный гормон гипофиза (Исследование уровня тиреотропного гормона (ТТГ) в крови)
УЗИ
ультразвуковое исследование (Ультразвуковое исследование щитовидной железы и паращитовидных желез)
УТЗ
узловой токсический зоб
ЧСС
частота сердечных сокращений
ЩЖ
щитовидная железа
ЭОП
эндокринная офтальмопатия
CAS
Шкала клинической активности эндокринной офтальмопатии [Clinical Activity Score]
EUGOGO
Европейская группа по изучению эндокринной офтальмопатии
ATA
Американская тиреоидная ассоциация
ETA
Европейская тиреоидная ассоциация
** -
препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения
*** -
входит в перечень медицинских изделий при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи
Термины и определения
Тиреотоксикоз - синдром, обусловленный избыточным содержанием тиреоидных гормонов в крови и их токсическим действием на различные органы и ткани.
Диффузный токсический зоб (Болезнь Грейвса/Базедова) - аутоиммунное заболевание, развивающееся вследствие выработки стимулирующих антител к рецептору тиреотропного гормона (рТТГ).
Узловой/многоузловой зоб - заболевание, возникающее вследствие развития функциональной автономии (независимо от ТТГ) узловых образований щитовидной железы (ЩЖ).
Эндокринная офтальмопатия (ЭОП) - самостоятельное аутоиммунное заболевание, тесно связанное с аутоиммунной патологией ЩЖ.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Болезнь Грейвса (БГ, тиреотоксикоз с диффузным зобом) представляет собой органоспецифическое аутоиммунное заболевание, развивающееся вследствие выработки стимулирующих антител к рТТГ, клинически проявляющееся диффузным поражением ЩЖ с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (ЭОП, претибиальная микседема, акропатия).
Узловой/многоузловой токсический зоб (тиреотоксикоз с узловым/многоузловым зобом; УТЗ) - заболевание ЩЖ, клинически проявляющееся узловым поражением ЩЖ с развитием синдрома тиреотоксикоза вследствие автономного, независимого от тиреотропного гормона (ТТГ) функционирования узловых образований ЩЖ.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Наиболее часто эндогенный гипертиреоз возникает вследствие болезни Грейвса или узлового образования щитовидной железы. БГ является одной из форм тиреотоксикоза, вызванного гиперсекрецией гормонов ЩЖ под влиянием антител к рТТГ [1 - 4]. Антитела к рТТГ имеют преимущественно изотип IgG1 и связываются с эпитопом внеклеточного домена рТТГ [5]. рТТГ взаимодействует с рецептором инсулиноподобного фактора роста 1 (рИРФ1) на поверхности тиреоцитов и на орбитальных фибробластах, причем антитела к рТТГ активируют как нисходящие пути рИРФ1, так и активацию рТТГ [6]. Циркулирующие стимулирующие антитела к рТТГ, связываясь с рТТГ, усиливают выработку внутриклеточного циклического аденозинмонофосфата (АМФ), что приводит к высвобождению тиреоидных гормонов и росту тиреоцитов. Около 30% пациентов с БГ имеют членов семьи, которые также имеют БГ или тиреоидит Хашимото. Близнецовые исследования показали, что 80% восприимчивости к БГ является генетической [7]. Существуют хорошо установленные ассоциации между аллелями основного комплекса гистосовместимости с БГ, причем восприимчивость переносится с гаплотипами HLA-DR3 и HLA-DR4 [8]. К другим локусам восприимчивости, в которых была реплицирована ассоциация, относятся локусы цитотоксического T-лимфоцитарного антигена-4, нерецепторный белок тирозинфосфатазы-22, основной лейциновый фактор транскрипции 2 и CD40 [9]. Факторы окружающей среды, такие как курение сигарет, стресс и беременность, также предрасполагают к БГ [10, 11]. В регионах с нормальным потреблением йода БГ является наиболее частым заболеванием в нозологической структуре синдрома тиреотоксикоза.
В йододефицитных районах наиболее частой причиной тиреотоксикоза является функциональная автономия узлов ЩЖ [12 - 13]. Автономию можно определить, как функционирование фолликулярных клеток ЩЖ в отсутствие главного физиологического стимулятора - ТТГ гипофиза. При функциональной автономии клетки ЩЖ выходят из-под контроля гипофиза и синтезируют гормоны в избыточном количестве. Если продукция тиреоидных гормонов автономными образованиями превышает физиологическую потребность, у больного разовьется тиреотоксикоз. Это может произойти в результате естественного течения узлового зоба или после поступления в организм дополнительных количеств йода с йодными добавками или в составе препаратов йода. Процесс развития функциональной автономии длится годами и приводит к клиническим проявлениям тиреотоксикоза, в основном у лиц старшей возрастной группы (после 45 лет).
Помимо вышеизложенного, причинами развития тиреотоксикоза могут быть экстратиреоидные факторы: эндогенные (струма оварии, метастатический вариант дифференцированного рака щитовидной железы и пр.) и экзогенные (передозировка левотироксина).
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Наиболее частыми причинами тиреотоксикоза являются БГ и узловой/многоузловой токсический зоб. БГ является наиболее распространенной причиной тиреотоксикоза в богатых йодом географических районах, где ежегодно регистрируется 20 - 30 случаев на 100 000 человек [14]. В 2001 г. распространенность тиреотоксикоза в России составила 18,4 случая на 100 000 населения [15]. По данным Американской тиреоидной ассоциации (АТА), в 2011 г. распространенность тиреотоксикоза составила 1,2 - 1,6%, явного тиреотоксикоза - 0,5 - 0,6% и субклинического - 0,7 - 1,0% [16]. БГ чаще встречается у женщин и имеет популяционную распространенность 1 - 1,5%. Примерно у 3% женщин и 0,5% мужчин БГ развивается в течение жизни [17]. Пик заболеваемости БГ приходится на пациентов в возрасте 30 - 60 лет, причем повышенная заболеваемость наблюдается среди афроамериканцев [18].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
E05.0 Тиреотоксикоз с диффузным зобом.
E05.1 Тиреотоксикоз с токсическим одноузловым зобом.
E05.2 Тиреотоксикоз с токсическим многоузловым зобом.
E05.3 Тиреотоксикоз с эктопией тиреоидной ткани
E05.4 Тиреотоксикоз искусственный
E05.5 Тиреотоксический криз или кома
E05.8. Гиперсекреция тиреостимулирующего гормона
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Таблица 1. Классификация зоба (ВОЗ, 2001)
Степень
Характеристика
0
Зоба нет (объем долей не превышает объема дистальной фаланги большого пальца обследуемого)
I
Зоб пальпируется, но не виден при нормальном положении шеи (отсутствует видимое увеличение ЩЖ). Сюда же относятся узловые образования, которые не приводят к увеличению самой ЩЖ
II
Зоб четко виден при нормальном положении шеи
Таблица 2. Классификация тиреотоксикоза по степени выраженности клинических проявлений
Степень тяжести
Критерии
Субклинический тиреотоксикоз
Устанавливается преимущественно на основании данных гормонального исследования при стертой клинической картине. Определяется сниженный (подавленный) уровень ТТГ при нормальных показателях свободного тироксина (СТ4) и свободного трийодтиронина (СТ3)
Манифестный тиреотоксикоз
Имеются развернутая клиническая картина заболевания и характерные гормональные сдвиги - сниженный уровень ТТГ при высоком уровне СТ4 и/или СТ3
Осложненный тиреотоксикоз
Имеются тяжелые осложнения: фибрилляция предсердий, сердечная недостаточность, тромбоэмболические осложнения, надпочечниковая недостаточность, токсический гепатит, дистрофические изменения паренхиматозных органов, психоз, кахексия и др.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Жалобы и анамнез.
Пациенты с тиреотоксикозом предъявляют жалобы на повышенную возбудимость, эмоциональную лабильность, плаксивость, беспокойство, нарушение сна, суетливость, нарушение концентрации внимания, слабость, потливость, сердцебиения, дрожь в теле, потерю веса. Нередко больные отмечают увеличение ЩЖ, частый стул, нарушение менструального цикла, снижение потенции. Очень часто больные предъявляют жалобы на мышечную слабость [19]. Серьезную опасность для лиц пожилого возраста представляют сердечные эффекты тиреотоксикоза [20, 21]. Фибрилляции предсердий - грозное осложнение тиреотоксикоза. Фибрилляция предсердий развивается не только у лиц с манифестным, но и у лиц с субклиническим тиреотоксикозом, особенно имеющих сопутствующую сердечно-сосудистую патологию [22, 23]. В начале появления фибрилляция предсердий обычно носит пароксизмальный характер, но при сохраняющемся тиреотоксикозе переходит в постоянную форму. У больных с тиреотоксикозом и фибрилляцией предсердий повышен риск тромбоэмболических осложнений [24]. При длительно существующем тиреотоксикозе у больных может развиться дилятационная кардиомиопатия, которая обусловливает снижение функционального резерва сердца и появление симптомов сердечной недостаточности [25, 26]. Примерно у 40 - 50% пациентов с БГ развивается ЭОП, которая характеризуется поражением мягких тканей орбиты: ретробульбарной клетчатки, глазодвигательных мышц с вовлечением зрительного нерва и вспомогательного аппарата глаза (век, роговицы, конъюнктивы, слезной железы). У больных развиваются спонтанная ретробульбарная боль, боль при движениях глазами, эритема век, отек или припухлость век, гиперемия конъюнктивы, хемоз, проптоз, ограничение подвижности глазодвигательных мышц. Наиболее тяжелыми осложнениями ЭОП являются нейропатия зрительного нерва, кератопатия с формированием бельма, перфорация роговицы, офтальмоплегия, диплопия [27].
Развитие функциональной автономии, преимущественно у лиц пожилого возраста, определяет клинические особенности данного заболевания. В клинической картине, как правило, доминируют сердечно-сосудистые и психические расстройства: апатия, депрессия, отсутствие аппетита, слабость, сердцебиения, нарушения сердечного ритма, симптомы недостаточности кровообращения [28 - 30]. Сопутствующие сердечно-сосудистые заболевания, патология пищеварительного тракта, неврологические расстройства маскируют основную причину заболевания.
В отличие от функциональной автономии узлов ЩЖ, при которой имеется длительный многолетний анамнез узлового/многоузлового зоба, при БГ обычно имеет место короткий анамнез: симптомы развиваются и прогрессируют быстро и в большинстве случаев приводят пациента к врачу через 6 - 12 мес от начала заболевания.
Физикальное обследование.
Внешние проявления: пациенты выглядят встревоженными, беспокойными, суетливыми. Кожные покровы горячие и влажные. На отдельных участках кожи иногда определяют депигментированные очаги (витилиго). Волосы тонкие и ломкие, ногти мягкие, исчерченные и ломкие. В ряде случаев наблюдается дермопатия или претибиальная микседема.
Пальпация ЩЖ: ЩЖ в 80% случаев при БГ диффузно увеличена, умеренной плотности, безболезненная, подвижная. При наложении на нее фонендоскопа можно выслушать систолический шум, что вызвано значительным усилением кровоснабжения органа. При узловом/многоузловом зобе в ЩЖ пальпируются очаговые образования.
Сердечно-сосудистая система: при осмотре выявляются тахикардия, увеличение пульсового давления, систолический шум, систолическая гипертензия, фибрилляция предсердий. Хотя все эти изменения присутствуют у большинства больных с тиреотоксикозом, на первый план по клинической значимости выходит фибрилляция предсердий, которая развивается у 5 - 15% пациентов. Этот процент выше среди пожилых больных и пациентов с предшествующим органическим поражением сердца. ИБС, гипертоническая болезнь, пороки сердца могут сами по себе вызывать нарушение ритма. В таких случаях тиреотоксикоз лишь ускоряет этот процесс. Существует прямая зависимость фибрилляции предсердий от степени тяжести и длительности заболевания. В начале заболевания фибрилляция предсердий носит пароксизмальный характер, но с прогрессированием тиреотоксикоза может перейти в постоянную форму. При эффективном лечении тиреотоксикоза чаще всего синусовый ритм восстанавливается после достижения эутиреоза. У больных с предшествующим заболеванием сердца или более длительным течением мерцательной аритмии синусовый ритм восстанавливается гораздо реже. Трепетание предсердий встречается довольно редко (1,2 - 2,3%), экстрасистолия - в 5 - 7% случаев, пароксизмальная тахикардия - в 0,2 - 3,3% случаев. В редких случаях встречается синусовая брадикардия. Это может быть связано с врожденными изменениями либо с истощением функции синусового узла и развитием синдрома его слабости.
Фибрилляция предсердий может вызывать тромбоэмболии сосудов, особенно мозговых, что требует назначения антикоагулянтной терапии [31, 32]. У пожилых больных тиреотоксикоз может сочетаться с ишемической болезнью сердца (ИБС) [33]. Увеличение частоты сердечных сокращений (ЧСС) и потребности миокарда в кислороде может проявить скрытую форму стенокардии и привести к декомпенсации сердечной недостаточности. Поражение сердечно-сосудистой системы при тиреотоксикозе определяют тяжесть и прогноз заболевания. Более того, состояние сердечно-сосудистой системы после устранения тиреотоксикоза будет определять качество жизни и трудоспособность "выздоровевшего" человека. Известно, что при тиреотоксикозе уже в покое миокард развивает гиперфункцию и за счет нее обеспечивает организм увеличенными запросами в кислороде. С другой стороны, при физической нагрузке или в критической ситуации миокард должен резко увеличить свою работу, т.е. использовать свой функциональный резерв. Именно от функционального резерва сердца зависит адаптация организма к возросшим потребностям при тиреотоксикозе. У пациентов с тиреотоксикозом функциональный резерв сердца значительно снижен, но при достижении эутиреоза повышается, не достигая исходного уровня, что при определенных условиях может определять в дальнейшем развитие сердечной недостаточности.
Желудочно-кишечный тракт: несмотря на повышенный аппетит, для тиреотоксикоза характерно прогрессирующее снижение массы тела. Редко на фоне некомпенсированного тиреотоксикоза вес может увеличиваться, при этом у больных отмечается повышенный уровень иммунореактивного инсулина, при нормальном уровне C-пептида.
Опорно-двигательный аппарат: нарушения проявляются нарастающей слабостью, проксимальной мышечной атрофией, тремором мелких мышечных групп всего тела (симптом "телеграфного столба"), развитием периодических транзиторных параличей и парезов, снижением содержания миоглобина, повышением риска переломов [34, 35].
ЦНС: отмечаются увеличение скорости прохождения рефлексов, тремор пальцев вытянутых рук (симптом Мари).
Глазные симптомы, сопровождающие тиреотоксикоз:
- симптом Грефе - отставание верхнего века от верхнего лимба при взгляде вниз (обусловлено гипертонусом мышцы, поднимающей верхнее веко);
- симптом Кохера - отставание верхнего века от верхнего лимба при взгляде вверх, верхнее веко передвигается кверху быстрее, чем глазное яблоко;
- симптом Дальримпля - расширение глазной щели с появлением белой полоски между верхним лимбом и краем верхнего века (ретракция век);
- симптом Штельвага - редкое мигание век в сочетании с расширением глазной щели. В норме у здоровых людей наблюдается 3 мигания в 1 мин.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза диффузного токсического зоба: на основании патогномоничных данных:
1. анамнестических данных
2. физикального обследования
3. лабораторных исследований
4. инструментального обследования.
Критерии установления диагноза узлового/многоузлового зоба: на основании патогномоничных данных:
1. анамнестических данных
2. физикального обследования
3. лабораторных исследований
4. инструментального обследования.
2.1 Жалобы и анамнез
(раздел 1.6) на повышенную возбудимость, эмоциональную лабильность, плаксивость, беспокойство, нарушение сна, суетливость, нарушение концентрации внимания, слабость, потливость, сердцебиения, одышку, нарушение ритма сердца, дрожь в теле, потерю веса, увеличение ЩЖ, частый стул, нарушение менструального цикла, снижение потенции, мышечную слабость, пучеглазие. При БГ короткий анамнез. При УТЗ/МТЗ многолетний длительный анамнез узлового зоба.
2.2 Физикальное обследование
(раздел 1.6) Увеличение ЩЖ, тахикардия, фибрилляция или трепетание предсердий, тремор рук, тела, экзофтальм, ретракция век, косоглазие, претибиальная микседема.
2.3 Лабораторные диагностические исследования
2.3.1. Лабораторные диагностические исследования при болезни Грейвса
- Рекомендуется исследование уровня тиреотропного гормона (ТТГ) в крови как первоначального скринингового теста у пациентов с клиникой тиреотоксикоза [36 - 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. Исследование уровня тиреотропного гормона (ТТГ) в крови обладает самой высокой чувствительностью и специфичностью из всех одиночных анализов крови, используемых при подозрении на тиреотоксикоз, и должно использоваться в качестве первоначального скринингового теста. При тиреотоксикозе уровень тиреотропного гормона (ТТГ) должен быть низким (< 0,1 мЕ/л).
- Рекомендуется исследование уровня тиреоидных гормонов: свободного тироксина (СТ4) сыворотки крови и свободного трийодтиронина (СТ3) в крови у пациентов с низким уровнем ТТГ [36 - 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. При манифестном тиреотоксикозе определяется повышенный уровень СТ4 и/или СТ3 в крови. При субклиническом тиреотоксикозе уровни СТ4 и СТ3 в сыворотке крови в пределах нормы. Возможны случаи, когда в сыворотке крови повышен уровень только СТ3 при нормальном уровне СТ4 и низком уровне ТТГ. Такие лабораторные данные названы "Т3-токсикозом".
- Рекомендуется определение содержания антител к рецептору ТТГ в крови у пациентов с тиреотоксикозом для диагностики и дифференциальной диагностики БГ [41].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1).
Комментарии. Антитела к рецептору ТТГ являются специфическими биомаркерами БГ. Метаанализ 21 исследования показал, что чувствительность и специфичность сывороточной концентрации антител к рецептору ТТГ, измеренной с помощью анализов связывания второго и третьего поколений, составила 97 и 98% соответственно [41]. В процессе лечения или спонтанной ремиссии заболевания уровни антител могут снижаться или исчезать. Кроме того, определение содержания антител к рецептору ТТГ в крови является высокочувствительным и прогностическим биомаркером экстратиреоидных проявлений БГ [42 - 45], а также полезным прогностическим показателем фетального или неонатального гипертиреоза [46].
- Не рекомендуется рутинное определение содержания антител к тиреопероксидазе (ТПО) в крови и антител к тиреоглобулину (ТГ) в сыворотке крови для диагностики БГ [47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. Антитела к ТГ и ТПО выявляются у 40 - 60% пациентов с БГ и примерно у 80 - 90% пациентов с аутоиммунным тиреоидитом. При воспалительных и деструктивных процессах в ЩЖ неаутоиммунной природы антитела могут присутствовать, но их уровень чаще невысок.
2.3.2. Лабораторные диагностические исследования при узловом/многоузловом токсическом зобе.
- Рекомендуется исследование уровня тиреотропного гормона (ТТГ) в крови как первоначального скринингового теста у пациентов с узловым или многоузловым зобом [36 - 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется определение уровня тиреоидных гормонов: свободного тироксина (СТ4) в сыворотке крови и свободного трийодтиронина (СТ3) в крови у пациентов с низким уровнем тиреотропного гормона (ТТГ) [36 - 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется определение содержания антител к рецептору ТТГ в крови у пациентов с наличием УТЗ и МТЗ для дифференциальной диагностики с БГ [40, 41, 47].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1).
Комментарии. Антитела к рецептору ТТГ являются специфическими биомаркерами БГ [40, 41, 47]. Определение содержания антител к рецептору ТТГ в крови проводится в рамках дифференциальной диагностики УТЗ и МТЗ с БГ.
2.4 Инструментальные диагностические исследования
2.4.1. Инструментальные диагностические исследования при болезни Грейвса.
- Рекомендуется проведение УЗИ ЩЖ и паращитовидных желез всем пациентам с БГ для определения объема ЩЖ и структурных изменений [47, 48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется проведение дуплексного сканирования сосудов ЩЖ всем пациентам с БГ для исследования уровня васкуляризации ЩЖ [49 - 50].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. УЗИ - это удобный, неинвазивный, быстрый и эффективный метод исследования пациентов с БГ [48]. С помощью УЗИ определяются объем и эхоструктура ЩЖ. В норме объем ЩЖ у женщин не должен превышать 18 мл, у мужчин 25 мл, эхогенность железы средняя, структура равномерная. Эхогенность ЩЖ при БГ снижена, эхоструктура обычно однородная. С целью оценки кровоснабжения ЩЖ проводится дуплексное сканирование сосудов ЩЖ. При БГ отмечается его усиление [49 - 52].
- Рекомендуется проведение компьютерной томографии верхних дыхательных путей и шеи (КТ), спиральной компьютерной томографии шеи (МСКТ), магнитно-резонансной томографии шеи (МРТ) пациентам с БГ (объем ЩЖ более 80 см3) для исключения компрессии трахеи и пищевода и загрудинного расположения зоба [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. КТ, МСКТ, МРТ помогают диагностировать загрудинный зоб, уточнить расположение зоба по отношению к окружающей ткани, определить смещение или сдавление трахеи и пищевода. Значительно менее информативна в этом плане рентгеноскопия пищевода с контрастированием
- Рекомендуется проведение сцинтиграфии ЩЖ пациентам с ДТЗ для проведения дифференциальной диагностики с другими формами тиреотоксикоза при наличии показаний [3, 53 - 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии. Важным показанием к сцинтиграфии ЩЖ является дифференциальная диагностика гиперфункции ЩЖ при БГ с заболеваниями, протекающими с деструктивным тиреотоксикозом (аутоиммунный тиреоидит, подострый тиреоидит, амиодарон-индуцированный тиреотоксикоз 2 типа. В отличие от натрия пертехнетат [99mTc], который проникает в клетки посредством натрий-йодного симпортера, #технеций [99mTc] сестамиби проходит через мембрану тиреоцитов путем пассивной диффузии и накапливается в митохондриях, что позволяет исключить фактор йодной блокады, возникший на фоне приема амиодарона** на визуализацию и выявить деструкцию тиреоидной ткани [55].
2.4.2. Инструментальные диагностические исследования при узловом/многоузловом токсическом зобе.
- Рекомендуется проведение УЗИ ЩЖ и паращитовидных желез всем пациентам с узловым/многоузловым токсическим зобом для определения объема ЩЖ, наличия узлов и структурных изменений [47, 54].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. При проведении УЗИ определяют объем и эхоструктуру ЩЖ, наличие узловых образований. Протокол УЗИ (обсуждается в отдельных рекомендациях) должен включать описание локализации и размеров образования ЩЖ, лимфоузлов с учетом их ультразвуковых характеристик.
- Рекомендуется проведение сцинтиграфии ЩЖ всем пациентам узловым/многоузловым токсическим зобом для исключения функциональной автономии узлов [3, 52 - 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3).
Комментарии. По накоплению и распределению изотопа технеция - Натрия пертехнетат [99mTc] и #Технеция [99mTc] сестамиби (185 - 370 MBq) - можно судить о функциональной активности ЩЖ, характере ее поражения (диффузном или узловом), объеме ткани после резекции или тиреоидэктомии, наличии эктопированной ткани [52 - 56]. При функциональной автономии изотоп накапливает активно функционирующий узел (узлы), при этом окружающая тиреоидная ткань находится в состоянии супрессии. В ряде случаев автономия может носить диффузный характер, за счет диссеминации автономно функционирующих участков по всей ЩЖ. При БГ отмечается диффузное усиление захвата изотопа всей ЩЖ.
- Рекомендуется проведение компьютерной томографии верхних дыхательных путей и шеи (КТ), спиральной компьютерной томографии шеи (МСКТ), у пациентов с большим узловым/многоузловым токсическим зобом и/или его загрудинном расположении для исключения компрессии трахеи и пищевода и загрудинного расположения зоба [53, 57].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. КТ, МСКТ, МРТ помогают диагностировать загрудинный зоб, уточнить расположение зоба по отношению к окружающей ткани, определить смещение или сдавление трахеи и пищевода. Значительно менее информативно в этом плане рентгеноскопия пищевода с контрастированием.
Пункционная биопсия и цитологическое исследование микропрепарата тканей ЩЖ проводятся при наличии узловых образований ЩЖ, что обсуждается в отдельных рекомендациях. Если у пациента с БГ обнаружен узел ЩЖ, его следует оценить и лечить в соответствии с рекомендациями, касающимися узлового эутиреоидного зоба.
2.5 Иные диагностические исследования
В связи с возможностью сопутствующих заболеваний, высокой вероятностью осложнений тиреотоксикоза, необходимостью оценки и коррекции сердечно-сосудистых факторов риска, влияющей на выбор тактики лечения, а также для обеспечения безопасного применения антитиреоидных препаратов пациентам с тиреотоксикозом, необходимо проведение дополнительного обследования при планировании лечения.
- Рекомендуется:
- исследование общего (клинического) анализа крови лицам с диагностированным тиреотоксикозом для исключения наличия лейкопении и последующей безопасной медикаментозной коррекции тиреотоксикоза [58, 59].
- анализ крови биохимический общетерапевтический: исследование уровня альбумина в крови, исследование уровня мочевины в крови, исследование уровня общего билирубина в крови, исследование уровня глюкозы в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня неорганического фосфора в крови, исследование уровня хлоридов в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови лицам с диагностированным тиреотоксикозом для последующей безопасной медикаментозной коррекции тиреотоксикоза [60, 61, 70].
- исследование общего (клинического) анализа мочи лицам с диагностированным тиреотоксикозом для уточнения наличия инфекции мочевых путей [62].
- регистрация электрокардиограммы в покое лицам с диагностированным тиреотоксикозом для скрининга сердечно-сосудистой патологии [56].
- прием (осмотр, консультация) врача-офтальмолога первичный пациентов с глазными симптомами с целью выявления эндокринной офтальмопатии [63].
- прием (осмотр, консультация) врача-кардиолога первичный пациентов с нарушением ритма сердца, фибрилляцией предсердий, экстрасистолией, сердечной недостаточностью [31 - 33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Введение в раздел. В настоящее время существует три метода лечения тиреотоксикоза с диффузным/узловым токсическим зобом:
- консервативное лечение;
- хирургическое лечение;
- РЙТ - терапия натрия йодидом [131I]
3.1. Лечение болезни Грейвса.
- Рекомендуется терапию тиреотоксикоза всегда начинать с назначения антитиреоидных препаратов независимо от выбора метода лечения БГ [64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3).
3.1.1. Консервативное лечение. [Приложение А3]
Консервативное лечение назначается для достижения эутиреоза перед оперативным лечением или проведением курса РЙТ, а также в отдельных группах пациентов - в качестве базового длительного (12 - 24 месяца) курса лечения, который в некоторых случаях приводит к стойкой ремиссии [14, 65 - 66]. Важными условиями планирования длительной антитиреоидной терапии являются готовность пациента следовать рекомендациям врача (комплаентность) и доступность квалифицированной эндокринологической помощи.
Цель лечения: устранение клинических симптомов тиреотоксикоза, стойкая нормализация уровня тиреоидных гормонов и ТТГ. Лечение тиреотоксикоза, обусловленного гиперпродукцией тиреоидных гормонов, начинается с приема антитиреоидных препаратов.
Немедикаментозное лечение. До достижения эутиреоза следует ограничить физическую нагрузку и поступление препаратов йода, отказаться от курения.
- Рекомендуется начинать лечение пациентов с тиреотоксикозом с назначения антитиреоидных препаратов при впервые выявленной манифестной БГ [36, 66, 67] с целью восстановления эутиреоидного состояния.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. К антитиреоидным препаратам относятся серосодержащие производные имидазола (тиамазол**) и пропилтиоурацила (пропилтиоурацил) [62, 64]. Эти препараты подавляют действие ТПО, ингибируют окисление йода, йодирование ТГ и конденсацию йодтирозинов, в результате чего снижается синтез гормонов ЩЖ. Кроме того, пропилтиоурацил нарушает конверсию Т4 в Т3. Период полувыведения из крови тиамазола** составляет 4 - 6 ч, пропилтиоурацила - 1 - 2 ч. Длительность действия тиамазола** продолжается более суток, пропилтиоурацила - 12 - 24 ч. Тиамазол** является препаратом выбора для всех пациентов, которым планируется проведение консервативного лечения БГ.
- Рекомендуется определение общего (клинического) анализа крови развернутого с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы), а также определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, исследование уровня общего билирубина в крови у пациентов с тиреотоксикозом перед началом антитиреоидной терапии для исключения наличия лейкопении, повреждения печени и последующей безопасной медикаментозной коррекции тиреотоксикоза [68 - 70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3).
- Рекомендуется определять общий (клинический) анализ крови развернутый с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы) у всех пациентов, получающих антитиреоидные препараты, при фебрильных состояниях, фарингите и ангине [66, 67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется информировать пациентов о потенциальных побочных эффектах антитиреоидных препаратов и необходимости немедленного информирования врача в случае развития у них желтухи, легкой простуды, жидкого стула, темной мочи, лихорадки, фарингита или цистита [70 - 72].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. Агранулоцитоз является редким (0,06%), но грозным осложнением приема антитиреоидных препаратов [58, 59, 68, 72], крайне редко возникает изолированная тромбоцитопения. До получения результатов анализа крови следует отменить прием антитиреоидных препаратов. При выявлении нейтропении (абсолютное количество нейтрофилов < 1,5 x 109/л) или агранулоцитоза (абсолютное количество нейтрофилов < 0,5 x 109/л) прием антитиреоидных препаратов не возобновляется. Показана госпитализация. Следует отменить назначенные ранее препараты, вызывающие нейтропению: метамизол натрия, парацетамол, Ко-тримоксазол, производные нитрофурана и т.д. Показано проведение эмпирической терапии антибактериальными препаратами системного действия, внутривенно. Возможно (желательно, но необязательно) применение колониестимулирующих факторов (КСФ): филграстим**; вплоть до достижения абсолютного количества нейтрофилов 1,5 x 109/л. Контроль общего (клинического) анализа крови проводится ежедневно. Консультация врача-гематолога по показаниям. После нормализации количества нейтрофилов и стабилизации состояния - оперативное лечение или РЙТ.
К другим крайне редким тяжелым побочным эффектам относят острый некроз печени, холестатический гепатит, волчаночноподобный синдром и васкулит, которые могут быть ассоциированы с антинейтрофильными цитоплазматическими антителами [50, 61, 67, 70, 71, 73].
Рутинное периодическое определение общего (клинического) анализа крови на фоне антитиреоидной терапии не показано [67]. Легкие лейкопенические реакции возникают нередко, но они почти всегда транзиторны.
Тиамазол** изначально назначается в дозах: 20 - 30 - 40 мг (на 2 приема), пропилтиоурацил - 200 - 300 - 400 мг (на 3 - 4 приема) в зависимости от тяжести тиреотоксикоза, соответственно. На фоне такой терапии спустя 3 - 4 недели удается достичь нормализации уровней СТ4 и СТ3. Уровень ТТГ может сохраняться ниже нормы в течение 4 месяцев, несмотря на нормальные и даже пониженные концентрации тиреоидных гормонов в крови, поэтому его определение не имеет большого значения в тактике ведения больного в первые месяцы лечения.
После нормализации уровней СТ4 и СТ3 начинают снижать дозу антитиреоидных препаратов.
- Рекомендуется у пациентов, получающих антитиреоидные препараты, через 3 - 4 недели от начала лечения исследование уровня свободного тироксина (СТ4) сыворотки крови, исследование уровня свободного трийодтиронина (СТ3) в крови для коррекции дозировки антитиреоидного препарата [53, 62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Следует контролировать уровень СТ4 и СТ3 в сыворотке крови, поскольку уровень СТ4 может нормализоваться, несмотря на стойкое повышение СТ3. Уровень ТТГ в сыворотке может оставаться подавленным в течение нескольких месяцев от начала терапии, поэтому исследование уровня тиреотропного гормона (ТТГ) в крови для мониторинга эффективности проводимого лечения нецелесообразна.
Надо помнить, что быстрое уменьшение дозы тиамазола** до 5 мг в начале лечения часто приводит к декомпенсации тиреотоксикоза. После нормализации уровня тиреоидных гормонов возможен переход на одну из двух схем антитиреоидной терапии [74]: схема "блокируй" - подразумевает монотерапию антитиреоидным препаратом в относительно небольшой дозе (7,5 - 10 мг тиамазола**) под ежемесячным исследованием уровня свободного тироксина (СТ4) сыворотки крови и уровня свободного трийодтиронина (СТ3) в крови. Плюсом этой схемы является назначение относительно небольшой дозы препарата, относительным минусом - менее надежная блокада ЩЖ, в связи с чем приходится часто менять дозу (титрационный режим). Схема "блокируй и замещай" - антитиреоидный препарат (тиамазол**) назначается в большей дозе (10 - 15 - 20 мг/сут) и одновременно, начиная от момента нормализации уровня СТ4 или несколько позже, пациенту назначается #левотироксин натрия** в дозе 25 - 50 мкг в день [53, 112].
Вероятность развития стойкой ремиссии одинакова при использовании схемы "блокируй и замещай" или монотерапии антитиреоидными препаратами [74, 75].
- Рекомендуется назначение бета-адреноблокаторов пациентам с тиреотоксикозом и тахикардией на период до достижения эутиреоза, а зачастую и на более длительный срок [76].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Бета-адреноблокаторы: пропранолол** (20 - 40 мг каждые 6 ч) или бета-адреноблокаторы более длительного действия (атенолол**/#бисопролол** 2.5 - 5 мг 1 раз в сутки) назначаются для контроля адренергических симптомов, таких как учащенное сердцебиение и тремор, особенно на ранних стадиях до начала действия антитиреоидных препаратов [53, 77]. Высокие дозы пропранолола** (40 мг 4 раза в день) подавляют периферическое превращение тироксина в трийодтиронин.
- Рекомендуется продолжить лечение БГ антитиреоидными препаратами в течение 12 - 18 месяцев, затем лечение отменить, если уровни ТТГ и антител к рецептору ТТГ нормализовались [75, 78].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
- Рекомендуется определение содержания антител к рецептору тиреотропного гормона (ТТГ) в крови у пациентов с БГ перед отменой приема антитиреоидных препаратов, т.к. это позволяет предсказать вероятность рецидива тиреотоксикоза. В отсутствие антител больше шансов длительной ремиссии заболевания [78, 79].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии. Следует учитывать, что антитела к рТТГ могут оставаться повышенными в связи с возможностью появления блокирующих функцию ЩЖ антител к рецептору тиреотропного гормона (ТТГ) [80, 81].
Длительную консервативную терапию в большинстве случаев нецелесообразно проводить в некоторых группах пациентов (имеет значение сочетание нескольких признаков: значительное увеличение объема ЩЖ (более 40 мл), длительный анамнез тиреотоксикоза (более 2 лет), включая сохранение или рецидив тиреотоксикоза после 1 - 2-летнего курса тиреостатической терапии, тяжелые осложнения тиреотоксикоза (фибрилляция предсердий, сердечная недостаточность), агранулоцитоз в анамнезе, невозможность частого (раз в 1 - 2 месяца в начале лечения) контроля функции ЩЖ и наблюдения врача-эндокринолога, в том числе вследствие низкой приверженности пациента к лечению).
Частота сохранения тиреотоксикоза после отмены антитиреоидных препаратов и/или его отдаленных рецидивов составляет 70% и более. Если у пациента с БГ после отмены антитиреоидной терапии вновь развивается тиреотоксикоз, необходимо рассмотреть вопрос о проведении радиойодтерапии или тиреоидэктомии [82, 83].
3.1.2. Лечение натрия йодидом [131I] (РЙТ)
РЙТ - эффективный, безопасный и экономически выгодный метод лечения пациентов с различными формами токсического зоба [84]. Целями РЙТ являются ликвидация тиреотоксикоза путем разрушения гиперфункционирующей ткани ЩЖ и достижение стойкого гипотиреоидного состояния.
РЙТ при БГ проводится в случае рецидива тиреотоксикоза после правильно проведенного консервативного лечения (непрерывная терапия антитиреоидными препаратами с подтвержденным эутиреозом в течение 12 - 18 месяцев), невозможности приема антитиреоидных препаратов (лейкопения, аллергические реакции), отсутствия условий для консервативного лечения и наблюдения за больным, после неадекватных по объему операций, а также в качестве первоначального лечения БГ [85].
РЙТ осуществляется путем проведения целого комплекса технологических процессов, взаимно связанных между собой. РЙТ включает следующие технологии: предварительное обследование, радионуклидную диагностику с внутривенным введением радиофармацевтических препаратов для диагностики заболеваний щитовидной железы (РФП), подготовку РФП, РЙТ с пероральным введением РФП, технологию дозиметрического сопровождения (дозиметрическое планирование РЙТ, контроль реальных доз облучения пациентов при РЙТ, радиационный контроль больных, радиационный контроль персонала и помещений отделения РЙТ) [85]. РЙТ может проводиться только в специализированных центрах, способных обеспечить радиационную и экологическую безопасность для больных, сотрудников и окружающей среды.
- Не рекомендуется проведение РЙТ БГ в период беременности и грудного вскармливания. РЙТ в этих случаях абсолютно противопоказана [86, 87].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется проведение теста на беременность у пациенток репродуктивного возраста за 48 ч до проведения РЙТ с целью исключения беременности [14, 88].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется отложить зачатие как минимум на 6 месяцев после радиойодтерапии как у мужчин, так и у женщин [89].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Плоды, которые подвергаются воздействию РЙТ после 10 - 11-й недели гестации, могут рождаться без ЩЖ, а также имеют больший риск снижения интеллекта [90]. В настоящее время нет данных о влиянии терапии на фертильность, частоту самопроизвольного прерывания беременности, мертворождения, а также врожденных дефектов развития у потомства в долгосрочном периоде [91].
- Рекомендуется наблюдение пациентов в течение первых 1 - 2 месяцев после РЙТ БГ, включая исследование уровня свободного тироксина (СТ4) сыворотки крови, исследование уровня свободного трийодтиронина (СТ3) в крови, исследование уровня тиреотропного гормона (ТТГ) в крови. Мониторинг функции щитовидной железы следует продолжать в течение 6 месяцев с 4 - 6-недельными интервалами или до тех пор, пока развившийся у пациента гипотиреоз не будет компенсирован назначением левотироксина натрия** [92 - 94].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Если у пациента сохраняется тиреотоксикоз, наблюдение должно быть продолжено с интервалом 4 - 6 недель.
Комментарии. Гипотиреоз может развиваться в период от 4 недель (у 40% пациентов развитие гипотиреоза отмечается к 8-й неделе и у более чем 80% - к 16-й неделе) [95]. Частота развития гипотиреоза через год после РЙТ составляет 5 - 50% и положительно коррелирует с дозой натрия йодида [131I]. Далее ежегодная частота достижения гипотиреоза составляет 3 - 5% и мало зависит от дозы натрия йодида [131I] [96]. Даже при использовании низких доз натрия йодида [131I], что связано с увеличением частоты персистирования и рецидива заболевания, развитие гипотиреоза не может быть исключено [97]. Транзиторный гипотиреоз развивается в ранние сроки после РЙТ (примерно через 4 - 6 недель), встречается редко и сопровождается последующим полным восстановлением функции ЩЖ или рецидивом тиреотоксикоза [98].
Принцип наиболее низкой эффективной дозы важен в рамках терапии натрия йодидом [131I], но зачастую это труднодостижимо при желании сохранить баланс между быстрым купированием тиреотоксикоза и отсроченным наступлением гипотиреоза. Поэтому многие специалисты отказываются от точного расчета доз натрия йодида [131I] и предлагают фиксированные (185, 370 или 555 МБк) на основании клинических параметров, например, таких, как размер ЩЖ [99]. Поскольку уровень ТТГ может оставаться подавленным в течение месяца или дольше, этот показатель следует интерпретировать с осторожностью и только в совокупности с уровнем СТ4, СТ3, изолированно он не должен использоваться для решения вопроса о начале терапии левотироксином натрия**. При инициации терапии левотироксином натрия** его дозу следует титровать с использованием оценки уровня СТ4. Необходимая доза может быть меньше стандартной заместительной дозы. Следует избегать наступления манифестного гипотиреоза, особенно у пациентов с активной фазой ЭОП. При достижении эутиреоидного состояния рекомендована оценка функции ЩЖ пожизненно как минимум ежегодно, а также при развитии у пациента симптомов гипотиреоза или тиреотоксикоза.
- Рекомендуется проведение РЙТ повторно пациентам с БГ, у которых сохраняется тиреотоксикоз в течение 6 месяцев после РЙТ [98].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. Пациенты, у которых отмечается персистирующий подавленный уровень ТТГ в сочетании с нормальными уровнями свободных фракций Т4 и Т3, могут не требовать немедленного повторного проведения РЙТ, однако нуждаются в более тщательном наблюдении на случай возникновения рецидива или развития гипотиреоза. До проведения РЙТ необходимо устранить симптомы тиреотоксикоза. Пациент должен получать адекватные дозы антитиреоидных препаратов до нормализации концентраций СТ4 и СТ3. Предварительная терапия необходима, так как развитие радиационного тиреоидита может утяжелить симптомы тиреотоксикоза вследствие выброса ранее синтезированных тиреоидных гормонов в кровь [100]. Предшествующий прием антитиреоидных препаратов не подавляет проникновение натрия йодида [131I] в ЩЖ и не снижает эффективность РЙТ в случае, если антитиреоидные препараты отменены за неделю до и в течение недели после проведения РЙТ [101]. При субклиническом тиреотоксикозе РЙТ можно проводить без назначения антитиреоидных препаратов. Пациенты, которые находятся в группе повышенного риска развития осложнений за счет усугубления тиреотоксикоза, включая пожилых и пациентов с заболеваниями сердечно-сосудистой системы или тяжелым тиреотоксикозом, должны получать терапию бета-адреноблокаторами и антитиреоидными препаратами перед терапией натрия йодидом [131I] и до того момента, пока не будет достигнут эутиреоз [102, 103]. В случае если бета-адреноблокаторы применялись до проведения РЙТ, они должны быть отменены при нормализации уровней свободных фракций Т4 и Т3.
- Рекомендуется рассмотреть возобновление терапии антитиреоидными препаратами у пожилых пациентов с сопутствующей сердечно-сосудистой патологией через 3 - 7 дней после проведения РЙТ БГ с постепенной их отменой по мере нормализации функции ЩЖ [104, 53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Среди нежелательных эффектов РЙТ могут наблюдаться боль в области ЩЖ, отек и сиалоаденит [105]. Отсутствуют доказательства увеличения частоты рака ЩЖ, а также общей смертности вследствие онкологических заболеваний после терапии натрия йодидом [131I]. При лечении БГ отмечается снижение смертности по сравнению с нелечеными пациентами [106].
3.1.3. Оперативное лечение болезни Грейвса
Оперативное лечение является радикальным методом лечения и показано при нецелесообразности консервативной терапии (критерии см. выше), при рецидиве тиреотоксикоза после курса антитиреоидной терапии, предпочтении пациента, большом объеме ЩЖ с компрессионным синдромом.
- Рекомендуется нормализовать уровень тиреоидных гормонов (СТ4 и СТ3) у пациентов с БГ до хирургического лечения, чтобы снизить риск послеоперационного обострения тиреотоксикоза [107, 53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется проводить коррекцию дефицита 25-гидроксивитамина D у пациентов с БГ до хирургического лечения, чтобы снизить риск послеоперационной гипокальциемии [108].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
- Рекомендуется проведение тотальной тиреоидэктомии у пациентов с БГ в качестве метода выбора хирургического лечения [109].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1).
Комментарии. Предельно-субтотальная резекция ЩЖ или тотальная тиреоидэктомия несколько отличаются технически, но не отличаются с функциональной точки зрения - в обоих случаях исходом операции является гипотиреоз. Чтобы свести к минимуму риск осложнений (гипопаратиреоз, паралич гортанного нерва, раневую инфекцию), хирургическое вмешательство должно выполняться квалифицированным врачом-хирургом, владеющим техникой тиреоидэктомии [110, 111].
- Рекомендуется в исключительных обстоятельствах, когда достижение эутиреоидного состояния у пациентов с тиреотоксикозом невозможно (аллергия на антитиреоидные препараты, агранулоцитоз) и существует необходимость в срочном проведении тиреоидэктомии (проведение РЙТ невозможно) назначение плазмафереза или назначение пациенту #Йод + [Калия йодид + Глицерол]** непосредственно в предоперационном периоде в сочетании с бета-адреноблокаторами для быстрой нормализации уровня тиреоидных гормонов в крови [112, 113, 53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: назначается 8 мг #Йод + [Калия йодид + Глицерол]** в виде 5 - 7 капель (0,25 - 0,35 мл), с водой в течение 10 дней до операции [112, 113, 53].
После тиреоидэктомии показано исследование уровня ионизированного кальция и паратиреоидного гормона в крови и, при необходимости, назначение дополнительно препаратов кальция и витамина D и его аналогов. Прием антитиреоидных препаратов необходимо прекратить. Препараты #левотироксина натрия** назначаются сразу в полной заместительной дозе из расчета ориентировочно 1,7 мкг/кг веса пациента [113]. Исследование уровня тиреотропного гормона (ТТГ) в крови следует проводить через 6 - 8 недель после операции.
3.2. Лечение болезни Грейвса во время беременности и послеродовом периоде.
3.2.1. Планирование беременности при болезни Грейвса
Планирование беременности следует отложить, пока эутиреоз не будет достигнут и подтвержден дважды в течение двух месяцев на стабильном терапевтическом режиме. Женщины должны быть проинформированы: (1) о повышенном риске врожденных дефектов, вызванных приемом антитиреоидных препаратов; (2) возможности прекращения приема антитиреоидных препаратов в течение 6 - 10 недель беременности; (3) предпочтении приема пропилтиоурацила до/во время I триместра беременности; (4) приеме тиамазола** с 16-й недели беременности; (5) противопоказании лечения по схеме "блокируй и замещай". Беременность должна быть отсрочена на 6 месяцев после РЙТ, в этот период рекомендуется контрацепция. Тиреоидэктомия показана в случае противопоказаний или несогласия приема антитиреоидных препаратов/проведения РЙТ. После операции эутиреоз должен быть подтвержден до зачатия [53, 114 - 118].
- Рекомендуется иметь стабильный эутиреоз перед попыткой забеременеть женщинам репродуктивного возраста с БГ [14, 119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется предупреждать о немедленном подтверждении беременности и обращении к врачу женщин репродуктивного возраста с БГ [14, 119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
3.2.2. Беременность и болезнь Грейвса
Во время беременности потребность организма женщины в тиреоидных гормонах возрастает на 30 - 50%, поэтому изменение функции ЩЖ происходит уже с первых недель беременности [119, 120]. Повышение продукции тиреоидных гормонов является результатом влияния специфических факторов, приводящих к гиперстимуляции ЩЖ. У 2% беременных развивается гестационный гипертиреоз в результате стимулирующего влияния хорионического гонадотропина [119, 120, 121].
- Рекомендуется исследование уровня свободного тироксина (СТ4) сыворотки крови, исследование уровня свободного трийодтиронина (СТ3) в крови при выявлении у беременных женщин (особенно в первой половине беременности) подавленного уровня ТТГ (менее 0,1 мЕд/л) [122 - 125].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. Дифференциальная диагностика БГ и гестационного гипертиреоза основывается на выявлении антител к рецептору тиреотропного гормона (ТТГ) наличии ЭОП, данных УЗИ ЩЖ; выявление антител к ТПО этого сделать не позволяет. Проведение сцинтиграфии ЩЖ абсолютно противопоказано (смотреть выше) [123].
- Рекомендуется определение содержания антител к рецептору тиреотропного гормона (ТТГ) в крови всем женщинам с аутоиммунными заболеваниями ЩЖ в анамнезе при первом выявлении беременности [126 - 129].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется отменить тиамазол** и назначить прием пропилтиоурацила женщинам в 1 триместре беременности [118, 130 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется назначать минимально возможную дозу пропилтиоурацила женщинам во время беременности, режим "блокируй и замещай" противопоказан [118, 134 - 138].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии. Методом выбора лечения тиреотоксикоза во время беременности являются антитиреоидные препараты. Целью приема антитиреоидных препаратов является смягчение симптомов тиреотоксикоза у матери без развития гипотиреоза у плода [138]. Это достигается путем подбора таких доз антитиреоидных препаратов, которые позволяют сохранить умеренно повышенный уровень СТ4, не добиваясь нормализации ТТГ.
- Рекомендуется исследование уровня свободного тироксина (СТ4) сыворотки крови и исследование уровня тиреотропного гормона (ТТГ) в крови каждые 2 недели после начала приема антитиреоидных препаратов у женщин во время беременности и каждые 4 недели после достижения целевого значения [53, 119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется рассмотреть вопрос о переходе на прием тиамазола** у женщин с 16-й недели беременности [53, 119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется отменить прием антитиреоидных препаратов до 6 - 10 недели гестации, если беременность наступила на фоне приема низких доз тиамазола** (5 - 10 мг в сутки) или пропилтиоурацила (50 - 100 мг в сутки) [119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Начальная суточная доза антитиреоидных препаратов зависит от тяжести тиреотоксикоза: #тиамазол** 5 - 15 мг, пропилтиоурацил 50 - 200 мг. Эмбриопатия на фоне приема тиамазола** встречается у 2 - 4% детей, особенно в течение 6 - 10-й недели беременности. Распространенность врожденных дефектов одинакова при приеме пропилтиоурацила, но спектр дефектов менее выражен, поэтому препаратом выбора в I триместре является пропилтиоурацил. Во II и III триместре пропилтиоурацил (вследствие более выраженной гепатотоксичности) следует заменить тиамазолом** [132 - 135, 138].
Пропранолол** 10 - 40 мг 3 - 4 раза в день можно использовать, однако следует избегать длительного лечения, так как бета-адреноблокаторы могут вызывать ограничение внутриутробного роста, брадикардию плода и неонатальную гипогликемию [139].
- Рекомендуется оперативное лечение беременных женщин в случае тяжелого течения тиреотоксикоза и необходимости приема высоких доз антитиреоидных препаратов, а также непереносимости антитиреоидных препаратов (аллергические реакции или выраженная лейкопения), которое можно проводить во II триместре [53, 119, 138, 140].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. В I триместре высока вероятность спонтанного аборта, а в III - преждевременных родов [53, 118]. После тиреоидэктомии или предельно субтотальной резекции ЩЖ назначается заместительная терапия левотироксином натрия** из расчета 2,3 мкг/кг [53, 119, 113].
- Не рекомендуется проведение РЙТ беременным. РЙТ во время беременности абсолютно противопоказана [119, 141, 142].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. Если терапия натрия йодидом [131I] была случайно назначена беременной, ее необходимо информировать о радиационном риске, включая риск разрушения у плода ЩЖ, если натрий йодид [131I] был принят после 12-й недели беременности. Рекомендации "за" или "против" прерывания беременности, во время которой женщина получила натрия йодид [131I] отсутствуют.
- Рекомендуется отменить прием антитиреоидных препаратов до 10-й недели беременности у женщин, получающих низкие дозы тиамазола** (5 - 10 мг/сут) или пропилтиоурацила (50 - 100 мг/сут) [119, 143].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Только у 5% пациентов с отрицательными антителами к рецептору ТТГ развивается рецидив тиреотоксикоза в течение 8 недель после отмены антитиреоидных препаратов [144, 145]. Поэтому в I триместре возможна отмена антитиреоидных препаратов с обязательным исследованием уровня свободного тироксина (СТ4) сыворотки крови, и уровня тиреотропного гормона (ТТГ) в крови каждые 2 недели. Если у беременной женщины сохраняется эутиреоз, то функцию ЩЖ контролируют каждые 4 недели в течение II/III триместра.
- Рекомендуется определять содержание антител к рецептору тиреотропного гормона (ТТГ) в крови у беременных на 18 - 22-й неделе беременности [127, 128].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Антитела к рТТГ свободно проникают через трансплацентарный барьер и могут вызвать транзиторный тиреотоксикоз у плода и новорожденного [123, 124]. У женщин с повышенным уровнем антител к рТТГ (> 3-кратного увеличения) необходимо проведение УЗИ плода с целью выявления признаков нарушения функции ЩЖ, к которым относятся задержка роста, отечность, зоб, сердечная недостаточность. Если у женщины не определяются антитела к рТТГ, риск фетального или неонатального нарушения функции ЩЖ очень низок.
3.2.3. Послеродовой период и болезнь Грейвса
- Рекомендуется назначать те же методы лечения кормящим женщинам с БГ, что и не кормящим женщинам [119, 138].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется назначение тиамазола** женщинам во время лактации, учитывая опасения по поводу пропилтиоурацил-опосредованной гепатотоксичности [119, 138, 145].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Небольшие количества антитиреоидных препаратов поступают в грудное молоко, поэтому низкие дозы пропилтиоурацила (< 250 мг) и #тиамазола** (< 20 мг) считаются безопасными для матери и ребенка. Антитиреоидные препараты следует принимать после кормления ребенка грудью и в разделенных дозах [53, 119, 138].
3.3. Лечение болезни Грейвса у пациентов с эндокринной офтальмопатией.
Введение. Длительный некомпенсированный тиреотоксикоз является установленным фактором риска тяжелого течения ЭОП, что определяет необходимость компенсации тиреотоксикоза в максимально возможные сроки [146]. Остается актуальной проблема выбора метода лечения тиреотоксикоза у пациентов с ЭОП [147, 148]. Лечение болезни Грейвса всегда начинают с компенсации тиреотоксикоза антитиреоидными препаратами. В настоящее время нет убедительных данных о влиянии дозы или режима приема антитиреоидных препаратов (монотерапии или блокирования с последующим приемом левотироксина натрия**) на течение ЭОП, но в отдельных случаях, когда трудно добиться стойкой компенсации, схема "блокируй и замещай" может иметь преимущество, так как позволяет длительно поддерживать эутиреоидное состояние, не прибегая к титрованию дозы [149, 150]. Антитиреоидная терапия напрямую не влияет на течение ЭОП, но может оказывать положительный эффект опосредованно, через достижение эутиреоза. По данным ряда исследований, РЙТ вызывает прогрессирование ЭОП или ее развитие de novo [151], особенно у курильщиков, пациентов с ЭОП в анамнезе или недавно диагностированной [151], с поздней коррекцией гипотиреоза после РЙТ [152, 153] и высоким уровнем антител к рецептору ТТГ [154]. У пациентов группы риска эффективным является назначение низких доз пероральных глюкокортикоидов [155] на 3 день после РЙТ, согласно результатам двух рандомизированных контролируемых исследований [156, 157] и результатам двух метаанализов [158, 159]. Профилактическое назначение пероральных глюкокортикоидов не требуется у пациентов без ЭОП или у пациентов с неактивной ЭОП, если другие факторы риска развития ЭОП, ассоциированной с РЙТ, отсутствуют [160, 161].
У пациентов с ЭОП легкой степени, в неактивной фазе выбор метода лечения тиреотоксикоза проводится независимо от ЭОП ввиду малых рисков прогрессирования ЭОП [162]. Если методом выбора является РЙТ, профилактическое назначение пероральных глюкокортикоидов не показано при отсутствии других факторов риска прогрессирования ЭОП [163, 164]. Реабилитационная хирургия ЭОП может потребоваться с целью устранения косметических и функциональных дефектов.
У пациентов с ЭОП легкой степени, в активной фазе выбор метода лечения тиреотоксикоза не зависит от ЭОП и проводится согласно установленным критериям [2]. Если методом выбора является РЙТ, показано профилактическое назначение пероральных глюкокортикоидов [164].
У пациентов с ЭОП средней и тяжелой степени, в неактивной фазе выбор метода лечения тиреотоксикоза не зависит от ЭОП. Если методом выбора является РЙТ, профилактическое назначение пероральных глюкокортикоидов не требуется при отсутствии других факторов риска реактивации ЭОП [164].
У пациентов с ЭОП средней и тяжелой степени, в активной фазе быстрая нормализация функции ЩЖ и стойкое поддержание эутиреоза являются приоритетными [164]. Предпочтительным методом выбора радикального лечения является тиреоидэктомия [164, 165]. Рекомендована неотложная терапия ЭОП.
- Рекомендуется лечение тиреотоксикоза антитиреоидными препаратами и неотложное лечение ЭОП высокими дозами внутривенных глюкокортикоидов с последующей костной декомпрессией наружных стенок орбиты при условии отсутствия эффекта от лечения в течение 2 - 4 недель у пациентов с ЭОП тяжелой степени с угрозой потери зрения [164].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется быстрая нормализация функции ЩЖ и поддержание стойкого эутиреоза у пациентов с БГ и ЭОП [164].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется профилактическое назначение пероральных глюкокортикоидов после проведения РЙТ БГ пациентам группы риска прогрессирования ЭОП легкой степени в активной фазе [164].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется быстрое достижение и стойкая компенсация тиреотоксикоза с использованием антитиреоидной терапии у пациентов БГ с активной ЭОП средней и тяжелой степени. Лечение ЭОП должно быть приоритетным и выполнено до проведения радикального лечения тиреотоксикоза [164].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется проводить лечение тиреотоксикоза у пациентов БГ с неактивной ЭОП независимо от наличия ЭОП [164].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
3.4. Лечение субклинического тиреотоксикоза.
Субклинический тиреотоксикоз (СТ) ассоциирован с повышенным риском смертности от ИБС, фибрилляции предсердий, сердечной недостаточности, переломов и повышенной смертности у пациентов с уровнем ТТГ в сыворотке крови < 0,1 мМЕ/л [166 - 170]. Кроме того, при наличии антител к рецептору ТТГ, определяющих наличие БГ, частота прогрессирования СТ до явного гипертиреоза составляет до 30% в последующие 3 года [170]. В связи с этим, несмотря на отсутствие рандомизированных исследований, лечение показано пациентам старше 65 лет с уровнем ТТГ, который устойчиво составляет < 0,1 мМЕ/л, чтобы потенциально избежать этих серьезных нежелательных явлений и риска прогрессирования до явного гипертиреоза. Лечение также может быть рассмотрено у пациентов старше 65 лет с уровнем ТТГ 0,1 - 0,39 мМЕ/л из-за повышенного риска развития фибрилляции предсердий, а также может быть целесообразным у более молодых (< 65 лет) пациентов с ТТГ < 0,1 мМЕ/л из-за риска прогрессирования, особенно при наличии факторов риска или сопутствующей патологии.
- Рекомендуется лечение субклинического тиреотоксикоза пациентам с БГ > 65 лет с устойчивым уровнем ТТГ < 0,1 мМЕ/л [171].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется назначение антитиреоидных препаратов в качестве первого выбора лечения субклинического тиреотоксикоза пациентам с БГ [171].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
3.5. Лечение тиреотоксического криза.
Тиреотоксический криз (ТК) - опасное состояние, угрожающее жизни больного. При смертности, оцениваемой в 10%, ТК требует быстрой диагностики и экстренного лечения [172, 173]. Это состояние проявляется резким увеличением выраженности симптомов тиреотоксикоза, гипертермией, нарушением сознания, сердечной недостаточностью, диареей, желтухой. Диагностические критерии ТК у пациентов с тяжелым течением БГ включают лихорадку, тахикардию, аритмию, застойную сердечную недостаточность, возбуждение, бред, психоз, ступор, кому, тошноту, рвоту, диарею, печеночную недостаточность [174]. Общенациональные исследования в Японии выявили высокий уровень заболеваемости и смертности от этого заболевания и впоследствии предложили мультимодальное лечение (комплексный подход к лечению), включая прием тиамазола** или #пропилтиоурацила (40 мг или 400 мг каждые 8 ч, соответственно), системные глюкокортикоиды (#метилпреднизолон** 50 мг внутривенно), бета-адреноблокаторы (пропранолол** 40 мг каждые 6 ч) и мониторинг в отделении интенсивной терапии [175]. Наиболее частой причиной смерти от ТК была полиорганная недостаточность, за которой следовали сердечная и дыхательная недостаточность, аритмия, диссеминированное внутрисосудистое свертывание крови, перфорация желудочно-кишечного тракта, гипоксический синдром мозга и сепсис [176].
- Рекомендуется использовать мультимодальный подход к лечению пациентов с БГ и тиреотоксическим кризом, включающий терапию антитиреоидными препаратами, введение системных глюкокортикоидов, бета-адреноблокаторов, ликвидацию гипоксии, гипертермии, дегидратации, реанимационные мероприятия, симптоматическую терапию, пищевую поддержку, респираторную помощь и мониторинг в отделении интенсивной терапии [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
3.6. Лечение узлового/многоузлового токсического зоба (УТЗ/МТЗ).
Пациентам с УТЗ/МТЗ показана РЙТ или тиреоидэктомия после подготовки антитиреоидными препаратами. Длительное лечение антитиреоидными препаратами целесообразно лишь в случаях невозможности выполнить радикальное лечение (престарелый возраст, наличие тяжелой сопутствующей патологии).
- Рекомендуется проведение РЙТ или хирургического лечения пациентам с УТЗ/МТЗ. Длительное лечение антитиреоидными препаратами целесообразно лишь в случаях невозможности выполнить радикальное лечение [14, 177, 178].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. При принятии решения о лечении следует учитывать несколько клинических и демографических факторов, а также предпочтения пациента. После постановки диагноза лечащий врач и пациент должны обсудить каждый из вариантов лечения, включая преимущества, ожидаемую скорость выздоровления, побочные эффекты. Показания к РЙТ включают пожилой возраст пациента, сопутствующую коморбидную патологию, предшествующие операции на ЩЖ, небольшой размер зоба [178]. Показаниями к хирургическому лечению являются: наличие симптомов компрессии органов шеи, большой размер зоба (> 80 см3), загрудинное расположение зоба [179, 180].
Предварительное лечение тиамазолом** перед проведением РЙТ при УТЗ/МТЗ должно обсуждаться для пациентов, имеющих повышенный риск развития осложнений в связи с усилением тиреотоксикоза, включая пожилых пациентов и тех, у кого имеются заболевания сердечно-сосудистой системы или тяжелый тиреотоксикоз [181].
- Рекомендуется проведение терапии бета-адреноблокаторами и антитиреоидными препаратами перед РЙТ, пока не будет достигнут эутиреоз (нормализация уровня свободного тироксина (СТ4), свободного трийодтиронина (СТ3) крови и уровня тиреотропного гормона (ТТГ) в крови у пациентов с УТЗ/МТЗ, которые находятся в группе повышенного риска развития осложнений за счет усугубления тиреотоксикоза, включая пожилых и пациентов с заболеваниями сердечно-сосудистой системы или тяжелым тиреотоксикозом [14, 182, 183].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется рассмотреть возможность возобновления приема антитиреоидных препаратов через 3 - 7 дней после проведения РЙТ у пациентов с повышенным риском осложнений вследствие обострения тиреотоксикоза [14, 182 - 184].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Если антитиреоидные препараты используются при подготовке к РЙТ у пациентов с УТЗ/МТЗ, следует не допускать нормализации или повышения уровня ТТГ, чтобы предупредить прямое воздействие РЙТ на перинодулярную и контралатеральную нормальную ткань ЩЖ, что увеличивает риск развития гипотиреоза [183, 184].
- Рекомендуется вводить однократно достаточную активность натрия йодида [131I] пациентам с УТЗ/МТЗ для ликвидации тиреотоксикоза и восстановления эутиреоза [14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Для лечения УТЗ/МТЗ применяют более высокие активности (350 - 450 Гр), поскольку натрия йодид [131I] поглощается только автономными участками и частота развития гипотиреоза значительно ниже, чем при РЙТ БГ [185, 186]. Целью лечения автономии может быть деструкция автономно функционирующей ткани с восстановлением эутиреоза, хотя достижение гипотиреоза и в этой ситуации более надежно страхует от рецидива тиреотоксикоза.
- Рекомендуется наблюдение пациентов после РЙТ по поводу УТЗ/МТЗ в течение 1 - 2 месяцев с оценкой уровня свободного тироксина (СТ4) сыворотки крови и уровня тиреотропного гормона (ТТГ) в крови. Исследование уровня свободного тироксина (СТ4) сыворотки крови и уровня тиреотропного гормона (ТТГ) в крови следует проводить с интервалом от 4 до 6 недель в течение 6 месяцев или до тех пор, пока у пациента не разовьется гипотиреоз и он не будет стабильно получать заместительную терапию гормонами щитовидной железы. В дальнейшем - как минимум 1 раз в год по клиническим показаниям [14, 186 - 188].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. РЙТ УТЗ/МТЗ приводит к восстановлению эутиреоза примерно у 55% пациентов через 3 месяца и у 80% пациентов через 6 месяцев [187, 188]. Объем зоба уменьшается в течение 24 месяцев примерно на 40% [189]. Риск персистирующего или рецидивирующего тиреотоксикоза варьирует от 0 до 30%, в зависимости от исходных данных [188].
- Рекомендуется повторное проведения РЙТ у пациентов с УТЗ/МТЗ, если тиреотоксикоз сохраняется в течение 6 месяцев [189].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. В рефрактерных случаях стойкого тиреотоксикоза, вызванного УТЗ/МТЗ, после РЙТ может быть рассмотрено хирургическое вмешательство [190, 191]. У некоторых пациентов с персистирующим тиреотоксикозом после РЙТ назначение антитиреоидных препаратов с последующим исследованием уровня свободного тироксина (СТ4) сыворотки крови и уровня тиреотропного гормона (ТТГ) в крови позволяет контролировать тиреотоксикоз до тех пор, пока РЙТ не станет эффективной.
- Рекомендуется достижение эутиреоза на фоне терапии антитиреоидными препаратами, возможно в комбинации с бета-адреноблокаторами у пациентов с УТЗ/МТЗ, если в качестве метода лечения выбрана операция [14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Операцией выбора при МТЗ является тиреоидэктомия [191 - 193]. Резекция пораженной доли ЩЖ может рассматриваться при УТЗ [194]. После тиреоидэктомии по поводу МТЗ показано исследование уровня ионизированного кальция в крови и, основываясь на полученных результатах, дополнительное назначение препаратов кальция и витамина D и его аналогов. После тиреоидэктомии по поводу МТЗ заместительная терапия препаратами #левотироксина натрия** должна быть начата в дозе, соответствующей весу пациента (1,7 мкг/кг) [53, 113, 119]. ТТГ должен определяться каждые 2 месяца до тех пор, пока он не стабилизируется, а затем - ежегодно. После операции по поводу УТЗ уровень ТТГ и СТ4 должны быть определены через 4 - 6 недель и при устойчивом повышении уровня ТТГ должна быть начата терапия препаратами левотироксина натрия**.
- Рекомендуется исследование уровня ионизированного кальция в крови и уровня паратиреоидного гормона в крови пациентам после тиреоидэктомии по поводу МТЗ для решения вопроса о назначении терапии препаратами кальция и витамина D и его аналогов на основе полученных результатов [109].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
- Рекомендуется начинать заместительную терапию гормонами щитовидной железы в дозе, соответствующей весу и возрасту у пациентов после тиреоидэктомии по поводу МТЗ. Исследовать уровень тиреотропного гормона (ТТГ) в крови следует каждые 1 - 2 месяца до стабильного уровня, а затем ежегодно [195].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3).
- Рекомендуется исследовать уровень свободного тироксина (СТ4) сыворотки крови и уровень тиреотропного гормона (ТТГ) в крови через 4 - 6 недель после гемитиреоидэктомии у пациентов с УТЗ с целью начала приема препаратов левотироксина натрия**, если наблюдается стойкое повышение ТТГ выше референсного диапазона [196].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. После гемитиреоидэктомии по поводу УТЗ не требуется исследовать уровень общего или ионизированного кальция в крови. Назначение гормонов щитовидной железы требуется примерно у 15 - 20% пациентов после гемитиреоидэктомии [191, 193, 196]. Уровень ТТГ может оставаться в высоком нормальном диапазоне в течение 3 - 6 месяцев после гемитиреоидэктомии, поэтому продолжение наблюдения у бессимптомного пациента в течение 4 - 6 месяцев после операции является целесообразным, поскольку может произойти восстановление нормальной функции ЩЖ.
- Рекомендуется проведение РЙТ пациентам после неадекватной по объему операции по поводу МТЗ и персистенции тиреотоксикоза для достижения гипотиреоза [197].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии. Стойкий или рецидивирующий тиреотоксикоз после операции свидетельствует о неадекватности хирургического вмешательства. Поскольку повторная операция на ЩЖ сопряжена со значительно повышенным риском гипопаратиреоза и повреждения возвратного нерва, методом выбора лечения тиреотоксикоза является терапия натрия йодидом [131I] [197].
- Рекомендуется длительное (пожизненное) лечение антитиреоидными препаратами УТЗ/МТЗ у пожилых или иных больных пациентов с ограниченной ожидаемой продолжительностью жизни, а также у пациентов с повышенным хирургическим риском, которым противопоказано хирургическое вмешательство или РЙТ, а также пациентам, которые предпочитают этот вариант лечения [198].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. Антитиреоидные препараты не вызывают ремиссии у пациентов с УТЗ/МТЗ. Поэтому прекращение лечения приводит к рецидиву тиреотоксикоза. Однако длительная (пожизненная) терапия антитиреоидными препаратами может быть лучшим выбором для некоторых лиц с ограниченной ожидаемой продолжительностью жизни и с противопоказаниями к хирургическому лечению или РЙТ [198]. Необходимая доза тиамазола** для восстановления эутиреоидного состояния у пациентов с УТЗ/МТЗ обычно составляет (5 - 10 мг/сут).
Лечение субклинического тиреотоксикоза и тиреотоксического криза у пациентов с УТЗ/МТЗ описано в разделах 3.5, 3.6.
3.7. Иное лечение.
До достижения эутиреоза следует ограничить физическую нагрузку и прием препаратов йода, отказаться от курения. Пациенты с симптомами ЭОП направляются на консультацию к врачу-офтальмологу. Пациенты с тиреоидной кардиопатией, нарушением ритма сердца должны наблюдаться врачом-кардиологом. При нелеченом тиреотоксикозе, отсутствии компенсации на фоне проводимого лечения, несоблюдении рекомендаций врача повышается риск развития аритмий, недостаточности кровообращения, тромбоэмболических осложнений.
3.8. Редкие формы тиреотоксикоза [199]
E05.3. Тиреотоксикоз с эктопией тиреоидной ткани: синдром тиреотоксикоза при трофобластических опухолях, струма яичника (struma ovarii), пузырный занос, хориокарцинома (хорионэпителиома).
Пузырный занос (развивается во время беременности и характеризуется отеком всех или части ворсин хориона, гиперплазией трофобласта) и хорионэпителиома (злокачественная опухоль, исходящая из клеток трофобласта) секретируют большие количества хорионического гонадотропина (ХГ). ХГ, подобно ТТГ стимулирует тиреоциты ЩЖ, вызывая развитие тиреотоксикоза. Решающее значение в постановке диагноза имеют: наличие маточных кровотечений, связь с беременностью и родами, характерные признаки на УЗИ яичников и наличие высокого титра ХГ в сыворотке крови и моче.
Струма яичника - доброкачественная опухоль (тератома), по гистологической структуре похожа на ЩЖ, продуцирует тиреоидные гомоны, вызывая тиреотоксикоз. Диагноз устанавливается, как правило, на основании анамнеза, данных УЗИ малого таза, повышенного захвата радиофармпрепарата в области малого таза при сканировании всего тела. Злокачественная струма яичника чаще всего имеет картину папиллярного рака.
E05.4. Тиреотоксикоз искусственный: медикаментозный тиреотоксикоз, ятрогенный тиреотоксикоз, передозировка гормонов щитовидной железы - патологическое состояние, обусловленное поступлением в организм избыточного количества тиреоидных гормонов. Диагноз при ятрогенном тиреотоксикозе не представляет затруднений, если знать, какие препараты принимал больной. Отсутствие зоба и наличие тиреоидэктомии в анамнезе также свидетельствуют о медикаментозном тиреотоксикозе. При сцинтиграфии ЩЖ выявляется низкий захват радиофармпрепарата. При УЗИ - размеры ЩЖ нормальные, уменьшены или не визуализируются после тиреоидэктомии.
E05.8. Гиперсекреция тиреостимулирующего гормона: ТТГ-продуцирующая аденома гипофиза: увеличение уровня ТТГ, ![]() -субъединицы ТТГ, Диагностика ТТГ-секретирующей аденомы гипофиза основывается на сочетании высоких уровней ТТГ и тиреоидных гормонов, снижении уровней СТ3 и СТ4 на фоне введения соматостатина и аналогов пролонгированного действия, визуализации макроаденомы или микроаденомы при МРТ гипофиза. Дифференциальный диагноз с синдромом резистентности к тиреоидным гормонам (мутации в гене b-изоформы рецептора к тиреоидным гормонам). Лечение - оперативное.
-субъединицы ТТГ, Диагностика ТТГ-секретирующей аденомы гипофиза основывается на сочетании высоких уровней ТТГ и тиреоидных гормонов, снижении уровней СТ3 и СТ4 на фоне введения соматостатина и аналогов пролонгированного действия, визуализации макроаденомы или микроаденомы при МРТ гипофиза. Дифференциальный диагноз с синдромом резистентности к тиреоидным гормонам (мутации в гене b-изоформы рецептора к тиреоидным гормонам). Лечение - оперативное.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Пациенты с тиреотоксикозом должны находиться под активным наблюдением врача-эндокринолога. Вовремя начатое адекватное лечение способствует более быстрому восстановлению эутиреоидного состояния и предотвращает развитие осложнений. До достижения эутиреоза следует ограничить физическую нагрузку и поступление препаратов йода, отказаться от курения.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Первичная профилактика не проводится. Скрининг экономически не оправдан.
Среди провоцирующих аутоиммунный тиреотоксикоз факторов внешней среды предполагают инфекцию, но это остается недоказанным. Другой фактор - стресс. Имеются случаи быстрого развития тиреотоксикоза после тяжелых потрясений. Известна, например, высокая частота этого заболевания среди узников концлагерей и в период ведения войн. У пациентов с функциональной автономией ЩЖ развитие тиреотоксикоза может быть вызвано избыточным потреблением йода, введением препаратов йода.
План наблюдения. Все пациенты с клиническими и лабораторными признаками тиреотоксикоза должны быть направлены на консультацию к врачу-эндокринологу для проведения дифференциальной диагностики различных форм тиреотоксикоза и определения тактики лечения. В дальнейшем пациента может наблюдать врач общей практики (семейный врач) и при необходимости консультировать врач-эндокринолог. Пациенты с симптомами ЭОП направляются на консультацию к врачу-офтальмологу. При обследовании важно определить тяжесть и активность ЭОП, решить вопрос об экстренной или плановой госпитализации в специализированные центры. В срочном направлении на госпитализацию нуждаются пациенты с необъяснимым ухудшением остроты зрения, изменением интенсивности цветового зрения, неожиданным выпадением глаза из глазницы, видимым помутнением роговицы, лагофтальмом, отеком диска зрительного нерва. Пациенты с тиреоидной кардиопатией, нарушением ритма сердца должны наблюдаться у врача-кардиолога или врача-терапевта.
Консервативное лечение ДТЗ проводится в течение 12 - 18 месяцев. Основное условие - восстановление эутиреоидного состояния и нормализация уровня СТ3, СТ4 и ТТГ. Пациенту показано исследование СТ3 и СТ4 в первые 2 - 3 месяца. Затем определяют уровень ТТГ. После нормализации ТТГ достаточно исследовать только его уровень. Перед отменой консервативного лечения определяют уровень антител к рецептору тиреотропного гормона (ТТГ) в крови. В случае рецидива тиреотоксикоза решают вопрос о радикальном лечении. Пациенты с функциональной автономией (токсическими формами узлового зоба) после нормализации уровня СТ3 и СТ4 направляются на РЙТ или оперативное лечение.
6. Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
1) декомпенсация тиреотоксикоза (плановая госпитализация);
2) осложненные формы тиреотоксикоза: фибрилляция предсердий, сердечная недостаточность, тромбоэмболические осложнения, надпочечниковая недостаточность, токсический гепатит, дистрофические изменения паренхиматозных органов, психоз, кахексия и др. (экстренная госпитализация);
3) Тиреотоксический криз (экстренная госпитализация);
4) декомпенсация тиреотоксикоза, осложненного ЭОП (плановая, экстренная).
Показания к выписке пациента из медицинской организации.
Стойкое улучшение состояния пациента, отсутствие необходимости в дальнейшем его пребывании в стационаре.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
При нелеченом тиреотоксикозе, отсутствии нормализации тиреоидных гормонов на фоне проводимого лечения, несоблюдении рекомендаций врача повышается риск развития аритмий, недостаточности кровообращения, тромбоэмболических осложнений.
Критерии оценки качества медицинской помощи
Таблица 3. Критерии оценки качества медицинской помощи взрослым при Тиреотоксикозе с диффузным зобом (болезнь Грейвса), узловым/многоузловым зобом
N
Критерии качества
Оценка выполнения Да/нет
1
Выполнено исследование уровня тиреотропного гормона (ТТГ) в крови до начала лечения
Да/нет
2
Выполнено исследование уровня свободного тироксина (СТ4) сыворотки крови
Да/нет
3
Выполнено исследование уровня свободного трийодтиронина (СТ3) в крови
Да/нет
4
Выполнено определение содержания антител к рецептору тиреотропного гормона (ТТГ) в крови
Да/нет
5
Выполнен общий (клинический) анализ крови развернутый с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы)
Да/нет
6
Выполнен общий (клинический) анализ мочи лицам с диагностированным тиреотоксикозом
Да/нет
7
Выполнен анализ крови биохимический общетерапевтический до начала лечения: исследование уровня альбумина в крови, исследование уровня мочевины в крови, исследование уровня общего билирубина в крови, исследование уровня глюкозы в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня неорганического фосфора в крови, исследование уровня хлоридов в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови
Да/нет
8
Выполнена регистрация электрокардиограммы в покое лицам с диагностированным тиреотоксикозом
Да/нет
9
Выполнено ультразвуковое исследование щитовидной железы и паращитовидных желез
Да/нет
10
Выполнено ультразвуковое исследование щитовидной железы и паращитовидных желез с дуплексным сканированием сосудов щитовидной железы
Да/нет
11
Выполнена сцинтиграфия щитовидной железы при наличии тиреотоксикоза и узлового/многоузлового зоба
Да/нет
12
Выполнен прием (осмотр, консультация) врача-офтальмолога первичный при наличии симптомов ЭОП
Да/нет
13
Выполнен прием (осмотр, консультация) врача-кардиолога первичный при наличии нарушений ритма сердца, фибрилляции предсердий, экстрасистолии, сердечной недостаточности
Да/нет
14
Назначена/проведена коррекция антитиреоидной терапии тиамазолом**/пропилтиоурацилом в соответствии с клиническими рекомендациями
Да/нет
Список литературы
1. Фадеев В.В., Абрамова Н.А., Прокофьев С.А., Гитель Е.П., Мельниченко Г.А, Дедов И.И. Антитела к рецептору ТТГ в дифференциальной диагностике токсического зоба. Проблемы эндокринологии. 2005; 51(4): 10 - 18. doi: 10.14341/probl200551410-18
2. Свириденко Н.Ю., Лихванцева В.Г., Беловалова И.М., Шеремета М.С., Табеева К.И. Антитела к рецептору ТТГ как предикторы тяжести и исходов эндокринной офтальмопатии у пациентов с болезнью Грейвса. Проблемы эндокринологии. 2011; 2: 23 - 26. doi: 10.14341/probl201157223-26
3. Smith TJ, Hegedus L. Graves' disease. N Engl J Med. 2016; 375: 1552 - 1565. doi: 10.1056/NEJMra1510030
4. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. М.: ГЭОТАР-Медиа; 2009. 422 с.
5. Rapoport B, McLachlan SM. TSH receptor cleavage into subunits and shedding of the Asubunit; a molecular and clinical perspective. Endocr Rev. 2016; 37: 114 - 134. doi: 10.1210/er.2015-1098
6. Smith TJ, Hegedus L, Douglas RS. Role of insulin-like growth factor-1 (IGF-1) pathway in the pathogenesis of Graves' orbitopathy. Best Pract Res. Clin Endocrinol Metab. 2012; 26(3): 291 - 302. doi: 10.1016/j.beem.2011.10.002
7. Brix TH, Kyvik KO, Christensen K, Hegedus L: Evidence for a major role of heredity in Graves' disease: a population-based study of two Danish twin cohorts. J Clin Endocrinol Metab. 2001; 86: 930 - 934. doi: 10.1210/jcem.86.2.7242.
8. Inaba H, De Groot LJ, Akamizu T: Thyrotropin receptor epitope and human leukocyte antigen in Graves' disease. Front Endocrinol. 2016; 7: 120. doi: 10.3389/fendo.2016.00120.
9. Lee HJ, Li CW, Hammerstad SS, Stefan M, Tomer Y. Immunogenetics of autoimmune thyroid diseases: a comprehensive review. J Autoimmun. 2015; 64: 82 - 90. doi: 10.1016/j.jaut.2015.07.009.
10. Brix TH, Hansen PS, Kyvik KO, Hegedus L. Cigarette smoking and risk of clinically overt thyroid disease: a population-based twin case-control study. Arch Intern Med. 2000; 160: 661 - 666. doi: 10.1001/archinte.160.5.661.
11. Manji N, Carr-Smith JD, Boelaert K, et al. Influences of age, gender, smoking and family history on autoimmune thyroid disease phenotype. J Clin Endocrinol Metab. 2006; 91(12): 4873 - 4880. doi: 10.1210/jc.2006-1402.
12. Свириденко Н.Ю. Функциональная автономия при эндемическом зобе. Проблемы эндокринологии. 2005; 1: 40 - 42. doi: 10.14341/probl200551140-41
13. Gozu HI, Lublinghoff J, Bircan R, Paschke R. Genetics and phenomics of inherited and sporadic non-autoimmune hyperthyroidism. Mol Cell Endocrinol. 2010; 322: 125 - 134. doi: 10.1016/j.mce.2010.02.001
14. Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, Rivkees SA, Samuels M, Sosa JA, Stan MN, Walter MA. 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid. 2016; 26(10): 1343 - 1421. doi: 10.1089/thy.2016.0229
15. Российская ассоциация эндокринологов. Национальные рекомендации: Тиреотоксикоз с диффузным зобом (диффузный токсический зоб, болезнь Грейвса-Базедова), узловым/многоузловым зобом. М.; 2014.
16. Bahn RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I, Laurberg P, McDougall IR, Montori VM, Rivkees SA, Ross DS, Sosa JA, Stan MN. Hyperthyroidism and Other Causes of Thyrotoxicosis: Management Guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr. Pract. 2011; 17(3): 456 - 520. doi: 10.4158/ep.17.3.456
17. Nystrom HF, Jansson S, Berg G. Incidence rate and clinical features of hyperthyroidism in a long-term iodine sufficient area of Sweden (Gothenburg) 2003 - 2005. Clin Endocrinol. 2013; 78: 768 - 776. doi: 10.1111/cen.12060
18. McLeod DS, Caturegli P, Cooper DS, Matos PG, Hutfless S. Variation in rates of autoimmune thyroid disease by race/ethnicity in US military personnel. JAMA. 2014; 311: 1563 - 1565. doi: 10.1001/jama.2013.285606
19. Свириденко Н.Ю. Тиреотоксикоз. Национальное руководство "Общая врачебная практика"/под редакцией И.Н. Денисова, О.М. Лесняк. М.: ГЭОТАР-Медиа; 2013. С. 677 - 689.
20. van de Ven AC, Netea-Maier RT, de Vegt F, Ross HA, Sweep FC, Kiemeney LA, Smit JW, Hermus AR, den Heijer M. Associations between thyroid function and mortality: the influence of age. Eur J Endocrinol. 2014; 171(2): 183 - 191. doi: 10.1530/EJE-13-1070.
21. Asvold BO, Bjoro T, Platou C, Vatten LJ. Thyroid function and the risk of coronary heart disease: 12-year follow-up of the HUNT study in Norway. Clin Endocrinol (Oxf). 2012; 77: 911 - 917. doi: 10.1111/j.1365-2265.2012.04477.x.
22. Biondi B, Kahaly GJ. Cardiovascular involvement in patients with different causes of hyperthyroidism. Nat Rev Endocrinol. 2010; 6: 431 - 443. doi: 10.1038/nrendo.2010.105.
23. Selmer C, Olesen JB, Hansen ML, von Kappelgaard LM, Madsen JC, Hansen PR, Pedersen OD, Faber J, Torp-Pedersen C, Gislason GH. Subclinical and overt thyroid dysfunction and risk of all-cause mortality and cardiovascular events: a large population study. J Clin Endocrinol Metab. 2014; 99(7): 2372 - 2382. doi: 10.1210/jc.2013-4184
24. Дедов И.И., Калашников В.Ю., Терехин С.А., Головенко Е.Н., Свириденко Н.Ю., Мелкозеров К.В., Парфененкова А.А., Копылов Ф.Ю., Грибанова А.В. Фатальный спазм коронарной артерии у пациента с тиреотоксикозом. Кардиология. 2012; 52(11): 92 - 96. ISSN0022-9040
25. Свириденко Н.Ю., Тугеева Э.Ф., Арипов М.А., Бузиашвили Ю.И. Функциональный резерв сердца и показатели левого желудочка у больных диффузным токсическим зобом после медикаментозного восстановления эутиреоза тиамазолом. Проблемы эндокринологии. 2009; 55(3): 21 - 24. doi.10.14341/probl200955321-24
26. Арипов М.А., Свириденко Н.Ю., Тугеева Э.Ф., Бузиашвили Ю.И. Ремоделирование левого желудочка у больных тиреотоксикозом. Проблемы эндокринологии. 2009; 55(4): 11 - 15. doi.10.14341/probl200955411-15
27. Свириденко Н.Ю., Беловалова И.М., Шеремета М.С., Табеева К.И., Ремизов О.В. Болезнь Грейвса и эндокринная офтальмопатия/Под редакцией академика РАН И.И. Дедова и академика РАН Г.А. Мельниченко. М.: МАИ-ПРИНТ; 2012. 143 с.
28. Fadeyev V. Clinical Aspects of Thyroid Disorders in the Elderly Thyroid international. 2007; 3: 4 - 15.
29. Nanchen D, Gussekloo J, Westendorp RG, Stott DJ, Jukema JW, Trompet S, Ford I, Welsh P, Sattar N, Macfarlane PW, Mooijaart SP, Rodondi N, de Craen AJPROSPER Group. Subclinical thyroid dysfunction and the risk of heart failure in older persons at high cardiovascular risk. J Clin Endocrinol Metab. 2012: 97(3): 852 - 861. doi: 10.1210/jc.2011-1978.
30. Waring AC, Harrison S, Samuels MH, Ensrud KE, LeBLanc ES, Hoffman AR, Orwoll E, Fink HA, Barrett-Connor E, Bauer DC. Thyroid function and mortality in older men: a prospective study. J Clin Endocrinol Metab. 2012; 97(3): 862 - 870. doi: 10.1210/jc.2011-2684.
31. Ceresini G, Ceda GP, Lauretani F, Maggio M, Usberti E, Marina M, Bandinelli S, Guralnik JM, Valenti G, Ferrucci L. Thyroid status and 6-year mortality in elderly people living in a mildly iodine-deficient area: the aging in the Chianti Area Study. J Am Geriatr Soc. 2013; 61: 868 - 874.
32. Segna D, ![]() M, Limacher A, Baumgartner C, Blum MR, Beer JH, Kucher N, Righini M, Matter CM, Frauchiger B, Cornuz J, Aschwanden M, Banyai M, Osterwalder J, Husmann M, Egloff M, Staub D,
M, Limacher A, Baumgartner C, Blum MR, Beer JH, Kucher N, Righini M, Matter CM, Frauchiger B, Cornuz J, Aschwanden M, Banyai M, Osterwalder J, Husmann M, Egloff M, Staub D,  B, Angelillo-Scherrer A, Aujesky D, Rodondi N. Association between thyroid dysfunction and venous thromboembolism in the elderly: a prospective cohort study. J Thromb Haemost. 2016 Apr; 14(4): 685 - 94. doi: 10.1111/jth.13276
B, Angelillo-Scherrer A, Aujesky D, Rodondi N. Association between thyroid dysfunction and venous thromboembolism in the elderly: a prospective cohort study. J Thromb Haemost. 2016 Apr; 14(4): 685 - 94. doi: 10.1111/jth.13276
33. Sohn SY, Lee E, Lee MK, Lee JH. The Association of Overt and Subclinical Hyperthyroidism with the Risk of Cardiovascular Events and Cardiovascular Mortality: Meta-Analysis and Systematic Review of Cohort Studies. Endocrinol Metab (Seoul). 2020; 35(4): 786 - 800. doi: 10.3803/EnM.2020.728
34. Blum MR, Bauer DC, Collet TH, Fink HA, Cappola AR, da Costa BR, Wirth CD, Peeters RP, Asvold BO, den Elzen WP, Luben RN, Imaizumi M, Bremner AP, Gogakos A, Eastell R, Kearney PM, Strotmeyer ES, Wallace ER, Hoff M, Ceresini G, Rivadeneira F, Uitterlinden AG, Stott DJ, Westendorp RG, Khaw KT, Langhammer A, Ferrucci L, Gussekloo J, Williams GR, Walsh JP, Juni P, Aujesky D, Rodondi N, Thyroid Studies Collaboration. Subclinical thyroid dysfunction and fracture risk: a meta-analysis. JAMA. 2015; 313(20): 2055 - 2065. doi: 10.1001/jama.2015.5161.
35. Chaker L, Baumgartner C, Ikram MA, Dehghan A, Medici M, Visser WE, Hofman A, Rodondi N, Peeters RP, Franco OH. Subclinical thyroid dysfunction and the risk of stroke: a systematic review and meta-analysis. Eur J Epidemiol. 2014; 29(11): 791 - 800. doi: 10.1007/s10654-014-9946-8.
36. Bartalena L. Diagnosis and management of Graves disease: a global overview. Nat Rev Endocrinol. 2013; 9(12): 724 - 734. doi: 10.1038/nrendo.2013.193.
37. Grebe SK, Kahaly GJ. Laboratory testing in hyperthyroidism. Am J Med. 2012; 125(9): S2. doi: 10.1016/j.amjmed.2012.05.013.
38. Bartalena L, Burch HB, Burman KD, Kahaly GJ. A 2013 European survey of clinical practice patterns in the management of Graves'disease. Clin Endocrinol. 2016; 84(1): 115 - 120. doi: 10.1111/cen.12688.
39. Smith TJ, Hegedus LN. Graves' disease. Engl J Med. 2016; 375(16): 1552 - 1565. doi: 10.1056/NEJMra1510030
40. Kahaly GJ, Olivo PD. Graves' disease. N Engl J Med. 2017; 376(2): 184. doi: 10.1056/NEJMc1614624.
41. Tozzoli R, Bagnasco M, Giavarina D, Bizzaro N. TSH receptor autoantibody immunoassay in patients with Graves' disease: improvement of diagnostic accuracy over different generations of methods: systematic review and meta-analysis. Autoimmun Rev. 2012; 12(2): 107 - 113. doi: 10.1016/j.autrev.2012.07.003.
42. Kahaly GJ, Diana T. TSH receptor antibody functionality and nomenclature. Front Endocrinol. 2017; 8: 28. doi: 10.3389/fendo.2017.00028.
43. Ponto KA, Kanitz M, Olivo PD, Pitz S, Pfeiffer N, Kahaly GJ. Clinical relevance of thyroidstimulating immunoglobulins in graves'ophthalmopathy. Ophthalmology. 2011; 118 (11): 2279 - 2285. doi: 10.1016/j.ophtha.2011.03.030.
44. Ponto KA, Diana T, Binder H, Matheis N, Pitz S, Pfeiffer N, Kahaly GJ. Thyroid-stimulating immunoglobulins indicate the onset of dysthyroid optic neuropathy. J Endocrinol Invest. 2015; 38(7): 769 - 777. doi: 10.1007/s40618-015-0254-2
45. Kampmann E, Diana T, Kanitz M, Hoppe D, Kahaly GJ. Thyroid stimulating but not blocking autoantibodies are highly prevalent in severe and active thyroid-associated orbitopathy: a prospective study. Int J Endocrinol. 2015; 2015: 678194. doi: 10.1155/2015/678194.
46. Kiefer FW, Klebermass-Schrehof K, Steiner M, Worda C, Kasprian G, Diana T, Kahaly GJ, Gessl A. Fetal/neonatal thyrotoxicosis in a newborn from a hypothyroid woman with Hashimoto thyroiditis. J Clin Endocrinol Metab. 2017; 102(1): 6 - 9. doi: 10.1210/jc.2016-2999.
47. Goichot B, Bouee S, Castello-Bridoux C, Caron P: Survey of clinical practice patterns in the management of 992 hyperthyroid patients in France. Eur Thyroid J. 2017; 6(3): 152 - 159. doi: 10.1159/000453260
48. Hegedus L. Thyroid ultrasound. Endocrinol Metab Clin North Am. 2001; 30(2): 339 - 360. doi: 10.1016/s0889-8529(05)70190-0.
49. Erdogan MF, Anil C, Cesur M, Baskal N, Erdogan G. Color flow Doppler sonography for the etiologic diagnosis of hyperthyroidism. Thyroid. 2007; 17(3): 223 - 228. doi: 10.1089/thy.2006.0104.
50. Ralls PW, Mayekawa DS, Lee KP, Colletti PM, Radin DR, Boswell WD, Halls JM. Color-flow Doppler sonography in Graves disease: thyroid inferno. AJR Am J Roentgenol. 1988; 150(4): 781 - 784. doi: 10.2214/ajr.150.4.781.
51. Kim TK, Lee EJ: The value of the mean peak systolic velocity of the superior thyroidal artery in the differential diagnosis of thyrotoxicosis. Ultrasonography. 2015; 34(4): 292 - 296. doi: 10.14366/usg.14059
52. Bogazzi F, Vitti P. Could improved ultrasound and power Doppler replace thyroidal radioiodine uptake to assess thyroid disease? Nat Clin Pract Endocrinol Metab. 2008; 4(2): 70 - 71. doi: 10.1038/ncpendmet0692.
53. Kahaly GJ, Bartalena L, Hegedus L, Leenhardt L., Poppe K., Pearce S.H. 2018 European Thyroid Association Guideline for the Management of Graves' Hyperthyroidism. European Thyroid Journal. 2018; 7(4): 167 - 186. DOI: https: /doi.org/10.1159/000490384
54. Kwak JY, Han KH, Yoon JH, Moon HJ, Son EJ, Park SH, Jung HK, Choi JS, Kim BM, Kim EK. Thyroid Imaging Reporting and Data System for US Features of Nodules: A Step in Establishing Better Stratification of Cancer Risk. Radiology. 2011; 260(3): 892 - 899. doi: 10.1148/radiol.11110206
55. Wang J, Zhang R Evaluation of 99mTc-MIBI in thyroid gland imaging for the diagnosis of amiodarone-induced thyrotoxicosis. Br J Radiol. 2017 Mar; 90(1071): 20160836. doi: 10.1259/bjr.20160836
56. Свириденко Н.Ю., Платонова Н.М., Молашенко Н.В., Голицин С.П., Бакалов С.А., Сердюк С.Е. Эндокринные аспекты применения амиодарона в клинической практике. (Алгоритм наблюдения и лечения функциональных расстройств щитовидной железы). Российский кардиологический журнал. 2012; 2(94): 63 - 71.
57. Бельцевич Д.Г., Ванушко В.Э., Мельниченко Г.А., Румянцев П.О., Фадеев В.В. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению (много) узлового зоба у взрослых. Эндокринная хирургия. 2016; 10(1): 5 - 12. doi: 10.14341/serg201615-12
58. Yang J, Zhu YJ, Zhong JJ, Zhang J, Weng WW, Liu ZF, Xu Q, Dong MJ. Characteristics of antithyroid drug-induced agranulocytosis in patients with hyperthyroidism: a retrospective analysis of 114 cases in a single institution in China involving 9690 patients referred for radioiodine treatment over 15 years. Thyroid. 2016(5); 26: 627 - 633. doi: 10.1089/thy.2015.0439.
59. Watanabe N, Narimatsu H, Noh JY, Yamaguchi T, Kobayashi K, Kami M, Kunii Y, Mukasa K, Ito K, Ito K. Antithyroid drug-induced hematopoietic damage: a retrospective cohort study of agranulocytosis and pancytopenia involving 50,385 patients with Graves'disease. J Clin Endocrinol Metab. 2012; 97(1): E49 - E53. doi: 10.1210/jc.2011-2221.
60. Pearce SH. Spontaneous reporting of adverse reactions to carbimazole and propylthiouracil in the UK. Clin Endocrinol. 2004; 61(5): 589 - 594. doi: 10.1111/j.1365-2265.2004.02135.x.
61. Otsuka F, Noh JY, Chino T, Shimizu T, Mukasa K, Ito K, Ito K, Taniyama M. Hepatotoxicity and cutaneous reactions after antithyroid drug administration. Clin Endocrinol (Oxf). 2012; 77(2): 310 - 315. doi: 10.1111/j.1365-2265.2012.04365.x.
62. Свириденко Н.Ю., Колода Д.Е. Антитиреоидные средства. В кн.: Рациональная фармакотерапия заболеваний эндокринной системы и нарушения обмена веществ: Руководство для практикующих врачей/Под общ. ред. И.И. Дедова, Г.А. Мельниченко. М.: Литтерра, 2013. С. 85 - 90.
63. Laurberg P, Berman DC, Andersen S, Bulow Pedersen I: Sustained control of Graves' hyperthyroidism during long-term low-dose antithyroid drug therapy of patients with severe Graves' orbitopathy. Thyroid. 2011; 21(9): 951 - 956. doi: 10.1089/thy.2011.0039.
64. Cooper DS. Antithyroid drugs in the management of patients with Graves' disease: an evidence-based approach to therapeutic controversies. J Clin Endocrinol Metab. 2003; 88(8): 3474 - 3481. doi: 10.1210/jc.2003-030185.
65. Emiliano AB, Governale L, Parks M, Cooper DS. Shifts in propylthiouracil and methimazole prescribing practices: antithyroid drug use in the United States from 1991 to 2008. J Clin Endocrinol Metab. 2010; 95(5): 2227 - 2233. doi: 10.1210/jc.2009-2752.
66. Corvilain B, Hamy A., Brunaud L., Borson-Chazot F., Jacques Orgiazzi J., Hachmi LB., Semrouni M., Patrice Rodien P., Lepeutre C. Treatment of adult Graves' disease. Ann Endocrinol (Paris) (2018). doi.org/10.1016/j.ando.2018.08.003
67. Brito JP, Schilz S, Singh Ospina N, Rodriguez-Gutierrez R, Maraka S, Sangaralingham LR, Montori VM. Antithyroid drugs - the most common treatment for Graves' disease in the United States: a nationwide population-based study. Thyroid. 2016; 26(8): 1144 - 1145. doi: 10.1089/thy.2016.0222.
68. Hallberg P, Eriksson N, Ibanez L, Bondon-Guitton E, Kreutz R, Carva-jal A, et al. Genetic variants associated with antithyroid drug-induced agranulocytosis: a genome-wide association study in a European population. Lancet Diabetes Endocrinol. 2016; 4: 507 - 16.
69. Cooper DS. Antithyroid drugs. N Engl J Med. 2005; 3: 352(9): 905 - 917. doi: 10.1056/NEJMra042972.
70. Rivkees SA, Mattison DR. Ending propylthiouracil-induced liver failure in children. N Engl J Med. 2009; 360(15): 1574 - 1575. doi: 10.1056/NEJMc0809750.
71. Wang MT, Lee WJ, Huang TY, Chu CL, Hsieh CH. Antithyroid drug-related hepatotoxicity in hyperthyroidism patients: a populationbased cohort study. Br J Clin Pharmacol. 2014; 78(3): 619 - 629. doi: 10.1111/bcp.12336.
72. Nakamura H, Miyauchi A, Miyawaki N, Imagawa J. Analysis of 754 cases of antithyroid drug-induced agranulocytosis over 30 years in Japan. J Clin Endocrinol Metab. 2013; 98(12): 4776 - 4783. doi: 10.1210/jc.2013-2569
73. Yang J, Li LF, Xu Q, Zhang J, Weng WW, Zhu YJ, Dong MJ. Analysis of 90 cases of antithyroid drug-induced severe hepatotoxicity over 13 years in China. Thyroid. 2015; 25(3): 278 - 283. doi: 10.1089/thy.2014.0350.
74. Abraham P, Avenell A, McGeoch SC, Clark LF, Bevan JS. Antithyroid drug regimen for reating Graves' hyperthyroidism. Cochrane Database Syst Rev. 2010; 1: CD003420. doi: 10.1002/14651858.CD003420.pub4.
75. Sundaresh V, Brito JP, Wang Z, Prokop LJ, Stan MN, Murad MH, Bahn RS. Comparative effectiveness of therapies for Graves' hyperthyroidism: a systematic review and network meta-analysis. J Clin Endocrinol Metab. 2013; 98(9): 3671 - 3677. doi: 10.1210/jc.2013-1954.
76. Tagami T, Yambe Y, Tanaka T, Tanaka T, Ogo A, Yoshizumi H, Kaise K, Higashi K, Tanabe M, Shimazu S, Usui T, Shimatsu A, Naruse M. BBGD Study Group. Shortterm effects of beta-adrenergic antagonists and methimazole in new-onset thyrotoxicosis caused by Graves' disease. Intern Med. 2012; 51(17): 2285 - 2290. doi: 10.2169/internalmedicine.51.7302.
77. Biondi B, Fazio S, Carella C, Sabatini D, Amato G, Cittadini A, Bellastella A, Lombardi G, ![]() L. Control of adrenergic overactivity by beta-blockade improves the quality of life in patients receiving long term suppressive therapy with levothyroxine. J Clin Endocrinol Metab. 1994 May; 78(5): 1028 - 33. doi: 10.1210/jcem.78.5.8175955
L. Control of adrenergic overactivity by beta-blockade improves the quality of life in patients receiving long term suppressive therapy with levothyroxine. J Clin Endocrinol Metab. 1994 May; 78(5): 1028 - 33. doi: 10.1210/jcem.78.5.8175955
78. Struja T, Fehlberg H, Kutz A, Guebelin L, Degen C, Mueller B, Schuetz P. Can we predict relapse in Graves' disease? Results from a systematic review and meta-analysis. Eur J Endocrinol. 2017; 176: 87 - 97.
79. Vos XG, Endert E, Zwinderman AH, Tijssen JG, Wiersinga WM: Predicting the risk of recurrence before the start of antithyroid drug therapy in patients with Graves' hyperthyroidism. J Clin Endocrinol Metab. 2016; 101: 1381 - 1389.
80. Diana T, Krause J, Olivo PD, Konig J, Kanitz M, Decallonne B, Kahaly GJ: Prevalence and clinical relevance of thyroid stimulating hormone receptor-blocking antibodies in autoimmune thyroid disease. Clin Exp Immunol. 2017; 189: 304 - 309.
81. Diana T, Wьster C, Olivo PD, Unterrainer A, Kцnig J, Kanitz M, Bossowski A, Decallonne B, Kahaly GJ: Performance and specificity of six immunoassays for TSH receptor antibodies: a multicenter study. Eur Thyroid J. 2017; 6: 2.
82. Villagelin D, Romaldini JH, Santos RB, Milkos AB, Ward LS: Outcomes in relapsed Graves' disease patients following radioiodine or prolonged low dose of methimazole treatment. Thyroid. 2015; 25: 12821290.
83. Azizi F, Ataie L, Hedayati M, Mehrabi Y, Sheikholeslami F. Effect of long-term continuous methimazole treatment of hyperthyroidism: comparison with radioiodine. Eur J Endocrinol. 2005; 152: 695 - 701.
84. Donovan PJ, McLeod DS, Little R, Gordon L. Cost-utility analysis comparing radioactive iodine, anti-thyroid drugs and total thyroidectomy for primary treatment of Graves' disease. Eur J Endocrinol. 2016; 175(6): 595 - 603. doi: 10.1530/EJE-16-0527.
85. Фомин Д.К., Свириденко Н.Ю., Румянцев П.О. Терапия радиоактивным йодом. В кн.: Национальное руководство: Эндокринология/Под ред. И.И. Дедова, Г.А. Мельниченко. М.: ГЭОТАР-Медиа, 2016. С. 381 - 390.
86. ICRP, 2000. Pregnancy and Medical Radiation. ICRP Publication 84. Ann. ICRP 30 (1).
87. Meier DA, Brill DR, Becker DV, Clarke SE, Silberstein EB, Royal HD, Balon HR; Society of Nuclear Medicine. Procedure guideline for therapy of thyroid disease with (131)iodine. J Nucl Med. 2002 Jun; 43(6): 856 - 61. PMID: 12050333.
88. Kravets I. Hyperthyroidism: Diagnosis and Treatment. Am Fam Physician. 2016 Mar 1; 93(5): 363 - 70. PMID: 26926973.
89. American Thyroid Association Taskforce On Radioiodine Safety, Sisson JC, Freitas J, McDougall IR, Dauer LT, Hurley JR, Brierley JD, Edinboro CH, Rosenthal D, Thomas MJ, Wexler JA, Asamoah E, Avram AM, Milas M, Greenlee C. Radiation safety in the treatment of patients with thyroid diseases by radioiodine 131I: practice recommendations of the American Thyroid Association. Thyroid. 2011 Apr; 21(4): 335 - 46. doi: 10.1089/thy.2010.0403.
90. Berg GE,  EH, Jacobsson L, Lindberg S, Lindstedt RG, Mattsson S, Niklasson CA,
EH, Jacobsson L, Lindberg S, Lindstedt RG, Mattsson S, Niklasson CA, ![]() AH, Westphal OG. Radioiodine treatment of hyperthyroidism in a pregnant women. J Nucl Med. 1998; 39(2): 357 - 361. PMID: 9476950.
AH, Westphal OG. Radioiodine treatment of hyperthyroidism in a pregnant women. J Nucl Med. 1998; 39(2): 357 - 361. PMID: 9476950.
91. Sawka AM, Lakra DC, Lea J, Alshehri B, Tsang RW, Brierley JD, Straus S, Thabane L, Gafni A, Ezzat S, George SR, Goldstein DP. A systematic review examining the effects of therapeutic radioactive iodine on ovarian function and future pregnancy in female thyroid cancer survivors. Clin Endocrinol (Oxf). 2008; 69(3): 479 - 90. doi: 10.1111/j.1365-2265.2008.03222.x.
92. Silberstein EB, Alavi A, Balon HR, Clarke SE, Divgi C, Gelfand MJ, Goldsmith SJ, Jadvar H, Marcus CS, Martin WH, Parker JA, Royal HD, Sarkar SD, Stabin M, Waxman AD. The SNMMI practice guideline for therapy of thyroid disease with 131I 3.0. J Nucl Med. 2012 Oct; 53(10): 1633 - 51. doi: 10.2967/jnumed.112.105148. Epub 2012 Jul 11. PMID: 22787108.
93. Ross D.S. (2015) Radioiodine Treatment in Patients with Graves' Disease. In: Bahn R. (eds) Graves' Disease. Springer, New York, NY. https: //doi.org/10.1007/978-1-4939-2534-6_7
94. Iakovou, I., Giannoula, E., Exadaktylou, P., & Papadopoulos, N. (2021). RAI Therapy for Graves' Hyperthyroidism. In (Ed.), Graves' Disease. IntechOpen. https://doi.org/10.5772/intechopen.96083.
95. Stan MN, Durski JM, Brito JP, Bhagra S, Thapa P, Bahn RS. Cohort study on radioactive iodine-induced hypothyroidism: implications for Graves' ophthalmopathy and optimal timing for thyroid hormone assessment. Thyroid. 2013; 23(5): 620 - 625. doi: 10.1089/thy.2012.0258.
96. Nygaard B,  L, Gervil M, Hjalgrim H, Hansen BM,
L, Gervil M, Hjalgrim H, Hansen BM,  P, Hansen JM. Influence of compensated radioiodine therapy on thyroid volume and incidence of hypothyroidism in Graves' disease. J Intern Med. 1995; 238(6): 491 - 497. doi: 10.1111/j.1365-2796.1995.tb01230.x.
P, Hansen JM. Influence of compensated radioiodine therapy on thyroid volume and incidence of hypothyroidism in Graves' disease. J Intern Med. 1995; 238(6): 491 - 497. doi: 10.1111/j.1365-2796.1995.tb01230.x.
97. Sridama V, McCormick M, Kaplan EL, Fauchet R, DeGroot LJ. Long-term follow-up study of compensated low-dose 131I therapy for Graves' disease. N Engl J Med. 1984; 16: 311(7): 426 - 32. doi: 10.1056/NEJM198408163110702.
98. Фадеев В.В., Дроздовский Б.Я., Гусева Т.Н., Гарбузов П.И., Бузиашвили И.И., Мельниченко Г.А. Отдаленные результаты лечения токсического зоба радиоактивным 131I. Проблемы эндокринологии. 2005; 51(1): 3 - 9. doi.org/10.14341/probl20055113-9.
99. Esfahani AF, Kakhki VR, Fallahi B, Eftekhari M, Beiki D, Saghari M, Takavar A. Comparative evaluation of two fixed doses of 185 and 370 MBq 131I, for the treatment of Graves' disease resistant to antithyroid drugs. Hell J. Nucl. Med. 2005; 8(3): 158 - 161. PMID: 16390021.
100. Bonnema SJ,  L. Radioiodine therapy in benign thyroid diseases: effects, side effects, and factors affecting therapeutic outcome. Endocr Rev. 2012; 33(6): 920 - 80. doi: 10.1210/er.2012-1030.
L. Radioiodine therapy in benign thyroid diseases: effects, side effects, and factors affecting therapeutic outcome. Endocr Rev. 2012; 33(6): 920 - 80. doi: 10.1210/er.2012-1030.
101. Walter MA, Briel M, Christ-Crain M, Bonnema SJ, Connell J, Cooper DS, Bucher HC,  J,
J, ![]() B. Effects of antithyroid drugs on radioiodine treatment: systematic review and meta-analysis of randomised controlled trials. BMJ. 2007; 334(7592): 514. doi: 10.1136/bmj.39114.670150.BE.
B. Effects of antithyroid drugs on radioiodine treatment: systematic review and meta-analysis of randomised controlled trials. BMJ. 2007; 334(7592): 514. doi: 10.1136/bmj.39114.670150.BE.
102. Burch HB, Solomon BL, Cooper DS, Ferguson P, Walpert N, Howard R. The effect of antithyroid drug pretreatment on acute changes in thyroid hormone levels after (131)I ablation for Graves' disease. J Clin Endocrinol Metab. 2001 Jul; 86(7): 3016 - 21. doi: 10.1210/jcem.86.7.7639. PMID: 11443161.]
103. Andrade VA, Gross JL, Maia AL. Effect of methimazole pretreatment on serum thyroid hormone levels after radioactive treatment in Graves' hyperthyroidism. J Clin Endocrinol Metab. 1999; 84(11): 4012 - 4016. doi: 10.1210/jcem.84.11.6149.
104. Bonnema SJ, Bennedbaek FN, Gram J, Veje A, Marving J, Hegedus L. Resumption of methimazole after 131I therapy of hyperthyroid diseases: effect on thyroid function and volume evaluated by a randomized clinical trial. Eur J Endocrinol. 2003; 149(6): 485 - 492. doi: 10.1530/eje.0.1490485.
105. Bartalena L, Tanda ML, Piantanida E, Lai A. Glucocorticoids and outcome of radioactive iodine therapy for Graves' hyperthyroidism. Eur J Endocrinol. 2005; 153(1): 13 - 14. doi: 10.1530/eje.1.01938.
106. Lillevang-Johansen M, Abrahamsen B,  HL, Brix TH,
HL, Brix TH,  L. Excess Mortality in Treated and Untreated Hyperthyroidism Is Related to Cumulative Periods of Low Serum TSH. J Clin Endocrinol Metab. 2017; 1: 102(7): 2301 - 2309. doi: 10.1210/jc.2017-00166.
L. Excess Mortality in Treated and Untreated Hyperthyroidism Is Related to Cumulative Periods of Low Serum TSH. J Clin Endocrinol Metab. 2017; 1: 102(7): 2301 - 2309. doi: 10.1210/jc.2017-00166.
107. Corvilain B, Hamy A, Brunaud L, Borson-Chazot F, Orgiazzi J, Hachmi LB, Semrouni M, Rodien P, Lepeutre C. Consensus. Treatment of adult Graves' disease. 2018. Annales d'Endocrinologie. https: /doi.org/10.1016/j.ando.2018.08.003
108. Edafe O, Antakia R, Laskar N, Uttley L, Balasubramanian SP. Systematic review and meta-analysis of predictors of post-thyroidectomy hypocalcaemia. Br J Surg. 2014; 101(4): 307 - 320. doi: 10.1002/bjs.9384.
109. Guo Z, Yu P, Liu Z, Si Y, Jin M: Total thyroidectomy vs bilateral subtotal thyroidectomy in patients with Graves' diseases: a meta-analysis of randomized clinical trials. Clin Endocrinol. 2013; 79(5): 739 - 746. doi: 10.1111/cen.12209.
110. Sosa JA, Bowman HM, Tielsch JM, Powe NR, Gordon TA, Udelsman R. The importance of surgeon experience for clinical and economic outcomes from thyroidectomy. Ann Surg. 2008; 228(3): 320 - 330. doi: 10.1097/00000658 - 199809000-00005.
111. Genovese BM, Noureldine SI, Gleeson EM, Tufano RP, Kandil E. What is the best definitive treatment for Graves' disease? A systematic review of the existing literature. Ann Surg Oncol. 2013; 20(2): 660 - 667. doi: 10.1245/s10434-012-2606-x.
112. Piantanida E. Preoperative management in patients with Graves' disease. Gland Surg. 2017 Oct; 6(5): 476 - 481. doi: 10.21037/gs.2017.05.09
113. Трошина Е.А., Свириденко Н.Ю., Ванушко В.Э., Румянцев П.О., Фадеев В.В., Петунина Н.А. Федеральные клинические рекомендации по диагностике и лечению токсического зоба. Проблемы Эндокринологии. 2014; 60(6): 67 - 77. https: /doi.org/10.14341/probl201460667-77
114. Krassas GE, Poppe K, Glinoer D. Thyroid function and human reproductive health. Endocr Rev. 2010; 31(5): 702 - 755. doi: 10.1210/er.2009-0041.
115. Andersen SL, Olsen J, Laurberg P. Antithyroid drug side effects in the population and in pregnancy. J Clin Endocrinol Metab. 2016; 101(4): 1606 - 1614. doi: 10.1210/jc.2015-4274.
116. Andersen SL, Olsen J, Laurberg P. Maternal thyroid disease in the Danish National Birth Cohort: prevalence and risk factors. Eur J Endocrinol. 2016; 174(2): 203 - 212. doi: 10.1530/EJE-15-0816.
117. Li H, Zheng J, Luo J, Zeng R, Feng N, Zhu N, Feng O. Congenital anomalies in children exposed to antithyroid drugs in-utero: a meta-analysis of cohort studies. PloS One. 2015; 10(5): e0126610. doi: 10.1371/journal.pone.0126610.
118. Yoshihara Noh JY, Watanabe Fukushita M, Matsumoto M, Suzuki N, Hoshiyama A, Suzuki A, Mitsumatsu T, Kinoshita A, Kentaro Mikura K, Yoshimura R, Sugino K, Ito K. Exposure to Propylthiouracil in the First Trimester of Pregnancy and Birth Defects: A Study at a Single Institution. J Endocr Soc. 2021; 19; 5(3): 204. doi: 10.1210/jendso/bvaa204.
119. Эндокринные заболевания и беременность в вопросах и ответах. Руководство для врачей/под ред. И.И. Дедова, Г.А. Мельниченко, Ф.Ф. Бурумкуловой. Москва.: Е-ното, 2024. 336 с. ISBN 978-5-906023-36-0
120. Cooper DS, Laurberg P. Hyperthyroidism in pregnancy. Lancet Diabetes Endocrinol. 2013; 1(3): 238 - 249. doi: 10.1016/S2213-8587(13)70086-X.
121. Soldin OP, Tractenberg RE, Hollowell JG, Jonklaas J, Janicic N, Soldin SJ.  changes in maternal thyroid hormone, thyrotropin, and thyroglobulin concentrations during gestation: trends and associations across trimesters in iodine
changes in maternal thyroid hormone, thyrotropin, and thyroglobulin concentrations during gestation: trends and associations across trimesters in iodine  . Thyroid. 2004; 14(12): 1084 - 1090. doi: 10.1089/thy.2004.14.1084.
. Thyroid. 2004; 14(12): 1084 - 1090. doi: 10.1089/thy.2004.14.1084.
122. Lo JC, Rivkees SA, Chandra M, Gonzalez JR, Korelitz JJ, Kuzniewicz MW. Gestational thyrotoxicosis, antithyroid drug use and neonatal outcomes within an integrated healthcare delivery system. Thyroid. 2015; 25(6): 698 - 705. doi: 10.1089/thy.2014.0434.
123. Andersen SL, Olsen J, Carle A, Laurberg P. Hyperthyroidism incidence fluctuates widely in and around pregnancy and is at variance with some other autoimmune diseases: a Danish population-based study. J Clin Endocrinol Metab. 2015; 100(3): 1164 - 1171. doi: 10.1210/jc.2014-3588.
124. Grebe SK, Kahaly GJ. Laboratory testing in hyperthyroidism. Am J Med. 2012; 125(9): S2. doi: 10.1016/j.amjmed.2012.05.013.
125. Bartalena L, Burch HB, Burman KD, Kahaly GJ. A 2013 European survey of clinical practice patterns in the management of Graves'disease. Clin Endocrinol. 2016; 84(1): 115 - 120. doi: 10.1111/cen.12688.
126. Kahaly GJ, Olivo PD. Graves' disease. N Engl J Med. 2017; 376(2): 184. doi: 10.1056/NEJMc1614624.
127. McKenzie JM, Zakarija M. Fetal and neonatal hyperthyroidism and hypothyroidism due to maternal TSH receptor antibodies. Thyroid. 1992; 2(2): 155 - 159. doi: 10.1089/thy.1992.2.155.
128. Abeillon-du Payrat J, Chikh K, Bossard N, Bretones P, Gaucherand P, Claris O, Charrie A, Raverot V, Orgiazzi J, Borson-Chazot F, Bournaud C. Predictive value of maternal second-generation thyroid-binding inhibitory immunoglobulin assay for neonatal autoimmune hyperthyroidism. Eur J Endocrinol. 2014; 171(4): 451 - 460. doi: 10.1530/EJE-14-0254.
129. Nakamura H, Noh JY, Itoh K, Fukata S, Miyauchi A, Hamada N: Comparison of methimazole and propylthiouracil in patients with hyperthyroidism caused by Graves'disease. J Clin Endocrinol. Metab. 2007; 92: 2157 - 2162.
130. Yoshihara A, Noh J, Yamaguchi T, Ohye H, Sato S, Sekiya K, Kosuga Y, Suzuki M, Matsumoto M, Kunii Y, Watanabe N, Mukasa K, Ito K, Ito K. Treatment of Graves' disease with antithyroid drugs in the first trimester of pregnancy and the prevalence of congenital malformation. J Clin Endocrinol Metab. 2012; 97: 2396 - 2403.
131. Andersen SL, Olsen J, Laurberg P. Antithyroid drug side effects in the population and in pregnancy. J Clin Endocrinol Metab. 2016; 101: 1606 - 1614.
132. Andersen SL,  L, Olsen J, Vestergaard P, Andersen S. Maternal thyroid function, use of antithyroid drugs in early pregnancy, and birth defects. J Clin Endocrinol Metab. 2019; 104(12): 6040 - 6048. doi: 10.1210/jc.2019-01343.
L, Olsen J, Vestergaard P, Andersen S. Maternal thyroid function, use of antithyroid drugs in early pregnancy, and birth defects. J Clin Endocrinol Metab. 2019; 104(12): 6040 - 6048. doi: 10.1210/jc.2019-01343.
133. Seo GH, Kim TH, Chung JH. Antithyroid drugs and congenital malformations: a nationwide Korean cohort study. Ann Intern Med. 2018; 168(6): 405 - 413. doi: 10.7326/M17-1398.
134. Li H, Zheng J, Luo J, Zeng R, Feng N, Zhu N, Feng O. Congenital anomalies in children exposed to antithyroid drugs in-utero: a meta-analysis of cohort studies. PloS One. 2015; 10(5): e0126610. doi: 10.1371/journal.pone.0126610.
135. Andersen SL, Olsen J, Wu CS, Laurberg P. Severity of birth defects after propylthiouracil exposure in early pregnancy. Thyroid. 2014; 24(10): 1533 - 1540. doi: 10.1089/thy.2014.0150.
136. Laurberg P, Andersen SL. Therapy of endocrine disease: antithyroid drug use in early pregnancy and birth defects: time windows of relative safety and high risk? Eur J Endocrinol. 2014; 171(1): 13 - R20. doi: 10.1530/EJE-14-0135.
137. Korelitz JJ, McNally DL, Masters MN, Li SX, Xu Y, Rivkees SA. Prevalence of thyrotoxicosis, antithyroid medication use, and complications among pregnant women in the United States. Thyroid. 2013; 23(6): 758 - 765. doi: 10.1089/thy.2012.0488.
138. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, Grobman WA, Laurberg P, Lazarus JH, Mandel SJ, Peeters RP, Sullivan S. 2017 guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017; 27(3): 315 - 389. doi: 10.1089/thy.2016.0457.
139. Rubin PC. Current concepts: beta-blockers in pregnancy. N Engl J Med. 1981; 305(22): 1323 - 1326. doi: 10.1056/NEJM198111263052205.
140. Laurberg P, Bournaud C, Karmisholt J, Orgiazzi J. Management of Graves' hyperthyroidism in pregnancy: focus on both maternal and foetal thyroid function, and caution against surgical thyroidectomy in pregnancy. Eur J Endocrinol. 2009; 160(1): 1 - 8. doi: 10.1530/EJE-08-0663.
141. Sawka AM, Lakra DC, Lea J, Alshehri B, Tsang RW, Brierley JD, Straus S, Thabane L, Gafni A, Ezzat S, George SR, Goldstein. A systematic review examining the effects of therapeutic radioactive iodine on ovarian function and future pregnancy in female thyroid cancer survivors. Clin Endocrinol. 2008; 69(3): 479 - 490. doi: 10.1111/j.1365-2265.2008.03222.x
142. Tran P, Desimone S, Barrett M, Bachrach B. I-131 treatment of graves' disease in an unsuspected first trimester pregnancy; the potential for adverse effects on the fetus and a review of the current guidelines for pregnancy screening. Int J Pediatr Endocrinol. 2010; 2010: 858359. doi: 10.1155/2010/858359.
143. Nedrebo BG, Holm PI, Uhlving S, Sorheim JI, Skeie S, Eide GE, Husebye ES, Lien EA, Aanderud S. Predictors of outcome and comparison of different drug regimens for the prevention of relapse in patients with Graves' disease. Eur J Endocrinol. 2002; 147(5): 583 - 589. doi: 10.1530/eje.0.1470583.
144. Laurberg P/Remission of Graves' disease during anti-thyroid drug therapy: time to reconsider the mechanism? Eur J Endocrinol. 2006; 155(6): 783 - 786. doi: 10.1530/eje.1.02295.
145. Mandel SJ, Cooper DS. The use of antithyroid drugs in pregnancy and lactation. J Clin Endocrinol Metab. 2001; 86(6): 2354 - 2359. doi: 10.1210/jcem.86.6.7573.
146. Bartalena L, Marcocci C, Bogazzi F, Manetti L, Tanda ML, Dell'Unto E, Bruno-Bossio G, Nardi M, Bartolomei MP, Lepri A, Rossi G, Martino E, Pinchera A. Relation between therapy for hyperthyroidism and the course of Graves' ophthalmopathy. N Engl J Med. 1998; 338: 73 - 78. doi: 10.1056/NEJM199801083380201.
147. Tallstedt L, Lundell G, Torring O, Wallin G, Ljunggren JG, Blomgren H, Taube A. Occurrence of ophthalmopathy after treatment for Graves' hyperthyroidism. The Thyroid Study Group. N Engl J Med. 1992; 326: 1733 - 1738. doi: 10.1056/NEJM199206253262603.
148. Bartalena L. The dilemma of how to manage Graves' hyperthyroidism in patients with associated orbitopathy. J Clin Endocrinol Metab. 2011; 96: 592 - 599. doi: 10.1210/jc.2010-2329.
149. Табеева К.И. Клиническое течение эндокринной офтальмопатии после хирургического лечения болезни Грейвса. Дисс.... к-та мед. наук. М.$ 2010. С 51 - 69.
150. Laurberg P, Wallin G, Tallstedt L, Abraham-Nordling M, Lundell G, Torring O. TSH-receptor autoimmunity in Graves' disease after therapy with anti-thyroid drugs, surgery, or radioiodine: a 5-year prospective randomized study. Eur J Endocrinol. 2008; 158: 69 - 75. DOI: 10.1530/EJE-07-0450.
151. Chen DY., Schneider PF., Zhang XS., Luo XY, He ZM, Chen TH. Changes in graves' ophthalmopathy after radioiodine and anti-thyroid drug treatment of Graves' disease from 2 prospective, randomized, open-label, blinded end point studies. Exp Clin Endocrinol Diabetes. 2014; 122(1): 1 - 6. doi: 10.1055/s-0033-1358484.
152. Bartalena L, Baldeschi L, Boboridis K, Eckstein A, Kahaly GJ, Marcocci C, Perros P, Salvi M, Wiersinga WM. European Group on Graves Orbitopathy: The 2016 European Thyroid Association/European Group on Graves' Orbitopathy guidelines for the management of Graves' orbitopathy. Eur Thyroid J. 2016; 5: 9 - 26. doi: 10.1159/000443828.
153. Tallstedt L, Lundell G, Blomgren H, Bring J. Does early administration of thyroxine reduce the development of Graves' ophthalmopathy after radioiodine treatment? Eur J Endocrinol. 1994; 130: 494 - 497. doi: 10.1530/eje.0.1300494.
154. Karlsson F, Dahlberg P, Jansson R, Westermark K, Enoksson P. Importance of TSH receptor activation in the development of severe endocrine ophthalmopathy. Acta Endocrinol. 1989; 121(2): 132 - 141.
155. Bartalena L, Macchia PE, Marcocci C, Salvi M, Vermiglio F. Effects of treatment modalities for Graves' hyperthyroidism on Graves' orbitopathy: a 2015 Italian Society of Endocrinology Consensus Statement. J Endocrnol Invest. 2015; 38: 481 - 487. doi: 10.1007/s40618-015-0257-z.
156. Lai A, Sassi L, Compri E, Marino F, Sivelli P, Piantanida E, Tanda ML, Bartalena L. Lower dose prednisone prevents radioiodine-associated exacerbation of initially mild or absent Graves' orbitopathy: a retrospective cohort study. J Clin Endocrinol Metab. 2010; 95: 1333 - 1337. doi: 10.1210/jc.2009-2130.
157. Perros P, Kendall-Taylor P, Neoh C, Frewin S, Dickinson J. A prospective study of the effects of radioiodine therapy for hyperthyroidism in patients with minimally active Graves' ophthalmopathy. J Clin Endocrinol Metab. 2005; 90: 5321 - 5323. doi: 10.1210/jc.2005-0507.
158. Acharya SH, Avenell A, Philip S, Burr J, Bevan JS, Abraham P. Radioiodine therapy (RAI) for Graves' disease (GD) and the effect on ophthalmopathy: a systematic review. Clin Endocrinol. 2008; 69: 943 - 950. doi: 10.1111/j.1365-2265.2008.03279.x.
159. Shiber S, Stiebel-Kalish H, Shimon I, Grossman A, Robenshtok E. Glucocorticoid regimens for prevention of Graves' ophthalmopathy progression following radioiodine treatment: systematic review and meta-analysis. Thyroid. 2014; 24: 1515 - 1523. doi: 10.1089/thy.2014.0218.
160. Bartalena L, Marcocci C, Bogazzi F, Panicucci M, Lepri A, Pinchera A. Use of corticosteroids to prevent progression of Graves' ophthalmopathy after radioiodine therapy for hyperthyroidism. N Engl J Med. 1989; 321: 1349 - 1352. doi: 10.1056/NEJM198911163212001.
161. Traisk F, Tallstedt L, Abraham-Nordling M, Andersson T, Berg G, Calissendorff J, Hallengren B, Hedner P, Lantz M, Nystrom E, Ponjavic V, Taube A, Torring O, Wallin G, Asman P, Lundell G. Thyroid Study Group of TT 96: Thyroid-associated ophthalmopathy after treatment for Graves' hyperthyroidism with antithyroid drugs or iodine-131. J Clin Endocrinol Metab. 2009; 94: 3700 - 3707. doi: 10.1210/jc.2009-0747.
162. Vannucchi G, Campi I, Covelli D, Dazzi D, Curro N, Simonetta S, Ratiglia R, Beck-Peccoz P, Salvi M. Graves' orbitopathy activation after radioactive iodine therapy with and without steroid prophylaxis. J Clin Endocrinol Metab. 2009; 94: 3381 - 3386. doi: 10.1210/jc.2009-0506.
163. Kung AW, Yau CC, Cheng A. The incidence of ophthalmopathy after radioiodine therapy for Graves' disease: prognostic factors and the role of methimazole. J Clin Endocrinol Metab. 1994; 79: 542 - 546. doi: 10.1210/jcem.79.2.7913934.
164. Bartalena L, Kahaly GJ, Baldeschi L, Dayan CM, Eckstein A, Marcocci C,  M, Vaidya B, Wiersinga WM, EUGOGO. The 2021 European Group on Graves' orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves' orbitopathy. Eur J Endocrinol. 2021; 185(4): G43 - G67. doi: 10.1530/EJE-21-0479.
M, Vaidya B, Wiersinga WM, EUGOGO. The 2021 European Group on Graves' orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves' orbitopathy. Eur J Endocrinol. 2021; 185(4): G43 - G67. doi: 10.1530/EJE-21-0479.
165. Marcocci C, Bruno-Bossio G, Manetti L, Tanda ML, Miccoli P, Iacconi P, Bartolomei MP, Nardi M, Pinchera A, Bartalena L. The course of Graves' ophthalmopathy is not influenced by near total thyroidectomy: a case-control study. Clin Endocrinol. 1999; 51: 503 - 508. doi: 10.1046/j.1365-2265.1999.00843.x.
166. Biondi B, Bartalena L, Cooper DS, Hegedus L, Laurberg P, Kahaly GJ. The 2015 European Thyroid Association guidelines on diagnosis and treatment of endogenous subclinical hyperthyroidism. Eur Thyroid J. 2015; 4(3): 149 - 163. doi: 10.1159/000438750.
167. Collet TH, Gussekloo J, Bauer DC, den Elzen WP, Cappola AR, Balmer P, Iervasi G, Asvold BO, Sgarbi JA, Volzke H, Gencer B, Maciel RM, Molinaro S, Bremner A, Luben RN, Maisonneuve P, Cornuz J, Newman AB, Khaw KT, Westendorp RG, Franklyn JA, Vittinghoff E, Walsh JP, Rodondi N. Thyroid Studies Collaboration: Subclinical hyperthyroidism and the risk of coronary heart disease and mortality. Arch Intern Med. 2012; 172(10): 799 - 809. doi: 10.1001/archinternmed.2012.402.
168. Gencer B, Collet TH, Virgini V, Bauer DC, Gussekloo J, Cappola AR, Nanchen D, den Elzen WP, Balmer P, Luben RN, Iacoviello M, Triggiani V, Cornuz J, Newman AB, Khaw KT, Jukema JW, Westendorp RG, Vittinghoff E, Aujesky D, Rodondi N. Thyroid Studies Collaboration: Subclinical thyroid dysfunction and the risk of heart failure events: an inpidual participant data analysis from 6 prospective cohorts. Circulation. 2012; 126(9): 1040 - 1049. doi: 10.1161/CIRCULATIONAHA.112.096024.
169. Wirth CD, Blum MR, da Costa BR, Baumgartner C, Collet TH, Medici M, Peeters RP, Aujesky D, Bauer DC, Rodondi N. Subclinical thyroid dysfunction and the risk for fractures: a systematic review and meta-analysis. Ann Intern Med. 2014; 161(3): 189 - 199. doi: 10.7326/M14-0125.
170. Blum MR, Bauer DC, Collet TH, Fink HA, Cappola AR, da Costa BR, Wirth CD, Peeters RP, Asvold BO, den Elzen WP, Luben RN, Imaizumi M, Bremner AP, Gogakos A, Eastell R, Kearney PM, Strotmeyer ES, Wallace ER, Hoff M, Ceresini G, Rivadeneira F, Uitterlinden AG, Stott DJ, Westendorp RG, Khaw KT, Langhammer A, Ferrucci L, Gussekloo J, Williams GR, Walsh JP, Juni P, Aujesky D, Rodondi N. Thyroid Studies Collaboration: Subclinical thyroid dysfunction and fracture risk: a meta-analysis. JAMA. 2015; 313(20): 2055 - 2065. doi: 10.1001/jama.2015.5161.
171. Zhyzhneuskaya S, Addison C, Tsatlidis V, Weaver JU, Razvi S. The natural history of subclinical hyperthyroidism in Graves' disease: the rule of thirds. Thyroid. 2016; 26(6): 765 - 769. doi: 10.1089/thy.2015.0470.
172. Satoh T, Isozaki O, Suzuki A, Wakino S, Iburi T, Tsuboi K, Kanamoto N, Otani H, Furukawa Y, Teramukai S, Akamizu T. 2016 guidelines for the management of thyroid storm from the Japan Thyroid Association and Japan Endocrine Society (first edition). Endocr J. 2016; 63: 1025 - 1064. doi: 10.1507/endocrj.EJ16-0336.
173. Akamizu T. Thyroid storm: a Japanese perspective. Thyroid. 2018; 28: 32 - 40. doi: 10.1089/thy.2017.0243.
174. Burch HB, Wartofsky L. Life-threatening thyrotoxicosis: thyroid storm. Endocrinol Metab Clin North Am. 1993; 22: 263 - 277.
175. Akamizu T, Satoh T, Isozaki O, Suzuki A, Wakino S, Iburi T, Tsuboi K, Monden T, Kouki T, Otani H, Teramukai S, Uehara R, Nakamura Y, Nagai M, Mori M. Japan Thyroid Association: Diagnostic criteria, clinical features, and incidence of thyroid storm based on nationwide surveys. Thyroid. 2012; 22: 661 - 679. doi: 10.1089/thy.2011.0334
176. Isozaki O, Satoh T, Wakino S, Suzuki A, Iburi T, Tsuboi K, Kanamoto N, Otani H, Furukawa Y, Teramukai S, Akamizu T. Treatment and management of thyroid storm: analysis of the nationwide surveys: the taskforce committee of the Japan Thyroid Association and Japan Endocrine Society for the establishment of diagnostic criteria and nationwide surveys for thyroid storm. Clin Endocrinol. 2016; 84: 912 - 918. doi: 10.1111/cen.12949.
177. Brandt F, Thvilum M, Almind D, Christensen K, Green A, Hegedus L, Brix TH. Graves' disease and toxic nodular goiter are both associated with increased mortality but differ with respect to the cause of death: a Danish population-based register study. Thyroid. 2013; 23: 408 - 413. doi: 10.1089/thy.2012.0500
178. Erkan ME, Demirin H, Asik M, Celbek G, Yildirim M, Aydin Y, Gungor A, Dogan AS. Efficiency of radioactive I-131 therapy in geriatric patients with toxic nodular goiter. Aging Clin Exp Res. 2012; 24: 714 - 717. doi: 10.3275/8759
179. Kang AS, Grant CS, Thompson GB, van Heerden JA. 2002 Current treatment of nodular goiter with hyperthyroidism (Plummer's disease): surgery versus radioiodine. Surgery. 2002; 132: 916 - 923; discussion 923. doi: 10.1067/msy.2002.128691.
180. Porterfield JRJr, Thompson GB, Farley DR, Grant CS, Richards ML. Evidence-based management of toxic multinodular goiter (Plummer's disease). World J Surg. 2008; 32: 1278 - 1284. doi: 10.1007/s00268-008-9566-0.
181. Albino CC, Graf H, Sampaio AP, Vigario A, Paz-Filho GJ. Thiamazole as an adjuvant to radioiodine for volume reduction of multinodular goiter. Expert Opin Investig Drugs. 2008; 17: 1781 - 1786. doi: 10.1517/13543780802501325.
182. Gharib H, Papini E, Paschke R, Duick DS, Valcavi R, Hegedus L, Vitti P AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: executive summary of recommendations. Endocr Pract. 2010; 16: 468 - 475. doi: 10.4158/10024.GL.
183. Lee YY, Tam KW, Lin YM, Leu WJ, Chang JC, Hsiao CL, Hsu MT, Hsieh AT. Recombinant human thyrotropin before (131) I therapy in patients with nodular goitre: a meta-analysis of randomized controlled trials. Clin Endocrinol (Oxf). 2015; 83: 702 - 710. doi: 10.1210/jc.2004-1550.
184. Zakavi SR, Mousavi Z, Davachi B. Comparison of four different protocols of I-131 therapy for treating single toxic thyroid nodule. Nucl Med Commun. 2009; 30: 169 - 175. doi: 10.1097/MNM.0b013e3283169148.
185. Camargo R, Corigliano S, Friguglietti C, Gauna A, Harach R, Munizaga F, Niepomniszcze H, Pitoia F, Pretell E, Vaisman M, Ward LS, Wohllk N, Tomimori E. Latin American thyroid society. Latin American thyroid society recommendations for the management of thyroid nodules. Arq Bras Endocrinol Metabol. 2009; 53: 1167 - 1175. doi: 10.1590/s0004 - 27302009000900014.
186. Ceccarelli C, Bencivelli W, Vitti P, Grasso L, Pinchera A. Outcome of radioiodine-131 therapy in hyperfunctioning thyroid nodules: a 20 years' retrospective study. Clin Endocrinol (Oxf). 2005; 62: 331 - 335. doi.10.1111/j.1365-2265.2005.02218.x
187. Nygaard B, Hegedus L, Ulriksen P, Nielsen KG, Hansen JM. Radioiodine therapy for multinodular toxic goiter. Arch Intern Med. 1999; 159: 1364 - 1368. doi: 10.1001/archinte.159.12.1364.
188. Akbulut, A., Aydinbelge, F.N., & Koca, G. (2017). Radioiodine Treatment for Benign Thyroid Diseases. In (Ed.), Radionuclide Treatments. IntechOpen. https: //doi.org/10.5772/intechopen.68575
189. Vidal-Trecan GM, Stahl JE, Eckman MH. Radioiodine or surgery for toxic thyroid adenoma: dissecting an important decision. A cost-effectiveness analysis. Thyroid. 2004; 14: 933 - 945. doi: 10.1089/thy.2004.14.933.
190. Wahl RA, Rimpl I, Saalabian S, Schabram J. Differentiated operative therapy of thyroid autonomy (Plummer's disease). Exp Clin Endocrinol Diabetes. 1998; 4: 78 - 84.
191. Hisham AN, Azlina AF, Aina EN, Sarojah A. Total thyroidectomy: the procedure of choice for multinodular goitre. Eur J Surg. 2001; 167: 403 - 405.
192. Agarwal G, Aggarwal V. Is total thyroidectomy the surgical procedure of choice for benign multinodular goiter? An evidence-based review. World J Surg. 2008; 32(7): 1313 - 24. doi: 10.1007/s00268-008-9579-8.
193. Mishra A, Agarwal A, Agarwal G, Mishra SK. Total thyroidectomy for benign thyroid disorders in an endemic region. World J Surg. 2001; 25: 307 - 310. doi: 10.1007/s002680020100.
194. Stoll SJ, Pitt SC, Liu J, Schaefer S, Sippel RS, Chen H. Thyroid hormone replacement after thyroid lobectomy. Surgery. 2009; 146: 554 - 558; discussion 558 - 60. doi: 10.1016/j.surg.2009.06.026
195. Di Donna V, Santoro MG, de Waure C, Ricciato MP, Paragliola RM, Pontecorvi A, Corsello SM. 2014 A new strategy to estimate levothyroxine requirement after total thyroidectomy for benign thyroid disease. Thyroid. 2014 Dec; 24(12): 1759 - 64. doi: 10.1089/thy.2014.0111
196. Matte R, Ste-Marie LG, Comtois R, D'Amour P, Lacroix A, Chartrand R, Poisson R, Bastomsky CH. The pituitary-thyroid axis after hemithyroidectomy in euthyroid man. J Clin Endocrinol Metab. 1981; 53: 377 - 380. doi: 10.1210/jcem-53-2-377.
197. Thomusch O, Machens A, Sekulla C, Ukkat J, Lippert H, Gastinger I, Dralle H. Multivariate analysis of risk factors for postoperative complications in benign goiter surgery: prospective multicenter study in Germany. World J Surg. 2000; 24: 1335 - 1341. doi: 10.1007/s002680010221.
198. Takats KI, Szabolcs I, Foldes J, Foldes I, Ferencz A, Rimanoczy E, Goth M, Dohan O, Kovacs L, Szilagyi G. The efficacy of long term thyrostatic treatment in elderly patients with toxic nodular goitre compared to radioiodine therapy with different doses. Exp Clin Endocrinol Diabetes. 1999; 107: 70 - 74. doi: 10.1055/s-0029-1212076.
199. Мельниченко Г.А., Ларина И.И. Синдром тиреотоксикоза. Дифференциальная диагностика и лечение. Терапевтический архив. 2018; 90(10): 4 - 13. DOI: https: /doi.org/10.26442/terarkh201890104-13
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
РУКОВОДИТЕЛИ:
Дедов И.И., д.м.н., профессор, академик РАН, Москва, Президент Российской ассоциации эндокринологов.
Мокрышева Н.Г., д.м.н., профессор, член-корреспондент РАН, Москва, член Российской ассоциации эндокринологов.
Мельниченко Г.А., д.м.н., профессор, академик РАН, Москва, вице-президент Российской ассоциации эндокринологов.
Рабочая группа:
1. Трошина Е.А. - член-корр. РАН, профессор, д.м.н., член Общественной организации "Российская ассоциация эндокринологов".
2. Свириденко Н.Ю. - профессор, д.м.н., член Общественной организации "Российская ассоциация эндокринологов".
3. Платонова Н.М. - д.м.н., член Общественной организации "Российская ассоциация эндокринологов"
4. Беловалова И.М. - к.м.н., член Общественной организации "Российская ассоциация эндокринологов".
5. Шеремета М.С. - к.м.н., член Общественной организации "Российская ассоциация эндокринологов".
6. Бессмертная Е.Г. - к.м.н., член Общественной организации "Российская ассоциация эндокринологов".
7. Яновская Е.А. - к.м.н., член Общественной организации "Российская ассоциация эндокринологов".
8. Александров Ю.К. - д.м.н., член Ассоциации эндокринных хирургов, член Совета Ассоциации эндокринных хирургов.
9. Ясюченя В.С. - врач-эндокринолог, член Общественной организации "Российская ассоциация эндокринологов".
10. Сырцова Е.И. - врач-эндокринолог, член Общественной организации "Российская ассоциация эндокринологов".
Конфликт интересов:
Ни у кого из членов рабочей группы при разработке настоящих клинических рекомендаций не возникло конфликта интересов, а именно персональной заинтересованности в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей, а также иных обязанностей, в том числе связанных с разработкой и рассмотрением клинических рекомендаций, вследствие противоречия между личной заинтересованностью указанных лиц и интересами пациентов
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. врач-эндокринолог;
2. врач общей практики (семейный врач);
3. врач-офтальмолог;
4. врач-терапевт;
5. врач-кардиолог;
6. врач-радиолог;
7. врач-радиотерапевт;
8. врач ультразвуковой диагностики;
9. врач-хирург.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
ATX-классификация
Международное непатентованное название
Суточная доза
Кратность приема (раз/сутки)
Длительность действия (часы)
гормоны щитовидной железы
Левотироксин натрия**
-
1 раз
24
антитиреоидные препараты серосодержащие производные имидазола
Тиамазол**
20 - 40 мг
2 - 3 раза
24
неселективные бета-адреноблокаторы
Пропранолол**
40 - 160 мг
2 - 4 раза
20 - 24
селективные бета-адреноблокаторы
#Бисопролол**
2,5 - 5 мг [77]
1 раз
24
Атенолол**
50 - 100 мг
1 раз
24
Диагностические радиофармацевтические средства
-
-
-
#Натрия пертехнетат [99mTc]**
-
-
-
#технеция [99mTc] сестамиби** (99Tc-технетрил)
-
185 - 370 MBq [55]
1 раз
-
Приказ Минздрава России от 28.02.19 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации"
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
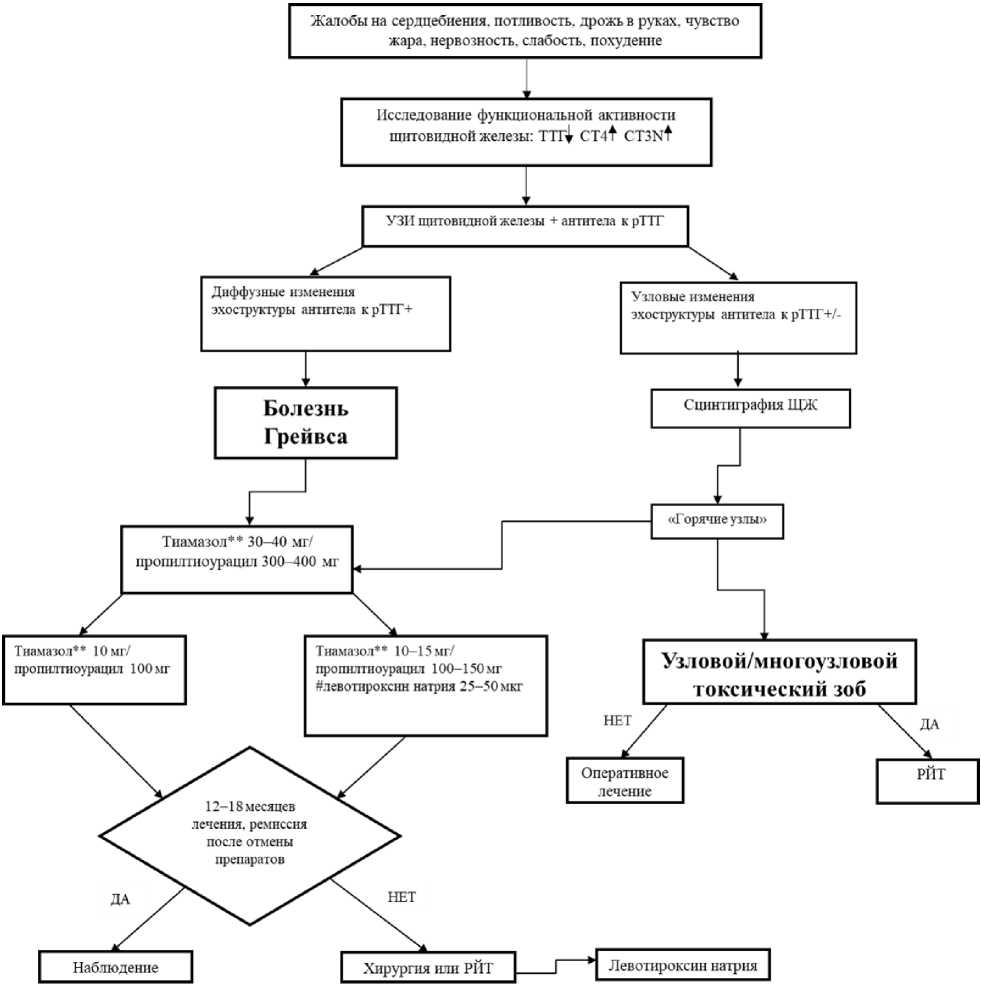
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
ЩЖ вырабатывает два гормона: Т4 и очень небольшие количества Т4. Эти гормоны с током крови доставляются к каждой клетке и контролируют работу этих клеток. Если же гормонов по той или иной причине становится слишком много, развивается тиреотоксикоз.
Наиболее типичными симптомами тиреотоксикоза являются: похудение, частый пульс с неприятным ощущением сердцебиений, мышечная слабость, быстрая утомляемость. Опасен тиреотоксикоз тяжелыми изменениями, в первую очередь со стороны сердца. Если он долго не лечится, в сердечной мышце развиваются дистрофические изменения, которые проявляются нарушениями ритма (фибрилляция или мерцание предсердий), а в дальнейшем - сердечной недостаточностью. Кроме того, стойкие изменения развиваются со стороны центральной нервной системы, костей, печени и других органов; на этом фоне нарушается работа половой системы.
Существует три метода лечения тиреотоксикоза: консервативная медикаментозная терапия антитиреоидными препаратами, хирургическое лечение и терапия радиоактивным йодом (Йод-131-содержащие средства). Если пациенту назначен курс тиреостатической терапии, ему необходимо регулярно принимать препараты и проходить гормональные исследования. Пациент должен незамедлительно прекратить прием препаратов и обратиться к врачу при появлении симптомов, которые могут быть связаны с наличием агранулоцитоза или повреждением печени: при появлении зудящей сыпи, желтухи (пожелтения кожных покровов), ахолического кала или потемнения мочи, артралгии, болей в животе, тошноты, лихорадки или фарингита. Вероятность стойкой ремиссии, т.е. выздоровления, существенно ниже у курящих. В связи с этим им необходимо прекратить курение.
До тех пор, пока не придет в норму уровень гормонов ЩЖ, необходимо значительно ограничить физическую активность. Нередко пациентов с тяжелым тиреотоксикозом нужно госпитализировать в эндокринологический стационар. После того, как нормализуется уровень тиреоидных гормонов, физическую активность можно постепенно расширять, тем не менее, слишком интенсивных нагрузок все-таки лучше избегать. Доказательные данные о том, что смена часовых и климатических поясов может отразиться на течении заболевания, на сегодняшний день отсутствуют. При передозировке антитиреоидных препаратов может развиться медикаментозный гипотиреоз. Его симптомами являются: сонливость, снижение памяти, задержка жидкости и отечность, вялость работы кишечника, депрессия, нередко увеличение ЩЖ. При регулярном контроле уровня тиреоидных гормонов (в начале лечения ежемесячном) можно своевременно скорректировать дозу препаратов.
Планировать беременность во время тиреостатической терапии нельзя - такая беременность несет повышенный риск, а ее ведение требует высокой квалификации врача-эндокринолога. Если речь идет о мужчинах, принимающих антитиреоидные препараты, эта терапия не является противопоказанием к зачатию ребенка.
Выбор метода лечения тиреотоксикоза не следует полностью возлагать на врача - в этом должен принимать участие и сам пациент. Врач совместно с пациентом должен взвесить все за и против того или иного метода лечения и его последствий. После хирургического удаления ЩЖ или РЙТ развивается гипотиреоз, который требует регулярного проведения заместительной терапии, качество жизни у пациентов при этом не страдает. Гипотиреоз - не осложнение, а в большинстве случаев цель лечения.
При нелеченом тиреотоксикозе, отсутствии компенсации на фоне проводимого лечения, несоблюдении рекомендаций врача повышается риск развития аритмий, недостаточности кровообращения, тромбоэмболических осложнений.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не предусмотрено
