"Клинические рекомендации "Брадиаритмии и нарушения проводимости"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
БРАДИАРИТМИИ И НАРУШЕНИЯ ПРОВОДИМОСТИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I44, I46, I44.0, I44.1, I44.2, I44.3, I44.4, I44.5, I44.6, I44.7, I45.0, I45.1, I45.2, I45.3, I45.4, I45.5, I45.8, I45.9, I46.0, I46.1, I46.9, I49.5
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 160_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации Ассоциация сердечно-сосудистых хирургов России, Общероссийская общественная организация "Российское кардиологическое общество", Всероссийское научное общество специалистов по клинической электрофизиологии, аритмологии и электростимуляции
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
ААТ - антиаритмическая терапия
БА - брадиаритмия
БЛНПГ - блокада левой ножки пучка Гиса
БНПГ - блокада ножки пучка Гиса
БПНПГ - блокада правой ножки пучка Гиса
ВВФСУ - время восстановления функции синусового узла
ВПС - врожденные пороки сердца
Временная электрокардиостимуляция сердца - временная электрокардиостимуляция чрескожным доступом или временная электрокардиостимуляция наружным доступом
ГКМП - гипертрофическая кардиомиопатия
ДСУ - дисфункция синусового узла
ДН - дистанционное наблюдение за показателями частоты сердечных сокращений
ЕОК - Европейское общество кардиологов
ИБС - ишемическая болезнь сердца
ИКМ - имплантируемые кардиомониторы
ИМ - инфаркт миокарда
КС - каротидный синус
КТ/МСКТ - компьютерная томография сердца с внутривенным контрастированием и ЭКГ синхронизаций
ЛЖ - левый желудочек
МЖП - межжелудочковая перегородка
МРТ - Магнитно-резонансная томография
ОМТ - оптимальная медикаментозная терапия
ПЖ - правый желудочек
ПЖБ - предсердно-желудочковая блокада
ПЖС - предсердно-желудочковое соединение
ПЖУ - предсердно-желудочковый узел
ПСС - проводящая система сердца
ПФН - проведение теста с физической нагрузкой с использованием эргометра
ПЭКС - постоянный электрокардиостимулятор
ПЭТ - позитронно-эмиссионная томография миокарда
РКО - Российское кардиологическое общество
РФ - Российская Федерация
СН - сердечная недостаточность
СНнФВ - сердечная недостаточность с низкой ФВ
СНсФВ - сердечная недостаточность с сохранной ФВ ЛЖ
СНусФВ - сердечная недостаточность с промежуточной ФВ (40 - 49%)
СПБ - синусно-предсердная блокада
СПГ - стимуляция пучка Гиса
СПУ - синусно-предсердный узел
СРТ - Имплантация трехкамерного электрокардиостимулятора (ресинхронизирующая терапия), Имплантация электрокардиостимулятора трехкамерного (бивентрикулярного) эндоваскулярным доступом/имплантация электрокардиостимулятора трехкамерного (бивентрикулярного) открытым доступом
СССУ - синдром слабости синусно-предсердного узла
ТИАК - Имплантация аортального клапана транскатетерная эндоваскулярная
ТК - трикуспидальный клапан
Удаление электродов - удаление эндокардиальных электродов эндоваскулярным доступом или удаление эндокардиальных электродов открытым доступом
ФВ ЛЖ - фракция выброса левого желудочка
ФП - фибрилляция предсердий
ЧЖС - частота желудочковых сокращений
ЧСС - частота сердечных сокращений
ЭКГ - электрокардиография, регистрация электрокардиограммы
ЭКС - электрокардиостимулятор
ЭФИ - электрофизиологическое исследование
ЭхоЭКГ - эхокардиография
ЭЭ - эндокардиальные электроды
** - препарат включен в перечень жизненно необходимых и важнейших лекарственных препаратов
*** - медицинское изделие, имплантируемое при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи
# - лекарственный препарат для медицинского применения, используемого в несоответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата
Термины и определения
Доказательная медицина - надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в процессе принятия решений о состоянии здоровья и лечении пациента [1, 2].
Заболевание - возникающее в связи с воздействием патогенных факторов нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма [3].
Инструментальная диагностика - диагностика с использованием для обследования пациента различных приборов, аппаратов и инструментов.
Исход - любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [4].
Конфликт интересов - ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [3].
Клиническое исследование - любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов, и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность. Термины "клиническое испытание" и "клиническое исследование" являются синонимами [5].
Лабораторная диагностика - совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
Лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности [6].
Медицинское вмешательство - выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и/или медицинских манипуляций, а также искусственное прерывание беременности [3].
Медицинский работник - физическое лицо, которое имеет медицинское или иное образование, работает в медицинской организации и в трудовые (должностные) обязанности которого входит осуществление медицинской деятельности, либо физическое лицо, которое является индивидуальным предпринимателем, непосредственно осуществляющим медицинскую деятельность [3].
Пациент - физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [3].
Рабочая группа по разработке/актуализации клинических рекомендаций - коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы.
Синдром - устойчивая совокупность ряда симптомов с единым патогенезом [7].
Тезис-рекомендация - положение, отражающее порядок и правильность выполнения того или иного медицинского вмешательства, имеющего доказанную эффективность и безопасность.
Уровень достоверности доказательств (УДД) - степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным [8].
Уровень убедительности рекомендаций (УУР) - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [8].
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Брадиаритмии (БА) - группа нарушений ритма и проводимости сердца, характеризующихся замедленной выработкой электрических импульсов, регулярным и нерегулярным или замедленным ритмом желудочков, связанным с блокадой проведения импульсов [9].
БА включают в себя два важнейших симптомокомплекса: дисфункцию синусового узла (ДСУ) и предсердно-желудочковые блокады (ПЖБ) различных уровней и внутри-желудочковые блокады (ВЖБ). Синдром слабости синусового узла (СССУ) - симптомокомплекс, относящийся к ДСУ и характеризующийся наличием клинической симптоматики брадикардии.
Дисфункция синусового узла (ДСУ) - состояние, когда частота сокращений предсердий не соответствует физиологическим потребностям.
Синдром слабости синусового узла (СССУ) - сочетание клинических и электрофизиологических признаков, отражающих структурные повреждения синуснопредсердного узла (СПУ), его неспособность нормально выполнять функцию водителя ритма сердца и обеспечивать регулярное проведение автоматических импульсов к предсердиям.
Предсердножелудочковая блокада (ПЖБ) - частичное или полное прерывание проведения импульса от предсердий к желудочкам.
Электрокардиостимулятор (ЭКС***) - искусственный водитель ритма, медицинский прибор, предназначенный для стимуляции и коррекции частоты и последовательности сокращения камер сердца.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Причины БА могут быть врожденные и приобретенные. Врожденные БА, как правило, диагностируются и лечатся в детском возрасте. В основе лежит нарушение эмбрионального развития проводящей системы сердца (ПСС). Причины приобретенных БА можно разделить на обратимые, что может быть обусловлено влиянием лекарственных препаратов или нейрокардиальными рефлекторными факторами, а также обратимые БА после хирургических вмешательств на сердце. Необратимые причины могут быть обусловлены инфекционными, воспалительными, дегенеративными или ишемическими изменениями синусно-предсердного узла (СПУ), предсердно-желудочкового соединения (ПЖС) и ПСС.
Важнейшей внутренней причиной ДСУ является замещение ткани СПУ фиброзной и/или жировой тканью, причем дегенеративный процесс обычно распространяется на перинодальную зону, миокард предсердий и предсердно-желудочковый узел (ПЖУ).
Основной причиной медленно прогрессирующей ПЖБ являются дегенеративно-склеротические изменения внутрижелудочковой проводящей системы (болезнь Ленегра) или фиброз и кальцификация проводящих структур, исходящих из соединительнотканного каркаса сердца (болезнь Лева). Это врожденное первичное электрическое заболевание, появление которого не связано с другой патологией сердца.
При пороках аортального и митрального клапанов фиброз и кальцификация клапанных колец могут распространяться на ПСС и соответственно явиться причиной нарушения проводимости.
При ИБС поражение ПСС происходит как в результате инфаркта миокарда, так и под влиянием хронической ишемии миокарда.
Дегенеративному процессу способствуют возрастной фактор и артериолосклероз, сопутствующий артериальной гипертонии.
При врожденных ПЖБ имеются 4 варианта патологии ПСС: отсутствие связи миокарда предсердий с ПЖУ, прерывание связи между ПЖУ и пучком Гиса на уровне пенетрирующего отдела пучка, прерывание целостности проводящей системы на уровне ветвления ножек пучка Гиса и ненормальное формирование с прерыванием пучка Гиса. Прерывания представляют собой фиброзное и жировое, возможно с кальцификатами, замещение специализированной ткани ПСС.
Нормальная функция СПУ осуществляется за счет спонтанной деполяризации его пейсмекерных N-клеток (функция автоматизма) и проведения возникающих импульсов транзиторными T-клетками на миокард предсердий через синусно-предсердную зону (синусно-предсердная проводимость). Автономная нервная система модулирует функцию СПУ, так что парасимпатические влияния (ацетилхолин) снижают ее, а симпатические (норадреналин) увеличивают. Нарушения любого из этих компонентов приводят к ДСУ. Важную роль в проявлениях ДСУ играет феномен overdrive suppression - подавление автоматизма водителей ритма более частой внешней импульсацией. Этот механизм определяет активность СПУ и поведение нижележащих водителей ритма в момент прерывания предсердных тахикардий при синдроме тахикардии-брадикардии. На проведение импульсов по ПСС также оказывает существенное влияние автономная нервная система: парасимпатическая система угнетает проведение по ПЖУ, не влияя на внутрипредсердную и внутрижелудочковую проводимость, а симпатическая система улучшает проведение по ПЖУ и за счет укорочения рефрактерного периода улучшает проведение по системе Гиса-Пуркинье. При поражении ПСС парасимпатические влияния проявляются в более выраженной форме, а симпатические оказываются не в состоянии улучшить проведение. Кроме этого, важную роль играет сама частота следования импульсов: пропускная способность ПЖУ снижается при его поражении. При вовлечении в патологический процесс внутрижелудочковой ПСС минимальные изменения частоты импульсации способны приводить к блокаде проведения: при критическом урежении ритма за счет спонтанной диастолической деполяризации в волокнах Пуркинье и при критическом учащении ритма за счет удлинения их рефрактерного периода.
Основные причины БА:
Внутренние причины
Дегенеративные:
возрастной идиопатический дегенеративный фиброз -
болезнь Лева-Ленегра (прогрессирующее поражение ПСС)
Ишемическая болезнь сердца:
хроническая ишемия миокарда, инфаркт миокарда
атеросклеротическое, тромботическое или иное поражение артерии СПУ
Инфильтративные процессы:
амилоидоз, саркоидоз, гемохроматоз, лимфогрануломотоз и другие лимфомы, множественная миелома, последствия лучевой терапии
Инфекционные заболевания:
дифтерия, болезнь Чагаса, болезнь Лайма, токсоплазмоз, сифилис
Коллагенозы:
ревматизм, системная красная волчанка, склеродермия, ревматоидный артрит
Нейромышечные заболевания:
миотоническая мышечная дистрофия, синдром Kearns-Sayre, миопатия Эрба иперонеальная мышечная атрофия
Воспалительные заболевания:
миокардит, перикардит
Хирургическая травма:
коррекция врожденных пороков сердца,
протезирование аортального и митрального клапанов, осложнение радиочастотной катетерной абляции наджелудочковых тахикардий, абляция AB-соединения
Внешние причины
Лекарственные препараты:
бета-адреноблокаторы, блокаторы "медленных кальциевых" каналов (C08 Блокаторы кальциевых каналов), сердечные гликозиды, антиаритмические препараты I и III классов (C01B Антиаритмические препараты, классы I и III), др.
Нейро-кардиальные рефлекторные влияния:
гиперчувствительность каротидного синуса, вазовагальные обмороки, рефлекторные реакции на кашель, рвоту, мочеиспускание, дефекацию
Электролитные нарушения:
гипокалиемия, гиперкалиемия.
Эндокринные нарушения:
гипотиреоз, редко гипертиреоз
Гипотермия,
повышение внутричерепного давления,
гипоксия:
синдром ночного апноэ
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Распространенность ДСУ не может быть оценена адекватно из-за невозможности учета бессимптомных случаев и трудности диагностики патологической брадикардии в популяционных исследованиях.
Частота выявления ДСУ растет с возрастом, но в группе старше 50 лет она составляет всего 5/3000 (0,17%). На долю ДСУ приходится около половины всех имплантаций ЭКС***, но число имплантаций неадекватно оценивает частоту симптоматичных случаев ДСУ.
У здоровых подростков транзиторная ПЖБ I степени встречается в 12% случаев, у молодых взрослых - в 4 - 6%. Постоянная форма ПЖБ I степени у взрослых старше 20 лет встречается не чаще 1%, после 50 лет возрастает до 5% и более, а у лиц старше 65 лет может достигать 30%. Частота возникновения приобретенной, далеко зашедшей ПЖБ II степени и полной ПЖБ оценивается в 200 случаев на миллион в год, врожденной полной блокады - 1/20000 новорожденных.
ПЖБ, ассоциированная с хирургическим вмешательством, является одним из частых осложнений операции (до 3%) [10].
В настоящее время более 85% пациентов с врожденными пороками сердца доживают до взрослого возраста. Чаще всего имеют место нарушения ПЖ проведения (до 65%), реже ДСУ (до 29%).
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I44 - Предсердно-желудочковая (атриовентрикулярная) блокада и блокада левой ножки пучка Гиса
I44.0 - Предсердно-желудочковая блокада первой степени
I44.1 - Предсердно-желудочковая блокада второй степени
I44.2 - Предсердно-желудочковая блокада полная
I44.3 - Другая и неуточненная предсердно-желудочковая блокада
I44.4 - Блокада передней ветви левой ножки пучка
I44.5 - Блокада задней ветви левой ножки пучка
I44.6 - Другие и неуточненные блокады пучка
I44.7 - Блокада левой ножки пучка неуточненная
I45.0 - Блокада правой ножки пучка
I45.1 - Другая и неуточненная блокада правой ножки пучка
I45.2 - Двухпучковая блокада
I45.3 - Трехпучковая блокада
I45.4 - Неспецифическая внутрижелудочковая блокада
I45.5 - Другая уточненная блокада сердца
I45.8 - Другие уточненные нарушения проводимости
I45.9 - Нарушение проводимости неуточненное
I46 - Остановка сердца
I46.0 - Остановка сердца с успешным восстановлением сердечной деятельности
I46.1 - Внезапная сердечная смерть, так описанная
I46.9 - Остановка сердца неуточненная
I49.5 - Синдром слабости синусового узла
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Дисфункция синусового узла (ДСУ)
ДСУ объединяет спектр аритмий:
- синусовая брадикардия,
- отказ синусового узла,
- синусно-предсердная блокада (СПБ), которую разделяют на:
- СПБ I степени (удлинение времени СП проведения),
- СПБ II степени тип I - прогрессивное увеличение времени СП проведения с последующей блокадой импульса в СП зоне,
- СПБ II степени тип II - периодическое блокирование импульсов в СП зоне без предшествующего увеличения времени СП проведения,
- далеко зашедшая СПБ II степени - блокирование каждого второго или нескольких синусовых импульсов подряд,
- СПБ III степени - полная блокада СП проведения с отсутствием возбуждений предсердий из СПУ,
- синдром тахи-брадикардии - чередование пароксизмов наджелудочковой тахиаритмии (фибрилляция предсердий (ФП) и трепетание предсердий (ТП) с эпизодами синусового или замещающего ритма с низкой частотой желудочковых сокращений (ЧЖС) и/или асистолией желудочков,
- хронотропная несостоятельность (недостаточность).
Предсердно-желудочковые или атриовентрикулярные блокады
1. По этиологии различают приобретенные и врожденные ПЖБ.
2. По степени выраженности нарушений различают:
- ПЖБ I степени - замедление проведения импульса от предсердий к желудочкам с проведением каждого импульса.
- ПЖБ II степени - периодические прерывания проведения предсердных импульсов на желудочки.
Она имеет три разновидности:
- Мобитц тип I - блокирование импульса с предшествующим прогрессивным замедлением проведения от предсердий к желудочкам (периодика Венкебаха),
- Мобитц тип II - блокирование импульса без предшествующего удлинения времени предсердно-желудочкового проведения,
- Далеко зашедшая ПЖБ II степени - блокирование каждого второго или нескольких подряд предсердных импульсов.
- ПЖБ III степени - полная блокада проведения предсердных импульсов на желудочки с развитием полной предсердно-желудочковой диссоциации.
3. По локализации нарушений проведения в ABC выделяют:
- блокада на уровне предсердий (внутрипредсердная),
- на уровне предсердно-желудочкового узла (ПЖУ),
- ниже ПЖУ:
- на уровне пучка Гиса - интрагисиальные,
- на уровне ветвления ножек пучка Гиса - инфрагисиальные.
4. Изолированные блокады разветвлений пучка Гиса обозначают как фасцикулярные (пучковые) блокады:
- блокада правой ножки пучка Гиса (БПНПГ),
- передневерхняя фасцикулярная блокада (ПВФБ),
- задненижняя фасцикулярная блокада (ЗНФБ),
- комбинации из двух указанных блокад обозначают как двухпучковые (бифасцикулярные) блокады: БПНПГ в сочетании с ПВФБ, БПНПГ в сочетании с ЗНФБ и блокада левой ножки пучка Гиса (БЛНПГ),
- трехпучковой (трифасцикулярной) блокадой понимают альтернирующую внутрижелудочковую блокаду (истинная трехпучковая блокада), когда чередуются две разновидности двухпучковых блокад (например, БПНПГ и БЛНПГ), или сочетание двухпучковой блокады с ПЖБ I - II степени.
5. По характеру течения ПЖБ разделяют на преходящие (интермиттирующие) и постоянные (персистирующие).
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления БА разнообразны и часто неспецифичны. Может быть бессимптомное течение. В клинической картине брадиаритмии выделяют две основные группы симптомов: церебральные и кардиальные. Постоянные и длительно существующие брадиаритмии могут проявляться усталостью, повышенной утомляемостью, вялостью, апатией, снижением умственных способностей. Наиболее ярко проявляются последствия гипоперфузии головного мозга: при острых нарушениях могут возникать внезапные головокружения, спутанность сознания, в более тяжелых случаях - пресинкопальные и синкопальные состояния вплоть до развернутой картины приступов Морганьи-Эдамса-Стокса.
БА могут приводить также к усугублению течения стенокардии, артериальной гипертензии и хронической сердечной недостаточности. Нередко наблюдается снижение толерантности к физическим нагрузкам с обычными в этих случаях проявлениями в виде быстрой усталости и одышки [11, 12].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза
Диагноз БА и нарушений проводимости устанавливается в соответствии с классификациями, представленными в разделе 1.5. на основании документированного подтверждения любым из инструментальных методов исследования: электрокардиография и/или длительное мониторирование ЭКГ в сочетании с клинической симптоматикой.
Диагностика БА включает следующие этапы:
- выяснение жалоб и сбор анамнеза;
- выполнение ЭКГ и/или длительного мониторирования ЭКГ;
- объективное обследование;
- другие дополнительные методы исследования - на втором этапе обследования (по показаниям);
- исключение обратимых причин при необходимости;
Необходимо классифицировать анатомические уровни нарушений, вызвавшие БА или нарушения проводимости: СПУ, ПЖУ и нарушения проводимости в ножках п. Гиса
Принципы формулировки диагноза.
Необходимо указать уровень нарушений: СПУ, ПЖУ или ножки п. Гиса.
При нарушениях СПУ: указывается основное состояние - ДСУ, разновидность дисфункции: синусовая брадикардия, отказ синусового узла, СПБ, с указанием степени, синдром тахи-брадикардии или хронотропная несостоятельность.
Примеры формулировки диагноза:
- ДСУ. Синусовая брадикардия.
- ДСУ. СПБ II степени тип II.
- ДСУ. Синдром тахи-брадикардии.
При нарушениях ПЖУ - если известно, то указывается этиологический фактор ПЖБ и степень блокады.
2.1 Жалобы и анамнез
Клинические проявления и жалобы зависят от того, является ли брадикардия постоянной или имеет преходящий характер. При этом даже при выраженной брадикардии клинических проявлений может не быть. Бессимптомный характер, как правило, носят БА, которые появляются в период сна. Особое внимание заслуживают пациенты с синкопальными и пресинкопальными состояниями.
Симптоматическая брадикардия может быть определена как документированная брадикардия, которая непосредственно соответствует клиническим проявлениям обмороков или предобморочных состояний, преходящих головокружений или слабости, симптомам сердечной недостаточности или спутанности сознания.
2.2 Физикальное обследование
При длительно существующей брадикардии может наблюдаться бледность кожных покровов.
Брадикардия может определяться при пальпации пульса на периферических артериях. Однако более информативным является аускультация сердца, когда выслушиваются редкие сердечные тоны.
- Рекомендуется проведение физикального обследования пациента для диагностики основного заболевания, вызвавшего БА, с особым вниманием к выявлению преходящих, обратимых причин БА, в том числе определяемых проводимым лечением [15 - 19].
ЕОК IB (УУР A, УДД 3)
- Рекомендуется при выявлении ятрогенной, связанной с лекарственными препаратами, природы БА определить, является ли применение причинных препаратов обязательным у данного пациента [13 - 19].
ЕОК IB (УУР A, УДД 3)
- Рекомендуется в процессе обследования проводить выявление и диагностику сопутствующих нарушений ритма сердца и аритмогенных электрокардиографических синдромов [13 - 19].
ЕОК IB (УУР A, УДД 3)
Комментарии: При сборе анамнеза необходимо уточнить частоту, время, продолжительность, сроки возникновения, факторы, провоцирующие и смягчающие симптомы, на основании которых можно заподозрить брадикардию или нарушения проводимости. Также важно отметить связь симптомов с лекарственными препаратами, едой, медицинским вмешательством, эмоциональным расстройством, физической нагрузкой, изменениями положения тела или другими факторами (например, мочеиспускание, дефекация, кашель, длительное положение стоя, бритье, влияние стесняющей одежды и поворот головы), что может помочь провести дифференциальный диагноз.
Брадикардия и нарушения ритма могут быть первым проявлением системных заболеваний или болезней сердца, поэтому полный сбор анамнеза должен включать всестороннюю оценку риска сердечно-сосудистых заболеваний, семейный анамнез заболеваний других органов и систем.
Алгоритм действий врача - Приложение Б, таблица 1.
2.3 Лабораторные диагностические исследования
Специфической лабораторной диагностики БА не существует. Изменения в лабораторных показателях неспецифичны и являются проявлениями других сопутствующих заболеваний.
В отдельных случаях некоторые состояния могут быть связаны с брадикардией, а лабораторные исследования, направленные на диагностику конкретного заболевания, могут быть полезны (например, исследование уровня тиреотропного гормона (ТТГ) в крови у пациентов с брадикардией при подозрении на гипотиреоз). Тем не менее не было исследований с систематическим изучением дополнительной ценности лабораторных обследований при БА.
- Рекомендовано пациентам с брадикардией проведение общего (клинического) анализа крови и анализа крови биохимического общетерапевтического в рамках первичного обследования и в процессе динамического наблюдения, а также исследование тиреотропного гормона (ТТГ) в сухом пятне крови, исследование уровня натрия в крови, исследование уровня калия в крови для подтверждения основного диагноза [20 - 24, 721].
ЕОК IC (УУР C, УДД 4)
2.4 Инструментальные диагностические исследования
2.4.1. Электрокардиография
В большинстве случаев достаточную информацию дают неинвазивные методы исследования. При постоянной форме БА наружная электрокардиография оказывается вполне информативной. При интермиттирующем течении БА для выявления и клинико-электрокардиографической корреляции требуются методы длительного мониторирования электрокардиограммы (ЭКГ). В случаях, когда преходящие БА предполагаются, но не документированы, требуется использование провоцирующих проб.
- Пациентам с подозрением на брадикардию или нарушение проводимости проведение электрокардиографии в 12 отведениях рекомендуется для документации характера ритма, частоты сокращений, проводимости, а также для верификации структурных и системных заболеваний сердца [15 - 18, 715].
ЕОК I C (УУР A, УДД 3)
Комментарии: Электрокардиографическое исследование в покое с использованием 12 стандартных отведений показано всем пациентам с имеющимися или предполагаемыми БА. Даже если оно не решает задач по выявлению и диагностике аритмий ввиду их отсутствия в момент регистрации ЭКГ, оно несет важную информацию относительно частоты ритма сердца, состояния предсердно-желудочковой и внутрижелудочковой проводимости, процессов реполяризации миокарда желудочков. Оно позволяет выявить нарушения и признаки, с высокой вероятностью указывающие на риск развития определенных видов аритмий со схожей БА симптоматикой (обмороки). К их числу относятся проявления аномального предсердно-желудочкового проведения (короткий интервал PQ, преждевременное возбуждение желудочков), электрокардиографические проявления синдрома Бругада, удлинение или укорочение интервала QT, волна эпсилон при аритмогенной правожелудочковой кардиомиопатии. Регистрация ЭКГ покоя обязательна перед выполнением таких исследований, как амбулаторное мониторирование ЭКГ, электрокардиография с физической нагрузкой, электрофизиологическое исследование (ЭФИ) сердца.
2.4.2. Мониторинг электрокардиографических данных
Существует несколько видов амбулаторного мониторирования ЭКГ. Первый из них предполагает классическую форму суточного (или более) мониторирования ЭКГ по Холтеру, которая позволяет проводить наблюдение за ритмом сердца на протяжении 24 - 48 часов, хотя имеются варианты регистрирующих устройств с длительностью записи до 7 суток.
Второй разновидностью является интермиттирующая запись ЭКГ с помощью портативных регистраторов, объединяемых под общим названием "амбулаторные регистраторы событий".
Наиболее распространены для диагностики БА "непрерывные регистраторы с петлевой памятью". Они позволяют фиксировать симптоматичные события на протяжении от 30 суток до 3 лет.
- Для выявления брадикардии и нарушений проводимости, клинико-электрокардиографической корреляции с симптомами рекомендуется проведение длительного мониторирования сердечного ритма [25 - 28, 715].
ЕОК I C (УУР C, УДД 4)
- Рекомендуется выполнение длительного мониторинга сердечного ритма пациентам с документированной или подозреваемой брадикардией или нарушением проводимости для установления корреляции между частотой сердечных сокращений или нарушениями проводимости с симптомами с использованием кардиомонитора, выбранного на основе частоты, характера симптомов, а также предпочтения пациента [25 - 28].
ЕОК нет (УУР C, УДД 4)
- Рекомендуется использовать различные виды длительного мониторирования ЭКГ в зависимости от частоты развития клинических симптомов, связанных с брадикардиями или нарушениями проводимости [29 - 34, 715].
ЕОК нет (УУР B, УДД 2)
- Рекомендуется при хронической БА без гемодинамической нестабильности и при интермиттирующих редко возникающих БА проведение обследования пациента в амбулаторных условиях или в условиях госпитального дистанционного наблюдения за электрокардиографическими данными ЭКГ [29 - 38, 715].
ЕОК нет (УУР B, УДД 2)
Комментарии: Непрерывное наблюдение за ритмом сердца может потребовать дифференцировки нормальных явлений и патологических состояний. Физиологическая синусовая брадикардия может наблюдаться в дневное время суток в состоянии покоя и в ночное время в качестве преобладающего ритма сердца. Предельное нормальное снижение частоты ритма днем в покое определяется величиной 40 имп/мин, ночью - 35 имп/мин и не зависит от пола и возраста. Допускается также развитие синусовых пауз, длительность которых не превышает 2 секунд. Часто у спортсменов высокой квалификации, а также у лиц тяжелого физического труда, у юношей регистрируют брадикардию с частотой ниже указанных цифр, возможно, в сочетании с другими проявлениями дисфункции синусового узла. Эти состояния могут быть отнесены к нормальным только в тех случаях, когда они бессимптомны и имеется адекватный прирост частоты синусового ритма в ответ на физическую нагрузку. У здоровых лиц транзиторное развитие ПЖБ I степени не является редкостью. При ее постоянной регистрации узкие комплексы QRS и исчезновение блокады при физической нагрузке или при пробе с Атропином** указывают на функциональный характер нарушения. В преходящей форме ночью во сне ПЖБ II степени тип I может регистрироваться у молодых здоровых лиц, особенно у хорошо тренированных спортсменов. Прогноз при этом абсолютно благоприятен.
Методы длительного мониторирования ЭКГ в зависимости от частоты развития эпизодов БА [13, 715]:
Частота эпизодов
Метод и длительность мониторирования
Ежедневно
Суточное мониторирование 24 часа, госпитальное мониторирование или телеметрическая регистрация ЭКГ
Еженедельно и чаще
Суточное мониторирование 24 часа, госпитальное мониторирование или телеметрическая регистрация ЭКГ до 7 суток или мониторинг электрокардиографических данных амбулаторно
Ежемесячно
Мониторинг электрокардиографических данных до 14 - 30 суток
Реже 1 раза в месяц
Имплантация петлевого регистратора для долговременной регистрации электрической активности проводящей системы сердца
2.4.3. Методы визуализации
Так как БА или нарушения проводимости могут выявляться при самых разных сердечно-сосудистых и системных заболеваниях, а прогноз документированных БА в этих случаях зависит от основного заболевания сердца, оценка структурных и функциональных характеристик сердца необходима. Выполнение эхокардиографического исследования у симптомных пациентов позволяет диагностировать структурные заболевания (например, аортальный стеноз, гипертрофическую кардиомиопатию или сердечную недостаточность). Могут использоваться и другие методы визуализации для диагностики других заболеваний сердца, связанных с брадикардией или нарушениями проводимости, которые не выявляются с использованием эхокардиографии [39].
- Пациентам с брадикардией или нарушениями проводимости БЛНПГ и ПЖБ II степени Мобитц II, ПЖБ высокой степени или ПЖБ III степени трансторакальная эхокардиография рекомендована, если подозревается структурное заболевание сердца [40 - 54, 720].
ЕОК IB (УУР B, УДД 3)
- При оценке пациентов с бессимптомной синусовой брадикардией или ПЖБ I степени и отсутствием клинических признаков структурного заболевания сердца рутинная компьютерная томография сердца не рекомендована [55 - 60].
ЕОК IIIC (УУР C, УДД 5)
- Для исключения структурных заболеваний сердца в диагностике специфических состояний, связанных с нарушением проводимости, требующих имплантации ЭКС, рекомендовано выполнение дополнительных методов визуализации сердца [11, 461 - 465].
ЕОК IIa C (УУР C, УДД 5)
2.4.4. Диагностика брадиаритмий и ночного апноэ
Ночные БА распространены как у здоровых лиц, так и при различных заболеваниях. Синусовая брадикардия является наиболее часто встречающейся БА во время сна. Тем не менее синусовый арест, блокады СПУ, все степени ПЖБ, ритм ПЖУ и периоды асистолии также встречаются. Это особенно распространено у молодых и у подготовленных спортсменов. В большинстве случаев это физиологические, опосредованные, бессимптомные события, которые не требуют вмешательства. Частота ночных БА, по-видимому, уменьшается у людей среднего и старшего возраста. У таких людей в период бодрствования аритмии встречаются редко, и эти ночные аритмии обычно протекают бессимптомно.
Лечение апноэ сна не только уменьшает частоту и выраженность эпизодов апноэ/гипопноэ, но также устраняет необходимость в имплантации кардиостимулятора у большинства пациентов.
- Пациентам с ночной брадикардией или нарушением проводимости и документированным обструктивным апноэ сна рекомендовано лечение апноэ во сне (например, путем поддержания постоянного положительного давления в дыхательных путях и снижения веса) [61 - 78].
ЕОК нет (УУР B, УДД 3)
- Пациентам, которые рассматриваются на предмет постоянной кардиостимуляции по поводу брадикардии или нарушения проводимости, рекомендовано выполнение полисомнографии [77 - 78, 466 - 468].
ЕОК I C (УУР C, УДД 4)
2.5 Иные диагностические исследования
2.5.1. Электрокардиография с физической нагрузкой
Для диагностики хронотропной несостоятельности определяют так называемый хронотропный индекс, который вычисляют по результатам электрокардиографии с физической нагрузкой (ПФН) по протоколу максимальной переносимости, лимитированной симптомами физической нагрузки. Он представляет собой отношение разности между пиковой ЧСС на максимуме нагрузки и ЧСС покоя (хронотропный ответ) к разности между предсказанной по возрасту максимальной ЧСС, вычисляемой по формуле 220 - возраст имп/мин, и ЧСС покоя (хронотропный резерв) [5]. Полагают, что в норме величина хронотропного индекса >= 80%. Изучение хронотропной функции у пациентов с дисфункцией синусового узла оказывается крайне ценным в связи с выбором частотно-адаптивной функции ЭКС***, планируемого для имплантации.
- Рекомендуется проведение электрокардиографии с физической нагрузкой для оценки хронотропной функции пациентам с ДСУ [86, 272 - 274, 469, 715].
ЕОК IIa B (УУР C, УДД 4)
- Рекомендуется проведение электрокардиографии с физической нагрузкой для оценки хронотропной функции пациентам с врожденной ПЖБ III степени при решении вопроса о занятиях физкультурой и спортом [272 - 274, 715].
ЕОК нет (УУР C, УДД 5)
- Рекомендуется рассмотреть возможность проведения электрокардиографии с физической нагрузкой для выявления ДСУ или ПЖБ пациентам с клинической симптоматикой БА, провоцируемой физической активностью [76, 75, 86, 405 - 408, 470 - 472, 715].
ЕОК IIb C (УУР C, УДД 4)
Комментарии: За счет повышения частоты импульсации СУ или за счет развития ишемии миокарда ПФН способна выявить ДСУ (частотно-зависимая САБ, выраженная брадикардия или остановки СУ при нагрузке) и нарушения предсердно-желудочковой проводимости (ПЖБ II и III степени при нагрузке). Это может явиться важным объяснением причины синкопальных состояний, возникающих при физической активности.
2.5.2. Ортостатическая проба
- Рекомендуется проведение пассивной длительной ортостатической пробы (проба на наклонном столе головой вверх) пациентам с синкопальными состояниями, генез которых неясен после исключения кардиальной патологии (ЭКГ, ЭхоКГ, мониторирование ЭКГ, внутрисердечное ЭФИ) для выявления вазовагальных причин [410 - 423, 470, 715, 720].
ЕОК IIa B (УУР A, УДД 2)
Комментарии: "Пассивность" пробы указывает, с одной стороны, на отсутствие активных мышечных движений ног при повороте в ортостатическое положение и пребывании в нем, поскольку пациент упирается ногами в специальную площадку. С другой стороны, "пассивность" означает факт отсутствия медикаментозных провокаций (введения изопротеренола или нитроглицерина).
Длительность ортостатического положения в различных протоколах колеблется от 10 мин. до 1 ч. Проба продолжается до развития приступа потери сознания (значимый для постановки диагноза результат исследования) или до 45 мин. при отрицательном результате. В момент синкопе фиксируют показатели ЭКГ, АД, электроэнцефалографии и другие. По завершении пробы делается заключение, в котором указывается факт отсутствия или наличия потери сознания, время возникновения и тип индуцированного приступа.
2.5.3. Массаж каротидного синуса
Для дифференциальной диагностики с состояниями, связанными с парасимпатическими влияниями на сердце, используют пробы механического воздействия на ветви блуждающего нерва.
- Пациентам с брадикардией или синкопальными состояниями неясного генеза при отсутствии кардиальных причин рекомендуется проведение синокаротидной пробы для диагностики синдрома каротидного синуса [424 - 426, 473].
ЕОК I B (УУР B, УДД 3)
Комментарии: Проба основана на рефлекторном усилении парасимпатических влияний на сердце при механическом воздействии на синокаротидную область. Проявлениями служат снижение частоты синусового ритма и замедление ПЖ проводимости. При этом диагностическое значение имеет синусовая пауза продолжительностью более 3 секунд (кардиоингибиторный вариант ответа).
Перед проведением массажа необходимо убедиться в отсутствии шума над сонными артериями. Рекомендуют дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока. Проба выполняется в положении пациента лежа. Регистрируются ЭКГ и АД. Попеременно, справа и слева, проводится массаж синокаротидных зон продолжительностью обычно не более 10 секунд.
Если у пациента с подозрением на синдром каротидного синуса в положении лежа получен отрицательный результат, проба повторяется в положении стоя. Снижение систолического АД более чем на 50 мм рт. ст. при наличии симптомов (головокружение, обморок) расценивается как значимый результат (вазодепрессорный вариант ответа). Бывают смешанные формы вариантов ответа.
2.5.4. Медикаментозные тесты
- Рекомендуется проведение провокационного дозируемого теста с лекарственным препаратом - #Атропином** для выявления функциональной синусовой брадикардии и ПЖБ I степени у бессимптомных пациентов [137, 430 - 432, 710 - 713].
ЕОК нет (УУР C, УДД 4)
Комментарии: Показано проведение теста с внутривенным введением #Атропина** в дозе 0,02 - 0,04 мг/кг (максимально до 2 мг) для выявления функциональной синусовой брадикардии и ПЖБ I степени у бессимптомных пациентов [710 - 713]. Увеличение частоты синусового ритма более чем на 25% от исходной или более 90 имп/мин свидетельствует о вагусной природе дисфункции синусового узла. Исчезновение нарушений ПЖ проводимости указывает на их вагусную природу и локализацию нарушения на уровне ПЖУ.
2.5.5. Генетическое тестирование
Большинство нарушений проводящей системы сердца связаны с возрастными или структурными аномалиями проводящей системы сердца. При этом идентифицированы гены, ответственные за наследственные заболевания сердца ассоциированные с нарушениями проводимости [474 - 476].
Генетические мутации ассоциированы с рядом аномалий, которые могут проявляться изолировано нарушением проводимости или в комбинации с кардиомиопатиями, врожденной патологией сердца или внесердечными заболеваниями. Большинство генетически опосредованных нарушений проводимости имеют аутосомно-доминантный тип наследования [474, 475].
- Рекомендовано определение вариантов генов, приводящих к развитию моногенных заболеваний, в крови методом полноэкзомного высокопроизводительного секвенирования у пациентов с ранней манифестацией (< 50 лет) брадиаритмий и нарушений проводимости [474, 477].
ЕОК IIa C (УУР C УДД 5)
- Рекомендовано рассмотреть возможность диспансерного приема (осмотра, консультации) врача-генетика членов семьи после выявления патологического генетического варианта, который объясняет клинический фенотип нарушения проводящей системы сердца у первичного пациента [474].
ЕОК IIa C (УУР C УДД 5)
2.5.6. Имплантируемые кардиомониторы***
У пациентов могут иметь место нечастые эпизоды брадикардии, которые не могут быть обнаружены стандартными методами наружного мониторирования ЭКГ. Если диагностируемые события возникают очень редко, а также при обмороках по недиагностированной причине возможно использование имплантируемых кардиомониторов (ИКМ)*** - регистрирующих устройств, которые представляют разновидность петлевых регистраторов. Они способны выполнять длительный мониторинг (до 3 лет) и не зависят от активного участия пациента. ИКМ*** увеличивают продолжительность амбулаторного мониторинга и дают возможность получить необходимую корреляцию между брадикардией, симптомами и обмороками.
ИКМ*** предназначены для автоматического определения нарушений ритма и записи приступов аритмий у пациента. При этом устройство может распознать как брадиаритмии (асистолию более 3 - 4,5 секунд, синусовую брадикардию), так и тахикардии (желудочковую тахикардию, предсердные тахикардии и фибрилляцию предсердий). Алгоритм распознавания в основном основан на измерении циклов RR-интервалов ЭКГ, записанной устройством. При возникновении интервала RR свыше заданного времени устройства фиксируют данный участок ЭКГ в памяти. При возникновении ФП устройства определяют нерегулярные, хаотичные интервалы RR и классифицирует их как ФП, после чего происходит запись ЭКГ до начала детекции и последующее сохранение его в памяти.
Ряд устройств может быть активирован также и пациентом для записи сердечного ритма во время симптоматического приступа. ИКМ*** позволяют установить взаимосвязь симптомов с сердечным ритмом у пациентов с редкими приступами аритмий, регистрировать нарушения ритма в течение длительного времени; а также выявлять асимптомные, клинически значимые нарушения ритма. Основным преимуществом метода является возможность визуализации и анализа записи ЭКГ ретроспективно после возникновения события.
Поэтому в настоящее время имплантируемые устройства используются как для выявления брадиаритмий, так и для диагностики и ведения пациентов с тахиаритмиями и фибрилляцией предсердий.
- Пациентам с редкими симптомами (> 30 дней между симптомами), предположительно вызванными брадикардией, рекомендована имплантация петлевого регистратора*** для долговременной регистрации электрической активности проводящей системы сердца, если изначально неинвазивная оценка другими методами неинформативна [87 - 102, 478 - 480].
ЕОК I A (УУР B, УДД 2)
- Имплантация петлевого регистратора*** для долговременной регистрации электрической активности проводящей системы сердца рекомендовано вместо полного традиционного обследования пациентам с обмороками неясного генеза и сохранной функцией левого желудочка, когда клинические или ЭКГ-данные позволяют предположить аритмогенную природу обмороков [87 - 102].
ЕОК I A (УУР B, УДД 2)
Комментарии: Диагностическая значимость данных ИКМ*** не вызывает сомнения и изучалась в следующих клинических ситуациях: у пациентов с подозрением на эпилепсию с неэффективным лечением данной патологии; у пациентов с предварительным диагнозом нейрогенный обморок без установленного механизма спонтанного обморока; у пациентов с блокадой ножки пучка Гиса, у которых вероятен диагноз пароксизмальная атриовентрикулярная блокада, несмотря на отрицательные результаты полного электрофизиологического обследования; у пациентов с органическими заболеваниями сердца и/или нестойкой желудочковой тахиаритмией, у которых вероятно наличие желудочковой тахиаритмии, несмотря на отрицательные результаты полного электрофизиологического обследования.
Диагностически не значимыми данные ИКМ*** являются в случаях, когда связь синкопе с нарушениями ритма (брадикардия или тахикардия) очевидна; пресинкопальные состояния с признаками AB-блокады II и III степени и паузами более 3 секунд (исключая ситуации во время сна и ситуации, связанные с медикаментозной терапией, урежающей ритм), а также тахикардии с ЧСС более 160 имп/мин продолжительностью более 32 комплексов; во время синкопальных состояний не выявляется аритмогенная причина по данным ИКМ***. Данные ИКМ*** не имеют диагностической значимости в случаях, когда аритмия носит асимптомный характер (кроме перечисленных выше нарушений ритма); синусовая брадикардия без связи с симптомами.
2.5.7. Внутрисердечное электрофизиологическое исследование
Внутрисердечное электрофизиологическое исследование (ЭФИ) является инвазивной катетерной процедурой, которая может использоваться для проверки проводящей системы сердца и оценки потенциальной индуцируемости различных тахиаритмий. ЭФИ хорошо переносится, и риск серьезных осложнений, таких как тампонада сердца и угрожающие жизни аритмии, минимальны. Целью ЭФИ в контексте оценки брадикардии является выявление наличия аномальной функции синусового узла или атриовентрикулярной проводимости, а также анатомический уровень нарушения проводимости. Возможно введение фармакологических препаратов во время ЭФИ как части протокола исследования для модуляции вегетативного тонуса или "стресса" синусового узла, атриовентрикулярной проводимости и внутрижелудочковой проводимости. ЭФИ у пациентов, у которых предположительно имеется брадикардия, может выявить возможные механизмы для появления симптомов. ЭФИ обычно не выполняется как первая линия для диагностической оценки у пациентов с подозрением на брадикардию. Большинство пациентов, которым выполняется ЭФИ, уже прошли ряд неинвазивных кардиологических исследований, таких как ЭКГ, проведения ортостатической пробы, эхокардиограмма и/или амбулаторный электрокардиографический мониторинг, который был неубедительным.
Также выполняются ЭФИ у пациентов с необъяснимыми обмороком или предобморочными состояниями для верификации случаев, связанных с брадикардией.
- Пациентам с симптомами, предположительно связанными с брадикардией, внутрисердечное электрофизиологическое исследование рекомендовано для диагностики и определения механизма брадикардии, если исходно неинвазивные методы неинформативны [52, 103 - 123, 481, 482].
ЕОК IIb B (УУР B, УДД 3)
- У пациентов с обмороками и двухпучковой блокадой, рекомендуется рассмотреть возможность выполнения ЭФИ если после выполнения неинвазивных методов диагностики причина обморока остается неясной или если требуется немедленное принятие решения об имплантации ЭКС у тяжелых пациентов, в тех случаях, когда эмпирическая имплантация ЭКС не желательны (особенно у пожилых и ослабленных пациентов) [482 - 488].
ЕОК IIa B (УУР B, УДД 3)
Комментарии: Клиническое выявление возможной ДСУ зачастую затруднено, поскольку вызывающие симптомы аномалии могут быть преходящими и доброкачественными, а у не имеющих симптомов пациентов возможно значительное изменение вариабельности синусового ритма. Были предложены различные инвазивные тесты для оценки функции СПУ. Время восстановления функции СПУ (ВВФСУ) используется для оценки влияния сверхчастого подавления на автоматизм СПУ. Часто вносится поправка на длительность синусового цикла (ДСЦ), что определяется как корригированное время восстановления функции СПУ (КВВФСУ = ВВФСУ - ДСЦ). Синусно-предсердное проведение может быть измерено непосредственно или с помощью нанесения предсердного экстрастимула на фоне синусового ритма (3 - 5) или при стимуляции предсердий.
Возможна регистрация электрограмм СПУ с помощью катетера, и эти прямые измерения времени проведения хорошо коррелируют с непрямыми измерениями, описанными выше. Время восстановления функции СПУ и время синусно-предсердного проведения часто отличаются от нормы у пациентов со структурным поражением синусового узла, но обычно соответствуют норме у пациентов с синусовыми БА, вызванными преходящими факторами, такими как влияние автономной нервной системы.
Полная оценка функции СПУ часто требует непрерывной или периодической амбулаторной регистрации ЭКГ, проведения нагрузочных тестов для оценки хронотропной состоятельности, теста на поворотном столе (тилт-тест) или манипуляций с автономной нервной системой наряду с данными ЭФИ. Пациенты с дисфункцией СПУ также могут быть подвержены другим аритмиям, которые могут быть выявлены при ЭФИ.
Электрограмма пучка Гиса позволяет разграничить три анатомических уровня ПЖБ.
1. Проксимальный (над пучком Гиса), отражающий задержку или блокаду проведения в ПЖУ - удлинение AH-интервала.
2. Медиальный (интрагисиальный), отражающий задержку или блокаду проведения внутри пучка Гиса - удлинение длительности спайка пучка Гиса.
3. Дистальный (инфрагисиальный), отражающий блокаду или задержку на участке регистрации, дистальном по отношении к спайку пучка Гиса - удлинение HV-интервала [129 - 131].
Согласно электрокардиографической классификации, проводящая система желудочков состоит из трех пучков: передней и задней ветвей левой ножки и правой ножки пучка Гиса. Интервал HV у пациентов с двухпучковой блокадой характеризует условия и время проведения импульса через сохранившуюся ножку. Большинство данных о значимости интервала HV в отношении прогноза последующего развития AB-блокады были получены у пациентов с двухпучковой блокадой. Пациенты с двухпучковой блокадой и удлиненным интервалом HV (> 55 мс) имеют повышенный риск развития трехпучковой блокады. Хотя удлинение интервала HV встречается довольно часто, полная блокада развивается редко (обычно 2 - 3% в год и особенно если интервал HV превышает 100 мс). При этом вероятность ее прогрессирования в отсутствие влияния острых воздействий (препараты, электролитные нарушения, ишемия) невысока.
Итак, интервал HV имеет высокую чувствительность (82%), но низкую специфичность (63%) для прогноза развития полной трехпучковой блокады. Для повышения специфичности электрофизиологического тестирования пациентов с двухпучковой блокадой применяется частая стимуляция предсердий при выполнении ЭФИ. Аномальный ответ состоит в возникновении блокады проведения дистальнее пучка Гиса в момент учащающей стимуляции предсердий при AB узловом проведении 1:1. Функциональный блок, возникающий дистальнее по отношению к пучку Гиса и связанный с внезапным укорочением интервала сцепления (как при чередовании коротких и длинных циклов при периодике Венкебаха или при начале стимуляции), не рассматривается как положительный результат. Возникновение дистальной блокады пучка Гиса, вызванной стимуляцией предсердий, имеет относительно низкую чувствительность, но ее предсказательная ценность в отношении развития полной AB-блокады высока.
Внутрисердечное электрофизиологическое исследование пациентов с нарушениями внутрижелудочкового проведения и необъяснимыми симптомами должно также включать исследование ПЖУ и оценку функции СПУ, а также программированную предсердную и желудочковую стимуляцию с целью индукции тахиаритмий для прогноза развития как БА, так и жизнеугрожающих тахиаритмий.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Лечение целесообразно разделить на коррекцию острых состояний, которые могут быть обратимыми, и плановое лечение БА.
При острых состояниях это медикаментозная терапия и временная кардиостимуляция сердца. При хронических брадикардиях и нарушениях проводимости - постоянная кардиостимуляция сердца с помощью имплантируемых электрокардиостимуляторов (ЭКС***).
В некоторых случаях синусовые БА обусловлены потенциально обратимыми причинами, такими как острый инфаркт миокарда, предсердные тахиаритмии, электролитные нарушения, гипотиреоз, лекарства, инфекции и метаболические нарушения.
- Пациентам с симптомами ДСУ рекомендована оценка состояния и лечение обратимых причин [124 - 131].
ЕОК IC (УУР C, УДД 4)
Комментарии: Если пациенты стабильны и имеют минимальную симптоматику ДСУ, требуется терапия, а также оценка ДСУ и потенциально обратимых причин, то это может выполняться в амбулаторных условиях. В некоторых случаях при оценке обратимых причин лечение может не потребоваться (например, прекращение приема селективных бета-адреноблокаторов у пациента без стенокардии с синусовой брадикардией после перенесенного инфаркта миокарда). Примечательно, что у некоторых пациентов с синдромом тахи-бради может быть улучшение синусно-предсердного проведения после лечения, направленного на поддержание синусового ритма.
3.1. Медикаментозное лечение неотложных состояний
Для острого лечения брадикардии может использоваться медикаментозная терапия, которая временно может увеличить ЧСС и нивелировать острую ситуацию.
3.1.1. Острое медикаментозное лечение ДСУ
- Пациентам с ДСУ с наличием симптоматики или гемодинамически нестабильным состоянием введение Атропина** рекомендовано для увеличения частоты синусового ритма [132 - 146].
ЕОК нет (УУР C, УДД 4)
Комментарии: Атропин** является алкалоидом белладонны, блокирующим мускариновые рецепторы ацетилхолина. В синусовом узле его действие улучшает синусно-предсердную проводимость и увеличивает автоматизм синусового узла в дозах примерно от 0,5 до 2 мг с периодом полураспада около 2 часов.
- Пациентам с ДСУ с наличием симптоматики или гемодинамическими нарушениями при низкой вероятности ишемической болезни сердца #Допамин** рекомендован как препарат для увеличения частоты сердечных сокращений и улучшения симптоматики [127 - 134].
ЕОК нет (УУР B, УДД 2)
3.1.2. Острое медикаментозное лечение ПЖБ
- Пациентам с ПЖБ II и III степени с наличием симптоматики или гемодинамически значимым состоянием введение Атропина** рекомендовано для улучшения атриовентрикулярной проводимости и увеличения ЧСС [137, 430 - 432].
ЕОК нет (УУР C, УДД 4)
- Пациентам с ПЖБ II и III с наличием симптоматики или гемодинамически значимым состоянием при низкой вероятности ишемической болезни сердца #Допамин** рекомендован как препарат для улучшения атриовентрикулярной проводимости, увеличения частоты сердечных сокращений и улучшения симптоматики [127 - 134].
ЕОК нет (УУР B, УДД 2)
Комментарии: Острое лечение брадикардии, связанной с ПЖБ, начинается своевременно с выявления и устранения потенциальных причинных факторов, а также медикаментозной терапии. Атропин** имеет длинную историю применения в этих ситуациях из-за простоты введения и относительно низкого риска неблагоприятных реакций. Он наиболее эффективен при ПЖБ на уровне ПЖУ и при брадикардиях, обусловленных избыточным тонусом блуждающего нерва. Из-за его короткой продолжительности действия он обычно используется как "мост" к более длительной терапии, такой как введение адренэргических средств (C01CA Адренергические и дофаминергические средства) или временная электрокардиостимуляция чрескожным доступом или временная электрокардиостимуляция наружным доступом
Схемы введения препаратов - Приложение Б, таблица 2.
3.2. Временная стимуляция для лечения неотложных БА состояний
Установка временного однокамерного не частотно-адаптивного электрокардиостимулятора используется для острого лечения брадикардий, вызывающих гемодинамическую нестабильность, таких как длительные и симптоматические паузы, опасные для жизни желудочковые аритмии, опосредованные брадикардией, или тяжелых симптоматических брадикардий, обусловленных обратимой причиной.
Установка временного однокамерного не частотно-адаптивного электрокардиостимулятора используется как промежуточный этап перед имплантацией постоянного ЭКС*** или до разрешения острой ситуации. Временная электрокардиостимуляция сердца осуществлена чрескожно, через чреспищеводный доступ или путем введения трансвенозного электрода для кардиостимуляции или катетера для стимуляции. Экстренная временная стимуляция для лечения брадикардии, ассоциированной с гемодинамической нестабильностью, обычно включает стимуляцию правого желудочка из-за легкости трансвенозного доступа при брадикардиях, обусловленных ДСУ или ПЖБ. В редких случаях используется временная стимуляция правого предсердия (отдельно или в сочетании с желудочковой стимуляцией), когда критически важно поддержание атриовентрикулярной синхронизации.
- Временная электрокардиостимуляция сердца рекомендована при гемодинамически значимой брадиаритмии, рефрактерной к внутривенному введению ритм-учащающих препаратов [153, 489].
ЕОК I C (УУР C, УДД 3)
- Временная электрокардиостимуляция сердца сердца рекомендована при гемодинамически значимой брадиаритмии, когда временная трансвенозная стимуляция сердца невозможна или недоступна [164, 490, 491].
ЕОК IIa C (УУР B, УДД 3)
- Временная электрокардиостимуляция сердца рекомендована при обратимых причинах и экстренных показаниях к стимуляции, а также при ишемии миокарда, миокардите, электролитных нарушениях, интоксикации или после кардиохирургических операций [147, 151, 166].
ЕОК IIa C (УУР C, УДД 4)
- Временная электрокардиостимуляция сердца рекомендована в качестве временной меры перед имплантацией постоянного ЭКС, когда эта процедура недоступна или невозможна из-за сопутствующей инфекции [147, 151, 166].
ЕОК IIa C (УУР C УДД 4)
- Для длительной временной электрокардиостимуляции сердца рекомендованы электроды с активной фиксацией, подключенные к внешнему временному ЭКС [183, 492, 493, 494].
ЕОК IIa C (УУР B УДД 2)
3.2.1. Временная стимуляция при ДСУ
- Пациентам с персистирующей гемодинамически нестабильной ДСУ, рефрактерной к медикаментозной терапии, установка временного однокамерного или двухкамерного не частотно-адаптивного ЭКС*** рекомендовано для увеличения частоты сердечных сокращений и улучшения симптоматики, пока не будет установлен постоянный ЭКС или устранена брадикардия [143 - 161].
ЕОК IC (УУР B, УДД 2)
- Пациентам с ДСУ и выраженными симптомами или нестабильной гемодинамикой установка временного однокамерного или двухкамерного не частотно-адаптивного ЭКС*** рекомендовано для увеличения частоты сердечных сокращений и улучшения симптоматики до установки постоянного ЭКС*** или до разрешения брадикардии [143 - 161].
ЕОК нет (УУР A, УДД 2)
- Пациентам с ДСУ и минимальными и/или нечастыми симптомами без гемодинамических расстройств установка временного однокамерного или двухкамерного ЭКС*** без частотной адаптации не рекомендовано [162 - 165].
ЕОК/РКО IIIC (УУР C, УДД 4)
Комментарии: Использование временной трансвенозной стимуляции при брадикардиях встречается редко, поскольку риск возникновения острого неблагоприятного сердечно-сосудистого события, связанного с ДСУ или ПЖБ, низкий, а временная стимуляция связана с осложнениями. Сообщается о частоте нежелательных явлений, связанных с временным трансвенозным доступом от 14 до 40%. Осложнения включают венозный тромбоз (18 - 85% при установке через бедренный доступ, когда бедренная вена используется в качестве доступа), легочная эмболия (50 - 60% при бедренном доступе), опасные для жизни аритмии (обычно связанные с нестабильностью электрода или положением в правом желудочке), потеря захвата (10 - 37%), перфорация и смерть.
Риск осложнения может быть снижен при использовании баллонной вальвулопластики или использовании рентгеноскопии. Риск инфекционных осложнений при установке постоянного ЭКС*** увеличивается у пациентов, у которых есть временный кардиостимулятор до постоянной имплантации. Однако в ряде случаев установка временного однокамерного электрокардиостимулятора без частотной адаптации считается клинически необходимой.
3.2.2. Временная стимуляция при ПЖБ
- Пациентам с симптоматичной ПЖБ II и III степени и гемодинамическими расстройствами и при рефрактерности к медикаментозной терапии рекомендована установка временного однокамерного или двухкамерного ЭКС*** без частотной адаптации для увеличения частоты сердечных сокращений и улучшения симптоматики [166 - 183].
ЕОК IC (УУР C, УДД 4)
- Пациентам с симптоматичной ПЖБ II и III степени и гемодинамическими расстройствами и при рефрактерности к медикаментозной терапии установка временного однокамерного или двухкамерного ЭКС*** без частотной адаптации рекомендована до установки постоянного ЭКС*** [183 - 192].
ЕОК нет (УУР C, УДД 5)
Комментарии: Причина ПЖБ должна учитываться при рассмотрении сроков и необходимости временной ЭКС. Установка временного однокамерного или двухкамерного ЭКС без частотной адаптации, разработанная более 60 лет назад, играет определенную роль при остром лечении ПЖБ.
Алгоритм действий врача - Приложение Б, таблица 3.
3.2.3. Временная стимуляция у пациентов с риском развития брадикардии во время внесердечных операций
- У пациентов с высоким риском развития интраоперационной или перипроцедурной брадикардии из-за особенностей пациента или типа процедуры, рекомендована профилактическая установка временного однокамерного или двухкамерного ЭКС без частотной адаптации [456 - 460].
ЕОК нет (УУР C, УДД 4)
- У пациентов с БЛНПГ, которым требуется катетеризация легочной артерии для интраоперационного мониторинга, рутинная профилактическая временная установка временного однокамерного или двухкамерного ЭКС без частотной адаптации не рекомендована [456 - 460]
ЕОК нет (УУР C, УДД 4)
3.3. Постоянная электрокардиостимуляция
Постоянная кардиостимуляция осуществляется путем имплантации кардиостимулятора (ЭКС***) - одно-, двух- или трехкамерного. Доступы для имплантации могут быть эндокардиальные или эпикардиальные. В первом случае электроды кардиостимулирующей системы имплантируются в сердце трансвенозно, во втором имплантация осуществляется эпикардиально во время операции на открытом сердце или отдельным способом путем миниторакотомии.
3.3.1. Постоянная кардиостимуляция при ДСУ
Показано, что постоянная кардиостимуляция облегчает симптомы гипоперфузии головного мозга, связанные с брадикардией, когда исключены другие возможные излечимые или обратимые причины. Симптомная ДСУ является наиболее распространенным показанием для постоянной стимуляции, сопровождаемой атриовентрикулярной блокадой. Наилучший ответ на кардиостимуляцию демонстрируется, когда выявлена корреляция между симптомами и брадикардией. Преимущество стимуляции при ДСУ - значимое улучшение качества жизни.
- Пациентам с симптомной брадикардией, обусловленной ДСУ, рекомендована имплантация ЭКС*** для увеличения ЧСС и улучшения симптоматики [193 - 197].
ЕОК IB (УУР C, УДД 4)
- Пациентам с симптомной синусовой брадикардией, которые получают медикаментозную терапию, и продолжение лечения является клинически необходимым, имплантация ЭКС*** рекомендуется для увеличения частоты сердечных сокращений и улучшения симптоматики [193 - 197].
ЕОК нет (УУР C, УДД 5)
- Пациентам с синдромом тахибрадикардии и симптомами, связанными с брадикардией, имплантация кардиостимулятора рекомендована для увеличения частоты сердечных сокращений и уменьшения симптомов, связанных с гипоперфузией [434 - 443].
ЕОК IB (УУР B, УДД 2)
- Пациентам с симптомной хронотропной недостаточностью имплантация ЭКС*** с программированием режимов частотной адаптации рекомендована для увеличения частоты сердечных сокращений и улучшения симптоматики [434 - 443].
ЕОК IIA (УУР B, УДД 2)
- Пациентам с симптомной ДСУ и нормальной атриовентрикулярной проводимостью рекомендуется имплантация ЭКС*** [434 - 443].
ЕОК IB (УУР B, УДД 2)
- Пациентам с симптомной ДСУ и имплантированным двухкамерным ЭКС*** и нормальной атриовентрикулярной проводимостью рекомендован двухкамерный режим с минимизацией желудочковой стимуляции [434 - 443, 501 - 507].
ЕОК IA (УУР A, УДД 2)
- Имплантация ЭКС*** рекомендована симптомным пациентам с брадитахиформой ДСУ для коррекции брадиаритмии и возможности назначения медикаментозной терапии, если аблация тахиаритмии не предпочтительна [436, 437, 508 - 511, 513].
ЕОК IB (УУР A, УДД 2)
- Пациентам симптомной хронотропной недостаточностью рекомендуется имплантация двухкамерного ЭКС*** с частотно-адаптивным режимом [514 - 515].
ЕОК IIa B (УУР A, УДД 2)
- Рекомендована аблация ФП как стратегия лечения, чтобы избежать имплантации ЭКС***, у пациентов с ФП-ассоциированной брадикардией и симптомными преавтоматическими паузами, после конверсии ФП, с учетом клинической ситуации [510 - 518].
ЕОК IIa C (УУР C, УДД 3)
- У пациентов с брадитахиформой ДСУ рекомендуется рассмотреть программирование ЭКС*** [519 - 520].
ЕОК IIb C (УУР A, УДД 2)
- У пациентов с обмороками рекомендуется рассмотреть имплантацию ЭКС*** для уменьшения рецидивирующих обмороков если документирована бессимптомная пауза > 6 сек на фоне синус-ареста [96, 521].
ЕОК IIb C (УУР A, УДД 2)
- ЭКС не рекомендована пациентам с брадикардией на фоне ДСУ, если она бессимптомна или обоснована наличием обратимых причин, которые могут быть скорректированы и предотвращены [353].
ЕОК III C (УУР C, УДД 5)
Комментарии: При ДСУ режимы предсердной кардиостимуляции дают преимущество перед желудочковой стимуляцией. Отмечено положительное влияние предсердных режимов стимуляции на профилактику ФП, сердечной недостаточности или инсульта, а также данные режимы способствуют улучшению качества жизни пациентов.
3.3.2. Постоянная кардиостимуляция при ПЖБ
- Пациентам с приобретенной ПЖБ II степени Мобитц II, ПЖБ высокой степени или ПЖБ III степени, не относящейся к обратимым или физиологическим причинам, имплантация ЭКС*** рекомендуется независимо от наличия симптомов [444 - 450].
ЕОК IC (УУР B, УДД 3)
- Пациентам с нервно-мышечными заболеваниями, связанными с нарушениями проводимости, включая мышечную дистрофию (например, тип миотонической дистрофии), у которых есть признаки ПЖБ II и III степени или HV-интервал 70 мс или более, независимо от симптомов постоянная стимуляция рекомендуется [200 - 210].
ЕОК IB (УУР B, УДД 3)
- Пациентам с постоянной ФП и симптомной брадикардией рекомендуется постоянная стимуляция [198 - 210].
ЕОК IC (УУР C, УДД 4)
- Пациентам, у которых развивается симптоматическая ПЖБ в результате терапии и альтернативного лечения нет, а продолжение лечения клинически необходимо, постоянная стимуляция рекомендуется для увеличения частоты сердечных сокращений и улучшения симптоматики [200 - 210].
ЕОК нет (УУР C, УДД 4)
Комментарии: Все брадикардии, имеющие потенциально обратимые причины, в рекомендациях ЕОК относят к III классу - нет необходимости в постоянной ЭС.
- Пациентам с саркоидозом или амилоидозом, ПЖБ II степени Мобитц II, ПЖБ высокой степени или ПЖБ III степени постоянная стимуляция рекомендуется [198 - 210].
ЕОК нет (УУР B, УДД 3)
- Пациентам с мышечными дистрофиями с интервалом PR, превышающим 240 мс, и БЛНПГ постоянная стимуляция рекомендована [200 - 210].
ЕОК нет (УУР B, УДД 3)
- Пациентам с ПЖБ I и II степени Мобитц I с четко выраженными симптомами, характерными для ПЖБ, постоянная стимуляция рекомендована [200 - 210].
ЕОК IIA (УУР B, УДД 3)
- Пациентам с нервно-мышечными заболеваниями (такими как миотоническая дистрофия тип I), с интервалом PR более 240 мс, продолжительностью QRS больше 200 мс или трифасцикулярным блоком постоянная стимуляция рекомендована [205 - 210].
ЕОК нет (УУР B, УДД 3)
Комментарии: Наличие симптомов является важным фактором для определения необходимости постоянной стимуляции. Если пациент симптомный, независимо от уровня ПЖБ и вероятности будущей прогрессии ПЖБ, показана постоянная стимуляция. Однако, в отличие от ДСУ, инфранодальная ПЖБ, независимо от наличия или отсутствия симптомов, предполагает постоянную кардиостимуляцию, потому что симптомы могут начаться внезапно в результате полной ПЖБ и проявиться в виде обморока.
- Пациентам с ДСУ и ПЖБ, которым требуется постоянная стимуляция, рекомендуется двухкамерная стимуляция [198 - 225].
ЕОК IIA (УУР A, УДД 2)
- Пациентам с синусовым ритмом и однокамерной желудочковой стимуляцией, у которых развивается синдром кардиостимулятора, переход на двухкамерную стимуляцию рекомендован [198 - 225].
ЕОК IA (УУР A, УДД 2)
- Пациентам с ПЖБ, у которых есть показания к постоянной стимуляции с ФВ ЛЖ между 30 и 50% и ожидается желудочковая стимуляция более 40% времени, рекомендованы методы стимуляции, поддерживающие физиологическую активацию желудочков (например, бивентрикулярная стимуляция или стимуляция пучка Гиса), которые имеют преимущества перед обычной стимуляцией правого желудочка [444 - 454].
ЕОК нет (УУР C, УДД 4)
- Пациентам с постоянной или персистирующей ФП, у которых не запланирована стратегия контроля ритма, имплантация двухкамерного кардиостимулятора не рекомендована [210 - 225].
ЕОК IC (УУР B, УДД 2)
- Пациентам с постоянной ФП и потребностью в ЭКС*** рекомендована имплантация двухкамерного кардиостимулятора с функцией частотной адаптации [522 - 524].
ЕОК IC (УУР B, УДД 2)
- Имплантация кардиостимулятора рекомендована пациентам с симптомной ПЖБ II степени Мобитц I, или при обнаружении интра- или инфрагисиальной ПЖБ по данным ЭФИ [200, 525, 526, 444].
ЕОК IIa C (УУР C, УДД 4)
- Имплантация постоянного ЭКС*** рекомендована пациентам с сохраняющимися симптомами, характерными для пейсмекерного синдрома и связанными с ПЖБ первой степени (PR > 300 мс). [527 - 529].
ЕОК IIa C (УУР C, УДД 4)
Комментарии: Очевидны преимущества двухкамерной стимуляции при ПЖБ по сравнению с желудочковой стимуляцией, но при двухкамерной стимуляции не было показано влияние на смертность от всех причин, а также на сердечно-сосудистую смертность. Не было показано по этическим соображениям - невозможности планирования проспективных исследований по данному вопросу.
Однако, независимо от видов стимуляции, пациенты с ПЖБ требуют имплантация двухкамерного кардиостимулятора. Специализированные способы стимуляции, такие как имплантация электрокардиостимулятора трехкамерного (бивентрикулярного) эндоваскулярным доступом, могут смягчить отрицательные воздействия правожелудочковой стимуляции у этих пациентов. При определении типа кардиостимулятора (однокамерный, двухкамерный, бивентрикулярный) у многих пациентов должны быть рассмотрены все факторы, в том числе прогнозируемый процент желудочковой стимуляции и ФВ ЛЖ. Благоприятной для пациентов, у которых ФВ ЛЖ <= 35% с ожидаемой потребностью в значительной желудочковой стимуляции (> 40%), считается бивентрикулярная стимуляция.
3.3.3. Кардиостимуляция при нарушениях проводимости (при атриовентрикулярной проводимости 1:1 и нормальном PR-интервале)
- Пациентам с обмороками и блокадами ножек пучка Гиса (БНПГ) с HV-интервалом 70 мс или более или доказанной при ЭФИ внутриузловой блокаде рекомендована имплантация кардиостимулятора [226 - 230].
ЕОК IB (УУР B, УДД 3)
- Пациентам с альтернирующей блокадой ножек пучка Гиса с симтоматикой или без нее рекомендуется постоянная стимуляция [226 - 236].
ЕОК IC (УУР A, УДД 3)
- Бессимптомным пациентам с изолированным нарушением проводимости, атриовентрикулярной проводимостью 1:1 и отсутствием других показаний к стимуляции постоянная стимуляция не рекомендована [226 - 236].
ЕОК IIIB (УУР A, УДД 3)
- Рекомендуется рассмотреть возможность постоянной стимуляции пациентов с необъяснимыми обмороками и двухпучковой блокадой без данных ЭФИ (пожилые, ослабленные пациенты, высокого риска или с рецидивирующими обмороками) [530].
ЕОК IIb C (УУР A, УДД 2)
Комментарии: Пациенты с нарушениями проводимости с атриовентрикулярной проводимостью 1:1 и нормальным интервалом PR требуют дополнительной диагностики основного заболевания сердца, оценки наличия симптоматики и анализа исходной ЭКГ (БПГ, неспецифической внутрижелудочковой задержки, изолированной фасцикулярной блокады или комбинации нарушений).
Тактика лечения зависит от присутствия или отсутствия симптомов при наличии основного расстройства, связанного с прогрессированием заболевания (например, мышечной дистрофии). Чередующаяся блокада ветвей (комплексы QRS с чередующимися морфологиями ЛНПГ и ПНПГ) свидетельствует о значимом заболевании проводящей системы и высокой вероятности развития внезапного начала полной блокады сердца с редким или отсутствием желудочкового ответа.
3.3.4. Имплантация трехкамерного электрокардиостимулятора (ресинхронизирующая терапия)
Концепция СРТ основана на том, что у пациентов с СН и систолической дисфункцией ЛЖ нередко наблюдаются выраженные нарушения внутрижелудочковой проводимости с преобладанием продолжительности QRS > 120 мс в 25 - 50% случаев и БЛПНПГ в 15 - 27% случаев. Более того, у таких пациентов ПЖ-диссинхрония часто сочетается с удлинением интервала PR на поверхностной ЭКГ [531 - 533].
Описанные электрические аномалии могут вызывать атриовентрикулярную, межжелудочковую и внутрилевожелудочковую механическую диссинхронию [534 - 535].
В недавнем крупном метаанализе 5 РКИ (COMPANION, CARE-HF, MADIT-CRT, RAFT, и REVERSE), включившем 6523 участника (1755 пациентов с морфологией QRS, отличной от БЛНПГ) СРТ не была ассоциирована с уменьшением смертности и/или госпитализаций по поводу СН у пациентов без БЛНПГ (ОР, 0,99, 95% ДИ 0,82 - 1,2) [536].
Поскольку почти во всех исследованиях и post-hoc анализах благоприятного влияния морфологии QRS на эффективность СРТ пациенты были объединены в категорию "без БЛНПГ", невозможно предоставить отдельные рекомендации по СРТ у пациентов с диффузными нарушениями внутрижелудочковой проводимости и БПНПГ [537 - 542]. Пациенты с БПНПГ не получают положительного эффекта от СРТ [543], если у них нет так называемой маскированной БЛНПГ на ЭКГ [542], характеризующейся широким, двухпиковым, иногда зазубренным зубцом R в I и aVL отведениях в сочетании с отклонением электрической оси влево. У этих пациентов решающим является индивидуальное позиционирование ЛЖ электрода.
В последнее время появилось представление о возможной роли удлиненного интервала PR у пациентов с СН без БЛНПГ. Несколько одноцентровых исследований и два post-hoc анализа крупных РКИ (COMPANION и MADIT-CRT) продемонстрировали потенциальную пользу от имплантации СРТ у этой группы пациентов [543 - 544].
ЭКГ критерии нарушений внутрижелудочковой проводимости, морфологии QRS по типу БЛНПГ и без БЛНПГ ранее не были определены и представлены в исследованиях СРТ [543 - 544]. Также не сообщалось о способе измерения длительности QRS (автоматический или ручной, и аппарат для записи ЭКГ). Однако, выбор критериев ЭКГ вероятно влияет на твердые конечные точки [545 - 549]. Аналогичным образом было показано, что способ записи ЭКГ и производитель аппарата ЭКГ могут влиять на автоматически измеренную длительность QRS
Рекомендации по СРТ у пациентов с синусовым ритмом с морфологией QRS по типу БЛНПГ
- Имплантация трехкамерного электрокардиостимулятора (ресинхронизирующая терапия) рекомендуется симптомным пациентам с СН на синусовом ритме с ФВ ЛЖ <= 35%, длительностью QRS >= 150 мс, и морфологией QRS с БЛНПГ несмотря на оптимальную медикаментозную терапию, для улучшения симптомов, снижения морбидности и смертности [550 - 567].
ЕОК I A (УУР B, УДД 1)
- СРТ рекомендована у симптомных пациентов с СН на синусовом ритме с ФВ ЛЖ <= 35%, длительностью QRS 130 - 149 мс и морфологией QRS по типу БЛНПГ несмотря на оптимальную медикаментозную терапию, для улучшения симптомов, снижения морбидности и смертности [550 - 567].
ЕОК IIa B (УУР C, УДД 1)
Рекомендации по СРТ у пациентов с синововым ритмом с морфологией QRS отличной от БЛНПГ
- СРТ рекомендована симптомным пациентам с СН на синусовом ритме с ФВ ЛЖ <= 35%, длительностью QRS >= 150 мс и морфологией QRS, отличной от БЛНПГ несмотря на оптимальную медикаментозную терапию, для улучшения симптомов, снижения морбидности и смертности [550 - 567].
ЕОК IIa B (УУР B, УДД 1)
- Рекомендуется рассмотреть возможность СРТ у симптомных пациентов с СН на синусовом ритме с ФВ ЛЖ <= 35%, длительностью QRS 130 - 149 мс, морфологией QRS, отличной от БЛНПГ несмотря на оптимальную медикаментозную терапию, для улучшения симптомов и снижения морбидности [568 - 574]
ЕОК IIb B (УУР B, УДД 1)
- СРТ не рекомендована пациентам с СН и длительностью QRS < 130 мс без показаний к стимуляции ПЖ [563, 575].
ЕОК III A (УУР A, УДД 2)
Рекомендации по СРТ у пациентов с персистирующей и постоянной ФП.
Пациенты с постоянной ФП и ХСН, которые являются кандидатами для СРТ:
- СРТ рекомендована пациентам с постоянной ФП, ХСН III и IV ФК и ФВ ЛЖ <= 35% на фоне оптимальной медикаментозной терапии и длительностью QRS >= 130 мс, обеспечивая эффективную бивентрикулярную стимуляцию для уменьшения симптоматики, снижения морбидности и риска смерти [576 - 579].
ЕОК IIa C (УУР B, УДД 2)
- Создание искусственной атриовентрикулярной блокады рекомендовано при неполном достижении бивентрикулярной стимуляции на фоне ФП (< 90 - 95%) [579 - 580].
ЕОК IIa B (УУР A, УДД 2)
Пациенты с симптомной ФП и неконтролируемой ЧЖС, которые являются кандидатами для аблации АВС (независимо от длительности комплекса QRS):
- Пациентам с СНнФВ рекомендуется СРТ [580 - 583].
ЕОК I B (УУР A, УДД 2)
- Пациентам с СНусФВ рекомендована СРТ вместо стимуляции ПЖ. [580 - 583]
ЕОК IIa C (УУР C, УДД 4)
- Пациентам с СНсФВ рекомендована стимуляция ПЖ [217, 582, 585].
ЕОК IIa B (УУР A, УДД 2)
- Пациентам с СНусФВ рекомендовано рассмотреть возможность имплантации СРТ [584].
ЕОК IIb C (УУР C, УДД 5)
Рекомендации по переходу от стимуляции ПЖ к СРТ
- Рекомендована замена имплантированного кардиостимулятора (в НМУ Удаление или замена имплантированного кардиостимулятора) на СРТ у пациентов с высоким процентом стимуляции ПЖ, ФВ ЛЖ <= 35% и прогрессирующим течением СН несмотря на оптимальную медикаментозную терапию [586 - 600].
ЕОК IIa B (УУР A, УДД 2)
Доля ПЖ-симуляции в 20%, рассматриваемая как значение, способное вызвать ЭКС-индуцированную СН, подтверждено данными наблюдательных исследований. Однако нет данных в пользу того, что какой-либо процент стимуляции ПЖ может считаться определяющим пределом, ниже которого стимуляция ПЖ безопасна, а выше которого - вредна. Для пациентов с сохранной ФВ ЛЖ существуют противоречивые данные о пользе СРТ в отношении госпитализаций по поводу СН. Преимуществ СРТ в отношении смертности также не было выявлено [585, 601 - 603]. Однако бивентрикулярная стимуляция предотвращала неблагоприятное ремоделирование, вызванное стимуляцией ПЖ, особенно в течение длительного периода наблюдения [585, 601 - 604] В любом случае неблагоприятное ремоделирование, вызванное стимуляцией ПЖ, может быть предотвращено бивентрикулярной стимуляцией, особенно в отдаленном периоде. Одноцентровое исследование показало, что стимуляция ПЖ > 20% была ассоциирована с патологическим ремоделированием ЛЖ у пациентов с АВБ и сохранной ФВ ЛЖ [605].
- СРТ, а не ПЖ стимуляция рекомендуется пациентам с СНнФВ (< 40%), независимо от ФК NYHA, при наличии показаний к желудочковой стимуляции и ПЖБ высокой градации для снижения морбидности, включая и пациентов с ФП [580 - 583].
ЕОК I A (УУР A, УДД 2)
3.3.5. Стимуляция проводящей системы
Альтернативные зоны стимуляции ПЖ (противопоставляемые верхушечной стимуляции ПЖ), включают выходной тракт ПЖ, средние и базальные отделы межжелудочковой перегородки (МЖП), СПГ, парагисиальную стимуляцию и стимуляцию области ЛНПГ, которая включает в себя стимуляцию МЖП ЛЖ и стимуляцию ЛНПГ.
- Рекомендована имплантация дополнительного правожелудочкового электрода пациентам с СПГ в следующих ситуациях (зависимость от ЭКС, ПЖБ высокой степени, инфранодальная ПЖБ высокий порог стимуляции, планируемая ПЖБ) или для улучшения детекции (например, риск недостаточной желудочковой чувствительности или чрезмерной чувствительности предсердных событий и потенциала пучка Гиса) [609, 613, 614]
ЕОК IIa C (УУР B, УДД 3)
- Пациентам с ЭКС*** и СПГ или стимуляцией области ЛНПГ программирование устройства рекомендовано выполнять в соответствии со специальными требованиями к стимуляции проводящей системы сердца [606 - 607].
ЕОК IC (УУР C, УДД 5)
- Рекомендовано рассмотреть возможность СПГ или стимуляции области ЛНПГ как альтернативу стимуляции ПЖ у пациентов с ПЖБ и ФВ ЛЖ > 40% у которых ожидается более 20% желудочковой стимуляции [619 - 620]
РКО IIb C (УУР C, УДД 4)
Комментарий: у некоторых пациентов со сниженной ФВЛЖ может быть рассмотрена возможность стимуляции области ЛНПГ как альтернатива имплантации левожелудочковому электроду после тщательного взвешивания потенциального риска и пользы, а также принимая во внимание отсутствие результатов длительного наблюдения в многоцентровых рандомизированных исследованиях сравнения стимуляции ЛНПГ и классической СРТ, что также должно быть обсуждено с пациентом и/или его представителем [706].
- Рекомендована СПГ или стимуляция области ЛНПГ для кандидатов на СРТ, у которых ранее были безуспешные попытки имплантации ЛЖ электрода в вену коронарного синуса [608 - 612].
ЕОК IIa B (УУР C, УДД 4)
- Рекомендовано рассмотреть возможность СПГ или стимуляции области ЛНПГ у пациентов, которым показана стратегия "кардиостимуляция и абляция" для лечения тахисистолической наджелудочковой аритмии, особенно при узком собственном комплексе QRS [615 - 618].
ЕОК IIb C (УУР C, УДД 4)
Комментарий: на усмотрение оператора может быть имплантирован страховочный желудочковый электрод.
3.4. Показания к кардиостимуляции при отдельных видах патологических состояний
3.4.1. Кардиостимуляция у пациентов после некоторых операций на сердце
Риски брадиаритмий после операций на сердце в значительной степени связаны с типом кардиохирургического вмешательства. Можно выделить специфические операции и состояния сердца: шунтирование коронарных артерий, открытые операции на клапанах сердца, включая вмешательства на аортальном, трехстворчатом и митральном клапанах, транскатетерную имплантацию аортального клапана; операции при врожденных пороках; трансплантацию сердца и послеоперационные осложнения после лечения ФП.
Восстановление атриовентрикулярной проводимости после операции происходит примерно от 12 до 13% у пациентов в течение 6 месяцев и зависит от операции, предоперационных нарушений проводимости, наличия эндокардита и течения послеоперационного периода, а именно наблюдаются ли преходящие послеоперационные нарушения атриовентрикулярной проводимости.
- Пациентам с послеоперационной симптомной ДСУ или ПЖБ или гемодинамической нестабильностью, которая не разрешается после кардиохирургической операции, постоянная стимуляция рекомендована [237 - 253, 260 - 268, 269 - 278].
ЕОК IC (УУР B, УДД 2)
- Рекомендован период клинического наблюдения не менее 5 дней у пациентов с далеко зашедшей или полной ПЖБ после кардиохирургических операций для исключения возможных транзиторных нарушений ритма сердца [621, 623].
ЕОК I C (УУР C, УДД 5)
Хирургическое лечение клапанного эндокардита и интраоперационная полная ПЖБ
- Рекомендована имплантация эпикардиальной системы для электрокардиостимуляции у пациентов с полной ПЖБ после кардиохирургических операций по поводу клапанного эндокардита при наличии одного из следующих факторов: существующие ранее нарушения проводимости, инфекция золотистого стафилококка, внутрисердечный абсцесс, поражение ТК или перенесенная операция на клапанах сердца [622].
ЕОК IIa C (УУР C, УДД 4)
- Пациентам, перенесшим кардиохирургическую операцию на открытом сердце, временная имплантация эпикардиальной системы для электрокардиостимуляции рекомендована [237 - 271, 275 - 278].
ЕОК нет (УУР B, УДД 2)
- Пациентам, перенесшим кардиохирургическую операцию на открытом сердце, которым требуются бивентрикулярная или желудочковая стимуляция, имплантация эпикардиальной системы для электрокардиостимуляции на левый желудочек рекомендована [250 - 259, 265 - 268, 270 - 274].
ЕОК нет (УУР C, УДД 4)
Комментарии: Частота возникновения нарушений проводимости после изолированного коронарного шунтирования открытым доступом варьируется от 2 до 58%, и это осложнение связано с такими факторами, как хроническое дегенеративное заболевание сердца, прямое хирургическое повреждение проводящей системы, ишемия миокарда или недостаточная защита миокарда. Достижения в современной хирургической практике способствуют снижению частоты возникновения нарушений проводимости, но не могут полностью устранить их.
Успешная хирургическая коррекция ФП связана с улучшением выживаемости пациентов по сравнению с пациентами с рецидивирующей ФП, при этом 65% пациентов при протезировании митрального клапана одномоментно подвергаются и операции по коррекции ФП. В одноцентровом исследовании было показано, что 11% пациентов, которым выполнена операция "Лабиринт" (CoxMaze IV) в дополнение к коррекции митрального клапана, требуется послеоперационная имплантация ЭКС [278 - 279].
Наиболее распространенными причинами нарушения проводимости после хирургической замены аортального клапана являются отек, травма при манипуляциях с удалением кальция или повреждение из-за глубоко наложенных швов. Необходимость кардиостимуляции после замены аортального клапана является распространенной и варьируется от 3 до 8,5%: наибольший риск вероятен у пациентов с дооперационным нарушением проводимости. Имеющиеся данные свидетельствуют о том, что у большинства пациентов не восстанавливается атриовентрикулярная проводимость. Одно исследование показало, что пациенты, у которых была потребность в имплантации кардиостимулятора в течение 30 дней после замены клапана аорты, имели более высокий риск смерти.
Возникновение ПЖБ отмечается у 23,5% пациентов, перенесших замену митрального клапана или пластические операции. В исследовании 55 сердец от пациентов без операции на сердце оценивалась связь между предсердно-желудочковым узлом, атриовентрикулярной узловой артерией и митральным кольцом. В 23% случаев отмечалось, что атриовентрикулярная узловая артерия проходила близко к митральному клапану, таким образом было предположено, что повреждение артерии может играть роль в развитии ПЖБ после операции на митральном клапане. Необходимость в ЭКС*** после митральной коррекции колеблется от 1 до 9%. Это зависит от типа операции и может быть ниже после реконструктивных операций, при которых неполная аннулопластика может быть ассоциирована с более низким риском повреждения атриовентрикулярной узловой артерии.
3.4.2. Рекомендации по проведению кардиостимуляции у пациентов после хирургических вмешательств на трикуспидальном клапане:
- Рекомендовано имплантация эпикардиальной системы для электрокардиостимуляции и избегать имплантации эндокардиальных электродов через ТК. Во время оперативного вмешательства на ТК следует отдавать предпочтение удалению ранее имплантированного правожелудочкового электрода, а не подшиванию его между фиброзным кольцом клапана и сердечным клапаном аллогенным или между фиброзным кольцом и опорным кольцом. В случае изолированной аннулопластики ТК, оценивая индивидуально риск и пользу, ранее имплантированный правожелудочковый электрод можно оставить на месте и не закреплять его между фиброзным и опорным кольцом [622, 624].
ЕОК IIa C (УУР C, УДД 4)
Пациенты, требующие ЭКС после протезирования ТК пластики кольца ТК
- При наличии показаний для желудочковой стимуляции рекомендовано отдавать предпочтение малоинвазивной имплантации электрокардиостимулятора однокамерного или двухкамерного открытым доступом или имплантации электрокардиостимулятора трехкамерного (бивентрикулярного) открытым доступом [624].
ЕОК IIa C (УУР C, УДД 4)
Пациенты, требующие ЭКС после протезирования ТК механическим протезом
- Имплантация кардиостимулятора через механический протез ТК не рекомендована [624].
ЕОК III C (УУР C, УДД 4)
Комментарии: атриовентрикулярный узел тесно связан с трехстворчатым клапаном и расположен между его передней и септальными створками; это делает предсердно-желудочковый узел особенно восприимчивым к повреждению при любых вмешательствах на трикуспидальном клапане. Врачами-хирургами разработаны многочисленные методы реконструкции, чтобы избежать травмы узла, в том числе несколько вариантов неполных колец для аннулопластики трехстворчатого клапана, которые имеют промежутки между передней и перегородочной створками. Эти методы позволяют избежать наложения шва в области атриовентрикулярного узла и, следовательно, его повреждения.
Сообщалось, что потребность в кардиостимуляторе после реконструкции составляет всего лишь 2,3%. Поскольку изолированная трикуспидальная хирургия редко проводится у взрослого населения, точную частоту нарушений проводимости, связанной с изолированным трикуспидальным вмешательством, трудно установить. В нескольких исследованиях сообщалось о гораздо более высокой частоте нарушений AB-проведения - до 22%. Лечение нарушений проводимости в группе пациентов с механическим трикуспидальным клапаном дополнительно осложняется невозможностью использования трансвенозных электродов для кардиостимуляции, в случае наличия искусственного клапана нарушением его закрытия после имплантации электрода в правый желудочек. Даже собственные клапаны почти в четверти случаев имеют значимую трикуспидальную регургитацию после установки электрода. У пациентов, которым имплантирован ЭКС*** после реконструкции ТК, частота появления разной степени регургитации составляет до 42%.
3.4.3. Рекомендации по проведению кардиостимуляции у пациентов после транскатетерной имплантации аортального клапана:
Частота имплантации кардиостимулятора после ТИАК колеблется от 3,4% до 25,9% в РКИ и крупных регистрах [625 - 637]. В то время, как ассоциация между ЭКС после ТИАК и исходом является спорной [638 - 643], считается, что стимуляция ПЖ может приводить к ухудшению функции ЛЖ [216, 644, 645].
Таким образом, необходимо минимизировать ненужную постоянную стимуляцию ПЖ.
Предикторы постоянной стимуляции после ТИАК [455]
ЭКГ:
- БПНПГ
- Удлинение интервала PR БПВРЛНПГ
- Пациент
- Пожилой возраст (риск увеличивается с каждым годом)
- Мужской пол
- Больший индекс массы тела (риск увеличивается с каждой единицей веса)
Анатомические особенности:
- Выраженная кальцификация кольца митрального клапана
- Кальцификация выходного тракта левого желудочка
- Длина мембранозной части межжелудочковой перегородки
- "Фарфоровая аорта"
- Высокий средний градиент на аортальном клапане
Процедурные особенности:
- Саморасширяющийся клапан
- Более глубокая имплантация клапана
- Большее соотношение между диаметром протеза и диаметром фиброзного кольца или выходного тракта ЛЖ
- Баллонная постдилатация
- ТКИАК в нативный клапан против имплантации "клапана в клапан"
- Постоянная стимуляция рекомендуется пациентам с далеко зашедшей или полной ПЖБ, персистирующей > 24 - 48 ч после ТИАК [279 - 296, 647].
ЕОК I B УУР A, УДД 2)
- Постоянная стимуляция рекомендуется пациентам с впервые возникшей альтернирующей БНПГ после ТИАК [279 - 296, 646]
ЕОК I C (УУР A, УДД 2)
- Рекомендована ранняя постоянная стимуляция у пациентов с ранее существующей ПБПНПГ, у которых прогрессируют или возникают новые нарушения проводимости после ТИАК [279 - 296, 646].
ЕОК IIa B (УУР B, УДД 2)
- Рекомендовано многосуточный мониторинг электрокардиографических данных или ЭФИ для пациентов с впервые возникшей ПБЛНПГ с QRS > 150 мс или PR > 240 мс без дальнейшего прогрессирования через > 48 ч после ТИАК [648 - 650, 715].
ЕОК IIa C (УУР C, УДД 4)
- Рекомендовано рассмотреть возможность амбулаторного мониторирования ЭКГ или ЭФИ для пациентов с ранее существующими нарушениями проводимости с дальнейшим увеличением длительности QRS или PR > 20 мс после ТИАК. [648 - 650, 715].
ЕОК IIb C (УУР C, УДД 5)
- Пациентам с ПБПНПГ, не имеющих показаний для ПЭКС, не рекомендуется профилактическая имплантация постоянного ЭКС*** перед процедурой ТИАК [648 - 650].
ЕОК III C (УУР C, УДД 3)
Комментарии: После транскатетерной имплантации аортального клапана БЛНПГ встречается у 19 - 55% пациентов (и ПЖБ высокой степени примерно у 10% пациентов. В половине случаев нарушения проводимости разрешаются. Кроме того, только у половины пациентов в последующем могут возникнуть нарушения проводимости, что потребует постоянной ЭКС***. Вероятность новых нарушений проводимости зависит от клинических особенностей пациента и перипроцедурных факторов. После имплантации аортального клапана новые нарушения проводимости связаны с повышенным риском имплантации ЭКС*** и повышенным риском поздней смертности от всех причин и сердечной смертности, независимо от того, был ли имплантирован новый ЭКС***.
3.4.4. Рекомендации по проведению кардиостимулляции после трансплантации сердца
- При ДСУ после кардиохирургических операций и трансплантации сердца рекомендовано устанавливать срок наблюдения до 6 нед. перед имплантацией постоянного ЭКС [651, 714].
ЕОК IIa C (УУР C, УДД 5)
- Рекомендовано имплантация ЭКС*** при хронотропной недостаточности после трансплантации сердца, сохраняющейся более 6 нед. после трансплантации сердца для улучшения качества жизни [652, 714].
ЕОК IIa C (УУР C, УДД 5)
3.4.5. Кардиостимуляция у пациентов с врожденными пороками сердца
Постоянная стимуляция у пациентов со сложными и умеренно сложными пороками сердца должна выполняться в специализированных центрах с многопрофильной командой специалистов по лечению ВПС и ЭКС. Как правило, принятие решения об имплантации постоянного И-ЭКС у пациентов с ВПС основывается на экспертном консенсусе и индивидуальной оценке из-за отсутствия доказательной базы в РКИ. При наличии внутрисердечного шунта между системным и малым кругами кровообращения эндокардиальная имплантация электродов относительно противопоказана из-за риска артериальной эмболии [314].
- Взрослым пациентам с ВПС и симптомной ДСУ или хронотропной недостаточностью постоянная стимуляция рекомендована [297 - 314].
ЕОК IIB (УУР A, УДД 3)
- Взрослым пациентам с ВПС и симптомной ПЖБ рекомендована постоянная стимуляция [297 - 314].
ЕОК IC (УУР A, УДД 3)
- Взрослым пациентам с ВПС и врожденной ПЖБ любой степени и симптомной брадикардией, широким QRS, средней ЧСС в дневное время ниже 50 имп/мин, желудочковой эктопией или дисфункцией желудочков, паузы, превышающие в три раза длину цикла выскальзывающего желудочкового ритма, длинный QT интервал постоянная стимуляция рекомендована [297 - 314].
ЕОК IC (УУР A, УДД 3)
- Взрослым пациентам с ВПС и послеоперационной ПЖБ II степени Мобитц II, ПЖБ высокой степени или ПЖБ III степени, которая не разрешается спонтанно, рекомендована постоянная стимуляция [297 - 314].
ЕОК нет (УУР A, УДД 3)
- Бессимптомным взрослым пациентам с ВПС и врожденной полной ПЖБ даже при отсутствии факторов риска постоянная стимуляция рекомендована [305 - 314].
ЕОК IIb (УУР B, УДД 3)
- Взрослым пациентам с ВПС с ранее существовавшей ДСУ и/или ПЖБ во время операции на сердце интраоперационная имплантация эпикардиальной системы для электрокардиостимуляции рекомендована [305 - 314].
ЕОК нет (УУР C, УДД 4)
- Взрослым пациентам с ВПС и системными внутрисердечными шунтами имплантация кардиостимулятора с эндокардиальными электродами не рекомендована [297 - 314].
ЕОК нет (УУР C, УДД 4)
- У пациентов со стойкой послеоперационной бифасцикулярной блокадой в сочетании с транзиторной полной ПЖБ рекомендовано рассмотреть возможность постоянного ЭКС*** [653, 714].
ЕОК IIb C (УУР C, УДД 5)
- У пациентов со сложными ВПС и бессимптомной брадикардией (ЧСС в состоянии покоя < 40 уд/мин или паузы > 3 с) рекомендовано рассмотреть возможность постоянного ЭКС*** в индивидуальном порядке [653, 714].
ЕОК IIb C (УУР C, УДД 5)
Комментарии: Взрослые пациенты с ВПС представляют собой разнообразную группу пациентов с различной анатомией проводящей системы, венозным возвратом к сердцу и прогрессированием нарушений проводимости. Многие ВПС имеют свои специфические особенности, связанные с гипертрофией, дилятацией или ремоделированием предсердий. Перед установкой эндокардиальных электродов следует учитывать все факторы. Специализированную помощь таким пациентам следует оказывать в специализированных центрах с опытом ведения пациентов такого типа.
3.4.6. Кардиостимуляция у пациентов с инфарктом миокарда
- Пациентам с острым ИМ рекомендована временная стимуляция при рефрактерной к медицинской терапии симптоматичной или гемодинамически значимой брадикардии, связанной с ДСУ или ПЖБ [315 - 336].
ЕОК IC (УУР B, УДД 2)
- Пациентам с острым ИМ и ПЖБ II степени Мобитц II, ПЖБ высокой степени, с блокадами ветвей пучка Гиса или АВБ III степени постоянная стимуляция рекомендована [315 - 336].
ЕОК нет (УУР B, УДД 2)
- Пациентам с острым ИМ с симптомной или гемодинамически значимой синусовой брадикардией или ПЖБ рекомендовано введение Атропина** [325].
ЕОК нет (УУР C, УДД 4)
- Пациентам с острым ИМ и преходящей ПЖБ, которая спонтанно разрешается, постоянная стимуляция не рекомендована [315 - 336].
ЕОК нет (УУР B, УДД 2)
- Пациентам с острым ИМ и БНПГ или изолированной фасцикулярной блокадой при отсутствии ПЖБ II и III степени постоянная стимуляция не рекомендована [315 - 336].
ЕОК нет (УУР B, УДД 2)
- Рекомендована имплантации постоянного ЭКС*** в соответствии с рекомендациями для населения в целом, когда ПЖБ не разрешается в течение периода ожидания продолжительностью не менее 5 дней после ИМ. [315 - 336]
ЕОК I C (УУР B, УДД 3)
- У некоторых пациентов с ПЖБ и острой СН, возникших на фоне ИМ передней стенки, рекомендовано рассмотреть возможность ранней имплантации трехкамерного кардиостимулятора (ресинхронизирующая терапия) (СРТ-Р/СРТ-Д) [654].
ЕОК IIb C (УУР C, УДД 5)
- ЭКС*** не рекомендуется, если ПЖБ разрешается после спонтанно [319, 323, 326, 655].
ЕОК III C (УУР B, УДД 3)
Комментарии: Хотя преходящая ДСУ может возникнуть в контексте острого ИМ, необратимое повреждение ПЖУ составляет большинство показаний для стимуляции. Например, ДСУ и ПЖБ при поражении нижней стенки при ИМ может влиять на кратковременное повышение тонуса блуждающего нерва или снижение кровоснабжения ПЖУ - или, реже, СПУ. Необходимость временной стимуляции сама по себе не является показанием для постоянной кардиостимуляции. Долгосрочный прогноз для пациентов после ИМ и ПЖБ в первую очередь зависит от степени повреждения миокарда и характера нарушений внутрижелудочковой проводимости, а не от самой атриовентрикулярной блокады. Независимо от того, является ли инфаркт передним или нижним, развитие нарушений внутрижелудочковой проводимости скорее отражает обширное повреждение миокарда.
3.4.7. Кардиостимуляция у пациентов с синкопальными состояниями
- Пациентам в возрасте > 40 лет со спонтанными симптомными верицифированными асистолиями > 3 секунд или бессимптомными паузами > 6 секунд вследствие синус-ареста, ПЖБ или их сочетания рекомендована имплантация ЭКС*** с целью снижения частоты рецидивов синкопе [337 - 352].
ЕОК I A (УУР B, УДД 2)
- Пациентам в возрасте > 40 лет с рецидивирующими непредсказуемыми синкопе при кардиоингибиторном синдроме каротидного синуса рекомендована имплантация ЭКС*** с целью снижения частоты рецидивов синкопе [337 - 352].
ЕОК I A (УУР A, УДД 2)
- Пациентам в возрасте > 40 лет с рецидивирующими непредсказуемыми синкопе при выявлении асистолии во время тилт-теста рекомендована имплантация ЭКС*** с целью снижения частоты рецидивов синкопе [348 - 352].
ЕОК I A (УУР B, УДД 2)
- Пациентам с клиническими признаками аденозинчувствительного синкопе рекомендована имплантация двухкамерного ЭКС*** с целью снижения частоты рецидивов синкопе [348 - 352].
ЕОК IIbB (УУР B, УДД 2)
- Пациентам при отсутствии верифицированного кардиоингибиторного рефлекторного ответа имплантация ЭКС*** не рекомендована [337 - 353].
ЕОК IIIB (УУР A, УДД 2)
- ЭКС*** не рекомендована пациентам с необъяснимыми обмороками без подтвержденных ДСУ и нарушения проводимости [656, 657].
ЕОК IIIC (УУР C, УДД 4)
Комментарии: Решение об имплантации ЭКС*** должно приниматься с учетом клинического контекста доброкачественности состояния и частого возникновения у молодых пациентов. Таким образом, имплантация ЭКС*** показана ограниченному числу пациентов, отобранных согласно жестким критериям, с выраженными рефлекторными синкопе. Для имплантации ЭКС*** следует рассматривать пациентов старшего возраста с анамнезом начала рецидивирующих синкопе в среднем и старшем возрасте и с частыми травмами, вероятно, вследствие отсутствия предвестников. У небольшого числа пациентов рецидивы синкопе возможны, несмотря на электрокардиостимуляцию.
Ответ при проведении тилт-теста является самым сильным предиктором эффективности электрокардиостимуляции. У пациентов с отрицательным ответом на тилт-тест ожидается низкий риск рецидивов синкопе, сопоставимый с таковым у пациентов с имплантированными ЭКС*** в связи с идиопатической ПЖБ. Дальнейшие исследования с низкой вероятностью могут повлиять на изменение данной оценки эффекта. Напротив, у пациентов с положительным ответом на тилт-тест отмечается более высокий риск развития рецидивов синкопе с большим доверительным интервалом, что затрудняет оценку пользы электрокардиостимуляции. (Приложение Б, таблица 4).
3.4.8. Кардиоостимуляция у пациентов с ГКМП
У пациентов с симптомами, вызванными обструкцией выходного тракта ЛЖ, варианты лечения включают медикаментозную терапию, хирургическое вмешательство, спиртовую аблацию МЖП и последовательную AB-стимуляцию с короткой AB-задержкой. В трех небольших плацебо-контролируемых РКИ и нескольких наблюдательных исследованиях с длительным сроком наблюдения сообщалось о снижении градиента в выходном тракте ЛЖ, улучшении симптомов и качества жизни при последовательной атриовентрикулярной ЭКС [658 - 663]. Миоэктомия показала лучшие гемодинамические результаты по сравнению с последовательной двухкамерной стимуляцией [664], но это вмешательство является более инвазивным и рискованным. Анализ подгрупп в одном исследовании показал, что пациенты более старшего возраста (> 65 лет) с большей вероятностью получат пользу от последовательной двухкамерной ЭКС [660]. Недавний метаанализ, включавший 34 исследования и 1135 пациентов, показал, что ЭКС приводила к уменьшению градиента в выходном тракте ЛЖ на 35% и незначительной тенденции уменьшения ФК ХСН (NYHA) [665]. Следует принимать совместное решение при выборе метода лечения для пациентов с обструктивной ГКМП.
- Рекомендовано рассмотреть возможность последовательной AB-стимуляции с короткой AB-задержкой у пациентов с синусовым ритмом, у которых есть другие показания для стимуляции или ИКД, если симптомы сохраняются на фоне лекарственной терапии или максимальный градиент в выводном отделе левого желудочка в покое или при провокационных пробах >= 50 мм рт.ст. [658 - 662, 665, 666].
ЕОК IIb B (УУР B, УДД 2)
- Рекомендовано рассмотреть возможность последовательной AB-стимуляции с короткой AB-задержкой у отдельных пациентов с синусовым ритмом, у которых симптомы сохраняются на фоне лекарственной терапии, или максимальный градиент в выводном отделе левого желудочка в покое или при провокационных пробах >= 50 мм рт.ст., и у которых существует высокий риск развития ПЖБ во время септальной спиртовой аблации [667, 668].
ЕОК IIb C (УУР C, УДД 4)
3.4.9. Кардиоостимуляция при редких заболеваниях
- У пациентов с нейромышечными заболеваниями, такими как миотоническая дистрофия 1 типа в сочетании с любой второй или третьей степени ПЖБ или интервалом HV >= 70 мс рекомендована постоянная ЭКС*** вне зависимости от наличия или отсутствия симптомов [207 - 208, 451, 669].
ЕОК нет (УУР B, УДД 3)
- Рекомендовано рассмотреть возможность последовательной AB-стимуляции с короткой AB-задержкой у отдельных пациентов с синусовым ритмом, у которых симптомы сохраняются на фоне лекарственной терапии, или максимальный градиент в выводном отделе левого желудочка в покое или при провокационных пробах >= 50 мм рт.ст., и у которых существует высокий риск развития ПЖБ во время септальной спиртовой аблации [667, 668].
ЕОК нет (УУР C, УДД 4)
- У пациентов с нейромышечными заболеваниями, такими как миотоническая дистрофия 1 типа в сочетании с увеличением интервала PR >= 240 мс или увеличением продолжительности QRS >= 120 мс может рекомендовано рассмотреть возможность имплантации постоянного ЭКС*** [208, 204, 205].
ЕОК IIb C (УУР B, УДД 3)
- У пациентов с саркоидозом сердца, стойкой или транзиторной ПЖБ, рекомендовано рассмотреть возможность имплантации ЭКС*** [220, 629, 673].
ЕОК IIa C (УУР B, УДД 3)
- У пациентов с саркоидозом сердца, ФВ ЛЖ < 50% и показаниями к постоянной ЭКС*** рекомендована имплантация устройства СРТ [671, 672].
ЕОК IIa C (УУР C, УДД 5)
3.5. Имплантация ЭКС и периоперационное ведение пациента
- Для уменьшения риска инфекционных осложнений у пациентов перед имплантацией или заменой кардиостимулятора или электродов рекомендуется проведение предоперационной антибиотикопрофилактики не ранее, чем за 1 ч до разреза кожи. [455].
ЕОК I A (УУР C, УДД 5)
- Для дезинфекции кожи рекомендовано использовать спиртовой раствор хлоргексидина**, а не спиртовой раствор повидон-йода** [674, 675].
ЕОК IIa B (УУР A, УДД 2)
- При венозном доступе рекомендовано рассматривать головную или подмышечную вену [676, 677].
ЕОК IIa B (УУР C, УДД 4)
- Для подтверждения целевой позиции желудочкового электрода при имплантации кардиостимулятора рекомендовано использовать рентгеновские изображения в нескольких проекциях (рентгенография органов грудной клетки) [718, 719].
ЕОК IIa C (УУР A, УДД 3)
- При имплантации электродов в коронарный синус рекомендовано отдавать предпочтение многополюсным электродам [678 - 680].
ЕОК IIa C (УУР A, УДД 3)
- Перед ушиванием раны рекомендовано промывать ложе устройства раствором натрия хлорида** [681, 682].
ЕОК IIa C (УУР A, УДД 1)
- Рекомендовано рассмотреть возможность стимуляции средней части МЖП у пациентов с высоким риском перфорации (например, пожилые люди, перфорация в прошлом, низкий индекс массы тела, женщины) [685 - 686].
ЕОК IIb C (УУР C, УДД 4)
- У пациентов с низким индексом массы тела, при синдроме "накручивания устройства" или по эстетическим причинам рекомендовано рассмотреть возможность формирования ложа устройства под мышцей. [685 - 686].
ЕОК IIb C (УУР C, УДД 4)
- Пациентам, получающим антикоагулянтную терапию, не рекомендуется "мост - терапия" гепарином натрия** [687 - 688].
ЕОК III A (УУР A, УДД 2)
- Имплантация постоянного ЭКС*** не рекомендуется пациентам с лихорадкой. Следует отложить имплантацию до тех пор, пока у пациента не будет лихорадки в течение не менее 24 ч. [455, 674, 675].
ЕОК III B (УУР C, УДД 5)
3.6. Выбор режимов кардиостимуляции
Важная задача при выборе системы для кардиостимуляции - предупреждение прогрессирования нарушений автоматизма и проводимости. Необходимо выбрать систему, которая предотвратит развитие сердечной недостаточности, связанной со стимуляцией сердца. В связи с этим целесообразен подбор ЭКС*** с большими возможностями программирования, чем это необходимо на момент имплантации. Так, у пациента с ДСУ и пароксизмальной ФП в дальнейшем может развиться ПЖБ (результат прогрессирования заболевания, приема препаратов или катетерной абляции), а наличие двухкамерного ЭКС*** у такого пациента диктует необходимость функции переключения режима стимуляции.
В международной практике используется 5-буквенный номенклатурный код, который представляет собой совместную разработку рабочих групп Североамериканского общества по стимуляции и электрофизиологии (NASPE) и Британской группы по стимуляции и электрофизиологии (BPEG), известный как общий код NBG-NASPE/BPEG. Как правило, используют первые 3 буквы, а буква R (IV позиция) используется для программируемых ЭКС*** с изменяющейся частотой ритмовождения - VVIR, DDDR (адаптация по частоте). 5-я буква в коде NBG связана с антитахикардитическими функциями. В октябре 2001 года рабочие группы Североамериканского общества по стимуляции и электрофизиологии (NASPE) и Британской группы по стимуляции и электрофизиологии (BPEG) приняли обновленный 5-буквенный номенклатурный код для антибрадикардитических устройств (Приложение Б, Таблица 5).
Для корректной работы стимулирующей системы необходимы практические навыки врача по программированию, а также техническое оснащение стационара. После имплантации ЭКС*** врачу предстоит подбор и программирование некоторых параметров ЭКС***.
В современных однокамерных ЭКС*** программируемые параметры включают выбор режима стимуляции, нижнего уровня частоты стимуляции, амплитуды и длительности импульса, амплитуды чувствительности и рефрактерного периода.
В двухкамерных ЭКС***, кроме этого, программируется максимальный уровень частоты синхронизации, ПЖ-задержка, режим переключения в ответ на предсердные тахикардии. Частотно-адаптивные ЭКС*** содержат программу для регуляции соотношения чувствительности к физической нагрузке и частоты стимуляции, ограничения по максимальной детектируемой частоте стимуляции. С появлением более сложных систем электрокардиостимуляции оптимальное программирование становится еще более сложным и специфичным, что требует особых знаний врача (Приложение Б, Таблица 6) [353 - 357].
3.7 Альтарнативные методы лечения ДСУ и ПЖБ
У ряда пациентов с выраженной активацией парасимпатического тонуса, часто сочетающейся с временным угнетением симпатической системы, могут возникать вазовагальные рефлекторные обмороки, вагус-индуцированная синусовая брадикардия, остановка синусового узла или атриовентрикулярная блокада. Радиочастотная абляция аритмогенных зон с высокой концентрацией парасимпатических ганглиев приводит к увеличению ЧСС, снижению вариабельности ритма сердца. Это сопровождается отсутствием реакции частоты ритма сердца на введение атропина**.
- Пациентам с документированными рецидивирующими вазовагальными обмороками, развивающимися преимущественно по кардиоингибиторному типу, рекомендовано рассмотреть возможность деструкции проводящих путей и аритмогенных зон сердца - ганглионарных сплетений (кардионейроаблация) как альтернативу ЭКС, если обмороки не сопровождаются травматизацией [707, 708, 709]
РКО IIb B (УУР C, УДД 3)
Комментарий: решение о выполнении кардионейроаблации должно быть принято вместе с пациентом и/или его представителем после обсуждения потенциальной пользы и риска, а также с учетом отсутствия результатов длительного наблюдения (более 24 месяцев) в многоцентровых рандомизированных исследованиях. Обследование на предмет причин обмороков и целесообразности катетерной деструкции ганглионарных сплетений необходимо проводить в опытном центре. В программу обследования пациента, помимо прочего, должна входить проба с пассивным ортостазом.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Если у пациента имеется основное заболевание, то мероприятия по реабилитации должны осуществляться согласно основному заболеванию.
Специальной реабилитации пациенты после имплантации ЭКС*** и заживления раны не требуют. В отдельных случаях предполагается ограничение значительных физических нагрузок в течение 1 месяца после имплантации ЭКС***, щадящий режим физической активности, ограничение подвижности большой амплитуды конечности на стороне имплантации. В дальнейшем проводится расширение уровня физической активности.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Пациентам с ЭКС*** рекомендуется регулярно посещать медицинскую организацию для мониторинга показателей, получаемых от имплантируемого антиаритмического устройства [455].
ЕОК нет (УУР C, УДД 5)
Комментарии: После имплантации ЭКС*** рекомендуется тщательное динамическое наблюдение за пациентом. Перед выпиской пациента необходимо провести мониторинг показателей, получаемых от имплантируемого антиаритмического устройства, программированных во время имплантации. Эти параметры должны быть изменены в случае необходимости при последующих визитах пациента, с учетом результатов считанных исходных статистических данных, тестирования параметров электродов и имплантированного устройства и жалоб пациента. Программирование амплитуды, длительности импульса и проведение диагностических функций, влияющих на состояние батареи ЭКС***, не должно подвергать риску безопасность пациента.
Автоматические функции, например автоматическая оценка порога стимуляции, широко используются в моделях электрокардиостимуляторов и облегчают наблюдение за отдаленно живущими пациентами. Однако автоматические функции не универсальны и не могут заменить индивидуальное программирование и тестирование, особенно сопровождающееся сбором анамнеза и осмотром пациента.
Наблюдение в условиях клиники включает в себя осмотр пациента и мониторинг показателей получаемых от имплантируемого антиаритмического устройства, подбор параметров работы однокамерного или двухкамерного электрокардиостимулятора, программирование однокамерного или двухкамерного электрокардиостимулятора Расписание осмотров в условиях клиники составляется на усмотрение врачей, наблюдающих этих пациентов.
Возможно использование в качестве метода наблюдения за пациентом удаленного мониторирования работы ЭКС***, а частота передачи данных определяется частотой обследований в зависимости от вида ЭКС*** и клинического состояния пациента [356].
Визит
Визит + удаленное мониторирование
Все имплантируемые устройства
72 часа в клинике и 2 - 12 нед после имплантации
СРТ или СПГ
Каждые 6 мес
Удаленно каждые 6 мес и очно каждые 12 мес
Одно и двухкамерные ЭКС
Каждые 12 мес, затем каждые 3 - 6 мес при появлении признаков разряда батареи
Удаленно каждые 6 мес и в клинике каждые 18 - 24 мес
Рекомендации по динамическому наблюдению за пациентами с имплантированными ЭКС***:
- Рекомендовано проводить оптимизацию работы ЭКС*** у каждого пациента индивидуально [353 - 356].
ЕОК IC (УУР C, УДД 5)
- Взрослым пациентам с ЭКС*** после имплантации рекомендовано проводить тестирование работы ЭКС*** дважды в течение полугода, затем ежегодно, пациентам с двухкамерными ЭКС*** после имплантации - дважды в течение 6 месяцев, затем не менее одного раза в год [353 - 356].
ЕОК нет (УУР C, УДД 5)
- Пациентам, которым имплантирован ЭКС*** с возможностью беспроводного удаленного мониторинга, рекомендовано дистанционное наблюдение за показателями частоты сердечных сокращений как составляющая часть стандартной стратегии длительного наблюдения [353 - 356].
ЕОК IA (УУР C, УДД 5)
- При наблюдении за пациентами с ДСУ и имплантированным ЭКС*** рекомендован мониторинг показателей, получаемых от имплантируемого антиаритмического устройства для раннего выявления ФП, в том числе бессимптомной, в связи с необходимостью своевременного назначения антикоагулянтной терапии [353 - 356].
ЕОК IA (УУР C, УДД 5)
- Пациентам с персистирующей ДСУ, которым при установленном диагнозе не рекомендована имплантация ЭКС***, рекомендовано избегать назначения или назначать с осторожностью лекарственные препараты, угнетающие функцию СПУ (антигипертензивные препараты, бета-адреноблокаторы, психоаналептики средства и др.) [353 - 356].
ЕОК IC (УУР C, УДД 5)
- Пациентам с персистирующей ПЖБ I и II степени, которым при установленном диагнозе не рекомендована имплантация ЭКС***, рекомендовано избегать назначения или назначать с осторожностью лекарственные препараты, угнетающие функцию ПЖ-проведения (антигипертензивные препараты, сердечные гликозиды, бета-адреноблокаторы, блокаторы кальциевых каналов, психоаналептики и др.) [355 - 356].
ЕОК IC (УУР C, УДД 5)
Комментарии: Частота и способ наблюдения зависят от множества факторов, в том числе от различных сердечно-сосудистых заболеваний и медицинских проблем, возраста ЭКС***, географической отдаленности пациента от медицинского центра. Некоторые центры предпочитают использование удаленного мониторирования для общего наблюдения с эпизодическим исследованием клинических данных. Другие центры выполняют большинство манипуляций для наблюдения за пациентами очно в условиях клиники.
Удаленный мониторинг за пациентами с имплантируемыми устройствами (дистанционное наблюдение за показателями частоты сердечных сокращений)
Дистанционное наблюдение за показателями частоты сердечных сокращений позволяет осуществлять непрерывное наблюдение за имплантированной системой и отдельными показателями пациента, в несколько раз сокращая количество запланированных и дополнительных визитов к врачу. Дистанционное наблюдение за показателями частоты сердечных сокращений (ДН) также позволяет незамедлительно выявлять или предупреждать возникающие осложнения, что в ряде случаев помогает спасти жизнь пациента. Немаловажна экономическая выгода для здравоохранения и самого пациента путем уменьшения затрат на лечение осложнений. Информация от пациента до врача может быть доставлена всего лишь за несколько минут. Для клиник и их пациентов создана замкнутая информационная сеть "пациент - сервисный центр - врач", которая обеспечивает новый высокотехнологичный уровень наблюдения и лечения пациента.
- ДН рекомендуется для сокращения очных визитов в клинику пациентов с ЭКС***, которые испытывают трудности посещения клиники (например, из-за ограниченной подвижности или других обстоятельств, или в соответствии с предпочтениями пациента) [689 - 681].
ЕОК I A (УУР A, УДД 2)
- ДН рекомендуется в случаях, когда устройство было отозвано из-за неисправностей или требует более тщательного наблюдения, для обеспечения раннего обнаружения событий, требующих принятия мер, особенно у пациентов высокого риска (например, в случае зависимости от ЭКС***) [455, 689 - 690].
ЕОК I C (УУР C, УДД 5)
- При ДН у пациентов с одно- и двухкамерными кардиостимуляторами рекомендовано программировать эти устройства с интервалом до 24 месяцев [689 - 690].
ЕОК IIa A (УУР A, УДД 2)
- Рекомендовано использование ДН кардиостимулирующих устройств для обеспечения более раннего обнаружения клинических (напр., аритмии) или технических проблем (напр., перелом электрода или истощение батареи) [690, 810].
ЕОК IIa B (УУР A, УДД 2)
6. Организация оказания медицинской помощи
Вид помощи и порядок ее оказания зависят от вида БА и сопутствующей патологии. Структурная или функциональная патология сердца, ее прогрессирование могут являться основным показанием для госпитализации.
Медицинская помощь пациентам с БА ограничивается случаями:
- пациентов с БА, требующими обследования или лечения сопутствующей или основной патологии;
- обследование пациентов с БА, связанными с приемом медикаментозных препаратов;
- пациентов с острыми БА, требующими неотложной помощи;
- наблюдение за пациентами после имплантации постоянного ЭКС***.
Экстренные профилактические мероприятия или медикаментозная терапия должны быть начаты бригадой скорой медицинской помощи пациентам с БА, остановкой кровообращения/обмороками.
Госпитализация пациента должна быть осуществлена в лечебное учреждение, которое имеет возможность оказания реаниматологической помощи и непрерывного мониторного наблюдения. Оптимальна госпитализация в стационар, располагающий возможностями и опытом установки временной и постоянной кардиостимуляции.
Имплантация электрокардиостимулятора при наличии показаний или, при отсутствии технической возможности, направление в учреждение, где проводится имплантация ЭКС***.
Полное выполнение стандарта клинического обследования, инструментального обследования, обоснованное назначение, выполнение и анализ дополнительных методов обследования, в том числе и инвазивных, и установка развернутого клинического диагноза, соответствующего МКБ-10, с указанием определенного или подтвержденного основного заболевания. Диагноз должен быть установлен своевременно как этиологический, так и клиникоэлектрокардиографический.
Необходимо проведение комплекса неотложных и плановых мероприятий для купирования острого или нормализации хронического состояния, связанного с БА, коррекция оптимальной терапии основного заболевания, а также определение показаний и выполнение временной или постоянной кардиостимуляции.
После имплантации необходимо проведение оптимизации программы имплантированного кардиостимулятора для персонализации его функционирования, снижения энергозатрат, профилактики осложнений, проведение регулярного программирования устройства и использование возможности удаленного телемониторинга устройства (если возможно).
Показания для плановой госпитализации
1. Появление симптоматики, потенциально ассоциированной с брадикардией (обморок, предобморочное состояние, слабость, головокружение и др.).
2. Ухудшение состояния и нарастание симптоматики, связанной с БА.
3. Плановая имплантация постоянного ЭКС***.
4. Плановая замена имплантированного ЭКС***.
5. Дисфункция имплантированного ЭКС***, требующая хирургического вмешательства.
6. Инфекционные осложнения, связанные с системой стимуляции.
7. Подбор антиаритмической терапии, когда это невозможно в амбулаторных условиях или сопряжено с высоким риском осложнений.
Показания для экстренной госпитализации
1. Островозникшая БА, требующая неотложной помощи.
2. Состояния, требующие временной стимуляции сердца.
3. Нарушения гемодинамики, связанные с БА или дисфункциями ЭКС***.
4. Острая дисфункция ЭКС***, требующая хирургической коррекции.
5. Состояние после остановки кровообращения и восстановления нормальной сердечной деятельности.
Показания для выписки пациента из стационара
1. Пациенты с имплантированными ЭКС***, которым дальнейшее стационарное лечение не требуется.
2. Стабилизация состояния пациентов при обратимых или медикаментозных БА.
3. Успешная коррекция медикаментозной терапии.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1. Экстракция электродов
В ряде случаев дисфункции системы кардиостимуляции - по причине имплантированных электродов или инфекционных осложнениях - рассматривается вопрос удаления электродов из сердца. Это может быть выполнено трансвенозно или на открытом сердце путем открытой торакотомии.
Причины экстракции электродов - инфекционные, обусловленные системной инфекцией: клапанный эндокардит, электрод-ассоциированный эндокардит, сепсис или инфицирование ложа, венозный тромбоз или стеноз, хроническая боль и дисфункции электродов (дислокации, переломы, нарушения изоляции).
Во всех случаях показания к экстракции и метод ее выполнения обсуждаются индивидуально, а проблема удаления эндокардиальных электродов (ЭЭ) выделяется как отдельное направление в аритмологии.
Рекомендации к экстракции электродов при инфекционных осложнениях:
- При верифицированной системной инфекции - клапанный эндокардит, электрод-ассоциированный эндокардит, сепсис - рекомендовано удаление эндокардиальных электродов [357 - 371, 716, 717].
ЕОК нет (УУР B, УДД 3)
- При верифицированной инфекции, связанной с местом имплантированной системы ЭКС*** - абсцесс ложа, пролежень, кожная эрозия, свищ, - даже при отсутствии клинических доказательств вовлечения в процесс внутрисосудистой порции ЭЭ рекомендовано удаление электродов [357 - 371, 716, 717].
ЕОК нет (УУР B, УДД 3)
- При подтвержденной инфекции внутригрудной части эпикардиальных электродов рекомендовано полное удаление электродов [357 - 371, 716, 717].
ЕОК нет (УУР B, УДД 3)
- При клинической манифестации (бактериемия) латентной грамположительной инфекции рекомендовано удаление электродов и всех ранее имплантированных ЭЭ [360 - 371, 716, 717].
ЕОК нет (УУР B, УДД 3)
- При сохраняющейся бактериемии, вызванной грамотрицательными микроорганизмами, рекомендовано полное удаление системы стимуляции и всех ранее имплантированных ЭЭ [360 - 361].
ЕОК нет (УУР C, УДД 4)
- При поверхностном инфицировании послеоперационной раны в области имплантации рекомендовано удаление системы стимуляции и ее компонентов [360 - 371].
ЕОК нет (УУР B, УДД 3)
- При длительной антибактериальной терапии хронической бактериемии в случаях, когда доказан другой источник инфекции, удаление системы стимуляции и ее компонентов не рекомендовано [357 - 371].
ЕОК нет (УУР A, УДД 3)
Рекомендации к экстракции электродов при неинфекционных осложнениях:
- Пациентам с выраженной хронической болью в области имплантированного устройства, когда ее проявления невозможно устранить медикаментозным или хирургическим путем и отсутствует какая-либо альтернатива разрешения проблемы, рекомендовано удаление системы стимуляции или ее компонентов [372 - 404].
ЕОК нет (УУР B, УДД 3)
- Пациентам с клинически значимыми проявлениями тромбоэмболического синдрома, связанного с образованием тромбов на электроде или фрагменте электрода, рекомендовано удаление ЭЭ [372 - 404].
ЕОК нет (УУР B, УДД 3)
- Пациентам с двусторонними тромбозами подключичных вен или тромбозом ВПВ, препятствующими имплантации необходимого для пациента ЭЭ, рекомендовано удаление ЭЭ [372 - 404].
ЕОК нет (УУР A, УДД 3)
- При необходимости стентирования вены, уже использованной для доставки ЭЭ к сердцу (содержащей ЭЭ), рекомендовано удаление ЭЭ [372 - 404].
ЕОК нет (УУР B, УДД 3)
- При окклюзии или стенозе ВПВ, имеющих значимые клинические проявления, рекомендовано удаление ЭЭ [372 - 404].
ЕОК нет (УУР A, УДД 3)
- При наличии четырех и более ЭЭ на одной из сторон - или через ВПВ проведено пять и более ЭЭ - рекомендовано удаление ЭЭ [390 - 404].
ЕОК нет (УУР B, УДД 3)
- Пациентам с тромбозом подключичной вены на стороне ранее имплантированного устройства в случаях, когда есть необходимость в имплантации дополнительного ЭЭ, но имеются противопоказания к использованию противоположной подключичной вены - артериовенозная фистула, постоянный венозный порт, перенесенная мастэктомия и др., - рекомендовано удаление ЭЭ [372 - 404].
ЕОК нет (УУР C, УДД 4)
- Удаление ЭЭ рекомендовано пациентам с жизнеугрожающими аритмиями, причиной которых являются сами электроды [372 - 404].
ЕОК нет (УУР C, УДД 4)
- Удаление ЭЭ рекомендовано в случаях, когда ЭЭ из-за их дизайна или нарушения целостности представляют собой непосредственную угрозу (напр., перелом и протрузия стилета в J-образных электродах) [369 - 404].
ЕОК нет (УУР C, УДД 4)
- Удаление ЭЭ рекомендовано в случаях, когда они препятствуют проведению противоопухолевого лечения (радиационная терапия, реконструктивная хирургия) [372 - 404].
ЕОК нет (УУР C, УДД 4)
- Удаление ЭЭ рекомендовано в случаях, когда диагностика состояния пациента требует безальтернативного выполнения магнитно-резонансная томографии (МРТ) сердца с контрастированием [372 - 404].
ЕОК нет (УУР B, УДД 3)
- Удаление ЭЭ не рекомендовано пациентам с прогнозируемой длительностью жизни менее 1 года [364 - 404].
ЕОК нет (УУР C, УДД 4)
- Удаление ЭЭ не рекомендовано в ситуациях, когда установлено аномальное позиционирование ЭЭ (имплантирован через подключичную артерию, аорту, плевру, средостение, стенку предсердия или желудочка). В случаях клинической необходимости используются дополнительные методики с обязательной хирургической страховкой [372 - 404].
ЕОК нет (УУР B, УДД 3)
7.2. Выполнение магнитно-резонансной томографии сердца у пациентов с имплантированными устройствами
Пациентам с имплантированными ЭКС нередко требуется МРТ сердца с контрастированием. Это потенциально может вызвать нежелательные побочные эффекты, такие как неправильная работа устройства из-за перезагрузки устройства или проблемы с чувствительностью, индукцию токов, приводящих к захвату миокарда, нагреву кончика электрода с изменением порогов чувствительности или стимуляции, или перфорации электрода.
В настоящее время большинство производителей ЭКС предлагают МРТ-совместимые устройства. Производитель обычно указывает период ожидания в течение 6 нед. после имплантации, но выполнить МРТ можно и раньше, если это клинически оправдано.
Существует достаточно доказательств того, что МРТ можно безопасно выполнять пациентам с МРТ-несовместимыми ЭКС при соблюдении ряда мер предосторожности [692 - 694]. В 2017 г Общество сердечного ритма опубликовало консенсусное заключение экспертов по МРТ у пациентов с ИЭУ, которое было разработано и одобрено рядом ассоциаций, включая Европейскую ассоциацию сердечного ритма и несколько радиологических ассоциаций [693]. Оценка необходимости выполнения МРТ должна проводиться в каждом конкретном случае, сопоставляя преимущества МРТ с потенциальными рисками и доступностью альтернативных методов визуализации, используя совместное принятие решения. Обычно МРТ следует выполнять строго в соответствии с утвержденным стандартизированным в конкретном учреждении протоколом, соблюдая соответствующие условия (включая программирование ИЭУ [395, 692, 694 - 696].
- У пациентов с МРТ-совместимыми системами ЭКС***, МРТ рекомендовано безопасно выполнять в соответствии с инструкциями производителя [395, 693, 696].
ЕОК I A (УУР A, УДД 2)
- У пациентов с МРТ-несовместимыми устройствами выполнение МРТ рекомендовано при отсутствии альтернативных методов визуализации, а также эпикардиальных отведений, заглушенных или поврежденных отведений, адаптеров/удлинителей отведений [692, 694].
ЕОК IIa B (УУР C, УДД 4)
- Рекомендовано рассмотреть возможность выполнения МРТ у пациентов с системами ЭКС*** и заглушенными эндокардиальными электродами, если нет доступных альтернативных методов визуализации [697 - 700].
ЕОК IIb C (УУР C, УДД 4)
7.3. Если постоянная стимуляция больше не показана
Возможны несколько вариантов ведения пациентов с имплантированными кардиостимулирующими системами, которым стимуляция более не показана:
1. Оставить на месте всю систему стимуляции, включая устройство и электроды
2. Удалить устройство и оставить электроды
3. Удалить устройство и электроды
Выбор варианта 1 зависит от срока службы имплантированного устройства, который зависит от производителя и в редких случаях может приводить к осложнениям [701]. Вариант 1 является предпочтительным для ослабленных и пожилых пациентов.
Вариант 2 сопряжен с более низким интраоперационным риском, но в дальнейшем, могут возникать осложнения со стороны оставленного электрода, например, при выполнении МРТ. Особенно у молодых пациентов может возникнуть потребность удаления оставленных электродов в будущем из-за инфекции и более высокий риск осложнений за счет увеличения длительности процедуры имплантации. В нескольких исследованиях было показано, что процедура удаления заглушенных электродов сопряжена с более высоким риском осложнений и меньшей эффективностью [702 - 705].
Вариант 3 ассоциирован с высоким риском осложнений, связанных с процедурой удаления электродов, но при этом исключается вероятность возникновения связанных с устройством осложнений в будущем. Высокая эффективность и низкий уровень осложнений наблюдаются при процедурах экстракции электродов, выполненных в специализированных центрах с большим объемом операций и современным оборудованием [704]. Последний вариант может подходить при сочетании таких факторов как молодой возраст пациента, низкий риск экстракции электрода и опыт специалиста.
В рамках пациент-ориентированного ведения решение в таких ситуациях должно быть основано на индивидуальном соотношении риска и пользы и принято совместно с пациентом и лицами, осуществляющими уход за ним. Для получения информированного согласия необходимо предоставление достаточной информации. Следует учитывать такие факторы как возраст пациента, его клиническое состояние, сопутствующие заболевания, систему ЭКС, давность имплантации электрода и ожидаемую продолжительность жизни пациента.
- Когда ЭКС*** больше не показана, рекомендован индивидуальной анализ риска и пользы для принятия решения совместного с пациентом. [714]
ЕОК I C (УУР C, УДД 5)
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи взрослым при брадиаритмии и нарушениях проводимости (коды по МКБ-10: I44 (I44.0, I44.1, I44.2, I44.3, I44.4, I44.5, I44.6, I44.7), I45 (I45.0, I45.1, I45.2, I45.3, I45.4, I45.5, I45.8, I45.9), I46 (I46.0, I46.1, I46.9), I49.5)
N п/п
Критерии оценки качества
Оценка выполнения
1.
Выполнен осмотр со сбором жалоб, анамнеза, проведено физикальное обследование пациента
Да/Нет
2.
Выполнена регистрация электрокардиограммы в 12 отведениях
Да/Нет
3.
Выполнено длительное мониторирование сердечного ритма с использованием кардиомонитора, выбранного на основе частоты, характера симптомов, а также предпочтения пациента
Да/Нет
4.
Выполнена трансторакальная эхокардиография пациентам с брадикардией или нарушениями проводимости (блокада левой ножки пучка Гиса и предсердно-желудочковая блокада II степени Мобитц II, предсердно-желудочковая блокада высокой степени или предсердно-желудочковая блокада III степени) при подозрении на структурное заболевание сердца или пациент направлен в специализированную медицинскую организацию для проведения исследования
Да/Нет
5.
Выполнено тестирование работы электрокардиостимулятора после его имплантации дважды в течение 6 месяцев, затем не реже 1 раза в год, пациентам с двухкамерными электрокардиостимуляторами после имплантации - дважды в течение 6 месяцев, затем не реже 1 раза в год, или пациент направлен в специализированную медицинскую организацию для тестирования электрокардиостимулятора
Да/Нет
6.
Выполнена постановка на диспансерное наблюдение врачом-кардиологом при наличии имплантированного электронного искусственного водителя сердечного ритма, при наличии брадиаритмии и нарушениях внутрисердечной проводимости, связанных с высоким риском смерти
Да/Нет
Критерии оценки качества специализированной медицинской помощи взрослым при брадиаритмии и нарушениях проводимости (коды по МКБ-10: I44 (I44.0, I44.1, I44.2, I44.3, I44.4, I44.5, I44.6, I44.7), I45 (I45.0, I45.1, I45.2, I45.3, I45.4, I45.5, I45.8, I45.9), I46 (I46.0, I46.1, I46.9), I49.5)
N п/п
Критерии оценки качества
Оценка выполнения
1.
Выполнен осмотр со сбором жалоб, анамнеза, проведено физикальное обследование пациента
Да/Нет
2.
Выполнена регистрация электрокардиограммы в 12 отведениях
Да/Нет
3.
Выполнено длительное мониторирование сердечного ритма с использованием кардиомонитора, выбранного на основе частоты, характера симптомов, а также предпочтения пациента
Да/Нет
4.
Выполнена трансторакальная эхокардиография пациентам с брадикардией или нарушениями проводимости (блокада левой ножки пучка Гиса и предсердно-желудочковая блокада II степени Мобитц II, предсердно-желудочковая блокада высокой степени или предсердно-желудочковая блокада III степени) при подозрении на структурное заболевание сердца или пациент направлен в специализированную медицинскую организацию для проведения исследования
Да/Нет
5.
Выполнена имплантация постоянного электрокардиостимулятора с обеспечением однокамерной или двухкамерной стимуляции сердца для устранения брадикардии и ее клинической симптоматики при отсутствии обратимости или при отсутствии физиологического характера брадикардии, или пациент направлен в специализированную медицинскую организацию для выполнения имплантации
Да/Нет
6.
Выполнено тестирование работы электрокардиостимулятора после его имплантации дважды в течение 6 месяцев, затем не реже 1 раза в год, пациентам с двухкамерными электрокардиостимуляторами после имплантации - дважды в течение 6 месяцев, затем не реже 1 раза в год, или пациент направлен в специализированную медицинскую организацию для тестирования электрокардиостимулятора
Да/Нет
Список литературы
1. Howick JH. The Philosophy of Evidence-based Medicine. Wiley. p. 15. ISBN 978-1-4443-4266-6.
2. Sackett DL, Rosenberg WM, Gray JA, et al. Evidence based medicine: what it is and what it isn't. BMJ. 1996; 312: 71 - 72.
3. Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 03.04.2017) "Об основах охраны здоровья граждан в Российской Федерации".
4. Эпидемиологический словарь/под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. - 4-е изд. - Москва, 2009. - 316 с.
5. Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТ Р 52379-2005. Надлежащая клиническая практика. - Москва, 2005.
6. Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 03.07.2016) "Об обращении лекарственных средств"
7. Малая медицинская энциклопедия. М.: Медицинская энциклопедия. 1991 - 96 гг. http://www.rubricon.com/mme_1.asp
8. Андреева Н.С., Реброва О.Ю., Зорин Н.А. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации.//Медицинские технологии. Оценка и выбор. - 2012. - N 4. - С. 10 - 24.
9. Robles de Medina E.O., Bernard R., Coumel Ph. et al. Definition of terms related to cardiac rhythm. WHO/ISFC Task Force. Eur J Cardiol, 1978, v. 8, 127 - 144.
10. Егоров Д.Ф., Гордеев О.Л. Диагностика и лечение пациентов с имплантированными антиаритмическими устройствами. - СПб.: Человек, 2005. - 256 с.
11. Writing Committee Members, Kusumoto FM, Schoenfeld MH, Barrett C, Edgerton JR, Ellenbogen KA, Gold MR, Goldschlager NF, Hamilton RM, Joglar JA, Kim RJ, Lee R, Marine JE, McLeod CJ, Oken KR, Patton KK, Pellegrini CN, Selzman KA, Thompson A, Varosy PD. 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients with Bradycardia and Cardiac Conduction Delay. JACC. 2019. Vol.74. Issue 7.
12. Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA, Cleland J, Deharo JC, Delgado V, Elliott PM, Gorenek B, Israel CW, Leclercq C, Linde C, Mont L, Padeletti L, Sutton R, Vardas PE.. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. European Heart Journal. 2013; 34: 2281 - 2329.
13. Brignole M, Auricchio A, Baron-Esquivias G, et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. The Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). European Heart Journal. 2013; 34: 2281 - 2329.
14. Бокерия Л.А., Ревишвили А.Ш., Левант А.Д., Жданов А.М., Колпаков Е.В., Егоров Д.Ф., Пекарский В.В., Дрогайцев А.Д. Рекомендации для имплантации электрокардиостимуляторов при брадикардиях, 1993. УДК 616.12-008.314-089.844.
15. Del Rosso A, Ungar A, Maggi R, et al. Clinical predictors of cardiac syncope at initial evaluation in patients referred urgently to a general hospital: the EGSYS score. Heart. 2008; 94: 1620 - 6.
16. Linzer M, Yang EH, Estes NA 3rd, et al. Diagnosing syncope. Part 1: Value of history, physical examination, and electrocardiography. Clinical Efficacy Assessment Project of the American College of Physicians. Ann Intern Med. 1997; 126: 989 - 96.
17. Perez-Rodon J, Martinez-Alday J, Baron-Esquivias G, et al. Prognostic value of the electrocardiogram in patients with syncope: data from the group for syncope study in the emergency room (GESINUR). Heart Rhythm. 2014; 11: 2035 - 44.
18. Thiruganasambandamoorthy V, Hess EP, Turko E, et al. Defining abnormal electrocardiography in adult emergency department syncope patients: the Ottawa Electrocardiographic Criteria. CJEM. 2012; 14: 248 - 58.
19. Shen WK, Sheldon RS, Benditt DG, et al. 2017 ACC/AHA/HRS guideline for the evaluation and management of patients with syncope: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2017; 136: e60 - 122
20. Chon SB, Kwak YH, Hwang SS, et al. Severe hyperkalemia can be detected immediately by quantitative electrocardiography and clinical history in patients with symptomatic or extreme bradycardia: a retrospective cross-sectional study. J Crit Care. 2013; 28: 1112. e7 - 13.
21. Mandell BF. Cardiovascular involvement in systemic lupus erythematosus. Semin Arthritis Rheum. 1987; 17: 126 - 41.
22. Nakayama Y, Ohno M, Yonemura S, et al. A case of transient 2:1 atrioventricular block, resolved by thyroxine supplementation for subclinical hypothyroidism. Pacing Clin Electrophysiol. 2006; 29: 106 - 8.
23. Noble K, Isles C. Hyperkalaemia causing profound bradycardia. Heart. 2006; 92: 1063.
24. Wan D, Blakely C, Branscombe P, et al. Lyme carditis and high-degree atrioventricular block. Am J Cardiol. 2018; 121: 1102 - 4.
25. Barrett PM, Komatireddy R, Haaser S, et al. Comparison of 24-hour Holter monitoring with 14-day novel adhesive patch electrocardiographic monitoring. Am J Med. 2014; 127: 95. e11 - 7.
26. Brown AP, Dawkins KD, Davies JG. Detection of arrhythmias: use of a patient-activated ambulatory electrocardiogram device with a solid-state memory loop. Br Heart J. 1987; 58: 251 - 3.
27. Cumbee SR, Pryor RE, Linzer M. Cardiac loop ECG recording: a new noninvasive diagnostic test in recurrent syncope. South Med J. 1990; 83: 39 - 43.
28. Gibson TC, Heitzman MR. Diagnostic efficacy of 24-hour electrocardiographic monitoring for syncope. Am J Cardiol. 1984; 53: 1013 - 7.
29. Joshi AK, Kowey PR, Prystowsky EN, et al. First experience with a Mobile Cardiac Outpatient Telemetry (MCOT) system for the diagnosis and management of cardiac arrhythmia. Am J Cardiol. 2005; 95: 878 - 81.
30. Linzer M, Yang EH, Estes NA 3rd, et al. Diagnosing syncope. Part 2: unexplained syncope. Clinical Efficacy Assessment Project of the American College of Physicians. Ann Intern Med. 1997; 127: 76 - 86.
31. Locati ET, Moya A, Oliveira M, et al. External prolonged electrocardiogram monitoring in unexplained syncope and palpitations: results of the SYNARR-Flash study. Europace. 2016; 18: 1265 - 72.
32. Reiffel JA, Schwarzberg R, Murry M. Comparison of autotriggered memory loop recorders versus standard loop recorders versus 24-hour Holter monitors for arrhythmia detection. Am J Cardiol. 2005; 95: 1055 - 9.
33. Rosenberg MA, Samuel M, Thosani A, et al. Use of a noninvasive continuous monitoring device in the management of atrial fibrillation: a pilot study. Pacing Clin Electrophysiol. 2013; 36: 328 - 33.
34. Rothman SA, Laughlin JC, Seltzer J, et al. The diagnosis of cardiac arrhythmias: a prospective multi-center randomized study comparing mobile cardiac outpatient telemetry versus standard loop event monitoring. J Cardiovasc Electrophysiol. 2007; 18: 241 - 7.
35. Sivakumaran S, Krahn AD, Klein GJ, et al. A prospective randomized comparison of loop recorders versus Holter monitors in patients with syncope or presyncope. Am J Med. 2003; 115: 1 - 5.
36. Turakhia MP, Hoang DD, Zimetbaum P, et al. Diagnostic utility of a novel leadless arrhythmia monitoring device. Am J Cardiol. 2013; 112: 520 - 4.
37. Brignole M, Auricchio A, Baron-Esquivias G, et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. The Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). European Heart Journal. 2013; 34: 2281 - 2329.
38. Ревишвили А.Ш. Бойцов С.А., Давтян К.В., Зенин С.А., Кузнецов В.А., Купцов В.В., Лебедев Д.С., Ломидзе Н.Н., Медведев М.М., Недоступ А.В., Неминущий Н.М., Певзнер А.В., Покушалов Е.А., Рзаев Ф.Г., Татарский Б.А., Термосесов С.А., Тюрина Т.В., Шубик Ю.В., Яшин С.М. Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств. - Москва, 2017. - 702 с.
39. Dagres N, Bongiorni MG, Dobreanu D, et al. Current investigation and management of patients with syncope: results of the European Heart Rhythm Association survey. Europace. 2013; 15: 1812 - 5.
40. Schneider JF, Thomas HE Jr, Kreger BE, et al. Newly acquired left bundle-branch block: the Framingham study. Ann Intern Med. 1979; 90: 303 - 10.
41. Schneider JF, Thomas HE Jr, Sorlie P, et al. Comparative features of newly acquired left and right bundle branch block in the general population: the Framingham study. Am J Cardiol. 1981; 47: 931 - 40.
42. Talreja D, Gruver C, Sklenar J, et al. Efficient utilization of echocardiography for the assessment of left ventricular systolic function. Am Heart J. 2000; 139: 394 - 8.
43. Dhingra R, Ho Nam B, Benjamin EJ, et al. Cross-sectional relations of electrocardiographic QRS duration to left ventricular dimensions: the Framingham Heart Study. J Am Coll Cardiol. 2005; 45: 685 - 9.
44. Dhingra R, Pencina MJ, Wang TJ, et al. Electrocardiographic QRS duration and the risk of congestive heart failure: the Framingham Heart Study. Hypertension. 2006; 47: 861 - 7.
45. Badheka AO, Singh V, Patel NJ, et al. QRS duration on electrocardiography and cardiovascular mortality (from the National Health and Nutrition Examination Survey-III). Am J Cardiol. 2013; 112: 671 - 7.
46. Bogale N, Orn S, James M, et al. Usefulness of either or both left and right bundle branch block at baseline or during follow-up for predicting death in patients following acute myocardial infarction. Am J Cardiol. 2007; 99: 647 - 50.
47. Eriksson P, Hansson PO, Eriksson H, et al. Bundle-branch block in a general male population: the study of men born 1913. Circulation. 1998; 98: 2494 - 500.
48. Fahy GJ, Pinski SL, Miller DP, et al. Natural history of isolated bundle branch block. Am J Cardiol. 1996; 77: 1185 - 90.
49. Imanishi R, Seto S, Ichimaru S, et al. Prognostic significance of incident complete left bundle branch block observed over a 40-year period. Am J Cardiol. 2006; 98: 644 - 8.
50. Chiu DT, Shapiro NI, Sun BC, et al. Are echocardiography, telemetry, ambulatory electrocardiography monitoring, and cardiac enzymes in emergency department patients presenting with syncope useful tests? A preliminary investigation. J Emerg Med. 2014; 47: 113 - 8.
51. Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/ HFSA/HRS/SCAI/SCCM/SCCT/SCMR. 2011 Appropriate use criteria for echocardiography: a report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiography, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance American College of Chest Physicians. J Am Soc Echocardiogr. 2011; 24: 229 - 67.
52. Menozzi C, Brignole M, Alboni P, et al. The natural course of untreated sick sinus syndrome and identification of the variables predictive of unfavorable outcome. Am J Cardiol. 1998; 82: 1205 - 9.
53. Bluemke DA, Achenbach S, Budoff M, et al. Noninvasive coronary artery imaging: magnetic resonance angiography and multidetector computed tomography angiography: a scientific statement from the american heart association committee on cardiovascular imaging and intervention of the council on cardiovascular radiology and intervention, and the councils on clinical cardiology and cardiovascular disease in the young. Circulation. 2008; 118: 586 - 606.
54. Bokhari S, Castano A, Pozniakoff T, et al. (99m)Tc-pyrophosphate scintigraphy for differentiating light-chain cardiac amyloidosis from the transthyretin-related familial and senile cardiac amyloidoses. Circ Cardiovasc Imaging. 2013; 6: 195 - 201.
55. Cheong B, Huber S, Muthupillai R, et al. Evaluation of myocardial iron overload by T(2)* cardiovascular magnetic resonance imaging. Tex Heart Inst J. 2005; 32: 448 - 9.
56. Fontana M, Pica S, Reant P, et al. Prognostic value of late gadolinium enhancement cardiovascular magnetic resonance in cardiac amyloidosis. Circulation. 2015; 132: 1570 - 9.
57. Franco A, Javidi S, Ruehm SG. Delayed myocardial enhancement in cardiac magnetic resonance imaging. J Radiol Case Rep. 2015; 9: 6 - 18.
58. Greulich S, Deluigi CC, Gloekler S, et al. CMR imaging predicts death and other adverse events in suspected cardiac sarcoidosis. JACC Cardiovasc Imaging. 2013; 6: 501 - 11.
59. Haq M, Pawar S, Berk JL, et al. Can 99mTc-pyrophosphate aid in early detection of cardiac involvement in asymptomatic variant TTR amyloidosis? JACC Cardiovasc Imaging. 2017; 10: 713 - 4.
60. Taylor AJ, Cerqueira M, Hodgson JM, et al. ACCF/SCCT/ACR/ AHA/ASE/ASNC/NASCI/SCAI/SCMR 2010 appropriate use criteria for cardiac computed tomography: a report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, the Society of Cardiovascular Computed Tomography, the American College of Radiology, the American Heart Association, the American Society of Echocardiography, the American Society of Nuclear Cardiology, the North American Society for Cardiovascular Imaging, the Society for Cardiovascular Angiography and Interventions, and the Society for Cardiovascular Magnetic Resonance. Circulation. 2010; 122: e525 - 55.
61. Mendu ML, McAvay G, Lampert R, et al. Yield of diagnostic tests in evaluating syncopal episodes in older patients. Arch Intern Med. 2009; 169: 1299 - 305.
62. Recchia D, Barzilai B. Echocardiography in the evaluation of patients with syncope. J Gen Intern Med. 1995; 10: 649 - 55.
63. Tilkian AG, Guilleminault C, Schroeder JS, et al. Sleep-induced apnea syndrome. Prevalence of cardiac arrhythmias and their reversal after tracheostomy. Am J Med. 1977; 63: 348 - 58. S4.2.7 - 2.
64. Guilleminault C, Connolly SJ, Winkle RA. Cardiac arrhythmia and conduction disturbances during sleep in 400 patients with sleep apnea syndrome. Am J Cardiol. 1983; 52: 490 - 4. S4.2.7 - 3.
65. Shepard JW Jr, Garrison MW, Grither DA, et al. Relationship of ventricular ectopy to oxyhemoglobin desaturation in patients with obstructive sleep apnea. Chest. 1985; 88: 335 - 40.
66. Shepard JW Jr. Gas exchange and hemodynamics during sleep. Med Clin North Am. 1985; 69: 1243 - 64.
67. Hoffstein V, Mateika S. Cardiac arrhythmias, snoring, and sleep apnea. Chest. 1994; 106: 466 - 71.
68. Boudoulas H, Schmidt HS, Clark RW, et al. Anthropometric characteristics, cardiac abnormalities and adrenergic activity in patients with primary disorders of sleep. J Med. 1983; 14: 223 - 38.
69. Mehra R, Benjamin EJ, Shahar E, et al. Association of nocturnal arrhythmias with sleepdisordered breathing: The Sleep Heart Health Study. Am J Respir Crit Care Med. 2006; 173: 910 - 6.
70. Miller WP. Cardiac arrhythmias and conduction disturbances in the sleep apnea syndrome. Prevalence and significance. Am J Med. 1982; 73: 317 - 21.
71. Flemons WW, Remmers JE, Gillis AM. Sleep apnea and cardiac arrhythmias. Is there a relationship? Am Rev Respir Dis. 1993; 148: 618 - 21.
72. Stegman SS, Burroughs JM, Henthorn RW. Asymptomatic bradyarrhythmias as a marker for sleep apnea: appropriate recognition and treatment may reduce the need for pacemaker therapy. Pacing Clin Electrophysiol. 1996; 19: 899 - 904.
73. Garrigue S, Pepin JL, Defaye P, et al. High prevalence of sleep apnea syndrome in patients with long-term pacing: the European Multicenter Polysomnographic Study. Circulation. 2007; 115: 1703 - 9.
74. Becker H, Brandenburg U, Peter JH, et al. Reversal of sinus arrest and atrioventricular conduction block in patients with sleep apnea during nasal continuous positive airway pressure. Am J Respir Crit Care Med. 1995; 151: 215 - 8.
75. Koehler U, Fus E, Grimm W, et al. Heart block in patients with obstructive sleep apnoea: pathogenetic factors and effects of treatment. Eur Respir J. 1998; 11: 434 - 9.
76. Grimm W, Koehler U, Fus E, et al. Outcome of patients with sleep apnea-associated severe bradyarrhythmias after continuous positive airway pressure therapy. Am J Cardiol. 2000; 86: 688 - 92, a9.
77. Harbison J, O'Reilly P, McNicholas WT. Cardiac rhythm disturbances in the obstructive sleep apnea syndrome: effects of nasal continuous positive airway pressure therapy. Chest. 2000; 118: 591 - 5.
78. Daccarett M, Segerson NM, Hamdan AL, et al. Relation of daytime bradyarrhythmias with high risk features of sleep apnea. Am J Cardiol. 2008; 101: 1147 - 50.
79. Bjerregaard P. Premature beats in healthy subjects 40 - 79 years of age. Eur Heart J. 1982; 3: 493 - 503.
80. Clarke JM, Hamer J, Shelton JR, et al. The rhythm of the normal human heart. Lancet. 1976; 1: 508 - 12.
81. Fleg JL, Kennedy HL. Cardiac arrhythmias in a healthy elderly population: detection by 24-hour ambulatory electrocardiography. Chest. 1982; 81: 302 - 7.
82. Brodsky M, Wu D, Denes P, et al. Arrhythmias documented by 24 hour continuous electrocardiographic monitoring in 50 male medical students without apparent heart disease. Am J Cardiol. 1977; 39: 390 - 5.
83. Meytes I, Kaplinsky E, Yahini JH, et al. Wenckebach A-V block: a frequent feature following heavy physical training. Am Heart J. 1975; 90: 426 - 30.
84. Northcote RJ, Canning GP, Ballantyne D. Electrocardiographic findings in male veteran endurance athletes. Br Heart J. 1989; 61: 155 - 60.
85. Viitasalo MT, Kala R, Eisalo A. Ambulatory electrocardiographic recording in endurance athletes. Br Heart J. 1982; 47: 213 - 20.
86. Brubaker H. and Kitzman D.W. Chronotropic Incompetence: Causes, Consequences, and Management. Circulation. 2011; 123: 1010 - 1020.
87. Morise A. Exercise Testing in Nonatherosclerotic Heart Disease, Hypertrophic Cardiomyopathy, Valvular Heart Disease, and Arrhythmias. Circulation. 2011; 123: 216 - 225.
88. Farwell DJ, Freemantle N, Sulke AN. Use of implantable loop recorders in the diagnosis and management of syncope. Eur Heart J. 2004; 25: 1257 - 63.
89. Krahn AD, Klein GJ, Yee R, et al. Randomized assessment of syncope trial: conventional diagnostic testing versus a prolonged monitoring strategy. Circulation. 2001; 104: 46 - 51.
90. Podoleanu C, DaCosta A, Defaye P, et al. Early use of an implantable loop recorder in syncope evaluation: a randomized study in the context of the French healthcare system (FRESH study). Arch Cardiovasc Dis. 2014; 107: 546 - 52.
91. Krahn AD, Klein GJ, Yee R, et al. Final results from a pilot study with an implantable loop recorder to determine the etiology of syncope in patients with negative noninvasive and invasive testing. American Journal of Cardiology. 1998; 82: A8 - A9.
92. Shen WK, Sheldon RS, Benditt DG, et al. 2017 ACC/AHA/HRS guideline for the evaluation and management of patients with syncope: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2017; 136: e60 - 122.
93. Brignole M, Vardas P, Hoffman E, Huikuri H, Moya A, Ricci R, Sulke N, Wieling W; EHRA Scientific Documents Committee, Auricchio A, Lip GY, Almendral J, Kirchhof P, Aliot E, Gasparini M, Braunschweig F; Document Reviewers, Lip GY, Almendral J, Kirchhof P, Botto GL; EHRA Scientific Documents Committee.. Indications for the use of diagnostic implantable and external ECG loop recorders. Europace. 2009; 11: 671 - 687
94. Assar M, Krahn A, Klein G, Yee R, Skanes A. Optimal duration of monitoring in patients with unexplained syncope. Am J Cardiol. 2003; 92: 1231 - 123
95. Farwell D, Freemantle N, Sulke N. The clinical impact of implantable loop recorders in patients with syncope. Eur Heart J. 2006; 27: 351 - 6.
96. Brignole M, Sutton R, Menozzi C, Garcia-Civera R, Moya A, Wieling W, Andresen D, Benditt DG, Vardas P; International Study on Syncope of Uncertain Etiology 2 (ISSUE2) Group. Early application of an implantable loop recorder allows effective specific therapy in patients with recurrent suspected neurally mediated syncope. Eur Heart J. 2006; 27: 1085 - 1092.
97. Brignole M, Menozzi C, Maggi R, Solano A, Donateo P, Bottoni N et al. The usage and diagnostic yield of the implantable loop recorder in detection of the mechanism of syncope and in guiding effective antiarrhythmic therapy in older people. Europace. 2005; 7: 273 - 279
98. Krahn AD, Klein GJ, Yee R, Hoch JS, Skanes AC Cost implications of testing strategy in patients with syncope: randomized assessment of syncope trial. J Am Coll Cardiol. 2003 Aug 6; 42(3): 495 - 501.
99. Solano A, Menozzi C, Maggi R, Donateo P, Bottoni N, Lolli G et al. Incidence, diagnostic yield and safety of the implantable looprecorder to detect the mechanismof syncope in patients with and without structural heart disease. Eur Heart J. 2004; 25: 1116 - 9.
100. Brignole M, Vardas P, Hoffman E, Huikuri H, Moya A, Ricci R, Sulke N, Wieling W; EHRA Scientific Documents Committee, Auricchio A, Lip GY, Almendral J, Kirchhof P, Aliot E, Gasparini M, Braunschweig F; Document Reviewers, Lip GY, Almendral J, Kirchhof P, Botto GL; EHRA Scientific Documents Committee. Indications for the use of diagnostic implantable and external ECG loop recorders. Europace. 2009; 11: 671 - 687.
101. Toshiyuki Furukawa, M.D., Ph.D., Robertomaggi, M. D. Additional Diagnostic Value of Very Prolonged Observation by Implantable Loop Recorder in Patients with Unexplained Syncope. Journal of Cardiovascular Electrophysiology. Vol. 23, No. 1, January 2012
102. ESC, Guidelines on Management (Diagnosis and Treatment) of Syncope. The Task Force on Syncope, European Society of Cardiology. Europace. 2009; 6: 467 - 537.
103. Zaidi A, Clough P, Cooper P, Scheepers B, Fitzpatrick AP. Misdiagnosis of epilepsy: many seizure-like attacks have a cardiovascular cause. J Am Coll Cardiol 2000; 36: 181 - 184.
104. Brignole M, Menozzi C, Moya A, Garcia-Civera R, Mont L, Alvarez M, Errazquin F, Beiras J, Bottoni N, Donateo P; International Study on Syncope of Uncertain Etiology (ISSUE) Investigators. Mechanism of syncope in patients with bundle branch block and negative electrophysiological test. Circulation. 2001; 104: 2045 - 2050.
105. Menozzi C, Brignole M, Garcia-Civera R, Moya A, Botto G, Tercedor L, Migliorini R, Navarro X; International Study on Syncope of Uncertain Etiology (ISSUE) Investigators. Mechanism of syncope in patients with heart disease and negative electrophysiologic test. Circulation. 2002; 105: 2741 - 2745.
106. DiMarco JP, Garan H, Ruskin JN. Approach to the patient with recurrent syncope of unknown cause. Mod Concepts Cardiovasc Dis. 1983; 52: 11 - 6.
107. Fisher JD. Role of electrophysiologic testing in the diagnosis and treatment of patients with known and suspected bradycardias and tachycardias. Prog Cardiovasc Dis. 1981; 24: 25 - 90.
108. Gulamhusein S, Naccarelli GV, Ko PT, et al. Value and limitations of clinical electrophysiologic study in assessment of patients with unexplained syncope. Am J Med. 1982; 73: A53.
109. Krol RB, Morady F, Flaker GC, et al. Electrophysiologic testing in patients with unexplained syncope: clinical and noninvasive predictors of outcome. J Am Coll Cardiol. 1987; 10: 358 - 63.
110. Denniss AR, Ross DL, Richards DA, et al. Electrophysiologic studies in patients with unexplained syncope. Int J Cardiol. 1992; 35: 211 - 7.
111. Shen WK, Sheldon RS, Benditt DG, et al. 2017 ACC/AHA/HRS guideline for the evaluation and management of patients with syncope: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2017; 136: e60 - 122.
112. Altschuler H, Fisher JD, Furman S. Significance of isolated H-V interval prolongation in symptomatic patients without documented heart block. Am Heart J. 1979; 97: 19 - 26.
113. Fujimura O, Yee R, Klein GJ, et al. The diagnostic sensitivity of electrophysiologic testing inpatients with syncope caused by transient bradycardia. N Engl J Med. 1989; 321: 1703 - 7.
114. Strauss HC, Bigger JT Jr, Saroff AL, Giardina EG. Electrophysiologic evaluation of sinus node function in patients with sinus node dysfunction. Circulation. 1976; 53: 763 - 776.
115. Strauss HC, Saroff AL, Bigger JT Jr, Giardina EG. Premature atrial stimulation as a key to the understanding of sinoatrial conduction in man: presentation of data and critical review of the literature. Circulation. 1973; 47: 86 - 93
116. Breithardt G, Seipel L, Loogen F. Sinus node recovery time and calculated sinoatrial conduction time in normal subjects and patients with sinus node dysfunction. Circulation. 1977; 56: 43 - 50.
117. Gann D, Tolentino A, Samet P. Electrophysiologic evaluation of elderly patients with sinus bradycardia: a long-term follow-up study. Ann Intern Med. 1979; 90: 24 - 29.16, 17.
118. A study of heart block in man using His bundle recordings. Circulation. 1969; 39: 297 - 305.
119. Faster V, Ryden LE, Asinger RW et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation) Developed in col-laboration with the North American Society of Pacing and Electrophysiology. Circulation. 2001; 104: 2118 - 50.
120. Scheinman MM, Huang S. The 1998 NASPE prospective catheter ablation registry. Pacing Clin Electrophysiol. 2000; 23: 1020 - 8.
121. Crawford MH, Bernstein SJ, Deedwania PC et al. ACC/AHA guidelines for ambulatory electrocardiography: executive summary and recommendations, a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the Guidelines for Ambulatory Electrocardiography). Circulation. 1999; 100: 886 - 93.
122. Page RL, Joglar JA, Caldwell MA, Calkins H, Conti JB, Deal BJ, Estes NAM 3rd, Field ME, Goldberger ZD, Hammill SC, Indik JH, Lindsay BD, Olshansky B, Russo AM, Shen WK, Tracy CM, Al-Khatib SM. 2015 ACC/AHA/HRS Guideline for the Management of Adult Patients With Supraventricular Tachycardia Circulation. 133: e506 - e5746, 7, 12.
123. Jackson LR 2nd, Rathakrishnan B, Campbell K, et al. Sinus node dysfunction and atrial fibrillation: a reversible phenomenon? Pacing Clin Electrophysiol. 2017; 40: 442 - 50.
124. Aghamohammadi H, Mehrabi S, Mohammad Ali Beigi F. Prevention of bradycardia by atropine sulfate during urological laparoscopic surgery: a randomized controlled trial. Urol J. 2009; 6: 92 - 5.
125. Grmec S, Strnad M, Podgorsek D. Comparison of the characteristics and outcome among patients suffering from out-of-hospital primary cardiac arrest and drowning victims incardiac arrest. Int J Emerg Med. 2009; 2: 7 - 12.
126. Cunha BA. The diagnostic significance of relative bradycardia in infectious disease. Clin Microbiol Infect. 2000; 6: 633 - 4.
127. Herman SC, Zhou J. Isoproterenol infusion for treatment of refractory symptomatic bradycardia in parturients with congenital complete heart block. Int J Obstet Anesth. 2011; 20: 361 - 3; author reply 3.
128. Mandel WJ, Hayakawa H, Allen HN, et al. Assessment of sinus node function in patients with the sick sinus syndrome. Circulation. 1972; 46: 761 - 9.
129. Ogawa H, Inoue T, Miwa S, et al. Heart rate responses to autonomic drugs in sick sinus syndrome--correlation with syncope and electrophysiologic data. Jpn Circ J. 1991; 55: 15 - 23.
130. Sodeck GH, Domanovits H, Meron G, et al. Compromising bradycardia: management in the emergency department. Resuscitation. 2007; 73: 96 - 102.
131. Strauss HC, Bigger JT, Saroff AL, et al. Electrophysiologic evaluation of sinus node function in patients with sinus node dysfunction. Circulation. 1976; 53: 763 - 76.
132. Morrison LJ, Long J, Vermeulen M, et al. A randomized controlled feasibility trial comparing safety and effectiveness of prehospital pacing versus conventional treatment: "PrePACE". Resuscitation. 2008; 76: 341 - 9.
133. Bernheim A, Fatio R, Kiowski W, et al. Atropine often results in complete atrioventricular block or sinus arrest after cardiac transplantation: an unpredictable and dose-independent phenomenon. Transplantation. 2004; 77: 1181 - 5.
134. Link MS, Berkow LC, Kudenchuk PJ, et al. Part 7: adult advanced cardiovascular life support: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015; 132: S444 - 64.
135. Dhingra RC, Deedwania PC, Cummings JM, et al. Electrophysiologic effects of lidocaine on sinus node and atrium in patients with and without sinoatrial dysfunction. Circulation. 1978; 57: 448 - 54.
136. Meyer EC, Sommers DK, Schoeman HS, et al. The effect of atropine on heart-rate: a comparison between two ethnic groups. Br J Clin Pharmacol. 1988; 25: 776 - 7.
137. Brady WJ, Swart G, DeBehnke DJ, et al. The efficacy of atropine in the treatment of hemodynamically unstable bradycardia and atrioventricular block: prehospital and emergency department considerations. Resuscitation. 1999; 41: 47 - 55.
138. Feigl D, Ashkenazy J, Kishon Y. Early and late atrioventricular block in acute inferior myocardial infarction. J Am Coll Cardiol. 1984; 4: 35 - 8.
139. Sodeck GH, Domanovits H, Meron G, et al. Compromising bradycardia: management in the emergency department. Resuscitation. 2007; 73: 96 - 102.
140. Chihrin SM, Mohamed U, Yee R, et al. Utility of isoproterenol in unmasking latent escape rhythm in pacemaker dependent patients undergoing pacemaker replacement. Am J Cardiol. 2008; 101: 631 - 3. S6.3.2 - 5.
141. Dhingra RC, Winslow E, Pouget JM, et al. The effect of isoproterenol on atrioventricularand intraventricular conduction. Am J Cardiol. 1973; 32: 629 - 36.
142. Hatle L, Rokseth R. Conservative treatment of AV block in acute myocardial infarction. Results in 105 consecutive patients. Br Heart J. 1971; 33: 595 - 600.
143. Morrison LJ, Long J, Vermeulen M, et al. A randomized controlled feasibility trial comparing safety and effectiveness of prehospital pacing versus conventional treatment: "PrePACE". Resuscitation. 2008; 76: 341 - 9.
144. Hedges JR, Feero S, Shultz B, et al. Prehospital transcutaneous cardiac pacing for symptomatic bradycardia. Pacing Clin Electrophysiol. 1991; 14: 1473 - 8.
145. Gallagher JJ, Smith WM, Kerr CR, et al. Esophageal pacing: a diagnostic and therapeutic tool. Circulation. 1982; 65: 336 - 41.
146. Smith I, Monk TG, White PF. Comparison of transesophageal atrial pacing with anticholinergic drugs for the treatment of intraoperative bradycardia. Anesth Analg. 1994; 78: 245 - 52.
147. ![]() Ayerbe J,
Ayerbe J,  R,
R, ![]()
![]() C, et al. Temporary pacemakers: current use and complications. Revista
C, et al. Temporary pacemakers: current use and complications. Revista  de
de  (Engl Ed). 2004; 57: 1045 - 52.
(Engl Ed). 2004; 57: 1045 - 52.
148. Ferguson JD, Banning AP, Bashir Y. Randomised trial of temporary cardiac pacing with emirigid and balloon-flotation electrode catheters. Lancet. 1997; 349: 1883.
149. Austin JL, Preis LK, Crampton RS, et al. Analysis of pacemaker malfunction and complications of temporary pacing in the coronary care unit. Am J Cardiol. 1982; 49: 301 - 6.
150. Betts TR. Regional survey of temporary transvenous pacing procedures and complications. Postgrad Med J. 2003; 79: 463 - 5.
151. Bjornstad CC, Gjertsen E, Thorup F, et al. Temporary cardiac pacemaker treatment in five Norwegian regional hospitals. Scand Cardiovasc J. 2012; 46: 137 - 43.
152. Garcia Guerrero JJ, Fernandez de la Concha Castaneda J, Lopez Quero D, et al. Lower incidence of venous thrombosis with temporary active-fixation lead implantation in mobile patients. Europace. 2010; 12: 1604 - 7.
153. Hynes JK, Holmes DR Jr, Harrison CE. Five-year experience with temporary pacemaker therapy in the coronary care unit. Mayo Clin Proc. 1983; 58: 122 - 6.
154. Jou YL, Hsu HP, Tuan TC, et al. Trends of temporary pacemaker implant and underlying disease substrate. Pacing Clin Electrophysiol. 2010; 33: 1475 - 84.
155. Jowett NI, Thompson DR, Pohl JE. Temporary transvenous cardiac pacing: 6 years experience in one coronary care unit. Postgrad Med J. 1989; 65: 211 - 5.
156. McCann P. A review of temporary cardiac pacing wires. Indian Pacing Electrophysiol J. 2007; 7: 40 - 9.
157.  Bono J, Prieto Palomino MA,
Bono J, Prieto Palomino MA,  Guarasa I, et al. Efficacy and safety of nonpermanent transvenous pacemaker implantation in an intensive care unit. Medicina Intensiva (Engl Ed). 2011; 35: 410 - 6.
Guarasa I, et al. Efficacy and safety of nonpermanent transvenous pacemaker implantation in an intensive care unit. Medicina Intensiva (Engl Ed). 2011; 35: 410 - 6.
158. Nolewajka AJ, Goddard MD, Brown TC. Temporary transvenous pacing and femoral vein thrombosis. Circulation. 1980; 62: 646 - 50.
159. Sodeck GH, Domanovits H, Meron G, et al. Compromising bradycardia: management in the emergency department. Resuscitation. 2007; 73: 96 - 102.
160. Weinstein J, Gnoj J, Mazzara JT, et al. Temporary transvenous pacing via the percutaneous femoral vein approach. A prospective study of 100 cases. Am Heart J. 1973; 85: 695 - 705.
161. Bektas F, Soyuncu S. The efficacy of transcutaneous cardiac pacing in ED. Am J Emerg Med. 2016; 34: 2090 - 3.
162. Clinton JE, Zoll PM, Zoll R, et al. Emergency noninvasive external cardiac pacing. J Emerg Med. 1985; 2: 155 - 62.
163. Morrison LJ, Long J, Vermeulen M, et al. A randomized controlled feasibility trial comparing safety and effectiveness of prehospital pacing versus conventional treatment: "PrePACE". Resuscitation. 2008; 76: 341 - 9.
164. Sherbino J, Verbeek PR, MacDonald RD, et al. Prehospital transcutaneous cardiac pacing for symptomatic bradycardia or bradyasystolic cardiac arrest: a systematic review. Resuscitation. 2006; 70: 193 - 200.
165. Zoll PM, Zoll RH, Falk RH, et al. External noninvasive temporary cardiac pacing: clinical trials. Circulation. 1985; 71: 937 - 44.
166. Murphy JJ. Current practice and complications of temporary transvenous cardiac pacing. BMJ. 1996; 312: 1134.
167. Epstein AE, DiMarco JP, Ellenbogen KA, et al. ACC/AHA/HRS 2008 guidelines for devicebased therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices). Developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. Circulation. 2008; 117: e350 - 408.
168. Silver MD, Goldschlager N. Temporary transvenous cardiac pacing in the critical care setting. Chest. 1988; 93: 607 - 13.
169. McLeod AA, Jokhi PP. Pacemaker induced ventricular fibrillation in coronary care units. BMJ. 2004; 328: 1249 - 50.
170. Braun MU, Rauwolf T, Bock M, et al. Percutaneous lead implantation connected to an external device in stimulation-dependent patients with systemic infection--a prospective and controlled study. Pacing Clin Electrophysiol. 2006; 29: 875 - 9.
171. Bjornstad CC, Gjertsen E, Thorup F, et al. Temporary cardiac pacemaker treatment in five Norwegian regional hospitals. Scand Cardiovasc J. 2012; 46: 137 - 43.
172. Murphy JJ. Current practice and complications of temporary transvenous cardiac pacing. BMJ. 1996; 312: 1134.
173. Betts TR. Regional survey of temporary transvenous pacing procedures and complications. Postgrad Med J. 2003; 79: 463 - 5.
174. Hynes JK, Holmes DR Jr, Harrison CE. Five-year experience with temporary pacemaker therapy in the coronary care unit. Mayo Clin Proc. 1983; 58: 122 - 6.
175. ![]() Ayerbe J,
Ayerbe J,  R,
R, ![]()
![]() C, et al. Temporary pacemakers: current use and complications. Revista
C, et al. Temporary pacemakers: current use and complications. Revista  de
de  (Engl Ed). 2004; 57: 1045 - 52.
(Engl Ed). 2004; 57: 1045 - 52.
176. Ferguson JD, Banning AP, Bashir Y. Randomised trial of temporary cardiac pacing with semirigid and balloon-flotation electrode catheters. Lancet. 1997; 349: 1883.
177. Lang R, David D, Klein HO, et al. The use of the balloon-tipped floating catheter in temporary transvenous cardiac pacing. Pacing Clin Electrophysiol. 1981; 4: 491 - 6.
178. Braun MU, Rauwolf T, Bock M, et al. Percutaneous lead implantation connected to an external device in stimulation-dependent patients with systemic infection - a prospective and controlled study. Pacing Clin Electrophysiol. 2006; 29: 875 - 9.
179. Chihrin SM, Mohammed U, Yee R, et al. Utility and cost effectiveness of temporary pacing using active fixation leads and an externally placed reusable permanent pacemaker. Am J Cardiol. 2006; 98: 1613 - 5.
180. De Cock CC, Van Campen CM, In't Veld JA, et al. Utility and safety of prolonged temporary transvenous pacing using an active-fixation lead: comparison with a conventional lead. Pacing Clin Electrophysiol. 2003; 26: 1245 - 8.
181. Kawata H, Pretorius V, Phan H, et al. Utility and safety of temporary pacing using active fixation leads and externalized re-usable permanent pacemakers after lead extraction. Europace. 2013; 15: 1287 - 91.
182. Kornberger A, Schmid E, Kalender G, et al. Bridge to recovery or permanent system implantation: an eight-year single-center experience in transvenous semipermanent pacing. Pacing Clin Electrophysiol. 2013; 36: 1096 - 103.
183. Lever N, Ferguson JD, Bashir Y, et al. Prolonged temporary cardiac pacing using subcutaneous tunnelled active-fixation permanent pacing leads. Heart. 2003; 89: 209 - 10.
184. Zei PC, Eckart RE, Epstein LM. Modified temporary cardiac pacing using transvenous active fixation leads and external re-sterilized pulse generators. J Am Coll Cardiol. 2006; 47: 1487 - 9.
185. Hwang YM, Kim CM, Moon KW. Periprocedural temporary pacing in primary percutaneous coronary intervention for patients with acute inferior myocardial infarction. Clin Interv Aging. 2016; 11: 287 - 92.
186. Bocka JJ. External transcutaneous pacemakers. Ann Emerg Med. 1989; 18: 1280 - 6. (S6.3.3 - 21/S6.3.3 - 22).
187. Sharma AD, Rizo-Patron C, Hallstrom AP, et al. Percent right ventricular pacing predicts outcomes in the DAVID trial. Heart Rhythm. 2005; 2: 830 - 4.
188. Sweeney MO, Prinzen FW. A new paradigm for physiologic ventricular pacing. J Am Coll Cardiol. 2006; 47: 282 - 8.
189. Alboni P, Menozzi C, Brignole M, et al. Effects of permanent pacemaker and oral theophylline in sick sinus syndrome the THEOPACE study: a randomized controlled trial. Circulation. 1997; 96: 260 - 6.
190. Saito D, Matsubara K, Yamanari H, et al. Effects of oral theophylline on sick sinus syndrome. J Am Coll Cardiol. 1993; 21: 1199 - 204.
191. Yancy CW, Jessup M, Bozkurt B, et al. 2016 ACC/AHA/HFSA focused update on new pharmacological therapy for heart failure: an update of the 2013 ACCF/AHA Guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2016; 134: e282 - 93.
192. Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013; 128: e240 - 327.
193. Jackson LR 2nd, Rathakrishnan B, Campbell K, et al. Sinus node dysfunction and atrial fibrillation: a reversible phenomenon? Pacing Clin Electrophysiol. 2017; 40: 442 - 50.
194. Dhingra RC, Denes P, Wu D, et al. The significance of second degree atrioventricular block and bundle branch block. Observations regarding site and type of block. Circulation. 1974; 49: 638 - 46.
195. Ector H, Rolies L, De Geest H. Dynamic electrocardiography and ventricular pauses of 3 seconds and more: etiology and therapeutic implications. Pacing Clin Electrophysiol. 1983; 6: 548 - 51.
196. Edhag O, Swahn A. Prognosis of patients with complete heart block or arrhythmic syncope who were not treated with artificial pacemakers. A long-term follow-up study of 101 patients. Acta Med Scand. 1976; 200: 457 - 63.
197. Shaw DB, Eraut D. Prevalence and morbidity of heart block in Devon. Br Med J. 1970; 1: 144 - 7.
198. Shaw DB, Kekwick CA, Veale D, et al. Survival in second degree atrioventricular block. Br Heart J. 1985; 53: 587 - 93.
199. Simon AB, Zloto AE. Atrioventricular block: natural history after permanent ventricular pacing. Am J Cardiol. 1978; 41: 500 - 7.
200. Strasberg B, Amat YLF, Dhingra RC, et al. Natural history of chronic second-degree atrioventricular nodal block. Circulation. 1981; 63: 1043 - 9.
201. Bhakta D, Shen C, Kron J, et al. Pacemaker and implantable cardioverter-defibrillator use in a US myotonic dystrophy type 1 population. J Cardiovasc Electrophysiol. 2011; 22: 1369 - 75.
202. Facenda-Lorenzo M, Hernandez-Afonso J, Rodriguez-Esteban M, et al. Cardiac manifestations in myotonic dystrophy type 1 patients followed using a standard protocol in a specialized unit. Rev Esp Cardiol (Engl Ed). 2013; 66: 193 - 7.
203. Groh WJ. Arrhythmias in the muscular dystrophies. Heart Rhythm. 2012; 9: 1890 - 5.
204. Groh WJ, Groh MR, Saha C, et al. Electrocardiographic abnormalities and sudden death in myotonic dystrophy type 1. N Engl J Med. 2008; 358: 2688 - 97.
205. Ha AH, Tarnopolsky MA, Bergstra TG, et al. Predictors of atrio-ventricular conduction disease, long-term outcomes in patients with myotonic dystrophy types I and II. Pacing Clin Electrophysiol. 2012; 35: 1262 - 9.
206. Kabunga P, Lau AK, Phan K, et al. Systematic review of cardiac electrical disease in Kearns-Sayre syndrome and mitochondrial cytopathy. Int J Cardiol. 2015; 181: 303 - 10.
207. Lazarus A, Varin J, Babuty D, et al. Long-term follow-up of arrhythmias in patients with myotonic dystrophy treated by pacing: a multicenter diagnostic pacemaker study. J Am Coll Cardiol. 2002; 40: 1645 - 52.
208. Wahbi K, Meune C, Porcher R, et al. Electrophysiological study with prophylactic pacing and survival in adults with myotonic dystrophy and conduction system disease. JAMA. 2012; 307: 1292 - 301.
209. Hilgard J, Ezri MD, Denes P. Significance of ventricular pauses of three seconds or more detected on twenty-four-hour Holter recordings. Am J Cardiol. 1985; 55: 1005 - 8.
210. Saxon LA, Albert BH, Uretz EF, et al. Permanent pacemaker placement in chronic atrial fibrillation associated with intermittent AV block and cerebral symptoms. Pacing Clin Electrophysiol. 1990; 13: 724 - 9.
211. O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013; 127: e362 - 425.
212. Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014; 130: e344 - 426.
213. Rationale, design and organization of the Second Chinese Cardiac Study (CCS-2): a randomized trial of clopidogrel plus aspirin, and of metoprolol, among patients with suspected acute myocardial infarction. Second Chinese Cardiac Study (CCS-2) Collaborative Group. J Cardiovasc Risk. 2000; 7: 435 - 41.
214. Packer M, Coats AJ, Fowler MB, et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001; 344: 1651 - 8.
215. Dargie HJ. Design and methodology of the CAPRICORN trial - a randomised double blind placebo controlled study of the impact of carvedilol on morbidity and mortality in patients with left ventricular dysfunction after myocardial infarction. Eur J Heart Fail. 2000; 2: 325 - 32.
216. Sweeney MO, Hellkamp AS, Ellenbogen KA, et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation. 2003; 107: 2932 - 7.
217. Kiehl EL, Makki T, Kumar R, et al. Incidence and predictors of right ventricular pacinginduced cardiomyopathy in patients with complete atrioventricular block and preserved left ventricular systolic function. Heart Rhythm. 2016; 13: 2272 - 8.
218. Kato Y, Morimoto S, Uemura A, et al. Efficacy of corticosteroids in sarcoidosis presenting with atrioventricular block. Sarcoidosis Vasc Diffuse Lung Dis. 2003; 20: 133 - 7.
219. Reisinger J, Dubrey SW, Lavalley M, et al. Electrophysiologic abnormalities in AL (primary) amyloidosis with cardiac involvement. J Am Coll Cardiol. 1997; 30: 1046 - 51.
220. Sadek MM, Yung D, Birnie DH, et al. Corticosteroid therapy for cardiac sarcoidosis: a systematic review. Can J Cardiol. 2013; 29: 1034 - 41.
221. Sayed RH, Rogers D, Khan F, et al. A study of implanted cardiac rhythm recorders in advanced cardiac AL amyloidosis. Eur Heart J. 2015; 36: 1098 - 105.
222. Takaya Y, Kusano KF, Nakamura K, et al. Outcomes in patients with high-degree atrioventricular block as the initial manifestation of cardiac sarcoidosis. Am J Cardiol. 2015; 115: 505 - 9.
223. Zhou Y, Lower EE, Li HP, et al. Cardiac sarcoidosis: the impact of age and implanted devices on survival. Chest. 2017; 151: 139 - 48.
224. Arbustini E, Pilotto A, Repetto A, et al. Autosomal dominant dilated cardiomyopathy with atrioventricular block: a lamin A/C defect-related disease. J Am Coll Cardiol. 2002; 39: 981 - 90.
225. Anselme F, Moubarak G, Savoure A, et al. Implantable cardioverter-defibrillators in lamin A/C mutation carriers with cardiac conduction disorders. HeartRhythm. 2013; 10: 1492 - 8.
226. Scheinman MM, Peters RW, Suave MJ, et al. Value of the H-Q interval in patients with bundle branch block and the role of prophylactic permanent pacing. Am J Cardiol. 1982; 50: 1316 - 22.
227. Morady F, Higgins J, Peters RW, et al. Electrophysiologic testing in bundle branch block and unexplained syncope. Am J Cardiol. 1984; 54: 587 - 91.
228. Kubis M, Svejda J. Indication of permanent pacing after acute myocardial infarction complicated by combined intraventricular block. Cor Vasa. 1982; 24: 295 - 301.
229. Witt CM, Wu G, Yang D, et al. Outcomes with left bundle branch block and mildly to moderately reduced left ventricular function. JACC Heart Fail. 2016; 4: 897 - 903.
230. Chung ES, Katra RP, Ghio S, et al. Cardiac resynchronization therapy may benefit patients with left ventricular ejection fraction > 35%: a PROSPECT trial substudy. Eur J Heart Fail. 2010; 12: 581 - 7.
231. Peters RW, Scheinman MM, Modin C, et al. Prophylactic permanent pacemakers for patients with chronic bundle branch block. Am J Med. 1979; 66: 978 - 85.
232. DePasquale NP, Bruno MS. Natural history of combined right bundle branch block and left anterior hemiblock (bilateral bundle branch block). Am J Med. 1973; 54: 297 - 303.
233. Gadler F, Valzania C, Linde C. Current use of implantable electrical devices in Sweden: data from the Swedish pacemaker and implantable cardioverter-defibrillator registry. Europace. 2015; 17: 69 - 77.
234. Armaganijan LV, Toff WD, Nielsen JC, et al. Are elderly patients at increased risk of complications following pacemaker implantation? A meta-analysis of randomized trials. Pacing Clin Electrophysiol. 2012; 35: 131 - 4.
235. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017; 14: e503 - 51.
236. Lee JZ, Ling J, Diehl NN, et al. Mortality and cerebrovascular events after heart rhythm disorder management procedures. Circulation. 2018; 137: 24 - 33.
237. Bougioukas I, Jebran AF, Grossmann M, et al. Is there a correlation between late reexploration after cardiac surgery and removal of epicardial pacemaker wires? J Cardiothorac Surg. 2017; 12: 3.
238. Gordon RS, Ivanov J, Cohen G, et al. Permanent cardiac pacing after a cardiac operation: predicting the use of permanent pacemakers. AnnThoracSurg. 1998; 66: 1698 - 704
239. Caspi Y, Safadi T, Ammar R, et al. The significance of bundle branch block in the immediate postoperative electrocardiograms of patients undergoing coronary artery bypass. J Thorac Cardiovasc Surg. 1987; 93: 442 - 6.
240. Cook DJ, Bailon JM, Douglas TT, et al. Changing incidence, type, and natural history of conduction defects after coronary artery bypass grafting. Ann Thorac Surg. 2005; 80: 1732 - 7.
241. Mackstaller LL, Alpert JS. Atrial fibrillation: a review of mechanism, etiology, and therapy. Clin Cardiol. 1997; 20: 640 - 50.
242. Ngaage DL, Schaff HV, Mullany CJ, et al. Does preoperative atrial fibrillation influence early and late outcomes of coronary artery bypass grafting? J Thorac Cardiovasc Surg. 2007; 133: 182 - 9.
243. Puskas JD, Sharoni E, Williams WH, et al. Is routine use of temporary epicardial pacing wires necessary after either OPCAB or conventional CABG/CPB? Heart Surg Forum. 2003; 6: E103 - 6.
244. Satinsky JD, Collins JJ Jr, Dalen JE. Conduction defects after cardiac surgery. Circulation. 1974; 50: Ii170 - 4.
245. Tuzcu EM, Emre A, Goormastic M, et al. Incidence and prognostic significance of intraventricular conduction abnormalities after coronary bypass surgery. J Am Coll Cardiol. 1990; 16: 607 - 10.
246. Yesil M, Bayata S, Arikan E, et al. Should we revascularize before implanting a pacemaker? Clin Cardiol. 2008; 31: 498 - 501.
247. Zeldis SM, Morganroth J, Horowitz LN, et al. Fascicular conduction distrubances after coronary bypass surgery. Am J Cardiol. 1978; 41: 860 - 4.
248. Bethea BT, Salazar JD, Grega MA, et al. Determining the utility of temporary pacing wires after coronary artery bypass surgery. Ann Thorac Surg. 2005; 79: 104 - 7.
249. Bougioukas I, Jebran AF, Grossmann M, et al. Is there a correlation between late reexploration after cardiac surgery and removal of epicardial pacemaker wires? JCardiothoracSurg. 2017; 12: 3.
250. Caspi Y, Safadi T, Ammar R, et al. The significance of bundle branch block in the immediate postoperative electrocardiograms of patients undergoing coronary artery bypass. J Thorac Cardiovasc Surg. 1987; 93: 442 - 6.
251. Cook DJ, Bailon JM, Douglas TT, et al. Changing incidence, type, and natural history of conduction defects after coronary artery bypass grafting. Ann Thorac Surg. 2005; 80: 1732 - 7.
252. Mackstaller LL, Alpert JS. Atrial fibrillation: a review of mechanism, etiology, and therapy. Clin Cardiol. 1997; 20: 640 - 50.
253. Ngaage DL, Schaff HV, Mullany CJ, et al. Does preoperative atrial fibrillation influence early and late outcomes of coronary artery bypass grafting? J Thorac Cardiovasc Surg. 2007; 133: 182 - 9.
254. Gammie JS, Haddad M, Milford-Beland S, et al. Atrial fibrillation correction surgery: lessons from the Society of Thoracic Surgeons National Cardiac Database. Ann Thorac Surg. 2008; 85: 909 - 14.
255. Gillinov AM, Gelijns AC, Parides MK, et al. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med. 2015; 372: 1399 - 409.
256. Phan K, Xie A, La Meir M, et al. Surgical ablation for treatment of atrial fibrillation in cardiac surgery: a cumulative meta-analysis of randomised controlled trials. Heart. 2014; 100: 722 - 30.
257. Saint LL, Damiano RJ Jr, Cuculich PS, et al. Incremental risk of the Cox-maze IV procedure for patients with atrial fibrillation undergoing mitral valve surgery. J Thorac Cardiovasc Surg. 2013; 146: 1072 - 7.
258. Lee R, McCarthy PM, Wang EC, et al. Midterm survival in patients treated for atrial fibrillation: a propensity-matched comparison to patients without a history of atrial fibrillation. J Thorac Cardiovasc Surg. 2012; 143: 1341 - 51; discussion 50 - 1.
259. Ad N, Suri RM, Gammie JS, et al. Surgical ablation of atrial fibrillation trends and outcomes in North America. J Thorac Cardiovasc Surg. 2012; 144: 1051 - 60.
260. Bagur R, Manazzoni JM, Dumont ![]() , et al. Permanent pacemaker implantation following isolated aortic valve replacement in a large cohort of elderly patients with severe aortic stenosis. Heart. 2011; 97: 1687 - 94.
, et al. Permanent pacemaker implantation following isolated aortic valve replacement in a large cohort of elderly patients with severe aortic stenosis. Heart. 2011; 97: 1687 - 94.
261. Dawkins S, Hobson AR, Kalra PR, et al. Permanent pacemaker implantation after isolated aortic valve replacement: incidence, indications, and predictors. Ann Thorac Surg. 2008; 85: 108 - 12.
262. Limongelli G, Ducceschi V, D'Andrea A, et al. Risk factors for pacemaker implantation following aortic valve replacement: a single centre experience. Heart. 2003; 89: 901 - 4.
263. Bagur R, Manazzoni JM, Dumont ![]() , et al. Permanent pacemaker implantation following isolated aortic valve replacement in a large cohort of elderly patients with severe aortic stenosis. Heart. 2011; 97: 1687 - 94.
, et al. Permanent pacemaker implantation following isolated aortic valve replacement in a large cohort of elderly patients with severe aortic stenosis. Heart. 2011; 97: 1687 - 94.
264. Dawkins S, Hobson AR, Kalra PR, et al. Permanent pacemaker implantation after isolated aortic valve replacement: incidence, indications, and predictors. Ann Thorac Surg. 2008; 85: 108 - 12.
265. Limongelli G, Ducceschi V, D'Andrea A, et al. Risk factors for pacemaker implantation following aortic valve replacement: a single centre experience. Heart. 2003; 89: 901 - 4.
266. Baraki H, Al Ahmad A, Jeng-Singh S, et al. Pacemaker dependency after isolated aortic valve replacement: do conductance disorders recover over time? Interact Cardiovasc Thorac Surg. 2013; 16: 476 - 81.
267. Greason KL, Lahr BD, Stulak JM, et al. Long-Term Mortality Effect of Early Pacemaker Implantation After Surgical Aortic Valve Replacement. Ann Thorac Surg. 2017; 104: 1259 - 64.
268. Schurr UP, Berli J, Berdajs D, et al. Incidence and risk factors for pacemaker implantation following aortic valve replacement. InteractCardiovascThoracSurg. 2010; 11: 556 - 60.
269. Berdajs D, Schurr UP, Wagner A, et al. Incidence and pathophysiology of atrioventricular block following mitral valve replacement and ring annuloplasty. Eur J Cardiothorac Surg. 2008; 34: 55 - 61.
270. Goldstein D, Moskowitz AJ, Gelijns AC, et al. Two-year outcomes of surgical treatment of severe ischemic mitral regurgitation. N Engl J Med. 2016; 374: 344 - 53.
271. Levin R, Leacche M, Petracek MR, et al. Extending the use of the pacing pulmonary artery catheter for safe minimally invasive cardiac surgery. J Cardiothor Vasc Anesthes. 2010; 24: 568 - 73.
272. Brubaker P.H. and Kitzman D.W. Chronotropic Incompetence: Causes, Consequences, and Management. Circulation. 2011; 123: 1010 - 1020
273. Christoph Melzer and Henryk Dreger. Chronotropic incompetence: a never-ending story. Europace (2010) 12, 464 - 465.
274. E. Adornato, E.M.F. Adornato. Chronotropic Incompetence: How to Diagnose and Treat It? Cardiac Arrhythmias. 1997, 479 - 484.
275. Chikwe J, Itagaki S, Anyanwu A, et al. Impact of concomitant tricuspid annuloplasty on tricuspid regurgitation, right ventricular function, and pulmonary artery hypertension after repair of mitral valve prolapse. J Am Coll Cardiol. 2015; 65: 1931 - 8.
276. Jokinen JJ, Turpeinen AK, Pitkanen O, et al. Pacemaker therapy after tricuspid valve operations: implications on mortality, morbidity, and quality of life. Ann Thorac Surg. 2009; 87: 1806 - 14.
277. McCarthy PM, Bhudia SK, Rajeswaran J, et al. Tricuspid valve repair: durability and risk factors for failure. J Thorac Cardiovasc Surg. 2004; 127: 674 - 85.
278. Scully HE, Armstrong CS. Tricuspid valve replacement. Fifteen years of experience with mechanical prostheses and bioprostheses. J Thorac Cardiovasc Surg. 1995; 109: 1035 - 41.
279. De Cock CC, Vinkers M, Van Campe LC, et al. Long-term outcome of patients with multiple (> or = 3) noninfected transvenous leads: a clinical and echocardiographic study. Pacing Clin Electrophysiol. 2000; 23: 423 - 6.
280. Piazza N, Onuma Y, Jesserun E, et al. Early and persistent intraventricular conduction abnormalities and requirements for pacemaking after percutaneous replacement of the aortic valve. JACC Cardiovasc Interv. 2008; 1: 310 - 6.
281. Siontis GC, Juni P, Pilgrim T, et al. Predictors of permanent pacemaker implantation in patients with severe aortic stenosis undergoing TAVR: a meta-analysis. J Am Coll Cardiol. 2014; 64: 129 - 40.
282. Boerlage-Van Dijk K, Kooiman KM, Yong ZY, et al. Predictors and permanency of cardiac conduction disorders and necessity of pacing after transcatheter aortic valve implantation. Pacing Clin Electrophysiol. 2014; 37: 1520 - 9.
283. Regueiro A, Abdul-Jawad Altisent O, Del Trigo M, et al. Impact of new-onset left bundle branch block and periprocedural permanent pacemaker implantation on clinical outcomes in patients undergoing transcatheter aortic valve replacement: a systematic review and meta-analysis. Circ Cardiovasc Interv. 2016; 9: e003635.
284. Watanabe Y, Kozuma K, Hioki H, et al. Pre-existing right bundle branch block increases risk for death after transcatheter aortic valve replacement with a balloon-expandable valve. JACC Cardiovasc Interv. 2016; 9: 2210 - 6.
285. Egger F, Nurnberg M, Rohla M, et al. High-degree atrioventricular block in patients with preexisting bundle branch block or bundle branch block occurring during transcatheter aortic valve implantation. Heart Rhythm. 2014; 11: 2176 - 82.
286. Roten L, Wenaweser P, Delacretaz E, et al. Incidence and predictors of atrioventricular conduction impairment after transcatheter aortic valve implantation. Am J Cardiol. 2010; 106: 1473 - 80.
287. Nazif TM, Dizon JM, Hahn RT, et al. Predictors and clinical outcomes of permanent pacemaker implantation after transcatheter aortic valve replacement: the PARTNER (Placement of AoRticTraNscathetER Valves) trial and registry. JACC Cardiovasc Interv. 2015; 8: 60 - 9.
288. Urena M, Mok M, Serra V, et al. Predictive factors and long-term clinical consequences of persistent left bundle branch block following transcatheter aortic valve implantation with a balloon-expandable valve. J Am Coll Cardiol. 2012; 60: 1743 - 52.
289. Testa L, Latib A, De Marco F, et al. Clinical impact of persistent left bundle-branch block after transcatheter aortic valve implantation with CoreValveRevalving System. Circulation. 2013; 127: 1300 - 7.
290. Franzoni I, Latib A, Maisano F, et al. Comparison of incidence and predictors of left bundle branch block after transcatheter aortic valve implantation using the CoreValve versus the Edwards valve. Am J Cardiol. 2013; 112: 554 - 9.
291. Toggweiler S, Stortecky S, Holy E, et al. The electrocardiogram after transcatheter aortic valve replacement determines the risk for post-procedural high-degree AV block and the need for telemetry monitoring. JACC Cardiovasc Interv. 2016; 9: 1269 - 76.
292. Van der Boon RM, Van Mieghem NM, Theuns DA, et al. Pacemaker dependency after transcatheter aortic valve implantation with the self-expanding Medtronic Core Valve System. Int J Cardiol. 2013; 168: 1269 - 73.
293. Dizon JM, Nazif TM, Hess PL, et al. Chronic pacing and adverse outcomes after transcatheter aortic valve implantation. Heart. 2015; 101: 1665 - 71.
294. Mauri V, Reimann A, Stern D, et al. Predictors of permanent pacemaker implantation after transcatheter aortic valve replacement with the SAPIEN 3. JACC Cardiovasc Interv. 2016; 9: 2200 - 9.
295. Schymik G, Tzamalis P, Bramlage P, et al. Clinical impact of a new left bundle branch block following TAVI implantation: 1-year results of the TAVIK cohort. Clin Res Cardiol. 2015; 104: 351 - 62.
296. Urena M, Webb JG, Eltchaninoff H, et al. Late cardiac death in patients undergoing transcatheter aortic valve replacement: incidence and predictors of advanced heart failure and sudden cardiac death. J Am Coll Cardiol. 2015; 65: 437 - 48.
297. Albin G, Hayes DL, Holmes DR Jr. Sinus node dysfunction in pediatric and young adult patients: treatment by implantation of a permanent pacemaker in 39 cases. Mayo Clin Proc. 1985; 60: 667 - 72.
298. Diller GP, Dimopoulos K, Okonko D, et al. Heart rate response during exercise predicts survival in adults with congenital heart disease. J Am Coll Cardiol. 2006; 48: 1250 - 6.
299. Fishberger SB, Wernovsky G, Gentles TL, et al. Factors that influence the development of atrial flutter after the Fontan operation. J Thorac Cardiovasc Surg. 1997; 113: 80 - 6.
300. Gelatt M, Hamilton RM, McCrindle BW, et al. Arrhythmia and mortality after the Mustard procedure: a 30-year single-center experience. J Am Coll Cardiol. 1997; 29: 194 - 201.
301. Helbing WA, Hansen B, Ottenkamp J, et al. Long-term results of atrial correction for transposition of the great arteries. Comparison of Mustard and Senning operations. J Thorac Cardiovasc Surg. 1994; 108: 363 - 72.
302. Sanders P, Morton JB, Kistler PM, et al. Electrophysiological and electroanatomic characterization of the atria in sinus node disease: evidence of diffuse atrial remodeling. Circulation. 2004; 109: 1514 - 22.
303. Connelly MS, Liu PP, Williams WG, et al. Congenitally corrected transposition of the great arteries in the adult: functional status and complications. J Am Coll Cardiol. 1996; 27: 1238 - 43.
304. Graham TP Jr, Bernard YD, Mellen BG, et al. Long-term outcome in congenitally corrected transposition of the great arteries: a multi-institutional study. J Am Coll Cardiol. 2000; 36: 255 - 61.
305. Lundstrom U, Bull C, Wyse RK, et al. The natural and "unnatural" history of congenitally corrected transposition. Am J Cardiol. 1990; 65: 1222 - 9.
306. Dewey RC, Capeless MA, Levy AM. Use of ambulatory electrocardiographic monitoring to identify high-risk patients with congenital complete heart block. N Engl J Med. 1987; 316: 835 - 9.
307. Michaelsson M, Jonzon A, Riesenfeld T. Isolated congenital complete atrioventricular block in adult life. A prospective study. Circulation. 1995; 92: 442 - 9.
308. Glikson M, Dearani JA, Hyberger LK, et al. Indications, effectiveness, and long-term dependency in permanent pacing after cardiac surgery. Am J Cardiol. 1997; 80: 1309 - 13.
309. Kim MH, Deeb GM, Eagle KA, et al. Complete atrioventricular block after valvular heart surgery and the timing of pacemaker implantation. Am J Cardiol. 2001; 87: 649 - 51, a10.
310. Rhodes LA, Walsh EP, Gamble WJ, et al. Benefits and potential risks of atrial antitachycardia pacing after repair of congenital heart disease. Pacing Clin Electrophysiol. 1995; 18: 1005 - S8.2 - 16.
311. Stephenson EA, Casavant D, Tuzi J, et al. Efficacy of atrial antitachycardia pacing using the Medtronic AT500 pacemaker in patients with congenital heart disease. Am J Cardiol. 2003; 92: 871 - 6.
312. Janousek J, Paul T, Luhmer I, et al. Atrial baffle procedures for complete transposition of the great arteries: natural course of sinus node dysfunction and risk factors for dysrhythmias and sudden death. Z Kardiol. 1994; 83: 933 - 8.
313. DeSimone CV, Friedman PA, Noheria A, et al. Stroke or transient ischemic attack in patients with transvenous pacemaker or defibrillator and echocardiographically detected patent foramen ovale. Circulation. 2013; 128: 1433 - 41.
314. Khairy P, Landzberg MJ, Gatzoulis MA, et al. Transvenous pacing leads and systemic thromboemboli in patients with intracardiac shunts: a multicenter study. Circulation. 2006; 113: 2391 - 7.
315. Auffret V, Loirat A, Leurent G, et al. High-degree atrioventricular block complicating ST segment elevation myocardial infarction in the contemporary era. Heart. 2016; 102: 40 - 9.
316. Hynes JK, Holmes DR Jr, Harrison CE. Five-year experience with temporary pacemaker therapy in the coronary care unit. Mayo Clin Proc. 1983; 58: 122 - 6.
317. Jowett NI, Thompson DR, Pohl JE. Temporary transvenous cardiac pacing: 6 years experience in one coronary care unit. Postgrad Med J. 1989; 65: 211 - 5.
318. Kim HL, Kim SH, Seo JB, et al. Influence of second-and third-degree heart block on 30-day outcome following acute myocardial infarction in the drug-eluting stent era. Am J Cardiol. 2014; 114: 1658 - 62.
319. Ginks WR, Sutton R, Oh W, et al. Long-term prognosis after acute anterior infarction with atrioventricular block. Br Heart J. 1977; 39: 186 - 9.
320. Singh SM, FitzGerald G, Yan AT, et al. High-grade atrioventricular block in acute coronary syndromes: insights from the Global Registry of Acute Coronary Events. Eur Heart J. 2015; 36: 976 - 83.
321. Watson RD, Glover DR, Page AJ, et al. The Birmingham trial of permanent pacing inpatients with intraventricular conduction disorders after acute myocardial infarction. Am Heart J. 1984; 108: 496 - 501.
322. Ritter WS, Atkins JM, Blomqvist CG, et al. Permanent pacing in patients with transient trifascicular block during acute myocardial infarction. Am J Cardiol. 1976; 38: 205 - 8.
323. Feigl D, Ashkenazy J, Kishon Y. Early and late atrioventricular block in acute inferior myocardial infarction. J Am Coll Cardiol. 1984; 4: 35 - 8.
324. Scheinman MM, Thorburn D, Abbott JA. Use of atropine in patients with acute myocardial infarction and sinus bradycardia. Circulation. 1975; 52: 627 - 33.
325. Swart G, Brady WJ Jr, DeBehnke DJ, et al. Acute myocardial infarction complicated by hemodynamically unstable bradyarrhythmia: prehospital and ED treatment with atropine. Am J Emerg Med. 1999; 17: 647 - 52.
326. Gang UJ, Hvelplund A, Pedersen S, et al. High-degree atrioventricular block complicating ST-segment elevation myocardial infarction in the era of primary percutaneous coronary intervention. Europace. 2012; 14: 1639 - 45.
327. Gadler F, Valzania C, Linde C. Current use of implantable electrical devices in Sweden: data from the Swedish pacemaker and implantable cardioverter-defibrillator registry. Europace. 2015; 17: 69 - 77.
328. Armaganijan LV, Toff WD, Nielsen JC, et al. Are elderly patients at increased risk of complications following pacemaker implantation? A meta-analysis of randomized trials. Pacing Clin Electrophysiol. 2012; 35: 131 - 4.
329. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017; 14: e503 - 51.
330. Lee JZ, Ling J, Diehl NN, et al. Mortality and cerebrovascular events after heart rhythm disorder management procedures. Circulation. 2018; 137: 24 - 33.
331. Col JJ, Weinberg SL. The incidence and mortality of intraventricular conduction defects in acute myocardial infarction. Am J Cardiol. 1972; 29: 344 - 50.
332. Hindman MC, Wagner GS, JaRo M, et al. The clinical significance of bundle branch block complicating acute myocardial infarction. 2. Indications for temporary and permanent pacemaker insertion. Circulation. 1978; 58: 689 - 99.
333. Hindman MC, Wagner GS, JaRo M, et al. The clinical significance of bundle branch block complicating acute myocardial infarction. 1. Clinical characteristics, hospital mortality, and one-year follow-up. Circulation. 1978; 58: 679 - 88.
334. Alnsasra H, Ben-Avraham B, Gottlieb S, et al. High-grade atrioventricular block in patients with acute myocardial infarction. Insights from a contemporary multi-center survey. J Electrocardiol. 2018; 51: 386 - 91.
335. Kosmidou I, Redfors B, Dordi R, et al. Incidence, predictors, and outcomes of high-grade atrioventricular block in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention (from the HORIZONS-AMI Trial). Am J Cardiol. 2017; 119: 1295 - 301.
336. Melgarejo-Moreno A, Galcera-Tomas J, Consuegra-Sanchez L, et al. Relation of new permanent right or left bundle branch block on short- and long-term mortality in acute myocardial infarction bundle branch block and myocardial infarction. Am J Cardiol. 2015; 116: 1003 - 9.
337. Brignole M, Sutton R, Menozzi C, Garcia-Civera R, Moya A, Wieling W, Andresen D, Benditt DG, Vardas P, International Study on Syncope of Uncertain Etiology 2 (ISSUE 2) Group. Early application of an implantable loop recorder allows effective specific therapy in patients with recurrent suspected neurally mediated syncope. Eur Heart J. 2006; 27: 1085 - 1092.
338. Brignole M, Menozzi C, Moya A, Andresen D, Blanc JJ, Krahn AD, Wieling W, Beiras X, Deharo JC, Russo V, Tomaino M, Sutton R, International Study on Syncope of Uncertain Etiology 3 (ISSUE-3) Investigators. Pacemaker therapy in patients with neurally mediated syncope and documented asystole: Third International Study on Syncope of Uncertain Etiology (ISSUE-3): a randomized trial. Circulation. 2012; 125: 2566 - 2571.
339. Sud S, Klein GJ, Skanes AC, Gula LJ, Yee R, Krahn AD. Implications of mechanism of bradycardia on response to pacing in patients with unexplained syncope. Europace. 2007; 9: 312 - 318.
340. Brignole M, Arabia F, Ammirati F, Tomaino M, Quartieri F, Rafanelli M, Del Rosso A, Rita Vecchi M, Russo V, Gaggioli G, Syncope Unit Project 2 (SUP 2) investigators. Standardized algorithm for cardiac pacing in older patients affected by severe unpredictable reflex syncope: 3-year insights from the Syncope Unit Project 2 (SUP 2) study. Europace. 2016; 18: 1427 - 1433.
341. Puggioni E, Guiducci V, Brignole M, Menozzi C, Oddone D, Donateo P, Croci F, Solano A, Lolli G, Tomasi C, Bottoni N. Results and complications of the carotid sinus massage performed according to the "method of symptoms". Am J Cardiol. 2002; 89: 599 - 601.
342. Brignole M, Arabia F, Ammirati F, Tomaino M, Quartieri F, Rafanelli M, Del Rosso A, Rita Vecchi M, Russo V, Gaggioli G, Syncope Unit Project 2 (SUP 2) investigators. Standardized algorithm for cardiac pacing in older patients affected by severe unpredictable reflex syncope: 3-year insights from the Syncope Unit Project 2 (SUP 2) study. Europace. 2016; 18: 1427 - 1433.
343. Brignole M, Menozzi C. The natural history of carotid sinus syncope and the effect of cardiac pacing. Europace. 2011; 13: 462 - 464.
344. Sutton R, Brignole M, Menozzi C, Raviele A, Alboni P, Giani P, Moya A. Dualchamber pacing in the treatment of neurally mediated tilt-positive cardioinhibitory syncope: pacemaker versus no therapy: a multicenter randomized study. The Vasovagal Syncope International Study (VASIS) Investigators. Circulation. 2000; 102: 294 - 299.
345. Ammirati F, Colivicchi F, Santini M, Syncope Diagnosis and Treatment Study Investigators. Permanent cardiac pacing versus medical treatment for the prevention of recurrent vasovagal syncope: a multicenter, randomized, controlled trial. Circulation. 2001; 104: 52 - 57.
346. Baron-Esquivias G, Morillo CA, Moya-Mitjans A, Martinez-Alday J, Ruiz-Granell R, Lacunza-Ruiz J, Garcia-Civera R, Gutierrez-Carretero E, Romero-Garrido R. Dual-chamber pacing with closed loop stimulation in recurrent reflex vasovagal syncope: the SPAIN Study. J Am Coll Cardiol. 2017; 70: 1720 - 1728.
347. Brignole M, Deharo JC, De Roy L, Menozzi C, Blommaert D, Dabiri L, Ruf J, Guieu R. Syncope due to idiopathic paroxysmal atrioventricular block: longterm follow-up of a distinct form of atrioventricular block. J Am Coll Cardiol. 2011; 58: 167 - 173.
348. Flammang D, Church TR, De Roy L, Blanc JJ, Leroy J, Mairesse GH, Otmani A, Graux PJ, Frank R, Purnode P, ATP Multicenter Study. Treatment of unexplained syncope: a multicenter, randomized trial of cardiac pacing guided by adenosine 5'-triphosphate testing. Circulation. 2012; 125: 31 - 36.
349. Brignole M, Guieu R, Tomaino M, Iori M, Ungar A, Bertolone C, Unterhuber M, Bottoni N, Tesi F, Claude Deharo J. Mechanism of syncope without prodromes with normal heart and normal electrocardiogram. Heart Rhythm. 2017; 14: 234 - 239.
350. Connolly SJ, Sheldon R, Thorpe KE, Roberts RS, Ellenbogen KA, Wilkoff BL, Morillo C, Gent M, VPS II Investigators. Pacemaker therapy for prevention of syncope in patients with recurrent severe vasovagal syncope: Second Vasovagal Pacemaker Study (VPS II): a randomized trial. JAMA. 2003; 289: 2224 - 2229.
351. Raviele A, Giada F, Menozzi C, Speca G, Orazi S, Gasparini G, Sutton R, Brignole M, Vasovagal Syncope and Pacing Trial Investigators. A randomized, double-blind, placebo-controlled study of permanent cardiac pacing for the treatment of recurrent tilt-induced vasovagal syncope. The Vasovagal Syncope and Pacing Trial (SYNPACE). Eur Heart J. 2004; 25: 1741 - 1748.
352. Brignole M, Deharo JC, Menozzi C, Moya A, Sutton R, Tomaino M, Ungar A. The benefit of pacemaker therapy in patients with neurally-mediated syncope and documented asystole: a meta-analysis of implantable loop recorder studies. Europace; doi: 10.1093/europace/eux321. Published online ahead of print 15 December 2017.
353. Brignole M., Auricchio A., Baron-Esquivias G. et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. The Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). European Heart Journal. 2013; 34: 2281 - 2329.
354. Hayes DL, Barold SS, Camm AJ, Goldschlager NF. Evolving indications for permanent cardiac pacing: an appraisal of the 1998 American College of Cardiology/American Heart Association Guidelines. Am J Cardiol. 1998; 82: 1082 - 6, A6.
355. Epstein A, DiMarco J, Ellenbogen K, et al. ACC/AHA/HRS 2008 guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: a Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2008; 117: 2820 - 2840.
356. Slotwiner D, Varma N, Akar JG, et al. Совместное экспертное заключение Американского общества сердечного ритма (HRS) по удаленной телеметрии и мониторингу сердечно-сосудистых имплантируемых электронных устройств.//Вестник аритмологии. - 2015. - N 82. - С. 43 - 72.
357. Sohail MR, Uslan DZ, Khan AH, Friedman PA, Hayes DL, Wilson WR, Steckelberg JM, Stoner S, Baddour LM. Anagement and outcome of permanentpacemaker and implantable cardioverter-defibrillator infections. J Am Coll Cardiol. 2007; 49: 1851 - 1859.
358. Baddour LM, IDSA's Emerging Infections Network. Long-term suppressiveantimicrobial therapy for intravascular device-related infections. Am J Med Sci. 2001; 322: 209 - 212.
359. Chamis AL, Peterson GE, Cabell CH, Corey GR, Sorrentino RA, Greenfield RA, Ryan T, Reller LB, Fowler VG, Jr. Staphylococcus aureus bacteremia in patientswith permanent pacemakers or implantable cardioverter-defibrillators. Circulation. 2001; 104: 1029 - 1033.
360. Dy Chua J, Abdul-Karim A, Mawhorter S, Procop GW, Tchou P, Niebauer M, Saliba W, Schweikert R, Wilkoff BL. The role of swab and tissue culture in thediagnosis of implantable cardiac device infection. Pacing Clin Electrophysiol. 2005; 28: 1276 - 1281.
361. Klug D, Lacroix D, Savoye C, Goullard L, Grandmougin D, Hennequin JL, Kacet S, Lekieffre J. Systemic infection related to endocarditis on pacemakerleads: clinical presentation and management. Circulation. 1997; 95: 2098 - 2107.
362. Mansur AJ, Grinberg M, Costa R, Ven Chung C, Pileggi F. Dura mater valveendocarditis related to retained fragment of postoperative temporary epicardial pacemaker lead. Am Heart J. 1984; 108: 1049 - 1052.
363. Wilkoff BL, Love CJ, Byrd CL, Bongiorni MG, Carrillo RG, Crossley GH 3rd, Epstein LM, Friedman RA, Kennergren CE, Mitkowski P, Schaerf RH, Wazni OM, Heart Rhythm Society; American Heart Association. Transvenous lead extraction: Heart Rhythm Society expert consensus on facilities, training, indications, and patient management: this document was endorsed by the American Heart Association (AHA). Heart Rhythm. 2009; 6: 1085 - 1104.
364. Rusanov A, Spotnitz HM. A 15-year experience with permanent pacemaker and defibrillator lead and patch extractions. Ann Thorac Surg. 2010; 89: 44 - 50.
365. Riaz T, Nienaber JJ, Baddour LM, Walker RC, Park SJ, Sohail MR. Cardiovascular implantable electronic device infections in left ventricular assist device recipients. Pacing Clin Electrophysiology. 2014; 37: 225 - 230.
366. Viola GM, Awan LL, Ostrosky-Zeichner L, Chan W, Darouiche RO. Infections of cardiac implantable electronic devices: a retrospective multicenter observational study. Medicine (Baltimore). 2012; 91: 123 - 130.
367. Epstein AE, Kay GN, Plumb VJ, McElderry HT, Doppalapudi H, Yamada T, Shafiroff J, Syed ZA, Shkurovich S, ACT Investigators. Implantable cardioverter-defibrillator prescription in the elderly. Heart Rhythm. 2009; 6: 1136 - 1143.
368. Baddour LM, Infectious Diseases Society of America's Emerging Infections Network. Long-term suppressive antimicrobial therapy for intravascular device-related infections. Am J Med Sci. 2001; 322: 209 - 212.
369. Braun MU, Rauwolf T, Bock M, Kappert U, Boscheri A, Schnabel A, Strasser RH. Percutaneous lead implantation connected to an external device in stimulation-dependent patients with systemic infection-a prospective and controlled study. Pacing Clin Electrophysiology. 2006; 29: 875 - 879.
370. Kang J, Simpson CS, Campbell D, Borici-Mazi R, Redfearn DP, Michael KA, Abdollah H, Baranchuk A. Case Report: Cardiac rhythm device contact dermatitis. Ann Noninvasive Electrocardiol. 2013; 18: 79 - 83.
371. Citerne O, Gomes S, Scanu P, Milliez P. Painful eczema mimicking pocket infection in a patient with an ICD. Circulation. 2011; 123: 1241 - 1242.
372. Bode K, Breithardt OA, Kreuzhuber M, et al. Patient discomfort following catheter ablation and rhythm device surgery. Europace. 2015; 17: 1129 - 1135.
373. Celikyurt U, Agacdiken A, Bozyel S, Argan O, Sade I, Vural A, Ural D. Assessment of shoulder pain and shoulder disability in patients with implantable cardioverter-defibrillator. J Interv Card Electrophysiol. 2013; 36: 91 - 94.
374. Khairy P, Landzberg MJ, Gatzoulis MA, Mercier LA, Fernandes SM, ![]() JM, Lavoie JP, Fournier A, Guerra PG, Frogoudaki A, Walsh EP, Dore A. Transvenous pacing leads and systemic thromboemboli in patients with intracardiac shunts, a mulitcenter study. Circulation. 2006; 113: 2391 - 2397.
JM, Lavoie JP, Fournier A, Guerra PG, Frogoudaki A, Walsh EP, Dore A. Transvenous pacing leads and systemic thromboemboli in patients with intracardiac shunts, a mulitcenter study. Circulation. 2006; 113: 2391 - 2397.
375. Larsen JM, Theuns DA,  AM. Paradoxical thromboembolic stroke during extraction of a recalled St Jude Medical Riata defibrillator lead with conductor externalization. Europace. 2014; 16: 240.
AM. Paradoxical thromboembolic stroke during extraction of a recalled St Jude Medical Riata defibrillator lead with conductor externalization. Europace. 2014; 16: 240.
376. Noheria A, Ponamgi SP, Desimone CV, et al. Pulmonary embolism in patients with transvenous cardiac implantable electronic device leads. Europace. 2016; 18: 246 - 252.
377. Fu HX, Huang XM, Zhong L, Osborn MJ, Bjarnason H, Mulpuru S, Zhao XX, Friedman PA, Cha YM. Outcome and management of pacemaker-induced superior vena cava syndrome. Pacing Clin Electrophysiol. 2014; 37: 1470 - 1476.
378. Riley RF, Petersen SE, Ferguson JD, Bashir Y. Managing superior vena cava syndrome as a complication of pacemaker implantation: a pooled analysis of clinical practice. Pacing Clin Electrophysiol. 2010; 33: 420 - 425.
379. Sohal M, Williams S, Akhtar M, et al. Laser lead extraction to facilitate cardiac implantable electronic device upgrade and revision in the presence of central venous obstruction. Europace. 2014; 16: 81 - 87.
380. Gula LJ, Ames A, Woodburn A, Matkins J, McCormick M, Bell J, Sink D, McConville J, Epstein LM. Central venous occlusion is not an obstacle to device upgrade with the assistance of laser extraction. Pacing Clin Electrophysiol. 2005; 28: 661 - 666.
381. Glikson M, Suleiman M, Luria DM, Martin ML, Hodge DO, Shen WK, Bradley DJ, Munger TM, Rea RF, Hayes DL, Hammill SC, Friedman PA. Do abandoned leads pose risk to implantable cardioverter-defibrillator patients? Heart Rhythm. 2009; 6: 65 - 68.
382. Indik JH, Gimbel JR, Abe H, et al. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2017; 14: e97 - e153.
383. Mollerus M, Albin G, Lipinski M, Lucca J. Magnetic resonance imaging of pacemakers and implantable cardioverter-defibrillators without specific absorption rate restrictions. Europace. 2010; 12: 947 - 951.
384. Lee JC, Epstein LM, Huffer LL, Stevenson WG, Koplan BA, Tedrow UB. ICD lead proarrhythmia cured by lead extraction. Heart Rhythm. 2009; 6: 613 - 618.
385. Valentino V, Greenberg YJ, Saunders P, Yang F. An unusual interaction between an abandoned pacing lead and an ICD lead. Heart Rhythm. 2015; 12: 1400 - 1401.
386. Landolina M, Gasparini M, Lunati M, et al. Long-term complications related to biventricular defibrillator implantation: rate of surgical revisions and impact on survival: insights from the Italian Clinical Service Database. Circulation. 2011; 123: 2526 - 2535.
387. Worley SJ, Gohn DC, Pulliam RW, Raifsnider MA, Ebersole BI, Tuzi J. Subclavian venoplasty by the implanting physicians in 373 patients over 11 years. Heart Rhythm. 2011; 8: 526 - 533.
388. Cohen JD, Costa HS, Russo RJ. Determining the risks of magnetic resonance imaging at 1.5 tesla for patients with pacemakers and implantable cardioverter defibrillators. Am J Cardiol. 2012; 110: 1631 - 1636.
389. Russo RJ, Costa HS, Silva PD, et al. Assessing the risks associated with MRI in patients with a pacemaker or defibrillator. N Engl J Med. 2017; 376: 755 - 764.
390. Nazarian S, Roguin A, Zviman MM, Lardo AC, Dickfeld TL, Calkins H, Weiss RG, Berger RD, Bluemke DA, Halperin HR. Clinical utility and safety of a protocol for noncardiac and cardiac magnetic resonance imaging of patients with permanent pacemakers and implantable-cardioverter defibrillators at 1.5 tesla. Circulation. 2006; 114: 1277 - 1284.
391. Ji SY, Gundewar S, Palma EC. Subclavian venoplasty may reduce implant times and implant failures in the era of increasing device upgrades. Pacing Clin Electrophysiol. 2012; 35: 444 - 448.
392. Worley SJ, Gohn DC, Pulliam RW. Excimer laser to open refractory subclavian occlusion in 12 consecutive patients. Heart Rhythm. 2010; 7: 634 - 638.
393. Wazni O, Epstein LM, Carrillo RG, et al. Lead extraction in the contemporary setting: theLExICon study: an observational retrospective study of consecutive laser lead extractions. J Am Coll Cardiol. 2010; 55: 579 - 586.
394. Huang XM, Fu H, Osborn MJ, Asirvatham SJ, McLeod CJ, Glickson M, Acker NG, Friedman PA, Cha YM. Extraction of superfluous device leads: A comparison with removal of infected leads. Heart Rhythm. 2015; 12: 1177 - 1182.
395. Wilkoff BL, Bello D, Taborsky M, et al. Magnetic resonance imaging in patients with a pacemaker system designed for the magnetic resonance environment. Heart Rhythm. 2011; 8: 65 - 73.
396. Naehle CP, Meyer C, Thomas D, Remerie S, Krautmacher C, Litt H, Luechinger R, Fimmers R, Schild H, Sommer T. Safety of brain 3-T MR imaging with transmit-receive head coil in patients with cardiac pacemakers: pilot prospective study with 51 examinations. Radiology. 2008; 249: 991 - 1001.
397. Polewczyk A, Kutarski A, Tomaszewski A, Brzozowski W, Czajkowski M, Polewczyk M, Janion M. Lead dependent tricuspid dysfunction: analysis of the mechanism and management in patients referred for transvenous lead extraction. Cardiol J. 2013; 20: 402 - 410.
398. Padmanabhan D, Kella DK, Mehta R, et al. Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned leads. Heart Rhythm. 2017; 14 (Suppl.): S105.
399. Austin CO, Landolfo K, Parikh PP, Patel PC, Venkatachalam KL, Kusumoto FM. Retained cardiac implantable electronic device fragments are not associated with magnetic resonance imaging safety issues, morbidity, or mortality after orthotopic heart transplant. Am Heart J. 2017; 190: 46 - 53.
400. Lin G, Nishimura RA, Connolly HM, Dearani JA, Sundt TM 3rd, Hayes DL. Severe symptomatic tricuspid valve regurgitation due to permanent pacemaker or implantable cardioverter-defibrillator leads. J Am Coll Cardiol. 2005; 45: 1672 - 1675.
401. Postaci N, ![]() K, Bayata S,
K, Bayata S, ![]() M. Effect of the number of ventricular leads on right ventricular hemodynamics in patients with permanent pacemaker. Angiology. 1995; 46: 421 - 424.
M. Effect of the number of ventricular leads on right ventricular hemodynamics in patients with permanent pacemaker. Angiology. 1995; 46: 421 - 424.
402. Suga C, Hayes DL, Hyberger LK, Lloyd MA. Is there an adverse outcome from abandoned pacing leads? J Interv Card Electrophysiol. 2000; 4: 493 - 499.
403. Franceschi F, Thuny F, Giorgi R, Sanaa I, Peyrouse E, Assouan X, ![]() S, Bastard E, Habib G, Deharo JC. Incidence, risk factors, and outcome of traumatic tricuspid regurgitation after percutaneous ventricular lead removal. J Am Coll Cardiol. 2009; 53: 2168 - 2174.
S, Bastard E, Habib G, Deharo JC. Incidence, risk factors, and outcome of traumatic tricuspid regurgitation after percutaneous ventricular lead removal. J Am Coll Cardiol. 2009; 53: 2168 - 2174.
404. Atallah J, Erickson CC, Cecchin F, et al. A multi-institutional study of implantable defibrillator lead performance in children and young adults: Results of the pediatric lead extractability and survival evaluation (PLEASE) study. Circulation. 2013; 127: 2393 - 2402.
405. Woelfel AK, Simpson RJ Jr, Gettes LS, Foster JR. Exercise-induced distal atrioventricular block. J Am Coll Cardiol 1983; 2: 578 - 581.
406. Byrne JM, Marais HJ, Cheek GA. Exercise-induced complete heart block in a patient with chronic bifascicular block. J Electrocardiol 1994; 27: 339 - 342.
407. Aste M, Oddone D, Donateo P, Solano A, Maggi R, Croci F, Solari D, Brignole M. Syncope in patients paced for atrioventricular block. Europace 2016; 18: 1735 - 1739.
408. Sumiyoshi M, Nakata Y, Yasuda M, Tokano T, Ogura S, Nakazato Y, Yamaguchi H. Clinical and electrophysiologic features of exercise-induced atrioventricular block. Am Heart J 1996; 132: 1277 - 1281.
409. Wissocq L, Ennezat PV, Mouquet F. Exercise-induced high-degree atrioventricular block. Arch Cardiovasc Dis 2009; 102: 733 - 735. 23. Podoleanu C, Maggi R, Brignole M, Croci F, Incze A, Solano A, Puggioni E, Carasca E. Lower limb and abdominal compression bandages prevent progressive orthostatic hypotension in elderly persons: a randomized single-blind controlled study. J Am Coll Cardiol 2006; 48: 1425 - 1432.
410. Gibbons CH, Freeman R. Delayed orthostatic hypotension: a frequent cause of orthostatic intolerance. Neurology 2006; 67: 28 - 32.
411. Kenny RA, Ingram A, Bayliss J, Sutton R. Head-up tilt: a useful test for investigating unexplained syncope. Lancet 1986; 1: 1352 - 1355.
412. Bartoletti A, Alboni P, Ammirati F, Brignole M, Del Rosso A, Foglia Manzillo G, Menozzi C, Raviele A, Sutton R. 'The Italian Protocol': a simplified head-up tilt testing potentiated with oral nitroglycerin to assess patients with unexplained syncope. Europace 2000; 2: 339 - 342.
413. Kenny RA, O'Shea D, Parry SW. The Newcastle protocols for head-up tilt table testing in the diagnosis of vasovagal syncope, carotid sinus hypersensitivity, and related disorders. Heart 2000; 83: 564 - 569.
414. Benditt DG, Ferguson DW, Grubb BP, Kapoor WN, Kugler J, Lerman BB, Maloney JD, Raviele A, Ross B, Sutton R, Wolk MJ, Wood DL. Tilt table testing for assessing syncope. American College of Cardiology. J Am Coll Cardiol 1996; 28: 263 - 275.
415. Morillo CA, Klein GJ, Zandri S, Yee R. Diagnostic accuracy of a low-dose isoproterenol head-up tilt protocol. Am Heart J 1995; 129: 901 - 906.
416. Parry SW, Gray JC, Newton JL, Reeve P, O'Shea D, Kenny RA. 'Front-loaded' head-up tilt table testing: validation of a rapid first line nitrate-provoked tilt protocol for the diagnosis of vasovagal syncope. Age Ageing 2008; 37: 411 - 415.
417. Verheyden B, Gisolf J, Beckers F, Karemaker JM, Wesseling KH, Aubert AE, Wieling W. Impact of age on the vasovagal response provoked by sublingual nitroglycerine in routine tilt testing. Clin Sci (Lond) 2007; 113: 329 - 337.
418. Nilsson D, Sutton R, Tas W, Burri P, Melander O, Fedorowski A. Orthostatic changes in hemodynamics and cardiovascular biomarkers in dysautonomic patients. PLoS One 2015; 10: e0128962.
419. Low PA, Sandroni P, Joyner M, Shen WK. Postural tachycardia syndrome (POTS). J Cardiovasc Electrophysiol 2009; 20: 352 - 358.
420. Petersen ME, Williams TR, Sutton R. Psychogenic syncope diagnosed by prolonged head-up tilt testing. QJM 1995; 88: 209 - 213.
421. Tannemaat MR, van Niekerk J, Reijntjes RH, Thijs RD, Sutton R, van Dijk JG. The semiology of tilt-induced psychogenic pseudosyncope. Neurology 2013; 81: 752 - 758.
422. Blad H, Lamberts RJ, van Dijk GJ, Thijs RD. Tilt-induced vasovagal syncope and psychogenic pseudosyncope: Overlapping clinical entities. Neurology 2015; 85: 2006 - 2010.
423. Moya A, Permanyer-Solari D, Maggi R, Oddone D, Solano A, Croci F, Donateo P, Brignole M. Clinical context and outcome of carotid sinus syndrome diagnosed by means of the 'method of symptoms'. Europace 2014; 16: 928 - 934. Solari D, Maggi R, Oddone D, Solano A, Croci F, Donateo P, Brignole M. Clinical context and outcome of carotid sinus syndrome diagnosed by means of the 'method of symptoms'. Europace 2014; 16: 928 - 934.
424. Solari D, Maggi R, Oddone D, Solano A, Croci F, Donateo P, Wieling W, Brignole M. Assessment of the vasodepressor reflex in carotid sinus syndrome. Circ Arrhythm Electrophysiol 2014; 7: 505 - 510.
425. Solari D, Maggi R, Oddone D, Solano A, Croci F, Donateo P, Brignole M. Clinical context and outcome of carotid sinus syndrome diagnosed by means of the 'method of symptoms'. Europace 2014; 16: 928 - 934.
426. Brignole M, Ungar A, Casagranda I, Gulizia M, Lunati M, Ammirati F, Del Rosso A, Sasdelli M, Santini M, Maggi R, Vitale E, Morrione A, Francese GM, Vecchi MR, Giada F, Syncope Unit Project (SUP) investigators. Prospective multicenter systematic guideline-based management of patients referred to the Syncope Units of general hospitals. Europace 2010; 12: 109 - 118.
427. Guieu R, Deharo JC, Ruf J, Mottola G, Kipson N, Bruzzese L, Gerolami V, Franceschi F, Ungar A, Tomaino M, Iori M, Brignole M. Adenosine and clinical forms of neurally-mediated syncope. J Am Coll Cardiol 2015; 66: 204 - 205.
428. Flammang D, Church TR, De Roy L, Blanc JJ, Leroy J, Mairesse GH, Otmani A, Graux PJ, Frank R, Purnode P, ATP Multicenter Study. Treatment of unexplained syncope: a multicenter, randomized trial of cardiac pacing guided by adenosine 5'-triphosphate testing. Circulation 2012; 125: 31 - 36.
429. Brignole M, Gaggioli G, Menozzi C, Gianfranchi L, Bartoletti A, Bottoni N, Lolli G, Oddone D, Del Rosso A, Pellinghelli G. Adenosine-induced atrioventricular block in patients with unexplained syncope: the diagnostic value of ATP testing. Circulation 1997; 96: 3921 - 3927.
430. Scheinman MM, Thorburn D, Abbott JA. Use of atropine in patients with acute myocardial infarction and sinus bradycardia. Circulation. 1975; 52: 627 - 33.
431. Swart G, Brady WJ Jr, DeBehnke DJ, et al. Acute myocardial infarction complicated by hemodynamically unstable bradyarrhythmia: prehospital and ED treatment with atropine. Am J Emerg Med. 1999; 17: 647 - 52.
432. Warren JV, Lewis RP. Beneficial effects of atropine in the pre-hospital phase of coronary care. Am J Cardiol. 1976; 37: 68 - 72.
433. Gee SW, Karsies TJ. Listeria meningitis-associated bradyarrhythmia treated with isoproterenol. Am J Emerg Med. 2015; 33: 306. e1 - 2.
434. Andersen HR, Nielsen JC, Thomsen PE, et al. Long-term follow-up of patients from a randomised trial of atrial versus ventricular pacing for sick-sinus syndrome. Lancet. 1997; 350: 1210 - 6.
435. Connolly SJ, Kerr CR, Gent M, et al. Effects of physiologic pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes. Canadian Trial of Physiologic Pacing Investigators. N Engl J Med. 2000; 342: 1385 - 91.
436. Lamas GA, Lee KL, Sweeney MO, et al. Ventricular pacing or dual-chamber pacing for sinus-node dysfunction. N Engl J Med. 2002; 346: 1854 - 62.
437. Lamas GA, Orav EJ, Stambler BS, et al. Quality of life and clinical outcomes in elderly patients treated with ventricular pacing as compared with dual-chamber pacing. Pacemaker Selection in the Elderly Investigators. N Engl J Med. 1998; 338: 1097 - 104.
438. Brandt NH, Kirkfeldt RE, Nielsen JC, et al. Single lead atrial vs. dual chamber pacing in sick sinus syndrome: extended register-based follow-up in the DANPACE trial. Europace. 2016;
439. Sweeney MO, Bank AJ, Nsah E, et al. Minimizing ventricular pacing to reduce atrial fibrillation in sinus-node disease. N Engl J Med. 2007; 357: 1000 - 8.
440. Gillis AM, Russo AM, Ellenbogen KA, et al. HRS/ACCF expert consensus statement on pacemaker device and mode selection. J Am Coll Cardiol. 2012; 60: 682 - 703.
441. Dretzke J, Toff WD, Lip GY, et al. Dual chamber versus single chamber ventricular pacemakers for sick sinus syndrome and atrioventricular block. Cochrane Database Syst Rev. 2004; CD003710.
442. Andersen HR, Nielsen JC, Thomsen PE, et al. Atrioventricular conduction during long-term follow-up of patients with sick sinus syndrome. Circulation. 1998; 98: 1315 - 21.
443. Brandt J, Anderson H, Fahraeus T, et al. Natural history of sinus node disease treated with atrial pacing in 213 patients: implications for selection of stimulation mode. J Am Coll Cardiol. 1992; 20: 633 - 9.
444. Dhingra RC, Denes P, Wu D, et al. The significance of second degree atrioventricular block and bundle branch block. Observations regarding site and type of block. Circulation. 1974; 49: 638 - 46.
445. Ector H, Rolies L, De Geest H. Dynamic electrocardiography and ventricular pauses of 3 seconds and more: etiology and therapeutic implications. Pacing Clin Electrophysiol. 1983; 6: 548 - 51.
446. Edhag O, Swahn A. Prognosis of patients with complete heart block or arrhythmic syncope who were not treated with artificial pacemakers. A long-term follow-up study of 101 patients. Acta Med Scand. 1976; 200: 457 - 63.
447. Shaw DB, Eraut D. Prevalence and morbidity of heart block in Devon. Br Med J. 1970; 1: 144 - 7.
448. Shaw DB, Kekwick CA, Veale D, et al. Survival in second degree atrioventricular block. Br Heart J. 1985; 53: 587 - 93.
449. Simon AB, Zloto AE. Atrioventricular block: natural history after permanent ventricular pacing. Am J Cardiol. 1978; 41: 500 - 7.
450. Strasberg B, Amat YLF, Dhingra RC, et al. Natural history of chronic second-degree atrioventricular nodal block. Circulation. 1981; 63: 1043 - 9.
451. Bhakta D, Shen C, Kron J, et al. Pacemaker and implantable cardioverter-defibrillator use in a US myotonic dystrophy type 1 population. J Cardiovasc Electrophysiol. 2011; 22: 1369 - 75.
452. Facenda-Lorenzo M, Hernandez-Afonso J, Rodriguez-Esteban M, et al. Cardiac manifestations in myotonic dystrophy type 1 patients followed using a standard protocol in a specialized unit. Rev Esp Cardiol (Engl Ed). 2013; 66: 193 - 7.
453. Groh WJ. Arrhythmias in the muscular dystrophies. Heart Rhythm. 2012; 9: 1890 - 5.
454. Groh WJ, Groh MR, Saha C, et al. Electrocardiographic abnormalities and sudden death in myotonic dystrophy type 1. N Engl J Med. 2008; 358: 2688 - 97.
455. Glikson M, Nielsen J C, Kronborg M B, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA). European Heart Journal (2021) 00,1 - 94.
456. Gauss A, Hubner C, Meierhenrich R, et al. Perioperative transcutaneous pacemaker in patients with chronic bifascicular block or left bundle branch block and additional first-degree atrioventricular block. Acta Anaesthesiol Scand. 1999; 43: 731 - 6.
457. Im SH, Han MH, Kim SH, et al. Transcutaneous temporary cardiac pacing in carotid stenting: noninvasive prevention of angioplastyinduced bradycardia and hypotension. J Endovasc Ther. 2008; 15: 110 - 6.
458. Marrocco-Trischitta MM, Mazzone P, Vitale R, et al. Temporary transvenous pacemaker implantation during carotid endarterectomy in patients with trifascicular block. Ann Vasc Surg. 2016; 34: 206 - 11.
459. Morris D, Mulvihill D, Lew WY. Risk of developing complete heart block during bedside pulmonary artery catheterization in patients with left bundle-branch block. Arch Intern Med. 1987; 147: 2005 - 10.
460. Unnikrishnan D, Idris N, Varshneya N. Complete heart block during central venous catheter placement in a patient with pre-existing left bundle branch block. Br J Anaesth. 2003; 91: 747 - 9.
461. Halliday BP, Gulati A, Ali A, Guha K, Newsome S, Arzanauskaite M, Vassiliou VS, Lota A, Izgi C, Tayal U, Khalique Z, Stirrat C, Auger D, Pareek N, Ismail TF, Rosen SD, Vazir A, Alpendurada F, Gregson J, Frenneaux MP, Cowie MR, Cleland JGF, Cook SA, Pennell DJ, Prasad SK. Association between midwall late gadolinium enhancement and sudden cardiac death in patients with dilated cardiomyopathy and mild and moderate left ventricular systolic dysfunction. Circulation 2017; 135: 2106_2115.
462. Kazmirczak F, Chen KA, Adabag S, von Wald L, Roukoz H, Benditt DG, Okasha O, Farzaneh-Far A, Markowitz J, Nijjar PS, Velangi PS, Bhargava M, Perlman D, Duval S, Akcakaya M, Shenoy C. Assessment of the 2017 AHA/ACC/HRS Guideline Recommendations for Implantable Cardioverter-Defibrillator Implantation in Cardiac Sarcoidosis. Circ Arrhythm Electrophysiol 2019; 12: e007488.
463. Aquaro GD, Perfetti M, Camastra G, Monti L, Dellegrottaglie S, Moro C, Pepe A, Todiere G, Lanzillo C, Scatteia A, Di Roma M, Pontone G, Perazzolo Marra M, Barison A, Di Bella G. Cardiac MR with late gadolinium enhancement in acute myocarditis with preserved systolic function: ITAMY Study. J Am Coll Cardiol 2017; 70: 1977_1987.
464. Ferreira VM, Schulz-Menger J, Holmvang G, Kramer CM, Carbone I, Sechtem U, Kindermann I, Gutberlet M, Cooper LT, Liu P, Friedrich MG. Cardiovascular magnetic resonance in nonischemic myocardial inflammation: expert recommendations. J Am Coll Cardiol 2018; 72: 3158_3176.
465. Kandolin R, Lehtonen J, Kupari M. Cardiac sarcoidosis and giant cell myocarditis as causes of atrioventricular block in young and middle-aged adults. Circ Arrhythm Electrophysiol 2011; 4: 303_309.
466. Grimm W, Hoffmann J, Menz V, Kohler U, Heitmann J, Peter JH, Maisch B. Electrophysiologic evaluation of sinus node function and atrioventricular conduction in patients with prolonged ventricular asystole during obstructive sleep apnea. Am J Cardiol 1996; 77: 1310_1314. 102. Zwillich C, Devlin T, White D, Douglas N, Weil J, Martin R. Bradycardia during sleep apnea. Characteristics and mechanism. J Clin Invest 1982; 69: 1286_1292.
467. Guilleminault C, Pool P, Motta J, Gillis AM. Sinus arrest during REM sleep in young adults. N Engl J Med 1984; 311: 1006_1010.
468. Simantirakis EN, Schiza SI, Marketou ME, Chrysostomakis SI, Chlouverakis GI, Klapsinos NC, Siafakas NS, Vardas PE. Severe bradyarrhythmias in patients with sleep apnoea: the effect of continuous positive airway pressure treatment: a long-term evaluation using an insertable loop recorder. Eur Heart J 2004; 25: 1070_1076.
469. Savonen KP, Kiviniemi V, Laukkanen JA, Lakka TA, Rauramaa TH, Salonen JT, Rauramaa R. Chronotropic incompetence and mortality in middle-aged men with known or suspected coronary heart disease. Eur Heart J 2008; 29: 1896_1902.
470. Brignole M, Moya A, de Lange FJ, Deharo JC, Elliott PM, Fanciulli A, Fedorowski A, Furlan R, Kenny RA, Martin A, Probst V, Reed MJ, Rice CP, Sutton R, Ungar A, van Dijk JG. 2018 ESC Guidelines for the diagnosis and management of syncope. Eur Heart J 2018; 39: 1883_1948.
471. Wissocq L, Ennezat PV, Mouquet F. Exercise-induced high-degree atrioventricular block. Arch Cardiovasc Dis 2009; 102: 733_735.
472. Oliveros RA, Seaworth J, Weiland FL, Boucher CA. Intermittent left anterior hemiblock during treadmill exercise test. Correlation with coronary arteriogram. Chest 1977; 72: 492_494.
473. Solari D, Maggi R, Oddone D, Solano A, Croci F, Donateo P, Wieling W, Brignole M. Assessment of the vasodepressor reflex in carotid sinus syndrome. Circ Arrhythm Electrophysiol 2014; 7: 505_510. 65.
474. Ackerman MJ, Priori SG, Willems S, Berul C, Brugada R, Calkins H, Camm AJ, Ellinor PT, Gollob M, Hamilton R, Hershberger RE, Judge DP, Le Marec H, McKenna WJ, Schulze-Bahr E, Semsarian C, Towbin JA, Watkins H, Wilde A, Wolpert C, Zipes DP. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies. Heart Rhythm 2011; 8: 1308_1339.
475. Ishikawa T, Tsuji Y, Makita N. Inherited bradyarrhythmia: a perse genetic background. J Arrhythm 2016; 32: 352_358.
476. Smits JP, Veldkamp MW, Wilde AA. Mechanisms of inherited cardiac conduction disease. Europace 2005; 7: 122_137.
477. Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, Blom N, Brugada J, Chiang CE, Huikuri H, Kannankeril P, Krahn A, Leenhardt A, Moss A, Schwartz PJ, Shimizu W, Tomaselli G, Tracy C. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes: document endorsed by HRS, EHRA, and APHRS in May 2013 and by ACCF, AHA, PACES, and AEPC in June 2013. Heart Rhythm 2013; 10: 1932_1963.
478. Da Costa A, Defaye P, Romeyer-Bouchard C, Roche F, Dauphinot V, Deharo JC, Jacon P, Lamaison D, Bathelemy JC, Isaaz K, Laurent G. Clinical impact of the implantable loop recorder in patients with isolated syncope, bundle branch block and negative workup: a randomized multicentre prospective study. Arch Cardiovasc Dis 2013; 106: 146_154.
479. Podoleanu C, DaCosta A, Defaye P, Taieb J, Galley D, Bru P, Maury P, Mabo P, Boveda S, Cellarier G, Anselme F, Kouakam C, Delarche N, Deharo JC. Early use of an implantable loop recorder in syncope evaluation: a randomized study in the context of the French healthcare system (FRESH study). Arch Cardiovasc Dis 2014; 107: 546_552.
480. Sulke N, Sugihara C, Hong P, Patel N, Freemantle N. The benefit of a remotely monitored implantable loop recorder as a first line investigation in unexplained syncope: the EaSyAS II trial. Europace 2016; 18: 912_918.
481. Gann D, Tolentino A, Samet P. Electrophysiologic evaluation of elderly patients with sinus bradycardia: a long-term follow-up study. Ann Intern Med 1979; 90: 24_29.
482. McAnulty JH, Rahimtoola SH, Murphy E, DeMots H, Ritzmann L, Kanarek PE, Kauffman S. Natural history of 'high-risk' bundle-branch block: final report of a prospective study. N Engl J Med 1982; 307: 137_143.
483. Gronda M, Magnani A, Occhetta E, Sauro G, D'Aulerio M, Carfora A, Rossi P. Electrophysiological study of atrio-ventricular block and ventricular conduction defects. Prognostic and therapeutical implications. G Ital Cardiol 984; 14: 768_773.
484. Bergfeldt L, Edvardsson N, Rosenqvist M, Vallin H, Edhag O. Atrioventricular block progression in patients with bifascicular block assessed by repeated electrocardiography and a bradycardia-detecting pacemaker. Am J Cardiol 1994; 74: 1129_1132.
485. Kaul U, Dev V, Narula J, Malhotra AK, Talwar KK, Bhatia ML. Evaluation of patients with bundle branch block and 'unexplained' syncope: a study based on comprehensive electrophysiologic testing and ajmaline stress. Pacing Clin Electrophysiol 1988; 11: 289_297.
486. Moya A, Garcia-Civera R, Croci F, Menozzi C, Brugada J, Ammirati F, Del Rosso A, Bellver-Navarro A, Garcia-Sacristan J, Bortnik M, Mont L, Ruiz-Granell R, Navarro X. Diagnosis, management, and outcomes of patients with syncope and bundle branch block. Eur Heart J 2011; 32: 1535_1541.
487. Twidale N, Heddle WF, Tonkin AM. Procainamide administration during electrophysiology study-utility as a provocative test for intermittent atrioventricular block. Pacing Clin Electrophysiol 1988; 11: 1388_1397.
488. Scheinman MM, Peters RW, Suave MJ, Desai J, Abbott JA, Cogan J, Wohl B, Williams K. Value of the H_Q interval in patients with bundle branch block and the role of prophylactic permanent pacing. Am J Cardiol 1982; 50: 1316_1322
489. Tjong FVY, de Ruijter UW, Beurskens NEG, Knops RE. A comprehensive scoping review on transvenous temporary pacing therapy. Neth Heart J 2019; 27: 462_473.
490. Bektas F, Soyuncu S. The efficacy of transcutaneous cardiac pacing in ED. Am J Emerg Med 2016; 34: 2090_2093.
491. Quast ABE, Beurskens NEG, Ebner A, Wasley R, Vehmeijer JT, Marcovecchio A, Sanghera R, Knops RE, Burke MC. Feasibility of an entirely extracardiac, minimally invasive, temporary pacing system. Circ Arrhythm Electrophysiol 2019; 12: e007182.
492. Polyzos KA, Konstantelias AA, Falagas ME. Risk factors for cardiac implantable electronic device infection: a systematic review and meta-analysis. Europace 2015; 17: 767_777.
493. Rastan AJ, Doll N, Walther T, Mohr FW. Pacemaker dependent patients with device infection-a modified approach. Eur J Cardiothorac Surg 2005; 27: 1116_1118.
494. Kawata H, Pretorius V, Phan H, Mulpuru S, Gadiyaram V, Patel J, Steltzner D, Krummen D, Feld G, Birgersdotter-Green U. Utility and safety of temporary pacing using active fixation leads and externalized re-usable permanent pacemakers after lead extraction. Europace 2013; 15: 1287_1291.
495. Dwamena F, Holmes-Rovner M, Gaulden CM, Jorgenson S, Sadigh G, Sikorskii A, Lewin S, Smith RC, Coffey J, Olomu A. Interventions for providers to promote a patient-centred approach in clinical consultations. Cochrane Database Syst Rev 2012; 12: Cd003267.
496. Olsson LE, Jakobsson Ung E, Swedberg K, Ekman I. Efficacy of person-centred care as an intervention in controlled trials - a systematic review. J Clin Nurs 2013; 22: 456_465.
497. McMillan SS, Kendall E, Sav A, King MA, Whitty JA, Kelly F, Wheeler AJ. Patientcentered approaches to health care: a systematic review of randomized controlled trials. Med Care Res Rev 2013; 70: 567_596.
498. Ekman I, Wolf A, Olsson LE, Taft C, Dudas K, Schaufelberger M, Swedberg K. Effects of person-centred care in patients with chronic heart failure: the PCCHF study. Eur Heart J 2012; 33: 1112_1119.
499. Ulin K, Olsson LE, Wolf A, Ekman I. Person-centred care - an approach that improves the discharge process. Eur J Cardiovasc Nurs 2016; 15: e19_e26.
500. Dudas K, Olsson LE, Wolf A, Swedberg K, Taft C, Schaufelberger M, Ekman I. Uncertainty in illness among patients with chronic heart failure is less in person-centred care than in usual care. Eur J Cardiovasc Nurs 2013; 12: 521_528.
501. Auricchio A, Ellenbogen KA. Reducing ventricular pacing frequency in patients with atrioventricular block: is it time to change the current pacing paradigm? Circ Arrhythm Electrophysiol 2016; 9: e004404.
502. Stockburger M, Boveda S, Moreno J, Da Costa A, Hatala R, Brachmann J, Butter C, Garcia Seara J, Rolando M, Defaye P. Long-term clinical effects of ventricular pacing reduction with a changeover mode to minimize ventricular pacing in a general pacemaker population. Eur Heart J 2015; 36: 151_157.
503. Boriani G, Tukkie R, Manolis AS, Mont L, Purerfellner H, Santini M, Inama G, Serra P, de Sousa J, Botto GL, Mangoni L, Grammatico A, Padeletti L, MINERVA Investigators. Atrial antitachycardia pacing and managed ventricular pacing in bradycardia patients with paroxysmal or persistent atrial tachyarrhythmias: the MINERVA randomized multicentre international trial. Eur Heart J 2014; 35: 2352_2362.
504. Stockburger M, Gomez-Doblas JJ, Lamas G, Alzueta J, Fernandez-Lozano I, Cobo E, Wiegand U, Concha JF, Navarro X, Navarro-Lopez F, de Teresa E. Preventing ventricular dysfunction in pacemaker patients without advanced heart failure: results from a multicentre international randomized trial (PREVENT-HF). Eur J Heart Fail 2011; 13: 633_641.
505. Stockburger M, Defaye P, Boveda S, Stancak B, Lazarus A, Sipotz J, Nardi S, Rolando M, Moreno J. Safety and efficiency of ventricular pacing prevention with an AAI-DDD changeover mode in patients with sinus node disease or atrioventricular block: impact on battery longevity - a sub-study of the ANSWER trial. Europace 2016; 18: 739_746.
506. Thibault B, Simpson C, Gagne CE, Blier L, Senaratne M, McNicoll S, Stuglin C, Williams R, Pinter A, Khaykin Y, Nitzsche R. Impact of AV conduction disorders on SafeR mode performance. Pacing Clin Electrophysiol 2009; 32 Suppl 1: S231_235.
507. Thibault B, Ducharme A, Baranchuk A, Dubuc M, Dyrda K, Guerra PG, Macle L, Mondesert B, Rivard L, Roy D, Talajic M, Andrade J, Nitzsche R, Khairy P, CAN-SAVE R Study Investigators. Very low ventricular pacing rates can be achieved safely in a heterogeneous pacemaker population and provide clinical benefits: the CANadian Multi-Centre Randomised Study-Spontaneous AtrioVEntricular Conduction pReservation (CAN-SAVE R) Trial. J Am Heart Assoc 2015; 4: e001983
508. Bellocci F, Spampinato A, Ricci R, Puglisi A, Capucci A, Dini P, Boriani G, Botto G, Curnis A, Moracchini PV, Nicotra G, Lisi F, Nigro P. Antiarrhythmic benefits of dual chamber stimulation with rate-response in patients with paroxysmal atrial fibrillation and chronotropic incompetence: a prospective, multicentre study. Europace 1999; 1: 220_225.
509. Santini M, Ricci R, Puglisi A, Mangiameli S, Proclemer A, Menozzi C, De Fabrizio G, Leoni G, Lisi F, De Seta F. Long-term haemodynamic and antiarrhythmic benefits of DDIR versus DDI pacing mode in sick sinus syndrome and chronotropic incompetence. G Ital Cardiol 1997; 27: 892_900.
510. Calkins H, Hindricks G, Cappato R, Kim YH, Saad EB, Aguinaga L, Akar JG, Badhwar V, Brugada J, Camm J, Chen PS, Chen SA, Chung MK, Cosedis Nielsen J, Curtis AB, Davies DW, Day JD, d'Avila A, Natasja de Groot NMS, Di Biase L, Duytschaever M, Edgerton JR, Ellenbogen KA, Ellinor PT, Ernst S, Fenelon G, Gerstenfeld EP, Haines DE, Haissaguerre M, Helm RH, Hylek E, Jackman WM, Jalife J, Kalman JM, Kautzner J, Kottkamp H, Kuck KH, Kumagai K, Lee R, Lewalter T, Lindsay BD, Macle L, Mansour M, Marchlinski FE, Michaud GF, Nakagawa H, Natale A, Nattel S, Okumura K, Packer D, Pokushalov E, Reynolds MR, Sanders P, Scanavacca M, Schilling R, Tondo C, Tsao HM, Verma A, Wilber DJ, Yamane T, Document Reviewers. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace 2018; 20: e1_e160.
511. Chen YW, Bai R, Lin T, Salim M, Sang CH, Long DY, Yu RH, Tang RB, Guo XY, Yan XL, Nie JG, Du X, Dong JZ, Ma CS. Pacing or ablation: which is better for paroxysmal atrial fibrillation-related tachycardia_bradycardia syndrome? Pacing Clin Electrophysiol 2014; 37: 403_411.
512. Inada K, Yamane T, Tokutake K, Yokoyama K, Mishima T, Hioki M, Narui R, Ito K, Tanigawa S, Yamashita S, Tokuda M, Matsuo S, Shibayama K, Miyanaga S, Date T, Sugimoto K, Yoshimura M. The role of successful catheter ablation in patients with paroxysmal atrial fibrillation and prolonged sinus pauses: outcome during a 5-year follow-up. Europace 2014; 16: 208_213.
513. Fleischmann KE, Orav EJ, Lamas GA, Mangione CM, Schron E, Lee KL, Goldman L. Pacemaker implantation and quality of life in the Mode Selection Trial (MOST). Heart Rhythm 2006; 3: 653_659.
514. Capucci A, Boriani G, Specchia S, Marinelli M, Santarelli A, Magnani B.Evaluation by cardiopulmonary exercise test of DDDR versus DDD pacing. Pacing Clin Electrophysiol 1992; 15: 1908_1913.
515. Lamas GA, Knight JD, Sweeney MO, Mianulli M, Jorapur V, Khalighi K, Cook JR, Silverman R, Rosenthal L, Clapp-Channing N, Lee KL, Mark DB. Impact of ratemodulated pacing on quality of life and exercise capacity - evidence from the Advanced Elements of Pacing Randomized Controlled Trial (ADEPT). Heart Rhythm 2007; 4: 1125_1132.
516. Hocini M, Sanders P, Deisenhofer I, Jais P, Hsu LF, Scavee C, Weerasoriya R, Raybaud F, Macle L, Shah DC, Garrigue S, Le Metayer P, Clementy J, Haissaguerre M. Reverse remodeling of sinus node function after catheter ablation of atrial fibrillation in patients with prolonged sinus pauses. Circulation 2003; 108: 1172_1175.
517. Inada K, Yamane T, Tokutake K, Yokoyama K, Mishima T, Hioki M, Narui R, Ito K, Tanigawa S, Yamashita S, Tokuda M, Matsuo S, Shibayama K, Miyanaga S, Date T, Sugimoto K, Yoshimura M. The role of successful catheter ablation in patients with paroxysmal atrial fibrillation and prolonged sinus pauses: outcome during a 5-year follow-up. Europace 2014; 16: 208_213.
518. Jackson LR, 2nd, Rathakrishnan B, Campbell K, Thomas KL, Piccini JP, Bahnson T, Stiber JA, Daubert JP. Sinus node dysfunction and atrial fibrillation: a reversible phenomenon? Pacing Clin Electrophysiol 2017; 40: 442_450.
519. Boriani G, Tukkie R, Manolis AS, Mont L, Purerfellner H, Santini M, Inama G, Serra P, de Sousa J, Botto GL, Mangoni L, Grammatico A, Padeletti L, MINERVA Investigators. Atrial antitachycardia pacing and managed ventricular pacing in bradycardia patients with paroxysmal or persistent atrial tachyarrhythmias: the MINERVA randomized multicentre international trial. Eur Heart J 2014; 35: 2352_2362.
520. Crossley GH, Padeletti L, Zweibel S, Hudnall JH, Zhang Y, Boriani G. Reactive atrial-based antitachycardia pacing therapy reduces atrial tachyarrhythmias. Pacing Clin Electrophysiol 2019; 42: 970_979.
521. Brignole M, Menozzi C, Moya A, Andresen D, Blanc JJ, Krahn AD, Wieling W, Beiras X, Deharo JC, Russo V, Tomaino M, Sutton R, International Study on Syncope of Uncertain Etiology Investigators. Pacemaker therapy in patients with neurally mediated syncope and documented asystole: Third International Study on Syncope of Uncertain Etiology (ISSUE-3): a randomized trial. Circulation 2012; 125: 2566_2571.
522. Lau CP, Rushby J, Leigh-Jones M, Tam CY, Poloniecki J, Ingram A, Sutton R, Camm AJ. Symptomatology and quality of life in patients with rate-responsive pacemakers: a double-blind, randomized, crossover study. Clin Cardiol 1989; 12: 505_512.
523. Leung SK, Lau CP. Developments in sensor-driven pacing. Cardiol Clin 2000; 18: 113_155, ix. 203. Oto MA, Muderrisoglu H, Ozin MB, Korkmaz ME, Karamehmetoglu A, Oram A, Oram E, Ugurlu S. Quality of life in patients with rate responsive pacemakers: a randomized, cross-over study. Pacing Clin Electrophysiol 1991; 14: 800_806.
524. Proietti R, Manzoni G, Di Biase L, Castelnuovo G, Lombardi L, Fundaro C, Vegliante N, Pietrabissa G, Santangeli P, Canby RA, Sagone A, Viecca M, Natale Closed loop stimulation is effective in improving heart rate and blood pressure response to mental stress: report of a single-chamber pacemaker study in patients with chronotropic incompetent atrial fibrillation. Pacing Clin Electrophysiol 2012; 35: 990_998.
525. Shaw DB, Gowers JI, Kekwick CA, New KH, Whistance AW. Is Mobitz type I atrioventricular block benign in adults? Heart 2004; 90: 169_174.
526. Coumbe AG, Naksuk N, Newell MC, Somasundaram PE, Benditt DG, Adabag S. Long-term follow-up of older patients with Mobitz type I second degree atrioventricular block. Heart 2013; 99: 334_338.
527. Barold SS. Indications for permanent cardiac pacing in first-degree AV block: class I, II, or III? Pacing Clin Electrophysiol 1996; 19: 747_751.
528. Brecker SJ, Xiao HB, Sparrow J, Gibson DG. Effects of dual-chamber pacing with short atrioventricular delay in dilated cardiomyopathy. Lancet 1992; 340: 1308_1312.
529. Carroz P, Delay D, Girod G. Pseudo-pacemaker syndrome in a young woman with first-degree atrio-ventricular block. Europace 2010; 12: 594_596.
530. Santini M, Castro A, Giada F, Ricci R, Inama G, Gaggioli G, Calo L, Orazi S, Viscusi M, Chiodi L, Bartoletti A, Foglia-Manzillo G, Ammirati F, Loricchio ML, Pedrinazzi C, Turreni F, Gasparini G, Accardi F, Raciti G, Raviele A. Prevention of syncope through permanent cardiac pacing in patients with bifascicular block and syncope of unexplained origin: the PRESS study. Circ Arrhythm Electrophysiol 2013; 6: 101_107.
531. Olshansky B, Day JD, Sullivan RM, Yong P, Galle E, Steinberg JS. Does cardiac resynchronization therapy provide unrecognized benefit in patients with prolonged PR intervals? The impact of restoring atrioventricular synchrony: an analysis from the COMPANION Trial. Heart Rhythm 2012; 9: 34_39.
532. Gervais R, Leclercq C, Shankar A, Jacobs S, Eiskjaer H, Johannessen A, Freemantle N, Cleland JG, Tavazzi L, Daubert C, CARE-HF investigators. Surface electrocardiogram to predict outcome in candidates for cardiac resynchronization therapy: a sub-analysis of the CARE-HF trial. Eur J Heart Fail 2009; 11: 699_705.
533. Friedman DJ, Bao H, Spatz ES, Curtis JP, Daubert JP, Al-Khatib SM. Association Between a Prolonged PR interval and outcomes of cardiac resynchronization therapy: a report from the National Cardiovascular Data Registry. Circulation 2016; 134: 1617_1628.
534. Leclercq C, Kass DA. Retiming the failing heart: principles and current clinical status of cardiac resynchronization. J Am Coll Cardiol 2002; 39: 194_201.
535. Leclercq C, Hare JM. Ventricular resynchronization: current state of the art. Circulation 2004; 109: 296_299.
536. Cunnington C, Kwok CS, Satchithananda DK, Patwala A, Khan MA, Zaidi A, Ahmed FZ, Mamas MA. Cardiac resynchronisation therapy is not associated with a reduction in mortality or heart failure hospitalisation in patients with non-left bundle branch block QRS morphology: meta-analysis of randomized controlled trials. Heart 2015; 101: 1456_1462.
537. Zareba W, Klein H, Cygankiewicz I, Hall WJ, McNitt S, Brown M, Cannom D, Daubert JP, Eldar M, Gold MR, Goldberger JJ, Goldenberg I, Lichstein E, Pitschner H, Rashtian M, Solomon S, Viskin S, Wang P, Moss AJ. Effectiveness of cardiac resynchronization therapy by QRS morphology in the Multicenter Automatic Defibrillator Implantation Trial-Cardiac Resynchronization Therapy (MADIT-CRT). Circulation 2011; 123: 1061_1072.
538. Birnie DH, Ha A, Higginson L, Sidhu K, Green M, Philippon F, Thibault B, Wells G, Tang A. Impact of QRS morphology and duration on outcomes after cardiac resynchronization therapy: results from the Resynchronization-Defibrillation for Ambulatory Heart Failure Trial (RAFT). Circ Heart Fail 2013; 6: 1190_1198.
539. Bilchick KC, Kamath S, DiMarco JP, Stukenborg GJ. Bundle-branch block morphology and other predictors of outcome after cardiac resynchronization therapy in Medicare patients. Circulation 2010; 122: 2022_2030.
540. Woods B, Hawkins N, Mealing S, Sutton A, Abraham WT, Beshai JF, Klein H, Sculpher M, Plummer CJ, Cowie MR. Inpidual patient data network metaanalysis of mortality effects of implantable cardiac devices. Heart 2015; 101: 1800_1806.
541. Gold MR, Thebault C, Linde C, Abraham WT, Gerritse B, Ghio S, St John Sutton M, Daubert JC. Effect of QRS duration and morphology on cardiac resynchronization therapy outcomes in mild heart failure: results from the Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction (REVERSE) study. Circulation 2012; 126: 822_829.
542. Fantoni C, Kawabata M, Massaro R, Regoli F, Raffa S, Arora V, Salerno-Uriarte JA, Klein HU, Auricchio A. Right and left ventricular activation sequence in patients with heart failure and right bundle branch block: a detailed analysis using three-dimensional non-fluoroscopic electroanatomic mapping system. J Cardiovasc Electrophysiol 2005; 16: 112_119; discussion 120_121.
543. Nery PB, Ha AC, Keren A, Birnie DH. Cardiac resynchronization therapy in patients with left ventricular systolic dysfunction and right bundle branch block: a systematic review. Heart Rhythm 2011; 8: 1083_1087.
544. Kutyifa V, Stockburger M, Daubert JP, Holmqvist F, Olshansky B, Schuger C, Klein H, Goldenberg I, Brenyo A, McNitt S, Merkely B, Zareba W, Moss AJ. PR interval identifies clinical response in patients with non-left bundle branch block: a Multicenter Automatic Defibrillator Implantation Trial-Cardiac Resynchronization Therapy substudy. Circ Arrhythm Electrophysiol 2014; 7: 645_651.
545. Kewcharoen J, Kanitsoraphan C. Prolonged PR interval and outcome in cardiac resynchronization therapy. Arq Bras Cardiol 2019; 113: 109_110.
546. Caputo ML, van Stipdonk A, Illner A, D'Ambrosio G, Regoli F, Conte G, Moccetti T, Klersy C, Prinzen FW, Vernooy K, Auricchio A. The definition of left bundle branch block influences the response to cardiac resynchronization therapy. Int J Cardiol 2018; 269: 165_169.
547. Van Stipdonk AMW, Vanbelle S, Ter Horst IAH, Luermans JG, Meine M, Maass AH, Auricchio A, Prinzen FW, Vernooy K. Large variability in clinical judgement and definitions of left bundle branch block to identify candidates for cardiac resynchronisation therapy. Int J Cardiol 2019; 286: 61_65.
548. Tomlinson DR, Bashir Y, Betts TR, Rajappan K. Accuracy of manual QRS duration assessment: its importance in patient selection for cardiac resynchronization and implantable cardioverter defibrillator therapy. Europace 2009; 11: 638_642.
549. Vancura V, Wichterle D, Ulc I, Smid J, Brabec M, Zarybnicka M, Rokyta R. The variability of automated QRS duration measurement. Europace 2017; 19: 636_643.
550. Tang AS, Wells GA, Talajic M, Arnold MO, Sheldon R, Connolly S, Hohnloser SH, Nichol G, Birnie DH, Sapp JL, Yee R, Healey JS, Rouleau JL. Cardiac-resynchronization therapy for mild-to-moderate heart failure. N Engl J Med 2010; 363: 2385_2395.
551. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352: 1539_1549.
552. Moss AJ, Hall WJ, Cannom DS, Klein H, Brown MW, Daubert JP, Estes NA 3rd, Foster E, Greenberg H, Higgins SL, Pfeffer MA, Solomon SD, Wilber D, Zareba W, MADIT-CRT Trial Investigators. Cardiac-resynchronization therapy for the prevention of heart-failure events. N Engl J Med 2009; 361: 1329_1338.
553. Auricchio A, Stellbrink C, Sack S, Block M, Vogt J, Bakker P, Huth C, Schondube F, Wolfhard U, Bocker D, Krahnefeld O, Kirkels H. Long-term clinical effect of hemodynamically optimized cardiac resynchronization therapy in patients with heart failure and ventricular conduction delay. J Am Coll Cardiol 2002; 39: 2026_2033.
554. Auricchio A, Stellbrink C, Butter C, Sack S, Vogt J, Misier AR, Bocker D, Block M, Kirkels JH, Kramer A, Huvelle E. Clinical efficacy of cardiac resynchronization therapy using left ventricular pacing in heart failure patients stratified by severity of ventricular conduction delay. J Am Coll Cardiol 2003; 42: 2109_2116.
555. Cazeau S, Leclercq C, Lavergne T, Walker S, Varma C, Linde C, Garrigue S, Kappenberger L, Haywood GA, Santini M, Bailleul C, Daubert JC. Effects of multisite biventricular pacing in patients with heart failure and intraventricular conduction delay. N Engl J Med 2001; 344: 873_880.
556. Linde C, Leclercq C, Rex S, Garrigue S, Lavergne T, Cazeau S, McKenna W, Fitzgerald M, Deharo JC, Alonso C, Walker S, Braunschweig F, Bailleul C, Daubert JC. Long-term benefits of biventricular pacing in congestive heart failure: results from the MUltisite STimulation in cardiomyopathy (MUSTIC) study. J Am Coll Cardiol 2002; 40: 111_118.
557. Abraham WT, Fisher WG, Smith AL, Delurgio DB, Leon AR, Loh E, Kocovic DZ, Packer M, Clavell AL, Hayes DL, Ellestad M, Trupp RJ, Underwood J, Pickering F, Truex C, McAtee P, Messenger J. Cardiac resynchronization in chronic heart failure. N Engl J Med 2002; 346: 1845_1853.
558. Abraham WT, Young JB, Leon AR, Adler S, Bank AJ, Hall SA, Lieberman R, Liem LB, O'Connell JB, Schroeder JS, Wheelan KR. Effects of cardiac resynchronization on disease progression in patients with left ventricular systolic dysfunction, an indication for an implantable cardioverter-defibrillator, and mildly symptomatic chronic heart failure. Circulation 2004; 110: 2864_2868.
559. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, Carson P, DiCarlo L, DeMets D, White BG, DeVries DW, Feldman AM. Cardiac-resynchronization therapy with or without an implantable defibrillator in advancedchronic heart failure. N Engl J Med 2004; 350: 2140_2150.
560. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L. Longer-term effects of cardiac resynchronization therapy on mortality in heart failure [the CArdiac REsynchronization-Heart Failure (CARE-HF) trial extension phase]. Eur Heart J 2006; 27: 1928_1932.
561. Linde C, Abraham WT, Gold MR, St John Sutton M, Ghio S, Daubert C. Randomized trial of cardiac resynchronization in mildly symptomatic heart failure patients and in asymptomatic patients with left ventricular dysfunction and previous heart failure symptoms. J Am Coll Cardiol 2008; 52: 1834_1843.
562. Daubert C, Gold MR, Abraham WT, Ghio S, Hassager C, Goode G, Szili-Torok T, Linde C. Prevention of disease progression by cardiac resynchronization therapy in patients with asymptomatic or mildly symptomatic left ventricular dysfunction: insights from the European cohort of the REVERSE (Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction) trial. J Am Coll Cardiol 2009; 54: 1837_1846.
563. Ruschitzka F, Abraham WT, Singh JP, Bax JJ, Borer JS, Brugada J, Dickstein K, Ford I, Gorcsan J 3rd, Gras D, Krum H, Sogaard P, Holzmeister J. Cardiacresynchronization therapy in heart failure with a narrow QRS complex. N Engl J Med 2013; 369: 1395_1405.
564. Goldenberg I, Kutyifa V, Moss AJ. Survival with cardiac-resynchronization therapy. N Engl J Med 2014; 371: 477_478.
565. Cleland JG, Abraham WT, Linde C, Gold MR, Young JB, Claude Daubert J, Sherfesee L, Wells GA, Tang AS. An inpidual patient meta-analysis of five randomized trials assessing the effects of cardiac resynchronization therapy on morbidity and mortality in patients with symptomatic heart failure. Eur Heart J 2013; 34: 3547_3556.
566. Zusterzeel R, Selzman KA, Sanders WE, Canos DA, O'Callaghan KM, Carpenter JL, Pina IL, Strauss DG. Cardiac resynchronization therapy in women: US Food and Drug Administration meta-analysis of patient-level data. JAMA Intern Med 2014; 174: 1340_1348.
567. Zweerink A, Friedman DJ, Klem I, van de Ven PM, Vink C, Biesbroek PS, Hansen SM, Emerek K, Kim RJ, van Rossum AC, Atwater BD, Nijveldt R, Allaart CP. Size Matters: Normalization of QRS duration to left ventricular dimension improves prediction of long-term cardiac resynchronization therapy outcome. Circ Arrhythm Electrophysiol 2018; 11: e006_767.
568. Birnie DH, Ha A, Higginson L, Sidhu K, Green M, Philippon F, Thibault B, Wells G, Tang A. Impact of QRS morphology and duration on outcomes after cardiac resynchronization therapy: results from the Resynchronization-Defibrillation for Ambulatory Heart Failure Trial (RAFT). Circ Heart Fail 2013; 6: 1190_1198.
569. Bilchick KC, Kamath S, DiMarco JP, Stukenborg GJ. Bundle-branch block morphology and other predictors of outcome after cardiac resynchronization therapy in Medicare patients. Circulation 2010; 122: 2022_2030.
570. Woods B, Hawkins N, Mealing S, Sutton A, Abraham WT, Beshai JF, Klein H, Sculpher M, Plummer CJ, Cowie MR. Inpidual patient data network metaanalysis of mortality effects of implantable cardiac devices. Heart 2015; 101: 1800_1806.
571. Gold MR, Thebault C, Linde C, Abraham WT, Gerritse B, Ghio S, St John Sutton M, Daubert JC. Effect of QRS duration and morphology on cardiac resynchronization therapy outcomes in mild heart failure: results from the Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction (REVERSE) study. Circulation 2012; 126: 822_829.
572. Fantoni C, Kawabata M, Massaro R, Regoli F, Raffa S, Arora V, Salerno-Uriarte JA, Klein HU, Auricchio A. Right and left ventricular activation sequence in patients with heart failure and right bundle branch block: a detailed analysis using three-dimensional non-fluoroscopic electroanatomic mapping system. J Cardiovasc Electrophysiol 2005; 16: 112_119; discussion 120_121.
573. Nery PB, Ha AC, Keren A, Birnie DH. Cardiac resynchronization therapy in patients with left ventricular systolic dysfunction and right bundle branch block: a systematic review. Heart Rhythm 2011; 8: 1083_1087.
574. Steffel J, Robertson M, Singh JP, Abraham WT, Bax JJ, Borer JS, Dickstein K, Ford I, Gorcsan J 3rd, Gras D, Krum H, Sogaard P, Holzmeister J, Brugada J, Ruschitzka F. The effect of QRS duration on cardiac resynchronization therapy in patients with a narrow QRS complex: a subgroup analysis of the EchoCRT trial. Eur Heart J 2015; 36: 1983_1989.
575. Arshad A, Moss AJ, Foster E, Padeletti L, Barsheshet A, Goldenberg I, Greenberg H, Hall WJ, McNitt S, Zareba W, Solomon S, Steinberg JS. Cardiac resynchronization therapy is more effective in women than in men: the MADIT-CRT (Multicenter Automatic Defibrillator Implantation Trial with Cardiac Resynchronization Therapy) trial. J Am Coll Cardiol 2011; 57: 813_820.
576. Gasparini M, Leclercq C, Lunati M, Landolina M, Auricchio A, Santini M, Boriani G, Lamp B, Proclemer A, Curnis A, Klersy C, Leyva F. Cardiac resynchronization therapy in patients with atrial fibrillation: the CERTIFY study (Cardiac Resynchronization Therapy in Atrial Fibrillation Patients Multinational Registry). JACC Heart Fail 2013; 1: 500_507
577. Yin J, Hu H, Wang Y, Xue M, Li X, Cheng W, Li X, Yan S. Effects of atrioventricular nodal ablation on permanent atrial fibrillation patients with cardiac resynchronization therapy: a systematic review and meta-analysis. Clin Cardiol 2014; 37: 707_715.
578. Tolosana JM, Arnau AM, Madrid AH, Macias A, Lozano IF, Osca J, Quesada A, Toquero J, France's RM, Bolao IG, Berruezo A, Sitges M, Alcal_a MG, Brugada J, Mont L. Cardiac resynchronization therapy in patients with permanent atrial fibrillation. Is it mandatory to ablate the atrioventricular junction to obtain a good response? Eur J Heart Fail 2012; 14: 635_641.
579. Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, Castella M, Diener HC, Heidbuchel H, Hendriks J, Hindricks G, Manolis AS, Oldgren J, Popescu BA, Schotten U, Van Putte B, Vardas P. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37: 2893_2962
580. Yin J, Hu H, Wang Y, Xue M, Li X, Cheng W, Li X, Yan S. Effects of atrioventricular nodal ablation on permanent atrial fibrillation patients with cardiac resynchronization therapy: a systematic review and meta-analysis. Clin Cardiol 2014; 37: 707_715. art J 2016; 37: 2893_2962.
581. Tolosana JM, Trucco E, Khatib M, Doltra A, Borras R, Castel M, Berruezo A, Arbelo E, Sitges M, Matas M, Guasch E, Brugada J, Mont L. Complete atrioventricular block does not reduce long-term mortality in patients with permanent atrial fibrillation treated with cardiac resynchronization therapy. Eur J Heart Fail 2013; 15: 1412_1418
582. Doshi RN, Daoud EG, Fellows C, Turk K, Duran A, Hamdan MH, Pires LA, PAVE Study Group. Left ventricular-based cardiac stimulation post AV nodal ablation evaluation (the PAVE study). J Cardiovasc Electrophysiol 2005; 16: 1160_1165.
583. Huang W, Su L, Wu S, Xu L, Xiao F, Zhou X, Ellenbogen KA. Benefits of permanent His bundle pacing combined with atrioventricular node ablation in atrial fibrillation patients with heart failure with both preserved and reduced left ventricular ejection fraction. J Am Heart Assoc 2017; 6: e005_309.
584. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, ![]() M, Burri H, Butler J, _Celutkiene J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Piepoli MF, Price S, Rosano GMC, Ruschitzka F, Skibelund AK; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; doi: 10.1093/eurheartj/ehab368.
M, Burri H, Butler J, _Celutkiene J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Piepoli MF, Price S, Rosano GMC, Ruschitzka F, Skibelund AK; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; doi: 10.1093/eurheartj/ehab368.
585. Yu CM, Chan JY, Zhang Q, Omar R, Yip GW, Hussin A, Fang F, Lam KH, Chan HC, Fung JW. Biventricular pacing in patients with bradycardia and normal ejection fraction. N Engl J Med 2009; 361: 2123_2134.
586. Tang AS, Wells GA, Talajic M, Arnold MO, Sheldon R, Connolly S, Hohnloser SH, Nichol G, Birnie DH, Sapp JL, Yee R, Healey JS, Rouleau JL. Cardiac-resynchronization therapy for mild-to-moderate heart failure. N Engl J Med 2010; 363: 2385_2395
587. Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia H, Kutalek SP, Sharma A, Dual Chamber VVI Implantable Defibrillator Trial Investigators. Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA 2002; 288: 3115_3123.
588. Curtis AB, Worley SJ, Adamson PB, Chung ES, Niazi I, Sherfesee L, Shinn T, Sutton MS, Biventricular versus Right Ventricular Pacing in Heart Failure Patients with Atrioventricular Block Trial Investigators. Biventricular pacing for atrioventricular block and systolic dysfunction. N Engl J Med 2013; 368: 1585_1593.
589. Baker CM, Christopher TJ, Smith PF, Langberg JJ, Delurgio DB, Leon AR. Addition of a left ventricular lead to conventional pacing systems in patients with congestive heart failure: feasibility, safety, and early results in 60 consecutive patients. Pacing Clin Electrophysiol 2002; 25: 1166_1171.
590. Valls-Bertault V, Fatemi M, Gilard M, Pennec PY, Etienne Y, Blanc JJ. Assessment of upgrading to biventricular pacing in patients with right ventricular pacing and congestive heart failure after atrioventricular junctional ablation for chronic atrial fibrillation. Europace 2004; 6: 438_443.
591. Eldadah ZA, Rosen B, Hay I, Edvardsen T, Jayam V, Dickfeld T, Meininger GR, Judge DP, Hare J, Lima JB, Calkins H, Berger RD. The benefit of upgrading chronically right ventricle-paced heart failure patients to resynchronization therapy demonstrated by strain rate imaging. Heart Rhythm 2006; 3: 435_442.
592. Shimano M, Tsuji Y, Yoshida Y, Inden Y, Tsuboi N, Itoh T, Suzuki H, Muramatsu T, Okada T, Harata S, Yamada T, Hirayama H, Nattel S, Murohara T. Acute and chronic effects of cardiac resynchronization in patients developing heart failure with long-term pacemaker therapy for acquired complete atrioventricular block. Europace 2007; 9: 869_874.
593. Laurenzi F, Achilli A, Avella A, Peraldo C, Orazi S, Perego GB, Cesario A, Valsecchi S, De Santo T, Puglisi A, Tondo C. Biventricular upgrading in patients with conventional pacing system and congestive heart failure: results and response predictors. Pacing Clin Electrophysiol 2007; 30: 1096_1104.
594. Vatankulu MA, Goktekin O, Kaya MG, Ayhan S, Kucukdurmaz Z, Sutton R, Henein M. Effect of long-term resynchronization therapy on left ventricular remodeling in pacemaker patients upgraded to biventricular devices. Am J Cardiol 2009; 103: 1280_1284.
595. Hoijer CJ, Meurling C, Brandt J. Upgrade to biventricular pacing in patients withconventional pacemakers and heart failure: a double-blind, randomized crossoverstudy. Europace 2006; 8: 51_55.
596. Delnoy PP, Ottervanger JP, Vos DH, Elvan A, Misier AR, Beukema WP, Steendijk P, van Hemel NM. Upgrading to biventricular pacing guided by pressure _volume loop analysis during implantation. J Cardiovasc Electrophysiol 2011; 22: 677_683.
597. Van Geldorp IE, Vernooy K, Delhaas T, Prins MH, Crijns HJ, Prinzen FW, Dijkman B. Beneficial effects of biventricular pacing in chronically right ventricular paced patients with mild cardiomyopathy. Europace 2010; 12: 223_229.
598. Leclercq C, Cazeau S, Lellouche D, Fossati F, Anselme F, Davy JM, Sadoul N, Klug D, Mollo L, Daubert JC. Upgrading from single chamber right ventricular to biventricular pacing in permanently paced patients with worsening heart failure: the RD-CHF Study. Pacing Clin Electrophysiol 2007; 30 Suppl 1: S23_S30.
599. Kosztin A, Vamos M, Aradi D, Schwertner WR, Kovacs A, Nagy KV, Zima E, Geller L, Duray GZ, Kutyifa V, Merkely B. De novo implantation vs. upgrade cardiac resynchronization therapy: a systematic review and meta-analysis. Heart Fail Rev 2018; 23: 15_26.
600. Linde CM, Normand C, Bogale N, Auricchio A, Sterlinski M, Marinskis G, Sticherling C, Bulava A, Perez OC, Maass AH, Witte KK, Rekvava R, Abdelali S, Dickstein K. Upgrades from a previous device compared to de novo cardiac resynchronization therapy in the European Society of Cardiology CRT Survey II. II. Eur J Heart Fail 2018; 20: 1457_1468.
601. Stockburger M, Gomez-Doblas JJ, Lamas G, Alzueta J, Fernandez-Lozano I, Cobo E, Wiegand U, Concha JF, Navarro X, Navarro-Lopez F, de Teresa E. Preventing ventricular dysfunction in pacemaker patients without advanced heart failure: results from a multicentre international randomized trial (PREVENT-HF). Eur J Heart Fail 2011; 13: 633_641. Eur J Heart Fail 2018; 20: 1457_1468.
602. Funck RC, Mueller HH, Lunati M, Piorkowski C, De Roy L, Paul V, Wittenberg M, Wuensch D, Blanc JJ. Characteristics of a large sample of candidates for permanent ventricular pacing included in the Biventricular Pacing for Atrioventricular Block to Prevent Cardiac Desynchronization Study (BioPace). Europace 2014; 16: 354_362.
603. Yu CM, Fang F, Luo XX, Zhang Q, Azlan H, Razali O. Long-term follow-up results of the pacing to avoid cardiac enlargement (PACE) trial. Eur J Heart Fail 2014; 16: 1016_1025.
604. Albertsen AE, Mortensen PT, Jensen HK, Poulsen SH, Egeblad H, Nielsen JC. Adverse effect of right ventricular pacing prevented by biventricular pacing during long-term follow-up: a randomized comparison. Eur J Echocardiogr 2011; 12: 767_772.
605. Kiehl EL, Makki T, Kumar R, Gumber D, Kwon DH, Rickard JW, Kanj M, Wazni OM, Saliba WI, Varma N, Wilkoff BL, Cantillon DJ. Incidence and predictors of right ventricular pacing-induced cardiomyopathy in patients with complete atrioventricular block and preserved left ventricular systolic function. Heart Rhythm 2016; 13: 2272_2278
606. Starr N, Dayal N, Domenichini G, Stettler C, Burri H. Electrical parameters with His-bundle pacing: considerations for automated programming. Heart Rhythm 2019; 16: 1817_1824.
607. Burri H, Keene D, Whinnett Z, Zanon F, Vijayaraman P. Device programming for His bundle pacing. Circ Arrhythm Electrophysiol 2019; 12: e006_816.
608. Sharma PS, Dandamudi G, Herweg B, Wilson D, Singh R, Naperkowski A, Koneru JN, Ellenbogen KA, Vijayaraman P. Permanent His-bundle pacing as an alternative to biventricular pacing for cardiac resynchronization therapy: a multicenter experience. Heart Rhythm 2018; 15: 413_420.
609. Keene D, Arnold AD, Jastrzebski M, Burri H, Zweibel S, Crespo E, Chandrasekaran B, Bassi S, Joghetaei N, Swift M, Moskal P, Francis DP, Foley P, Shun-Shin MJ, Whinnett ZI. His bundle pacing, learning curve, procedure characteristics, safety, and feasibility: insights from a large international observational study. J Cardiovasc Electrophysiol 2019; 30: 1984_1993.
610. Vijayaraman P, Dandamudi G, Zanon F, Sharma PS, Tung R, Huang W, Koneru J, Tada H, Ellenbogen KA, Lustgarten DL. Permanent His bundle pacing: recommendations from a Multicenter His Bundle Pacing Collaborative Working Group for standardization of definitions, implant measurements, and follow-up. Heart Rhythm 2018; 15: 460_468
611. Giraldi F, Cattadori G, Roberto M, Carbucicchio C, Pepi M, Ballerini G, Alamanni F, Della Bella P, Pontone G, Andreini D, Tondo C, Agostoni PG. Long-term effectiveness of cardiac resynchronization therapy in heart failure patients with unfavorable cardiac veins anatomy comparison of surgical versus hemodynamic procedure. J Am Coll Cardiol 2011; 58: 483_490.
612. Barba-Pichardo R, Manovel Sanchez A, Fernandez-Gomez JM, Morina-Vazquez P, Venegas-Gamero J, Herrera-Carranza M. Ventricular resynchronization therapy by direct His-bundle pacing using an internal cardioverter defibrillator. Europace 2013; 15: 83_88.
613. Teigeler T, Kolominsky J, Vo C, Shepard RK, Kalahasty G, Kron J, Huizar JF, Kaszala K, Tan AY, Koneru JN, Ellenbogen KA, Padala SK. Intermediate term performance and safety of His bundle pacing leads: a single center experience. Heart Rhythm 2021; 18: 743_749.
614. Zweerink A, Bakelants E, Stettler C, Burri H. Cryoablation vs. radiofrequency ablation of the atrioventricular node in patients with His-bundle pacing. Europace 2020; 23: 421_430. Heart Rhythm 2021; 18: 743_749.
615. Huang W, Su L, Wu S, Xu L, Xiao F, Zhou X, Ellenbogen KA. Benefits of permanent His bundle pacing combined with atrioventricular node ablation in atrial fibrillation patients with heart failure with both preserved and reduced left ventricular ejection fraction. J Am Heart Assoc 2017; 6: e005_309
616. Deshmukh P, Casavant DA, Romanyshyn M, Anderson K. Permanent, direct His-bundle pacing: a novel approach to cardiac pacing in patients with normal His_Purkinje activation. Circulation 2000; 101: 869_877.
617. Occhetta E, Bortnik M, Magnani A, Francalacci G, Piccinino C, Plebani L, Marino P. Prevention of ventricular desynchronization by permanent para-Hisian pacing after atrioventricular node ablation in chronic atrial fibrillation: a crossover, blinded, randomized study versus apical right ventricular pacing. J Am Coll Cardiol 2006; 47: 1938_1945.
618. Sharma PS, Dandamudi G, Herweg B, Wilson D, Singh R, Naperkowski A, Koneru JN, Ellenbogen KA, Vijayaraman P. Permanent His-bundle pacing as an alternative to biventricular pacing for cardiac resynchronization therapy: a multicenter experience. Heart Rhythm 2018; 15: 413_420.
619. Vijayaraman P, Naperkowski A, Ellenbogen KA, Dandamudi G. Electrophysiologic insights into site of atrioventricular block. JACC Clin Electrophysiol 2015; 1: 571_581.
620. Abdelrahman M, Subzposh FA, Beer D, Durr B, Naperkowski A, Sun H, Oren JW, Dandamudi G, Vijayaraman P. Clinical outcomes of His bundle pacing compared to right ventricular pacing. J Am Coll Cardiol 2018; 71: 2319_2330.
621. Chung MK. Cardiac surgery: postoperative arrhythmias. Crit Care Med 2000; 28: N 136_N 14
622. Hill TE, Kiehl EL, Shrestha NK, Gordon SM, Pettersson GB, Mohan C, Hussein A, Hussain S, Wazni O, Wilkoff BL, Menon V, Tarakji KG. Predictors of permanent pacemaker requirement after cardiac surgery for infective endocarditis. Eur Heart J Acute Cardiovasc Care 2021; 10: 329_334.
623. Knops RE, Tjong FV, Neuzil P, Sperzel J, Miller MA, Petru J, Simon J, Sepa L, de Groot JR, Dukkipati SR, Koruth JS, Wilde AA, Kautzner J, Reddy VY. Chronic performance of a leadless cardiac pacemaker: 1-year follow-up of the LEADLESS trial. J Am Coll Cardiol 2015; 65: 1497_1504.
624. Noheria A, van Zyl M, Scott LR, Srivathsan K, Madhavan M, Asirvatham SJ, McLeod CJ. Single-site ventricular pacing via the coronary sinus in patients with tricuspid valve disease. Europace 2018; 20: 636_642.
625. Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, Tuzcu EM, Webb JG, Fontana GP, Makkar RR, Brown DL, Block PC, Guyton RA, Pichard AD, Bavaria JE, Herrmann HC, Douglas PS, Petersen JL, Akin JJ, Anderson WN, Wang D, Pocock S. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010; 363: 1597_1607.
626. Smith CR, Leon MB, Mack MJ, Miller DC, Moses JW, Svensson LG, Tuzcu EM, Webb JG, Fontana GP, Makkar RR, Williams M, Dewey T, Kapadia S, Babaliaros V, Thourani VH, Corso P, Pichard AD, Bavaria JE, Herrmann HC, Akin JJ, Anderson WN, Wang D, Pocock SJ. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011; 364: 2187_2198.
627. Leon MB, Smith CR, Mack MJ, Makkar RR, Svensson LG, Kodali SK, Thourani VH, Tuzcu EM, Miller DC, Herrmann HC, Doshi D, Cohen DJ, Pichard AD, Kapadia S, Dewey T, Babaliaros V, Szeto WY, Williams MR, Kereiakes D, Zajarias A, Greason KL, Whisenant BK, Hodson RW, Moses JW, Trento A, Brown DL, Fearon WF, Pibarot P, Hahn RT, Jaber WA, Anderson WN, Alu MC, Webb JG. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med 2016; 374: 1609_1620.
628. Mack MJ, Leon MB, Thourani VH, Makkar R, Kodali SK, Russo M, Kapadia SR, Malaisrie SC, Cohen DJ, Pibarot P, Leipsic J, Hahn RT, Blanke P, Williams MR, McCabe JM, Brown DL, Babaliaros V, Goldman S, Szeto WY, Genereux P, Pershad A, Pocock SJ, Alu MC, Webb JG, Smith CR. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med 2019; 380: 1695_1705.
629. Adams DH, Popma JJ, Reardon MJ, Yakubov SJ, Coselli JS, Deeb GM, Gleason TG, Buchbinder M, Hermiller J Jr, Kleiman NS, Chetcuti S, Heiser J, Merhi W, Zorn G, Tadros P, Robinson N, Petrossian G, Hughes GC, Harrison JK, Conte J, Maini B, Mumtaz M, Chenoweth S, Oh JK. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med 2014; 370: 1790_1798.
630. Popma JJ, Deeb GM, Yakubov SJ, Mumtaz M, Gada H, O'Hair D, Bajwa T, Heiser JC, Merhi W, Kleiman NS, Askew J, Sorajja P, Rovin J, Chetcuti SJ, Adams DH, Teirstein PS, Zorn GL 3rd, Forrest JK, Tchetche D, Resar J, Walton A, Piazza N, Ramlawi B, Robinson N, Petrossian G, Gleason TG, Oh JK, Boulware MJ, Qiao H, Mugglin AS, Reardon MJ. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. N Engl J Med 2019; 380: 1706_1715.
631. Reardon MJ, Van Mieghem NM, Popma JJ, Kleiman NS, Sondergaard L, Mumtaz M, Adams DH, Deeb GM, Maini B, Gada H, Chetcuti S, Gleason T, Heiser J, Lange R, Merhi W, Oh JK, Olsen PS, Piazza N, Williams M, Windecker S, Yakubov SJ, Grube E, Makkar R, Lee JS, Conte J, Vang E, Nguyen H, Chang Y, Mugglin AS, Serruys PW, Kappetein AP. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med 2017; 376: 1321_1331.
632. Barbash IM, Finkelstein A, Barsheshet A, Segev A, Steinvil A, Assali A, Ben Gal Y, Vaknin Assa H, Fefer P, Sagie A, Guetta V, Kornowski R. Outcomes of patients at estimated low, intermediate, and high risk undergoing transcatheter aortic valve implantation for aortic stenosis. Am J Cardiol 2015; 116: 1916_1922.
633. Bekeredjian R, Szabo G, Balaban U, Bleiziffer S, Bauer T, Ensminger S, Frerker C, Herrmann E, Beyersdorf F, Hamm C, Beckmann A, Mollmann H, Karck M, Katus HA, Walther T. Patients at low surgical risk as defined by the Society of Thoracic Surgeons Score undergoing isolated interventional or surgical aortic valve implantation: in-hospital data and 1-year results from the German Aortic Valve Registry (GARY). Eur Heart J 2019; 40: 1323_1330.
634. Gilard M, Eltchaninoff H, Iung B, Donzeau-Gouge P, Chevreul K, Fajadet J, Leprince P, Leguerrier A, Lievre M, Prat A, Teiger E, Lefevre T, Himbert D, Tchetche D, Carrie D, Albat B, Cribier A, Rioufol G, Sudre A, Blanchard D, Collet F, Dos Santos P, Meneveau N, Tirouvanziam A, Caussin C, Guyon P, Boschat J, Le Breton H, Collart F, Houel R, Delpine S, Souteyrand G, Favereau X, Ohlmann P, Doisy V, Grollier G, Gommeaux A, Claudel JP, Bourlon F, Bertrand B, Van Belle E, Laskar M. Registry of transcatheter aortic-valve implantation in high-risk patients. N Engl J Med 2012; 366: 1705_1715.
635. Moat NE, Ludman P, de Belder MA, Bridgewater B, Cunningham AD, Young CP, Thomas M, Kovac J, Spyt T, MacCarthy PA, Wendler O, Hildick-Smith D, Davies SW, Trivedi U, Blackman DJ, Levy RD, Brecker SJ, Baumbach A, Daniel T, Gray H, Mullen MJ. Long-term outcomes after transcatheter aortic valve implantation in high-risk patients with severe aortic stenosis: the U.K. TAVI (United Kingdom Transcatheter Aortic Valve Implantation) Registry. J Am Coll Cardiol 2011; 58: 2130_2138.
636. Thomas M, Schymik G, Walther T, Himbert D, Lefevre T, Treede H, Eggebrecht H, Rubino P, Michev I, Lange R, Anderson WN, Wendler O. Thirty-day results of the SAPIEN aortic Bioprosthesis European Outcome (SOURCE) Registry: a European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve. Circulation 2010; 122: 62_69.
637. Werner N, Zahn R, Beckmann A, Bauer T, Bleiziffer S, Hamm CW, Berkeredjian R, Berkowitsch A, Mohr FW, Landwehr S, Katus HA, Harringer W, Ensminger S, Frerker C, Mollmann H, Walther T, Schneider S, Lange R. Patients at intermediate surgical risk undergoing isolated interventional or surgical aortic valve implantation for severe symptomatic aortic valve stenosis. Circulation 2018; 138: 2611_2623.
638. Fadahunsi OO, Olowoyeye A, Ukaigwe A, Li Z, Vora AN, Vemulapalli S, Elgin E, Donato A. Incidence, predictors, and outcomes of permanent pacemaker implantation following transcatheter aortic valve replacement: analysis from the U.S. Society of Thoracic Surgeons/American College of Cardiology TVT Registry. JACC Cardiovasc Interv 2016; 9: 2189_2199.
639. Chamandi C, Barbanti M, Munoz-Garcia A, Latib A, Nombela-Franco L, Gutierrez-Ibanez E, Veiga-Fernandez G, Cheema AN, Cruz-Gonzalez I, Serra V, Tamburino C, Mangieri A, Colombo A, Jimenez-Quevedo P, Elizaga J, Laughlin G, Lee DH, Garcia Del Blanco B, Rodriguez-Gabella T, Marsal JR, Cote M, Philippon F, Rodes-Cabau J. Long-term outcomes in patients with new permanent pacemaker implantation following transcatheter aortic valve replacement. JACC Cardiovasc Interv 2018; 11: 301_310.
640. Mohananey D, Jobanputra Y, Kumar A, Krishnaswamy A, Mick S, White JM, Kapadia SR. Clinical and echocardiographic outcomes following permanent pacemaker implantation after transcatheter aortic valve replacement: metaanalysis and meta-regression. Circ Cardiovasc Interv 2017; 10: e005_046.
641. Ueshima D, Nai Fovino L, Mojoli M, Napodano M, Fraccaro C, Tarantini G. The interplay between permanent pacemaker implantation and mortality in patients treated by transcatheter aortic valve implantation: a systematic review and meta-analysis. Catheter Cardiovasc Interv 2018; 92: E159_E167.
642. Urena M, Webb JG, Tamburino C, Munoz-Garcia AJ, Cheema A, Dager AE, Serra V, Amat-Santos IJ, Barbanti M, Imme S, Briales JH, Benitez LM, Al Lawati H, Cucalon AM, Garcia Del Blanco B, Lopez J, Dumont E, Delarochelliere R, Ribeiro HB, Nombela-Franco L, Philippon F, Rodes-Cabau J. Permanent pacemaker implantation after transcatheter aortic valve implantation: impact on late clinical outcomes and left ventricular function. Circulation 2014; 129: 1233_1243
643. Fujita B, Schmidt T, Bleiziffer S, Bauer T, Beckmann A, Bekeredjian R, Mollmann H, Walther T, Landwehr S, Hamm C, Beyersdorf F, Katus HA, Harringer W, Ensminger S, Frerker C, GARY Executive Board. Impact of new pacemaker implantation following surgical and transcatheter aortic valve replacement on 1-year outcome. Eur J Cardiothorac Surg 2020; 57: 151_159.
644. Zhang XH, Chen H, Siu CW, Yiu KH, Chan WS, Lee KL, Chan HW, Lee SW, Fu GS, Lau CP, Tse HF. New-onset heart failure after permanent right ventricular apical pacing in patients with acquired high-grade atrioventricular block and normal left ventricular function. J Cardiovasc Electrophysiol 2008; 19: 136_141.
645. Dizon JM, Nazif TM, Hess PL, Biviano A, Garan H, Douglas PS, Kapadia S, Babaliaros V, Herrmann HC, Szeto WY, Jilaihawi H, Fearon WF, Tuzcu EM, Pichard AD, Makkar R, Williams M, Hahn RT, Xu K, Smith CR, Leon MB, Kodali SK. Chronic pacing and adverse outcomes after transcatheter aortic valve implantation. Heart 2015; 101: 1665_1671.
646. Auffret V, Webb JG, Eltchaninoff H, Munoz-Garcia AJ, Himbert D, Tamburino C, Nombela-Franco L, Nietlispach F, Moris C, Ruel M, Dager AE, Serra V, Cheema AN, Amat-Santos IJ, de Brito FS Jr, Lemos PA, Abizaid A, Sarmento-Leite R, Dumont E, Barbanti M, Durand E, Alonso Briales JH, Vahanian A, Bouleti C, Imme S, Maisano F, Del Valle R, Benitez LM, Garcia Del Blanco B, Puri R, Philippon F, Urena M, Rodes-Cabau J. Clinical impact of baseline right bundle branch block in patients undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv 2017; 10: 1564_1574.
647. Junquera L, Freitas-Ferraz AB, Padron R, Silva I, Nunes Ferreira-Neto A, Guimaraes L, Mohammadi S, Moris C, Philippon F, Rodes-Cabau J. Intraprocedural high-degree atrioventricular block or complete heart block in transcatheter aortic valve replacement recipients with no prior intraventricular conduction disturbances. Catheter Cardiovasc Interv 2019; 95: 982_990.
648. Jorgensen TH, De Backer O, Gerds TA, Bieliauskas G, Svendsen JH, Sondergaard L. Immediate post-procedural 12-lead electrocardiography as predictor of late conduction defects after transcatheter aortic valve replacement. JACC Cardiovasc Interv 2018; 11: 1509_1518.
649. Rodes-Cabau J, Urena M, Nombela-Franco L, Amat-Santos I, Kleiman N, Munoz-Garcia A, Atienza F, Serra V, Deyell MW, Veiga-Fernandez G, Masson JB, Canadas-Godoy V, Himbert D, Castrodeza J, Elizaga J, Francisco Pascual J, Webb JG, de la Torre JM, Asmarats L, Pelletier-Beaumont E, Philippon F. Arrhythmic burden as determined by ambulatory continuous cardiac monitoring in patients with new-onset persistent left bundle branch block following transcatheter aortic valve replacement: the MARE study. JACC Cardiovasc Interv 2018; 11: 1495_1505.
650. Urena M, Webb JG, Eltchaninoff H, Munoz-Garcia AJ, Bouleti C, Tamburino C, Nombela-Franco L, Nietlispach F, Moris C, Ruel M, Dager AE, Serra V, Cheema AN, Amat-Santos IJ, de Brito FS, Lemos PA, Abizaid A, Sarmento-Leite R, Ribeiro HB, Dumont E, Barbanti M, Durand E, Alonso Briales JH, Himbert D, Vahanian A, Imme S, Garcia E, Maisano F, del Valle R, Benitez LM, Garcia del Blanco B, Gutierrez H, Perin MA, Siqueira D, Bernardi G, Philippon F, Rodes Cabau J. Late cardiac death in patients undergoing transcatheter aortic valve replacement: incidence and predictors of advanced heart failure and sudden cardiac death. J Am Coll Cardiol 2015; 65: 437_448.
651. Chung MK. Cardiac surgery: postoperative arrhythmias. Crit Care Med 2000; 28: N 136_N14
652. Holt ND, McComb JM. Cardiac transplantation and pacemakers: when and what to implant. Card Electrophysiol Rev 2002; 6: 140_151.
653. Krongrad E. Prognosis for patients with congenital heart disease and postoperative intraventricular conduction defects. Circulation 1978; 57: 867_870.
654. Kusumoto FM, Calkins H, Boehmer J, Buxton AE, Chung MK, Gold MR, Hohnloser SH, Indik J, Lee R, Mehra MR, Menon V, Page RL, Shen WK, Slotwiner DJ, Stevenson LW, Varosy PD, Welikovitch L. HRS/ACC/AHA expert consensus statement on the use of implantable cardioverter-defibrillator therapy in patients who are not included or not well represented in clinical trials. Circulation 2014; 130: 94_125.
655. Jim MH, Chan AO, Tse HF, Barold SS, Lau CP. Clinical and angiographic findings of complete atrioventricular block in acute inferior myocardial infarction. Ann Acad Med Singapore 2010; 39: 185_190.
656. Proclemer A, Facchin D, Feruglio GA. [Syncope of unknown origin after electrophysiologic study: is the treatment with pacemaker useful?]. G Ital Cardiol 1990; 20: 195_201.
657. Raviele A, Proclemer A, Gasparini G, Di Pede F, Delise P, Piccolo E, Feruglio GA. Long-term follow-up of patients with unexplained syncope and negative electrophysiologic study. Eur Heart J 1989; 10: 127_132.
658. Nishimura RA, Trusty JM, Hayes DL, Ilstrup DM, Larson DR, Hayes SN, Allison TG, Tajik AJ. Dual-chamber pacing for hypertrophic cardiomyopathy: a randomized, double-blind, crossover trial. J Am Coll Cardiol 1997; 29: 435_441.
659. Kappenberger L, Linde C, Daubert C, McKenna W, Meisel E, Sadoul N, Chojnowska L, Guize L, Gras D, Jeanrenaud X, Ryden L. Pacing in hypertrophic obstructive cardiomyopathy: a randomized crossover study. Eur Heart J 1997; 18: 1249_1256.
660. Maron BJ, Nishimura RA, McKenna WJ, Rakowski H, Josephson ME, Kieval RS. Assessment of permanent dual-chamber pacing as a treatment for drug-refractory symptomatic patients with obstructive hypertrophic cardiomyopathy. A randomized, double-blind, crossover study (M-PATHY). Circulation 1999; 99: 2927_2933.
661. Slade AK, Sadoul N, Shapiro L, Chojnowska L, Simon JP, Saumarez RC, Dodinot B, Camm AJ, McKenna WJ, Aliot E. DDD pacing in hypertrophic cardiomyopathy: a multicentre clinical experience. Heart 1996; 75: 44_49.
662. Megevand A, Ingles J, Richmond DR, Semsarian C. Long-term follow-up of patients with obstructive hypertrophic cardiomyopathy treated with dual-chamber pacing. Am J Cardiol 2005; 95: 991_993.
663. Linde C, Gadler F, Kappenberger L, Ryden L. Placebo effect of pacemaker implantation in obstructive hypertrophic cardiomyopathy. PIC Study Group. Pacing In Cardiomyopathy. Am J Cardiol 1999; 83: 903_907.
664. Ommen SR, Nishimura RA, Squires RW, Schaff HV, Danielson GK, Tajik AJ. Comparison of dual-chamber pacing versus septal myectomy for the treatment of patients with hypertrophic obstructive cardiomyopathy: a comparison of objective hemodynamic and exercise end points. J Am Coll Cardiol 1999; 34: 191_196.
665. Arnold AD, Howard JP, Chiew K, Kerrigan WJ, de Vere F, Johns HT, Churlilov L, Ahmad Y, Keene D, Shun-Shin MJ, Cole GD, Kanagaratnam P, Sohaib SMA, Varnava A, Francis DP, Whinnett ZI. Right ventricular pacing for hypertrophic obstructive cardiomyopathy: meta-analysis and meta-regression of clinical trials. Eur Heart J Qual Care Clin Outcomes 2019; 5: 321_333.
666. Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, Hagege AA, Lafont A, Limongelli G, Mahrholdt H, McKenna WJ, Mogensen J, Nihoyannopoulos P, Nistri S, Pieper PG, Pieske B, Rapezzi C, Rutten FH, Tillmanns C, Watkins H. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2733_2779.
667. Chang SM, Nagueh SF, Spencer WH 3rd, Lakkis NM. Complete heart block: determinants and clinical impact in patients with hypertrophic obstructive cardiomyopathy undergoing nonsurgical septal reduction therapy. J Am Coll Cardiol 2003; 42: 296_300.
668. Lawrenz T, Lieder F, Bartelsmeier M, Leuner C, Borchert B, Meyer zu Vilsendorf D, Strunk-Mueller C, Reinhardt J, Feuchtl A, Stellbrink C, Kuhn H. Predictors of complete heart block after transcoronary ablation of septal hypertrophy: results of a prospective electrophysiological investigation in 172 patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol 2007; 49: 2356_2363.
669. Laurenzi F, Achilli A, Avella A, Peraldo C, Orazi S, Perego GB, Cesario A, Laurent V, Pellieux S, Corcia P, Magro P, Pierre B, Fauchier L, Raynaud M, Babuty D. Mortality in myotonic dystrophy patients in the area of prophylactic pacing devices. Int J Cardiol 2011; 150: 54_58.
670. Mankad P, Mitchell B, Birnie D, Kron J. Cardiac sarcoidosis. Curr Cardiol Rep 2019; 21: 152.
671. Birnie DH, Sauer WH, Bogun F, Cooper JM, Culver DA, Duvernoy CS, Judson MA, Kron J, Mehta D, Cosedis Nielsen J, Patel AR, Ohe T, Raatikainen P, Soejima K. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm 2014; 11: 1305_1323.
672. Birnie DH, Sauer WH, Judson MA. Consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart 2016; 102: 411_414
673. Bradshaw PJ, Stobie P, Knuiman MW, Briffa TG, Hobbs MS. Trends in the incdence and prevalence of cardiac pacemaker insertions in an ageing population. Open Heart 2014; 1: e000177.
674. Mimoz O, Lucet J-C, Kerforne T, Pascal J, Souweine B, Goudet V, Mercat A, Bouadma L, Lasocki S, Alfandari S, Friggeri A, Wallet F, Allou N, Ruckly S, Balayn D, Lepape A, Timsit J-F. Skin antisepsis with chlorhexidinealcohol versus povidone iodinealcohol, with and without skin scrubbing, for prevention of intravascular-catheter-related infection (CLEAN): an open-label, multicentre, randomised, controlled, two-by-two factorial trial. Lancet 2015; 386: 2069_2077.
675. Darouiche RO, Wall MJ Jr, Itani KM, Otterson MF, Webb AL, Carrick MM, Miller HJ, Awad SS, Crosby CT, Mosier MC, Alsharif A, Berger DH. Chlorhexidinealcohol versus povidone-iodine for surgical-site antisepsis. N Engl J Med 2010; 362: 18_26.
676. Kirkfeldt RE, Johansen JB, Nohr EA, Moller M, Arnsbo P, Nielsen JC. Pneumothorax in cardiac pacing: a population-based cohort study of 28 860 Danish patients. Europace 2012; 14: 1132_1138.
677. Liu P, Zhou Y-F, Yang P, Gao Y-S, Zhao G-R, Ren S-Y, Li X-L. Optimized axillary vein technique versus subclavian vein technique in cardiovascular implantable electronic device implantation. Chin Med J 2016; 129: 2647_2651
678. Behar JM, Bostock J, Zhu Li AP, Chin HMS, Jubb S, Lent E, Gamble J, Foley PWX, Betts TR, Rinaldi CA, Herring N. Cardiac resynchronization therapy delivered via a multipolar left ventricular lead is associated with reduced mortality and elimination of phrenic nerve stimulation: long-term follow-up from a multicenter registry. J Cardiovasc Electrophysiol 2015; 26: 540_546.
679. Forleo GB, Di Biase L, Panattoni G, Mantica M, Parisi Q, Martino A, Pappalardo A, Sergi D, Tesauro M, Papavasileiou LP, Santini L, Calo L, Tondo C, Natale A, Romeo F. Improved implant and postoperative lead performance in CRT-D patients implanted with a quadripolar left ventricular lead. A 6-month follow-up analysis from a multicenter rospective comparative study. J Interv Card Electrophysiol 2015; 42: 59_66.
680. Leyva F, Zegard A, Qiu T, Acquaye E, Ferrante G, Walton J, Marshall H. Cardiac resynchronization therapy using quadripolar versus non-quadripolar left ventricular leads programmed to biventricular pacing with single-site left ventricular pacing: impact on survival and heart failure hospitalization. J Am Heart Assoc 2017; 6: e007_026.
681. Lakshmanadoss U, Nuanez B, Kutinsky I, Khalid R, Haines DE, Wong WS. Incidence of pocket infection postcardiac device implantation using antibiotic versus saline solution for pocket irrigation. Pacing Clin Electrophysiol 2016; 39: 978_984.
682. Mueller TC, Loos M, Haller B, Mihaljevic AL, Nitsche U, Wilhelm D, Friess H, Kleeff J, Bader FG. Intra-operative wound irrigation to reduce surgical site infections after abdominal surgery: a systematic review and meta-analysis. Langenbeck's Arch Surg 2015; 400: 167_181.
683. Tarakji KG, Mittal S, Kennergren C, Corey R, Poole JE, Schloss E, Gallastegui J, Pickett RA, Evonich R, Philippon F, McComb JM, Roark SF, Sorrentino D, Sholevar D, Cronin E, Berman B, Riggio D, Biffi M, Khan H, Silver MT, Collier J, Eldadah Z, Wright DJ, Lande JD, Lexcen DR, Cheng A, Wilkoff BL, WRAP-IT Investigators. Antibacterial envelope to prevent cardiac implantable device infection. N Engl J Med 2019; 380: 1895_1905.
684. Henrikson CA, Sohail MR, Acosta H, Johnson EE, Rosenthal L, Pachulski R, Dan D, Paladino W, Khairallah FS, Gleed K, Hanna I, Cheng A, Lexcen DR, Simons GR. Antibacterial envelope is associated with low infection rates after implantable cardioverter-defibrillator and cardiac resynchronization therapy device replacement: results of the Citadel and Centurion studies. JACC Clin Electrophysiol 2017; 3: 1158_1167.
685. Cano O, Andres A, Alonso P, Osca J, Sancho-Tello MJ, Olague J, Martinez-Dolz L. Incidence and predictors of clinically relevant cardiac perforation associated with systematic implantation of active-fixation pacing and defibrillation leads: a single-centre experience with over 3800 implanted leads. Europace 2017; 19: 96_102.
686. Mahapatra S, Bybee KA, Bunch TJ, Espinosa RE, Sinak LJ, McGoon MD, Hayes DL. Incidence and predictors of cardiac perforation after permanent pacemaker placement. Heart Rhythm 2005; 2: 907_911.
687. Birnie DH, Healey JS, Wells GA, Verma A, Tang AS, Krahn AD, Simpson CS, Ayala-Paredes F, Coutu B, Leiria TLL, Essebag V, BRUISE CONTROL Investigators. Pacemaker or defibrillator surgery without interruption of anticoagulation. N Engl J Med 2013; 368: 2084_2093.
688. Ghanbari H, Phard WS, Al-Ameri H, Latchamsetty R, Jongnarngsin K, Crawford T, Good E, Chugh A, Oral H, Bogun F, Morady F, Pelosi F Jr. Meta-analysis of safety and efficacy of uninterrupted warfarin compared to heparin-based bridging therapy during implantation of cardiac rhythm devices. Am J Cardiol 2012; 110: 1482_1488
689. Garcia-Fernandez FJ, Osca Asensi J, Romero R, Fernandez Lozano I, Larrazabal JM, Martinez Ferrer J, Ortiz R, Pombo M, Tornes FJ, Moradi Kolbolandi M. Safety and efficiency of a common and simplified protocol for pacemaker and defibrillator surveillance based on remote monitoring only: a long-term randomized trial (RM-ALONE). Eur Heart J 2019; 40: 1837_1846.
690. Mabo P, Victor F, Bazin P, Ahres S, Babuty D, Da Costa A, Binet D, Daubert JC, COMPAS Trial Investigators. A randomized trial of long-term remote monitoring of pacemaker recipients (the COMPAS trial). Eur Heart J 2012; 33: 1105_1111
691. Ricci RP, Morichelli L, Santini M. Remote control of implanted devices through Home Monitoring technology improves detection and clinical management of atrial fibrillation. Europace 2009; 11: 54_61
692. Russo RJ, Costa HS, Silva PD, Anderson JL, Arshad A, Biederman RW, Boyle NG, Frabizzio JV, Birgersdotter-Green U, Higgins SL, Lampert R, Machado CE, Martin ET, Rivard AL, Rubenstein JC, Schaerf RH, Schwartz JD, Shah DJ, Tomassoni GF, Tominaga GT, Tonkin AE, Uretsky S, Wolff SD. Assessing the risks associated with MRI in patients with a pacemaker or defibrillator. N Engl J Med 2017; 376: 755_764.
693. Indik JH, Gimbel JR, Abe H, Alkmim-Teixeira R, Birgersdotter-Green U, Clarke GD, Dickfeld TL, Froelich JW, Grant J, Hayes DL, Heidbuchel H, Idriss SF, Kanal E, Lampert R, Machado CE, Mandrola JM, Nazarian S, Patton KK, Rozner MA, Russo RJ, Shen WK, Shinbane JS, Teo WS, Uribe W, Verma A, Wilkoff BL, Woodard PK. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm 2017; 14: e97_e153.
694. Nazarian S, Hansford R, Rahsepar AA, Weltin V, McVeigh D, Gucuk Ipek E, Kwan A, Berger RD, Calkins H, Lardo AC, Kraut MA, Kamel IR, Zimmerman SL, Halperin HR. Safety of magnetic resonance imaging in patients with cardiac devices. N Engl J Med 2017; 377: 2555_2564.
695. Shenthar J, Milasinovic G, Al Fagih A, Gotte M, Engel G, Wolff S, Tse HF, Herr J, Carrithers J, Cerkvenik J, Nahle CP. MRI scanning in patients with new and existing CapSureFix Novus 5076 pacemaker leads: randomized trial results. Heart Rhythm 2015; 12: 759_765.
696. Gimbel JR, Bello D, Schmitt M, Merkely B, Schwitter J, Hayes DL, Sommer T, Schloss EJ, Chang Y, Willey S, Kanal E. Randomized trial of pacemaker and lead system for safe scanning at 1.5 Tesla. Heart Rhythm 2013; 10: 685_691
697. Higgins JV, Gard JJ, Sheldon SH, Espinosa RE, Wood CP, Felmlee JP, Cha YM, Asirvatham SJ, Dalzell C, Acker N, Watson RE Jr, Friedman PA. Safety and outcomes of magnetic resonance imaging in patients with abandoned pacemaker and defibrillator leads. Pacing Clin Electrophysiol 2014; 37: 1284_1290.
698. Padmanabhan D, Kella DK, Mehta R, Kapa S, Deshmukh A, Mulpuru S, Jaffe AS, Felmlee JP, Jondal ML, Dalzell CM, Asirvatham SJ, Cha YM, Watson RE Jr, Friedman PA. Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned leads. Heart Rhythm 2018; 15: 228_233.
699. Horwood L, Attili A, Luba F, Ibrahim EH, Parmar H, Stojanovska J, Gadoth-Goodman S, Fette C, Oral H, Bogun F. Magnetic resonance imaging in patients with cardiac implanted electronic devices: focus on contraindications to magnetic resonance imaging protocols. Europace 2017; 19: 812_817.
700. Vuorinen AM, Pakarinen S, Jaakkola I, Holmstrom M, Kivisto S, Kaasalainen T. Clinical experience of magnetic resonance imaging in patients with cardiac pacing devices: unrestricted patient population. Acta Radiol 2019; 60: 1414_1421.
701. Hauser RG, Hayes DL, Kallinen LM, Cannom DS, Epstein AE, Almquist AK, Song SL, Tyers GF, Vlay SC, Irwin M. Clinical experience with pacemaker pulse generators and transvenous leads: an 8-year prospective multicenter study. Heart Rhythm 2007; 4: 154_160.
702. Merchant FM, Tejada T, Patel A, El-Khalil J, Desai Y, Keeling B, Lattouf OM, Leon AR, El-Chami MF. Procedural outcomes and long-term survival associated with lead extraction in patients with abandoned leads. Heart Rhythm 2018; 15: 855_859.
703. Diemberger I, Mazzotti A, Giulia MB, Biffi M, Cristian M, Massaro G, Matteo M, Martignani C, Letizia ZM, Ziacchi M, Reggiani B, Reggiani ML, Battistini P, Boriani G. From lead management to implanted patient management: systematic review and meta-analysis of the last 15 years of experience in lead extraction. Expert Rev Med Devices 2013; 10: 551_573.
704. Bongiorni MG, Kennergren C, Butter C, Deharo JC, Kutarski A, Rinaldi CA, Romano SL, Maggioni AP, Andarala M, Auricchio A, Kuck KH, Blomstro" m-Lundqvist C, ELECTRa Investigators. The European Lead Extraction ConTRolled (ELECTRa) study: a European Heart Rhythm Association (EHRA) registry of transvenous lead extraction outcomes. Eur Heart J 2017; 38: 2995_3005.
705. Segreti L, Rinaldi CA, Claridge S, Svendsen JH, Blomstrom-Lundqvist C, Auricchio A, Butter C, Dagres N, Deharo JC, Maggioni AP, Kutarski A, Kennergren C, Laroche C, Kempa M, Magnani A, Casteigt B, Bongiorni MG, ELECTRa Investigators. Procedural outcomes associated with transvenous lead extraction in patients with abandoned leads: an ESC-EHRA ELECTRa (European Lead Extraction ConTRolled) registry sub-analysis. Europace 2019; 21: 645_654.
706. El Iskandarani M., Golamari R., Shatla I., et al. Left bundle branch area pacing in heart failure: a systematic review and meta-analysis with meta-regression. J. Cardiovasc. Electrophysiol. - 2024. - V. 35 (8). - P. 1536 - 1547
707. Piotrowski R., Baran J., Sikorska A., et al. Cardioneuroablation for reflex syncope: efficacy and effects on autonomic cardiac regulation-a prospective randomized trial / // JACC Clin. Electrophysiol. - 2023. - V. 9 (1). - P. 85 - 95.
708. Pachon-M EI, Pachon-Mateos JC, Higuti C, et al. Relation of Fractionated Atrial Potentials With the Vagal Innervation Evaluated by Extracardiac Vagal Stimulation During Cardioneuroablation / // Circ. Arrhythm. Electrophysiol. - 2020. - V. 13 (4). - e007_900.
709. Hu F, Zheng L, Liang E, et al. Right anterior ganglionated plexus: the primary target of cardioneuroablation? / // Heart Rhythm. - 2019. - V. 16 (10). - P. 1545 - 1551.
710. Rishniw M, Kittleson MD, Jaffe RS, Kass PH. Characterization of parasympatholytic chronotropic responses following intravenous administration of atropine to clinically normal dogs. Am J Vet Res. August 1999; 60: 1000 - 1003.
711. Rishniw M; Tobias, AH; Slinker BK. Characterization of chronotropic and dysrhythmogenic effects of atropine in dogs with bradycardia. Am J Vet Res. March 1996; 57 (3): 337 - 34
712. Atropine Response Test Protocol URL: https://www.idexx.com/files/the-atropine-response-test-en.pdf
713. Д.И. Дорошенко, О.В. Илюхин, А.К. Пром, В.В. Иваненко. Основы электрокардиографической диагностики нарушений ритма сердца: учебное пособие/ - Волгоград: Изд-во ВолгГМУ, 2022. - 68 с.
714. Kusumoto FM, Schoenfeld MH, Barrett C, Edgerton JR, Ellenbogen KA, Gold MR, Goldschlager NF, Hamilton RM, Joglar JA, Kim RJ, Lee R, Marine JE, McLeod CJ, Oken KR, Patton KK, Pellegrini CN, Selzman KA, Thompson A, Varosy PD. 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients with Bradycardia and Cardiac Conduction Delay. JACC. 2019. Vol. 74. Issue 7.
715. Дроздов Д.В., Макаров Л.М., Баркан В.С., Газашвили Т.М., Ефимова В.П., Жук М.Ю., Иртюга О.Б., Калинин Л.А., Ковалев И.А., Комолятова В.Н., Пармон Е.В., Рогоза А.Н., Стручков П.В., Татаринова А.А., Терегулов Ю.Э., Трешкур Т.В., Шутов Д.В. Регистрация электрокардиограммы покоя в 12 общепринятых отведениях взрослым и детям 2023. Методические рекомендации. Российский кардиологический журнал. 2023; 28 (10): 5631. doi: 10.15829/1560-4071-2023-5631
716. С.Ю. Сергуладзе, Е.А. Артюхина, Б.И. Кваша, И.В. Ежова, Р.Г. Такаландзе. Отдаленные результаты имплантации эпикардиальных стероидных электродов после хирургического удаления эндокардиальных электродов у пациента с септическим электродным эндокардитом. Вестник аритмологии. 2016. N 83. Стр 81 - 63.
717. Руководство по экстракции электродов имплантируемых электронных устройств - показания, методики, оснащение, ведение пациентов. Под редакцией Ревишвили А.Ш. Айвазьян С.А., Артюхина Е.А., Гарькина С.В., Гуреев С.В., Косоногов А.Я., Криволапов С.Н., Лебедев Д.С., Нечепуренко А.А., Подоляк Д.Г., Ревишвили А.Ш., Сапельников О.В., Хомутинин Д.Н., Видар. 2021 г.
718. Burri H, Starck C, Auricchio A, Biffi M, Burri M, D'Avila ALR, Deharo JC, Glikson M, Israel C, Lau CAR, Leclercq C, Love C, Nielsen JC, Vernooy K, Reviewers, Dagres NRC, Boveda SRC, Butter C, Marijon E, Braunschweig F, Mairesse GH, Gleva M, Defaye P, Zanon F, Lopez-Cabanillas N, Guerra JM, Vassilikos VP, Martins Oliveira M. EHRA expert consensus statement and practical guide on optimal implantation technique for conventional pacemakers and implantable cardioverter-defibrillators: endorsed by the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), and the Latin-American Heart Rhythm Society (LAHRS). Europace 2021; doi: 10.1093/europace/euaa367
719. Sommer A, Kronborg MB, Norgaard BL, Gerdes C, Mortensen PT, Nielsen JC. Left and right ventricular lead positions are imprecisely determined by fluoroscopy in cardiac resynchronization therapy: a comparison with cardiac computed tomography. Europace 2014; 16: 1334_1341.
720. Мацкеплишвили С.Т., Саидова М.А., Мироненко М.Ю., Сафарова А.Ф., Павлюкова Е.Н., Бощенко А.А., Ярославская Е.И., Ахунова С.Ю., Скидан В.И., Иртюга О.Б., Козленок А.В., Федорова Д.Н. Выполнение стандартной трансторакальной эхокардиографии. Методические рекомендации 2024. Российский кардиологический журнал. 2025; 30(2): 6271. https://doi.org/10.15829/1560-4071-2025-6271. EDN: TNLDFN.
721. Sidhu, Sunjeet, and Joseph E Marine. "Evaluating and managing bradycardia." Trends in cardiovascular medicine vol. 30,5 (2020): 265 - 272. doi: 10.1016/j.tcm.2019.07.001
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Президиум рабочей группы:
1. Ревишвили А.Ш., академик РАН, д.м.н., профессор (Москва), ВНОА
2. Глезер М.Г., д.м.н., профессор (Москва), РКО
3. Артюхина Е.А., д.м.н. (Москва)
Рабочая группа:
4. Базаев В.А., д.м.н. (Москва)
5. Баталов Р.Е., д.м.н. (Томск), АССХ
6. Бокерия Л.А., академик РАН (Москва), АССХ
7. Давтян К.В., д.м.н., профессор (Москва)
8. Лебедев Д.С., д.м.н., профессор (Санкт-Петербург), РКО, ВНОА
9. Лебедева В.К., д.м.н. (Санкт-Петербург), РКО
10. Любимцева Т.А., к.м.н. (Санкт-Петербург), РКО, ВНОА
11. Михайлов Е.Н., д.м.н. (Санкт-Петербург), РКО
12. Попов С.В., академик РАН, д.м.н., профессор (Томск), ВНОА, РКО
13. Романов А.Б., д.м.н. (Новосибирск)
14. Сергуладзе С.Ю, д.м.н. (Москва)
15. Сопов О.В., к.м.н. (Москва)
16. Филатов А.Г, д.м.н. (Москва)
Члены рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Представленные рекомендации разработаны на основе:
- Клинических рекомендаций по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств" Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и электрокардиостимуляции (ВНОА) (2017 г.);
- Клинических рекомендаций "Брадиаритмии" Минздрава РФ (2017 г.);
- Руководства по оценке и ведению пациентов с брадикардией и нарушениями сердечной проводимости ACC/AHA/HRS (2018 г.);
- Рекомендации ЕОК по диагностике и лечению синкопальных состояний (2018 г.);
- Консенсусного заключения экспертов HRS 2017 года по управлению сердечно-сосудистыми имплантируемыми электронными устройствами и экстракции электродов;
- Консенсусного заключения EHRA 2018 года по экстракции электродов;
- Рекомендации ЕОК по электрокардиостимуляции и сердечной ресинхронизирующей терапии (2013 г.);
- Рекомендации ЕОК по ведению инфекционного эндокардита (2015 г.).
В рекомендациях представлены основные принципы диагностики и современные подходы к лечению брадиаритмий и нарушений проводимости на основе обобщенного и систематизированного анализа имеющихся клинических исследований по профилактике, диагностике и лечению пациентов с БА.
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог.
2. Врач-терапевт.
3. Врач общей практики (семейный врач).
4. Врач-сердечно-сосудистый хирург.
5. Врач по по рентгенэндоваскулярным диагностике и лечению.
Вследствие того, что Российское кардиологическое общество (РКО) входит в состав Европейского общества кардиологов (ЕОК), и члены РКО также являются членами ЕОК, все европейские рекомендации формируются с участием российских экспертов, которые являются соавторами рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов.
В связи с этим, формирование национальных рекомендаций проводилось на основе рекомендаций ЕОК с учетом национальной специфики, особенностей обследования, лечения, доступности той или иной медицинской помощи. По этой причине в ходе разработки российских клинических рекомендаций РКО использованы международные классы показаний рекомендаций, позволяющие оценить необходимость выполнения тезиса рекомендаций и уровни достоверности доказательств данных классов (Таблицы А2/1 и А2/2).
В тех случаях, когда в европейских рекомендациях отсутствовали классы и уровни доказательности, но по мнению экспертов РКО данные тезисы являлись крайне необходимыми для выполнения или, наоборот, абсолютно не рекомендованы к применению, эксперты РКО, основываясь на правилах формирования классов показаний согласно рекомендациям Европейского общества кардиологов, сами проставляли классы и уровни. В данной ситуации обозначение ЕОК заменено на РКО-классы и уровни, проставленные экспертами РКО.
Кроме того, добавлена новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы А2/3, А2/4 и А2/5), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Таким образом, в тексте клинических рекомендаций, разрабатываемых экспертами РКО, одновременно использованы две шкалы (Таблицы А2/1, А2/2, А2/3, А2/4, А2/5).
Таблица А2/1. Классы показаний согласно рекомендациям Европейского общества кардиологов (ЕОК)
Класс рекомендаций ЕОК
Определение
Предлагаемая формулировка
I
Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными
Рекомендовано/показано
II
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения
Целесообразно применять
IIa
IIb
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
Можно применять
III
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/не эффективны, а в ряде случаев могут приносить вред
Не рекомендуется применять
Таблица А2/2. Уровни достоверности доказательств согласно рекомендациям Европейского общества кардиологов (ЕОК)
Уровни достоверности доказательств ЕОК
A
Данные многочисленных рандомизированных клинических исследований или метаанализов
B
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
C
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Таблица А2/3. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2/4. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А2/5. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация/отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество, и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Медицинские препараты, зарегистрированные в России, для медикаментозного тестирования БА у пациентов с синкопальными состояниями.
Препарат (класс)
Дозы и схемы
Применение
Параметры ЭКГ, требующие внимания
Нежелательные побочные эффекты
Межлекарственные взаимодействия
Атропин**
1 - 2 мг (до 0,04 мг/кг),
Внутривенно
Медикаментозный тест при обследовании пациентов с синкопальными состояниями
Функциональная синусовая брадикардия и АВБ I степени.
Увеличение частоты синусового ритма более чем на 25% от исходной или более 90 имп/мин свидетельствует о вагусной природе дисфункции синусового узла. Исчезновение нарушений АВ проводимости указывает на их вагусную природу и локализацию нарушения на уровне АВУ
Сухость во рту, расширение зрачка, парез аккомодации, тахикардия, затруднение мочеиспускания, атония кишечника, головокружение, головная боль
Со средствами, обладающими антихолинергической активностью - усиление антихолинергического действия.
С фенилэфрином** - повышение АД.
С органическими нитратами - повышение внутриглазного давления.
С Прокаинамидом** - усиление антихолинергическое действия.
Не рекомендовано выполнение медикаментозного тестирования пациентам нарушение функции почек и печени, пожилых и беременных.
Медицинские препараты, зарегистрированные в России, для острого медикаментозного лечения БА
Препарат (класс)
Дозы и схемы
Применение
Параметры ЭКГ, требующие внимания
Нежелательные побочные эффекты
Межлекарственные взаимодействия
Атропин**
Начало - 0,5 - 1 мг,
Повторное введение - каждые 3 - 5 мин. до максимальной дозы 3 мг,
Внутривенно
Острое медикаментозное лечение ДСУ и АВБ
Увеличение частоты сердечных сокращений
Сухость во рту, расширение зрачка, парез аккомодации, тахикардия, затруднение мочеиспускания, атония кишечника, головокружение, головная боль
С антихолинергическими средствами и средствами, обладающими антихолинергической активностью - усиление антихолинергического действия.
С фенилэфрином** - повышение АД.
С органическими нитратами - повышение внутриглазного давления.
С прокаинамидом** - усиление антихолинергическое действия.
#Допамин** [11]
5 - 20 мкг/кг/мин
Начало с 5 мкг/кг/мин и увеличение на 5 мкг/кг/мин каждые 2 мин., внутривенно
Острое медикаментозное лечение ДСУ и АВБ
Увеличение частоты сердечных сокращений
Головная боль, тревожность, двигательное беспокойство, тремор пальцев рук, снижение АД, нарушение проводимости, расширение комплекса QRS, вазоспазм, тошнота, рвота
С диуретиками - усиливается мочегонное действие #допамина**.
С некоторыми препаратами - фуразолидоном, прокарбазином**, - усиление интенсивности и длительности кардиостимулирующего и прессорного эффектов #допамина**.
С бета-адреноблокаторами - уменьшение действия.
С окситоцином** - увеличение вазоконстрикторного эффекта, риск возникновения ишемии и гангрены, а также тяжелой артериальной гипертензии, вплоть до внутричерепного кровоизлияния.
С сердечными гликозидами возможно - повышение риска развития нарушений сердечного ритма, аддитивный положительный инотропный эффект.
Не рекомендовано введение препаратов пациентам нарушение функции почек и печени, пожилых и беременных.
Связанные документы
1. Приказ Министерства здравоохранения Российской Федерации от 15.11.2012 N 918н "Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями".
2. Стандарт медицинской помощи больным фибрилляций и трепетанием предсердий (при оказании специализированной помощи), утвержден приказом Министерства здравоохранения Российской Федерации от 28.12.2012 N 1622н.
3. Приказ Министерства здравоохранения Российской Федерации от 15.07.2016 N 520н "Об утверждении критериев оценки качества медицинской помощи".
4. Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации" (зарегистрирован 08.05.2019 N 54588).
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Таблица 1. Алгоритм оценки состояния пациента при подозрении на брадикардию и нарушения проводимости

- ЭКГ - регистрация электрокардиограммы
- Длительный мониторинг - холтеровское мониторирование сердечного ритма
- Имплантация кардиомонитора - имлантация петлевого регистратора для долговременной регистрации электрической активности проводящей системы сердца
Таблица 2. Острое медикаментозное лечение брадикардии при симптомной ДСУ и АВБ
Атропин**
Внутривенно
Начало 0,5 - 1 мг
Повторное введение каждые 3 - 5 мин до максимальной дозы 3 мг
#Допамин** [11]
Внутривенно
5 - 20 мкг/кг/мин
Начало с 5 мкг/кг/мин и увеличение на 5 мкг/кг/мин каждые 2 мин
Таблица 3. Алгоритм действий при острой брадикардии

Таблица 4. Алгоритм принятия решения при рефлекторном синкопе
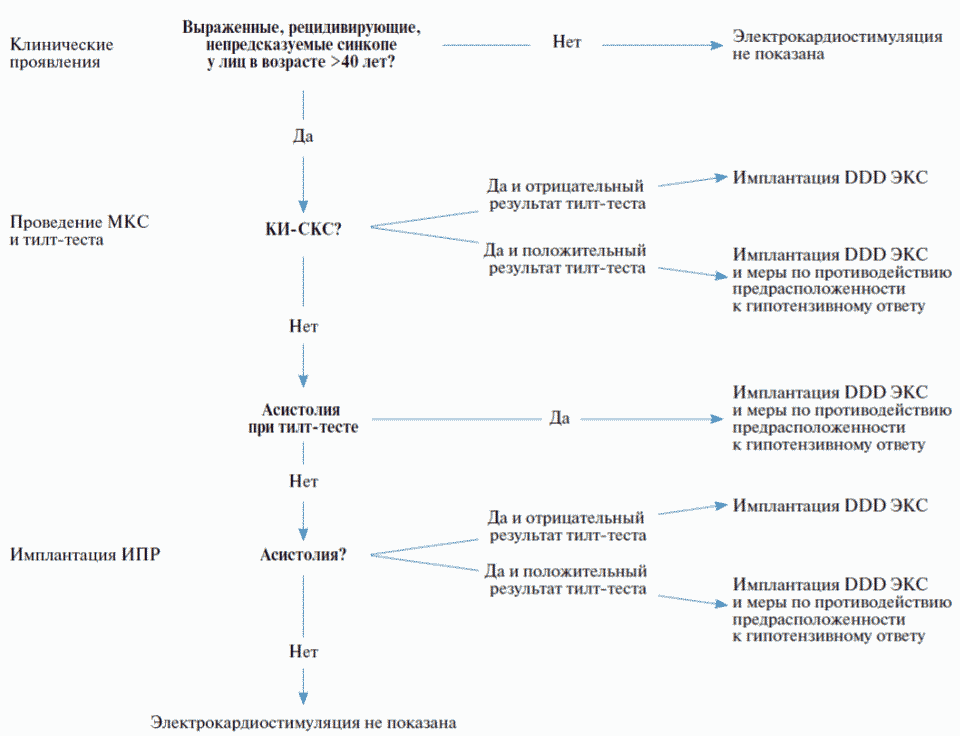
Таблица 5. Единый Код ЭКС*** - номенклатура NBG-NASPE/BPEG (2001 г.)
Позиция букв в номенклатуре кода
I
II
III
IV
V
функциональное значение букв в номенклатуре кода
камера(ы) стимулируемая(ые)
камера(ы) воспринимаемая(ые)
вид ответа
на собственную активность
наличие частотной адаптации
многокамерная стимуляция
0 - нет
A - предсердие
V - желудочек
D - обе камеры
(A + V)
0 - нет
A - предсердие
V - желудочек
D - обе камеры
(A + V)
0 - нет
T - триггер
1 - подавление
D - обе функции
(T + 1)
0 - нет
R - частотная адаптация
0 - нет
A - предсердная
V - желудочковая
D - двойная функция (A + V)
S - однокамерная (A или V)
S - однокамерная (A или V)
Таблица 6. Рекомендации по выбору модели ЭКС*** согласно определенным показаниям электрокардиостимуляции
Дисфункция СПУ
АВ-блокада
Рефлекторные синкопе
Однокамерная предсердная стимуляция (AAI)
Интактность AB-проведения и отсутствие риска развития AB-блокады в будущем.
Неприемлема
Неприемлема
Поддержание AB-синхронизации во время стимуляции.
Наличие частотной адаптации
(при необходимости).
Однокамерная желудочковая стимуляция (VVI)
Нет необходимости поддержания AB-синхронизацим во время стимуляции.
Хроническая фибрилляция предсердий или другие предсердные тахиаритмии или нет необходимости поддержания AB-синхронизации
Хроническая фибрилляция предсердий или другие предсердные тахиаритмии.
Наличие частотной адаптации (при необходимости).
Наличие частотной адаптации (при необходимости).
Наличие частотной адаптации (при необходимости).
Двухкамерная стимуляция (DDD)
Поддержание AB-синхронизации.
Наличие частотной адаптации (при желании).
Наличие синусового ритма.
Подозрение на нарушение AB-проведения или высокий риск развития AB-блокады в будущем.
Поддержание AB-синхронизации.
Наличие частотной адаптации (при необходимости).
Наличие частотной адаптации (при необходимости).
Стимуляция предсердий.
Моноэлектродные желудочковые ЭКС с детекцией предсердной активности (VDD)
Неприемлема
Нормальная функция СПУ и нет необходимости в стимуляции предсердий.
Неприемлема
Желание ограничить количество эндокардиальных электродов.
Алгоритм наблюдения за пациентами с имплантированными ЭКС***:
1. Первое программирование ЭКС*** - интраоперационно.
2. Повторное программирование ЭКС*** - перед выпиской пациента из стационара (при необходимости раньше).
3. Через 3 - 4 месяца после имплантации ЭКС*** пациент должен быть осмотрен в кабинете программирования.
4. Поддерживающий период наблюдения пациента при отсутствии нарушений работы ЭКС*** проводится через 3 - 4 месяца после имплантации с периодичностью последующих осмотров 1 раз в 6 - 12 месяцев.
5. Период интенсивного наблюдения пациента - по достижении времени рекомендуемой замены ЭКС***.
Алгоритмы программирования пациентов с имплантированными ЭКС***:
- Первое программирование ЭКС*** осуществляется специалистами, непосредственно принимающими участие в процедуре имплантации ЭКС***.
- Интраоперационно: внесение данных пациента, клинических показаний к имплантации, референтных и серийных номеров имплантируемых электродов, измерение порогов стимуляции предсердного и/или желудочкового электродов, амплитуды предсердной и/или желудочковой эндограммы, сопротивления (импеданса) и полярности электродов. Устанавливаются базовые параметры стимуляции: режимы (AAI(R), VVI(R), DDD(R) или другие применительно к конкретной клинической ситуации.
- Частота базового и максимального ритма электрокардиостимуляции, длительность детектируемой и стимулированной AB-задержки, чувствительность по предсердному и/или желудочковому электродам. Данные тестов и параметры первичного программирования заносятся в протокол операции. Повторное программирование ЭКС*** осуществляется перед выпиской пациента из стационара (при необходимости раньше) специалистами кабинета программирования ЭКС***.
- Проводится подробное информирование пациента об имплантированном ему устройстве, характере его работы, правилах безопасности.
- На руки необходимо выдать заполненный паспорт ЭКС***.
- Назначается срок повторного осмотра.
Через 3 - 4 месяца после имплантации ЭКС*** пациент должен быть осмотрен в кабинете программирования.
- Во время посещения проводится регистрация ЭКГ в 12 отведениях и контроль всех параметров кардиостимулятора по протоколу.
Период интенсивного наблюдения пациента:
- По достижении времени рекомендуемой замены ЭКС***.
- В течение 3-х месяцев данного периода должна быть выполнена реимплантация ЭКС***.
- При невозможности быстрой замены ЭКС*** осмотр осуществляется не реже чем 1 раз в месяц - проводится оценка эффективности стимуляции.
- При достижении периода экстренной замены батареи заменить ЭКС*** немедленно.
Протокол программирования ЭКС:
- Клиническая оценка состояния пациента (жалобы, субъективная оценка пациентом самочувствия, качества жизни, переносимости физических нагрузок; наличие таких симптомов, как обмороки, слабость, одышка, отеки, головокружения и т.д.). Сравнение клинической картины в динамике относительно предыдущего визита.
- Оценка данных диагностических исследований, проведенных в период после предыдущего визита
1. Электрокардиография (для оценки эффективности стимуляции/детекции и нарушения работы ЭКС***).
2. Оценка клинического состояния пациента на момент осмотра и сравнение со статусом до имплантации (уточнение субъективного состояния и предъявляемых жалоб, толерантность к физическим нагрузкам).
3. Внешний осмотр ложа ЭКС*** (состояние кожных покровов в области ЭКС***, исключение синдрома вертуна).
- Тестирование состояния постоянного имплантируемого антиаритмического устройства - регистрация эндограммы с имплантированных электродов, аннотированной эндограммы или ЭКГ (маркер-канала) при наличии подобных функций в ЭКС.
4. Оценка сопротивления электродов.
5. Оценка порогов стимуляции по активным электродам.
6. Оценка порога чувствительности по электродам.
7. Тестирование состояния постоянного имплантируемого антиаритмического устройства - выполнение пробы с отключением ЭКС или временным переводом на минимальную частоту электростимуляции 30 имп/мин для оценки времени восстановления спонтанного ритма, его вида, устойчивости и частоты, наличия желудочковых аритмий, симптоматики и степени зависимости пациента от ЭКС.
8. Тестирование состояния постоянного имплантируемого антиаритмического устройства - проведение магнитного теста, прогнозирование времени истощения батареи, определение сроков замены ЭКС***.
9. Программирование основных параметров кардиостимуляции:
- режим стимуляции (VVI(R), DDI(R), DDD(R) и др.
- базовая частота стимуляции;
- максимальная частота стимуляции;
- длительность детектируемой и стимулированной предсердно-желудочковых задержек;
- функция автозахвата (autocapture);
- полярность электродов;
- амплитуда импульса, длительность импульса и порог чувствительности для предсердного и/или желудочкового электрода.
10. Программирование расширенных параметров кардиостимуляции (для DDI(R), DDD(R)):
- активация алгоритма "поиск собственного проведения";
- активация алгоритма "поиск положительного/отрицательного гистерезиса";
- активация алгоритма автоматического переключения режима стимуляции;
- включение желудочкового периода безопасности;
- включение алгоритмов предупреждения и купирования пейсмейкерной тахикардии (PVC options, PMT options).
11. Программирование функции частотной адаптации (в зависимости от доступности в ЭКС; по показаниям):
- частотно-адаптивная предсердно-желудочковая задержка (rateresponsive AV/PV delay);
- активация сенсора.
12. Оценка стабильности контакта электродов с миокардом и корпусом ЭКС*** (респираторный тест, изменение положения тела, надавливание на область корпуса ЭКС*** и др.).
13. Диагностика и устранение нарушений работы ЭКС*** (низкая/высокая чувствительность, низкий/высокий порог стимуляции, миопотенциальное ингибирование, перекрестная детекция (crosstalk, far-field), ЭКС*** - опосредованные тахикардии, стимуляция скелетных мышц и диафрагмы и др.).
- Оценка эффективности проводимой медикаментозной терапии, при необходимости - ее коррекция.
- Оценка сопутствующих аритмий и при необходимости - определение показаний к возможному оперативному лечению.
- При необходимости - экстренная госпитализация в палату интенсивной терапии, рекомендации о плановой госпитализации в кардиологический стационар или консультациях соответствующих специалистов.
- Введение результатов обследования и программирования ЭКС в компьютерную базу данных.
- Подробное информирование пациента и родственников о медицинском состоянии его организма, работе имплантированной системы, произведенных изменениях программируемых параметров и терапии, правилах поведения.
14. Выдача справки о результатах визита, проведенных обследований и диагностических тестов, программированных параметрах работы.
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
ЧТО ТАКОЕ БРАДИКАРДИЯ?
Брадикардия - это состояние, при котором сердце бьется слишком медленно. Здоровое сердце бьется с частотой 60 - 100 ударов в минуту, перекачивая приблизительно 284 л крови каждый час. При брадикардии сердце бьется с частотой менее 60 ударов в минуту. При такой скорости сердце не может перекачивать достаточное количество обогащенной кислородом крови в организме при обычной деятельности или физических нагрузках. В результате вы можете испытывать головокружение, усталость, одышку или приступы потери сознания.
ЧТО ВЫЗЫВАЕТ БРАДИКАРДИЮ?
Брадикардия может развиться по целому ряду причин. К наиболее частым относятся:
- наследственная болезнь сердца (состояние, с которым вы родились);
- определенные заболевания или прием некоторых лекарственных препаратов;
- естественный процесс старения;
- рубцы на сердце после сердечного приступа;
- синдром слабости синусового узла также называемый дисфункцией синусового узла (нарушение работы естественного кардиостимулятора);
- блокада сердца (нерегулярность или блокирование прохождения электрического импульса из верхней камеры сердца в нижнюю).
СИМПТОМЫ БРАДИКАРДИИ
Когда ваше сердце бьется слишком медленно, вы можете испытывать различные симптомы:
- головокружение или обморочное состояние,
- хроническую слабость,
- одышку.
Эти симптомы помогут вашему врачу оценить степень тяжести вашего состояния и определить подходящее лечение.
ДИАГНОСТИКА БРАДИКАРДИИ
Только врач может диагностировать брадикардию и степень ее тяжести. Чтобы исключить или подтвердить диагноз брадикардия, могут потребоваться определенные тесты, в зависимости от предполагаемого нарушения сердечного ритма. К ним относятся:
- электрокардиограмма (ЭКГ),
- нагрузочный ЭКГ-тест (измеряет сердечный ритм во время физических упражнений),
- холтеровское или суточное мониторирование,
- наружный петлевой регистратор,
- имплантируемый кардиомонитор,
- пассивная ортостатическая проба,
- электрофизиологическое исследование.
ЛЕЧЕНИЕ БРАДИКАРДИИ
Лечение брадикардии зависит от ее причины. Брадикардия может быть вызвана недостаточностью функции щитовидной железы (гипотиреоз), электролитным дисбалансом или лекарственными препаратами, принимаемыми для лечения определенных состояний. Замена данных препаратов на аналоги или коррекция дозы могут восстановить нормальное сердцебиение. Если лекарственная терапия не помогает или замедленное сердцебиение вызвано повреждением электрической системы сердца, вам может быть показана установка или имплантация кардиостимулятора.
ЧТО ТАКОЕ КАРДИОСТИМУЛЯТОР?
Когда говорят о традиционном кардиостимуляторе, обычно имеют в виду систему кардиостимуляции, состоящую из кардиостимулятора и электродов. Кардиостимулятор - это небольшое устройство, имплантируемое подкожно, как правило, в подключичной области. Данное устройство помогает регулировать неравномерное, прерывистое или замедленное сердцебиение. Электроды - это тонкие, мягкие, изолированные провода диаметром около 2 мм. Электроды передают электрический импульс от кардиостимулятора к сердцу и возвращают информацию о естественной активности сердца обратно в кардиостимулятор.
КАК РАБОТАЕТ КАРДИОСТИМУЛЯТОР?
Кардиостимулятор разработан как аналог естественного кардиостимулятора - синусового узла. У кардиостимулятора есть две основные задачи: стимуляция и контроль.
СТИМУЛЯЦИЯ: Кардиостимулятор передает электрический импульс в сердце через электрод, когда собственный ритм сердца замедлен или прерывается. Электрический импульс стимулирует сердцебиение.
КОНТРОЛЬ: Кардиостимулятор также "чувствует" (контролирует) естественную электрическую активность сердца. Когда кардиостимулятор регистрирует нормальный сердечный ритм, он не отправляет стимулирующий сигнал.
ИМПЛАНТАЦИЯ ТРАДИЦИОННОГО КАРДИОСТИМУЛЯТОРА
Процедура имплантации кардиостимулятора не требует операции на открытом сердце, и большинство пациентов отправляются домой в течение 24 часов. Перед хирургической операцией вам будет назначен лекарственный препарат, обладающий снотворным и успокаивающим действием. Как правило, процедура проводится под местной анестезией.
СТАНДАРТНЫЕ ЭТАПЫ ИМПЛАНТАЦИИ КАРДИОСТИМУЛЯТОРА:
В верхней части грудной клетки под ключицей делают небольшой надрез длиной приблизительно 5 - 10 см. Один или два электрода проводят через вену к сердцу, электроды подключают к кардиостимулятору. Программируют настройки кардиостимулятора, проводят проверку кардиостимулятора, чтобы убедиться в его правильной работе, кардиостимулятор устанавливают подкожно, после чего зашивают надрез.
ПОСЛЕДУЮЩЕЕ ЛЕЧЕНИЕ И КОНТРОЛЬ
Последующее наблюдение позволит проверить работу кардиостимулятора. В ходе проверки врач может:
- проконтролировать состояние батареи кардиостимулятора;
- проверить электроды, чтобы определить их взаимодействие с кардиостимулятором и сердцем;
- проверить настройки кардиостимулятора, чтобы убедиться, что они соответствуют вашим потребностям,
- скорректировать настройки кардиостимулятора помимо контроля во время очного визита к врачу,
Ваша клиника может осуществлять удаленный контроль работы кардиостимулятора. Удаленный контроль может заменить некоторые (но не все) визиты к врачу. Вашему доктору может потребоваться провести физический осмотр или корректировку настроек кардиостимулятора или лекарственной терапии.
ЕСЛИ СИСТЕМА ОСНАЩЕНА УДАЛЕННЫМ КОНТРОЛЕМ
Система позволяет отправлять информацию, хранящуюся в имплантируемом кардиостимуляторе, в клинику согласно инструкциям врача при помощи монитора пациента с мобильным интернетом или через ваш смартфон. Затем информация с вашего кардиостимулятора передается на безопасный интернет-сайт, где ваша клиника получает к ней доступ для проверки информации о состоянии сердца и работе кардиостимулятора. Система предоставляет вашему врачу ту же информацию с кардиостимулятора, что он может получить во время визита в клинику. Обсудите с врачом оптимальные варианты лечения при вашем состоянии.
ПОКАЗАНИЯ К ВНЕОЧЕРЕДНОМУ ОБРАЩЕНИЮ К ВРАЧУ
1. Возобновление жалоб, в том числе появление головокружений, предобморочных состояний, потерь сознания.
2. Появление неэффективной стимуляции, по данным ЭКГ.
3. Стимуляция мышц плечевого пояса, диафрагмы.
4. Травма области расположения кардиостимулятора (удар, падение).
5. Перед проведением и после проведения медицинских процедур, которые могут оказать влияние на работу ЭКС.
6. Электротравма.
7. Внешние изменения кожных покровов (покраснение, цианоз, истончение кожи над аппаратом), болезненные ощущения, отделяемое в области шва или ложа ЭКС.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
МОГУ ЛИ Я ПОЛЬЗОВАТЬСЯ МОБИЛЬНЫМ ТЕЛЕФОНОМ?
Да. Во время разговора по мобильному телефону держите антенну телефона на расстоянии не менее 16 см от кардиостимулятора и держите телефон у уха с противоположной стороны от кардиостимулятора. Мы также рекомендуем не класть мобильный телефон в карман рядом с кардиостимулятором.
БЕЗОПАСНО ЛИ ИСПОЛЬЗОВАТЬ БЫТОВУЮ ТЕХНИКУ?
Да. Бытовая техника преимущественно безопасна для использования при надлежащем обслуживании и в хорошем рабочем состоянии. Это относится к микроволновым печам, крупной бытовой технике, одеялам с электрообогревом и электрогрелкам.
ВЛИЯЮТ ЛИ НА МОЕ УСТРОЙСТВО МАГНИТЫ?
Предметы, содержащие магниты, включая продукцию для магнитотерапии, стереоколонки и ручные массажеры, могут оказывать временное воздействие на работу кардиостимулятора. Поэтому рекомендуется держать предметы, содержащие магниты, на расстоянии не менее 16 см от имплантируемого кардиостимулятора. Мы не рекомендуем использовать магнитные матрасы и подушки, поскольку при их использовании трудно обеспечить расстояние 16 см от прибора.
СМОГУ ЛИ Я ПУТЕШЕСТВОВАТЬ?
Учитывая короткую продолжительность досмотра, маловероятно, что детекторы металла (ворота и переносные детекторы), а также сканеры тела (именуемые сканерами миллиметрового диапазона и 3D-сканерами), которые имеются в аэропортах, судах и тюрьмах, повлияют на работу кардиостимулятора. Детектор металла может отреагировать на металлический корпус вашего кардиостимулятора. Для минимизации риска временного воздействия на кардиостимулятор в ходе досмотра не прикасайтесь к металлическим поверхностям оборудования. Не останавливайтесь и не задерживайтесь в воротах, просто пройдите через ворота обычным шагом. При использовании переносного детектора попросите оператора не держать его в области кардиостимулятора и не проводить им рядом с кардиостимулятором. Возможно, в качестве альтернативы вас попросят пройти ручной метод досмотра. Если вас беспокоят методы досмотра, покажите идентификационную карточку кардиостимулятора и попросите осуществить альтернативный досмотр, после чего следуйте указаниям персонала.
СМОГУ ЛИ Я ЗАНИМАТЬСЯ СПОРТОМ? СМОГУ ЛИ Я ЗАНИМАТЬСЯ ПОВСЕДНЕВНОЙ ДЕЯТЕЛЬНОСТЬЮ?
Вы сможете вернуться к обычной деятельности, если она не превышает текущую физическую нагрузку.
ЖИЗНЬ С КАРДИОСТИМУЛЯТОРОМ
Многие люди с кардиостимулятором продолжают обычную повседневную деятельность после восстановления от процедуры имплантации. Врач может попросить вас избегать определенных ситуаций. Обсудите с врачом вашу активность и образ жизни, чтобы разработать оптимальный для вас план.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не используются.
