"Клинические рекомендации "Аневризмы брюшной аорты"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
АНЕВРИЗМЫ БРЮШНОЙ АОРТЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I71.3, I71.4
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 53_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Ассоциация сердечно-сосудистых хирургов России, Ассоциация флебологов России, Общероссийская общественная организация "Российское кардиологическое общество", Российское общество ангиологов и сосудистых хирургов, Общероссийская общественная организация "Российское общество хирургов", Автономная некоммерческая организация "Национальное общество по изучению атеросклероза", Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению, Российская Ассоциация специалистов функциональной диагностики
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
ЭЛАБА - endovascular aneurysm repair (эндоваскулярное лечение аневризмы брюшной аорты)
АВС - активированное время свертывания
АД - артериальное давление
АБА - аневризма брюшной аорты
АГА - аневризма грудной аорты
АЛТ - аланинаминотрансфераза
Анкер*** - анкер для крепления мягких тканей, нерассасывающийся***
Антикоагулянты - B01A Антитромботические средства
АПА - аневризма подвздошной артерии
АСК - ацетилсалициловая кислота**
АСТ - аспартатаминотрансфераза
БАБ - бета-адреноблокаторы
БОА - окклюзии аорты с помощью баллона
ВПА - внутренняя подвздошная артерия
ВБА - верхняя брыжеечная артерия
ВАБА - воспалительная аневризма аорты
ДААТ - двойная дезагрегантная терапия
ДПА - добавочная почечная артерия
ЕОК - Европейское общество кардиологов
ЖКТ - желудочно-кишечный тракт
ИМГ - интрамуральная гематома
Ингибиторы АПФ (иАПФ) - ингибиторы ангиотензинпревращающего фермента
ИРБА - изолированное расслоение брюшной аорты
ИПП - инструкция по применению
КТА брюшной аорты - компьютерно-томографическая ангиография брюшной аорты
КУУЗИ - контрастусиленное ультразвуковое исследование
КШ - коронарное шунтирование в условиях искусственного кровообращения или на работающем сердце без использования искусственного кровообращения
МАА - микотическая аневризма аорты
МРА-КУ - магнитно-резонансная ангиография с контрастированием (одна область)
МР ангиография - магнитно-резонансная ангиография (одна область)
МСКТ - мультиспиральная компьютерная томография
МСКТА КА - компьютерно-томографическая коронарография
МЭ - метаболический эквивалент
НМГ - низкомолекулярный гепарин (группа гепарина)
НПА - наружная подвздошная артерия
НФГ - нефракционированный гепарин (гепарин натрия**)
ОПА - общая подвздошная артерия
ОПП - объем почечной паренхимы
ОЦК - объем циркулирующей крови
ОХ - открытая хирургическая реконструкция
ПОАК - прямые пероральные антикоагулянты (антитромботические средства)
ПОП - подковообразная почка
ПЭТ-КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП
ПЯА - пенетрирующая язва аорты
РКИ - рандомизированное клиническое исследование
РКО - Российское кардиологическое общество
рАБА - разрыв аневризмы брюшной аорты
рСКФ - расчетная скорость клубочковой фильтрации, исследование функции нефронов по клиренсу креатинина (проба Реберга)
срАБА - супраренальная аневризма брюшной аорты
РПБ - обзорная рентгенография органов брюшной полости
РФ - Российская Федерация
РЭБОА - реанимационная эндоваскулярная баллонная окклюзия аорты
СЭД - синдром Элерса-Данлоса
СЛД - синдром Лойса-Дитца
Статины - ингибиторы ГМГ-КоА-редуктазы
Стент-графт*** - стент-графт эндоваскулярный для абдоминальной аорты***
Стент для коронарных артерий*** - стент для коронарных артерий выделяющий лекарственное средство, полностью рассасывающийся***; стент для коронарных артерий, выделяющий лекарственное средство, с рассасывающимся полимерным покрытием***; стент для коронарных артерий, выделяющий лекарственное средство, с нерассасывающимся полимерным покрытием***
ТААА - торакоабдоминальная аневризма аорты
ТААТ - тройная антитромботическая терапия
Тиенопиридины - антиагреганты кроме гепарина
ТТГ - тиреотропный гормон
УЗИ - ультразвуковое исследование
УЗДС аорты - ультразвуковое дуплексное сканирование аорты
ФР - факторы риска
ХОБЛ - хроническая обструктивная болезнь легких
ЧС - чревный ствол
ЧСС - частота сердечных сокращений
ЭГК - регистрация электрокардиограммы
Эндопротезирование аорты - эндопротезирование аорты с использованием стент-графта***
ЮРАБА - юкстаренальная аневризма аорты
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
ESVS - European Society for Vascular Surgery (Европейское общество сосудистых хирургов)
ESC - European Society of Cardiology (Европейское общество кардиологов)
CHA2DS2VASc - шкала оценки риска развития инсульта и тромбоэмболических осложнений у пациентов с трепетанием и фибрилляцией предсердий.
** - препарат включен в перечень жизненно необходимых и важнейших лекарственных препаратов
*** - медицинское изделие, имплантируемое при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи
# - назначение лекарственного препарата по показаниям, не утвержденным государственными регулирующими органами, не упомянутым в инструкции по применению.
Термины и определения
Аневризма - патологическое расширение сосуда с увеличением диаметра более чем в 2 раза в сравнении с нормой или локальным выбуханием стенки.
Симптомная аневризма - аневризма брюшной аорты (АБА) с клинической триадой: боль в животе и/или в пояснице (или симптомы сдавления внутренних органов), пульсирующее образование в брюшной полости и гипотензия.
Эндолик - неполное выключение аневризматического мешка с постоянным притоком крови в мешок после ЭЛАБА
Проксимальная шейка инфраренальной аневризмы брюшной аорты - участок аорты, имеющий нормальный диаметр, начиная от уровня отхождения почечных артерий и заканчивая началом расширения аорты.
Юкстаренальная аневризма брюшной аорты - аневризма брюшной аорты дистальнее почечных артерий, но в непосредственной близости к ним.
Параренальная аневризма брюшной аорты - аневризма брюшной аорты с вовлечением одной или обеих почечных артерий.
Супраренальная аневризма брюшной аорты - аневризма брюшной аорты с вовлечением висцерального сегмента аорты, содержащая верхнюю брыжеечную артерию (ВБА) и чревный ствол (ЧС), и, в частности, относящаяся к торакоабдоминальным аневризмам IV типа, если достигают ножки диафрагмы.
Истинная аневризма - аневризма, стенками которой являются структурные элементы сосудистой стенки.
Ложная аневризма - наполненная кровью полость, лежащая в тканях вне артерии, но сообщающейся с ней через отверстие в стенке.
Тезис-рекомендация - положение, отражающее порядок и правильность выполнения того или иного медицинского вмешательства, имеющего доказанную эффективность и безопасность.
Уровень достоверности доказательств (УДД) - степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным [1].
Уровень убедительности рекомендаций (УУР) - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [1].
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
Клинические рекомендации отражают наиболее частую практику в отношении усредненного пациента. Однако, в индивидуальном случае, основываясь на научных данных, локальных клинических протоколах, логистических и финансовых особенностях, решение может быть обоснованно изменено консенсусом сердечно-сосудистой команды.
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Аневризма - термин, происходящий от древнегреческого слова 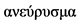 , означает дилатацию или расширение кровеносного сосуда. В отечественной литературе под аневризмой абдоминальной аорты понимают ее патологическое расширение с увеличением диаметра более чем в 2 раза в сравнении с нормой или локальным выбуханием стенки [2]. Другое определение, основанное на ультразвуковом измерении наружного диаметра аорты, указывает: под аневризмой следует понимать диаметр брюшной аорты 3,0 см и более, что обычно более чем на 2 стандартных отклонения превышает средний диаметр у мужчин [3]. Это определение имеет чувствительность 67% и специфичность 97% в отношении прогнозирования необходимости реконструкции АБА в течение 10 лет [4]. Специфичность и чувствительность УЗДС брюшного отдела аорты в выявлении АБА у асимптомных больных достигает 100%. На сегодняшний день нет четкого консенсуса в правилах измерения размеров по данным ультразвукового исследования, но наиболее точным считается измерение переднезаднего размера в плоскости, перпендикулярной к ее оси [5]. В среднем диаметр брюшного отдела аорты в инфраренальном сегменте составляет 18 - 22 мм. Для женщин и некоторых групп населения азиатского происхождения может быть более целесообразным установление более низкого порогового значения в связи с большей частотой разрывов [6, 7]. АБА диагностируется при расширении брюшной аорты более 3,0 см в диаметре [8].
, означает дилатацию или расширение кровеносного сосуда. В отечественной литературе под аневризмой абдоминальной аорты понимают ее патологическое расширение с увеличением диаметра более чем в 2 раза в сравнении с нормой или локальным выбуханием стенки [2]. Другое определение, основанное на ультразвуковом измерении наружного диаметра аорты, указывает: под аневризмой следует понимать диаметр брюшной аорты 3,0 см и более, что обычно более чем на 2 стандартных отклонения превышает средний диаметр у мужчин [3]. Это определение имеет чувствительность 67% и специфичность 97% в отношении прогнозирования необходимости реконструкции АБА в течение 10 лет [4]. Специфичность и чувствительность УЗДС брюшного отдела аорты в выявлении АБА у асимптомных больных достигает 100%. На сегодняшний день нет четкого консенсуса в правилах измерения размеров по данным ультразвукового исследования, но наиболее точным считается измерение переднезаднего размера в плоскости, перпендикулярной к ее оси [5]. В среднем диаметр брюшного отдела аорты в инфраренальном сегменте составляет 18 - 22 мм. Для женщин и некоторых групп населения азиатского происхождения может быть более целесообразным установление более низкого порогового значения в связи с большей частотой разрывов [6, 7]. АБА диагностируется при расширении брюшной аорты более 3,0 см в диаметре [8].
Разрыв АБА определяется как острое кровотечение из АБА за пределы истинной стенки аорты со скоплением крови в забрюшинном и/или внутрибрюшинном пространстве. Чаще всего встречается двухэтапный разрыв, когда первоначальный надрыв стенки и кровотечение из аорты приводит к коллапсу и тампонируется тромбом, который при подъеме давления выбивается и наступает второй этап разрыва. Многоэтапные разрывы встречаются при забрюшинной локализации места разрыва и гематомы.
Наиболее общепринятое определение аневризмы подвздошной артерии (АПА) - дилатация сосуда более чем в 1,5 раза по сравнению с его нормальным диаметром [9]. В целом дилатация общей подвздошной артерии (ОПА) >= 18 мм у мужчин и >= 15 мм у женщин, а внутренней подвздошной артерии (ВПА) >= 8 мм считается аневризматической [9 - 11].
Еще одно заболевание аорты, впервые описанное Walker и соавт. в 1972 г. [12], представляет собой воспалительную аневризму брюшной аорты (ВАБА), на долю которой приходится 4 - 7% от всех АБА [13, 14].
Определяется по:
- атипичному утолщению стенки аневризмы,
- блестящему перианевризматическому и ретроперитонеальному фиброзу белого цвета,
- плотным спайкам прилегающих внутрибрюшных структур.
Пенетрирующая язва аорты (ПЯА), впервые описанная в 1934 г. [15], определяется как изъязвление атеросклеротической бляшки, распространяющееся за пределы интимы аорты, что приводит к образованию гематом в стенке аорты, количество которых может различаться. Такие поражения обычно возникают у пациентов пожилого возраста с системным атеросклерозом и сопутствующими заболеваниями. На основе обзора литературы расчетная частота ПЯА составляет 1% в популяции пациентов с сосудистыми заболеваниями, при этом ПЯА в брюшном отделе (11 - 24%) возникает реже, чем в грудном отделе (76 - 86%), но могут наблюдаться множественные поражения и связанные с ними аневризмы [16 - 20].
Мешотчатые АБА рассматриваются как отдельная нозологическая единица и определяются как сферические аневризмы с вовлечением лишь части окружности аорты [21]. Во всех случаях следует исключить инфекцию, а в случае ее наличия необходимо назначить соответствующее лечение [22].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Наиболее часто аневризмы аорты и периферических артерий являются следствием деградации медии, вызванной сложными биологическими механизмами. Традиционно считается, что большинство аневризм возникают из-за дегенеративных атеросклеротических изменений, другие данные свидетельствуют о том, что многие формы аневризм возникают в ответ на изменение уровня тканевых металлопротеиназ, что способствует нарушению целостности артериальной стенки. Микотические или первично инфицированные аневризмы аорты (МАА) развиваются в связи с попаданием септических эмболов в "vasa vasorum", в результате гематогенного распространения во время бактериемии или прямым распространением смежной инфекции, приводящей к инфекционной дегенерации артериальной стенки и образованию аневризмы. Термин "микотический" был введен Ослером (Osler) в 1885 году из-за грибоподобного внешнего вида аневризм, что вводит в заблуждение, поскольку большинство МАА вызывается обычными микроорганизмами, включая грамположительные, в основном различные виды стафилококков и энтерококков, а также Streptococcus pneumoniae и виды бактерий рода Clostridium. Среди грамотрицательных палочек в основном встречаются различные виды сальмонелл, но также могут быть идентифицированы Coxiella burnetti, микобактерии и грибы [23 - 26]. Большинство пациентов с МАА являются лицами мужского пола и, как правило, моложе (средний возраст 69 - 70 лет) пациентов с дегенеративной неинфицированной аневризмой (74 - 78 лет) [22, 27].
Патогенез воспалительной аневризмы аорты (ВАБА) остается неизвестным. Аутоиммунные механизмы, вероятно, играют важную роль в возникновении этой хронической воспалительной реакции, либо в результате локального патологического процесса, основанного на воспалительной реакции на компоненты атеросклеротических бляшек, либо как проявление системного заболевания [28]. На основе иммунологических исследований была предложена классификация воспаления, связанного и не связанного с иммуноглобулином (Ig) G4, что подчеркивает иммунологическую роль в развитии заболевания [29 - 32]. Большинство ВАБА относятся к группе хронического периаортита (идиопатический перианевризматический ретроперитониальный фиброз). На момент постановки диагноза возраст этих пациентов составляет 62 - 68 лет, что приблизительно на 5 - 10 лет меньше, чем у пациентов с дегенеративной АБА. Большинство пациентов являются мужчинами (соотношение М:Ж [6 - 30]:1), заядлыми курильщиками (85 - 90%) с артериальной гипертензией, ИБС и облитерирующими ЗПА в анамнезе.
Изолированное расслоение брюшной аорты (ИРБА) возникает редко и гораздо реже, чем расслоение брюшной аорты в сочетании с расслоением грудной аорты [33]. Расслоение обусловлено разрывом интимы, через который происходит истечение крови в прилегающее пространство с формированием ложного просвета. Входной разрыв обычно возникает ниже или на уровне почечных артерий (82%) [34]. У 41% пациентов с клиническими проявлениями ИРБА имеется сопутствующая АБА [33, 35]. Интрамуральная гематома (ИМГ) представляет собой скопление крови в стенке аорты без разрыва интимы или точки входа при визуализирующем исследовании, и она редко возникает только в брюшной аорте.
Факторы риска развития АБА
Наиболее важным фактором риска развития АБА является курение. Отношение шансов для наличия такой связи составляет > 3 [36, 37], и выше у женщин [38, 39]. К другим факторам риска относятся возраст, атеросклероз, артериальная гипертензия, этническая принадлежность и отягощенный семейный анамнез по АБА [36, 38]. Уникальные исследования на основе реестра близнецов, проведенные в Швеции и Дании, свидетельствуют о том, что вклад наследственности может достигать 70% [40, 41].
Риск развития АБА у лиц с сахарным диабетом, особенно 2-го типа, примерно в два раза ниже, чем у лиц без него [42, 43].
Таким образом, основными ФР развития АБА считаются пожилой возраст, мужской пол, курение и семейный анамнез АБА. Количество кардиоваскулярных ФР и распространенность атеросклероза периферических артерий прямо коррелирует с диаметром брюшной аорты, а наличие ИБС связано с увеличением риска наличия АБА в 2,29 раза (p < 0,0001) [44, 45].
Несмотря на то, что классические факторы сердечно-сосудистого риска являются основной причиной развития АБА, у пациентов молодого и среднего возраста (< 60 лет) необходим особый диагностический подход для выявления основных генетических нарушений и/или нарушений со стороны соединительной ткани. Описано более 30 наследственных состояний, которые потенциально могут проявляться аневризмами аорты или артерий. Одно и то же наследственное заболевание аорты, как правило, ассоциированное с грудной аортой, также может поражать брюшную аорту, но в гораздо меньшей степени, в частности синдром Марфана, сосудистый тип синдрома Элерса-Данло (СЭД), синдром Лойса-Дитца (СЛД), синдром извитости артерий и синдром аневризмы-остеоартрита [24, 46 - 48].
Мутации в генах, кодирующих компоненты внеклеточного матрикса (например, фибриллин-1, альфа-1 цепь коллагена III типа, альфа-5 цепь коллагена IV типа); сократительный аппарат гладкомышечных клеток (например, альфа-2 актин гладкомышечных клеток аорты, цГМФ-(циклический гуанозинмонофосфат)-зависимая протеинкиназа типа I); сигнального пути трансформирующего фактора роста бета-3 (например, TGFBR 1, 2, малые матери против декапентаплегического гомолога 3, TGFB3), как известно, связаны с повышенным риском патологии брюшной аорты и образованием аневризмы. У лиц с идентичными мутациями может отмечаться значительная вариабельность клинических проявлений [49].
Естественное клиническое течение АБА
У большинства пациентов естественное течение малых АБА характеризуется прогрессирующим увеличением диаметра. В исследовании RESCAN, метаанализе на основе индивидуальных данных более > 15 000 пациентов с АБА диаметром 3,0 - 5,5 см, было показано, что нет различий в скорости роста аневризмы между мужчинами и женщинами, в среднем 2,2 мм/год, при курении скорость роста аневризмы увеличивается на 0,35 мм/год (приблизительно 16%) при сахарном диабете скорость роста аневризмы снижается на 0,51 мм/год (снижение приблизительно на 25%) [50].
В пределах исследованного диапазона диаметров было отмечено экспоненциальное увеличение средней скорости роста от 1,3 мм/год для аневризм диаметром 3,0 см до 3,6 мм/год для аневризм диаметром 5,0 см. Показатели скорости роста аневризм не изменились за последние 25 лет [51].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В настоящее время частота аневризм абдоминальной аорты в РФ в зависимости от региона составляет 10 - 40 случаев на 100000 населения, в США - 36,2 [2, 52]. За последние 20 лет распространенность АБА снизилась, что частично объясняется уменьшением в популяции числа курящих людей [36, 53, 54]. Распространенность заболевания АБА увеличивается с возрастом пациентов, более 80% это лица старше 60 лет. Большинство исследований показывают, что распространенность АБА среди женщин в 4 - 8 раза ниже, чем среди мужчин. В 89 - 96% наблюдений аневризма брюшной аорты имеет инфраренальную локализацию и в 28% случаев может сочетаться с аневризмой подвздошных артерий.
Аневризмы выявляются в 0,16 - 1% от всех вскрытий и являются по значимости десятой причиной смерти человека. Частота разрывов аневризм брюшной аорты составляет 5,6 - 7,5 случаев на 100000 населения.
Заболеваемость МАА составляет до 1,3% от всех аневризм аорты в западных странах и (по сообщениям) выше в Восточной Азии [23 - 26]. Предлагаемые диагностические критерии микотической аневризмы аорты представлены в Таблице ПБ-1.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Аневризма и расслоение аорты (I71)
I71.3 - Аневризма брюшной аорты разорванная
I71.4 - Аневризма брюшной аорты без упоминания о разрыве
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Анатомическая классификация аневризм аорты
Классификация торакоабдоминальной аневризмы аорты (ТААА), предложенная Стэнли Э. Кроуфордом (Stanley E. Crawford) в 1986 г., по-прежнему является общепринятой (Рисунок 1) [55, 56]. Эта классификация описывает протяженность аневризмы аорты на основе проксимальной и дистальной анатомических границ, и вовлечения висцеральных артерий. От протяженности аневризмы зависит выбор хирургического подхода, места пережатия и методов реконструкции.
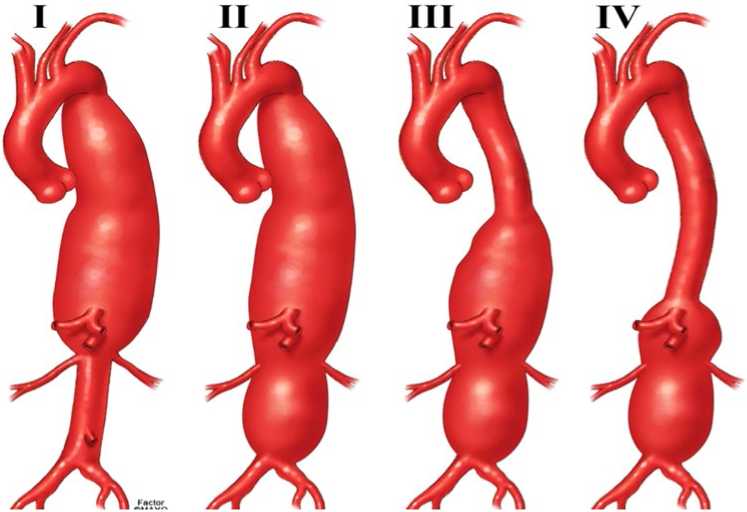
Рисунок 1. Классификация типов аневризм торакоабдоминального отдела аорты (ТААА) по Crawford.
Эта классификация полезна для описания хирургических подходов, объема реконструкции аорты, прогноза риска ишемии спинного мозга и других периоперационных осложнений, оценка риска которых в значительной степени основана на степени поражения аорты. Эта система классификации исходит из предположения о том, что место пережатия и линия анастомоза находятся вблизи начала и конца аневризматического расширения, что не характерно для эндоваскулярных вмешательств. При эндоваскулярной реконструкции стенки сосуда в качестве зон имплантации стент-графта*** эндоваскулярного для абдоминальной аорты (Рисунок 2) выбирают протяженные здоровые участки аорты с неизмененными стенками, расположенные на несколько сантиметров выше проксимальной и ниже дистальной линии анастомоза.
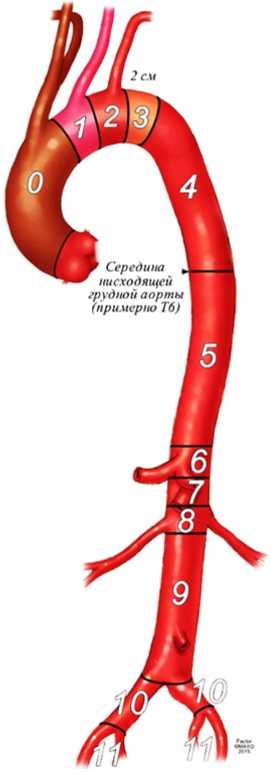
Рисунок 2. Зоны имплантации стент-графта*** эндоваскулярного для абдоминальной аорты. Предлагаемая классификация включает зоны 0 - 3 (от восходящей аорты до дистальной границы дуги аорты), 4 - 5 (от проксимальной до дистальной границы грудного отдела аорты), 6 - 8 (висцеральный отдел аорты), 9 (инфраренальный отдел аорты), 10 - 11 (подвздошные артерии).
Это означает, что область реконструкции аневризмы аорты расширяется в проксимальном направлении (часто в грудной отдел аорты) по сравнению с той, которая обычно используется при открытой хирургической реконструкции. Таким образом, при одной и той же степени заболевания аорты величина подлежащего протезированию сегмента может различаться в зависимости от выбора открытой или эндоваскулярной методики, а также конструкции стент-графта*** эндоваскулярного для абдоминальной аорты. Это приводит к значительным различиям между традиционной открытой и эндоваскулярной реконструкциями стенки сосуда, поскольку увеличение длины перекрываемой аорты в проксимальном направлении (при эндоваскулярной процедуре) может сопровождаться более высоким риском ишемии спинного мозга и других периоперационных осложнений, чем предполагает анатомическая классификация, хотя это и не обязательно приведет к увеличению риска возникновения симптомного или клинически значимого осложнения.
В таблицах N 1 и N 2 иллюстрируется типичная корреляция между анатомической классификацией и объемом эндоваскулярной реконструкции стенки сосуда, исходя из сегмента, в котором расположена проксимальная зона имплантации стент-графта*** эндоваскулярного для абдоминальной аорты, и протяженности перекрываемого участка аорты. Для пациентов, у которых ранее выполнялась открытая или эндоваскулярная реконструкция стенки восходящей аорты, дуги, грудного отдела аорты или брюшного отдела аорты, используется классификация, охватывающая общую протяженность вмешательства на аорте. Например, если выполняли открытое протезирование в проксимальном сегменте грудного отдела аорты, дистальная эндоваскулярная реконструкция стенки сосуда до уровня инфраренального отдела аорты будет описываться как "завершение реконструкции ТААА II типа" [57].
Таблица 1. Корреляция анатомической классификации аневризм и объема реконструкции аорты, исходя из количества перекрываемых сегментов аорты
Анатомическая протяженность заболевания аорты
Минимальная расчетная проксимальная зона герметизации
Расчетное количество перекрываемых сегментов
Объем эндоваскулярной реконструкции стенки аорты
Аневризма брюшной аорты
Инфраренальная аневризма
9
9 - 10
Инфраренально
Юкстаренальная аневризма
7
8 - 10
Параренально
Параренальная аневризма
6
6 - 10
Тип IV
Аневризма торакоабдоминального отдела аорты
Тип IV
5
5 - 10
Тип III
Тип III
4
4 - 10
Тип II
Тип II
3
3 - 10
Тип II
Тип I
3
3 - 9
Тип II
Тип по классификации Crawford (Рисунок 1); Зона герметизации соответствует зонам имплантации на Рисунок 2
Таблица 2. Классификация сложных аневризм брюшной аорты (АБА) и корреляции между открытой хирургической и эндоваскулярной реконструкцией стенки сосуда
Протяженность заболевания аорты
Объем открытой реконструкции (сегмент наложения анастомоза)
Объем эндоваскулярной реконструкции стенки сосуда (сегмент зоны герметизации стента)
Инфраренальная аневризма
Инфраренально (зона 9)
Инфраренально (зона 9)
Юкстаренальная аневризма
Юкстаренально (зона 8)
Параренально (зона 7)
Параренальная аневризма
Параренально (зона 7)
Тип IV (зона 6)
Тип IV
Тип IV (зона 6)
Тип III (зона 5)
Тип III
Тип III (зона 5)
Тип II (зона 4)
Тип II
Тип II (зона 3)
Тип II (зона 3)
Тип I
Тип I (зоны 3 - 8)
Тип II (зоны 3 - 9)
Наибольшее значение имеют классификации аневризм брюшной аорты по локализации, размерам, клиническому течению.
По локализации:
Классификация А.В. Покровского (Рисунок 3):
- проксимального сегмента брюшной аорты с вовлечением висцеральных ветвей;
- инфраренального отдела аорты без вовлечения бифуркации;
- инфраренального отдела аорты с вовлечением бифуркации аорты и подвздошных артерий;
- тотальное поражение брюшной аорты.
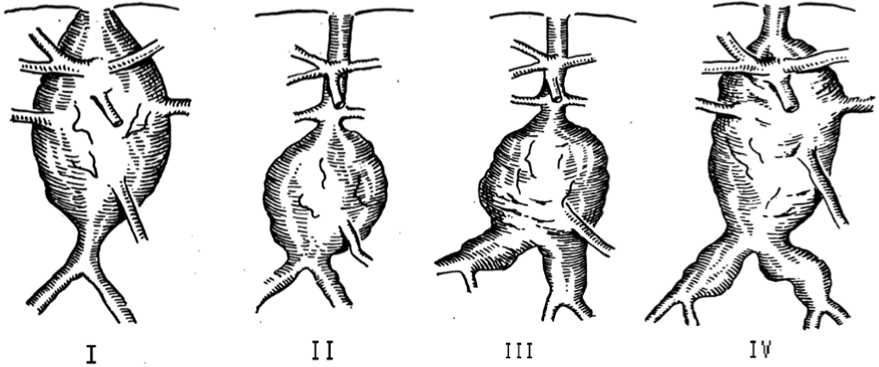
Рисунок 3. Классификация аневризм брюшной аорты по А.В. Покровскому
По размерам:
- Малые аневризмы (D 3 - 5 см);
- Средние (D 5 - 7 см);
- Большие (D более 7 см);
- "Гигантские" (в 8 - 10 раз превышают диаметр инфраренального сегмента аорты).
По клиническому течению:
Асимптомные:
- отсутствуют какие-либо жалобы;
- аневризма является случайной находкой при неинвазивной диагностике (ультразвуковое исследование органов брюшной полости (комплексное), компьютерная томография органов брюшной полости и магнитно-резонансная томография органов брюшной полости).
Безболевые:
- субъективные ощущения пульсации в животе;
- объективное пальпаторное определение врачом пульсирующего безболезненного образования в животе.
Болевая стадия заболевания:
- болезненность, появляющаяся при пальпации образования в животе;
- типичные боли в животе и в поясничной области;
- атипичные, клинические симптомы: абдоминальный, урологический, ишиорадикулярный симптомокомплекс.
Стадия осложнений:
- угрожающий разрыв;
- разрыв, прорыв;
- расслоение;
- некардиогенная эмболизация артерий.
Предложено несколько классификаций изолированных АПА [58 - 60]. Анатомическая классификация Ребера по типам I - IV, по-видимому, хорошо подходит для сравнения исходов различных анатомических образований (Рисунок 4), в то время как классификация Фарни основана на оценке пригодности шейки для эндопротезирования аорты, которая может меняться в зависимости от времени, медицинских изделий и метода операции. Существуют дегенеративные аневризмы, псевдоаневризмы, пенетрирующая язва, расслаивающиеся аневризмы, микотические аневризмы и травматические аневризмы [61].
Изолированные АПА чаще всего поражают ОПА (тип I по Реберу) и реже НПА (тип IV по Реберу) [62 - 65]. По имеющимся данным их общая частота составляет до 7% от всех аневризм аорто-подвздошного сегмента, и 12 - 48% всех изолированных АПА являются двусторонними [63, 65, 66]. Большинство случаев изолированных АПА приходится на долю мужчин (90%) и диагностируется на седьмом и восьмом десятилетии жизни [64, 66, 67].
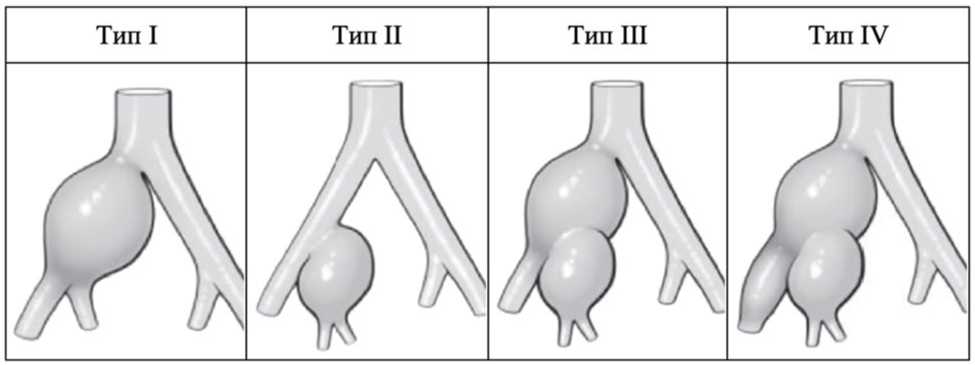
Рисунок 4. Классификация изолированных аневризм подвздошной артерии по Реберу [59].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Аневризма аорты во многих случаях никак себя не проявляет. Симптоматика может возникать при формировании большого аневризматического мешка, сдавливающего окружающие структуры: кашель, одышка, осиплость голоса (вследствие сдавления возвратного нерва), отек верхних конечностей (в результате сдавления верхней полой или брахиоцефальной вены), болезненное или нарушенное глотание (по причине сдавления пищевода) при больших аневризмах грудной аорты, постоянные или периодические боли или дискомфорт в животе, ощущение "пульсации" в животе, чувство переполнения желудка после приема минимального количества пищи при больших аневризмах брюшной аорты [68].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Как минимум, у всех пациентов должен быть собран анамнез, и все они должны пройти клиническое обследование, функциональную оценку с проведением общего (клинического) анализа крови и исследованием уровня натрия, калия, хлоридов в крови, включая оценку функции почек, и регистрацию электрокардиограммы.
Проведение дополнительных исследований, включая статическую эхокардиографию и функциональные пробы легких, зависят от особенностей состояния пациента, как описано ниже.
2.1 Жалобы и анамнез
Течение АБА обычно клинически бессимптомно.
Основными симптомами или признаками интактной АБА, являются боль или болезненность при пальпации в области локализации АБА или с иррадиацией в спину или половые органы. Симптомы связаны с формированием большого аневризматического мешка, сдавливающего окружающие структуры: непроходимость двенадцатиперстной кишки, отек нижних конечностей, обструкция мочеточника, кашель, одышка, осиплость голоса (вследствие сдавления возвратного нерва), отек верхних конечностей (в результате сдавления верхней полой или брахиоцефальной вены), болезненное или нарушенное глотание (по причине сдавления пищевода) при больших аневризмах грудной аорты, постоянные или периодические боли или дискомфорт в животе, ощущение "пульсации" в животе, чувство переполнения желудка после приема минимального количества пищи при больших аневризмах брюшной аорты, либо дистальной эмболией [69].
Симптомные АБА проявляются болью в животе и/или спине, болезненностью при пальпации или эмболическими явлениями, симптомами сдавления окружающих органов, но без нарушения целостности стенки аорты.
Классическая триада, состоящая из артериальной гипотензии, боли в животе и/или спине и пульсирующего образования в брюшной полости, присутствует примерно у 50% пациентов с разрывом аневризмы (рАБА). Наиболее распространенными ошибочными дифференциальными диагнозами являются почечная колика и инфаркт миокарда.
- Рекомендуется сбор анамнеза и жалоб у всех пациентов с подозрением на АБА для верификации диагноза [69].
РКО I C (УДД 5 УУР C)
Комментарий: при разрыве аневризмы признаки обычно более выражены (гемодинамическая недостаточность, бледность, боль в животе и/или спине, вздутие живота и редко первичная аортокишечная или артериовенозная фистула) [69].
2.2 Физикальное обследование
При физикальном обследовании можно выявить пульсирующее образование, однако чувствительность метода пальпации живота для выявления АБА составляет < 50% [70] и ниже у пациентов с обхватом талии более 100 см. Таким образом, метод пальпации живота не является надежным для диагностики АБА.
2.3 Лабораторные диагностические исследования
- Рекомендуется выполнение общего (клинического) анализа крови в рамках первичного обследования и в процессе динамического наблюдения у всех пациентов с АБА для исключения сопутствующих заболеваний и осложнений лечения [69, 71].
РКО I C (УДД 5 УУР C)
- Рекомендуется проведение исследований уровня креатинина, натрия, калия, глюкозы, общего белка, C-реактивного белка, общего билирубина, мочевой кислоты, тиреотропного гормона (ТТГ) в крови, определение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) в крови у всех пациентов с АБА в рамках первичного обследования и в процессе динамического наблюдения для исключения сопутствующих заболеваний и осложнений лечения [69, 71].
РКО I C (УДД 5 УУР C)
- У пациентов высокого риска осложнений перед операцией по поводу АБА, с известным или подозреваемым ССЗ необходимо проводить анализ на биомаркеры: исследования уровня тропонинов T, I и уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови) [72 - 75].
РКО I C (УДД 4 УУР C)
- Рутинное использование анализов на биомаркеры (например, исследование уровня тропонинов T, I и уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови) для предоперационной стратификации риска не рекомендуется пациентам перед вмешательством по поводу АБА [73 - 75].
ESVS/ЕОК III C (УДД 5 УУР C)
Комментарий: Анализ на биомаркеры (например, исследования уровня тропонинов T, I и уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови) не следует использовать рутинно в предоперационной стратификации риска, однако его можно рассматривать выборочно у пациентов с высоким риском [73 - 75], например, с низкой функциональной способностью или подозрением на клинически значимую ишемическую болезнь сердца.
- У пациентов, которым проводится реконструкция аневризмы брюшной аорты, рекомендуется предоперационная оценка функции почек путем исследования уровня креатинина в крови и оценки СКФ, а пациентов с тяжелой почечной недостаточностью (расчетная скорость клубочковой фильтрации < 30 мл/мин/1,73 м2) следует направлять к врачу-нефрологу [76, 77].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий: Несмотря на отсутствие установленных критериев степени нарушения функции почек, требующей направления к врачу-нефрологу, рСКФ < 60 мл/мин может быть классифицирована как свидетельство существенного нарушения функции почек, а < 30 мл/мин - как тяжелая почечная недостаточность, требующая срочного направления к врачу-нефрологу.
Пациенты с тяжелой почечной недостаточностью (например, хроническая болезнь почек 4 или 5 стадии; рСКФ < 30 мл/мин/1,73 м2) должны быть обследованы врачом-нефрологом для улучшения функции почек перед плановой реконструкцией аорты. Пациентам с почечной недостаточностью легкой и средней степени тяжести (т.е. хронической болезнью почек 2 или 3 стадии; рСКФ < 60 и > 30 мл/мин/1,73 м2) перед реконструкцией АБА следует обеспечить адекватную гидратацию, особенно при внутривенном введении контрастного средства [76].
- У пациентов, которым проводится плановая реконструкция аневризмы брюшной аорты, рекомендуется оценка предоперационного статуса питания путем исследования уровня альбумина в крови с концентрацией альбумина < 2,8 г/дл (28 г/л) в качестве порогового значения для предоперационной коррекции [78].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий: По результатам анализа данных наблюдений 15 000 пациентов, которым проводилась реконструкция АБА, 30-дневная смертность и частота повторных вмешательств и легочных осложнений возрастали на фоне гипоальбуминемии как после открытой (n = 4956), так и после эндоваскулярной (n = 10 046) реконструкции АБА [78]. Поэтому перед хирургическим вмешательством на аорте необходимо оценивать статус питания для стратификации риска.
Концентрацию альбумина < 2,8 г/дл следует относить к тяжелой степени снижения, которая связана со значительно худшими исходами [78]. В этой ситуации недостаточность питательных веществ следует устранить перед плановым открытым вмешательством и плановой ЭЛАБА, даже несмотря на то, что эффективность этой меры не оценивалась в РКИ у пациентов с АБА. Направление к врачу-диетологу может быть целесообразным и должно оцениваться в зависимости от степени и качества недостаточности питательных веществ.
2.4 Инструментальные диагностические исследования
Ультразвуковое исследование (УЗИ) органов брюшной полости (комплексное) и ультразвуковое дуплексное сканирование (УЗДС) аорты являются методами визуализации первой линии для выявления и определения тактики лечения малых АБА, обладающими высокой чувствительностью и специфичностью [79, 80]. В настоящее время разработан метод ультразвукового исследования брюшного отдела аорты, направленный на выявление асимптомных форм АБА у лиц из групп риска [81]. УЗИ органов брюшной полости (комплексное) используется как метод первой линии для выявления АБА в условиях отделения неотложной помощи, где принципиально важным с точки зрения диагностики является выявления факта наличия заболевания и развития его осложнений [82, 83].
Однако исследования по оценке точности измерения диаметра в экстренной ситуации не проводились. К ограничениям визуализации относятся:
- ожирение или избыточное газообразование;
- изменение диаметра аорты во время сердечного цикла;
- отсутствие серийной реконструкции изображений для планирования установки стент-графта эндоваскулярного для абдоминальной аорты***;
- затруднение визуализации супраренального отдела аорты и невозможность визуализация грудной аорты.
- Всем пациентам с подозрением на АБА первым этапом обследования рекомендуется проведение УЗИ органов брюшной полости (комплексного) и ультразвукового дуплексного сканирования (УЗДС) аорты для подтверждения диагноза, определения дальнейшей тактики ведения и динамического наблюдения [3, 42, 70, 81, 84].
РКО I C (УДД 4 УУР C)
- Всем пациентам с АБА при выполнении ультразвукового дуплексного сканирования (УЗДС) аорты для определения ее размеров рекомендуется проводить измерения в плоскости, перпендикулярной продольной оси аорты, которая изменяется при наличии извитости аорты. Могут быть измерены/зарегистрированы различные диаметры: переднезадний, поперечный, максимальный в любом направлении. Положение измерительных меток должно быть в обязательном порядке зафиксировано в протоколе исследования [79, 80, 85].
РКО I C (УДД 2 УУР B)
Комментарий: в обзоре, проведенном Beales, коэффициенты воспроизводимости измерений переднезаднего и поперечного диаметров для одного оператора варьируют от 1,6 до 7,5 мм и от 2,8 до 15,4 мм соответственно [86], что подтверждает целесообразность использования переднезаднего диаметра в качестве основной плоскости измерения.
Физикальное обследование не способно выявить АПА. Возможности УЗДС аорты во многом определяются классом используемой аппаратуры и особенностями пациента (объем живота, газообразование и подобное), в то время как КТА брюшной аорты обладает высокой точностью для выявления АПА [60, 87].
С расширением использования методов визуализации поперечного сечения АПА все чаще выявляются на бессимптомной стадии.
Компьютерно-томографическая ангиография (КТА) брюшной аорты играет ключевую роль в оценке патологического процесса, его протяженности, а также в выборе метода лечения и планировании хирургического вмешательства. КТА брюшной аорты также показано выполнять в качестве метода визуализации осложненных форм аневризм аорты, диагностики разрыва аневризмы и является важным методом наблюдения после реконструктивного вмешательства [88].
Основы измерения методом УЗИ, относятся и к КТ-измерению, пациентам с АБА при выполнении КТА брюшной аорты измерение должно проводиться в плоскости, перпендикулярной продольной оси аорты, которая изменяется при наличии извитости аорты.
- Всем пациентам с подозрением или подтвержденным диагнозом АБА по данным ультразвукового исследования органов брюшной полости (комплексного) и/или ультразвукового дуплексного сканирования аорты для подтверждения диагноза, а также симптомным пациентам для оценки протяженности патологического процесса, исключения разрыва аневризмы и других осложнений а также для выбора метода лечения, планировании хирургического вмешательства исключения разрыва аневризмы и наблюдения после реконструктивного вмешательства рекомендуется выполнение компьютерно-томографической ангиографии (КТА) аорты [8, 85, 86, 89, 90].
ЕОК/РКО I B (УДД 3 УУР B)
Комментарий: к ограничениям компьютерно-томографической ангиографии (КТА) аорты относится лучевая нагрузка, а также необходимость использования рентгенконтрастных средств, содержащих йод, противопоказаниями к введению которых является нарушение функции почек, отягощенный аллергологический анамнез и повышение уровня гормонов щитовидной железы. При выявлении данных отклонений перед проведением исследования может потребоваться консультация врача-нефролога (Прием (осмотр, консультация) врача-нефролога первичный), аллерголога (Прием (осмотр, консультация) врача-аллерголога-иммунолога первичный).
- Рекомендовано использовать УЗИ органов брюшной полости (комплексное) у пациентов малыми АБА с целью наблюдения, а компьютерно-томографическую ангиографию (КТА) брюшной аорты - для предоперационной визуализации, в случае если у пациента достигнуто пороговое значение диаметра для реконструктивного вмешательства при измерении методом УЗИ [80, 88].
РКО I C (УДД 3 УУР B)
Комментарий: следует отметить, что нередко диаметры, измеренные при УЗИ органов брюшной полости (комплексного) и КТА брюшной аорты, не совпадают, что особенно важно при оценке значений близких к пороговому значению диаметра для хирургического вмешательства. Такое расхождение, вероятно, в основном связано с ненадлежащими стандартами предоставления отчетности в отношении определения оси аорты, плоскости измерения и расположения измерительных меток, однако этому также способствуют различия в оборудовании. Чаще всего это приводит к тому, что диаметр, измеренный при КТА брюшной аорты, ше, чем при УЗИ органов брюшной полости (комплексного); до 70% АБА, диаметр которых составляет 50 - 55 мм при УЗИ органов брюшной полости (комплексного), имеют диаметр более 55 мм при КТА брюшной орты [91]. При КТА брюшной аорты наиболее точным считается измерение диаметра аорты в ортогональной плоскости с захватом всей толщины стенок [8].
- Пациентам с подозрением или подтвержденным диагнозом АБА по данным ультразвукового исследования органов брюшной полости (комплексного) и/или ультразвукового дуплексного сканирования аорты, а также симптомным пациентам, для оценки протяженности патологического процесса, исключения разрыва аневризмы и других осложнений рекомендуется рассмотреть возможность выполнения магнитно-резонансной (МР) ангиографии (одна область) [71].
РКО IIb C (УДД 5 УУР C)
Комментарий: Магнитно-резонансная (МР) ангиография аорты (одна область) используется реже, чем КТА брюшной аорты; противопоказания включают в себя клаустрофобию и наличие металлических имплантатов. Однако использование МР ангиография аорты (одна область) не сопровождается облучением или введением рентгенконтрастных средств, содержащих йод, и, следовательно, она имеет преимущество перед КТА брюшной аорты, когда требуется повторная визуализация АБА. Данные об использовании МР ангиография аорты (одна область) ограничены у пациентов с АБА в рутинной клинической практике: как для МР ангиография (одна область), так и для магнитно-резонансной ангиографии с контрастированием (одна область) (МРА-КУ).
- Пациентам с подозрением на воспалительно-инфекционную этиологию АБА, включая микотические АБА, инфицированние протезами сосудистыми и стент-графтами эндоваскулярными для абдоминальной аорты***, для верификации этиологии АБА и для динамического наблюдения рекомендуется рассмотреть возможность выполнения позитронной эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) с флудезоксиглюкозой [18F] [92, 93].
РКО IIb C (УДД 4 УУР C)
Комментарий: ПЭТ-КТ с флудезоксиглюкозой [18F] позволяет локализовать и количественно оценить метаболическую активность клеток, включая воспалительные клетки. ПЭТ-КТ с флудезоксиглюкозой [18F] - это дополнительный метод визуализации для диагностики и наблюдения за патологическими изменениями аорты, связанными с воспалительной аневризмой [92], инфекцией аорты, включая микотические АБА [47], инфицированными протезами сосудистыми и стент-графтами эндоваскулярными для абдоминальной аорты***. Помимо этих показаний, ПЭТ-КТ с флудезоксиглюкозой [18F] главным образом используется в научно-исследовательских целях.
Диагноз ВАБА основывается на сочетании клинико-лабораторных показателях и результатах визуализирующих исследований, включая УЗИ органов брюшной полости (комплексное) и КТА брюшной аорты [94].
- Рекомендуется рассмотреть возможность выполнения эргоспирометрии пациента с АБА и сниженной толерантностью к физической нагрузке (ТФН) для определения рисков операционных осложнений [95].
РКО IIb C (УДД 5 УУР C)
- Рутинное назначение эргоспирометрии не рекомендуется пациентам перед вмешательством по поводу АБА [95].
ESVS/ЕОК III C (УДД 5 УУР C)
Комментарий: Эргоспирометрия приобрела популярность при многих видах обширных внесердечных хирургических вмешательств для выявления пациентов, которым необходимо последующее улучшение состояния сердца и легких перед операцией. Несмотря на многочисленные публикации, получено мало данных, позволяющих рекомендовать рутинное обследование пациентов перед вмешательством по поводу АБА [95].
- Рекомендуется регистрация 12-канальной электрокардиограммы (ЭКГ) в покое всем пациентам для выявления признаков ишемии, наличия зубца Q, исключения сопутствующих нарушений ритма и проводимости сердца [37, 42, 44, 96].
ЕОК I C (УДД 4 УУР C)
Комментарий: при неосложненной стабильной ишемической болезни сердца (ИБС) специфические ЭКГ-признаки ишемии миокарда вне нагрузки обычно отсутствуют. Единственным достаточно специфичным признаком ИБС на ЭКГ покоя является зубец Q после перенесенного острого инфаркта миокарда (ОИМ). Изолированные изменения зубца T малоспецифичные и требуют сопоставления с клиникой заболевания и данными других исследований [97].
- Рекомендуется проведение трансторакальной эхокардиографии (ЭхоКГ) всем пациентам с подтвержденной АБА для исключения аневризмы грудного отдела аорты и сопутствующей клапанной патологии [71, 98].
РКО I C (УДД 5 УУР C)
- Рутинный скрининг на бессимптомный стеноз сонных артерий перед реконструкцией аневризмы брюшной аорты не рекомендуется [99 - 102].
ESVS/ЕОК III C (УДД 4 УУР C)
Комментарий: польза скрининга поражения сонных артерий перед реконструкцией АБА не оценивалась [102], и имеющиеся данные не подтверждают целесообразность проведения рутинного предоперационного скрининга. Руководство ESVS по сонным артериям содержит слабую рекомендацию для селективного скрининга при бессимптомных стенозах сонных артерий у пациентов с множественными сосудистыми факторами риска. Данная рекомендация целесообразна для оптимизации контроля факторов риска и медикаментозной терапии, снижения частоты сердечно-сосудистых осложнений и смертности в позднем периоде, а не для выявления кандидатов на инвазивные вмешательства на сонных артериях [99, 100, 102, 103].
- У всех пациентов перед плановой реконструкцией аневризмы брюшной аорты рекомендуется рассмотреть возможность исследования спровоцированных дыхательных объемов (ФВД) [76, 104].
РКО IIb (УДД 5 УУР C)
Комментарий: пациенты с объемом форсированного выдоха за первую секунду (ОФВ1) или форсированной жизненной емкостью легких (ФЖЕЛ) менее 70% от должного значения имеют повышенный риск периоперационных легочных осложнений, как и пациенты с ОФВ1/ФЖЕЛ менее 0,65 [104].
- Прицельная рентгенография органов грудной клетки рекомендуется пациентам перед реконструкцией аневризмы брюшной аорты [76, 105].
РКО IIa C (УДД 5 УУР C)
Комментарий: Однако рутинное прицельное рентгенологическое исследование органов грудной клетки является избыточным, поскольку, как правило, выполняется КТА всей аорты (включая грудную клетку) и, кроме того, не улучшает предоперационную стратификацию риска [105].
- Рекомендуется формулировать диагноз МАА на основании сочетания клинико-лабораторных показателей и результатах визуализирующих исследований [22, 26, 27, 106].
ESVS/ЕОК I C (УДД 4 УУР C)
- У гемодинамически стабильных пациентов с подозрением на разрыв аневризмы брюшной аорты в качестве предпочтительного метода визуализации рекомендуется срочная КТА брюшной аорты, однако выбор доступного метода визуализации выбирается решением сосудистой команды [107 - 110].
ESVS/ЕОК I B (УДД 2 УУР B)
- У гемодинамически нестабильных пациентов с подозрением на разрыв аневризмы брюшной аорты рекомендуется рассмотреть вопрос о срочной КТА торакоабдоминального отдела аорты, позволяющей оценить целесообразность эндоваскулярной реконструкции, перед переводом пациента в операционную, однако выбор доступного метода визуализации выбирается решением сосудистой команды [109, 111, 112].
ESVS/ЕОК IIa B (УДД 4 УУР C)
Комментарий: если пациент недостаточно стабилен для проведения МСКТ, его следует доставить непосредственно в операционную для верификации забрюшинной гематомы, проведения экстренного открытого хирургического вмешательства (экстренной ОХ) или интраоперационной визуализации для определения пригодности для эндоваскулярного лечения аневризмы брюшной аорты (ЭЛАБА).
Интраоперационная брюшная аортография в сочетании с БОА или без нее может быть неотложным компромиссным решением для определения первоначальной пригодности к ЭЛАБА и выбора изделия с последующими измерениями либо при рентгеноскопическом исследовании, либо при внутрисосудистом ультразвуковом исследовании сосудистой стенки [113].
Особенности проведения скрининга населения по поводу АБА
Естественное течение аневризм брюшной аорты или подвздошных артерий характеризуется длительным асимптомным течением, а первые ее проявления связаны с развитием осложнений, наиболее грозным из них является разрыв. Из инструментальных методов диагностики при проведении скрининга по поводу АБА предпочтение следует отдавать ультразвуковым методам исследования.
- С целью раннего выявления аневризм брюшной аорты и предотвращения разрыва рекомендовано рассмотреть возможность скринингового обследования мужчин старше 65 лет [114 - 118].
ESVS/ЕОК I A (УДД 1 УУР A)
- Однократное скрининговое фокусированное УЗИ органов брюшной полости (комплексное) на выявление АБА рекомендуется:
- Мужчинам в возрасте >= 65 лет, которые когда-либо курили, рекомендуется ультразвуковой скрининг для выявления АБА [119].
- Мужчинам или женщинам в возрасте >= 65 лет, которые являются родственниками первой степени родства пациентов с АБА, рекомендуется ультразвуковой скрининг для выявления АБА [120].
РКО I C (УДД 3 УУР B)
- Рекомендуется рассмотреть возможность проведение скрининга аневризмы брюшной аорты у всех мужчин и женщин с истинной аневризмой периферических артерий с периодичностью один раз в 5 - 10 лет [121].
ESVS/ЕОК IIb C (УДД 4 УУР C)
Комментарий: Естественное течение аневризм брюшной аорты или подвздошных артерий характеризуется длительным асимптомным течением, а первые ее проявления связаны с развитием осложнений, наиболее грозным из них является разрыв. Раннее и своевременное выявление АБА и контроль за динамикой ее развития является актуальной задачей на пути улучшения результатов лечения. Из инструментальных методов диагностики при проведении скрининга по поводу АБА предпочтение следует отдавать ультразвуковым методам исследования.
УЗИ органов брюшной полости (комплексное) позволяет надежно визуализировать инфраренальный отдел аорты у 98,5% пациентов [3], но следует учитывать, что в некоторых случаях визуализация аорты может быть затруднена (1 - 2%). В сложных случаях пациент должен быть повторно обследован квалифицированным врачом ультразвуковой или функциональной диагностики после подготовки в условиях стационара.
Поскольку АБА часто сочетаются с другими аневризмами периферических артерий (подвздошной, бедренной, подколенной), этих пациентов регулярно обследуют на АБА, а также на другие аневризмы периферических артерий. В исследовании с участием 190 пациентов, прооперированных по поводу аневризмы подколенной артерии, у 39% развилась новая аневризма в течение периода наблюдения в среднем 7 лет, и у 43% из них это были АБА [121].
- При обнаружении у пациента АБА во время несосудистого обследования рекомендуется направить его к врачу-сердечно-сосудистому хирургу (прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный) для дальнейшего обследования и лечения [116, 122].
ESVS/ЕОК I A (УДД 1 УУР B)
2.5 Иные диагностические исследования
Генетическое консультирование при наследственных заболеваниях соединительной ткани включает тщательное клиническое обследование с акцентом на скелетные, глазные, кожные и черепно-лицевые особенности, подробное картирование семейного анамнеза с составлением родословной трех поколений и сбором клинических данных у родственников первой степени родства [123, 124]. Соответствующее генетическое консультирование и тестирование пациента и членов семьи должны быть начаты на ранней стадии не только для определения надлежащей тактики медикаментозного/хирургического лечения у отдельно взятого пациента, но и для выявления последствий для членов семьи.
- У пациентов с аневризмой брюшной аорты, у которых заболевание не может быть объяснено исключительно негенетической причиной, в частности у пациентов < 60 лет или у пациентов с семейным анамнезом, рекомендуется генетическое консультирование (врача-генетика, врача-кардиолога с опытом ведения данной группы пациентов) перед генетическим тестированием [123 - 126].
ESVS/ЕОК I C (УДД 2 УУР B)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
В настоящее время не существует специальной медикаментозной терапии замедляющий скорость роста аневризмы брюшной аорты в дооперационном периоде [127, 128]. В рандомизированных исследованиях оценивали несколько различных классов препаратов на предмет способности снижать скорость роста малых аневризм. На сегодняшний день не доказана эффективность ни одного класса препаратов, включая #доксициклин** (АТХ: J01AA02), бета-адреноблокаторы, ингибиторы АПФ [90, 127, 128], а другие исследования все еще продолжаются.
- У пациентов с АБА и средним САД >= 130 мм рт. ст. или средним ДАД >= 80 мм рт. ст. рекомендуется применение антигипертензивных средств для снижения риска сердечно-сосудистых осложнений [71].
РКО I C (УДД 5 УУР C)
- У пациентов с АБА и признаками атеросклероза аорты рекомендуется терапия статинами согласно действующим клиническим рекомендаций по нарушениям липидного обмена [71, 129].
РКО I C (УДД 5 УУР C)
Комментарий: в недавнем метаанализе более 20 когортных исследований с участием 80428 пациентов показано, что использование статинов связано со средним снижением скорости роста АБА на 0,82 мм/год (95% доверительный интервал 0,33, 1,32, P = 0,001, I2 = 86%). Лечение статинами также ассоциировано с более низким риском разрыва (отношение шансов 0,63, 95% доверительный интервал 0,51, 0,78, P < 0,0001, I2 = 27%), а предоперационное использование статинов было связано с более низкой 30-дневной смертностью после плановой пластики АБА (отношение шансов 0,55, 95% доверительный интервал 0,36, 0,83, P = 0,005, I2 = 57%). Сделан вывод, что терапия статинами связана с уменьшением прогрессирования АБА, частоты разрывов и более низкой частотой периоперационных осложнений и смертности после плановой пластики АБА [72].
- У пациентов с АБА с сопутствующей атеромой и/или пенетрирующей атеросклеротической язвой рекомендуется рассмотреть возможность применения низких доз #ацетилсалициловой кислоты (АСК)** 75 - 100 мг (АТХ: B01AC06) 1 раз в день, перорально, неопределенно долго, если нет противопоказаний с целью профилактики тромботических осложнений [71].
РКО IIA C (УДД 5 УУР C)
- Терапия статинами умеренной или высокой интенсивности рекомендуется пациентам с АБА вне зависимости от диаметра аневризмы для снижения скорости ее роста, частоты разрывов и частоты периоперационных осложнений и смертности после плановой реконструкции АБА [130].
ESVS/ЕОК IIa B (УДД 2 УУР B)
Комментарий: в недавнем метаанализе более 20 когортных исследований с участием 80428 пациентов показано, что использование статинов связано со средним снижением скорости роста АБА на 0,82 мм/год (95% доверительный интервал 0,33, 1,32, P = 0,001, I2 = 86%). Лечение статинами также ассоциировано с более низким риском разрыва (отношение шансов 0,63, 95% доверительный интервал 0,51, 0,78, P < 0,0001), а предоперационное использование статинов было связано с более низкой 30-дневной смертностью после плановой пластики АБА (отношение шансов 0,55, 95% доверительный интервал 0,36, 0,83, P = 0,005). Сделан вывод, что терапия статинами связана с уменьшением прогрессирования АБА, частоты разрывов и более низкой частотой периоперационных осложнений и смертности после плановой пластики АБА [130]. Исследование, в котором оценивали препараты, принимаемые 12 485 британскими пациентами, с зарегистрированным диагнозом АБА, показало, что пятилетняя выживаемость была значимо выше у пациентов, получавших статины (68% по сравнению с 42%), антитромботические средства (64% по сравнению с 40%) или антигипертензивные средства (62% по сравнению с 39%), по сравнению с пациентами с АБА, не принимавшими эти препараты. Более подробный анализ применяемых антигипертензивных средств показал, что диуретики могут быть менее эффективными, чем препараты других классов [131].
- При подозрении на МАА рекомендуется лечение пациентов антибактериальными препаратами системного действия для внутривенного введения как перед ЭЛАБА, так и перед ОХ [8, 132 - 134].
ESVS/ЕОК I C (УДД 4 УУР C)
- Эмпирическую антибактериальную терапию, направленную против золотистого стафилококка (Staphylococcus aureus) и грамотрицательных палочек рекомендуется начинать, как только будут получены результаты посева, и продолжать у пациентов с отрицательными результатами посева [8, 132 - 137].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарии: Источник инфекции у пациентов с первично инфицированной аневризмой аорты невозможно идентифицировать у одной трети пациентов, равно как и возбудитель инфекции в 21 - 40% [132, 138, 139].
Оптимальная тактика ведения пациентов с ВАБА остается неопределенной, и предпочтительно, чтобы все пациенты с ВАБА находились под пристальным наблюдением междисциплинарной команды.
- Консервативное медикаментозное лечение кортикостероидами системного действия рекомендуется при симптомных аневризмах диаметром ниже порогового значения для реконструкции при наличии интенсивного болевого синдрома и снижении массы тела, связанных с выраженным гидронефрозом, свидетельствующих о периоперационных сложностях [140].
РКО IIb C (УДД 4 УУР C)
Комментарий: Оптимальная доза и продолжительность медикаментозного лечения не до конца ясны, поскольку отсутствуют контролируемые клинические исследования, в которых бы оценивалась долгосрочная эффективность кортикостероидов системного действия при ВАБА [141 - 144].
- Всем пациентам с симптомными воспалительными аневризмами брюшной аорты рекомендуется назначить медикаментозное противовоспалительное лечение [94, 148 - 150].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Показатели острой фазы воспаления (СОЭ, СРБ) сами по себе не являются надежными маркерами для определения тактики ведения и последующего наблюдения, поскольку они часто не соответствуют метаболической оценке заболевания.
- Всем пациентам с пенетрирующей язвой аорты, изолированным расслоением брюшной аорты, псевдоаневризмой аорты или интрамуральной гематомой рекомендуется медикаментозное лечение, включая контроль артериального давления [24, 151 - 153].
ESVS/ЕОК IIa C (УДД 3 УУР C)
Оптимальная медикаментозная терапия в периоперационном периоде
Применение бета-адреноблокаторов в периоперационном периоде изучалось в РКИ. Действующее руководство ESC предусматривает совместное принятие решений врачом-хирургом, врачом-кардиологом и врачом-анестезиологом-реаниматологом в каждом конкретном случае [75]. Пациенты, которые уже принимают бета-адреноблокаторы, должны продолжать лечение соответствующей дозой.
- В отношении медикаментозной терапии бета-адреноблокаторами рекомендуется руководствоваться следующими положениями:
1. в периоперационном периоде рекомендуется продолжить терапию ранее назначенными бета-адреноблокаторами;
2. больным с двумя и более факторами риска или ASA > 3 имеет смысл предоперационное назначение бета-адреноблокаторов;
3. больным с ИБС или ишемией миокарда следует рассмотреть вопрос о предоперационном назначении бета-адреноблокаторов;
4. при назначении бета-адреноблокаторов приоритет следует отдавать #бисопрололу** (АТХ: C07AB07) в начальной дозе 1,25 - 2,5 мг\сут, перорально, длительно, с последующей титрацией дозы до целевой 10 мг\сут. [75]
ESVS/ЕОК IIa B (УДД 5 УУР C)
Комментарий: в рандомизированных исследованиях по оценке применения бета-адреноблокаторов в первые 24 часа после сосудистых хирургических вмешательств либо не было продемонстрировано преимуществ у пациентов с низким риском (исследование POBBLE [154], исследование MaVS [155]), либо было отмечено увеличение смертности от всех причин, частоты артериальной гипотензии и инсульта, несмотря на снижение частоты периоперационного инфаркта миокарда (исследование POISE [156]).
- Назначение сразу больших доз бета-адреноблокаторов и без титрования дозы не рекомендуется пациентам с АБА [75, 157].
ESVS/ЕОК III C (УДД 5 УУР C)
- Пациентам с АБА рекомендуется начать проводить терапию статинами до (по возможности, не менее чем за 4 недели) планового хирургического вмешательства по поводу АБА для снижения частоты сердечно-сосудистых осложнений [75, 158, 159].
ESVS/ЕОК I A (УДД 4 УУР C)
Комментарий: последние результаты метаанализа 1 рандомизированного и 36 когортных исследований (n = 134 290 пациентов) показали, что по сравнению с пациентами, не принимавшими статины, пациенты, получавшие статины, имели значительно более низкую долгосрочную смертность (отношение шансов 0,67; 95% доверительный интервал 0,59 - 0,75; P < 0,001; I2 = 71,7%) и более низкую краткосрочную смертность после операции при аневризме брюшной аорты (отношение шансов 0,51; 95% доверительный интервал 0,36 - 0,73; P < 0,001; I2 = 81,4%). Не было обнаружено существенных различий между пациентами, принимающими или не принимающими статины, по периоперационным сердечно-сосудистым осложнениям после эндоваскулярной пластики аневризмы. Эти данные свидетельствуют о том, что использование статинов связано со значительным снижением долгосрочной и краткосрочной смертности у пациентов после операций по поводу АБА [160].
- Пациентам перед оперативным вмешательством на аорте в предоперационном периоде рекомендуется рассмотреть возможность физической нагрузки под контролем врача с целью снижения частоты послеоперационных сердечных, дыхательных и почечных осложнений, а также уменьшения длительности госпитализации [161].
РКО IIb B (УДД 2 УРР B)
Комментарий: Недавнее РКИ в Великобритании показало, что физическая нагрузка под контролем врача в предоперационном периоде полезна для пациентов, которым проводится открытое или эндоваскулярное хирургическое вмешательство на аорте, так как снижает частоту послеоперационных сердечных, дыхательных и почечных осложнений, а также уменьшает длительность госпитализации [161].
Антитромботическая терапия
Монотерапия АСК** (АТХ: B01AC06) или тиенопиридинами, (например, клопидогрелом** (АТХ: B01AC04) не представляет риска обильного кровотечения при реконструкции АБА [162]. Несмотря на то, что такая терапия связана с повышенным риском кровотечения после внесердечных хирургических вмешательств, не отмечено увеличения количества эпизодов тяжелых кровотечений [163].
Таким образом, антитромбоцитарную монотерапию можно продолжать до проведения эндоваскулярной или открытой реконструкции с целью снижения тромботического и сердечного риска.
- В отношении антитромботической монотерапии у пациентов, планируемых на реконструкцию АБА рекомендуется:
- назначенную монотерапию АСК** 75 - 100 мг/сут (АТХ: B01AC06) по 1 таблетке, 1 раз в день, продолжать в периоперационном периоде до открытой и эндоваскулярной реконструкции аневризмы брюшной аорты и после, неопределенно долго, при отсутствии противопоказаний [163];
ESVS/ЕОК I B (УДД 2 УУР A)
- монотерапию тиенопиридинами (например, клопидогрелом** (АТХ: B01AC04) 75 мг в сутки перорально) отменить за 3 - 7 дней и, по возможности, заменить его на АСК** (АТХ: B01AC06) [164].
ESVS/ЕОК I B (УДД 4 УУР C)
Комментарий: при определенных обстоятельствах может потребоваться продолжение двойной дезагрегантной терапии (ДААТ) (см. контроль сердечного риска), но это, вероятно, будет касаться пациентов с высоким риском, у которых необходимо тщательно оценивать соотношение рисков при реконструкции АБА [146]. Опыт проведения двойной терапии, включающей более мощные антитромботические средства, такие как #прасугрел (АТХ: B01AC22) в дозе 10 мг по 1 таб. в сут. перорально и #тикагрелор** (АТХ: B01AC24) в дозе 90 мг - 1 таб., 2 раза в сут. перорально, и реконструктивного вмешательства по поводу АБА весьма ограничен, но, вероятно, это связано с высоким риском серьезного кровотечения, и этого следует избегать [151, 165, 166]. Лечение антагонистами витамина К и прямыми пероральными антикоагулянтами (ПОАК) следует прекратить не менее чем за пять дней с контролем международного нормализованного отношения (МНО) и два дня до хирургического вмешательства соответственно с целью снижения риска значительного кровотечения. В зависимости от показаний к применению в периоперационном периоде в качестве антикоагулянтной терапии можно применять такой препарат короткого действия, как низкомолекулярный (НМГ) или нефракционированный гепарин (НФГ).
Отмена двойной антиагрегантной терапии (ДААТ)
Существует практика перевода больных с тиеноперидинов на НМГ за 5 - 7 дней до операции.
- ДААТ необходимо возобновить как можно скорее пациентам после операции по поводу АБА, по возможности - в течение 48 часов [75, 157].
РКО I C (УДД 5 УУР C)
Комментарий: при высоком риске тромбоза дается перорально нагрузочная доза 300 - 600 мг клопидогреля** однократно или 60 мг #прасугреля однократно или 180 мг #тикагрелора** однократно. При высоком риске послеоперационного кровотечения пероральная антиагрегантная терапия назначается через 48 - 72 часа. Для реверсии действия антиагрегантов (B01AC Антиагреганты кроме гепарина) используют гемотрансфузии, желательно под контролем агрегации тромбоцитов [75, 167].
- У пациентов, получающих ДААТ после интервенционной коронарной реваскуляризации, рекомендуется рассмотреть возможность отсрочки реконструкции аневризмы брюшной аорты до перевода на монотерапию. В качестве альтернативы, если возникает необходимость реконструкции АБА, можно рассмотреть возможность проведения ЭЛАБА на фоне ДААТ [168, 169].
ESVS/ЕОК IIb C (УДД 5 УУР C)
Комментарий: у пациентов, которым проводится интервенционная коронарная реваскуляризация перед реконструкцией АБА, риск тромбоза стента для коронарных артерий наиболее высок в течение первых 6 недель после стентирования коронарной артерии. По этой причине не следует отменять ДДАТ в этот период. Если использовались стенты для коронарных артерий с лекарственным покрытием, ДААТ не следует отменять в течение 6 месяцев [168, 170, 171], поэтому плановую реконструкцию АБА, как правило, следует по возможности отложить, если ДААТ должна быть отменена по причине хирургического вмешательства. В качестве альтернативы можно выполнить ЭЛАБА в сочетании с ДААТ. У пациентов с симптомной АБА и ИБС со сложными поражениями коронарных артерий одновременное коронарное шунтирование в условиях искусственного кровообращения или на работающем сердце без использования искусственного кровообращения (КШ) и открытая реконструкция АБА являются теоретическими вариантами при определенных обстоятельствах, но, как правило, ЭЛАБА, выполняемая под местной анестезией, предпочтительнее непосредственно после КШ.
Отмена тройной антитромботической терапии (ТААТ)
Отмена тройной антитромботической терапии должна проводиться в соответствии с действующими рекомендациями.
- Пациентам перед операцией по поводу АБА рекомендуется не прекращать прием небольших доз АСК** (АТХ: B01AC06) 75 - 100 мг, перорально, 1 таб., 1 раз в день, в случае возможности отмены в соответствии с действующими рекомендациями, клопидогрел** отменяется минимум за 5 дней (#тикагрелор** - за 3 - 5 дней, #прасугрел - за 7 дней), антикоагулянты (B01A Антитромботические средства) - за 24 - 48 - 72 ч. до вмешательства (в зависимости от степени риска возникновения кровотечения и клиренса креатинина) [157, 170, 172].
РКО I B (УДД 5 УУР C)
Ведение больных, получающих антитромботические средства
Антикоагулянтная терапия так же ассоциируется с повышенным риском развития кровотечений в интра- и послеоперационном периоде. У части больных с низким риском тромботических осложнений возможна отмена антикоагулянтов перед операцией, в этом случае необходимо знать правила их отмены. У другой части пациентов отменить антикоагулянты невозможно в связи с высоким риском тромбоза, поэтому единственным выходом может служить изменение препарата, его дозировки и времени назначения. Традиционно для длительного применения используют ПОАК.
Антагонисты витамина K
Долгие годы антагонисты витамина K (АВК: варфарин**) были единственными пероральными антикоагулянтами.
- Пациентам, которым перед хирургическим вмешательством нельзя отменять прием АВК в связи с высоким риском тромбоэмболических осложнений, рекомендуется переход (бридж-терапия или терапия "моста") на НМГ или НФГ [75, 167, 173].
РКО I B (УДД 5 УУР C)
Комментарий: существуют группы пациентов, которым нельзя отменять АВК в связи с высоким риском тромбоэмболических осложнений:
- больные с механическими клапанами сердца или с имплантированными биологическими клапанами (биопротез сердечного клапана трупный, стерильный***) в течение последних 3 мес.;
- больные после реконструкции митрального клапана в течение последних 3 мес.;
- больные после недавнего (последние 3 мес.) венозного тромбоза или эмболии;
- ФП с тяжелым митральным стенозом;
- пациенты с высоким риском тромбоэмболии (тромб левого желудочка, дефицит антитромбина, дефицит протеина C или/и S, наследственная тромбофилия) [75, 167, 173].
Эта категория пациентов нуждается в переходе (бридж-терапия или терапия "моста") на НМГ/НФГ.
Стандартно АВК отменяют за 3 - 5 дней до вмешательства (в зависимости от препарата; варфарин** отменяют за 5 - 7 дней). После этого необходимо ежедневное определение международного нормализованного отношения (МНО); МНО <= 1,5 означает, что можно оперировать пациента и начинать введение НМГ/НФГ на следующий день.
Коррекцию дозировки НМГ после подкожного введения препарата проводят в зависимости от массы тела пациента, почечной функции, лабораторного контроля не требуется. Больным с высоким риском развития венозных тромбоэмболий необходимо назначать терапевтические дозировки дважды в день. Последняя инъекция НМГ производится не ранее 12 часов до разреза.
У больных с механическими протезами клапанов (протез аортального клапана механический двустворчатый***, протез митрального клапана механический двустворчатый***) доказательств эффективного использования НФГ больше, поэтому возможно введение НФГ с последней инъекцией за 4 часа до разреза.
В послеоперационном периоде ведение НФГ/НМГ возобновляют вечером в день вмешательства, по гемостазу, обычно через 12 часов после операции. АВК также возобновляют в первый день после операции одновременно с НФГ/НМГ, определяя ежедневно МНО. Дозировка АВК остается прежней. При достижении МНО >= 2,0 НФГ/НМГ отменяют, в случае механического протеза в митральной позиции (протеза митрального клапана механического двустворчатого***) НФГ отменяют при МНО > 2,5 [75, 167, 173].
Пероральные антикоагулянты (ПОАК)
- Пациентам перед оперативным вмешательством рекомендуется стандартно при нормальном клиренсе креатинина отменять ПОАК за 2 - 3 периода полувыведения при операциях низкого риска кровотечения и за 4 - 5 - при операциях высокого риска, в т.ч. на аорте, то есть за 48 часов до вмешательства на аорте. При клиренсе креатинина менее 50 мл/мин дабигатрана этексилат** отменяют за 96 часов [75, 167, 173].
РКО IIa B (УДД 5 УУР C)
Комментарий: прием ПОАК при операции с минимальным и низким риском кровотечения возобновляется в день или на следующий день утром после операции, в случае операции с высоким риском кровотечений возобновление ПОАК через 2 дня и больше по гемостазу, с использованием "моста" [75, 167, 173].
- В периоперационном периоде пациентам при плановой реконструкции АБА не рекомендуется применение ДААТ или пероральных антикоагулянтов [151].
ESVS/ЕОК III C (УДД 5 УУР C)
Особенности антикоагулянтной терапии и профилактики ТГВ
Несмотря на то, что это общепринятая стратегия при проведении планового реконструктивного вмешательства по поводу АБА, интраоперационное внутривенное введение (НФГ) при открытой или эндоваскулярной реконструкции по поводу рАБА является спорным. Риск усиления кровотечения следует сопоставлять с преимуществами, связанными с противоэмболическим действием НФГ [174, 175]. Независимо от того, проводится ли системная антикоагулянтная терапия с самого начала, следует серьезно рассмотреть вопрос о введении (НФГ) и проведении системной антикоагулянтной терапии во время ЭЛАБА сразу же после полного исключения аневризма из кровотока (когда еще не извлечена система доставки и интродьюсеры) или обеспечения контроля аорты с помощью БОА. Если антикоагулянтная терапия не проводится во время хирургического вмешательства, может потребоваться тромбэктомия (тромбэмболэктомия из подвздошных и бедренных артерий) или переход на открытую операцию в связи с развитием внутрисосудистого тромбоза.
- При реконструкции разорванной аневризмы брюшной аорты рекомендуется интраоперационное введение системного антикоагулянта (НФГ) после купирования кровотечения из места разрыва [151].
ESVS/ЕОК IIa C (УДД 5 УУР C)
- Пациентам, перенесшим реконструктивное вмешательство по поводу рАБА рекомендовано проводить профилактику ТГВ в зависимости от соотношения риска развития ТГВ и риска кровотечений [176, 177].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Комментарий: Обоснованным подходом является механическая профилактика с использованием изделий для последовательной компрессии до тех пор, пока риск большого кровотечения не уменьшится. После снижения высокого риска большого кровотечения можно начинать медикаментозную профилактику НМГ или НФГ. У большинства пациентов ее можно безопасно начинать в течение 24 - 48 часов после операции при отсутствии признаков продолжающегося кровотечения или клинически значимой коагулопатии [178]. Такую профилактику следует продолжать на протяжении всего срока госпитализации, а у некоторых пациентов и после выписки, в зависимости от индивидуальных факторов риска и уровня мобилизации [178, 179].
Системная антибиотикопрофилактика
Многочисленные рандомизированные исследования показали преимущества антибиотикопрофилактики при проведении реконструктивных хирургических вмешательств на артериях [180]. В связи с этим показано проведение периоперационной внутривенной антибактериальной профилактики как перед открытой, так и перед эндоваскулярной реконструкцией АБА, при этом выбор препарата основывается на местных институциональных руководящих принципах.
- Всем пациентам, которым проводится открытая или эндоваскулярная реконструкция аневризмы брюшной аорты, рекомендуется периоперационная системная антибактериальная профилактика, для профилактики инфекционных осложнений [180].
ESVS/ЕОК I A (УДД 1 УУР C)
3.2 Хирургическое лечение
Пороговое значение размера аневризмы для плановой реконструкции АБА
Непосредственное решение о размере аневризмы, при котором следует проводить реконструктивное вмешательство, основано на соотношении между риском разрыва аневризмы (который по-прежнему приводит к летальному исходу в > 80% случаев) [107, 181] и риском послеоперационной смертности при реконструкции аневризмы.
В исследованиях CAESAR и PIVOTAL были четко определены стратегии в отношении проведения хирургического вмешательства для групп наблюдения, в дополнение к достижению порогового значения диаметра: они включали быстрый рост аневризмы (> 1 см в год и появление симптомов, характерных для аневризмы) [182].
- При быстром росте аневризмы брюшной аорты (>= 1 см/год) рекомендуется направить пациента к врачу-сердечно-сосудистому хирургу в срочном порядке, а также провести дополнительную визуализацию АБА [183 - 185].
ESVS/ЕОК IIa C (УДД 4 УУР C)
- Пациентов с симптомной аневризмой брюшной аорты рекомендуется направлять к врачу-сердечно-сосудистому хирургу в экстренном порядке [183, 186, 187].
ESVS/ЕОК I C (УДД 3 УУР A)
Показания к хирургическому вмешательству
Исходя из результатов наблюдения за больными с малыми АБА, на современном этапе оперативное лечение АБА показано при достижении ее диаметра 5,5 см (внешнего), быстром росте (более 1 см в год) и появлении симптомов, связанных с АБА. Такая тактика считается безопасной. Тем не менее, в некоторых странах оперируются аневризмы и меньшего диаметра. Так происходит и в нашей стране, где пограничным считался диаметр 5,0 см [101]. Это показание наши эксперты вывели из результатов тех же исследований ADAM и UkSAT, в которых указывается, что более 80% аневризм при диаметре на момент скрининга 4,9 - 5,5 см в дальнейшем были прооперированы [188, 189].
Хирургическое лечение рекомендуется:
- мужчинам с АБА при диаметре аневризмы 5 - 5,5 см;
- женщинам с АБА и приемлемым хирургическим риском при диаметре аневризмы >= 4,5 - 5,0 см;
- пациентам с АБА при быстром росте аневризмы - более 1,0 см в год - срочное обращение к врачу-сердечно-сосудистому хирургу (прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный) для дополнительного обследования [71].
ESVS/ЕОК IIa C (УДД 5 УУР C)
Тактика ведения пациентов, не подходящих для раннего вмешательства по поводу АБА
Значительное число пациентов с АБА не подходят для реконструктивного вмешательства (в том числе ЭЛАБА) из-за наличия других сопутствующих заболеваний или ограниченной ожидаемой продолжительности жизни [190 - 192]. Для этих пациентов особое значение приобретают стратегии по снижению сердечно-сосудистого риска. Имеются данные наблюдений, позволяющие предположить, статины могут снижать риск разрыва большой АБА [50, 193] и что риск разрыва в два раза выше у текущих курильщиков [50, 193].
- У пациентов, которые изначально не являются кандидатами на реконструктивное вмешательство по поводу АБА, рекомендовано дальнейшее наблюдение, направление к другим врачам-специалистам для оптимизации их физического состояния и последующей повторной оценки [194, 195].
ESVS/ЕОК IIa C (УДД 2 УУР B)
Клинические системы оценки сопутствующих заболеваний
Одним из главных показателей исхода по-прежнему служат осложнения со стороны сердца, и для определения риска сердечных событий было разработано несколько систем клинической оценки [105, 196, 197]. Модифицированная система оценки, разработанная группой сосудистых исследований (Vascular Study Group of New England) (Приложение Г2) и недавно предложенная в практическом руководстве по АБА, основана на семи переменных для прогнозирования одной из категорий риска смертности у пациентов: низкий риск (0,12 - 1%), промежуточный риск (1,7 - 4,9%), высокий риск (8 - 20%) и чрезвычайно высокий риск (31 - 70%) [8, 72, 198]. Эта система была валидирована для инфраренальных аневризм и не изучалась при сложных аневризмах аорты.
Оценка и оптимизация операционных рисков
Открытая реконструкция аорты классифицируется как вмешательство с высоким риском (определяемое как связанный риск смерти от сердечно-сосудистых заболеваний или инфаркта миокарда 5% и более в течение 30 дней), тогда как ЭЛАБА классифицируется как вмешательство промежуточного риска с сердечным риском в пределах 1 - 5% [72].
Существует подробное руководство по оценке и снижению операционных рисков [75], краткое изложение которого было недавно представлено [199], и к которому следует обращаться для получения подробной информации. В этом разделе представлен широкий обзор соответствующих факторов, которые следует учитывать при выполнении реконструкции аорты.
Контроль сердечного риска
Осложнения со стороны сердца являются причиной более 40% периоперационных летальных исходов после внесердечных хирургических вмешательств [200 - 202], поэтому уровень сердечного риска следует оценивать с клинической точки зрения [97, 203].
При активном течении сердечно-сосудистого заболевания, такого как нестабильная стенокардия, декомпенсированная сердечная недостаточность, тяжелые клапанные пороки и выраженная аритмия, перед планированием реконструкции АБА требуется дополнительное заключение врача-кардиолога и назначение соответствующего лечения.
- Рекомендуется консультация врача-кардиолога (Прием (осмотр, консультация) врача-кардиолога первичный), включающее неинвазивную оценку дисфункции левого желудочка, заболеваний сердечных клапанов и ишемии миокарда в рамках предоперационного обследования пациентов с АБА [75, 105].
ESVS/ЕОК I B (УДД 5 УУР C)
Комментарий: коронарография, должна выполняться по тем же показаниям, что и при нехирургических вмешательствах, и не использоваться рутинно для оценки периоперационного риска перед хирургическим вмешательством на аорте [75].
- Не рекомендуется рутинное направление пациентов с АБА на кардиологическое обследование, коронарографию и эргоспирометрию до реконструкции аневризмы брюшной аорты [75, 105].
ESVS/ЕОК III B (УДД 5 УУР C)
- У пациентов с тяжелым стенозом аортального клапана рекомендуется обследование, консультация врача-сердечно-сосудистого хирурга (Прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный) для решения вопроса о протезировании аортального клапана в условиях искусственного кровообращения/эндоваскулярное протезирование аортального клапана до плановой реконструкции аневризмы брюшной аорты [75, 105, 204, 205].
ESVS/ЕОК I B (УДД 5 УУР C)
Комментарий: стеноз аортального клапана является наиболее значимым клапанным пороком сердца в контексте реконструкции АБА, поскольку он увеличивает риск, связанный с кровопотерей, объемными нарушениями и аритмией. У пациентов с тяжелым стенозом аортального клапана (определяемым как средний градиент > 40 мм рт. ст., площадь клапана < 1 см2 и пиковая скорость потока > 4,0 м/с) следует рассмотреть возможность протезирования аортального клапана в условиях искусственного кровообращения/эндоваскулярное протезирование аортального клапана до плановой реконструкции АБА [75, 105, 204, 206, 207].
Периоперационное ведение пациентов с ишемической болезнью сердца, застойной болезнью сердца в соответствии с действующими рекомендациями [75, 105, 157, 208, 209].
Контроль функции почек
Послеоперационное нарушение функции почек приводит к удлинению сроков госпитализации и является известным предиктором высокой частоты осложнений и смертности в отдаленном периоде [75, 76, 100, 210]. К группе особого риска относятся пациенты с предшествующей почечной недостаточностью, застойной болезнью сердца, хронической обструктивной болезнью легких (ХОБЛ), окклюзионным заболеванием периферических артерий (ОЗПА), сахарным диабетом или артериальной гипертензией [97, 211, 212]. В контексте открытой или эндоваскулярной реконструкции АБА предшествующее нарушение функции почек является одним из наиболее важных предикторов периоперационной заболеваемости и смертности [77, 213, 214].
- Пациентам с почечной недостаточностью рекомендуется адекватная гидратация перед плановой реконструкцией аневризмы брюшной аорты. После реконструкции аневризмы брюшной аорты рекомендуется контроль расчетной скорости клубочковой фильтрации, поступления жидкости и диурез с целью выявления снижения функции почек и определения дальнейшей тактики ведения [75, 76].
ESVS/ЕОК I C (УДД 5 УУР C)
- При эндоваскулярной реконструкции сложной аневризмы брюшной аорты рекомендуется использовать стратегию сохранения функции почек путем снижения дозы рентгенконтрастного средства, содержащего йод, отмены нефротоксичных препаратов и обеспечения достаточной гидратации [151].
ESVS/ЕОК IIa C (УДД 5 УУР C)
Стенозы сонных артерий тактика
- У пациентов с аневризмой брюшной аорты и сопутствующим симптомным стенозом сонных артерий рекомендуется рассмотреть необходимость хирургического вмешательства на сонных артериях перед реконструкцией аневризмы [103].
ESVS/ЕОК IIa A (УДД 5 УУР C)
Комментарий: пациентам с симптомным стенозом внутренней сонной артерии (< 6 месяцев) требуется лечение стеноза сонной артерии до реконструкции АБА для снижения общего риска инсульта. Для диагностики и терапевтического лечения симптомного заболевания сонных артерий следует обращаться к соответствующим руководствам [102, 103].
- Рутинное профилактическое вмешательство на сонных артериях при бессимптомном стенозе сонных артерий перед реконструкцией аневризмы брюшной аорты не рекомендуется [103].
ESVS/ЕОК III C (УДД 5 УУР C)
Комментарий: профилактическая предоперационная каротидная эндартерэктомия или стентирование брахиоцефальных артерий не оказывает благоприятного эффекта у пациентов с бессимптомным стенозом сонной артерии даже при тяжелом поражении [103].
Плановая реконструкция АБА
Выбор хирургической тактики
- Плановую открытую хирургию АБА рекомендуется проводить в стационарах с ежегодным объемом не менее 10 - 20 операций в год. При меньшем объеме рекомендуется направлять пациента с АБА в специализированный областной или федеральный центр для плановой хирургии АБА [215 - 221].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Комментарии: Выбор хирургического метода должен обсуждаться между лечащим врачом и пациентом, и необходимо учитывать ряд факторов при составлении индивидуального плана лечения пациента. К ним относятся:
- благоприятная анатомия для ЭЛАБА;
- физиологические резервы и отсутствие медицинских противопоказаний для проведения хирургического вмешательства;
- ожидаемая продолжительность жизни;
- предпочтения пациента;
- потребности и ожидания, включая важность сексуальной функции и предполагаемое соблюдение требований в отношении высокой периодичности наблюдения в течение всей жизни и последующего наблюдения.
Таким образом, решение о том, в каких случаях и каким методом проводить хирургическое вмешательство по поводу АБА, является чрезвычайно сложным, и необходимо учитывать множество факторов и принимать решение индивидуально [222].
- У большинства возрастных пациентов с подходящей анатомией и средней в популяции ожидаемой продолжительностью жизни эндоваскулярная реконструкция аневризмы брюшной аорты рекомендуется как предпочтительный метод лечения [194, 195, 222 - 239].
ESVS/ЕОК I A (УДД 1 УУР B)
- У большинства пациентов с большой ожидаемой продолжительностью жизни открытая реконструкция аневризмы брюшной аорты рекомендуется как предпочтительный метод лечения [226, 229 - 233, 240 - 242].
ESVS/ЕОК I A (УДД 1 УУР B)
Комментарий: несмотря на то, что ЭЛАБА следует считать предпочтительным методом лечения у большинства пациентов, целесообразно рассматривать ОХ в качестве стратегии первой линии у пациентов более молодого возраста, не имеющих медицинских противопоказаний, с ожидаемой продолжительностью жизни > 10 - 15 лет. Расчетная (средняя) выживаемость после плановой реконструкции АБА составляет приблизительно 9 лет [243].
- У пациентов с ограниченной ожидаемой продолжительностью жизни (например, пациентам с неизлечимой формой рака или тяжелой сердечной недостаточностью) не рекомендуется проведение плановой реконструкции аневризмы брюшной аорты [194, 224].
ESVS/ЕОК III B (УДД 2 УУР B)
Отбор пациентов для ЭЛАБА
На основании диаметра аорты и длины целевой проксимальной зоны имплантации осуществляется выбор основного аортального стент-графта*** и оценку соответствия проксимальной зоны имплантации стент-графта*** согласно инструкции по пользованию. Другие характеристики: ангуляция проксимальной шейки аневризмы, наличие тромбов, геометрическая конфигурация (т.е. параллельные стенки) и кальцификация.
Для определения размеров и планирования сохранения боковых ветвей следует точно измерить расстояния на основе изображений криволинейных плоскостных реконструкций или многоплоскостных реконструкций с выпрямленной центральной линией потока.
Сильно выраженная извитость сосудов и небольшой диаметр подвздошных артерий (менее 6 мм) - первый фактор, препятствующий проведению стандартного ЭЛАБА.
С точки зрения возможности проведения стандартного эндоваскулярного лечения аорты важным фактором является конфигурация шейки аневризмы. По данным Дельфийского консенсуса, опубликованного в 2019 году, описано пять критериев неблагоприятной анатомии шейки аневризмы: диаметр, ангуляция, коническая форма и длина шейки аневризмы, а также наличие циркулярного кальциноза [244, 245]
- Проведение стандартного эндоваскулярного лечения аорты не рекомендовано пациентам с АБА при следующих параметрах шейки аневризмы: длина менее 10 мм, ширина более 32 мм, угол шейки острее 75°, циркулярный кальциноз более 50%, а также коническая форма [244, 245].
ESVS/ЕОК - нет (УДД 5 УУР C)
3.2.1 Эндоваскулярное лечение аневризм брюшной аорты
Сложные АБА
Под сложными АБА (Рисунок 5; Таблица 2) понимают аневризмы с вовлечением почечных или брыжеечных артерий, которые распространяются до уровня чревного ствола или диафрагмы, но не переходят на грудной отдел аорты [196].
Для сложных АБА часто используется анатомическая система классификации, которая включает описание инфраренальных аневризм аорты с короткой шейкой, длиной 4 - 10 мм [246] и юкстаренальных аневризм аорты, определяемых по длине инфраренальной шейки <= 4 мм, которые достигают почечных артерий, но не выходят за их пределы [247]. В этих двух подгруппах почечные артерии отходят от нормальных сегментов аорты и не связаны с аневризмой. Параренальные аневризмы аорты характеризуются вовлечением как минимум одной из почечных артерий и распространяются до ВБА, но не выше. Парависцеральные аневризмы аорты характеризуются вовлечением почечных артерий и ВБА, но не чревного ствола. Часто используется термин "супраренальная аневризма аорты", который объединяет параренальные и парависцеральные аневризмы аорты в одну категорию. Под торакоабдоминальными аневризмами IV типа понимают проксимальное распространение аневризмы до уровня чревного ствола или диафрагмы.
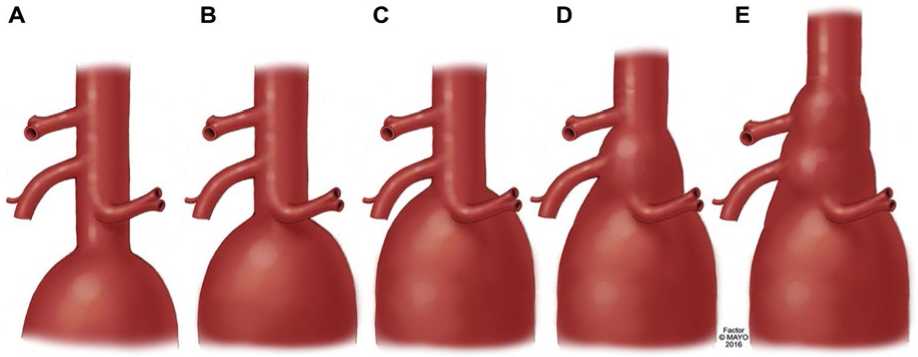
Рисунок 5. Классификация аневризм брюшного отдела аорты (АБА), включая инфраренальные с короткой шейкой (< 10 мм) (A), юкстаренальные (B), параренальные (C), парависцеральные (D) аневризмы и аневризмы торакоабдоминального отдела аорты IV типа (E).
- Чрескожный доступ при эндоваскулярной реконструкции аневризмы брюшной аорты рекомендуется выполнять под контролем визуализирующих методов [248 - 251].
ESVS/ЕОК IIa A (УДД 1 УУР A)
- При плановой эндоваскулярной реконструкции аневризмы брюшной аорты рекомендуется рассмотреть возможность применения регионарной, а не тотальной внутривенной анестезии [151, 252 - 254].
ESVS/ЕОК IIb C (УДД 4 УУР C)
Анатомические факторы, влияющие на тактику ЭЛАБА
Добавочные почечные артерии
- При эндоваскулярной реконструкции аневризмы рекомендуется, по возможности, сохранять крупные добавочные почечные артерии (> 4 мм) или артерии, кровоснабжающие значительную часть почки (> 1/3) [151, 255].
ESVS/ЕОК IIa C (УДД 3 УУР C)
Комментарий: В клинических рекомендациях ESVS и SVS предлагается поддерживать проходимость добавочных почечных артерий диаметром более 4 мм как при открытом, так и при эндоваскулярном лечении АБА добавочные почечные артерии (ДПА) присутствуют у 9 - 16% пациентов, которым проводится ЭЛАБА, при этом, примерно, в половине случаев выполняется их окклюзия [255]. Потенциальными последствиями являются: инфаркт почки с риском ухудшения функции почек (особенно при предшествующей почечной недостаточности) и риск стойкого эндоподтекания типа II [256] в качестве приоритетного варианта лечения АБА следует рассматривать открытое вмешательство.
Пристеночный тромб в аорте
- Для прогнозирования риска эмболизации во время эндоваскулярных процедур рекомендуется использовать количественную оценку пристеночного тромба аорты (ПТА) [257, 258].
РКО IIa C (УДД 4 УУР C)
Комментарии: для упрощения оценки ПТА в клинической практике, Ribeiro и соавт. [257] предложили систему классификации на основе шкалы от 0 до 10 для количественной оценки типа тромба (т.е. гладкий или неправильный), толщины, вовлеченной области, распространения по окружности и количества пораженных сегментов (Рисунок 6). Для получения оценки по этой системе выполняют анализ наиболее тяжело пораженного сегмента аорты с использованием осевых срезов. Этот сегмент выбирают после изучения аорты по всей длине.
Рисунок 6. Измерение пристеночного тромба в аорте (ПТА) с использованием количественной оценки методом компьютерной томографической ангиографии (КТА) на основе количества сегментов, пораженных тромбом, а также типа, толщины, площади и окружности тромба.
Оценка возможности подвздошно-бедренного доступа
- Как и при любой эндоваскулярной процедуре на аорте, пациентам с АБА рекомендуется выполнение ультразвукового дуплексного сканирования артерий нижних конечностей и компьютерно-томографической ангиографии брюшной аорты и подвздошных сосудов для определения возможности доставки имплантируемых устройств [53, 259].
РКО I C (УДД 4 УУР C)
Комментарий: Значительная доля нежелательных явлений, возникающих при ЭЛАБА, связана с осложнениями доступа. Чтобы избежать таких осложнений, необходимо выполнить оценку диаметра, длины и других морфологических особенностей подвздошной и бедренной артерий [53].
Варианты сохранения ветвей брюшной аорты
Параллельные стент-графты***
Известные в настоящее время методики CHIMPS ("дымоход" - chimney, "перископ" - periscope и "сэндвич" - sandwich), не имеют конкретных показаний к применению, а стандартизация практики между центрами отсутствует [260 - 266].
- Для первичных, одно-, двух- или многоэтапных и вспомогательных процедур пациентам с АБА рекомендуется указать время выполнения: в предоперационном, интраоперационном или послеоперационном периоде [267, 268].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий:
Описание методов сохранения ветвей брюшной аорты
Наблюдается все более частое использование поэтапных и вспомогательных процедур с целью увеличения зон имплантации или снижения риска осложнений, таких как повреждение спинного мозга [267 - 275]. На основании этого можно выделить следующие типы процедур: первичные, поэтапные и вспомогательные.
Первичная процедура. Основной, или первичной, считается процедура, которая вносит наибольший вклад в лечение заболевания аорты, по поводу которой проводится операция, включающая сохранение почечных и брыжеечных артерий, независимо от выбранной методики. Первичная процедура может быть выполнена за один сеанс (одноэтапная), за два (двухэтапная) и более сеансов, включая плановые последующие вмешательства, такие как окклюзия питающей ветви аневризматического мешка [262, 265]. Эти последующие ожидаемые процедуры не следует описывать как "запланированные вторичные вмешательства", поскольку они являются обязательным компонентом запланированной поэтапной стратегии реконструкции.
Одно-, двух- или многоэтапные процедуры. Термин "одноэтапная процедура" описывает лечение заболевания аорты за одну операцию. И применяется при использовании второй вспомогательной операции до или после основной процедуры. В этих случаях указывают основную операцию, как описано выше, а также конкретные показания для дополнительных операций.
Вспомогательные процедуры. Вспомогательной процедурой называется любая другая процедура, предназначенная для улучшения эффектов основной процедуры. К таким процедурам относятся хирургический дебранчинг сегмента аорты с помощью шунтирования (например, сонно-сонное шунтирование, подвздошно-чревное шунтирование), стентирование артериальной ветви (например, при исходном наличии стеноза), эмболизация межреберной артерии, усиление проксимальной фиксации при помощи голометаллических непокрытых аортальных стентов.
Новое поколение стент-графтов***
- Для эндоваскулярных стент-графтов для абдоминальной аорты*** новых поколений на основе существующих платформ, в частности низкопрофильных изделий, рекомендуется долгосрочное наблюдение и оценка долговечности в проспективных регистрах [276 - 278].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий: когда в клинической практике используются обновления существующих платформ, необходимо признать необходимость долгосрочного последующего наблюдения, и оценку в проспективных регистрах с полным последующим наблюдением [277, 278].
Альтернативная концепция, называемая эндоваскулярной герметизацией аневризмы (EVAS), заключается в полном перекрытии аневризматического мешка аорты. При этом используются наполненные полимером полиуретановые мешки, окружающие баллонорасширяемые стенты, покрытые ПТФЭ. Этот подход был разработан для предотвращения некоторых осложнений ЭЛАБА, в том числе эндоподтекания и миграции стент-графта***.
Новые и дополнительные методы сохранения ветвей брюшной аорты
- При необходимости выполнения фенестраций или имплантации параллельных стент-графтов эндоваскулярных для абдоминальной аорты***. Во время ЭЛАБА рекомендуется рассмотреть возможность использование анкеров*** [279].
РКО IIb B (УДД 4 УУР C)
Комментарий: для обеспечения надежной фиксации стент-графтов***, если ожидается, что проксимальная герметизация после ЭЛАБА будет недостаточной из-за короткой или ангулированной шейки, анкеры***. Во многоцентровом регистре из 208 случаев первичного профилактического использования фиксаторов технический отказ (3/57, 5,3%) и эндоподтекание типа I (2/45, 4,4%) чаще встречались у пациентов с шейкой аорты < 10 мм по сравнению с > 10 мм: один из 95 (1,1%) и один из 73 (1,4%) соответственно [279]. В среднем через 14 месяцев последующего наблюдения у 130 пациентов распространенность эндоподтекания типа Ia составила 1,5% (n = 2).
Специфические поздние осложнения эндоваскулярного лечения
Долгосрочный исход при использовании стент-графтов для абдоминальной аорты** (с дополнительными компонентами - бранши и модификациями - фенестрированный), ЭЛАБА, выполняемой с параллельными графтами с висцеральными артериями, а также новых концепций, в частности герметизации аневризмы [280], может отличаться от исхода при использовании стандартных изделий. Следовательно, для этих сложных процедур ЭЛАБА и новых технологий может потребоваться изменение графиков последующего наблюдения.
Значимые нежелательные явления [281, 282]:
- Смертность от всех причин;
- Инфаркт миокарда;
- Дыхательная недостаточность с необходимостью длительной (> 24 часов относительно ожидаемой) искусственной вентиляции легких или повторной интубации трахеи;
- Снижение функции почек в виде снижения рСКФ более чем на 50% относительно исходного уровня или впервые начатого диализа;
- Ишемия кишечника, которая требует хирургической резекции или не устраняется медикаментозной терапией;
- Обширный инсульт;
- Параплегия (3 степени).
Осложнения со стороны отдельных систем
Послеоперационные осложнения в соответствии стандартам предоставления отчетности по эндоваскулярному лечению АБА и ТАА, включает следующую классификацию:
- Легкая степень: осложнение разрешилось самостоятельно или с незначительным вмешательством и не привело к увеличению длительности госпитализации или к развитию необратимого ухудшения;
- Средняя степень: осложнение потребовало значимого вмешательства или продления госпитализации более чем на 24 часа и привело к незначительному стойкому нарушению жизнедеятельности, не влияющему на нормальную повседневную деятельность;
- Тяжелая степень: осложнение требует серьезного хирургического вмешательства или лечения, может сопровождаться длительным периодом восстановления и обычно связано с длительным или стойким нарушением жизнедеятельности, или приводит к смерти.
Эндоподтекания
Эндоподтекание (Endoleak) означает наличие кровотока в аневризматическом мешке за пределами трансплантата после ЭЛАБА [283], что встречается приблизительно в одной трети случаев [284], хотя распространенность зависит от типа используемого стент-графта, а также от визуализирующего исследования, выполняемого во время последующего наблюдения. Классификация эндоподтеканий была предложена в стандартах предоставлений отчетности по ЭЛАБА [260, 285, 286]. Пересмотренная система классификации обобщена на Рисунке 7.
Рисунок 7. Классификация эндоподтеканий. НБА - нижняя брыжеечная артерия.
Классификация эндоподтеканий была пересмотрена в связи в том числе в связи с сохранением боковых ветвей.
Эндоподтекания I типа. Эндоподтекание I типа по определению связаны с сохранением канала снаружи стент-графта*** и, следовательно, с недостаточной герметизацией в местах прикрепления аортального стент-графта*** и его модульных компонентов. В новой предложенной классификации используются буквенные категории A, B и C для обозначения мест прикрепления фенестрированных, браншированных или параллельных стент-графтов*** в проксимальном, дистальном отношении и в целевом сосуде. Классификация эндоподтеканий типа IC расширяет предыдущее определение эндоподтеканий, связанных с подвздошным окклюдером, который используется в редких случаях.
Стойкий прямой кровоток в аневризматическом мешке из-за ненадлежащего проксимального (тип IA) или дистального (тип IB) прилегания стент-графта*** представляет опасность и связан с высоким риском разрыва аневризмы [287, 288]. Прямой кровоток также может возникать из-за отсутствия герметизации в области окклюдера для закрытия подвздошных артерий (тип IC), при односторонней аорто-подвздошной реконструкции и перекрестном имплантате. Эндоподтекание типа I требует незамедлительного вмешательства, с целью исключения аневризмы из кровообращения под давлением.
- У пациентов с эндоподтеканием типа I после эндоваскулярной реконструкции аневризмы брюшной аорты рекомендуется оценить необходимость повторного вмешательства для достижения герметизации, прежде всего эндоваскулярными методами [287, 288].
ESVS/ЕОК IIa C (УДД 4 УУР C)
- При эндоподтекании в проксимальной зоне фиксации протеза после эндоваскулярной реконструкции аневризмы брюшной аорты из всех методик эндоваскулярного вмешательства, в первую очередь, рекомендуется расширение проксимальной зоны имплантации стент-графта*** с использованием фенестрированных и браншированных изделий [151, 289 - 295].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Эндоподтекания II типа. Эндоподтекания II типа связаны с ретроградным кровотоком в аневризматический мешок. Зачастую они представляют собой сложные эндоподтекания с несколькими каналами притока и оттока. Ретроградный кровоток может поступать из поясничных артерий, нижней брыжеечной артерии, добавочных почечных артерий или других коллатеральных сосудов. Поскольку между ВБА и чревной артерией имеется устойчивое коллатеральное сообщение, эндоподтекание II типа может возникнуть из чревного ствола, если для этого сосуда отсутствует фенестрация или бранша и не выполнено стентирование. Часто он самопроизвольно прекращается, а риск разрыва низок (< 1%) [284, 296, 297]. При наличии расширения аневризматического мешка из-за подозрения на эндоподтекание типа II необходимо провести соответствующее визуализирующее исследование, чтобы исключить другие причины увеличения, например ненадлежащая герметизация или эндоподтекание типа III (соединение, целостность протеза или отверстия от швов) [297].
Описаны различные методы лечения эндоподтекания типа II. Эндоваскулярное лечение заключается в трансартериальной, транслюмбальной, транскавальной эмболизации аневризматического мешка и питающих сосудов. Для лечения эндоподтекания типа II используют несколько материалов для эмболизации [281]. Эндоваскулярное лечение успешно в 60 - 80% случаев; однако четкое определение успешного вмешательства отсутствует, что может повлиять на интерпретацию этих результатов. Согласно систематическому обзору, транслюмбальная эмболизация может иметь более высокий уровень успеха при меньшем количестве осложнений [297].
- Расширение аневризматического мешка в диаметре на >= 1 см, выявляемое при последующем наблюдении после эндоваскулярной реконструкции аневризмы брюшной аорты с использованием одного визуализирующего метода и методики измерения, рекомендуется рассматривать как обоснованное пороговое значение значимого увеличения [71].
ESVS/ЕОК I B (УДД 5 УУР C)
- Вопрос о повторном вмешательстве по поводу эндоподтекания типа II после эндоваскулярной реконструкции аневризмы брюшной аорты, главным образом эндоваскулярными методами, рекомендуется рассматривать при наличии значимого роста аневризмы [71, 297].
ESVS/ЕОК I B (УДД 3 УУР B)
- При сохраняющемся увеличении аневризматического мешка после попытки (попыток) эндоваскулярного устранения эндоподтеканий II типа рекомендуется плановая конверсия в открытое вмешательство с сохранением или удалением стент-графта*** [151, 298 - 300].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Эндоподтекания III типа. Эндоподтекания III типа могут возникать в результате отсоединения, стент-графта***, недостаточного перекрытия, разрыва или отсоединения ткани. Для обозначения локализации эндоподтекания в конкретном модульном компоненте также используют буквы A, B и C. Эндоподтекание типа IIIA описывает недостаточное перекрытие или соединение между любыми из модульных компонентов в аорте или подвздошных сосудах, включая любой проксимальный стент-графт*** грудного отдела аорты, фенестрированный или браншированный компонент. Эндоподтекание типа IIIB по-прежнему определяют как разрыв ткани протеза, который может быть дополнительно охарактеризован как незначительный (< 2 мм) или крупный (>= 2 мм). Наконец, новую категорию типа IIIC определяют как недостаточное перекрытие или соединение, либо разъединение между одним или несколькими соединительными стентами (трубки соединительные) целевого сосуда или между соединительным стентом (трубкой соединительной) целевого сосуда и манжетой или фенестрацией аортального эндопротеза.
- У пациентов с эндоподтеканием типа III после эндоваскулярной реконструкции аневризмы брюшной аорты рекомендуется оценить необходимость повторного вмешательства, главным образом эндоваскулярными методами [287].
ESVS/ЕОК I C (УДД 3 УУР B)
Эндоподтекания IV типа. Под эндоподтеканиями IV типа понимают наличие кровотока через неповрежденный аортальный стент-графт, обусловленное пористой тканью, в течение первых 30 дней после процедуры. Это обозначение не применимо к разрывам ткани протеза или сохранению кровотока через ткань в течение более чем 30 дней, что следует классифицировать как эндоподтекание типа IIIB.
Неопределенное эндоподтекание. Термином "неопределенное эндоподтекание" обозначают эндоподтекания, которые обнаруживают при визуализирующих исследованиях, но которые не имеют определенного источника.
Эндотензия. Увеличение аневризматического мешка более чем на 5 мм без признаков эндоподтекания при визуализирующих исследованиях классифицируют как эндотензию. Она может возникать вследствие эндоподтекания, которое не определяется из-за неоптимального проведения визуализирующих исследований или ограничений доступных методов визуализирующих исследований.
Эндотензия может привести к разрыву АБА, хотя это случается крайне редко, и в литературе описаны только единичные случаи [287].
- Значимое увеличение размера аневризматического мешка после эндоваскулярной реконструкции аневризмы брюшной аорты без видимого эндоподтекания по результатам стандартного визуализирующего исследования рекомендуется рассматривать в качестве основания для дополнительного диагностического обследования с использованием альтернативных методов визуализации, чтобы исключить наличие неидентифицированного эндоподтекания, при этом также рекомендуется проведение соответствующего лечения [71, 287, 301 - 303].
ESVS/ЕОК I C (УДД 4 УУР C)
- При наличии эндоподтекания, сопровождающегося увеличением сердечного выброса, сердечной недостаточностью или эмболией легочной артерии, после эндоваскулярной реконструкции аневризмы брюшной аорты с разрывом в нижнюю полую вену рекомендуется рассмотреть возможность эндоваскулярного закрытия аорто-кавальной фистулы [151].
ESVS/ЕОК IIb C (УДД 5 УУР C)
Комментарии: Изменение диаметра аневризматического мешка следует описывать за конкретный период последующего наблюдения. В отчетах о сложной эндоваскулярной реконструкции аорты также следует указывать клиническую корреляцию диаметра аневризматического мешка и наличия эндоподтеканий или других осложнений. Поскольку размер может изменяться в каждом из трех измерений, важными параметрами являются как объем, так и диаметр мешка. Под "увеличением" или "сокращением аневризматического мешка" понимают увеличение или уменьшение диаметра более чем на 5 мм или измеренного объема более чем на 5% соответственно.
Миграция стент-графта*** обычно определяется как смещение стент-графта*** на > 10 мм по сравнению с фиксированными анатомическими ориентирами, подтвержденными на реконструкциях КТ-изображений по осевой линии потока, или любая миграция, приводящая к появлению симптомов или повторному вмешательству [304]. Миграция может привести к эндоподтеканию I типа, разъединению модулей стент-графта***, его перекручиванию и окклюзии. Факторами риска проксимальной миграции являются короткая проксимальная фиксация, изогнутая шейка, большой размер аневризмы и тип стент-графта*** [304 - 306]. Роль чрезмерного размера является спорной, однако есть признаки того, что превышение размера стент-графта*** больше чем на 30% относительно номинального может повышать риск миграции [307, 308]. Прогрессирование заболевания с расширением шейки может быть причиной поздней миграции и связано с исходным диаметром шейки [309].
В Таблице ПБ-2 обобщены важные показатели морфологических и технических исходов, включая диаметр, длину, объем, эндоподтекание, размеры места прикрепления, смещение, извитость и морфологию ветвей сосудов.
3.2.2 Открытая реконструкция
Показания к открытой хирургической реконструкции
Основные показания к проведению ОХ АБА:
- Дегенеративные АБА с благоприятной анатомией при невысоком риске смертельного исхода и осложнений, и высокой ожидаемой продолжительности жизни
- Дегенеративные АБА с неблагоприятной анатомией (ЮАБА) при невысоком риске смертельного исхода и осложнений
- Воспалительные АБА при выраженном гидронефрозе и предположительно низком риске смертельного исхода и осложнений
- Микотические АБА
- Тромбированные АБА и сочетание АБА и синдрома Лериша
- АБА при наличии добавочных почечных артерий
- АБА у пациентов с наследственными заболеваниями соединительной ткани
- Проведение ОЛ в отдаленном периоде после ЭЛАБА
- Разрыв АБА в условиях:
- выраженной нестабильности гемодинамики;
- неблагоприятной анатомии;
- наличия обширной забрюшинной гематомы;
- наличия первичной аорто-дуоденальной фистулы.
Типы протезов
Нет никаких данных, позволяющих предположить, что какой-либо один протез будет лучше другого [306].
В хирургии инфраренальной АБА могут применяться как вязаные синтетические сосудистые протезы (Dacron), так и из вспененного политетрафторэтилена (PTFE). В хирургии юкста- и супра-ренальной аорты - только вязаные сосудистые протезы.
Хирургический доступ
- Решение о варианте доступа к брюшной аорте пациентам с АБА рекомендовано принимать с учетом предпочтений врача-хирурга и факторов связанных с (в т.ч. желании) пациентом [310].
ESVS/ЕОК I C (УДД 2 УУР A)
Комментарий: Срединная лапаротомия (по белой линии живота от мечевидного отростка до лобка) является широко используемой техникой из-за ее гибкости и возможности относительно легкого доступа ко всем органам брюшной полости. Альтернативным доступом является поперечный подреберный разрез ниже грудной клетки, обеспечивающий хороший доступ к юкстаренальной, супраренальной и чревной частям аорты. В Кокрановском обзоре, однако, не было обнаружено клинически значимой разницы между срединным и поперечным разрезами при общих хирургических вмешательствах на органах брюшной полости [311], что было подтверждено в более позднем РКИ [310].
Основные принципы открытого протезирования аорты
Чтобы свести к минимуму риск тромбоза из-за стаза, НМГ\НФГ, как правило, вводят системно перед поперечным пережатием. Приемлемые дозы находятся в диапазоне от 50 до 100 МЕ/кг [312], а эффективность гепарина натрия** можно проверить на основании результатов анализа активированного времени свертывания крови (АВС) для обеспечения адекватной антикоагулянтной активности [313]. После восстановления периферической перфузии может быть введена расчетная доза протамина сульфата** для инактивации НФГ на основании результатов анализа АВС и наличия диффузного кровотечения.
- Перед поперечным пережатием аорты рекомендуется внутривенное введение #Гепарин натрия** (50 - 100 МЕ/кг) для профилактики тромбоэмболических осложнений [313].
ESVS/ЕОК I A (УДД 3 УУР B)
- Рекомендуется накладывать проксимальный анастомоз как можно ближе к почечным артериям, чтобы предотвратить дальнейшее развитие аневризмы в оставшемся инфраренальном сегменте аорты [314, 315].
ESVS/ЕОК I C (УДД 4 УУР C)
- При открытой реконструкции аневризмы брюшной аорты рекомендуется сохранить приток крови хотя бы к одной внутренней подвздошной артерии для снижения риска развития ягодичной перемежающейся хромоты и ишемии толстой кишки [316 - 319].
ESVS/ЕОК I C (УДД 4 УУР C)
- Возможность сохранения почечного перешейка и аномальных почечных артерий диаметром > 3 мм рекомендуется рассматривать как при открытой, так и эндоваскулярной реконструкции аневризмы брюшной аорты с сопутствующим наличием подковообразной почки [260, 320, 321].
ESVS/ЕОК IIa B (УДД 3 УУР B)
- Ретроперитонеальный доступ для пациентов, нуждающихся в открытой хирургической или гибридной реконструкции, при наличии анатомических возможностей, рекомендуется рассматривать как предпочтительный вариант хирургического лечения аневризмы брюшной аорты с сопутствующим наличием подковообразной почки [251, 321, 322].
ESVS/ЕОК IIa B (УДД 3 УУР C)
Нижняя брыжеечная артерия и внутренние подвздошные артерии
Наличие ретроградного кровотока из НБА при нормальном внешнем виде ободочной кишки свидетельствует о ее безопасной перевязке при проведении ОХ АБА. Такую перевязку следует выполнять в устье НБА с целью сохранения кровотока в левой ободочной артерии. Реконструкцию проходимой НБА следует рассмотреть при неудовлетворительном ретроградном кровотоке и повышенном риске развития ишемии ободочной кишки, который присутствует при окклюзии чревного ствола/верхней брыжеечной артерии, после резекции кишечника, при длительном пережатии аорты, массивной кровопотере во время и после операции, а также при отключении кровотока обеих внутренних подвздошных артерий [53, 323 - 325]. По той же причине предлагается сохранить кровоток как минимум к одной из проходимых внутренних подвздошных артерий.
- При подозрении на недостаточную перфузию органов малого таза с риском ишемии толстой кишки рекомендуется реконструкция нижней брыжеечной артерии во время открытой реконструкции аневризмы брюшной аорты [326, 327].
ESVS/ЕОК I B (УДД 2 УУР B)
Открытое лечение аорты в отдаленном периоде после эндоваскулярного лечения
- Открытое хирургическое вмешательство на аорте после эндоваскулярного лечения рекомендуется только в условиях специализированных центров [71].
ESVS/ЕОК I C (УДД 5 УУР C)
Комментарий: При проведении ОХ аорты после эндоваскулярного лечения необходимо решить ряд технических вопросов, а именно: выбрать хирургический доступ, определить уровень пережатия аорты, разработать тактику по отношению к установленному ранее стент-графту***, формирования проксимального анастомоза и других вспомогательных вмешательств [328].
Если ОХ после эндоваскулярного лечения проводится с целью устранения вторичной аорто-дуоденальной фистулы, комплексное вмешательство на тонком кишечнике следует проводить после завершения операции на сосудах [328].
При проведении ОХ после эндоваскулярного лечения 30-дневная смертность выше по сравнению с первичным открытым вмешательством на АБА, что обусловлено обширностью хирургического доступа, большей длительностью операции, пережатием аорты на более высоком уровне, необходимостью установки бифуркационного и более высокой частотой кровотечений во время и после операции. Согласно последним опубликованным данным, смертность при проведении ОХ после эндоваскулярного лечения достигает 22% [328].
- В отдельных случаях при нарушении герметичности в проксимальной зоне фиксации стент-графта*** после эндоваскулярной реконструкции аневризмы брюшной аорты рекомендуется рассмотреть возможность плановой конверсии в открытое вмешательство в качестве альтернативы сложным эндоваскулярным вмешательствам при условии приемлемости хирургического риска [151, 289].
ESVS/ЕОК IIb C (УДД 5 УУР C)
3.2.3 Лапароскопическая реконструкция аорты
Лапароскопическое хирургическое вмешательство на аорте - это минимально инвазивная альтернатива открытому хирургическому вмешательству в тех случаях, когда не показана ЭЛАБА [329, 330].
Лапароскопические методы лечения АБА включают полностью лапароскопический подход, хирургический подход с лапароскопической ассистенцией (лапароскопическая диссекция с эндоаневризморрафией через минилапаротомию), лапароскопический доступ с ручной ассистенцией и роботизированный лапароскопический доступ.
Эти методы технически сложны и требуют большого опыта в лапароскопической хирургии.
- Лапароскопическая реконструкция аневризмы брюшной аорты не рекомендуется в рутинной клинической практике, вне узкоспециализированных центров, регистров или исследований [330].
ESVS/ЕОК III B (УДД 4 УУР C)
Послеоперационное ведение
Несвоевременное выявление и лечение осложнений - это главный определяющий фактор периоперационной смертности как после открытой, так и после эндоваскулярной реконструкции АБА. В связи с этим пациентов, которым проводится открытая реконструкция АБА, как правило, следует госпитализировать в ОРИТ для дополнительного наблюдения и своевременного выявления и лечения осложнений. Местная оснащенность и ресурсы влияют на выбор пациентов, которым необходима госпитализация в ОРИТ, но обычно всем пациентам, которым проводится ОХ, и пациентам с повышенным периоперационным риском, которым проводится ЭЛАБА, следует предлагать наблюдение в условиях ОРИТ. Кроме того, реконструкция АБА должна проводиться на базе больниц с постоянным и непосредственным доступом к оборудованию для катетеризации коронарных артерий [75]. Информация о стратегиях ведения пациентов после хирургической реконструкции АБА представлена в соответствующем определении.
3.2.4 Тактика ведения пациентов с разрывом АБА
Хирургические вмешательства при симптомной АБА
Оптимальные сроки хирургического вмешательства при симптомной неразорвавшейся АБА окончательно не определены. Считается, что при этих аневризмах выше риск разрыва, чем при бессимптомных аневризмах, в то же время экстренное реконструктивное вмешательство при менее благоприятных обстоятельствах связано с более высоким риском периоперационных осложнений [331 - 334]. Тактика ведения должна включать короткий период быстрой оценки и оптимизации с последующим проведением отсроченного реконструктивного вмешательства в оптимальных условиях [332]. В период ожидания хирургической реконструкции также важен тщательный суточный мониторинг со строгим контролем АД.
- Пациентов с симптомной аневризмой и болевым синдромом рекомендуется госпитализировать в отделение реанимации для мониторинга, проведения гипотензивной терапии, выполнения необходимого дообследования [331 - 334].
ESVS/ЕОК I B (УДД 4 УУР C)
Комментарий: при усилении болевого синдрома показана экстренная операция. При стабильном состоянии, купировании болевого синдрома и снижения АД операцию следует выполнять в срочном порядке (48 - 72 часа) квалифицированными врачами-хирургами. Экстренная операция также показана больным, у которых имеются предикторы разрыва по данным УЗИ органов брюшной полости (комплексного) и КТА брюшной аорты (признак "серпа", фиссурация пристеночного тромба, локальный частичный надрыв стенки аорты, синдром "драпирующей" аорты) [71].
Периоперационное ведение
Оптимальная гипотензия
Интенсивное восстановление объема циркулирующей крови у пациентов с разрывом АБА приводит к выраженному повышению артериального давления, которое может привести к возобновлению кровотечения [335]. Первым методику так называемой "допустимой гипотензии" предложил Э. Кроуфорд (E. Crawford) [336]. У пациентов с разрывом АБА до операции объем циркулирующей крови следует восполнить до уровня допустимой гипотензии (80 - 100 мм рт. ст.) [335, 337].
- У пациентов с разрывом аневризмы брюшной аорты, находящихся в сознании, рекомендуется проводить стратегию допустимой гипотензии, ограничивая интенсивную инфузионно-трансфузионную терапию [335, 338 - 342].
ESVS/ЕОК I B (УДД 4 УУР C)
Комментарий: Большинство авторов советуют проводить стратегию допустимой гипотензии, пока пациент остается в сознании, с целевым значением систолического давления 70 - 90 мм рт. ст. [335, 338 - 342].
Анестезиологическое пособие
Необходимо тесное сотрудничество между врачом-анестезиологом-реаниматологом и врачом-хирургом, поскольку вазодилатация при индукции анестезии часто приводит к внезапной артериальной гипотензии. Таким образом, хирургическая бригада должна готова к операции, операционное поле должно быть подготовлено до начала анестезии. Это важно для сведения к минимуму задержек и быстрой остановки кровотечения.
В отличие от ОХ, одним из основных преимуществ ЭЛАБА при рАБА является возможность проведения вмешательства под местной анестезией в сочетании, если это необходимо, с тотальной внутривенной анестезией [343].
- В качестве предпочтительного метода анестезии при эндоваскулярном реконструктивном вмешательстве по поводу разрыва аневризмы брюшной аорты рекомендуется рассматривать местную анестезию, если это приемлемо для пациента [343 - 345].
ESVS/ЕОК IIa B (УДД 4 УУР C)
Хирургическая тактика: открытая и эндоваскулярная реконструкция стенки сосуда
- У пациентов с разрывом аневризмы брюшной аорты и подходящей анатомией в качестве метода выбора рекомендуется эндоваскулярная реконструкция. В зависимости от состояния пациента, анатомических особенностей, местной практики, опыта бригады и предпочтений пациента, хирургическая тактика может быть изменена решением сосудистой команды [346 - 348].
ESVS/ЕОК IIa B (УДД 1 УУР B)
- Возможность проведения открытой реконструкции или сложной эндоваскулярной реконструкции у пациентов с юкстаренальной аневризмой брюшной аорты рекомендуется рассмотреть после оценки состояния пациента, анатомических особенностей, местной практики, опыта бригады и предпочтений пациента [349, 350].
ESVS/ЕОК IIb C (УДД 4 УУР C)
- При открытой реконструкции аневризмы брюшной аорты выбор между срединной и поперечной лапаротомией или между трансперитонеальным и ретроперитонеальным доступом рекомендуется осуществлять исходя от предпочтений врача-хирурга и факторов риска со стороны пациента [151, 351].
ESVS/ЕОК IIa B (УДД 1 УУР A)
Комментарий: Проксимальный контроль аорты при ОХ достигается либо путем пережатия инфраренального отдела аорты, либо путем супраренального или надчревного пережатия с последующим перемещением зажима в инфраренальное положение как можно скорее. В ряде случаев возможно формирование проксимального сосудистого анастомоза магистральной артерии без выделения стенки аневризмы на супрацелиакальном зажиме.
Проксимальный контроль аорты также может быть достигнут с помощью эндоваскулярной БОА в качестве альтернативы обычному поперечному пережатию аорты у гемодинамически нестабильных пациентов, которым проводится ОХ [176]. БОА в том числе может быть исполнена под контролем глаза через стенку аорты во время ОХ, по сравнению с обычным пережатием аорты БОА приводила к снижению интраоперационной смертности, но не госпитальной летальности [113].
Реконструкция стенки сосудов. Для реконструкции стенки сосудов в ходе ОХ разрыва АБА следует выбирать самый простой метод [177, 323, 352]. По мнению некоторых специалистов, использование эндопротеза с бифуркацией может быть сопряжено с повышенной периоперационной смертностью по причине увеличения общей продолжительности операции.
Забрюшинная гематома. Чтобы не допустить развития АКС, следует по возможности удалить гематому и сгустки крови. Дренировать забрюшинную гематому, малый таз и брюшную полость. При парезе кишечника обязательна установка кишечного зонда тонкого кишечника для профилактики компартмент-синдрома и энтерального питания больных в послеоперационном периоде. [177, 323, 352]
Вспомогательные вмешательства. Интраоперационная аутогемотрансфузия (гемотрансфузия) для сохранения уровня ОЦК значимо снижает смертность во время ОХ разрыва АБА и в ранний послеоперационный период [337, 353]. Указанное вмешательство должно входить в стандартный протокол лечения таких пациентов.
- Рекомендуется разработка внутреннего протокола ведения неотложных состояний при аневризме аорты, исходя из оснащенности, предпочитаемой хирургической техники и накопленного опыта [354 - 358].
ESVS/ЕОК I B (УДД 4 УУР C)
Комментарии: Специальный протокол может обеспечить быструю и безопасную диагностику, рутинное использование допустимой гипотензии в предоперационном периоде [359, 360], упростить использование ЭЛАБА [357], местной анестезии [356], а также окклюзии аорты с помощью баллона (БОА) в случае необходимости [30]. Следует определить, когда и как уведомлять бригаду эндоваскулярных хирургов и обеспечивать подходящую операционную среду, предпочтительно гибридную операционную. Также настоятельно просят протокольное ведение опасных для жизни послеоперационных осложнений, в частности абдоминального компартмент-синдрома (АКС) [31, 361].
Конфигурация протеза и выбор стент-графта***
Во время ОХ пораженный сегмент аорты заменяется протезом на основе материала Dacron или из PTFE в линейной или бифуркационной конфигурации так же, как и при плановом реконструктивном вмешательстве. Следует всегда прилагать все усилия для восстановления кровотока хотя бы в одной ВПА, если она проходима.
- Пациентам, которым проводится эндоваскулярное реконструктивное вмешательство по поводу разрыва аневризмы брюшной аорты, рекомендуется имплантировать бифуркационный протез, а не линейный, если это анатомически осуществимо [340, 345, 362 - 364].
ESVS/ЕОК IIa C (УДД 2 УУР B)
- В случаях, когда визуализирующее исследование при эндоваскулярной реконструкции разорванной аневризмы брюшной аорты проводят на фоне допустимой гипотензии, рекомендуется превышение размера (оверсайзинга) стент-графта эндоваскулярного для абдоминальной аорты*** на величину до 30% [151, 365].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Комментарий: важным техническим аспектом экстренной ЭЛАБА является степень превышения размера стент-графта*** в условиях имеющейся гиповолемии. Гемодинамическое состояние пациента на момент поступления может повлиять на этот аспект, и, чтобы избежать интраоперационного или позднего эндоподтекания типа Ia, предпочтительнее превышение размера на 30% при проведении вмешательства по поводу рАБА, когда КТА брюшной аорты выполнялась в условиях допустимой гипотензии [151].
Эндоваскулярная реконструкция с использованием баллонной окклюзии аорты при разрыве АБА
Примерно треть пациентов с рАБА, которым проводится ЭЛАБА, находится в гемодинамически нестабильном состоянии, а у каждого четвертого пациента наблюдается полный сосудистый коллапс [364, 366, 367]. В таких случаях требуется немедленная окклюзия проксимального отдела аорты для остановки кровотечения путем быстрого раздувания эластичного баллонного катетера для БОА. Постоянный контроль с помощью баллонного катетера до имплантации стент-графта*** и окклюзии места разрыва имеет решающее значение для выживания. Метаанализ результатов 39 исследований показал, что в общей сложности 200 из 1277 пациентов (14,1%) была показана БОА [368]. Смертность была значимо ниже в исследованиях с более высокой частотой проведения БОА. Это свидетельствует о том, что у гемодинамически нестабильных пациентов с рАБА, которым проводится ЭЛАБА, БОА может улучшить результаты.
- У гемодинамически нестабильных пациентов с разрывом аневризмы брюшной аорты, которым проводится открытое или эндоваскулярное реконструктивное вмешательство, рекомендуется рассматривать возможность окклюзии аорты с помощью баллона для обеспечения проксимального контроля в зависимости от состояния пациента, анатомических особенностей, местной практики, опыта бригады и предпочтений пациента [151, 339 - 341, 343, 364, 367 - 371].
ESVS/ЕОК IIb C (УДД 2 УУР B)
Комментарий: Эндоваскулярное лечение следует рассматривать в качестве приоритетного варианта вмешательства у большинства пациентов с разрывом АБА [107, 362, 372, 373].
Эндоваскулярное лечение разрыва аневризмы брюшной аорты с неблагоприятной анатомией
- У пациентов с разрывом юкста/параренальной аневризмы брюшной аорты рекомендуется рассмотреть вопрос об открытой реконструкции или сложной эндоваскулярной реконструкции (с использованием фенестрированного/браншированного стент-графта*** или методики параллельных стент-графтов***) в зависимости от состояния пациента, анатомических особенностей, местной практики, опыта бригады и предпочтений пациента [374, 375].
ESVS/ЕОК IIb C (УДД 4 УУР C)
- При открытой или эндоваскулярной реконструкции разрыва аневризмы брюшной аорты у пациентов с подозрением на ишемию толстой кишки рекомендуется сигмоидоскопия (ректосигмоидоскопия) гибким эндоскопом для подтверждения диагноза [151, 376 - 381].
ESVS/ЕОК IIa B (УДД 4 УУР C)
Абдоминальный компартмент-синдром и внутрибрюшная гипертензия
Смертность в случае развития абдоминального компартмент-синдрома (АКС) после открытого и эндоваскулярного лечения разрыва АБА очень высока. Хирургическое удаление скоплений крови в забрюшинном пространстве и дренирование забрюшинного пространства при проведении ОЛ разрыва АБА значимо снижает частоту развития АКС (3%) по сравнению с эндоваскулярным лечением (20%) [323, 352, 382]. Наличие обширной забрюшинной гематомы вследствие разрыва АБА также можно рассматривать в качестве показания к ОЛ.
ВБГ определяется как устойчивое или повторяющееся патологическое повышение внутрибрюшного давления (ВБД) > 12 мм рт. ст. АКС определяется как устойчивое ВБД > 20 мм рт. ст. (в сочетании со снижением абдоминального перфузионного давления < 60 мм рт. ст. или без него), которое сопровождается нарушением/недостаточностью функции органов. Абдоминальное перфузионное давление определяется как разность среднего артериального давления и ВБД [383].
У пациентов, которым проводится ЭЛАБА по поводу рАБА, факторы риска развития АКС включают (1) использование БОА; (2) тяжелую коагулопатию; (3) потребность в массивном переливании крови; (4) предоперационную потерю сознания; (5) низкое предоперационное АД; и (6) экстренный переход с модульных бифуркационных стент-графтов на ОАП конфигурацию изделия [347]. В связи с этим все такие пациенты должны находиться под пристальным наблюдением, чтобы можно было начать лечение на ранней стадии.
Алгоритм ведения пациентов с ВБГ/АКС представлен на Рисунке ПБ-2. При подозрении на ВБГ/АКС сначала следует попытаться консервативным способом (Таблица ПБ-3) уменьшить ВБД.
При неэффективности консервативных мер и развитии полномасштабного АКС показана абдоминальная декомпрессия [362, 383 - 385]. В идеале для этого используется срединная лапаротомия.
Описаны менее инвазивные методы, такие как транслюмбальная абдоминальная декомпрессия, но их безопасность не подтверждена [362, 386].
- При развитии абдоминального компартмент-синдрома после открытого или эндоваскулярного лечения разрыва аневризмы брюшной аорты рекомендуется декомпрессивная лапаротомия [340, 387 - 389].
ESVS/ЕОК I B (УДД 4 УУР C)
- При лечении с помощью открытой декомпрессии по поводу абдоминального компартмент-синдрома после открытого или эндоваскулярного лечения разрыва аневризмы брюшной аорты рекомендуется рассмотреть возможность использования вакуумной системы [387 - 389].
ESVS/ЕОК IIa C (УДД 4 УУР C)
3.2.5 Хирургическое лечение юкстаренальной аневризмы брюшной аорты
- Рекомендуется рассмотреть возможность централизации оказания медицинской помощи в крупных специализированных центрах, на базе которых проводятся как сложные открытые, так и сложные эндоваскулярные хирургические вмешательства при юкстаренальных аневризмах брюшной аорты [71].
ESVS/ЕОК IIb C (УДД 5 УУР C)
- При сложной эндоваскулярной реконструкции юкстаренальной аневризмы брюшной аорты в качестве предпочтительного варианта лечения в применимых случаях рекомендуется рассматривать вопрос о проведении эндоваскулярной реконструкции с использованием фенестрированного стент-графта*** [71, 247, 390].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Другими дополнениями или новыми инструментами для вмешательства, которые потенциально могут расширить возможности эндоваскулярного лечения, в том числе случаев рАБА с нетипичной проксимальной шейкой, являются готовый фенестрированный стент-графт***, модификация стандартных стент-графтов непосредственно перед операцией с формированием выемок и фенестраций, использование анкеров*** для обеспечения проксимальной фиксации.
- У пациентов с юкстаренальной аневризмой брюшной аорты не рекомендуются в качестве лечения первой линии новые методы/концепции, включая эндоваскулярную герметизацию аневризмы, использование анкеров*** для фиксации и фенестрацию in situ [279, 391].
ESVS/ЕОК III C (УДД 3 УУР C)
- При сложной эндоваскулярной реконструкции юкстаренальной аневризмы брюшной аорты использование методики установки параллельных стент-графтов*** рекомендуется рассматривать в качестве альтернативы при неотложных состояниях, или когда модифицированные (фенестрированные) стент-графты*** не показаны или недоступны, или в качестве временного средства в экстренной ситуации, в идеальном случае с имплантацией не более двух стент-графтов*** по типу "дымохода" [391, 392].
ESVS/ЕОК IIa C (УДД 4 УУР B)
Поскольку методика EVAS уже использовалась при разрыве инфраренальной аневризмы [376], она также может быть показана при ЮРАБА в сочетании с имплантацией стент-графтов по типу "дымохода" [392]. Ожидаются результаты использования этой технологии при разрыве ЮРАБА.
- У пациентов с юкстаренальной аневризмой брюшной аорты с приемлемым хирургическим риском рекомендуется использовать диаметр 5 - 5,5 см в качестве минимального порогового значения для рассмотрения вопроса о проведении планового реконструктивного вмешательства [182].
ESVS/ЕОК I A (УДД 1 УУР A)
- У пациентов, которым проводится открытая реконструкция по поводу юкстаренальной аневризмы брюшной аорты, рекомендуется стратегия по сохранению функции почек с помощью метода перфузии почек холодным солевым раствором [393, 394].
ESVS/ЕОК IIa B (УДД 4 УУР C)
3.2.6 Хирургическое лечение аневризмы подвздошных артерий
Естественное клиническое течение и пороговый диаметр для реконструктивного хирургического вмешательства
Зарегистрированная скорость роста АПА аналогична таковой при АБА - приблизительно 1 - 4 мм/год в зависимости от диаметра аневризмы [395, 396].
Согласно опубликованным данным, в большинстве случаев разрыв АПА происходит при диаметре более 5 см и редко при диаметре менее 4 см [10, 11, 63, 64, 397 - 399].
Цель хирургического лечения АПА заключается в исключении аневризмы из кровотока для предотвращения дальнейшего роста и разрыва. До внедрения эндоваскулярных реконструктивных вмешательств в начале 90-х годов XX века ОХ была основным методом лечения АПА. Устойчивый переход к эндоваскулярным методам лечения начиная с 2000 г. сопровождался значительным снижением послеоперационных осложнений и смертности [400], а также уменьшением количества осложнений и сокращением длительности госпитализации [62, 64, 65, 400].
- В качестве порогового значения для проведения планового реконструктивного вмешательства при изолированной аневризме подвздошной артерии (общей подвздошной артерии, внутренней подвздошной артерии и наружной подвздошной артерии или их сочетания) рекомендуется рассматривать диаметр >= 4,0 см [10, 11, 63, 64, 151, 397 - 399].
ESVS/ЕОК IIa C (УДД 4 УУР C)
- Методику реконструкции аневризмы подвздошной артерии пациентам с АПА рекомендуется выбирать с учетом индивидуальных особенностей пациента и характера поражения [151, 401 - 405].
ESVS/ЕОК IIa B (УДД 4 УУР C)
Комментарий: ОХ обычно проводится под общей анестезией через ретроперитонеальный или трансабдоминальный доступ. В зависимости от протяженности аневризматического участка реконструкция выполняется с использованием линейного протеза подвздошной артерии или бифуркационного протеза, включая инфраренальный отдел аорты, в сочетании с реваскуляризацией ВПА или без нее. Менее инвазивным методом в отдельных случаях является перевязка подвздошной артерии с реперфузией контралатеральной бедренной артерии и/или ВПА с помощью перекрестного бедренно-бедренного шунтирования [10, 406].
Из-за глубокой внутритазовой локализации выполнение ОХ при АПА сопряжено с повышенным риском ятрогенных повреждений вен, мочеточника или нерва, что приводит к периоперационной кровопотере, осложнениям и росту смертности [64].
Эндоваскулярная реконструкция
Эндоваскулярное лечение АПА первоначально включало в себя эмболизацию ВПА и имплантацию стент-графта*** в участок от ОПА до НПА. Для обеспечения надлежащей проксимальной герметизации при реконструктивном вмешательстве иногда требуется вовлечение инфраренального отдела аорты и контралатеральной подвздошной артерии [60, 64, 67]. Таким образом, эндоваскулярная реконструкция стенки сосуда чаще связана с окклюзией поясничных артерий и нижней брыжеечной артерии, что необходимо учитывать. В то же время при ОХ по поводу изолированной АПА можно оставить интактными инфраренальный отдел аорты и контралатеральные подвздошные артерии.
- При лечении пациентов с аневризмой подвздошной артерии в качестве метода первой линии рекомендуется рассмотреть возможность эндоваскулярной реконструкции [64, 400, 403, 407].
ESVS/ЕОК IIb B (УДД 4 УУР C)
Комментарий: Значительным преимуществом эндоваскулярной реконструкции, особенно при разрыве изолированной АПА, является возможность проведения операции под местной анестезией. По имеющимся данным в редких случаях требуется переход на ОХ [398].
- При формировании параанастомотической аневризмы неинфекционного происхождения в аорто-подвздошном сегменте после реконструкции аневризмы брюшной аорты следует предпочесть эндоваскулярную реконструкцию [151, 408].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Особенности тазового кровообращения
- При проведении открытой хирургической реконструкции и эндоваскулярной реконструкции по поводу аневризмы подвздошной артерии рекомендуется сохранить кровоток хотя бы в одной внутренней подвздошной артерии [409].
ESVS/ЕОК I B (УДД 5 УУР C)
Комментарий: наиболее частым осложнением эндоваскулярного лечения АПА является ягодичная хромота, частота которой, по имеющимся данным, достигает 28% [62, 64 - 67]. В этой связи показано сохранение кровотока хотя бы в одной ВПА, если это не ставит под угрозу основную цель лечения - исключение аневризмы из кровотока. Благодаря доступности в настоящее время стент-графто*** в с боковой ветвью, в большинстве случаев можно сохранить кровоток в ВПА, что обеспечивает снижению частоты ягодичной хромоты при лечении АБА аорто-подвздошного сегмента и АПА с вовлечением ВПА [403, 410].
- У пациентов, которым показана эндоваскулярная эмболизация или перевязка внутренней подвздошной артерии, рекомендуется выполнять эндоваскулярную окклюзирующую операцию проксимального главного ствола сосуда (устье ВПА), если это технически осуществимо, для сохранения дистального коллатерального кровообращения в малом тазу [409].
ESVS/ЕОК I C (УДД 5 УУР C)
Комментарий: в случаях покрытия стент-графтом*** длинного участка аорты с окклюзией сегментарных артерий важное значение имеет сохранение кровотока в ВПА для профилактики ишемии спинного мозга, поскольку на этом уровне обеспечивается коллатеральное кровоснабжение спинного мозга [411].
- При эндоваскулярной реконструкции аневризмы брюшной аорты не показаны рутинная профилактическая эмболизация нижней брыжеечной артерии и поясничных артерий, а также неселективная эндоваскулярная эмболизация аневризматического мешка [151, 412 - 415].
ESVS/ЕОК III B (УДД 2 УУР A)
3.2.7 Хирургическое лечение микотической аневризмы брюшной аорты
У пациентов с микотической аневризмой брюшной аорты повышен риск разрыва аневризмы и развития других осложнений, поэтому лечение следует проводить обязательно независимо от диаметра поражения. Сходные результаты лечения инфицированной ткани независимо от выбранной стратегии не позволяют сделать однозначных выводов относительно приоритетного варианта вмешательства. Согласно данным шведского реестра, открытое лечение in situ и эндоваскулярное вмешательство у пациентов с МАА с точки зрения долгосрочной выживаемости и смертности от инфекций не различаются [8, 23].
Открытая реконструкция
Ранняя диагностика, немедленное назначение антибактериальных препаратов системного действия и своевременное хирургическое лечение имеют решающее значение для улучшения ранних исходов. Несмотря на отсутствие доказательств, ОХ считается золотым стандартом для радикального лечения МАА.
ОХ включает в себя аневризмэктомию с протезированием и пластикой ветвей, обширную местную хирургическую обработку и реваскуляризацию с помощью экстраанатомического шунтирования аорты или реконструкции in situ. Варианты использования сосудистых протезов in situ включают предпочтительно аутологичную вену (формирование из бедренной или большой подкожной вены ноги нео-аорто-подвздошной системы), криоконсервированные артерии, ксенотрансплантат сосудистый в зависимости от предпочтений врача-хирурга [139, 416 - 418].
Материал, полученный в ходе вмешательства, необходимо направить на микробиологическое исследование, должна быть проведена обширная хирургическая обработка раны или инфицированной ткани, и инфекционный процесс должен быть отделен от протеза сальником.
- Хирургические методы, используемые при МАА, рекомендуется рассматривать с учетом состояния пациента и опыта бригады, при этом эндоваскулярная реконструкция стенки сосуда является приемлемой альтернативой открытой реконструкции [22, 26, 416, 419].
ESVS/ЕОК IIa B (УДД 4 УУР C)
Эндоваскулярная реконструкция
В последние 15 лет МАА все чаще успешно лечится эндоваскулярными методами. К ЭЛАБА относились со скептицизмом из-за серьезных опасений по поводу сохранения инфицированной ткани в зоне вмешательства, включая саму аневризму, и риска рецидивирующей/персистирующей инфекции. С другой стороны, ЭЛАБА является менее инвазивной альтернативой, чем стандартная ОХ при МАА, что позволяет лечить ослабленных пациентов и пациентов с сопутствующей патологией со сложной анатомией аневризмы и избегать серьезных хирургических травм (пережатие аорты, гепаринизация и массивное переливание крови).
- После реконструктивного вмешательства по поводу МАА рекомендуется проведение длительной антибиотикотерапии (6 - 12 месяцев или пожизненно) и последующего наблюдения [8, 134, 416].
ESVS/ЕОК IIa B (УДД 4 УУР C)
Таким образом, МАА является редким и опасным для жизни заболеванием. Раннее выявление и антибиотикотерапия с последующим хирургическим вмешательством играют центральную роль в лечении данной аневризмы. Результаты крупнейших и самых последних исследований с долгосрочным последующим наблюдением свидетельствуют о том, что ЭЛАБА может иметь краткосрочное преимущество по сравнению с открытой реконструкцией без каких-либо поздних недостатков. Однако из-за редкости MAA отсутствуют убедительные доказательства, что затрудняет выработку надежных рекомендаций.
- Реконструкция по поводу МАА рекомендуется независимо от размера аневризмы [8, 22, 420].
ESVS/ЕОК I C (УДД 4 УУР C)
- Пациентов с МАА брюшной аорты рекомендуется направлять в крупные центры сосудистой хирургии, поскольку для их лечения требуется мультидисциплинарный подход [151].
ESVS/ЕОК I C (УДД 5 УУР C)
3.2.8 Хирургическое лечение воспалительной аневризмы брюшной аорты
Пожизненный риск разрыва невелик < 5% [12]. Используется то же пороговое значение диаметра для реконструктивного вмешательства, что и при обычной дегенеративной АБА. В редких случаях пациентам с сохраняющими клиническими проявлениями на фоне медикаментозного лечения может быть показано инвазивное лечение для контроля воспалительного процесса [421]. В случае выраженного гидронефроза в предоперационном периоде могут быть установлены мочеточниковые стенты Double-J в мочевые пути.
Проведение ОХ осложняется наличием воспалительных спаек со стенкой двенадцатиперстной кишки, левой почечной вены, нижней полой вены и мочеточников. Трансперитонеальный доступ с ограниченной диссекцией проксимальной шейки, оставлением двенадцатиперстной кишки прикрепленной к утолщенной оболочке и проксимальным пережатием аорты на удалении от утолщенных частей стенки аневризмы позволяет уменьшить хирургическое повреждение прилегающих органов и связанную с этим хирургическую смертность (6 - 11%) [150, 421].
Для эндоваскулярного лечения характерна более низкая общая смертность в течение одного года после операции. Однако по данным систематического обзора от 2009 года, смертность от осложнений, связанных с аневризмой, одинакова независимо от варианта вмешательства. При этом в группе ОХ отмечалась значимо более высокая частота послеоперационного уменьшения выраженности гидронефроза. Значимых различий с точки зрения 30-дневной смертности и частоты уменьшения воспаления периаортальных тканей не установлено. По указанным выше причинам в большинстве случаев в качестве приоритетного варианта лечения вАБА следует рассматривать эндоваскулярное вмешательство, тогда как ОХ показано при выраженном гидронефрозе и низком риске смертельного исхода и осложнений [150, 422].
- В качестве метода выбора при хирургическом лечении ВАБА, при пороговом значении диаметра аневризмы 5,5 см и подходящей анатомией у пациентов с воспалительной аневризмой брюшной аорты рекомендуется эндоваскулярная реконструкция стенки сосуда [29, 71, 150, 423 - 425].
ESVS/ЕОК IIa C (УДД 4 УУР C)
Гидронефроз и парааортальный фиброз могут сохраняться и даже прогрессировать, несмотря на проведение ОХ или ЭЛАБА [150]. В связи с этим для уменьшения или стабилизации парааортального воспаления показано продолжение иммуносупрессивной терапии [144, 148] и тщательное послеоперационное наблюдение, но иногда может потребоваться установка стента в мочевыводящие пути, нефропиелостомия или проведение открытой хирургической операции.
3.2.9 Хирургическое лечение расслоения стенки аорты, мешотчатой аневризмы, пенетрирующей язвы аорты, интрамуральной гематомы, псевдоаневризмы
Осложненная ПЯА означает сочетание экстрааортальной гематомы (псевдоаневризмы), симптомов эмболии, приступов боли, ПЯА с первоначальными размерами > 20 мм в ширину или > 10 мм в глубину или увеличения общего диаметра брюшной аорты [426, 427]. Аналогично, осложненная ИМГ/ИРБА означает наличие приступов боли, роста ИМГ, парааортальной гематомы, разрыва интимы или мальперфузии.
- Пациентам с осложненной пенетрирующей язвой аорты, расслоением, интрамуральной гематомой и псевдоаневризмой брюшной аорты рекомендуется реконструктивное вмешательство [24, 46, 71, 152].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий: при осложненной ПЯА/ИМГ/ИРБА показано инвазивное лечение, как при ИРБА, которое связано с сопутствующими аневризмами, даже при поражениях диаметром < 5 см [21], однако некоторые специалисты советуют агрессивный подход при общем диаметре аорты > 3 см [34].
- У пациентов с осложненной пенетрирующей язвой аорты, расслоением, интрамуральной гематомой или псевдоаневризмой брюшной аорты в качестве метода выбора рекомендуется рассматривать эндоваскулярную реконструкцию стенки сосуда [16, 18 - 20, 153, 426, 427].
ESVS/ЕОК IIa C (УДД 3 УУР B)
Комментарий: благодаря очаговому характеру эти патологические изменения идеально подходят для эндоваскулярной реконструкции стенки сосуда с использованием стент-графтов эндоваскулярных для абдоминальной аорты***. Такое вмешательство характеризуется высокой частотой технического успеха в осложненных случаях, но может быть связано с высокой госпитальной летальностью (10%) из-за ослабленного состояния пациентов с данной патологией [426, 427].
- При мешотчатых аневризмах брюшной аорты рекомендуется рассмотреть возможность раннего лечения с более низким пороговым значением диаметра для планового реконструктивного вмешательства, чем при обычных веретенообразных аневризмах брюшной аорты [21].
ESVS/ЕОК IIb C (УДД 4 УУР C)
3.2.10 Хирургическое лечение АБА при наследственных заболеваниях соединительной ткани
Стратегии ведения пациентов, включая визуализирующие исследования в рамках последующего наблюдения (КТА/МР ангиография (одна область)/УЗДС аорты), медикаментозное лечение или хирургическое вмешательство у отдельно взятого пациента, должны обсуждаться в рамках междисциплинарной команды специалистов в области патологии аорты.
Первостепенное значение имеет индивидуальный подход, поскольку риск разрыва выше при меньших значениях диаметра аорты, например при СЛД (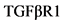 , 2) и синдроме аневризмы-остеоартрита (SMAD 3), чем у пациентов с синдромом Марфана (FBN1-фибриллин-1), а хирургическая реконструкция является более сложной при СЭД из-за повышенной предрасположенности к разрушению стенок артерий, чем при синдроме Марфана.
, 2) и синдроме аневризмы-остеоартрита (SMAD 3), чем у пациентов с синдромом Марфана (FBN1-фибриллин-1), а хирургическая реконструкция является более сложной при СЭД из-за повышенной предрасположенности к разрушению стенок артерий, чем при синдроме Марфана.
Крайне редко изолированная АБА может быть проявлением заболеваний соединительной ткани. В литературе описано всего несколько таких случаев [428 - 431]. Эндоваскулярное лечение при такой этиологии АБА не показано. Воздействие радиальной силы, необходимое для установки стент-графтов***, противопоказано пациентам с заболеваниями соединительной ткани по причине повышенной хрупкости стенок аорты [432, 433].
Это может привести к возникновению эндоподтекания I типа и смещению стент-графта***. У пациентов с заболеваниями соединительной ткани эндоваскулярное лечение можно провести в качестве экстренного переходного вмешательства для сохранения жизни в случае кровопотери, вызванной разрывом аневризмы. Тем не менее в реальной клинической практике редко складываются идеальные условия для вмешательства. Если ранее пациенту уже проводили хирургическое лечение или если у него присутствуют несколько сопутствующих заболеваний или другие клинические обстоятельства, повышающие риски при проведении ОХ, оптимальной тактикой будет проведение эндоваскулярного лечения. Однако ОХ следует рассматривать как приоритетный вариант вмешательства при лечении АБА у подавляющего большинства пациентов с заболеваниями соединительной ткани.
- При аневризмах брюшной аорты у пациентов с генетической предрасположенностью пороговое значение диаметра аневризмы для реконструктивного вмешательства определяют индивидуально, в зависимости от результатов генетических исследований и анатомических особенностей [151].
ESVS/ЕОК I C (УДД 5 УУР C)
- Для ведения пациентов с патологией аорты при подозрении на наличие основной генетической причины их рекомендуется направлять в узкоспециализированный центр к междисциплинарной команде специалистов в области патологии аорты [434, 435].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий: в недавнем международном консенсусном отчете по диагностике, естественному течению и лечению СЭД сделан вывод о том, что неограниченные разрывы или клинически нестабильные аневризмы (до разрыва), или ложные аневризмы часто требуют проведения соответствующего вмешательства. В зависимости от локализации может быть показано эндоваскулярное лечение (эмболизация кровоточащей артерии) или открытое хирургическое вмешательство (аорта и подвздошные сосуды), хотя инвазивные процедуры могут спровоцировать развитие дальнейших осложнений [436].
В идеале лечение пациентов с СЭД по возможности должно сосредотачиваться в центрах передового опыта [436]. Европейская справочная сеть по редким мультисистемным сосудистым заболеваниям (European Reference Network on Rare Multisystemic Vascular Diseases) (http://vascern.eu/) содержит подробную информацию о тактике ведения этого редкого заболевания.
- У молодых пациентов с подозрением на нарушения со стороны соединительной ткани и с аневризмой брюшной аорты в качестве метода выбора рекомендуется открытое хирургическое вмешательство [435].
ESVS/ЕОК I C (УДД 4 УУР C)
3.3 Иное лечение
Паллиативная медицинская помощь
Чтобы предсказать нецелесообразность открытого или эндоваскулярного хирургического вмешательства при рАБА и отобрать пациентов для паллиативной медицинской помощи, были протестированы различные шкалы оценки и алгоритмы, но на сегодняшний день ни одна из них не доказала свою точность [437]. Отказ в хирургии АБА у соматически тяжелых пациентов, с онкозаболеваниями IV стадии, в агональных состояниях должен приниматься консилиумом специалистов с привлечением главных врача-хирурга и врача-анестезиолога-реаниматолога медицинской организации или их замещающих специалистов, в которой находится пациент.
- Не рекомендуется проводить отбор пациентов с разрывом аневризмы брюшной аорты для паллиативной медицинской помощи исключительно на основе шкал оценки или исключительно исходя из преклонного возраста [343 - 345, 438 - 446].
ESVS/ЕОК III C (УДД 3 УУР B)
Сопутствующие злокачественные заболевания
Зарегистрированная частота сопутствующих злокачественных заболеваний и АБА составляет 5,4 - 6,7% [447 - 450].
Будучи профилактическим вмешательством, проведение реконструкции АБА целесообразно только в том случае, если пожизненный риск разрыва превышает риск, связанный с лечением, у пациентов с разумной ожидаемой продолжительностью жизни. Таким образом, прогноз сопутствующего злокачественного новообразования занимает центральное место в процессе принятия решений наряду с другими сопутствующими заболеваниями (возраст, физиологическое благополучие) и предпочтениями пациента. Другими аспектами являются предполагаемый повышенный риск разрыва АБА после хирургического вмешательства по поводу злокачественного новообразования брюшной полости [451, 452], по сравнению со значительной отсрочкой лечения злокачественного новообразования в случае первоочередного лечения АБА с применением метода ОХР, а также риск инфицирования сосудистого протеза.
- У пациентов с сопутствующим злокачественным новообразованием рекомендуется рассмотреть возможность длительного профилактического введения НМГ до четырех недель после реконструкции аневризмы брюшной аорты [71, 447, 453, 454].
ESVS/ЕОК IIa C (УДД 3 УУР B)
Комментарий: существует вероятность повышенного риска тромбоза глубоких вен и тромбоэмболии легочной артерии, а также тромбоза конечности после ЭЛАБА (до 7%), возможно, из-за гиперкоагуляции, тромбофилии, паранеопластического синдрома, химиотерапии и литотомического положения [447, 449, 455 - 458]. У пациентов с сопутствующим злокачественным новообразованием следует рассмотреть возможность длительного профилактического введения НМГ до четырех недель после ЭЛАБА [453, 454].
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Программа раннего восстановления после операции
Раннее восстановление после операции при открытой реконструкции АБА.
- С целью ускорения послеоперационного восстановления хирургических пациентов, оперированных по поводу АБА\АПА за счет уменьшения реакции на хирургический стресс рекомендуется использовать программы раннего или "ускоренного" восстановления после операции (ERAS/FAST-TRACK Surgery) [459 - 461].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий: В ограниченном количестве исследований оценивали протоколы ERAS при открытой реконструкции АБА и было отмечено сокращение сроков госпитализации и уменьшение легочных осложнений [460, 461].
ERAS зависит от комплексного междисциплинарного общего подхода, включающего тщательное предоперационное консультирование для психологической подготовки пациента, использование эпидуральной анестезии и минимально инвазивного хирургического доступа, оптимальное обезболивание с минимизацией побочных эффектов, раннюю послеоперационную мобилизацию и пероральное питание, а также отказ от использования (или раннее удаление) всех видов дренажей и мочевых катетеров из верхних мочевыводящий путей [459].
FAST-TRACK Surgery. Ускоренная реабилитация или fast-track surgery в последние годы приобретает все больше сторонников. Стратегия основывается на уменьшении хирургического стресса и заключается в:
- Устном и письменном информировании пациента;
- Отсутствии подготовки кишечника;
- Сокращении времени предоперационного голодания;
- Отсутствии премедикации;
- Профилактике тромбоэмболических осложнений;
- Антимикробной профилактике;
- Комбинированной анестезии;
- Минидоступах;
- Профилактике интраоперационной гипотермии;
- Предотвращении и лечении синдрома послеоперационной тошноты;
- Уменьшении объема послеоперационных инфузий;
- Ранней мобилизации больных.
Все это позволяет активизировать больного как можно раньше и сократить время его пребывания на больничной койке.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Преданевризматическое расширение аорты
- Рекомендовано проведение повторного скрининга спустя 5 - 10 лет мужчинам с преданевризматической дилатацией аорты и достаточной ожидаемой продолжительностью жизни [462, 463].
ESVS/ЕОК I B (УДД 2 УУР B)
- Для наблюдения за пациентами с АБА рекомендуется ультразвуковое дуплексное сканирование брюшной аорты с частотой: один раз в три года при аневризмах диаметром 3 - 3,9 см, один раз в год при аневризмах диаметром 4,0 - 4,9 см и один раз в 3 - 6 месяцев при аневризмах >= 5,0 см. [463].
ESVS/ЕОК I B (УДД 2 УУР B)
Комментарий: для малых аневризм (3 - 3,9 см) безопасной является периодичность наблюдения один раз в три года (однако можно рассмотреть и более длительный интервал), для аневризм диаметром 4,0 - 4,9 см безопасно ежегодное наблюдение. Предполагаемая периодичность наблюдения, экстраполированная на основе периодичности наблюдения при АБА, может составлять один раз в три года для АПА ВПА диаметром 2,0 - 2,9 см и один раз в год при диаметре 3,0 - 3,4 см.
- При аневризмах подвздошной артерии (общей подвздошной артерии, внутренней подвздошной артерии, наружной подвздошной артерии или их комбинации) рекомендуется наблюдение с дуплексным сканированием брюшного отдела аорты, подвздошных и общих бедренных артерий один раз в 3 года при аневризмах диаметром 20 - 24 мм, один раз в 2 года при аневризмах диаметром 25 - 29 мм и один раз в год при аневризмах диаметром >= 30 мм [151, 464].
ESVS/ЕОК IIa C (УДД УУР C)
Контроль скорости роста аневризмы
- Пациентам с АБА рекомендуется отказаться от курения (для снижения скорости роста аневризмы брюшной аорты и риска ее разрыва) и обратиться за консультацией по вопросам отказа от курения [50, 465].
ESVS/ЕОК I B (УДД 2 УУР B)
- Пациентам с АБА, которые регулярно курят табак или используют альтернативные источники доставки никотина (АИДН) рекомендован полный отказ от никотина при каждом посещении лечащего врача [50, 465].
ESVS/ЕОК I B (УДД 2 УУР B)
- У пациентов с ССЗ, которые регулярно курят табак, полный переход на употребление никотин-содержащих продуктов, исключающих горение табака, рекомендован как способ снижения рисков и путь к прекращению курения, хотя риск длительного употребления и неизвестная долгосрочная безопасность требует последующего наблюдения [50, 465].
ESVS/ЕОК I B (УДД 2 УУР B)
- Пациентам с ССЗ рекомендовано избегать пассивного курения для снижения риска сердечно-сосудистых осложнений [50, 465].
ESVS/ЕОК I B (УДД 2 УУР B)
Комментарий: все наблюдательные исследования показывают, что текущее курение связано с повышенной скоростью роста АБА, а отказ от курения, вероятно, связан с замедлением скорости роста примерно на 20%, а также с двукратным снижением риска разрыва аневризмы [50]. Многие рандомизированные исследования показали, что отказ от курения наиболее эффективен на фоне применения лекарственных препаратов, применяемых при никотиновой зависимости, и консультирования по вопросам отказа от курения [465]. У пациентов с сахарным диабетом также ниже скорость роста АБА, чем у пациентов без сахарного диабета, что, согласно последним предположениям, связано с приемом метформина** (АТХ: A10BA02), назначаемого для лечения сахарного диабета 2 типа [50, 466].
- При неосложненной пенетрирующей язве аорты, расслоении или интрамуральной гематоме брюшной аорты рекомендуется динамическое наблюдение с помощью КТА брюшной аорты или МР ангиографии аорты (одна область) [46, 152].
ESVS/ЕОК I C (УДД 4 УУР C)
Комментарий: С учетом того, что о естественном течении почти ничего неизвестно, обосновано динамическое наблюдение с помощью КТА брюшной аорты или МР ангиографии аорты (одна область) [426, 427]. Оценка язвы включает в себя измерение максимального диаметра аорты на уровне локализации язвы, глубины язвы и длины дефекта интимы (ширины) на уровне локализации язвы. Скорость роста ПЯА в брюшном отделе составляет приблизительно 3 мм/год.
Стратегия снижения сердечно-сосудистого риска
- У всех пациентов с аневризмой брюшной аорты рекомендуется рассматривать стратегии, направленные на здоровый образ жизни, включая физические упражнения и здоровое питание [467 - 469].
ESVS/ЕОК IIa B (УДД 5 УУР C)
- У всех пациентов с аневризмой брюшной аорты рекомендуется контролировать артериальное давление (препаратами первой линии являются иАПФ и БАБ), применять статины и антитромботические средства [131, 193, 468, 469].
ESVS/ЕОК IIa B (УДД 4 УУР C)
Комментарий: Пациенты с АБА имеют высокий риск развития сердечно-сосудистых событий в будущем. Систематический обзор показал, что у пациентов с малыми АБА годовой риск сердечно-сосудистой смерти составлял 3,0% (95% ДИ 1,7 - 4,3) [470]. Согласно Европейским рекомендациям по профилактике сердечно-сосудистых заболеваний, все пациенты с заболеваниями периферических артерий с клиническими проявлениями в случае отсутствия противопоказаний должны получать антитромботическую терапию, гиполипидемические средства при уровне холестерина липопротеинов низкой плотности (ЛПНП) > 2,5 ммоль/л (> 97 мг/дл) и антигипертензивные средства при систолическом АД > 140 мм рт. ст. [131, 467, 468]. Британское исследование по защите сердца (UK Heart Protection Study) показало, что у пациентов с заболеванием периферических артерий прием 40 мг симвастатина** (АТХ: C10AA01) 1 раз в день снижал частоту первого основного неблагоприятного сердечно-сосудистого события на 22% по сравнению с пациентами, рандомизированными на получение плацебо [471].
Особенности послеоперационного наблюдения после ЭЛАБА (мониторинг)
Из-за риска осложнений, связанных с протезом, и его разрыва после ЭЛАБА считается обязательным регулярное проведение различных визуализирующих исследований в рамках последующего наблюдения.
- В раннем послеоперационном периоде всех пациентов с АБА после открытой реконструкции и пациентов из группы высокого риска после эндоваскулярной реконструкции рекомендуется наблюдать в отделении реанимации и интенсивной терапии или в палате интенсивной терапии [151].
ESVS/ЕОК I C (УДД 5 УУР C)
- Рекомендуется выполнение общего (клинического) анализа крови в процессе динамического наблюдения у всех пациентов с АБА для исключения сопутствующих заболеваний и осложнений лечения [69, 71].
РКО I C (УДД 5 УУР C)
- Рекомендуется проведение исследований уровня креатинина, натрия, калия, глюкозы, общего белка, C-реактивного белка, общего билирубина, мочевой кислоты, тиреотропного гормона (ТТГ) в крови, определение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) в крови у всех пациентов с АБА в процессе динамического наблюдения для исключения сопутствующих заболеваний и осложнений лечения [69, 71].
РКО I C (УДД 5 УУР C)
- Рекомендуется регистрация 12-канальной электрокардиограммы (ЭКГ) в покое всем пациентам для выявления признаков ишемии, наличия зубца Q, исключения сопутствующих нарушений ритма и проводимости сердца [96].
ЕОК I C (УУР C, УДД 5)
Визуализирующие исследования после ЭЛАБА
Перечень методов визуализации, их положительных и отрицательных характеристик представлен в Таблице ПБ-4. Как правило, КТА брюшной аорты и/или УЗДС аорты составляют основу для визуализации в рамках последующего наблюдения после ЭЛАБА [472].
Обзорная рентгенография органов брюшной полости
Традиционно обзорная рентгенография органов брюшной полости в переднезадней и боковой проекциях использовалась в рамках последующего наблюдения для выявления переломов и миграции стент-графта*** [473]. Однако этот метод визуализации крайне ограничен в обнаружении возможных осложнений ЭЛАБА и, следовательно, не подходит в качестве единственного метода визуализации для последующего наблюдения.
- Рекомендуется рассмотреть возможность проведения обзорной рентгенография органов брюшной полости в переднезадней и боковой проекциях в рамках последующего наблюдения пациентов после ЭЛАБА для выявления переломов и миграции имплантированных устройств [473].
РКО IIb C (УДД 5 УУР C)
Мультиспиральная компьютерная томография
КТ-ангиография (КТА) позволяет оценить и выявить большинство осложнений ЭЛАБА (Таблица ПБ-4).
- Пациентам после ЭЛАБА рекомендуется выполнение КТА брюшной аорты (A06.12.052) для выявления возможных осложнений [474].
РКО I B (УДД 1 УУР B)
Комментарии: Действующие инструкции по применению для стент-графтов*** включают рекомендации относительно регулярного последующего наблюдения с проведением до пяти КТ-обследований в течение первого года после операции [475, 476].
Магнитно-резонансная (МР) ангиография аорты
МР ангиографию аорты (одна область) можно использовать у отдельных пациентов для последующего наблюдения после ЭЛАБА. Измерения диаметра аневризмы с помощью МР ангиографии аорты (одна область) сопоставимы с данными измерений, выполняемых с помощью КТА брюшной аорты [477]. В систематическом обзоре данных одиннадцати исследований по сравнению результатов обследования с помощью МР ангиографии аорты (одна область) и КТА брюшной аорты после ЭЛАБА. МР ангиография аорты (одна область) оказалась более чувствительной в отношении выявления эндоподтекания типа II [478]. Таким образом, МР ангиография аорты (одна область) может играть особую роль в визуализирующих исследованиях у пациентов с увеличением размеров аневризматического мешка после ЭЛАБА, когда на КТА брюшной аорты получены отрицательные или неубедительные результаты. Использование стент-графтов*** из ферромагнитных материалов приводит к появлению значительных артефактов, которые затрудняют анализ изображений.
- Пациентам после ЭЛАБА в рамках наблюдения и исключения осложнений рекомендуется рассмотреть возможность необходимости выполнения МР ангиографии аорты (одна область) [477].
РКО IIb B (УДД 3 УУР B)
Ультразвуковое дуплексное сканирование аорты
УЗДС аорты обеспечивает возможность многократного и надежного измерения максимального диаметра аневризмы при низких затратах и без воздействия на пациента ионизирующего излучения или нефротоксичного контрастного средства. Результаты измерения диаметра с помощью УЗДС аорты нельзя напрямую сравнивать с результатами измерений при КТА брюшной аорты [479], и поэтому для оценки динамики изменения размеров аневризматического мешка после ЭЛАБА требуются повторные исследования с использованием одного и того же метода визуализации.
- В отдельных случаях по прошествии года после эндоваскулярного лечения сложной аневризмы брюшной аорты в качестве альтернативы наблюдению с использованием КТА брюшной аорты рекомендуется рассмотреть возможность наблюдения с использованием УЗДС аорты [151, 480, 481].
ESVS/ЕОК IIb C (УДД 4 УУР C)
Алгоритм последующего наблюдения после ЭЛАБА
- После эндоваскулярной реконструкции аневризмы брюшной аорты, независимо от исходной группы риска, рекомендуется раннее (в течение 30 дней) послеоперационное последующее наблюдение, включающее в себя визуализирующее исследование (УЗИ органов брюшной полости (комплексное) или КТ-ангиография) стент-графта эндоваскулярного для абдоминальной аорты*** для оценки наличия эндоподтекания, перекрытия компонентов, длины зоны герметизации, динамики размеров аневризматического мешка [71, 151, 482 - 484].
ESVS/ЕОК I B (УДД 2 УУР B)
Комментарий: современный алгоритм последующего наблюдения после ЭЛАБА должен включать визуализирующее исследование в раннем послеоперационном периоде с целью определения наличия эндоподтекания и оценки прилегания стент-графта эндоваскулярного для абдоминальной аорты*** к артериальной стенке [71].
После этого возможна стратификация пациентов на три группы на основании результатов первоначального визуализирующего исследования (Рисунок 9):
- группа низкого риска (отсутствие эндоподтекания, анатомия соответствует описанию в ИПП, надлежащее перекрытие и герметизация проксимального и дистального прилегания стент-графта эндоваскулярного для абдоминальной аорты*** к стенке артерии >= 10 мм) может быть рассмотрена для ограниченного последующего наблюдения с отсроченным проведением визуализирующего исследования в пределах пяти лет после реконструкции;
- группа промежуточного риска (надлежащее перекрытие и герметизация, однако наличие эндоподтекания типа II). Пациенты из этой группы подлежат последующему наблюдению для оценки увеличения или уменьшения размеров аневризматического мешка. Пациентов с уменьшением размеров аневризматического мешка на >= 1 см при наличии эндоподтекания типа II можно отнести к группе низкого риска неудачи с ограничением последующего наблюдения, как и для группы низкого риска;
- группа высокого риска (наличие эндоподтекания типа I или типа III, ненадлежащее перекрытие или герметизация < 10 мм). У таких пациентов потребность в повторном вмешательстве должна оцениваться на основании результатов исследований. При этом повторное вмешательство рекомендуется при эндоподтекания типа I или типа III или перегибе стент-графта эндоваскулярного для абдоминальной аорты***. У пациентов с ненадлежащим перекрытием или герметизацией < 10 мм, с отсутствием признаков эндоподтекания, рекомендуется повторное визуализирующее исследование, в первую очередь КТА, для точной оценки перекрытия, герметизации, эндоподтекания и увеличения размеров аневризматического мешка во время последующего наблюдения.
У пациентов с низким риском неудачи эндоваскулярной реконструкции аорты после первой послеоперационной КТА брюшной аорты рекомендуется стратификация для менее частого проведения визуализирующих исследований в рамках последующего наблюдения в соответствии с нижеприведенным алгоритмом (Рисунок ПБ-3) [482, 483, 485, 486].
- Рекомендуется рассмотреть возможность консилиумного обсуждения сосудистой командой предпочтительного метода ежегодной визуализации (КТА брюшной аорты или УЗДС аорты) для наблюдения пациентов, перенесших ЭЛАБА, после первой послеоперационной КТА брюшной аорты [482, 483, 485, 486].
ESVS/ЕОК IIb C (УДД 4 УУР C)
Данная схема последующего наблюдения после ЭЛАБА показана при использовании стандартных изделий. Сложные процедуры, в частности ЭЛАБА с использованием фенестрированных/браншированных стент-графтов***, пациенты, которым реконструкция выполняется с использованием параллельных стент-графтов*** по типу "дымохода" или новыми системами изделий, предназначенными для ЭЛАБА и основанными на нестандартной технологии, требуют индивидуального подхода к последующему наблюдению, исходя из используемого изделия, реконструкции и предполагаемого риска поздней неудачи.
- Пациентам, которым проводится эндоваскулярная реконструкция стенки сосуда по поводу юкстаренальной аневризмы брюшной аорты, рекомендуется программа долгосрочного последующего наблюдения, включающая проведение компьютерно-томографической ангиографии аорты один раз в год [71, 391].
ESVS/ЕОК I C (УДД 5 УУР C)
Хотя все пациенты с АБА должны получать антитромботическую терапию, во многих крупных исследованиях по комплексной эндоваскулярной реконструкции не указывался режим послеоперационной антикоагулянтной терапии [391, 487, 488], в то время как в других исследованиях применяли АСК** (АТХ: B01AC06) 75 - 100 мг по 1 таб., 1 раз в день, перорально или ДААТ [392].
- Всем пациентам, которым проводится открытое или эндоваскулярное лечение при разрыве аневризмы брюшной аорты, рекомендуется мониторинг внутрибрюшного давления для ранней диагностики и лечения внутрибрюшной гипертензии/абдоминального компартмент-синдрома [362, 383, 384, 387, 388].
ESVS/ЕОК I B (УДД 5 УУР C)
6. Организация оказания медицинской помощи
Медицинская помощь пациентам с аневризмой брюшной аорты (АБА) может оказываться в следующих условиях:
- амбулаторно (в условиях, не предусматривающих круглосуточное медицинское наблюдение и лечение);
- в дневном стационаре (в условиях, предусматривающих медицинское наблюдение и лечение в дневное время, не требующих круглосуточного медицинского наблюдения и лечения);
- стационарно (в условиях, обеспечивающих круглосуточное медицинское наблюдение и лечение).
Медицинская помощь пациентам с АБА оказывается в виде:
- первичной медико-санитарной помощи;
- скорой, в том числе скорой специализированной, медицинской помощи;
- специализированной, в том числе высокотехнологичной, медицинской помощи.
Первичная медико-санитарная помощь предусматривает мероприятия по скринингу, диагностике, наблюдению при АБА, медицинской реабилитации, формированию здорового образа жизни
Первичная медико-санитарная помощь пациентам с АБА предусматривает:
1) первичную доврачебную медико-санитарную помощь;
2) первичную врачебную медико-санитарную помощь;
3) первичную специализированную медико-санитарную помощь.
Первичная доврачебная медико-санитарная помощь осуществляется амбулаторно работниками со средним медицинским образованием фельдшерских здравпунктов, фельдшерско-акушерских пунктов, врачебных амбулаторий, здравпунктов, поликлиник, поликлинических подразделений медицинских организаций, отделений (кабинетов) медицинской профилактики, центров здоровья.
Первичная врачебная медико-санитарная помощь осуществляется врачом-терапевтом участковым, врачом общей практики (семейным врачом) в амбулаторных условиях. При выявлении признаков АБА пациент направляется к профильному специалисту для оказания первичной специализированной медико-санитарной помощи.
Особенностью ведения пациентов с АБА является необходимость регулярных промежуточных исследований. При технической возможности, диагностические скрининги, в том числе с применением методов лучевой диагностики, следует проводить в амбулаторных условиях с дальнейшей интерпретацией полученных данных профильными врачами-хирургами.
Первичная специализированная медико-санитарная помощь оказывается пациентам с АБА врачами-хирургами, врачами-сердечно-сосудистыми хирургами. Для проведения диагностических исследований привлекаются врачи ультразвуковой диагностики, врачи функциональной диагностики, врачи-рентгенологи. При невозможности оказания медицинской помощи в рамках первичной медико-санитарной помощи и наличии медицинских показаний больной направляется в медицинскую организацию, оказывающую специализированную медицинскую помощь.
Скорая, в том числе специализированная, медицинская помощь (СМП) больным с АБА, требующим срочного медицинского вмешательства, оказывается фельдшерскими общепрофильными выездными бригадами СМП, врачебными общепрофильными выездными бригадами СМП, специализированными выездными бригадами СМП анестезиологии-реанимации, выездными экстренными консультативными бригадами СМП в соответствии с Порядком оказания скорой, в том числе скорой специализированной, медицинской помощи, утвержденным приказом Министерства здравоохранения РФ от 20 июня 2013 г. N 388н. Скорая, в том числе специализированная, медицинская помощь (СМП) оказывается пациентам с АБА в случае развития жизнеугрожающих состояний, таких как разрыв АБА, различные формы осложненной АБА, симптомные аневризмы, а также расширение аорты более 9 см. При оказании скорой медицинской помощи в случае необходимости осуществляется медицинская эвакуация, которая включает в себя санитарно-авиационную и санитарную эвакуацию другими видами транспорта.
Бригада скорой медицинской помощи доставляет больных с угрожающими жизни состояниями в медицинские организации, оказывающие круглосуточную медицинскую помощь по профилю "сердечно-сосудистая хирургия" или "хирургия".
При наличии медицинских показаний после устранения угрожающих жизни состояний больные переводятся в отделение сердечно-сосудистой или сосудистой хирургии, или хирургическое отделение медицинской организации для оказания специализированной медицинской помощи.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается в условиях стационара врачами сердечно-сосудистыми хирургами, в ряде случаев врачами по рентгенэндоваскулярным диагностике и лечению, в стационарных условиях, а также в хирургическом отделении, имеющем в своем составе сосудистые койки, и включает в себя диагностику, лечение, требующих использования специальных методов и сложных медицинских технологий, а также медицинскую реабилитацию. При наличии медицинских показаний лечение проводят с привлечением врачей-специалистов по специальностям, предусмотренным Номенклатурой специальностей специалистов с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения Российской Федерации, утвержденной приказом Министерства здравоохранения Российской Федерации от 07.10.2015 N 700н, в частности - врачи ультразвуковой диагностики, врачи функциональной диагностики, врачи-рентгенологи, врачи-радиологи, врачи-анестезиологи-реаниматологи, врачи по медицинской реабилитации.
Плановая медицинская помощь оказывается пациентам с АБА в стадии заболевания, не сопровождающейся угрозой жизни, не требующей экстренной и неотложной помощи, отсрочка оказания которой на определенное время не повлечет за собой ухудшение состояния, угрозу жизни и здоровью больного.
Показаниями для плановой госпитализации пациентов с АБА в стационар являются:
- оперативное лечение АБА;
- оперативное лечение состояний и осложнений после открытых и эндоваскулярных вмешательств на АБА.
Не является показанием для госпитализации:
- проведение периодических диагностических скринингов АБА, при условии технической возможности их выполнения в амбулаторном порядке.
Оказание медицинской помощи в медицинской организации, оказывающей специализированную медицинскую помощь, осуществляется по медицинским показаниям при самостоятельном обращении больного, по направлению фельдшера, врача-терапевта участкового, врача общей практики (семейного врача), врача-хирурга, врача-сердечно-сосудистого-хирурга медицинской организации, оказывающей первичную медико-санитарную помощь, а также при доставлении больного бригадой скорой медицинской помощи.
Показания для экстренной госпитализации пациентов с АБА в стационар являются:
- подозрение на разрыв аневризмы;
- симптомная аневризма, а также клинические ситуации, в которых при наличии АБА не представляется возможным исключить взаимосвязь болевого синдрома с расширением аорты;
- прочие осложненные формы АБА (расслоение стенки аорты, мешотчатая аневризма, пенетрирующая язва аорты, интрамуральная гематома, псевдоаневризма, угрожающий разрыв, аорто-органные или аорты-венозные фистулы);
- гигантские (более 9 см в диаметре) аневризмы;
- тромбоз аневризмы, тромбоэмболия периферических артерий из просвета аневризмы.
В отношении пациентов с рАБА возможны следующие стратегии:
- пациентов в стабильном состоянии с рАБА следует госпитализировать в медицинское учреждение с круглосуточным сосудистым отделением;
- пациентов с рАБА в крайне тяжелом состоянии при отсутствии возможности доставки в специализированный стационар рекомендуется транспортировать в ближайший хирургический стационар с последующим вызовом бригады врачей - сердечно-сосудистых хирургов по линии санитарной авиации [489 - 494].
Рекомендуемый состав выездной сосудистой бригады из специализированного учреждения на рАБА: минимум два врача по рентгенэндоваскулярным диагностике и лечению и врач-анестезиолог-реаниматолог сосудистой команды [29, 71, 490].
Критерии выписки из стационара:
- завершенное оперативное лечение АБА, состояний или осложнений после открытых и эндоваскулярных вмешательств на АБА.
Пациенты, перенесшие хирургические вмешательства по поводу различных форм АБА, при наличии медицинских показаний направляются для проведения реабилитационных мероприятий в специализированные медицинские и санаторно-курортные организации.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи медицинской помощи взрослым при аневризме брюшной аорты без упоминания о разрыве (код МКБ-10: I71.4)
N
Критерии качества
Оценка выполнения
1
Проведен сбор жалоб и анамнеза у всех пациентов с подозрением на АБА
да/нет
2
Проведено физикальное обследование у всех пациентов с подозрением на АБА
да/нет
3
Выполнен общий (клинический) анализ крови в рамках первичного обследования и в процессе динамического наблюдения у всех пациентов с АБА для исключения сопутствующих заболеваний и осложнений лечения
да/нет
4
Выполнено исследование уровня креатинина, натрия, калия, глюкозы, общего белка, C-реактивного белка, активности АЛТ, АСТ, общего билирубина, мочевой кислоты, ТТГ в крови у всех пациентов с АБА в рамках первичного обследования и в процессе динамического наблюдения для исключения сопутствующих заболеваний и осложнений лечения
да/нет
5
Выполнена регистрация 12-канальной ЭКГ в покое всем пациентам с АБА для выявления признаков ишемии, наличия зубца Q, исключения сопутствующих нарушений ритма и проводимости сердца
да/нет
6
Выполнена эхокардиография (трансторакальная) всем пациентам с подтвержденной АБА для исключения аневризмы грудного отдела аорты
да/нет
7
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и ультразвуковое дуплексное сканирование брюшной аорты всем пациентам с подозрением на АБА первым этапом для подтверждения диагноза, определения дальнейшей тактики ведения и динамического наблюдения
да/нет
8
Выполнена компьютерно-томографическая ангиография аорты всем пациентам с подозрением или подтвержденным диагнозом АБА по данным ультразвукового исследования органов брюшной полости (комплексного) и/или ультразвукового дуплексного сканирования брюшной аорты для подтверждения диагноза, а также симптомным пациентам для оценке протяженности патологического процесса, исключения разрыва аневризмы и других осложнений а также для выбора метода лечения, планировании хирургического вмешательства исключения разрыва аневризмы и наблюдения после реконструктивного вмешательства
да/нет
Критерии оценки качества специализированной медицинской помощи взрослым при аневризме брюшной аорты без упоминания о разрыве (код МКБ-10: I71.4)
N
Критерии качества
Оценка выполнения
1
Проведен сбор жалоб и анамнеза у всех пациентов с подозрением на АБА
да/нет
2
Проведено физикальное обследование
да/нет
3
Выполнен общий (клинический) анализ крови в рамках первичного обследования и в процессе динамического наблюдения у всех пациентов с АБА для исключения сопутствующих заболеваний и осложнений лечения
да/нет
4
Выполнено исследование уровня креатинина, натрия, калия, глюкозы, общего белка, C-реактивного белка, активности АЛТ, АСТ, общего билирубина, мочевой кислоты, ТТГ в крови у всех пациентов с АБА в рамках первичного обследования и в процессе динамического наблюдения для исключения сопутствующих заболеваний и осложнений лечения
да/нет
5
Выполнена регистрация 12-канальной ЭКГ в покое всем пациентам с АБА для выявления признаков ишемии, наличия зубца Q, исключения сопутствующих нарушений ритма и проводимости сердца
да/нет
6
Выполнена эхокардиография (трансторакальная) всем пациентам с подтвержденной АБА для исключения аневризмы грудного отдела аорты.
да/нет
7
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и ультразвуковое дуплексное сканирование брюшной аорты всем пациентам с подозрением на АБА первым этапом для подтверждения диагноза, определения дальнейшей тактики ведения и динамического наблюдения
да/нет
8
Выполнена компьютерно-томографическая ангиография аорты всем пациентам с подозрением или подтвержденным диагнозом АБА по данным ультразвукового исследования органов брюшной полости (комплексного) и/или ультразвукового дуплексного сканирования брюшной аорты для подтверждения диагноза, а также симптомным пациентам для оценке протяженности патологического процесса, исключения разрыва аневризмы и других осложнений а также для выбора метода лечения, планировании хирургического вмешательства исключения разрыва аневризмы и наблюдения после реконструктивного вмешательства
да/нет
9
Выполнено пациентам с АБА УЗИ ультразвуковое дуплексное сканирование брюшной аорты с частотой: один раз в три года при аневризмах диаметром 3 - 3,9 см, один раз в год при аневризмах диаметром 4,0 - 4,9 см и один раз в 3 - 6 месяцев при аневризмах >= 5,0 см
да/нет
10
Проведена консультация врача-кардиолога.
да/нет
11
Выполнена хирургическая реконструкция АБА при наличии показаний (мужчинам с АБА при диаметре аневризмы 5 - 5,5 см; женщинам с АБА и приемлемым хирургическим риском при диаметре аневризмы >= 4,5 - 5,0 см; пациентам с АБА при быстром росте аневризмы - более 1,0 см в год - срочное обращение к врачу-сердечно-сосудистому хирургу для дополнительного обследования)
да/нет
12
Выполнена визуализация зоны реконструкции (КТ-ангиография стент-графта) АБА в течение 30 дней после хирургического вмешательства
да/нет
Критерии оценки качества первичной медико-санитарной помощи медицинской помощи взрослым при аневризме брюшной аорты разорванной (код МКБ-10: I71.3)
N
Критерии качества
Оценка выполнения
1
Проведен сбор жалоб и анамнеза у всех пациентов с подозрением на рАБА
да/нет
2
Проведено физикальное обследование
да/нет
3
Выполнен общий (клинический) анализ крови в рамках первичного обследования и в процессе динамического наблюдения у всех пациентов с АБА для исключения сопутствующих заболеваний и осложнений лечения
да/нет
4
Выполнено исследование уровня креатинина, натрия, калия, глюкозы, общего белка, C-реактивного белка, активности АЛТ, АСТ, общего билирубина, мочевой кислоты, ТТГ в крови у всех пациентов с АБА в рамках первичного обследования и в процессе динамического наблюдения для исключения сопутствующих заболеваний и осложнений лечения
да/нет
5
Выполнена регистрация 12-канальной ЭКГ в покое всем пациентам с АБА для выявления признаков ишемии, наличия зубца Q, исключения сопутствующих нарушений ритма и проводимости сердца
да/нет
6
Выполнена эхокардиография (трансторакальная) всем пациентам с подтвержденной АБА для исключения аневризмы грудного отдела аорты.
да/нет
7
Выполнена срочная КТА брюшной аорты у гемодинамически стабильных пациентов с подозрением на разрыв аневризмы брюшной аорты, однако выбор доступного метода визуализации выбирается решением сосудистой команды
да/нет
8
Пациенты с разрывом АБА в стабильном состоянии госпитализированы в медицинское учреждение с круглосуточным сосудистым отделением;
Пациенты с разрывом АБА в крайне тяжелом состоянии при отсутствии возможности доставки в специализированный стационар, транспортированы в ближайший хирургический стационар с последующим вызовом бригады врачей - сердечно-сосудистых хирургов по линии санитарной авиации.
да/нет
Критерии оценки качества специализированной медицинской помощи взрослым при аневризме брюшной аорты разорванной (код МКБ-10: I71.3)
N
Критерии качества
Оценка выполнения
1
Проведен сбор жалоб и анамнеза у всех пациентов с подозрением на рАБА
да/нет
2
Проведено физикальное обследование
да/нет
3
Выполнен общий (клинический) анализ крови в рамках первичного обследования и в процессе динамического наблюдения у всех пациентов с АБА для исключения сопутствующих заболеваний и осложнений лечения
да/нет
4
Выполнено исследование уровня креатинина, натрия, калия, глюкозы, общего белка, C-реактивного белка, активности АЛТ, АСТ, общего билирубина, мочевой кислоты, ТТГ в крови у всех пациентов с АБА в рамках первичного обследования и в процессе динамического наблюдения для исключения сопутствующих заболеваний и осложнений лечения
да/нет
5
Выполнена регистрация 12-канальной ЭКГ в покое всем пациентам с АБА для выявления признаков ишемии, наличия зубца Q, исключения сопутствующих нарушений ритма и проводимости сердца
да/нет
6
Выполнена эхокардиография (трансторакальная) всем пациентам с подтвержденной АБА для исключения аневризмы грудного отдела аорты.
да/нет
7
Выполнена срочная КТА брюшной аорты у гемодинамически стабильных пациентов с подозрением на разрыв аневризмы брюшной аорты, однако выбор доступного метода визуализации выбирается решением сосудистой команды
да/нет
8
Пациенты с разрывом АБА в стабильном состоянии госпитализированы в медицинское учреждение с круглосуточным сосудистым отделением;
Пациенты с разрывом АБА в крайне тяжелом состоянии при отсутствии возможности доставки в специализированный стационар, транспортированы в ближайший хирургический стационар с последующим вызовом бригады врачей-сердечно-сосудистых хирургов по линии санитарной авиации.
да/нет
Список литературы
1. Андреева Н.С., Реброва О.Ю., Зорин Н.А., Авксентьева М.В., Омельяновский В.В. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии Оценка и выбор. 2012; 4 (10): 10 - 24.
2. Покровский А.В., Абрамова Н.Н., Амбатьело С.Г., Аракелян В.С., Беличенко О.И., Богатов Ю.П. и др. Клиническая Ангиология: Руководство. Vol 1. "Медицина". (Покровский А.В., ed.).; 2004.
3. Ellis M, Powell JT, Greenhalgh RM. Limitations of ultrasonography in surveillance of small abdominal aortic aneurysms. British Journal of Surgery. 2005; 78(5): 614 - 616. doi: 10.1002/bjs.1800780529
4. Freiberg MS, Arnold AM, Newman AB, Edwards MS, Kraemer KL, Kuller LH. Abdominal Aortic Aneurysms, Increasing Infrarenal Aortic Diameter, and Risk of Total Mortality and Incident Cardiovascular Disease Events. Circulation. 2008; 117(8): 1010 - 1017. doi: 10.1161/CIRCULATIONAHA.107.720219
5. Sparks A.R., Johnson P.L., Meyer M.C. Imaging of abdominal aortic aneurysms. 2002; 65(8): 1565 - 1570.
6. Li K, Zhang K, Li T, Zhai S. Primary results of abdominal aortic aneurysm screening in the at-risk residents in middle China. BMC Cardiovasc Disord. 2018; 18(1): 60. doi: 10.1186/s12872-018-0793-5
7. Sweeting MJ, Masconi KL, Jones E, et al. Analysis of clinical benefit, harms, and cost-effectiveness of screening women for abdominal aortic aneurysm. The Lancet. 2018; 392(10146): 487 - 495. doi: 10.1016/S0140-6736(18)31222-4
8. Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018; 67(1): 2 - 77. e2. doi: 10.1016/j.jvs.2017.10.044
9. Ockert S, Schumacher H,  D, Megges I, Allenberg JR. Early and Midterm Results After Open and Endovascular Repair of Ruptured Abdominal Aortic Aneurysms in a Comparative Analysis. Journal of Endovascular Therapy. 2007; 14(3): 324 - 332. doi: 10.1583/06-2065.1
D, Megges I, Allenberg JR. Early and Midterm Results After Open and Endovascular Repair of Ruptured Abdominal Aortic Aneurysms in a Comparative Analysis. Journal of Endovascular Therapy. 2007; 14(3): 324 - 332. doi: 10.1583/06-2065.1
10. Pitoulias GA, Donas KP, Schulte S, Horsch S, Papadimitriou DK. Isolated iliac artery aneurysms: Endovascular versus open elective repair. J Vasc Surg. 2007; 46(4): 648 - 654. doi: 10.1016/j.jvs.2007.05.047
11. Гайсина Э.А. ЭШМАВ Максимов, Макаримов Э.Ш., Максимов А.В. Опыт эндоваскулярного лечения аневризм подвздошных артерий. Ангиология и сосудистая хирургия. 2020; 26(3): 54 - 57.
12. Тихановская Е.О. Воспалительные аневризмы брюшной аорты. Вестник Российской военно-медицинской академия им. С.М. Кирова. 2012; 1(37): 305 - 308.
13. Patel ND, Crawford T, Magruder JT, et al. Cardiovascular operations for Loeys-Dietz syndrome: Intermediate-term results. J Thorac Cardiovasc Surg. 2017; 153(2): 406 - 412. doi: 10.1016/j.jtcvs.2016.10.088
14. Oderich GS, Panneton JM, Bower TC, et al. Infected aortic aneurysms: Aggressive presentation, complicated early outcome, but durable results. J Vasc Surg. 2001; 34(5): 900 - 908. doi: 10.1067/mva.2001.118084
15. Kakkos SK, Papazoglou KO, Tsolakis IA, Lampropoulos G, Papadoulas SI, Antoniadis PN. Open Versus Endovascular Repair of Inflammatory Abdominal Aortic Aneurysms. Vasc Endovascular Surg. 2015; 49(5-6): 110 - 118. doi: 10.1177/1538574415602780
16. Vasquez J, Poultsides GA, Lorenzo AC, Foster JE, Drezner AD, Gallagher J. Endovascular stent-graft placement for nonaneurysmal infrarenal aortic rupture: a case report and review of the literature. J Vasc Surg. 2003; 38(4): 836 - 839. doi: 10.1016/S0741-5214(03)00557-3
17. Batt M, Haudebourg P, Planchard PF, Ferrari E, Hassen-Khodja R, Bouillanne PJ. Penetrating Atherosclerotic Ulcers of the Infrarenal Aorta: Life-threatening Lesions. European Journal of Vascular and Endovascular Surgery. 2005; 29(1): 35 - 42. doi: 10.1016/j.ejvs.2004.09.025
18. Мозговой П.В., Луковскова А.А., Спиридонов Е.Г., Жаркин Ф.Н., Уфимцев В.С., Моисеев Д.В. Результаты эндоваскулярного протезирования у пациентов с аневризмами инфраренальной аорты. Вестник Волгоградского государственного медицинского университета. 2020; 2(74): 135 - 138.
19. Покровский А.В., Вафина Г.Р. Пенетрирующие атеросклеротические язвы аорты. Ангиология и сосудистая хирургия. 2012; 18(4): 8 - 14.
20. Ягафаров И.Р., Сайфуллин Р.Р., Исхаков М.М., et al. Лечение пациента с острым разрывом пенетрирующей атеросклеротической язвы грудного отдела аорты. Казанский медицинский журнал. 2015; 96(3): 377 - 380.
21. Jawadi N, Bisdas T, Torsello G, Stavroulakis K, Donas KP. Endovascular Treatment of Isolated Abdominal Aortic Dissections: Long-term Results. Journal of Endovascular Therapy. 2014; 21(2): 324 - 328. doi: 10.1583/13-4467MR.1
22. Macedo TA, Stanson AW, Oderich GS, Johnson CM, Panneton JM, Tie ML. Infected Aortic Aneurysms: Imaging Findings. Radiology. 2004; 231(1): 250 - 257. doi: 10.1148/radiol.2311021700
23. Hsu RB, Tsay YG, Wang SS, Chu SH. Surgical treatment for primary infected aneurysm of the descending thoracic aorta, abdominal aorta, and iliac arteries. J Vasc Surg. 2002; 36(4): 746 - 750. doi: 10.1067/mva.2002.126557
24. Лызиков А.А., Каплан М.Л. Первично инфицированная аневризма инфраренального отдела брюшной аорты. Проблемы здоровья и экологии. 2018; 3(57): 66 - 70.
25. Eagleton MJ, Shah S, Petkosevek D, Mastracci TM, Greenberg RK. Hypogastric and subclavian artery patency affects onset and recovery of spinal cord ischemia associated with aortic endografting. J Vasc Surg. 2014; 59(1): 89 - 95. doi: 10.1016/j.jvs.2013.07.007
26. Bekdache K, Dietzek AM, Cha A, Neychev V. Endovascular Hypogastric Artery Preservation During Endovascular Aneurysm Repair: A Review of Current Techniques and Devices. Ann Vasc Surg. 2015; 29(2): 367 - 376. doi: 10.1016/j.avsg.2014.10.019
27.  K, Mani K,
K, Mani K, ![]() M, et al. Endovascular Treatment of Mycotic Aortic Aneurysms. Circulation. 2014; 130(24): 2136 - 2142. doi: 10.1161/CIRCULATIONAHA.114.009481
M, et al. Endovascular Treatment of Mycotic Aortic Aneurysms. Circulation. 2014; 130(24): 2136 - 2142. doi: 10.1161/CIRCULATIONAHA.114.009481
28. Yusuf K, Murat B, Unal A, et al. Inflammatory abdominal aortic aneurysm: Predictors of long-term outcome in a case-control study. Surgery. 2007; 141(1): 83 - 89. doi: 10.1016/j.surg.2006.04.007
29. НАЦИОНАЛЬНЫЕ РЕКОМЕНДАЦИИ ПО ВЕДЕНИЮ ПАЦИЕНТОВ С АНЕВРИЗМАМИ БРЮШНОЙ АОРТЫ.; 2013.
30. Ullery BW, Tran K, Chandra V, et al. Association of an Endovascular-First Protocol for Ruptured Abdominal Aortic Aneurysms With Survival and Discharge Disposition. JAMA Surg. 2015; 150(11): 1058 - 1065. doi: 10.1001/jamasurg.2015.1861
31. Malina M, Veith F, Ivancev K, Sonesson B. Balloon occlusion of the aorta during endovascular repair of ruptured abdominal aortic aneurysm. J Endovasc Ther. 2005; 12(5): 556 - 559. doi: 10.1583/05-1587.1
32. Kirkpatrick AW, Roberts DJ, De Waele J, et al. Intra-abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013; 39(7): 1190 - 1206. doi: 10.1007/s00134-013-2906-z
33. Nathan DP, Boonn W, Lai E, et al. Presentation, complications, and natural history of penetrating atherosclerotic ulcer disease. J Vasc Surg. 2012; 55(1): 10 - 15. doi: 10.1016/j.jvs.2011.08.005
34. Trimarchi S, Tsai T, Eagle KA, et al. Acute abdominal aortic dissection: Insight from the International Registry of Acute Aortic Dissection (IRAD). J Vasc Surg. 2007; 46(5): 913 - 919.e1. doi: 10.1016/j.jvs.2007.07.030
35. Белов Ю.В., Чарчян Э.Р., Алексеев И.А., Пырля М.И. Хирургическое лечение спонтанного разрыва аорты при пенетрирующей атеросклеротической язве. Хирургия Журнал им. Н.И. Пирогова. 2011; 10: 82 - 84.
36.  S,
S, ![]() M,
M,  M, Djavani Gidlund K, Hellberg A, Wanhainen A. Low Prevalence of Abdominal Aortic Aneurysm Among 65-Year-Old Swedish Men Indicates a Change in the Epidemiology of the Disease. Circulation. 2011; 124(10): 1118 - 1123. doi: 10.1161/CIRCULATIONAHA.111.030379
M, Djavani Gidlund K, Hellberg A, Wanhainen A. Low Prevalence of Abdominal Aortic Aneurysm Among 65-Year-Old Swedish Men Indicates a Change in the Epidemiology of the Disease. Circulation. 2011; 124(10): 1118 - 1123. doi: 10.1161/CIRCULATIONAHA.111.030379
37. Lederle FA. The Aneurysm Detection and Management Study Screening Program. Arch Intern Med. 2000; 160(10): 1425. doi: 10.1001/archinte.160.10.1425
38. Jahangir E, Lipworth L, Edwards TL, et al. Smoking, sex, risk factors and abdominal aortic aneurysms: a prospective study of 18 782 persons aged above 65 years in the Southern Community Cohort Study. J Epidemiol Community Health (1978). 2015; 69(5): 481 - 488. doi: 10.1136/jech-2014-204920
39. Stackelberg O, ![]() M, Larsson SC, Orsini N, Wolk A. Sex differences in the association between smoking and abdominal aortic aneurysm. British Journal of Surgery. 2014; 101(10): 1230 - 1237. doi: 10.1002/bjs.9526
M, Larsson SC, Orsini N, Wolk A. Sex differences in the association between smoking and abdominal aortic aneurysm. British Journal of Surgery. 2014; 101(10): 1230 - 1237. doi: 10.1002/bjs.9526
40. Wahlgren CM, Larsson E, Magnusson PKE, Hultgren R, Swedenborg J. Genetic and environmental contributions to abdominal aortic aneurysm development in a twin population. J Vasc Surg. 2010; 51(1): 3 - 7. doi: 10.1016/j.jvs.2009.08.036
41. Joergensen TMM, Christensen K, Lindholt JS, Larsen LA, Green A, Houlind K. Editor's Choice - High Heritability of Liability to Abdominal Aortic Aneurysms: A Population Based Twin Study. European Journal of Vascular and Endovascular Surgery. 2016; 52(1): 41 - 46. doi: 10.1016/j.ejvs.2016.03.012
42. Lederle FA. The Strange Relationship between Diabetes and Abdominal Aortic Aneurysm. European Journal of Vascular and Endovascular Surgery. 2012; 43(3): 254 - 256. doi: 10.1016/j.ejvs.2011.12.026
43. Dinesh Shah A, Langenberg C, Rapsomaniki E, et al. Type 2 diabetes and incidence of a wide range of cardiovascular diseases: a cohort study in 1·9 million people. The Lancet. 2015; 385: S86. doi: 10.1016/S0140-6736(15)60401-9
44. GENKEL V, KUZNETCOVA A, SHAPOSHNIK I. Relationship between the abdominal aortic diameter and carotid atherosclerosis in middle-aged patients without established atherosclerotic cardiovascular diseases. International Angiology. 2021; 40(2). doi: 10.23736/S0392-9590.21.04493-X
45. Altobelli E, Rapacchietta L, Profeta V, Fagnano R. Risk Factors for Abdominal Aortic Aneurysm in Population-Based Studies: A Systematic Review and Meta-Analysis. Int J Environ Res Public Health. 2018; 15(12): 2805. doi: 10.3390/ijerph15122805
46. Прозоров С.А., Михайлов И.П. Лучевая диагностика расслоений брюшного отдела аорты. Вестник рентгенологии и радиологии. 2013; 1: 39 - 41.
47. FARGE D, DEBOURDEAU P, BECKERS M, et al. International clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. Journal of Thrombosis and Haemostasis. 2013; 11(1): 56 - 70. doi: 10.1111/jth.12070
48. Riambau V,  D, Brunkwall J, et al. Editor's Choice - Management of Descending Thoracic Aorta Diseases. European Journal of Vascular and Endovascular Surgery. 2017; 53(1): 4 - 52. doi: 10.1016/j.ejvs.2016.06.005
D, Brunkwall J, et al. Editor's Choice - Management of Descending Thoracic Aorta Diseases. European Journal of Vascular and Endovascular Surgery. 2017; 53(1): 4 - 52. doi: 10.1016/j.ejvs.2016.06.005
49. van der Linde D, Bekkers JA, Mattace-Raso FUS, et al. Progression Rate and Early Surgical Experience in the New Aggressive Aneurysms-Osteoarthritis Syndrome. Ann Thorac Surg. 2013; 95(2): 563 - 569. doi: 10.1016/j.athoracsur.2012.07.009
50. Sweeting MJ, Thompson SG, Brown LC, Powell JT. Meta-analysis of inpidual patient data to examine factors affecting growth and rupture of small abdominal aortic aneurysms. British Journal of Surgery. 2012; 99(5): 655 - 665. doi: 10.1002/bjs.8707
51. Oliver-Williams C, Sweeting MJ, Turton G, et al. Lessons learned about prevalence and growth rates of abdominal aortic aneurysms from a 25-year ultrasound population screening programme. British Journal of Surgery. 2017; 105(1): 68 - 74. doi: 10.1002/bjs.10715
52. Bandyk D. F. Vascular injury associated with extremity trauma. Clin Orthop Relat Res. 1995; 318: 117 - 124.
53. Wanhainen A, Verzini F, Van Herzeele I, et al. Editor's Choice - European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. European Journal of Vascular and Endovascular Surgery. 2019; 57(1): 8 - 93. doi: 10.1016/j.ejvs.2018.09.020
54. Sampson UKA, Norman PE, Fowkes FGR, et al. Estimation of Global and Regional Incidence and Prevalence of Abdominal Aortic Aneurysms 1990 to 2010. Glob Heart. 2014; 9(1): 159. doi: 10.1016/j.gheart.2013.12.009
55. Crawford ES, Crawford JL, Safi HJ, et al. Thoracoabdominal aortic aneurysms: Preoperative and intraoperative factors determining immediate and long-term results of operations in 605 patients. J Vasc Surg. 1986; 3(3): avs0030389. doi: 10.1067/mva.1986.avs0030389
56. Svensson LG, Crawford ES, Hess KR, Coselli JS, Safi HJ. Experience with 1509 patients undergoing thoracoabdominal aortic operations. J Vasc Surg. 1993; 17(2): 357 - 370. doi: 10.1016/0741-5214(93)90421-H
57. Oderich GS, Forbes TL, Chaer R, et al. Reporting standards for endovascular aortic repair of aneurysms involving the renal-mesenteric arteries. J Vasc Surg. 2021; 73(1): 4S - 52S. doi: 10.1016/j.jvs.2020.06.011
58. Richardson JW, Greenfield LJ. Natural history and management of iliac aneurysms. J Vasc Surg. 1988; 8(2): 165 - 171.
59. Fahrni M, Lachat MM, Wildermuth S, Pfammatter T. Endovascular Therapeutic Options for Isolated Iliac Aneurysms with a Working Classification. Cardiovasc Intervent Radiol. 2003; 26(5). doi: 10.1007/s00270-003-0005-1
60. Reber PU, Brunner K, Hakki H, Stirnemann P, Kniemeyer HW.  , Klassifikation und Therapie der isolierten Beckenarterienaneurysmen. Der Chirurg. 2001; 72(4): 419 - 424. doi: 10.1007/s001040051324
, Klassifikation und Therapie der isolierten Beckenarterienaneurysmen. Der Chirurg. 2001; 72(4): 419 - 424. doi: 10.1007/s001040051324
61. Sandhu RS, Pipinos II. Isolated Iliac Artery Aneurysms. Semin Vasc Surg. 2005; 18(4): 209 - 215. doi: 10.1053/j.semvascsurg.2005.09.007
62. Johnston KW, Rutherford RB, Tilson MD, Shah DM, Hollier L, Stanley JC. Suggested standards for reporting on arterial aneurysms. J Vasc Surg. 1991; 13(3): 452 - 458. doi: 10.1067/mva.1991.26737
63. Laine MT, ![]() M, Beiles CB, et al. Few internal iliac artery aneurysms rupture under 4 cm. J Vasc Surg. 2017; 65(1): 76 - 81. doi: 10.1016/j.jvs.2016.06.109
M, Beiles CB, et al. Few internal iliac artery aneurysms rupture under 4 cm. J Vasc Surg. 2017; 65(1): 76 - 81. doi: 10.1016/j.jvs.2016.06.109
64. Michael Bacharach J, Slovut DP. State of the art: Management of iliac artery aneurysmal disease. Catheterization and Cardiovascular Interventions. 2008; 71(5): 708 - 714. doi: 10.1002/ccd.21507
65. Chaer RA, Barbato JE, Lin SC, Zenati M, Kent KC, McKinsey JF. Isolated iliac artery aneurysms: A contemporary comparison of endovascular and open repair. J Vasc Surg. 2008; 47(4): 708 - 713. e1. doi: 10.1016/j.jvs.2007.11.008
66. Patel N V., Long GW, Cheema ZF, Rimar K, Brown OW, Shanley CJ. Open vs. endovascular repair of isolated iliac artery aneurysms: A 12-year experience. J Vasc Surg. 2009; 49(5): 1147 - 1153. doi: 10.1016/j.jvs.2008.11.101
67. Boules TN, Selzer F, Stanziale SF, et al. Endovascular management of isolated iliac artery aneurysms. J Vasc Surg. 2006; 44(1): 29 - 37. doi: 10.1016/j.jvs.2006.02.055
68. Gao J, Cao H, Hu G, et al. The mechanism and therapy of aortic aneurysms. Signal Transduct Target Ther. 2023; 8(1): 55. doi: 10.1038/s41392-023-01325-7
69. Шляхто Е.В. Кардиология. Национальное Руководство. Краткое Издание. ГЭОТАР-Медиа. (Шляхто Е.В., ed.).; 2022.
70. Karkos C, Mukhopadhyay U, Papakostas I, Ghosh J, Thomson G, Hughes R. Abdominal Aortic Aneurysm: the Role of Clinical Examination and Opportunistic Detection. European Journal of Vascular and Endovascular Surgery. 2000; 19(3): 299 - 303. doi: 10.1053/ejvs.1999.1002
71. Isselbacher EM, Preventza O, Hamilton Black J, et al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022; 146(24). doi: 10.1161/CIR.0000000000001106
72. Eslami MH, Rybin D, Doros G, Kalish JA, Farber A. Comparison of a Vascular Study Group of New England risk prediction model with established risk prediction models of in-hospital mortality after elective abdominal aortic aneurysm repair. J Vasc Surg. 2015; 62(5): 1125 - 1133. e2. doi: 10.1016/j.jvs.2015.06.051
73. Duceppe E, Patel A, Chan MTV, et al. Preoperative N-Terminal Pro-B-Type Natriuretic Peptide and Cardiovascular Events After Noncardiac Surgery: A Cohort Study. Ann Intern Med. 2020; 172(2): 96. doi: 10.7326/M19-2501
74. Weber M, Luchner A, Manfred S, et al. Incremental value of high-sensitive troponin T in addition to the revised cardiac index for peri-operative risk stratification in non-cardiac surgery. Eur Heart J. 2013; 34(11): 853 - 862. doi: 10.1093/eurheartj/ehs445
75. Halvorsen S, Mehilli J, Cassese S, et al. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J. 2022; 43(39): 3826 - 3924. doi: 10.1093/eurheartj/ehac270
76. De Hert S, Imberger G, Carlisle J, et al. Preoperative evaluation of the adult patient undergoing non-cardiac surgery. Eur J Anaesthesiol. 2011; 28(10): 684 - 722. doi: 10.1097/EJA.0b013e3283499e3b
77. Saratzis A, Nduwayo S, Sarafidis P, Sayers RD, Bown MJ. Renal Function is the Main Predictor of Acute Kidney Injury after Endovascular Abdominal Aortic Aneurysm Repair. Ann Vasc Surg. 2016; 31: 52 - 59. doi: 10.1016/j.avsg.2015.10.010
78. Inagaki E, Farber A, Eslami MH, et al. Preoperative hypoalbuminemia is associated with poor clinical outcomes after open and endovascular abdominal aortic aneurysm repair. J Vasc Surg. 2017; 66(1): 53 - 63. e1. doi: 10.1016/j.jvs.2016.10.110
79. Lindholt JS, Vammen S, Juul S, Henneberg EW, Fasting H. The Validity of Ultrasonographic Scanning as Screening Method for Abdominal Aortic Aneurysm. European Journal of Vascular and Endovascular Surgery. 1999; 17(6): 472 - 475. doi: 10.1053/ejvs.1999.0835
80. Long A, Rouet L, Lindholt JS, Allaire E. Measuring the Maximum Diameter of Native Abdominal Aortic Aneurysms: Review and Critical Analysis. European Journal of Vascular and Endovascular Surgery. 2012; 43(5): 515 - 524. doi: 10.1016/j.ejvs.2012.01.018
81. Balakhonova TV., Ershova AI, Ezhov MV., et al. Focused vascular ultrasound. Consensus of Russian experts. Cardiovascular Therapy and Prevention. 2022; 21(7): 3333. doi: 10.15829/1728-8800-2022-3333
82. Dent B, Kendall RJ, Boyle AA, Atkinson PRT. Emergency ultrasound of the abdominal aorta by UK emergency physicians: a prospective cohort study. Emergency Medicine Journal. 2007; 24(8): 547 - 549. doi: 10.1136/emj.2007.048405
83. Rubano E, Mehta N, Caputo W, Paladino L, Sinert R. Systematic Review: Emergency Department Bedside Ultrasonography for Diagnosing Suspected Abdominal Aortic Aneurysm. Academic Emergency Medicine. 2013; 20(2): 128 - 138. doi: 10.1111/acem.12080
84. Sidhu P, Cantisani V, Dietrich C, et al. The EFSUMB Guidelines and Recommendations for the Clinical Practice of Contrast-Enhanced Ultrasound (CEUS) in Non-Hepatic Applications: Update 2017 (Long Version). Ultraschall in der Medizin - European Journal of Ultrasound. 2018; 39(02): e2 - e44. doi: 10.1055/a-0586-1107
85. Bredahl K, Eldrup N, Meyer C, Eiberg JE, Sillesen H. Reproducibility of ECG-gated Ultrasound Diameter Assessment of Small Abdominal Aortic Aneurysms. European Journal of Vascular and Endovascular Surgery. 2013; 45(3): 235 - 240. doi: 10.1016/j.ejvs.2012.12.010
86. Beales L, Wolstenhulme S, Evans JA, West R, Scott DJA. Reproducibility of ultrasound measurement of the abdominal aorta. British Journal of Surgery. 2011; 98(11): 1517 - 1525. doi: 10.1002/bjs.7628
87. Hiromatsu S, Hosokawa Y, Egawa N, Yokokura H, Akaiwa K, Aoyagi S. Strategy for Isolated Iliac Artery Aneurysms. Asian Cardiovasc Thorac Ann. 2007; 15(4): 280 - 284. doi: 10.1177/021849230701500403
88. Roy J, Labruto F, Beckman MO, Danielson J, Johansson G, Swedenborg J. Bleeding into the intraluminal thrombus in abdominal aortic aneurysms is associated with rupture. J Vasc Surg. 2008; 48(5): 1108 - 1113. doi: 10.1016/j.jvs.2008.06.063
89. Andreevskaya MV., Kabardieva MR, Komlev AE, Imaev T![]() , Naumov VG, Saidova MA. Role of contrast enhancement in ultrasound examination of the aortic abdominal portion. Angiology and vascular surgery. 2019; 25(3): 54. doi: 10.33529/ANGIO2019323
, Naumov VG, Saidova MA. Role of contrast enhancement in ultrasound examination of the aortic abdominal portion. Angiology and vascular surgery. 2019; 25(3): 54. doi: 10.33529/ANGIO2019323
90. Bicknell CD, Kiru G, Falaschetti E, Powell JT, Poulter NR. An evaluation of the effect of an angiotensin-converting enzyme inhibitor on the growth rate of small abdominal aortic aneurysms: a randomized placebo-controlled trial (AARDVARK). Eur Heart J. 2016; 37(42): 3213 - 3221. doi: 10.1093/eurheartj/ehw257
91. Foo FJ, Hammond CJ, Goldstone AR, et al. Agreement between Computed Tomography and Ultrasound on Abdominal Aortic Aneurysms and Implications on Clinical Decisions. European Journal of Vascular and Endovascular Surgery. 2011; 42(5): 608 - 614. doi: 10.1016/j.ejvs.2011.07.003
92. Sakamoto A, Nagai R, Saito K, et al. Idiopathic retroperitoneal fibrosis, inflammatory aortic aneurysm, and inflammatory pericarditis-Retrospective analysis of 11 case histories. J Cardiol. 2012; 59(2): 139 - 146. doi: 10.1016/j.jjcc.2011.07.014
93. Brambilla M, Cerini P, Lizio D, Vigna L, Carriero A, Fossaceca R. Cumulative radiation dose and radiation risk from medical imaging in patients subjected to endovascular aortic aneurysm repair. Radiol Med. 2015; 120(6): 563 - 570. doi: 10.1007/s11547-014-0485-x
94. Hellmann DB, Grand DJ, Freischlag JA. Inflammatory Abdominal Aortic Aneurysm. JAMA. 2007; 297(4): 395. doi: 10.1001/jama.297.4.395
95. Ватутин Н.Т., Смирнова А.С., Гасендич Е.С., Тов И.В. Современный взгляд на кардиопульмональное нагрузочное тестирование (обзор рекомендаций EACPR/AHA, 2016). Архивъ внутренней медицины. 2017; 1(33): 5 - 14.
96. Дроздов Д.В., Макаров Л.М., Баркан В.С., et al. Регистрация электрокардиограммы покоя в 12 общепринятых отведениях взрослым и детям 2023. Методические рекомендации. Российский кардиологический журнал. 2023; 28(10): 5631. doi: 10.15829/1560-4071-2023-5631
97. Заболотских И.Б., Лебединский К.М., Григорьев Е.В., et al. Периоперационное ведение больных с сопутствующей ишемической болезнью сердца. Анестезиология и реаниматология. 2013; 6: 67 - 78.
98. Мацкеплишвили С.Т., Саидова М.А., Мироненко М.Ю., et al. Выполнение стандартной трансторакальной эхокардиографии. Методические рекомендации 2024.. Российский кардиологический журнал 2025; 30(2): 6271.
99. Kurvers HAJM, van der Graaf Y, Blankensteijn JD, Visseren FLJ, Eikelboom BC. Screening for asymptomatic internal carotid artery stenosis and aneurysm of the abdominal aorta: comparing the yield between patients with manifest atherosclerosis and patients with risk factors for atherosclerosis only1 1Competition of interest: none. J Vasc Surg. 2003; 37(6): 1226 - 1233. doi: 10.1016/S0741-5214(02)75140-9
100. Аракелян В.С., Жане А.К. Тактика хирургического лечения аневризмы брюшной аорты при сочетанных поражениях коронарных и сонных артерий. Кардиоангиология. 2012; 2: 47 - 56.
101. Бокерия Л.А. и др. Национальные рекомендации по ведению пациентов с заболеваниями брахиоцефальных артерий. Published online 2013.
102. Jonas DE, Feltner C, Amick HR, et al. Screening for Asymptomatic Carotid Artery Stenosis: A Systematic Review and Meta-analysis for the U.S. Preventive Services Task Force. Ann Intern Med. 2014; 161(5): 336. doi: 10.7326/M14-0530
103. Zeebregts CJ, Paraskevas KI. The New 2023 European Society for Vascular Surgery (ESVS) Carotid Guidelines - The European Perspective. European Journal of Vascular and Endovascular Surgery. 2023; 65(1): 3 - 4. doi: 10.1016/j.ejvs.2022.04.033
104. Qaseem A, Snow V, Fitterman N, et al. Risk Assessment for and Strategies To Reduce Perioperative Pulmonary Complications for Patients Undergoing Noncardiothoracic Surgery: A Guideline from the American College of Physicians. Ann Intern Med. 2006; 144(8): 575. doi: 10.7326/0003-4819-144-8-200604180-00008
105. Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA Guideline on Perioperative Cardiovascular Evaluation and Management of Patients Undergoing Noncardiac Surgery. J Am Coll Cardiol. 2014; 64(22): e77 - e137. doi: 10.1016/j.jacc.2014.07.944
106. Davidovic LB, Maksic M, Koncar I, et al. Open Repair of AAA in a High Volume Center. World J Surg. 2017; 41(3): 884 - 891. doi: 10.1007/s00268-016-3788-3
107. Reimerink JJ, Hoornweg LL, Vahl AC, et al. Endovascular Repair Versus Open Repair of Ruptured Abdominal Aortic Aneurysms. Ann Surg. 2013; 258(2): 248 - 256. doi: 10.1097/SLA.0b013e31828d4b76
108. Schwartz SA, Taljanovic MS, Smyth S, O'Brien MJ, Rogers LF. CT Findings of Rupture, Impending Rupture, and Contained Rupture of Abdominal Aortic Aneurysms. American Journal of Roentgenology. 2007; 188(1): W57 - W62. doi: 10.2214/AJR.05.1554
109. Lloyd GM, Bown MJ, Norwood MGA, et al. Feasibility of preoperative computer tomography in patients with ruptured abdominal aortic aneurysm: a time-to-death study in patients without operation. J Vasc Surg. 2004; 39(4): 788 - 791. doi: 10.1016/j.jvs.2003.11.041
110. Biancari F, Paone R, Venermo M, D'Andrea V, ![]() J. Diagnostic Accuracy of Computed Tomography in Patients with Suspected Abdominal Aortic Aneurysm Rupture. European Journal of Vascular and Endovascular Surgery. 2013; 45(3): 227 - 230. doi: 10.1016/j.ejvs.2012.12.006
J. Diagnostic Accuracy of Computed Tomography in Patients with Suspected Abdominal Aortic Aneurysm Rupture. European Journal of Vascular and Endovascular Surgery. 2013; 45(3): 227 - 230. doi: 10.1016/j.ejvs.2012.12.006
111. Boyle JR, Gibbs PJ, Kruger A, Shearman CP, Raptis S, Phillips MJ. Existing Delays Following the Presentation of Ruptured Abdominal Aortic Aneurysm Allow Sufficient Time to Assess Patients for Endovascular Repair. European Journal of Vascular and Endovascular Surgery. 2005; 29(5): 505 - 509. doi: 10.1016/j.ejvs.2005.01.027
112. Smidfelt K, Drott C,  K, Nordanstig J, Herlitz J,
K, Nordanstig J, Herlitz J,  M. The Impact of Initial Misdiagnosis of Ruptured Abdominal Aortic Aneurysms on Lead Times, Complication Rate, and Survival. European Journal of Vascular and Endovascular Surgery. 2017; 54(1): 21 - 27. doi: 10.1016/j.ejvs.2017.03.022
M. The Impact of Initial Misdiagnosis of Ruptured Abdominal Aortic Aneurysms on Lead Times, Complication Rate, and Survival. European Journal of Vascular and Endovascular Surgery. 2017; 54(1): 21 - 27. doi: 10.1016/j.ejvs.2017.03.022
113. Raux M, Marzelle J, Kobeiter H, et al. Endovascular balloon occlusion is associated with reduced intraoperative mortality of unstable patients with ruptured abdominal aortic aneurysm but fails to improve other outcomes. J Vasc Surg. 2015; 61(2): 304 - 308. doi: 10.1016/j.jvs.2014.07.098
114. Cosford PA, Leng GC, Thomas J. Screening for abdominal aortic aneurysm. Cochrane Database of Systematic Reviews. Published online April 18, 2007. doi: 10.1002/14651858.CD002945.pub2
115. Scott R. The Multicentre Aneurysm Screening Study (MASS) into the effect of abdominal aortic aneurysm screening on mortality in men: a randomised controlled trial. The Lancet. 2002; 360(9345): 1531 - 1539. doi: 10.1016/S0140-6736(02)11522-4
116. Wanhainen A, Hultgren R, ![]() A, et al. Outcome of the Swedish Nationwide Abdominal Aortic Aneurysm Screening Program. Circulation. 2016; 134(16): 1141 - 1148. doi: 10.1161/CIRCULATIONAHA.116.022305
A, et al. Outcome of the Swedish Nationwide Abdominal Aortic Aneurysm Screening Program. Circulation. 2016; 134(16): 1141 - 1148. doi: 10.1161/CIRCULATIONAHA.116.022305
117. Ying AJ, Affan ET. Abdominal Aortic Aneurysm Screening: A Systematic Review and Meta-analysis of Efficacy and Cost. Ann Vasc Surg. 2019; 54: 298 - 303. e3. doi: 10.1016/j.avsg.2018.05.044
118. Takagi H, Goto S nosuke, Matsui M, Manabe H, Umemoto T. A further meta-analysis of population-based screening for abdominal aortic aneurysm. J Vasc Surg. 2010; 52(4): 1103 - 1108. doi: 10.1016/j.jvs.2010.02.283
119. Guirguis-Blake JM, Beil TL, Senger CA, Coppola EL. Primary Care Screening for Abdominal Aortic Aneurysm. JAMA. 2019; 322(22): 2219. doi: 10.1001/jama.2019.17021
120. Sakalihasan N, Defraigne JO, Kerstenne MA, et al. Family Members of Patients with Abdominal Aortic Aneurysms Are at Increased Risk for Aneurysms: Analysis of 618 Probands and Their Families from the ![]() AAA Family Study. Ann Vasc Surg. 2014; 28(4): 787 - 797. doi: 10.1016/j.avsg.2013.11.005
AAA Family Study. Ann Vasc Surg. 2014; 28(4): 787 - 797. doi: 10.1016/j.avsg.2013.11.005
121. Ravn H, Wanhainen A, ![]() M. Risk of new aneurysms after surgery for popliteal artery aneurysm. British Journal of Surgery. 2008; 95(5): 571 - 575. doi: 10.1002/bjs.6074
M. Risk of new aneurysms after surgery for popliteal artery aneurysm. British Journal of Surgery. 2008; 95(5): 571 - 575. doi: 10.1002/bjs.6074
122. Lindholt JS, Norman PE. Meta-analysis of postoperative mortality after elective repair of abdominal aortic aneurysms detected by screening. British Journal of Surgery. 2011; 98(5): 619 - 622. doi: 10.1002/bjs.7464
123. Bradley DT, Badger SA, McFarland M, Hughes AE. Abdominal Aortic Aneurysm Genetic Associations: Mostly False? A Systematic Review and Meta-analysis. European Journal of Vascular and Endovascular Surgery. 2016; 51(1): 64 - 75. doi: 10.1016/j.ejvs.2015.09.006
124. Трисветова Е.Л. Синдром аневризмы-остеоартрита. Актуальные вопросы внутренних болезней: материалы междунар науч-практ конф (Минск, 1 нояб. 2013 г.)/Белорус. гос. мед. ун-т, Белорус о-во терапевтов; под ред. Н.Ф. Сороки, В.Е. Ягура - Минск: БГМУ. Published online 2013: 63 - 67.
125. Byers PH, Belmont J, Black J, et al. Diagnosis, natural history, and management in vascular Ehlers-Danlos syndrome. Am J Med Genet C Semin Med Genet. 2017; 175(1): 40 - 47. doi: 10.1002/ajmg.c.31553
126. De Backer J, Fishman E, Spevak P, et al. Detailed description of cardiovascular findings in fifty patients with Loeys Dietz syndrome: all or nothing? Eur Heart J. 2009; 30: 992.
127. Kokje VBC, Hamming JF, Lindeman JHN. Editor's Choice - Pharmaceutical Management of Small Abdominal Aortic Aneurysms: A Systematic Review of the Clinical Evidence. European Journal of Vascular and Endovascular Surgery. 2015; 50(6): 702 - 713. doi: 10.1016/j.ejvs.2015.08.010
128. Rughani G, Robertson L, Clarke M. Medical treatment for small abdominal aortic aneurysms. Cochrane Database of Systematic Reviews. Published online September 12, 2012. doi: 10.1002/14651858.CD009536.pub2
129. Ежов М.В., Кухарчук В.В., Сергиенко И.В. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023; 28(5): 5471.
130. Salata K, Syed M, Hussain MA, et al. Statins Reduce Abdominal Aortic Aneurysm Growth, Rupture, and Perioperative Mortality: A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2018; 7(19). doi: 10.1161/JAHA.118.008657
131. Aboyans V, Ricco JB, Bartelink MLEL, et al. Editor's Choice - 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). European Journal of Vascular and Endovascular Surgery. 2018; 55(3): 305 - 368. doi: 10.1016/j.ejvs.2017.07.018
132. Jones KG, Bell RE, Sabharwal T, Aukett M, Reidy JF, Taylor PR. Treatment of Mycotic Aortic Aneurysms with Endoluminal Grafts. European Journal of Vascular and Endovascular Surgery. 2005; 29(2): 139 - 144. doi: 10.1016/j.ejvs.2004.11.008
133. Soravia-Dunand VA, Loo VG, Salit IE. Aortitis due to Salmonella: report of 10 cases and comprehensive review of the literature. Clin Infect Dis. 1999; 29(4): 862 - 868. doi: 10.1086/520450
134. Buono A, Maloberti A, Bossi IM, et al. Mycotic coronary aneurysms. Journal of Cardiovascular Medicine. 2019; 20(1): 10 - 15. doi: 10.2459/JCM.0000000000000734
135. Kan CD, Lee HL, Yang YJ. Outcome after endovascular stent graft treatment for mycotic aortic aneurysm: A systematic review. J Vasc Surg. 2007; 46(5): 906 - 912. doi: 10.1016/j.jvs.2007.07.025
136. Аракелян В.С., Гамзаев Н.Р., Чшиева И.В., et al. Клинически-случайное хирургическое лечение больного с инфицированной микотической аневризмой нисходящего отдела грудной аорты после перенесенного сальмонеллеза. Комплексные проблемы сердечно-сосудистых заболеваний. 2012; 2.
137. Люсов В.А., Соболева В.Н., Евсиков Е.М., Власенко В.К., Борисова Г.Г., Вищипанов А.С. К вопросу о микотических аневризмах при инфекционном эндокардите. Лечебное дело. 2004; 2: 72 - 76.
138. Woon CYL, Sebastian MG, Tay KH, Tan SG. Extra-anatomic revascularization and aortic exclusion for mycotic aneurysms of the infrarenal aorta and iliac arteries in an Asian population. The American Journal of Surgery. 2008; 195(1): 66 - 72. doi: 10.1016/j.amjsurg.2007.01.032
139. Yu S, Hsieh H, Ko P, Huang Y, Chu J, Lee C. Surgical Outcome for Mycotic Aortic and Iliac Anuerysm. World J Surg. 2011; 35(7): 1671 - 1678. doi: 10.1007/s00268-011-1104-9
140. Kamper L, Haage P, Brandt AS, et al. Diffusion-weighted MRI in the follow-up of chronic periaortitis. Br J Radiol. 2015; 88(1052): 20150145. doi: 10.1259/bjr.20150145
141. Vaglio A, Palmisano A, Alberici F, et al. Prednisone versus tamoxifen in patients with idiopathic retroperitoneal fibrosis: an open-label randomised controlled trial. The Lancet. 2011; 378(9788): 338 - 346. doi: 10.1016/S0140-6736(11)60934-3
142. van der Bilt FE, Hendriksz TR, van der Meijden WAG, Brilman LG, van Bommel EFH. Outcome in patients with idiopathic retroperitoneal fibrosis treated with corticosteroid or tamoxifen monotherapy. Clin Kidney J. 2016; 9(2): 184 - 191. doi: 10.1093/ckj/sfv148
143. van Bommel E, van der Veer S, Hendriksz T, Bleumink G. Persistent chronic peri-aortitis ('inflammatory aneurysm') after abdominal aortic aneurysm repair: systematic review of the literature. Vascular Medicine. 2008; 13(4): 293 - 303. doi: 10.1177/1358863X08091147
144. Skeik N, Ostertag-Hill CA, Garberich RF, et al. Diagnosis, Management, and Outcome of Aortitis at a Single Center. Vasc Endovascular Surg. 2017; 51(7): 470 - 479. doi: 10.1177/1538574417704296
145. Годзенко А.А., Бочкова А.Г., Мухортова О.В., Асланиди И.П., Бунчук Н.В. Аортит при анкилозирующем спондилите: возможности диагностики и лечения. Научно-практическая ревматология. 2013; 51(4): 451 - 455.
146. Муркамилов И.Т. СИС, ФВВ, МЖА. Фокально-сегментарный гломерулосклероз: современное состояние проблемы. Архивъ внутренней медицины. 2020; 1(51).
147. Кундер Е.В. Лечение пациентов с анкилозирующим спондилитом. Медицинские новости 2012 N 3.
148. van Bommel EFH, Pelkmans LG, van Damme H, Hendriksz TR. Long-term safety and efficacy of a tamoxifen-based treatment strategy for idiopathic retroperitoneal fibrosis. Eur J Intern Med. 2013; 24(5): 444 - 450. doi: 10.1016/j.ejim.2012.11.010
149. Nitecki SS, Hallett JW, Stanson AW, et al. Inflammatory abdominal aortic aneurysms: A case-control study. J Vasc Surg. 1996; 23(5): 860 - 869. doi: 10.1016/S0741-5214(96)70249-5
150. Balaji MR, Lindblad BR, Almgren BR, et al. Abdominal aortic aneurysm with perianeurysmal fibrosis: Experience from 11 Swedish vascular centers. J Vasc Surg. 1991; 13(2): a25583. doi: 10.1067/mva.1991.25583
151. Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's Choice -- European Society for Vascular Surgery (ESVS) 2024 Clinical Practice Guidelines on the Management of Abdominal Aorto-Iliac Artery Aneurysms. European Journal of Vascular and Endovascular Surgery. 2024; 67(2): 192 - 331. doi: 10.1016/j.ejvs.2023.11.002
152. Georgiadis GS, Trellopoulos G, Antoniou GA, et al. Endovascular therapy for penetrating ulcers of the infrarenal aorta. ANZ J Surg. 2013; 83(10): 758 - 763. doi: 10.1111/ans.12074
153. Jonker FHW,  FJ V., Moll FL, Muhs BE. Dissection of the Abdominal Aorta. Current Evidence and Implications for Treatment Strategies: A Review and Meta-Analysis of 92 Patients. Journal of Endovascular Therapy. 2009; 16(1): 71 - 80. doi: 10.1583/08-2601.1
FJ V., Moll FL, Muhs BE. Dissection of the Abdominal Aorta. Current Evidence and Implications for Treatment Strategies: A Review and Meta-Analysis of 92 Patients. Journal of Endovascular Therapy. 2009; 16(1): 71 - 80. doi: 10.1583/08-2601.1
154. Powell JT. Perioperative  (Pobble) for patients undergoing infrarenal vascular surgery: Results of a randomized double-blind controlled trial. J Vasc Surg. 2005; 41(4): 602 - 609. doi: 10.1016/j.jvs.2005.01.048
(Pobble) for patients undergoing infrarenal vascular surgery: Results of a randomized double-blind controlled trial. J Vasc Surg. 2005; 41(4): 602 - 609. doi: 10.1016/j.jvs.2005.01.048
155. Yang H, Raymer K, Butler R, Parlow J, Roberts R. The effects of perioperative  : Results of the Metoprolol after Vascular Surgery (MaVS) study, a randomized controlled trial. Am Heart J. 2006; 152(5): 983 - 990. doi: 10.1016/j.ahj.2006.07.024
: Results of the Metoprolol after Vascular Surgery (MaVS) study, a randomized controlled trial. Am Heart J. 2006; 152(5): 983 - 990. doi: 10.1016/j.ahj.2006.07.024
156. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. The Lancet. 2008; 371(9627): 1839 - 1847. doi: 10.1016/S0140-6736(08)60601-7
157. Сумин А.Н., Дупляков Д.В., Белялов Ф.И., et al. Рекомендации по оценке и коррекции сердечно-сосудистых рисков при несердечных операциях 2023. Российский кардиологический журнал. 2023; 28(8): 5555. doi: 10.15829/1560-4071-20235555
158. Самойленко В.В., Шевченко О.П., Бурцев В.И. Применение статинов в периоперационном периоде с позиций доказательной медицины.. Рациональная фармакотерапия в кардиологии. 2014; 10(5): 548 - 553.
159. De Martino RR, Hoel AW, Beck AW, et al. Participation in the Vascular Quality Initiative is associated with improved perioperative medication use, which is associated with longer patient survival. J Vasc Surg. 2015; 61(4): 1010 - 1019. doi: 10.1016/j.jvs.2014.11.073
160. Xiong X, Wu Z, Qin X, et al. Meta-analysis suggests statins reduce mortality after abdominal aortic aneurysm repair. J Vasc Surg. 2022; 75(1): 356 - 362. e4. doi: 10.1016/j.jvs.2021.06.033
161. Barakat HM, Shahin Y, Khan JA, McCollum PT, Chetter IC. Preoperative Supervised Exercise Improves Outcomes After Elective Abdominal Aortic Aneurysm Repair. Ann Surg. 2016; 264(1): 47 - 53. doi: 10.1097/SLA.0000000000001609
162. Harder S, Klinkhardt U, Alvarez JM. Avoidance of Bleeding During Surgery in Patients Receiving Anticoagulant and/or Antiplatelet Therapy. Clin Pharmacokinet. 2004; 43(14): 963 - 981. doi: 10.2165/00003088-200443140-00002
163. BURGER W, CHEMNITIUS J-M., KNEISSL GD,  G. Low-dose aspirin for secondary cardiovascular prevention - cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuation - review and meta-analysis. J Intern Med. 2005; 257(5): 399 - 414. doi: 10.1111/j.1365-2796.2005.01477.x
G. Low-dose aspirin for secondary cardiovascular prevention - cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuation - review and meta-analysis. J Intern Med. 2005; 257(5): 399 - 414. doi: 10.1111/j.1365-2796.2005.01477.x
164. Stone DH, Goodney PP, Schanzer A, et al. Clopidogrel is not associated with major bleeding complications during peripheral arterial surgery. J Vasc Surg. 2011; 54(3): 779 - 784. doi: 10.1016/j.jvs.2011.03.003
165. Darvish-Kazem S, Gandhi M, Marcucci M, Douketis JD. Perioperative Management of Antiplatelet Therapy in Patients With a Coronary Stent Who Need Noncardiac Surgery. Chest. 2013; 144(6): 1848 - 1856. doi: 10.1378/chest.13-0459
166. Columbo JA, Lambour AJ, Sundling RA, et al. A Meta-analysis of the Impact of Aspirin, Clopidogrel, and Dual Antiplatelet Therapy on Bleeding Complications in Noncardiac Surgery. Ann Surg. 2018; 267(1): 1 - 10. doi: 10.1097/SLA.0000000000002279
167. Sumin AN, Belyalov FI. Novel Russian guidelines for the assessment and modification of cardiovascular risk in non-cardiac surgery. Russian Journal of Cardiology. 2023; 28(4S): 5704. doi: 10.15829/1560-4071-2023-5704
168. Levine GN, Bates ER, Bittl JA, et al. 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease. Circulation. 2016; 134(10). doi: 10.1161/CIR.0000000000000404
169. ДВОЙНАЯ АНТИТРОМБОЦИТАРНАЯ ТЕРАПИЯ ПРИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА: ОБНОВЛЕННАЯ ВЕРСИЯ 2017 ГОДА. Российский кардиологический журнал 2018; (8): 113 - 163. 2018; 8: 113 - 163.
170. Editorial A. 2017 ESC FOCUSED UPDATE ON DUAL ANTIPLATELET THERAPY IN CORONARY ARTERY DISEASE DEVELOPED IN COLLABORATION WITH EACTS. Russian Journal of Cardiology. 2018; (8): 113 - 163. doi: 10.15829/1560-4071-2018-8-113-163
171. Панченко Е.П., Комаров А.Л., Кропачева Е.С., Добровольский А.Б. Панченко, Е.П. Комаров, Протокол ведения пациентов, нуждающихся в длительном приеме антитромботической терапии, при инвазивных вмешательствах.. Кардиологический вестник. 2020; 2: 63 - 68.
172. Siller-Matula JM, Petre A, Delle-Karth G, et al. Impact of preoperative use of P2Y12 receptor inhibitors on clinical outcomes in cardiac and non-cardiac surgery: A systematic review and meta-analysis. Eur Heart J Acute Cardiovasc Care. 2017; 6(8): 753 - 770. doi: 10.1177/2048872615585516
173. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022; 43(7): 561 - 632. doi: 10.1093/eurheartj/ehab395
174. Vanommeslaeghe F, De Mulder E, Van de Bruaene C, Van de Bruaene L, Lameire N, Van Biesen W. Selecting a strategy for prevention of contrast-induced nephropathy in clinical practice: an evaluation of different clinical practice guidelines using the AGREE tool: FIGURE 1: Nephrology Dialysis Transplantation. 2015; 30(8): 1300 - 1306. doi: 10.1093/ndt/gfv220
175. Graham AP, Fitzgerald O'Connor E, Hinchliffe RJ, Loftus IM, Thompson MM, Black SA. The use of heparin in patients with ruptured abdominal aortic aneurysms. Vascular. 2012; 20(2): 61 - 64. doi: 10.1258/vasc.2011.ra0051
176. Yilmaz N, Peppelenbosch N, Cuypers PWM, Tielbeek A V., Duijm LEM, Buth J. Emergency Treatment of Symptomatic or Ruptured Abdominal Aortic Aneurysms: The Role of Endovascular Repair. Journal of Endovascular Therapy. 2002; 9(4): 449 - 457. doi: 10.1177/152660280200900411
177. Markovic M, Davidovic L, Kostic D, et al. Ruptured Abdominal Aortic Aneurysm. Herz. 2004; 29(1): 123 - 129. doi: 10.1007/s00059-004-2540-1
178. Guyatt GH, Akl EA, Crowther M, Gutterman DD,  HJ. Executive Summary. Chest. 2012; 141(2): 7S - 47S. doi: 10.1378/chest.1412S3
HJ. Executive Summary. Chest. 2012; 141(2): 7S - 47S. doi: 10.1378/chest.1412S3
179. Lammy S, Blackmur JP, Perkins JM. Intravenous heparin during ruptured abdominal aortic aneurysmal repair. Cochrane Database of Systematic Reviews. 2016; 2016(8). doi: 10.1002/14651858.CD011486.pub2
180. Stewart AH, Eyers PS, Earnshaw JJ. Prevention of infection in peripheral arterial reconstruction: A systematic review and meta-analysis. J Vasc Surg. 2007; 46(1): 148 - 155. doi: 10.1016/j.jvs.2007.02.065
181. Reimerink JJ, van der Laan MJ, Koelemay MJ, Balm R, Legemate DA. Systematic review and meta-analysis of population-based mortality from ruptured abdominal aortic aneurysm. British Journal of Surgery. 2013; 100(11): 1405 - 1413. doi: 10.1002/bjs.9235
182. Filardo G, Powell JT, Martinez MAM, Ballard DJ. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database of Systematic Reviews. Published online February 8, 2015. doi: 10.1002/14651858.CD001835.pub4
183. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J. 2014; 35(41): 2873 - 2926. doi: 10.1093/eurheartj/ehu281
184. Kurvers H, Veith FJ, Lipsitz EC, et al. Discontinuous, staccato growth of abdominal aortic aneurysms. J Am Coll Surg. 2004; 199(5): 709 - 715. doi: 10.1016/j.jamcollsurg.2004.07.031
185. Sharp MA, Collin J. A myth exposed: Fast growth in diameter does not justify precocious abdominal aortic aneurysm repair. European Journal of Vascular and Endovascular Surgery. 2003; 25(5): 408 - 411. doi: 10.1053/ejvs.2002.1850
186. Soden PA, Zettervall SL, Ultee KHJ, et al. Outcomes for symptomatic abdominal aortic aneurysms in the American College of Surgeons National Surgical Quality Improvement Program. J Vasc Surg. 2016; 64(2): 297 - 305. doi: 10.1016/j.jvs.2016.02.055
187. Ten Bosch JA, Koning SW, Willigendael EM, et al. Symptomatic abdominal aortic aneurysm repair: to wait or not to wait. J Cardiovasc Surg (Torino). 2016; 57(6): 830 - 838.
188. Li Y, Wang W, Li L, Khalil RA. MMPs and ADAMs/ADAMTS inhibition therapy of abdominal aortic aneurysm. Life Sci. 2020; 253: 117659. doi: 10.1016/j.lfs.2020.117659
189. Brown LC, Thompson SG, Greenhalgh RM, Powell JT. Fit patients with small abdominal aortic aneurysms (AAAs) do not benefit from early intervention. J Vasc Surg. 2008; 48(6): 1375 - 1381. doi: 10.1016/j.jvs.2008.07.014
190. Jacomelli J, Summers L, Stevenson A, Lees T, Earnshaw JJ. Impact of the first 5 years of a national abdominal aortic aneurysm screening programme. British Journal of Surgery. 2016; 103(9): 1125 - 1131. doi: 10.1002/bjs.10173
191. Ulug P, Sweeting MJ, von Allmen RS, et al. Morphological suitability for endovascular repair, non-intervention rates, and operative mortality in women and men assessed for intact abdominal aortic aneurysm repair: systematic reviews with meta-analysis. The Lancet. 2017; 389(10088): 2482 - 2491. doi: 10.1016/S0140-6736(17)30639-6
192. Karthikesalingam A, Nicoli TK, Holt PJ, et al. The Fate of Patients Referred to a Specialist Vascular Unit with Large Infra-renal Abdominal Aortic Aneurysms over a Two-year Period. European Journal of Vascular and Endovascular Surgery. 2011; 42(3): 295 - 301. doi: 10.1016/j.ejvs.2011.04.022
193. Wemmelund H, ![]() A, Hundborg HH, Thomsen RW, Johnsen SP, Lindholt JS. Statin use and rupture of abdominal aortic aneurysm. British Journal of Surgery. 2014; 101(8): 966 - 975. doi: 10.1002/bjs.9517
A, Hundborg HH, Thomsen RW, Johnsen SP, Lindholt JS. Statin use and rupture of abdominal aortic aneurysm. British Journal of Surgery. 2014; 101(8): 966 - 975. doi: 10.1002/bjs.9517
194. Endovascular Repair of Aortic Aneurysm in Patients Physically Ineligible for Open Repair. New England Journal of Medicine. 2010; 362(20): 1872 - 1880. doi: 10.1056/NEJMoa0911056
195. Sweeting MJ, Patel R, Powell JT, Greenhalgh RM. Endovascular Repair of Abdominal Aortic Aneurysm in Patients Physically Ineligible for Open Repair. Ann Surg. 2017; 266(5): 713 - 719. doi: 10.1097/SLA.0000000000002392
196. Chaikof EL, Blankensteijn JD, Harris PL, et al. Reporting standards for endovascular aortic aneurysm repair. J Vasc Surg. 2002; 35(5): 1048 - 1060. doi: 10.1067/mva.2002.123763
197. Затевахин И.И., Матюшкин А.В., Толстов П.А., Тищенко И.С., Острокостова Н.В., Горелик И.Л. Оценка риска периоперационных кардиальных осложнений при плановых резекциях аневризм абдоминальной части аорты. Русский медицинский журнал. 2005; 13(4): 582 - 583.
198. DeMartino RR, Huang Y, Mandrekar J, et al. External validation of a 5-year survival prediction model after elective abdominal aortic aneurysm repair. J Vasc Surg. 2018; 67(1): 151 - 156. e3. doi: 10.1016/j.jvs.2017.05.104
199. Котова Д.П., Шеменкова В.С. Факторы риска респираторных осложнений у пациентов в периоперационном периоде. Клиницист. 2018; 12(3-4): 15 - 20.
200. Association Between Postoperative Troponin Levels and 30-Day Mortality Among Patients Undergoing Noncardiac Surgery. JAMA. 2012; 307(21): 2295. doi: 10.1001/jama.2012.5502
201. Мурашко С.С., Пасечник И.Н., Бернс С.А. Миокардиальное повреждение при некардиальной хирургии: трудности диагностики. Комплексные проблемы сердечно-сосудистых заболеваний. 2020; 9(3): 59 - 68.
202. Панов А.В., Кулешова Э.В., Лоховинина Н.Л., et al. Оценка сердечно-сосудистого риска и профилактика осложнений при внесердечной хирургии у больных ишемической болезнью сердца. Артериальная гипертензия. 2020; 26(6): 629 - 639.
203. Karkos CD. What is appropriate coronary assessment prior to abdominal aortic surgery? European Journal of Vascular and Endovascular Surgery. 2003; 25(6): 487 - 492. doi: 10.1053/ejvs.2002.1832
204. McFalls EO, Ward HB, Moritz TE, et al. Coronary-Artery Revascularization before Elective Major Vascular Surgery. New England Journal of Medicine. 2004; 351(27): 2795 - 2804. doi: 10.1056/NEJMoa041905
205. Lancellotti P. Grading aortic stenosis severity when the flow modifies the gradientvalve area correlation. Cardiovasc Diagn Ther. 2012; 2(1): 6 - 9. doi: 10.3978/j.issn.2223-3652.2012.02.03
206. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021; 77(4): 450 - 500. doi: 10.1016/J.JACC.2020.11.035
207. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease. J Am Coll Cardiol. 2021; 77(4): e25 - e197. doi: 10.1016/j.jacc.2020.11.018
208. Российское кардиологическое общество (РКО). Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020; 25(11): 4076.
209. Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020; 20(11): 4083.
210. van Eps RGS, Leurs LJ, Hobo R, Harris PL, Buth J. Impact of renal dysfunction on operative mortality following endovascular abdominal aortic aneurysm surgery. British Journal of Surgery. 2007; 94(2): 174 - 178. doi: 10.1002/bjs.5561
211. Kheterpal S, Tremper KK, Englesbe MJ, et al. Predictors of Postoperative Acute Renal Failure after Noncardiac Surgery in Patients with Previously Normal Renal Function. Anesthesiology. 2007; 107(6): 892 - 902. doi: 10.1097/01.anes.0000290588.29668.38
212. Kheterpal S, Tremper KK, Heung M, et al. Development and Validation of an Acute Kidney Injury Risk Index for Patients Undergoing General Surgery. Anesthesiology. 2009; 110(3): 505 - 515. doi: 10.1097/ALN.0b013e3181979440
213. Castagno C, Varetto G, Quaglino S, et al. Acute kidney injury after open and endovascular elective repair for infrarenal abdominal aortic aneurysms. J Vasc Surg. 2016; 64(4): 928 - 933. e1. doi: 10.1016/j.jvs.2016.02.048
214. Глушков Н.И., Иванов М.А., Самко К.В., et al. Операции на абдоминальном отделе аорты и острое повреждение почек. Вестник хирургии имени И.И. Грекова. 2020; 179(2): 20 - 25.
215. Eckstein HH, Bruckner T, Heider P, et al. The Relationship Between Volume and Outcome Following Elective Open Repair of Abdominal Aortic Aneurysms (AAA) in 131 German Hospitals. European Journal of Vascular and Endovascular Surgery. 2007; 34(3): 260 - 266. doi: 10.1016/j.ejvs.2007.05.006
216. Dimick JB, Cowan JA, Stanley JC, Henke PK, Pronovost PJ, Upchurch GR. Surgeon specialty and provider volumes are related to outcome of intact abdominal aortic aneurysm repair in the united states. J Vasc Surg. 2003; 38(4): 739 - 744. doi: 10.1016/S0741-5214(03)00470-1
217. Gifford ED, de Virgilio C. Aortic Centers of Excellence. JAMA Surg. 2016; 151(9): 845. doi: 10.1001/jamasurg.2016.0838
218. Gray WK, Day J, Horrocks M. Editor's Choice - Volume-Outcome Relationships in Elective Abdominal Aortic Aneurysm Surgery: Analysis of the UK Hospital Episodes Statistics Database for the Getting It Right First Time (GIRFT) Programme. European Journal of Vascular and Endovascular Surgery. 2020; 60(4): 509 - 517. doi: 10.1016/j.ejvs.2020.07.069
219. Sawang M, Paravastu SCV, Liu Z, et al. The Relationship Between Operative Volume and Peri-operative Mortality After Non-elective Aortic Aneurysm Repair in Australia. European Journal of Vascular and Endovascular Surgery. 2020; 60(4): 519 - 530. doi: 10.1016/j.ejvs.2020.04.029
220. Tripodi P, Mestres G, Riambau V, et al. Impact of Centralisation on Abdominal Aortic Aneurysm Repair Outcomes: Early Experience in Catalonia. European Journal of Vascular and Endovascular Surgery. 2020; 60(4): 531 - 538. doi: 10.1016/j.ejvs.2020.03.009
221. Young EL, Holt PJE, Poloniecki JD, Loftus IM, Thompson MM. Meta-analysis and systematic review of the relationship between surgeon annual caseload and mortality for elective open abdominal aortic aneurysm repairs. J Vasc Surg. 2007; 46(6): 1287 - 1294. doi: 10.1016/j.jvs.2007.06.038
222. Reise JA, Sheldon H, Earnshaw J, et al. Patient Preference for Surgical Method of Abdominal Aortic Aneurysm Repair: Postal Survey. European Journal of Vascular and Endovascular Surgery. 2010; 39(1): 55 - 61. doi: 10.1016/j.ejvs.2009.08.008
223. Endovascular aneurysm repair versus open repair in patients with abdominal aortic aneurysm (EVAR trial 1): randomised controlled trial. The Lancet. 2005; 365(9478): 2179 - 2186. doi: 10.1016/S0140-6736(05)66627-5
224. Endovascular aneurysm repair and outcome in patients unfit for open repair of abdominal aortic aneurysm (EVAR trial 2): randomised controlled trial. The Lancet. 2005; 365(9478): 2187 - 2192. doi: 10.1016/S0140-6736(05)66628-7
225. Beck AW, Sedrakyan A, Mao J, et al. Variations in Abdominal Aortic Aneurysm Care: A Report From the International Consortium of Vascular Registries. Circulation. 2016; 134(24): 1948 - 1958. doi: 10.1161/CIRCULATIONAHA.116.024870
226. Greenhalgh R. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30-day operative mortality results: randomised controlled trial. The Lancet. 2004; 364(9437): 843 - 848. doi: 10.1016/S0140-6736(04)16979-1
227. Lederle FA. Outcomes Following Endovascular vs Open Repair of Abdominal Aortic Aneurysm< subtitle> A Randomized Trial</subtitle> JAMA. 2009; 302(14): 1535. doi: 10.1001/jama.2009.1426
228. Patel R, Sweeting MJ, Powell JT, Greenhalgh RM. Endovascular versus open repair of abdominal aortic aneurysm in 15-years' follow-up of the UK endovascular aneurysm repair trial 1 (EVAR trial 1): a randomised controlled trial. The Lancet. 2016; 388(10058): 2366 - 2374. doi: 10.1016/S0140-6736(16)31135-7
229. Powell JT, Sweeting MJ, Ulug P, et al. Meta-analysis of inpidual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. British Journal of Surgery. 2017; 104(3): 166 - 178. doi: 10.1002/bjs.10430
230. Blankensteijn JD, de Jong SECA, Prinssen M, et al. Two-Year Outcomes after Conventional or Endovascular Repair of Abdominal Aortic Aneurysms. New England Journal of Medicine. 2005; 352(23): 2398 - 2405. doi: 10.1056/NEJMoa051255
231. Prinssen M, Verhoeven ELG, Buth J, et al. A Randomized Trial Comparing Conventional and Endovascular Repair of Abdominal Aortic Aneurysms. New England Journal of Medicine. 2004; 351(16): 1607 - 1618. doi: 10.1056/NEJMoa042002
232. Lederle FA, Freischlag JA, Kyriakides TC, et al. Long-Term Comparison of Endovascular and Open Repair of Abdominal Aortic Aneurysm. New England Journal of Medicine. 2012; 367(21): 1988 - 1997. doi: 10.1056/NEJMoa1207481
233. Lederle FA, Stroupe KT, Kyriakides TC, Ge L, Freischlag JA. Long-term Cost-effectiveness in the Veterans Affairs Open vs Endovascular Repair Study of Aortic Abdominal Aneurysm. JAMA Surg. 2016; 151(12): 1139. doi: 10.1001/jamasurg.2016.2783
234. Trenner M, Kuehnl A, Reutersberg B, Salvermoser M, Eckstein HH. Nationwide analysis of risk factors for in-hospital mortality in patients undergoing abdominal aortic aneurysm repair. British Journal of Surgery. 2018; 105(4): 379 - 387. doi: 10.1002/bjs.10714
235. Yin K, Locham SS, Schermerhorn ML, Malas MB. Trends of 30-day mortality and morbidities in endovascular repair of intact abdominal aortic aneurysm during the last decade. J Vasc Surg. 2019; 69(1): 64 - 73. doi: 10.1016/j.jvs.2018.04.032
236. Budtz-Lilly J, Venermo M, Debus S, et al. Editor's Choice - Assessment of International Outcomes of Intact Abdominal Aortic Aneurysm Repair over 9 Years. European Journal of Vascular and Endovascular Surgery. 2017; 54(1): 13 - 20. doi: 10.1016/j.ejvs.2017.03.003
237. Hicks CW, Obeid T, Arhuidese I, Qazi U, Malas MB. Abdominal aortic aneurysm repair in octogenarians is associated with higher mortality compared with nonoctogenarians. J Vasc Surg. 2016; 64(4): 956 - 965.e1. doi: 10.1016/j.jvs.2016.03.440
238.  M,
M, ![]() I,
I, ![]() N, et al. The Rationale for Continuing Open Repair of Ruptured Abdominal Aortic Aneurysm. Ann Vasc Surg. 2016; 36: 64 - 73. doi: 10.1016/j.avsg.2016.02.037
N, et al. The Rationale for Continuing Open Repair of Ruptured Abdominal Aortic Aneurysm. Ann Vasc Surg. 2016; 36: 64 - 73. doi: 10.1016/j.avsg.2016.02.037
239. Lilja F, Mani K, Wanhainen A. Editor's Choice - Trend-break in Abdominal Aortic Aneurysm Repair With Decreasing Surgical Workload. European Journal of Vascular and Endovascular Surgery. 2017; 53(6): 811 - 819. doi: 10.1016/j.ejvs.2017.02.031
240. van Schaik TG, de Bruin J, van Sambeek M, et al. RS09. Very Long-Term Follow-Up (12 - 15 Years) of the Dutch Randomized Endovascular Aneurysm Repair Management (DREAM) Trial. J Vasc Surg. 2016; 63(6): 143S. doi: 10.1016/j.jvs.2016.03.248
241. Patel R, Powell JT, Sweeting MJ, Epstein DM, Barrett JK, Greenhalgh RM. The UK EndoVascular Aneurysm Repair (EVAR) randomised controlled trials: long-term follow-up and cost-effectiveness analysis. Health Technol Assess (Rockv). 2018; 22(5): 1 - 132. doi: 10.3310/hta22050
242. Lederle FA, Freischlag JA, Kyriakides TC, et al. Outcomes following endovascular vs open repair of abdominal aortic aneurysm: a randomized trial. JAMA. 2009; 302(14): 1535 - 1542. doi: 10.1001/jama.2009.1426
243. Mani K, ![]() M, Lundkvist J, Wanhainen A. Improved Long-Term Survival After Abdominal Aortic Aneurysm Repair. Circulation. 2009; 120(3): 201 - 211. doi: 10.1161/CIRCULATIONAHA.108.832774
M, Lundkvist J, Wanhainen A. Improved Long-Term Survival After Abdominal Aortic Aneurysm Repair. Circulation. 2009; 120(3): 201 - 211. doi: 10.1161/CIRCULATIONAHA.108.832774
244. DAVIDOVIC LB, DUCIC S. Is there a role for open repair of abdominal aortic aneurysm in the endovascular era? J Cardiovasc Surg (Torino). 2022; 62(6). doi: 10.23736/S0021-9509.21.12045-2
245. Marone EM, Freyrie A, Ruotolo C, et al. Expert Opinion on Hostile Neck Definition in Endovascular Treatment of Abdominal Aortic Aneurysms (a Delphi Consensus). Ann Vasc Surg. 2020; 62: 173 - 182. doi: 10.1016/j.avsg.2019.05.049
246. Rouwet EV, Torsello G, de Vries JPPM, et al. Final Results of the Prospective European Trial of the Endurant Stent Graft for Endovascular Abdominal Aortic Aneurysm Repair. European Journal of Vascular and Endovascular Surgery. 2011; 42(4): 489 - 497. doi: 10.1016/j.ejvs.2011.06.008
247. Oderich GS, Greenberg RK, Farber M, et al. Results of the United States multicenter prospective study evaluating the Zenith fenestrated endovascular graft for treatment of juxtarenal abdominal aortic aneurysms. J Vasc Surg. 2014; 60(6): 1420 - 1428. e5. doi: 10.1016/j.jvs.2014.08.061
248. Eisenack M, Umscheid T, Tessarek J, Torsello GF, Torsello GB. Percutaneous Endovascular Aortic Aneurysm Repair: A Prospective Evaluation of Safety, Efficiency, and Risk Factors. Journal of Endovascular Therapy. 2009; 16(6): 708 - 713. doi: 10.1583/08-2622.1
249. Pratesi G, Barbante M, Pulli R, et al. Italian Percutaneous EVAR (IPER) Registry: outcomes of 2381 percutaneous femoral access sites' closure for aortic stent-graft. J Cardiovasc Surg (Torino). 2015; 56(6): 889 - 898.
250. Gimzewska M, Jackson AI, Yeoh SE, Clarke M. Totally percutaneous versus surgical cut-down femoral artery access for elective bifurcated abdominal endovascular aneurysm repair. Cochrane Database of Systematic Reviews. 2017; 2017(2). doi: 10.1002/14651858.CD010185.pub3
251. Sobolev M, Slovut DP, Lee Chang A, Shiloh AL, Eisen LA. Ultrasound-Guided Catheterization of the Femoral Artery: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Invasive Cardiol. 2015; 27(7): 318 - 323.
252. Dovell G, Rogers CA, Armstrong R, Harris RA, Hinchliffe RJ, Mouton R. The Effect of Mode of Anaesthesia on Outcomes After Elective Endovascular Repair of Abdominal Aortic Aneurysm. European Journal of Vascular and Endovascular Surgery. 2020; 59(5): 729 - 738. doi: 10.1016/j.ejvs.2020.01.031
253. Cheng M, Chen Q, Tran-McCaslin M, Chun L, Lew W, Patel K. Endovascular Abdominal Aortic Aneurysm Repair: Does Anesthesia Type Matter? Ann Vasc Surg. 2019; 61: 284 - 290. doi: 10.1016/j.avsg.2019.04.031
254. Liu Y, Wang T, Zhao J, et al. Influence of Anesthetic Techniques on Perioperative Outcomes after Endovascular Aneurysm Repair. Ann Vasc Surg. 2021; 73: 375 - 384. doi: 10.1016/j.avsg.2020.11.034
255. Lareyre F, Panthier F, Jean-Baptiste E, Hassen-Khodja R, Raffort J. Coverage of Accessory Renal Arteries During Endovascular Aortic Aneurysm Repair: What Are the Consequences and the Implications for Clinical Practice? Angiology. 2019; 70(1): 12 - 19. doi: 10.1177/0003319718771249
256. Sadeghi-Azandaryani M, Zimmermann H, Korten I, et al. Altered renal functions in patients with occlusion of an accessory renal artery after endovascular stenting of an infrarenal aneurysm. J Vasc Surg. 2017; 65(3): 635 - 642. doi: 10.1016/j.jvs.2016.06.116
257. Ribeiro M, Oderich GS, Macedo T, et al. Assessment of aortic wall thrombus predicts outcomes of endovascular repair of complex aortic aneurysms using fenestrated and branched endografts. J Vasc Surg. 2017; 66(5): 1321 - 1333. doi: 10.1016/j.jvs.2017.03.428
258. Sandri G de A, Oderich GS, Tenorio ER, et al. Impact of aortic wall thrombus on late changes in renal function among patients treated by fenestrated-branched endografts. J Vasc Surg. 2019; 69(3): 651 - 660. e4. doi: 10.1016/j.jvs.2018.05.243
259. Martinelli O, Alunno A, Drudi FM, Malaj A, Irace L. Duplex ultrasound versus CT angiography for the treatment planning of lower-limb arterial disease. J Ultrasound. 2021; 24(4): 471 - 479. doi: 10.1007/s40477-020-00534-y
260. Chan YC, Qing KX, Ting AC, Cheng SW. Endovascular infrarenal aneurysm repair in patients with horseshoe kidneys: case series and literature review. Vascular. 2011; 19(3): 126 - 131. doi: 10.1258/vasc.2010.cr0256
261. Donas KP, Inchingolo M, Cao P, et al. Secondary Procedures Following Iliac Branch Device Treatment of Aneurysms Involving the Iliac Bifurcation: The pELVIS Registry. Journal of Endovascular Therapy. 2017; 24(3): 405 - 410. doi: 10.1177/1526602817705134
262. Lee JT, Greenberg JI, Dalman RL. Early experience with the snorkel technique for juxtarenal aneurysms. J Vasc Surg. 2012; 55(4): 935 - 946. doi: 10.1016/j.jvs.2011.11.041
263. Greenberg RK, Clair D, Srivastava S, et al. Should patients with challenging anatomy be offered endovascular aneurysm repair? J Vasc Surg. 2003; 38(5): 990 - 996. doi: 10.1016/S0741-5214(03)00896-6
264. Montelione N, Pecoraro F, Puippe G, et al. A 12-Year Experience With Chimney and Periscope Grafts for Treatment of Type I Endoleaks. Journal of Endovascular Therapy. 2015; 22(4): 568 - 574. doi: 10.1177/1526602815586972
265. Lobato AC. Sandwich Technique for Aortoiliac Aneurysms Extending to the Internal Iliac Artery or Isolated Common/Internal Iliac Artery Aneurysms: A New Endovascular Approach to Preserve Pelvic Circulation. Journal of Endovascular Therapy. 2011; 18(1): 106 - 111. doi: 10.1583/10-3320.1
266. Li Y, Hu Z, Bai C, et al. Fenestrated and Chimney Technique for Juxtarenal Aortic Aneurysm: A Systematic Review and Pooled Data Analysis. Sci Rep. 2016; 6(1): 20497. doi: 10.1038/srep20497
267. Kasprzak PM, Gallis K, Cucuruz B, Pfister K, Janotta M, Kopp R. Editor's Choice - Temporary Aneurysm Sac Perfusion as an Adjunct for Prevention of Spinal Cord Ischemia After Branched Endovascular Repair of Thoracoabdominal Aneurysms. European Journal of Vascular and Endovascular Surgery. 2014; 48(3): 258 - 265. doi: 10.1016/j.ejvs.2014.05.020
268. Lioupis C, Corriveau MM, MacKenzie KS, et al. Paraplegia prevention branches: A new adjunct for preventing or treating spinal cord injury after endovascular repair of thoracoabdominal aneurysms. J Vasc Surg. 2011; 54(1): 252 - 257. doi: 10.1016/j.jvs.2010.11.131
269. Eagleton MJ, Greenberg RK. Spinal and visceral ischemia after endovascular aortic repair. J Cardiovasc Surg (Torino). 2010; 51(1): 71 - 83.
270. Maurel B, Delclaux N, Sobocinski J, et al. Editor's Choice - The Impact of Early Pelvic and Lower Limb Reperfusion and Attentive Peri-operative Management on the Incidence of Spinal Cord Ischemia During Thoracoabdominal Aortic Aneurysm Endovascular Repair. European Journal of Vascular and Endovascular Surgery. 2015; 49(3): 248 - 254. doi: 10.1016/j.ejvs.2014.11.017
271. Harrison SC, Agu O, Harris PL, Ivancev K. Elective sac perfusion to reduce the risk of neurologic events following endovascular repair of thoracoabdominal aneurysms. J Vasc Surg. 2012; 55(4): 1202 - 1205. doi: 10.1016/j.jvs.2011.10.079
272. Banga PV., Oderich GS, Reis de Souza L, et al. Neuromonitoring, Cerebrospinal Fluid Drainage, and Selective Use of Iliofemoral Conduits to Minimize Risk of Spinal Cord Injury During Complex Endovascular Aortic Repair. Journal of Endovascular Therapy. 2016; 23(1): 139 - 149. doi: 10.1177/1526602815620898
273. Etz CD, Kari FA, Mueller CS, et al. The collateral network concept: A reassessment of the anatomy of spinal cord perfusion. J Thorac Cardiovasc Surg. 2011; 141(4): 1020 - 1028. doi: 10.1016/j.jtcvs.2010.06.023
274. Etz CD, Homann TM, Plestis KA, et al. Spinal cord perfusion after extensive segmental artery sacrifice: can paraplegia be prevented? European Journal of Cardio-Thoracic Surgery. 2007; 31(4): 643 - 648. doi: 10.1016/j.ejcts.2007.01.023
275. Etz CD, Weigang E, Hartert M, et al. Contemporary spinal cord protection during thoracic and thoracoabdominal aortic surgery and endovascular aortic repair: a position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery ![]() . European Journal of Cardio-Thoracic Surgery. 2015; 47(6): 943 - 957. doi: 10.1093/ejcts/ezv142
. European Journal of Cardio-Thoracic Surgery. 2015; 47(6): 943 - 957. doi: 10.1093/ejcts/ezv142
276. Sobocinski J, Briffa F, Holt PJ, et al. Evaluation of the Zenith low-profile abdominal aortic aneurysm stent graft. J Vasc Surg. 2015; 62(4): 841 - 847. doi: 10.1016/j.jvs.2015.04.452
277. McCulloch P, Altman DG, Campbell WB, et al. No surgical innovation without evaluation: the IDEAL recommendations. The Lancet. 2009; 374(9695): 1105 - 1112. doi: 10.1016/S0140-6736(09)61116-8
278. Campbell B, Wilkinson J, Marlow M, Sheldon M. Long-term evidence for new high-risk medical devices. The Lancet. 2018; 391(10136): 2194 - 2195. doi: 10.1016/S0140-6736(18)30975-9
279. Jordan WD, de Vries JPPM, Ouriel K, et al. Midterm Outcome of EndoAnchors for the Prevention of Endoleak and Stent-Graft Migration in Patients With Challenging Proximal Aortic Neck Anatomy. Journal of Endovascular Therapy. 2015; 22(2): 163 - 170. doi: 10.1177/1526602815574685
280. van den Ham LH, Holden A, Savlovskis J, et al. Editor's Choice - Occurrence and Classification of Proximal Type I Endoleaks After EndoVascular Aneurysm Sealing Using the NellixTM Device. European Journal of Vascular and Endovascular Surgery. 2017; 54(6): 729 - 736. doi: 10.1016/j.ejvs.2017.09.016
281. Sarac TP, Gibbons C, Vargas L, et al. Long-term follow-up of type II endoleak embolization reveals the need for close surveillance. J Vasc Surg. 2012; 55(1): 33 - 40. doi: 10.1016/j.jvs.2011.07.092
282. Ouriel K, Fowl RJ, Davies MG, Forbes TL, Gambhir RPS, Ricci MA. Disease-specific guidelines for reporting adverse events for peripheral vascular medical devices. J Vasc Surg. 2014; 60(1): 212 - 225. doi: 10.1016/j.jvs.2014.04.061
283. White GH, May J, Waugh RC, Chaufour X, Yu W. Type III and Type IV Endoleak: Toward a Complete Definition of Blood Flow in the Sac after Endoluminal AAA Repair. Journal of Endovascular Therapy. 1998; 5(4): 305 - 309. doi: 10.1177/152660289800500403
284. Lal BK, Zhou W, Li Z, et al. Predictors and outcomes of endoleaks in the Veterans Affairs Open Versus Endovascular Repair (OVER) Trial of Abdominal Aortic Aneurysms. J Vasc Surg. 2015; 62(6): 1394 - 1404. doi: 10.1016/j.jvs.2015.02.003
285. Fillinger MF, Greenberg RK, McKinsey JF, Chaikof EL. Reporting standards for thoracic endovascular aortic repair (TEVAR). J Vasc Surg. 2010; 52(4): 1022 - 1033. e5. doi: 10.1016/j.jvs.2010.07.008
286.  JM, Tenorio ER, Jain A, et al. Outcomes of target vessel endoleaks after fenestrated-branched endovascular aortic repair. J Vasc Surg. 2020; 72(2): 445 - 455. doi: 10.1016/j.jvs.2019.09.055
JM, Tenorio ER, Jain A, et al. Outcomes of target vessel endoleaks after fenestrated-branched endovascular aortic repair. J Vasc Surg. 2020; 72(2): 445 - 455. doi: 10.1016/j.jvs.2019.09.055
287.  FJV, Gusberg RJ, Dardik A, et al. Aneurysm Rupture after EVAR: Can the Ultimate Failure be Predicted? European Journal of Vascular and Endovascular Surgery. 2009; 37(1): 15 - 22. doi: 10.1016/j.ejvs.2008.10.011
FJV, Gusberg RJ, Dardik A, et al. Aneurysm Rupture after EVAR: Can the Ultimate Failure be Predicted? European Journal of Vascular and Endovascular Surgery. 2009; 37(1): 15 - 22. doi: 10.1016/j.ejvs.2008.10.011
288. Fransen GAJ, Vallabhaneni SR, van Marrewijk CJ, Laheij RJF, Harris PL, Buth J. Rupture of Infra-renal Aortic Aneurysm after Endovascular Repair: A Series from EUROSTAR Registry. European Journal of Vascular and Endovascular Surgery. 2003; 26(5): 487 - 493. doi: 10.1016/S1078-5884(03)00350-2
289. Doumenc B, Mesnard T, Patterson BO, et al. Management of Type IA Endoleak After EVAR by Explantation or Custom Made Fenestrated Endovascular Aortic Aneurysm Repair. European Journal of Vascular and Endovascular Surgery. 2021; 61(4): 571 - 578. doi: 10.1016/j.ejvs.2020.10.033
290. Martin Z, Greenberg RK, Mastracci TM, Eagleton MJ, O'Callaghan A, Bena J. Late rescue of proximal endograft failure using fenestrated and branched devices. J Vasc Surg. 2014; 59(6): 1479 - 1487. doi: 10.1016/j.jvs.2013.12.028
291. Wang SK, Drucker NA, Sawchuk AP, et al. Use of the Zenith Fenestrated platform to rescue failing endovascular and open aortic reconstructions is safe and technically feasible. J Vasc Surg. 2018; 68(4): 1017 - 1022. doi: 10.1016/j.jvs.2018.01.038
292. Falkensammer J, Taher F, Uhlmann M, Hirsch K, Strassegger J, Assadian A. Rescue of failed endovascular aortic aneurysm repair using the fenestrated Anaconda device. J Vasc Surg. 2017; 66(5): 1334 - 1339. doi: 10.1016/j.jvs.2017.02.048
293. Budtz-Lilly J, D'Oria M, Gallitto E, et al. European Multicentric Experience With Fenestrated-branched ENDOvascular Stent Grafting After Previous FAILed Infrarenal Aortic Repair. Ann Surg. 2023; 278(2): e389 - e395. doi: 10.1097/SLA.0000000000005577
294. Juszczak M, Vezzosi M, Nasr H, Claridge M, Adam DJ. Fenestrated-Branch Endovascular Repair After Prior Abdominal Aortic Aneurysm Repair. European Journal of Vascular and Endovascular Surgery. 2021; 62(5): 728 - 737. doi: 10.1016/j.ejvs.2021.07.003
295. Juszczak MT, Vezzosi M, Khan M, Mascaro J, Claridge M, Adam D. Endovascular repair of acute juxtarenal and thoracoabdominal aortic aneurysms with surgeon-modified fenestrated endografts. J Vasc Surg. 2020; 72(2): 435 - 444. doi: 10.1016/j.jvs.2019.10.056
296. Lo RC, Buck DB, Herrmann J, et al. Risk factors and consequences of persistent type II endoleaks. J Vasc Surg. 2016; 63(4): 895 - 901. doi: 10.1016/j.jvs.2015.10.088
297. Sidloff DA, Stather PW, Choke E, Bown MJ, Sayers RD. Type II endoleak after endovascular aneurysm repair. British Journal of Surgery. 2013; 100(10): 1262 - 1270. doi: 10.1002/bjs.9181
298. Ultee KHJ,  S, Huurman R, et al. Editor's Choice - Systematic Review and Meta-Analysis of the Outcome of Treatment for Type II Endoleak Following Endovascular Aneurysm Repair. European Journal of Vascular and Endovascular Surgery. 2018; 56(6): 794 - 807. doi: 10.1016/j.ejvs.2018.06.009
S, Huurman R, et al. Editor's Choice - Systematic Review and Meta-Analysis of the Outcome of Treatment for Type II Endoleak Following Endovascular Aneurysm Repair. European Journal of Vascular and Endovascular Surgery. 2018; 56(6): 794 - 807. doi: 10.1016/j.ejvs.2018.06.009
299. Wu WW, Swerdlow NJ, Dansey K, Shuja F, Wyers MC, Schermerhorn ML. Surgical treatment patterns and clinical outcomes of patients treated for expanding aneurysm sacs with type II endoleaks after endovascular aneurysm repair. J Vasc Surg. 2021; 73(2): 484 - 493. doi: 10.1016/j.jvs.2020.05.062
300. Madigan MC, Singh MJ, Chaer RA, Al-Khoury GE, Makaroun MS. Occult type I or III endoleaks are a common cause of failure of type II endoleak treatment after endovascular aortic repair. J Vasc Surg. 2019; 69(2): 432 - 439. doi: 10.1016/j.jvs.2018.04.054
301. Bussmann A, Heim F, Delay C, et al. Textile Aging Characterization on New Generations of Explanted Commercial Endoprostheses: A Preliminary Study. European Journal of Vascular and Endovascular Surgery. 2017; 54(3): 378 - 386. doi: 10.1016/j.ejvs.2017.06.004
302. Yoshitake A, Hachiya T, Itoh T, et al. Nonvisualized Type III Endoleak Masquerading as Endotension: A Case Report. Ann Vasc Surg. 2015; 29(3): 595.e15 - 595.e17. doi: 10.1016/j.avsg.2014.10.039
303. Turney EJ, Steenberge SP, Lyden SP, et al. Late graft explants in endovascular aneurysm repair. J Vasc Surg. 2014; 59(4): 886 - 893. doi: 10.1016/j.jvs.2013.10.079
304. Cao P, Verzini F, Zannetti S, et al. Device migration after endoluminal abdominal aortic aneurysm repair: Analysis of 113 cases with a minimum follow-up period of 2 years. J Vasc Surg. 2002; 35(2): 229 - 235. doi: 10.1067/mva.2002.120045
305. Albertini JN, Kalliafas S, Travis S, et al. Anatomical Risk Factors for Proximal Perigraft Endoleak and Graft Migration Following Endovascular Repair of Abdominal Aortic Aneurysms. European Journal of Vascular and Endovascular Surgery. 2000; 19(3): 308 - 312. doi: 10.1053/ejvs.1999.1045
306. Pintoux D, Chaillou P, Azema L, et al. Long-Term Influence of Suprarenal or Infrarenal Fixation on Proximal Neck Dilatation and Stentgraft Migration After EVAR. Ann Vasc Surg. 2011; 25(8): 1012 - 1019. doi: 10.1016/j.avsg.2010.08.013
307. Sternbergh WC, Money SR, Greenberg RK, Chuter TAM. Influence of endograft oversizing on device migration, endoleak, aneurysm shrinkage, and aortic neck dilation: results from the zenith multicenter trial. J Vasc Surg. 2004; 39(1): 20 - 26. doi: 10.1016/j.jvs.2003.09.022
308. van Prehn J,  FJV, Muhs BE, Verhagen HJM, Moll FL, van Herwaarden JA. Oversizing of Aortic Stent Grafts for Abdominal Aneurysm Repair: A Systematic Review of the Benefits and Risks. European Journal of Vascular and Endovascular Surgery. 2009; 38(1): 42 - 53. doi: 10.1016/j.ejvs.2009.03.025
FJV, Muhs BE, Verhagen HJM, Moll FL, van Herwaarden JA. Oversizing of Aortic Stent Grafts for Abdominal Aneurysm Repair: A Systematic Review of the Benefits and Risks. European Journal of Vascular and Endovascular Surgery. 2009; 38(1): 42 - 53. doi: 10.1016/j.ejvs.2009.03.025
309. Cao P, Verzini F, Parlani G, et al. Predictive factors and clinical consequences of proximal aortic neck dilatation in 230 patients undergoing abdominal aorta aneurysm repair with self-expandable stent-grafts1 1Competition of interest: none. J Vasc Surg. 2003; 37(6): 1200 - 1205. doi: 10.1016/S0741-5214(02)75340-8
310. Seiler CM, Deckert A, Diener MK, et al. Midline Versus Transverse Incision in Major Abdominal Surgery. Ann Surg. 2009; 249(6): 913 - 920. doi: 10.1097/SLA.0b013e3181a77c92
311. Brown SR, Tiernan J. Transverse verses midline incisions for abdominal surgery. Cochrane Database of Systematic Reviews. 2005; 2011(10). doi: 10.1002/14651858.CD005199.pub2
312. Wiersema AM, Jongkind V, Bruijninckx CMA, et al. Prophylactic Perioperative Anti-Thrombotics in Open and Endovascular Abdominal Aortic Aneurysm (AAA) Surgery: A Systematic Review. European Journal of Vascular and Endovascular Surgery. 2012; 44(4): 359 - 367. doi: 10.1016/j.ejvs.2012.06.008
313. Goldhammer JE, Zimmerman D. Pro: Activated Clotting Time Should Be Monitored During Heparinization For Vascular Surgery. J Cardiothorac Vasc Anesth. 2018; 32(3): 1494 - 1496. doi: 10.1053/j.jvca.2017.04.047
314. Cao P, De Rango P, Parlani G, Verzini F. Fate of Proximal Aorta Following Open Infrarenal Aneurysm Repair. Semin Vasc Surg. 2009; 22(2): 93 - 98. doi: 10.1053/j.semvascsurg.2009.04.005
315. Lipski DA, Ernst CB. Natural history of the residual infrarenal aorta after infrarenal abdominal aortic aneurysm repair. J Vasc Surg. 1998; 27(5): 805 - 812. doi: 10.1016/S0741-5214(98)70259-9
316. Becquemin JP, Majewski M, Fermani N, et al. Colon ischemia following abdominal aortic aneurysm repair in the era of endovascular abdominal aortic repair. J Vasc Surg. 2008; 47(2): 258 - 263. doi: 10.1016/j.jvs.2007.10.001
317. ![]() M,
M,  T, Bergqvist D. Risk factors for intestinal ischaemia after aortoiliac surgery: a combined cohort and case-control study of 2824 operations. European Journal of Vascular and Endovascular Surgery. 1997; 13(6): 531 - 539. doi: 10.1016/S1078-5884(97)80061-5
T, Bergqvist D. Risk factors for intestinal ischaemia after aortoiliac surgery: a combined cohort and case-control study of 2824 operations. European Journal of Vascular and Endovascular Surgery. 1997; 13(6): 531 - 539. doi: 10.1016/S1078-5884(97)80061-5
318. ![]() M, Lindberg F, Broman G, Bergqvist D. pHi Monitoring of the Sigmoid Colon after Aortoiliac Surgery. A Five-year Prospective Study. European Journal of Vascular and Endovascular Surgery. 2000; 20(3): 273 - 280. doi: 10.1053/ejvs.2000.1148
M, Lindberg F, Broman G, Bergqvist D. pHi Monitoring of the Sigmoid Colon after Aortoiliac Surgery. A Five-year Prospective Study. European Journal of Vascular and Endovascular Surgery. 2000; 20(3): 273 - 280. doi: 10.1053/ejvs.2000.1148
319. Marconi M, Ceragioli S, Mocellin DM, et al. Open Surgical Management of Hypogastric Artery during Aortic Surgery: Ligate or Not Ligate? Ann Vasc Surg. 2015; 29(4): 780 - 785. doi: 10.1016/j.avsg.2014.12.025
320.  L,
L,  M, Ilic N, et al. Repair of abdominal aortic aneurysms in the presence of the horseshoe kidney. Int Angiol. 2011; 30(6): 534 - 540.
M, Ilic N, et al. Repair of abdominal aortic aneurysms in the presence of the horseshoe kidney. Int Angiol. 2011; 30(6): 534 - 540.
321. Stroosma OB, Kootstra G, Schurink GWH. Management of aortic aneurysm in the presence of a horseshoe kidney. British Journal of Surgery. 2002; 88(4): 500 - 509. doi: 10.1046/j.1365-2168.2001.01718.x
322. O'Hara PJ, Hakaim AG, Hertzer NR, Krajewski LP, Cox GS, Beven EG. Surgical management of aortic aneurysm and coexistent horseshoe kidney: review of a 31-year experience. J Vasc Surg. 1993; 17(5): 940 - 947.
323. Davidovic L, Koncar I. Elective and emergent repair of abdominal aortic aneurysm: selection of open or endovascular strategy. In: Vascular Surgery. Elsevier; 2022: 145 - 156. doi: 10.1016/B978-0-12-822113-6.00018-8
324. Davidovic L. Open Repair for infrarenal AAA. Management of Abdominal Aortic Aneurysms Edizioni Minerva Medica Turin-Italy. Published online 2016: 16 - 27.
325. Woo E.Y., Damrauer S.M. Abdominal aortic aneurysms: open surgical treatment. Rutherford's vascular surgery 8th ed Philadelphia (PA): Elsevier Saunders. Published online 2014: 2014 - 2045.
326. Killen DA, Reed WA, Gorton ME, et al. Is Routine Postaneurysmectomy Hemodynamic Assessment of the Inferior Mesenteric Artery Circulation Helpful? Ann Vasc Surg. 1999; 13(5): 533 - 538. doi: 10.1007/s100169900293
327. Senekowitsch C, Assadian A, Assadian O, Hartleb H, Ptakovsky H,  GW. Replanting the inferior mesentery artery during infrarenal aortic aneurysm repair: Influence on postoperative colon ischemia. J Vasc Surg. 2006; 43(4): 689 - 694. doi: 10.1016/j.jvs.2005.12.016
GW. Replanting the inferior mesentery artery during infrarenal aortic aneurysm repair: Influence on postoperative colon ischemia. J Vasc Surg. 2006; 43(4): 689 - 694. doi: 10.1016/j.jvs.2005.12.016
328. Davidovic LB, Palombo D, Treska V, et al. Late open conversion after endovascular abdominal aortic aneurysm repair: experience of three-high volume centers. J Cardiovasc Surg (Torino). 2020; 61(2). doi: 10.23736/S0021-9509.19.10972-X
329. Coscas R, Coggia M, Di Centa I, Javerliat I, Cochennec F,  O. Laparoscopic Aortic Surgery in Obese Patients. Ann Vasc Surg. 2009; 23(6): 717 - 721. doi: 10.1016/j.avsg.2009.01.003
O. Laparoscopic Aortic Surgery in Obese Patients. Ann Vasc Surg. 2009; 23(6): 717 - 721. doi: 10.1016/j.avsg.2009.01.003
330. Javerliat I, Capdevila C, Beauchet A, Di Centa I,  O, Coggia M. Results of Laparoscopic Surgery for Abdominal Aortic Aneurysms in Patients With Standard Surgical Risk and Anatomic Criteria Compatible With EVAR. Ann Vasc Surg. 2013; 27(4): 412 - 417. doi: 10.1016/j.avsg.2012.07.006
O, Coggia M. Results of Laparoscopic Surgery for Abdominal Aortic Aneurysms in Patients With Standard Surgical Risk and Anatomic Criteria Compatible With EVAR. Ann Vasc Surg. 2013; 27(4): 412 - 417. doi: 10.1016/j.avsg.2012.07.006
331. Cambria RA, Gloviczki P, Stanson AW, et al. Symptomatic, Nonruptured Abdominal Aortic Aneurysms: Are Emergent Operations Necessary? Ann Vasc Surg. 1994; 8(2): 121 - 126. doi: 10.1007/BF02018859
332. De Martino RR, Nolan BW, Goodney PP, et al. Outcomes of symptomatic abdominal aortic aneurysm repair. J Vasc Surg. 2010; 52(1): 5 - 12.e1. doi: 10.1016/j.jvs.2010.01.095
333. Haug ES, Romundstad P, Aadahl P, Myhre HO. Emergency Non-ruptured Abdominal Aortic Aneurysm. European Journal of Vascular and Endovascular Surgery. 2004; 28(6): 612 - 618. doi: 10.1016/j.ejvs.2004.09.013
334. Tambyraja AL, Raza Z, Stuart WP, Murie JA, Chalmers RTA. Does Immediate Operation for Symptomatic Non-ruptured Abdominal Aortic Aneurysm Compromise Outcome? European Journal of Vascular and Endovascular Surgery. 2004; 28(5): 543 - 546. doi: 10.1016/j.ejvs.2004.06.017
335. Roberts K, Revell M, Youssef H, Bradbury AW, Adam DJ. Hypotensive Resuscitation in Patients with Ruptured Abdominal Aortic Aneurysm. European Journal of Vascular and Endovascular Surgery. 2006; 31(4): 339 - 344. doi: 10.1016/j.ejvs.2005.11.003
336. Crawford ES. Ruptured abdominal aortic aneurysm: An editorial. J Vasc Surg. 1991; 13(2): 348 - 350. doi: 10.1016/0741-5214(91)90228-M
337. Hamilton H, Constantinou J, Ivancev K. The role of permissive hypotension in the management of ruptured abdominal aortic aneurysms. J Cardiovasc Surg (Torino). 2014; 55(2): 151 - 159.
338. Dick F, Erdoes G, Opfermann P, Eberle B, Schmidli J, von Allmen RS. Delayed volume resuscitation during initial management of ruptured abdominal aortic aneurysm. J Vasc Surg. 2013; 57(4): 943 - 950. doi: 10.1016/j.jvs.2012.09.072
339. Hechelhammer L, Lachat ML, Wildermuth S, Bettex D, Mayer D, Pfammatter T. Midterm outcome of endovascular repair of ruptured abdominal aortic aneurysms. J Vasc Surg. 2005; 41(5): 752 - 757. doi: 10.1016/j.jvs.2005.02.023
340. Mayer D, Pfammatter T, Rancic Z, et al. 10 Years of Emergency Endovascular Aneurysm Repair for Ruptured Abdominal Aortoiliac Aneurysms: Lessons Learned. Ann Surg. 2009; 249(3): 510 - 515. doi: 10.1097/SLA.0b013e31819a8b65
341. Veith FJ, Ohki T. Endovascular approaches to ruptured infrarenal aorto-iliac aneurysms. J Cardiovasc Surg (Torino). 2002; 43(3): 369 - 378.
342. van der Vliet JA, van Aalst DL, Schultze Kool LJ, Wever JJ, Blankensteijn JD. Hypotensive Hemostatis (Permissive Hypotension) for Ruptured Abdominal Aortic Aneurysm: Are We Really in Control? Vascular. 2007; 15(4): 197 - 200. doi: 10.2310/6670.2007.00028
343. Lachat ML, Pfammatter Th, Witzke HJ, et al. Endovascular Repair with Bifurcated Stent-Grafts under Local Anaesthesia to Improve Outcome of Ruptured Aortoiliac Aneurysms. European Journal of Vascular and Endovascular Surgery. 2002; 23(6): 528 - 536. doi: 10.1053/ejvs.2002.1622
344. Karkos CD, Karamanos D, Papazoglou KO, et al. Usefulness of the Hardman index in predicting outcome after endovascular repair of ruptured abdominal aortic aneurysms. J Vasc Surg. 2008; 48(4): 788 - 794. doi: 10.1016/j.jvs.2008.05.065
345. IMPROVE Trial Investigators, Powell JT, Sweeting MJ, et al. Endovascular or open repair strategy for ruptured abdominal aortic aneurysm: 30 day outcomes from IMPROVE randomised trial. BMJ. 2014; 348: f7661. doi: 10.1136/bmj.f7661
346. Robinson WP, Schanzer A, Aiello FA, et al. Endovascular repair of ruptured abdominal aortic aneurysms does not reduce later mortality compared with open repair. J Vasc Surg. 2016; 63(3): 617 - 624. doi: 10.1016/j.jvs.2015.09.057
347. Sweeting MJ, Ulug P, Powell JT, Desgranges P, Balm R. Ruptured Aneurysm Trials: The Importance of Longer-term Outcomes and Meta-analysis for 1-year Mortality. European Journal of Vascular and Endovascular Surgery. 2015; 50(3): 297 - 302. doi: 10.1016/j.ejvs.2015.04.015
348. IMPROVE Trial Investigators. The effect of aortic morphology on peri-operative mortality of ruptured abdominal aortic aneurysm. Eur Heart J. 2015; 36(21): 1328 - 1334. doi: 10.1093/eurheartj/ehu521
349. Mell MW, Starnes BW, Kraiss LW, Schneider PA, Pevec WC. Western Vascular Society guidelines for transfer of patients with ruptured abdominal aortic aneurysm. J Vasc Surg. 2017; 65(3): 603 - 608. doi: 10.1016/j.jvs.2016.10.097
350. Orr NT, Davenport DL, Minion DJ, Xenos ES. Comparison of perioperative outcomes in endovascular versus open repair for juxtarenal and pararenal aortic aneurysms: A propensity-matched analysis. Vascular. 2017; 25(4): 339 - 345. doi: 10.1177/1708538116681911
351. Mei F, Hu K, Zhao B, et al. Retroperitoneal versus transperitoneal approach for elective open abdominal aortic aneurysm repair. Cochrane Database of Systematic Reviews. 2021; 2021(6). doi: 10.1002/14651858.CD010373.pub3
352.  L,
L,  M,
M, ![]() D, et al. Ruptured abdominal aortic aneurysms: factors influencing early survival. Ann Vasc Surg. 2005; 19(1): 29 - 34. doi: 10.1007/s10016-004-0148-9
D, et al. Ruptured abdominal aortic aneurysms: factors influencing early survival. Ann Vasc Surg. 2005; 19(1): 29 - 34. doi: 10.1007/s10016-004-0148-9
353.  M,
M,  L,
L, ![]() N,
N,  R, Ille T,
R, Ille T,  M. Intraoperative Cell Salvage versus Allogeneic Transfusion during Abdominal Aortic Surgery: Clinical and Financial Outcomes. Vascular. 2009; 17(2): 83 - 92. doi: 10.2310/6670.2009.00009
M. Intraoperative Cell Salvage versus Allogeneic Transfusion during Abdominal Aortic Surgery: Clinical and Financial Outcomes. Vascular. 2009; 17(2): 83 - 92. doi: 10.2310/6670.2009.00009
354. Karkos CD, Menexes GC, Patelis N, Kalogirou TE, Giagtzidis IT, Harkin DW. A systematic review and meta-analysis of abdominal compartment syndrome after endovascular repair of ruptured abdominal aortic aneurysms. J Vasc Surg. 2014; 59(3): 829 - 842. doi: 10.1016/j.jvs.2013.11.085
355. Mehta M, Taggert J, Darling RC, et al. Establishing a protocol for endovascular treatment of ruptured abdominal aortic aneurysms: outcomes of a prospective analysis. J Vasc Surg. 2006; 44(1): 1 - 8; discussion 8. doi: 10.1016/j.jvs.2006.02.057
356. Moore R, Nutley M, Cina CS, Motamedi M, Faris P, Abuznadah W. Improved survival after introduction of an emergency endovascular therapy protocol for ruptured abdominal aortic aneurysms. J Vasc Surg. 2007; 45(3): 443 - 450. doi: 10.1016/j.jvs.2006.11.047
357. Veith FJ, Ohki T, Lipsitz EC, Suggs WD, Cynamon J. Endovascular grafts and other catheter-directed techniques in the management of ruptured abdominal aortic aneurysms. Semin Vasc Surg. 2003; 16(4): 326 - 331. doi: 10.1053/j.semvascsurg.2003.08.011
358. Hafez H, Owen LW, Lorimer CFK, Bajwa A. Advantage of a one-stop referral and management service for ruptured abdominal aortic aneurysms. Br J Surg. 2009; 96(12): 141 - 1421. doi: 10.1002/bjs.6783
359. Starnes BW, Quiroga E, Hutter C, et al. Management of ruptured abdominal aortic aneurysm in the endovascular era. J Vasc Surg. 2010; 51(1): 9 - 18. doi: 10.1016/j.jvs.2009.08.038
360. Lachat M, Enzler M. Innovations in the treatment of ruptured AAA may improve future outcome. Vasa. 2007; 36(4): 227 - 228. doi: 10.1024/0301-1526.36.4.227
361. ![]() M, Wanhainen A. Management of abdominal compartment syndrome and the open abdomen. Eur J Vasc Endovasc Surg. 2014; 47(3): 279 - 287. doi: 10.1016/j.ejvs.2013.12.014
M, Wanhainen A. Management of abdominal compartment syndrome and the open abdomen. Eur J Vasc Endovasc Surg. 2014; 47(3): 279 - 287. doi: 10.1016/j.ejvs.2013.12.014
362. Desgranges P, Kobeiter H, Katsahian S, et al. Editor's Choice - ECAR (Endovasculaire ou Chirurgie dans les  aorto-iliaques Rompus): A French Randomized Controlled Trial of Endovascular Versus Open Surgical Repair of Ruptured Aorto-iliac Aneurysms. Eur J Vasc Endovasc Surg. 2015; 50(3): 303 - 310. doi: 10.1016/j.ejvs.2015.03.028
aorto-iliaques Rompus): A French Randomized Controlled Trial of Endovascular Versus Open Surgical Repair of Ruptured Aorto-iliac Aneurysms. Eur J Vasc Endovasc Surg. 2015; 50(3): 303 - 310. doi: 10.1016/j.ejvs.2015.03.028
363. Hinchliffe RJ, Yusuf SW, Macierewicz JA, MacSweeney STR, Wenham PW, Hopkinson BR. Endovascular Repair of Ruptured Abdominal Aortic Aneurysm - a Challenge to Open Repair? Results of a Single Centre Experience in 20 Patients. European Journal of Vascular and Endovascular Surgery. 2001; 22(6): 528 - 534. doi: 10.1053/ejvs.2001.1513
364. Karkos CD, Harkin DW, Giannakou A, Gerassimidis TS. Mortality after endovascular repair of ruptured abdominal aortic aneurysms: a systematic review and meta-analysis. Arch Surg. 2009; 144(8): 770-778. doi: 10.1001/archsurg.2009.132
365. van der Riet C, Schuurmann RCL, Karelis A, et al. Supra- and Infra-Renal Aortic Neck Diameter Increase after Endovascular Repair of a Ruptured Abdominal Aortic Aneurysm. J Clin Med. 2022; 11(5): 1203. doi: 10.3390/jcm11051203
366. Hinchliffe RJ, Yusuf SW, Macierewicz JA, MacSweeney ST, Wenham PW, Hopkinson BR. Endovascular repair of ruptured abdominal aortic aneurysm--a challenge to open repair? Results of a single centre experience in 20 patients. Eur J Vasc Endovasc Surg. 2001; 22(6): 528 - 534. doi: 10.1053/ejvs.2001.1513
367. Shantikumar S, Patel S, Handa A. The Role of Cell Salvage Autotransfusion in Abdominal Aortic Aneurysm Surgery. European Journal of Vascular and Endovascular Surgery. 2011; 42(5): 577 - 584. doi: 10.1016/j.ejvs.2011.04.014
368. Veith FJ, Lachat M, Mayer D, et al. Collected World and Single Center Experience With Endovascular Treatment of Ruptured Abdominal Aortic Aneurysms. Ann Surg. 2009; 250(5): 818 - 824. doi: 10.1097/SLA.0b013e3181bdd7f5
369. Ohki T, Veith FJ. Endovascular Grafts and Other Image-Guided Catheter-Based Adjuncts to Improve the Treatment of Ruptured Aortoiliac Aneurysms. Ann Surg. 2000; 232(4): 466 - 479. doi: 10.1097/00000658-200010000-00002
370. Karkos CD, Papadimitriou CT, Chatzivasileiadis TN, et al. The Impact of Aortic Occlusion Balloon on Mortality After Endovascular Repair of Ruptured Abdominal Aortic Aneurysms: A Meta-analysis and Meta-regression Analysis. Cardiovasc Intervent Radiol. 2015; 38(6): 1425 - 1437. doi: 10.1007/s00270-015-1132-1
371. Berland TL, Veith FJ, Cayne NS, Mehta M, Mayer D, Lachat M. Technique of supraceliac balloon control of the aorta during endovascular repair of ruptured abdominal aortic aneurysms. J Vasc Surg. 2013; 57(1): 272 - 275. doi: 10.1016/j.jvs.2012.09.001
372. Malina M, Holst J. Balloon control for ruptured AAAs: when and when not to use? J Cardiovasc Surg (Torino). 2014; 55(2): 161 - 167.
373. IMPROVE trial investigators, Powell JT, Hinchliffe RJ, et al. Observations from the IMPROVE trial concerning the clinical care of patients with ruptured abdominal aortic aneurysm. Br J Surg. 2014; 101(3): 216 - 224; discussion 224. doi: 10.1002/bjs.9410
374. Baderkhan H,  FMB, Oliveira NG, et al. Challenging Anatomy Predicts Mortality and Complications After Endovascular Treatment of Ruptured Abdominal Aortic Aneurysm. Journal of Endovascular Therapy. 2016; 23(6): 919 - 927. doi: 10.1177/1526602816658494
FMB, Oliveira NG, et al. Challenging Anatomy Predicts Mortality and Complications After Endovascular Treatment of Ruptured Abdominal Aortic Aneurysm. Journal of Endovascular Therapy. 2016; 23(6): 919 - 927. doi: 10.1177/1526602816658494
375. Kristmundsson T, Sveinsson M,  K,
K,  P, Dias N. Suitability of the Zenith p-Branch Standard Fenestrated Endovascular Graft for Treatment of Ruptured Abdominal Aortic Aneurysms. Journal of Endovascular Therapy. 2015; 22(5): 760 - 764. doi: 10.1177/1526602815601096
P, Dias N. Suitability of the Zenith p-Branch Standard Fenestrated Endovascular Graft for Treatment of Ruptured Abdominal Aortic Aneurysms. Journal of Endovascular Therapy. 2015; 22(5): 760 - 764. doi: 10.1177/1526602815601096
376. Djavani K, Wanhainen A, Valtysson J, ![]() M. Colonic ischaemia and intra-abdominal hypertension following open repair of ruptured abdominal aortic aneurysm. British Journal of Surgery. 2009; 96(6): 621 - 627. doi: 10.1002/bjs.6592
M. Colonic ischaemia and intra-abdominal hypertension following open repair of ruptured abdominal aortic aneurysm. British Journal of Surgery. 2009; 96(6): 621 - 627. doi: 10.1002/bjs.6592
377. Urbonavicius S, Feuerhake IL, Srinanthalogen R, et al. Value of Routine Flexible Sigmoidoscopy and Potential Predictive Factors for Colonic Ischemia after Open Ruptured Abdominal Aortic Aneurysm Repair. Medicina (B Aires). 2020; 56(5): 229. doi: 10.3390/medicina56050229
378. Champagne BJ, Lee EC, Valerian B, Mulhotra N, Mehta M. Incidence of Colonic Ischemia after Repair of Ruptured Abdominal Aortic Aneurysm with Endograft. J Am Coll Surg. 2007; 204(4): 597 - 602. doi: 10.1016/j.jamcollsurg.2007.01.030
379.  M, Fedder AM, Jensen RH,
M, Fedder AM, Jensen RH, ![]() A, Laustsen J. The Value of Routine Flexible Sigmoidoscopy Within 48 Hours After Surgical Repair of Ruptured Abdominal Aortic Aneurysms. Ann Vasc Surg. 2013; 27(6): 714 - 718. doi: 10.1016/j.avsg.2012.07.030
A, Laustsen J. The Value of Routine Flexible Sigmoidoscopy Within 48 Hours After Surgical Repair of Ruptured Abdominal Aortic Aneurysms. Ann Vasc Surg. 2013; 27(6): 714 - 718. doi: 10.1016/j.avsg.2012.07.030
380. Megalopoulos A, Vasiliadis K, Tsalis K, et al. Reliability of Selective Surveillance Colonoscopy in the Early Diagnosis of Colonic Ischemia After Successful Ruptured Abdominal Aortic Aneurysm Repair. Vasc Endovascular Surg. 2008; 41(6): 509 - 515. doi: 10.1177/1538574407306797
381. Jalalzadeh H, van Schaik TG, Duin JJ, et al. The Value of Sigmoidoscopy to Detect Colonic Ischaemia After Ruptured Abdominal Aortic Aneurysm Repair. European Journal of Vascular and Endovascular Surgery. 2019; 57(2): 229 - 237. doi: 10.1016/j.ejvs.2018.08.041
382. Markovic M, Davidovic L, Kostic D, et al. Ruptured Abdominal Aortic Aneurysm. Herz. 2004; 29(1): 123 - 129. doi: 10.1007/s00059-004-2540-1
383. Powell JT, Sweeting MJ, Ulug P, Thompson MM, Hinchliffe RJ. Editor's Choice - Re-interventions After Repair of Ruptured Abdominal Aortic Aneurysm: A Report From the IMPROVE Randomised Trial. European Journal of Vascular and Endovascular Surgery. 2018; 55(5): 625 - 632. doi: 10.1016/j.ejvs.2018.01.028
384. Mehta M, Darling RC, Roddy SP, et al. Factors associated with abdominal compartment syndrome complicating endovascular repair of ruptured abdominal aortic aneurysms. J Vasc Surg. 2005; 42(6): 1047 - 1051. doi: 10.1016/j.jvs.2005.08.033
385. Mayer D, Rancic Z, Veith FJ, Pecoraro F, Pfammatter T, Lachat M. How to diagnose and treat abdominal compartment syndrome after endovascular and open repair of ruptured abdominal aortic aneurysms. J Cardiovasc Surg (Torino). 2014; 55(2): 179 - 192.
386. Seternes A, Rekstad LC, Mo S, et al. Open Abdomen Treated with Negative Pressure Wound Therapy: Indications, Management and Survival. World J Surg. 2017; 41(1): 152 - 161. doi: 10.1007/s00268-016-3694-8
387. Van Herzeele I, Vermassen F, Durieux C, Randon C, De Roose J. Endovascular repair of aortic rupture. European Journal of Vascular and Endovascular Surgery. 2003; 26(3): 311 - 316. doi: 10.1053/ejvs.2002.2007
388. Oelschlager BK, Boyle EM, Johansen K, Meissner MH. Delayed abdominal closure in the management of ruptured abdominal aortic aneurysms. The American Journal of Surgery. 1997; 173(5): 411 - 415. doi: 10.1016/S0002-9610(97)00081-0
389. Malbrain MLNG, Cheatham ML, Kirkpatrick A, et al. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. I. Definitions. Intensive Care Med. 2006; 32(11): 1722 - 1732. doi: 10.1007/s00134-006-0349-5
390. Mastracci TM, Eagleton MJ, Kuramochi Y, Bathurst S, Wolski K. Twelve-year results of fenestrated endografts for juxtarenal and group IV thoracoabdominal aneurysms. J Vasc Surg. 2015; 61(2): 355 - 364. doi: 10.1016/j.jvs.2014.09.068
391. Glorion M, Coscas R, McWilliams RG, Javerliat I,  O, Coggia M. A Comprehensive Review of In Situ Fenestration of Aortic Endografts. European Journal of Vascular and Endovascular Surgery. 2016; 52(6): 787 - 800. doi: 10.1016/j.ejvs.2016.10.001
O, Coggia M. A Comprehensive Review of In Situ Fenestration of Aortic Endografts. European Journal of Vascular and Endovascular Surgery. 2016; 52(6): 787 - 800. doi: 10.1016/j.ejvs.2016.10.001
392. De Bruin JL, Brownrigg JR, Patterson BO, et al. The Endovascular Sealing Device in Combination with Parallel Grafts for Treatment of Juxta/Suprarenal Abdominal Aortic Aneurysms: Short-term Results of a Novel Alternative. European Journal of Vascular and Endovascular Surgery. 2016; 52(4): 458 - 465. doi: 10.1016/j.ejvs.2016.05.013
393. Yeung KK, Tangelder GJ, Fung WY, et al. Open surgical repair of ruptured juxtarenal aortic aneurysms with and without renal cooling: Observations regarding morbidity and mortality. J Vasc Surg. 2010; 51(3): 551 - 558. doi: 10.1016/j.jvs.2009.09.051
394. Ambler G, Boyle JR, Cousins C, et al. Early Results of Fenestrated Endovascular Repair of Juxtarenal Aortic Aneurysms in the United Kingdom. Circulation. 2012; 125(22): 2707 - 2715. doi: 10.1161/CIRCULATIONAHA.111.070334
395. Chemelli A, Hugl B, Klocker J, et al. Endovascular Repair of Isolated Iliac Artery Aneurysms. Journal of Endovascular Therapy. 2010; 17(4): 492 - 503. doi: 10.1583/10-3047.1
396. McCready RA, Pairolero PC, Gilmore JC, Kazmier FJ, Cherry KJ, Hollier LH. Isolated iliac artery aneurysms. Surgery. 1983; 93(5): 688 - 693.
397. Santilli SM, Wernsing SE, Lee ES. Expansion rates and outcomes for iliac artery aneurysms. J Vasc Surg. 2000; 31(1): 114 - 121. doi: 10.1016/S0741-5214(00)70073-5
398. Fossaceca R, Guzzardi G, Cerini P, et al. Isolated iliac artery aneurysms: a single-centre experience. Radiol Med. 2015; 120(5): 440 - 448. doi: 10.1007/s11547-014-0468-y
399. Huang Y, Gloviczki P, Duncan AA, et al. Common iliac artery aneurysm: Expansion rate and results of open surgical and endovascular repair. J Vasc Surg. 2008; 47(6): 1203 - 1211.e2. doi: 10.1016/j.jvs.2008.01.050
400. KASIRAJAN V. Management of isolated common iliac artery aneurysms. Cardiovascular Surgery. 1998; 6(2): 171 - 177. doi: 10.1016/S0967-2109(97)00136-1
401. Buck DB, Bensley RP, Darling J, et al. The effect of endovascular treatment on isolated iliac artery aneurysm treatment and mortality. J Vasc Surg. 2015; 62(2): 331 - 335. doi: 10.1016/j.jvs.2015.03.027
402. Yang M, Li L, Liu Y, et al. Therapeutic management of isolated internal iliac artery aneurysms. J Vasc Surg. 2020; 72(6): 1968 - 1975. doi: 10.1016/j.jvs.2020.02.038
403. Illuminati G, D'Urso A, Ceccanei G, ![]() MA. Iliac side branch device for bilateral endovascular exclusion of isolated common iliac artery aneurysms without brachial access. J Vasc Surg. 2009; 49(1): 225. doi: 10.1016/j.jvs.2008.05.071
MA. Iliac side branch device for bilateral endovascular exclusion of isolated common iliac artery aneurysms without brachial access. J Vasc Surg. 2009; 49(1): 225. doi: 10.1016/j.jvs.2008.05.071
404. Giaquinta A, Ardita V, Ferrer C, et al. Isolated Common Iliac Artery Aneurysms Treated Solely With Iliac Branch Stent-Grafts: Midterm Results of a Multicenter Registry. Journal of Endovascular Therapy. 2018; 25(2): 169 - 177. doi: 10.1177/1526602818754862
405. Kouvelos GN, Katsargyris A, Antoniou GA, Oikonomou K, Verhoeven ELG. Outcome after Interruption or Preservation of Internal Iliac Artery Flow During Endovascular Repair of Abdominal Aorto-iliac Aneurysms. European Journal of Vascular and Endovascular Surgery. 2016; 52(5): 621 - 634. doi: 10.1016/j.ejvs.2016.07.081
406. Светликов А.В., Мельников М.В., Хардиков И.Е., Мельников В.М., Винничук С.А. Хирургическое лечение больного с гигантской аневризмой внутренней подвздошной артерии. Кардиология и сердечно-сосудистая хирургия. 2016; 9(2): 71 - 73.
407. Баженова Ю.В., Дрантусова Н.С., Шантуров В.А., Подашев Б.И. Компьютерная томография в диагностике аневризм аорты. Сибирский медицинский журнал (Иркутск). 2014; 130(7): 37 - 41.
408. Gallitto E, Sobocinski J, Mascoli C, et al. Fenestrated and Branched Thoraco-abdominal Endografting after Previous Open Abdominal Aortic Repair. European Journal of Vascular and Endovascular Surgery. 2020; 60(6): 843 - 852. doi: 10.1016/j.ejvs.2020.07.071
409. Вахненко Ю.В., Домке А.П., Доровских И.Е., Поляков Д.С. АКТУАЛЬНЫЕ АСПЕКТЫ ДИАГНОСТИКИ АНЕВРИЗМЫ АОРТЫ. Амурский медицинский журнал. 2021; 1: 23 - 33.
410. Simonte G, Parlani G, Farchioni L, et al. Lesson Learned with the Use of Iliac Branch Devices: Single Centre 10 Year Experience in 157 Consecutive Procedures. European Journal of Vascular and Endovascular Surgery. 2017; 54(1): 95 - 103. doi: 10.1016/j.ejvs.2017.03.026
411. Noel-Lamy M, Jaskolka J, Lindsay TF, Oreopoulos GD, Tan KT. Internal Iliac Aneurysm Repair Outcomes Using a Modification of the Iliac Branch Graft. European Journal of Vascular and Endovascular Surgery. 2015; 50(4): 474 - 479. doi: 10.1016/j.ejvs.2015.05.021
412. Zhang H, Yang Y, Kou L, Sun H, Chen Z. Effectiveness of collateral arteries embolization before endovascular aneurysm repair to prevent type II endoleaks: A systematic review and meta-analysis. Vascular. 2022; 30(5): 813 - 824. doi: 10.1177/17085381211032764
413. Samura M, Morikage N, Otsuka R, et al. Endovascular Aneurysm Repair With Inferior Mesenteric Artery Embolization for Preventing Type II Endoleak. Ann Surg. 2020; 271(2): 238 - 244. doi: 10.1097/SLA.0000000000003299
414. Li Q, Hou P. Sac Embolization and Side Branch Embolization for Preventing Type II Endoleaks After Endovascular Aneurysm Repair: A Meta-analysis. Journal of Endovascular Therapy. 2020; 27(1): 109 - 116. doi: 10.1177/1526602819878411
415. Kontopodis N, Galanakis N, Kiparakis M, et al. Pre-Emptive Embolization of the Aneurysm Sac or Aortic Side Branches in Endovascular Aneurysm Repair: Meta-Analysis and Trial Sequential Analysis of Randomized Controlled Trials. Ann Vasc Surg. 2023; 91: 90 - 107. doi: 10.1016/j.avsg.2022.10.027
416. Вахитов Д., Суоминен В., Корхонен Дж., Куорилехто Т., Салениус Дж.-П. Эндоваскулярное лечение больного с микотическими аневризмами брюшной аорты и нижней брыжеечной артерии. Ангиология и сосудистая хирургия. 2016; 22(1): 83 - 85.
417. ![]() BT, Wegener OR, Grabitz K, Pillny M, Thomas L, Sandmann W. Mycotic aneurysms of the thoracic and abdominal aorta and iliac arteries: Experience with anatomic and extra-anatomic repair in 33 cases. J Vasc Surg. 2001; 33(1): 106 - 113. doi: 10.1067/mva.2001.110356
BT, Wegener OR, Grabitz K, Pillny M, Thomas L, Sandmann W. Mycotic aneurysms of the thoracic and abdominal aorta and iliac arteries: Experience with anatomic and extra-anatomic repair in 33 cases. J Vasc Surg. 2001; 33(1): 106 - 113. doi: 10.1067/mva.2001.110356
418. Лунева Е.Б., Малев Э.Г., Панкова И.А., Земцовский Э.В. Медикаментозная терапия при аневризме грудного отдела аорты. Артериальная гипертензия. 2018; 24(3): 264 - 271.
419. Luo CM, Chan CY, Chen YS, Wang SS, Chi NH, Wu IH. Long-term Outcome of Endovascular Treatment for Mycotic Aortic Aneurysm. European Journal of Vascular and Endovascular Surgery. 2017; 54(4): 464 - 471. doi: 10.1016/j.ejvs.2017.07.004
420. Лызиков А.А. Применение искусственных протезов в реконструкциях сосудов. Новости хирургии. 2010; 18(4): 135 - 145.
421. Pennell RC, Hollier LH, Lie JT, et al. Inflammatory abdominal aortic aneurysms: a thirty-year review. J Vasc Surg. 1985; 2(6): 859 - 869.
422. Nuellari E, Prifti E, Esposito G, Kuci S, Kapedani E. Surgical treatment of inflammatory abdominal aortic aneurysms: Outcome and predictors analysis. Interv Med Appl Sci. 2014; 6(3): 104 - 110. doi: 10.1556/imas.6.2014.3.2
423. Cvetkovic S, Koncar I, Ducic S, et al. Early and long-term results of open repair of inflammatory abdominal aortic aneurysms: Comparison with a propensity score-matched cohort. J Vasc Surg. 2020; 72(3): 910 - 917. doi: 10.1016/j.jvs.2019.11.040
424. Paravastu SCV, Ghosh J, Murray D, Farquharson FG, Serracino-Inglott F, Walker MG. A Systematic Review of Open Versus Endovascular Repair of Inflammatory Abdominal Aortic Aneurysms. European Journal of Vascular and Endovascular Surgery. 2009; 38(3): 291 - 297. doi: 10.1016/j.ejvs.2009.05.005
425. Зипунников В.П., Комаров А.В., Сапожников А.Д. Ретроперитонеальный фиброз. Вестник Волгоградского государственного медицинского университета. 2010; 4(36): 7 - 10.
426. Stanson AW, Kazmier FJ, Hollier LH, et al. Penetrating atherosclerotic ulcers of the thoracic aorta: natural history and clinicopathologic correlations. Ann Vasc Surg. 1986; 1(1): 15 - 23. doi: 10.1016/S0890-5096(06)60697-3
427. Georgiadis GS, Antoniou GA, Georgakarakos EI, et al. Surgical or Endovascular Therapy of Abdominal Penetrating Aortic Ulcers and Their Natural History: A Systematic Review. Journal of Vascular and Interventional Radiology. 2013; 24(10): 1437 - 1449.e3. doi: 10.1016/j.jvir.2013.05.067
428. Mariucci EM, Lovato L, Rosati M, Palena LM, Bonvicini M, Fattori R. Dilation of peripheral vessels in Marfan syndrome: Importance of thoracoabdominal MR angiography. Int J Cardiol. 2013; 167(6): 2928 - 2931. doi: 10.1016/j.ijcard.2012.08.001
429. van Ooijen B. Marfan's syndrome and isolated aneurysm of the abdominal aorta. Heart. 1988; 59(1): 81 - 84. doi: 10.1136/hrt.59.1.81
430. Ugwu B, Ardill W, Yiltok S, Momoh J, Lenkop D, Uba F. Marfan's syndrome presenting with abdominal aortic aneurysm: A case for vigilance. West Afr J Med. 2004; 22(1). doi: 10.4314/wajm.v22i1.27990
431. Takayama T, Miyata T, Nagawa H. True abdominal aortic aneurysm in Marfan syndrome. J Vasc Surg. 2009; 49(5): 1162 - 1165. doi: 10.1016/j.jvs.2008.12.007
432. Рудой А.С., Бова А.А. Синдром семейных аневризм и расслоений грудного отдела аорты: генетическая диссекция и дифференциальная диагностика. Медицинские новости. 2015; 3(246): 6 - 12.
433. Хрыщанович В.Я., Третьяк С.И., Климчук И.П., et al. Разрыв аневризм брюшной аорты: прогностические факторы летальности. Новости хирургии. 2013; 21(4): 51 - 56.
434. Brown CR, Greenberg RK, Wong S, et al. Family history of aortic disease predicts disease patterns and progression and is a significant influence on management strategies for patients and their relatives. J Vasc Surg. 2013; 58(3): 573 - 581. doi: 10.1016/j.jvs.2013.02.239
435. van der Linde D, Verhagen HJM, Moelker A, et al. Aneurysm-osteoarthritis syndrome with visceral and iliac artery aneurysms. J Vasc Surg. 2013; 57(1): 96 - 102. doi: 10.1016/j.jvs.2012.06.107
436. Bergqvist D, ![]() M, Wanhainen A. Treatment of Vascular Ehlers-Danlos Syndrome. Ann Surg. 2013; 258(2): 257 - 261. doi: 10.1097/SLA.0b013e31829c7a59
M, Wanhainen A. Treatment of Vascular Ehlers-Danlos Syndrome. Ann Surg. 2013; 258(2): 257 - 261. doi: 10.1097/SLA.0b013e31829c7a59
437. De Rango P, Simonte G, Manzone A, et al. Arbitrary Palliation of Ruptured Abdominal Aortic Aneurysms in the Elderly is no Longer Warranted. European Journal of Vascular and Endovascular Surgery. 2016; 51(6): 802 - 809. doi: 10.1016/j.ejvs.2016.02.007
438. Siracuse JJ, Krafcik BM, Farber A, et al. Contemporary open repair of ruptured abdominal aortic aneurysms. J Vasc Surg. 2017; 65(4): 1023 - 1028. doi: 10.1016/j.jvs.2016.08.115
439. Biancari F, Mazziotti MA, Paone R, Laukontaus S, Venermo M,  M. Outcome after Open Repair of Ruptured Abdominal Aortic Aneurysm in Patients > 80 Years Old: A Systematic Review and Meta-analysis. World J Surg. 2011; 35(7): 1662 - 1670. doi: 10.1007/s00268-011-1103-x
M. Outcome after Open Repair of Ruptured Abdominal Aortic Aneurysm in Patients > 80 Years Old: A Systematic Review and Meta-analysis. World J Surg. 2011; 35(7): 1662 - 1670. doi: 10.1007/s00268-011-1103-x
440. Broos PPHL, 't Mannetje YW, Loos MJA, et al. A ruptured abdominal aortic aneurysm that requires preoperative cardiopulmonary resuscitation is not necessarily lethal. J Vasc Surg. 2016; 63(1): 49 - 54. doi: 10.1016/j.jvs.2015.08.061
441. Conroy DM, Altaf N, Goode SD, Braithwaite BD, MacSweeney ST, Richards T. Use of the Hardman Index in Predicting Mortality in Endovascular Repair of Ruptured Abdominal Aortic Aneurysms. Perspect Vasc Surg Endovasc Ther. 2011; 23(4): 274 - 279. doi: 10.1177/1531003511408737
442. Robinson WP, Schanzer A, Li Y, et al. Derivation and validation of a practical risk score for prediction of mortality after open repair of ruptured abdominal aortic aneurysms in a U.S. regional cohort and comparison to existing scoring systems. J Vasc Surg. 2013; 57(2): 354 - 361. doi: 10.1016/j.jvs.2012.08.120
443. Sharif MA, Arya N, Soong CV, et al. Validity of the Hardman Index to Predict Outcome in Ruptured Abdominal Aortic Aneurysm. Ann Vasc Surg. 2007; 21(1): 34 - 38. doi: 10.1016/j.avsg.2006.08.002
444. Tambyraja AL, Fraser SCA, Murie JA, Chalmers RTA. Validity of the Glasgow Aneurysm Score and the Hardman Index in predicting outcome after ruptured abdominal aortic aneurysm repair. British Journal of Surgery. 2005; 92(5): 570 - 573. doi: 10.1002/bjs.4907
445. Thompson PC, Dalman RL, Harris EJ, Chandra V, Lee JT, Mell MW. Predictive models for mortality after ruptured aortic aneurysm repair do not predict futility and are not useful for clinical decision making. J Vasc Surg. 2016; 64(6): 1617 - 1622. doi: 10.1016/j.jvs.2016.07.121
446. van Beek SC, Reimerink JJ, Vahl AC, et al. Editor's Choice - External Validation of Models Predicting Survival After Ruptured Abdominal Aortic Aneurysm Repair. European Journal of Vascular and Endovascular Surgery. 2015; 49(1): 10 - 16. doi: 10.1016/j.ejvs.2014.10.012
447. Kristmundsson T, Dias N, Resch T, Sonesson B. Morphology of Small Abdominal Aortic Aneurysms Should be Considered before Continued Ultrasound Surveillance. Ann Vasc Surg. 2016; 31: 18 - 22. doi: 10.1016/j.avsg.2015.09.016
448. Maeda K, Ohki T, Kanaoka Y, et al. Current surgical management of abdominal aortic aneurysm with concomitant malignancy in the endovascular era. Surg Today. 2016; 46(8): 985 - 994. doi: 10.1007/s00595-015-1262-8
449. Губанова М.В., Добрынина Л.А., Калашникова Л.А. Сосудистый тип синдрома Элерса-Данло. Анналы клинической и экспериментальной неврологии. 2016; 10(4): 45 - 51.
450. Яицкий Н.А., Бедров А.Я., Цветкова Е.А., Мартыненко Г.И. Хирургическая тактика у больных с аневризмой брюшной аорты в сочетании со злокачественными новообразованиями различной локализации. Вестник хирургии имени И.И. Грекова. 2013; 172(2): 011 - 014.
451. Veraldi GF, Tasselli S, De Manzoni G, Cordiano C. Surgical treatment of abdominal aortic aneurysm with concomitant renal cell carcinoma: a single-centre experience with review of the literature. J Cardiovasc Surg (Torino). 2006; 47(6): 643 - 649.
452. Зеньков А.А., Деркач В.В., Пушков И.Е., et al. Симультанная операция по поводу расслаивающей аневризмы брюшного отдела аорты и рака правой почки T1N0M0. Новости хирургии. 2008; 16(3): 141 - 143.
453. Veraldi GF, Minicozzi AM, Bernini M, Genco B, Tedeschi U. Treatment of abdominal aortic aneurysms associated with pancreatic tumors: personal experience and review of the literature (1967 - 2006). Int Angiol. 2008; 27(6): 539 - 542.
454. Чарчян Э.Р., Абугов С.А., Степаненко А.Б., et al. Сравнительная оценка результатов хирургического и эндоваскулярного методов лечения аневризмы брюшной аорты у пациентов с низкими и средними факторами риска. Патология кровообращения и кардиохирургия. 2015; 19(2): 77 - 83.
455. Zanow J, Leistner Y, Ludewig S, Rauchfuss F, Settmacher U. Unusual course of an abdominal aortic aneurysm in a patient treated with chemotherapy for gastric cancer. J Vasc Surg. 2012; 55(3): 841 - 843. doi: 10.1016/j.jvs.2011.09.005
456. Kouvelos GN, Patelis N, Antoniou GA, Lazaris A, Bali C, Matsagkas M. Management of concomitant abdominal aortic aneurysm and colorectal cancer. J Vasc Surg. 2016; 63(5): 1384 - 1393. doi: 10.1016/j.jvs.2016.01.026
457. Lin PH, Barshes NR, Albo D, et al. Concomitant Colorectal Cancer and Abdominal Aortic Aneurysm: Evolution of Treatment Paradigm in the Endovascular Era. J Am Coll Surg. 2008; 206(5): 1065 - 1073. doi: 10.1016/j.jamcollsurg.2007.12.011
458. Белов Ю.В., Фролов К.Б., Комаров Р.Н., Салех А.З., Чилингариди К.Е. Симультанная операция у больного ложной аневризмой общей подвздошной артерии и раком поджелудочной железы. Хирургия Журнал им. Н.И. Пирогова. 2015; 6: 70 - 71.
459. Feo C V., Portinari M, Tsolaki E, et al. The effect of an Enhanced Recovery Program in elective retroperitoneal abdominal aortic aneurysm repair. J Vasc Surg. 2016; 63(4): 888 - 894. doi: 10.1016/j.jvs.2015.09.060
460. Krajcer Z, Ramaiah V, Huetter M. Fast-track endovascular aneurysm repair: rationale and design of the multicenter Least Invasive Fast-Track EVAR (LIFE) registry. BMC Cardiovasc Disord. 2015; 15(1): 174. doi: 10.1186/s12872-015-0167-1
461. Pasin L, Nardelli P, Landoni G, et al. Enhanced recovery after surgery program in elective infrarenal abdominal aortic aneurysm repair. J Cardiovasc Surg (Torino). Published online 2016.
462. Thompson SG, Ashton HA, Gao L, Buxton MJ, Scott RAP. Final follow-up of the Multicentre Aneurysm Screening Study (MASS) randomized trial of abdominal aortic aneurysm screening. British Journal of Surgery. 2012; 99(12): 1649 - 1656. doi: 10.1002/bjs.8897
463. Surveillance Intervals for Small Abdominal Aortic Aneurysms. JAMA. 2013; 309(8): 806. doi: 10.1001/jama.2013.950
464. Steenberge SP, Caputo FJ, Rowse JW, et al. Natural history and growth rates of isolated common iliac artery aneurysms. J Vasc Surg. 2022; 76(2): 461 - 465. doi: 10.1016/j.jvs.2022.01.022
465. Hartmann-Boyce J, Aveyard P. Drugs for smoking cessation. BMJ. Published online February 23, 2016: i571. doi: 10.1136/bmj.i571
466. Golledge J, Moxon J, Pinchbeck J, et al. Association between metformin prescription and growth rates of abdominal aortic aneurysms. British Journal of Surgery. 2017; 104(11): 1486 - 1493. doi: 10.1002/bjs.10587
467. Graham I. European guidelines on cardiovascular disease prevention in clinical practice: Executive summary. Atherosclerosis. 2007; 194(1): 1 - 45. doi: 10.1016/j.atherosclerosis.2007.08.024
468. Piepoli MF, Hoes AW, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2016; 37(29): 2315 - 2381. doi: 10.1093/eurheartj/ehw106
469. Bahia SS, Vidal-Diez A, Seshasai SRK, et al. Cardiovascular risk prevention and all-cause mortality in primary care patients with an abdominal aortic aneurysm. British Journal of Surgery. 2016; 103(12): 1626 - 1633. doi: 10.1002/bjs.10269
470. Bath MF, Gokani VJ, Sidloff DA, et al. Systematic review of cardiovascular disease and cardiovascular death in patients with a small abdominal aortic aneurysm. British Journal of Surgery. 2015; 102(8): 866 - 872. doi: 10.1002/bjs.9837
471. Randomized trial of the effects of cholesterol-lowering with simvastatin on peripheral vascular and other major vascular outcomes in 20,536 people with peripheral arterial disease and other high-risk conditions. J Vasc Surg. 2007; 45(4): 645 - 654.e1. doi: 10.1016/j.jvs.2006.12.054
472. Mirza TA, Karthikesalingam A, Jackson D, et al. Duplex Ultrasound and Contrast-Enhanced Ultrasound Versus Computed Tomography for the Detection of Endoleak after EVAR: Systematic Review and Bivariate Meta-Analysis. European Journal of Vascular and Endovascular Surgery. 2010; 39(4): 418 - 428. doi: 10.1016/j.ejvs.2010.01.001
473. Fearn S, Lawrence-Brown MMD, Semmens JB, Hartley D. Follow-up after Endovascular Aortic Aneurysm Repair: The Plain Radiograph Has an Essential Role in Surveillance. Journal of Endovascular Therapy. 2003; 10(5): 894 - 901. doi: 10.1177/152660280301000508
474. Karanikola E, Dalainas I, Karaolanis G, Zografos G, Filis K. Duplex Ultrasound versus Computed Tomography for the Postoperative Follow-Up of Endovascular Abdominal Aortic Aneurysm Repair. Where Do We Stand Now? International Journal of Angiology. 2014; 23(03): 155 - 164. doi: 10.1055/s-0034-1387925
475. Zenith flex AAA endovascular graft physician reference manual. Cook Medical.
476. Mestres G, Zarka ZA,  C, Riambau V. Early Abdominal Aortic Endografts: A Decade Follow-up Results. European Journal of Vascular and Endovascular Surgery. 2010; 40(6): 722 - 728. doi: 10.1016/j.ejvs.2010.08.018
C, Riambau V. Early Abdominal Aortic Endografts: A Decade Follow-up Results. European Journal of Vascular and Endovascular Surgery. 2010; 40(6): 722 - 728. doi: 10.1016/j.ejvs.2010.08.018
477. Ayuso JR, de Caralt TM, Pages M, et al. MRA is useful as a follow-up technique after endovascular repair of aortic aneurysms with nitinol endoprostheses. Journal of Magnetic Resonance Imaging. 2004; 20(5): 803 - 810. doi: 10.1002/jmri.20170
478. Habets J, Zandvoort HJA, Reitsma JB, et al. Magnetic Resonance Imaging is More Sensitive than Computed Tomography Angiography for the Detection of Endoleaks after Endovascular Abdominal Aortic Aneurysm Repair: A Systematic Review. European Journal of Vascular and Endovascular Surgery. 2013; 45(4): 340 - 350. doi: 10.1016/j.ejvs.2012.12.014
479. Wanhainen A, Bergqvist D, ![]() M. Measuring the Abdominal Aorta with Ultrasonography and Computed Tomography - Difference and Variability. European Journal of Vascular and Endovascular Surgery. 2002; 24(5): 428 - 434. doi: 10.1053/ejvs.2002.1748
M. Measuring the Abdominal Aorta with Ultrasonography and Computed Tomography - Difference and Variability. European Journal of Vascular and Endovascular Surgery. 2002; 24(5): 428 - 434. doi: 10.1053/ejvs.2002.1748
480. Gargiulo M, Gallitto E, Serra C, et al. Could Four-dimensional Contrast-enhanced Ultrasound Replace Computed Tomography Angiography During Follow up of Fenestrated Endografts? Results of a Preliminary Experience. European Journal of Vascular and Endovascular Surgery. 2014; 48(5): 536 - 542. doi: 10.1016/j.ejvs.2014.05.025
481. Heneghan RE, Starnes BW, Nathan DP, Zierler RE. Renal duplex ultrasound findings in fenestrated endovascular aortic repair for juxtarenal aortic aneurysms. J Vasc Surg. 2016; 63(4): 915 - 921. doi: 10.1016/j.jvs.2015.10.090
482. Bastos  F, Baderkhan H, Verhagen HJM, et al. Early sac shrinkage predicts a low risk of late complications after endovascular aortic aneurysm repair. British Journal of Surgery. 2014; 101(7): 802 - 810. doi: 10.1002/bjs.9516
F, Baderkhan H, Verhagen HJM, et al. Early sac shrinkage predicts a low risk of late complications after endovascular aortic aneurysm repair. British Journal of Surgery. 2014; 101(7): 802 - 810. doi: 10.1002/bjs.9516
483. Bastos  F, van de Luijtgaarden KM, Hoeks SE, et al. Adequate seal and no endoleak on the first postoperative computed tomography angiography as criteria for no additional imaging up to 5 years after endovascular aneurysm repair. J Vasc Surg. 2013; 57(6): 1503 - 1511. doi: 10.1016/j.jvs.2012.11.085
F, van de Luijtgaarden KM, Hoeks SE, et al. Adequate seal and no endoleak on the first postoperative computed tomography angiography as criteria for no additional imaging up to 5 years after endovascular aneurysm repair. J Vasc Surg. 2013; 57(6): 1503 - 1511. doi: 10.1016/j.jvs.2012.11.085
484. Brown LC, Greenhalgh RM, Powell JT, Thompson SG. Use of baseline factors to predict complications and reinterventions after endovascular repair of abdominal aortic aneurysm. British Journal of Surgery. 2010; 97(8): 1207 - 1217. doi: 10.1002/bjs.7104
485. Baderkhan H, Haller O, Wanhainen A, ![]() M, Mani K. Follow-up after endovascular aortic aneurysm repair can be stratified based on first postoperative imaging. British Journal of Surgery. 2018; 105(6): 709 - 718. doi: 10.1002/bjs.10766
M, Mani K. Follow-up after endovascular aortic aneurysm repair can be stratified based on first postoperative imaging. British Journal of Surgery. 2018; 105(6): 709 - 718. doi: 10.1002/bjs.10766
486. Patel MS, Carpenter JP. The value of the initial post-EVAR computed tomography angiography scan in predicting future secondary procedures using the Powerlink stent graft. J Vasc Surg. 2010; 52(5): 1135 - 1139. doi: 10.1016/j.jvs.2010.06.019
487. Bosanquet DC, Wilcox C, Whitehurst L, et al. Systematic Review and Meta-analysis of the Effect of Internal Iliac Artery Exclusion for Patients Undergoing EVAR. European Journal of Vascular and Endovascular Surgery. 2017; 53(4): 534 - 548. doi: 10.1016/j.ejvs.2017.01.009
488. Reijnen MMPJ, de Bruin JL, Mathijssen EGE, et al. Global Experience With the Nellix Endosystem for Ruptured and Symptomatic Abdominal Aortic Aneurysms. Journal of Endovascular Therapy. 2016; 23(1): 21 - 28. doi: 10.1177/1526602815618492
489. Никульников П.И., Ликсунов А.В., Ратушнюк А.В., Влайков Г.Г., Нагребецкий А.А., Северин В.Л. Хирургическое лечение разрыва аневризмы брюшной части аорты. Актуальнi проблеми  медицини: Вiсник
медицини: Вiсник 

 . 2009; 1(25): 322 - 324.
. 2009; 1(25): 322 - 324.
490. Червяков Ю.В., Борисов А.В., Староверов И.Н., Смуров С.Ю. Хирургическая тактика при разрывах аневризмы брюшной аорты. Кардиология и сердечно-сосудистая хирургия. 2013; 6(3): 55 - 58.
491. Червяков Ю.В., Смуров С.Ю. Особенности лечебной тактики при аневризме брюшной аорты. Вестник хирургии имени И.И. Грекова. 2011; 170(5): 57 - 61.
492. Михалев С.А. Диагностика и хирургическая тактика на этапах медицинской помощи у больных с разрывом аневризм брюшной аорты: диссертация на соискание ученой степени канд. мед. наук. Тверская государственная медицинская академия. Published online 2011.
493. Berridge DC, Chamberlain J, Guy AJ, Lambert D. Prospective audit of abdominal aortic aneurysm surgery in the northern region from 1988 to 1992. British Journal of Surgery. 2005; 82(7): 906 - 910. doi: 10.1002/bjs.1800820716
494. Тупикин Р.С., Чибиров К.С., Зебелян А.А., Федорченко А.Н. СЛУЧАЙ УСПЕШНОГО ЭКСТРЕННОГО ЭНДОПРОТЕЗИРОВАНИЯ РАЗОРВАВШЕЙСЯ АНЕВРИЗМЫ БРЮШНОЙ АОРТЫ В СЛОЖНЫХ АНАТОМИЧЕСКИХ УСЛОВИЯХ. Инновационная медицина Кубани. 2021; 1: 56 - 60.
495. Dellagrammaticas D, Baderkhan H, Mani K. Management of Aortic Sac Enlargement Following Successful EVAR in a Frail Patient. European Journal of Vascular and Endovascular Surgery. 2016; 51(2): 302 - 308. doi: 10.1016/j.ejvs.2015.09.003
496. Tiwari S,  ML, Jacobsen BK, et al. CHA2DS2-VASc score, left atrial size and atrial fibrillation as stroke risk factors in the
ML, Jacobsen BK, et al. CHA2DS2-VASc score, left atrial size and atrial fibrillation as stroke risk factors in the  Study. Open Heart. 2016; 3(2): e000439. doi: 10.1136/openhrt-2016-000439
Study. Open Heart. 2016; 3(2): e000439. doi: 10.1136/openhrt-2016-000439
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки или другого конфликта интересов при составлении данных рекомендаций.
Ответственный исполнитель: Светликов Алексей Владимирович, д.м.н., профессор кафедры госпитальной хирургии Санкт-Петербургского государственного университета, Российское общество ангиологов и сосудистых хирургов (Санкт-Петербург)
Ответственный секретарь: Сухоручкин Владислав Александрович. Российское общество ангиологов и сосудистых хирургов (Санкт-Петербург)
Иртюга Ольга Борисовна, д.м.н., заведующая НИЛ врожденных и приобретенных пороков сердца, профессор кафедры кардиологии ФГБУ "НМИЦ им. В.А. Алмазова" (Санкт-Петербург), Российское кардиологическое общество (РКО)
Абугов Сергей Александрович, д.м.н., профессор, член-корреспондент РАН Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению. Российское общество ангиологов и сосудистых хирургов
Акчурин Ренат Сулейманович, академик РАН, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Алексеева Дарья Владимировна, заведующая отделением лучевой диагностики N 1, ассистент кафедры лучевой диагностики и медицинской визуализации ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России (Санкт-Петербург), Российское кардиологическое общество (РКО), Российское общество рентгенологов и радиологов (РОРР)
Алекян Баграт Гегамович, академик РАН, д.м.н., профессор, Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Андрейчук Константин Анатольевич, к.м.н., доцент, Ассоциация сердечно-сосудистых хирургов России, Российское общество ангиологов и сосудистых хирургов,
Аракелян Валерий Сергеевич, д.м.н. профессор, Российское общество ангиологов и сосудистых хирургов
Бабакехян Мэри Вартановна, м.н.с. НИЛ врожденных и приобретенных пороков сердца, ассистент кафедры кардиологии ФГБУ "НМИЦ им. В.А. Алмазова" (Санкт-Петербург), Российское кардиологическое общества (РКО)
Базылев Владлен Владленович, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Балахонова Татьяна Валентиновна, д.м.н., Член Исполкома Российской Ассоциации специалистов ультразвуковой диагностики в медицине (РАСУДМ), Президиум правления Национального общества по изучению атеросклероза (НОА), Российское кардиологическое общество (РКО), Европейская федерация ассоциаций в медицине и биологии (EFSUMB), Всемирная федерации ультразвука в медицине и биологии (WFUMB), Европейское общество кардиологов (ESC)
Басек Илона Владимировна, к.м.н, заведующая отделом лучевой диагностики, доцент кафедры кафедры лучевой диагностики и медицинской визуализации (Санкт-Петербург) РКО, РОРР
Белов Юрий Владимирович, академик РАН, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Бредихин Роман Александрович, д.м.н., Российское общество ангиологов и сосудистых хирургов,
Ванюркин Алмаз Гафурович, научный сотрудник Научно-исследовательского отдела сосудистой и интервенционной хирургии, сердечно-сосудистый хирург (Санкт-Петербург) РКО, АССХ
Вачев Алексей Николаевич, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Виноградов Роман Александрович, д.м.н., доцент, Ассоциация сердечно-сосудистых хирургов России, Российское общество ангиологов и сосудистых хирургов,
Гавриленко Александр Васильевич, академик РАН, академик РАН, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Головюк Александр Леонидович, к.м.н., Российское общество ангиологов и сосудистых хирургов
Гуревич Виктор Савельевич, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов, Национальное общество по изучению атеросклероза
Енькина Татьяна Николаевна, к.м.н., Российская Ассоциация специалистов ультразвуковой диагностики в медицине (РАСУДМ)
Ежов Марат Владиславович, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов. Национальное общество по изучению атеросклероза
Затевахин Игорь Иванович, академик РАН, д.м.н., профессор, президент российского общества хирургов (Москва)
Игнатьев Игорь Михайлович, д.м.н., профессор. Российское общество ангиологов и сосудистых хирургов
Имаев Тимур Имвярович, д.м.н., Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Кавтеладзе Заза Александрович, д.м.н., профессор, Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Калинин Роман Евгеньевич, д.м.н., профессор, член Правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), Ассоциации сердечно-сосудистых хирургов России (АССХ)
Карпенко Андрей Анатольевич, д.м.н., профессор. Российское общество ангиологов и сосудистых хирургов
Комаров Роман Николаевич д.м.н., профессор, Ассоциация сердечно-сосудистых хирургов России
Конради Александра Олеговна, заместитель генерального директора по научной работе ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России, заведующий НИО артериальной гипертензии, заведующий кафедрой организации управления и экономики здравоохранения Института медицинского образования Центра Алмазова, д.м.н., профессор, академик РАН. (Санкт-Петербург) РКО
Лепилин Петр Михайлович, д.м.н., Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Майстренко Дмитрий Николаевич, д.м.н., Российское общество ангиологов и сосудистых хирургов
Максимов Александр Владимирович, д.м.н., Российское общество ангиологов и сосудистых хирургов
Малев Эдуард Геннадиевич, д.м.н., ведущий научный сотрудник НИО некоронарогенных заболеваний сердца, профессор кафедры факультетской терапии с клиникой (Санкт-Петербург) РКО
Матюшкин Андрей Валерьевич, д.м.н., профессор Российское общество ангиологов и сосудистых хирургов
Мельников Михаил Викторович, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Михайлов Игорь Петрович, д.м.н., профессор, Ассоциация сердечно-сосудистых хирургов России, Российское общество хирургов, Российское общество ангиологов и сосудистых хирургов
Поляков Роман Сергеевич, к.м.н., Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Пугина Маргарита Юрьевна, м.н.с. НИЛ врожденных и приобретенных пороков сердца ФГБУ "НМИЦ им. В. А. Алмазова" (Санкт-Петербург) РКО
Пшенников Александр Сергеевич, д.м.н., доцент, Российское общество ангиологов и сосудистых хирургов, Ассоциации флебологов России (АФР)
Сазонов Андрей Борисович, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов,
Сокуренко Герман Юрьевич, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Сорока Владимир Васильевич, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Сучков Игорь Александрович, д.м.н., профессор, член Правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), Ассоциации сердечно-сосудистых хирургов России (АССХ), International Union of Angiology (IUA)
Тимина Ирина Евгеньевна, д.м.н., Российская Ассоциация специалистов ультразвуковой диагностики в медицине (РАСУДМ)
Троицкий Александр Витальевич, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Успенский Владимир Евгеньевич, д.м.н., заведующий НИЛ заболеваний аорты и аортального клапана, доцент кафедры сердечно-сосудистой хирургии ФГБУ "НМИЦ им. В. А. Алмазова" (Санкт-Петербург) РКО, АССХ
Хабазов Роберт Иосифович д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Харазов Александр Феликсович, к.м.н., Российское общество ангиологов и сосудистых хирургов
Хубулава Геннадий Григорьевич, академик РАН, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов. Ассоциации сердечно-сосудистых хирургов России (АССХ)
Чарчян Эдуард Рафаэлович д.м.н., член-корреспондент РАН, профессор, Ассоциация сердечно-сосудистых хирургов России, EACTS (European Association for Cardio-Thoracic Surgery), STS (The Society of Thoracoc Surgeons)
Черная Наталья Ресовна, к.м.н., Российское общество ангиологов и сосудистых хирургов
Чернявский Александр Михайлович, д.м.н., профессор, член-корреспондент РАН Российское общество ангиологов и сосудистых хирургов
Чернявский Михаил Александрович, д.м.н, заведующий Научно-исследовательским отделом сосудистой и интервенционной хирургии, сердечно-сосудистый хирург. (Санкт-Петербург) РКО, АССХ
Чупин Андрей Валерьевич, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
Шломин Владимир Владимирович, к.м.н. член правления Российского общества ангиологов и сосудистых хирургов
Фокин Алексей Анатольевич, д.м.н., профессор, Российское общество ангиологов и сосудистых хирургов
George Geroulakos, (Athens, Greece), European Society for Vascular Surgery
Gustavo Oderich, (USA, Houston) Society for Vascular Surgery, European Society for Vascular Surgery and American Surgical Association.
Lazar Davidovic, (Belgrad, Serbia), European Society for Vascular Surgery
Stephan Haulon, (Paris, France) European Society for Vascular Surgery
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
Целевая аудитория разработанных клинических рекомендаций:
Врач-сердечно-сосудистый хирург;
Врач-хирург;
Врач-кардиолог;
Врач-терапевт участковый;
Врач общей практики (семейный врач).
Студенты медицинских ВУЗов, ординаторы, аспиранты.
Рекомендации основаны на совокупном анализе доказательств, представленных в мировой литературе и полученных в результате клинического применения современных принципов и методов диагностики и лечения варикозной болезни вен нижних конечностей. Основные положения Рекомендаций ранжируются в соответствии с Приказом Министерства здравоохранения РФ от 28 февраля 2019 г. N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации".
Формирование Национальных рекомендаций проводилось на основе рекомендаций ESVS, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ESVS с УУР и УДД. Добавлены классы рекомендаций ESVS = ESC, позволяющие оценить необходимость выполнения тезиса рекомендаций.
Таблица ПА2-1. Классы показаний согласно рекомендациям European Society for Vascular Surgery (ESVS).
Класс рекомендаций ESVS
Определение
Предлагаемая формулировка
I
Доказано или общепризнано, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными
Рекомендовано/показано
II
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения
Целесообразно применять
IIa
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
IIb
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
Можно применять
III
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/не эффективны, а в ряде случаев могут приносить вред.
Не рекомендуется применять
Таблица ПА2-2. Уровни достоверности доказательств согласно рекомендациям European Society for Vascular Surgery (ESVS).
Уровни достоверности доказательств ESVS
A
Данные многочисленных рандомизированных клинических исследований или метаанализов
B
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
C
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Рекомендации подготовлены в соответствии с Методическими рекомендациями по проведению оценки научной обоснованности включаемой в клинические рекомендации информации, ФГБУ "Центр экспертизы и контроля качества медицинской помощи" Министерства здравоохранения Российской Федерации, 2019 г.
Таблица ПА2-3. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица ПА2-4. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица ПА2-5. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными))
Вследствие того, что Российское кардиологическое общество (РКО) входит в состав Европейского общества кардиологов (ЕОК), и члены РКО также являются членами ЕОК, все европейские рекомендации формируются с участием российских экспертов, которые являются соавторами рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов.
В связи с этим, формирование национальных рекомендаций проводилось на основе рекомендаций ЕОК с учетом национальной специфики, особенностей обследования, лечения, доступности той или иной медицинской помощи. По этой причине в ходе разработки российских клинических рекомендаций РКО использованы международные классы показаний рекомендаций, позволяющие оценить необходимость выполнения тезиса рекомендаций и уровни достоверности доказательств данных классов (Таблицы ПА2-6 и ПА2-7).
В тех случаях, когда в европейских рекомендациях отсутствовали классы и уровни доказательности, но по мнению экспертов РКО данные тезисы являлись крайне необходимыми для выполнения или, наоборот, абсолютно не рекомендованы к применению, эксперты РКО, основываясь на правилах формирования классов показаний согласно рекомендациям Европейского общества кардиологов, сами проставляли классы и уровни. В данной ситуации обозначение ЕОК заменено на РКО-классы и уровни, проставленные экспертами РКО.
Кроме того, добавлена новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы ПА2-8, ПА2-9 и ПА2-10), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Таким образом, в тексте клинических рекомендаций, разрабатываемых экспертами РКО, одновременно использованы две шкалы (Таблицы ПА2-6 - ПА2-10).
Таблица ПА2-6. Классы показаний согласно рекомендациям Европейского Общества Кардиологов (ЕОК).
Класс рекомендаций ЕОК
Определение
Предлагаемая формулировка
I
Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными
Рекомендовано/
показано
II
IIa
IIb
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
Целесообразно применять
Можно применять
III
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/неэффективны, а в ряде случаев могут приносить вред.
Не рекомендуется применять
Таблица ПА2-7. Уровни достоверности доказательств согласно рекомендациям Европейского Общества Кардиологов (ЕОК).
Уровни достоверности доказательств ЕОК
A
Данные многочисленных рандомизированных клинических исследований или метаанализов
B
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
C
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Таблица ПА2-8. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица ПА2-9. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица ПА2-10. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества: все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Актуальные инструкции по применению лекарственных препаратов расположены на официальном сайте Минздрава России http://grls.rosminzdrav.ru (http://grls.rosminzdrav.ru/Default.aspx).
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
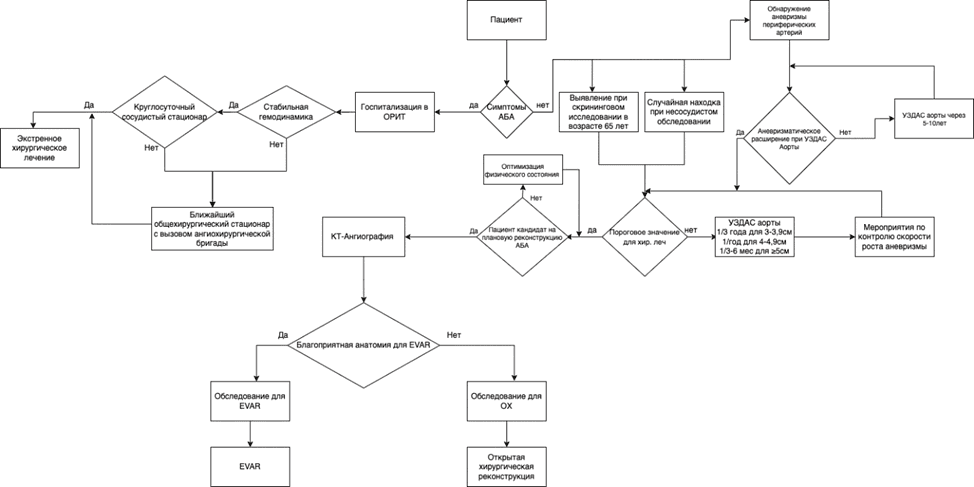
Рисунок ПБ-1. Алгоритм ведения пациента с аневризмой брюшной аорты.
Рисунок ПБ-2. Алгоритм ведения пациентов с абдоминальным компартмент-синдромом после открытого или эндоваскулярного реконструктивного вмешательства по поводу разрыва аневризмы брюшной аорты. ВБД - внутрибрюшное давление.
Рисунок ПБ-3. Алгоритм последующего наблюдения после эндоваскулярной реконструкции аневризмы со стратификацией пациентов на основании результатов первоначального визуализирующего исследования. Всем пациентам должно быть предложено пожизненное последующее наблюдение, включающее в себя проведение КТА брюшной аорты не реже одного раза в 5 лет. При необходимости более частые визуализирующие исследования могут быть выполнены с помощью КТА брюшной аорты или УЗДС аорты в зависимости от цели визуализирующего исследования (для оценки длины участка герметизации и целостности стент-графта эндоваскулярного для абдоминальной аорты*** требуется КТА брюшной аорты, оценка наличия эндоподтекания и размеров аневризматического мешка может быть выполнена с помощью ультразвукового дуплексного сканирования аорты).
Таблица ПБ-1. Предлагаемые диагностические критерии микотической аневризмы аорты [23].
Сочетание следующих факторов:
Клиническая картина
Боль в животе/спине
Лихорадка
Сепсис/шок
Результаты лабораторных и микробиологических исследований
C-реактивный белок ![]()
Лейкоциты ![]()
Положительный результат посева крови или тканей аорты
Результаты визуализации (УЗИ органов брюшной полости (комплексное), КТ-ангиография)
Мешковидный/многодольчатая/эксцентричный
Наличие газа в парааортальной области/образование мягких тканей
Быстрое расширение (дни) и/или разрыв
Атипичная локализация (например, пара-висцеральная) или множественные аневризмы разной локализации
Таблица ПБ-2. Предлагаемые морфологические переменные для оценки исходов эндоваскулярной реконструкции аорты фенестрированным и браншированным стент-графтом
Переменная
Определение
Изменения аневризматического мешка
Значения максимального и минимального диаметра, длины и объема аневризмы должны измеряться по одной и той же методике в одном и том же месте
Увеличение
Увеличение диаметра мешка более чем на 5 мм по сравнению с результатом исходного обследования, выполненного непосредственно до или после (в течение 1 месяца) имплантации стент-графта
Сокращение
Уменьшение диаметра мешка более чем на 5 мм по сравнению с результатом исходного обследования, выполненного непосредственно до или после (в течение 1 месяца) имплантации стент-графта
Стабильность
Изменение диаметра мешка менее чем на 5 мм
Объем
Общий объем аневризмы, измеренный в пределах стенки нативной аорты
Полное разрешение аневризмы
Термин, используемый для описания объема аневризматического мешка < 10% от исходного объема
Классификация эндоподтекания
(Рисунок 7)
Тип IA
Проксимальная зона герметизации в аорте
Тип IB
Дистальная зона герметизации в аорте или подвздошной артерии
Тип IC
Зона герметизации целевого сосуда или окклюдер ветви аорты/подвздошной артерии (например, окклюдер подключичной или подвздошной артерии)
Тип II
Ретроградное эндоподтекание через проходимую боковую ветвь аорты (например, поясничную, межреберную, добавочную почечную артерию или нижнюю брыжеечную артерию)
Тип IIIA
Разъединение или недостаточное сцепление модулей в основном аортальном компоненте протеза, раздвоенном устройстве или удлинительных стентах подвздошных артерий
Тип IIIB
Разрыв ткани протеза аорты
Тип IIIC
Разъединение или неудачное сцепление соединительного стент-графта*** целевого сосуда
Тип IV
Кровоток из пористой ткани эндопротеза аорты менее чем через 30 дней после установки
Неопределенный
Кровоток определяется методами визуализации, но источник не обнаружен
Сложный или смешанный
Выявлены множественные источники эндоподтекания (например, тип I и тип III)
Смещение
Перемещение более чем на 10 мм в проксимальном или дистальном направлении
Таблица ПБ-3. Краткий обзор методов консервативного лечения при внутрибрюшной гипертензии/абдоминальном компартмент-синдроме.
Оптимизация тонуса брюшной стенки
Обезболивание (эпидуральная анестезия)
Отказ от применения морфина
Нервно-мышечная блокада (может снизить ВБД на 50%)
Эвакуация внутрипросветного/внутрибрюшного содержимого
Абдоминальная декомпрессия Парацентез с регулируемым удалением перитонеального транссудата (выполняется редко)
Коррекция нарушения водного баланса
Ограничение объема интенсивной инфузионно-трансфузионной реанимации и солевых растворов Цельная кровь и кровезаменители и препараты плазмы крови (20% альбумин**) Диуретики (#фуросемид** в начальной дозе 20 мг\сут. перорально с последующей титрацией) [131]
Заместительная почечная терапия по показаниям
Поддержка функции органов
Оптимизация искусственной вентиляции легких (PEEP)
Адренергические и дофаминергические средства (АПД > 60 мм рт. ст.)
ВБГ - внутрибрюшная гипертензия; АКС - абдоминальный компартмент-синдром; ВБД - внутрибрюшное давление; PEEP - положительное давление в конце выдоха (positive end expiratory pressure); АПД - абдоминальное перфузионное давление.
Таблица ПБ-4. Методы визуализации, применимые для выявления осложнений эндоваскулярной реконструкции аневризмы и используемые при последующем наблюдении (с изменениями по материалам Dellagrammaticas и соавт. [495]).
Метод визуализации
РБП
УЗДС аорты
КУ-УЗДС аорты
КТ
КТА аорты
МРА аорты
ПЭТ-КТ
Выявление возможного осложнения ЭЛАБА
Увеличение аневризматического мешка
Нет
Да
Да
Да
Да
Да
Да
Эндоподтекание
Нет
Да
Да
Нет
Да
Да
Нет
Зона герметизации и перекрытие компонентов
Да
Ограничено
Ограничено
Да
Да
Нет
Да
Миграция
Да
Ограничено
Ограничено
Да
Да
Нет
Да
Перегиб или окклюзия ответвления
Нет
Да
Да
Перегиб
Да
Да
Перегиб
Инфицирование стент-графта
Нет
Ограничено
Ограничено
Ограничено
Да
Да
Да
Риски
Ионизирующее излучение
Ни один из известных
Ни один из известных
Ионизирующее излучение
Ионизирующее излучение. контраст-индуцированное острое повреждение почек.
Риск нефрогенного системного фиброза, если рСКФ < 30
Ионизирующее излучение
Технические аспекты
Воспроизводимость затруднена из-за изменения положения пациента
Зависит от специалиста, проводящего исследование, и пациента
Как и для УЗДС
Отсутствуют
артериальная фаза сканирования и отсроченное сканирование на 60 с
Не подходит для пациентов с ферромагнитными стентами и кардиостимуляторами.
Артефакты.
Неспецифические маркеры воспаления/пролиферации клеток, риск ложноположительных результатов.
Подходит в качестве единственного метода при последующем наблюдении после ЭЛАБА
Нет, в сочетании с УЗДС/КУ-УЗДС
Нет, в сочетании с КТА или РБП +/- КУ-УЗДС
Нет, в сочетании с КТА или РБП
Нет, в сочетании с УЗДС/КУ-УЗДС
Да
Нет, в качестве дополнения к КТ/РБП + УЗДС/КУ-УЗДС
Нет, только при подозрении на инфицирование
ЭЛАБА - эндоваскулярное лечение аневризмы брюшной аорты; РБП - обзорная рентгенография органов брюшной полости; УЗДС аорты - ультразвуковое дуплексное сканирование аорты; КУ-УЗДС - ультразвуковое дуплексное сканирование аорты с контрастным усилением; КТА - компьютерно-томографическая ангиография брюшной аорты; МРА - магнитно-резонансная ангиография аорты (одна область); рСКФ - расчетная скорость клубочковой фильтрации.
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Следующая часть документа содержит ту же информацию, но она представлена в формате для лиц, не являющихся специалистами. Подробные сведения о процессе, использованном для разработки этой информации, и об уровне доказательности данных для каждой части информации, приведены в конце настоящего раздела. В случае наличия данных очень высокого уровня доказательности в отношении тактики ведения пациентов с АБА они включены в представленную здесь информацию.
Что такое аневризма брюшной аорты?
Аневризма брюшной аорты - это расширение или раздувание главной артерии тела при прохождении крови через брюшную полость к ногам. Эти аневризмы очень редко возникают в возрасте до 60 лет. Они чаще встречаются у лиц, которые когда-либо курили (текущих или бывших курильщиков), чем у тех, кто никогда не курил. Они также чаще встречаются у мужчин, чем у женщин. В редких случаях аневризма брюшной аорты может быть генетически обусловленной.
Большинство аневризм не вызывают никаких симптомов, и пациенты с аневризмой обычно не знают, что она у них есть, пока она не будет выявлена врачом, при медицинских обследованиях или в случае ее разрыва.
Как диагностируется аневризма брюшной аорты?
Иногда врач обнаруживает аневризму во время осмотра пациента. Однако это ненадежный метод диагностики аневризмы.
В случае подозрения на аневризму брюшной аорты лучшим способом подтвердить диагноз является использование специального вида ультразвукового исследования (УЗИ) - ультразвукового дуплексного сканирования аорты. Это хороший неинвазивный метод обследования аорты в задней части брюшной полости (где чаще всего образуются аневризмы). УЗИ не связано с каким-либо излучением и выполняется быстро и просто. Во многих случаях наличие аневризмы не подозреваются до тех пор, как она не будет диагностирована, и большинство людей, у которых диагностируется аневризма, обычно проходят сканирование по другой причине или в рамках программы скрининга (см. ниже).
Более подробную информацию об аневризме можно получить с помощью компьютерной томографии (КТ). Это включает введение в вашу вену контрастного средства, которое можно увидеть при сканировании. Это контрастное средство четко показывает детали артерий и аневризмы. Это хороший метод для того, чтобы увидеть кровеносные сосуды и части аневризмы, которые не видны при УЗИ (например, части аорты в грудной клетке). Компьютерную томографию чаще всего используют при рассмотрении вопроса о хирургической операции по реконструкции аневризмы, или если ваш врач хочет убедиться, что аневризма не разорвалась. Врач может заподозрить разрыв аневризмы, если у пациента с подтвержденной аневризмой внезапно появляется сильная боль в животе или спине, или происходит потеря сознания.
Как проводится скрининг на аневризму брюшной аорты?
Предложение мужчинам в возрасте 65 лет (или старше) пройти скрининговое УЗИ органов брюшной полости (комплексное) снижает риск смерти от аневризмы, поскольку позволяет обнаружить ее до разрыва. Предложение пройти скрининг действительно способствует увеличению числа пациентов, которым показана хирургическая операция по реконструкции аневризмы, и эти операции намного безопаснее, чем оставить аневризму нетронутой. Было доказано, что скрининг экономически эффективен у мужчин, но в настоящее время нет информации о том, получат ли женщины пользу от скрининга.
Мы рекомендуем предлагать всем мужчинам в возрасте 65 лет пройти однократное ультразвуковое исследование органов брюшной полости (комплексное) на предмет наличия аневризмы брюшной аорты.
Что произойдет, если мне поставят диагноз аневризмы брюшной аорты?
В случае обнаружения аневризмы брюшной аорты вам сообщат, является ли она малой (от 3 см до 5 см) или большой (5 см и больше). Размер аневризмы обычно измеряется при УЗИ органов брюшной полости (комплексное) в переднезаднем направлении. В случае измерения при КТА брюшной аорты размер обычно немного больше, чем при измерении методом УЗИ органов брюшной полости (комплексное). Тем не менее, наиболее важным является измерение при УЗИ органов брюшной полости (комплексное).
Пока аневризма остается малой, она вряд ли вызовет у вас какие-либо проблемы, но вам необходимо будет регулярно контролировать размер аневризмы, даже если предусмотрена периодичность наблюдения один раз в три года для малых аневризм.
Если у меня выявлена аневризма брюшной аорты, каков риск ее разрыва?
Если ваша аневризма является малой, риск ее разрыва крайне низок. Риск разрыва аневризмы возрастает по мере увеличения ее размера. При аневризме диаметром 3,0 см риск ее разрыва в течение одного года составляет примерно один к 2000 (0,005%) для мужчин и один к 500 (0,02%) для женщин. При аневризме диаметром 5,0 см риск составляет примерно один к 150 (0,66%) для мужчин и один к 30 (3,3%) для женщин. Известно, что риск разрыва аневризмы увеличивается при аневризмах диаметром более 5 см, но поскольку большинству пациентов с большими аневризмами предлагается хирургическое вмешательство, неизвестно, каков риск разрыва у пациентов с большими аневризмами. Для аневризм диаметром более 5 см риск составляет примерно один к 10 в год, но он выше для очень больших аневризм.
Что я могу сделать, чтобы остановить рост аневризмы?
На данный момент нет убедительных доказательств того, что какое-либо конкретное вмешательство (лекарственный препарат, диета или физические упражнения) способно остановить рост аневризмы. Однако, если вы курильщик, это способствует более быстрому росту аневризмы. Отказ от курения снижает вероятность быстрого роста аневризмы.
Наличие у меня аневризмы повлияет на другие части моего тела или на мое общее состояние здоровья?
Наличие АБА часто является сигналом, предупреждающим о заболевании других кровеносных сосудов, в том числе тех, которые кровоснабжают сердце. Это не является прямым следствием наличия аневризмы. Просто те же причины, которые вызывают образование аневризмы, например курение, также вызывают патологические изменения в других кровеносных сосудах. В связи с этим ваш врач может порекомендовать вам, в дополнение к улучшению физической формы, принимать один или несколько препаратов для снижения вероятности возникновения проблем с сердцем или инсульта в будущем. Мы рекомендуем назначать препараты, снижающие уровень холестерина (статины), всем лицам с диагнозом АБА с целью снижения риска возникновения других сердечно-сосудистых заболеваний.
Что произойдет, если имеющаяся у меня малая аневризма начнет расти?
Если аневризма растет и становится большой аневризмой, ваш врач, вероятнее всего, порекомендует вам хирургическую операцию по реконструкции аневризмы. У многих пациентов этого не происходит в течение всей жизни. Мы рекомендуем направлять мужчин к врачу-хирургу в случае роста АБА до 5 см или более для рассмотрения вопроса о хирургической операции по реконструкции аневризмы.
У женщин обычно используется диаметр 4,5 см в качестве порогового значения для направления на хирургическую операцию. Некоторые специалисты рекомендуют направлять женщин на операцию при диаметре аневризмы 5,0 см. В настоящее время нет никаких доказательств за или против другой рекомендации для женщин, и решение должно приниматься после консультации с вашим врачом или врачом-хирургом. Известно, что у женщин чаще происходит разрыв аневризмы, чем у мужчин, однако у женщин хирургическая операция по реконструкции аневризмы сопряжена с более высокими рисками, чем у мужчин.
Что произойдет, если меня направят к врачу-сердечно-сосудистому хирургу для обсуждения вопроса о хирургической операции?
После того как вас осмотрит врач-сердечно-сосудистый хирург для обсуждения дальнейшей тактики лечения аневризмы брюшной аорты, необходимо рассмотреть главный вопрос относительно того, получите ли вы пользу от проведения хирургической операции. Не каждый пациент с аневризмой брюшной аорты может получить пользу от проведения реконструктивной операции. Это связано с тем, что существуют риски, связанные с хирургической операцией по реконструкции аневризмы брюшной аорты. Если эти риски превышают риск разрыва аневризмы, то хирургическая операция не рекомендуется.
Обычно проводится два вида хирургической операции: открытая и эндоваскулярная (минимально инвазивная) операция. Мы рекомендуем, чтобы у пациентов, подходящих как для открытой, так и для эндоваскулярной реконструкции, выбор вида хирургической операции основывался на личных предпочтениях пациента. Это решение должно быть принято после консультации с врачом-сердечно-сосудистым хирургом. У пациентов, подверженных несколько более высокому риску, чем обычно, из-за наличия других проблем со здоровьем, мы рекомендуем проводить эндоваскулярную реконструкцию.
Для мужчин риск смерти от осложнений во время или сразу после плановой хирургической операции составляет примерно 1 к 25 (4%) при открытой реконструкции и 1 к 140 (0,7%) при эндоваскулярной реконструкции. Риски, связанные с хирургической операцией, выше у женщин: примерно 1 к 15 (6,9%) при открытой реконструкции и 1 к 55 (1,8%) при эндоваскулярной реконструкции.
Как проводится хирургическая операция по реконструкции аневризмы брюшной аорты?
Открытая операция по реконструкции аневризмы брюшной аорты проводится через большой разрез брюшной стенки. Выделяют аорту в задней части брюшной полости и временно останавливают кровоток через аорту. Затем вместо пораженного аневризмой участка вшивается сосудистый протез и восстанавливается кровоток через аорту.
Эндоваскулярная операция проводится через небольшие разрезы в паховой области. Под рентгенологическим контролем сосудистый протез с пружинным каркасом (также называемый стентом) вводят в аорту через артерии в паховой области.
После того как протез установлен на нужное место, он раскрывается. Часто требуется имплантация трех или четырех компонентов протеза, но после завершения этой процедуры эндопротез снимает напряжение со стенки аневризмы. Не все пациенты подходят для проведения эндоваскулярной реконструкции аорты. Один из аспектов, которые врачи-хирурги оценивают при осмотре пациентов с аневризмами брюшной аорты - это их пригодность к эндоваскулярной реконструкции. Приблизительно 70 - 80% пациентов с аневризмами подходят для эндоваскулярной реконструкции.
Какие основные преимущества и недостатки открытой и эндоваскулярной реконструкции аневризмы брюшной аорты?
Основным преимуществом эндоваскулярной реконструкции по сравнению с открытой реконструкцией является сокращение сроков госпитализации для хирургической операции и снижение риска, связанного с операцией. Основным недостатком эндоваскулярной реконструкции является то, что после операции вам необходимо будет наблюдаться у вашего врача-хирурга, чтобы убедиться, что эндопротез не смещается и не протекает. Некоторым пациентам в будущем потребуется дополнительная хирургическая операция для замены или предотвращения отказа эндопротеза, и с течением времени это создает дополнительные риски. При сравнении групп пациентов, которым проводилась открытая и эндоваскулярная реконструкция аневризмы, в течение длительных периодов времени (лет) риски сопоставимы. В рамках мониторинга после хирургической операции иногда требуется проведение КТ, при которой используется рентгеновское излучение, и это связано с очень небольшим теоретическим риском развития злокачественного новообразования и заболевания почек. Раньше многие врачи-хирурги считали, что нет необходимости наблюдать пациентов после завершения восстановительного периода после открытой операции. Это считалось одним из преимуществ открытой операции, и поэтому многие пациенты отдавали предпочтение проведению открытой операции. Однако наша рабочая группа по разработке Российских клинических рекомендаций, представленная ведущими отечественными и иностранными экспертами в области лечения аневризм брюшной аорты и подвздошных артерий рекомендует предлагать пациентам регулярные обследования брюшной полости после реконструкции аневризмы брюшной аорты, будь то эндоваскулярная или открытая операция, с целью оценки результативности реконструктивной операции и определения наличия дополнительных новых аневризм соседних артерий.
Что произойдет, если у меня имеются медицинские противопоказания к проведению хирургической операции по реконструкции аневризмы?
Некоторые пациенты имеют повышенные риски, связанные с хирургической операцией по реконструкции аневризмы. К примеру, у лиц с заболеваниями легких или почек, чаще возникают послеоперационные осложнения. Если риск, связанный с хирургической операцией, превышает риск разрыва аневризмы, врачи-хирурги обычно рекомендуют отложить операцию до тех пор, пока аневризма не увеличится, или же вообще отказаться от ее проведения.
Имеются весьма ограниченные данные об оптимальной тактике ведения в случае невозможности устранения медицинских противопоказаний к операции. У пациентов, имеющих медицинские противопоказания, реконструкция аневризмы, вероятнее всего, позволит предотвратить разрыв, но нет никаких доказательств того, что такая операция продлит жизнь. Если вы курильщик, то отказ от курения уменьшит риск роста и разрыва аневризмы.
Если пациент настаивает на проведении хирургической операции по реконструкции аневризмы, средний риск смерти от операции составляет приблизительно 7% (1 к 14 по сравнению с 1 к 50 или 1 к 100 у пациентов, не имеющих медицинских противопоказаний). Следует отметить, что такой средний риск имеется у всех пациентов с медицинскими противопоказаниями. Многие пациенты подвержены более высокому риску, и решение о проведении операции должно приниматься на основе рекомендаций врача-хирурга и врача-анестезиолога-реаниматолога в рамках рассмотрения вопроса о проведении хирургической операции.
Что произойдет, если аневризма разорвется?
Разрыв аневризмы - это состояние, требующее оказания экстренной медицинской помощи. В случае наличия у вас аневризмы при появлении внезапной сильной боли в спине или животе или потере сознания следует немедленно обратиться за медицинской помощью и обязательно сообщить медицинским работникам о наличии у вас аневризмы. К сожалению, многие не выживают после разрыва аневризмы. Тем, кто поступает в больницу, может быть проведена экстренная операция. Такая операция связана с гораздо более высоким риском, чем плановая операция; примерно каждый третий пациент не выживает после операции по поводу разрыва АБА. Многим пациентам, выжившим после операции, требуется много месяцев для восстановления или же они становятся физически недееспособными. Из-за этих рисков некоторые пациенты отказываются от реконструктивной операции при разрыве аневризмы несмотря на то, что почти все пациенты с разрывом аневризмы умирают в течение нескольких дней.
При разрыве аневризмы можно проводить те же операции, что и при плановом хирургическом лечении. На основании последних данных мы рекомендуем эндоваскулярную реконструкцию в качестве метода выбора, когда это возможно, у пациентов с разрывом аневризмы, подходящих для этой операции.
Редкие причины аневризмы брюшной аорты
В большинстве случаев образование аневризмы вызвано сочетанием таких факторов, как генетический фон человека, который предрасполагает определенные группы к образованию АБА, и внешних факторов, таких как курение. Эти факторы в сочетании вызывают нарушение структуры стенки аорты и образование аневризмы. В редких случаях образование аневризмы может быть вызвано другими факторами. Трудно выработать рекомендации по лечению этих редких аневризм, потому что мы, как правило, знаем меньше о заболеваниях, которые являются редкими.
Образование аневризм происходит при некоторых наследственных заболеваниях. В таких случаях лечение обычно проводится специалистами в области клинической генетики в сотрудничестве с врачами-хирургами, если пациенту показана реконструктивная операция на аорте. У большинства из этих пациентов предпочтительнее провести открытую реконструкцию, чем эндоваскулярную реконструктивную операцию.
Большинство редких аневризм, возникающих в более позднем возрасте, развиваются на фоне инфекции, воспаления или других заболеваний аорты. Лечение этих аневризм может отличаться от обычных аневризм, и поэтому приведенные выше рекомендации могут не быть применимы к вам. Если ваш врач считает, что у вас аневризма вызвана одной из таких причин, он скажет вам об этом и разъяснит, какое лечение является наилучшим для вас.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА
ОЦЕНКИ РИСКА ИНСУЛЬТА И СИСТЕМНОЙ ТРОМБОЭМБОЛИИ
У ПАЦИЕНТОВ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ (CHA2DS2-VASC)
Название на русском языке: Шкала оценки риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий
Оригинальное название (если есть): CHA2DS2-VASc Score for Stroke Risk Assessment in Atrial Fibrillation
Источник: [496]
Тип: шкала оценки
Назначение: оценка факторов риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий
Содержание (шаблон):
Таблица Г1. Шкала оценки риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий (CHA2DS2-VASC)
Факторы риска и определения
Начисленные баллы
Комментарий
C
Застойная сердечная недостаточность Клиническая СН или объективные данные за умеренную или тяжелую дисфункцию ЛЖ, или ГКМП
1
Недавний анамнез декомпенсированной СН независимо от ФВ ЛЖ (включая СНнФВ или СНсФВ) или наличие (даже бессимптомное) умеренно-тяжелой систолической дисфункции ЛЖ по данным визуализации; ГКМП повышает риск инсульта, прием ОАК снижает риск инсульта.
H
Гипертензия или прием гипотензивной терапии
1
Артериальная гипертензия может приводить к сосудистым изменениям, которые предрасполагают к инсульту, и адекватный контроль АД со времени может меняться. Оптимальное целевое значение АД, связанное с наименьшим риском ишемического инсульта, смерти и других сердечно-сосудистых исходов 120 - 129 / < 80 мм. рт. ст.
A
Возраст 75 лет и старше
2
Возраст является мощным фактором риска инсульта, и большинство популяционных когорт показывают, что риск увеличивается у пациентов 65 лет и старше. Риск, связанный с возрастом, является континуумом, но из соображений простоты и практичности 1 балл присуждается для возраста 65 - 74 лет и 2 балла для возраста >= 75 лет.
D
Сахарный диабет
Лечение пероральными гипогликемическими препаратами и/или инсулином, или уровень глюкозы в крови натощак > 125 мг/дл (7 ммоль/л)
1
Сахарный диабет является общепризнанным фактором риска инсульта, и в последнее время было выявлено, что риск инсульта связан с продолжительностью сахарного диабета (чем дольше анамнез сахарного диабета, тем выше риск тромбоэмболии) и повреждения органов-мишеней, например, ретинопатии. Сахарный диабет 1-го и 2-го типа связаны с приблизительно одинаковым риском тромбоэмболии у пациентов с ФП, хотя этот риск может быть немного выше у пациентов в возрасте < 65 лет с сахарным диабетом 2 типа по сравнению с пациентами с сахарным диабетом 1 типа.
S
Инсульт
Инсульт, ТИА или тромбоэмболия в анамнезе
2
Перенесенный ранее инсульт, системная эмболия или ТИА ассоциированы с более высоким риском ишемического инсульта, поэтому оцениваются в 2 балла. Несмотря на то, что пациенты с ФП и ВЧК (включая геморрагический инсульт) исключаются из РКИ, они имеют крайне высокий риск последующего ишемического инсульта, и недавние наблюдательные исследования показали, что польза от назначения ОАК превышает риски у этой группы пациентов.
V
Сосудистые заболевания Ангиографически значимое поражение коронарных артерий, перенесенный инфаркт миокарда, поражение периферических артерий или бляшка в аорте
1
Сосудистые заболевания (ЗПА или инфаркт миокарда) сопряжены с 17 - 22% повышенным риском, особенно у пациентов азиатского происхождения. Значимое поражение коронарных артерий по данным ангиографии является независимым фактором риска ишемического инсульта у пациентов с ФП. Сложная бляшка в нисходящей аорте, индикатор серьезного сосудистого заболевания, также является мощным предиктором ишемического инсульта.
A
Возраст 65 - 74 года
1
Недавние данные из Азии показали, что риск инсульта может увеличиваться в возрасте 50 - 55 лет и выше, и у пациентов азиатского происхождения можно использовать модифицированную шкалу CHA2DS2-VASc
Sc
Категория пола (женский)
1
Скорее модификатор риска инсульта, а не фактор риска.
Максимальный балл
9
Примечание: АД - артериальное давление, ВЧК - внутричерепное кровотечение, ГКМП - гипертрофическая кардиомиопатия, ЗПА - заболевания периферических артерий, ОАК - оральные антикоагулянты, ЛЖ - левый желудочек, РКИ - рандомизированное клиническое исследование, СН - сердечная недостаточность, СНнФВ - сердечная недостаточность с низкой фракцией выброса, СНсФВ - сердечная недостаточность с сохранной фракцией выброса, ТИА - транзиторная ишемическая атака, ФВ ЛЖ - фракция выброса левого желудочка, ФП - фибрилляция предсердий.
Ключ (интерпретация): Постоянный прием пероральных антикоагулянтов с целью профилактики ТЭО рекомендован пациентам мужского пола с суммой баллов по шкале CHA2DS2-VASc >= 2 и пациентам женского пола с суммой баллов по шкале CHA2DS2-VASc >= 3.
Назначение пероральных антикоагулянтов с целью профилактики ТЭО рекомендовано мужчинам с CHA2DS2-VASc = 1 и женщинам с CHA2DS2-VASc = 2, принимая во внимание индивидуальные особенности и предпочтения пациента.
Приложение Г2
КЛИНИЧЕСКАЯ СИСТЕМА ОЦЕНКИ СОПУТСТВУЮЩИХ ЗАБОЛЕВАНИЙ
АМЕРИКАНСКОГО ОБЩЕСТВА СОСУДИСТЫХ ХИРУРГОВ (SVS)
Название на русском языке: Клиническая система оценки сопутствующих заболеваний Американского общества сосудистых хирургов (SVS)
Источник: [8, 72, 198]
Тип: шкала оценки
Назначение: оценка факторов риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий
Содержание (шаблон):
Таблица Г2. Клиническая система оценки сопутствующих заболеваний Американского общества сосудистых хирургов (SVS)
Балл
Описание
Вес
Состояние сердца
x 4
0
Симптомы отсутствуют, нормальные результаты эхокардиографии
0
1
Симптомы отсутствуют, но имеется инфаркт миокарда в анамнезе (> 6 месяцев), скрытый инфаркт миокарда по данным электрокардиографии или фиксированный дефект по данным дипиридамол-таллиевой перфузионной сцинтиграфии или аналогичного метода
4
2
Любой из следующих критериев: стабильная стенокардия; отсутствие стенокардии с наличием выраженного обратимого дефекта перфузии по данным дипиридамол-таллиевой перфузионной сцинтиграфии; выраженная скрытая ишемия (1% времени) при холтеровском мониторировании; фракция выброса 25 - 45%; контролируемая эктопия или бессимптомная аритмия; наличие в анамнезе застойной сердечной недостаточности, хорошо компенсированной в настоящее время
8
3
Любой из следующих критериев: нестабильная стенокардия; симптоматическая или недостаточно контролируемая эктопия/аритмия (хроническая/рецидивирующая); недостаточно компенсированная застойная сердечная недостаточность; фракция выброса < 25%; инфаркт миокарда в предыдущие 6 месяцев
12
Состояние легких
x 2
0
Симптомы отсутствуют, нормальные результаты прицельной рентгенографии органов грудной клетки, результаты легочных функциональных проб в пределах 20% от расчетных значений
0
1
Симптомы отсутствуют или слабая одышка при физической нагрузке, слабые хронические паренхиматозные изменения на рентгенограмме, результаты легочных функциональных проб 65 - 80% от расчетных значений
2
2
Критерии в интервале от 1 до 3 баллов
4
3
Жизненная емкость легких < 1,85 л, ОФВ1 < 1,2 л или < 35% от расчетного значений, максимальная произвольная вентиляция < 50% от расчетного значения, PCO2 > 45 мм рт. ст., дополнительная ингаляция кислорода по медицинским показаниям, наличие легочной гипертензии
6
Состояние почек
x 2
0
Отсутствие диагностированных заболеваний почек, нормальная концентрация креатинина в сыворотке крови
0
1
Умеренное повышение концентрации креатинина, до 2,4 мг/дл
2
2
Концентрация креатинина 2,5 - 5,9 мг/дл
4
3
Концентрация креатинина > 6,0 мг/дл, диализ или трансплантация почки
6
Артериальная гипертензия
x 1
0
Отсутствует (пороговый уровень, диастолическое давление обычно < 90 мм рт. ст.)
0
1
Контролируется одним препаратом
1
2
Контролируется двумя препаратами
2
3
Для контроля требуется более двух препаратов, или не контролируется
3
Возраст
x 1
0
< 55 лет
0
1
55 - 69 лет
1
2
70 - 79 лет
2
3
> 80 лет
3
Суммарно
30
Модифицированная система оценки, разработанная Vascular Study Group of New England
Тип реконструкции
0
ЭЛАБА
1
Открытая хирургическая реконструкция с инфраренальным пережатием
2
Открытая хирургическая реконструкция с супраренальным пережатием
Диаметр аневризмы
0
< 65 мм
1
>= 65 мм
Возраст
0
<= 75 лет
1
> 75 лет
Пол
0
Мужской
1
Женский
Сопутствующие заболевания
1
Инфаркт миокарда
2
Хроническая обструктивная болезнь легких
0
Концентрация креатинина в сыворотке крови < 1,5 мг/дл
1
Концентрация креатинина в сыворотке крови 1,5 - 2,0 мг/дл
2
Концентрация креатинина в сыворотке крови >= 2 мг/дл
Прогнозируемый риск смертности
Суммарная оценка
Смертность, %
0 - 4
Низкий риск
0,12 - 1
5 - 7
Промежуточный риск
1,7 - 4,9
8 - 10
Высокий риск
8 - 20
>= 11
Чрезвычайно высокий риск
31 - 70
Примечание: ЭЛАБА - эндоваскулярное лечение аневризмы брюшной аорты; ОФВ1 - объем форсированного выдоха за 1 секунду; Pco2 - парциальное давление углекислого газа.
Ключ (интерпретация): Методика расчета: сумма (балл * вес) для каждой системы органов = балл для суммарной оценки.
0 - 4 балла - низкий прогнозируемый риск смертности
5 - 7 баллов - промежуточный прогнозируемый риск смертности
8 - 10 баллов - высокий прогнозируемый риск смертности
>= 11 баллов - чрезвычайно высокий прогнозируемый риск смертности
