"Клинические рекомендации "Мезотелиома плевры, брюшины и других локализаций"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
МЕЗОТЕЛИОМА ПЛЕВРЫ, БРЮШИНЫ И ДРУГИХ ЛОКАЛИЗАЦИЙ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C45, C38.4, D20.1, D38.2, D48.4
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 497_2
Возрастная категория: Взрослые
Специальность: Онкология
Разработчик клинической рекомендации
Ассоциация онкологов России, Общероссийская общественная организация "Российское общество клинической онкологии"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
** - жизненно необходимые и важнейшие лекарственные препараты
AJCC - American Joint Committee on Cancer
AUC - площадь под фармакокинетической прямой для расчета дозы карбоплатина**
ECOG - Восточная объединенная группа онкологов
PD-L1 - лиганд 1 типа к мембранному белку запрограммированной клеточной смерти
АФП - альфа-фетопротеин
ВБП - выживаемость без прогрессирования
ВОЗ - Всемирная организация здравоохранения
ДЛТ - дистанционная лучевая терапия
ИГХ - иммуногистохимия
ИТ - иммунотерапия
КТ - компьютерная томография
МП - мезотелиома плевры
МБ - мезотелиома брюшины
МРТ - магнитно-резонансная томография
ОВ - общая выживаемость
мОВ - медиана общей выживаемости
ПЭТ-КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП
ЭПП - экстраплевральная пневмонэктоми
Термины и определения
Плевроцентез - это пункция плевральной полости.
Плевродез - это облитерация плевральной полости.
Лапароцентез - это малоинвазивная лечебно-диагностическая хирургическая манипуляция в виде пункции и дренирования брюшной полости с эвакуацией жидкости из нее (Дренирование брюшной полости под контролем ультразвукового исследования).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Мезотелиома - эпителиальная злокачественная опухоль, развивающаяся из мезотелиальных клеток, выстилающих естественные полости организма и характеризующаяся поражением париетальной, висцеральной плевры, брюшины, перикарда и оболочек яичка.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Чаще встречается поражение плевры (80 - 90%), на втором месте - поражение брюшины (15 - 20%), а мезотелиома перикарда и оболочек яичка составляет не более 1% [1]. В этиологии мезотелиомы плевры (далее - МП) основную роль играет контакт с асбестом. Риск развития МП в 300 раз чаще лиц, контактирующих с асбестом. Латентный период между первым контактом с асбестом и возникновением опухоли обычно составляет 30 - 40 лет. Наиболее часто заболевание диагностируется в возрасте 60 - 70 лет [2 - 4]. Также в литературе имеются указания на вирусную природу болезни (вирус SV-40), влияние ионизирующего излучения (описаны случаи развития мезотелиомы плевры через 20 - 30 лет после лучевой терапии лимфогранулематоза) и генетическую предрасположенность [5 - 8]. Для мезотелиомы других локализаций таких причинно-следственных связей не доказано.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Частота встречаемости заболевания мезотелиомой среди населения в разных регионах мира весьма неоднородна. В 2022 г. в мире зарегистрировано 30 870 новых случаев [9]. Частота выявления мезотелиомы в США и Канаде отлична от Австралии, Франции и Великобритании, где количество заболевших значительно выше и продолжает увеличиваться [10 - 13]. В Европе частота возникновения МП составляет 18 - 20 случаев на миллион в год с большой территориальной вариацией. В Японии - 7:1 000 000 жителей в год. Пик заболеваемости ожидается в 2020 - 2025 гг. Мужчины болеют значительно чаще, соотношение полов составляет 6: 1 [4]. В Российской Федерации вопросу эпидемиологии мезотелиом не уделяется должного внимания. Статистических данных по заболеваемости и смертности нет [14, 15].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
По Международной классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра мезотелиома кодируется в соответствии с локализацией первичного поражения [16].
Мезотелиома (C45):
- C45.0 Мезотелиома плевры;
- C45.1 Мезотелиома брюшины;
- C45.2 Мезотелиома перикарда;
- C45.7 Мезотелиома других локализаций;
- C45.9 Мезотелиома неуточненная.
Злокачественные новообразования сердца, средостения и плевры (C38):
- C38.4 Злокачественное новобразование плевры
Новообразования неопределенного или неизвестного характера среднего уха, органов дыхания и грудной клетки (D38):
- D38.2 Новообразование неопределенного или неизвестного характера: плевры
Доброкачественное новообразование мягких тканей забрюшинного пространства и брюшины (B20):
- D20.1 Доброкачественное новообразование: брюшины
Новообразование неопределенного или неизвестного характера других и неуточненных локализаций (D48):
- D48.4 Новообразование неопределенного или неизвестного характера: брюшины
Комментарий: Поскольку мезотелиома это конкретный морфологический тип опухоли, то не всякое новообразование плевры и брюшины может быть кодировано C45. Новообразования могут иметь доброкачественный характер или иметь неизвестный/неуточненный злокачественный потенциал. К примеру, перитонеальная инклюзионная киста (ПИК) брюшины относится к опухолевоподобным заболеваниям (D20). Это доброкачественное кистозное образование брюшной полости или малого таза, возникающее в результате усиленной пролиферативной активности мезотелия. ПИК встречаются у женщин репродуктивного и пременопаузального возраста. Чаще всего лечением пациентов с ПИК занимаются хирурги общей практики и гинекологи. Поскольку ранее ПИК имела альтернативные названия, такие как доброкачественная мезотелиома брюшины, мультикистозная мезотелиома, заболевание расценивалось как злокачественная мезотелиома и ошибочно кодировалось как C45.1. ПИК не имеет злокачественного потенциала, но образование кист может носить рецидивирующий характер, поэтому пациентов направляют к онкологам. Отдельного алгоритма диагностики ПИК нет, так как диагноз устанавливается после получения морфологического заключения чаще всего случайно в процессе лечения по поводу любой иной хирургической патологии в брюшной полости. Именно поэтому лечение ПИК и рассматривается в этих рекомендациях.
Другие неуточненные новообразования плевры и брюшины, не классифицированные как мезотелоима, могут быть рассмотрены как в этих рекомендациях, так и в принципах лечения первичного рака брюшины или опухолей средостения, поскольку единой концепции их лечения нет.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Гистологическая классификация мезотелиомы (МКБ-0)
В международной гистологической классификации ВОЗ 2021 года (5-е издание) появились новые термины и подходы к морфологической диагностике мезотелиом. В первую очередь, принципиальным отличием от классификации 2015 и 2017 гг. стало понимание, что все мезотелиомы злокачественные. Плевральная мезотелиома и мезотелиома перикарда были объединены в одну главу, тогда как ранее мезотелиома перикарда была классифицирована как опухоль сердца. Высокодифференцированная мезотелиальная опухоль более не рассматривается как злокачественная и переходит в разряд предраковых новообразований, однако подход к лечению рассматривается по-прежнему в данных рекомендация. (Thoracic Tumours. WHO Classification of Tumours, 5th Edition, Volume 5. 2021)
Доброкачественные и преинвазивные опухоли
- 9054/0 Аденоматоидная опухоль
- 9052/1 Высокодифференцированная сосочковая мезотелиальная опухоль
- 9050/2 Мезотелиома in situ.
Мезотелиома
- 9050/3 Локализованная мезотелиома
- 9050/3 Диффузная мезотелиома, без дополнительного уточнения
- 9051/3 Саркоматоидная мезотелиома
- 9052/3 Эпителиоидная мезотелиома
- 9053/3 Мезотелиома, бифазная
Стадирование мезотелиомы плевры по TNM
Для определения стадии заболевания используется классификация, предложенная Международной группой по изучению мезотелиомы (IMIG) (AJCC, 8-е изд. - 2017 г.). Стадирование по TNM применимо только к мезотелиоме плевры (табл. 1). Несмотря на то, что выпот в плевральной полости при МП встречается у 40 - 70% пациентов, при стадировании наличие плеврита не учитывается [17, 18].
Первичная опухоль:
- Tx - первичная опухоль не может быть оценена;
- T0 - первичная опухоль не определяется;
- T1 - опухоль ограничена париетальной плеврой на стороне поражения с вовлечением или без вовлечения висцеральной плевры, либо медиастенальной плевры, либо диафрагмальной плевры;
- T2 - опухоль прорастает любую поверхность париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
- инвазия в диафрагмальные мышцы;
- инвазия в подлежащую паренхиму легкого.
- T3 - опухоль локально распространенная, но потенциально резектабельная, прорастает любую поверхность париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
- инвазия во внутригрудную фасцию;
- инвазия в жировую ткань средостения;
- единичный опухолевый узел, прорастающий в мягкие ткани грудной клетки
- поражение перикарда, но без прорастания на всю толщу.
- T4 - местно-распространенный, но технически нерезектабельный процесс. Опухоль прорастает все поверхности париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
- диффузная или многоочаговая инвазия в мягкие ткани грудной клетки с поражением ребер или без него;
- прорастание через диафрагму в брюшину;
- прорастание в любой орган (органы) средостения;
- непосредственное распространение на плевру противоположной стороны;
- прорастание в позвоночник;
- распространение на внутреннюю поверхность перикарда;
- выпот в перикарде с положительной цитологией;
- прорастание в миокард;
- поражение плечевого сплетения.
Регионарные лимфатические узлы:
- Nx - региональные лимфатические узлы не могут быть оценены;
- N0 - нет метастазов в региональных лимфатических узлах;
- N1 - метастазы в бронхопульмональных лимфатических узлах (узле) и/или лимфатических узлах (узле) корня легкого на стороне поражения, медиастинальных лимфатических узлах, включая парастернальные, околодиафрагмальные, перикардиальной клетчатки и интеркостальные на стороне поражения;
- N2 - в надключичных лимфатических узлах (узле) на стороне поражения или противоположной стороне. Контрлатеральные медиастинальные лимфатические узлы.
Отдаленные метастазы:
- M0 - нет отдаленных метастазов;
- M1 - есть отдаленные метастазы (печень, паренхима легких, кости, головной мозг).
Для мезотелиомы брюшины регионарными лимфатическими узлами являются забрюшинные лимфатические узлы. Для мезотелиомы оболочек яичка регионарными лимфатическими узлами являются паховые и подвздошные лимфатические узлы.
Таблица 1. Группировка мезотелиомы плевры по стадиям
Стадия
T
N
M
Ia
1
0
0
Ib
2 - 3
0
0
II
1 - 2
1
0
IIIА
3
1
0
IIIВ
1 - 3
2
0
4
Любая
0
IV
Любая
Любая
1
Для уточнения локализации отдаленного метастатического очага (M) применяют дополнительную градацию:
PUL - легкое PER - брюшная полость
MAR - костный мозг BRA - головной мозг
OSS - кости SKI - кожа
PLE - плевра LYM - лимфатические узлы
ADP - почки SADP - надпочечники
HEP - печень OTH - другие
При клинической оценке распространенности опухолевого процесса перед символами TNM ставится "c", а при патогистологической классификации - "p". Требования к определению категории pT, pN, pM аналогичны таковым для категории cT, vN, vM.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Мезотелиома плевры имеет тенденцию к локорегионарному росту, чаще ограничиваясь гемитораксом. Рост мезотелиомы обычно медленный, поэтому симптомы появляются уже в поздней стадии заболевания. Часто в плевральной полости выявляется жидкость, что, как правило, является первой причиной обращения к врачу. Типичными симптомами болезни являются: одышка и боли на стороне поражения, реже встречаются кашель, осиплость голоса, синдром Горнера, синдром сдавления верхней полой вены. Заболевание не только распространяется на противоположную сторону грудной клетки, но и метастазирует в печень (31,9%), почки и надпочечники (31%), селезенку (10,8%), щитовидную железу (6,9%), головной мозг (3%), кости (3%) [19].
Для мезотелиомы брюшины характерны увеличение живота в объеме за счет асцита и болевой синдром в брюшной полости без четкой локализации, склонность к запорам.
Метастазы мезотелиомы брюшины могут обнаруживаться в регионарных лимфоузлах, легких, печени (чаще по капсуле), кишечнике, яичниках, головном мозге, костном мозге, перикарде и миокарде.
При мезотелиоме оболочек яичка на первый план выходит гидроцеле.
При мезотелиоме перикарда специфических симптомов нет, клиника схожа с хронической сердечной недостаточностью. Беспокоят потеря аппетита, общая слабость, тупые боли в грудной клетке, сухой кашель, анемия, повышение температуры тела, учащенное сердцебиение. Мезотелиома может локализоваться в перикарде или диффузно охватывать сердце. Опухоль может проникать в миокард, предсердия, коронарные пазухи, коронарные артерии и проводящую систему сердца. Может давать метастазы в регионарные лимфатические узлы и легкие (30 - 50%).
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния: патогномоничных симптомов нет.
Скрининговых программ для выявления мезотелиомы не существует. Диагностика мезотелиомы плевры сложная, особенно в плане дифференциального диагноза с метастазами рака молочной железы, легкого, почки, толстой кишки, яичников; с поражением плевры синовиальной саркомой. Мезотелиому брюшины необходимо дифференцировать с канцероматозом брюшины при раке яичников; мезотелиому оболочек яичка - с доброкачественным гидроцеле или герминогенными опухолями.
2.1 Жалобы и анамнез
- Рекомендуется у всех пациентов с подозрением на мезотелиому провести сбор анамнеза и жалоб с целью выявления этиологических факторов и факторов, которые могут повлиять на выбор тактики лечения. Сбор анамнеза при мезотелиоме не отличается от сбора анамнеза при других заболеваниях и соответсвует профессиональным стандартам специальностей по приказу Минздрава России от 07.10.2015 N 700н (ред. от 11.10.2016) "О номенклатуре специальностей специалистов, имеющих высшее медицинское и фармацевтическое образование", в трудовые функции которых входят навыки общения с пациентами [19, 23, 136, 137].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Жалобы и анамнез описаны в разделе "клиническая картина"
2.2 Физикальное обследование
- Рекомендуется у всех пациентов с подозрением на мезотелиому проводить тщательное физикальное обследование, включающее пальпацию органов брюшной полости, аускультацию и перкуссию легких, осмотр наружных половых органов, пальпацию шейно-надключичных, подключичных, шейных, подмышечных и паховых лумфоузлов, согласно общим приципам диагностики внутренних болезней [138, 139, 140].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: особое внимание следует уделять внешнему виду пациентки во время осмотра и оценке состояния тяжести пациентки по версии ВОЗ/ECOG и/или шкале Карновского (Приложение Г2), оценке алиментарного статуса. Также необходимо обратить внимание на температуру тела, болевой синдром, наличие плеврита, асцита. Данные физикального обследования описаны в разделе "клиническая картина"
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам выполнять общий (клинический) анализ крови развернутый как минимальный диагностический объем обследования с целью определения функциональных возможностей организма и выявления негативных явлений (например для диагностики анемии смешанного генеза, лейкоцитоза, тромбоцитоза) [20, 21, 22]
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- Рекомендуется всем пациентам выполнять: анализ крови биохимический общетерапевтический, коагулограмму (ориентировочное исследование системы гемостаза) (характерна коагулопатия с повышенной свертываемостью) для исключения сопутствующей патологии и как минимальный диагностический объем обследования с целью определения функциональных возможностей организма [23, 24, 25, 26]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Для мезотелиомы оболочек яичка не характерно повышение лактатдегидрогеназы
- Рекомендуется всем пациентам выполнять общий (клинический) анализ мочи для выявлений скрытых отклонений инфекционно-воспалительного характера, которые могут послужить поводом провести более тщательное обследование. Этот анализ входит в минимальный диагностический объем обследования [27, 28].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется всем пациентам выполнять определение уровня альфа-фетопротеина и исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови для дифференциального диагноза с герминогенными опухолями и исследование уровня антигена аденогенных раков CA 125 в крови у женщин - с опухолями яичника [29, 30, 31, 32].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Характерно повышение опухолевого маркера CA-125. Для мезотелиомы оболочек яичка не характерно повышение альфа-фетопротеина и бета-хорионического гонадотропина человека.
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам с подозрением на мезотелиому плевры/брюшины или других локализаций выполнить компьютерную томографию (КТ) органов грудной полости и брюшной полости с внутривенным болюсным контрастированием с целью определения распространенности опухолевого процесса, дифференциального диагноза, а также в процессе лечения для оценки эффективности проводимой терапии [33, 34, 35].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: Компьютерная томография - основной метод в диагностике и стадировании мезотелиомы плевры и мезотелиомы брюшины, обладающий высокой чувствительностью и специфичностью при оценке опухолевых изменений по плевре и в легком, плеврита. В то же время КТ обладает низкой чувствительностью и специфичностью в оценке статуса медиастинальных лимфатических узлов.
- Проведение дополнительных методов обследования, таких как сцинтиграфия костей всего тела или магнитно-резонансная томография с контрастированием (выбор зависит от локализации патологического очага и клинических проявлений) рекомендуется при наличии жалоб у пациента или при I - III стадии болезни для исключения отдаленных метастазов перед операцией. Так же МРТ сердца с контрастированием является информативным в диагностике поражения перикарда и миокарда [36, 37, 38, 39, 40].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Магнитно-резонансная томография с контрастированием является методом уточняющей диагностики при оценке местного распространения опухоли. КТ органов грудной полости с в/в болюсным контрастированием и МРТ органов грудной клетки с в/в контрастированием играют важную роль в оценке распространенности опухоли по диафрагме, средостению, верхней части грудной клетки. При неинвазивной стадии очень трудно провести различия между T1 и T2.
- Рекомендуется проведение ПЭТ-КТ с флудезоксиглюкозой [18F] в диагностике поражения плевры и в качестве контроля после проведенного лечения [41, 42].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
2.5 Иные диагностические исследования
Для точного определения гистологического типа опухоли необходимо проведение патолого-анатомического исследования биопсийного (операционного) материала с применением иммуногистохимических методов.
- Рекомендуется при выявлении поражения плевры выполнить торакоскопию с биопсией или при поражении брюшины - диагностическую лапароскопию с биопсией с обязательным патолого-анатомическим исследованием биопсийного (операционного) материала с применением иммуногистохимических методов (ИГХ) для морфологического подтверждения диагноза, определения гистотипа опухоли и выработки адекватной стратегии лечения [23, 42, 43, 44, 45].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: диагностическая торакоскопия является наиболее важным методом диагностики, позволяющим получить необходимое количество материала для последующего патолого-анатомического исследования биопсийного (операционного) материала с применением иммуногистохимических методов и визуально оценить характер изменений по плевре. Для мезотелиомы характерно наличие ряда маркеров. Позитивные маркеры: кальретинин, антиген WT-1, виментин, мезотелин, D2-40, негативные маркеры: TTF-1, клаудин-4, РЭА
По гистологической классификации ВОЗ (1999 г.) злокачественные мезотелиомы делятся на эпителиоидные (до 70%), саркоматоидные (7 - 20%) и смешанные (бифазные, 20 - 25%) [46, 47].
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Хирургическое лечение
Хирургический метод лечения является основным для локализованного процесса и эпителиоидного типа опухоли. Как и при других видах опухолей хирургический метод лечения направлен на удаление опухолевого проявления болезни. Целью циторедукции при мезотелиоме плевры является "максимально возможное макроскопическое удаление" опухоли. Иными словами необходимо удаление всех "видимых" проявлений заболевания. Операция типа R0 представляется сомнительной. Вариантами выбора объема оперативного лечения являются: 1) плеврэктомия/декортикация легкого с медиастинальной лимфаденэктомией с использованием видеоэндоскопических технологий с/без резекцией перикарда +/- диафрагмы с их реконструкцией и 2) экстраплевральная пневмонэктомия (далее - ЭПП) с резекцией легкого, плевры, перикарда и диафрагмы или без нее.
- Рекомендуется пациентам с ранними стадиями эпителиоидной мезотелиомы плевры I - IIIA (без N 2) проведение экстраплевральной пневмонэктомии (далее - ЭПП) с резекцией перикарда и диафрагмы или без нее, которая считается более оптимальной с онкологической точки зрения, хотя и сопряжена с большим числом осложнений и послеоперационной смертности - до 7%. Декортикация в данном случае считается более безопасной (2 - 3% послеоперационных осложнений и смертности). Однако, выбор объема операции зависит от многих факторов в каждом конкретном случае [48, 49, 50, 51, 52, 53].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: саркоматоидный гистологический тип опухоли и поражение лимфатических узлов N 2 являются спорными факторами для хирургического вмешательства. ЭПП с резекцией перикарда и диафрагмы может сопровождаться высокой частотой осложнений и должна выполняться опытными торакальными хирургами. Хирургическое лечение МП проводится при соблюдении критериев отбора, которыми являются: ранняя стадия заболевания и удовлетворительное состояние пациента по ECOG (0 - 1) (Приложение Г).
- Пациентам с мезотелиомой плевры и удовлетворительным функциональным статусом рекомендуется плеврэктомия при любой стадии болезни для купирования постоянного накопления жидкости в плевральной полости, как этап при мультимодальном лечении для достижения максимального лечебного противоопухолевого эффекта и улучшения качества жизни [54, 55].
Уровень убедительности рекомендаций C - (уровень достоверности доказательств - 5).
Комментарии: плеврэктомия не показала увеличения выживаемости по сравнению с расширенной пневмонэктомией, но смогла сократить рецидивы накопления плевральной жидкости лучше, чем плевродез тальком. Париетальная плеврэктомия или плевродез показаны для купирования рецидивирующего плеврита.
- Рекомендуется пациентам при клинически значимом перикардите перикардиоцентез с паллиативной целью [56, 57, 58, 65].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Варианты лечения для контроля злокачественных выпотов перикарда или тампонады должны быть индивидуализированы, чтобы максимально облегчить симптомы болезни. Существует несколько различных методов: чрескожный перикардиоцентез, субксифоидное перикардиальное окно, перикардэктомия или перикардэктомия с помощью торакотомии или видеоторакоскопической перикардэктомии. Дренирование желательно у пациентов с внутриперикардиальным кровотечением и у пациентов со сгустками гемоперикарда, которые делают дренирование иглой (перикардиоцентез) трудным или неэффективным. К сожалению, рецидив выпота в полости перикарда встречается в 21 - 50% случаев [59, 60]
- Рекомендуется пациентам при мезотелиоме оболочек яичка удаление яичка с фрагментом семенного канатика (орхофуникулэктомия) с/без паховой и забрюшинной лимфаденэктомией для увеличения выживаемости пациентов [61].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарии: Локальное иссечение оболочки яичка связано с локальной частотой рецидивов в 36%, и для местного контроля часто требуется односторонний разрез мошонки и влагалищной оболочки с пластикой мошонки (гемискротэктомия), тогда как местный рецидив после орхиэктомии отмечается у 10,5 - 11,5% пациентов. Наиболее распространенным вариантом лечения является хирургическое [62]. Поскольку в большинстве случаев злокачественная мезотелиома яичка диагностируется интраоперационно или в результате патоморфологического исследования удаленных образцов, то в случае первоначально выполненной гемискротэктомии на втором этапе объем оперативного вмешательства расширяют до радикального. Вопрос о необходимости пахово-подвздошной лимфаденэктомии стается дискутабельным [63, 64].
- Рекомендуется пациентам при мезотелиоме перикарда проведение перикардэктомии для паллиативного лечения с целью уменьшения симптомов болезни (затрудненное дыхание, боль в груди, учащенное сердцебиение и усталость) [65].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: При частичной перикардэктомии удаляется пораженная часть оболочки сердца, в то время как при полной перикардэктомии удаляется как можно больший объем пораженной оболочки сердца в пределах здоровых тканей. В некоторых случаях эта процедура может увеличить продолжительность жизни пациента [66].
Комбинированные методы лечения
Вопрос о комбинированной терапии решается индивидуально.
- Рекомендуется пациентам при мезотелиоме брюшины комбинированный подход: оптимальная циторедуктивная операция с интраоперационной внутрибрюшинной химиотерапией в условиях гипертермии (HIPEC) для увеличения продолжительности жизни пациента [67].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: Если у пациента нет сопутствующих заболеваний, которые могут привести к высокому хирургическому риску, и если прогнозируется полная циторедукция или значительный деблокинг, целесообразно применять максимальную циторедукцию (объем операции зависит от степени поражения). Операция должна выполняться опытной хирургической бригадой, при том понимании, что полная циторедукция может потребовать до шести процедур перитонэктомии и множественных висцеральных резекций [68]. Хирургическая бригада должна иметь опыт выработки необходимых интраоперационных суждений относительно различных хирургических маневров, которые могут потребоваться. Хотя степень перитонэктомии в большинстве учреждений ограничена перитонеальными поверхностями, которые поражаются в результате заболевания (селективная перитонэктомия), или же в виде полной париетальной перитонэктомией (систематическая перитонэктомия) [69, 70, 71, 72]. Внутрибрюшная ХТ может быть проведена интраоперационно в виде HIPEC, либо в раннем послеоперационном периоде EPIC (early postoperative intraperitoneal chemotherapy), или в виде норметермической ХТ NIPEC (normothermic intraperitoneal chemotherapy). Хотя в большинстве случаев используется HIPEC. В качестве химиотерапевтических препаратов для HIPEC могут использоваться в монорежиме #цисплатин**, митомицин**, доксорубицин**, #паклитаксел, #оксалиплатин**, #фторурацил**, #иринотекан**, #доцетаксел**, #карбоплатин**. Доза и концентрация препарата рассчитываются в мг/м2 и л/м2. Температура нагревания также различается - от 31 до 44 °C. Длительность перфузии составляет от 30 мин до 2 ч. На сегодняшний день нет согласованной стандартизированной методики HIPEC и дозирования противоопухолевых препаратов для нее. Это дает большой диапазон данных по ОВ после использования HIPEC: от 30 до 92 мес [73] с показателями 5-летней ОВ от 41 до 67% [74].
Оценка лимфатических узлов в областях, которые исследуются хирургическим путем, обычно выполняется некоторыми, но не всеми центрами. Все увеличенные лимфатические узлы должны быть удалены (лимфаденэктомия) и представлены на патолого-анатомическое исследование (патолого-анатомическое исследование биопсийного (операционного) материала лимфоузла). Точные анатомические зоны, которые будут использоваться для лимфаденэктомии, не были четко определены. Группы лимфатических узлов, которые были рекомендованы для гистопатологической оценки, чтобы исключить присутствие вовлеченных брюшных или тазовых лимфатических узлов, включают глубокие эпигастральные лимфатические узлы, внешние подвздошные лимфатические узлы на внутреннем паховом кольце, общие подвздошные лимфатические узлы, лимфатические узлы по ходу желудочно-сальниковых сосудов или доступные лимфатические узлы, присутствующие в средостении непосредственно над верхней поверхностью диафрагмы [75, 76, 77].
- Рекомендуется пациентам при метастатической мезотелиоме плевры возможный комбинированный подход: оптимальная циторедуктивная операция + интраоперационная внутриплевральная гипертермическая химиотерапия для увеличения продолжительности жизни пациента [78].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарии: данный метод лечения позволяет достичь медианы общей выживаемости в 15,4 мес.
3.2. Лучевая терапия
Дистанционная лучевая терапия как самостоятельный метод лечения не улучшает эффективность и не увеличивает выживаемость пациентов мезотелиомой плевры.
При мезотелиоме брюшины ЛТ имеет ограниченные возможности. Данных об эффективности ЛТ (как с лечебной целью, так и адъювантно) при мезотелиоме перикарда или оболочек яичка нет.
- При проведении послеоперационной адъювантной дистанцинной лучевой терапии рекомендуется включить в поле облучения всю париетальную плевру (в случае декортикации легкого), границы хирургических клипс (после пневмонэктомии) и участки с возможными потенциальными остаточными проявлениями с целью получения максимально противоопухолевого эффекта и улучшения качества жизни пациентов [79, 80, 81, 82].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Проведение дистанционной лучевой терапии на лимфатические узлы средостения и надключичных зон не целесообразно. Послеоперационная ДЛТ возможна у пациентов с ECOG 0 - 1, с адекватно сохраненной легочной функцией, при которой пациент не нуждается в кислородотерапии, без признаков почечной недостаточности, при отсутствии отдаленных метастазов.
Таблица 2. Рекомендуемые дозы дистанционной лучевой терапии при мезотелиоме плевры [79, 83 - 88, 127].
Назначение
Суммарная очаговая доза
Разовая доза
Длительность лечения
После операции
После пульмонэктомии (при отсутствии опухолевых клеток в краях резекции)
45 - 54 Гр
1,8 - 2 Гр
5 - 6 недель
После пульионэктомии (при микро-макроскопическом позитивном крае резекции)
54 - 60 Гр
1,8 - 2 Гр
6 - 7 недель
После плеврэктомии (при отсутствии опухолевых клеток в краях резекции)
45 - 50,4 Гр
1,8 - 2 Гр
5 - 6 недель
После плеврэктомии (при микроскопическом позитивном крае резекции)
50 - 54 Гр
1,8 - 2 Гр
5 - 6 недель
Паллиативно
С обезболивающей целью на грудную клетку
20 - 40 Гр
3 - 4 Гр
1 - 2 недели
Метастазы в головном мозге или костях
30 Гр
3 Гр
2 недели
3.3. Лекарственное лечение
При невозможности выполнения оперативного вмешательства при ранней стадии, смешанном или саркоматоидном подтипе и при распространенном опухолевом процессе (IIIB - IV стадии для мезотелиомы плевры) применяется лекарственное лечениие (табл. 3).
- Рекомендуются следующие режимы первой линии:
1. Оптимальный режим лекарственного лечения 1-й линии: пеметрексед** + #цисплатин** (или #карбоплатин**) [89, 90, 141].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2 для #цисплатина** и 3-для #карбоплатина**).
2. Альтернативный режим лекарственного лечения 1-й линии: #гемцитабин** + #цисплатин** [91, 92].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
3. Комбинация режима пеметрексед** + #цисплатин** (#карбоплатин**) + таргетный препрат #бевацизумаб** [93, 94, 95].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2 для #цисплатина** и 4- для #карбоплатина**).
4. Иммунотерапия #ниволумабом** и #ипилимумабом** (особенно предпочтительна для саркоматиодного варианта опухоли) [96].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
5. Комбинация режима пеметрексед** + #цисплатин** (#карбоплатин**) + #пембролизумаб** для эпителиоидного варианта опухоли [103, 104].
Комментарии: В исследовании III фазы MAPS было показано, что добавление #бевацизумаба** к ХТ пеметрекседом** + #цисплатином** улучшило как ВБП (9,2 против 7,3 мес, ОР, 0,61, 95% ДИ 0,50 - 0,75), так и ОВ (18,8 против 16,1 мес, ОР, 0,77, 95% ДИ 0,62 - 0,95), но привело к увеличению токсичности. Добавление #бевацизумаба** к режиму #гемцитабин** + #цисплатин** не улучшило показатели ОВ и ВБП у пациентов с МП [97].
Преимущество ИТ в исследовании CheckMate-743 было отмечено у пациентов с неэпителиоидным гистотипом (мОВ 18,1мес против 8,8 мес в группе с ХТ) и с PD-L1-позитивными (> 1%) опухолями (мОВ 18,0 мес при ИТ против 13,3 месяцев при ХТ)
Медиана ОВ при проведении ИТ при эпителиоидном типе МП составила 18,7 мес против 16,5 месяцев в группе с ХТ. Не получено достоверной разницы между двумя лечебными подходами при PD-L1-негативном варианте (мОВ при ИТ составила 17,3 мес против 16,5 месяцев при ХТ). Эти пациенты не получили явного преимущества от комбинированной иммунотерапии, и, таким образом, химиотерапия пеметрекседом** с соединениями платины, возможно, с добавлением #бевацизумаба**, пока остается разумным вариантом первой линии лечения у них.
Исследование KEYNOTE-483 продемонстрировало статистически значимое улучшение ОВ у пациентов, получавших #пембролизумаб** с химиотерапией, по сравнению с теми, кто получал только химиотерапию. Медиана ОВ составила 17,3 месяца (95% ДИ: 14,4, 21,3) по сравнению с 16,1 месяца (95% ДИ: 13,1, 18,2) (коэффициент риска [HR] 0,79 [95% ДИ: 0,64, 0,98]; p = 0,0162).
Медиана ВБП составила 7,1 месяца (95% ДИ: 6,9, 8,1) против 7,1 месяца (95% ДИ: 6,8, 7,7) в группе #пембролизумаба** плюс химиотерапия и в группе только химиотерапии соответственно (HR 0,80 [95% ДИ: 0,65, 0,99]; p = 0,0194). Подтвержденный объективный эффект составил 52% (95% ДИ: 45,5, 59,0) в группе #пембролизумаба** плюс химиотерапия и 29% (95% ДИ: 23,0, 35,4) в группе только химиотерапии. Медиана длительности ответа составила 6,9 месяца (95% ДИ: 5,8, 8,3) и 6,8 месяца (95% ДИ: 5,5, 8,5) соответственно.
Данные исследования IND.227 свидетельствуют о том, что сочетание #пембролизумаба** и химиотерапии на основе платины улучшает общую выживаемость и выживаемость без прогрессирования заболевания по сравнению с химиотерапией на основе платины только у пациентов с нелеченой неоперабельной плевральной мезотелиомой. Отношение рисков (HR) при сравнении групп составило 0,79 (95% ДИ [0,64, 0,98]; P = .0324). Медиана общей выживаемости для пациентов, получавших химиотерапию и #пембролизумаб**, составила 17,28 месяцев по сравнению с 16,13 месяцами для пациентов в группе, получавшей только химиотерапию. Трехлетняя общая выживаемость в группах, получавших химиотерапию и #пембролизумаб**, и в группах, получавших только химиотерапию, составила 25% и 17% соответственно.
- Рекомендуется: всем пациентам при прогрессировании опухолевого заболевания режимы 2й и последующих линий лечения, указанные в таблице 3 (при условии, что ранее они не применялись) с целью увеличения продолжительности жизни [99, 100, 101, 102, 105, 108].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
Комментарии: Стандартов II и последующих линий не существует. Для мезотелиом других локализаций используются те же режимы лечения, что и для мезотелиомы плевры.
Назначается проведение 6 курсов химиотерапии с последующим динамическим наблюдением. Смена режима химиотерапии должна проводиться только при доказанном прогрессировании заболевания или в случае непереносимости лекарственного лечения. В случае прогрессирования болезни после 6 мес и более от последнего курса химиотерапии желательна реиндукция режима 1-й линии лечения. При раннем прогрессировании (на фоне химиотерапии или менее 6 мес после завершения химиотерапии) назначается вторая линия терапии. Поскольку #гемцитабин** назначается в 1-й и 8-й дни 3-недельного цикла, а пеметрексед** - только в 1-й день 3-недельного цикла, пеметрексед** включает в себя более низкую частоту посещений больницы, что приносит пользу пациентам. Данных о повторном назначении иммунотерапии после длительной ремиссии нет. Алгоритм диагностики и лечения диссеминированной мезотелиомы плевры представлен в приложении Б.
Таблица 3. Наиболее распространенные схемы лекарственного лечения мезотелиомы плевры [89 - 104]
Схемы лечения
Режим химиотерапии
Длительность
Примечание
PemPt [89]
Пеметрексед** 500 мг/м2 в 1-й день
#Цисплатин** 75 мг/м2 в 1-й день
Каждые 21 день. Максимум 6 курсов
Эффективность поддерживающей терапии пеметрекседом** не доказана
PemCarb [90, 141]
Пеметрексед** 500 мг/м2 в 1-й день
#Карбоплатин** AUC-5 в 1-й день
(фактическая доза #карбоплатина** рассчитывается индивидуально, исходя из показателя креатитина в анализе крови пациента накануне проведения лечения)
Каждые 21 день. Максимум 6 курсов
GemPt [91, 92]
#Гемцитабин** 1000 - 1250 мг/м2 в 1, 8 (15) дни
#Цисплатин** 75 мг/м2 в 1-й день
Каждые 21 день. Максимум 6 курсов
-
PemPt
+ Bev
[93, 94]
Пеметрексед** 500 мг/м2 в 1-й день
#Цисплатин** 75 мг/м2 в 1-й день
#Бевацизумаб** 15 мг/кг в 1 день
Каждые 21 день. Максимум 6 курсов
После 6 курсов тройной комбинации проводится поддерживающая терапия #бевацизумабом** каждые 3 недели до прогрессирования или развития непереносимой токсичности
PemCarb
+ Bev
[95]
Пеметрексед** 500 мг/м2 в 1-й день
#Карбоплатин** AUC-5 в 1-й день
(фактическая доза #карбоплатина** рассчитывается индивидуально, исходя из показателя креатитина в анализе крови пациента накануне проведения лечения).
#Бевацизумаб** 15 мг/кг в 1 день
Каждые 21 день. Максимум 6 курсов
После 6 курсов тройной комбинации проводится поддерживающая терапия #бевацизумабом** каждые 3 недели до прогрессирования или развития непереносимой токсичности
Nivo/Ipi
[96]
Ниволумаб** 360 мг в 1-й день каждые 3 нед (допустима доза 240 мг каждые 14 дней или 3 мг/кг каждые 14 дней).
#Ипилимумаб** 1 мг/кг в 1-й день каждые 6 нед
Каждые 21 день или каждые 14 дней в зависимости от дозы.
Максимум 2 года
Режим является приоритетным для неэпителиоидного гистологического типа
Gem [98, 99]
#Гемцитабин ** 1000 - 1250 мг/м2 в/в в 1-й и 8-й дни
Каждые 21 день. Максимум 6 курсов
При невозможности применения соединений платины
Рem [100]
Пеметрексед** 500 мг/м2 в 1-й день
Каждые 21 день. Максимум 6 курсов
При невозможности применения соединений платины
Vin [99, 101, 102]
#Винорелбин** 25 или 30 мг/м2 1 раз в неделю (2, 3-я линия лечения)
Максимум 6 курсов
-
PemPt
+ pembro
[103, 104]
Пеметрексед** 500 мг/м2 в 1-й день
#Цисплатин** 75 мг/м2 в 1-й день (или #Карбоплатин** AUC-5 в 1-й день
(фактическая доза #карбоплатина** рассчитывается индивидуально, исходя из показателя креатитина в анализе крови пациента накануне проведения лечения).
#Пембролизумаб** 200 мг в 1-й день
Каждые 21 день. Максимум 6 курсов
Режим для эпителиоидного гистологического типа.
После 6 курсов тройной комбинации проводится поддерживающая терапия #пембролизумабом** каждые 3 недели до прогрессирования или развития непереносимой токсичности
Nivo
[107 - 111]
#ниволумаб** 360 мг в 1-й день каждые 3 нед (допустима доза 240 мг каждые 14 дней или 3 мг/кг каждые 14 дней).
до прогрессирования или развития непереносимой токсичности, или не более 2 лет Рекомендуется пациентам с мезотелиомой брюшины при наличии MSI-H в качестве II - III линии лечения иммунотерапия #пембролизумабом** 200 мг в/в капельно каждые 3 недели [105, 106].
- Рекомендуется пациентам с мезотелиомой брюшины при наличии MSI-H в качестве II - III линии лечения иммунотерапия #пембролизумабом** 200мг в/в капельно каждые 3 недели [105, 106].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: #Пембролизумаб** зарегистрирован в РФ для солидных опухолей при наличии микросателлитной нестабильности (MSI-high) в опухоли, а при мезотелиоме брюшины этот маркер встречается в 1 - 2% случаев. Эффективность #пембролизумаба** при мезотелиоме перикарда и оболочек яичка не изучалась. Пембролизумаб у больных без MSI-H не показал преимуществ по сравнению с ХТ.
- Рекомендуется всем пациентам в качестве II - III линии лечения комбинированная иммунотерапия #ниволумабом** 3 мг/кг внутривенно капельно каждые 14 дней +/- #ипилимумаб** 1 мг/кг в/в капельно каждые 6 недель при условии, что эта комбинация не применялась в I линии [107, 108, 109, 110, 111].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: также в клинических исследованиях изучалась дозировка #ниволумаба** 240 мг [111].
- Рекомендуется пациентам с эпителиоидной мезотелиомой плевры тримодальная (трехкомпонентная) комбинированная терапия предполагающая 2 - 4 курса предоперационной химиотерапии с последующим хирургическим вмешательством и послеоперационной лучевой терапией [112, 113].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Поскольку ожидается, что хирургическая циторедукция при МП не приведет к резекции R0, показано проводить комбинированную терапию с химиотерапией и/или лучевой терапией. Пациенты с мезотелиомой плевры с трансдиафрагмальным заболеванием, мультифокальной инвазией в грудную стенку или с гистологически подтвержденным поражением контралатеральных средостенных или надключичных лимфатических узлов должны получить неоадъювантную терапию до рассмотрения максимальной хирургической циторедукции; В контексте комплексного лечения, до или после операции можно назначать от четырех до шести циклов химиотерапии; комбинированное лечение позволяет обеспечить медиану общей выживаемости, равную 43,3 мес, и 2-летнюю выживаемость 77%. [114, 115]. Таргетная терапия #бевацизумабом** и иммунотерапия не используются в неоадъювантном режиме.
- Рекомендуется пациентам адъювантная химиотерапия после пульмонэктомии и радикальной плеврэктомии при мезотелиоме плевры с метастазами в л/у (N1), после циторедуктивной перитонэктомии при мезотелиоме брюшины для продления жизни пациентов [116, 117, 118].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Если планируется адъювантная химиотерапия, необходимо убедиться, что пациент сможет пройти это лечение после радикальной операции по поводу мезотелиомы плевры. Химиотерапия после операции должна начаться не позднее, чем через 3 месяца [118]. Если считается, что пациент находится на грани операбельности, например, с плохим состоянием показателей функционального статуса по шкале ECOG, то, может быть, более целесообразным начать лечение с неоадъювантной химиотерапии, учитывая, что функциональный статус будет ухудшаться непосредственно после операции независимо от объема операции.
После орхофуникулэктомии при мезотелиоме оболочек яичка и перикардэктомии при мезотелиоме перикарда вопрос об адъювантной химиотерапии решается индивидуально.
3.4. Обезболивание и диетотерапия
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов с мезотелиомой и хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях "Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи".
3.5. Сопроводительная терапия
Принципы лечения и профилактики тошноты и рвоты у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ТОШНОТЫ И РВОТЫ" [119].
Принципы лечения и профилактики костных осложнений у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "ИСПОЛЬЗОВАНИЕ ОСТЕОМОДИФИЦИРУЮЩИХ АГЕНТОВ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПАТОЛОГИИ КОСТНОИ ТКАНИ ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ" [127].
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "ЛЕЧЕНИЕ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ ФЕБРИЛЬНОЙ НЕЙТРОПЕНИИ И НАЗНАЧЕНИЕ КОЛОНИЕСТИМУЛИРУЮЩИХ ФАКТОРОВ" [128].
Принципы профилактики и лечения гепатотоксичности у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "КОРРЕКЦИЯ ГЕПАТОТОКСИЧНОСТИ" [129].
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ КАРДИОВАСКУЛЯРНОИ ТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВОИ ЛЕКАРСТВЕННОИ ТЕРАПИИ" [130].
Принципы профилактики и лечения кожных осложнений у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕКАРСТВЕННОМУ ЛЕЧЕНИЮ ДЕРМАТОЛОГИЧЕСКИХ РЕАКЦИИ У ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ПРОТИВООПУХОЛЕВУЮ ЛЕКАРСТВЕННУЮ ТЕРАПИЮ" [131].
Принципы нутритивной поддержки у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НУТРИТИВНОИ ПОДДЕРЖКЕ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ" [132].
Принципы профилактики и лечения нефротоксичности у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ НЕФРОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ" [133].
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИИ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ" [134].
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с мезотелиомой соответствуют принципам, изложенным в методических рекомендациях "РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ПОСЛЕДСТВИИ ЭКСТРАВАЗАЦИИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ" [135].
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Реабилитацию необходимо проводить ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии.
Этапы реабилитации после хиругического лечения:
Первый этап реабилитации после хирургического лечения
- Медицинская реабилитация пациента, перенесшего хиругическое лечение по поводу мезетелиомы, включает обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию пациентов в 1-е сутки после операции [142].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: представленная тактика снижает риск ранних послеоперационных осложнений, уменьшает длительность пребывания в стационаре. Ранняя мобилизация с эластической компрессии нижних конечностей способствует профилактике тромбоэмболических осложнений в послеоперационном периоде.
Второй этап реабилитации после хирургического лечения
- Пациентам, перенесшим оперативные вмешательства по поводу мезетелиомы, рекомендуется адекватная физическая активность, проведение аэробных и анаэробных нагрузок, сочетание дыхательных статических и динамических упражнений с целью улучшения показателей внешнего дыхания, повышения общей физической работоспособности, расширения адаптивных возможностей организма, улучшения качества жизни пациентов [143].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Пациентам, перенесшим оперативные вмешательства по поводу мезетелиомы, рекомендуются регулярные занятия лечебной физкультурой, которая улучшает функцию внешнего дыхания, увеличивает выносливость, положительно влияет на психологический статус пациента, уменьшает выраженность тревожности и депрессии, слабости, болевого синдрома, улучшает настроение [144].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: после комбинированного лечения пациенту рекомендована работа с медицинским психологом, проведение релаксации, методы когнитивно-поведенческой терапии снижают симптомы депрессии и тревоги.
Третий этап реабилитации после хирургического лечения
- Пациентам после комбинированного лечения мезетелиомы рекомендуется вести активный образ жизни с возможностью достижения компенсированного функционального состояния, социальной адаптации и предотвращения формирования хронического стрессорного состояния [145].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: Лечебная физкультура и адекватная физическая активность приводят к уменьшению слабости, повышением мобильности пациента, снижают уровень депрессии, улучшают качество жизни и являются профилактикой сердечно-сосудистых и легочных осложнени. Применение методик аудиовизуальной релаксации уменьшает выраженность болевого синдрома, усталости, тревожности, улучшает качество жизни и социальную адаптацию пациента.
Реабилитация при химиотерапии
- Пациентам, с переферической полинейропатией после ХТ, рекомендуется проведение сеансов акупунктуры, которая увеличивает уровни ИЛ-2, CD3+ и CD4+, уменьшает супрессию костного мозга, а также снижает слабость и тошноту, улучшает показатели качества жизни [146].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- При возникновении индуцированной ХТ полинейропатии пациентам рекомендуется выполнять физические упражнения, практиковать лечение ходьбой с целью контроля клинических проявлений полинейропатии [147].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарий: выполнение упражнений на тренировку баланса эффективны для коррекции полинейропатии, чем сочетание упражнений на выносливость и силовых упражнений; регулярное выполнение с пациентом лечебной физкультуры на фоне ХТ снижает частоту развития кардиальных осложнений.
- В комплексном лечении периферической полинейропатии на фоне ХТ пациентам рекомендуется применение по показаниям физиотерапевтических методов лечения: низкоинтенсивной лазеротерапии (внутривенное облучение крови), общей магнитотерапии, чрескожной короткоимпульсной электростимуляции (ЧЭНС) [120, 147].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Для профилактики мукозита полости рта на фоне ХТ пациентам рекомендуется проведение гипотермии локальной [148].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Специфических профилактических мер не существует.
Для обеспечения безопасности на производстве при работе с асбестом применяются нормативные требования и стандарты, применяемые в условиях повышенного содержания пыли. Эти правила регламентируют методы контроля пыли, устанавливают допустимые уровни ее концентрации и предписывают использование определенных мер защиты. Как международные, так и российские стандарты обеспечивают защиту сотрудников, оборудования и окружающей среды от негативного воздействия асбестсодержащей пыли. При работе на асбестдобывающих предприятиях соблюдаются меры индивидуальной защиты от пыли согласно СанПин РФ 2.2.3.757-99 Работа с асбестом. [121].
После проведенного лечения согласно общим принципам проведения онкологического компонента диспансеризации проходить активное динамическое наблюдение с целью выявления ранних признаков прогрессирования заболевания/рецидива: 1-й год - каждые 3 мес, 2-й год - каждые 6 мес с проведением инструментальных исследований [122].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: проводятся следующие диагностические исследования:
1. Общий (клинический) анализ крови, общий (клинический) анализх крови развернутый и анализ крови биохимический общетерапевтический;
2. Компьютерная томография органов грудной полости, компьютерная томография органов малого таза у женщин и компьютерная томография органов таза у мужчин (в зависимости от локализации первичной опухоли и метастазов);
3. Ультразвуковое исследование органов брюшной полости (комплексное) и ультразвуковое исследование лимфатических узлов (одна анатомическая зона);
4. Регистрация электрокардиограммы + эхокардиографии при поражении перикарда.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности проведения в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсии плевры или брюшины, проведения иных диагностических исследований, пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 C81 - C96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее - федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики C37, C38, C40-C41, C45-C49, C58, D39, C62, C69-C70, C72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней - онкология (МКБ-О), 3 издания 8936, 906 - 909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка - национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
- цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- Патолого-анатомическое исследование биопсийного (операционного) материала тканей плевры с применением иммуногистохимических методов, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее - онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Прогностические факторы при мезотелиоме плевры приведены в табл. 4.
Таблица 4. Прогностические факторы при мезотелиоме плевры [123, 124, 125].
Параметр
Благоприятный прогностический фактор
Неблагоприятный прогностический фактор
Возраст
< 75 лет
![]() 75 лет
75 лет
Боль в грудной клетке
Нет
Есть
Число тромбоцитов
<400
![]() 400
400
Гемоглобин
![]() 14,6 г/дл
14,6 г/дл
< 11,2 г/дл
Потеря массы тела
Нет
Есть
ECOG
0
1 - 2
Гистологический вариант
Эпителиоидный
Неэпителиоидный
Пол
Женский
Мужской
Лейкоциты
< 8,3 x 109
![]() 8,3 x 109
8,3 x 109
Точность диагностики
Максимальная
Минимальная
PD-L1
Отрицательный, < 1%
Положительный, ![]() 1%
1%
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Выполнена КТ органов грудной полости (при установлении диагноза)
Да/Нет
2.
Выполнена диагностическая торакоскопия или лапароскопия с биопсией
Да/Нет
3.
Выполнено патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов (ИГХ)
Да/Нет
4.
Выполнено хирургическое вмешательство в объеме, соответствующем указанным в рекомендациях
Да/Нет
5.
Выполнена ДЛТ в объеме, соответствующем указанным в рекомендациях
Да/Нет
6.
Выполнена системная химиотерапия 1-й линии
Да/Нет
7.
Назначена комбинация химиотерапии и таргетной терапии при нерезектабельном опухолевом процессе
Да/Нет
8.
Назначена иммунотерапия при нерезектабельном опухолевом процессе
Да/Нет
Список литературы
1. Mesothelioma Types by Location. Mesothelioma.com. https://www.mesothelioma.com/mesothelioma/types/.Accessed March 12, 2020
2. Carbone M., Kanodia S., Chao A. et al. Consensus Report of the 2015 Weinman International Conference on Mesothelioma. J Thorac Oncol 2016; 11: 1246 - 1262.
3. Linton A., Vardy J., Clarkeet S. et al. The ticking time-bomb of asbestos: Its insidious role in the development of malignant mesothelioma. J Critical Rev Oncol 2012; 84(2): 200 - 212.
4. Asbestos (Chrysotile, Amosite, Crocidolite, Tremolite, Actinolite, and Anthophyllite). Arsenic, Metals, Fibres, and Dusts 100 C. Geneva: WHO Press, 2012. Pр. 219 - 310.
5. Brown L.M., Howard R.A., Travis L.B. The risk of secondary malignancies over 30 years after the treatment of non-Hodgkin lymphoma. Cancer 2006; 107: 2741 - 2742.
6. Teta M.J., Lau E., Sceurman B.K. et al. Therapeutic radiation for lymphoma: risk of malignant mesothelioma. Cancer 2007; 109: 1432 - 1438.
7. Dogan A.U., Baris Y.I., Dogan M. et al. Genetic predisposition to fiber carcinogenesis causes a mesothelioma epidemic in Turkey. Cancer Res 2006; 66,10: 5063 - 5068.
8. Bocchetta M.I., Resta Di, Powers A. et al. Human mesothelial cells are unusually susceptible to simian virus 40-mediated transformation and asbestos co-carcinogenesis. Proc Natl Acad Sci USA 2000; 97: 10214 - 10219.
9. Huang J., Chan S.C., Pang W.S., et al. Global Incidence, Risk Factors, and Temporal Trends of Mesothelioma: A Population Based Study. J Thorac Oncol 2023; 18(6): 792 - 802. https://doi.org/10.1016/j.jtho.2023.01.095
10. Музалевский П.Н., Шойхет Я.Н., Лазарев А.Ф. и др. Мезотелиома. Распространенность и модифицирующие факторы (литературный обзор). Сибирский онкологический журнал 2007; 2(22): 77 - 83.
11. Surveillance, Epidemiology and End Results (SEER)/Cancer Statistics Review 1973 - 1999. Anon (2003). Available at: http://seer.cancer.gov/csr/1973-1999/overview/overview21pdf.
12. Robinson B.M. Malignant pleural mesothelioma: an epidemiological perspective. Ann Cardiothorac Surg 2012; 1: 491 - 496.
13. Hodgson J.T., McElvenny D.M., Darnton A.J. et al. The expected burden of mesothelioma mortality in Great Britain from 2002 to 2050. Br J Cancer 2005; 92: 587 - 593.
14. Лазарев А.Ф., Григорук О.Г., Базулина Л.М. и др. Мезотелиома плевры: этиология, заболеваемость, диагностика, лечение, выживаемость. Российский онкологический журнал 2013; 5: 15 - 20.
15. Горбунова В.А. Характеристика пациентов с мезотелиомой плевры в Российской Федерации. Value in Health. 2014; 17(7): 323 - 686.
16. International Statistical Classification of Diseases and Related Health Problems 10th Revision. Available at: http://apps.who.int/classifications/icd10/browse/2016/en.
17. Rusch V.W., Chansky K., Kindler H.L. et al. The IASLC Malignant Pleural Mesothelioma Staging Project: proposals for the M descriptors and for the revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for mesothelioma. J. Thorac Oncol, 2016, in press.
18. Amin M.B., Edge S.B., Greene F.L. et al. AJCC (American Joint Committee on Cancer). Cancer Staging Manual. 8th edn. Chicago: Springer, 2017.
19. Finn R.S., Brims F.J.H., Gandhi A. et al. Postmortem Findings of Malignant Pleural Mesothelioma: A Two-Center Study of 318 Patients. Chest 2012; 142(5): 1267 - 1273.
20. Howard A Gutman. Lung cancer and mesothelioma. Book.Copyright. 2011; 2: 183 - 184
21. Tural Onur et al. Are neutrophil/lymphocyte ratio and platelet/lymphocyte ratio reliable parameters as prognostic indicator in malignant mesothelioma? Therap and Clin Risk Management. 2016; 12: 651 - 656
22. Rochet N. et al. The role of complete blood cell count in prognosis - watch this space! Oncol and Hematol rew. 2012; 8(1): 76 - 82
23. Van Zandwijk N. et al. Guidelines for the diagnosis and treatment of malignant pleural mesothelioma. J. Thorac Dis. 2013; 5: E254 - 307
24. Koksal D. et al. Thromboembolic events in malignant pleural mesothelioma//Clinical and Applied Thrombosis/Hemostasis. - 2016. - Т. 22. - N. 4. - С. 390 - 394
25. Takamori S. et al. The C-reactive protein/albumin ratio is a novel significant prognostic factor in patients with malignant pleural mesothelioma: a retrospective multi-institutional study//Annals of surgical oncology. - 2018. - Т. 25. - N. 6. - С. 1555 - 1563
26. Harris E. J. A. et al. Prediction modelling using routine clinical parameters to stratify survival in Malignant Pleural Mesothelioma patients undergoing cytoreductive surgery//Journal of Thoracic Oncology. - 2019. - Т. 14. - N. 2. - С. 288 - 293
27. Boudville N et al. Mesothelin and kidney function analysis of relationship and implications for mesothelioma screening. Lung Cancer. 2011; 73(3): 320-4
28. Rump A, Morikawa Y, Tanaka M, Minami S, Umesaki N, Takeuchi M, Miyajima A. Binding of ovarian cancer antigen CA125/MUC16 to mesothelin mediates cell adhesion. J Biol Chem. 2004; 279: 9190-8
29. Cheng et al. Clinical significance of serum CA125 in diffuse malignant mesothelioma. SpringerPlus. 2016; 5: 368.
30. Creaney J. et al. Combined CA125 and Mesothelin Levels for the Diagnosis of Malignant Mesothelioma. Chest J. 2007; 132: 1239 - 1246.
31. Shalaby A.O. et al. A study of CA-125 in patient with pleural effusion. Egypt J Bronchol. 2015; 9: 283-6.
32. Резников Ю.П. и коллеги. Оценка соотношения онкомаркеров в поиске первичного очага опухоли (к 50-летию открытия АФП как опухолевого маркера). Клиническая лабораторная диагностика. 2014; 2: 15 - 19.
33. Truong M.T., Viswanathan C., Godoy M.B. et al. Malignant Pleural Mesothelioma: Role of CT, MRI, and PET/CT in Staging Evaluation and Treatment Considerations. J Semin Roentgenol 2013; 48(4): 323 - 334.
34. Kawashima A., Libshitz H. I. Malignant pleural mesothelioma: CT manifestations in 50 cases//AJR. American journal of roentgenology. - 1990. - Т. 155. - N. 5. - С. 965 - 969.
35. Heelan R. T. et al. Staging of malignant pleural mesothelioma: comparison of CT and MR imaging//AJR. American journal of roentgenology. - 1999. - Т. 172. - N. 4. - С. 1039 - 1047.
36. Armato G. et al. Imaging in Pleural Mesothelioma: A Review of the 13th International Conference of the International Mesothelioma Interest Group. Lung Cancer. Author manuscript; available in PMC. 2017; 101: 48 - 58.
37. Gossinger HD et al. Magnetic resonance imaging findings in a patient with pericardial mesothelioma. Arm Heart J. 1988; 115(6): 1321-22.
38. Fazekas T. et al. Primary malignant pericardial mesothelioma. Orv Hetil. 1991; 132 (48): 2677-80.
39. Collins D. et al. Patterns of metastases in malignant pleural mesothelioma in the modern ers: Redefining the spread of an old disease. J Clin Oncol. 2017; 8556
40. Kruse M., Sherry S., Paidpally V. et al. FDG PET/CT in the Management of Primary Pleural Tumors and Pleural Metastases. Am J Roentgenol 2013; 201: 215 - 226.
41. Yildirim H. et al. Clinical value of fluorodeoxyglucose-positron emission tomography/computed tomography in differentiation of malignant mesothelioma from asbestos-related benign pleural disease: an observational pilot study//Journal of Thoracic Oncology. - 2009. - Т. 4. - N. 12. - С. 1480 - 1484.
42. Kao SC et al. Accuracy of diagnostic biopsy of the histological subtype of the malignant pleural mesothelioma. J Thorac Oncol. 2011; 6: 602 - 605.
43. Greillier L. Et al. Accuracy of pleural biopsy using thoracoscopy for the diagnosis of histologic subtype in patients with malignant pleural mesothelioma.Cancer 2007; 110: 2248 - 2252.
44. Wald O. et al. Role of thoracoscopy, mediastinoscopy and laparoscopy in the diagnosis and staging of malignant pleural mesothelioma. J Vis Surg. 2016; 2: 129.
45. Rice D. C. et al. Extended surgical staging for potentially resectable malignant pleural mesothelioma//The Annals of thoracic surgery. - 2005. - Т. 80. - N. 6. - С. 1988 - 1993.
46. Travis W.D., Colby T.V., Corrin B. et al. (WHO). Histological typing of lung and pleural tumour. Berlin: Springer, 1999. ISBN: 13978-3-540-65219-9.
47. Husain AN, Colby TV, Ordonez NG, et al. Guidelines for pathologic diagnosis of malignant mesothelioma 2017 Update of the consensus statement from the international mesothelioma interest group. Arch Pathol Lab Med 2018; 142: 89 - 108.
48. Flores RM et al. Extrapleural pneumonectomy versus pleurectomy/decortication in the surgical management of malignant pleural mesothelioma: results in 663 patients. J Thorac Cardiovasc Surg. 2008; 135: 620 - 626
49. Spaggiari L. et al. Extapleural pneumonectomy for malignant mesothelioma: an Italian multicenter retrospective study. Ann Thorac Surg. 2014; 97: 1859-65
50. Flores RM et al. Frequency of use and predictors of cancer-directed surgery in the management of malignant pleural mesothelioma in a community-based (SEER) population. J Thorac Oncol. 2010; 5: 1649-54
51. Treasure T. et al. Extra-pleural pneumonectomy versus no extra-pleural pneumonectomy for patient with malignant pleural mesothelioma: clinical outcomes of the Mesothelioma and Radical Surgery (MARS) randomized feasibility study. Lancet Oncol. 2011; 12: 763 - 772
52. Rusch V.W., Piantadosi S., Holmes E.C. The role of extrapleural pneumonectomy in malignant pleural mesothelioma. A lung cancer study group trial. J Thorac Cardiovasc Surg 1991; 102(1): 1 - 9.
53. Trousse D.S., Avaro J.P., D'Journo X.B. et al. Is malignant pleural mesothelioma a surgical disease? A review of 83 consecutive extra-pleural pneumonectomies. Eur J Cardiothorac Surg 2009; 36(4): 759 - 763.
54. Rintoul R.C., Ritchie A.J., Edwards J.G. et al. MesoVATS Collaborators: Efficacy and cost of video-assisted thoracoscopic partial pleurectomy versus talc pleurodesis in patients with malignant pleural mesothelioma (MesoVATS): an open-label, randomised, controlled trial. Lancet. 2014; 384: 1118 - 1127.
55. Walker S., Bibby A.C., Maskell N.A. Current best practice in the evaluation and management of malignant pleural effusions. Ther Adv Respir Dis. 2017; 11(2): 105 - 114
56. Girardi L. et al. Periocardiocentesis and intrapericardial sclerosis: effective therapy for malignant pericardial effusions. The Annals of Thoracic Surgery. 1997; 64(5): 1422 - 1428
57. Catot S. et al. Primary malignant pericardial methotelioma. ResearchGate. 2012; 4: 39 - 48
58. Vigneswaran WT. & Stefanacci PR. Pericardial mesothelioma. Current Treatment Options in Oncology. 2000; 1(4): 299 - 302
59. Anderson TM et al. Pericardial catheter sclerosis versus surgical procedures for pericardial effusions in cancer patients. Journal of Cardiovascular Surgery (Torino). 2001; 42 (3): 415-9
60. Tsang TS et al. Outcomes of primary and secondary treatment of pericardial effusion in patients with malignancy. Mayo Clinic Proceedings. 2000; 75(3): 248-53
61. Plas E et al: Malignant mesothelioma of the tunica vaginalis testis: review of the literature and assessment of prognostic parameters. Cancer. 1998; 83: 2437 - 2446.
62. Gupta N.P., Kumar R. Malignant gonadal mesothelioma// Curr. Treat. Opt. Oncol. 2002. V. 3 (5). P. 363 - 367
63. Plas E., Riedl C.R., Pfl ger H. Malignant mesothelioma of the tunica vaginalis testis. Review of the literature and assessment of prognostic parameters//Cancer. 1998. V. 83. P. 2437 - 2446.
64. Огнерубов Н.А., Огнерубова И.Н. Мезотелиома оболочек яичка. Весник ТГУ. 2013; 18(4): 1326-29
65. Bang J.H. et al. Surgical experience of pericardial mesothelioma presenting as constrictive pericarditis. J of Cardiology Cases.2010; 2: e96 - 98.
66. Bassem et al.Unusual Presentation of a Primary Pericardial Malignant Mesothelioma: Constrictive Pericarditis A Case Report and Review of the Literature. J Tumor Res. 2015; 1: 1.
67. Yan T.D. et al. A systematic review on the efficacy of cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for diffuse malignancy peritoneal mesothelioma. Ann Oncol. 2007; 18(5): 827-34.
68. Sugarbaker PH. Peritonectomy procedures. Ann Surg. 1995; 221: 29 - 42.
69. Feldman AL, Libutti SK, Pingpank JF, et al: Analysis of factors associated with outcome in patients with malignant peritoneal mesothelioma undergoing surgical debulking and intraperitoneal chemotherapy J Clin Oncol. 2003; 21: 4560 - 4567.
70. Brigand C. et al. Peritoneal mesothelioma treated by cytoreductive surgery and intraperitoneal hyperthermic chemotherapy: Results of a prospective study. Ann Surg Oncol. 2006; 13: 405 - 412.
71. Yano H. et al. Cytoreductive surgery and intraperitoneal chemotherapy for peritoneal mesothelioma. Eur J Surg Oncol. 2009; 35: 980 - 985.
72. Blackham A.U. et al. Cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for malignant peritoneal mesothelioma: Mitomycin versus cisplatin. Ann Surg Oncol. 2010; 17: 2720 - 2727.
73. Helderman R.F.C.P.A., L ke D.R., Kok H.P. et al. Variati on in Clinical Application of Hyperthermic Intraperitoneal Chemotherapy: A Review//Cancers (Basel). 2019, Jan. 11. Vol. 11, N 1. P. 78. doi: 10.3390/cancers11010078.
74. Kim J., Bhagwandin S., Labow D.M. Malignant peritoneal mesothelioma: a review//Ann. Transl. Med. 2017, Jun. Vol. 5, N 11. P. 236.
75. Baratti D. et al. Lymph node metastases in diffuse malignant peritoneal mesothelioma. Ann Surg Oncol. 2010; 17: 45 - 53.
76. Yan TD, Yoo D, Sugarbaker PH. Significance of lymph node metastasis in patients with diffuse malignant peritoneal mesothelioma. Eur J Surg Oncol.2006; 32: 948 - 953.
77. Helm JH, Miura JT, Glenn JA et al: Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma: A systematic review and meta-analysis. Ann Surg Oncol. 2015; 22: 1686 - 1693.
78. Isik AF, Sanli M, Yilmaz M, et al. Intrapleural hyperthermic perfusion chemotherapy in subjects with metastatic pleural malignancies. Respir Med. 2013; 107: 762-7.
79. Gupta V et al. Hemithoracic radiation therapy after pleurectomy/decortications for malignant pleural mesothelioma. Int J Radiat Oncol Biol Phys. 2005; 63: 1045 - 1052
80. Gupta V et al. Patterns of local and nodal failure in malignant pleural mesothelioma after extrapleural pneumonectomy and photon-electron radiotherapy. J Thorac Oncol 2009; 4: 746 - 750
81. Bolukbas M et al. Survival after trimodality therapy for malignant pleural mesothelioma: radical pleuroectomy, chemotherapy with cisplatin/pemetrexed and radiotherapy. Lung Cancer 2011; 71: 75 - 81
82. Hasani A et al. Outcome for patients with malignant pleural mesothelioma referred for trimodality therapy in Western Australia. J Thorac Oncol 2009; 4: 1010 - 1016
83. Rimner A., Zauderer M.G., Gomez D.R. et al. Phase II study of Hemithoracic Intensity-Modulated Pleural Radiation Therapy (IMPRINT) as part of lung-sparing multimodality therapy in patients with malignant pleural mesothelioma. J Clin Oncol 2016; 34: 2761 - 2768.
84. Finkelstein S.E., Timmerman R., McBride W.H. et al. The confluence of stereotactic ablative radiotherapy and tumor immunology. Clin Dev Immunol 2011; 439752: 7.
85. Rusch V.W., Rosenzweig K., Venkatraman E. et al. A phase II trial of surgical resection and adjuvant high-dose hemithoracic radiation for malignant pleural mesothelioma. J Thorac Cardiovasc Surg 2001; 122: 788 - 795.
86. Boutin C et al. Prevention of malignant seeding after invasive procedures in patients with malignant pleural mesothelioma. A randomized trial of local radiotherapy. Chest 1995; 108: 754 - 758
87. Ball DL et al. The treatment of malignant mesothelioma of pleura: review of a 5-years experience, with special reference to radiotherapy. Am J Clin Oncol 1999; 13: 4 - 9
88. Chance WW et al. Hemithoracic intensity modulated radiation therapy after pleuroectomy/decortication for malignant pleural mesothelioma: toxicity, patterns of failure, and a matched survival analysis. Int J Radiat Oncol Biol Phys 2015; 91: 149 - 156
89. Vogelzang N.J., Rusthoven J.J., Symanowski J. et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol 2003; 21: 2636 - 2644.
90. Castagneto B., Bota M., Aitini E. et al. Phase II study of pemetrexed in combination with carboplatin in patients with malignant pleural mesothelioma. Ann Oncol 2008; 19: 370 - 373.
91. Nowak A.K., Byrne M.J., Willianson R. et al. A multicentre phase II study of cisplatin and gemcitabine for malignant mesothelioma. Br J Cancer 2002; 87: 491 - 496.
92. Van Haarst J.M., Baas J., Manegold C.H. et al. Multicentre phase II study of gemcitabine and cisplatin in malignant pleural mesothelioma. Br J Cancer 2002; 86: 342 - 345.
93. Zalcman G, Mazieres J, Margery J, et al. Bevacizumab for newly diagnosed pleural mesothelioma in the Mesothelioma Avastin Cisplatin Pemetrexed Study (MAPS): a randomised, controlled, open-label, phase 3 trial. Lancet 2016; 387: 1405-14.
94. Dowell J.E., Dunphy F.R., Taub R.N. et al. A multicenter phase II study of cisplatin, pemetrexed, and bevacizumab in patients with advanced malignant mesothelioma. Lung Cancer 2012; 77: 567 - 571.
95. Ceresoli GL et al. Phase II study of pemetrexed and carboplatin plus bevasizumab as first-line therapy in malignant pleural mesothelioma. Br J Cancer 2013; 109: 552 - 558.
96. Baas P., Scherpereel A., Nowak A, Fujimoto N, Peters S. et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet. 2021; 397(10272): 375 - 386.
97. Kindler H.L., Karrison T.G., Gandara D.R. et al. Multicenter, double-blind, placebo-controlled, randomized phase II trial of gemcitabine/cisplatin plus bevacizumab or placebo in patients with malignant mesothelioma. J Clin Oncol 2012; 30: 2509 - 2515.Zalcman G et al.
98. Van Meerbeeck JP et al. A phase II study of gemcitabine in patients with malignant pleural mesothelioma. European Organization for Research and Treatment of Cancer Lung Cancer Cooperative Group. Cancer 1999; 85: 2577 - 2282
99. Zauderer M.G. Vinorelbine and gemcitabine as second- or third-line therapy for malignant pleural mesothelioma/M.G. Zauderer, S.L. Kass, K. Woo et al.//Lung Cancer 2014; 84: 271 - 274
100. Taylor P et al. Single-agent pemetrexed for chemonaive and pretreated patients with malignant pleural mesothelioma: results of an International Expanded Access Program. J Thorac Oncol 2008; 3: 764 - 771
101. Stebbing, J. The efficacy and safety of weekly vinorelbine in relapsed malignant pleural mesothelioma/J. Stebbing, T. Powles, K. McPherson et al.//Lung Cancer. - 2009. - Vol. 63. - P. 94 - 97.
102. Muers MF et al. Active symptom control with or without chemotherapy in the treatment of patients with malignant pleural mesothelioma (MS01): multicentre randomized trial. Lancet 2008; 371: 1685 - 1894
103. Chu Q, Perrone F, Greillier L, et al. Pembrolizumab plus chemotherapy versus chemotherapy in untreated advanced pleural mesothelioma in Canada, Italy, and France: a phase 3, open-label, randomised controlled trial. Lancet 2023; 16; 402: 2295 - 2306.
104. Chu Q, Piccirillo M, Greillier L, et al/IND227 phase III (P3) study of cisplatin/pemetrexed (CP) with or without pembrolizumab (pembro) in patients (pts) with malignant pleural mesothelioma (PM): A CCTG, NCIN, and IFCT trial. J of Clin Onc. 2023; 41(17)/https://doi.org/10.1200/JCO.2023.41.17_suppl.LBA8505
105. Popat S, Cunoni-Fontecedro A, Polydoropoulou V, et al. A multicenter randomized phase III trial comparing pembrolizumab (P) vs single agent chemotherapy (CT) for advanced pre-treated malignant pleural mesothelioma (MPM)-results from the European Thoracic Oncology Platform (ETOP 9 - 15) PROMISE-meso trial. Presented at: 2019 ESMO Congress; September 27 to October 1, 2019. Abstract LBA91.
106. Alley EW, Lopez J, Santoro A, et al. Clinical safety and activity of pembrolizumab in patients with malignant pleural mesothelioma (KEYNOTE-028): preliminary results from a non-randomised, open-label, phase 1b trial. Lancet Oncol 2017; 18: 623-30.
107. Disselhorst M, Harms E, Van Tinteren H, et al. Ipilimumab and Nivolumab in the Treatment of Recurrent Malignant Pleural Mesothelioma: A Phase II Study. J Thorac Oncol. 2012; 11: S1746.
108. Disselhorst MJ, Quispel-Janssen J, Lalezari F, et al. Ipilimumab and nivolumab in the treatment of recurrent malignant pleural mesothelioma (INITIATE): results of a prospective, single-arm, phase 2 trial. Lancet Respir Med 2019; 7: 260 - 270.
109. Quispel-Janssen J, Zago G, Schouten R, et al. A Phase II Study of Nivolumab in Malignant Pleural Mesothelioma (NivoMes): with Translational Research (TR) Biopies. J Thorac Oncol. 2017; 12: S292-3.
110. Fennell DA, Ewings S, Ottensmeier C, et al; CONFIRM trial investigators. Nivolumab versus placebo in patients with relapsed malignant mesothelioma (CONFIRM): a multicentre, double-blind, randomised, phase 3 trial. Lancet Oncol 2021; 22: 1530 - 1540.
111. Scherpereel A, Mazieres J, Greillier L, et al. Nivolumab or nivolumab plus ipilimumab in patients with relapsed malignant pleural mesothelioma (IFCT-1501 MAPS2): a multicentre, open-label, randomized, non-comparative, phase 2 trial. Lancet Oncol 2019; 20: 239 - 253.
112. Bolukbas S., Manegold C., Eberlein M. Safety and efficacy of trimodality therapy in patients undergoing extrapleural pneumonectomy. Lung Cancer 2011; 71: 75 - 81.
113. Hasegava S. et al. Evoluation of surgical approach in malignant pleural mesothelioma. 2016. Abst. MS09.06. iMig2016.org.
114. Kushalnagar P., Engelman A., Sadler G. Deaf patient-provider communication and lung cancer screening: Health Information National Trends survey in American Sign Language (HINTS-ASL). Patient Educ Couns 2018 Jul; 101(7): 1232 - 1239.
115. Bovolato P, Casadio C, Bill A, et al. Does surgery improve survival of patients with malignant pleural mesothelioma?: A multicenter retrospective analysis of 1365 consecutive patients. J Thorac Oncol. 2014; 9: 390-6.
116. Kepenekian V. et al. RENAPE Database: Multi-Institutional Retrospective Study. Eur J Cancer. 2016; 65: 69 - 79.
117. Sharkey A.J. et al. Induction or adjuvant chemotherapy for radical multimodality therapy. SHC. 2018; 2(7): 1 - 8.
118. Sharkey A.J. et al. How does the timing of chemotherapy affect outcome following radical surgery for malignant pleural mesothelioma? Lung Cancer. 2016; 100: 5 - 13.
119. Владимирова Л.Ю., Гладков О.А., Королева И.А. и соавт. Тошнота и рвота. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 32 - 47.
120. Muzi J.L., Look R.M., Turner C., Gardiner S.K., Wagie T., Douglas J., Sorenson L., Evans L., Kirchner S., Dashkoff C., Garrett K., Johnson N. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. Journal of Clinical Oncology. 2012; 30(15): 9019.
121. Конвенции и рекомендации по охране труда при использовании асбеста. 1957 - 1990. Женева. Том 1. Рекомендации N 172. [Электронный ресурс] https://www.ilo.org/sites/default/files/wcmsp5/groups/public/@ed_norm/@normes/documents/normativeinstrument/wcms_r172_ru.htm
122. Приказ Министерства здравоохранения Российской Федерации от 04.06.2020 N 548н "Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями" (Зарегистрирован 26.06.2020 N 58786). Номер опубликования: 0001202006300011. [Электронный ресурс] Режим доступа//URL: http://publication.pravo.gov.ru/Document/View/0001202006300011
123. Краткие методические указания по учету и диспансеризации больных с предраковыми и злокачественными новообразованиями. [Электронный ресурс] Режим доступа//URL: http://www.oncology.ru/service/organization/table1.htm. Дата последнего обращения: 2 апреля 2020 г.
124. Edwards J.G., Abrams K.R., Leverment J.N. et al. Prognostic factors for malignant mesothelioma in 142 patients: validation of CALGB and EORTC prognostic scoring systems. Thorax. 2000; 55: 731 - 735.
125. Карпенко Т.Д., Козлов Н.А., Любченко Л.Н. и др. Анализ экспрессии белка PD-L1 в клетках злокачественной мезотелиомы плевры. Российский онкологический журнал. 2018; 23(1): 4 - 9.
126. Scherpereel A., Astoul P., Baas P. et al. Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J. 2010; 35: 479 - 495.
127. Багрова С.Г., Басин Е.М., Борзов К.А. и соавт. Патология костной ткани. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 48 - 60.
128. Сакаева Д.Д., Борисов К.Е., Булавина И.С. и соавт. Фебрильная нейтропения. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 61 - 70.
129. Ткаченко П.Е., Маевская М.В., Ивашкин В.Т. Гепатотоксичность. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 83 - 96.
130. Виценя М.В., Агеев Ф.Т., Орлова Р.В. и соавт. Кардиоваскулярная токсичность. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 97 - 121.
131. Королева И.А., Болотина Л.В., Гладков О.А. и соавт. Дерматологические реакции. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 122 - 162.
132. Сытов А.В., Зузов С.А., Кукош М.Ю. и соавт. Нутритивная поддержка. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 163 - 173.
133. Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т. и соавт. Нефротоксичность. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 184 - 201.
134. Сомонова О.В., Антух Э.А., Варданян А.В. и соавт. Тромбоэмболические осложнения. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 202 - 215.
135. Буйденок Ю.В., Обухова О.А. Экстравазация противоопухолевых препаратов. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли 2024; 14(3s2): 216 - 226.
136. Навыки эффективного общения для оказания пациент-ориентированной медицинской помощи научно-методическое издание/авторы-сост. Боттаев Н.А., Горина К.А., Грибков Д.М., Давыдова Н.С., Дьяченко Е.В., Ковтун О.П., Макарочкин А.Г., Попов А.А., Самойленко Н.В. Сизова Ж.М., Сонькина А.А., Теплякова О.В. и др. М.: Издательство РОСОМЕД (Российское общество симуляционного обучения в медицине), 2018. 32 с. http://rosomed.ru/system/documents/files/000/000/102/original/Раздатка-Руководствопо-Калгари-Кембриджской-модели.pdf?1528916127
137. Методические рекомендации по созданию сценариев по коммуникативным навыкам (навыкам общения) для симулированных пациентов при аккредитации специалистов здравоохранения/авторы-составители Давыдова Н.С., Собетова Г.В., Куликов А.В., Серкина А.В., Боттаев Н.А., Дьяченко Е.В., Шубина Л.Б., Грибков Д.М. Москва, 2018. 20 с. http://fmza.ru/upload/medialibrary/c92/mr-dlya-sozdaniyaekzamenatsionnykh-stsenariev-po-kn.pdf.
138. Руководство по клиническому обследованию больного. Пер. с англ./Под ред. А.А. Баранова, И.Н. Денисова, В.Т. Ивашкина, Н.А. Мухина. - М.: ГЭОТАР-Медиа, 2007. - 648 с.
139. Основы семиотики заболеваний внутренних органов: Учебн. пособ./А.В. Струтынский, А.П. Баранов, Г.Е. Ройтберг, Ю.П. Гапоненков. - М.: МЕДпрессинформ, 2008. - 5-е изд. - 304 с.
140. Основы семиотики заболеваний внутренних органов: Учебн. пособ./А.В. Струтынский, А.П. Баранов, Г.Е. Ройтберг, Ю.П. Гапоненков. - М.: МЕДпрессинформ, 2008. - 5-е изд. - 304 с.
141. Ceresoli GL, Zucali PA, Favaretto AG, et al. Phase II study of pemetrexed plus carboplatin in malignant pleural mesothelioma. J Clin Oncol 2006; 24: 1443 - 1448.
142. Rogers L.J., Bleetman D., Messenger D.E., Joshi N.A. et al. The impact of enhanced recovery after surgery (ERAS) protocol compliance on morbidity from resection for primary lung cancer. J Thorac Cardiovasc Surg. 2018; 155(4): 1843-52.
143. Imperatori A., Grande A., Castiglioni M. et al. Chest pain control with kinesiology taping after lobectomy for lung cancer: initial results of a randomized placebocontrolled study. Interact Cardiovasc Thorac Surg 2016; 23: 223-30.
144. Park H., Park J., Woo S.Y. et al. Effect of high-frequency chest wall oscillation on pulmonary function after pulmonary lobectomy for non-small cell lung cancer. Crit Care Med 2012; 40(9): 2583-9
145. Janssen S.M., Abbink J.J., Lindeboom R., Vliet Vlieland T.P. Outcomes of pulmonary rehabilitation after treatment for non-small cell lung cancer stages I to IIIa: an observational study. J Cardiopulm Rehabil Prev 2017; 37(1): 65 - 71.
146. Chen H.Y., Li S.G., Cho W.C.S., Zhang Z.J. The role of acupoint stimulation as an adjunct therapy for lung cancer: a systematic review and meta-analysis. BMC Complement Altern Med 2013; 13: 362
147. Streckmann F., Zopf E.M., Lehmann H.C. et al: Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014; 44: 1289-304
148. Oberoi S., Zamperlini-Netto G., Beyene J. et al. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. PLoS One 2014; 9(9): e107418
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Барболина Татьяна Дмитриевна, к.м.н., врач-онколог, научный сотрудник отделения химиотерапии N 3 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина", ассистент кафедры онкологии Научно-образовательного института непрерывного профессионального образования им. Н.Д. Ющука ФГБОУ ВО "Российский университет медицины" Минздрава России, доцент кафедры постдипломного образования врачей (направление подготовки "Онкология") департамента профессионального образования ФГБУ "НМИЦ онкологии им. Н.Н. Блохина".
2. Бармин Виталий Валерьевич, к.м.н., доцент, руководитель Центра патологии средостения и миастении, заведующий группой миастении отдела торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, член АОР, ESTS, IASLC.
3. Болотина Лариса Владимировна, д.м.н., доцент, заведующая отделением химиотерапии отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
4. Владимирова Любовь Юрьевна, д.м.н., профессор, зав. отделением противоопухолевой лекарственной терапии N 1 ФГБУ "Ростовский научно-исследовательский онкологический институт" Минздрава России.
5. Гамаюнов Сергей Викторович, д.м.н, главный врач ГАУЗ НО НИИКО "Нижегородский областной клинический онкологический диспансер".
6. Гриневич Вячеслав Николаевич, президент Российского общества онкопатологов, к.м.н., заведующий отделением онкопатологии Московского научно-исследовательского онкологического института им. П.А. Герцена - филиала ФГБУ "Национальный медицинский исследовательский центр радиологии" Минздрава России.
7. Деньгина Наталья Владимировна, к.м.н., заведующая радиологическим отделением Областного клинического диспансера г. Ульяновск.
8. Драпкина Оксана Михайловна, директор Национального медицинского исследовательского центра профилактической медицины, главный внештатный специалист-терапевт Минздрава России, д.м.н., профессор, член-корреспондент РАН.
9. Козлов Николай Александрович, к.м.н., врач-патологоанатом патологоанатомического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
10. Левченко Евгений Владимирович, д.м.н., зав. хирургическим торакальным отделением, зав. научным отделением торакальной онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
11. Пикин Олег Валентинович, д.м.н., профессор, заведующий торакальным хирургическим отделением МНИОИ имени П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, врач-онколог (председатель рабочей группы).
12. Сакаева Дина Дамировна, д.м.н., профессор, заместитель главного врача по онкологии КГ "Мать и Дитя", врач-онколог онкологического отделения противоопухолевой лекарственной терапии 1 Клиники БГМУ.
13. Снеговой Антон Владимирович, д.м.н., профессор, заведующий отделом лекарственного противоопухолевого лечения НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
14. Фалалеева Наталья Александровна, д.м.н., заведующая отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
15. Филоненко Елена Вячеславовна, д.м.н., профессор, заведующий Центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
Блок по организации медицинской помощи:
1. Геворкян Тигран Гагикович, заместитель директора по реализации федеральных проектов ФГБУ "НМИЦ онкологии им. Н.Н. Блохина", Минздрава России.
2. Иванов Сергей Анатольевич, член-корреспондент РАН, д.м.н., проф. РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
3. Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
5. Комаров Юрий Игоревич, к.м.н., заместитель директора по организационно-методической работе ФГБУ "НМИЦ онкологии им. Н. Н. Петрова" Минздрава России.
Блок по сопроводительной терапии:
1. Гладков Олег Александрович, профессор, д.м.н., директор медицинского центра ООО "ЭВИМЕД".
2. Карасева Вера Витальевна, д.м.н., доцент, профессор, кафедра онкологии ИНОПР ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- врачи-онкологи;
- врачи-хирурги;
- врачи-патологоанатомы.
Таблица 1. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематические обзоры исследований с контролем референтным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референтным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референтным методом или исследования с референтным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай - контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендаций
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Актуальные инструкции к лекарственным препаратам, упоминаемым в данной клинической рекомендации, можно найти на сайте grls.rosminzdrav.ru и на сайте RUSSCO.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
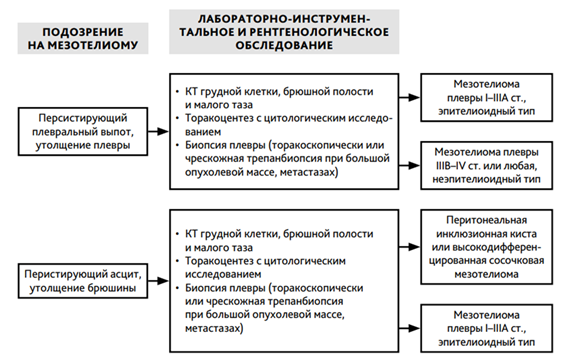
Рис. 1. Алгоритм первичной диагностики при подозрении на мезотелиому
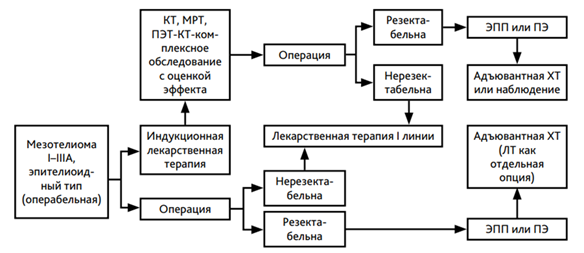
Рис. 2. Алгоритм лечения локализованной мезотелиомы плевры
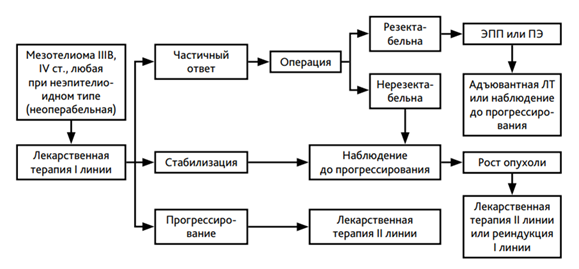
Рис. 3. Алгоритм лечения диссеминированной мезотелиомы плевры
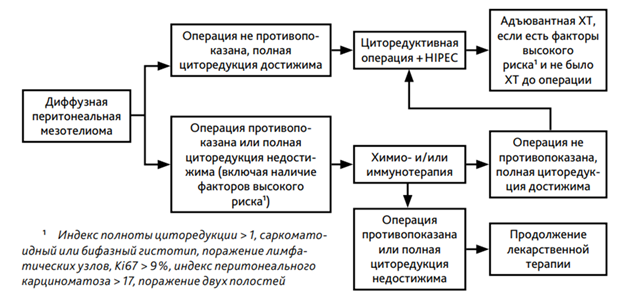
Рис. 4. Алгоритм лечения диффузной перитонеальной мезотелиомы
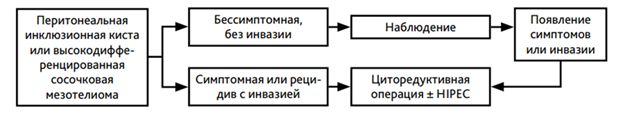
Рис. 5. Алгоритм лечения перитонеальной инклюзионной кисты или высокодифференцированной сосочковой мезотелиомы
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Своевременное взаимодействие с вашим лечащим врачом и медицинской сестрой по поводу состояния вашего здоровья, являющееся важной составляющей помощи вашей медицинской команде в защите вас в процессе лечения, настолько безопасно, насколько это возможно. Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением, были выявлены и пролечены в самом начале их проявлении, это поможет предотвратить их переход в более тяжелые степени. Вовремя сообщайте врачу об изменениях в состоянии вашего здоровья.
При осложнениях химиотерапии необходимо связаться с химиотерапевтом.
1. При повышении температуры тела 38 °C и выше:
- начать прием антибактериальных препаратов системного действия по рекомендации лечащего врача.
2. При стоматите:
- диета - механическое, термическое щажение;
- частое полоскание рта (каждый час) - ромашки аптечной цветки, дуба кора, шалфея лекарственного листья, смазывать рот облепиховым (персиковым) маслом;
- обрабатывать полость рта по рекомендации лечащего врача.
3. При диарее:
- диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку;
- можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
- принимать препараты по рекомендации лечащего врача.
4. При тошноте:
- принимать препараты по рекомендации лечащего врача.
Информация для пациента, получающего терапию моноклональными антителами - блокаторами PD1 (АТХ L01FF02, # пембролизумаб** (АТХ - L01XC18)) Своевременное взаимодействие с вашим лечащим врачом и медицинской сестрой по поводу состояния вашего здоровья является важной составляющей помощи медицинской команде в защите вас в процессе лечения настолько безопасно, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами PD1 (АТХ L01FF02, #пембролизумаб** (АТХ - L01XC18)), были выявлены и излечены в самом начале их проявлений, это поможет предотвратить их переход в более тяжелые степени. МКА-блокаторы PD1 (АТХ L01FF02, #пембролизумаб** (АТХ - L01XC18)) разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом.
Наиболее частые побочные эффекты, с которыми Вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей.
Побочные явления, которые могут появиться у вас, обычно возникают в первые 12 нед лечения, но могут появиться и позже. Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами PD1. Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые степени. Если после лечения МКА-блокаторами PD1 (АТХ L01FF02, #пембролизумаб** (АТХ - L01XC18)) у вас возникли симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные явления после терапии блокаторами PD1:
- увеличение числа актов дефекации до 2 и более в день или любая диарея в ночное время, любой стул со слизью и кровью;
- боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства
- красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
- желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи на солнце;
- вновь возникший кашель или одышка;
- усталость или сонливость; - затрудненная концентрация внимания или спутанность сознания;
- головная боль, боль в теле или в месте опухоли;
- лихорадка (повышение температура тела до +38 °C);
- внезапное снижение или увеличение массы тела; 53
- вновь появившаяся эректильная дисфункция или потеря интереса к интимной жизни.
Пожалуйста, уделите особое внимание любым изменениям на фоне лечения.
Приложение Г1 - ГN
ШКАЛЫ
ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки общего состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status
Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology
Group. Am J Clin Oncol 1982; 5(6): 649 - 655.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Таблица 9. Шкала оценки общего состояния пациента по версии ВОЗ/ECOG
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
смерть
Ключ (интерпретация): приведен в самой шкале.
Приложение Г2
ШКАЛА КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS.
Источник (официальный сайт разработчиков, публикация с валидацией): [Karnofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod C. New York: Columbia University Press; 1949: 191 - 205]
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Таблица 10. Шкала Карновского
Шкала Карновского
100 - состояние нормальное, жалоб нет
90 - способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 - нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 - обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60 - нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 - нуждается в значительной помощи и медицинском обслуживании
40 - инвалид, нуждается в специальной помощи, в том числе медицинской
30 - тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20 - тяжелый больной. Необходимы госпитализация и активное лечение
10 - умирающий
0 - смерть
Ключ (интерпретация): приведен в самой шкале.
