"Клинические рекомендации "Острый промиелоцитарный лейкоз"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОСТРЫЙ ПРОМИЕЛОЦИТАРНЫЙ ЛЕЙКОЗ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C92.4
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 132_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Ассоциация онкологов России, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
Алло-ТГСК - трансплантация аллогенных гемопоэтических стволовых клеток (трансплантация костного мозга или трансфузия гемопоэтических клеток)
Ауто-ТГСК - трансплантация аутологичных гемопоэтических стволовых клеток (трансплантация костного мозга или трансфузия гемопоэтических клеток)
Антикоагулянты - лекарственные препараты АТХ-группы Антитромботические средства
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БРВ - безрецидивная выживаемость
в/в - внутривенно
ДВС-синдром - синдром диссеминированного внутрисосудистого свертывания
ДС - дифференцировочный синдром
Ингибиторы фибринолиза - лекарственные препараты группы АТХ Антифибринолитические средства
ИР - индукция ремиссии
КИ - клиническое исследование
КМ - костный мозг
Криопреципитат - компонент донорской крови, содержащий криоглобулиновую фракцию плазмы, получаемый посредством переработки плазмы
КТ - компьютерная томография
МОБ - минимальная остаточная болезнь
НМГ - низкомолекулярные гепарины (группа гепарина)
НПВП - нестероидные противовоспалительные и противоревматические препараты
ОВ - общая выживаемость
ОЛ - острый лейкоз
ОМЛ - острый миелоидный лейкоз
ОПЛ - острый промиелоцитарный лейкоз
ОТ-ПЦР - полимеразная цепная реакция с обратной транскриптазой
ПК - периферическая кровь
ПР - полная ремиссия
ПЦР - полимеразная цепная реакция
Ретиноиды - лекарственные препараты, применяющиеся для лечения острого промиелоцитарного лейкоза АТХ-группы L01XF: Ретиноиды для лечения рака
СЗП - свежезамороженная плазма
ТГСК - трансплантация гемопоэтических стволовых клеток
ТКМ - трансплантация костного мозга
УДД - уровень достоверности доказательств
УЗИ - ультразвуковое исследование
УУР - уровень убедительности рекомендаций
ФАБ-классификация - классификация Франко-американско-британской группы экспертов
ХТ - химиотерапия
ЦНС - центральная нервная система
ARA-C - цитарабин**
ATO - мышьяка триоксид
ATRA - полностью транс-ретиноевая кислота (третиноин**)
CD - кластер дифференцировки
FISH-исследование - исследование методом флуоресцентной гибридизации in situ
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся без соответствия с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Дифференцировочный синдром - жизнеугрожающее осложнение, развивающееся при лечении острого промиелоцитарного лейкоза полностью транс-ретиноевой кислотой (третиноин**) и мышьяка триоксидом, которое диагностируют при наличии не менее 4 симптомов из следующего симптомокомплекса: лихорадка без выявленной причины, респираторный дистресс-синдром, инфильтрация легочной ткани по данным инструментальных исследований, гипоксемия, отеки (в том числе гидроторакс и гидроперикард), прибавка массы тела, почечная недостаточность, артериальная гипотензия. Целесообразно в диагностике дифференцировочного синдрома использовать термины "органы-мишени", "органные поражения" вместо "пневмония", "гепатит", "панкреатит" и т.д.
Полной ремиссией острого промиелоцитарного лейкоза принято называть состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается ![]() 5% бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови > 1,0 x 109/л, при количестве тромбоцитов
5% бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови > 1,0 x 109/л, при количестве тромбоцитов ![]() 100 x 109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Указанные показатели должны сохраняться в течение
100 x 109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Указанные показатели должны сохраняться в течение ![]() 1 мес.
1 мес.
Резистентная форма острого промиелоцитарного лейкоза может быть констатирована при отсутствии полной ремиссии после завершения 1 курса индукционной терапии. По мнению большинства международных и российских экспертов, у пациентов с острым промиелоцитарным лейкозом, доказанным молекулярно-цитогенетическими исследованиями, при использовании третиноина** в сочетании с химиотерапией или мышьяка триоксидом рефрактерных форм острого промиелоцитарного лейкоза не существует.
Ранняя смерть - смерть пациентов в период индукционной терапии.
Рецидив острого промиелоцитарного лейкоза констатируют при обнаружении в пунктате костного мозга > 5% бластных клеток и/или появлении экстрамедуллярных очагов.
Минимальной остаточной болезнью, или минимальной резидуальной болезнью, называют небольшую популяцию опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 104-6 исследуемых.
Цитогенетическая ремиссия - это полная клинико-гематологическая ремиссия, при которой методом FISH (исследование методом флуоресцентной гибридизации in situ) не выявляется сливной ген PML::RARA.
Цитогенетический рецидив - повторное появление гена PML::RARA, определяющееся методом FISH, на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия - это полная клинико-гематологическая ремиссия, при которой не обнаруживают исходно определявшийся методом полимеразно-цепной реакции химерный транскрипт PML/RARA при чувствительности метода 10-4.
Молекулярный рецидив - появление исходно определявшегося химерного транскрипта PML/RARA в двух повторных анализах (проведенных с коротким интервалом времени - 7 - 10 дней) на фоне сохраняющейся клинико-гематологической ремиссии.
Трансплантация гемопоэтических стволовых клеток - под этим термином объединены трансплантация гемопоэтических стволовых клеток костного мозга, периферической, пуповинной (плацентарной) крови.
Общая выживаемость. Для ее оценки анализируют временные параметры всех пациентов, включенных в исследование. Анализ осуществляют методом Каплана-Майера. Точкой отсчета является день начала терапии. Событием считается только смерть пациентов от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива).
Безрецидивная выживаемость. При ее анализе учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Анализ осуществляют методом Каплана-Майера. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив и смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например суицида).
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только о тех пациентах, у которых достигнута полная ремиссия. Анализ осуществляют методом Каплана-Майера. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания, смерть при полной ремиссии считается цензурированием. Также цензурируют всех пациентов, кто жив при полной ремиссии в момент проведения анализа.
Бессобытийная выживаемость. Этот показатель оценивает все события (недостижение полной ремиссии после индукционного этапа, смерть в индукции, смерть при полной ремиссии, смерть от любых других причин, рецидив заболевания) у всех пациентов, включенных в анализ, с момента начала терапии.
Индукция ремиссии - период начального лечения, целью которого являются максимально быстрое и существенное уменьшение опухолевой массы и достижение полной ремиссии (обычно 1 - 2 курса). Именно в этот период на фоне применения цитостатических средств (L01: Противоопухолевые препараты) количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т.е. в момент констатации полной ремиссии в костном мозге морфологически определяется < 5% опухолевых клеток.
Консолидация ремиссии - второй этап терапии острого промиелоцитарного лейкоза, является периодом закрепления достигнутого противоопухолевого эффекта.
Противорецидивное или поддерживающее лечение. Продолжение цитостатического воздействия в течение двух лет от окончания индукции/консолидации. Понятия поддерживающего лечения не существует в программах лечения первичных больных острым промиелоцитарным лейкозом мышьяка триоксидом.
Профилактика или - при необходимости - лечение нейролейкемии является принципиальным этапом при лечении пациентов с острым промиелоцитарным лейкозом из группы высокого риска. Этот этап распределяется на все периоды программного лечения - индукцию ремиссии, консолидацию и поддерживающее лечение.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Острый промиелоцитарный лейкоз - особый вариант острого миелоидного лейкоза с преобладанием аномальных промиелоцитов, характеризующийся генетическими мутациями, приводящими к рекомбинации гена RARA с геном PML (мутация t (15; 17) (q22; q11-12)) или с другими генами-партнерами.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология ОПЛ в большинстве случаев неизвестна. В последние годы описывается все больше случаев возникновения ОПЛ как лейкоза, связанного с предшествующей химиотерапией (ХТ) или облучением. Большие многоцентровые исследования свидетельствуют о том, что ОПЛ, индуцированный предшествующей терапией, в большинстве случаев возникает не позднее трех лет после завершения ХТ по поводу первичного онкологического заболевания ингибиторами топоизомеразы II (L01DB: Антрациклины и родственные соединения, или митоксантрон**, реже этопозид**). У 57% пациентов первичной опухолью был рак молочной железы, далее следуют неходжкинские лимфомы, значительно реже - лимфома Ходжкина. Среднее время от завершения терапии по поводу первичной опухоли до момента диагностики вторичного ОПЛ составляет 24 мес (от 15 мес до 8 лет). По мере увеличения агрессивности химиотерапевтического воздействия увеличивается вероятность развития вторичного ОПЛ, как, впрочем, может уменьшаться и временной интервал от момента завершения ХТ до возникновения ОЛ.
ОПЛ относят к острым миелоидным лейкозам (ОМЛ), которые представляют собой гетерогенную группу опухолевых заболеваний системы крови, возникающих в результате мутации в стволовой клетке-предшественнице гемопоэза, в результате чего происходит блок дифференцировки и начинается неконтролируемая пролиферация недифференцируемых опухолевых кроветворных клеток, вытесняющих нормальные.
Интересно отметить, что описаны промиелоцитарные бластные кризы хронического миелолейкоза.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Истинная частота возникновения ОПЛ неизвестна, поскольку в регистры заболеваемости ОПЛ вносят вместе с другими вариантами ОМЛ. Считается, что ОПЛ встречается в 5 - 15% всех случаев ОМЛ. И если в 2005 г. в США предполагаемая частота возникновения ОМЛ оценивалась как 11 930 случаев в год, то вероятная частота диагностики ОПЛ составляет 600-800 случаев в год [1, 3, 4].
Существует несколько отличий в эпидемиологических характеристиках между ОМЛ и ОПЛ, особенно это касается вероятности возникновения ОПЛ в зависимости от возраста. Так, для ОМЛ вероятность возникновения постепенно увеличивается пропорционально возрасту до 55 лет, а затем отмечается резкий экспоненциальный рост заболеваемости. При ОПЛ эта закономерность не выявляется. Хотя заболевание диагностируется во всех возрастных группах, его частота крайне низка у пациентов в возрасте до 10 лет. В возрастной группе от 0 до 17 лет частота ОПЛ среди всех случаев ОМЛ составляет 3 - 4%. В возрасте от 10 до 20 лет вероятность возникновения ОПЛ постепенно возрастает, затем наблюдается плато до возраста 60 лет, после чего вероятность возникновения заболевания снижается. Большинство случаев ОПЛ диагностируют в возрасте от 20 до 60 лет. Медиана возраста при диагностике ОПЛ составляет 38 лет. По данным Российского регистрационного исследования, проведенного российской исследовательской группой по изучению острых лейкозов, ОПЛ диагностируют в 7,25% случаев всех ОЛ взрослых, и медиана возраста составляет 47 лет (без учета пациентов детского возраста) [2]. Реальных показателей заболеваемости и распространенности ОПЛ в России не существует.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C92.4 - острый промиелоцитарный лейкоз
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Пациенты с ОПЛ подразделяются на группы риска в зависимости от лабораторных показателей общего анализа крови при манифестации заболевания [1, 2, 4]:
- группа низкого риска: лейкоциты < 10 x 109/л
- группа высокого риска: лейкоциты ![]() 10 x 109/л
10 x 109/л
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Острый промиелоцитарный лейкоз представляет собой четко очерченную нозологическую форму с настолько характерными клинико-лабораторными признаками (типичная морфология опухолевых клеток, тяжелый геморрагический синдром, гематомный тип кровоточивости, избыточно активированный фибринолиз, ДВС-синдром, обычно - лейкопения), что диагноз порой можно установить, основываясь лишь на клинических проявлениях. При этом существуют ОПЛ, которые протекают не столь драматично: отсутствуют проявления геморрагического синдрома, больные в течение нескольких месяцев наблюдаются по поводу лейкопении, умеренной тромбоцитопении. Проявления геморрагического синдрома (кровоточивость десен, повышенная травмируемость кожных покровов, синяки, петехии, нередко кровотечения из носа, желудочно-кишечного тракта) на момент диагностики имеются у 90% пациентов. Гепатоспленомегалия или лимфаденопатия определяются менее чем у 20% пациентов [4].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния: ОПЛ устанавливают независимо от процентного содержания бластных клеток в пунктате костного мозга или в периферической крови (ПК) при наличии патогномоничной для ОПЛ транслокации t(15;17) (q22; q11-12) PML::RARА или вариантной транслокации с участием RARA и другого гена-партнера.
2.1 Жалобы и анамнез
- Рекомендуется всем пациентам при подозрении или установленном диагнозе ОПЛ проведение сбора анамнеза и жалоб для верификации диагноза, для оценки состояния пациента, а также для установления факторов, которые могут оказать влияние на определение лечебной тактики пациента [1 - 3].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: Манифестация клинических проявлений ОПЛ сопровождается жалобами анемического характера, развитием геморрагического синдрома различной интенсивности и инфекционных осложнений на фоне нейтропении. Данные проявления могут развиться остро или постепенно нарастать. Также из анамнестических данных можно выявить связь с возможными токсическими, лекарственными агентами. Необходим тщательный сбор семейного анамнеза для исключения врожденных аномалий, а также на наличие сиблингов (родных братьев и/или сестер) [1 - 3, 5].
2.2 Физикальное обследование
- Рекомендуется всем пациентам проводить физикальное обследование, включающее измерение роста и массы тела, температуры тела (термометрия общая), оценку состояния кожных покровов, костно-суставной системы, выявление признаков геморрагического синдрома, наличие гепатоспленомегалии, лимфаденопатии, наличие признаков дисфункции сердца, легких, печени, органов эндокринной, нервной системы для верификации диагноза и оценки статуса по шкалам Восточной объединенной онкологической группы (ECOG) (см. Приложение Г3) [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: проводятся измерение роста и массы тела, температуры тела (термометрия общая), оценка состояния костно-суставной системы, выявление признаков геморрагического синдрома, наличия гепатоспленомегалии, лимфаденопатии, наличия признаков дисфункции сердца, легких, печени, органов эндокринной системы. В случае появления папулезных высыпаний на коже рассмотреть вопрос о биопсии кожи (подозрение на экстрамедуллярное лейкемическое поражение).
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам до начала и во время лечения ОПЛ выполнение общего (клинического) анализа крови (ПК) с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула) и исследованием уровня ретикулоцитов и тромбоцитов в крови для верификации диагноза, контроля за лечением и выработки тактики ведения пациента [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: У 80% пациентов манифестация заболевания характеризуется лейкопенией. Если у пациента в момент диагностики ОЛ определяется лейкопения < 1 x 109/л, особенно в сочетании с гипофибриногенемией, то с большой долей вероятности можно предполагать промиелоцитарный вариант ОМЛ. У 15 - 20% пациентов в дебюте болезни выявляется лейкоцитоз. У подавляющего числа пациентов (80 - 90%) определяется анемия, причем у половины из них концентрация гемоглобина составляет < 100 г/л. У 75% пациентов содержание тромбоцитов снижается до ![]() 50 x 109/л. Общий (клинический) анализ крови (особенно число лейкоцитов и тромбоцитов) выполняется ежедневно в первые дни терапии третиноином** для оценки риска возникновения дифференцировочного синдрома (ДС), затем - через день - два до констатации ремиссии. Развернутая формула - 2 раза в неделю.
50 x 109/л. Общий (клинический) анализ крови (особенно число лейкоцитов и тромбоцитов) выполняется ежедневно в первые дни терапии третиноином** для оценки риска возникновения дифференцировочного синдрома (ДС), затем - через день - два до констатации ремиссии. Развернутая формула - 2 раза в неделю.
- Рекомендуется до начала лечения ОПЛ для верификации диагноза, а также при подозрении на рецидив всем пациентам необходимо получение цитологического препарата костного мозга путем пункции для проведения цитологическое исследование мазка костного мозга (миелограмма) и цитохимическое исследование микропрепарата костного мозга, и всем больным после окончания программы индукции ремиссии, в ходе консолидации и поддерживающей терапии выполнять контрольное цитологическое исследование мазка костного мозга (миелограмма) оценку ответа на лечение, оценку состояния костномозгового кроветворения и диагностику рецидива [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: Бластные клетки при ОПЛ у большинства пациентов прежде всего характеризуются значительным ядерным полиморфизмом и наличием крупной фиолетово-бурой зернистости, густо заполняющей цитоплазму, большим количеством палочек Ауэра (классический гипергранулярный вариант ОПЛ) [6]. У 15 - 20% пациентов в цитоплазме опухолевых клеток обнаруживается лишь несколько мелких гранул или они не выявляются вовсе, при этом все остальные признаки (клинические, цитохимические, цитогенетические) ОПЛ присутствуют. Классическим признаком опухолевых клеток ОПЛ является очень выраженная цитохимическая реакция на миелопероксидазу (MPO), липиды, которая выявляется с помощью суданового черного (SBB), и на хлорацетатэстеразу.
- Рекомендуется всем пациентам с подозрением на ОПЛ до начала лечения выполнить иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге для повышения точности диагностики ОПЛ [1 - 3, 5, 7].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: иммунофенотипирование с использованием многоцветной проточной цитометрии может повысить точность морфологических исследований ОПЛ, но не является ключевым методом диагностики. Как правило, PML::RARА-положительные бластные клетки имеют иммунофенотип, аналогичный нормальным промиелоцитам (CD34-/+ гетерогенный, CD117-/+ dim, HLADR-/+ dim, CD13+/++, CD11b-). Тем не менее в отличие от нормальных промиелоцитов PML::RARА-положительные промиелоциты имеют крайне низкий уровень CD15 (CD15-/+ dim вместо CD15+++). Бластные клетки при гипогранулярной (вариантной) форме ОПЛ (M3V) часто коэкспрессируют Т-линейные маркеры, такие как CD2, совместно с миелоидными маркерами, такими как CD13 и CD33.
- Рекомендуется всем пациентам с подозрением на ОПЛ до начала лечения выполнить цитогенетическое исследование (кариотип), а также для получения быстрого ответа о наличии химерного гена PML::RARА - определение экспрессии pML-RAR-a (количественное), молекулярно-генетическое исследование мутаций в гене PML-RARA методом ПЦР для верификации диагноза и выполнения в дальнейшем мониторинга минимальной остаточной болезни (МОБ) [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: все случаи ОПЛ, установленного морфологическими и цитохимическими методами исследования, должны быть подтверждены методом ПЦР или FISH в момент установления диагноза, так как в 5 - 10% случаев при отсутствии классической t (15; 17) обнаруживается транскрипт PML/RARA.
Также следует помнить, что менее чем в 2% случаях ОПЛ при кариотипировании может обнаруживаться рекомбинация RARA с другим геном, отличным от PML: ZBTB16::RARA, NPM::RARA, NuMA::RARA, STAT5b::RARA, FIP1L12::RARA и т.д.
Эффективность таргетного лечения на основе ретиноидов и/или производных мышьяка (G01AB: Соединения мышьяка) строго зависит от наличия химерного гена PML::RARА, поэтому генетическое подтверждение диагноза является обязательным во всех случаях [8]. Генетическое подтверждение диагноза должно выполняться, если возможно, на бластных клетках, полученных из КМ. Идентификация ОПЛ-специфических генетических поломок в бластных клетках осуществляется с использованием стандартного кариотипирования, флуоресцентной in situ гибридизации (FISH), полимеразно-цепной реакции с обратной транскриптазой (ОТ-ПЦР) или анти-PML моноклональных антител.
В клиниках, в которых нет возможности выполнить цитогенетическое исследование (кариотип) или определение экспрессии pML-RAR-a (количественное), диагноз должен быть подтвержден в референс-лаборатории. Образцы КМ или ПК должны быть доставлены в лабораторию до начала терапии.
- Рекомендуется всем пациентам до начала лечения ОПЛ (с целью уточнения варианта мутации) и во время лечения ОПЛ (для выполнения мониторинга МОБ) проведение молекулярного исследования транскриптов гена PML::RARА bcr-1, bcr-2 и bcr-3 в КМ [9, 10].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: в клиниках, в которых нет возможности выполнить молекулярное исследование, диагноз должен быть подтвержден в референс-лаборатории. Образцы КМ или ПК должны быть доставлены в лабораторию до начала терапии. Варианты транскрипта PML/RARA (bcr1, bcr2, bcr3) и экспрессия транскрипта RARA-PML служат маркерами для мониторинга МОБ при ОПЛ с t (15; 17), но не определяют прогноз заболевания.
- Рекомендуется всем пациентам до начала и во время лечения ОПЛ в ходе терапии проведение биохимического анализа крови общетерапевтического (исследование уровней общего белка, альбумина, мочевины, креатинина, калия, натрия, общего кальция в крови, исследование уровня общего магния в сыворотке крови, определение активности лактатдегидрогеназы, щелочной фосфатазы, аланинаминотрансферазы, аспартатаминотрансферазы в крови, исследование уровней общего, свободного и связанного билирубина в крови) для диагностики сопутствующей патологии (заболеваний) и определения тактики сопроводительной терапии [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам до начала и во время лечения ОПЛ оценка коагулограммы (ориентировочное исследование системы гемостаза), определение активированного частичного тромбопластинового времени, определение протромбинового времени в крови или в плазме, определение протромбинового времени, тромбинового времени, исследование уровня фибриногена в крови для диагностики сопутствующей патологии и осложнений, а также определения тактики сопроводительной терапии [1, 2, 11].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: Лабораторные признаки диссеминированного внутрисосудистого свертывания (ДВС) и истощенного фибринолиза определяются у 80 - 90% пациентов [4].
У пациентов с малейшими признаками коагулопатиии на этапе индукции ремиссии все указанные показатели должны мониторироваться ежедневно. Если есть возможность, в систему мониторинга целесообразно включить тромбоэластографию.
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии выполнять общий (клинический) анализ мочи с частотой от еженедельного до ежемесячного для диагностики сопутствующей патологии и определения тактики сопроводительной терапии [1, 3, 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: при наличии показаний выполняются дополнительные исследования мочи, например, для исключения инфекции и уточнения типа возбудителя - исследование мочи методом Нечипоренко, исследование мочи методом Зимницкого, различные микробиологические (культуральные) исследования мочи и микроскопическое исследование мочи.
- Не рекомендуется рутинное молекулярно-генетическое исследование мутации гена FLT3 (fms-подобная тирозин-киназа-3) в ПК (молекулярно-генетическое исследование мутации гена FLT3 (fmsподобная тирозин-киназа третьего типа) в крови) или КМ (молекулярно-генетическое исследование мутации гена FLT3 (fms-подобная тирозин-киназа третьего типа) в костном мозге) всем пациентам с впервые диагностированным ОПЛ [2, 3].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: мутации в гене, кодирующем FMS-подобную тирозинкиназу-3 (FLT3), при ОПЛ наблюдаются чаще, чем при других ОМЛ - у 30 - 40% пациентов. Однако, хотя FLT3-мутации ассоциированы с более высоким числом лейкоцитов в момент диагностики ОЛ, в лечении впервые диагностированного ОПЛ ингибиторы FLT3 (L01E: Ингибиторы протеинкиназы) не используются.
- Рекомендуется всем пациентам, достигшим ремиссии, проводить определение экспрессии PML-RARA (количественное) для оценки МОБ методом ПЦР каждые 2 мес. в течение первого года лечения, затем 1 раз в 3 месяца в течение 2 лет после завершения консолидации [1, 3, 4, 12 - 14, 62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: больным из группы низкого риска (лейкоциты в дебюте заболевания < 10 x 109/л) при достижении ими молекулярной ремиссии мониторинг можно осуществлять только в течение первого года лечения.
- Рекомендуется использовать КМ в качестве материала для определения МОБ, поскольку исследование МОБ в КМ более достоверно (выше чувствительность), чем в ПК [14].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется для пациентов с ПЦР-позитивным результатом, полученным после консолидации, исследование КМ (цитологическое исследование мазка костного мозга (миелограмма) и определение экспрессии PML-RARA (количественное)) повторить спустя 2 недели (желательно как в местной, так и в референс-лаборатории для получения независимого результата) [2, 4].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОПЛ с подозрением на экстрамедуллярное поражение (лейкемид, объемные образования) проведение биопсии с цитологическим и гистологическим исследованием биоптата при условии коррекции гипокоагуляции и тромбоцитопении [1, 3, 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: наиболее часто выполняется спинномозговая пункция с цитологическим исследованием клеток спинномозговой жидкости, бронхоальвеолярный лаваж с цитологическим исследованием лаважной жидкости, однако по показаниям может выполняться биопсия любого доступного органа и ткани с последующим цитологическим осследованием, в том числе - микропрепарата тканей полости рта, перитонеальной жидкости, микропрепарата кожи, препарата тканей лимфоузла, биоптатов опухолей, опухолеподобных образований костей, тканей печени, тканей толстой кишки, аспирата из полости матки, тканей влагалища, тканей матки, тканей предстательной железы, тканей яичка, почки, мочевого пузыря, пунктатов и отпечатков биоптатов опухолей забрюшинного пространства.
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии с частотой 1 раз в 3 - 6 месяцев молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии [2, 15].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии с частотой 1 раз в 3 - 6 месяцев выполнение молекулярно-биологического исследования крови на вирус гепатита B (Hepatitis B virus) и молекулярно-биологического исследования крови на вирус гепатита C (Hepatitis C virus) с целью уточнения риска реактивации вирусного гепатита и в случае необходимости - ее профилактики [2, 16, 17].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении на ОПЛ, а также в случае развития рецидива и после выполнения алло-ТГСК определение основных групп крови по системе AB0 и определение антигена D системы Резус (резус-фактор) для возможности выполнения заместительной гемокомпонентной терапии при наличии показаний до, во время или после терапии [2, 18].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с рецидивом ОПЛ после достижения второй и последующих ремиссий, пациентам с персистенцией химерного транскрипта PML/RARA, а также их сиблингам определение HLA-антигенов и консультация в трансплантационном центре с целью определения целесообразности и возможности выполнения ауто- или алло-ТГСК [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам на момент диагностики ОПЛ и в ходе терапии выполнять регулярно (при лечении мышьяка триоксидом - не реже 1 раза в неделю в период индукции ремиссии (ИР), далее - 1 раз в 2 - 3 недели) регистрацию, расшифровку, описание и интерпретацию электрокардиографических данных для выявления и/или мониторинга нарушений проводимости импульсов в сердечной мышце для своевременной диагностики синдрома удлиненного QT-интервала. Предпочтительно отслеживание QTcF [19, 20].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, а также в ходе лечения ежемесячное (с учетом наличия сопутствующей патологии и клинической ситуации может быть чаще), а также при необходимости в любой момент в течение всего периода лечения выполнение эхокардиографии для оценки функционального состояния сердечной мышцы [2, 20].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, в ходе лечения с частотой от 1 раза в месяц или реже (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение рентгенографии легких и/или компьютерной томографии (КТ) органов грудной полости для выявления изменений легочной ткани и органов средостения [2, 4].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, в ходе лечения с частотой от 1 раза в месяц и реже (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение КТ головного мозга без контраста для выявления и/или мониторинга изменений в структурах головного мозга [2, 4].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: КТ головного мозга при ОПЛ надо выполнять всем пациентам в первые дни диагностики, так как могут быть бессимптомные интракраниальные кровоизлияния. При появлении головных болей, менингизма, сонливости, загруженности на фоне терапии ретиноидами КТ головы выполняется обязательно, а спинномозговая пункция выполняется после КТ (если позволяет количество тромбоцитов).
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, в ходе лечения с частотой от 1 раза в месяц или реже (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение ультразвукового исследования (УЗИ) органов брюшной полости (комплексного) с определением размеров печени, селезенки и внутрибрюшных лимфатических узлов, а также УЗИ органов малого таза комплексного (трансвагинального и трансабдоминального) у женщин и предстательной железы у мужчин для диагностики и мониторинга сопутствующей патологии [2, 4].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ на любом этапе диагностики и лечения при наличии клинических показаний проведение необходимых инструментальных исследований (ларингоскопия, бронхоскопия, трахеоскопия, торакоскопия, эзофагогастродуоденоскопия, колоноскопия, цистоскопия и других) для уточнения типа поражения и контроля лечения [2, 4].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
2.5 Иные диагностические исследования
- Рекомендуется всем пациентам с подозрением на экстрамедуллярное поражение при ОПЛ выполнение биопсии образования и патологоанатомического исследования с применением иммуногистохимических методов для верификации диагноза [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуются всем пациентам с ОПЛ при наличии показаний и определении сопутствующей патологии (с коморбидностью, которая может повлиять на выбор программы противоопухолевой терапии), на любом этапе диагностики и лечения прием (осмотр, консультация) соответствующего врача-специалиста (врача-хирурга, врача-сердечно-сосудистого хирурга, врача-кардиолога, врача-невролога, врача-нейрохирурга, врача-оториноларинолога, врача-офтальмолога, врача-уролога, врача-нефролога, врача-колопроктолога, врача-эндокринолога, врача-пульмонолога, врача-фтизиатра, врача-гастроэнтеролога, врача-дерматовенеролога врача-стоматолога-терапевта, врача-стоматолога-хирурга, врача-травматолога-ортопеда, врача-психиатра и др. - первичный и повторный), всем женщинам - прием (осмотр, консультация) врача-акушера-гинеколога первичный [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Схемы лечения с указанием режимов дозирования - см. приложение А3.1
3.1. Основные принципы лечения ОПЛ
- Рекомендуется пациентам при возникновении подозрений на ОПЛ клиническую ситуацию и любые действия в отношении пациента расценивать как неотложные и незамедлительные, в том числе до генетического подтверждения диагноза начинать сопроводительную терапию, направленную на коррекцию гемостаза, и специфическую терапию #третиноином** в дозе 45 мг/м2 в сутки до полной ремиссии (см. раздел 3.2. "Первичные действия по проведению сопроводительной терапии при подозрении на диагноз ОПЛ" и раздел 3.3.3. "Лечение коагулопатии") [1 - 3, 5, 37].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: хотя существует общий консенсус в отношении необходимости молекулярно-генетического подтверждения диагноза ОПЛ, дифференцирующая (таргетная) и сопроводительная терапия должны быть начаты до получения результатов генетических тестов. Необходимо учитывать любые подозрения на ОПЛ: наличие у пациента тяжелой коагулопатии, геморрагического синдрома, лейкопении, характерной морфологической картины бластных клеток. Во всех таких случаях следует начинать терапию #третиноином** немедленно и продолжать ее до момента подтверждения диагноза или его опровержения на основе генетического исследования.
- Рекомендуется пациентам с верифицированным ОПЛ индукционная терапия, включающая сочетанное применение #третиноина** в дозе 45 мг/м2 в сутки и антрациклинов с цитарабином** или без него (стандартный подход, см. Приложение А3.1. Протоколы лечения острого промилоцитарного синдрома: схема лечения ОПЛ по программе AIDA/mAIDA) либо третиноина** и мышьяка триоксида (альтернативный подход, см. Приложение А3.1. Протоколы лечения острого промилоцитарного синдрома: Схема лечения ОПЛ по программе ATO + ATRA) [1 - 3, 5, 37].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: всем пациентам независимо от инициального лейкоцитоза курс ХТ должен быть начат не позднее 3-го дня от начала лечения #третиноина**. Пациентам с числом лейкоцитов ![]() 10 x 109/л курс противоопухолевыми препаратами начинают одномоментно с #третиноином**. Оптимальным днем начала курса ХТ для пациентов с числом лейкоцитов < 10 x 109/л может считаться 2-й день от начала приема #третиноина**, поскольку к этому времени уже должен быть подтвержден диагноз ОПЛ и вероятность развития раннего ретиноидного синдрома крайне мала.
10 x 109/л курс противоопухолевыми препаратами начинают одномоментно с #третиноином**. Оптимальным днем начала курса ХТ для пациентов с числом лейкоцитов < 10 x 109/л может считаться 2-й день от начала приема #третиноина**, поскольку к этому времени уже должен быть подтвержден диагноз ОПЛ и вероятность развития раннего ретиноидного синдрома крайне мала.
3.2. Первичные действия по проведению сопроводительной терапии при подозрении на диагноз ОПЛ
Сопроводительная терапия, направленная на коррекцию гемостаза
Внутримозговые кровоизлияния, легочные и другие кровотечения являются частыми жизнеугрожающими осложнениями ОПЛ вследствие грубых коагуляционных нарушений. Эти осложнения не только становятся наиболее частой причиной смерти на ранних этапах индукционной терапии, но нередко развиваются до установления диагноза ОПЛ и начала терапии [21, 22].
- Рекомендуется всем пациентам начало сопроводительной терапии, направленной на коррекцию коагулопатии, начинать немедленно при минимальном подозрении на ОПЛ [23, 24].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
Комментарии: терапия должна включать трансфузии свежезамороженной плазмы (СЗП), криопреципитата, концентрата тромбоцитов для поддержания уровня концентрации фибриногена > 2 г/л и количества тромбоцитов > 50 x 109/л. Мониторинг этих показателей должен выполняться по крайней мере 1 раз в день (при необходимости - чаще). Такая терапия должна продолжаться в течение всего периода индукционной терапии до исчезновения всех клинических и лабораторных признаков коагулопатии. Следует обращать внимание на факторы, повышающие риск развития фатальных кровоизлияний и кровотечений. Эти факторы следующие: уже состоявшееся или активное кровотечение, гипофибриногенемия (< 1,0 г/л), повышение уровня продуктов деградации фибрина или D-димеров в сочетании с увеличением протромбинового времени или активированного частичного тромбопластинового времени, а также гиперлейкоцитоз, наличие бластных клеток в ПК, высокий уровень креатинина, плохой соматический статус. Следует избегать катетеризации центральных вен, спинномозговых пункций и других инвазивных процедур (например, бронхоскопии) перед началом терапии и в период ИР в связи с высоким риском геморрагических осложнений. Проведение интратекальной химиотерапии и инвазивных методом обследования и лечения требует поддержания количества тромбоцитов ![]() 100 x 109/л. Установка центрального венозного катетера должна выполняться опытными врачами только после коррекции коагуляционных нарушений. Кроме того, прокоагуляционный статус при ОПЛ может не только приводить к увеличению риска геморрагических осложнений, но и увеличивать риск тромбозов. Преимущество от использования гепарина натрия**, транексамовой кислоты**, аминокапроновой кислоты**, других антикоагулянтов (B01A: Антитромботические средства) или ингибиторов фибринолиза спорно и не доказано, и эти препараты не должны использоваться вне клинических испытаний. Есть также сообщения о случаях использования рекомбинантного фактора свертывания крови VII** в случае тяжелого, жизнеугрожающего кровотечения [25, 26].
100 x 109/л. Установка центрального венозного катетера должна выполняться опытными врачами только после коррекции коагуляционных нарушений. Кроме того, прокоагуляционный статус при ОПЛ может не только приводить к увеличению риска геморрагических осложнений, но и увеличивать риск тромбозов. Преимущество от использования гепарина натрия**, транексамовой кислоты**, аминокапроновой кислоты**, других антикоагулянтов (B01A: Антитромботические средства) или ингибиторов фибринолиза спорно и не доказано, и эти препараты не должны использоваться вне клинических испытаний. Есть также сообщения о случаях использования рекомбинантного фактора свертывания крови VII** в случае тяжелого, жизнеугрожающего кровотечения [25, 26].
3.3. Лечение пациентов с впервые установленным диагнозом ОПЛ
3.3.1. Специфическая (таргетная, целенаправленная) терапия индукции ремиссии
- Рекомендуется пациентам с впервые выявленным ОПЛ терапия индукции ремиссии, представляющая собой одновременное применение дифференцирующего лечения (#третиноин** в дозе 45 мг/м2 в сутки) и цитостатического воздействия, включающего высокие дозы антрациклинов (L01DB: Антрациклины и родственные соединения) и цитарабина** (могут применяться режимы AIDA, 7+3 или другие - см. приложение А3.1.) для оптимальной терапии и достижения хороших результатов лечения [27, 37].
Уровень убедительности рекомендации - A (уровень достоверности доказательств - 2)
Комментарии: самые первые рандомизированные исследования по сочетанному применению #третиноина** и ХТ показали безусловные преимущества данного подхода перед стандартной ХТ: французская группа продемонстрировала в рандомизированном исследовании APL-91, что процент достижения ремиссии в группе, где с ХТ применялась и #третиноин**, составил 91% в сравнении с 81% в группе ХТ. Анализ долгосрочной эффективности лечения этих же пациентов показал, что четырехлетняя бессобытийная выживаемость пациентов, которым проводилась ХТ совместно с #третиноином**, составила 62% в сравнении с 15% у пациентов, у которых была только ХТ (p < 0,0001) [28]. Однозначных жестких рекомендаций по выбору программы ХТ нет. Большинство исследователей склоняются к применению риск-адаптированного испанского протокола AIDA, поскольку при одинаковой эффективности у него существенно меньшие показатели токсичности. [27].
- Рекомендуется пациентам с ОПЛ низкого риска при наличии возможности применение в индукционной терапии комбинации третиноина** и мышьяка триоксидом (см. Приложение А3.1. Протоколы лечения острого промилоцитарного синдрома: Схема лечения ОПЛ по программе ATO + ATRA)) [27].
Уровень убедительности рекомендации - A (уровень достоверности доказательств - 2)
Комментарии: частота достижения ПР в этих клинических исследованиях, оценивавших эффективность терапии мышьяка триоксидом, варьировала от 86 до 95%. Однако следует отметить, что мышьяка триоксид сочетался с терапией третиноином** и/или ХТ. [30 - 34].
Поскольку мышьяка триоксид стали широко применять в качестве терапии как 2-й, так и 1-й линии у пациентов с ОПЛ, то побочным эффектам, возникающим вследствие его использования, постоянно уделяют существенное внимание. К серьезным осложнениям относят синдром дифференцировки опухолевых клеток ОПЛ, развитие гиперлейкоцитоза, удлинение QT/QTc-интервала, периферическую полинейропатию, повреждение печени и почек [33, 34].
- Рекомендуется продолжить лечение #третиноином** до констатации полной гематологической ремиссии [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Не рекомендуется менять стандартную индукционную терапию в зависимости от выявления маркеров, которые рассматриваются как факторы неблагоприятного прогноза (такие как вторичные хромосомные нарушения, мутация в гене FLT3, экспрессия CD56 и bcr3-вариант транскрипта PML/RARA) [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Не рекомендуется модифицировать лечение, основываясь на обнаружении бластных клеток в КМ, даже на 50-й и более день лечения (поздняя терминальная дифференцировка) и при выявлении химерного гена с помощью цитогенетического или молекулярного анализа в эти же сроки [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОПЛ с вариантной транслокацией, отличной от PML-RARA, проводить лечение #третиноином** и/или мышьяка триоксидом только при наличии чувствительности к данным препаратам [1].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: случаи ОПЛ с вариантной транслокацией крайне редки. Если для ОПЛ с транслокацией ZBTB16-RARA зарегистрировано чуть более 30 случаев, то количество описаний остальных исчисляется единицами. Поэтому тактика противоопухолевой и сопроводительной терапии для варинатных ОПЛ разработана слабо. Можно сказать, что использование третиноина и мышьяка триоксида является оправданным только при наличии к ним чувствительности. При наличии резистентности пациентам должна рассматриваться терапия на основе применения венетоклакса и гипометилирующих препаратов. Например, описаны случаи эффективности терапии ОПЛ с транслокацией RARA::HNRNPCP2, RARA::THRAP3, PLZF-RARA венетоклаксом в сочетании с гипометилирующей терапией, при транслокации STAT5B::RARA - сочетания венетоклакса и химиотерапии. Также есть сообщения о возможности достижения полной ремиссии при ОПЛ с транслокацией ZBTB16-RARA при использовании монотерапии венетоклакса [153 - 157]. Данные о чувствительности ОПЛ с вариантными транслокациями к дифференцирующей терапии представлены в приложении А3.5.
3.3.2. Лечение коагулопатии
- Рекомендуется пациентам с верифицированным ОПЛ в процессе индукционной терапии применять трансфузионную терапию концентратами тромбоцитов для поддержания уровня тромбоцитов крови ![]() 50 x 109/л и СЗП/криопреципитатом для поддержания уровня фибриногена > 2 г/л, протромбинового индекса - > 70% [131, 132].
50 x 109/л и СЗП/криопреципитатом для поддержания уровня фибриногена > 2 г/л, протромбинового индекса - > 70% [131, 132].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: использование #третиноина** не отменило агрессивной заместительной терапии компонентами крови, а лишь несколько уменьшило объемы используемых трансфузионных средств.
- Не рекомендуется использовать в рутинной практике гепарин натрия**, транексамовую кислоту**, другие антикоагулянты или ингибиторы фибринолиза, так как их преимущество остается спорным [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
3.3.3. Лечение гиперлейкоцитоза
- Рекомендуется пациентам с верифицированным ОПЛ с гиперлейкоцитозом (лейкоциты более 50 x 109/л) на фоне программы ХТ начало введение антрациклинов с первого дня терапии #третиноином** [1 - 3, 5, 35].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с верифицированным ОПЛ с гиперлейкоцитозом (лейкоциты более 50 x 109/л) на фоне программы ХТ проведение плазмаферезов (плазмаобменов до 1,5 - 2 л) [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: выполнение плазмаферезов показано не только в качестве процедуры, направленной на профилактику и лечение синдрома распада опухоли, но также и на коррекцию коагуляционных осложнений (ДВС-синдром).
- Рекомендуется пациентам с ОПЛ с гиперлейкоцитозом в случае неэффективности циторедуктивной терапии антрациклинами использование лейкоцитафереза при условии максимально возможного контроля геморрагического синдрома [3].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
3.3.4. Лечение побочных эффектов #третиноина** и мышьяка триоксида. Профилактика и лечение синдрома дифференцировки опухолевых клеток
- Рекомендуется всем пациентам подбирать индивидуально режим терапии #третиноином** и мышьяка триоксидом, при необходимости его изменять для уменьшения побочного действия препарата и предотвращения развития или уменьшения проявлений ДС (см. приложения А 3.2., А3.3.) [35].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОПЛ при увеличении количества лейкоцитов > 10 x 109/л на фоне терапии назначать #дексаметазон** в дозе 4 мг 2 раза в сутки внутривенно (в/в) в течение 2 - 3 дней с целью профилактики развития ДС [62].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется у пациентов с ОПЛ из группы низкого риска, получающих терапию #третиноином** и #мышьяка триоксидом, в случае увеличения количества лейкоцитов более 10 х 109/л на фоне курса индукции применять #гидроксикарбамид** в дозе 2 г в день до снижения количества лейкоцитов менее 10 x 109/л [1, 3].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется у пациентов с ОПЛ в случае увеличения количества лейкоцитов более 10 x 109/л на фоне дифференцировочного синдрома применять #гидроксикарбамид** в дозе 2 г в день до снижения количества лейкоцитов менее 10 x 109/л [1, 3].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОПЛ при увеличении количества лейкоцитов на фоне терапии, сопровождающегося выраженными болями в костях и осслагиями, проводить циторедуктивную терапию [62].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5
Комментарии: в случае возникновения клинически значимого лейкоцитоза с целью иторедукции назначается цитарабин, 100 мг в/в 2 раза в день (не более 3 введений). При неэффективности циторедукции возможна временная отмена дифференцирующей терапии.
- Рекомендуется всем пациентам с ОПЛ с минимальными подозрениями на начало развития ДС незамедлительное назначение #дексаметазона** в дозе 10 мг/м2 2 раза в сутки внутривенно до купирования ДС [35].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: введение #дексаметазона** даже при малейшем подозрении на ДС является стандартным подходом к лечению ДС, несмотря на то что прямые доказательства тому, что профилактическое введение глюкокортикоидов снижает летальность, связанную с этим синдромом, отсутствуют.
- Рекомендуется всем пациентам с ОПЛ проводить строгий контроль диуреза и агрессивную диуретическую терапию в связи с высоким риском развития отечного синдрома и объемной перегрузки [171, 172].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: применение #третиноина и мышьяка триоксида может вызывать значительную задержку жидкости, которая в сочетании с необходимыми при ОПЛ массивными трансфузиями концентрата тромбоцитов, свежезамороженной плазмы, а также внутривенных инфузий, что может привести к отечному синдрому и, как следствие, легочной и полиорганной недостаточности, что может потребовать проведения искусственной вентиляции легких и заместительной почечной терапии. Кроме того, возможно развитие острого почечного повреждения, связанного с синдромом распада опухоли и назначением нефротоксичных препаратов. В таком случае важно строго контролировать наличие периферических отеков, свободной жидкости в полостях, объемы вводимой и выводимой жидкости, массу тела в динамике и величину центрального венозного давления (при наличии центрального венозного катетера). При признаках отрицательного диуреза или отечного синдрома необходимо проведение терапии петлевыми диуретиками под контролем артериального давления и концентрации электролитов в сыворотке крови. Важно дифференцировать изолированный отечный синдром от дифференцировочного синдрома, в симптомокомплекс которого тоже может входить наличие отеков, так как в первом случае назначение глюкокортикостероидных гормонов необоснованно.
- Рекомендуется временное прекращение специфической терапии (#третиноин** и/или мышьяка триоксид) только в случаях тяжело протекающего ДС [1 - 3, 5, 35].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
3.3.5. Оценка эффективности индукционной терапии
- Рекомендуется всем пациентам с ОПЛ выполнить цитологическое исследование мазка костного мозга (миелограмма) после окончания программы индукции ремиссии, для оценки ответа на лечение [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: У пациентов с ОПЛ после курса ХТ наблюдается две волны выхода из агранулоцитоза. Первое контрольное цитологическое исследование мазка костного мозга (миелограмму) следует выполнять не ранее завершения второй волны выхода, в среднем на 30-й день после завершения курса ХТ. Более ранний анализ пунктата КМ может привести к ложному подсчету процента бластных клеток, продолжающих дифференцироваться опухолевых клеток, которые через 7 - 10 дней полностью исчезнут из КМ. Таким образом, первое цитологическое исследование мазка костного мозга (миелограмма) осуществляется в среднем на 30-й день после последнего введения идарубицина** (то есть на 36 - 40-й день от начала курса) или при окончательном восстановлении показателей ПК.
У пациентов, индукционное лечение которым выполняют мышьяка триоксидом в сочетании с #третиноином**, описанная выше закономерность отсутствует.
- Не рекомендуется менять стандартную терапию в зависимости от достижения или недостижения молекулярной ремиссии после индукционной терапии [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: положительный результат ПЦР на этой стадии может отражать задержку созревания опухолевых клеток, а не истинную резистентность.
3.4. Консолидирующая терапия
- Рекомендуется пациентам с ОПЛ, завершившим индукционный этап лечения, применение консолидирующей терапии с включением #третиноина** для снижения вероятности развития рецидива заболевания [1 - 3, 5, 36].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: применение #третиноина** в стандартной дозе (45 мг/м2 в день) в течение 15 дней в сочетании с ХТ в период консолидирующего лечения снижает риск развития рецидива [37]. Российская группа по лечению ОЛ рекомендует применение #третиноина** на всех этапах терапии ОПЛ [4].
- Рекомендуется пациентам с ОПЛ, получавшим на индукционном этапе #третиноин** и ХТ, проводить 3 курса консолидации, включающей антрациклины (L01DB: Антрациклины и родственные соединения) (#идарубицин**, даунорубицин** и митоксантрон**) (см. приложение А 3.1.) [27].
Уровень убедительности рекомендации - A (уровень достоверности доказательств - 2)
- Рекомендуется пациентам с ОПЛ высокого риска, получавшим на индукционном этапе #третиноин** и ХТ, проводить консолидацию с включением по крайней мере 1 курса ХТ со стандартными или средними дозами цитарабина** (см. приложение А3.1.) [38].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
- Рекомендуется пациентам с ОПЛ, получавшим на индукционном этапе третиноин** и мышьяка триоксид, проводить консолидацию также комбинацией #третиноина** и мышьяка триоксида (см. приложение А3.1.) [33, 34].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 2)
Комментарий: в настоящее время проведены рандомизированные проспективные исследования, которые доказали высокую эффективность мышьяка триоксида при низкой токсичности в лечении пациентов с ОПЛ из группы низкого риска. В этих исследованиях были предусмотрены четыре 4-недельных курса консолидации мышьяка триоксида и восемь 2-недельных курсов #третиноином** [33, 34].
- Рекомендуется пациентам с ОПЛ, завершившим программу консолидирующей терапии, молекулярно-генетическое исследование мутаций в гене PML-RARA методом ПЦР с чувствительностью по крайней мере 1 x 10-4 по КМ для оценки молекулярной ремиссии [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
3.5. Поддерживающая терапия
- Рекомендуется у пациентов с ОПЛ, завершивших программу индукции и консолидации ремиссии без применения мышьяка триоксида, проводить поддерживающее лечение #третиноином**, #метотрексатом** и меркаптопурином** в течение двух лет либо до констатации рецидива [29, 39].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 2)
Комментарии: поддерживающая терапия меркаптопурином** в дозе 50 мг/м2 внутрь 1 раз в день постоянно (молоком не запивать) и #метотрексатом** в дозе 15 мг/м2 п/к или в/м 1 раз в неделю начинается через 30 дней после последнего курса консолидации. #третиноин** - в течение 2 нед. (1 - 15-й дни) и применяется 1 раз в 3 мес. [4]. ХТ прекращается через 2 года от момента завершения консолидации, если в течение всего периода наблюдения не были определены молекулярные рецидивы.
- Рекомендуется всем пациентам с ОПЛ, получающим поддерживающую терапию, регулярное выполнение общего (клинического) анализа крови (ПК) с подсчетом лейкоцитарной формулы и исследованием уровня ретикулоцитов и тромбоцитов для своевременной модификации доз цитостатических препаратов (L01: Противоопухолевые препараты) [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОПЛ, получающим поддерживающую терапию, с частотой 1 раз в 3 мес выполнять цитологическое исследование мазка костного мозга (миелограмму) а также молекулярно-генетическое исследование гена PML::RARA методом ПЦР с чувствительностью по крайней мере 1 x 10-4 по КМ для контроля МОБ и своевременной диагностики рецидива [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: при констатации молекулярного рецидива (дважды позитивный ответ ПЦР или сочетание ПЦР и FISH), возникшего на фоне поддерживающего лечения, терапия меняется.
3.6. Профилактика и терапия нейролейкемии
Поражение центральной нервной системы (ЦНС) является самым частым экстрамедуллярным очагом при ОПЛ. Так, по крайней мере около 10% гематологических рецидивов сопровождаются вовлечением ЦНС. Поэтому возможность вовлечения ЦНС следует рассматривать у любого из пациентов с ОПЛ с неврологическими симптомами, и она должна быть исключена у всех пациентов с рецидивом [2].
- Рекомендуется пациентам с ОПЛ высокого риска, с ранее диагностированной нейролейкемией, интракраниальными кровоизляниями в дебюте, а также пациентам с рецидивом ОПЛ при условии купирования коагуляционных нарушений выполнить спинномозговую пункцию для проведения общего (клинического) анализа спинномозговой жидкости и цитологического исследования клеток спинномозговой жидкости и профилактики нейролейкемии [62].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
Комментарии: Желательно поддерживать число тромбоцитов перед выполнением спинномозговой пункции 30 x 109/л и выше. Если уровень тромбоцитов не удается повысить до 30 x 109/л и выше, при отсутствии клинических признаков поражения центральной нервной системы от пункции можно воздержаться до повышения тромбоцитов в гемограмме выше 30 x 109/л.
Если у пациента определяется лейкоцитоз, первую спинномозговую пункцию следует отложить до редукции числа лейкоцитов менее 10 x 109/л.
- Рекомендуется пациентам с ОПЛ с диагностированной нейролейкемией проведение терапии нейролейкемии - выполнение спинномозговых пункций с интратекальными введением стандартного набора препаратов (#метотрексат** вводится в дозе 12,5 мг/м2, максимальная доза - 15 мг, концентрация его в растворе должна быть 1,5 мг/мл, то есть объем раствора должен составлять 10 мл; цитарабин** 20 мг/м2, объем раствора должен составлять 3 мл; #дексаметазон** 4 мг, объем раствора должен составлять 3 мл) с интервалом каждые 3 дня. После нормализации показателей ликвора должно быть сделано минимум 3 пункции с таким же интервалом между введениями [35, 62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Нейролейкемию диагностируют при обнаружении в спинномозговой жидкости, полученной при первой диагностической спинномозговой пункции, любого количества бластных клеток при любом цитозе или цитоза 15/3 и более (т.е. более 5 клеток в 1 мкл).
- Рекомендуется пациентам с рецидивом ОПЛ с нейролейкемией, после достижения ремиссии интратекальному введению метотрексата, цитарабина и дексаметазона, проведение краниального облучения [149].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: фракционированное облучение головы в суммарной дозе 24 Гр может рассматриваться для профилактики нейролейкемии у тех пациентов с рецидивом ОПЛ, у кого была достигнута ремиссия (достижение нормального клеточного состава спинномозговой жидкости по данным цитологического исследования ликвора и отсутствия клеток с аберрантным иммунофенотипом по данным проточной цитометрии) после системной и интратекальной терапии.
- Рекомендуется пациентам с ОПЛ с нейролейкемией, рефрактерной к интратекальному введению метотрексата, цитарабина и дексаметазона, добавление к противоопухолевой терапии мультикиназного ингибитора #сорафениба** (L01E: Ингибиторы протеинкиназы) [151].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: была продемонстрирована способность #сорафениба** проникать через гематоэнцефалический барьер с достижением терапевтических концентраций, благодаря чему он может быть использован в случаях с рефрактерной нейролекемией. В многоцентровом исследовании была показана эффективность сорафениба в дозе 400 мг 2 раза в день в течение 8 недель: из 27 пациентов с острыми лейкозами и рефрактерным поражением ЦНС у 21 была достигнута санация ликвора. Трое из 27 были пациентами с ОПЛ: у всех была достигнута ремиссия нейролейкемии. Эффективность сорафениба в этом исследовании не была связана с наличием мутации в гене FLT3.
- Рекомендуется для лечения рецидивов ОПЛ с вовлечением ЦНС, рефрактерных к терапии мышьяка триоксидом и интратекальным введениям, использование #венетоклакса** как в монотерапии, так и в сочетании с азацитидином [60,61].
Комментарии: есть сообщение об эффективности применения венетокласка у пациента с рецидивом ОПЛ с рефрактерным вовлечением ЦНС, у которого через две недели терапии венетоклаксом, сочетанной с интратекальными введениями химиопрепаратов, была достигнута санация ликвора. При этом было показано, что венетоклакс может пересекать гематоэнцефалический барьер и его концентрация в ликворе составляет приблизительно 1/1000 от концентрации в плазме. Также в сообщении Y.Li и др. комбинированная терапия венетоклаксом в дозе 400 мг в сутки (постепенное увеличение дозы с 100 до 400 мг за 3 дня) в течение 21 дня и азацитидином в дозе 75 мг/м2 в сутки в течение 7 дней позволила достичь ремиссии у пациента с рецидивирующей формой ОПЛ с поражением ЦНС.
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется пациентам с ОПЛ высокого риска, с ранее диагностированной нейролейкемией, интракраниальными кровоизлияниями в дебюте, а также пациентам с рецидивом ОПЛ после достижения первой ПР профилактика нейролейкемии интратекальным введением #метотрексата** 15 мг, цитарабина** 30 мг и #дексаметазона** 4 мг (введение лекарственных препаратов в спинномозговой канал) [62].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
Комментарий: поскольку большинство ЦНС-рецидивов возникает у пациентов с гиперлейкоцитозом, некоторые исследователи включают профилактику вовлечения ЦНС у пациентов группы высокого риска. Для таких пациентов целесообразно отложить профилактику нейролейкемии до момента достижения ПР, так как в период индукционной терапии очень высок риск осложнений, связанных со спинномозговой пункцией. Пациентам выполняется 5 спинномозговых пункций (с последовательным введением 3 препаратов) в период курсов индукции/консолидации, затем 1 раз в 3 мес на фоне поддерживающей терапии. [4].
- Не рекомендуется профилактика нейролейкемии у пациентов с ОПЛ низкого риска, т.е. если исходное число лейкоцитов не превышало 10 x 109/л [40].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
3.7. Особые случаи ОПЛ
3.7.1. Пациенты старшей возрастной группы
- Рекомендуется пациентов старше 60 лет в хорошем соматическом статусе лечить так же, как и остальных пациентов с ОПЛ с учетом коррекции доз цитостатических препаратов (L01: Противоопухолевые препараты) [41].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарий: в отличие от других форм ОМЛ, ОПЛ у пожилых пациентов выявляется сравнительно редко и имеет относительно благоприятный исход. Эффективность лечения пожилых пациентов с ОПЛ сопоставима с таковой у молодых. Кроме того, пожилых пациентов чаще всего относят к группе низкого риска по сравнению молодыми. Однако у пожилых лиц значительно выше показатели токсичности, обусловленной терапией (более высокая частота развития сепсиса и увеличение смертности, связанной с лечением). Российская исследовательская группа рекомендует применять у пожилых пациентов протокол AIDA, в котором предусмотрено снижение дозировок антрациклинов (L01DB: Антрациклины и родственные соединения) [4].
- Рекомендуется пациентам с ОПЛ из группы высокого риска старше 60 лет или с сопутствующей кардиальной патологией, получающим терапию #третиноином** и #мышьяка триоксидом, для проведения циторедукции использовать сниженную дозу #идарубицина** 8 мг/м2 [62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.7.2. Пациенты с тяжелой сопутствующей патологией
- Рекомендуется пациентам с тяжелой сопутствующей патологией рассмотреть возможность лечения комбинацией третиноина** и мышьяка триоксида без использования цитостатических препаратов (см. Приложение А3.1. Протоколы лечения острого промилоцитарного синдрома: Схема лечения ОПЛ по программе ATO + ATRA)) [1 - 3, 5, 36].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: было разработано несколько альтернативных подходов в лечении пациентов с ОПЛ, направленных на сведение к минимуму применения ХТ. Большинство из них основаны на применении третиноина** и мышьяка триоксида с минимальной ХТ или без ХТ. Эти подходы могут быть использованы у пожилых и молодых пациентов с тяжелой сопутствующей патологией, которым интенсивная ХТ противопоказана (например, у пациентов с кардиальной патологией или другой серьезной органной патологией). Как и при терапии третиноином** с антрациклинами (L01DB: Антрациклины и родственные соединения), целью лечения у таких пациентов должно быть достижение молекулярной ремиссии с постоянным мониторингом МОБ с целью определения необходимости в дополнительной терапии.
- Рекомендуется пациентам с ОПЛ из группы высокого риска, которым невозможна терапия антрациклинами (идарубициин, даунорубицин) и антрацендионами (митоксантрон) из-за кардиальной патологии, сопровождающейся снижением фракции выброса левого желудочка, рассмотреть терапию третиноином**, мышьяка триоксидом и #гемтузумабом озогамицином без использования химиопрепаратов (см. Приложение А3.1. Протоколы лечения острого промиелоцитарного синдрома) [3].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: кардиотоксичность, связанная с антрациклинами, основывается на субклиническом повреждении клеток миокарда, прогрессирующего до бессимптомного снижения фракции выброса левого желудочка, а затем и до сердечной недостаточности. Клинические проявления могут возникнуть в любой момент после лечения вследствие неспособности сердца компенсировать первоначальное повреждение. В редких случаях острая кардиотоксичность может развиться в любое время во время или вскоре после лечения антрациклинами и, как правило, обратима после отмены препарата.
- Рекомендуется пациентам с ОПЛ, которым невозможна терапия мышьяка триоксидом из-за удлинения интервала QT, не корректирующегося симптоматической терапией, рассмотреть терапию третиноином** и #гемтузумабом озогамицином (см. Приложение А3.1. Протоколы лечения острого промилоцитарного синдрома) [3].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
3.7.3. Лечение ОПЛ при беременности
- Рекомендуется пациенткам при диагностике ОПЛ в течение I триместра беременности выполнить искусственное прерывание беременности по медицинским показаниям [42, 44].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: #третиноин** обладает высоким тератогенным действием и запрещена для использования в I триместре беременности.
- Не рекомендуется беременным пациентка с ОПЛ применять производные мышьяка (L01XX Прочие противоопухолевые препараты), как высоко эмбриотоксичные, в любом триместре беременности [43, 45]
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется у пациенток с ОПЛ в I триместре беременности, не желающих прерывать беременность, в качестве индукции использовать #даунорубицин** в монотерапии или в сочетании с #цитарабином** в дозах, аналогичных таковым при лечении небеременных пациенток (см. приложение А3.1.) [42].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
- Рекомендуется пациенткам с ОПЛ, диагностированным во II или III триместре беременности, в качестве индукции использовать #третиноин** в комбинации с #идарубицином** (см. приложение А3.1.) [43].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется беременным пациенткам выполнять родоразрешение методом кесарева сечения [43].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: выбор способа родоразрешения определяется состоянием плода, соматическим статусом пациентки, гематологическими показателями и строго в соответствии с акушерскими показаниями. Самопроизвольные роды могут быть выбраны как способ родоразрешения только при наличии у пациентки ремиссии ОМЛ, удовлетворительных показателей общего (клинического) анализа крови, при хорошем соматическом статусе пациентки и состоянии плода.
- Рекомендуется беременным пациенткам, получающим лечение по поводу ОПЛ, родоразрешение выполнять в период между курсами (оптимально на 33 - 34-й неделе) [43].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: несмотря на безопасность ХТ во II и III триместре беременности, ее проведение связано с высоким риском спонтанных абортов и преждевременных родов.
- Рекомендуется выполнять еженедельный комплекс исследований для оценки функционального состояния плода с особым вниманием к кардиальной функции на фоне программной ХТ ОПЛ [42].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
- Рекомендуется при плановом преждевременном родоразрешении на сроке 24 - 35 нед проводить профилактику синдрома острого респираторного дистресса у новорожденного - в/в введение #дексаметазона** 12 мг 2 введения через 12 часов за 2 суток до родов [46].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
- Не рекомендуется кормление грудью после родоразрешения на фоне продолжающейся специфической терапии [42].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 3)
- Рекомендуется пациенткам после родоразрешения для подавления лактации проведение терапии каберголином 0,5 мг 1 мг (2 таб.) однократно в первый день после родов, или для подавления установившейся лактации по 0,25 мг (1/2 таб.) 2 р/сут через каждые 12 ч в течение 2 дней (общая доза 1 мг) [135].
- Не рекомендуется женщинам с ОПЛ планирование беременности в период лечения #третиноином** во время консолидирующей или поддерживающей терапии (тератогенный эффект #третиноина**) [44].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
3.8. Лечение рецидива ОПЛ
- Рекомендуется у пациентов с подтвержденным молекулярным рецидивом ОПЛ (определенным как 2 последовательных ПЦР-положительных анализа со стабильным нарастанием уровня PML/RARA-транскрипта по результатам определения экспрессии pML-RAR-a (количественное)) незамедлительно начать терапию, включающую третиноин** и мышьяка триоксид (см. Приложение А3.1. Протоколы лечения острого промилоцитарного синдрома: Схема лечения ОПЛ по программе ATO + ATRA)), с целью предотвращения развернутого рецидива [47, 48].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: хотя третиноин** в сочетании с ХТ может быть использована в качестве терапии спасения, схемы на основе мышьяка триоксида в настоящее время считаются 1-й линией лечения рецидива ОПЛ после химиотерапии.
- Рекомендуется пациентам без молекулярной ремиссии после завершения курсов консолидации или с рецидивом ОПЛ выбирать противорецидивную терапию в зависимости от ранее проведенного лечения и длительности первой ремиссии [1].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: пациентам с рецидивом после терапии третиноином в сочетании с химиотерапией следует лечить с использованием подходов, основанных на использовании мышьяка триоксида. В случае рецидива после терапии третиноином и мышьяка триоксидом рекомендовано использование комбинации третиноина и химиотерапии. Исключением могут быть пациенты с поздним рецидивом (длительность первой ремиссии > 2 лет). При достижении повторной молекулярной ремиссии должна быть рассмотрена возможность выполнения трансплантации стволовых клеток крови (см. 3.11 Трансплантация гемопоэтических стволовых клеток при ОПЛ).
- Рекомендуется для пациентов с рецидивом ОПЛ, протекающим только с поражением ЦНС, индукционная терапия из минимум еженедельного (оптимально 2 раза в неделю) интратекального введения 3 препаратов (#метотрексата** 15 мг, цитарабина** 30 мг и #дексаметазона** 4 мг) до полной элиминации опухолевых клеток из спинномозговой жидкости, затем выполняется от 6 до 10 интратекальных введений в качестве консолидации. Параллельно обязательно должно проводиться системное лечение как при костномозговом рецидиве [144].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется для лечения рецидивов ОПЛ после лечения мышьяка триоксидом использование #бортезомиба** в сочетании с мышьяка триоксидом, #третиноином** и #митоксантроном** [58, 59].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 3)
Комментарии: Противорецидивная терапия включает курсы индукции и консолидации. Больным с достигнутой молекулярной ремиссией проводится ауто-ТГСК с обязательной профилактикой нейролейкемии с интратекальным введением #метотрексата** 1 раз в месяц в течение 6 месяцев. В случае невозможности выполнения ауто-ТГСК проводится поддерживающая терапия. В случае проявлений нейротоксичности на терапии #бортезомибом** возможно уменьшение дозы #бортезомиба** до 1 мг/м2 или до 0,7 мг/м2 на введение. Подробная схема протокола представлена в приложении (А3.1) [58, 59].
- Рекомендуется для лечения рецидивов ОПЛ, в том числе - экстрамедуллярных, включая рецидивы в ЦНС, рефрактерных к терапии комбинацией мышьяка триоксида, третиноина, бортезомиба и митоксантрона, использование #венетоклакса** 400 мг в сочетании с гипометилирующими препаратами [60, 152].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: в сообщении Y.Li и др. комбинированная терапия венетоклаксом в дозе 400 мг в сутки (постепенное увеличение дозы с 100 до 400 мг за 3 дня) в течение 21 дня и азацитидином в дозе 75 мг/м2 в сутки в течение 7 дней позволила достичь ремиссии у пациента с рецидивирующей формой ОПЛ с поражением ЦНС. Кроме того, относительно низкая токсичность венетоклакс-содержащих курсов позволяет рассматривать их в качестве альтернативы бортезомиб-содержащему курсу у пожилых и у пациентов с плохим соматическим статусом, а также у пациентов с тяжелой полинейропатией.
- Рекомендуется для лечения рецидивов ОПЛ с мутацией в гене FLT3, в том числе - экстрамедуллярных, включая рецидивы в ЦНС, рефрактерных к терапии мышьяка триоксидом, использование ингибиторов FLT3 (L01E: Ингибиторы протеинкиназы) в дозах и режимах, аналогичных для терапии ОМЛ, в сочетании с другими противоопухолевыми препаратами [150].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4).
Комментарии: для лечения пациентов с впервые выявленным ОПЛ с мутацией FLT3, ингибиторы тиразинкиназ не используются, так как долгосрочные результаты лечения пациентов с мутацией FLT3 третиноином в сочетании с химиотерапией и, в особенности, мышьяка триоксидом, аналогичны результатам лечения пациентов без мутации. Однако, ингибиторы FLT3 могут быть использованы при неэффективности других противоопухолевых препаратов для лечения пациентов с рецидивом ОПЛ. Есть сообщения об эффективности использования гилтеритиниба для лечения резистентного рецидива ОПЛ с эсктрамедуллярным компонентом [150].
3.9. Терапия ОПЛ, индуцированного предшествующей химиотерапией
- Рекомендуется лечение пациентов с ОПЛ, индуцированного предшествующей химиотерапией, как пациентов с первичным ОПЛ с поправкой на возможную кардиотоксичность вследствие предшествующей терапии антрациклинами (L01DB: Антрациклины и родственные соединения) и перенесенных инфекционных осложнений [1 - 3, 5, 36].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
3.10. Сопроводительная терапия
- Рекомендуется всем пациентам сопроводительная терапия для профилактики осложнений на фоне основной терапии [1 - 3, 5].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: с целью лечения гиперурикемии назначают аллопуринол** в дозах, согласно инструкции препарата. Объем вводимой жидкости при ОПЛ (раствор натрия хлорида**, раствор декстрозы**, СЗП, креоприцепитата, альбумина**, при необходимости, тромбоциты, эритроциты) в течение суток может составлять более 3 л, поэтому необходимы очень жесткий контроль водного баланса и стимуляция диуреза. Также следует помнить, что гиперволемия при ОПЛ может провоцировать более высокий риск легочных осложнений, сердечной недостаточности, имитировать синдром дифференцировки опухолевых клеток.
Важным для купирования осложнений на фоне начала ХТ при гиперлейкоцитозе, особенно на фоне большой волемической нагрузки и коагуляционных нарушений, является выполнение плазмообмена.
Назначение антибактериальных препаратов, противогрибковых препаратов системного действия, противовирусных препаратов регламентируется при ОПЛ теми же правилами, которые используются в лечении ОМЛ. Применение колониестимулирующих факторов при ОПЛ не показано.
- Рекомендуется всем пациентам с ОПЛ проводить строгий контроль диуреза и агрессивную диуретическую терапию в связи с высоким риском развития отечного синдрома и объемной перегрузки [171, 172].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарий: часто у пациентов с ОПЛ выраженные коагуляционные нарушения и инфекционные осложнения требуют проведения массивных трансфузий компонентов крови и внутривенных инфузий, что может привести к отечному синдрому и объемной перегрузке жидкостью. Кроме того, возможно развитие острого почечного повреждения, связанного с синдромом распада опухоли и назначением нефротоксичных препаратов. В таком случае важно строго контролировать наличие периферических отеков, свободной жидкости в полостях, объемы вводимой и выводимой жидкости, массу тела в динамике и величину центрального венозного давления (при наличии центрального венозного катетера). При признаках отрицательного диуреза или отечного синдрома необходимо проведение терапии петлевыми диуретиками под контролем артериального давления и концентрации электролитов в сыворотке крови. Важно дифференцировать изолированный отечный синдром от дифференцировочного синдрома, в симптомокомплекс которого тоже может входить наличие отеков, так как в первом случае назначение кглюкокортикостероидных гормонов необоснованно.
- Не рекомендуется пациентам с ОПЛ назначение филграстима** в связи с высоким риском развития интракраниальных кровоизлияний, за исключением необходимости сбора аутологичных стволовых клеток для выполнения ауто-ТГСК [170, 171].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: анализ медицинской документации 101 пациента с ОПЛ, получавшего терапию в MD Anderson, продемонстрировал, что именно введение филграстима пациентам с ОПЛ с лейкоцитопенией, а не течение заболевания привело к росту количества лейкоцитов. Однако для опухолевых промиелоцитов характерна высокая экспрессия рецептора Г-КСФ, следовательно, воздействие филграстима приводит к стимуляции роста преимущественно опухолевой популяции, а не нормальных миелоидных предшественников. Так как была доказана корреляция между количеством лейкоцитов с коагуляционными нарушениями, назначение филграстима может повысить риск развития жизнеугрожающих кровотечений при ОПЛ.
- Рекомендуется всем пациентам при проведении ХТ профилактика и лечение тошноты и рвоты в зависимости от эметогенного потенциала проводимого лечения согласно существующим профильным рекомендациям [52].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуется при возникновении острого или хронического болевого синдрома уточнение этиологии боли; при выявлении очага воспаления - проведение необходимых мероприятий по его лечению согласно соответствующим клиническим рекомендациям (включая при необходимости хирургическое лечение); при исключении инфекционно-воспалительной природы болевого синдрома рекомендуется проведение обезболивающей терапии согласно существующим протоколам обезболивания (см. соответствующие клинические рекомендации по хронической боли, клинические рекомендации по анестезиологии), в том числе по показаниям - с применением опиоидных анальгетиков, с учетом возможных противопоказаний, связанных с цитопенией, иными клиническими ситуациями [54].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОПЛ воздержаться от проведения инвазивных манипуляций в связи с коагуляционными нарушениями до их купирования [62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: в том числе следует воздержаться от установки ЦВК в связи с высоким риском образования массивных гематом в области шеи. В условиях плохо контролируемого гемостаза методом выбора обеспечения сосудистого доступа являются ПИЦВК, устанавливаемые через кубитальную или брахиальную вены в полость правого предсердия. ПИЦВК можно безопасно установить даже при самых выраженных нарушениях гемостаза, а высокопоточный ПИЦВК позволяет обеспечить достаточный объем инфузионной терапии [145].
- Рекомендуется пациенткам с ОПЛ при развитии маточных кровотечений выполнение общего (клинического) анализа крови и коагулограммы (ориентировочное исследование системы гемостаза) для определения необходимости назначения B02 Гемостатических средств или проведения трансфузионной терапии [135].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: показания к трансфузиям компонентами донорской крови определяются на основании результатов лабораторных исследований и выраженности геморрагического и анемического синдромов. Из гемостатических средств показано использование транексамовая кислоты** - 250 - 500 мг внутрь x 3 - 4 р/день; или внутривенно 1000 мг x 3 - 4 раза в сутки; апротинин и др [135].
- Рекомендуется пациенткам с ОПЛ при развитии маточных кровотечений выполнение ультразвукового исследования матки и придатков трансвагиального и приема (осмотр, консультация) врача-акушера-гинеколога повторного для определения причины кровотечений и объема необходимых диагностических и лечебных манипуляций [135].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациенткам с ОПЛ при развитии маточных кровотечений и неэффективности B02 Гемостатических средств или трансфузионной терапии назначение комбинированных оральных контрацептивов (G03A Гормональные контрацептивы системного действия) [135].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациенткам с ОПЛ при развитии маточных кровотечений и эффективности B02 Гемостатических средств, трансфузионной терапии и комбинированных оральных контрацептивов (G03A Гормональные контрацептивы системного действия) применение хирургических методов остановки маточных кровотечений при условии купирования коагуляционных нарушений [135].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОПЛ при развитии внутричерепных кровоизлияний придерживаться общепринятой тактики диагностики и терапии [136].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Не рекомендуется пациентам с ОПЛ при развитии внутричерепных кровоизлияний и наличии показаний для выполнения оперативного вмешательства при условии компенсации коагуляционных нарушений отказ или задержка в выполнении оперативного вмешательства [136].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОПЛ при развитии тромботических осложнений придерживаться общепринятой тактики диагностики, терапии и профилактики [137].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОПЛ, получающим терапию #третиноином** в сочетании с химиотерапией с признаками декомпенсации сердечно-сосудистой патологии снижение дозы антрациклинов (L01DB: Антрациклинов и родственных соединений) [138, 139].
Комментарии: при лечении по протоколу AIDA больным из группы низкого риска старше 55 лет или с сопутствующей кардиальной патологией митоксантрон вводится в течение трех дней. Больным из группы высокого риска (инициальный лейкоцитоз ![]() 10 x 109/л) в качестве второго курса консолидации ремиссии проводят курс 5 + 2 вместо 7 + 3.
10 x 109/л) в качестве второго курса консолидации ремиссии проводят курс 5 + 2 вместо 7 + 3.
- Рекомендуется пациентам с ОПЛ, получающим терапию #третиноином** и триоксидом мышьяка, избегать назначения препаратов, удлиняющих интервал QT [62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОПЛ, получающим терапию #третиноином** и триоксидом мышьяка, при удлинении интервала QTс более 500 мс отменить триоксид мышьяка и проводить симптоматическую терапию до нормализации QT [62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОПЛ проводить диагностику и лечение инфекционных осложнений согласно рекомендациям ведения пациентов с заболеваниями системы крови [140 - 142].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Не рекомендуется пациентам с ОПЛ проводить первичную противовирусную и антибактериальную профилактику [143].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОПЛ проводить первичную противогрибковую профилактику на этапах индукции и консолидации при ожидаемой длительной нейтропении (от 7 дней и более) [143].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: больным ОПЛ противогрибковые препараты (J02 Противогрибковые препараты системного действия) для профилактики назначают в индукции. Профилактика на этапе консолидации химиотерапии также может быть проведена при курсах химиотерапии, приводящих к длительной нейтропении. Препаратом выбора для профилактики является позаконазол** в суспензии (по 200 мг 3 раза после еды).
- Рекомендуется пациентам с ОПЛ, имевшим в анамнезе инвазивный микоз, вызванный плесневыми грибами (инвазивный аспергиллез, мукормикоз и др.), а также диссеминированный инвазивный кандидоз (инвазия в органы), проводить вторичную противогрибковую профилактику во время очередного курса химиотерапии, если ожидается нейтропения от 7 дней и более [143].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: вторичная противогрибковая профилактика показана при курсах химиотерапии, сопровождающихся нейтропенией, и при использовании иммуносупресивных препаратов. Для вторичной профилактики назначают препарат, при использовании которого было достигнуто излечение от инвазивного микоза, с 1-го дня послекурсового периода или при количестве гранулоцитов ![]() 0,5 x 109/л.
0,5 x 109/л.
3.11. Трансплантация гемопоэтических стволовых клеток при ОПЛ
- Не рекомендуется у пациентов с ОПЛ в первой молекулярной ремиссии выполнять ауто- или алло-ТГСК [1 - 3, 5, 36].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с рецидивом ОПЛ моложе 45 лет и с хорошим соматическим статусом, у которых получена 2-я молекулярная ПР, рассмотреть возможность выполнения ауто-ТГСК [49].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: заготовка аутологичных стволовых клеток производится в перерыве между курсами консолидации при условии достижения пациентом молекулярной ремиссии. Ауто-ТГСК может выполняться только в случае, если в заготовленном аутотрансплантате отсутствует молекулярный маркер. Ауто-ТГСК выполняется после завершения всех курсов консолидации и восстановления показателей крови. Трансплантации предшествует кондиционирование в миелоаблативном режиме с включением #бусульфана** и циклофосфамида** (см. приложение А3.4. Протокол кондиционирования в миелоаблативном режиме при выполнении ауто-ТГСК пациентам с рецидивом ОПЛ) [49].
- Рекомендуется пациентам с рецидивом ОПЛ, которым запланировано выполнение ауто-ТГСК, для мобилизации и сбора аутологичных стволовых клеток крови использование филграстима** в дозе 10 мг/кг/сут [130].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
Комментарии: в настоящее время принято считать, что минимальным количеством клеток, необходимым для проведения одной аутологичной трансплантации, является 2 x 106 CD34+ клеток/кг веса больного, а оптимальным количеством - значение 3 - 5 x 106 CD34+ клеток/кг [49].
- Рекомендуется у пациентов с ОПЛ, которым была выполнена ауто-ТГСК, проводить поддерживающее лечение #третиноином**, #метотрексатом** и меркаптопурином** в течение года либо до констатации рецидива [49].
Уровень убедительности рекомендации - B (уровень достоверности доказательств - 2)
Комментарии: поддерживающая терапия начинается через 30 дней после проведения ауто-ТГСК при условии восстановления показателей крови (тромбоциты более 100 * 109/л, нейтрофилы более 1 * 109/л). Включает меркаптопурин** в дозе 50 мг/м2 1 раз в день постоянно (молоком не запивать) и #метотрексат** в дозе 15 мг/м2 1 раз в неделю, #третиноин** - 45 мг/м2 внутрь ежедневно после еды (можно в 2 приема) в течение 2 нед. (1 - 15-й дни) и применяется 1 раз в 3 мес [62]. ХТ прекращается через 2 года от момента завершения консолидации, если в течение всего периода наблюдения не были определены молекулярные рецидивы [49].
- Не рекомендуется пациентам с рецидивом ОПЛ старше 40 лет или с отягощенным кардиологическим анамнезом выполнять ауто-ТГСК из-за высокого риска осложнений вследствие миелоаблативного кондиционирования [62].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется пациентам с рецидивом ОПЛ старше 40 лет или с отягощенным кардиологическим анамнезом при наличии полностью совместимого донора после достижения молекулярной ремиссии проведение алло-ТГСК с кондиционированием пониженной интенсивности [62].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется пациентам с рецидивом ОПЛ с цитогенетическими аномалиями, ассоциированными с МДС, после достижения молекулярной ремиссии проведение алло-ТГСК с кондиционированием пониженной интенсивности [62].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется пациентам с рецидивом ОПЛ старше 40 лет или с отягощенным кардиологическим анамнезом при невозможности выполнения алло-ТГСК выполнять проводить поддерживающее лечение, включающее меркаптопурин** в дозе 50 мг/м2 1 раз в день постоянно (молоком не запивать) и #метотрексат** в дозе 15 мг/м2 1 раз в неделю п/к или в/м, #третиноин** - 45 мг/м2 внутрь ежедневно после еды (можно в 2 приема) в течение 2 нед. (1 - 15-й дни) 1 раз в 3 мес. в течение года либо до констатации рецидива [62].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
- Рекомендуется пациентам с ОПЛ, у которых не достигнута 2-я молекулярная ремиссия, рассмотреть возможность выполнения алло-ТГСК [50].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 4)
3.12. Лечебное питание пациентов с ОПЛ
- Рекомендуется обеспечение пациентов с ОПЛ, госпитализированных в круглосуточный стационар, диетическим лечебным питанием в соответствии с приказами Министерства здравоохранения РФ, и с учетом соматического статуса и коморбидности пациента, а также с учетом ограничений в питании, связанных с наличием и степенью выраженности цитопении [146 - 148].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: организация диетического лечебного питания пациентов с ОПЛ при стационарном лечении в медицинских организациях проводится в соответствии приказами Министерства здравоохранения Российской Федерации от 05.08.2003 N 330 "О мерах по совершенствованию лечебного питания в лечебно-профилактических учреждениях Российской Федерации", от 21.06.2013 N 395н "Об утверждении норм лечебного питания" и от 23.09.2020 N 1008н "Об утверждении порядка обеспечения пациентов лечебным питанием" [146 - 148].
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется проведение реабилитации при возникновении осложнений после завершения программы терапии ОПЛ в рамках соответствующих нозологий [55].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Специальных методов реабилитации при ОПЛ не существует.
После окончания лечения рекомендуется вести здоровый образ жизни, исключить инсоляцию и физиотерапевтические процедуры. При проведении ХТ возможна кардио-, гепато-, нейро-, нефро- и другая токсичность, последствия которой могут проявляться и после ее окончания.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется в рамках диспансерного наблюдения пациентов после окончания программы терапии ОПЛ выполнять исследование общего (клинического) анализа крови (ПК), коагулограммы (ориентировочное исследование системы гемостаза), анализа крови биохимического общетерапевтического каждый месяц в течение первых 2 лет и затем 1 раз в 2 - 3 месяца до 5 лет от начала лечения; выполнять цитологическое исследование мазка костного мозга (миелограмму) с определением экспрессии pML-RAR-a (количественное) в течение 1-го года - 1 раз в 3 месяца, далее - 1 раз в 6 месяцев в течение 2-го года, далее - 1 раз в год до 5 лет наблюдения для контроля эффективности лечения и своевременного выявления рецидива [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Специфической профилактики возникновения ОПЛ не существует. Внеплановое выполнение общего (клинического) анализа крови показано при любых изменениях в состоянии пациента. Внеплановое исследование КМ (цитологическое исследование мазка костного мозга (миелограмму) и определение экспрессии pML-RAR-a (количественное)) показано при выявлении любых изменений гемограммы. Большинство рецидивов происходит в течение 1 - 3 лет после окончания терапии. Стандартизованные временные точки взятия КМ необходимы при мониторинге МОБ.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
- в соответствии с Положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
- в соответствии с порядком оказания помощи по профилю "гематология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
- на основе настоящих клинических рекомендаций;
- с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у больного острого промиелоцитарного лейкоза (ОПЛ) или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют больного на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог/врач-онколог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания. В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь больным с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении ОПЛ или подозрении на него в ходе оказания скорой медицинской помощи больного переводят или направляют в медицинские организации, оказывающие медицинскую помощь больным с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами/врачами-онкологами в медицинских организациях, оказывающих медицинскую помощь больным ОПЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь больным ОПЛ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, если потребуется - с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию больного.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилям "гематология" и "онкология" определяются врачом-гематологом/врачом-онкологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
- подтвержденный диагноз ОПЛ;
- проведение ИР;
- проведение консолидирующего лечения.
Показания для экстренной госпитализации:
- подозрение на диагноз ОПЛ.
Показания к выписке пациента из стационара:
- достижение ремиссии в ходе индукционного лечения;
- проведение терапии консолидации ремиссии.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами-специалистами медицинской организации, в которую планируется перевод.
Организационные вопросы. Учитывая рекомендации европейского и мирового сообщества, а также собственный опыт по лечению ОМЛ и ОПЛ в академических и региональных центрах, хотелось бы подчеркнуть, что лечение пациентов с ОЛ (в частности, ОПЛ) должно осуществляться лишь в тех медицинских организациях, в которых есть врачи всех специальностей (многопрофильные клинические больницы, при которых существуют собственные отделения переливания крови или доступна круглосуточная трансфузионная помощь) и охват населения у которых составляет не менее 500 тыс. Индукционная терапия должна проводиться лишь в тех центрах, в которых число пациентов с ОМЛ в год составляет не менее 5 и в которых выполняется в том числе и высокодозная ХТ. В соответствии с этими рекомендациями центры, которые проводят лечение 5 - 10 пациентов с ОМЛ в год, будут сталкиваться не более чем с 1 пациентом с ОПЛ каждые 2 года. Хотя это и ограничивает опыт небольших центров в лечении ОПЛ, совершенно ясно, что оптимальный результат зависит от быстрого проведения диагностических процедур, доступа к третиноину** и компонентам крови. Это подчеркивает необходимость создания национальных рекомендаций, клинических протоколов, проведения кооперированных исследований с целью повышения клинической настороженности и быстроты действий, которые необходимы для своевременной диагностики ОПЛ и адекватной сопроводительной терапии, направленной на снижение летальности в период индукции, независимо от величины гематологического центра.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1. Подготовка образцов для молекулярно-генетических исследований и их хранение
FISH
Для FISH-исследования необходимо от 3 до 4 мазков КМ и от 3 до 4 мазков ПК, полученных на момент установления диагноза. Образцы могут быть отправлены при комнатной температуре. Мазки, которые не используются немедленно, должны храниться при -20 °C, покрытые алюминиевой бумагой.
ОТ-ПЦР
Для выделения РНК и ОТ-ПЦР требуется 1 пробирка с КМ (2 - 3 мл) или 1 пробирка с ПК (20 - 30 мл, поскольку часто при ОПЛ регистрируется глубокая лейкопения), содержащая либо цитрат натрия, либо этилендиаминтетрауксусную кислоту (EDTA). Образцы КМ или ПК должны быть обработаны в течение 24 ч. Выделенные мононуклеарные клетки в гуанидине изотиоцианате могут храниться при -20 °C. Для всех исследований предпочтителен КМ.
Кариотипирование и FISH
Для обычного кариотипирования и FISH-исследования КМ (объем 1 - 2 мл) должен быть помещен в пробирку с гепарином и отправлен при комнатной температуре. Образцы, обработанные при поступлении в лабораторию в виде осажденных ядер, фиксированных с помощью метанола и уксусной кислоты (3:1), могут храниться при температуре -20 °C.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
У пациента с подозрением на ОПЛ выполнен сбор анамнеза (в том числе семейного и профессионального) и жалоб
Да/нет
2.
Пациенту с подозрением на ОПЛ проведено физикальное обследование, включающее измерение роста и массы тела, температуры тела, оценку состояния кожных покровов, костно-суставной системы, выявление признаков геморрагического синдрома, наличие гепатоспленомегалии, лимфаденопатии, наличие признаков дисфункции сердца, легких, печени, органов эндокринной, нервной системы
Да/нет
3.
Пациенту с подозрением на ОПЛ или с верифицированным ОПЛ до начала лечения и в ходе терапии выполнен общий (клинический) анализ крови (ПК) с подсчетом лейкоцитарной формулы и определением числа ретикулоцитов и тромбоцитов
Да/нет
4.
Пациенту с подозрением на ОПЛ или с верифицированным ОПЛ до начала лечения и в ходе терапии выполнен анализ крови биохимический общетерапевтический (общий белок, альбумин, мочевина, креатинин, калий, натрий, кальций, лактатдегидрогеназа, щелочная фосфатаза, трансаминазы аланиновая и аспарагиновая, билирубин общий, свободный и связанный)
Да/нет
5.
Пациенту с подозрением на ОПЛ или с верифицированным ОПЛ до начала лечения и в ходе терапии выполнена коагулограмма (ориентировочное исследование системы гемостаза) (активированное частичное тромбопластиновое время, протромбиновое время, тромбиновое время, фибриноген)
Да/нет
6.
У пациента с подозрением на ОПЛ или с верифицированным ОПЛ до начала лечения и в ходе терапии выполнено УЗИ органов брюшной полости (комплексное) с определением размеров печени, селезенки и внутрибрюшных лимфатических узлов, а также УЗИ органов малого таза комплексное (трансвагинальное и трансабдоминальное) у женщин и УЗИ предстательной железы у мужчин
Да/нет
7.
У пациента с подозрением на ОПЛ или с верифицированным ОПЛ до начала лечения и в ходе терапии выполнена рентгенография легких и/или КТ органов грудной полости
Да/нет
8.
У пациента с подозрением на ОПЛ или с верифицированным ОПЛ до начала лечения и в ходе терапии выполнена КТ головного мозга
Да/нет
9.
У пациента с подозрением на ОПЛ или с верифицированным ОПЛ до начала лечения и в ходе терапии выполнены цитологическое исследование мазка костного мозга (миелограмма) и цитохимическое исследование микропрепарата костного мозга
Да/нет
10.
Пациенту с ОПЛ цитогенетическое исследование (кариотип) или молекулярно-генетическое исследование транслокации t(15;17) в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH) или определение экспрессии pML-RAR-a (количественное)
Да/нет
11.
У пациента с подозрением на ОПЛ незамедлительно, до генетического подтверждения диагноза, начата сопроводительная терапия, направленная на коррекцию гемостаза, и специфическая терапия #третиноином**
Да/нет
12.
Пациенту с верифицированным ОПЛ проведена специфическая терапия, включающая дифференцирующее лечение (#третиноин**) и цитотоксическую терапию либо мышьяка триоксид
Да/нет
Список литературы
1. Sanz M.A. et al. Management of acute promyelocytic leukemia: updated recommendations from an expert panel of the European LeukemiaNet. Blood 2019; 133 (15): 1630 - 1643.
2. Савченко В.Г., Паровичникова Е.Н. Острый промиелоцитарный лейкоз. М.: Литерра, 2010. 200 p.
3. Acute Myeloid Leukemia. National Comprehensive Cancer Network (NCCN) Guidelines. 2 - 2024. [Electronic resource]. URL:https://www.nccn.org/professionals/physician_gls/pdf/aml
4. Паровичникова Е.Н., Соколов А.Н., Савченко В.Г. Протокол лечения острого промиелоцитарного лейкоза AIDA//Программное лечение заболеваний крови, под ред. Савченко В.Г. 2012. P. 265 - 287.
5. Tallman M.S., Altman J.K. How I treat acute promyelocytic leukemia//Blood. 2009. Vol. 114, N 25. P. 5126 - 5135.
6. Brain B.J. Acute promyelocytic leukemia//Leukemia Diagnosis/ed. Brain B.J. Blackwell Science, 1999. P. 14 - 19.
7. Bene M.C. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL).//Leukemia. 1995. Vol. 9, N 10. P. 1783 - 1786.
8. Rowley J.D., Golomb H.M., Dougherty C. 15/17 translocation, a consistent chromosomal change in acute promyelocytic leukaemia//The Lancet. 1977. Vol. 309, N 8010. P. 549 - 550.
9. Fukutani H. et al. Molecular Heterogeneity of the PML Gene Rearrangement in Acute Promyelocytic Leukemia: Prevalence and Clinical Significance//Japanese J. Cancer Res. 1993. Vol. 84, N 3. P. 257 - 264.
10. Baba S.M. et al. Influence of bcr-3  transcript on outcome in Acute Promyelocytic Leukemia patients of Kashmir treated with all-trans retinoic acid and/or arsenic tri-oxide.//Cancer Genet. 2019. Vol. 231 - 232. P. 14 - 21.
transcript on outcome in Acute Promyelocytic Leukemia patients of Kashmir treated with all-trans retinoic acid and/or arsenic tri-oxide.//Cancer Genet. 2019. Vol. 231 - 232. P. 14 - 21.
11. Ku G.H. et al. Venous thromboembolism in patients with acute leukemia: Incidence, risk factors, and effect on survival//Blood. 2009. Vol. 113, N 17. P. 3911 - 3917.
12. Grimwade D. The significance of minimal residual disease in patients with t(15;17)//Best Pract. Res. Clin. Haematol. Bailliere Tindall Ltd, 2002. Vol. 15, N 1. P. 137 - 158.
13. Chendamarai E. et al. Role of minimal residual disease monitoring in acute promyelocytic leukemia treated with arsenic trioxide in frontline therapy.//Blood. 2012. Vol. 119, N 15. P. 3413 - 3419.
14. Ravandi F., Walter R.B., Freeman S.D. Evaluating measurable residual disease in acute myeloid leukemia.//Blood Adv. 2018. Vol. 2, N 11. P. 1356 - 1366.
15. Fang R.C., Aboulafia D.M. HIV infection and myelodysplastic syndrome/acute myeloid leukemia//HIV-Associated Hematological Malignancies. 2016. P. 133 - 144.
16. Freeman A.J. et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection.//Hepatology. 2001. Vol. 34, N 4 Pt 1. P. 809 - 816.
17. Ribas A. et al. How important is hepatitis C virus (HCV)-infection in persons with acute leukemia?//Leuk. Res. 1997. Vol. 21, N 8. P. 785 - 788.
18. Leahy M.F., Mukhtar S.A. From blood transfusion to patient blood management: a new paradigm for patient care and cost assessment of blood transfusion practice.//Intern. Med. J. 2012. Vol. 42, N 3. P. 332 - 338.
19. Barbey J.T., Pezzullo J.C., Soignet S.L. Effect of arsenic trioxide on QT interval in patients with advanced malignancies//J. Clin. Oncol. 2003. Vol. 21, N 19. P. 3609 - 3615.
20. Herrmann J. et al. Evaluation and management of patients with heart disease and cancer: Cardio-oncology//Mayo Clin. Proc. 2014. Vol. 89, N 9. P. 1287 - 1306.
21. Park J.H. et al. Early death rate in acute promyelocytic leukemia remains high despite all-trans retinoic acid.//Blood. 2011. Vol. 118, N 5. P. 1248 - 1254.
22. Lehmann S. et al. Continuing high early death rate in acute promyelocytic leukemia: a population-based report from the Swedish Adult Acute Leukemia Registry.//Leukemia. 2011. Vol. 25, N 7. P. 1128 - 1134.
23. Mantha S., Tallman M.S., Soff G.A. What's new in the pathogenesis of the coagulopathy in acute promyelocytic leukemia?//Curr. Opin. Hematol. 2016. Vol. 23, N 2. P. 121 - 126.
24. Mantha S. et al. Determinants of fatal bleeding during induction therapy for acute promyelocytic leukemia in the ATRA era.//Blood. 2017. Vol. 129, N 13. P. 1763 - 1767.
25. Meijer K. et al. Successful treatment of massive hemoptysis in acute leukemia with recombinant factor VIIa.//Arch. Intern. Med. 2000. Vol. 160, N 14. P. 2216 - 2217.
26. Pemmaraju N. et al. Successful Treatment of Intracranial Hemorrhage with Recombinant Activated Factor VII in a Patient with Newly Diagnosed Acute Myeloid Leukemia: A Case Report and Review of the Literature.//Front. Oncol. 2015. Vol. 5. P. 29.
27. Li X. et al. Combined chemotherapy for acute promyelocytic leukemia: a meta-analysis//Hematology. Taylor and Francis Ltd., 2017. Vol. 22, N 8. P. 450 - 459.
28. Fenaux P. et al. Long-term follow-up confirms the benefit of all-trans retinoic acid in acute promyelocytic leukemia. European APL group.//Leukemia. 2000. Vol. 14, N 8. P. 1371 - 1377.
29. Fenaux P. et al. A randomized comparison of all transretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. The European APL Group.//Blood. 1999. Vol. 94, N 4. P. 1192 - 1200.
30. Shen Z.-X. et al. All-trans retinoic acid/As2O3 combination yields a high quality remission and survival in newly diagnosed acute promyelocytic leukemia.//Proc. Natl. Acad. Sci. U. S. A. 2004. Vol. 101, N 15. P. 5328 - 5335.
31. Powell B.L. et al. Arsenic trioxide improves event-free and overall survival for adults with acute promyelocytic leukemia: North American Leukemia Intergroup Study C9710.//Blood. 2010. Vol. 116, N 19. P. 3751 - 3757.
32. Iland H.J. et al. Use of arsenic trioxide in remission induction and consolidation therapy for acute promyelocytic leukaemia in the Australasian Leukaemia and Lymphoma Group (ALLG) APML4 study: A non-randomised phase 2 trial//Lancet Haematol. 2015. Vol. 2, N 9. P. e357-e366.
33. Lo-Coco F. et al. Retinoic Acid and Arsenic Trioxide for APL//N. Engl. J. Med. 2013. Vol. 369, N 2. P. 111 - 121.
34. Platzbecker U. et al. Improved Outcomes With ATRA and ATO compared with ATRA and Chemo in non-high-risk APL_Final Results of APL0406 trial//J. Clin. Oncol. American Society of Clinical Oncology, 2017. Vol. 35, N 6. P. 605 - 612.
35. Sanz M.A., Montesinos P. How we prevent and treat differentiation syndrome in patients with acute promyelocytic leukemia.//Blood. 2014. Vol. 123, N 18. P. 2777 - 2782.
36. Lo-Coco F., Cicconi L., Breccia M. Current standard treatment of adult acute promyelocytic leukaemia.//Br. J. Haematol. 2016. Vol. 172, N 6. P. 841 - 854.
37. Lo-Coco F. et al. Front-line treatment of acute promyelocytic leukemia with AIDA induction followed by risk-adapted consolidation for adults younger than 61 years: Results of the AIDA-2000 trial of the GIMEMA Group//Blood. 2010. Vol. 116, N 17. P. 3171 - 3179.
38. Sanz M.A. et al. Definition of relapse risk and role of nonanthracycline drugs for consolidation in patients with acute promyelocytic leukemia: a joint study of the PETHEMA and GIMEMA cooperative groups.//Blood. 2000. Vol. 96, N 4. P. 1247 - 1253.
39. Tallman M.S. et al. All-trans retinoic acid in acute promyelocytic leukemia: Long-term outcome and prognostic factor analysis from the North American Intergroup protocol//Blood. 2002. Vol. 100, N 13. P. 4298 - 4302.
40. Montesinos P. et al. Central nervous system involvement at first relapse in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline monochemotherapy without intrathecal prophylaxis.//Haematologica. 2009. Vol. 94, N 9. P. 1242 - 1249.
41. Finsinger P. et al. Acute promyelocytic leukemia in patients aged >70 years: the cure beyond the age.//Ann. Hematol. 2015. Vol. 94, N 2. P. 195 - 200.
42. Chang A., Patel S. Treatment of Acute Myeloid Leukemia During Pregnancy//Annals of Pharmacotherapy. 2015. Vol. 49, N 1. P. 48 - 68.
43. Троицкая В.В. et al. Лечение острого промиелоцитарного лейкоза на фоне беременности//Терапевтический архив. 2013. Vol. 10. P. 56 - 63.
44. Browne H., Mason G., Tang T. Retinoids and pregnancy: an update//Obstet. Gynaecol. 2014. Vol. 16. P. 7 - 11.
45. Arsenic trioxide Pregnancy and Breastfeeding Warnings [Electronic resource]. 2018. URL: https://www.drugs.com/pregnancy/arsenic-trioxide.html#ref_pregnancy.
46. Salem M.N., Abbas A.M., Ashry M. Dexamethasone for the prevention of neonatal respiratory morbidity before elective cesarean section at term//Proc. Obstet. Gynecol. 2016. Vol. 6, N 3. P. 1 - 10.
47. Gill H. et al. Long-term outcome of relapsed acute promyelocytic leukemia treated with oral arsenic trioxide-based reinduction and maintenance regimens: A 15-year prospective study.//Cancer. 2018. Vol. 124, N 11. P. 2316 - 2326.
48. Lengfelder E. et al. Arsenic trioxide-based therapy of relapsed acute promyelocytic leukemia: registry results from the European LeukemiaNet//Leukemia. 2015. Vol. 29, N 5. P. 1084 - 1091.
49. Ganzel C. et al. Autologous transplant remains the preferred therapy for relapsed APL in CR2//Bone Marrow Transplant. Nature Publishing Group, 2016. Vol. 51, N 9. P. 1180 - 1183.
50. Ramadan S.M. et al. Allogeneic stem cell transplantation for advanced acute promyelocytic leukemia in the ATRA and ATO era//Haematologica. 2012. Vol. 97, N 11. P. 1731 - 1735.
51. Furuya A. et al. Central nervous system involvement of acute promyelocytic leukemia, three case reports//Clin. Case Reports. Wiley, 2017. Vol. 5, N 5. P. 645 653.
52.  J. et al. Chemotherapy-induced nausea and vomiting in acute leukemia and stem cell transplant patients: results of a multicenter, observational study.//Haematologica. 2006. Vol. 91, N 1. P. 84 9 .
J. et al. Chemotherapy-induced nausea and vomiting in acute leukemia and stem cell transplant patients: results of a multicenter, observational study.//Haematologica. 2006. Vol. 91, N 1. P. 84 9 .
54. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
55. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
56. Sanz M.A. et al. A modified AIDA protocol with anthracycline-based consolidation results in high antileukemic efficacy and reduced toxicity in newly diagnosed PML/RAR-positive acute promyelocytic leukemia//Blood. 1999. Vol. 94, N 9. P. 3015 - 3021.
57. Burnett A.K. et al. Arsenic trioxide and all-trans retinoic acid treatment for acute promyelocytic leukaemia in all risk groups (AML17): Results of a randomised, controlled, phase 3 trial//Lancet Oncol. Lancet Publishing Group, 2015. Vol. 16, N 13. P. 1295 - 1305.
58. Kulkarni U. et al. A phase II study evaluating the role of bortezomib in the management of relapsed acute promyelocytic leukemia treated upfront with arsenic trioxide. Cancer Med. 2020 Apr; 9(8): 2603 - 2610
59. Соколов А.Н., Паровичникова Е.Н., Троицкая В.В. Лечение рецидивов и резистентных форм острых миелоидных лейкозов/Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под ред. Е.Н. Паровичниковой. Том 1. - М.: Практика, 2024. Р. 747 - 762
60. Wang Q. et al. Venetoclax for arsenic-resistant acute promyelocytic leukaemia. Br J Haematol. 2022 Feb 17. pp 1 - 3.
61. Zhang X. et al. Treatment of Central Nervous System Relapse in Acute Promyelocytic Leukemia by Venetoclax: A Case Report. Front. Oncol., 05 July 2021, Volume 11, pp 1 - 5.
62. Троицкая В.В., Паровичникова Е.Н., Соколов А.Н. Протокол "Риск-адаптированная программа терапии больных ОПЛ (ATRA-ATO-CT) с обзательным молекулярным мониторингом"/Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под ред. Е.Н. Паровичниковой. Том 1. - М.: Практика, 2024. Р. 713 - 746
63. Доброхотова Ю.Э. et al. Аномальные маточные кровотечения: алгоритмы ведения, методы терапии//РМЖ. Мать и дитя. 2020. Vol. 3, N 1. P. 55 - 60.
64. Мамонов В.Е. Неотложная нейрохирургия внутричерепных кровоизлияний у пациентов гематологического стационара//Гематология и трансфузиология. 2020. Vol. 65, N S1. P. 174 - 175.
65. Annibali O. et al. Incidence of venous thromboembolism and use of anticoagulation in hematological malignancies: Critical review of the literature//Critical Reviews in Oncology/Hematology. Elsevier Ireland Ltd, 2018. Vol. 124. P. 41 - 50.
66. Falanga A., Marchetti M., Russo L. Venous thromboembolism in the hematologic malignancies//Current Opinion in Oncology. Curr Opin Oncol, 2012. Vol. 24, N 6. P. 702 - 710.
67. Воробьев А.И. et al. Гиперкоагуляционный синдром: классификация, патогенез, диагностика, терапия//Гематология и трансфузиология. 2016. Vol. 61, N 3. P. 116 - 122.
68. Пантелеев М.А. et al. Практическая коагулология. 2010. 192 p.
69. Annibali O. et al. Incidence of venous thromboembolism and use of anticoagulation in hematological malignancies: Critical review of the literature//Critical Reviews in Oncology/Hematology. Elsevier Ireland Ltd, 2018. Vol. 124. P. 41 - 50.
70. Weitz I.C. et al. Chemotherapy-induced activation of hemostasis: effect of a low molecular weight heparin (dalteparin sodium) on plasma markers of hemostatic activation//Thromb. Haemost. 2002. Vol. 88, N 2. P. 213 - 220.
71. Sharifi M. et al. New oral anticoagulants in the treatment of heparin-Induced thrombocytopenia//Thromb. Res. Elsevier Ltd, 2015. Vol. 135, N 4. P. 607 - 609.
72. Гендлин Г.Е. et al. Современный взгляд на кардиотоксичность химиотерапии онкологических заболеваний, включающей антрациклиновые антибиотики.//Российский кардиологический журнал. 2017. Vol. 143, N 3. P. 145 - 154.
73. Zamorano J.L. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines//European Heart Journal. Oxford University Press, 2016. Vol. 37, N 36. P. 2768 - 2801.
74. Larsen C.M., Mulvagh S.L. Cardio-oncology: What you need to know now for clinical practice and echocardiography//Echo Research and Practice. BioScientifica Ltd., 2017. Vol. 4, N 1. P. R33 - R41.
75. Охмат В.А. et al. Спектр и этиология инфекционных осложнений у больных острыми миелоидными лейкозами на этапах индукции и консолидации ремиссии//Гематология и трансфузиология. 2017. Vol. 62, N 1. P. 9 - 15.
76. Клясова Г.А. et al. Возбудители сепсиса у иммунокомпрометированных больных: структура и проблемы антибиотикорезистентности (результаты многоцентрового исследования)//Гематология и трансфузиология. 2007. Vol. 52, N 1. P. 11 - 18.
77. Клясова Г.А., Охмат В.А. Антимикробная терапия//Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Под редакцией Савченко В.Г. Москва: Практика, 2018. P. 1067 - 1114.
78. Maertens J. et al. European guidelines for antifungal management in leukemia and hematopoietic stem cell transplant recipients: Summary of the ECIL 32009 update//Bone Marrow Transplant. Nature Publishing Group, 2011. Vol. 46, N 5. P. 709 - 718.
79. Kollef M.H. et al. Ceftolozane-tazobactam versus meropenem for treatment of nosocomial pneumonia (ASPECT-NP): a randomised, controlled, double-blind, phase 3, non-inferiority trial//Lancet Infect. Dis. Lancet Publishing Group, 2019. Vol. 19, N 12. P. 1299 - 1311.
80. Averbuch D. et al. Targeted therapy against multi-resistant bacteria in leukemic and hematopoietic stem cell transplant recipients: Guidelines of the 4th European conference on Infections in Leukemia (ECIL-4, 2011)//Haematologica. Ferrata Storti Foundation, 2013. Vol. 98, N 12. P. 1836 - 1847.
81. Debast S.B. et al. European society of clinical microbiology and infectious diseases: Update of the treatment guidance document for Clostridium difficile infection//Clin. Microbiol. Infect. Blackwell Publishing Ltd, 2014. Vol. 20, N S2. P. 1 - 26.
82. Styczynski J. et al. Management of HSV, VZV and EBV infections in patients with hematological malignancies and after SCT: Guidelines from the Second European Conference on Infections in Leukemia//Bone Marrow Transplant. Bone Marrow Transplant, 2009. Vol. 43, N 10. P. 757 - 770.
83. Ljungman P. et al. Management of CMV, HHV-6, HHV-7 and Kaposi-sarcoma herpesvirus (HHV-8) infections in patients with hematological malignancies and after SCT//Bone Marrow Transplant. Bone Marrow Transplant, 2008. Vol. 42, N 4. P. 227 - 240.
84. Arendrup M.C. et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of rare invasive yeast infections//Clin. Microbiol. Infect. Blackwell Publishing Ltd, 2014. Vol. 20, N S3. P. 76 - 98.
85. Tissot F. et al. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients//Haematologica. Ferrata Storti Foundation, 2017. Vol. 102, N 3. P. 433 - 444.
86. Мальчикова А.О., Клясова Г.А. Формирование биопленок у изолятов Candida spp, выделенных из гемокультуры от больных с опухолями системы крови//Клиническая микробиология и антимикробная химиотерапия. 2018. Vol. 20, N 2. P. 126 - 130.
87. Ullmann A.J. et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline//Clin. Microbiol. Infect. Elsevier B.V., 2018. Vol. 24. P. e1 - e38.
88. Cornely O.A. et al. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium//The Lancet Infectious Diseases. Lancet Publishing Group, 2019. Vol. 19, N 12. P. e405 - e421.
89. Tortorano A.M. et al. ESCMID and ECMM joint guidelines on diagnosis and management of hyalohyphomycosis: Fusarium spp., Scedosporium spp. and others//Clin. Microbiol. Infect. Blackwell Publishing Ltd, 2014. Vol. 20, N S3. P. 27 - 46.
90. Maschmeyer G. et al. ECIL guidelines for treatment of Pneumocystis jirovecii pneumonia in non-HIV-infected haematology patients//J. Antimicrob. Chemother. J Antimicrob Chemother, 2016. Vol. 71, N 9. P. 2405 - 2413.
91. Maertens J. et al. ECIL guidelines for preventing Pneumocystis jirovecii pneumonia in patients with haematological malignancies and stem cell transplant recipients//Journal of Antimicrobial Chemotherapy. Oxford University Press, 2016. Vol. 71, N 9. P. 1 - 8.
92. Титова В.Б., Беляева Н.М. Вирусный гепатит В у иммуносупрессивных пациентов с онкологическими заболеваниями: патогенез, ведение и профилактика//Инфекционные болезни. 2014. Vol. 12, N 3. P. 51 - 60.
93. Papatheodoridis G. et al. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection//Journal of Hepatology. Elsevier B.V., 2012. Vol. 57, N 1. P. 167 - 185.
94. Coppola N. et al. Reactivation of overt and occult hepatitis B infection in various immunosuppressive settings//J. Med. Virol. J Med Virol, 2011. Vol. 83, N 11. P. 1909-1916.
95. Sanchez M.J. et al. Successful use of entecavir for a severe case of reactivation of hepatitis B virus following polychemotherapy containing rituximab q//J. Hepatol. Vol. 51. P. 1091 - 1096.
96. Liang R. How I treat and monitor viral hepatitis B infection in patients receiving intensive immunosuppressive therapies or undergoing hematopoietic stem cell transplantation//Blood. American Society of Hematology, 2009. Vol. 113, N 14. P. 3147 - 3153.
97. Firpi R.J., Nelson D.R. Management of viral hepatitis in hematologic malignancies//Blood Rev. 2008. Vol. 22, N 3. P. 117 - 126.
98. Ennishi D. et al. Monitoring serum hepatitis C virus (HCV) RNA in patients with HCV-infected CD20-positive B-cell lymphoma undergoing rituximab combination chemotherapy//Am. J. Hematol. John Wiley & Sons, Ltd, 2008. Vol. 83, N 1. P. 59 - 62.
99. Roche B., Samuel D. The difficulties of managing severe hepatitis B virus reactivation//Liver Int. Liver Int, 2011. Vol. 31, N SUPPL. 1. P. 104 - 110.
100. Baumeister M.A. et al. Hepatitis B virus e antigen specific epitopes and limitations of commercial anti-HBe immunoassays//J. Med. Virol. John Wiley & Sons, Ltd, 2000. Vol. 60, N 3. P. 256 - 263.
101. Torres H.A., Davila M. Reactivation of hepatitis B virus and hepatitis C virus in patients with cancer//Nature Reviews Clinical Oncology. Nat Rev Clin Oncol, 2012. Vol. 9, N 3. P. 156 - 166.
102. Rupp D., Bartenschlager R. Targets for antiviral therapy of hepatitis C//Semin. Liver Dis. Thieme Medical Publishers, Inc., 2014. Vol. 34, N 1. P. 9 - 21.
103. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278 - 288.
104. Когония Л.М. et al. Практические рекомендации по лечению хронического болевого синдрома у онкологических больных.//Злокачественные опухоли: Практические рекомендации RUSSCO. 2018. P. 617 - 635.
105. Fallon M. et al. Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines.//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2018. Vol. 29, N Suppl 4. P. iv166 - iv191.
106. SPIRIN M., GALSTYAN G., DROKOV M. Central venous access in lymphoma patients (pts) with superior vena cava syndrome (SVCS)//INTENSIVE CARE Med. Exp. 2019. Vol. 7, N Suppl. 3:001341. P. 388 - 389.
107. Pluschnig U. et al. Extravasation emergencies: state-of-the-art management and progress in clinical research.//Memo. Springer, 2016. Vol. 9, N 4. P. 226 - 230.
108. Zeidler K. et al. Optimal preprocedural platelet transfusion threshold for central venous catheter insertions in patients with thrombocytopenia.//Transfusion. 2011. Vol. 51, N 11. P. 2269 - 2276.
109. Zerati A.E. et al. Totally implantable venous catheters: history, implantation technique and complications.//J Vasc Bras. 2017. Vol. 16, N 2. P. 128 - 139.
110. Gow K.W., Tapper D., Hickman R.O. Between the lines: The 50th anniversary of long-term central venous catheters//Am. J. Surg. Elsevier Ltd, 2017. Vol. 213, N 5. P. 837 - 848.
111. Yeral M. et al. Tunnelled central venous catheter-related problems in the early phase of haematopoietic stem cell transplantation and effects on transplant outcome.//Turkish J. Haematol. Off. J. Turkish Soc. Haematol. Galenos Yayinevi, 2015. Vol. 32, N 1. P. 51 - 57.
112. Maki D.G., Kluger D.M., Crnich C.J. The Risk of Bloodstream Infection in Adults With Different Intravascular Devices: A Systematic Review of 200 Published Prospective Studies//Mayo Clin. Proc. Elsevier, 2006. Vol. 81, N 9. P. 1159 - 1171.
113. Hamilton H. Central Venous Catheters/ed. Bodenham A.R. Oxford, UK: Wiley-Blackwell, 2009.
114. Biffi R. Introduction and Overview of PICC History//Peripherally Inserted Central Venous Catheters. Milano: Springer Milan, 2014. P. 1 - 6.
115. Linenberger M.L. Catheter-related thrombosis: risks, diagnosis, and management.//J. Natl. Compr. Canc. Netw. 2006. Vol. 4, N 9. P. 889 - 901.
116. Lee A.Y.Y., Kamphuisen P.W. Epidemiology and prevention of catheter-related thrombosis in patients with cancer//J. Thromb. Haemost. 2012. N 10. P. 1491 - 1499.
117. Цепенщинков Л., Лядов В.К. Периферически имплантируемый центральный венозный катетер: обзор литераутры.//Клиническая онкогематология. 2014. Vol. 7, N 2. P. 220 - 228.
118. Linder L.E. et al. Material thrombogenicity in central venous catheterization: a comparison between soft, antebrachial catheters of silicone elastomer and polyurethane.//JPEN. J. Parenter. Enteral Nutr. 1984. Vol. 8, N 4. P. 399 - 406.
119. Watters V.A., Grant J.P. Use of Electrocardiogram to Position Right Atrial Catheters During Surgery//Ann. Surg. Vol. 225, N 2. P. 165 - 171.
120. Taal M.W., Chesterton L.J., McIntyre C.W. Venography at insertion of tunnelled internal jugular vein dialysis catheters reveals significant occult stenosis//Nephrol. Dial. Transplant. Oxford University Press, 2004. Vol. 19, N 6. P. 1542 - 1545.
121. Lobato E.B. et al. Cross-sectional area of the right and left internal jugular veins.//J. Cardiothorac. Vasc. Anesth. 1999. Vol. 13, N 2. P. 136 - 138.
122. Червонцева А.М. Повреждение сосудистого эндотелия в процессе лечения острых миелоидных лейкозов. 2008.
123. Багирова Н.С. Инфекции, связанные с внутрисосудистыми устройствами: терминология, диагностика, профилактика и терапия//Злокачественные опухоли. 2014. N 3. P. 164 - 171.
124. Bannon M.P., Heller S.F., Rivera M. Anatomic considerations for central venous cannulation.//Risk Manag. Healthc. Policy. Dove Press, 2011. Vol. 4. P. 27-39.
125. Milling T.J. et al. Randomized, controlled clinical trial of point-of-care limited ultrasonography assistance of central venous cannulation: The Third Sonography Outcomes Assessment Program (SOAP-3) Trial*//Crit. Care Med. 2005. Vol. 33, N 8. P. 1764 - 1769.
126. Галстян Г.М. НАРУШЕНИЯ ГЕМОСТАЗА, ОБУСЛОВЛЕННЫЕ ДЕФИЦИТОМ ВИТАМИН К-ЗАВИСИМЫХ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ - ПАТОГЕНЕЗ, СПОСОБЫ КОРРЕКЦИИ И РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ.//Гематология и трансфузиология. 2012. Vol. 27, N 2. P. 7 - 21.
127. Криволапов Ю.А. Технические аспекты выполнения трепанобиопсий костного мозга. Клиническая онкогематология 2014; 7: 290 - 295//Клиническая онкогематология. 2014. Vol. 7. P. 290 - 295.
128. Fong B., Van Bendegon J.M. Lumbar puncture. Neurologic and neurosurgical procedures//Rechman, E.F., Simon, R.R., eds. Emergency Medicine Procedures. New York: McGraw-Hill, 2004. P. 859 - 880.
129. Singh C. et al. High-dose hydroxyurea with differentiating agents for treating ultra-high-risk acute promyelocytic leukemia in resource-challenged settings//Acta Oncologica. - 2022. - Т. 61. - N. 12. - С. 1512 - 1514
130. Методическое руководство "Трансплантация аутологичных гемопоэтических стволовых клеток при гемобластозах", под ред. Савченко В.Г., 2020 г. Национальное гематологическое общество.
131. Жибурт Е., Камельских Д., Чемоданов И. Трансфузионные реакции: как предотвратить, определить, лечить. Заместитель главного врача, 2018; 5: 94 - 105.
132. Fry, J.L., Arnold, D.M., Clase, C.M. et al. Transfusion premedication to prevent acute transfusion reactions: a retrospective observational studyt
133. Barrios-Alarcon J, Aldrete AJ, Paragas-Tapia DRelief of Post-Lumbar Puncture Headache with Epidural Dextran 40: A Preliminary ReportRegional Anesthesia: The Journal of Neural Blockade in Obstetrics, Surgery, & Pain Control 1989; 14: 78 - 80.
135. Махиня С.А., Ходжаев Г.Г. Терапия аномальных маточных кровотечений при гематологических заболеваниях/Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 157 - 164
136. Мамонов В.Е. Внутричерепные кровоизлияния у пациентов с гематологическими заболеваниями - тактика нейрохирургического лечения/Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 165 - 172
137. Зозуля Н.И., Васильев С.А., Марголин О.В., и др. Профилактика, диагностика и лечение тромботических осложнений при гематологических заболеваниях/Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 173 - 198
138. Модел С.В., Троицкая В.В. Кардиологическое обследование и лечение пациентов с гемаологическими заболеваниями./Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 247 - 262
139. Паровичникова Е.Н., Троицкая В.В., Соколов А.Н., Савченко В.Г. Протокол терапии острого промиелоцитарного лейкоза по модифицированной программе AIDA (mAIDA)/Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Под редакцией Савченко В.Г. Том 1. Москва: Практика, 2018. P. 703 - 730.
140. Клясова Г.А., Штыркова С.В. Диагностика и лечение бактериальных инфекционных осложнений у пациентов с гематологическими заболеваниями./Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 69 - 96
141. Клясова Г.А., Мальчикова А.О. Диагностика и лечение инфекций, вызванных грибами, у пациентов с гематологическими заболеваниями./Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 97 - 128
142. Клясова Г.А. Герпесвирусные инфекции у пациентов с гематологическими заболеваниями./Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 129 - 134
143. Клясова Г.А. Профилактика инфекционных осложнений у пациентов с гематологическими заболеваниями./Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 61 - 68
144. de Botton S, Sanz MA, Chevret S, et al.; European APL Group; PETHEMA Group. Extramedullary relapse in acute promyelocytic leukemia treated with all-trans retinoic acid and chemotherapy. Leukemia. 2006 Jan; 20(1): 35 - 41. doi: 10.1038/sj.leu.2404006. PMID: 16307026.
145. Спирин М.В., Галстян Г.М. Алгоритм обеспечения сосудистого доступа в гематологии./Сопроводительная терапия при лечении забоелваний системы крови. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. Р. 487 - 494
146. Приказ Министерства здравоохранения Российской Федерации от 05.08.2003 N 330 "О мерах по совершенствованию лечебного питания в лечебно-профилактических учреждениях Российской Федерации".
147. Приказ Министерства здравоохранения Российской Федерации от 21.06.2013 N 395н "Об утверждении норм лечебного питания".
148. Приказ Министерства здравоохранения Российской Федерации от 23.09.2020 г. N 1008н "Об утверждении порядка обкспечения пациентов лечебным питанием".
149. Wu SY, Short NJ, Nasr L, Dabaja BS, Fang PQ. Central Nervous System Prophylaxis and Treatment in Acute Leukemias. Curr Treat Options Oncol. 2022 Dec; 23(12): 1829 - 1844. doi: 10.1007/s11864-022-01032-5. Epub 2022 Dec 13. PMID: 36510037; PMCID: PMC9767998.
150. Hou, C. xiao, Chen, Y., Liu, S. hao, Jiang, Y. zhi, Huang, D. ping, & Chen, S. ning. (2023). Effective treatment with Gilteritinib-based regimens for FLT3-mutant extramedullary relapse in acute promyelocytic leukemia. Hematology, 29(1). https://doi.org/10.1080/16078454.2023.2293496
151. Chen, X., Huang, J., Xu, N., Fan, Z., Nie, D., Huang, F., Sun, Q., Zhang, X., Liang, X., Shi, P., Wang, Z., Liu, H., Xu, J., Dai, M., Yu, G., Zhang, Y., Sun, J., Liu, Q. and Xuan, L. (2022), A phase 2 study of sorafenib combined with conventional therapies in refractory central nervous system leukemia. Cancer, 128: 2138 - 2147. https://doi.org/10.1002/cncr.34182
152. Li, Y., Dai, H., Yao, D. et al. Central nervous system relapse of acute promyelocytic leukemia treated by oral Venetoclax with Azacitidine achieved complete remission. Ann Hematol 101, 1865 - 1867 (2022). https://doi.org/10.1007/s00277-022-04823-w
153. Liu M, Zhao X, Pan W, et al. A novel HNRNPC-RARA fusion in acute promyelocytic leukaemia lacking PML-RARA rearrangement, sensitive to venetoclax-based therapy. Br J Haematol. 2021; 195(2): e123 - e128.
154. Song B, Wang X, Kong X, et al. Clinical response to venetoclax and decitabine in acute promyelocytic leukemia with a novel RARA-THRAP3 fusion: a case report. Front Oncol. 2022; 12:828852.
155. Zhou, Z., Chen, E., Jiang, J., Xue, L., Zhu, L., Hu, X.,... Tong, J. (2024). Successfully treatment of PLZF-RAR positive acute promyelocytic leukemia by Venetoclax combining with decitabine: a case report and literature review. Hematology, 29(1). https://doi.org/10.1080/16078454.2024.2399362
156. Zhang G, Song Y, Wan L, et al. Treatment of STAT5b-RARA positive acute promyelocytic leukemia by venetoclax combining with homoharringtonine, cytarabine: a case report and literature review. Blood Sci. 2022; 4(2): 93 - 96.
157. Li H, Xiang X, Ding H, et al. Differentiation therapy using low-dose venetoclax in a variant acute promyelocytic leukaemia carrying ZBTB16-RARA. Br J Haematol. 2022; 199(5): 768 - 771.
158. Chen Z, Brand NJ, Chen A, et al. Fusion between a novel Kr ppel-like zinc finger gene and the retinoic acid receptor-alpha locus due to a variant t(11;17) translocation associated with acute promyelocytic leukaemia. EMBO J. 1993; 12(3): 1161 - 1167.
159. Corey SJ, Locker J, Oliveri DR, et al. A non-classical translocation involving 17q12 (retinoic acid receptor alpha) in acute promyelocytic leukemia (APML) with atypical features. Leukemia. 1994; 8(8): 1350 - 1353.
160. Wells RA, Catzavelos C, Kamel-Reid S. Fusion of retinoic acid receptor alpha to NuMA, the nuclear mitotic apparatus protein, by a variant translocation in acute promyelocytic leukaemia. Nat Genet. 1997; 17(1): 109 - 113.
161. Arnould C, Philippe C, Bourdon V, Gr goire MJ, Berger R, Jonveaux P. The signal transducer and activator of transcription STAT5b gene is a new partner of retinoic acid receptor alpha in acute promyelocytic-like leukaemia. Hum Mol Genet. 1999; 8(9): 1741 - 1749.
162. Catalano A, Dawson MA, Somana K, et al. The PRKAR1A gene is fused to RARA in a new variant acute promyelocytic leukemia. Blood. 2007; 110(12): 4073 - 4076.
163. Kondo T, Mori A, Darmanin S, Hashino S, Tanaka J, Asaka M. The seventh pathogenic fusion gene FIP1L1-RARA was isolated from a t(4;17)-positive acute promyelocytic leukemia. Haematologica. 2008; 93(9): 1414 - 1416.
164. Yamamoto Y, Tsuzuki S, Tsuzuki M, Handa K, Inaguma Y, Emi N. BCOR as a novel fusion partner of retinoic acid receptor alpha in a t(X;17)(p11;q12) variant of acute promyelocytic leukemia. Blood. 2010; 116(20): 4274 - 4283.
165. Won D, Shin SY, Park C-J, et al. OBFC2A/RARA: a novel fusion gene in variant acute promyelocytic leukemia. Blood. 2013; 121(8): 1432 - 1435.
166. Chen Y, Li S, Zhou C, et al. TBLR1 fuses to retinoid acid receptor in a variant t(3;17)(q26;q21) translocation of acute promyelocytic leukemia. Blood. 2014; 124(6): 936 - 945.
167. Li J, Zhong H-Y, Zhang Y, et al. GTF2I-RARA is a novel fusion transcript in a t(7;17) variant of acute promyelocytic leukaemia with clinical resistance to retinoic acid. Br J Haematol. 2015; 168(6): 904 - 908.
168. Yin CC, Jain N, Mehrotra M, et al. Identification of a novel fusion gene, IRF2BP2-RARA, in acute promyelocytic leukemia. J Natl Compr Canc Netw. 2015; 13(1): 19 - 22.
169. Cheng CK, Wang AZ, Wong THY, et al. FNDC3B is another novel partner fused to RARA in the t(3;17)(q26;q21) variant of acute promyelocytic leukemia. Blood. 2017; 129(19): 2705 - 2709.
170. Tsimberidou, AM., Estey, E., Kantarjian, H. et al. Введение фактора стимуляции колоний гранулоцитов, связанное с кровоизлиянием в мозг при остром промиелоцитарном лейкозе. Leukemia 20, 1452 - 1453 (2006). https://doi.org/10.1038/sj.leu.2404272
171. Kantarjian HM, DiNardo CD, Kadia TM, Daver NG, Altman JK, Stein EM, Jabbour E, Schiffer CA, Lang A, Ravandi F. Acute myeloid leukemia management and research in 2025. CA Cancer J Clin. 2025 Jan-Feb; 75(1): 46 - 67. doi: 10.3322/caac.21873. Epub 2024 Dec 10. PMID: 39656142; PMCID: PMC11745214.
172. Chamoun K, Kantarjian HM, Wang X, Naqvi K, Aung F, Garcia-Manero G, Borthakur G, Jabbour E, Kadia T, Daver N, DiNardo CD, Jain N, Konopleva M, Cortes J, Ravandi F, Yilmaz M. Unrecognized fluid overload during induction therapy increases morbidity in patients with acute promyelocytic leukemia. Cancer. 2019 Sep 15; 125(18): 3219 - 3224. doi: 10.1002/cncr.32196. Epub 2019 May 31. PMID: 31150121.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Паровичникова Е.Н., д.м.н., Генеральный директор ФГБУ "НМИЦ гематологии" Минздрава России (Москва), член Национального гематологического общества.
2. Троицкая В.В., д.м.н., Первый заместитель Генерального директора ФГБУ "НМИЦ гематологии" Минздрава России (Москва), член Национального гематологического общества.
3. Соколов А.Н., к.м.н., старший научный сотрудник отдела химиотерапии гемобластозов, депрессий кроветворения и трансплантации костного мозга ФГБУ "НМИЦ гематологии" Минздрава России (Москва), член Национального гематологического общества.
4. Семенова А.А., врач-гематолог отделения химиотерапии гемобластозов и депрессий кроветворения с блоком трансплантации костного мозга и гемопоэтических стволовых клеток, член Национального гематологического общества.
5. Бондаренко С.Н., д.м.н., руководитель отдела онкологии, гематологии и трансплантологии для подростков и взрослых НИИ детской гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова" Минздрава России (Санкт-Петербург), член Национального гематологического общества.
6. Кузьмина Л.А., к.м.н., заведующая отделением интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным стационаром ФГБУ "НМИЦ гематологии" Минздрава России (Москва), член Национального гематологического общества.
7. Клясова Г.А., д.м.н., профессор, заведующая лабораторией клинической бактериологии, микологии и антибиотической терапии ФГБУ "НМИЦ гематологии" Минздрава России (Москва), член Национального гематологического общества.
8. Грицаев С.В., д.м.н., руководитель Республиканского центра трансплантации костного мозга ФГБУ "Российский НИИ гематологии и трансфузиологии ФМБА" (Санкт-Петербург), член Национального гематологического общества.
9. Семочкин С.В., д.м.н., профессор кафедры онкологии и гематологии ФГБОУ ВО "Российский национальный исследовательский медицинский университет им. Н.И. Пирогова" Минздрава России (Москва), член Национального гематологического общества.
10. Лапин В.А., к.м.н., заведующий отделением гематологии ГБУЗ ЯО "Областная клиническая больница" (Ярославль), член Национального гематологического общества.
11. Константинова Т.С., к.м.н., ГБУЗ СО "Областной гематологический центр Свердловской областной клинической больницы N 1" (Екатеринбург), член Национального гематологического общества.
12. Самойлова О.С., к.м.н., заведующая отделением гематологии ГБУЗ Нижегородской области "Нижегородская областная клиническая больница им. Н.А. Семашко" (Нижний Новгород), член Национального гематологического общества.
13. Капорская Т.С., к.м.н., заведующая отделением гематологии ГБУЗ "Иркутская ордена "Знак Почета" областная клиническая больница" (Иркутск), член Национального гематологического общества.
Блок по организации медицинской помощи:
14. Геворкян Тигран Гагикович, заместитель директора НИИ КЭР ФГБУ "НМИЦ онкологии им. Н.Н. Блохина", главный специалист-онколог Московской области.
15. Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
16. Лазарева Ольга Вениаминовна, к.м.н., руководитель управления регионального и межведомственного сотрудничества по профилю "гематология" ФГБУ "НМИЦ гематологии"
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория клинических рекомендаций:
1. Врачи-гематологи
2. Врачи-онкологи
3. Врачи-терапевты
4. Врачи-акушеры-гинекологи
5. Врачи-анестезиологи-реаниматологи
6. Врачи-клинические фармакологи
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составила 10 лет.
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
РАСШИФРОВКА
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных КИ с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2.2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных КИ с применением метаанализа
2
Отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Описание метода валидизации рекомендаций:
- Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
- Получены комментарии со стороны врачей первичного звена и участковых терапевтов в отношении доходчивости изложения рекомендаций и их оценка важности рекомендаций как рабочего инструмента повседневной практики.
- Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев с точки зрения перспектив пациентов.
- Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
- Предварительная версия была выставлена для широкого обсуждения на сайте НГО с целью широкого обсуждения и совершенствования рекомендаций.
- Проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать прежде всего доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ПРОТОКОЛЫ ЛЕЧЕНИЯ ОСТРОГО ПРОМИЕЛОЦИТАРНОГО ЛЕЙКОЗА
Схема лечения ОПЛ по программе AIDA/mAIDA [4, 37, 56]
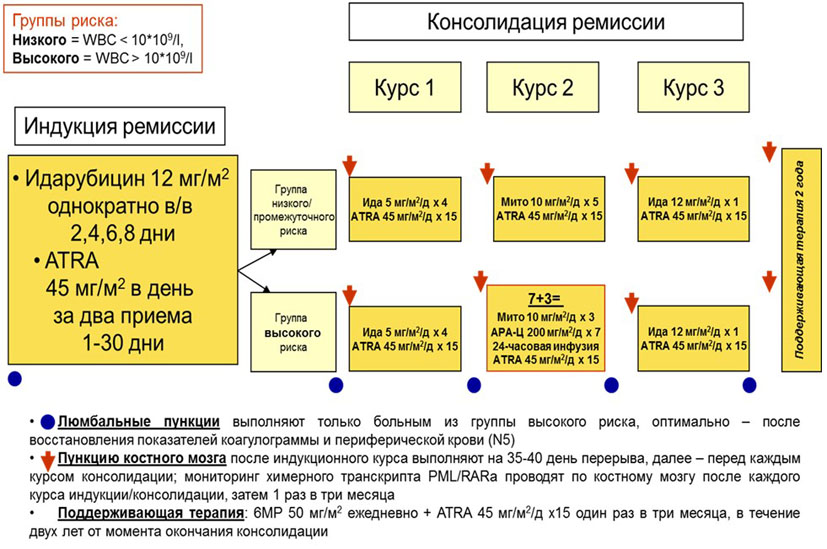
Индукция:
- #третиноин** 45 мг/м2, ежедневно, после еды (в 2 приема) в течение минимум 30 дней.
- #Идарубицин** 12 мг/м2 1 раз в день, во 2, 4, 6, 8-й дни от начала приема третиноина**, короткая инфузия.
Консолидация (1-й курс)
- #Идарубицин** 5 мг/м2 1 раз в день короткая инфузия, 1 - 4-й день.
- #третиноин** 45 мг/м2 ежедневно, после еды (в 2 приема), 1 - 15-й день.
Консолидация (2-й курс) (AIDA)
- #Митоксантрон** 10 мг/м2 1 раз в день короткая инфузия, 1 - 5-й день.
- #третиноин** 45 мг/м2 ежедневно, после еды (в 2 приема), 1 - 15-й день.
Консолидация (2 курс) (mAIDA)
- Митоксантрон** 10 мг/м2 1 раз в день короткая инфузия, 1 - 3-й день.
- Цитарабин** 200 мг/м2 круглосуточная инфузия, 1 - 7-й день.
- #третиноин** 45 мг/м2 ежедневно, после еды (в 2 приема), 1 - 15-й день.
Консолидация (3-й курс)
- #Идарубицин** 12 мг/м2 1 раз в день короткая инфузия, 1 день.
- #третиноин** 45 мг/м2 ежедневно, после еды (в 2 приема), 1 - 15-й день.
Поддерживающая терапия
- Меркаптопурин** 50 мг/м2 1 раз в день, постоянно в течение 2 лет от момента завершения консолидации.
- #Метотрексат** 15 мг/м2 1 раз в неделю в/в в течение 2 лет от момента завершения консолидации.
- #третиноин** 45 мг/м2 ежедневно, после еды (в 2 приема), 1 - 15-й день каждого 3-го месяца в течение 2 лет от момента завершения консолидации.
Схема лечения ОПЛ по программе 7 + 3
Программа индукции/консолидации
Препараты
7 + 3 (1) + #третиноин**
Цитарабин** 100 мг/м2 в/в 2 раза в сутки в 1 - 7-й день
- Даунорубицин** 60 мг/м2 в/в 1 раз в день в 1 - 3-й день
или
- митоксантрон** 10 мг/м2 в/в 1 раз в день в 1 - 3-й день
или
- идарубицин** 12 мг/м2 в/в 1 раз в день в 1 - 3-й день
#третиноин** 45 мг/м2 ежедневно, после еды (в 2 приема), до достижения ПР
7 + 3 (2) + #третиноин**
Цитарабин** 200 мг/м2 в/в круглосуточно, в 1 - 7-й день
- Даунорубицин** 60 мг/м2 в/в 1 раз в день в 3 - 5-й день
или
- митоксантрон** 10 мг/м2 в/в 1 раз в день в 3 - 5-й день
или
- идарубицин** 12 мг/м2 в/в 1 раз в день в 3 - 5-й день
#третиноин** 45 мг/м2 ежедневно, после еды (в 2 приема), до достижения ПР
Схема лечения ОПЛ по программе ATO + ATRA [62]
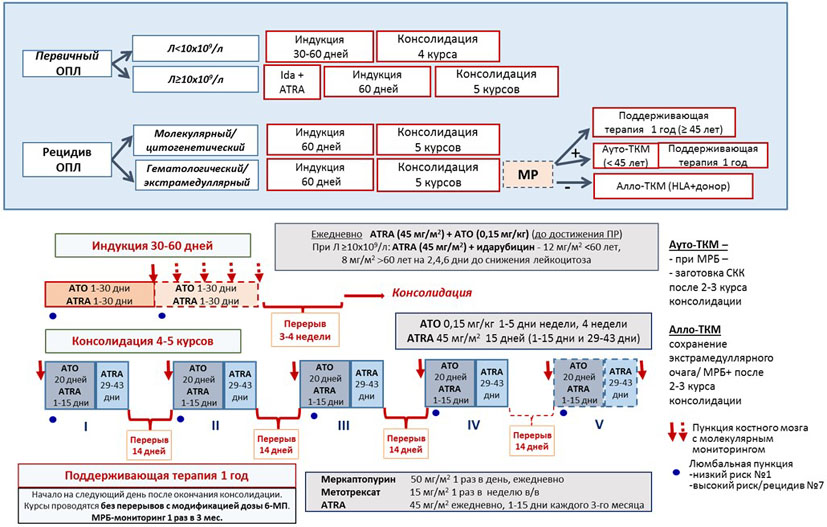
Схема лечения рецидива ОПЛ после индукции и консолидации мышьяка триоксидом [58, 59]
Индукция
- Триоксид мышьяка, 10 мг внутривенно 1 раз в сутки (у больных весом менее 45 кг - 0,15 мг/кг) в течение 42 - 60 дней (если на 42 день ремиссия не достигнута, то 60 дней).
- #Третиноин**, 45 мг/м2 в сутки внутрь после еды в 2 приема в течение 42 - 60 дней (если на 42 день ремиссия не достигнута, то 60 дней).
- #Митоксантрон**, 10 мг/м2 внутривенно 1 раз в сутки, дни 1 - 2.
- #Бортезомиб**, 1,4 мг/м2 подкожно 1 раз в сутки, дни 2 и 5.
Консолидация
- Триоксид мышьяка, 10 мг внутривенно 1 раз в сутки (у больных весом менее 45 кг - 0,15 мг/кг) в течение 28 дней.
- #Третиноин**, 45 мг/м2 в сутки внутрь после еды в 2 приема в течение 28 дней.
- #Бортезомиб**, 1,4 мг/м2 подкожно 1 раз в сутки, дни 2 и 5.
Поддерживающая терапия
- Триоксид мышьяка, 10 мг внутривенно 1 раз в сутки (у больных весом менее 45 кг - 0,15 мг/кг) дни 1 - 10 каждого месяца в течение 6 месяцев.
- #Третиноин**, 45 мг/м2 в сутки внутрь после еды в 2 приема дни 1 - 10 каждого месяца в течение 6 месяцев.
- #Бортезомиб**, 1,4 мг/м2 подкожно 1 раз в сутки, 2 день каждого месяца в течение 6 месяцев.
- #Метотрексат**, 12,5 мг интратекально, 1 день каждого месяца в течение 6 месяцев.
Схема лечения пациентов с ОПЛ из группы высокого риска со сниженной фракцией выброса с включением #гемтузумаба озогамицина [3]
Индукция
- Мышьяка триоксид, 0,15 мг/кг внутривенно 1 раз в сутки в течение 28 - 60 дней (если на 28 день по данным пункции костного мозга ремиссия не достигнута, продолжить терапию и повторить пункцию через 1 неделю).
- #Третиноин**, 45 мг/м2 в сутки внутрь после еды в 2 приема в течение 28 - 60 дней (если на 28 день по данным пункции костного мозга ремиссия не достигнута, продолжить терапию и повторить пункцию через 1 неделю).
- #Гемтузумаб озогамицин, 9 мг/м2 однократно в день 1.
Консолидация
- Мышьяка триоксид, 0,15 мг/кг внутривенно 1 раз в сутки 5 дней в неделю в течение 4 неделю каждые 8 недель (4 недели с введением мышьяка триоксида, 4 недели без введения) - всего 4 цикла.
- #Третиноин**, 45 мг/м2 в сутки внутрь после еды в 2 приема в течение 2 недель каждые 4 недели - всего 7 циклов.
- Если мышьяка треиоксид и/или #третиноин будут отменены из-за токсичности, то возможно введение #гемтузумаба озогамицин, в дозе 9 мг/м2 однократно каждые 4 - 5 недель до достижения молекулярной ремиссии при количестве нейтрофилов ![]() 1 x 109/л и тромбоцитов
1 x 109/л и тромбоцитов ![]() 100 x 109/л.
100 x 109/л.
Схема лечения пациентов с ОПЛ с рефрактерным к терапии удлинением электрической систолы сердца с включением #гемтузумаба озогамицина [3]
Индукция
- #Третиноин**, 45 мг/м2 в сутки внутрь после еды в 2 приема в течение 28 - 60 дней (если на 28 день по данным пункции костного мозга ремиссия не достигнута, продолжить терапию и повторить пункцию через 1 неделю).
- #Гемтузумаб озогамицин, 9 мг/м2 однократно в день 1.
Консолидация
- #Третиноин**, 45 мг/м2 в сутки внутрь после еды в 2 приема в течение 2 недель каждые 4 недели - всего 7 циклов.
- #Гемтузумаба озогамицин, в дозе 9 мг/м2 однократно ежемесячно до достижения молекулярной ремиссии.
Приложение А3.2
ДОЗИРОВКА,
СПОСОБ ПРИМЕНЕНИЯ, НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ #ТРЕТИНОИНА** [4]
Доза #третиноина** составляет 45 мг/м2 в день внутрь, доза может разделяться на 2 приема - утром и вечером после еды (желательно с определенным содержанием жиров). Препарат принимается ежедневно до достижения ПР (минимум 30 дней, но не более 90 дней).
На фоне терапии #третиноином** возможно развитие следующих побочных эффектов:
1) головная боль, сонливость, могут определяться менингеальные знаки (ригидность затылочных мышц, синдром Кернига), нистагм;
2) тошнота, рвота (развитие панкреатита);
3) температура, которая может быть как субфебрильной, так и подниматься до 40 °C. При отмене #третиноина** температура нормализуется в среднем через 24 ч. В некоторых случаях, когда есть трудности в дифференциальной диагностике природы лихорадки - инфекционная или на фоне приема ретиноидов, возможна отмена #третиноина** на 1 - 2 дня. Фебрильная лихорадка чаще всего сопровождается симптоматикой дифференцировочного синдрома;
4) кожный зуд, сухость кожи и слизистых;
5) боли в костях;
6) отеки;
7) специфические инфильтраты (как лейкемиды) в коже, на глазном дне;
8) появление цитоза в спинномозговой жидкости (при исходном ее нормальном составе);
9) повышение уровня трансаминаз.
Побочные эффекты, развившиеся на фоне применения #третиноина**, могут потребовать изменения терапии.
#Третиноин может вызывать сильные головные боли и, в редких случаях, псевдоопухоль головного мозга, которая характеризуется повышением внутричерепного давления без признаков инфекции, сосудистых или структурных аномалий. Причина данного осложнения обусловлено увеличением продукции и нарушением всасывания спинномозговой жидкости сосудистым сплетением. В таком случае показаны добавление #ацетазоламида** (125 - 250 мг два-четыре раза в день), введение маннитола** внутривенно в дозе 1 - 1,5 г/кг/сут, анальгетическая терапия. При сохранении выраженных головных болей на фоне анальгетической и диуретической терапии можно уменьшить дозу #третиноина** до 25 мг/м2 [171, 62].
При сохраняющихся головных болях (после исключения их анемической природы или в связи с введением #третиноин**) целесообразно выполнить: 1) КТ головного мозга или магнитно-резонансную томографию головного мозга (с целью выявления кровоизлияния); 2) спинномозговую пункцию после исключения рисков вклинения ствола головного мозга в большое затылочное отверстие по данным КТ или МРТ головного мозга и адекватной трансфузиологической подготовки (переливание тромбоконцентрата) с целью исключения нейролейкемии, инфекционного процесса (вирусный менингоэнцефалит, криптококкоз и др.).
Сухость кожи и слизистых лечат симптоматическими средствами (увлажняющий крем, полоскания), кожный зуд - препаратами для лечения зуда (включая антигистаминные средства системного действия и анестетики).
Повышение активности трансаминаз, изменения в общих (клинических) анализах мочи (за исключением значительной протеинурии - > 1 г/л) не требуют, кроме постоянного контроля, какого-либо терапевтического воздействия. Вновь возникшая значительная протеинурия может быть проявлением ДС или очень редким побочным эффектом. ДС купируют #дексаметазоном** 10 мг/м2 2 раза в сутки в/в [62].
Фебрильная лихорадка без выявленного очага инфекции (выполняется тщательный поиск инфекционного очага - катетер, парапроктит, инфильтрат половых губ, гайморит; осуществляется неоднократный рентгенологический (КТ) контроль легочной ткани, посевы крови из вены и катетера, контроль уровня галактоманнана в крови и т.д.) при отсутствии других побочных явлений может быть первым признаком развития ДС.
Также нередко при переливании значительных объемов жидкости у пациентов развивается перегрузка по малому кругу кровообращения (отек легких), что может имитировать картину ДС, поэтому необходим жесткий контроль диуреза, стимулирование диуреза, введение в/в нитратов, калийсберегающих диуретиков, кардиотоников.
В связи с тем, что развернутый ДС является жизнеугрожающим состоянием, при малейших признаках ДС (1) фебрильная лихорадка без признаков инфекции, 2) дыхательная недостаточность +\- кровохарканье, 3) прибавка в массе тела (отеки +5 кг), 4) рентгенологическая картина с инфильтратами, похожая на легочный дистресс-синдром, 5) плевральный или перикардиальный выпот, 6) гипотензия, 7) острая почечная недостаточность) - немедленно назначается #дексаметазон** 10 мг/м2 2 раза в день до купирования признаков ДС и с достаточно быстрой отменой впоследствии (общая продолжительность введения #дексаметазона** - оптимально 7 дней, вследствие высокого риска развития инфекционных осложнений, особенно грибковых) [35]. Такой подход настоятельно рекомендуется, несмотря на тот факт, что ни один из вышеупомянутых признаков и симптомов не является патогномоничным, и они сами по себе могут быть связаны с сопутствующими соматическими проблемами, такими как бактериемия, сепсис, грибковые инфекции или застойная сердечная недостаточность. При наличии инфекционного процесса, застойной сердечной недостаточности диагноз ДС не устанавливают, но даже в этих ситуациях назначение #дексаметазона** оправдано. Частота назначения #дексаметазона** во всех исследованиях никогда не совпадает с частотой развития ДС [35].
Развития синдрома дифференцировки опухолевых клеток можно ожидать как в первые дни приема #третиноина**, так и после завершения введения противоопухолевых препаратов на фоне продолжающегося приема третиноина**, на выходе из агранулоцитоза, даже при низких цифрах лейкоцитов (например, < 2 x 109/л). Частота диагностики ДС зависит от программы лечения и критериев диагностики, варьируя от 2 до 50%, на программе AIDA составляя 25%.
Выделяют ДС: средней тяжести - 2/3 симптома (в среднем у 50% пациентов) и тяжелый - 4 и более симптомов (в среднем у 50%). Также отмечают ранний ДС (до 7 дней, примерно у 54%) и поздний (8 - 14-й день - 5%, 15 - 30-й день - 36%, 31 - 46-й день = 5%), которые отличаются по проценту летальности: 36 и 9% соответственно.
При тяжелом ДС (искусственная вентиляция легких, острая почечная недостаточность) терапия #третиноином** должна отменяться, ее прием возобновляется после купирования дыхательной, печеночной и почечной недостаточности (можно в половинной дозе).
Временное прекращение терапии #третиноином** показано лишь в случае развития серьезных проявлений синдрома дифференцировки ОПЛ (если у пациента развивается почечная недостаточность или требующий перевода в отделение интенсивной терапии респираторный дистресс-синдром). Во всех других случаях терапия #третиноином** должна быть продолжена.
Если на фоне назначения #дексаметазона** и продолженного приема #третиноина** регистрируется прогрессия ДС или отсутствие эффекта на введение #дексаметазона**, то #третиноин** следует отменить. Если после этого ответ на введение #дексаметазона** получен, следует продолжить терапию до полного исчезновения симптомов, а затем возобновить #третиноин**.
Приложение А3.3
ДОЗИРОВКА,
СПОСОБ ПРИМЕНЕНИЯ, НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ
МЫШЬЯКА ТРИОКСИДА [62]
Доза мышьяка триоксида (ATO) составляет 0,15 мг/кг в день, препарат растворяют в 250 мл 0,9% натрия хлорида или 5% глюкозы и вводят внутривенно в течение 3 часов.
Осложнения терапии мышьяка триоксидом:
- Дифференцировочный синдром (ДС) - патогенез, клиническая картина и терапия аналогичны таковым при ретиноидном синдроме.
Отмена терапии мышьяка триоксидом происходит в случае неэффективности терапии #дексаметазоном** или при развитии ДС тяжелой степени (![]() 4 симптомов). После купирования ДС терапия ATRA+ATO возобновляется. Для профилактики ДС пациентам из группы высокого риска назначается #дексаметазон** в дозе 4 мг/м2 2 р/с в/в до снижения лейкоцитоза (не более 7 дней), также проводится циторедукция 1 - 3 введениями антрациклиновых антибиотиков (L01DB: Антрациклины и родственные соединения). При развитии лейкоцитоза на фоне терапии для профилактики ДС также назначается #дексаметазон** в дозе 4 мг/м2 2 р/с в/в до снижения лейкоцитоза (не более 7 дней). Если лейкоцитоз сопровождается выраженными оссалгиями, клиникой лейкостазов, рекомендовано введение цитарабина** в дозе 100 мг 2 р/с в/в до купирования симптомов, но не более 3 введений
4 симптомов). После купирования ДС терапия ATRA+ATO возобновляется. Для профилактики ДС пациентам из группы высокого риска назначается #дексаметазон** в дозе 4 мг/м2 2 р/с в/в до снижения лейкоцитоза (не более 7 дней), также проводится циторедукция 1 - 3 введениями антрациклиновых антибиотиков (L01DB: Антрациклины и родственные соединения). При развитии лейкоцитоза на фоне терапии для профилактики ДС также назначается #дексаметазон** в дозе 4 мг/м2 2 р/с в/в до снижения лейкоцитоза (не более 7 дней). Если лейкоцитоз сопровождается выраженными оссалгиями, клиникой лейкостазов, рекомендовано введение цитарабина** в дозе 100 мг 2 р/с в/в до купирования симптомов, но не более 3 введений
- Токсический гепатит наблюдается примерно у 60% больных. Показан мониторинг показателей печеночной функции (билирубин, АСТ, АЛТ). Повышение активности печеночных трансаминаз в 5 раз и более требует снижения дозы триоксида мышьяка до 0,1 мг/кг/сут, а при отсутствии эффекта - временной отмены (на 5 - 7 дней) мышьяка триоксида и/или ATRA до уменьшения названных показателей меньше значения, превышающего норму в 2 раза.
- Удлинение корригированного интервала QT на фоне терапии мышьяка триоксидом является следствием удлинения времени реполяризации желудочков сердца. Первые введения мышьяка триоксиды выполняют под контролем кардиомонитора. Контроль длительности корригированного интервала QT выполняется один раз в неделю или чаще при наличии показаний. При развитии кардиотоксичности с удлинением интервала QTс более 500 мс [по Базетту (ЧСС 60 - 100 уд/мин) или Фредерику (при тахи-, брадикардии)], введение триоксида мышьяка может быть приостановлено до нормализации данного показателя (QTc < 450 мс). Также должны быть отменены все другие препараты, удлиняющие интервал QT. Необходимо контролировать концентрации электролитов (K+, Mg2+) в сыворотке крови и проводить коррекцию их нарушений, применять бета-адреноблокаторы.
- Для своевременной диагностики токсического паркеатита пациентам показан мониторинг концентрации сывороточной амилазы. При развитии острого панкреатита доза мышьяка триоксида снижается до 0,1 мг/кг/сут и проводится симптоматическая терапия (голод, антисекреторные препараты (A02 Препараты для лечения заболеваний связанных с нарушением кислотности)). При неэффективности этих мер мышьяка триоксид и/или #третиноин** временно отменятся (на 5 - 7 дней), терапия возобновляется в случае регрессии клинических проявлений. При бессимптомном повышении концентрации амилазы в сыворотке крови показан более частый мониторинг амилазы.
Приложение А3.4
ПРОТОКОЛ
КОНДИЦИОНИРОВАНИЯ В МИЕЛОАБЛАТИВНОМ РЕЖИМЕ ПРИ ВЫПОЛНЕНИИ
АУТО-ТГСК ПАЦИЕНТАМ С РЕЦИДИВОМ ОПЛ [49, 130]
Препарат
Суточная доза
Курсовая доза
Дни введения
Порядок введения
Кондиционирование
#Бусульфан**
4 мг/кг
12 мг/кг
С -6 по -4 день
Внутрь, суммарная суточная доза разделяется на 4 приема с интервалом 6 часов.
Циклофосфамид**
60 мг/кг
120 мг/кг
-3, -2 дни
В/в, в течение 2 ч
Сопроводительная терапия
Месна**
120% от дозы циклофосфамида
-
-3, -2 дни
в/в, инфузия в течение 24 ч, начиная за 2 часа до введения циклофосфамида
Гепарин натрия**
12000 ЕД
-
с -7-го п +14-день (до +28-го дня включительно при инфицировании гепатитом B, C и/или тромбозах в анамнезе)
в/в, инфузия в течение 24 ч
Сопроводительная терапия
ондансетрон**
24 мг
-
с -6-го по -1-й день
в/в 8 мг 3 раза/сут
аллопуринол**
200 мг/м2
-
с -8-го по -1-й день
внутрь, суточная доза разделяется на 2 приема
#карбамазепин**
200 мг
-
с -8-го по -2-й день
внутрь, 100 мг 2 раза/сут
#диазепам**
10 мг
-
с -6-го по -2-й день
в/в, на ночь
урсодезоксихолевая кислота**
12 мг/кг
-
с -6 по +180-й день
внутрь, суточная доза разделяется на 1 - 2 приема
профилактика инфекций
противогрибковая
применяется протокол, принятый в данном трансплантационном центре
противовирусная
Приложение А3.5
ОПЛ С ВАРИАНТНЫМИ ТРАНСЛОКАЦИЯМИ
И ИХ ЛЕКАРСТВЕННАЯ ЧУВСТВИТЕЛЬНОСТЬ [49, 130]
Перестройка
Транслокация
Чувствительность к третиноину
Чувствительность к мышьяка триоксиду
ZBTB16-RARA [158]
t(11;17)(q23;q21)
слабая
слабая
NPM-RARA [159]
t(5;17)(q35;q21)
да
неизвестно
NuMA-RARA [160]
t(11;17)(q13;q21)
да
неизвестно
STAT5b-RARA [161]
der(17)
слабая
слабая
PRKAR1A-RARA [162]
t(17;17)(q21;q24) или del(17)(q21;q24)
да
да
FIP1L1-RARA [163]
t(4;17)(q12;q21)
да в 1 случае
неизвестно
BCoR-RARA [164]
t(X;17)(p11;q21)
да в 2 случаях
нет в 1 случае
OBFC2A-RARA [165]
t(2;17)(q32;q21)
да
неизвестно
TBLR1-RARA [166]
t(3;17)(q26;q21)
нет
неизвестно
GTF2I-RARA [167]
t(7;17)(;q11;q21)
да
да
IRF2BP2-RARA [168]
t(1;17)(q42;q21)
да
да
FNDC3B-RARA [169]
t(1;17)(q42;q21)
да
да
HNRNPC-RARA [153]
-
нет
неизвестно
THRAP3::RARA [154]
-
нет
нет
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Алгоритм ведения пациентов с ОПЛ на программе AIDA
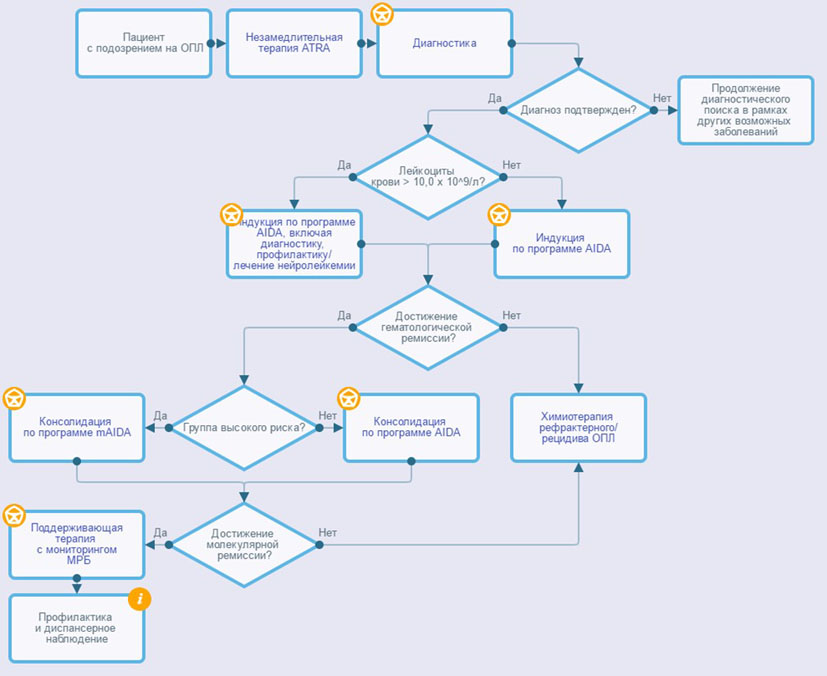
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Изменения в 2 хромосомах приводят к заболеванию, которое называется острый промиелоцитарный лейкоз (ОПЛ). Почти во всех случаях ОПЛ происходит транслокация, т.е. перемещение части одной хромосомы на другую. Это хромосомы 15 и 17. В этом случае образуется поломка в хромосоме 15, которая образует разрыв в области расположенного на ней гена PML (ген промиелоцитарной лейкемии), и поломка в хромосоме 17, в результате которой образуется разрыв в области гена RARA (альфа-ген рецептора ретиноевой кислоты). В результате перемещения частей хромосом образуется слияние этих генов и формируется так называемый сливной ген PML. Этот аномальный ген кодирует образование протеина, который останавливает созревание предшественников зрелых миелоидных клеток крови и костного мозга на промежуточной стадии промиелоцита. Эта транслокация имеет обозначение t (15; 17).
Идентификация характерной транслокации как пускового механизма ОПЛ и развитие так называемой целенаправленной (таргетной) терапии привели к тому, что практически у всех пациентов, которым начальное лечение может быть реализовано в полном объеме, возможно достижение так называемой полной ремиссии, т.е. исчезновения всех симптомов лейкемии и восстановления нормального кроветворения. В результате целенаправленной терапии лейкемические бластные клетки могут созреть и в дальнейшем истощить свой потенциал неконтролируемого роста и погибнуть. Тем не менее на этой стадии все еще существует остаточная популяция лейкемических клеток, поэтому, если остановить лечение на этом этапе, заболевание рано или поздно обязательно рецидивирует, что сделает излечение почти невозможным. Следующие важные компоненты лечения ОПЛ должны быть также обязательно реализованы: консолидирующее и поддерживающее лечение. Последовательное выполнение всех компонентов лечения привело к тому, что сегодня 9 из 10 пациентов имеют реальную возможность достичь вероятности прожить без признаков болезни более 5-7 лет. Достижения в развитии биологических технологий привели к тому, что теперь целью детекции остаточной популяции лейкемических клеток является распознавание 1 патологической клетки приблизительно на 10 - 100 тыс. нормальных - это стало возможным с помощью технологии полимеразно-цепной реакции. В настоящее время так называемая молекулярная ремиссия ОПЛ является целью лечения пациентов с ОПЛ. Наряду с достижением молекулярной ремиссии (или молекулярного "ответа") важным компонентом наблюдения за больным является также регулярное исследование костного мозга методом полимеразно-цепной реакции в последующие этапы - молекулярный мониторинг минимальной остаточной (резидуальной) болезни.
В арсенале современной медицины есть все препараты для эффективного лечения ОПЛ.
Неотъемлемым компонентом лечения пациентов с впервые диагностированным ОПЛ является также сопроводительная трансфузионная терапия компонентами донорской крови, прежде всего свежезамороженной плазмой и концентратом тромбоцитов. Эти компоненты необходимы прежде всего в лечении так называемой коагулопатии ОПЛ - состояния, при котором происходят нарушения свертываемости крови, в которых имеется повышенный риск кровоизлияний в сочетании с возможностью также и тромботических осложнений.
В заключение следует сказать, что, хотя ОПЛ часто рассматривается в рамках так называемых миелоидных лейкозов, он лечится по несколько иным принципам, чем другие миелоидные лейкозы. Трансплантация костного мозга редко рассматривается как компонент лечения пациентов с впервые выявленным ОПЛ. В то же время трансплантация костного мозга может быть важным компонентом лечения рецидивов ОПЛ.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА
ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ВОСТОЧНОЙ ОБЪЕДИНЕННОЙ
ОНКОЛОГИЧЕСКОЙ ГРУППЫ (ECOG)
Оригинальное название: The ECOG Scale of Performance Status Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5(6): 649-65
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания.
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу).
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования.
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели.
5
Смерть пациента
Приложение Г2
ШКАЛА
KHORANA ДЛЯ ОЦЕНКИ РИСКА ВЕНОЗНЫХ ТРОМБОЭМБОЛИЧЕСКИХ
ОСЛОЖНЕНИЙ (ВТЭО) У ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ХИМИОТЕРАПИЮ
Источник: Development and Validation of a predictive model for chemotherapy associated thrombosis. Blood. 2008; 111(10): 4902 - 4907
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Факторы риска
Баллы
Локализация опухоли:
- очень высокий риск: желудок, поджелудочная железа
- высокий риск: легкие, лимфома, кровь, яички, яичники, матка
1
2
Количество тромбоцитов в крови перед началом химиотерапии ![]() 350* 109/л
350* 109/л
1
Уровень гемоглобина менее 100 г/л или использование эритропоэтина
1
Количество лейкоцитов в крови перед началом химиотерапии ![]() 11* 109/л
11* 109/л
1
Индекс массы тела ![]() 35 кг/м2
35 кг/м2
1
Риск развития ВТЭО в течение 2 - 5 мес.
Вероятность, %
Высокий (сумма баллов ![]() 3)
3)
6,7 - 7,1
Средний (1 - 2 балла)
1,8 - 2
Низкий (0 баллов)
0,3 - 0,8
