"Клинические рекомендации "Рак коры надпочечника (Адренокортикальный рак)"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК КОРЫ НАДПОЧЕЧНИКА (АДРЕНОКОРТИКАЛЬНЫЙ РАК)
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C74.0, C74.9, D44.1
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 341_2
Возрастная категория: Взрослые, Дети
Специальность: Онкология, Эндокринология
Разработчик клинической рекомендации
Российская ассоциация эндокринологов, Ассоциация онкологов России, Ассоциации эндокринных хирургов, Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
18ФДГ-ПЭТ/КТ - позитронно-эмиссионная томография с Флудезоксиглюкозой [18F], совмещенная с компьютерной томографией (A07.30.043.01 Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием)
AJCC - Американский объединенный комитет по раку
ENSAT - Европейская рабочая группа по изучению опухолей надпочечников (European Network for the Study of Adrenal Tumors)
HU (единицы Хаунсфилда) - денситометрические показатели при проведении КТ
[123I] - Йобенгуан [123I] - радиофармацевтическое диагностическое средство
RECIST - Критерии ответа солидных опухолей на терапию (Response evaluation criteria in solid tumors)
SUV (standartised uptake value) - накопительный критерий при 18ФДГ-ПЭТ/КТ
TNM - Международная классификация стадий злокачественных новообразований (аббревиатура от Tumor, Nodus, Metastasis)
UICC - Международный союз по борьбе с раком (Union for International Cancer Control)
АГ - артериальная гипертензия
АКР - рак коры надпочечника (син.: адренокортикальный рак)
АКТГ - адренокортикотропный гормон
АЛТ - аланин-амминотрансфераза
АРС - альдостерон-рениновое соотношение
АСТ - аспартат-аминотрансфераза
ВОЗ - Всемирная организация здравоохранения
ДЛТ - дистанционная лучевая терапия
ГГТП - гамма-глутамил-транспептидаза
ГСПГ - глобулин, связывающий половые стероиды
ИГХ - иммуногистохимическое исследование
КУ - контрастное усиление
ЛГ - лютеинизирующий гормон
ЛДГ - лактатдегидрогеназа
МКБ-10 - Международная классификация болезней 10-го пересмотра
МРТ - магнитно-резонансная томография
МСКТ - мультиспиральная компьютерная томография
МЭН - синдром множественных эндокринных неоплазий
НБП - нейробластома
НПВ - нижняя полая вена
ОБП - органы брюшной полости
ОГК - органы грудной клетки
ПГА - первичный гиперальдостеронизм
РЧА - радиочастотная абляция (A16.14.037)
ФХЦ/ПГ - феохромоцитома/параганглиома
ФСГ - фолликулостимулирующий гормон
СИК - синдром Иценко-Кушинга
ТТГ - тиреотропный гормон
УЗИ - ультразвуковое исследование
Термины и определения
Адъювантная химиотерапия - химиотерапия, применяемая после локального воздействия на опухоль в целях эрадикации или длительного подавления микрометастазов
Герминативная мутация - изменение структуры гена (последовательности нуклеотидов, хромосомы, генома), по сравнению с референсной последовательностью, возникшее в половых (зародышевых) клетках.
Гиперкортицизм (эндогенный) - комплекс клинических симптомов, обусловленных длительным воздействием кортикостероидов на организм вследствие их избыточной эндогенной продукции.
Драйверная мутация - изменение структуры гена (последовательности нуклеотидов, хромосомы, генома), инициирующее превращение нормальной клетки в раковую
Инциденталома надпочечника - собирательное понятие, включающее разнообразную по морфологии группу опухолей более 1 см в диаметре, случайно выявленных при радиологическом обследовании.
Канцерогенез - сложный патофизиологический процесс зарождения и развития опухоли.
Мутация - стойкое (то есть такое, которое может быть унаследовано потомками данной клетки или организма в случае герминативной мутации) изменение генома.
Нейробластома - злокачественная опухоль, развивающаяся из клеток предшественников симпатической нервной системы (СНС).
Острая надпочечниковая недостаточность - симптомокомплекс, обусловленный резким снижением или полным прекращением функциональной деятельности коры надпочечников.
Орфанное заболевание - редкое заболевание, которое встречается у небольшого количества людей относительно общей численности населения: в Европе редким принято считать заболевание с распространенностью 1 человек на 2000 населения, в США - если затрагивают не более 2000 человек, в России - не более 10 человек на 100 000 населения.
Первичный гиперальдостеронизм - клинический синдром, развивающийся в результате избыточной продукции альдостерона клубочковой зоной коркового вещества надпочечников, при котором секреция альдостерона полностью или частично автономна по отношению к ренин-ангиотензиновой системе, что обусловливает развитие низкорениновой гипокалиемической артериальной гипертензии.
Сигнальный путь - последовательность молекул, посредством которых информация от клеточного рецептора передается внутри клетки.
Синдром "неуправляемой гемодинамики" - патологическое состояние, возникающее на фоне катехоламинпродуцирующей опухоли надпочечника и характеризующееся резким учащением гипертензивных высокоамплитудных кризов с усугубляющейся некурабельной гипотонией в межприступном периоде
Системная химиотерапия - введение препаратов внутрь, подкожно, внутривенно, внутримышечно, рассчитанное на общий противоопухолевый эффект.
Феохромоцитома - опухоль хромаффинных клеток симпато-адреналовой системы надпочечниковой или вненадпочечниковой локализации, как правило, секретирующая катехоламины.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Рак коры надпочечника (син.: адренокортикальный рак; АКР) - редкая злокачественная опухоль коры надпочечников, характеризующая, как правило, поздним сроком выявления, агрессивностью клинического течения и неблагоприятным лечебным прогнозом.
АКР может быть гормонально-активным, являясь, чаще всего, причиной субклинического или манифестного синдрома Кушинга (или смешанных синдромов), или может быть гормонально-неактивной опухолью [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Канцерогенез при АКР обусловлен драйверными мутациями ряда генов и активацией соответствующих сигнальных путей [2]. В большинстве случаев эти мутации возникают спонтанно в клетках коры надпочечника, приводя к спорадическим случаям заболевания. Также в основе патогенеза АКР могут лежать герминативные мутации: в этом случае заболевание будет наблюдаться в рамках того или иного наследственного синдрома [3].
Описано несколько наследственных синдромов, компонентом которых является АКР (Табл. 1). При этих синдромах отмечается низкая фенотипическая пенетрантность АКР, в связи с чем, проследить наследственный характер заболевания анамнестически достаточно сложно [1]. Самым распространенным наследственным синдромом, включающим АКР, является синдром Ли-Фраумени, обнаруживаемый в большинстве случаев АКР в детском возрасте - до 80% всех пациентов; он также является самой частой причиной наследственного АКР во взрослом возрасте - до 5% всех случаев заболевания. Распространенность остальных синдромов, ассоциированных с АКР, составляет от долей процента до 3 - 4% среди взрослых пациентов с АКР [3].
Таблица 1. Наследственные синдромы, ассоциированные с АКР [3]
Синдром
Драйверные гены
Распространенность среди пациентов с АКР
Синдром Ли-Фраумени
TP53
3 - 5% среди взрослых; 50 - 80% среди детей
Синдром Линча
MSH2, MSH6, MLH1, PMS2
3% среди взрослых
МЭН 1 типа
MEN1
1 - 2% среди взрослых
менее 1% у детей
Семейный аденоматозный полипоз (синдром Гарднера)
APC
менее 1%
Комплекс (синдром) Карнея
PRKAR1A
менее 1%
Синдром Беквита-Видемана
IGF2, H19 в локусе 11p15
менее 1%
Нейрофиброматоз 1 типа
NF1
менее 1%
Генез синдрома Ли-Фраумени связан с инактивирующей мутацией в гене TP53, гене-супрессоре опухолевого роста. Синдром характеризуется развитием сарком мягких тканей, рака молочной железы, новообразований головного мозга, лейкозов и АКР. Он наиболее часто встречается в южных регионах Бразилии, где 0,3% популяции являются носителями герминативной мутации R337H в гене TP53.
В основе патогенеза синдрома Линча лежат герминативные мутации в одном из генов системы репарации ДНК (MSH2, MSH6, MLH1, PMS2), что приводит к развитию рака проксимальных отделов толстой кишки (до 80% случаев синдрома Линча). Помимо колоректального рака и АКР, у пациентов с синдромом Линча повышены риски злокачественных образований других локализаций: рака эндометрия (50 - 71% случаев синдрома Линча), мочевыводящих путей, яичников, желудка, тонкой кишки, поджелудочной железы, а также глиобластом головного мозга и опухолей сальных желез.
Синдром множественных эндокринных неоплазий (МЭН) 1 типа обусловлен герминативными мутациями в гене-супрессоре опухолевого роста MEN1. Наиболее распространенным поражением надпочечников, наблюдаемых при синдроме МЭН 1 типа, являются односторонняя или двусторонняя гиперплазия коры и аденомы. Эти поражения встречаются у 45 - 55% пациентов с МЭН 1 и могут быть гормонально-активными или нефункциональными. Распространенность АКР в рамках синдрома МЭН 1 типа достигает 22%. Другими проявлениями синдрома МЭН 1 типа наиболее часто являются гиперплазия или опухоли околощитовидных желез, приводящие к первичному гиперпаратиреозу, панкреатические нейроэндокринные опухоли, опухоли гипофиза.
АКР также может выявляться в составе синдромов Гарднера (аденоматозный полипоз кишки), Беквита-Видемана, комплекса Карнея, нейрофиброматоз 1 типа. Доля этих синдромов в структуре АКР, по данным литературы, не превышает 1% [3].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Ежегодное выявление АКР составляет 0,5 - 2 случая на 1 миллион населения, в структуре онкологической смертности составляет 0,04 - 0,2%. Отмечаются региональные различия в показателях заболеваемости. Показатель заболеваемости на юге Бразилии самый высокий и варьирует от 3,4 - 4,2 случаев на 1 миллион населения, что примерно в 10 раз превышает средний показатель в других странах [229]. Заболевание проявляется преимущественно у взрослых и очень редко у детей с бимодальным распределением возраста. У взрослых на момент постановки диагноза средний возраст заболевания составляет 50 - 60 лет, у детей - 3 - 4 года. Женщины болеют чаще, соотношение женщины/мужчины составляет 2,5:1 [2, 4, 230]. Эпидемиологические данные по Российской Федерации оценить крайне затруднительно, так как онкологическая отчетность отдельно по АКР не формируется, регистр отсутствует. АКР включен в перечень орфанных заболеваний в РФ [5].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C74 Злокачественное новообразование надпочечника
C74.0 Коры надпочечника
C74.9 Надпочечника неуточненной части
D44.1 Новообразование неопределенного или неизвестного характера эндокринных желез. Надпочечника.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Международная гистологическая классификация
Согласно Международной гистологической (классификация Всемирной организации здравоохранения (ВОЗ), 5-е издание, 2022 г.), АКР кодируется как 8370/3 (Табл. 2) [2].
Таблица 2. Классификация ВОЗ опухолей коры надпочечников, 2022 г.
Эктопическая ткань надпочечника (адренокортикальные остатки)
Кисты надпочечника
Миелолипома
ICD-O code 8870/0
Адренокортикальные опухоли
Врожденная гиперплазия коры надпочечников
Адренокортикальная нодулярная болезнь
Адренокортикальный рак
ICD-O code 8370/3
Адренокортикальная аденома
ICD-O code 8370/0
Опухоли стромы полового тяжа и прочие опухоли
Опухоли стромы полового тяжа
ICD-O code 8590/1
Аденоматоидная опухоль
ICD-O code 9054/0
Меланома
ICD-O code 8720/3
Морфологические коды приведены в соответствии с Международной классификацией онкологических заболеваний (ICD-O):
/0 - доброкачественная опухоль,
/1 - опухоль с неуточненным, пограничным или неопределенным злокачественным потенциалом,
/2 - carcinoma in situ или интраэпителиальная неоплазия высокой степени злокачественности (grade 3),
/3 - злокачественная опухоль.
1.5.2. Стадирование
Стадирование АКР у взрослых проводят по классификации TNM Американского объединенного комитета по раку (AJCC)/Союза международного контроля над раком (UICC) 8-го пересмотра (2017 г.) и по классификации Европейской рабочей группы по изучению опухолей надпочечников (ENSAT, European Network for the Study of Adrenal Tumors) [6, 7]. Стадирование АКР у детей проводят по классификации TNM и по системе Детской онкологической группы (COG, Children's Oncology Group) [7, 230, 231].
Клиническое стадирование АКР осуществляется на предоперационном этапе у детей и взрослых на основании результатов лучевых методов исследования, у детей дополнительным параметром является оценка объема опухоли. После проведения хирургического лечения для надлежащего стадирования АКР (pTNM) необходимо гистологическое подтверждение. У детей дополнительным параметром является масса опухоли, оцененная после выполнения хирургического вмешательства.
Первичная опухоль (T/pT). Критерий T отражает распространенность первичной опухоли и содержит следующие градации:
Tx: Первичная опухоль не может быть оценена
T0: нет данных о наличии первичной опухоли
T1: размер опухоли ![]() 5 см;
5 см;
T2: размер опухоли > 5 см;
T3: опухоль любого размера с локальной инвазией, без вовлечения окружающих органов*;
--------------------------------
<*> Окружающими органами являются: почка, диафрагма, крупные сосуды, поджелудочная железа, печень.
T4: опухоль любого размера с инвазий опухоли в окружающие органы и/или тромбоз нижней полой вены (НПВ) и/или тромбоз почечной вены.
Регионарные лимфатические узлы (N/pN). Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах
Nx: регионарные лимфоузлы не могут быть оценены;
N0: отсутствие метастатического поражения лимфоузлов;
N1: метастатическое поражение лимфоузлов
Регионарными считаются лимфоузлы ворот почки, парааортальные и паракавальные. Сторона поражения надпочечника не учитывается.
Отдаленные метастазы (M). Критерий M характеризует наличие или отсутствие отдаленных метастазов:
M0: отдаленных метастазов отсутствуют
M1: отдаленные метастазы присутствуют
Группировка критериев TNM для определения стадии АКР по UICC и ENSAT представлена в таблице 3. Критерии установления стадии АКР идентичны как для UICC, так и для ENSAT. Стадирование АКР у детей по системе COG представлена в таблице 4.
Таблица 3. Стадирование АКР по TNM AJCC/UICC 8-го пересмотра и ENSAT
Стадия по AJCC/UICC 8-го пересмотра и ENSAT
Критерии стадирования TNM по AJCC/UICC 8
ENSAT
Стадия 1
T1
N0
M0
Как в UICC TNM 8
Стадия 2
T2
N0
M0
Как в UICC TNM 8
Стадия 3
T1/T2
N1
M0
Опухоль с метастазами в лимфоузлы
- распространением инфильтрации за пределы надпочечника
- опухолевым тромбозом НПВ или почечной вены
T3/T4
N0/N1
M0
Стадия 4
T1-4
N0-1
M1
Любая опухоль с отдаленными метастазами
Таблица 4. Стадирование АКР у детей по системе COG
Стадия по COG
Критерии стадирования
Стадия 1
1. Полностью удаленная опухоль
2. Объем опухоли < 200 см3 по данным рентгенологических методов исследований
3. Масса опухоли < 100 граммов
4. Нормальный уровень гормонов после операции
Стадия 2
1. Полностью удаленная опухоль
2. Объем опухоли ![]() 200 см3 по данным рентгенологических методов исследований
200 см3 по данным рентгенологических методов исследований
3. Масса опухоли ![]() 100 граммов
100 граммов
4. Нормальный уровень гормонов после операции
Стадия 3
1. Микроскопически остаточная опухоль
2. Неоперабельная или местнораспространенная опухоль
3. Отсутствие нормализации гормонов после радикального удаления опухоли
4. Пациенты с пораженными лимфатическими узлами забрюшинного пространства
Стадия 4
1. Наличие отдаленного метастазирования
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
АКР может быть гормонально-активным, являясь, чаще всего, причиной субклинического или манифестного синдрома Кушинга, и/или вирильного синдрома, или может быть случайно выявленной гормонально-неактивной опухолью надпочечника
Клинические проявления АКР в разных возрастных группах несколько отличаются.
У взрослых пациентов клинические проявления АКР включают симптомы избыточной гормональной секреции (50 - 60%) и неспецифические симптомы, связанные с ростом опухоли (30 - 35%) [2]. В остальных случаях (10 - 15%) заболевание обнаруживается случайно при проведении лучевых методов исследований: мультиспиральной компьютерной томографии (МСКТ) и/или магнитно-резонансной томографии (МРТ) и/или ультразвукового исследования (УЗИ) как инциденталома (Табл. 5) [8 - 13].
Таблица 5. Клинические проявления АКР у взрослых пациентов [8]
Проявления АКР
Распространенность
Автономная гормональная гиперпродукция
50 - 60%
· Гиперкортицизм (синдром Иценко-Кушинга)
50 - 80%
· Гиперпродукция андрогенов (вирилизация у женщин)
20 - 30%
· Гиперпродукция эстрогенов
5%
· Первичный гиперальдостеронизм
2 - 3%
Неспецифические проявления
30 - 35%
Инциденталома
10 - 15%
Наиболее распространенным проявлением гормональной гиперпродукции является гиперкортицизм, как изолированный (30 - 50%), так и в сочетании с симптомами вирилизации (20 - 30%). Таким образом, гиперкортицизм достигает 50 - 80% среди всех случаев гормонально-активного АКР.
Изолированная гиперпродукция андрогенов является вторым по распространенности проявлением гормональной активности АКР (до 20% пациентов). Гиперандрогенемия у женщин может приводить к развитию гирсутизма, вирилизации и нарушению менструального цикла. У мужчин избыток андрогенов часто остается незамеченным ввиду скудности симптомов. Гиперпродукция эстрогенов при АКР встречается редко (менее 2%), вызывает у мужчин развитие гинекомастии и атрофии яичек, у женщин в постменопаузе проявляется метроррагиями. Избыточная секреция половых гормонов при обнаружении опухоли надпочечника особенно подозрительна в отношении АКР.
Наиболее редкий вариант эндокринопатии при АКР связан с проявлениями первичного гиперальдостеронизма, который проявляется выраженной артериальной гипертензией и гипокалиемией. Повышенная продукция альдостерона отмечается несколько чаще в рамках смешанной гормональной продукции.
В большинстве случаев АКР имеет относительно большие размеры, в среднем - более 10 см. Неспецифические симптомы АКР, такие как дискомфорт или боли, боль в поясничной области и в животе, ощущение переполнения желудка, обусловлены ростом опухоли в размерах и компрессией прилежащих органов [14].
Симптомы, традиционно ассоциируемые с онкологическим заболеванием (выраженная потеря массы тела, слабость, субфебрильная лихорадка), как правило, не характерны для АКР [8].
У детей гормональная активность АКР выявляется в 90% случаев. Преждевременное половое развитие (ППР) или вирилизация изосексуального или гетеросексуального характера встречается часто и характерируется высоким уровнем тестостерона или эстрогена с низким уровнем ФСГ и ЛГ в плазме крови [232]. Большинство опухолей изолированно секретирует кортизол (65%) или андрогены в комбинации с кортизолом (30%). Другие варианты гормональной активности в детском возрасте можно считать казуистическими. Пациенты могут иметь неспецифическую картину, которая проявляется в виде артериальной гипертензии и судорог. В половине случаев презентация заболевания может быть связана с большой массой пальпируемого образования, сопровождающее болевым синдромом и снижением массы тела (Табл. 6) [232].
Таблица 6. Клинические проявления АКР у детей и подростков [230, 232, 233]
Проявления АКР
Распространенность
Автономная гормональная гиперпродукция
90%
-
Изолированный гиперкортицизм (синдром Иценко-Кушинга)
65%
-
Вирилизация
80%
Артериальная гипертензия
50%
Судороги
10%
Пальпируемое образование, болевой синдром
50%
Несекретирующие опухоли
10%
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза АКР включают
1. жалобы пациента;
2. данные индивидуального и семейного анамнеза;
3. результаты физикального обследования;
4. результаты лабораторных, инструментальных и иных диагностических исследований.
Диагностика неметастатического АКР осуществляется в случае выявления опухоли надпочечника. С этой точки зрения диагностика АКР рассматривается в рамках дифференциального диагноза с другими опухолями надпочечников, наиболее часто выявляемыми случайно (инциденталомами). Термин "инциденталома надпочечника" является собирательным, включающим разнообразную по морфологии группу опухолей более 1 см в диаметре, случайно выявленных при радиологическом обследовании [15]. Выявленное образование может
- оказаться как гормонально-неактивным, так и активным;
- исходить из различных зон надпочечника или иметь неспецифичную органную принадлежность;
- быть злокачественным или доброкачественным.
Диагностика местнораспространенного или метастатического рака как правило не вызывает трудностей, иногда проводится дифференциальная диагностика с опухолями печени, почки, забрюшинными неорганными опухолями.
При АКР небольших размеров с массивным отдаленным метастатическим поражением может возникнуть необходимость дифференциальной диагностики с другой злокачественной опухолью с метастазом в надпочечнике (например, рака легкого).
У детей до года АКР без выраженной клинической картины в виде вирилизации или течения артериальной гипертензии и с нормальным гормональным фоном необходимо дифференцировать с нейробластомой (НБЛ), которая является самой частой экстракраниальной солидной опухолью у детей и подростков и самой частой опухолью надпочечников [234]. У детей старшего возраста с течением артериальной гипертензии и нормальным гормональным фоном дифференциальную диагностику следует проводить с ФХ, которая является в 2% случаев причиной артериальной гипертензии у детей и подростков [235].
2.1 Жалобы и анамнез
Жалобы пациентов с гормонально-активным АКР определяются характером секреторного спектра опухоли:
- гиперкортицизм: общая слабость, головные боли, диспластичное (центрипетальное) ожирение, артериальная гипертензия, мышечная слабость, матронизм, "климактерический горбик", яркие широкие стрии (передняя брюшная стенка, бедра, подмышечные области и т.д.), нарушения менструального цикла, снижение полового влечения, сахарный диабет, и др.;
- гиперандрогенемия: у женщин гирсутизм, нарушения менструального цикла, увеличение клитора; повышение жирности и нечистота кожи;
- гиперэстрогенемия: импотенция, гинекомастия у мужчин, метроррагии у женщин в постменопаузе;
- гиперальдостеронизм: артериальная гипертензия, не корригируемая многокомпонентной терапией, мышечная слабость.
Гормонально-неактивные АКР могут проявляться неспецифическими жалобами на дискомфорт/болью в животе или спине, ощущение переполнения в животе, наличие объемного образования в брюшной полости, определяемого самостоятельно при ощупывании живота.
В 10 - 15% всех случаев пациенты с АКР не предъявляют жалоб, в этом случае АКР первично выявляется как инциденталома.
2.2 Физикальное обследование
Некоторые проявления АКР, обусловленные симптоматикой гормональной гиперпродукии, могут быть выявлены при физикальном обследовании (см. разделы 1.6 и 2.1). Опухоль больших размеров в некоторых случаях может быть обнаружена пальпаторно. Клинические проявления могут иметь метастазы АКР в печени, легких, костях.
2.3 Лабораторные диагностические исследования
- 2.3.1. Рекомендуется всем пациентам ![]() 18 лет при выявлении опухоли надпочечника размером более 1 см в первую очередь лабораторные исследования для исключения или подтверждения гормональной активности образования, которая может проявляться гиперкатехоламинемией, АКТГ-независимым гиперкортицизмом, первичным гиперальдостеронизмом [8, 13, 16, 211].
18 лет при выявлении опухоли надпочечника размером более 1 см в первую очередь лабораторные исследования для исключения или подтверждения гормональной активности образования, которая может проявляться гиперкатехоламинемией, АКТГ-независимым гиперкортицизмом, первичным гиперальдостеронизмом [8, 13, 16, 211].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
Комментарий. Согласно статистике аутопсий, распространенность случайно выявленных опухолей надпочечника составляет в среднем - 6%. Инциденталомы надпочечников выявляются у 4% пациентов, обследованных по иному поводу. [17]. В возрасте до 30 лет инциденталома встречается приблизительно у 0,2% обследованных, но в группе пациентов старше 70 лет частота возрастает до 7%.
Частота АКР среди инциденталом невысокая. Так, по данным W.F. Young и соавт. [16], частота АКР оценивалась чуть более 4%. Другой анализ [13] большого числа пациентов продемонстрировал распространенность АКР среди инциденталом не более 1,9%. Вероятность выявить АКР при инциденталомах зависит от размера, и достигает 25% при размере опухоли больше 6 см.
- 2.3.2. Исследование гормональной активности опухоли надпочечника регламентировано и рекомендуется учитывать его результаты у каждого пациента для периоперационного ведения и планирования лекарственной терапии [8, 13, 18].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
Комментарий. Отсутствие явных клинических проявлений гормональной активности не говорит о гормонально не активной опухоли - возможна субклиническая гормональная активность.
Известно также, что ФХ могут продуцировать АКТГ и вызвать клинику гиперкортицизма. [19 - 22].
- 2.3.3.1 Рекомендуется всем пациентам взрослого возраста с выявленной опухолью надпочечника и пациентов детского возраста с подозрением на АКР проводить исследование уровня общего кортизола в крови в ранние утренние часы на фоне подавляющего теста с 1 мг #дексаметазона** внутрь с целью выявления АКТГ-независимого гиперкортицизма [8, 19, 23]. Недооценка наличия гиперкортицизма (в том числе субклинического) связана с высоким риском развития острой надпочечниковой недостаточности в послеоперационном периоде.
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
- 2.3.3.2. При отсутствии физиологического подавления уровня кортизола пациентам ![]() 18 лет и пациентам детского возраста с выявленной опухолью надпочечника в качестве подтверждающего теста рекомендуется использовать исследование уровня адренокортикотропного гормона в крови (АКТГ) в утренние часы (A09.05.067 Исследование уровня адренокортикотропного гормона в крови) [8, 13, 16, 18].
18 лет и пациентам детского возраста с выявленной опухолью надпочечника в качестве подтверждающего теста рекомендуется использовать исследование уровня адренокортикотропного гормона в крови (АКТГ) в утренние часы (A09.05.067 Исследование уровня адренокортикотропного гормона в крови) [8, 13, 16, 18].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
Комментарий: у здоровых лиц назначение глюкокортикоидов приводит к подавлению АКТГ и синтеза кортизола. При назначении низких доз синтетического глюкокортикоида дексаметазона** у больных с синдромом эндогенного гиперкортицизма любого генеза, этого подавления не происходит [24]. Подавляющий тест проводится следующим образом: 1 мг #дексаметазона** внутрь принимается между 23 и 24 часами, кортизол измеряется в крови, взятой следующим утром между 8 и 9 часами. Более высокие дозы (1,5 или 2 мг) не улучшают точность теста [8, 25].
В качестве диагностического критерия предложено считать подавление утреннего кортизола менее 50 нмоль/л (чувствительность более 95%) [18, 24, 25].
Специфичность подавляющего теста при пороговом значении менее 50 нмоль/л не превышает 80%. Для уменьшения числа ложноположительных результатов используется определение в утренние часы уровня АКТГ. Подавленный уровень АКТГ подтверждает наличие гиперкортицизма у пациентов с опухолями надпочечников [26]. Измерение АКТГ не является методом первичной диагностики, однако может служить подтверждающим признаком субклинических проявлений гиперкортицизма в этой группе пациентов.
Опухоль коры надпочечника, автономно продуцирующая кортизол, является причиной атрофии коры контрлатерального надпочечника. При длительном течении гиперкортицизма возможна необратимая атрофия коры, требующая длительной, иногда пожизненной заместительной терапии [27].
Диагностика субклинического гиперкортицизма проводится для оценки возможности возникновения послеоперационной острой надпочечниковой недостаточности. Клинические проявления надпочечниковой недостаточности являются неспецифическими для послеоперационного периода и часто мимикрируют под другие осложнения (кровотечение, интоксикация, острый инфаркт миокарда и т.д.): отсутствие аппетита, слабость, тошнота, умеренная гипотония, вздутие живота, вечерние гектические подъемы температуры. Несвоевременно распознанные и не купированные, эти клинические проявления могут привести к фатальному исходу [28].
- 2.3.4 Рекомендуется всем взрослым пациентам с выявленной опухолью надпочечника проводить исследование уровней метанефрина и норметанефрина в крови или в суточной порции мочи с целью исключения ФХЦ/ПГ (A09.05.133.001 Исследование уровня метанефринов в крови, A09.05.133.002 Исследование уровня норметанефринов в крови) [8, 13, 29 - 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
- 2.3.5. Рекомендуется всем детям в возрасте 0 - 18 лет при выявлении объемного образования в области надпочечников для исключения НБЛ оценивать уровень опухолевых маркеров: лактатдегидрогеназы (ЛДГ), ферритина, нейронспецифической энолазы (НСЕ) в плазме крови (A09.05.039 Определение активности лактатдегидрогеназы в крови, A09.05.076 Исследование уровня ферритина в крови, A09.05.246 Исследование уровня нейронспецифической енолазы в крови) [234, 236];
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий: НБЛ является самой частой злокачественной экстракраниальной солидной опухолью детского возраста и самой частой опухолью надпочечников у детей [234]. Учитывая высокую частоту встречаемости, НБЛ следует включать в дифференциальный ряд опухолей надпочечников у детей и подростков [234, 236]. При НБЛ часто наблюдается повышение уровня НСЕ, ЛДГ и ферритина в плазме крови, в связи с чем необходима оценка последних, также при возможности провести оценку уровня метаболитов катехоламинов (ванилилминдальная кислота (ВМК), гомованилиновая кислота (ГВК)) в моче. Алгоритм обследования и лечения при подозрении на НБЛ подробно изложены в клинических рекомендациях по лечению данной нозологии [236]. Феохромоцитома/парагангилома встречается крайне редко у детей в 0,2 - 0,5 случаев на миллион детского населения, при этом надпочечниковая локализация (ФХ) встречается в 85% случаев [237]. В 80% ФХ у детей является функциональной или секретирующей и проявляется в виде артериальной гипертензии. Гиперпродукция катехоламинов лежит в основе клинической картины и диагностики ФХ методом определения фракционированных метанефринов/норметанефринов в моче (A09.28.034.001, A09.28.034.002) или в плазме крови (A09.05.133.001, A09.05.133.002) [235].
- 2.3.6 Рекомендуется всем взрослым пациентам с опухолью надпочечника при наличии артериальной гипертензии проводить определение соотношения между уровнем альдостерона и активностью ренина плазмы крови для исключения первичного гиперальдостеронизма (A09.05.069 Исследование уровня альдостерона в крови, A09.05.121 Исследование уровня ренина в крови) [8, 32, 33].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
Комментарий. Алгоритм обследования при первичном гиперальдостеронизме подробно изложен в клинических рекомендациях по диагностике и лечению данной нозологии [32, 34].
- 2.3.7 Рекомендуется всем взрослым пациентам с опухолью надпочечника при клиническом подозрении на изолированную или сочетанную с гиперкортицизмом опухолевую гиперпродукцию половых гормонов проводить комплексное определение концентрации стероидных гормонов в крови: дегидроэпиандростерона сульфата (A09.05.149 Исследование уровня дегидроэпиандростерона сульфата в крови), 17-гидроксипрогестерона (A09.05.139 Исследование уровня 17-гидроксипрогестерона в крови), андростендиона (A09.05.146 Исследование уровня андростендиона в крови), общего тестостерона у женщин (A09.05.078 Исследование уровня общего тестостерона в крови), общего эстрадиола у мужчин и женщин в менопаузе (A09.05.154 Исследование уровня общего эстрадиола в крови), 11-дезоксикортикостерона (A09.05.141 Исследование уровня 11-дезоксикортикостерона в крови) [8].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
Комментарий. Сочетанная автономная гиперпродукция андрогенов и кортизола у пациентов обоего пола, секреция предшественников стероидов или эстрадиола у мужчин говорят в пользу диагноза АКР. Умеренно выраженный, длительный гирсутизм на фоне гиперандрогенемии у женщин более вероятно обусловлен синдромом поликистозных яичников или неклассической формой врожденной дисфункции коры надпочечников [35].
- 2.3.8. Рекомендуется всем детям в возрасте 0 - 18 лет с подозрением на АКР при инициальной диагностике и в процессе проведения специфического лечения проводить определение концентрации стероидных гормонов в крови: дегидроэпиандростерона сульфата (A09.05.149 Исследование уровня дегидроэпиандростерона сульфата в крови), 17-гидроксипрогестерона (A09.05.139 Исследование уровня 17-гидроксипрогестерона в крови), андростендиона (A09.05.146 Исследование уровня андростендиона в крови), тестостерона (A09.05.078 Исследование уровня общего тестостерона в крови), общего эстрадиола (A09.05.154 Исследование уровня общего эстрадиола в крови), 11-дезоксикортикостерона (A09.05.141 Исследование уровня 11-дезоксикортикостерона в крови) [233].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
2.4 Инструментальные диагностические исследования
- 2.4.1. Рекомендуется всем пациентам с опухолью надпочечника для диагностики злокачественного потенциала опухоли провести оценку количественных денситометрических показателей при трехфазной Компьютерной томографии органов брюшной полости с внутривенным болюсным контрастированием (A06.30.005.003 Компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием) при отсутствии абсолютных противопоказаний к проведению КТ:
- плотность тканевого компонента до контрастирования (нативная);
- плотность в тканевую фазу контрастирования (артериальная и венозная фазы);
- плотность в отсроченную (через 10 мин. после введения контрастного средства фазу контрастирования (фаза вымывания) (только для взрослых пациентов). [4, 8, 13, 36, 37].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. При получении высокой плотности опухоли по КТ в нативную фазу, задержки контрастного средства в отсроченной фазе - злокачественный потенциал опухоли должен оцениваться, как высокий. Размер опухоли, как единственный показатель, не является признаком злокачественности. При этом известно, что при размере опухоли 4см и более, 25% из них злокачественные, а также более чем в 80% случаев АКР при выявлении имеет размер 6см и больше [33].
Богатые липидами ткани (имеющие низкую плотность при КТ) характерны для доброкачественных аденом коры надпочечника. При этом, около 25% аденом могут не иметь низкой нативной плотности, так называемые аденомы низким содержанием жира. Однако при аденомах наблюдается быстрое вымывание контрастного средства из ткани (более чем на 50% через 10 мин.), в то время как злокачественные опухоли надпочечников имеют тенденцию к задержке контрастного средства. Процент абсолютного вымывания контрастного средства по формуле [(HU порт. фаза) - (HU отср. 15m)] / [(HU порт. фаза) - (HU нат. фаза)] x 100 для злокачественных опухолей составляет больше 60% и относительного вымывания по формуле [(HU порт. фаза) - (HU отср. 15м)] / (HU порт. фаза) x 100 - больше 40%.
Низкая (менее 10 - 15 HU) нативная плотность тканевого компонента при КТ или быстрое снижение плотности после внутривенного контрастирования нехарактерны для АКР, метастазов и ФХЦ/ПГ.
Для дифференциальной диагностики НБЛ, ФХЦ/ПГ и АКР применяются другие методы лучевой диагностики сцинтиграфия с [123I] (A07.30.039.001. Сцинтиграфия с туморотропными РФП в режиме "все тело"), ПЭТ-КТ с 18F-ДОПА (A07.30.043.01 Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) или 68Ga-DOTA-TATE/68Ga-DOTA-NOC (A07.30.043.01 Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием)) и лабораторная диагностика.
МРТ и УЗИ обладают высокой чувствительностью в выявлении злокачественных опухолей надпочечников, однако специфичность методов ниже в связи с отсутствием общепринятых четких объективных показателей.
Метастатическое поражение должно быть исключено/подтверждено в первую очередь у пациентов с анамнезом онкологического заболевания. Также, вероятность метастатического поражения рассматривается при двустороннем поражении надпочечников, особенно при отсутствии явлений гормональной активности, при наличии КТ-признаков, характерных для метастазов. Пациенты с подобными поражениями должны проходить необходимое обследование для исключения распространенного опухолевого процесса (в первую очередь рака легкого, желудка, колоректального рака).
- 2.4.2. Рекомендуется пациентам с подозрением на опухоль надпочечника и наличием противопоказаний к выполнению КТ с контрастным усилением провести МРТ органов брюшной полости (ОБП) и забрюшинного пространства в рамках первичной диагностики [4, 8, 9].
Уровень убедительности рекомендаций - B, уровень достоверности доказательств - 2.
Комментарий. МРТ обладает высокой чувствительностью в выявлении опухолей надпочечников оценки распространенности процесса, в том числе поражения смежных структур. Однако специфичность методов значительно ниже КТ в связи с отсутствием общепринятых объективных показателей [9].
- 2.4.3. Рекомендуется взрослым пациентам с опухолью надпочечника неопределенного злокачественного потенциала по данным КТ (размер до 4 см, с высокой нативной плотностью более 10 - 15 ед. Н или мозаичной плотностью) выполнить позитронную эмиссионную томографию с Флудезоксиглюкозой [18F] (A07.30.043.01 Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием), совмещенную с компьютерной томографией (18ФДГ-ПЭТ/КТ). Высокая метаболическая активность (SUV более 3,5 или в 1,5 раза больше SUV печени) является критерием, позволяющим с высокой степенью вероятности предполагать злокачественную природу опухоли [37 - 40].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
- 2.4.3.1 Рекомендуется детям в возрасте 0 - 18 лет при подозрении на АКР выполнить позитронную эмиссионную томографию с Флудезоксиглюкозой [18F] (A07.30.043.01 Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием), совмещенную с компьютерной томографией (18ФДГ-ПЭТ/КТ) и компьютерную томографию органов грудной полости с внутривенным болюсным контрастированием (A06.09.005.002) [244].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. При подозрении на опухоли нейрогенного генеза, включая НБЛ у детей в возрасте 0 - 18 лет целесообрано выполнение сцинтиграфии с 123Iв режиме все тело, включая протоколы однофотонной эмиссионной компьютерной томографии (ОФЭКТ) или ОФЭКТ совмещенную с компьютерной томографией (ОФЭКТ/КТ) (A07.30.041.001 Однофотонная эмиссионная компьютерная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) [239]. Алгоритм обследования при НБЛ подробно изложен в клинических рекомендациях по диагностике и лечению данной нозологии.
- 2.4.3.2 Рекомендуется взрослым пациентам с опухолью надпочечника с высоким злокачественным потенциалом по данным КТ (размер более 4 см с высокой нативной плотностью, признаками инвазии) выполнить позитронную эмиссионную томографию с Флудезоксиглюкозой [18F] или, компьютерную томографию органов грудной полости с внутривенным болюсным контрастированием (A06.09.005.002) и компьютерную томографию органов брюшной полости с внутривенным болюсным контрастированием (A06.30.005.003) для определения распространенности опухолевого процесса [8].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. В случае подозрения на АКР или метастазы при гормонально-неактивных КТ-плотных образованиях малого размера (например, до 4 см) показано проведение Позитронную эмиссионную томографию совмещенная с компьютерной томографией с туморотропными РФП так как метод позволяет определить метаболическую активность образования. Если определяемый при этом исследовании накопительный критерий SUV (standartised uptake value) более 3,5 (или больше, чем SUV печени 1,5 раза), то вероятность злокачественного поражения превышает 80% [37 - 41].
- 2.4.4. Рекомендуется выполнение Сцинтиграфии костей всего тела (A07.03.001.001) (только для взрослых пациентов); КТ или МРТ головного мозга (для пациентов взрослого и детского возраста), при подозрении на их метастатическое поражение [4, 8, 13, 244].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
- 2.4.5. Не рекомендуется рутинное выполнение пункционной биопсии (тонкоигольной или трепан-биопсии) опухоли надпочечника для морфологической верификации. Информативность данного метода низкая для дифференциальной диагностики опухолей надпочечников. Биопсия опухоли надпочечника может быть рекомендована:
- при обоснованном подозрении на метастатическое (вторичное) поражение надпочечника;
- при подозрении на лимфопролиферативное заболевание;
- в случае неоперабельного метастатического опухолевого процесса перед началом лекарственной противоопухолевой терапии [8, 231, 244].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. При ФХ биопсия может быть потенциально опасна [8, 13, 42]. У многих больных диагноз АКР гистологически устанавливается только после операции на основании проведенного ИГХ-исследования. Следовательно, хирургическая тактика основывается на данных объективных методов исследования, в связи с чем правильное их назначение и интерпретация имеют решающее значение. В дифференциальном диагнозе органоспецифичных опухолей надпочечника пункционная биопсия (трепан-биопсия или тонкоигольная аспирационная биопсия) не имеет доказанных преимуществ, ассоциируется с низкой чувствительностью, специфичностью, а также с вероятностью осложнений, в том числе имплантационного метастазирования. Пункционная биопсия показана при подозрении на неходжкинскую лимфому с изолированным поражением надпочечников. Заболевание встречается крайне редко, характеризуется двусторонним инфильтративным поражением надпочечников, быстрым темпом роста опухоли, а также косвенными признаками, позволяющими подозревать лимфому, такими как выраженные явления общей интоксикации, повышение ЛДГ в сыворотке крови и т.д. При других вариантах надпочечниковых опухолей у взрослых диагностическая ценность предоперационной пункционной биопсии неудовлетворительна (чувствительность не превышает 65%) [43].
У детей при подозрении на НБЛ, как наиболее частую опухоль надпочечника, при наличии [123I] - позитивной местнораспространенной опухоли и/или опухоли с наличием отдаленных метастазов, возможно выполнение биопсии опухоли в целях максимально раннего начала системной ХТ [236]. Алгоритм обследования и лечения при НБЛ подробно изложен в клинических рекомендациях по диагностике и лечению данной нозологии. У детей при подозрении на АКР необходимо придерживаться приведенных выше принципиов в отношении выполнения пункционной биопсии.
2.5 Иные диагностические исследования
2.5.1. Патологоанатомическая диагностика
- 2.5.1.1. Рекомендуется выполнить патологоанатомическое исследование операционного материала (табл. 7), включающее одну из принятых систем балльнои оценки злокачественного потенциала опухоли, с применением иммуногистохимических методов (A08.22.002.002 Патолого-анатомическое исследование биопсийного (операционного) материала тканей удаленного новообразования желез внутренней секреции с применением иммуногистохимических методов) всем пациентам с новообразованием надпочечника с целью оценки органнои принадлежности опухоли и ее злокачественного потенциала [2, 44].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Таблица 7. Схема протокола исследования макропрепарата опухолей надпочечника
Характер присланного материала (анатомическое обозначение объектов операционного препарата)
Тип операции
Тип опухоли
Максимальный размер опухоли
Масса опухоли
Инвазия опухоли в капсулу, окружающие ткани, кровеносные сосуды
Степень полноты резекции и состояние краев резекции. При отсутствии элементов опухолевого роста в краях резекции указывают значение R0 в pTNM-стадии, при микроскопической идентификации опухоли в крае резекции - R1, при макроскопической идентификации опухоли в крае резекции - R2. При этом важно учитывать, что R2-критерий применяется только к непосредственному присутствию опухоли в крае резекции и не указывается, если узел покрыт капсулой и лишь просматривается с поверхности.
Состояние лимфатических узлов.
Гистологическая верификация наличия или отсутствия метастазов.
Комментарии: Диагноз карциномы коры надпочечников основывается на обнаружении инвазивного роста (например, инвазии в сосуды, капсулу, местной макроскопической инвазии), повышенной пролиферативной активности и сочетании цитологических и архитектурных особенностей [2].
Во время вырезки операционного материала опухоли надпочечника в ряде случаев удается проследить ход надпочечниковой вены, расположенной центрально в надпочечнике при рассечении его перпендикулярно продольной оси. Блок ткани с веной следует забрать для микроскопического исследования на предмет обнаружения венозной инвазии и наличия опухолевого тромба [45].
Особое внимание нужно уделить обнаружению лимфатических узлов, каждый из которых забирается (A08.06.002.001 Патолого-анатомическое исследование биопсийного (операционного) материала лимфоузла с применением иммуногистохимических методов) [45]. Следует отметить, что приудалении надпочечника довольно редко лимфатические узлы расположены непосредственно в окружающей клетчатке и могут быть присланы хирургом в виде отдельных фрагментов.
При эндоскопических вмешательствах препараты надпочечника часто фрагментированы, что может привести к затруднениям при морфологической оценке размеров опухолевого узла, врастания опухоли в капсулу надпочечника, кровеносные сосуды, полноценности удаления опухоли и т.д. Фрагментарное удаление надпочечника требует указания клиническими специалистами точных размеров и характеристик опухоли, определенных при обследовании пациента (МРТ, МСКТ, УЗИ), а также в ходе операции.
При формировании блоков для гистологической проводки опухоли размером до 30 мм в диаметре должны забираться на исследование целиком [45]. В случае более крупных образований блоки формируются из расчета как минимум 1 дополнительный блок на каждые дополнительные 10 мм опухоли.
При этом ориентация блоков должна учитывать необходимость последующей микроскопической оценки не только собственно ткани опухоли (некрозы, кисты, кровоизлияния), но и отношение опухоли к крупным сосудам, окружающей ткани надпочечника, его капсуле и окружающим тканям и органам [45].
Гистологические признаки обычно оцениваются с помощью одного из нескольких принятых многофакторных алгоритмов/балльных систем [2, 44]. К ним относятся шкала Weiss, система Lin-Weiss-Bisceglia, ретикулиновый алгоритм и система Helsinki [6, 7, 46, 47]. На данном этапе ни одна из систем не была признана чувствительной или специфичной для всех клинических ситуаций.
Система балльной оценки злокачественного потенциала опухоли Weiss, разработанная в 1984 году (Weiss-шкала) [46] и модифицированная в 1989 [48], продолжает использоваться для классификации классического варианта АКР у взрослых [49, 50] (Табл. 8).
Каждый из 9 критериев оценивается в 1 балл. При наборе 3 баллов и более по Weiss-шкале подтверждается высокий злокачественный потенциал опухоли и ставится диагноз АКР.
С учетом того, что онкоцитарные новообразования состоят из клеток с эозинофильной цитоплазмой, высоким ядерным полиморфизмом и почти всегда с диффузным характером роста, в случае диагностики онкоцитарного варианта АКР применяется система Lin-Weiss-Bisceglia (Табл. 9) [6].
Онкоцитарный вариант АКР диагностируется при наличии как минимум одного "большого критерия", онкоцитарная АКА с пограничным злокачественным потенциалом - при наличии как минимум одного "малого критерия", если отсутствуют все большие и малые критерии, онкоцитарная опухоль считается доброкачественной. Следует учитывать, что онкоцитарные клетки должны составлять более 90% площади опухоли для того, чтобы ее можно было рассматривать как полностью ("pure") онкоцитарное новообразование коры надпочечников. В противном случае необходимо применять критерии, используемые для диагностики классического варианта АКР.
Миксоидный вариант АКР характеризуется наличием внеклеточного муцина, составляющего более 20% площади опухоли [2]. Миксоидные опухоли также отличаются наличием мелких или средних по размеру мономорфных клеток со слабо или умеренно выраженной ядерной атипией, небольшим количеством слабоэозинофильной цитоплазмы [51].
Саркоматоидный вариант АКР характеризуется потерей кортикальной дифференцировки или может быть мозаичным с наличием типичных дифференцированных участков [51].
При диагностике классических, онкоцитарных и миксоидных новообразований коры надпочечников также могут быть использованы ретикулиновый алгоритм [7] и система Helsinki [47]. В первом случае злокачественный характер новообразования подтверждается, когда нарушение организации ретикулиновых волокон, выявленное при импрегнации солями серебра (гистохимическое исследование), сочетается с одним из следующих параметров: (1) количество митозов > 5 на 10 мм2 (50 полей зрения при увеличении микроскопа x 400), (2) наличие опухолевого некроза или (3) инвазия сосудов (ангиоинвазия). Система Helsinki базируется на применении параметров системы Weiss, использует пошаговый регрессионный анализ и предлагает следующую формулу: 3 x (митотическая активность > 5/50 HPF) + 5 x (наличие опухолевого некроза) + уровень пролиферативной активности по Ki-67. Сумма параметров более 8,5 ассоциируется с высоким метастатическим потенциалом и неблагоприятным прогнозом (соответствует АКР).
Большинство стандартных систем критериев оценки были разработаны с участием материала исключительно взрослых пациентов. Их использование с целью определения злокачественного потенциала педиатрических адренокортикальных опухолей приводит к гипердиагностике АКР [52]. Для определения злокачественного потенциала адренокортикальных опухолей у детей применяются критерии Wieneke/Armed Forces Institute of Pathology (AFIP) (Табл. 10) [53].
- 2.5.1.2. Рекомендуется Определение индекса пролиферативной активности экспрессии Ki-67 иммуногистохимическим методом и митотической активности пациентам при наличии соответствующих гистологических признаков и с подозрением на АКР с целью подтверждения злокачественного потенциала опухоли и прогностической стратификации [2, 44].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: АКР является злокачественной опухолью, управляемой пролиферацией, что подтверждается многочисленными геномными исследованиями. Поэтому оценка пролиферативной активности с помощью подсчета митозов и определение индекса пролиферативной активности экспрессии Ki-67 иммуногистохимическим методом является важным этапом диагностики и определения прогноза [2, 44, 54, 55].
Высокая митотическая активность, определяемая как > 5 митозов на 10 мм2 (50 полей зрения при увеличении микроскопа x 400), является частью всех диагностических алгоритмов. Количество митозов подсчитывается в участках с наибольшей плотностью, так как в АКР может наблюдаться пролиферативная гетерогенность. Облегчить идентификацию митотических фигур в опухолях с низкой митотической активностью может иммуногистохимическое окрашивание фосфогистоном H3 [56]. Важным критерием являются также атипичные фигуры митоза, которые указывают на аномальное содержание хромосом (анеуплоидию). Классификация адренокортикальных карцином на low-grade (![]() 20 митозов на 10 мм2) и high-grade (> 20 митозов на 10 мм2) имеет прогностическое значение.
20 митозов на 10 мм2) и high-grade (> 20 митозов на 10 мм2) имеет прогностическое значение.
В соответствии с результатами многочисленных исследований для большинства адренокортикальных карцином характерно значение индекса мечения Ki-67 более 5% [2, 54]. Ki-67 является также прогностически значимым маркером [54 - 57], обуславливающим необходимость назначения адъювантной терапии митотаном** [58].
- 2.5.1.3. Рекомендуется проведение патолого-анатомическго исследования биопсийного (операционного) материала тканей удаленного новообразования желез внутренней секреции с применением иммуногистохимических методоввсем пациентам с опухолью надпочечника, кроме очевидных доброкачественных аденом для дифференциальной диагностики адренокортикальной опухоли и опухоли иного гистогенеза, подтверждения злокачественного потенциала опухоли и прогностической стратификации [2, 44, 58].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: Новообразования коры надпочечников экспрессируют маркеры, специфичные для стероидпродуцирующих клеток: SF-1 и ингибин-альфа, а также маркеры, характерные для опухолей других типов: мелан-A, кальретинин, синаптофизин [58].
SF-1 имеет наибольшую чувствительность и специфичность [58], другие маркеры имеют гетерогенный тип реактивности, экспрессируются только в части случаев и могут быть использованы совместно в панели маркеров. Следует учитывать, что синаптофизин и ингибин-альфа могут экспрессироваться в ФХ. Экспрессия эпителиальных маркеров (цитокератин, EMA, CEA) обычно отсутствуют. Иммуногистохимическое исследование с антимитохондриальными антителами, а именно наличие сильного диффузного окрашивания эозинофильной гранулярной цитоплазмы, способствует идентификации онкоцитарной дифференцировки опухоли.
High-grade карциномы коры надпочечников или опухоли с инвазивным ростом часто не представляют диагностических трудностей, однако дифференциальная диагностика low-grade опухолей, ограниченных надпочечником, и опухолей с аденомоподобными участками может потребовать использования дополнительных биомаркеров [55, 58, 59].
Молекулярные исследования не используются в качестве стандарта клинической практики [2].
- 2.5.1.4. Рекомендуется патолого-анатомическое исследование биопсийного (операционного) материала тканей удаленного новообразования с применением иммуногистохимических методов, включающему, как минимум, следующие данные: инвазия опухоли в капсулу, окружающие ткани, кровеносные сосуды, степень полноты резекции и состояние краев резекции, состояние лимфатических узлов, количество баллов по одной из принятых систем балльнои оценки злокачественного потенциала опухоли, иммуногистохимическое окрашивание антителами к SF-1, Хромогранину A, Ki-67, оценка индекса пролиферативной активности и митотической активности (A08.22.002.002 Патолого-анатомическое исследование биопсийного (операционного) материала тканей удаленного новообразования желез внутренней секреции с применением иммуногистохимических методов) всем пациентам с новообразованием надпочечника с целью установления диагноза АКР и определения прогноза у пациентов [3].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: Установление диагноза АКР требует морфологического и иммуногистохимического подтверждения адренокортикального гистогенеза и злокачественного потенциала опухоли, которое обычно основывается на мультипараметрических алгоритмах и результатах патолого-анатомического исследования биопсийного (операционного) материала тканей удаленного новообразования желез внутренней секреции с применением иммуногистохимических методов [2]. Помимо дифференциальной диагностики в патологии АКР возникает проблема определения прогностических параметров, которые могут быть использованы для выбора наиболее эффективной терапевтической стратегии. В настоящий момент не существует единой повсеместно признанной системы для прогностической стратификации АКР. Продвинутая стадия опухоли, идентификация элементов опухолевого роста в краях резекции, сосудистая инвазия, high-grade опухоли, высокие значения индекса пролиферации Ki-67, а также некоторые молекулярные характеристики рассматриваются в качестве важнейших прогностических факторов [2].
Предполагается, что вариабельность прогноза при АКР обусловлена его выраженной морфологической, пролиферативной и молекулярной гетерогенностью [60].
В соответствии с последними данными Ki-67 более 15% является надежным предиктором неблагоприятного исхода у пациентов с АКР [55, 61].
Иммуногистохимические маркеры p53 и бета-катенин могут использоваться при стратификации риска в дополнение к индексу Ki-67 и количеству митозов [58, 59]. Молекулярные исследования подчеркнули прогностическую ценность данных маркеров, так как большинство адренокортикальных карцином, относящихся к неблагоприятным молекулярным кластерам, как правило, демонстрируют ядерную экспрессию бета-катенина и/или аберрантное окрашивание p53 (гиперэкспрессия или глобальная потеря).
Рассматривается применение иммуногистохимического маркера MMR для скрининга случаев АКР, ассоциированных с синдромом Линча [58, 59, 62]. Было предложено несколько потенциальных предикторов ответа на митотан** (например, RRM1 и CYP2W1) [63, 64], но ни один из них на данный момент не был валидирован для использования в клинической практике.
2.5.2 Генетическое тестирование
- 2.5.2.1. Рекомендуется всем пациентам взрослого возраста с верифицированным диагнозом АКР с отягощенным семейным анамнезом по различным злокачественным опухолям стандартное генетическое консультирование (Прием врача-генетика B01.006.001), включающее изучение анамнеза жизни, анамнеза заболевания и семейного анамнеза, для выявления или исключения наследственного синдрома, ассоциированного с АКР [2, 8, 44, 212].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Своевременное выявление герминативной мутации и, соответственно, диагностика наследственного синдрома, включающего АКР, позволяют прогнозировать развитие других ассоциированных заболеваний у пациента, а также целенаправленно обследовать его кровных родственников.
Пациентам с АКР может быть назначен молекулярно-генетический скрининг на предмет выявления синдромов Ли-Фраумени и Линча, которые встречаются в 3 - 5% случаев АКР и имеют достаточно разработанные клинические рекомендации.
Распространенность герминативных мутаций de novo в гене TP53 достигает 20 - 25% среди всех пациентов взрослого возраста с аберрациями в данном гене, следовательно, у таких пациентов не будет семейного анамнеза АКР или других опухолей. В связи с этим проводится молекулярно-генетическое исследование мутаций в гене TP53 в крови (A27.05.048).
Синдром Линча присутствует у 3 - 5% пациентов с AКР. Его диагностика может проводиться путем непосредственного молекулярно-генетического исследования генов MSH2, MLH1, PMS2, MSH6 и EPCAM (A27.05.049 Молекулярно-генетическое исследование мутаций в генах MLH1, MSH2, MSH6, PMS2 в крови) или путем иммуногистохимического исследования с антителами к MSH2, MLH1, PMS2, MSH6 и оценки микросателлитной нестабильности (A08.30.040 Определение мутаций в генах MLH1, MSH2, MSH6, PMS2 иммуногистохимическим методом;).
- 2.5.2.2. Рекомендуется всем детям в возрасте 0 - 18 лет с верифицированным диагнозом АКР независимо от семейного анамнеза проведение стандартного генетического консультирования, а также проведение молекулярно-генетического анализа для выявления патогенных герминативных мутаций в гене TP53 (A27.05.048 Молекулярно-генетическое исследование мутаций в гене TP53 в крови), поскольку 50 - 90% случаев АКР в детском возрасте наблюдается в рамках синдрома Ли-Фраумени [44, 47, 65].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Хирургическое лечение
- 3.1 Рекомендуется провести хирургическое лечение больных с АКР в специализированном центре, имеющем в составе следующих специалистов взрослого или детского профиля: врач-хирург, врач-онколог, врач-патологоанатом, врач-рентгенолог, врач-радиолог [8, 231, 244].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Врач-хирург, выполняющий оперативное вмешательство при АКР у взрослых пациентов, должен обладать опытом не менее 15 операций на надпочечниках в год. Учреждение, где проводится хирургическое лечение больного с АКР, должно иметь опыт хирургии печени, поджелудочной железы, сосудистой хирургии, либо иметь возможность включения в операционную бригаду соответствующих специалистов. Опыт врача-хирурга и объем помощи, оказываемой в больнице по данному заболеванию, имеют влияние на результаты лечения при таких онкологических заболеваниях, как рак печени, пищевода, поджелудочной железы и тд. При адренокортикальном раке частота R0 резекции выше у врачей-хирургов, обладающих большим опытом хирургии рака надпочечника [8, 207].
- 3.1.1 Рекомендуется всем взрослым пациентам с АКР I - III стадии по ENSAT и детям в возрасте 0 - 18 лет с АКР I - IV стадии по COG при возможности R0-резекции в специализированном центре провести хирургическое лечение. Объем операции при АКР - тотальная адреналэктомия в пределах здоровых тканей, без нарушения целостности капсулы опухоли. Выполнение операций с попыткой сохранения ткани надпочечника недопустимо. Необходимовсем пациентам выполнить оперативное пособие в кратчайшие сроки после проведения полноценной диагностики и стадирования опухолевого процесса [8 - 10, 231, 244]
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Единственным возможным вариантом полного излечения при АКР в настоящее время является радикальное хирургическое вмешательство (A16.22.004.001
Односторонняя адреналэктомия лапаротомным доступом, A16.28.064 Расширенная адреналэктомия, или адреналэктомия с резекцией соседних органов) (см. также Приложение А3 Табл. 16) [66].
- 3.1.2 Рекомендуется всем пациентам с клиническим или морфологически верифицировнным диагнозом АКР выполнять хирургическое лечение соблюдая следующие принципы:
- выполнение тотальной адреналэктомии в пределах здоровых тканей (A16.22.004.001 Односторонняя адреналэктомия лапаротомным доступом, A16.22.015 Эндоскопическая адреналэктомия односторонняя);
- сохранение целостности капсулы опухоли;
- доступ операции при АКР - лапаротомный (различные виды лапаротомии или тораколапаротомия);
- выполнение адреналэктомии с резекцией соседных органов при инвазии опухоли в окружающие органы и структуры (A16.28.064 Расширенная адреналэктомия, или адреналэктомия с резекцией соседних органов);
- выполнение прямой тромбэктомии из магистральных вен и камер сердца при опухолевом тромбозе [67];
- выполнение лимфаденэктомии забрюшинной расширенной в аортокавальной зоне и зоне ворот почки [8 - 10, 68 - 72].
- Пациентам детского возраста 0 - 18 лет при подозрении на АКР I стадии по COG рекомендована биопсия регионарных лимфатических узлов, при II - IV стадии по COG регионарная лимфаденэктомии [231, 244];
- Пациенты детского возраста 0 - 18 лет с инициально нерезектабельной опухолью или с остаточной опухолью после инициального хирургического вмешательства могут быть рассмотрены в качестве кандидатов на хирургическое вмешательство после 2 - 4 курсов химиотерапии [231, 244];
- Пациентам детского возраста 0 - 18 лет при АКР IV стадии по COG диагноз может быть подтвержден на основании биопсии метастатических очагов или открытой биопсии первичной опухоли при невозможности радикального удаления опухоли [231, 244];
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Особенностями роста опухоли при АКР и хирургических вмешательств являются следующие:
- инвазия опухолью окружающих органов и структур: паранефральной клетчатки, почки, печени, диафрагмы, селезенки, поджелудочной железы, крупных сосудов (нижней полой вены, почечной вены, воротной вены). Местная распространенность опухоли должна быть оценена до операции для планирования ее объема. При необходимости выполняют резекции печени, поджелудочной железы, спленэктомия. Удаление почки показано только при инвазии структур ворот почки. Паранефральная клетчатка должна удалятся до уровня ворот почки в ходе удаления надпочечника при АКР.
- инвазия нижней полой вены/почечной вены, которая наблюдается по данным литературы от 5 - 7% до 30% случаев АКР и требует резекции сосудов в разном объеме (продольная или циркулярная) с последующей ее восстановлением или без нее.
- опухолевый тромбоз нижней полой вены или почечной вены (при левостороннем поражении), проксимальная граница которого может достигать до правых отделов сердца. У пациентов без отдаленных метастазов показана прямая тромбэктомия из магистральных вен; возможность тромбэктомии следует рассматривать также у пациентов с отдаленными метастазами в виду отсутствия эффективных способов консервативного лечения и высокого риска летальных осложнений течения болезни, в первую очередь ТЭЛА и опухолевой эмболии ветвей легочной артерии. Прямая тромбэктомия из магистральных вен (A16.12.035) или предсердия выполняется как с искусственным кровообращением, так и без него, в зависимости от уровня тромбоза. Необходимо предпринять меры по профилактике эмболии легочной артерии опухолевыми массами. Необходимость восстановления нижней полой вены сосудистим протезом после тромбэктомии, часто сопровождаемой ее резекцией (резекция сосуда), в том числе циркулярной, определяется в зависимости от степени нарушения кровотока по ней и развития коллатерального кровотока, на основании предоперационной оценки;
- Нарушение капсулы опухоли значительно повышает риск местного рецидива или диссеминации АКР. Прецизионность манипуляций при удалении опухоли является одной из ключевых задач хирурга, так как нарушение целостности капсулы приводит к местной опухолевой диссеминации даже после выполнения формально "R0" резекции [8, 73, 74].
- При АКР показано удаление регионарных лимфоузлов в случае их метастатического поражения или при подозрении на поражение по клинико-инструментальным данным [43, 75]. Преимущества лимфодиссекции при АКР продемонстрированы в исследовании J. Reibetanz и соавт. [76], где на достаточно большой выборке пациентов доказано статистически значимое улучшение безрецидивной выживаемости и АКР-ассоциированной смертности у пациентов с R0-резекцией. В качестве дополнительного довода приводится факт, что в группе с лимфодиссекцией средний размер опухоли был достоверно больше и комбинированные резекции выполнялись чаще, однако, несмотря на это, достигнуты лучшие результаты. В исследовании Gaujoux S. и соавт. [69] указывается, что вовлеченность лимфоузлов в опухолевый процесс у пациентов с АКР, без стратификации по стадиям, составляет 20%, что является, по мнению авторов, показанием к более широкому выполнению лимфодиссекции. Границы превентивной лимфодиссекции не точно определены, по имеющимся данным подлежат удалению лимфоузлы ворот почки, паракавальные справа и парааортальные слева.
- При отсутствии явных признаков инвазии опухоли надпочечника в паренхиму почки или структуры ворота почки, необходимости в "превентивном" удалении почки (нефрадреналэктомии), для повышения радикальности резекции, нет. Достаточна резекция жировой капсулы почки до уровня ее ворот.
- 3.1.3. Взрослым пациентам с клиническим диагнозом АКР может рекомендоваться выполнение эндоскопической (лапароскопической, ретроперитонеоскопической) адреналэктомии при обязательном сочетании всех следующих факторов: размер опухоли менее 6 см, I и II стадия заболевания по ENSAT (отсутствие признаков инвазии опухоли в окружающие структуры), достаточный опыт у врача-хирурга и лечебного учреждения по лечению больных с АКР и видеоэндоскопических вмешательств. При большей распространенности процесса эндоскопическая операция противопоказана, так как возможность выполнения лимфаденэктомии и адекватной ревизии и резекции соседних органов ограничена, радикальность вмешательства сомнительна [8, 13, 77, 78]. Пациентам детского возраста 0 - 18 лет при подозрении на АКР предпочтительнее выполнять открытые операции, так как эндоскопические операции связаны с высоким риском разрыва капсулы опухоли и перитонеального канцероматоза [230, 231, 238, 244].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. В связи с широким распространением эндоскопических операций увеличивается количество больных с АКР, прооперированных лапароскопическим доступом, в том числе в учреждениях, не специализирующихся на лечении АКР. Основная проблема эндоскопической адреналэктомии - высокая частота диссеминации опухоли по брюшине после операции, вследствие интраоперационного повреждения капсулы опухоли. Большая часть экспертов придерживается мнения, что при размере опухоли более 5 см и/или подозрении на злокачественность опухоли по результатам предоперационного обследования - вероятность диссеминации опухоли при нарушении капсулы значительно выше, чем при открытом вмешательстве [8, 43, 68, 70, 73, 77].
Недискутабельным пунктом данной рекомендации является специализированный характер учреждения и опыт врача-хирурга.
- 3.1.4. Рекомендуется пациентам с резектабельными формах местного рецидива или при солитарных/единичных метастазах, возникших после операции, выполнить повторную R0-резекцию как наиболее эффективный и предпочтительный вариант лечения, обеспечивающий наиболее длительный безрецидивный период или продолжительность жизни (см. также Приложение Б Рис. 1). Безрецидивный период более 1 года после первой операции является благоприятным прогностическим фактором при хирургическом лечении рецидивов или метастазов АКР. Больные с ранним рецидивом (менее 6 мес.) после R0 операций как правило не являются кандидатами на повторную операцию. Целесообразность повторных операций при рецидивах или метастазах определяется индивидуально, мультидисциплинарным консилиумом, с учетом распространенности процесса, возможности достижения полной циторедукции, биологических особенностей опухоли и возможности консервативного лечения [70, 80, 81, 82]. Лапароскопические операции не применимы также при рецидивном АКР. Хирургическое лечение при метастатическом АКР редко приводит к излечению, но может быть ассоциировано с увеличением продолжительности жизни. При метастатическом АКР для выбора больных на хирургическое лечение необходимо учитывать прогностические факторы: количество метастатических локализаций и высокий митотический индекс [8].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Частота прогрессирования АКР после хирургического лечения в течение 5 лет при III стадии заболевания составляет от 40% до 80 - 85%. Единственным методом, обеспечивающим длительное выживание при рецидивах или метастазах остается повторная "радикальная", то есть R0-резекция. Ее возможность следует рассматривать у каждого пациента с учетом распространенности процесса, особенностей предыдущего хирургического лечения, биологических особенностей опухоли, таких как степень злокачественности и темп роста.
Возможность хирургического лечения при рецидивах и метастазах АКР изучена в классической работе из противоракового центра Sloan-Kettering, США [80]. Повторные резекции выполнены у 47 больных с местным рецидивом или отдаленными метастазами АКР, из которых четверо оперированы 5 и 6 раз, один больной перенес 7 вмешательств. В 62 случаях операция была радикальной, в 21 - паллиативной. Среди радикальных операций 43 (69%) выполнено по поводу отдаленного метастаза, 14 (23%) - по поводу местного рецидива, 5 (8%) - по поводу и рецидива и метастаза. Среди локализаций отдаленных метастазов самыми частыми были печень (28), легкие (17), брюшина (8). Медиана жизни больных, подвергшихся повторной радикальной резекции, составила 74 месяцев, 5-летняя выживаемость - 57%; у больных после паллиативной повторной резекции - 16 мес. и 0% соответственно, различия были статистически значимы. В этом исследовании впервые проведен мультфакторный анализ выживаемости у подобной группы больных и было показано, что стадия болезни и радикальность первой операции являются независимыми факторами прогноза.
Немецкая группа по изучению АКР сравнила результаты лечения 101 больного, прооперированного повторно и 99 больных, получавших лекарственное лечение при рецидивах АКР. Многофакторный анализ показал, что два фактора имели достоверное прогностическое значение, как для общей выживаемости, так и для выживаемости без прогрессирования: время до первого рецидива более 12 месяцев и радикальность первой операции. Медиана ВБП у пациентов 2 двумя благоприятными факторами составила 24 месяца, общей выживаемости - 60 месяцев. Медиана ВБП у пациентов оперированных повторно в объеме R0 составила 19 мес., после R2 операций - 6 мес, паллиативных резекций (debulking) - 5 мес., у не оперированных пациентов - 4 мес. Медиана общей выживаемости у пациентов оперированных повторно в объеме R0 составила 88 мес., после R2 операций - 30 мес, паллиативных резекций (debulking) - 22 мес., у не оперированных пациентов - 16 мес. [69].
В Туринском университете [81] ретроспективно анализировали сравнительный опыт лечения рецидивов АКР: группа A - 22 пациентов оперированы, 17 - в объеме удаления рецидива, 5 - удаление отдаленного метастаза (средний балл Weiss - 6, среднее время до прогрессирования - 22 мес, средний Ki-67 - 18%). Группа B - 17 пациентов получили химиотерапию по схеме #доксорубицин**, #этопозид**, #цисплатин** и митотан** (средний балл Weiss - 7, среднее время до прогрессирования - 9,5 мес, средний Ki-67 - 28%). В группе A у 5 пациентов рецидива не наблюдалось, у 17 возник рецидив в среднем через 23 мес, 8 пациентов повторно оперированы; средняя общая выживаемость составила 86 мес. В группе В 88% пациентов за время наблюдения умерли от прогрессирования; средняя общая выживаемость составила 33,5 мес - достоверно меньше.
Повторное хирургическое вмешательство приводит к увеличению продолжительности жизни, если выполнено в объеме R0.
Индивидуализация показаний к повторным операциям является нерешенной задачей и требует дальнейших исследований с учетом также биологических особенностей опухоли [82]. В случае АКР серьезное влияние на тактику может оказать гормональная активность опухоли. Также следует иметь в виду, что повторные операции приводят к уменьшению симптоматики у многих пациентов [82].
- 3.1.5. Не рекомендуется рутинное выполнение паллиативной R2 адреналэктомии (A16.22.004.001 Односторонняя адреналэктомия лапаротомным доступом, A16.28.064 Расширенная адреналэктомия, или адреналэктомия с резекцией соседних органов) (таблица 18, Приложение Г5) при метастатическом АКР. При гормонально-активной опухоли, сопровождающейся тяжелыми соматическими проявлениями гиперкортицизма, может быть оправдана тактика, направленная на максимальную циторедукцию [8, 9].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Выживаемость без прогрессирования у больных метастатическим АКР не подвергшихся хирургическому лечению и прооперированных в паллиативном (R2) объеме одинаковая. Однако паллиативная адреналэктомия может быть рассмотрена как опция у больных с массивной или симптомной/гормонально - активной опухолью.
- 3.1.6. Всем пациентам с АКР и гиперкортицизмом (манифестным или субклиническим) рекомендуется проведение заместительной терапии надпочечниковой недостаточности в послеоперационном периоде [13, 18, 19].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Манифестный гиперкортицизм и функционально автономная гиперпродукция кортизола, как правило, приводят к развитию надпочечниковой недостаточности после адреналэктомии с опухолью. В связи с этим всем пациентам с АКР и верифицированным/высоковероятным гиперкортицизмом показано проведение2заместительной терапии надпочечниковой недостаточности интраоперационно и в послеоперационном периоде в соответствии с клиническими рекомендациями [9].
3.2 Лекарственное лечение.
- 3.2.1 Не рекомендуется проведение адъювантной терапии пациентам с адренокортикальной опухолью неопределенного злокачественного потенциала [8, 83 - 86].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
- 3.2.2. Не рекомендуется проведение адъювантной терапии митотаном** взрослым пациентам с низким риском рецидива (T1-2N0 и Ki-67 ![]() 10%) после R0-резекции, согласно результатам рандомизированного исследования ADIUVO и детям в возрасте 0-18 лет с I - II стадии по COG согласно протоколу ARAR0332 группы COG [87, 231, 240, 244].
10%) после R0-резекции, согласно результатам рандомизированного исследования ADIUVO и детям в возрасте 0-18 лет с I - II стадии по COG согласно протоколу ARAR0332 группы COG [87, 231, 240, 244].
Для взрослых пациентов Уровень убедительности рекомендаций - B, уровень достоверности доказательств - 2.
Для детей Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. В единственном проспективном рандомизированном исследовании ADIUVO изучалась эффективность адъювантной терапии митотаном** в подгруппе пациентов с низким риском рецидива заболевания (Ki-67 ![]() 10%) после R0-резекции по поводу I - III стадии АКР [87]. В исследование включен 91 пациент, которые были рандомизированы в 2 группы 1:1 - наблюдение и митотан**. Достоверных различий в безрецидивной и общей выживаемости не наблюдалось. Следует отметить, что в исследование включены всего 13% пациентов (N = 6) с III стадией в группе митотана** и 11% (N = 5) в группе наблюдения, что не позволяет сделать однозначный вывод о неэффективности назначения митотана** в подгруппе пациентов с III-стадией и Ki-67
10%) после R0-резекции по поводу I - III стадии АКР [87]. В исследование включен 91 пациент, которые были рандомизированы в 2 группы 1:1 - наблюдение и митотан**. Достоверных различий в безрецидивной и общей выживаемости не наблюдалось. Следует отметить, что в исследование включены всего 13% пациентов (N = 6) с III стадией в группе митотана** и 11% (N = 5) в группе наблюдения, что не позволяет сделать однозначный вывод о неэффективности назначения митотана** в подгруппе пациентов с III-стадией и Ki-67 ![]() 10%.
10%.
Согласно проспективному интервенционному исследованию ARAR0332 были изучены результаты терапии пациентов детского возраста с I - IV стадией по COG. В ходе анализа были продемонстрированы высокие показатели 5-летней ОВ у пациентов при I стадии по COG (95,2%), и II стадии по COG (78,8%) [231]. Тем не менее 5-летняя БСВ у пациентов со стадией II составляет лишь 53,3%. Целесообразность назначения митотана** детям с II стадии по COG изучена недостаточно, и данная подгруппа пациентов требует индивидуального обсуждения каждого случая со специалистами федеральных центров [231, 240, 244].
- 3.2.3 Рекомендуется взрослым пациентам назначение адъювантной терапии митотаном** при уровне Ki-67 > 10% в течение 2 - 5 лет [8, 87, 91 - 94, 213] (таблица 12).
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 2.
Комментарий. В феврале 2018 г. митотан** впервые зарегистрирован в России и разрешен к применению. Препарат включен в реестр жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) [88].
Терапия митотаном** должна быть начата в кратчайшие сроки после хирургического лечения. Уровень препарата в крови требует постоянного лабораторного мониторирования и, при условии его переносимости, рекомендованный диапазон терапевтической концентрации составляет от 14 до 20 мкг/мл. Доза митотана**, необходимая для достижения и/или поддержания его концентрации в крови в терапевтическом диапазоне, индивидуальна, и, как правило, составляет 4 - 8 г/сут. При отсутствии рецидива АКР адъювантное лечение проводится от 2 до 5 лет (см. также Приложение А3). Проспективных исследований, сравнивающих различную длительность адъювантной терапии митотаном**, нет. В небольшом ретроспективном анализе, включившем 154 пациента, получивших адъювантную терапию митотаном** после R0-резекции по поводу АКР, было показано отсутствие достоверных различий в безрецидивной и общей выживаемости при продолжении адъювантной терапии митотаном** более 2 лет [89]. Однако, следует отметить, что большая часть пациентов, включенных в этот анализ, относилась к низкой группе риска рецидива (T1-2N0 - 80%, Ki-67 ![]() 10% - 60%) и эти данные могут не быть воспроизведены в группе пациентов с высоким риском рецидива.
10% - 60%) и эти данные могут не быть воспроизведены в группе пациентов с высоким риском рецидива.
В небольшом итальянском ретроспективном исследовании, включившем 152 пациента после R0-резекции по поводу АКР I - III стадии, из которых 100 получили адъювантную терапию митотаном**, было показано достоверное увеличение безрецидивной выживаемости при назначении митотана** [90]. Важнейшим предиктором рецидива и смерти было значение уровня Ki-67 > 10%. По данным многофакторного анализа, назначение митотана** достоверно улучшило безрецидивную и общую выживаемость в подгруппе пациентов с Ki-67 > 10%, а также общую выживаемость в подгруппе с III-стадией.
В мультицентровом исследовании и мета-анализе немецко-итальянского регистра пациентов с АКР проанализированы результаты лечения 177 пациентов и продемонстрировано увеличение безрецидивного периода при проведении адъювантной терапии - 42 мес против 10 и 25 мес в двух контрольных группах и снижение частоты рецидива до 49% против 73% и 91% соответственно [91].
Наряду с противоопухолевым воздействием, митотан** обладает адренолитическим эффектом, повреждая внутриклеточные ферменты, участвующие в синтезе стероидов, таким образом, снижая интенсивность надпочечникового стероидогенеза [92,93]. В связи с блокированием стероидогенеза пациенты, получающие митотан**, нуждаются в заместительной терапии глюкокортикоидами. Уменьшение уровня глюкокортикоидов в крови связано не только с адренолитической активностью митотана**, но и с индукцией им печеночного клиренса стероидов [94], в связи с чем необходимо минимум двукратное увеличение стандартной дозы заместительной терапии надпочечниковой недостаточности. Недостаточная доза заместительной терапии ухудшает переносимость митотана** и утяжеляет его побочные эффекты.
- 3.2.4 Рекомендуется взрослым пациентам рассмотреть проведение адъювантной терапии митотаном, продолжительностью 2 года при промежуточном риске рецидива/прогрессирования (T3-4 при уровне Ki-67 ![]() 10%) [8, 87, 90, 214] (таблица 12).
10%) [8, 87, 90, 214] (таблица 12).
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. В небольшом итальянском ретроспективном исследовании, включившем 152 пациента после R0-резекции по поводу АКР I - III стадии, из которых 100 получили адъювантную терапию митотаном**, было показано достоверное увеличение безрецидивной выживаемости при назначении митотана**. Важнейшим предиктором рецидива и смерти было значение уровня Ki-67 > 10% [90]. По данным многофакторного анализа назначение митотана** достоверно улучшило безрецидивную и общую выживаемость в подгруппе пациентов с Ki-67 > 10%, а также общую выживаемость в подгруппе с III-стадией.
В единственном проспективном рандомизированном исследовании ADIUVO, изучалась эффективность адъювантной терапии митотаном** в подгруппе пациентов с низким риском рецидива заболевания (Ki-67 ![]() 10%) после R0-резекции по поводу I - III стадии АКР [87]. Всего 91 пациент были рандомизированы на 2 группы - наблюдение и митотан** 1:1. Достоверных различий в безрецидивной и общей выживаемости не наблюдалось. Следует отметить, что в исследование включены всего 13% пациентов (N = 6) с III стадией в группе митотана** и 11% (N = 5) в группе наблюдения, что не позволяет сделать однозначный вывод о неэффективности назначения митотана** в подгруппе пациентов с III-стадией и Ki-67
10%) после R0-резекции по поводу I - III стадии АКР [87]. Всего 91 пациент были рандомизированы на 2 группы - наблюдение и митотан** 1:1. Достоверных различий в безрецидивной и общей выживаемости не наблюдалось. Следует отметить, что в исследование включены всего 13% пациентов (N = 6) с III стадией в группе митотана** и 11% (N = 5) в группе наблюдения, что не позволяет сделать однозначный вывод о неэффективности назначения митотана** в подгруппе пациентов с III-стадией и Ki-67 ![]() 10%.
10%.
- 3.2.5 Рекомендуется всем пациентам, которым показана терапия #митотаном**, начинать лечение с небольших доз с постепенной эскалацией, под контролем состояния пациента, переносимости лечения, концентрации митотана** в плазме крови (см. также Приложение А3) [8, 87, 95-100, 215].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Существуют разные схемы терапии митотаном**, ни одна из них не обладает доказанным преимуществом на сегодняшний день. Наиболее широко используется схема, предполагающая старт терапии с дозы 2 г/сут с постепенной эскалацией дозы на 0.5 - 1 г/сут каждые 3 - 7 дней до суммарной дозы в 4 г/сут [87]. Согласно результатам исследования ADIUVO начальная доза #митотана** 1 г в сутки с постепенным повышением дозы на 0.5 - 1 г/сут каждые 3 - 7 дней до суммарной дозы в 4 г/сут обеспечивает достижение терапевтической концентрации у 56% пациентов и может быть использована в рутинной клинической практике [87].
Международные эксперты детям и подросткам с АКР рекомендуют начинать терапию #митотаном** в дозе 50 мг/кг/сутки или 1500 мг/м2/сутки с постепенной эскалацией дозы на 20 мг/кг/сутки или на 500 мг/м2 каждые 1 - 2 недели до суммарной дозы 4000 мг/м2/сутки под контролем концентрации митотана** в сыворотке крови (норма 14 - 20 мкг/мл) [240].
Коррекция дозы митотана** проводится в соответствии с его концентрацией в крови (необходимо определение через 4 недели от момента выхода на дозу 4 или 6 г/сут; на фоне высокодозного режима контроль концентрации митотана** (A09.05.035 Исследование уровня лекарственных препаратов в крови) должен проводиться каждые 2 - 3 недели) и переносимостью [95 - 97]. Митотан** имеет узкий терапевтический диапазон дозирования, ограниченный, с одной стороны, необходимостью быстрейшего достижения терапевтической концентрации препарата более 14 мг/л, с другой - переносимостью препарата. Интенсивность и амплитуда нежелательных клинических проявлений нарастает с проявлениями кумулятивного эффекта, проявления исчезают с отменой препарата (Табл. 11) [98].
Достижение целевой концентрации митотана** в крови не всегда зависит от принимаемой дозы препарата, в большей степени зависит от кумуляции дозы, связанной с длительным периодом полужизни препарата, что доказывает необходимость тщательного мониторинга уровня митотана** в крови и постоянной коррекции дозы [99, 100]. В сравнительном фармакокинетическом исследовании режим с высокими дозами на старте терапии позволил достичь терапевического диапазона выше 14 мкг/мл у большего количества пациентов. Однако, эти результаты не были статистически значимыми из-за недостаточной мощности исследования. Помимо этих двух режимов, существует множество других вариаций; выбор зависит от опыта врача, особенностей клинического течения АКР и состояния пациента. Рекомендации по применению митотана** в качестве адъювантной терапии см. также в Приложении А3.
Митотан** является липофильным лекарственным средством и, как предполагается, лучше всасывается из кишечника при совместном потреблении с жиросодержащими продуктами, например, с молоком или шоколадом. В случае ограниченной желудочно-кишечной толерантности должно быть предложено симптоматическое лечение тошноты/рвоты и/или диареи.
У всех пациентов, получающих терапию митотаном**, необходимо проверять его лекарственные взаимодействия с другими препаратами (в частности, из-за индукции цитохрома CYP3A4 под влиянием митотана**). Все сопутствующие лекарства должны быть проверены на предмет метаболизма CYP3A4 и заменены альтернативными, если это возможно. Молекулярные механизмы эффектов митотана** до сих пор изучены недостаточно. Тем не менее, известно, что митотан** повышает экспрессию печеночной монооксигеназы CYP3A4, метаболизирующей ряд лекарственных веществ. В связи с этим, все препараты, которые назначаются пациенту одновременно с приемом митотана** и/или на фоне присутствия его концентрации в крови, должны быть проверены на предмет метаболизма CYP3A4 и заменены альтернативными, если это возможно [85].
Назначение митотана** требует гормонзаместительной терапии гидрокортизоном** или преднизолоном** у большинства пациентов и, как правило, она начинается с первого дня терапии и продолжается после завершения его приема [101]. В небольшом наблюдательном исследовании было показано, что у 78,3% (18/23) гипоталамо-гипофизарно-надпочечниковая система полностью восстанавливается после отмены митотана**, у 13% (3/23) не удалось отказаться от глюкокортикостероидов (АТХ H02AB Глюкокортикоиды) при нормальном значении гормональных тестов и у 8,7% (2/23) функция гипоталамо-гипофизарно-надпочечниковой системы не восстановилась. Медиана до восстановления гипоталамо-гипофизарно-надпочечниковой системы составила 2,5 года, что следует помнить при завершении адъювантной терапии митотаном**.
Таблица 11. Побочные эффекты митотана**
Симптомы
Частота
Гастроинтестинальные: тошнота, рвота, диарея
Очень часто
ЦНС: сонливость, заторможенность, атаксия, дизартрия, головокружение, депрессия, снижение памяти, полинейропатия
Очень часто
Надпочечниковая недостаточность
Очень часто
Вираж печеночных ферментов (в основном ГГТП)
Очень часто
Увеличение уровня связывающих белков
Очень часто
Гиперхолестеринемия, гипертриглицеридемия
Очень часто
Увеличение времени кровотечения
Очень часто
Индукция микросомальных печеночных ферментов, увеличивающих метаболический клиренс глюкокортикостероидов (АТХ H02AB Глюкокортикоиды), барбитуратов, варфарина**
Очень часто
Первичный гипогонадизм у мужчин
Часто
Гинекомастия
Часто
Кожная сыпь
Часто
Лейкопения
Часто
Аутоиммунный гепатит
Редко
Тромбоцитопения, анемия
Редко
Артериальная гипертензия
Очень редко
Диплопия, ретинопатия, катаракта, макулярный отек
Очень редко
Геморрагический цистит
Очень редко
Определение частоты побочных эффектов: очень часто (![]() 1/10), часто (>
1/10), часто (>![]() 1/100 to < 1/10), нечасто (
1/100 to < 1/10), нечасто (![]() 1/1000 to < 1/100), редко (от
1/1000 to < 1/100), редко (от ![]() 1/10 000 до < 1/1000), очень редко rare (< 1/10 000), не известно (не может быть определено на основании имеющихся на сегодняшний день результатов исследований).
1/10 000 до < 1/1000), очень редко rare (< 1/10 000), не известно (не может быть определено на основании имеющихся на сегодняшний день результатов исследований).
- 3.2.6 Рекомендуется рассмотреть проведение комбинации платиносодержащей химиотерапии (EDP, EP или ЕС) в комбинации с #митотаном** в адъювантном режиме у взрослых пациентов с очень высоким риском рецидива/прогрессирования (Ki-67 ![]() 20% и Т3-4, см. также Приложение Б Рис. 1) и у пациентов 0 - 18 лет с III - IV стадией по COG [85, 102 - 104, 231, 244] (таблица 12).
20% и Т3-4, см. также Приложение Б Рис. 1) и у пациентов 0 - 18 лет с III - IV стадией по COG [85, 102 - 104, 231, 244] (таблица 12).
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Назначение адъювантной ХТ при раке коры надпочечника остается предметом дискуссий и не рекомендовано к использованию в рутинной клинической практике. Проспективные исследования по изучению эффективности адъювантной терапии после радикальной резекции АКР I - III стадий не проводились. Тем не менее, большинство экспертов Европейского общества эндокринологов (European Society of Endocrinology) и ENSAT одобряют индивидуальное решение вопроса о возможности проведения полихимотерапии АКР в адъювантном режиме у пациентов с очень высоким риском рецидива/прогрессирования (Т3-4 и Ki-67 ![]() 20%) [103].
20%) [103].
В небольшом ретроспективном исследовании "случай-контроль" изучалась эффективность назначения 2 - 8 курсов платиносодержащей химиотерапии после хирургического лечения по поводу АКР I - IV стадий [104]. В исследование включено 62 пациента, из них 64,5% с III - IV стадией, у 6,5% и 13% пациентов выполнена R1 и Rx-резекция, 75% имели уровень Ki-67 ![]() 20%. Большая часть пациентов - 77,4% получили химиотерапию по схеме #этопозид** +# цисплатин**/#карбоплатин**. Назначение адъювантной химиотерапии в этой выборке пациентов с очень высоким риском рецидива было связано с достоверным улучшением медианы безрецидивной выживаемости с 7,3 до 17,7 месяцев (p = 0,021) и общей выживаемости (p = 0,01).
20%. Большая часть пациентов - 77,4% получили химиотерапию по схеме #этопозид** +# цисплатин**/#карбоплатин**. Назначение адъювантной химиотерапии в этой выборке пациентов с очень высоким риском рецидива было связано с достоверным улучшением медианы безрецидивной выживаемости с 7,3 до 17,7 месяцев (p = 0,021) и общей выживаемости (p = 0,01).
Таким образом, при очень высоком риске рецидива (Ki 67 ![]() 20% и III - IV стадия) в индивидуальном порядке следует рассмотреть добавление к митотану** комбинированной химиотерапии с включением #этопозида** и #цисплатина**/#карбоплатина** в количестве 4 - 6 курсов. [104].
20% и III - IV стадия) в индивидуальном порядке следует рассмотреть добавление к митотану** комбинированной химиотерапии с включением #этопозида** и #цисплатина**/#карбоплатина** в количестве 4 - 6 курсов. [104].
Всем пациентам от 0 - 18 лет с морфологически верифицированным АКР III и IV стадии по COG с целью улучшения показателей выживаемости показано назначение адьювантной химиотерапии по схеме #этопозид** + #цисплатин** + #доксорубицин** с добавлением #митотана** [231, 240]. Количество курсов химиотерапии зависит от индивидиульной переносимости пациента и может составлять от 6 до 8 курсов химиотерапии. Согласно протоколу ARAR0332 длительность приема #митотана** составляет 8 месяцев [231, 240]. Однако в настоящее время длительность терапии #митотаном** в педиатрической популяции с АКР дискутабельна. В одном из исследований было показано, что продолжительность терапии #митотаном** менее 9 месяцев, низкая концентрация митотана** (ниже 14 мг/л) статистически значимо оказывали негативное влияние на показатели выживаемости [241]. Учитывая, что достижение терапевтической концентрации митотана** может занимать несколько месяцев, авторами международных исследовании предложено увеличить длительность приема #митотана** у детей и подростков с АКР от 2 до 5 лет [240]. Таким образом, длительность терапии #митотана** у пациентов в возрасте от 0 до 18 лет с АКР может быть обсуждена в индивидуальном порядке конкретного случая со специалистами федеральных центров.
- 3.2.7 Рекомендуется взрослым пациентам рассматривать все случаи с R2-резекцией как распространенный АКР (см разд. 5.3.1 и Приложение Б Рис. 2) [8].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Таблица 12. Режимы адъювантной терапии АКР
Режим
Препараты
#Митотан** (для детей и взрослых пациентов)
ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии
EP+M (для взрослых пациентов)
#Этопозид** 100 мг/м2 в/в в 1 - 3-й дни + #цисплатин** 75 мг/м2 в/в в 1 день. Курс каждые 21 день. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно
EC+M (для взрослых пациентов)
#Этопозид** 100 мг/м2 в/в в 1 - 3-й дни + #карбоплатин** AUC5 мг/м2 в/в в 1 день. Курс каждые 21 день. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно
EDP+M (для взрослых пациентов)
#Этопозид** 100 мг/м2 в/в во 2 - 4-й дни + #доксорубицин** 40 мг/м2 в/в в 1-й день + #цисплатин** 40 мг/м2 в/в в 3-й и 4-й дни. Курс каждые 28 дней. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно.
EDP+M (протокол ARAR0332 для пациентов 0-18 лет)
#Этопозид** 100 мг/м2 в/в в 1 - 3-й дни + #доксорубицин** 25 мг/м2 в/в в 4 - 5-й день + #цисплатин** 50 мг/м2 в/в в 1 - 2-й дни. Курс каждые 21 день. Одновременно с ХТ-#митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно [231, 244].
Системная терапия метастатического и неоперабельного АКР
- 3.2.8 Рекомендуется взрослым пациентам с небольшой распространенностью и медленной прогрессией заболевания, низким уровнем Ki-67 (< 10%) рассмотреть вопрос о монотерапии митотаном** в комбинации с возможными циторедуктивными вмешательствами или другими методами местного воздействия (например радиологическими или интервенционными) в качестве первичного лечения (см. также Приложение Б Рис. 2) [85, 102, 105 - 108].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. В проспективном исследовании, включившем 127 пациентов, изучена эффективность митотана** в монорежиме в лечении метастатического АКР [107]. Частота объективного ответа (ЧОО) составила 20,5%, стабилизация заболевания более 6 мес. наблюдалась у 18,1% пациентов. Медианы выживаемости без прогрессирования и общей выживаемости составили 4,1 и 18,5 мес. соответственно. Достижение терапевтической концентрации было связано с достоверным улучшением частоты объективного ответа - 31,9% против 11,1% и общей выживаемости. В группе пациентов с низким уровнем Ki-67 ![]() 10% наблюдалась наиболее высокая частота длительного контроля заболевания - 54% против 24% при Ki-67 > 20%. По данным мультипараметрического анализа, количество метастатических очагов менее 10 достоверно ассоциировалось со снижением риска прогрессирования заболевания и смерти. Приведенные выше данные свидетельствуют о том, что у пациентов с индолентным течением заболевания, низким уровнем Ki-67 и небольшой распространенностью заболевания митотан** в монорежиме может быть назначен в качестве первой линии терапии. При анализе эффективности митотана** у 246 пациентов с распространенными формами АКР (IV стадия ENSAT) в 26% наблюдений отмечен объективный ответ в соответствии с критериями RECIST (11 пациентов - полный ответ, 52 - частичный ответ) [108].
10% наблюдалась наиболее высокая частота длительного контроля заболевания - 54% против 24% при Ki-67 > 20%. По данным мультипараметрического анализа, количество метастатических очагов менее 10 достоверно ассоциировалось со снижением риска прогрессирования заболевания и смерти. Приведенные выше данные свидетельствуют о том, что у пациентов с индолентным течением заболевания, низким уровнем Ki-67 и небольшой распространенностью заболевания митотан** в монорежиме может быть назначен в качестве первой линии терапии. При анализе эффективности митотана** у 246 пациентов с распространенными формами АКР (IV стадия ENSAT) в 26% наблюдений отмечен объективный ответ в соответствии с критериями RECIST (11 пациентов - полный ответ, 52 - частичный ответ) [108].
- 3.2.9 Рекомендуется пациентам взрослого и детского возраста с неоперабельным АКР, наличием распространенного метастатического процесса, быстрым прогрессированием заболевания проводить химиотерапию по схеме #этопозид**, #доксорубицин**, #цисплатин** (режим приведен в таблице 13 - на фоне продолжающегося приема #митотана** ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии (схема EDP-M для взрослых пациентов, схема EDP-M протокола ARAR0332 у детей) [105, 231, 244]. Продолжительность терапии 6 - 8 курсов, затем продолжается поддерживающая терапия #митотаном** в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл.
Для взрослых Уровень убедительности рекомендаций - A, уровень достоверности доказательств - 2.
Для детей Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Наиболее эффективным режимом терапии, по данным рандомизированного исследования FIRM-ACT, признана комбинация #этопозида**, #доксорубицина** и #цисплатина** на фоне постоянного приема митотана** (схема EDP-M). Исследование включало 304 пациента с распространенным вариантом АКР. Назначение комбинации EDP + m позволило достичь частоты объективных ответов 23,2% и медианы ВБП 5 мес. [105].
Терапевтические опции для детской популяции пациентов с АКР также весьма ограничены и в целом совпадают с таковыми для взрослых [109] Доказательная база основана преимущественно на результатах исследований с участием взрослых пациентов; исследования с участием детей единичные, характеризуются малым объемом выборки. В исследовании с участием 11 детей с распространенным АКР полный или частичный ответ достигнут в 81% случаев (9 пациентов) при применении протокола EDP-M на фоне достижения терапевтической концентрации митотана** в крови [110]. Протокол EDP-M используется в качестве 1 линии полихимиотерапии, вне зависимости от возраста пациента (см. Табл. 13). В клинической практике для взрослых пациентов с АКР наиболее часто используется первый режим дозирования, в детской популяции - второй и четвертый.
У пациентов с непереносимостью митотана** (развитием тяжелых некупируемых побочных явлений при концентрации митотана** в рамках референсных значений) допускается проведение химиотерапии с исключением из схемы митотана**.
- 3.2.10 Рекомендуется взрослым пациентам с неоперабельным АКР, наличием распространенного метастатического процесса, быстрым прогрессированием заболевания при наличии противопоказаний к назначению антрациклинов (L01DB: Антрациклины и родственные соединения) проводить цитотоксическую терапию по схеме #этопозид**, #цисплатин**/#карбоплатин** (режим приведен в таблице 13 - на фоне продолжающегося приема митотана** ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии [111, 117, 216, 226, 249]]. Продолжительность терапии 6 - 8 курсов, затем продолжается поддерживающая терапия митотаном** в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл.
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. В небольшом ретроспективном исследовании изучалась эффективность комбинации #этопозида** и #карбоплатина** в терапии метастатического или местнораспространенного АКР у пациентов с противопоказаниями к назначению #цисплатина** [111]. В исследование были включены 12 пациентов, из которых 7 получали химиотерапию на фоне митотана**, 5 без митотана**. ЧОО наблюдалась у 33% пациентов (n = 4), все ответы на лечение были частичными, стабилизация заболевания - также у 33% (n = 4). Медиана ОВ составила 17,2 мес. Таким образом можно сделать вывод о возможности назначения комбинации #этопозида**, #карбоплатина** и митотана** у пациентов с наличием противопоказаний к #цисплатину**.
У пациентов с непереносимостью митотана** (развитием тяжелых некупируемых побочных явлений при концентрации митотана** в рамках референсных значений) допускается проведение химиотерапии с исключением из схемы митотана**.
- 3.2.11 Рекомендуется рассмотреть добавление локальных методов контроля (хирургическое лечение, стереотаксическая лучевая терапия/хирургия (Конформная дистанционная лучевая терапия, в том числе IMRT, IGRT, ViMAT, стереотаксическая.), интервенционные вмешательства) у взрослых пациентов с олигометастатическим заболеванием при контроле заболевания на фоне системной терапии не менее 6 мес [8, 112, 217].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Около 20% пациентов имеют длительный контроль заболевания после проведенного лечения, данные пациенты могут быть кандидатами для хирургического лечения после завершения платиносодержащей химиотерапии [112]. В небольшом ретроспективном исследовании, включившем 58 пациентов, резекция остаточной опухоли на фоне контроля заболевания после 6 - 8 циклов химиотерапии 1й линии по схеме EDP-M была выполнена 26 пациентам, была достоверно ассоциирована с увеличением медианы ВБП по сравнению с группой наблюдения - 13,1 против 7,4 мес. (p = 0,053) и медианы ОВ - 29,8 мес. и 10,8 мес. (p = 0,0001) соответственно. Эффективность подобного подхода у детей с АКР не оценивалась, целесообразна консультация пациентов с олигометастатическим заболеванием со специалистами федеральных центров [244].
- 3.2.12 Рекомендуется выполнять всем пациентам с метастатическим АКР при подозрении на синдром Линча выполнять иммуногистохимическое исследование с антителами к MSH2, MLH1, PMS2, MSH6 (A08.30.040 Определение мутаций в генах MLH1, MSH2, MSH6, PMS2 иммуногистохимическим методом) [предпочтительный метод] или ПЦР для оценки статуса микросателлитной нестабильности (A27.30.001 определение микросателлитной нестабильности в биопсийном (операционном) материале методом ПЦР (8, 113).
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. У 3 - 6% пациентов определяется высокий уровень микросателлитной нестабильности (MSI-high), что является показанием для назначения #пембролизумаба** в качестве второй и последующих линий терапии [114].
Таблица 13. Режимы терапии, используемые в качестве 1 линии терапии
Режим
Препараты
1.
EDP+M (для взрослых пациентов)
#Этопозид** 100 мг/м2 в/в во 2 - 4-й дни + #доксорубицин** 40 мг/м2 в/в в 1-й день + #цисплатин** 40 мг/м2 в/в в 3-й и 4-й дни. Курс каждые 28 дней. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно
1.
EP+M (для взрослых пациентов)
#Этопозид** 100 мг/м2 в/в в 1 - 3-й дни + #цисплатин** 75 мг/м2 в/в в 1 день. Курс каждые 21 день. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно
1.
EC+M (для взрослых пациентов)
#Этопозид** 100 мг/м2 в/в в 1 - 3-й дни + #карбоплатин** AUC5 в/в в 1 день. Курс каждые 21 день. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно
1.
EDP+M (протокол ARAR0332 для пациентов 0-18 лет)
#Этопозид** 100 мг/м2 в/в в 1 - 3-й дни + #доксорубицин** 25 мг/м2 в/в в 4 - 5-й день + #цисплатин** 50 мг/м2 в/в в 1 - 2-й дни. Курс каждые 21 день. Одновременно с ХТ-#митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно [231, 244].
1.
#Митотан** офф-лейбл (всем пациентам)
ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии
- 3.2.13 Рекомендуется пациентам с высоким уровнем микросателлитной нестабильности (MSI-H) назначить пембролизумаб** взрослым 200 мг в/в каждые 3 недели или 400 мг в/в каждые 6 недель в виде в/в инфузии или #пембролизумаб** + митотан** в качестве второй и последующих линий терапии метастатического АКР. Продолжительность терапии до прогрессирования заболевания или неприемлемой токсичности, но не более 2х лет [114 - 115, 246]. Дозовый режим #пембролизумаба** у детей составляет 2 мг/кг в/в каждые 3 недели [242].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. В исследовании II фазы была изучена эффективность пембролизумаба** в качестве 2й и последующих линий терапии метастатических опухолей с MSI-H, исключая колоректальный рак [114]. Терапия пембролизумабом** в дозе 200 мг каждые 3 недели проводилась до прогрессирования заболевания или неприемлемой токсичности, но не более 2х лет. Всего в исследование включено 233 пациента, в том числе 5 с АКР. Частота объективного ответа составила 34,3%, медиана выживаемости без прогрессирования 4,1 месяцев. Одно- и двухлетняя выживаемость без прогрессирования составили 33,9 и 29,3% соответственно.
Эффективность пембролизумаба** изучалась при распространенном АКР после прогрессирования на предшествующих режимах химиотерапии независимо от уровня MSI. В одном из исследований II фазы было включено 39 пациентов с прогрессирующим АКР. Пациенты получали пембролизумаб** в дозе 200 мг в/в каждые 21 день до прогрессирования или развития неприемлемой токсичности, но не более 24 мес [115]. При этом прием митотана** не допускался. Частота объективного ответа на терапию пембролизумабом** составила 23%, контроль за болезнью - 52%, медиана выжимаемости без прогрессирования - 2,1 мес., медиана продолжительности жизни - 24,9 мес. У шести пациентов (16%) были выявлены генетические нарушения в системе репарации неспаренных оснований ДНК (dMMR/MSI-H). Из них у двух был выявлен частичный ответ, у двух - стабилизация болезни, еще два пациента прогрессировали на терапии пембролизумабом**. При этом статус dMMR/MSI-H не являлся значимым маркером, предполагающим ответ на пембролизумаб** (P = 0,61)
Следует отметить, что эффективность пембролизумаба** при адренокортикальном раке изучалась только в монорежиме. Комбинирование митотана** с другим ингибитором контрольных точек иммунного ответа - авелумабом** привело к увеличению частоты нежелательных явлений 3 - 4 степени с 8% до 24%, в том числе повышения печеночных трансаминаз 3 - 4 степени, которое встречалось только в группе комбинации с митотаном** (8% против 0%) [116].
Однако у взрослых пациентов с гиперкортицизмом целесообразно назначение комбинации #пембролизумаба** и митотана ** [246].
- 3.2.14 Рекомендуется рассмотреть для взрослых пациентов назначение терапии #пембролизумаб** +/- митотан** в качестве второй и последующих линий терапии метастатического АКР у пациентов с опухолями без дефектов репарации неспаренных оснований (MSS) со статусом ECOG 0 - 1. Продолжительность терапии до прогрессирования заболевания или неприемлемой токсичности, но не более 2х лет [115, 246].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Эффективность пембролизумаба** изучалась при распространенном АКР после прогрессирования на предшествующих режимах химиотерапии независимо от уровня MSI. В одном из исследований II фазы было включено 39 пациентов с прогрессирующим АКР. Пациенты получали пембролизумаб** в дозе 200 мг в/в каждые 21 день до прогрессирования или развития неприемлемой токсичности, но не более 24 мес [115]. При этом прием митотана** не допускался. Частота объективного ответа на терапию пембролизумабом** составила 23%, контроль за болезнью - 52%, медиана выжимаемости без прогрессирования - 2,1 мес., медиана продолжительности жизни - 24,9 мес. У шести пациентов (16%) были выявлены генетические нарушения в системе репарации неспаренных оснований ДНК (dMMR/MSI-H). Из них у двух был выявлен частичный ответ, у двух - стабилизация болезни, еще два пациента прогрессировали на терапии пембролизумабом**. При этом статус dMMR/MSI-H не являлся значимым маркером, предполагающим ответ на пембролизумаб** (P = 0,61). В исследовании KEYNOTE-051 у 2/4 педиатрических пациентов с прогрессирующим/рецидивирующим АКР зафиксирован частичный ответ на фоне терапии #пембролизумабом** [242]. Однако у взрослых пациентов с гиперкортицизмом целесообразно назначение комбинации #пембролизумаба** и митотана** [246].
- 3.2.15 Рекомендуется взрослым пациентам с прогрессированием не ранее 6 мес. после завершения платиносодержащей химиотерапии по поводу метастатического АКР рассмотреть проведение ре-индукции платиносодержащей химиотерапии на фоне продолжающегося приема митотана**. При достижении предельно допустимой кумулятивной дозы #доксорубицина** (450 мг/м2), рекомендовано продолжить проведение химиотерапии по схеме ЕР/ЕС до 6 - 8 циклов [117].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. В небольшом ретроспективном исследовании, включившем 17 пациентов, было показано, что назначение ре-индукции платиносодержащей химиотерапии при бесплатиновом интервале не менее 6 мес. позволяет добиться контроля заболевания ![]() 6 мес. у 52,9% пациентов [117]. Медиана ВБП составила 6,17 месяцев. В настоящий момент, принимая во внимание единичные международные публикации, описывающие использование схем противорецидивной терапии взрослых пациентов на очень ограниченной группе пациентов педиатрического возраста с прогрессирующим/рецидивирующим АКР, стандарты цитостатической терапии второй линии у детей 0 - 18 лет с АКР недостаточно изучены [244]. При развитии рецидива/прогрессии заболевания у детей и подростков с АКР необходима консультация со специалистами федеральных центров [251].
6 мес. у 52,9% пациентов [117]. Медиана ВБП составила 6,17 месяцев. В настоящий момент, принимая во внимание единичные международные публикации, описывающие использование схем противорецидивной терапии взрослых пациентов на очень ограниченной группе пациентов педиатрического возраста с прогрессирующим/рецидивирующим АКР, стандарты цитостатической терапии второй линии у детей 0 - 18 лет с АКР недостаточно изучены [244]. При развитии рецидива/прогрессии заболевания у детей и подростков с АКР необходима консультация со специалистами федеральных центров [251].
- 3.2.16 Рекомендуется взрослым пациентам с распространенным АКР после прогрессирования на платиносодержащей химиотерапии назначение комбинации #гемцитабина** и #капецитабина** до прогрессирования или неприемлемой токсичности на фоне продолжающегося приема митотана** ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии [8, 118 - 120, 214, 215, 226].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Частота объективного ответа на фоне #гемцитабин**-содержащей химиотерапии составляет 4 - 7%, примерно у половины пациентов удается достичь контроля заболевания не менее 4 месяцев. В наиболее крупном ретроспективном исследовании, оценившем эффективность #гемцитабин**-содержащих режимов химиотерапии при метастатическом АКР (n = 145), в том числе #гемцитабин** + #капецитабин** (n = 132), частота объективного ответа составила 4,9%, а медиана ВБП - 12 недель [119]. При этом 6 из 7 объективных ответов наблюдались у пациентов, достигших терапевтической концентрации митотана**. Таким образом, комбинация #гемцитабина** и #капецитабина** без митотана** или при низкой его концентрации в крови обладает минимальной клинической эффективностью, что определяет необходимость продолжения терапии митотаном** и поддержания его терапевтической концентрации даже после прогрессирования заболевания на фоне митотана**.
- 3.2.17 Рекомендуется взрослым пациентам рассмотреть отмену митотана** в третьей и последующих линиях терапии у пациентов с бесплатиновым интервалом менее 6 мес. при отсутствии признаков гиперкортицизма. При его удовлетворительной переносимости рекомендуется продолжить митотан** на протяжении всех последующих линий терапии [120, 121, 214].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Пациенты с прогрессированием на 2х и более линиях терапии с резистентностью к препаратам платины (L01XA) (бесплатиновый интервал менее 6 мес.) имеют крайне неблагоприятный прогноз, медиана общей выживаемости в различных исследованиях как с включением митотана, так и без него составляет 6 - 7 мес. (155, 218) в связи с чем при плохой переносимости митотана** возможна его отмена.
- 3.2.18 Рекомендуется взрослым пациентам с распространенным АКР при прогрессировании на платиносодержащей и #гемцитабин**-содержащей химиотерапии рассмотреть назначение #темозоломида** +/- митотан** ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии [155, 226].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. В ретроспективном исследовании, изучавшем эффективность #темозоломида** в качестве 2й и последующих линий химиотерапии метастатического АКР частота объективного ответа составила 21,5% (N = 6/28), медианы выживаемости без прогрессирования и общей выживаемости составили 3,5 мес. и 7,2 мес. соответственно [155, 226].
Режимы химиотерапии, применяемые во 2й и последующих линиях лечения распространенного рака коры надпочечников, представлены в таблице 14.
Таблица 14. Режимы полихимиотерапии, используемые в качестве 2 линии терапии
Режим
Препараты
GemCap+M (для взрослых пациентов)
#Гемцитабин** 800 мг/м2 в/в 1, 8 дни + #капецитабин** 1500 мг/сут внутрь ежедневно. Курс каждые 21 день. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно
GemCap+M (для взрослых пациентов)
#Гемцитабин** 800 мг/м2 в/в 1, 8 дни + #капецитабин** 1650 - 2000 мг/м2/сут внутрь 1 - 14 день. Курс каждые 21 день. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно
#Темозоломид** +/- M (для взрослых пациентов)
#Темозоломид** 200 мг/м2/сутки внутрь 1 - 5 дни. Курс каждые 28 дней. Одновременно с ХТ-митотан** ежедневно в дозе, обеспечивающей его содержание в крови на уровне 14 - 20 мкг/мл, непрерывно.
#Пембролизумаб** +/-митотан** (для пациентов взрослого и детского возраста)
#Пембролизумаб** 200 мг в/в капельно 30 мин каждые 3 нед или 400 мг в/в каждые 6 нед. Целесообразно рассмотреть одновременное назначение митотана** при необходимости контроля гиперкортицизма. Продолжительность терапии до прогрессирования заболевания или неприемлемой токсичности, но не более 2х лет.
3.3 Иное лечение
3.3.1 Дистанционная лучевая терапия
- 3.3.1.1 Рекомендуется взрослым пациентам с костными метастазами АКР и болевым синдромом решить вопрос о проведении паллиативной дистанционной лучевой терапии (A07.22.001 Дистанционная лучевая терапия новообразований желез внутренней секреции) с целью уменьшения болевого синдрома. Лучевая терапия может проводиться различными режимами фракционирования - 24 Гр за 6 фракций за 2 недели, 30 Гр за 10 фракций за 2 недели, 8 Гр за 1 фракцию [219, 247 - 250].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Длительное время АКР считался радионечувствительной опухолью. В настоящее время известно, что ДЛТ является методом выбора для паллиативной терапии при метастазах АКР в кости и центральную нервную систему (30 - 40 Грей). Исследуются возможности конформной дистанционной лучевой терапии с 3D-планировкой как при нерезектабельных формах заболевания, так и в качестве дополнительного метода местного воздействия после нерадикального хирургического лечения. Использование лучевой терапии у детей и подростков с АКР ограничено [244]. Учитывая высокую частоту встречаемости мутации в гене ТР53 у детей и подростков с АКР, лучевая терапия может повысить риск развития вторичной опухоли [243, 244].
- 3.3.1.2 Рекомендуется рассмотреть проведение ДЛТ (A07.22.001 Дистанционная лучевая терапия новообразований желез внутренней секреции) у взрослых пациентов в дополнение к терапии митотаном** на индивидуальной основе у пациентов после R1 резекции в ранние сроки после операции (в течение месяца) при невозможности повторной операции. Следует учитывать, что проведение ДЛТ может усложнить повторные хирургические вмешательства. В связи с чем ДЛТ не должна назначаться рутинно, вопрос о ее проведении должен решаться на индивидуальной основе [121 - 125, 228].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Длительное время АКР считался радионечувствительной опухолью. По данным литературы, применение ДЛТ (A07.22.001 Дистанционная лучевая терапия новообразований желез внутренней секреции) способно предотвратить местное рецидивирование, но не оказывает значительного влияния на риск отдаленного метастазирования и общую выживаемость [121 - 123].
Известно, что именно отдаленные метастазы являются проявлением повтора заболевания в 40 - 60% случаев АКР и оказывают значительное влияние на прогноз пациента, и их труднее эффективно лечить. Тем не менее, профилактика осложнений, вызванных местными рецидивами, свидетельствует о возможной пользе лучевой терапии. Адъювантная ДЛТ может быть целесообразной у пациентов с резекцией R1. Следует подчеркнуть, что методом выбора у этих пациентов является повторное хирургическое вмешательство. Проведение ДЛТ может затруднить последующие хирургические вмешательства и повысить их риск, поэтому ДЛТ следует применить при обоснованном отказе от повторных хирургических вмешательств. Возможность проведения повторных хирургических вмешательств должно быть оценено в специализированных центрах.
Длительное время АКР считался радионечувствительной опухолью. По данным литературы, применение ДЛТ способно предотвратить местное рецидивирование, но не оказывает значительного влияния на риск отдаленного метастазирования и общую выживаемость [121 - 123].
Недопустима отсрочка терапии митотаном** и/или системной химиотерапии из-за проведения ДЛТ.
Высокий риск интраоперационнной опухолевой диссеминации не является показанием к проведению ДЛТ.
3.3.2 Заместительная терапия надпочечниковой недостаточности при лечении митотаном**.
- 3.3.2.1 Рекомендуется всем пациентам, получающим терапию митотаном**, проводить заместительную терапию надпочечниковой недостаточности. В случае гиперкортицизма необходимость проведения заместительной терапии должна обсуждаться индивидуально. Оптимальными препаратами являются гидрокортизон**. Прием митотана** приводит к индукции печеночного клиренса стероидов и повышению уровня кортизол-связывающего глобулина в крови, в связи с этим необходимо минимум двукратное увеличение стандартной дозы заместительной терапии надпочечниковой недостаточности [37, 126 - 129].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Заместительную терапию надпочечниковой недостаточности, обусловленной приемом митотана**, как правило, начинают с первого дня его применения. Наиболее распространенной стратегией является старт терапии с использованием полной заместительной дозы глюкокортикоидов, которая должна, как минимум, в два раза превышать стандартную (см. также разд. 3.2.2). Альтернативная стратегия состоит в том, чтобы начать заместительную терапию в редуцированной дозе - 20 мг/сут гидрокортизона** с постепенной эскалацией в течение нескольких недель. Суммарная доза гидрокортизона** обычно составляет 50 мг/сут, однако некоторым пациентам требуются суточные дозы до 100 мг. Учитывая высокий риск надпочечниковой недостаточности в послеоперационном периоде у детей и подростков возможно назначение гидрокортизона** внутривенно в дозе 50 - 100 мг/м2 с постепенным снижение дозы [244, 245]. Согласно протоколу ARAR0332 заместительная терапия назначается через одну или две недели после начала приема митотана**: гидрокортизон** в дозе 30 мг/м2 (разделенный на 2 или 3 приема в день), флудрокортизон** 0,15 - 0,2 мг/сутки [240, 244, 251]. Совместно с врачом-детским эндокринологом доза гидрокортизона** и флудрокортизона** на фоне приема митотана** может быть скорректирована в зависимости от показателей АКТГ, кортизола в плазме крови [240, 244].
Не существует надежного лабораторного маркера для определения оптимальной дозы гидрокортизона**. Адекватность заместительной терапии надпочечниковой недостаточности на фоне терапии митотаном** должна основываться на параметрах клинической картины, таких как артериальное давление, пульс, аппетит, тошнота/рвота, динамика массы тела. В качестве вспомогательных биомаркеров, помимо клинической картины, могут учитываться концентрации АКТГ и калия крови.
При присоединении интеркуррентных заболеваний, стрессе (психологические или тяжелые физические нагрузки) необходимо увеличивать дозу глюкокортикоидов в 1.5 - 3 раза на время острой фазы заболевания или момент воздействия стресса. В дальнейшем целесообразен возврат к обычной заместительной дозе, которую пациент принимал до болезни. В случае невозможности перорального приема глюкокортикоидов по любым причинам, возникновения любых острых состояний необходим переход на парентеральный путь их введения. Оптимальным препаратом также является гидрокортизон**.
У некоторых пациентов, получающих митотан**, могут наблюдаться симптомы минералкортикоидной недостаточности (гиперкалиемия, гипонатриемия, гипотония, слабость), несмотря на применение глюкокортикоидов в полной заместительной дозе. В этом случае необходимо решить вопрос о добавлении к терапии флудрокортизона**, с учетом клинической картины, уровня электролитов и ренина/активности ренина плазмы [9].
3.3.3 Антирезорбтивная терапия
- 3.3.3.1 Рекомендуется взрослым пациентам с АКР и костными метастазами проводить антирезорбтивную терапию [8, 13].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Метастазы в кости у пациентов с АКР ассоциированы с низким качеством жизни из-за болевого синдрома, в также с возникновением патологических переломов, компрессии спинного мозга и гиперкальциемии. В ходе нескольких рандомизированных исследований III фазы было показано, что ингибиторы костной резорбции (M05B: Препараты, влияющие на структуру и минерализацию костей), такие как бисфосфонаты (M05BA) и деносумаб** (M05BX04), эффективны у пациентов с метастазами в кости при первичных злокачественных новообразований молочной железы, предстательной железы, легких. Достаточных данных для пациентов с АКР в настоящее время нет. Однако, основываясь на этих результатах, лечение пациентов с костными метастазами любых раков с помощью антирезорбтивной терапии стало общепринятой практикой. Поэтому у пациентов с АКР и костными метастазами целесообразно назначать бисфосфонаты (M05BA) в лечебных дозах в сочетании с потреблением кальция (A12AA Препараты кальция) и витамина D (A11CC05 колекальциферол**).
У пациентов с АКР и гиперкортицизмом отмечен повышенный риск глюкортикоидного остеопороза и остеопоротических переломов. Этой группе пациентов целесообразно проведение антирезорбтивной терапии с использованием "антиостеопорозных доз" бисфосфонатов (M05BA) или деносумаба** (M05BX04. Поскольку риск переломов быстро снижается после нормализации уровня кортизола в крови, продолжение антиостеопоротической терапии обычно не требуется после купирования гиперкортицизма.
3.3.4 Контрацепция
- 3.3.4.1 Рекомендуется пациенткам репродуктивного возраста, получающим цитотоксическую химиотерапию и/или терапию митотаном** подобрать эффективные методы контрацепции [130].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Цитотоксическая химиотерапии и терапия митотаном** ассоциированы с потенциальными тератогенными эффектами, в связи с чем наступление беременности на фоне применения этих методов лечения противопоказано. Для предотвращения наступления нежелательной беременности пациенткам репродуктивного возраста целесообразно применение эффективных методов контрацепции (см также разд. 5.4).
На сегодняшний день известно, что клетки АКР могут экспрессировать эстрогеновые рецепторы. Кроме того, в доклинических исследованиях было показано, что эстрогены могут стимулировать прогрессирование АКР за счет перекрестных взаимодействий с сигнальными путями инсулиноподобного фактора роста (IGF, insulin-like growth factor). В связи с этим предпочтение следует отдавать не содержащим эстрогены контрацептивным препаратам (G03A Гормональные контрацептивы системного действия) и барьерным методам контрацепции [220].
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется провдить реабилитацию (B05.027.001 Услуги по медицинской реабилитации пациента, перенесшего операцию по поводу онкологического заболевания B05.027.002 Услуги по медицинской реабилитации пациента, перенесшего химиотерапию, B05.027.003 Услуги по медицинской реабилитации пациента, перенесшего лучевую терапию, B05.058.001 Услуги по медицинской реабилитации пациента с заболеваниями эндокринных желез) пациентов с АКР, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии. Реабилитация пациентов, оперированных по поводу гормонально-активной опухоли, должна включать профилактику надпочечниковой недостаточности в послеоперационном периоде [221 - 223].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1 Профилактика АКР
Первичная профилактика АКР отсутствуют.
Вторичная профилактика прогрессирования АКР заключается в надлежащем лечении и регулярном обследовании пациентов в полном объеме (см. разд. 3 и 5.2).
5.2 Послеоперационное наблюдение пациентов с АКР
- 5.2.1 Всем пациентам с АКР рекомендуется регулярное обследование, включающее (1) визуализирующие исследования органов брюшной полости, малого таза, грудной клетки, (2) лабораторные исследования гормональной опухолевой секреции. В течение первых 2-х лет от момента постановки диагноза после радикального хирургического лечения обследование проводят не реже 1 раза в 2-3 месяца, далее - не реже 1 раза в 3 - 6 месяцев в течение последующих 3х лет. После 5-ти лет безрецидивного течения АКР интервалы могут быть увеличены до 6 - 12 месяцев. В случае распространенного/прогрессирующего АКР решение об оптимальной периодичности обследования принимается индивидуально; как правило, оно проводится не реже 1 раза в 2-3 месяца [1, 8, 9] (см также Приложение Б Рис 1. И Рис. 2).
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Регулярное стадирование опухолевого процесса в динамике необходимо для своевременной коррекции лечебной тактики и прогнозирования течения заболевания. Определение распространенности опухолевого процесса - выявления локо-регионарного рецидива или отдаленного метастазирования - проводится на основании КТ грудной клетки (A06.09.005.002) и компьютерной томографии органов брюшной полости с внутривенным болюсным контрастированием (A06.30.005.003) или 18ФДГ-ПЭТ/КТ (A07.30.043 Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП). До настоящего времени нет опубликованных исследований, посвященных оптимальной периодичности обследования при АКР. В связи с этим рекомендации основаны на мнении экспертов Европейского общества эндокринологов (European Society of Endocrinology) и ENSAT.
Всем пациентам с АКР показано регулярное проведение лабораторных тестов для определения гормональной опухолевой секреции, что способствует раннему выявлению рецидива/прогрессирования заболевания. Очевидно, что биохимической оценке, в первую очередь, подлежат стероидные гормоны и/или метаболиты, которые присутствовали во время диагностики исходной опухоли [9].
- 5.2.2 Всем пациентам с АКР, получающим терапию митотаном**, рекомендуется регулярное определение концентрации митотана** (A09.05.035 Исследование уровня лекарственных препаратов в крови) в крови. Целевой диапазон концентрации митотана** в крови составляет 14 - 20 мкг/мл [8, 126, 131, 132, 215] (см. также Приложение А3).
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарий. Узкий терапевтический диапазон митотана** обусловливает необходимость регулярного мониторирования его концентрации в плазме крови. Определение уровня митотана** (A09.05.035 Исследование уровня лекарственных препаратов в крови) в плазме оптимально проводить в утренние часы через, по крайней мере, 12 часов от момента последнего его приема.
На старте или при возобновлении терапии митотаном**, до тех пор, пока его концентрация не достигла целевого уровня > 14 мкг/мл, следует проводить мониторирование не реже 1 раза в 3 - 4 недели; в дальнейшем после достижения и стабильного сохранения терапевтической концентрации в крови достаточно определять уровень митотана** (A09.05.035 Исследование уровня лекарственных препаратов в крови) в плазме каждые 4 - 12 недель.
На старте или при возобновлении терапии митотаном**, до тех пор, пока его концентрация < 14 мкг/мл, целесообразно проводить постепенную эскалацию суточной дозы при нормальной переносимости до достижения терапевтического диапазона. При подборе оптимальной дозы митотана** необходимо учитывать особенности его фармакокинетики, в частности, высокую липофильность, обусловливающую депонирование в жировой ткани и медленное высвобождение в кровь в дальнейшем.
Большинство пациентов отмечает те или иные побочные эффекты митотана**, выраженность которых коррелирует, как правило, с его концентрацией в крови (см. также разд. 3.2.2 и табл. 9). Тем не менее, некоторые желудочно-кишечные побочные эффекты (такие как диарея), по-видимому, в большей степени коррелируют с пероральной дозировкой, чем с уровнем в плазме, и встречаются чаще в начале лечения [8, 126, 131, 132]. Нежелательные явления неврологического характера чаще возникают при превышении концентрации 20 мкг/мл [134 - 135]. Поэтому многие эксперты рекомендуют поддерживать концентрацию в плазме ниже 20 мкг/мл. Однако есть данные о том, что более высокие уровни митотана** в плазме также могут быть связаны с более высокой эффективностью. Кроме того, некоторые пациенты не испытывают соответствующих нежелательных явлений даже при уровнях в плазме значительно выше 20 мкг/мл.
- 5.2.3 Всем пациентам с АКР, получающим терапию митотаном**, рекомендуется регулярное обследование на предмет нежелательных явлений, и своевременное их лечение [36, 133 - 135].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Помимо надпочечниковой недостаточности лечение митотаном** может сопровождаться множеством потенциальных нежелательных явлений (см также разд. 3.2.2 и табл. 11). Всем пациентам с АКР, получающим терапию митотаном** необходимо проводить регулярное обследование на предмет нежелательных явлений (Табл. 15). Важность своевременного их выявления и купирования очевидна [9].
Таблица 15. Объем регулярного обследования на фоне терапии митотаном**
Исследование
Частота обследования
Комментарии
Определение концентрации митотана** в плазме крови (A09.05.035 Исследование уровня лекарственных препаратов в крови)
1 раз в 3 - 4 недели до достижения терапевтического диапазона; 1 раз в 4 - 12 месяца на фоне достижения и стабильного сохранения концентрации митотана** в целевом диапазоне
Терапевтический диапазон концентрации митотана** в крови 14 - 20 мкг/мл
Общий (клинический) анализ крови
1 раз в 3 - 4 недели на старте терапии, далее 1 раз в 4 - 8 недель или при наличии клинических показаний
Необходимо мониторирование редких, но потенциально возможных нежелательных явлений, таких как: лейкопения, тромбоцитопения, анемия
Анализ крови биохимический общетерапевтический: АЛТ (A09.05.042), АСТ (A09.05.041), ГГТП (A09.05.044), щелочная фосфатаза (A09.05.046), креатинин (A09.05.020), калий (A09.05.031), натрий (A09.05.030), общий белок (A09.05.010), общий билирубин (A09.05.021), глюкоза (A09.05.023)
1 раз в 3 - 4 недели на старте терапии, далее 1 раз в 4 - 8 недель или при наличии клинических показаний
Необходимо мониторирование потенциально возможных осложнений от бессмптомного повышения трансаминаз и/или ГГТП до аутоиммунного/токсического гепатиита (повышение печеночных ферментов более 5N повышает риск поражения печени и требует отмены митотана**)
Анализ крови по оценке нарушений липидного обмена биохимический: холестерин общий (A09.05.026), ЛПВП (A09.05.004), ЛПНП (A09.05.028), триглицериды (A09.05.025)
1 раз в 3 мес., при гиперхолестиринемии для подбора доз статинов (C10AA) возможен контроль каждые 2 - 4 недели
Необходимо мониторирование потенциально возможных гиперхолестеринемии, дислипидемии, их лечение
Исследование уровня тиреотропного гормона (ТТГ) в крови (A09.05.065), исследование уровня свободного тироксина (св. Т4) сыворотки крови (A09.05.063)
1 раз в 3 мес. или при наличии клинических показаний
Необходимо мониторирование потенциально возможного вторичного (с нормальным уровнем ТТТ и низким св. Т4) гипотиреоза, проведение заместительной терапии левотироксином натрия** (224)
Исследование уровня адренокортикотропного гормона в крови (A09.05.067)
1 раз в 3 - 4 недели или при наличии клинических показаний
Мониторирование лабораторных маркеров, дополнительно используемых для оценки адекватности заместительной терапии глюкортикортикоидной недостаточности
Исследование уровня ренина в крови/Определение рениновой активности плазмы крови (A09.05.121)
1 раз в 3 - 6 месяцев или при наличии клинических показаний
Мониторирование биохимического маркера, используемого наряду с клинической картиной для выявления минералкортикоидной недостаточности
Исследование уровня общего тестостерона (A09.05.078) и исследование уровня глобулина, связывающего половые гормоны (A09.05.160), в крови
У мужчин каждые 3 - 6 месяцев или при наличии клинических показаний
Выявление лабораторных маркеров гипогонадизма, при наличии клинической картины показано решение вопроса о заместительной терапии
Желудочно-кишечные побочные эффекты нередки, особенно в первые месяцы терапии митотаном**. Поддерживающая терапия должна включать противорвотные (A04A) и противодиарейные препараты (A07X), если необходимо (215, 227). Следует помнить, что тошнота/рвота также могут быть признаками надпочечниковой недостаточности, которая требует незамедлительного лечения. Важно отметить, что ключевым фактором, влияющим на достижения терапевтического диапазона митотана** в плазме, является именно переносимость терапии.
В случае развития умеренных побочных эффектов со стороны центральной нервной системы или ЖКТ дозу митотана** следует снизить на 0.5 - 1 г/сут и провести соответствующее симптоматическое лечение. В случае серьезных, но не жизнеугорожающих побочных эффектов со стороны ЦНС или любых жизнеугрожающих побочных эффектов и/или повышения уровня ферментов печени > в 5 раз, кроме ГГТП, необходимо временно прекратить прием митотана** и провести соответствующее симптоматическое лечение. Возобновление приема митотана** в редуцированной дозе (50 - 75% от последней дозы) возможно после купирования побочных эффектов под строгим контролем состояния пациента.
На фоне приема митотана** возможно развитие клинической картины гипотиреоза, как правило центрального генеза (в связи с чем повышение ТТГ не обязательный симптом) в связи с чем необходимо регулярное определение ТТГ, Т4 св. и проведение заместительной терапии левотироксином натрия** по показаниям (224).
Оценка уровней тестостерона и ГСПГ в динамике, а также при развитии клинической картины гипогонадизма, является оправданной у мужчин, получающих терапию митотаном**. В случае симптоматики гипогонадизма в сочетании со снижением тестостерона необходимо рассмотреть вопрос заместительной терапии.
Яичниковый стероидогенез, как и женская репродуктивная функция, в целом, менее подвержены влиянию митотана**. Однако у женщин репродуктивного возраста, получающих митотан**, могут наблюдаться множественные кисты яичников.
Гиперхолестеринемия и/или дислипидемия являются частыми нежелательными явлениями терапии митотаном**. Гиполипидемическая терапия с ипользованием статинов (C10AA) НЕ метаболизируемых CYP3A4 (правастатин, розувастатин и другие не метоболизирующиеся через CYP3A4 препараты), показана пациентам, получающим митотан**, с учетом прогноза, кардиоваскулярных рисков и т.п. (при индексе атерогенности выше 3,5).
Рекомендации по заместительной терапии см. также в Приложении А3.
5.3 Прогноз
- 5.3.1 Для оценки прогноза и определения оптимального лечебного алгоритма на момент постановки диагноза рекомендуется учитывать следующие факторы: стадия заболевания, резекционный статус, индекс Ki-67, автономная секреция кортизола и общее состояние пациента [136 - 143].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Прогноз АКР, в основном, зависит от стадии заболевания по ENSAT, так как она отражает распространенность опухолевого процесса: 5-летняя выживаемость при I стадии составляет 70 - 80%, при II стадии - 60 - 70%, при III - 20 - 40%, при IV - 0 - 10% соответственно. Общая, неранжированная по стадиям, пятилетняя выживаемость колеблется от 16 до 38%. Медиана общей выживаемости при IV стадии - менее 12 месяцев. [144 - 146].
По результатам ряда исследований [136 - 141], резекционный статус и пролиферативный индекс Ki-67 были отнесены к важным прогностическим факторам. При распространенных формах заболевания (более 40% пациентов на момент первичной диагностики) значительное отрицательное влияние на сроки выживания оказывает синдром гиперкортицизма. Наконец, общее состояние пациента является очевидным прогностическим фактором, особенно в пожилом возрасте [141].
В 2015 г. группой ENSAT проведен ретроспективный анализ прогностической значимости индекса Ki-67 при АКР [142]. Отдельно анализировали немецкую группу от остальной как более гомогенную. Критические значения индекса Ki-67 были приняты от 5 до 10%, 10 - 20% и более 20%. Как общая, так и безрецидивная выживаемость достоверно отличались как в германской, так и в общей группе при проведении однофакторного и многофакторного анализа. В этом исследовании другими достоверными прогностическими факторами оказались размер опухоли и инвазия венозных структур. На основании чего были сформированы группы риска: с индексом Ki67 больше 10% и больше 20%, наличие венозной инвазии или размер опухоли 15 - 20 см приравнялись к третьей группе риска.
Международное исследование индекса Ki-67 в 101 случае АКР с помощью традиционного метода подсчета, в том числе - пересмотр несколькими специалистами, а также с применением метода цифрового анализа изображений, показало, что имеется разброс результатов, и они зависят от метода. Авторы пришли к выводу, что при подсчете индекса Ki-67 с применением цифрового анализа изображений, группы пациентов со значением индекса как 0 - 10 - 20%, так и 0 - 15 - 30% достоверно отличались по прогнозу, когда анализировали общую выживаемость [143].
При распространенном АКР (IV стадия по ENSAT, определяемая по наличию отдаленных метастазов, и/или рецидив заболевания, не подлежащий хирургическому лечению в объеме R0, и/или R2-резекционный статус) основными прогностическими факторами, связанными с худшим прогнозом, являются распространенность опухоли, высокий пролиферативный индекс Ki-67 и плохо контролируемая опухолевая симптоматика.
В исследовании СOG в период с 2006 года 2013 года было включено 78 детей и подростков с АКР. При анализе данных было показано, что 5-летняя бессобытийная выживаемость у пациентов с I (n = 24), II (n = 15), III (n = 24) и IV (n = 14) стадии по COG составили 86,2%, 53,3%, 81% и 7,1%, соответственно; в то время когда 5-летняя общая выживаемость составила 95,2% при I стадии по COG, 78,8% II стадии по COG, 94,7% III стадии по COG и 15,6% при IV стадии по COG, соответственно. При однофакторном анализе было показано, что старший возраст, распространенная стадия, наличие вирилизации, синдром гиперкортицизма, артериальная гипертензия, мутация в гене TP53, наличие соматической мутации ATRX были связаны с худшими показателями выживаемости [231].
- 5.3.2 В ходе динамического наблюдения рекомендуется пересматривать прогноз при каждом контрольном визите для определения оптимальной тактики лечения. [1, 8, 9]
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
После проведения радикального хирургического лечения главным прогностическим фактором является факт рецидива опухоли. В случае его возникновения прогностическую роль играют время до прогрессирования, распространенность опухолевого процесса и резектабельность.
При метастатическом АКР, спектр прогностических факторов включает пролиферативный индекс Ki-67, распространенность опухолевого процесса, общее состояние пациента, динамику прогрессирования, ответ на лечение.
Важно отметить, что оценка этих факторов в совокупности позволяет сделать лишь предварительные выводы; прогностические многофакторные системы до настоящего времени не разработаны.
5.4 АКР и беременность
- 5.4.1 При выявлении опухоли с высоким злокачественным потенциалом во время беременности, рекомендуется проведение хирургического лечения в кратчайшие сроки, вне зависимости от триместра беременности [147, 148].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Учитывая важность быстрого и радикального хирургического лечения для дальнейшего прогноза при АКР, оперативное лечение необходимо провести в кратчайшие сроки от постановки диагноза и независимо от срока беременности. При этом преждевременные роды (особенно в третьем триместре) и потеря беременности являются очевидными хирургическими рисками. Очевидно, что решение об оптимальной тактике лечения беременной пациентки с высоковероятным диагнозом АКР должно быть коллегиальным, с участием мультидисциплинарной команды. Оно должно учитывать прогноз заболевания и риск для матери и плода в связи с основным заболеванием и интервенционными процедурами. Пациентка должна быть информирована о возможных рисках и преимуществах хирургического лечения во время беременности и должна принять участие в информированном обсуждении.
На сегодняшний день нет убедительных данных относительно безопасности и оптимальных сроков наступления беременности при АКР. Важно отметить, что основной проблемой является в целом неблагоприятный прогноз при АКР, а также вероятность того, что беременность может увеличить риск рецидива. Имеются ограниченные данные о том, что АКР, выявленный во время беременности или в послеродовом периоде, имеет худший прогноз, чем у небеременных женщин [149]. Была выдвинута гипотеза о том, что беременность может способствовать развитию более агрессивного варианта АКР. В то же время Pauline de Corbi re и соавт. [147, 148, 150 - 153] не выявили негативного влияния беременности на клиническое течение и прогноз АКР у пациенток, предварительно получивших надлежащее лечение АКР. Ограничениями исследования являются малый объем выборки (17 пациенток, 21 беременность) и ретроспективный дизайн, не позволяющий обеспечить достаточную достоверность.
В связи с крайним дефицитом доказательной базы по проблеме беременности и АКР необходимо информировать пациенток о значительном риске рецидива АКР болезни в первые годы после постановки диагноза, а также о возможном прогрессировании АКР на фоне беременности.
- 5.4.2 Наступление беременности на фоне терапии митотаном**не рекомендуется [9, 225].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 4.
Комментарий. Проблема применения митотана** во время беременности связана с потенциальными тератогенными эффектами, которые могут быть обусловлены его проникновением через плаценту и адренолитическим эффектом на плод. На сегодняшний день опубликованы единичные сообщения о случаях беременности при приеме митотана**. Фактическое отсутствие доказательной базы не позволяет сделать окончательные выводы о безопасности лечения митотаном** во время беременности или связанных с ним рисках. Пациентка, получающая митотан**, должна быть проинформирована об этих рисках и обеспечить эффективную контрацепцию.
Рассмотрение вопроса о планировании беременности возможно только после прекращения терапии митотаном** и снижения его концентрации в крови до неопределяемых значений (это может занять 3 - 12 месяцев).
В случае наступления беременности во время терапии митотаном** пациентка должна быть информирована о возможных рисках для плода, связанных с приемом митотана**, и возможных рисках прогрессирования АКР на фоне отмены митотана**. В случае, если пациентка желает сохранить беременность, лечение митотаном** следует прекратить [9].
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 C81 - C96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее - федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики C37, C38, C40 - C41, C45 - C49, C58, D39, C62, C69 - C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней - онкология (МКБ-О), 3 издания 8936, 906 - 909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка - национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее - онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Факторы, влияющие на течение и исход АКР, включают следующие:
1. Распространенность опухолевого процесса;
2. Локализация метастатических очагов;
3. Биологические особенности опухоли;
4. Развитие нежелательных явлений при приеме препаратов для противоопухолевой терапии.
Критерии оценки качества медицинской помощи
Таблица 16. Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Выполнено КТ с контрастным усилением органов брюшной полости, определены плотность тканевого компонента до контрастирования (нативная), плотность в тканевую фазу контрастирования (артериальная и венозная фазы), плотность в отсроченную (через 10 мин. после введения контрастного средства фазу контрастирования (фаза вымывания, у взрослых пациентов) [A06.30.005.003].
Да/Нет
2.
Выполнено 18ФДГ-ПЭТ/КТ у взрослых пациентов и детского возраста как один из параметров клинической верификации злокачественного потенциала опухоли/метастатического распространения опухоли, определен SUV
Да/Нет
3.
Выполнена сцинтиграфия костей всего тела при подозрении на метастатическое поражение костей скелета у взрослых пациентов
Да/Нет
4.
В случае невозможности проведения КТ с контрастным усилением выполнено МРТ органов брюшной полости и забрюшинного пространства
Да/Нет
5.
Выполнено определение кортизола в ранние утренние часы на фоне подавляющего теста с 1 мг #дексаметазона**. При отсутствии физиологического подавления уровня кортизола в качестве подтверждающего теста выполнено определение АКТГ в утренние часы.
Да/Нет
6.
Выполнено определение уровней метанефрина и норметанефрина в суточной моче (A09.28.034.001, A09.28.034.002) или плазме (A09.05.133.001, A09.05.133.002) у взрослых пациентов.
Да/Нет
7.
Выполнено определение соотношения между уровнем альдостерона и активностью ренина плазмы для исключения первичного гиперальдостеронизма при наличии у взрослого пациента с опухолью надпочечника артериальной гипертензии.
Да/Нет
8.
При наличии клинических проявлений выполнено комплексное определение концентрации стероидных гормонов/определение стероидных гормонов сыворотки крови: дегидроэпиандростерона сульфатадегидроэпиандростерон-сульфат ((A09.05.149), 17-гидроксипрогестерона (A09.05.139), андростендиона (A09.05.146), общего тестостерона (у женщин) [A09.05.078], общего эстрадиола 17-![]() -эстрадиол (у мужчин и женщин в менопаузе) [A09.05.154], 11-дезоксикортикостерона дезоксикортизол (A09.05.141) при наличии клинических показаний
-эстрадиол (у мужчин и женщин в менопаузе) [A09.05.154], 11-дезоксикортикостерона дезоксикортизол (A09.05.141) при наличии клинических показаний
Да/Нет
9.
Проведено стадирование опухолевого процесса по TNM и ENSAT у взрослых; по TNM и COG у детей.
Да/Нет
10.
Выбран и выполнен оптимальный объем оперативного вмешательства
Да/Нет
11.
При наличии АКР и гиперкортицизма в послеоперационном периоде проведена заместительная терапия надпочечниковой недостаточности
Да/Нет
12.
Выполнено патолого-анатомическое исследование биопсийного (операционного), включая иммуногистохимическое исследование (A08.22.002.002). Протокол содержит, как минимум, следующую информацию: количество баллов по шкале Weiss или иной шкале балльной оценки злокачественного потенциала опухоли, определена экспрессия SF-1, хромогранина A, пролиферативный индекс Ki-67, резекционный статус (инвазия капсулы опухоли, и/или окружающих тканей, и/или прилежащих органов или ее отсутствие), наличие или отсутствие поражения лимфатических узлов
Да/Нет
13.
Взрослым пациентам с верифицированным патоморфологически диагнозом АКР проводится терапия митотаном** в адъювантном режиме при наличии клинических показаний (уровень Ki-67 > 10% или Т3-4 или N 1)
Да/Нет
14.
Пациентам от 0 - 18 лет с АКР III - IV cтадии по COG проводится терапия #митотаном** в сочетании с химиотерапии по схеме #этопозид** + #доксорубицин** + #цисплатин**
Да/Нет
15.
Пациентам с неоперабельным АКР, наличием распространенного метастатического процесса после резекции первичной опухоли, быстрым прогрессированием заболевания проводится химиотерапия на фоне продолжающегося приема митотана** ежедневно в дозе, обеспечивающей его содержание в сыворотке крови на уровне 14 - 20 мкг/мл без перерыва между циклами химиотерапии
Да/Нет
16.
Всем пациентам, получающим терапию митотаном**, проводится заместительная терапия надпочечниковой недостаточности. В случае гиперкортицизма необходимость проведения заместительной терапии должна обсуждаться индивидуально.
Да/Нет
17.
Взрослым пациентам с костными местастазами АКР проводится антирезорбтивная терапия и/или ДЛТ (Дистанционная лучевая терапия при поражении костей)
Да/Нет
18.
С пациентками репродуктивного возраста проведена разъяснительная беседа о необходимости использования контрацепции на фоне противоопухолевой терапии
Да/Нет
19.
Пациенткам репродуктивного возраста, получающим терапию митотаном** и/или цитотоксическую химиотерапию рекомендованы оптимальные методы контрацепции
Да/Нет
20.
Всем пациентам с АКР после радикального хирургического лечения проводится регулярное обследование, включающее (1) визуализирующие исследования органов брюшной полости, малого таза, грудной клетки, для пациентов с метастатической/неоперабельной формой АКР по мимо визуализирующих исследований показан регулярный контроль (2) лабораторных исследований гормональной опухолевой секреции
Да/Нет
21.
Всем пациентам, получающим терапию митотаном**, проводится регулярное определение его концентрации в крови с коррекцией суточной дозы по показаниям.
Да/Нет
22.
Всем пациентам, получающим терапию митотаном**, проводится регулярное обследование на предмет нежелательных явлений, и своевременное их лечение
Да/Нет
23.
Всем пациентам с АКР на основании результатов динамического наблюдения и обследования проводится необходимая коррекция лечения и плана дальнейшего ведения
Да/Нет
Список литературы
1. Мельниченко Г.А., Стилиди И.С., Алексеев Б.Я., Горбунова В.А., Бельцевич Д.Г., Райхман А.О., Кузнецов Н.С., Жуков Н.В., Бохян В.Ю. Федеральные клинические рекомендации по диагностике и лечению адренокортикального рака. Проблемы эндокринологии. 2014; 60(2): 51 - 67. doi: 10.14341/probl201460251-67
2. Lloyd RV, Osamura RY, Kl ppel G, Rosai J, eds. WHO Classification of Tumours of Endocrine Organs. Fourth Edition. Lyon: IARC; 2022
3. Селиванова Л.С., Рослякова А.А., Боголюбова А.В., Тертычный А.С., Бельцевич Д.Г., Абросимов А.Ю., Мельниченко Г.А. Молекулярно-генетические маркеры и критерии прогноза адренокортикального рака. Архив патологии. 2019; 81(5): 92 - 96. doi: 10.17116/patol20198105192
4. Schteingart DE, Doherty GM, Gauger PG, et al. Management of patients with adrenal cancer: recommendations of an international consensus conference. Endocr Relat Cancer. 2005;12:667. doi: 10.1677/erc.1.01029
5. Министерство здравоохранения Российской Федерации. Перечень редких (орфанных) заболеваний. https://www.rosminzdrav.ru/documents/8048 [ссылка активна на 27.10.2019]
6. Bisceglia M. et al. Adrenocortical oncocytic tumors: Report of 10 cases and review of the literature//Int. J. Surg. Pathol. 2004. Vol. 12, N 3. P. 231 - 243.
7. Adrenal Cortical Carcinoma. In: Brierley JD, Gospodarowicz MK, Wittekind C (eds). TNM Classification of Malignant Tumours (8th edition). Oxford, UK: Wiley-Blackwell, 2017
8. Fassnacht M, Dekkers O, Else T, Baudin E, Berruti A, de Krijger RR, Haak HR, Mihai R, Assie G, Terzolo M. European Society of Endocrinology Clinical Practice Guidelines on the Management of Adrenocortical Carcinoma in Adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. EJE. 2018; 179(4): G1 - G46. doi: 10.1530/EJE-18-0608.
9. Fassnacht M, Allolio B. Clinical management of adrenocortical carcinoma. Best Pract Res ClinEndocrinolMetab. 2009; 23(2): 273-89. doi: 10.1016/j.beem.2008.10.008
10. Chuang B, Fassnacht M. Adrenocortical carcinoma: clinical update. J ClinEndocrinolMetab. 2006; 91(6): 2027-37. doi: 10.1210/jc.2005-2639
11. Terzolo M, Ali A, Osella G, Mazza E. Prevalence of adrenal carcinoma among incidentally discovered adrenal masses. A retrospective study from 1989 to 1994. Gruppo Piemontese Incidentalomi Surrenalici. Arch Surg. 1997; 132(2): 914 - 919. doi: 10.1001/archsurg.1997.01430320116020
12. Cawood TJ, Hunt PJ, O'Shea D, Cole D, Soule S. Recommended evaluation of adrenal incidentalomas is costly, has high false-positive rates and confers a risk of fatal cancer that is similar to the risk of the adrenal lesion becoming malignant; time for a rethink? Eur J Endocrinol. 2009; 161(4): 513-27. doi: 10.1530/EJE-09-0234.
13. Fassnacht M, Arlt W, Bancos I, Dralle H, Newell-Price J, Sahdev A, Tabarin A, Terzolo M, Tsagarakis S, Dekkers OM. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2016; 175(2): G1 - G34. doi: 10.1530/EJE-16-0467.
14. Селиванова Л.С., Рослякова А.А., Коваленко Ю.А., Боголюбова А.В., Тертычный А.С., Бельцевич Д.Г., Абросимов А.Ю., Мельниченко Г.А. Современные критерии диагностики адренокортикального рака. Архив патологии. 2019; 81(3): 66 - 73. https://doi.org/10.17116/patol20198103166
15. Бельцевич Д.Г., Кузнецов Н.С., Солдатова Т.В., Ванушко В.Э. Инциденталома надпочечников. Эндокринная хирургия. 2009; 3(1): 19 - 23.
16. Young WFJr. The Incidentally Discovered Adrenal Mass. N Engl J Med. 2007; 356: 601-10. doi: 10.1056/NEJMcp065470
17. Bovio S, Cataldi A, Reimondo G, et al. Prevalence of adrenal incidentaloma in a contemporary computerized tomography series. J Endocrinol Invest. 2006; 29(4): 298 - 302. doi: 10.1007/BF03344099
18. Nieman LK, Biller BMK, Findling JW et al. The diagnosis of Cushing's syndrome: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2008; 93(5): 1526-40. doi: 10.1210/jc.2008-0125.
19. Terzolo M, Reimondo G, Bovio S, Angeli A Subclinical Cushing's syndrome. Pituitary. 2004; 7(4): 217 - 223. doi: 10.1007/s11102-005-4024-6
20. Kirkby-Bott J, Brunaud L, Mathonet M, Hamoir E, Kraimps JL, Tr sallet C, Amar L, Rault A, Henry JF, Carnaille B. Ectopic hormone-secreting pheochromocytoma: a francophone observational study. World J Surg. 2012; 36(6): 1382-8. doi: 10.1007/s00268-012-1488-1.
21. Li XG, Zhang DX, Li X, Cui XG, Xu DF, Li Y, Gao Y, Yin L, Ren JZ Adrenocorticotropic hormone-producing pheochromocytoma: a case report and review of the literature. Chin Med J (Engl). 2012; 125(6): 1193 - 1196. doi: 10.3760/cma.j.issn.0366-6999.2012.06.042
22. Cohade C, Broussaud S, Louiset E, Bennet A, Huyghe E, Caron P. Ectopic Cushing's syndrome due to a pheochromocytoma: a new case in the post-partum and review of literature. Gynecol Endocrinol. 2009; 25(9): 624 - 627. doi: 10.1080/09513590903015411
23. Tsagarakis S, Vassiliadi D, Thalassinos N. Endogenous subclinical hypercortisolism: diagnostic uncertainties and clinical implications. J Endocrinol Invest. 2006; 29(5): 471-82. doi: 10.1007/BF03344133
24. Newell-Price J, Trainer P, Besser M, Grossman A. The diagnosis and differential diagnosis of Cushing's syndrome and pseudo-Cushing's states. Endocr Rev. 1998; 19(5): 647 - 672. doi: 10.1210/edrv.19.5.0346
25. Pecori Giraldi F, Ambrogio AG, De Martin M, et al. Specificity of first-line tests for the diagnosis of Cushing's syndrome: assessment in a large series. J Clin Endocrinol Metab. 2007; 92(11): 4123-9. doi: 10.1210/jc.2007-0596
26. Mitchell IC, Auchus RJ, Juneja K, et al. "Subclinical Cushing's syndrome" is not subclinical: improvement after adrenalectomy in 9 patients. Surgery 2007; 142(6): 900 - 905. doi: 10.1016/j.surg.2007.10.001
27. Reincke M. Subclinical Cushing's syndrome. Endocrinol Metab Clin North Am. 2000; 29(1): 43 - 56. doi: 10.1016/S0889-8529(05) 70115-8
28. Barzon L, Fallo F, Sonino N, Boscaro M. Development of overt Cushing's syndrome in patients with adrenal incidentaloma. Eur J Endocrinol. 2002; 146(1): 61 - 66. doi: 0.1530/eje.0.1460061
29. Pacak K. Preoperative management of the pheochromocytoma patient. J Clin Endocrinol Metab 2007; 92: 4069 - 4079. doi: 10.1210/jc.2007-1720
30. Williams DT, Dann S, Wheeler MH. Phaeochromocytoma - views on current management. Eur J Surg Oncol. 2003; 29(6): 483 - 490
31. Kinney M, Narr BJ, Warner MA. Perioperative management of pheochromocytoma. J Cardiothorac Vasc Anesth. 2002; 16: 359 - 369. doi: 10.1053/jcan.2002.124150
32. An Endocrine Society Clinical Practice Guidelines. Case Detection, Diagnosis, and Treatment of Patients with Primary Aldosteronism. J Clin Endocrinol Metab. 2008; 93(9): 3266 - 3281.
33. Мельниченко Г.А., Платонова Н.М., Бельцевич Д.Г. и др. Первичный гиперальдостеронизм: диагностика и лечение. Новый взгляд на проблему. По материалам Проекта клинических рекомендаций Российской ассоциации эндокринологов по диагностике и лечению первичного гиперальдостеронизма. Consilium Medicum. 2017; 19(4): 75 - 85.
34. Дедов И.И., Бельцевич Д.Г., Кузнецов Н.С., Мельниченко Г.А. Феохромоцитома. Москва: Практ. медицина; 2005; 47 - 70.
35. Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, Pasquali R & Welt CK. Diagnosis and 2279 treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin 2280 Endocrinol Metab 2013 98 4565 - 4592.
36. Allolio B, Hahner S, Weismann D, Fassnacht M. Management of adrenocortical carcinoma. Clin Endocrinol (Oxf). 2004; 60: 273 - 287. 19: 540 - 544.
37. Metser U, Miller E, Lerman H et al. 18F-FDG PET/CT in the Evaluation of Adrenal Masses. J Nucl Med. 2006; 47(1): 32 - 37.
38. M. Blake, P. Prakash, C. Cronin. PET/CT for Adrenal Assessment Am J Roentgenology. 2010; 195(2): 195.
39. Mackie GC, Shulkin BL, Ribeiro RC, et al. Use of [18F] fluorodeoxyglucose positron emission tomography in evaluating locally recurrent and metastatic adrenocortical carcinoma. J Clin Endocrinol Metab. 2006; 91: 2665.
40. Leboulleux S, Dromain C, Bonniaud G et al. Diagnostic and prognostic value of 18-fluorodeoxyglucose positron emission tomography in adrenocortical carcinoma: a prospective comparison with computed tomography. J Clin Endocrinol Metab. 2006; 91: 920.
41. Angeli A, Osella G, Ali A, Terzolo M. Adrenal incidentaloma: an overview of clinical and epidemiological data from the National Italian Study Group. Horm Res. 1997; 47: 279 - 283.
42. Sasano, H. Recent advances in histopathology and immunohistochemistry of adrenocortical carcinoma/H. Sasano, T. Suzuki, T. Moriya//Endocr. Pathol. - 2006. - Vol. 17, N 4. - P. 345 - 354.
43. Deandreis D, Leboulleux S, Caramella C, et al. FDG PET in the management of patients with adrenal masses and adrenocortical carcinoma. Horm Cancer. 2011; 2: 354.
44. Giordano T.J. et al. Data set for reporting of carcinoma of the adrenal cortex: explanations and recommendations of the guidelines from the International Collaboration on Cancer Reporting//Hum. Pathol. Elsevier Inc., 2021. Vol. 110. P. 50 - 61.
45. Макроскопическое исследование биопсийного и операционного материала. Руководство для врачей-патологоанатомов/под ред. Ю.А. Криволапова. - М.: Практическая медицина, 2020. - 352 с.: ил.
46. Weiss L.M. Comparative histologic study of 43 metastasizing and nonmetastasizing adrenocortical tumors//American Journal of Surgical Pathology. 1984. Vol. 8, N 3. P. 163 - 169.
47. Pennanen M. et al. Helsinki score - A novel model for prediction of metastases in adrenocortical carcinomas//Hum. Pathol. Elsevier Inc., 2015. Vol. 46, N 3. P. 404 - 410.
48. Aubert S. et al. Weiss system revisited: A clinicopathologic and immunohistochemical study of 49 adrenocortical tumors//Am. J. Surg. Pathol. 2002. Vol. 26, N 12. P. 1612 - 1619.
49. Бохян В.Ю., Павловская А.И., Губина Г.И., Стилиди И.С. Клиническая оценка гистологических систем диагностики адренокортикальных опухолей. Архив патологии, 2015; 77(3): 17 - 22.
50. Бохян В.Ю., Стилиди И.С., Павловская А.И. Сравнительный клинический анализ гистологических систем диагностики адренокортикальных опухолей. Вопросы онкологии, 2015; 61(6): 925 - 931.
51. Ткачук А.В. и др. Адренокортикальный рак: морфологические варианты, иммуногистохимическая характеристика//Архив патологии. 2021. Т. 83, N 3. Стр. 10 - 18.
52. Dehner L.P. et al. Adrenal Cortical Neoplasms in Children: Why So Many Carcinomas and Yet So Many Survivors?//Pediatric and Developmental Pathology. 2009. N 12. P. 284-91.
53. Wieneke J.A. et al. Adrenal cortical neoplasms in the pediatric population: A clinicopathologic and immunophenotype analysis of 83 patients//Am J Surg Pathol. 2003. N 27. P. 867 - 881.
54. Mete O. et al. Diagnostic and prognostic biomarkers of adrenal cortical carcinoma//Am. J. Surg. Pathol. 2018. Vol. 42, N 2. P. 201 - 213.
55. Martins-Filho S.N. et al. Clinical Impact of Pathological Features Including the Ki-67 Labeling Index on Diagnosis and Prognosis of Adult and Pediatric Adrenocortical Tumors//Endocr. Pathol. Springer US, 2021. Vol. 32, N 2. P. 288 - 300.
56. Duregon E. et al. Comparative diagnostic and prognostic performances of the hematoxylin-eosin and phospho-histone H3 mitotic count and Ki-67 index in adrenocortical carcinoma//Mod. Pathol. Nature Publishing Group, 2014. Vol. 27, N 9. P. 1246 - 1254.
57. Beuschlein F. et al. Major prognostic role of Ki67 in localized adrenocortical carcinoma after complete resection//J. Clin. Endocrinol. Metab. 2015. Vol. 100, N 3. P. 841 - 849.
58. Mete O. et al. Immunohistochemical Biomarkers of Adrenal Cortical Neoplasms//Endocr. Pathol. Endocrine Pathology, 2018. Vol. 29, N 2. P. 137 - 149.
59. Juhlin C.C. et al. What Did We Learn from the Molecular Biology of Adrenal Cortical Neoplasia? From Histopathology to Translational Genomics//Endocrine Pathology. Springer US, 2021. Vol. 32, N 1. P. 102 - 133.
60. Селиванова Л.С. и др. Молекулярно-генетические маркеры и критерии прогноза адренокортикального рака//Архив патологии. 2019. Т. 81, N 5. Стр. 92 - 96.
61. Picard C. et al. Revisiting the role of the pathological grading in pediatric adrenal cortical tumors: results from a national cohort study with pathological review//Mod. Pathol. Springer US, 2019. Vol. 32, N 4. P. 546 - 559.
62. Dom nech M. et al. Characteristics of Adrenocortical Carcinoma Associated With Lynch Syndrome//J Clin Endocrinol Metab. 2021. Vol. 106 N 2. P. 318 - 325.
63. Volante M. et al. Ribonucleotide reductase large subunit (RRM1) gene expression may predict efficacy of adjuvant mitotane in adrenocortical cancer//Clin. Cancer Res. 2012. Vol. 18, N 12. P. 3452 - 3461.
64. Ronchi C.L. et al. CYP2W1 is highly expressed in adrenal glands and is positively associated with the response to mitotane in adrenocortical carcinoma//PLoS One. 2014. Vol. 9, N 8.
65. Adrenal Cortical Carcinoma. In: Brierley JD, Gospodarowicz MK, Wittekind C (eds). TNM Classification of Malignant Tumours (8th edition). Oxford, UK: Wiley-Blackwell, 2017.
66. Else T. Association of Adrenocortical Carcinoma with Familial Cancer Susceptibility Syndromes. Mol Cell Endocrinol. 2012; 351(1): 66 - 70. doi: 10.1016/j.mce.2011.12.008
67. Стилиди И.С., Бохян В.Ю., Карманов И.Е., Перегородиев И.Н., Абгарян М.Г. Поражение нижней полой вены при адренокортикальном раке: результаты хирургического лечения. Анналы хирургии. 2016; 21 (4): 248 - 256.
68. Dackiw AP, Lee JE, Gagel RF, Evans DB. Adrenal cortical carcinoma. World J Surg. 2001; 25: 914 - 926
69. Reibetanz J, Jurowich C, Erdogan I et al. Impact of lymphadenectomy on the oncologic outcome of patients with adrenocortical carcinoma. Ann Surg. 2012; 255: 363
70. Gaujoux S, Brennan MF. Recommendation for standardized surgical management of primary adrenocortical carcinoma. Surgery. 2012 152(1): 123-32
71. Icard P, Chapuis Y, Andreassian B, et al. Adrenocortical carcinoma in surgically treated patients: a retrospective study on 156 cases by the French Association of Endocrine Surgery. Surgery. 1992; 112(6): 972 - 979.
72. Icard P, Chapuis Y, Andreassian B, et al. Adrenocortical carcinoma in surgically treated patients: a retrospective study on 156 cases by the French Association of Endocrine Surgery. Surgery. 1992; 112(6): 972 - 979.
73. Филиппова ОВ. Адренокортикальный рак: клинические проявления и морфологическая диагностика/Филиппова О.В., Хмельницкая Н.М.//Медицинский альманах. 2011; 5: 113 - 116.
74. W ngberg B, Khorram-Manesh A, Jansson S, et al. The long-term survival in adrenocortical carcinoma with active surgical management and use of monitored mitotane. Endocr Relat Cancer. 2010; 17: 265.
75. Филимонюк А.В., Харченко Н.В., Леонов Б.И., Смирнова Е.А., Антонов А.К., Смелкова Н.И. Непосредственные и отдаленные результаты хирургического лечения больных адренокортикальным раком. Вестник новых медицинских технологий (электронное издание). 2013; 1 [Электронный ресурс].
76. Casola G, Nicolet V, van Sonnenberg E et al. Unsuspected pheochromocytoma: risk of blood-pressure alterations during percutaneous adrenal biopsy. Radiology. 1986; 159: 733 - 735.
77. Leboulleux S, Deandreis D, Ghuzlan A Al et al. Adrenocortical carcinoma: is the surgical approach a risk factor of peritoneal carcinomatosis? Eur J Endocrinol. 2010; 162: 1147 - 1153
78. Brix D, Allolio B, Fenske W et al. Laparoscopic versus open adrenalectomy for adrenocortical carcinoma: surgical and oncologic outcome in 152 patients. Eur Urol. 2010; 58: 609.
79. Miller BS, Gauger PG, Hammer GD et al. Proposal for modification of the ENSAT staging system for adrenocortical carcinoma using tumor grade. Langenbecks Arch Surg. 2010; 395: 955/
80. Schulick RD, Brennan MF. Long-term survival after complete resection and repeat resection in patients with adrenocortical carcinoma. Ann Surg Oncol. 1999; 6(8): 719 - 726
81. Bellantone R, Ferrante A, Boscherini M, et al.: Role of reoperation in recurrence of adrenal cortical carcinoma: results from 188 cases collected in the Italian National Registry for Adrenal Cortical Carcinoma. Surgery. 1997, 122: 1212 - 1218.
82. Porpiglia F, Fiori C, Scarpa RM et al. The role of surgery in the management of recurrent adrenocortical carcinoma: results of a retrospective study. Eur Urol Suppl. 2009; 8(4): 305.
83. Terzolo, M. Adjuvant mitotane treatment for adrenocortical carcinoma/M. Terzolo Angeli A, Fassnacht M et al.//N. Engl. J. Med. - 2007. - Vol. 356, N 23. - P. 2372 - 2380.
84. Huang H, FojoT. Adjuvant mitotane for adrenocortical cancer - a recurring controversy. Journal of Clinical Endocrinology and Metabolism. 2008; 93(10): 3730 - 3732. doi: 10.1210/jc.2008-0579.
85. Terzolo M, Fassnacht M, Ciccone G, Allolio B, Berruti A. Adjuvant Mitotane for Adrenocortical Cancer-Working through Uncertainty. The Journal of Clinical Endocrinology & Metabolism. 2009; 94(6): 1879 - 1880. doi: 10.1210/jc.2009-0120.
86. Berruti A, Grisanti S, Pulzer A, et al. Long-term outcomes of adjuvant mitotane therapy in patients with radically resected adrenocortical carcinoma. Journal of Clinical Endocrinology and Metabolism. 2017; 102: 1358 - 1365. doi: 10.1210/jc.2016-2894.
87. Terzolo M, Fassnacht M, Perotti P. et al. Results of the ADIUVO Study, the First Randomized Trial on Adjuvant Mitotane in Adrenocortical Carcinoma Patients. J Endocr Soc. 2021 May 3; 5(Suppl 1):A166-7. doi: 10.1210/jendso/bvab048.336. PMCID: PMC8265733.
88. Hague RV, May W, Cullen DR. Hepatic microsomal enzyme induction and adrenal crisis due to o,p_DDD therapy for metastatic adrenocortical carcinoma. Clin Endocrinol (Oxf). 1989; 31: 51 - 57.
89. Basile V, Puglisi S, Altieri B. et al. What Is the Optimal Duration of Adjuvant Mitotane Therapy in Adrenocortical Carcinoma? An Unanswered Question. J Pers Med. 2021 Apr 4; 11(4): 269. doi: 10.3390/jpm11040269. PMID: 33916613; PMCID: PMC8066814.
90. Calabrese A, Basile V, Puglisi S et al. Adjuvant mitotane therapy is beneficial in non-metastatic adrenocortical carcinoma at high risk of recurrence. Eur J Endocrinol. 2019 Jun 1; 180(6): 387 - 396. doi: 10.1530/EJE-18-0923. PMID: 30991359.
91. Decker RA, Kuehner ME. Adrenocortical carcinoma. Am Surg. 1991; 57: 502 - 513.
92. Brix D, Allolio B, Fenske W et al. Laparoscopic versus open adrenalectomy for adrenocortical carcinoma: surgical and oncologic outcome in 152 patients. Eur Urol. 2010; 58: 609.
93. Hahner S, Fassnacht M. Mitotane for adrenocortical carcinoma treatment. Curr Opin Investig Drugs. 2005; 6: 386 - 394.
94. Schteingart DE. Conventional and novel strategies in the treatment of adrenocortical cancer. Braz J Med Biol Res. 2000; 33: 1197 - 1200.
95. Krzisnik C, Petric G, Jereb B. Complete response of metastatic adrenal cortical carcinoma to o,p -DDD in a child. Pediatr Hematol Oncol. 1988; 5: 65 - 69.
96. Terzolo M, Daffara F, Ardito A, Zaggia B, Basile V, Ferrari L, Berruti A. Management of adrenal cancer: a 2013 update. Endocrinol Invest. 2014; 37(3): 207-17. doi: 10.1007/s40618-013-0049.
97. Huang H, FojoT. Adjuvant mitotane for adrenocortical cancer - a recurring controversy. Journal of Clinical Endocrinology and Metabolism. 2008; 93(10): 3730 - 3732. doi: 10.1210/jc.2008-0579.
98. Fassnacht M, Dekkers O, Else T. et al. European Society of Endocrinology Clinical Practice Guidelines on the Management of Adrenocortical Carcinoma in Adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. EJE. 2018; 179(4): G1 - G46. doi: 10.1530/EJE18-0608.
99. Haak HR, Hermans J, van de Velde CJ et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in a consecutive series of 96 patients. Br J Cancer. 1994; 69: 947 - 951.
100. Baudin E, Pellegriti G, Bonnay M et al. Impact of monitoring plasma 1,1-dichlorodiphenildichloroethane (o,p_DDD) levels on the treatment of patients with adrenocortical carcinoma. Cancer. 2001; 92: 1385 - 1392.
101. Poirier J, Gagnon N, Terzolo M et al. Recovery of Adrenal Insufficiency Is Frequent After Adjuvant Mitotane Therapy in Patients with Adrenocortical Carcinoma. Cancers (Basel). 2020 Mar 10; 12(3): 639. doi: 10.3390/cancers12030639. PMID: 32164326; PMCID: PMC7139486.
102. Fassnacht M, Arlt W, Bancos I et al. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2016; 175(2): G1 - G34. doi: 10.1530/EJE-16-0467.
103. Fassnacht M, Dekkers OM, Else T et al. European Society of Endocrinology Clinical Practice Guidelines on the management of adrenocortical carcinoma in adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2018 Oct 1; 179(4): G1 - G46. doi: 10.1530/EJE-18-0608. PMID: 30299884.
104. Kimpel O, Bedrose S, Megerle F et al. Adjuvant platinum-based chemotherapy in radically resected adrenocortical carcinoma: a cohort study. Br J Cancer. 2021 Oct; 125(9): 1233 - 1238. doi: 10.1038/s41416-021-01513-8. Epub 2021 Aug 16. PMID: 34400803; PMCID: PMC8548516.
105. Fassnacht M, Terzolo M, Allolio B et al. Combination chemotherapy in advanced adrenocortical carcinoma. FIRM-ACT Study GroupN Engl J Med. 2012; 366(23): 2189.
106. Berruti A, Grisanti S, Pulzer A, et al. Long-term outcomes of adjuvant mitotane therapy in patients with radically resected adrenocortical carcinoma. Journal of Clinical Endocrinology and Metabolism. 2017; 102: 1358 - 1365. doi: 10.1210/jc.2016-2894.
107. Megerle F, Herrmann W, Schloetelburg W et al. Mitotane Monotherapy in Patients With Advanced Adrenocortical Carcinoma. J Clin Endocrinol Metab. 2018 Apr 1; 103(4): 1686 - 1695. doi: 10.1210/jc.2017-02591. PMID: 29452402.
108. Allolio B, Hahner S, Weismann D, Fassnacht M. Management of adrenocortical carcinoma. Clin Endocrinol (Oxf). 2004; 60: 273 - 287. 19: 540 - 544.
109. Rodriguez-Galindo C, Figueiredo BC, Zambetti GP, et al.: Biology, clinical characteristics, and management of adrenocortical tumors in children. Pediatr Blood Cancer 45 (3): 265-73, 2005.
110. Zancanella P, Pianovski MA, Oliveira BH, et al.: Mitotane associated with cisplatin, etoposide, and doxorubicin in advanced childhood adrenocortical carcinoma: mitotane monitoring and tumor regression. J Pediatr Hematol Oncol 28 (8): 513-24, 2006.
111. Matthew T. Campbell, Emily Lemke, Khaled M. Elsayes et al. A retrospective analysis of carboplatin plus etoposide in patients with adrenal cortical carcinoma. Journal of Clinical Oncology 2018 36: 15_suppl, e16591 - e16591.
112. Lagan M, Grisanti S, Cosentini D et al. Efficacy of the EDP-M Scheme Plus Adjunctive Surgery in the Management of Patients with Advanced Adrenocortical Carcinoma: The Brescia Experience. Cancers (Basel). 2020 Apr 10; 12(4): 941. doi: 10.3390/cancers12040941. PMID: 32290298; PMCID: PMC7226395.
113. Raymond VM, Everett JN, Furtado LV et al. Adrenocortical carcinoma is a lynch syndrome-associated cancer. J Clin Oncol. 2013 Aug 20; 31(24): 3012-8. doi: 10.1200/JCO.2012.48.0988. Epub 2013 Jul 22. Erratum in: J Clin Oncol. 2013 Oct 1; 31(28): 3612. PMID: 23752102; PMCID: PMC3739861.
114. Maio M, Ascierto PA, Manzyuk L et al. Pembrolizumab in microsatellite instability high or mismatch repair deficient cancers: updated analysis from the phase II KEYNOTE-158 study. Ann Oncol. 2022 Sep; 33(9): 929 - 938. doi: 10.1016/j.annonc.2022.05.519. Epub 2022 Jun 6. PMID: 35680043.
115. Raj N, Zheng Y, Kelly V et al. PD-1 Blockade in Advanced Adrenocortical Carcinoma. J Clin Oncol. 2020 Jan 1; 38(1): 71 - 80. doi: 10.1200/JCO.19.01586. Epub 2019 Oct 23. PMID: 31644329; PMCID: PMC7351334.
116. Le Tourneau C, Hoimes C, Zarwan C, et al. Avelumab in patients with previously treated metastatic adrenocortical carcinoma: phase 1b results from the JAVELIN solid tumor trial. J Immunother Cancer. 2018; 6(1): 111.
117. Zhulikov Ya., Kovalenko E., Bokhian V. et al. Efficiency of platinum-based chemotherapy re-induction for adrenocortical cancer treatment, SCIREA Journal of Clinical Medicine. Vol. 7, No. 5, 2022, pp. 302 - 311. doi: 10.54647/cm32932.
118. Sperone P, Ferrero A, Daffara F, et al. Gemcitabine plus metronomic 5-fluorouracil or capecitabine as a second-/third-line chemotherapy in advanced adrenocortical carcinoma: a multicenter phase II study. Endocr Relat Cancer. 2010; 17(2): 445 - 453.
119. Henning JEK, Deutschbein T, Altieri B, et al. Gemcitabine-Based Chemotherapy in Adrenocortical Carcinoma: A Multicenter Study of Efficacy and Predictive Factors. J Clin Endocrinol Metab. 2017; 102(11): 4323 - 4332.
120. Жуликов Я.А., Коваленко Е.И., Бохян В.Ю. et al. Эффективность химиотерапии по схеме GemCap + митотан во 2-й и последующих линиях лечения метастатического адренокортикального рака. Тазовая хирургия и онкология. 2022; 12(3): 36 - 42. https://doi.org/10.17650/2686-9594-2022-12-3-36-42
121. Berruti A, Grisanti S, Pulzer A, et al. Long-term outcomes of adjuvant mitotane therapy in patients with radically resected adrenocortical carcinoma. Journal of Clinical Endocrinology and Metabolism.2017; 102: 1358 - 1365. doi: 10.1210/jc.2016-2894
122. Fassnacht M, Hahner S, Polat B, et al. Effcacy of adjuvant radiotherapy of the tumor bed on local recurrence of adrenocortical carcinoma. Journal of Clinical Endocrinology and Metabolism. 2006; 91: 4501 - 4504.
123. Habra MA, Ejaz S, Feng L, et al. A Retrospective Cohort Analysis of the Effcacy of Adjuvant Radiotherapy after Primary Surgical Resection in Patients with Adrenocortical Carcinoma. Journal of Clinical Endocrinology and Metabolism. 2013; 98: 192 - 197. doi: 10.1210/jc.2012-2367)
124. Sabolch A, Else T, Griffth KA, et al. Adjuvant radiation therapy improves local control after surgical resection in patients with localized adrenocortical carcinoma. International Journal of Radiation Oncology, Biology, Physics. 2015; 92: 252 - 259. doi: 10.1016/j.ijrobp.2015.01.007
125. Cerquetti L, Bucci B, Marchese R, et al. Mitotane increases the radiotherapy inhibitory effect and induces G2-arrest in combined treatment on both H295R and SW13 adrenocortical cell lines. Endocrine-Related Cancer. 2008; 15: 623 - 634. doi: 10.1677/erc.1.1315
126. Krzisnik C, Petric G, Jereb B. Complete response of metastatic adrenal cortical carcinoma to o,p -DDD in a child. Pediatr Hematol Oncol. 1988; 5: 65 - 69.
127. Huang H, FojoT. Adjuvant mitotane for adrenocortical cancer - a recurring controversy. Journal of Clinical Endocrinology and Metabolism. 2008; 93(10): 3730 - 3732. doi: 10.1210/jc.2008-0579
128. Fassnacht M, Terzolo M, Allolio B et al. Combination chemotherapy in advanced adrenocortical carcinoma. FIRM-ACT Study GroupN Engl J Med. 2012; 366(23): 2189.
129. Chortis V, Taylor AE, Schneider P, Tomlinson JW, Hughes BA, O'Neil DM, Lib R, Allolio B, Bertagna X, Bertherat J, et al. Mitotane therapy in adrenocortical cancer induces CYP3A4 and inhibits 5-reductase, explaining the need for personalized glucocorticoid and androgen replacement. Journal of Clinical Endocrinology and Metabolism 2013 98 161 - 171. (https://doi.org/10.1210/jc.2012-2851)]
130. Abiven-Lepage G, Coste J, Tissier F, et al. Adrenocortical carcinoma and pregnancy: clinical and biological features and prognosis. European Journal of Endocrinology 2010; 163: 793 - 800. doi: 10.1530/EJE-10-0412)
131. Sirianni R, Zolea F, Chimento A, et al. Targeting estrogen receptor-alpha reduces adrenocortical cancer (ACC) cell growth in vitro and in vivo: potential therapeutic role of selective estrogen receptor modulators (SERMs) for ACC treatment. Journal of Clinical Endocrinology and Metabolism. 2012; 97: E2238 - E2250. doi: 10.1210/jc.2012-2374
132. Icard P, Goudet P, Charpenay C. Adrenocortical carcinomas: surgical trends and results of a 253-patient series from the French Association of Endocrine Surgeons Study Group. World J Surg. 2001; 25: 891 - 897.
133. Hahner S, Fassnacht M. Mitotane for adrenocortical carcinoma treatment. Curr Opin Investig Drugs. 2005; 6: 386 - 394
134. Van Slooten H, Moolenaar AJ, van Seters AP, Smeenk D. The treatment of adrenocortical carcinoma with o,p-DDD: prognostic implications of serum level monitoring. Eur J Cancer Clin Oncol. 1984; 20: 47 - 53.
135. Haak HR, Hermans J, van de Velde CJ et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in a consecutive series of 96 patients. Br J Cancer. 1994; 69: 947 - 951.
136. Vassilopoulou-Sellin R, Schultz PN. Adrenocortical carcinoma. Clinical outcome at the end of the 20th century. Cancer. 2001; 92: 1113 - 1121.
137. Johanssen S, Hahner S, Saeger W, et al. Defcits in the management of patients with adrenocortical carcinoma in germany. Deutsches Arzteblatt International.2010; 107: U885 - U889.
138. Bilimoria KY, Shen WT, Elaraj D, et al. Adrenocortical carcinoma in the United States: treatment utilization and prognostic factors. Cancer. 2008; 113: 3130 - 3136. (doi: 10.1002/cncr.23886)
139. Libe R, Borget I, Ronchi CL, et al. Prognostic factors in stage III-IV adrenocortical carcinomas (ACC): an European Network for the Study of Adrenal Tumor (ENSAT) study. Annals of Oncology.
140. Miller BS, Gauger PG, Hammer GD, Giordano TJ & Doherty GM. Proposal for modifcation of the ENSAT staging system for adrenocortical carcinoma using tumor grade. Langenbecks Archives of Surgery 2010 395 955 - 961. (https://doi.org/10.1007/s00423-010-0698-y)
141. Weiss LM, Medeiros LJ, Vickery AL Jr. Pathologic features of prognostic signifcance in adrenocortical carcinoma. American Journal of Surgical Pathology. 1989; 13: 202 - 206. doi: 10.1097/00000478-198903000-00004Morimoto R, Satoh F, Murakami O, et al. Immunohistochemistry of aproliferation marker Ki67/MIB1 in adrenocortical carcinomas: Ki67/MIB1 labeling index is a predictor for recurrence of adrenocortical carcinomas. Endocrine Journal.2008; 55: 49 - 55.doi: org/10.1507/endocrj.K07-079
142. Beuschlein, F. Major Prognostic Role of Ki67 in Localized Adrenocortical Carcinoma After Complete Resection/F. Beuschlein, J. Weigel, W. Saeger et al.//J Clin Endocrinol Metab, 2015. - Vol. 100. - P. 841 - 849.
143. Papathomas, T. An International Ki67 Reproducibility Study in Adrenal Cortical Carcinoma/T. Papathomas, E. Pucci, T. Giordano et al.//Am J Surg Pathol. - 2016. - Vol. 40. - P. 569 - 576.
144. Crucitti F, Bellantone R, Ferrante A, et al. The Italian Registry for Adrenal Cortical Carcinoma: analysis of a multiinstitutional series of 129 patients. The ACC Italian Registry Study Group. Surgery. 1996; 119: 161 - 170.
145. Pommier RF, Brennan MF. An eleven-year experience with adrenocortical carcinoma. Surgery 1992; 112: 963 - 970; discussion, 970 - 971.
146. Soreide JA, Brabrand K, Thoresen SO. Adrenal cortical carcinoma in Norway, 1970-1984. World J Surg. 1992; 16: 663 - 667; discussion, 668.
147. Abiven-Lepage G, Coste J, Tissier F, et al. Adrenocortical carcinoma and pregnancy: clinical and biological features and prognosis. European Journal of Endocrinology. 2010; 163: 793 - 800. doi: 10.1530/EJE-10-0412
148. De Corbiere P, Ritzel K, Cazabat L, et al. Pregnancy in women previously treated for an adrenocortical carcinoma. Journal of Clinical Endocrinology and Metabolism. 2015; 100: 4604 - 4611. doi: 10.1210/jc.2015-2341
149. Asare EA, Wang TS, Winchester DP, et al. A novel staging system for adrenocortical carcinoma better predicts survival in patients with stage I/II disease. Surgery. 2014; 156: 1378 - 1386. doi: 10.1016/j.surg.2014.08.018
150. Всероссийское общество редких (орфанных) заболеваний (http://akr.rare-diseases.ru/)
151. Pennanen, M. Helsinki score-a novel model for prediction of metastases in adrenocortical carcinomas/M. Pennanen, I. Heiskanen, T. Sane et al.//Human Pathology. - 2015. - Vol. 46, N 3. - P. 404 - 410.
152. Hough, A.J. Prognostic factors in adrenal cortical tumors. A mathematical analysis of clinical and morphologic data/A.J. Hough, J.W. Hollifield, D.L. Page et al.//Am J Clin Pathol. - 1979. - Vol. 72. - P. 390 - 399.
153. Aubert, S. Weiss system revisited: a clinicopathologic and immunohistochemical study of 49 adrenocortical tumors/S. Aubert, A. Wacrenier, X. Leroy et al.//Am. J. Surg. Pathol. - 2002. - Vol. 26, N 12. - P. 1612 - 1619.
154. Duregon E. et al. The Reticulin Algorithm for Adrenocortical Tumor Diagnosis//Am. J. Surg. Pathol. 2013. Vol. 37, N 9. P. 1433 - 1440.
155. Cosentini D, Badalamenti G, Grisanti S et al. Activity and safety of temozolomide in advanced adrenocortical carcinoma patients. Eur J Endocrinol. 2019 Dec; 181(6): 681 - 689. doi: 10.1530/EJE-19-0570. PMID: 31639772.
156. Libe R, Dall'Asta C, Barbetta L et al. Long-term follow-up study of patients with adrenal incidentalomas. Eur J Endocrinol. 2002; 147: 489 - 494. doi: 10.1530/eje.0.1470489
157. Gardet V et al. Lessons from an unpleasant surprise: a biochemical strategy for the diagnosis of pheochromocytoma. J Hypertens. 2001; 19(6): 1029 - 1035. 10.1097/00004872-200106000-00006
158. Pacak K et al. Recent advances in genetics, diagnosis, localization, and treatment of pheochromocytoma. Ann Intern Med. 2001; 134(4): 315 - 329. doi: 10.7326/0003-4819-134-4-200102200-00016
159. Mantero F, Terzolo M, Arnaldi G, et al. A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. J Clin Endocrinol Metab. 2000; 85(2): 637 - 644.
160. Welch TJ, Sheedy PF II, Stephens DH et al. Percutaneous adrenal biopsy: review of a 10-year experience. Radiology. 1994; 193: 341 - 344
161 Pacak K, Eisenhofer G, Ahlman H et al. Pheochromocytoma: recommendations for clinical practice from the First International Symposium. Nat Clin Pract Endocrinol Metab. 2007; 3: 92 - 102
162. Ng L, Libertino JM. Adrenocortical carcinoma: diagnosis, evaluation and treatment. J Urol. 2003; 169: 5 - 11
163. Weiss LM. Comparative histologic study of 43 metastasizing and nonmetastasizing adrenocortical tumors. Am J Surg Pathol. 1984; 8(3): 163 - 169.
164. Lau SK, Weiss LM. The Weiss system for evaluating adrenocortical neoplasms: 25 years later. Hum Pathol. 2009; 40(6): 757 - 768.
165. Van Slooten H, Schaberg A, Smeenk D, Moolenar AJ. Morphologic characteristics of benign and malignant adrenocortical tumors. Cancer. 1985 Feb 15; 55(4): 766 - 773.
166. Blanes A et al. Histologic criteria for adrenocortical proliferative lesions: value of mitotic figure variability. Am J Clin Pathol. 2007; 127(3): 398 - 408.
167. Shen WT, Sturgeon C, Duh QY. From incidentaloma to adrenocortical carcinoma: the surgical management of adrenal tumors. J Surg Oncol. 2005; 89(3): 186-92. doi: 10.1002/jso.20180
168. Hahner S, Fassnacht M. Mitotane for adrenocortical carcinoma treatment. Curr Opin Investig Drugs. 2005; 6: 386 - 394.
169. Schteingart DE. Conventional and novel strategies in the treatment of adrenocortical cancer. Braz J Med Biol Res. 2000; 33: 1197 - 1200
170. Hague RV, May W, Cullen DR. Hepatic microsomal enzyme induction and adrenal crisis due to o,p_DDD therapy for metastatic adrenocortical carcinoma. Clin Endocrinol (Oxf). 1989; 31: 51 - 57
171. Министерство здравоохранения Российской Федерации. Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения. https://www.rosminzdrav.ru/
172. Lim MC, Tan YO, Chong PY, Cheah JS. Treatment of adrenal cortical carcinoma with mitotane: outcome and complications. Ann Acad Med Singapore. 1990.
173. Decker RA, Kuehner ME. Adrenocortical carcinoma. Am Surg. 1991; 57: 502 - 513.
174. Terzolo, M. Adjuvant mitotane treatment for adrenocortical carcinoma/M. Terzolo Angeli A, Fassnacht M et al.//N. Engl. J. Med. - 2007. - Vol. 356, N 23. - P. 2372 - 2380.
175. Ilias I, Alevizaki M, Philippou G, Anastasiou E, Souvatzoglou A. Sustained remission of metastatic adrenal carcinoma during long-term administration of low-dose mitotane. J Endocrinol Invest. 2001; 24: 532 - 535.
176. Baudin E, Pellegriti G, Bonnay M et al. Impact of monitoring plasma 1,1-dichlorodiphenildichloroethane (o,p_DDD) levels on the treatment of patients with adrenocortical carcinoma. Cancer. 2001; 92: 1385 - 1392.
177. Heilmann P, Wagner P, Nawroth PP, Ziegler R [Therapy of the adrenocortical carcinoma with Lysodren (o,p'-DDD). Therapeutic management by monitoring o,p_-DDD blood levels]. Med Klin. 2001; 96: 371 - 377
178. Becker D, Schumacher OP. o,p'DDD therapy in invasive adrenocortical carcinoma. Ann Intern Med. 1975; 82: 677 - 679.
179. Boven E, Vermorken JB, van Slooten H, PinedoHM. Complete response of metastasized adrenal cortical carcinoma with o,p_-DDD. Case report and literature review. Cancer. 1984; 53: 26 - 29.
180. Terzolo M, Fassnacht M, Ciccone G, Allolio B, Berruti A. Adjuvant Mitotane for Adrenocortical Cancer-Working through Uncertainty. The Journal of Clinical Endocrinology & Metabolism. 2009; 94(6): 1879 - 1880. doi: 10.1210/jc.2009-0120
181. Kroiss M, Quinkler M, Lutz WK, Allolio B, Fassnacht M. Drug interactions with mitotane by induction of CYP3A4 metabolism in the clinical management of adrenocortical carcinoma. Clinical Endocrinology; 2011; 75: 585 - 591. doi: 10.1111/j.1365-2265.2011.04214.x
182. Cordon-Cardo C, O'Brien JP, Boccia J et al. Expression of the multidrug resistance gene product (P-glycoprotein) in human normal and tumor tissues. J Histochem Cytochem. 1990; 38: 1277 - 1287.
183. Flynn SD, Murren JR, Kirby WM et al. P-glycoprotein expression and multidrug resistance in adrenocortical carcinoma. Surgery. 1992; 112: 981 - 986.
184. Goldstein LJ, Galski H, Fojo A, et al. Expression of a multidrug resistance gene in human cancers. J Natl Cancer Inst. 1989; 81: 116 - 124.
185. Fridborg H, Larsson R, Juhlin C, Rastad J, Akerstrom G, Backlin K, Nygren P P-glycoprotein expression and activity of resistance modifying agents in primary cultures of human renal and adrenocortical carcinoma cells. An-ticancer Res. 1994; 14: 1009 - 1016.
186. Haak HR, van Seters AP, Moolenaar AJ, Fleuren GJ Expression of P-glycoprotein in relation to clinical manifestation, treatment and prognosis of adrenocortical cancer. Eur J Cancer. 1993; 29A: 1036 - 1038.
187. Sperone P, Ferrero A, Daffara F, et al. Gemcitabine plus metronomic 5-fluorouracil or capecitabine as a second-/third-line chemotherapy in advanced adrenocortical carcinoma: a multicenter phase II study. Endocr Relat Cancer. 2010; 17(2): 445-53.
188. Papotti, M. The Weiss score and beyond - histopathology for adrenocortical carcinoma/M. Papotti, R. Lib , E. Duregon et al.//Horm. Cancer. - 2011. - Vol. 2, N 6. - P. 333 - 340.
189. Volante, M. Pathological and molecular features of adrenocortical carcinoma: an update/M. Volante, C. Buttigliero, E. Greco et al.//J. Clin. Pathol. - 2008. - Vol. 61. - N 7. - P. 787 - 793.
190. Adrenal Cortical Carcinoma. In: Brierley JD, Gospodarowicz MK, Wittekind C (eds). TNM Classification of Malignant Tumours (8th edition). Oxford, UK: Wiley-Blackwell, 2017.
191. Libe, R. Prognostic factors in stage III-IY adrenocortical cancinoma (ACC): an European Network for the study of adrenal tumor (ENSAT) study/R. Libe, I. Borget, L. Ronchi//Annals of Oncology. - 2015. - Vol. 26. - P. 2119 - 2125.
192. Бохян, В.Ю., Павловская А.И., Губина Г.И., Стилиди И.С. Клиническая оценка гистологических систем диагностики адренокортикальных опухолей//Архив патологии. - 2015. - N 3. - Т. 77. - Стр. 17 - 22.
193. Fassnacht M, Kenn W & Allolio B. Adrenal tumors: How to establish malignancy? J Endocrinol Invest 2270 2004 27 387 - 399.
194. Rodriguez-Galindo C, Figueiredo BC, Zambetti GP, et al.: Biology, clinical characteristics, and management of adrenocortical tumors in children. Pediatr Blood Cancer 45 (3): 265-73, 2005.
195. Zancanella P, Pianovski MA, Oliveira BH, et al.: Mitotane associated with cisplatin, etoposide, and doxorubicin in advanced childhood adrenocortical carcinoma: mitotane monitoring and tumor regression. J Pediatr Hematol Oncol 28 (8): 513-24, 2006.
196. Berruti A, Terzolo M, Pia A, et al. Mitotane associated with etoposide, doxorubicin, and cisplatin in the treatment of advanced adrenocortical carcinoma. Italian Group for the Study of Adrenal Cancer. Cancer. 1998; 83: 2194 - 2200
197. Майстренко Н.А., Ромащенко П.Н., Бабич А.И. Современные подходы к диагностике и лечению злокачественных новообразований надпочечников//Мед. акад. журн. - 2011. - Т. 11, N 2. - С. 117 - 126.
198. Бабич А.И., Ромащенко П.Н., Орлова Р.В., Бабич А.И. Адренокортикальный рак: диагностика и лечение//Вестн. Рос. Воен.-мед. акад. - 2014. - N 2. - С. 214 - 215.
199. Майстренко Н.А., Орлова Р.В., Ромащенко П.Н., Бабич А.И. Комбинированное лечение местно-распространенного адренокортикального рака [Электронный ресурс] ///Медлайн.Ру. - 2014. - Т. 15. - С. 495 - 497. - Режим доступа: http://www.medline.ru/public/art/tom15/art59.html.
200. Fassnacht M. et al. European Society of Endocrinology Clinical Practice Guidelines on the Management of Adrenocortical Carcinoma in Adults, in collaboration with the European Network for the Study of Adrenal Tumors//Eur J Endocrinol. EJE. 2018. Vol. 179, N 4. P. G1 - G46.
201. Araujo-Castro M et al. Immunotherapy in Adrenocortical Carcinoma: Predictors of Response, Efficacy, Safety, and Mechanisms of Resistance//Biomedicines. 2021. Vol. 9 N 3. P. 304.
202. Georgantzoglou N. et al. Tumor microenvironment in adrenocortical carcinoma: Barrier to immunotherapy success?//Cancers (Basel). 2021. Vol. 13, N 8. P. 1 - 19.
203. De Reyni s A. et al. Gene expression profiling reveals a new classification of adrenocortical tumors and identifies molecular predictors of malignancy and survival//J. Clin. Oncol. 2009. Vol. 27, N 7. P. 1108 - 1115.
204. Giordano T.J. et al. Molecular classification and prognostication of adrenocortical tumors by transcriptome profiling//Clin. Cancer Res. 2009. Vol. 15, N 2. P. 668 - 676.
205. Assi G. et al. Integrated genomic characterization of adrenocortical carcinoma//Nat. Genet. Nature Publishing Group, 2014. Vol. 46, N 6. P. 607 - 612.
206. Chabre O. et al. Serum miR-483-5p and miR-195 are predictive of recurrence risk in adrenocortical cancer patients//Endocr. Relat. Cancer. 2013. Vol. 20, N 4. P. 579 - 594.
207. Soon P.S.H. et al. miR-195 and miR-483-5p identified as predictors of poor prognosis in adrenocortical cancer//Clin. Cancer Res. 2009. Vol. 15, N 24. P. 7684 - 7692.
208. Barreau O. et al. Identification of a CpG island methylator phenotype in adrenocortical carcinomas//J. Clin. Endocrinol. Metab. 2013. Vol. 98, N 1. P. 174 - 184.
209. Mohan D.R. et al. Targeted Assessment of G0S2 Methylation Identifies a Rapidly Recurrent, Routinely Fatal Molecular Subtype of Adrenocortical Carcinoma//Clin Cancer Res. 2019. Vol. 25 N 11. P. 3276 - 3288.
210. Terzolo M, Daffara F, Ardito A, Zaggia B, Basile V, Ferrari L, Berruti A. Management of adrenal cancer: a 2013 update. Endocrinol Invest. 2014; 37(3): 207-17. doi: 10.1007/s40618-013-0049/
211. Puglisi S, Perotti P, Pia A, Reimondo G, Terzolo M. Adrenocortical Carcinoma with Hypercortisolism. Endocrinol Metab Clin North Am. 2018 Jun; 47(2): 395 - 407. doi: 10.1016/j.ecl.2018.02.003. Epub 2018 Apr 9. PMID: 29754640.
212. Raymond VM, Everett JN, Furtado LV, Gustafson SL, Jungbluth CR, Gruber SB, Hammer GD, Stoffel EM, Greenson JK, Giordano TJ, Else T. Adrenocortical carcinoma is a lynch syndrome-associated cancer. J Clin Oncol. 2013 Aug 20; 31(24): 3012-8. doi: 10.1200/JCO.2012.48.0988. Epub 2013 Jul 22. Erratum in: J Clin Oncol. 2013 Oct 1; 31(28): 3612. PMID: 23752102; PMCID: PMC3739861.
213. suboi I, Kardoust Parizi M, Matsukawa A, Mancon S, Miszczyk M, Schulz RJ, Fazekas T, Cadenar A, Laukhtina E, Kawada T, Katayama S, Iwata T, Bekku K, Wada K, Remzi M, Karakiewicz PI, Araki M, Shariat SF. The efficacy of adjuvant mitotane therapy and radiotherapy following adrenalectomy in patients with adrenocortical carcinoma: A systematic review and meta-analysis. Urol Oncol. 2024 Oct 7: S1078-1439(24) 00654-9. doi: 10.1016/j.urolonc.2024.09.014. Epub ahead of print. PMID: 39379210.
214. Горбунова В.А., Бельцевич Д.Г., Бохян В.Ю. и соавт. Рак коры надпочечника. Практические рекомендации RUSSCO, часть 1.1. Злокачественные опухоли 2024; 14(3s2): 445 - 451.
215. Fassnacht M, Assie G, Baudin E, Eisenhofer G, de la Fouchardiere C, Haak HR, de Krijger R, Porpiglia F, Terzolo M, Berruti A; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Adrenocortical carcinomas and malignant phaeochromocytomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020 Nov; 31(11): 1476 - 1490. doi: 10.1016/j.annonc.2020.08.2099. Epub 2020 Aug 27. Erratum in: Ann Oncol. 2023 Jul; 34(7): 631. doi: 10.1016/j.annonc.2022.12.006. PMID: 32861807.
216. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Neuroendocrine and Adrenal Tumors. Version 1.2025. Plymouth Meeting, PA: National Comprehensive Cancer Network; 2025.
217. Zhulikov YA, et al. Role of adjunctive surgery after platinum-based chemotherapy in management patients with adrenocortical carcinoma: Observation study. Ann Oncol. 2024; 35(Suppl): S537.
218. Lagan M, Grisanti S, Ambrosini R, Cosentini D, Abate A, Zamparini M, Ferrari VD, Gianoncelli A, Turla A, Canu L, Terzolo M, Tiberio GAM, Sigala S, Berruti A. Phase II study of cabazitaxel as second-third line treatment in patients with metastatic adrenocortical carcinoma. ESMO Open. 2022 Apr; 7(2): 100422. doi: 10.1016/j.esmoop.2022.100422. Epub 2022 Mar 7. PMID: 35272132; PMCID: PMC9058897.
219. Oldenburger E, Brown S., Willmann J., et al ESTRO ACROP guidelines for external beam radiotherapy of patients with complicated bone metastases. Radiother Oncol. 2022 Aug; 173: 240 - 253. doi: 10.1016/j.radonc.2022.06.002.
220. Фогт С.Н., Калугина В.В., Ворохобина Н.В., Кузнецова А.В., Серебрякова И.П. Текущий статус лекарственной терапии аденокортикального рака. Медицинский вестник Юга России. 2022; 13(2): 154 - 161. https://doi.org/10.21886/2219-8075-2022-13-2-154-161.
221. Cifu D. X., Lew H. L. Braddom s Rehabilitation Care: A Clinical Handbook E-Book. - Elsevier Health Sciences, 2017.
222. Van den Berg J. P. et al. Guideline" Cancer rehabilitation"//Nederlands tijdschrift voor geneeskunde. - 2011. - Т. 155. - N. 51. - С. A4104.
223. Fu J. B., Morishita S. The future of rehabilitation in oncology. - 2017.
224. Poirier J, Godemel S, Mourot A, Grunenwald S, Olney HJ, Le XK, Lacroix A, Caron P, Bourdeau I. Central Hypothyroidism is Frequent During Mitotane Therapy in Adrenocortical Cancer Patients: Prevalence and Timeline. J Clin Endocrinol Metab. 2023 Aug 18; 108(9): 2336 - 2342. doi: 10.1210/clinem/dgad115. PMID: 36856782.
225. Magkou D, Do Cao C, Bouvattier C, Douillard C, de Marcellus C, Cazabat L, G rard M, Raffin-Sanson ML, Young J. Foetal exposure to mitotane/Op'DDD: Post-natal study of four children. Clin Endocrinol (Oxf). 2018 Dec; 89(6): 805 - 812. doi: 10.1111/cen.13854. Epub 2018 Oct 16. PMID: 30222204.
226. Жуликов Я.А. Лекарственная терапия и роль повторных хирургических вмешательств в лечении местнораспространенного и метастатического адренокортикального рака: дис. канд. мед. наук: 3.1.6 - Онкология, лучевая терапия/ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России. - М., 2025.
227. Bianchini M, Puliani G, Chiefari A, Mormando M, Lauretta R, Appetecchia M. Metabolic and Endocrine Toxicities of Mitotane: A Systematic Review. Cancers (Basel). 2021 Oct 5; 13(19): 5001. doi: 10.3390/cancers13195001. PMID: 34638485; PMCID: PMC8508479.
228. Ma S, Wu L, Ye L, Habra MA, Balderrama-Brondani V, Wang W. Adjuvant radiation therapy improves outcome of patients with surgical resected adrenocortical carcinoma. Endocrine. 2025 Jan 25. doi: 10.1007/s12020-025-04163-5. Epub ahead of print. PMID: 39862362.
229. Ribeiro R, Figueiredo B. Childhood adrenocortical tumours. Eur J Cancer. 2004; 40(8): 1117 - 1126. doi: 10.1016/j.ejca.2004.01.031
230. Kuhlen M, Mier P, Kunstreich M, Lessel L, Slavetinsky C, Fuchs J, Seitz G, Holterhus PM, Wudy SA, Vokuhl C, Fr hwald MC, Vorwerk P, Redlich A. Locally Advanced Adrenocortical Carcinoma in Children and Adolescents-Enigmatic and Challenging Cases. Cancers (Basel). 2023 Aug 28; 15(17): 4296.
231. Rodriguez-Galindo C., Krailo M.D., Pinto E.M., Pashankar F., Weldon C.B., Huang L., Caran E.M., Hicks J., McCarville M.B., Malkin D., et al. Treatment of Pediatric Adrenocortical Carcinoma With Surgery, Retroperitoneal Lymph Node Dissection, and Chemotherapy: The Children's Oncology Group ARAR0332 Protocol. J. Clin. Oncol. 2021; 39: 2463 - 2473.
232. Sandru F, Petca RC, Carsote M, Petca A, Dumitrascu MC, Ghemigian A. Adrenocortical carcinoma: Pediatric aspects (Review). Exp Ther Med. 2022 Apr; 23(4): 287.
233. Pinto EM, Zambetti GP, Rodriguez-Galindo C. Pediatric adrenocortical tumours. Best Pract Res Clin Endocrinol Metab. 2020 May; 34(3): 101448. doi: 10.1016/j.beem.2020.101448. Epub 2020 Jul 3.
234. Berthold F., Simon T. Clinical presentation//Neuroblastoma. 2005. P. 63 - 86.
235. Bholah R, Bunchman TE. Review of Pediatric Pheochromocytoma and Paraganglioma. Front Pediatr. 2017 Jul 13; 5: 155.
236. Berthold F. NB2004 Trial Protocol for Risk Adapted Treatment of Children with Neuroblastoma Principal investigator [Electronic resource]. 2004. URL: http://nodgo.org/sites/default/files/protokol_neuroblastoma-1.pdf (accessed: 12.12.2019).
237. Barontini M, Levin G, Sanso G. Characteristics of pheochromocytoma in a 4 - to 20-year-old population. Ann N Y Acad Sci. 2006 Aug; 1073: 30-7. doi: 10.1196/annals.1353.003.
238. Ilanchezhian M, Varghese DG, Glod JW, Reilly KM, Widemann BC, Pommier Y, Kaplan RN, Del Rivero J. Pediatric adrenocortical carcinoma. Front Endocrinol (Lausanne). 2022 Oct 31; 13: 961650.
239. Xia J. et al. Comparison of diagnosing and staging accuracy of PET (CT) and MIBG on patients with neuroblastoma: Systemic review and meta-analysis//J. Huazhong Univ. Sci. Technol. - Med. Sci. 2017. Vol. 37, N 5. P. 649 - 660.
240. Riedmeier M, Antonini SRR, Brandalise S, Costa TEJB, Daiggi CM, de Figueiredo BC, de Krijger RR, De S Rodrigues KE, Deal C, Del Rivero J, Engstler G, Fassnacht M, Fernandes Luiz Canali GC, Molina CAF, Gonc EN, G ltekin M, Haak HR, Guran T, Hendriks Allaird EJ, Idkowiak J, Kuhlen M, Malkin D, Meena JP, Pamporaki C, Pinto E, Puglisi S, Ribeiro RC, Thompson LDR, Yalcin B, Van Noesel M, Wiegering V. International consensus on mitotane treatment in pediatric patients with adrenal cortical tumors: indications, therapy, and management of adverse effects. Eur J Endocrinol. 2024 Mar 30; 190(4): G15 - G24.
241. Kuhlen M, Mier P, Kunstreich M, Lessel L, Schneider D, Brecht I, Schewe DM, Fr hwald MC, Vorwerk P, Redlich A. Key factors for effective mitotane therapy in children with adrenocortical carcinoma. Endocr Relat Cancer. 2022 Aug 1; 29(9): 545 - 555.
242. Geoerger B, Kang HJ, Yalon-Oren M, Marshall LV, Vezina C, Pappo A, Laetsch TW, Petrilli AS, Ebinger M, Toporski J, Glade-Bender J, Nicholls W, Fox E, DuBois SG, Macy ME, Cohn SL, Pathiraja K, Diede SJ, Ebbinghaus S, Pinto N. Pembrolizumab in paediatric patients with advanced melanoma or a PD-L1-positive, advanced, relapsed, or refractory solid tumour or lymphoma (KEYNOTE-051): interim analysis of an open-label, single-arm, phase 1 - 2 trial. Lancet Oncol. 2020 Jan; 21(1): 121 - 133. doi: 10.1016/S1470-2045(19) 30671-0. Epub 2019 Dec 4.
243. Driver CP, Birch J, Gough DC, Bruce J. Adrenal cortical tumors in childhood. Pediatr Hematol Oncol (1998) 15: 527-32.
244. Virgone C, Roganovic J, Vorwerk P, Redlich A, Schneider DT, Janic D, Bien E, L pez-Almaraz R, Godzinski J, Osterlundh G, Stachowicz-Stencel T, Brugi res L, Brecht IB, Thomas-Teinturier C, Fresneau B, Surun A, Ferrari A, Bisogno G, Orbach D. Adrenocortical tumours in children and adolescents: The EXPeRT/PARTNER diagnostic and therapeutic recommendations. Pediatr Blood Cancer. 2021 Jun; 68 Suppl 4: e29025.
245. Bornstein SR, Allolio B, Arlt W, Barthel A, Don-Wauchope A, Hammer GD, Husebye ES, Merke DP, Murad MH, Stratakis CA, Torpy DJ. Diagnosis and Treatment of Primary Adrenal Insufficiency: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016 Feb; 101(2): 364-89. doi: 10.1210/jc.2015-1710. Epub 2016 Jan 13.
246. Head L, Kiseljak-Vassiliades K, Clark TJ, Somerset H, King J, Raeburn C, Albuja-Cruz M, Weyant M, Cleveland J, Wierman ME, Leong S. Response to Immunotherapy in Combination With Mitotane in Patients With Metastatic Adrenocortical Cancer. J Endocr Soc. 2019 Oct 11; 3(12): 2295 - 2304. doi: 10.1210/js.2019-00305. PMID: 31745526; PMCID: PMC6853671.
247. Gillespie EF, Lapen K, Wang DG, Wijetunga N, Pastrana GL, Kollmeier MA, Yamada J, Schmitt AM, Higginson DS, Vaynrub M, Santos Martin E, Xu AJ, Tsai C, Yerramilli D, Cahlon O, Yang T. Replacing 30 Gy in 10 fractions with stereotactic body radiation therapy for bone metastases: A large multi-site single institution experience 2016 - 2018. Clin Transl Radiat Oncol. 2020 Oct 8; 25: 75 - 80. doi: 10.1016/j.ctro.2020.10.001. PMID: 33102818; PMCID: PMC7575833.
248. Roos DE, Turner SL, O'Brien PC, Smith JG, Spry NA, Burmeister BH, Hoskin PJ, Ball DL; Trans-Tasman Radiation Oncology Group, TROG 96.05. Randomized trial of 8 Gy in 1 versus 20 Gy in 5 fractions of radiotherapy for neuropathic pain due to bone metastases (Trans-Tasman Radiation Oncology Group, TROG 96.05). Radiother Oncol. 2005 Apr; 75(1): 54 - 63. doi: 10.1016/j.radonc.2004.09.017. Epub 2004 Oct 28. PMID: 15878101.
249. Malandrino P, Al Ghuzlan A, Castaing M, Young J, Caillou B, Travagli JP, Elias D, de Baere T, Dromain C, Paci A, Chanson P, Schlumberger M, Leboulleux S, Baudin E. Prognostic markers of survival after combined mitotane- and platinum-based chemotherapy in metastatic adrenocortical carcinoma. Endocr Relat Cancer. 2010 Aug 16; 17(3): 797 - 807. doi: 10.1677/ERC-09-0341. PMID: 20592067.
250. Meeuse JJ, van der Linden YM, van Tienhoven G, Gans RO, Leer JW, Reyners AK; Dutch Bone Metastasis Study Group. Efficacy of radiotherapy for painful bone metastases during the last 12 weeks of life: results from the Dutch Bone Metastasis Study. Cancer. 2010 Jun 1; 116(11): 2716-25. doi: 10.1002/cncr.25062. PMID: 20225326.
251. https://www.sehop.org/wp-content/uploads/2015/07/ARAR0332.-T.-adrenocorticales.pdf
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Мельниченко Галина Афанасьевна, д.м.н., профессор, академик РАН, заместитель директора Центра по научной работе, заведующая кафедрой клинической эндокринологии ИВиДПО ФГБУ "НМИЦ эндокринологии" Минздрава России.
Алексеев Борис Яковлевич, д.м.н., профессор, заместитель генерального директора по науке ФГБУ "НМИЦ радиологии" Минздрава России.
Бельцевич Дмитрий Германович, д.м.н., профессор, главный научный сотрудник, заведующий хирургическим отделением N 1 ФГБУ "НМИЦ эндокринологии" Минздрава России.
Стилиди Иван Сократович, д.м.н., профессор, академик РАН, Директор ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Горбунова Вера Андреевна, д.м.н., профессор, главный научный консультант отделения противоопухолевой лекарственной терапии N 1 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Артамонова Елена Владимировна, д.м.н., профессор, заведующая отделением противоопухолевой лекарственной терапии N 1 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России. Профессор кафедры онкологии и лучевой терапии ЛФ ФГАОУ ВО "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова".
Бохян Ваган Юрикович, д.м.н., заведующий отделением абдоминальной онкологии N 4 (эндокринной хирургии) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России. Профессор кафедры онкологии и лучевой терапии ЛФ ФГАОУ ВО "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова".
Коломейцева Алина Андреевна, к.м.н., заведующая дневным стационаром лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
Горяинов Дмитрий Александрович, к.м.н., врач-онколог, заведующий онкологического отделения службы внебюджетной медицинской деятельности ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Калпинский Алексей Сергеевич, к.м.н., член Правления РООУ, заведующий хирургическим отделом МНИОИ им. П. А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава РФ.
Жуликов Ярослав Андреевич, врач-онколог отделения противоопухолевой лекарственной терапии N 1 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Коваленко Елена Игоревна, к.м.н., старший научный сотрудник, врач-онколог отделения противоопухолевой лекарственной терапии N 1 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Орлова Рашида Вахидовна, д.м.н., профессор, заведующая кафедрой онкологии медицинского факультета ФГБОУВО "Санкт-Петербургский государственный университет", главный специалист по клинической онкологии и реабилитации СПб ГБУЗ "Городской клинический онкологический диспансер".
Нестерова Альфия Ирековна, к.м.н. доцент кафедры онкологии, радиологии и паллиативной медицины КГМА, доцент кафедры хирургии ИФМиБ КФУ, руководитель отдела трансляционной онкологии и телемедицинских технологий ГАУЗ РКОД имени М.З. Сигал МЗ РТ.
Делекторская Вера Владимировна, д.м.н., профессор, ведущий научный сотрудник, врач-патологоанатом патологоанатомического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Ассоциации специалистов по проблемам меланомы.
Клецкая Ирина Семеновна, врач-патологоанатом, РДКБ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Урусова Лилия Сергеевна, д.м.н., доцент, ведущий научный сотрудник, заведующая отделом фундаментальной патоморфологии НМИЦ Эндокринологии Минздрава России.
Ромашенко Павел Николаевич, д.м.н., профессор, член-корреспондент РАН, начальник кафедры и клиники факультетской хирургии им. С.П. Федорова ФГБВОУ ВО "Военно-медицинская академия имени С.М. Кирова" МО РФ.
Майстренко Николай Анатольевич, д.м.н., профессор, академик РАН, профессор кафедры факультетской хирургии им. С.П. Федорова ФГБВОУ ВО "Военно-медицинская академия имени С.М. Кирова" МО РФ.
Рослякова Анна Александровна, врач-эндокринолог отдела хирургии ФГБУ "НМИЦ эндокринологии" Минздрава России.
Шаманская Татьяна Викторовна, д.м.н., член РОДОГ, заведующая отделом изучения эмбриональных опухолей Института онкологии, радиологии и ядерной медицины ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Качанов Денис Юрьевич, д.м.н., член РОДОГ, заведующий отделением клинической онкологии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России, зам. директора Института онкологии, радиологии и ядерной медицины ФГБУ НМИЦ ДГОИ им. Д. Рогачева.
Уталиева Динара Тиморкановна, член РОДОГ, врач-детский онколог отделения клинической онкологии, лаборант-исследователь отдела катамнеза детей, перенесших онкологическое заболевания ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Рубанская Марина Владимировна, к.м.н., врач-детский онколог, заведующая детским онкологичесим отделением N 1 (химиотерапии опухолей торакоабдоминальной локализации) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Белохвостова Анна Сергеевна, к.м.н., заведующий отделением противоопухолевой лекарственной терапии МРНЦ им. А. Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России, доцент кафедры радионуклидной медицины ИАТЭ НИЯУ МИФИ.
Дмитриев Вадим Николаевич, д.м.н., заведующий отделением дневного стационара противоопухолевой лекарственной терапии МРНЦ им А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России, профессор кафедры факультетской хирургии, медицинского института НИУ БелГУ.
Блок по организации медицинской помощи
Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
Иванов Сергей Анатольевич, д.м.н., профессор, член-корреспондент РАН, заслуженный врач РФ, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России, главный внештатный специалист-онколог ЦФО Минздрава России.
Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
Геворкян Тигран Гагикович, заместитель директора по реализации федеральных проектов ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Комаров Юрий Игоревич, к.м.н., заместитель директора по организационно-методической работе ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Предлагаемые клинические рекомендации, на настоящий момент, являются основным согласительным документаом, регулирующим положения практической деятельности врачей при АКР.
Настоящие Клинические рекомендации направлены на улучшение результатов диагностики и лечения пациентов с адренокортикальным раком.
Настоящие Клинические рекомендации не рассматривают абсолютно все аспекты проблемы и возможные исключения из правил.
Настоящие Клинические рекомендации не могут гарантировать определенный результат и при этом они не устанавливают стандарты ведения пациентов.
Настоящие Клинические рекомендации не предназначены для лечения конкретного пациента. Решение об оптимальной тактике ведения каждого пациента должны основываться на результатах обследования с учетом индивидуальных обстоятельств.
Редкость АКР обусловливает объективные трудности из-за отсутствия проспективных исследований достаточной мощности и достаточного опыта лечения этого заболевания вне специализированных учреждений, концентрирующих таких пациентов. За рубежом в течение последних 30 - 40 лет проведены крупные, как проспективные, так и ретроспективные исследования, часть из которых включают в себя до 500 пациентов. К сожалению, в России исследований с подобным объемом выборки не проводилось. В связи с этим, настоящие Клинические рекомендации в основном опираются на зарубежную доказательную базу и учитывают экспертное мнение зарубежных исследователей.
В основу клинических рекомендаций положены существующие консенсусы и клинические рекомендации: (1) Классификация Всемирной Организации Здравоохранения (WHO) опухолей эндокринной системы, 4-е издание, 2017 год; (2) Клинические рекомендации по диагностике и лечению адренокортикального рака Европейского общества эндокринологов (European Society of Endocrinology), совместно с Европейским обществом по изучению опухолей надпочечников (European Network for the Study of Adrenal Tumors), 2018 год; (3) Клинические рекомендации по диагностике и лечению адренокортикального рака, 2015 год - а также отечественные и зарубежные научные работы по данной проблематике.
Методы, использованные для сбора/селекции доказательств: проводился поиск в электронных базах данных, по ключевым словам, связанным с АКР и соответствующими разделами клинических рекомендаций; проводилась оценка качества и релевантности найденных источников.
Описание методов, использованных для сбора/селекции доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE, e-library. Глубина поиска составляла до 40 лет.
Методы, использованные для оценки уровней достоверности доказательств:
- Консенсус экспертов;
- Оценка значимости в соответствии с уровнями доказательности.
В связи с орфанностью заболевания и отсутствием проспективных исследований достаточной мощности ряд рекомендаций характеризуется низким уровнем доказательности по формальному признаку.
Таблица 17. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Не сравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 18. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай - контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 19. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ: анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Методы валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-онкологи (врачи-хирурги, врачи-урологи).
2. Врачи-детские онкологи
3. Врачи-детские хирурги
4. Врачи-эндокринологи.
5. Врачи-детские эндокринологи
6. Врачи-педиатры
7. Врачи-радиотерапевты.
8. Врачи-патологоанатомы.
9. Врачи-терапевты.
10. Врачи общей практики (семейный врач).
Диагностические и лечебные опции в отношении пациентов с АКР требуют мультидисциплинарного подхода.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Рекомендации по заместительной терапии при лечении митотаном**
1. Абсолютная недостаточность глюкокортикоидов
- Глюкокортикоиды: с начала лечения митотаном** дозы превышают стандартные:
-- Гидрокортизон** 50 - 75 мг/сут
-- У детей и подростков с АКР доза гидрокортизона** будет зависеть от уровня кортизола и АКТГ в плазме крови под контролем детского-врача эндокринолога
- Оценка адекватности заместительной терапии производится по клиническим критериям, включая артериальное давление, пульс, наличие/отсутствие аппетита, динамику массы тела. Также необходимо принимать во внимание уровень электролитов крови.
2. Минералкортикоидная недостаточность регулярно оценивается по уровню электролитов крови, коррекция - флудрокортизон**
3. Гипогонадизм у мужчин оценивается по клиническим проявлениям (эректильная дисфункция и гинекомастия), подтверждается результатами гормонального обследования, требует заместительной терапии.
4. Вторичный гипотиреоз регулярно оценивается по уровню ТТГ, Т4 св. (ТТГ - норма, снижение св. Т4 - снижен) и требует заместительной терапии.
Рекомендации по применению митотана** в качестве адьювантной терапии
-- Начальная доза #митотана** составляет 1 - 2 г/сут (2 - 4 табл/сут). Каждые 3 - 7 дней проводится повышение на 0.5 - 2 г/сут (с учетом переносимости) до дозы 4 - 8 г/сут (8 - 16 табл/сут), или до максимально переносимой дозы; препарат принимается 2 - 5 раз/сут во время еды [215, 225]. У детей и подростков начальная доза митотана составляет 1,5 г/м2 (50 мг/кг/сутки). Каждые 1 - 2 недели проводится повышение дозы на 20 мг/кг/сутки или на 500 мг/м2 до максимальной дозы 4 г/м2/сутки под контролем концентрации митотана** в сыворотке крови (норма 14 - 20 мкг/мл) [231, 240, 244].
-- Повышение дозы регулируется
- переносимостью препарата;
- достигнутой терапевтической концентрацией (14 - 20 мкг/мл)
-- Оценивать уровень митотана** в крови необходимо
- каждые 4 - 8 нед до достижения целевой зоны;
- при достижении целевой зоны каждые 2 - 3 мес в течение 2 лет, в дальнейшем возможна оценка через более длительные интервалы
-- Клиническая и топическая оценка проводится не реже 1 раз в 2 - 3 месяца
-- Необходимо определение уровня митотана** (A09.05.035) в крови при возникновении побочных эффектов
-- При возникновении побочных эффектов:
- незначительных/умеренных - продолжить прием митотана**, проводить симптоматическую терапию;
- значительных - вернутся к последней переносимой дозе, проводить симптоматическую терапию;
- тяжелых - прекратить прием митотана**, провести специфическое лечение симптомов, затем возобновить митотана**, начиная с малых доз.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
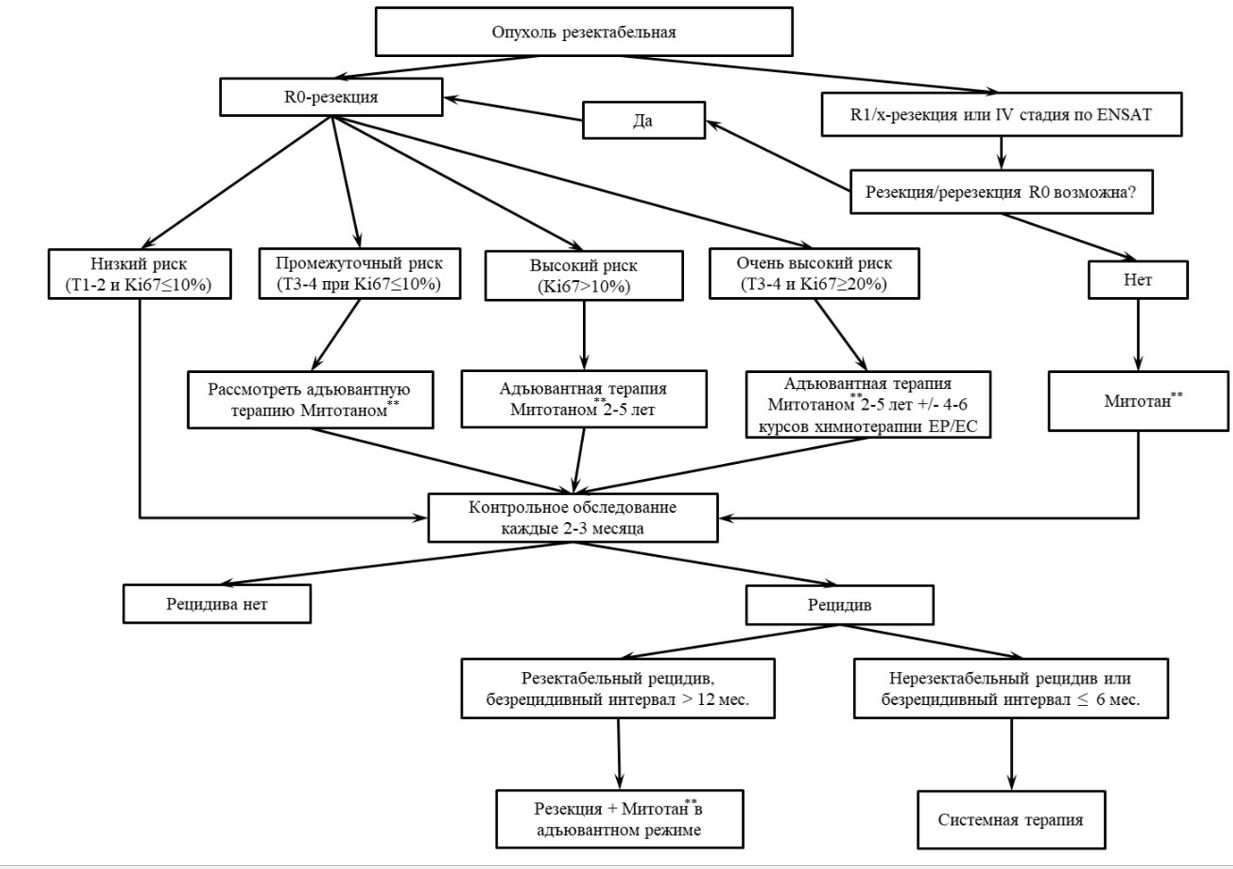
Рисунок 1. Алгоритм лечения при резектабельном АКР
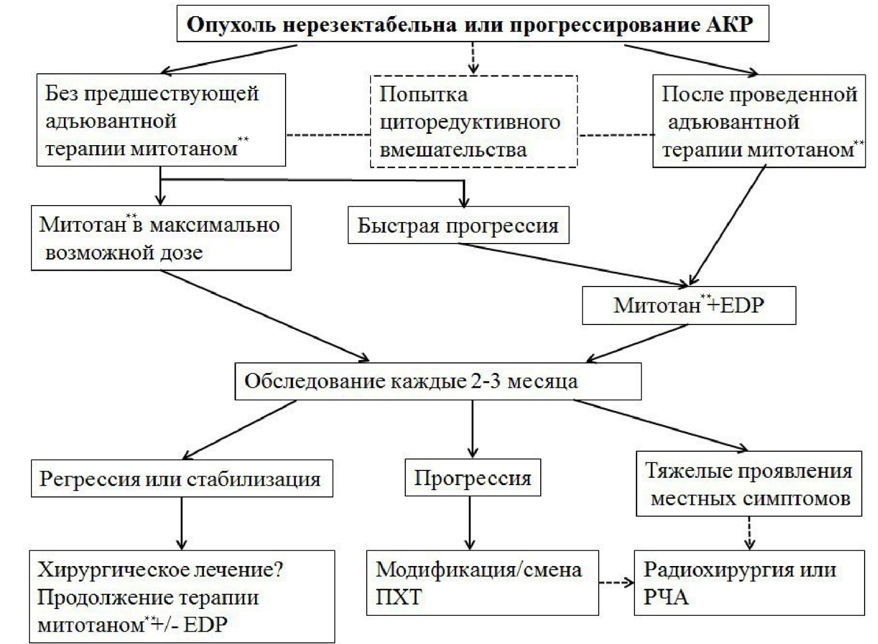
Рисунок 2. Алгоритм лечения при нерезектабельном или прогрессирующем АКР
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Рак коры надпочечника, или адренокортикальный рак (АКР) - редкое (орфанное) опухолевое заболевание, характеризующееся, как правило, поздним сроком выявления и, при несвоевременном и неполном лечении, неблагоприятным прогнозом. АКР примерно в половине наблюдений может сопровождаться повышенным выделением в кровь гормонов надпочечников [148].
АКР - одна из самых редких опухолей человека. Ежегодно выявляют 0,5 - 2 случая АКР на миллион населения. Женщины болеют в 2.5 раза чаще мужчин, средний возраст пациентов составляет 46 лет. В России АКР внесен в Перечень редких (орфанных) заболеваний Минздрава РФ.
Причины развития АКР
Причины возникновения и прогрессирования АКР, очевидно, заключаются в генетических дефектах. Они могут затрагивать исключительно клетки коры надпочечника, из которых и развивается опухоль. В этом случае заболевание затрагивает только самого пациента и не наследуется его детьми. Гораздо реже (3 - 5% от всех случаев АКР среди взрослых пациентов) АКР развивается из-за врожденных генетических дефектов, присутствующих во всех клетках организма. В этом случае говорят о развитии АКР в рамках наследственного синдрома. На сегодняшний день, АКР описан как компонент следующих синдромов: Ли-Фраумени, Линча, множественной эндокринной неоплазии 1 типа, Гарднера (семейный аденоматозный полипоз), комплекса Карни, Беквита-Вайдемана, нейрофиброматоза 1 типа. В случае, если у пациента выявлен АКР в составе наследственного синдрома, необходимо обследовать его кровных родственников и, прежде всего, детей.
Важно отметить, что среди всех случаев АКР в детском возрасте 80% обусловлены врожденными генетическими дефектами, приводящими к развитию синдрома Ли-Фраумени.
Четкой связи между возникновением АКР и образом жизни или внешними факторами до настоящего времени не обнаружено.
Проявления АКР
В 50 - 60% случаев АКР сопровождается повышенной продукцией гормонов коры надпочечников, а именно:
1. глюкокортикоиды (кортизол и кортизон);
2. минералокортикоиды (альдостерон, кортикостерон и дезоксикортикостерон);
3. половые гормоны (андрогены и эстрогены).
Большинство опухолей изолированно секретирует кортизол (до 60%) или андрогены в комбинации с кортизолом (30%).
Жалобы пациентов с гормонально-активным АКР определяются повышенной продукцией соответствующих гормонов:
- кортизола (общая слабость, головные боли, ожирение, с типичным отложением жировой клетчатки в области лица, шеи, груди, живота. Лицо при этом выглядит округлым, лунообразным. На щеках появляется пурпурный румянец. Руки и ноги наоборот становятся тонкими из-за уменьшения массы мышц. На коже появляются угревые высыпания. Раны и порезы заживают медленно. Возникают боли в костях и склонность к переломам, бесплодие, повышение артериального давления и др.);
- альдостерона (повышение артериального давления, слабость мышц вследствие потери калия);
- тестостерона (рост нежелательных волос на теле, понижение тембра голоса, увеличение клитора у женщин, повышение жирности и нечистота кожи);
- эстрогенов (импотенция, увеличение грудных желез у мужчин, маточные кровотечения у женщин в постменопаузе).
Гормонально-неактивные опухоли встречаются в 40% случаев и коварны потому, что долгое время могут никак о себе не заявлять и в дальнейшем, при увеличении размеров опухоли, проявляться общими неспецифичными симптомами: дискомфортом или болями в животе или спине, ощущением переполнения в животе, наличием объемного образования в брюшной полости, определяемого врачом или самостоятельно пациентом при ощупывании живота.
Выявление (диагностика) АКР
Широкое внедрение в клиническую практику методов лучевой диагностики, таких как ультразвуковое исследование (УЗИ) почек и надпочечников (A04.28.001), компьютерная томография (КТ) брюшной полости (A06.30.005.003), магнитно-резонансная томография (МРТ) брюшной полости (A05.30.005.001), привело к резкому увеличению числа случайно выявленных опухолей надпочечников. Случайно выявленная опухоль надпочечника может оказаться как гормонально-неактивной, так и активно производить различные гормоны (смотри выше); исходить из различных частей надпочечника, быть злокачественной или доброкачественной. Среди всех случайно выявленных опухолей надпочечника АКР встречается примерно в 4% случаев.
При подозрении на АКР проводится лабораторная диагностика, которая заключается в выявлении гормональных нарушений, характерных для гормонально-активного АКР. Для подтверждения/исключения гормональной активности опухоли рекомендованы следующие методы лабораторной диагностики:
- определение кортизола в ранние утренние часы на фоне подавляющего теста с #дексаметазоном**;
- при отсутствии физиологического подавления уровня кортизола - определение адренокортикотропного гормона в утренние часы;
- всем пациентам с выявленной опухолью надпочечника для исключения другой опасной опухоли - феохромоцитомы, показано определение норметанефрина и метанефрина в суточной моче (A09.28.034.001, A09.28.034.002) или плазме (A09.05.133.001, A09.05.133.002);
- при наличии у пациента с опухолью надпочечника артериальной гипертензии показано определение соотношения между уровнем альдостерона и активностью ренина плазмы для исключения первичного гиперальдостеронизма;
- при подозрении на изолированную или сочетанную (с гиперкортицизмом) опухолевую гиперпродукцию половых гормонов показано определение стероидных гормонов сыворотки крови (дегидроэпиандростерон-сульфат [A09.05.149], 17-гидроксипрогестерон [A09.05.139], андростендион [A09.05.146], тестостерон [A09.05.078], эстрадиол [A09.05.153] у мужчин и женщин в менопаузе).
Методы лучевой диагностики на современном этапе имеют важнейшее значение для дооперационного подтверждения диагноза АКР. И если наличие прямых признаков злокачественности опухоли, таких как прорастание в окружающие органы, метастатическое поражение лимфоузлов, печени, легких, делает диагноз АКР практически очевидным, то их отсутствие ставит задачу по выявлению признаков, характерных именно для этой опухоли.
Компьютерная томография (КТ) брюшной полости с внутривенным болюсным контрастированием [A06.30.005.003] - "золотой стандарт" лучевой диагностики опухолей надпочечников.
Ультразвуковое исследование (УЗИ) [A04.28.001] используется довольно часто в качестве первичного диагностического метода. УЗИ очень хорошо определяет опухоль, но, к сожалению, не всегда может точно определить происхождение этой опухоли. УЗИ может быть использовано для первичной диагностики опухолей надпочечников в случае невозможности выполнения компьютерной томографии.
Магнитно-резонансная томография (МРТ) головного мозга (A05.23.009.001) рекомендована для первичной диагностики опухолей надпочечников, а также для исключения метастазов в головном мозге. МРТ обладает высокой чувствительностью в выявлении опухолей надпочечников, оценки состояния опухоли, в том числе поражения соседних органов. Однако точность данного метода пока ниже, чем КТ.
Остеосцинтиграфия (сцинтиграфия костей всего тела) показана при подозрении на метастазы костей скелета.
Позитронно-эмиссионная томография (ПЭТ) с флудезоксиглюкозой [18F] (ФДГ) (A07.30.043 Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП, A07.30.043.001 Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) показана для определения стадии и распространенности процесса, а также в качестве диагностического метода, позволяющего определить злокачественный потенциал при небольших размерах опухоли (до 4 см).
Пункционная биопсия в случае АКР не имеет доказанных преимуществ, обладает низкой чувствительностью, недостаточной информативностью и высокой вероятностью осложнений, поэтому ее проведение не показано.
Лечение АКР
Диагностика и лечение АКР должны происходить с участием врача-онколога, врача-эндокринолога, врача-хирурга, врача-клинической лабораторной диагностики, врача-радиолога в специализированном учреждении/отделении.
Наиболее эффективным методом лечения является хирургический. При выявлении АКР на ранних стадиях заболевания, когда нет прорастания опухоли в жизненно важные органы и/или многочисленных метастазов, операция является первым этапом комплексной терапии. Далее при отсутствии метастазов хирургическое лечение может быть дополнено назначением ЛС в адъювантном режиме). Решение о лечении принимается на основании особенностей опухоли (прежде всего, индекс Ki-67) и течения АКР у данного пациента.
В случае наличия метастазов на момент выявления АКР или возникновения их в дальнейшем комплексное лечение должно включать и химиотерапию.
Множественные метастазы и/или прорастание опухоли в жизненно важные органы на момент постановки диагноза АКР, как правило, не позволяют провести адекватное хирургическое лечение или могут привести к серьезным осложнениям во время операции. Поэтому в такой ситуации лечение начинают с химиотерапии, что, в большинстве случае, приводит к уменьшению размеров опухолевых очагов; далее проводят операцию.
Дистанционная лучевая терапия (ДЛТ) показана в качестве паллиативной терапии при метастазах АКР в кости с болевым синдромом (Дистанционная лучевая терапия при поражении костей) и центральную нервную систему (Дистанционная лучевая терапия при поражении центральной нервной системы и головного мозга).
Прогноз
В целом, прогноз АКР определяется своевременностью выявления заболевания, эффективностью проводимого лечения и приверженностью пациента к терапии.
Лечение АКР является длительным и трудоемким процессом, требует усилий не только команды врачей и самого пациента. Приверженность к лечению, выполнение рекомендаций по своевременному обследованию и лечению, как правило, позволяют добиться улучшения или стабилизация АКР. Наиболее неблагоприятный прогноз отмечается у пациентов, которые отрицают свое заболевание и не выполняют рекомендаций лечащего врача.
Приложение Г1 - ГN
ШКАЛЫ
ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Название на русском языке: Шкала Вейсса для гистологической оценки злокачественности опухоли коры надпочечника
Оригинальное название: Wiess scale
Источник (публикация с валидацией):
Lau SK, Weiss LM. The Weiss system for evaluating adrenocortical neoplasms: 25 years later. Hum Pathol. 2009; 40(6): 757 - 768.
Тип: Шкала оценки
Назначение: гистологическая оценка злокачественности опухоли коры надпочечника
Таблица 8. Система балльной оценки злокачественного потенциала опухолей коры надпочечника Weiss
Критерий шкалы Вейсс
Описание
Высокий ядерный индекс (основан на критериях Fuhrman - grade III или IV)
Увеличенные, овальные или сегментированные ядра с крупнозернистым, гиперхромным хроматином и легко различимыми ядрышками.
Количество митозов более 5 на 50 полей зрения при большом увеличении
Оценка в 10 полях при большом увеличении, в зоне наибольшей митотической активности в каждом из 5 стекол, что в общей сложности составляет 50 полей зрения.
Патологические митозы
Атипичное распределение хромосом или избыточное количество митотических веретен деления с мультиполярной морфологической структурой.
Менее 25% клеток со светлой цитоплазмой
Светлые клетки, богатые липидами, с вакуолизированной цитоплазмой, напоминающие клетки пучковой зоны надпочечника.
Диффузный характер роста более 1/3 опухолевой ткани
Неструктурированные пласты клеток, занимающие более 1/3 опухолевой ткани.
Участки некроза опухоли
Сливающиеся участки некроза. Изолированный некроз отдельных клеток выявляется редко.
Венозная инвазия
Опухоль в виде слепков сосудов или полиповидных выступов в просвете сосуда, покрытых слоем эндотелиальных клеток. Необходимо отличать последние от свободно "плавающих" опухолевых клеток, которые могут быть артефактами.
Инвазия опухоли в синусоиды
Сосуды, выстланные эндотелием, без гладкомышечной стенки.
Инвазия в капсулу
Опухоль врастает или пенетрирует капсулу при наличии ассоциированной стромальной реакции.
Пояснения. Каждый из 9 критериев оценивается в 1 балл. При наборе 3 баллов и более по Weiss-шкале подтверждается высокий злокачественный потенциал опухоли и ставится диагноз АКР.
Приложение Г2
ШКАЛА
БАЛЛЬНОЙ ОЦЕНКИ ЗЛОКАЧЕСТВЕННОГО ПОТЕНЦИАЛА ОНКОЦИТАРНЫХ
ОПУХОЛЕЙ КОРЫ НАДПОЧЕЧНИКА
Название на русском языке: Шкала Вин-Вейсс-Виселия для гистологической оценки злокачественности онкоцитарной опухоли коры надпочечника
Оригинальное название: Lin-Weiss-Bisceglia scale
Источник (публикация с валидацией):
Bisceglia M. et al. Adrenocortical oncocytic tumors: Report of 10 cases and review of the literature//Int. J. Surg. Pathol. 2004. Vol. 12, N 3. P. 231 - 243.
Тип: Шкала оценки
Назначение: гистологическая оценка злокачественности онкоцитарной опухоли коры надпочечника
Таблица 9. Система балльной оценки злокачественного потенциала онкоцитарной опухоли коры надпочечника Lin-Weiss-Bisceglia
Определяющие критерии для включения опухоли в группу онкоцитарных
- Преобладание клеток с эозинофильной гранулярной цитоплазмой
- Высокое ядерно-цитоплазматическое соотношение
- Диффузный характер роста
Большие критерии
- Митотическая активность более 5 митозов в 50 полях зрения
- Атипичные митозы
- Венозная инвазия
Малые критерии
- Размер более 10 см и/или масса более 200 г
- Некроз
- Инвазия синусоидов
- Инвазия капсулы
Пояснение. Онкоцитарный вариант АКР диагностируется при наличии как минимум одного "большого критерия", онкоцитарная АКА с пограничным злокачественным потенциалом - при наличии как минимум одного "малого критерия", если отсутствуют все большие и малые критерии, онкоцитарная опухоль считается доброкачественной. Следует учитывать, что онкоцитарные клетки должны составлять более 90% площади опухоли для того, чтобы ее можно было рассматривать как полностью ("pure") онкоцитарное новообразование коры надпочечников. В противном случае необходимо применять критерии, используемые для диагностики классического варианта АКР.
Приложение Г3
ШКАЛА
БАЛЛЬНОЙ ОЦЕНКИ ЗЛОКАЧЕСТВЕННОГО ПОТЕНЦИАЛА ОПУХОЛЕЙ КОРЫ
НАДПОЧЕЧНИКА У ДЕТЕЙ
Название на русском языке: Критерии Виенеке для гистологической оценки злокачественности опухоли коры надпочечника у детей
Оригинальное название: Wieneke/Armed Forces Institute of Pathology criteria
Источник (публикация с валидацией):
Wieneke J.A. et al. Adrenal cortical neoplasms in the pediatric population: A clinicopathologic and immunophenotype analysis of 83 patients//Am J Surg Pathol. 2003. N 27. P. 867 - 881.
Тип: Шкала оценки
Назначение: гистологическая оценка злокачественности опухоли коры надпочечника у детей
Таблица 10. Критерии Wieneke для определения злокачественности опухолей коры надпочечника у детей (возраст < 20 лет) [53]
1. Масса опухоли > 400 г
2. Размер опухоли > 10.5 см
3. Локальная инвазия и/или распространение в прилежащие органы
4. Инвазия полой вены
5. Венозная инвазия
6. Инвазия капсулы
7. Наличие опухолевого некроза
8. > 15 митозов на 20 полей зрения при увеличении x 400
9. Присутствие атипичных митозов
Ключ:
0 - 2 критерия - доброкачественная опухоль, благоприятный прогноз.
3 критерия - неопределенный злокачественный потенциал
> 3 критериев - злокачественная опухоль, неблагоприятный прогноз.
Приложение Г4
КРИТЕРИИ ОЦЕНКИ ОТВЕТА ОПУХОЛИ НА ЛЕЧЕНИЕ (RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1)
Оригинальное название: Response evaluation criteria in solid tumors 1.1 (RECIST 1.1)
Источник (публикация с валидацией):
Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009, 45(2): 228 - 247
Источник (на русском языке):
Гомболевский ВА, Лайпан АШ, Шапиев АН, Владзимирский АВ, Морозов СП (ред.): Методические рекомендации по применению критериев ответа солидных опухолей на химиотерапевтическое лечение (RECIST 1.1). Методические рекомендации N 46; 2018. http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf
Тип: Шкала оценки
Назначение: оценка ответа на химиотерапевтическое лечение
Таблица 20. Оценка размеров основного опухолевого очага
Полный ответ
(Complete Response - CR)
Исчезновение всех экстранодальных целевых образований. Все патологические лимфатические узлы должны уменьшиться < 10 мм по короткой оси в абсолютном значении.
Частичный ответ
(Partial Response - PR)
Уменьшение суммы наибольших размеров очагов более чем на 30%; для сравнения берется первичное исследование.
Прогрессирование заболевания (Progressive Disease - PD)
- Увеличение суммы наибольших размеров не менее чем на 20% по сравнению с временной точкой, имеющей наименьшую сумму наибольших размеров (надир)
- Сумма наибольших размеров должна демонстрировать абсолютное увеличение размеров не менее чем на 5 мм.
- Достоверное появление нового опухолевого очага
Стабилизация заболевания (Stable Disease - SD)
Несоответствие критериям CR или PR при отсутствии PD.
Таблица 21. Оценка метастатических очагов
Полный ответ (Complete Response - CR)
- Исчезновение всех дополнительных очагов и нормализация уровня опухолевых маркеров.
- Все лимфатические узлы должны иметь размер менее 10 мм по короткой оси.
- Нормализация уровня опухолевых маркеров
Прогрессирование заболевания (Progressive Disease - PD)
Однозначная прогрессия дополнительных очагов, появление одного или нескольких новых очагов.
Таблица 22. Суммарная оценка заболевания
Целевые очаги
Нецелевые очаги
Новые очаги
Общий ответ
Полный ответ
Полный ответ
Нет
Полный ответ
Полный ответ
Частичный ответ/стабильный процесс
Нет
Частичный ответ
Полный ответ
Нельзя оценить
Нет
Частичный ответ
Частичный ответ
Нет прогрессирования заболевания или нельзя оценить
Нет
Частичный ответ
Стабильное заболевание
Нет прогрессирования заболевания или нельзя оценить
Нет
Стабильное заболевание
Нельзя оценить
Нет прогрессирования заболевания
Нет
Нельзя оценить
Прогрессирование заболевания
Любое состояние
Любое состояние
Прогрессирование заболевания
Любое состояние
Прогрессирование заболевания
Любое состояние
Прогрессирование заболевания
Любое состояние
Любое состояние
Есть
Прогрессирование заболевания
Приложение Г5
КРИТЕРИИ АДЕКВАТНОСТИ ОПЕРАЦИИ
Название на русском языке: Классификаций резидуальных опухолей (R Классификация)
Оригинальное название: Residual Tumour (R) Classification
Источник (публикация с валидацией):
Brierley J, Gospodarowicz MK, Wittekind Ch (eds). TNM classification of malignant tumours. Oxford, UK; Hoboken, NJ: John Wiley & Sons, Inc., 2017.
Тип: Шкала оценки
Назначение: оценка адекватности хирургического лечения по наличию/отсутствию резидуальной опухоли
Таблица 23. Классификаций резидуальных опухолей (R Классификация)
R0
Резидуальная опухоль отсутствует (полная резекция с отсутствием признаков опухолевого роста)
R1
Резидуальная опухоль определяется микроскопически (признаки опухолевого роста в краях удаленной ткани)
R2
Резидуальная опухоль определяется макроскопически (остатки опухоли, макроскопически видимые во время операции)
Rx
Недостаточно данных для определения резидуальной опухоли (оценить адекватность операции невозможно или данные сомнительны)
