"Клинические рекомендации "Синдром поликистозных яичников"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
СИНДРОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E28.2
Год утверждения (частота пересмотра): 2025 Пересмотр не позднее: 2027
ID: 910_1
Возрастная категория: Взрослые, Дети
Специальность:
Разработчик клинической рекомендации Российская ассоциация эндокринологов, Российское общество акушеров-гинекологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АД - артериальное давление;
АКТГ - адренокортикотропный гормон;
ВРТ - вспомогательные репродуктивные технологии;
ДЭАС - дегидроэпиандростерона сульфат;
ИМТ - индекс массы тела;
ИР - инсулинорезистентность;
ИСА - индекс свободных андрогенов;
КГК - комбинированные гормональные контрацептивы (АТХ Гестагены и эстрогены, фиксированные комбинации);
ЛГ - лютеинизирующий гормон;
МКБ 10 - международная классификация болезней 10 пересмотра;
МРТ - магнитно-резонансная томография;
нВДКН - неклассическая форма врожденной дисфункции коры надпочечников;
НТГ - нарушение толерантности к глюкозе;
ОТ - окружность талии;
ПГТТ - пероральный глюкозотолерантный тест (Проведение глюкозотолерантного теста);
ПКЯ - поликистозные яичники;
СД - сахарный диабет;
СГЯ - синдром гиперстимуляции яичников;
СОАС - синдром обструктивного апноэ сна;
СПЯ - синдром поликистозных яичников;
ССЗ - сердечно-сосудистые заболевания;
ГСПГ - глобулин, связывающий половые гормоны;
ТГ - триглицериды;
ТТГ - тиреотропный гормон;
УЗИ - ультразвуковое исследование;
ФСГ - фолликулостимулирующий гормон;
ХГЧ - хорионический гонадотропин человека;
ХС - холестерин;
ХС ЛПНП - липопротеины низкой плотности;
ХС ЛПВП - липопротеины высокой плотности;
ЦА/КГТ - ципротерон/комбинированные гормональные контрацептивы (КГК (АТХ - гестагены и эстрогены, фиксированные сочетания);
ГЭ - гиперплазия эндометрия;
РЭ - рак эндометрия;
ASRM - American Society for Reproductive Medicine;
ESHRE - European Society of Human Reproduction and Embryology;
HOMA - Homeostasis model assessment
Термины и определения
Ановуляция (от латинского "an" - отсутствие, и "ovulatio" - овуляция) - состояние, в процессе которого яйцеклетка не созревает и не выходит из фолликула. Может быть как при регулярном, так и при нарушенном менструальном цикле.
Гиперандрогения - состояние, связанное с избыточной секрецией андрогенов и/или усиленным их воздействием на организм, которое у женщин чаще всего проявляется вирилизацией (появление мужских черт) и андрогензависимой дермопатией (акне, гирсутизм, алопеция).
Гирсутизм - это избыточный рост терминальных волос у женщин по мужскому типу. Терминальные - темные, жесткие и длинные волосы, в отличие от пушковых, которые слабоокрашены, мягкие и короткие.
Гипертрихоз - заболевание, проявляющееся в избыточном росте волос, не свойственном данному участку кожи, не соответствующем полу и/или возрасту.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Синдром поликистозных яичников (СПЯ) - полигенное эндокринное расстройство, обусловленное как генетическими, так и эпигенетическими факторами. В зависимости от периода жизни женщины от менархе до перехода к менопаузе клиническая картина, диагностика, лечебная тактика заболевания различна. СПЯ имеет комплекс репродуктивных, метаболических и психологических особенностей [1].
СПЯ у подростков <1> диагностируется при наличии клинической и/или биохимической гиперандрогении и олиго-аменореи с менархе [143].
--------------------------------
<1> В данных клинических рекомендациях различия в оценках показателей и тактике ведения у детей и подростков описываются отдельно.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
СПЯ является одним из наиболее частых эндокринных расстройств у женщин репродуктивного возраста. СПЯ является фактором риска развития бесплодия, андрогензависимой дермопатии (акне, гирсутизма, алопеции), нарушений углеводного обмена (НТГ, СД 2 типа), дислипидемий, сердечно-сосудистой патологии, гиперпластических процессов эндометрия, нарушений психологического статуса (например, депрессия, тревожные расстройства, нарушения настроения), онкологических заболеваний. Общий риск рака эндометрия, яичников, молочной железы повышен при СПЯ, чему в значительной степени способствует наличие у 40 - 85% женщин избыточной массы тела или ожирения [2 - 4, 98 - 100]. Несмотря на многочисленные исследования, до настоящего времени так и не удалось сформулировать единую концепцию патогенеза и этиологии СПЯ. В патогенезе заболевания условно можно выделить нарушения в четырех различных отделах нейроэндокринной системы, каждое из которых, может претендовать на стартовую роль. Это нарушения на уровне гипоталамо-гипофизарной системы, яичников, надпочечников и периферических инсулинчувствительных тканей [141 - 142]. У подростков с СПЯ метаболический синдром встречается в 10,8 - 33,3% случаях, что в 3 - 5 раз чаще по сравнению с сопоставимой по возрастному критерию и индексу массы тела группой здоровых девушек.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В общей популяции женщин репродуктивного возраста распространенность синдрома составляет от 8 до 21%. Показатели распространенности СПЯ зависят от особенностей популяционной выборки и используемых критериев диагностики [5].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Дисфункция яичников (E28):
E28.2 - синдром поликистоза яичников.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Европейским обществом репродукции (European Society of Human Reproduction and Embryology, ESHRE) и эмбриологии человека и Американским обществом репродуктивной медицины (American Society for Reproductive Medicine, ASRM) (Роттердам, 2003) [6, 7] выделены основные критерии СПЯ: олигоановуляция, гиперандрогения (клиническая или биохимическая), поликистозная морфология яичников по данным ультразвукового исследования (УЗИ). Согласно ASRM/ESHRE (2003), International PCOS Network (2023) наличие любых 2-х из 3-х основных критериев определяет наличие определенного вида (фенотипа) СПЯ [1, 5, 7] (табл. 1).
Таблица 1. Основные виды (фенотипы) СПЯ
Ановуляция
Гиперандрогения (клиническая и/или биохимическая)
Поликистозная структура яичников по данным УЗИ
Вид (фенотип) A ("классический")
+
+
+
Вид (фенотип) B ("ановуляторный")
+
+
Вид (фенотип) C ("овуляторный")
+
+
Вид (фенотип) D ("неандрогенный")
+
+
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
См. раздел 2.1 "Жалобы и анамнез"
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагностика СПЯ осуществляется на основании:
1) Клинико-анамнестических данных - олиго-аменорея;
2) Физикального обследования - проявления клинической гиперандрогении (гирсутизма);
3) Лабораторного обследования - олигоановуляция, биохимическая гиперандрогения;
4) Инструментального обследования - поликистозная морфология яичников по данным УЗИ органов малого таза комплексного (трансвагинального и трансабдоминального).
Диагностические подходы отличаются у подростков и женщин репродуктивного возраста. У подростков СПЯ диагностируется при наличии клинической и/или биохимической гиперандрогении и олиго-аменореи с менархе, при этом ультразвуковые критерии практически не используются.
До начала обследования необходимо получить информированное добровольное у родителя (иного законного представителя) у пациентки в возрасте до 15 лет (больной наркоманией - в возрасте 16 лет или пациентки, признанной в установленном законом порядке недееспособной в возрасте от менархе до 17 лет включительно, если такая девочка по своему состоянию не способна дать согласие на медицинское вмешательство) в порядке и по форме, утвержденными приказом Минздрава России от 12.11.2021 N 1051н "Об утверждении порядка дачи информированного добровольного согласия на медицинское вмешательство и отказа от медицинского вмешательства в отношении определенных видов медицинских вмешательств, форм информированного добровольного согласия на медицинское вмешательство и форм отказа от медицинского вмешательства".
2.1 Жалобы и анамнез
Пациентки с СПЯ предъявляют жалобы на:
- Задержки менструации
- Проявления андрогенизации (акне, избыточный рост волос на теле и лице, алопеция)
- Бесплодие
- Избыточную массу тела или ожирение, набор веса
- При сборе анамнеза у пациенток с СПЯ рекомендовано акцентировать внимание на наличие у родственников по 1 линии родства СПЯ или клинических проявлений синдрома в отсутствие установленного диагноза (олиго/аменореи, бесплодия), а также на сопутствующие гинекологические и экстрагенитальные состояния, ассоциированные с СПЯ, такие как аномальные маточные кровотечения (в том числе - ювенильные) и диагностированную гиперплазию эндометрия в анамнезе, сахарный диабет, артериальную гипертензию, обструктивное апноэ сна и другие [1, 2, 8, 23, 30].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.2 Физикальное обследование
При наличии клинической гиперандрогении (акне, избыточный рост волос на теле и лице, выпадение волос на волосистой части головы) необходимо провести определенные оценочные методики.
- Рекомендован подсчет гирсутного числа женщинам с жалобами на избыточный рост волос на лице и теле для оценки степени выраженности гирсутизма по модифицированной Шкале Ферримана-Галлвея (приложение Г1, рис. 1) [5, 8, 9, 10, 11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Распространенность гирсутизма при классическом фенотипе СПЯ достигает 75%. Согласно последним рекомендациям, о гирсутизме, как правило, свидетельствует сумма баллов по модифицированной Шкале Ферримана-Галлвея >= 4 - 6, однако имеются расовые особенности оценки гирсутизма [1]. У некоторых представительниц европеоидной и негроидной рас патогномоничным является повышение значения суммы баллов по указанной шкале >= 8. У представительниц Юго-Восточной Азии диагностически значимо повышение суммы баллов по данной шкале >= 3 [12]. Более выраженный гирсутизм характерен для женщин Ближнего Востока, Латинской Америки и Средиземноморья [1]. Однако степень гирсутизма при СПЯ не всегда коррелирует со степенью избытка андрогенов. Тяжелый гирсутизм может наблюдаться при незначительном повышении уровня андрогенов в сыворотке крови, а значительное повышение показателей не всегда сопровождается гирсутизмом. Это несоответствие между уровнем гормонов и степенью выраженности гирсутизма отражает разную индивидуальную чувствительность ткани-мишени к андрогенам.
- Рекомендована оценка стадии полового развития по Таннеру у подростков с СПЯ с балльной оценкой молочных желез (B1-5), лобкового оволосения (P1-5), наличия и характера ритма менструаций (Me0-3) [143, 145]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Балльная система Ферримана-Галлвея не адаптирована для детей, поэтому Обществом по гиперандрогении (AES) и Обществом по СПЯ не используется для оценки гирсутизма у подростков [143].
- Рекомендован прием (осмотр, консультация) врача-дерматовенеролога при наличии жалоб на акне и выпадение волос для выявления причины этих патологических состояний [10, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: Нет валидированных оценочных шкал для определения степени тяжести угревых высыпаний. Наличие акне и алопеции не являются надежными критериями гиперандрогении. У подростков в качестве клинического признака гиперандрогении рассматриваются только выраженные акне.
- Рекомендовано проводить физикальное обследование с оценкой наличия черного акантоза при СПЯ для исключения клинических признаков инсулинорезистентности [13, 14, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: К клиническим маркерам ИР у пациенток с СПЯ относится черный акантоз (папиллярно-пигментная дистрофия кожи в виде локализованных участков бурой гиперпигментации в области кожных складок, чаще шеи, подмышечных впадин, паховой области, которые гистологически характеризуются гиперкератозом и папилломатозом).
- Рекомендовано всем пациенткам с подозрением на СПЯ проводить измерения роста и массы тела с вычислением ИМТ для диагностики избыточной массы тела или ожирения (приложение А3.1) [1, 7, 17, 18, 19, 20, 109]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: ИМТ вычисляется по формуле: ИМТ (кг/м2) = масса тела (кг)/рост2 (м2). Повышение ИМТ при СПЯ встречается чаще, чем в общей популяции, что в 4 раза увеличивает риск СД 2 типа в этой популяции [90].
Ожирение при СПЯ - это:
- дополнительный фактор риска сердечно-сосудистых заболеваний;
- фактор риска рака эндометрия (который встречается в 2 - 6 раза чаще в сравнении с женщинами без СПЯ);
- усугубляющий фактор риска депрессивных и тревожных состояний;
- фактор, влияющий на процент рождаемости, ответ на восстановление репродуктивной функции и исходы беременности.
- Рекомендовано всем пациенткам с подозрением на СПЯ проводить измерение окружности талии (ОТ) (A02.03.007.004) для диагностики абдоминального (висцерального) ожирения (приложение А3.1) [17, 18, 19, 20].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Показателем абдоминального (висцерального или мужского) типа ожирения (с которым и связаны более высокие риски нарушений углеводного обмена и сердечно-сосудистых заболеваний) у женщин является окружность талии > 80 см. В Японии используют значения 85 см для мужчин и 90 см для женщин [101]. Женщины с СПЯ чаще имеют абдоминальное ожирение, которое ассоциировано с метаболическими заболеваниями. Абдоминальное ожирение напрямую связано с инсулинорезистентностью (ИР). Измерение окружности талии (A02.03.007.004) - информативный и простой антропометрический метод, позволяющий выявить метаболические нарушения, поскольку этот показатель прямо коррелирует с количеством абдоминального жира.
2.3 Лабораторные диагностические исследования
- Рекомендовано всем женщинам с подозрением на СПЯ исследование уровня общего тестостерона в крови, исследование уровня глобулина, связывающего половые гормоны, в крови методом иммуноферментного анализа с расчетом индекса свободных андрогенов для оценки наличия биохимической гиперандрогении [1, 2, 4, 7, 21 - 23, 120]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: индекс свободных андрогенов (ИСА) - это показатель соотношения общего тестостерона к глобулину, связывающему половые стероиды (ГСПГ). Для расчета ИСА используют формулу: ИСА = общий тестостерон (нмоль/л)/ГСПГ (нмоль/л) x 100. Следует учитывать, что у большинства подростков уровень андрогенов достигает "взрослого" диапазона не ранее 12 - 15 лет, и оценка биохимической гиперандрогении носит необъективный характер [127].
- Рекомендовано для оценки наличия биохимической гиперандрогении у пациенток с подозрением на СПЯ выполнение исследований уровня общего тестостерона в крови, уровня свободного тестостерона в крови методом жидкостной хроматографии с масс-спектрометрией, газовой хроматографии с масс-спектрометрией [1, 2, 4, 7, 21 - 23, 119].
Для взрослых пациенток Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Для подростков Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: При интерпретации показателей тестостерона необходимо руководствоваться возрастными референсными интервалами, используемыми лабораториями [127, 147].
- Рекомендовано всем пациенткам с СПЯ исследование уровня дегидроэпиандростерона сульфата (ДГЭА-С) в крови и уровня андростендиона в крови в случае, когда уровни общего и свободного тестостерона не повышены, хотя эти маркеры представляют ограниченную дополнительную информацию в диагностике СПЯ [1, 2, 4, 7, 21 - 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: О гиперандрогенемии свидетельствует повышение хотя бы одного любого из определяемых андрогенов, индекса свободных андрогенов.
- Рекомендовано исследование уровня антимюллерова гормона (АМГ) в крови у взрослых женщин с подозрением на СПЯ в качестве одного из диагностических критериев СПЯ [127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Повышенный уровень АМГ не является обязательным критерием диагностики СПЯ у взрослых и его не следует использовать как единственный критерий диагностики СПЯ. Сывороточный АМГ следует использовать только в соответствии с диагностическим алгоритмом, учитывая, что у пациенток с нерегулярным менструальным циклом и гиперандрогенией уровень АМГ не является необходимым для диагностики СПЯ. Оценку уровня АМГ в сыворотке крови не следует проводить у подростков. На уровни АМГ может влиять возраст женщины, индекс массы тела, прием гормональных препаратов, например, гормональной контрацепции, хирургическое лечение заболеваний яичников [127].
- Не рекомендована оценка биохимической гиперандрогении у женщин, принимающих комбинированные гормональные контрацептивы (по анатомо-терапевтическо-химической классификации (АТХ) - гестагены и эстрогены, фиксированные сочетания)) или иные гормон-содержащие препараты, влияющие на уровни тестостерона вследствие возможного получения ложных результатов (по АТХ - Спиронолактон**, Антиандрогены) [1, 2, 4, 7, 21 - 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Если необходима оценка уровня андрогенов в сыворотке крови, то необходима отмена гормональных препаратов на 3 месяца. На время отмены КГК (по АТХ - гестагены и эстрогены, фиксированные сочетания) женщинам, не планирующим беременность, необходимо предлагать негормональные методы контрацепции.
- Рекомендована оценка гликемического статуса путем проведения глюкозотолерантного теста 2-часового перорального (ПГТТ) с 75 г декстрозы (МНН декстроза, порошок для приготовления раствора для приема внутрь) или исследование уровня гликированного гемоглобина в крови пациенткам с СПЯ без сахарного диабета, вне зависимости от ИМТ и других факторов риска для выявления нарушений углеводного обмена, в последующем каждые 1 - 3 года с учетом индивидуальных факторов риска нарушений углеводного обмена [1, 2, 4, 118, 127 - 130].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Глюкозотолерантный тест является оптимальным для скрининга и диагностики нарушения толерантности к глюкозе и СД2 у женщин с СПЯ и имеет преимущества над исследованием уровня глюкозы в крови (натощак) и гликированного гемоглобина [148].
У женщин репродуктивного возраста с СПЯ чаще, чем в общей популяции, развиваются нарушения углеводного обмена (в 5 раз - в Азии, в 4 раза - в США и в 3 раза - в Европе), независимо от ожирения, но усугубляется его наличием. Оценку показаний к проведению ПГТТ у пациенток с СПЯ необходимо проводить на первичной консультации, на этапе прегравидарной подготовки и в период беременности между 24-й и 28-й неделями (при отсутствии прегестационного сахарного диабета) [1, 2, 4, 7, 21 - 23, 127 - 130].
- Не рекомендовано рутинное исследование уровня инсулина плазмы крови и индексов ИР у пациенток с подозрением на СПЯ или при верифицированном СПЯ, ввиду их ограниченной клинической значимости [1, 24 - 30, 35]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: В ряде случаев для оценки ИР может использоваться значение индекса HOMA (уровень глюкозы натощак (ммоль/л) x уровень инсулина натощак (мЕд/л)/22,5, в норме для женщин репродуктивного возраста - менее 2,7). Индекс HOMA не относят к числу надежных маркеров ИР у подростков [127].
- Рекомендовано исследовать липидный спектр сыворотки крови (Исследование уровня холестерина в крови, исследование уровня холестерина липопротеинов высокой плотности в крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня триглицеридов в крови) для диагностики дислипидемии всем пациенткам с СПЯ [1, 6].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарий: Наиболее частой формой нарушений метаболизма липидов у пациенток с СПЯ является дислипидемия (повышение ХС, ТГ, ХС ЛПНП и/или снижение ХС ЛПВП), встречающаяся чаще у пациенток с ожирением. Оценка липидограммы проводится 1 раз в год при различных дислипидемиях и/или избыточной массе тела [1, 6].
2.4 Инструментальные диагностические исследования
- Рекомендовано проведение ультразвукового исследования (УЗИ) органов малого таза комплексного (трансвагинального и трансабдоминального) пациенткам с СПЯ или при подозрении на него для верификации диагноза [1, 7, 38 - 41, 116].
Для взрослых пациенток Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Для подростков Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Количество фолликулов в яичнике - в срезе и объем яичника, следует считать ультразвуковыми маркерами поликистозных яичников у взрослых [127].
Ультрасонографические критерии поликистозных яичников:
- при использовании трансвагинальных датчиков >= 8 МГц - наличие >= 20 фолликулов диаметром 2 - 9 мм в любом яичнике и/или увеличение объема любого яичника >= 10 см3 (при отсутствии желтого тела, кист или доминантных фолликулов),
- при использовании трансвагинальных датчиков с меньшими разрешающими характеристиками или при трансабдоминальном исследовании - увеличение объема любого яичника >= 10 см3 (при отсутствии желтого тела, кист или доминантных фолликулов)
При наличии желтого тела, кист или доминантных фолликулов УЗИ выполняется повторно, после спонтанной или индуцированной менструации.
- Не рекомендовано использовать ультразвуковые признаки поликистозных яичников у подростков с подозрением на СПЯ в течение 8 лет после наступления менархе в качестве диагностического критерия в связи с высокой частотой мультифолликулярного строения яичников в этом возрасте [1, 38, 39, 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендовано использование трансвагинального доступа при УЗИ органов малого таза комплексного (трансвагинального и трансабдоминального) или УЗИ матки и придатков трансвагинальное при сохранном менструальном цикле - в фолликулярной фазе, а при олиго/аменорее - либо независимо от менструации, либо на 3 - 5 дни после менструации, индуцированной прогестагенами [1, 7, 38]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Данные критерии не следует применять у женщин, получающих КГК (комбинированные гормональные контрацептивы) (АТХ Гестагены и эстрогены, фиксированные комбинации).
2.5 Иные диагностические исследования
Диагностика нерегулярного менструального цикла (олиго-аменорея)
- Рекомендовано использовать следующие критерии диагностики нерегулярного менструального цикла у женщин репродуктивного периода:
- продолжительность цикла более 35 дней или менее 8 менструальных циклов в год у женщин;
- продолжительность цикла менее 21 дней [144].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендовано использовать следующие критерии нерегулярного цикла у подростков [102, 144]:
- продолжительность > 90 дней для любого цикла на первом году после менархе, < 21 или > 45 дней в период от 1 до 3 лет после менархе,
- первичная аменорея к 15-летнему возрасту или после 3-х лет после телархе, < 21 или > 35 дней или < 8 циклов в год в период от 3-х лет после менархе.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Используя данные обширных эпидемиологических исследований, FIFA ранее определила, что для лиц в возрасте 18 - 45 лет и с использованием процентилей 5 - 95% крупномасштабных популяционных исследований нормальная частота менструаций составляет 24 - 38 дней. В этих исследованиях не проводилась оценка наличия овуляции [145, 146].
Для подростков, которые имеют характерные признаки СПЯ, но не соответствуют диагностическим критериям, можно рассматривать "повышенный риск" формирования СПЯ и назначить повторную оценку показателей через 1 год [1].
- Рекомендовано при регулярном менструальном цикле исследование уровня прогестерона в крови в прогнозируемой лютеиновой фазе для верификации овуляторной дисфункции у женщин репродуктивного периода [1, 7, 38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Исследование проводится на 6 - 8 день после предполагаемой овуляции. Уровень прогестерона менее 3 нг/мл в середине лютеиновой фазы свидетельствует об отсутствии овуляции, ниже 10 нг/мл или сумма измерений в 3 последовательных циклах менее 30 нг/мл может свидетельствовать о неполноценной лютеиновой фазе менструального цикла.
При регулярных менструальных циклах возможна оценка овуляторной функции яичников по данным УЗИ органов малого таза комплексного (трансвагинального и трансабдоминального) на 20 - 24 день менструального цикла.
Оценка риска сердечно-сосудистых заболеваний (ССЗ) у женщин с СПЯ
- Рекомендовано проводить измерение АД на периферических артериях женщинам с СПЯ ежегодно, а также при планировании беременности в естественном цикле и при планировании протокола ВРТ, наличие жалоб чаще в связи с повышенным риском развития ССЗ [1, 7, 46 - 51, 113, 127, 137 - 139]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендовано проводить измерение ОТ (A02.03.007.004) и расчет ИМТ при каждом визите у всех женщин с СПЯ в связи с повышенным риском ССЗ [1, 7, 46 - 51, 113].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
- Рекомендовано проводить оценку липидного профиля (анализ крови по оценке нарушений липидного обмена биохимический) и оценку риска ССЗ у пациентов с СПЯ на первичном приеме (осмотр, консультация) врача-акушера-гинеколога в связи с повышенным риском ССЗ, а далее частота исследования зависит от выявленной патологии [1, 7, 46 - 51, 113].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: К группе риска относят женщин с СПЯ при наличии хотя бы одного из следующих факторов: ожирение (особенно абдоминальное), курение, гипертензия, гиподинамия, дислипидемия, субклинический атеросклероз, нарушение толерантности к глюкозе, семейный анамнез по ранним ССЗ (менее 55 лет у родственников мужского пола, менее 65 лет - у родственниц женского пола).
- Рекомендовано женщинам с СПЯ, имеющим избыточную массу тела или ожирение, прием (осмотр, консультация) врача-диетолога, прием (тестирование, консультация) медицинского психолога для коррекции рациона питания и исключения/выявления нарушений пищевого поведения, а также тревожно-депрессивных расстройств [127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Цели лечения: нормализация массы тела и коррекция метаболических нарушений, устранение проявлений андрогензависимой дерматопатии, регуляция менструального цикла для профилактики гиперплазии эндометрия, восстановление овуляторного менструального цикла и фертильности, предупреждение поздних осложнений СПЯ.
Ведение пациенток проводится с учетом основных жалоб, репродуктивных планов, наличия риска сердечно-сосудистых заболеваний и прочих факторов.
КГК, #метформин**, #летрозол и другие лекарственные препараты при СПЯ используются off label (без официальных показаний в инструкции), однако имеется множество научных исследований, подтверждающих их эффективность. Врачи должны информировать пациенток и обсуждать эффективность, возможные побочные эффекты и последствия терапии для выработки персонализированной тактики ведения. Способ применения и дозы представлены ниже.
3.1 Консервативное лечение
- Рекомендовано использовать у пациенток с СПЯ модификацию образа жизни, включающую физические упражнения и рациональное сбалансированное питание, для достижения и поддержания нормальной массы тела, общего состояния здоровья и качества жизни на протяжении всей жизни [56 - 58].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Достижимые цели, такие как потеря веса на 5 - 10% в течение 6 месяцев у пациенток с избыточным весом, приводят к значительным клиническим улучшениям. Снижение массы тела на фоне модификации образа жизни у пациенток с СПЯ способствует нормализации менструальной функции и улучшению ряда метаболических показателей (преимущественно - углеводного обмена), однако ответ имеет индивидуальный характер. При СПЯ недостаточно доказательств предпочтения какой-либо конкретной диеты. Важно адаптировать диетические изменения в пищевых привычках пациентки с применением гибкого и индивидуального подхода по снижению калорийности питания и избегать излишне ограничительных и несбалансированных диет. Физическая активность у взрослых 18 - 64 лет должна составлять минимум 150 минут в неделю физической активности средней интенсивности или 75 минут в неделю высокой интенсивности или эквивалентная комбинация обоих, включая упражнения на укрепление мышц в течение 2 дней в неделю, не следующих подряд.
- Рекомендовано проводить терапию комбинированными гормональными контрацептивами (КГК (АТХ - гестагены и эстрогены, фиксированные сочетания) у пациенток с СПЯ, с нарушениями менструального цикла и клиническими проявлениями гиперандрогении (гирсутизм и акне) в качестве терапии первой линии [1, 59 - 64, 127, 140].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: Женщинам с СПЯ, не заинтересованным в беременности, назначаются КГК с минимально эффективной дозой этинилэстрадиола (20 - 30 мкг) или натуральными эстрогенами, с учетом критериев приемлемости контрацепции ВОЗ [65] и Национальных критерием приемлемости методов контрацепции [140]. КГК можно рассматривать в качестве терапии у подростков в группе риска развития СПЯ или с диагноз "формирующийся СПЯ" с гирсутизмом и нерегулярным менструальным циклом. Прогестагенный компонент КГК подавляет секрецию ЛГ, что приводит к снижению продукции овариальных андрогенов; эстрогенный компонент способствует повышению уровней ГСПГ и снижению свободно циркулирующего тестостерона. Для терапии у взрослых женщин с СПЯ может использоваться любой КГК с любой дозой эстрогенов, однако препараты, содержащие 35 мкг этинилэстрадиола и ципротерон (эффективнее при гирсутизме, биохимической гиперандрогении по сравнению с обычными КГК), не должны рассматриваться как препараты первой линии при СПЯ из-за побочных эффектов, включая риск венозных тромбоэмболий [1]. Следует выбирать препарат с гестагеном без остаточной андрогенной активностью. Необходимо также учитывать наличие таких ассоциированных с СПЯ состояний, как избыточный вес и ожирение, гиперлипидемия и артериальная гипертензия. Результаты исследований показывают, что у пациенток с СПЯ в 3 раза чаще встречается гипергомоцистеинемия, являющаяся фактором риска сердечно-сосудистой патологии. В большинстве случаев повышение уровня гомоцистеина - результат дефицита фолатов в организме, поэтому пациенткам с СПЯ могут быть назначены КГК с фолатами [92 - 96, 103 - 107, 140 - 141].
- Рекомендовано использовать сочетание КГК и нестероидных антиандрогенов при лечении гирсутизма в случае, если через 6 месяцев КГК не оказали значительного клинического эффекта [59, 111].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
- Рекомендовано применение антиандрогенов при гирсутизме в качестве монотерапии только при наличии противопоказаний к применению КГК или при непереносимости КГК [66, 111].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: При назначении антиандрогенов необходима надежная контрацепция.
- Рекомендованы следующие режимы применения антиандрогенов при гирсутизме [1]:
- #Спиронолактон** (от 50 - 100 в сутки) (меньший риск побочных эффектов) для лечения акне [1, 2, 122].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- #Финастерид (2,5 - 5 мг в сутки в течение 6 - 12 месяцев) или #флутамид (250 - 500 мг в сутки (250 мг 1 - 2 раз в сутки) в течение 6 - 12 месяцев) - не зарегистрированы в России для лечения гирсутизма у женщин, хотя они могут быть эффективны [111]. #Финастерид и #флутамид обладают гепатотоксичностью, что следует принимать во внимание при подборе терапии [127]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 2)
- Ципротерон** >= 10 мг в сутки для лечения гирсутизма не рекомендуется в связи с высокими рисками, в т.ч. менингиомы у пациенток 18 лет и старше [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендовано женщинам с СПЯ назначение терапии прогестагенами (по АТХ - гестагены) в циклическом режиме для регуляции цикла и профилактики гиперплазии и рака эндометрия - при нежелании использовать комбинированные оральные контрацептивы или при наличии противопоказаний к их применению [127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Согласно международным рекомендациям по СПЯ от 2023 года [127] в качестве сильной рекомендации указано, что медицинские работники должны учитывать тот факт, что женщины в репродуктивном возрасте с СПЯ имеют значительно более высокий риск развития гиперплазии и рака эндометрия. К превентивным стратегиям в отношении рисков гиперплазии и рака эндометрия относятся снижение массы тела, регуляция менструального цикла и регулярный прием гестагенов. В инструкциях к гестагенам в качестве показаний указано: нарушения менструального цикла вследствие нарушения овуляции; нерегулярные менструации; вторичная аменорея.
- Рекомендовано использовать #метформин** в качестве 2-й линии терапии у пациенток с СПЯ и нерегулярными менструациями в случае наличия противопоказаний к использованию КГК или их непереносимости, в том числе при нормальном ИМТ [59, 66, 68, 127].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: #Метформин** назначается в дозе 500 мг в сутки с постепенным еженедельным повышением по 500 мг. Максимальная суточная доза составляет 2,5 г для взрослых и 2 г для подростков [1, 59, 66, 68, 69].
- Рекомендовано применять #метформин** в дополнение к модификации образа жизни у женщин с СПЯ и ИМТ >= 25 кг/м2 для контроля массы тела и улучшения метаболических исходов, а также подросткам "группы риска" или с установленным диагнозом СПЯ [66, 69].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: #Метформин** может оказать терапевтический эффект в группах женщин с высоким метаболическим риском (факторы риска сахарного диабета, наличие нарушенной толерантности к глюкозе или определенные этнические группы высокого риска). При назначении #метформина** необходимо учитывать побочные эффекты со стороны желудочно-кишечного тракта, которые, как правило, зависят от дозы. Поэтому необходимо начинать с низкой дозы, с шагом 500 мг 1 - 2 раза в неделю [1]. Препараты с пролонгированным высвобождением могут минимизировать побочные эффекты. Следует помнить, что длительное применение #метформина** может приводить к снижению витамина B12, поэтому назначение данной терапии должно обсуждаться с пациенткой. Следует информировать женщину о возможной эффективности, рисках и побочных эффектах этого лечения.
- Рекомендовано использовать #метформин** (МФ) у взрослых женщин с СПЯ и ИМТ >= 25 кг/м2 в рамках комплексного подхода коррекции метаболического синдрома (улучшение чувствительности тканей к инсулину, профилактики развития нарушений углеводного обмена, коррекции дислипидемии) [127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Монотерапия МФ может рассматриваться у подростков с риском формирования СПЯ или с СПЯ для регуляции менструального цикла.
При назначении МФ необходимо учитывать следующее:
- Назначение МФ эффективно при активной модификации образа жизни;
- Могут быть легкие побочные эффекты со стороны желудочно-кишечного тракта, которые зависят от дозы и приходят самостоятельно;
- Старт терапии с низкой дозы с шагом 500 мг 1 - 2 раза в неделю и применяя препараты пролонгированного действия (что способствует снижению риска нежелательных побочных эффектов);
- Прием может сопровождаться формированием низкого уровня витамина B12, особенно у людей с факторами риска низкого уровня витамина B12 (например, СД, кг/м)
- Рекомендовано сочетание КГК и #метформина** (по ранее указанной схеме) у женщин с СПЯ и ИМТ > 30 кг/м2 в группе высокого риска развития нарушений углеводного обмена, группе высокого этнического риска для коррекции метаболических нарушений, когда применение КГК и изменение образа жизни не приводят к достижению желаемых целей [127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендовано использовать фармакотерапию ожирения у пациенток с СПЯ и ИМТ >= 30 кг/м2 или ИМТ >= 27 кг/м2 при наличии хотя бы одного из следующих осложнений: артериальная гипертензия, дислипидемия, СД 2 типа, синдрома обструктивного апное сна согласно клиническим рекомендациям "Ожирение" [1, 66, 70, 71, 127, 151 - 152].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Поведенческая терапия с целью уменьшения потребления пищи и увеличения физической активности является обязательным условием проводимого лечения. Фармакологическая поддержка может быть назначена, включая лираглутид, семаглутид**, орлистат, в дополнении к модификации образа жизни у женщин с СПЯ и избыточным весом/ожирением. Оценку эффективности лекарственной терапии ожирения следует проводить спустя 3 месяца от начала лечения. Неэффективным может считаться снижение массы тела менее чем 5% от исходной в течение 3 месяцев. Лечение ожирения у женщин с СПЯ должно проводиться при сопровождении специалиста - медицинского психолога/врача-психотерапевта с учетом данных по нарушению/расстройству пищевого поведения. Обязательно обсуждение с пациенткой, принимающей фармакотерапию ожирения, консультирование по контрацепции. Подробнее - см. соответствующие клинические рекомендации.
Использование фармакотерапии (в комбинации с изменением образа жизни) у детей и подростков с ожирением назначается с 12 летнего возраста при неэффективности мероприятий, направленных на формирование здорового образа жизни, длительность которых составляла не менее 1 года. См. клинические рекомендации "Ожирение у детей".
- Рекомендуется применение бариатрической хирургии при СПЯ и ИМТ >= 35 кг/м2 или >= 30 кг/м2 при наличии осложнений, связанных с ожирением [66, 150].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Хирургические методы лечения морбидного ожирения (бариатрическая хирургия) у подростков получают все большее распространение в мире в последние десятилетия. Основными преимуществами бариатрической хирургии являются быстрое снижение веса, улучшение метаболических показателей и качества жизни пациентов с морбидным ожирением. Согласно клиническим рекомендациям Международного Эндокринологического общества, бариатрическая хирургия является методом выбора для лечения морбидного осложненного ожирения у подростков [149].
- Рекомендовано использовать кломифен** у пациенток с СПЯ в качестве терапии первой линии для лечения ановуляторного бесплодия [73].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: Цель лечения пациенток с СПЯ - восстановление овуляторных менструальных циклов. Модификация образа жизни, в частности, лечение ожирения, должны предшествовать индукции овуляции при СПЯ. Перед индукцией овуляции у женщин с СПЯ должны быть исключены другие причины бесплодия в паре (трубно-перитонеальный, мужской факторы).
Кломифен** назначается в течение 5 дней, начиная со 2 - 5 дня спонтанного или индуцированного менструального цикла. Стартовая доза составляет, как правило, 50 мг в день, максимальная суточная доза - 150 мг. Частота овуляции достигает 70 - 80%, беременности - 22% на цикл. Лечение кломифеном** проводится в течение не более 6 менструальных циклов. Кумулятивная частота рождения живых детей в расчете на 6 циклов индукции овуляции составляет 50 - 60% [91]. Повышенный индекс свободного тестостерона и ИМТ, наличие аменореи, увеличенный объем яичников являются предикторами неэффективного применения кломифена** [92].
- Рекомендован в качестве альтернативной схемы лечения ановуляторного бесплодия у пациенток с СПЯ #летрозол [126].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Согласно международным клиническим рекомендациям препаратом первой линии для лечения ановуляторного бесплодия является нестероидный ингибитор ароматазы - #летрозол [1], однако, в России данное назначение офф-лейбл. Стимуляция овуляции #летрозолом проводится в дозе 2,5 мг в сутки (перорально) с 3 по 7 или с 5 по 9 дни менструального цикла, в случае отсутствия овуляции в следующем цикле стимуляции возможно увеличение дозы #летрозола до 5мг в сутки. Максимальная дозировка #летрозола в протоколе стимуляции овуляции составляет 7,5 мг в сутки [124, 126]. Согласно данным проведенных РКИ и метаанализов #летрозол в 1,5 раза эффективнее кломифена** в достижении овуляции, наступлении беременности и живорождения без увеличения рисков многоплодной беременности или невынашивания [125].
- Рекомендовано использовать #метформин** (по ранее указанной схеме) у пациенток с СПЯ и ановуляторным бесплодием, а также отсутствием других факторов бесплодия в качестве альтернативной схемы стимуляции овуляции и улучшения овуляторной функции как в виде монотерапии, так и в сочетании с кломифеном** (КЦ) по стандартной схеме применения непрямых индукторов овуляции [73 - 75].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: Для преодоления резистентности к КЦ его можно комбинировать с #метформином** для повышения шансов на беременность (повышение частоты овуляции и зачатия в 1,6 раза, частоты живорождений - в 1,2 раза. Если #метформин** используется для индукции овуляции у женщин с СПЯ, ожирением (ИМТ >= 30 кг/м2), ановуляторным бесплодием и отсутствием других факторов бесплодия, можно добавить КЦ (по стандартной схеме) для улучшения овуляторной функции и вероятности беременности.
- Рекомендовано у пациенток с СПЯ и ановуляторным бесплодии проводить стимуляцию овуляции гонадотропинами или лапароскопию с дриллингом яичников в качестве 2-й линии терапии при неэффективности КЦ или отсутствии условий для его применения [76, 77, 112].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: Гонадотропины могут использоваться в сочетании с #метформином** (режим дозирования - см. выше) у женщин с СПЯ, ановуляторным бесплодием, резистентностью к КЦ и отсутствием других факторов бесплодия для улучшения овуляторной функции, увеличения вероятности наступления беременности и рождаемости. Продолжительность использования гонадотропинов не должна превышать 6 циклов. При проведении стимуляции гонадотропинами необходимо мониторировать овариальный ответ.
- Рекомендовано взрослым пациенткам с СПЯ назначение инозитола в качестве альтернативы #метформину** при нерегулярном менструальном цикле, метаболическом синдроме, ожирении [127, 131 - 136].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Следует информировать пациенток об ограниченном клиническом эффекте. Конкретный состав добавки, доза и длительность терапии в настоящее время не определены [127, 131 - 136].
3.2 Хирургическое лечение
- Рекомендовано проведение лапароскопии (лапароскопического дриллинга) у женщин с СПЯ и бесплодием при резистентности к КЦ, высоком уровне ЛГ, прочих показаниях к лапароскопической операции у пациенток (эндометриоз, трубно-перитонеальный фактор бесплодия), невозможности мониторинга при использовании гонадотропинов [78].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: Эффективность лапароскопического дриллинга и применения гонадотропинов сопоставимы. Монополярная электрокаутеризация и лазер применяются с одинаковой эффективностью [67, 108]. Для достижения эффекта при СПЯ достаточно 4-х пункций яичника, с большим их числом ассоциировано возрастание преждевременной овариальной недостаточности. У 50% пациентов после лапароскопии требуется индукция овуляции. Если через 12 недель после лапароскопии овуляция отсутствует, следует использовать стимуляцию КЦ, а через 6 месяцев применения КЦ возможно применение гонадотропинов.
- Не рекомендовано проводить лапароскопический дриллинг у пациенток с СПЯ с целью решения проблем, напрямую не связанных с бесплодием, а именно: для коррекции нерегулярного менструального цикла или гиперандрогении [79].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфическая реабилитация не разработана
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Учитывая отдаленные сердечно-сосудистые риски, рекомендовано диспансерное наблюдение (Диспансерный прием (осмотр, консультация) врача-акушера-гинеколога) пациенток с СПЯ, также необходимо соблюдение принципов рационального питания и получение дозированных физических нагрузок [110, 127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
6. Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
1) Оперативное лечение СПЯ
Критерии выписки: клиническое выздоровление
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дифференциальная диагностика
Наиболее часто встречающиеся нозологии, протекающие под маской СПЯ представлены в приложении А3.2.
- Рекомендовано у пациенток с подозрением на СПЯ исключить заболевания щитовидной железы, гиперпролактинемию и неклассическую форму врожденной дисфункции коры надпочечников (нВДКН) при проведении дифференциальной диагностики с проведением исследования уровня тиреотропного гормона (ТТГ) в крови, исследования уровня общего тироксина (Т4) сыворотки крови, исследованием уровня пролактина в крови [1, 7, 38, 43, 46].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Критериями диагностики манифестного гипотиреоза является повышение уровня тиреотропного гормона (ТТГ) в крови выше его нормальных значений и снижение уровня свободного тироксина (СТ4) сыворотки крови. Снижение уровня ТТГ менее нижней границы нормы (обычно менее 0,1 мЕД/л), свидетельствует о гипертиреозе. Целесообразно как минимум двукратное проведение лабораторного исследования уровня пролактина.
- Рекомендовано у женщин с признаками гирсутизма, алопеции, акне, нарушениями менструального цикла, бесплодием и/или привычным невынашиванием беременности исследование уровня 17-гидроксипрогестерона в крови в раннюю фолликулярную фазу утром для диагностики нВДКН, при пограничных значениях 17-гидроксипрогестерона также исследование патогенных вариантов гена CYP21A2 [1, 7, 38, 43, 46, 115].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Для диагностики неклассической формы забор крови на 17ОНР проводят рано утром в фолликулярную фазу цикла (не позднее 5 - 7 дня), при аменорее - в любой день, строго вне беременности. Нормой считаются показатели менее 6 нмоль/л или менее 2 нг/мл, ниже этих уровней нВДКН практически не встречается. Следует помнить, что референсные значения, которые приводятся различными лабораториями, обычно отличаются и могут быть значительно ниже указанных "отрезных точек" для диагностики нВДКН. В случае значений базального 17ОНР более 30 нмоль/л или 10 нг/мл, диагноз ВДКН считается подтвержденным, и дополнительной диагностики не требуется. При пограничных значениях 17ОНР (6 - 30 нмоль/л или 2 - 10 нг/мл - так называемая "серая зона"), выявленных минимум при двукратном определении, целесообразно исследование патогенных вариантов гена CYP21A2.
7.1 ВРТ и СПЯ
- Рекомендовано применять вспомогательные репродуктивные технологии (ВРТ) у женщин с СПЯ и бесплодием при неэффективности стимуляции овуляции и лапароскопии; сопутствующей патологии (трубно-перитонеальный фактор бесплодия, эндометриоз, мужской фактор), необходимости преимплантационной диагностики [76, 82, 121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: У пациенток с СПЯ при применении ВРТ высок риск гиперстимуляции яичников. Частота наступления клинической беременности на лечебный цикл у женщин с СПЯ составляет 35%, что сопоставимо с таковой у пациенток без СПЯ.
Предпочтителен протокол с антагонистами ГнРГ (по АТХ - Аналоги гонадотропин-рилизинг гормона) для уменьшения длительности стимуляции, дозы гонадотропинов и частоты СГЯ.
- Агонисты ГнРГ (по АТХ - Аналоги гонадотропин-рилизинг гормона) в качестве триггера финального созревания ооцитов рекомендованы при повышенном риске СГЯ или в случае отсроченного переноса эмбрионов [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендовано использовать #метформин** для предотвращения синдрома гиперстимуляции яичников в качестве адъювантной терапии у женщин с СПЯ, проходящих лечение с помощью ВРТ [1, 83 - 86].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: #Метформин** может снизить риски гиперстимуляции, однако значимо не влияет на уровень живорождения. #Метформин** назначается в дозе от 1000 до 2500 мг в сутки [1, 83 - 86]. При применении Invitromaturation (IVM) не характерно развитие синдрома гиперстимуляции яичников, что позволяет рассматривать данный метод, как альтернативный
7.2 Акушерские аспекты СПЯ
- Рекомендовано проводить прегравидарную подготовку у женщин с СПЯ для снижения гестационных осложнений [87, 88].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Женщины с СПЯ представляют собой группу риска по развитию неблагоприятных исходов беременности: прерывание беременности, ГСД, гипертония при беременности и преэклампсия, задержка внутриутробного развития, макросомия, преждевременные роды, кесарево сечение. Частота ГСД, артериальной гипертензии, преэклампсии, согласно результатам метаанализов, повышается в 3 - 4 раза. Риск осложненного течения беременности выше у женщин с "классическим" фенотипом СПЯ. Преконцепционная подготовка должна включать: отказ от курения, модификацию образа жизни, использование фолиевой кислоты [87 - 89, 127]
- Рекомендовано обязательное наблюдение женщины с СПЯ во время беременности в связи с повышенным риском развития гестационного диабета, гипертензивных осложнений, преэклампсии и связанных с этим осложнений, в частности, увеличением риска заболеваемости новорожденных [87 - 89].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Критерии оценки качества медицинской помощи
В данном разделе размещены рекомендуемые Рабочей группой критерии оценки качества медицинской помощи при синдроме поликистоза яичника с указанием уровня достоверности доказательств и уровня убедительности рекомендаций (Таблица 2).
Таблица 2. Критерии оценки качества медицинской помощи при СПЯ
N
Критерии качества
Оценка выполнения (да/нет)
Выполнено исследование уровня общего тестостерона в крови, исследование уровня глобулина, связывающего половые гормоны, в крови и подсчет индекса свободных андрогенов
Да/нет
Выполнено ультразвуковое исследование органов малого таза комплексное (трансвагинальное и трансабдоминальное)
Да/нет
Выполнена оценка гликемического статуса путем проведения глюкозотолерантного теста 2-часового перорального с 75 г декстрозы или исследование уровня гликированного гемоглобина в крови пациенткам с СПЯ
Да/нет
Выполнено измерения роста и массы тела с вычислением индекса массы тела и измерение ОТ (A02.03.007.004) у пациенток с СПЯ
Да/нет
Выполнено измерение АД на периферических артериях у пациенток с СПЯ
Да/нет
Выполнено назначение медикаментозной терапии при нарушениях менструального цикла, гирсутизме и акне (КГК, нестероидные антиандрогены, прогестагены (АТХ - гестагены) в циклическом режиме)
Да/нет
Даны рекомендации по модификации образа жизни, включающие физические упражнения и рациональное сбалансированное питание для лечения ожирения и избыточной массы тела у пациенток с СПЯ
Да/нет
Выполнено назначение кломифена** в качестве терапии первой линии для лечения ановуляторного бесплодия при СПЯ
Да/нет
Выполнена стимуляция овуляции гонадотропинами или лапароскопия (лапароскопический дриллинг) в качестве 2-й линии терапии при неэффективности кломифена** или отсутствии условий для его применения
Да/нет
Список литературы
1. Recommendations from the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome/H.J. Teede [et al.]//Human Reproduction. - 2023. - N 9 (38). - P. 1655 - 1679.
2. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E; American Association of Clinical Endocrinologists (AACE); American College of Endocrinology (ACE); Androgen Excess and PCOS Society. American Association of Clinical Endocrinologists, American College Of Endocrinology, And Androgen Excess and Pcos Society Disease State Clinical Review: guide to the best practices in the evaluation and treatment of polycystic ovary syndrome - part 2. Endocr Pract. 2015 Dec; 21(12): 1415 - 26.
3. Long-term cardiometabolic disease risk in women with PCOS: a systematic review and meta-analysis/V. Wekker [et al.]//Human reproduction update. - 2020. - N 6 (26). - P. 942 - 960.
4. Azziz R, Carmina E, Chen Z, Dunaif A, Laven JS, Legro RS, et al. Polycysticovarysyndrome. NatureReviewsDiseasePrimers 2016; 2: 16057.
5. Neven ACH, Laven J, Teede HJ, Boyle JA. A Summary on Polycystic Ovary Syndrome: Diagnostic Criteria, Prevalence, Clinical Manifestations, and Management According to the Latest International Guidelines. Semin Reprod Med. 2018; 36(1): 5 - 12.
6. Carmina E, Guastella E, Longo RA. Advances in the Diagnosis and Treatment of PCOS. Curr Pharm Des. 2016; 22(36): 5508 - 5514.
7. Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004; 19(1): 41 - 7.
8. Spritzer PM, Marchesan LB, Santos BR, Fighera TM. Hirsutism, Normal Androgens and Diagnosis of PCOS. Diagnostics (Basel). 2022 Aug 9; 12(8): 1922. doi: 10.3390/diagnostics12081922.
9. Ezeh U, Huang A, Landay M, Azziz R. Long-Term Response of Hirsutism and Other Hyperandrogenic Symptoms to Combination Therapy in Polycystic Ovary Syndrome. J Womens Health (Larchmt). 2018 Jul; 27(7): 892 - 902.
10. Lizneva D, Gavrilova-Jordan L, Walker W, Azziz R. Androgen excess: Investigations and management. Best Pract Res Clin Obstet Gynaecol. 2016 Nov; 37: 98 - 118.
11. Dokras A, Stener-Victorin E, Yildiz BO, Li R, Ottey S, Shah D, Epperson N, Teede H. Androgen Excess-Polycystic Ovary Syndrome Society: position statement on depression, anxiety, quality of life, and eating disorders in polycystic ovary syndrome. Fertil Steril. 2018 May; 109(5): 888 - 899.
12. Legro RS, Schlaff WD, Diamond MP et al. Total testosterone assays in women with polycystic ovary syndrome: precision and correlation with hirsutism. J Clin Endocrinol Metab. 2010 Dec; 95(12): 5305 - 13.
13. Lause M, Kamboj A, Fernandez Faith E. Dermatologic manifestations of endocrine disorders. Transl Pediatr. 2017 Oct; 6(4): 300 - 312.
14. Melibary YT. Hidradenitis suppurativa in a patient with hyperandrogenism, insulin-resistance and acanthosis nigricans (HAIR-AN syndrome). Dermatol Reports. 2018; 10(1): 7546.
15. Keen MA, Shah IH, Sheikh G. Cutaneous Manifestations of Polycystic Ovary Syndrome: A Cross-Sectional Clinical Study. Indian Dermatol Online J. 2017; 8(2): 104 - 110.
16. Rodgers R, Avery J, Moore V, Davies M, Azziz R, Stener-Victorin E, Moran L, Robertson S, Stepto N, Norman R, Teede HJ. Complex diseases and co-morbidities: polycystic ovary syndrome and type 2 diabetes mellitus. Endocr Connect. 2019 Feb 1. pii: EC-18-0502.R2.
17. Glueck CJ, Goldenberg N. Characteristics of obesity in polycystic ovary syndrome: Etiology, treatment, and genetics. Metabolism. 2019 Mar; 92: 108 - 120.
18. Lim S.S. et al. The effect of obesity on polycystic ovary syndrome: a systematic review and meta-analysis//Obesity Reviews. - 2013. - Т. 14. - N. 2. - С. 95 - 109
19. Pasquali R, Oriolo C. Obesity and Androgens in Women. Front Horm Res. 2019; 53: 120 - 134.
20. Zheng SH, Li XL. Visceral adiposity index as a predictor of clinical severity and therapeutic outcome of PCOS. Gynecol Endocrinol. 2016; 32(3): 177 - 83.
21. Gibson-Helm M, Teede H, Dunaif A, Dokras A, et al. Delayed diagnosis and a lack of information associated with dissatisfaction in women with polycystic ovary syndrome. J Clin Endocrinol Metab 2017; 102(2): 604 - 12
22. Dokras A, Saini S, Gibson-Helm M, Schulkin J, Cooney L, Teede H. Gaps in knowledge among physicians regarding diagnostic criteria and management of polycystic ovary syndrome. Fertil Steril 2017; 107(6): 1380 - 6. e1.
23. Balen AH, Morley LC, Misso M, Franks S, Legro RS, Wijeyaratne CN, et al. The management of anovulatory infertility in women with polycystic ovary syndrome: An analysis of the evidence to support the development of global WHO guidance. Hum Reprod Update 2016; 22(6): 687 - 708.
24. Alexandraki KI, Kandaraki EA, Poulia KA, Piperi C, Papadimitriou E, Papaioannou TG. Assessment of Early Markers of Cardiovascular Risk in Polycystic Ovary Syndrome. touchREV Endocrinol. 2021 Apr; 17(1): 37 - 53.
25. Andersen M, Glintborg D. Diagnosis and follow-up of type 2 diabetes in women with PCOS: a role for OGTT? Eur J Endocrinol. 2018 Sep; 179(3): D1 - D14. doi: 10.1530/EJE-18-0237.
26. Anagnostis P, Tarlatzis BC, Kauffman RP. Polycystic ovarian syndrome (PCOS): Long-term metabolic consequences. Metabolism. 2018; 86: 33 - 43.
27. Nolan CJ, Prentki M. Insulin resistance and insulin hypersecretion in the metabolic syndrome and type 2 diabetes: Time for a conceptual framework shift. Diab Vasc Dis Res. 2019 Mar; 16(2): 118 - 127.
28. Pelanis R, Mellembakken JR,  I, et al. The prevalence of Type 2 diabetes is not increased in normal-weight women with PCOS. Hum Reprod. 2017; 32(11): 2279 - 2286.
I, et al. The prevalence of Type 2 diabetes is not increased in normal-weight women with PCOS. Hum Reprod. 2017; 32(11): 2279 - 2286.
29. Condorelli RA, Calogero AE, Di Mauro M, La Vignera S. PCOS and diabetes mellitus: from insulin resistance to altered beta pancreatic function, a link in evolution. Gynecol Endocrinol. 2017 Sep; 33(9): 665 - 667.
30. Jeanes YM, Reeves S. Metabolic consequences of obesity and insulin resistance in polycystic ovary syndrome: diagnostic and methodological challenges. Nutr Res Rev. 2017 Jun; 30(1): 97 - 105.
31. Bani Mohammad M, Majdi Seghinsara A. Polycystic Ovary Syndrome (PCOS), Diagnostic Criteria, and AMH. Asian Pac J Cancer Prev. 2017 Jan 1; 18(1): 17 - 21.
32. Teede H, Misso M, Tassone EC, Dewailly D, Ng EH, Azziz R, Norman RJ, Andersen M, Franks S, Hoeger K, Hutchison S, Oberfield S, Shah D, Hohmann F, Ottey S, Dabadghao P, Laven JSE.  Hormone in PCOS: A Review Informing International Guidelines. Trends Endocrinol Metab. 2019 Jul; 30(7): 467 - 478.
Hormone in PCOS: A Review Informing International Guidelines. Trends Endocrinol Metab. 2019 Jul; 30(7): 467 - 478.
33. Garg D, Tal R. The role of AMH in the pathophysiology of polycystic ovarian syndrome. Reprod Biomed Online. 2016 Jul; 33(1): 15 - 28.
34. Sova H, Unkila-Kallio L, Tiitinen A,  M, Perheentupa A, Tinkanen H, Puukka K, Bloigu R, Piltonen T, Tapanainen JS, Morin-Papunen L. Hormone profiling, including
M, Perheentupa A, Tinkanen H, Puukka K, Bloigu R, Piltonen T, Tapanainen JS, Morin-Papunen L. Hormone profiling, including  hormone (AMH), for the diagnosis of polycystic ovary syndrome (PCOS) and characterization of PCOS phenotypes. Gynecol Endocrinol. 2019; 35(7): 595 - 600.
hormone (AMH), for the diagnosis of polycystic ovary syndrome (PCOS) and characterization of PCOS phenotypes. Gynecol Endocrinol. 2019; 35(7): 595 - 600.
35. Sangaraju SL, Yepez D, Grandes XA, Talanki Manjunatha R, Habib S. Cardio-Metabolic Disease and Polycystic Ovarian Syndrome (PCOS): A Narrative Review. Cureus. 2022 May 17; 14(5): e25076.
36. Rochlani Y, Pothineni NV, Kovelamudi S, Mehta JL. Metabolic syndrome: pathophysiology, management, and modulation by natural compounds. Ther Adv Cardiovasc Dis. 2017 Aug; 11(8): 215 - 225.
37. Kakoly NS, Khomami MB, Joham AE, Cooray SD, Misso ML, Norman RJ, Harrison CL, Ranasinha S, Teede HJ, Moran LJ. Ethnicity, obesity and the prevalence of impaired glucose tolerance and type 2 diabetes in PCOS: a systematic review and meta-regression. Hum Reprod Update. 2018 Jul 1; 24(4): 455 - 467.
38. Hoeger KM, Dokras A, Piltonen T. Update on PCOS: Consequences, Challenges, and Guiding Treatment. J Clin Endocrinol Metab. 2021 Mar 8; 106(3): e1071 - e1083.
39. Rosenfield RL. The Polycystic Ovary Morphology-Polycystic Ovary Syndrome Spectrum. J Pediatr Adolesc Gynecol. 2015 Dec; 28(6): 412 - 9.
40. Dewailly D, Lujan ME, Carmina E, Cedars MI, Laven J, Norman RJ, Escobar-Morreale HF. Definition and significance of polycystic ovarian morphology: a task force report from the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2014 May-Jun; 20(3): 334 - 52.
41. Zhu RY, Wong YC, Yong EL. Sonographic evaluation of polycystic ovaries. Best Pract Res Clin Obstet Gynaecol. 2016 Nov; 37: 25 - 37.
42. Федеральные клинические рекомендации Болезнь Иценко-Кушинга, 2016
43. Федеральные клинические рекомендации Врожденная дисфункция коры надпочечников у взрослых, 2016
44. Федеральные клинические рекомендации Гиперпролактинемия, 2016
45. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, Grobman WA, Laurberg P, Lazarus JH, Mandel SJ, Peeters RP, Sullivan S. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017 Mar; 27(3): 315 - 389.
46. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, Janssen OE, Legro RS, Norman RJ, Taylor AE, Witchel SF. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertil Steril. 2009; 91: 456 - 88.
47. Osibogun O, Ogunmoroti O, Michos ED. Polycystic ovary syndrome and cardiometabolic risk: Opportunities for cardiovascular disease prevention. Trends Cardiovasc Med. 2020 Oct; 30(7): 399 - 404.
48. Wild RA. Dyslipidemia in PCOS. Steroids. 2012 Mar 10; 77(4): 295 - 9.
49. Papadakis G, Kandaraki E, Papalou O, Vryonidou A, Diamanti-Kandarakis E. Is cardiovascular risk in women with PCOS a real risk? Current insights. Minerva Endocrinol. 2017 Dec; 42(4): 340 - 355.
50. Meun C, Gunning MN, Louwers YV, Peters H, Roos-Hesselink J, Roeters van Lennep J, Rueda Ochoa OL, Appelman Y, Lambalk N, Boersma E, Kavousi M, Fauser BC, Laven JS; CREW consortium. The cardiovascular risk profile of middle-aged women with polycystic ovary syndrome. Clin Endocrinol (Oxf). 2020 Feb; 92(2): 150 - 158.
51. Delitala AP, Capobianco G, Delitala G, Cherchi PL, Dessole S. Polycystic ovary syndrome, adipose tissue and metabolic syndrome. Arch Gynecol Obstet. 2017 Sep; 296(3): 405 - 419.
52. Damone AL, Joham AE, Loxton D, Earnest A, Teede HJ, Moran LJ. Depression, anxiety and perceived stress in women with and without PCOS: a community-based study. Psychol Med. 2019 Jul; 49(9): 1510 - 1520.
53. Cooney LG, Dokras A. Depression and Anxiety in Polycystic Ovary Syndrome: Etiology and Treatment. Curr Psychiatry Rep. 2017 Sep 20; 19(11): 83.
54. Rodriguez-Paris D, Remlinger-Molenda A, Kurzawa R,  A,
A,  R, Rybakowski F,
R, Rybakowski F,  L, Banaszewska B. Psychiatric disorders in women with polycystic ovary syndrome. Psychiatr Pol. 2019 Aug 31; 53(4): 955 - 966.
L, Banaszewska B. Psychiatric disorders in women with polycystic ovary syndrome. Psychiatr Pol. 2019 Aug 31; 53(4): 955 - 966.
55. Brutocao C, Zaiem F, Alsawas M, Morrow AS, Murad MH, Javed A. Psychiatric disorders in women with polycystic ovary syndrome: a systematic review and meta-analysis. Endocrine. 2018 Nov; 62(2): 318 - 325.
56. Lim SS, Hutchison SK, Van Ryswyk E, Norman RJ, Teede HJ, Moran LJ. Lifestyle changes in women with polycystic ovary syndrome. Cochrane Database Syst Rev 2019; 3: CD007506.
57. Oberg E, Gidlof S, Jakson I, Mitsell M, Tollet Egnell P, Hirschberg AL. Improved menstrual function in obese women with polycystic ovary syndrome after behavioural modification intervention-A randomized controlled trial. Clin Endocrinol (Oxf) 2019; 90: 468 - 478.
58. Dos Santos IK, Ashe MC, Cobucci RN, Soares GM, de Oliveira Maranhao TM, Dantas PMS. The effect of exercise as an intervention for women with polycystic ovary syndrome: A systematic review and meta-analysis. Medicine (Baltimore) 2020; 99: e19644.
59. Teede H, Tassone EC, Piltonen T, Malhotra J, Mol BW, ![]() A, Witchel SF, Joham A, McAllister V, Romualdi D, Thondan M, Costello M, Misso ML. Effect of the combined oral contraceptive pill and/or metformin in the management of polycystic ovary syndrome: A systematic review with meta-analyses. Clin Endocrinol (Oxf). 2019 Oct; 91(4): 479 - 489.
A, Witchel SF, Joham A, McAllister V, Romualdi D, Thondan M, Costello M, Misso ML. Effect of the combined oral contraceptive pill and/or metformin in the management of polycystic ovary syndrome: A systematic review with meta-analyses. Clin Endocrinol (Oxf). 2019 Oct; 91(4): 479 - 489.
60. Wang QY, et al. Comparison of drospirenone-with cyproterone acetate-containing oral contraceptives, combined with metformin and lifestyle modifications in women with polycystic ovary syndrome and metabolic disorders: A prospective randomized control trial. Chinese medical journal. 2016; 129(8): 883 - 90.
61. Feng W, et al. Management of polycystic ovarian syndrome with Diane-35 or Diane-35 plus metformin. Gynecological Endocrinology. 2016; 32(2): 147 - 50.
62. Shah A, Dodson WC, Kris-Etherton PM, et al. Effects of Oral Contraception and Lifestyle Modification on Incretins and ![]() Superfamily Hormones in PCOS. J Clin Endocrinol Metab. 2021 Jan 1; 106(1): 108 - 119.
Superfamily Hormones in PCOS. J Clin Endocrinol Metab. 2021 Jan 1; 106(1): 108 - 119.
63. Amiri M, Nahidi F, Yarandi RB, Khalili D, Tohidi M, Tehrani FR. Effects of oral contraceptives on the quality of life of women with polycystic ovary syndrome: a crossover randomized controlled trial. Health Qual Life Outcomes. 2020 Aug 31; 18(1): 293.
64. Fonseka S, Wijeyaratne CN, Gawarammana IB, Kalupahana NS, Rosairo S, Ratnatunga N, Kumarasiri R. Effectiveness of Low-dose Ethinylestradiol/Cyproterone Acetate and Ethinylestradiol/Desogestrel with and without Metformin on Hirsutism in Polycystic Ovary Syndrome: A Randomized, Double-blind, Triple-dummy Study. J Clin Aesthet Dermatol. 2020 Jul; 13(7): 18 - 23.
65. World Health Organization. 2015 Quick Reference Chart for the WHO Medical Eligibility Criteria for Contraceptive Use. Adapted from Medical Eligibility Criteria for Contraceptive Use, 5th Edition 2015; Available from: https://www.fhi360.org/sites/default/files/media/documents/chart-medical-eligibility-contraceptives-english.pdf.
66. Carlsson LMS,  K, Jacobson P, et al. Life Expectancy after Bariatric Surgery in the Swedish Obese Subjects Study. New England Journal of Medicine 2020; 383: 1535 - 43.
K, Jacobson P, et al. Life Expectancy after Bariatric Surgery in the Swedish Obese Subjects Study. New England Journal of Medicine 2020; 383: 1535 - 43.
67. Bayram N, van Wely M, Kaaijk EM, Bossuyt PM, van der Veen F. Using an electrocautery strategy or recombinant follicle stimulating hormone to induce ovulation in polycystic ovary syndrome: randomised controlled trial. BMJ. 2004 Jan 24; 328(7433): 192.
68. Fraison E, Kostova E, Moran LJ, Bilal S, Ee CC, Venetis C, Costello MF. Metformin versus the combined oral contraceptive pill for hirsutism, acne, and menstrual pattern in polycystic ovary syndrome. Cochrane Database Syst Rev. 2020 Aug 13; 8(8): CD005552.
69. Jensterle M, Kravos NA, Ferjan S, Goricar K, Dolzan V, Janez A. Long-term efficacy of metformin in overweight-obese PCOS: longitudinal follow-up of retrospective cohort. Endocr Connect. 2020; 9(1): 44 - 54.
70. Panda SR, Jain M, Jain S, Saxena R, Hota S. Effect of Orlistat Versus Metformin in Various Aspects of Polycystic Ovarian Syndrome: A Systematic Review of Randomized Control Trials. J Obstet Gynaecol India. 2018 Oct; 68(5): 336 - 343.
71. Abdalla MA, Deshmukh H, Atkin S, Sathyapalan T. A review of therapeutic options for managing the metabolic aspects of polycystic ovary syndrome. TherAdvEndocrinolMetab. 2020; 11: 2042018820938305.
72. Showell MG, Mackenzie-Proctor R, Jordan V, Hodgson R, Farquhar C. Inositol for subfertile women with polycystic ovary syndrome. Cochrane Database Syst Rev 2018; 12: CD012378.
73. Wang R, Li W, Bordewijk EM, et al. First-line ovulation induction for polycystic ovary syndrome: an inpidual participant data meta-analysis. Hum Reprod Update 2019; 25: 717 - 732.
74. Morley LC, Tang T, Yasmin E, Norman RJ, Balen AH. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst Rev. 2017; 11(11): CD003053.
75. Sharpe A, Morley LC, Tang T, Norman RJ, Balen AH. Metformin for ovulation induction (excluding gonadotrophins) in women with polycystic ovary syndrome. Cochrane Database Syst Rev 2019; 12: CD013505.
76. Wang R, Kim B, van Wely M et al. Treatment strategies for women with WHO group II anovulation: systematic review and network meta-analysis. BMJ 2017; 356: j138.
77. Weiss NS, Kostova E, Nahuis M, Mol BWJ, van der Veen F, van Wely M. Gonadotrophins for ovulation induction in women with polycystic ovary syndrome. CochraneDatabaseSystRev. 2019 Jan 16; 1(1): CD010290.
78. Bordewijk EM, Ng KYB, Rakic L, et al. Laparoscopic ovarian drilling for ovulation induction in women with anovulatory polycystic ovary syndrome. Cochrane Database Syst Rev 2020; 2: CD001122.
79. Lepine S, Jo J, Metwally M, Cheong YC. Ovarian surgery for symptom relief in women with polycystic ovary syndrome. Cochrane Database Syst Rev. 2017; 11(11): CD009526.
80. Christ JP, Falcone T. Bariatric Surgery Improves Hyperandrogenism, Menstrual Irregularities, and Metabolic Dysfunction Among Women with Polycystic Ovary Syndrome (PCOS). Obes Surg. 2018 Aug; 28(8): 2171 - 2177.
81. Singh D, Arumalla K, Aggarwal S, Singla V, Ganie A, Malhotra N. Impact of Bariatric Surgery on Clinical, Biochemical, and Hormonal Parameters in Women with Polycystic Ovary Syndrome (PCOS). ObesSurg. 2020 Jun; 30(6): 2294 - 2300.
82. Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Consensus on infertility treatment related to polycystic ovary syndrome. Hum Reprod. 2008; 23(3): 462 - 77.
83.  A, Bakacak M, Bakacak Z. The efficacy of different insulin-sensitizing agents on treatment outcomes in patients with polycystic ovary syndrome who underwent in-vitro fertilization: A retrospective, record-based, comparative study. J Gynecol Obstet Hum Reprod. 2020 Nov 23; 50(1): 102006.
A, Bakacak M, Bakacak Z. The efficacy of different insulin-sensitizing agents on treatment outcomes in patients with polycystic ovary syndrome who underwent in-vitro fertilization: A retrospective, record-based, comparative study. J Gynecol Obstet Hum Reprod. 2020 Nov 23; 50(1): 102006.
84. Bordewijk E, Nahuis M, Costello M et al. Metformin during ovulation induction with gonadotrophins followed by timed intercourse or intrauterine insemination for subfertility associated with polycystic ovary syndrome. Cochrane Database Syst Rev 2017; 1: CD009090.
85. Tso LO, Costello MF, Albuquerque LET, Andriolo RB, Macedo CR. Metformin treatment before and during IVF or ICSI in women with polycystic ovary syndrome. Cochrane Database Syst Rev. 2020 Dec 21; 12: CD006105.
86. Wu Y, Tu M, Huang Y, Liu Y, Zhang D. Association of Metformin With Pregnancy Outcomes in Women With Polycystic Ovarian Syndrome Undergoing In Vitro Fertilization: A Systematic Review and Meta-analysis. JAMA Netw Open. 2020 Aug 3; 3(8): e2011995.
87. Bahri Khomami M, Joham AE, Boyle JA, Piltonen T, Arora C, Silagy M, Misso ML, Teede HJ, Moran LJ. The role of maternal obesity in infant outcomes in polycystic ovary syndrome-A systematic review, meta-analysis, and meta-regression. Obes Rev. 2019 Jun; 20(6): 842 - 858.
88. Bahri Khomami M, Joham AE, Boyle JA, Piltonen T, Silagy M, Arora C, Misso ML, Teede HJ, Moran LJ. Increased maternal pregnancy complications in polycystic ovary syndrome appear to be independent of obesity-A systematic review, meta-analysis, and meta-regression. Obes Rev. 2019 May; 20(5): 659 - 674.
89. Gunning MN, Sir Petermann T, Crisosto N, van Rijn BB, de Wilde MA, Christ JP, Uiterwaal CSPM, de Jager W, Eijkemans MJC, Kunselman AR, Legro RS, Fauser BCJM. Cardiometabolic health in offspring of women with PCOS compared to healthy controls: a systematic review and inpidual participant data meta-analysis. Hum Reprod Update. 2020 Jan 1; 26(1): 103 - 117.
90. Rodgers R, Avery J, Moore V, Davies M, Azziz R, Stener-Victorin E, Moran L, Robertson S, Stepto N, Norman R1, Teede HJ. Complex diseases and co-morbidities: polycystic ovary syndrome and type 2 diabetes mellitus. Endocr Connect. 2019 Feb 1. pii: EC-18-0502.R2. doi: 10.1530/EC-18-0502.
91. Horowitz E, Weissman A. The stair-step approach in treatment of anovulatory PCOS patients. Ther Adv Reprod Health. 2020 May 22; 14: 2633494120908818. doi: 10.1177/2633494120908818.
92. Gadalla MA, Norman RJ, Tay CT, Hiam DS, Melder A, Pundir J, Thangaratinam S, Teede HJ, Mol BWJ, Moran LJ. Medical and Surgical Treatment of Reproductive Outcomes in Polycystic Ovary Syndrome: An Overview of Systematic Reviews. Int J Fertil Steril. 2020 Jan; 13(4): 257 - 270. doi: 10.22074/ijfs.2020.5608.
93. Obeid R., Schцn C., Wilhelm M., Pietrzik K., Pilz S. Dietary and lifestyle predictors of folate insufficiency in non-supplemented German women. 1nt J Food Sci Nutr. 2018;
94. Czeizel AE, ![]() I, Vereczkey A,
I, Vereczkey A,  F. Folate deficiency and folic acid supplementation: the prevention of neural-tube defects and congenital heart defects. Nutrients. 2013 Nov 21; 5(11): 4760 - 75.
F. Folate deficiency and folic acid supplementation: the prevention of neural-tube defects and congenital heart defects. Nutrients. 2013 Nov 21; 5(11): 4760 - 75.
95. Moreno L.A., Gottrand F., Huybrechts 1., Ruiz J.R., Gonzalez-Gross M., OeHenauw S.; HELENA Study Group. Nutrition and lifestyle in eu ropean adolescents: the HELENA (Healthy Lifestyle in Europe by Nutrition in Adolescence) study. Adv Nutr. 2014 Sep; 5(5): 615S - 623S.
96. Osterhues A, Holzgreve W and Michels KB. Shall we put the world on folate? Lancet 2009; 374(9694): 959 - 61
97. Rudnicka E, Suchta K, Grymowicz M, Calik-Ksepka A, Smolarczyk K, Duszewska AM, Smolarczyk R, Meczekalski B. Chronic Low Grade Inflammation in Pathogenesis of PCOS. Int J Mol Sci. 2021 Apr 6; 22(7): 3789.
98. Carvalho MJ, Subtil S, Rodrigues ![]() , Oliveira J, Figueiredo-Dias M. Controversial association between polycystic ovary syndrome and breast cancer. Eur J Obstet Gynecol Reprod Biol. 2019 Dec; 243: 125 - 132. doi: 10.1016/j.ejogrb.2019.10.011.
, Oliveira J, Figueiredo-Dias M. Controversial association between polycystic ovary syndrome and breast cancer. Eur J Obstet Gynecol Reprod Biol. 2019 Dec; 243: 125 - 132. doi: 10.1016/j.ejogrb.2019.10.011.
99. Meczekalski B,  GR,
GR,  MT, Chedraui P,
MT, Chedraui P,  FR. The polycystic ovary syndrome and gynecological cancer risk. Gynecol Endocrinol. 2020 Apr; 36(4): 289 - 293. doi: 10.1080/09513590.2020.1730794.
FR. The polycystic ovary syndrome and gynecological cancer risk. Gynecol Endocrinol. 2020 Apr; 36(4): 289 - 293. doi: 10.1080/09513590.2020.1730794.
100. Wen Y, Wu X, Peng H, Li C, Jiang Y, Su Z, Liang H, Liu J, He J, Liang W. Breast cancer risk in patients with polycystic ovary syndrome: a Mendelian randomization analysis. Breast Cancer Res Treat. 2021 Feb; 185(3): 799 - 806. doi: 10.1007/s10549-020-05973-z.
101. Беленькая Лилия Васильевна Критерии ожирения в азиатской популяции. Обзор литературы//Acta Biomedica Scientifica. 2018. N 3, 99 - 102
102. ![]() AS, Witchel SF, Hoeger KM, Oberfield SE, Vogiatzi MG, Misso M, Garad R, Dabadghao P, Teede H. Adolescent polycystic ovary syndrome according to the international evidence-based guideline. BMC Med. 2020 Mar 24; 18(1): 72. doi: 10.1186/s12916-020-01516-x. PMID: 32204714; PMCID: PMC7092491.
AS, Witchel SF, Hoeger KM, Oberfield SE, Vogiatzi MG, Misso M, Garad R, Dabadghao P, Teede H. Adolescent polycystic ovary syndrome according to the international evidence-based guideline. BMC Med. 2020 Mar 24; 18(1): 72. doi: 10.1186/s12916-020-01516-x. PMID: 32204714; PMCID: PMC7092491.
103. Aversa A, La Vignera S, Rago R, Gambineri A, Nappi RE, Calogero AE and Ferlin A (2020) Fundamental Concepts and Novel Aspects of Polycystic Ovarian Syndrome: Expert Consensus Resolutions. Front. Endocrinol. 11: 516. Doi: 10.3389/fendo.2020.00516
104. Alesi S, Ee C, Moran LJ, Rao V, Mousa A. Nutritional Supplements and Complementary Therapies in Polycystic Ovary Syndrome. Adv Nutr. 2022 Aug 1; 13(4): 1243 - 1266.
105. Mondal K, Chakraborty P, Kabir SN. Hyperhomocysteinemia and hyperandrogenemia share PCSK9-LDLR pathway to disrupt lipid homeostasis in PCOS. Res Commun. 2018 Apr 13. pii: S0006-291X(18)30847-7
106. Escobar-Morreale HF Polycystic ovary syndrome: definition, aetiology, diagnosis and treatment. Nat Rev Endocrinol. 2018 May; 14(5): 270 - 284.
107. Glintborg D, Rubin KH, Nybo M, Abrahamsen B, Andersen M. Cardiovascular disease in a nationwide population of Danish women with polycystic ovary syndrome. Cardiovasc Diabetol. 2018 Mar 8; 17(1): 37.
108. Farquhar C, Brown J, Marjoribanks J. Laparoscopic drilling by diathermy or laser for ovulation induction in anovulatory polycystic ovary syndrome. Cochrane Database Syst Rev. 2012 Jun 13; 6: CD001122.
109. Wekker V, van Dammen L, Koning A, Heida KY, Painter RC, Limpens J, Laven JSE, Roeters van Lennep JE, Roseboom TJ, Hoek A. Long-term cardiometabolic disease risk in women with PCOS: a systematic review and meta-analysis. Hum Reprod Update. 2020 Nov 1; 26(6): 942 - 960.
110. Cooney LG, Dokras A. Beyond fertility: polycystic ovary syndrome and long-term health. Fertil Steril. 2018 Oct; 110(5): 794 - 809.
111. van Zuuren E.J. et al. Interventions for hirsutism (excluding laser and photoepilation therapy alone)//Cochrane database of systematic reviews. - 2015. - N. 4.
112. Hashim H.A., Foda O., El Rakhawy M. Unilateral or bilateral laparoscopic ovarian drilling in polycystic ovary syndrome: a meta-analysis of randomized trials//Archives of gynecology and obstetrics. - 2018. - Т. 297. - N. 4. - С. 859 - 870.
113. Mulder C.L. et al. Cardio-metabolic risk factors among young infertile women: a systematic review and meta-analysis//BJOG: An International Journal of Obstetrics & Gynaecology. - 2020. - Т. 127. - N. 8. - С. 930 - 939.
114. Kahal H. et al. The prevalence of obstructive sleep apnoea in women with polycystic ovary syndrome: a systematic review and meta-analysis//Sleep and Breathing. - 2020. - Т. 24. - N. 1. - С. 339 - 350.
115. Oriolo C. et al. Steroid biomarkers for identifying non-classic adrenal hyperplasia due to 21-hydroxylase deficiency in a population of PCOS with suspicious levels of 17OH-progesterone//Journal of endocrinological investigation. - 2020. - Т. 43. - N. 10. - С. 1499 - 1509.
116. Jonard S., Robert Y., Dewailly D. Revisiting the ovarian volume as a diagnostic criterion for polycystic ovaries//Human reproduction. - 2005. - Т. 20. - N. 10. - С. 2893 - 2898.
117. Pinola P. et al.  hormone: correlation with testosterone and oligo-or amenorrhoea in female adolescence in a population-based cohort study//Human Reproduction. - 2014. - Т. 29. - N. 10. - С. 2317 - 2325.
hormone: correlation with testosterone and oligo-or amenorrhoea in female adolescence in a population-based cohort study//Human Reproduction. - 2014. - Т. 29. - N. 10. - С. 2317 - 2325.
118. Moran L.J. et al. Impaired glucose tolerance, type 2 diabetes and metabolic syndrome in polycystic ovary syndrome: a systematic review and meta-analysis//Human reproduction update. - 2010. - Т. 16. - N. 4. - С. 347 - 363.
119. Tosi F. et al. Implications of androgen assay accuracy in the phenotyping of women with polycystic ovary syndrome//The Journal of Clinical Endocrinology & Metabolism. - 2016. - Т. 101. - N. 2. - С. 610 - 618.
120. Steck T., Wernze H. Is determination of the" free androgen index" for hormone screening in polycystic ovaries of value?//Gynakologisch-geburtshilfliche Rundschau. - 1993. - Т. 33. - N. 3. - С. 173 - 179.
121. Kollmann M. et al. Strategies for improving outcome of assisted reproduction in women with polycystic ovary syndrome: systematic review and meta-analysis//Ultrasound in Obstetrics & Gynecology. - 2016. - Т. 48. - N. 6. - С. 709 - 718.
122. Zaenglein AL, Pathy AL, Schlosser BJ, Alikhan A, Baldwin HE, Berson DS, Bowe WP, Graber EM, Harper JC, Kang S, Keri JE, Leyden JJ, Reynolds RV, Silverberg NB, Stein Gold LF, Tollefson MM, Weiss JS, Dolan NC, Sagan AA, Stern M, Boyer KM, Bhushan R. Guidelines of care for the management of acne vulgaris. J Am Acad Dermatol. 2016 May; 74(5): 945 - 73. e33. doi: 10.1016/j.jaad.2015.12.037. Epub 2016 Feb 17. Erratum in: J Am Acad Dermatol. 2020 Jun; 82(6): 1576.
123. Barrionuevo P, Nabhan M, Altayar O, Wang Z, Erwin PJ, Asi N, Martin KA, Murad MH. Treatment Options for Hirsutism: A Systematic Review and Network Meta-Analysis. J Clin Endocrinol Metab. 2018 Apr 1; 103(4): 1258 - 1264.
124. Derewianka-Polak M. et al. Polycystic ovary syndrome and mental disorders-discussion on the recommendations of the European Society of Human Reproduction and Embryology (ESHRE)//Current Problems of Psychiatry. - 2019. - Т. 20. - N. 4
125. Zeinalzadeh M., Basirat Z., Esmailpour M. Efficacy of letrozole in ovulation induction compared to that of clomiphene citrate in patients with polycystic ovarian syndrome//The Journal of reproductive medicine. - 2010. - Т. 55. - N. 1-2. - С. 36 - 40
126. Franik, S., Eltrop, S.M., Kremer, J.A., Kiesel, L., & Farquhar, C. (2018). Aromatase inhibitors (letrozole) for subfertile women with polycystic ovary syndrome. Cochrane Database of Systematic Reviews. doi:10.1002/14651858.cd010287.pub3
127. Teede HJ, Tay CT, Laven JJE, Dokras A, Moran LJ, Piltonen TT, Costello MF, Boivin J, Redman LM, Boyle JA, Norman RJ, Mousa A, Joham AE; International PCOS Network. Recommendations from the 2023 international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Eur J Endocrinol. 2023 Aug 2; 189(2): G43 - G64. doi: 10.1093/ejendo/lvad096.
128. Agrawal A 4th, Dave A, Jaiswal A. Type 2 Diabetes Mellitus in Patients With Polycystic Ovary Syndrome. Cureus. 2023 Oct 11; 15(10): e46859. doi: 10.7759/cureus.46859.
129. Livadas S, Anagnostis P, Bosdou JK, Bantouna D, Paparodis R. Polycystic ovary syndrome and type 2 diabetes mellitus: A state-of-the-art review. World J Diabetes. 2022 Jan 15; 13(1): 5 - 26. doi: 10.4239/wjd.v13.i1.5.
130. Long C, Feng H, Duan W, Chen X, Zhao Y, Lan Y, Yue R. Prevalence of polycystic ovary syndrome in patients with type 2 diabetes: A systematic review and meta-analysis. Front Endocrinol (Lausanne). 2022 Aug 31; 13: 980405. doi: 10.3389/fendo.2022.980405.
131. Zhao H, Xing C, Zhang J, He B. Comparative efficacy of oral insulin sensitizers metformin, thiazolidinediones, inositol, and berberine in improving endocrine and metabolic profiles in women with PCOS: a network meta-analysis. Reprod Health. 2021 Aug 18; 18(1): 171. doi: 10.1186/s12978-021-01207-7.
132. Greff D, ![]() AE,
AE,  S,
S, ![]() A, Sipos Z, Szinte J, Park S, Hegyi P,
A, Sipos Z, Szinte J, Park S, Hegyi P,  P,
P, ![]() N,
N,  S,
S,  EM. Inositol is an effective and safe treatment in polycystic ovary syndrome: a systematic review and meta-analysis of randomized controlled trials. Reprod Biol Endocrinol. 2023 Jan 26; 21(1): 10. doi: 10.1186/s12958-023-01055-z.
EM. Inositol is an effective and safe treatment in polycystic ovary syndrome: a systematic review and meta-analysis of randomized controlled trials. Reprod Biol Endocrinol. 2023 Jan 26; 21(1): 10. doi: 10.1186/s12958-023-01055-z.
133. Cianci A, Vitale SG. D-Chiro-inositol and PCOS: between myth and reality. The never-ending story. Int J Food Sci Nutr. 2022 Aug; 73(5): 565 - 570. doi: 10.1080/09637486.2022.2029830.
134. Azizi Kutenaei M, Hosseini Teshnizi S, Ghaemmaghami P, Eini F, Roozbeh N. The effects of myo-inositol vs. metformin on the ovarian function in the polycystic ovary syndrome: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci. 2021 Apr; 25(7): 3105 - 3115. doi: 10.26355/eurrev_202104_25565.
135. Zarezadeh M, Dehghani A, Faghfouri AH, Radkhah N, Naemi Kermanshahi M, Hamedi Kalajahi F, Mohammadzadeh Honarvar N, Ghoreishi Z, Ostadrahimi A, Ebrahimi Mamaghani M. Inositol supplementation and body mass index: A systematic review and meta-analysis of randomized clinical trials. Obes Sci Pract. 2021 Oct 22; 8(3): 387 - 397. doi: 10.1002/osp4.569.
136. Jethaliya H, Gajjar N, Patel V, Deshpande S, Patel R. Efficacy of Myo-inositol on Anthropometric, Metabolic, and Endocrine Outcomes in PCOS Patients: a Meta-analysis of Randomized Controlled Trial. Reprod Sci. 2022 Aug; 29(8): 2282 - 2298. doi: 10.1007/s43032-022-00933-y.
137. Bahri Khomami M, Teede HJ, Joham AE, Moran LJ, Piltonen TT, Boyle JA. Clinical management of pregnancy in women with polycystic ovary syndrome: An expert opinion. Clin Endocrinol (Oxf). 2022 Aug; 97(2): 227 - 236. doi: 10.1111/cen.14723.
138. Bahri Khomami M, Joham AE, Boyle JA, et al. Increased maternal pregnancy complications in polycystic ovary syndrome appear to be independent of obesity-a systematic review, meta-analysis, and meta-regression. Obesity Reviews. 2019; 20(5): 659 - 674.
139. Wendland EM, Duncan BB,  JM, Vigo A, Schmidt MI. Gestational diabetes and pre-eclampsia: common antecedents? Arquivos Brasil Endocrinol Metab. 2008; 52: 975 - 984.
JM, Vigo A, Schmidt MI. Gestational diabetes and pre-eclampsia: common antecedents? Arquivos Brasil Endocrinol Metab. 2008; 52: 975 - 984.
140. Национальные медицинские критерии приемлемости методов контрацепции. Адаптированный документ "Медицинские критерии приемлемости использования методов контрацепции ВОЗ, 5 издание, 2015" Москва 2023
141. Different kinds of oral contraceptive pills in polycystic ovary syndrome: A systematic review and meta-analysis. July 2023. European Journal of Endocrinology 189(1). DOI: 10.1093/ejendo/lvad082 Maria Forslund, Johanna Melin, Simon Alesi, Helena Teede, European Journal oEndocrinology, 2023, 189, S1 - S16
141. Amiri M, Bidhendi-Yarandi R, Fallahzadeh A, Marzban Z, Ramezani Tehrani F. Risk of endometrial, ovarian, and breast cancers in women with polycystic ovary syndrome: A systematic review and meta-analysis. Int J Reprod Biomed. 2022; 20(11): 893 - 914.
142. Li Z, Wang YH, Wang LL, et al. Polycystic ovary syndrome and the risk of endometrial, ovarian and breast cancer: An updated meta-analysis. Scott Med J. 2022; 67(3): 109 - 120.
143. American association of clinical endocrinologists, american college of endocrinology, and androgen excess and pcos society disease state clinical review: guide to the best practices in the evaluation and treatment of polycystic ovary syndrome/N.F. Goodman [et al.]//Endocr Pract. - 2015.
144. Teede HJ, Misso ML, Costello MF, Dokras A, Laven J, Moran L, Piltonen T, Norman RJ; International PCOS Network. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril. 2018 Aug; 110(3): 364 - 379
145. Marshall W.A., Tanner J.M. Variations in pattern of pubertal changes in girls//Archives of disease in childhood. - 1969. - Т. 44. - N. 235. - С. 291.
146. Munro M.G. et al. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions//International Journal of Gynecology & Obstetrics. - 2018
147. Suturina L, Lizneva D, Atalyan A, Lazareva L, et al Establishing Normative Values to Determine the Prevalence of Biochemical Hyperandrogenism in Premenopausal Women of Different Ethnicities from Eastern Siberia. Diagnostics (Basel). 2022
148. Belsti Y, Enticott J, Azumah R, Tay CT, Moran L, Ma RCW, Joham AE, Laven J, Teede H, Mousa A. Diagnostic accuracy of oral glucose tolerance tests, fasting plasma glucose and haemoglobin A1c for type 2 diabetes in women with polycystic ovary syndrome: A systematic review and meta-analysis. Diabetes Metab Syndr. 2024 Mar; 18(3): 102970. doi: 10.1016/j.dsx.2024.102970. Epub 2024 Feb 28. PMID: 38442646.
149. Paulus GF1, de Vaan LE, Verdam FJ, Bouvy ND, Ambergen TA, van Heurn LW. Bariatric surgery in morbidly obese adolescents: a systematic review and meta-analysis. Obes Surg. 2015 May; 25(5): 860 - 78. doi: 10.1007/s11695-015-1581-2.
150. Eisenberg D, Shikora SA, Aarts E, et al. 2022 American Society for Metabolic and Bariatric Surgery (ASMBS) and International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO): Indications for Metabolic and Bariatric Surgery. Surg Obes Relat Dis 2022; 18: 1345 - 56.
151. Goldberg A, Graca S, Liu J, Rao V, Witchel SF, Pena A, Li R, Mousa A, Tay CT, Pattuwage L, Teede H, Yildiz BO, Ee C. Anti-obesity pharmacological agents for polycystic ovary syndrome: A systematic review and meta-analysis to inform the 2023 international evidence-based guideline. Obes Rev. 2024 May; 25(5): e13704. doi: 10.1111/obr.13704.
152. Wang FF, Wu Y, Zhu YH, Ding T, Batterham RL, Qu F, Hardiman PJ. Pharmacologic therapy to induce weight loss in women who have obesity/overweight with polycystic ovary syndrome: a systematic review and network meta-analysis. Obes Rev. 2018 Oct; 19(10): 1424 - 1445. doi: 10.1111/obr.12720.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Адамян
Лейла Владимировна
академик РАН, доктор медицинских наук, профессор, заместитель директора ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, Заслуженный деятель науки России, заведующая кафедрой акушерства, гинекологии и Репродуктивной медицины Российского Университета Медицины, главный специалист Минздрава России по гинекологии, является членом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, Российского общества акушеров-гинекологов.
Андреева
Елена Николаевна
доктор медицинских наук, профессор, заместитель директора - директор Института репродуктивной медицины, зав. отделением эндокринной гинекологии, профессор кафедры эндокринологии ГНЦ "Национальный медицинский исследовательский центр эндокринологии" Минздрава России, профессор кафедры акушерства, гинекологии и Репродуктивной медицины Российского Университета Медицины, президент Международной ассоциация акушеров, гинекологов и эндокринологов, член Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, Российского общества акушеров-гинекологов, РОСГЭМ.
Абсатарова
Юлия Сергеевна
кандидат медицинских наук, старший научный сотрудник отделения эндокринной гинекологии ГНЦ ФГБУ "Национальный медицинский исследовательский центр эндокринологии" Минздрава России, является членом международной ассоциации акушеров-гинекологов и эндокринологов.
Григорян
Ольга Рафаэльевна
Главный научный сотрудник отделения эндокринной гинекологии ГНЦ ФГБУ "Национального медицинского исследовательского центра эндокринологии" Минздрава России, д.м.н., профессор
Дедов
Иван Иванович
Президент ГНЦ ФГБУ "Национального медицинского исследовательского центра эндокринологии" Минздрава России, главный внештатный специалист эндокринолог Минздрава России, академик РАН, член Российской ассоциации эндокринологов
Мельниченко
Галина Афанасьевна
Заместитель директора ГНЦ ФГБУ "Национального медицинского исследовательского центра эндокринологии" Минздрава России по науке, академик РАН, член Российской ассоциации эндокринологов
Сметник
Антонина Александровна
к.м.н., заведующая отделением гинекологической эндокринологии ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Министерства Здравоохранения РФ, президент Российского общества специалистов по гинекологической эндокринологии и менопаузе
Сутурина
Лариса Викторовна
Главный научный сотрудник, руководитель отдела охраны репродуктивного здоровья ФГБНУ Научный центр проблем здоровья семьи и репродукции человека, д.м.н., профессор, член Ассоциации гинекологов-эндокринологов России, член международного Общества избытка андрогенов и синдрома поликистозных яичников (AE-PCOSSociety)
Филиппов
Олег Семенович
д.м.н., профессор, заслуженный врач РФ, главный внештатный акушер-гинеколог ФМБА России, заместитель директора ФНКЦ детей и подростков ФМБА России, профессор кафедры акушерства, гинекологии и Репродуктивной медицины Российского Университета Медицины
Шереметьева
Екатерина Викторовна
Ведущий научный сотрудник отделения эндокринологии ГНЦ ФГБУ "Национального медицинского исследовательского центра эндокринологии" Минздрава России, к.м.н., член Ассоциации гинекологов-эндокринологов России, Российской ассоциации эндокринологов, международной ассоциации акушеров-гинекологов и эндокринологов
Уварова
Елена Витальевна
Член-корреспондент РАН, д.м.н., профессор, заслуженный деятель науки РФ, заведующая 2 гинекологическим отделением ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Министерства здравоохранения Российской Федерации, профессор кафедры акушерства, гинекологии и репродуктологии ИПО ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" (Сеченовский университет) Министерства здравоохранения Российской Федерации, главный внештатный специалист гинеколог детского и юношеского возраста Министерства здравоохранения Российской Федерации, президент Ассоциации детских и подростковых гинекологов России, член Российского общества акушеров-гинекологов
Хащенко
Елена Петровна
Кандидат медицинских наук, ведущий научный сотрудник 2 гинекологического отделения ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, главный внештатный специалист гинеколог детского и юношеского возраста МЗ РФ в ЦФО
Чернуха
Галина Евгеньевна
д.м.н., профессор, главный научный сотрудник отделением гинекологической эндокринологии ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, президент МОО Ассоциация гинекологов-эндокринологов
Ярмолинская
Мария Игоревна
профессор РАН, доктор медицинских наук, профессор, заведующий отделом гинекологии и эндокринологии репродукции ФГБУ "НИИ акушерства и гинекологии имени Д.О. Отта", профессор кафедры акушерства и гинекологии ФГБОУ ВО СЗГМУ имени И.И. Мечникова Минздрава России, является членом Российского общества акушеров-гинекологов
Все члены рабочей группы являются членами Российского общества акушеров-гинекологов, кроме указанных отдельно.
Конфликт интересов:
Все члены рабочей группы заявляют об отсутствии конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-акушеры-гинекологи, врачи-эндокринологи, врачи-терапевты, врачи общей практики;
2. Студенты, ординаторы, аспиранты;
3. Преподаватели, научные сотрудники.
В данных клинических рекомендациях все сведения ранжированы по уровню убедительности рекомендаций и достоверности доказательств в зависимости от количества и качества исследований по данной проблеме (Таблица 3, Таблица 4, Таблица 5).
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 4. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 5. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ
К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1) Приказ Минздрава России от 20.10.2020 N 1130н "Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология" (Зарегистрировано в Минюсте России 12.11.2020 N 60869);
2) Порядок использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению (приказ Министерства здравоохранения Российской Федерации от 31 июля 2020 г. N 803н).
Приложение А3.1
КРИТЕРИИ ИЗБЫТОЧНОГО ВЕСА И ОЖИРЕНИЯ В РАЗЛИЧНЫХ ПОПУЛЯЦИЯХ
Раса
Европеоиды
Азиаты
Избыточный вес
ИМТ = 25,0 - 29,9 кг/м2
ИМТ = 23,0 - 24,9 кг/м2
Ожирение
ИМТ >= 30 кг/м2 (39)
ИМТ >= 27,5 кг/м2 (39)
Приложение А3.2
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ СПЯ С ДРУГИМИ НОЗОЛОГИЯМИ
Заболевания и состояния, некоторые проявления которых совпадают с симптомами СПЯ
Заболевания и состояния
Клинические проявления
Тесты, позволяющие провести дифференциальный диагноз
Беременность
Аменорея (а не олигоменорея), прочие симптомы беременности
Исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови
Исследование мочи на хорионический гонадотропин (позитивный)
Гипоталамическая аменорея
Аменорея, снижение веса/индекса массы тела (ИМТ), интенсивные физические нагрузки в анамнезе, не характерны клинические признаки гиперандрогении, иногда выявляются мультифолликулярные яичники
Исследование уровня лютеинизирующего гормона в сыворотке крови
Исследование уровня фолликулостимулирующего гормона в сыворотке крови (снижены или на нижней границе нормы), Исследование уровня общего эстрадиола в крови (снижен)
Преждевременная овариальная недостаточность
Аменорея сочетается с симптомами эстрогенного дефицита, включая приливы жара и урогенитальные симптомы
Исследование уровня фолликулостимулирующего гормона в сыворотке крови (повышен), Исследование уровня общего эстрадиола в крови (снижен)
Андроген-продуцирующие опухоли
Вирилизация (включая изменение голоса, андрогенную алопецию, клиторомегалию), быстрая манифестация симптомов
Исследование уровня общего тестостерона в крови
Исследование уровня дегидроэпиандростерона сульфата в крови (значительно повышены)
Ультразвуковое исследование органов малого таза комплексное (трансвагинальное и трансабдоминальное)
Магнитно-резонансная томография (МРТ) надпочечников
Синдром или болезнь Иценко-Кушинга
Наряду с клиническими проявлениями, сходными с СПЯ (ожирение по центральному типу, гиперандрогения, нарушения толерантности к углеводам), имеются более специфические симптомы: часто на лице - "лунообразное" лицо) с одновременным уменьшением верхних и нижних конечностей в обхвате из-за атрофии мышечной и жировой ткани, "матронизм" (яркий румянец цианотического оттенка в совокупности с округлившимися чертами лица), скошенные ягодицы (вследствие атрофии мышц), широкие (часто более 1 см) багрово-фиолетовые стрии на животе, внутренней поверхности бедер и плеч, у женщин - на молочных железах, множественные подкожные кровоизлияния, возникающие даже при незначительных травмах и другие проявления
Исследование уровня свободного кортизола в суточной моче (повышен), исследование уровня свободного кортизола в слюне (повышен), супрессивный ночной тест с дексаметазоном (недостаточная супрессия уровня кортизола в сыворотке крови утром)
Акромегалия
Специфичные симптомы: головная боль, сужение полей зрения, увеличение челюсти, языка, размера обуви и перчаток
Исследование уровня инсулиноподобного ростового фактора I в крови (повышен) МРТ гипофиза
Примеры обоснования диагноза СПЯ
- СПЯ (гирсутизм, гиперандрогенемия, олигоановуляция, поликистоз яичников по УЗИ)
- СПЯ (гирсутизм, олигоановуляция, поликистоз яичников по УЗИ)
- СПЯ (гиперандрогенемия, олигоановуляция, поликистоз яичников по УЗИ)
- СПЯ (гирсутизм, поликистоз яичников по УЗИ)
- СПЯ (гиперандрогенемия, поликистоз яичников по УЗИ)
- СПЯ (гирсутизм, гиперандрогенемия, поликистоз яичников по УЗИ)
- СПЯ (олигоановуляция, поликистоз яичников по УЗИ)
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Диагностика СПЯ

1 - исследование уровня тестостерона в крови; 2 - исследование уровня глобулина, связывающего половые стероиды в крови; 3 - индекс свободных андрогенов; 4 - УЗИ органов малого таза комплексное (трансвагинальное и трансабдоминальное); 5 - исследование уровня пролактина в крови; 6 - исследование уровня тиреотропного гормона в крови; 7 - исследование уровня свободного тироксина в крови; 8 - исследование уровня 17-гидроксипрогестерона в крови.
Алгоритм ведения пациенток с СПЯ, не планирующих беременность

Алгоритм лечения ановуляторного бесплодия при СПЯ
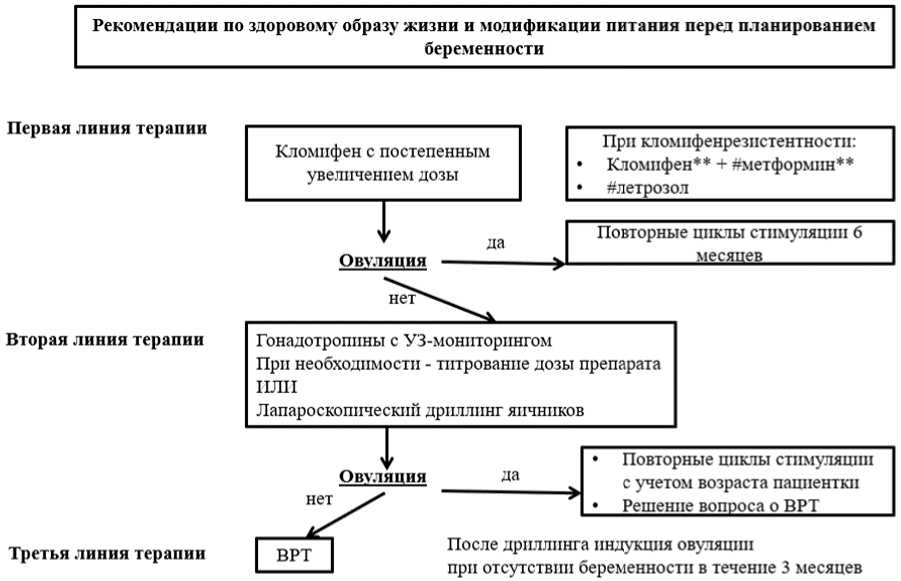
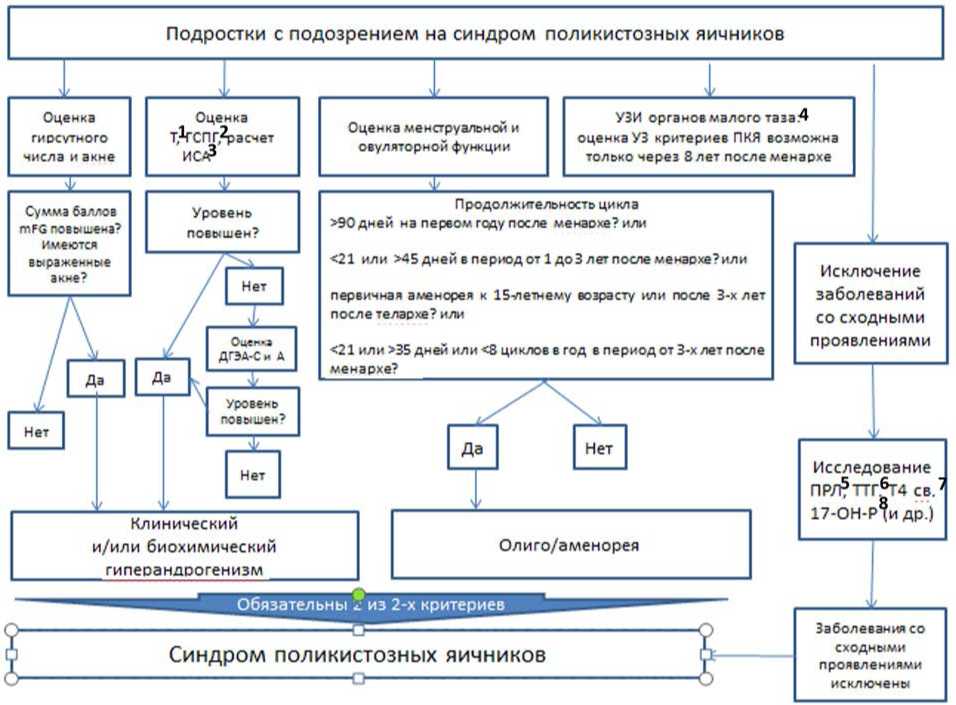
1 - исследование уровня тестостерона в крови; 2 - исследование уровня глобулина, связывающего половые стероиды в крови; 3 - индекс свободных андрогенов; 4 - УЗИ органов малого таза комплексное (трансвагинальное и трансабдоминальное); 5 - исследование уровня пролактина в крови; 6 - исследование уровня тиреотропного гормона в крови; 7 - исследование уровня свободного тироксина в крови; 8 - исследование уровня 17-гидроксипрогестерона в крови.
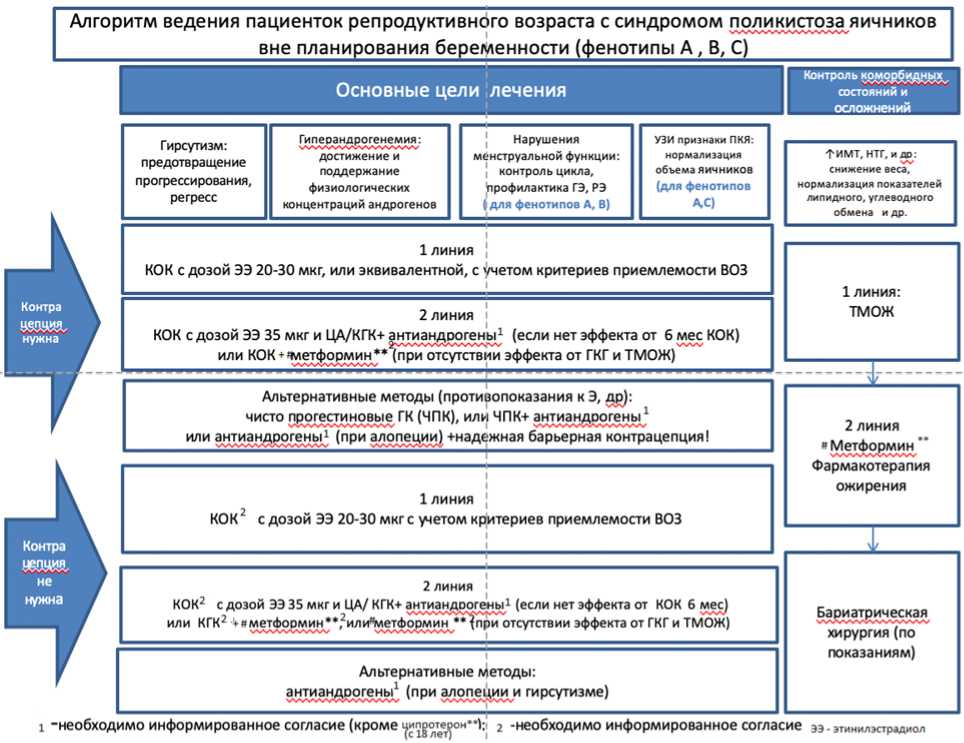
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Синдром поликистозных яичников (СПЯ) является самой распространенной гормональной и репродуктивной проблемой, затрагивающей женщин детородного возраста. По статистике, от 8 до 21% женщин страдают от этого расстройства.
Диагноз СПЯ можно поставить при наличии хотя бы 2-х любых из нижеперечисленных признаков:
- отсутствие овуляции в течение длительного периода времени;
- высокий уровень андрогенов (мужских гормонов);
- множество мелких кист в яичниках.
СПЯ возникает в результате нескольких факторов. Многие женщины с СПЯ имеют резистентность к инсулину, при этом состоянии организм не может использовать инсулин эффективно. Это приводит к тому, что в крови циркулирует большое количество инсулина - гиперинсулинемия. Считается, что гиперинсулинемия связана с повышенным уровнем андрогенов, а также с ожирением и сахарным диабетом 2 типа. В свою очередь, ожирение может увеличить уровень инсулина, вызывая ухудшение СПЯ.
Овуляция - это процесс, при котором зрелые (готовые к оплодотворению) яйцеклетки, освобождаются из яичников. При овуляторных проблемах репродуктивная система женщины не производит надлежащего количества гормонов, необходимых для развития яйцеклетки. Когда яичники не производят гормоны, необходимые для овуляции и нормального протекания менструального цикла, они увеличиваются и в них происходит развитие множества маленьких кист, которые производят андрогены. Повышенный уровень андрогенов может не влиять на менструальный цикл. Некоторые женщины с СПЯ имеют нормальный менструальный цикл.
Признаки и симптомы СПЯ связаны с гормональным дисбалансом, отсутствием овуляции, и резистентностью к инсулину и могут включать:
- нерегулярные, редкие или отсутствующие менструации;
- гирсутизм - избыточный рост волос на теле и лице, включая грудь, живот, и прочее;
- акне и жирную кожу;
- увеличенные яичники с множеством кист на поверхности;
- бесплодие;
- избыточный вес или ожирение, особенно вокруг талии (центральное ожирение) и живота;
- облысение по мужскому типу или истончение волос;
- затемненные участки кожи на шее, в подмышечных впадинах и под грудью.
Симптомы СПЯ могут быть похожи на другие медицинские проблемы, поэтому всегда консультируйтесь со своим врачом, который проведет дифференциальную диагностику.
Диагностика СПЯ
В дополнение к полной истории болезни и физическому обследованию, диагностические процедуры для СПЯ могут включать в себя:
- гинекологическое обследование - внешнее и внутреннее обследование женских половых органов;
- УЗИ - диагностический метод визуализации, который использует высокочастотные звуковые волны и компьютер для создания изображения кровеносных сосудов, тканей и органов. Ультразвук может определить, увеличены яичники женщины или нет, есть ли кисты, оценить толщину эндометрия. Вагинальное ультразвуковое исследование, при котором ультразвуковой датчик вводится во влагалище, иногда используется для просмотра эндометрия;
- анализ крови для определения уровня андрогенов и других гормонов.
Лечение СПЯ
Специальное лечение СПЯ будет определено врачом на основе Вашего возраста, общего состояния здоровья и истории болезни, степени расстройства, причин расстройства, ваших симптомов, вашей переносимости лекарств, процедур, ваших мнений и предпочтений, а также ожиданий от терапии.
Лечение СПЯ также зависит от наличия или отсутствия желания женщины забеременеть. Для женщин, которые хотят ребенка, назначается лечение, направленное на снижение веса и стимуляцию овуляции. Оно может включать:
- меры для снижения веса - здоровое питание и повышение физической активности. Эти меры позволят также организму более эффективно расходовать инсулин, снизят уровень глюкозы в крови и могут поспособствовать тому, что у женщин нормализуется регулярность овуляций;
- назначение лекарств для стимуляции овуляции, которые помогут яичникам произвести один или несколько фолликулов и вовремя выйти созревшей для оплодотворения яйцеклетке.
Женщины часто ведут длительную борьбу с физическими изменениями, которые провоцирует СПЯ. К ним относятся: чрезмерный рост волос на теле, прыщи, избыточный вес. В качестве дополнения к диете и лекарствам, нелишним будет электролиз и лазерное удаление волос, которые могут помочь женщине чувствовать себя уверенней в себе.
Из-за возможных отдаленных рисков, к которым приводит СПЯ (болезни сердца, сахарный диабет 2 типа), женщины с данным заболеванием должны проконсультироваться со своим врачом по поводу назначения соответственного лечения.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ФЕРРИМАНА-ГАЛЛВЕЯ
Название на русском языке: Шкала Ферримана-Галлвея
Оригинальное название (если есть): Ferriman gallwey score
Источник (официальный сайт разработчиков, публикация с валидацией): Yildizetal., 2010
Тип (подчеркнуть): шкала оценки
Назначение: Оценка степени выраженности оволосения
Содержание (шаблон): Оценивается степень выраженности оволосения в 9 областях тела по 4-балльной шкале
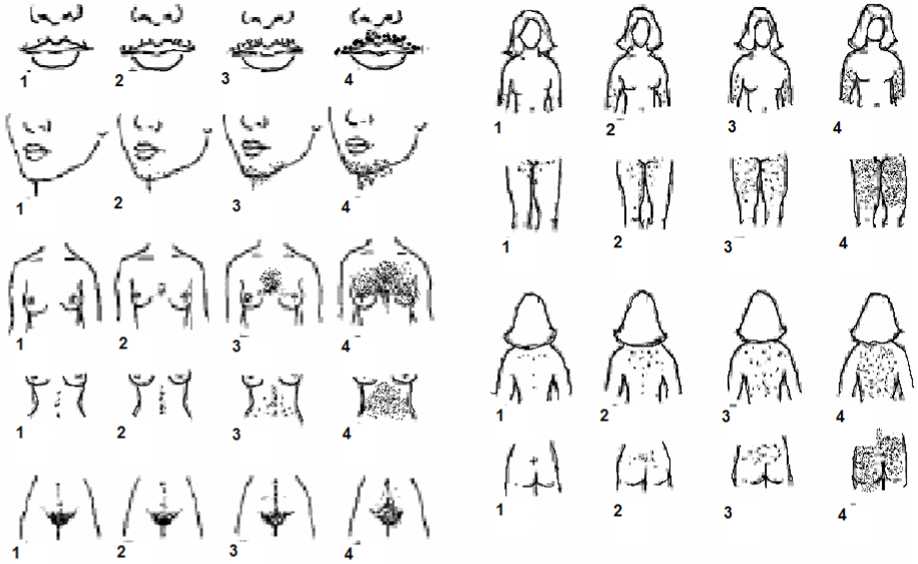
Рис. 1. Модифицированная шкала Ферримана-Галлвея (Yildizetal., 2010)
Ключ (интерпретация): Сумма баллов по всем областям называется гирсутным числом.
Пояснения: Рекомендуется не прибегать к депиляции или удалять волосы с помощью воска в течение, как минимум, 4-х недель и избегать сбривания волос в течение не менее 5 дней до проведения исследования.
Приложение Г2
ВОЗРАСТНАЯ ХАРАКТЕРИСТИКА СТАДИЙ ПОЛОВОГО СОЗРЕВАНИЯ
ДЕВОЧЕК (ПО TANNER J.M., MARSHAL W.A., 1969)
Название на русском языке: Возрастная характеристика стадий полового созревания девочек
Оригинальное название (если есть): Tanner Stages
Источник (официальный сайт разработчиков, публикация с валидацией): Hamlin A., Robertson M., Wilson D.R. Tanner Stages and Pubertal Development//Journal of Pediatric Surgical Nursing. - 2022
Тип (подчеркнуть): шкала оценки
Назначение: Оценка степени развития вторичных половых признаков
Содержание (шаблон): Оценивается степень развития вторичных половых признаков по стадиям (молочная железа и лобковое оволосение)
Ключ (интерпретация): Соответствие развития вторичных половых признаков возрасту пациентки
Пояснения: При несоответствии развития вторичных половых признаков возрасту пациентки устанавливается диагноз нарушения полового созревания
Стадия
Изображение
Развитие молочных желез, признаки
Лобковое оволосение, признаки
Средний возраст, годы
I
Препубертатное, железистая ткань отсутствует, диаметр ареолы менее 2 см, ареолы бледно окрашены, увеличение только соска.
Препубертатное, отсутствие волос.
Препубертатный период
II
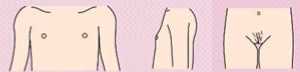
Появление железистой ткани молочных желез, уплотнение грудных желез заметно или пальпируется, железа начинает выступать над поверхностью грудной клетки, увеличение диаметра ареол.
Редкие волосы, длинные, прямые или слегка вьющиеся, минимум пигментированных волос, в основном, на половых губах.
10,5 - 11,5
III
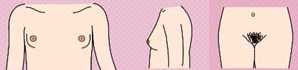
Дальнейшее увеличение грудных желез и ареол без выделения их контуров, молочные железы и ареолы выступают в виде конуса, без границы между ними, появляется окрашивание ареолы.
Более темные и грубые волосы, распространяющиеся по лобку.
12,0 - 12,5
IV
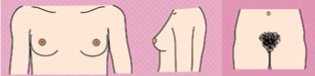
Выступание ареолы и соска над грудной железой, ареола интенсивно окрашена, выступает в виде второго конуса над тканью молочной железы.
Густые, взрослого типа волосы, не распространяющиеся на медиальную поверхность бедер.
13,0 - 13,5
V
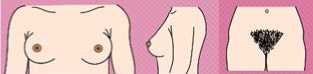
Взрослые контуры грудной железы с выступанием только соска, контур между тканью молочной железы и ареолой сглажен.
Волосы взрослого типа, распространяющиеся в форме классического треугольника.
14,0 - 15,0
