"Клинические рекомендации "Острые миелоидные лейкозы"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОСТРЫЕ МИЕЛОИДНЫЕ ЛЕЙКОЗЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C92.0, C92.3, C92.5, C92.6, C92.7, C92.8, C92.9, C93.0, C94.0, C94.2
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 586_3
Возрастная категория: Дети
Специальность: Гематология, Детская онкология
Разработчик клинической рекомендации
Национальное общество детских гематологов, онкологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
алло-ТГСК - аллогенная трансплантация гемопоэтических стволовых клеток
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
ауто-ТГСК - аутологичная трансплантация стволовых гемопоэтических клеток
БЛРС - бета-лактамазы расширенного спектра
ВДЦ - высокие дозы цитарабина**
ВИЧ - вирус иммунодефицита человека
ВОЗ - Всемирная ОрганизацияЗдравоохранения
ВДПХТ - высокодозная полихимиотерапия
ДНК - дезоксирибонуклеиновая кислота
ЖКТ - желудочно-кишечный тракт
ИА - инвазивный аспергиллез
ИФТ - иммунофенотипическое исследование
КМ - костный мозг
КИ - клинические исследования
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
МДС - миелодиспластический синдром
МДЦ - малые дозы цитарабина**
МОБ - минимальная остаточная болезнь
МП - меркаптопурин
МПЗ - миелопролиферативное заболевание
МС - миелоидная саркома
ОЛ - острый лейкоз
ОЛЛ - острый лимфобластный лейкоз
ОЛСФ - острый лейкоз смешанного фенотипа
ОМЛ - острый миелоидный лейкоз
ОПЛ - острый промиелоцитарный лейкоз
ПР - полная ремиссия
ПЦР - полимеразная цепная реакция
РКИ - рандомизированное клиническое исследование
РНК - рибонуклеиновая кислота
РТПХ - реакция "трансплантат против хозяина"
ТКМ - трансплантация костного мозга
УДД - уровень достоверности доказательств
УЗИ - ультразвуковое исследование
УУР - уровень убедительности рекомендаций
ХТ - химиотерапия
ЦМВ - цитомегаловирус
ЦНС - центральная нервная система
ЭКГ - электрокардиография
Эхо-КГ - эхо-электрокардиография
FAB классификация - французско-американско-британская классификация
FISH - флюоресцентная in situ гибридизация
NCCN - Национальная общественная противораковая сеть
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся вне показаний к применению, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Острые миелоидные лейкозы (ОМЛ) - клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становится блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток [1, 2].
Оценка эффективности терапии:
Полная клинико-гематологическая ремиссия (ПР) ОМЛ определяется как, состояние при котором в пунктате костного мозга обнаруживается не более 5% бластных клеток при нормальной клеточности и гармоничным соотношении всех ростков кроветворения, отсутствии бластных клеток с палочками Ауэра, при восстановлении содержания нейтрофилов в периферической крови 31,0 x 109/л, тромбоцитов 31,0 x 109/л, при отсутствии экстрамедуллярных лейкемических очагов (центральная нервная система, кожа) и спленомегалии. Указанные показатели должны сохраняться в стабильном состоянии в течение 1 месяца и более. ПР констатируется без учета данных определения "минимальной остаточной болезни" (МОБ) с помощью проточной цитометрии (иммунофенотипирования, ИФТ) или молекулярно-биологическими методами (количественная ПЦР, определение экспрессии генов).
ПР с неполным восстановлением - полная ремиссия при сохраняющейся нейтропении (< 1 x 109/л) и/или тромбоцитопении (< 100 x 109/л).
Полная ремиссия (ПР) с отсутствием минимальной остаточной болезни (МОБ(-) ПР) - полная ремиссия с отсутствием в аспирате костного мозга обнаруженного генетического маркера или гемопоэтических клеток с аберрантным опухолевым иммунофенотипом.
Минимальная остаточная болезнь (МОБ) - это популяция опухолевых клеток, которая не может быть выявлена с помощью световой микроскопии, но обнаруживается более точными методами исследования, способными детектировать 1 лейкемическую клетку на 104 - 106 исследуемых.
Неудачи в лечении:
Резистентный (рефрактерный) ОМЛ - недостижение полной ремиссии (определение - выше) после проведения блока индукции (AME/ADE/AIE).
При бластозе менее 15% в пунктате костного мозга и отсутствии однозначных признаков наличия лейкемических бластов (например, палочек Ауэра) необходимо подтверждение рефрактерности с помощью ИФТ и/или цитогенетических/молекулярных маркеров.
В отличие от протоколов лечения ОМЛ конца 20-го - начала 21 века, в который резистентность констатировалась после проведения двух курсов химиотерапии, в современных протоколах показано, что у пациентов не достигших ПР после курса индукционной химиотерапии, риск рецидива высок даже при достижении ПР после второго курса.
Рецидив - более 10% лейкемических бластов в костном мозге или любое экстрамедуллярное поражение не менее чем через 1 месяц после установления первой полной клинико-гематологической ремиссии. Учитывая возможность ложной диагностики рецидива в результате повышения содержания предшественников B-лимфоцитов (гематогонов), необходимо соотнесение бластоза, "титра" выявленного молекулярного маркера и иммунофенотипирования.
Молекулярный рецидив - выявление МОБ методом проточной цитометрии и/или ПЦР в последовательном двухкратном исследовании с интервалом не менее 2-х недель, при условии анализа аберрантного иммунофенотипа или выполнения молекулярного исследования до начала терапии.
Нейролейкоз - любое количество бластных клеток в цитопрепарате, не объяснимое контаминацией ликвора примесью периферической крови в результате травматической пункции; и/или симптомы поражения черепно-мозговых нервов или иная неврологическая симптоматика, связанная с хлоромным ростом. Интракраниальные и интраспинальные эпидуральные "хлоромы" при отсутствии лейкемических клеток в ликворе не считаются нейролейкозом. Градация статуса ЦНС поражения определяется протоколом терапии.
Индукция ремиссии - первый курс химиотерапии, имеющий целью достижение ПР.
Консолидация ремиссии - постремиссионная терапия, имеющая целью "углубление" ремиссии, то есть дальнейшую редукцию опухолевой популяции. Пациентам, не подлежащим аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК), обычно проводится 3 - 4 курса терапии на основе промежуточных/высоких доз цитарабина**.
Поддерживающее лечение - продолжение химиотерапии после завершения интенсивной фазы протокола, с целью постепенной элиминации пула резидуальных стволовых клеток опухолевого клона. В качестве поддерживающей терапии применяются антиметаболиты (6-Меркаптопурин и цитарабин**) и ингибиторы критических сигнальных путей (ингибиторы flt-3) и эпигенетические препараты.
Профилактика или, при необходимости, лечение нейролейкемии нейролейкоза - этот этап распределяется на все периоды программного лечения - индукцию ремиссии, консолидацию и поддерживающее лечение.
Трансплантация гемопоэтических стволовых клеток - под этим термином объединены трансплантация гемопоэтических стволовых клеток костного мозга, периферической крови и пуповинной (плацентарной) крови.
Стандартные определения при развитии инфекционных осложнений: bnl
Нейтропения - количество гранулоцитов менее 0,5 x 109/л, либо менее 1,0 x 109/л с ожидаемым снижением в течение нескольких последующих дней.
Фебрилитет - однократный подъем температуры тела 38,3 °C или температура тела 37,8 °C, сохраняющаяся в течение одного и более часа [109, 110].
Гипотермия - снижение температуры тела менее 36 °C. Данный показатель является важным признаком инфекционного процесса, особенно у детей младшего возраста и у пациентов, получающих глюкокортикостероиды [111, 112].
Лихорадка неясной этиологии - состояние, характеризующееся фебрилитетом при отсутствии клинико-рентгенологических проявлений инфекции и микробиологических данных.
Бактериемия - идентификация микроорганизма из гемокультуры, взятой во время фебрильного эпизода, не являющегося присевным. К ложной бактериемии относится идентификация так называемых присевных микроорганизмов - комменсалов кожи: коагулазонегативных стафилококков, Propionibacterium spp., Micrococcus spp., и др. - в случае их однократной идентификации [106, 110, 113, 114].
Доказанной является инфекция, с идентификацией микроорганизма из стерильных субстратов организма (кровь, ликвор, моча, биопсийный материал) при наличии симптомов воспалительной реакции, либо изоляция патогена из нестерильных субстратов (кожа, слизистые, желудочно-кишечный тракт) при соответствующей локальной клинической картине инфекции.
Вероятной является инфекция без идентификации микроорганизма из исследуемых сред при наличии клинических и/или радиологическиих признаков инфекции с быстрым ответом на противоинфекционную терапию.
Фебрильная нейтропения (ФН) - симптомокомплекс, сочетающий развитие фебрилитета или гипотермии у пациента с критериями нейтропении. Является наиболее ожидаемым инфекционным осложнением и развивается у подавляющего большинства пациентов группы высокого риска.
К группе высокого риска относятся пациенты с ОМЛ в течение всего периода ХТ, реципиенты трансплантатов гематопоэтических стволовых клеток (ТГСК).
У пациентов, находящихся в нейтропении, вследствие нарушения барьерной функции слизистых оболочек желудочно-кишечного тракта, может развиваться феномен транслокации эндогенной флоры кишечника непосредственно в кровоток. Во время развития инфекционного эпизода локальная клиническая симптоматика может отсутствовать и единственным признаком быть фебрильная лихорадка/гипотермия, вялость либо нарушение сознания.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Острый миелоидный лейкоз - это клональное опухолевое заболевание кроветворной ткани, связанное с мутацией в клетке-предшественнице гемопоэза, следствием которой становится блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ОМЛ является следствием повреждения - мутации - в генетическом материале аппарат клоногенной кроветворной клетки. В результате этой мутации происходит нарушение контроля за клеточным циклом, изменение процесса транскрипции и продукции ряда ключевых белков. Вследствие бесконтрольной пролиферации в отсутствие дифференцировки происходит накопление патологических клеток. Тот факт, что патогенез острых лейкозов связан с генетическими поломками довольно часто подтверждается обнаружением различных хромосомных аберраций (транслокаций, делеций, инверсий и т.д.). В большинстве случаев, конкретная причина возникновения ОМЛ остается неизвестной. Однако, существует несколько предрасполагающих факторов, которые значительно увеличивают риск развития этого заболевания. Четко доказанная взаимосвязь между ионизирующей радиацией при взрыве атомной бомбы, а также химио- и радиотерапией по поводу других опухолей злокачественных новообразований с повышенным риском возникновения острых лейкозов заставила изучить другие возможные лейкемогенные факторы (низкие дозы радиации, химические вещества, курение, электромагнитные волны). Доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет. Ряд исследователей предполагает, что около 20% ОМЛ являются следствием курения. Бензол при длительном воздействии на организм человека обладает канцерогенным эффектом, дает лейкемогенный эффект, но при небольших концентрациях этого вещества, с которыми чаще всего сталкиваются люди на производстве, не доказана взаимосвязь с повышенным риском возникновения ОМЛ. При изучении постоянного воздействия малых доз радиации пока не получено доказательств в пользу увеличения частоты заболеваемости ОМЛ. Впервые взаимосвязь между предшествующей химиотерапией (ХТ), лучевым лечением каких-либо других опухолевых заболеваний и повышенным риском развития ОМЛ была отмечена у пациентов, излеченных от лимфомы Ходжкина. Доказано, что не столько кумулятивная доза, сколько интенсивность дозового воздействия обусловливает повышение частоты заболеваемости ОМЛ. Риск развития вторичного ОМЛ наиболее высок в период от 2 до 9 лет после завершения предшествующей ХТ. В 85% случаев вторичные лейкозы возникают в сроки до 10 лет от окончания лечения [3, 4]. Этиология и специфические факторы, приводящие к развитию вторичных ОМЛ, полностью не изучены. В патогенез вовлечены многие генетические пути и кооперативные мутации. "Вторичные" ОМЛ, ассоциированные с применением алкилирующих агентов, часто дебютируют с миелодиспластического синдрома (МДС) с моносомией или частичной делецией хромосом 5 и 7. Этот тип ОМЛ возникает относительно поздно, в среднем через 5 - 7 лет после излечения больных от первичного ЗНО.
Вероятность развития лейкозов увеличивается при следующих генетически обусловленных заболеваниях: врожденная агаммаглобулинемия, синдром Швахмана-Даймонда, атаксия-телеангиоэктазия, синдром Ли-Фраумени, нейрофиброматоз, анемия Даймонда - Блекфана, тяжелая врожденная нейтропения, анемия Фанкони, синдром Дауна, синдром Блума.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Считается, что ОМЛ заболевает в среднем 3 - 5 человек на 100 тыс. населения в год. При этом заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12 - 13 человек на 100 тыс. у людей в возрасте старше 80 лет. Медиана возраста этого заболевания составляет 65 лет. Эпидемиология ОМЛ среди детского населения в Российской Федерации изучена недостаточно. Острый миелоидный лейкоз встречается в 20% от всех острых лейкозов у детей, составляет 6% от всех опухолей у детей. Новые случаи ОМЛ у детей составляют 0,7 - 1,2/100 000 в год [1, 5].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C92.0 Острый миелоидный лейкоз
Исключение: обострение хронического миелоидного лейкоза (C92.1)
C92.3 Миелоидная саркома (хлорома, гранулоцитарная саркома)
C92.5 Острый миеломоноцитарный лейкоз
C92.6 Острый миелоидный лейкоз с 11q23-аномалией
C92.7 Другой миелоидный лейкоз
C92.8 Острая миелоидная лейкемия с мультилинейной дисплазией
C92.9 Миелоидный лейкоз неуточненный
C93.0 Острый моноцитарный лейкоз
C94.0 Острая эритремия и эритролейкоз
C94.2 Острый мегакариобластный лейкоз
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Перечень вариантов ОМЛ и других опухолей с миелоидной дифференцировкой (ВОЗ, 2016) [6, 7]:
Классификация ВОЗ (2016) подразделяет все ОМЛ, основываясь на их цитогенетических и молекулярно-генетических особенностях (подробнее в Приложении А3.4), и именно эти особенности формируют клинико-патологические группы:
ОМЛ с устойчиво выявляемыми генетическими аномалиями
ОМЛ с t(8; 21) (q22; q22); RUNX1-RUNX1T1
ОМЛ с inv(16) (p13.1q22) или t(16; 16) (p13.1; q22); CBFB-MYH11
ОПЛ с t(15; 17) (q22; q12); PML-RARA
ОМЛ с t(9; 11) (p22; q23); MLLT3-MLL
ОМЛ с t(6; 9) (p23; q34); DEK-NUP214
ОМЛ с inv(3) (q21q26.2) или t(3; 3) (q21; q26.2); RPN1-EVI1
ОМЛ (мегакариобластный) с t(1; 22) (p13; q13); RBM15-MKL1
ОМЛ с BCR/ABL1*
ОМЛ с генными мутациями <*>:
ОМЛ с мутированным геном NPM1 <*>
ОМЛ с биаллельной мутацией гена CEBPA <*>
ОМЛ с мутированным геном RUNX1 <*>
ОМЛ с изменениями, связанными с миелодисплазией
Миелоидные неоплазии, связанные с предшествующей ХТ
ОМЛ, по-другому не специфицированные (NOS)
Острый миелобластный лейкоз с минимальной дифференцировкой
Острый миелобластный лейкоз без созревания
Острый миелобластный лейкоз с созреванием
Острый миеломонобластный лейкоз
Острый монобластный/моноцитарный лейкоз
Острый эритромиелоз
Острый мегакариобластный лейкоз
Острый лейкоз из базофилов
Острый панмиелоз с миелофиброзом (син.: острый миелофиброз; острый миелосклероз)
Миелоидная саркома (син.: экстрамедуллярная миелоидная опухоль; гранулоцитарная саркома; хлорома)
Миелоидные опухоли, связанные с синдромом Дауна
Транзиторный аномальный миелопоэз (син.: транзиторное МПЗ)
Миелоидный лейкоз, связанный с синдромом Дауна
Опухоль из плазмацитоидных дендритных клеток
Острые лейкозы неопределенной линии дифференцировки
Острый недифференцированный лейкоз
Острый лейкоз смешанного фенотипа с t(9; 22) (q34; q11.2); BCR-ABL1
Острый лейкоз смешанного фенотипа с t(v; 11q23.3); реаранжировка гена KMT2A (ранее - MLL)
Острый лейкоз смешанного фенотипа, B/миелоидный, NOS
Острый лейкоз смешанного фенотипа, T/миелоидный, NOS
Острый лейкоз смешанного фенотипа NOS*
Острые лейкозы неопределенной линии дифференцировки NOS*
--------------------------------
<*> Новые группы, введенные в классификацию ВОЗ в 2016 г.
Подгруппа "ОМЛ с устойчиво выявляемыми хромосомными аномалиями" объединяет несколько вариантов ОМЛ:
"ОМЛ с t(8; 21) (q22; q22); RUNX1-RUNX1T1"
"ОМЛ с inv(16) (p13.1q22) или t(16; 16) (p13.1; q22); CBFB-MYH11" (при выявлении указанных хромосомных перестроек, несмотря на число бластных клеток в пунктате костного мозга, всегда устанавливают диагноз острого миелоидного лейкоза).
"ОПЛ с t(15; 17) (q22; q12); PML-RARA"; транслокации RARA с другими партнерами выделяются в отдельные формы ОМЛ, например, ОМЛ с t(11; 17) (q23; q12); ZBTB16-RARA; ОМЛ с t(11; 17) (q13; q12); NUMA1-RARA; ОМЛ с t(5; 17) (q35; q12); NPM1-RARA; ОМЛ с STAT5BRARA.
Ранее выделяемая категория "ОМЛ с аномалиями 11q23 (MLL)" была переведена в категорию "ОМЛ с t(9; 11) (p22; q23); MLLT3-MLL"; другие транслокации, отличающиеся от тех, что включают MLLT3, должны быть отдельно указаны в диагнозе, например ОМЛ с t(6; 11) (q27; q23); MLLT4-MLL; ОМЛ с t(11; 19) (q23; p13.3); MLLMLLT1; ОМЛ с t(11; 19) (q23; p13.1); MLL-ELL; ОМЛ с t(10; 11) (p12; q23); MLLT10-MLL
Были выделены три новых подгруппы: "ОМЛ с t(6; 9) (p23; q34); DEK-NUP214", "ОМЛ с inv(3) (q21q26.2) или t(3; 3) (q21; q26.2); RPN1-EVI1" и "ОМЛ (мегакариобластный) с t(1; 22) (p13; q13); RBM15-MKL1", редкий вариант ОЛ, наиболее часто диагностируемый у детей.
У пациентов ОМЛ с нормальным кариотипом были выделены две новые категории: "ОМЛ с мутированным геном NPM1 (нуклеофозмин (ядерный фосфопротеин B23, нуматрин))" и "ОМЛ с мутированным геном CEBPA (белок, связывающий энхансер CCAAT альфа (CCAAT/enhancer binding protein (C/EBP) alpha))". Накапливается все больше доказательств в пользу того, что эти мутации определяют нарушения дифференцировки гемопоэтических клеток, и относятся к так называемым мутациям 2-го класса.
Мутации в гене fms-связанной тирозинкиназы 3 (fms-related tyrosine kinase, FLT3) обнаруживают при многих вариантах ОМЛ, и их относят к мутациям 1-го класса, т.е. к тем, которые определяют преимущество опухолевых клеток в пролиферации и/или выживании. ОМЛ с мутациями FLT3 не выделяются в отдельную категорию, однако, необходимо определять эти мутации, так как они имеют прогностическую значимость. Рекомендуется не только определять наличие FLT3-ITD, но и определять, так называемое, аллельное соотношение, которое характеризует объем опухоли. Аллельное соотношение считается высоким при значениях, равных и более 0,5, и низким - при значениях менее 0,5. Прогностическую значимость имеют высокие значения.
Ранее выделяемая подгруппа "ОМЛ с мультилинейной дисплазией" в классификации ВОЗ (2016) определяется как "ОМЛ с изменениями, связанными с миелодисплазией". ОМЛ могут относиться к категории "ОМЛ с изменениями, связанными с миелодисплазией", если:
1) 320% бластных клеток в костном мозге или периферической крови
2) существует предшествующая история МДС или иного миелопролиферативного заболевания (МПЗ);
3) существуют цитогенетические аномалии, ассоциированные с миелодисплазией:
а - комплексный кариотип (3 хромосомных аномалии и более);
б - несбалансрованные перестройки: -7 или del(7q); -5 или del(5q); i(17q) или t(17p); -13 или del(13q); del(11q); del(12p) or t(12p); del(9q); idic(X) (q13);
в - сбалансированные перестройки (транслокации): t(11; 16) (q23; p13.3); t(3; 21) (q26.2; q22.1); t(1; 3) (p36.3; q21.1); t(2; 11) (p21; q23); t(5; 12) (q33; p12); t(5; 7) (q33; q11.2); t(5; 17) (q33; p13); t(5; 10) (q33; q21); t(3; 5) (q25; q34).
4) мультилинейная дисплазия;
5) отсутствуют "устойчиво выявляемые хромосомные аномалии";
6) ранее не проводилась ХТ по поводу другого заболевания.
ОМЛ, как другие миелоидные опухоли, возникшие вследствие ранее проводимой ХТ по поводу других заболеваний, в отдельную форму ОМЛ не выделяются.
Прогностические факторы
У детей обусловлены биологическими характеристиками лейкемического клона
Факторы прогноза, связанные с заболеванием (ОМЛ)
Факторы, связанные с заболеванием и влияющие на результаты терапии, следует анализировать на всех этапах лечения. Это обусловлено тем, что лейкоз-ассоциированные факторы прогноза позволяют оценить объем опухолевой массы, чувствительность бластных клеток к цитостатическим препаратам, скорость элиминации лейкемических клеток и объем МОБ.
Прежде всего, необходимо учитывать такие вполне доступные клинико-гематологические параметры, ассоциированные с неблагоприятным течением ОМЛ, как лейкоцитоз выше 100 x 109/л, недостижение ПР после первого индукционного курса.
Одним из важнейших факторов прогноза, сопряженных с ОМЛ, является кариотип лейкемических клеток. Исследование кариотипа необходимо проводить в обязательном порядке всем пациентам с подозрением на ОМЛ. Данные цитогенетического исследования позволяют верифицировать ОМЛ в случаях, когда принципиальным является не количество бластных клеток (меньше или больше 20%), а обнаружение характерных хромосомных аберраций. Речь идет, в частности, о так называемом CBF (Core Binding Factor) ОМЛ, который объединяет случаи с транслокацией t(8; 21) и инверсией inv(16), независимо от отсутствия или наличия дополнительных хромосомных аберраций.
Помимо этого, на основании изучения кариотипа, представляется возможным стратифицировать пациентов ОМЛ на 3 основные группы: благоприятного, промежуточного и неблагоприятного прогноза (см. Приложение А3.5. Подразделение пациентов ОМЛ на эти группы целесообразно с точки зрения выбора тактики постремиссионной терапии: применение цитарабина** в высоких дозах (ВДЦ), использование трансплантации аллогенных стволовых гемопоэтических клеток (аллоТГСК).. В последнее время рядом российских и американских экспертов пациентам с неблагоприятными аномалиями кариотипа вообще не рекомендуют стандартную химиотерапию вследствие ее низкой эффективности, а предлагают иные режимы низких доз и включение таргетных препаратов с первого курса индукции [8].
Следует отметить, что у половины пациентов с ОМЛ определяется нормальный кариотип лейкозных клеток. В связи с тем, что у ряда пациентов обнаруживают нормальный кариотип, необходимо проведение FISH-исследования или молекулярно-генетических исследований с целью поиска отдельных химерных генов или поломок кариотипа, ассоциированных с определенным вариантом ОМЛ: RUNX1-RUNX1T1 (t(8; 21)), CBFB-MYH11 (inv16), PML-RARa (t(15; 17)), MLLT3-MLL (t(9; 11)), DEK-NUP214, моносомии 5, 7, инверсии 3 хромосомы и ряда других.
Факторы прогноза, связанные с ХТ
Фактором неблагоприятного прогноза является уменьшение расчетных доз цитостатических препаратов и значительное удлинение интервалов между курсами [3].
Без полноценной диагностики, выполненной в дебюте заболевания, современное лечение ОМЛ невозможно.
Основной причиной заболеваемости и смертности пациентов с ОМЛ в период ХТ и ТГСК являются инфекционные осложнения, развитие которых приводит к редукции доз и нарушению тайминга ХТ [105 - 107]. Развитие инфекций, вызванных устойчивыми к действию антибиотиков микроорганизмами приводит к жизнеугрожающим осложнениям в связи с крайне ограниченными терапевтическими возможностями [108]. Грамотное и рациональное назначение антибактериальной и противогрибковой терапии является значимым прогностическим фактором при лечении пациентов с ОМЛ.
При невозможности соблюдения данных требований, требуется рассмотрение вопроса о маршрутизации ребенка в медицинскую организацию, в которой данные условия будут соблюдены в полном объеме.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В основном клинические проявления связаны с замещением нормальной гемопоэтической ткани опухолевыми клетками (анемия, тромбоцитопения, гранулоцитопения), инфильтрацией ими различных органов и продукцией различных цитокинов [9]. Дебют ОМЛ может быть острым со значительным повышением температуры тела, резкой слабостью, интоксикацией, кровоточивостью, тяжелыми инфекциями. Однако, диагноз в ряде случаев устанавливают при диспансеризации или в случае госпитализации по другой причине.
При объективном обследовании может не наблюдаться никаких симптомов. Но довольно часто выявляется увеличение периферических лимфатических узлов, печени, селезенки (что наиболее характерно для моно- и миеломонобластного лейкоза), гиперплазия десен (при миеломоно- и монобластных вариантах), инфильтрация кожи (при миеломоно- и монобластных вариантах), геморрагический синдром различной степени тяжести - от петехиальных высыпаний до тяжелых кровотечений, боли в костях, артралгии, неврологическая симптоматика (менингеальные знаки - головная боль, ригидность затылочных мышц, симптом Кернига, парез лицевого, глазодвигательного и других нервов, парезы нижних конечностей и т.д.). В анализах крови могут быть неспецифические изменения: трехростковая цитопения, или анемия, или только лейкопения или лейкоцитоз, или тромбоцитопения. Бластные клетки могут не определяться в анализе периферической крови и, наоборот, составлять 90 - 95% всех лейкоцитов. Количество лейкоцитов также варьирует от менее 1,0 до 200 - 300 x 109/л и более. Примерно в 15% случаев в дебюте заболевания определяется лейкоцитоз более 100 x 109/л.
Дифференциальная диагностика: при обнаружении патологических бластных клеток в пунктате костного мозга и/или в периферической крови, диагноз сомнений не вызывает. Отсутствие бластных клеток в периферической крови не исключает отсутствия ОМЛ. Увеличение числа лейкоцитов со сдвигом формулы влево при различных инфекционных процессах, а также тромбоцитопения, анемия и геморрагический синдром при тяжелых инфекциях и сепсисе могут вызывать сомнения в диагнозе ОМЛ, но в таких случаях никогда не обнаруживаются патологические бластные клетки. Нередко требуется дифференциальная диагностика с инфекционным мононуклеозом и некоторыми другими вирусными инфекциями, тем более что клиническая симптоматика (повышение температуры тела, боли в горле, увеличение лимфатических узлов, печени, селезенки) может напоминать таковую при ОМЛ. Дифференциальный диагноз должен проводиться со следующими заболеваниями: другие острые лейкозы: острый лимфобластный лейкоз, острый лейкоз со смешанным фенотипом, миелодиспластический синдром, ювенильный миеломоноцитарный лейкоз, лейкемоидные реакции, апластическая анемия; ЗНО негематологической природы (нейробластома, саркомы и др.), особенно при наличии экстрамедуллярных поражений, с бластным кризом хронического миелолейкоза (присутствие филадельфийской хромосомы могут обнаруживать и при впервые диагностированных ОЛ).
Особого внимания заслуживают внекостномозговые проявления ОЛ, особенно нейролейкоз, который может определяться и в момент диагностики ОЛ. Возникновение нейролейкоза обусловлено распространением лейкозных клеток в оболочки головного и спинного мозга. В ряде случаев наблюдается лейкозная инфильтрация периферических нервов с разнообразными двигательными и чувствительными нарушениями, или обнаруживается очаговое поражение вещества головного мозга. Нейролейкоз характеризуется менингеальным и гипертензионным синдромом: отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, ригидность затылочных мышц, симптом Кернига. При ОМЛ нейролейкоз довольно редок в дебюте болезни, тем не менее встречается при миеломоно- и монобластных вариантах, особенно при тех формах лейкозов, когда обнаруживают поломку 16 хромосомы - inv(16) (у 30% таких пациентов при отсутствии профилактики возникает нейролейкоз). При ОМЛ к экстрамедуллярным относят поражения кожи (лейкемиды - чаще всего это багрово-синюшные уплотнения, узелки в коже), сетчатки, десен, яичек, яичников. Описаны поражения лимфатических узлов, легких, кишечника, сердечной мышцы, мочеточников. При ОМЛ экстрамедуллярные поражения мягких тканей ранее называли "хлоромой". В настоящее время для обозначения поражения мягких тканей и органов используют термин миелоидная или гранулоцитарная саркома.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу в соответствии с шкалами оценки уровня достоверности доказательств (УДД) и уровня убедительности рекомендаций (УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза/состояния: диагноз ОМЛ устанавливают на основании обнаружения в пунктатое (аспиратое) костного мозга или в периферической крови не менее 20% бластных клеток, либо независимо от процентного содержания бластных клеток при наличии патогномоничных для ОМЛ морфологических признаков (палочек Ауэра) и хромосомных аномалий: t(8;21) (q22; q22) AML/ETO, t(15; 17) (q12; q11 - 12), inv(16) или t(16; 16) (p12; q23) CBF/MYH11, t(1; 22).
Сводная таблица исследований, необходимых для диагностики и верификации диагноза ОМЛ, представлена в Приложении А3.1. На основании клинической картины, а также анализа результатов перечисленных исследований, пациентов стратифицируют на молекулярно-генетические (см. Приложение А3.5), а также клинические группы прогноза.
2.1 Жалобы и анамнез
Клинические проявления при ОМЛ обычно связаны с изменениями в гемограмме - цитопенией:
Нейтропения - бактериальные инфекции, проявляющиеся, как правило, лихорадкой;
Анемия - слабость, утомляемость. Общая слабость присутствует у большинства пациентов;
Тромбоцитопения - геморрагический синдром в виде петехий, кровоточивости десен, носовых кровотечений, мено- и метроррагии.
В некоторых случаях могут наблюдаться оссалгии, B-симптомы (лихорадка, снижение массы тела, выраженная потливость).
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ: тщательный сбор анамнеза заболевания с уточнением терапии, которая проводилась в связи с этим заболеванием или по поводу других заболеваний ранее, семейного анамнеза, а также подробное описание жалоб пациента [1, 3, 10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.2 Физикальное обследование
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ проводить физикальное обследование, включающее измерение роста и массы тела, температуры тела; оценку состояния кожных покровов, костно-суставной системы; выявление признаков геморрагического синдрома; наличие гепатоспленомегалии, лимфаденопатии; наличие признаков патологии сердечно-сосудистой системы, легких, печени, органов эндокринной, нервной системы [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при физикальном обследовании у части пациентов (в основном, с острым миеломонобластным лейкозом, острым монобластным лейкозом) выявляют признаки "пролиферативного" синдрома - спленомегалия, увеличение лимфатических узлов, кожные лейкемиды. Лейкемиды выявляют в 13% случаев и имеют вид узлов с измененным цветом кожи над ними [12]. При миелоидной саркоме выявляют экстрамедуллярные опухолевые образования различной локализации [13]. В остальном проявления малоспецифичны и включают симптомы, связанные с цитопенией.
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам при подозрении, диагностике ОМЛ, а также в ходе терапии с частотой до ежедневного (по показаниям), выполнение общего (клинического) анализа крови с дифференцированным подсчетом лейкоцитов на автоматическом анализаторе (лейкоцитарной формулы), не на автоматическом - по показаниям (см. комментарий) и исследованием уровня тромбоцитов в крови [14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: как правило, в дебюте ОМЛ, выявляется нормохромная, нормоцитарная анемия различной степени тяжести. Количество ретикулоцитов в пределах нормы или снижено. Примерно у 75% пациентов имеется тромбоцитопения. Средний уровень лейкоцитов на этапе установления диагноза около 15 x 109/л. У 20% пациентов фиксируют лейкоцитоз более 100 x 109/л.
По показаниям подсчет лейкоцитарной формулы необходимо выполнять не на автоматическом анализаторе. Рекомендуется исследовать как минимум 200 лейкоцитов в мазке периферической крови.
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой вплоть до ежедневной (но не реже 1 раза в неделю), выполнить анализ крови биохимический общетерапевтический (исследование уровня общего белка в крови, исследование уровня альбумина в крови, мочевины, креатинина, билирубина (общего), АЛТ, АСТ, ЛДГ, натрия, калия, общего кальция, глюкозы) для диагностики сопутствующей патологии (заболеваний) и определения тактики сопроводительной терапии [14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой вплоть до ежедневного (но не реже 1 раза в неделю) выполнить коагулограмму (ориентировочное исследование системы гемостаза): АЧТВ, протромбиновое время, фибриноген для диагностики сопутствующей патологии и осложнений, а также определения тактики сопроводительной терапии [3, 14, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии выполнить общий (клинический) анализ мочи с частотой от еженедельного до ежемесячного (по показаниям) для диагностики сопутствующей патологии и определения тактики сопроводительной терапии [14, 16].
- Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой 1 раз в 3 месяцев (при госпитализации пациента) определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови, определение антигена p24 вируса иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови и при необходимости молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии [3, 14, 17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой 1 раз в 3 месяцев (при госпитализации пациента) определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, и, при необходимости, молекулярно-биологического исследования крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus) с целью уточнения риска реактивации вирусного гепатита и, в случае необходимости, ее профилактики [3, 14, 18, 19]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, молекулярно-биологическое исследование крови на вирус простого герпеса (Herpes simplex virus), на цитомегаловирус (Cytomegalovirus), на вирус Эпштейна-Барр (Epstein - Barr virus) с целью уточнения риска развития герпетической инфекции и, в случае необходимости, ее профилактики (по показаниям) [3, 14, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ с подозрением или выявлением ФН до назначения антимикробной терапии проведение микробиологического (культурального) исследования крови на стерильность с целью выявления бактериемии/фунгемии [104 - 117].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: микробиологическое исследование крови на стерильность проводят до назначения антибиотиков. Взятие крови производится из катетера венозного центрального (ЦВК) периферически вводимого, а в случае его отсутствия - из периферической вены при фебрильном подъеме температуры, эпизоде гипотермии, ознобе и/или нестабильности гемодинамики, появлении септикопиемических очагов. При наличии у пациента многоканального ЦВК и подозрении на развитие катетерной инфекции необходимо набирать образцы крови из каждого канала. Получение достоверных результатов возможно при правильном выборе флаконов и соответствии объема набираемой для исследования крови: детям до 10 - 12 кг - в педиатрические флаконы в объеме 1 - 3 мл, детям старше трех лет - в аэробные флаконы в объеме 6 - 10 мл (наиболее оптимально использовать автоматический анализатор для гемокультур). При возможной анаэробной этиологии инфекционного процесса - в анаэробные флаконы, при подозрении на грибковую инфекцию - в микотические. Во избежание контаминации и ложной интерпретации необходимо четкое соблюдение техники асептики при взятии крови. Для повышения чувствительности исследования показано проведение двух- или трехкратного взятия крови в течение первых суток лихорадки. После верификации микроорганизма дальнейшие исследования крови проводят через 24 - 48 часов от назначения антибактериальной терапии и до получения первого отрицательного результата. Повторное микробиологическое исследование крови необходимо проводить при персистенции ФН в течение 72 часов, а также перед эскалацией антибактериальной терапии [114 - 117].
- Рекомендуется всем пациентам с ОМЛ с фебрильной нейтропенией при положительном результате микробиологического исследования крови определение чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам (наиболее оптимально - методом разведений - A26.30.004.003, с использованием автоматических анализаторов - A26.30.004.004) для назначения адекватного лечения [114 - 117].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: с учетом растущей частоты антибиотикорезистентности необходимо проводить определение чувствительности антимикробным химиотерапевтическим препаратам, в том числе - группы резерва, а также определять детерминанты резистентности.
- Рекомендуется всем пациентам с ОМЛ проводить микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы с целью выявления колонизации слизистой оболочки грамотрицательными бактериями, устойчивыми к действию антибиотиков [120 - 123].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
Комментарии: микробиологические исследования проводят для прецизионной антибиотической терапии в ходе лечения при наличии фебрильной лихорадки и инфекционных осложнений.
- Рекомендуется всем пациентам с ОМЛ и ФН с диагностической целью микробиологическое (культуральное) исследование отделяемого из полости рта; микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы [3, 21, 22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в случае развития рецидива и после выполнения алло-ТГСК, определение основных групп крови по системе AB0 и определение антигена D системы Резус (резус-фактор) для возможности выполнения заместительной гемокомпонентной терапии при наличии показаний до, во время или после терапии [3, 14, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам выполнение цитологического исследования мазка костного мозга (миелограммы) при подозрении на ОЛ, а также пациентам с верифицированным ОМЛ в процессе лечения, после окончания программы индукции, консолидации, в ходе проведения поддерживающей терапии, перед выполнением алло-ТГСК, после завершения всей запланированной программы лечения, а также при выявлении изменений в общем клиническом анализе крови вне связи с проводимым лечением и/или подозрении на рецидив ОМЛ с целью контроля статуса заболевания [3, 14, 24, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при констатации рецидива выполнить дополнительно к цитологическому исследованию мазка костного мозга (миелограммы) цитохимическое исследование микропрепарата костного мозга (или отпечатков трепанобиоптата костного мозга, при невозможности получения аспирата) с морфологическим и цитохимическим исследованиями бластных клеток для подтверждения рецидива и идентификации клеточной дифференцировки [3, 14, 24, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: получение цитологического препарата костного мозга путем пункции является обязательной рутинной диагностической процедурой. Процедура должна проводиться под наркозом (при согласии законного представителя ребенка и/или ребенка в возрасте от 15 лет)!
Мазки костного мозга исследуют с помощью окраски по Маю-Грюнвальду, Паппенгейму или Райту-Гимзе. Выполнение трепанбиопсии не является обязательным, за исключением ситуаций с так называемым "сухим проколом" или очень скудным пунктатом костного мозга. Следуетисследовать как минимум 500 ядросодержащих клеток в мазке костного мозга.
Для установления диагноза ОМЛ в мазке периферической крови или костного мозга необходимо наличие 20% или более бластных клеток. При ОМЛ с t(15; 17), t(8; 21), inv(16) или t(16; 16) и при некоторых случаях острого эритромиелоза доля бластных клеток может быть менее 20%. В соответствии с новой классификацией ВОЗ 2016 года процент бластных клеток подсчитывают вне зависимости от доли красного ростка.
Миелобласты, монобласты и мегакариобласты включают в общее число бластных клеток. В случаях ОМЛ с монобластной, моноцитарной и миеломоноцитарной дифференцировкой промоноциты (но не атипические/зрелые моноциты) также считают эквивалентами бластных клеток. Эритробласты не включают в общее число бластных клеток.
Для верификации диагноза истинного эритробластного лейкоза при подсчете пунктата костного мозга клетки эритроидного ряда должны составлять > 80% от всех клеток костного мозга, при этом проэритробласты должны быть > 30%, без учета миелобластов. Проэритробласты, в соответствии с номенклатурой ВОЗ, - это незрелые эритрокариоциты, при этом, в соответствии с терминологией клеток эритропоэза по И.А. Кассирскому и Г.А. Алексееву, - это эритробласты и пронормобласты. При истинном эритробластном лейкозе дисмегакароцитопоэз встречается часто, в то время как дисгранулоцитопоэз - редко [26].
Выполнение цитохимического исследования микропрепарата костного мозга необходимо, даже если определяется высокое содержание бластных клеток в периферической крови. Это связано с тем, что в ряде случаев цитохимические реакции могут давать различные результаты в клетках периферической крови и костного мозга, что может повлечь за собой установление ошибочного диагноза. Диагноз основывают на результатах исследования, полученного на клетках костного мозга. Используют реакции на миелопероксидазу (myeloperoxidase - МРО) или судановый черный, неспецифическую эстеразу (альфа-нафтилацетатэстеразу, подавляемую или нет фторидом натрия) и PAS (Periodic Acid Schiff). Обнаружение миелопероксидазы в 3% и более бластных клеток указывает на миелоидную линию дифференцировки. В то же время ее отсутствие не исключает миелоидную направленность клеток, потому что в ранних миелобластах, а также монобластах, мегакариобластах и эритробластах МРО < 3% или не определяется. Окраска судановым черным аналогична МРО, но является менее специфичной. Неспецифическая эстераза имеет высокую диффузную или гранулярную цитоплазматическую активность (в зависимости от методики проведения реакции) в монобластах и промоноцитах, которая должна подавляться полностью или значительно фторидом натрия. PAS-реакция в миелобластах определяется в диффузном виде, в монобластах и промоноцитах - в диффузно-гранулярном, в эритробластах - в виде гранул или блоков. На основании морфоцитохимического исследования бластных клеток может быть диагностировано около 90% случаев ОМЛ, при отсутствии активности MPO и неспецифической эстеразы необходимо проведение иммунофенотипического исследования методом проточной цитофлюориметрии.
- Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, выполнить иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге для определения принадлежности бластных клеток к той или иной линии клеточной дифференцировки [3, 6, 14, 27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: ИФТ выполняется всегда на клетках костного мозга, даже если определяется высокое содержание бластных клеток в периферической крови. Определение процента бластных клеток методом проточной цитофлуориметрии при первичной диагностике не является заменой морфологического подсчета, так как результаты этих двух исследований могут не совпадать [27].
Для подтверждения миелоидной направленности опухолевых клеток необходимо оценить экспрессию миелоидных антигенов. MPO - линейно-специфический маркер миелоидной линии, лизосомальный фермент гранулоцитов. К менее специфичным миелоид-ассоциированным антигенам относятся CD11b, CD11c, CD13, CD15, CD16, CD33, CD64, CD65, CD66b, лизоцим и другие. Диагноз ОМЛ может быть установлен и в том случае, если MPO не выявляется, а опухолевые клетки экспрессируют другие, менее специфичные миелоидные маркеры, и исключен лимфобластный вариант ОЛ.
Между морфоцитохимической классификацией FAB и иммунофенотипическими признаками нет четкой корреляции. Большинство миелоидных маркеров могут быть как позитивными, так и негативными при разных вариантах ОМЛ по FAB, за исключением специфических антигенов CD41a и CD61, которые характерны только для мегакариоцитарной/тромбоцитарной линии. Даже гликофорин A (CD235a), маркер эритроидной линии, может быть негативным при эритробластном лейкозе, если опухолевые клетки происходят из более ранних предшественников. Таким образом, по данным ИФТ исследования нельзя определять FAB-вариант ОМЛ.
Бластные клетки считаются позитивными по экспрессии мембранного антигена, если он определяется на 20% бластных клеток и более (пороговое значение). Для цитоплазматических маркеров (таких, как цитоплазматический CD3, MPO, лизоцим, ядерная TdT и другие) используют более низкий порог - 10%.
В случае невозможности получения аспирата костного мозга, выполняется иммуногистохимическое исследование трепанобиоптата костного мозга.
ИФТ выполняют с помощью мультипараметрической проточной цитофлюориметрии (обычно как минимум 3- или 4-цветной). В случае анализа трепанобиоптата выполняется его ИГХ исследование. Особенно ИФТ исследование необходимо для установления диагноза ОМЛ с минимальной дифференцировкой, острого мегакариоцитарного лейкоза и ОЛ с неопределенной дифференцировкой.
- Рекомендуется всем пациентам при первичной диагностике ОЛ а также при обследовании по поводу диагностированного рецидива ОМЛ, выполнить цитогенетическое исследование (кариотип) аспирата костного мозга с целью выявления аномалии кариотипа и стратификации пациентов по группам риска, а также для определения тактики лечения и выявления маркера для мониторинга динамики опухолевого клона на фоне терапии [3, 6, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: стандартное цитогенетическое исследование является необходимым компонентом диагностических процедур у пациента с подозрением на ОЛ. Хромосомные аномалии выявляются примерно у половины пациентов ОМЛ. Семь транслокаций и инверсий (и их варианты) относятся ВОЗ в категорию "ОМЛ с устойчиво выявляемыми хромосомными аномалиями". Более того, обнаружение некоторых генетических аномалий при наличии 20% и более бластных клеток в костном мозге является достаточным для установления диагноза "ОМЛ с признаками миелодисплазии". Для определения кариотипа достоверным считается исследование как минимум 20 метафаз. Аномалии кариотипа могут устанавливаться и на основании исследования клеток периферической крови. Мониторинг выявленных при первичном исследовании аномалий кариотипа позволяет оценить полноту достигнутого эффекта терапии. Определение тех или иных цитогенетических аномалий уже на момент диагностики ОМЛ может определить терапевтическую тактику для конкретного пациента: например, выявление комплексных изменений кариотипа или моносомного кариотипа свидетельствует о необходимости применения отличного от стандартного цитостатического воздействия и обязательного обсуждения вопроса о возможности предельно раннего включения алло-ТГСК в программу лечения ОМЛ, вплоть до проведения алло-ТГСК в аплазии после первого индукционного курса (по результатам консилиума).
- Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, выполнить молекулярно-генетическое исследование мутаций в гене RUNX1-RUNX1T1 методом ПЦР, молекулярно-генетическое исследование мутаций в гене CBFB-MYH11 методом ПЦР и молекулярно-генетическое исследование мутаций в гене FLT3-TKI методом секвенирования в аспирате костного мозга для стратификации пациентов по группам риска и определения тактики лечения, а также с целью выявления маркера для мониторинга динамики опухолевого клона на фоне терапии [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: тестирование мутаций NPM1, CEBPA и FLT3 является желательным, поскольку современные подходы к лечению ОМЛ предполагают наличие информации об этих мутациях, так как это может влиять на определение терапевтической тактики. ОМЛ с мутациями в генах NPM1 или CEBPA определены ВОЗ как условные категории. Экспрессия генов ERG, MN1, EVI1, BAALC, мутации генов WT1, RUNX1, MLL, KITRAS, TP53, TET2, IDH1 и определение МОБ исследуются в рамках КИ. Молекулярный скрининг на указанные маркеры самостоятельного значения не имеет, но как вспомогательный метод может быть использован при отсутствии результатов стандартного цитогенетического исследования. В современной молекулярной диагностике ОМЛ широко применяется и метод секвенирования нового поколения, созданы так называемые диагностические панели из нескольких десятков генов, вовлеченных в патогенез ОМЛ, которые позволяют четко отнести исследуемый ОМЛ к той или иной категории риска.
- Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, которым не выполнено цитогенетическое исследование (кариотип) аспирата костного мозга (мало материала, не было получено митозов или получено менее 20 митозов) или получен нормальный кариотип, но при этом выявляются яркие клинико-лабораторные симптомы, характерные для определенных вариантов ОМЛ, выполнить молекулярно-цитогенетическое исследование (FISH-метод) для детекции реарранжировок генов в аспирате костного мозга с целью выявления маркера для мониторинга динамики опухолевого клона на фоне терапии [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при ОМЛ исследуются RUNX1-RUNX1T1, CBFB-MYH11, PML/RARA, MLL и EVI1 или потеря хромосомы 5q и 7. FISH зачастую необходим для идентификации слияний MLL при транслокациях региона 11q23. Возможно также проведение FISH на морфологических и гистологических препаратах костного мозга.
- Рекомендуется всем пациентам, у которых имеется информация о наличии молекулярного маркера или известен аберрантный иммунофенотип (выявленные на момент диагностики ОМЛ), ИФТ биологического материала для выявления маркеров минимальной остаточной болезни при ОМЛ (для группы промежуточного прогноза) или молекулярно-генетическое исследование минимальной остаточной болезни при помощи пациент - специфичных праймеров (для группы благоприятного прогноза) для контроля за лечением и определения тактики постиндукционной терапии [3, 14, 28, 29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: для подтверждения полноты достигнутого ответа на терапию и его сохранение, в соответствии с современными международными рекомендациями, необходимо выполнять в контрольные точки оценку МОБ методом проточной цитофлюориметрии (аберрантный иммунофенотип), а для группы благоприятного прогноза - только молекулярное исследование МОБ методом ПЦР (количественная оценка экспрессии генов RUNX1-RUNX1T1, CBFB-MYH1, NPM1) [29, 30].
По результатам исследований, проводимых Российской группой по терапии острых лейкозов, - при достижении МОБ-негативной ремиссии после 1-го курса терапии у пациентов из группы промежуточного прогноза, при выполнении дальнейшего тщательного мониторинга МОБ, возможно рассмотрение вопроса о продолжении ХТ без выполнения алло-ТГСК. У пациентов из группы благоприятного прогноза динамика химерного транскрипта также определяет целесообразность выполнения пациентам алло-ТГСК [31].
- Рекомендуется всем пациентам выполнить спинномозговую пункцию с общим (клиническим) анализом спинномозговой жидкости с целью диагностики нейролейкоза [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: при ОМЛ в целом вовлечение ЦНС встречается менее чем у 5% пациентов, при ряде вариантов ОМЛ, особенно с моноцитарной дифференцировкой, вероятность вовлечения в процесс оболочек головного мозга выше.
Желательно поддерживать число тромбоцитов в периферической крови перед выполнением спинномозговой пункции 30 x 109/л и выше. Если уровень тромбоцитов не удается повысить до 30 x 109/л и выше, при отсутствии клинических признаков поражения ЦНС, от пункции можно воздержаться до повышения тромбоцитов в гемограмме выше 30 x 109/л.
Если у пациента определяется лейкоцитоз выше 100 x 109/л в крови, то первую спинномозговую пункцию следует отложить до редукции числа лейкоцитов менее 20 x 109/л.
- Рекомендуется всем пациентам выделять первичную ДНК или РНК из клеток костного мозга и сохранять ее в биобанке либо направлять материал на хранение в лаборатории федеральных медицинских организаций для возможности последующего выполнения молекулярных исследований [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: сохранение первичного биологического материала осуществляется в виде ДНК и/или РНК, выделенных из костномозговых клеток или замороженных клеток. Материал может в последующем понадобиться для проведения молекулярных исследований, позволяющих определить группы риска, а также в рамках клинических исследований (КИ).
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раз в неделю до ежемесячного (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения, регистрация, расшифровка, описание и интерпретация электрокардиографических данных для выявления и/или мониторинга нарушений проводимости импульсов в сердечной мышце [3, 14, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раза в неделю до ежемесячного (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения, выполнение эхокардиографии для оценки функционального состояния сердечной мышцы, учитывая кардиотоксичность препаратов [3, 14, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии по показаниям с учетом наличия сопутствующей патологии и клинической ситуации, а также при необходимости в любой момент в течение всего периода лечения выполнение компьютерной томографии (КТ) головного мозга без контраста для выявления и/или мониторинга изменений в структурах головного мозга [1, 3, 4, 8, 33 - 35].
- Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ при наличии нейролейкоза выполнение МРТ головного и спинного мозга с внутривенным контрастированием (по показаниям), для оценки вещества головного мозга и оболочек головного и спинного мозга [1, 3, 4, 8, 33 - 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раза в 2 - 3 недели до 1 раза в 2 - 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение КТ органов грудной полости для выявления изменений легочной ткани и органов средостения (в первую очередь при наличии стойкой ФН в течение 72 - 96 часов, респираторной симптоматики в виде кашля, одышки, десатурации, болей в грудной клетке) [3, 14, 33 - 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: КТ органов грудной полости необходимо выполнить при развитии рефрактерной ФН даже при отсутствии какой-либо клинической симптоматики со стороны органов дыхательной системы. При выявлении признаков пневмонии необходимо выполнить трахеобронхоскопию и бронхо-альвеолярный лаваж (БАЛ). Объем исследования должен быть максимальным и, при необходимости, включать: микроскопические, микробиологические, микологические и молекулярно-биологические исследования в соответствии с указанными в приложении 3.6 Наибольшая диагностическая ценность будет у результатов БАЛ, выполненного до назначения противоинфекционной терапии [125 - 127].
Необходимо помнить, что рентгенологическое исследование легких у пациентов в нейтропении обладает низкой диагностической возможностью и его выполнение показано только для диагностики таких осложнений, как пневмо- или гидроторакс, гидроперикард, а также для контроля положения ЦВК, плевральных дренажей или интубационной трубки [124, 128, 129].
- Рекомендуется всем пациентам с ОМЛ на любом этапе ведения с подозрением на наличие экстрамедуллярных очагов выполнение компьютерной томографии органов грудной полости и/или органов брюшной полости и/или органов таза у мужчин с контрастированием или органов малого таза у женщин с внутривенным болюсным контрастированием и/или компьютерная томография мягких тканей с контрастированием и/или магнитно-резонансная томография мягких тканей с контрастированием для уточнения распространенности заболевания или диагностики экстрамедуллярного рецидива [3, 33 - 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: объем и область исследования определяется клинической картиной.
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раза в 2 - 3 недели до 1 раза в 2 - 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения, для определения объема опухолевой массы и диагностики и мониторинга сопутствующей патологии (в том числе при болях в животе, энтероколите или задержке стула более 3-х дней) выполнение ультразвукового исследование (УЗИ) органов брюшной полости с определением размеров печени, селезенки и внутрибрюшных лимфатических узлов, а также оценка состояния органов брюшной полости и выполнение ультразвукового исследования органов малого таза комплексного (трансвагинального и трансабдоминального) и ультразвукового исследования органов мошонки у мальчиков [3, 33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: в зависимости от клинической ситуации проводятся комплексное УЗИ внутренних органов, эхокардиография (для исключения эндокардита), дуплексное сканирование вен верхних конечностей в проекции нахождения ЦВК (для исключения тромботических наложений, ассоциированных с ЦВК). КТ или МРТ органов брюшной полости, забрюшинного пространства, малого таза с контрастированием (для исключения поражения внутренних органов, кишечника), эзофагогастродуоденоскопия, колоноскопия (для исключения эрозивно-язвенного процесса, патологической инфильтрации)
- Рекомендуется всем пациентам с ОМЛ с фебрильной нейтропенией и клиникой синусита выполнение КТ придаточных пазух носа (ППН), гортани с целью исключения инвазивного поражения ППН [124].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3).
2.5 Иные диагностические исследования
- Рекомендуется пациентам с подозрением на экстрамедуллярные очаги ОМЛ выполнение биопсии опухолей, опухолеподобных образований мягких тканей (по показаниям) вовлеченного органа/ткани в объеме, необходимом для выполнения патолого-анатомического исследования биопсийного (операционного) материала с применением иммуногистохимических методов и цитогенетического исследования биопсийного (операционного) материала [36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с ОМЛ и наличием неблагоприятных прогностических факторов, обращение в трансплантационный центр для инициации поиска донора и определения показаний и сроков выполнения алло-ТГСК [3, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ и респираторной симптоматикой получение мазков со слизистой оболочки ротоглотки с проведением исследований на респираторные вирусы в соответствии с приложением А3.6 с целью верификации вируса [130 - 132].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4).
- Рекомендуется всем пациентам с ОМЛ и фебрильной нейтропенией при наличии симптомов мукозита/гингивита микробиологическое (культуральное) исследование отделяемого полости рта, микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, а также молекулярно-биологическое исследование соскоба из носоглотки на вирус простого герпеса (Herpes simplex virus) с целью диагностички и последующей этиотропной терапии [132].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4).
- Рекомендуется всем пациентам с ОМЛ и фебрильной нейтропенией при наличии диареи с целью диагностики и последующей этиотропной терапии определение токсинов возбудителя диффициального клостридиоза (Clostridium difficile) в образцах фекалий, а также определение следующих маркеров вирусов, ассоциированных с диарейным синдромом: определение антигенов ротавирусов в образцах фекалий (Rotavirus gr. A) либо молекулярно-биологическое исследование фекалий на ротавирусы (Rotavirus gr. A), определение антигенов норовирусов (Norovirus) в образцах фекалий либо молекулярно-биологическое исследование фекалий на калицивирусы (норовирусы, саповирусы) (Caliciviridae (Norovirus, Sapovirus)), определение антигенов аденовирусов (Adenovirus) в образцах фекалий либо молекулярно-биологическое исследование фекалий на аденовирусы (Adenovirus) [133 - 135].
Уровень убедительности рекомендации C (уровень достоверности доказательств 3).
- Рекомендуется всем пациентам с ОМЛ и фебрильной нейтропенией проводить мониторинг определения метаболитов грибов (определение галактоманна) с целью раннего выявления инвазивного аспергиллеза [136 - 138].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарий: определение галактоманнана в крови может проводиться только пациентам с нейтропенией, не получающим профилактику противогрибковыми препаратами системного действия, активными в отношении плесневых грибов, с периодичностью 2 раза в неделю.
- Рекомендуется всем пациентам с ОМЛ и фебрильной нейтропенией при выявлении пневмонии проводить определение метаболитов грибов (галактоманнана) в жидкости БАЛ [137 - 139].
Уровень убедительности рекомендации B (уровень достоверности доказательств 2).
Комментарий: При невозможности выполнения бронхоскопии определение галактоманнана у пациента с нейтропенией проводить в сыворотке крови.
- Рекомендуется всем пациентам с ОМЛ при наличии очагового поражения паренхиматозных органов (печени, селезенки и др.) определение метаболитов грибов в крови (маннанового антигена грибов рода кандида) и исследование уровня антител к антигенам растительного, животного и химического происхождения в крови (антител к грибам рода кандида) для исключения диссеминированного/инвазивного кандидоза [140, 141].
Уровень убедительности рекомендации B (уровень достоверности доказательств 2).
- Рекомендуется всем пациентам с ОМЛ при подозрении на инфекцию центральной нервной системы определение антигена грибов рода Криптококкус (Cryptococcus spp.) в спинномозговой жидкости для исключения криптококковой инфекции [142].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5).
Комментарий: для выявления криптококка могут выполняться иные методы, в том числе определение ДНК, микроскопия. В связи с неспецифической клинико-радиологической картиной помимо криптококковой инфекции центральной нервной системы в диагностический поиск необходимо включать инвазивные микозы, токсоплазмоз, листериоз, герпес-вирусную инфекцию, микобактериозы, в том числе атипичные.
- Рекомендуется при наличии показаний прием (осмотр, консультация) врача-невролога, врача-офтальмолога, врача-оториноларинголога, врача-кардиолога, врача-детского хирурга, всем девочкам старше 14 лет прием (осмотр, консультация) врача-акушера-гинеколога [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Эффективность ХТ миелолейкоза зависит от двух ключевых факторов - специфичности цитостатического воздействия и адекватности сопроводительного лечения. Основными принципами лечения ОЛ является максимум эффективности (за счет специфичности и адекватности воздействия) при минимуме токсичности (за счет грамотной сопроводительной терапии).
Лечение ОМЛ у детей основано на интенсивной полихимиотерапии, которая должна быть дополнена аллогенной трансплантацией гемпоэтических ствловых клеток (алло-ТГСК) от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Необходимость трансплантации у пациентов группы промежуточного риска продолжает дискутироваться; она показана только при наличии HLA-геноидентичного сиблинга.
В связи с интенсивностью проводимой специфической и сопроводительной терапии до начала лечения пациенту необходима катетеризация подключичной и других центральных вен с использованием туннельного или двухпросветного манжеточного туннельного катетера.
3.1 Терапия впервые выявленного ОМЛ
- Рекомендуется всем пациентам с впервые выявленным ОМЛ. При наличии возможности - участие в клинических исследованиях [37].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: в настоящее время единого стандарта терапии ОМЛ у детей не разработано. Без специфической химиотерапии все пациенты с ОМЛ умирают в течение 2 - 3 месяцев.
- Рекомендуется всем пациентам с впервые выявленным ОМЛ, которые не могут быть включены в клинические исследования, проведение курса индукции с последующей консолидацией и, для пациентов высокой группы риска, трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК) (см. приложение А3.2) [1, 2, 38 - 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: начало терапии - это курс индукции ремиссии, состоящей из базовых препаратов, эффективных в отношении ОМЛ (цитарабин**, антрациклины и этопозид**). После достижения ремиссии и восстановления гемопоэза следует короткая (не более 3 курсов) консолидирующая терапия, основанная на высоких дозах цитарабина** 2000 - 3000 мг/м2 каждые 12 часов.
При наличии HLA-совместимого родственного донора все пациенты высокой группы должны быть трансплантированы в первой ремиссии после трех блоков консолидирующей терапии. Пациенты, относящиеся к группе высокого риска, должны получить трансплантацию от HLA совместимого родственного или неродственного донора, или от альтернативного донора (гаплоидентичного).
Алло-ТГСК проводится только в специализированных центрах, куда информация о пациентах должна направляться заблаговременно. Заявку на проведение ТГСК в трансплантационный центр следует подавать сразу же после констатации у пациента высокого риска или наличия HLA идентичного родственного донора.
- Рекомендуется всем пациентам с впервые выявленным ОМЛ с целью достижения ремиссии проведение индукции ремиссии согласно одной из представленных ниже схем [39, 68, 70, 92, 104, 181, 182]:
1. AIE (Цитарабин**, #Идарубицин**, Этопозид**) [68, 181, 182]
Цитарабин** 100 мг/м2 в сутки дни 1 - 2 постоянной инфузией
Цитарабин** 100 мг/м2 30-минутной инфузией каждые 12 часов дни 3 - 8 постоянной инфузией
#Идарубицин** 12 мг/м2 в сутки 4-х часовой инфузией дни в течение 3-х дней (в зависимости от предписанного протоколом терапии)
#Этопозид** 150 мг/м2 1-часовой инфузией дни 6,7,8
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
2. АМ42Е (Цитарабин**, #Митоксантрон**,Этопозид**) [182]
Цитарабин** 100 мг/м2 1-часовой инфузией каждые 12 часов дни 1 - 7
#Митоксантрон** 14 мг/м2 в сутки 1-х часовой инфузией дни 2,3,4 (всего 3 дозы)
#Этопозид** 100 мг/м2 1-часовой инфузией дни 5,6,7 (всего 3 дозы)
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3. АМ36Е (Цитарабин**, #Митоксантрон**,Этопозид**) - для пациентов с ОМЛ c inv16 [182]
Цитарабин** 100 мг/м2 1-часовой инфузией каждые 12 часов дни 1 - 7
#Митоксантрон** 12 мг/м2 в сутки 1-х часовой инфузией дни 2,3,4 (всего 3 дозы)
#Этопозид** 100 мг/м2 1-часовой инфузией дни 5,6,7 (всего 3 дозы)
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
4. ADE (Цитарабин**, Даунорубицин**,Этопозид**) (уровень доказательности 4С) [69]
Цитарабин** 100 мг/м2, в/в 2 раза в сутки в 1 - 10-й дни, всего 20 доз в 1 цикл, далее в 1 - 8 дни, всего 16 доз
Даунорубицин** 50 мг/м2, дни 1, 3 и 5
#Этопозид** 100 мг/м2, дни 1 - 5
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
5. ADEGO (Цитарабин**, Даунорубицин**, Этопозид**, Гемтузумаб озогамицин) - для пациентов с ОМЛ с inv16 (CBF::MYH) и t(8;21) (RUNX1::RUNX1T) [104, 181, 182]
Цитарабин** 100 мг/м2 1-часовой инфузией каждые 12 часов дни 1 - 10
Даунорубицин** 50 мг/м2 в сутки дни 2, 4, 6
Этопозид** 100 мг/м2 в сутки дни 2 - 6
Гемтузумаб озогамицин 3 мг/м2 2-х часовой инфузией день 6
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: При отсутствии одного из антрациклиновых препаратов осуществляется замена на альтернативный, имеющийся в наличии препарат, в эквивалентных миелотоксических дозах: #идарубицин**: #митоксантрон** 1:1, #идарубицин**: даунорубицин** 1:5, даунорубицин**: #митоксантрон** 5:1. При замене #митоксантрона** на #идарубицин** в цикле АМ42Е доза разовая доза #идарубицина** составляет 12 мг/м2
- Рекомендуется всем пациентам с ОМЛ после окончания индукции ремиссии с целью консолидации ремиссии проведение консолидационной терапии в количестве 3 - 4 курсов, основанной на высоких дозах цитарабина** (см. схемы ниже) [62, 68, 70, 72, 74, 99 - 103, 174, 175, 178, 181, 182].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Схемы консолидации:
Курс 1 проводится по одной из следующих схем:
1. НАМ 30 [72,175, 181, 182]
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1,2,3 (всего 6 доз)
#Митоксантрон** 10 мг/м2 1-часовой инфузией дни 2,3,4 (всего 3 дозы)
2. HAM 20 [96, 175, 181, 182]
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1,2,3 всего 6 доз
#Митоксантрон** 10 мг/м2 30-минутной инфузией дни 4, 5, всего 2 дозы
3. HA (для пациентов с ОМЛ с inv 16) [74, 181, 182]
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1,2,3 (всего 6 доз)
4. AI [68, 181, 182]
#Цитарабин** 500 мг/м2 в сутки 96-часовой инфузией дни 1,2,3,4
#Идарубицин** 7 мг/м2 60-минутной инфузией дни 3,5 всего 2 дозы
Курс консолидации 2 проводится по одной из следующих схем:
1. haM [68,175, 181, 182]
#Цитарабин** 1000 мг/м2 3-х часовой инфузией каждые 12 часов в течение 3-х дней (всего 6 доз)
#Митоксантрон** 10 мг/м2 30-минутной инфузией в течение 2-х дней (всего 2 дозы)
2. AI (для получивших HAM 20 в курсе) [68, 181, 182]
#Цитарабин** 500 мг/м2 в сутки 96-часовой инфузией дни 1,2,3,4
#Идарубицин** 7 мг/м2 60-минутной инфузией дни 3,5 всего 2 дозы
3. НАЕ [68, 181, 182]
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1,2,3 (всего 6 доз)
#Этопозид 125 мг/м2 2-часовой инфузией дни 2,3,4,5 (всего 4 дозы)
4. haM24 (для пациентов с ОМЛ с inv 16) [70, 175, 181, 182]
#Цитарабин** 1000 мг/м2 2-х часовой инфузией каждые 12 часов дни 1,2,3,4 всего 8 доз
#Митоксантрон** 12 мг/м2 60-минутной инфузией дни 3,4 всего 2 дозы
Режим MidAC очень токсичен для консолидации, сумарная доза митоксантрона в этом режиме 50 мг, что составляет 250 мг при пересчете на даунорубицин.
5. FLA (для пациентов высокого риска, для которых запланирована ТГСК) [99,103, 181, 182]
#Флударабин** 30 мг/м2 30-минутной инфузией дни 1,2,3,4,5, всего 5 доз. Интервал между началом инфузии #флударабина** и началом инфузии цитарабина** должен составлять 4 часа
Режим FLA может применяться как с антрациклином, так и без него
Цитарабин** 2000 мг/м2 3-х часовой инфузией каждые 24 часа дни 1,2,3,4,5 всего 10 доз
6. haMGO (для пациентов с ОМЛ с inv 16 и t(8;21) [183]
#Цитарабин** 1000 мг/м2 2-х часовой инфузией каждые 12 часов в течение 4-х дней (всего 8 доз)
#Митоксантрон** 12 мг/м2 60-минутной инфузией в дни 3 - 6 (всего 4 дозы)
Гемтузумаб озогамицин 3 мг/м2 2-х часовой инфузией однократно в день 7
Для пациентов с inv(16) и t(8;21) суммарная доза митоксантрона 48 мг в постиндукционной терапии слишком токсична, поэтому доза снижена до 24 мг.
Курс консолидации 3 проводится по одной из следующих схем:
1. НАЕ [68,97, 181, 182]
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1,2,3 (всего 6 доз)
#Этопозид 125 мг/м2 2-часовой инфузией дни 2,3,4,5 (всего 4 дозы)
2. haM [181]
#Цитарабин** 1000 мг/м2 3-х часовой инфузией каждые 12 часов дни в течение 3-х дней (всего 6 доз)
#Митоксантрон** 10 мг/м2 30-минутной инфузией в течение 2-х дней (всего 2 дозы)
3. HA (для пациентов с ОМЛ с inv 16) [74, 181, 182]
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1,2,3 (всего 6 доз)
4. AI [101, 181, 182]
#Цитарабин** 500 мг/м2 2-часовой инфузией каждые 12 часов дни в течение 4 дней (всего 8 доз)
#Идарубицин** 7 мг/м2 60-минутной инфузией в дни 3, 5 всего 2 дозы
Курс консолидации 4 (если последний предусмотрен протоколом) проводится по схеме:
1. НАЕ [101, 102, 181, 182]
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1,2,3 (всего 6 доз)
#Этопозид** 125 мг/м2 1-часовой инфузией дни 2,3,4,5 (всего 4 дозы)
Комментарии: При необходимости очередность циклов консолидации может меняться.
- Рекомендуется всем пациентам с ОМЛ при невозможности проведения интенсивной ПХТ проведение молекулярной целенаправленной (таргетной) терапии, состоящей из #Венетоклакс** (дозы см. Таблица 1) в сочетании с #децитабином или без него. [84, 86, 87, 98, 184, 185]
Уровень убедительности рекомендаций C (уровень достоверности - 4)
Комментарии: #Венетоклакс** назначается в виде таблеток по 50мг и/или 100 мг с первого дня курса, 1 раз в сутки в постепенно повышающихся дозах во избежании синдрома опухолевого лизиса, описанного при терапии пациентов с ХЛЛ. Целевая суточная доза достигается на 3-й день приема (дозы см. Таблица 1). Длительность приема #венетоклакса** составляет 28 дней у детей, которым невозможно проведение индуктивной химиотерапии в связи с тяжелым соматическим состоянием (течение тяжелого инфекционного процесса, нарушение мозгового кровообращения, искусственная вентиляция легких, заместительная почечная терапия, острая сердечная и сосудистая недостаточность, тяжелая печеночная недостаточность).
С целью достижения более глубокой и качественной ремиссии #венетоклакс** назначается с 16 дня от начала индукции в течение 14 дней после окончания индукции ремиссии.
Таблица 1. Расчет дозы #венетоклакса** в зависимости от массы ребенка
Доза мг/сут*
Вес, кг
День 1
День 2
День 3
10 - 20
50
120
250
20 - 30
80
170
350
30 - 45
120
250
500
> 45
200
400
800
Модификация дозы #венетоклакса** при одновременном приеме препаратов, влияющих на его метаболизм.
Ингибиторы CYP3A4
Умеренные ингибиторы
Флуконазол**, апрепитант, ципрофлоксацин**, эритромицин
Редукция дозы на 50%
Сильные ингибиторы
Позаконазол**, вориконазол**, кларитромицин**
Редукция дозы на 75%
Индукторы CYP3A4
Сильные индукторы
Рифампицин**, фенобарбитал**, фенитоин**
Совместное назначение запрещено
#Децитабин назначается в дозе 5 мг/м2 в дни 1,3,5,8,10,12,15,17,19,22,24 и 26 каждого цикла подкожно. Рекомендуется местное обезболивание кремом, содержащим фиксированную комбинацию лидокаин+прилокаин накладываемым за 2,5 часа до п/к инъекции. Введение первых 6 доз #децитабина является обязательным. При развитии аплазии кроветворения ко дню 15, фебрилитете и полной редукции бластоза - следующие 6 введений можно не проводить. Прием #венетоклакса** продолжается все 28 дней цикла [84, 86, 98].
- Рекомендуется с целью достижения более глубокой ремиссии после курса индукции ремиссии проведение эпигенетической терапии, состоящей из #Вальпроевой кислоты**, полностью транс-ретиноевой кислоты (#Третиноин** или ATRA), #децитабин (если данную опцию предусматривает протокол лечения) [90].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3)
Комментарии: #Вальпроевая кислота** при лечении больных ОМЛ применяется, как препарат деметилирующий ДНК посредством ингибирования гистондеацетилазы. Назначается с первого дня химиотерапии на протяжении всего курса терапии в дозе 50 мг/кг ежедневно на протяжении всей терапии per os.
#Третиноин** в сочетании с #вальпроевой кислотой** потенцирует действие последней и назначается в дозе 45 мг/м2 ежедневно первые 42 дня, далее в течение 14 дней начиная с первого дня каждого последующего курса консолидации [89 - 91].
#Децитабин назначается в режиме "окна" на 5 дней в дозе 20 мг/м2[90].
- Рекомендуется всем пациентам, получающим терапию по поводу ОМЛ, выполнение спинномозговой пункции и интратекальная терапия (введение лекарственных препаратов в спинномозговой канал) (см. приложение А3.2) [1,2,38 - 40].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: при инициальном лейкоцитозе 100х109/л и более люмбальная пункция проводится не в первый день индукции, а только после редукции лейкоцитов до уровня 50х109/л - во избежание получения ложного диагноза нейролейкоза из-за контаминации ликвора бластами периферической крови и из-за риска кровотечения в спинномозговой канал вследствие коагулопатии [1].
- Рекомендуется проведение интратекальной терапии состоящей из интратекальных введений цитарабина** в возрастной дозировке (см. табл. 2). [41]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Дозы цитарабина** для интратекального введения в зависимости от возраста [41].
Возраст
Доза, мг
Меньше 1 года
20
1 - 2 года
26
2 - 3 года
34
Старше 3 лет
40
Профилактическая терапия (без инициального поражения ЦНС): интратекальные введения цитарабина (5 введений): одно введение перед началом каждого блока терапии и после окончания последнего блока и восстановления гемопоэза еще 2 введения с интервалом в 1 месяц.
Терапия при инициальном поражении ЦНС: интратекальные введения цитарабина** проводятся 1 раз в неделю до тех пор, пока ликвор не будет санирован, но не менее 3 раз. Затем введения цитарабина** в спинномозговой канал продолжаются по такой же схеме, как в профилактическом лечении, то есть перед началом каждого блока химиотерапии и после окончания последнего блока и восстановления гемопоэза еще 2 введения с интервалом в 1 месяц.
- Рекомендуется пациентам старше 3 лет с ОМЛ с inv (16) без первичного поражения ЦНС в рамках проведения модификаций протокола BFM-2004 может проводиться дистанционная прецизионная лучевая терапия со стереотаксическим наведением на линейном ускорителе с фокусировкой при поражении центральной нервной системы и головного мозга СОД 12 Гр (по решению консилиума) [42].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: профилактическое краниальное облучение проводится как минимум через 4 недели после окончания последнего блока при восстановлении гемопоэза. Два последних введения цитарабина** должны быть проведены во время облучения с интервалом 2 недели.
- Рекомендуется всем пациентам с ОМЛ старше 3 лет с первичным поражением ЦНС, которые не достигли санации ликвора после 3 интратекальных введений цитарабина**, дистанционная прецизионная лучевая терапия со стереотаксическим наведением на линейном ускорителе с фокусировкой при поражении центральной нервной системы и головного мозга СОД 18 Гр (по решению консилиума) [38, 43 - 46].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: краниальное облучение проводится при помощи линейного ускорителя. При этом в поле облучения должен попасть весь нейрокраниум, включая верхнюю часть шейного отдела позвоночника до C2 включительно, ретробульбарное пространство и все основание черепа, особое внимание следует уделить средней мозговой ямке, часто оказывающейся лежащей глубже общего уровня; попадание в область облучения челюстных суставов не должно влиять на конфигурацию поля. Ежедневная разовая доза составляет 1,5 Гр, таким образом в течение недели пациент получает 7,5 Гр. Общая продолжительность облучения составляет от 2 до 3 недель. Спинальное облучение не производится никому. Пациентам, которым планируется ТГСК, облучение и 2 последних интратекальных введения цитарабина** проводятся после трансплантации по решению консилиума.
- Рекомендуется всем пациентам с ОМЛ после завершения индукционной и консолидационной терапии по протоколу BFM-2004 или следующих версий (см. приложение А3.2), рассмотреть вопрос о проведении поддерживающей терапии с учетом возможной пользы и риска для пациента целью которой является дополнительное закрепление достигнутой ремиссии [1, 2, 33, 46, 48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: этап поддерживающей терапии начинается после восстановления гемопоэза после последнего курса химиотерапии. Меркаптопурин** назначается в стартовой дозе 50 мг/м2 внутрь ежедневно, цитарабин** в дозе 40 мг/м2 1 раз в день подкожно x 4 дня каждого месяца. Длительность поддерживающей терапии - 12 месяцев [38, 47].
Ценность поддерживающей терапии после высокоинтенсивной "блоковой" терапии, согласно данным проведенных исследований, сомнительна. Более того, есть данные о негативном влиянии поддерживающей терапии на общую выживаемость [33, 48]
3.2 Терапия рецидивов и резистентных (рефрактерных) форм ОМЛ
- Рекомендуется пациентам с первичной рефрактерностью ОМЛ (недостижение полной ремиссии после курса индукции) и при развитии рецидива ОМЛ переводить на терапию высокими дозами цитарабина** в дозе 2 г/м2 ежедневно в виде внутривенной инфузии в течение 4 часов, начиная через 4 часа после завершения инфузии флударабина (пять доз со 2-го по 6-й день) и #флударабином** в дозе 30 мг/м2 ежедневно (максимальная доза 50 мг) в виде 30-минутной внутривенной инфузии (пять доз со 2-го по 6-й день), и #идарубицином** вводили в дозе 8 мг/м2 ежедневно внутривенно в течение 1 часа в дни 4, 5 и 6 (три дозы), начиная за 1 час до введения флударабина и цитарабина по решению консилиума. [49, 85, 103, 181, 182].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам c рецидивами и рефрактерным течением ОМЛ рекомендуется проведение одной из схем интенсивной высокодозной полихимиотерапии (ВДПХТ) решением врачебной комиссии медицинской организации с целью получения полной ремиссии и последующим выполнением алло-ТГСК (см. приложение А3.2) [48]. Схема профилактики РТПХ/ выбор донора, сопроводительная терапия манипуляции с трансплантатом определяются трансплантационным центром [48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Лечение пациентов при рефрактерности или рецидиве ОМЛ, схемы терапии.
1. FLAIda [85, 103, 181, 182]
#Флударабин 30 мг/м2 30-минутной инфузией дни 1, 2, 3, 4, 5, всего 5 доз. Интервал между началом инфузии #флударабина и началом инфузии цитарабина** должен составлять 4 часа
Цитарабин** 2000 мг/м2 3-х часовой инфузией каждые 24 часа дни 1, 2, 3, 4, 5 всего 10 доз
#Идарубицин** 10 мг/м2 60-минутной инфузией в дни 1, 3, 5
(при отсутствии идарубицина может быть применен #митоксантрон** 10 мг/м2 в/в в течение 60 минут в дни 1, 3, 5 - курс FLAM)
2. FLA [99, 103, 181, 182]
#Флударабин 30 мг/м2 30-минутной инфузией дни 1, 2, 3, 4, 5, всего 5 доз. Интервал между началом инфузии #флударабина и началом инфузии цитарабина** должен составлять 4 часа
Цитарабин** 2000 мг/м2 3-х часовой инфузией каждые 24 часа дни 1, 2, 3, 4, 5 всего 10 доз
- Пациентам с ОМЛ с рецидивами и рефрактерностью к терапии при невозможности проведения интенсивной химиотерапии рекомендуется проведение молекулярной целенаправленной (таргетной) терапии, состоящей из #Венетоклакса** и деметилирующего агента #децитабина. [98, 184, 185]
Уровень убедительности рекомендаций C (уровень достоверности - 4)
Комментарии: #Венетоклакс** назначается в дозе 400 мг однократно в сутки перорально. Длительность приема #венетоклакса** составляет 28 дней у детей, которым невозможно проведение индуктивной химиотерапии в связи с тяжелым соматическим состоянием (течение тяжелого инфекционного процесса, нарушение мозгового кровообращения, искусственная вентиляция легких, заместительная почечная терапия, острая сердечная и сосудистая недостаточность, тяжелая печеночная недостаточность).
Модификация дозы #венетоклакса** при одновременном приеме препаратов, влияющих на его метаболизм.
Ингибиторы CYP3A4
Умеренные ингибиторы
Флуконазол**, апрепитант, ципрофлоксацин**, эритромицин
Редукция дозы на 50%
Сильные ингибиторы
Позаконазол**, вориконазол**, кларитромицин**
Редукция дозы на 75%
Индукторы CYP3A4
Сильные индукторы
Рифампицин**, фенобарбитал**, Фенитоин**
Совместное назначение запрещено
#Децитабин назначается в дозе 20 мг/м2 в дни 3 - 10 каждого цикла внутривенно. Введение первых 6 доз #децитабина является обязательным. При развитии аплазии кроветворения ко дню 15, фебрилитете и полной редукции бластоза - следующие 6 введений можно не проводить. Прием #венетоклакса** продолжается все 28 дней цикла.
Препарат #Венетоклакс** в комбинации с #Децитабином (Вен + Дец) показан для лечения детей с рецидивами, рефрактерными формами ОМЛ и которым не показана интенсивная индукционная химиотерапия в связи с наличием сопутствующих заболеваний [84, 86, 87, 98, 184]
Для проведения гемотрансфузионной терапии у пациентов после терапии #флударабином должны быть использованы облученные препараты крови.
При достижении ремиссии необходимо проведение курса аналогичной терапии без антрациклина и далее - проведение аллогенной трансплантации от HLA-геноидентичного или альтернативного донора. До начала химиотерапии рефрактерного или рецидивного ОМЛ необходимо проведение HLA-типирования пациента, сиблингов и родителей и направить данные в трансплантационный центр.
- Рекомендуется в качестве таргетной терапии у детей с мутацией гена FLT3-ITD применение #сорафениба** и #гилтеритиниба [51, 180]
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
Комментарии: #сорафениб** in vitro вызывает угнетение фосфорилирования внутрицитоплазматической части ITD-Flt-3 рецептора; появилось сообщение об успешном применении #сорафениба** 300 мг/м2 ежедневно в течение 47 дней с последующей поддерживающей терапией #сорафенибом** 170 мг/м2 ежедневно у пациента с экстрамедуллярным рецидивом ОМЛ после алло-ТГСК [50, 51]. Данные проспективных проведенных рандомизированных исследований ингибиторов ITD-Flt-3 (мидостаурин**, гилтеритиниб) в первой линии терапии у детей ожидают публикации.
- Пациентам с ОМЛ с рецидивами и рефрактерностью к терапии в качестве альтернативной терапевтической опции с целью достижения ремисии рекомендуется индукции с использованием следующей схемы: #кладрибин** (9 мг/м2 в течение 5 дней) с цитарабином** (500 мг/м2 в течение 5 дней), после чего еще 2 курса DAV (даунорубицин** 30 мг/м2 в 1 - 3 дни 72-часовая инфузия, цитарабин** 250 мг/м2 в 1 - 5 дни 120-часовая инфузия, #этопозид** 200 мг/м2 в 4 и 5 дни 48-часовая инфузия) [52].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
3.3 Лечение ОМЛ и транзиторного аномально миелопоэза у пациентов с синдромом Дауна
Дети с синдромом Дауна (ДС) имеют аномально высокий риск развития гемобластозов. Частота острого миелоидного лейкоза у детей с ДС выше в 150 - 400 раз, чем у пациентов без ДС. В то же время показатели выживаемости и прогноз у детей с ОМЛ-ДС значительно выше, чем у детей без ДС.
Миелопролиферативные заболевания, ассоциированные с синдромом Дауна, вследствие своих уникальных клинико-биологических признаков занимают отдельное место в последней классификации ВОЗ (2017 г.) и представлены транзиторным аномальным миелопоэзом (ТАМ) и ОМЛ. ТАМ встречается у 5 - 30% детей с ДС и ОМЛ, составляющим около 20% от всех ОМЛ.
Транзиторный аномальный миелопоэз (ТАМ), тразиторное миелопролиферативное расстройство, транзиторная лейкемия - это транзиторный клональный миелопролиферативный синдром, определяющими признаками которого является наличие повышенного количества бластных клеток в периферической крови, морфологически и иммунофенотипически относящихся к мегакариобластам, а также выявление приобретенной мутации в гене GATA1. Данный синдром характерен для новорожденных с синдромом Дауна. Частота выявления ТАМ у таких пациентов варьирует от 5 до 30%. По данным литературы, в 80% случаев ТАМ спонтанно разрешается в течение нескольких недель или месяцев после рождения (как правило до 6 месяцев). Но в 20 - 30% случаев может эволюционировать в ОМЛ.
Данный синдром чаще всего развивается в первые дни/месяцы жизни ребенка. Иногда может выявляться внутриутробно и приводить к внутриутробной гибели плода или смерти в периоде новорожденности. Клинические проявления ТАМ могут быть различны, от бессимптомных изменений в анализах крови до тяжелой диссеминированной лейкемической инфильтрации органов. Клинически выраженный ТАМ развивается у 10 - 30% пациентов.
Наиболее частыми проявлениями являются гепатоспленомегалия, желтуха, сыпь, перикардиальный/плевральный выпот, асцит, почечная недостаточность, гематологические нарушения (лейкоцитоз со сдвигом лейкоцитарной формулы влево, нейтрофилез, тромбоцитопения). Необходимо отметить, что нет специфических признаков, за исключением повышенного количества бластных клеток в крови > 20% и наличия мутации в гене GATA1. Примерно у 20% новорожденных нет ни клинических, ни гематологических проявлений ТАМ - это так называемый "молчащий" ТАМ.
В 15 - 20% случаев ТАМ может иметь тяжелое жизнеугрожающее течение, что требует проведения терапии низкими дозами цитарабина** в дозе от 0,5 до 2 мг/кг.
Манифестация ОМЛ у детей с ДС, как правило, приходится на первые 5 лет жизни, с пиком заболеваемости в 2 - 4 года. По данным литературы, дети с ОМЛ и ДС имеют лучшие результаты лечения и более высокие показатели выживаемости, чем дети без ДС. При проведении химиотерапии сниженной интенсивности вероятность излечения ОМЛ составляет 80% и более. В то же время, стандартная интенсивная химиотерапия (с высокими дозами антрациклинов и "интенсивным" таймингом" индукции) ассоциирована у таких пациентов с высокой токсичностью и значительной смертностью от инфекционных осложнений [76, 77, 80].
У пациентов с синдромом Дауна может также развиваться миелодиспластический синдром (МДС), который характеризуется цитопенией и дисплазией в 1-ой или более клеточных линиях. У детей этот синдром представлен 2 формами: рефрактерной цитопенией и МДС с избытком бластов.
Совершенно очевидно, что МДС у пациентов с синдром Дауна неминуемо трансформируется в ОМЛ, в связи с чем таким пациентам необходимо проведение химотерапии (ХТ), аналогичной той, которую получают дети с ОМЛ-ДС [81].
Частота рецидивов у пациентов с ОМЛ-ДС низка и не превышает 8 - 10%. Однако при возникновении рецидива или рефрактерном течение заболевания терапевтические опции весьма ограничены (проведение ТГСК), а показатели выживаемости крайне неудовлетворительные. Показатели ОВ пациентов с СД и рецидивом ОМЛ не превышают 25% [76, 77, 80].
Таким образом, лечение ОМЛ/МДС у детей с синдромом Дауна должно быть основано на снижении дозы химиотерапевтических агентов, отсутствии интенсивного тайминга и оптимизации качества сопроводительной терапии.
В настоящее время единого стандарта терапии ОМЛ у детей с ДС не разработано. Зачастую для проведения терапии используется протокол ML-DS-2006.
В России применяются протоколы немецкой группы - BFM (Berlin-Frankfurt-M nster) - AML-BFM-98, AML-BFM-2004, ML-DS-2006. Трехлетняя выживаемость пациентов, получавших лечение в исследовании AML-BFM 98, составила 90%. В относительно недавнем международном мультицентровом исследовании ML-DS 2006, выполненном в период с 2006 по 2015 годы, в сравнении с исследованием AML-BFM 98 интенсивность терапии снижена за счет уменьшения кумулятивной дозы этопозида**, сокращения количества ЛП, а также отмены поддерживающей терапии. В результате проведенной терапии полная ремиссия достигнута у 85% детей. Несмотря на редукцию ХТ, показатели общей и бессобытийной выживаемости составили 89% и 87%, а кумулятивный риск рецидива/рефрактерности - 6%. Данные результаты оказались схожими с контрольной группой - BFM 98. Смертность, ассоциированная с терапией, составила 2,9% против 5%. Частота тяжелых инфекционных осложнений была снижена в исследовании ML-DS-2006 практически вдвое [82].
Пациентам с ОМЛ/МДС и ДС рекомендуется проведение терапии по протоколу ML-DS-2006. Терапия по протоколу для всех пациентов включает 4 цикла химиотерапии: индукцию ремиссии и 3 цикла консолидации.
- Рекомендуется всем пациентам с синдромом Дауна и ОМЛ терапия сниженными дозами химиопрепаратов по одной из указанных ниже схем терапии со стандартным таймингом, то есть необходимостью восстановления гемопоэза перед началом каждого цикла постремиссионной терапии [82, 181, 182].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Индукция ремиссии
AIE: [74, 181, 182]
Цитарабин** 100 мг/м2/день в виде непрерывной в/в инфузии в течение 48 часов, начиная с утра 1 дня до утра 3 дня.
Цитарабин** 100 мг/м2 каждые 12 часов в виде 30-минутной в/в инфузии с 3 дня до 8 дня включительно (всего 12 доз);
#Идарубицин** 8 мг/м2/день в виде 4-часовой в/в инфузии в дни 3, 5 и 7, вводить непосредственно перед цитарабином** (всего 3 дозы);
#Этопозид** 150 мг/м2/день в виде одночасовой в/в инфузии каждые 24 часа в дни 6, 7 и 8 (всего 3 дозы), вводить до цитарабина**;
Цитарабин** интратекально в возрастной дозировке в день 1.
Консолидация 1
цикл AI: [74, 181, 182]
Критерии начала химиотерапии: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 500 мг/м2/день в виде непрерывной 24-часововой в/в инфузии в дни 1 - 4 включительно (всего 96 часов);
#Идарубицин** 5 мг/м2 в виде 1-часовой в/в инфузии в день 3 и день 5 (2 дозы);
Цитарабин** интратекально в возрастной дозировке в день 0.
Консолидация 2
haM: [68, 100, 181]
Критерии начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 1 г/м2 в виде 3-часовой в/в инфузии каждые 12 часов в течение 3-х дней (всего 6 доз);
#Митоксантрон** 10 мг/м2/день в виде 30-минутной в/в инфузии 1 раз в день в течение 2-х дней (всего 2 дозы);
Цитарабин** интратекально в возрастной дозировке в день 0.
Консолидация 3
HA: [74, 181, 182]
Критерии начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Высокие дозы цитарабина** 3 г/м2 в виде 3-часовой в/в инфузии каждые 12 часов в дни 1 - 3 включительно (всего 6 доз);
Цитарабин** интратекально в возрастной дозировке в день 0.
В случае отсутствия #идарубицина** в клинике возможно применение #митоксантрона** (перерасчет с #идарубицином** 1:1) или даунорубицина** (соотношение 1:5).
Дозы цитарабина** для интратекального введения в зависимости от возраста
Возраст
Доза, мг
Меньше 1 года
20
1 - 2 года
26
2 - 3 года
34
Старше 3 лет
40
Комментарии: Для детей с массой тела ![]() 12 кг или возрастом < 1 года, дозы внутривенной химиотерапии должны рассчитываться в соответствии с массой тела (кг) ребенка, а не площадью поверхности тела.
12 кг или возрастом < 1 года, дозы внутривенной химиотерапии должны рассчитываться в соответствии с массой тела (кг) ребенка, а не площадью поверхности тела.
- Рекомендуется всем новорожденным пациентам с ДС придерживаться следующей тактики ведения [82, 182]:
1. проведение общего (клинического) анализа крови с просмотром мазка крови для анализа аномалий морфологии эритроцитов, тромбоцитов и лейкоцитов с целью поиска и подсчета бластных клеток;
2. проведение визуального осмотра с целью выявления клинических проявлений;
3. при обнаружении повышенного количества бластных клеток в периферической крови или наличии клинических признаков необходимо:
- определить наличие тяжелых жизнеугрожающих симптомов;
- провести молекулярно-генетическое исследование мутаций в гене GATA1 методом секвенирования.
4. При наличии жизнеугрожающих симптомов (лейкоцитоз > 100 тыс/мкл, конъюгированный билирубин > 83 ммоль/л, выраженная гепатоспленомегалия, водянка плода, плевральный/перикардиальный выпоты, почечная недостаточность, ДВС) - необходимо начать терапию низкими дозами цитарабина**.
5. При отсутствии тяжелой симптоматики - мониторинг до нормализации показателей кроветворения и последующее диспансерное наблюдение до 5 лет (ввиду риска развития ОМЛ).
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
3.4 Сопутствующая и сопроводительная терапия
- Всем пациентам, получающим терапию по поводу ОМЛ рекомендуется проведение сопутствующей и сопроводительной терапии в соответствии с профильными рекомендациями [1, 53 - 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Показана изоляция детей в боксированные палаты, проведение инфузионной терапии, применение колониестимулирующих факторов по показаниям.
- Рекомендуется пациентам с ОМЛ после терапии флударабином или кладрибином профилактика пневмоцистной пневмонии сульфаметоксазол + триметоприм** в дозе 150/750 мг/м2 /день или 5 мг/кг/день по триметоприму 3 дня в неделю [57].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Не рекомендуется всем пациентам с ОМЛ, учитывая высокую вероятность формирования резистентной микрофлоры, а также высокую частоту инфекций, вызванных энтеробактериями с продукцией бета-лактамаз расширенного спектра (БЛРС), проведение первичной профилактики бактериальных инфекций при ОМЛ антибиотиками, в том числе "селективной деконтаминации" кишечника неабсорбируемыми антимикробными препаратами [21, 22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ОМЛ в период нейтропении проведение профилактики инвазивных микозов: позаконазолом** (детям старше 13 лет), вориконазолом** (старше 2-х лет), итраконазолом (старше 2-х лет) или, при невозможности назначения азолов, другими противогрибковыми препаратами системного действия (по показаниям) [21, 22, 59, 153, 154].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: прием противогрибковых препаратов системного действия продолжается до повышения гранулоцитов выше 0,5 x 109/л.
- Рекомендуется пациентам с ОМЛ и ранее установленным инвазивным микозом (ИМ) проведение вторичной противогрибковой профилактики препаратом, при назначении которого было достигнуто излечение от ИМ [21, 60 - 62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ при развитиии ФН в течение не более 60 минут инициировать эмпирическую терапию бета-лактамным антибактериальным препаратом, пенициллиными (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз; цефалоспорины третьего либо четвертого поколения), с активностью против грамположительных и грамотрицательных бактерий, включая синегнойную палочку. [111, 113, 114, 145 - 147].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5).
Комментарии: Выбор стартовой терапии зависит от соматического состояния, результатов скрининга и предшествующего инфекционного анамнеза пациента, а также локальных эпидемиологических данных и рекомендаций. Введение противомикробных препаратов системного действия пациентам с ОМЛ осуществляется только внутривенно.
- Рекомендуется всем пациентам с ОМЛ и фебрильной нейтропенией при стабильном клиническом состоянием (адекватный уровень сознания, нормальные показатели гемодинамики, отсутствие клиники локальной инфекции) назначение бета-лактамных антибактериальных препаратов, пенициллинов: цефалоспоринов (ЦФ) третьего, четвертого поколения либо #пиперациллин/тазобактама в комбинации с аминогликозидами. [22, 108, 109, 110, 111, 113, 120, 122 - 124, 146, 147].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Дополнительно может быть выполнено назначение антибиотиков гликопептидной структуры, в зависимости от клинической картины, локальных рекомендаций и колонизации пациента. Назначение карбапенемов в качестве антибактериальных препаратов системного действия первой линии обосновано у пациентов с тяжелыми инфекциями, при поражении брюшной, параректальной областей, при развитии сепсиса. Модификацию антимикробной терапии проводят на основании клинических симптомов, результатов инструментальных и микробиологических исследований При стабильном клиническом состоянии и отсутствии очагов инфекции допустимо продолжение стартовой антибактериальной терапии в течение 48 - 72-х часов, поскольку лихорадка не является единственным показателем тяжести инфекционного процесса.
- Рекомендуется пациентам с ОМЛ и персистирующей ФН при эмпирической эскалации антибактериальной терапии учитывать результаты микробиологических (культуральных) исследований кала на аэробные и факультативно-анаэробные микроорганизмы для назначения прецизионной антибактериальной терапии [164, 165].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Пациентам с колонизацией резистенстными бактериями необходимо назначение препаратов группы резерва (в соответствии с данными антибиотикограммы).
- Рекомендуется пациентам с ОМЛ при развитии персистирующей ФН, тяжелой инфекции, признаков сепсиса и септического шока назначение бета-лактамных антибактериальных препаратов наиболее широкого спектра действия (карбапенемов) в сочетании с аминогликозидом и ванкомицином**, а пациентам с известной колонизацией - препараты группы резерва. [149 - 152, 175, 176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: При развитии тяжелых инфекционных осложнений и/или сепсиса антибактериальные препараты назначаются в максимальных дозах, предпочтительно пролонгированными инфузиями в связи с нарушением клиренса и перераспределением жидкости в организме. Препаратами резервной группы являются колистиметат натрия, полимиксин B**, тигециклин**, #цефтолозан/тазобактам**, цефтазидим/авибактам** (в некоторых ситуациях в комбинации с азтреонамом**) [175 - 178].
- Рекомендуется всем пациентам с ОМЛ проведение эмпирической противогрибковой терапии [124, 126, 127, 153, 154].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 3).
- Упреждающая противогрибковая терапия рекомендована всем пациентам с ОМЛ в случае выявления признаков инвазивного микоза при проведении полного комплекса диагностических обследований: КТ органов грудной полости, бронхоскопии с последующим микробиологическим исследованием бронхоальвеолярной лаважной жидкости (в соответствии с приложением А3.6) [124, 153 - 155].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5).
- Рекомендуется всем пациентам с ОМЛ при развитии кандидемии/инвазивного кандидоза назначение терапии противогрибковыми препаратами системного действия [144, 145, 153 - 156]
Уровень убедительности рекомендации C (уровень достоверности доказательств 5).
- Всем пациентам с ОМЛ и нейтропенией и/или гемодинамической нестабильностью для лечения кандидемии флуконазол** не рекомендован [154].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5).
- При развитии инвазивного аспергиллеза всем пациентам с ОМЛ рекомендуется незамедлительное начало терапии противогрибковыми препаратами системного действия [154 - 160].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5).
- При развитии инвазивного мукормикоза всем пациентам с ОМЛ рекомендуется незамедлительное проведение комбинированной терапии, включающей противогрибковые препараты системного действия и хирургическое вмешательство [154, 161 - 163].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4).
- Рекомендуется всем пациентам младше 18 лет с ОМЛ при снижении уровня тромбоцитов ниже 20 x 109/л либо при более высоких показателях тромбоцитов при наличии коагулопатии (гипофириногенемия, повышение АЧТВ и МНО) геморрагического синдрома или инфекции трансфузия концентрата тромбоцитов [53, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Любое проявление геморрагического синдрома (петехиальные высыпания, особенно на слизистой полости рта, на лице и передней поверхности грудной клетки, любые кровотечения) и/или повышение температуры тела выше 37,5 °C даже в отсутствие явного очага инфекции, требует выполнения трансфузии тромбоконцентрата даже при количестве тромбоцитов в периферической крови более 20 x 109/л. Аналогичные показания для трансфузии тромбоконцентрата при подготовке пациента перед выполнением инвазивных процедур.
Для проведения первой фазы индукции и для выполнения инвазивных манипуляций (люмбальной пункции, катетеризации центральной вены) уровень тромбоцитов должен быть не менее 30 x 109/л. В период аплазии кроветворения после любого курса полихимиотерапии, если нет кровотечений и/или инфекций с фебрильной лихорадкой - тромбоциты должны поддерживаться на уровне не менее 15 x 109/л. При присоединении инфекций с фебрильной лихорадкой и при применении Амфотерицина B** тромбоциты должны поддерживаться на уровне не менее 20 x 109/л.
Выраженная кровоточивость со слизистых, кровотечение в ЖКТ, легочное кровотечение, кровоизлияние в мозг - показания к трансфузии тромбоконцентрата при любых показателях тромбоцитов
Пациенты, получавшие кладрибин** и #флударабин**, должны переливаться облученными препаратами крови.
- Рекомендуется всем пациентам с ОМЛ при снижении гемоглобина ниже 70 г/л и гематокрите менее 0,3 или развитии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка) трансфузия эритроцитной массы [53, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: пациенты, получавшие кладрибин**, должны переливаться облученными препаратами крови.
- Рекомендуется при наличии нарушений плазменного гемостаза (гипо- и гиперкоагуляция) выполнение трансфузии компонентов крови [65].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Показания и объем трансфузионной поддержки определяется показателями коагулограммы и клинической ситуацией.
Пациенты, получавшие кладрибин** и #флюдарабин**, должны переливаться облученными препаратами крови.
Трансфузии свежезамороженной плазмы проводятся только при серьезных изменениях в коагулограмме: фибриноген менее 1 г/л, протромбиновый индекс менее 50%, АЧТВ более 55 секунд.
- Рекомендуется при возникновении острого или хронического болевого синдрома уточнение этиологии боли; при выявлении очага воспаления - проведение необходимых мероприятий по лечению очага воспаления согласно соответствующим клиническим рекомендациям (включая, при необходимости, хирургическое лечение); при исключении инфекционно-воспалительной природы болевого синдрома рекомендуется проведение обезболивающей терапии согласно существующим протоколам обезболивания (см. соответствующие клинические рекомендации по хронической боли, клинические рекомендации по анестезиологии), в том числе, по показаниям - с применением наркотических и психотропных лекарственных препаратов, с учетом возможных противопоказаний, связанных с цитопенией, иными клиническими ситуациями [66].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Подход к реабилитации и диспансерное наблюдение пациентов с ОМЛ. Диспансерное наблюдение включает систематические осмотры и целенаправленное лабораторное и инструментальное обследование, направленное на оценку статуса ремиссии основного заболевания и возможных осложнений, связанных с перенесенной полихимиотерапией.
Специальных методов реабилитации при ОМЛ не существует.
- Рекомендуется проведение реабилитации при возникновении осложнений после завершения программы терапии ОМЛ в рамках соответствующих нозологий [67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: после окончания лечения рекомендуется вести здоровый образ жизни, исключить инсоляцию и физиотерапевтические процедуры.
При проведении полихимиотерапии возможна кардио-, гепато-, нейро-, нефро- и другая токсичность, последствия которой могут проявляться и после ее окончания.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Первичная профилактика ОМЛ невозможна в связи с низкой базовой заболеваемостью и неустановленными причинами болезни.
Профилактика рецидива заболевания основана на полном выполнении протокола терапии первой линии и выполнении ТГСК и проведении регулярного динамического наблюдения
- Рекомендуется в течение поддерживающей терапии выполнение общего (клинического) анализа крови 1 раз в месяц. [1, 3, 4, 8, 25]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется после окончания терапии наблюдение врачом-гематологом и/или врачом-педиатром по месту жительства с выполнением необходимого объема обследований со следующей периодичностью: [1]
1. Пациенты, получившие алло-ТГСК, наблюдаются согласно рекомендациям трансплантационного центра.
2. Пациенты без алло-ТГСК:
1) общий (клинический) анализ крови с подсчетом лейкоцитарной формулы 1 раз в месяц первые 3 мес., затем 1 раз в 6 мес в течение 5 лет
2) молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1), определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови через 6 месяцев после окончания химиотерапии.
3. Анализ крови биохимический общетерапевтический с оценкой - альбумина, АЛТ, АСТ, ЛДГ, билирубина (общего и прямого), мочевины и креатинина, ферритина 1 раз в год в течение 5 лет
4. ЭКГ и эхокардиография 1 раз в год в течение 5 лет
5. КТ/МРТ зон экстрамедуллярных очагов через 6 мес. от окончания химиотерапии
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
6. Организация оказания медицинской помощи
Показания для плановой госпитализации:
1. Подозрение/установление диагноза ОЛ
2. Диагностика рецидива ОМЛ
3. Проведение очередного курса ХТ в условиях круглосуточного стационара
4. Проведение запланированной ТГСК
5. Выполнение плановых хирургических вмешательств,
6. Выполнение плановых экстракорпоральных методов очищения крови и заместительной почечной терапии
7. Проведение заместительной гемокомпонентной терапии
Показания для экстренной госпитализации:
Неотложные состояния у пациентов с ОМЛ и при подозрении на ОЛ:
- лейкоцитоз более 100х109/л
- фебрильная лихорадка и инфекционные осложнения на фоне нейтропении после курса ХТ
- геморрагический синдром
- тромботические осложнения
- необходимость проведения экстренной заместительной гемокомпонентной терапии
- другие системные нарушения, обусловленные течением основного заболевания или развившиеся вследствие проведенного лечения
Показания к выписке пациента из стационара:
1. Восстановление показателей периферической крови (лейкоциты более 1 x 109/л, гранулоциты более 0,5 x 109/л, тромбоциты более 50 x 109/л, гемоглобин - более 80 г/л) после очередного курса ХТ
2. Нормотермия в течение 3 - 5 суток и отсутствие неконтролируемых инфекционных осложнений в послекурсовом периоде
3. Купирование геморрагических осложнений
4. Купирование тромботических осложнений
5. Купирование системных нарушения, обусловленных течением основного заболевания или развившихся вследствие проведенного лечения.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
"Молекулярно-направленная" терапия
Прогресс в изучении молекулярного патогенеза ОМЛ привел к разработке новых "молекулярных" препаратов, т.е. молекул, механизм действия которых связан с влиянием на белки, функция которых изменяется в результате мутации или транслокации (таргетное воздействие). Например, генетические изменения приводят к мутациям в генах, активирующих каскады трансдукции сигнала (например, FLT3, KIT, RAS), к слиянию генов или мутациям, приводящим к повышению или угнетению транскрипционной активности (например, PML-RARA, RUNX1-RUNX1T1, CBFB-MYH11, CEBPA) или к нарушению функции генов, вовлеченных в передачу сигнала (например, NPM1, NUP98, NUP). Хотя для некоторых препаратов, действующих на молекулярном уровне, и была продемонстрирована эффективность при ОМЛ, уже на стадии КИ было понятно, что большинство из них необходимо использовать в сочетании со стандартными цитостатическими препаратами. В настоящее время проводится большое число КИ по изучению эффективности при ОМЛ и безопасности препаратов из различных фармацевтических групп.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен сбор жалоб, анамнеза и оценка объективного статуса
Да/Нет
2.
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен общий (клинический) анализ крови с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы) и исследованием уровня тромбоцитов в крови
Да/Нет
3.
У пациента с подозрением на ОМЛ выполнено цитологическое исследование мазка костного мозга (миелограммы) и цитохимическое исследование микропрепарата костного мозга
Да/Нет
4.
У пациента с подозрением на ОМЛ выполнено цитогенетическое исследование (кариотип) аспирата костного мозга
Да/Нет
5.
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен анализ крови биохимический общетерапевтический (креатинин, общий белок, общий билирубин, ЛДГ)
Да/Нет
6.
У пациента с подозрением на ОМЛ выполнен общий (клинический) анализ спинномозговой жидкости
Да/Нет
7.
У пациента с подозрением на ОМЛ выполнена рентгенография органов грудной клетки и/или КТ органов грудной полости и/или головного мозга
Да/Нет
8.
Пациент с впервые диагностированным ОМЛ при наличии возможности включен в клиническое исследование
Да/Нет
9.
У пациента с впервые диагностированным ОМЛ, который не может быть включен в клиническое исследование, после завершения всех диагностических мероприятий проведена индукционная терапия
Да/Нет
10.
У пациента с верифицированным ОМЛ, получающего терапию вне рамок клинических исследований и достигшего ПР после индукционного этапа терапии, выполнена программа консолидации ремиссии
Да/Нет
11.
У пациента с верифицированным ОМЛ, получающего терапию вне рамок клинических исследований и достигшего ПР после индукционного этапа терапии, проведена консультация в трансплантационном центре для решения вопроса о возможности и целесообразности выполнения алло-ТКМ/алло-ТГСК
Да/Нет
12.
У пациента, получающего терапию по поводу верифицированного ОМЛ вне рамок клинических исследований, после окончания 1 и 2 курсов индукции ремиссии проведено цитологическое исследование мазка костного мозга (миелограммы)
Да/Нет
13.
У пациента, получающего терапию по поводу верифицированного ОМЛ вне рамок клинических исследований, после окончания консолидации ремиссии проведено цитологическое исследование мазка костного мозга (миелограммы)
Да/Нет
14.
У пациента, получающего терапию по поводу верифицированного ОМЛ вне рамок клинических исследований, после завершения всей программы терапии проведено цитологическое исследование мазка костного мозга (миелограммы)
Да/Нет
Список литературы
1. Детская гематология Под ред: А.Г. Румянцева, А.А. Масчана, Е.В. Жуковской. 2015. 656 p.
2. Pui C.-H. Childhood leukemias. 2012. 880 p.
3. Савченко В.Г., Паровичникова Е.Н. Острые лейкозы//Клиническая онкогематология: руководство для врачей. Под ред. Волковой М.А. 2-е изд., перераб. и доп. 2007. P. 409 - 502.
4. Паровичникова Е.Н. et al. Клинический протокол ОМЛ-01.10 по лечению острых миелоидных лейкозов взрослых//Программное лечение заболеваний крови, под ред. Савченко В.Г. М.: Практика, 2012. P. 153 - 207.
5. Shallis R.M. et al. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges.//Blood Rev. 2019. Vol. 36. P. 70 - 87.
6. Swerdlow S.H. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms//Blood. 2016.
7. Arber D.A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia//Blood. 2016.
8. Acute Myeloid Leukemia. National Comprehensive Cancer Network (NCCN) Guidelines. 2-2020. [Electronic resource]. URL: https://www.nccn.org/professionals/physician_gls/pdf/aml.pdf.
9. Kulsoom B. et al. Clinical presentation of acute myeloid leukaemia - A decade-long institutional follow-up.//J. Pak. Med. Assoc. 2017. Vol. 67, N 12. P. 1837 - 1842.
10. Godley L.A. Inherited predisposition to acute myeloid leukemia.//Semin. Hematol. 2014. Vol. 51, N 4. P. 306 - 321.
11. Rubnitz J.E., Gibson B., Smith F.O. Acute Myeloid Leukemia//Hematology/Oncology Clinics of North America. 2010. Vol. 24, N 1. P. 35 - 63.
12. Agis H. et al. A comparative study on demographic, hematological, and cytogenetic findings and prognosis in acute myeloid leukemia with and without leukemia cutis.//Ann. Hematol. 2002. Vol. 81, N 2. P. 90 - 95.
13. Avni B. et al. Clinical implications of acute myeloid leukemia presenting as myeloid sarcoma.//Hematol. Oncol. 2012. Vol. 30, N 1. P. 34 - 40.
14. Creutzig U. et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: Recommendations from an international expert panel//Blood. American Society of Hematology, 2012. Vol. 120, N 16. P. 3167 - 3205.
15. Ku G.H. et al. Venous thromboembolism in patients with acute leukemia: Incidence, risk factors, and effect on survival//Blood. 2009. Vol. 113, N 17. P. 3911 - 3917.
16. Муфтахова Г.М., Аксенова М.Е. Поздние эффекты противоопухолевой терапии со стороны мочеполовой системы (отсроченное влияние противоопухолевой терапии на органы мочеполовой системы)//Российский журнал детской гематологии и онкологии. 2019. Vol. 5, N 4. P. 114 - 119.
17. Fang R.C., Aboulafia D.M. HIV infection and myelodysplastic syndrome/acute myeloid leukemia//HIV-Associated Hematological Malignancies. 2016. P. 133 - 144.
18. Freeman A.J. et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection.//Hepatology. 2001. Vol. 34, N 4 Pt 1. P. 809 - 816.
19. Ribas A. et al. How important is hepatitis C virus (HCV)-infection in persons with acute leukemia?//Leuk. Res. 1997. Vol. 21, N 8. P. 785 - 788.
20. Lam M.T. et al. Herpes simplex infection in acute myelogenous leukemia and other hematologic malignancies: a prospective study.//Cancer. 1981. Vol. 48, N 10. P. 2168 - 2171.
21. Averbuch D. et al. Targeted therapy against multi-resistant bacteria in leukemic and hematopoietic stem cell transplant recipients: Guidelines of the 4th European conference on Infections in Leukemia (ECIL-4, 2011)//Haematologica. 2013. Vol. 98, N 12. P. 1836 - 1847.
22. Averbuch D. et al. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: Summary of the 2011 4th European Conference on Infections in Leukemia//Haematologica. 2013. Vol. 98, N 12. P. 1826 - 1835.
23. Leahy M.F., Mukhtar S.A. From blood transfusion to patient blood management: a new paradigm for patient care and cost assessment of blood transfusion practice.//Intern. Med. J. 2012. Vol. 42, N 3. P. 332 - 338.
24.  et al. Diagnosis and management of acute myeloid leukemia in adults: Recommendations from an international expert panel, on behalf of the European LeukemiaNet//Blood. 2010. Vol. 115, N 3. P. 453 - 474.
et al. Diagnosis and management of acute myeloid leukemia in adults: Recommendations from an international expert panel, on behalf of the European LeukemiaNet//Blood. 2010. Vol. 115, N 3. P. 453 - 474.
25.  et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel//Blood. 2017. Vol. 129, N 4. P. 424 - 447.
et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel//Blood. 2017. Vol. 129, N 4. P. 424 - 447.
26. Olsen R.J. et al. Acute leukemia immunohistochemistry: a systematic diagnostic approach.//Arch. Pathol. Lab. Med. 2008. Vol. 132, N 3. P. 462 - 475.
27. Bene M.C. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL).//Leukemia. 1995. Vol. 9, N 10. P. 1783 - 1786.
28. Wu D. et al. Efficacy and safety of different doses of cytarabine in consolidation therapy for adult acute myeloid leukemia patients: A network meta-analysis//Sci. Rep. 2017. Vol. 7, N 1. P. 9509.
29. Ravandi F., Walter R.B., Freeman S.D. Evaluating measurable residual disease in acute myeloid leukemia.//Blood Adv. 2018. Vol. 2, N 11. P. 1356 - 1366.
30. Лобанова Т.И., Гальцева И.В., Паровичникова Е.Н. Исследование минимальной остаточной болезни у пациентов с острыми миелоидными лейкозами методом многоцветной проточной цитофлуориметрии (обзор литературы)//Онкогематология. 2018. Vol. 13, N 1. P. 83 - 102.
31. Лобанова Т.И. "Клиренс опухолевого клона у пациентов с разными молекулярно-генетическими вариантами острых миелоидных лейкозов": диссертация. кандидата медицинских наук: 14.01.21. 2018. 166 p.
32. Herrmann J. et al. Evaluation and management of patients with heart disease and cancer: Cardio-oncology//Mayo Clin. Proc. 2014. Vol. 89, N 9. P. 1287 - 1306.
33. Roberts A.S. et al. Extramedullary haematopoiesis: radiological imaging features//Clinical Radiology. 2016. Vol. 71, N 9. P. 807 - 814.
34. Fritz J. et al. Radiologic spectrum of extramedullary relapse of myelogenous leukemia in adults.//AJR. Am. J. Roentgenol. 2007. Vol. 189, N 1. P. 209 - 218.
35. Arrigan M. et al. Imaging findings in recurrent extramedullary leukaemias//Cancer Imaging. 2013. Vol. 13, N 1. P. 26 - 35.
36. Almond L.M. et al. Myeloid Sarcoma: Presentation, Diagnosis, and Treatment//Clinical Lymphoma, Myeloma and Leukemia. Elsevier Inc., 2017. Vol. 17, N 5. P. 263 - 267.
37. Winestone L.E. et al. Disparities in pediatric acute myeloid leukemia (AML) clinical trial enrollment//Leuk. Lymphoma. Taylor and Francis Ltd, 2019. Vol. 60, N 9. P. 2190 - 2198.
38. Perel Y. et al. Treatment of childhood acute myeloblastic leukemia: Dose intensification improves outcome and maintenance therapy is of no benefit - Multicenter studies of the French LAME (Leuc mie Aigu My loblastique Enfant) Cooperative Group//Leukemia. Nature Publishing Group, 2005. Vol. 19, N 12. P. 2082 - 2089.
39. Rasche M. et al. Successes and challenges in the treatment of pediatric acute myeloid leukemia: a retrospective analysis of the AML-BFM trials from 1987 to 2012//Leukemia. Nature Publishing Group, 2018. Vol. 32, N 10. P. 2167 - 2177.
40. Шнейдер М.М. Эффективность риск-адаптированной терапии острого миелоидного лейкоза у детей с использованием режимов интенсивного тайминга и трансплантации гемопоэтических стволовых клеток. Диссертация на соискание ученой степени доктора медицинских наук. 2009. 223 p.
41.  et al. Practical aspects of the use of intrathecal chemotherapy Aspectos
et al. Practical aspects of the use of intrathecal chemotherapy Aspectos  de la utilizaci n de quimioterapia intratecal//Farm Hosp. 2017. Vol. 41, N 1. P. 105 - 129.
de la utilizaci n de quimioterapia intratecal//Farm Hosp. 2017. Vol. 41, N 1. P. 105 - 129.
42. Creutzig U. et al. CNS irradiation in pediatric acute myleoid leukemia: Equal results by 12 or 18 Gy in studies AML-BFM98 and 2004//Pediatr. Blood Cancer. 2011. Vol. 57, N 6. P. 986 - 992.
43. Stevens R.F. et al. Marked improvements in outcome with chemotherapy alone in paediatric acute myeloid leukaemia: Results of the United Kingdom Medical Research Council's 10th AML trial//Br. J. Haematol. 1998. Vol. 101, N 1. P. 130 - 140.
44. Ravindranath Y. et al. Pediatric Oncology Group (POG) studies of acute myeloid leukemia (AML): A review of four consecutive childhood AML trials conducted between 1981 and 2000//Leukemia. Nature Publishing Group, 2005. Vol. 19, N 12. P. 2101 - 2116.
45. Kardos G. et al. Treatment strategy and results in children treated on three Dutch Childhood Oncology Group acute myeloid leukemia trials//Leukemia. Nature Publishing Group, 2005. Vol. 19, N 12. P. 2063 - 2071.
46. Smith F.O. et al. Long-term results of children with acute myeloid leukemia: A report of three consecutive Phase III trials by the Children's Cancer Group: CCG 251, CCG 213 and CCG 2891//Leukemia. Nature Publishing Group, 2005. Vol. 19, N 12. P. 2054 - 2062.
47. Perel Y. et al. Maintenance therapy in childhood acute myeloid leukemia//Ann. Hematol. 2004. Vol. Supp. 1. P. S116 - S119.
48. Toyama D. et al. Successful Treatment of Pediatric Refractory/Relapsed AML with KIR-Ligand-Mismatched Cord Blood Transplant after FLAG-IDA Reinduction Therapy with or without the GO Regimen//Case Rep. Hematol. Hindawi Limited, 2020. Vol. 2020.
49. Hashmi K.U. et al. FLAG-IDA in the treatment of refractory/relapsed acute leukaemias: Single centre study//J. Pak. Med. Assoc. 2005. Vol. 55, N 6. P. 234 - 238.
50. Safaian N.N. et al. Sorafenib ( ) induces molecular remission and regression of extramedullary disease in a patient with FLT3-ITD+ acute myeloid leukemia//Leuk. Res. 2009. Vol. 33, N 2. P. 348 - 350.
) induces molecular remission and regression of extramedullary disease in a patient with FLT3-ITD+ acute myeloid leukemia//Leuk. Res. 2009. Vol. 33, N 2. P. 348 - 350.
51. Osone S. et al. Sorafenib Therapy for Pediatric Acute Myeloid Leukemia with FMS-like Tyrosine Kinase 3-internal Tandem Duplication Mutations: 2 Case Reports//J. Pediatr. Hematol. Oncol. Lippincott Williams and Wilkins, 2017. Vol. 39, N 4. P. e199 - e202.
52. Crews K.R. et al. Interim comparison of a continuous infusion versus a short daily infusion of cytarabine given in combination with cladribine for pediatric acute myeloid leukemia//J. Clin. Oncol. 2002. Vol. 20, N 20. P. 4217 - 4224.
53. Румянцев А.Г., Масчан А.А., Самочатова Е.В. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. 2009. 448 p.
54. Coiffier B. et al. Guidelines for the management of pediatric and adult tumor lysis syndrome: An evidence-based review//Journal of Clinical Oncology. 2008. Vol. 26, N 16. P. 2767 - 2778.
55. Cairo M.S. et al. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant diseases: An expert TLS panel consensus//Br. J. Haematol. 2010. Vol. 149, N 4. P. 578 - 586.
56. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. М.: Издательская группа РОНЦ. Практическая медицина, 2012. 684 p.
57. Maertens J. et al. ECIL guidelines for preventing Pneumocystis jirovecii pneumonia in patients with haematological malignancies and stem cell transplant recipients//J. Antimicrobal Chemother. 2016. Vol. 71, N 9. P. 2397 - 2404.
58. Chen M. et al. Pyridoxine for Prevention of Hand-Foot Syndrome Caused by Chemotherapy: A Systematic Review//PLoS One. Public Library of Science, 2013. Vol. 8, N 8.
59. Korula A. et al. Invasive fungal infection following chemotherapy for acute myeloid leukaemia-Experience from a developing country//Mycoses. Blackwell Publishing Ltd, 2017. Vol. 60, N 10. P. 686 - 691.
60. Fisher B.T. et al. Effect of Caspofungin vs Fluconazole Prophylaxis on Invasive Fungal Disease among Children and Young Adults with Acute Myeloid Leukemia: A Randomized Clinical Trial//JAMA - J. Am. Med. Assoc. American Medical Association, 2019. Vol. 322, N 17. P. 1673 - 1681.
61. Mandhaniya S. et al. Oral voriconazole versus intravenous low dose amphotericin B for primary antifungal prophylaxis in pediatric acute leukemia induction: A prospective, randomized, clinical study//J. Pediatr. Hematol. Oncol. 2011. Vol. 33, N 8. P. e333-41.
62. Cornely O.A. et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia//N. Engl. J. Med. Massachussetts Medical Society, 2007. Vol. 356, N 4. P. 348 - 359.
63. Ueda M. et al. Immunoglobulin therapy in hematologic neoplasms and after hematopoietic cell transplantation.//Blood Rev. 2018. Vol. 32, N 2. P. 106 - 115.
64. Nellis M.E., Goel R., Karam O. Transfusion Management in Pediatric Oncology Patients//Hematology/Oncology Clinics of North America. W.B. Saunders, 2019. Vol. 33, N 5. P. 903 - 913.
65. Szczepiorkowski Z.M., Dunbar N.M. Transfusion guidelines: when to transfuse.//Hematology/the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2013. Vol. 2013. P. 638 - 644.
66. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
67. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
68. Tramsen L. et al. Lack of effectiveness of neutropenic diet and social restrictions as anti-infective measures in children with acute myeloid leukemia: An analysis of the AML-BFM 2004 trial//J. Clin. Oncol. American Society of Clinical Oncology, 2016. Vol. 34, N 23. P. 2776 - 2783.
69. Milligan D.W. et al. Fludarabine and cytosine are less effective than standard ADE chemotherapy in high-risk acute myeloid leukemia, and addition of G-CSF and ATRA are not beneficial: Results of the MRC AML-HR randomized trial//Blood. American Society of Hematology, 2006. Vol. 107, N 12. P. 4614 - 4622.
70. Gibson B.E.S. et al. Results of a randomized trial in children with Acute Myeloid Leukaemia: Medical Research Council AML12 trial//Br. J. Haematol. 2011. Vol. 155, N 3. P. 366 - 376.
71. Creutzig U. et al. Toxicity and effectivity of high-dose Idarubicin during AML induction therapy: Results of a pilot study in children//Klin. Padiatr. 2000. Vol. 212, N 4. P. 163 - 168.
72. Creutzig U. et al. Improved treatment results in high-risk pediatric acute myeloid leukemia patients after intensification with high-dose cytarabine and mitoxantrone: Results of study acute myeloid Leukemia-Berlin-Frankfurt-M nster 93//J. Clin. Oncol. Lippincott Williams and Wilkins, 2001. Vol. 19, N 10. P. 2705 - 2713.
73. Acute myeloid leukemia. NCCN evidence blocks. 2020.
74. Uffmann M. et al. Therapy reduction in patients with Down syndrome and myeloid leukemia: the international ML-DS 2006 trial//Blood. American Society of Hematology, 2017. Vol. 129, N 25. P. 3314 - 3321.
75. Cornelissen J.J. et al. The European LeukemiaNet AML Working Party consensus statement on allogeneic HSCT for patients with AML in remission: An integrated-risk adapted approach//Nature Reviews Clinical Oncology. 2012. Vol. 9, N 10. P. 579 - 590 76.
76. Abildgaard L, Ellebaek E, Gustafsson G, Abrahamsson J, Hovi L, Jonmundsson G, Zeller B, Hasle H. Optimal treatment intensity in children with Down syndrome and myeloid leukaemia: data from 56 children treated on NOPHO-AML protocols and a review of the literature. Ann Hematol. 2006 May; 85(5): 275-80.
77. Hassler A, Bochennek K, Gilfert J, Perner C, Sch ning S, Creutzig U, Reinhardt D, Lehrnbecher T. Infectious Complications in Children With Acute Myeloid Leukemia and Down Syndrome: Analysis of the Prospective Multicenter Trial AML-BFM 2004. Pediatr Blood Cancer. 2016 Jun; 63(6): 1070-4.
78. Bertrums EJM, Zwaan CM, Hasegawa D, De Haas V, Reinhardt DN, Locatelli F, De Moerloose B, Dworzak M, Buijs A, Smisek P, Kolenova A, Pronk CJ, Klusmann JH,  , Ferster A, Antoniou E, Meshinchi S, Raimondi SC, Niemeyer CM, Hasle H, Van den Heuvel-Eibrink MM, Goemans BF. Guideline for management of non-Down syndrome neonates with a myeloproliferative disease on behalf of the I-BFM AML Study Group and EWOG-MDS. Haematologica. 2022 Mar 1; 107(3): 759 - 764.
, Ferster A, Antoniou E, Meshinchi S, Raimondi SC, Niemeyer CM, Hasle H, Van den Heuvel-Eibrink MM, Goemans BF. Guideline for management of non-Down syndrome neonates with a myeloproliferative disease on behalf of the I-BFM AML Study Group and EWOG-MDS. Haematologica. 2022 Mar 1; 107(3): 759 - 764.
79. Kudo K, Hama A, Kojima S, Ishii R, Morimoto A, Bessho F, Sunami S, Kobayashi N, Kinoshita A, Okimoto Y, Tawa A, Tsukimoto I. Mosaic Down syndrome-associated acute myeloid leukemia does not require high-dose cytarabine treatment for induction and consolidation therapy. Int J Hematol. 2010 May; 91(4): 630-5.
80. Taga T, Shimomura Y, Horikoshi Y, Ogawa A, Itoh M, Okada M, Ueyama J, Higa T, Watanabe A, Kanegane H, Iwai A, Saiwakawa Y, Kogawa K, Yamanaka J, Tsurusawa M. Continuous and high-dose cytarabine combined chemotherapy in children with down syndrome and acute myeloid leukemia: Report from the Japanese children's cancer and leukemia study group (JCCLSG) AML 9805 down study. Pediatr Blood Cancer. 2011 Jul 15; 57(1): 36 - 40.
81. Ravindranath Y, Abella E, Krischer JP, Wiley J, Inoue S, Harris M, Chauvenet A, Alvarado CS, Dubowy R, Ritchey AK, et al. Acute myeloid leukemia (AML) in Down's syndrome is highly responsive to chemotherapy: experience on Pediatric Oncology Group AML Study 8498. Blood. 1992 Nov 1; 80(9): 2210-4.
82. Uffmann M, Rasche M, Zimmermann M, von Neuhoff C, Creutzig U, Dworzak M, Scheffers L, Hasle H, Zwaan CM, Reinhardt D, Klusmann JH. Therapy reduction in patients with Down syndrome and myeloid leukemia: the international ML-DS 2006 trial. Blood. 2017 Jun 22; 129(25): 3314 - 3321.
83. Lange BJ, Kobrinsky N, Barnard DR, Arthur DC, Buckley JD, Howells WB, Gold S, Sanders J, Neudorf S, Smith FO, Woods WG. Distinctive demography, biology, and outcome of acute myeloid leukemia and myelodysplastic syndrome in children with Down syndrome: Children's Cancer Group Studies 2861 and 2891. Blood. 1998 Jan 15; 91(2): 608-15.
84. Инструкция по медицинскому применению лекарственного препарата Венклекста. Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=a1111a51-349d-4ff6-b92a-40e2bc0da33d Доступ от 17.04.2023.
85. Omima M, Khalid A, Aeshah A, Naglla E, Mohammed B.A. and Wasil J. FLAG/FLAG-IDA regimen for children with relapsed/refractory acute leukemiain the era of targeted novel therapies. Journal of Oncology Pharmacy Practice. 2019. Vol. 25(8): 1831 - 1838.
86. Международных рекомендациях Национального онкологического общества по терапии ОМЛ (NCCN), США. Международные рекомендации Национального онкологического общества (NCCN), США (NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines(R)) Acute Myeloid leukemia Version. 2. 2023) [Электронный ресурс]. Доступ от 22.03.2023. Режим доступа: https://www.nccn.org/professionals/physician_gls/pdf/aml.pdf.
87. Европейских рекомендациях по лечению острого миелоидного лейкоза (ESMO). Европейские рекомендации по лечению острого миелоидного лейкоза (Acute myeloid leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up) Heuser M, Ofran Y, Boissel N, Mauri SB, Craddock C, Janssen J, Wierzbowska A, Buske C, on behalf of the ESMO Guidelines Committee, Acute myeloid leukaemia inadult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, Annals of Oncology (2020), [Электронный ресурс]. Доступ от 22.03.2023. Режим доступа: https://www.annalsofoncology.org/article/S0923-7534(20) 36079-8/fulltext.
88. Trus MR, Yang L, Saiz FSet al. The histone deacetylase inhibitor valproic acid alters sensitivity towards all trans retinoic acid in acute myeloblastic leukemia cells. Leukemia. 2005; 19: 1161 - 1168. doi: 10.1038/sj.leu.2403773.
89. Попа А.В., Горохова Е.В., Флейшман Е.В. и др. Эпигенетическая терапия - важная составляющая в лечении детей, больных острым миелоидным лейкозом. Клиническая онкогематология. 2011; 4(1): 20 - 26.
90. А.В. Попа, В.С. Немировченко, Е.В. Флейшман, О.И. Сокова, Н.Н. Субботина, И.Н. Серебрякова, Л.Ю. Гривцова, Г.Л. Менткевич. Ингибиторы гистондеацетилазы и ДНК-метилтрансферазы в лечении детей, больных острым миелоидным лейкозом, их эффективность и место в терапии. Российский журнал детской гематологии и онкологии. 2016, Т. 3, N 4, с. 48 - 54.
91. А.В. Попа, О.А. Тиганова, О.И. Сокова, Н.Н. Субботина, Ю.В. Ольшанская, Б.В. Курдюков, И.Н. Серебрякова, А.Д. Палладина, Н.Н. Тупицын, О.Б. Курасова, А.Б. Моисеев, Г.Л. Менткевич. Значение эпигенетической терапии в лечении детей, больных острым миелоидным лейкозом. Вопросы онкологии, гематологии, иммунологии 2025, 24(1) (статья сдана в печать).
92 Г.А. Новичкова, А.В. Попа, А.А. Масчан и др. Промежуточные результаты лечения детей с ОМЛ по протоколу AML MRD-2018. Вопросы онкологии, гематологии, иммунологии 2025, 24(1) (статья сдана в печать).
93. Tierens A, Arad-Cohen N, Cheuk D, De Moerloose B, Fernandez Navarro JM, Hasle H, Jahnukainen K, Juul-Dam KL, Kaspers G, Kovalova Z, Lausen B, Nor n-Nystr m U, Palle J, Pasauliene R, Jan Pronk C, Saks K, Zeller B, Abrahamsson J. Mitoxantrone Versus Liposomal Daunorubicin in Induction of Pediatric AML With Risk Stratification Based on Flow Cytometry Measurement of Residual Disease. J Clin Oncol. 2024 Jun 20; 42(18): 2174 - 2185. doi: 10.1200/JCO.23.01841.
94. Saro H. Armenian, and Matthew J. Ehrhardt. Optimizing Cardiovascular Care in Children With Acute Myeloid Leukemia to Improve Cancer-Related Outcomes. JCO. 2018; 37(1): 1 - 7.
95. Katerin Tarlock, Todd A Alonzo, Robert B G erbing, Susana C Raimondi, et al. Gemtuzumab ozogamicin reduces relapse risk in FLT3/ITD acute myeloid leukemia: a report from the Children's Oncology Group. Clin Cancer Res. 2016 April 15; 22(8): 1951 - 1957. doi: 10.1158/1078-0432.CCR-15-1349.
96. Creutzig U, Zimmermann M, Ritter О, Reinhardt D, et al. Treatment strategies and long-term results in pediatric patients treated in four consecutive AML-BFM trials. Leukemia. 2005; 19: 2030 - 2042. DOI: 10.1038/sj.leu.2403920.
97. Rasche M, Zimmermann M, Borschel L, et al. Successes and challenges in the treatment of pediatric acute myeloid leukemia: a retrospective analysis of the AML-BFM trials from 1987 to 2012. Leukemia. 2018; 32: 2167 - 2177. DOI: 10.1038/s41375-018-0071-7.
98. Adriana Trabal, Amber Gibson, Jiasen HeM, et al/ Venetoclax for Acute Myeloid Leukemia in Pediatric Patients: A Texas Medical Center Experience. Cancers 2023, 15: 1983 - 1999. https://doi.org/10.3390/ cancers15071983.
99. Mathilde Penel-Page, Adriana Plesa, Sandrine Girard, et al. Association of fludarabin, cytarabine, and fractioned gemtuzumab followed by hematopoietic stem cell transplantation for first-line refractory acute myeloid leukemia in children: A single-center experience. Pediatr Blood Cancer. 2020; 67: e28305. DOI: 10.1002/pbc.28305.
100. Todd M. Coope, Janet Franklin, Robert B. Gerbing et al. MD15AAML03P1, a Pilot Study of the Safety ofGemtuzumab Ozogamicin in CombinationWith Chemotherapy for Newly DiagnosedChildhood Acute Myeloid Leukemia. Cancer, 2012, v. 118, issure 3, pp 579 - 769.
101. U. Creutzig, M. Zimmermann, J-P Bourquin et al. Favorable outcome in infants with AML after intensive first - and second-line treatment: an AML-BFM study group report. Leukemia (2012) 26, 654 - 661. doi: 10.1038/leu.2011.267.
102. Creutzig U, Zimmermann M, Lehrnbecher T, Graf N, Hermann J, Niemeyer CM, et al. Less toxicity by optimizing chemotherapy, but not by addition of granulocyte colony-stimulating factor in children and adolescents with acute myeloid leukemia: results of AML-BFM 98. J Clin Oncol. 2006; 24: 4499 - 506.
103. Tavil B., Aytac S., MD, Balc YI et al. Fludarabine, cytarabine, granulocyte colony-stimulating factor, and idarubicin (flag-ida) for the treatment of children with poor-prognosis acute leukemia: the hacettepe experience. Pediatr Hematol Oncol. 2010; 27(7): 517 - 528.
104. Jeffrey E. Rubnitz, Hiroto Inaba, Gary Dahl et al. Minimal Residual Disease-Directed Therapy for Childhood Acute Myeloid Leukemia: Results of the AML02 Multicenter Trial. Lancet Oncol. 2010 June; 11(6): 543 - 552. doi: 10.1016/S1470-2045(10) 70090-5.
105. Kuderer NM, Dale DC, Crawford J, Cosler LE, Lyman GH. Mortality, morbidity and cost associated with febrile neutropenia in adult cancer patients. Cancer, 2006; 106(10): 2258 - 2266.
106. Mikulska M, Viscoli C, Orasch C, Livermore DM, Averbuch D, Cordonnier C et al. Aetiology and resistance in bacteriaemias among adult and paediatric haematology and cancer patients. Jornal of infection (2014), 68: 321 - 331.
107. Lyman GH, Rolston KVI. How we treat febrile neutropenia in patients receiving cancer chemotherapy. Journal of oncology practice, 2010; 6(3): 149 - 152.
108. Averbuch D, Orasch C, Cordonnier C, Livermore DM, Mikulska M, Viscoli C et al. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: summary of the 2011 4th European Conference of Infections in Luekemia. Haematologica 2013; 98 (12): 1826 - 1835.
109. De la Court J.R. et al The Dutch working party on antibiotic policy (SWAB) recommendation for the diagnosis and management of febrile neutropenia in patients with cancer.//Infect Dis Ther 2022; 11(6): 2063 - 2098.
110. Hakim H, Flynn PM, Knapp KM, Srivastava DK, Gaur AH. Etiology and clinical course of febrile neutropenia in children with cancer. J Pediatr Hematol Oncol, 2009; 31(9): 623 - 629.
111. Hartman S et al A new Framework to implement model-informed dosing in clinical guidelines: piperacillin and amikacin as proof of concept.//Front Pharmacol 2020; 11: 592204.
112. Miranda M., Nadel S. Pediatric Sepsis: a Summary of Current Definitions and Management Recommendations//Curr Pediatr Rep. Springer Nature, 2023. Vol. 11, N 2. P. 29 - 39.
113. Lehrnbecher T, Phillips R, Alexander S, Alvaro F, Carlesse F, Fisher B et al. Guidlenes for the management of fever and neutropenia in children with cancer and/or undergoing hematopoietic stem-cell transplantation. J Clin Oncol, 2012; 30(35): 4427 - 4438.
114. Simon A. et al. Surveillance of bloodstream infections in pediatric cancer centers - what have we learned and how do we move on?//GMS Hyg Infect Control. German Medical Science, 2016. Vol. 11. P. Doc11.
115. Bard J.D., TeKippe E.M.E. Diagnosis of Bloodstream Infections in Children//J Clin Microbiol. J Clin Microbiol, 2016. Vol. 54, N 6. P. 1418 - 1424.
116. Petty L.A. et al. Repeated Blood Cultures in Pediatric Febrile Neutropenia: Would Following the Guidelines Alter the Outcome?//Pediatr Blood Cancer. Pediatr Blood Cancer, 2016. Vol. 63, N 7. P. 1244 - 1249.
117. Scheler M. et al. Management of children with fever and neutropenia: results of a survey in 51 pediatric cancer centers in Germany, Austria, and Switzerland//Infection. Springer Science and Business Media Deutschland GmbH, 2020. Vol. 48, N 4. P. 607 - 618.
118. Lee A. et al. Detection of bloodstream infections in adults: how many blood cultures are needed?//J Clin Microbiol. J Clin Microbiol, 2007. Vol. 45, N 11. P. 3546 - 3548.
119. Белобородов В.Б., Голощапов О.В., Гусаров В.Г., Дехнич А.В., Замятин М.Н., Зубарева Н.А., Зырянов С.К., Камышова Д.А., Климко Н.Н., Козлов Р.С., Кулабухов В.В., Петрушин М.А., Полушин Ю.С., Попов Д.А., Руднов В.А., Сидоренко С.В., Соколов Д.В., Шлык И.В., Эйдельштейн М.В., Яковлев С.В. Методические рекомендации Российской некоммерческой общественной организации "Ассоциация анестезиологов-реаниматологов", Межрегиональной общественной организации "Альянс клинических химиотерапевтов и микробиологов", Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), общественной организации "Российский Сепсис Форум" "Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов" (обновление 2022 г.). Вестник анестезиологии и реаниматологии. 2022; 19(2): 84 - 114. https://doi.org/10.21292/2078-5658-2022-19-2-84-114.
120. Cattaneo C. et al. Bloodstream infections in haematological cancer patients colonized by multidrug-resistant bacteria//Annals of Hematology, 2018 Vol. 97, p. 1717 - 1726.
121. Jaiswal S.R. et al. Gut Colonization with Carbapenem-resistant Enterobacteriaceae Adversely Impacts the Outcome in Patients with Hematological Malignancies: Results of A Prospective Surveillance Study//Mediterr J Hematol Infect Dis. Catholic University in Rome, 2018. Vol. 10, N 1. P. 2018025.
122. Girmenia C. et al. Incidence, Risk Factors and Outcome of Pre-engraftment Gram-Negative Bacteremia After Allogeneic and Autologous Hematopoietic Stem Cell Transplantation: An Italian Prospective Multicenter Survey//Clin Infect Dis. Clin Infect Dis, 2017. Vol. 65, N 11. P. 1884 - 1896.
123. Tang Girdwood S. et al - lactam precision dosing in critically ill children: current state and knowledge gaps//Front Pharmacol 2022; 13: 1044683.
124. Morrissey C., Gilroy N., Macesic N., Walker P., Nanda-Rajah M. et al. Consensus guidelines for the use of empiric and diagnostic-driven antifungal treatment strategies in haematological malignancy, 2014. Intern Med J, 2014; 44: 1298 - 1314.
125. Groll AH, Werner C, Tebbe J, Solopova G, Becker K et al. Pulmonale Infectionen in der p diatrischen H matologie und Oncologie. Monatsschr Kinderheilkd, 2011; 159: 233 - 241.
126. Ruhnke M and Schwartz S. Recent developments in the management of invasive fungal infections in patients with oncohematological diseases. Ther Adv Hematol, 2016; 7(6): 345 - 359.
127. Tissot F., Agrawai S., Pagano L., Petrikkos G., Groll A.H. et al. ECIL-6 Guidelines for the Treatment of Invasive Candidiasis, Aspergillosis and Mucormycosis in Liekemia and Hematopoietic Stem Cell Transplant Patients. Hematologica, 2017; 102: 433 - 444.
128. Heussel C., Kauczor H., Heussel G., Fischer B., Begrich M. et al. Pneumonia in febrile neutropenic patients and in bone marrow and blood stem-cell transplant recipients: use of high-resolution computed tomography. J Clin Oncol, 1999; 17: 796 - 805.
129. Новичкова Г.А., Горонкова О.В., Балашов Д.Н., Байдильдина Д.Д., Жарикова Л.И. и др. Диагностика, клиника и лечение инвазивного аспергиллеза у детей с приобретенной апластической анемией: анализ 20 собственных случаев. Гематология и трансфузиология, январь 2005.
130. Soudani N. et al Prevalence and characteristics of acute respiratory virus infections in pediatric cancer patients//J Med Virol 2019; 91(7): 1191 - 1201.
131. Солопова Г.Г., Цыганова Е.В., Кондрашова А.В., Гордеева Г.Н., Розанцева Е.В., Бегунова С.В., Воронин К.А., Копосова А.О., Новичкова Г.А. "Особенности течения новой коронавирусной инфекции COVID-19 у детей с онкологическими, онкогематологическими и тяжелыми иммунологическими заболеваниями. Опыт НМИЦ ДГОИ им. Дмитрия Рогачева". Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2021 т. 20 N 4: 89 - 99.
132. Righini-Grunder F et al/Frequency of oral mucositis and local virus reactivation in herpes simplex virus seropositive children with myelosupressive therapy//Klin Padiatr. 2015; 227(6 - 7): 335-8.
133. Spruit J L, Knight T, Sweeney C, Salimnia H, Sava an S. Clostridium difficile infection in a children's hospital with specific patterns among pediatric oncology and hematopoietic stem cell transplantation populations Pediatr Hematol Oncol. 2020 Apr; 37(3): 211 - 222. doi: 10.1080/08880018.2019.1711473.
134. Tai E, Richardson LC, Townsend J, Howard E, Mcdonald LC Clostridium difficile infection among children with cancer Pediatr Infect Dis J. 2011 Jul; 30(7): 610-2.
135. Castagnola E., Ruberto E., Guarino A. Gastrointestinal and liver infections in children undergoing antineoplastic chemotherapy in the years 2000//World J Gastroenterol. Baishideng Publishing Group Inc, 2016. Vol. 22, N 25. P. 5853.
136. Maertens J.A. et al. Optimization of the cutoff value for the Aspergillus double-sandwich enzyme immunoassay//Clin Infect Dis. Clin Infect Dis, 2007. Vol. 44, N 10. P. 1329 - 1336.
137. Lehrnbecher T, Robinson PD, Fisher BT, Castagnola E, Groll AH, Steinbach WJ, Zaoutis TE, Negeri ZF, Beyene J, Phillips B, Sung L. Galactomannan, -D-Glucan, and Polymerase Chain Reaction-Based Assays for the Diagnosis of Invasive Fungal Disease in Pediatric Cancer and Hematopoietic Stem Cell Transplantation: A Systematic Review and Meta-Analysis. Clin Infect Dis. 2016 Nov 15; 63(10): 1340 - 1348. doi: 10.1093/cid/ciw592.
138. Warris A, Lehrnbecher T Progress in the Diagnosis of Invasive Fungal Disease in Children Curr Fungal Infect Rep. 2017; 11(2): 35 - 44. doi: 10.1007/s12281-017-0274-9.
139. Gupta A, Capoor MR, Shende T, Sharma B, Mohindra R, Suri JC, Gupta DK. Comparative evaluation of galactomannan test with bronchoalveolar lavage and serum for the diagnosis of invasive aspergillosis in patients with hematological malignancies. J Lab Physicians. 2017 Oct-Dec; 9(4): 234 - 238. doi: 10.4103/JLP.JLP_127_16.
140. Mikulska M, Calandra T, Sanguinetti M, Poulain D, Viscoli C. The use of mannan antigen and anti-mannan antibodies in the diagnosis of invasive candidiasis: recommendations from the Third European Conference on Infections in Leukemia. Crit Care. 2010; 14(6): R222. doi: 10.1186/cc9365.
141. Fisher BT et al Multicenter prospective study of biomarkers for diagnosis of invasive candidiasis in children and adolescents.//Clin Infect Dis 2022; 75(2): 248 - 259.
142. Chang CC, Harrison TS, Bicanic TA, Chayakulkeeree M, Sorrell TC, Warris A, et al. Global guideline for the diagnosis and management of cryptococcosis: an initiative of the ECMM and ISHAM in cooperation with the ASM.. Lancet Infect Dis. 2024 Feb 9: S1473 - 3099(23) 00731-4. doi: 10.1016/S1473-3099(23) 00731-4.
143. Freifeld A.G. et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the infectious diseases society of america//Clin Infect Dis. Clin Infect Dis, 2011. Vol. 52, N 4.
144. Lehrnbecher T, Robinson P, Fisher B, Alexander S, Ammann RA, et al. Guideline for the Management of Fever and Neutropenia in Children With Cancer and Hematopoietic Stem-Cell Transplantation Recipients: 2017 Update. J Clin Oncol. 2017 Jun 20; 35(18): 2082 - 2094. doi: 10.1200/JCO.2016.71.7017.
145. Lehrnbecher T. et al. Guideline for the Management of Fever and Neutropenia in Pediatric Patients With Cancer and Hematopoietic Cell Transplantation Recipients: 2023 Update//J Clin Oncol. J Clin Oncol, 2023. Vol. 41, N 9. P. 1774 - 1785.
146. Lehrnbecher T. et al. 8th European Conference on Infections in Leukaemia: 2020 guidelines for the use of antibiotics in paediatric patients with cancer or post-haematopoietic cell transplantation//Lancet Oncol. Lancet Oncol, 2021. Vol. 22, N 6. P. e270 - e280.
147. Солопова Г.Г., Новичкова Г.А. Опыт внедрения алгоритма эмпирической антибактериальной терапии при развитии фебрильной нейтропении в Центре детской гематологии/онкологии//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2017. Vol. 16, N 3. P. 35 - 47.
148. Lehrnbecher T. Treatment of fever in neutropenia in pediatric oncology patients Current Opinion in Pediatrics 31(1): p 35 - 40, February 2019. | DOI: 10.1097/MOP.0000000000000708.
149. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H et al. Surviving sepsis campain: international guidlines for management of severe sepsis and septic shock, 2012. Intensive Care Med, 2013; 39(2): 165 - 228.
150. Ferrer R. et al. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: results from a guideline-based performance improvement program//Crit Care Med. Crit Care Med, 2014. Vol. 42, N 8. P. 1749 - 1755.
151. Van Vliet M. et al. How prompt is prompt in daily practice? Earlier initiation of empirical antibacterial therapy for the febrile neutropenic patient//Eur J Cancer Care (Engl). Eur J Cancer Care (Engl), 2011. Vol. 20, N 5. P. 679 - 685.
152. Morales Castro D. et al. Pharmacokinetic Alterations Associated with Critical Illness//Clin Pharmacokinet. Adis, 2023. Vol. 62, N 2. P. 209 - 220.
153. Groll AH et al Fourth European conference on infections in luekaemia (ECIL-4): guidelines for diagnosis, prevention, and treatment of invasive fungal diseases in paediatric patients with cancer or allogeneic hematopoietic stem-cell transplantation.//Lancet.Oncol. 2014; 15: 327 - 340.
154. Groll AH, Pana D, Lanternier F, Mesini A, Ammann RA8th European Conference on Infections in Leukaemia: 2020 guidelines for the diagnosis, prevention, and treatment of invasive fungal diseases in paediatric patients with cancer or post-haematopoietic cell transplantation. Lancet Oncol. 2021 Jun; 22(6): e254 - e269. doi: 10.1016/S1470-2045(20) 30723-3.
155. Солопова Г.Г., Масчан А.А., Новичкова Г.Г. "Рекомендации 2020 года по диагностике и терапии инвазивного аспергиллеза у детей с онкогематологическими заболеваниями". Вопросы гематологии/онкологии и иммунопатологии. 2020 т. 19 N 1, стр. 158 - 166.
156. Soler-Palacin P. et al Voriconazole drug monitoring in the management of invasive fungal infection in immunocompromised children: a prospective trile. J Antimicrob Chemother 2012; 67(3): 700 - 706.
157. Papachristou S. et al Invasive aspergillosis in pediatric leukemia patients: prevention and treatment.//J Fungi 2019; 5(1): 14.
158. De Pauw B., Walsh T.J., Donnelly J.P., Stevens E.E., Edwards J.E. et al. Revised Definitions of Invasive Fungal Disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis, 2008; 46(12): 1813 - 1821.
159. Patterson TF, Thompson GR, Denning DW, Fishman JA, Hadley S et al. Practice guidelines for the diagnosis and management of aspergillosis: 2016 update by the infectious diseases society of America. Clin Infect Dis, 2016; 63(4): e1 - e60.
160. Hsu AJ. Et al Challenges in the treatment of invasive aspergillosis in immunocompromised children.//Antimicrob Agents Chemother 2022; 66(7): e02156-21.
161. Cornely O., Rikan-Akdagli S., Dannaoui E., Groll A., Lagrou, K. et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of mucormycosis 2013. Clin Microbiol Infect, 2014; 20 (Suppl. 3): 5 - 26.
162. Солопова Г.Г, Рачков В.Е., Ускова Н.Г., Оганесян Р.С., Коновалов Д.М. и Новичкова Г.А. Мукормикоз гастроинтестинальной локализации у пациента с острым миелобластным лейкозом. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2014; 13(4): 69 - 74.
163. Pana Z., Seidel D., Skiada A., Groll A., Petrikkos G. et al. Invasive mucormycosis in children: an epidemiologic study in European and non-European countries based on two registries. BMC Infect Dis, 2016; 16(1): 667.
164. Liu L-P et al High risk of bloodstream infection of carbapenem-resisstant Enterobacteriaceae carriers in neutropenic children with hematological diseases.//Antimicrob Resist Infect Control. 2023; 12(1): 66.
165. Castagnola E. Et al/Antibiotic Resistant Bloodstream Infections in Pediatric Patients Receveiving Chemotherapy or Hematopoietic Stem Cell Transplant: Factors Associated with Development of Resistance, Intensive Care Admission and Mortality//Antibiotics 2021; 10(3): 266.
166. Kontou A. et al. Use of newer and repurposed antibiotics against gram-negative bacteria in neonates.//Antibiotics 2023; 12(6): 1072.
167. Chiotos K. et al Treatment of carbapenem-resistant Enterobacteriaceae incections in children.
168. Hassan H et al Dosage regimen for meropenem in children with Pseudomonas infections do not meet serum concentration targets.//Clin Transl Sci 2020; 13(2): 301 - 308.
169. Patel K, Goldman J L. Safety Concerns Surrounding Quinolone Use in children.//J Clin Pharmacol 2016; 56(9): 1060 - 1075.
170. Aslan K. et al Clinical and laboratory responses to tigecycline in children.//J Clin Pharm Ther 2022; 47(10): 1585 - 1590.
171. Rodriguez BA et al. Ceftazidime/avibactam and ceftalosane/tazobactam: novel therapy for multidrug resistant gram negative infections in children.
172. Papachatzi E et al Daptomycin use for persistent coagulase-negative staphylococcal bacteremia in a neonatal intensive care unit.//Antibiotics 2024; 13(3): 254.
173. Decembrino N et al A case series and literature review of isavuconazole use in pediatric patients with hemato-oncologic diseases and hematopoietic stem cell transplantation.//Antimicrob Agents Chemother 2020; 64(3): e01783-19.
174. Fernandez Ladesma B et al Isavuconazole use and TDM in real-word pediatric practice.//Antimicrob Agents Chemother 2023; 67(12): e00829-23.
175. SO Lie, J Abrahamsson, N Clausen et al. Long-term results in children with AML: NOPHO-AML Study Group - report of three consecutive trials. Leukemia. 2005. Vol. 19: 2090 - 2100.
176. Wang Q. et al. Venetoclax for arsenic-resistant acute promyelocytic leukaemia. Br J Haematol. 2022 Feb 17. pp 1 - 3.
177. Zhang X. et al. Treatment of Central Nervous System Relapse in Acute Promyelocytic Leukemia by Venetoclax: A Case Report. Front. Oncol., 05 July 2021, Volume 11, pp 1 - 5.
178. Gamis A, Alonzo T, Meshinchi S, Sung L, Gerbing R, et al. Gemtuzumab Ozogamicin in Children and Adolescents With De NovoAcute Myeloid Leukemia Improves Event-Free Survival by Reducing Relapse Risk: Results From the Randomized Phase III Children's Oncology Group Trial AAML0531. J Clin Oncol. 2014. 32 (27): 3021 - 3032.
179. Haynes A. et al Time for a Change considering vancomycin alternatives for pediatric methicillin-resistant Staphylococcus aureus bacteremia.//JPIDS 2023: 12(5): 308 - 318.
180. McCall D. et al. Gilteritinib combination therapies in pediatric patients with FLT3-mutated acute myeloid leukemia//Blood Advances. - 2021. - Т. 5. - N. 23. - С. 5215 - 5219.
181. Selected schedules in the therapy of childhood cancers, 1st edition/G. Henze, H. Weinberger; Baxter oncology Gmbh - Berlin, 2012. - 125 p. - ISBN 976-3-927105-97-3.
182. Диагностика и лечение острого миелоидного лейкоза у детей/И.И. Калинина, А.А. Масчан, Ю.В. Ольшанская [и др.]; Организация-разработчик: ФГБУ НМИЦ Детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева Министерства здравоохранения Российской Федерации. - Москва: Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Д. Рогачева, 2021. - 104 с. - ISBN 978-5-6047047-2-1. - EDN QTNIHQ.
183. Aplenc R, Alonzo TA, Gerbing RB, Lange BJ, Hurwitz CA, Wells RJ, Bernstein I, Buckley P, Krimmel K, Smith FO, Sievers EL, Arceci RJ; Children's Oncology Group. Safety and efficacy of gemtuzumab ozogamicin in combination with chemotherapy for pediatric acute myeloid leukemia: a report from the Children's Oncology Group. J Clin Oncol. 2008 May 10; 26(14): 2390 - 3295. doi: 10.1200/JCO.2007.13.0096. PMID: 18467731; PMCID: PMC4558626.
184. LeBlanc FR, Breese EH, Burns KC, Chang EK, Jones LM, Lee L, Mizukawa B, Norris RE, O'Brien MM, Phillips CL, Perentesis JP, Rubinstein J, Pommert L. Clinical outcomes of hypomethylating agents and venetoclax in newly diagnosed unfit and relapsed/refractory paediatric, adolescent and young adult acute myeloid leukaemia patients. Br J Haematol. 2024 Sep; 205(3): 1055 - 1066. doi: 10.1111/bjh.19679. Epub 2024 Jul 31. PMID: 39082439.
185. Badawi M, Gopalakrishnan S, Engelhardt B, Palenski T, Karol SE, Rubnitz JE, Menon R, Salem AH. Dosing of Venetoclax in Pediatric Patients with Relapsed Acute Myeloid Leukemia: Analysis of Developmental Pharmacokinetics and Exposure-Response Relationships. Clin Ther. 2024 O.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Масчан А.А. - д.м.н., профессор, член-корреспондент РАН, директор института гематологии, иммунологии и клеточных технологий ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Масчан М.А. - д.м.н., зам. генерального директора по науке ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член Российского общества детских онкологов и гематологов.
Новичкова Г.А. - д.м.н., профессор, научный руководитель, заведующий кафедрой гематологии и клеточных технологий ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, главный внештатный детский специалист онколог/гематолог Минздрава России.
Попа А.В. - д.м.н., профессор РАН, заведующий отделом эпидемиологии и исследования поздних эффектов у детей, перенесших онкологическое заболевание ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, профессор кафедры пропедевтики детских болезней ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Солопова Г.Г. - к.м.н., заместитель главного врача по инфекционному контролю ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Абашидзе З.А. - врач-гематолог боксированного отделения ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Румянцев А.Г., д.м.н., академик РАН, научный руководитель ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Валиев Т.Т. - д.м.н., заведующий отделением химиотерапии гемобластозов N 1 НИИ ДОиГ им. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Калинина И.И., к.м.н., врач-гематолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория клинических рекомендаций:
1. Врачи-детские онкологи-гематологи
2. Врачи-гематологи;
3. Врачи-детские онкологи;
4. Врачи-педиатры;
5. Врачи-анестезиологи-реаниматологи;
6. Врачи-клинические фармакологи.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях;
Поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- Обзоры опубликованных мета-анализов;
- Систематические обзоры с таблицами доказательств.
- Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А2.1 - А2.3).
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2.2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов, страдающих ОМЛ. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ДИАГНОСТИЧЕСКИЕ ТЕСТЫ И ИССЛЕДОВАНИЯ,
ПРИМЕНЯЕМЫЕ У ПАЦИЕНТОВ ВПЕРВЫЕ ВЫЯВЛЕННЫМ ОМЛ
Показатель
Исследования
Необходимость проведения исследования
Исследования, необходимые для установления диагноза
Клинический анализ крови с формулой
Да
Аспират костного мозга
Да
Трепанобиопсия
По показаниям
Иммунофенотипирование
Да
Цитогенетика
Да
FISH
По показаниям
Скрининг RUNX1-RUNX1T1, CBFB-MYH1, PML/RARA или других генов
Да
Люмбальная пункция
Да
Необходимые исследования до начала лечения
Анамнез жизни и заболевания
Да
Статус пациента (по шкалам ECOG/WHO)
Да
Биохимическое исследование, коагулограмма
Да
Тест на беременность
Да
HLA-типирование
Да
Тестирование крови на маркеры вирусов гепатитов B, C; ВИЧ
Да
Рентгенография органов грудной клетки
Да
КТ органов грудной клетки, головного мозга
Да
ЭКГ; ЭХО-КГ
Да
Биобанкинг
Рекомендательно
Мутации генов NPM1, CEBPA, FLT3
Рекомендательно
Мутации генов WT1, RUNX1, MLL, KIT
В рамках исследований
Исследование прогностических маркеров
RAS, TP53, TET2, IDH1
В рамках исследований
Экспрессия генов ERG, MN1, EVI1, BAALC
В рамках исследований
Определение МОБ
В рамках исследований
Приложение А3.2
ВАРИАНТЫ КУРСОВ ХИМИОТЕРАПИИ ПРИ ОМЛ
В России традиционно применяются протоколы немецкой группы BFM (Berlin-Frankfurt-M nster). Протокол 1998 года исследовался в Германии в течение 5 лет, в настоящее время это исследование завершено, его итоги подведены. У 424 пациентов оценены уровень достижения ремиссии, общая выживаемость (overall survival, OS), бессобытийная выживаемость (event-free-survival, EFS) и безрецидивная выживаемость (relapse-free-survival, RFS). Результаты приведены в таблице 1. Терапевтическая схема приведена в разделе "Описание лечения".
Таблица 1. Результаты терапии по протоколу AML-BFM-98.
Достижение ремиссии, %
Вероятность ОВ в течение 4 лет. %
Вероятность БСВ в течение 4 лет, %
Вероятность БРВ в течение 4 лет, %
Все пациенты
90
67
55
61
Стандартный риск
91
78
65
71
Высокий риск
87
55
40
46
БСВ - бессобытийная выживаемость, ОВ-общая выживаемость, БРВ-безрецидивная выживаемость.
Исследование AML-BFM-98, которое было призвано сравнить эффективность ранней шестинедельной постремиссионной терапии стандартными дозами цитарабина**, преднизолона**, меркаптопурина**, циклофосфамида** и доксорубицина** с двумя "блоками" высокодозного цитарабина**, показало, что при одинаковой эффективности, частота инфекционных осложнений в группе длительной терапии была выше. В связи с этим группа BFM отказалась от 6-недельной консолидации, использовавшейся в течение 20 лет, в пользу короткой высокодозной терапии [39].
В настоящее время в большинстве клиник РФ применяются модифицированные схемы протокола BFM 2004 года [39].
Описание лечения.
Терапия по модифицированной версии протокола AML-BFM-98/2004 показана детям с первичным ОМЛ, которые не могут быть включены в современные клинические исследования. Пациенты со вторичным и бифенотипическим ОМЛ также могут получать это лечение, однако для них может потребоваться индивидуальная коррекция протокола.
Модифицированная версия протокола AML-BFM-2004 (ветвь высокодозной терапии)
Химиотерапия, согласно "блоковой" ветви протокола состоит из 5 циклов химиотерапии и поддерживающей терапией меркаптопурином** - ежедневно и стандартными дозами цитарабина** ежемесячно. (схема 1)
Блоки [68, 181, 182].
Индукция ремиссии AIE:
Начинается независимо от наличия лейкопении и тромбоцитопении!!!
Цитарабин** 100 мг/м2 в сутки дни 1 - 2 постоянной инфузией
Цитарабин** 100 мг/м2 30-минутной инфузией каждые 12 часов дни 3 - 8 постоянной инфузией
#Идарубицин** 12 мг/м2 в сутки 4-х часовой инфузией дни в течение 3-х дней (в зависимости от предписанного протоколом терапии)
#Этопозид** 150 мг/м2 1-часовой инфузией дни 6, 7, 8
Цитарабин** интратекально в возрастной дозировке в день 1 и 8.
HAM20:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Высокие дозы цитарабина** 3000 мг/м2 3-часовой инфузией каждые 12 часов в дни 1 - 3;
#Митоксантрон** 10 мг/м2 60-минутной инфузией в дни 3 и 4;
Цитарабин** интратекально в возрастной дозировке в день 1.
AI:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
#Цитарабин** 500 мг/м2 2-часовой инфузией каждые 12 часов дни в течение 4 дней (всего 8 доз)
#Идарубицин** 7 мг/м2 60-минутной инфузией в течение 2-х дней всего 2 дозы Цитарабин** интратекально в возрастной дозировке в дни 1, 6.
haM:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
#Цитарабин** 1000 мг/м2 3-х часовой инфузией каждые 12 часов дни в течение 3-х дней (всего 6 доз)
#Митоксантрон** 10 мг/м2 30-минутной инфузией в течение 2-х дней (всего 2 дозы) Цитарабин** интратекально в возрастной дозировке в дни 1, 6.
HAE:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 3000 мг/м2 3-х часовой инфузией каждые 12 часов дни 1, 2, 3 (всего 6 доз)
#Этопозид 125 мг/м2 2-часовой инфузией дни 2, 3, 4, 5 (всего 4 дозы)
Цитарабин** интратекально в возрастной дозировке в день 1.
Поддерживающая терапия:
В протоколах группы BFM поддерживающая терапия цитарабином** по 40 мг/м2 подкожно 1 раз в сутки по 4 дня каждого месяца применяется после восстановления гемопоэза после последнего курса интенсивной химиотерапии до истечения 18 месяцев от начала лечения.
Однако другими исследовательскими группами после аналогичной интенсивной химиотерапии низкодозная поддерживающая терапия не применяется [38].
Профилактика осложнений, связанных с легочным и церебральным лейкостазом при инициальном гиперлейкоцитозе. Данное осложнение наиболее характерно для пациентов с вариантами M4 и M5 и инициальным лейкоцитозом более 50 x 109/л и с вариантами M1 и M2 с инициальным лейкоцитозом > 100 x 109/л, хотя может развиться и при существенно более низких показателях лейкоцитоза. Популяцию наивысшего риска развития синдрома лейкостаза составляют дети младшего возраста с моноцитарными субвариантами ОМЛ, сопровождаемыми коагулопатией. В этой группе пациентов назначение полных доз цитозин-арабинозида сопряжено с резким возрастание риска лейкостаза, вследствие этого таким пациентов показано проведение лейкоцитафереза (либо заменного переливания у пациентов до 3-х летнего возраста), и/или медикаментозной циторедукции.
Последняя может включать меркаптопурин 40 мг/м2 в сутки в сочетании с гидроксимочевиной в дозе 1500 мг/м2 в сутки и назначаться до снижения лейкоцитоза ниже 50 x 109/л.
Опыт НМИЦ ДГОИ свидетельствует об эффективности циторедукции сниженными дозами этопозида** и даунорубицина** (или другого антрациклина) без цитозин-арабинозида. Даунорубицин** (22,5 мг/м2/сутки) и этопозид** (50 мг/м2/сутки) вводятся постоянной инфузией до тех пор, пока уровень лейкоцитов не достигнет 50 x 109/л, но не более 3-х суток. Далее проводится индукция цитарабином** с дозами антрациклина и VP-16, из которых вычтена суммарная доза этих препаратов, полученных на фазе циторедукции. Кроме того, на протяжении циторедуктивной фазы применяется дексаметазон** внутривенно струйно в дозе 10 мг/м2 /сутки (разделить на 3 введения). В течение всего курса циторедукции не следует проводить заместительные трансфузии эритроцитов, если уровень гемоглобина не снижается ниже 70 г/л [40].
Варианты курсов индукции и консолидации [68, 69, 70, 71, 72, 73, 181, 182]
Программа индукции/консолидации
Препараты
ADE
Цитарабин** 100 мг/м2, в/в 2 раза в сутки в 1 - 10-й дни, всего 20 доз в 1 цикл, далее в 1 - 8 дни, всего 16 доз
Даунорубицин** 50 мг/м2, дни 1, 3 и 5
Этопозид 100 мг/м2, дни 1 - 5
АМЕ
Цитарабин** 100 мг/м2, в/в 2 раза в сутки в 1 - 10-й дни, всего 20 доз
#Митоксантрон** 12 мг/м2 в/в, дни 1, 3, 5
Этопозид** 100 мг/м2 в/в, дни 1 - 5
AIE
Цитарабин** 100 мг/м2 в/в 2 раза в сутки в 1 - 2 дни, всего 4 дозы, 120 мг/м2 в/в 2 раза в сутки в 3 - 8 дни (всего 12 доз)
#Идарубицин** 12 мг/м2 в/в, дни 3, 5, 7
#Этопозид** 150 мг/м2 в/в, дни 68
НАМ30
Цитарабин** 3000 мг/м2 в/в x 2 раза в сутки 1 - 3 дни
#Митоксантрон** 10 мг/м2 в/в 1 раз в день в 4 - 5 й дни
HiDAC
Цитарабин** 3000 мг/м2 3-часовая в/в инфузия x 2 раза в день, дни 1 - 3
FLAI
#Флударабин** 30 мг/м2 в/в 30-минутная инфузия 1 - 5 дни
Цитарабин** 2000 мг/м2 3-часовая в/в инфузия 1 раз в день через
4 часа после введения #флударабина**, в/ в 1 - 5 дни
#Идарубицин** 12 мг/м2 в/в 10 минутная инфузия после окончания #флударабина** в 1, 3, 5 дни курса
Протокол AML-BFM DS 2006
У детей с ОМЛ, развившимся на фоне синдрома Дауна, токсичность высоких доз антрациклинов в сочетании с высокими дозами цитарабина** гораздо выше, чем у пациентов без синдрома Дауна; поэтому они должны получать лечение по специальному протоколу (AML-BFM DS 2006) [74].
Схема 2. Общий план химиотерапии согласно протоколу AML-BFM DS 2006.
Блоки [68, 69, 181, 182]
AIE:
Цитарабин** 100 мг/м2/сутки постоянной инфузией в течение 1-х и 2-х суток, затем
Цитарабин** 100 мг/м2 30-минутной инфузией каждые 12 часов в дни 3 - 8;
#Идарубицин** 8 мг/м2 60-минутной инфузией каждые 24 часа в дни 3, 5, 7 перед цитарабином**;
#Этопозид** 150 мг/м2 2-часовой инфузией в дни 6 - 8, за 6 часов до цитарабина**;
Цитарабин** интратекально в возрастной дозировке в день 1.
AI:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 500 мг/м2 /сутки непрерывной инфузией в течение 4 дней;
#Идарубицин** 5 мг/м2 60-минутной инфузией в дни 3 и 5;
Цитарабин** интратекально в возрастной дозировке в день 0.
haM:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
#Цитарабин** 1000 мг/м2 3-х часовой инфузией каждые 12 часов в течение 3-х дней (всего 6 доз)
#Митоксантрон** 10 мг/м2 30-минутной инфузией в течение 2-х дней (всего 2 дозы)
Цитарабин** интратекально в возрастной дозировке в день 0.
HA:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Высокие дозы цитарабина** 3 г/м2 3-часовой инфузией каждые 12 часов в дни 1 - 3;
Цитарабин** интратекально в возрастной дозировке в день 0.
Приложение А3.3
ПОКАЗАНИЯ К АЛЛО-ТКМ/АЛЛО-ТГСК В ПЕРВОЙ ПОЛНОЙ РЕМИССИИ ОМЛ
Таблица 3.3.1. Синтетические показания к алло-ТКМ в первой полной ремиссии ОМЛ в зависимости от молекулярно-генетических, клинических характеристик ОМЛ и риска трансплантационной летальности [75]
Группа интегрированного риска
Определение группы риска
Риск развития рецидива в зависимости от выполнения
Бальная оценка прогноза летальности, не связанной с рецидивом, которая позволяет считать алло-ТГСК предпочтительным вариантом консолидации
ХТ или ауто-ТГСК, %
алло-ТГСК, %
шкала ЕВМТ
шкала HCT-CI
риск смерти, не связанный с рецидивом, %
Благоприятный
- t(8;21) и л. ![]() 20 x 109/л
20 x 109/л
- inv16; t(16; 16) возраст до 35 лет
- мутация CEBPA (2-аллельная)
- мутация NPM без FLT3-ITD мутаций
- ПР после 1-го курса индукции
- Отсутствие МОБ
35 - 40
15 - 20
![]() 1
1
< 1
10 - 15
Промежуточный
- t(8; 21) и л. > 20 x 109/л
- Нормальный кариотип (или потеря только X, или только Y хромосомы) с л. ![]() 100 x 109/л и при достижении ПР после 1-го курса
100 x 109/л и при достижении ПР после 1-го курса
50 - 55
20 - 25
![]() 2
2
< 2
< 20 - 25
Плохой
- Недостижение ПР после 1-го курса у пациентов из групп благоприятного и промежуточного риска
- Нормальный кариотип и л. > 100 x 109/л
- Аномальный кариотип, неотмеченный в группе промежуточного и очень плохого прогноза
70 - 80
30 - 40
< 3 - 4
< 3 - 4
< 30
Очень плохой
Моносомный кариотип
> 90
40 - 50
![]() 5
5
![]() 5
5
< 40
Приложение А3.4
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ОМЛ
Таблица 3.4.1. European Leukemia Net (ELN) молекулярно-генетическая классификация ОМЛ (2017 г.) [25].
Категории риска
Молекулярно-генетические характеристики
Благоприятный прогноз
t(8; 21) (q22; q22.1); RUNX1-RUNX1T1
inv(16) (p13.1q22) или t(16; 16) (p13.1; q22); CBFB-MYH11
Мутации NPM1 без FLT3-ITD или с FLT3-ITD и низкой аллельной нагрузкой <*>
Биаллельная мутация CEBPA
Промежуточный прогноз
Мутации NPM1 и FLT3-ITD с высокой аллельной нагрузкой**
Дикий тип гена NPM1 без FLT3-ITD или с FLT3-ITD с низкой аллельной нагрузкой (при отсутствии цитогенетических критериев неблагоприятного прогноза)
t(9; 11) (p21.3; q23.3); MLLT3-KMT2Ad
Цитогенетические аномалии, которые не относятся к категории благоприятного прогноза или неблагоприятного прогноза
Неблагоприятный прогноз
t(6; 9) (p23; q34.1); DEK-NUP214
t(v; 11q23.3); перестройки KMT2A
t(9; 22) (q34.1; q11.2); BCR-ABL1
inv(3) (q21.3q26.2) или t(3; 3) (q21.3; q26.2); GATA2, MECOM(EVI1)
-5 or del(5q); -7; -17/abn(17p)
Комплексный кариотип
Моносомный кариотип
Дикий тип гена NPM1 и FLT3-ITD с высокой аллельной нагрузкой <**>
Мутации RUNX1 <***>
Мутации ASXL1 <***>
Мутации TP53
--------------------------------
<*> Низкая аллельная нагрузка (0,5).
<**> Высокая аллельная нагрузка (> 0,5).
<***> Если указанные мутации обнаруживают у пациентов с благоприятными цитогенетическими аномалиями, то их обнаружение не имеет значимости.
Приложение А3.5
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
РИСКА ПРИ ОМЛ
Таблица 3.5.1. Молекулярно-генетические и клинические признаки ОМЛ, разделяющие пациентов на благоприятную и неблагоприятную прогностические группы [25]
Цитогенетические маркеры
Молекулярные маркеры
Клинические факторы
Благоприятные прогностические факторы:
t(15; 17), (t(8; 21) (q22; q22); inv(16) (p13.1q22) или t(16; 16) (p13.1; q22)
Мутированный CEBPA (биаллельная мутация),
мутированный NPM1 без FLT3-ITD при нормальном кариотипе
Негативные маркеры МОБ
Неблагоприятные прогностические факторы:
inv(3) (q21q26.2) или t(3; 3) (q21; q26.2);
t(9; 22),
t(6; 9) (p23; q34);
t(v;11) (v; q23);
-5 или del(5q);
-7;
аберрации (17p);
комплексный кариотип, моносомный кариотип
Увеличена экспрессия Evi1;
MLL-реаранжировки;
FLT3-ITD-мутация;
DNMT3A-мутация;
С-KIT-мутация (для t(8; 21); inv(16))
BAALC-экспрессия
ERG-экспрессия
MN1-экспрессия
WT1-полиморфизм
BCR-ABL-позитивность
Вторичный ОМЛ
Гиперлейкоцитоз (> 100 x 109/л для любого
M0-вариант по FAB)
Экспрессия CD34 на бластных клетках
Экстрамедуллярные поражения (особенно, кожа)
Отсутствие ремиссии после первого курса
Персистенция маркеров МОБ
Приложение А3.6
ДИАГНОСТИКА ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ
Таблица А3.6
Название исследования
Код НМУ
Исследования жидкости БАЛ, трахео-бронхиального аспирата
Микроскопическое исследование лаважной жидкости
A12.09.011
Микроскопическое исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелиальные)
A26.09.027
Микроскопическое исследование бронхоальвеолярной лаважной жидкости на микобактерий туберкулеза (Mycobacterium tuberculosis)
A12.09.091
Микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii)
A26.09.035
Микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы
A26.09.011
Микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные)
A26.09.030
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на респираторно-синтициальный вирус (Respiratory Syncytial virus)
A26.09.017
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на аденовирус (Adenovirus)
A26.09.018
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на вирус гриппа (Influenza virus)
A26.09.019
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на метапневмовирус (Human Metapneumovirus)
A26.09.055
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на вирусы парагриппа (Human Parainfluenza virus)
A26.09.056
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на риновирусы (Human Rhinovirus)
A26.09.057
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на бокавирус (Human Bocavirus)
A26.09.058
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на коронавирус ТОРС (SARS-cov)
A26.09.060
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на Mycoplasma pneumoniae
A26.09.062
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на Chlamydophila pneumoniae
A26.09.063
Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважной жидкости на цитомегаловирус (Cytomegalovirus)
A26.09.071
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости, мокроты, эндотрахеального аспирата на Pneumocystis jirovecii
A26.09.072
Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважнои жидкости или промывных вод бронхов на Mycobacterium tuberculosis complex (микобактерии туберкулеза)
A26.09.080
Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважной жидкости или промывных вод бронхов для дифференциации видов Mycobacterium tuberculosis complex (M. tuberculosis, M. bovis, M. bovis BCG)
A26.09.081
Микробиологическое (культуральное) исследование биоптата легкого на легионеллу пневмонии (Legionella pneumophilia)
A26.09.008
Определение антигена возбудителя легионеллеза (Legionella/pneumophila) в моче
A26.08.010
Определение метаболитов грибов (галактоманнана) в жидкости БАЛ, крови
A26.30.007
Исследования мазков со слизистой оболочки ротоглотки
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на вирус гриппа (Influenza virus)
A26.08.038
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на респираторно-синцитиальный вирус (Human Respiratory Syncytial virus)
A26.08.039
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на аденовирус (Human Adenovirus)
A26.08.040
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на метапневмовирус (Human Metapneumo virus)
A26.08.041
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки вирусов парагриппа (Human Parainfluenza virus)
A26.08.042
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на риновирусы (Human Rhino virus)
A26.08.043
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на бокавирус (Human Bocavirus)
A26.08.044
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на коронавирус ТОРС (SARS-cov)
A26.08.046
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
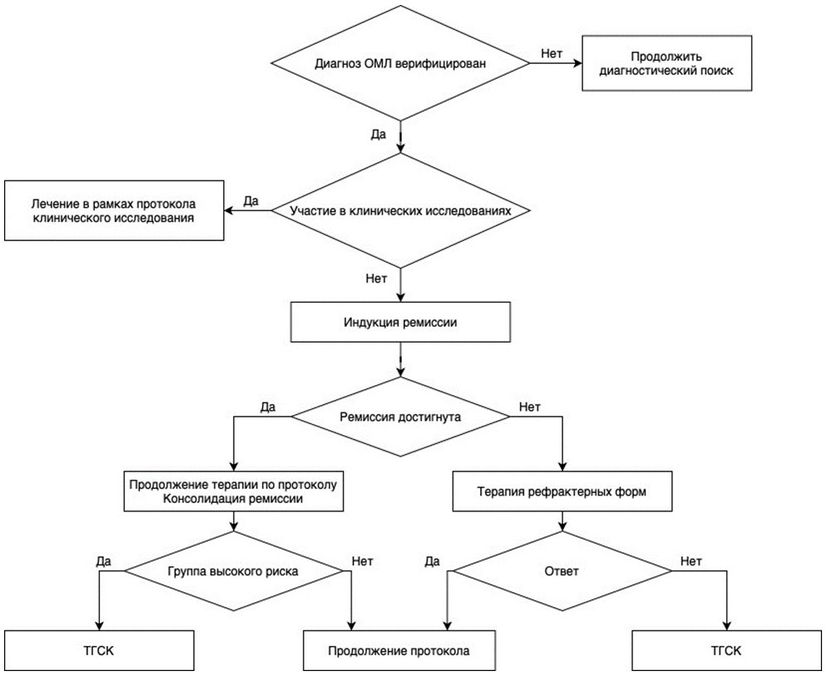
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Острый миелоидный лейкоз - редкое злокачественное заболевание кроветворной ткани, характеризующееся неконтролируемой пролиферацией, нарушением дифференцировки и накоплением в костном мозге и периферической крови незрелых гемопоэтических клеток
При развитии ОМЛ поражаются все органы и системы, т.к. заболевание носит генерализованный (распространенный) характер. В клинической картине заболевания преобладают синдромы, связанные с прогрессирующим нарастанием количества злокачественных клеток в костном мозге, а также в печени, селезенке, так же возможно поражение ЦНС и других органов и систем. Наиболее частое проявление заболевания:
1) Лихорадка.
Повышение температуры тела выше 38,0 C может быть первым и единственным проявлением заболевания, в связи с наличием бластных (опухолевых) клеток, выделением их продуктов жизнедеятельности, а также в связи с развитием инфекционного процесса
2) Инфекционный процесс (ангина, стоматит, пневмония и др.) развивается в связи с вытеснением бластными клетками клеток нормального кроветворения - лейкоцитов/нейтрофилов, защищающих в здоровом состоянии организм ребенка от бактериальной и грибковой инфекции
3) Геморрагический синдром (кровотечения, появления синяков) в следствии вытеснения бластными клетками из нормального кроветворения тромбоцитов (клеток ответственных за остановку кровотечения)
4) Анемический синдром (бледность, вялость, быстрая утомляемость, слабость), так же развивается из - за отсутствия эритроцитов (снижение гемоглобина) в костном мозге пациента с ОМЛ.
5) Боль в костях и других пораженных органах
6) Увеличение размеров печени и селезенки, появление желтухи
7) Поражение ЦНС может проявляться головной болью, рвотой, судорогами
Для установления диагноза необходимо выполнение большого количества исследований крови, пункции костного мозга и люмбальной пункции, рентгеновских и томографических исследований. Для проведения химиотерапии необходима постановка центрального венозного катетера (ЦВК), во избежание многочисленных уколов в периферические вены.
Все инвазивные процедуры (пункции, постановка ЦВК) выполняются под общей анестезией.
Лечение острого миелоидного лейкоза состоит в основном из двух этапов: интенсивная фаза терапии и проведение трансплантации гемопоэтических стволовых клеток. Во время интенсивной фазы химиотерапия проводится с небольшими интервалами, часто необходимо пребывание пациента в стационаре. Химиотерапия первой линии состоит из трех основных препаратов: цитарабин** этопозид**, даунорубицин** (#идарубицин** или митроксантрон). Затем проводится несколько курсов высокодозной химиотерапии.
Побочные эффекты химиотерапии:
1. Выпадение волос
2. Тошнота и рвота
3. Снижение/изменение аппетита
4. Лихорадка
5. Развитие инфекционных очагов
6. Целью терапии является излечение болезни, предотвращение рецидивов и осложнений связанных как с проявлениями болезни так и с развитием индуцированной (вызванной химиотерапией) аплазии кроветворения. Суммарная длительность терапии составляет около 6 месяцев, без проведения ТГСК. Сокращение длительности терапии может привести к увеличению риска рецидива болезни. При терапии в соответствии с современными программами лечения вероятность выздоровления составляет около 70%.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не предусмотрено.
