"Клинические рекомендации "Хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ХРОНИЧЕСКИЙ ЛИМФОЦИТАРНЫЙ ЛЕЙКОЗ/ЛИМФОМА ИЗ МАЛЫХ ЛИМФОЦИТОВ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C91.1
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 134_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Ассоциация онкологов России, Российское общество онкогематологов, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АВ-блокада - атриовентрикулярная блокада
АГ - артериальная гипертензия
АД - артериальное давление
АЛТ - аланинаминотрансфераза
АРА - антагонисты рецепторов ангиотензина II
АСТ - аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БАЛ - бронхоальвеолярный лаваж
БЛРС - 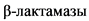 расширенного спектра
расширенного спектра
БПА - болезнь периферических артерий
ВБП - выживаемость без прогрессирования
ВИЧ - вирус иммунодефицита человека
ГСК - гемопоэтические стволовые клетки
ДИ - доверительный интервал
ДНК - дезоксирибонуклеиновая кислота
иАПФ - ингибиторы АПФ (ангиотензин превращающего фермента)
ИБС - ишемическая болезнь сердца
КАГ - Коронарография (коронароангиография)
КОЕ - колониеобразующая единица
КТ - компьютерная томография
КФК общ. - креатинфосфокиназа общая
КФК-МБ - фракция креатинкиназы, являющаяся специфичным и чувствительным индикатором повреждения миокарда.
ЛМЛ - лимфома из малых лимфоцитов
ЛПНП - липопротеиды низкой плотности
МВКЛ - моноклональный В-клеточный лимфоцитоз
МЕ - международная единица
МНО - международное нормализованное отношение
МОБ - минимальная остаточная болезнь
МПИ - международный прогностический индекс
МПК - минимальная подавляющая концентрация
МРТ - магнитно-резонансная томография
ОВ - общая выживаемость
ОМЛ - острый миелоидный лейкоз
ОКС - острый коронарный синдром
ОПН - острая почечная недостаточность
ОР - отношение рисков
ПХТ - полихимиотерапия
ПЦР - полимеразная цепная реакция
рРНК - рибосомная рибонуклеиновая кислота
РТПХ - реакция "трансплантат против хозяина"
СМЖ - спинномозговая жидкость
ТГСК - трансплантация гемопоэтических стволовых клеток
ФВЛЖ - фракция выброса левого желудочка
ФП - фибрилляция предсердий
УЗИ - ультразвуковое исследование
ХБП - хроническая болезнь почек
ХЛЛ - хронический лимфоцитарный лейкоз
ХПН - хроническая почечная недостаточность
ХСН - хроническая сердечная недостаточность
ЦВК - центральный венозный катетер
ЦНС - центральная нервная система
ЧПЭХО-КГ - эхокардиография чреспищеводная
ЧСС - частота сердечных сокращений
ЭКГ - электрокардиография
ЭхоКГ - эхокардиография
A. baumannii - Acinetobacter baumannii
C. albicans - Candida albicans
C. albidus - Cryptococcus albidus
C. difficile - Clostridioides difficile
C. gattii - Cryptococcus gattii
C. glabrata - Candida glabrata
C. krusei - Candida krusei
C. laurentii - Cryptococcus laurentii
C. neumonia - Chlamydophila neumonia
Chl-G - режим иммунохимиотерапии, включающий обинутузумаб** и хлорамбуцил** (схемы режимов лечения см. в приложении А3.3)
Chl-R - режим иммунохимиотерапии, включающий ритуксимаб** и хлорамбуцил** (схемы режимов лечения см. в приложении А3.3)
CIM - carbapenem inactivation method
CMV - цитомегаловирус (cytomegalovirus)
CTC - общие критерии токсичности
E. faecalis - Enterococcus faecalis
E. faecium - Enterococcus faecium
E. coli - Escherichia coli
EBV - вирус Эпштейн-Барр (Epstein-Barr virus)
FCR - режим иммунохимиотерапии, включающий ритуксимаб**, флударабин** и циклофосфамид** (схемы режимов лечения см. в приложении А3.3)
FCR-Lite - режим иммунохимиотерапии, включающий ритуксимаб**, флударабин** и циклофосфамид** с редукцией доз противоопухолевых препаратов (схемы режимов лечения см. в приложении А3.3)
FISH - флуоресцентная гибридизация in situ
HHV-6 - Human herpes virus 6
HSV - Herpes simplex virus
HZV - Herpes zoster virus
IGHV - вариабельные участки тяжелых цепей иммуноглобулинов
IWCLL - Международная рабочая группа по изучению хронического лимфоцитарного лейкоза
K. pneumonia - Klebsiella pneumonia
KPC - Klebsiellap neumonia carbapenemase
L. pneumophila - Legionella pneumophila
L. monocytogenes - Listeria monocytogenes
mCIM - modified carbapenem inactivation method (модифицированный метод инактивации карбапенемов)
M. furfur - Malassezia furfur
M. pachydermatis - Malassezia pachydermatis
M. pneumonia - Mycoplasma pneumonia
NDM - New Delhi 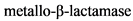 (Металло-бета-лактамаза из Нью-Дели)
(Металло-бета-лактамаза из Нью-Дели)
OXA-48 - oxacillinase-48
QTc - корригированный интервал QT на электрокардиограмме
R. glutinis - Rhodotorula glutinis
P. jirovecii - Pneumocystis jirovecii
R. minuta - Rhodotorula minuta
R. mucilaginosa - Rhodotorula mucilaginosa
R. rubra - Rhodotorula rubra
RB - режим иммунохимиотерапии, включающий ритуксимаб** и бендамустин** (схемы режимов лечения см. в приложении А3.3)
S. aureus - Staphylococcus aureus
S. boulardii - Saccharomyces boulardii
S. capitata - Saprochaete capitata
S. maltophilia - Stenotrophomonas maltophilia
S. prolificans - Scedosporium prolificans
Термины и определения
ECOG - оценка общего состояния пациента по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) (см. приложение Г1).
В-симптомы - неспецифические симптомы опухолевой интоксикации, включающие лихорадку (температуру тела выше 38 °C) более 2 нед. подряд без признаков воспаления, ночные профузные поты, похудание на 10% массы тела за последние 6 мес.
Лимфома из малых лимфоцитов - это В-клеточная опухоль из малых В-лимфоцитов с иммунофенотипом хронического лимфоцитарного лейкоза, характеризующаяся наличием лимфаденопатии и/или спленомегалии с содержанием В-лимфоцитов в периферической крови ![]() 5 x 109/л без морфологических признаков поражения костного мозга.
5 x 109/л без морфологических признаков поражения костного мозга.
Синдром Рихтера - появление крупноклеточной лимфомы на фоне хронического лимфоцитарного лейкоза.
Ходжкинская трансформация - появление лимфомы Ходжкина на фоне хронического лимфоцитарного лейкоза.
Хронический лимфоцитарный лейкоз - это опухоль из малых В-лимфоцитов, характеризующаяся пролиферацией и накоплением аберрантных лимфоидных клеток в костном мозге, крови, лимфоидных тканях; критерием постановки диагноза является обнаружение абсолютного В-клеточного лимфоцитоза в крови (> 5 x 109/л моноклональных В-лимфоцитов). Хронический лимфоцитарный лейкоз и лимфома из малых лимфоцитов представляют собой различные проявления одного и того же заболевания, что унифицирует подходы к проводимой терапии.
Трансформация - развитие диффузной В-клеточной крупноклеточной лимфомы или лимфомы Ходжкина на фоне хронического лимфоцитарного лейкоза или лимфомы из малых лимфоцитов.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Хронический лимфоцитарный лейкоз (ХЛЛ) и лимфома из малых лимфоцитов (ЛМЛ) - это В-клеточные опухоли из малых В-лимфоцитов. ХЛЛ и ЛМЛ биологически представляют собой одну нозологическую форму. Отличие между ними состоит в том, что при ХЛЛ в крови наблюдается значительный лимфоцитоз (![]() 5000 моноклональных В-лимфоцитов), тогда как при ЛМЛ выявляется поражение лимфатических узлов, селезенки, но содержание клональных В-клеток в крови
5000 моноклональных В-лимфоцитов), тогда как при ЛМЛ выявляется поражение лимфатических узлов, селезенки, но содержание клональных В-клеток в крови ![]() 5 x 109/л.
5 x 109/л.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Молекулярный патогенез ХЛЛ - комплексный многоступенчатый процесс, который приводит к репликации клона В-лимфоцитов [1 - 3]. Почти во всех случаях хроническому лимфолейкозу предшествует моноклональный В-клеточный лимфоцитоз (МВКЛ), который обнаруживается высокоточными методами иммунофенотипирования у 5 - 15% лиц старше 40 лет, риск развития МВКЛ увеличивается с возрастом [4]. МВКЛ инициируется комплексом факторов, который включает мутации ряда генов, антигенную стимуляцию, сигналы от микроокружения, эпигенетические модификации и, наконец, цитогенетические нарушения. В результате появляется клон лимфоцитов с фенотипом клеток ХЛЛ. Учитывая многократно преобладающую частоту МВКЛ, к развитию ХЛЛ приводят дополнительные генетические нарушения в 1 из 100 случаев МВКЛ. Клетки ХЛЛ существенно влияют на микроокружение, инициируя появление особого микроокружения и даже специализированных клеток (nurse-like cells), которые определяют их клональную экспансию и дают возможность переживать генотоксические стрессы. Время и химиотерапия приводят к клональной эволюции с накоплением генетических нарушений, которые делают клетки ХЛЛ все более автономными, быстро делящимися и рефракторными к терапии.
Клетки ХЛЛ/ЛМЛ экспрессируют В-клеточные антигенные рецепторы с ограниченным репертуаром специфичности. Постоянная передача сигнала через эти рецепторы и характер этой передачи являются ключевым фактором, определяющим жизнеспособность клеток ХЛЛ и также характер развития этой опухоли. Предполагается, что сигнальный путь В-клеточного рецептора не зависит от антигенов, но осуществляется автономно, возможно при взаимодействии клеток ХЛЛ друг с другом [5, 6].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ХЛЛ - самый частый вид лейкоза у взрослых. В европейских странах заболеваемость им составляет 5 случаев на 100 тыс. человек в год. Заболеваемость увеличивается с возрастом. У лиц старше 70 лет она составляет более 20 случаев на 100 тыс. человек в год. Медиана возраста на момент установления диагноза в европейских странах - 69 лет [7 - 10]. В Российской Федерации ХЛЛ выявляется реже: в 2017 г. заболеваемость составила 2,95 случая на 100 тыс. человек, медиана возраста на момент установления диагноза - 68 лет [11].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C91.1 - Хронический лимфоцитарный лейкоз
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
ХЛЛ может классифицироваться по стадиям (см. раздел 1.5.1 Стадирование), а также по группам риска (см. раздел 1.5.2 Определение групп риска) [12].
1.5.1. Стадирование
Стадию ХЛЛ устанавливают на основании физикального исследования и анализа крови по критериям J.L. Binet (табл. 1) [12]. Компьютерная томография (КТ), рентгеновское и ультразвуковое исследование (УЗИ) для установления стадии не требуется. Стадия констатируется на текущий момент, указывается в диагнозе и служит ориентиром при определении показаний к терапии.
Стадирование ЛМЛ осуществляется по результатам обследования в соответствии с критериями классификации Ann Arbor (см. раздел 7.1 данных рекомендаций) [13].
Таблица 1. Стадии хронического лимфоцитарного лейкоза по Binet
Стадия
Характеристика
Медиана выживаемости, мес.
Доля пациентов в дебюте, %
A
Гемоглобин > 100 г/л, тромбоциты > 100 x 109/л, поражено < 3 лимфатических областей <*>
> 120
60
B
Гемоглобин > 100 г/л, тромбоциты > 100 x 109/л, поражено > 3 лимфатических областей <*>
61
30
C
Гемоглобин < 100 г/л или уровень тромбоцитов < 100 x 109/л
32
10
--------------------------------
<*> Лимфатические области: шейные лимфатические узлы, подмышечные лимфатические узлы (с 1 или 2 сторон), паховые лимфатические узлы (с 1 или 2 сторон), печень, селезенка.
1.5.2. Определение групп риска
Международный прогностический индекс (МПИ) для ХЛЛ разработан на основании анализа выживаемости 3 472 пациентов, включенных в 8 исследований, которые проведены в Европе и США [14]. Индекс учитывает 5 параметров:
1) наличие del(17p) и/или мутаций TP53,
2) мутационный статус генов вариабельного региона иммуноглобулинов (IGHV),
3) уровень 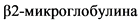 ,
,
4) стадию,
5) возраст пациентов.
Каждому из этих параметров присвоен балл, отражающий отношение рисков (ОР) прогрессии или смерти (табл. 2). МПИ для ХЛЛ позволяет распределить пациентов по 4 группам: с низким риском прогрессирования (0 - 1 балл), с промежуточным риском прогрессирования (2 - 3 балла), с высоким риском прогрессирования (4 - 6 баллов) и с очень высоким риском прогрессирования (7 - 10 баллов). Общая выживаемость (ОВ) в этих группах приведена в разделе 7.2 данных рекомендаций.
Необходимо обратить внимание, что данная шкала применима только для нелеченных пациентов и для пациентов, получавших ИХТ/ХТ до использования новых молекулярных препаратов в терапии ХЛЛ, которые нивелировали значение многих неблагоприятных прогностических факторов.
Таблица 2. Международный прогностический индекс
Параметр
Отрицательное значение
Отношение рисков
Баллы
TP53 (17p)
Делеция/мутация
4,2
4
Статус IGHV
Без мутаций
2,6
2
Уровень 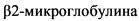 , мг/л
, мг/л
> 3,5
2,0
2
Стадия
B/C по Binet или I - IV по Rai
1,6
1
Возраст
65 лет
1,7
1
Возможные значения шкалы
0 - 10
При использовании в качестве первой линии комбинации обинутузумаба** и венетоклакса** предиктивными маркерами неблагоприятного исхода является делеция 17p, мутационный статус IGHV и размеры лимфатических узлов > 5 см. Наличие этих признаков склоняет выбор в пользу ингибитора тирозинкиназы брутона (BTK). Предиктивные маркеры при использовании ингибиторов BTK в первой линии менее разработаны.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Заболевание может протекать бессимптомно или проявляться лимфаденопатией, увеличением миндалин, спленомегалией, гепатомегалией и неспецифическими симптомами, обусловленными анемией (утомляемость, недомогание), тромбоцитопенией (геморрагический синдром), иммуносупрессией (присоединением инфекционных осложнений), интоксикацией (В-симптомами - температурой тела > 38 °C более 2 нед. подряд без признаков воспаления, ночными профузными потами, похуданием на 10% массы тела за последние 6 мес.).
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния
Для постановки диагноза ХЛЛ требуются общий анализ крови и иммунофенотипическое исследование с использованием многоцветной проточной цитофлуориметрии, которое предпочтительнее выполнять по крови.
Диагностические критерии ХЛЛ (ВОЗ, 2016) [15]:
- МВКЛ > 5 000 в 1 мкл крови;
- фенотип CD19+, CD5+, CD23+, CD79b + dim, CD20 + dim, CD22 + dim, sIg dim, CD81dim, CD160dim;
- рестрикция легких цепей (каппа либо лямбда);
- > 30% лимфоцитов в костном мозге;
- диагноз ХЛЛ не устанавливается при наличии цитопении или связанных с заболеванием симптомов при количестве моноклональных В-лимфоцитов < 5 000/мкл.
Диагноз устанавливают при выявлении в крови > 5 000 В-лимфоцитов в 1 мкл периферической крови при условии, что лимфоцитоз сохраняется более 3 мес. Клональность В-лимфоцитов должна быть подтверждена с помощью иммунофенотипирования.
ЛМЛ диагностируется при наличии лимфаденопатии, и/или спленомегалии, и/или цитопении, вызванной поражением костного мозга, при условии, что абсолютное число моноклональных В-лимфоцитов в крови не превышает 5 000 в 1 мкл. Иммуногистохимический фенотип опухолевых В-лимфоцитов соответствует ХЛЛ. Диагноз должен быть подтвержден биопсией лимфатического узла, костного мозга или пораженного органа.
2.1 Жалобы и анамнез
- Всем пациентам с подозрением на ХЛЛ, а также всем пациентам с верифицированным ХЛЛ при каждом приеме у врача-гематолога рекомендуется сбор анамнеза и жалоб при заболеваниях органов кроветворения и крови для оценки состояния пациента, а также для выявления факторов, которые могут оказать влияние на выбор лечебной тактики пациента [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при сборе анамнеза необходимо уточнить наличие в семейном анамнезе заболеваний органов кроветворения и крови. Жалобы могут отсутствовать, и тогда признаки заболевания выявляются при случайном обследовании. Может быть выявлено бессимптомное увеличение лимфатических узлов любой локализации. Могут присутствовать любые жалобы, связанные с вовлечением органов и тканей. При сборе жалоб особое внимание необходимо уделить выявлению неспецифических симптомов интоксикации (температуры тела > 38 °C более 2 нед. подряд без признаков воспаления, ночных профузных потов; похудания на 10% массы тела за последние 6 мес.). При наличии лихорадки, которая может служить основанием для начала специфической терапии, необходим тщательный скрининг с целью исключения инфекционной патологии.
2.2 Физикальное обследование
- Всем пациентам с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального терапевтического осмотра, терапевтической пальпации и терапевтической аускультации для уточнения распространенности заболевания и оценки состояния пациента, в том числе отдельных органов и систем [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: при осмотре необходимо оценить общее состояние пациента по шкале ECOG (см. приложение Г1), а также осмотреть миндалины и полость рта; пальпация должна включать в себя пальпацию всех доступных групп периферических лимфатических узлов, печени, селезенки.
2.3 Лабораторные диагностические исследования
2.3.1. Лабораторные исследования для оценки общего состояния пациента
- Всем пациентам с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, перед проведением противоопухолевой терапии, в процессе лечения, при оценке ремиссии после завершения терапии, при контрольных обследованиях в процессе динамического наблюдения и при подозрении на рецидив заболевания либо на рефрактерное течение на любом этапе заболевания рекомендуется выполнить общий (клинический) анализ крови развернутый с определением уровня общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, ретикулоцитов в крови, дифференцированным подсчетом лейкоцитов (лейкоцитарная формула) для верификации диагноза, уточнения активности заболевания, определения возможности проведения терапии и/или (в случае ранее проведенной терапии) - развития нежелательных явлений лечения [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: в окрашенных препаратах периферической крови клетки ХЛЛ имеют морфологию малых лимфоцитов с узким ободком цитоплазмы, плотным ядром, глыбчатым хроматином, без отчетливого ядрышка. Реже встречается морфология активированных лимфоцитов - с более широким ободком цитоплазмы синего цвета или краевой базофилией. Среди лимфоцитов около 5% могут составлять атипичные клетки (с расщепленными, складчатыми ядрами), а также пролимфоциты - более крупные клетки с неравномерно распределенным хроматином в ядре, 1 - 2 нуклеолами, что не противоречит диагнозу ХЛЛ. Для ХЛЛ характерно выявление в крови разрушенных клеток - теней Гумпрехта. При выявлении более 20% пролимфоцитов в крови диагностируют пролимфоцитаррную трансформацию ХЛЛ. В-клеточный пролимфоцитарный лейкоз исключен из ВОЗ классификации 2022 года.
- Всем пациентам с ХЛЛ/ЛМЛ при первичной диагностике или диагностике рецидива заболевания, при контрольных обследованиях в процессе динамического наблюдения, перед проведением противоопухолевой терапии, в процессе лечения, при оценке эффективности терапии, при рефрактерном течении на любом этапе заболевания для оценки общего состояния, определения необходимости проведения сопутствующей или сопроводительной терапии или редукции доз препаратов рекомендуется выполнение следующих лабораторных исследований:
- анализа крови биохимического общетерапевтического (с определением уровня активности лактатдегидрогеназы, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы в крови, исследование уровня мочевой кислоты, мочевины, креатинина, общего белка, альбумина, общего билирубина, калия, натрия, хлоридов, общего кальция, бета-2-микроглобулина) в крови [12, 16];
- коагулограммы (ориентировочного исследования системы гемостаза) (Определение протромбинового (тромбопластинового) времени в крови или в плазме, фибриногена, активности антитромбина III, плазминогена, концентрации Д-димера в крови, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время в крови) [12, 16];
- прямого антиглобулинового теста (прямой пробы Кумбса) для уточнения наличия предрасположенности к гемолитическим осложнениям ХЛЛ [12, 16];
- общего (клинического) анализа мочи [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ХЛЛ/ЛМЛ или при подозрении на ХЛЛ/ЛМЛ при наличии анемии рекомендуется с целью дифференциальной диагностики анемии выполнение следующих лабораторных исследований [17]:
- исследования уровня железа сыворотки крови
- исследования уровня ферритина в крови
- исследования уровня фолиевой кислоты в сыворотке крови
- определения уровня витамина B12 (цианокобаламин) в крови
- исследования уровня эритропоэтина крови
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.3.2. Лабораторные исследования для верификации диагноза и оценки прогностических факторов
- При подозрении на ХЛЛ у пациентов с числом В-лимфоцитов ![]() 5000 в 1 мкл рекомендуется выполнить исследование биологического материала (лимфоцитов крови) методом проточной цитофлуориметрии с целью верификации диагноза [18].
5000 в 1 мкл рекомендуется выполнить исследование биологического материала (лимфоцитов крови) методом проточной цитофлуориметрии с целью верификации диагноза [18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: диагноз ХЛЛ устанавливают при выявлении ![]() 5000 В-лимфоцитов в 1 мкл периферической крови при условии, что лимфоцитоз сохраняется более 3 мес. Клональность В-лимфоцитов должна быть подтверждена с помощью иммунофенотипирования. Рекомендуемая для диагностики ХЛЛ минимальная диагностическая панель должна включать следующие маркеры: CD19, CD5, CD23, CD20, каппа, лямбда. В качестве дополнительных диагностических маркеров рекомендуется использовать CD43, CD200, CD79b, CD81. Часто рекомендуемые, но необязательные для диагностики и мониторирования опухолевой популяции ХЛЛ маркеры: CD22, FMC7, CD38. Классический фенотип клеток ХЛЛ характеризуется экспрессией В-клеточных антигенов CD19, CD20, CD22, CD79b в сочетании с "Т-клеточным" маркером CD5 и активационным маркером CD23. Опухолевые клетки экспрессируют один тип легкой цепи иммуноглобулинов (каппа или лямбда). Интенсивность экспрессии В-клеточных антигенов (CD20, CD22, CD79b), а также поверхностных иммуноглобулинов на клетках ХЛЛ ниже, чем на нормальных В-лимфоцитах. Тем не менее можно встретить немало случаев, когда фенотип опухолевых клеток не вполне соответствует ХЛЛ. В таких случаях крайне важное значение имеет определение экспрессии CD200, который всегда ярко экспрессирован на клетках ХЛЛ.
5000 В-лимфоцитов в 1 мкл периферической крови при условии, что лимфоцитоз сохраняется более 3 мес. Клональность В-лимфоцитов должна быть подтверждена с помощью иммунофенотипирования. Рекомендуемая для диагностики ХЛЛ минимальная диагностическая панель должна включать следующие маркеры: CD19, CD5, CD23, CD20, каппа, лямбда. В качестве дополнительных диагностических маркеров рекомендуется использовать CD43, CD200, CD79b, CD81. Часто рекомендуемые, но необязательные для диагностики и мониторирования опухолевой популяции ХЛЛ маркеры: CD22, FMC7, CD38. Классический фенотип клеток ХЛЛ характеризуется экспрессией В-клеточных антигенов CD19, CD20, CD22, CD79b в сочетании с "Т-клеточным" маркером CD5 и активационным маркером CD23. Опухолевые клетки экспрессируют один тип легкой цепи иммуноглобулинов (каппа или лямбда). Интенсивность экспрессии В-клеточных антигенов (CD20, CD22, CD79b), а также поверхностных иммуноглобулинов на клетках ХЛЛ ниже, чем на нормальных В-лимфоцитах. Тем не менее можно встретить немало случаев, когда фенотип опухолевых клеток не вполне соответствует ХЛЛ. В таких случаях крайне важное значение имеет определение экспрессии CD200, который всегда ярко экспрессирован на клетках ХЛЛ.
- При подозрении на ЛМЛ у пациентов без клинического лимфоцитоза в крови, а также у пациентов с ХЛЛ/ЛМЛ с подозрением на трансформацию рекомендуется выполнить биопсию лимфатического узла (или иного очага поражения) и провести цитологическое исследование биоптатов лимфоузлов (или иного очага поражения), патолого-анатомическое исследование биопсийного (операционного) материала лимфатического узла (или иного очага поражения) с применением иммуногистохимических методов для верификации диагноза [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: в гистологических препаратах морфологический субстрат представлен диффузным ростом небольших лимфоидных клеток с округлыми ядрами, комковатым хроматином, без отчетливых ядрышек. В срезах ткани лимфатического узла нередко присутствуют фолликулоподобные структуры - псевдофолликулы, так называемые зоны роста, представленные увеличенным количеством параиммунобластов, клеток с морфологией пролимфоцитов с различимыми ядрышками. Детальное описание морфологической картины дается в соответствующих разделах рекомендаций. При прогрессии ХЛЛ размер этих псевдофолликулов увеличивается, они могут сливаться. У 3 - 5% пациентов с ХЛЛ и ЛМЛ развивается диффузная В-крупноклеточная лимфома или лимфома Ходжкина. Появление крупноклеточной лимфомы на фоне ХЛЛ называется синдромом Рихтера. Отличительной особенностью клеток является сохранение фенотипа исходной популяции. Появление лимфомы Ходжкина на фоне ХЛЛ называется ходжкинской трансформацией. Во всех случаях локального быстрого увеличения лимфатических узлов или существенного изменения клинической картины болезни (появления В-симптомов - внезапной потери веса, ночной потливости) необходимо выполнить биопсию лимфатического узла, костного мозга или экстранодального очага. Синдром Рихтера констатируется только на основании гистологического исследования.
- Всем пациентам с ХЛЛ/ЛМЛ спустя 2 месяца после окончания терапии при наличии возможности рекомендуется иммунофенотипирование биологического материала методом проточной цитофлуориметрии для выявления маркеров минимальной остаточной болезни (МОБ) при гемобластозах [20].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: оптимальным (наиболее информативным) материалом для исследования является костный мозг.
При финальной оценке эффекта после завершения иммунохимиотерапии МОБ позволяет прогнозировать время до рецидива и ОВ. Большинство прогностических схем построено на оценке МОБ в крови, однако исследование костного мозга позволяет достоверно подтвердить МОБ-негативную полную ремиссию.
Неоднократно показано, что количественная характеристика МОБ в крови по завершении терапии коррелирует с выживаемостью и поэтому может использоваться как руководство к действию. Остаточная популяция клеток ХЛЛ в крови > 1% предвещает ранний рецидив и может служить основанием для смены терапии. Остаточная популяция клеток ХЛЛ в крови 0,90 - 0,01% характеризует группу пациентов с медианой выживаемости без прогрессирования (ВБП) около 3 лет; у данной категории пациентов можно рассматривать возможность поддерживающей терапии. Остаточная популяция клеток ХЛЛ в крови < 0,01% свидетельствует о высокой вероятности длительной ремиссии (> 5 лет).
При проведении таргетной терапии ингибиторором антиапоптозного белка BCL-2, (L01XX Прочие противоопухолевые препараты) ингибиторами тирозинкиназы брутона (BTK) с обинутузумабом**, а также комбинации ибрутиниб** + венетоклакс** мониторинг МОБ начинают проводить с 9 месяца от начала терапии [21 - 24].
После трансплантации аллогенных гемопоэтических стволовых клеток МОБ определяется каждые 3 мес. в течение года или до наступления рецидива.
- Пациентам с подозрением на ХЛЛ/ЛМЛ для оценки объема поражения костного мозга и состояния остальных ростков кроветворения, исключения поражения костного мозга другими опухолями и инфекциями, а также для получения исходного образца костного мозга, необходимого для сравнения с образцом, полученным после проведения терапии рекомендуется: 1) получение цитологического препарата костного мозга путем пункции (стернальной пункции), цитологическое (миелограмма) и иммунофенотипическое исследование биологического материала (костного мозга) методом проточной цитофлуориметрии либо 2) получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов в следующих случаях [18]:
- перед началом терапии у пациентов, ранее не проходивших ее (необязательно, но желательно);
- при подозрении на трансформацию.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: гистологический диагноз ХЛЛ устанавливается при наличии в костном мозге диффузного лимфоидного пролиферата из мономорфных клеток небольшого размера с округлыми ядрами, комковатым хроматином, в зависимости от условий фиксации - с неотчетливыми ядрышками или без них, с тонкостенными сосудами капиллярного/венулярного типа; обычно разрозненно расположены крупные клетки с морфологией параиммунобластов, иногда присутствуют псевдофолликулы (пролиферативные центры). При иммуногистохимическом исследовании лимфоидный пролиферат характеризуется экспрессией CD20 (гетерогенная по интенсивности, преимущественно слабая мембранная реакция), CD79a, IgM, ядерной экспрессией PAX 5, LEF1 (ядерная реакция), коэкспрессией CD5 (мембранная реакция) и CD23 (мембранная реакция), CD43 при отсутствии экспрессии CD10, BCL-6, Cyclin D1. Экспрессия LEF1 (ядерная экспрессия) более интенсивно выражена в клетках пролиферативных центров, в клетках с морфологией пролимфоцитов. Для клеток пролиферативных центров характерна более интенсивная экспрессия CD20, IgM, LEF1, иногда часть клеток псевдофолликулов (пролиферативных центров) экспрессирует cyclin D1 (слабая ядерная реакция). Индекс пролиферативной активности Ki-67 невысокий, обычно составляет 5 - 15% позитивных клеток в зонах диффузного мелкоклеточного инфильтрата. При иммуногистохимическом исследовании на парафиновом материале может отсутствовать экспрессия CD5 (до 20 - 25% случаев). Экспрессией BCL-2 характеризуются все варианты мелкоклеточных В-клеточных лимфом, коэкспрессия IgM и IgD характерна для лимфоцитарной лимфомы и лимфомы из клеток мантии. Экспрессия LEF1 характерна для лимфоцитарной лимфомы с трансформацией в диффузную В-клеточную крупноклеточную лимфому (синдрома Рихтера) и позволяет провести дифференциальную диагностику с CD5+ диффузной В-клеточной крупноклеточной лимфомой.
Получение гистологического препарата костного мозга (трепанобиопсия костного мозга) не требуется для подтверждения и формулирования диагноза ХЛЛ/ЛМЛ.
Биопсия костного мозга является необязательной, но желательной процедурой перед началом терапии. ХЛЛ нередко сочетается с другими опухолями, которые могут метастазировать в костный мозг, выявляться только при биопсии и даже быть причиной цитопении. Иммунохимиотерапия в флударабин**-содержащем режиме нередко осложняется цитопенией. Наличие исходного образца костного мозга позволяет дифференцировать прогрессирование, аплазию, развитие миелодиспластического синдрома/острого миелоидного лейкоза, аутоиммунные цитопении.
- Всем пациентам с ХЛЛ/ЛМЛ перед началом 1-й и всех последующих линий терапии по возможности рекомендуется проведение молекулярно-цитогенетического исследования (FISH-метод) на одну пару хромосом (делеция 17p) и молекулярно-генетического исследования мутаций в гене TP53 в крови), а также (при наличии возможности) цитогенетическое исследование (кариотип) для исключения наличия комплексного кариотипа [14].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: делеция 17p является главным цитогенетическим маркером, непосредственно влияющим на терапевтическую тактику. Рекомендуется проводить скрининг на делецию 17p у всех пациентов, имеющих показания к началу терапии, и/или при неэффективности стандартной терапии, особенно у пациентов моложе 55 лет, у которых может быть проведена аллогенная трансплантация.
В настоящее время благодаря методам глубокого секвенирования установлено, что большинство случаев рефрактерности обусловлено утратой TP53 либо за счет делеции в сочетании с мутациями, либо за счет мутаций гена. Поэтому сегодня выполнение FISH на делецию 17p недостаточно. Для того чтобы идентифицировать наибольшее число пациентов с устойчивостью к иммунохимиотерапии, необходимо также исследовать мутации гена TP53. Наличие мутации констатируется, если аллельная нагрузка с мутацией превышает 10%.
Под комплексным кариотипом понимается наличие 3 и более аберраций у пациентов с del(17p) или наличие 5 и более аберраций у пациентов без делеции 17p.
- Всем пациентам с ХЛЛ/ЛМЛ на момент установления диагноза по возможности рекомендуется определение мутации генов IGHV для уточнения прогноза заболевания [14].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: мутации генов IGHV имеют прогностическое значение. В настоящее время прогноз у пациентов с ХЛЛ оценивают по международному прогностическому индексу для ХЛЛ (см. раздел 5.1). Индекс требует оценки уровня бета-2-микроглобулина, мутационного статуса IGHV, а также цитогенетического исследования. Определение этих показателей желательно. С учетом высокой информативной ценности в отношении времени до терапии, эффективности иммунохимиотерапии, времени до рецидива мутационный статус генов IGHV рекомендуется определять, так как это является основанием для выбора терапии первой линии и раннего назначения ингибитора антиапоптозного белка BCL-2 (L01XX Прочие противоопухолевые препараты и ингибиторов тирозинкиназы брутона (BTK) в случае немутированного варианта.
2.3.2. Другие обязательные лабораторные исследования
- Всем пациентам с ХЛЛ/ЛМЛ перед проведением 1-й линии противоопухолевой терапии рекомендуется определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактора), определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy, определение фенотипа по антигенам C, c, E, e, Cw, K, k для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ХЛЛ/ЛМЛ перед проведением терапии CD20 (кластеры дифференцировки 20) ингибиторами с целью уточнения риска и в случае необходимости профилактики реактивации вирусного гепатита рекомендуется выполнение вирусологического исследования для выявления маркеров вируса гепатита B, которое должно включать определение [25]:
- антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови;
- антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови;
- антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови;
- ДНК вируса гепатита B (Hepatitis B virus) в крови методом полимеразной цепной реакции (качественное исследование).
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: значения маркеров вирусного гепатита B представлены в приложении А3.1.
Реактивация вирусного гепатита B при терапии CD20 (кластеры дифференцировки 20) ингибиторами связана с В-клеточной деплецией и, как следствие, падением титра контролирующих анти-HBs антител. Восстановление титра антител происходит спустя 6 месяцев после последнего введения препаратов. Наличие гепатита не является противопоказанием к началу терапии ХЛЛ CD20 (кластеры дифференцировки 20) ингибиторами, однако это требует сопроводительной терапии противовирусными препаратами системного действия и тщательного мониторинга функций печени.
- Всем пациентам с ХЛЛ/ЛМЛ на этапе диагностики и, при наличии показаний, на любом этапе наблюдения или лечения рекомендуется молекулярно-биологическое исследование крови на наличие вируса иммунодефицита человека (исследование уровня антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1/2 и антигена p24 (Human immunodeficiency virus HIV 1/2 + Agp24) в крови) для уточнения коморбидности и необходимости проведения противоопухолевой и антиретровирусной терапии [16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ХЛЛ/ЛМЛ на момент установления диагноза, после каждой иммуносупрессивной терапии и после каждой тяжелой бактериальной инфекции по возможности рекомендуется исследование уровня иммуноглобулинов A, M, G в крови для уточнения показаний к применению внутривенного иммуноглобулина [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.4 Инструментальные диагностические исследования
- Всем пациентам на этапе диагностики, перед началом терапии ХЛЛ/ЛМЛ, при оценке ремиссии через 2 мес. после завершения терапии (если имелось поражение лимфатических узлов области средостения и/или легочной ткани), а также при подозрении на рецидив/прогрессирование заболевания рекомендуется для уточнения наличия и распространенности лимфаденопатии или оценки противоопухолевого эффекта, если исследование выполнено в динамике выполнение следующих диагностических исследований [12, 16]:
- КТ органов грудной полости, КТ органов брюшной полости и КТ органов малого таза
- Прицельную рентгенографию органов грудной клетки в 2 проекциях (при отсутствии КТ органов грудной полости);
- УЗИ лимфатических узлов (периферических, внутрибрюшных и забрюшинных) и, при отсутствии КТ брюшной полости, УЗИ внутренних органов (УЗИ органов брюшной полости (комплексное) и УЗИ органов малого таза (комплексное)).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с подозрением на ХЛЛ/ЛМЛ либо с установленным диагнозом ХЛЛ/ЛМЛ, у которых имеются клинические признаки синдрома Рихтера или ходжкинской трансформации (прогрессирующий рост лимфатических узлов, потеря веса, персистирующая лихорадка без признаков инфекции, высокий уровень лактатдегидрогеназы, гиперкальциемия), рекомендуется выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией с туморотропными ФДГ (флудезоксиглюкозой [18F]) для выявления зон с вероятной трансформацией и выбора оптимального очага для проведения биопсии [26].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: при значениях SUV < 5 вероятность синдрома Рихтера составляет около 3% [27]. Для синдрома Рихтера типичны значения SUV > 15%. Если интенсивность накопления препарата отчетливо различается в разных зонах, необходимо выполнение биопсии наиболее активного узла или очага.
- Всем пациентам с верифицированным ХЛЛ/ЛМЛ при первичной диагностике или диагностике рецидива заболевания, при контрольных обследованиях в процессе динамического наблюдения, перед проведением противоопухолевой терапии, в процессе лечения, при оценке эффективности терапии, при рефрактерном течении на любом этапе заболевания для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой, дыхательной и пищеварительной систем и для определения необходимости их профилактики или лечения рекомендуется выполнить следующие исследования [16]:
- регистрация электрокардиограммы (всем);
- эхокардиография (по показаниям);
- ультразвуковая допплерография сосудов (артерий и вен) нижних конечностей (по показаниям);
- рентгенография легких (по показаниям);
- компьютерная томография органов грудной полости (по показаниям);
- ультразвуковое исследование органов брюшной полости (комплексное) (по показаниям);
- компьютерная томография органов брюшной полости (по показаниям);
- эзофагогастродуоденоскопия (по показаниям);
- колоноскопия (по показаниям);
- ректороманоскопия (по показаниям).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.5 Иные диагностические исследования
- Всем пациентам с ХЛЛ/ЛМЛ с коморбидностью, которая может повлиять на выбор программы противоопухолевого лечения, перед началом терапии рекомендуется прием (осмотр, консультация) соответствующего врача-специалиста (врача-акушера-гинеколога, врача-кардиолога, врача-невролога, врача-оториноларинолога, врача-уролога, врача-колопроктолога, врача-эндокринолога, врача-пульмонолога, врача-фтизиатра, врача-инфекциониста и др.) первичный [16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ХЛЛ/ЛМЛ на любом этапе диагностики, наблюдения, лечения, при подозрении на развитие инфекционного осложнения рекомендуется выполнение диагностических исследований для уточнения локализации инфекции, типа возбудителя инфекции, динамического контроля в процессе лечения [28, 29].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Показания к началу терапии В-клеточного ХЛЛ
- Всем пациентам с верифицированным ХЛЛ/ЛМЛ рекомендуется начало специфической терапии только при наличии показаний в соответствии с критериями IWCLL 2018 (см. приложение А3.2) [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: около 30% пациентов имеют медленно прогрессирующее течение ХЛЛ, причем продолжительность их жизни близка к общепопуляционной. Наличие такой группы пациентов делает обоснованной тактику выжидательного наблюдения до появления показаний к терапии. Терапия ХЛЛ должна начинаться при наличии показаний по критериям IWCLL 2018. Пациенты в стадии А с аутоиммунной гемолитической анемией или идиопатической тромбоцитопенической пурпурой должны получать лечение по поводу этих осложнений. Если аутоиммунное осложнение плохо отвечает на терапию глюкокортикоидами, возможно применение направленной на ХЛЛ иммунохимиотерапии. Бессимптомная гипогаммаглобулинемия и наличие моноклональной секреции сами по себе не являются показаниями к лечению. Выявление маркеров отрицательного прогноза, в том числе делеции 17p не является показанием к началу терапии.
Учитывая ограниченные данные по ведению беременности при ХЛЛ, решение вопроса у беременных пациенток с ХЛЛ о возможности пролонгации беременности или необходимости ее прерывания, сроках начала и схеме лечения определяется индивидуально, в зависимости от наличия или отсутствия показаний к началу специфической терапии лейкоза, с привлечением междисциплинарной команды, желательно с проведением консультации со специалистами федеральных медицинских учреждений.
3.2. Первая линия лечения ХЛЛ
Выбор терапии первой линии зависит от наличия факторов неблагоприятного прогноза (делеция 17p или мутации TP53, комплексный кариотип, вариант без мутаций IGVH), сопутствующих заболеваний и в меньшей степени от календарного возраста.
Результаты крупных клинических исследований 2000-х гг. убедительно свидетельствуют о низкой эффективности иммунохимиотерапии у пациентов с делецией 17p и мутациями TP53. Делеция 17p выявляется до начала терапии 1-й линии у 7% пациентов. Большинство пациентов с делецией 17p, выявляемой более, чем в 20% клеток одновременно имеют мутации TP53. Кроме того, 5 - 7% имеют только мутации TP53, без делеции. Особую группу составляют пациенты с комплексным кариотипом. Сегодня доказано, что комплексный кариотип является независимым предиктором неблагоприятного прогноза у пациентов, получающих иммунохимиотерапию. Так, в проспективном исследовании пациентов с ХЛЛ, получавших схемы первой линии на основе хлорамбуцила**, Herling и соавт. показали, что комплексный кариотип (n = 30 из 154, 19,5%) ассоциировался с более короткой общей выживаемостью в многовариантном анализе (P = 0,004) [81]. Le Bris и соавт. обнаружили, что комплексный кариотип был связана с более короткой БПВ и 5-летней ОВ в когорте пациентов с ХЛЛ, получавших FCR первой линии [82]. В эру таргетной терапии комплексный кариотип приобретает еще более важное значение: при значительном увеличении БПВ и ОВ в общей группе больных, прогноз у пациентов с КК значимо отличается в худшую сторону [22, 83].
На сегодня нет убедительных данных о превосходстве какого либо, режима терапии у пациентов с КК, однако наилучшие результаты достигаются у пациентов, получающих комбинированную терапию ингибиторами тирозинкиназы брутона (BTK) и венетоклаксом** [84].
При выборе терапии 1 линии пациенты могут быть распределены на 4 группы.
1. К 1-й группе относятся пациенты с делецией 17p и/или мутацией TP53 и/или комплексным кариотипом независимо от возраста и коморбидности. Терапией выбора у этих пациентов является применение ингибиторов тирозинкиназы брутона (BTK): акалабрутиниб** в монотерапии или в комбинации с #обинутузумабом** [21], #занубрутиниб в монотерапии [30, 31], ибрутиниб** в монотерапии или комбинации с #обинутузумабом** [32 - 35], венетоклакс** в комбинации с ингибитором тирозинкиназы брутона (BTK) [23, 24, 36, 37] (препараты перечислены в алфавитном порядке; в реальной практике следует учитывать индивидуальные характеристики пациента и доступность препарата). Использование венетоклакса** в комбинации с #обинутузумабом** возможно, но число рецидивов в течение 5 лет будет значительно больше [22]. Согласно данным пулированного анализа 4 исследований, при назначении ингибитора тирозинкиназы брутона (BTK) в монорежиме или в комбинации с моноклональными антителами и конъюгатами антитело-лекарственное средство в первой линии пациентам с делецией 17p или мутациями TP53 4-летняя БПВ и ОВ составляют 79% и 88%, соответственно [85]. По данным большого Итальянского исследования, у пациентов с аберрациями TP53, получающих терапию ибрутинибом** в 1 линии, 2-летнее время до отмены терапии составило 63.4%, а общая выживаемость 82.6% [87]. В связи с этими данными проведение аллогенной трансплантации в качестве консолидации ремиссии после терапии ингибиторами тирозинкиназы брутона (BTK) в 1 линии не целесообразно. Терапия продолжается до прогрессии. При развитии прогрессии целесообразно переключение на венетоклакс**-содержащий режим и проведение аллогенной трансплантации при наличии возможности. При возможности, всем пациентам необходимо исследование комплексного кариотипа. Комплексный кариотип является независимым предиктором прогноза у пациентов, получающих ибрутиниб**. В этой подгруппе больных оптимальной комбинацией является венетоклакс** в комбинации с ингибитором тирозинкиназы брутона (BTK) [23, 24, 36, 37], могут быть эффективными акалабрутиниб** +/-#обинутузумаб** [21], венетоклакс** в комбинации с #обинутузумабом** [22], #занубрутиниб в монотерапии [30, 31], ибрутиниб** в монотерапии или комбинации с #обинутузумабом** [32 - 35] (препараты перечислены в алфавитном порядке; в реальной практике следует учитывать индивидуальные характеристики пациента и доступность препарата). Применение конечной терапии (венетоклакс** + #обинутузумаб**) должно рассматриваться в индивидуальном порядке с учетом возможного прогноза и риска прогрессирования заболевания. В подгруппе пациентов с комплексным кариотипом комбинация #венетоклакса** и ибрутиниба** может рассматриваться как подготовка к трансплантации, так как позволяет достичь неопределяемой МОБ и/или ПР у значительного числа пациентов.
2. К 2-й группе относятся пациенты без аберраций TP53 и комплексного кариотипа, относящиеся к группе менее благоприятного прогноза в связи с наличием варианта ХЛЛ без мутаций IGHV. В этой подгруппе пациентов высокую эффективность продемонстрировали таргетные препараты: акалабрутиниб** +/- #обинутузумаб** [21], венетоклакс** в комбинации с #обинутузумабом** [22], #занубрутиниб в монотерапии [30, 31], ибрутиниб** в монотерапии или комбинации с #обинутузумабом** [32 - 35] (препараты перечислены в алфавитном порядке; в реальной практике следует учитывать индивидуальные характеристики пациента и доступность препарата). Высокого числа достижения МОБ-негативного статуса можно ожидать при использовании венетоклакса** с обинутузумабом** [22]. Ингибитор антиапоптозного белка BCL-2 (L01XX Прочие противоопухолевые препараты) и ингибиторы тирозинкиназы брутона (BTK) обладают иным профилем токсичности, по сравнению с химиотерапией, поэтому могут использоваться независимо от возраста. У молодых пациентов предпочтительна терапия с фиксированной длительностью и достижение МОБ-негативной ремиссии. В связи с этим, оптимальными режимами являются схемы с венетоклаксом** в комбинации с моноклональными антителами и конъюгатами антитело-лекарственное средство. У пожилых пациентов возможно использование постоянной терапии до прогрессии или непереносимой токсичности.
3. К третьей группе относятся пациенты без аберраций TP53 и комплексного кариотипа, относящиеся к группе благоприятного прогноза в связи с наличием варианта ХЛЛ с мутациями IGHV. Большинство этих пациентов достигают длительной ремиссии после иммунохимиотерапии. Поэтому у этих пациентов иммунохимиотерапия остается основным выбором. FCR-содержащие схемы значительно хуже переносятся пожилыми пациентами, в связи с чем в этой группе принципиально выделение подгрупп молодых и пожилых пациентов.
3.1. У молодых пациентов (моложе 65 лет) без значимой коморбидности с мутированным вариантом IGHV предпочтительна курсовая иммунохимиотерапия режимами FCR или BR.
3.2. У пациентов преклонного возраста (старше 65 лет), имеющих значимую коморбидность, могут использоваться режимы хлорамбуцил** + обинутузумаб**, BR, низкоинтенсивные FCR-подобные режимы [38, 39].
4. К 4 группе относятся очень пожилые пациенты, со старческой немощностью и гериатрическими синдромами, деменцией, пациенты с неконтролируемыми органными недостаточностями. В этой группе больных цель терапии исключительно паллиативной.
- Пациентам с верифицированным ХЛЛ/ЛМЛ с наличием делеции 17p и/или мутации TP53 и/или наличием комплексного кариотипа, независимо от возраста и коморбидности в качестве одной из опций 1-й линии терапии рекомендуется таргетная терапия по одной из следующих схем (препараты перечислены в алфавитном порядке; в реальной практике следует учитывать индивидуальные характеристики пациента и доступность препарата):
- акалабрутиниб** в монорежиме 100 мг (1 капсула) 2 раза в день до прогрессирования или развития непереносимой токсичности или в комбинации с #обинутузумабом** 100 мг в/в в течение 4 часов день 1, 900 мг в/в день 2, 1000 мг в/в, дни 8 - 15 (цикл 2), 1000 мг в/в, день 1 (циклы 3 - 7), цикл возобновляется на 29 день (схемы режимов лечения см. в приложении А3.3) [21];
- #венетоклакс** + ибрутиниб**: ибрутиниб** в дозе 420 мг/сут (3 капсулы) внутрь 1 раз в день в течение 3 циклов, #венетоклакс** в комбинации с ибрутинибом** с 1 дня 4 цикла ибрутиниба** в режиме rump-up 20 мг/сут 1 нед, 50 мг/сут 2 неделя; 100 мг/сут 3 неделя; 200 мг/сут 4 неделя; 400 мг/сут 5 неделя и далее доза #венетоклакса** 400 мг/сут в комбинации с ибрутинибом** в течение 12 циклов (схемы режимов лечения см. в приложении А3.3) [23, 24]; Эта схема наиболее предпочтительна у пациентов с комплексным кариотипом.
- венетоклакс** + #обинутузумаб**: венетоклакс** 20 мг/сут, дни 22 - 28 цикла 1; 50 мг/сут дни 1 - 7 цикла 2; 100 мг/сут дни 8 - 14 цикла 2; 200 мг/сут дни 15 - 21 цикла 2; 400 мг/сут дни 22 - 28 цикла 2, далее 400 мг/сут в течение 12 циклов + обинутузумаб** 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3 - 6 (схемы режимов лечения см. в приложении А3.3) [22];
- #занубрутиниб в монорежиме 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности (схемы режимов лечения см. в приложении А3.3) [30, 31];
- ибрутиниб** в монорежиме или в комбинации с #обинутузумабом** до прогрессии или непереносимой токсичности в дозе 420 мг/сут (3 капсулы) внутрь 1 раз в день (схемы режимов лечения см. в приложении А3.3) [34, 40].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Молодым пациентам с верифицированным ХЛЛ/ЛМЛ без значимой коморбидности с делецией del(17p) и комплексным кариотипом после терапии акалабрутинибом**, венетоклаксом**, #занубрутинибом или ибрутинибом** и при достижении полной ремиссии в 1-й линии рекомендовано рассмотреть возможность проведения трансплантации аллогенных гемопоэтических стволовых клеток в качестве консолидации [41, 42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: оптимальным сроком проведения трансплантации следует считать 2-й год терапии ибрутинибом** или акалабрутинибом** или достижение МОБ-негативной ремиссии на венетоклаксе**.
- Пациентам с верифицированным ХЛЛ/ЛМЛ, не имеющим аберраций TP53 и комплексного кариотипа, с вариантом ХЛЛ без мутаций генов IGHV при наличии возможности в качестве одной из опций 1-й линии терапии рекомендуется один из следующих вариантов лечения для достижения ремиссии (препараты перечислены в алфавитном порядке; в реальной практике следует учитывать индивидуальные характеристики пациента и доступность препарата) (схемы режимов лечения см. в приложении А3.3):
- акалабрутиниб** в монорежиме 100 мг (1 капсула) 2 раза в день до прогрессирования или развития непереносимой токсичности или в комбинации с #обинутузумабом** 100 мг в/в в течение 4 часов день 1, 900 мг в/в день 2, 1000 мг в/в, дни 8 - 15 (цикл 2), 1000 мг в/в, день 1 (циклы 3 - 7), цикл возобновляется на 29 день [21];
- венетоклакс** в комбинации с #обинутузумабом**: венетоклакс** 20 мг/сут, дни 22 - 28 цикла 1; 50 мг/сут дни 1 - 7 цикла 2; 100 мг/сут дни 8 - 14 цикла 2; 200 мг/сут дни 15 - 21 цикла 2; 400 мг/сут дни 22 - 28 цикла 2, далее 400 мг/сут в течение 12 циклов + #обинутузумаб** 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3 - 6 [22];
- #венетоклакс** + ибрутиниб**: ибрутиниб** в дозе 420 мг/сут (3 капсулы) внутрь 1 раз в день в течение 3 циклов, #венетоклакс** в комбинации с ибрутинибом** с 1 дня 4 цикла ибрутиниба** в режиме rump-up 20 мг/сут 1 нед, 50 мг/сут 2 неделя; 100 мг/сут 3 неделя; 200 мг/сут 4 неделя; 400 мг/сут 5 неделя и далее доза #венетоклакса** 400 мг/сут в комбинации с ибрутинибом** в течение 12 циклов [23, 24, 43]
- #занубрутиниб в монорежиме 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности [30, 31];
ибрутиниб** в монорежиме или в комбинации с #обинутузумабом** до прогрессирования или непереносимой токсичности: ибрутиниб** 420 мг/сут (3 капсулы) внутрь 1 раз в день, ежедневно; обинутузумаб** 1000 мг в/в, день 1 (100 мг в течение 4 часов), 2 (900 мг), 8, 15 (цикл 1), день 1 (циклы 2 - 6) [32, 34, 40].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- При отсутствии возможности обеспечения ингибиторами антиапоптозного белка BCL-2 (L01XX Прочие противоопухолевые препараты) или ингибиторами тирозинкиназы брутона (BTK) пациентам с вариантом ХЛЛ без мутаций IGHV возможно проведение иммунохимиотерапии (FCR, RB, FCR-Lite, хлорамбуцил**, в том числе, в сочетании с ритуксимабом** или обинутузумабом**) [44, 45].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с верифицированным ХЛЛ/ЛМЛ моложе 65 лет без значимой коморбидности (физически активным, без тяжелых сопутствующих заболеваний, с нормальной функцией почек), с мутированным вариантом IGHV, без аберраций TP53 и комплексного кариотипа в качестве 1-й линии лечения рекомендуется один из следующих вариантов лечения для достижения ремиссии:
- FCR: (ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап. или #ритуксимаб** 1600 мг п/к, день 1; #флударабин** - 25 мг/м2 в/в кап., дни 1 - 3; #циклофосфамид** - 250 мг/м2 в/в кап., дни 1 - 3). (схемы режимов лечения см. в приложении А3.3) [46 - 48];
- RB (ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап.; #бендамустин** - 90 мг/м2 в/в кап., дни 1, 2) для достижения ремиссии (схемы режимов лечения см. в приложении А3.3) [38, 49];
- венетоклакс** в комбинации с #обинутузумабом**: венетоклакс** 20 мг/сут, дни 22 - 28 цикла 1; 50 мг/сут дни 1 - 7 цикла 2; 100 мг/сут дни 8 - 14 цикла 2; 200 мг/сут дни 15 - 21 цикла 2; 400 мг/сут дни 22 - 28 цикла 2, далее 400 мг/сут в течение 12 циклов + #обинутузумаб** 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3 - 6 [22].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Пациентам с верифицированным ХЛЛ/ЛМЛ старше 65 - 70 лет, тяжелыми сопутствующими заболеваниями или угнетением почечной функции, с мутированным вариантом IGHV, без аберраций TP53 и комплексного кариотипа в качестве 1-й линии лечения рекомендуется проведение 1-й линии проведение терапии по одной из следующих схем цитостатической терапии в зависимости от предпочтений и опыта медицинского центра и лечащего врача (препараты перечислены в алфавитном порядке) (схемы режимов лечения см. в приложении А3.3):
- #бендамустин** 90 мг/м2 в/в кап., дни 1, 2 +/- ритуксимаб** 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап. Лечение возобновляется на 29-й день, всего 6 циклов [38, 48 - 50];
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
режим FCR-Lite (ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап.; #флударабин** - 20 мг/м2 внутрь, дни 1 - 3; #циклофосфамид** - 150 мг/м2 внутрь, дни 1 - 3. Лечение возобновляется на 29-й день), всего 6 циклов [44,51];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- #хлорамбуцил** 10 мг/м2 внутрь, дни 1 - 7 + ритуксимаб** 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап. Лечение возобновляется на 29-й день, всего 6 циклов [53];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- #хлорамбуцил** 0,5 мг/кг внутрь, дни 1, 15 + #обинутузумаб** 1000 мг в/в, день 1 8, 15 (цикл 1), день 1 (циклы 2 - 6). Лечение возобновляется на 29-й день, всего 6 циклов [54].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Пациентам старше 75 - 80 лет с верифицированным ХЛЛ/ЛМЛ и невысокой ожидаемой продолжительностью жизни, обусловленной возрастом, некупируемыми органными недостаточностями, деменцией и гериатрическими синдромами рекомендованы наименее токсичные варианты терапии [44, 45]:
- Наилучшая сопроводительная терапия, включающая гемотрансфузии по показаниям, назначение антибактериальных препаратов системного действия с лечебной и профилактической целью, назначение колониестимулирующих факторов.
- монотерапия #хлорамбуцилом** 70 мг/м2 внутрь ежедневно в течение 2 - 4 нед. с последующим подбором дозы [55];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- монотерапия CD20 (кластеры дифференцировки 20) ингибиторами - ритуксимаб** в соответствующей зарегистрированной инструкции дозировке [56];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.3. Выбор терапии рецидива ХЛЛ (2 и последующие линии)
Выбор терапии при рецидивах ХЛЛ зависит от следующих факторов:
1. наличие маркеров высокого риска (del17p, мутации TP53, комплексный кариотип);
2. Предшествующей терапии;
3. Срока наступления рецидива;
4. Коморбидности, сопутствующей терапии.
В терапии рецидива, как и в терапии 1-й линии, принципиальное значение имеет определение делеции 17p, мутации TP53, комплексного кариотипа. При выявлении этих маркеров, как и в 1-й линии терапии, наиболее оправданным является назначение ингибиторов ВТК: акалабрутиниба**, #занубрутиниба, ибрутиниба** (препараты перечислены в алфавитном порядке), а также комбинированных схем, включающих ингибиторы тирозинкиназы брутона (BTK) и венетоклакс**. В реальной практике следует учитывать индивидуальные характеристики пациента и доступность, если они не применялись ранее.
У пациентов с прогрессией, развившейся на фоне постоянного приема ингибитора тирозинкиназы брутона (BTK) наиболее предпочтительным является использование венетоклакса** в комбинации с моноклональными антителами и конъюгатами антитело-лекарственное средство. Венетоклакс** содержащие режимы значительно превосходят иммунохимиотерапию, в особенности, если ингибитор тирозинкиназы брутона (BTK) был назначен по поводу рецидива.
У пациентов, которые прекратили терапию ингибитором тирозинкиназы брутона (BTK) из-за развития нежелательных явлений, возможно использование альтернативного ингибитора тирозинкиназы брутона (BTK) или смена терапии на венетоклакс**-содержащие режимы. Проведение иммунохимиотерапии менее предпочтительно, особенно если она уже назначалась ранее. Противорецидивная терапия назначается при наличии показаний к терапии. Они могут присутствовать на момент прекращения терапии из-за токсичности или появиться со временем.
При назначении терапии у пациентов с рецидивом, возникшим после терапии венетоклаксом** учитывают срок возникновения рецидива. При поздних рецидивах, развившихся более, чем через 2 - 3 года после терапии, возможно возвращение к венетоклакс**-содержащей схеме. При прогрессии на фоне лечения или раннем рецидиве, возникшем в течение 2 лет после завершения венетоклакс**-содержащего режима, целесообразно переключение на ингибитор тирозинкиназы брутона (BTK).
При назначении терапии у пациентов с рецидивом, возникшим после применения иммунохимиотерапии, не имеющих аберраций TP53 и комплексного кариотипа, учитывают срок возникновения рецидива. При поздних рецидивах, развившихся более, чем через 3 года после терапии, возможно повторение того же, или альтернативного химиотерапевтического режима. При прогрессии на фоне лечения или раннем рецидиве, возникшем в течение 3 лет после иммунохимиотерапии, целесообразно переключение на ингибитор тирозинкиназы брутона (BTK) или венетоклакс**.
- Пациентам с ХЛЛ/ЛМЛ, у которых наблюдался рецидив во время приема ингибитора тирозинкиназы брутона (BTK), при наличии возможности рекомендуется назначение венетоклакса** в монорежиме или в комбинации с ритуксимабом** [57, 58].
- венетоклакс** + ритуксимаб**: венетоклакс** 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса** 400 мг/сут, далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений [57];
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Венетоклакс** прием до прогрессии или непереносимой токсичности в дозе 400 мг/сут, начиная с фазы эскалации.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: рецидив или рефрактерность во время приема ингибитора тирозинкиназы брутона (BTK) ибрутиниба** может быть связан с мутациями генов BTK, в связи с чем целесообразно исследовать мутацию р.С481S в гене ВТК, наиболее часто ассоциированную с резистентностью к ибрутинибу**.
- Пациентам с ХЛЛ/ЛМЛ моложе 65 лет без значимой коморбидности, которые после прогрессии на фоне постоянной терапии ингибитором BTK достигли ремиссии после переключения на венетоклакс** рекомендуется рассмотреть возможность аллогенной трансплантации гемопоэтических стволовых клеток в качестве консолидации [41, 42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Пациентам с ХЛЛ/ЛМЛ и рецидивом, развившимся после прекращения терапии ингибитором BTK из-за токсичности рекомендуется один из следующих вариантов лечения (схемы режимов лечения см. в приложении А3.3):
- акалабрутиниб** 100 мг (1 капсула) 2 раза в день в монотерапии независимо от приема пищи до прогрессии заболевания или развития неприемлемой токсичности [59];
- #занубрутиниб в монорежиме 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности [30, 31, 52];
- венетоклакс** + ритуксимаб**: венетоклакс** 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса** 400 мг/сут, далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений [57];
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Пациентам с ХЛЛ/ЛМЛ и ранним рецидивом, развившимся после прекращения терапии венетоклаксом** или прогрессией на фоне терапии венетоклакс**-содержащим режимом рекомендуется один из следующих вариантов лечения (схемы режимов лечения см. в приложении А3.3):
- акалабрутиниб** 100 мг (1 капсула) 2 раза в день в монотерапии независимо от приема пищи до прогрессии заболевания или развития неприемлемой токсичности [59];
- #занубрутиниб в монорежиме 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности [60];
- ибрутиниб** 420 мг/сут (3 капсулы) внутрь 1 раз в день в день до прогрессирования или развития непереносимой токсичности [34].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Пациентам с ХЛЛ/ЛМЛ и поздним рецидивом, развившимся после прекращения терапии венетоклаксом** рекомендуется один из следующих вариантов лечения (схемы режимов лечения см. в приложении А3.3):
- акалабрутиниб** 100 мг (1 капсула) 2 раза в день в монотерапии независимо от приема пищи до прогрессии заболевания или развития неприемлемой токсичности [59];
- #занубрутиниб в монорежиме 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности [60];
- ибрутиниб** 420 мг/сут (3 капсулы) внутрь 1 раз в день в день до прогрессирования или развития непереносимой токсичности [34];
- венетоклакс** + ритуксимаб**: венетоклакс** 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса** 400 мг/сут, далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений [57].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Пациентам с поздним рецидивом ХЛЛ/ЛМЛ после иммунохимиотерапии (> 24 мес. от последней химиотерапии) при отсутствии делеции 17p и мутации TP53 рекомендуется один из следующих вариантов лечения (схемы режимов лечения см. в приложении А3.3):
- повтор иммунохимиотерапии 1-й линии [61];
альтернативный режим иммунохимиотерапии [61, 62];
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- акалабрутиниб** 100 мг (1 капсула) 2 раза в день в монотерапии независимо от приема пищи до прогрессии заболевания или развития неприемлемой токсичности [59];
- венетоклакс** + ритуксимаб**: венетоклакс** 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса** 400 мг/сут, далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений [57];
- #занубрутиниб в монорежиме 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности [52, 60];
- ибрутиниб** 420 мг/сут (3 капсулы) внутрь 1 раз в день ежедневно в течение всего курса и далее (после завершения циклов BR) - до прогрессирования или развития неприемлемой токсичности ![]() BR (#бендамустин** - 70 мг/м2 в/в кап., дни 2 - 3 цикла 1; дни 1, 2 циклов 2 - 6; ритуксимаб** - 375 мг/м2 в/в кап., день 1 цикла 1; далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений. Лечение возобновляется на 29-й день [63, 64].
BR (#бендамустин** - 70 мг/м2 в/в кап., дни 2 - 3 цикла 1; дни 1, 2 циклов 2 - 6; ритуксимаб** - 375 мг/м2 в/в кап., день 1 цикла 1; далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений. Лечение возобновляется на 29-й день [63, 64].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: у пациентов с поздним рецидивом выбор терапии зависит от вида, результатов и переносимости предшествующей терапии, общего состояния и коморбидности пациента, а также предпочтений и возможностей клиники. Повторные флударабин**-содержащие курсы возможны при условии, что при проведении этой терапии в качестве 1-й линии не наблюдались явления значительной токсичности - тяжелые затяжные цитопении, повлекшие за собой многомесячные перерывы в лечении, развитие тяжелых инфекционных осложнений. В качестве терапии 2-й линии можно использовать ту же схему. В исследованиях II фазы получены убедительные данные об эффективности режима BR (бендамустин** + ритуксимаб**). У пациентов, ранее получавших хлорамбуцил**, может быть эффективна терапия бендамустином**, режимы BR и FCR-Lite.
- Пациентам с ранним (< 24 мес. после окончания терапии 1 линии) рецидивом с показаниями к терапии либо прогрессией ХЛЛ/ЛМЛ, ранее не получавших новые молекулярные препараты, по возможности рекомендована терапия нижеследующими препаратами (препараты перечислены в алфавитном порядке. В реальной практике следует учитывать индивидуальные характеристики пациента и доступность препарата):
- акалабрутиниб** 100 мг (1 капсула) 2 раза в день в монотерапии независимо от приема пищи до прогрессии заболевания или развития неприемлемой токсичности [59];
- венетоклакс** + ритуксимаб**: венетоклакс** 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса** 400 мг/сут, далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений [57];
- #занубрутиниб в монорежиме 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности [52, 60];
- ибрутиниб** 420 мг/сут (3 капсулы) внутрь 1 раз в день ежедневно в течение всего курса и далее (после завершения циклов BR) - до прогрессирования или развития неприемлемой токсичности +/- BR (#бендамустин** - 70 мг/м2 в/в кап., дни 2 - 3 цикла 1; дни 1, 2 циклов 2 - 6; ритуксимаб** - 375 мг/м2 в/в кап., день 1 цикла 1; далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно. Лечение возобновляется на 29-й день, всего 6 циклов) [63, 64].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Пациентам с ХЛЛ/ЛМЛ моложе 65 лет без значимой коморбидности, которые в связи с ранним рецидивом или в связи с выявлением при рецидиве делеции 17p и/или мутации TP53 проводилась таргетная терапия, при достижении полной ремиссии рекомендуется рассмотреть возможность аллогенной трансплантации гемопоэтических стволовых клеток в качестве консолидации [41, 42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Пациентам, получающим ритуксимаб** по поводу рецидива либо рефрактерного течения ХЛЛ/ЛМЛ, при сложности осуществления венозного доступа начиная со 2-й дозы может быть рекомендовано применение подкожной формы ритуксимаба** в фиксированной дозе 1600 мг (схемы режимов лечения см. в приложении А3.3) [48].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
3.4. Сопутствующая и сопроводительная терапия
- Пациентам с ХЛЛ/ЛМЛ на любом этапе диагностики, наблюдения, лечения, при подозрении на развитие инфекционного осложнения или при диагностированном инфекционном осложнении рекомендуется проведение лекарственной терапии инфекционного осложнения в зависимости от возбудителя инфекции и локализации инфекции (см. приложение А3.5) [28, 29, 65, 66].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с ХЛЛ/ЛМЛ на любом этапе лечения, у которых выявлен уровень иммуноглобулина G < 5 г/л (с тяжелой формой вторичной гипогаммаглобулинемии) и отмечаются рецидивирующие бактериальные инфекции, рекомендовано при наличии возможности проведение постоянной заместительной терапии внутривенным иммуноглобулином (АТХ: J06B) для снижения риска инфекционных осложнений [67].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: инфекции являются главной причиной смерти у 10 - 15% пациентов с ХЛЛ. В нескольких рандомизированных исследованиях показано, что постоянная заместительная терапия внутривенным иммуноглобулином эффективно снижает частоту бактериальных инфекций. Эффект наиболее значим в подгруппе пациентов с гипогаммаглобулинемией и рецидивирующими инфекциями, поэтому заместительная терапия в настоящее время рекомендуется только этой категории пациентов.
Иммуноглобулин человека нормальный** в форме выпуска раствор для инфузий назначается в виде разовых инъекций в дозе 200 - 400 мг/кг 1 раз в месяц в течение года. Цель терапии состоит в поддержании уровня IgG на уровне > 5 г/л. При подборе дозы и кратности введений ориентируются на пиковую и минимальную концентрацию IgG. Контроль пиковой концентрации IgG осуществляют не ранее чем через сутки после 1-го внутривенного введения иммуноглобулина. Минимальную концентрацию определяют непосредственно перед следующим введением иммуноглобулина. Минимальная концентрация IgG должна составлять > 5 г/л. Повторные определения минимальной концентрации проводят 1 раз в 3 - 6 мес. Постоянную заместительную терапию иммуноглобулином завершают при отсутствии тяжелых бактериальных инфекций в течение года.
- Всем пациентам с ХЛЛ/ЛМЛ после установления диагноза рекомендуется при отсутствии противопоказаний проведение вакцинации [68 - 71]:
- сезонная вакцинация вакциной для профилактики гриппа [живой]** или вакциной для профилактики гриппа [инактивированной]** (только после восстановления уровня В-лимфоцитов, т.е. через 9 мес. после терапии CD20 (кластеры дифференцировки 20) ингибиторами);
- двукратная вакцинация вакциной для профилактики пневмококковых инфекций при отсутствии противопоказаний;
- вакцинация для профилактики опоясывающего герпеса, при отсутствии противопоказаний.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: пневмококковая иммунизация осуществляется двукратно. Сначала вводится вакцина для профилактики пневмококковой инфекции полисахаридная, конъюгированная, адсорбированная, содержащая 13 пневмококковых антигенов. Через 2 мес. осуществляют введение вакцины для профилактики пневмококковых инфекций, содержащей 23 пневмококковых антигена. Пневмококковая ревакцинация проводится 1 раз в 5 лет.
Применение вакцин против инкапсулированных организмов, таких как Streptococcus pneumoniae, Haemophilus influenzae и Neisseria meningitidis, рекомендовано во многих странах пациентам с ХЛЛ до химиотерапии (не менее чем за 2 нед.) или после восстановления иммунной системы после терапии (не ранее чем через 3 мес). Это особенно важно для пациентов с функциональной аспленией или для тех, у кого планируется спленэктомия. Методика последовательной двукратной вакцинации сформировалась эмпирически на основании того, что ответ на 23-валентную вакцину слабее, чем на 13-валентную. С другой стороны, 23-валентная вакцина позволяет расширить иммунный ответ и усилить его.
Вакцина для профилактики опоясывающего герпеса (рекомбинантная, адъювантная) вводится двукратно с интервалом 2 - 6 месяцев.
Вакцинации по эпидемиологическим показаниям проводятся соответствующими вакцинами (неживыми).
- Всем пациентам с ХЛЛ/ЛМЛ на любом этапе лечения, у которых выявлена клинически значимая анемия, рекомендуется проведение заместительной гемотрансфузионной терапии эритроцитсодержащими компонентами крови (см. приложение А3.6) [72]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ХЛЛ/ЛМЛ на любом этапе лечения, у которых выявлена клинически значимая тромбоцитопения, рекомендуется проведение заместительной терапии тромбоконцентратом (см. приложение А3.6) [73]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.5. Оценка ответа на лечение
- Всем пациентам с ХЛЛ/ЛМЛ рекомендуется оценка терапии по критериям IWCLL 2018 (см. раздел 7.3 данных рекомендаций) при терапии ограниченной длительности (не менее чем через 2 мес. после ее окончания), при непрерывной или поддерживающей терапии (не менее чем через 2 мес. после достижения максимального ответа) [12].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: максимальный ответ определяется как ответ, который не становится лучше в течение последних 2 мес. терапии. Ингибиторы тирозинкиназы брутона (BTK вызывают перераспределительный лимфоцитоз. Персистирующий лимфоцитоз при терапии ибрутинибом** не является признаком рефрактерности. Это состояние обозначается как частичный ответ с лимфоцитозом. Срок нормализации уровня лимфоцитов варьирует в разных исследованиях от 4 до 12 мес.; однако при применении ибрутиниба** лимфоцитоз может персистировать в течение 12 мес. и более, что не влияет на прогноз. У ряда пациентов уровень лимфоцитов никогда не возвращается к норме.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам с ХЛЛ/ЛМЛ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также при необходимости поддерживающая терапия для улучшения результатов лечения и качества жизни пациента [74].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: специальных методов реабилитации при ХЛЛ/ЛМЛ не существует. Реабилитация пациентов с ХЛЛ должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия социальных работников и психологов. Программы реабилитации разрабатываются индивидуально в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем.
Реабилитация при возникновении осложнений заболевания и лечения проводится в рамках соответствующих нозологий.
Поддерживающая терапия при необходимости проводится по месту жительства под наблюдением врача-гематолога или врача-онколога. Врач-гематолог или врач-онколог по месту жительства руководствуется рекомендациями, которые даны специалистами учреждения, проводившего лечение.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Методов профилактики ХЛЛ/ЛМЛ в настоящее время не существует, поскольку неизвестен этиологический фактор или факторы, ведущие к развитию заболевания.
- Всем пациентам с ХЛЛ/ЛМЛ на протяжении всей жизни пациента (как в период лечения, так и вне его) рекомендуется диспансерное наблюдение у врача-гематолога [12, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: в течение 1-го года после завершения лечения пациент должен наблюдаться у врача-гематолога не реже 1 раза в 3 мес. Далее частота наблюдения устанавливается врачом-гематологом индивидуально в зависимости от общего состояния и самочувствия пациента, осложнений проведенной терапии, достигнутого ответа на терапию, но не должна составлять менее 1 раза в год.
При диспансерном наблюдении кроме осмотра пациента и сбора анамнеза необходимо выполнять общий (клинический) анализ крови с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулой), а также, если заболевание сопровождалось лимфаденопатией, инструментальное исследование периферических лимфатических узлов (УЗИ или КТ). Остальные методы обследования могут применяться по усмотрению врача-гематолога.
- Пациентам, у которых проводилось/проводится лечение по поводу ХЛЛ/ЛМЛ, рекомендуется проведение регулярных плановых скрининговых обследований из-за повышенного риска развития вторых опухолей [75, 76].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю "гематология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ХЛЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь пациентам с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении ХЛЛ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь пациентам с ХЛЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ХЛЛ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости - с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "гематология", определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания к экстренной госпитализации:
1. Развитие тяжелой инфекции (необязательна госпитализация в гематологический стационар).
2. Развитие угрожающих жизни цитопений (глубокой анемии, геморрагического синдрома, нейтропении).
3. Развитие осложнений ХЛЛ, включая синдром Рихтера, симптоматическую лимфаденопатию и органомегалию с риском развития тяжелых осложнений, нейролейкемию, специфический плеврит и хилоторакс с признаками дыхательной недостаточности, паранеопластические и аутоиммунные синдромы, другие осложнения, угрожающие жизни.
4. Развитие осложнений терапии, включая синдром лизиса опухоли, тяжелые инфузионные реакции, миелотоксический агранулоцитоз с лихорадкой и другие осложнения, угрожающие жизни.
Показания к плановой госпитализации:
1. Проведение терапии в случаях, требующих круглосуточного наблюдения за пациентом по причине тяжести состояния, обусловленного опухолью, или по причине риска осложнений, связанных с программой лечения или сопутствующими заболеваниями.
2. Обследование пациента, включающее биопсию и инвазивные вмешательства, в случаях, когда оно не может быть проведено амбулаторно.
Показания к выписке пациента из медицинской организации:
1. Завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
2. Отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
3. Необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
4. Решение врачебной комиссии об отсутствии показаний к пребыванию пациента в стационаре в связи с бесперспективностью лечения и необходимостью оказания только паллиативной помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1. Стадирование лимфомы из малых лимфоцитов
Стадирование ЛМЛ осуществляется по результатам обследования в соответствии с критериями классификации Ann Arbor (табл. 7.1) [13].
Таблица 7.1. Стадирование лимфом по Ann Arbor, модификация Cotswold
Стадия I
- Поражение одной лимфатической зоны или структуры [1]
Стадия II
- Поражение 2 или более лимфатических зон по одну сторону диафрагмы;
- локализованное в пределах 1 сегмента поражение 1 экстралимфатического органа или ткани и его регионарных лимфатических узлов с поражением или без поражения других лимфатических областей по ту же сторону диафрагмы
Стадия III
- Поражение лимфатических узлов или структур по обе стороны диафрагмы;
- локализованное в пределах 1 сегмента поражение 1 экстралимфатического органа или ткани и его регионарных лимфатических узлов с поражением других лимфатических областей по обе стороны диафрагмы
Стадия IV
- Диссеминированное (многофокусное) поражение 1 или нескольких экстралимфатических органов с поражением или без поражения лимфатических узлов;
- изолированное поражение экстралимфатического органа с поражением отдаленных (не регионарных) лимфатических узлов;
- поражение печени и/или костного мозга
Для всех стадий
A
- Отсутствие признаков В-стадии
B
Один или более из следующих симптомов:
- температура тела выше 38 °C не менее 3 дней подряд без признаков воспаления;
- ночные профузные поты;
- похудание на 10% массы тела за последние 6 мес.
E
Локализованное экстранодальное поражение (при I - II стадиях):
- локализованное поражение 1 экстралимфатического органа или ткани в пределах 1 сегмента без поражения лимфатических узлов;
- стадия I или II с ограниченным экстранодальным вовлечением прилежащего органа или ткани
--------------------------------
[1] К лимфатическим структурам относят лимфатические узлы, селезенку, вилочковую железу, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки.
7.2. Общая выживаемость пациентов в группах по МПИ
Таблица 7.2. Общая выживаемость пациентов в группах по МПИ
Группа риска
Балл
Число пациентов, абс. (%)
5-летняя ОВ, %
Низкая
0 - 1
340 (29)
93,2
Промежуточная
2 - 3
464 (39)
79,4
Высокая
4 - 6
326 (27)
63,6
Очень высокая
7 - 10
62 (5)
23,3
7.3. Оценка ответа на лечение при ХЛЛ
Оценка ответа на лечение проводится в соответствии с обновленными критериями, предложенными Международной рабочей группой по ХЛЛ (IWCLL) в 2018 г. (табл. 7.3) [12].
Таблица 7.3. Оценка ответа на лечение при хроническом лимфоцитарном лейкозе
Показатель
Полная ремиссия
Частичная ремиссия
Прогрессия
А. Параметры, характеризующие массу опухоли
Лимфаденопатия
отсутствие узлов > 1,5 см
Уменьшение ![]() 50%
50%
Увеличение ![]() 50%
50%
Гепатомегалия
Нет
Уменьшение ![]() 50%
50%
Увеличение ![]() 50%
50%
Спленомегалия
Кранио-каудальный размер селезенки < 13 см
Уменьшение ![]() 50% от величины, на которую увеличена исходно
50% от величины, на которую увеличена исходно
Увеличение ![]() 50%
50%
Лимфоциты крови
< 4 x 109/л
Уменьшение ![]() 50% от исходного уровня
50% от исходного уровня
Увеличение ![]() 50% от исходного уровня
50% от исходного уровня
Костный мозг
Нормоклеточный, < 30% лимфоцитов, нет нодулярного поражения
Уменьшение инфильтрации костного мозга на 50%
-
Конституциональные симптомы
Нет
Любые
Любые
А. Параметры, характеризующие функцию костного мозга
Тромбоциты
> 100 x 109/л
> 100 x 109/л или повышение ![]() 50% от исходного
50% от исходного
Снижение ![]() 50% от исходного по причине ХЛЛ
50% от исходного по причине ХЛЛ
Гемоглобин
> 110 г/л (без трансфузий и эритропоэтинов (B03XA Другие антианемические препараты))
> 110 г/л или повышение ![]() 50% от исходного
50% от исходного
Снижение ![]() 20 г/л от исходного по причине ХЛЛ
20 г/л от исходного по причине ХЛЛ
Нейтрофилы
> 1,5 x 109/л
> 1,5 x 109/л или
повышение > 50% от исходного
-
Стабилизация заболевания устанавливается в ситуациях, не удовлетворяющих критериям ни частичной ремиссии, ни прогрессии.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Выполнен общий (клинический) анализ крови развернутый (при установлении диагноза, при контрольных обследованиях, после завершения терапии, при подозрении на рецидив заболевания)
Да/Нет
2
Выполнено исследование периферической крови методом проточной цитофлуориметрии при наличии абсолютного лимфоцитоза (при установлении диагноза, или подозрении на рецидив заболевания)
Да/Нет
3
Выполнена биопсия лимфатического узла (очага поражения) (при подозрении на лимфому из малых лимфоцитов без лимфоцитоза в крови или при подозрении на трансформацию)
Да/Нет
4
Выполнено патологоанатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов
Да/Нет
5
Выполнена компьютерная томография грудной полости или прицельная рентгенография органов грудной клетки (перед началом терапии, после завершения терапии, при подозрении на рецидив заболевания)
Да/Нет
6
Выполнена компьютерная томография органов брюшной полости или ультразвуковое исследование лимфатических узлов или ультразвуковое исследование органов брюшной полости (комплексное) (перед началом терапии, после завершения терапии, при подозрении на рецидив заболевания)
Да/Нет
7
Проведена противоопухолевая терапия (при наличии показаний)
Да/Нет
Список литературы
1. Packham G., Stevenson F. The role of the B-cell receptor in the pathogenesis of chronic lymphocytic leukaemia//Seminars in Cancer Biology. 2010. Vol. 20, N 6. P. 391 - 399.
2. Vardi A. et al. Immunogenetic studies of chronic lymphocytic leukemia: Revelations and speculations about ontogeny and clinical evolution//Cancer Research. American Association for Cancer Research Inc., 2014. Vol. 74, N 16. P. 4211 - 4216.
3. Murray F. et al. Stereotyped patterns of somatic hypermutation in subsets of patients with chronic lymphocytic leukemia: Implications for the role of antigen selection in leukemogenesis//Blood. 2008. Vol. 111, N 3. P. 1524 - 1533.
4. Strati P., Shanafelt T.D. Monoclonal B-cell lymphocytosis and early-stage chronic lymphocytic leukemia: Diagnosis, natural history, and risk stratification//Blood. American Society of Hematology, 2015. Vol. 126, N 4. P. 454 - 462.
5. Zhang S., Kipps T.J. The Pathogenesis of Chronic Lymphocytic Leukemia//Annual Review of Pathology: Mechanisms of Disease. 2014. Vol. 9, N 1. P. 103 - 118.
6. Burger J.A., Chiorazzi N. B cell receptor signaling in chronic lymphocytic leukemia//Trends in Immunology. 2013. Vol. 34, N 12. P. 592 - 601.
7. Morton L.M. et al. Lymphoma incidence patterns by WHO subtype in the United States, 1992 - 2001//Blood. 2006. Vol. 107, N 1. P. 265 - 276.
8. Watson L., Wyld P., Catovsky D. Disease burden of chronic lymphocytic leukaemia within the European Union//Eur J Haematol. 2008. Vol. 81, N 4. P. 253 - 258.
9. Jemal A. et al. Cancer statistics, 2007.//CA Cancer J Clin. 2007. Vol. 57, N 1. P. 43 - 66.
10. Dores G.M. et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: Overview of the descriptive epidemiology//Br J Haematol. 2007. Vol. 139, N 5. P. 809 - 819.
11. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2018.
12. Hallek M. et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL//Blood. American Society of Hematology, 2018. Vol. 131, N 25. P. 2745 - 2760.
13. Armitage J.O. Staging Non-Hodgkin Lymphoma//CA Cancer J Clin. Wiley, 2005. Vol. 55, N 6. P. 368 - 376.
14. An international prognostic index for patients with chronic lymphocytic leukaemia (CLL-IPI): a meta-analysis of inpidual patient data//Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, N 6. P. 779 - 790.
15. Swerdlow S.H. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms//Blood. 2016.
16. Никитин Е.А. et al. Хронический лимфолейкоз.//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 179 - 200.
17. Мещерякова Л.Н. et al. Лабораторные возможности дифференциальной диагностики анемий//Онкогематология. 2015. Vol. 10, N 2. P. 46 - 50.
18. Morice W.G. et al. Predictive value of blood and bone marrow flow cytometry in B-cell lymphoma classification: Comparative analysis of flow cytometry and tissue biopsy in 252 patients//Mayo Clin Proc. Elsevier Ltd, 2008. Vol. 83, N 7. P. 776 - 785.
19. Rawstron A.C. et al. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia//New England Journal of Medicine. Massachussetts Medical Society, 2008. Vol. 359, N 6. P. 575 - 583.
20. Molica S., Giannarelli D., Montserrat E. Minimal Residual Disease and Survival Outcomes in Patients With Chronic Lymphocytic Leukemia: A Systematic Review and Meta-analysis.//Clin Lymphoma Myeloma Leuk. 2019. Vol. 19, N 7. P. 423 - 430.
21. Sharman J.P. et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3 trial//The Lancet. Lancet Publishing Group, 2020. Vol. 395, N 10232. P. 1278 - 1291.
22. Fischer K. et al. Venetoclax and Obinutuzumab in Patients with CLL and Coexisting Conditions//N Engl J Med. Massachussetts Medical Society, 2019. Vol. 380, N 23. P. 2225 - 2236.
23. Wierda W.G. et al. Ibrutinib Plus Venetoclax for First-Line Treatment of Chronic Lymphocytic Leukemia: Primary Analysis Results From the Minimal Residual Disease Cohort of the Randomized Phase II CAPTIVATE Study//J Clin Oncol. J Clin Oncol, 2021. Vol. 39, N 34. P. 3853 - 3865.
24. Jain N. et al. Ibrutinib and Venetoclax for First-Line Treatment of CLL//N Engl J Med. N Engl J Med, 2019. Vol. 380, N 22. P. 2095 - 2103.
25. Rossi D. et al. Occult hepatitis B virus infection of peripheral blood mononuclear cells among treatment-na ve patients with chronic lymphocytic leukemia//Leuk Lymphoma. 2009. Vol. 50, N 4. P. 604 - 611.
26. Conte M.J. et al. Use of positron emission tomography-computed tomography in the management of patients with chronic lymphocytic leukemia/small lymphocytic lymphoma//Leuk Lymphoma. Informa Healthcare, 2014. Vol. 55, N 9. P. 2079 - 2084.
27. Parikh S.A., Kay N.E., Shanafelt T.D. How we treat Richter syndrome.//Blood. 2014. Vol. 123, N 11. P. 1647 - 1657.
28. Bodey G.P., Kontoyiannis D., Keating M.J. Infections in Patients With Chronic Lymphocytic Leukemia//Chronic Lymphocytic Leukemia. Totowa, NJ: Humana Press, 2004. P. 343 - 359.
29. Клясова Г.А. et al. Возбудители сепсиса у иммунокомпрометированных больных: структура и проблемы антибиотикорезистентности (результаты многоцентрового исследования)//Гематология и трансфузиология. 2007. Vol. 52, N 1. P. 11 - 18.
30. Tam C.S. et al. SEQUOIA: Results of a Phase 3 Randomized Study of Zanubrutinib versus Bendamustine + Rituximab (BR) in Patients with Treatment-Na ve (TN) Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma (CLL/SLL)//Blood. 2021. Vol. 138, N Supplement 1. P. 396 - 396.
31. Tam C.S. et al. Zanubrutinib monotherapy for patients with treatment na ve chronic lymphocytic leukemia and 17p deletion//Haematologica. Haematologica, 2020. Vol. 106, N 9. P. 2354 - 2363.
32. Shanafelt T., Wang V., Kay N. A randomized phase III study of ibrutinib (PCI-32765)-based therapy vs. standard fludarabine, cyclophosphamide, and rituximab (FCR) chemoimmunotherapy in untreated younger patients with chronic lymphocytic leukemia (CLL): a trial of the ECOG-ACRIN Cancer//ASH Annual Meeting. 2018. P. LBA-4.
33. Burger J.A. et al. Ibrutinib for First-Line Treatment of Older Patients With Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma (CLL/SLL): A 4-Year Experience From the REASONATE-2 Study//EHA 23 Proceedings. 2018. P. Abstract PF343.
34. Burger J.A. et al. Randomized trial of ibrutinib vs ibrutinib plus rituximab in patients with chronic lymphocytic leukemia.//Blood. 2019. Vol. 133, N 10. P. 1011 - 1019.
35. Woyach J.A. et al. Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL.//N Engl J Med. 2018. Vol. 379, N 26. P. 2517 - 2528.
36. Woyach J.A. et al. Acalabrutinib plus Obinutuzumab in 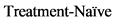 and Relapsed/Refractory Chronic Lymphocytic Leukemia//Cancer Discov. Cancer Discov, 2020. Vol. 10, N 3. P. 394 - 405.
and Relapsed/Refractory Chronic Lymphocytic Leukemia//Cancer Discov. Cancer Discov, 2020. Vol. 10, N 3. P. 394 - 405.
37. Davids M.S. et al. Acalabrutinib, venetoclax, and obinutuzumab as frontline treatment for chronic lymphocytic leukaemia: a single-arm, open-label, phase 2 study//Lancet Oncol. Lancet Oncol, 2021. Vol. 22, N 10. P. 1391 - 1402.
38. Eichhorst B. et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial//Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, N 7. P. 928 - 942.
39. Goede V. et al. Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: updated results of the CLL11 study//Leukemia. Leukemia, 2015. Vol. 29, N 7. P. 1602 - 1604.
40. Moreno C. et al. Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (iLLUMINATE): a multicentre, randomised, open-label, phase 3 trial//Lancet Oncol. 2019. Vol. 20, N 1. P. 43 - 56.
41. Sorror M.L. et al. Five-year follow-up of patients with advanced chronic lymphocytic leukemia treated with allogeneic hematopoietic cell transplantation after nonmyeloablative conditioning//Journal of Clinical Oncology. 2008. Vol. 26, N 30. P. 4912 - 4920.
42. Dreger P. et al. Allogeneic stem cell transplantation provides durable disease control in poor-risk chronic lymphocytic leukemia: Long-term clinical and MRD results of the German CLL Study Group CLL3X trial//Blood. 2010. Vol. 116, N 14. P. 2438 - 2447.
43. Инструкция по медицинскому применению лекарственного препарата Венклекста (ЛП-004678). 2021.
44. Никитин Е.А., Птушкин В.В. Иммунохимиотерапия в лечении хронического лимфолейкоза//Хронический лимфолейкоз. Современная диагностика и лечение. 2nd ed. / ed. Никитин Е.А., Птушкин В.В. Москва: ГЭОТАР-Медиа, 2023. P. 219 - 246.
45. Калашникова О.Б. et al. Современные возможности терапии хронического лимфолейкоза и клиническая практика//Хронический лимфолейкоз. Современная диагностика и лечение. 2nd ed. / ed. Никитин Е.А., Птушкин В.В. Москва: ГЭОТАР-Медиа, 2023. P. 398 - 430.
46. Hallek M. et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: A randomised, open-label, phase 3 trial//The Lancet. Lancet Publishing Group, 2010. Vol. 376, N 9747. P. 1164 - 1174.
47. Fischer K. et al. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: Updated results of the CLL8 trial//Blood. American Society of Hematology, 2016. Vol. 127, N 2. P. 208 - 215.
48. Assouline S. et al. Pharmacokinetics, safety, and efficacy of subcutaneous versus intravenous rituximab plus chemotherapy as treatment for chronic lymphocytic leukaemia (SAWYER): a phase 1b, open-label, randomised controlled non-inferiority trial.//Lancet Haematol. 2016. Vol. 3, N 3. P. e128 - 38.
49. Fischer K. et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: A multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group//Journal of Clinical Oncology. 2012. Vol. 30, N 26. P. 3209 - 3216.
50. Michallet A.S. et al. Rituximab plus bendamustine or chlorambucil for chronic lymphocytic leukemia: Primary analysis of the randomized, open-label mable study//Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, N 4. P. 698 - 706.
51. Nikitin E. Randomised Comparison Of FCR-Lite And ClbR (Chlorambucil Plus Rituximab) Regimens In Elderly Patients With Chronic Lymphocytic Leukemia//EHA 18 Proceedings. 2013. P. Abstract NS1147.
52. Xu W. et al. Treatment of relapsed/refractory chronic lymphocytic leukemia/small lymphocytic lymphoma with the BTK inhibitor zanubrutinib: phase 2, single-arm, multicenter study//Journal of hematology & oncology. - 2020. - Т. 13. - С. 1 - 12.
53. Hillmen P. et al. Rituximab plus chlorambucil as first-line treatment for chronic lymphocytic leukemia: Final analysis of an open-label phase II study//Journal of Clinical Oncology. American Society of Clinical Oncology, 2014. Vol. 32, N 12. P. 1236 - 1241.
54. Goede V. et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions//New England Journal of Medicine. Massachussetts Medical Society, 2014. Vol. 370, N 12. P. 1101 - 1110.
55. Catovsky D., Else M., Richards S. Chlorambucil-still not bad: A reappraisal//Clinical Lymphoma, Myeloma and Leukemia. Elsevier Inc., 2011. Vol. 11, N SUPPL.1. P. S2.
56. Hainsworth J.D. et al. Single-agent rituximab as first-line and maintenance treatment for patients with chronic lymphocytic leukemia or small lymphocytic lymphoma: A phase II trial of the Minnie Pearl Cancer Research Network//Journal of Clinical Oncology. 2003. Vol. 21, N 9. P. 1746 - 1751.
57. Seymour J.F. et al. Venetoclax-Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia.//N Engl J Med. 2018. Vol. 378, N 12. P. 1107 - 1120.
58. Stilgenbauer S. et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: a multicentre, open-label, phase 2 study//Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, N 6. P. 768 - 778.
59. Ghia P. et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia//Journal of Clinical Oncology. American Society of Clinical Oncology (ASCO), 2020. Vol. 38, N 25. P. JCO.19.03355.
60. Hillmen P. et al. First Interim Analysis of ALPINE Study: Results of a Phase 3 Randomized Study of Zanubrutinib vs Ibrutinib in Patients with Relapsed/Refractory Chronic Lymphocytic Lymphoma//EHA Library. 2021. P. 330170.
61. Tam C.S. et al. Life After FCR: Outcomes of patients with chronic lymphocytic leukemia who progress after frontline treatment with Fludarabine, Cyclophosphamide and Rituximab.//Blood. 2014. P. 3059 - 3064.
62. Fischer K. et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: A Multicenter Phase II trial of the German Chronic Lymphocytic Leukemia Study Group//Journal of Clinical Oncology. 2011. Vol. 29, N 26. P. 3559 - 3566.
63. Chanan-Khan A. et al. Ibrutinib combined with bendamustine and rituximab compared with placebo, bendamustine, and rituximab for previously treated chronic lymphocytic leukaemia or small lymphocytic lymphoma (HELIOS): A randomised, double-blind, phase 3 study//Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, N 2. P. 200 - 211.
64. Hallek M. et al. Three-year follow-up of patients with previously treated chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL) receiving ibrutinib plus bendamustine and rituximab (BR) versus placebo plus BR: an update of the HELIOS study.//Leuk Lymphoma. 2017. Vol. 58. P. 192 - 194.
65. Савченко В.Г. и др. Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Москва: Практика, 2018. 1008 p.
66. Maertens J. et al. ECIL guidelines for preventing Pneumocystis jirovecii pneumonia in patients with haematological malignancies and stem cell transplant recipients//Journal of Antimicrobial Chemotherapy. Oxford University Press, 2016. Vol. 71, N 9. P. 1 - 8.
67. Raanani P. et al. Immunoglobulin prophylaxis in chronic lymphocytic leukemia and multiple myeloma: systematic review and meta-analysis.//Leuk Lymphoma. 2009. Vol. 50, N 5. P. 764 - 772.
68. Константинова Т.С., Клясова Г.А., Капланов К.Д. Лечение и профилактика инфекционных осложнений у пациентов с лимфопролиферативными заболеваниями.//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 289 - 311.
69. Rubin L.G. et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host.//Clin Infect Dis. 2014. Vol. 58, N 3. P. 309 - 318.
70. Sinisalo M. et al. Response to vaccination against different types of antigens in patients with chronic lymphocytic leukaemia.//Br J Haematol. 2001. Vol. 114, N 1. P. 107 - 110.
71. Pleyer C. et al. Response to the Shingrix Varicella Zoster Virus (VZV) Vaccine in Patients with Chronic Lymphocytic Leukemia (CLL) That Are Treatment Naive or Treated with a Bruton's Tyrosine Kinase Inhibitor (BTK-I)//Blood. Content Repository Only!, 2019. Vol. 134, N Supplement_1. P. 3053.
72. Busti F. et al. Anemia and iron deficiency in cancer patients: Role of iron replacement therapy//Pharmaceuticals. MDPI AG, 2018. Vol. 11, N 4.
73. Rai K.R., Stilgenbauer S. Overview of the complications of chronic lymphocytic leukemia [Electronic resource]. URL: https://www.uptodate.com/contents/overview-of-the-complications-of-chronic-lymphocytic-leukemia (accessed: 30.10.2020).
74. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am J Phys Med Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
75. Reda G. et al. Secondary Malignancies in Chronic Lymphocytic Leukemia: A Single Centre Retrospective Analysis of 514 Cases//Blood. 2015. Vol. 126, N 23.
76. Beiggi S. et al. Increased risk of second malignancies in chronic lymphocytic leukaemia patients as compared with follicular lymphoma patients: a Canadian population-based study.//Br J Cancer. 2013. Vol. 109, N 5. P. 1287 - 1290.
77. Wo owiec D. et al. Safety and Efficacy of Bendamustine Monotherapy in the First-Line Treatment of Patients with Chronic Lymphocytic Leukemia: Polish Lymphoma Research Group Real-Life Analysis//Chemotherapy. 2019. Vol. 64, N 3. P. 155 - 162.
78. Baltasar P. et al. Efficacy and Safety of Treatment Venetoclax Monotherapy or Combined with Rituximab in Patients with Relapsed/Refractory Chronic Lymphocytic Leukemia (CLL) in the Real-World Setting in Spain: The Venares Study//Blood. 2021. Vol. 138, N Supplement 1. P. 1561 - 1561.
79. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am J Clin Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
80. Linn B.S., Linn M.W., Gurel L. Cumulative illness rating scale//J Am Geriatr Soc. 1968. Vol. 16, N 5. P. 622 - 626.
81. D. Catovsky, S. Richards, E. Matutes, et al., UK National Cancer Research Institute (NCRI) Haematological Oncology Clinical Studies Group; NCRI Chronic Lymphocytic Leukaemia Working Group Assessment of fludarabine plus cyclophosphamide for patients with chronic lymphocytic leukaemia (the LRF CLL4 trial): a randomised controlled trial Lancet, 370 (2007), pp. 230 - 239.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Аль-Ради Любовь Саттаровна, к.м.н., зам. заведующего консультативным гематологическим отделением с дневным стационаром по проведению интенсивной высокодозной терапии "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
2. Бялик Татьяна Евгеньевна, к.м.н., врач-онкогематолог, ассистент кафедры онкологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России.
3. Капланов Камиль Даниялович, к.м.н., заведующий гематологическим отделением N 11, ГБУЗ ГКБ им. С.П. Боткина ДЗМ, член Российского общества онкогематологов, член Национального гематологического общества.
4. Лопаткина Татьяна Николаевна, к.м.н., врач-терапевт, гастроэнтеролог, доцент кафедры терапии, профессиональных болезней и пульмонологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России.
5. Луговская Светлана Алексеевна, д.м.н., профессор кафедры клинической лабораторной диагностики ГБОУ ДПО РМАНПО Минздрава России, член Национального гематологического общества.
6. Мухортова Ольга Валентиновна, д.м.н., врач-радилог высшей категории, старший научный сотрудник отдела ядерной диагностики (ПЭТ-центра) на базе ФГБУ "НМИЦ сердечно-сосудистой хирургии им. А.Н. Бакулева" Минздрава России.
7. Никитин Евгений Александрович, д.м.н., профессор, заведующий дневным стационаром гематологии, онкологии и химиотерапии городского гематологического центра ГБУЗ ГКБ им. С.П. Боткина ДЗМ, член правления Российского общества онкогематологов, член правления Национального гематологического общества.
8. Османов Евгений Александрович, д.м.н., профессор, зав. отделом гематологии и трансплантации костного мозга ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, профессор кафедры онкологии ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России, член правления Национального гематологического общества.
9. Поддубная Ирина Владимировна, академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов.
10. Самойлова Ольга Сергеевна, к.м.н., врач-гематолог, заведующая гематологическим отделением Нижегородской областной клинической больницы им. Н.А. Семашко, главный внештатный гематолог Приволжского федерального округа, член Российского общества онкогематологов, член Национального гематологического общества.
11. Стадник Елена Александровна, к.м.н., доцент кафедры факультетской терапии ФГБОУ ВО "ПСПбГМУ им. И.П. Павлова" Минздрава России, старший научный сотрудник ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России, член Российского общества онкогематологов.
12. Стефанов Дмитрий Николаевич, научный сотрудник научно-организационного отдела, ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, врач-резидент отделения патологии, медицинский центр Шиба Тель аШомер, член Российского общества онкогематологов
13. Фалалеева Наталья Александровна, д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов.
14. Байков Вадим Валентинович, д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
15. Ковригина Алла Михайловна, д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением "НМИЦ гематологии" Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- врачи-гематологи;
- врачи-онкологи;
- студенты медицинских вузов.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств: поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0,3.
Поиск в электронных базах данных.
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных метаанализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А1 - А3).
В настоящих клинических рекомендациях приведены уровни достоверности доказательств и уровни убедительности рекомендаций в соответствии рекомендациями по разработке и актуализации клинических рекомендаций (приказ Минздрава России от 28.02.2019 N 103н).
Таблица А1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Методология валидизации рекомендаций
Методы валидизации:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание методики валидизации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2017 - 2018 гг., на форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний "Лимфорум", ежегодной российской конференции с международным участием "Злокачественные лимфомы", а также в рамках IV Конгресса гематологов России.
Порядок обновления клинических рекомендаций
Актуализация проводится не реже чем 1 раз в 3 года или при появлении новой информации о диагностике и тактике ведения пациентов, страдающих ХЛЛ/ЛМЛ, но не чаще 1 раза в 6 месяцев. Решение об обновлении принимает Минздрав России на основе предложений медицинских профессиональных некоммерческих организаций. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ЗНАЧЕНИЕ МАРКЕРОВ ВИРУСА ГЕПАТИТА B ПРИ ХЛЛ
Клетки ХЛЛ могут быть дополнительным резервуаром для вируса гепатита В. Латентная инфекция, вызванная HBV, выявляется у пациентов с ХЛЛ чаще. Значение маркеров HBV-инфекции и предполагаемые действия представлены в табл. 3.1.
Таблица А3.1. Значение маркеров вирусного гепатита B
Расшифровка
HBs-Ag
Анти-HBc
Анти-HBs
ДНК HBV
Действия
Не контактировал с HBV
-
-
-
-
Провести вакцинацию.
Противопоказаний к CD20 (кластеры дифференцировки 20) ингибиторам нет
Вакцинация проведена
-
-
+
-
Противопоказаний к CD20 (кластеры дифференцировки 20) ингибиторам нет
Реконвалесцент
-
+
+
-
Противопоказаний к CD20 (кластеры дифференцировки 20) ингибиторам нет
Возможное латентное носительство HBV
-
+
-
+/-
Контроль ДНК HBV каждые 2 мес. во время терапии CD20 (кластеры дифференцировки 20) ингибиторами назначение противовирусной терапии при появлении HBsAg или ДНК HBV
Неактивное носительство HBsAg
+
![]()
-
![]()
Назначение противовирусных препаратов системного действия во время терапии CD20 (кластеры дифференцировки 20) ингибиторы + + год после окончания
Хронический гепатит B
+
<*>
<*>
![]()
Отказаться от CD20 (кластеры дифференцировки 20) ингибиторов или противовирусная терапия до терапии, весь период лечения + 1 год после окончания <*>
--------------------------------
<*> При необходимости назначения CD20 (кластеры дифференцировки 20) ингибиторов показан постоянный прием энтекавира** 0,5 мг/сут. Энтекавир** назначают на весь период лечения/поддерживающей терапии и не менее 1 года после завершения иммуносупрессивной терапии при неоднократных отрицательных результатах тестирования на ДНК вируса гепатита B в крови. Оптимальная продолжительность терапии энтекавиром** после завершения терапии ритуксимабом** не определена. Если пациенту с ХЛЛ специфическая терапия не показана, в профилактическом назначении энтекавира** нет необходимости. Ламивудин** не должен применяться у пациентов с ХЛЛ, поскольку речь всегда идет о длительном приеме противовирусных препаратов системного действия. К концу 2-го года приема ламивудина** к этому препарату устойчиво более 40% штаммов HBV, к концу 4-го года приема - 70% штаммов HBV. При развитии устойчивости к энтекавиру** показан переход на тенофовир**.
Приложение А3.2
ПОКАЗАНИЯ К НАЧАЛУ ЛЕЧЕНИЯ ХЛЛ/ЛМЛ
Терапия ХЛЛ/ЛМЛ должна начинаться при наличии как минимум 1 из следующих показаний по критериям IWCLL 2018 [12]:
1. Стадия С по J.L. Binet.
2. Один или более симптомов интоксикации:
- потеря > 10% массы тела за 6 мес. (если пациент не принимал меры для похудания);
- слабость (общее состояние по ECOG ![]() 2, нетрудоспособность);
2, нетрудоспособность);
- субфебрильная лихорадка в течение ![]() 2 нед. без признаков инфекции;
2 нед. без признаков инфекции;
- ночные поты, сохраняющиеся более 1 мес., без признаков инфекции.
3. Нарастающая анемия и/или тромбоцитопения, обусловленная инфильтрацией костного мозга.
4. Аутоиммунная анемия и/или тромбоцитопения, резистентная к преднизолону.
5. Большие размеры селезенки (> 6 см ниже реберной дуги), явное увеличение органа.
6. Массивная (![]() 10 см в максимальном диаметре) и/или нарастающая лимфаденопатия.
10 см в максимальном диаметре) и/или нарастающая лимфаденопатия.
7. Время удвоения числа лимфоцитов менее 6 мес.
8. Экстранодальное поражение, симптомное или влияющее на функцию пораженного органа.
Приложение А3.3
РЕЖИМЫ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ ХЛЛ
Монотерапия
Монотерапия хлорамбуцилом** - курсовой формат [81];
- #Хлорамбуцил** - 10 мг/м2 внутрь в 1 - 7-й дни.
Лечение возобновляется на 29-й день.
Монотерапия #хлорамбуцилом** - постоянный формат [55];
- #Хлорамбуцил** - 60 - 70 мг/м2 внутрь ежедневно в течение 2 - 4 нед. с последующим подбором дозы.
Монотерапия #бендамустином** [77]
- #Бендамустин** - 100 мг/м2 в/в в 1-й, 2-й дни.
Лечение возобновляется на 29-й день.
Монотерапия ибрутинибом** [32].
- Ибрутиниб** - 420 мг/сут (3 капсулы) внутрь 1 раз в день до прогрессирования или развития непереносимой токсичности.
Монотерапия акалабрутинибом** [59];
- Акалабрутиниб** - 100 мг (1 капсула) внутрь 2 раза в день до прогрессирования или развития непереносимой токсичности.
Монотерапия венетоклаксом** [78]
- Венетоклакс** - 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), до прогрессирования или развития непереносимой токсичности.
Монотерапия #занубрутинибом [30, 31]
- #Занубрутиниб - 160 мг (2 капсулы) 2 раза в день до прогрессирования или развития непереносимой токсичности.
Полихимиотерапия
FCR внутривенный [32, 44, 46]
- Ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап. или #ритуксимаб** 1600 мг п/к, день 1 [48].
- #Флударабин** - 25 мг/м2 в/в кап., дни 1 - 3.
- #Циклофосфамид** - 250 мг/м2 в/в кап., дни 1 - 3.
Лечение возобновляется на 29-й день.
Рекомендованное количество циклов 6.
FCR пероральный [44]
- Ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап. или #ритуксимаб** 1600 мг п/к, день 1 [48].
- #Флударабин** - 40 мг/м2 внутрь, дни 1 - 3.
- #Циклофосфамид** - 250 мг/м2 внутрь, дни 1 - 3.
Лечение возобновляется на 29-й день.
FCR-Lite [44, 51]
- Ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап.
- #Флударабин** - 20 мг/м2 внутрь, дни 1 - 3.
- #Циклофосфамид** - 150 мг/м2 внутрь, дни 1 - 3.
Лечение возобновляется на 29-й день.
RB [38, 49, 50]
- Ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап.
- #Бендамустин** - 90 мг/м2 в/в кап., дни 1, 2.
Лечение возобновляется на 29-й день.
Chl-R [53]
- Ритуксимаб** - 1 цикл: 375 мг/м2 в/в кап., день 1, последующие циклы: ритуксимаб** 500 мг/м2 в/в кап.
- #Хлорамбуцил** - 10 мг/м2 внутрь, дни 1 - 7.
Лечение возобновляется на 29-й день.
Chl-G [21, 40, 54]
- Обинутузумаб** - 1000 мг в/в, день 1 (100 мг в течение 4 часов), 2 (900 мг), 8, 15 (цикл 1), день 1 (циклы 2 - 6).
- #Хлорамбуцил** - 0,5 мг/кг внутрь, дни 1, 15.
Лечение возобновляется на 29-й день.
Акалабрутиниб** + #обинутузумаб ** [21, 36]
- Акалабрутиниб** - 100 мг (1 капсула) внутрь 2 раза в день до прогрессирования или развития непереносимой токсичности.
- #Обинутузумаб** - 100 мг, день 1 цикла 2; 900 мг день 2 цикла 2; 1000 мг день 8 цикла 2; 1000 мг день 15 цикла 2; 1000 мг день 1 циклов 3 - 7.
Лечение возобновляется на 29-й день, всего 7 циклов.
Венетоклакс** + ритуксимаб** [57, 78]
- Венетоклакс** - 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом**.
- Ритуксимаб** - 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса** 400 мг/сут, далее - ритуксимаб** 500 мг/м2 в/в кап. ежемесячно, всего 6 введений.
Венетоклакс** + #обинутузумаб** [22]
- #Обинутузумаб** - 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3 - 6.
- Венетоклакс** - 20 мг/сут, дни 22 - 28 цикла 1; 50 мг/сут дни 1 - 7 цикла 2; 100 мг/сут дни 8 - 14 цикла 2; 200 мг/сут дни 15 - 21 цикла 2; 400 мг/сут дни 22 - 28 цикла 2, далее 400 мг/сут в течение 12 циклов по 28 дней каждый.
#Венетоклакс** + ибрутиниб** [23, 24]
- Ибрутиниб** - 420 мг/сут (3 капсулы) внутрь 1 раз в день в течение 3 циклов, далее в комбинации с венетоклаксом** в течение 12 циклов
- #Венетоклакс** - 20 мг/сут 1 неделя, 50 мг/сут 2 неделя; 100 мг/сут 3 неделя; 200 мг/сут 4 неделя; 400 мг/сут 5 неделя и далее 400 мг/сут, с 1 дня 4 цикла ибрутиниба**.
Ибрутиниб** + BR [63, 64]
- Ибрутиниб** - 420 мг/сут (3 капсулы) внутрь 1 раз в день ежедневно в течение всего курса и далее (после завершения циклов BR) - до прогрессирования или развития неприемлемой токсичности.
- #Бендамустин** - 70 мг/м2 в/в кап., дни 2 - 3 цикла 1; дни 1, 2 циклов 2 - 6.
- Ритуксимаб** - 375 мг/м2 в/в кап., день 1 цикла 1; ритуксимаб** 500 мг/м2 в/в кап.
Лечение возобновляется на 29-й день, всего 6 циклов.
Ибрутиниб** + #обинутузумаб** [40]
- Ибрутиниб** - 420 мг/сут (3 капсулы) внутрь 1 раз в день ежедневно в течение всего курса и далее (после завершения циклов BR) - до прогрессирования или развития неприемлемой токсичности.
- #Обинутузумаб** - 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3 - 6.
Приложение А3.4
СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ
ПРИ ВВЕДЕНИИ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ И КОНЪЮГАТОВ
АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО У ПАЦИЕНТОВ С ХЛЛ/ЛМЛ
Моноклональные антитела и конъюгаты антитело-лекарственное средство - это класс препаратов, которые обладают высокой селективностью в отношении молекулярной мишени, являющейся, как правило, одним из ключевых компонентов патологического процесса. Антитела обладают способностью точно связываться с антигеном благодаря специальным антигенсвязывающим участкам, имеющим к нему высокую специфичность.
В последнее десятилетие методы таргетного воздействия на опухолевые клетки при злокачественных новообразованиях крови показали свою высокую эффективность и были включены в многочисленные национальные рекомендации по лечению гемобластозов, как при рецидиве, так и впервой линии терапии.
Учитывая, что моноклональные антитела и конъюгаты антитело-лекарственное средство представлены белковой молекулой, способной вызывать нежелательные реакции, главным образом инфузионные, разработан алгоритм, позволяющий упразднить побочные явления, связанные с введением терапевтических моноклональных антител и конъюгаты антитело-лекарственное средство.
Моноклональные антитела и конъюгаты антитело-лекарственное средство вызывают развитие широкого спектра побочных эффектов: от головной боли и сыпи до анафилаксии и токсидермии. Инфузионные реакции на введение моноклональных антител и конъюгаты антитело-лекарственное средство предположительно имеют в своей основе иммунные механизмы: массивное высвобождение цитокинов и IgE-опосредованные механизмы.
Для предупреждения развития инфузионных реакций непосредственно перед введением моноклональных антител и конъюгатов антитело-лекарственное средство рекомендовано проведение премедикации.
При возникновении инфузионных реакций: заложенность носа, кашель, аллергический ринит, озноб, першение в горле, одышка, тошнота, отек, изменение артериального давления - любой степени тяжести, следует немедленно прекратить введение препарата и устранить возникшие симптомы путем введения глюкокортикоидов, кислорода, препаратов для лечения обструктивных заболеваний дыхательных путей, антигистаминных средств системного действия, затем решить вопрос о возможности продолжения введения. При развитии тяжелых или труднокупируемых инфузионных реакций проводится осмотр (консультация) врачом-анестезиологом-реаниматологом первичный. При развитии анафилактического шока первым вводится эпинефрин** и инфузионная нагрузка с последующим введением дексаметазона** или преднизолона**.
А3.4.1. Ритуксимаб**
Введение ритуксимаба** может сопровождаться инфузионными реакциями: озноб, слабость, одышка, диспепсия, тошнота, сыпь, артериальная гипотензия или гипертензия, лихорадка, зуд, крапивница, раздражение глотки, ринит, тахикардия, рвота, боли, признаки синдрома лизиса опухоли. Препарат вводят согласно инструкции.
У большинства больных в ходе первой инфузии отмечается инфузионный симптомокомплекс от легкой до умеренной степени выраженности, заключающийся в появлении лихорадки и озноба/дрожи. Другими часто наблюдающимися инфузионными симптомами являются тошнота, зуд, ангионевротический отек, астения, гипотензия, головная боль, бронхоспазм, раздражение в горле, ринит, крапивница, сыпь, рвота, миалгия, головокружение, гипертензия. Как правило, эти реакции возникают в пределах 30 - 120 мин после начала первой инфузии и исчезают после замедления или прерывания введения препарата и проведения поддерживающих мероприятий Легкие или умеренно выраженные реакции могут быть устранены уменьшением скорости введения, которую можно вновь увеличить после исчезновения симптоматики. Пациентам, у которых развились инфузионные реакции 1 - 3 степени, следует снизить скорость введения при возобновлении инфузии. При развитии анафилактической реакции или жизнеугрожающей инфузионной реакции 4-й степени необходимо окончательно прекратить введение ритуксимаба** и оказать необходимую экстренную помощь.
В связи с опасностью развития гипотензии рекомендуется отмена антигипертензивных препаратов за 12 ч до начала и на протяжении всего времени инфузии ритуксимаба**.
А3.4.2. Обинутузумаб**
Рекомендуемая доза обинутузумаба** при хроническом лимфолейкозе составляет 1000 мг внутривенно в дни 1 (или 1 + 2), в день 8 и день 15 1-го 28-дневного цикла (таб. 3), затем 1000 мг в циклах 2 - 6; при лимфомах доза обинутузумаба** составляет 1000 мг в каждом цикле лечения. Препарат вводят согласно инструкции.
При применении обинутузумаба** могут наблюдаться инфузионные реакции (в том числе, тяжелые. Наиболее частые - тошнота, рвота, озноб, понижение/повышение АД, повышение температуры тела, одышка, приливы, головная боль, тахикардия и диарея. В соответствии с инструкцией по применению препарата, для предупреждения развития инфузионных реакций всем пациентам следует проводить премедикацию препаратами из группы анальгетиков (N02 по АТХ), антигистаминных средств системного действия (R06A по АТХ) и глюкокортикоидов (H02AB по АТХ); отменять прием антигипертензивных препаратов (C02 по АТХ) утром в день первой инфузии, а также поэтапно вводить дозу в цикле 1.
При развитии инфузионной реакции следует скорректировать скорость инфузии в зависимости от степени тяжести наблюдаемой реакции: при развитии реакции 1 - 3 степени следует временно приостановить инфузию и провести медикаментозную терапию, необходимую для устранения симптомов. При развитии реакции 4-й степени следует прервать инфузию и полностью прекратить терапию. После разрешения симптомов инфузионной реакции инфузию можно возобновить (за исключением случаев 4-й степени) со скоростью в 2 раза ниже, чем скорость, при которой развились реакции. Если у пациента не наблюдается повторение того же самого нежелательного явления той же самой степени тяжести, можно повышать скорость инфузии с тем же шагом и интервалом, которые рекомендованы. Если скорость возобновленной инфузии переносится плохо, необходимо следовать рекомендациям по скорости инфузии для цикла 1, день 1 и день 2.
Во время инфузии обинутузумаба** возможно понижение АД. В связи с этим следует рассмотреть возможность приостановки лечения антигипертензивными препаратами в течение 12 ч перед каждой инфузией, на протяжении каждой инфузии и в продолжение 1 ч после введения обинутузумаба**.
На фоне терапии обинутузумабом** возможно развитие анафилаксии, при этом возможны затруднения при дифференциальной диагностике реакции гиперчувствительности и инфузионной реакции. Если во время инфузии подозревается развитие реакции гиперчувствительности (развитие симптомов происходит, как правило, при последующих введениях, очень редко симптомы развиваются во время первой инфузии), введение должно быть прекращено, и терапию обинутузумабом** следует отменить.
Пациентам из группы риска развития синдрома лизиса опухоли (с большой опухолевой массой и/или высоким содержанием лимфоцитов в периферической крови и/или почечной недостаточностью с клиренсом креатинина < 70 мл/мин) необходимо провести профилактику синдрома, включающую адекватную гидратацию и назначение ингибиторов образования мочевой кислоты до начала инфузии.
Приложение А3.5
ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ
Инфекции являются ведущими осложнениями при лечении ХЛЛ/ЛМЛ, частота инфекционных осложнений варьирует от 10 до 30%, она выше в период индукции ремиссии, при резистентном варианте заболевания, при сопутствующей гипогаммаглобулинемии, в период вынужденной гиподинамии и постоянного постельного режима. Важным фактором, определяющим развитие инфекционных осложнений, является нейтропения (нейтрофилы < 0,5 x 109/л) или лейкопения (лейкоциты ![]() 000 x 109/л), а также длительность нейтропении - частота инфекций существенно возрастает при длительности нейтропении более 10 дней. Риск развития инфекций возрастает при нарушении фагоцитарной функции нейтрофилов, при дефектах клеточного и гуморального иммунитета, повреждении слизистых оболочек желудочно-кишечного тракта (особенно мукозитах III - IV степени), наличии центрального венозного катетера (ЦВК). Источником развития инфекции, как правило, является желудочно-кишечный тракт, когда активно происходит транслокация микроорганизмов со слизистой оболочки, поврежденной в результате химиотерапии. Другие основные входные ворота инфекции при нейтропении - ЦВК. Инфекционные осложнения у пациентов с ХЛЛ/ЛМЛ характеризуются разнообразием как по этиологии, так и по локализации инфекционного процесса.
000 x 109/л), а также длительность нейтропении - частота инфекций существенно возрастает при длительности нейтропении более 10 дней. Риск развития инфекций возрастает при нарушении фагоцитарной функции нейтрофилов, при дефектах клеточного и гуморального иммунитета, повреждении слизистых оболочек желудочно-кишечного тракта (особенно мукозитах III - IV степени), наличии центрального венозного катетера (ЦВК). Источником развития инфекции, как правило, является желудочно-кишечный тракт, когда активно происходит транслокация микроорганизмов со слизистой оболочки, поврежденной в результате химиотерапии. Другие основные входные ворота инфекции при нейтропении - ЦВК. Инфекционные осложнения у пациентов с ХЛЛ/ЛМЛ характеризуются разнообразием как по этиологии, так и по локализации инфекционного процесса.
Высокая частота инфекционных осложнений у гематологических пациентов, особенно в период нейтропении, диктует необходимость назначения препаратов для профилактики. Профилактика показана для инфекций, вызванных грибами и вирусами в группе высокого риска. Профилактика бактериальных инфекций становится менее актуальной по причине увеличения полирезистентных бактерий и проводится у определенной категории больных.
Профилактика пневмоцистной пневмонии [65, 66]:
- Показания:
- Терапия глюкокортикоидами.
- Лечение препаратами, приводящими к снижению числа лимфоцитов CD4.
- Пациенты, имеющие в анамнезе пневмоцистную пневмонию.
- Назначают один из следующих препаратов:
- Ко-тримоксазол [Сульфаметоксазол + Триметоприм]** назначают по 800 мг + 160 мг 1 раз в сутки в течение 7 дней. В случае плохой переносимости препарата можно рассмотреть снижение суточной дозы до 400 мг + 80 мг ежедневно.
- #Дапсон** 100 мг внутрь ежедневно.
- Препараты могут применяться в период цитостатической терапии и в течение всего периода нейтропении.
- Использование Ко-тримоксазола [Сульфаметоксазол + Триметоприм]** одновременно предупреждает инфекции, вызываемые Toxoplasma gondii, Listeria monocytogenes, Nocardia asteroides.
Противогрибковая профилактика [65]:
- Проводится пациентам с отягощенным анамнезом (острый диссеминированный кандидоз, хронический диссеминированный кандидоз, мукормикоз или инвазивный аспергиллез).
- Назначают препарат, при использовании которого было достигнуто излечение от инвазивного микоза.
- Пациенты с наличием в анамнезе острого или хронического диссеминированного кандидоза (обычно один препарат из перечня) в дозировках согласно инструкции по применению:
- Флуконазол**, по 400 мг в сутки, внутривенно или внутрь;
- #Микафунгин**, по 50 мг в сутки внутривенно;
- Пациенты с наличием в анамнезе инвазивного аспергиллеза (обычно один препарат из перечня) в дозировках согласно инструкции по применению:
- #Вориконазол**, по 200 мг 2 раза в сутки внутрь (в таблетках, натощак) или 3 - 4 мг/кг 2 раза в сутки внутривенно;
- Позаконазол**, по 200 мг 3 раза в сутки внутрь (после еды);
- #Итраконазол, по 5 мг/кг 2 раза в сутки внутрь (натощак).
- Пациенты с наличием в анамнезе мукормикоза:
- Позаконазол** (суспензия), по 200 мг 3 раза в сутки внутрь (после еды).
Профилактика вирусных инфекций [65]:
- Показана пациентам, имеющим отягощенный анамнез (частые, рецидивирующие эпизоды герпетических инфекций).
- Используют следующие препараты для профилактики вирусных инфекций в дозировках согласно инструкции по применению:
- #Ацикловир**;
- Валациковир**;
- #Фамцикловир.
- Противовирусную профилактику применяют в течение 3 - 5 недель с 1-го дня специфической терапии. Перевод с пероральной на внутривенную форму проводят у пациентов с мукозитом.
Приложение А3.6
ПРИМЕНЕНИЕ КОМПОНЕНТОВ ДОНОРСКОЙ КРОВИ
Применение компонентов донорской крови у пациентов с хроническим лимфолейкозом регламентируется Приказами Минздрава РФ 797, 1170н, 1134н, 1128н.
Основным медицинским показанием к трансфузии эритроцитов у гематологических пациентов является неадекватная оксигенация органов и тканей и связанный с этим риск осложнений. Переливание донорских тромбоцитов гематологическим пациентам проводят с целью профилактики спонтанных геморрагических осложнений на фоне глубокой тромбоцитопении, индуцированной проведением интенсивной химиотерапии, или с лечебной целью пациентам с уже имеющимися геморрагическими осложнениями.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Приложение Б1
АЛГОРИТМ ВЫБОРА ПЕРВОЙ ЛИНИИ ТЕРАПИИ ПАЦИЕНТА С ХЛЛ/ЛМЛ
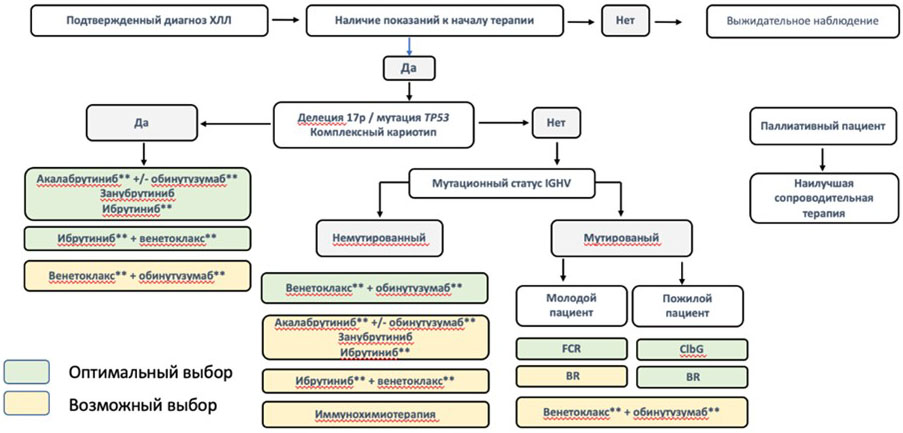
Приложение Б2
АЛГОРИТМ ВЫБОРА ТЕРАПИИ РЕЦИДИВА ХЛЛ/ЛМЛ
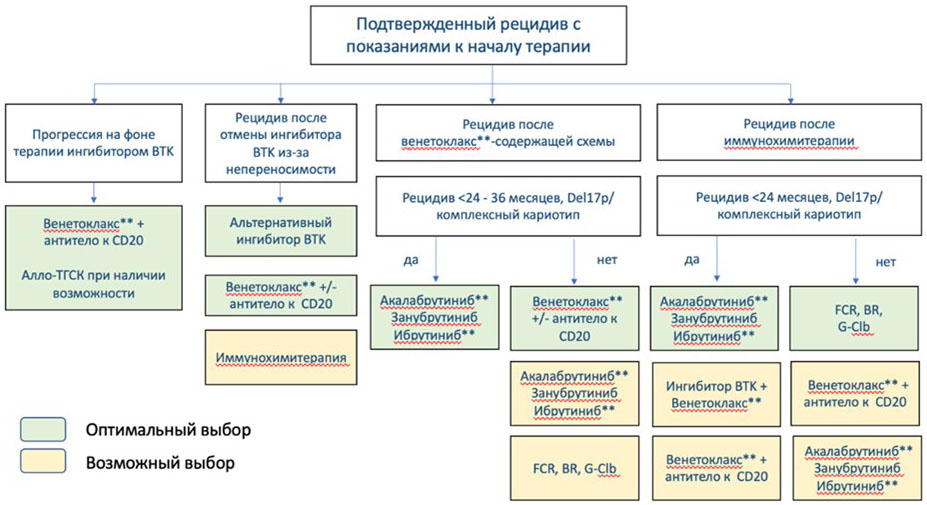
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Хронический лимфоцитарный лейкоз (ХЛЛ) представляет собой онкологическое заболевание, поражающее клетки крови и костного мозга. При хроническом ХЛЛ костный мозг вырабатывает патологически измененные, не способные выполнять свои функции лимфоциты. Они накапливаются в крови и различных органах и вытесняют нормальные клетки крови. Слово "хронический" в названии указывает, что это заболевание протекает доброкачественно.
Лимфомой из малых лимфоцитов (ЛМЛ) называется особое проявление хронического ХЛЛ, при котором патологические лимфоциты накапливаются не в крови или костном мозге, а в лимфатических узлах.
Еще 10 лет назад считалось, что ХЛЛ/ЛМЛ заболевают в основном пожилые люди. Однако по мере улучшения диагностики оказалось, что это заболевание может возникать и у молодых людей (40 - 50 лет), причем в этом возрасте оно протекает менее благоприятно.
Врач может заподозрить ХЛЛ/ЛМЛ, опираясь на Ваши жалобы и обнаружив соответствующие симптомы при осмотре. В этом случае будет необходимо пройти ряд обследований, включая анализ крови и костного мозга. При ХЛЛ самый важный анализ - это анализ крови, без него диагноз не ставится. В анализе крови выявляется увеличение числа лимфоцитов. Диагноз обязательно подтверждается специальным исследованием - иммунофенотипированием лимфоцитов. Могут понадобиться и другие уточняющие диагноз исследования. При ЛМЛ диагноз ставится по результатам гистологического и иммуногистохимического исследования пораженного лимфатического узла.
К сожалению, на сегодняшний день ХЛЛ/ЛМЛ неизлечим. Однако у некоторых пациентов необходимость в лечении не возникает никогда - ХЛЛ/ЛМЛ может оставаться в стабильном состоянии в течение многих лет и даже десятилетий. Было проведено много исследований, в которых сравнивалось выжидательное наблюдение и раннее начало терапии (сразу после установления диагноза). Оказалось, что лечение на ранних этапах никакого преимущества не дает, но вызывает токсические эффекты. Поэтому тактика ведения ХЛЛ/ЛМЛ выстраивается с учетом течения этой болезни - лечение применяют по мере необходимости, поскольку оно само по себе небезопасно, и тактика выжидательного наблюдения остается стандартом для многих пациентов.
Если имеются четкие признаки прогрессирования заболевания - устойчивый рост лимфоцитоза, увеличение лимфатических узлов, селезенки, появление анемии и тромбоцитопении, врач предложит определенный курс лечения.
Выбирая лечение, доктор учитывает:
- состояние болезни (клиническую картину и прогностические факторы);
- состояние пациента (возраст, сопутствующие заболевания);
- какое лечение проводилось раньше и когда наступил рецидив.
В результате у большинства пациентов заболевание удается эффективно контролировать современными лекарствами.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ECOG
Клиническая оценка общего состояния пациента с ХЛЛ/ЛМЛ проводится по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) [79].
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 65
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Смерть
Приложение Г2
ШКАЛА ОЦЕНКИ КОМОРБИДНОСТИ CIRS
Клиническая оценка коморбидности пациента с ХЛЛ/ЛМЛ может проводиться по Кумуляционной шкале коморбидности [80].
Оригинальное название: Cumulative Illness Rating Scale
Источник: Linn, B. et al. Cumulative Illness Rating Scale. Journal of the American Geriatrics Society.
Тип: шкала оценки
Назначение: клиническая оценка коморбидности
Содержание и интерпретация:
Баллы
0
1
2
3
4
Болезни сердца
Болезни сосудов (кровеносных и лимфатических)
Болезни крови (костного мозга, селезенки и периферической крови
Болезни органов дыхательной системы (трахеи, бронхов и легких)
Болезни органов чувств (глаз, носа, ушей, глотки и гортани)
Болезни органов верхних отделов пищеварительной системы (пищевода, желудка, двенадцатиперстной кишки, поджелудочной железы (не включая СД) и желчного пузыря)
Болезни органов нижних отделов пищеварительной системы (тонкого и толстого кишечника)
Болезни печени
Болезни почек
Болезни органов мочеполовой системы (мочеточников, мочевого пузыря, мочеиспускательного канала, предстательной железы и половых органов)
Болезни органов опорно-двигательной системы (мышц, суставов, костей) и кожных покровов
Болезни органов центральной и периферической нервной системы (головного мозга, спинного мозга и нервов)
Болезни органов эндокринной системы и нарушения метаболизма (включая сахарный диабет)
Психические нарушения
Сумма баллов
Оценка органов и систем:
0 баллов: отсутствие заболеваний в этой системе органов или наличие патологии, которая не мешает нормальной жизнедеятельности, не влияет на прогноз и не требует лечения.
1 балл: легкие отклонения от нормы или перенесенные в прошлом заболевания.
2 балла: заболевание, при котором необходимо назначение медикаментозной терапии.
3 балла: заболевание, ставшее причиной инвалидности.
4 балла: жизнеугрожающее заболевание, требующее проведения неотложной терапии.
