"Клинические рекомендации "Экстракраниальные герминогенные опухоли"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЭКСТРАКРАНИАЛЬНЫЕ ГЕРМИНОГЕННЫЕ ОПУХОЛИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C38.1, C48.0, C49.5, C62, C49.0, C49.9, C62.0, C62.1, C62.9, C56, D15, D20, D21, D28, D29, D36
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 69_2
Возрастная категория: Дети
Специальность:
Разработчик клинической рекомендации
Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АФП - альфа-фетопротеин
БЛРС - бета-лактамазы расширенного спектра
БЭН - белково-энергетическая недостаточность
![]() -ХГЧ -
-ХГЧ - ![]() -субъединица хорионического гонадотропина человека
-субъединица хорионического гонадотропина человека
БАК - биохимический анализ крови общетерапевтический
ВОЗ - Всемирная организация здравоохранения
ГКО - герминогенные опухоли
ДНК - дезоксирибонуклеиновая кислота
ИГХ - иммуногистохимическое исследование
ИФА - иммуноферментный анализ
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
МРТ - магнитно-резонансная томография
МСКТ - мультиспиральная компьютерная томография
МРСЗ - метициллин-резистентный золотистый стафилококк
МТС - метастатическое поражение
ОЖМ - опухоль желточного мешка
ПСКК - аферез периферических стволовых клеток крови
ПХТ - полихимиотерапия
ПЦР - полимеразная цепная реакция
ПЭТ - позитронно-эмиссионная томография
СРБ - С-реактивный белок
ТИР - тошнота и рвота
УЗИ - ультразвуковое исследование
ФН - фебрильная нейтропения
ФСГ - фолликулостимулирующий гормон
ХК - хориокарцинома
ЦФ - цефалоспорины
ЭКГ - электрокардиограмма
ЭхоКГ - эхокардиограмма
ЭК - эмбриональная карцинома
PEI - cisplatin, etoposide, ifosfamide (цисплатин**, этопозид**, ифосфамид**)
BEP - bleomycin, etoposide, cisplatin (блеомицин**, этопозид**, цисплатин**)
GI - GIII - степень злокачественности незрелой тератомы
SIOP - Международное общество детских онкологов
TNM - Международная классификация по стадированию злокачественных опухолей
Термины и определения
Безрецидивная выживаемость (БРВ) - время от момента наступления ремиссии до момента возникновения рецидива.
Общая выживаемость (ОВ) - время от начала лечения до окончания исследования или смерти пациента.
Полихимиотерапия - схема введения нескольких химиопрепаратов, в которой учитывается доза, кратность, дни и способ введения лекарственного препарата.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Герминогенные опухоли (ГКО) происходят из плюрипотентных зародышевых клеток и представляют собой гетерогенную группу новообразований с различной гистологической картиной, локализацией, клиническим течением и прогнозом [1]. Нарушения дифференцировки этих клеток приводят к возникновению эмбриональной карциномы и тератомы (эмбриональная линия дифференцировки) или хориокарциномы и опухоли желточного мешка (экстраэмбриональный путь дифференцировки). Нарушение развития унипотентных примитивных зародышевых клеток приводит к развитию герминомы. ГКО могут возникать как в половых органах, так и вне их. Внегонадные ГКО локализуются по срединной линии тела, т.е. вдоль пути миграции примордиальных зародышевых клеток.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ГКО - это новообразования, развивающиеся из первичных половых клеток человеческого эмбриона, из которых в норме формируются сперматозоиды и яйцеклетки [2]. Первичные половые клетки происходят из энтодермы желточного мешка и мигрируют вдоль задней кишки к урогенитальному гребню, где становятся частью развивающихся гонад. При нарушении процесса миграции зародышевые клетки могут задерживаться в любом месте на пути следования и вызывать опухолевый рост. Поэтому ГКО могут возникать как в половых органах, так и экстрагонадно, локализуясь по средней линии. Наиболее часто ГКО у детей локализуются в яичках (25%), яичниках (25%), крестцово-копчиковой области (20%) и головном мозге (20%). К редким локализациям относятся средостение (в том числе - вилочковая железа), забрюшинное пространство, урогенитальный тракт, носоглотка, влагалище, мочевой пузырь, печень. При этом частота поражения различных органов зависит от возраста. Для новорожденных и детей первого года жизни характерно поражение крестцово-копчиковой области, составляющее около 45% всех ГКО в этом возрасте. У мальчиков до 2 лет чаще поражается яичко. ГКО половых органов нередко сочетаются с пороками развития (крипторхизм, дисгенезия гонад и др.).
ГКО метастазируют по сосудам в лимфатические узлы, легкие или печень.
При аномальной дифференцировке зародышевых клеток возникают различные гистологические варианты ГКО. В случае нарушения гонадной дифференцировки возникают герминомы, семиномы и дисгерминомы. Нарушение соматической дифференцировки приводит к возникновению тератомы различной степени зрелости и эмбриональной карциномы, а экстраэмбриональной дифференцировки - к развитию опухоли желточного мешка и хориокарциномы.
Кроме так называемых "чистых вариантов" ГКО различают смешанные опухоли, состоящие из тканей более чем одного гистологического типа. Выделяют 3 степени зрелости тератомы (Т) в зависимости от содержания в тератоме незрелой эмбриональной ткани. Степень злокачественности этих опухолей различна.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ГКО составляют менее 3% всех злокачественных новообразований у детей. При этом биологические особенности герминогенных опухолей отличаются в различных возрастных группах [3].
ГКО относятся к редким видам опухолей у детей, и составляют 3 - 4% всех злокачественных новообразований у детей в возрасте до от 0 - 15 лет. Достоверных эпидемиологических данных по ГКО у детей и подростков в России в настоящее время нет. По данным немецкого детского регистра опухолей, тератомы составляют 48,2% случаев, опухоли желточного мешка - 19,1%, смешанные ГКО - 18%; герминомы - 12,2%; эмбриональные карциномы - 1,6%; хориокарциномы - 0,9%. Среди подтипов тератом чаще определяется зрелая тератома (54,5%), реже - злокачественная тератома (7,8%). Зрелая тератома имеет наилучший прогноз.
Хориокарцинома - наиболее агрессивный гистологический тип ГКО, поэтому пациенты без лечения имеют наихудшие показатели выживаемости.
Для детей первого года жизни характерны внегонадные герминогенные опухоли, большинство из которых представлено тератомами. Тератомы содержат элементы всех трех зародышевых листков (эктодермы, эндодермы и мезодермы). Зрелая тератома состоит из хорошо дифференцированных тканей. Незрелая тератома подразделяется на три гистологических подтипа в зависимости от содержания незрелой нейроглиальной или бластемной тканей. Тератомы (как зрелая, так и незрелая) могут содержать клетки различных гистологических типов ГКО, а в редких случаях - элементы других опухолей (нейробластомы, ретинобластомы). Наиболее часто тератомы локализуются в крестцово-копчиковой области.
У детей второго полугодия жизни начинают преобладать опухоли желточного мешка (ОЖМ). В неонатальный период заболеваемость ГКО составляет у девочек 2,6 на 100 000; у мальчиков - 0,9 на 100 000. У подростков (детей старше 10 лет) заболеваемость ГКО составляет менее 0,1 на 100 000.
Тестикулярные ГКО встречаются в младенческом возрасте, второй пик заболеваемости ГКО данной локализации отмечается у подростков (7-8 на 100000). У юношей ГКО яичек составляют 14% случаев.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
- C38.1 - злокачественное новообразование переднего средостения
- C48.0 - злокачественное новообразование забрюшинного пространства
- C49.0 - злокачественное новообразование соединительной и мягких тканей головы, лица и шеи
- C49.5 - злокачественное новообразование соединительной и мягких тканей таза
- C49.9 - злокачественное новообразование соединительной и мягких тканей неуточненной локализации
- C56 - злокачественное новообразование яичника
- C62 - злокачественное новообразование яичка
- C62.0 - неопустившегося яичка
- C62.1 - опущенного яичка
- C62.9 - яичка неуточненное
- D15 - Доброкачественное новообразование других и неуточненных органов грудной клетки
- D20 - Доброкачественное новообразование мягких тканей забрюшинного пространства и брюшины
- D21 - Другие доброкачественные новообразования соединительной и других мягких тканей
- D28 - Доброкачественное новообразование других и неуточненных женских половых органов
- D29 - Доброкачественное новообразование мужских половых органов
- D36 - Доброкачественное новообразование других и неуточненных локализаций
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1 Гистологическая классификация герминогенных опухолей ВОЗ (Mostofi, Talerman) + современная классификация степени зрелости для тератом*:
- тератома (Таблица 1);
- герминома (семинома яичка, дисгерминома яичника);
- опухоль желточного мешка (ОЖМ);
- эмбриональная карцинома (ЭК);
- хориокарцинома (ХК)
*Комментарий:
Классификация степени зрелости тератом основывается на количестве полей зрения (диаметр - 4,5 мм, увеличение 40х), в которых определяется агрегаты незрелого нейроэпителия в любом срезе.
Таблица 1. Классификация степени зрелости тератомы
Число полей зрения
Grade (3-уровневая система)
Grade (2-уровневая система)
![]() 1
1
Grade 1
Low grade
> 1, но ![]() 3
3
Grade 2
High grade
> 3
Grade 3
High grade
Различные гистологические варианты могут проявляться как в "чистой" форме, так и в виде смешанных опухолей.
Встречаются гистологические варианты тератомы со злокачественным соматическим компонентом (+карцинома, нейроэндокринная опухоль, нейробластома, рабдомиосаркома, рабдомиосаркома + липосаркома, хондросаркома, хондросаркома + примитивная нейроэктодермальная опухоль, злокачественная опухоль из оболочек периферических нервов). Такие тератомы, как правило, имеют худший прогноз.
1.5.2 Стадирование ГКО
ЭКСТРАГОНАДНЫЕ ЛОКАЛИЗАЦИИ: TNM (до лечения, после операции)
T - первичная опухоль
TX - первичная опухоль не может быть оценена
T0 - нет данных о первичной опухоли
T1 - опухоль ограничена органом
T1а - опухоль диаметром ![]() 5 см
5 см
T1b - опухоль диаметром > 5 см
T2 - опухоль вовлекает соседние органы
T2a - опухоль диаметром ![]() 5 см
5 см
T2b - опухоль диаметром > 5 см
N - регионарные лимфоузлы
NX - недостаточно данных для оценки состояния регионарных лимфоузлов
N0 - нет признаков поражения регионарных лимфоузлов
N1 - региональные лимфоузлы поражены
M - отдаленные метастазы
MX - недостаточно данных для определения отдаленных метастазов
M0 - нет отдаленных метастазов
M1 - есть отдаленные метастазы
ОПУХОЛЬ ЯИЧКА: LUGANO стадии
LUGANO
I - Локализованная опухоль
IA - опухоль ограничена яичком
IB - опухоль инфильтрирует семенной канатик или опухоль в неопущенном яичке
IC - опухоль инфильтрирует мошонку или ранее проведена операция или опухоль была удалена или биопсирована трансскроатальным доступом
II - Распространение метастазов в поддиафрагмальные лимфоузлы
IIA - все узлы ![]() 2 см
2 см
IIB - по крайней мере один узел размерами от 2 до 5 см
IIC - по крайней мере один узел размерами > 5 см
IID - пальпируемая абдоминальная опухоль или неподвижные паховые лимфоузлы
III - Распространение метастазов в наддиафрагмальные лимфоузлы или отдаленные метастазы
IIIA - медиастинальные и/или надключичные лимфоузлы, но при отсутствии отдаленных гематогенных метастазов
IIIB - отдаленные метастазы только в легкие:
"minimal": < 5 метастазов в каждом легком, все размерами ![]() 2 см
2 см
"advanced": > 5 метастазов в каждом легком или > 2 см плеврального выпота
IIIC - гематогенное распространение за пределы легких
IIID - определение персистирующих опухолевых маркеров после комплексной терапии, но без очевидно обнаруживаемой опухоли
ОПУХОЛЬ ЯИЧНИКА: FIGO стадии
FIGO
I - опухоль в пределах яичника или фаллопиевых труб
IA - опухоль, ограниченная одним яичником (капсула интактна), микроскопически удалена полностью, нет опухолевых клеток в асцитической жидкости или смывах
IB - двусторонняя опухоль, ограничена яичником, микроскопически удалена полностью, капсула интактна, нет опухолевых клеток в асцитической жидкости или смывах
IC - опухоль ограничена одним или двумя яичниками
- IC1 - интраоперационный разрыв опухоли
- IC2 - повреждение капсулы опухоли до операции или опухолевые клетки на поверхности яичника или фаллопиевой трубы
- IC3 - опухолевые клетки в асцитической жидкости или смывах
II - поражение одного или обоих яичников с распространением в малый таз или по брюшине
IIA - распространение в матку и/или в фаллопиевы трубы
IIB - распространение в другие структуры малого таза
III - поражение одного или обоих яичников с микроскопически подтвержденными перитонеальными метастазами за пределами малого таза и/или метастатическим поражением забрюшинных лимфоузлов
IIIA - метастатическое поражение забрюшинных лимфоузлов, подтвержденное гистологически
IIIB - метастазы по брюшине (![]() 2 см в диаметре) за пределами таза с или без метастазирования в забрюшинные лимфоузлы
2 см в диаметре) за пределами таза с или без метастазирования в забрюшинные лимфоузлы
IIIC - метастазы по брюшине (> 2 см в диаметре) за пределами таза с или без метастазирования в забрюшинные лимфоузлы (включая распространение опухоли в капсулу печени или селезенки, но без вовлечения паренхимы этих органов)
IV - отдаленные метастазы (не включая перитонеальный канцероматоз)
IVA - опухолевые клетки в плевральном выпоте
IVB - метастазы в паренхиму органов брюшной полости и в органы за пределами брюшной полости (включая паховые лимфоузлы и лимфоузлы вне брюшной полости)
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Злокачественные ГКО могут секретировать опухолевые маркеры.
Повышение уровня альфа-фетопротеина (АФП) встречается у пациентов с опухолями желточного мешка (ОЖМ), в то время как повышение уровня ![]() -хорионического гонадотропина человека (
-хорионического гонадотропина человека (![]() -ХГЧ) характерно для хориокарциномы (ХК).
-ХГЧ) характерно для хориокарциномы (ХК).
Уровень АФП и ![]() -ХГЧ коррелирует с количеством продуцирующих их опухолевых клеток.
-ХГЧ коррелирует с количеством продуцирующих их опухолевых клеток.
У здоровых доношенных новорожденных концентрация АФП в сыворотке крови может колебаться в больших пределах, но в норме уровень маркера снижается по мере взросления ребенка (таблица 26). Таким образом, нарастание АФП в динамике у младенцев может служить диагностическим критерием наличия компонента ОЖМ, не требующим гистологического подтверждения.
Маркеры АФП и ![]() -ХГЧ используются для диагностики ГКО, оценки ответа опухоли на терапию и определения рецидива.
-ХГЧ используются для диагностики ГКО, оценки ответа опухоли на терапию и определения рецидива.
При ГКО показано проведение цитогенетического исследования (кариотипирования) для исключения заболеваний, сопровождающихся нарушением формирования пола.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
1) данные анамнеза;
2) данные физикального обследования;
3) данные лабораторных исследовании;
4) данные инструментального обследования;
5) данные патологоанатомического исследования биопсии ного (операционного) материала.
Клиническии диагноз основан на комбинации результатов:
1) физикального осмотра (визуального осмотра и пальпации), при котором выявляют критерии, указывающие на возможное новообразование яичка, брюшной или грудной полости.
2) лабораторных исследовании, при которых выявляют повышенный уровень сывороточных онкомаркеров (АФП, ХГЧ);
3) морфологической верификации диагноза (при нормальных показателях онкомаркеров).
2.1 Жалобы и анамнез
- Рекомендуется сбор жалоб и анамнеза у пациента (прием (осмотр, консультация) врача-детского онколога первичный) с герминогенной опухолью для выявления факторов, которые могут повлиять на выбор тактики лечения, методов диагностики и вторичной профилактики [3].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: подробный сбор семейного анамнеза, детальное выяснение акушерского анамнеза матери, особенности беременности и развития пациента от рождения до момента обследования. Уточнение онкологического анамнеза - наличие доброкачественных или злокачественных опухолей у членов семьи, а также наличие в семье или у пациента врожденных пороков развития.
Локализация опухоли в мягких тканях черепа:
Нарушения жевания, глотания, дыхания.
Наличие объемного образования во рту (при соответствующей локализации опухоли). В зависимости от характера распространения: болевой синдром, в том числе головная боль.
Локализация опухоли в крестцово-копчиковой области:
Беспокойство ребенка при попытке усадить.
Нарушение ритма дефекации и мочеиспускания.
Появление объемного образования в перианальной и крестцово-копчиковой области.
Локализация опухоли в яичках:
Увеличение яичка (безболезненное или болезненное в раннем возрасте и чаще болезненное у подростков).
Достаточно часто образование яичка у детеи до 7 лет жизни обнаруживают при прохождении медицинского осмотра с последующим проведением УЗИ мошонки (в декретированные сроки осмотра осмотра врача-детского хирурга и врача детского андролога-уролога). Дифференциальную диагностику необходимо проводить с варикоцеле, гематомой яичка.
Локализация опухоли в яичнике/яичниках:
Боли в животе, клиника острого живота.
Увеличение живота при относительно хорошем самочувствии.
Появление выделении из влагалища.
Нарушение пубертатного развития.
Локализация опухоли в забрюшинном пространстве:
Увеличение живота в объеме.
Боли в животе.
Пальпируемое образование в брюшной полости.
Нарушение стула.
Дизурические расстроиства.
Локализация опухоли в средостении:
Кашель.
Нарушение глотания.
Нарушение сердечного ритма.
Образование может быть выявлено случаи но при прохождении рентгенологических видов исследования и/или УЗИ щитовидной железы в декретированные сроки.
2.2 Физикальное обследование
Первичный осмотр включает:
1) Полное физикальное обследование
a. антропометрические измерения (вес, рост и площадь поверхности тела)
b. оценка нутритивного статуса (процентили)
c. оценка физического развития
d. оценка наличия пороков развития и стигм дизэмбриогенеза
2) Оценку кожных покровов и слизистых
a. выявление пятен "кофе с молоком"
b. выявление пальпируемого образования, определение локализации, характеристики опухоли (отек, спаянность с тканями), степень функциональных нарушении
3) Оценку костно-мышечной системы
a. выявление болевого синдрома
b. выявление нарушения функции конечностей
4) Оценку функции сердечно-сосудистой системы
5) Оценку функции легочной системы
6) Пальпацию живота с оценкой наличия гепатоспленомегалии
7) Оценку размеров лимфатических узлов
a. вовлечение регионарных лимфоузлов, размеры во всех случаях должны регистрироваться.
8) Характеристика функции тазовых органов
a. выявление дисфункции внутренних органов
2.3 Лабораторные диагностические исследования
- Рекомендуется выполнять следующие общеклинические методы обследования для определения общего состояния пациента, возможности проведения хирургического вмешательства и лекарственного лечения, необходимости назначения сопутствующей и сопроводительной терапии [3] [4]:
- Общий (клинический) анализ крови
- Общий (клинический) анализ мочи
- Анализ крови биохимический общетерапевтический (исследование уровня общего белка, альбумина, мочевины, креатинина, калия, натрия, глюкозы, общий билирубин, билирубина связанного (конъюгированного) в крови, определение активности АЛТ, АСТ, ЛДГ в крови); электролиты крови (исследование уровня общего кальция в крови, исследование уровня ионизированного кальция в крови, исследование уровня неорганического фосфора в крови, исследование уровня ионизированного магния в крови)
- Определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор)
- Молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus);
- Молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1);
- Коагулограмма (ориентировочное исследование системы гемостаза)
- Исследование уровня иммуноглобулинов A, M, G в крови;
- Молекулярно-биологическое исследование крови на цитомегаловирус (Cytomegalovirus) у детей первого года при необходимости проведения ПХТ;
- Исследование функции нефронов по клиренсу креатинина (проба Реберга) или по уровню цистатина С в сыворотке крови.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам до начала лечения (до хирургического вмешательства, в том числе до биопсии), а также в случае "секретирующих опухолей" перед каждым этапом лечения оценивать следующие опухолевые маркеры [2] [4] [5]:
- Исследование уровня альфа-фетопротеина (АФП) в сыворотке крови (исследование уровня связанного с беременностью плазменного протеина A (PAPP-A) в сыворотке крови).
- Исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: маркеры определяют до начала лечения (до хирургического вмешательства, в том числе до проведения биопсии). При оценке результатов анализов необходимо ориентироваться на нормы лаборатории.
Необходимо исследовать онкомаркеры в динамике с интервалом в 5 - 7 дней.
Нарастание опухолевых маркеров в случае типичной локализации (яички, яичники) делает клинико-рентгенологический диагноз секретирующей ГКО несомненным.
В случае "секретирующих опухолеи" исследование онкомаркеров повторять перед каждым этапом лечения
На фоне проведения ПХТ контроль онкомаркеров проводят 1 раз в 7 дней.
2.4 Инструментальные диагностические исследования
- Рекомендуется выполнять следующие инструментальные методы диагностики для оценки распространенности заболевания, определения общего состояния пациента, возможности проведения хирургического вмешательства и лекарственного лечения, необходимости назначения сопутствующей и сопроводительной терапии [4] [5]:
- УЗИ первичной опухоли (определение объема опухоли) в зависимости от локализации: ультразвуковое исследование органов малого таза (комплексное), ультразвуковое исследование органов мошонки, ультразвуковое исследование мягких тканей (одна анатомическая зона).
- Компьютерная томография/Магнитно-резонансная томография первичной опухоли в зависимости от локализации: компьютерная томография органов грудной полости с внутривенным болюсным контрастированием; компьютерная томография брюшной полости с внутривенным болюсным контрастированием; компьютерная томография органов малого таза у женщин с контрастированием; компьютерная томография органов малого таза у мужчин с контрастированием; магнитно-резонансная томография органов брюшной полости, забрюшинного пространства с внутривенным контрастированием; магнитно-резонансная томография органов малого таза с внутривенным контрастированием;
- Регистрация электрокардиограммы, Эхо-КГ.
- УЗИ органов брюшной полости (комплексное), забрюшинного пространства, ультразвуковое исследование органов малого таза комплексное (трансабдоминальное и трансвагинальное).
- Компьютерная томография органов грудной полости с внутривенным болюсным контрастированием.
- Магнитно-резонансная томография головного мозга с контрастированием при подозрении на 4-ю стадию заболевания, у подростков с первичной локализацией опухоли в яичке или в средостении, а также в случае гистологического диагноза хорионкарцинома.
- При необходимости и/или в сложных случаях возможно рассмотрение вопроса о проведении ПЭТ-КТ (позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.5 Иные диагностические исследования
- Для морфологической верификации диагноза выполнение у пациентов с внегонадной локализацией первичной опухоли и при нормальном уровне специфических онкомаркерах (АФП, бета-ХГЧ) рекомендуется выполнение биопсии первичной опухоли в зависимости от локализации: средостение, брюшная полость, забрюшинное пространство, крестцово-копчиковая локализация [6].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- У пациентов с верифицированной герминогенной опухолью или при подозрении на нее не рекомендуется проведение костно-мозговых пункций для проведения цитологического исследования костного мозга [7].
Комментарий: при герминогенных опухолях поражение костного мозга является чрезвычайно редким событием. В литературе имеются лишь единичные описания поражения костного мозга при герминогенных опухолях.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется выполнение стандартного цитогенетического исследования (кариотип) при гонадной локализации опухоли, а также при локализации в средостении при подозрении на нарушение полового развития [8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется прием (осмотр, консультация) врача-генетика первичный в случае ГКО у детей до года и при подтверждении синдрома Клайнфельтера и Свайер-синдрома [9].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Типичная локализация опухоли и повышенная концентрация опухолевых маркеров в сыворотке крови позволяет установить диагноз ГКО без морфологического подтверждения, что особенно важно при распространенных опухолевых процессах.
Тактика лечения ГКО определяется с учетом возраста, гистологического варианта, локализации опухоли, стадии заболевания и уровня опухолевых маркеров.
Хирургическое лечение
Первым и важнейшим терапевтическим мероприятием при экстракраниальных ГКО является полная резекция опухоли.
Микроскопически тотальная резекция опухоли (R0) является одним из наиболее значимых прогностических факторов.
При злокачественных ГКО дополнительно необходима адъювантная химиотерапия.
При неоперабельных опухолях первично показано проведение неоадъювантной химиотерапии (ХТ) в целях сокращения объема опухоли, выполнения радикального удаления опухоли, предотвращения калечащей операции.
Возможно клиническое установление диагноза на основании визуализирующих методов и повышенных опухолевых маркеров, что позволяет в единичных случаях отказаться от биопсии.
Наибольшую эффективность имеет комбинированная химиотерапия, включающая 3 препарата, одним из которых всегда является соединение платины.
Цисплатин** (P) относится к наиболее эффективным препаратам, которыи, однако, может привести к тубулярным нарушениям функции почек и тугоухости.
В сравнении с этим #карбоплатин** является менее токсичным. У пациентов со злокачественными ГКО первых 4 месяцев жизни применяется комбинация 2 препаратов - цисплатина** и этопозида** (внутривенное введение).
- На первичном этапе ребенку с подозрением на ГКО и нормальном уровне онкомаркеров рекомендуется проведение хирургического удаления/биопсии первичной опухоли в зависимости от локализации: средостение/яичник/яичники/яичко/яички/крестцово-копчиковая область или другие локализации с последующим патолого-анатомическим исследованием. (см. раздел 7.2) [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: по жизненным показаниям возможно проведение биопсии/удаления первичного образования (средостения/яичника/яичка/крестцово-копчиковой области или других локализаций) до завершения клинического обследования. Однако в стандартных ситуациях следует рассматривать вопрос об объеме первичного хирургического вмешательства только после завершения комплексного обследования. В случае четко отграниченной опухоли, отсутствии данных за инфильтрацию окружающих органов возможно рассмотреть вопрос о проведении радикальной операции. Следует минимизировать возможные хирургические риски. В случае инфильтрации опухолью как жизненно важных структур, так и других органов и тканей, а также при наличии большого количества послеоперационных осложнении показано проведение биопсии образования с последующим принятием решения о тактике ведения по результатам гистологического и ИГХ-исследовании.
Оперативные методики при ГКО
Крестцово-копчиковая локализация
- Рекомендуется радикальное удаление новообразования крестцово-копчиковой области единым блоком через дорзальный доступ [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Опухоли с локализацией в крестцово-копчиковой области часто клинически проявляются наличием в виде огромной массы. Наиболее удобен дорзальный доступ. Инфильтрированные участки кожи должны быть удалены единым блоком вместе с опухолью, так как последующее закрытие кожей операционного поля не проблематично. Отделение опухоли от прямой кишки возможно при пальцевом контроле. После операции функции кишки и мочевого пузыря обычно восстанавливаются. Резекция копчика вместе с опухолью является абсолютно обязательной при копчиковых локализациях. Копчиковая кость должна быть удалена в едином блоке с опухолью для избежания разрыва опухоли.
При IV типе крестцово-копчиковой локализации по Альтману (огромная опухолевая часть находится в малом тазу, включая копчиковую область) необходимо обсудить проведение предоперационной химиотерапии до оперативного вмешательства в случае секретирующей ГКО. В этом случае для достижения радикального удаления новообразования крестцово-копчиковой области и единым блоком полезным является дополнительный вентральный доступ. Таким образом, при локализации в крестцово-копчиковой области опухоль должна быть удалена единым блоком с копчиковой костью, что предотвращает развитие рецидива в большинстве случаев. При зрелой тератоме и в некоторых случаях злокачественной ГКО достаточно проведения радикальной операции и обеспечения последующего тщательного диспансерного наблюдения.
Опухоли яичников
- Рекомендуется радикальное удаление новообразований яичника/яичников абдоминальным срединным доступом [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При опухолях яичников лучший интраоперационный обзор дает абдоминальный доступ через срединную линию, чем традиционный доступ. При опухолях яичников важно первоначально лигировать яичниковые вены и артерии, чтобы избежать диссеминации опухолевых клеток. Придатки инфильтрированного участка должны быть удалены тотально в блоке с опухолью. Для интраоперационного стадирования важным являются точный размер опухоли, точная идентификация и цитология интраперитонеальной жидкости, а также обследование контралатерального участка. Необходимо провести биопсию всех подозрительных участков и отдаленных лимфатических узлов (биопсия лимфатического узла).
Пациенты с герминомой яичника с кариотипом XY должны быть обсуждены в дальнейшем в отношении удаления контралатерального яичника.
Опухоли яичек
- Рекомендуется использовать паховый доступ с лигированием семенного канатика при выявлении новообразования яичка. Пр [10] Применение трансскроатального доступа противопоказано.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Другие локализации
Хирургический доступ к другим местам первичных локализаций, таких, как средостение, забрюшинное пространство, должен быть запланирован в соответствии с выявленной ситуацией. Изолированные ретроперитонеальные опухоли лучше всего лечить аналогично опухолям копчика. Большинство опухолей средостения типично располагаются в переднем средостении, вызывая клинические симптомы вследствие смещения соседних структур. Оперативным доступом в основном является правосторонняя торакотомия, иногда - стернотомия. В некоторых случаях отделение опухоли от крупных сосудов или ворот легких является проблематичным. Поэтому весьма важна анатомическая информация, полученная с помощью визуализирующих методов, таких как КТ- или МРТ-сканирование. Если при КТ- или МРТ-сканировании выявлена инфильтрация в окружающую ткань или метастазы в лимфоузлы или печень, легкие и др., первым терапевтическим шагом будет первичная химиотерапия после клинической диагностики с помощью опухолевых маркеров. При инфильтрирующем росте "несекретирующей" (т.е. уровень АФП и ![]() -ХГЧ не повышен) опухоли для подтверждения гистологического диагноза необходимо выполнить биопсию опухоли/опухолеподобных образований мягких тканей.
-ХГЧ не повышен) опухоли для подтверждения гистологического диагноза необходимо выполнить биопсию опухоли/опухолеподобных образований мягких тканей.
Биопсия
Биопсия опухоли (опухоли средостения/яичника/яичка/крестцово-копчиковой области или других локализаций первичной опухоли) сопровождается риском диссеминации опухолевых клеток. Поэтому биопсия показана только в случае наличия массивной опухоли при отсутствии возможности полного удаления, а опухолевые маркеры не повышены. Тогда вид опухоли может быть диагностирован только гистологически. В этом случае важно избежать осложнений во время биопсии. Это означает безопасную обработку окружающей ткани, а также определение границы, затронутой опухолевым поражением.
Консервативное лечение
- Рекомендуется ребенку после оперативного лечения по поводу ГКО выбор послеоперационной терапии в зависимости от стадии заболевания, возраста, локализации опухоли, гистологического варианта, радикальности проведенной операции [5] [11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Терапевтические опции после оперативного лечения (Таблица 2).
7.3.1. "ЧИСТАЯ" ТЕРАТОМА И ТЕРАТОМА С МИКРОФОКУСАМИ ЗРЕЛАЯ (G 0) и незрелая тератома (G 1-2), злокачественная тератома (G 3) (классификация "Grad" по Гонзалес-Крузи)
Таблица 2. Терапевтические опции для пациентов с тератомой
Резекция
Злокачественные микрофокусы
Группа риска
Терапия
Гонадальные и негонадальные тератомы
Grad 0 - 3
R0 или R1
Нет
Благоприятная
W&W каждые три месяца
Есть
неопределенная
W&W ежемесячно
R2
Нет
неопределенная
W&W ежемесячно
есть
неблагоприятная
Лечение как при злокачественных ГКО
Примечание. Тератома яичника с глиоматозом брюшины - FIGO 1с - только операция с последующим ежемесячным наблюдением.
ПАЦИЕНТЫ ГРУППЫ НАБЛЮДЕНИЯ
- Тератомы (Grade 0 - 2) различной локализации после радикально выполненной операции при регулярном!!! контроле.
- ОЖМ яичка IA стадии после R0 у детей в возрасте до 2 лет жизни.
- Опухоли яичника I стадии после радикально выполненной операции при регулярном наблюдении (известно, что из этой группы пациентов нуждаются в дальнейшем в ХТ только 25% по случаю рецидива. Отсроченная ХТ не приводит к ухудшению выживаемости в данной группе, в то время как у 75% не будет токсичности, связанной с проведением ХТ) [12].
ТЕРАПИЯ ВНЕГОНАДНЫХ ЗЛОКАЧЕСТВЕННЫХ ГКО [3]
TNM
Оперативное лечение первичной опухоли (средостения/яичника/яичка/крестцово-копчиковой области и других локализаций)
T1aN0M0
R0
R1
R2
w&w
3*PEI
3*PEI - (2nd look) - 1*PEI
T1bN0M0
R0
R1
R2
w&w
3*PEI
3*PEI - (2nd look) - 1*PEI
T2a/bN0M0
R0
R1
R2
4*PEI
4*PEI
3*PEI - (2nd look) - 1*PEI
N 1 или M1 у детей младше 10 лет
биопсия
Консультация с Федеральным Центром!
N 1 или M1 у детей старше 10 лет
биопсия
Консультация с Федеральным Центром!
Неполный ответ, рефрактерное течение или рецидив ГКО
Консультация с Федеральным Центром!
Схемы лечения - см. приложение А3.1
Увеличение количества циклов при отсутствии ответа на терапию в виде сокращения опухоли и/или нормализации опухолевых маркеров не приводит к выздоровлению или профилактики рецидива.
Эти пациенты нуждаются в проведении другой терапии вне клинических рекомендаций.
Пациенты старше 10 лет со злокачественной внегонадной ГКО с поражением региональных лимфоузлов и отдаленными метастазами имеют наихудший прогноз.
После проведения биопсии и 1 курса ХТ (в целях сдерживания опухоли) должны быть обсуждены с Федеральным центром в целях интенсификации терапии вне клинических рекомендаций.
7.3.4. ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ ЯИЧКА [13]
Таблица 3. Терапевтические опции для ГКО яичка
ВЫСОКАЯ ПАХОВАЯ ОРХИЭКТОМИЯ
LUGANO
I A
"чистая" ОЖМ
Watch - and - wait
I A
Другая/смешанная ГКО
2 * PE
I B
I C
II A
2 * PEI
ПОВТОРНАЯ ОЦЕНКА ОПУХОЛИ
CR
STOP
PR
2nd look
II B
3 * PEI
CR
1 * PEI
II C
II D
IHA
IIIB
PR
2nd look
+
1 * PEI
IIIC
IIID
- пациенты с инвазией опухоли в лимфоузлы или сосуды должны лечиться по высокой группе риска (с #ифосфамидом**);
- при задержке ответа на лечение (отсутствии нормализации опухолевых маркеров после 2 циклов терапии) - обсуждение пациента с Федеральным Центром;
- объем опухоли неизменный/нарастающие опухолевые маркеры - "growing teratoma syndrom" - скорейшая операция;
- объем опухоли неизменный/нарастающие опухолевые маркеры или замедлена нормализация маркеров/прогрессия - менять группу риска;
- пациенты с R1-2 резекцией опухоли и/или "живой" опухолью после 2nd look - интенсификация терапии вне клинических рекомендаций;
- подростки с тератомой яичка обсуждаются для проведения ХТ, так как у этой группы пациентов высокий риск отдаленных отсроченных рецидивов (таблица 3).
7.3.5. ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ ЯИЧНИКОВ [13]
Таблица 4. Терапевтические опции для ГКО яичника
FI GO
la
Удаление опухоли яичника (A16.20.011.0 13)
R0 - R1
Watch and wait
lb
Ic
R2
2 PE
second-look
IIa
Удаление опухоли яичника [A16.20.011.013)
R0 - R1
2PE
IIb
IIC
R2
3PEI
second-look
1PEI
IIIa
предоперационная XT
3PEI
удаление остаточного компонента опухоли
1PEI
IIIb
IIIC
IV
- при гепатоидной или эндометриоидной дифференциации ОЖМ терапия проводится по более высокой группе риска (при стадиях III и IV - по терапии высокой группы риска внегонадных ГКО;
- пациенты с FIGO 1 и наличием опухоли в лимфоузлах, сосудах должны лечиться по более высокой группе риска - FIGO 2;
- при замедленном ответе (отсутствии нормализации опухолевых маркеров после 2 циклов терапии) - обсуждение пациента с Федеральным Центром;
- объем опухоли неизменный/нарастающие опухолевые маркеры - "growing teratoma syndrome" - скорейшая операция; объем опухоли неизменный/нарастающие опухолевые маркеры или замедлена нормализация маркеров/прогрессия - менять группу риска;
- Пациенты с R1-2 резекцией опухоли и/или "живой" опухолью после 2nd look - интенсификация терапии вне клинических рекомендаций (Таблица 4).
- Рекомендуется всем пациентам младше 18 лет с рефрактерным течением ГКО или рецидивом ГКО лекарственная противоопухолевая терапия с использованием одного из режимов второй линии: CarboPET, TIP, TI-CE, #Гемцитабин** + #Паклитаксел**, #Гемцитабин** + #Паклитаксел** + #Оксалиплатин**, JEB (см. приложение А3.1) [13] [14] [15] [17] [31] [32] [36].
Комментарии: Выбор оптимального режима второй линии осуществляется после консультации с Федеральным Центром!
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам младше 18 лет с ГКО на период лечения в целях лечения и профилактики тошноты и рвоты, обусловленных проведением противоопухолевой терапии, оценивать уровень эметогенности лекарственных препаратов, проводить лечение и профилактику тошноты и рвоты с использованием лекарственных препаратов (см. Приложение А3.2.) [18].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1)
- Рекомендуется всем пациентам младше 18 лет с ГКО в период лечения при развитии анемического синдрома, кровотечения, высокого риска геморрагического синдрома проведение гемотрансфузионной поддержки препаратами крови [19] (см. Приложение А3.4)
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам младше 18 лет с ГКО на период интенсивной терапии установка порта/катетера инфузионного/инъекционного имплантируемого*** (см. Приложение А3.5.) [20] [21] [22].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: наличие центрального венозного катетера, обеспечивающего возможность мониторинга ЦВД, частых заборов крови и высокую скорость введения жидкостей является абсолютно необходимым на начальных этапах терапии и у пациентов группы высокого риска, получающих интенсивную высокодозную химиотерапию.
- Рекомендуется всем пациентам с ГКО при развитии инфекционных осложнений грамотное и рациональное назначение антибактериальных препаратов системного действия (см. Приложение А 3.6) [23] [24].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется включить в план реабилитационных мероприятий на всем протяжении специального лечения оказание социально-педагогической помощи (нейропсихологическая реабилитация, врачебно-педагогическое наблюдение) ребенку, а также социально-психологическую поддержку семьи (семейное клинико-психологическое консультирование) [22].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Объем, длительность и характер реабилитационных мероприятий зависит от возраста пациента на момент постановки первичного диагноза и времени проведения реабилитационных мероприятий, объема проведенного лечения (полихимиотерапия, хирургия, лучевая терапия, высокодозная полихимиотерапия и ауто-ТГСК и д.р.), сопутствующей патологии. Начало реабилитационных мероприятий зависит от стадии, группы риска, и начинается на этапах проведения первичной полихимиотерапии и продолжается после ее окончания на всех этапах динамического наблюдения. Реабилитационные мероприятия проходят под контролем врача-детского онколога, медицинского учреждения, где больной получал все основные этапы терапии. Реабилитация делится на медицинскую, психологическую, социальную и др. В программе принимают участие педагоги (дошкольного и школьного образования), социальные работники, психологи и врачи разных специальностей (врачи физической и реабилитационной медицины,, неврологи, детские эндокринологи, детские кардиологи, травматологи-ортопеды и т.д.). Реабилитация проводится в региональных центрах на базе поликлиник и в специализированных лечебно-реабилитационных центрах. Кратность реабилитации 2 - 3 раза в год и может быть увеличена в зависимости от психосоматического статуса пациента [25] [26] [27].
- Рекомендуется всем пациентам младше 18 лет с ГКО на период лечения и реабилитации оценивать нутритивный статус с проведением его коррекции при выявлении нутритивных нарушений (см. Приложение А3.3.) [28] [29].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется всем пациентам с экстракраниальными герминогенными опухолями следующая программа наблюдения после химиотерапии (таблица 5) [30]:
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Таблица 5. Диспансерное наблюдение
Показатель
1-й год наблюдения
2-й год наблюдения
3 - 5-й годы наблюдения
Антропометрия
ежемесячно
каждые 4 мес.
каждые 6 мес.
Физикальный осмотр
ежемесячно
каждые 2 мес.
каждые 3 мес.
УЗИ первичной локализации опухоли (органов брюшной полости (комплексное), органов малого таза комплексное (трансвагинальное и трансабдоминальное), мягких тканей (одна анатомическая зона))
ежемесячно
каждые 2 мес.
каждые 3 мес.
Компьютерная томография/магнитно-резонансная томография области первчиной опухоли (средостение)
каждые 2 мес.
каждые 4 мес.
каждые 6 мес.
Тональная аудиометрия
каждые 6 мес.
каждые 6 мес.
каждые 6 мес.
Исследование функции нефронов по клиренсу креатинина (проба Реберга);
Общий (клинический) анализ крови развернутый, Общий (клинический) анализ мочи
ежемесячно
каждые 4 мес.
каждые 6 мес.
Онкомаркеры:
АФП (исследование уровня связанного с беременностью плазменного протеина A (PAPP-A) в сыворотке крови), Исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови
ежемесячно
каждые 4 мес.
каждые 6 мес.
Определение половых гормонов
Однократно или при патологии.
При нарушении пубертата - исследование уровня фолликулостимулирующего гормона в сыворотке крови, исследование уровня лютеинизирующего гормона в сыворотке крови, пролактина.
У девочек (при нарушении цикла) исследование уровня общего эстрадиола в крови.
У юношей - исследование уровня общего тестостерона в крови
6. Организация оказания медицинской помощи
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
- наличие осложнении ГКО, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
- наличие осложнении лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т.д.) ГКО.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
- необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
- наличие показании к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
- завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условиях отсутствия осложнении лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнении основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или данным предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1 Определение статуса резекции при ГКО
Микроскопически тотальная (R0):
- полная резекция опухоли единым блоком с органом происхождения (в случае ГКО крестцово-копчиковой области - полностью с копчиковой костью; в случае ГКО яичка - всего яичка паховым доступом, в случае ГКО яичника - всего яичника с фаллопиевой трубой);
- отсутствие предыдущей биопсии;
- опухолевая киста не подвергалась пункции и не было разрыва во время операции с излитием содержимого;
- при гистологической оценке - капсула или псевдокапсула опухоли свободны от опухолевых клеток (отсутствие опухолевых клеток в крае резекции);
- отсутствие опухолевых клеток в асцитической или лаважной абдоминальной жидкости.
Макроскопически тотальная, микроскопически резидуальная (R1):
- удаление всей опухоли несколькими частями, удаление опухоли при повторной операции;
- резекция копчиковой кости, яичника или яичка отдельными частями;
- трансскроатальная хирургия тестикулярных опухолей;
- нарушение целостности опухолевой капсулы, например, при разрыве опухоли, пункции опухолевой кисты, или интраоперационной биопсии для гистологического исследования;
- опухолевые клетки в асцитическом или плевральном экссудате;
- опухолевые клетки на поверхности органа или в крае резекции.
Макроскопически остаточная (R2):
- энуклеация опухоли из органа с оставлением органа: всей копчиковой кости, яичника или яичка;
- остатки видимой опухоли или инфильтрация тканей;
- метастатические остатки в пределах хирургического поля, например, перитонеальные импланты (исключая глиоматоз) или метастатическое поражение региональных лимфатических узлов. Исключены отдаленные метастазы в легкие, печень или другие участки;
- жидкая консистенция опухоли.
Образование псевдокапсулы возникает вследствие компрессии опухоли соседними структурами. Только достаточное и безопасное расстояние гарантирует возможность полного удаления опухоли.
Если ткань опухоли ограничена нечетко, обязательно отдельное исследование срезов за пределами подозрительной области для гистологического уточнения, независимо от того, замечена ли инвазия опухоли хирургом.
Необходимо удаление и маркировка всех лимфоузлов для последующей гистологической верификации.
Определение понятий полной или неполной резекции опухоли.
Под полной резекцией понимают удаление всего объема опухолевой ткани:
- при опухолях, локализованных в области копчика, проводится резекция опухоли, капсулы и копчика в одном блоке;
- при опухолях яичника должны быть резецированы яичник, придаток яичника и фаллопиева труба;
- для правильного стадирования, если необходимо, удаляются регионарные лимфатические узлы.
Под неполной резекцией понимают, такую резекцию, если:
- во время или после операции произошел разрыв капсулы;
- обнаружена инфильтрация опухоли в окружающие ткани или наблюдается прилегание (срастание) опухоли к (с) окружающей ткани, в результате которой полная резекция опухоли невозможна. При инфильтрации опухоли в окружающую ткань необходимо выполнение гистологического исследования ткани в краях резекции. Опухолевая псевдокапсула появляется в результате сдавления опухолью прилегающих структур. Только достаточная и безопасная дистанция гарантирует возможность полного удаления опухоли.
Если возможна полная резекция опухоли и точно диагностирована 1а стадия заболевания, на этом этапе лечение может быть завершено, в случае поражения яичника или другой экстракраниальной локализации, за исключением крестцово-копчиковой локализации. Однако такие пациенты должны тщательно наблюдаться в строго установленные сроки.
7.2 Критерии ответа
Полный ответ (CR)
- Отсутствие клинических признаков болезни;
- Отсутствие опухоли по данным визуализации с контрастным усилением.
- Нормальный уровень опухолевых онкомаркеров (АФП, ![]() -ХГЧ).
-ХГЧ).
Частичный ответ (PR)
- Уменьшение объема первичной опухоли, и очагов метастатического поражения более чем на 50% (по максимальным размерам); в случае если единственным проявлением заболевания являлись высокие цифры онкомаркеров - снижение уровня на 90% и более.
- Отсутствие новых очагов опухолевого роста.
- Нормальный уровень опухолевых онкомаркеров (АФП, ![]() -ХГЧ).
-ХГЧ).
Стабилизация болезни (SD)
- Уменьшение объема первичной опухоли и очагов метастатического поражения менее чем на 50% суммы объема всех измеряемых поражений.
- Отсутствие новых очагов опухолевого роста.
- Нет динамики/либо незначительное снижение опухолевых маркеров (АФП или ![]() -ХГЧ).
-ХГЧ).
Прогрессирование болезни (PD)
- Увеличение более чем на 25% размера любого из измеряемых поражений.
- Появление новых очагов опухолевого роста.
- Повышение уровня онкомаркеров (исключая первую неделю ХТ).
7.3 Терапевтические опции для пациентов с рецидивом или рефрактерным течением ГКО
Лекарственная терапия в случае рецидива/рефрактерного течения ГКО подразумевает наличие куративных и паллиативных подходов лечения. Оптимальный режим лечения определяется ранней предлеченностью.
- Показано с куративной целью проведение тандемной высокодозной химиотерапии в режиме CarboPET с использованием препаратов #Карбоплатин** + Этопозид** + Тиотепа с поддержкой аутологичных периферических стволовых клеток [13] (см. приложение А.3.1)).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется с куративной целью проведение индукционной химиотерапии стандартными дозами препаратов (режим TI-CE) #Паклитаксел** + #Ифосфамид** с последующей высокодозной химиотерапией с использованием препаратов #Карбоплатин** + Этопозид** с поддержкой аутологичных периферических стволовых клеток [14] (см. приложение А3.1).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется с куративной целью проведение химиотерапии стандартными дозами препаратов (режим терапии TIP) #Паклитаксел** + #Ифосфамид** + Цисплатин** [14], [31]. (см. приложение А3.1)
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется с паллиативной целью проведение химиотерапии стандартными дозами препаратов #Гемцитабин** + #Паклитаксел** [15] (см. приложение А3.1).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется с паллиативной целью проведение химиотерапии стандартными дозами препаратов #Гемцитабин** + #Паклитаксел** + #Оксалиплатин** [32]. (см. приложение А3.1)
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется с паллиативной целью проведение химиотерапии стандартными дозами препаратов #Иринотекан** + #Оксалиплатин** [33] (см. приложение А3.1).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется с паллиативной целью использование перорального #Этопозида** [85] (см. приложение А3.1)
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется с паллиативной целью проведение локального контроля (хирургической резекции и/или лучевой терапии) в случае технической возможности [35]. Объем операции, а также дозы и объемы лучевой терапии обсуждаются индивидуально для каждого пациента с привлечением специалистов Федерального Центра!
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: решение о возможности и целесообразности проведения хирургической резекции и/или лучевой терапии принимается на междисциплинарном совещании врачей и после консультации с Федеральным Центром!
7.3.1. Режимы терапии второй линии для детей младшего возраста
Для детей младшего возраста (до 10 лет) с рефрактерными формами или рецидивами ГКО возможно применение следующих режимов химиотерапии: режим JEB, высокодозный режим CarboPET [13] (см. приложение А3.1). Решение о выборе оптимального режима второй линии терапии принимается индивидуально для каждого пациента после обсуждения клинической ситуации с Федеральным центром!
Критерии оценки качества медицинской помощи
N п/п
Критерии качества
Оценка выполнения
1
Выполнен прием (осмотр, консультация) врачом-детским онкологом первичный (при установлении диагноза)
Да/нет
2
Выполнена МРТ органов малого таза и брюшной полости и забрюшинного пространства с внутривенным контрастированием (при установлении диагноза)
Да/нет
3
Выполнено ультразвуковое исследование органов малого таза комплекснное (трансвагинальное и трансабдоминальное), ультразвуковое исследование органов брюшной полости (комплексное) и и ультразвуковое исследование первичного опухолевого очага (при установлении диагноза)
Да/нет
4
Выполнена КТ органов грудной полости (при установлении диагноза)
Да/нет
5
Выполнено исследование уровня АФП (исследование уровня связанного с беременностью плазменного протеина A (PAPP-A) в сыворотке крови) в сыворотке крови (при установлении диагноза)
Да/нет
6
Выполнено исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови (при установлении диагноза)
Да/нет
7
Выполнено исследование уровня ЛДГ в крови (при установлении диагноза)
Да/нет
8
Выполнено удаление опухоли средостение/яичник/яичники/яичко/яички/крестцово-копчиковая область без повреждения ее капсулы (при радикальном хирургическом вмешательстве)
Да/нет
9
Выполнено ультразвуковое исследование органов малого таза комплекснное (трансвагинальное и трансабдоминальное), ультразвуковое исследование органов и брюшной полости (комплексное) и ультразвуковое исследование первичного опухолевого очага перед началом каждого курса ПХТ
Да/нет
10
Выполнена повторная МРТ органов малого таза и брюшной полости и забрюшинного пространства (перед хирургическим вмешательством) с внутривенным контрастированием
Да/нет
11
Выполнена КТ органов грудной полости.
Да/нет
12
Выполнено исследование уровня АФП (исследование уровня связанного с беременностью плазменного протеина A (PAPP-A) в сыворотке крови) перед каждым курсом ПХТ
Да/нет
13
Выполнено исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке кров перед каждым курсом ПХТ
Да/нет
14
Выполнено исследование уровня ЛДГ в крови перед каждым курсом ПХТ
Да/нет
15
Выполнен общий (клинический) анализ крови развернутый перед каждым курсом ПХТ и не реже 1 раза в неделю при проведении лучевой терапии или ПХТ
Да/нет
16
Выполнен анализ крови биохимический общетерапевтический (исследование уровня общего белка, альбумина, мочевины, креатинина, калия, натрия, общего билирубина в крови, определение активности АЛТ, АСТ в крови)
Да/нет
27
Выполнен общий (клинический) анализ мочи
Да/нет
Список литературы
1. Dehner L.P. Gonadal and extragonadal germ cell neoplasia of childhood // Hum. Pathol. 1983. Vol. 14, N 6. P. 493 - 511.
2.  et al. Germ-cell tumors in childhood and adolescence. GPOH MAKEI and the MAHO study groups // Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2000. Vol. 11, N 3. P. 263 - 271.
et al. Germ-cell tumors in childhood and adolescence. GPOH MAKEI and the MAHO study groups // Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2000. Vol. 11, N 3. P. 263 - 271.
3. Детская онкология. Национальное руководство под редакцией М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой - сборник | ИСТИНА - Интеллектуальная Система Тематического Исследования НАукометрических данных [Electronic resource]. URL: https://istina.msu.ru/collections/441588665/ (accessed: 31.05.2024).
4. Calaminus G. et al. Age-Dependent Presentation and Clinical Course of 1465 Patients Aged 0 to Less than 18 Years with Ovarian or Testicular Germ Cell Tumors; Data of the MAKEI 96 Protocol Revisited in the Light of Prenatal Germ Cell Biology // Cancers. 2020. Vol. 12, N 3. P. 611.
5. Cecchetto G. Gonadal germ cell tumors in children and adolescents // J. Indian Assoc. Pediatr. Surg. 2014. Vol. 19, N 4. P. 189 - 194.
6. Hussain H.K. et al. Imaging-guided core biopsy for the diagnosis of malignant tumors in pediatric patients // AJR Am. J. Roentgenol. 2001. Vol. 176, N 1. P. 43 - 47.
7. Garbay D. et al. Bone marrow metastases in a patient with primary mediastinal non-seminomatous germ cell tumor - an unusual pattern of relapse // Onkologie. 2012. Vol. 35, N 1 - 2. P. 40 - 42.
8. Piazza M.J., Urbanetz A.A. Germ Cell Tumors in Dysgenetic Gonads // Clinics. 2019. Vol. 74. P. e408.
9. Lu L., Luo F., Wang X. Gonadal tumor risk in pediatric and adolescent phenotypic females with disorders of sex development and Y chromosomal constitution with different genetic etiologies // Front. Pediatr. 2022. Vol. 10. P. 856128.
10. Rich B.S. et al. Current surgical approach: Extracranial malignant germ cell tumors // Pediatr. Blood Cancer. 2024. P. e31217.
11. Marina N. et al. Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988 // Cancer. 1992. Vol. 70, N 10. P. 2568 - 2575.
12. Marina N.M. et al. Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study // J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 1999. Vol. 17, N 7. P. 2137 - 2143.
13. MAKEI 05 protocol (versie 1). - URL: https://prinsesmaxima.iprova.nl/Portal/#/QC/22-67-GH (дата обращения: 15.11.2024). - Текст: электронный.
14. Ongoing Clinical Trials in Testicular Cancer: The TIGER Trial | Oncology Research and Treatment | Karger Publishers. - URL: https://karger.com/ort/article/39/9/553/263230/Ongoing-Clinical-Trials-in-Testicular-Cancer-The (дата обращения: 15.11.2024). - Текст: электронный.
15. Einhorn L.H. et al. Phase II study of paclitaxel plus gemcitabine salvage chemotherapy for germ cell tumors after progression following high-dose chemotherapy with tandem transplant // J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2007. Vol. 25, N 5. P. 513 - 516.
16. Bokemeyer C. et al. Combination chemotherapy with gemcitabine, oxaliplatin, and paclitaxel in patients with cisplatin-refractory or multiply relapsed germ-cell tumors: a study of the German Testicular Cancer Study Group // Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2008. Vol. 19, N 3. P. 448 - 453.
17. Al F. et al. Comparison of carboplatin versus cisplatin in the treatment of paediatric extracranial malignant germ cell tumours: A report of the Malignant Germ Cell International Consortium // Eur. J. Cancer Oxf. Engl. 1990. Eur J Cancer, 2018. Vol. 98.
18. Patel P. et al. Interventions for the prevention of acute phase chemotherapy-induced nausea and vomiting in adult and pediatric patients: a systematic review and meta-analysis // Support. Care Cancer Off. J. Multinatl. Assoc. Support. Care Cancer. 2022. Vol. 30, N 11. P. 8855 - 8869.
19. Трахтман П.Е., Старостин Н.Н., Новичкова Г.А., Ворожцов И.Н. Трансфузионная терапия в клинической практике: учеб. пособие / Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Д. Рогачева. Москва, 2021. 76 с.
20. Румянцев А.Г. Федеральные клинические рекомендации по организации оптимально венозного доступа у детей с гематологическими, онкологическими и иммунологическими заболеваниями. / А.Г. Румянцев, А.А. Масчан, Д. Ш. Биккулова. - 2015.; Венозный катетер. Использование, уход, контроль, осложнения: учебное пособие / Сацук А.В., Солопова Г.Г., Щукин В.В., Литвинов Д.В., Пименова О.В. Климова Н.А., Щемелинская Ю.Л., Масчан А.А, Новичкова Г.А. - М. АО "Информатика", 2023. - 152 с.: ил. ISBN 978-5-6049537-2-3.;
21. Венозный катетер. Использование, уход, контроль, осложнения: учебное пособие / Сацук А.В., Солопова Г.Г., Щукин В.В., Литвинов Д.В., Пименова О.В. Климова Н.А., Щемелинская Ю.Л., Масчан А.А, Новичкова Г.А. - М. АО "Информатика", 2023. - 152 с.: ил. ISBN 978-5-6049537-2-3.;
22. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях [Electronic resource]. URL: https://elibrary.ru/item.asp?id=19537193 (accessed: 31.05.2024).
23. Mikulska M, Viscoli C, Orasch C, Livermore DM, Averbuch D, Cordonnier C et al. Aetiology and resistance in bacteriaemias among adult and paediatric haematology and cancer patients. Jornal of infection (2014), 68: 321 - 331.
24. Tam C.S. et al. Use of empiric antimicrobial therapy in neutropenic fever. Australian Consensus Guidelines 2011 Steering Committee // Intern. Med. J. 2011. Vol. 41, N 1b. P. 90 - 101.
25. L'Hotta A.J. et al. Clinical practice guideline and expert consensus recommendations for rehabilitation among children with cancer: A systematic review // CA. Cancer J. Clin. 2023. Vol. 73, N 5. P. 524 - 545.
26. Fischmeister G. et al. Rehabilitation for children and adolescents after cancer: importance and implementation in Austria // Memo - Mag. Eur. Med. Oncol. 2021. Vol. 14, N 3. P. 278 - 283.
27. Ospina P.A. et al. Physical Rehabilitation Practices for Children and Adolescents with Cancer in Canada // Physiother. Can. Physiother. Can. 2020. Vol. 72, N 2. P. 207 - 216.
28. Vasilyeva E.S., Vashura A., Litvinov D. Nutritional status of children with cancer and hematological malignancies during treatment in FSBI Federal Scientific Clinical Center of Pediatric Hematology, Oncology and Immunology named after Dmitry Rogachev (screening results) // Mod. Oncol. 2016. Vol. 18. P. 48 - 52.
29. Muscaritoli M. et al. ESPEN practical guideline: Clinical Nutrition in cancer // Clin. Nutr. Edinb. Scotl. 2021. Vol. 40, N 5. P. 2898 - 2913.
30. Практическое руководство по детским болезням. Т. 4. Гематология/онкология детского возраста [Electronic resource]. URL: https://mdk-arbat.ru/book/4292955 (accessed: 31.05.2024).
31. Mead G.M. et al. A phase II trial of TIP (paclitaxel, ifosfamide and cisplatin) given as second-line (post-BEP) salvage chemotherapy for patients with metastatic germ cell cancer: a medical research council trial // Br. J. Cancer. 2005. Vol. 93, N 2. P. 178 - 184.
32. Shatara M. et al. GCT-66. FINAL REPORT OF THE PROSPECTIVE NEXT/CNS-GCT-4 CONSORTIUM TRIAL (GemPOx FOLLOWED BY MARROW-ABLATIVE CHEMOTHERAPY) IN PATIENTS WITH REFRACTORY/RECURRENT CNS GERM CELL TUMORS // Neuro-Oncol. 2020. Vol. 22, N Suppl 3. P. iii341.
33. McGregor L.M. et al. Phase I Study of Oxaliplatin and Irinotecan in Pediatric Patients with Refractory Solid Tumors: A Children's Oncology Group Study // Cancer. 2009. Vol. 115, N 8. P. 1765.
34. Saxman S. Oral etoposide in germ cell tumours // Drugs. 1999. Vol. 58 Suppl 3. P. 31 - 34.
35. Hulsker C.C.C. et al. Malignant extracranial germ cell tumors in the Netherlands between 1990 and 2018: Stable incidence and improved survival // EJC Paediatr. Oncol. 2024. Vol. 3. P. 100148.
36. Frazier A.L. et al. Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States // J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2015. Vol. 33, N 2. P. 195 - 201.
37. Antiemetics: ASCO Guideline Update - PubMed [Electronic resource]. URL: https://pubmed.ncbi.nlm.nih.gov/32658626/ (accessed: 31.05.2024).
38. Naik R.D. et al. Olanzapine for Prevention of Vomiting in Children and Adolescents Receiving Highly Emetogenic Chemotherapy: Investigator-Initiated, Randomized, Open-Label Trial // J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2020. Vol. 38, N 32. P. 3785 - 3793.
39. Эффективность и безопасность малых доз оланзапина в профилактике тошноты и рвоты у детей и подростков, получающих высокоэметогенную химиотерапию. Промежуточные результаты рандомизированного исследования | Жуков | Вопросы гематологии/онкологии и иммунопатологии в педиатрии [Electronic resource]. URL: https://www.hemoncim.com/jour/article/view/680?locale=ru_RU (accessed: 31.05.2024).
40. Patel P. et al. Dexamethasone dosing for prevention of acute chemotherapy-induced vomiting in pediatric patients: A systematic review // Pediatr. Blood Cancer. 2020. Vol. 67, N 12. P. e28716.
41. Efficacy, safety and cost effectiveness of reduced-dose olanzapine versus aprepitant as a part of triple-antiemetic therapy in the prevention of chemotherapy induced nausea and vomiting. | Journal of Clinical Oncology [Electronic resource]. URL: https://ascopubs.org/doi/10.1200/JCO.2022.40.16_suppl.e24078 (accessed: 31.05.2024).
42. Navari R.M. et al. Olanzapine With or Without Fosaprepitant for Preventing Chemotherapy Induced Nausea and Vomiting in Patients Receiving Highly Emetogenic Chemotherapy: A Phase III Randomized, Double-Blind, Placebo-Controlled Trial (ALLIANCE A221602) // The Oncologist. 2023. Vol. 28, N 8. P. 722 - 729.
43. Patil V. et al. Comparison of antiemetic efficacy and safety of palonosetron vs ondansetron in the prevention of chemotherapy-induced nausea and vomiting in children // J. Community Support. Oncol. 2015. Vol. 13, N 6. P. 209 - 213.
44. Chaudhary N.K. et al. Palonosetron is a Better Choice Compared With Ondansetron for the Prevention of Chemotherapy-induced Nausea and Vomiting (CINV) in a Resource-limited Pediatric Oncology Center: Results From a Randomized Control Trial // J. Pediatr. Hematol. Oncol. 2019. Vol. 41, N 4. P. 294 - 297.
45. Jain S. et al. A randomized, open-label non-inferiority study to compare palonosetron and ondansetron for prevention of acute chemotherapy-induced vomiting in children with cancer receiving moderate or high emetogenic chemotherapy // Support. Care Cancer Off. J. Multinatl. Assoc. Support. Care Cancer. 2018. Vol. 26, N 9. P. 3091 - 3097.
46. Flank J. et al. Guideline for the Treatment of Breakthrough and the Prevention of Refractory Chemotherapy-Induced Nausea and Vomiting in Children With Cancer // Pediatr. Blood Cancer. 2016. Vol. 63, N 7. P. 1144 - 1151.
47. Mehta N.M. et al. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions // JPEN J. Parenter. Enteral Nutr. 2013. Vol. 37, N 4. P. 460 - 481.
48. Jang R.W. et al. Simple prognostic model for patients with advanced cancer based on performance status // J. Oncol. Pract. 2014. Vol. 10, N 5. P. e335-341.
49. Martin L. et al. Diagnostic Criteria for the Classification of Cancer-Associated Weight Loss // J. Clin. Oncol. Wolters Kluwer, 2015. Vol. 33, N 1. P. 90 - 99.
50. Вашура А.Ю. et al. Роль и актуальность нутрициологического диагноза в онкопедиатрии: 12 // Медицинский Совет. 2023. Vol. 0, N 12. P. 99 - 109.
51. Yaprak D.S. et al. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins // Pediatr. Blood Cancer. 2021. Vol. 68, N 1. P. e28752.
52.  et al. Obesity and metabolic changes are common in young childhood brain tumor survivors // Pediatr. Blood Cancer. 2009. Vol. 52, N 7. P. 853 - 859.
et al. Obesity and metabolic changes are common in young childhood brain tumor survivors // Pediatr. Blood Cancer. 2009. Vol. 52, N 7. P. 853 - 859.
53. Rayar M. et al. Sarcopenia in children with acute lymphoblastic leukemia // J. Pediatr. Hematol. Oncol. 2013. Vol. 35, N 2. P. 98 - 102.
54. Langius J.A.E. et al. Effect of nutritional interventions on nutritional status, quality of life and mortality in patients with head and neck cancer receiving (chemo)radiotherapy: a systematic review // Clin. Nutr. Edinb. Scotl. 2013. Vol. 32, N 5. P. 671 - 678.
55. Парентеральное и энтеральное питание детей: практические рекомендации [Electronic resource]. URL: https://www.rosmedlib.ru/book/ISBN9785970439920.html (accessed: 31.05.2024).
56. Bercovitz R.S., Josephson C.D. Transfusion Considerations in Pediatric Hematology and Oncology Patients // Hematol. Oncol. Clin. North Am. 2016. Vol. 30, N 3. P. 695 - 709.
57. Steiner M.E. et al. Recommendations on RBC Transfusion Support in Children With Hematologic and Oncologic Diagnoses From the Pediatric Critical Care Transfusion and Anemia Expertise Initiative // Pediatr. Crit. Care Med. J. Soc. Crit. Care Med. World Fed. Pediatr. Intensive Crit. Care Soc. 2018. Vol. 19, N 9S Suppl 1. P. S149 - S156.
58. Shah N., Andrews J., Goodnough L.T. Transfusions for anemia in adult and pediatric patients with malignancies // Blood Rev. 2015. Vol. 29, N 5. P. 291 - 299.
59. Nellis M.E., Goel R., Karam O. Transfusion Management in Pediatric Oncology Patients // Hematol. Oncol. Clin. North Am. 2019. Vol. 33, N 5. P. 903 - 913.
60. ISBT. WHO Educational modules on clinical use of blood [Electronic resource]. URL: https://www.isbtweb.org/resource/who-educational-modules-on-clinical-use-of-blood.html (accessed: 31.05.2024).
61. O'Shaughnessy D.F. et al. Guidelines for the use of fresh-frozen plasma, cryoprecipitate and cryosupernatant // Br. J. Haematol. 2004. Vol. 126, N 1. P. 11 - 28.
62. Cellini M. et al. Guidelines of the Italian Association of Pediatric Hematology and Oncology for the management of the central venous access devices in pediatric patients with onco-hematological disease // J. Vasc. Access. 2022. Vol. 23, N 1. P. 3 - 17.
63. Cameron G.S. Central venous catheters for children with malignant disease: surgical issues // J. Pediatr. Surg. 1987. Vol. 22, N 8. P. 702 - 704.
64. Bonciarelli G. et al. GAVeCeLT* consensus statement on the correct use of totally implantable venous access devices for diagnostic radiology procedures // J. Vasc. Access. 2011. Vol. 12, N 4. P. 292 - 305.
65. Burbridge B. et al. Randomized Clinical Trial Evaluating Complications and Complication-Related Removal of Arm-Situated Power-Injectable and Non-Power-Injectable Totally Implanted Venous Access Devices among Cancer Patients // J. Vasc. Interv. Radiol. JVIR. 2018. Vol. 29, N 5. P. 648-656.e3.
66. Skinner R. et al. Prevention and management of central venous catheter occlusion and thrombosis in children with cancer // Pediatr. Blood Cancer. 2008. Vol. 50, N 4. P. 826 - 830.
67. Thurman C.B. et al. Risk for Health Care-Associated Bloodstream Infections in Pediatric Oncology Patients With Various Malignancies // J. Pediatr. Oncol. Nurs. Off. J. Assoc. Pediatr. Oncol. Nurses. 2017. Vol. 34, N 3. P. 196 - 202.
68. Pittiruti M. et al. European recommendations on the proper indication and use of peripheral venous access devices (the ERPIUP consensus): A WoCoVA project // J. Vasc. Access. 2023. Vol. 24, N 1. P. 165 - 182.
69. Lehrnbecher T. et al. Guideline for the management of fever and neutropenia in children with cancer and/or undergoing hematopoietic stem-cell transplantation // J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2012. Vol. 30, N 35. P. 4427 - 4438.
70. Simon A. et al. Surveillance of bloodstream infections in pediatric cancer centers - what have we learned and how do we move on? // GMS Hyg. Infect. Control. 2016. Vol. 11. P. Doc11.
71. Mart nez Campos L. et al. Consensus document on the management of febrile neutropenia in paediatric haematology and oncology patients of the Spanish Society of Pediatric Infectious Diseases (SEIP) and the Spanish Society of Pediatric Hematology and Oncology (SEHOP) // An. Pediatr. 2023. Vol. 98, N 6. P. 446 - 459.
72. Campbell C.T., Poisson M.O., Hand E.O. An Updated Review of Clostridium difficile Treatment in Pediatrics // J. Pediatr. Pharmacol. Ther. JPPT Off. J. PPAG. 2019. Vol. 24, N 2. P. 90 - 98.
73. Dufrayer M.C. et al. Safety of levofloxacin as an antibiotic prophylaxis in the induction phase of children newly diagnosed with acute lymphoblastic leukemia: an interim analysis of a randomized, open-label trial in Brazil // Braz. J. Infect. Dis. Brazilian Society of Infectious Diseases, 2023. Vol. 27. P. 102745.
74. Chibabhai V. et al. Appropriate use of colistin in neonates, infants and children: Interim guidance // South. Afr. J. Infect. Dis. 2023. Vol. 38, N 1. P. 555.
75. Iosifidis E. et al. Use of Tigecycline in Pediatric Patients With Infections Predominantly Due to Extensively Drug-Resistant Gram-Negative Bacteria // J. Pediatr. Infect. Dis. Soc. 2017. Vol. 6, N 2. P. 123 - 128.
76. Araujo da Silva A.R., Quijada R. Use of Ceftazidime-Avibactam in Children Admitted to Pediatric Intensive Care Units // Child. Basel Switz. 2024. Vol. 11, N 6. P. 664.
77. Dellinger R.P. et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012 // Crit. Care Med. 2013. Vol. 41, N 2. P. 580 - 637.
78. Ferrer R. et al. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: results from a guideline-based performance improvement program // Crit. Care Med. 2014. Vol. 42, N 8. P. 1749 - 1755.
79. Morales Castro D. et al. Pharmacokinetic Alterations Associated with Critical Illness // Clin. Pharmacokinet. 2023. Vol. 62, N 2. P. 209 - 220.
80. Morrissey C.O. et al. Consensus guidelines for the use of empiric and diagnostic-driven antifungal treatment strategies in haematological malignancy, 2014 // Intern. Med. J. 2014. Vol. 44, N 12b. P. 1298 - 1314.
81. Ruhnke M., Schwartz S. Recent developments in the management of invasive fungal infections in patients with oncohematological diseases // Ther. Adv. Hematol. 2016. Vol. 7, N 6. P. 345 - 359.
82. Cordonnier C. et al. Empirical versus preemptive antifungal therapy for high-risk, febrile, neutropenic patients: a randomized, controlled trial // Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. 2009. Vol. 48, N 8. P. 1042 - 1051.
83. D. A. Karnofsky and J. H. Burchenal, "The Clinical Evaluation of Chemotherapeutic Agents in Cancer," In C. M. MacLeod, Ed., Evaluation of Chemotherapeutic Agents, Columbia University Press, New York, 1949, P. 196. - References - Scientific Research Publishing [Electronic resource]. URL: https://www.scirp.org/reference/ReferencesPapers?ReferenceID=966779 (accessed: 18.11.2024).
84. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
85. Miller JC, Einhorn LH. Phase II study of daily oral etoposide in refractory germ cell tumors. Semin
Oncol. 1990 Feb;17(1 Suppl 2): 36-9. PMID: 2154858
86. https://www.eortc.be/services/forms/1407/1407%20Tiger-Outline%2020140919.pdf
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Указаны в алфавитном порядке
1. Ахаладзе Дмитрия Гурамович, доктор медицинских наук, директор института онкологии и детской хирургии, заместитель главного врача по хирургии
2. Варфоломеева Светлана Рафаэлевна, профессор, доктор медицинских наук, президент РОДОГ, директор НИИ детской онкологии и гематологии им. акад. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, профессор кафедры детской онкологии ФГБОУ ДПО РМАНПО Минздрава России.
3. Жуков Николай Владимирович, доктор медицинских наук, руководитель отдела междисциплинарной онкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
4. Карачунский Александр Исаакович, доктор медицинских наук, директор Института онкологии, радиологии и ядерной медицины ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
5. Качанов Денис Юрьевич, доктор медицинских наук, заместитель директора Института онкологии, радиологии и ядерной медицины ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, заведующий отделением клинической онкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
6. Киргизов Кирилл Игоревич, кандидат медицинских наук, заместитель директора по научной работе НИИ ДОиГ имени академика РАМН Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
7. Литвинов Дмитрий Витальевич, доктор медицинских наук, главный врач - заместитель генерального директора по лечебной работе ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
8. Наймушина Полина Андреевна, врач-детский онколог отделения онкологии и гематологии старшего возраста ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
9. Рабаева Лилия Леонидовна, кандидат медицинских наук, заведующий отделением онкологии и гематологии старшего возраста ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
10. Рубанская Марина Владимировна, кандидат медицинских наук, заведующая детским онкологическим отделением N 1 (химиотерапии опухолей торакоабдоминальной локализации) НИИ детской онкологии и гематологии имени академика РАМН Л.А. Дурнова (НИИ ДОиГ) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
11. Сулейманова Амина Магомедовна, врач-детский онколог, старший научный сотрудник детского онкологического отделения N 1 (химиотерапии опухолей торакоабдоминальной локализации) НИИ детской онкологии и гематологии имени академика РАМН Л.А. Дурнова (НИИ ДОиГ) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
12. Шевцов Денис Валерьевич, врач-детский онколог отделения онкологии, детской хирургии головы и шеи и нейроонкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Конфликт интересов: отсутствует
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-детские онкологи-гематологи
2. Студенты медицинских ВУЗов, ординаторы, аспиранты
Таблица 6. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 7. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 8. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
СХЕМЫ ХИМИОТЕРАПИИ С СОПРОВОДИТЕЛЬНОЙ ТЕРАПИЕЙ
Таблица 9. Схема терапии Цисплатин**/этопозид** (PE) [13]
Препарат
Доза, сут
Продолжительность инфузии
Дни курса
Кумулятивная Доза за курс
Цисплатин** (P)
20 мг/м2
1 ч
1, 2, 3, 4, 5
100 мг/м2
#Этопозид** (E)
100 мг/м2
1 ч (до цисплатина**)
1, 2, 3
300 мг/м2
Таблица 10. Схема терапии Цисплатин**/этопозид**/#ифосфамид** (PEI) [13]
Препарат
Доза, сут
Продолжительность инфузии
Дни курса
Кумулятивная Доза за курс
Цисплатин** (P)
20 мг/м2
1 ч
1, 2, 3, 4, 5
100 мг/м2
#Этопозид** (E)
100 мг/м2
1 ч (до цисплатина**)
1, 2, 3
300 мг/м2
#Ифосфамид** (I) на фоне инфузионной терапии месной**
1500 мг/м2
22 ч
1, 2, 3, 4, 5
7 500 мг/м2
Рекомендации по проведению химиотерапии
- интервал между курсами ХТ - 21 день;
- детям младше 2 лет, либо меньше 10 кг доза должна быть рассчитана на кг (30 кг = 1 м2);
- при индексе Карновского менее 50 - доза #ифосфамида** 1000 мг/м2/день, дни 1 - 5;
- в возрасте менее 4 месяцев #ифосфамид** исключается из схемы лечения;
- условия для продолжения ХТ:
- количество лейкоцитов более 1,5 x 109/л o количество тромбоцитов более 50 x 109/л;
Режимы терапии второй линии
Режим терапии CarboPET [13]
Таблица 11. 1 курс - #Карбоплатин** + Этопозид**
Препарат
Доза
Путь введения
Дни введения
#Карбоплатин**
400 мг/м2
внутривенно за 3 часа
- 5 - 4 - 3
#Этопозид**
500 мг/м2
внутривенно за 3 часа
- 5 - 4 - 3
ПСКК
2 - 4 x 106 CD34/кг
внутривенно за 1 час
0
Таблица 12. 2 курс - Тиотепа + Этопозид на 28-е сутки от начала 1-го курса
Препарат
Доза
Путь введения
Дни введения
#Тиотепа
300 мг/м2
внутривенно за 3 часа
- 5 - 4 - 3
#Этопозид**
500 мг/м2
внутривенно за 3 часа
- 5 - 4 - 3
ПСКК
2 - 4 x 106 CD34/кг
внутривенно за 1 час
0
Режим терапии TI-CE [14] [86]
Табоица 13. 1 этап - 2 цикла индукционной химиотерапии с аферезом ПСКК
Препарат
Доза
Путь введения
Дни введения
#Паклитаксел**
200 мг/м2
внутривенно за 24 часа
1
#Ифосфамид** на фоне профилактики Уромитексаном
2000 мг/м2
внутривенно за 3 часа
2 - 4
Тайминг между курсами 14 дней
Количество целевых клеток для каждой реинфузии составляло не менее 2 x 10 клеток CD34/кг массы тела.
Таблица 14. 2 этап - 3 цикла высокодозной химиотерапии с поддержкой аутологичных ПСКК
Препарат
Доза
Путь введения
Дни введения
#Этопозид**
400 мг/м2
внутривенно за 1 час
- 4 - 2
#Карбоплатин**
AUC = 8
внутривенно за 1 час
- 4 - 2
Тайминг между курсами 21 - 28 дней
Режим терапии TIP [14] [31]
Таблица 15. Схема терапии TIP
Препарат
Доза
Путь введения
Дни введения
#Паклитаксел**
175 мг/м2
внутривенно за 3 часа
1
Ифосфамид** на фоне профилактики месной** 500 мг/м2**
1000 мг/м2
внутривенно за 1 час
1 - 5
Цисплатин**
20 мг/м2
внутривенно за 1 час
1 - 5
Тайминг между курсами 21 день
Режим терапии #Гемцитабин** + #Паклитаксел** [15]
Таблица 16. Схема терапии #Гемцитабин** + #Паклитаксел**
Препарат
Доза
Путь введения
Дни введения
#Гемцитабин**
1000 мг/м2
внутривенно за 30 минут
1, 8, 15
#Паклитаксел**
100 мг/м2
внутривенно за 1 час
1, 8, 15
Тайминг между курсами 28 день
Режим терапии #Гемцитабин** + #Паклитаксел** + Оксалиплатин** [32]
Таблица 17. Схема терапии #Гемцитабин**+ #Паклитаксел** + Оксалиплатин**
Препарат
Доза
Путь введения
Дни введения
#Гемцитабин**
800 мг/м2
внутривенно за 30 минут
1, 8
#Паклитаксел**
80 мг/м2
внутривенно за 1 час
1, 8
#Оксалиплатин**
130 мг/м2
внутривенно за 2 часа
1
Тайминг между курсами 21 день
Для детей младшего возраста (до 10 лет) с рефрактерными формами или рецидивами ГКО возможно применение следующих режимов химиотерапии: режим JEB, высокодозный режим CarboPET [13]. Решение о выборе оптимального режима второй линии терапии принимается индивидуально для каждого пациента после обсуждения клинической ситуации с Федеральным центром!
Режим терапии JEB
Таблица 19. Схема терапии JEB (#Карбоплатин** + Этопозид** + Блеомицин**) [36]
Препарат
Доза
Путь введения
Дни введения
#Карбоплатин**
600 мг/м2
внутривенно за 3 часа
2
#Этопозид**
120 мг/м2
внутривенно за 3 часа
1 - 3
Блеомицин**
15 мг/м2
внутривенно за 1 час
3
Тайминг между курсами - 21 день
Приложение А3.2
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ
ТОШНОТЫ И РВОТЫ, ОБУСЛОВЛЕННЫХ ПРОВЕДЕНИЕМ
ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
А3.2.1. Определение уровня эметогенности и варианта профилактики ТИР
Для выбора адекватного режима профилактики ТИР на первом этапе необходимо определение уровня эметогенности (риска развития ТИР) режима противоопухолевой терапии, который планируется использовать у пациента. Уровень эметогенности влияет на выбор препаратов для профилактики ТИР, их дозы и длительность применения [18].
В Приложении А3.2.6. (Таблица 20) представлена общая классификация эметогенности препаратов химиотерапии согласно рекомендациям ASCO (American Society of Clinical Oncology) [18] [37].
А3.2.2. Профилактика тошноты и рвоты на фоне высокоэметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, для детей в возрасте от 5 лет и/или массой 15 кг и более подходит использование четырехкомпонентной схемы, включающей блокаторы серотониновых 5HT3-рецепторов, антагониста NK1-рецепторов (другие противорвотные препараты), #дексаметазон**, и #оланзапин** [18] [38] [39] [40]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется. Использование #оланзапина** у детей в возрасте менее 5 лет и/или массой тела менее 15 кг не исследовалось и не может быть рекомендовано.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 3-х дней после завершения введения препаратов химиотерапии, подходит использование комбинации #дексаметазона** и #оланзапина** [39] [41] [40]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
В случае отсутствия возможности назначения антагониста NK1-рецепторов (другие противорвотные препараты) использование комбинации, состоящей из любого блокаторы серотониновых 5HT3-рецепторов, #дексаметазона** и #оланзапина** [41] [42] [40]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
В случае отсутствия возможности назначения #дексаметазона** в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов используется палоносетрон в комбинации с антагонистом NK1-рецепторов (другие противорвотные препараты, при возможности назначения) и #оланзапином** [43] [44]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
А3.2.3. Профилактика тошноты и рвоты на фоне умеренно эметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, использование двухкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов и #дексаметазон** [18]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 1 дня после завершения введения противоопухолевых препаратов, использование #дексаметазона** [18]. Режимы и дозы представлены в Приложении А3.2.6 (Таблица 1).
В случае отсутствия возможности назначения #дексаметазона** использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов и антагониста NK1-рецептора (другие противорвотные препараты). Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
В случае отсутствия возможности назначения и #дексаметазона**, и антагониста NK1-рецепторов (другие противорвотные препараты), в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов использование палоносетрона [18] [45]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
А3.2.4. Профилактика тошноты и рвоты на фоне низко- и минимально эметогенной химиотерапии
Профилактика ТИР на фоне низко- и минимально эметогенной химиотерапии включает в себя однокомпонентную профилактику, включающей блокаторы серотониновых 5HT3-рецепторов, при низкоэметогенной терапии или же вовсе отсутствие ее в случае химиотерапии с минимальной эметогенной активностью [18]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
А3.2.5. Лечение прорывной и рефрактерной рвоты
Пациентам с прорывной и рефрактерной рвотой на фоне цитостатической терапии показано:
1. Если прорывная ТИР возникла на фоне цитостатической терапии (и соответственно профилактики), относящейся к минимально, низко- или среднеэметогенному уровню, то необходимо использовать препараты, предусмотренные следующим, более высоким уровнем профилактики.
2. Если пациент и так получает профилактику, предусмотренную для высокоэметогенной терапии, то при возникновении прорывной ТИР необходимо рассмотреть вопрос о добавлении #оланзапина** (если он не применялся ранее в связи с неподходящим возрастом или массой тела). При невозможности использовать #оланзапин** в качестве альтернативы может быть применен метоклопрамид**.
В случае, если у пациента наблюдается рефрактерная ТИР и он еще не получает максимальный уровень профилактики, то необходимо провести эскалацию противорвотной терапии. Если рефрактерная ТИР наблюдается на фоне максимального уровня профилактики, возможна замена использующегося блокатора серотониновых 5HT3-рецепторовна палоносетрон, введение дополнительных доз блокаторов серотониновых 5HT3-рецепторов. При неудаче этих подходов к профилактике показано на постоянной основе добавить #оланзапин**, метоклопрамид** или другие препараты, показавшие у пациента эффективность при лечении прорывной рвоты [46].
А3.2.6 Таблица 20 - Уровень эметогенности противоопухолевых препаратов
Степень эметогенности (риск развития рвоты)
Рекомендации COG 2022 (педиатрические)
+
Рекомендации ASCO 2020 (общие для взрослых и детей)
Высокая
(> 90%)
Монотерапия
Аспарагиназа** (в/в) ![]() 20 000 МЕ/м2
20 000 МЕ/м2
Бусульфан (в/в) ![]() 0,8 мг/кг
0,8 мг/кг
Бусульфан** (р.о.) ![]() 1 мг/кг
1 мг/кг
Дакарбазин** (в/в)
Дактиномицин (в/в) ![]() 1,35 мг/м2
1,35 мг/м2
Доксорубицин** (в/в) ![]() 30 мг/м2
30 мг/м2
Идарубицин (р.о.) ![]() 30 мг/м2
30 мг/м2
Карбоплатин** (в/в) ![]() 175 мг/м2
175 мг/м2
Кармустин** (в/в)
Мелфалан** (в/в)
Метотрексат** (в/в) ![]() 12 г/м2
12 г/м2
Цисплатин** (в/в) ![]() 12 мг/м2
12 мг/м2
Циклофосфамид** (в/в) ![]() 1200 мг/м2
1200 мг/м2
Цитарабин** (в/в) ![]() 3 г/м2/сутки
3 г/м2/сутки
Комбинированные режимы
Дакарбазин** ![]() 250 мг/м2 (в/в) + доксорубицин** (в/в)
250 мг/м2 (в/в) + доксорубицин** (в/в) ![]() 60 мг/м2
60 мг/м2
Дактиномицин 900 мкг/м2 (в/в) + ифосфамид** 3 г/м2
Циклофосфамид** > 600 мг/м2 + дактиномицин ![]() 1 мг/м2
1 мг/м2
Циклофосфамид** ![]() 400 мг/м2 + доксорубицин**
400 мг/м2 + доксорубицин** ![]() 40 мг/м2
40 мг/м2
Цитарабин** ![]() 90 мг/м2 (в/в) +
90 мг/м2 (в/в) +
метотрексат** (в/в) ![]() 150 мг/м2
150 мг/м2
Этопозид** (в/в) ![]() 60 мг/м2 +
60 мг/м2 +
ифосфамид** (в/в) ![]() 1,2 г/м2
1,2 г/м2
Этопозид** (в/в) ![]() 250 мг/м2 +
250 мг/м2 +
тиотепа (в/в) ![]() 300 мг/м2
300 мг/м2
Умеренная
(31 - 90%)
Монотерапия
Алемтузумаб** (в/в)
Бендамустин** (в/в)
Дактиномицин (в/в) 10 мг/кг
Даунорубицин** (в/в)
Доксорубицин** (в/в) 25 мг/м2
Идарубицин** (в/в)
Иксабепилон** (в/в) 3 - 10 мг/м2
Иматиниб** (р.о.) > 260 мг/м2/сутки
Интерферон альфа** (в/в) 15 - 30 млнМЕ/м2/сутки
Иринотекан** (в/в)
Ифосфамид** (в/в)
Карбоплатин** (в/в)
Клофарабин (в/в)
Метотрексат** (в/в) 5 г/м2
Метотрексат** (и/т)
Оксалиплатин** (в/в)
Темозоломид** (в/в)
Тиотепа (в/в)
Циклофосфамид** (в/в) 1000 мг/м2
Цитарабин** (в/в) 75 мг/м2
Эпирубицин** (в/в)
Комбинированные режимы
Цитарабин** (в/в) 100 мг/м2 +
Даунорубицин** (в/в) 45 мг/м2 +
Этопозид** (в/в) 100 мг/м2 +
Преднизолон** (р.о.)
Цитарабин** 60 или 90 мг/м2 +
Метотрексат** 120 мг/м2
Низкая
(10 - 30%)
Монотерапия
Афлиберцепт** (в/в)
Блинатумомаб** (в/в)
Бортезомиб** (в/в)
Децитабин (в/в)
Доцетаксел** (в/в)
Гемцитабин** (в/в)
Гефитиниб** (р.о.) 150 - 500 мг/м2/сутки
Иматиниб** (р.о.) 260 мг/м2/сутки
Инотузумаб озогамицин (в/в)
Кабазитаксел** (в/в)
Карфилзомиб** (в/в)
Мелфалан** (р.о.) 0,2 мг/г
Меркаптопурин** (р.о.) ![]() 4,2 мг/кг
4,2 мг/кг
Метотрексат** (в/в) 38 - 83 мг/м2
Митоксантрон** (в/в) ![]() 33 мг/м2
33 мг/м2
Митомицин** (в/в)
Неларабин** (в/в)
Паклитаксел** (в/в)
Панитумумаб** (в/в)
Пегилированный липосомальный доксорубицин** (в/в)
Пеметрексед** (в/в)
Пертузумаб** (в/в)
Прокарбазин (р.о.) 50 - 100 мг/м2/сутки
Руксолитиниб** (р.о.) 15 - 21 мг/м2
Селуметиниб (р.о.) 20 - 30 мг/м2
Сорафениб** (р.о.) 150 - 325 мг/м2
Темозоломид** (р.о.) 200 мг/м2
Темсиролимус (в/в)
Топотекан (в/в)
Фторурацил** (в/в)
Цетуксимаб** (в/в)
Циклофосфамид** (в/в) 500 мг/м2
Циклофосфамид** (р.о.) 2 - 3 мг/кг
Эверолимус** (р.о.) 0,8 - 9 мг/м2/сутки
Элотузумаб** (в/в)
Энфортумаб ведотин (в/в)
Эрлотиниб** (р.о.) 35 - 150 мг/м2/сутки
Эрибулин** (в/в)
Этопозид** (в/в)
Комбинированная терапия
Цитарабин** (в/в) 60 мг/м2 + метотрексат** (в/в) 90 мг/м2
Минимальная (< 10%)
Монотерапия
Авелумаб** (в/в)
Атезолизумаб** (в/в)
Бевацизумаб** (в/в)
Блеомицин** (в/в)
Бусульфан** (в/в)
Винбластин** (в/в)
Винкристин** (в/в) ![]() 1,5 мг/м2
1,5 мг/м2
Винорелбин** (в/в)
Даратумумаб (в/в)
Доксорубицин** (в/в) 10 мг/м2
Дурвалумаб** (в/в)
Ипилимумаб** (в/в)
Кладрибин (в/в)
Меркаптопурин** (р.о.) ![]() 4.2 мг/кг
4.2 мг/кг
Метотрексат** (р.о.) ![]() 10 мг/м2
10 мг/м2
Ниволумаб** (в/в)
Обинутузумаб** (в/в)
Офатумумаб (в/в)
Пембролизумаб** (в/в)
Полатузумаб ведотин (в/в)
Рамуцирумаб** (в/в)
Ритуксимаб** (в/в)
Трастузумаб (в/в)
Хлорамбуцил** (р.о.) ![]() 0.2 мг/кг/сутки
0.2 мг/кг/сутки
Флударабин** (в/в)
Комбинированные режимы
Меркаптопурин** (р.о.) ![]() 2.5 мг/кг +метотрексат** (р.о.)
2.5 мг/кг +метотрексат** (р.о.) ![]() 0.1 мг/кг/сутки
0.1 мг/кг/сутки
Цисплатин** ![]() 60 мг/м2 (в/а) + доксорубицин**
60 мг/м2 (в/а) + доксорубицин** ![]() 30 мг/м2 (в/а)
30 мг/м2 (в/а)
А3.2.7 Таблица 21 - Дозы и режимы противорвотных препаратов
Степень эметогенности
Режимы
Дозы
Высокая
Блокаторы серотониновых 5HT3-рецепторов
+
#Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
+
#Оланзапин**
I. #Дексаметазон**
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 внутривенно/перорально все дни химиотерапии и три дня после ее заверешения;
2. Дети, получающие химиотерапию с умеренной эметогенной активностью:
![]() 0,6 м2: 2 мг внутривенно/перорально каждые 12 часов;
0,6 м2: 2 мг внутривенно/перорально каждые 12 часов;
>0,6 м2: 4 мг внутривенно/перорально каждые 12 часов.
При одновременном применении с #апрепитантом необходимо уменьшение дозы дексаметазона на 50%.
II. Блокаторы серотониновых 5HT3-рецепторов
#Гранисетрон
1. Дети, получающие высокоэметогенную химиотерапию: 40 мкг/кг внутривенно однократно.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 40 мкг/кг внутривенно однократно.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 40 мкг/кг внутривенно однократно.
#Ондансетрон**
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 (0,15 мг/кг) внутривенно/перорально перед терапией однократно, а затем каждые 8 часов.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 5 мг/м2 (0,15 мг/кг; максимум 8 мг) внутривенно/перорально перед терапией однократно, а затем каждые 12 часов.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 10 мг/м2 (0,3 мг/кг; максимум 16 мг внутривенно или 24 мг перорально) до начала терапии однократно.
Палоносетрон
1. Дети от 1 месяца до 17 лет: 0,02 мг/кг (максимум 1,5 мг) внутривенно один раз перед терапией.
2. Дети 17 лет и старше: 0,5 мг внутривенно однократно перед терапией.
III. Антагонисты NK-1 рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты)
#Апрепитант
Дети старше 6 месяцев:
- 1-й день: 3 мг/кг (максимум 125 мг) перорально 1 раз в сутки за 1 час до химиотерапии
- 2-й и 3-й дни: 2 мг/кг (максимум 80 мг) перорально один раз в сутки.
#Фосапрепитант
1. Дети от 6 месяцев до 2-х лет: 5 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
2. Дети от 2-х до 12 лет: 4 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
3. Дети от 12 до 17 лет: 150 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день
Комбинация #апрепитант + #фосапрепитант
1. Дети от 6 месяцев до 12 лет:
- 3 мг/кг (максимальная доза 115 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
- 2 мг/кг (максимальная доза 80 мг) перорально, дни 2, 3;
2. Дети от 12 до 17 лет:
- 115 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день
- 80 мг перорально, дни 2, 3.
IV. #Оланзапин**
1. Дети весом от 30 кг - 0,07 мг/кг (от 30 до 55 кг - 2,5 мг/сут, свыше 55 кг - 5 мг/сут) перорально за 1 час до введения противоопухолевых препаратов, все дни химиотерапии и три дня после ее завершения;
2. Дети весом > 15 и < 30 кг - 2,5 мг/сут перорально за 1 час до введения противоопухолевых препаратов, все дни химиотерапии и три дня после ее завершения;
Для детей весом менее 15 кг и/или возрастом менее 5 лет - неприменимо в силу отсутствия данных исследований об эффективности и безопасности #оланзапина**.
Блокаторы серотониновых 5HT3-рецепторов+
#Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов+
#Дексаметазон**
+
#Оланзапин**
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
+
#Оланзапин**
![]()
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Умеренная
Блокаторы серотониновых 5HT3-рецепторов+
#Дексаметазон**
Блокаторы серотониновых 5HT3-рецепторов+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
Низкая
Блокаторы серотониновых 5HT3-рецепторов
Минимальная
Блокаторы серотониновых 5HT3-рецепторов или
отсутствие профилактики
Приложение А3.3
РЕКОМЕНДАЦИИ ПО ОЦЕНКЕ НУТРИТИВНОГО СТАТУСА И ЕГО КОРРЕКЦИИ
А3.3.1. Нутритивный скрининг и мониторинг
Всем пациентам при поступлении в стационар и далее от 1 до 4 раз в месяц показано проводить нутритивный скрининг (скрининговую оценку нутритивного статуса) с целью выявления белково-энергетической недостаточности либо риска ее развития [47] [28] [48]
Выявление нутритивных нарушений на ранних этапах их развития, особенно до начала противоопухолевой терапии позволяет своевременно начать нутритивную коррекцию. Критерии белково-энергетической недостаточности, ожирения и факторы нутритивного риска - см. приложение А3.3.2. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/инструментов для проведения нутритивного скрининга [49].
Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [29].
Для проведения нутритивного скрининга необходимо использовать специальные валидированные опросники/ инструменты, особенно актуальным их использование является на этапе первичного поступления в стационар и/или на (очередном) этапе поступления в клиническое отделение [29] [50].
В своем большинстве скрининговые инструменты ориентированы на объединение данных об основном диагнозе, клиническом статусе, антропометрических показателях, динамике массы тела, состоянии питания и интеграции этих данных в общий балл с последующим разделением пациентов на 2 или 3 когорты: не нуждаются в нутритивной коррекции (поддержке); требуют повторного скрининга в динамике ("тревожная" группа); нуждаются в нутритивной коррекции (поддержке). Клиническое подразделение (или учреждение) вправе использовать тот инструмент, или комбинацию инструментов, которую посчитает наиболее приемлемой для проведения нутритивного скрининга среди своих пациентов. Необходимо помнить, что существующие скрининговые инструменты не предназначены для ответа на вопрос об объеме и способе необходимой нутритивной поддержки, не несут в себе прогностической информации для конкретного пациента, поскольку их применение нацелено исключительно на медицинскую сортировку. К тому же, универсального инструмента для скрининга в педиатрии не существует
Для первичной (общей) оценки нутритивного статуса и выявления нутритивного риска необходимо учитывать антропометрические показатели, изменение массы тела за определенный период (3, 6 или 12 месяцев), данные о питании (режим, привычный состав питания, особенности приема пищи, возможные нарушения приема пищи, наличие непереносимости/аллергии на компоненты пищи), об эндокринном статусе (данные о выявленных эндокринных нарушениях у ребенка), данные о выявленных гастроинтестинальных нарушениях [29] [50].
В качестве обязательного минимума основных антропометрических параметров для первичной и регулярной оценки нутритивного статуса необходимо использовать следующие: масса тела, рост (длина тела), индекс массы тела [29] [47].
В качестве дополнительных антропометрических параметров в случае потребности в детальном антропометрическом исследовании для первичной и регулярной оценки нутритивного статуса используются следующие: измерение окружностей, длин, толщины складок, кистевая динамометрия [28] [47].
Для соотнесения полученных данных антропометрии (рост, масса тела, индекс массы тела, окружность плеча) с нормативными значениями по педиатрической популяции используются референсные значения (шкалы), либо локальных (отечественных) референсов, либо мировых общеиспользуемых номограмм: центильные значения/перцентили, либо величина отклонения полученного значения от среднего по популяции (SDS или z-score) [47] [50].
Часто используемыми "по умолчанию" в РФ являются референсы ВОЗ (WHO growth charts), для удобства работы с которыми существуют свободно доступные программы (WHO anthro и WHO anthro plus), которые быстро позволяют высчитать ключевые антропометрические параметры в соотнесении их с референсными данными ВОЗ. Однако возможно использование и других референтных данных для соотнесения данных пациента с нормативами - в таком случае необходимо указывать, какие конкретно референсы применялись.
Пациентам с выявленными нутритивными нарушениями при первичном скрининге рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный осмотр и опрос на предмет выявления нутритивно-метаболических нарушений и их предикторов [29].
Ввиду высокой распространенности в детской популяции с онкологическими заболеваниями нарушений состава тела, тканевого дисбаланса в виде скрытой белково-энергетической недостаточности (саркопении), скрытого ожирения (накопления жировой массы), в виду распространенности отеков (в том числе и скрытых), а также нарушений распределения компартментов жидкости показана оценка состава тела различными имеющимися методами: биоимпедансный анализ, двухэнергетическая рентгеновская абсорбциометрия, МРТ, КТ и др. - для уточняющей и углубленной оценки состава тела в группах риска. Эти группы следующие: хроническая белково-энергетическая недостаточность, длительная, более 2 месяцев, необходимость в парентеральном питании, включение в терапию гормональных препаратов, опухоли ЦНС, хронические расстройства приема пищи (пищевого поведения), реципиенты ГСК при выявленных антропометрически нутритивных нарушениях [29] [50].
Всем пациентам, получающим нутритивную поддержку, показано проводить нутритивный мониторинг, в который включается опрос, антропометрию, анализ тканевого состава тела, лабораторные показатели (анализ крови биохимический общетерапевтический, копрологическое исследование) [29] [51]
А3.3.2. Нутритивная поддержка
Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) показано проведение нутритивной поддержки (НП) [29].
Наличие белково-энергетической недостаточности или высокого риска ее развития у детей с ЗНО в процессе противоопухолевого лечения обуславливает связанные с этим риски увеличения инвалидизации, увеличения длительности и объема основного и сопроводительного лечения, низкой успешности проводимого лечения, увеличения смертности и общих финансовых затрат на лечебно-реабилитационные мероприятия - в процессе активного противоопухолевого лечения и после его окончания. Скрытая БЭН (например, избытком жировой массы на фоне длительного приема глюкокортикоидов) сопровождается такими же рисками. Поэтому, учитывая высокую вероятность усугубления нутритивных проблем на фоне лечения, пациентам целесообразно назначать нутритивную поддержку в дополнение к существующему рациону или заменяя его.
У пациентов с ожирением (избытком жировой массы) возможно развитие скрытой белково-энергетической недостаточности, определяемой дефицитом безжировой массы тела и критическим уменьшением ее скелетно-мышечного компартмента, в связи с чем показано проведение коррекции данного вида дефицита, наличие ожирения само по себе не является противопоказанием для проведения нутритивной поддержки энтеральным или парентеральным путем [50] [52] [53].
При выборе формы, метода, вида и объема нутритивной поддержки необходимо руководствоваться, в первую очередь, принципом индивидуального пациент-ориентированного подхода - сообразно клинической ситуации и логике [29].
В случае, если пациент не может/не хочет/не готов принимать назначенный объем смеси в необходимом режиме самостоятельно показана установка назогастрального или назоинтестинального зонда или гастростомия [29] [54].
Отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через зонд питательный назогастральный. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) - в этих случаях показана реализация ЭП через зонд назоеюнальный стерильный однократного применения.
При текущей или потенциальной необходимости проведения зондового питания продолжительностью более 6 недель, показана гастростомия [29].
В случае, когда выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), возможно превентивная гастростомия, минуя этап зондового питания.
Ключевым показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность (как минимум, на уровне энергопотребности основного обмена) пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе.
Начало парентерального питания необходимо производить постепенно, ступенчато увеличивая объем (и скорость) суточной инфузии, начиная от трети/ половины расчетного целевого объема и, под мониторингом показателей анализа крови биохимического общетерапевтического (прежде всего, глюкоза, прямой билирубин, мочевина), исследование кислотно-основного состояния и газов крови, за несколько суток (скорость достижения целевого объема определяется индивидуально по клинической ситуации) довести объем до целевого. Отмену парентерального питания необходимо производить также постепенно, ступенчато, в обратном порядке.
Крайне нежелательно назначение парентерального питания сразу в полном объеме, равно как разовая ("со следующих суток") отмена полного парентерального питания. Особенно опасным является назначение полного парентерального питания больным с длительным отсутствием алиментации - ввиду возможного развития рефидинг-синдрома. Объем ПП должно постепенно (ступенчато) увеличивать под параллельным контролем КЩС (исследование кислотно-основного состояния и газов крови), электролитов, глюкозы, мочевины, прямого билирубина в крови. При необходимости, объем и состав ПП должны корректироваться.
А3.3.3. Справочно-информационные таблицы по оценке нутритивного статуса и его коррекции.
Таблица 22. Интерпретация нутритивного статуса на основании Z-score согласно референсным данным ВОЗ [48].
Степень/Форма (варианты интерпретации)
Z-скор, SDS
Показатели *
Недостаточность питания тяжелой степени/Белково-энергетическая недостаточность тяжелой степени
-3,00 и ниже
Масса тела на возраст, ИМТ на возраст,
окружность плеча на возраст
Недостаточность питания умеренной степени 1 Белково-энергетическая недостаточность умеренной степени
От -2,00 до -2,99
Недостаточность питания легкой степени/Белково-энергетическая недостаточность легкой степени
От -1,00 до -1,99
Эутрофня/Нормотрофня/Нормальный нутритивный статус
От -0,99 до +0,99
Избыточное питание
От +1,00 до -1,99
Ожирение 1 степени
От +2,00 до -2,49
Ожирение 2 степени
От +2,50 до -2,99
Ожирение 3 степени
От +3,00 до -3,99
Ожирение морбндное
+4,00 и выше
Примечания: нутритивный статус в онкопедиатрии оценивается по совокупным данным (клинические, лабораторные, инструментальные), с учетом нутритивного риска, антропометрические показатели позволяют критериально ориентироваться в определении нутритивного статуса и не могут быть единственно определяющими [50].
* - в определении нутритивного статуса используется показатель с минимальным SDS; SDS - standard deviation score (величина стандартного отклонения), ожирение - простое; гипоталамическое; при нейроэндокринных заболеваниях; ятрогенное; моногенное; синдромальное
Таблица 23. Факторы высокого риска развития нарушений нутритивного статуса [50]
Критерии
1. Нарушения аппетита в течение ближайшей недели или особенности аппетита (избирательность, привередливость в питании, нестабильный и непостоянный аппетит и др.), выявленные анамнестически, свойственные данному ребенку с раннего возраста
2. Снижение объема потребления пищи на 1/3 - 1/2 и более от рекомендуемых возрастных норм (или снижение частоты/объема питания в динамике за неделю по данным опроса или данным пищевого дневника)
3. Потеря более 2% массы тела за неделю или более 5% за месяц
4. Исходная гастроинтестинальная дисфункция (хронические заболевания ЖКТ, непереносимость компонентов пищи и пищевая аллергия) или сформировавшаяся на фоне противоопухолевого лечения
5. Заболевания обмена веществ и/или эндокринные заболевания
6. Опухоли брюшной полости, малого таза, локализованные забрюшинно, опухоли головы и шеи
7. Предстоящая ТГСК и ранний - до 3-х месяцев - посттрансплантационный период
8. Возраст менее 3 лет
Примечание: При наличии минимум двух вышеперечисленных критериев пациент относится к группе высокого нутритивного риска - вне зависимости от текущего нутритивного статуса, его текущего питания и клинической ситуации
Таблица 24. Основные скрининговые инструменты для выявления риска нутритивных нарушений в педиатрии [51] [50]
Скрининговый инструмент
Данные, необходимые для оценки риска
Определение степени острой и хронической БЭН
Антропометрические данные
Простая педиатрическая шкала для выявления детей с риском недоедания (PNRS)
Антропометрические данные
Прием пищи
Желудочно-кишечная дисфункция
Симптомы, которые могут нарушать аппетит (боль, одышка, депрессия)
Тяжесть основного заболевания
Инструмент скрининга для оценки недоедания в педиатрии (STAMP)
Антропометрические данные
Прием пищи
Тяжесть основного заболевания
Инструмент скрининга нутритивного риска у детей в стационаре (STRONGkids)
Прием пищи
Субъективная клиническая оценка
Тяжесть основного заболевания
Потеря веса
Детская шкала недоедания по Йоркиллу (PYMS)
Индекс массы тела
Потеря веса
Изменения в приеме пищи
Инструмент нутритивного скрининга для детской онкологии (SCAN)
Тип онкологического заболевания
Интенсивность лечения (химиотерапия, лучевая терапия, ТГСК)
Желудочно-кишечная дисфункция
Прием пищи
Потеря веса
Субъективная клиническая оценка
Субъективная глобальная оценка питания (SGNA)
Антропометрические данные
Потеря веса
Желудочно-кишечная дисфункция
Клинический статус
Прием пищи
Таблица 25. Рекомендуемые потребности детей в основных нутриентах и энергии (на кг массы тела в сутки) при расчете диетотерапии и энтерального питания [55].
Возраст
Белки, г/кг в сутки
Жиры, г/кг в сутки
Углеводы, г/кг в сутки
Энергия, ккал/кг в сутки
Новорожденные
1,5 - 4
3 - 4
18
110 - 120
до 1 года
1 - 2,5
3 - 4
16 - 18
90 - 100
1 - 2 года
1 - 2
2 - 3
12 - 14
75 - 90
3 - 6 лет
10 - 12
75 - 90
7 - 12 лет
до 12
60 - 75
13 - 18 лет
до 10
30 - 60
Примечания: Потребности приведены для ориентировки расчета и назначения энтерального питания; они не отменяют и не заменяют пациент-ориентированный подход в назначении нутритивной поддержки: в каждом конкретном случае следует учитывать клиническую картину, возможные метаболические и органные дисфункции и корректировать поступление нутриентов с учетом возможности и переносимости ребенком
Приложение А3.4
ГЕМОТРАНСФУЗИОННАЯ ПОДДЕРЖКА
Приказ Министерства здравоохранения РФ от 28 октября 2020 г. N 1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология", зарег. в Минюсте РФ 27.11.2020 N 61123 регламентирует порядок гемотрансфузионной поддержки пациентов, нуждающихся в оказании такого рода медицинской помощи.
Детям со злокачественными новообразованиями, получающими химио- и/или лучевую терапию, при тяжелой анемии (Нв 70 г/л, Ht 25%) с проявлениями симптомов и признаков анемической гипоксии и без кровотечений рекомендуются трансфузии эритроцитсодержащих компонентов донорской крови [56].
Трансфузии могут не потребоваться для хорошо компенсированных пациентов, восстанавливающихся после индуцированной аплазии. Однако, в случае предстоящей интенсивной химиотерапии в отсутствии клинических проявлений анемического синдрома трансфузии эритроцитсодержащих компонентов донорской крови могут быть оправданы. Решение о применении трансфузий должно обосновываться, прежде всего, клиническими, а не лабораторными данными [57] [58].
Стабильным пациентам детского возраста со злокачественными новообразованиями в отсутствие кровотечений показано проводить трансфузии эритроцитсодержащих компонентов донорской крови в дозе 10 - 15 мл на кг массы тела [57] [58].
Пациентам детского возраста с онкологическими заболеваниями проводят трансфузии лейкоредуцированных компонентов донорской крови [59].
Было показано, что применение лейкоредуцированных компонентов донорской крови позволяет снизить частоту фебрильных негемолитических трансфузионных реакций, а также существенно снижает вероятность HLA-аллоиммунизации пациента и передачу некоторых гемотрансмиссивных инфекций (цитомегаловирус, вирус Эпштейна-Барр).
С целью предотвращения посттрансфузионной реакции трансплантат против хозяина, пациентам со злокачественными заболеваниями, получающими химио- и/или лучевую терапию и находящимися в иммуносупрессии, рекомендуется проводить трансфузии клеточных компонентов крови, облученных ионизирующим излучением в дозе 25 Гр [59].
У детей со злокачественными новообразованиями и гипопролиферативной тромбоцитопенией, вызванной основным заболеванием и/или его лечением, показаны профилактические трансфузии концентрата тромбоцитов при следующих условиях [60]:
- стабильным новорожденным при снижении количества тромбоцитов ![]() 25 x 109/л;
25 x 109/л;
- стабильным пациентам при снижении количества тромбоцитов ![]() 10 x 109/л;
10 x 109/л;
- пациентам с лихорадкой при снижении количества тромбоцитов ![]() 15 x 109/л;
15 x 109/л;
- у пациентов с повышенным риском кровотечений при снижении количества тромбоцитов ![]() 20 x 109/л;
20 x 109/л;
- перед выполнением малой хирургической манипуляции в некритических локусах при снижении количества тромбоцитов ![]() 20 x 109/л;
20 x 109/л;
- перед выполнением люмбальной пункции, при снижении количества тромбоцитов ![]() 40 x 109/л;
40 x 109/л;
- перед выполнением чрескожной биопсии печени, если количество тромбоцитов ![]() 50 x 109/л;
50 x 109/л;
- при хирургических вмешательства в критических локализациях (например, центральная нервная система), если количество тромбоцитов ![]() 75 - 100 x 109/л;
75 - 100 x 109/л;
- перед иными оперативными вмешательствами при количестве тромбоцитов ![]() 50 x 109/л
50 x 109/л
Повышенный риск кровотечений имеют пациенты получающие антитромботические средства, пациенты с ДВС, сепсисом и др.
Трансфузии концентрата тромбоцитов у детей с гипопролиферативной тромбоцитопенией и геморрагическим синдромом используются при [60]:
- малом геморрагическом синдроме и снижении количества тромбоцитов ![]() 10 x 109/л;
10 x 109/л;
- умеренном геморрагическом синдроме и снижении количестве тромбоцитов ![]() 20 x 109/л;
20 x 109/л;
- тяжелом геморрагическом синдроме и снижении количестве тромбоцитов ![]() 30 x 109/л;
30 x 109/л;
- при кровотечении в критически важной локализации (например, ЦНС) синдроме и снижении количестве тромбоцитов ![]() 100 x 109/л
100 x 109/л
Трансфузии тромбоцитов у детей со злокачественными новообразованиями показаны в следующей дозе [60]:
- новорожденные 10 - 15 мл/кг
- дети с массой тела более 10 кг: 10 мл/кг
Трансфузии гранулоцитного концентрата показаны детям с онкологическими заболеваниями и тяжелой, затяжной нейтропенией (количество нейтрофилов менее 200/мкл) при наличии тяжелой бактериальной или грибковой инфекции, не поддающейся лечению адекватной противомикробной терапией [59].
Трансфузии донорской свежезамороженной плазмы крови показаны детям с онкологическими заболеваниями при наличии клинически-значимого кровотечения в сочетании с повышением активированного частичного тромбопластинового времени (АЧТВ) и/или международного нормализованного отношения (МНО) более чем в 1,5 раза от верхней границы нормы [59].
Трансфузии донорской свежезамороженной плазмы детям со злокачественными новообразованиями показаны в дозе 15 мл/кг массы тела [59].
Трансфузии криопреципитата у детей с онкологическими заболеваниями показаны при снижении концентрации фибриногена менее 1 - 1.5 г/л [61].
Трансфузии криопреципитата при приобретенном дефиците фибриногена, вызванном различными причинами, показаны при снижении его концентрации в сыворотке менее 1 г/л. Трансфузии криопреципитата при снижении его концентрации в крови ниже 1,5 г/л показан для пациентов с острым промиелоцитарным лейкозом, при тяжелом интраоперационном кровотечении и у пациентов с сепсисом при развитии геморрагического синдрома.
Приложение А3.5
ОСОБЕННОСТИ
ВЕНОЗНОГО ДОСТУПА В ОБЕСПЕЧЕНИИ УСПЕШНЫХ ДИАГНОСТИЧЕСКИХ
И ЛЕЧЕБНЫХ МЕРОПРИЯТИЙ У ДЕТЕЙ С ОНКОЛОГИЧЕСКИМИ
И ГЕМАТОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ.
3.5.1 Общие особенности венозного доступа.
Прилагаемая производителем инструкция и документация к устройству венозного доступа позволяет предоставить ключевую информацию об устройстве, возможных скоростях и ограничении давления при введении, объеме заполнения устройства всему персоналу занимающемуся ежедневным уходом за пациентом или проводящим диагностические процедуры [62]. Данная документация должна быть быстро и постоянно доступна персоналу, работающему с пациентом.
3.5.2 Рекомендации по выбору устройства
Выбор устройства венозного доступа должен основываться на потребностях пациента и учитывать:
- Диагноз, план ведения и ожидаемую продолжительность внутривенного лечения;
- Возраст пациента;
- Возможные предпочтения пациента в отношении типа или расположения устройства;
- Состояние вен пациента;
- Доступные ресурсы для установки и поддержания работоспособности устройства.
Не существует достаточных доказательств для однозначного преимущества одного устройства перед другим для каждой категории пациентов. Желательно использовать центральный венозный катетер с наименьшим числом просветов [63].
При наличии противопоказаний к введению центрального венозного катетера через вены бассейна верхней полой вены используются центральные венозные катетеры, вводимые через бедренную вену.
Для постоянного использования (ежедневно или хотя бы один раз в неделю) показано применять внешние катетеры такие как PICC, CICC, для периодического использования (реже одного раза в неделю) - полностью имплантированные системы (порт) (порт/катетер инфузионный/инъекционный, имплантируемый***) [62].
3.5.3 Рекомендации по установке устройства
Устройство центрального венозного доступа вводится по срочным и плановым показаниям в условиях асептического операционного зала. Подробное описание имеется в клинических рекомендациях ФАР.
Выбор вены зависит от состояния венозной системы пациента. Предпочтительнее использовать устройства, позволяющие вводить высокие потоки и контрастное средство [64] [65]. Следует стремиться чтобы соотношение диаметра центрального венозного катетера к диаметру вены не превышало 1/3.
Использование многопросветных центральных венозных катетеров, хоть и показано некоторым специфическим категориям пациентов, но при этом связано с повышенным риском инфицирования [66] [67].
Выбирать материал центрального венозного катетера необходимо, основываясь на высоких характеристиках потока и сопротивления давлению, а также долговечности устройств.
3.5.4. Уход за венозным доступом и его удаление.
Уход за венозным доступом осуществляется с соблюдением правил асептики и антисептики, показана периодическая смена повязки, промывание венозного доступа, его "закрытие" в случае прерывистого характера лечения, удаление в соответствие с показаниями [68].
Приложение А3.6
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ИНФЕКЦИЙ
3.6.1 Используемые стандартные определения
Нейтропения определяется количеством гранулоцитов менее 0,5 x 109/л, либо менее 1,0 x 109/л с ожидаемым снижением в течение нескольких последующих дней.
Фебрилитет - однократный подъем температуры тела ![]() 38,3 °C или температура тела
38,3 °C или температура тела ![]() 37,8 °C, сохраняющаяся в течение одного и более часа.
37,8 °C, сохраняющаяся в течение одного и более часа.
Гипотермия - снижение температуры тела менее 36 °C. Данный показатель является важным признаком инфекционного процесса, особенно у детей младшего возраста и у пациентов, получающих глюкокортикоиды.
Лихорадка неясной этиологии - состояние, характеризующееся фебрилитетом при отсутствии клинико-рентгенологических проявлений инфекции и микробиологических данных.
Бактериемия - идентификация микроорганизма из гемокультуры, взятой во время фебрильного эпизода, не являющегося присевным. К ложной бактериемии относится идентификация так называемых присевных микроорганизмов - комменсалов кожи рук: коагулазонегативных стафилококков, Propionibacterium spp., Micrococcus spp., и др. - в случае их однократной идентификации.
Доказанной является инфекция, при которой имеется идентификация микроорганизма из стерильных субстратов организма (кровь, ликвор, моча, биопсийный материал) при наличии симптомов воспалительной реакции, либо изоляция патогена из нестерильных субстратов (кожа, слизистые, желудочно-кишечный тракт) при соответствующей локальной клинической картине инфекции.
Вероятной является инфекция, при которой нет идентификации микроорганизма из исследуемых сред, а имеются клинические и/или радиологические признаки инфекции с быстрым ответом на противоинфекционную терапию.
Фебрильная нейтропения - симптомокомплекс, сочетающий развитие фебрилитета или гипотермии у пациента с критериями нейтропении. Является наиболее ожидаемым инфекционным осложнением и развивается у подавляющего большинства пациентов группы высокого риска, реже - у пациентов стандартного риска.
Пациенты с ГКО относятся к стандартной группе риска. В данной группе ожидаемая продолжительность нейтропении менее 7 дней.
3.6.2 Антибиотикотерапия
При развитии фебрильной нейтропении после забора крови для микробиологического исследования крови на стерильность показано незамедлительное внутривенное назначение антибиотиков широкого спектра действия (антибактериальные препараты системного действия) - при стабильном состоянии пациентов максимально допустимый интервал не должен превышать 60 минут, а в случае нестабильной гемодинамики 30 минут [24] [69] [70]. Все остальное обследование в необходимом объеме должно быть проведено после назначения стартовой терапии.
При развитии ФН необходимо инициировать эмпирическую антибиотикотерапию широкого спектра с активностью против грамположительных и грамотрицательных бактерий, включая синегнойную палочку. Выбор стартовой терапии зависит от группы риска, соматического состояния пациента, локальных эпидемиологических данных и рекомендаций, а также результатов скрининга и предшествующего инфекционного анамнеза пациента [70] [21]. Для пациентов стандартной группы риска показано назначение цефалоспоринов (ЦФ) третьего поколения [21].
Целесообразные варианты эмпирической антибиотикотерапии:
- #Пиперациллин + [Тазобактам] 300 (400) мг/кг/сут за 3-4 введения или непрерывной инфузией (максимальная суточная доза 16 г) ![]() #амикацин** 15-22,5 мг/кг/сут за одно введение) [71]
#амикацин** 15-22,5 мг/кг/сут за одно введение) [71]
- #Цефепим** (150 мг/кг/сут за 3 введения (максимальная суточная доза 6 г) ![]() #амикацин** 15 - 22,5 мг/кг/сут за одно введение) [71].
#амикацин** 15 - 22,5 мг/кг/сут за одно введение) [71].
- #Цефоперазон+ [Сульбактам]** 40 - 80 мг/кг/сутки (4 г x 2 раза либо 160 мг/кг/сут по цефоперазону за 3 введения ![]() #амикацин** 15 - 22,5 мг/кг/сут за одно введение) [71].
#амикацин** 15 - 22,5 мг/кг/сут за одно введение) [71].
- Цефтазидим** (по 2 г x 3 раза либо 100 - 150 мг/кг/сут за 3 введения) [71].
1. В клиниках с низкой частотой детекции энтеробактерий с продукцией БЛРС допустимо назначение:
- #Цефепим** (по 2 г x 3 раза либо 100 - 150 мг/кг/сут за 3 введения) [71].
- Цефтазидим** (2 г x 3 раза, внутривенно либо 100 - 150 мг/кг/сут за 3 введения) [71].
Назначение ванкомицина** внутривенно в дополнение к базовому препарату в первой линии терапии показано при развитии язвенно-некротического стоматита, поражении мягких тканей, подозрении на катетерную инфекцию (до получения микробиологического подтверждения), у пациентов после проведения ХТ с применением высоких доз цитарабина**, а также в случае предшествующей колонизации пациента метициллин-резистентным золотистым стафилококком (МРЗС);
2. При тяжелой инфекции в 1-й линии терапии могут быть назначены карбапенемы (интраабдоминальная инфекция, поражение мягких тканей параректальной области и др.):
- #Имипенем+ [Циластатин]** 60 - 100 мг/кг/сут за 3 - 4 введения + #амикацин** 15 - 20 мг/кг/сут за одно введение) [71].
- #Меропенем** 60 мг/кг/сутки каждые 8 часов, при тяжелой инфекции 120 мг/кг/сутки каждые 8 часов (максимальная суточная доза 6 г) + #амикацин** 15 - 20 мг/кг/сут за одно введение) [71].
3. При подозрении на развитие анаэробной инфекции (гингивит, целлюлит периоральной области, интраабдоминальная или параректальная инфекция) необходимо назначение антибиотиков, обладающих антианаэробной активностью (#Пиперациллин + [Тазобактам], #Имипенем + [Циластатин]**, #метронидазол*) [71, 72].
4. При развитии клостридиальной инфекции или диареи при невозможности определения токсина C. difficile в кале - #метронидазол** (0,5 г каждые 8 часов, внутривенно или 10 мг/кг каждые 8 часов. При тяжелом течении энтероколита возможно пероральное назначение ванкомицина** в суточной дозе 500 мг x 4 раза в сутки [72].
5. При аллергии на бета-лактамные антибактериальные препараты, пенициллины в качестве альтернативной схемы могут быть назначены фторхинолоны:
- #Левофлоксацин** (10 мг/кг x 2 р/сут в/в - детям до 5 лет, 10 мг/кг в/в за одно введение (максимум 750 мг/сут) - детям старше 5 лет [73].
Модификация противомикробной терапии проводится на основании клинических симптомов, инструментальных и микробиологических исследований. При сохранении фебрилитета и стабильном клиническом состоянии пациентов, допустимо ожидать клинического ответа на стартовую антибактериальную терапию в течение 48 - 72-х часов, поскольку лихорадка не является единственным показателем тяжести инфекционного процесса. У больных с персистирующей фебрильной нейтропенией и отрицательной гемокультурой при модификации учитывают чувствительность грамотрицательных бактерий, колонизирующих слизистую оболочку кишечника. Препаратами резервной группы являются #колистиметат натрия, полимиксин В**, #тигециклин**, #Цефтолозан + [Тазобактам]**, Цефтазидим + [Авибактам]** (в некоторых ситуациях в комбинации с азтреонамом).
Рекомендованные дозы:
- #Колистиметат натрия - нагрузочная доза 118 000 ЕД/кг, далее по 74 000 ЕД/кг каждые 12 часов (максимально 320 мг x 2 р/сут) [74]
- Полимиксин В** 2,5 мг/кг/сут за 2 введения; у детей до 1 года 4 мг/кг/сут за 2 введения
- #Тигециклин**
#Тигециклин** (дети от 2,5 до 8 лет): нагрузочная доза 2 мг/кг (100 мг), далее по 1,2 мг/кг (50 мг) каждые 12 часов [75].
#Тигециклин** (дети от 8 д о 11 лет и от 12 до 17 лет): 1,2 мг/кг каждые 12 часов (максимальная доза 50 мг), далее каждые 12 часов 50 мг [75].
- #Цефтазидим+ [Авибактам]** 120 мг/кг/сутки в/в по сутки по цефтазидиму каждые 8 часов для детей старше для детей 3 - 5 месяцев, 150 мг/кг/сутки в/в каждые 8 часов для детей старше 6 месяцев (максимальная суточная доза 6 г) [76].
- При необходимости назначения #Цефтазидим + [Авибактам]** в комбинации с азтреонамом** препараты должны вводиться одновременно параллельными инфузиями.
При развитии признаков сепсиса и септического шока следует назначить антибактериальные препараты системного действия наиболее широкого спектра действия: карбапенемы в сочетании с аминогликозидами и ванкомицином**, а пациентам с известной колонизацией - препараты группы резерва. При развитии тяжелых инфекционных осложнений и/или сепсиса антибактериальные препараты системного действия назначаются в максимальных дозах, предпочтительно пролонгированными инфузиями в связи с нарушением клиренса и перераспределением жидкости в организме [77] [78] [79].
При развитии инфекций, ассоциированных с грамположительной флорой, выбор антибактериальных препаратов системного действия должен проходить с учетом данных чувствительности и наибольшей эффективности в контексте конкретной клинической ситуации:
3.6.4 Эмпирическое назначение противогрибковых препаратов системного действия
При сохранении фебрилитета в течение 96 - 120 часов, несмотря на проводимую эмпирическую антибактериальную терапию первой и второй линий, и отсутствие очагов инфекции начало эмпирической противогрибковой терапии [80] [81] [82]:
- Каспофунгин** (дети старше 3 мес) 70 мг/м2 в первые сутки (не более 70 мг в сутки), далее по 50 мг/м2 (не более 70 мг в сутки) внутривенно 1 раз в сутки
- Амфотерицина В [липосомальный] (дети старше 1 мес) (3 мг/кг/сут за 1 введение)
- Альтернативными препаратами являются другие эхинокандины (другие противогрибковые препараты системного действия) - микафунгин** [81]:
- Микафунгин** (дети старше 16 лет): масса тела > 40 кг - 100 мг/сутки, масса тела < 40 кг: 2 мг/кг/сутки;
- Микафунгин** (дети старше 4 месяцев и младше 16 лет): масса тела > 40 кг - 100 мг/сутки, масса тела < 40 кг: 2 мг/кг/сутки;
- Микафунгин** (дети < 4 месяцев): 4 - 10 мг/кг сутки.
Приложение А3.7
УРОВЕНЬ АЛЬФА-ФЕТОПРОТЕИНА У ЗДОРОВЫХ НОВОРОЖДЕННЫХ
Таблица 26. Уровень альфа-фетопротеина у здоровых новорожденных
Возраст, дни
Медиана АФП, ng/ml
АФП 95% интервал, ng/ml
Период полураспада в днях
0
158 125
31 261 - 799 834
1
140 605
27 797 - 711 214
2
125 026
24 717 - 732 412
6
3
111 173
21 979 - 562 341
4
98 855
19 543 - 500 035
5
87 902
17 371 - 444 631
6
77 625
15 346 - 392 645
7
69 183
12 589 - 349 945
8 - 14
43 401
6 039 - 311 889
15 - 21
19 230
2 667 - 151 356
22 - 28
12 246
1 164 - 118 850
14
29 - 45
5 129
389 - 79 433
46 - 60
2 443
91 - 39 084
61 - 90
1 047
19 - 21 878
91 - 120
398
9 - 18 620
28
121 - 150
193
4 - 8 318
151 - 180
108
3 - 4 365
181 - 270
47
0,8 - 2 630
271 - 360
18
0,4 - 832
100
361 - 720
4
0 - 372
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Алгоритм 1. Для детей с впервые выявленными образованиями гонад.
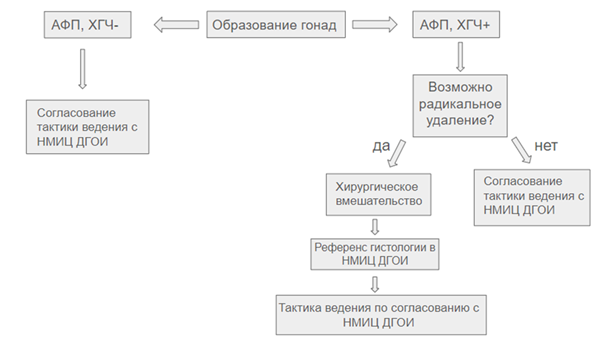
Алгоритм 2. Для детей с впервые выявленными внегонадными образованиями по срединной линии тела
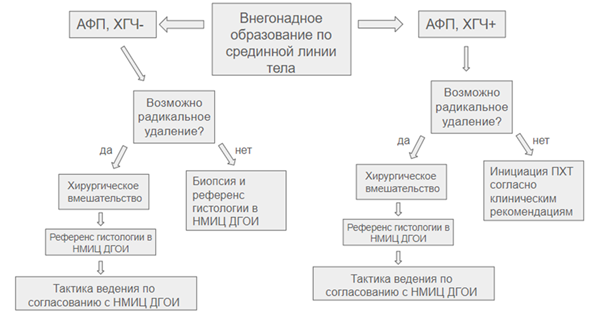
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Герминогенные опухоли - достаточно редкое заболевание у детей, частота их в популяции 4 - 6 случаев на 1 млн детского населения. Герминогенные опухоли развиваются из предшественников половых клеток (эмбриональных соматических клеток). В зависимости от конкретной локализации к этой группе заболеваний относятся: герминогенные опухоли гонад (яички и яичники), а также внегонадные локализации (крестцово-копчиковая область, переднее средостение, забрюшинная клетчатка, влагалище, почка. Крайне редко выявляется опухоль в желудке, шее, орбите.
Подходы к лечению этих заболеваний несколько отличаются: при локализациях в гонадах - на первом этапе показано хирургическое лечение, при внегонадных локализациях - лечение начинают с химиотерапии.
Установлены два возрастных пика заболеваемости герминогенными опухолями у детей: до 3 лет (крестцово-копчиковые, яички, влагалище, орбита, шея, забрюшинная локализации) и после 12 лет (яичники, яички и средостение).
Основная опасность герминогенных опухолей яичников - разрыв опухоли, что может вызвать диссеминацию процесса по брюшине. При герминогенных опухолях яичка - метастазирование в регионарные и забрюшинные лимфатические узлы, что может приводить к сдавлению магистральных вен и образованию тромбозов. Герминогенные опухоли, локализованные в крестцово-копчиковой области, могут вызывать кишечную непроходимость (то есть полностью перекрывать просвет кишки и препятствовать прохождению пищи), вызывать запоры и нарушение мочеиспускания. Все герминогенные опухоли могут метастазировать (т.е. формировать новые очаги болезни) в регионарных и отдаленных лимфатических узлах, а также в других органах (чаще всего в легких, реже печени, головном мозге и костях). Метастатическое поражение головного мозга приводит к неврологической симптоматике. К счастью, на сегодняшний день большинство даже запущенных форм герминогенных опухолей успешно излечивается, при условии, что лечением исходно занимается квалифицированный специалист в этой области.
Большинство пациентов могут полностью выздороветь и полноценно вернуться к привычному образу жизни. Исключение составляют ситуации, когда герминогенные опухоли локализованы в средостении, а также после проведения при ГО расширенной биопсии в неспециализированных учреждениях, длительного диагностического этапа и при выявлении множественных метастазов в печени и головном мозге. Но даже в таких случаях, при невозможности полного излечения, пациентам можно значительно увеличить продолжительность жизни и облегчить симптомы заболевания.
Лечение герминогенных опухолей у детей - задача не одного специалиста. В зависимости от конкретной ситуации, требуется наличие в клиники квалифицированного врача-хирурга, врача-детского онколога, врача-анестезиолога-реаниматолога, врача-кардиолога, врача-невролога.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ПО ИНДЕКСУ КАРНОВСКОГО [83].
Название на русском языке: Шкала Карновского.
Оригинальное название: Karnofsky Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией):
Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949: 191-205 [83].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т.д.).
Содержание и интерпритация:
Нормальная физическая активность, больнои не нуждается в специальном уходе
100%
Состояние нормальное, нет жалоб и симптомов заболевания
90%
Нормальная активность сохранена, но имеются незначительные симптомы заболевания
80%
Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания
Ограничение нормальной активности при сохранении полной независимости больного
70%
Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе
60%
Больной иногда нуждается в помощи, но в основном обслуживает себя сам
50%
Больному часто требуется помощь и медицинское обслуживание
Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация
40%
Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь
30%
Больной прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно
20%
Сильные проявления болезни, необходима госпитализация и поддерживающая терапия
10%
Умирающий больной, быстрое прогрессирование заболевания
0%
Смерть
Пояснения: всем пациентам с ГКО при первичном приеме, а также при каждом приеме (осмотре, консультации) врача-детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении проводится оценка общего состояния пациента.
Приложение Г2
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ БОЛЬНОГО ECOG [84].
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5(6): 649-65 [84].
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
0
Больной полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Пояснения: всем пациентам с ГКО при первичном приеме, а также при каждом приеме (осмотре, консультации) врача-детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении проводится оценка общего состояния пациента.
