"Клинические рекомендации "Рак полости носа и придаточных пазух"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК ПОЛОСТИ НОСА И ПРИДАТОЧНЫХ ПАЗУХ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C30, C31
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 3_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Ассоциация онкологов России, Общероссийская общественная организация "Российское общество специалистов по опухолям головы и шеи", Общероссийская общественная организация "Российское общество клинической онкологии", Общероссийская общественная организация "Федерация специалистов по лечению заболеваний головы и шеи", Некоммерческая организация "Ассоциация онкологических организаций Сибири и Дальнего Востока
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
БТ - брахитерапия
Гр - Грей
ДЛТ - дистанционная лучевая терапия
ЗНО - злокачественные новообразования
ИТ - иммунотерапия
ИХТ - индукционная химиотерапия
КТ - компьютерная томография
ЛАЭ - лимфаденэктомия
ЛТ - лучевая терапия
ЛУ - лимфатический узел
ЛФК - лечебная физическая культура
МАТ - моноклональное антитело
МРТ - магнитно-резонансная томография
НПФ - неблагоприятные прогностические факторы
ПХТ - полихимиотерапия
ПЭГ - чрескожная (перкутанная) эндоскопическая гастростома
ПЭТ-КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией
УЗ - ультразвуковой
УЗИ - ультразвуковое исследование
ФЛС - фиброларингоскопия
ФДТ - фотодинамическая терапия
ФС - фотосенсибилизатор
ХБС - хронический болевой синдром
ХЛТ - химиолучевая терапия
ХТ - химиотерапия
ЭФГДС - эзофагогастродуоденоскопия
AUC* (area under the curve) - фармакокинетический параметр, определяющий концентрацию препарата. Необходим для расчета дозы препарата в зависимости от клиренса креатинина.
Cf-252 - радионуклиды калифорний-252
CTV - (Clinical Target Volume) клинический объем мишени
CPS - combined positive score
ECOG - шкала оценки общего состояния пациента, разработанная Восточной Кооперативной Группой Исследования Рака
ENE - экстранодальное распространение опухоли в лимфатических узлах (extranodalextension)
GTV - (Gross Tumor Volume) макроскопический объем опухоли PTV - (Planning Target Volume) планируемый объем мишени
IMRT - ротационное объемно-модулированное облучение
Ir-192 - радионуклиды иридий-192
PD-L1 - лиганд программируемой клеточной гибели, который экспрессируется опухолевыми клетками
R - символ, означающий край резекции, R0 - чистый край резекции, R1 - опухоль по краю резекции
TNM - (аббревиатура от tumor, nodus и metastasis) международная классификация стадий развития раковых опухолей
VMAT - лучевая терапия с модуляцией интенсивности
Термины и определения
Адъювантная химиолучевая терапия - вид химиолучевой терапии, проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
Адъювантная лучевая терапия - вид лучевой терапии, проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
Верхняя стенка полости носа - представлена сетевидной пластинкой, передней стенкой основной пазухи, передними клетками решетчатого лабиринта.
Внутренняя стенка полости носа - представлена перегородкой носа.
Задняя стенка полости носа - представлена хоанами.
Курс химиотерапии - период времени, исчисляемый с первого до последнего дня введения цитостатиков.
Наружная стенка полости носа - представлена медиальной стенкой верхнечелюстной пазухи.
Передняя стенка полости носа - представлена грушевидное отверстие.
Прогрессирование болезни - появление нового опухолевого очага и/или рост первичного опухолевого очага, метастатических очагов более чем на 25%.
Радикальная операция (R0) - удаление пораженного органа в пределах здоровых тканей вместе с зонами регионарного метастазирования без остаточных проявлений опухолевого процесса.
Симптоматическое лечение - комплекс лечебных мероприятий, направленных на устранение наиболее тягостных проявлений опухолевого процесса либо на лечение осложнений или коррекцию последствий, связанных с противоопухолевым лечением.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Рак полости носа и придаточных пазух - злокачественная опухоль, развивающаяся из элементов слизистой полости носа и придаточных пазух.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основными этиологическими факторами развития злокачественных опухолей полости носа и придаточных пазух являются:
- Хронические воспалительные заболевания (хронические синуситы, вазомоторный ринит, бронхиальная астма, инвертированная папиллома)
- Неблагоприятные факторы внешней среды
- Воздействие канцерогенных веществ физической и химической природы, особенно в группе лиц, связанных с вредным производством [1, 2, 6, 11, 12].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Злокачественные опухоли полости носа и придаточных пазух составляют 1,4% среди всех злокачественных опухолей. В 2021 году в России зарегистрировано 1012 новых случаев рака полости носа и придаточных пазух [1, 2].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Кодирование по МКБ-10
Злокачественное новообразование полости носа и среднего уха (C30):
C30.0 - Злокачественное новообразование полости носа
C30.1 - Злокачественное новообразование среднего уха
Злокачественное новообразование придаточных пазух (C31):
C31.0 - Злокачественное новообразование верхнечелюстной пазухи
C31.1 - Злокачественное новообразование решетчатой пазухи
C31.2 - Злокачественное новообразование лобной пазухи
C31.3 - Злокачественное новообразование клиновидной пазухи
C31.8 - Поражение придаточных пазух, выходящее за пределы одной и более вышеуказанных локализаций
C31.9 - Злокачественное новообразование придаточной пазухи неуточненное
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Степень распространенности злокачественных опухолей полости носа и придаточных пазух представлена в классификации TNM (8-е издание, 2017) г. (за исключением меланомы слизистой оболочки полости носа и придаточных пазух)
Символ T указывает на первичную опухоль и содержит следующие градации:
Tx
T0
Недостаточно данных для оценки первичной опухоли
Первичная опухоль не определяется
Tis
Преинвазивная карцинома (рак in situ)
Верхнечелюстная пазуха:
T1
Опухоль ограничена слизистой оболочкой без эрозии или деструкции кости
T2
Опухоль вызывает эрозию или разрушает кость, включая твердое небо и/или средний носовой ход, исключая распространение на заднюю стенку верхнечелюстной пазухи или крыловидные отростки
T3
Опухоль распространяется на любую из следующих структур: заднюю стенку гайморовой пазухи, подкожную клетчатку, дно или медиальную стенку орбиты, крыловидную ямку, клетки решетчатого лабиринта
T4a
Опухоль распространяется на следующие структуры: передний край орбиты, кожу щеки, крыловидные отростки, подвисочную ямку, сетевидную пластинку, основную или лобную пазухи
T4b
Опухоль распространяется на следующие структуры: купол орбиты, твердую мозговую оболочку, головной мозг, среднюю черепную ямку, черепные нервы за исключением верхнечелюстной ветви тройничного нерва, носоглотку, скат основания черепа (clivus)
Полость носа, клетки решетчатого лабиринта:
T1
Опухоль ограничена одной стороной полости носа или клеток решетчатого лабиринта с эрозией/без эрозии кости
T2
Опухоль распространяется на две стороны полости носа и прилежащие участки в пределах полости носа и клеток решетчатого лабиринта с эрозией/без эрозии кости
T3
Опухоль распространяется на медиальную стенку или дно орбиты, верхнечелюстную пазуху, небо, клетки решетчатого лабиринта
T4a
Опухоль распространяется на любую из следующих структур: передние структуры орбиты, кожу носа или щек, минимально на переднюю черепную ямку, крыловидные отростки, основную или лобную пазуху
T4b
Опухоль распространяется на следующие структуры: купол орбиты, твердую мозговую оболочку, головной мозг, среднюю черепную ямку, черепные нервы за исключением верхнечелюстной ветви тройничного нерва, носоглотку, скат основания черепа (clivus).
Символ pN указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (ЛУ) по данным планового патолого-анатомического исследования операционного материала:
Nx
Недостаточно данных для оценки состояния регионарных ЛУ
N0
Нет признаков метастатического поражения регионарных ЛУ
N1
Метастазы в одном ЛУ на стороне поражения до 3 см (и менее) в наибольшем измерении, экстракапсулярная инвазия (ENE) отсутствует
N2
Метастазы в одном ЛУ на стороне поражения до 3 см (и менее) и ENE+, более 3 см и менее 6 см в наибольшем измерении и ENE отсутствует; или метастазы в нескольких ЛУ шеи на стороне поражения до 6 см в наибольшем измерении и ENE отсутствует; или с обеих сторон либо с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует
N2a
Метастазы в одном ЛУ на стороне поражения до 3 см (и менее) и ENE+; или более 3 см, но не более 6 см в наибольшем измерении, ENE отсутствует
N2b
Метастазы в нескольких ЛУ на стороне поражения до 6 см в наибольшем измерении и ENE отсутствует
N2c
Метастазы в ЛУ шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует
N3
Метастазы в ЛУ более 6 см в наибольшем измерении и ENE отсутствует; или в одном ипсилатеральном ЛУ более 3 см и ENE+; или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE+; или единственный контралатеральный метастаз любых размеров с ENE+
N3a
Метастазы в ЛУ более 6 см в наибольшем измерении и ENE отсутствует
N3b
Метастаз в одном ипсилатеральном ЛУ более 3 см и ENE+;
или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE+; или единственный контралатеральный метастаз любых размеров и ENE+
Символ M характеризует наличие или отсутствие отдаленных метастазов:
M0
Отдаленных метастазов нет
M1
Наличие отдаленных метастазов
Символ M характеризует наличие или отсутствие отдаленных метастазов
M0 - отдаленных метастазов нет.
M1 - наличие отдаленных метастазов.
Таблица 1 - Группировка по стадиям
Стадия
T
N
M
0
Is
0
0
I
1
0
0
II
2
0
0
III
3
0
0
1
1
0
2
1
0
3
1
0
IVA
4a
0
0
4a
1
0
1
2
0
2
2
0
3
2
0
4a
2
0
IVB
любое T
3
0
4b
любое N
0
IVC
любое T
любое N
1
Степень гистологической дифференцировки
Gx - недостаточно данных для оценки степени дифференцировки
G1 - высоко дифференцированная
G2 - умеренно дифференцированная
G3 - плохо дифференцированная
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Злокачественные опухоли полости носа и придаточных пазух в 70% случаев имеют эпителиальную природу. Из них в 80% - плоскоклеточный рак, 6% - аденокарцинома, в 10% случаев - эстезионейробластома, редко - меланома. Наиболее часто первыми клиническими проявлениями заболевания являются заложенность носа, выделения из полости носа, болевой синдром, экзофтальм при распространении опухоли в полость орбиты.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз устанавливается на основании:
- анамнестических данных, а именно наличие заложенности носа, не поддающейся консервативному лечению в течение 2 - 3 нед.;
- физикального обследования, включающего тщательный клинический осмотр, пальпацию образования и прилежащих тканей и регионарных лимфатических узлов (ЛУ);
- цитологического исследования соскоба, мазков, пунктата из первичной опухоли, пунктата из увеличенных или подозрительных ЛУ; (цитологического исследования из первичной опухоли (цитологического исследования отделяемого верхних дыхательных путей и отпечатков, цитологического исследования мазков с поверхности слизистой оболочки верхних дыхательных путей, цитологического исследования микропрепарата тканей верхних дыхательных путей), цитологического исследования биоптатов лимфоузлов (увеличенных или подозрительных), цитологического исследования препарата тканей лимфоузла)
- патологоанатомического исследования биопсийного (операционного) материала;
- инструментального обследований, включая ультразвуковое исследование (УЗИ) шеи, (инструментального обследований, включая ультразвуковое исследование (УЗИ) шеи, (ультразвуковое исследование мягких тканей (одна анатомическая зона), компьютерную томографию (КТ) компьютерную томографию (КТ) лицевого отдела черепа и шеи с внутривенным болюсным контрастированием/магнитно-резонансную томографию (МРТ) шеи, (МРТ лицевого отдела черепа, шеи с внутривенным контрастированием), позитронная эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ-КТ) с флудезоксиглюкоза [18F] (18F-ФДГ) (выполнение позитронной эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) с туморотропным РФП (флудезоксиглюкозой [18F]) с контрастированием), фиброларингоскопию (ФЛС) по показаниям [5, 7, 9].
2.1 Жалобы и анамнез
- Рекомендуется всем пациентам с предполагаемым раком слизистой оболочки полости и придаточных пазух носа тщательный сбор жалоб и анамнеза у пациента с целью выявления факторов, которые могут повлиять на выбор тактики лечения [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.2 Физикальное обследование
- Рекомендуются всем пациентам с предполагаемым раком слизистой оболочки полости и придаточных пазух носа тщательный физикальный осмотр, включающий осмотр и пальпацию (бимануальную) очага поражения и регионарных ЛУ, оценка нутритивного статуса для оценки распространенности заболевания, планирования дальнейшей диагностики и оценки общего состояния [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.3 Лабораторные диагностические исследования
- Рекомендуется всем больным раком слизистой оболочки полости и придаточных пазух носа проводить патолого-анатомическое исследование операционного материала с целью оценки радикальности хирургического лечения и планирования дальнейшей тактики лечения и наблюдения [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: В плановом патолого-анатомическом исследовании должны быть отражены следующие параметры:
1. Размеры опухоли.
2. Глубина инвазии опухоли.
3. Гистологическое строение опухоли.
4. Степень дифференцировки опухоли.
1. Наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован).
2. Размеры и распространенность первичной опухоли (рТ).
1. Статус регионарных лимфатических узлов (pN) (с указанием общего числа исследованных и пораженных лимфоузлов, признаков экстранодального распространения опухоли).
1. Наличие поражения краев резекции (отрицательный результат также должен быть констатирован) [5].
2.4 Инструментальные диагностические исследования
- Рекомендуется всем больным раком слизистой оболочки полости и придаточных пазух носа выполнять биопсию слизистой оболочки полости носа [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при положительном результате патолого-анатомическое исследование биопсийного (операционного) материала тканей верхних дыхательных путей (злокачественная опухоль верифицирована) необходимо определить гистологический тип опухоли, при этом целесообразно установить степень дифференцировки. При сомнительном результате патологоанатомического исследования биопсийного материала (диагноз опухоли не верифицирован) тканей верхних дыхательных путей в обязательном порядке выполнить повторную биопсию в достаточном объеме для проведения патолого-анатомического исследования биопсийного (операционного) материала тканей верхних дыхательных путей с применением иммуногистохимических методов. При повторно отрицательном результате патологоанатомического исследования биопсийного материала (диагноз опухоли не верифицирован) тканей верхних дыхательных путей повторная биопсия целесообразна при наличии убедительных клинических и/или рентгенологических признаков злокачественного новообразования
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа для оценки распространенности опухолевого процесса КТ лицевого отдела черепа и шеи с внутривенным болюсным контрастированием и/или МРТ лицевого отдела черепа, шеи с внутривенным контрастированием [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа для оценки распространенности опухолевого процесса выполнение фиброларингоскопии и эзофагогастродуоденоскопии при наличии показаний [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа для оценки распространенности опухолевого процесса выполнение ультразвукового исследования (УЗИ) лимфатических узлов шеи [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа для оценки распространенности опухолевого процесса выполнить ТАБ измененных л/у шеи под УЗИ или КТ навигацией [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа для оценки распространенности опухолевого процесса выполнить УЗИ органов брюшной полости (комплексное) [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа для оценки распространенности опухолевого процесса до начала лечения с целью стадирования выполнить компьютерную томографию (КТ) органов грудной полости [5]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при невозможности выполнения КТ органов грудной полости возможно выполнение рентгенографии легких
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа с местно-распространенным процессом (T3 - T4 или N ![]() 1) выполнение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) с туморотропным РФП или компьютерной томографии (КТ) органов грудной и брюшной полостей с внутривенным болюсным контрастированием [5].
1) выполнение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) с туморотропным РФП или компьютерной томографии (КТ) органов грудной и брюшной полостей с внутривенным болюсным контрастированием [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при невозможности проведения ПЭТ-КТ или КТ, в целях стадирования опухолевого процесса и планирования алгоритма лечения необходимо выполнить рентгенографию легких и УЗИ органов брюшной полости (комплексное).
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа при подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводить дополнительное обследование: эхокардиографию, холтеровское мониторирование сердечного ритма, исследование показателей внешнего дыхания, ультразвуковая допплерография сосудов (артерии и вен) нижних конечностеи, приемы (осмотры, консультации) врача-кардиолога, врача-эндокринолога, врача-невролога и т.п. [5 - 7, 9, 13]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.4.2 Оценка эффективности противоопухолевого лечения
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа через 2 - 3 месяца после проведения ЛТ/ХЛТ, для оценки эффекта от проведенного лечения первичной опухоли и зон регионарного метастазирования выполнить ПЭТ/КТ с флудезоксиглюкозой [18F] (ПЭТ-КТ с туморотропным РФП (флудезоксиглюкозой [18F]) с контрастированием) или МРТ с в/в болюсным контрастированием (МРТ лицевого отдела черепа, шеи с внутривенным контрастированием) [10, 11].
Уровень убедительности рекомендаций - В (уровень достоверности - 2)
2.4.3 Динамическое наблюдение
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа выполнение фиброларингоскопии и эзофагогастроскопии при наличии жалоб [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа выполнение УЗИ лимфатических узлов шеи с 2 сторон в течение первого года после лечения каждые 3 месяца, второй год после лечения 3 - 6 месяцев. 3 - 5 годы - периодичность контрольного обследования 1 раз в год [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа КТ органов грудной полости каждые 12 месяцев [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при невозможности выполнения КТ органов грудной полости проведение рентгенографии легких
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа выполнение УЗИ органов брюшной полости (комплексное) в течение первого года после лечения каждые 3 месяца, второй год после лечения 3 - 6 месяцев. 3 - 5 годы - периодичность контрольного обследования 1 раз в 6 месяцев, 1 раз в год. [5]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа выполнение КТ лицевого отдела черепа и шеи с внутривенным болюсным контрастированием и/или МРТ лицевого отдела черепа, шеи с внутривенным контрастированием в течение первого года после лечения каждые 3 месяца, второй год после лечения 3 - 6 месяцев. 3 - 5 годы - периодичность контрольного обследования 1 раз в 6 месяцев, 1 раз в год при наличии клинических показаний. [5]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендовано всем больным раком слизистой оболочки полости и придаточных пазух носа при наличии симптомов, свидетельствующих о рецидиве заболевания или установленном рецидиве заболевания, с целью оценки распространенности опухолевого процесса и выработки тактики лечения выполнение позитронной эмиссионной томографии совмещенной с компьютерной томографией с туморотропными РФП с флудезоксиглюкозой [18F] [18F] или компьютерной томографии (КТ) органов грудной полости с внутривенным болюсным контрастированием + компьютерной томографии (КТ) органов брюшной полости с внутривенным болюсным контрастированием [5]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при невозможности выполнения ПЭТ-КТ или КТ органов грудной и брюшной полостей с в/в болюсным усилением рекомендуется проведение прицельной рентгенографии органов грудной клетки и УЗИ органов брюшной полости (комплексное)
2.5 Иные диагностические исследования
- Рекомендуется проводить патолого-анатомическое исследование операционного материала (хирургически удаленного опухолевого препарата), при этом в морфологическом заключении рекомендуется отразить следующие параметры [3, 10, - 22]:
1. Размеры опухоли;
2. Глубина инвазии опухоли
3. Гистологическое строение опухоли;
4. Степень дифференцировки опухоли;
5. Наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован)
6. pT;
1. pN (с указанием общего числа исследованных и пораженных лимфоузлов, признаков экстранодального распространения опухоли);
1. Наличие поражения краев резекции (отрицательный результат также должен быть констатирован);
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Общая концепция лечения
Рак полости носа, клеток решетчатого лабиринта
- При T1 - T2, первично выявленном, рекомендовано хирургическое лечение. После операции рекомендована ЛТ. Наблюдение рекомендовано только при стадии T1 и благоприятных прогностических признаках ("чистые" края резекции, отсутствие прилежания опухоли к ситовидной пластинке и медиальной стенке орбиты, высокодифференцированные опухоли) [5 - 7, 9, 13, 22, 23]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- При T3 - T4a, первично выявленном, рекомендовано хирургическое лечение на первом этапе или ЛТ/ХЛТ или индукционная ХТ с последующим оперативным вмешательством или сочетанной ХЛТ. В дальнейшем проводится послеоперационная ЛТ или одновременная ХЛТ (при наличии неблагоприятных прогностических факторов: опухолевые клетки в краях резекции и/или внутричерепное распространение) [5 - 7, 9, 18, 19, 22, 26, 27]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- При T4b N0 - N3, M0 первично выявленном, или при отказе пациента от выполнения обширного хирургического вмешательства, или абсолютных противопоказаниях к хирургическому лечению рекомендуется включение пациента в клинические исследования или выбор метода лечения в зависимости от общего состояния, оцененного по шкале ECOG:
ECOG 0 - 1 Проведение одновременной ХЛТ или индукционной ХТ с последующей ЛТ или сочетанной ХЛТ.
ECOG 2 Проведение ЛТ +/- ХТ (в зависимости от общего состояния)
ECOG 3 Паллиативная ЛТ или монохимиотерапия или паллиативная помощь [5, 16 - 20].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: В большинстве случаев ранний рак решетчатого лабиринта диагностируется при морфологическом исследовании удаленного операционного материала после проведения вмешательств по поводу предполагаемых неопухолевых процессов (полипозный этмоидит, полипы полости носа и др.). Таким образом, морфологическая верификация, как правило, является результатом нерадикального вмешательства. Пациентам с нерадикальной операцией на первом этапе, которая фактически носит характер расширенной биопсии, в дальнейшем показаны такие же лечебные подходы, как и при впервые установленном диагнозе.
В случае если на этапе обследования выполнялось КТ/МРТ исследование, нерадикальная операция может быть дополнена одной радикальной ЛТ - при отсутствии распространения процесса на основание черепа, т.е. только при формальной T1, T2 стадии. Необходимый радикальный объем хирургического вмешательства достигается выполнением резекции различного объема до получения "чистых" краев. Метастазы в региональные л/у шеи (N+) крайне редки при раке слизистой полости носа и клеток решетчатого лабиринта, однако в случае выявления требуют выполнения шейной лимфодиссекции с соответствующей последующей адьювантной терапией.
- Если диагноз установлен после неполного удаления (полипэктомия и др.), и сохраняется остаточная опухоль, то рекомендовано хирургическое удаление или ЛТ либо конкурентная ХЛТ. После операции рекомендована ЛТ или одновременная ХЛТ при наличии неблагоприятных прогностических факторов: опухолевые клетки в краях резекции, прилежание опухоли к сетевидной пластинке, медиальной стенке орбиты, интракраниальное или внутриорбитальное распространение, неблагоприятная гистология (низкодифференцированные опухоли, аденокистозный рак), периневральная или лимфатическая инвазия.
- Рекомендуется для синоназальной недифференцированной карциномы, низкодифференцированной эстейзеонейробластомы или синоназального нейроэндокринного рака включать в план лечения системную химиотерапию [5, 26, 27, 30 - 41].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Если диагноз установлен после нерадикального удаления, клинически и по данным специальных методов обследования остаточная опухоль не определяется, то рекомендована ЛТ или хирургическое вмешательство. В послеоперационном периоде рекомендовано проведение ЛТ. Наблюдение только при стадии T1 и благоприятных прогностических признаках (R0 резекция, центрально расположенные, высокодифференцированные опухоли, отсутствие периневральной и лимфатической инвазии) [5 - 7, 18, 22, 23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Рак верхнечелюстной пазухи (кроме меланомы, саркомы и лимфомы)
- T1 - T2, N0 (любая гистология кроме аденокистозного рака): Рекомендована радикальная хирургическая операция с последующим динамическим наблюдением. При периневральной, сосудистой или лимфатической инвазии - ЛТ или одновременная ХЛТ. При положительных краях - хирургическая резекция с последующей ЛТ, при повторной нерадикальной операции - одновременная ХЛТ [5 - 7, 9, 13, 22, 23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- T1 - T2, N0, аденокистозный рак: Рекомендована радикальная хирургическая операция с последующей ЛТ. Динамическое наблюдение возможно при R0 резекции и отсутствии периневральной инвазии по данным гистологического исследования [5 - 7, 9, 13, 22, 23, 25, 26, 28, 31, 32].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- T3 - T4a, N0. Рекомендована радикальная хирургическая операция. После операции ЛТ на первичный очаг или при наличии неблагоприятных прогностических факторов (опухолевые клетки в краях резекции) рекомендована одновременная ХЛТ [5 - 7, 9, 13, 21 - 23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- T1 - Y4a, N+: Рекомендовано хирургическое удаление первичного очага и лимфаденэктомия шейная расширенная После операции ЛТ на первичный очаг и регионарные ЛУ или при наличии неблагоприятных прогностических факторов (опухолевые клетки в краях резекции, экстракапсулярное распространение метастаза в ЛУ) рекомендована конкурентная ХЛТ [3, 5, 7, 9, 10, 13, 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- При T4b, N0 - N3 M0 первично выявленном, или при отказе пациента от выполнения обширного хирургического вмешательства, рекомендуется включение пациента в клинические исследования или выбор метода лечения в зависимости от общего состояния, оцененного по шкале ECOG:
ECOG 0 - 1 Проведение одновременной ХЛТ или ИХТ с последующей ЛТ или одновременной ХЛТ.
ECOG 2 Проведение ЛТ +/- ХТ (в зависимости от общего состояния)
ECOG 3 Паллиативная ЛТ или монохимиотерапия или паллиативная помощь [5, 16 - 20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2)
- Локальный рецидив или остаточная опухоль без предшествующей лучевой терапии. Рекомендовано хирургическое вмешательство или одновременная ХЛТ терапия или индукционная ХТ с последующей одновременной ХЛТ [5, 7, 9, 13, 16 - 22].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: В случае выявления после хирургического вмешательства при плановом гистологическом исследовании неблагоприятных гистологических признаков (прорастание опухолью капсулы ЛУ, наличие периневральной инвазии, опухолевых эмболов в сосудах) показана одновременная ХЛТ, при положительных краях резекции - рекомендовано рассмотреть вопрос о повторном оперативном вмешательстве или проведении ЛТ.
- Локальный рецидив или остаточная опухоль после ЛТ. Рекомендовано хирургическое вмешательство с обсуждением вопроса о повторной ЛТ или в случае невозможности выполнения оперативного вмешательства повторная ЛТ с последующей противорецидивной ХТ [5, 7, 9, 13, 16 - 22]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Локальный рецидив или остаточная опухоль с отдаленными метастазами M1 рекомендуется включение пациента в клинические исследования или выбор метода лечения в зависимости от общего состояния, оцененного по шкале ECOG:
ECOG 0 - 1 Проведение одновременной ХЛТ или индукционной ХТ с последующей ЛТ или одновременной ХЛТ.
ECOG 2 Проведение ЛТ +/- одновременная ХТ (в зависимости от общего состояния)
ECOG 3 Паллиативная ЛТ или монохимиотерапия или паллиативная помощь [5, 16, 22].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.1. Лучевая терапия
Введение:
Всех пациентов до лечения должен оценивать врач-радиотерапевт, предпочтительно специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия: рассмотреть адекватность морфологической верификации, стадирования и визуализации опухолевого процесса (КТ, МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность проведения ЛТ/ХЛТ. Для пациентов, которым проводится ХТ/ХЛТ, необходимо проработать тактику реализации противоопухолевой терапии в полном объеме и в оптимальные сроки.
Лучевая терапия в качестве основного или адъювантного лечения должна проводиться в специализированных учреждениях с соответствующим оснащением и опытом лечения больных раком полости и придаточных пазух носа.
Требуется глубокое понимание анатомии, клинической ситуации и визуализации специфических проявлений заболевания. Предпочтительно проведение ЛТ с применением высокопрецизионных способов - IMRT (лучевая терапия с модуляцией интенсивности (volumetric modulated arc therapy)), VMAT (объемно-модулированная лучевая терапия (volumetric modulated arc therapy)). При значительных ограничениях дозы со стороны нормальных тканей рассматривается проведение протонной терапии. Также допустимо проведение 3D-конформной ЛТ.
Оптимальным подходом в клинической практике является подведение запланированных доз ионизирующего излучения в мишень наряду с максимальным снижением дозы на область органов риска. Допустимо обсуждение вопроса о сокращении объема за счет исключения из него жизненно важных структур, свободных от опухолевого поражения, на момент планирования ЛТ, в случае превышения предельно допустимой дозной нагрузки на них согласно критериям QUANTEC (практическое руководство для оценки дозолимитирующих параметров критических органов (quantitative analyses of normal tissue effects in the clinic)). Объем облучения до радикальных доз не следует модифицировать на основании клинического ответа, полученного до ЛТ (после индукционной ПХТ), за исключением случаев прогрессии опухоли. Анатомические изменения в процессе проведения курса ЛТ (например, быстрое уменьшение размера опухоли, значительная потеря массы тела) могут потребовать повторной диагностической визуализации и повторного планирования (адаптации) лечения.
- ЛТ в самостоятельном варианте. Рекомендовано: на первичную опухоль и клинически определяемые метастазы в л/у шеи 70 Гр (1,8 - 2,0 Гр/фракция) ежедневно с понедельника по пятницу в течении 7 недель; на клинически не измененные л/у 50 Гр (2.0 Гр/фракция) [58, 59].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Послеоперационная ЛТ: Рекомендовано: на первичный очаг: СОД 60 - 66 Гр (РОД 2 Гр). На ЛУ шеи: определяемые клинически метастазы в ЛУ - 60 - 66 Гр (РОД 2 Гр); при отсутствии клинических признаков поражения - 50 Гр (РОД 2,0 Гр) [5, 18, 27, 58, 59].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: Предпочтительный интервал после операции составляет < 6 нед. и не должен превышать 3 мес.
- Одновременная послеоперационная химио-лучевая терапия: рекомендуется одновременная послеоперационная ХЛТ больным раком слизистой оболочки полости и придаточных пазух носа в следующем режиме: ЛТ на первичный очаг и клинически определяемые регионарные метастазы (область высокого риска) в дозе 66 - 70 Грей (Гр) (2,0 Гр/фракция) ежедневно с понедельника по пятницу в течение 6 - 7 нед., на локорегионарную область, включая регионарные ЛУ (область промежуточного/низкого риска), - 46 - 54 Гр (1,8 - 2,0 Гр/фракция). Облучение проводится в два (46 - 54 Гр/66 - 70 Гр) или три (46 - 54/60/66 - 70 Гр) этапа с последовательным сокращением объема облучения [5, 18, 27, 58, 5970].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Предпочтительна сочетанная ХЛТ с цисплатином** в дозе 100 мг/м2 на фоне гипергидратации в 1, 22 и 43-й дни ЛТ либо в еженедельном режиме (#40 мг/м2 в/в на фоне гипергидратации). Рекомендуемая суммарная доза цисплатина** за курс ЛТ - 300 мг/м2 [5, 27, 71].
Комментарии: в качестве альтернативных вариантов, особенно при наличии этапа индукционной ХТ, возможно использование цетуксимаба** или карбоплатина** с учетом переносимости ХЛТ и соматического состояния пациента. Также возможно применение ЛТ в сочетании с карбоплатином** AUC1,5 - 2 внутривенно еженедельно, до 7 введений [5? 18, 27, 72, 75]
- При наличии сопутствующей патологии, препятствующей проведению одновременной ХЛТ с включением препаратов соединений платины (хроническая почечная недостаточность, скорость клубочковой фильтрации < 50 - 60 мл/мин, возраст пациентов > 65 лет, выраженная сопутствующая почечная, сердечно-сосудистая, неврологическая, печеночная патология и/или ослабленное состояние пациента (ECOG > 1) предпочтительным является замена препаратов соединений платины на цетуксимаб** на фоне проведения ЛТ [18, 19, 58, 59].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Паллиативная ЛТ рекомендована для облегчения или профилактики локорегионарных симптомов в случае невозможности проведения радикального лечения со стандартной ЛТ. Возможен выбор схемы ЛТ по индивидуальному плану с учетом минимизации токсичности лечения, в том числе в дозе 50 Гр (2, 5 Гр/фракция) и 30 Гр (3 Гр/фракция) [73, 74].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
3.2. Лекарственное лечение
Выбор ХТ должен быть индивидуализирован в зависимости от характеристик пациента (общее состояние, цели лечения).
- Индукционная ХТ с последующей одновременной ХЛТ проводится по схеме: Доцетаксел** + цисплатин** + фторурацил**, всего 2 - 3 курса ХТ с интервалом 3 недели [75].
В случае синоназальной нейроэндокринной опухоли и низкодифференцированной эстейзеонейробластомы рекомендованы следующие режимы индукционной ПХТ: карбоплатин** AUC 5 - 6 + #этопозид** 100 мг/м2 1 - 3 дни, цисплатин** 75 мг/м2 + #этопозид** 100 мг/м2 1 - 3 дни, #цисплатин** 50 мг/м2 + доксорубицин** 50 мг/м2 + #циклофосфамид** 500 мг/м2 в 1-й день каждые 3 недели [46, 49, 75]
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Одновременная ХЛТ. Рекомендуемые режимы химиотерапии - Цисплатин** (предпочтительно) или карбоплатин** или цетуксимаб** + ЛТ. ЛТ на первичный очаг и клинически определяемые регионарные метастазы - 70 Гр (2,0 Гр/фракция) ежедневно с понедельника по пятницу в течении 6 - 7 недель; на клинически неизмененные ЛУ 44 - 60 Гр (2.0 Гр/фракция); Цисплатин** в дозе 100 мг/м2 на фоне гипергидратации в 1, 22 и 43-й дни ЛТ (суммарная доза во время ЛТ - 300 мг/м2) или возможно еженедельное введение карбоплатина** 1,5 - 2,0 AUC или цетуксимаба** 400 мг/м2 за неделю до начала лучевой терапии и 250 мг/м2 еженедельно во время проведения ЛТ [57, 58]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Противорецидивная химиотерапия (при невозможности выполнения оперативного вмешательства и ЛТ) Для лечения рецидивных, первично-неоперабельных опухолей или метастатического опухолевого процесса, при отсутствии возможности проведения одновременной ХЛТ, рекомендуется поли- или монохимиотерапия для улучшения выживаемости пациентов. С учетом общего состояния пациента и/или целей лечения могут быть рекомендованы следующие комбинации препаратов (количество курсов определяется переносимостью лечения и эффективностью лечения) [15 - 20, 75]:
Название режима
Схема проведения
PF + Cet
Цисплатин** 75 - 100 мг/м2 в/в в 1-й день + #фторурацил** 1000 мг/м2/сут. в/в 96-часовая инфузия в 1 - 4-й дни, каждые 3 нед. + цетуксимаб** 400 мг/м2 (нагрузочная доза), далее - 250 мг/м2 в/в еженедельно. После 6 циклов ХТ завершается, и в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 250 мг/м2 в/в еженедельно [75]
DC + Cet
#Доцетаксел** 75 мг/м2 в/в в 1-й день + цисплатин** 75 мг/м2 в/в в 1-й день, каждые 3 нед. + цетуксимаб** 400 мг/м2 (нагрузочная доза) в/в, далее - 250 мг/м2 в/в еженедельно. После 4 циклов ХТ завершается, и в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 500 мг/м2 в/в 1 раз в 2 недели [75, 76]
Цисплатин + Cet
Цисплатин** 75 - 100 мг/м2 1 раз в 3 недели (не более 6 - 8 введений) + цетуксимаб** 400 мг/м2 (нагрузочная доза) в/в в 1 день, далее - 250 мг/м2 в/в еженедельно до прогрессирования или непереносимой токсичности [75]
Pacli + Carbo + Cet
#Паклитаксел** 100 мг/м2 в/в + карбоплатин** AUC 2,5 в/в в 1-й и 8-й дни + цетуксимаб** 400 мг/м2 в/в (2-часовая инфузия) в 1-й день 1-го цикла (нагрузочная доза), далее - 250 мг/м2 в/в (1-часовая инфузия) еженедельно. Длительность цикла 21 день. После завершения 6 циклов ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 250 мг/м2 в/в еженедельно [75, 77]
Pacli + Carbo + Cet <1>
#Паклитаксел** 80 мг/м2 в/в еженедельно + карбоплатин** AUC 2,0 в/в еженедельно + цетуксимаб** 400 мг/м2 в/в (2-часовая инфузия) в 1-й день 1-го цикла, далее - 250 мг/м2 в/в еженедельно. После завершения ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 250 мг/м2 в/в еженедельно. Количество введений цитостатиков (L01: противоопухолевых препаратов) определяется индивидуально [75, 78]
PF <2>
Цисплатин** 75 - 100 мг/м2 в/в в 1-й день + фторурацил** 1000 мг/м2/сут. в/в 96-часовая инфузия в 1 - 4-й дни, каждые 3 нед. [75, 79, 80]
Карбоплатин** AUC-5 в/в в 1-й день + фторурацил** 1000 мг/м2 в/в 96-часовая инфузия в 1 - 4-й дни, каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8 [81, 70].
Pacli +Carbo <2>
#Паклитаксел** 175 мг/м2 в/в в 1-й день + карбоплатин** AUC-5 - 6 в/в в 1-й день каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8 [75, 83].
#Паклитаксел** 60 - 80 мг/м2 в/в еженедельно + карбоплатин** AUC-2 в/в еженедельно до прогрессирования или неприемлемой токсичности, но не более 18 недель [75, 84].
DC <2>
#Доцетаксел** 75 мг/м2 в/в в 1-й день + цисплатин** 75 мг/м2 в/в в 1-й день, каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8 [75, 85, 86].
Ниволумаб <3>
Ниволумаб** 3 мг/кг в/в 1 раз в 2 нед. или 240 мг 1 раз в 2 нед. или 480 мг 1 раз в 4 нед. 60-минутная инфузия (первое введение), далее - 30-минутная инфузия до прогрессирования или неприемлемой токсичности, но не более 2 лет [75].
Пембролизумаб <4>
Пембролизумаб** 200 мг в/в 1 раз в 3 нед. (30-минутная инфузия) или 400 мг 1 раз в 6 нед. до прогрессирования или неприемлемой токсичности, но не более 2 лет [75]
PF + Пембролизумаб <5>
Пембролизумаб** 200 мг + карбоплатин** AUC 5 или цисплатин** 100 мг/м2 + ФУ 1000 мг/м2 1 - 4 дни 1 раз в 3 недели (6 циклов), далее пембролизумаб** 200 мг 1 раз в 3 недели или 400 мг 1 раз в 6 нед. Максимум - до 35 введений в целом [75, 87]
Монотерапия для пациентов в общем состоянии по ECOG > 2 баллов
Цисплатин** 60 - 70 мг/м2 в/в 1 раз в 3 нед. Количество введений определяется индивидуально, но целесообразность длительности более 6 - 8 введений представляется сомнительной [75].
Карбоплатин** AUC 5 - 6 в/в 1 раз в 3 нед. или карбоплатин** AUC 2 в/в еженедельно. Количество введений определяется индивидуально. [75]
#Паклитаксел** 175 мг/м2 в/в 1 раз в 3 нед. или паклитаксел** 80 мг/м2 в/в еженедельно. Количество введений определяется индивидуально [75].
#Доцетаксел** 70 - 75 мг/м2 в/в 1 раз в 3 нед. Количество введений определяется индивидуально [75].
#Капецитабин** 2000 мг/м2 внутрь в 2 приема в 1 - 14-й дни, перерыв 1 неделя или 2000 мг/сут. внутрь ежедневно в метрономном режиме. Длительность терапии определяется индивидуально [75].
#Метотрексат** 40 мг/м2 в/в еженедельно. Количество введений определяется индивидуально7 [75].
Цетуксимаб** 400 мг/м2 в/в (2-часовая инфузия) в 1-й день 1-го курса, далее - 250 мг/м2 в/в еженедельно [75]
--------------------------------
<1> Для пациентов в общем состоянии по ECOG 2 балла.
<2> Неоптимальные режимы лечения; возможны к применению только в случае абсолютных противопоказаний к назначению анти-EGFR МКА.
<3> Во 2 и последующих линиях терапии при платино-резистентных опухолях. Может назначаться независимо от уровня экспрессии PD-L1.
<4> В качестве 1 линии при наличии экспрессии PD-L1 CPS ![]() 1. При прогрессировании на фоне или после ХТ, включающей препараты платины (L01XA: Соединения платины), при уровне TPS
1. При прогрессировании на фоне или после ХТ, включающей препараты платины (L01XA: Соединения платины), при уровне TPS ![]() 50%. Рекомендуемая длительность применения соответствует дизайну регистрационных исследований.
50%. Рекомендуемая длительность применения соответствует дизайну регистрационных исследований.
<5> В качестве 1 линии при CPS ![]() 1
1
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.3 Хирургическое лечение
- Рекомендовано проводить оценку всех пациентов до лечения врачом-хирургом и врачом-онкологом, специализирующимся на опухолях головы и шеи, которому рекомендовано предпринять следующие действия: рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ, МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность хирургического лечения, если первичное лечение было нехирургическим, разработать проспективный план наблюдения, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации [5, 7, 21 - 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Для пациентов, которым выполняют плановые операции, рекомендовано проработать хирургическое вмешательство, края резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями [5, 7, 21 - 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Хирургическое вмешательство не следует модифицировать на основании клинического ответа, полученного до лечения. Поражение опухолью следующих структур связано с плохим прогнозом: (например, неоперабельность, ассоциированная с технической невозможностью получить чистые края резекции) значительное поражение крыловидно-небной ямки, тяжелые тризмы из-за инфильтрации опухолью крыловидных мышц; макроскопическое распространение опухоли на основание черепа (например, эрозия крыловидных пластинок или основной кости, расширение овального отверстия и др.); возможная инвазия (охват) стенки общей или внутренней сонной артерии. Охват обычно оценивается радиологически (по данным КТ и МРТ) и диагностируется, если опухоль окружает ![]() 270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения, предпозвоночную фасцию или шейные позвонки. Необходимо выполнять удаление первичной опухоли единым блоком. Необходимо планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию для получения чистого края резекции. Подтверждено, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное гистологическое исследование). Предпочтительно выполнять одномоментную реконструкцию резецированного участка нерва. Адекватное удаление определяется как расстояние от края резекции до макроскопически видимой опухоли
270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения, предпозвоночную фасцию или шейные позвонки. Необходимо выполнять удаление первичной опухоли единым блоком. Необходимо планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию для получения чистого края резекции. Подтверждено, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное гистологическое исследование). Предпочтительно выполнять одномоментную реконструкцию резецированного участка нерва. Адекватное удаление определяется как расстояние от края резекции до макроскопически видимой опухоли ![]() 2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов обычно проводят интраоперационно, если зона, макроскопически свободная от опухоли по краю резекции составляет < 2 см, невозможно определить линию резекции в связи с нечеткой границей опухоли или имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли, который составляет
2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов обычно проводят интраоперационно, если зона, макроскопически свободная от опухоли по краю резекции составляет < 2 см, невозможно определить линию резекции в связи с нечеткой границей опухоли или имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли, который составляет ![]() 5 мм от края резекции. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции, равное < 5 мм. Первичную опухоль следует помечать таким образом, чтобы патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга.
5 мм от края резекции. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции, равное < 5 мм. Первичную опухоль следует помечать таким образом, чтобы патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга.
- По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции, свободными от опухоли. По усмотрению хирурга выполняется пластическое ушивание с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с/без реконструкции верхней челюсти [5, 7, 21 - 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Пациентам с местно-распространенными формами рака головы и шеи, а также при угрозе кровотечения из опухолевых узлов в области головы и шеи рекомендовано:
Произвести клиническую оценку состояния опухолевого процесса и оценить риски возникновения кровотечения, размеры опухоли и переход опухоли на соседние структуры в случае изъявления опухоли, имеющейся полости в области опухоли или рецидива опухоли, близости к ветвям сонной артерии, наличие незаживающей раны, состоявшееся кровотечение из опухоли [5, 23, 66 - 69].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- В случае констатации риска кровотечения из опухолевых узлов рекомендовано произвести ангиографию сонной артерии избирательной и при отсутствии противопоказаний произвести суперселективную внутриартериальную эмболизацию сосудов опухоли с целью снижения рисков кровотечения и фатальных осложнений [5, 23, 66 - 69].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется всем больным раком слизистой оболочки полости носа и придаточных пазух носа после первичного лечения соблюдать следующую периодичность и методы наблюдения после завершения лечения [5]:
В первые 1 - 2 года физикальный осмотр и сбор жалоб необходимо проводить каждые 36 месяца, на сроке 3 - 5 лет - 1 раз в 6 - 12 месяцев. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Объем обследования:
1. Анамнез и физикальное обследование
2. УЗИ л/у шеи с 2-х сторон, органов брюшной полости и малого таза каждые 3 - 6 мес. в зависимости от риска прогрессирования;
3. Рентгенография органов грудной клетки каждые 12 мес.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей головы и шеи.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 C81 - C96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее - федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики C37, C38, C40 - C41, C45 - C49, C58, D39, C62, C69 - C70, C72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней - онкология (МКБ-О), 3 издания 8936, 906 - 909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка - национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) [1] путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее - онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Факторами, влияющими на прогноз заболевания, являются:
- размер и распространенность первичной опухоли; степень дифференцировки опухоли;
- наличие/отсутствие периваскулярной, перилимфатической, периневральной инвазии; статус регионарных ЛУ (pN) (метастазы в ЛУ шеи вдвое снижают выживаемость больных); экстранодальное распространение опухоли;
- активность клеточной пролиферации (индекс Ki-67); статус краев резекции (R0-1).
Критерии оценки качества медицинской помощи
N п/п
Критерии качества
Оценка выполнения
1.
Выполнена фиброларингоскопия, эзофагогастроскопия (при установлении диагноза)
Да/Нет
2.
Выполнено патологоанатомическое исследование биопсийного (операционного) материала
Да/Нет
3.
Выполнено КТ лицевого отдела черепа и шеи с внутривенным болюсным контрастированием и/или МРТ лицевого отдела черепа, шеи с внутривенным контрастированием
Да/Нет
Список литературы
1. Каприн А.Д., Старинский В.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность) - М.: МНИОИ им. П.А. Герцена филиал ФГБУ "НМИРЦ" Минздрава России, 2017, с. 11, 15, 16.
2. Давыдов М.И. Энциклопедия клинической онкологии Москва, ООО "РЛС-2004", 2004.
3. Teymoortash, A. Current advanced in diagnosis and surgical treatment of lymph node metastasis in head and neck cancer/A. Teymoortash, J.A. Werner//GMS Curr. Top Otorhinolaryngol. Head Neck Surg. - 2012. - Vol. 11. - P. 04.
4. Soo KC, Tan EH, Wee J, Lim D, Tai BC, Khoo ML, et al.: Surgery and adjuvant radiotherapy vs concurrent chemoradiotherapy in stage III/IV nonmetastatic squamous cell head and neck cancer: a randomised comparison. Br J Cancer 2005; 93: 279-86.
5. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines(R)). Head and Neck Cancers. Version 2.2023.
6. Ang KK, Trotti A, Brown BW, Garden AS, Foote RL, Morrison WH, et al.: Randomized trial addressing risk features and time factors of surgery plus radiotherapy in advanced head-and-neck cancer. Int J Radiat Oncol Biol Phys 2001; 51: 571-8.
7. Simmer LA, Carrau RL. Neoplasms of the nose and paranasal sinuses. Bailey BJ, Johnson JT, Newland SD, eds. Head & Neck Surgery - Otolaryngology. 4th. Lippincott, Williams & Wilkins; 2006.
8. Caplan LS, Hall I, Levine RS, Zhu K. Preventable risk factors for nasal cancer. Ann Epidemiol. 2000. 10: 186-91.
9.
10. Mehanna H, Wong WL, McConkey CC, et al. PET-CT surveillance versus neck dissection in advanced head and neck cancer. N Engl J Med 2016; 374: 1444 - 1454.
11. d"Errico A, Pasian S, Baratti A, et al. A case-controlled study on occupational risk factors for sino-nasal cancer. Occup Environ Med. 2009. 66: 448-55.
12. Benninger MS. The impact of cigarette smoking and environmental tobacco smoke on nasal and sinus disease: a review of the literature. Am J Rhinol. 1999 Nov - Dec. 13(6): 435-8. [Medline].
13. _______
14. Sasaki M, Eida S, Sumi M, Nakamura T. Apparent diffusion coefficient mapping for sinonasal diseases: differentiation of benign and malignant lesions. AJNR Am J Neuroradiol. 2011 Jun. 32(6): 1100-6. [Medline].
15. Snyderman CH, Carrau RL, deVries EJ. Johnson JT, Derkay CS, Mandell-Brown MK, Newman RK eds. Carotid artery resection: update on preoperative evaluation. Mosby; 1993. 6: 341-4.
16. Zenda S, Kohno R, Kawashima M, et al. Proton beam therapy for unresectable malignancies of the nasal cavity and paranasal sinuses. Int J Radiat Oncol Biol Phys 2011; 81: 1473 - 1478.
17. Adelstein DJ, Li Y, Adams GL, et al. An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol 2003; 21: 92 - 98.
18. Ang KK, Zhang Q, Rosenthal DI, et al. Randomized phase III trial of concurrent accelerated radiation plus cisplatin with or without cetuximab for stage III to IV head and neck carcinoma: RTOG 0522. J Clin Oncol 2014; 32: 2940 - 2950.
19. Geoffrois L, Martin L, De Raucourt D, et al. Induction chemotherapy followed by cetuximab radiotherapy is not superior to concurrent chemoradiotherapy for head and neck carcinomas: results of the GORTEC 2007-02 phase III randomized trial. J Clin Oncol 2018; 36: 3077 - 3083.
20. Cohen EEW, Soulieres D, Le Tourneau C, et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study. Lancet 2019; 393: 156 - 167.
21. Soldatova L, Campbell RG, Carrau RL, et al. Sinonasal carcinomas with neuroendocrine features: histopathological differentiation and treatment outcomes. J Neurol Surg B Skull Base 2016; 77: 456 - 465.
22. Hanna EYN, Westfall C. Cancer of the nasal cavity, paranasal sinuses and orbit. Myers EN, Suen JY, Myers JN, Hanna EYN, eds. Cancer of the head and neck. 4th. Saunders; 2003.
23. Barnes L. Surgical pathology of the head and neck. 2nd. Marcel Dekker; 2001.
24. Kida A, Endo S, Iida H, et al. Clinical assessment of squamous cell carcinoma of the nasal cavity proper. Auris Nasus Larynx. 1995. 22(3): 172-7. [Medline].
25. Heffner DK, Hyams VJ, Hauck KW, Lingeman C. Low-grade adenocarcinoma of the nasal cavity and paranasal sinuses. Cancer. 1982 Jul 15. 50(2): 312-22. [Medline].
26. Van Gerven L, Jorissen M, Nuyts S, Hermans R, Vander Poorten V. Long-term followup of 44 patients with adenocarcinoma of the nasal cavity and sinuses primarily treated with endoscopic resection followed by radiotherapy. Head Neck. 2011 Jun. 33(6): 898904. [Medline].
27. Claus F, Boterberg T, Ost P, et al. Postoperative radiotherapy for adenocarcinoma of the ethmoid sinuses: treatment results for 47 patients. Int J Radiat Oncol Biol Phys. 2002 Nov 15. 54(4): 1089-94. [Medline].
28. Lund VJ, Chisholm EJ, Takes RP, et al. Evidence for treatment strategies in sinonasal adenocarcinoma. Head Neck. 2012 Aug. 34(8): 1168-78. [Medline].
29. Knegt PP, Ah-See KW, vd Velden LA, Kerrebijn J. Adenocarcinoma of the ethmoidal sinus complex: surgical debulking and topical fluorouracil may be the optimal treatment. Arch Otolaryngol Head Neck Surg. 2001 Feb. 127(2): 141-6. [Medline].
30. Almeyda R, Capper J. Is surgical debridement and topical 5 fluorouracil the optimum treatment for woodworkers" adenocarcinoma of the ethmoid sinuses? A case-controlled study of a 20-year experience. Clin Otolaryngol. 2008 Oct. 33(5): 435-41. [Medline].
31. Rhee CS, Won TB, Lee CH, et al. Adenoid cystic carcinoma of the sinonasal tract: treatment results. Laryngoscope. 2006 Jun. 116(6): 982-6. [Medline].
32. Lupinetti AD, Roberts DB, Williams MD, et al. Sinonasal adenoid cystic carcinoma: the M. D. Anderson Cancer Center experience. Cancer. 2007 Dec 15. 110(12): 2726-31. [Medline].
33. Szanto PA, Luna MA, Tortoledo ME, White RA. Histologic grading of adenoid cystic carcinoma of the salivary glands. Cancer. 1984 Sep 15. 54(6): 1062-9. [Medline].
34. Spiro RH. Distant metastasis in adenoid cystic carcinoma of salivary origin. Am J Surg. 1997 Nov. 174(5): 495-8. [Medline].
35. Frierson HF Jr, Mills SE, Fechner RE, Taxy JB, Levine PA. Sinonasal undifferentiated carcinoma. An aggressive neoplasm derived from schneiderian epithelium and distinct from olfactory neuroblastoma. Am J Surg Pathol. 1986 Nov. 10(11): 771-9. [Medline].
36. Enepekides DJ. Sinonasal undifferentiated carcinoma: an update. Curr Opin Otolaryngol Head Neck Surg. 2005 Aug. 13(4): 222-5. [Medline].
37. Cerilli LA, Holst VA, Brandwein MS, Stoler MH, Mills SE. Sinonasal undifferentiated carcinoma: immunohistochemical profile and lack of EBV association. Am J Surg Pathol. 2001 Feb. 25(2): 156-63. [Medline].
38. Mendenhall WM, Mendenhall CM, Riggs CE Jr, Villaret DB, Mendenhall NP. Sinonasal undifferentiated carcinoma. Am J Clin Oncol. 2006 Feb. 29(1): 27 - 31. [Medline].
39. Hyams VJ. Olfactory neuroblastoma (case 6). Batsakis JG, Hyams VJ, Morales AR, eds. Specifial tumors of the head and neck. Chicago: American Society of Clinical Pathologist Press; 1992. 24 - 29.
40. Malouf GG, Casiraghi O, Deutsch E, Guigay J, Temam S, Bourhis J. Low - and highgrade esthesioneuroblastomas display a distinct natural history and outcome. Eur J Cancer. 2013 Apr. 49(6): 1324-34. [Medline].
41. Dulguerov P, Calcaterra T. Esthesioneuroblastoma: the UCLA experience 1970 - 1990. Laryngoscope. 1992 Aug. 102(8): 843-9. [Medline].
42. Folbe A, Herzallah I, Duvvuri U, et al. Endoscopic endonasal resection of esthesioneuroblastoma: a multicenter study. Am J Rhinol Allergy. 2009 Jan-Feb. 23(1): 91-4. [Medline].
43. Devaiah AK, Andreoli MT. Treatment of esthesioneuroblastoma: a 16-year meta-analysis of 361 patients. Laryngoscope. 2009 Jul. 119(7): 1412-6. [Medline].
44. Dulguerov P, Allal AS, Calcaterra TC. Esthesioneuroblastoma: a meta-analysis and review. Lancet Oncol. 2001 Nov. 2(11): 683-90. [Medline].
45. Loy AH, Reibel JF, Read PW, et al. Esthesioneuroblastoma: continued follow-up of a single institution"s experience. Arch Otolaryngol Head Neck Surg. 2006 Feb. 132(2): 134-8. [Medline].
46. Patil VM, Joshi A, Noronha V, et al. Neoadjuvant chemotherapy in locally advanced and borderline resectable nonsquamous sinonasal tumors (esthesioneuroblastoma and sinonasal tumor with neuroendocrinedifferentiation). Int J Surg Oncol 2016; 2016: 6923730.
47. Lewis JE, Rohlinger AL, Weaver AL, Olsen KD. Sinonasal melanoma: a clinicopathologic review of 61 cases. Otolaryngol Head Neck Surg. 2008 Mar. 138(3): 347-52. [Medline].
48. Mendenhall WM, Amdur RJ, Hinerman RW, Werning JW, Villaret DB, Mendenhall NP. Head and neck mucosal melanoma. Am J Clin Oncol. 2005 Dec. 28(6): 626-30. [Medline].
49. Resto VA, Eisele DW, Forastiere A, et al. Esthesioneuroblastoma: the Johns Hopkins experience. Head Neck 2000; 22: 550 - 558.
50. Wagner M, Morris CG, Werning JW, Mendenhall WM. Mucosal melanoma of the head and neck. Am J Clin Oncol. 2008 Feb. 31(1): 43-8. [Medline].
51. Hillstrom RP, Zarbo RJ, Jacobs JR. Nerve sheath tumors of the paranasal sinuses: electron microscopy and histopathologic diagnosis. Otolaryngol Head Neck Surg. 1990 Mar. 102(3): 257-63. [Medline].
52. Greene FL, Page DL, Fleming ID, et al. eds. Nasal cavity and paranasalsinues. AJCC Cancer Staging Manual. New York: Springer - Verlga; 2002. 6: 59 - 67.
53. Hojo H, Zenda S, Akimoto T, et al. Impact of early radiological response evaluation on radiotherapeutic outcomes in the patients with nasal cavity and paranasal sinus malignancies. J Radiat Res. 2012 Sep. 53(5): 704-9. [Medline]. [Full Text].
54. Swegal W, Koyfman S, Scharpf J, et al. Endoscopic and open surgical approaches to locally advanced sinonasal melanoma: comparing the therapeutic benefits. JAMA Otolaryngol Head Neck Surg. 2014 Sep. 140 (9): 840-5. [Medline].
55. Hadad G, Bassagasteguy L, Carrau RL, et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 2006 Oct. 116(10): 1882-6. [Medline].
56. Nicolai P, Battaglia P, Bignami M, et al. Endoscopic surgery for malignant tumors of the sinonasal tract and adjacent skull base: a 10-year experience. Am J Rhinol. 2008 MayJun. 22(3): 308-16. [Medline].
57. Резолюция экспертного совета по вопросу о роли цетуксимаба в лечении пациентов с плоскоклеточным раком головы и шеи. Опухоли головы и шеи 2019; 8: 71-3.
58. Wu Q, Mohan R, Morris M, et al. Simultaneous integrated boost intensitymodulated radiotherapy for locally advanced head-and-neck squamous cell carcinomas. I: dosimetric results. Int J Radiat Oncol Biol Phys 2003; 56: 573 - 585.
59. Стандарты лучевой терапии. Под ред. А.Д. Каприна, А.А. Костина, Е.В. Хмелевского. М.: ГЭОТАР-Медиа, 2019. С. 15 - 35.
60. Hoppe BS, Stegman LD, Zelefsky MJ, et al. Treatment of nasal cavity and paranasal sinus cancer with modern radiotherapy techniques in the postoperative setting--the MSKCC experience. Int J Radiat Oncol Biol Phys. 2007 Mar 1. 67(3): 691 - 702. [Medline].
61. Daly ME, Chen AM, Bucci MK, et al. Intensity-modulated radiation therapy for malignancies of the nasal cavity and paranasal sinuses. Int J Radiat Oncol Biol Phys. 2007 Jan 1. 67(1): 151-7. [Medline].
62. Patel SG, Singh B, Polluri A, et al. Craniofacial surgery for malignant skull base tumors: report of an international collaborative study. Cancer. 2003 Sep 15. 98(6): 1179-87. [Medline].
63. Suarez C, Ferlito A, Lund VJ, et al. Management of the orbit in malignant sinonasal tumors. Head Neck. 2008 Feb. 30(2): 242-50. [Medline].
64. Self EM, Bumpous J, Ziegler C, Wilson L, Potts K. Risk factors for hemorrhage after chemoradiation for oropharyngeal squamous cell carcinoma. JAMA Otolaryngol Head Neck Surg. 2013 Apr; 139(4): 356-61. doi: 10.1001/jamaoto. 2013.103. PMID: 23599070.
65. TaunkNK, HafftyBG, Kostis JB, Goyal S. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol. 2015 Feb 18; 5: 39. doi: 10.3389/fonc.2015.00039. PMID: 25741474; PMCID: PMC4332338. (Self EM, Bumpous J, Ziegler C, Wilson L, Potts K. Risk factors for hemorrhage after chemoradiation for oropharyngeal squamous cell carcinoma. JAMA Otolaryngol Head Neck Surg. 2013 Apr; 139(4): 356-61. doi: 10.1001/jamaoto.2013.103. PMID: 23599070.).
66. Sittel C, Gossmann A, Jungehu lsing M, Za hringer M. Superselective embolization as palliative treatment of recurrent hemorrhage in advanced carcinoma of the head and neck. Ann Otol Rhinol Laryngol. 2001; 110(12): 1126 - 1128.
67. Kumra V, Vastola AP, Keiserman S, Lucente FE. Spontaneous tonsillar hemorrhage. Otolaryngol Head Neck Surg. 2001; 124(1): 51 - 52.
68. Smith TP. Embolization in the external carotid artery. J VascIntervRadiol. 2006 Dec; 17(12): 1897-912; quiz 1913. doi: 10.1097/01.RVI.0000247301.64269.27. PMID: 17185685.
69. Kumar T, Yadav V, Ravi K, Ramaswamy K, Patel MH, Kothari K. External Carotid Artery Ligation in Squamous Cell Carcinomas of the Oral Cavity and Oropharynx: an Oncological Emergency. Indian J Surg. 2015 Dec; 77 (Suppl 3): 850-2. doi: 10.1007/s12262-014-1035-4. Epub2014 Jan 23. PMID: 27011469; PMCID: PMC4775627.
70. Bourhis J, Sire C, Graff P, et al. Concomitant chemoradiotherapy versus acceleration of radiotherapy with or without concomitant chemotherapy in locally advanced head and neck carcinoma (GORTEC 99-02): an openlabel phase 3 randomised trial. Lancet Oncol 2012; 13: 145 - 153.
71. Beckmann GK, Hoppe F, Pfreundner L, Flentje MP. Hyperfractionated accelerated radiotherapy in combination with weekly cisplatin for locally advanced head and neck cancer. Head Neck 2005; 27: 36 - 43.
72. Haddad R, O'Neill A, Rabinowits G, et al. Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial. Lancet Oncol 2013; 14: 257 - 264.
73. Stevens CM, Huang SH, Fung S, et al. Retrospective study of palliative radiotherapy in newly diagnosed head and neck carcinoma. Int J Radiat Oncol Biol Phys 2011; 81: 958 - 963.
74. Porceddu SV, Rosser B, Burmeister BH, et al. Hypofractioned radiotherapy for the palliation of advanced head and neck cancer in patients unsuitable for curative treatment-"Hypo Trial." Radiother Oncol 2007; 85: 456 - 462.
75. Болотина Л.В., Владимирова Л.Ю., Деньгина Н.В., Новик А.В., Романов И.С. Практические рекомендации по лечению злокачественных опухолей головы и шеи//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 71 - 82.
76. Guigay J, Fayette J, Dillies A-F, et al. Cetuximab, docetaxel, and cisplatin (TPEx) as first-line treatment in patients with recurrent or metastatic (R/M) squamous cell carcinoma of the head and neck (SCCHN): Final results of phase II trial GORTEC 2008-03 [abstract]. J Clin Oncol 2012; 30 (suppl 15): Abstract 5505.
77. Herbst RS, Arquette M, Shin DM, et al. Phase II multicenter study of the epidermal growth factor receptor antibody cetuximab and cisplatin for recurrent and refractory squamous cell carcinoma of the head and neck. J Clin Oncol 2005; 23: 5578 - 5587.
78. Leeann Geraghty Thomas E. Schultz Sarah E. Hoffman Kyle Porter Majd Issa Vidhya Karivedu Marcelo Bonomi Weekly vs. 3-weekly paclitaxel, carboplatin, and cetuximab (PCC) in recurrent/metastatic head and neck cancer MOLECULAR AND CLINICAL ONCOLOGY 15: 240, 2021.
79. Gibson MK, Li Y, Murphy B, et al. Randomized phase III evaluation of cisplatin plus fluorouracil versus cisplatin plus paclitaxel in advanced head and neck cancer (E1395): an intergroup trial of the Eastern Cooperative Oncology Group. J Clin Oncol 2005; 23: 3562 - 3567.
80. Forastiere AA, Metch B, Schuller DE, et al. Randomized comparison of cisplatin plus fluorouracil and carboplatin plus fluorouracil versus methotrexate in advanced squamous-cell carcinoma of the head and neck: a Southwest Oncology Group study. J Clin Oncol 1992; 10: 1245 - 1251.
81. Denis F, Garaud P, Bardet E, et al. Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol. 2004; 22: 69 - 76.
82. ________
83. Samlowski WE, Moon J, Kuebler JP, et al. Evaluation of the combination of docetaxel/carboplatin in patients with metastatic or recurrent squamous cell carcinoma of the head and neck (SCCHN): a Southwest Oncology Group Phase II study. Cancer Invest. 2007; 25: 182 - 188.
84. Adeline P tre, C cile Dalban, Andy Karabajakian, Eve-Marie Neidhardt, Pierre Eric Roux, Marc Poupart, Sophie Deneuve, Philippe Zrounba and J rome Fayette. Carboplatin in combination with weekly Paclitaxel as first-line therapy in patients with recurrent/metastatic head and neck squamous cell carcinoma unfit to EXTREME schedule. Oncotarget. 2018 Apr 24; 9(31): 22038 - 22046. doi: 10.18632/oncotarget.25157.
85. Samlowski WE, Moon J, Kuebler JP, et al. Evaluation of the combination of docetaxel/carboplatin in patients with metastatic or recurrent squamous cell carcinoma of the head and neck (SCCHN): a Southwest Oncology Group Phase II study. Cancer Invest 2007; 25: 182 - 188.
86. L. Specht, S. Kornum Larsen2, H. Sand Hansen Phase II study of docetaxel and cisplatin in patients with recurrent or disseminated squamous-cell carcinoma of the head and neck. Annals of Oncology 11: 845 - 849, 2000.
87. Burtness B, Harrington KJ, Greil R, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019; 394: 1915 - 1928.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Кропотов Михаил Алексеевич, д.м.н., заведующий отделением хирургическим отделением N 10 опухолей головы и шеи ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
2. Болотин Михаил Викторович, д.м.н., старший научный сотрудник отделения хирургического N 11 опухолей верхних дыхательно-пищеварительных путей ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
1. Агабабян Татев Артаковна, заведующая отделением лучевой диагностики МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России, к.м.н., Обнинск https://orcid.org/0000-0002-9971-3451.
2. Алиева Севил Багатуровна, д.м.н., ведущий научный сотрудник отделения радиационной онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
3. Алымов Юрий Владимирович, к.м.н., врач-онколог отделения хирургических методов лечения N 5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, исполнительный директор Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"; ORCID: https://orcid.org/0000-0002-6851-9867.
4. Артемьева Анна Сергеевна, к.м.н., врач-патоморфолог, руководитель научной лаборатории морфологии опухолей ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова.
5. Бойко Анна Владимировна, д.м.н., профессор, заведующая отделением лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
6. Болотина Лариса Владимировна, д.м.н., доцент РАН, заведующая отделением химиотерапии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России. Председатель группы опухолей головы и шеи практических рекомендаций Российского общества клинической онкологии, член Правления.
7. Виноградов Вячеслав Вячеславович, д.м.н., профессор, руководитель научно-клинического отдела лор-онкологии ФГБУ "Научно-клинический центр оториноларингологии" ФМБА России.
8. Владимирова Любовь Юрьевна, д.м.н., профессор, руководитель отдела лекарственного лечения опухолей, ФГБУ "НМИЦ онкологии" МЗ РФ.
9. Геворков Артем Рубенович, к.м.н., с.н.с., врач-радиотерапевт отделения лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
10. Гиршович Михаил Маркович, к.м.н., врач-радиотерапевт ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России; https://orcid.org/0000-0002-7925-9570.
11. Гулидов Игорь Александрович, заведующий отделом лучевой терапии МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
12. Гузь Александр Олегович, к.м.н., врач-онколог, заведующий отделением опухолей головы и шеи ГБУЗ "Челябинский областной клинический центр онкологии и ядерной медицины".
13. Дайхес Николай Аркадьевич, член-корр. РАН, д.м.н., профессор, директор ФГБУ "Научно-клинический центр оториноларингологии" ФМБА России.
14. Дронова Екатерина Леонидовна, врач-радиолог ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
15. Енгибарян Марина Александровна, д.м.н., заведующая отделением опухолей головы и шеи ФГБУ "НМИЦ онкологии" МЗ РФ, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
16. Игнатова Анастасия Валерьевна, к.м.н., врач-онколог отделения хирургических методов лечения N 5 НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи", ассистент кафедры общей и клинической стоматологии ФГАОУ ВО РУДН. ORCID: https://orcid.org/0000-0002-6796-0968.
17. Клименко Вероника Викторовна, к.м.н., врач клинико-диагностического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России; https://orcid.org/0000-0003-1079-4492.
18. Корниецкая Анна Леонидовна, к.м.н., старший научный сотрудник отделения химиотерапии отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
19. Костромина Екатерина Викторовна, к.м.н., врач ультразвуковой диагностики, врач-рентгенолог отделения лучевой диагностики, научный сотрудник научного отделения диагностической и интервенционной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" МЗ РФ, доцент кафедры лучевой диагностики и медицинской визуализации ФП и ДПО ФГБОУ ВО СПбГМУ; https://orcid.org/0000-0002-4245-687X.
1. Красильникова Лариса Анваровна, к.м.н., врач-цитолог ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
2. Кутукова Светлана Игоревна, д.м.н., доцент, ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации, СПб ГБУЗ "Городской клинический онкологический диспансер".
3. Кульбакин Денис Евгеньевич, д.м.н., старший научный сотрудник, врач-онколог отделения опухолей головы и шеи НИИ онкологии Томского НИМЦ.
20. Мордовский Александр Валентинович - к.м.н., научный сотрудник отделения микрохирургии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Мудунов Али Мурадович, д.м.н., профессор РАН, президент Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
5. Мусин Шамиль Исмагилович, к.м.н., заведующий хирургическим отделением N 6 ГАУЗ РКОД Минздрава РБ.
21. Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России, вице-президент Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
22. Полькин Вячеслав Викторович, к.м.н. заведующий отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
23. Поляков Андрей Павлович, д.м.н., доцент, заведующий отделением микрохирургии МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
6. Пономарева Ольга Игоревна, врач-рентгенолог отделения радиотерапии НМИЦ онкологии им. Н.Н. Петрова; https://orcid.org/0000-0002-7004-9630.
7. Раджабова Замира Ахмед-Гаджиевна, д.м.н., доцент РАН, заведующий отделением опухолей головы и шеи ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова https://orcid.org/0000-0002-6895-0497.
24. Решетов Игорь Владимирович, д.м.н., академик РАН, заведующий кафедрой онкологии, радиотерапии и реконструктивной хирургии Первого Московского медицинского университета им. И.М. Сеченова, президент Общероссийской общественной организации "Федерация специалистов по лечению заболеваний головы и шеи".
25. Романов Илья Станиславович, д.м.н, старший научный сотрудник отделения онкоэндокринологии ФГБУ "НМИЦ Онкологии им. Н.Н. Блохина", доцент кафедры онкологии ФДПО, РНИМУ им Н.И. Пирогова.
26. Рубцова Наталья Алефтиновна, д.м.н., заведующая отделом лучевой диагностики МНИОИ им. П.А. Герцена - филиал "НМИЦ радиологии" Минздрава России. Главный внештатный специалист по лучевой и инструментальной диагностике Минздрава России по Центральному федеральному округу Российской Федерации.
27. Рудык Андрей Николаевич, к.м.н., врач-онколог онкологического отделения N 5 (опухолей головы и шеи) ГАУЗ "Республиканский клинический онкологический диспансер Министерства здравоохранения Республики Татарстан имени профессора М.З. Сигала", и.о. заведующего кафедрой челюстно-лицевой хирургии и хирургической стоматологии, доцент кафедры онкологии, радиологии и паллиативной медицины КГМА - филиал ФГБОУ ДПО РМАНПО Минздрава России, доцент кафедры хирургических болезней постдипломного образования ИФМиБ ФГАОУ ВО "Казанский (Приволжский) федеральный университет", г. Казань.
28. Саприна Оксана Александровна, к.м.н., врач-онколог, отделение хирургическое N 11 опухолей головы и шеи ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
8. Семиглазова Татьяна Юрьевна, д.м.н., профессор, заведующий научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
29. Степанова Александра Михайловна, заведующая отделением реабилитации МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
9. Сукорцева Наталья Сергеевна, ассистент кафедры онкологии, реконструктивной хирургии и радиотерапии, врач онколог Университетской клинической больницы N 1 Сеченовского университета.
10. Ткаченко Елена Викторовна, к.м.н., заведующий отделением краткосрочной противоопухолевой лекарственной терапии, научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, https://orcid.org/0000-0001-6375-8335.
11. Фалалеева Наталья Александровна, заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
12. Феденко Александр Александрович, д.м.н., профессор РАН, заведующий Отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
13. Хмелевский Евгений Витальевич, д.м.н., профессор, заведующий отделом лучевой терапии МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, врач-радиотерапевт МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
14. Ходжибекова Малика Маратовна, д.м.н., врач-радиолог отделения радионуклидной диагностики МНИОИ им. П.А. Герцена - филиал "НМИЦ радиологии" Минздрава России.
15. Цырлина Евгения Владимировна, к.м.н., врач-эндокринолог отделения функциональной диагностики ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
30. Чойнзонов Евгений Лхамацыренович, д.м.н., академик РАН, директор НИИ онкологии Томского НИМЦ, заведующий отделением опухолей головы и шеи НИИ онкологии Томского НИМЦ, заведующий кафедрой онкологии ФГБОУ ВО СибГМУ Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
31. Яковлева Лилия Павловна, к.м.н., врач-онколог, заведующая центром диагностики и лечения опухолей головы и шеи ГБУЗ МКНЦ имени А.С. Логинова МЗ РФ.
Блок Организация оказания медицинской помощи
1. Геворкян Тигран Гагикович, заместитель директора ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
32. Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
33. Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
2. Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-онкологи;
2. Врачи-хирурги;
3. Врачи-радиологи;
4. Врачи-химиотерапевты;
5. Врачи-генетики;
6. Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с опухолями головы и шеи. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Информация отсутствует
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
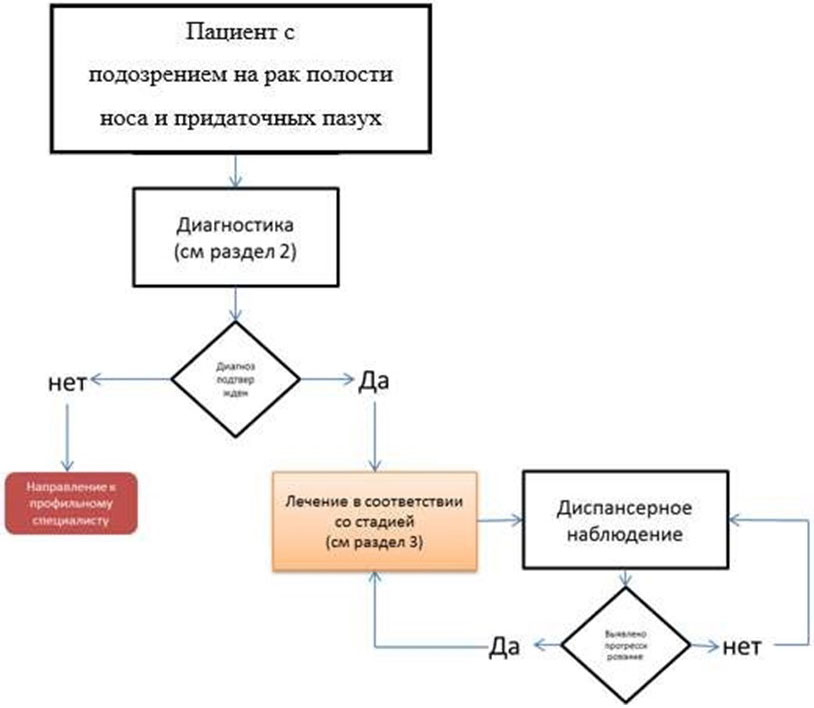
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Рекомендации при осложнениях химиотерапии - связаться с химиотерапевтом.
1) При повышении температуры тела 38 °C и выше:
- Начать прием антибиотиков: по рекомендации химиотерапевта
2) При стоматите:
- Диета - механическое, термическое щажение;
- Частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
- Обрабатывать полость рта по рекомендации химиотерапевта
1) При диарее:
- Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку.
Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
- Принимать препараты по рекомендации химиотерапевта
4) При тошноте:
- Принимать препараты по рекомендации химиотерапевта
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА EGOG/ВОЗ ДЛЯ ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА
Название на русском языке: шкала оценки общего состояния пациента, разработанная Восточной Кооперативной Группой Исследования Рака.
Оригинальное название (если есть): The ECOG Scale of Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status/ [119].
Тип: шкала оценки.
Назначение: оценка общего состояния пациента.
Содержание (шаблон) и Ключ (интерпретация).
Оценка
EGOG
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания (90 - 100 баллов по шкале Карновского)
1
Пациент выполняет сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80 баллов по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60 баллов по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40 баллов по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20 баллов по шкале Карновского) Смерть
Приложение Г2
ШКАЛА
ОЦЕНКИ ЛЕЧЕБНОГО ПАТОМОРФОЗА ОПУХОЛИ ПО Г.А. ЛАВНИКОВОЙ
Название на русском языке: Шкала оценки лечебного патоморфоза опухоли по Г.А. Лавниковой
Оригинальное название: Шкала оценки лечебного патоморфоза опухоли по Г.А. Лавниковой
Источник (официальный сайт разработчиков, публикация с валидацией): https://cr.minzdrav.gov.ru/scale/eb218f32-ee25-4f18-bfb6-c3b6917a8e97
Лавникова Г.А. (1979) Гистологический метод количественной оценки терапевтического повреждения опухоли. Москва.: Методические рекомендации, 13 с
Тип: шкала оценки.
Назначение: оценка лечебного патоморфоза опухоли.
Содержание (шаблон) и Ключ (интерпретация).
Оценка
I. степень - более 50% опухолевой паренхимы сохранено;
II. степень - сохранено 20 - 50% опухолевой паренхимы;
III. степень - до 20% паренхимы опухоли сохранилось в виде отдельных очагов;
IV. степень - полное отсутствие опухолевой паренхимы
Пояснения: отсутствуют.
