"Клинические рекомендации "Нейробластома"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
НЕЙРОБЛАСТОМА
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C47.3, C47.4, C47.5, C47.6, C47.8, C47.9, C48.0, C74.1, C74.9, C76.0, C76.1, C76.2, C76.7, C76.8, C47.0, D48.3, C38.2
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 78_2
Возрастная категория: Дети
Специальность: Гематология, Детская онкология
Разработчик клинической рекомендации
Национальное общество детских гематологов, онкологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АД - артериальное давление
АКС - абдоминальный компартмент синдром
АЧТВ - активированное частичное тромбопластиновое время
БСВ - бессобытийная выживаемость
БАЛ - бронхоальвеолярный лаваж
ВДПХТ - высокодозная полихимиотерапия
ВОЗ - Всемирная организация здравоохранения
Г-КСФ - Гранулоцитарный колониестимулирующий фактор
ГН - ганглионейрома
ГМ - галакоманнана
ГНБ - ганглионейробластома
ДВИ - диффузионно-взвешенные изображения
ДВС - диссеминированное внутрисосудистое свертывание
ДЛТ - дистанционная лучевая терапия
ДНК - дезоксирибонуклеи новая кислота
ЗНО - злокачественные новообразования
ЖУС - жизнеугрожающие симптомы
ЖКТ - желудочно-кишечный тракт
ИВЛ - искусственная вентиляция легких
ИФА - иммуноферметный анализ
ИПП - ингибиторов протонной помпы
КАИК - катетер-ассоциированные инфекции кровотока
КТ - компьютерная томография
КУ - контрастное усиление
КК - конверсионный коэффициент.
КЩС - кислотно-основное состояние
123-I-МИ БГ - мета-йодбензилгуанидин [123I]
МРТ - магнитно-резонансная томография
МНО - международного нормализованного отношения
МРЗС - метициллин-резистентным золотистым стафилококком
НБ - нейробластома
НСЕ - нейронспецифическая енолаза
НПВС - нестероидные противовоспалительные средства
ОВ - общая выживаемость
ОМС - опсоклонус-миоклонус синдром
ОФЭКТ - однофотонная эмиссионная компьютерная томография
ОХЧО - очень хороший частичный ответ
ПВК - периферический венозный катетер
ПО - полный ответ
ПХТ - полихимиотерапия
ПЦР - полимеразная цепная реакция
ПП - парэнтеральное питание
РОД - разовая очаговая доза
РФ - Российская Федерация
РФП - радиофармпрепарат
СОД - суммарная очаговая доза
СНС - симпатическая нервная система
СПОН - синдром полиорганной недостаточности
СКТ - спиральная компьютерная томография
ТГСК - трансплантация гемопоэтических стволовых клеток
ТРЭ - тотальный расход энергии
ТИР - тошноты и рвоты
ЦВК - центральный венозный катетер
ЦВД - центральное венозное давление
ЦНС - центральная нервная система
УЗИ - ультразвуковое исследование
ФН - фебрильная нейтропения
ХТ - химиотерапия
ЦФ - цефалоспоринов
ЩФ - щелочная фосфатаза
ЭХО-КГ - эхокардиография
ЭК - эпидуральная компрессия
ЭОО - энергия основного обмена
ЭП - энтеральное питание
ANTT - Aseptic Non-Touch Technique
ASCO - American Society of Clinical Oncology
BuMel - режим кондиционирования бусульфан/ мелфалан
CEM - режим кондиционировани карбоплатин/ этопозид/ мелфалан
CTV - clinical target volume
COG - Children Oncology Group
del1p - делеция 1 р
FISH - флуоресцентая гибридизация in situ
GTV - gross tumor volume
IDRF - Image Defined Risk Factors
imb1p - дисбаланс 1р
IMRT - Intensity-Modulated Radiation Therapy
INRGSS - International Neuroblastoma Risk Group Staging System
MLPA - мультиплексная лигандо-зависимая амплификация зондов
NSS - International Neuroblastoma Staging System
PTV - planning target volume
TreoMel - режим кондиционирования треосульфан/ мелфалан
VMAT - VoluMetric Arc Therapy
Термины и определения
Общая выживаемость (ОВ) оценивается как время, прошедшее от момента постановки диагноза НБ до смерти пациента от любых причин или до последнего наблюдения за пациентом.
Бессобытийная выживаемость (БСВ) оценивается как время, прошедшее от момента постановки диагноза НБ до неблагоприятного события, под которым понимают прогрессию, рецидив (в случае достижения полного ответа), развитие вторичной злокачественной опухоли, смерть от любой причины, или даты последнего наблюдения за пациентом.
Под прогрессией заболевания понимают появление любого нового опухолевого очага; увеличение любого ранее существующего доступного измерению очага > 25%; выявление поражения костного мозга клетками НБ в случае, если ранее костный мозг был не поражен.
Под рецидивом заболевания понимают появление любых новых опухолевых очагов у пациентов, достигших ранее ПО согласно критериям оценки ответа на терапию у пациентов с НБ.
Необходимо отметить, что определение событий отличается у пациентов группы наблюдения.
У пациентов группы наблюдения под рецидивом/прогрессией подразумеваются следующие ситуации:
- при стадиях 1 - 3: появление отдаленных метастазов;
- при стадии 4S: прогрессия поражения костного мозга, при котором количество опухолевых клеток превышало 10% от числа ядросодержащих клеток, и/или появление метастазов в других органах помимо поражения печени и кожи (так называемая трансформация в 4-ю стадию);
- локальная прогрессия первичной опухоли (при стадиях 1 - 3) или прогрессия органомегалии (при стадии 4S), которые приводили к развитию ЖУС.
Под регрессией понимают:
- отсутствие изменений: изменения не соответствуют критериям прогрессии, регрессия < 10% во всех проекциях;
- минимальная регрессия: регрессия первичной опухоли ![]() 10% и < 25% в одной или нескольких проекциях и < 10% при оценке в других проекциях по данным УЗИ, МРТ или КТ (предыдущее исследование должно быть доступно для подтверждения регрессии);
10% и < 25% в одной или нескольких проекциях и < 10% при оценке в других проекциях по данным УЗИ, МРТ или КТ (предыдущее исследование должно быть доступно для подтверждения регрессии);
- несомненная регрессия: регрессия ![]() 25% в одной или нескольких проекциях и < 25% при оценке в других проекциях по данным УЗИ, МРТ или КТ;
25% в одной или нескольких проекциях и < 25% при оценке в других проекциях по данным УЗИ, МРТ или КТ;
- полная регрессия: отсутствие остаточной первичной опухоли, определяемой методами визуализации (соответствует определению полного ответа в соответствии с критериями INSS).
Под первичной резистентностью понимают:
Первичная резистентность констатируется на основании обследования, выполняемого на промежуточном этапе индукционной терапии (не позднее 4 курса индукционной терапии) либо по ее завершению (после 6 курса индукционной терапии) для пациентов группы высокого риска. Резистентностью считается менее, чем частичный ответ на предшествующую терапию (за исключением прогрессирования). Нейтропения определяется количеством гранулоцитов менее 0,5х109/л, либо менее 1,0х109/л с ожидаемым снижением в течение нескольких последующих дней.
Фебрилитет - однократный подъем температуры тела ![]() 38,3 °C или температура тела
38,3 °C или температура тела ![]() 37,8 °C, сохраняющаяся в течение одного и более часа.
37,8 °C, сохраняющаяся в течение одного и более часа.
Гипотермия - снижение температуры тела менее 36 °C. Данный показатель является важным признаком инфекционного процесса, особенно у детей младшего возраста и у пациентов, получающих глюкокортикостероиды.
Лихорадка неясной этиологии - состояние, характеризующееся фебрилитетом при отсутствии клинико-рентгенологических проявлений инфекции и микробиологических данных.
Бактериемия - идентификация микроорганизма из гемокультуры, взятой во время фебрильного эпизода, не являющегося присевным. К ложной бактериемии относится идентификация так называемых присевных микроорганизмов - комменсалов кожи рук: коагулазонегативных стафилококков, Propionibacterium spp., Micrococcus spp., и др. - в случае их однократной идентификации.
Доказанной является инфекция с идентификацией микроорганизма из стерильных субстратов организма (кровь, ликвор, моча, биопсийный материал) при наличии симптомов воспалительной реакции, либо изоляция патогена из нестерильных субстратов (кожа, слизистые, желудочно-кишечный тракт) при соответствующей локальной клинической картине инфекции.
Вероятной является инфекция без идентификации микроорганизма из исследуемых сред и наличии клинических и/или радиологических признаков инфекции с быстрым ответом на противоинфекционную терапию.
Фебрильная нейтропения - симптомокомплекс, сочетающий развитие фебрилитета или гипотермии у пациента с критериями нейтропении..
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Нейробластома (НБ) - злокачественная опухоль, развивающаяся из клеток предшественников симпатической нервной системы (СНС). НБ является самой частой злокачественной экстракраниальной солидной опухолью детского возраста. На долю НБ приходится 7 - 8% всех злокачественных новообразований (ЗНО) у детей в возрасте 0 - 14 лет [1 - 3]. Это наиболее частая солидная опухоль у детей раннего возраста, пик заболеваемости приходится на 18 мес. и 90% случаев диагностируется в возрасте до 10 лет.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Большинство случаев НБ рассматриваются как спорадические, однако показана возможность развития опухоли у лиц, имеющих генетическую предрасположенность, включая семейные формы заболевания и формирование НБ на фоне определенных генетических синдромов. В ранних популяционных исследованиях, направленных на оценку вклада генетических факторов в развитие ЗНО детского возраста, было показано, что наследственность ответственна за 1 - 2% всех случаев НБ. Однако, в последние годы широкое внедрение молекулярно-генетических исследований позволило гораздо лучше охарактеризовать генетические события, способствующие развитию НБ и выявить дополнительные генетические синдромы, характеризующиеся повышенной частотой развития НБ, а также лучше охарактеризовать семейные случаи заболевания [4].
Биологические особенности НБ представляют одну из наиболее важных инициальных характеристик опухоли, оказывающих влияние на прогноз заболевания [5]. В основе биологической и клинической гетерогенности НБ лежат генетические нарушения, которые могут быть объединены в две большие группы: нарушения числа хромосом и сегментарные нарушения. Последние характерны для опухолей, характеризующихся агрессивным клиническим течением.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Показатель заболеваемости НБ составляет 0,95 - 1,4 на 100 тыс. детского населения в возрасте 0 - 14 лет, при этом пик заболеваемости приходится на детей первого года жизни. НБ является самым частым видом ЗНО у детей первого года жизни, составляя до 28,6 - 35% всех случаев заболевания в этой возрастной группе [6 - 8].
Необходимость оптимизации терапевтических подходов у пациентов с НБ подчеркивается тем фактом, что НБ занимает непропорционально высокое место в структуре смертности детского населения в развитых странах, располагаясь на 3-м месте и уступая только лейкозам и опухолям центральной нервной системы (ЦНС). При этом удельный вес НБ в структуре смертности доходит до 15% [6 - 8].
Дифференцированный подход к лечению пациентов со ЗНО в целом и, в частности, НБ у детей в настоящее время рассматривается как стандарт оказания специализированной медицинской помощи. В основу данного подхода положен анализ различных клинических характеристик и биологических особенностей опухоли, которые обладают влиянием на течение и прогноз заболевания, с последующей адаптацией объема и интенсивности проводимой противоопухолевой терапии в зависимости от наличия или отсутствия неблагоприятных факторов прогноза. Следует отметить, что основной задачей является минимализация терапевтического воздействия у пациентов с благоприятными характеристиками заболевания путем уменьшения количества и кумулятивных доз цитостатических препаратов, уменьшения числа пациентов, требующих проведения лучевой терапии (ЛТ) и больше-объемных хирургических вмешательств, и, следовательно, снижения риска отдаленных последствий терапии при сохранении высоких показателей бессобытийной выживаемости (БСВ) и общей выживаемости (ОВ). Напротив, у пациентов с сочетанием неблагоприятных характеристик опухоли предпринимаются попытки интенсификации терапии, включения новых терапевтических опций с целью нивелирования неблагоприятного влияния на прогноз заболевания упомянутых выше факторов.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
С38.2 - ЗНО заднего средостения
С47.0 - ЗНО Периферических нервов и вегетативной нервной системы головы,
лица и шеи
C47.3 - ЗНО Периферических нервов грудной клетки
C47.4 - ЗНО Периферических нервов живота
C47.5 - ЗНО Периферических нервов таза
C47.6 - ЗНО Периферических нервов туловища неуточненное
C47.8 - ЗНО Поражение периферических нервов и вегетативной нервной системы, выходящее за пределы одной и более вышеуказанных локализаций
C47.9 - ЗНО Периферических нервов и вегетативной нервной системы неуточненной локализации
С48.0 - ЗНО Забрюшинного пространства
С74.1 - ЗНО Мозгового слоя надпочечника
С74.9 - ЗНО Надпочечника неуточненной части
С76.0 - ЗНО Головы, лица и шеи
С76.1 - ЗНО Грудной клетки
С76.2 - ЗНО Живота
С76.7 - ЗНО Других неуточненных локализаций
С76.8 - ЗНО Других неточно обозначенных локализаций, выходящее за пределы одной и более вышеуказанных локализаций.
D48.3 - Новообразования неопределенного и неизвестного характера других и неуточненных локализаций забрюшинного пространства
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В зависимости от степени дифференцировки различают НБ, ганглионейробластому (ГНБ) и ганглионейрому (ГН).
Терапия пациентов с НБ основывается на их разделении на группы риска в зависимости от сочетания прогностических факторов, таких как возраст на момент постановки диагноза, стадия заболевания, молекулярно-генетические характеристики опухоли, включающие статус гена MYCN и делецию 1p.
Оценка распространенности процесса при НБ проводится в рамках международной системы стадирования - INSS (International Neuroblastoma Staging System - INSS) [9]. Необходимо отметить, что INSS является постхирургической системой оценки стадии (табл. 1).
Таблица 1. Международная система оценки стадии при нейробластоме (INSS)
Стадия
Описание
1-я
- Макроскопически полностью удаленная опухоль с или без микроскопически остаточной опухоли;
- ипсилатеральные лимфатические узлы не поражены, что подтверждено микроскопически (допускается вовлечение непосредственно прилежащих к опухоли полностью удаленных лимфатических узлов).
Макроскопически полностью удаленная срединно расположенная опухоль без поражения ипсилатеральных (при их поражении - стадия 2А) и контрлатеральных (при их поражении - стадия 2В) лимфатических узлов трактуется как стадия 1
2А
- Макроскопически неполностью удаленная локализованная опухоль;
- ипсилатеральные, не связанные с опухолью лимфатические узлы не поражены, что подтверждено микроскопически
2В
- Локализованная опухоль макроскопически полностью или неполностью удаленная;
- поражение ипсилатеральных, не связанных с опухолью лимфатических узлов. Отсутствие поражения увеличенных контрлатеральных лимфатических узлов должно быть подтверждено микроскопически
3-я
- Неполностью удаленная унилатеральная опухоль, переходящая срединную линию с или без поражения лимфатических узлов;
- локализованная унилатеральная опухоль с поражением контрлатеральных лимфатических узлов;
- неполностью удаленная срединная опухоль с билатеральным распространением за счет инфильтративного роста или двустороннего поражения лимфатических узлов.
За срединную линию принимается позвоночный столб. Опухоли, располагающиеся на одной стороне и пересекающие срединную линию, должны инфильтрировать противоположный край позвоночного столба
4-я
Любая первичная опухоль с диссеминацией опухоли в удаленные лимфатические узлы, кости, костный мозг, печень, кожу и/или другие органы (за исключением ситуаций, описанных при 4S стадии)
4S
Локализованная опухоль (соответствующая стадиям 1, 2А или 2В) с диссеминацией, ограниченной только печенью, кожей и/или костным мозгом у детей младше 1 года.
Поражение костного мозга при 4S стадии должно быть минимальным и не превышать 10% от числа ядросодержащих клеток при оценке миелограммы или трепанобиоптата. Более массивное поражение костного мозга трактуется как 4-я стадия. Патологическое накопление препарата при сцинтиграфии с Йобенгуаном [123I] (далее - МЙБГ) в костном мозге отсутствует
Стадия заболевания при мультифокальных опухолях (например, двухстороннее поражение надпочечников) оценивается по наиболее пораженной стороне и обозначается буквой М (например, 2м).
В 2009 г. была опубликована и внедрена новая система стратификации по стадиям, основанная не на оценке объема хирургического вмешательства, а на выявлении факторов риска при визуализации (Image Defined Risk Factors - IDRF) определяемых по данным визуализационных методов исследования (КТ и МРТ) - INRGSS (International Neuroblastoma Risk Group Staging System). IDRF включают вовлечение опухолью крупных сосудов, нервных стволов, почечной ножки и других факторов, которые могут ограничить объем хирургического вмешательства и предопределить хирургические осложнения [10] (табл. 2).
Таблица 2. Факторы риска при нейробластоме выявляемые при проведение визуализационных методов исследования (КТ и/или МРТ) (Image Defined Risk Factors - IDRF) [10].
Ипсилатеральное распространение опухоли в пределах двух анатомических областей
(шея-грудь, грудь-живот, живот-область таза)
Шея
Опухоль охватывает каротидную и/или позвоночную артерии и/или внутреннюю яремную вену
Распространение опухоли на основание черепа
Сдавление опухолью трахеи
Шейно-грудной отдел
Вовлечение плечевого сплетения
Вовлечение подключичных сосудов и/или позвоночной и/или каротидной артерий
Сдавление трахеи
Грудная полость
Вовлечение аорты и/или крупных ветвей
Сдавление трахеи и/или главных бронхов
Опухоль нижних отделов средостения, инфильтрирующая реберно-позвононый угол на уровне Th9 - Th12
Брюшная полость/область таза
Инфильтрация ворот печени и/или гепатодуоденальной связки
Вовлечение ветвей верхней брыжеечной артерии на уровне корня брыжейки
Вовлечение чревного ствола и/или верхней брыжеечной артерии
Инвазия в одну/обе почечные ножки
Вовлечение аорты и/или полой вены
Вовлечение подвздошных сосудов
Опухоль малого таза пересекает седалищную вырезку
Интравертебральный рост опухоли независимо от локализации при условии:
поражение более одной трети спинномозгового канала на аксиальных срезах и/или перимедуллярные лептоменингеальные пространства не визуализируются и/или нарушение сигнала со спинного мозга
Инфильтрация прилежащих органов и структур:
Перикард, диафрагма, почки, печень, область 12-перстной кишки и поджелудочной железы, брыжейка
Состояния, требующие регистрации, но не относящиеся к IDRF:
Мультифокальная первичная опухоль
Плевральный выпот
Асцит
INRGSS является предоперационной системой стадирования, в рамках нее выделяют четыре стадии - L1, L2, M и MS (таб. 3).
Таблица 3. Международная система стадирования при нейробластоме, основанная на анализе факторов риска при визуализации (INRGSS) [11].
стадия
описание
L1
Локализованная опухоль, без вовлечения жизненноважных структур, определяемые, как факторы риска, выявляемые при визуализации, ограниченная одним компартментом тела
L2
Локо-регионарная опухоль с наличием одного или более факторов риска выявляемых при визуализации
M
Наличие отдаленных метастазов (исключая MS стадию)
MS
Метастатическое заболевание у детей младше 18 мес. с наличием метастазов в кожу, кости и/или костный мозг
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина заболевания обусловлена анатомической локализацией первичной опухоли, степенью инвазии и компрессии прилежащих органов и тканей, а также анатомической локализацией метастазов. Клиническая картина может варьировать от бессимптомного течения - являться случайно находкой при проведении диспансерного обследования или обследования по поводу другого заболевания, или проявляться пальпируемыми опухолевыми массами в брюшной полости, увеличением в размерах живота, болевым синдром, кашлем и одышкой при локализации опухоли в средостении. При инвазии опухоли в спинномозговой канал, сдавлении периферических нервных стволов возможно развитие неврологической симптоматики в виде парезов, параличей, нарушение функции тазовых органов, отека конечностей, болевого синдрома и других проявлений [2].
При метастатических формах клиническая картина обусловлена локализацией метастазов, варьируя от случайной находки при выполнении обследования, до развития анемического синдрома при поражение костного мозга, болевого синдрома при поражении костей, нарушение зрения при наличии метастазов в орбите, вплоть до полной слепоты. Массивное метастатическое поражение печени может проявляться в виде увеличения в размерах живота, гепатомегалии.
Клиническая картина заболевания так же может быть обусловлена наличием и характером паранеопластического синдрома.
НБ является опухолью, которая по сравнению с другими видами ЗНО наиболее часто сопровождается развитием паранеопластических синдромов.
Паранеопластические синдромы при НБ включают следующие состояния: секреторная диарея (первичная и вторичная), синдром опсоклонус-миоклонус (ОМС), запоры, артериальная гипертензия и другие.
Так, у ряда пациентов продукция вазоинтестинального пептида приводит к длительной, некупируемой диареи, сопровождающейся электролитными нарушениями.
НБ рассматривается как высоко иммуногенная опухоль, при которой описано развитие иммуноопосредованных паранеопластических синдромов. Одним из наиболее частых паранеопластических синдромов при НБ является ОМС - опсоклонус - миоклонус синдром. Частота ОМС при НБ достигает 2 - 4%. ОМС, известный под синонимами "синдром танцующих глаз" и "энцефалопатия Кинсбурна", характеризуется тремя основными проявлениями: опсоклонус (совместные быстрые, нерегулярные и неравномерные по амплитуде движения глазных яблок, обычно в горизонтальной плоскости, наиболее выраженные в начале фиксации взгляда), миоклонус (подергивания неэпилептического характера, которые захватывают туловище, конечности и лицо) и атаксия. Эти симптомы часто ассоциированы с поведенческими нарушениями (например, раздражительностью, плаксивостью, вплоть до проявлений аутоагрессии и агрессии по отношению к родителям), нарушением сна и когнитивными расстройствами [13].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагнозы нейробластомы и ганглионейробластомы устанавливаются на основании международных критериев (Brodeur G.M., 1993), которые включают [12]:
- патолого-анатомическое исследование ткани первичной опухоли/метастаза/трепанобиоптата костного мозга с применением иммуногистохимических методов;
ИЛИ
- патолого-анатомическое исследование ткани первичной опухоли/метастаза/трепанобиоптата костного мозга (с или без выполнения иммуногистохимического исследования) и повышения уровня метаболитов катехоламинов в сыворотке крови и/или моче);
ИЛИ
- выявление клеток нейробластомы в костном мозге, полученном при костномозговых пункциях и/или трепанобиопсии, и повышение уровня метаболитов катехоламинов в сыворотке крови и/или моче.
Комментарии:
В случае получения гистологического диагноза отличного от НБ, ГНБ или ГН пациент должен получать терапию в соответствии клиническими рекомендациями по данному заболеванию.
1. Диагностика и ведение пациентов в возрасте до 6 месяцев в хорошем клиническом состоянии с локализованным образованием надпочечников.
Новорожденные или дети раннего возраста имеют хороший прогноз даже без специфического лечения. Образования надпочечников, выявляемые при выполнении стандартного УЗИ, у ребенка первого года жизни с хорошим клиническим статусом могут являться как нейробластомой, так и кровоизлиянием. Так же для нейробластомы характерен феномен спонтанной регрессии. В данном случае первичное обследование может состоять из двух этапов [13, 14].
- Рекомендуется: проведение обследования при выявление объемного образования локализованного в области надпочечников у детей первых 6 месяцев жизни в объеме [14]:
- 1. Обследования, необходимые для всех детей в возрасте до 6 месяцев с подозрением на наличие образования в области надпочечников:
- a. клинический статус - особое внимание нужно уделить кожным покровам, окружности живота, размерам печени при пальпации;
- b. полный анализ крови: электролиты, оценка функции печени (АЛТ, АСТ, ГГТ), почек (креатинин, мочевина, мочевая кислота) и коагулограмма;
- c. опухолевые маркеры: ЛДГ, ферритин, НСЕ, при возможности - уровень метаболитов катехоламинов (ВМК, ГВК) в сыворотке крови и моче;
- d. УЗИ шеи, брюшной полости (с оценкой размеров образования надпочечника и с оценкой размеров и структуры печени для исключения метастатического поражения), таза и головного мозга;
- e. КТ/МРТ ОБП с КУ с описанием IDFR;
- f. При возможности проведение сцинтиграфии с 123-I-МЙБГ.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: В случае наличия у ребенка первых 6-х месяцев жизни локализованного объемного образования надпочечника размерами менее 3 см при солидной структуре образования и менее 5 см при кистозной форме, без компрессии окружающих органов по данным УЗИ ОБП/КТ ОБП с КУ/МРТ ОБПс КУ; отсутствии данных за метастатическое поражение по результатам клинического осмотра и инструментальных методов исследования (УЗИ/КТ/МРТ); L1 стадии по INRGSS; при удовлетворительном соматическом статусе, ребенок может быть оставлен под динамическим наблюдением в течение 12 мес. от выявления образования с регулярной оценкой общего состояния детским онкологом и педиатром и выполнением УЗИ ОБП (не реже 1 раза в 2 недели) и оценке уровня онкомаркеров (НСЕ, ЛДГ) (не реже 1 раза в 2 - 3 мес.), метаболитов катехоламинов мочи (ГВК и ВМК (не реже 1 раза в 2 - 3 мес), КТ ОБП с КУ/МРТ ОБП с КУ (1 раз в 3 мес. или раньше при выявлении отрицательной динамики по УЗИ ОБП и/или появлении клинической симптоматики. Так же показано выполнение КТ ОБП с КУ/МРТ ОБП с КУ через 12 мес. от момента выявления образования надпочечников или ранее при появлении клинической симптоматики и/или повышение уровня онкомаркеров (НСЕ, ферритин, ЛДГ, метаболитов катехоламинов мочи (ГВК и ВМК)) и/или увеличения образования по данным УЗИ ОБП, подозрение на метастатическое распространение, появление образования во втором надпочечнике для определения показаний к хирургическому лечению
При подозрении на билатеральное поражение надпочечников или на метастатическое распространение показано проведение полного обследования, указанного в разделе "Диагностика".
При наличии клинической симптоматики в виде артериальной гипертензии и/или преждевременного полового развития необходимо проводить обследование для исключения других нейроэндокринных опухолей.
Обследования, необходимые при сохранении опухоли в течение 12 мес. динамического наблюдения.
В случае сохранения объемного образования надпочечника у ребенка в течение 12 мес. динамического наблюдения или при появлении отрицательной динамики в более ранние сроки, проводится весь комплекс лабораторных и инструментальных обследований, указанных в разделе "Диагностика" и рассмотрение вопроса о хирургическом удалении.
В случае полной регрессии образования надпочечника необходимо продолжить динамического наблюдение в объеме: УЗИ ОБП, определения уровня онкомаркеров (НСЕ, ЛДГ) не реже 1 раза в год длительностью не менее 3-х лет.
В случае полной регрессии образования надпочечника, но сохранение повышения уровня онкомаркеров, необходимо проведение полного обследования.
Показания к хирургическому лечению:
Размеры образования ![]() 5 см при кистозной форме;
5 см при кистозной форме; ![]() 3 см при солидной структуре (см. максимальный размер образования);
3 см при солидной структуре (см. максимальный размер образования);
L2 стадия по INRGSS;
Увеличение объема опухоли > 50% при проведении динамического наблюдения;
Повышение уровня метаболитов катехоламинов мочи (ГВК и ВМК) > 50%, не снижающееся до базового уровня в течение 12 недель (при возможности их оценки);
Объемное образование, сохраняющееся к 12 мес. наблюдения размером > 2 мл (диаметр 1,6 см) или любые размеры образования в случае повышения уровня метаболитов катехоламинов. Необходим референс контрольной визуализации в национальном/федеральном центре и обсуждение показаний к хирургическому удалению образования надпочечника;
Подозрение на метастатическое распространение.
2.1 Жалобы и анамнез
Клиническая симптоматика при НБ обусловлена анатомической локализацией первичной опухоли и метастазов. Общие симптомы (слабость, снижение аппетита, лихорадка, потливость и другие) наиболее часто выявляются при распространенном характере процесса. При локализации опухоли в забрюшинном пространстве наиболее частые жалобы на увеличение в размерах живота, болевой синдром, нарушение стула (от запоров до развития длительной некупируемой диареи, как проявление паранеопластического синдрома - секреторной диареи). При локализации опухоли в заднем средостении - кашель, одышка. Неврологическая симптоматика в виде парезов и нарушения функции тазовых органов, выявляется при распространении опухоли в канал спинного мозга и развитии эпидуральной компрессии (ЭК).
Необходимо активно расспросить ребенка/родителей пациента о наличие жалоб и времени их появления.
В ряде случаев НБ выявляется при прохождение диспансерного обследования или обследования по поводу другого заболевания (например, острого бронхита).
- Рекомендуется сбор следующей информации всем пациентам при подозрении на НБ для выявления клинической симптоматики характерной для основного заболевания, врожденных и семейных форм [2, 13]:
- акушерский анамнез,
- предшествующие заболевания,
- вакцинация,
- семейные анамнез,
- клинические признаки на момент дебюта заболевания, динамика и терапевтические опции до постановки диагноза НБ
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Рекомендована консультация генетика и/или генетическое тестирование при:
- наличии у пациента отягощенного семейного онкоанамнеза (опухоли у родственников первой линии родства в возрасте младше 45 лет; 2 и более опухоли у родственников второй линии родства в возрасте младше 45 лет; 2 и более злокачественной опухоли у членов семьи в рамках 3 поколения в детском возрасте),
- близкородственного брака,
- наличии у пациента двух ЗНО,
- наличии у пациента врожденных аномалий развития,
- наличии у пациента мультифокальной опухоли (более одной анатомической локализации первичного очага),
- обнаружении потенциально герминального патогенного варианта при проведении генетического анализа на ткани опухоли.
2.2 Физикальное обследование
- Рекомендуется проведение первичного осмотра всем пациентам с подозрением на НБ для оценки общего соматического статуса и распространенности заболевания (выявления отдаленных метастазов), который должен быть проведен до начала химиотерапии и выполнения хирургических вмешательств [2, 13 - 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии:
Первичный осмотр включает:
- антропометрические измерения (вес, рост и площадь поверхности тела) и оценка нутритивного статуса (процентили). Оценка наличия пороков развития и стигм дизэмбриогенеза;
- оценку кожных покровов и слизистых;
- оценку функции сердечно-сосудистой системы;
- оценку функции легочной системы;
- пальпацию живота, измерение окружности живота, оценку размеров печени и селезенки, исключение или подтверждение пальпируемых образований в брюшной полости;
- оценку размеров периферических лимфатических узлов;
- характеристику функции тазовых органов;
- оценку двигательной активности.
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам с подозрением на НБ выполнение общего клинического анализа крови развернутого (дифференцированный подсчет лейкоцитов (лейкоцитарная формула)), гемоглобин, тромбоциты, СОЭ) для выявления изменений, которые могут косвенно указывать на метастатическое поражение костного мозга и проявляются в виде анемии и тромбоцитопении, перед началом терапии, на фоне проведения курсов ПХТ, для контроля за развитием осложнений на фоне проведения специфической терапии, перед хирургическим вмешательством и/или другими терапевтическими опциями [2, 13 - 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с подозрением на НБ выполнение анализа крови биохимического общетерапевтического: лактатдегидрогеназа (ЛДГ), общий билирубин и фракции (прямой и непрямой), аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), общий белок, альбумин, креатинин, мочевина, щелочная фосфатаза (ЩФ), электролиты (Na+, K+, Cl-, Ca++, Mg++, фосфаты), для оценки функции почек и печени, а так же уровня общей опухолевой нагрузки (оценка уровня ЛДГ, мочевой кислоты). Динамика данных показателей так же проводится в процессе терапии пациентов для оценки органной токсичности и ответа на терапию [2, 13 - 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с подозрением на НБ выполнение коагулограммы (ориентировочного исследования системы гемостаза) (особенно для пациентов с 4S стадией заболевания - метастатическим поражением печени) или перед выполнением хирургических вмешательств любой степени сложности для исключения нарушения в свертывание и определение показаний для их коррекции [2, 13 - 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с подозрением на НБ определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактор) с целью подбора инфузионных сред и минимализации трасфузионных осложнений [15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с подозрением на НБ определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антигена вируса гепатита C (Hepatitis C virus), в крови определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови для исключения сопутствующей патологии. При необходимости - молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) для уточнения необходимости проведения антиретровирусной терапии [15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с подозрением на НБ при инициальной диагностике и в процессе проведения специфического лечения проведение оценки скорость клубочковой фильтрации по клиренсу эндогенного креатинина или исследование уровня цистатина С в крови для исключения патологии со стороны почек [15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: данные исследования выполняются так же и перед началом курсов химиотерапии, включающих нефротоксичные лекарственные препараты.
- Рекомендуется пациентам с подозрением на НБ первых 12 месяцев жизни выполнение молекулярно-биологического исследования крови на цитомегаловирус (Cytomegalovirus) для исключения сопутствующей инфекционной патологии [2, 13, 17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с подозрением на НБ выполнение общего анализа мочи для исключения сопутствующей патологии [2, 13, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с подозрением на НБ, которым планируется терапия с включением #ифосфамида**, выполнение оценки тубулярной функции почек, с использованием фракционированной экскреции фосфатов (оценка креатинина и фосфора в моче) для исключения сопутствующей патологии [18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: оценку тубулярной функции целесообразно проводить до начала проведения ПХТ, и в последующем использовать исходные показатели для исключения тубулярных повреждений у пациентов, получающих терапию #ифосфамидом**.
Опухолевые маркеры:
- Рекомендуется пациентам с подозрением на НБ определение уровня ферритина в сыворотке крови для подтверждения/исключения опухолевого процесса и степени распространенности при НБ [2, 13, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: результат зависит от возраста пациента и теста, с помощью которого определяется показатель. Показатели "норма" или "повышение" определяются в соответствии с нормативами лаборатории, в которой проводится измерение.
- Рекомендуется пациентам с подозрением на НБ исследование уровня нейронспецифической енолазы (НСЕ) в сыворотке крови для подтверждения/исключения опухолевого процесса и степени распространенности при НБ [2, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: на уровень НСЕ влияет гемолиз и деградация при комнатной температуре. Поэтому негемолизированная проба крови должна быть исследована в течение 2 - 6 ч в местной лаборатории. Если проба отсылается в другую лабораторию, то необходимо использовать только сыворотку. Результат зависит от возраста пациента и теста, используемого для определения. Показатели "норма" или "повышение" определяются в соответствии с нормативами лаборатории, в которой проводится измерение.
- Рекомендуется пациентам с подозрением на НБ определение уровня метаболитов катехоламинов: ванилилминдальной (ВМК) и гомованилиловой (ГВК) кислот в моче (разовая или суточная) для подтверждения/исключения опухолевого процесса и степени распространенности при НБ [2, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: в случае, если результат нормализуется по концентрации креатинина, нет необходимости в сборе суточной мочи. Показатели "норма" или "повышение" определяются в соответствии с нормативами лаборатории, в которой проводится измерение.
Данное исследование проводится в зависимости от доступности метода. Оценка уровня ГВК и ВМК проводится инициально, в процессе терапии и на этапах катамнестического наблюдения.
2.4 Инструментальные диагностические исследования
- Рекомендуется выполнение аудиологического обследования пациентам с установленным диагнозом НБ, которым планируется проведение химиотерапии с включением ототоксичных препаратов (цисплатин**, #карбоплатин**) для оценки функции слухового анализатора [2, 13, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: желательные сроки проведения аудиологического тестирования:
- Базовое тестирование перед началом лечения.
- После каждого курса ПХТ с использованием цисплатина**. При выявлении нейросенсорной тугоухости, вызванной ототоксическим действием препаратов платины, обсудить возможное изменение схемы лечения.
- Через 4 - 6 недель после завершения лечения (последнего введения цисплатина**, #карбоплатина**).
- Ежегодно после завершения специфической терапии.
Основные методы исследования слуха для выявления тугоухости, вызванной ототоксическим действием лекарственных препаратов:
- Тональная пороговая аудиометрия в стандартном и расширенном диапазоне частот до 1620 кГц (методика определения тональных порогов слуха зависит от возраста и уровня развития ребенка: аудиометрия со зрительным подкреплением от 6 до 24 мес., игровая аудиометрия от 2 до 5 лет или стандартная аудиометрия от 5 лет).
- Регистрация отоакустической эмиссии на частоте продукта искажения в диапазоне частот до 8 - 10 кГц.
- Импедансометрия.
- Регистрация коротколатентных и тоно-специфичных слуховых вызванных потенциалов (например, стационарных слуховых вызванных потенциалов - ASSR) для детей раннего возраста при отсутствии отоакустической эмиссии и невозможности проведения тональной пороговой аудиометрии.
При выявлении тугоухости пациент направляется к врачу сурдологу-оториноларингологу для определения индивидуальной программы наблюдения, лечения, реабилитации. Алгоритм аудиологического исследования представлен в приложении А3.1.
- Рекомендуется выполнение регистрации зрительных вызванных потенциалов коры головного мозга детям первого года жизни на момент постановки диагноза НБ и пациентам любого возраста с подозрением на наличие орбитальных метастазов НБ для оценки функции зрительного анализатора [2, 13, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется выполнение электрокардиографии (ЭКГ) и эхокардиографии (Эхо-КГ) всем пациентам с подозрением на НБ для оценки функции сердечно-сосудистой системы [15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: при наличии пороков развития сердечно-сосудистой системы необходима консультация врача-генетика и врача-детского кардиолога; при наличии изменений по данным Эхо-КГ и ЭКГ - врача-детского кардиолога. Выполнение данных методов обследования показано всем пациентам при установленном диагнозе НБ перед началом курсов химиотерапии с включением кардиотоксичных препаратов (например, доксорубицин**) и в дальнейшем после завершения специфического лечения и при длительном динамическом наблюдении, учитывая потенциальную возможность развития отдаленной кардиотоксичности. При выявлении патологии или появлении клинической симптоматики (одышка, отеки), показана консультация врача-детского кардиолога.
- Рекомендуется выполнение ультразвукового исследования (УЗИ) брюшной полости и других вовлеченных областей (например, область шеи), исключая случаи, при которых анатомические причины не позволяют его выполнить (например, внутригрудная локализация) всем пациентам с подозрением на НБ для оценки состояния различных органов и систем, локализации первичной опухоли и оценки метастатического распространения [2, 13, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии. УЗИ можно использовать для оценки размеров и характера кожных и мягкотканных метастазов. Рутинное УЗИ является основным методом обследованием у всех пациентов. Оно должно включать исследование шеи, брюшной полости, особенно печени (маленькие метастазы могут быть пропущены, если не используется высокочастотный датчик), забрюшинное пространство и головной мозг (если роднички еще открыты). В дальнейшем УЗ исследование выполняется перед каждым курсом химиотерапии и при динамическом наблюдении.
- Рекомендуется выполнение рентгенографии грудной клетки (прямая и боковая проекции) всем пациентам с подозрением на НБ с целью первичной диагностики (выявления образований расположенных в средостении и метастатического поражения легких), а так же для исключения/подтверждения наличия воспалительной инфильтрации легочной ткани [2, 13, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии. В некоторых случаях внутригрудная НБ может быть выявлена с помощью рентгенограммы грудной клетки при наличии респираторных симптомов. Так как УЗИ грудной клетки ограничено из-за заполненных воздухом легких, наблюдение за пациентами с внутригрудной НБ включает в себя стандартную рентгенографию органов грудной клетки, но не УЗИ. Выполнение рентгенографии органов грудной клетки показано так же после катетеризации центральной вены для исключения пневмоторакса и определения места стояния катетера.
- Рекомендуется выполнение спиральной компьютерной томографии (МСКТ) с внутривенным контрастным усилением всем пациентам с подозрением на НБ с целью анатомической верификации первичной опухоли и метастазов, а также пациентам с установленным диагнозом НБ во время лечения (для оценки ответа на проводимую терапию), при планировании оперативного вмешательства, после завершения специфического лечения и в процессе динамического наблюдения [2, 11, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: для оценки распространенности опухолевого процесса инициально рекомендуется выполнять МСКТ органов грудной клетки, брюшной полости и малого таза.
МСКТ шеи и органов грудной клетки выполняется всем пациентам для исключения вторичного поражения легких, внутригрудных лимфатических узлов и мультифокального поражения при НБ.
МСКТ проводится нативно и с внутривенным болюсным фазовым контрастированием в артериальную, венозную и паренхиматозную фазы исследования. Артериальная фаза контрастирования - первые секунды исследования, в момент попадания болюса контраста в аорту. Венозная фаза контрастирования на 60 - 80 секундах от момента введения контрастного препарата. Паренхиматозная фаза контрастирования на 1 мин 50 сек - 2 мин 30 сек от момента введения контрастного препарата.
Особенности проведения томографических исследований у детей - см. раздел 7.2 данных рекомендаций.
- Рекомендуется выполнение магнитно-резонансной (МРТ) томографии с внутривенным контрастированием всем пациентам с подозрением на НБ с целью анатомической верификации первичной опухоли и метастазов, а также пациентам с установленным диагнозом НБ во время лечения (для оценки ответа на проводимую терапию), после завершения специфического лечения и в процессе динамического наблюдения [2, 11, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: МРТ-исследование спинного мозга строго обязательно при первичной диагностике в случае паравертебральной локализации образования и/или при наличие неврологической симптоматики подозрительной в отношение интраканального распространения опухоли и развитии компрессии спинного мозга. Если НБ обнаруживается в паравертебральной области, МРТ требуется для документирования и подтверждения интрафораминального или интраканального распространения, даже если у пациента нет неврологических проявлений. КТ не является приемлемой, так как небольшие интраканальные опухолевые массы могут быть пропущены. При наличии неврологической симптоматики (двигательные нарушения, нарушение чувствительности и функции тазовых органов) выполнение МРТ головного и спинного мозга с контрастным усилением является строго обязательным.
Выполнение МРТ предпочтительно при локализации первичной опухоли в области шеи и малого таза; строго обязательно при наличии данных за метастатические поражение печени.
МРТ может использоваться у детей раннего возраста для проведения дифференциальной диагностики между 4 и 4S стадией НБ (для подтверждения наличия/отсутствия костных/костно-мозговых/ подкожных метастазов).
Для всех пациентов с 4-й стадией заболевания, несмотря на результаты сцинтиграфии с МЙБГ или других радиоизотопных методов исследования, необходимо проведение МРТ головного мозга для подтверждения или исключения интракраниального и интраорбитального поражения;
Выполнение МРТ головного мозга показано при инициальной диагностике пациентов с первичной МЙБГ-негативной НБ или пациентам, которым инициально не может быть выполнена сцинтиграфия с МЙБГ.
МРТ рекомендована при наличии единичного метастаза по данным сцинтиграфии с МЙБГ или других радиоизотопных методов исследования для подтверждения его наличия и топографии.
МРТ не должна заменяться МСКТ в виду следующих причин:
- высокая разрешающая способность;
- лучшее контрастирование мягких тканей;
- лучшее определение интраканального и интрафораминального распространения опухолевого процесса;
- отсутствие лучевого воздействия.
Для детей до 6 лет общая анестезия обязательна при проведении исследования.
Комментарии: Особенности проведения томографических исследований у детей.
1. С целью минимизаций артефактов от дыхательных движений и возможной непроизвольной реакции в момент введения контрастного препарата, детям младшего возраста требуется проведение исследования при анестезиологическом пособии. На МСКТ - ингаляционный наркоз, МРТ - интубационный.
2. МСКТ исследование у пациентов с подозрением на нейрогенную опухоль должно проводиться с внутривенным болюсным контрастированием.
3. При МСКТ исследованиях применяют йодсодержащие контрастные препараты. Перед введением контрастного препарата каждый пациент, законный представитель пациента или опекун должны быть проинформированы о возможных побочных реакциях на йодсодержащий контрастный препарат, и должны подписать информированное согласие на проведение исследования.
4. Доступ осуществляется через периферическую вену (катетер) (диаметр катетера может варьировать) или ЦВК (в зависимости от его типа). Скорость проведения контрастирования следует адаптировать к возрасту пациента и диаметру внутривенного катетера.
5. Доза контрастного препарата рассчитывается индивидуально в зависимости от веса пациента. Доза 1,5 - 2 мл/кг (max = 3 мл/кг); скорость - от 0,5 до 3,5 мл/сек в зависимости от диаметра внутривенного катетера. Наиболее часто скорость введения в интервале от 0,8 до 2,0 мл/сек.
6. По возможности проводят МСКТ сканирование с использованием программного снижения дозовой нагрузки, с последующей реконструкцией. Например, МСКТ - шаг сканирования - 5 мм с последующей реконструкцией по 0,625 мм, скорость вращения трубки 35 мм/оборот, движение стола относительно вращению трубки 1,75:1.
7. Для уменьшения времени проведения исследования рекомендуется использовать минимальное время вращения трубки за счет увеличения скорости движения стола. Напряжение и ток трубки должны быть адаптированы как к возрасту и весу пациента, так и к исследуемой анатомической области. Напряжение трубки обычно устанавливается между 100 до 120 кВ, сила тока от 60 до 85 мА.
8. Рентгенологический протокол описания пациентов с НБ должен включать указание, выявленных факторов риска при визуализации в соответствии с рекомендуемым перечнем.
9. При описании данных МСКТ и МРТ обязательно указывается наличие/отсутствие хирургических факторов риска выявляемых при визуализации (IDFR) для планирования сроков и объема хирургического вмешательства.
10. Все полученные МСКТ и МРТ изображения должны быть записаны и сохранены в международно признанном формате для хранения рентгенологических исследований - Digital Imaging and Communications in Medicine (DICOM).
МРТ проводится в 3-х плоскостях: аксиальной, коронарной и сагиттальной. Все исследования проводятся с гадолиний содержащими контрастными препаратами.
Болюсное контрастное усиление с применением парамагнетика в артериальную фазу в момент введения контрастного препарата, в венозную фазу контрастирования с 50-й сек от момента введения контрастного препарата и в отсроченную фазу контрастирования на 2 - 3 минуту от введения контрастного препарата.
МРТ брюшной полости проводится с синхронизацией программ сканирования с дыханием пациента, с толщиной среза 3 - 4 мм
- T1ВИ нативные и Т1ВИ постконтрастные в аксиальной и корональной проекциях
- Т2ВИ в аксиальной, коронарной и сагиттальной проекциях
- Т2FatSat/STIR (программы с подавлением жира) в аксиальной, и коронарной проекциях
- Диффузионно-взвешенные изображения (ДВИ) с построением ADC карт.
МРТ позвоночника и паравертебральных тканей при нейрогенных опухолях паравертебральной локализации, проводятся с толщиной среза 3 мм.
- T1ВИ и Т1ВИ FatSat/STIR до и после контрастирования в аксиальной, корональной и сагиттальной проекциях
- Т2ВИ и Т2FatSat/STIR (программы с подавлением жира) в аксиальной, корональной и сагиттальной проекциях
- Аксиальные ДВИ на область интереса
При исследовании МРТ ЦНС желательна возможность одновременной установки головной и спинальной катушек для проведения исследования всей ЦНС без перекладки пациента.
При исследовании головного мозга:
- До введения парамагнетика: Т1-SE/TSE, T2-SE/TSE, Т2FatSat/STIR, T2-FLAIR, ДВИ (c b-фактором 1000 мс) все в аксиальной проекции. Т1ВИ в сагиттальной и Т2FatSat/STIR в корональной.
- После введения контраста Т1-SE/TSE во всех плоскостях или Т13D.
При исследовании спинного мозга:
- До введения парамагнетика: Т1-SE/TSE, T2-SE/TSE, T2-STIR в сагиттальных проекциях. Толщиной среза 3 мм, межсрезовый промежуток 0,5 мм.
- После введения парамагнетика: Т1-SE/TSE сагиттальные (совпадающие по геометрии с нативными), при необходимости Т1-SE/TSE аксиальные на зону интереса.
- Рекомендуется всем пациентам с подозрением на НБ (выявленное по данным МСКТ/МРТ образование и/или при наличие атипичных клеток в костном мозге) или с верифицированной НБ проведение сцинтиграфии с 123I-метайодбензилгуанидином (МИ БГ) в режиме все тело, включая протоколы однофотонной эмиссионной компьютерной томографии (ОФЭКТ) или ОФЭКТ совмещенную с компьютерной томографией (ОФЭКТ/КТ) в следующих клинических ситуациях [19]:
- для постановки диагноза (при подозрении на НБ);
- при первичной оценке распространенности опухолевого процесса;
- при оценке эффективности проводимой терапии;
- до и после выполнения хирургического лечения;
- при динамическим наблюдении, после окончания терапии с целью ранней диагностики рецидива;
- перед планированием других терапевтических опций.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии.
Подготовка пациента и меры предосторожности перед проведением сцинтиграфии с 123I-метайодбензилгуанидином (МИ БГ):
- Отмена (прекращение) применения лекарственных препаратов
Особенно это касается пациентов с опухолями, секретирующими метаболиты катехоламинов, у которых может отмечаться повышение артериального давления, и которые вследствие этого могут принимать ряд препаратов, например 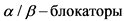 , оказывающих влияние на поглощение МЙБГ. У детей список таких лекарственных препаратов ограничен. Однако о приеме некоторых средств необходимо заблаговременно (до введения радиофармпрепарата) сообщить лечащему врачу и врачу-радиологу. К таким лекарственным средствам относятся: бронходилататоры, содержащие фенотерол, сальбутамол, тербуталин, назальные капли и спреи, содержащие ксилометазолин,
, оказывающих влияние на поглощение МЙБГ. У детей список таких лекарственных препаратов ограничен. Однако о приеме некоторых средств необходимо заблаговременно (до введения радиофармпрепарата) сообщить лечащему врачу и врачу-радиологу. К таким лекарственным средствам относятся: бронходилататоры, содержащие фенотерол, сальбутамол, тербуталин, назальные капли и спреи, содержащие ксилометазолин, 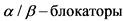 , блокаторы кальциевых каналов, нейролептики, трициклические антидепрессанты. На время проведения исследования необходимо либо прервать прием этих препаратов, либо перенести исследование на другое время. Необходимость прекращения приема некоторых лекарственных препаратов или их замена перед сцинтиграфией с МЙБГ должна быть оценена лечащим врачом.
, блокаторы кальциевых каналов, нейролептики, трициклические антидепрессанты. На время проведения исследования необходимо либо прервать прием этих препаратов, либо перенести исследование на другое время. Необходимость прекращения приема некоторых лекарственных препаратов или их замена перед сцинтиграфией с МЙБГ должна быть оценена лечащим врачом.
- Блокада щитовидной железы
Блокада щитовидной железы выполняется с помощью раствора Люголя или йодид калия (таблетки) с целью ее насыщения для предотвращения накопления радиоактивного йода.
А) Блокада щитовидной железы с использованием 1% #Йод+[Калия йодид+Глицерол] 1 капля на кг массы тела ребенка в сутки, но не более 40 капель в сутки, суточную дозу следует разделить на три приема. Прием препарата начинают за два дня до введения МЙБГ и продолжают в день введения.
Б) Блокада щитовидной железы с использованием #йодид калия** (таблетки): Новорожденные - 16 мг только в день до введения радиоактивного йода; 1 месяц - 3 года - 32 мг за день до введения радиоактивного йода и далее в течение 2 дней (суммарно 3 дня); 3 - 13 лет - 65 мг за день до введения радиоактивного йода и далее в течение 2 дней (суммарно 3 дня); старше 13 лет - 130 мг за день до введения радиоактивного йода и далее в течение 2 дней (суммарно 3 дня) [88, 89].
- Для лучшего выделения радиофармпрепарата пациенту рекомендуют принимать большое количество жидкости.
- Необходимо исключить продукты питания, содержащие ванилин и катехоламиноподобные вещества (шоколад и сыр с голубой плесенью), т.к. они могут влиять на накопление МЙБГ.
В связи с длительностью исследования пациенты детского возраста нуждаются в особой подготовке к исследованию, опытный персонал проводит беседу с родителями и пациентом, оказывает необходимую помощь, отвечает на вопросы. Пациентам до 6-ти лет исследование, как правило, проводят с использованием анестезиологического пособия. Дети, которые проходят исследование без анестезии, могут принимать воду и пищу без ограничений по времени. Пациентам, которым планируется исследование под наркозом необходимо исключить прием любой пищи и жидкости за 6 часов перед исследованием, исключение составляет грудное вскармливание (в таком случае голод 4 часа).
Перед инъекцией МЙБГ
Врач-радиолог должен учитывать все клинические данные пациента и принять во внимание любые данные, которые могут помочь в интерпретации сцинтиграфических изображений:
- анамнез подозреваемой первичной или остаточной опухоли;
- применение препаратов, влияющих на биораспределение МЙБГ
- отсутствие или наличие симптомов
- результаты лабораторных исследований (уровень метаболитов катехоламинов, нейронспецифической енолазы, кальцитонина и т.д.)
- результаты других методов визуализации (МСКТ, МРТ, УЗИ, рентгенография)
- предшествующее лечение (хирургическое, химиотерапия, лучевая терапия)
Расчет дозы 123I-МЙБГ, введение, время проведения исследования.
Минимальная вводимая доза 37 МБк, максимальная доза не должна превышать 370 МБк. Для расчета дозы у детей можно использовать калькулятор на сайте Европейской ассоциации ядерной медицины www.eanm.org/publications/dosage-calculator. В среднем, для детей, 123I-МЙБГ вводят из расчета 4,2 - 5,2 МБк/кг, но не меньше 37 МБк. Препарат, растворенный в соответствии с инструкцией производителя, вводят внутривенно медленно, как правило, в периферическую вену. При наличии центрального венозного катетера (ЦВК), особенно у маленьких детей, препарат вводят через ЦВК соблюдая правила асептики и скорости введения (медленно, в течение 5-ти минут). После введения 123I-МЙБГ - ЦВК промывают введением 10 - 20 мл физиологического раствора.
Побочные эффекты
Побочные эффекты (тахикардия, бледность, рвота, боль в животе) связаны с фармакологическими эффектами молекулы, а не с аллергией, и при правильном медленном внутривенном введении МЙБГ встречаются очень редко.
Выбор коллиматора
Для проведения сцинтиграфии с 123I-МЙБГ можно использовать как низкоэнергетический коллиматор, так и среднеэнергетический (3% фотонов 123I обладают энергией более 400 кэВ, что может влиять на четкость изображения и его качество при использовании низкоэнергетического коллиматора). Рекомендации производителя, качество получаемых изображений и опыт позволяет сделать правильный выбор.
Протокол исследования (сбор данных)
Исследование выполняют через 24 часа после введения 123I-МЙБГ. Стандартная визуализация включает планарное сканирование всего тела в передней и задней проекции, головы в боковых проекциях (для лучшей визуализации костей свода черепа). Планарные изображения в режиме "всего тела" получают при скорости движения стола 5 см в минуту на матрицу 256 x 256. Прицельная проекция головы в боковых проекциях: сбор данных в течение 5 - 10 минут. В случаях получения сомнительных результатов и отсутствия необходимого технического оснащения для выполнения протокола ОФЭКТ/КТ выполняют отсроченное сканирование через 48 часов после введения. На сцинтиграммах, полученных через 48 часов после введения МЙБГ, повышается накопление МЙБГ в опухоли по сравнению с физиологическим накоплением. Кроме того, через 48 часов происходит вымывание и перераспредениение физиологического захвата (в кишечнике, мочевых путях, при ателектазах), что также облегчает возможность дифференцировать их с патологическим накоплением в образованиях. Однако, необходимо отметить, что при отсроченных исследованиях повышается шум изображения и как следствие ухудшается качество изображения.
В настоящее время, благодаря имеющейся возможности выполнять протокол ОФЭКТ/КТ - исследования через 48 часов практически не выполняются. Выполнение ОФЭКТ/КТ протокола исключает необходимость еще одного визита пациента в отделение, на повторное исследование через 48 часов, как и необходимость в дополнительном анестезиологическом пособии для детей, исследование у которых может быть выполнено только под наркозом [20].
Выполнение ОФЭКТ и/или ОФЭКТ/КТ протокола, после получения планарного изображения в режиме все тело, в большинстве случаях является не только очень важным, но необходимым так как позволяет существенно улучшить качество и диагностическую значимость сцинтиграфии с МЙБГ. Сбор данных ОФЭКТ выполняют при следующих условиях: 3 градуса, 25 - 35 сек, матрица 128 x 128. Протокол КТ выбирают, учитывая массу тел (кг) ребенка.
Показания к выполнению протокола ОФЭКТ и/или ОФЭКТ/КТ достаточно широки и имеют большую клиническую значимость при опухолях малых размеров, гетерогенных опухолях больших размеров, не накапливающих МЙБГ в режиме "все тело", при расположении опухоли за органами, в которых происходит физиологическое накопление препарата, для дифференциальной диагностики накопления в мягких тканях и костной ткани, для дифференциальной диагностики физиологического и патологического накопления. Только в случаях диффузного метастатического поражения можно отказаться от проведения ОФЭКТ/КТ.
Безусловно выполнение протокола ОФЭКТ/КТ делает исследование более длительным (дополнительно требуется около 30 - 40 минут только на исследование одной области интереса). Однако, получаемая выгода, от выполнения данного протокола исследования, значительно превосходит недостаток, связанный с увеличением времени исследования.
Нормальное распределение МЙБГ
МЙБГ в норме накапливается в слюнных железах, слизистой оболочке полости носа, миокарде, печени, кишечнике и мочевом пузыре. В некоторых случаях возможно накопление МЙБГ в слезных железах, в небольшом количестве накапливается в селезенке. Возможно физиологическое повышенное накопление МЙБГ в буром жире, это связано с симпатической иннервацией бурой жировой ткани. Физиологическое накопление МЙБГ на планарных изображениях визуализируется как симметрично повышенное накопление преимущественно в проекции шеи и надключичных областей. При неправильной подготовке определяется накопление в щитовидной железе. У пациентов после адреналэктомии часто происходит накопление МЙБГ в оставшемся надпочечнике, интенсивность накопления может различаться, по-видимому, это отражает степень физиологической компенсации функций оставшейся тканью надпочечника. Как правило, на планарных сцинтиграммах накопление МЙБГ в надпочечнике выглядит как очаговое накопление в паравертебральной зоне, наиболее заметное на заднем детекторе. На ОФЭКТ/КТ совмещенных изображениях, накопление локализуется над областью почек (в месте ожидаемой локализации надпочечников) и связано с неизмененными надпочечниками Y- или V-образной формы. Важно удостовериться в том, что очаговое накопление МЙБГ происходит именно в неизмененном надпочечнике, а не в возможно прилежащих мягкотканых или узловых патологических образованиях.
Ложноположительные результаты
Накопление МЙБГ, имитирующее патологическое возможно при некоторых доброкачественных состояниях, таких как: ателектазы, пневмония, фокальная нодулярная гиперплазия печени, радиационное повреждение печени, большая добавочная селезенка, фокальный пиелонефрит, сосудистые мальформации. Большинство из этих ложноположительных результатов могут быть исключены при помощи ОФЭКТ/КТ.
Все сомнительные единичные очаги, выявляемые по данным сцинтиграфии 123I-МЙБГ, должны быть подтверждены другими дополнительным методами визуализации. В случае отсутствия убедительных данных за метастатическое поражение, но влияющих на определение стадии и группы риска должны повергаться биопсии с последующим гистологическим исследованием.
- Рекомендовано пациентам с подозрением на НБ, которым не может быть выполнена сцинтиграфия с МЙБГ, выполнение сцинтиграфии костей скелета с 99mTc-фосфатными комплексами в режиме все тело для поиска костных метастазов в следующих случаях [2, 11, 15]:
- при невозможности проведения сцинтиграфии с 123I-МЙБГ;
- при всех 123I-МЙБГ-негативных НБ вне зависимости от стадии для поиска костных метастазов при отсутствии возможности выполнения ПЭТ/КТ с 18F-ФДГ;
- при сомнительных результатах сцинтиграфии 123I-МЙБГ для дифференциальной диагностики между костномозговым поражением и поражением костной ткани;
- в случае, если инициальная сцинтиграфия с 123I-МЙБГ не выполнялась, а исследование, проведенное на фоне начала специального лечения, показало отсутствие патологических очагов накопления;
- в случае отсутствия очагов патологического накопления при проведении сцинтиграфии с 123I-МЙБГ, выполненной после этапа хирургического лечения, при отсутствии возможности выполнения ПЭТ/КТ с 18F-ФДГ.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии. Чувствительность и специфичность данного метода достаточно низкая. Исследование проводится по показаниям и только в отсутствие возможности выполнения сцинтиграфии с МЙБГ или ПЭТ/КТ с 18F-ФДГ.
Для проведения исследования специальная подготовка не требуется. Детям, которым планируется исследование под наркозом, необходимо исключить прием любой пищи и жидкости за 6 часов до исследования, исключение составляет грудное вскармливание (в таком случае голод 4 часа).
Исследование выполняют через 2,5 - 3 часа после в/в введения радиофармпрепарата через центральный или периферический катетер в дозе ![]() 7 МБк/кг. Для расчета дозы можно использовать калькулятор доз на сайте Европейской Общества Ядерной Медицины www.eanm.org/publications/dosage-calculator.
7 МБк/кг. Для расчета дозы можно использовать калькулятор доз на сайте Европейской Общества Ядерной Медицины www.eanm.org/publications/dosage-calculator.
Значимых побочных эффектов на введения радиофармпрепарата отмечено не было.
Параметры сбора данных для получения планарных изображений в режиме все тело: детекторы в положении "anterior and posterior" с коллиматорами для низких энергий с высоким разрешением; энергетический пик изотопа 140 keV; ширина энергетического окна 10%; скорость движения стола 8 см/мин. Статическое изображение головы в боковых проекциях получают путем сбора гамма-квантов в течение 5 мин на матрицу 256 x 256. Протокол ОФЭКТ выполняют только по указанию врача радиолога после просмотра планарных изображений: угол вращения детекторов 6° время сбора 20 секунд, на матрицу 128 x 128. Для получения совмещенных ОФЭКТ/КТ изображений выполняют низкодозовое КТ (для анатомической локализации и коррекции на аттенуацию) с учетом массы тела пациента (кг).
Физиологическая гиперфиксация радиофармпрепарата в зонах роста костей скелета не позволяет достоверно определить метастатическое поражение в этих областях.
Все сомнительные единичные очаги, выявляемые по данным сцинтиграфии костей скелета с 99mTc-фосфатными комплексами, должны быть подтверждены другими дополнительным методами визуализации. В случае отсутствия убедительных данных за метастатическое поражение, но влияющих на определение стадии и группы риска должны повергаться биопсии с последующим гистологическим исследованием.
- Рекомендуется выполнение ПЭТ/КТ с 18F-ФДГ в режиме все тело у пациентов с гистологически верифицированной НБ по следующим показаниям [19, 21]:
- оценка распространенности процесса у пациентов с первичной МЙБГ-негативной НБ;
- при наличии сомнительных/противоречивых результатов сцинтиграфии с 123I-МЙБГ и результатов КТ/МРТ;
- оценка распространенности процесса у 123I-МЙБГ негативных пациентов, исследование которым выполнялось после удаления первичного образования.
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: Исследование выполняется строго натощак (до исследования исключить прием пищи минимум за 6 часов до назначенного времени). Пациентам, которым исследование будет выполняться без наркоза, разрешается пить чистую питьевую воду (не сладкую и не газированную). Пациентам, у которых проведение исследования планируется с наркозом, исключить прием пищи и жидкости за 6 часов до исследования.
На исследование прийти в теплой, удобной одежде без молний, металлических заклепок или пуговиц и т.д.
За сутки до исследования исключить физические нагрузки и употребление легко усваиваемых (быстрых) углеводов.
Радиофармпрепарат (18F-ФДГ) вводится в/в через центральный или периферический катетер в дозе 5,2 МБк/кг. При этом, минимальная вводимая доза должна быть не менее 75 МБк, а максимальная не более 400 МБк. Для расчета дозы у детей можно использовать калькулятор на сайте Европейской ассоциации ядерной медицины (www.eanm.org/publications/dosage-calculator/). Вводимая доза может быть уменьшена при сохраненном времени сканирования при выполнении исследования на современном оборудовании (смотри рекомендации производителя и рекомендации сайта www.eanm.org/publications/dosage-calculator/). Исследование выполняют приблизительно через 60 минут после в/в введения радиофармпрепарата в режиме "все тело" скорость сбора данных 3 мин / кровать (в зависимости от характеристик ПЭТ/КТ сканера и вводимой дозы скорость сбора данных может быть изменена как в сторону уменьшения, так и увеличения). Протокол КТ выбирают, учитывая массу тела (кг) ребенка.
Значимых побочных эффектов на введения радиофармпрепарата не отмечено.
Для минимизации количества ложно-положительных и ложно-отрицательных результатов инициальное исследование необходимо выполнять до начала лечения пациента. Направление на исследование должно сопровождаться максимально подробной выпиской, включающие даты и протоколы хирургических вмешательств, различных инструментальных исследований (заключения-протоколы визуализации и запись на внешние накопители - диски) и с указанием диагностированных инфекционных очагов (при их наличии).
Все сомнительные единичные очаги, выявляемые по данным ПЭТ/КТ с ФДГ, должны быть подтверждены другими дополнительным методами визуализации. В случае отсутствия убедительных данных за метастатическое поражение, но влияющих на определение стадии и группы риска должны повергаться биопсии с последующим гистологическим исследованием.
- Рекомендуется в качестве альтернативы сцинтиграфии с 123I-МЙБГ (при наличии такой возможности) рассмотреть возможность выполнения ПЭТ/КТ с радиофармацевтическими лекарственными препаратами, обладающими определенной специфичностью [22, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: так, 18F-DOPA является прямым предшественником дофамина и по механизму своего накопления сходен с метаболизмом катехоламинов, поэтому ПЭТ с 18F-DOPA может стать хорошей альтернативой сцинтиграфии с 123I-МЙБГ для пациентов с нейробластомой.
Высокая экспрессия соматостатиновых рецепторов на клетках нейроэндокринных опухолей, включая и клетки нейробластомы, дает возможность применять методы ядерной медицины с использованием 68Ga, связанного с молекулой аналога соматостатина (DOTA-TOC, DOTA-NOC, DOTA-TATE) [24, 25].
Еще один РФЛП для ПЭТ/КТ у детей с нейробластомой, который в настоящее время демонстрирует хорошую диагностическую значимость и широко изучается, является метафторбензилгуанидин, связанный с 18F (18F-mFBG) [26]
Указанные выше радиофармацевтические лекарственные препараты для ПЭТ/КТ могут использоваться в качестве альтернативы сцинтиграфии с 123I-МЙБГ, у детей с нейробластомой, при инициальном обследовании (первичное стадирование), для оценки ответа на лечение и выявления рецидива заболевания.
2.5 Иные диагностические исследования
- Рекомендуется всем пациентам с подозрением на НБ получение цитологического препарата костного мозга путем пункции из 4-х точек и цитологическое исследование мазка костного мозга (миелограмма), детям старше 12 мес. дополнительно осуществляется - получение гистологического препарата костного мозга (трепанобиопсия) из 2-х точек, патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов для выявления/исключения наличия атипичных клеток и определения стадии заболевания [2, 11, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: поражение костного мозга при НБ является очаговым. В связи с этим пункция костного мозга из одной точки не является приемлемой. Требуется выполнение костномозговых пункций как минимум из 4 различных точек. Дополнительно детям старше 12 мес. должна быть выполнена трепанобиопсия из 2-х точек. Целесообразно в случае выполнения пункции костного мозга приготавливать по 10 стекол из каждой точки. Таким образом, при выполнении пункции костного мозга из 4 точек общее число стекол составит 40. Трепанобиопсия не проводится детям первого года жизни.
Дополнительно оценка поражения костного мозга по данным миелограммы и трепанобиопсии проводится на этапах терапии и при динамическом наблюдение в случае подозрения на прогрессию заболевания.
- Рекомендуется всем пациентам с подозрением на НБ, у которых при проведении хирургического удаления образования или биопсии/трепанообиопсии опухоли был получен биопсийный материал, выполнение патолого-анатомического исследования биопсийного (операционного) материала [2, 11, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: после проведения комплексного обследования в рамках ранее описанного алгоритма все пациенты рассматриваются как кандидаты на выполнение инициального хирургического вмешательства, объем которого определяется после совместного обсуждения врачом - детским онкологом, врачом детским хирургом, врачом ультразвуковой диагностики и врачом-рентгенологом. При проведении предоперационного планирования оценивается топография первичнои опухоли и ее взаимосвязь с жизненно важными структурами (магистральными сосудами, паренхиматозными органами и т.д.), определяются факторы хирургического риска по данным визуализации - IDRF.
Методом выбора доступа для проведения биопсии опухоли является "открытый" доступ (лапаротомия, торакотомия) и малоинвазивный доступ (лапароскопия, лапаротомия). Данные методы позволяют получить достаточное количество материала для проведения гистологического и цитогенетического исследований [27, 28].
Пациенты с локализованной опухолью до 7 см в забрюшинной области и до 9 см в заднем средостении при отсутствии факторов хирургического риска, а именно при отсутствии тотального вовлечения магистральной артерии в опухоль и сохранении просвета магистральной вены могут быть претендентами на малоинвазивное хирургическое лечение. Полная резекция показана только в том случае, если предполагаемыи риск развития послеоперационных осложнении является низким. Операция не должна носить калечащии характер (например, нефрэктомия). Если предполагаемыи риск осложнении является высоким, то допустимо проведение частичнои резекции опухоли или только биопсии. См. таже раздел 7.4.
Биопсия метастазов.
В ряде случаев возможно проведение биопсии метастатических очагов. Например, биопсия подкожных метастазов, печени при 4S стадии НБ, биопсия метастатически пораженных отдаленных лимфатических узлов и т.д.
Патолого-анатомическое исследование является основным методом окончательной верификации диагноза у пациентов с НБ. В заключении должен быть указан вариант нейрогенной опухоли по Международной гистологической классификацией нейрогенных опухолей (International Neuroblastoma Pathology Classification) [29].
Гистология опухоли и молекулярно-генетическое исследование являются критическими для стратификации пациентов с локализованными формами нейробластомы, при 4S стадии и при 4-й стадии у детей первого года жизни. Поэтому биопсия опухоли всегда требуется при локализованных формах заболевания.
В случае 4-й стадии заболевания статус MYCN и хромосомы 1р могут быть оценены в костном мозге при условии, если поражение опухолевыми клетками превышает 60%. Определение других параметров (например, опухоль-ассоциированных антигенов) невозможно при использовании проб костного мозга. Поэтому открытая биопсия для получения опухолевой ткани рекомендуется даже пациентам с 4-й стадией заболевания.
Детский онколог должен контролировать сбор опухолевого материала. Тесное сотрудничество между детским онкологом и патологоанатомом является предпосылкой для получения и отправки достаточного объема опухолевой ткани. Обработка и разделение опухолевой ткани должно быть выполнено патологом в региональной лаборатории. Ткань опухоли должна быть доставлена из операционной в лабораторию патоморфологии незамедлительно и обработана в течении 30 мин. При наличии возможности криоконсервации образца ткани (наличие жидкого азота для шоковой заморозки и низкотемпературного хранилища с температурой хранения образцов не выше -80 C°) врач-патологоанатом может разделить образец на фрагмент (фрагменты), необходимые для диагностики и фрагмент ткани для криоконсервации с целью последующего молекулярно-генетического исследования. Патолог решает, какую часть опухоли можно заморозить без ущерба для диагностики. Если возможно, он должен собрать материал как минимум из 2 макроскопически различных областей (если они присутствуют). Ткань, направленная на криоконсервацию должна быть разделена на фрагменты не превосходящие по массе 50 мг или по линейным размерам 3 x 3 x 3 мм. По одному фрагменту ткани помещается в криопробирку (пробирка объемом 1,5 - 2 мл с резьбовой крышкой с резиновым уплотнением), которая должна быть промаркирована (с указанием паспортных данных пациента, даты и времени криоконсервации, а также этапа взятия биоматериала (первичная диагностика, операция "второго просмотра", биопсия при верификации рецидива) и незамедлительно погружена в жидкий азот (объемом 200 - 500 мл). После полного испарения жидкого азота пробирка перемещается в морозильную камеру (температура не выше -80 C°). Не допускается криоконсервация ткани в морозильной камере бытового холодильника!
Отпечатки опухоли должны быть выполнены до помещения материала в формалин. В дополнение периферическая кровь должна быть собрана для выполнения молекулярного анализа.
Оставшаяся после криоконсервации ткань или вся ткань опухоли, если криоконсервация невозможна, фиксируется в буферном 4% формалине для гистологического исследования. Множественные блоки из макроскопически разных областей опухоли, особенно опухолевые узлы, должны быть собраны. Участки некрозов и регрессирующая опухолевая ткань должны быть собраны в соответствии с отношением их объема к объему всей опухоли, что позволит правильно установить степень регрессии.
Патолог в локальной патоморфологической лаборатории должен классифицировать опухоль в соответствии Международной гистологической классификацией нейрогенных опухолей (International Neuroblastoma Pathology Classification), включая оценку индекса митоз-кариорексис. Оценены должны быть также степень регрессии и дифференцировки и вовлеченность краев резекции. В зависимости от степени дифференцировки, индекса митоз-кариорексис и возраста пациента опухоли делятся на благоприятный и неблагоприятный типы.
После химиотерапии опухоль должна быть классифицирована в соответствии с упомянутой схемой с указанием в протоколе гистологического исследования,
- Рекомендуется всем пациентам с гистологически подтвержденным диагнозом НБ - молекулярно-генетическое исследование на определение амплификации гена MYCN и делеции/дисбаланса 1р в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH) для определения группы риска При невозможности выполнения инициальной биопсии опухоли или метастаза и при тотальной инфильтрации костного мозга опухолевыми клетками (>60%), исследование может быть выполнено на препаратах костного мозга с последующем подтверждением на ткани опухоли при выполнение отсроченного хирургического лечения [2, 11, 15, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: оценка молекулярно-генетических маркеров является обязательным диагностическим тестом у пациентов с НБ.
Для терапевтической стратификации статусы онкогена MYCN и дистальной части хромосомы 1p (1p36) целесообразно оценивать с использованием следующих методик следующих методик: флуоресцентной in situ гибридизации (FISH) и полимеразной цепной реакции (ПЦР).
Критерии статуса MYCN, 1p по данным FISH
Амплификация гена MYCN определяется при 4-кратном увеличении и более числа копий гена MYCN в сравнении с числом хромосом 2 (контрольный регион для определения количества хромосом 2 - центромера хромосомы 2).
Понятие "гейн MYCN" (Gain MYCN - наличие дополнительных копий) определяется при соотношении числа копий гена MYCN к контрольному региону хромосомы 2 от 1,5 до 4.
Делеция региона 1p определяется при наличии одного сигнала от соответствующего региона 1p36 в 33% исследуемых ядер и более. Имбаланс по региону 1p определялся при преобладании сигналов от контрольного региона 1(q25) над количеством сигналов от региона 1(p36).
Критерии статуса MYCN, 1p по данным ПЦР
Для оценки статуса MYCN проводится количественная ПЦР в режиме реального времени с детекцией фрагментов гена MYCN и референсного гена (например, POLR2D или NAGK). Количество копий гена MYCN рассчитывается по формуле:
Где N - количество копий гена MYCN, CqMYCN - величина порогового цикла ПЦР для гена MYCN, CqРГ - величина порогового цикла ПЦР для референсного гена. Величина ![]() 2 свидетельствует о нормальном количестве копий (равном 2); 3 - 9 - увеличение количества копий, не достигающее порога амплификации (gain). Может наблюдаться при три- и тетраплоидном наборе хромосом, для уточнения необходимо исследование методом FISH;
2 свидетельствует о нормальном количестве копий (равном 2); 3 - 9 - увеличение количества копий, не достигающее порога амплификации (gain). Может наблюдаться при три- и тетраплоидном наборе хромосом, для уточнения необходимо исследование методом FISH; ![]() 10 - амплификация гена MYCN.
10 - амплификация гена MYCN.
Определение статуса 1p проводится методом стандартной ПЦР с детекцией микросателлитных повторов в области короткого плеча хромосомы 1 (D1S2697, D1S436, D1S214, D1S2663, D1S80, D1S76). Необходим параллельный анализ ткани опухоли и конституционального материала (ДНК из лейкоцитов периферической крови или клеток буккального эпителия). В случае обнаружения двух ПЦР-продуктов для каждого локуса в опухолевом и конституциональном материале определяется гетерозиготное (нормальное) состояние короткого плеча хромосомы 1. Если выявляется по одному ПЦР-продукту - гомозиготное состояние, анализ по данному локусу неинформативен. В случае выявления одного ПЦР-продукта при анализе ДНК из ткани опухоли и двух продуктов при исследовании конституциональной ДНК - потеря гетерогиготности, сопровождающая делецию 1p.
Наиболее часто делеция затрагивает дистально расположенные локусы: D1S436, D1S80, D1S76).
Метод мультиплексной лигазно-зависимой амплификации зондов (MLPA)
Определение числа копий гена MYCN, короткого плеча хромосомы 1, а также других клинически-значимых хромосомных регионов и генов (ALK, 11q) может быть выполнено методом мультиплексной лигазно-зависимой амплификации зондов (MLPA) с использованием наборов SALSA MLPA P251, P252, P253. Анализ данных осуществляется в программном обеспечении Coffalyser.NET. Величина нормализованного соотношения сигналов от соответствующего локуса < 0,75 интерпретируется как делеция, 0,75 - 1,25 - нормальное число копий, 1,25 - 3,00 - увеличение числа копий, > 3,00 - амплификация.
Для пациентов группы высокого риска, а также при развитии рецидива, прогрессии и рефрактерного течения заболевания целесообразно проведения молекулярно-генетического исследования для поиска мишеней для молекулярно-направленной терапии. К ним, в первую очередь, относятся активирующие миссенс-мутации в тирозинкиназном домене ALK (p.F1174L, p.F1245V/C, p.R1275Q), которые могут быть выявлены методами аллель-специфической ПЦР или секвенирования по Сэнгеру. Отсутствие мутаций в "горячих точках" не исключает наличия других активирующих вариантов в гене ALK или редких потенциально таргетируемых аберраций (мутации в генах BRAF, PDGFRA и других). В связи с этим, при наличии технической возможности, рекомендуется проведение высокопроизводительного секвенирования ДНК, выделенной из ткани опухоли. Редким предиктивным маркером потенциальной эффективности ингибиторов ALK является амплификация соответствующего гена, которая может быть выявлена с помощью FISH или MLPA [30].
- Рекомендуется при возможности пациентам с нейробластомой группы высокого риска проведение углубленного молекулярно-генетического исследования для поиска мишений для молекулярно-направленной терапии [90, 91].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется использовать мультидиспиплинарный подход к диагностике и ведению пациентов с НБ на этапах лечения с привлечением на консультацию следующих специалистов для исключения сопутствующей патологии, выбора тактики ведения для обсуждения и разработки ранних подходов к реабилитации [2, 13, 14]:
- врач-детский онколог (врач-гематолог);
- врач-неонатолог (для детей первых месяцев жизни)
- врач-невролог;
- врач-офтальмолог;
- врач-детский хирург;
- врач-генетик;
- врач-нейрохирург (при наличии неврологической симптоматики);
- врач-анестезиолог-реаниматолог и иных врачей-специалистов.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Терапия пациентов с НБ осуществляется в зависимости от стадии заболевания и группы риска [13]. Данные рекомендации разработаны на основе протокола NB-2004 [13].
Перед началом любого вида терапии врач берет информированное добровольное согласие от пациента старше 15 лет (или от родителей/законных представителей пациента для пациентов младше 15 лет) в письменном виде.
Пациенту (родителям/законным представителям) следует объяснить: информацию о диагнозе в доступной форме, объеме предстоящего лечения, о необходимости проведения химиотерапии, прогнозе без проведения соответствующей терапии, прогноз при проведении адекватнои терапии, возможность развития рефрактерного заболевания, основных механизмах действия химиопрепаратов (в том числе ранние и отдаленные побочные эффекты), необходимости соблюдения режима ухода за пациентом, основные правила диеты, необходимость катетеризации центральнои вены, необходимость трансфузии препаратов крови, риске развития возможных осложнениях трансфузии.
- Рекомендуется всем пациентам с подтвержденным диагнозом НБ перед началом проведения химиотерапии или другого вида специфического лечения катетеризация подключичной вены [31, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: необходимо отметить, что в ряде исследований выявлено повышение риска возникновения инфекционных осложнений у пациентов с центральным венозным катетером, в связи с чем необходим контроль, своевременные профилактика и контроль возможных катетер-ассоциированных осложнений [33 - 35].
- Рекомендуется относить пациентов с подтвержденным диагнозом НБ к группе наблюдения (низкого риска) при их соответствии следующим критериям [13]:
- Стадия 1, возраст 0 - 18 лет, отсутствие амплификации гена MYCN
- Стадия 2, возраст 0 - 18 лет, отсутствие амплификации гена MYCN, отсутствие аберраций 1p (del1p, imb1p)
- Стадия 3, возраст 0 - 2 года, отсутствие амплификации гена MYCN, отсутствие аберраций 1p (del1p, imb1p)
- Стадия 4S, возраст < 1 года, отсутствие амплификации гена MYCN
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: оценка молекулярно-генетических маркеров является обязательным диагностическим тестом у пациентов
- Рекомендуется относить пациентов с подтвержденным диагнозом НБ к группе промежуточного риска при их соответствии следующим критериям [13, 29]:
- Стадия 2/3, возраст 0 - 18 лет, отсутствие амплификации гена MYCN, наличие аберраций 1p (del1p, imb1p)
- Стадия 3, возраст 2 - 18 года, отсутствие амплификации гена MYCN
- Стадия 4, возраст < 1 года, отсутствие амплификации гена MYCN
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется относить пациентов с подтвержденным диагнозом НБ к группе высокого риска при их соответствии следующим критериям [13, 29]:
- Стадия 4, возраст 1 - 18 лет
- Амплификация гена MYCN независимо от стадии заболевания и возраста
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: пациенты с 1 стадией по системе стадирования INSS и L1 стадией по системе стадирования INRGSS и при наличие амплификации гена MYCN могут быть стратифицированы в группу промежуточного риска (с отказом от проведения высокодозной химиотерапии и ауто-ТГСК, GD2-иммунотерапии) в случае проведения всего комплекса диагностического обследования (включая обязательное выполнение сцинтиграфии с 123-IМЙБГ или иных радиоизотопных методов исследования (см. выше) перед проведением хирургического вмешательства. Тактика ведения этих больных должна быть согласована с национальным/федеральным специализированным центром [36].
Обязательным является наличие подробного протокола операции, подтверждающего макроскопически полное удаление опухоли и послеоперационной визуализации (МСКТ/МРТ), свидетельствующей об отсутствии остаточной опухоли.
Пациенты с 4 стадией заболевания по системе стадирования INSS или М стадией по системе стадирования INRGSS в возрасте от 12 до 18 мес. при отсутствии амплификации гена MYCN и других сегментарных аномалий, подтвержденных методом MLPА, могут быть стратифицированы в группу промежуточного риска (с отказом от проведения высокодозной химиотерапии и ауто-ТГСК и GD2-иммунотерапии). Тактика ведения этих больных должна быть согласована с национальным/федеральным специализированным центром [37].
1. Лечение пациентов группы наблюдения (низкого риска)
Инициальный объем терапии пациентов, стратифицированных в группу наблюдения, определяется в зависимости от распространенности опухолевого процесса (локальные формы заболевания или стадия 4S) и наличия жизнеугрожающих симптомов (ЖУС) на момент постановки диагноза.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы наблюдения после проведения комплексного обследования выполнение хирургического вмешательства, объем которого определяется индивидуально врачебным консилиумом, включающим детских онкологов, хирургов и специалистов по визуализации [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: при проведении предоперационного планирования оценивается топография первичной опухоли и ее взаимосвязь с жизненно важными структурами (магистральными сосудами, паренхиматозными органами и т.д.) - факторы риска при визуализации (IDRF). Полная резекция показана только в том случае, если предполагаемый риск развития послеоперационных осложнений является низким (как правило, пациенты без IDRF). Операция не должна носить калечащий характер (например, нефрэктомия). Если предполагаемый риск осложнений за счет наличия IDRF является высоким, то допустимо проведение частичной резекции опухоли или только биопсии.
- Не рекомендуется проведение полихимиотерапии после оперативного вмешательства пациентам с нейробластомой группы наблюдения без инициальных жизнеугрожающих симптомов [13, 38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: в группе пациентов с 1 - 3-й стадиями заболевания без инициальных ЖУС проведение адъювантной ПХТ не показано независимо от объема выполненной операции и размеров остаточной опухоли. Всем пациентам данной группы проводится динамическое наблюдение (схема представлена в соответствующем разделе). Объем и сроки выполнения обследований различаются у пациентов с 1 - 2-й стадиями без макроскопической опухоли и пациентов со 2 - 3-й стадиями при наличии макроскопически остаточной опухоли. В случае наличия остаточной опухоли регулярное наблюдение проводится до 2-летнего возраста (при возрасте на момент диагностики менее 1 года) или 12 месяцев после инициальной операции (при возрасте на момент диагностики 1 год и более). При констатации полного регресса опухоли продолжается диспансерное наблюдение в рамках рекомендаций для пациентов, достигших полного ответа. В случае сохранения остаточной опухоли обсуждается возможность проведения хирургического вмешательства в объеме ее удаления.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы наблюдения при наличии инициально (за исключением пациентов, у которых ЖУС были купированы хирургическим вмешательством) или при появлении в процессе динамического наблюдения ЖУС после оперативного вмешательства проведение полихимиотерапии по схеме N 4 (см. приложение А3.2) [13, 38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: в случае наличия ЖУС при инициальной диагностике, выявления локальной прогрессии остаточной опухоли и/или появления ЖУС в процессе динамического наблюдения, показано проведение ПХТ по схеме N 4, включающей винкристин**, доксорубицин** и циклофосфамид** (см. приложение А3.2).
Критерии для начала курса ПХТ:
- лейкоциты > 2000/мкл;
- лимфоциты > 1000/мкл;
- тромбоциты > 50000/мкл;
- отсутствие признаков инфекции.
Оценка ответа на терапию проводится после каждого курса лечения (оценка ответа включает проведение визуализационных методов исследования - МСКТ и МРТ). Проведение ПХТ завершается, как только отмечается купирование ЖУС и стабилизация опухолевого процесса. В случае сохранения ЖУС или дальнейшего прогрессирования опухолевого процесса продолжается проведение ПХТ по схеме N 4. Максимальное число курсов терапии составляет 4. В случае отсутствия контроля над опухолевым процессом после проведения 4 курсов по схеме N 4 пациент переводится на более интенсивную программу терапии, изначально разработанную для пациентов группы промежуточного риска (курсы N 5, N 6 - см. приложение А3.2). Необходимо подчеркнуть, что до перевода пациента на более интенсивную терапию рекомендовано выполнение повторной биопсии или удаление опухоли с повторной оценкой молекулярно-генетических маркеров, а также степени выраженности лекарственного патоморфоза и дифференцировки опухолевых клеток.
К ЖУС относят следующие состояния, обусловленные локальным ростом первичной опухоли (при стадиях 1 - 3) или органомегалией за счет метастатического поражения (например, метастатическое поражение печени при стадии 4S стадии):
- тяжелое общее состояние;
- тяжелые нарушения питания, ведущие к снижению разового объема кормления и/или потере веса;
- дыхательная недостаточность, определенная по потребности в дотации кислорода (или проведение ИВЛ) для поддержания уровня рО2 в артериальной крови выше 60 мм рт ст или уровня сатурации кислорода при пульсоксиметрии выше 90% или элиминации CO2, превышающей 60 мм рт ст;
- сердечно-сосудистая недостаточность, определяемая как артериальная гипотензия или гипертензия; тахикардия / брадикардия в соответствии с возрастными нормами артериального давления и ЧСС;
- печеночная недостаточность, определяемая как III степень токсичности по билирубину, фибриногену или тромбиновому времени в соответствии с критериями токсичности Национального института рака США (National Cancer Institute Common Toxicity Criteria);
- почечная недостаточность, определяемая по нарушению выделения мочевины или креатинина, вновь развившийся гидроуретер или гидронефроз или ухудшение имевшегося гидронефроза;
- интраканальное распространение опухоли с развитием симптомов эпидуральной компрессии или интраканальное распространение, документированное по МРТ независимо от наличия симптомов в зависимости от уровня инвазии в позвоночный канал и степени компрессии спинного мозга;
- недостаточность других органов или систем.
После проведения комплексного обследования в рамках ранее описанного алгоритма все пациенты рассматриваются как кандидаты на выполнение инициального хирургического вмешательства, объем которого определяется после совместного обсуждения детскими онкологами, хирургами, врачами ультразвуковой диагностики и врачами-рентгенологами.
После проведения инициального хирургического вмешательства и выполнения гистологического исследования операционного материала окончательно верифицируется стадия заболевания по системе INSS и повторно оценивается наличие ЖУС.
В группе пациентов с 1 - 3-й стадиями заболевания с наличием инициальных ЖУС показания к проведению адъювантной ПХТ после инициального хирургического вмешательства оцениваются в зависимости от эффективности операции в контроле над ЖУС. В случае, если ЖУС были купированы хирургическим вмешательством, проведение ПХТ не показано. При сохранении ЖУС проводится адъювантная ПХТ по схеме N 4 с оценкой ответа и степени выраженности ЖУС после каждого курса. Терапия завершается, как только отмечается купирование ЖУС.
1.1. Ведение пациентов группы наблюдения (низкого риска) при развитии абдоминального компартмент-синдрома
- Рекомендуется проведение специального лечения у пациентов с НБ и развитием абдоминального компартмент-синдрома, как ЖУС, обусловленного большими размерами первичной опухоли и/или метастатическим поражением печени [61, 221, 222, 223].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с установленным диагнозом нейробластомы 4S стадии в случае развития абдоминального компартмент-синдрома, как ЖУС, обусловленного большими размерами первичной опухоли и/или метастатическим поражением печени, проведение оценки органной дисфункции и выбор терапевтических подходов для своевременной курации ЖУС и предотвращения летального исхода (см. раздел 7.3 данных рекомендаций) [41 - 43].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии. Если НБ осложняется значительным повышением внутрибрюшного давления развивается специфическое состояние, получившее название абдоминальный компартмент-синдром (АКС). Данное состояние характеризуется развитием деструкции тканей из-за компрессионной ишемии и микроциркуляторных нарушений и формированием на этом фоне синдрома полиорганной недостаточности (СПОН). Как правило, АКС сопровождается развитием ЖУС, при которых ребенку показана госпитализация в отделение реанимации и интенсивной терапии.
Показания для перевода пациентов в ОРИТ являются:
1. вторичная дыхательная недостаточность (потребность в дотации высоких потоков кислорода, снижение сатурации до 90% и ниже; одышка, тахипноэ, "высокая цена" дыхания, гиперкапния/гипоксемия по КЩС).
2. сердечно-сосудистая недостаточность (артериальная гипотензия/гипертензия, тахикардия/брадикардия, нарушения сердечного ритма).
3. острая почечная недостаточность (снижение темпов диуреза менее 1 мл/кг/час, отсутствие ответа на инфузионную терапию и петлевые диуретики, высокие цифры азотемии, клинические признаки или высокий риск развития синдрома острого лизиса опухоли).
4. развитие инфекционных осложнений (сепсис, септический шок).
5. неврологические нарушения (снижение уровня сознания, судорожный синдром).
6. выраженные водно-электролитные нарушения с неуспешностью их коррекции на предыдущих этапах оказания помощи, необходимостью тщательного и частого мониторинга лабораторных показателей).
Внутрибрюшное давление (ВБД)
Под внутрибрюшным давлением (ВБД) понимают установившееся давление в брюшной полости. Нормальный уровень ВБД составляет 5 - 7 мм рт. ст. и существенно не зависит от пола, массы тела ребенка и даже проводимой искусственной вентиляции легких.
Уровень внутрибрюшного давления напрямую зависит от объема полых органов, наличие асцита, крови и других пространство-занимающих повреждений/образований (в том числе, например, и нейробластома забрюшинного пространства).
Методы измерения ВБД подразделяются на прямые (при проведении лапароскопии) и непрямые. В настоящее время "золотым стандартом" непрямого измерения является использование мочевого пузыря. Эластичная и хорошо растяжимая стенка мочевого пузыря выполняет функцию пассивной мембраны и точно передает давление брюшной полости.
Противопоказанием к данному методу является повреждение мочевого пузыря или его сдавление гематомой или опухолью. При наличии противопоказаний возможно измерение внутрижелудочного давления.
Методика измерения интравезикального давления: в асептических условиях проводится постановка урологического (мочевого) катетера и опорожнение мочевого пузыря. В положении пациента горизонтально на спине в мочевой катетер вводят теплый стерильный физиологический раствор из расчета 1 мл/кг массы тела, не более 25 мл.
Измерения проводят в течение 2 минут. За нулевую отметку принимают среднеподмышечную линию.
Показания конвертируют в mmHg из расчета 1 ммHg = 1.36 ст H2О (результат измерения следует разделить на 1.36).
Важные замечания: если пациент находится на ИВЛ, следует учитывать, что уровень PEEP увеличивает уровень ВБД. Для более точного результата следует вычитать уровень положительного давления в конце выдоха (из расчета 1 mBar = 1 см вод. ст.).
Внутрибрюшная гипертензия (ВБГ) - это постоянно или периодически (но не кратковременно) регистрируемое патологическое повышение ВБД более 12 мм рт. ст. Различают несколько степеней ВБГ согласно критериям Всемирного общества по изучению синдрома интраабдоминальной гипертензии (World Society of the Abdominal Compartment Syndrome (WSACS), (по Б.Р. Гельфанд, 2008) [61]:
- I степень - 12 - 15 мм рт. ст.
- II степень - 16 - 20 мм рт. ст.
- III степень - 21 - 25 мм рт. ст.
- IV степень - > 25 мм рт. ст.
У детей применяются нормы WSACS с педиатрическими поправками:
- I степень - 10 - 12 мм рт. ст.
- II степень - 13 - 15 мм рт. ст.
- III степень - 16 - 18 мм рт. ст.
- IV степень - > 18 мм рт. ст.
Абдоминальный компартмент синдром (АКС) - это устойчивое повышение внутрибрюшного давления более 20 мм рт. ст. с развитием органной недостаточности или дисфункции органа/системы органов. Немаловажную роль играет скорость нарастания объема брюшной полости. Тяжесть течения и вероятность развития ПОН увеличиваются пропорционально скорости нарастания внутрибрюшной гипертензии, так как при быстром увеличении объема компенсаторные возможности растяжимости передней брюшной стенки не успевают развиться.
На тканевом уровне АКС проявляется снижением доставки кислорода, гипоксией, ишемией, развитием анаэробного пути метаболизма с выделением повреждающих эндотелий биологически активных веществ, медиаторов неспецифического воспаления и вазоактивных субстанций (интерлейкины, серотонин, гистамин и др), увеличивается проницаемость эндотелия, отек интерстиция, что усугубляет ишемию и трансмембранный транспорт. В конечном итоге это реализуется в развитие СПОН.
В диагностике АКС играют роль следующие клинические симптомы:
- наличие болевого синдрома;
- увеличения живота в объеме, его напряжение;
- наличие одышки, признаки дыхательной недостаточности, прогрессирующей, несмотря даже на проведение ИВЛ;
- снижение темпа мочеотделения;
- уменьшение сердечного выброса, сердечных объемов и индексов;
- нарушение пассажа по ЖКТ.
Оценка дыхательной функции, показания для перевода на ИВЛ.
При АКС высокое стояние диафрагмы вызывает повышение внутригрудного давления (от 25% до 80% от общего уровня внутрибрюшного давления). Происходит снижение функциональной остаточной емкости легких, динамического комплайнса легочной ткани, увеличение мертвого пространства и шунта крови, коллабирование альвеол базальных отделов, развитие участков ателектазирования. Развивается дыхательная недостаточность (увеличение PaCO2, снижение PaO2, развитие респираторного ацидоза).
Для объективизации поражения легочной ткани, дифференциальной диагностики ДН целесообразно проведение обзорной рентгенограммы и компьютерной томографии органов грудной клетки, ультразвуковое исследование плевральных полостей.
Показаниями к переводу пациента на ИВЛ могут служить следующие клинические симптомы:
- отсутствие дыхания (апноэ) или патологические типы дыхания;
- высокая "цена" дыхания;
- Гиперкапния (раСО2) > 55 - 60 мм рт ст; и/или гипоксемия (раО2) < 55 - 50 мм рт ст;
- Декомпенсированныи респираторныи алкалоз (раСО2 < 25 мм рт ст)
- Снижение pvО2 < 30 мм рт ст
- Снижение SvО2 менее 60% (Коэффициент экстракции кислорода > 40%)
- неэффективность оксигенации (снижение сатурации < 90%, несмотря на дотацию кислорода);
- развитие паренхиматозной дыхательной недостаточности (рентгенологическая картина РДС);
- Снижение респираторного индекса крови (PaО2/FiО2) < 200 или (SpO2/FiO2) < 200;
- Нарушения гемодинамики (жизнеопасные нарушения ритма, гипотензия и тд);
- Рефрактерный септический шок с высокой потребностью в симпатомиметической терапии.
При проведении ИВЛ рекомендуется избегать превышения Pinsp > 35 - 38 мм рт ст из-за риска баротравмы. При высоких цифрах Pinsp (более 30 mBar) целесообразно использование миоплегии недеполирезующими миорелаксантами (рокуроний из расчета 0.4 - 0.6 мг/кг/час).
В некоторых случаях предпочтительнее вентилировать пациента в режимах с контролем по объему (Volume Control), определяя дыхательный объема из расчета 5 - 7 мл/кг с целью уменьшения среднего давления в дыхательных путях (Pсред).
Через 30 - 60 мин после начала ИВЛ рекомендовано проведение исследования КОС крови для корректировки параметров ИВЛ. В последующем КОС контролируют каждые 6 часов.
Оценка сердечно-сосудистой системы, кардиотоническая поддержка.
Механическое сдавление нижней полой и портальных вен, активация ренин-ангиотензин-альдостероновой системы ведет к снижению венозного возврата и увеличению общего периферического сопротивления сосудов.
Одновременно происходит рост внутригрудного давления, что приводит к компрессии сердца, магистральных сосудов, снижению конечного диастолического объема.
Присутствующая в большинстве случаев гиповолемия и использование высоких цифр PEEP при ИВЛ могут дополнительно усугублять явления сердечно-сосудистой недостаточности.
Клинически признаки сердечно-сосудистой недостаточности могут включать:
- артериальная гипотензия, не коррегируемая с помощью волемической нагрузки;
- артериальная гипертензия;
- изменение частоты сердечных сокращений (тахикардия, брадикардия);
- жизнеугрожающие нарушения сердечного ритма.
Табл. 7.3.1. Нормальные цифры Среднего артериального давления (МАР), мм рт. ст.:
< 1 мес
1 - 11 мес
12 - 23 мес
2 - 5 лет
5 - 12 лет
12 - 18 лет
> 18 лет
![]() 46
46
![]() 55
55
![]() 60
60
![]() 62
62
![]() 65
65
![]() 67
67
![]() 70
70
Для оценки динамических параметров работы сердечно-сосудистой системы рекомендовано использовать измерение сердечного выброса, сердечных объемов и индексов:
- В норме СИ 3,5 - 5,5 л/(мин · м) 2
- ударный индекс: 30 - 60 мл/м2
- индекс ОПСС (общего периферического сосудистого сопротивления): 800 - 1600 дин · с · см-5/м2
При наличии признаков гиповолемии, целесообразно проведение гидратации из расчета 20 мл/кг.
Необходимо отметить, что измерение уровня ЦВД не является достоверным диагностическим критерием, так как при ВБГ происходит сдавление центральных вен. Достоверным инструментальным методом определения гиповолемии при ВБГ является измерение остаточного диастолического объема ЛЖ (эхокардиография).
При неэффективности болюсной волемической нагрузки, сохраняющейся гипотензии, при наличии признаков гипоперфузии тканей (мраморность кожных покровов, нарастание уровня лактатемии) пациенту показано проведение симпатомиметической терапии. При выборе препарата может быть полезным определение уровня сердечного индекса (СИ).
- Сердечный индекс 3,5 - 4 л/мин/м2 - допамин** (5 - 20 мкг/кг/мин) или норэпинефрин (0,1 - 0,3 мкгр/кг/мин, желательно не более 1 мкгр/кг/мин),
- Сердечный индекс < 3,5 л/мин/м2 - добутамин** (5 - 20 мкг/кг/мин, возможно в комбинации с норэпинефрином** или допамином**).
Одним из наиболее точных предикторов висцеральной перфузии является уровень абдоминального перфузионного давления (АПД), который определяется уровнями систолического и внубрибрюшного давлений: АПД = САД - ВБД.
Доказано, что АПД < 60 мм рт ст напрямую коррелирует с выживаемостью пациентов с интраабдоминальной гипертензией. Главной целью кардиотонической поддержки при ВБГ является поддержание уровня абдоминального перфузионного давления > 60 мм рт ст.
Оценка почечной недостаточности, показания к проведению почечной заместительной терапии.
При АКС страдает как артериальный, так и венозный почечный кровоток. Это обусловлено прямой компрессией сосудов почек (почечные вены более подвержены компрессии), а также высвобождением вазоактивных медиаторов, таких как эндотелин и/или гормоны ренин-ангиотензин-альдостероновой системы. Снижение венозного возврата приводит к уменьшению секреции натрийуретического пептида предсердий. Вышеуказанные факторы приводят к снижению скорости клубочковой фильтрации.
Суточный темп мочеотделения уменьшается более чем в 2 раза при цифрах ВБД до 15 мм рт ст (которое сохраняется в течение 24 часов). Повышение ВБД до уровня 20 - 30 мм рт ст приводит к анурии, без ответа на диуретические препараты.
При снижении темпа диуреза менее 0,5 мл/кг/час, развитии отечного синдрома пациенту показана терапия петлевыми диуретиками (фуросемид**) из расчета 5 - 10 мг/кг/сут.
При подозрении на развитие острого повреждения почек необходимо тщательное мониторирование уровней калия (2 - 4 раза в сутки), азотемии (креатинин, мочевина, цистатин С; не реже 2 раз/сут), контроль водного баланса, желательно с регулярным взвешиванием пациента.
Табл. 7.3.2 Нормальные цифры уровня креатинина в зависимости от возраста, mg/dL:
< 1 мес
1 - 11 мес
12 - 23 мес
2 - 5 лет
5 - 12 лет
12 - 18 лет
> 18 лет
< 0,8
< 0,3
< 0,4
< 0,6
< 0,7
< 1,0
< 1,2
Основные показания к началу проведения почечно-заместительной терапии включают:
- Объемная перегрузка жидкостью с клинически значимым отеком органов и тканей (особенно отек легких) или положительный баланс жидкости > 20 - 40 мл/кг/24 ч;
- Необструктивная олигурия/анурия (снижение темпов диуреза менее 0.5 мл/кг/час), резистентная к диуретической терапии (лазикс 10 мг/кг/сут) в течение 6 - 12 часов;
- Гиперкалиемия (К+ > 6 - 6,5 ммоль/л) или стремительный рост гиперкалиемии;
- Выраженная диснатриемия (115 < Na > 160 ммоль/л);
- Азотемия (креатинин 250 - 300 мкм/л, или прирост на 40 - 44 и более мкмоль/л/сут; мочевина > 25 - 30 ммоль/л).
Оценка центральной нервной системы, уровня сознания.
На фоне повышенного внутригрудного давления у пациентов нарушается отток крови по яремным венам, что может реализоваться внутричерепной гипертензией.
При снижении уровня сознания по Шкале ком Глазго до уровня сопора и ниже показан перевод пациента на ИВЛ.
Оценка печеночной недостаточности и функции гемостаза.
При снижении синтетической функции печени пациенту показано проведение коррекции:
- при снижении уровня альбумина < 20 г/л показана экстренная коррекция (желательно 20% альбумином для снижения риска перегрузки объемом) из расчета 1 г/кг в течение 1 часа. При уровне альбумина 20 - 29 г/л показана коррекция продленной инфузией из расчета 1 - 2 - 2.5 г/кг/сут.
- при снижении уровня фибриногена менее 1 г/л, признаков или высокого риска развития геморрагического синдрома показана заместительная терапия СЗП (15 - 20 мл/кг) или криопреципитатом (1 доза (40 мл) на 10 кг).
- при наличии геморрагического синдрома целесообразно поддерживать уровень тромбоцитов не менее 50 тыс/л. Заместительную терапию проводят тромбоконцентратом (из расчета 1 доза на 10 кг).
Оценка функции желудочно-кишечного тракта.
Для декомпрессии желудка пациентам показана установка желудочного зонда.
Клинические исследования продемонстрировали связь между АКС и развитием в слизистой стенке кишечника гипоперфузии и ишемии с транслокацией кишечной флоры и токсинов в портальный кровоток и лимфоузлы. В связи с этим отмечается высокий риск и высокая частота инфекционных осложнений различной локализации и делает целесообразным назначение противоинфекционной терапии (антибиотики широкого спектра, фунгицидная терапия).
Для выявления возможных возбудителей инфекционного процесса, деэскалации противоинфекционной терапии необходим тщательный микробиологический мониторинг с выполнением посевов бронхо-альвеолярного аспирата (1 - 2 раза в неделю), посевы крови (1 - 2 раза в неделю, дополнительно по клиническим показаниям; посевы асцитической/плевральной жидкости, желудочного, кишечного отделяемого, других секретов организма. Для исключения участия вирусной флоры целесообразно проведение ПЦР-исследований (прежде всего БАЛ, крови) с решением вопроса о целесообразности проведения противовирусной терапии.
1.2. Ведение пациентов группы наблюдения (низкого риска) при развитии эпидуральной компрессии.
- Рекомендовано проведение специального лечения (ПХТ, нефрохирургическая операция) или динамического наблюдения пациентам с НБ и эпидуральной компрессией в зависимости от наличия/отсутствия клинической симптоматики, длительности ее проявления, возраста больного, уровня инвазии опухоли в позвоночный канал и спепени компрессии спинного мозга [62, 225, 226, 227].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Коментарии. В 10 - 15% НБ по типу песочных часов распространяется в межпозвонковые отверстия и/или позвоночный канал на одном или нескольких уровнях. По отношению к спинному мозгу опухолевый узел всегда располагается экстрадурально. У 5 - 7% больных выявляется симптоматика сдавления спинного мозга разной степени выраженности (эпидуральная компрессия - ЭК) - боль в спине, парапарез или параплегия, нарушение функции тазовых органов и расстройства чувствительности. В ряде случаев это является первыми жалобами больного. Симптомы могут возникнуть остро, но чаще развиваются постепенно в течение многих недель и даже месяцев. Иногда неврологическая симптоматика выявляется уже при рождении ребенка.
Современный опыт лечения детей с интраканальным распространением опухоли не выявляет преимуществ хирургической декомпрессии спинного мозга перед химиотерапией [62]. Само по себе наличие опухоли в позвоночном канале, верифицированное по МРТ, как бессимптомное, так и с признаками компрессии спинного мозга, еще не является безусловным показанием к изменению тактики терапии, описанной в разделе 3 данных рекомендаций, и к ее незамедлительному хирургическому удалению. Если неврологический статус больного стабильный (причем без существенной разницы - стабильно хороший или стабильно плохой), предпринимать удаление интраканального компонента опухоли не обязательно. Вопрос этот должен обсуждаться с детским онкологом и чаще всего методом выбора может быть химиотерапия. Операция (нейрохирургическая) безусловно показана, если происходит быстрое (в течение нескольких дней, недель) нарастание неврологического дефицита. В этом случае фактор скорости декомпрессии играет важную роль. Операция показана, если известно, что данный вариант опухоли не требует химиотерапии и по протоколу лечение больного только хирургическое. Операция может рассматриваться как первая опция, когда для определения гистологического типа опухоли необходим образец ткани и хирургическое вмешательство все равно должно быть выполнено как альтернатива лапаротомии или торакотомии. Так же нейрохирургическое лечение может быть выполнено в случае ухудшения неврологического статуса после инициации ПХТ или при динамическом наблюдении.
Решение о необходимости нейрохирургического вмешательства принимается на основе общего консилиума с участием врача-детского онколога, врача-нейрохирурга, врача-невролога, врача-рентгенолога.
Решение в пользу операции принимается при отрицательной динамике в неврологическом статусе ребенка. При стабильном неврологическом статусе предпочтительно проведение химиотерапии.
Операция выполняется специалистом по детской нейрохирургии. Положение больного на хирургическом столе - на спине или на боку. Предпочтительно выполнение костно-пластической ламинотомии, а не ламинэктомии, с последующим восстановлением костного блока остистых отростков и задних дужек позвонков. Удаление опухоли происходит с использованием микрохирургической техники в пределах видимых границ опухоли. При угрозе повреждения спинно-мозговых корешков или спинного мозга возможно оставить фрагменты опухоли, чтобы избежать нарушения целостности нервных структур.
1.3. Ведение пациентов группы наблюдения (низкого риска) при развитии прогрессии/рецидива заболевания
В случае выявления локального рецидива у пациентов группы низкого риска после регрессии первичной опухоли, необходимо рассмотреть вопрос о проведении повторной биопсии и дообследования (см. разделы 2.3, 2,4, 2.5). При получение гистологического заключеняе - нейробластома, рассмотреть вопрос об инициации химиотерапии; при гистологическом заключении - ганглионейрома, смешанная ганглионейробластома, рассмотреть вопрос об повторном хирургическом вмешательстве.
В случае непрерывного медленного бессимптомного увеличения остаточного компонента опухоли у пациентов группы наблюдения, может быть рассмотрен вопрос о проведении повторной биопсии и дообследования (см. разделы 2.3, 2,4, 2.5). При гистологическом заключение - нейробластома, рассмотреть вопрос об инициации химиотерапии; при гистологическом заключении - ганглионейрома, смешанная ганглионейробластома, рассмотреть вопрос об повторном хирургическом вмешательстве.
В случае трансформации в 4-ю стадию объем терапии зависит от возраста пациента. Необходимо рассмотреть вопрос о проведении дообследования (см. разделы 2.3, 2,4, 2.5). В случае констатации трансформации в 4-ю стадию у пациентов в возрасте младше 1 года рекомендовано проведение интенсивной ПХТ в рамках рекомендаций для пациентов группы промежуточного риска, у пациентов в возрасте старше 1 года - терапия по протоколу лечения пациентов группы высокого риска.
При прогрессии у пациентов группы наблюдения в рамках 4S стадии тактика ведения определяется в зависимости от клинического статуса и появления/отсутствия ЖУС. При развитии ЖУС показано проведение ПХТ по схеме N 4 (не более 4 курсов).
В группе пациентов с нейробластомой 4S стадии общая концепция лечения соответствует таковой у пациентов с 1 - 3-й стадиями. Основным принципом, положенным в основу концепции лечения, является максимальная деэскалация терапии. Следует отметить, что важным свойством опухоли при нейробластоме 4S стадии является способность к прогрессии с последующим развитием спонтанной регрессии. При этом прогрессия может быть обусловлена как увеличением размеров первичного очага/очагов, так и количества и размеров метастатических очагов, преимущественно в печени, с развитием массивной гепатомегалии. Рост первичной опухоли, увеличение поражения печени или кожных метастазов без клинического ухудшения не требует проведения специального лечения. Показанием к проведению ПХТ по схеме N 4 является развитие клинически значимых ЖУС. Терапия проводится до момента констатации индукции регресса опухоли и купирования ЖУС. Оценка ответа на проводимую терапию осуществляется после каждого курса ПХТ. Максимальное число курсов терапии 4.
- Рекомендуется пациентам с установленным диагнозом нейробластомы 1 - 3, 4S стадий в случае выявления локального рецидива проведении повторной биопсии и дообследования (см. разделы 2.3, 2.4, 2.5). При получение гистологического заключения - нейробластома, рассмотреть вопрос об инициации химиотерапии; при гистологическом заключении - ганглионейрома, смешанная ганглионейробластома, рассмотреть вопрос об повторном хирургическом вмешательстве [13, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с установленным диагнозом нейробластомы 1 - 3, 4S стадий в случае медленного бессимптомного увеличения остаточного компонента опухоли у пациентов группы наблюдения проведение повторной биопсии и дообследования (см. разделы 2.3, 2,4., 2.5). При гистологическом заключение - нейробластома, рассмотреть вопрос об инициации химиотерапии; при гистологическом заключении - ганглионейрома, смешанная ганглионейробластома, рассмотреть вопрос об повторном хирургическом вмешательстве [13, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с установленным диагнозом нейробластомы 1 - 3, 4S стадий при констатации трансформации в 4 стадию в возрасте до 12 мес. показано проведение интенсивной ПХТ в рамках рекомендаций для пациентов группы промежуточного риска [13, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с установленным диагнозом нейробластомы 1 - 3, 4S стадий при констатации трансформации в 4 стадию в возрасте старше 12 мес. проведение интенсивной ПХТ в рамках рекомендаций для пациентов группы высокого риска [13, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с установленным диагнозом нейробластомы 4S стадии при прогрессировании степени тяжести ЖУС за счет массивной гепатомегалии и развития абдоминального компартмент-синдрома проведение дополнительно к основному лечению лучевой терапии на область печени, СОД 4,5 - 6 Гр [40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: проведение лучевой терапии в этой категории пациентов требует особо слаженной работы всего коллектива отделения лучевой терапии, включая выделение места на своевременное проведение топографического и топометрического планирования лучевой терапии. Необходимо предусмотреть освобождения врача для быстрого оконтуривания печени и почек, а также медицинского физика для расчета лечебного плана.
КТ-разметка и последующие сеансы облучения рекомендуется проводить в состоянии естественного сна ребенка. При этом, как правило, общая анестезия не требуется.
Топометрия выполняется с использованием матраса иммобилизационного вакуумного.
Объем опухоли (GTV) соответствует клиническому объему мишени (CTV) и включает всю паренхиму печени. Отступ на PTV составляет 4 - 5 мм. Также требуется оконтуривание почек для снижения на них дозовой нагрузки при расчете плана облучения.
Планируемые РОД 1,5 Гр, СОД 4,5 - 6 Гр за 3 - 4 ежедневные фракции.
Поскольку ситуация требует незамедлительного начала терапии, планирование и начало облучения необходимо проводить в один день. При этом допустимо первый сеанс провести с использованием "простой" методики облучения, например, с двух боковых полей, с выведением из полей облучения почечной паренхимы. Для последующих сеансов нужно подобрать методику более адекватную по степени покрытия мишени, применяя конформную дистанционную лучевую терапию, в том числе IMRT (VMAT).
Опираясь на состояние ребенка, после коллегиального обсуждения допустимы перерывы в терапии на один-два дня для реализации эффекта облучения.
Данная терапевтическая опция не является обязательной и зависит от тяжести состояния ребенка, оснащенности и опыта работы медицинской организации. Определение окончательных показаний требует консультации в федеральном/национальном центре.
1.4. Динамическое наблюдение пациентов группы наблюдения (низкого риска).
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы наблюдения через 3 месяца после оперативного вмешательства или завершения последнего курса химиотерапии независимо от статуса остаточной опухоли пройти обследование для выявления событий (см. раздел 7.6 данных рекомендаций), а также для последующего контроля над заболеванием, в следующем объеме [13, 38]:
- клиническое обследование (см. раздел 2 данных рекомендаций);
- опухолевые маркеры (см. раздел 2 данных рекомендаций);
- МРТ/МСКТ пораженной анатомической области с КУ;
- МЙБГ-сцинтиграфию или ПЭТ/КТ с ФДГ (при инициальном МЙБГ-негативном статусе опухоли) или другие радиоизотопные методы исследования, которые использовались ранее при первичной постановке диагноза (если отмечено накопление до операции) - пациентам группы наблюдения через 3 месяца после операции или завершения химиотерапии.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы наблюдения, получающим терапию по схеме N 4 проходить обследование для контроля симптомов и выявления событий (см. раздел 7.6 данных рекомендаций) в следующем объеме [13, 38]:
- клиническое обследование (см. раздел 2 данных рекомендаций) - перед каждым циклом N 4 или #карбоплатин**/этопозид**;
- опухолевые маркеры (см. раздел 2 данных рекомендаций) - перед каждым циклом N 4;
- УЗИ зон расположения первичной опухоли и метастазов - перед каждым циклом N 4 или #карбоплатин**/этопозид**;
- ЭКГ/ЭхоКГ - перед каждым циклом N 4;
- МРТ/МСКТ пораженной анатомической области с КУ - после каждого курса N 4 или #карбополатин**/этопозид** или ранее, если необходимо;
- 123I-МЙБГ-сцинтиграфию или ПЭТ/КТ с ФДГ или другие радиоизотопные метолы исследования описанные в разделе "диагностика" (в зависимости от того какой метод выполнялся при постановке диагноза, но предпочтение надо отдавать сцинтиграфии с 123I-МЙБГ) - после последнего курса N 4 или #карбоплатин**/этопозид** или ранее, если необходимо;
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: если в процессе наблюдения будет выявлен рецидив или прогрессия, результаты могут быть сопоставлены с послеоперационным статусом.
2. Лечение пациентов группы промежуточного риска
- Рекомендуется пациентам с установленным диагнозом нейробластома группы промежуточного риска после проведения комплексного обследования выполнение хирургического вмешательства, сроки и объем которого определяется индивидуально врачебным консилиумом, включающим детских онкологов, хирургов и специалистов по визуализации, с целью удаления первичного очага опухоли [13, 38, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: при проведении предоперационного планирования оценивается топография опухоли и ее взаимосвязь с окружающими анатомическими структурами (магистральными сосудами, паренхиматозными органами) (факторы риска при визуализации). Полная резекция показана только в том случае, если предполагаемый риск развития послеоперационных осложнений является низким. Операция не должна носить калечащий характер (например, нефрэктомия). Если предполагаемый риск осложнений является высоким, то допустимо проведение только биопсии.
После проведения инициального хирургического вмешательства и выполнения патологоанатомического исследования операционного материала окончательно верифицируется стадия заболевания по системе INSS.
При планировании хирургического лечения обязательным является оценка факторов риска при визуализации (IDRF). Хирургическое вмешательство, направленное на удаление первичной опухоли, как правило, является отсроченным (операция second-look). Проведение предшествующей ПХТ направлено на сокращение размеров первичной опухоли в целях увеличения частоты макроскопически полного ее удаления, уменьшения рисков развития хирургических осложнений и снижения риска интраоперационного разрыва. Отсроченное хирургическое вмешательств рекомендовано выполнять после 4-го, 5-го или 6-го курса индукционной ПХТ. Объем хирургического вмешательства определяется после совместного обсуждения детскими онкологами, хирургами и специалистами по визуализации. При проведении предоперационного планирования оценивается взаимосвязь опухоли с жизненно важными структурами. Риск операции должен быть сбалансирован с пользой от радикального удаления первичной опухоли. Микроскопически радикальное удаление опухоли не требуется. Наличие микроскопически и даже макроскопически остаточной опухоли является приемлемым.
Поскольку выполнение хирургического вмешательства после курса лучевой терапии может быть затруднено развитием постлучевого фиброза, попытка резекции опухоли планируется перед проведением лучевой терапии. Необходимо отметить, что поскольку разрыв опухоли менее вероятен после проведения химиотерапии, нарушение целостности опухоли во время операции second-look является приемлемым и может способствовать полной резекции.
- Рекомендуется пациентам в возрасте 6 месяцев и старше с установленным диагнозом нейробластомы группы промежуточного риска после проведения инициального оперативного вмешательства проведение курсов химиотерапии по схемам N 5 и N 6 в альтернирующем режиме (см. приложение А3.2, приложение Б, рис. Б3). Суммарно предусмотрено 6 курсов индукционной терапии. Следующий курс начинается на 21-й день от первого дня предыдущего курса [13, 38, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: критерии для начала курса ПХТ:
- лейкоциты > 2000/мкл;
- лимфоциты > 1000/мкл;
- тромбоциты > 50000/мкл;
- отсутствие признаков инфекции.
Если эти критерии не были достигнуты, начало курса ПХТ откладывается. Если задержка превышает 7 дней или имеет место течение инфекционного эпизода ![]() III степени тяжести, дозы препаратов в последующем цикле модифицируются.
III степени тяжести, дозы препаратов в последующем цикле модифицируются.
- Рекомендуется пациентам в возрасте младше 6 месяцев с установленным диагнозом нейробластомы группы промежуточного риска после инициального оперативного вмешательства проведение курсов химиотерапии по схеме N 4 до исполнения возраста 6 месяцев, после исполнения 6 месяцев - продолжение терапии по схемам N 5 и N 6 до 6 циклов интенсивной химиотерапии (см. приложение А3.2). Суммарно предусмотрено 6 курсов индукционной терапии. Следующий курс начинается на 21-й день от первого дня предыдущего курса [13, 38, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: кумулятивная доза доксорубицина** не должна превышать 180 мг/м2 в целях уменьшения риска отсроченной кардиотоксичности.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы промежуточного риска без признаков прогрессирования после завершения индукционной терапии, включающей 6 курсов интенсивной терапии и отсроченное оперативное вмешательство, рекомендовано проведение 4 курсов химиотерапии по схеме N 7 (см. приложение А3.2). Следующий курс начинается на 21-й день от первого дня предыдущего курса [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется только для пациентов 4 стадией заболевания по системе стадирования INSS или M стадией по системе стадирования INRGSS в возрасте от 12 до 18 мес. при отсутствии амплификации гена MYCN и других сегментарных аномалий, подтвержденных методом MLPА стратифицированным в группу промежуточного риска, и пациентам с 1 стадией по INSS и L1 по INRGSS при наличии амплификации гена MYCN (см. выше систему стадирования) с установленным диагнозом нейробластомы группы промежуточного риска без признаков прогрессирования после завершения 4 курсов терапии по схеме N 7, проведение дифференцировочной терапией #изотретиноином [13, 39, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: проведение дифференцировочной терапии #изотретиноином, которую начинают через 21 день от начала последнего курса схемы N 7. #Изотретиноин назначается в дозе 160 мг/м2 в 2 - 3 приема в течение 14 дней с последующим 14-дневным перерывом, затем начинается следующий цикл. После 6 циклов терапии предусмотрен 3-месячный перерыв с последующим проведением еще 3 курсов терапии #изотретиноином в прежнем режиме. Таким образом, суммарно проводится 9 курсов терапии #изотретиноином [13, 39, 44].
Препарат следует принимать совместно с жирной пищей (молоко).
Критерии начала цикла: отсутствие инфекционных очагов, отсутствие мукозита и дерматита, лейкоциты более 1 x 109/л, печеночная токсичность не выше 2 степени, нормальные показатели кальция в сыворотке крови. На фоне терапии рекомендован контроль общеклинического анализа крови, биохимического анализа крови (электролиты, обязательно кальций, печеночные ферменты, билирубин, мочевина, креатинин, триглицериды) на 1, 8, 15 дни курса. При развитии гиперкальциемии > 3,0 ммоль/л #изотретиноин отменяется.
Противопоказана избыточная инсоляция на фоне терапии #изотретиноином. В случае развития дерматита - уход за кожей средствами с альфа-токоферола ацетатом, при отсутствии эффекта - применение кортикостероидов для лечения заболеваний кожи для наружного применения.
Решение вопроса о проведение дифференцировочной терапии #изотретиноином для пациентов с НБ группы промежуточного риска остается на усмотрение центра, проводящего терапию данному пациенту.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы промежуточного риска после завершения индукционной терапии, включающей 6 курсов интенсивной терапии и оперативное вмешательство, при наличии метаболически активной остаточной опухоли проведение лучевой терапии одновременно с поддерживающей терапией (курсами N 7) для пациентов в возрасте старше 2-х лет [13, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: метаболически активная остаточная опухоль определяется как:
- остаточная опухоль, накапливающая радиофармпрепарат при проведении сцинтиграфии с МЙБГ (при условии инициально МЙБГ-позитивной опухоли) или ПЭТ/КТ с ФДГ (при условии иницально МЙБГ-негативной опухоли или при инициальном выполнение ПЭТ/КТ с ФДГ) или других радиоизотопных методов исследования (при условии проведения данных радиоизотопных методов при постановке диагноза);
- однозначное накопление контраста при проведении МРТ (только для опухолей, которые были полностью негативны при проведении инициальной сцинтиграфии с МЙБГ).
Остаточная метаболически неактивная опухоль при отсутствии объективных признаков прогрессирования по данным КТ, МРТ или УЗИ не требует проведения дистанционной лучевой терапии.
Требования к ЛТ и особенности проведения ЛТ у пациентов с нейробластомой - см. раздел 7.5 данных рекомендаций.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы промежуточного риска проходить обследование для контроля симптомов и оценки ответа на проводимую терапию в следующем объеме [13, 39]:
- оценку уровня НСЕ (после каждого курса индукционной, поддерживающей терапии и терапии #изотретиноином);
- УЗИ пораженной области после каждого курса индукционной терапии, после 2-го и 4-го курсов поддерживающей терапии и далее 1 раз в 6 нед. На фоне терапии #изотретиноином;
- МСКТ/МРТ пораженной анатомической области после 2-го, 4-го и 6-го курсов индукционной терапии, после 2 и 4 курса по схеме N 7, далее после 3, 6-го, перед 7 и после 9-го курсов терапии #изотретиноином;
- сцинтиграфию с МЙБГ и/или ПЭТ/КТ с ФДГ и/или другие радиоизотопные методы исследования (см. выше) после 6 курсов индукционной терапии, после поддерживающей терапии и после окончания терапии (метод радиоизотопной диагностики может быть выбран в зависимости от того какой метод использовался при постановке диагноза, но предпочтение должно отдаваться сцинтиграфии с МЙБГ);
- оценку статуса костного мозга (миелограмма из 4-х точек и для детей старше 12 мес. дополнительно трепанобиопсия из 2-х точек) (у пациентов в возрасте младше 1 года при 4-й стадии заболевания с поражением костного мозга) после 2-го (у всех пациентов), 4-го (в случае отсутствия санации после 2-го курса), 6-го курсов и перед завершением терапии.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: мониторинг побочных эффектов химиопрепаратов включает в себя оценку общего (клинического) анализа крови и мочи, анализа крови биохимического общетерапевтического перед каждым курсом терапии. Перед курсами, содержащими доксорубицин**, выполняется ЭхоКГ. Перед курсами с цисплатином** проводится оценка скорости клубочковой фильтрации по формуле Шварца (Schwartz G.J., 1987) или используется исследование уровня цистатина C в крови. С учетом возможности повреждения почечных канальцев у пациентов, получающих #ифосфамид**, до введения препарата проводился мониторинг тубулярных нарушений, основанный на оценкефракционированной реабсорбции фосфатов. Перед проведением курсов терапии #изотретиноином оценивается уровень сывороточного кальция и триглицеридов.
3. Лечение пациентов группы высокого риска
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска после проведения комплексного обследования выполнение хирургического вмешательства, сроки и объем которого определяется индивидуально врачебным консилиумом, включающим детских онкологов, хирургов и специалистов по визуализации, с целью удаления первичного очага опухоли [13, 15, 16, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: при проведении предоперационного планирования оценивается топография опухоли и ее взаимосвязь с жизненно важными структурами (магистральными сосудами, паренхиматозными органами) (факторы риска при виузализации - IDRF). Полная резекция показана только в том случае, если предполагаемый риск развития послеоперационных осложнений является низким. Операция не должна носить калечащий характер (например, нефрэктомия). У пациентов с наличием отдаленных метастазов на момент постановки диагноза, укладывающихся в критерии 4-й стадии по системе INSS, предпочтительнее выполнение только биопсии опухоли в целях максимально раннего начала системной ПХТ.
Хирургическое вмешательство, направленное на удаление первичнои опухоли, как правило, является отсроченным (операция second-look). Проведение предшествующеи ПХТ направлено на сокращение размеров первичнои опухоли в целях увеличения частоты макроскопически полного ее удаления, уменьшения рисков развития хирургических осложнении и снижения риска интраоперационного разрыва. Отсроченное хирургическое вмешательство рекомендовано выполнять после 4-го, 5-го или 6-го курса индукционнои ПХТ. Объем хирургического вмешательства определяется после совместного обсуждения детскими онкологами, хирургами и специалистами по визуализации. При проведении предоперационного планирования оценивается взаимосвязь опухоли с жизненно важными структурами (магистральными сосудами, паренхиматозными органами и т.д.), определяются факторы хирургического риска IDRF. Пациенты с локализованной опухолью до 7 см в забрюшинной области и до 9 см в заднем средостении при отсутствии факторов хирургического риска, а именно при отсутствии тотального вовлечения магистральной артерии в опухоль и сохранении просвета магистральной вены могут быть претендентами на малоинвазивное хирургическое лечение. При наличии факторов хирургического риска, а именно при вовлечении в опухоль магистральных сосудов и прорастании опухолью рядом расположенных органов, рекомендовано выполнять открытое оперативное вмешательство. В таком случае стандартным оперативным вмешательством являются лапаротомные, торакотомные, а также комбинированные доступы, позволяющие максимально визуализировать оперативное поле. Хирургическая бригада должна обладать большим опытом, навыками прецизионной микрохирургической техники и проведения реконструктивных операций, обязательно использование увеличительной оптики. Необходимо всегда стремиться к максимальному удалению опухоли, но в то же время нужно предотвращать риск развития послеоперационных осложнений, что может значительно отсрочить сроки ПХТ и ухудшить прогноз для пациента. Сверхрадикальные операции у пациентов с большим количеством факторов хирургического риска нередко приводят к развитию осложнений, в первую очередь к нарушению кровоснабжения внутренних органов.
Поскольку выполнение хирургического вмешательства после курса лучевои терапии может быть затруднено развитием постлучевого фиброза, попытка резекции опухоли планируется перед проведением лучевои терапии. Необходимо отметить, что поскольку разрыв опухоли менее вероятен после проведения химиотерапии, нарушение целостности опухоли во время операции second-look является приемлемым и может способствовать полнои резекции.
- Рекомендуется пациентам в возрасте 6 месяцев и старше с установленным диагнозом нейробластомы группы высокого риска после оперативного вмешательства проведение курсов химиотерапии по схемам N 5 и N 6 в альтернирующем режиме (см. приложение А3.2). Суммарно предусмотрено 6 курсов терапии. Следующий курс начинается на 21-й день от первого дня предыдущего курса [13, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: критерии для начала курса ПХТ:
- лейкоциты > 2000/мкл;
- лимфоциты > 1000/мкл;
- тромбоциты > 50000/мкл;
- отсутствие признаков инфекции.
Если эти критерии не были достигнуты, начало курса ПХТ откладывается. Если задержка превышает 7 дней или имеет место течение инфекционного эпизода ![]() III степени тяжести, или другие виды тяжелой органной токсичности дозы препаратов в последующем цикле модифицируются на 25 - 50%.
III степени тяжести, или другие виды тяжелой органной токсичности дозы препаратов в последующем цикле модифицируются на 25 - 50%.
Пациентам старше 18 месяцев жизни до 18 лет с диагнозом нейробластома или ганглионейробластома группы высокого риска с 4-й стадией заболевания по INSS может быть предусмотрено применение двух стандартных курсов индукционной химиотерапии по схеме N 5 и N 6 с последующими 4 курсами аналогичной химиотерапии в сочетании с анти-GD2 моноклональными антителами ch14.18/CHO (динутуксимаб бета) - курсы N 5-Q и N 6-Q (схема курсов - см. приложение А3.2, приложение Б, рис. Б4) [46]. Отсроченная операция может выполняться после 4-го или 6-го курса индукционной терапии, аферез гемопоэтических стволовых клеток может выполняться после 2 - 5-го курсов индукционной терапии. Данный вид терапии может проводиться только в специализированных лечебных учреждениях, обладающих большим опытом проведения иммунотерапии моноклональными антителами и после получения консилиума в национальном/федеральном центре.
- Рекомендуется пациентам в возрасте младше 6 месяцев с установленным диагнозом нейробластомы группы высокого риска после оперативного вмешательства проведение курсов химиотерапии по схеме N 4 до исполнения возраста 6 месяцев, после исполнения 6 месяцев - продолжение терапии по схемам N 5 и N 6 до 6 циклов интенсивной химиотерапии (см. приложение А3.2). Суммарно предусмотрено 6 курсов терапии. Следующий курс начинается на 21-й день от первого дня предыдущего курса [13, 39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: кумулятивная доза доксорубицина** не должна превышать 180 мг/м2 в целях уменьшения риска отсроченной кардиотоксичности.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска после 3 или 5 курса терапии в случае подтверждения санации костного мозга по данным миелограммы и трепанобиопсии (для детей старше 12 мес.) проведение мобилизации и афереза периферических стволовых клеток [13, 45].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: у пациентов, у которых не достигнута санация костного мозга после 4 курса индукционной терапии, допустимо проведение афереза периферических столовых клеток после 5 курса.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска, достигших после 4 - 6 курса индукционной терапии по данным контрольного обследования смешанный ответ (СО) или стабилизация (СТ) в рамках критериев оценки ответа на терапию (таб. 7.7.1) проведение интенсификации индукционного этапа лечения на основе курсов с применением препаратов #иринотекан** и #темозоломид**; #иринотекан**, #темозоломид** и #бевацизумаб**, #топотекан** и #темозоломид**; #топотекан** и циклофосфамид**, или других комбинаций химиопрепаратов применяющихся при лечении рецидива заболевания, или применения химиоиммунотерапии (ПХТ и динутуксимаб бета), с оценкой ответа после 2 - 4 курсов (максимальное количество курсов 6). В случае отсутствия ответа на интенсификацию индукционной терапии необходима консультация национального/федерального центра [47, 76, 77]. Схемы терапии описаны в приложение А3.2.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска, после завершения этапа стандартной индукционной терапии, включающего 6 курсов интенсивной ПХТ и/или интенсифицированной индукционной терапии, и, как правило, отсроченного хирургического вмешательства, в случае отсутствия данных за прогрессирование по результатам комплексного обследования, проведение высокодозной ХТ с последующей ауто-ТГСК [13, 35, 48 - 52].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: критически важным для обеспечения сроков проведения высокодозной терапии и ауто-ТГСК является извещение трансплантационного центра о пациенте с нейробластомой группы высокого риска в момент постановке диагноза и начала проведения специального лечения.
Режимы кондиционирования включают схемы #карбоплатин**/этопозид**/мелфалан** или #треосульфан/мелфалан** или бусульфан**/мелфалан** - на усмотрение клиники, проводящей ауто-ТГСК [48 - 51, 93]. В случае применения бусульфан-содержащего режима необходимо включение в режим сопроводительной терапии противосудорожного препарата с целью профилактики развития нейротоксичности режима [92]. Возможно проведение одноэтапной или тандемной ВХТ и ауто-ТГСК (на усмотрение клиники проводящей ТГСК). Выбор режимов ВХТ при проведении тандемной ауто-ТГСК осуществляется в соответствии с внутренними рекомендациями клиники, выполняющей тандемную ауто-ТГСК. Режимы кондиционирования, используемые в рамках тандемной ауто-ТГСК включают схемы #карбоплатин**/этопозид**/мелфалан** или #треосульфан/мелфалан** или бусульфан**/мелфалан** или тиотепа**/циклофосфамид** или тиотепа** - на усмотрение клиники, проводящей ауто-ТГСК [74 - 75, 86]. В случае проведения процедуры ТГСК отделением трансплантации, не входящим в состав федерального центра, специализирующегося на выполнении ТГСК у детей, рекомендуется согласование тактики с национальным/федеральным центром. Режимы высокодозной терапии описаны в приложении А3.1.
Деконтаминация не проводится. Антибактериальная, противовирусная и противогрибковая терапия, сопроводительная и инфузионная терапия, противорвотная терапия, применение колониестимулирующих факторов и лабораторный контроль состояния пациента осуществляются в соответствии с локальным протоколом трансплантационного центра [13].
Критерии для проведения ауто-ТГСК:
- общий анализ крови: лейкоциты > 2000/мкл, лимфоциты > 1000/ мкл, тромбоциты > 50 000/мкл;
- ототоксичность < II степени (т. е. уменьшение ![]() 30 Дб на 2 Кгц, требуется аудиометрия);
30 Дб на 2 Кгц, требуется аудиометрия);
- креатинин ![]() 150% от верхней границы нормы, клиренс по эндогенному креатинину
150% от верхней границы нормы, клиренс по эндогенному креатинину ![]() 70 мл/мин x 1,73 м2;
70 мл/мин x 1,73 м2;
- уровень гепатотоксичности < II степени
- кардиомиопатия < I степени (по данным ЭхоКГ и ЭКГ);
- отсутствие признаков тяжелой инфекции (сепсис, септический шок) в течение 14 дней (афебрилитет, отсутствие очагов инфекции, полная стабилизация состояния);
- наличие центрального венозного катетера систем Certofix, Broviac, Hickman, Port-A-Cath.
- отсутствие прогрессирования заболевания по данным комплексного обследования, проведенного после этапа индукционной терапии.
Необходимо:
- выполнить мобилизацию, забор и CD34-селекцию ![]() 2 x 106/кг (см. соответствующий протокол);
2 x 106/кг (см. соответствующий протокол);
- подготовить пациента;
- подготовить бокс;
- подготовить сопровождающего (родители ребенка или другое лицо, на которое родителями оформлена нотариально заверенная доверенность, с наличием информированного согласия).
Критерии приживления трансплантата:
- гранулоциты > 500/мкл;
- лейкоциты > 1000/мкл;
- тромбоциты > 30/мкл при условии отсутствия трансфузий тромбоконцентрата в течении 3 сут.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска после завершения высокодозной ХТ с последующей ауто-ТГСК (одиночной или тандемной) проведение дифференцировочной терапии #изотретиноином [44, 52].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
Комментарии: после приживления трансплантата на +30-е сутки после процедуры миелоинфузии планируется начало дифференцировочной терапии #изотретиноином, которую назначают в дозе 160 мг/м2 в 2 - 3 приема в течение 14 дней с последующим 14-дневным перерывом, затем начинается следующий цикл. После 6 циклов терапии предусмотрен 3-месячный перерыв с последующим проведением еще 3 курсов терапии #изотретиноином в прежнем режиме. Таким образом, суммарно проводится 9 курсов терапии #изотретиноином. Дифференцировочная терапия может проводиться или не проводиться на усмотрение лечебного учреждения, проводящего терапию данному пациенту. В случае проведения иммунотерапии антителами к GD2 в соответствии с установленными данными рекомендациями сроками (60 - 100 дней с дня ауто-ТГСК) цикл дифференцирующей терапии может быть остановлен на время проведения иммунотерапии по усмотрению центра, проводящего иммунотерапию.
Препарат следует принимать совместно с жирной пищей (молоко).
Критерии начала цикла: отсутствие инфекционных очагов, отсутствие мукозита и дерматита, лейкоциты более 1 x 109/л, печеночная токсичность не выше 2 степени, нормальные показатели кальция в сыворотке крови. На фоне терапии рекомендован контроль общеклинического анализа крови, биохимического анализа крови (электролиты, обязательно кальций, печеночные ферменты, билирубин, мочевина, креатинин, триглицериды) на 1, 8, 15 дни курса. При развитии гиперкальциемии > 3,0 ммоль/л 13-цис-ретиноевая кислота отменяется.
Противопоказана избыточная инсоляция на фоне терапии #изотретиноином. В случае развития дерматита - уход за кожей средствами с витамином Е, при отсутствии эффекта - применение мазей с кортикостероидами.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска при сохранении метаболически активной опухоли после 6 курсов индукционной терапии и хирургического вмешательства (по данным обследования перед этапом ауто-ТГСК), проведение дистанционной лучевой терапии СОД 36 - 40 Гр при классическом фракционировании (1 раз в день 5 дней в неделю) и РОД 1,6 - 1,8 Гр [53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: метаболически активная остаточная опухоль определяется как:
- остаточная опухоль, накапливающая радиофармпрепарат при проведении сцинтиграфии с МЙБГ (при условии инициально МЙБГ-позитивной опухоли) или ПЭТ/КТ с ФДГ (при условии инициально МЙБГ-негативной опухоли или при инициальном выполнение ПЭТ/КТ с ФДГ) или других радиоизотопных методов исследования (при условии их выполнения при постановке диагноза);
- однозначное накопление контраста при проведении МСКТ/МРТ (только для опухолей, которые были полностью негативны при проведении инициальной сцинтиграфии с МЙБГ).
Остаточная метаболически неактивная опухоль в отсутствие признаков прогрессирования по данным МСКТ, МРТ или УЗИ не требует проведения лучевой терапии.
Проведение лучевой терапии рекомендовано после проведения ауто-ТГСК и достижения приживления трансплантата. С учетом необходимости начала терапии #изотретионином на +30-е сутки после ауто-ТГСК и возможности усиления лучевых реакций на фоне одновременного проведения лучевой терапии и приема 13-цис-ретиноевой кислоты лучевая терапия проводится после первого курса дифференцировочной терапии. Минимальный интервал от момента приема 13-цис-ретиноевой кислоты до начала лучевой терапии составляет 7 дней. Дифференцировочная терапия возобновляется через 7 - 10 дней после завершения курса лучевой терапии.
Исключение составляют пациенты, получавшие высокодозную терапию по схеме BuMel. В случае наличия показаний к проведению ДЛТ последняя должна быть отложена не менее чем на 60 дней от момента проведения ауто-ТГСК, учитывая возможное потенциирование бусульфаном** лучевых реакций.
При невозможности обеспечения толерантных доз на здоровые структуры при планировании облучения в этом режиме, рекомендуется применять СОД 21 Гр при РОД 1,5 Гр.
Планирование и принципы проведения ДЛТ у пациентов группы высокого риска соответствуют таковым у пациентов группы промежуточного риска. Детали представлены в разделе "Дистанционная лучевая терапия у пациентов группы промежуточного риска".
В рамках рекомендаций оригинального протокола NB-2004 облучение метастатических очагов (даже метаболически активных) в рутинной практике не проводится.
Однако в случае сохранения солитарного метаболически активного очага, подтвержденного данными КТ/МРТ, сцинтиграфии с МЙБГ, ПЭТ/КТ с ФДГ или другими радиоизотопными методами исследования, локальная лучевая терапия может рассматривается в качестве дополнительной терапевтический опции. Показания к ДЛТ определяются строго индивидуально при проведении медицинского консилиума.
Применяются РОД 1,5 - 1,8 Гр, СОД 21 Гр в зависимости от локализации и близости критических структур.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска в возрасте 12 мес. или старше, достигшим ПО, ОХЧО, ЧО на индукционный этап терапии (стандартная индукционная терапия или интенсификация индукции), после завершения ВХТ с последующей ауто-ТГСК проведение иммунотерапии GD2-моноклональными антителами (динутуксимаб бета) (сопроводительная терапия и критерии отмены динутусимаба бета представлены в приложении А3.3) с или без #изотретиноина (схема приема #изотретиноина указана ранее) [54].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Показано применение антител динутуксимаба бета в виде 5 циклов с интервалом между курсами длительностью 36 дней. Препарат вводится непрерывной инфузией в течение 10 дней. Суммарная курсовая доза - 100 мг/м2, разовая доза - 10 мг/м2/день. Суммарно запланировано проведение 5 курсов иммунотерапии. Оптимальные сроки начала иммунотерапии 60 - 100 дни от ауто-ТГСК в зависимости от соматического статуса пациента, сроков восстановления кроветворения, сроков проведения лучевой терапии. На 11 день от начала первого курса иммунотерапии динутуксимаба бета начинается очередной курс #изотретиноина (14 дней) для пациентов, которым проводится дифференцировочная и иммунотерапия (решение принимает лечебное учреждение, проводящее лечение больного). Далее следует перерыв в течение 14 дней. В дальнейшем проводится второй цикл иммунотерапии динутуксимаба бета терапии, который начинается с введения динутуксимаба бета (в/в 10 мг/м2/день) в течение 10 дней и т.д. После завершения 5 курсов иммунотерапии (к данному моменту проведено 6 курсов терапии #изотретиноином) рекомендован перерыв длительностью 3 месяца, с последующим проведением 3-х курсов терапии #изотретиноином. Расчет дозы динутуксимаба бета происходит в зависимости от площади тела или массы пациента:
- Пациенты с массой тела > 12 кг расчет дозы динутуксимаба бета в соответствии с площадью поверхности тела - 10 мг/м2/сут. Суммарная доза динутуксимаба бета, вводимая за цикл, составляет 100 мг/м2 поверхности тела.
- Пациенты с массой тела < 12 кг и > 5 кг расчет дозы динутуксимаба бета происходит на массу тела (кг) - 0,33 мг/кг/сут. Общая доза динутуксимаба, вводимого за цикл, составляет 3,3 мг/кг массы тела.
Критерии начала курса иммунотерапии динутуксимабом бета:
- Удовлетворительное общее состояние (по шкале Лански или Карновски > 70)
- Отсутствие клинических проявлений инфекционного процесса (не повреждены кожные покровы, губы и слизистые оболочки)
- Отсутствие признаков лекарственно-индуцированной нейропатии или нейропатической боли
- Адекватная функция костного мозга: абсолютное число нейтрофилов ![]() 500/мкл, число тромбоцитов
500/мкл, число тромбоцитов ![]() 20000/мкл, гемоглобин > 8,0 г/дл.
20000/мкл, гемоглобин > 8,0 г/дл.
- Адекватная функция почек: клиренс креатинина или скорость клубочковой фильтрации (СКФ) > 60 мл/мин/1,73 м2.
- Показатели коагулограммы (ПТВ 70 - 120%, АЧТВ < 36 сек).
- Отсутствие клинических признаков сердечной недостаточности, ФВ (фракция выброса) ![]() 55%
55%
- Оценка функции дыхательной системы (O2-сатурация на пульсоксиметре > 94% без применения кислорода, нет нарушения дыхания в покое), отсутствие патологии при проведение рентгенографии ОГК.
- Отсутствие прогрессии основного заболевания
Путь введения препарата.
- Обязательным условием начала терапии динутуксимабом бета является наличие адекватно функционирующего центрального венозного катетера (желательно двухпросветного).
- Динутуксимаб бета предназначен для внутривенной инфузии. Раствор должен вводиться через центральную вену. Другие одновременно вводимые внутривенные препараты должны доставляться по отдельной инфузионной линии.
При непрерывных инфузиях раствор вводится со скоростью 2 мл в час (48 мл в сутки) с помощью инфузионного насоса.
- Рекомендуется пациентам с установленным диагнозом нейробластомы группы высокого риска проходить обследование для контроля симптомов и оценки ответа на проводимую терапию в следующем объеме [13, 39]:
- оценка уровня НСЕ после каждого курса индукционной терапии, ауто-ТГСК и каждого курса терапии #изотретиноином и перед завершением терапии;
- УЗИ пораженной области после каждого курса индукционной терапии, ауто-ТГСК и далее 1 раз в 6 нед. на фоне терапии #изотретиноином и перед завершением терапии;
- МСКТ/МРТ пораженной анатомической области после 2-го, 4-го, 6-го курсов индукционной терапии, далее через 3, 6, 9 мес от момента ауто-ТГСК и перед завершением терапии;
- МСКТ ОГК И ОБП с КУ после 2-го, 4-го, 6-го курсов индукционной терапии, далее через 3, 6, 9 мес от момента ауто-ТГСК и после завершения терапии;
- МРТ головного мозга с КУ после 6-го курсов индукционной терапии, перед началом иммунотерапии и далее каждые 6 мес. и перед завершением терапии;
- сцинтиграфия с 123I-МЙБГ (или другие методы радиоизотопной диагностики (см. выше)) после 4-го и 6-го курсов индукционной терапии, через 3 мес. после ауто-ТГСК (в случае сохранения патологического накопления при предшествующем исследовании), далее каждые 6 мес. до нормализации; перед завершением терапии;
- оценка статуса костного мозга (миелограмма из 4-х точек и для детей старше 12 мес. дополнительно трепанобиопсия из 2-х точек) (у пациентов с поражением костного мозга) после 2-го курса (у всех пациентов) в случае отсутствия санации после 2 курсов, после 4-г курса терапии (в случае отсутствия санации после 2-го курса), после 6-го курса терапии (у всех пациентов), через 3 мес. после ауто-ТГСК (в случае отсутствия санации до ТГСК) и перед завершением терапии.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Мониторинг побочных эффектов химиопрепаратов включает в себя оценку общего (клинического) анализа крови и мочи, анализа крови биохимического общетерапевтическогоперед каждым курсом терапии. Перед курсами, содержащими доксорубицин**, выполняется ЭхоКГ. Перед курсами с цисплатином** проводится оценка скорости клубочковой фильтрации по формуле Шварца или оценке уровня цистатина С в сыворотке крови. С учетом возможности повреждения почечных канальцев у пациентов, получающих #ифосфамид**, до введения препарата проводили мониторинг тубулярных нарушений, основанный на оценке фракционированной реабсорбции фосфатов. Перед проведением курсов терапии #изотретиноином оценивается уровень сывороточного кальция и триглицеридов. После этапа индукционной терапии осуществлялась оценка слуха с помощью технологии вызванных слуховых потенциалов или аудиометрии.
4. Лечение рецидивов/прогрессии заболевания
- Рекомендуется в случае развития рецидива/прогрессии заболевания у пациентов группы наблюдения (низкого риска) проведение полного обследования (см. пункты 2.3, 2.4, 2.5) и терапии (представлено в разделе 3.1) [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в случае развития рецидива/прогрессии заболевания у пациентов в группе промежуточного риска проведение полного обследования (см. пункты 2.3, 2.4, 2.5) и рассмотрение вопроса о биопсии при наличие мягкотканого компонента (первичная опухоль и/или метастатический очаг) для проведения гистологического и углубленного молекулярно-генетического исследования [70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в случае развития рецидива/прогрессии заболевания у пациентов в группе высокого риска проведение полного обследования (см. пункты 2.3, 2.4, 2.5) и рассмотрение вопроса о биопсии при наличие мягкотканого компонента (первичная опухоль и/или метастатический очаг) для проведения гистологического и углубленного молекулярно-генетического исследования [70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется проведение терапии второй линии пациентам группы высокого риска с подтвержденной первичной резистентностью на этапе индукционной терапии, пациентам группы высокого и промежуточного риска при развитии прогрессии/рецидива заболевания. Объем терапии и ее длительность будут зависеть от характера рецидива (локальный, метастатический, комбинированный), объема и переносимости терапии первой линии, соматического статуса пациента. Терапия может включать: хирургическое лечение, ПХТ, лучевую терапию, иммунотерапию, высокодозную химиотерапию и ТГСК [70, 71].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- Рекомендуется пациентам с рецидивом/прогрессией нейробластомы проведение обследования (см. пункты 2.3, 2.4, 2.5) [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: в рамках обследования рекомендуется исследование лабораторных показателей (общий (клинический) анализ крови, анализ крови биохимический общетерапевтический, коагулограмма, определение основных групп крови по системе AB0, определение антигена D системы Резус, общий (клинический) анализ мочи, определение уровня ферритина и нейронспецифической енолазы, при возможности определение уровня метаболитов катехоламинов (ГВК и МВК)), инструментальные методы исследования (УЗИ органов брюшной полости и других вовлеченных областей, рентгенографии органов грудной клетки и/или МСКТ и/или МРТ), исследования костного мозга, сцинтиграфии с 123I-МЙБГ либо ПЭТ/КТ с 18F-ФДГ либо других радиоизотопных методов исследования. При отсутствии технической возможности проведения, сцинтиграфии с 123I-МЙБГ либо ПЭТ/КТ с 18F-ФДГ при наличии убедительных данных за развитие рецидива заболевания (на основании данных визуализации, исследования костного мозга и т.д.) данные исследования могут проводиться на более поздних этапах после завершения одного из курсов терапии. Исследования выполняются в соответствии с рекомендациями для инициального обследования (разделы 2.3 - 2.5). С целью верификации возможного поражения ЦНС рекомендуется выполнение МРТ головного мозга с КУ и при наличии показаний МРТ спинного мозга с КУ. При наличие неврологической симптоматики или выявление поражения головного/спинного мозга по данным визуализационных методов исследования может быть рекомендовано выполнение люмбальной пункции с цитологическим, бактериологическим (при наличии показаний) исследованием ликвора. При наличии доступного для биопсии мягкотканого компонента и отсутствии значимых хирургических рисков возможна морфологическая верификация рецидива. В том случае, если биопсия мягкотканого компонента сопряжена с хирургическими рисками, возможно начало терапии на основании данных визуализации и лабораторных исследований.
Выбор схемы противорецидивной терапии осуществляется в соответствии с внутренними рекомендациями клиники. Возможна смена схемы противорецидивной терапии в случае развития токсичности, препятствующей проведению последующих курсов лечения (например, диарея, ассоциированная с применением иринотекана, гематологическая токсичность и т.д.) или отсутствие ответа на лечение или дальнейшая прогрессия заболевания. Следующий курс начинается на 21-й день от первого дня предыдущего курса.
Критерии для начала курса ПХТ:
- лейкоциты > 2000/мкл;
- лимфоциты > 750/мкл;
- тромбоциты > 50000/мкл;
- отсутствие признаков инфекции.
Если эти критерии не были достигнуты, начало курса ПХТ откладывается. Если задержка превышает 7 дней или имеет место течение инфекционного эпизода ![]() III степени тяжести, дозы препаратов в последующем цикле модифицируются (допустимо снижение дозы на 25 - 50%).
III степени тяжести, дозы препаратов в последующем цикле модифицируются (допустимо снижение дозы на 25 - 50%).
Оценка эффективности противорецидивной терапии проводится каждые 2 - 4 курса терапии второй (либо третьей и более при переходе к другой схеме терапии вследствие токсичности или неэффективности лечения) линии. Рекомендовано обсуждение дальнейших этапов терапии (консолидации и постконсолидации) с национальным/федеральным центром.
Возможно использование следующий вариантов противорецидивной химиотерапии: #иринотекан** и #темозоломид**; #иринотекан**, #темозоломид** и бевцизумаб**; #топотекан** и #темозоломид**; #топотекан** и циклофосфамид**, химиоиммунотерапия (ПХТ+динутуксимаб бета), RIST, метрономная терапия (схемы терапии смотри в приложении А3.2).
- Рекомендуется в случае выявления на основании молекулярно-генетического исследования образца опухоли (биопсийный материал, опухолевые клетки, полученные при исследовании костного мозга) мишеней для таргетной терапии допускается проведение таргетной терапии одновременно и/или после завершения противорецидивной терапии. Режим и длительность таргетной терапии согласовывается с национальным/федеральным центром [30].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- Рекомендуется рассмотреть вопрос о показаниях к лучевой терапии (облучение первичной опухоли и/или метастатических очагов) в зависимости от характера рецидива/прогрессии, ответа на терапию и применения лучевой терапии в первой линии [70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется рассмотреть возможность хирургического лечения, как в момент констатации рецидива/прогрессии, так и на этапах противорецидивной терапии [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Данный метод лечения может использоваться до начала системной противорецидивной терапии в случае симптоматического поражения, требующего экстренного вмешательства (например, ЦНС-рецидив). При наличии асимптоматических очагов либо выявлении дополнительных очагов поражения за пределами ЦНС хирургическое лечение согласовывается с национальным/федеральным центром.
Допустима установка резервуара Оммайя с интравентрикулярным введением химиопрепаратов (этопозид**, #топотекан**) для пациентов с метастатическим ЦНС-рецидивом. Терапия может проводиться одновременно с использованием системной терапии (химиотерапия, химио-иммунотерапия, таргетная терапия). Схема лечения согласовывается с национальным/федеральным центром.
При достижении стабилизации, частичного или полного ответа на основании промежуточного стадирования, выполняемого после 1 - 5 курса системной терапии допустимо использования химио-иммунотерапии. Схема лечения согласовывается с национальным/федеральным центром.
При достижении полного ответа со стороны очагов поражения ЦНС, полного или частичного ответа со стороны очагов поражения за пределами ЦНС (при их наличии) рекомендуется использование методов консолидирующей терапии и поддерживающей терапии (повторная ауто-ТГСК (более предпочтительно при позднем рецидиве), аллогенная-ТГСК, монотерапия #темозоломидом**, метрономная терапия, иммунотерапия, химиоиммунотерапия. Схема лечения должная быть согласована с национальным/федеральным центром.
Допускается лечение пациентов в рамках клинических исследований в том случае, если предлагаемые в рамах исследования методы лечения не противоречат данным рекомендациям.
- Рекомендуется первичным пациентам с НБ группы высокого риска/рецидивами/прогрессией заболевания проведение молекулярно-направленной терапии при выявлении потенциальных мищений при проведении углубленного молекулярно-генетического исследования [90, 91, 107]
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
5. Нутритивная поддержка
Нутритивная поддержка проводится посредством назначения специализированных продуктов энтерального питания. Пищевая продукция энтерального питания или лечебная питательная смесь - жидкая или сухая (восстановленная до готовой к употреблению) пищевая продукция диетического лечебного или диетического профилактического питания, предназначенная для перорального употребления непосредственно или введения через зонд при невозможности обеспечения организма в пищевых веществах и энергии обычным способом [108]. Лечебные смеси - специально разработанные пищевые продукты с заданным химическим составом, энергетической ценностью, физическими свойствами и доказанным лечебным эффектом, отвечающие физиологическим потребностям организма, учитывающие нарушения процессов метаболизма больного человека [109]. При выборе формы, метода, вида и объема нутритивной поддержки рекомендуется руководствоваться, в первую очередь, принципом индивидуального пациент-ориентированного подхода - сообразно клинической ситуации и логике [110, 111]
У пациентов с ожирением (избытком жировой массы) возможно развитие скрытой белково-энергетической недостаточности, определяемой дефицитом безжировой массы тела и критическим уменьшением ее скелетно-мышечного компартмента, в связи с чем рекомендуется проведение коррекции данного вида дефицита, наличие ожирения само по себе не является противопоказанием для проведения нутритивной поддержки энтеральным или парентеральным путем [111 - 113].
- Рекомендуется расчет объема нутритивной поддержки осуществлять посредством расчета нутритивной потребности, или тотального расхода энергии (ТРЭ) [110, 114].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО x КК, где ЭОО - энергия основного обмена, КК - конверсионный коэффициент. Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield) [15]. Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК = 0,85 - 1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации.
- Рекомендуется при выборе пути нутритивной поддержки в качестве приоритетного использование энтерального питания (ЭП) [115, 116].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: ЭП является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, препятствует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание
- Рекомендуется в случае если пациент не может/ не хочет/ не готов принимать назначенный объем смеси в необходимом режиме самостоятельно использование для энтерального питания назогастрального (-еюнального) зонда или гастростомы [111, 115, 116]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через назогастральный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) - в этих случаях показана реализация ЭП через назоеюнальный зонд.
- Рекомендуется при текущей или потенциальной необходимости проведения зондового питания продолжительностью более 6 недель, наложение гастростомы [116].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: в случае, когда выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), возможно превентивное наложение гастростомы, минуя этап зондового питания.
- Рекомендуется постановка гастростомы в случае невозможности адекватной алиментации другими методами ЭП, при отсутствии противопоказаний для проведения ЭП и самой гастростомии [111, 117].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в случаях наличия у ребенка тяжелой хронической белково-энергетической недостаточности, с высоким риском ее усугубления в дальнейшем, особенно если ему еще предстоит продолжение противоопухолевого лечения постановка гастростомы, минуя этап зондового питания и даже сипинга [111, 117].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с гастроинтестинальными нарушениями начинать энтеральную нутритивную поддержку рекомендуется со специализированной лечебной питательной смеси для энтерального питания с калорической плотностью 1 ккал/мл (изокалорическая смесь), и, если необходимо, с последующим переходом на лечебную питательную смесь для энтерального питания с калорической плотностью более 1 ккал/мл (гиперкалорической) - под контролем переносимости [115].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: смеси по своей энергетической плотности делятся на изокалорические (1 ккал/мл для детей старше года и 0,67 - 0,69 ккал/мл для детей до года) и гиперкалорические (более 1 ккал/мл для детей старше года, и 1 ккал/мл для детей до года). Начинать нутритивную поддержку, особенно детям с имеющимися в анамнезе или в настоящее время гастроинтестинальными нарушениями и/или никогда до этого не получавшими энтерального питания, целесообразно с изокалорических формул.
- Рекомендуется при наличии явлений мальабсорбции/ тяжелых гастроинтестинальных нарушений (но отсутствии противопоказаний для проведения ЭП), тяжелой пищевой аллергии (или аллергии к белкам коровьего молока) назначение полуэлементной/олигомерной (или, по показаниям, элементной) специализированной лечебной питательной смеси для энтерального питания [115, 118].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: смеси по своему химическому составу делятся на полимерные (в своей основе содержат цельный белок) и олигомерные (содержат гидролизат белка) или полуэлементные. Элементные смеси не содержат белок как таковой: белковый компонент в них представлен аминокислотами. Обычно элементные смеси назначаются при установленной аллергии к белкам коровьего молока
- Рекомендуется всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем и/или в случаях, когда ЭП не может обеспечить потребности энергии основного обмена, назначение парентерального питания (при отсутствии противопоказаний для проведения парентерального питания). В числе этих пациентов особое внимание должно уделяться детям с имеющейся белково-энергетической недостаточностью, особенно умеренной и тяжелой степени [114, 119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: ключевым показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность (как минимум, на уровне энергопотребности основного обмена) пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе.
- Рекомендуется начало парентерального питания производить постепенно, ступенчато увеличивая объем (и скорость) суточной инфузии, начиная от трети/ половины расчетного целевого объема и, под мониторингом показателей анализа крови биохимического общетерапевтического (прежде всего, глюкоза, прямой билирубин, мочевина) и кислотно-основного состояния и газов крови, за несколько суток (скорость достижения целевого объема определяется индивидуально по клинической ситуации) довести объем до целевого. Отмену парентерального питания рекомендуется производить также постепенно, ступенчато, в обратном порядке [110, 115, 117].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: крайне нежелательно назначение парентерального питания сразу в полном объеме, равно как разовая ("со следующих суток") отмена полного парентерального питания. Особенно опасным является назначение полного парентерального питания больным с длительным отсутствием алиментации - в виду возможного развития рефидинг-синдрома. Объем ПП должно постепенно (ступенчато) увеличивать под параллельным контролем КЩС, электролитов, глюкозы, мочевины, прямого билирубина в крови. При необходимости, объем и состав ПП должны корректироваться.
Таблицы см. в приложении А.4.
6. Инфекционные осложнения и сопроводительная терапия.
Инфекционные осложнения по-прежнему остаются основной причиной заболеваемости и смертности у пациентов со злокачественными заболеваниями в период проведения ПХТ и ТГСК [120]. Грамотное и рациональное назначение антимикробных препаратов является залогом успеха терапии как инфекционных осложнений, так и основного заболевания, так как позволяет проводить химиотерапию в полных дозах и с сохранением тайминга [121, 122]. В последнее десятилетие все более глобальной становится проблема развития инфекций, вызванных микроорганизмами, устойчивыми к действию антибиотиков, в том числе препаратов группы резерва [123]. В результате, жизнеугрожающими становятся даже банальные инфекции в связи с крайне ограниченными возможностями их лечения. Внедрение стандартов диагностики, антибактериальной и противогрибковой терапии являются значимыми элементами сопроводительной терапии.
К группе высокого риска относятся пациенты с числом гранулоцитов < 0,5 x 109/л и длительностью нейтропении более 7 дней; пациенты с ожидаемой продолжительностью нейтропении менее 7 дней относятся к группе стандартного риска..
У пациентов в нейтропенивследствие нарушения барьерной функции слизистых оболочек желудочно-кишечного тракта может развиваться феномен транслокации эндогенной флоры кишечника непосредственно в кровоток. Во время развития инфекционного эпизода локальная клиническая симптоматика может отсутствовать и единственным признаком быть фебрильная лихорадка/гипотермия, вялость либо нарушение сознания.
- Рекомендуется всем пациентам с диагнозом НБ с подозрением на фебрильную нейтропению или выявленной фебрильной нейтропенией проведение микробиологического (культурального) исследования крови на стерильность [129 - 132].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: микробиологическое исследование крови проводят до назначения антибиотиков. Взятие крови производится из катетера венозного центрального (ЦВК) периферически вводимого, а в случае его отсутствия - из периферической вены при фебрильном подъеме температуры, эпизоде гипотермии, ознобе и/или нестабильности гемодинамики, появлении септикопиемических очагов. При наличии у пациента многоканального ЦВК и симптомах катетерной инфекции необходимо набирать образцы крови из каждого канала. Получение достоверных результатов возможно при правильном выборе флаконов и соответствии объема набираемой для исследования крови: детям до 10 - 12 кг - в педиатрические флаконы в объеме 1 - 3 мл, детям старше трех лет - в аэробные флаконы в объеме 6 - 10 мл (наиболее оптимально использовать автоматический анализатор для гемокультур). При возможной анаэробной этиологии инфекционного процесса - в анаэробные флаконы, при подозрении на грибковую инфекцию - в микотические. Во избежание контаминации и ложной интерпретации необходимо соблюдение техники асептики при заборе и инокуляции крови. Для повышения эффективности гемокультивирования показано проведение двух- или трехкратного забора крови в течение первых суток лихорадки. После верификации микроорганизма дальнейшие исследования крови проводят через 24 - 48 часов от назначения антибактериальной терапии и до получения первой отрицательной гемокультуры. Повторное микробиологическое исследование крови необходимо проводить при персистенции фебрильной нейтропении (ФН) в течение 72 часов, а также перед эскалацией антибактериальной терапии [129 - 132].
- Рекомендуется всем пациентам с диагнозом НБ с фебрильной нейтропенией (ФН) при положительном результате микробиологического исследования крови определение чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам (наиболее оптимально - методом разведений - А26.30.004.003, с использованием автоматических анализаторов - А26.30.004.004) для назначения адекватного лечения [129 - 132].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарий: с учетом растущей частоты антибиотикорезистентности необходимо проводить определение чувствительности, в том числе к антибактериальным препаратам системного действиягруппы резерва, а также определять детерминанты резистентности.
- Рекомендуется всем пациентам с диагнозом НБ, до и после ТГСК, пациентам с первичными иммунодефицитными состояниями, а также получающих иммуносупрессивную терапию, пациентам отделений интенсивной терапии при поступлении в стационар, а также перед началом специфической терапии или оперативного вмешательства проводить микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы госпитальный скрининг с целью выявления колонизации слизистой оболочки грамотрицательными бактериями, устойчивыми к действию антибиотиков [133 - 136].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: микробиологические исследования проводят для прецизионной антибиотической терапии в ходе лечения при наличии фебрильной лихорадки и инфекционных осложнений.
- Рекомендуется всем пациентам с диагнозом НБ с ФН при наличии кашля, одышки, десатурации, болей в грудной клетке, а также при рефрактерной ФН вне зависимости от наличия респираторной симптоматики КТ органов грудной полости с диагностической целью.-; - [128, 132, 137].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
Комментарий При выявлении признаков пневмонии необходимо выполнить трахеобронхоскопию и бронхоальвеолярный лаваж (БАЛ). Объем исследования должен быть максимальным и, при необходимости, включать: молекулярно-биологическое исследование на респираторно-синтициальный вирус, аденовирус, вирусы гриппа, метапневмовирус, вирусы парагриппа, риновирусы, бокавирус, коронавирусы, Mycoplasma pneumoniae, Chlamydophila pneumonia, Pneumocystis jirovecii, Mycobacterium tuberculosis complex, цитомегаловирус, микроскопическое исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелиальные) и микобактерии туберкулеза, микробиологическое (культуральное) исследование на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование на грибы (дрожжевые и мицелиальные), на легионеллу пневмонии, определение метаболитов грибов (галакоманнана). Наибольшая диагностическая ценность будет у результатов БАЛ, выполненного в кратчайшие сроки от выявления поражения легких [138 - 140].
Необходимо помнить, что результаты рентгенологического исследования легких у пациентов в нейтропении являются недостоверными и "запаздывают" в сравнении с данными СКТ. Рентгенография обладает низкой диагностической возможностью и ее выполнение показано только для диагностики таких осложнений, как пневмо- или гидроторакс, гидроперикард, а также для контроля положения ЦВК, плевральных дренажей или интубационной трубки [137, 141, 142].
- Рекомендуется всем пациентам с диагнозом НБ с ФН в зависимости от клинических симптомов проведение: при болях в животе и/или задержке стула более 3-х дней - комплексное ультразвуковое исследование (УЗИ) внутренних органов; при признаках синусита - КТ придаточных пазух носа, гортани с диагностической целью [137].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
Комментарий: в зависимости от клинической ситуации проводятся эхокардиография (для исключения эндокардита), дуплексное сканирование вен верхних конечностей в проекции нахождения ЦВК (для исключения тромботических наложений, ассоциированных с ЦВК), КТ или МРТ органов брюшной полости, забрюшинного пространства, малого таза с контрастированием (для исключения поражения внутренних органов, кишечника), эзофагогастродуоденоскопия, колоноскопия (для исключения эрозивно-язвенного процесса, патологической инфильтрации, выявления источника кровотечения).
Иные диагностические исследования
- Рекомендуется всем пациентам с НБ и респираторной симптоматикой (клиникой ОРВИ) получение мазков со слизистой оболочки носоглотки и ротоглотки с проведением молекулярно-биологического исследования на респираторные вирусы: респираторно-синтициальный вирус, аденовирус, вирусы гриппа, метапневмовирус, вирусы парагриппа, риновирусы, бокавирус, коронавирусы, новую коронавирусную инфекцию COVID-19 [143 - 145].
Уровень убедительности рекомендации B (уровень достоверности доказательств 3)
Комментарий: определение респираторных вирусов можно проводить как методом ПЦР, так и с помощью выявления антигенов методом флюоресцирующих антител.
- Рекомендуется всем пациентам с НБ и ФБ при наличии симптомов мукозита, стоматита или гингивита с целью диагностики и последующей этиотропной терапии микробиологическое (культуральное) исследование отделяемого из полости рта, микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, а также молекулярно-биологическое исследование соскоба из носоглотки на вирус простого герпеса (Herpes simplex virus) [143 - 145].
Уровень убедительности рекомендации B (уровень достоверности доказательств 3)
- Рекомендуется всем пациентам с НБ при наличии диареи определение токсинов возбудителя диффициального клостридиоза (Clostridium difficile) в образцах фекалий, а также определение следующих маркеров вирусов, ассоциированных с диарейным синдромом: определение антигенов ротавирусов (Rotavirus gr.A) в образцах фекалий либо молекулярно-биологическое исследование фекалий на ротавирусы (Rotavirus gr.A), определение антигенов норовирусов (Norovirus) в образцах фекалий либо молекулярно-биологическое исследование фекалий на калицивирусы (норовирусы, саповирусы) (Caliciviridae (Norovirus, Sapovirus)), определение антигенов аденовирусов (Adenovirus) в образцах фекалий либо молекулярно-биологическое исследование фекалий на аденовирусы (Adenovirus). [146 - 148].
Уровень убедительности рекомендации A (уровень достоверности доказательств 2)
- Рекомендуется всем пациентам с диагнозом НБ при выявлении пневмонии проводить определение метаболитов грибов (галактоманнана) в жидкости БАЛ [149 - 152].
Уровень убедительности рекомендации A (уровень достоверности доказательств 2)
Комментарий: При невозможности выполнения бронхоскопии определение галактоманнана можно проводить в сыворотке крови.
- Рекомендуется всем пациентам с диагнозом НБ с фебрильной нейтропенией при наличии очагов в печени и/или других паренхиматозных органах определение метаболитов грибов в крови (маннановый антиген грибов рода кандида) и исследование уровня антител к антигенам растительного, животного и химического происхождения (антител к грибам рода кандида) для исключения диссеминированного/инвазивного кандидоза [153, 154].
Уровень убедительности рекомендации B (уровень достоверности доказательств 2)
- Рекомендуется всем пациентам с диагнозом НБ при подозрении на инфекцию центральной нервной системы определение антигена грибов рода Криптококкус (Cryptococcus spp) в спинномозговой жидкости [155].
Уровень убедительности рекомендации B (уровень достоверности доказательств 3)
Комментарий: для выявления криптококка могут выполняться иные методы, в том числе определение ДНК, микроскопия и др.
В связи с неспецифической клинико-радиологической картиной помимо криптококковой инфекции центральной нервной системы в диагностический поиск необходимо включать инвазивные микозы, токсоплазму, листерию, герпес-вирусы, микобактериозы, в том числе атипичные.
Лечение при фебрильной нейтропении
- Рекомендуется всем пациентам с диагнозом НБ с ФН инициировать эмпирическую терапию бета-лактамным антибактериальным препаратом (комбинации пенициллинов, включая ингибиторы бета-лактамаз; цефалоспорины третьего либо четвертого поколения) с активностью против грамположительных и грамотрицательных бактерий, включая синегнойную палочку. Выбор стартовой терапии зависит от группы риска, соматического состояния пациента, локальных эпидемиологических данных и рекомендаций, а также результатов скрининга и предшествующего инфекционного анамнеза пациента [126, 128, 129, 156 - 159].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
Комментарии: назначение антибактериальных препаратов системного действия проводится незамедлительно после взятия крови для гемокультивирования, введение осуществляется только внутривенно.
Антибиотики, парентеральное введение.
- Рекомендуется всем пациентам с диагнозом НБ стандартной группы риска назначение цефалоспоринов (ЦФ) третьего поколения [158, 159].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
- Рекомендуется всем пациентам с диагнозом НБ высокой группы риска в случае стабильного клинического состояния (адекватный уровень сознания, нормальные показатели гемодинамики, отсутствие клиники локальной инфекции) назначение бета-лактамных антибактериальных препаратов (комбинации пенициллинов, включая ингибиторы бета-лактамаз; цефалоспорины четвертого поколения) в режиме монотерапии. Дополнительно может быть рекомендован аминогликозид и/или антибиотик гликопептидной структуры в зависимости от клинической картины, локальных рекомендаций и колонизации пациента [123, 125, 126, 128, 133, 135 - 137].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
Комментарии: модификацию противомикробной терапии проводят на основании клинических симптомов, результатов инструментальных и микробиологических исследований. При сохранении фебрилитета и стабильном клиническом состоянии пациентов допустимо ожидать клинического ответа на стартовую антибактериальную терапию в течение 48 - 72-х часов, поскольку лихорадка не является единственным показателем тяжести инфекционного процесса. Назначение карбапенемов в качестве антибактериальных препаратов системного действия первой линии при фебрильной нейтропении обосновано у пациентов с тяжелыми инфекциями, при поражении брюшной, параректальной областей, при развитии сепсиса.
- Рекомендуется пациентам с НБ и персистирующей ФН учитывать результаты микробиологических (культуральных) исследований кала на аэробные и факультативно-анаэробные микроорганизмы для назначения прецизионной антибактериальной терапии. В связи с высоким уровнем летальности пациентов с ФН при развитии грамотрицательного сепсиса, вызванного микроорганизмами, резистентными к действию антибиотиков (в том числе карбапенемам) необходимо назначать препараты резервной группы - колистиметат натрия, полимиксин В**, тигециклин**, #цефтолозан/тазобактам**, цефтазидим/авибактам** (в некоторых ситуациях в комбинации с азтреонамом**) [220, 228 - 231].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с НБ при развитии тяжелых инфекций, признаков сепсиса и септического шока назначение бета-лактамных антибактериальных препаратов наиболее широкого спектра действия (карбапенемов) в сочетании с аминогликозидами и ванкомицином**, пациентам с известной колонизацией - препараты группы резерва - в максимальных дозах, предпочтительно пролонгированными инфузиями в связи с нарушением клиренса и перераспределением жидкости в организме [160 - 163, 229 - 232].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии к антибактериальной терапии резерва:
· Колистиметат натрия - нагрузочная доза 100 тыс - 150 тыс Ед/кг, максимально 9 млн Ед, что эквивалентно дозе 8 - 10 мг/кг (максимально 720 мг) за 4 часа, далее по 50 тыс - 75 тыс Ед/кг каждые 12 часов (максимально 9 млн Ед/сут), что эквивалентно дозе 4,5 - 6,5 мг/кг каждые 12 часов (максимально 360 мг x 2 р/сут)
· Полимиксин В** 2,5 мг/кг/сут за 2 введения; у детей до 1 года 4 мг/кг/сут за 2 введения
· #Тигециклин** - нагрузочная доза 2 мг/кг (100 мг), далее по 1,2 мг/кг (50 мг) каждые 12 часов в первую очередь при осложненных инфекциях мягких тканей и осложненных интраабдоминальных инфекциях
· #Цефтолозан/тазобактам** 3 гр x 3 р/сут или 120 мг/кг/сут по цефталозану за 3 введения
· Цефтазидим + [авибактам**] 2,5 гр x 3 р/сут или детям старше трехмесяцев 150 мг/кг/сут по цефтазидиму или детям старше трех месяцев 120 мг/кг/сут по цефтазидиму за 3 введения, каждое введение 2 - 3 часаПри необходимости назначения #Цефтазидима + [авибактама**] в комбинации с #азтреонамом** препараты должны вводиться одновременно параллельными инфузиями.
При развитии инфекций, ассоциированных с грамположительной флорой, выбор антибактериальных препаратов должен проходить с учетом данных чувствительности и наибольшей эффективности в контексте конкретной клинической ситуации:
- При инфекции кровотока, эндокардите, инфекции, ассоциированной с инородным устройством предпочтение необходимо отдавать препаратам, обладающим бактерицидной активностью в отношении грам-положительных микроорганизмов - ванкомицину**, детям старше 1 года даптомицину** (8 - 10 мг/кг/сут за одно введение), цефтаролину фосамилу** (600 мг x 3 р/сут или 12 мг/кг x 3 р/сут);
- При развитии пневмонии - препаратам, обладающим большей биодоступностью в легкие - линезолиду** (600 мг x 2 р/сут или 10 мг/кг x 3 р/сут детям младше 12 лет), ванкомицину**;
- При поражении мягких тканей - линезолиду**, даптомицину**, тигециклину**, ванкомицину**
Эмпирическое назначение противогрибковых препаратов
- Рекомендуется всем пациентам с НБ проведение эмпирической противогрибковой терапии - при сохранении рефрактерной ФН в течение 96 - 120 часов, несмотря на проводимую антибактериальную терапию первой и второй линий и отсутствие очагов инфекции [137 - 139, 164, 165]:
- Каспофунгин** 70 мг в первые сутки, далее по 50 мг внутривенно 1 раз в сутки или 70 мг/м2 в первые сутки и далее по 50 мг/м2/сут) - детям старше трех месяцев
- Амфотерицина В [липосомальный] (3 мг/кг/сут за 1 введение)
- Альтернативными препаратами являются другие противомикробные препараты системного действия - эхинокандины - микафунгин** 100 мг один раз в сутки внутривенно или 2 - 4 мг/кг в сутки (детям первого месяца жизни при подозрении на инфекцию ЦНС доза может быть увеличена до 10 мг/кг/сут); анидулафунгин** - детям старше 1 месяца 200 мг в первые сутки, далее по 100 мг 1 раз в сутки или 3 мг/кг в первые сутки, далее 1,5 мг/кг/сутки (препарат выбора для пациентов с печеночной недостаточностью);
Уровень убедительности рекомендации B (уровень достоверности доказательств 2)
Комментарий для выбора эмпирической противогрибковой терапии необходимо принимать во внимание проводимую противогрибковую профилактику - дозу препарата, путь введения, при возможности - концентрацию в сыворотке крови. В случае предшествующего назначения пероральных форм препаратов и достижения терапевтической концентрации в крови, их следует отменить и назначить эмпирическую терапию противогрибковыми препаратами системного действия (из группы эхинокандинов или липосомальную форму амфотерицина В)., При выявлении концентрации ниже терапевтической, пероральные формы препаратов нужно отменить и детям старше двух лет назначить вориконазол** внутривенно с целью достижения эффективной концентрации. Если, несмотря на достижение терапевтической концентрации вориконазола** в крови, сохраняется стойкий фебрилитет, то необходимо перейти к стратегии эмпирической противогрибковой терапии. Продолжать эмпирическую терапию следует до выхода пациента из агранулоцитоза [165 - 168]. Амфотерицин В дезоксихолат в эмпирической терапии у детей не применяется.
Упреждающая и целенаправленная противогрибковая терапия
- Всем пациентам с НБ и выявленными признаками инвазивного микоза рекомендуется проведение упреждающей противогрибковой терапии. Данная стратегия осуществима только в клиниках с возможностью незамедлительного выполнения полного комплекса диагностических мероприятий (КТ органов грудной полости, бронхоскопия с последующим исследованием жидкости БАЛ, при необходимости - выполнение биопсии пораженных органов и тканей) НБ [137, 164 - 166].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5)
Терапия выбора при развитии кандидемии/инвазивного кандидоза:
- Рекомендуется при развитии кандидемии/инвазивного кандидоза всем пациентам с НБ назначение внутривенной терапии [156, 157, 164 - 167]:
- Каспофунгин в дозе 70 мг/м2 - 1 сутки (максимально 70 мг/сут), далее 50 мг/м2/сут (максимально 50 мг/сут) - детям старше трех месяцев
- Микафунгин** 100 мг один раз в сутки внутривенно или 2 - 4 мг/кг в сутки (детям первого месяца жизни доза может быть увеличена до 10 мг/кг/сут при подозрении на поражение ЦНС)
- Анидулафунгин** в дозе 200 мг в первые сутки, далее по 100 мг 1 раз в сутки или 3 мг/кг в первые сутки, далее 1,5 мг/кг/сутки - детям старше одного месяца (препарат выбора для пациентов с печеночной недостаточностью)
- Амфотерицин В [липосомальный] 3 мг/кг/сут
- Вориконазол** (детям 2 - 12 лет и менее 40 кг нагрузочная доза 18 мг/кг/сут за 2 введения - первые сутки, далее 16 мг/кг/сут за 2 введения; старше 12 лет - 12 мг/кг/сут за 2 введения первые сутки, далее 8 мг/кг/сут за 2 введения. Терапию вориконазолом** всегда начинают с внутривенных введений.
Уровень убедительности рекомендации C (уровень достоверности доказательств 5)
Комментарии: при выявлении у пациентов с НБ и фебрилитетом очагов в печени или других паренхиматозных органах необходимо исключать диссеминированный инвазивный кандидоз, для лечения которого используют противогрибковые препараты системного действия (из группы эхинокандинов или липидные/липосомальные формы амфотерицина В).).
Флюконазол** не рекомендован для назначения у пациентов c нейтропенией и/или при гемодинамической нестабильности [165].
Терапия выбора при развитии инвазивного аспергиллеза:
- При развитии инвазивного аспергиллеза (ИА) всем пациентам с НБ рекомендовано незамедлительное начало внутривенной противогрибковой терапии [165 - 171].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5)
Комментарий:
- Для детей старше двух лет препаратом первой линии является вориконазол** (начало терапии всегда с внутривенных форм с дальнейшим переходом при стабилизации процесса на пероральный прием. с определением концентрации вориконазола** в сыворотке крови с целью поддержания ее в терапевтическом диапазоне 1,0 - 4,0 мкг/мл [167, 168];
- #Изавуконазол в нагрузочной дозе 10 мг/кг x 3 р/сут в течение двух дней (максимально 200 мг), далее по 10 мг/кг/сут внутривенно или перорально - детям от 1 года; детям от 6 месяцев до 1 года разовая доза составляет 6 мг/кг (с аналогичным режимом введения) Контроль концентрации препарата в сыворотке крови не требуется. В связи с отсутствием регистрации педиатрических показаний является препаратом второй линии терапии [233, 234];
- Амфотерицин В [липосомальный] в дозе 3 - 5 мг/кг/сут;
- Комбинированная терапия вориконазол**/амфотерицин В [липидный комплекс] + препарат из группы другие противогрибковые препараты системного действия (каспофунгин**, микафунгин**, анидулафунгин)
Терапия назначается на длительный срок (до окончания действия факторов риска) - не менее 12 недель. При развитии инвазивного аспергиллеза на фоне предшествующей противогрибковой профилактики производными триазола и тетразола (вориконазол**, позаконазол) необходима смена класса препарата на липосомальный/липидный комплекс амфотерицина В. При развитии поражения ЦНС, почек препаратами с наилучшей биодоступностью являются вориконазол и #изавуконазол. При возобновлении действия факторов риска у пациента с ИА в анамнезе необходимо проведение вторичной противогрибковой профилактики эффективным ранее препаратом. [167 - 171].
Терапия выбора при развитии инвазивного мукормикоза:
Рекомендовано при развитии инвазивного мукормикоза всем пациентам с НБ незамедлительное проведение комбинированной терапии, включающей внутривенную противогрибковую терапию и хирургическое вмешательство [165, 172 - 174]:
Уровень убедительности рекомендации A (уровень достоверности доказательств 2)
- Амфотерицин В [липосомальный] в дозе 5 - 10 мг/кг/сут (при развитии церебрального поражения рекомендованы максимальные дозы);
- #Изавуконазол в нагрузочной дозе 10 мг/кг x 3 р/сут в течение двух дней (максимально 200 мг), далее по 10 мг/кг/сут. Контроль концентрации препарата в сыворотке крови не требуется. В связи с отсутствием регистрации педиатрических показаний является препаратом второй линии терапии [233, 234];
- Комбинированная терапия противогрибковыми препаратами системного действия: амфотерицин В [липосомальный] или [липидный комплекс] + позаконазол** или #изавуконазол +/- каспофунгин** (детям старше трех месяцев) может быть рассмотрена в качестве терапии спасения, второй линии терапии.
- Проведение хирургического вмешательства, мультидисциплинарная тактика ведения пациента.
- Позаконазол 15 - 20 мг/кг/сут (до 800 мг/сут за 4 приема). В связи с необходимостью мониторинга терапевтической концентрации препарата в сыворотке крови и крайне вариабельной фармакокинетикой предпочтительна таблетированная форма. Препарат назначается после стабилизации пациента, в том числе для долечивания и проведения вторичной профилактики.
7. Особенности венозного доступа в обеспечении успешных диагностических и лечебных мероприятий у детей
- Рекомендуется использование и уход за венозными катетерами осуществлять только обученными сотрудниками. Обучение должны проходить все вновь устраивающиеся на работу сотрудники. Ежегодный контроль знаний и навыков должны проходить все сотрудники, осуществляющие использование и уход за венозными катетерами, в том числе вспомогательные службы (лучевая диагностика, трансфузиология, анестезиология и реанимация) [175 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- При использовании и уходе за венозным катетером, при приготовлении инфузий рекомендуется выполнение асептической техники [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применять асептическую технику ANTT (Aseptic Non-Touch Technique) при использовании и уходе за венозным катетером, при приготовлении инфузий. Асептическая техника должна быть стандартизована, персонал должен быть обучен методам асептической техники [175 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется при использовании и уходе за венозным катетером проводить гигиеническую обработку рук путем втирания спиртосодержащего кожного антисептика или мытья с мылом и водой. Мытье с мылом и водой рекомендуется проводить в случае загрязнения рук или после контакта с пациентом, страдающим энтероколитом, вызванным спорообразующей флорой (клостридиальный колит) или норовирусом [176 - 180].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарий:
Гигиеническую обработку рук следует проводить:
- до/после контакта с пациентом,
- до/после контакта с инвазивным, в т.ч. инфузионным оборудованием,
- до/после процедур или манипуляций с катетером,
- после контакта с поверхностями в палате,
- после контакта с биологическим жидкостями,
- при переходе от более контаминированному к менее контаминированному участку одного пациента,
- после снятия перчаток.
- Рекомендуется для работы с катетером использовать нестерильные перчатки. При прямом контакте с ключевыми зонами (согласно правилам асептической техники ANTT) используйте стерильные перчатки (например, смена повязки ЦВК, пункция резервуара катетера Порт) [176 - 180].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Рекомендуется применение дополнительных инфузионных устройств, например:
- удлинителя катетера - с целью удлинения катетера, работы на удалении от пациента, для фиксации катетера, применения зажима,
- безыгольного коннектора - с целью применения инфузионной истемы в закрытом виде,
- инфузионных фильтров,
- трехходового крана или блока кранов - с целью увеличения количества инфузионных доступов и др. [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применение интегрированных (спаянных или собранных) дополнительных инфузионных устройств или применение дополнительных инфузионных устройств с люер-лок соединением [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять дополнительные инфузионные устройства вместе с инфузионной системой, а также в случае повреждения материала, загрязнения, нарушения проходимости и согласно рекомендациям производителя устройства [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применение безыгольных коннекторов на всех портах (канюлях) люер соединений катетера и инфузионной системы, в т.ч. дополнительных устройств [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять безыгольный коннектор вместе с инфузионной системой, а также в случае его отсоединения, повреждения, загрязнения, нарушения проходимости, перед взятием крови из катетера на гемокультивирование и согласно рекомендациям производителя устройства [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется закрывать зажим на катетере перед отсоединением устройств от катетера и смене инфузионной системы с целью профилактики воздушной эмболии [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: в случае утраты зажима на ЦВК и при длительном применении ПВК требуется использование зажима, что можно обеспечить применением удлинителя катетера. Удлинитель катетера обеспечивает в том числе возможность асептического применения катетера, применения техники положительного давления при закрывании катетера, что предупреждает рефлюкс крови в катетер.
- Рекомендуется проведение "Хлоргексидинового душа" у пациентов (в том числе детей) с установленным ЦВК для профилактики катетер-ассоциированных инфекций кровотока (КАИК) [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: "хлоргексидиновый душ" проводится путем ежедневного обтирания кожи пациента водным раствором хлоргексидина биглюконата 2%.
- Не рекомендовано системное применение антикоагулянтов с целью профилактики тромботической окклюзии катетера [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Инфузионная система.
- Рекомендуется менять непрерывную инфузионную систему не чаще, чем 1 раз в 7 дней, (кроме инфузионных линий для введения компонентов крови, парентерального питания, липидов), а также в случае повреждения материала, дисфункции и при смене катетера [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять прерывающуюся инфузионную систему и прерывающиеся вторичные инфузионные линии каждые 24 ч [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять всю инфузионную систему (если препарат вводился через первичную инфузионную линию) и вторичные инфузионные линии (если препарат вводился через вторичную инфузионную линию), используемые для введения компонентов крови, парентерального питания, липидов с частотой:
- кровь и ее компоненты - при удалении/ смене пакета [181],
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
- пропофол - каждые 6 - 12 ч [176 - 179],
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- парентеральное питание - каждые 24 ч, при ручном введении липидов в пакет - при смене пакета [176],
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- липидная эмульсия - каждые 12 ч [176,179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Рекомендации по использованию катетера.
- Рекомендуется проводить антисептическую обработку порта (канюли) катетера/ мембраны безыгольного коннектора/ инъекционного порта перед каждым доступом к катетеру спиртосодержащим антисептиком с хлоргексидином биглюконатом не менее 0,5% или без него [176-179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется перед каждым доступом к катетеру проводить проверку функционировании: аспирация закрывающего раствора с последующей утилизацией и промывание катетера [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Функционирование (работоспособность) катетера - это способность свободно аспирировать кровь из просвета катетера и вводить инфузии в просвет катетера.
Признаки нарушения функционирования (работоспособности) катетера - это признаки окклюзии:
- обратный ток крови через катетер медленный или затрудненный, или полностью отсутствует,
- при введении инфузии (промывании) ощущается сопротивление или отсутствие возможности введения инфузии (промывания) (при использовании инфузионного насоса появляются частые сигналы о высоком давлении),
- в зоне входного отверстия появляется припухлость или подтекание инфузии.
В случае нарушения работоспособности катетера рекомендуется следовать алгоритму ведения катетера и разрешения окклюзии согласно внутреннему регламенту [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется восстанавливать работоспособность катетера, что более предпочтительно, чем его удаление, за исключением случаев наличия противопоказаний к тромболитической терапии, сепсиса, вызванного пленкообразующими возбудителями (золотистый стафилококк, кандида, синегнойная палочка) [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применение следующих тромболитиков/фибринолитиков для восстановления работоспособности ЦВК в случае тромботической окклюзии [176-180]:
- тканевой активатор плазминогена (Алтеплаза) - 1 мг/мл, макс. доза 4 мг,
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Урокиназа 5000 ед/мл,
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- препараты на основе Тауролидина с Урокиназой 5000 ед/мл,
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Ретеплаза, Тенектеплаза, Альфимепраза.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 2)
- Рекомендуется вводить тромболитики/фибринолитики в объеме, аналогичном рекомендованному для закрывающих растворов (1 объем внутреннего просвета катетера плюс объем дополнительных устройств плюс 10% (в педиатрии)/20% (у взрослых) от полученного объема) [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У детей весом менее 30 кг рекомендуется введение тромболитика/фибринолитика в объеме 110% от объема внутреннего просвета катетера [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Промывание.
- Рекомендуется проводить промывание ЦВК и ПВК при проверке функционирования катетера (после удаления закрывающего раствора) перед осуществлением доступа к катетеру, после каждого введения лекарственного препарата и после взятия крови на анализ [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется для промывания ЦВК и ПВК использовать шприцы объемом не менее 10 мл или с диаметром поршня, как у шприца объемом 10 мл (5С) [175, 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется промывать ЦВК и ПВК стерильным физиологическим раствором (раствор натрия хлорида NaCl 0,9%) [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в случае несовместимости лекарственного препарата с физиологическим раствором для промывания ЦВК и ПВК использовать раствор глюкозы 5%, а затем физиологический раствор [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применять растворы для промывания катетера в индивидуальной или одноразовой упаковке [176, 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: рекомендуется применять однодозовые флаконы/ ампулы, одноразовое применение флаконов большого объема или преднаполненные стерильные шприцы.
- Рекомендуется промывать ЦВК и ПВК техникой "старт-стоп" [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Рекомендуется промывать катетер прерывистыми болюсами по 1 мл с короткой паузой.
- Рекомендуется плановое промывание неиспользуемых ЦВК и ПВК (замена закрывающего раствора) с частотой, предписанной согласно рекомендациям производителя катетера или закрывающего раствора [177 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется промывать неиспользуемый ПВК (в т.ч. Мидлайн) каждые 24 часа [175, 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в детской онкологической практике промывать неиспользуемый катетер Порт каждый месяц [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется промывать неиспользуемый катетер Порт с установленной иглой Губера ежедневно [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Закрывание/отключение.
- Рекомендуется при отключении катетера/ канала катетера (ЦВК и ПВК) закрывать его новой стерильной заглушкой (колпачком) [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Безыгольный коннектор нельзя закрывать заглушкой, это повреждает его конструкцию.
- Рекомендуется при отключении ЦВК и ПВК (катетер не используется, на паузе в эксплуатации) вводить в каждый канал/резервуар катетера Порта закрывающий раствор [175, 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: рекомендуется вводить закрывающие растворы в объеме, не превышающем 1 объем внутреннего просвета катетера плюс объем дополнительных устройств плюс 10% (в педиатрии)/20% (у взрослых) от полученного объема.
- Рекомендуется для рутинного закрывания ПВК (в т.ч. Мидлайна) в педиатрической практике в качестве закрывающего раствора применять стерильный физиологический раствор натрия хлорида** 0,9% или раствор гепарина натрия** 0,5-10 Ед/мл [175].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется для рутинного закрывания ЦВК в педиатрической практике в качестве закрывающего раствора применять стерильный физиологический раствор натрия хлорида** 0,9%** или раствор гепарина натрия** в концентрации, рекомендованной производителем катетера [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в детской онкологической практике для рутинного закрывания ЦВК в качестве закрывающего раствора применять стерильный физиологический раствор NaCl 0,9% и закрывающие растворы на основе Тауролидина [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется для рутинного закрывания катетера Порт в качестве закрывающего раствора применять стерильный физиологический раствор NaCl 0,9% или раствор гепарина натрия** 100 Ед/мл или согласно рекомендациям производителя катетера [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется по показаниям в качестве закрывающего раствора применять закрывающие растворы с антибактериальным препаратовм системного действия или антисептическим [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Показаниями являются лечение и профилактика КАИК у пациентов с долгосрочными ЦВК в случае множественных случаев КАИК в анамнезе, у пациентов с высоким риском развития КАИК.
- Рекомендуется в качестве закрывающего раствора применять антибактериальные препараты системного действия в высокой концентрации широкого спектра действия [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в качестве закрывающего раствора применять антисептические закрывающие растворы, включающие этиловый спирт 70%, препараты на основе тауролидина, цитрата натрия, высоко концентрированный раствор натрия хлорида [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Перед применением закрывающих растворов по показаниям необходимо оценить их системное действие и совместимость этилового спирта с материалом катетера
- Рекомендуется применять технику положительного давления (антирефлюксная техника) при введении закрывающих растворов в ЦВК и ПВК с целью предотвращения рефлюкса крови в дистальный конец катетера [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Для поддержания положительного давления в катетере оставляйте небольшое количество закрывающего раствора в шприце перед его отсоединением или закрывайте зажим на катетере одновременно вводя последние 0,5 мл закрывающего раствора. Учитывайте антирефлюксные характеристики катетера и безыгольного коннектора.
- Рекомендуется удалять из катетера закрывающие растворы в объеме, введенном в катетер (1 объем внутреннего просвета катетера плюс объем дополнительных устройств плюс 10% (в педиатрии)/20% (у взрослых) от полученного объема). Удаление закрывающего раствора является этапом проверки функционирования катетера перед осуществлением доступа к нему [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применять растворы для рутинного закрывания катетера в индивидуальной или одноразовой упаковке [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Рекомендации по уходу за катетером
Фиксация.
- Рекомендуется фиксировать венозный катетер. Для фиксации ЦВК рекомендуется использовать бесшовные фиксаторы: самоклеящийся накожный фиксатор или тканевой клей (цианакрилатный клей) [176, 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Не рекомендуется использовать шовную фиксацию по причине высокого риска инфекционных осложнений [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Фиксация катетера профилактирует осложнения, связанные с дислокацией катетера и движениями катетера, снижает частоту флебита и тромбоза, снижает вероятность инфицированию раны входного отверстия и КАИК.
При отсутствии фиксирующих устройств для фиксации может использоваться нестерильный рулонный пластырь матовый или прозрачный (в зависимости от вида стерильной повязки), а также безадгезивные бинты (трубчатый, самофиксирующийся эластичный бинт). Бинты обеспечивают низкий уровень фиксации.
Смена фиксирующих устройств проводится согласно рекомендациям производителя или во время смены повязки.
- Рекомендуется для фиксации иглы Губера катетера Порт подсоединять удлинитель катетера или использовать иглы Губера с интегрированными удлинителями [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется Ддя фиксации длительно используемого ПВК подсоединять удлинитель катетера [175].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Использование удлинителя позволяет зафиксировать катетер, исключает микродвижения катетера, позволяет работать с катетером через порт (канюлю) удлинителя. Использование удлинителя снижает частоту флебита, тромбоза, дислокации, инфицирования раны входного отверстия. Рекомендовано применение интегрированных ПВК (конструкция катетера имеет удлинитель).
- Рекомендуется для фиксации длительно используемого ПВК применение цианакрилатного клея [175].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется для фиксации длинного ПВК и Мидлайна использовать самоклеящийся накожный фиксатор [177].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Смена повязки.
- Рекомендуется на рану входного отверстия ПВК и ЦВК накладывать стерильную повязку [175 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
- Рекомендуется применять 2 вида стерильных повязок:
1) безадгезивная стерильная марлевая салфетка,
2) адгезивная:
- прозрачная полиуретановая с/без хлоргексидином,
- непрозрачная из нетканого материала.
Выбор повязки зависит от: типа катетера, вероятности кровотечения и инфекции раны входного отверстия, состояния кожи, аллергии или чувствительности на тот или иной тип повязки, предпочтений пациента, длительности фиксирующих свойств повязки в зависимости от типа кожи, простоты смены. Предпочтение следует отдавать той повязке, с которой будет ассоциироваться минимальная вероятность осложнений, поскольку частая смена повязок увеличивает риск инфицирования.
- Рекомендуется использовать безадгезивную стерильную марлевую салфетку только по показаниям: отделяемое из раны, пациент сильно потеет, непереносимость адгезивных повязок, повреждение кожи [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применять прозрачные полиуретановые повязки, импрегнированные хлоргексидином, для профилактики КАИК у пациентов старше 2 месяцев, в том числе у онкогематологических пациентов [177 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Противопоказаниями к применению являются чувствительность или аллергия на хлоргексидин (2%), кожные заболевания, обильная эксудация.
- Рекомендуется применять прозрачные полиуретановые повязки, импрегнированные хлоргексидином, для профилактики КАИК у пациентов с катетером Порт при использовании иглы Губера в течение более 4 - 6 часов [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применять прозрачные полиуретановые повязки, импрегнированные хлоргексидином, для профилактики КАИК у пациентов с катетером для гемодиализа [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано применение стерильных повязок с серебром для профилактики КАИК у пациентов отделений реанимации интенсивной терапии [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется при кровотечении из раны входного отверстия использовать гемостатическую губку под стерильную повязку или цианакрилатный клей [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять адгезивные стерильные повязки на ЦВК не реже 1 раза в 7 дней (кроме новорожденных), а также по показаниям:
- отклеивание, в т.ч. частичное края,
- визуальное загрязнение,
- конденсат под повязкой,
- отделяемое/ кровь в области раны входного отверстия,
- намокание,
- признаки нарушения целостности кожи под повязкой,
- необходимость визуализации под матовой повязкой (только в случае локальной болезненности или других признаках местной инфекции, в остальных случаях для оценки используйте пальпацию) [176 - 179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Не рекомендуется у новорожденных пациентов менять повязки ЦВК в плановом порядке, только по показаниям (загрязнение, намокание, отклеивание с отсутствием фиксации) из-за риска смещения катетера, дискомфорта пациента, повреждения кожи [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять безадгезивные марлевые повязки каждые 2 дня, а также по показаниям: намокание, визуальное загрязнение, повязка сместилась или отклеилась [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять адгезивные повязки на ПВК каждые 5 - 7 дней и по показаниям (загрязнение, намокание, отклеивание с отсутствием фиксации) [175].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется во время смены повязки у ЦВК и ПВК проводить антисептическую обработку раны входного отверстия и кожи вокруг нее [176-179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется антисептическую обработку раны входного отверстия и кожи вокруг нее проводить спиртосодержащим кожным антисептиком с содержанием хлоргексидина биглюконата не менее 2% [175, 176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется при непереносимости хлоргексидина использовать спиртосодержащие антисептики без хлоргексидина. При непереносимости спирта рекомендуется использовать антисептики на водной основе: повидон йод, водный раствор хлоргексидина биглюконата не менее 2% [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у новрожденных использовать спиртосодержащие антисептики без хлоргексидина, антисептики на водной основе: повидон йод, водный раствор хлоргексидина биглюконата не менее 2% [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется удалять волосы в области раны входного отверстия при помощи индивидуальных/чистых ножниц или хирургического клипера с одноразовыми стерильными съемными насадками. Брить волосы бритвой с лезвием не рекомендуется.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Не рекомендуется применять антибактериальные мази, кремы, порошки на рану входного отверстия ЦВК [179].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется применять антибактериальные мази (на основе повидон-йода, бацитрацина, грамицидина, полимиксина В) на гемодиализный катетер согласно инструкции производителя катетера, если не используется повязка с импрегнированным хлогексидином. Мазь необходимо накладывать после имплантации катетера и после каждой процедуры гемодиализа [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Катетер Порт.
- Рекомендуется доступ к катетеру Порт осуществлять только при помощи бескерновой иглы Губера [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется иметь иглы Губера разной длины для адекватного позиционирования в резервуаре и предотвращения дислокации иглы [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется при использовании катетера Порт рану входного отверстия иглы Губера закрывать стерильной повязкой [176 - 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется производить выбор и смену повязок катетера Порт аналогично другим ЦВК [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется проводить антисептическую обработку раны входного отверстия иглы Губера и кожи вокруг нее перед каждой установкой иглы Губера [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется менять иглу Губера с частотой, указанной в инструкции к игле, или согласно внутренним регламентам медицинской организации. Рекомендаций относительно частоты смены иглы Губера при непрерывной инфузии нет [176-180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в детской онкологической практике менять иглу Губера каждые 7 дней [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий:
Смену иглы Губера удобно совмещать со сменой повязок.
Удаление катетера.
- Не рекомендовано рутинное удаление и переустановка ЦВК и ПВК при отсутствии показаний (Приложение А.5) [175].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии:
Не проводите рутинное микробиологическое исследование удаленных ЦВК и ПВК при отсутствии подозрения на КАИК.
8. Трансфузионная поддержка
- Рекомендовано детям с диагнозом НБ, получающими химио- и/или лучевую терапию, при тяжелой анемии (Нв 70 г/л, Ht 25%) с проявлениями симптомов и признаков анемической гипоксии и без кровотечений трансфузии эритроцитных компонентов крови [183].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Трансфузии могут не потребоваться для хорошо компенсированных пациентов, восстанавливающихся после индуцированной аплазии. Однако, в случае предстоящей интенсивной химиотерапии в отсутствии клинических проявлений анемического синдрома трансфузии эритроцитных компонентов крови могут быть оправданы. Решение о применении трансфузий должно обосновываться, прежде всего, клиническими, а не лабораторными данными [184, 185].
- Рекомендовано детям с диагнозом НБ в отсутствие кровотечений проводить трансфузии эритроцитных компонентов в дозе 10-15 мл на кг массы тела [186, 187].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано пациентам с диагнозом НБ проводить трансфузии лейкоредуцированных компонентов крови [186].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: было показано, что применение лейкоредуцированных компонентов крови позволяет снизить частоту фебрильных негемолитических трансфузионных реакций, а также существенно снижает вероятность HLA-аллоиммунизации пациента и передачу некоторых гемотрансмиссивных инфекций (цитомегаловирус, вирус Эбштейн-Барра).
- Рекомендовано пациентам с диагнозом НБ с целью предотвращения посттрансфузионной реакции трансплантат против хозяина, пациентам со злокачественными заболеваниями, получающими химио- и/или лучевую терапию и находящимися в иммуносупрессии проводить трансфузии клеточных компонентов крови, облученных ионизирующим излучением в дозе 25 Гр [186].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано детям диагнозом НБ и гипопролиферативной тромбоцитопенией, вызванной основным заболеванием и/или его лечением, профилактические трансфузии тромбоцитного концентрата при следующих условиях [187]:
- стабильным новорожденным при снижении количества тромбоцитов ![]() 25 x 109/л;
25 x 109/л;
- стабильным пациентам при снижении количества тромбоцитов ![]() 10 x 109/л;
10 x 109/л;
- пациентам с лихорадкой при снижении количества тромбоцитов ![]() 15 x 109/л;
15 x 109/л;
- у пациентов с повышенным риском кровотечений при снижении количества тромбоцитов ![]() 20 x 109/л;
20 x 109/л;
- перед выполнением малой хирургической манипуляции в некритических локусах при снижении количества тромбоцитов ![]() 20 x 109/л;
20 x 109/л;
- перед выполнением люмбальной пункции, при снижении количества тромбоцитов ![]() 40 x 109/л;
40 x 109/л;
- перед выполнением чрезкожной биопсии печени, если количество тромбоцитов ![]() 50 x 109/л;
50 x 109/л;
- при хирургических вмешательства в критических сайтах (например, центральная нервная система), если количество тромбоцитов ![]() 75 - 100 x 109/л;
75 - 100 x 109/л;
- перед иными оперативными вмешательствами при количестве тромбоцитов ![]() 50 x 109/л
50 x 109/л
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: повышенный риск кровотечений имеют пациенты получающие антикоагулянты, пациенты с ДВС, сепсисом и др.
- Рекомендовано детям с диагнозом НБ с гипопролиферативной тромбоцитопенией и геморрагическим синдромом трансфузии тромбоцитного концентрата [187]:
- малом геморрагическом синдроме и снижении количества тромбоцитов ![]() 10 x 109/л;
10 x 109/л;
- умеренном геморрагическом синдроме и снижении количестве тромбоцитов ![]() 20 x 109/л;
20 x 109/л;
- тяжелом геморрагическом синдроме и снижении количестве тромбоцитов ![]() 30 x 109/л;
30 x 109/л;
- при кровотечении в критически важной локализации (например, ЦНС) синдроме и снижении количестве тромбоцитов ![]() 100 x 109/л
100 x 109/л
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано пациентам с диагнозом НБ трансфузии тромбоцитов в следующей дозе [187]:
- новорожденные 10-15 мл/кг
- дети с массой тела более 10 кг: 10 мл/кг
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано пациентам с диагнозом НБ затяжной нейтропенией (количество нейтрофилов менее 200/мкл) при наличии тяжелой бактериальной или грибковой инфекции, неподдающейся лечению адекватной противомикробной терапией трансфузии гранулоцитного концентрата детям [186].
- Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендован пациентам с диагнозом НБ трансфузии донорской плазмы крови при наличии клинически-значимого кровотечения в сочетании с повышением активированного частичного тромбопластинового времени (АЧТВ) и/или международного нормализованного отношения (МНО) более чем в 1,5 раза от верхней границы нормы [186].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано пациентам с диагнозом НБ трансфузии донорской плазмы в дозе 15 мл/кг массы тела [186].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано пациентам с диагнозом НБ трансфузии криопреципитата при снижении концентрации фибриногена менее 1 - 1.5 г/л [188 - 192].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: трансфузии криопреципитата при приобретенном дефиците фибриногена, вызванном различными причинами, рекомендуются при снижении его концентрации в сыворотке менее 1 г/л. Трансфузии криопреципитата при снижении его концентрации в крови ниже 1,5 г/л рекомендованы для пациентов с острым промиелоцитарным лейкозом, при тяжелом интраоперационном кровотечении и у пациентов с сепсисом при развитии геморрагического синдрома.
- Рекомендовано пациентам с диагнозом НБ трансфузии криопреципитат в дозе 1 единица на каждые 5 кг массы тела больного [10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
9. Диагностика и лечение венозных тромбозов
- Рекомендовано у детей с НБ и подозрением на венозный тромбоз применять методы визуализации в соответствии с локализацией предполагаемого тромбоза (УЗИ, МРТ) [193, 194 - 196].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии.
В настоящее время отсутствуют специфические рекомендации по выбору того или иного метода визуализации у детей с подозрением на тромбоз в зависимости от возраста и локализации предполагаемого тромбоза. При выборе метода визуализации необходимо ориентироваться на доступность метода, а также рекомендации, принятые у взрослых пациентов. Так для выявления тромбоза вен верхних и нижних конечностей, а также подмышечной, подключичной и внутренней яремной вен показано применять ультразвуковые методы диагностики, например, ультразвуковую допплерографию (УЗДГ). При этом, при сохранении клинических признаков тромбоза вен голени и негативных результатах УЗДГ, рекомендовано повторить УЗДГ через неделю в целях исключения распространения тромбоза вен голени. При подозрении на проксимальное распространение тромбоза бедренной вены, возможно использовать магнитно-резонансную венографию. Для диагностики тромбоза центральных вен, рекомендовано использовать метод контрастной магнитно-резонансной венографии. В случае невозможности использования данного метода диагностики, возможно применение мульти-детекторной компьютерно-томографической венографии. Для диагностики тромбоэмболии легочной артерии (ТЭЛА) проведение КТ-ангиографии легких. при наличии противопоказания к ведению йод-содержащего контраста или рентгеновскому излучению возможно применение метода МР-ангиографии. Для диагностики тромбоза центральных венозных синусов (ТЦВС) показано провести МРТ с использованием Т2* и ангио- режимов. При невозможности ургентной диагностики с использованием МРТ, возможно применение контрастной КТ-венографии. При подозрении на тромбоз, локализованный в области камер сердца возможно проведение эхокардиографии.
- Не рекомендовано проводить рутинное обследование пациентов, направленное на выявление асимптоматического ЦВК-ассоциированного тромбоза [196, 198, 199, 200, 201].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: асимтоматические (инцедентальные) венозные тромбозы у детей достаточно часто встречаются у детей, особенно, в случаях длительного использования ЦВК. Рекомендация не использовать рутинное обследование пациентов для выявления асимптоматического ЦВК-ассоциированного тромбоза основана на том, что выявление такого тромбоза может влиять на терапию основного заболевания, а также приводить к необоснованному повышению риска геморрагических осложнений.
Лабораторные методы диагностики венозных тромбозов у детей.
- Не рекомендовано использовать результаты лабораторных исследований как единственный облигатный маркер венозного тромбоза у детей [202 - 204, 194, 195, 205, 206 - 208, 209 - 210].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии:
В настоящее время отсутствуют крупные проспективные исследования, позволяющие связать изменения в коагулологических методах исследования с наличием тромба. Учитывая, что подавляющее большинство тромбозов у детей носят спровоцированный характер, изменения со стороны таких показателей как АЧТВ, ПВ, фибриноген, концентрация D-димеров, волчаночного антикоагулянта, протеинов C, S, антитромбина, активности факторов свертывания, а также изменения со стороны глобальных методов оценки системы гемостаза (тромбодинамика, тромбоэластография, тромбоэластометрия, тест генерации тромбина) и тромбоцитов (агрегация тромбоцитов, цитофлуориметрия, микроскопия) могут потенциально быть следствием течения основного заболевания и/или его осложнения, а не тромбоза. Единственнымметодом позволяющим выявить венозный тромбоз у ребенка является визуализация (УЗИ, УЗДГ, МРТ, МР-ангиография, КТ, КТ-ангиография, рентгенография, ангиография) метод которой будет зависеть от локализации предполагаемого венозного тромбоза.
В случае выявления венозного тромбоза рекомендовано проводить коагулологическое исследование (коагулограмма, антитромбин), исследование общего (клинического) анализа крови с подсчетом количества тромбоцитов [194, 195, 211, 212].
Выявление подлежащего дефицита антитромбина или коагулопатии может влиять на выбор препарата для профилактики и лечения тромбоза и влиять на его дозирование и показатели, используемые при мониторинге антитромботической терапии и профилактики.
Лечение венозного тромбоза.
- Рекомендовано при выявлении симптоматического венозного тромбоза глубоких вен проводить антитромботическую терапию и/или профилактику [194, 195, 198, 199, 201 - 205, 213 - 219].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии.
Выбор терапевтического агента и режима терапии будет зависеть от локализации, степени выраженности явлений венозной недостаточности, состояния пациента и наличия противопоказаний к тому или иному виду терапии. В большинстве случаев нежизнеугрожающего тромбоза может применяться антикоагулянтная терапия или вторичная антитромботическая профилактика препаратами низкомолекулярного или нефракционированного гепарина. Терапия препаратом из группы низкомолекулярных гепаринов натрия начинается со стартовой дозы 100 МЕ/кг в виде подкожных инъекций через каждые 12 часов. У первых 6 месяцев жизни стартовая доза составляет 150 МЕ/кг. В некоторых случаях может применяться внутривенное введение низкомолекулярного гепарина, однако при таком подходе следует учитывать сокращение периода полувыведения препарата вследствие внутривенного пути введения. В тех случаях, когда имеются риски кровотечений или коагулологических нарушений, а также случаях, когда необходима стабильная управляемая фармакокинетика препарата, рекомендуется использовать продленную внутривенную инфузию нефракционированного гепарина** под контролем показателей коагулограммы и/или анти-Ха активности. Также возможно применение фондапаринукса. При необходимости проведения длительной вторичной антитромботической профилактики возможно применение пероральных антикоагулянтов (варфарин**, ривароксабан**) в возрастных дозах. В случаях применения варфарина** обязателен контроль МНО с целью поддержания целевых значений антикогауляции. В редких ситуациях когда возникший тромбоз угрожает состоянию пациента или его жизни необходимо рассматривать применение тромболитической терапии (проурокиназа**, алтеплаза**, тенектеплаза**) или хирургической тромбэктомии с обязательной сопроводительной терапией, в том числе, препаратами крови (СЗП, криопреципитат), а также факторами свертывания крови (факторы свертывания крови II, VII, IX, X в комбинации) **, эптаког альфа (активированный)** и факторами противосвертывающей системы (антитромбин III человеческий, протеин С человеческий). В случае выявления резистентности к проведению антикоагулянтной терапии нефракционированным или низкомолекулярным гепарином**, а также фондапаринуксом, показана оценка активности антитромбина и, при ее снижении, заместительная терапия концентратом антитромбина III человеческого.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам с НБ на всех этапах терапии заболевания, а также после завершения лечения рекомендуется комплексная реабилитация, а также при необходимости сопроводительная терапия для улучшения результатов лечения и качества жизни пациента, в зависимости от коморбидной патологии и осложнений основной терапии [55].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: реабилитация пациентов должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия психологов. Программы реабилитации разрабатываются индивидуально в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем. Реабилитация при возникновении осложнений заболевания и лечения проводится в рамках соответствующих нозологий. Врач - детский онколог по месту жительства руководствуется рекомендациями, которые даны специалистами учреждения, проводившего лечение.
Объем, длительность и характер реабилитационных мероприятий зависит от возраста пациента на момент постановки первичного диагноза и времени проведения реабилитационных мероприятий, объема проведенного лечения (полихимиотерапия, хирургия, лучевая терапия, высокодозная полихимиотерапия и ауто-ТГСК и др.), сопутствующей патологии как обусловленной НБ (эпидуральная компрессия, синдром опсоклонус-миоклонус и др.), так состояниями не связанными с опухолью (врожденный порок сердца и др.).
Начало реабилитационных мероприятий зависит от стадии, группы риска и начинается на этапах проведения первичной полихимиотперапии и продолжается после ее окончания на всех этапах динамического наблюдения.
Реабилитационные мероприятия проходят под контролем врача-детского онколога из медицинской организации, где пациент получал все основные этапы терапии.
Реабилитация делится на медицинскую, психологическую, социальную и др.
В программе принимают участие педагоги (дошкольного и школьного образования), социальные работники, психологи и врачи разных специальностей (реабилитологи, неврологи, эндокринологи, кардиологи, ортопеды и т.д.).
Реабилитация проводится в региональных центрах на базе поликлиник и в специализированных лечебно-реабилитационных центрах.
Кратность реабилитации 2 - 3 раза в год и может быть увеличена в зависимости от психосоматического статуса пациента.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
План динамического наблюдения для пациентов с НБ.
- Рекомендуется пациентам с установленным диагнозом нейробластомы на фоне проведения полихимиотерапии проведение профилактических мероприятий [56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии:
Профилактика инфекции Pneumocystis carinii [57]:
a) #Ко-тримоксазол [Сульфаметоксазол+Триметоприм] в дозе 150/750 мг/м2 /день, что эквивалентно 5 мг/кг/день по триметоприму 2 - 3 дня в неделю (суббота, воскресенье или понедельник, среда, пятница)
b) Дезинфекция кожи: ежедневное мытье под душем или обтирание водным раствором хлоргексидина**, обработка мацерации и повреждении раствором бриллиантового зеленого**.
c) Необходима ежедневная дезинфекция места пребывания пациента с помощью дезрастворов, бактерицидных ламп, при наличии агранулоцитоза - ежедневная смена постельного и нательного белья.
d) Обязательна личная гигиена родителеи и посетителеи, мытье рук персонала при входе в палату (бокс).
- Рекомендуется проведение динамического обследования и наблюдения за пациентами с нейробластомой группы наблюдения после завершения специфической терапии [13, 58, 59].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: у пациентов группы наблюдения через 3 мес. от операции или окончания ПХТ проводится контрольное обследование, включающее оценку уровня онкомаркеров (НСЕ, ферритин, ЛДГ), УЗИ пораженной области, МСКТ/МРТ пораженной анатомической области с КУ, сцинтиграфию с 123I-МЙБГ (при инициально МЙБГ-позитивных опухолях) или ПЭТ/КТ с ФДГ (при инициально МЙБГ-негативных опухолях или если ПЭТ/КТ с ФДГ выполнялось при постановке диагноза) или другие радиоизотопные методы исследования (если они выполнялись при постановке диагноза) (табл. 5.1, 5.2). В целях минимизации лучевой нагрузки предпочтительным являлось выполнение МРТ. Последующий алгоритм наблюдения различался в
Таблица 5.1. Комплексный клинико-лабораторный и инструментальный мониторинг пациентов с нейробластомой группы наблюдения при отсутствии остаточной опухоли после операции
Обследование
1 год
2 - 5 лет
Более 5 лет
Клинический осмотр детского онколога, педиатра
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Метаболиты катехоламинов мочи (ГВК, ВМК, дофамин) (при доступности методики)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Общий анализ (клинический) крови
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Анализ крови биохимический общетерапевтический (с обязательным определением уровня ЛДГ)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Оценка уровня кортизола (при билатеральном поражение надпочечников)
Каждые 6 мес.
Каждые 12 мес.
Каждые 12 мес.
Онкомаркеры (НСЕ, ферритин)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
УЗИ органов брюшной полости/рентгенография органов грудной клетки <*>
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Оценка функции внешнего дыхания/ЭКГ/ЭХО-КГ
(после выполнения торакальных операций)
1 раз в год
1 раз в 2-3 года
Каждые 5 лет
МРТ/МСКТ с КУ
1 раз в 6 мес.
Только при наличии изменений при проведении УЗИ/рентгенографии
Сцинтиграфия с 123I-МЙБГ/ПЭТ/КТ с ФДГ/другие радиоизотопные методы исследования
При наличии изменений при проведении других визуализационных методов обследования
--------------------------------
Примечание. <*> - начальной точкой отсчета представленных схем диспансерного наблюдения является проведенное обследование через 3 мес. после операции.
Комментарии: кратность и объем обследования могут быть скорректированы в зависимости от статуса по основному заболеванию, появлению клинической симптоматики подозрительной в отношении рецидива/прогрессии заболевания, появлению отдаленных нежелательных эффектов терапии.
Таблица 5.2. Комплексный клинико-лабораторный и инструментальный мониторинг пациентов с нейробластомой группы наблюдения с наличием остаточной опухоли после операции/химиотерапии.
Обследование
1 год
2 - 5 лет
Более 5 лет
Клинический осмотр детского онколога, педиатра
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Метаболиты катехоламинов мочи (ГВК, ВМК, норадреналин) (при доступности методики)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Общий (клинический) анализ крови
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Анализ крови биохимический общетерапевтический (с обязательным определением уровня ЛДГ)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Онкомаркеры (НСЕ, ферритин)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Оценка функции внешнего дыхания (после выполнения торакальных операций)
1 раз в год
1 раз в 2 - 3 года
Каждые 5 лет
Оценка уровня кортизола (при билатеральном поражение надпочечников)
Каждые 6 мес.
Каждые 12 мес.
Каждые 12 мес.
УЗИ органов брюшной полости/рентгенография органов грудной клетки в зависимости от локализации опухоли
Каждые 6 нед.
Каждые 3 мес.
Каждые 6-12 мес.
МСКТ/МРТ <**> с КУ
Каждые 3 мес.
Каждые 12 мес.
При наличии изменений при проведении УЗИ/рентгенографии
Сцинтиграфия с 123I-МЙБГ, ПЭТ/КТ с ФДГ/другие радиоизотопные методы исследования
Каждые 6 мес до нормализации, далее при наличии изменений при проведении других визуализационных методов обследования
ЭКГ, ЭхоКГ
(пациентам, получавшим доксорубицин или после торакальной операции)
1 раз в год
Консультации невролога
Для пациентов с интракальным распространением нейробластомы кратность осмотра определяется неврологом в зависимости от степени выраженности неврологических нарушений
Консультация узких специалистов (для пациентов, получавших химиотерапию)
(детский кардиолог, нефролог, офтальмолог, травматолог-ортопед, гастроэнтеролог, детский стоматолог и т.д.)
Ежегодно
--------------------------------
Примечание. <*> - начальной точкой отсчета представленных схем диспансерного наблюдения является проведенное обследование через 3 мес. после операции; <**> - возможно более частое проведение исследования при наличии остаточной опухоли с интраспинальным/интраформинальным распространением.
Комментарии: кратность и объем обследования могут быть скорректированы в зависимости от статуса по основному заболеванию (наличию остаточной опухоли), появлению клинической симптоматики подозрительной в отношении рецидива/прогрессии заболевания, появлению отдаленных нежелательных эффектов терапии.
- Рекомендуется проведение динамического обследования и наблюдения за пациентами с нейробластомой промежуточного риска после завершения специфической терапии [59].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: у пациентов группы промежуточного риска 1 раз в 3 мес. проводят оценку уровня онкомаркеров, УЗИ пораженной области, КТ/МРТ вовлеченной анатомической области с КУ (табл. 5.3). Сцинтиграфия с 123I-МЙБГ/ПЭТ/МСКТ с ФДГ/другие радиоизотопные методы исследования проводится только пациентам с сохраняющимся патологическим накоплением радиофармпрепарата 1 раз в 6 мес. до нормализации или при подозрении на рецидив заболевания.
Таблица 5.3. Диспансерное наблюдение за пациентами группы промежуточного риска
Обследование
1 год
2 - 5 лет
После 5 лет
Клинический осмотр детского онколога, педиатра
Каждые 6 нед.
Каждые 3 мес.
Не реже 1 раза в год
Анализ крови биохимический общетерапевтический (с обязательным определением уровня ЛДГ)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Оценка тубулярной функции по формуле Шварца
Каждые 12 мес.
Каждые 1 - 2 года
Каждые 2 - 3 года
Онкомаркеры (НСЕ, ферритин)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
УЗИ органов брюшной полости/рентгенография органов грудной клетки <*> в зависимости от локализации опухоли
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Метаболиты катехоламинов мочи (ГВК и ВМК) (при доступности методики)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 мес.
МСКТ/МРТ <**> с КУ
Каждые 3 мес.
Каждые 3 - 6 мес., если предыдущее обследование дало патологический результат
Сцинтиграфия с 123I-МЙБГ
Каждые 6 мес. до нормализации, затем при подозрение на рецидив/прогрессию
Оценка статуса костного мозга (миелограмма из 4-х точек и трепанобиопсия из 2-х точек (для детей старше 12 мес.)
Каждые 6 мес. до нормализации, затем при подозрении на рецидив/прогрессию
Спирометрия (для пациентов после торакальных операций или ЛТ на область грудной клетки)
1 раз в год
1 раз в год
Каждые 5 лет
Исследование уровня соматотропного гормона роста в крови
По показаниям
Денситометрия
По показаниям
Консультация узких специалистов: офтальмолог, сурдолог-оториноларинголог, детский стоматолог, детский кардиолог, невролог, акушер-гинеколог/детский уролог-андролог, детский эндокринолог, диетолог, нефролог, травматолог-ортопед, медицинский психолог, детский психиатр
Ежегодно
Каждые 2 года
ЭКГ/ЭхоКГ, аудиометрия (см. алгоритм), почечные тесты, тиреотропный гормон, трийодтиронин, тироксин, массо-ростовые показатели, оценка пубертатного развития
1 раз в год
Каждые 2 года
--------------------------------
Примечание. Здесь и в табл. 12: <*> - для внутригрудных опухолей не применяется УЗИ, поэтому необходимо выполнение рентгенограммы грудной клетки; <**> - более частое выполнение МРТ допустимо при наличии интракального/интрафораминального распространения остаточной опухоли.
Комментарии: кратность и объем обследования могут быть скорректированы в зависимости от статуса по основному заболеванию (наличию остаточной опухоли и/или метастатических очагов), появлению клинической симптоматики подозрительной в отношении рецидива/прогрессии заболевания, появлению отдаленных нежелательных эффектов терапии.
- Рекомендуется проведение динамического обследования и наблюдения за пациентами с нейробластомой высокого риска после завершения специфической терапии [59].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: у пациентов группы высокого риска 1 раз в 3 мес. проводят оценку уровня онкомаркеров, УЗИ пораженной области, МСКТ/МРТ вовлеченной анатомической области с КУ (табл. 17), МРТ головного мозга с КУ. Сцинтиграфия с 123-IМЙБГ, ПЭТ/КТ с ФДГ/другие радиоизотопные методы исследования проводятся только пациентам с сохраняющимся патологическим накоплением радиофармпрепарата 1 раз в 6 мес. до нормализации или при подозрении на рецидив заболевания.
Таблица 17. Диспансерное наблюдение за пациентами группы высокого риска
Обследование
1 год
2 - 5 лет
После 5 лет
Клинический осмотр детского онколога, педиатра
Каждые 6 нед.
Каждые 3 мес.
Не реже 1 раза в год
Оценка тубулярной функции по формуле Шварца
Каждые 12 мес.
Каждые 1 - 2 года
Каждые 2 - 3 года
Анализ крови биохимический общетерапевтический (с обязательным определением уровня ЛДГ)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
Метаболиты катехоламинов мочи (ГВК и ВМК) (при доступности методики),
УЗИ/рентгенография грудной клетки <*>
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 мес.
Онкомаркеры (НСЕ, ферритин)
Каждые 6 нед.
Каждые 3 мес.
Каждые 6 - 12 мес.
МРТ головного мозга с КУ
Каждые 6 мес.
Каждые 12 мес.
По показаниям
МСКТ/МРТ с КУ (область локализации первичной опухоли)
Каждые 3 мес.
Каждые 3 - 6 мес., если предыдущее обследование дало патологический результат
МСКТ ОГК с КУ (при наличие показаний)
Каждые 3 мес.
Каждые 3 - 6 мес., если предыдущее обследование дало патологический результат
Сцинтиграфия с 123-I-МЙБГ, ПЭТ/КТ/другие радиоизотопные методы исследования
Каждые 6 мес. до нормализации, затем при подозрении на прогрессию/рецидив заболевания
Исследования уроаня саматотропного гормона в крови
По показаниям
Денситометрия
По показаниям
Оценка статуса костного мозга (миелограмма из 4-х точек и трепанобиопсия из 2-х точек (для детей старше 12 мес.)
Каждые 3 - 6 мес. до нормализации, затем не рутинно
Консультация узких специалистов: офтальмолог, сурдолог, стоматолог, детский кардиолог, невролог, акушер-гинеколог/детский уролог-андролог, детский эндокринолог, диетолог, нефролог, травматолог-ортопед, медицинский психолог, детский психиатр
Ежегодно
Каждые 2 года
ЭКГ/ЭхоКГ, аудиометрия, (см. алгоритм), спирометрия, почечные тесты, тиреотропный гормон, трийодтиронин, тироксин, массо-ростовые показатели, оценка пубертата
1 раз в год
Каждые 2 года
Комментарии: кратность и объем обследования могут быть скорректированы в зависимости от статуса по основному заболеванию (наличию остаточной опухоли и/или метастатических очагов), появлению клинической симптоматики подозрительной в отношении рецидива/прогрессии заболевания, появлению отдаленных нежелательных эффектов терапии.
- Рекомендуется всем пациентам младше 18 лет с онкологическим заболеванием нейробластома на период лечения в целях лечения и профилактики тошноты и рвоты, обусловленных проведением противоопухолевой терапии, рекомендуется оценивать уровень эметогенности лекарственных препаратов, проводить лечение и профилактику тошноты и рвоты (ТИР) с использованием лекарственных препаратов [97-106] (см. Приложение А.3.4).
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
6. Организация оказания медицинской помощи
Госпитализация в круглосуточный стационар по профилю "детская онкология/гематология" осуществляется по следующим показаниям:
- в случае подозрения на НБ (первичная диагностика);
- при установленном диагнозе НБ для продолжения этапной терапии;
- при установленном диагнозе НБ для проведения контрольного обследования для оценки статуса по основному заболеванию и оценке токсичности терапии.
Требования к условиям пребывания пациента в стационаре и терапии:
A. желательно наличие в палатах воздухоочистителеи или центральной вентиляции.
B. необходимо наличие в структуре ЛПУ, проводящего лечение пациентов со злокачественными опухолями, в том числе с НБ, отделения или палаты интенсивнои терапии, оснащенного всеми необходимыми препаратами и оборудованием для ведения пациента с тяжелои дыхательнои и сердечно-сосудистои недостаточностью, септическим и др. видами шока, геморрагическим синдромом, почечнои недостаточностью и др. Необходимо иметь возможность проведения экстракорпоральнои детоксикации (гемодиализ), аппаратнои ИВЛ.
C. требования к наличию специалистов и лечебно-диагностических площадок смежных специальностеи:
Медицинская организация, проводящая лечение пациента с НБ должно иметь в структуре отделение (палату) анестезиологии-реанимации, отделение хирургии, способное выполнять торакальные и абдоминальные операции любои степени сложности. Кроме того, необходимо иметь в штате эндокринолога, невролога, окулиста, ЛОР-врача, нейрохирурга. Обязательно наличие цитологическои, иммунологическои, бактериологическои, биохимическои и экспресс-лаборатории.
В случае отсутствие вышеперечисленных условий или невозможности проведения ряда лечебных процедур (например, нейрохирургическое вмешательство у пациентов с интраканальным распространением НБ и т.д.) пациенты должны быть направлены в профильные медицинские учреждения более высокого уровня (федеральные, национальные центры).
Показания к экстренной госпитализации:
- при установленном диагнозе НБ и при наличие ЖУС;
- при установленном диагнозе НБ при подозрении на рецидив/прогрессию заболевания;
- при установленном диагнозе НБ при развитии выраженной органной токсичности на фоне проведения специфической терапии.
Показанием для выписки пациента из стационара является:
- завершение всей проводимой терапии или одного из этапов лечения при удовлетворительной соматическом статусе пациента.
Пациент передается врачу-педиатру /врачу-гематологу/ врачу-детскому онкологу) по месту жительства после завершения этапа или всего протокола лечения. Врач-педиатр (гематолог/детский онколог) по месту жительства руководствуется рекомендациями, данными специалистами учреждения, проводившего основные этапы лечения.
Диспансерный учет врачу-педиатром, детским онкологом/гематологом ведется до передачи пациента во взрослую сеть.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
1. Стратификация пациентов на группы риска
Современное лечение пациентов с НБ основано на дифференцированных подходах терапии в трех группах риска - наблюдения, промежуточного и высокого риска [60]. В рамках настоящих рекомендаций по лечению НБ используются критерии для стратификации пациентов на группы риска Немецкой онкологической группы по лечению данного заболевания (протокол NB2004) [13]. В рамках данного подхода стратификационные критерии включают возраст на момент постановки диагноза (дети первого года жизни и дети старше 1 года), стадию опухолевого процесса по Международной системе оценки стадии по нейробластоме (International Neuroblastoma Staging System - INSS), статус гена MYCN (наличие или отсутствие амплификации) и статус локуса 1р (наличие или отсутствие аберраций). В зависимости от сочетания прогностических факторов пациентов делят на 3 группы: наблюдения (низкого риска), промежуточного и высокого риска (табл. 4).
Таблица 4. Критерии стратификации на группы риска <*>
Группа риска
Критерии
Группа наблюдения
- Стадия 1;
- возраст 0 - 18 год;
- отсутствие амплификации гена MYCN
- Стадия 2;
- возраст 0 - 18 год;
- отсутствие амплификации гена MYCN;
- отсутствие аберраций 1p (del1p, imb1p)
- Стадия 3;
- возраст 0 - 2 года;
- отсутствие амплификации гена MYCN;
- отсутствие аберраций 1p (del1p, imb1p)
- Стадия 4S;
- возраст < 1 года;
- отсутствие амплификации гена MYCN
Группа промежуточного риска
- Стадия 2/3;
- возраст 0 - 18 год;
- отсутствие амплификации гена MYCN;
- наличие аберрации 1p (del1p, imb1p)
- Стадия 3;
- возраст 2 - 18 год;
- отсутствие амплификации гена MYCN
- Стадия 4;
- возраст < 1 года;
- отсутствие амплификации гена MYCN
Группа высокого риска
- Стадия 4;
- возраст 1 - 18 год
Амплификации гена MYCN не зависимо от стадии заболевания и возраста (0 - 18 год)
--------------------------------
<*> см. комментарии для пациентов с 1 стадией по INSS при наличии амплификации гена MYCN и пациентов с 4 по INSS стадией заболевания в возрасте 12 - 18 мес. при отсутствии амплификации гена MYCN и отсутствии сегментарных аномалий методом MLPA.
Группа наблюдения
Инициальный объем терапии пациентов, стратифицированных в группу наблюдения (низкого риска), определяется в зависимости от распространенности опухолевого процесса (локальные формы заболевания или метастатическая - стадия 4S) и наличия жизнеугрожающих симптомов (ЖУС) на момент постановки диагноза. Хирургическое вмешательство рассматривается в качестве основного метода лечения, преимущественно у пациентов с локальными стадиями заболевания. В случае наличия ЖУС показано проведение химиотерапии по схеме N 4 (максимальное число курсов 4) [13]. Для пациентов с инракальным распространением опухоли может рассматриваться вопрос о проведение нейрохирургического вмешательства.
Группа промежуточного риска
Всем пациентам, стратифицированным в группу промежуточного риска, показано проведение интенсивной индукционной ПХТ, включающей 6 альтернирующих курсов по схемам N 5 и N 6 (курсы N 4 проводятся у детей младше 6 мес.), хирургическое лечение может быть выполнено инициально или отсроченно. После завершения индукционной терапии проводится 4 курса терапии по схеме N 7 с последующей дифференцировочной терапией (9 курсов). Дистанционная лучевая терапия на ложе первичной опухоли проводится пациентам при наличии метаболически активной опухоли после этапа индукционной терапии и в зависимости от возраста пациента [13].
Группа высокого риска
Всем пациентам, стратифицированным в группу высокого риска, показано проведение интенсивной индукционной ПХТ, включающей проведение 6 альтернирующих курсов по схемам N 5 и N 6 (курсы N 4 проводятся у детей младше 6 мес.) или химиоиммунотерапии (по показаниям) и отсроченного хирургического лечения. После завершения индукционной терапии проводится высокодозная терапия c последующей аутологичной трансплантацией периферических гемопоэтических стволовых клеток (ауто-ТГСК). В дальнейшем рекомендовано проведение дифференцировочной терапии (9 курсов) и 5 курсов иммунотерапии динутуксимабом бета. Дистанционная лучевая терапия на ложе первичной опухоли проводится пациентам при наличии метаболически активной опухоли после этапа индукционной терапии [13].
2. Оценка ответа на лечение пациентов с нейробластомой всех групп риска
Для анализа эффективности проводимой терапии используются международные критерии оценки ответа на терапию у пациентов с нейробластомой [12] с модификацией в виде обязательного применения сцинтиграфии с МЙБГ и/или ПЭТ/КТ с ФДГ и/или других радиоизотопных методов исследования. В рамках данных критериев выделяются следующие варианты ответа: полный ответ, очень хороший частичный ответ, частичный ответ, смешанный ответ, стабилизация и прогрессирование (табл. 7.7.1). Для оценки ответа на проводимую терапию используются все диагностические методы, указанные в разделе "Диагностика".
Таблица 7.7.1. Критерии оценки ответа на терапию у пациентов с нейробластомой
Ответ
Первичная опухоль
Метастатические очаги
Полный ответ
(Complete Response)
Нет опухоли
- Метастазы отсутствуют
Очень хороший частичный ответ
(Very Good Partial Response)
Уменьшение на 90 - 99%
- Метастазы отсутствуют
Частичный ответ
(Partial Response)
Уменьшение > 50%
Уменьшение всех доступных измерению очагов > 50%.
Кости и костный мозг:
- уменьшение числа позитивных очагов > 50%;
- не более 1 точки костного мозга с опухолевыми клетками (если это представляет собой уменьшение по сравнению с числом пораженных точек на момент постановки диагноза)
Смешанный ответ
(Mixed Response)
- Отсутствие новых опухолевых очагов;
- уменьшение любых доступных измерению очагов > 50% (первичная опухоль или метастазы) при уменьшении других очагов < 50%;
- увеличение любого из существовавших очагов < 25%
Стабилизация
(No Response)
- Отсутствие новых очагов;
- уменьшение очагов < 50%;
- увеличение любого из существовавших очагов < 25%
Прогрессирование
(Progressive Disease)
- Появление любого нового опухолевого очага;
- увеличение любого доступного измерению очага > 25%;
- ранее не пораженный костный мозг содержит опухолевые клетки
Оценка ответа для пациентов группы наблюдения проводится через 3 мес. после проведения хирургического лечения или через 3 мес. от окончания ПХТ (для пациентов с ЖУС, которым проводилась химиотерапия).
Оценка ответа для пациентов группы промежуточного риска проводится после завершения этапа индукционной терапии и по окончанию всего плана лечения.
Оценка ответа для пациентов группы высокого риска проводится после 4 - 6 курса индукционной терапии, после интенсифицированной индукционной терапии (если такая проводилась), через три месяца после ВХТ и ауто-ТГСК, перед началом иммунотерапии, на этапах постконсолидационого лечения и по окончанию всего плана терапии.
3. Особенности проведения лучевой терапии пациентам с нейробластомой
Рекомендации по проведению лучевой терапии - см. раздел 3 данных рекомендаций.
Технические требования к оборудованию для ДЛТ
Линейный ускоритель электронов с энергией фотонов 6 МэВ - 10 МэВ, оснащенный многолепестковым коллиматором и, крайне желательно, системой/системами визуального контроля укладки (IGRT).
Фиксирующие приспособления для головы и тела.
Рентгеновский компьютерный томограф для топометрии.
Система 3-D планирования облучения.
Предлучевая подготовка
Планирование проводится на основании топометрии, проведенной на рентгеновском компьютерном томографе, приспособленном для нужд радиотерапии (КТ-разметка). Разметка проводится с использованием индивидуальных средств фиксации: при локализации в области головы и шеи - термопластических масок и вакуумного матраса, при локализации в области средостения, брюшной полости и полости малого таза - вакуумного матраса.
Сканирование проводится с толщиной среза 1 - 5 мм в зависимости от локализации метаболически активной остаточной опухоли: в области головы и шеи - 1 - 2 мм, в области средостения, брюшной полости и малого таза - 2 - 5 мм.
Необходимо предусмотреть, что при топометрии и лучевой терапии пациентов младше 5 лет может потребоваться общая анестезия.
Определение объемов облучения
Макроскопический объем опухоли (GTV) определяется как метаболически активная остаточная опухоль. Для его уточнения предпочтительно совмещение разметочных КТ-грамм и МРТ-изображений, проведенных с диагностической целью перед планированием лечения, данных ОФЭТ/КТ при MIBG-сцинтиграфии.
Клинический объем мишени (CTV) включает GTV с отступом 1 - 2 см, в зависимости от возраста пациента, локализации и объема остаточной опухоли с учетом анатомических барьеров распространения опухоли (кости, паренхиматозные органы).
Планируемый объем мишени (PTV) включает CTV с дополнительным отступом 3 - 10 мм в соответствии с внутренними стандартами клиники и должен составлять:
- для головы и шеи - 3 - 7 мм
- для средостения, забрюшинного пространства и малом тазу - 5 - 10 мм
Допустимо уменьшение отступов на PTV при выполнении ежедневного контроля укладки с помощью компьютерной томографии в коническом пучке (CBCT) на столе линейного ускорителя перед сеансом облучения.
Доза и фракционирование
Суммарная очаговая доза (СОД) составляет 36 - 40 Гр при классическом фракционировании (1 раз в день 5 дней в неделю) и разовой очаговой дозе (РОД) 1,6 - 1,8 Гр. При невозможности обеспечения толерантных доз на здоровые структуры при планировании облучения в этом режиме, рекомендуется применять СОД 21 Гр при РОД 1,5 Гр.
Планирование облучения.
Минимальные требования к планированию лечебных планов - 3-D конформная лучевая терапия.
Для большинства пациентов применение современных методик радиотерапии с модулированной интенсивностью (IMRT, VMAT) может уменьшить объем тканей, получающих большую дозу облучения. Однако следует учитывать, что при этом может возрасти объем тканей, облученных малыми дозами радиации.
При планировании должны учитываться предельно допустимые дозы облучения для окружающих критических органов.
- Почки: если возможно, Dmean < 15 Гр, V20 < 32%, а при единственной сохраненной почке Dmax < 12 Гр, V10 < 25 - 30%
- Печень: V20 < 50%
- Кости: при включении позвоночника в PTV, его следует облучать симметрично во избежание сколиоза (допустимая минимальная доза в облучаемом позвонке 80% от предписанной)
- Спинной мозг: по возможности доза на спинной мозг не должна превышать 30 Гр для небольшого участка (2-3 позвонка) или 20 Гр для б льших участков, особенно у маленьких детей.
- Для большинства органов толерантные дозы для детей не определены. Необходимо руководствоваться рекомендациями QUANTEC.
Реализация лечебных планов.
Контроль положения мишени проводится путем проведения CBCT или, что менее предпочтительно, получением портальных изображений для коррекции смещений. Обычно контроль выполняется в течение первых 3 - 4 сеансов облучения для исключения систематической ошибки укладки, далее - 1 раз в неделю. При уменьшении отступов на PTV или больших случайных смещениях, определенных в первые дни облучения, рекомендуется ежедневный контроль положения пациента.
Лучевые реакции и осложнения.
Острые лучевые осложнения возникают во время облучения и в первые 90 дней после его окончания. Эти эффекты специфичны для облучаемых тканей и обычно хорошо переносятся пациентами. Однако иногда они могут быть достаточно серьезными, требовать дополнительной медикаментозной коррекции и перерыва в лечении. Острые эффекты большей частью являются временными и не вызывают стойкого ухудшения состояния тканей и органов.
Наиболее часто возникают тошнота, рвота, диарея, изменения показателей крови. Степень выраженности во многом зависит от объема облучения, локализации остаточной опухоли, возраста пациента. Большинство из них купируется назначением адекватной симптоматической терапии и проходит без следа для здоровья маленького пациента.
При снижениях показателей крови проводится заместительная трансфузионная терапия, применяются колониестимулирующие препараты, назначение которых необходимо планировать вне периода облучения, т.е. в конце недели и в выходные дни.
Степень выраженности поздних лучевых реакций зависит от локализации, СОД и возраста ребенка. Серьезные отдаленные последствия, как правило, возникают редко из-за небольшого объема облучаемых тканей и благодаря применению современных методик радиотерапии.
Развитие деформаций скелета, в том числе позвоночника, можно избежать при симметричном облучении тел позвонков. Повреждения спинного мозга при соблюдении допустимых доз облучения не возникают.
Наиболее серьезных осложнений следуют опасаться со стороны почек при облучении больших забрюшинных опухолей. Превышение толерантных доз может вызвать дегенерацию и склероз почечных артериол. В результате уменьшенный кровоток приводит к дегенерации почечных клубочков и канальцев, фиброзу почечной паренхимы. Почечная дисфункция вызывает гипертонию, отеки, уремию и может быть фатальной.
Вторичные опухоли считаются наиболее серьезным последствием лечения рака. Их развитию способствуют как лучевая терапия, так и химиотерапия. Они могут возникать через много лет после завершения программного лечения. По сравнению со взрослыми пациентами дети живут намного дольше после лучевой терапии, и риск развития вторичных опухолей для них наиболее актуален.
4. Особенности хирургического лечения нейробластомы
Хирургическое лечение пациентов с НБ всех групп риска является предметом научной дискуссии на протяжении нескольких десятилетий. Хирургическое лечение является основным методом терапии пациентов группы наблюдения. У пациентов с локализованными формами группы наблюдения необходима обязательная оценка факторов риска при визуализации с целью планирования объема хирургического вмешательства, при этом само вмешательство не должно носить калечащего характера.
НБ группы высокого риска чаще характеризуется местноинвазивным ростом с возможностью вовлечения жизненно важных структур, включая магистральные сосуды и паренхиматозные органы. Предметом обсуждения является влияние выполнения радикальных хирургических вмешательств у данного контингента пациентов на прогноз заболевания при условии наличия отдаленных метастазов и высокого риска тяжелых хирургических осложнений при попытках радикального удаления опухоли. Кроме того, дискутабельным оставался вопрос о сроках выполнения хирургического вмешательства и о критериях оценки радикальности вмешательства. Необходимо отметить, что в отличие от других видов ЗНО при которых под радикальным вмешательством понимают доказанные негативнее края резекции (микроскопически радикальное удаление), при НБ микроскопического подтверждения краев вмешательства не требуется и к радикальным относят хирургические вмешательства, при которых проводится макроскопически полное удаление. Последнее включает в себя удаление всей массы опухоли и региональных лимфатических узлов, которые выявляются при визуальном осмотре и пальпации во время хирургического вмешательства оперирующим хирургом. Крайне целесообразно, подтверждение полноты резекции путем выполнения послеоперационной анатомической визуализации.
Хирургическое лечение (в том числе сроки выполнения) было рассмотрено в контексте общего плана терапии по группам риска, так как является неотъемлемым этапом мультимодальной терапии пациентов с НБ.
Малоинвазивный доступ (лапароскопия, торакоскопия) для удаления нейробластомы рекомендован при локализованных формах опухоли (нейробластома надпочечника, заднего средостения) и отсутствии факторов риска IDRF по данным предоперационной визуализации. При контакте опухоли с магистральными сосудами может быть рассмотрен малоинвазивный доступ при условии наличия опыта выполнения подобных оперативных вмешательств хирурга и операционной бригады [27, 28].
Декомпрессионная лапаростомия показана пациентам с нейробластомой и развитием интраабдоминальной гипертензии за счет больших размеров первичной опухоли или гепатомегалии при метастатическом поражении печени [63 - 69]. Подходы к хирургическому лечению АКС у пациентов с НБ (преимущественно 4S стадии):
1. Принимать интраабдоминальную гипертензию у детей, как устойчивое повышение внутрибрюшного давления от 10 мм.рт.ст. и более, регистрируемое при трех стандартных измерениях с интервалом 4 - 6 часов.
2. Учитывая тяжесть состояния пациента, необратимость развития течения АКС на фоне онкологической патологии, все пациенты должны наблюдаться в условиях отделения реанимации и интенсивной терапии. Тактика обследования и лечения, а также сроки проведения тех или иных процедур вырабатывается индивидуально в каждом клиническом случае, согласно протоколу лечения основного заболевания.
3. Измерять внутрибрюшное давления в полости мочевого пузыря, предпочтительно при помощи закрытых систем - с целью профилактики восходящей мочевой инфекции у иммунокомпрометированных пациентов онкогематологического стационара. Проводить мониторинг внутрибрюшного давления, как рутинную процедуру у пациентов группы риска по развитию абдоминального компартмент синдрома.
4. Тактику ведения пациента осуществлять в рамках междисциплинарного взаимодействия с участием анестезиолога-реаниматолога, онколога и хирурга, что при наблюдении данной группы пациентов является залогом успешной терапии.
5. Развитие абдоминального компартмент синдрома считать абсолютным показанием для проведения декомпрессионной лапаростомии, ввиду необратимости процесса. Показания к выполнению декомпрессионной лапаростомии, необходимость проведения симультанной биопсии, возможность первичного удаления опухоли, а также сроки и риски проведения данных оперативных вмешательств определять в рамках междисциплинарного взаимодействия.
6. В качестве пластического компонента для проведения декомпрессионной лапаростомии может быть использован любой устойчивый к инфекции и гистологически инертный нерассасывающийся пластинчатый материал - эндопротез полимерный***. Фиксацию материала также осуществлять нерассасывающимся хирургическим шовным материалом.
7. При отсутствии необходимости проникновения в брюшную полость, по возможности сохранять целостность париетальной брюшины при выполнении декомпрессии и фиксировать пластический материал к краям мышечно-апоневротической раны непосредственно над ней.
8. Ушивание лапаротомной раны по завершении декомпрессии выполнять под контролем интраабдоминального давления, параметров вентиляции и сердечно-сосудистой деятельности.
9. В послеоперационном периоде при развитии подкожной гематомы после установки пластины необходимо провести эвакуацию/дренирование гематомы, во избежание ее нагноения.
10. При нагноении раны после проведения декомпрессионной лапаростомии, необходимо проведение ревизионного оперативного вмешательства с удалением пластины, санацией гнойных очагов, иссечением краев раны. При необходимости допустимо вшивание пластины большего размера.
11. В случае некроза участка отсепарированного кожно-жирового лоскута над пластиной, допустимо консервативное ведение раны "под струпом" при условии отсутствия развития гнойного процесса. Консервативное ведение возможно осуществлять до определяемого протоколом срока проведения оперативного вмешательства по поводу основного заболевания или до окончания лечения основного заболевания.
12. При прогрессировании абдоминального компартмент синдрома после проведения декомпрессионной лапаростомии, показано проведение повторной декомпрессии с вшиванием пластины большего размера.
13. Удаление пластины может быть выполнено одномоментно с удалением опухоли, в сроки, определяемые протоколом лечения. При отсутствии необходимости удаления опухоли, пластический материал можно не удалять.
14. В случае, если на этапах лечения отмечался некроз участка кожно-жирового лоскута и проводилось консервативное ведение раны "под струпом", во избежание формирования грубых рубцов передней брюшной стенки в дальнейшем, даже при отсутствии показаний к удалению опухоли во время или после завершения лечения основного заболевания, необходимо выполнить удаление пластины с одномоментной пластикой передней брюшной стенки местными тканями.
15. Реконструкцию передней брюшной стенки после удаления пластического материала, по возможности, выполнять собственными тканями, последовательно сопоставляя одноименные слои.
16. Катамнез пациента осуществляется в сроки и в объеме, определенными протоколом лечения основного заболевания.
Критерии оценки качества медицинской помощи
XII. Критерии оценки качества медицинской помощи
N N п/п
Критерии оценки качества
Оценка выполнения
21.
Выполнен анализ крови биохимический общетерапевтический (мочевина, креатинин, общий белок, альбумин, общий билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, натрий, калий, глюкоза) (перед началом каждого курса химиотерапии при наличии медицинских показаний)
Да/Нет
32.
Выполнен общий (клинический) анализ крови развернутый (перед началом каждого курса химиотерапии при наличии медицинских показаний)
Да/Нет
43.
Выполнена компьютерная томография органов грудной полости с/без внутривенного контрастирования (при установлении диагноза)
Да/Нет
54.
Выполнена магнитно-резонансная томография с внутривенным контрастированием зоны первичного опухолевого очага и/или компьютерная томография зоны первичного опухолевого очага с внутривенным контрастированием (при установлении диагноза в случае)
Да/Нет
65.
Выполнено цитологическое исследование мазка костного мозга (миелограмма) (за исключением случаев возраста пациента до 3 - 6 месяцев с локализованным образованием в области надпочечника)
Да/Нет
76.
Выполнено патолого-анатомическое исследование ткани первичной опухоли и/или очагов, подозрительных на метастатические и/или морфологическое/цитологическое исследование костного мозга (за исключением случаев возраста пациента до 3 - 6 месяцев с локализованным образованием в области надпочечника)
Да/Нет
87.
Выполнено ультразвуковое исследование органов брюшной полости и забрюшинного пространства (комплексное) (при установлении диагноза в случае)
Да/Нет
Список литературы
1. Berthold F., Hero B. Neuroblastoma: Current drug therapy recommendations as part of the total treatment approach // Drugs. Adis International Ltd, 2000. Vol. 59, N 6. P. 1261 - 1277.
2. Berthold F., Simon T. Clinical presentation // Neuroblastoma. 2005. P. 63 - 86.
3. Brodeur G.M. Neuroblastoma: Biological insights into a clinical enigma // Nature Reviews Cancer. 2003. Vol. 3, N 3. P. 203 - 216.
4. Narod S.A., Lenoir G.M., Stiller C. An estimate of the heritable fraction of childhood cancer // Br. J. Cancer. 1991. Vol. 63, N 6. P. 993 - 999.
5. Ambros P.F. et al. International consensus for neuroblastoma molecular diagnostics: Report from the International Neuroblastoma Risk Group (INRG) Biology Committee // British Journal of Cancer. 2009. Vol. 100, N 9. P. 1471 - 1482.
6. J.G. G. et al. Infant cancer in the U.S.: Histology-specific incidence and trends, 1973 to 1992 // J. Pediatr. Hematol. Oncol. 1997. Vol. 19, N 5. P. 428 - 432.
7. Kaatsch P., Spix C. German Childhood Cancer Registry - Annual Report 2015 (1980 - 2014) Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz. 2015. 118 p.
8. Tulla M. et al. Incidence, trends, and survival of children with embryonal tumors // Pediatrics. American Academy of Pediatrics, 2015. Vol. 136, N 3. P. e623 - e632.
9. Brodeur G.M. et al. International criteria for diagnosis, staging, and response to treatment in patients with neuroblastoma // J. Clin. Oncol. 1988. Vol. 6, N 12. P. 1874 - 1881.
10. Monclair T. et al. The International Neuroblastoma Risk Group (INRG) staging system: An INRG Task Force report // J. Clin. Oncol. 2009. Vol. 27, N 2. P. 298 - 303.
11. Brisse H.J. et al. Guidelines for imaging and staging of neuroblastic tumors: Consensus report from the international neuroblastoma risk group project // Radiology. 2011. Vol. 261, N 1. P. 243 - 257.
12. Brodeur G.M. et al. Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment // J. Clin. Oncol. Lippincott Williams and Wilkins, 1993. Vol. 11, N 8. P. 1466 - 1477.
13. Berthold F. NB2004 Trial Protocol for Risk Adapted Treatment of Children with Neuroblastoma Principal investigator [Electronic resource]. 2004. URL: http://nodgo.org/sites/default/files/protokol_neuroblastoma-1.pdf (accessed: 12.12.2019).
14. Nuchtern J. G, et al. A prospective study of expectant observation as primary therapy for neuroblastoma in young infants: a Children's Oncology Group study // Ann Surg. 2012. Vol. 256, N 4. Р. 573 - 80.
15. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. М.: Издательская группа РОНЦ. Практическая медицина, 2012. 684 p.
16. Варфоломеева С.Р. Нейробластома // Педиатрия. Национальное руководство в 2 томах. Под редакцией А.А. Баранова. 2009.
17. Wolmer-Solberg N. et al. Frequent detection of human cytomegalovirus in neuroblastoma: A novel therapeutic target? // Int. J. Cancer. 2013. Vol. 133, N 10. P. 2351 - 2361.
18. Nissim I. et al. Ifosfamide-induced nephrotoxicity: Mechanism and prevention // Cancer Res. 2006. Vol. 66, N 15. P. 7824 - 7831.
19. Xia J. et al. Comparison of diagnosing and staging accuracy of PET (CT) and MIBG on patients with neuroblastoma: Systemic review and meta-analysis // J. Huazhong Univ. Sci. Technol. - Med. Sci. 2017. Vol. 37, N 5. P. 649 - 660.
20. Киреева Е.Д., и соавт. Значение протокола однофотонной эмиссионной компьютерной томографии, совмещенной с компьютерной томографией, при сцинтиграфии с 123I-метайодбензилгуанидином у детей с нейробластомой // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2021. Т. 20. N 4. C. 22 - 32.
21. Piccardo A. et al. PET/CT imaging in neuroblastoma. // Q. J. Nucl. Med. Mol. Imaging. 2013. Vol. 57, N 1. P. 29 - 39.
22. Jager P.L., et al. 6-L-18F-fluorodihydroxyphenylalanine PET in neuroendocrine tumors: basic aspects and emerging clinical applications // J Nucl Med. 2008. Vol. 49, N 4. Р. 573-86.
23. Hemrom A., et al. Comparative Role of 18F-DOPA PET/CT and 131I-MIBG Scintigraphy in Neuroblastoma and Application of Curie and SIOPEN Scoring Systems in 18F-DOPA PET/CT // Nucl Med Mol Imaging. 2022. Vol. 56. N 5. Р. 236 - 244.
24. Zhang L., et al. Correlation of Somatostatin Receptor-2 Expression with Gallium-68-DOTA-TATE Uptake in Neuroblastoma Xenograft Models // Contrast Media Mol Imaging. 2017. 9481276.
25. Kroiss A., et al. Functional imaging in phaeochromocytoma and neuroblastoma with 68Ga-DOTA-Tyr 3-octreotide positron emission tomography and 123I-metaiodobenzylguanidine // Eur J Nucl Med Mol Imaging. 2011. Vol. 38. N 5. Р. 865-73.
26. Pandit-Taskar N., et al. Biodistribution and Dosimetry of 18F-Meta-Fluorobenzylguanidine: A First-in-Human PET/CT Imaging Study of Patients with Neuroendocrine Malignancies //J Nucl Med. 2018. Vol. 59/ N 1. Р. 147 - 153.
27. Iwanaka T., et al. The laparoscopic approach of neuroblastoma // Semin Pediatr Surg. 2007 Nov; 16(4): 259-65.
28. Fascetti-Leon F., et al. Minimally invasive resection of adrenal masses in infants and children: results of a European multi-center survey // Surg Endosc. 2017 Nov; 31(11): 4505 - 4512.
29. Shimada H. et al. International neuroblastoma pathology classification for prognostic evaluation of patients with peripheral neuroblastic tumors: a report from the Children's Cancer Group. // Cancer. 2001. Vol. 92, N 9. P. 2451 - 2461.
30. Goldsmith K.C., et al. Lorlatinib with or without chemotherapy in ALK-driven refractory/relapsed neuroblastoma: phase 1 trial results // Nat Med. 2023. Vol/.29. N 5. Р. 1092 - 1102.
31. Madabhavi I. et al. A study of the use of peripherally inserted central catheters in cancer patients: A single-center experience // J. Vasc. Nurs. Mosby Inc., 2018. Vol. 36, N 3. P. 149 - 156.
32. Rykov M.Y. et al. Peripherally inserted central catheters in the treatment of children with cancer: Results of a multicenter study // J. Vasc. Access. SAGE Publications Ltd, 2018. Vol. 19, N 4. P. 378-381.
33. van den Bosch C.H. et al. Incidence, severity and outcome of central line related complications in pediatric oncology patients; A single center study // J. Pediatr. Surg. W.B. Saunders, 2019. Vol. 54, N 9. P. 1894 - 1900.
34. Whittle S.B., Williamson K.C., Russell H. V. Incidence and risk factors of bacterial and fungal infection during induction chemotherapy for high-risk neuroblastoma // Pediatr. Hematol. Oncol. Taylor and Francis Ltd, 2017. Vol. 34, N 5. P. 331 - 342.
35. Devrim I. et al. A single center's experience with Candida parapsilosis related long-term central venous access device infections: The port removal decision and its outcomes // Pediatr. Hematol. Oncol. Informa Healthcare, 2014. Vol. 31, N 5. P. 435 - 441.
36. М.Б. Белогурова, с соавтр. Нейробластома 1-й стадии с амплификацией гена MYCN: результаты ретроспективного мультицентрового исследования // Вопросы онкологии, гематологии и иммунопатологии в педиатрии. 2022. Том. 21. N 4. С. 45 - 52.
37. Schmidt M.L., et al. Favorable prognosis for patients 12 to 18 months of age with stage 4 nonamplified MYCN neuroblastoma: A Children's Cancer Group Study // Journal of Clinical Oncology - 2005. - Vol. 23. - N 27. - Р. 6474 - 6480.
38. Berthold F. et al. Incidence, Survival, and Treatment of Localized and Metastatic Neuroblastoma in Germany 1979 - 2015 // Pediatr. Drugs. Springer International Publishing, 2017. Vol. 19, N 6. P. 577 - 593.
39. Simon T., et al. 2017 GPOH Guidelines for Diagnosis and Treatment of Patients with Neuroblastic Tumors // Klin Padiatr. 2017. Vol. 229. N 3. Р. 147 - 167.
40. Gupta M., Dhasmana A. Radiation Therapy in Metastatic Neuroblastoma // Nuclear Medicine Physics. IntechOpen, 2019.
41. Boztug K. et al. Successful treatment of MYCN amplified, progressive stage 4S neuroblastoma in a neonate with hepatic artery embolization in addition to multimodality treatment // Pediatr. Blood Cancer. 2006. Vol. 46, N 2. P. 253 - 257.
42. McGahren E.D., Rodgers B.M., Waldron P.E. Successful management of stage 4S neuroblastoma and severe hepatomegaly using absorbable mesh in an infant. // J. Pediatr. Surg. 1998. Vol. 33, N 10. P. 1554 - 1557.
43. Roberts S. et al. Unique management of stage 4S neuroblastoma complicated by massive hepatomegaly: Case report and review of the literature // Am. J. Pediatr. Hematol. Oncol. 2002. Vol. 24, N 2. P. 142 - 144.
44. Reynolds C.P. et al. Retinoid therapy of high-risk neuroblastoma // Cancer Letters. Elsevier Ireland Ltd, 2003. Vol. 197, N 1-2. P. 185 - 192.
45. Курникова Е.Е. et al. Результаты мобилизации, афереза и аутореинфузии гемопоэтических стволовых клеток у детей с нейробластомой: роль мониторинга количества CD34+ клеток в периферической крови // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2017. Vol. 16, N 1. P. 28 - 39.
46. Шаманская Т.В., с соавт. Переносимость и токсичность индукционной химиоиммунотерапии с динутуксимабом бета у первичных пациентов с нейробластомой группы высокого риска // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2024. Vol. 23, N 1. P. 108 - 108.
47. Amoroso L., et al. Topotecan-Vincristine-Doxorubicin in stage 4 high-risk neuroblastoma patients failing to achieve a complete metastatic response to rapid COJEC: A SIOPEN study // Cancer Research and Treatment - 2018. - Vol. 50. - N 1. - P. 148 - 155.
48. Ladenstein R. et al. Busulfan and melphalan versus carboplatin, etoposide, and melphalan as high-dose chemotherapy for high-risk neuroblastoma (HR-NBL1/SIOPEN): an international, randomised, multi-arm, open-label, phase 3 trial // Lancet Oncol. Lancet Publishing Group, 2017. Vol. 18, N 4. P. 500 - 514.
49. Berthold F. et al. Myeloablative megatherapy with autologous stem-cell rescue versus oral maintenance chemotherapy as consolidation treatment in patients with high-risk neuroblastoma: A randomised controlled trial // Lancet Oncol. 2005. Vol. 6, N 9. P. 649 - 658.
50. Granger M. et al. Myeloablative busulfan/melphalan (BuMel) consolidation following induction chemotherapy for patients with high-risk neuroblastoma: A Children's Oncology Group (COG) study. // J. Clin. Oncol. American Society of Clinical Oncology (ASCO), 2016. Vol. 34, N 15 suppl. P. 10528 - 10528.
51. Proust-Houdemont S. et al. Busulfan-melphalan in high-risk neuroblastoma: The 30-year experience of a single institution // Bone Marrow Transplant. Nature Publishing Group, 2016. Vol. 51, N 8. P. 1076 - 1081.
52. Matthay K.K. et al. Long-term results for children with high-risk neuroblastoma treated on a randomized trial of myeloablative therapy followed by 13-cis-retinoic acid: A children's oncology group study // J. Clin. Oncol. 2009. Vol. 27, N 7. P. 1007 - 1013.
53. Simon T. et al. Intensified external-beam radiation therapy improves the outcome of stage 4 neuroblastoma in children > 1 year with residual local disease // Strahlentherapie und Onkol. Springer, 2006. Vol. 182, N 7. P. 389 - 394.
54. Ladenstein R., et al. Investigation of the role of dinutuximab beta-based immunotherapy in the SIOPEN high-risk neuroblastoma 1 Trial (HR-NBL1) // Cancers (Basel) - 2020. - Vol. 12. - N 2. - P. 309.
55. Tanner L. et al. Cancer Rehabilitation in the Pediatric and Adolescent/Young Adult Population // Seminars in Oncology Nursing. Elsevier Inc, 2020. Vol. 36, N 1. P. 150984.
56. Солопова Г.Г. et al. Организация службы инфекционного контроля в клинике детской гематологии/онкологии. Педиатрия Онкогематология N 10 (111) / 2015 // Доктор.Ру. 2015. Vol. 111, N 10. P. 14 - 22.
57. Prasad P., Nania J.J., Shankar S.M. Pneumocystis pneumonia in children receiving chemotherapy // Pediatr. Blood Cancer. 2008. Vol. 50, N 4. P. 896 - 898.
58. Качанов Д.Ю. et al. Диспансерное наблюдение за пациентами с нейробластомой группы низкого риска (за исключением 4S стадии) // Российский журнал детской гематологии и онкологии. 2015. Vol. 2 N 1. P. 101 - 106.
59. Bansal D. et al. Management of Neuroblastoma: ICMR Consensus Document // Indian J. Pediatr. Springer India, 2017. Vol. 84, N 6. P. 446 4 55.
60. Park J.R., Eggert A., Caron H. Neuroblastoma: Biology, Prognosis, and Treatment // Hematology/Oncology Clinics of North America. 2010. Vol. 24, N 1. P. 65 - 86.
61. Морозов Д.А. et al. Синдром интраабдоминальной гипертензии у детей//Новости хирургии. 2017. Vol. 25, N 6; P. 621 - 631.
62. De Bernardi B. et al. Epidural compression in neuroblastoma: Diagnostic and therapeutic aspects // Cancer Letters. 2005. Vol. 228, N 1-2. P. 283 - 299.
63. Papavramidis T.S. et al. Abdominal compartment syndrome - Intra-abdominal hypertension: Defining, diagnosing, and managing // Journal of Emergencies, Trauma and Shock. 2011. Vol. 4, N 2. P. 279 - 291.
64. Вагнер К.Э. Об изменении внутрибрюшного давления при различных условиях // Врач. Vol. 9 N 12. P. 233.
65. Хрипун А.И. et al. Синдром интраабдоминальной гипертензии. История и современное состояние вопроса // Acta Biomed. Sci. 2010. Vol. 3. P. 374 - 378.
66. Fietsam R. et al. Intra-abdominal compartment syndrome as a complication of ruptured abdominal aortic aneurysm repair // Am. Surg. 1989. Vol. 55, N 6. P. 396 - 402.
67. Kron I.L., Harman P.K., Nolan S.P. The measurement of intra-abdominal pressure as a criterion for abdominal re-exploration // Ann. Surg. 1984. Vol. 199, N 1. P. 28 - 30.
68. Patel A. et al. Abdominal compartment syndrome // American Journal of Roentgenology. 2007. Vol. 189, N 5. P. 1037 - 1043.
69. Гареев Р.Н. et al. Интраабдоминальная гипертензия // Медицинский вестник Башкортостана. 2012. Vol. 7 (4). P. 66 - 73.
70. Zage E.P. Novel Therapies for Relapsed and Refractory Neuroblastoma // Children (Basel). 2018 Nov; 5(11). Р. 148.
71. Moreno L. Bevacizumab, Irinotecan, or Topotecan Added to Temozolomide for Children With Relapsed and Refractory Neuroblastoma: Results of the ITCC-SIOPEN BEACON-Neuroblastoma Trial // J Clin Oncol. 2024 Apr 1; 42(10). P. 1135 - 1145.
72. Nelson R.L. The comparative clinical pharmacology and pharmacokinetics of vindesine, vincristine, and vinblastine in human patients with cancer // Med. Pediatr. Oncol. 1982. Vol. 10, N 2. P. 115 - 127.
73. Nelson R.L., Dyke R.W., Root M.A. Comparative pharmacokinetics of vindesine, vincristine and vinblastine in patients with cancer // Cancer Treat. Rev. Elsevier, 1980. Vol. 7, N SUPPL. 1. P. 17 - 24.
74. Park J.R., Kreissman S.G., London W.B. Effect of Tandem Autologous Stem Cell Transplant vs Single Transplant on Event-Free Survival in Patients With High-Risk Neuroblastoma: A Randomized Clinical Trial. // JAMA. 2019 Vol. 322, N 8. P. 746 - 755.
75. Pasqualini C., Dufour C., Raquin M-A. Tandem high-dose chemotherapy with thiotepa and busulfan-melphalan and autologous stem cell transplantation in very high-risk neuroblastoma patients. // Bone Marrow Transplant. 2016 Vol. 51, N 2. P. 227 - 231.
76. Desai A.V., et al. Efficacy of post-induction therapy for high-risk neuroblastoma patients with end-induction residual disease // Cancer - 2022. - Vol. 128. - N 15. - Р. 2967 - 2977.
77. Amoroso L., et al. Topotecan-Vincristine-Doxorubicin in stage 4 high-risk neuroblastoma patients failing to achieve a complete metastatic response to rapid COJEC: A SIOPEN study// Cancer Research and Treatment - 2018. - Vol. 50. - N 1. - P. 148 - 155.
78. Шаманская Т.В., с соавт. Переносимость и токсичность индукционной химиоиммунотерапии с динутуксимабом бетау первичных пациентов с нейробластомой группы высокого риска // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2024. - Том 23. - N 1. С. 108 - 118.
79. Kushner B.H, et al. Irinotecan Plus Temozolomide for Relapsed or Refractory Neuroblastoma. J Clin Oncol: Off J Am Soc Clin Oncol (2006) 24: 5271-6.
80. Lucas Moreno, et al. Bevacizumab, Irinotecan, or Topotecan Added to Temozolomide for Children With Relapsed and Refractory Neuroblastoma: Results of the ITCC-SIOPEN BEACON-Neuroblastoma Trial. J Clin Oncol. 2024 Apr 1; 42(10): 1135 - 1145.
81. Corbacioglu S., et al. Irinotecan and temozolomide in combination with dasatinib and rapamycin versus irinotecan and temozolomide for patients with relapsed or refractory neuroblastoma (RIST-rNB-2011): a multicentre, open-label, andomized, controlled, phase 2 trial. Lancet Oncol. 2024 Jul; 25(7): 922 - 932.
82. Giannatale A.D., et al. Phase II study of temozolomide in combination with topotecan (TOTEM) in relapsed or refractory neuroblastoma: a European Innovative Therapies for Children with Cancer-SIOP-European Neuroblastoma study. Eur J Cancer. 2014 Jan; 50(1): 170-7.
83. Wieczorek A., et al. Dinutuximab beta combined with chemotherapy in patients with relapsed or refractory neuroblastoma. Front Oncol. 2023 Feb 3: 13:1082771.
84. Шаманская Т.В., с соавт. Результаты терапии пациентов с нейробластомой группы высокого риска: опыт НМИЦ ДГОИ им. Дмитрия Рогачева // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2023. - Том 22. - N 2. - С. 65 - 91.
85. Park JR et al. Effect of Tandem Autologous Stem Cell Transplant vs Single Transplant on Event-Free Survival in Patients With High-Risk Neuroblastoma: A Randomized Clinical Trial. JAMA 2019; 322(8): 746 - 755.
86. Pascualini C et al. Tandem high-dose chemotherapy with thiotepa and busulphan-melphalan and autologous stem cell transplantation in very high-risk neuroblastoma patients. Bone Marrow Transplant 2016; 51(2): 227-31.
87. Balaguer J. et al. Recent Evidence-Based Clinical Guide for the Use of Dinutuximab Beta in Pediatric Patients with Neuroblastoma. Target Oncol. 2023; 18(1): 77 - 93.
88. Киреева Е.Д., соавт. Методические рекомендации по проведению сцинтиграфических исследований с 123I-MIBG при различных патологических состояниях организма. Раздел 1. Диагностика онкологических заболеваний. Москва. 2019. УДК 615.84+616-073.75. ББК 53.6. П 78. Серия "Лучшие практики лучевой и инструментальной диагностики".
89. Bombardieri E., et al. 131I/123I-metaiodobenzylguanidine (mIBG) scintigraphy: procedure guidelines for tumour imaging. Eur J Nucl Med Mol Imaging. 2010 Dec; 37(12): 2436-46.
90. Lau L.M.S., et al. Precision-guided treatment in high-risk pediatric cancers. Nat Med 30, 1913 - 1922 (2024).
91. Pugh T.J., et al. The genetic landscape of high-risk neuroblastoma. Nat Genet. 2013 Mar; 45(3): 279-84. doi: 10.1038/ng.2529. Epub 2013 Jan 20. PMID: 23334666; PMCID: PMC3682833.
92. Tavajohi R., et al. Optimal regimen of levetiracetam for prevention of busulfan-induced seizure in patients undergoing hematopoietic stem cell transplantation: A review of available evidence. J Oncol Pharm Pract. 2023; 29(4): 927 - 933.
93. Шаманская Т.В., с соавт. Результаты терапии пациентов с нейробластомой группы высокого риска: опыт НМИЦ ДГОИ им. Дмитрия Рогачева. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2023; 22(2): 65 - 91.
94. Childrens cancer and leukaemia group (CCLG). Neuroblastoma special interest group. Treatment of Patients with Low/Intermediate Risk Neuroblastoma https://www.cclg.org.uk/write/MediaUploads/Member%20area/Treatment%20guidelines/CCLG_Low-Inter_Risk_Neuroblastoma_guidelines_FINAL_March_2015(1).pdf.
95. Provider Guide: Prevention and Management of Irinotecan-Induced Diarrhea. https://www.pogo.ca/wp-content/uploads/2022/01/3.7.2-Provider-Guide-%E2%80%93-Prevention-and-Management-of-Irinotecan-Induced-Diarrhea.pdf.
96. Palmer J et al. Personalizing Busulfan-Based Conditioning: Considerations from the American Society for Blood and Marrow Transplantation Practice Guidelines Committee. Biol Blood Marrow Transplant. 2016; 22(11): 1915 - 1925.
97. Patel P. Interventions for the prevention of acute phase chemotherapy-induced nausea and vomiting in adult and pediatric patients: a systematic review and meta-analysis. // Patel P, Robinson PD, Wahib N [et al] // Support Care Cancer. 2022 Nov; 30(11): 8855 - 8869.
98. Hesketh, P.J. Antiemetics: ASCO Guideline Update / P.J. Hesketh, M.G. Kris, E. Basch [et al.] // J Clin Oncol. - 2020. - JCO2001296. - doi: 10.1200/JCO.20.01296.
99. Patel, P. Prevention and treatment of anticipatory chemotherapy-induced nausea and vomiting in pediatric cancer patients and hematopoietic stem cell recipients: Clinical practice guideline update / P. Patel, P.D. Robinson, K.A. Devine [et al.] // Pediatr Blood Cancer. - 2021. - Vol. 68 (5). - P. e28947.
100. Жуков, Н.В. Эффективность и безопасность малых доз оланзапина в профилактике тошноты и рвоты у детей и подростков, получающих высокоэметогенную химиотерапию. Промежуточные результаты рандомизированного исследования / Н.В. Жуков, Л.Л. Рабаева, Д.В. Литвинов // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2022. - N 4. - С. 70 - 82.
101. Jain S. A randomized, open-label non-inferiority study to compare palonosetron and ondansetron for prevention of acute chemotherapy-induced vomiting in children with cancer receiving moderate or high emetogenic chemotherapy / Jain S., Kapoor G, Koneru S, Vishwakarma G // Support Care Cancer - 2018 Sep; 26(9): 3091 - 3097.
102. Patel P. Dexamethasone dosing for prevention of acute chemotherapy-induced vomiting in pediatric patients: A systematic review / Patel P, Olteanu A, Cabral S, Santesso N, Robinson PD, Dupuis LL. // Pediatr Blood Cancer. 2020 Dec; 67(12): e28716.
103. Ramavath, D.N. Olanzapine for Prevention of Vomiting in Children and Adolescents Receiving Highly Emetogenic Chemotherapy: Investigator-Initiated, Randomized, Open-Label Trial / D.N. Ramavath, V. Sreenivas, S. Vishwajeet [et al.] // Journal of Clinical Oncology. - 2020. - Vol. 38 (32). - P. 3785 - 3793.
104. Chaudhary, N.K. Palonosetron is a Better Choice Compared with Ondansetron for the Prevention of Chemotherapy-induced Nausea and Vomiting (CINV) in a Resource-limited Pediatric Oncology Center: Results from a Randomized Control Trial / N.K. Chaudhary, R.R. John, D. Boddu [et al.] // J Pediatr Hematol Oncol. - 2019. - Vol. 41 (4). - P. 294 - 297.
105. Jain S. A randomized, open-label non-inferiority study to compare palonosetron and ondansetron for prevention of acute chemotherapy-induced vomiting in children with cancer receiving moderate or high emetogenic chemotherapy / Jain S., Kapoor G, Koneru S, Vishwakarma G // Support Care Cancer - 2018 Sep; 26(9): 3091 - 3097.
106. Flank, J. Guideline for the Treatment of Breakthrough and the Prevention of Refractory Chemotherapy-Induced Nausea and Vomiting in Children with Cancer / J. Flank, P.D. Robinson, M. Holdsworth [et al.] // Pediatr Blood Cancer. - 2016. - Vol. 63 (7). - P. 1144 - 1151.
107. Goldsmith K.C., et al. Lorlatinib with or without chemotherapy in ALK-driven refractory/relapsed neuroblastoma: phase 1 trial results. Nat Med. 2023; 29(5): 1092 - 1102. doi: 10.1038/s41591-023-02297-5.
108. Методические указания. Порядок проведения клинических исследований для оценки эффективности специализированной пищевой продукции диетического лечебного и диетического профилактического питания/ ФГБУН "ФИЦ питания и биотехнологии", Роспотребнадзор, Минздрав России, ФГБУН "ФНЦГ им. Ф.Ф. Эрисмана" Роспотребнадзора. - Москва. - 2023. - 28 с.
109. Методическое руководство. Стандарты лечебного питания/ ФГБУН "ФИЦ питания и биотехнологии". - Москва. - 2017. - 338 с.
110. Muscaritoli M, Arends J, Bachmann P, Baracos V, Barthelemy N, Bertz H, Bozzetti F, H tterer E, Isenring E, Kaasa S, Krznaric Z, Laird B, Larsson M, Laviano A, M hlebach S, Oldervoll L, Ravasco P, Solheim TS, Strasser F, de van der Schueren M, Preiser JC, Bischoff SC. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutr. 2021; 40(5): 2898 - 2913.
111. Вашура А.Ю., Пятаева А.А., Карелин А.Ф. Питание и нутритивная поддержка детей со злокачественными новообразованиями после завершения лечения: основные аспекты. Вопросы детской диетологии. 2022; 20(6): 64 - 70.
112. Вашура АЮ, Кучер МА, Ковтун ТА, Алымова ЮA, Литвинов ДВ, Зубаровская ЛС, Кулагин АД. Роль и актуальность нутрициологического диагноза в онкопедиатрии. Медицинский Совет. 2023; (12): 99 - 109.
113. Rayar M., Webber C.E., Nayiager T., Sala A., Barr R.D. Sarcopenia in children with acute lymphoblastic leukemia. J Pediatr Hematol Oncol. 2013; 35: 98-102; Pietila S., Makipernaa A., Sievanen H., Koivisto A.M., Wigren T., Lenko H.L. Obesity and metabolic changes are common in young childhood brain tumor survivors. Pediatr Blood Cancer. 2009; 52: 853-9.
114. Joosten K, Embleton N, Yan W, Senterre T; ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Energy. Clin Nutr. 2018; 37 (6 Pt B): 2309 - 2314.
115. Парентеральное и энтеральное питание: национальное руководство / под ред. М.Ш. Хубутия, Т.С. Поповой, А.И. Салтанова. - М.: ГЭОТАР-Медиа, 2014. - 800 с.
116. Особенности нутриционной поддержки больных в педиатрии. В кн.: Клиническое питание больных в интенсивной медицине: практическое руководство /под ред. Луфта В.М., Багненко С.Ф., издание второе, дополненное. СПб.: Арт-Экспресс, 2013 - 460.
117. Парентеральное и энтеральное питание детей. Практические рекомендации. Под ред. Ерпулевой Ю.В., Чубаровой А.И., Чугуновой Ю.Л. ГЭОТАР-Медиа, 2016 г. 304 с.; Arends J. et al. ESPEN guidelines on nutrition in cancer patients // Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, N 1. P. 11-48.
118. Современные рекомендации по питанию детей / под ред. Проф. Ю.Г. Мухиной, проф. И.Я. Коня. - М.: ИД "МЕДПРАКТИКА-М", 2010, 568 с.
119. Ерпулева Ю.В. Парентеральное питание у детей Российский вестник детской хирургии, анестезиологии и реаниматологии. 2018; 8(1): 49 - 56.
120. Kuderer NM, Dale DC, Crawford J, Cosler LE, Lyman GH. Mortality, morbidity and cost associated with febrile neutropenia in adult cancer patients. Cancer, 2006; 106(10): 2258 - 2266.
121. Mikulska M, Viscoli C, Orasch C, Livermore DM, Averbuch D, Cordonnier C et al. Aetiology and resistance in bacteriaemias among adult and paediatric haematology and cancer patients. Jornal of infection (2014), 68: 321 - 331.
122. Lyman GH, Rolston KVI. How we treat febrile neutropenia in patients receiving cancer chemotherapy. Journal of oncology practice, 2010; 6(3): 149 - 152.
123. Averbuch D, Orasch C, Cordonnier C, Livermore DM, Mikulska M, Viscoli C et al. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: summary of the 2011 4th European Conference of Infections in Luekemia. Нaematologica 2013; 98 (12): 1826 - 1835.
124. Flowers CR, Seidenfeld J, Bow EJ, Karten C, Gleason C, Hawley DK et al. Antimicrobial prophycaxis and outpatient management of fever and neutropenia in adults treated for malignancy: american society of clinical oncology clinical practice guidline. American society of clinical oncology 2012, www.asco.org/guedlines/outpatient.
125. Hakim H, Flynn PM, Knapp KM, Srivastava DK, Gaur AH. Etiology and clinical course of febrile neutropenia in children with cancer. J Pediatr Hematol Oncol, 2009; 31(9): 623 - 629.
126. Tam CS, O'Reilly M, Andresen D, Lingaratnam S, Kelly A, Burbury K et al. Use of empiric antimicrobial therapy in neutripenic fever. Intern Med J, 2011; 41: 90-101.
127. Miranda M., Nadel S. Pediatric Sepsis: a Summary of Current Definitions and Management Recommendations // Curr Pediatr Rep. Springer Nature, 2023. Vol. 11, N 2. P. 29 - 39.
128. Lehrnbecher T, Phillips R, Alexander S, Alvaro F, Carlesse F, Fisher B et al. Guidlenes for the management of fever and neutropenia in children with cancer and/or undergoing hematopoietic stem-cell transplantation. J Сlin Оncol, 2012; 30(35): 4427 - 4438.
129. Simon A. et al. Surveillance of bloodstream infections in pediatric cancer centers - what have we learned and how do we move on? // GMS Hyg Infect Control. German Medical Science, 2016. Vol. 11. P. Doc11.
130. Bard J.D., TeKippe E.M.E. Diagnosis of Bloodstream Infections in Children // J Clin Microbiol. J Clin Microbiol, 2016. Vol. 54, N 6. P. 1418 - 1424.
131. Petty L.A. et al. Repeated Blood Cultures in Pediatric Febrile Neutropenia: Would Following the Guidelines Alter the Outcome? // Pediatr Blood Cancer. Pediatr Blood Cancer, 2016. Vol. 63, N 7. P. 1244 - 1249.
132. Scheler M. et al. Management of children with fever and neutropenia: results of a survey in 51 pediatric cancer centers in Germany, Austria, and Switzerland // Infection. Springer Science and Business Media Deutschland GmbH, 2020. Vol. 48, N 4. P. 607 - 618.
133. Vehreschild M.J.G.T. et al. A multicentre cohort study on colonization and infection with ESBL-producing Enterobacteriaceae in high-risk patients with haematological malignancies // J Antimicrob Chemother. J Antimicrob Chemother, 2014. Vol. 69, N 12. P. 3387 - 3392.
134. Jaiswal S.R. et al. Gut Colonization with Carbapenem-resistant Enterobacteriaceae Adversely Impacts the Outcome in Patients with Hematological Malignancies: Results of A Prospective Surveillance Study // Mediterr J Hematol Infect Dis. Catholic University in Rome, 2018. Vol. 10, N 1. P. 2018025.
135. Girmenia C. et al. Incidence, Risk Factors and Outcome of Pre-engraftment Gram-Negative Bacteremia After Allogeneic and Autologous Hematopoietic Stem Cell Transplantation: An Italian Prospective Multicenter Survey // Clin Infect Dis. Clin Infect Dis, 2017. Vol. 65, N 11. P. 1884 - 1896.
136. Klastersky J., Awada A, Paesmans M, Aoun M. Febrile neutropenia: a critical review of the initial management. CID, 2004; 39(1): 32 - 37.
137. Morrissey C., Gilroy N., Macesic N., Walker P., Nanda-Rajah M. et al. Consensus guidelines for the use of empiric and diagnostic-driven antifungal treatment strategies in haematological malignancy, 2014. Intern Med J, 2014; 44: 1298 - 1314.
138. Groll AH, Werner C, Tebbe J, Solopova G, Becker K et al. Pulmonale Infectionen in der p diatrischen H matologie und Oncologie. Monatsschr Kinderheilkd, 2011; 159: 233 - 241.
139. Ruhnke M and Schwartz S. Recent developments in the management of invasive fungal infections in patients with oncohematological diseases. Ther Adv Hematol, 2016; 7(6): 345 - 359.
140. Tissot F., Agrawai S., Pagano L., Petrikkos G., Groll A.H. et al. ECIL-6 Guidelines for the Treatment of Invasive Candidiasis, Aspergillosis and Mucormycosis in Liekemia and Hematopoietic Stem Cell Transplant Patients. Hematologica, 2017; 102: 433 - 444.
141. Heussel C., Kauczor H., Heussel G., Fischer B., Begrich M. et al. Pneumonia in febrile neutropenic patients and in bone marrow and blood stem-cell transplant recipients: use of high-resolution computed tomography. J Clin Oncol, 1999; 17: 796 - 805.
142. Новичкова Г.А., Горонкова О.В., Балашов Д.Н., Байдильдина Д.Д., Жарикова Л.И. и др. Диагностика, клиника и лечение инвазивного аспергиллеза у детей с приобретенной апластической анемией: анализ 20 собственных случаев. Гематология и трансфузиология, январь 2005.
143. Ison M.G., Hirsch H.H. Community-Acquired Respiratory Viruses in Transplant Patients: Diversity, Impact, Unmet Clinical Needs // Clin Microbiol Rev. Clin Microbiol Rev, 2019. Vol. 32, N 4.
144. Hermann B. et al. Influenza virus infections in patients with malignancies -- characteristics and outcome of the season 2014/15. A survey conducted by the Infectious Diseases Working Party (AGIHO) of the German Society of Haematology and Medical Oncology (DGHO) // European Journal of Clinical Microbiology & Infectious Diseases. Springer, 2017. Vol. 36, N 3. P. 565.
145. Солопова Г.Г., Цыганова Е.В., Кондрашова А.В., Гордеева Г.Н., Розанцева Е.В., Бегунова С.В., Воронин К.А., Копосова А.О., Новичкова Г.А. "Особенности течения новой коронавирусной инфекции COVID-19 у детей с онкологическими, онкогематологическими и тяжелыми иммунологическими заболеваниями. Опыт НМИЦ ДГОИ им. Дмитрия Рогачева". Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2021 т. 20 N 4: 89 - 99.
146. Spruit J L, Knight T, Sweeney C, Salimnia H, Sava an S. Clostridium difficile infection in a children's hospital with specific patterns among pediatric oncology and hematopoietic stem cell transplantation populations Pediatr Hematol Oncol. 2020 Apr; 37(3): 211 - 222. doi: 10.1080/08880018.2019.1711473.
147. Tai E, Richardson LC, Townsend J, Howard E, Mcdonald LC Clostridium difficile infection among children with cancer Pediatr Infect Dis J. 2011 Jul; 30(7): 610-2.
148. Castagnola E., Ruberto E., Guarino A. Gastrointestinal and liver infections in children undergoing antineoplastic chemotherapy in the years 2000 // World J Gastroenterol. Baishideng Publishing Group Inc, 2016. Vol. 22, N 25. P. 5853.
149. Maertens J.A. et al. Optimization of the cutoff value for the Aspergillus double-sandwich enzyme immunoassay // Clin Infect Dis. Clin Infect Dis, 2007. Vol. 44, N 10. P. 1329 - 1336.
150. Lehrnbecher T, Robinson PD, Fisher BT, Castagnola E, Groll AH, Steinbach WJ, Zaoutis TE, Negeri ZF, Beyene J, Phillips B, Sung L. Galactomannan, -D-Glucan, and Polymerase Chain Reaction-Based Assays for the Diagnosis of Invasive Fungal Disease in Pediatric Cancer and Hematopoietic Stem Cell Transplantation: A Systematic Review and Meta-Analysis. Clin Infect Dis. 2016 Nov 15; 63(10): 1340 - 1348. doi: 10.1093/cid/ciw592.
151. Warris A, Lehrnbecher T Progress in the Diagnosis of Invasive Fungal Disease in Children Curr Fungal Infect Rep. 2017; 11(2): 35 - 44. doi: 10.1007/s12281-017-0274-9.
152. Gupta A, Capoor MR, Shende T, Sharma B, Mohindra R, Suri JC, Gupta DK. Comparative evaluation of galactomannan test with bronchoalveolar lavage and serum for the diagnosis of invasive aspergillosis in patients with hematological malignancies.
153. Mikulska M, Calandra T, Sanguinetti M, Poulain D, Viscoli C. The use of mannan antigen and anti-mannan antibodies in the diagnosis of invasive candidiasis: recommendations from the Third European Conference on Infections in Leukemia. Crit Care. 2010; 14(6): R222. doi: 10.1186/cc9365.
154. Duettmann W, Koidl C, Krause R, Lackner G, Woelfler A, Hoenigl M. Specificity of mannan antigen and anti-mannan antibody screening in patients with haematological malignancies at risk for fungal infection. Mycoses. 2016 Jun; 59(6): 374-8. doi: 10.1111/myc.12482.
155. Chang CC, Harrison TS, Bicanic TA, Chayakulkeeree M, Sorrell TC, Warris A, et al. Global guideline for the diagnosis and management of cryptococcosis: an initiative of the ECMM and ISHAM in cooperation with the ASM.. Lancet Infect Dis. 2024 Feb 9: S1473 - 3099(23) 00731-4. doi: 10.1016/S1473-3099(23) 00731-4.
156. Lehrnbecher T, Robinson P, Fisher B, Alexander S, Ammann RA, et al. Guideline for the Management of Fever and Neutropenia in Children With Cancer and Hematopoietic Stem-Cell Transplantation Recipients: 2017 Update. J Clin Oncol. 2017 Jun 20; 35(18): 2082 - 2094. doi: 10.1200/JCO.2016.71.7017.
157. Lehrnbecher T. et al. Guideline for the Management of Fever and Neutropenia in Pediatric Patients With Cancer and Hematopoietic Cell Transplantation Recipients: 2023 Update // J Clin Oncol. J Clin Oncol, 2023. Vol. 41, N 9. P. 1774 - 1785.
158. Lehrnbecher T. et al. 8th European Conference on Infections in Leukaemia: 2020 guidelines for the use of antibiotics in paediatric patients with cancer or post-haematopoietic cell transplantation // Lancet Oncol. Lancet Oncol, 2021. Vol. 22, N 6. P. e270 - e280.
159. Солопова Г.Г., Новичкова Г.А. Опыт внедрения алгоритма эмпирической антибактериальной терапии при развитии фебрильной нейтропении в Центре детской гематологии/онкологии // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2017. Vol. 16, N 3. P. 35 - 47.
160. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H et al. Surviving sepsis campain: international guidlines for management of severe sepsis and septic shock, 2012. Intensive Care Med, 2013; 39(2): 165 - 228.
161. Ferrer R. et al. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: results from a guideline-based performance improvement program // Crit Care Med. Crit Care Med, 2014. Vol. 42, N 8. P. 1749 - 1755.
162. Van Vliet M. et al. How prompt is prompt in daily practice? Earlier initiation of empirical antibacterial therapy for the febrile neutropenic patient // Eur J Cancer Care (Engl). Eur J Cancer Care (Engl), 2011. Vol. 20, N 5. P. 679 - 685.
163. Morales Castro D. et al. Pharmacokinetic Alterations Associated with Critical Illness // Clin Pharmacokinet. Adis, 2023. Vol. 62, N 2. P. 209 - 220.
164. Cordonnier C, Pautas C, Maury S, Vekhoff A, Farhat H et al. Empirical versus antifungal therapy for high-risk, febrile, neutropenic patients: a randomized, controlled trial. Clin Infect Dis, 2009; 48: 1042 - 1051.
165. Groll AH, Pana D, Lanternier F, Mesini A, Ammann RA8th European Conference on Infections in Leukaemia: 2020 guidelines for the diagnosis, prevention, and treatment of invasive fungal diseases in paediatric patients with cancer or post-haematopoietic cell transplantation. Lancet Oncol. 2021 Jun; 22(6): e254 - e269. doi: 10.1016/S1470-2045(20) 30723-3.
166. Солопова Г.Г., Масчан А.А., Новичкова Г.Г. "Рекомендации 2020 года по диагностике и терапии инвазивного аспергиллеза у детей с онкогематологическими заболеваниями". Вопросы гематологии/онкологии и иммунопатологии. 2020 т. 19 N 1, стр. 158 - 166.
167. Dolton MJ, Ray JE, Chen Sh.A., Ng K., Pont LG and McLachlan AJ. Multicenter study of voriconasol pharmacokinetics and therapeutic drug monitoring. Antimicrob Agents Chemother, 2012; 59(9): 4793 - 4799.
168. Dolton MJ, Ray JE, Chen Sh.A., Ng K., Pont LG and McLachlan AJ. Multicenter study of posaconazole therapeutic drug monitoring: exposure-response relationship and factors affecting concentration. Antimicrob Agents Chemother, 2012; 56(11): 5503 - 5510.
169. De Pauw B., Walsh T.J., Donnelly J.P., Stevens E.E., Edwards J.E. et al. Revised Definitions of Invasive Fungal Disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis, 2008; 46(12): 1813-1821.
170. Patterson TF, Thompson GR, Denning DW, Fishman JA, Hadley S et al. Practice guidelines for the diagnosis and management of aspergillosis: 2016 update by the infectious diseases society of America. Clin Infect Dis, 2016; 63(4): e1 - e60.
171. Cordonnier C., Rovira M., Maertens J., Olavarria E., Faucher C. et al. () Voriconazole for secondary prophylaxis of invasive fungal infection in allogeneic stem cell transplant recipients: Results of the VOSIFI study. Haematologica, 2010; 95: 1762 - 1768.
172. Cornely O., Rikan-Akdagli S., Dannaoui E., Groll A., Lagrou, K. et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of mucormycosis 2013. Clin Microbiol Infect, 2014; 20 (Suppl. 3): 5 - 26.
173. Солопова Г.Г, Рачков В.Е., Ускова Н.Г., Оганесян Р.С., Коновалов Д.М. и Новичкова Г.А. Мукормикоз гастроинтестинальной локализации у пациента с острым миелобластным лейкозом. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2014; 13(4): 69 - 74.
174. Pana Z., Seidel D., Skiada A., Groll A., Petrikkos G. et al. Invasive mucormycosis in children: an epidemiologic study in European and non-European countries based on two registries. BMC Infect Dis, 2016; 16(1): 667.
175. O'Grady NP, Alexander M, Burns LA, Dellinger EP, Garland J, Heard SO, Lipsett PA, Masur H, Mermel LA, Pearson ML, Raad II, Randolph AG, Rupp ME, Saint S; Healthcare Infection Control Practices Advisory Committee (HICPAC). Guidelines for the prevention of intravascular catheter-related infections. Clin Infect Dis. 2011 May; 52(9): e162-93. doi: 10.1093/cid/cir257. Epub 2011 Apr 1. PMID: 21460264; PMCID: PMC3106269.
176. Nickel B, Gorski L, Kleidon T, Kyes A, DeVries M, Keogh S, Meyer B, Sarver MJ, Crickman R, Ong J, Clare S, Hagle ME. Infusion Therapy Standards of Practice, 9th Edition. J Infus Nurs. 2024 Jan-Feb 01; 47(1S Suppl 1): S1 - S285. doi: 10.1097/NAN.0000000000000532. PMID: 38211609.
177. Венозный катетер. Использование, уход, контроль, осложнения: учебное пособие / Сацук А.В., Солопова Г.Г., Щукин В.В., Литвинов Д.В., Пименова О.В. Климова Н.А., Щемелинская Ю.Л., Масчан А.А, Новичкова Г.А. - М. АО "Информатика", 2023. - 152 с.: ил. ISBN 978-5-6049537-2-3.
178. Occlusion Management Guideline (OMG) [Electronic resource]. URL: https://cvaa.info/en/publications/occlusion-management-guideline-omg.
179. Pittiruti M, Van Boxtel T, Scoppettuolo G, Carr P, Konstantinou E, Ortiz Miluy G, Lamperti M, Goossens GA, Simcock L, Dupont C, Inwood S, Bertoglio S, Nicholson J, Pinelli F, Pepe G. European recommendations on the proper indication and use of peripheral venous access devices (the ERPIUP consensus): A WoCoVA project. J Vasc Access. 2023 Jan; 24(1): 165 - 182. doi: 10.1177/11297298211023274. Epub 2021 Jun 4. PMID: 34088239.
180. Cellini M, Bergadano A, Crocoli A, Badino C, Carraro F, Sidro L, Botta D, Pancaldi A, Rossetti F, Pitta F, Cesaro S. Guidelines of the Italian Association of Pediatric Hematology and Oncology for the management of the central venous access devices in pediatric patients with onco-hematological disease. J Vasc Access. 2020 Nov 10:1129729820969309. doi: 10.1177/1129729820969309. Epub ahead of print. PMID: 33169648.
181. Murgo M, Spencer T, Breeding J, Alexandrou E, Baliotis B, Hallett T, Guihermino M, Martinich I, Frogley M, Denham J, Whyte R, Ray-Barruel B and Richard C (2014) Central Venous Access Device - Post Insertion Management. Agency for Clinical Innovation NSW Health Australia 978-1-74187-953-7.
182. Rosenthal, Victor & Kanj, Souha & Desse, Javier & Alkhawaja, Safaa & Cimerman, Sergio & Rodriguez-Morales, Alfonso & El Kholy, Amani & Opintan, Japheth & Avortri, Gertrude & Singh, Sanjeev & Mehta, Yatin & Mitsuda, Toshihiro & Al-Abdely, Hail & Kamarulzaman, Adeeba & Mota, Maria & Trejo, Roxana & Ider, Bat-Erdene & Enciso, Hernan & Collantes, Sofia & Leblebicioglu, Hakan. (2017). Bundle of the International Nosocomial Infection Control Consortium (INICC) to Prevent Central and Peripheral Line-Related Bloodstream Infections.
183. Bercovitz R.S., Josephson C.D. Transfusion considerations in pediatric hematology and oncology patients // Hematol Oncol Clin North Am, 2016. Vol. 30, N 3. P. 695 - 709.
184. Steiner M.E., Zantek N.D., Stanworth S.J. et al. Recommendations on RBC Transfusion Support in Children With Hematologic and Oncologic Diagnoses From the Pediatric Critical Care Transfusion and Anemia Expertise Initiative // Pediatr Crit Care Med, 2018. Vol. 19 (9S Suppl 1). P. 149 - 156.
185. Shah N., Andrews J., Goodnough LT. Transfusions for anemia in adult and pediatric patients with malignancies // Blood Reviews, 2015. Vol. 29. N 5. P. 291 - 299.
186. Nellis M.E., Goel R., Karam O. Transfusion Management in Pediatric Oncology Patients // Hematol Oncol Clin North Am, 2019. Vol. 33, N 5. P. 903 - 913.
187. World Health Organization. (2021). Educational modules on clinical use of blood. https://www.who.int/publications/i/item/9789240033733.
188. Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. Москва: Триада, 2005 - с. 150.
189. Кречетова А.В. Нарушение гемостаза при сепсисе у онкогематологических больных с миелотоксическим агранулоцитозом: автореф. Дис канд мед. наук. М.: Гематологический научный центр; 2011.
190. Kozek-langenecker S.A., Afshari A., Albaladejo P. et al. Management of severe perioperative bleeding Guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol. 2013. Vol. 30: 270 - 382.
191. O'Shaughnessy D., Atterbury C., Bolton Maggs P. et al. Guidelines for the use of fresh-frozen plasma, cryoprecipitate and cryosupernatant // Br J Hematol, 2004. Vol. 126, N 1. P. 11 - 28.
192. Галстян Г.М., Гапонова Т.В., Жибурт Е.Б. et al. Клиническое использование криопреципитата // Гематология и трансфузиология. 2020. Vol. 65, N 1. P. 87 - 114.
193. Lim W, Gal GL, Bates SM et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: diagnosis of venous thromboembolism // Blood Adv. 2018. Vol. 2, N 22. Р. 3226 - 3256.
194. Евстратов Д.А., Жарков П.А., Дьяконова Ю.Ю. с соавт. Тромбоз венозных синусов головного мозга и кровоизлияние в ткань головного мозга у пациента с лимфобластной лимфомой // Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2015. Vol. 14, N 2, стр. 36 - 40.
195. Жарков П.А., Свирин П.В.: Венозные тромбозы. Детская гематология. Клинические рекомендации под ред. А.Г. Румянцева, А.А. Масчана, Е.В. Жуковской, Гэотар-Медиа, 2015, ISBN 978-5-9704-3475-8, 656 стр.
196. Жарков П.А., Грачева М.А., Ройтман Е.В. с соавт. Распространенность тромбозов глубоких вен у детей с онкогематологической патологией. Тромбоз, гемостаз и реология, 2015. N 3(63), стр. 29 - 34.
197. Жарков П.А., Морозова Д.С., Гобадзе Д.А. с соавт. Тромбозы глубоких вен у детей с заболеваниями крови. Онкогематология 2019; 14(1): 20 - 30.
198. Жарков П.А., Шифрин Ю.А., Новичкова Г.А. Эффективность антитромботической терапии тромбозов глубоких вен у детей с заболеваниями крови // Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2019; 18 (1): 34 - 43.
199. Морозова Д.С., Жарков П.А., Евстратов Д.А. Рецидивирующее течение тромбозов глубоких вен у детей с злокачественными заболеваниями крови. Обзор литературы // Онкогематология 2019; 14(2): 24 - 28.
200. Jones S., Monagle P., Newall F. Do asymptomatic clots in children matter? // Thromb Res. 2020. Vol. 189. P. 24 - 34.
201. Федорова Д.В., Жарков П.А., Пшонкин А.В. Тромботические наложения на центральных венозных катетерах как фактор риска развития катетер-ассоциированных тромбозов глубоких вен // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2016. T. 15(2): 20 - 26.
202. Monagle P., Cuello C.A., Augustine C. et al. American Society of Hematology 2018 Guidelines for management of venous thromboembolism: treatment of pediatric venous thromboembolism // Blood Adv 2018. Vol. 2. N 22. P. 3292 - 3316.
203. Monagle P., Chan A.K.C., Goldenberg N.A. et al. Antithrombotic therapy in neonates and children: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. 2012. Vol. 141, N 2 Suppl. P. e737S - e801S.
204. Lim W, Gal GL, Bates SM et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: diagnosis of venous thromboembolism // Blood Adv. 2018. Vol. 2, N 22. Р. 3226 - 3256.
205. Жарков П.А., Полетаев А.В., Грачева М.А. с соавт. Применение метода "Тромбориск" у детей с тромбозом глубоких вен на фоне терапии злокачественного заболевания. Доктор.ру. Гематология. 2016. N 5 (122). С. 48 - 51.
206. van Ommen C.H., Heijboer H., Buller H.R. et al. Venous thromboembolism in childhood: a prospective two-year registry in the Netherlands // J Pediatr. 2001; 139(5): 676 - 681.
207. Sabapathy C.A., Djouonang T.N., Kahn S.R. et al. Incidence trends and mortality from childhood venous thromboembolism: a population-based cohort study // J Pediatr. 2016. Vol. 172. P. 175 - 180. e1.
208. Raffini L, Huang YS, Witmer C, Feudtner C. Dramatic increase in venous thromboembolism in children's hospitals in the United States from 2001 to 2007 // Pediatrics. 2009. Vol. 124(4). P. 1001 - 1008.
209. Polikoff L.A., Faustino E.V. Venous thromboembolism in critically ill children // Curr Opin Pediatr. 2014. Vol. 26(3). P. 286 - 291.
210. Witmer C.M., Takemoto C.M. Pediatric hospital acquired venous thromboembolism // Front Pediatr. 2017. Vol. 5. P. 198.
211. Свирин П.В., Ларина Л.Е., Жарков П.А. et al. Педиатрические тромбозы: применение дальтепарина натрия для лечения и профилактики // Российский журнал детской гематологии и онкологии, 2015. N 1., с. 61 - 65.
212. Шифрин Ю.А., Жарков П.А., Пашанов Е.Д. Применение концентрата протеина С у детей с приобретенным дефицитом протеина С // Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2019; 18 (2), 59 - 65.
213. Brandao L.R., Tartakovsky I., Albisetti M. et al. Dabigatran in the treatment and secondary prophylaxis of venous thromboembolism in children with thrombophilia // Blood Adv. 2022. Vol. 6(22). P. 5908 - 5923.
214. Palumbo J.S., Lensing A.W.A., Brandao L.R. et al. Anticoagulation in pediatric cancer-associated venous thromboembolism: a subgroup analysis of EINSTEIN-Jr // Blood Adv. 2022. Vol. 6(22). P. 5821 - 5828.
215. Connor P., Sanchez van Kammen M., Lensing A.W.A. et al. Safety and efficacy of rivaroxaban in pediatric cerebral venous thrombosis (EINSTEIN-Jr CVT) // Blood Adv. 2020/ Vol. 4(24). P. 6250 - 6258.
216. Thom K., Lensing A.W.A., Nurmeev I. et al. Safety and efficacy of anticoagulant therapy in pediatric catheter-related venous thrombosis (EINSTEIN-Jr CVC-VTE) // Blood Adv. 2020. Vol. 4(19). P. 4632 - 4639.
217. Male C., Lensing A.W.A., Palumbo J.S. et al. Rivaroxaban compared with standard anticoagulants for the treatment of acute venous thromboembolism in children: a randomised, controlled, phase 3 trial // Lancet Haematol. 2020. Vol. 7(1). P. e18 - e27.
218. Monagle P., Lensing A.W.A, Thelen K. et al. Bodyweight-adjusted rivaroxaban for children with venous thromboembolism (EINSTEIN-Jr): results from three multicentre, single-arm, phase 2 studies // Lancet Haematol. 2019. Vol. 6(10). P. e500 - e509.
219. Lensing A.W.A., Male C., Young G. et al. Rivaroxaban versus standard anticoagulation for acute venous thromboembolism in childhood. Design of the EINSTEIN-Jr phase III study // Thromb J. 2018. Vol. 16. P. 34.
220. Hassan H et al Dosage regimen for meropenem in children with Pseudomonas infections do not meet serum concentration targets.//Clin Transl Sci 2020; 13(2): 301 - 308.
221. Муфтахова Г.М., Качанов Д.Ю., Панкратьева Л.Л., Шаманская Т.В., Нечеснюк А.В., Хамин И.Г., Варфоломеева С.Р. Применение лучевой терапии у детей с нейробластомой 4S стадии Вопросы практической педиатрии. 2015 Том 10 N 3 стр. 7 - 13.
222. P. Popowicz, R. K. Newman, E. Dominique. Abdominal Compartment Syndrome // Book. PMID: 28613682 Bookshelf ID: NBK430932.
223. G. V. Klimovich, C. T. Ramos-Irizarry, G. A. Falk, T. Loux. Development of abdominal compartment syndrome secondary to tumor lysis in an infant with disseminated stage 4 neuroblastoma despite decompressive laparotomy // Journal of Pediatric Surgery Case Reports Vol. 4, January 2016, P. 46 - 48.
225. Е.В. Горохова, Д.Ю. Качанов, О.Б. Меришавян, соавт. Эпидуральная компрессия при нейробластоме у детей первых 6 месяцев жизни: опыт НМИЦ ДГОИ им. Дмитрия Рогачева // Вопросы гематологии/онкологии и иммунопатологии в педиатрии, Том 19, N 4 (2020), С. 46 - 56.
226. T. Trahair, S. Sorrentino, S.J. Russell, et al. Spinal canal involvement in neuroblastoma // J. Pediatr. - 2017. - Vol. 188. - P. 294 - 298.
227. B. De Bernardi, W. Balwierz, J. Bejent, et al. Epidural compression in neuroblastoma: Diagnostic and therapeutic aspects / // Cancer Lett. - 2005. - Vol. 228 (1 - 2). - P. 283 - 299.
228. Liu L-P et al High risk of bloodstream infection of carbapenem-resisstant Enterobacteriaceae carriers in neutropenic children with hematological diseases.//Antimicrob Resist Infect Control. 2023; 12(1): 66.
229. Castagnola E. Et al/ Antibiotic Resistant Bloodstream Infections in Pediatric Patients Receveiving Chemotherapy or Hematopoietic Stem Cell Transplant: Factors Associated with Development of Resistance, Intensive Care Admission and Mortality// Antibiotics 2021; 10(3): 266.
230. Kontou A. et al. Use of newer and repurposed antibiotics against gram-negative bacteria in neonates.// Antibiotics 2023; 12(6): 1072.
231. Chiotos K. et al Treatment of carbapenem-resistant Enterobacteriaceae infections in children.
232. Сепсис у детей с онкологическими заболеваниями: учебно-методическое пособие / Н.В. Матинян, Н.Ю. Епифанова, Т.В. Горбунова [и др.]. - Москва: ГЭОТАР-Медиа, 2023. - 48 с. - DOI: 10.33029/9704-7973-5-SCC-2023-1-48.
233. Decembrino N et al A case series and literature review of isavuconazole use in pediatric patients with hemato-oncologic diseases and hematopoietic stem cell transplantation.// Antimicrob Agents Chemother 2020; 64(3): e01783-19.
234. Fernandez Ladesma B et al Isavuconazole use and TDM in real-word pediatric practice.// Antimicrob Agents Chemother 2023; 67(12): e00829-23.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Клинические онкологи:
Шаманская Татьяна Викторовна, д.м.н., член РОДОГ, заведующая отделом изучения эмбриональных опухолей Института онкологии, радиологии и ядерной медицины ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Варфоломеева Светлана Рафаэлевна, д.м.н., проф., президент РОДОГ, директор НИИ детской онкологии и гематологии аппарата управления ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, профессор кафедры детской онкологии им. акад. Л.А. Дурнова ФГБОУ ДПО РМАНПО Минздрава России, г. Москва.
Качанов Денис Юрьевич, д.м.н., член РОДОГ, заведующий отделением клинической онкологии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России, зам. директора Института онкологии, радиологии и ядерной медицины ФГБУ НМИЦ ДГОИ им. Д. Рогачева.
Новичкова Галина Анатольевна, д.м.н., проф., член РОДОГ, научный руководитель "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России, главный внештатный детский специалист онколог-гематолог Минздрава.
Белогурова Маргарита Борисовна - д.м.н., проф., член РОДОГ, заведующая кафедрой онкологии, детской онкологии и лучевой терапии Санкт-Петербургского государственного педиатрического университета, заведующая отделением химиотерапии (противоопухолевой лекарственной терапии) и комбинированного лечения опухолей у детей ГБУЗ "Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический) имени Н.П. Напалкова" Минздрава России.
Уталиева Динара Тиморкановна, член РОДОГ, врач-детский онколог отделения клинической онкологии, лаборант-исследователь отдела катамнеза детей, перенесших онкологическое заболевания ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Иванов Николай Сергеевич, член РОДОГ врач - детский онколог отделения клинической онкологии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Рубанская Марина Владимировна, к.м.н., член РОДОГ, заведующая детским онкологическим отделением N 1 (химиотерапии опухолей, тораабдоминальной локализации) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Фечина Лариса Геннадьевна, к.м.н., член РОДОГ, заместитель главного врача по онкологии и гематологии ГАУЗ СО "Областная детская клиническая больница", г. Екатеринбург.
Диникина Юлия Валерьевна, к.м.н., член РОДОГ, заведующая отделением химиотерапии онкогематологических заболеваний и трансплантации костного мозга для детей ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России.
2. Трансплантационная группа:
Казанцев Илья Викторович, к.м.н., член РОДОГ, к.м.н., заведующий ОТКМ для детей N 2 НИИДОГиТ им. Р.М. Горбачевой, доцент кафедры ГТТ с курсом детской онкологии им. проф. Б.В. Афанасьева ПСПбГМУ им. акад. И.П. Павлова.
Хисматулина Римма Данияловна - член РОДОГ, врач-гематолог отделения трансплантации гемопоэтических стволовых клеток N 1 ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Киргизов Кирилл Игоревич, к.м.н., член РОДОГ, заместитель директора по научной работе НИИ ДОиГ имени академика РАМН Л.А. Дурнова, и.о. заведующего отделением, ведущий научный сотрудник отделения детской трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
3. Врачи-реаниматологи
Хамин Игорь Геннадьевич, к.м.н., член РОДОГ, заведующий отделением реанимации и интенсивной терапии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Крюков Иван Александрович, член РОДОГ, врач - анестезиолог-реаниматолог отделения реанимации и интенсивной терапии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
4. Лучевые терапевты:
Нечеснюк Алексей Владимирович, д.м.н., член РОДОГ, зав. отделением лучевой терапии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Усычкина Анастасия Юрьевна, член РОДОГ, врач-детский онколог отделения лучевой терапии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
5. Хирургическая группа:
Грачев Николай Сергеевич, д.м.н., проф., член РОДОГ, генеральный директор ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Ахаладзе Дмитрий Гурамович, д.м.н, член РОДОГ, врач-детский хирург отделения онкологии и детской хирургии, руководитель торако-абдоминальной группы ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Талыпов Сергей Риммович, член РОДОГ, врач-детский хирург отделения онкологии и детской хирургии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Озеров Сергей Сергеевич, член РОДОГ, врач-нейрохирург Государственное бюджетное учреждение здравоохранения города Москвы "Морозовская детская городская клиническая больница Департамента здравоохранения города Москвы".
Керимов Полад Акшин оглы, член РОДОГ, д.м.н., заведующий хирургическим отделением N 2 (опухолей торакоабдоминальной локализации и опорно-двигательного аппарата) НИИ детской онкологии и гематологии имени академика РАМН Л.А. Дурнова (НИИ ДОиГ) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
6. Группа визуализации:
Терещенко Галина Викторовна, к.м.н., член РОДОГ, зав. рентгенологическим отделением ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
7. ПЭТ и радиоизотопные методы исследования:
Ликарь Юрий Николаевич, д.м.н., член РОДОГ, зав. отделением ПЭТ и радионуклидной диагностики ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
8. Лаборатория молекулярной генетики
Друй Александр Евгеньевич, к.м.н., член РОДОГ, заведующий отделением молекулярной онкологий ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Андреева Наталья Александровна, к.м.н., член РОДОГ, врач-детский онколог отделения клинической онкологии и научный сотрудник лаборатории молекулярной онкологии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
9. Лаборатория патологической анатомии
Коновалов Дмитрий Михайлович, к.м.н., член РОДОГ, зав. отделением патологической анатомии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Рощин Виталий Юрьевич, член РОДОГ, врач отделения патологической анатомии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
10. Группа нутритивной поддержки
Вашура Андрей Юрьевич, к.м.н., врач-диетолог, заведующий отделом научных основ питания и нутритивно-метаболической терапии ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
Коровина Ирина Васильевна, врач-диетолог ФГБУ "НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Минздрава России.
11. Группа по сопроводительной терапии
Жуков Николай Владимирович, д.м.н., руководитель отдела междисциплинаной онкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Литвинов Дмитрий Витальевич, д.м.н., главный врач ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Рабаева Лилия Леонидовна, к.м.н., врач-детский онколог отделения гематологии/онкологии старшего возраста и нейроонкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Солопова Галина Геннадьевна, к.м.н., заместитель главного врача по инфекционному контролю, заведующий отделением инфекционного контроля, врач-гематолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Тратхман Павел Евгеньевич, д.м.н., профессор, заведующий отделением трансфузиологии, заготовки и процессинга гемопоэтических стволовых клеток ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Сацук Анастасия Владимировна, к.м.н., заведующий отделом повышения квалификации среднего медицинского персонала, врач-эпидемиолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, старший научный сотрудник лаборатории профилактики внутрибольничных инфекций ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
Щукин Владислав Владимирович, к.м.н., заведующий отделением анестезиологии и реанимации с операционным блоком, врач анестезиолог-реаниматолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Пименова Ольга Владимировна, главная медицинская сестра ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Климова Наталья Александровна, старшая медицинская сестра отделения детской гематологии/онкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Щемелинская Юлия Леонидовна, врач-эпидемиолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Сорокина Людмила Федоровна, медицинская сестра отделения детской онкологии, хирургии головы и шеи и нейрохирургии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Жарков Павел Александрович, д.м.н., заведующий лабораторией патологии гемостаза ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- врачи-детские гематологи;
- врачи-детские онкологи;
- детские хирурги;
- лучевые терапевты;
- педиатры;
- детские реаниматологи.
Методология сбора доказательств
Методы, использованные для сбора / селекции доказательств: поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0,3.
Поиск в электронных базах данных.
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MEDLINE.
Методы, использованные для анализа доказательств:
- обзоры опубликованных исследований и метаанализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А2.1 - А2.3).
В настоящих клинических рекомендациях приведены уровни достоверности доказательств и уровни убедительности рекомендаций в соответствии рекомендациями по разработке и актуализации клинических рекомендаций (приказ Минздрава России от 28.02.2019 г. N 103н).
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2.2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Методология валидизации рекомендаций
Методы валидизации:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание методики валидизации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях Национального общества детских гематологов и онкологов (НОДГО) в 2018 и 2020 гг.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
АЛГОРИТМ
АУДИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАЦИЕНТАМ С УСТАНОВЛЕННЫМ
ДИАГНОЗОМ НБ, КОТОРЫМ ПЛАНИРУЕТСЯ ПРОВЕДЕНИЕ ХИМИОТЕРАПИИ
С ВКЛЮЧЕНИЕМ ОТОТОКСИЧНЫХ ПРЕПАРАТОВ (ЦИСПЛАТИН**,
#КАРБОПЛАТИН**) ДЛЯ ОЦЕНКИ ФУНКЦИИ
СЛУХОВОГО АНАЛИЗАТОРА
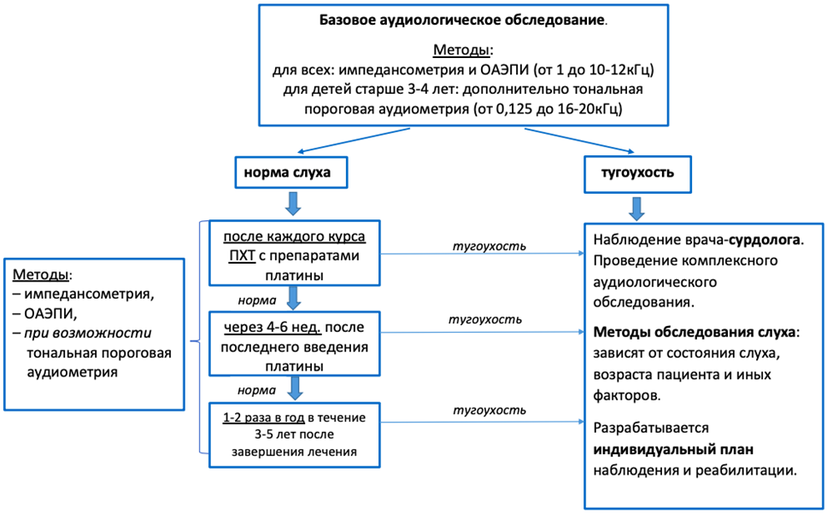
Приложение А3.2
КУРСЫ ХИМИОТЕРАПИИ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НЕЙРОБЛАСТОМЫ
Курс N 4 [13, 39]
Стандартный расчет доз препаратов:
- #Винкристин** 0,75 мг/м2 в/в струйно, дни 1, 3, 5 [13]
- Доксорубицин** 15 мг/м2 в/в за 30 мин, дни 1, 3, 5.
- Циклофосфамид** 300 мг/м2 в/в за 30 мин, дни 1 - 7.
- Сопроводительная терапия:
- Гидратация 2000 мл/м2, дни 1 - 7;
- месна** 60 мг/м2 x 3 раза в/в струйно 0, 4 и 8 ч от начала введения циклофосфамида**, дни 1 - 7;
- противорвотные препараты.
Расчет доз препаратов для новорожденных и детей младшего возраста (дети младше 12 месяцев и дети с массой тела < 10 кг):
- #Винкристин** 0,025 мг/кг/сут в/в струйно, дни 1, 3, 5 [13]
- Доксорубицин** 0,5 мг/кг/сут в/в за 30 мин, дни 1, 3 и 5.
- Циклофосфамид** 10 мг/кг /сут в/в за 30 мин, дни 1 - 7.
- Сопроводительная терапия:
- гидратация 50 мл/кг /сут, дни 1 - 7;
- месна** 2 мг/кг/сут 3 раза в/в струйно 0, 4 и 8 ч от начала введения циклофосфамида**, дни 1 - 7;
- противорвотные препараты в возрастных дозировках.
Интервал между курсами составляет 21 день.
Курс #карбоплатин** и этопозид** (для детей до 12 мес.) [94]
Стандартный расчет доз препаратов:
- #Карбоплатин** 6,6 мг/кг в/в 1-часовой инфузией или per os, дни 1 - 3.
- Этопозид** 5 мг/кг в/в 1-часовой инфузией или per os, дни 1 - 3.
- Сопроводительная терапия:
- гидратация 2000 мл/м2, дни 1 - 3;
- противорвотные препараты.
Курс N 5 [13, 39]
Стандартный расчет доз препаратов:
- Винкристин** 1,5 мг/м2 в/в капельно за 1 час, день 1 [72, 73].
- Цисплатин** 40 мг/м2 в/в капельно 24-часовой инфузией, дни 1 - 4.
- Этопозид **100 мг/м2 в/в капельно 24-часовой инфузией, дни 1 - 4.
- Сопроводительная терапия:
- гидратация 3000 мл/м2, дни 1 - 6;
- #маннитол 40 мл/м2 каждые 6 ч, в/в медленно, дни 1 - 5 [13];
- противорвотные препараты.
Расчет доз препаратов для новорожденных и детей младшего возраста (дети младше 12 месяцев и дети с массой тела < 10 кг):
- Винкристин** 0,05 мг/кг в/в капельно за 1 ч, день 1 [72, 73].
- Цисплатин** 1,3 мг/кг в/в капельно 24-часовой инфузией, дни 1 - 4.
- Этопозид** 4,2 мг/кг в/в капельно 24-часовой инфузией, дни 1 - 4.
- Сопроводительная терапия:
- Гидратация 3000 мл/м2, дни 1 - 6;
- o #маннитол** 40 мл/м2 каждые 6 ч, в/в медленно, дни 1 - 5 [13];
- противорвотные препараты.
Курс N 5-Q [78]
Стандартный расчет доз препаратов:
- Винкристин** 1,5 мг/м2 в/в капельно за 1 час, день 1 [72, 73].
- Цисплатин** 40 мг/м2 в/в капельно 24-часовой инфузией, дни 1 - 4.
- Этопозид **100 мг/м2 в/в капельно 24-часовой инфузией, дни 1 - 4.
- Сопроводительная терапия:
- Гидратация 3000 мл/м2, дни 1 - 6;
- #маннитол 40 мл/м2 каждые 6 ч, в/в медленно, дни 1 - 5 [13];
- противорвотные препараты.
- Динутуксимаб бета в дозе 10 мг/м2/сут
непрерывно в течение 5 сут, начиная с 5-го дня [78];
Комментарии: при намерении использовать препарат для профилактики ототоксичности режим введения цисплатина** может быть изменен: суммарная доза цисплатина** разбивается на 4 инфузии длительностью по 6 часов (через 6 часов после окончания введения цисплатина** проводится 15-минутная инфузия препарата для профилактики ототоксичности. Следующее введение цисплатина** - через 10 часов).
Курс N 6 [13, 39]
Стандартный расчет доз препаратов:
- #Винкристин** 1,5 мг/м2 в/в капельно за 1 ч, дни 1, 8 [13].
- #Дакарбазин** 200 мг/м2 в/в капельно 1-часовой инфузией, дни 1 - 5.
- #Ифосфамид** 1500 мг/м2 в/в капельно 20-часовой инфузией, дни 1 - 5.
- Доксорубицин** 30 мг/м2 в/в капельно 4-часовой инфузией, дни 6, 7.
- Сопроводительная терапия:
- Гидратация 3000 мл/м2, дни 1 - 8;
- месна** 900 мг/м2 в/в 24-часовой инфузией, дни 1 - 7;
- противорвотные препараты.
Расчет доз препаратов для новорожденных и детей младшего возраста (дети младше 12 месяцев и дети с массой тела < 10 кг):
- #Винкристин** 0,05 мг/кг в/в капельно за 1 час, дни 1, 8 [13].
- #Дакарбазин** 6,7 мг/кг в/в капельно 1-часовой инфузией, дни 1 - 5.
- #Ифосфамид** 50 мг/кг в/в капельно 20-часовой инфузией, дни 1 - 5.
- Доксорубицин** 1 мг/кг в/в капельно 4-часовой инфузией, дни 6, 7.
- Сопроводительная терапия:
- гидратация 3000 мл/м2, дни 1 - 8;
- месна** 30 мг/кг в/в 24-часовой инфузией, дни 1 - 7;
- противорвотные препараты.
Курс N 6-Q [13, 78]
Стандартный расчет доз препаратов:
- #Винкристин** 1,5 мг/м2 в/в капельно за 1 ч, дни 1, 8 [13, 78].
- #Дакарбазин** 200 мг/м2 в/в капельно 1-часовой инфузией, дни 1 - 5.
- #Ифосфамид** 1500 мг/м2 в/в капельно 20-часовой инфузией, дни 1 - 5.
- Доксорубицин** 30 мг/м2 в/в капельно 4-часовой инфузией, дни 6, 7.
- Сопроводительная терапия:
- гидратация 3000 мл/м2, дни 1 - 8;
- месна* 900 мг/м2 в/в 24-часовой инфузией, дни 1 - 7;
- противорвотные препараты.
- Динутуксимаб бета в дозе 10 мг/м2/сут непрерывной инфузией в течение 5 сут,
с 6-го дня.
Курс N 7 [13, 39]
Стандартный расчет доз препаратов:
- Циклофосфамид** 150 мг/м2 в/в 1-часовой инфузией или per os, дни 1 - 8.
- Сопроводительная терапия:
- месна** 30 мг/м2 x 3 раза в/в струйно или per os в 0, 4 и 8 ч от начала введения циклофосфамида**, дни 1 - 8;
- противорвотные препараты.
Расчет доз препаратов для новорожденных и детей младшего возраста (дети младше 12 месяцев и дети с массой тела < 10 кг):
- Циклофосфамид** 5 мг/кг в/в 1-часовой инфузией или per os, дни 1 - 8.
- Сопроводительная терапия:
- месна** 1 мг/кг x 3 раза в/в струйно или per os в 0, 4 и 8 ч от начала введения циклофосфамида**, дни 1 - 8;
- противорвотные препараты.
Модификация доз препаратов [13]
У пациентов с нарушением функции почек (гидронефроз, острая почечная недостаточность в анамнезе, тубулоинтерстициальные нарушения) целесообразно рассмотреть вопрос об исключении нефротоксичных цитостатических препаратов (цисплатин** и #ифосфамид**) и их замене на эквитоксичные дозы #карбоплатина** и циклофосфамида**.
В курсе N 5 цисплатин** заменяется на #карбоплатин** в дозе 100 мг/м2 в/в капельно 24-часовой инфузией, дни 1 - 4.
Расчет доз #карбоплатина** у новорожденных и детей младшего возраста (дети младше 12 месяцев и дети с массой тела < 10 кг): 3,3 мг/кг в/в капельно 24-часовой инфузией, дни 1 - 4.
В курсе N 6 #ифосфамид** заменяется на циклофосфамид** в дозе 375 в/в капельно за 1 час, дни 1 - 5.
Расчет доз циклофосфамида** у новорожденных и детей младшего возраста (дети младше 12 месяцев и дети с массой тела < 10 кг): 12,5 мг/кг в/в капельно за 1 час, дни 1 - 5.
Курс #иринотекан** и #темозоломид** [79]
- #Темозоломид** 150 мг/м2 в/в или per os за 1 час до введения иринотекана**, дни 1 - 5.
- #Иринотекан** 50 мг/м2 в/в капельно 1-часовой инфузией, дни 1 - 5.
- Сопроводительная терапия:
- гидратация 3000 мл/м2, дни 1 - 8;
- противорвотные препараты.
Комментарии: При введении #иринотекана** показано проведение профилактики иринотекан-ассоциированной диареи [95].
Курс #иринотекан**и #темозоломид** и #бевацизумаб** [80]
- #Темозоломид** 100 мг/м2 в/в или per os за 1 час до введения #иринотекана, дни 1 - 5.
- #Иринотекан** 50 мг/м2 в/в капельно 1-часовой инфузией, дни 1 - 5.
- #Бевацизумаб** 15 мг/кг в/в капельно 90-минутной инфузией, день 1 - 5.
- Сопроводительная терапия:
- гидратация 3000 мл/м2, дни 1 - 8;
- противорвотные препараты.
Комментарии: противопоказано введение #бевацизумаба** пациентам после хирургических вмешательств.
При введении #иринотекана** показано проведение профилактики ассоциированной диареи [95].
Курс RIST [81]
- #Темозоломид** 150 мг/м2 в/в капельно 1-часовой инфузией, дни 8 - 12.
- #Иринотекан** 50 мг/м2 в/в капельно 1-часовой инфузией, дни 8 - 12.
- #Сиролимус** 3 мг/м2 per os в день 1, ** 1 мг/м2 per os в дни 2 - 4.
- #Дазатиниб** 2 мг/кг per os в дни 2 - 4
- Сопроводительная терапия:
- гидратация 2000 мл/м2, дни 8 - 12;
- противорвотные препараты в дни 8 - 12.
Комментарии: При введении #иринотекана** показано проведение профилактики ассоциированной диареи [95].
Курс #топотекан** и #темозоломид** [82]
- #Топотекан** 0,75 мг/м2 в/в капельно 30 - 60-минутной инфузией, дни 1 - 5.
- #Темозоломид** 150 мг/м2 в/в капельно 1-часовой инфузией, дни 1 - 5.
- Сопроводительная терапия:
- гидратация 2000 мл/м2, дни 1 - 5;
- противорвотные препараты.
Курс N 8 [13]
- #Топотекан** 1 мг/м2 в/в капельно 24-часовой инфузией (168 часов), дни 1
- Циклофосфамид** 100 мг/м2 в/в капельно 1-часовой инфузией, дни 1 - 7.
- Этопозид** 100 мг/м2 в/в капельно 1-часовой инфузией, дни 8 - 10.
- Сопроводительная терапия:
- гидратация 2000 мл/м2, дни 1 - 5;
- противорвотные препараты.
Курс #иринотекан** и #темозоломид** и динутуксимаб бета (химиоиммунотерапия) [83]
- #Темозоломид** 100 мг/м2 в/в per os за 1 час до введения #иринотекана**, дни 1 - 5.
- #Иринотекан** 50 мг/м2 в/в капельно 1-часовой инфузией, дни 1 - 5.
- Динутуксимаб бета 10 мг/кв.м./сут в/в капельно 24-часовй инфузией, дни 1 - 10.
- Сопроводительная терапия:
- гидратация 2000 мл/м2, дни 1 - 8;
- противорвотные препараты.
Комментарии: При введении #иринотекана показано проведение профилактики иринотекан-ассоциированной диареи
Режимы высокодозной терапии:
1. Режим мелфалан + #треосульфан (TreoMel) [84, 93]:
- Мелфалан 140 мг/кв.м/курс в/в капельно 1-часовой инфузией, день - 2;
- #Треосульфан 42 г/кв.м/курс, 14 г/кв.м/сут в/в капельно 2-часовой инфузией, дни - 5, - 4, - 3;
Комментарии: При использовании в режиме тандемной ВДПХТ с ауто-ТГСК курсовая доза #треосульфана может быть снижена до 36 г/м2/курс (разовая доза 12 г/м2/день)
2. Режим мелфалан** + #бусульфан** (BuMel) [48,51]:
- Мелфалан** 140 мг/кв.м/курс в/в капельно 1-часовой инфузией, день - 2;
- #Бусульфан** 16 мг/кг/курс, 4 мг/кг/день per os, дни - 7, - 6, - 5, - 4 [96];
Комментарии:
- пероральный прием #бусульфана** осуществляется 4 раза/сут, разовая доза 1 мг/кг, необходимо соблюдать временной интервал в 6 часов между приемами препарата
- за сутки до начала приема бусульфана** (с дня - 8) по день - 3 проводится противосудорожная профилактика леветирацетамом** в дозе 20 мг/кг/сут в два приема
- при использовании внутривенных форм бусульфана** препарат вводится за 2 часа в разовой дозе, рассчитанной в соответствии с приведенной ниже таблицей [96]
Масса тела (кг)
Доза внутривенного бусульфана** (мг/кг)
< 9
1,0
9 < 16
1,2
16 - 23
1,1
> 23 - 34
0,95
> 34
0,8
2. Режим #карбоплатин** + этопозид** + мелфалан** (СEM) [48,51]:
- Мелфалан** 180 мг/м2/курс, 45 мг/кв.м, в/в капельно 30-минутной инфузией; дни - 8, - 7, - 6, - 5;
- Этопозид 40 мг/кг/курс, в/в капельно 4-часовой инфузией, день - 4;
- #Карбоплатин** 1500 мг/кв.м/курс, 500 мг/кв.м/день, в/в капельно 1-часовой инфузией; дни - 4, - 3, - 2;
4. Режим тиотепа + циклофосфамид**(TC) [85]:
- Тиотепа 900 мг/м2/курс, 300 мг/кв.м/сут, в/в капельно 1-часовой инфузией; дни - 7, - 6, - 5;
- Циклофосфамид **6000 мг/м2/курс, 1500 мг/кв.м/сут, в/в капельно 1-часовой инфузией; дни - 5, - 4, - 3, - 2;
Комментарии: необходима профилактика развития геморрагического цистита: месна 500 мг/м2 за 1 час непосредственно перед началом инфузии циклофосфамида**, далее продленной инфузией в дозе 1500 мг/м2/сут за 24 часа в дни - 5, - 4, - 3, - 2, - 1;
5. Режим тиотепа (T) [86]:
Тиотепа 900 мг/м2/курс, 300 мг/кв.м/сут, в/в капельно 1-часовой инфузией; дни - 7, - 6, - 5;
Комментарии: при проведении высокодозной терапии с аллогенной ТГСК режим кондиционирования и профилактики реакции трансплантат-против-хозяина выбирается в соответствии с внутренними рекомендациями трансплантационного центра.
Модификация доз препаратов
Модификация доз препаратов производится по решению специалистов транплантационного центра. Решение принимается в индивидуальном порядке в зависимости от переносимости предшествующих курсов ПХТ либо предыдущего режима ВДПХТ в случае проведения второй ауто-ТГСК в рамках тандемной ВДПХТ с ауто-ТГСК.
Приложение А3.3
ИММУНОТЕРАПИЯ
ДИНУТУКСИМАБОМ БЕТА. СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ [87]
Перед началом каждой инфузии проводится премедикация:
1. Габапентин [87].
Пациент должен получить первую дозу в 10 мг/кг/сут за 3 дня до начала инфузии динутуксимаба бета.
1-й день - 10 мг/кг/сут 1 раз в день р.о.
2-й день - 20 мг/кг/сут на 2 приема р.о.
3-й день - 30 мг/кг/сут на 3 приема р.о.
Максимальная однократная доза габапентина составляет 300 мг.
Суточная доза габапентина повышается до 2 x 10 мг/кг/сут перорально на следующий день и до 3 x 10 мг/кг/сут перорально в день перед началом инфузии динутуксимаба бета и далее.
Пероральный габапентин следует постепенно отменить после прекращения внутривенной инфузии антител (и начать за три дня до следующего цикла иммунотерапии); возможно продолжить прием габапентина на протяжении всех 5 циклов иммунотерапии, в этом случае габапентин следует отменить в последний день последнего введения динутуксимаба бета.
2. Опиоиды [87].
Из-за сильной висцеральной и нейропатической боли опиоиды являются стандартным обезболиванием при инфузии динутуксимаба бета.
Нежелательные эффекты при введении опиоидов - угнетение дыхания, тошнота, рвота, запоры, кожный зуд, задержка мочи, сниженный порог развития судорожных приступов.
Безопасность и эффективность непрерывного внутривенного введения опиоидов для лечения боли хорошо известны для всех возрастных групп.
Риск формирования зависимости классифицируется как низкий.
Терапия опиоидами является стандартной сопроводительной терапией при введении динутуксимаба бета.
Первый день инфузии и первый курс терапии обычно требуют более высоких доз морфина, чем последующие дни и курсы.
- Введение морфина** начинается за 2 часа до начала инфузии динутуксимаба бета в дозе 0,02 - 0,05 мг/кг/ч.
- После этого, одновременно с инфузией динутуксимаба бета рекомендуется введение морфина** со скоростью 0,03 мг/кг/ч. При необходимости возможно дополнительное болюсное введение препарата - 0,02 мг/кг/дозу.
- При непрерывном введении динутуксимаба бета, в зависимости от восприятия боли пациентом, у части пациентов возможна отмена морфина** в течение 3 - 5 дней путем прогрессивного снижения скорости его введения (например, до 0,02 мг/кг/ч, 0,01 мг/кг/ч, 0,005 мг/кг/ч).
- Если непрерывная инфузия морфина** требуется более 5 дней, необходимо постепенное снижение скорости введения препарата на 20% в сутки.
- Последующие циклы иммунотерапии следует начинать с внутривенного морфина, включая нагрузочную дозу, до тех пор, пока не будет установлен безопасный и хорошо переносимый режим лечения боли для отдельного пациента. При хорошей переносимости и отсутствии болевого синдрома 3 - 5-й курс иммунотерапии можно проводить без морфина**.
При умеренной нейропатической боли может использоваться пероральный трамадол**.
Другие обезболивающие средства, которые могут применяться:
Нестероидные противовоспалительные средства (НПВС) [87].
- парацетамол**. Анальгетическая активность ниже, чем у НПВС. При использовании необходимо учитывать низкую обезболивающую активность и узкий терапевтический диапазон. Рекомендуемые дозировки: согласно национальным рекомендациям
Парацетамол: 10 - 15 мг/кг каждые четыре-шесть часов либо перорально (максимум 90 мг/кг/24 часа), либо внутривенно (максимум 60 мг/кг/24 часа).
- ибупрофен**. Имеет более длительный период действия (8 часов).
- метамизол натрия. Из-за его спазмолитических свойств метамизол натрия особенно подходит для купирования висцеральной боли или спастической боли. Более полезным, чем повторные короткие вливания, является длительная инфузия с дозой 2,5 - 3,0 мг / кг / ч, всегда с тщательным контролем значений артериального давления. Рекомендуемые дозировки: Метамизол натрия 10 мг/кг каждые 6 часов или продленная инфузия в дозе 2,5 - 3,0 мг/кг/ч.
3. Премедикация антигистаминными средствами [87].
(например, #дифенгидрамином**) должна выполняться в виде внутривенных инъекций примерно за 20 минут до начала каждой инфузии динутуксимаба бета. Рекомендуется повторять введение антигистаминных средств через каждые 4-6 часов по мере необходимости во время инфузии динутуксимаба-бета.
Следует тщательно наблюдать за пациентами на предмет анафилактических и аллергических реакций, особенно во время первого и второго курсов терапии.
#Дифенгидрамин** - 0,5 - 1,0 мг/кг в\в или перорально до начала лечения и затем каждые 4 часа.
Цетиризин (таб. 10 мг) по 5 мг один раз в день (дети < 30 кг) и 5 мг два раза в день (дети > 30 кг)
Диметинден 0,1 мг/кг в\в.
Другая сопроводительная терапия [87]:
Для предупреждения и купирования потенциальных побочных эффектов неселективных НПВС в качестве ингибиторов циклооксигеназы (ЦОГ) типа I и II и его влияния на агрегацию тромбоцитов (повышенный риск геморрагических осложнений, повреждение слизистой оболочки желудочно-кишечного тракта) показано назначение ингибиторов протонной помпы (ИПП) или антагонистов Н2-рецепторов в соответствии с национальными рекомендациями.
Например, Омепразол 1 мг/кг/день р.о. или в\в.
Для купирования тошноты и рвоты индуцированной морфином:
- ондансентрон** - 5 мг/м2 день р.о. или в\в
Во время лечения в палате больного должны находиться следующие лекарственные препараты:
1. Доступ к кислороду (маска)
2. Внутривенные антигистаминные средства, адреналин** и преднизолон** для внутривенного введения должны быть в непосредственной доступности у постели больного в целях ведения при угрожающих жизни аллергических реакциях. Рекомендуется вводить препараты для лечения аллергических/анафилактических реакций, в том числе преднизолон**, внутривенно болюсно; адреналин** вводится внутривенно болюсно через каждые 3-5 минут по мере необходимости, в зависимости от клинического ответа. При реакции гиперчувствительности со стороны бронхов и/или легких рекомендуется ингаляция адреналина**, которую следует повторять через каждые 2 часа в зависимости от клинического ответа.
Наблюдение за больным во время введения препарата динутуксимаба бета
- Пульсоксиметрия 24 часа все дни инфузии
- Контроль артериального давления (АД): каждые 10 мин. первые 30 мин. введения, затем каждые 30 мин.
Показания для прекращения терапии динутуксимабом бета.
Терапию динутуксимабом-бета следует окончательно отменить при развитии следующих проявлений токсичности:
При этом пациенты должны продолжить получать дифференцировочную терапию #изотретионином (в случае решения о ее назначении).
- Аллергические реакции - бронхоспазм 3 степени тяжести и анафилаксические реакции 4 степени тяжести.
- Сывороточная болезнь 3 степени тяжести.
- Некупирующаяся нейропатическая боль 4 степени тяжести, не отвечающая на введение в/в наркотических средств и другие лекарственные средства, включая инфузии лидокаина.
- Нейротоксичность: 1) сенсорные изменения 3 степени тяжести, мешающие ежедневной деятельности длительностью более 2 недель после завершения введения динутуксимаба бета; 2) объективные моторные нарушения; 3) офтольмалогическая токсичность 3 степени тяжести (т.е. субтотальная потеря зрения по шкале токсичности).
- Гипонатриемия 4 степени тяжести (<120 мэкв/л), несмотря на адекватную коррекцию внутривенными растворами; гипонатриемия с наличием симптомов, персистирующая более 48 часов с уровнем натрия в сыворотке крови менее 125 ммоль/л.
- Синдром повышенной проницаемости капилляров, который рецидивирует (3 степени тяжести) или достигает 4 степени тяжести (требуется вентиляционная поддержка).
- Кожная токсичность 4 степени тяжести
- Гипотензия - гипотензия 4 степени тяжести, не отвечающая на проводимую сопроводительную терапию и/или требующая проведения ИВЛ; повторные эпизоды развития гипотензии 3 степени тяжести, не отвечающие на введение болюсов кристаллоидных растворов.
- Кардиотоксичность 3 степени тяжести и выше.
Модификация дозы динутуксимаба бета в зависимости от проявлений побочных эффектов
Общие симптомы и лихорадка
Повышение температуры > 37 °C следует купировать возрастными дозами парацетамола и НПВП. Стойкое повышение температуры более > 38 °C может быть купировано физическими методами охлаждения и ибупрофеном (при достаточном количестве тромбоцитов). Допускается использование других жаропонижающих средств, за исключением стероидов. Лихорадка не является основанием для модификации дозы динутуксимаба бета за исключением случаев, когда температура не превышает 40 °C и сохраняется более 6 часов, несмотря на проводимую антипиретическую терапию. В этом случае введение препарата прерывается.
Если у пациента развиваются конституционные симптомы или лихорадка 4 степени тяжести, несмотря на адекватную сопроводительную терапию, однако, симптомы разрешаются до 1 степени тяжести, введение динутуксимаба бета может быть возобновлено в дозе 50% от предшествующей дозы на протяжении всей последующей терапии.
Лихорадка 3 степени тяжести не требует коррекции дозы динутуксимаба бета при условии тщательного динамического наблюдения и при согласии родителей пациента.
Гипотензия:
В случае развития гипотензии 3 - 4 степени тяжести, не отвечающей на введение 20 мл/кг 0,9% раствора хлорида натрия проводится следующая модификация доз препарата:
Изменения дозы динутуксимаба бета в ходе текущего курса иммунотерапии:
- Прекратить инфузию динутуксимаба бета. Поддерживать АД с помощью в\в введения жидкостей и при необходимости вазопрессоров.
- Если гипотензия разрешается до уровня 1 степени тяжести с помощью болюсного введения жидкостей, можно возобновить инфузию антител с 50% скоростью через 1 час для того, чтобы завершить введение всей назначенной дозы динутуксимаба бета.
- Если развитие гипотензии 3 степени тяжести повторяется на введение антител, требуется прекращение введения динутуксимаба бета и в дальнейшем пациент исключается из настоящего протокола.
Инструкция по модификации дозы динутуксимаба бета для последующих курсов:
- Если пациент переносит 50% дозы динутуксимаба бета, то последующие курсы динутуксимаба бета должны начинаться в дозе 50%. Если данная доза переносится хорошо, то в следующих курсах можно увеличить дозу до полной.
- Если гипотензия не купируется на фоне проводимой терапией и/или пациент нуждается в проведении ИВЛ, иммунотерапия должна быть полностью отменена.
Нейротоксичность
При развитии нейротоксичности 3 и более степени тяжести (за исключением спутанности сознания), иммунотерапия должна быть прекращена.
Нарушения сознания
Нарушения сознания, которые явно не связаны с лихорадкой и применением препаратов сопроводительной терапии (дифенгидрамин**, морфин** и т.д.) требуют прерывания терапии. Нарушения сознания, связанные с температурными подъемами, требуют проведения агрессивной антипиретической терапии и использования физических методов охлаждения. Устойчивое нарушение сознания (> 6 часов), обусловленное любой причиной, требует прекращения терапии с последующим повторным назначением динутукимаба бета в 50% дозе, если реверсия этой токсичности происходит до следующей запланированной дозы препарата.
Нейропатия
Есть небольшое количество сообщений о развитии периферической нейропатии, связанной с введением антител. Пациенты, испытывающие любую длительную моторную слабость, ассоциированную с введением динутуксимаба бета должны полностью прекратить иммунотерапию, исключаются из настоящего протокола и продолжают дифференцировочную терапию 13-цис-ретиноевой кислотой.
Гипонатриемия, связанная с введением динутуксимаба бета.
Пациенты с симптоматической гипонатриемией, стойким (> 48 ч) снижением уровня натрием в сыворотке крови менее 125 ммоль/л или тяжелой гипонатриемией без клинических симптомов (натрий менее 120 ммоль / л) должны прекратить инфузию динутуксимаба бета. В дальнейшем таким пациентам иммунотерапия не проводится.
Уровень электролитного дисбаланса, соответствующий 3 степени токсичности по международной шкале (особенно гипонатриемия < 124 ммоль/л при отсутствии симптомов и осложнений со стороны ЦНС), который нормализуется течение 24 часа при проведении коррекции, НЕ потребует модификации дозы динутуксимаба бета при условии, если эта токсичность считается переносимой ответственным клиницистом, а также родителями пациента.
Общее состояния пациента
Лечение динутуксимабом бета прерывается в случае нарушений общего состояния пациента 4 степени тяжести (< 20). Если общее состояние улучшается > 20, возможно возобновление терапии антителами в дозе 50% от той дозы, на фоне которой зарегистрировано развитие токсичности.
Нарушения общего состояния 3 степени тяжести (30 - < 50) НЕ требует модификации дозы препарата, при условии эта токсичность считается переносимой ответственным клиницистом, а также родителями пациента.
Болевой синдром
Пациенты, испытывающие при введении динутуксимаба бета боль, несмотря на профилактику боли (как указано выше), должны получать дополнительно морфин или другие анальгетики по мере необходимости. Болевой синдром должен оцениваться в соответствии с международными критериями токсичности и с использованием методов самостоятельной оценки боли пациентами
Гематологическая токсичность
Все пациенты должны получать трансфузионную терапию для поддержания адекватного уровня гемоглобина и количества тромбоцитов. Если у пациента отмечается развитие нейтропении на фоне введения динутуксимаба бета, лечение не прекращается. Однако, если нейтропения не разрешилась к началу следующего курса лечения, следующий курс должен быть отложен до двух недель или до тех пор, пока уровень нейтрофилов не повысится до 1 x 109/л. Доза динутуксимаба бета при проведении следующих курсов должна быть редуцирована на 50%.
Гематологическая токсичность 4 степени тяжести, которая улучшается до значений не менее 2-й степени тяжести или базового уровня до начала терапии в течение одной недели после завершения лечения, НЕ будет нуждаться в модификации дозы динутуксимаба бета, при условии, что эта токсичность считается переносимой ответственным клиницистом, а также родителями пациента.
Печеночная токсичность.
Щелочная фосфатаза: при повышении уровня щелочной фосфатазы (ЩФ) инфузия динутуксимаба бета не должна прерываться, дозы не должны быть модифицированы, поскольку повышение уровня ЩФ отмечается достаточно часто и в последующем происходит самостоятельное снижение уровня ЩФ. В связи с этим повышение ЩФ не является проявлением печеночной токсичности.
Все другие проявления печеночной токсичности, за исключением уровня билирубина, должны трактоваться также.
Билирубин: Если отмечается повышение уровня билирубина более 3-х возрастных норм, иммунотерапия прерывается до тех пор, пока уровень билирубина не нормализуется. После нормализации уровня билирубина, терапия антителами возобновляется в дозе 100%.
Нефротоксичность
Адекватная почечная функция является обязательным условием для проведения иммунотерапии. Если отмечается нарушение почечной функции до 3 степени тяжести, рекомендуется избегать нефротоксичных препаратов (например, индометацин и др.).
Кардиотоксичность
Любые признаки сердечной патологии потребуют незамедлительного выполнения ЭКГ. При наличии признаков ишемии показано незамедлительное прекращение терапии. Пациенты с признаками бессимптомных предсердных нарушений, связанных с повышенной температурой, но не имеющие признаков ишемии миокарда или клинически значимой гипотензии, будут контролироваться, но могут продолжить терапию. Пациенты с кардиотоксичностью 3 степени тяжести требуют отмены иммунотерапии и исключаются из настоящего протокола.
Со стороны сердечно-сосудистой системы могут отмечаться изменения, связанные с перегрузкой жидкостью. Пациенты с клиническими проблемами, связанными с перегрузкой жидкости, должны получать фуросемид** при условии, что у них отмечается снижение систолического артериального давления не превышающее 40 ммрт.ст. от исходного.
Введение динутуксимаба бета должно быть остановлено при стойком снижении систолического артериального давления ниже 80 мм рт. ст., которое по меньшей мере на 20 мм рт. ст. уменьшилось от исходного и не восстановилось после болюсного введения кристаллоидных растворов или раствора альбумина (например, 20 мл/кг 0,9% хлорида натрия). Внутривенное введение вазопрессоров может использоваться при наличии клинических показаний. Лечение можно возобновить в 50% дозе динутуксимаба бета, после того, как артериальное давление повысилось до 80 мм рт. ст.
Одышка
Пациенты, у которых отмечается появление одышки и снижение насыщения кислородом менее 90%, должны получать кратковременную дотацию кислорода.
Если насыщение кислородом крови не повышается более 90% без дотации кислородом, введение антител следует прекратить. Возобновить введение в 50% дозе можно в случае купирования токсичности.
Тошнота, рвота и диарея
Тошнота, рвота и диарея 3 степени тяжести НЕ требует модификации доз антителпри условии, что указанная токсичность считается переносимой ответственным клиницистом и родителями пациента.
Кожная токсичность
Токсичность со стороны кожных покровов 3 степени тяжести, которая остается стабильной или улучшается на фоне проводимой терапии (например, в/в дифенгидрамин**) в течение 24 часов, НЕ требует модификации доз антител при условии, что указанная токсичность считается переносимой ответственным клиницистом и родителями пациента.
Пациентам с токсическими поражениями кожи 4 степени тяжести иммунотерапия отменяется и пациенты исключаются из настоящего протокола. Однако, терапия #изотретионином должна быть продолжена.
Нарушение зрения
Нарушение зрительной аккомодации, корректируемое в очках, не требует модификации дозы динутуксимаба бета при условии, что указанная токсичность считается переносимой ответственным клиницистом и родителями пациента.
Офтальмологическая токсичность 3 степени тяжести (т.е. субтотальная потеря зрения по шкале токсичности), требует прекращения инфузии антител. Однако, терапия #изотретионином должна быть продолжена.
Комментарии: перед началом курса иммунотерапии и после его завершения пациент должен быть осмотрен врачом-офтальмогом.
Изменения восприятия вкуса
Изменение восприятия вкуса не требует модификации дозы антител, при условии, что эта токсичность считается допустимой ответственным клиницистом и родителями пациента.
Реакции гиперчувствительности:
- Зуд и крапивница.
Зуд и крапивница требуют терапии антигистамиными препаратами (например, дифенгидрамин**). Учитывая возможность развития анафилактических реакций необходимы превентивные меры, включающие быстрый доступ к адреналину** и глюкокортикоидам. Кроме того, у пациента всегда должен быть дополнительный свободный в/в доступ.
- Умеренные симптомы (например, локализованные кожные реакции): снизить скорость инфузии динутуксимаба бета до 50% и восстановить скорость инфузии после купирования симптомов. Необходимо оставаться у постели больного и контролировать состояние. Инфузия препарата может быть полностью завершена в исходно рассчитанной дозе. Антигистаминные препараты (дифенгидрамин** или хлорфенамин) можно вводить каждые 4 - 6 часов по усмотрению лечащего врача.
- При наличии умеренных симптомов (например, гипотензия): прервать инфузию антител, проведение поддерживающей симптоматической терапии, нахождение у постели больного до разрешения симптомов. По усмотрению лечащего врача инфузию можно возобновить в 50% дозе от начальной скорости инфузии.
При появлении любых тяжелых симптомов (любая реакция, такая как бронхоспазм, ангионевротический отек или анафилактический шок): немедленное прекращение инфузии антител. Введение адреналина**, антигистаминных препаратов (дифенгидрамин** или хлорфенамин), кортикостероидов, бронходилататоров или проведение других медицинских мероприятий по мере необходимости. Пациенты должны контролироваться в стационаре в течение как минимум 24 часов и до купирования симптомов. Если курс введения динутуксимаба бета был остановлен необходимо начать проведение следующего курса #изотретионина.
Необходимо внимательно следить за развитием анафилаксии и аллергических реакций, особенно во время проведения 1 и 2 курса иммунотерапии. При развитии анафилаксии или аллергических реакций 4 степени тяжести пациенты должны прекратить проведение иммунотерапии. Однако, терапия #изотретионином должна быть продолжена.
Сывороточная болезнь 3 степени тяжести является показанием завершения проведения иммунотерапии. Однако, терапия #изотретионином должна быть продолжена.
Синдром повышенной капиллярной проницаемости
Инструкции по модификации дозы во время курса иммунотерапии в случае развития клиники синдрома повышенной капиллярной проницаемости 3 степени тяжести:
- Прекратить инфузию антител.
- Если синдром повышенной капиллярной проницаемости разрешается или клиническая картина улучшается до 1 степени тяжести с помощью сопроводительной терапии, можно возобновить инфузию динутуксимаба бета с 50% скоростью через 1 час, чтобы завершить введение назначенной дозы.
- Если клиника синдрома повышенной капиллярной проницаемости 3 степени тяжести повторяется при продолжении введения динутуксимаба бета, необходимо прекратить проведение иммунотерапии.
- Если синдром повышенной капиллярной проницаемости 3 степень тяжести сохраняется в течение менее 7 дней, то это не рассматривается как специфическая дозо-лимитирующая токсичность.
- Если клиника синдрома 4 степени тяжести требует проведения ИВЛ, пациенты прекращают проведение иммунотерапии. Однако, терапия #изотретионином должна быть продолжена.
Инструкция по модификации дозы для последующих курсов:
- Если пациент переносил 50%-ную инфузию динутуксимаба бета, возможно рассмотреть вопрос до увеличения дозы препарата до 100% дозы в следующей курсе.
- Если синдром повышенной капиллярной проницаемости не купируется при проведении сопроводительной терапии или требует респираторной поддержки, пациент должен отменить иммунотерапию.
Легочная токсичность
При развитии легочной токсичности 3 степени тяжести, развивающейся как компонента синдрома повышенной капиллярной проницаемости, следует руководствоваться теми же рекомендациями по модификации доз, что и при синдроме повышенной капиллярной проницаемости 3 степени тяжести.
Инфекционный статус
Развитие инфекционного процесса 3 степени тяжести при проведении инфузии динутуксимаба бета является показанием к отмене курса иммунотерапии. Пропущенные дозы не будут дополнительно вводиться в дальнейшем. Можно перейти к следующему плановому курсу иммунотерапии только тогда, когда инфекция полностью разрешиться или будет находиться под контролем (отсутствие клинических симптомов и отрицательные высевы из культуры крови).
Ожидаемое проявление токсичности, которое не требуют модификации дозы динутуксимаба бета.
Следующие ожидаемые проявления токсичности которые НЕ будут нуждаться в модификации дозы динутуксимаба бета при условии динамического наблюдения и при том, что эти проявления токсичности считаются допустимыми ответственным клиницистом.
- Болевой синдром 4-го класса (регулируемый в/в введением наркотических препаратов).
- Лихорадка 3-го класса.
- Тошнота и рвота, диарея 3 класса.
- Степень токсичности кожи 3 класса, которая остается стабильной и переносимой, или улучшается при лечении (например, в\в введением дифенгидрамина**) в течение 24 часов.
- Третий уровень электролитного дисбаланса (особенно гипонатриемия < 124 мэкв/л при отсутствии симптомов и осложнений ЦНС), которые улучшаются с помощью лечения в течение 24 часов.
- Печеночная токсичность 3 степени, которая возвращается к уровню 1 до начала следующего курса лечения динутуксимабом бета.
- Нейротоксичность 3-го класса с субъективными клиническими проявления (например, покалывание, горячие или холодные руки и т.д.).
- Гематологическая токсичность класса 4, которая улучшает свои значения по крайней мере до 2-го уровня или базового уровня после окончания курса иммунотерапии.
- Уровень 3 (30 - < 50%)
- Снижение остроты зрения, корригируемое очками.
- Нарушение вкуса.
Не рекомендованные дополнительные элементы терапии при введении динутуксимаба бета.
Следующие процедуры не разрешены.
- Глюкокортикоиды или другие препараты с известной иммуносупрессивной активностью не могут использоваться вовремя и в течение двух недель до начала терапии динутуксимабом бета, за исключением симптомов, угрожающих жизни.
- Использование внутривенных иммуноглобулинов настоятельно не рекомендуется, так как иммуноглобулины могут влиять на специфическую клеточную цитотоксичность антител (динутуксимаб бета). Иммуноглобулин для внутривенного введения не следует вводить в течение 2 недель после начала (динутуксимаб бета) и через 1 неделю после ее завершения (динутуксимаб бета).
- Не рекомендуется назначать Г-КСФ перед курсами иммунотерапии динутуксимабом бета.
- Не рекомендовано проводить лучевую терапию (интервал между завершением этапа лучевой терапии и началом курса иммунотерапии динутуксимабом бета не менее 2 - 3 недель).
- Проведение химиотерапии или других видов экспериментальной противоопухолей терапии за исключением описанной в настоящих рекомендациях.
Приложение А3.4
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ
ТОШНОТЫ И РВОТЫ, ОБУСЛОВЛЕННЫХ ПРОВЕДЕНИЕМ
ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
Всем пациентам младше 18 лет с онкологическим заболеванием нейробластома на период лечения в целях лечения и профилактики тошноты и рвоты, обусловленных проведением противоопухолевой терапии, рекомендуется оценивать уровень эметогенности лекарственных препаратов, проводить лечение и профилактику тошноты и рвоты (ТИР) с использованием лекарственных препаратов [1].
А.3.4.1. Определение уровня эметогенности и варианта профилактики ТИР
Для выбора адекватного режима профилактики ТИР на первом этапе необходимо определение уровня эметогенности (риска развития ТИР) режима противоопухолевой терапии, который планируется использовать у пациента. Уровень эметогенности влияет на выбор препаратов для профилактики ТИР, их дозы и длительность применения [97]. В Приложении А 3.2.6 (Таблица 1) представлена общая классификация эметогенности препаратов химиотерапии согласно рекомендациям ASCO (American Society of Clinical Oncology) [98] и рекомендациям COG (Children Oncology Group) [97].
А.3.4.2. Профилактика тошноты и рвоты на фоне высокоэметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, для детей в возрасте от 5 лет и/или массой 15 кг и более использование четырехкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов, антагонист NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты), #дексаметазон**, и #оланзапин** [99, 10, 101]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 2).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется. Использование #оланзапина** у детей в возрасте менее 5 лет и/или массой тела менее 15 кг не исследовалось и не может быть рекомендовано.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 3-х дней после завершения введения препаратов химиотерапии, использование комбинации #дексаметазона** и #оланзапина** [100, 103]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 2).
В случае отсутствия возможности назначения антагониста NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты) использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов, #дексаметазона** и #оланзапина** [99, 100, 102]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 2).
В случае отсутствия возможности назначения #дексаметазона** в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов используется палоносетрона** в комбинации с антагонистом NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты) (при возможности назначения) и #оланзапином** [97, 104]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 2).
А.3.4.3. Профилактика тошноты и рвот на фоне умеренноэметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, использование двухкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов и #дексаметазон** [97, 105]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 2).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 1 дня после завершения введения цитостатиков (по АТХ классификации L: Противоопухолевые препараты и иммуномодуляторы), использование #дексаметазона** [97, 105]. Режимы и дозы представлены в Приложении А3.2.6 (Таблица 1).
В случае отсутствия возможности назначения #дексаметазона** использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторови антагониста NK1-рецептора (по АТХ классификации A04AD: Другие противорвотные препараты) [97, 105]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 2).
В случае отсутствия возможности назначения и #дексаметазона**, и антагониста NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты), в качестве предпочтительного блокатора серотониновых 5HT3-рецепторовиспользование палоносетрона [97, 105]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 2).
А.3.4.4. Профилактика тошноты и рвоты на фоне низко- и минимально эметогенной химиотерапии
Профилактика ТИР на фоне низко- и минимально эметогенной химиотерапии включает в себя однокомпонентную профилактику, включающей блокатор серотониновых 5HT3-рецепторов, при низкоэметогенной терапии или же вовсе отсутствие ее в случае химиотерапии с минимальной эметогенной активностью [97].
Режимы и дозы представлены в Таблица 2.
А.3.4.5. Лечение прорывной и рефрактерной рвоты
Пациентам с прорывной и рефрактерной рвотой на фоне цитостатической терапии рекомендовано:
1. Если прорывная ТИР возникла на фоне цитостатической терапии (и соответственно профилактики), относящейся к минимально, низко- или среднеэметогенному уровню, то необходимо использовать препараты, предусмотренные следующим, более высоким уровнем профилактики.
2. Если пациент и так получает профилактику, предусмотренную для высокоэметогенной терапии, то при возникновении прорывной ТИР необходимо рассмотреть вопрос о добавлении #оланзапина** (если он не применялся ранее в связи с неподходящим возрастом или массой тела). При невозможности использовать #оланзапин** в качестве альтернативы может быть применен метоклопрамид.
3. В случае, если у пациента наблюдается рефрактерная ТИР и он еще не получает максимальный уровень профилактики, то необходимо провести эскалацию противорвотной терапии. Если рефрактерная ТИР наблюдется на фоне максимального уровня профилактики, возможна замена использующегося блокатора серотониновых 5HT3-рецепторовна палоносетрон, введение дополнительных доз блокаторов серотониновых 5HT3-рецепторов. При неудаче этих подходов к профилактике рекомендуется на постоянной основе добавить #оланзапин**, метоклопрамид** или другие препараты, показавшие у пациента эффективность при лечении прорывной рвоты [105, 106].
Таблица 1 - Уровень эметогенности противоопухолевых препаратов [97]
Степень эметогенности (риск развития рвоты)
Рекомендации COG 2022 (педиатрические)
+
Рекомендации ASCO 2020 (общие для взрослых и детей)
Высокая (> 90%)
Монотерапия
Аспарагиназа** (в/в) ![]() 20 000 МЕ/м2
20 000 МЕ/м2
Бусульфан (в/в) ![]() 0,8 мг/кг
0,8 мг/кг
Бусульфан** (р.о.) ![]() 1 мг/кг
1 мг/кг
Дакарбазин** (в/в)
Дактиномицин (в/в) ![]() 1,35 мг/м2
1,35 мг/м2
Доксорубицин** (в/в) ![]() 30 мг/м2
30 мг/м2
Идарубицин (р.о.) ![]() 30 мг/м2
30 мг/м2
Карбоплатин** (в/в) ![]() 175 мг/м2
175 мг/м2
Кармустин** (в/в)
Мелфалан** (в/в)
Метотрексат** (в/в) ![]() 12 г/м2
12 г/м2
Цисплатин** (в/в) ![]() 12 мг/м2
12 мг/м2
Циклофосфамид** (в/в) ![]() 1200 мг/м2
1200 мг/м2
Цитарабин** (в/в) ![]() 3 г/м2/сутки
3 г/м2/сутки
Комбинированные режимы
Дакарбазин** ![]() 250 мг/м2 (в/в) + доксорубицин** (в/в)
250 мг/м2 (в/в) + доксорубицин** (в/в) ![]() 60 мг/м2
60 мг/м2
Дактиномицин 900 мкг/м2(в/в) + ифосфамид** 3 г/м2
Циклофосфамид**> 600 мг/м2 + дактиномицин ![]() 1 мг/м2
1 мг/м2
Циклофосфамид** ![]() 400 мг/м2 + доксорубицин**
400 мг/м2 + доксорубицин** ![]() 40 мг/м2
40 мг/м2
Цитарабин** ![]() 90 мг/м2 (в/в) +
90 мг/м2 (в/в) +
метотрексат** (в/в) ![]() 150 мг/м2
150 мг/м2
Этопозид** (в/в) ![]() 60 мг/м2 +
60 мг/м2 +
ифосфамид** (в/в) ![]() 1,2 г/м2
1,2 г/м2
Этопозид** (в/в) ![]() 250 мг/м2 +
250 мг/м2 +
тиотепа (в/в) ![]() 300 мг/м2
300 мг/м2
Умеренная
(31 - 90%)
Монотерапия
Алемтузумаб** (в/в)
Бендамустин** (в/в)
Дактиномицин (в/в) 10 мг/кг
Даунорубицин** (в/в)
Доксорубицин** (в/в) 25 мг/м2
Идарубицин** (в/в)
Иксабепилон** (в/в) 3 - 10 мг/м2
Иматиниб** (р.о.)> 260 мг/м2/сутки
Интерферон альфа** (в/в) 15 - 30 млнМЕ/м2/сутки
Иринотекан** (в/в)
Ифосфамид** (в/в)
Карбоплатин** (в/в)
Клофарабин (в/в)
Метотрексат** (в/в) 5 г/м2
Метотрексат** (и/т)
Оксалиплатин** (в/в)
Темозоломид** (в/в)
Тиотепа (в/в)
Цикллосфамид** (в/в) 1000 мг/м2
Цитарабин** (в/в) 75 мг/м2
Эпирубицин** (в/в)
Комбинированные режимы
Цитарабин** (в/в) 100 мг/м2 +
Даунорубицин** (в/в) 45 мг/м2 +
Этопозид** (в/в) 100 мг/м2 +
Преднизолон** (р.о.)
Цитарабин** 60 или 90 мг/м2 +
Метотрексат** 120 мг/м2
Низкая
(10 - 30%)
Монотерапия
Афлиберцепт** (в/в)
Белиностат (в/в)
Блинатумомаб** (в/в)
Бортезомид** (в/в)
Децитабин (в/в)
Доцетаксел** (в/в)
Гемцитабин** (в/в)
Гефитиниб** (р.о.) 150 - 500 мг/м2/сутки
Иматиниб** (р.о.) 260 мг/м2/сутки
Инотузумаб озогамицин (в/в)
Кабазитаксел** (в/в)
Карфилзомиб** (в/в)
Мелфалан** (р.о.) 0,2 мг/г
Меркаптопурин** (р.о.) ![]() 4,2 мг/кг
4,2 мг/кг
Метотрексат** (в/в) 38 - 83 мг/м2
Митоксантрон** (в/в) ![]() 33 мг/м2
33 мг/м2
Митомицин** (в/в)
Неларабин** (в/в)
Паклитаксел** (в/в)
Панитумумаб** (в/в)
Пегилированный липосомальный доксорубицин** (в/в)
Пеметрексед** (в/в)
Пертузумаб** (в/в)
Прокарбазин (р.о.) 50 - 100 мг/м2/сути
Руксолитиниб** (р.о.) 15 - 21 мг/м2
Селуметиниб (р.о.) 20 - 30 мг/м2
Сорафениб** (р.о.) 150 - 325 мг/м2
Темозоломид** (р.о.) 200 мг/м2
Темсиролимус (в/в)
Тисагенлеклейсел (в/в)
Топотекан (в/в)
Фторурацил** (в/в)
Цетуксимаб** (в/в)
Циклофосфамид** (в/в) 500 мг/м2
Циклофосфамид** (р.о.) 2 - 3 мг/кг
Эверолимус** (р.о.) 0,8 - 9 мг/м2/сутки
Элотузумаб** (в/в)
Энфортумаб ведотин (в/в)
Эрлотиниб** (р.о.) 35 - 150 мг/м2/сутки
Эрибулин** (в/в)
Этопозид** (в/в)
Комбинированная терапия
Цитарабин** (в/в) 60 мг/м2 + метотрексат** (в/в) 90 мг/м2
Минимальная
(< 10%)
Монотерапия
Авелумаб** (в/в)
Атезолизумаб** (в/в)
Бевацизумаб** (в/в)
Блеомицин** (в/в)
Бусульфан** (в/в)
Винбластин** (в/в)
Винкристин** (в/в) ![]() 1,5 мг/м2
1,5 мг/м2
Винорелбин** (в/в)
Даратумумаб (в/в)
Доксорубицин** (в/в) 10 мг/м2
Дурвалумаб**(в/в)
Ипилимумаб** (в/в)
Кладрибин (в/в)
Липосомальный доксорубицин** (в/в) ![]() 50 мг/м2
50 мг/м2
Меркаптопурин** (р.о.) ![]() 4.2 мг/кг
4.2 мг/кг
Метотрексат** (р.о.) ![]() 10 мг/м2
10 мг/м2
Ниволумаб** (в/в)
Обинутузумаб** (в/в)
Офатумумаб (в/в)
Пембролизумаб** (в/в)
Полатузумаб ведотин (в/в)
Рамуцирумаб** (в/в)
Ритуксимаб** (в/в)
Трастузумаб (в/в)
Хлорамбуцил** (р.о.) ![]() 0.2 мг/кг/сутки
0.2 мг/кг/сутки
Флударабин** (в/в)
Комбинированные режимы
Меркаптопурин** (р.о.) ![]() 2.5 мг/кг +метотрексат** (р.о.)
2.5 мг/кг +метотрексат** (р.о.) ![]() 0.1 мг/кг/сутки
0.1 мг/кг/сутки
Цисплатин** ![]() 60 мг/м2 (в/а) + доксорубицин**
60 мг/м2 (в/а) + доксорубицин** ![]() 30 мг/м2 (в/а)
30 мг/м2 (в/а)
Таблица 2. Дозы и режимы противорвотных препаратов [87-95]
Степень эметогенности
Режимы
Дозы
Высокая
Блокаторы серотониновых 5HT3-рецепторов
+
Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
+
Оланзапин**
I. #Дексаметазон**
1.
Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 внутривенно/перорально все дни химиотерапии и три дня после ее заверешения;
2.
Дети, получающие химиотерапию с умеренной эметогенной активностью:
![]() 0,6 м2: 2 мг внутривенно/перорально каждые 12 часов;
0,6 м2: 2 мг внутривенно/перорально каждые 12 часов;
> 0,6 м2: 4 мг внутривенно/перорально каждые 12 часов.
При одновременном применении с #апрепитантом необходимо уменьшение дозы дексаметазона на 50%.
II. Блокаторы серотониновых 5HT3-рецепторов
#Гранисетрон
1. Дети, получающие высокоэметогенную химиотерапию: 40 мкг/кг внутривенно однократно.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 40 мкг/ кг внутривенно однократно.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 40 мкг/кг внутривенно однократно.
#Ондансетрон**
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 (0,15 мг/кг) внутривенно/перорально перед терапией однократно, а затем каждые 8 часов.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 5 мг/м2 (0,15 мг/кг; максимум 8 мг) внутривенно/ перорально перед терапией однократно, а затем каждые 12 часов.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 10 мг/м2 (0,3 мг/кг; максимум 16 мг внутривенно или 24 мг перорально) до начала терапии однократно.
Палоносетрон
1. Дети от 1 месяца до 17 лет: 0,02 мг/кг (максимум 1,5 мг) внутривенно один раз перед терапией.
2. Дети 17 лет и старше: 0,5 мг внутривенно однократно перед терапией.
III. Антагонисты NK-1 рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты)
#Апрепитант
Блокаторы серотониновых 5HT3-рецепторов+
Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов+
Дексаметазон**
+
Оланзапин**
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
+
Оланзапин**
+/-
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Умеренная
Блокаторы серотониновых 5HT3-рецепторов + Дексаметазон**
Блокаторы серотониновых 5HT3-рецепторов+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
Низкая
Блокаторы серотониновых 5HT3-рецепторов
Минимальная
Блокаторы серотониновых 5HT3-рецепторовили отсутствие профилактики
Дети старше 6 месяцев:
- 1-й день: 3 мг/кг (максимум 125 мг) перорально 1 раз в сутки
за 1 час до химиотерапии
- 2-й и 3-й дни: 2 мг/кг (максимум 80 мг) перорально один раз в сутки.
#Фосапрепитант
1. Дети от 6 месяцев до 2-х лет: 5 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60
минут до начала химиотерапии в первый день;
2. Дети от 2-х до 12 лет: 4 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до
начала химиотерапии в первый день;
3. Дети от 12 до 17 лет: 150 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в
первый день
Комбинация #апрепитант + #фосапрепитант
1. Дети от 6 месяцев до 12 лет:
- 3 мг/кг (максимальная доза 115 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
- 2 мг/кг (максимальная доза 80 мг) перорально, дни 2, 3;
2. Дети от 12 до 17 лет:
- 115 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день
- 80 мг перорально, дни 2, 3.
IV. #Оланзапин**
1. Дети весом от 30 кг - 0,07 мг/кг (от 30 до 55 кг - 2,5 мг/сут, свыше 55 кг - 5 мг/сут) перорально за 1 час до введения цитостатиков, все дни химиотерапии и три дня после ее завершения;
2. Дети весом > 15 и < 30 кг - 2,5 мг/сут перорально за 1 час до введения цитостатиков, все дни химиотерапии и три дня после ее завершения;
Для детей весом менее 15 кг и/или возрастом менее 5 лет - неприменимо в силу отсуствия данных исследований об эффективности и безопасности оланзапина.
Приложение А3.5
НУТРИТИВНЫЙ СКРИНИНГ И МОНИТОРИНГ (ОЦЕНКА
НУТРИТИВНОГО СТАТУСА)
Таблица А4.1. Интерпретация нутритивного статуса на основании Z-score согласно референсным данным ВОЗ [1].
Степень-Форма (варианты интерпретации)
Z-скор, SDS
Показатели *
Недостаточность питания тяжелой степени/
Белково-энергетическая недостаточность тяжелой степени
-3,00 и ниже
Масса тела на возраст, ИМТ на возраст, окружность плеча на возраст
Недостаточность питания умеренной степени/
Белково-энергетическая недостаточность умеренной степени
От -2,00 до -2,99
Недостаточность питания легкой степени/
Белково-энергетическая недостаточность легкой степени
От -1,00 до -1,99
Эутрофия/Нормотрофия/Нормальный нутритивный статут
От -0,99 до +0,99
Избыточное питание
От +1,00 до +1,99
Ожирение 1 степени
От -2,00 до +2,49
Ожирение 2 степени
От -2,50 до +2,99
Ожирение 3 степени
От +3,00 до +3,99
Ожирение морбндное
+4.00 и выше
Примечания: нутритивный статус в онкопедиатрии оценивается по совокупным данным (клинические, лабораторные, инструментальные), с учетом нутритивного риска, антропометрические показатели позволяют критериально ориентироваться в определении нутритивного статуса и не могут быть единственно определяющими [7]; *- в определении нутритивного статуса используется показатель с минимальным SDS; SDS - standard deviation score (величина стандартного отклонения), ожирение - простое; гипоталамическое; при нейроэндокринных заболеваниях; ятрогенное; моногенное; синдромальное
Таблица А.4.2. Факторы высокого риска развития нарушений нутритивного статуса [7].
Критерии
1. Нарушения аппетита в течение ближайшей недели или особенности аппетита (избирательность, привередливость в питании, нестабильный и непостоянный аппетит и др.), выявленные анамнестически, свойственные данному ребенку с раннего возраста
2. Снижение объема потребления пищи на 1/3 - 1/2 и более от рекомендуемых возрастных норм (или снижение частоты/ объема питания в динамике за неделю по данным опроса или данным пищевого дневника)
3. Потеря более 2% массы тела за неделю или более 5% за месяц
4. Исходная гастроинтестинальная дисфункция (хронические заболевания ЖКТ, непереносимость компонентов пищи и пищевая аллергия) или сформировавшаяся на фоне противоопухолевого лечения
5. Заболевания обмена веществ и/или эндокринные заболевания
6. Опухоли брюшной полости, малого таза, локализованные забрюшинно, опухоли головы и шеи
7. Предстоящая ТГСК и ранний - до 3-х месяцев - посттрансплантационный период
8. Возраст менее 3 лет
При наличии минимум двух вышеперечисленных критериев пациент относится к группе высокого нутритивного риска - вне зависимости от текущего нутритивного статуса, его текущего питания и клинической ситуации
Таблица А.4.3. Основные скрининговые инструменты для выявления риска нутритивных нарушений в педиатрии [7, 19]
Скрининговый инструмент
Данные, необходимые для оценки риска
Определение степени острой и хронической БЭН
Антропометрические данные
Простая педиатрическая шкала для выявления детей с риском недоедания (PNRS)
Антропометрические данные
Прием пищи
Желудочно-кишечная дисфункция
Симптомы, которые могут нарушать аппетит (боль, одышка, депрессия)
Тяжесть основного заболевания
Инструмент скрининга для оценки недоедания в педиатрии (STAMP)
Антропометрические данные
Прием пищи
Тяжесть основного заболевания
Инструмент скрининга нутритивного риска у детей в стационаре (STRONGkids)
Прием пищи
Субъективная клиническая оценка
Тяжесть основного заболевания
Потеря веса
Детская шкала недоедания по Йоркиллу (PYMS)
Индекс массы тела
Потеря веса
Изменения в приеме пищи
Инструмент нутритивного скрининга для детской онкологии (SCAN)
Тип онкологического заболевания
Интенсивность лечения (химиотерапия, лучевая терапия, ТГСК)
Желудочно-кишечная дисфункция
Прием пищи
Потеря веса
Субъективная клиническая оценка
Субъективная глобальная оценка питания (SGNA)
Антропометрические данные
Потеря веса
Желудочно-кишечная дисфункция
Клинический статус
Прием пищи
Таблица А.4.4. Рекомендуемые потребности детей в основных нутриентах и энергии (на кг массы тела в сутки) при расчете диетотерапии и энтерального питания [18]
Возраст
Белки, г/кг в сутки
Жиры, г/кг в сутки
Углеводы, г/кг в сутки
Энергия, ккал/кг в сутки
Новорожденные
1,5 - 4
3 - 4
18
110 - 120
до 1 года
1 - 2,5
3 - 4
16 - 18
90 - 100
1 - 2 года
1 - 2
2 - 3
12 - 14
75 - 90
3 - 6 лет
10 - 12
75 - 90
7 - 12 лет
до 12
60 - 75
13 - 18 лет
до 10
30 - 60
Примечания: Потребности приведены для ориентировки расчета и назначения энтерального питания; они не отменяют и не заменяют пациент-ориентированный подход в назначении нутритивной поддержки: в каждом конкретном случае следует учитывать клиническую картину, возможные метаболические и органные дисфункции и корректировать поступление нутриентов с учетом возможности и переносимости ребенком.
Приложение А3.6
ВЕНОЗНЫЙ ДОСТУП
Показания к удалению установленного ЦВК [182].
1. отсутствует необходимость в сосудистом доступе,
2. при наличии осложнений установленного ЦВК:
- местные и/или системные признаки инфекции* (см. Удаление/сохранение ЦВК при инфицировании),
- окклюзия, не купируемая мерами и средствами лечения,
- рентгенологически подтвержденный синдром pinch-off,
- повреждение катетера (при отсутствии возможности ремонта/замены по проводнику),
- миграция катетера, репозицию которого провести нельзя,
- механический/инфекционный флебит,
- экстравазация/инфильтрация, *
- глубокий тромбоз вен, **
3. катетер установлен без соблюдения асептической техники (по неотложным показаниям) - необходимо удалить в течение 48 часов. Маркируйте катетер, установленный без соблюдения асептической техники.
* Не являются обязательными показаниями к удалению катетера, решение об удалении принимается индивидуально в зависимости от необходимости и функционирования венозного доступа, возможности установки нового катетера, возможностей лечения осложнения.
** Не является показанием к удалению катетера, если кончик катетера расположен правильно, катетер функционирует, нет признаков инфицирования. Катетер может быть использован для системного лечения тромбоза (см. Катетер-ассоциированный глубокий тромбоз вен). Тромбоз вен при удалении ПВК или Пиклайна (PICC) не несет риска тромбоэмболии легочной артерии.
Удаление/ сохранение ЦВК при инфицировании [182].
При наличии местных и/или системных признаков воспаления необходимо оценить риски и пользу от удаления катетера или от его сохранения и лечения.
Оценка проводится на основе:
- типа катетера (долгосрочный или краткосрочный),
- типа микроорганизма,
- возможностей установки нового катетера,
- необходимости наличия венозного доступа.
Согласно National Healthcare Safety Network (NHSN)/Patient Safety Component Manual, Chapter 4. Bloodstream Infection Event (Central Line-Associated Bloodstream Infection and Non-central Line Associated Bloodstream Infection), 2024 г. существуют следующие критерии сохранения и удаления ЦВК при инфицировании [182].
Попытки сохранения и лечения катетера следует предпринять при:
1. наличии вторичной инфекции кровотока, связанной с наличием другого очага инфекции,
2. наличии только лихорадки при отрицательных гемокультурах,
3. лабораторно-подтвержденной КАИК и гемодинамически стабильном состоянии пациента в соответствии с типом микроорганизма, выделенным из гемокультуры.
Удалять катетер необходимо при:
1. развитии КАИК с идентификацией Staphylococcus aureus, Грам отрицательных бактерий (Pseudomonas spp, Acinetobacter spp, Achromobacter spp, Stenotrophomonas maltophilia и др.) либо дрожжеподобных/ плесневых грибов.
2. следующих состояниях пациента:
- тяжелый сепсис;
- гематогенное поражение органов и тканей;
- туннельная/карманная инфекция у туннелируемых и имплантированных ЦВК;
- гнойный тромбофлебит;
- эндокардит;
- персистенция бактериемии/ фунгемии на фоне целенаправленной противомикробной терапии в течение более 72 часов.
Не следует удалять катетер при отсутствии возможности обеспечения альтернативного венозного доступа в случае его крайней необходимости.
Показания к удалению установленного ПВК (у детей и взрослых) [175].
1. отсутствует необходимость в сосудистом доступе или катетер не используется в течении 24 часов и больше,
2. замена катетера на другой тип в связи с изменением плана лечения,
3. осложнения установленного ПВК (при наличии осложнения у длинного ПВК или Мидлайна рассмотрите возможность замены по проводнику):
- повреждение катетера,
- частичная или полная окклюзия катетера (обратная окклюзия не является показанием к удалению катетера),
- экстравазация/ инфильтрация (аспирируйте содержимое из катетера до его удаления),
- местная инфекция:
- наличие только покраснения или болезненности не являются показаниями к удалению ПВК,
- флебит, тромбофлебит, тромбоз:
- при тромбозе, связанном с Мидлайном, следует обсудить системное лечение с использование установленного катетера,
- смещение катетера:
- смещение ПВК менее чем на 2 см не требует вмешательства (при функционировании и отсутствии инфицирования), зафиксируйте катетер в имеющемся положении, используйте,
- смещенный Мидлайн более чем на 2 см можно заменить по проводнику (при отсутствии инфицирования),
- наличие лихорадки в течение короткой инфузии (1 час) или вскоре после окончания инфузии (в течение 30 мин) (возьмите кровь из катетера для гемокультивирования до его удаления),
4. катетер установлен без соблюдения асептической техники (по неотложным показаниям) - необходимо удалить как можно быстрей, в течение 24 - 48 часов. Маркируйте катетер, установленный без соблюдения асептической техники.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Рис. Б1. Алгоритм проведения первичной радиоизотопной диагностики у пациента с подозрением на нейрогенную опухоль.
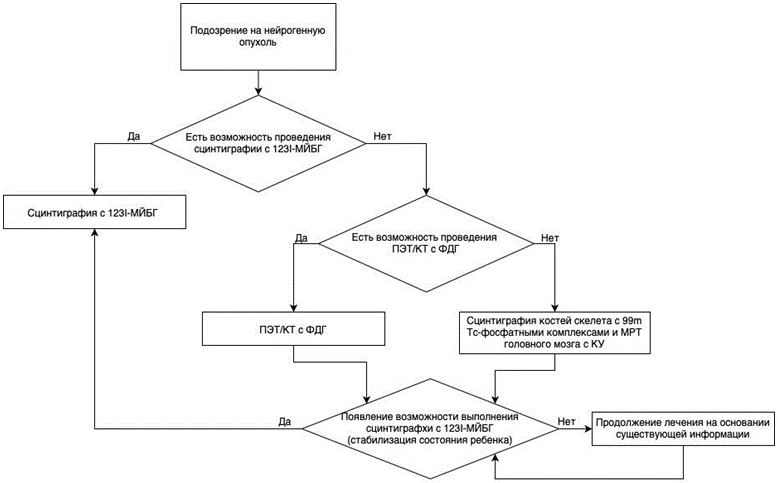
Комментарии: При отсутствии возможно проведение 123-I-сцинтиграфии с МЙБГ, возможно проведение ПЭТ/КТ с ФДГ или других радиоизотопных методов исследования, описанных в разделе "диагностика".
Рис. Б2. Алгоритм терапии пациентов группы наблюдения.
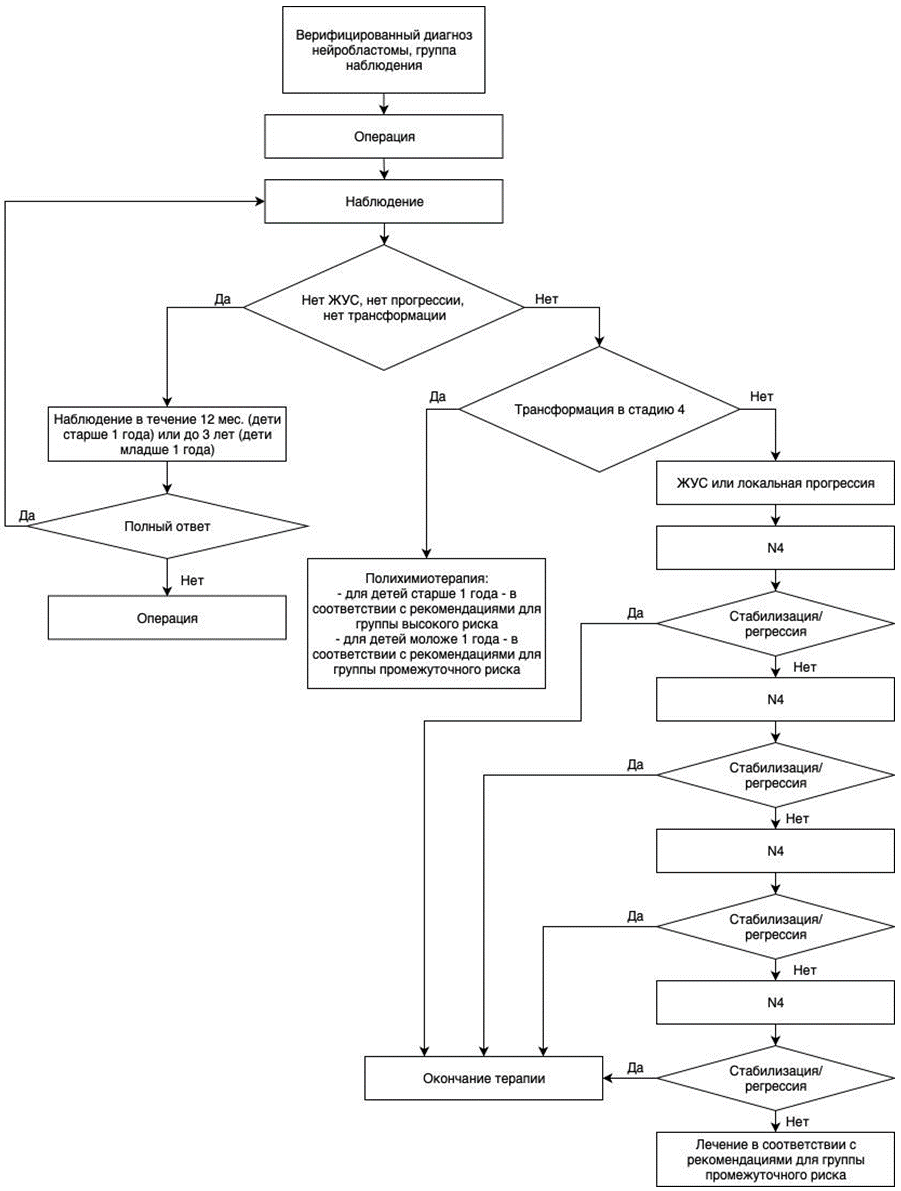
Рис. Б3. Алгоритм терапии пациентов группы промежуточного риска.
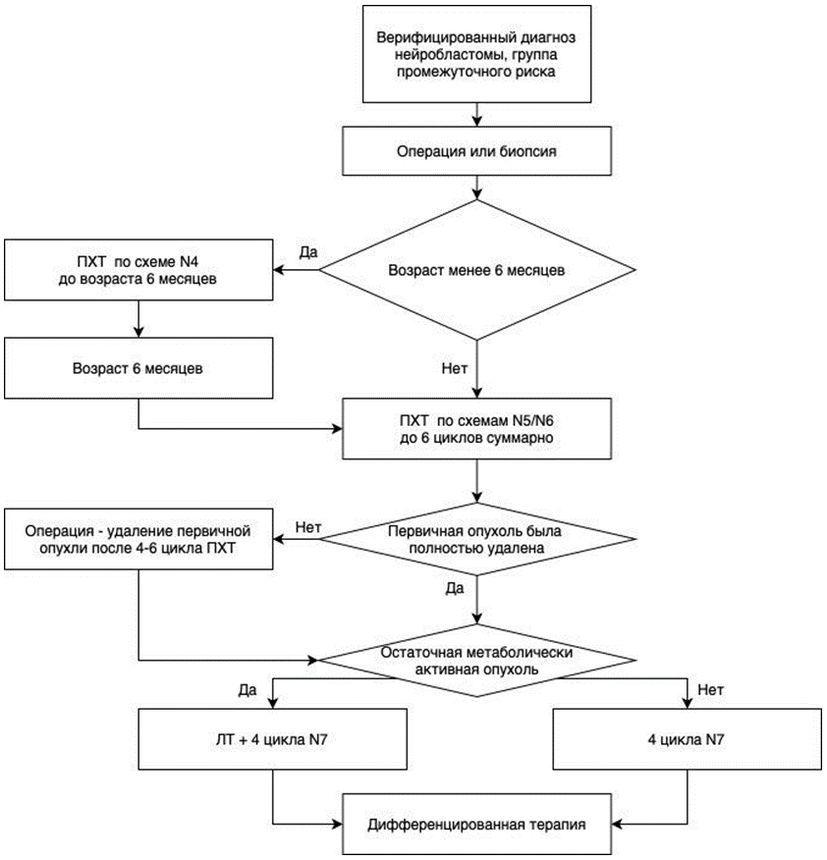
Рис. Б4. Алгоритм терапии пациентов группы высокого риска.
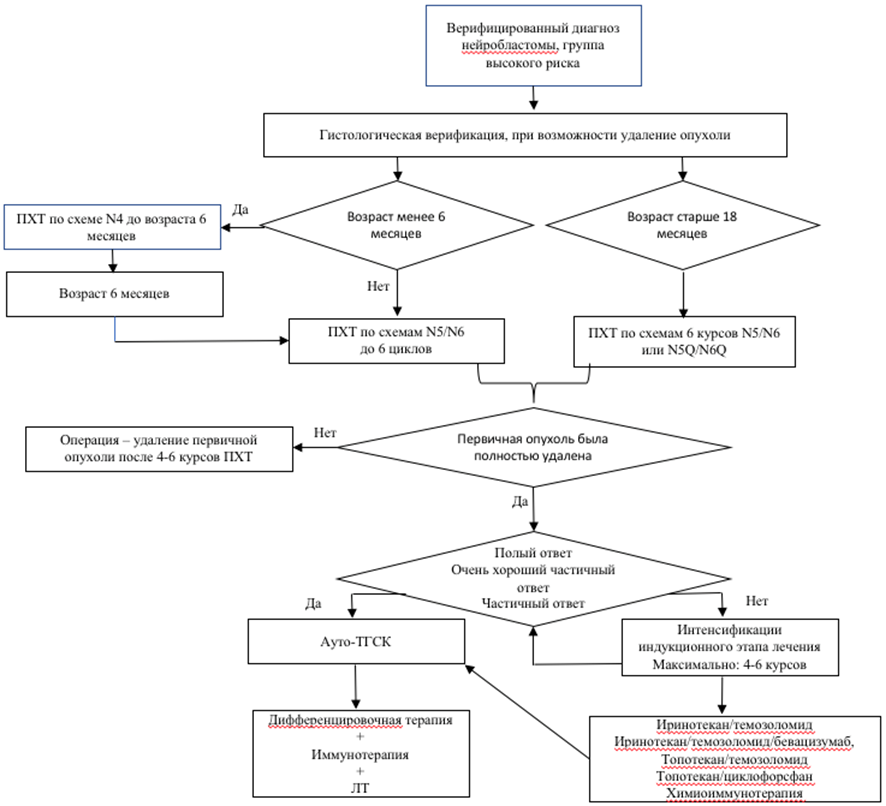
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Нейробластома является одним из видов злокачественных опухолей и встречается преимущественно у детей раннего возраста. Она возникает из измененных незрелых клеток симпатической нервной системы.
Нейробластома преимущественно встречается в раннем детском возрасте, являясь самой распространенной солидной опухолью у младенцев в возрастной группе до 1 года, где примерно каждый пятый диагноз из всех диагностированных случаев онкологических заболеваний приходится на этот вид рака.
Нейробластома может появиться везде, где есть нервные ткани симпатической нервной системы. Чаще всего она вырастает в мозговом слое надпочечников и в области нервных сплетений по обеим сторонам от позвоночного столба по ходу симпатического ствола. Если нейробластома возникла в симпатическом стволе, то опухоль может появиться в любом участке вдоль позвоночника - в области живота, таза, груди и шеи. Наиболее часто (примерно в 70% всех случаев) опухоль находится в области живота (например, в забрюшинном пространстве) - около половины таких опухолей локализуется в надпочечниках. Примерно одна пятая часть нейробластом выявляется в области груди и шеи.
В начале заболевания у многих детей с нейробластомой может не быть никаких симптомов. Опухоль у них находят случайно, например, при обычном осмотре у детского врача. Как правило, жалобы появляются тогда, когда опухоль достигает больших размеров (при локализации в забрюшинном пространстве, могут появиться жалобы на боли в животе, в средостении - на кашель и одышку) или появляется отдаленные метастазы (боли в ногах, слабость, снижение аппетита, повышение температуры, изменение в анализах крови - анемия и другие). Нейробластома может протекать под маской других заболеваний (ОРВИ, бронхит, кишечная инфекция). Поэтому, иногда по клиническим данным очень сложно заподозрить нейробластому.
При подозрении на нейробластому, ребенка должен обязательно проконсультировать детский онколог/гематолог и назначить углубленное обследование. Основные методы обследования включают выполнение УЗИ, КТ или МРТ грудной клетки и брюшной полости, костномозговые пункции, оценку уровня онкомаркеры (НСЕ, ферритин, ЛДГ). Важным диагностическим методом при нейробластоме является радиоизотопная диагностика - сцинтиграфия с 123I-МЙБГ.
Гистологическое исследование для подтверждения диагноза - нейробластома, можно провести после выполнения хирургического вмешательства (удаление опухоли или биопсия). При этом виде исследования изымается кусочек ткани. Биопсия осуществляется путем проведения операции под общим наркозом, при которой часть опухоли (первичной или, в ряде случаев, ее метастазов) берется через небольшой разрез.
После гистологического подтверждения диагноза - нейробластома, будет проведено молекулярно-генетическое исследование для выявления неблагоприятных генетических маркеров опухоли.
После получения всех результатов обследования, будет установлена стадия заболевания, и группа риска и определен план ведения ребенка. Тактика лечения зависит от группы риска. Группа риска определяется возрастом, характеристиками опухоли (гистология и генетика) и стадией (степень распространения заболевания). В настоящее время выделяют три группы риска: группа низкого риска (наблюдения), группы промежуточного и высокого риска.
В группе наблюдения врач может ограничиться проведением только хирургического вмешательства и проведение химиотерапии может понадобиться только при наличии состояний угрожающих жизни ребенка (массивном метастатическим поражение печение, распространение опухоли в канал спинного мозга).
Пациенты группы промежуточного и высокого риска получают интенсивную терапию, которая включает в себя проведение курсов химиотерапии, оперативное лечение, лучевую терапию, а для пациентов высокой группы риска высокодозную химиотерапию и ауто-ТГСК.
Наряду с введением химиопрепаратов, врач назначит ребенку сопроводительное лечение - антибиотики, лекарства повышение уровень лейкоцитов в крови, противорвотные средства, компоненты крови. Все это необходимо для уменьшения и устранения побочных действиях химиопрепаратов.
После окончания специфической терапии ребенок пройдет полное обследование, назначенное для оценки ответа опухоли на проведенную терапию. В дальнейшем будет назначен план динамического наблюдения и обследования.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ПО ИНДЕКСУ КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название: Karnofsky Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией):
Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949: 191 - 205 [45].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т.д.).
Таблица 48. Оценка общего состояния по индексу Карновского
Нормальная физическая активность, больной не нуждается в специальном уходе
100%
Состояние нормальное, нет жалоб и симптомов заболевания
90%
Нормальная активность сохранена, но имеются незначительные симптомы заболевания
80%
Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания
Ограничение нормальней активности при сохранении полной независимости больного
70%
Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе
60%
Больной иногда нуждается в помощи, но в основном обслуживает себя сам
50%
Больному часто требуется помощь и медицинское обслуживание
Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация
40%
Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь
30%
Больной прикован; к постели., показана госпитализация, хотя терминальное состояние не обязательно
20%
Сильные проявления болезни, необходима госпитализация и поддерживающая терапия
10%
Умирающий больной, быстрое прогрессирование забелевания
0%
Смерть
