"Клинические рекомендации "Миелодиспластический синдром. Миелодиспластические/миелопролиферативные новообразования"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
МИЕЛОДИСПЛАСТИЧЕСКИЙ СИНДРОМ.
МИЕЛОДИСПЛАСТИЧЕСКИЕ/МИЕЛОПРОЛИФЕРАТИВНЫЕ НОВООБРАЗОВАНИЯ
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 141_2
Возрастная категория: Взрослые
Специальность: Гематология, Онкология
Разработчик клинической рекомендации
Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
Алло-ТКМ - трансплантация аллогенного костного мозга
АЛТ - аланинаминотрансфераза
Анти-ДНК - антитела к ДНК
АСЛ-О - антистрептолизин-О
АСТ - аспартатаминотрансфераза
АТГ - иммуноглобулин антитимоцитарный**
АТ-ТПО - антитела к тиреоидной пероксидазе
аХМЛ - атипичный хронический миелолейкоз
АЧН - абсолютное число нейтрофилов
АЧТВ - активированное частичное тромбопластиновое время
БЛРС - бета-лактамазы расширенного спектра
ВИЧ - вирус иммунодефицита человека
ВОЗ - Всемирная организация здравоохранения
ГИФ - гипоксией индуцированный фактор
Г-КСФ - гранулоцитарный колониестимулирующий фактор (АТХ: L03AA - колониестимулирующие факторы: филграстим**,
ГМП - гипометилирующие препараты (АТХ: L01BC-аналоги пиримидина: азацитидин**, децитабин, цитарабин**)
ГСК - гемопоэтические стволовые клетки
ДНК - дезоксирибонуклеиновая кислота
ЖКТ - желудочно-кишечный тракт
ИБ-1 - избыток бластов-1
ИБ-2 - избыток бластов-2
ИГХ - иммуногистохимические методы
ИМТ - индекс массы тела
ИСТ - иммуносупрессивная терапия
КИ - клинические исследования
КМ - костный мозг
КС - кольцевые сидеробласты
КТ - компьютерная томография
ЛД - линейная дисплазия
ЛДГ - лактатдегидрогеназа
МД - мультилинейная дисплазия
МДС - миелодиспластический синдром
МДС/МПН - миелодиспластическое/миелопролиферативное новообразование
МДС-МПН-КСТ - миелодиспластическое/миелопролиферативное заболевание с кольцевыми сидеробластами и тромбоцитозом
МДС/МПН-Н - миелодиспластическое/миелопролиферативное заболевание неклассифицируемое
МДС-5q - МДС с изолированной делецией длинного плеча 5-й хромосомы
МДС-Н - МДС неклассифицируемый
МДЦ - малые дозы #цитарабина**
МОБ - минимальная остаточная болезнь
МРТ - магнитно-резонансная томография
ОВ - общая выживаемость
ОЛ - острый лейкоз
ОЛЛ - острый лимфобластный лейкоз
ОМЛ - острый миелоидный лейкоз
ПК - периферическая кровь
ПНГ - пароксизмальная ночная гемоглобинурия
ПР - полная ремиссия
ПХТ - полихимиотерапия
ПЦР - полимеразная цепная реакция
СРБ - С-реактивный белок
Т3 - трийодтиронин
Т4св - тироксин свободный
ТКМ - трансплантация костного мозга
ТТГ - тиреотропный гормон
УДД - уровень достоверности доказательств
УЗИ - ультразвуковое исследование
УУР - уровень убедительности рекомендаций
ХТ - химиотерапия
ХММЛ-хронический миеломоноцитарный лейкоз
ЦНС - центральная нервная система
ЦСА - #циклоспорин**
ЧР - частичная ремиссия
ЭБВ - вирус Эпштейна-Барр
ЭГДС - эзофагогастродуоденоскопия
ЭКГ - электрокардиография
ЭПО - эритропоэтин сыворотки
ЭПСП - эритропоэзстимулирующие препараты (АТХ: В03Х - другие антианемические препараты: эпоэтин альфа**, эпоэтин бета**, дарбэпоэтин альфа**)
ЭСКДК - эритроцитсодержащие компоненты донорской крови
ЭхоКГ - эхокардиография
EBMT - Европейское общество по трансплантации крови и костного мозга
FISH - флюоресцентная in situ гибридизация
Hb - гемоглобин
IBMTR - Международная база данных регистров по трансплантации костного мозга
IPSS - интернациональная прогностическая шкала
IPSS-R - пересмотренная интернациональная прогностическая шкала
MDS-CI - специфичный индекс коморбидности
NCCN - Национальная общественная противораковая сеть
WPSS - прогностическая шкала, основанная на ВОЗ классификации
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Анемический синдром - анемические жалобы (слабость, головокружение, одышка при физической нагрузке, сердцебиение) могут быть разной степени выраженности и встречаются в 80 - 90% случаев МДС.
В-симптомы - снижение массы тела, субфебрилитет в вечернее время, потливость
Геморрагический синдром - клинически значимая тромбоцитопения в анализах крови отмечена в 25 - 70% случаев, геморрагические проявления в дебюте заболевания отмечены в 15 - 30% (петехиальные высыпания на коже и слизистых, носовые, десневые, маточные, почечные и желудочно-кишечные кровотечения, кровоизлияния в склеры и головной мозг) и отражают не только степень тромбоцитопении, но и тромбоцитопатии.
Дисплазия (от греч. dys - нарушение и plaseo - образую) - морфологические отклонения от нормального развития, выявляемые на всех уровнях от клетки до тканей, органов и отдельных частей тела. Под дисмиелопоэзом подразумевают любые количественные и качественные нарушения, которые определяются в гемопоэтических клетках и кроветворной ткани костного мозга. При дифференцированном подсчете миелокариоцитов в миелограмме необходимо исследовать не менее 500 ядросодержащих клеток костного мозга, при подсчете лейкоцитов в периферической крови - не менее 200. Диагностически значимой дисплазией считается ситуация, когда доля клеток с признаками дисплазии превышает 10% от 100 подсчитанных эритрокариоцитов, 100 гранулоцитов и не менее 30 мегакариоцитов.
Иммуносупрессивная терапия (ИСТ) - комплекс лечебных мероприятий, проводимых поэтапно в течение года и более, включающий #циклоспорин** (ЦСА), иммуноглобулин антитимоцитарный** (АТГ) и другие методы ИСТ, позволяющий добиться максимально положительного эффекта и длительной выживаемости пациентов с МДС без и гипоплазией кроветворения.
Инфекционные осложнения - увеличение частоты инфекционных осложнений (10 - 40%) обусловлено нейтропенией и дисфункцией гранулоцитов, которая проявляется нарушением фагоцитарной адгезии, хемотаксисом. Наиболее частыми из инфекционных проявлений являются бактериальные пневмонии, абсцессы кожи и оппортунистические инфекции, включая вирусные, пневмоцистные, микобактериальные.
Костномозговая ремиссия - снижение бластных клеток в костном мозге менее 5%, и это снижение более чем на 50% от исходных значений, при этом в периферической крови нет полного восстановления показателей гемограммы.
Миелодиспластический синдром (МДС) - гетерогенная группа клональных заболеваний системы крови, возникающих вследствие клональных изменений в гемопоэтической стволовой клетки и характеризующихся цитопенией, как результат неэффективного гемопоэза, признаками дисмиелопоэза и высоким риском трансформации в острый лейкоз (ОЛ).
МДС с линейной (однолинейной) дисплазией - вариант МДС, для которого характерна одно-двух ростковая цитопения, без увеличения процента бластных клеток в периферической крови (< 1%) и костном мозге (< 5%), без увеличения кольцевых сидеробластов и абсолютного моноцитоза в периферической крови, при этом дисплазия более чем в 10% клеток выявляется только в 1 ростке кроветворения. Наиболее часто у этих пациентов ведущим симптомом является анемия.
МДС с кольцевыми сидеробластами (КС) и линейной (однолинейной) дисплазией - вариант МДС, для которого характерна анемия, чаще нормо- или макроцитарного характера; диагностически значимым является обнаружение кольцевых сидеробластов в костном мозге в 15% и более от клеток эритроидного ростка, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5% и более кольцевых сидеробластов; без увеличения процента бластных клеток в периферической крови (< 1%) и костном мозге (< 5%), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках красного ряда более чем в 10%, в гранулоцитарном и мегакариоцитарном ростках - менее чем в 10%.
МДС с КС и мультилинейной дисплазией - вариант МДС, для которого характерна цитопения любой степени выраженности; диагностически значимым является обнаружение кольцевых сидеробластов в костном мозге в 15% и более от клеток красного ряда, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5и более кольцевых сидеробластов; без увеличения процента бластных клеток в периферической крови (< 1%) и костном мозге (< 5%), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках эритроидного, гранулоцитарного и/или мегакариоцитарного ростков более чем в 10%.
МДС с мультилинейной (множественной) дисплазией - вариант МДС, для которого характерна цитопения любой степени выраженности, без увеличения процента бластных клеток в периферической крови (< 1%) и костном мозге (< 5%), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется более чем в 10% клеток двух и более ростков кроветворения.
МДС с избытком бластов-1 - вариант МДС, для которого характерна цитопения любой степени выраженности без абсолютного моноцитоза, при этом бласты без палочек Ауэра в периферической крови составляют менее 5%, а в костном мозге - от 5,0 до 9,9%, процент кольцевых сидеробластов может быть любой, вне зависимости от мутации гена SF3B1, так же, как и количество клеток с дисплазией.
МДС с избытком бластов-2 - вариант МДС, для которого характерна цитопения любой степени выраженности без абсолютного моноцитоза, при этом бласты, возможно с палочками Ауэра, в периферической крови составляют от 5 до 19,9%, в костном мозге - от 10 до 19,9%, процент кольцевых сидеробластов может быть любой, так же, как и количество клеток с дисплазией. В случае, когда при МДС с избытком бластов-1 в бластных клетках выявляют палочки Ауэра, верифицируют диагноз МДС с избытком бластов-2.
МДС с изолированной делецией (5q) (МДС-5q-) - вариант МДС, для которого характерна анемия, чаще макроцитарного характера, возможно в сочетании с нормальным или повышенным количеством тромбоцитов, без увеличения процента бластных клеток в периферической крови (< 1%) и костном мозге (< 5%), абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках эритроидного ростка и мегакариоцитах, при цитогенетическом исследовании костного мозга определяется изолированная делеция линного плеча хромосомы 5 (del(5q)), или в сочетании с другой аномалией, кроме аберраций хромосомы 7.
МДС неклассифицируемый (МДС-Н):
1. вариант МДС, с критериями МДС-ЛД, МДС-КС-ЛД, МДС-КС-МД, МДС-МД и МДС-5q-, но с количеством бластных клеток в периферической крови = 1%, при двух и более измерениях;
2. варианты МДС-ЛД, МДС-КС-ЛД и МДС-5q-, при которых выявляются клинически значимая панцитопения;
3. вариант МДС, при котором выявляется клинически значимая цитопения с бластемией < 2%, и бластными клетками < 5% в костном мозге, но дисплазия выявляется менее чем в 10% клеток любого ростка кроветворения, при этом обнаруживаются цитогенетические аномалии, патогномоничные для МДС.
МДС низкого риска - группа пациентов, у которых при подсчете прогностических индексов определена группа очень низкого, низкого и промежуточного (суммарный балл < 3,5) риска по шкале IPSS-R.
МДС высокого риска - группа пациентов, у которых при подсчете прогностических индексов определена группа промежуточного (суммарный балл > 3,5), высокого и очень высокого риска по шкале IPSS-R.
МДС/МПН - миелодиспластическое/миелопролиферативное новообразование-группа клональных заболеваний системы кроветворения, имеющих признаки и миелодиспластическое синдрома (наличие дисплазии более, чем в 10% клеток гранулоцитарного, и/или эритроидного и/или мегакариоцитарного ростков) и миелопролиферативного новообразования (лейкоцитоз, тромбоцитоз), при отсутствии данных за bcr-abll позитивный ХМЛ, истинную полицитемию, первичный миелофиброз, эссенциальную тромбоцитемию, в отсутствии мутаций в генах PDGFR, PDGFR, FGFR1, PCM-JAK, при отсутствии в анамнезе цитотоксической терапии по поводу другого заболевания и применения колониестимулирующих факторов. При любом варианте МДС/МПН может быть спленомегалия или гепатоспленомегалия.
ХММЛ - хронический миеломоноцитарный лейкоз, вариант МДС/МПН, для которого в крови характерно персистирующее увеличение количества от 10% и более моноцитов, в абсолютных значениях более 1 x 109/л, наличие дисплазии более, чем в 10% клеток в 1 и более ростков кроветворения, при количестве бластных клеток и их эквивалентов менее 20%, при иммунофенотипировании количество классических моноцитов составляет от 94% и более. В отсутствии дисплазии более, чем в 10% клеток: при наличии цитогенетических и молекулярно-генетических аномалиях, характерных для миелоидных новообразований; если моноцитоз персистирует в течение 3 месяцев и более в отсутствии данных за инфекционный и аутоиммунный процесс.
ХММЛ-0 - вариант ХММЛ, с количеством бластных клеток в анализе крови до 1% или костном мозге до 5%, бластные клетки без палочек Ауэра;
ХММЛ-1 - вариант ХММЛ, с количеством бластных клеток в анализе крови от 2 до 4% или костном мозге от 5 до 9%, бластные клетки без палочек Ауэра;
ХММЛ-2 - вариант ХММЛ, с количеством бластных клеток в анализе крови от 5 до 19% или костном мозге от 10 до 19% и/или палочки Ауэра при любом количестве бластных клеток.
аХМЛ - атипичный хронический миелолейкоз, bcr-abl1-негативный - вариант МДС/МПН, для которого характерно в крови повышение количества лейкоцитов от 13 x 109/л и выше, увеличение количества молодых форм нейтрофилов (промиелоциты+миелоциты+метамиелоциты) от 10% и более, базофилы < 2%, моноциты < 10%, при количестве бластных клеток менее 20%, в костном мозге количество бластных клеток менее 20%, пролиферация гранулоцитарного ростка, наличие признаков дисмиелопоэза более, чем в 10% клеток в 1 и более ростков кроветворения.
МДС/МПН-КС-Т-миелодиспластическое/миелопролиферативное новообразование с кольцевыми сидеробластами и тромбоцитозом, вариант МДС/МПН, для которого характерны в анализе крови анемия, тромбоцитоз от 450 x 109/л и выше, бластемия до 1%, в костном мозге выявление кольцевых сидеробластов от 15% и выше, количество бластных клеток до 5%, наличие дисплазии в 1 и более ростков кроветворения и наличие морфологических признаков, характерных для миелопролиферативных новообразований; не должно быть в анамнезе других миелопролиферативных новообразований, МДС, кроме МДС-КС, возможно наличие мутации в гене SF3B1, Jak2, CALR, MPL, в отсутствии делеции длинного плеча хромосомы 5, транслокации и делеции длинного плеча хромосомы 3.
МДС/МПН неклассифицируемое - миелодиспластическое/миелопролиферативное новообразование неклассифицируемое, для которого характерно наличие клинических и морфологических признаков МДС и МПН, но неклассифицируемых ни в одном из вариантов МДС, МПН и МДС/МПН: бластные клетки менее 20% в крови и костном мозге, наличие клинических и морфологических признаком миелодисплазии, в сочетании с клиническими и морфологическими признаками миелопролиферативного процесса (лейкоцитоз > 13 x 109/л и тромбоцитоз > 450 x 109/л).
Нейтрофильный ответ - увеличение числа нейтрофилов более чем на 100% от исходных значений.
Неудача лечения - летальный исход или прогрессия заболевания на фоне терапии.
Общая выживаемость (ОВ) - для оценки ОВ анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии или день верификации диагноза. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива).
Острый лейкоз (ОЛ) - гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации гемопоэтической стволовой клетки (ГСК) и приводящих к увеличению бластных клеток более 20% в костном мозге и/или периферической крови. По направленности бластных клеток ОЛ разделяют на:
Острый миелоидный лейкоз (ОМЛ) - миелоидная направленность бластных клеток.
Острый лимфобластный лейкоз (ОЛЛ) - лимфоидная направленность бластных клеток.
Полная ремиссия (ПР) - состояние кроветворной ткани, при котором гемоглобин > 110,0 г/л, нейтрофилы 1,0 x 109/л, бластные клетки отсутствуют, тромбоциты > 100,0 x 109/л, бластные клетки в костном мозге < 5%, возможна персистирующая дисплазия.
Полихимиотерапия (ПХТ) - наиболее оправданное сочетание противоопухолевых (цитостатических) препаратов, которое позволяет добиться максимально положительного эффекта, в частности ПР, при онкогематологических заболеваниях.
Прогрессия заболевания - увеличение количества бластных клеток более, чем на 50% и переход из первоначального варианта МДС в более продвинутый (МЛС-ЛД в МДС-МД, МДС-МД в МДС-ИБ-1, МДС-ИБ-1 в МДС-ИБ-2) (характеристика вариантов МДС представлена в разделе 1.5. "Классификация заболевания или состояния (группы заболеваний или состояний)", в табл. 1), при этом в анализах крови может отмечаться снижение показателей на 50% от максимальных значений, снижение Hb более чем на 20 г/л, появление трансфузионной зависимости. При стабильных показателях бластных клеток усугубление цитопении, без наличия других причин, также является признаком прогрессии заболевания.
Рецидив после ПР - увеличение количества бластных клеток > 5%; снижение на 50% и более числа тромбоцитов и нейтрофилов от максимальных значений во время ремиссии; снижение показателей гемоглобина на 15 г/л и более, появление трансфузионной зависимости от эритроцитсодержащих компонентов.
Спленомегалия - при МДС селезенка может быть увеличена незначительно, на 1 - 2 см, при МДС/МПН размеры селезенки могут быть значительными.
Стабилизация - отсутствие частичной ремиссии, но нет признаков прогрессирования в течение более 8 недель.
Трансформация/прогрессия - в ОМЛ констатируется при обнаружении в пунктате костного мозга (КМ) или периферической крови более 20% бластных клеток.
Трансплантация костного мозга - под этим термином объединены трансплантация гемопоэтических стволовых клеток крови, костного мозга и пуповинной (плацентарной) крови.
Концентрат тромбоцитов - компонент донорской крови, содержащий тромбоциты.
Тромбоцитарный ответ - увеличение числа тромбоцитов > 30 x 109/л, снижение зависимости от гемотрансфузий концентрата тромбоцитов.
Цитогенетическая ремиссия - это полная клинико-гематологическая ремиссия, при этом цитогенетическими методами не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным. Уменьшение количества клеток с хромосомными нарушениями минимум на 50% оценивается как частичный цитогенетический ответ.
Частичная ремиссия (ЧР) - те же критерии, что и для ПР, однако бластные клетки в костном мозге составляют более 5%.
Эритроидный ответ - повышение уровня гемоглобина на 15 г/л и более, снижение зависимости от гемотрансфузий эритроцитсодержащими компонентами донорской крови.
Эритроцитсодержащие компоненты донорской крови (ЭСКДК) - компоненты донорской крови, содержащие эритроциты (эритроцитная масса, эритроцитная взвесь и т.д.).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Миелодиспластические синдромы представляют собой гетерогенную группу клональных заболеваний системы крови, характеризующихся цитопенией, признаками дисмиелопоэза и высоким риском трансформации в ОМЛ [1, 2].
Миелодиспластическое/миелопролиферативное новообразование - гетерогенная группа заболеваний системы крови, характеризующееся одновременным наличием признаков миелодиспластического синдрома и миелопролиферативного новообразования [120].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В 80 - 90% случаев этиология МДС и МДС/МПН неизвестна, в 10 - 15% развитию заболевания предшествовала цитостатическая и/или лучевая терапия, которая проводилась по поводу системного поражения соединительной ткани или другого онкогематологического или онкологического процесса. Среди факторов, воздействие которых увеличивает риск развития МДС и МДС/МПН, можно выделить курение, контакт с бензином, инсектицидами, пестицидами, органическими веществами.
Изучение патогенеза МДС и МДС/МПН на протяжении нескольких десятков лет позволило выделить несколько основополагающих этапов развития этих заболеваний. Воздействие повреждающих факторов на плюрипотентные гемопоэтические стволовые клетки (ГСК) приводит к формированию клонального кроветворения, включающего все клеточные линии, реактивное изменение стромального микроокружения и лимфатической системы, что приводит к увеличению пролиферативной активности и гибели клеток костного мозга (КМ). Появление новых мутаций способствует дальнейшей клональной эволюции уже имеющегося патологического клона, что сопровождается уменьшением запрограммированной клеточной гибели (апоптоза) и трансформацией в ОЛ [1, 2, 120].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В Европе и США заболеваемость МДС в общей популяции составляет около 4 - 5 случаев на 100 тыс. населения в год. Более 80% пациентов МДС - это люди старше 60 лет. После 60 лет частота увеличивается до 20 - 50 случаев на 100 тыс. человек в год. В целом в Европе ежегодно диагностируют примерно 25 тыс. новых случаев. Учитывая неуклонное "старение" населения Европы, полагают, что число пациентов с МДС будет в ближайшие десятилетия возрастать [1 - 6].
Статистических данных о заболеваемости и распространенности МДС в России нет.
Заболеваемость ХММЛ составляет 0,4 на 100 000 населения, с увеличением до 3,8 человек на 100 000 среди людей старше 80 лет. Мужчины болеют чаще 0,5 на 100 000 мужского населения, чем женщины - 0,2 на 100 000 женского населения. Медиана возраста - 65 - 75 лет. Заболеваемость аХМЛ составляет 1 - 2 случая на 100 случаев BCR-ABL позитивного ХМЛ. Медиана возраста составляет 70 - 80 лет, соотношение мужчин и женщин-1:1. МДС/МПН-КС-Т медиана возраста - 74 года [120].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Миелодиспластические синдромы (D46)
D46.0 Рефрактерная анемия без сидеробластов, так обозначенная;
D46.1 Рефрактерная анемия с сидеробластами;
D46.2 Рефрактерная анемия с избытком бластов
D46.4 Рефрактерная анемия неуточненная
D46.5 Рефрактерная анемия с мультилинейной дисплазией
D46.6 Миелодиспластический синдром с изолированной del (5q) хромосомной аномалией
D46.7 Другие миелодиспластические синдромы
D46.9 Миелодиспластический синдром неуточненный
Миелодиспластические/миелопролиферативные новообразования
C93.1 Хронический миеломоноцитарный лейкоз
C92.2 Атипичный хронический миелоидный лейкоз, BCR-ABL-отрицательный.
C94.6 Миелодиспластическое и миелопролиферативное заболевание, не классифицированное в других рубриках
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
С 2000 г. при верификации диагноза МДС использовали классификации Всемирной организации здравоохранения (ВОЗ) (пересмотр от 2008 г. [7]), в которую в 2017 году после очередного пересмотра были внесены существенные изменения:
1. Изменение номенклатуры МДС. В настоящей классификации исключено ключевое понятие "рефрактерная анемия" для всех вариантов МДС. Для современного обозначения вариантов МДС ключевым стало понятие "миелодиспластический синдром". Например, МДС с кольцевыми сидеробластами (КС) и мультилинейной дисплазией, МДС с избытком бластов-2;
2. Особенности подсчета бластных клеток в КМ от всех ядросодержащих клеток костного мозга;
3. Интерпретация увеличенного количества кольцевых сидеробластов в зависимости от наличия или отсутствия мутации в гене SF3B1: при наличии мутации в гене SF3B1 пороговое значение кольцевых сидеробластов ![]() 5%, при ее отсутствии или невозможности определения
5%, при ее отсутствии или невозможности определения ![]() 15%;
15%;
4. У пациентов МДС с делецией длинного плеча 5-й хромосомы допустимо выявление еще одной аномалии кариотипа, за исключением аберрации 7-й хромосомы.
Учитывая вышеизложенное, варианты МДС в соответствии с актуальными критериями ВОЗ от 2017 года представлены ниже [8].
1. МДС с линейной (однолинейной) дисплазией (МДС-ЛД):
2. МДС с мультилинейной дисплазией (МДС-МД).
3. МДС с кольцевыми сидеробластами (МДС-КС):
- МДС с кольцевыми сидеробластами и линейной дисплазией (МДС-КС-ЛД).
- МДС с кольцевыми сидеробластами и мультилинейной дисплазией (МДС-КС-МД).
4. МДС с изолированной делецией длинного плеча 5-й хромосомы (МДС-5q-)
5. МДС с избытком бластов
- МДС с избытком бластов-1 (МДС-ИБ-1);
- МДС с избытком бластов-2 (МДС-ИБ-2);
6. МДС неклассифицируемый (МДС-Н).
Критерии вариантов МДС представлены в таблице 1.
Таблица 1. Классификация МДС в соответствии с 4 пересмотром ВОЗ от 2017 г. [8]
Вариант
Дисплазия, количество ростков
Цитопенияа, количество ростков
Кольцевые сидеробласты (при мутации SF3B1), %
Бластные клетки в КМ и ПК, %
Особен-ности кариотипа
МДС с линейной дисплазией
(МДС-ЛД)
1
1 - 2
< 15 (< 5)
КМ < 5,
ПК < 1, палочки Ауэра - нет
Любой, если не соответствует всем критериям МДС-5q-
МДС с мультилинейной дисплазией (МДС-МД)
2 - 3
1 - 3
< 15 (< 5)
КМ < 5,
ПК < 1, палочки Ауэра - нет
Любой, если не соответствует всем критериям МДС-5q-
МДС с кольцевыми сидеробластами (МДС-КС)
МДС-КС и линейной дисплазией
(МДС-КС-ЛД)
1
1 - 2
> 15
(> 5)
КМ < 5,
ПК < 1, палочки Ауэра - нет
Любой, если не соответствует всем критериям МДС-5q-
МДС-КС и мультилинейной дисплазией
(МДС-КС-МД)
2 - 3
1 - 3
> 15 (> 5)
КМ < 5,
ПК < 1, палочки Ауэра - нет
Любой, если не соответствует всем критериям МДС-5q-
МДС с изолированной делецией длинного плеча 5 хромосомы
(МДС-5q-)
1 - 3
1 - 2
Нет или любой
КМ < 5,
ПК < 1, палочки Ауэра - нет
5q- +/-1 добавочная аномалия за исключением -7/7q-
МДС с избытком бластов (МДС-ИБ)
МДС-ИБ-1
1 - 3
1 - 3
Нет или любой
КМ < 10 (5 - 9), ПК < 5
(2 - 4), палочки Ауэра - нет
Любой
МДС-ИБ-2
1 - 3
1 - 3
Нет или любой
КМ 10 - 19, ПК 5 - 19, п. Ауэра -/+
Любой
МДС неклассифицируемый (МДС-Н)
с 1% бластов в ПК
1 - 3
1 - 3
Нет или любой
КМ < 5, ПК = 1б, палочки Ауэра - нет
Любой
с линейной дисплазией и панцитопенией
1
3
Нет или любой
КМ < 5,
ПК < 1, п. Ауэра - нет
Любой
на основании цитогенетических изменений
0
1 - 3
< 15в
КМ < 5, ПК < 1, палочки Ауэра - нет
МДС-аномалииг
КМ - костный мозг; ПК - периферическая кровь. Дисплазия считается значимой, когда признаки дисплазии выявлены в > 10% клеток эритроидного, гранулоцитарного, мегакариоцитарного ростков.
- Уровень гемоглобина < 100 г/л, абсолютное количество нейтрофилов < 1,8 x 109/л, тромбоцитов < 100 x 109/л, моноцитов < 1,0 x 109/л.
- Если бласты в ПК определены в 2 и более анализах.
- Если КС > 15%, то это МДС с КС и линейной дисплазией.
- Аномалии кариотипа, наиболее часто встречающиеся при МДС: -5/5q-, -7/7q-, изохромосома 17q/t(17p), -13/13q-, 11q-, 12p-/t(12p), 9q-, idic(X)(q13), t(11;16), t(3;21), t(1;3), t(2;11), inv(3)/t(3;3), t(6;9). Аномалии кариотипа +8, 20q-, -Y без морфологических критериев не являются поводом верифицировать МДС.
При патолого-анатомическом исследовании биопсийного (операционного) материала костного мозга (трепанобиоптатов) у пациентов с МДС чаще всего выявляют нормо- или гиперклеточный КМ, и только в 10 - 15% случаев обнаруживается гипоплазия кроветворной ткани и в 10 - 15% - фиброз стромы 2 - 3 степени, что позволяет выделять МДС с гипоплазией кроветворения или МДС с фиброзом стромы. Данные особенности течения МДС целесообразно отражать в клиническом диагнозе, например: МДС с избытком бластов-1, протекающий с фиброзом стромы 2 степени; или МДС с мультилинейной дисплазией, протекающий с гипоплазией кроветворения.
Данное уточнение позволяет предположить особенности течения заболевания, определить тактику терапии и ее эффективность, а также вероятность прогрессии в ОЛ.
Варианты МДС/МПН в соответствии с актуальными критериями ВОЗ от 2017 года представлены ниже [120].
Таблица 2. Классификация МДС/МПН в соответствии с 4 пересмотром ВОЗ от 2017 года [120]
Диагноз
Периферическая кровь
Костный мозг
Клиническая картина
Хронический миеломоноцитарный лейкоз (ХММЛ)
Моноциты 1,0 x 109/л,
моноциты 10%
бластные клетки < 20%, лейкоцитоз,
анемия, тромбоцитопения
Дисплазия > 10% клеток в > 1 линии миелопоэза;
бластные клетки < 20%;
Гепатоспленомегалия, увеличение лимф. узлов, поражение кожи, В-симптомы, аутоиммунные проявления, боли в костях, инфекции
Атипичный хронический миелоидный лейкоз
Лейкоциты > 13,0 x 109/л,
незрелые нейтрофилы (п/мц+мц+м/мц) > 10%, дисплазия гранулоцитов, бластные клетки < 20%, анемия, тромбоцитопения
Гиперплазия и дисплазия > 10% клеток гранулоцитарного ростка -/+ дисплазия > 10% клеток мегакариоцитарного и/или эритроидного ростков;
бластные клетки < 20%;
Гепатоспленомегалия, анемический и геморрагический синдромы, инфекции
МДС/МПН с кольцевыми сидеробластами и тромбоцитозом
Анемия,
тромбоцитоз > 450 x 109/л, анизоцитоз тромбоцитов;
м.б. лейкоцитоз
Дизэритропоэз, кольцевые сидеробласты >15%, атипия мегакариоцитов, дисмегакарио-цитопоэз -/+ дисгранулоцитопоэз
Спленомегалия,
риск тромбозов, анемический синдром
МДС/МПН некласси-фицированное
Дисплазия+ миелопролиферативные изменения
Нет предшествующей истории МДС или МПН
Дисплазия+ миело-пролиферативные изменения, м.б. выраженный фиброз стромы
Гепатоспленомегалия, В-симптомы, тромбоэмболические осложнения, инфекции,
анемический и геморрагический синдром
Хронический миеломоноцитарный лейкоз на основании количества лейкоцитов разделяют на 2 подтипа: при лейкоцитах < 13 x 109/л - миелодиспластический ХММЛ (МД-ХММЛ),
при лейкоцитах > 13 x 109/л - миелопролиферативный ХММЛ (МП-ХММЛ).
На основании количества бластных клеток ХММЛ разделяет на 3 варианта: ХММЛ-0 - при количестве бластных клеток в костном мозге < 5%, в крови до 1%, ХММЛ-1 при количестве бластных клеток в костном мозге - 5 - 9%, в крови - 2 - 4%, ХММЛ2 - при количестве бластных клеток в костном мозге 10 - 19% и крови 5 - 19%.
При ХММЛ в 30% случаев могут выявлять фиброз стромы костного мозга при патоморфологическом исследовании. [120]
Миелодиспластические синдромы и миелодиспластические/миелопролиферативные новообразования, развившиеся после предшествующего цитотоскического (лекарственного или лучевого) воздействия, ранее называвшиеся "вторичными", в классификации ВОЗ 2017 г. отнесены в группу миелоидных неоплазий, связанных с предшествующей терапией (т-МДС, т-МДС/МПН) [120].
В 2022 году были представлены на обсуждение 5 пересмотр ВОЗ классификации МДС и МДС/МПН, а также классификационные критерии международной группы экспертов (ICC), которые по некоторым вопросам имеют существенные разночтения, в этой связи группа российских экспертов считает возможным продолжить классифицировать варианты МДС и МДС/МПН в соответствии с 4 пересмотром ВОЗ классификации от 2017 года.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Основные клинические проявления МДС неспецифичны и наиболее часто обусловлены как количественными, так и качественными изменениями системы кроветворения: цитопенический синдром (анемический синдром, геморрагический синдром, лейкопения), инфекционные осложнения, В-симптомы, незначительная спленомегалия, аутоиммунные проявления.
Аутоиммунные проявления в 10% случаев МДС манифестирует с аутоиммунного процесса: системный васкулит, некротический панникулит, серонегативный артрит, ревматическая полимиалгия, Кумбс-положительная гемолитическая анемия, перикардит, плеврит [1 - 5].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу в соответствии со шкалами оценки уровня достоверности доказательств (УДД) и уровня убедительности рекомендаций (УУР) по причине отсутствия посвященных им клинических исследований. Несмотря на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Для верификации диагноза МДС следует учитывать набор необходимых и решающих критериев.
1. Необходимые критерии
- Стабильная цитопения в 1 или более ростках в течение ![]() 4 месяцев, в частности:
4 месяцев, в частности:
показатели гемоглобина < 110 г/л, количество нейтрофилов < 1,8 x 109/л, тромбоцитов - < 100 x 109/л.
- Отсутствие других гематологических и негематологических заболеваний, протекающих с цитопениями.
2. Решающие критерии (не менее 1 критерия)
- Дисплазия ![]() 10% от всех клеток эритроидного и/или гранулоцитарного, и/или мегакариоцитарного ростков, выявленная при морфологическом исследовании костного мозга.
10% от всех клеток эритроидного и/или гранулоцитарного, и/или мегакариоцитарного ростков, выявленная при морфологическом исследовании костного мозга.
- ![]() 15% КС или
15% КС или ![]() 5% КС в сочетании с мутацией SF3B1.
5% КС в сочетании с мутацией SF3B1.
- 5 - 19% бластных клеток в КМ или 2 - 19% бластных клеток в периферической крови.
- Типичные аномалии кариотипа (-7, 5q- и др.), выявленные при стандартном цитогенетическом исследовании или методом FISH.
3. Дополнительные критерии
Если есть необходимые критерии (1), но нет решающих критериев (2), но есть клиническая картина, обусловленная макроцитарной анемией и трансфузионной зависимостью, то подтверждением диагноза могут быть:
Атипичный иммунофенотип клеток КМ со множественными МДС-ассоциированными аберрациями, выявленный при иммунофенотипировании и подтверждающий моноклональную популяцию эритроидных и миелоидных клеток.
Изменения в гистологической картине КМ, в том числе и при иммуногистохимическом исследовании, подтверждающие МДС [9].
Диагноз МДС подтверждают и при менее значимой цитопении (например, гемоглобин 115 г/л, количество тромбоцитов > 100 x 109/л), если при цитогенетическом исследовании КМ выявлены изменения кариотипа, характерные для МДС.
Признаки миелодисплазии могут выявляться в КМ или периферической крови не только при МДС, но и при других заболеваниях неклонального характера.
1. Дизэритропоэз может наблюдаться при:
- B12/фолатдефицитных анемиях;
- врожденной дизэритропоэтической анемии;
- аутоиммунных гемолитических анемиях;
- пароксизмальной ночной гемоглобинурии (ПНГ);
- алкогольной интоксикации;
- вирусных инфекциях (гепатиты B и C, вирус иммунодефицита человека (ВИЧ), вирус Эпштейна-Барр (ЭБВ), парвовирус B19);
- инфекционных заболеваниях (милиарный туберкулез, малярия, лейшманиоз);
- отравлении бензином, свинцом и другими тяжелыми металлами;
- как проявление паранеопластической реакции, в том числе при вовлечении КМ при лимфомах/лейкозах;
- аутоиммунных заболеваниях (системная красная волчанка, аутоиммунный тиреоидит);
- дефиците меди и/или избыточном поступлении цинка с пищей [10, 11].
2. Дисгранулопоэз может наблюдаться:
- при использовании лекарственных препаратов (колониестимулирующих факторов (рекомбинатный гранулоцитарный колониестимулирующий фактор человека [рчГ-КСФ]), антиметаболитов);
- при вирусных инфекциях (ВИЧ, ЭБВ);
- как проявление паранеопластической реакции;
- после химиотерапии (ХТ) и в период восстановления КМ.
3. Дисмегакариоцитопоэз может наблюдаться:
- при ВИЧ-инфекции;
- реактивном/паранеопластическом миелофиброзе;
- после трансплантации костного мозга (ТКМ) и проведенной химиотерапии.
Очень важно при проведении дифференциальной диагностики МДС учитывать анамнестические данные об имеющихся хронических заболеваниях, которые могут протекать с цитопеническим синдромом, предшествующих химио- или лучевой терапии, иммунотерапии, радиойодтерапии, профессиональных вредностях, связанных с воздействием вредных веществ (особенно бензола), употреблении алкоголя, курении, склонности к спонтанным кровотечениям и инфекциям. У молодых пациентов необходимо принять во внимание состояния, указывающие на наследственные нарушения гемопоэза, такие как анемия Фанкони и заболевания, связанные с нарушением длины теломер (наследственный дискератоз и др.). Для пожилых пациентов необходимо исключить вторичный характер изменений, в первую очередь ассоциированный с солидными опухолями. При отсутствии увеличения количества бластных клеток и/или характерных аномалий кариотипа диагноз МДС является диагнозом исключения, требующим тщательного обследования и динамического исследования костного мозга.
Для верификации диагноза из группы МДС/МДН необходимо наличие миелодиспластических и миелопролиферативных изменений. Признаки миелодисплазии описаны выше.
2.1 Жалобы и анамнез
- У всех пациентов при подозрении на МДС с целью уточнения диагноза и выявления клинически значимых сопутствующих заболеваний при сборе жалоб и анамнеза рекомендуется обращать внимание на время появления первых жалоб, динамику развития заболевания, наличие сопутствующей патологии, профессиональные вредности и условия жизни пациента, ранее проводимую терапию по поводу других заболеваний (особенно онкогематологических, аутоиммунных и др.) [1 - 5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при МДС специфических жалоб не существует. Наиболее часто поводом для обращения являются анемические жалобы (слабость, утомляемость, снижение толерантности к физическим нагрузкам), реже - геморрагический синдром и инфекционные осложнения; продолжительность анамнеза от 1 месяца до нескольких лет.
2.2 Физикальное обследование
- Всем пациентам с подозрением на МДС или подтвержденным МДС, а также пациентам с МДС/МПН рекомендуется проводить физикальное обследование при верификации диагноза и динамическом наблюдении [1 - 4, 120].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при физикальном осмотре необходимо оценивать: состояние кожных покровов, слизистых; наличие или отсутствие признаков геморрагического и отечного синдрома; специфического поражения кожи, гепатоспленомегалии, лимфоаденопатии; признаков дисфункции ЦНС, сердечно-сосудистой, легочной, мочевыделительной, эндокринной и костно-суставной систем, органов желудочно-кишечного тракта. Для расчета площади поверхности тела необходимо измерение роста и массы тела, в том числе перед каждым курсом терапии.
2.3 Лабораторные диагностические исследования
Ведущими симптомами МДС являются цитопении, которые диагностируют при стойком снижении гематологических показателей ниже пороговых значений: Hb < 110 г/л и/или абсолютного числа нейтрофилов (АЧН) < 1,8 x 109/л, и/или тромбоцитов < 100 x 109/л. При МДС/МПН изменения в анализе крови могут быть как при МДС в сочетании с лейкоцитозом > 13 x 109/л, тромбоцитозом > 450 x 109/л, а при ХММЛ обязательным условием является наличие моноцитоза > 10% и в абсолютных значения > 1,0 x 109/л/
Все диагностические процедуры направлены на исключение реактивных цитопений, цитозов или других клональных заболеваний кроветворной системы.
Спектр лабораторных исследований, который поможет в верификации диагноза МДС и МДС/МПН, представлен ниже.
После полного терапевтического обследования пациента, исключившего "вторичный" характер цитопении, цитоза и моноцитоза, необходимо проведение гематологического обследования, которое включает в себя:
- получение цитологического препарата костного мозга путем пункции;
- цитологическое исследование мазка костного мозга (миелограмма) для выявления качественных и количественных изменений в клеточном составе КМ;
- цитохимическое исследование микропрепарата костного мозга при количестве бластных клеток более 5% для выявления палочек Ауэра;
- определение сидеробластов и сидероцитов в костном мозге;
- цитогенетическое исследование (кариотип) костного мозга (исследование клеток костного мозга методом дифференциальной окраски хромосом для выявления клональных опухолевых клеток);
- иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге для выявления признаков дисмиелопоэза и определения варианта бластных клеток;
- молекулярно-генетическое исследование мутаций в генах;
- получение гистологического препарата костного мозга (трепанобиопсия) с последующим патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга.
Первичное подтверждение МДС целесообразно проводить в специализированных гематологических центрах, отделениях или кабинетах). Для адекватной верификации диагноза и оценки динамики течения болезни требуются повторные исследования КМ через несколько недель, месяцев или даже лет.
Диагноз МДС является правомочным, если после 4 месяцев наблюдения не было диагностировано любое другое гематологическое или негематологическое заболевание, которое могло бы объяснить наличие цитопении. Данный временной интервал наиболее оправдан для пациентов без избытка бластных клеток с цитопениями, не требующими проведения заместительной терапии компонентами крови. При выявлении увеличения количества бластных клеток и/или цитогенетических аберраций и клинически значимой цитопении, диагноз МДС и МДС/МПН может быть установлен сразу на основании данных полного гематологического обследования, без периода динамического наблюдения. Для верификации диагноза, определения варианта заболевания и выбора тактики терапии необходимо провести полное терапевтическое и гематологическое обследование [1 - 5].
- Всем пациентам при подозрении на МДС и МДС/МПН, а также после верификации заболевания в течение всего периода наблюдения и лечения рекомендуется выполнение общего (клинического) анализа крови развернутого с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы). Исследование уровня ретикулоцитов в крови. Исследование уровня тромбоцитов в крови на автоматическом анализаторе с целью уточнения варианта МДС, принадлежности к группе риска (см. раздел 7.1 данных рекомендаций) и выбора тактики лечения [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: выявленные изменения (гемоглобин < 110 г/л и/или абсолютное число нейтрофилов < 1,8 x 109/л и/или тромбоцитов - < 100 x 109/л при наличии признаков дисмиелопоэза и других критериев МДС) позволят верифицировать диагноз МДС или МДС/МПН, определить принадлежность к группе риска и помогут в выборе тактики терапии. Частота исследования зависит от варианта МДС и МДС/МПН, клинических проявлений и проводимой терапии и может колебаться от ежедневного исследования до ежеквартального. При частом определении, особенно в период проведения терапии, возможно выполнение общего (клинического) анализа крови на автоматическом анализаторе, без подсчета лейкоцитарной формулы в ручном режиме.
При указании на наличие гигантских тромбоцитов при подсчете на автоматическом анализаторе целесообразен пересчет тромбоцитов и анализ цитоморфологических особенностей при исследовании крови, особенно на момент верификации диагноза МДС и МДС/МПН, так как при наличии гигантских форм тромбоцитов возможно занижение количества тромбоцитов при подсчете на автоматическом анализаторе.
- Всем пациентам при подозрении на МДС и МДС/МПН, а также после верификации заболевания в течение всего периода наблюдения и лечения рекомендуется выполнение общего (клинического) анализа мочи для диагностики сопутствующей патологии и проявлений нефротоксичности на фоне проводимой терапии [1, 2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: частота исследования зависит от варианта МДС и МДС/МПН, клинических проявлений и проводимой терапии, и может колебаться от ежедневного исследования до ежегодного.
- Всем пациентам при подозрении на МДС и МДС/МПН, после верификации заболевания в течение всего периода наблюдения и лечения рекомендуется выполнение анализа крови: исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня иммуноглобулинов в крови, определение альбумин/глобулинового соотношения в крови, исследование уровня мочевины в крови, исследование уровня креатинина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, определение активности аланинаминотрансферазы в крови, определение активности аспартатаминотрансферазы в крови, определение активности лактатдегидрогеназы в крови, определение активности щелочной фосфатазы в крови, исследование уровня холестерина в крови, исследование уровня глюкозы в крови для выявления сопутствующей патологии и определения тактики терапии МДС [1, 2, 4, 5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: верификация отклонений от нормальных значений поможет определить объем опухолевой массы, наличие признаков гемолиза и сопутствующей патологии, а также оценить развитие побочных явлений на фоне проводимой терапии. Частота исследования и параметры биохимического анализа зависят от варианта МДС и МДС/МПН, клинических проявлений и проводимой терапии и может колебаться от ежедневного исследования до ежеквартального. При частом проведении исследований возможно мониторирование только клинически значимых параметров.
- Всем пациентам при подозрении на МДС и МДС/МПН, а также после верификации заболевания, во время всего периода наблюдения и лечения рекомендуется: Исследование уровня железа сыворотки крови. Исследование железосвязывающей способности сыворотки. Исследование уровня ферритина в крови. Исследование уровня трансферрина сыворотки крови. Исследование насыщения трансферрина железом с периодичностью 1 раз в 3 - 6 месяцев для оценки наличия или отсутствия дефицита железа, а также определения исходного уровня ферритина в крови и его изменения на фоне терапии, для своевременного назначения хелаторной терапии и оценки ее эффективности [1, 2, 4, 5].
Комментарии: при повышении ферритина сыворотки целесообразно исследование уровня C-реактивного белка в сыворотке крови (СРБ) для исключения воспалительного характера изменений.
- Всем пациентам при подозрении на МДС и МДС/МПН, после верификации диагноза в течение всего периода наблюдения и лечения рекомендуется определение уровня витамина B12 (цианокобаламин) в крови и исследование уровня фолиевой кислоты в сыворотке крови для оценки возможного дефицита витаминов группы B и назначения соответствующей терапии при их дефиците [1, 2, 4, 5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при проведении терапии МДС и МДС/МПН целесообразно определять уровни витамина В12 и фолиевой кислоты в сыворотке крови от 1 до 4 раз в год.
- Всем пациентам при верификации диагноза МДС и МДС/МПН из группы низкого риска (см. раздел 7.1 данных рекомендаций) с клинически значимой анемией рекомендуется, до начала трансфузионной терапии эритроцитсодержащими компонентами, исследование уровня эритропоэтина крови (ЭПО) для определения тактики терапии, в частности, возможности назначения стимуляторов гемопоэза (других антианемических препаратов - эритропоэзстимулирующих препаратов (ЭПСП)) [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Всем пациентам для верификации диагноза МДС и МДС/МПН, и на всем протяжении наблюдения при появлении клинико-лабораторной картины развития гемолитической анемии рекомендуется выполнение прямого и непрямого антиглобулинового теста (прямой пробы Кумбса и непрямой пробы Кумбса) и исследование уровня гаптоглобина крови [14].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: при появлении клинико-лабораторной картины гемолитической анемии необходимо исключить аутоиммунный характер изменений.
- Пациентам с количеством бластных клеток в КМ менее 5%, а также при наличии клинико-лабораторных признаков внутрисосудистого гемолиза при верификации диагноза МДС и МДС/МПН, а также при их появлении в период наблюдения и лечения рекомендуется иммунофенотипирование клеток периферической крови для диагностики пароксизмальной ночной гемоглобинурии расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин) для выявления клона клеток пароксизмальной ночной гемоглобинурии (ПНГ) [15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: наличие ПНГ-клона у пациентов с МДС определяется в 18 - 25% случаев, и размер клона может варьировать от минорного до клинически значимого. При обнаружении тромботических осложнений пациентам с ПНГ-клоном может потребоваться соответствующая терапия.
- Всем пациентам при верификации МДС и МДС/МПН и на всем протяжении наблюдения и лечения рекомендуется исследование: Коагулограмма (ориентировочное исследование системы гемостаза). Активированное частичное тромбопластиновое время. Определение протромбинового (тромбопластинового) времени в крови или в плазме. Исследование уровня фибриногена в крови. Исследование агрегации тромбоцитов (при наличии показаний) во время проведения специфической терапии, перед инвазивными вмешательствами (получение цитологического препарата костного мозга путем пункции, получение гистологического препарата костного мозга (трепанобиопсия), катетеризация подключичной и других центральных вен, оперативным лечением), для оценки состояния свертывающей системы крови, а также белок-синтетической функции печени [1, 2, 4, 5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при выявлении изменений в свертывающей системе крови проводится их коррекция.
- Всем пациентам с подозрением на МДС и МДС/МПН, а также подтвержденным диагнозом МДС и МДС/МПН при развитии тяжелых инфекционных осложнений во время проведения специфической терапии рекомендуется исследование уровня иммуноглобулинов в крови, исследование уровня иммуноглобулина A в крови, исследование уровня иммуноглобулина G в крови, исследование уровня иммуноглобулина M в крови, исследование моноклональности иммуноглобулинов в крови методом иммунофиксации, исследование уровня С-реактивного белка в сыворотке крови, исследование парапротеинов в моче [16 - 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: выявленные изменения позволят исключить секрецию патологического белка, а также определить тактику сопроводительной терапии на разных этапах проведения специфической терапии МДС.
- Всем пациентам с подозрением на МДС и МДС/МПН, а также при появлении симптомов, характерных для аутоиммунных заболеваний соединительной ткани, рекомендуется: определение антистрептолизина-О в сыворотке крови. Определение содержания ревматоидного фактора в крови. Определение содержания антител к ДНК нативной для диагностики аутоиммунных заболеваний [19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: аутоиммунные заболевания соединительной ткани нередко протекают с цитопеническим синдромом, что требует проведения дифференциальной диагностики МДС и МДС/МПН, в то же время при МДС в 10% случаев и ХММЛ выявляются симптомы и маркеры аутоиммунных заболеваний соединительной ткани.
- Всем пациентам с подозрением на МДС и МДС/МПН и во время дальнейшего лечения не менее 1 раза в год рекомендуются определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1/2 (Human immunodeficiency virus HIV 1/2) в крови; молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus); определение антител к бледной трепонеме (Treponema pallidum) в крови; для исключения наличия сопутствующей патологии [1, 2, 4, 5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: для исключения цитопении, связанной с инфицированием ВИЧ, при выявлении положительных маркеров - начало противовирусной и антибактериальной терапии. При подозрении на наличие острого или хронического вирусного гепатита проводится молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus). При выявлении положительных маркеров - начало противовирусной терапии.
- Пациентам с длительной цитопенией при наличии эпизодов субфебрильной или фебрильной лихорадки для верификации диагноза МДС или МДС/МПН, а также при проведении терапии МДС с целью исключения наличия сопутствующей патологии рекомендуются молекулярно-биологическое исследование крови на вирус простого герпеса (Herpes simplex virus); определение антител к вирусу простого герпеса (Herpes simplex virus) в крови; молекулярно-биологическое исследование крови на цитомегаловирус (Cytomegalovirus); определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барр (Epstein-Barr virus) в крови [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при выявлении положительных маркеров и наличии характерной клинической картины - начало противовирусной терапии.
- Всем пациентам с Hb < 100 г/л и красным ростком менее 10% рекомендуется молекулярно-биологическое исследование периферической и пуповинной крови на парвовирус B19 (Parvovirus B19), молекулярно-биологическое исследование ворсинок хориона, биоптатов плаценты, пунктатов костного мозга на парвовирус B19 (Parvovirus B19) для определения наличия инфицирования парвовирусом B19 [20], а так же определение антител класса G (IgG) и класса M (IgM) к парвовирусу B19 (Parvovirus B19) в крови.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5
Комментарии: при выявлении положительных маркеров - начало специфической терапии.
- Пациентам с изолированной анемией, особенно в молодом возрасте, при наличии признаков гемолиза для верификации диагноза МДС, а также при появлении признаков гемолиза в процессе терапии рекомендуется выявление типов гемоглобина и количественная оценка соотношения типов гемоглобина [21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: выполнение данного вида исследования возможно только в научных центрах.
- Пациентам, у которых при цитохимическом исследовании эритрокариоцитов определяются КС более чем в 15%, для исключения дефицита или избытка микроэлементов с целью дифференциальной диагностики рекомендуется исследование уровней меди и цинка в крови [22, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: при выявлении изменений - проведение их коррекции.
- Всем пациентам с цитопеническим синдромом, а также при длительном наблюдении, рекомендуется исследование уровня тиреотропного гормона (ТТГ) в крови, для исключения гипотиреоза в рамках дифференциальной диагностики и аутоиммунного тиреоидита [5, 24].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: при выявлении изменений - прием (осмотр, консультация) врача-эндокринолога первичный и проведение терапии.
- Всем пациентам для верификации диагноза, определения группы риска по прогностическим шкалам, выявления прогрессии заболевания в МДС с избытком бластов, в МДС/МПН или в ОЛ, констатации достижения ремиссии или резистентности к проводимой терапии рекомендуются получение цитологического препарата костного мозга путем пункции грудины или подвздошной кости с последующим цитологическим исследованием мазка КМ (миелограмма). При получении "сухого" пунктата - цитологическое исследование отпечатков трепанобиоптата костного мозга [25 - 28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: подсчет наличия и выраженности дисплазии в процентном соотношении необходим для верификации диагноза и при подозрении на прогрессию заболевания.
- Пациентам, у которых при исследовании КМ выявлена дисплазия лишь в одном из ростков кроветворения менее чем в 10% клеток, нет увеличения количества бластов в периферической крови или КМ, КС составляют менее 15% от эритроидных предшественников и не выявлено цитогенетических аномалий, рекомендуется повторное получение цитологического препарата костного мозга путем пункции с последующим цитологическим исследованием мазка КМ (миелограмма) через 1 - 6 месяцев, в зависимости от динамики клинических проявлений заболевания, для окончательной верификации диагноза, включая МДС [25 - 27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: такие пациенты, как правило, имеют умеренную цитопению, и быстрое прогрессирование заболевания у них маловероятно.
- Всем пациентам для верификации диагноза МДС и МДС/МПН, выявления прогрессии заболевания и в ряде случаев для оценки эффективности терапии рекомендуется исследование костного мозга на сидероциты и сидеробласты для выявления и подсчета кольцевых сидеробластов от общего количества эритрокариоцитов, при количестве бластных клеток менее 5% и эритроидном ростке от 10% и более [27 - 29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: с указанной целью применяется реакция с берлинской лазурью. На основании полученных результатов производится определение варианта МДС или МДС/МПН, и выбор тактики терапии.
- Всем пациентам с количеством бластных клеток от 5,0% до 9,9% для верификации варианта МДС или ХММЛ рекомендуется цитохимическое исследование микропрепарата костного мозга для выявления палочек Ауэра в бластных клетках [27 - 29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Для более точного определения варианта МДС и МДС/МПН целесообразно провести цитохимическую реакцию на миелопероксидазу для лучшей визуализации палочек Ауэра.
- Всем пациентам рекомендуется цитогенетическое исследование (кариотип) клеток КМ для верификации диагноза МДС или МДС/МПН, определения группы риска в соответствии с критериями прогностических шкал, выявления клональной эволюции, констатации достижения цитогенетической ремиссии [9, 30 - 38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: в соответствии с выявленными изменениями кариотипа будет определяться вариант МДС и решаться вопрос о тактике терапии.
- Всем пациентам с нормальным кариотипом, повторным отсутствием митозов при выполнении цитогенетического исследования (кариотипа) на момент верификации диагноза, при малом количестве митозов или малом количестве аномальных митозов, не позволяющим диагностировать аномалии кариотипа, для верификации диагноза МДС или МДС/МПН и определения группы прогноза, а также для оценки эффективности терапии МДС, при наличии возможности, рекомендуется Молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом для выявления аномалий 5, 7, 8 (только при отсутствии митозов), 3, 17 и других хромосом [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: выявление скрытых аномалий кариотипа помогает верифицировать вариант заболевания и определяет выбор тактики терапии. На сегодняшний день возможность выполнения данного вида исследования есть только в научных центрах или в ряде специализированных лабораторий.
- Всем пациентам рекомендуются получение гистологического препарата КМ (трепанобиопсия) и патолого-анатомическое исследование биопсийного (операционного) материала КМ для верификации диагноза МДС или МДС/МПН, динамического наблюдения; в сложных случаях диагностики МДС без избытка бластов для верификации диагноза и при необъяснимом усугублении цитопенического синдрома возможно выполнение данного исследования с двух сторон [9, 40 - 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: патоморфологическое исследование КМ позволяет верифицировать диагноз МДС или МДС/МПН, выявить гистологические особенности заболевания и дифференцированно подходить к выбору терапии.
- Всем пациентам на момент верификации МДС или МДС/МПН, а также в процессе лечения и прогрессии заболевания, в случаях, требующих более точной верификации изменений в КМ (наличие диспластичных мегакариоцитов, атипично расположенных незрелых предшественников и клеток с бластной морфологией, при наличии фиброза стромы и лимфоидных скоплений) рекомендуется патолого-анатомическое исследование биопсийного (операционного) материала КМ с применением иммуногистохимических (ИГХ) методов [9, 45 - 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов ИГХ исследования при МДС или МДС/МПН проводят на срезах парафиновых блоков трепанобиоптатов КМ. Антитела к CD34 применяют для визуализации и полуколичественной оценки клеток с бластной морфологией вне зон эндоста; антитела к CD61/CD42b для идентификации клеток мегакариоцитарного ростка, выявления мегакариобластов, мегакариоцитов небольших размеров с моно-билобулярными ядрами, микроформ (примечание - гиполобулярные ядра не имеет самостоятельного диагностического значения как признак дисплазии мегакариоцитарного ростка, лучше этот термин реже использовать, такие клетки часто встречаются среди мегакариоцитов в старшей возрастной группе, при аутоиммунных забол.). Также при иммуногистохимческом исследовании можно выявить: снижение экспрессии TdT+, CD19+ и PAX5+, что характерно для МДС; при дифференциальной диагностике - признаки моноцитарной дифференцировки при "левом сдвиге" гранулоцитарного ростка с хроническим миеломоноцитарным лейкозом, заболеванием из группы МДС.
Рекомендуемая панель антител для патолого-анатомического исследования биопсийного (операционного) материала костного мозга с применением и иммуногистохимического метода исследования при проведении дифференциальной диагностики МДС следующая:
- гранулоцитарный росток - миелопероксидаза (для МДС характерно снижение интенсивности экспрессии миелопероксидазы и количества положительных клеток);
- моноцитарный росток - CD14, CD68 (PG-M1), CD163, лизоцим;
- эритроидный росток - гемоглобин, CD71, гликофорин A или C;
- мегакариоцитарный росток - CD61, CD42b,
- незрелые клетки с бластной морфологией - CD34 и/или CD117/CD34 (в сочетании с CD71 для визуализации незрелых эритроидных предшественников) и др.
- окраска по Гомори - для выявления фиброза стромы костного мозга.
- В диагностически сложных случаях пациентам при подозрении на МДС, МДС/МПН и при прогрессии заболевания, при наличии возможности в лаборатории рекомендуется иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге для выявления маркеров гемобластозов и выявления иммунологических признаков дисплазии, а также определения маркеров минимальной остаточной болезни при гемобластозах после проведения специфической терапии [48 - 53].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге позволяет определить конкретные изменения клеток отдельных ростков кроветворения КМ. Ни один изолированный иммунофенотипический параметр не доказал свою диагностическую значимость для МДС, но с помощью анализа комбинаций отдельных признаков возможно отличить это заболевание от других видов цитопении. Однако, данный метод диагностики доступен только в федеральных центрах или в рамках клинических исследований.
- Всем пациентам с моноцитозом более 1 x 109/л в крови рекомендуется иммунофенотипирование биологического материала для выявления маркеров гемобластозов и определения доли классических моноцитов в крови [121, 122]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: иммунофенотипирование биологического материала для выявления маркеров гемобластозов позволяет определить количество классических моноцитов (CD 14+, CD16-) среди фракции зрелых моноцитов в крови, которые в большинстве случаев ХММЛ составляют > 94%.
- Всем пациентам с подтвержденным диагнозом МДС или МДС/МПН при наличии возможности в лаборатории рекомендуется молекулярно-генетическое исследование мутаций в гене SF3B1 в крови, молекулярно-генетическое исследование мутаций в гене ТР53 в крови, молекулярно-генетическое исследование мутаций в гене FLT3 (при бластных клетках от 10% и более), молекулярно-генетическое исследование мутаций в гене KRAS в биопсийном (операционном) материале, молекулярно-генетическое исследование мутаций в гене NRAS в биопсийном (операционном) материале, молекулярно-генетическое исследование мутаций в гене CEBPA в крови, молекулярно-генетическое исследование мутаций в гене IDH1 в биопсийном (операционном) материале, молекулярно-генетическое исследование мутаций в гене IDH2 в биопсийном (операционном) материале, молекулярно-генетическое исследование мутации гена NPM1 (нуклеофосмин 1) в костном мозге или молекулярно-генетическое исследование мутаций в гене NPM1 методом секвенирования также молекулярно-генетическое исследование мутаций в других генах (ASXL1, ETV6, RUNX1, GATA2, DNMT3A, TET2, SRSF2, EZH2, U2AF1, CBL, MLL SEPBP1, UBA1) в крови или КМ и определения прогноза заболевания [5, 54 - 56, 155].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: данный метод диагностики доступен только в федеральных центрах или в рамках клинических исследований. При наличии информации о мутационном статусе возможно более точно определить прогноз МДС и МДС/МПН.
- Пациентам с МДС, протекающим с фиброзом стромы, или при тромбоцитозе, а также всем пациентам с подозрением на МДС/МПН рекомендуется молекулярно-генетическое исследование маркеров Ph-негативных миелопролиферативных заболеваний (мутации в генах Jak2, MPL и CALR) для определения варианта заболевания, прогноза и выбора тактики терапии [57, 58].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Всем пациентам с подозрением на МДС/МПН рекомендуется определение экспрессии мРНК BCR-ABLp210 (количественное), молекулярно-генетическое исследование мутаций в гене PDGFRA, а также молекулярно-генетическое исследование мутаций в генах PDGFRB, FGFR1, PCM-JAK2 для исключения других миелопролиферативных новообразований [120].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам моложе 40 лет с подозрением на конституциональный характер аплазии кроветворения, предшествующей развитию МДС, рекомендуется цитогенетическое исследование (кариотип) крови. ДЭБ-тест (тест с диэпоксибутаном) для исключения анемии Фанкони [59].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Пациентам МДС из группы промежуточного, высокого и очень высокого риска по IPSS-R, МДС/МПН: ХММЛ-2, группа высокого риска, аХМЛ (см. раздел 7.1 данных рекомендаций), которые могут рассматриваться в качестве кандидатов для выполнения трансплантации костного мозга (ТКМ) от родственного или неродственного донора рекомендуется молекулярно-генетическое исследование гистосовместимости (HLA высокого разрешения при помощи секвенирования) для подбора донора костного мозга [1, 4, 5, 60].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: типирование пациентов с МДС и МДС/МПН и потенциальных родственных доноров по HLA-антигенам I и II класса проводится с целью поиска идентичных по антигенам тканевой совместимости пар для проведения ТКМ. Целесообразно также типирование реципиентов, не имеющих потенциальных родственных доноров, для осуществления поиска неродственного донора в российском и международном регистрах.
- Всем пациентам МДС и МДС/МПН, которым планируется проведение заместительной терапии компонентами крови, рекомендуется определение основных групп по системе AB0, антигена D системы Резус (резус-фактор), фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител с целью подбора трансфузионных сред и минимизации трансфузионных реакций [61].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: учитывая высокую частоту гемотрансфузий и развивающиеся впоследствии сенсибилизацию к донорским компонентам крови и эритроцитарный химеризм, гемотрансфузии следует проводить с учетом фенотипа.
- Всем пациентам при проведении терапии #циклоспорином** рекомендуется исследование уровня циклоспорина А, для подбора оптимальной дозы препарата [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: учитывая индивидуальные особенности подбор оптимальной дозы циклоспорина проводится с учетом биохимических показателей крови (уровень мочевины в крови, уровень креатинина в крови, уровень общего билирубина в крови, уровень свободного и связанного билирубина в крови) и уровня циклоспорина А, оптимальным считается уровень от 100 до 400 нг/мл.
- Всем пациентам после спленэктомии и биопсии печени рекомендуются патолого-анатомическое исследование биопсийного (операционного) материала селезенки и патолого-анатомическое исследование биопсийного (операционного) материала печени [9, 40 - 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: гистологическая картина удаленной селезенки позволяет подтвердить диагноз МДС или МДС/МПН, выявить признаки вторичной перегрузки железом.
- Всем пациентам после спленэктомии с биопсией печени при подозрении на инфильтрацию бластными клетками или наличие другого заболевания рекомендуется патолого-анатомическое исследование биопсийного (операционного) материала селезенки и биоптата печени с применением иммуногистохимических методов [9, 45 - 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: патолого-анатомическое исследование биопсийного (операционного) материала селезенки и печени с применением иммуногистохимических методов при МДС или МДС/МПН проводят на срезах парафиновых блоков селезенки и печени. Антитела к CD34 применяют для визуализации и полуколичественной оценки клеток с бластной морфологией, моноцитов - CD14, CD16, лизоцим. При подозрении на другие заболевания панель иммуногистохимических маркеров зависит от дифференциального поиска.
2.4 Инструментальные диагностические исследования
Инструментальные методы исследования позволяют проводить дифференциальную диагностику цитопенического синдрома и цитозов, а также выявить наличие сопутствующей патологии при МДС [1 - 5].
- Всем пациентам с подозрением на МДС и МДС/МПН рекомендуется выполнение ультразвукового исследования органов брюшной полости (комплексного), ультразвукового исследования почек, ультразвукового исследования щитовидной железы и паращитовидных желез, ультразвукового исследования органов малого таза комплексное (трансвагинальное и трансабдоминальное) для женщин и ультразвукового исследования предстательной железы, эхокардиографии для определения сопутствующей патологии [1, 120].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: УЗИ органов брюшной полости и забрюшинного пространства (печень, селезенка, поджелудочная железа, желчный пузырь, лимфатические узлы, в том числе и периферические) проводится при подозрении на МДС или МДС/МПН, в процессе лечения для выявления гепатоспленомегалии, лимфаденопатии и патологии других жизненно важных органов. Для исключения наличия патологии щитовидной железы (которая может протекать с анемией и тромбоцитопенией) проводят ультразвуковое исследование щитовидной железы и паращитовидных желез. УЗИ молочных желез или маммографию - для исключения новообразования; ЭхоКГ для оценки состояния сердечно-сосудистой системы при подозрении на МДС и в процессе лечения.
- Всем пациентам с подозрением на МДС и МДС/МПН рекомендуется проведение: магнитно-резонансной томографии головного мозга или компьютерной томографии головного мозга для исключения патологии ЦНС (в частности новообразований ЦНС), которая может сопровождаться цитопеническим синдромом [62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на МДС или МДС/МПН, а также на всех последующих этапах лечения рекомендуется выполнить: Компьютерную томографию органов грудной полости (для исключения поражения легких и органов средостения как воспалительного, так и невоспалительного характера) [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на МДС или МДС/МПН рекомендуется выполнить эзофагогастродуоденоскопию (ЭГДС) с любым исследованием на выявление Helicobacter pylori: микробиологическое (культурное) исследование биоптата стенки желудка на хеликобактер пилори (Helicobacter pylori) или микробиологическое (культурное) исследование биоптатов слизистой желудка хеликобактер пилори (Helicobacter pylori) или молекулярно-биологическое исследование биоптатов слизистой желудка на хеликобактер пилори (Helicobacter pylori) или определение ДНК хеликобактер пилори (Helicobacter pylori) в биоптатах слизистой желудка методом ПЦР или микроскопическое исследование материала желудка на хеликобактер пилори (Helicobacter pylori) для исключения хронических заболеваний или новообразований пищевода, желудка, 12-перстной кишки [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на МДС низкого риска (см. раздел 7.1 данных рекомендаций) или МДС/МПН рекомендуется выполнение колоноскопии для исключения хронических заболеваний и новообразований ЖКТ, которые могут сопровождаться цитопеническим синдромом [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на МДС или МДС/МПН, а также в процессе терапии рекомендуется регистрация электрокардиограммы для оценки состояния сердечно-сосудистой системы [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.5 Иные диагностические исследования
- Всем пациентам с МДС и МДС/МПН рекомендуется постоянное диспансерное динамическое наблюдение у врача-гематолога в течение всей жизни [1, 118].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: график диспансерного наблюдения не отработан, устанавливается индивидуально каждым врачом для каждого пациента в зависимости от варианта МДС и МДС/МПН, возраста пациента и наличия сопутствующей патологии.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Миелодиспластические синдромы являются чрезвычайно гетерогенной группой заболеваний, начиная от форм с почти нормальной продолжительностью жизни и заканчивая вариантами, сходными по течению с ОМЛ. Выбор персонализированной риск-адаптированной терапии является обязательным условием при такой разнородности. Прогностические факторы можно разделить на те, которые касаются характеристик самого пациента, и те, которые определяются особенностями конкретного варианта МДС.
К сожалению, необходимо признать, что в настоящее время нет универсальной прогностической шкалы, которая включала бы все значимые для МДС параметры (морфологический вариант, ЛДГ, 2-микроглобулин, ферритин и т.д.), и в этой связи при принятии решения о выборе тактики терапии можно оценивать прогноз по шкале IPSS-R (см. раздел 7.1 данных рекомендаций). Доказательства эффективности и безопасности доступных терапевтических опций получены в клинических исследованиях (КИ), в которых стратификация пациентов проводилась на основе системы IPSS, а в последние десять лет на основе IPSS-R. Как следствие, все фактические рекомендации на текущий момент по лечению основываются на разделении пациентов на группы согласно IPSS и IPSS-R. Учитывая разночтения в определении группы риска в 20 - 30% случаев между шкалами IPSS, WPSS и IPSS-R, целесообразно использовать одну шкалу во избежание разночтений в определении прогноза МДС. Российское экспертное сообщество рекомендует использовать IPSS-R в качестве базового инструмента для определения группы риска и выбора тактики терапии. Также следует подчеркнуть, что для формирования более четкого представления о течении заболевания и выбора оптимального терапевтического воздействия настоятельно рекомендуется выполнять повторное обследование пациентов, а не основываться на единичных результатах. Шкалы риска представлены в разделе Приложение Г1 данных рекомендаций [1, 2, 30, 63, 64]. В 2022 году была представлена новая шкала прогноза IPSS-M, в основу которой положены критерии шкалы IPSS-R с добавление данных молекулярно-генетических анализа 31 гена (16 основных и 15 дополнительных) [155]. Учитывая отсутствие в рутинной клинической практике технической возможности проведения молекулярно-генетического анализа в таком объеме, сообщество российских экспертов считает преждевременным внедрение данной шкалы для выбора тактики терапии,
Для пациентов с неоцененным в силу технических причин кариотипом при выборе терапевтического режима следует принимать во внимание морфологический вариант МДС по классификации ВОЗ, количество бластных клеток в КМ и динамику их изменения, клеточность КМ и тяжесть цитопений [1].
Выбор терапии зависит от возраста пациента, варианта МДС, принадлежности к группе риска, наличия и тяжести сопутствующей патологии, наличия HLA-совместимого донора. На сегодняшний день рекомендуется использовать шкалу IPSS-R для более точного определения прогноза заболевания.
В терапии МДС с учетом особенностей патогенеза и разнородности заболевания существует несколько направлений, однако наиболее эффективными и признанными во всем мире являются:
- симптоматическая терапия:
- заместительная терапия компонентами донорской крови (эритроцитсодержащие компоненты донорской крови, концентрат тромбоцитов, свежезамороженная плазма),
- хелаторная терапия,
- препараты стимуляторы гемопоэза (антианемические препараты, колониестимулирующие факторы, гемостатические средства),
- антибактериальная терапия;
- противоопухолевая химиотерапия:
- ПХТ по программам лечения ОМЛ,
- низкодозная ХТ,
- противоопухолевые препараты: антиметаболиты; аналоги пиримидина (гипометилирующие препараты);
- иммуносупрессивная и иммуномодулирующая терапия:
- АТГ**,
- #ЦСА**,
- леналидомид**,
- спленэктомия;
- аллогенная трансплантация костного мозга (алло-ТКМ) [1 - 5].
Единственным методом биологического излечения является алло-ТКМ однако только в 5 - 10% случаев удается реализовать эту программу, в связи с отсутствием HLA-идентичного донора, соматическим статусом и возрастом пациента, а также особенностями МДС или МДС/МПН.
При лечении пациентов с МДС допускается сочетание выше перечисленных видов терапии, а также ее последовательное назначение в связи с неэффективностью и/или прогрессией заболевания. Так, у одного пациента возможно проведение ИСТ и при прогрессии в МДС-ИБ-1 или ИБ-2 - назначение гипометилирующих препаратов (аналогов пиримидина) или ПХТ.
Неоднородность МДС осложняет также и оценку ответа на терапию. В 2000 г. Международная рабочая группа (IWG) определила стандартизованные критерии ответа при МДС. В последующем они были пересмотрены и обновлены в 2006 г. (см. Приложение Г2). Критерии IWG определяют различные аспекты ответа с учетом целей лечения и включают в себя ПР и ЧР, цитогенетический ответ, гематологические улучшения и качество жизни. Использование этих критериев рекомендовано как для клинической практики, так и при проведении КИ [65].
- Пациентам МДС из группы низкого и промежуточного-1 риска по шкале IPSS (см. раздел 7.1 данных рекомендаций) и очень низкого и низкого риска по шкале IPSS-R (см. раздел 7.1 данных рекомендаций) с бессимптомной цитопенией не рекомендуется проведение специфического лечения, а показано динамическое наблюдение - тактика, называемая "наблюдай и жди", с целью контроля за течением заболевания и при необходимости начала специфической терапии [1 - 5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: взрослые пациенты с первичным МДС из группы низкого риска с бессимптомной цитопенией, не требующей проведения заместительной терапии компонентами донорской крови, не нуждаются в лечении и лишь требуют регулярного обследования. Выжидательная стратегия может измениться в будущем, в случае разработки безопасных, менее агрессивных или таргетных методов лечения, способных влиять на прогноз заболевания. Необходимо подчеркнуть, что пациенты и члены их семьи должны понимать, что безопасность наблюдательного подхода зависит от регулярности мониторинга. Целью динамического наблюдения является раннее распознавание признаков усугубления цитопении, появления трансфузионной зависимости, увеличения числа бластных клеток в крови или КМ, а также оценка эволюции кариотипа.
- Пациентам из группы МДС/МПН рекомендуется динамическое наблюдение. Терапию ХММЛ необходимо начинать, когда заболевание носит симптоматический или прогрессирующий характер: в частности, лечение начинают при уровне гемоглобина < 100 г/л, бластных клетках в КМ > 5%, тромбоцитах < 100 x 109/л, прогрессирующем лейкоцитозе (> 30 x 109/л), экстрамедуллярных поражениях (поражения кожи, плевральный/перикардиальный выпот, лимфаденопатия), наличии конституциональных симптомов (потеря веса, лихорадка) и симптоматической спленомегалии или спленомегалии, пальпируемой на 5 см ниже левого реберного края. Для начала терапии необходимо наличие 2 и более симптомов ХММЛ. (4, 5).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3.1. Консервативное лечение
- Всем пациентам МДС и МДС/МПН с анемическими жалобами и симптомами гипоксемии при Hb < 85 - 80 г/л рекомендуется проведение заместительной терапии эритроцитсодержащими компонентами донорской крови (ЭСКДК) для компенсации/купирования симптомов анемии [66].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: данные о показаниях к назначению эритроцитсодержащих компонентов донорской крови при МДС носят ограниченный характер. Зависимость от заместительной терапии эритроцитсодержащих компонентов донорской крови у пациентов с МДС ассоциируется с плохим прогнозом и, как правило, объясняется более агрессивным характером течения болезни и токсичностью, связанной с гемотрансфузиями. Уровень гемоглобина ниже 90 г/л для мужчин и 80 г/л для женщин является независимым фактором прогноза, связанным с сокращением ОВ и высоким риском фатальных сердечно-сосудистых осложнений.
Никакой конкретный уровень гемоглобина не может быть рекомендован в качестве порогового и определяющего показания к гемотрансфузионной терапии. Решение следует принимать на основании имеющихся у пациента симптомов и сопутствующих заболеваний. Формализуя вышесказанное, Экспертная группа по диагностике и лечению пациентов с МДС рекомендует выполнение гемотрансфузий эритроцитсодержащих компонентов донорской крови при снижении гемоглобина ниже 85 - 80 г/л и клинически значимых симптомов анемии (гипоксемии). Гемотрансфузии ЭСКДК необходимо проводить после определения фенотипа по антигенам C, c, E, e, C w, K, k и определения антиэритроцитарных антител.
- Пациентам МДС и МДС/МПН при развитии критической тромбоцитопении (< 10 - 20 x 109/л) рекомендуется проведение заместительной терапии концентратами тромбоцитов для профилактики геморрагических осложнений, а при их наличии и при более высоких показателях тромбоцитов, с целью купирования геморрагических осложнений [1 - 5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: уровень тромбоцитов, при котором у пациентов с МДС и МДС/МПН возникают геморрагические осложнения, четко не определен и варьирует от пациента к пациенту. Имеющиеся данные о показаниях к гемотрансфузиям концентрата тромбоцитов при МДС и МДС/МПН крайне ограничены.
Профилактическая гемотрансфузия концентрата тромбоцитов рекомендуется пациентам с уровнем тромбоцитов ниже 10,0 x 109/л или при уровне ниже 20,0 x 109/л при наличии любого фактора риска для развития кровотечения (лихорадка, инфекция, быстрое снижение тромбоцитов, инвазивные процедуры. Многолетняя тромбоцитопения без геморрагического синдрома не нуждается в регулярных профилактических гемотрансфузиях концентрата тромбоцитов.
- Пациентам с МДС из группы низкого риска и промежуточного-1 риска по шкале IPSS и группы очень низкого, низкого и промежуточного риска по шкале IPSS-R (см. раздел 7.1 данных рекомендаций); всем кандидатам на проведение алло-ТКМ; пациентам с МДС из группы промежуточного-2 и высокого риска по шкале IPSS и из группы промежуточного, высокого и очень высокого риска по шкале IPSS-R при достижении ремиссии МДС, а также пациентам из группы МДС/МПН после гемотрансфузии 10 - 20 доз ЭСКДК, при повышении сывороточного ферритина более 1000 нг/мл рекомендуется проведение хелаторной терапии железосвязывающим препаратом деферазироксом** для устранения избыточного накопления железа [67 - 73].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2
Комментарии: у пациентов, которым регулярно проводятся гемотрансфузии ЭСКДК, неизменно развивается вторичная перегрузка железом. Одна единица ЭСКДК содержит от 200 до 250 мг железа, а перегрузка может возникнуть уже после 10 - 20 переливаний. Согласно Российским и международным публикациям выявлено статистически достоверное уменьшение ОВ в группе пациентов с перегрузкой железом, связанной с трансфузионной зависимостью. Косвенным биохимическим маркером перегрузки железом условно принято считать повышение уровня ферритина сыворотки крови более 1000 нг/мл. Превышение этого порога отчетливо коррелирует с ограниченной ОВ (HR 52,4; p < 0,0001) и повышенным риском трансформации в ОМЛ (HR 6,6; p < 0,0001).
Терапию железосвязывающим препаратом следует рассматривать в качестве необходимой опции трансфузионнозависимым пациентам с МДС-ЛД, МДС-КС, МДС-МД и МДС с 5q-. Значения ферритина необходимо определить в дебюте заболевания и отслеживать каждые 3 месяца в динамике. Исследование феррокинетики желательно проводить не ранее чем через 10 - 14 дней после последней гемотрансфузии ЭСКДК, вне инфекционного эпизода. Пациентам с МДС, которые являются потенциальными кандидатами на проведение алло-ТКМ, также проводится терапия железосвязывающим препаратом в предтрансплантационном периоде и после выполнения алло-ТКМ при сохранении признаков перегрузки железом.
Для больных МДС-ИБ при достижении клинико-гематологической ремиссии и наличии признаков вторичной перегрузки железом возможно назначение железосвязывающих препаратов (хелаторной терапии).
Рекомендуемая начальная доза деферазирокса**:
1. Диспергируемая таблетка - 20 мг/кг/сут, а при выраженной перегрузке железом - 30 мг/кг/сутки. Дозу препарата округляют до близкого размера целой таблетки (125, 250 и 500 мг).
2. Таблетка, покрытая пленочной оболочкой - 14 мг/кг/сут., а при выраженной перегрузке железом - 21 мг/кг/сут. Дозу препарата округляют до близкого размера целой таблетки (90, 180 и 360 мг).
Контроль за токсичностью деферазирокса** проводят ежемесячно, а за эффективностью - 1 раз в 3 месяца, ориентируясь на показатель ферритина, желательно в сочетании с СРБ в крови и насыщения трансферрина железом. Доза препарата пересчитывается каждые 3 - 6 месяцев с ее увеличением при неэффективности терапии, и редукцией при снижении показателя ферритина менее 1000 нг/мл и/или развитии признаков токсичности препарата. При снижении ферритина менее 500 нг/мл препарат отменяют.
- Пациентам с МДС из группы низкого и промежуточного-1 риска по шкале IPSS и группы очень низкого, низкого и промежуточного риска по шкале IPSS-R (см. раздел 7.1 данных рекомендаций), а также пациентам МДС/МПН, особенно ХММЛ-0, из группы низкого и промежуточного-1 риска, МДС/МПН-КСТ, МДС/МПН-н при эндогенном эритропоэтине предпочтительно < 200 МЕ/мл, но с учетом результатов международных клинических исследований < 500 МЕ/мл и гемоглобине < 100 г/л рекомендуется проведение терапии другими антианемическими препаратами: #эпоэтин альфа**, #эпоэтин бета**, #дарбэпоэтин альфа** (дозировки - см. приложение А3.2) с целью повышения показателей гемоглобина и снижения зависимости от гемотрансфузий ЭСКДК. [5, 74 - 77].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: применительно к МДС низкого и промежуточного-1 риска по шкале IPSS одним из подходов к лечению рефрактерных анемий является назначение ЭПСП. Применение других антианемических препаратов (#эпоэтин альфа**, #эпоэтин бета**, #дарбэпоэтин альфа**) позволяет повысить концентрацию гемоглобина, улучшить качество жизни пациентов, отказаться или снизить потребность в заместительной терапии ЭСКДК. Частота ответа на монотерапию ЭПСП при МДС без учета показателей эндогенного ЭПО невысока и не превышает 20%. Назначение ЭПСП необходимо осуществлять только после измерения концентрации эндогенного ЭПО. Так, при его концентрации менее 500 мЕ/мл и частоте гемотрансфузий ЭСКДК < 2 доз/мес. эффективность составляет около 60%. При содержании ЭПО в сыворотке крови более 500 мЕ/мл терапия ЭПО (другие антианемические препараты) малоэффективна (~ 10%). При парциальной красноклеточной аплазии ЭПО (другие антианемические препараты) не назначают. Однако, если при гистологическом исследовании красный росток нормальных размеров или даже расширен, терапию ЭПСП проводят.
Рекомендации по назначению ЭПСП представлены в Приложении А3.2.
При достижении целевого уровня Hb 110 - 120 г/л дозу ЭПСП (другие антианемические препараты) снижают и при стабильных показателях гемоглобина впоследствии отменяют.
В случае отсутствия ответа после повышения дозы ЭПО (другие антианемические препараты) и/или добавления Г-КСФ в течение 6 - 8 недель терапию останавливают.
Таким образом, по мнению экспертного сообщества, пациентам с МДС низкого и промежуточного-1 риска по IPSS (см. раздел 7.1 данных рекомендаций), с умеренной и тяжелой анемией (гемоглобин < 100 г/л), низким уровнем эндогенного ЭПО (< 500 мЕ/мл) и/или с ограниченной потребностью в гемотрансфузиях (менее 2 единиц эритроцитной массы в месяц) следует начинать терапию препаратами #эпоэтина альфа** или #эпоэтина бета** в начальной дозе 30 - 40 тысяч МЕ в неделю или использовать эквивалентные дозы #дарбопоэтина альфа** (150 - 300 мкг/неделю), сопоставимые по клинической эффективности с таковой #эпоэтина альфа** или #эпоэтина бета** [76, 77].
Для пациентов МДС-МД и МДС-ИБ из группы промежуточного-2 и высокого риска по шкале IPSS, группы промежуточного, высокого и очень высокого риска по шкале IPSS-R, также возможно назначение в качестве сопроводительной терапии в межкурсовом периоде, при проведении ХТ или гипометилирующей терапии.
- Пациентам с МДС при неэффективности терапии другими антианемическими препаратами, такими как ЭПСП, в монорежиме рекомендуется добавление к терапии колониестимулирующего фактора для повышения эффективности терапии ЭПСП (другие антианемические препараты) [5, 78 - 80, 167].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: вероятность ответа на комбинированную терапию с помощью других антианемических препаратов (ЭПСП) и колониестимулирующих факторов (Г-КСФ), в частности, выше у пациентов с низким уровнем эндогенного ЭПО (< 500 мЕ/мл) и ограниченной потребностью в гемотрансфузиях (< 2 единиц эритроцитсодержащих компонентов в месяц). При наличии двух неблагоприятных признаков вероятность ответа составляет 7%, одного - 23%, а при их отсутствии - 74%.
Следует подчеркнуть, что сочетанное применение других антианемических препаратов (ЭПСП) и колониестимулирующего фактора (Г-КСФ) наиболее эффективно у пациентов с МДС-КС при отсутствии ответа на монотерапию ЭПСП. Колониестимулирующий фактор (Г-КСФ) #филграстим** вводится подкожно от 1 до 2 мкг/кг 1 - 2 раза в неделю в течение 6 - 8 недель, доза подбирается индивидуально с учетом количества лейкоцитов менее 10 x 109/л [5, 167].
При проведении как стандартной, так и низкодозной ХТ возможно применение Г-КСФ (колониестимулирующих факторов) при ожидаемой длительной нейтропении в качестве сопроводительной терапии у пациентов с МДС.
Монотерапия Г-КСФ (колониестимулирующие факторы) в настоящее время не рассматривается как самостоятельное лечение нейтропении у пациентов с МДС.
- Всем пациентам с МДС без делеции длинного плеча хромосомы 5 с трансфузионно-зависимой анемией из группы очень низкого, низкого и промежуточного риска по IPSS-R, с отсутствием ответа на ЭПСП или которые не соответствуют критериям назначения ЭПСП, рекомендуется терапия луспатерцептом [123, 124].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарий: эффективность и безопасность луспатерцепта были изучены у больных МДС с кольцевыми сидеробластами из группы очень низкого, низкого и промежуточного риска по IPSS-R с трансфузионно-зависимой анемией, у которых не был получен ответ на лечение ЭПСП или которые не соответствовали критериям их назначения, в 3 Фазе рандомизированного исследования MEDALIST [124]. Пациенты были рандомизированы в две группы: получавшие луспатерцепт (в дозах от 1,0 мг/кг до 1,75 мг/кг массы тела) или плацебо, вводимые подкожно каждые 3 недели. Доля пациентов, достигших независимости от гемотрансфузий ЭСКДК в течение не менее 8 недель за период с 1-й по 24-ю недели исследования составила 38% в группе на луспатерцепте и 13% в группе плацебо (p <0.001). Рекомендуемая начальная доза луспатерцепта составляет 1 мг/кг подкожно каждые 3 недели. При отсутствии ответа в виде повышения гемоглобина и снижения зависимости от гемотрансфузий ЭСКДК дозу следует увеличить до 1,33 мг/кг, подкожно. При отсутствии ответа на дозе 1,33 мг/кг дозировку следует увеличить до 1,75 мг/кг. Повышение дозы нельзя производить чаще, чем один раз в 6 недель (два введения), максимальная дозировка не должна превышать 1,75 мг/кг 1 раз в 3 недели. В случае достижения ответа (повышение гемоглобина или снижение/отсутствие зависимости от гемотрансфузий ЭСКДК) терапия луспатецептом продолжается в эффективной дозе.
По результатам 3 фазы рандомизированного исследования COMMANDS была показана эффективность луспатерцепта в 1 линии терапии у 59% больных МДС из групп очень низкого, низкого и промежуточного риска без делеции длинного плеча хромосомы 5, в т.ч. и у пациента без кольцевых сидеробластов. Препарат назначали в стандартной дозе 1 мг/кг массы тела, подкожно, каждые 3 недели, с возможностью эскалации дозы при отсутствии ответа до 1,75 мг/кг каждые 6 недель [125, 126].
- Пациентам с МДС низкого риска без неблагоприятных аномалий кариотипа, фиброза стромы любой степени, у которых ведущим симптомом является клинически значимая тромбоцитопения, возможно иммунного генеза, рекомендуется рассмотреть возможность назначения других системных гемостатиков (#элтромбопага** от 50 до 150 мг внутрь, 1 раз в день или #ромиплостима** 500 - 750 мкг подкожно 1 раз в неделю) с целью повышения количества тромбоцитов, снижения зависимости от гемотрансфузий концентрата тромбоцитов и уменьшения проявлений геморрагического синдрома [24, 83 - 89].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: проведено несколько рандомизированных исследований, результаты которых демонстрируют эффективность данного вида терапии у пациентов с МДС из группы низкого риска в виде повышения количества тромбоцитов и уменьшения проявлений геморрагического синдрома в 46 - 65% случаев. Однако, у пациентов с МДС из группы высокого риска, в частности МДС с избытком бластов, добавление #элтромбопага** к терапии азацитидином** снизило эффективность последнего и увеличило частоту прогрессии в ОМЛ. У пациентов с МДС из группы низкого риска при терапии #ромиплостимом** вероятность прогрессии в ОМЛ в течение 5 лет была сопоставима с контрольной группой - 12% и 11%.
Для решения вопроса о назначении других гемостатических средств необходимо получение гистологического препарата КМ (трепанобиопсия) и патолого-анатомическое исследование биопсийного (операционного) материала КМ с применением иммуногистохимических (ИГХ) методов (с окраской по Гомори) для определения наличия фиброза стромы.
- У пациентов ХММЛ в 20 - 30% случаев возможно развитие аутоиммунных проявлений, включая и иммуноопосредованную тромбоцитопению. Пациентам с миелодиспластическим вариантом ХММЛ из группы низкого риска при наличии тромбоцитопении, вероятно иммунного генеза, рекомендовано назначение других системных гемостатиков (#элтромбопага** от 100 до 300 мг внутрь, 1 раз в день, средняя доза 150 мг) с целью повышения количества тромбоцитов, снижения зависимости от гемотрансфузий концентрата тромбоцитов и уменьшения проявлений геморрагического синдрома [127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: результаты II фазы клинического исследования NCT02323178 показали хорошую переносимость #элтромбопага** и эффективность, в виде повышения количества тромбоцитов у 46,7% больных ХММЛ [127].
- Пациентам с МДС из группы низкого и промежуточного-1 риска по шкале IPSS и группы низкого и промежуточного риска по шкале IPSS-R (см. раздел 7.1 данных рекомендаций) с гипоплазией кроветворения, нормальным кариотипом, аномалиями хорошего или промежуточного риска, за исключением 7q-, iso(17q), рекомендуется проведение иммуносупрессивной терапии (ИСТ): #циклоспорин** (#ЦСА**) в дозе 5 мг/кг/сут. в 2 приема, внутрь, под контролем концентрации #циклоспорина** в сыворотке крови в виде монотерапии или с сочетании с другими препаратами с целью достижения положительного ответа при иммунной цитопении, в том числе и полной клинико-гематологической ремиссии [1, 90, 154].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: определенное сходство клинических и морфологических проявлений гипопластических форм МДС и АА, доказанных иммунных механизмов развития цитопении при МДС с гипоплазией кроветворения, а также клинические наблюдения, касающиеся эффекта иммуносупрессивного воздействия у отдельных пациентов, легли в основу тестирования #АТГ** в качестве метода терапии в двух КИ 2-й и 3-й фаз. По объединенным данным этих проектов, ответили на терапию 30% пациентов с количеством бластных клеток в КМ менее 5%. В ситуации РАКС или РАИБ вероятность ответа незначительна. В результате пациенты МДС из группы низкого риска по IPSS, гипоклеточным КМ по данным патоморфологического исследования, с коротким периодом предшествующей гемотрансфузионной терапии и наличием HLA-DR15 имеют высокую вероятность ответа на ИСТ. Наилучшие результаты дает комбинированная терапия #АТГ** и #ЦСА**. Также, учитывая сходство патогенеза МДС с гипоплазией кроветворения и апластической анемии, возможно добавление других системных гемостатиков, в частности #элтромбопага** в дозе 150 мг/ сут, внутрь, к терапии #ЦСА** [127].
На основе имеющихся данных, комбинированную ИСТ #АТГ** и приема #ЦСА** внутрь в течение 6 месяцев следует рассматривать в качестве выбора для пациентов с МДС, с количеством бластных клеток в КМ менее 5%, нормальным кариотипом или трисомией хромосомы 8, гемотрансфузионной зависимостью менее 2 лет, которые не являются кандидатами на лечение ростовыми факторами, или терапия которыми оказалась неэффективной, с генотипом HLA-DR15, минимальным ПНГ-клоном и мутацией в гене STAT3.
На основании опыта российских исследовательских центров представляется возможным рекомендовать проведение монотерапии #ЦСА** для той же категории пациентов, а также пациентам с благоприятными вариантами кариотипа и трисомией 8. Проведение ИСТ пациентам с МДС можно начинать с назначения #ЦСА** в дозе 5 мг/кг/сут. внутрь, разделив дозу препарата на 2 приема, под контролем концентрации препарата в сыворотке крови и биохимических показателей крови. При его неэффективности в течение 3 - 6 месяцев, целесообразно проведение курса #АТГ** в дозе 20 мг/кг/сут в 1 - 5 дни в виде длительной внутривенной инфузии [1] с последующим возобновлением приема #ЦСА**. Возможным вариантом лечения является начало терапии с введения #АТГ** в дозе 20 мг/кг/сут. в течение 5 дней [1] или 40 мг/кг/сут. в течение 4 дней [90], с последующим назначением #ЦСА** на 14 день от начала ИСТ. При отсутствии эффекта от комбинированной ИСТ в течение 6 - 9 месяцев и отсутствии прогрессии заболевания в виде увеличения бластных клеток и появления новых цитогенетических изменений, возможно выполнение спленэктомии или повторного курса #АТГ**. Общая длительность терапии для пациентов, ответивших на #ЦСА**, должна составлять не менее 24 месяцев. ИСТ наиболее оправдана при гипоплазии кроветворения или неравномерной клеточности с участками гипоплазии или аплазии КМ. При МДС-ИБ-1 с благоприятными аномалиями кариотипа и гипоплазией кроветворения также может назначаться ИСТ, однако только после консультации в федеральном центре. При неэффективности ИСТ и сохранении выраженной зависимости от гемотрансфузий компонентами крови целесообразно решение вопроса о возможности выполнения алло-ТКМ.
- Пациентам с МДС с изолированной делецией длинного плеча хромосомы 5 (МДС-5q) при невозможности проведения или неэффективности терапии ЭПСП рекомендуется проведение терапии леналидомидом** с целью достижения полной клинико-гематологической и цитогенетической ремиссии, или любого другого положительного ответа [56, 91]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: в ходе проведения исследований была доказана высокая эффективность леналидомида** у пациентов с МДС с del(5q). Механизм действия препарата при МДС объясняется прямым цитостатическим воздействием на патологический клон клеток с del(5q) и стимулирующим эффектом в отношении нормальных эритроидных клеток КМ. Независимость от гемотрансфузий ЭСКДК была документирована в 61 и 70% случаев (p > 0,05). Медиана времени до достижения ответа составила 4 - 6 недель. У пациентов с МДС без del(5q) эффективность несколько ниже - 25 - 27% случаев.
Применение леналидомида** наиболее оправдано у трансфузионнозависимых пациентов с МДС с del(5q) (и дополнительной одной благоприятной поломкой, кроме аберраций 3 и 7 хромосом) или увеличением числа бластных клеток менее 10% из группы низкого или промежуточного-1 риска по IPSS, которые не являются кандидатами на терапию другими антианемическими препаратами (ЭПСП) или не получили эффекта от их применения. Леналидомид** назначается в дозе 10 мг внутрь в 1 - 21 дни, каждые 28 дней. При развитии гематологической или негематологической токсичности целесообразно снижение дозы до 5 мг/сут или 10 мг через день, в такой дозе возможен постоянный прием без перерыва. Оптимальная продолжительность терапии леналидомидом** не определена, но, по всей видимости, должна быть ограничена временем повышения показателей гемоглобина до верхней границы нормы, до момента начала прогрессирования или 24 месяцев общей продолжительности лечения в случае сохраняющегося ответа. В настоящее время, вопросы отмены леналидомида** при достижении стойкого гематологического и полного цитогенетического ответа должны рассматриваться индивидуально.
До начала терапии леналидомидом** целесообразно исследовать мутации в гене ТР53, так как при их наличии отмечена более короткая продолжительность положительного ответа и высокая вероятность прогрессии в ОМЛ.
- Пациентам с МДС из группы низкого и промежуточного 1 риска по IPSS, или очень низкого, низкого и промежуточного (< 3,5 баллов) риска по IPSS-R, в отсутствии неблагоприятных аномалий кариотипа при неэффективности терапии ЭПСП рекомендуется проведение терапии леналидомидом** в дозе 10 мг, внутрь, с 1 по 21 дни, каждые 28 дней, с оценкой эффекта после 4 курсов терапии, с целью достижения полной клинико-гематологической ремиссии, или любого другого положительного ответа в монорежиме или в сочетании с ЭПСП в стандартных дозах [81, 82]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: при неэффективности ЭПСП леналидомид** обеспечивает независимость от гемотрансфузий ЭСКДК в 20 - 30% случаев, а сочетанное применение ЭПСП в стандартных дозах с леналидомидом** позволяют повысить эффективность до 39 - 46%. По результатам рандомизированного исследования III фазы с участием 131 пациента с МДС без делеции 5q, из группы низкого риска, рефрактерных к ЭПСП и зависимыми от переливаний ЭСКДК эритроидный ответ был получен при монотерапии леналидомидом** в суточной дозе 10 мг внутрь, с 1 по 21 дни, каждые 28 дней после 4 циклов терапии в 23,1% случаев и на комбинированной терапии леналидомидом** в той же дозе в сочетании с ЭПСП (#эпоэтин бета** - 60 000 МЕ/неделю) в 39,4% (p = 0,044). Медиана продолжительности ответа составила 18,1 и 15,1 месяца, соответственно (p = 0,47). Побочные эффекты были схожими в обеих группах. Низкий уровень ЭПО в сыворотке крови является предиктором достижения эритроидного ответа. Аналогичное КИ III фазы эффективности леналидомида в монорежиме в сравнении с комбинированной терапией леналидомида в сочетании с #эпоэтином альфа** в течение 16 недель продемонстрировал сопоставимые показатели эффективности - 32,3% и 46,5%, соответственно. Терапию леналидомидом** целесообразно проводить при абсолютном количестве нейтрофилов > 0,5 x 109/л и тромбоцитов > 50 x 109/л.
- Пациентам с МДС/МПН: ХММЛ-0 или МДС/МПН с кольцевыми сидеробластами и тромбоцитозом при наличии трансфузионной зависимости от ЭСКДК и отсутствии эффекта, или невозможности назначения ЭПСП рекомендуется назначение #леналидомида** в суточной дозе 10 мг, внутрь с 1 по 21 дни, каждые 28 дней [128 - 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: назначение #леналидомида** пациентам с МДС/МПН-КС-Т при наличии трансфузионно-зависимой анемии привело к гематологическому улучшению в 42 - 50% случаев, с медианой продолжительности ответа 10 - 11 мес. [128, 130].
- Пациентам с МДС-ИБ или МДС без ИБ с неблагоприятными аномалиями кариотипа, которые при стратификации отнесены к группе промежуточного-2 и высокого риска по шкале IPSS или к группе промежуточного (> 3,5 баллов), высокого и очень высокого риска по шкале IPSS-R (см. раздел 7.1 данных рекомендаций), с ХММЛ-1, ХММЛ-2, аХМЛ, МДС/МПН-неклассифицированном, а также пациентам МДС из группы низкого риска при неэффективности первой и второй линий терапии, для достижения ремиссии или другого положительного ответа рекомендуется проведение терапии аналогами пиримидина - азацитидином** или децитабином [92 - 96, 131 - 134].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: азацитидин** и децитабин относятся к оригинальному классу аналогов пиримидина - гипометилирующих агентов или ингибиторов ДНК-метилтрансферазы, фермента, отвечающего за метилирование вновь синтезируемой ДНК.
В свете отсутствия прямых сравнительных исследований между азацитидином** и децитабином невозможно сделать окончательный вывод о преимуществе того или другого препарата.
Азацитидин** назначают в нескольких режимах:
- Азацитидин** - 75 мг/м2 подкожно 1 раз в сутки 1 - 7 дни каждые 28 дней или
- #Азацитидин** - 75 мг/м2 подкожно 1 раз в сутки 5 - 2 - 2 (препарат вводится 1 - 5-й и 8 - 9 дни курса, 6-й и 7-й дни - перерыв) каждые 28 дней [131] - этот режим можно использовать при лечении в дневном стационаре при невозможности введения препарата в выходные дни, в таком случае начинать курс целесообразно с понедельника, или
- #Азацитидин** - 75 мг/м2 подкожно 1 раз в сутки в 1 - 5 дни каждые 28 дней [96] или
- #Азацитидин** - 75 мг/м2 подкожно 1 раз в сутки в 1 - 3 дни каждые 28 дней [131].
Применение #азацитидина** в трехдневном режиме предпочтительно для пациентов с МДС из группы низкого риска, при отсутствии эффекта от терапии 1 и 2 линии, а также возможно при проведении поддерживающей терапии с учетом выявленной гематологической токсичности.
Наиболее предпочтительным является 7-дневный курс терапии азацитидином**.
При отсутствии прогрессии заболевания эффективность терапии необходимо оценивать после 4 - 6 курса (количество рекомендуемых курсов - минимум 6). При положительном ответе (полная, частичная или костномозговая ремиссия, гематологическое улучшение) терапию следует продолжить до момента развития выраженной гипоплазии (аплазии) кроветворения, как проявления гематологической токсичности или прогрессии заболевания. При не достижении клинически значимого гематологического ответа или развитии прогрессии МДС показана смена тактики терапии.
Децитабин можно использовать в нескольких режимах:
- Децитабин - 20 мг/м2 в виде 60-минутной инфузии 1 раз в день в 1 - 5 дни каждые 28 дней или
- Децитабин - 15 мг/м2 3 раза в день в виде 3 часов внутривенной инфузии в 1 - 3 дни, каждые 6 недель или
- #Децитабин - 20 мг/м2 в виде 60-минутной инфузии 1 раз в день в 1 - 3 дни каждые 28 дней. [131]
При отсутствии прогрессии заболевания эффективность терапии следует оценивать после 4 курсов (количество рекомендуемых курсов децитабина - минимум 4). При положительном ответе (полная, частичная или костномозговая ремиссия, гематологическое улучшение) терапию следует продолжить до момента развития выраженной гипоплазии кроветворения, как проявления гематологической токсичности или прогрессии заболевания. Трехдневный режим введения #децитабина предпочтительнее для пациентов с МДС из группы низкого риска, при отсутствии эффекта от терапии 1 и 2 линии, а также при проведении поддерживающей терапии при выявленной гематологической токсичности.
Вопрос о сроках окончания длительной терапии аналогами пиримидина без выполнения алло-ТКМ до сих пор не решен и находится на стадии обсуждения в международном гематологическом сообществе.
У пациентов с ХММЛ-1 и ХММЛ-2 из группы промежуточного-2 и высокого риска, аХМЛ, МДС/МПН-КСТ и МДС/МПН-неклассифицированным азацитидин** и децитабин продемонстрировали эффективность в 17 - 70% случаев, с достижением полных ремиссий в 7 - 45%. Наилучшие результаты были продемонстрированы при наличии мутаций в гене TET2, в отсутствии мутаций в гене ASXL1. При ХММЛ эффективность в виде достижения полных ремиссий на децитабине была несколько выше, чем на азацитидине**, 23% vs 10%, и наилучшие результаты на терапии децитабином были получены при ХММЛ-МД, чем при ХММЛ-МН. [131, 132, 133, 134]
Режимы введения азацитидина** и децитабина одинаковые при МДС и МДС/МПН.
- Пациентам МДС с избытком бластов из группы высокого и очень высокого риска по IPSS-R при наличии неблагоприятных аномалий кариотипа, ХММЛ-2 с неблагоприятными аномалиями кариотипа из группы промежуточного-2 и высокого риска по CPSS, аХМЛ и МДС/МПН-н с количеством бластов > 10% наличием неблагоприятных аномалий кариотипа в качестве индукционной терапии или при неэффективности 1 линии терапии или при развитии рецидива рекомендуется проведение терапии азацитидином** в сочетании с другим противоопухолевым препаратом: #венетоклаксом** [135, 136, 138, 139, 144].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: высокая эффективность при лечении ОМЛ комбинации #венетоклакса** (ингибитора bcl-2) с азацитидином**, привела к изучению данной комбинации у пациентов с МДС и МДС/МПН, которая позволила повысить эффективность до 87%, с достижением ПР в 35% случаев (азацитидин** и #венетоклакс**), что особенно важно для пациентов МДС из группы высокого риска и МДС/МПН, которым планируется выполнение алло-ТКМ.
Рекомендуемые схемы терапии:
#Венетоклакс**, внутрь, 1 день - 100 мг, 2 день - 200 мг, 3 - 14 дни - 400 мг, каждые 28 дней в сочетании с:
Азацитидин** 75 мг/м2, подкожно, 1 - 7 дни, каждые 28 дней или
#Азацитидин** 75 мг/м2, подкожно, 1 - 5 дни, каждые 28 дней или
При МДС/МПН 1-ый курс целесообразно начинать при количестве лейкоцитов < 10 - 20 x 109/л с эскалацией дозы #венетоклакса**.
#Венетоклакс** метаболизируется преимущественно под действием изоферментов цитохрома P450 семейства IIIA (CYP3A). При сочетанном приеме #венетоклакса** и умеренных и мощных ингибиторов CYP3A необходимо коррекция дозы препарата, в соответствии инструкции.
При развитии тяжелой нейтропении и инфекционных осложнений доза и продолжительность приема #венетоклакса** могут быть редуцированы.
- Пациентам МДС с избытком бластов из группы высокого и очень высокого риска по IPSS-R при наличии неблагоприятных аномалий кариотипа, ХММЛ-2 с неблагоприятными аномалиями кариотипа из группы промежуточного-2 и высокого риска по CPSS в качестве индукционной терапии или при неэффективности 1 линии терапии или при развитии рецидива рекомендуется проведение терапии децитабином в сочетании с другим противоопухолевым препаратом: #венетоклаксом** [136, 144].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: высокая эффективность при лечении ОМЛ комбинации #венетоклакса** (ингибитора bcl-2 (L01XX Прочие противоопухолевые препараты)) с децитабином привела к изучению данной комбинации у пациентов с МДС и МДС/МПН, которая позволила повысить эффективность до 74%, с достижением ПР в 47% случаев, что особенно важно для пациентов МДС из группы высокого риска и ХММЛ-2, которым планируется выполнение алло-ТКМ.
Рекомендуемые схемы терапии:
#Венетоклакс**, внутрь, 1 день - 100 мг, 2 день - 200 мг, 3 - 14 дни - 400 мг, каждые 28 дней в сочетании с:
Децитабин 20 мг/м2, внутривенно, 1 - 5 дни, каждые 28 дней или
При МДС/МПН 1-ый курс целесообразно начинать при количестве лейкоцитов < 10 - 20 x 109/л с эскалацией дозы #венетоклакса**.
При развитии тяжелой нейтропении и инфекционных осложнений дозы и продолжительность приема #венетоклакса** могут быть редуцированы.
- Пациентам МДС с избытком бластов из группы высокого и очень высокого риска по IPSS-R при наличии неблагоприятных аномалий кариотипа, ХММЛ-2 с неблагоприятными аномалиями кариотипа из группы промежуточного-2 и высокого риска по CPSS, с наличием неблагоприятных аномалий кариотипа в качестве индукционной терапии или при неэффективности 1 линии терапии или при развитии рецидива рекомендуется проведение терапии #цитарабином** в малых дозах в сочетании с другим противоопухолевым препаратом: #венетоклаксом** [140, 165].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: высокая эффективность при лечении ОМЛ комбинации #венетоклакса** (ингибитора bcl-2 (L01XX Прочие противоопухолевые препараты)) с #цитарабином** в малых дозах достигла 67%, при том, что треть пациентов была после терапии гипометилирующими препаратами на предыдущих этапах лечения МДС-ИБ из группы высокого риска. Учитывая этот факт, сообщество экспертов считает целесообразным рекомендовать для пациентов МДС-ИБ2 и ХММЛ-2 с неблагоприятными аномалиями кариотипа, а также при резистентности к проводимой терапии назначение комбинации #венетоклакса** (ингибитора bcl-2 (L01XX Прочие противоопухолевые препараты)) с #цитарабином** в малых дозах, с продолжительностью приема #венетоклакса** в течение 14 дней, по аналогии с курсами комбинированной терапии с гипометилирующими препаратами.
Рекомендуемые схемы терапии:
#Венетоклакс**, внутрь, 1 день - 100 мг, 2 день - 200 мг, 3 день 400 мг, 4 - 14 дни - 600 мг, каждые 28 дней в сочетании с:
#Цитарабин** 20 мг/м2, 1 раз в день, подкожно, 1 - 10 дни, каждые 28 дней или
#Цитарабин**, 10 мг/м2 x 2 раза в день, подкожно, 1 - 10 дни, каждые 28 дней. [140, 165, 166].
В настоящее время проводится дальнейшее изучение эффективности #венетоклакса** при МДС в различных комбинациях.
#Венетоклакс** метаболизируется преимущественно под действием изоферментов цитохрома P450 семейства IIIA (CYP3A). При сочетанном приеме #венетоклакса** и умеренных и мощных ингибиторов CYP3A необходимо коррекция дозы препарата, в соответствии инструкции.
При развитии тяжелой нейтропении и инфекционных осложнений дозы и продолжительность введения #цитарабина** и приема #венетоклакса** могут быть редуцированы.
- Пациентам с МДС из группы промежуточного-2 и высокого риска по шкале IPSS и из группы промежуточного, высокого и очень высокого риска по шкале IPSS-R, пациентам с МДС/МПН: ХММЛ-2 с неблагоприятными аномалиями кариотипа, аХМЛ и МДС/МПН-н с бластными клетками от 10% до 19% в качестве индукционной терапии при неэффективности низкодозной или стандартной ХТ при прогрессии МДС рекомендуется проведение курса #цитарабина** в малых дозах и #идарубицина** с гипометилирующим праймингом децитабина или азацитидина** (Dac-Ida-AraC Aza-Ida-AraC) с целью достижения положительного ответа, в том числе и полной клинико-гематологической ремиссии [97, 98, 156].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: проведение ПХТ по программам лечения ОЛ у пациентов с МДС сопровождается умеренной эффективностью, длительными миелотоксическими агранулоцитозами, высокой ранней летальностью (~ 20%) и небольшой продолжительностью ремиссии. Гипометилирующий прайминг перед курсом малых доз #цитарабина** и #идарубицина** увеличивает апоптоз в опухолевых клетках и приводит к увеличению цитотоксического эффекта на лейкемические клетки. Вероятность достижения ПР у пациентов с МДС из группы неблагоприятного риска составляет 40 - 60%, при невысокой ранней летальности.
В ФГБУ "НМИЦ гематологии" МЗ РФ разработан и внедрен в клиническую практику курс Aza/Dac-Ida-AraC: #азацитидин** 75 мг/м2 подкожно 1 раз в день или децитабин 20 мг/м2 внутривенно 1 раз в день 1 - 3 дни, #цитарабин** 10 мг/м2 2 раза в день подкожно 4 - 17 дни, #идарубицин** 3 мг/м2 внутривенно 1 раз в день 4 - 10 дни. [156]. При развитии аплазии кроветворения, тяжелых инфекционных или геморрагических осложнений возможно укорочение курса до 10 дней общей продолжительности (#цитарабин** вводится в течение 7 дней в 4 - 10 дни, #идарубицин** в течение 5 дней - 3 - 8 дни) [156].
Оценка эффекта при отсутствии прогрессии заболевания осуществляется после 2-го курса терапии через 28 - 35 дней после окончания курса. При достижении ПР проводят 2 курса консолидации КМР по той же схеме. Пациентам, у которых нет противопоказаний для выполнения алло-ТКМ и есть HLA-совместимый донор, необходимо как можно раньше выполнять алло-ТКМ
При невозможности выполнения алло-ТКМ поддерживающую терапию Aza/Dac-AraC проводят в течение 2 лет (см. Приложение А3.1) [99, 156].
- Пациентам с МДС-ИБ при нормальном кариотипе или одиночных аномалиях из группы благоприятного или промежуточного риска, а также пациентам с ХММЛ-1, ХММЛ-2, аХМЛ, МДС/МПН-н рекомендуется с лечебной целью проведение курса малых доз #цитарабина** (МДЦ) [100, 141, 157, 168].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: лечение #цитарабином** в малых дозах МДС и ХММЛ за пределами РФ проводят в течение 14 дней. В РФ данная терапия часто используется у пациентов с МДС-ИБ-1 и ИБ-2, ХММЛ при нормо- или гиперклеточном КМ. Общепринятым в РФ режимом использования МДЦ является назначение препарата в дозе 10 мг/м2 2 раза в день подкожно в течение 28 дней (21 - при развитии нейтропении и невозможности продолжения терапии) [168]. Вероятность достижения ПР у пациентов с РАИБ-2 существенно выше, если длительность курса была не менее 23 дней. Обнаружение, по данным патолого-анатомического исследования биопсийного (операционного) материала КМ, сниженной клеточности костного мозга поможет скорректировать выбор терапевтического подхода: длительность терапии МДЦ может быть уменьшена до 10 - 14 дней (и доза #цитарабина** может быть редуцирована до 10 мг 2 раза в день) Интервалы между циклами составляют 28 - 30 дней, а терапия проводится вплоть до прогрессирования или появления признаков неприемлемой токсичности, но не более 3 лет. При проведении 10 - 14-дневных курсов их повторяют каждые 28 - 35 дней. Применение МДЦ наиболее целесообразно у пациентов с нормальным кариотипом или с благоприятными аберрациями [1, 92, 100]. Терапия #цитарабином** в различных дозах и продолжительностью является базисом для добавления других противоопухолевых препаратов.
- Пациентам с МДС-ИБ-2 при невозможности проведения терапии аналогами пиримидина (азацитидином**, децитабином) в возрасте моложе 60 лет рекомендуется проведение курса индукционной терапии по программам "7+3", применяемых при лечении ОМЛ с использованием сочетаний следующих препаратов: #цитарабин**, #даунорубицин**, #идарубицин**, #митоксантрон** (см. Приложение А3.1, а также см. профильные рекомендации по лечению ОМЛ) [1 - 5, 101, 158 - 160, 164].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: терапию МДС-ИБ2 по программам лечения ОМЛ рассматривают для молодых пациентов, преимущественно с нормальным кариотипом, при невозможности проведения гипометилирующей терапии, в качестве подготовки для выполнения алло-ТКМ. Если алло-ТКМ не выполнена, то дальнейшая терапия реализуется по протоколу лечения ОМЛ [164].
- Пациентам с МДС/МПН при прогрессирующем лейкоцитозе > 30 x 109/л, анемии < 100 г/л, тромбоцитопении < 100 x 109/л, увеличении в костном мозге бластных клеток > 5%, спленомегалии (пальпируемая селезенка +5 см из-под края реберной дуги) или гепатоспленомегалии, наличии экстрамедуллярного поражения (кожа, плевральный или перикардиальный выпот, увеличении лимфатических узлов), наличии В-симптомов (потеря веса, повышение температуры тела), особенно у пациентов старше 70 лет, или при гиперлейкоцитозе, в качестве подготовки к началу противоопухолевой терапии, с целью снижения количества лейкоцитов рекомендуется #гидроксикарбамид** [142, 143].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: #гидроксикарбамид** назначают в дозе 1000 мг/сут. под контролем показателей гемограммы, при отсутствии ответа в течение 2 недель, доза увеличивается до 2000 мг, с возможной дальнейшей эскалацией для поддержания количества лейкоцитов в пределах 10 x 109/л. #Гидрокискарбамид** преимущественно назначают пациентам с миелопролиферативным ХММЛ. На фоне приема препарата может быть усугубление анемии и тромбоцитопении, что требует проведения гемотрансфузий и подбора дозы.
- Пациентам с МДС-ИБ при нормальном кариотипе и гипоплазии кроветворения при невозможности проведения программной (курсовой) противоопухолевой терапии рекомендуется проведение терапии #мелфаланом** - 2 мг/день для достижения положительного ответа, в том числе и полной ремиссии. [102, 103]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: использование малых доз #мелфалана** было исследовано в двух проспективных когортных исследованиях, которые суммарно включали 29 пациентов с МДС высокого риска. Общий ответ при этом составил 38 - 40%, отмечалась минимальная токсичность. Вероятность ответа на терапию была самой высокой у пациентов с гипоклеточным КМ, избытком бластов и нормальным кариотипом.
- Пациентам с МДС-ИБ, пациентам с ХММЛ, аХМЛ, МДС/ МПН-н при невозможности проведения терапии азацитидином**, децитабином, при резистентном течении к #гидроксикарбамиду** или рецидиве рекомендуется проведение терапии #меркаптопурином** [1, 2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: у пациентов с МДС, протекающим с увеличением количества бластных клеток, возможно осуществление терапии #меркаптопурином**. Препарат назначают в дозе 60 мг/м2 внутрь за 2 приема в постоянном режиме с коррекцией дозы или отменой при развитии глубокой цитопении. При снижении числа лейкоцитов менее 3,0 x 109/л доза препарата снижается на 25%, менее 2,0 x 109/л - на 50%, а при падении до уровня менее 1,5 x 109/л отменяется до восстановления показателей, когда лечение можно будет возобновить. Терапия #меркаптопурином**, как правило, рассматривается исключительно в качестве паллиативного подхода и может назначаться в меньшей дозировке [1, 2].
У пациентов с МДС/МПН, в частности при ХММЛ, аХМЛ, МДС/МПН-н при резистентном течении или при развитии рецидива возможно проведение терапии #меркаптопурином** для поддержания количества лейкоцитов в пределах 5 - 10 x 109/л.
- Пациентам с МДС из группы промежуточного-1 риска, при наличии неблагоприятных аномалий кариотипа, промежуточного-2 или высокого риска по шкале IPSS или из группы промежуточного, высокого и очень высокого риска по шкале IPSS-R (см. раздел 7.1 данных рекомендаций), пациентам МДС/МПН: ХММЛ из группы промежуточного 2 и высокого риска по шкале CPSS или CPSS-мол., аХМЛ, МДС/МПН-н в возрасте < 60 - 65 лет, при отсутствии тяжелых сопутствующих заболеваний, а также пациентам с МДС без избытка бластов из группы промежуточного-1 риска по шкале IPSS и промежуточного риска по шкале IPSS-R моложе 40 - 50 лет, резистентным к проводимой терапии, с выраженной зависимостью от гемотрансфузий рекомендуется проведение алло-ТКМ с целью достижения полного биологического излечения [104].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: рекомендации по проведению алло-ТКМ у пациентов с МДС опираются на проспективные рандомизированные и нерандомизированные, а также групповые КИ. По данным Международного регистра по трансплантации костного мозга (IBMTR), основанном на анализе результатов лечения 387 взрослых пациентов с МДС, которым была выполнена алло-ТКМ от HLA-идентичного сиблинга, кумулятивная смертность, связанная с трансплантацией, составила 32% в течение 1 года и 37% в течение 3 лет, кумулятивная частота рецидивов 17% и 23%, ОВ - 53% и 40% соответственно. Количество бластных клеток в КМ и риск по IPSS показали обратную зависимость с безрецидивной выживаемостью после трансплантации. Выживаемость без прогрессирования у пациентов из группы низкого или промежуточного-1 риска по шкале IPSS в течение 5 лет составила 60%, промежуточного-2 - 36 - 44% и высокого риска - 28 - 30%.
Оптимальные сроки для выполнения алло-ТКМ от HLA-совместимого донора при МДС определены в анализе клинических решений IBMTR. В этом исследовании было показано, что продолжительность жизни у пациентов из группы низкого или промежуточного-1 риска по шкале IPSS была выше, когда ТКМ была отсрочена во времени, но выполнялась до трансформации в ОМЛ. Напротив, для пациентов из групп промежуточного-2 и высокого риска именно немедленная ТКМ существенно улучшает показатели выживаемости. Привлечение неродственного донора в случае отсутствия совместимого по системе HLA родственного донора не приводит к увеличению летальности.
Риск заболевания в соответствии с IPSS, возраст и наличие сопутствующей патологии, оцененные по индексу коморбидности ТКМ (HCT-CI - см. Приложение Г3 [105]) являются наиболее значимыми клиническими данными при рассмотрении вопроса о проведении пациенту алло-ТКМ
При МДС/МПН (ХММЛ-1 или ХММЛ-2 из группы промежуточного-2 или высокого риска по CPSS или CPSS-мол), аХМЛ, МДС/МПН-н с количеством бластных клеток более 5% и с неблагоприятными аномалиями кариотипа эффективность алло-ТКМ в виде 3-х летней выживаемости составляет 30 - 48%
Проведение алло-ТКМ должно быть совместным решением врача, пациента и его семьи, поскольку их отношение к риску является определяющим.
3.2. Сопроводительная терапия
- Всем пациентам с МДС при проведении ХТ рекомендуется с целью профилактики тошноты и рвоты введение противорвотных препаратов [106, 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Всем пациентам с МДС при проведении индукционных курсов ХТ для лечения гиперурикемии рекомендуется прием аллопуринола** [107, 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с МДС при развитии фебрильной нейтропении или инфекционно-воспалительных заболеваний, в сочетании с лейкопенией (инфекции верхних и нижних дыхательных путей, сепсис, септицемия, инфекции мочевыводящих путей, инфекции кожи и мягких тканей и др.) рекомендуется использовать в качестве первой линии антибактериальных препаратов системного действия пиперациллин + тазобактам, цефепим**, цефтазидим** для купирования инфекционных осложнений [108, 109, 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при неэффективности антимикробной терапии 1 линии ее модификацию необходимо проводить с учетом данных проведенного обследования (компьютерная томография органов грудной полости, микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование мочи на бактериальные патогены с применением автоматизированного посева и т.д.). Назначение карбапенемов в качестве антибактериальных препаратов системного действия первого этапа при фебрильной нейтропении обосновано у пациентов с септическим шоком, а также в клиниках, где в этиологии инфекций преобладают энтеробактерии с продукцией бета-лактамаз расширенного спектра (БЛРС).
- Всем пациентам с МДС при проведении курса #АТГ** рекомендуется профилактический прием антибактериальных и противогрибковых препаратов системного действия [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Всем пациентам с МДС с 5q- с тромбоцитами > 200 x 109/л при проведении иммуномодулирующей терапии леналидомидом** рекомендуется проведение антиагрегантной терапии в связи с возможным развитием тромботических осложнений [111].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: при указании на наличие тромбозов в анамнезе целесообразно добавление антикоагулянтной терапии. При проведении иммуномодулирующей терапии тромботические осложнения могут развиваться не только в начале терапии при тромбоцитозах, но и при повышении гемоглобина до нормальных значений.
- Всем пациентам МДС перед выполнением гемотрансфузии компонентов донорской крови с целью профилактики цитратных и других реакций рекомендуется введение #глюконата кальция**, при необходимости антигистаминные средства системного действия [153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с МДС, у которых выявлены признаки аллосенсибилизации, рекомендуется переливать концентраты тромбоцитов по индивидуальному подбору для повышения эффективности трансфузий [112, 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: преодоление аллосенсибилизации у пациентов с МДС требует комплексного подхода, который помимо индивидуального подбора тромбоцитов включает в себя выполнение лечебных плазмаферезов (4 - 5 сеансов с замещением альбумином) с последующей трансфузией больших доз концентрата тромбоцитов (12 - 16 доз).
- Всем пациентам с МДС, состояние которых препятствует достаточному естественному питанию, рекомендуется обеспечение энергетическими и пластическими субстратами за счет энтерального и/или парентерального питания [113, 114, 153]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: недостаточность питания - отягощающий фактор при проведении цитостатической терапии и алло-ТКМ Общая суточная энергетическая емкость энтерального питания и парентерального питания у пациентов старше 18 лет рассчитывается на идеальную массу тела, в том числе при наличии ожирения, согласно уравнению Харриса-Бенедикта (25 - 30 ккал/кг, белок 1,2 - 1,5 г/кг/сут), а также с учетом коэффициентов, повышающих или понижающих энергетические потребности организма, например при реакции "трансплантат против хозяина" (РТПХ) кишечника - белок 1,5 - 2,0 г/кг/сут и количества естественного питания. Критерием отмены нутриционной терапии является восстановление естественного питания более 60% от необходимых суточных потребностей в течение 3-х последовательных дней.
3.3. Хирургическое лечение
- Пациентам с МДС из группы низкого риска (см. раздел 7.1 данных рекомендаций) с гипоплазией кроветворения при отсутствии эффекта от ИСТ или пациентам с признаками аутоиммунной анемии или тромбоцитопении в сочетании с МДС, или пациентам МДС с увеличенными размерами селезенки с лечебно-диагностической целью рекомендуется выполнение спленэктомии [1, 116].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: спленэктомия у пациентов с МДС в странах ЕС применяется редко, в основном у пациентов с глубокой тромбоцитопенией. В РФ накоплен опыт выполнения спленэктомии у 33 пациентов с МДС. Чаще операция проводилась при гипоплазии кроветворения по данным гистологического исследования КМ (75%). В 16 (48%) случаях до спленэктомии проводилась комбинированная ИСТ. В 6 (18%) случаях документировано увеличение размеров селезенки более 15 x 8 см. Как эффект от проведения спленэктомии у 16 (48%) пациентов отмечено снижение зависимости от гемотрансфузий.
Спленэктомию желательно выполнять лапароскопическим доступом.
- Пациентам с МДС/МПН: ХММЛ из группы низкого и промежуточного 1 риска по шкале CPSS или CPSS-мол. (см. раздел 7.1 данных рекомендаций), со спленомегалией, наличием признаков инфаркта селезенки или цитопении, ограничивающей проведение химиотерапии или иммунного генеза, а также перед проведением алло-ТКМ при размерах от 20 см и более из-под реберной дуги с лечебной целью рекомендуется выполнение спленэктомии [152].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: спленэктомия у пациентов с МДС/МПН может сопровождаться развитием кровотечений, тромбозов и инфекционными осложнениями в периоперационном периоде. Спленэктомию желательно выполнять лапароскопическим доступом.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам с МДС рекомендуется проведение медицинской реабилитации, которая включает в себя эффективную обезболивающую терапию, нутритивную поддержку, обеспечение психологического благополучия и максимально возможное физическое функционирование на всех этапах лечения и поддерживающей терапии [117].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: медицинская реабилитация при лечении пациентов с МДС является частью поддерживающей терапии, направленной на уменьшение осложнений, максимальное обеспечение физических, эмоциональных и социальных потребностей, улучшение качества жизни пациентов и членов их семей. Принципы реабилитации должны быть основаны на Международной классификации функционирования, ограничений жизнедеятельности и здоровья (МКФ), разработанной ВОЗ в 2002 году. Главные условия включают работу мультидисциплинарной бригады (МДБ), раннее начало, пациент-ориентированный подход, длительное наблюдение и преемственность по месту жительства пациента. В состав МДБ при работе с пациентами, страдающими МДС, входят врач по физической реабилитационной медицине, врач-гематолог, клинический психолог, инструктор-методист по лечебной физкультуре;, специалист по эргореабилитации (эргоспециалист), медицинская сестра, родственники пациента и сам пациент. В результате диагностики нарушений структур и функций организма, ограничений активности и участия пациента, а также оценки факторов окружающей среды и персональных факторов пациента, выставляется реабилитационный диагноз, определяется потенциал и разрабатывается индивидуальный план реабилитации пациента, основываясь на краткосрочные и долгосрочные цели реабилитации.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Всем пациентам с МДС рекомендуется постоянное динамическое наблюдение у гематолога в течение всей жизни [1, 118].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: график диспансерного наблюдения не отработан, устанавливается индивидуально каждым врачом для каждого пациента в зависимости от варианта МДС, возраста пациента и наличия сопутствующей патологии.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.12.2023) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
- в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
- в соответствии с порядком оказания помощи по профилю "гематология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
- на основе настоящих клинических рекомендаций;
- с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у больного миелодиспластического синдрома (МДС) или миелодиспластического/миелопролиферативного новообразования (МДС/МПН) или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), различные врачи-специалисты (врач-кардиолог, врач-гастроэнтеролог, врач-хирург и др.), средние медицинские работники в установленном порядке направляют больного на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь больным с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении МДС или МДС/МПН, или подозрении на него в ходе оказания скорой медицинской помощи больного переводят или направляют в медицинские организации, оказывающие медицинскую помощь больным с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь больным МДС или МДС/МПН, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь больным МДС или МДС/МПН, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости - с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию больного.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю "онкология" определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации
1. Обследование с целью верификации диагноза МДС или МДС/МПН у пациента с подозрением на МДС или МДС/МПН, при невозможности обследования в амбулаторных условиях.
2. Диагностика рецидива МДС или МДС/МПН, усугубления аплазии кроветворения или трансформации в ОЛ.
3. Проведение очередного курса ИСТ или ХТ в условиях круглосуточного либо дневного стационара.
4. Выполнение плановых хирургических вмешательств.
5. Выполнение плановых экстракорпоральных методов очищения крови и заместительной почечной терапии.
6. Проведение запланированной алло-ТКМ
7. Проведение заместительной гемокомпонентной терапии.
Показания для экстренной госпитализации
Неотложные состояния у пациентов с МДС или МДС/МПН, а также при подозрении на МДС или МДС/МПН:
- фебрильная лихорадка и инфекционные осложнения на фоне нейтропении после курса ХТ или на фоне ИМТ или ИСТ;
- геморрагический синдром;
- тромботические осложнения;
- необходимость проведения экстренной гемотрансфузии;
- для больных МДС/МПН гиперлейкоцитоз от 100 x 109/л и более;
- другие системные нарушения, обусловленные течением основного заболевания или осложнениями, развившимися вследствие проведенного лечения.
Показания к выписке пациента из стационара
1. Восстановление показателей периферической крови (лейкоциты более 1 x 109/л, гранулоциты более 0,5 x 109/л, тромбоциты более 30 - 50 x 109/л, гемоглобин более 80 г/л) после очередного курса ХТ, ИМТ или ИСТ.
2. Нормотермия в течение 3 - 5 суток и отсутствие неконтролируемых инфекционных осложнений.
3. Купирование геморрагических осложнений.
4. Купирование тромботических осложнений.
5. Купирование системных нарушений, обусловленных течением основного заболевания или осложнениями, развившимися вследствие проведенного лечения.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1. Факторы, связанные с болезнью (шкалы прогноза представлены в приложении Г1)
Определение риска, связанного с характеристикой варианта МДС, базируется на использовании прогностических систем оценки, объединяющих отдельные клинические и гематологические параметры. В 1997 г. под эгидой Международной школы анализа рисков миелодисплазии (IMRAW) P. Greenberg и соавторы разработали Международную прогностическую балльную систему (IPSS), учитывающую количество бластов в КМ, цитогенетические аномалии и выраженность периферических цитопений (табл. 1) [63].
Система IPSS оказалась полезной для прогнозирования общей выживаемости и риска трансформации в острый миелолейкоз (ОМЛ) пациентов с МДС, что помогает в принятии клинических решений [63].
Дополнительные факторы, которые также имеют прогностическое значение, в том числе мультилинейная дисплазия, тяжелая анемия с зависимостью от трансфузий, были включены в Прогностическую балльную систему ВОЗ (WPSS), которая позволяет разделить пациентов на 5 групп риска с различными показателями выживаемости и вероятности трансформации в ОМЛ (табл. 2). Эта шкала позволяет более точно определить прогноз отдельных пациентов с МДС, в особенности из групп низкого и промежуточного-1 риска по IPSS [64].
Относительно недавно Международная рабочая группа по прогнозированию МДС, проанализировав отдаленные результаты большого многоцентрового исследования по первичным пациентам с МДС, пересмотрела систему IPSS. В работе было проанализирована прогностическая значимость большого количества даже весьма редких аномалий кариотипа, что позволило классифицировать их на 5 цитогенетических групп риска. В конечном виде пересмотренная прогностическая балльная система (IPSS-R) позволяет классифицировать заболевание на 5 прогностических групп, учитывая кариотип, количество бластных клеток и тяжесть отдельных цитопений (табл. 3) [30].
Новая прогностическая система IPSS-R более совершенна и улучшает стратификацию пациентов. Оценка прогноза может технически быть упрощена с помощью Интернет-калькулятора (http://advanced.ipss-r.com) или бесплатного приложения IPSS-R для смартфонов и планшетных компьютеров.
7.2. Другие факторы
Отдельные параметры, характеризующие соматический статус пациента, могут влиять на естественное течение болезни и принятие терапевтических решений. К ним относятся возраст, сопутствующие заболевания, физические резервы, нутритивный и психический статус пациента.
При выявлении МДС возраст старше 60 лет является независимым неблагоприятным прогностическим фактором. Коррекция на возраст при оценке вероятности долгосрочной выживаемости была предоставлена для большинства прогностических систем. Тем не менее, хронологический возраст может отличаться от биологического, что необходимо учитывать при выборе тактики терапии.
Высокая частота сопутствующих заболеваний - обычное явление у пожилых людей. Одно или несколько сопутствующих заболеваний исходно встречается более чем у половины пациентов с МДС, что оказывает значительное влияние на выживаемость. Болезни сердца - это самые частые сопутствующие заболевания, определяющие коморбидность пациентов с МДС. Сердечно-сосудистые осложнения наиболее выражены у пациентов с тяжелой анемией и трансфузионной зависимостью.
Проблемы, связанные с наличием сопутствующих заболеваний, по-разному проявляются у пациентов с МДС из групп низкого и высокого риска. У пациентов с МДС из группы низкого риска, сопутствующие заболевания влияют на прогноз, непосредственно увеличивая риск смерти, не связанной с трансформацией в ОЛ. И наоборот, у пациентов из группы высокого риска клиническое значение нетяжелой сопутствующей патологии не так велико по сравнению с неблагоприятным прогнозом самого МДС. Однако и у этих пациентов коморбидность влияет на результаты лечения, ограничивая выбор возможных вариантов терапии.
Для прогнозирования влияния сопутствующих заболеваний на конечные результаты лечения у больных МДС наибольший интерес представляет МДС-специфичный индекс коморбидности (MDS-CI), для определения которого необходимо оценить функциональное состояние и/или наличие поражения сердца, печени, почек и легких, активных или излеченных солидных опухолей (Приложение Г3).
По сумме баллов, присвоенных каждому показателю, определяется прогностический вариант MDS-CI: низкий (0), промежуточный (1 - 2) и высокий (3 баллов). Последующее применение индекса коморбидности позволяет стратифицировать пациентов из группы низкого и промежуточного риска (но не высокого и очень высокого) на группы с разной выживаемостью. При прочих равных условиях высокое значение индекса MDS-CI как увеличивает риск смерти от причин, не связанных с трансформацией в ОЛ (HR 2,46; p < 0,001), так и уменьшает показатели ОВ в целом (HR 2,09; p < 0,001).
Таким образом, учет факторов, связанных как с заболеванием, так и с самим пациентом, значительно улучшает прогностическую мощность отдельных моделей, особенно в группах низкого риска [119].
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Выполнен общий (клинический) анализ крови развернутый. Дифференцированный подсчет лейкоцитов (лейкоцитарная формула). Исследование уровня ретикулоцитов в крови. Исследование уровня тромбоцитов в крови. (при установлении диагноза, при лечении и при диспансерном наблюдении)
Да/Нет
2
Выполнен анализ крови биохимический общетерапевтический. Исследование уровня общего белка в крови. Исследование уровня альбумина в крови. Исследование уровня креатинина в крови. Исследование уровня общего билирубина в крови. Исследование уровня свободного и связанного билирубина в крови. Определение активности аланинаминотрансферазы в крови. Определение активности аспартатаминотрансферазы в крови. Определение активности лактатдегидрогеназы в крови. Исследование уровня глюкозы в крови. (при установлении диагноза, при установленном диагнозе в процессе лечения, при диспансерном наблюдении)
Да/Нет
3
Выполнены исследования уровня железа сыворотки крови и исследование уровня ферритина в крови (при установлении диагноза и далее не реже 1 раза в 3 - 6 месяцев)
Да/Нет
4
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) (при установлении диагноза, если не выполнен в амбулаторных условиях)
Да/Нет
5
Выполнено цитологическое исследование мазка костного мозга (миелограмма) или отпечатков трепанобиоптата костного мозга (при установлении диагноза и в процессе лечения в случае, если не выполнено в амбулаторных условиях)
Да/Нет
6
Выполнено определение количества сидеробластов и сидероцитов в костном мозге при количестве бластных клеток менее 5% и эритроидном ростке более 10% (при установлении диагноза)
Да/Нет
7
Выполнено цитогенетическое исследование (кариотип) биопсийного (операционного) материала костного мозга (при установлении диагноза, при прогрессии заболевания и развитии рецидива в случае, если не выполнено в амбулаторных условиях)
Да/Нет
8
Выполнено патолого-анатомическое исследование биопсийного (операционного) материала костного мозга (при установлении диагноза)
Да/Нет
9
Начата специфическая терапия миелодиспластического синдрома (при наличии показаний) или миелодиспластического/миелопролиферативного новообразования
Да/Нет
Список литературы
1. Кохно А.В., Паровичникова Е.Н., Михайлова Е.А. Алгоритмы обследования и протоколы лечения больных с различными формами миелодиспластических. Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под редакцией Е.Н. Паровичниковой. Том 1. - М: Практика, 2024: 551 - 589.
2. Ширин А.Д., Френкель М.А. Миелодиспластические синдромы//Клиническая онкогематология: руководство для врачей. Под ред. Волковой М.А. 2-е изд., перераб. и доп. 2007. P. 502 - 551.
3. Garcia-Manero G. Myelodysplastic syndromes: 2015 Update on diagnosis, risk-stratification and management.//Am. J. Hematol. 2015. Vol. 90, N 9. P. 831 - 841.
4. Malcovati L. et al. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendations from the European LeukemiaNet.//Blood. 2013. Vol. 122, N 17. P. 2943 - 2964.
5. Greenberg P.L. et al. NCCN Clinical Practice Guidelines in Oncology. Myelodysplastic syndromes. Version 3.2024 - July 25, 2024. NCCN.org.
6. Goldberg S.L. et al. Incidence and clinical complications of myelodysplastic syndromes among United States Medicare beneficiaries.//J. Clin. Oncol. 2010. Vol. 28, N 17. P. 2847 - 2852.
7. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. International Agency for Research on Cancer, 2008. 439 p.
8. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Lyon, France: International Agency for Research in Cancer (IARC)/ed. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H T.J. 2017. 585 p.
9. Valent P. et al. Proposed minimal diagnostic criteria for myelodysplastic syndromes (MDS) and potential pre-MDS conditions//Oncotarget. Impact Journals, LLC, 2017. Vol. 8, N 43.
10. Gregg X.T., Reddy V., Prchal J.T. Copper deficiency masquerading as myelodysplastic syndrome.//Blood. 2002. Vol. 100, N 4. P. 1493 - 1495.
11. Irving J.A. et al. Element of caution: a case of reversible cytopenias associated with excessive zinc supplementation.//CMAJ. 2003. Vol. 169, N 2. P. 129 - 131.
12. Greenberg P.L., et al. Cytopenia levels for aiding establishment of the diagnosis of myelodysplastic syndromes Blood 2016; Vol. 128, N 16: Р. 2096 - 2097.
13. Hellstr m-Lindberg E. et al. Erythroid response to treatment with G-CSF plus erythropoietin for the anaemia of patients with myelodysplastic syndromes: proposal for a predictive model.//Br. J. Haematol. 1997. Vol. 99, N 2. P. 344 - 351.
14. Seguier J. et al. Autoimmune diseases in myelodysplastic syndrome favors patients survival: A case control study and literature review.//Autoimmun. Rev. 2019. Vol. 18, N 1. P. 36 - 42.
15. Wang H. et al. Clinical significance of a minor population of paroxysmal nocturnal hemoglobinuria-type cells in bone marrow failure syndrome//Blood. 2002. Vol. 100, N 12. P. 3897 - 3902.
16. Yoshida Y. et al. Co-occurrence of monoclonal gammopathy and myelodysplasia: a retrospective study of fourteen cases.//Int. J. Hematol. 2014. Vol. 99, N 6. P. 721 - 725.
17. Mufti G.J. et al. Immunological abnormalities in myelodysplastic syndromes I. SERUM IMMUNOGLOBULINS AND AUTOANTIBODIES//Br. J. Haematol. 1986. Vol. 63, N 1. P. 143 - 147.
18. De Hollanda A. et al. Systemic and immune manifestations in myelodysplasia: A multicenter retrospective study//Arthritis Care Res. 2011. Vol. 63, N 8. P. 1188 - 1194.
19. Wolach O., Stone R. Autoimmunity and Inflammation in Myelodysplastic Syndromes//Acta Haematol. 2016. Vol. 136, N 2. P. 108 - 117.
20. Means R.T. Pure red cell aplasia/ Hematologt Am Soc hematol Educ Programm. 2016 (1): P. 51 - 56.
21. Hara R. et al. Fetal hemoglobin level predicts lower-risk myelodysplastic syndrome. Int J Hematol. 2023; Vol. 117, N 5: P. 684 - 693.
22. Fong T. et al. Copper deficiency: An important consideration in the differential diagnosis of myelodysplastic syndrome//Haematologica. 2007. Vol. 92, N 10. P. 1429 - 1430.
23. Thakral B., Saluja K., Eldibany M. Zinc-induced copper deficiency: a diagnostic pitfall of myelodysplastic syndrome.//Pathology. 2014. Vol. 46, N 3. P. 246 - 248.
24. Komrokji R.S. et al. Autoimmunne diseases and myelodysplastic syndrome.//Am J Hematol. 2016. Vol. 91, N 5. E. 280 - 3.
25. Bennett J.M., Orazi A. Diagnostic criteria to distinguish hypocellular acute myeloid leukemia from hypocellular myelodysplastic syndromes and aplastic anemia: Recommendations for a standardized approach//Haematologica. 2009. Vol. 94, N 2. P. 264 - 268.
26. Goasguen J.E. et al. Quality control initiative on the evaluation of the dysmegakaryopoiesis in myeloid neoplasms: Difficulties in the assessment of dysplasia.//Leuk. Res. 2016. Vol. 45. P. 75 - 81.
27. Mufti G.J. et al. Diagnosis and classification of myelodysplastic syndrome: International Working Group on Morphology of myelodysplastic syndrome (IWGM-MDS) consensus proposals for the definition and enumeration of myeloblasts and ring sideroblasts.//Haematologica. 2008. Vol. 93, N 11. P. 1712 - 1717.
28. Patnaik M.M., Tefferi A. Refractory anemia with ring sideroblasts and RARS with thrombocytosis.//Am. J. Hematol. 2015. Vol. 90, N 6. P. 549 - 559.
29. Двирнык В.Н., с соав. Цитологическая и цитохимическая диагностика сидеробластных анемий. Гематология и трансфузиология, 2024. 69 (1). Стр. 80 - 88.
30. Greenberg P.L. et al. Revised international prognostic scoring system for myelodysplastic syndromes//Blood. 2012. Vol. 120, N 12. P. 2454 - 2465.
31. Gupta R. et al. Myelodysplastic syndrome with isolated deletion of chromosome 20q: an indolent disease with minimal morphological dysplasia and frequent thrombocytopenic presentation.//Br. J. Haematol. 2007. Vol. 139, N 2. P. 265 - 268.
32. Gyan E., Dreyfus F., Fenaux P. Refractory thrombocytopenia and neutropenia: a diagnostic challenge.//Mediterr. J. Hematol. Infect. Dis. 2015. Vol. 7, N 1. P. e2015018.
33. Mallo M. et al. Impact of adjunct cytogenetic abnormalities for prognostic stratification in patients with myelodysplastic syndrome and deletion 5q.//Leukemia. 2011. Vol. 25, N 1. P. 110 - 120.
34. Olney H.J., Le Beau M.M. Evaluation of recurring cytogenetic abnormalities in the treatment of myelodysplastic syndromes.//Leuk. Res. 2007. Vol. 31, N 4. P. 427 - 434.
35. Rogers H.J. et al. Complex or monosomal karyotype and not blast percentage is associated with poor survival in acute myeloid leukemia and myelodysplastic syndrome patients with inv(3) (q21q26.2)/t(3;3) (q21;q26.2): a Bone Marrow Pathology Group study.//Haematologica. 2014. Vol. 99, N 5. P. 821 - 829.
36. Schanz J. et al. New comprehensive cytogenetic scoring system for MDS and oligoblastic AML after MDS//J. Clin. Oncol. 2012. Vol. 30, N 8. P. 820 - 829.
37. Steensma D.P. et al. Clonal cytogenetic abnormalities in bone marrow specimens without clear morphologic evidence of dysplasia: a form fruste of myelodysplasia?//Leuk. Res. 2003. Vol. 27, N 3. P. 235 - 242.
38. Paulsson K., Johansson B. Trisomy 8 as the sole chromosomal aberration in acute myeloid leukemia and myelodysplastic syndromes.//Pathol. Biol. (Paris). 2007. Vol. 55, N 1. P. 37 - 48.
39. Bigoni R. et al. Multilineage involvement in the 5q-syndrome: a fluorescent in situ hybridization study on bone marrow smears.//Haematologica. 2001. Vol. 86, N 4. P. 375 - 381.
40. Fu B. et al. Bone marrow fibrosis in patients with primary myelodysplastic syndromes has prognostic value using current therapies and new risk stratification systems.//Mod. Pathol. 2014. Vol. 27, N 5. P. 681 - 689.
41. Huang T.C. et al. Comparison of hypoplastic myelodysplastic syndrome (MDS) with normo-/hypercellular MDS by International Prognostic Scoring System, cytogenetic and genetic studies//Leukemia. Nature Publishing Group, 2008. Vol. 22, N 3. P. 544 - 550.
42. Maschek H. et al. Myelofibrosis in primary myelodysplastic syndromes: a retrospective study of 352 patients.//Eur. J. Haematol. 1992. Vol. 48, N 4. P. 208 - 214.
43. Orazi A. Histopathology in the diagnosis and classification of acute myeloid leukemia, myelodysplastic syndromes, and myelodysplastic/myeloproliferative diseases//Pathobiology. 2007. Vol. 74, N 2. P. 97 - 114.
44. Yue G. et al. Hypocellularity in myelodysplastic syndrome is an independent factor which predicts a favorable outcome.//Leuk. Res. 2008. Vol. 32, N 4. P. 553 - 558.
45. Della Porta M.G. et al. Clinical relevance of bone marrow fibrosis and CD34-positive cell clusters in primary myelodysplastic syndromes.//J. Clin. Oncol. 2009. Vol. 27, N 5. P. 754 - 762.
46. Orazi A. et al. Hypoplastic myelodysplastic syndromes can be distinguished from acquired aplastic anemia by CD34 and PCNA immunostaining of bone marrow biopsy specimens.//Am. J. Clin. Pathol. 1997. Vol. 107, N 3. P. 268 - 274.
47. Verburgh E. et al. Additional prognostic value of bone marrow histology in patients subclassified according to the International Prognostic Scoring System for myelodysplastic syndromes.//J. Clin. Oncol. 2003. Vol. 21, N 2. P. 273 - 282.
48. Alhan C. et al. High flow cytometric scores identify adverse prognostic subgroups within the revised international prognostic scoring system for myelodysplastic syndromes.//Br. J. Haematol. 2014. Vol. 167, N 1. P. 100 - 109.
49. Alhan C. et al. Absence of aberrant myeloid progenitors by flow cytometry is associated with favorable response to azacitidine in higher risk myelodysplastic syndromes//Cytom. Part B - Clin. Cytom. Wiley-Liss Inc., 2014. Vol. 86, N 3. P. 207 - 215.
50. Bardet V. et al. Multicentric study underlining the interest of adding CD5, CD7 and CD56 expression assessment to the flow cytometric Ogata score in myelodysplastic syndromes and myelodysplastic/myeloproliferative neoplasms.//Haematologica. 2015. Vol. 100, N 4. P. 472 - 478.
51. Porta M.G.D. et al. Multicenter validation of a reproducible flow cytometric score for the diagnosis of low-grade myelodysplastic syndromes: Results of a European LeukemiaNET study//Haematologica. 2012. Vol. 97, N 8. P. 1209 - 1217.
52. Della Porta M.G. et al. Prognostic significance of reproducible immunophenotypic markers of marrow dysplasia.//Haematologica. 2014. Vol. 99, N 1. P. e8-10.
53. Kern W. et al. Clinical utility of multiparameter flow cytometry in the diagnosis of 1013 patients with suspected myelodysplastic syndrome: correlation to cytomorphology, cytogenetics, and clinical data.//Cancer. 2010. Vol. 116, N 19. P. 4549 - 4563.
54. Haferlach T. et al. Landscape of genetic lesions in 944 patients with myelodysplastic syndromes//Leukemia. 2014. Vol. 28, N 2. P. 241 - 247.
55. Malcovati L. et al. SF3B1 mutation identifies a distinct subset of myelodysplastic syndrome with ring sideroblasts//Blood. American Society of Hematology, 2015. Vol. 126, N 2. P. 233 - 241.
56. List A, Dewald G, Bennett J, et al. Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion. N Engl J Med 2006; 355: P. 1456 - 1465.
57. 57. Ingram W. et al. The JAK2 V617F mutation identifies a subgroup of MDS patients with isolated deletion 5q and a proliferative bone marrow.//Leukemia. 2006. Vol. 20, N 7. P. 1319 - 1321.
58. Malcovati L., Rumi E., Cazzola M. Somatic mutations of calreticulin in myeloproliferative neoplasms and myelodysplastic/myeloproliferative neoplasms//Haematologica. Ferrata Storti Foundation, 2014. Vol. 99, N 11. P. 1650 - 1652.
59. Savage S.A., Walsh M.F. Myelodysplastic Syndrome, Acute Myeloid Leukemia, and Cancer Surveillance in Fanconi Anemia//Hematology/Oncology Clinics of North America. W.B. Saunders, 2018. Vol. 32, N 4. P. 657 - 668.
60. Della Porta M.G. et al. Predictive factors for the outcome of allogeneic transplantation in patients with myelodysplastic syndrome stratified according to the revised International Prognostic Scoring System (IPSS-R).//Blood. 2014. P. 2333 - 2342.
61. Аксельрод Б.А. et al. Клиническое использование эритроцитсодержащих компонентов донорской крови//Гематология и трансфузиология. 2018. Vol. 63, N 4. P. 372 - 435.
62. Bruzzone M.G. et al. CT and MRI of brain tumors//Quarterly Journal of Nuclear Medicine and Molecular Imaging. 2012. Vol. 56, N 2. P. 112 - 137.
63. Greenberg P. et al. International scoring system for evaluating prognosis in myelodysplastic syndromes.//Blood. 1997. Vol. 89, N 6. P. 2079 - 2088.
64. Malcovati L. et al. Impact of the degree of anemia on the outcome of patients with myelodysplastic syndrome and its integration into the WHO classification-based Prognostic Scoring System (WPSS).//Haematologica. 2011. Vol. 96, N 10. P. 1433 - 1440.
65. Cheson B.D. et al. Clinical application and proposal for modification of the International Working Group (IWG) response criteria in myelodysplasia.//Blood. 2006. Vol. 108, N 2. P. 419 - 425.
66. Hoeks M.P.A. et al. Impact of red blood cell transfusion strategies in haemato-oncological patients: a systematic review and meta-analysis.//Br. J. Haematol. 2017. Vol. 178, N 1. P. 137 - 151.
67. Rose C. et al. Does iron chelation therapy improve survival in regularly transfused lower risk MDS patients? A multicenter study by the GFM (Groupe Francophone des My lodysplasies).//Leuk. Res. 2010. Vol. 34, N 7. P. 864 - 870.
68. Neukirchen J. et al. Improved survival in MDS patients receiving iron chelation therapy - a matched pair analysis of 188 patients from the D sseldorf MDS registry.//Leuk. Res. 2012. Vol. 36, N 8. P. 1067 - 1070.
69. Taher A. T.et al New film-coated tablet formulation of deferasirox is well tolerated in patients with thalassemia or lower-risk MDS: Results of the randomized, phase II ECLIPSE study.//Am J Hematol. 2017, 92(5): 420 - 428.
70. Tartaglione I. et al., Two-year long safety and efficacy of deferasirox film-coated in patients with talassemia or lower/intermediate risk MDS: phase 3 results from a subset of patients previously treated with deferasirox in the ECLIPSE study.//Exp Hematol Oncol. 2020 Aug 10:9:20.
71. Mainous A.G. et al. The impact of chelation therapy on survival in transfusional iron overload: a meta-analysis of myelodysplastic syndrome. Br J Haematol. 2014; 167: 720 - 723.
72. Delforge M. et al. Adequate iron chelation therapy for at least six months improves survival in transfusion-dependent patients with lower risk myelodysplastic syndromes.//Leuk. Res. 2014. Vol. 38, N 5. P. 557 - 563.
73. Remacha F. et al. Evolution of iron overload in patients with low-risk myelodysplastic syndrome: iron chelation therapy and organ complications.//Ann. Hematol. 2015. Vol. 94, N 5. P. 779 - 787.
74. Greenberg PL, Sun Z, Miller KB, et al. Treatment of myelobysplastic syndromes patients with erythropoietin with or without granulocyte colony-stimulating factor: result of a prospective randomized phase III trial by the Eastern Cooperative Oncology Group (E1996). Blood 2009; 114: 2393 - 2400.
75. Park S. et al. Efficacy and safety of darbepoetin alpha in patients with myelodysplastic syndromes: a systematic review and meta-analysis.//Br. J. Haematol. 2016. Vol. 174, N 5. P. 730 - 747.
76. Platzbecker U. et al. A phase 3 randomized placebo-controlled trial of darbepoetin alfa in patients with anemia and lower-risk myelodysplastic syndromes//Leukemia. Nature Publishing Group, 2017. Vol. 31, N 9. P. 1944 - 1950.
77. Gascon P. et al. Epoetin alfa for the treatment of myelodysplastic syndrome-related anemia: A review of clinical data, clinical guidelines, and treatment protocols//Leukemia Research, 2019, 81, Р. 35 - 42.
78. Hellstr m-Lindberg E. et al. Treatment of anemia in myelodysplastic syndromes with granulocyte colony-stimulating factor plus erythropoietin: results from a randomized phase II study and long-term follow-up of 71 patients.//Blood. 1998. Vol. 92, N 1. P. 68 - 75.
79. Balleari E. et al. Erythropoietin plus granulocyte colony-stimulating factor is better than erythropoietin alone to treat anemia in low-risk myelodysplastic syndromes: results from a randomized single-centre study.//Ann Hematol. 2006 Mar; 85(3): 174 - 80.
80. Park S. et al. Predictive factors of response and survival in myelodysplastic syndrome treated with erythropoietin and G-CSF: The GFM experience//Blood. American Society of Hematology, 2008. Vol. 111, N 2. P. 574 - 582.
81. Toma A., et al. Lenalidomide with or without erythropoietin in transfusion-dependent erythropoiesis-stimulating agent-refractory lower-risk MDS without 5q deletion.//Leukemia, 2016, 30(4): 897 - 905.
82. List A.F., et al. Lenalidomide-Epoetin Alfa Versus Lenalidomide Monotherapy in Myelodysplastic Syndromes Refractory to Recombinant Erythropoietin. J Clin Oncol. 2021 Jan 13; 39(9): 1001 - 1009.
83. Greenberg P.L. et al. A randomized controlled trial of romiplostim in patients with low or 17. P. 3163 - 3170.intermediate-risk myelodysplastic syndrome receiving decitabine.//Leuk. Lymphoma. 2013. Vol. 54, N 2. P. 321 - 328.
84. Kantarjian H.M. et al. Phase 2 study of romiplostim in patients with low or intermediate-risk myelodysplastic syndrome receiving azacitidine therapy.//Blood. 2010. Vol. 116, N 17. P. 3163 - 3170.
85. Sekeres M.A. et al. Subcutaneous or intravenous administration of romiplostim in thrombocytopenic patients with lower risk myelodysplastic syndromes.//Cancer. 2011. Vol. 117, N 5. P. 992 - 1000.
86. Giagounidis A. et al. Results of a randomized, double-blind study of romiplostim versus placebo in patients with low/intermediate-1-risk myelodysplastic syndrome and thrombocytopenia.//Cancer. 2014. Vol. 120, N 12. P. 1838 - 1846.
87. Oliva E.N. et al. Eltrombopag for the Treatment of Thrombocytopeults on Efficacy, Safety and Quality of Life of an International, Multicenter Prospective, Randomized, Trial//Blood. 2015. Vol. 126, N 23.
88. Oliva E.N. et al. Eltrombopag versus placebo for low-risk myelodysplastic syndromes with thrombocytopenia (EQoL-MDS): phase 1 results of a single-blind, randomised, controlled, phase 2 superiority trial.//Lancet. Haematol. 2017. Vol. 4, N 3. P. e127 - e136.
89. Mittelman M. et al. Eltrombopag for advanced myelodysplastic syndromes or acute myeloid leukaemia and severe thrombocytopenia (ASPIRE): a randomised, placebo-controlled, phase 2 trial.//Lancet. Haematol. 2018. Vol. 5, N 1. P. e34 - e43.
90. Stahl M. et al. Use of Immunosuppressive therapy for management of myelodysplastic syndromes: a systematic review and meta-analysis.//Haematologica. 2019.
91. Giagounidis A. et al. Outcomes in RBC transfusion-dependent patients with Low-/Intermediate-1-risk myelodysplastic syndromes with isolated deletion 5q treated with lenalidomide: a subset analysis from the MDS-004 study.//Eur J Haematol 2014; 93: 429 - 438.
92. Fenaux P. et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study//Lancet Oncol. 2009. Vol. 10, N 3. P. 223 - 232.
93. Kantarjlan H. et al. Decitabine improves patient outcomes in myelodysplastic syndromes: Results of a phase III randomized study//Cancer. 2006. Vol. 106, N 8. P. 1794 - 1803.
94. Silverman L.R. et al. Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: A study of the cancer and leukemia group B//J. Clin. Oncol. 2002. Vol. 20, N 10. P. 2429 - 2440.
95. Kantarjian H. et al. Results of a randomized study of 3 schedules of low-dose decitabine in higher-risk myelodysplastic syndrome and chronic myelomonocytic leukemia//Blood. 2007. Vol. 109, N 1. P. 52 - 57.
96. Pan T. et al. Addition of histone deacetylase inhibitors does not improve prognosis in patients with myelodysplastic syndrome and acute myeloid leukemia compared with hypomethylating agents alone: A systematic review and meta-analysis of seven prospective cohort studies//Leuk. Res. Elsevier Ltd, 2018. Vol. 71. P. 13 - 24.
97. Ye L. et al. Decitabine priming prior to low-dose chemotherapy improves patient outcomes in myelodysplastic syndromes-RAEB: a retrospective analysis vs. chemotherapy alone//J. Cancer Res. Clin. Oncol. Springer Verlag, 2017. Vol. 143, N 5. P. 873 - 882.
98. Ye X.-N. et al. Epigenetic priming with decitabine followed by low-dose idarubicin/cytarabine has an increased anti-leukemic effect compared to traditional chemotherapy in high-risk myeloid neoplasms.//Leuk. Lymphoma. 2016. Vol. 57, N 6. P. 1311 - 1318.
99. Кохно А.В., Паровичникова Е.Н., Савченко В.Г. Протокол сочетанного применения гипометилирующих препаратов с низкодозной полихимиотерапией у больных МДС из группы высокого риска, ОМЛ из МДС, МДС/ОМЛ после апластической анемии, МДС/ОМЛ после лучевой и цитостатической терапии по поводу другого заболеван//Алгоритмы диагностики и протоколы лечения заболеваний системы крови. НМИЦ Гематологии. Под ред. В.Г. Савченко. 2018. P. 829 - 840.
100. Zwierzina H. et al. Low-dose cytosine arabinoside (LD-AraC) vs LD-AraC plus granulocyte/macrophage colony stimulating factor vs LD-AraC plus Interleukin-3 for myelodysplastic syndrome patients with a high risk of developing acute leukemia: final results of a randomized phase III study (06903) of the EORTC Leukemia Cooperative Group//Leukemia. 2005 Nov; 19(11): 1929 - 33.
101. Estey E.H. et al. Comparison of idarubicin + ara-C-, fludarabine + ara-C-, and topotecan + ara-C-based regimens in treatment of newly diagnosed acute myeloid leukemia, refractory anemia with excess blasts in transformation, or refractory anemia with excess blasts.//Blood. 2001. Vol. 98, N 13. P. 3575 - 3583.
102. Robak T. et al. Efficacy and toxicity of low-dose melphalan in myelodysplastic syndromes and acute myeloid leukemia with multilineage dysplasia.//Neoplasma. 2003. Vol. 50, N 3. P. 172 - 175.
103. Omoto E. et al. Low-dose melphalan for treatment of high-risk myelodysplastic syndromes.//Leukemia. 1996. Vol. 10, N 4. P. 609 - 614.
104. Oliansky D.M. et al. The Role of Cytotoxic Therapy with Hematopoietic Stem Cell Transplantation in the Therapy of Myelodysplastic Syndromes: An Evidence-Based Review//Biology of Blood and Marrow Transplantation. Elsevier Inc., 2009. Vol. 15, N 2. P. 137 - 172.
105. Sorror M.L. et al. Hematopoietic cell transplantation (HCT)-specific comorbidity index: a new tool for risk assessment before allogeneic HCT.//Blood. 2005. Vol. 106, N 8. P. 2912 - 2919.
106. Hilarius D.L. et al. Chemotherapy-induced nausea and vomiting in daily clinical practice: a community hospital-based study.//Support. Care Cancer. 2012. Vol. 20, N 1. P. 107 - 117.
107. Belay Y., Yirdaw K., Enawgaw B. Tumor Lysis Syndrome in Patients with Hematological Malignancies//Journal of Oncology. Hindawi Limited, 2017. Vol. 2017.
108. Averbuch D. et al. Targeted therapy against multi-resistant bacteria in leukemic and hematopoietic stem cell transplant recipients: Guidelines of the 4th European conference on Infections in Leukemia (ECIL-4, 2011)//Haematologica. 2013. Vol. 98, N 12. P. 1836 - 1847.
109. Heinz W.J. et al. Diagnosis and empirical treatment of fever of unknown origin (FUO) in adult neutropenic patients: guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Medical Oncology (DGHO)//Annals of Hematology. Springer Verlag, 2017. Vol. 96, N 11. P. 1775 - 1792.
110. Loth K. et al. Infectious Complications Associated with the Use of Antithymocyte Globulin in Reduced Intensity Allogeneic Transplants//Antithymocyte Globul. Reduc. Intensity Allogeneic Transplants. Chemother. 2012. Vol. 2012, N 4. P. 106.
111. Alkharabsheh O.A. et al. Frequency of venous thrombotic events in patients with myelodysplastic syndrome and 5q deletion syndrome during lenalidomide therapy.//Ann. Hematol. 2019. Vol. 98, N 2. P. 331 - 337.
112. Stanworth S.J. et al. Platelet refractoriness--practical approaches and ongoing dilemmas in patient management.//Br. J. Haematol. 2015. Vol. 171, N 3. P. 297 - 305.
113. Weisdorf S.A. et al. Positive effect of prophylactic total parenteral nutrition on long-term outcome of bone marrow transplantation.//Transplantation. 1987. Vol. 43, N 6. P. 833 - 838.
114. Arends J. et al. ESPEN guidelines on nutrition in cancer patients//Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, N 1. P. 11 - 48.
115. Камельских Д.В., с соавт. Трансфузии донорской крови и (или) ее компонентов у взрослых пациентов с гематологическими заболеваниями. Сопроводительная терапия при лечении заболеваний системы крови. Под ред. Паровичниковой Е.Н., Галстяна Г.М. М: Практика, 2024: 387 - 406.
116. Bourgeois E. et al. Role of splenectomy in the treatment of myelodysplastic syndromes with peripheral thrombocytopenia: a report on six cases.//Leukemia. 2001. Vol. 15, N 6. P. 950 - 953.
117. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
118. European Physical and Rehabilitation Medicine Bodies Alliance. White book on physical and rehabilitation medicine in Europe (3th Edition): Chaper 1: Definition an conceps of PRM//Eur. J. Phys. Rehabil. Med. 2018. Vol. 54, N 2. P. 156 - 165.
119. Porta M. Della et al. Risk stratification based on both disease status and extra-hematologic comorbidities in patients with myelodysplastic syndrome//Haematologica. 2011. Vol. 96, N 3. P. 441 - 449.
120. Swerdlow S.H., et al. WHO classification of Tumors of Haematopoietic and Lymphoid Tissues, 2017, pp. 81 - 96.
121. Patnaik MM, Timm MM, Vallapureddy R, et al. Flow cytometry based monocyte subset analysis accurately distinguishes chronic myelomonocytic leukemia from myeloproliferative neoplasms with associated monocytosis. Blood Cancer J. 2017; 7(7): e584.
122. Pophali PA, Timm MM, Mangaonkar AA, et al. Practical limitations of monocyte subset repartitioning by multiparametric flow cytometry in chronic myelomonocytic leukemia. Blood Cancer J. 2019; 9(9): 65.
123. Akbar A. et al., A Systematic Review and Meta-Analysis of Luspatercept for Anemia Treatment in Low Risk Myelodysplastic Syndrome with Ring Sideroblast Subtype in Phase II and Phase III Clinical Trials. Blood 2020; 136 (Supplement 1): 40 - 41.
124. Fenaux P. et al. Luspatercept in Patients with Lower-Risk Myelodysplastic Syndromes. N Engl J Med. 2020; 382(2): 140 - 151.
125. Platzbecker U. et al. Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): interim analysis of a phase 3, open-label, randomised controlled trial. Lancet. 2023; 402(10399): 373 - 385.
126. Amitai I et al. Efficacy of Luspatercept in Low-Risk Myelodysplastic Syndrome: A Systematic Review and Meta-Analysis. Blood 2023; 142 (Supplement 1): 6487.
127. Rabian F. et al. Eltrombopag in Chronic Myelomonocytic Leukemia (CMML) with Severe Thrombocytopenia: Final Results of a Multicenter Phase II Study, Blood, 2020.
128. Melody M., et al. Lenalidomide Is Effective Treatment Option for Patients with Refractory Anemia with Ring Sideroblastsand Trombocytosis. Blood, 2018, 132, 4383.
129. Naqvi K., et al. Characteristics and Role Lenalidomide Therapy in Patients with Myelodysplastic/Myeloproliferative Neoplasm with Ring Sideroblasts and Trombocytosis. Blood, 2018, 132, 5513.
130. Komrokji R., et al. Treatment outcomes for patients with myelodysplastic/myeloproliferative neoplasms ring sideroblasts and thrombocytosis. Leuk. Lypphoma, 2022, 63, 199 - 204.
131. Xu R. et al. Hypomethylating agents in the treatment of chronic myelomonocytic leukemia: A meta-analysis and systematic review. Hematology 2021, 26, 312 - 320.
132. Santini V., et al. A phase II, multicentre trial of decitabine in higher-risk chronic myelomonocytic leukemia. Leukemia, 2018, 32, 413 - 418.
133. Mangaonkar A.A., et al. Clinicopathologic characteristics, prognostication and treatment outcomes for myelodysplastic/myeloproliferative neoplasm, unclassifiable (MDS/MPN-U): Mayo Clinical Cancer Center study of 135 consecutive patients. Leukemia, 2020, 34, 656 - 661.
134. Gerke V.B., et al. Definitions, Biology, and Current Therapeutic Landscape of Myelodisplastic/ Myeloproliferative Neoplasms. Cancer, 2023, 15, 3815.
135. Desikan S., et al. A phase I study of the combination of venetoclax and azacitidine in relapse/refractory higher risk myelodysplastic syndrome (MDS). Blood 2021; 138(Suppl 1): 3704.
136. Ball B.J., et al. Venetoclax and hypomethylating agents (HMAs) induce high response rates in MDS, including patients after HMA therapy failure. Blood Adv 2020; 4(13): 2866 - 2870.
137. Du Yu, et al. The efficacy and safety of venetoclax and azacytidine combination treatment in patients with acute myeloid leukemia and myelodysplastic syndrome: systematic review and meta-analysis. Hematology 2023; 28(1): 2198098.
138. El-Cheikh J. et al. Venetoclax: a new partner in the novel treatment era for acute myeloid leukemia and myelodysplastic syndrome. Clin Hematol Int 2023; 5(2-3): 143 - 154.
139. Zeidan А.М., et al. A phase 1b study of venetoclax and azacitidine combination in patients with relapsed or refractory myelodysplastic syndromes. Am J Hematol 2023; 98(2): 272 - 281.
140. Wei A.H., et al. Venetoclax combined with low-dose cytarabine for previously untreated patients with acute myeloid leukemia: results from a phase Ib/II study. J Clin Oncol 2019; 37(15): 1277 - 1284.
141. Fenaux P. et al. Low-Dose Cytosine Arabinoside in Adult Chronic Myelomonocytic Leukemia. J Clin Oncol (1987) 5: 1129 - 30.
142. Wattel E. et al. A Randomized Trial of Hydroxyurea Versus VP16 in Adult Chronic Myelomonocytic Leukemia. Groupe Francais Des Myelodysplasies and European CMML Group. Blood (1996) 88: 2480 - 7.
143. Itzykson R. et al. Decitabine Versus Hydroxyurea for Advanced Proliferative Chronic Myelomonocytic Leukemia: Results of a Randomized Phase III Trial Within the EMSCO Network. J Clinical Oncology, 2022; Vol. 41, N 10.
144. Zhang L., et al. A real-world experience of venetoclax combined with hypomethylating agents vs. monotherapy hypomethylating agents in patients with myelodysplastic syndromes and chronic myelomonocytic leukemia patients. Front Pharmacol. 2024; 15: 1265840.
145. N., et al. Allogeneic stem cell transplantation of adult chronic myelomonocytic leukaemia. A report on behalf of the Chronic Leukaemia Working Party of the European Group for Blood and Marrow Transplantation (EBMT) Br. J. Haematol. 2002; 118: 67 - 73.
146. Kerbauy D.M.B., et al. Allogeneic Hematopoietic Cell Transplantation for Chronic Myelomonocytic Leukemia. Biol. Blood Marrow Transplant. 2005; 11: 713 - 720.
147. Sharma P., et al. Allogeneic hematopoietic stem cell transplant in adult patients with myelodysplastic syndrome/myeloproliferative neoplasm (MDS/MPN) overlap syndromes. Leuk. Lymphoma. 2017; 58: 872 - 881.
148. Pophali P., et al. Prognostic impact and timing considerations for allogeneic hematopoietic stem cell transplantation in chronic myelomonocytic leukemia. Blood Cancer J. 2020; 10: 121.
149. Gagelmann N., et al. A prognostic score including mutation profile and clinical features for patients with CMML undergoing stem cell transplantation. Blood Adv. 2021; 5: 1760 - 1769.
150. Such E., et al. Development and validation of a prognostic scoring system for patients with chronic myelomonocytic leukemia. Blood. 2013; 121: 3005 - 3015.
151. Elena C., et al. Integrating clinical features and genetic lesions in the risk assessment of patients with chronic myelomonocytic leukemia. Blood. 2016; 128: 1408 - 1417.
152. Pophali P., et al. Splenectomy in patients with chronic myelomonocytic leukemia: Indications, histopathological findings and clinical outcomes in a single institutional series of thirty-nine patients. Am J Hematol. 2018 Nov; 93(11): 1347 - 1357.
153. Сопроводительная терапия при лечении заболеваний системы крови. Практическое руководство/под. ред. Е.Н. Паровичниковой, Г.М. Галстяна. М.: Практика, 2024, 512 с.
154. Кохно А.В., с соавт. Эффективность терапии циклоспорином А у больных миелодиспластическим синдромом. Терапевтический архив, 2010, том 82, N 8, стр. 48 - 53.
155. Bernard E. et al. Molecular International Prognosis Scoring System for Myelodysplastic Syndromes. NEJM Evid 2022; 1: Evidoa2200008. IPSS-M Web calculator: https://mds-risk-model.com.
156. Кохно А.В., Паровичникова Е.Н., Терапия миелодиспластических новообразований и миелодиспластических/миелопролиферативных новообразований из группы высокого риска. Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под редакцией Е.Н. Паровичниковой. Том 1. - М: Практика, 2024: 590 - 618.
157. Miller K.B., et al. The evaluation of low-dose cytarabine in the treatment of myelodysplastic syndromes: a phase-III intergroup study*, Ann Hematol (1992) 65: 162 - 168.
158. Buckley S.A., et al. Prediction of Adverse Events during Intensive Induction Chemotherapy for Acute Myeloid Leukemia or High-Grade Myelodysplastic Syndromes Am J Hematol. 2014 Feb 24; 89(4): 423 - 428.
159. Heisel R.W., et al. Vancomycin-resistant enterococci in acute myeloid leukemia and myelodysplastic syndrome patients undergoing induction chemotherapy with idarubicin and cytarabine. Leuk Lymphoma. 2017; 58(11): 2565 - 2572.
160. Ball B., et al. Evaluation of induction chemotherapies after hypomethylating agent failure in myelodysplastic syndromes and acute myeloid leukemia. Blood Adv, 2018; 2(16): 2063 - 2071.
161. Buccisano F., et al. Real-life use of erythropoiesis-stimulating agents in myelodysplastic syndromes: a "Gruppo Romano Mielodisplasie (GROM)" multicenter study. Ann Hematology, 2016, Vol. 95, P. 1059 - 1065.
162. Tatarelli C., et al. Recombinant human erythropoietin in very elderly patients with myelodysplastic syndromes: results from a retrospective study. Ann Hematol. 2014; Vol. 93, N 8, Р. 1413 - 20.
163. Mundle S., et al. An assessment of erythroid response to epoetin as a single agent versus in combination with granulocyte- or granulocyte-macrophage-colony-stimulating factor in myelodysplastic syndromes using a meta-analysis approach//Cancer, 2009, Vol. 115, N 4, Р. 706 - 715.
164. Клинические рекомендации "Острые миелоидные лейкозы", 2020.
165. Wei A.H., et al. Venetoclax plus LDAC for newly diagnosed AML ineligible for intensive chemotherapy: a phase 3 randomized placebo-controlled trial. Blood, 2020, Vol. 135 (24), Р. 2137 - 2145.
166. DiNardo C.D., et al. Clinical experience with the BCL2-inhibitor venetoclax in combination therapy for relapsed and refractory acute myeloid leukemia and related myeloid malignancies Am J Hematol. 2018; 93: P. 401 - 407.
167. Negrin RS, Stein R, Doherty K, et al. Maintenance treatment of the anemia of myelodysplastic syndromes with recombinant human granulocyte colony-stimulating factor and erythropoietin: evidence for in vivo synergy. Blood 1996; 87: 4076 - 4081.
168. Кохно А.В., Паровичникова Е.Н., Михайлова Е.А. Савченко В.Г. Алгоритмы обследования и протоколы лечения больных с различными формами миелодиспластических сндромов. Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под редакцией В.Г. Савченко. Том 1. - НМИЦ Гематологии, 2018: 441 - 478.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Кохно А.В., к.м.н., заведующий клинико-диагностическим отделением гематологии и миелоидных неоплазий, заведующий отделом диагностики и лечения гематологических заболеваний ФГБУ "Гематологический научный центр" Минздрава России, член Национального гематологического общества.
2. Байков В.В., д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова" Минздрава России, член Российского общества патологоанатомов, член Национального общества онкогематологов, член Европейского общества патологов (ESP), член Европейско-Американской ассоциации гематопатологов.
3. Грицаев С.В., д.м.н., врач-гематолог СПб ГБУЗ Городская больница N 15, член Национального гематологического общества.
4. Двирнык В.Н., к.м.н., заведующая централизованной клинико-диагностической лабораторией ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
5. Дудина Г.А., д.м.н., заведующий отделением гематологии ГБУЗ "Московский клинический научный центр им. А.С. Логинова ДЗМ", член Национального гематологического общества.
6. Ковригина А.М., д.м.н., профессор, заведующий патологоанатомическим отделением ФГБУ "НМИЦ гематологии" Минздрава России, член Российского общества патологоанатомов, член Национального общества онкогематологов, член Европейского общества патологов (ESP), член Европейско-Американской ассоциации гематопатологов.
7. Константинова Т.С., к.м.н., заведующий Областным гематологическим центром Свердловской областной клинической больницы N 1, член Национального гематологического общества.
8. Кузьмина Л.А., к.м.н., заведующий отделением химиотерапии гемобластозов и трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
9. Морозова Е.В., д.м.н., руководитель отдела онкологии, гематологии и трансплантологии НИИ ДОГиТ им Р.М. Горбачевой, доцент кафедры гематологии, трансфузиологии и трансплантологии ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова Минздрава России, член Национального гематологического общества.
10. Обухова Т.Н., к.м.н., заведующий лаборатории кариологии ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
11. Паровичникова Е.Н., д.м.н., генеральный директор ФГБУ "НМИЦ гематологии" Минздрава России, председатель Национального гематологического общества, эксперт Европейской группы по изучению острых лимфобластных лейкозов взрослых (EWGAALL).
12. Самойлова О.С., к.м.н., заведующий гематологическим отделением ГБУЗ НО "Нижегородская областная клиническая больница им. Н.А. Семашко", член Национального гематологического общества.
13. Семочкин С.В., д.м.н., заведующий группой высокодозной химиотерапии и трансплантации костного мозга ФГБУ "НМИЦ радиологии" Минздрава России, профессор кафедры онкологи, гематологии и лучевой терапии ФГБОУ ВО "Российский национальный медицинский исследовательский университет им. Н.И. Пирогова" Минздрава России, член Национального гематологического общества, член Национального общества детских гематологов и онкологов, член Национального общества онкологов и гематологов, член EACR.
14. Троицкая В.В., д.м.н., 1-ый заместитель генерального директора ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
15. Шатохин Ю.В., д.м.н., профессор, заведующий кафедрой гематологии и трансфузиологии ФПК и ППС Ростовского государственного медицинского университета, член Национального гематологического общества.
16. Ширин А.Д., к.м.н., старший научный сотрудник ФГБУ "Российский онкологический научный центр" им. Н.Н. Блохина Минздрава России, член Национального гематологического общества, член Национального общества онкологов и гематологов.
Блок по организации медицинской помощи:
1. Геворкян Тигран Гагикович, заместитель директора НИИ КЭР ФГБУ "НМИЦ онкологии им. Н.Н. Блохина", главный специалист-онколог Московской области.
2. Иванов Сергей Анатольевич, д.м.н., проф. РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
3. Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. 1. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- врачи-гематологи;
- врачи-онкологи;
- врачи-терапевты;
- врачи-анестезиологи-реаниматологи;
- врач-клинические фармакологи.
Рейтинговая схема для оценки уровня достоверности доказательств
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований (КИ) с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе - когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных КИ с применением мета-анализа
2
Отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
1. внешняя экспертная оценка;
2. внутренняя экспертная оценка.
Описание методики валидизации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Предварительная версия рекомендаций представлялась и обсуждалась на заседании Экспертного совета по гематологии и научных конференциях Национального гематологического общества.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами.
Окончательная редакция
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Последние изменения и окончательная редакция данных рекомендаций были рассмотрены и утверждены на заседании мультидисциплинарного Экспертного совета по гематологии в апреле 2018 г.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ВАРИАНТЫ КУРСОВ ИНДУКЦИИ И КОНСОЛИДАЦИИ
Программа индукции/консолидации
Препараты
7+3(1)
[92, 158, 159, 160]
#Цитарабин** 100 мг/м2 в/в 2 раза в сутки в 1 - 7 дни
- #Даунорубицин** 60 мг/м2 в/в 1 раз в день в 1 - 3 дни или
- #Митоксантрон** 10 мг/м2 в/в 1 раз в день в 1 - 3 дни или
- #Идарубицин** 12 мг/м2 в/в 1 раз в день в 1 - 3 дни
7+3(2)
[92, 158, 159, 160]
#Цитарабин** 200 мг/м2 в/в круглосуточно в 1 - 7 дни
- #Даунорубицин** 60 мг/м2 в/в 1 раз в день в 3 - 5 дни или
- #Митоксантрон** 10 мг/м2 в/в 1 раз в день в 3 - 5 дни или
- #Идарубицин** 12 мг/м2 в/в 1 раз в день в 3 - 5 дни
Варианты курсов поддерживающего лечения
Программа
Препарат
5 + 6-МП (2)
[1, 2,
#Цитарабин** 100 мг/м2 в/в 2 раза в день в 1 - 5 дни, или 50 мг/м2 подкожно 2 раза в день в 1 - 5 дни
#Меркаптопурин** 60 мг/м2 в сутки в 2 приема внутрь в 1 - 2 дни
Aza-Ara-C
[99, 156]
Азацитидин** 75 мг/м2 п/к 1 раз в день, в 1 - 3 дни
#Цитарабин** 10 мг/м2 п/к 2 раза в сутки с 4-го по 10 - 17 дни
Dac-Ara-C
[99, 156]
Децитабин 20 мг/м2 в/в 1 раз в день, в 1 - 3 дни
#Цитарабин** 10 мг/м2 п/к 2 раза в сутки с 4-го по 10 - 17 дни
Приложение А3.2
РЕКОМЕНДАЦИИ ПО НАЗНАЧЕНИЮ ЭПСП
Препараты
Стартовые дозы ЭПСП
При отсутствии эффекта <*> через 6 - 8 недель дозу ЭПСП увеличивают в 1,5 - 2,0 раза и/или добавляют Г-КСФ
#Эпоэтин альфа <**>
[74, 75, 77, 161, 163]
450 МЕ/кг в неделю,
вводимая за 1 - 3 раза в неделю
Возможно введение 36 - 40000 МЕ 1 раз в неделю [75, 77, 161]
900 МЕ/кг в неделю
вводимая за 1 - 3 раза в неделю
Максимальная доза 80000 МЕ/неделю
#Эпоэтин бета <**>
[161, 162]
450 МЕ/кг в неделю
вводимая за 1 - 3 раза в неделю
Возможно введение 30000 МЕ 1 раз в неделю
900 МЕ/кг в неделю,
вводимая за 1 - 3 раза в неделю
Максимальная доза 60000 МЕ/неделю
#Дарбэпоэтин альфа <**> [75, 76]
150 мкг (2,25 мкг/кг) 1 раз в неделю
500 мкг (6,75 мкг/кг) 1 раз в
3 недели
300 мкг (4,5 мкг/кг) 1 раз в неделю
Дозу не увеличивают
--------------------------------
<*> - нет повышения уровня Hb 10 г/л и/или снижения зависимости от гемотрансфузий.
<**> - доза Г-КСФ подбирается индивидуально, чтобы количество лейкоцитов в общем (клиническом) анализе крови было < 10 x 109 /л.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Общий алгоритм ведения пациентов с подозрением на МДС или МДС/МПН
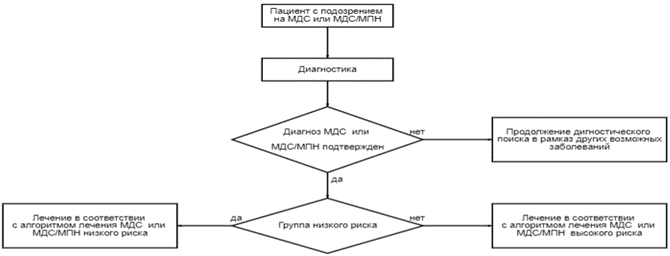
Алгоритм ведения пациентов МДС и МДС/МПН низкого риска:
- группы низкого и промежуточного-1 риска по шкале IPSS;
- группы очень низкого, низкого и промежуточного риска по шкале IPSS-R;
- группы низкого и промежуточного-1 риска по CPSS
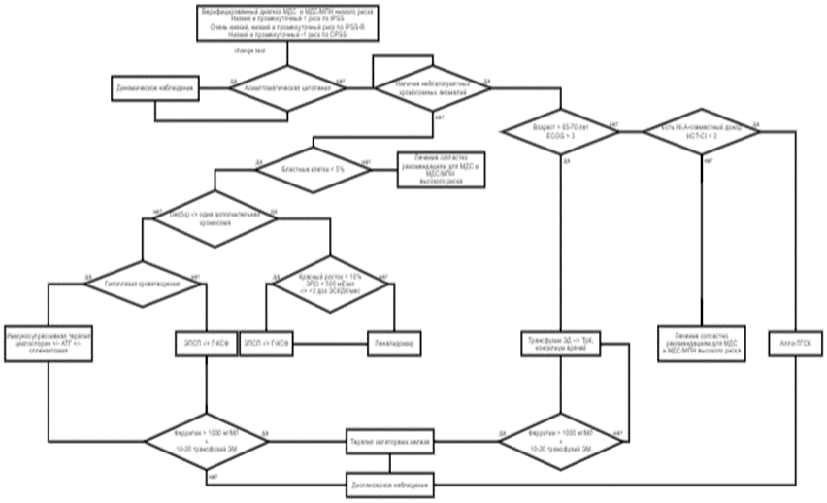
Алгоритм ведения пациентов МДС и МДС/МПН высокого риска:
- группы промежуточного-2 и высокого риска по шкале IPSS;
- группы промежуточного, высокого и очень высокого риска по шкале IPSS-R;
- группы промежуточного 2 и высокого риска по CPSS.
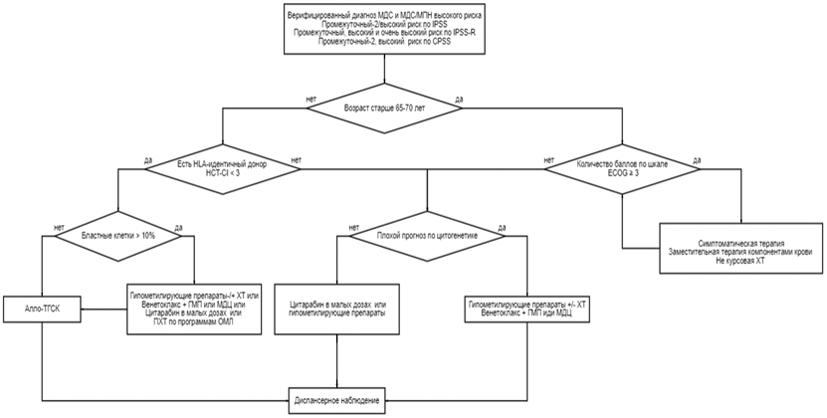
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Миелодиспластические синдромы (МДС) - это группа различных заболеваний костного мозга (КМ), проявляющихся в том, что КМ не вырабатывает достаточного количества здоровых клеток крови. МДС часто называют "болезнью недостаточности костного мозга". МДС страдают главным образом пожилые люди (возраст большинства пациентов превышает 65 лет), однако и среди лиц моложе 40 лет возможно выявление этого заболевания.
Основными признаками МДС является цитопения - это снижение количества эритроцитов и гемоглобина, лейкоцитов и тромбоцитов; помимо низкого количества клеток крови, зрелые клетки крови, циркулирующие в системе кровообращения, могут неправильно функционировать из-за так называемой дисплазии. Несмотря на то, что МДС - это не синдром, а болезнь, и даже группа заболеваний, обозначение "синдром" до сих пор остается в силе.
Основными типами цитопений являются:
1. Анемия - сниженное содержание эритроцитов в 1 мкл крови, но чаще используют параметры гемоглобина: у пациентов проявлениями анемии являются бледность кожных покровов, слабость, повышенная утомляемость, сонливость, головокружение, сердцебиение, одышка, как в покое, так и при физической нагрузке. Для каждого пациента существует свое, пороговое значение гемоглобина, при котором начинают появляться и усиливаться данные симптомы, которые заставляют обратиться к врачу и в дальнейшем помогают оценивать состояние пациента.
2. Лейкопения - низкое содержание лейкоцитов в 1 мкл крови. Снижение показателей лейкоцитов и нейтрофилов, а также нарушение их функции не сказывается на общем самочувствии пациентов, однако приводит к увеличению частоты инфекционных осложнений.
3. Тромбоцитопения - низкое содержание тромбоцитов в 1 мкл крови; у пациентов с тромбоцитопенией нередко выявляется геморрагический синдром (появление на коже и слизистых красных пятен-геморрагий, кровоточивость десен, чаще во время проведения гигиенических процедур, кровотечения из носа, желудочно-кишечного тракта и т.д.). С учетом нарушенной функции тромбоцитов эти проявления могут быть при уровне тромбоцитов > 20 x 109/л, однако чаще они встречаются при показателях менее 20 x 109/л.
Для диагностики МДС необходимо выполнить исследование крови, КМ с определением особенностей кариотипа (определить - есть поломки хромосом или нет), а также провести полное терапевтическое обследование. Это поможет врачу подтвердить наличие или отсутствие МДС, выяснить наличие сопутствующей патологии, а также выбрать тактику дальнейшей терапии.
В настоящее время существует много методов лечения МДС. Выбор зависит от варианта МДС, особенностей кроветворения, группы риска, возраста пациента, наличия и тяжести сопутствующей патологии, наличия подходящего по HLA-системе донора.
Решение о начале той или иной терапии, особенно о начале реализации программы трансплантации аллогенных гемопоэтических стволовых клеток (Трансплантация костного мозга), принимается врачом совместно с пациентом и его родственниками.
Адекватное выполнение пациентом назначений врача, своевременное соблюдение всех установленных правил позволяет получить максимально возможный результат.
Всем пациентам с МДС рекомендуется соблюдать предписания гематолога по лечению и не заниматься самолечением, исключить инсоляцию, посещение сауны/бани и физиотерапевтические процедуры. При наличии вредных условий труда желательна смена условий работы. К вредным условиям труда относятся: работа, связанная с тяжелым физическим и значительным нервно-психическим напряжением, воздействием токсических агентов, вибрации, пребыванием на высоте, обслуживанием движущихся механизмов, вождением транспортных средств, диспетчерские профессии и т.п.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ПРОГНОСТИЧЕСКИЕ ШКАЛЫ МДС
Для определения риска у пациентов МДС, а также при выборе тактики терапии используют прогностические системы оценки, объединяющие отдельные клинические и гематологические параметры. Ниже представлены 3 прогностические шкалы: IPSS, IPSS-R и WPSS.
Прогностическая шкала IPSS
Оригинальное название: International prognostic scoring system for myelodysplastic syndromes (IPSS) [63]
Источник - Greenberg P. et al. International scoring system for evaluating prognosis in myelodysplastic syndromes.//Blood. 1997. Vol. 89, N 6. P. 2079 - 2088.
Тип-шкала оценки
Назначение: клиническая оценка прогноза заболевания
Содержание и интерпретация:
Критерии прогноза
Баллы
0
0,5
1,0
1,5
2,0
Бласты в КМ, %
< 5
5 - 10
-
11 - 20
21 - 30
Кариотип
Хороший
Промежуточный
Плохой
Цитопении
0/1
2/3
Сумма баллов
Категория риска
Медиана общей выживаемости, лет
Медиана времени до трансформации в ОМЛ 25% пациентов, лет
0
Низкий
5,7
9,4
0,5 - 1,0
Промежуточный-1
3,5
3,3
1,5 - 2,0
Промежуточный-2
1,1
1,1
![]() 2,5
2,5
Высокий
0,4
0,2
Примечания:
Цитопения: Hb < 100 г/л; абсолютное число нейтрофилов < 1,5 x 109/л; тромбоциты < 100 x 109/л.
Кариотип: хороший - нормальный кариотип, -Y, -20, -5; плохой - аномалии 7-й хромосомы и комплексные аберрации (![]() 3 хромосом); промежуточный - все остальные.
3 хромосом); промежуточный - все остальные.
Прогностическая шкала IPSS-R
Оригинальное название: Revised international prognostic scoring system for myelodysplastic syndromes [30]
Источник - Greenberg P.L. et al. Revised international prognostic scoring system for myelodysplastic syndromes//Blood. 2012. Vol. 120, N 12. P. 2454 - 2465.
Тип-шкала оценки
Назначение: клиническая оценка прогноза заболевания
Содержание и интерпретация:
Параметры
Баллы
0
0:5
1
1.5
2
3 - 4
Кариотип
Очень
хороший
Хороший
Промежуточный
Плохой и очень плохой
Бласты в КМ, %
![]() 2
2
> 2 - < 5
-
5 - 10
> 10
Гемоглобин, г/л
![]() 100
100
-
80 - 99
< 80
-
-
Тромбоциты, x 109/л
![]() 100
100
50 - 99
< 50
-
-
-
Нейтрофилы, x 109/л
![]() 0,8
0,8
< 0,8
-
-
-
-
Группа риска
Сумма
баллов
Медиана обшей выживаемости, мес
Медиана времени до трансформации в ОМЛ 25% пациентов, мес
Очень низкий
![]() 1,5
1,5
9,3
Не достигнута
Низкий
> 1,5 - 3
6,3
Не достигнута
Промежуточный
> 3 - 4,5
3,4
2,4
Высокий
> 4,5 - 6
1,2
0,8
Очень высокий
> 6
0,6
0,6
Вариант кариотипа
Данные цитогенетического исследования
Очень хороший
-Y; del(11q)
Хороший
Нормальный; del(5q); del(12p): del(20q); del(5q) с дополнительной хромосомной аберрацией
Промежуточный
Del(7q); +8; +19; i(17q); любая другая изолированная или двойная аберрация
Плохой
-7; inv(3)/t(3q)/del(3q); двойная аберрация с -7/7q-; комплексный кариотип (3 аберрации)
Очень плохой
Комплексный кариотип (> 3 аберраций)
Прогностическая шкала WPSS
Оригинальное название: WHO classification-based Prognostic Scoring System (WPSS) [64]
Источник - Malcovati L. et al. Impact of the degree of anemia on the outcome of patients with myelodysplastic syndrome and its integration into the WHO classification-based Prognostic Scoring System (WPSS).//Haematologica. 2011. Vol. 96, N 10. P. 1433 - 1440.
Тип-шкала оценки
Назначение: клиническая оценка прогноза заболевания
Содержание и интерпретация:
Параметры
Баллы
0
1
2
3
Вариант по классификации ВОЗ <1>
РА,
РАКС,
5q-
РЦМД
РАИБ-1
РАИБ-2
Кариотип <2>
Хороший
Промежуточный
Плохой
-
Hb < 90 г/л для мужчин и < 80 г/л для женщин
Нет
Да
-
-
Сумма баллов
Категория риска
Медиана общей выживаемости, мес.
Вероятность прогрессии в ОМЛ (без лечения)
2 года
5 лет
0
Очень низкий
103
0
0,06
1
Низкий
72
0,11
0,24
2
Промежуточный
40
0,28
0,48
3 - 4
Высокий
21
0,52
0,63
5 - 6
Очень высокий
12
0,79
1
Примечания:
1. Морфологические варианты по ВОЗ: РА - рефрактерная анемия; РАКС - рефрактерная анемия с кольцевыми сидеробластами; 5q-синдром - МДС с изолированной делецией 5q; РЦМД - рефрактерная цитопения с мультилинейной дисплазией; РАИБ-1 - рефрактерная анемия с избытком бластов 1 и РАИБ-2 - рефрактерная анемия с избытком бластов-2.
2. Кариотип: хороший - нормальный, -Y, del(5q), del(20q); плохой - комплексные аномалии ![]() 3 аберраций и любые изменения 7-й хромосомы; промежуточный - все другие аномалии кариотипа.
3 аберраций и любые изменения 7-й хромосомы; промежуточный - все другие аномалии кариотипа.
3. Трансфузионная зависимость (регулярная) - это минимум одна трансфузия донорских эритроцитов каждые 8 недель на протяжении 4 месяцев [5]
Прогностические шкалы при ХММЛ
Шкала оценки прогноза ХММЛ (CPSS)
Оригинальное название: CMML-specific prognostic scoring system (CPSS) [150]
Источник - Such E., et al. Development and validation of a prognostic scoring system for patients with chronic myelomonocytic leukemia. Blood. 2013; 121: 3005 - 3015.
Тип-шкала оценки
Назначение: клиническая оценка прогноза заболевания
Содержание и интерпретация:
Параметры
Баллы
0
1
2
Вариант ХММЛ ВОЗ 2017
ХММЛ-0
ХММЛ-1
ХММЛ-2
-
Подтип ХММЛ
МД-ХММЛ
Лейкоциты < 13 x 109/л
МП-ХММЛ Лейкоциты ![]() 13 x 109/л
13 x 109/л
-
Цитогенетический
риск <*>
Низкий
Промежуточный
Высокий
Наличие трансфузий от ЭСКДК <**>
Нет
Да
-
--------------------------------
<*> - Цитогенетический риск: низкий - нормальный кариотип, -Y; промежуточный - все остальные аберрации (в т.ч.. del (20q), del (5q)); плохой - +8, -7/del (7q), комплексный кариотип.
<**> - гемотрансфузии ЭСКДК не менее 1 дозы каждые 8 недель в течение 4 месяцев.
Сумма баллов
Риск
Медиана общей выживаемости, мес.
Вероятность 2-летней прогрессии в ОМЛ, %
0
Низкий
72
7
1
Промежуточный-1
31
14
2 - 3
Промежуточный-2
13
37
4 - 5
Высокий
5
73
Специальная шкала оценки прогноза ХММЛ с учетом молекулярных маркеров, ХММЛ-мол. (CPSS-mol.) [151]
Оригинальное название: prognostic scoring system for patients with chronic myelomonocytic leukemia. [150] prognostic score values of the CPSS-Mol
Источник - Elena C., et al. Integrating clinical features and genetic lesions in the risk assessment of patients with chronic myelomonocytic leukemia. Blood. 2016; 128: 1408 - 1417.
Тип-шкала оценки
Назначение: клиническая оценка прогноза заболевания
Содержание и интерпретация:
Параметры
Баллы
0
1
2
Вариант ХММЛ ВОЗ 2017
ХММЛ-0
ХММЛ-1
ХММЛ-2
-
Подтип ХММЛ
мд-хммл
Лейкоциты < 13 x 109/л
МП-ХММЛ Лейкоциты ![]() 13 x 109/л
13 x 109/л
-
Цитогенетический риск <*>
Низкий
Промежуточный
Высокий
Молекулярно-генетический риск <**>
Низкий
Промежуточный
Высокий
Наличие трансфузий от ЭСКДК <***>
Нет
Да
-
--------------------------------
<*> Цитогенетический риск: низкий - нормальный кариотип, - Y; промежуточный - все остальные аберрации (в т.ч. del (20q), del (5q)); плохой - +8, -7/del (7q), комплексный кариотип.
<**> Молекулярно-генетический риск: низкий - нет мутаций в генах ASXL1, NRAS, RUNX1, SETBP1, промежуточный - мутации в генах ASXL1, NRAS, SETBP1; высокий - мутации в гене RUNX1.
<***> Гемотрансфузии ЭСКДК не менее 1 дозы каждые 8 недель в течение 4 месяцев.
Сумма баллов
Риск
Медиана общей выживаемости, мес.
Вероятность 4-летней прогрессии в ОМЛ, %
0
Низкий
Не достигнута
0
1
Промежуточный-1
64
3
2 - 3
Промежуточный-2
37
21
> 4
Приложение Г2
ОЦЕНКА ЭФФЕКТИВНОСТИ ТЕРАПИИ МДС И МДС/МПН
Эффективность терапии МДС должна оцениваться согласно критериям ответа на лечения Международной рабочей группы (IWG 2006) [3].
Оригинальное название: International Working Group (IWG) response criteria in myelodysplasia [65]
Тип: другое - критерии оценки ответа на лечение
Назначение: оценка эффективности терапии МДС
Содержание и интерпретация:
Оценка эффективности терапии (IWG 2006) [3]
Вид ответа
Критерии
Полная ремиссия
КМ: 5% и менее бластных клеток с нормальным созреванием всех типов клеточных линий; возможна персистирующая дисплазия
Периферическая кровь: Hb ![]() 110 г/л, тромбоциты
110 г/л, тромбоциты ![]() 100 x 109/л, нейтрофилы
100 x 109/л, нейтрофилы ![]() 1,0 x 109/л, бластные клетки 0%
1,0 x 109/л, бластные клетки 0%
Частичная ремиссия
Все критерии полной ремиссии соблюдаются за исключением того, что количество бластных клеток в КМ снизилось на 50% и более от исходного значения, но остается более 5%.
Клеточность и морфология не актуальны
Костно-мозговая ремиссия
КМ: 5% и менее бластных клеток и их количество в процессе терапии снизилось на 50% и более от исходного значения
Периферическая кровь: если наблюдается гематологическое улучшение, его следует добавлять к костно-мозговому ответу
Стабилизация
Отсутствие частичной ремиссии, но нет признаков прогрессирования в течение более 8 недель
Без эффекта
Летальный исход на фоне терапии или прогрессирование заболевания, характеризующиеся усугублением цитопении, увеличением количества бластных клеток в КМ или прогрессирование в более "продвинутый" морфологический вариант МДС по сравнению с тем вариантом, что был до терапии
Рецидив после полной или частичной ремиссии
Необходимо наличие хотя бы 1 из следующих признаков:
- процент бластных клеток вернулся к исходному значению до лечения;
- снижение на 50% и более от максимального количества гранулоцитов или тромбоцитов во время ремиссии/ответа;
- снижение концентрации Hb на 15 г/л и более или присоединение трансфузионной зависимости.
Цитогенетический ответ
Полный: исчезновение хромосомных изменений и отсутствие новых
Частичный: уменьшение количества клеток с хромосомными нарушениями минимум на 50%
Прогрессия заболевания
Для пациентов с количеством бластных клеток:
- менее 5% - увеличение на 50% и более, т.е. более 5%;
- 5 - 10% - увеличение на 50% и более, т.е. более 10%;
- 10 - 20% - увеличение на 50% и более, т.е. более 20%;
- 20 - 30% - увеличение на 50% и более, т.е. более 30%.
Наличие любого из следующих признаков:
- снижение количества гранулоцитов или тромбоцитов как минимум на 50% от максимального значения во время ремиссии/ответа;
- снижение концентрации Hb на 20 г/л и более;
- зависимость от трансфузионной терапии.
Гематологическое улучшение
Критерии ответа (ответ должен сохраняться не менее 8 недель)
Эритроидный ответ (исходно менее 110 г/л)
Повышение Hb на 15 г/л и более;
Снижение абсолютного числа единиц переливаемой эритроцитной массы, по крайней мере, на 4 единицы в течение 8 недель, по сравнению с исходным числом переливаемых единиц за предшествующие 8 недель;
При оценке интенсивности трансфузионной терапии необходимо учитывать гемотрансфузии, выполненные при Hb ![]() 90 г/л
90 г/л
Тромбоцитарный ответ (исходно менее 100 x 109/л)
Абсолютное число тромбоцитов увеличивается ![]() 30 x 109/л, при исходных значениях более 20 x 109/л;
30 x 109/л, при исходных значениях более 20 x 109/л;
Увеличение с менее 20 x 109/л до более 20 x 109/л и минимум на 100%
Нейтрофильный ответ (исходно менее 1,0 x 109/л)
Увеличение на 100% и увеличение абсолютного числа нейтрофилов до более 0,5 x 109/л
Прогрессия или рецидив после гематологического улучшения
Доказательство хотя бы одного из следующих признаков:
- снижение на 50% и более от максимального количества гранулоцитов или тромбоцитов;
- снижение Hb на 15 г/л и более;
- трансфузионная зависимость.
Приложение Г3
ШКАЛА КОМОРБИДНОСТИ ДЛЯ ПАЦИЕНТОВ С МДС
Для прогнозирования влияния сопутствующих заболеваний на конечные результаты лечения у больных МДС необходимо оценивать коморбидность пациента по МДС-специфичному индексу коморбидности (MDS-CI) [119].
Оригинальное название: MDS comorbidity index
Тип: шкала оценки
Назначение: клиническая оценка коморбидности
Содержание и интерпретация:
Шкала коморбидности для пациентов с МДС (MDS-CI)
Сопутствующие заболевания
Баллы
Болезни сердца
аритмия
заболевания клапанов
ишемическая болезнь или инфаркт миокарда
застойная сердечная недостаточность
2
Поражение печени средней и тяжелой степени
цирроз
фиброз
персистирующая гипербилирубинемия > 1,5 x ВГН или
АСТ/АЛТ > 2,5 x ВГН
1
Поражение легких тяжелой степени
диффузная способность и/или объем форсированного выдоха
за 1 с ![]() 65% или диспноэ в покое или необходимость в оксигенации
65% или диспноэ в покое или необходимость в оксигенации
1
Болезни почек
персистирующая креатининемия > 2 мг/дл
гемодиализ
трансплантация
1
Солидная опухоль
опухоль в анамнезе, за исключением немеланомного рака кожи
1
По сумме баллов, присвоенных каждому показателю, определяется прогностический вариант MDS-CI: низкий (0), промежуточный (1 - 2) и высокий (![]() 3 баллов). Последующее применение индекса коморбидности позволяет стратифицировать пациентов из группы низкого и промежуточного риска (но не высокого и очень высокого) на группы с разной выживаемостью. При прочих равных условиях высокое значение индекса MDS-CI как увеличивает риск смерти от причин, не связанных с трансформацией в ОЛ (HR 2,46; p < 0,001), так и уменьшает показатели ОВ в целом (HR 2,09; p < 0,001).
3 баллов). Последующее применение индекса коморбидности позволяет стратифицировать пациентов из группы низкого и промежуточного риска (но не высокого и очень высокого) на группы с разной выживаемостью. При прочих равных условиях высокое значение индекса MDS-CI как увеличивает риск смерти от причин, не связанных с трансформацией в ОЛ (HR 2,46; p < 0,001), так и уменьшает показатели ОВ в целом (HR 2,09; p < 0,001).
Приложение Г4
ШКАЛА
КОМОРБИДНОСТИ ДЛЯ ПАЦИЕНТОВ, КОТОРЫМ ПЛАНИРУЕТСЯ
ТРАНСПЛАНТАЦИЯ АЛЛОГЕННЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
У пациентов, которым планируется трансплантация гемопоэтических стволовых клеток (Трансплантация костного мозга), необходимо оценивать коморбидность пациента по индексу коморбидности ТКМ (HCT-CI) [105].
Оригинальное название: Hematopoietic cell transplantation comorbidity index
Тип: шкала оценки
Назначение: клиническая оценка коморбидности
Содержание и интерпретация:
Шкала коморбидности для пациентов, которым планируется трансплантация гемопоэтических стволовых клеток (Трансплантация костного мозга) (HSC-CI) [105]
Коморбидность
Баллы
Патология сердечно-сосудистой системы
Мерцательная аритмия или трепетание, синдром слабости синусового узла или желудочковые аритмии
1
ИБС, застойная сердечная недостаточность, инфаркт миокарда или ФВ < 50%:
1
Пороки сердца за исключением пролапса митрального клапана
3
Патология дыхательной системы
Объем форсированного выдоха за первую секунду < 65% или одышка в покое или потребность в кислородной поддержке
3
Объем форсированного выдоха за первую секунду 66 - 80% или одышка при небольшой физической нагрузке
2
Патология ЖКТ
Хронический гепатит, повышение билирубина до 1,5 норм или АЛТ/АСТ до 2,5 норм
1
Цирроз печени, билирубин > 1,5 норм или АЛТ/АСТ > 2,5 норм
3
Болезнь Крона или язвенный колит
1
Язвы ЖКТ, требующие лечения
2
Патология мочевыделительной системы
Креатинин более 200 мкмоль/л, диализ или почечный трансплантат
2
Патология эндокринной системы
Сахарный диабет, требующий лечения инсулином или пероральными препаратами
1
ИМТ более 35 кг/м2
1
Патология соединительной ткани
Системная красная волчанка, ревматоидный артрит, полимиозит, болезни соединительной ткани
2
Неврологический и психический статус
Транзиторная ишемическая атака или цереброваскулярные "события"
1
Депрессия или тревога, требующие психиатрической консультации или лечения
1
Инфекционные осложнения
Инфекции, требующие продолжения терапии после дня 0
1
Опухолевые заболевания в анамнезе
Терапия солидных опухолей в анамнезе, за исключением не меланомы кожи
3
