"Клинические рекомендации "Злокачественные новообразования костей и суставных хрящей: остеосаркома, саркома Юинга"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ КОСТЕЙ И СУСТАВНЫХ ХРЯЩЕЙ:
ОСТЕОСАРКОМА, САРКОМА ЮИНГА
Год утверждения (частота пересмотра): 2024 Пересмотр не позднее: 2026
ID: 70_2
Возрастная категория: Дети
Специальность:
Разработчик клинической рекомендации Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БСВ - бессобытийная выживаемость
ВОЗ - всемирная организация здравоохранения
ГКО - гигантоклеточная опухоль
Г-КСФ - гранулоцитарный колониестимулирующий фактор
ЗНО - злокачественное новообразование
ИГХ - иммуногистохимия
КУ - контрастное усиление
ЛДГ - лактатдегидрогеназа
ЛТ - лучевая терапия
МНО - международное нормализованное отношение
МРТ - магнито-резонансная томография
МСКТ - мультиспиральная компьютерная томография
НП - нутритивная поддержка
ОАК - общий (клинический) анализ крови
ОВ - общая выживаемость
ОС - остеосаркома
ОФД - остеофиброзная дисплазия
ОФЭКТ/КТ - однофотонная эмиссионная компьютерная томография, совмещенная с компьютерной томографией костей всего тела
ПП - парентеральное питание
ПХТ - полихимиотерапия
ПЦР - полимеразная цепная реакция
ПЭТ/КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией
РД - разовая доза
РОД - разовая очаговая доза
рчГ-КСФ - рекомбинантный гранулоцитарный колониестимулирующий фактор человека
СД - суммарная доза
СОД - суммарная очаговая доза
СЮ - саркома Юинга
ТГСК - трансплантация гемопоэтических стволовых клеток
ТРЭ - тотальный расход энергии
УЗИ - ультразвуковое исследование
ХС - хондросаркома
ЦВК - центральный венозный катетер
ЩФ - щелочная фосфатаза
ЭДТА - этилендиаминтетрауксусная кислота
ЭКГ - регистрация электрокардиограммы
ЭОК - экстраоссальный опухолевый компонент
ЭОП - электронно-оптический преобразователь
ЭП - энтеральное питание
ЭХО-КГ - эхокардиография
ЭЭГ - электроэнцефалография
AP - режим химиотерапии: доксорубицин**, цисплатин**
BuMel - режим кондиционирования бусульфан**/мелфалан**
CTV - clinical target volume
FISH - флуоресцентая гибридизация in situ
GTV - gross tumor volume
IE - режим химиотерапии: ифосфамид**, этопозид**
М - метотрексат**
PTV - planning target volume
TreoMel - режим кондиционирования треосульфан/мелфалан**
18F-ФДГ - флудезоксиглюкоза [18F]
Термины и определения
Бессобытийная выживаемость (БСВ) оценивается как период времени, прошедший от момента постановки диагноза до неблагоприятного события, под которым понимают рецидив, прогрессию заболевания, развитие вторичной злокачественной опухоли, смерть от любой причины, или даты последнего наблюдения за пациентом.
Общая выживаемость (ОВ) оценивается как период времени, прошедший от момента постановки диагноза до смерти пациента от любых причин или до последнего наблюдения за пациентом.
Прогрессия заболевания - появление на фоне проводимого лечения любого нового опухолевого очага или увеличение ранее существующего доступного измерению очага более чем на 25%.
Рецидив заболевания - появление любых новых опухолевых очагов у пациентов, достигших ремиссии заболевания.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Остеосаркома (ОС) - первично злокачественная опухоль костей, которая развивается из примитивных мезенхимальных стволовых клеток, продуцирующих патологический остеоид [1]. ОС является самой частой первичной злокачественной опухолью костей среди пациентов в группе от 10 до 18 лет [2].
Недифференцированные мелкокруглоклеточные саркомы - группа первично злокачественных новообразований костей, состоящих из мелких голубых круглых клеток, характеризующиеся типичными генетическими перестройками [1].
Саркома Юинга - высокозлокачественная опухоль, относящаяся к группе недифференцированных мелкокруглоклеточных сарком, характеризующаяся слиянием генов семейства FET (обычно EWSR1) с одним из членов семейства ETS [1].
Круглоклеточная саркома с перестройкой EWSR1-non-ETS - высокозлокачественная опухоль, относящаяся к группе недифференцированных мелкокруглоклеточных сарком, характеризующаяся абберациями в генах EWSR1 или FUS с партнерами, не связанных с семейством генов ETS [1].
CIC-перестроенная саркома - высокозлокачественная круглоклеточная недифференцированная саркома, характеризующая перестройками гена CIC, в большинстве случаев CIC-DUX [1].
Саркома с генетической альтерацией гена BCOR - высокозлокачественная опухоль, также относящаяся к группе недифференцированных мелкокруглоклеточных сарком, характеризующаяся генетической альтерацией гена BCOR, его онкогенной активацией и гиперэкспрессией [1].
Хондросаркома - термин, определяющий гетерогенную группу первично злокачественных опухолей костей, характеризующихся образованием опухолевыми клетками хрящевого матрикса [1].
Гигантоклеточная опухоль (ГКО) - остеолитичное новообразование костей скелета, относящееся к опухолям с промежуточным биологическим потенциалом, и характеризующееся локально агрессивным ростом, высокой частотой локальных рецидивов и низким метастатическим потенциалом [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Патогенез и этиология злокачественных опухолей костей в настоящий момент остается неизвестной. Эти заболевания являются мультифакторными и не имеют определенных драйверных мутаций. Генетические перестройки между генами семейств EWS и ETS вовлечены в патогенез саркомы Юинга [1, 3]. Большинство случаев остеосаркомы являются спорадическими. Реже развитие ОС ассоциировано с наличием у пациента наследственного синдрома предрасположенности к опухолям, к которым относятся синдром Ли-Фраумени (мутация гена TP53), наследственная ретинобластома (мутация в гене RB1), синдром Ротмунда-Томсона 2 типа (мутация в гене RecQ4), синдром Вернера (мутация в гене WRN), синдром Блума (мутация в гене BLM), анемия Даймонда-Блекфена [4]. Единственным достоверно изученным экзогенным фактором риска развития остеосаркомы является ионизирующее излучение [5].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Первичные злокачественные опухоли костей составляют около 0,2% среди всех злокачественных новообразований [6]. Среди пациентов младше 18 лет, злокачественные образования костей занимают 8 место с пиком заболеваемости во втором десятилетии жизни. На долю ЗНО костей приходится до 0,5% среди пациентов младше 5 лет, 5% в группе от 5 до 9 лет, и 14% в группе от 10 до 18 лет. Общая заболеваемость составляет 4.4 случая на 1 миллион детского населения. Соотношение мальчики: девочки составляет 1,4:1 [2, 7, 8].
Остеосаркома является самой частой первичной злокачественной опухолью костей среди детей и подростков, на ее долю приходится до 56% всех случаев ЗНО костей у детей [2]. Первичный очаг расположен, как правило, в метаэпифизах длинных трубчатых костей - чаще бедренной, большеберцовой и плечевой костях. Реже могут поражаться кости черепа, кости таза [7, 8]. Заболеваемость остеосаркомой составляет 4.8 случая на 1 миллион детского населения [8].
Саркома Юинга и другие опухоли, входящие в группу недифференцированных мелкокруглоклеточных сарком, занимают второе место в структуре злокачественных новообразований костей среди пациентов младше 18 лет. На их долю приходится до 34% всех случаев [2, 7, 8]. В отличие от остеосаркомы, саркома Юинга преимущественно поражает кости осевого скелета, а именно кости таза, позвонки, ребра, кости черепа (45%), реже процесс вовлекает диафизы длинных трубчатых костей верхних и нижних конечностей (14% и 29% соответственно) [8]. Заболеваемость саркомой Юинга составляет 2.9 случая на 1 миллион детского населения [8].
Хондросаркома, являющаяся самой частой первичной злокачественной опухолью костей во взрослой популяции, среди пациентов младше 18 лет занимает третье место, уступая остеосаркоме и саркоме Юинга [8, 9]. Общая заболеваемость хондросаркомой составляет 0.5 случая на 1 миллион детского населения [8]. Выделяют первичную (возникшую de novo) и вторичную хондросаркому, возникающую вследствие злокачественной трансформации доброкачественных хрящеобразующих образований, таких как энхондрома или остеохондрома (костно-хрящевой экзостоз). Злокачественная трансформация энходром при болезни Олье (энхондроматоз) и синдроме Мафуччи (энхондроматоз ассоциированный с сосудистыми образованиями) достигает 45% и 57% соответственно [10, 11].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
D48.0 - Новообразование неопределенного или неизвестного характера костей и суставных хрящей
C40 Злокачественное новообразование костей и суставных хрящей конечностей:
C40.0 - Злокачественное новообразование лопатки и длинных костей верхней конечности
C40.1 - Злокачественное новообразование коротких костей верхней конечности
C40.2 - Злокачественное новообразование длинных костей нижней конечности
C40.3 - Злокачественное новообразование коротких костей нижней конечности
C40.8 - Злокачественное новообразование костей и суставных хрящей конечностей, выходящее за пределы одной и более вышеуказанных локализаций
C40.9 - Злокачественное новообразование костей и суставных хрящей конечности неуточненной локализации
C41 Злокачественное новообразование костей и суставных хрящей других и неуточненных локализаций:
C41.0 - Злокачественное новообразование костей черепа и лица
C41.1 - Злокачественное новообразование нижней челюсти
C41.2 - Злокачественное новообразование позвоночного столба
C41.3 - Злокачественное новообразование ребер, грудины и ключицы
C41.4 - Злокачественное новообразование костей таза, крестца и копчика
C41.8 - Злокачественное новообразование костей и суставных хрящей других и неуточненных локализаций, выходящее за пределы одной и более вышеуказанных локализаций
C41.9 - Злокачественное новообразование костей и суставных хрящей неуточненное
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В настоящее время опухоли костей классифицируются в соответствии с международной классификацией опухолей костей ВОЗ 2020 [1].
Остеогенные опухоли:
Высокодифференцированная (low-grade) центральная остеосаркома 9187/3
Остеосаркома БДУ 9180/3
Конвенциональная остеосаркома 9180/3
Телангиэктатическая остеосаркома 9180/3
Мелкоклеточная остеосаркома 9180/3
Паростальная остеосаркома 9192/3
Периостальная остеосаркома 9193/3
Низкодифференцированная (high grade) поверхностная остеосаркома 9194/3
Вторичная остеосаркома 9184/3
Классификация недифференцированных мелкокруглоклеточных опухолей:
Саркома Юинга 9364/3
Круглоклеточная саркома с перестройкой EWSR1-non-ETS 9366/3
CIC-перестроенная саркома 9367/3
Саркома с генетической альтерацией гена BCOR 9368/3
Хондрогенные опухоли:
Хондросаркома высоко дифференцированная (grade1) 9222/3
Хондросаркома умеренно дифференцированная (grade 2) 9220/3
Хондросаркома низко дифференцированная (grade 3) 9220/3
Периостальная хондросаркома 9221/3
Светлоклеточная хондросаркома 9242/3
Мезенхимальная хондросаркома 9240/3
Дедифференцированная хондросаркома 9243/3
Сосудистые опухоли
Эпителиоидная гемангиоэндотелиома 9133/3
Ангиосаркома 9120/3
Гигантоклеточные опухоли
Опухоль промежуточного биологического потенциала:
Гигатоклеточная опухоль кости 9250/1
Злокачественные:
Злокачественная гигантоклеточная опухоль 9250/3
Опухоли нотохорды
Хордома 9370/3
Низкодифференцированная хордома 9370/3
Дедифференцированная хордома 9372/3
Другие мезенхимальные опухоли кости
Адамантинома 9261/3
Лейомиосаркома 8890/3
Недифференцированная (плеоморфная) саркома 8830/3
Стадирование первичных злокачественных опухолей костей осуществляется в соответствии с классификацией AJCC 8-го пересмотра, основанной на гистологическом типе опухоли и степени ее дифференцировки (G), размера и локализации первичного очага (T), наличия или отсутствия поражения регионарных лимфатических узлов (N) или отдаленного метастазирования (M) [1, 9, 12, 13].
Таблица 1.
Критерий T (первичная опухоль расположена в костях конечностей, ребрах, костях черепа)
Категория T
Критерии
Tx
Первичный очаг не может быть оценен
T0
Нет признаков первичного очага
T1
Опухоль <= 8 см в наибольшем измерении
T2
Опухоль >= 8 см в наибольшем измерении
T3
"Прерывающийся" первичный очаг в пораженной кости
Таблица 2.
Критерий T (первичная опухоль расположена в позвонке)
Категория T
Критерии
Tx
Первичный очаг не может быть оценен
T0
Нет признаков первичного очага
T1
Образование ограничено 1 сегментом позвонка или 2 прилежащими сегментами
T2
Образование ограничено 3 сегментами позвонка
T3
Образование ограничено 4 и более сегментами позвонка
T4
Образование распространяется в позвоночный канал или сосуды
T4a
Распространение в позвоночный канал
T4b
Инвазия в крупные сосуды, наличие опухолевого тромба
Таблица 3.
Критерий T (первичная опухоль расположена в костях таза, крестце, копчике)
Категория T
Критерии
Tx
Первичный очаг не может быть оценен
T0
Нет признаков первичного очага
T1
Образование ограничено 1 сегментом таза без экстраоссального опухолевого компонента (ЭОК)
T1a
Опухоль <= 8 см в наибольшем измерении
T1b
Опухоль >= 8 см в наибольшем измерении
T2
Образование ограничено 1 сегментом таза с наличием ЭОК или 2 сегментами без признаков ЭОК
T2a
Опухоль <= 8 см в наибольшем измерении
T2b
Опухоль >= 8 см в наибольшем измерении
T3
Образование вовлекает 2 сегмента таза с наличием ЭОК
T3a
Опухоль <= 8 см в наибольшем измерении
T3b
Опухоль >= 8 см в наибольшем измерении
T4
Образование вовлекает 3 сегмента таза или пересекает крестцово-подвздошное сочленение
T4a
Опухоль вовлекает крестцово-подвздошное сочленение с. распространением в крестцовые отверстия
T4b
Опухоль вовлекает наружные подвздошные сосуды или имеют место признаки тромбоза крупных сосудов малого таза
Таблица 4.
Критерий N (поражение регионарных лимфатических узлов)
Категория N
Критерии
Nx
Регионарные лимфатические узлы не могут быть оценены
N0
Нет признаков метастатического поражения регионарных лимфатических узлов
N1
Метастатическое поражение регионарных лимфатических узлоы
Таблица 5.
Критерий M (отдаленные метастазы)
Категория M
Критерии
Mx
Недостаточно данных для определения отдаленных метастазов
M0
Нет признаков отдаленного метастазирования
M1
Имеются признаки отдаленного метастазирования
M1a
Метастатическое поражение легких
M1b
Метастатическое поражение других органов и тканей помимо легких (кости, костный мозг и др.)
Таблица 6.
Критерий G (степень дифференцировки опухоли)
Категория G
Критерии
Gx
Степень дифференцировки не может быть установлена
G1
Высокая степень дифференцировки
G2
Средняя степень дифференцировки
G3
Низкая степень дифференцировки
G4
Недифференцированные опухоли
Таблица 7.
Группировка критериев TNMG для определения стадии заболевания
Не применимо для опухолей, первичный очаг которых расположен в костях таза или позвонках
T
N
M
G
Стадия
T1
N0
M0
G1, высокая степень дифференцировки
IA
T2, 3
N0
M0
G1, высокая степень дифференцировки
IB
T1
N0
M0
G2, 3
IIA
T2
N0
M0
G2, 3
IIB
T3
N0
M0
G2, 3
III
Любое T
N0
M1a
Любое G
IVA
Любое T
N1
Любое M
Любое G
IVB
Любое T
Любое N
M1b
Любое G
IVB
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина при злокачественных новообразованиях костей обусловлена анатомической локализацией первичного очага и его размерами, степенью инвазии и компрессии прилежащих органов и тканей, а также анатомической локализацией метастазов. В исключительно редких случаях, заболевание протекает бессимптомно и может являться случайной находкой при проведении диспансерного наблюдения или обследования по поводу другого заболевания.
Как правило, ведущим симптомом является боль в проекции объемного образования, к которой в динамике может присоединиться припухлость, нарушение движения в прилежащем суставе, если образование расположено в костях конечностей. В 10 - 15% случаев у пациентов встречается патологический перелом на уровне объемного образования.
В случае поражения костей черепа, помимо боли в проекции образования, может возникнуть экзофтальм, нарушение носового дыхания. При локализации образования в области грудной клетки возможно развитие одышки, затрудненного дыхания, кашля.
При инвазии опухоли в спинномозговой канал, сдавлении периферических нервных стволов возможно развитие неврологической симптоматики в виде парезов, параличей, нарушение функции тазовых органов.
В дальнейшем у пациента может отмечаться появление общих симптомов интоксикации, лихорадка, снижение массы тела.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Все пациенты с подозрением на злокачественное новообразование костей требуют обсуждения междисциплинарной команды, которая состоит из врача рентгенолога, патологоанатома, хирурга-ортопеда и детского онколога [1, 12, 14, 15]. Диагностические мероприятия, необходимые для оценки распространенности и характера первичного очага должны быть выполнены до проведения биопсии образования. Точный гистологический диагноз часто не может быть установлен без корреляции с рентгенологической картиной [11, 16].
Все дети с подозрением на опухоль должны направляться в детские онкологические центры (медицинское учреждение не ниже второго уровня), оснащенные необходимым оборудованием для постановки диагноза.
Критерии установления диагноза/состояния: диагноз устанавливается на основании патогномоничных данных:
1. анамнестические данные
2. физикальное обследование
3. лабораторные исследования
4. инструментальное обследование
5. гистологическое исследование
6. цитогенетическое исследование
2.1 Жалобы и анамнез
- Всем пациентам с подозрением на ЗНО кости или с установленным диагнозом ЗНО кости рекомендуется тщательный сбор жалоб и анамнеза, в том числе наследственного и онкологического, для оценки состояния пациента, а также для выявления факторов, которые могут оказать влияние на выбор лечебной тактики [9, 14, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: сбор анамнеза должен включать подробный сбор семейного анамнеза, уточнение онкологического анамнеза - наличие доброкачественных или злокачественных опухолей у членов семьи, а также анамнеза жизни (наличие ретинобластомы или других перенесенных онкологических заболеваний, травм, оперативных вмешательств, лучевой терапии или контакта с ионизирующим излучением).
Выявление случаев опухолевого заболевания в семье или в анамнезе у пациента требует проведения медико-генетического консультирования для выявления генетических механизмов, лежащих в основе предрасположенности.
При сборе жалоб необходимо обратить внимание на длительность и характер болевого синдрома, сохраняющегося более 2 недель вне зависимости от наличия или отсутствия травмы в анамнезе. Рекомендован тщательный сбор анамнеза при наличии перелома без предшествующей травмы или с травмой, которая не должна была по силе воздействия вызвать перелом.
2.2 Физикальное обследование
- Всем пациентам с подозрением на ЗНО кости или установленным диагнозом ЗНО кости при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется визуальный осмотр пациента терапевтический, пальпация терапевтическая, аускультация терапевтическая [16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: первичное обследование пациента направлено на оценку общего статуса пациента, наличии интоксикационного синдрома, установление первичного очага, возможного наличия метастазов, определения объема инициального обследования, объема оперативного вмешательства с целью верификации опухоли. При оценке общего состояния пациента также рекомендовано использовать оценочные шкалы (см. приложение Г1, приложение Г2).
Первичный осмотр должен включать:
- антропометрические измерения (вес, рост и площадь поверхности тела) и оценку нутритивного статуса (процентили);
- оценку кожных покровов и слизистых;
- поиск и выявление пальпируемого образования: определение локализации, характеристики опухоли, степень функциональных нарушений;
- оценку костно-мышечной системы (выявление наличия болевого синдрома, выявление нарушения функции конечностей);
- оценку функции сердечно-сосудистой системы;
- оценку функции легочной системы;
- пальпацию живота;
- оценку размеров периферических лимфатических узлов;
- характеристику функции тазовых органов.
2.3 Лабораторные диагностические исследования
- Всем пациентам с подозрением на ЗНО кости или установленным диагнозом ЗНО кости при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется для уточнения состояния пациента, планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии выполнение следующих лабораторных исследований [15]:
- общий (клинический) анализ крови развернутый;
- анализ крови биохимический общетерапевтический с включением следующих параметров: определение активности лактатдегидрогеназы в крови (ЛДГ), определение активности аланинаминорансферазы в крови (АЛТ), определение активности аспартатаминотрансферазы в крови (АСТ), исследование уровня общего билирубина в крови, определение активности щелочной фосфатазы в крови, исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня калия в крови, исследование уровня натрия в крови, исследование уровня хлоридов в крови, исследование уровня кальция в крови (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
- коагулограмма (ориентировочное исследование системы гемостаза) с включением следующих параметров: определение протромбинового (тромбопластинового) времени в крови, определение международного нормализованного отношения (МНО), активированное частичное тромбопластиновое время (АЧТВ), исследование уровня фибриногена в крови, определение тромбинового времени в крови, определение активности антитромбина III в крови, исследование уровня плазминогена в крови, определение концентрации Д-димера в крови;
- общий (клинический) анализ мочи, а также исследование мочи методом Нечипоренко
- определение скорости клубочковой фильтрации: исследование функции нефронов по клиренсу креатинина (проба Реберга);
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем ранее не получавшим лечение пациентам со злокачественным новообразованием кости перед началом лечения рекомендуется определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора) для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [17, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.4 Инструментальные диагностические исследования
- Всем пациентам с подозрением на ЗНО кости рекомендовано на первом этапе проведение рентгенографии области первичного очага с захватом двух смежных суставов в двух проекциях [9, 12, 14, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: рентгенография позволяет провести первичную диагностику, выявить характерные для злокачественных новообразований рентгенологические признаки - очаг деструкции, в том числе с повреждением кортикального слоя кости, игольчатый периостит, "козырек" Кодмана (остеосаркома), "луковичный" периостит (саркома Юинга) и др.
- Всем пациентам с подозрением на ЗНО кости или верифицированным ЗНО кости при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендовано выполнение магнитно-резонансной томографии (МРТ) пораженной области с контрастным усилением [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: Исследование МРТ на сегодняшний день является методом выбора для оценки первичного очага, расположенного в костях конечностей, таза, черепа и позвоночника. Исследование позволяет оценить структуру и характер образования, его распространенность - протяженность по костно-мозговому каналу, наличие экстраоссального опухолевого компонента, его взаимодействие с прилежащими сосудисто-нервными структурами.
Крайне важным является проведение диагностических исследований до любых хирургических вмешательств (манипуляций), поскольку биопсия может существенно затруднить анализ полученных изображений.
При направлении на МРТ-исследование необходимо оценивать риски и наличие противопоказаний к проведению исследования, которые подразделяются на абсолютные и относительные. Для уточнения списка противопоказаний и при недостаточной осведомленности о противопоказаниях врача-специалиста, необходима консультация у врача-рентгенолога перед записью пациента на исследование.
Пациентам с установленными массивными металлоимплантами (эндопротезы) проведение МРТ исследования не рекомендуется, в связи с невозможностью его интерпритации из-за наличия артефактов. Методом выбора в данном случае является компьютерная томография (КТ) пораженной области с контрастным усилением.
Исследование выполняется в 3-х плоскостях с проведением контрастного усиления. Основные импульсные последовательности - режим с подавлением жировой ткани, T1 ВИ, T2 ВИ и DWI. После введения парамагнетика помимо T1 ВИ серии проводится T1 с режимом подавления сигнала от жировой ткани в аксиальной плоскости.
Измерение объема опухоли
Расчет объема опухоли (V) для опухолей эллипсоидной или округлой формы
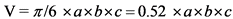 в см3
в см3
a = длина (в см)
b = ширина (в см)
c = толщина (в см)
Оценка инициального объема опухоли играет ключевую роль в выборе тактике лечения пациентов, а его измерения в динамике позволяют оценить ответ на проводимое лечение и провести ее модификацию, при необходимости.
- Всем пациентам с подозрением на ЗНО кости или верифицированным ЗНО кости при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендовано выполнение компьютерной томографии (КТ) пораженной области с контрастным усилением [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: Исследование КТ первичного очага может предоставить дополнительную информацию о характере образования (наличия кальцинации, периостита и деструкции кортикального слоя кости).
КТ и МРТ исследования не исключают и не заменяют друг друга. Для точной оценки костной патологии, оценки распространенности опухоли и постановки рентгенологического дифференциально-диагностического ряда оптимальным является комплексное обследование пациента с помощью сочетания МРТ и КТ исследований.
Исследование КТ является неотъемлемой частью предоперационного планирования, планирования реконструктивного оперативного вмешательства, при возможности его выполнения, а также изготовления индивидуального импланта.
- Всем пациентам с подозрением на ЗНО кости или выявленным ЗНО кости при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендовано выполнение КТ органов грудной полости с внутривенным болюсным контрастированием для исключения метастатического поражения легких [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: Стандартом первичной диагностики метастатического поражения легких при злокачественных новообразованиях костей является проведение КТ органов грудной полости с внутривенным болюсным контрастированием до начала специфической терапии.
Исследование выполняется с проведением 3 фаз - нативной, артериальной, венозной, с толщиной срезов не более 2,5 мм.
Результаты визуализации должны оцениваться экспертом-радиологом и обсуждаться с лечащим онкологом, так как легочное распространение опухоли играет критически важную роль в оценке распространенности опухолевого процесса.
При диагностике метастатических очагов используется несколько критериев: число, размеры, форма, структура и локализация. Но ни один из критериев не является 100% специфичным.
Признаком легочного метастазирования является присутствие одного или более легочных/плевральных очагов размером 10 мм, не менее двух очагов 5 - 10 мм, не менее двух очагов 5 - 10 мм или не менее пяти четко видных очагов менее 5 мм (если нет другого явного медицинского объяснения наличия этих очагов).
Более мелкие изолированные очаги (не более четырех мелких очагов < 5 мм) считаются сомнительными, кроме случаев, когда радиолог в достаточной мере уверен в их метастатической природе. В таких случаях можно провести биопсию, однако, в большинстве случаев она не рекомендуется.
У детей младше 10 лет следует обратить особое внимание на "атипичные легочные метастазы", так как подобные очаги поражения могут быть вызваны инфекцией. Может быть полезным исследование в динамике спустя небольшой промежуток времени.
- Всем пациентам с подозрением на ЗНО кости или выявленным ЗНО кости при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендовано выполнение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ/КТ) всего тела с флудезоксиглюкозой [18F] (18F-ФДГ) [9, 12, 14, 19, 20].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: все очаги, выявляемые по данным ПЭТ/КТ с 18F-ФДГ, должны быть подтверждены другими дополнительным методами визуализации (МРТ области выявленного очага с контрастным усилением).
Для минимизации количества ложно-положительных и ложно-отрицательных результатов инициальное исследование необходимо выполнять до начала лечения пациента. Направление на исследование должно сопровождаться максимально подробной выпиской, включающие даты и протоколы хирургических вмешательств, различных инструментальных исследований (заключения-протоколы визуализации и запись на внешние накопители - диски) и с указанием диагностированных инфекционных очагов (при их наличии).
- Всем пациентам с подозрением на ЗНО кости или выявленным ЗНО кости при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания при отсутствии возможности выполнить ПЭТ/КТ, а в некоторых случаях и в дополнение к ПЭТ/КТ рекомендовано выполнение сцинтиграфии костей скелета с соединениями технеция (99mTc) в режиме все тело с дополнительным выполнением протокола однофотонной эмиссионной компьютерной томографии, совмещенной с компьютерной томографией костей всего тела (ОФЭКТ/КТ) при наличии одиночного или нескольких сомнительных очагов гиперфиксации по результатам планарных изображений [9, 12, 14, 19, 20].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: все очаги, выявленные по данным сцинтиграфии костей скелета с соединениями технеция (99mTc), требуют дальнейшей оценки протоколом ОФЭКТ/КТ (при возможности), а также дополнительными методами визуализации (МРТ области выявленного очага с контрастным усилением).
Необходимо учитывать, что при выполнении исследования, физиологическая гиперфиксация радиофармацевтических средств для диагностики заболеваний костной ткани в зонах роста костей скелета не позволяет достоверно определить метастатическое поражение в этих областях.
- Всем пациентам с установленным диагнозом ЗНО кости при первичном обследовании, в процессе противоопухолевого лечения, включающего в себя препараты группы антрациклинов, перед каждым курсом полихимиотерапии, после окончания лечения, перед снятием с терапии рекомендуется регистрация электрокардиограммы (ЭКГ), расшифровка, описание и интерпретация электрокардиографических данных, а также выполнение эхокардиографии с определением фракции сердечного выброса для оценки функции сердечно-сосудистой системы, а также для контроля кардиологической токсичности у пациентов, получающих антрациклины и родственные соединения [21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при наличии снижения фракции выброса левого желудочка требуется консультация кардиолога, рассмотрение вопроса о редукции доз антрациклинов и родственных соединений.
- Всем пациентам с подозрением на ЗНО кости или установленным диагнозом ЗНО кости при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение ультразвукового исследования лимфатических узлов, органов брюшной полости (комплексного) [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: метастатическое поражение регионарных лимфатических узлов при злокачественных новообразованиях костей встречается исключительно редко. В случае подозрений на наличие метастатически измененных лимфатических узлов, требуется гистологическое подтверждение их поражения.
- Всем пациентам с верифицированным ЗНО кости при первичном обследовании, в процессе лечения и в динамическом наблюдении рекомендовано выполнение МРТ головного мозга с контрастным усилением для оценки нейротоксичности [22, 23, 24, 25, 26]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.5 Иные диагностические исследования
- Всем пациентам с подозрением на ЗНО кости по результатам клинического осмотра и инструментальных методов исследования рекомендована биопсия кости (объемного образования) с последующим патолого-анатомическим исследованием биопсийного (операционного) материала костной ткани, в том числе с применением иммуногистохимических и, при необходимости, цитогенетических методов для верификации диагноза [1, 9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: гистологическое исследование ткани опухоли является основным методом окончательной верификации диагноза у пациентов с ЗНО кости. Гистологический материал должен сопровождаться направлением, содержащим информацию о пациенте, длительности и характере заболевания, локализации очага поражения, описании биопсии с предоставлением протокола операции.
Весь необходимый объем диагностических мероприятий проводится до биопсии. В соответствии с ним принимается решение о проведении биопсии или, наоборот, отказе от нее.
Исследование МРТ пораженной области с контрастным усилением позволяет определить наиболее репрезентативную область в опухолевом очаге, найти наиболее короткий и безопасный путь к данной области. Проведение биопсии (хирургического вмешательства) до МРТ может не только привести к серьезным ошибкам в диагнозе, но и к осложнениям, влекущим за собой невозможность проведения органосохраняющего оперативного вмешательства и повышенному риску развития локального рецидива заболевания.
Стандарты выполнения биопсии:
1. Планирование места биопсии, по возможности, должно проводиться на междисциплинарном совещании при участии врача-онколога (детского онколога), врача-травматолога-ортопеда, врача-патологоанатома и врача-радиотерапевта или врача-радиолога. Это необходимо для выбора наиболее репрезентативного очага [27, 28, 29, 30].
2. Биопсия должна выполняться в специализированном онкологическом стационаре, при возможности, в операционной, оснащенной C-дугой (ЭОП), под общей анестезией [28, 29]. Допустимо проведение биопсии в региональном центре - областной больнице (медучреждение 2-го уровня) по согласованию с федеральным центром (локализация доступа, объем материала, вид биопсии), где в дальнейшем будет проводиться этап локального контроля - удаление опухоли.
3. При выполнении биопсии должен учитываться будущий операционный доступ (операция по удалению опухоли), на конечностях разрез должен быть продольный, при постановке дренажной системы типа Редон его точка выхода должна быть на одной линии с разрезом. По возможности, разрез должен быть не более 4 - 5 см [27, 31].
4. Техника проведения должна быть максимально аккуратной и щадящей. Необходимо исключить работу инструментом за пределами биопсийного тракта, в целях предотвращения контаминации опухолевыми клетками окружающих тканей. Не допускать повреждения анатомических границ между компартментами [27, 28, 32].
5. Забор материала лучше делать скальпелем или сосудистыми ножницами, чтобы избежать его повреждения [28].
6. При необходимости забора костной ткани - выполняется остеотомия в виде овала или прямоугольника с закругленными краями. Форма квадрата, прямоугольника, круг - должны быть исключены. При необходимости увеличения костного окна, в целях сохранения опороспособности кости, окно увеличивается в продольном направлении, ни в коем случае не в поперечном [27, 30].
7. Количество забранного материала должно быть достаточным для проведения всех видов гистологического исследования (при необходимости в операционную приглашается врач-патологоанатом для визуальной оценки материала), проведения цитогенетического исследования биопсийного (операционного) материала, для его консервации в био-банке, а также для архива и на случай необходимости пересмотра в референс-центрах [27, 28, 30].
8. При дифференциальном диагнозе с остеомиелитом необходимо дополнительно часть материала отправлять на бактериологическое исследование [27].
9. Как правило, биопсии проводят без наложения жгута, так как это может помешать проведению адекватного гемостаза. Если жгут все же используется, то его категорически нельзя накладывать на область, пораженную опухолью. Снимать его необходимо до ушивания раны, с целью проведения гемостаза [27, 28, 29].
Морфологическая диагностика опухолей костей представляет собой большую сложность, что связано с большим разнообразием нозологических форм и подтипов опухоли.
Достаточным может считаться объем материала, необходимый для достоверной верификации клинического диагноза и может варьировать от 3 - 5 мм диаметром до 1 - 1,5 см в наибольшем измерении. При невозможности избежать фрагментации материала суммарный объем должен составлять не менее 1,5 см3. Полученный после хирургических манипуляций материал сразу помещается в раствор 10% забуференного (pH 7,4) раствора формалина (с соответствующей разборчивой маркировкой) и направляется в патологоанатомическое отделение не позднее 1 суток с момента биопсии/операции. Крупные объекты исследования описываются (размер, цвет, состояние краев резекции и др.), производится распил по длиннику кости (опухоли), после чего производится параллельный распил с целью получения пластинки макропрепарата толщиной не более 0,3 - 0,4 см. После декальцинации (только с использованием специальных декальцинирующих растворов) производится разметка на квадранты, полученная карта макропрепарата фиксируется в протоколе исследования. Если при макроскопическом исследовании не представляется возможным судить о радикальности иссечения опухоли, применяют специальные окраски для маркировки краев резекции (отмечается в протоколе исследования). Сроки выполнения исследования не должны превышать 14 рабочих дней (включая все этапы: фиксация, декальцинация, гистологическая проводка, микротомия, окраска и заключение срезов).
В случае необходимости выполнения ИГХ исследования срок не должен превышать 5 рабочих дней. Для диагностики конвенциональной остеосаркомы следует ориентироваться на наличие признаков выраженной клеточной атипии и продукцию патологического остеоида. Для диагностики хондросаркомы следует ориентироваться на повышенную клеточность, инвазивный характер роста, миксоидный матрикс, наличие фигур митозов. Для диагностики саркомы Юинга необходимо провести ИГХ исследование (как минимум CD99-мембранный локус экспрессии) с последующим цитогенетическим исследованием (перестройка гена EWSR1/FUS). Для диагностики гигантоклеточной опухоли следует ориентироваться на наличие мононуклеарного неопластического компонента, гигантских многоядерных остеокластоподобных клеток; при ИГХ исследовании - на экспрессию G34W (H3F3A). Мутации IDH1 и IDH2 при классической хондросаркоме и амплификация MDM2 при паростальной и интрамедуллярной остеосаркоме низкой степени злокачественности не являются обязательными, но могут быть полезными для дифференциального диагноза.
Заключение формулируется с указанием локализации патологического процесса, конкретной нозологической единицы, с обязательным указанием кода по МКБ. Помимо этого, для опухолей костей необходимо указать ICD-O код.
- Всем пациентам с подозрением на саркому Юинга или другую недифференцированную мелкокруглоклеточную саркому кости с целью исключения метастатического поражения костного мозга при первичном обследовании, в процессе терапии (при подтверждении его поражения) и после окончания лечения перед снятием с терапии рекомендовано получение цитологического препарата костного мозга путем пункции (пункция костного мозга) с последующим цитологическим исследованием мазка костного мозга (миелограмма) [9, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: поражение костного мозга при саркоме Юинга и других недифференцированных мелкокруглоклеточных саркомах является очаговым. В связи с этим пункция костного мозга из одной точки не является приемлемой. Требуется выполнение костномозговых пункций из 4 различных точек. Целесообразно в случае выполнения пункции костного мозга приготовить по 10 стекол из каждой точки. Таким образом, при выполнении пункции костного мозга из 4 точек общее число стекол составит 40.
В случае выявления поражения костного мозга при первичном обследовании перед началом противоопухолевой терапии необходимо проведение повторной пункции костного мозга из четырех точек после 3 курсов ПХТ, после окончания лечения с целью оценки ответа на проведенную терапию и определения санации костного мозга.
- Всем пациентам с подозрением на саркому Юинга или другую недифференцированную мелкокруглоклеточную, высокодифференцированную центральную остесаркому, хондросаркому показано выполнение молекулярно-генетических исследований в зависимости от подозреваемого типа опухоли [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: молекулярно-генетические маркеры являются высокоспецифичными (патогномоничными) критериями отдельных типов сарком костей. Целесообразность их выявления и необходимый перечень определяются гистологическим типом опухоли и диагностической задачей, стоящей перед патологом. Материалом для проведения исследования является ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. Назначение цитогенетических и молекулярно-генетических диагностических методик осуществляется врачом-патологоанатомом, который готовит материал для соответствующего исследования. Проведения данных диагностических методик возможно только в условиях референс-лаборатории.
Таблица 8. Специфические транслокации при саркомах костей
Тип опухоли
Генетические события
Химерные транскрипты
Саркома Юинга
t(11;22)(q24;q12)
EWSR1-FLI1
t(21;22)(q22;q12)
EWSR1-ERG
t(2;22)(q36;q12)
EWSR1-FEV
t(7;22)(p22;q12)
EWSR1-ETV1
t(17;22)(q21;q12)
EWSR1-ETV4
Саркома с перестройками EWSR-non-ETS
t(20;22)(q13.2;q12.2)
EWSR1-NFATC2
t(16;20)(p11;q13)
FUS-NFATC2
inv (22)
EWSR1-PATZ1
CIC-перестроенная саркома
t(4;19)(q35;q13)
CIC-DUX4
t(10;19)(q26;q13)
t(X;19)(q13;q13)
CIC-FOXO4
t(10;19)(q23;q13)
CIC-NUTM2A
Саркома с генетической альтерацией гена BCOR
inv(X)(p11.4p11.22)
BCOR-CCNB3
t(X;4)(p11;q31)
BCOR-MAML3
t(10;17)(q23;p13)
YWHAE-NUTM2B
BCOR-ITD; внутренняя тамдемная дупликация гена BCOR
Хондросаркома
мутации IDH1, IDH2
Мезенхимальная хондросаркома
t(8;8)(q13;q21)
HEY1-NCOA2
t(1;5)(q42;q32)
IRFBP2-CDX1
Центральная (low grade) остеосаркома
amp 12q13-q15 (амплификация CDK4, MDM2)
- Всем пациентам с выявленным ЗНО кости перед началом терапии рекомендуется в зависимости от сопутствующей патологии прием (осмотр, консультация) врача-кардиолога, врача-невролога, врача-офтальмолога и других врачей-специалистов для определения необходимости терапии сопутствующих заболеваний [14, 21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.5.1 Обследования в процессе терапии
Обследования перед курсом полихимиотерапии
- Перед каждым курсом химиотерапии рекомендована оценка общего состояния с проведением физикального обследования, контроль лабораторных показателей. При планируемом введении антрациклинов и их производных в блоке полихимиотерапии (ПХТ) рекомендуется проведение эхокардиографии (ЭХО-КГ) до начала введения противоопухолевых препаратов. При планируемом введении алкилирующих средств (ифосфамид**, циклофосфамид**) рекомендовано проведение тестов тубулярной реабсорбции или исследование функции нефронов по клиренсу креатинина (проба Реберга) до начала введения химиопрепаратов с целью определения функции органа [16, 17, 21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: объем обследований перед курсом ПХТ определяется индивидуально для каждого пациента исходя из клинической ситуации, локализации опухоли, опухолевого распространения и объема терапии и сопутствующей патологии на усмотрение врача.
Контрольные обследования в процессе полихимиотерапии
- С целью оценки ответа на проводимое лечение рекомендовано выполнять обследования, используя те же методы, что и при инициальном обследования [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: для пациентов с остеосаркомой рекомендовано выполнение обследования в объеме МРТ области первичного очага с контрастным усилением, КТ органов грудной клетки с контрастным усилением, МРТ исследований метастатических очагов других локализаций, выявленных при инициальной диагностике после 6 недели терапии или после 4 курса неоадъювантной ПХТ. Затем исследования на фоне лечения выполняются не реже 1 раза в 2 месяца. В случае установки металлоимпланта, рекомендовано выполнение КТ области первичного очага с контрастным усилением.
Для пациентов с саркомой Юинга и другими недифференцированными мелкокруглоклеточными саркомами костей рекомендовано выполнение обследования в объеме МРТ области первичного очага с контрастным усилением, КТ органов грудной клетки с контрастным усилением, МРТ исследований метастатических очагов других локализаций, выявленных при инициальной диагностике, а также получения цитологического препарата костного мозга путем пункции после 6 и 12 недель терапии, что соответствует 3 и 6 курсам неоадъювантной ПХТ. Затем исследования на фоне лечения выполняются не реже 1 раза в 2 месяца. В случае установки металлоимпланта, рекомендовано выполнение КТ области первичного очага с контрастным усилением.
2.5.2 Оценка ответа на терапию
- Всем пациентам с верифицированным ЗНО кости рекомендовано проведение оценки ответа на проводимое лечение. Для определения ответа на проведенную терапию проводится волюметрическая оценка опухоли с помощью МРТ и/или КТ исследований. По возможности необходимо проведение того же исследования, что и проводилось при инициальном обследовании. Должны быть зафиксированы размеры опухоли в трех измерениях, для их сравнения следует по возможности использовать размеры на тех же уровнях, которые были выбраны при инициальной диагностике [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.5.3 Исследования перед завершением терапии
- Всем пациентам с верифицированным ЗНО костей перед завершением терапии рекомендовано выполнять обследование после проведения последнего, предусмотренного программной терапией курса ПХТ, в объеме [12, 16, 21]:
1. Детального физикального и неврологического обследования
2. Контроля лабораторных показателей (общий (клинический) анализ крови, анализ крови биохимический (общетерапевтический), общий (клинический) анализ мочи, коагулограмма (ориентировочное исследование системы гемостаза))
3. ЭХО-КГ, ЭКГ
4. Другие исследования по показаниям (например, электроэнцефалография (ЭЭГ), аудиометрия, исследование глазного дна, МРТ головного мозга с контрастным усилением)
5. КТ органов грудной клетки с контрастным усилением
6. МРТ области первичного очага с контрастным усилением или КТ области первичного очага с контрастным усилением
7. Цитологическое исследование мазка костного мозга (миелограмма) из 4 точек в случае его инициального метастатического поражения
8. ПЭТ/КТ всего тела
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: объем исследований перед завершением терапии определяется индивидуально для каждого пациента исходя из клинической ситуации и опухолевого распространения
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Выбор тактики лечения определяется в зависимости от возраста пациента, стадии заболевания, размера и локализации опухоли, степени дифференцировки опухоли [9, 16, 33].
При выборе тактики и проведении терапии следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Терапия пациентов с саркомами костей основывается на мультидисциплинарном подходе и должна осуществляться в специализированных центрах, имеющих опыт лечения данной группы пациентов. Основу терапии составляет применение адекватной системной терапии и локального контроля [9, 12, 16, 33]. Для этого используются хирургический метод, химиотерапия и лучевая терапия. Порядок назначения того или иного метода, а также его проведение зависит от размера опухоли, ее протяженности, гистологического варианта, локализации, резектабельности опухоли и возраста пациента.
Во всех случаях верифицированной злокачественной опухоли кости у пациентов младше 2 лет целесообразно обсуждение лечебной тактики в рамках консилиума и привлечением медицинского учреждения федерального уровня [12].
3.1 Лечение пациентов с остеосаркомой.
- Всем пациентам с верифицированной остеосаркомой высокой степени злокачественности рекомендовано комбинированное лечение, которое включает в себя неоадъювантную (предоперационную) полихимиотерапию, оперативное вмешательство и адъювантную (послеоперационную) ПХТ [9, 12, 14, 34, 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарий: Неоадъювантная и адъювантная ХТ в сочетании с радикальным хирургическим лечением позволяет повысить общую 5-летнюю выживаемость при остеосаркоме до 71%, а при локализованной форме - приблизить к 80%.
Оптимальное начало индукционной ХТ - не позднее 1 - 2 недель с момента диагностической биопсии кости (объемного образования). Предоперационное лекарственное лечение оказывает раннее воздействие на микрометастазы и улучшает условия для радикального локального лечения.
Эффективностью в отношении остеосарком обладают доксорубицин**, цисплатин**, высокодозный метотрексат**, высокодозный ифосфамид** [36, 37, 38].
Режим ПХТ по схеме МАР (AP: доксорубицин**, цисплатин**, М: высокодозный метотрексат**) является предпочтительным для пациентов младше 18 лет (см. схему 1).
Схема 1. Терапия пациентов с остеосаркомой
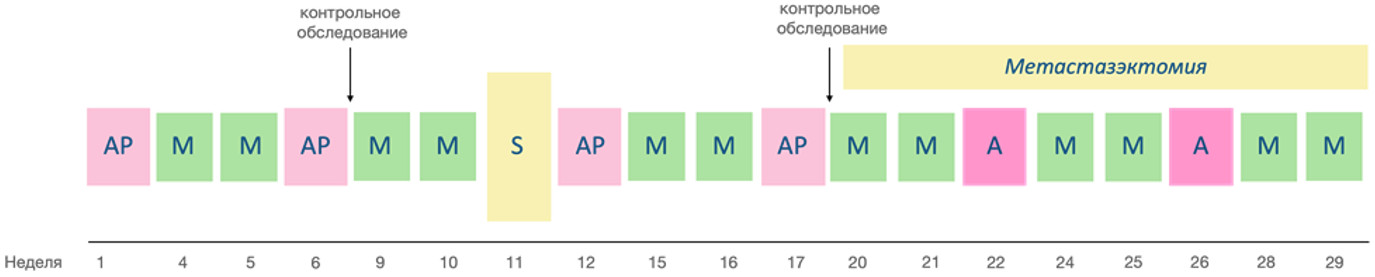
Курс AP:
Доксорубицин** - 37,5 мг/м2/сут, 48-часовая непрерывная инфузия, 1 - 2 сутки (СД = 70 мг/м2)
Цисплатин** - 40 мг/м2/сут, 72 часовая непрерывная инфузия 1 - 3 сутки (СД = 120 мг/м2), либо 60 мг/м2/сут, в виде 4-х часовой инфузии 1 - 2 сутки (СД = 120 мг/м2)
Сопроводительная терапия [12, 17, 39, 40, 143]:
Блок химиотерапии проводится на фоне гидратации 3000 мл/м2/сут, непрерывной инфузией, не позднее чем за 4 часа до начала введения цисплатина**. С целью снижения риска развития нефротоксичности, целевые значения темпа диуреза составляют > 100 мл/ч. Обязательным является плановое назначение #маннитола** (8 г/м2): введение #маннитола** 20% в дозе 40 мл/м2 или введение #маннитола** 15% в дозе 53 мл/м2 в/в медленно непосредственно перед введением цисплатина**. В случае непрерывной инфузии цисплатина** в течение 24 часов, введение #маннитола** (8 г/м2) осуществляется 4 раза в сутки (т.е. каждые 6 часов) в дни введения цисплатина**.
Пациентам, у которых курс химиотерапии сопровождается осложнением в виде выраженной затянувшейся нейтропении (вне зависимости от того, сопровождается ли она нейтропенической лихорадкой), рекомендовано использование рекомбинантного гранулоцитарного колониестимулирующего фактора человека [рчГ-КСФ] (Г-КСФ). Г-КСФ вводится подкожно в дозе в соответствии с инструкцией к применению лекарственного препарата. Его следует вводить не ранее чем через 24 часа от окончания введения химиопрепаратов до тех пор, пока абсолютное число нейтрофилов не будет составлять более 0,5 x 109/л в послеблоковом периоде [39, 143].
Антиэметическая терапия (см. приложение А3)
Критерии начала курса ПХТ:
- нейтрофилы >= 0,75 x 109/л
или лейкоциты >= 2 x 109/л
- тромбоциты >= 75 x 109/л
- билирубин <= 1,25 x верхняя граница нормы
- СКФ >= 70 мл/мин/1,73 м2
- ФВ левого желудочка >= 50%
В случае несоответствия критериев начала ПХТ необходимо отложить начало блока с контролем показателей через 2 - 3 дня.
В случае задержки начала блока более чем на 7 дней ввиду миелосупрессии несмотря на введение Г-КСФ, рекомендовано снижение дозы цисплатина на 25%.
Курс М:
Метотрексат** - 12000 мг/м2 в/в кап. За 4 часа
Важным является проведение именно пары метотрексатов** на 1 и 8 день.
Сопроводительная терапия [12, 17, 39]:
Блок химиотерапии проводится на фоне гидратации 3000 мл/м2/сут, непрерывной инфузией, не позднее чем за 4 часа до начала введения метотрексата** (с облигатным назначением натрия гидрокарбоната** - 60 ммоль на 1 литр натрия хлорида** или декстрозы** 5%: (60 мл 7,5% раствора натрия гидрокарбоната** либо 100 - 120 мл 4% раствора натрия гидрокарбоната**)).
Оценка pH мочи - целевое значение 7 - 8
Облигатное введение кальция фолината** начиная с 24 часа от начала инфузии метотрексата** и продолжая до тех пор, пока уровень метотрексата** в сыворотке крови не станет менее 0,1 мкмоль/л.
Оценка концентрации метотрексата крови проводится на 24, 48, 72 ч и продолжается до тех пор, пока уровень метотрексата** в сыворотке крови не станет менее 0,1 мкмоль/л. Кальция фолинат** вводится в дозе 15 мг/м2 каждые 6 часов, начиная с 24 ч от начала инфузии метотрексата**, с последним введением через 6 часов от момента, когда его концентрация достигла 0,1 мкмоль/л.
Верхняя граница концентрации метотрексата на 24 ч - 8 мкмоль/л, 48 ч - 1 мкмоль/л, 72 час - 0,1 мкмоль/л.
При задержке выведения метотрексата** показано увеличение дозы кальция фолината** по формуле: (60 мг/м2 x L): 2 = суточная доза кальция фолината** (мг), где L - концентрация метотрексата в сыворотке крови.
Пациентам, у которых курс химиотерапии сопровождается осложнением в виде выраженной затянувшейся нейтропении (вне зависимости от того, сопровождается ли она нейтропенической лихорадкой), рекомендовано использование рекомбинантного гранулоцитарного колониестимулирующего фактора человека [рчГ-КСФ] (Г-КСФ). Г-КСФ вводится подкожно в дозе в соответствии с инструкцией к применению лекарственного препарата. Его следует вводить не ранее чем через 24 часа от окончания введения химиопрепаратов до тех пор, пока абсолютное число нейтрофилов не будет составлять более 0,5 x 109/л в послеблоковом периоде [39, 143].
Антиэметическая терапия (см. приложение А3)
Критерии начала курса ПХТ:
- нейтрофилы >= 0,25 x 109/л
или лейкоциты >= 1 x 109/л
- тромбоциты >= 50 x 109/л
- билирубин <= 1,25 x верхняя граница нормы
- СКФ >= 70 мл/мин/1,73 м2
- ФВ левого желудочка >= 50%
- pH мочи > 7 непосредственно перед введением метотрексата
- возможность оценки концентрации метотрексата в сыворотке крови
- показатели АЛТ/АСТ < 5 норм
- отсутствие скопления жидкости в "третьем пространстве", т.е. в плевральных полостях, брюшной полости, послеоперационных зон, т.к. метотрексат** может задерживаться в них и вызывать ожоги.
Курс A:
Доксорубицин** - 37,5 мг/м2/сут, 48-часовая непрерывная инфузия, 1 - 2 сутки (СД = 70 мг/м2)
Сопроводительная терапия [12, 17, 39]:
Гидратация - 3000 мл/м2, непрерывная инфузия, за 24 часа до начала введения доксорубицина**, в 1 - 2 день курса ПХТ и 24 ч. после
Пациентам, у которых курс химиотерапии сопровождается осложнением в виде выраженной затянувшейся нейтропении (вне зависимости от того, сопровождается ли она нейтропенической лихорадкой), рекомендовано использование рекомбинантного гранулоцитарного колониестимулирующего фактора человека [рчГ-КСФ] (Г-КСФ). Г-КСФ вводится подкожно в дозе в соответствии с инструкцией к применению лекарственного препарата. Его следует вводить не ранее чем через 24 часа от окончания введения химиопрепаратов до тех пор, пока абсолютное число нейтрофилов не будет составлять более 0,5 x 109/л в послеблоковом периоде [39, 143].
Антиэметическая терапия (см. приложение А3)
Критерии начала курса ПХТ:
- нейтрофилы >= 0,75 x 109/л
или лейкоциты >= 2 x 109/л
- тромбоциты >= 75 x 109/л
- билирубин <= 1,25 x верхняя граница нормы
- СКФ >= 70 мл/мин/1,73 м2
- ФВ левого желудочка >= 50%
В случае несоответствия критериев начала ПХТ необходимо отложить начало блока с контролем показателей через 2 - 3 дня.
В случае задержки начала блока более чем на 7 дней ввиду миелосупрессии несмотря на введение Г-КСФ, рекомендовано снижение дозы доксорубицина** до 30 мг/м2/сут (СД = 60 мг/м2).
- Всем пациентам с локализованной формой центральной остеосаркомой (низкой степени злокачественности), периостальной или параостальной остеосаркомой (промежуточной степени злокачественности) не рекомендуется проведение ПХТ [9, 27, 41, 42, 43, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: центральная остеосаркома низкой степени злокачественности, периостальная и паростальная остеосаркома промежуточной степени злокачественности обладают низким метастатическим потенциалом, в связи с чем ключевым этапом лечения является проведение радикального оперативного вмешательства. Проведение ПХТ может быть рассмотрено у пациентов с наличием компонента высокозлокачественной остеосаркомы по результатам гистологического исследования и/или наличия отдаленных метастатических очагов [9, 12, 14, 43, 44].
- Всем пациентам с верифицированной периостальной или параостальной остеосаркомой рекомендовано проведение широкой хирургической резекции вне зависимости от степени распространенности опухоли [43, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Всем пациентам с верифицированным ЗНО кости, за исключением признанных инкурабельными решением междисциплинарного консилиума, при отсутствии показаний к выполнению органоуносящей операции рекомендуется органосохраняющая операция (резекция кости сегментарная с эндопротезированием, резекция сегментарная с реконструктивно-пластическим компонентом) [45, 46].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У всех пациентов при удалении ЗНО кости рекомендовано следовать следующим базовым принципам резекций [30, 47]:
- широкая резекция (en-block) подразумевает удаление опухоли без повреждения псевдокапсулы и в муфте из визуально неизмененных окружающих тканей;
- радикальная резекция - удаление опухоли с целым анатомическим компартментом, в котором она расположена.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с верифицированной злокачественной опухолью кости, за исключением признанных инкурабельными решением междисциплинарного консилиума, рекомендуется органоуносящая операция (ампутация или экзартикуляция) согласно срокам протокола лечения при наличии хотя бы одного из следующих показаний [27, 45, 47]:
- гигантские размеры опухоли, поражающей все окружающие ткани вплоть до кожных покровов
- вовлечение в опухолевый процесс магистрального сосудисто-нервного пучка, технически исключающее проведение реконструктивно-пластического этапа операции
- прогрессирование на фоне предоперационной ПХТ, необходимость санирующей операции
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с наличием метастатического поражения легких рекомендовано проведение торакотомии с мануальной пальпацией ткани легкого [48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при метастазах в легких полное хирургическое удаление метастазов может обеспечить достижение 40-процентной 5-летней выживаемости. Пациенты с метастатической формой заболевания должны получать такую же стандартизированную химиотерапию, как и пациенты с локализованным процессом, с соответствующим локальным воздействием на метастазы.
- Всем пациентам с локальным или отдаленным метастатическим рецидивом остеосаркомы рекомендовано проведение радикального хирургического вмешательства [9, 12, 14, 49, 50].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: в 40% случаев у пациентов с локализованной формой остеосарком, и в 80% случаев у пациентов с инициальными отдаленными метастазами диагностируется рецидив заболевания. При возникновении рецидива заболевания лечение направлено на достижение второй ремиссии путем хирургического удаления всех опухолевых образований [9, 12, 14, 49, 50]. В случае возникновения рецидива остеосаркомы, необходимо обсуждение тактики лечения, возможности и объема хирургического вмешательства совместно с федеральным учреждением.
- Всем пациентам с рецидивом остеосаркомы или прогрессией заболевания рекомендовано в рамках терапии второй и последующих линий проведение терапии следующих режимов:
IE + #ленватиниб** [51, 52]:
Ифосфамид** - 3000 мг/м2/сут, в/в за 3 часа, с 1 по 3 день (СД = 9000 мг/м2)
Этопозид** - 100 мг/м2/сут, в/в за 3 часа, с 1 по 3 день (СД = 300 мг/м2)
#Ленватиниб** 14 мг/м2/сут, per os, ежедневно, непрерывно до наступления непереносимой токсичности или прогрессии заболевания
Параллельное введение месны** 3000 мг/м2/сут в/в продленной инфузией с 1 - 4 дни + 20% дополнительно от дозы в/в болюсно перед каждым введением ифосфамида**. Рекомендуется гидратация не менее 3000 мл/м2/сут, начиная за 12 часов до и заканчивая через 24 - 48 ч после введения ифосфамида**.
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
HD-I [14, 53, 137]:
#Ифосфамид** - 3000 мг/м2/сут, в/в за 3 часа, с 1 по 5 день (СД = 15000 мг/м2) для пациентов старше 8 лет либо 2000 мг/м2/сут, в/в за 2 часа, каждые 12 часов, суммарно 7 введений (СД = 14000 мг/м2) для детей старше 6 лет.
Терапия #ифосфамидом** в дозе 3000 мг/м2/сут для пациентов старше 8 лет проводится на фоне параллельного введения месны** 3000 мг/м2/сут в/в продленной инфузией с 1 - 5 дни + 20% дополнительно от дозы в/в болюсно перед каждым введением #ифосфамида**.
Терапия #ифосфамидом** в дозе 2000 мг/м2/сут для пациентов старше 6 лет проводится на фоне параллельного введения месны** 4000 мг/м2/сут в/в продленной инфузией с 1 - 4 дни + 20% дополнительно от дозы в/в болюсно перед каждым введением #ифосфамида**.
Рекомендуется гидратация не менее 3000 мл/м2/сут, начиная за 12 часов до и заканчивая через 24 - 48 ч после введения ифосфамида.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Gem/Tax [9, 14, 54, 55, 56]:
#Гемцитабин** - 675 или 900 мг/м2/сут в/в за 90 мин, 1-й, 8-й день (СД = 1350 мг/м2 или 1800 мг/м2) для пациентов старше 8 лет.
#Доцетаксел** - 75 мг/м2/сут или 100 мг/м2/сут в/в за 1 час, 8-й день (СД = 75 мг/м2 или 100 мг/м2) для пациентов старше 8 лет.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
#Сорафениб** [9, 14, 57, 58]:
Для пациентов старше 15 лет и/или весом более 50 кг, доза #сорафениба** составляет 400 мг/сут, per os, 2 раза в день, каждые 12 часов. Терапия #сорафенибом** проводится непрерывно до наступления непереносимой токсичности или прогрессии заболевания.
Для пациентов младше 15 лет и весом 15 - 20 кг, доза #сорафениба** составляет 100 мг 2 раза в день (каждые 12 часов), для пациентов младше 15 лет и весом 20 - 30 кг доза #сорафениба** составляет 200 мг 2 раза в день (каждые 12 часов).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
#Регорафениб** [59, 60, 61]:
#Регорафениб** - 160 мг/сут, per os, непрерывно до наступления непереносимой токсичности или прогрессии заболевания
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
#Кабозантиниб** [60]:
#Кабозантиниб** - 60 мг/сут, per os, непрерывно до наступления непереносимой токсичности или прогрессии заболевания
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
3.2 Лечение пациентов с саркомой Юинга и другими недифференцированными мелкокруглоклеточными саркомами костей.
- Всем пациентам с саркомой Юинга и другими недифференцированными мелкокруглоклеточными саркомами костей рекомендовано комбинированное лечение, которое включает в себя неоадъювантную (предоперационную) полихимиотерапию, оперативное вмешательство и адъювантную (послеоперационную) ПХТ, а также лучевую терапию [9, 12, 14, 62, 63, 64, 65, 66].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: комплексное лечение, включающее в себя многокомпонентную ХТ, оперативное вмешательство и лучевую терапию позволило увеличить показатель общей 5-летней выживаемости до 70%. Наиболее активными в отношении саркомы Юинга являются препараты винкристин**, доксорубицин**, циклофосфамид**, ифосфамид**, этопозид**.
Интенсивный режим ПХТ с интервалом в 14 дней (альтернирующие курсы VDC/IE) на сегодняшний день является предпочтительным, т.к. по результатам рандомизированных исследований позволил достичь у пациентов с локализованной формой СЮ показателя 5-летней БСВ 73% в сравнении со стандартным режимом в 21 день (65%).
Суммарно пациентам проводится 14 курсов ПХТ, из них 9 курсов в рамках неоадъювантного этапа лечения и 5 курсов ПХТ в послеоперационном периоде. При достижении кумулятивной дозы антрациклинов и родственных соединений 375 мг/м2, что соответствует 5 курсам ПХТ по схеме VDC, послеопераионные блоки проводятся без доксорубицина (VC) (см. схему 2).
Схема 2. Терапия пациентов с саркомой Юинга
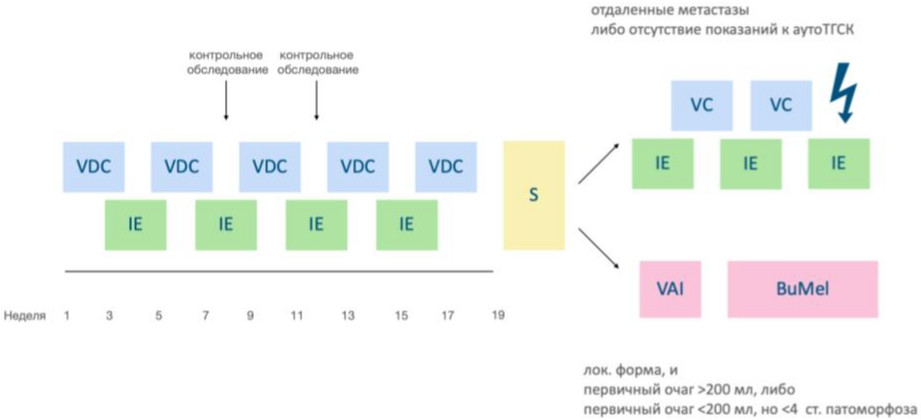
Курс VDC:
Винкристин** - 2 мг/м2 (не более 2 мг; 0,05 мг/кг для детей от 1 до 3 лет и 0,025 мг/кг для детей младше 1 года) в/в струйно медленно - день 1
Доксорубицин** - 37,5 мг/м2/сут (для детей < 1 года 1,25 мг/кг в день) в/в кап продленной инфузией за 48 часов - день 1,2 (суммарно 75 мг/м2)
Циклофосфамид** - 1200 мг/м2 в/в кап за 1 час - день 1
Сопроводительная терапия [12, 17, 66]:
Гидратация - 3000 мл/м2, непрерывная инфузия, за 24 часа до начала введения доксорубицина**, в 1 - 2 день курса ПХТ и 24 ч. после
Параллельное введение месны** 1200 мг/м2 за 24 часа в день введения циклофосфамида** + 20% дополнительно от дозы в/в болюстно перед введением циклофофсфамида**. Рекомендуется гидратация не менее 3000 мл/м2/сут, начиная за 12 часов до и заканчивая через 24 - 48 ч после окончания курса ПХТ.
Пациентам, у которых курс химиотерапии сопровождается осложнением в виде выраженной затянувшейся нейтропении (вне зависимости от того, сопровождается ли она нейтропенической лихорадкой), рекомендовано использование рекомбинантного гранулоцитарного колониестимулирующего фактора человека [рчГ-КСФ] (Г-КСФ). Г-КСФ вводится подкожно в дозе в соответствии с инструкцией к применению лекарственного препарата. Его следует вводить не ранее чем через 24 часа от окончания введения химиопрепаратов до тех пор, пока абсолютное число нейтрофилов не будет составлять более 0,5 x 109/л в послеблоковом периоде [66, 143].
Антиэметическая терапия (см. приложение А3)
Критерии начала курса ПХТ:
- нейтрофилы >= 0,75 x 109/л
или лейкоциты >= 2 x 109/л
- тромбоциты >= 75 x 109/л
- билирубин <= 1,25 x верхняя граница нормы
- СКФ >= 70 мл/мин/1,73 м2
- ФВ левого желудочка >= 50%
С целью соблюдения интенсивного тайминга ПХТ (1 раз в 14 дней), при несоответствии критериям начала курса ПХТ на 22 день, рекомендована редукция доз химиопрепаратов:
- редукция доксорубицина**, циклофосфамида** для последующих курсов на 25%
Курс IE:
Ифосфамид** - 1800 мг/м2/сут, в/в за 1 час, 1 - 5 день (СД = 9000 мг/м2)
Этопозид** - 100 мг/м2/сут, в/в за 2 часа, 1 - 5 день (СД = 500 мг/м2)
Сопроводительная терапия [12, 17, 66]:
Гидратация - 3000 мл/м2, непрерывная инфузия, за 24 часа до начала введения доксорубицина**, в 1 - 2 день курса ПХТ и 24 ч. после
Параллельное введение месны** 2000 мг/м2/сут в/в продленной инфузией с 1 - 5 дни + 20% дополнительно от дозы в/в болюсно перед каждым введением ифосфамида**. Рекомендуется гидратация не менее 3000 мл/м2/сут, начиная за 12 часов до и заканчивая через 24 - 48 ч после окончания курса ПХТ.
Пациентам, у которых курс химиотерапии сопровождается осложнением в виде выраженной затянувшейся нейтропении (вне зависимости от того, сопровождается ли она нейтропенической лихорадкой), рекомендовано использование рекомбинантного гранулоцитарного колониестимулирующего фактора человека [рчГ-КСФ] (Г-КСФ). Г-КСФ вводится подкожно в дозе в соответствии с инструкцией к применению лекарственного препарата. Его следует вводить не ранее чем через 24 часа от окончания введения химиопрепаратов до тех пор, пока абсолютное число нейтрофилов не будет составлять более 0,5 x 109/л в послеблоковом периоде [66, 143].
Антиэметическая терапия (см. приложение А3)
Критерии начала курса ПХТ:
- нейтрофилы >= 0,75 x 109/л
или лейкоциты >= 2 x 109/л
- тромбоциты >= 75 x 109/л
- билирубин <= 1,25 x верхняя граница нормы
- СКФ >= 70 мл/мин/1,73 м2
С целью соблюдения интенсивного тайминга ПХТ (1 раз в 14 дней), при несоответствии критериям начала курса ПХТ на 22 день, рекомендована редукция доз химиопрепаратов:
- редукция этопозида** для последующих курсов на 25%.
Курс VC:
Винкристин** - 2 мг/м2 (не более 2 мг; 0,05 мг/кг для детей от 1 до 3 лет и 0,025 мг/кг для детей младше 1 года) в/в струйно медленно - день 1
Циклофосфамид** - 1200 мг/м2 (для детей младше 3 лет 40 мг/кг х 1 в день) в/в кап за 1 час - день 1
Сопроводительная терапия [12, 17, 66]:
Гидратация - 3000 мл/м2, непрерывная инфузия, за 24 часа до начала введения доксорубицина**, в 1 - 2 день курса ПХТ и 24 ч. после
Параллельное введение месны** 1200 мг/м2 за 24 часа в день введения циклофосфамида** + 20% дополнительно от дозы в/в болюстно перед введением циклофосфамида**. Рекомендуется гидратация не менее 3000 мл/м2/сут, начиная за 12 часов до и заканчивая через 24 - 48 ч после окончания курса ПХТ.
Пациентам, у которых курс химиотерапии сопровождается осложнением в виде выраженной затянувшейся нейтропении (вне зависимости от того, сопровождается ли она нейтропенической лихорадкой), рекомендовано использование рекомбинантного гранулоцитарного колониестимулирующего фактора человека [рчГ-КСФ] (Г-КСФ). Г-КСФ вводится подкожно в дозе в соответствии с инструкцией к применению лекарственного препарата. Его следует вводить не ранее чем через 24 часа от окончания введения химиопрепаратов до тех пор, пока абсолютное число нейтрофилов не будет составлять более 0,5 x 109/л в послеблоковом периоде [66, 143].
Антиэметическая терапия (см. приложение А3)
С целью соблюдения интенсивного тайминга ПХТ (1 раз в 14 дней), при несоответствии критериям начала курса ПХТ на 22 день, рекомендована редукция доз химиопрепаратов:
- редукция циклофосфамида** для последующих курсов на 25%.
- Всем пациентам с локализованной формой саркомы Юинга, инициальный объем первичного очага которых составляет более 200 см3 рекомендовано проведение высокодозной химиотерапии с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК) [64, 65, 66, 68, 69, 70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Заготовка стволовых клеток производится исходя из принципов, принятых в центре, в котором планируется проведение процедуры. Кондиционирование перед ауто-ТГСК включает в себя использование #бусульфана** в комбинации с #мелфаланом** [66].
Схема 4. Режим кондиционирования #бусульфан**/#мелфалан**
#бусульфан**: с -7 дня по -3 день, каждые 6 часов, в/в за 30 мин (суммарно 16 введений),
< 9 кг = 1 мг/кг
9 - < 16 кг = 1,2 мг/кг
16 - 23 кг = 1,1 мг/кг
> 23 кг - 34 кг = 0,95 мг/кг
> 34 кг = 0,8 мг/кг
#мелфалан**: 140 мг/м2, в/в, за 30 мин, -2 день
- Всем пациентам с локализованной формой саркомы Юинга, инициальный объем первичного очага которых составляет менее 200 см3, а посттерапевтический патоморфоз соответствует 0 - 3 степени (> 10% витальных опухолевых клеток), рекомендовано проведение высокодозной химиотерапии с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК) [64, 65, 66, 68, 69, 70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: кроме пациентов с локализацией первичного очага в костях таза, позвонках и костях черепа.
- Всем пациентам с верифицированной саркомой Юинга и другими недифференцированными мелкокруглоклеточными саркомами костей с инициально выявленными отдаленными метастазами рекомендовано проведение поддерживающей терапии, начиная с 29 недели от момента начала терапии, в течение 12 месяцев [71, 72, 73, 74, 75, 76, 77, 78].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: поддерживающая терапия является одним из ключевых этапов лечения пациентов с метастатическими формами сарком мягких тканей (СМТ), в том числе и для группы пациентов с рабдомиосаркомоподобными опухолями, к которым на сегодняшний день относится экстраоссальная саркома Юинга и другие недифференцированные мелкокруглоклеточные саркомы мягких тканей с перестройкой генов CIC, BCOR, EWSR1-non-ETS. [71, 72, 78].
Проведение поддерживающей терапии пациентам с саркомой Юинга и другими недифференцированными мелкокруглоклеточными саркомами костей с инициальным метастатическим поражением легких, костей скелета, костного мозга и др. может позволить улучшить контроль над заболеванием, путем увеличения длительности специфической терапии, а также увеличить показатели общей и бессобытийной в данной группе пациентов [73, 74, 75, 76, 77, 78]
Поддерживающая терапия состоит из 28 дневных курсов терапии с включением циклофосфамида** и #винорелбина** [33, 78]. Циклофосфамид** в дозе 25 мг/м2/сут принимается per os непрерывно с 1 по 28 день, #винорелбин** вводится в 1, 8, 15 дни каждого курса в/в в дозе 25 мг/м2. Таким образом, суммарно за 12 месяцев проводится 12 курсов поддерживающей ПХТ [57, 78].
- Всем пациентам с верифицированной злокачественной опухолью кости, за исключением признанных инкурабельными решением междисциплинарного консилиума, при отсутствии показаний к выполнению органоуносящей операции рекомендуется органосохраняющая операция (резекция сегментарная кости с эндопротезированием, резекция сегментарная с реконструктивно-пластическим компонентом) [45, 46].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У всех пациентов при удалении ЗНО кости рекомендовано следовать следующим базовым принципам резекций [30, 47]:
- широкая резекция (en-block) подразумевает удаление опухоли без повреждения псевдокапсулы и в муфте из визуально неизмененных окружающих тканей;
- радикальная резекция - удаление опухоли с целым анатомическим компартментом, в котором она расположена.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с верифицированной злокачественной опухолью кости, за исключением признанных инкурабельными решением междисциплинарного консилиума, рекомендуется органоуносящая операция (ампутация или экзартикуляция) согласно срокам протокола лечения при наличии хотя бы одного из следующих показаний [27, 45, 46]:
- гигантские размеры опухоли, поражающей все окружающие ткани вплоть до кожных покровов
- вовлечение в опухолевый процесс магистрального сосудисто-нервного пучка, технически исключающее проведение реконструктивно-пластического этапа операции
- прогрессирование на фоне предоперационной ПХТ, необходимость санирующей операции
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с саркомой Юинга рекомендовано проведение лучевой терапии [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: лучевая терапия у пациентов с саркомой Юинга, как правило, применяется в комбинации с операцией, но может проводиться в самостоятельном плане у неоперабельных пациентов. Также может проводиться облучение метастатических очагов и тотальное облучение легких. Особенности лучевой терапии при саркоме Юинга.
- Всем пациентам с рецидивом саркомы Юинга и другими недифференцированными мелкокруглоклеточными саркомами костей или прогрессией заболевания рекомендовано в рамках терапии второй и последующих линий проведение терапии следующих режимов:
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
VIT [80]:
Для пациентов старше 1 год.
Винкристин** - 1,5 мг/м2/сут, в/в за 30 мин, 1 день
#Иринотекан** - 50 мг/м2/сут в/в за 1 час, с 1 по 5 день (СД = 250 мг/м2)
#Темозоломид** - 150 мг/м2/сут, per os, с 1 по 5 день (СД = 750 мг/м2)
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
ТС [82, 83, 84]:
#Топотекан** - 0,75 мг/м2/сут в/в кап за 1 час, с 1 по 5 день
Циклофосфамид** - 250 мг/м2/сут в/в за 1 час, с 1 по 5 день
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
HD-I [85, 144]:
#Ифосфамид** - 3000 мг/м2/сут, в/в за 24 часа, с 1 по 5 день (СД = 15000 мг/м2) для пациентов старше 4 лет.
Параллельное введение месны** по схеме: 400 мг/м2/сут в/в продленной инфузией за 1 час до начала введения #ифосфамида**, затем 3000 мг/м2/сут непрерывной инфузией 1 - 5 день на фоне введения, 800 мг/м2/сут после окончания введения. Рекомендуется гидратация не менее 3000 мл/м2/сут, начиная за 12 часов до и заканчивая через 24 - 48 ч после введения #ифосфамида**.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 2)
#Пазопаниб** [77, 86]:
#Пазопаниб** - 800 мг/сут, per os, непрерывно до наступления непереносимой токсичности или прогрессии заболевания
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
#Регорафениб** [60, 87]:
#Регорафениб** - 160 мг/сут, per os, непрерывно до наступления непереносимой токсичности или прогрессии заболевания
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
#Кабозантиниб** [60]:
#Кабозантиниб** - 60 мг/сут, per os, непрерывно до наступления непереносимой токсичности или прогрессии заболевания
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Пациентам с ранними рецидивами на этапе консолидации при наличии показаний рекомендовано проведение высокодозной химиотерапии с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК) [88, 89].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
3.3 Лечение пациентов с хондросаркомой
- Всем пациентам с хондросаркомой (вне зависимости от степени дифференцировки) рекомендовано проведение радикального хирургического вмешательства [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: у пациентов с небольшими по размеру опухолями и степенью дифференцировки G1 в ряде случаев возможно выполнение экскохлеации опухоли с тщательной обработкой полости с предварительным согласованием объема оперативного вмешательства с федеральным центром. Классическая хондросаркома отличается низкой чувствительностью к лекарственному лечению, лучевой терапии, в связи с чем необходима тщательная подготовка и планирование оперативного вмешательства, с целью снижения риска развития рецидива заболевания.
Перед проведением оперативного вмешательства, необходимо проведение комплексного обследования пациента, с целью исключения системного характера заболевания.
Рекомендована обязательная консультация пациентов с верифицированной хондросаркомой, в том числе мезенхимальной, дедифференцированной, а также ХС выявленной на фоне энхондроматоза в федеральном центре для согласования тактики ведения, включая тактику локального контроля.
3.4 Лечение пациентов с другими новообразованиями костей.
- Всем пациентам с гигантоклеточной опухолью рекомендовано проведение радикального хирургического вмешательства [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с целью улучшения функционального результата оперативного вмешательства или при неоперабельной ГКО рекомендовано проведение терапии препаратом #Деносумаб** [9, 12, 14, 90, 91, 92].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: учитывая локально агрессивный характер гигантоклеточной опухоли, высокий риск развития локального рецидива заболевания при неадекватном хирургическом вмешательства, а также возможность злокачественной трансформации ГКО, рекомендована обязательная консультация пациентов в федеральном центре для согласования тактики лечения, показаниях к назначению #Деносумаба**.
#Деносумаб** - День 1, 8, 15, 28: 120 мг п/к, далее - 1 раз в 28 дней, предоперационная длительность введения в зависимости от объема операции и локализации опухоли. Поддерживающая терапия 120 мг п/к 1 раз в 3 месяца, длительно (по согласованию со специалистами федеральных центров).
3.5 Трансфузионная поддержка
- Детям со злокачественными новообразованиями, получающими химио- и/или лучевую терапию, при тяжелой анемии (Hв < 70 г/л, Ht < 25%) с проявлениями симптомов и признаков анемической гипоксии и без кровотечений рекомендуются трансфузии эритроцитных компонентов донорской крови [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Трансфузии могут не потребоваться для хорошо компенсированных пациентов, восстанавливающихся после индуцированной аплазии. Однако, в случае предстоящей интенсивной химиотерапии в отсутствии клинических проявлений анемического синдрома трансфузии эритроцитных компонентов крови могут быть оправданы. Решение о применении трансфузий должно обосновываться, прежде всего, клиническими, а не лабораторными данными [93 - 102].
- Стабильным пациентам детского возраста со злокачественными новообразованиями в отсутствие кровотечений рекомендуется проводить трансфузии эритроцитсодержащих компонентов донорской крови в дозе 10 - 15 мл на кг массы тела [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Пациентам детского возраста с онкологическими заболеваниями рекомендуется проводить трансфузии лейкоредуцированных компонентов крови [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: было показано, что применение лейкоредуцированных компонентов крови позволяет снизить частоту фебрильных негемолитических трансфузионных реакций, а также существенно снижает вероятность HLA-аллоиммунизации пациента и передачу некоторых гемотрансмиссивных инфекций (цитомегаловирус, вирус Эбштейн-Барра).
- С целью предотвращения посттрансфузионной реакции трансплантат против хозяина, пациентам со злокачественными заболеваниями, получающими химио- и/или лучевую терапию и находящимися в иммуносупрессии, рекомендуется проводить трансфузии клеточных компонентов крови, облученных ионизирующим излучением в дозе 25 Гр [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У детей со злокачественными новообразованиями и гипопролиферативной тромбоцитопенией, вызванной основным заболеванием и/или его лечением, рекомендуются профилактические трансфузии концентрата тромбоцитов при следующих условиях [93 - 102].
- стабильным новорожденным при снижении количества тромбоцитов <= 25 x 109/л;
- стабильным пациентам при снижении количества тромбоцитов <= 10 x 109/л;
- пациентам с лихорадкой при снижении количества тромбоцитов <= 15 x 109/л;
- у пациентов с повышенным риском кровотечений при снижении количества тромбоцитов <= 20 x 109/л;
- перед выполнением малой хирургической манипуляции в некритических локусах при снижении количества тромбоцитов <= 20 x 109/л;
- перед выполнением люмбальной пункции, при снижении количества тромбоцитов <= 40 x 109/л;
- перед выполнением чрезкожной биопсии печени, если количество тромбоцитов <= 50 x 109/л;
- при хирургических вмешательства в критических сайтах (например, центральная нервная система), если количество тромбоцитов <= 75 - 100 x 109/л;
- перед иными оперативными вмешательствами при количестве тромбоцитов <= 50 x 109/л
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: повышенный риск кровотечений имеют пациенты получающие антитромботические средства, пациенты с ДВС, сепсисом и др.
- Трансфузии концентрата тромбоцитов у детей с гипопролиферативной тромбоцитопенией и геморрагическим синдромом рекомендуются при [93 - 102]:
- малом геморрагическом синдроме и снижении количества тромбоцитов <= 10 x 109/л;
- умеренном геморрагическом синдроме и снижении количестве тромбоцитов <= 20 x 109/л;
- тяжелом геморрагическом синдроме и снижении количестве тромбоцитов <= 30 x 109/л;
- при кровотечении в критически важной локализации (например, ЦНС) синдроме и снижении количестве тромбоцитов <= 100 x 109/л
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Трансфузии тромбоцитов у детей со злокачественными новообразованиями рекомендуются в следующей дозе [93 - 102]:
- новорожденные 10 - 15 мл/кг
- дети с массой тела более 10 кг: 10 мл/кг
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Трансфузии гранулоцитного концентрата рекомендуются детям с онкологическими заболеваниями и тяжелой, затяжной нейтропенией (количество нейтрофилов менее 200/мкл) при наличии тяжелой бактериальной или грибковой инфекции, неподдающейся лечению адекватной противомикробной терапией [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Трансфузии донорской плазмы крови рекомендуются детям с онкологическими заболеваниями при наличии клинически значимого кровотечения в сочетании с повышением активированного частичного тромбопластинового времени (АЧТВ) и/или международного нормализованного отношения (МНО) более чем в 1,5 раза от верхней границы нормы [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Трансфузии донорской плазмы детям со злокачественными новообразованиями рекомендованы в дозе 15 мл/кг массы тела [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Трансфузии криопреципитата у детей с онкологическими заболеваниями рекомендуются при снижении концентрации фибриногена менее 1 - 1.5 г/л [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: Трансфузии криопреципитата при приобретенном дефиците фибриногена, вызванном различными причинами, целесообразно при снижении его концентрации в сыворотке менее 1 г/л. Трансфузии криопреципитата при снижении его концентрации в крови ниже 1,5 г/л целесообразно для пациентов с острым промиелоцитарным лейкозом, при тяжелом интраоперационном кровотечении и у пациентов с сепсисом при развитии геморрагического синдрома.
- Трансфузии криопреципитат рекомендуется в дозе 1 единица на каждые 5 кг массы тела больного [93 - 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3.6 Профилактика и лечение тошноты и рвоты
- Всем пациентам с верифицированным ЗНО кости на период лечения в целях лечения и профилактики тошноты и рвоты, обусловленных проведением противоопухолевой терапии, рекомендуется оценивать уровень эметогенности лекарственных препаратов, проводить лечение и профилактику тошноты и рвоты с использованием лекарственных препаратов (см. Приложение А3.1) [103 - 112].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
3.7 Нутритивная поддержка
Диетотерапия
Лечебное питание является неотъемлемым компонентом лечебного процесса и профилактических мероприятий и включает в себя пищевые рационы, которые имеют установленный химический состав, энергетическую ценность, состоят из определенных продуктов, в т.ч. специализированных продуктов лечебного питания, включая смеси белковые композитные сухие и витаминно-минеральные комплексы, подвергаемых соответствующей технологической обработке, а также лечебные продукты энтерального питания (лечебные питательные смеси).
- Лечебное питание рекомендуется к назначению пациентам при поступлении в медицинскую организацию для оказания медицинской помощи в стационарных условиях. Лечебное питание назначается лечащим врачом или дежурным врачом медицинской организации в соответствии с нозологической формой заболевания по основному и/или сопутствующему диагнозу [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Вариант диеты зависит от состояния пациента, гастроинтестинальных и метаболических нарушений, основной или сопутствующей патологии и регламентируется приложением N 3 "К порядку обеспечения пациентов лечебным питанием", утвержденному приказом Министерства здравоохранения РФ от 23.09.2020 г. N 1008н
- Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (НП) [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: наличие белково-энергетической недостаточности или высокого риска ее развития у детей с ЗНО в процессе противоопухолевого лечения обуславливает связанные с этим риски увеличения инвалидизации, увеличения длительности и объема основного и сопроводительного лечения, низкой успешности проводимого лечения, увеличения смертности и общих финансовых затрат на лечебно-реабилитационные мероприятия - в процессе активного противоопухолевого лечения и после его окончания. Скрытая БЭН (например, скрытая избытком жировой массы на фоне длительного приема глюкокортикостероидов системного действия) сопровождается такими же рисками. Поэтому, учитывая высокую вероятность усугубления нутритивных проблем на фоне лечения, пациентам целесообразно назначать нутритивную поддержку в дополнение к существующему рациону или заменяя его.
Нутритивный скрининг и мониторинг (оценка нутритивного статуса)
- Рекомендуется всем пациентам при поступлении в стационар и далее регулярно проводить нутритивный скрининг (скрининговую оценку нутритивного статуса) с целью выявления белково-энергетической недостаточности либо риска ее развития [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: выявление нутритивных нарушений на ранних этапах их развития, особенно до начала противоопухолевой терапии позволяет своевременно начать нутритивную коррекцию. Критерии белково-энергетической недостаточности, ожирения и факторы нутритивного риска - см. приложение Г3, приложение Г4. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/инструментов для проведения нутритивного скрининга. Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [113 - 133].
- Рекомендуется для проведения нутритивного скрининга использовать специальные валидированные опросники (см. приложение Г3, приложение Г4), особенно актуальным их использование является на этапе первичного поступления в стационар и/или на (очередном) этапе поступления в клиническое отделение [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментраий: в своем большинстве скрининговые инструменты (опросники) ориентированы на объединение данных об основном диагнозе, клиническом статусе, антропометрических показателях, динамике массы тела, состоянии питания и интеграции этих данных в общий балл с последующим разделением пациентов на 2 или 3 когорты: не нуждаются в нутритивной коррекции (поддержке); требуют повторного скрининга в динамике ("тревожная" группа); нуждаются в нутритивной коррекции (поддержке). Клиническое подразделение (или учреждение) вправе использовать тот инструмент, или комбинацию инструментов, которую посчитает наиболее приемлемой для проведения нутритивного скрининга среди своих пациентов. Необходимо помнить, что существующие скрининговые инструменты не предназначены для ответа на вопрос об объеме и способе необходимой нутритивной поддержки, не несут в себе прогностической информации для конкретного пациента, поскольку их применение нацелено исключительно на медицинскую сортировку. К тому же, универсального инструмента для скрининга в педиатрии не существует
- Рекомендуется для первичной (общей) оценки нутритивного статуса и выявления нутритивного риска учитывать антропометрические показатели, изменение массы тела за определенный период (3, 6 или 12 месяцев), данные о питании (режим, привычный состав питания, особенности приема пищи, возможные нарушения приема пищи, наличие непереносимости/аллергии на компоненты пищи), об эндокринном статусе (данные о выявленных эндокринных нарушениях у ребенка), данные о выявленных гастроинтестинальных нарушениях [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется в качестве обязательного минимума основных антропометрических параметров для первичной и регулярной оценки нутритивного статуса использовать следующие: измерение массы тела, измерение роста (длины тела), вычисление индекса массы тела [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- В случае потребности в детальном антропометрическом исследовании для первичной и регулярной оценки нутритивного статуса в качестве дополнительных антропометрических параметров рекомендуется использовать следующие: измерение окружностей, длин, толщины складок, кистевая динамометрия [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется для соотнесения полученных данных антропометрии (рост, масса тела, индекс массы тела, окружность плеча) с нормативными значениями по педиатрической популяции использовать референсные значения (шкалы), либо локальных (отечественных) референсов, либо мировых общеиспользуемых номограмм: центильные значения/перцентили, либо величина отклонения полученного значения от среднего по популяции (SDS или z-score) [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: Часто используемыми "по умолчанию" в РФ являются референсы ВОЗ (WHO growth charts), для удобства работы с которыми существуют свободно доступные программы (WHO anthro и WHO anthro plus), которые быстро позволяют высчитать ключевые антропометрические параметры в соотнесении их с референсными данными ВОЗ. Однако возможно использование и других референтных данных для соотнесения данных пациента с нормативами - в таком случае необходимо указывать, какие конкретно референсы применялись.
- Пациентам с нутритивными нарушениями или пациентам с высоким нутритивным риском, выявленными при первичном скрининге рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка лабораторных показателей, а также детальный физикальный осмотр и опрос на предмет выявления нутритивно-метаболических нарушений и их предикторов [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Ввиду высокой распространенности в детской популяции с онкологическими заболеваниями нарушений состава тела, тканевого дисбаланса в виде скрытой белково-энергетической недостаточности (саркопении), скрытого ожирения (накопления жировой массы), ввиду распространенности отеков (в том числе и скрытых), а также нарушений распределения компартментов жидкости, в качестве дополнительного уточняющего метода оценки нутритивного статуса рекомендуется оценка состава тела различными имеющимися методами: биоимпедансный анализ (определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансметра), двухэнергетическая рентгеновская абсорбциометрия (рентгеновская денситометрия всего тела), МРТ, КТ - для уточняющей и углубленной оценки состава тела в группах риска. Эти группы следующие: хроническая белково-энергетическая недостаточность, длительная, более 2 месяцев, необходимость в парентеральном питании, включение в терапию гормональных препаратов, опухоли ЦНС, хронические расстройства приема пищи (пищевого поведения), реципиенты ГСК при выявленных антропометрически нутритивных нарушениях [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам, получающим нутритивную поддержку, рекомендуется проводить нутритивный мониторинг, который включает опрос, антропометрию, и при необходимости - анализ тканевого состава тела, лабораторные показатели (анализ крови биохимический общетерапевтический, копрологическое исследование) [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Нутритивная поддержка
Нутритивная поддержка проводится посредством назначения специализированных продуктов энтерального питания. Пищевая продукция энтерального питания или лечебная питательная смесь - жидкая или сухая (восстановленная до готовой к употреблению) пищевая продукция диетического лечебного или диетического профилактического питания, предназначенная для перорального употребления непосредственно или введения через зонд при невозможности обеспечения организма в пищевых веществах и энергии обычным способом [113 - 133]. Лечебные смеси - специально разработанные пищевые продукты с заданным химическим составом, энергетической ценностью, физическими свойствами и доказанным лечебным эффектом, отвечающие физиологическим потребностям организма, учитывающие нарушения процессов метаболизма больного человека. При выборе формы, метода, вида и объема нутритивной поддержки рекомендуется руководствоваться, в первую очередь, принципом индивидуального пациент-ориентированного подхода - сообразно клинической ситуации и логике [113 - 133].
- У пациентов с ожирением (избытком жировой массы) возможно развитие скрытой белково-энергетической недостаточности, определяемой дефицитом безжировой массы тела и критическим уменьшением ее скелетно-мышечного компартмента, в связи с чем рекомендуется проведение коррекции данного вида дефицита, наличие ожирения само по себе не является противопоказанием для проведения нутритивной поддержки энтеральным или парентеральным путем [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Расчет объема нутритивной поддержки рекомендуется осуществлять посредством расчета нутритивной потребности, или тотального расхода энергии (ТРЭ) [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО x КК, где ЭОО - энергия основного обмена, КК - конверсионный коэффициент. Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield). Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК = 0,85 - 1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации [113 - 133].
- При выборе пути нутритивной поддержки рекомендуется в качестве приоритетного использование энтерального питания (ЭП) [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: ЭП является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, препятствует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание
- В случае если пациент не может/не хочет/не готов принимать назначенный объем смеси в необходимом режиме самостоятельно рекомендуется использование для энтерального питания назогастрального(-еюнального) зонда или гастростомы (в составе набора для пункционной гастростомии, регистрационный номер медидинсокго изделия РЗН 2013/1309) [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через назогастральный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) - в этих случаях показана реализация ЭП через назоеюнальный зонд (зонд назоеюнальный стерильный, однократного применения с проводником и трубкой назальной).
- При текущей или потенциальной необходимости проведения зондового питания продолжительностью более 6 недель, рекомендуется наложение гастростомы [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: в случае, когда выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), возможно превентивное наложение гастростомы, минуя этап зондового питания
- Рекомендуется постановка гастростомы в случае невозможности адекватной алиментации другими методами ЭП, при отсутствии противопоказаний для проведения ЭП и самой гастростомии [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- В случаях наличия у ребенка тяжелой хронической белково-энергетической недостаточности, с высоким риском ее усугубления в дальнейшем, особенно если ему еще предстоит продолжение противоопухолевого лечения рекомендуется постановка гастростомы, минуя этап зондового питания и даже сипинга [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Пациентам с гастроинтестинальными нарушениями начинать энтеральную нутритивную поддержку рекомендуется со специализированной лечебной питательной смеси для энтерального питания с калорической плотностью 1 ккал/мл (изокалорическая смесь), и, если необходимо, с последующим переходом на лечебную питательную смесь для энтерального питания с калорической плотностью более 1 ккал/мл (гиперкалорической) - под контролем переносимости [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: смеси по своей энергетической плотности делятся на изокалорические (1 ккал/мл для детей старше года и 0,67 - 0,69 ккал/мл для детей до года) и гиперкалорические (более 1 ккал/мл для детей старше года, и 1 ккал/мл для детей до года). Начинать нутритивную поддержку, особенно детям с имеющимися в анамнезе или в настоящее время гастроинтестинальными нарушениями и/или никогда до этого не получавшими энтерального питания, целесообразно с изокалорических формул.
- При наличии явлений мальабсорбции/тяжелых гастроинтестинальных нарушений (но отсутствии противопоказаний для проведения ЭП), тяжелой пищевой аллергии (или аллергии к белкам коровьего молока) рекомендуется назначение полуэлементной/олигомерной (или, по показаниям, элементной) специализированной лечебной питательной смеси для энтерального питания [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: смеси по своему химическому составу делятся на полимерные (в своей основе содержат цельный белок) и олигомерные (содержат гидролизат белка) или полуэлементные. Элементные смеси не содержат белок как таковой: белковый компонент в них представлен аминокислотами. Обычно элементные смеси назначаются при установленной аллергии к белкам коровьего молока.
- Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем и/или в случаях, когда ЭП не может обеспечить потребности энергии основного обмена, рекомендуется назначение парентерального питания (при отсутствии противопоказаний для проведения парентерального питания). В числе этих пациентов особое внимание должно уделяться детям с имеющейся белково-энергетической недостаточностью, особенно умеренной и тяжелой степени [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: ключевым показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность (как минимум, на уровне энергопотребности основного обмена) пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе.
- Начало парентерального питания рекомендуется производить постепенно, ступенчато увеличивая объем (и скорость) суточной инфузии, начиная от трети/половины расчетного целевого объема и, под мониторингом показателей анализа крови биохимического общетерапевтического (прежде всего, глюкоза, прямой билирубин, мочевина) и кислотно-основного состояния и газов крови, за несколько суток (скорость достижения целевого объема определяется индивидуально по клинической ситуации) довести объем до целевого. Отмену парентерального питания рекомендуется производить также постепенно, ступенчато, в обратном порядке [113 - 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: крайне нежелательно назначение парентерального питания сразу в полном объеме, равно как разовая ("со следующих суток") отмена полного парентерального питания. Особенно опасным является назначение полного парентерального питания больным с длительным отсутствием алиментации - ввиду возможного развития рефидинг-синдрома. Объем ПП должно постепенно (ступенчато) увеличивать под параллельным контролем КЩС, электролитов, глюкозы, мочевины, прямого билирубина в крови. При необходимости, объем и состав ПП должны корректироваться.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам с верифицированным ЗНО кости на всех этапах терапии заболевания, а также после завершения лечения рекомендовано проведение комплексных реабилитацонных мероприятий, а также при необходимости сопроводительная терапия для улучшения результатов лечения и качества жизни пациента, в зависимости от коморбидной патологии и осложнений основной терапии [134, 135, 136].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: реабилитация представляет собой неотъемлемую часть лечебного процесса у пациентов с диагностированными злокачественными новообразованиями. Реабилитация включает в себя комплекс мероприятий, направленных на восстановление хорошего самочувствия и трудоспособности пациента (восстановительная реабилитация), повышение качества его жизни, социальную адаптацию и максимально возможное продление жизни с избавлением от боли (паллиативная реабилитация).
Правильно подобранный курс реабилитации позволит пациенту вернуться к полноценной жизни и/или продолжить програмную терапию.
Курс реабилитационных мероприятий разрабатывается индивидуально - с учетом состояния пациента, его функциональных возможностей и мотивации.
Начало реабилитационных мероприятий зависит от стадии, группы риска, и начинается на этапах проведения первичной полихимиотерапии и продолжается после ее окончания на всех этапах динамического наблюдения. Реабилитационные мероприятия проходят под контролем детского онколога, медицинского учреждения, где больной получал все основные этапы терапии. Реабилитация делится на медицинскую, психологическую, социальную и др. В программе принимают участие педагоги (дошкольного и школьного образования), социальные работники, психологи и врачи разных специальностей (врачи по медицинской реабилитации, неврологи, эндокринологи, кардиологи, травматологи-ортопеды и т.д.).
- Всем пациентам с установленным диагнозом ЗНО кости рекомендовано проведение реабилитационных мероприятий в региональных центрах на базе поликлиник и в специализированных лечебно-реабилитационных центрах. Кратность реабилитации 3 - 4 раза в год и может быть увеличена в зависимости от психо-соматического и ортопедического статуса пациента [134, 135, 136].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: одним из этапов реабилитации пациентов после эндопротезирования крупных суставов является удлинение эндопротезов с целью коррекции дефицита длины конечности на фоне активных методов физической реабилитации.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Всем пациентам, завершившим лечение по поводу ЗНО кости рекомендовано диспансерное наблюдение у участкового педиатра и врача-детского онколога в установленные сроки (см. табл. 9) [9, 12, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Таблица 9. Обследование пациентов с ЗНО костей
1 год
2 год
3 год
4 год
5 год
> 5 лет
Клинический осмотр
1 раз в 3 месяца
1 раз в 3 месяца
1 раз в 4 мес
1 раз в 6 мес
1 раз в 6 мес
1 раз в год
ОАК
1 раз в 3 месяца
1 раз в 3 месяца
1 раз в 4 мес
1 раз в 6 мес
1 раз в 6 мес
1 раз в год
Анализ крови биохимический общетерапевтический
1 раз в 3 месяца
1 раз в 3 месяца
1 раз в 4 мес
1 раз в 6 мес
1 раз в 6 мес
1 раз в год
Общий (клинический) анализ мочи
1 раз в 3 месяца
1 раз в 3 месяца
1 раз в 4 мес
1 раз в 6 мес
1 раз в 6 мес
1 раз в год
Исследование функции нефронов по клиренсу креатинина (проба Реберга)
1 раз в 6 месяцев
1 раз в 6 месяцев
1 раз в год
1 раз в год
1 раз в год
1 раз в год
УЗИ органов брюшной полости (комплексное)
1 раз в 3 месяца
1 раз в 3 месяца
1 раз в 4 мес
1 раз в 6 мес
1 раз в 6 мес
1 раз в год
КТ\МРТ с внутривенным болюсным контрастированием пораженной области
1 раз в 3 месяца
1 раз в 3 месяца
1 раз в 4 мес
1 раз в 6 мес
1 раз в 6 мес
По показаниям, max. 1 раз в год
КТ органов грудной полости с внутривенным болюсным контрастированием
1 раз в 3 месяца
1 раз в 3 месяца
1 раз в 4 мес
1 раз в 6 мес
1 раз в 6 мес
По показаниям, max. 1 раз в год
ПЭТ/КТ всего тела
1 раз в год
1 раз в год
1 раз в год
1 раз в год
1 раз в год
По показаниям
ЭКГ\ЭХО-КГ
1 раз в год
1 раз в год
1 раз в год
1 раз в год
1 раз в год
1 раз в год <5.>
Эндокринологическое обследование
При патологическом состоянии в период пубертата.
Спермограмма
При особенностях в периоде полового созревания
6. Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию
1. Необходимость проведения биопсии, оперативного лечения, лучевой терапии, химиотерапии;
2. Коррекция посткурсовой анемии, тромбоцитопении, нейтропении, фебрильной нейтропении;
3. Коррекция эндопротеза или другой замещающей имплантируемой конструкции;
4. Инфицирование эндопротеза или другой замещающей имплантируемой конструкции;
5. Необходимость проведения манипуляции под общей анестезией;
6. Необходимость постановки или уточнения диагноза.
Показания к выписке пациента из медицинской организации
1. Окончание этапа терапии, при условии, что пациент находится в стабильном удовлетворительном соматическом статусе
2. Окончания всего лечения, достижение ремиссии при условии, что пациент находится в стабильном удовлетворительном соматическом статусе
3. Инкурабельность пациента с возможностью его перевода под наблюдение паллиативной службы либо в хоспис
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
1. Особенности патологанатомического исследования ЗНО костей
1.1 Пробоподготовка
Направление на морфологическое исследование опухолей мягких тканей и костей должно включать необходимую информацию о пациенте, задачах исследования, предварительном лечении и характеристиках материала. Нативный материал доставляется в 10% растворе нейтрального формалина. Ткани после радикальных резекций перед фиксацией распиливаются для лучшей фиксации.
Мелкие фрагменты костной ткани декальцинируются в растворе ЭДТА, затем раскладываются по гистологическим кассетам. Мелкие фрагменты мягких тканей и биоптаты также раскладываются по кассетам. Костные пластинки декальцинируются, размечаются и распределяются по кассетам с маркировкой.
После этого материал подвергается проводке и заливке в парафин с формированием парафиновых блоков. Из полученных блоков изготавливаются срезы толщиной не более 4 мкм.
Срезы должны быть равномерно окрашены, без складок и разрывов, позволяя оценивать цитологические свойства клеток. При микроскопическом исследовании описываются компоненты патологической ткани, цитологические свойства клеток, гетерогенность, некроз, фиброз, хондрогенез, остеогенез, митотическая и апоптотическая активность, отношение к окружающим тканям. Выявленные изменения сопоставляются с клиническими данными.
1.2 Классическая остеосаркома
Классическая остеосаркома (КОС) обычно представляет собой большую (> 5 - 10 см) интрамедуллярную массу, расположенную в метафизарной области с различной степенью распространения на прилежащий диафиз и эпифиз. Поверхность разреза неоднородна и зависит от типа и степени минерализации преобладающего матрикса. Гистологически для диагностики КОС важно выявление неопластического костеобразования. Опухолевые клетки обычно демонстрируют выраженную анаплазию и плеоморфизм, они могут быть веретеновидными, плазмоцитоидными или эпителиоидными. Митотическая активность обычно высокая, часто присутствуют атипичные митозы. КОС имеет широкий гистоморфологический спектр и подразделяется на остеобластический (76 - 80%), хондробластический (10 - 13%) и фибробластический (10%) типы.
Телеангиэктатическая остеосаркома (ТАОС) проявляется как геморрагическое многокистозное образование, заполненное сгустками крови, классически описываемое как "мешок крови". Плотные мясистые или склеротические участки обычно не наблюдаются. Гистологически ТАОС состоит из заполненных кровью или пустых кистозных пространств, тесно имитирующих аневризмальную костную кисту. Перегородки имеют переменную толщину и заселены плеоморфными клетками с существенным ядерным гиперхроматизмом. Атипичные митозы легко идентифицируются.
Макроскопические особенности мелкоклеточной остеосаркомы (МКОС) неотличимы от КОС. Гистологически МКОС состоит из мелких клеток со скудной цитоплазмой, связанных с продукцией остеоида. Ядра круглые или овальные, хроматин может быть мелким или грубым; митозы легко обнаруживаются. В менее распространенном веретеноклеточном типе ядра короткие, овальные или веретеновидные, с зернистым хроматином и неприметными ядрышками. Может наблюдаться очаговый гемангиоперицитомоподобный рисунок.
Иммуногистохимически КОС имеет широкий иммунопрофиль, который не обладает диагностической специфичностью. Часто экспрессируются такие антигены, как SATB2, остеокальцин (BGLAP), остеонектин (SPARC), остеопротегерин (TNFRSF11B), RUNX2, S100, актины и CD99. ТАОС и МКОС имеют иммунофенотип, сходный с КОС. SATB2 считается очень чувствительным маркером остеобластической дифференцировки, но не обладает специфичностью. Он может помочь отличить МКОС от саркомы Юинга.
1.3 Паростальная остеосаркома
Паростальная остеосаркома (ПОС) макроскопически представляет собой экзофитную дольчатую массу, прикрепленную к кортексу широким основанием. На разрезе опухоль желтовато-белая, твердая, зернистая, с возможными узелками хряща. Гистологически ПОС состоит из костных трабекул с прослойками веретеновидных клеток. Обычно опухоль гипоклеточная с минимальной атипией и низкой митотической активностью. В 20% случаев опухоль более клеточная с умеренной атипией. В 50% случаев наблюдается хрящевая дифференцировка. Дедифференцировка происходит в 15 - 43% случаев. Иммуногистохимическое исследование MDM2 и CDK4 полезно для диагностики ПОС, особенно в небольших биоптатах. Дифференциальная диагностика включает доброкачественные фиброзные и фиброзно-костные поражения. Анализ амплификации MDM2 или иммуноокрашивание MDM2 и CDK4 помогает в дифференциальной диагностике. ПОС морфологически отличается от периостальной и высокозлокачественной поверхностной остеосарком. Наличие очагового низкозлокачественного веретеноклеточного компонента и/или амплификации MDM2 предполагает дедифференцированную ПОС.
1.4 Периостальная остеосаркома
Периостальная остеосаркома макроскопически имеет четко очерченный дольчатый вид с широким основанием, прикреплена к поверхности кортикальной пластинки, поднимая периост. Опухоль состоит из дольчатой хрящевой ткани. Может быть заметна спикулообразная реакция, и обычно имеется отграниченная поверхностная капсула, образованная периостом. Гистологически опухоль состоит из плохо очерченных долек цитологически атипичного хряща с прослойками примитивных саркоматозных клеток, в которых присутствует костеобразование. Могут встречаться атипичные фибробластические участки. Примитивные недифференцированные мезенхимальные клетки с ядерной атипией и митозами преобладают по периферии опухоли. В хрящевых областях происходит переход в остеоидный матрикс. Иммуногистохимическая экспрессия SATB2 не отличает хондробластическую остеосаркому от высокозлокачественной хондросаркомы и не помогает в диагностике. Дифференциальная диагностика включает периостальные хондросаркомы, паростальную остеосаркому и высокозлокачественную поверхностную остеосаркому. Периостальные хондросаркомы встречаются у пожилых людей, имеют метафизарное распределение, грубую кальцификацию и содержат большие дольки хорошо дифференцированного гиалинового хряща без опухолевой кости. Паростальная остеосаркома имеет выступающую грибовидную архитектуру, возникающую из наружных слоев периоста, и является фибробластической с более зрелым костеобразованием. Высокозлокачественная поверхностная остеосаркома имеет высокозлокачественные признаки на всем протяжении.
1.5 Высокозлокачественная поверхностная остеосаркома
Высокозлокачественная поверхностная остеосаркома (ВЗПОС) макроскопически обычно хорошо отграничена и расположена на периосте. Часто она распространяется через надкостницу, прикрепляясь или даже разрушая кортикальную пластинку. Может присутствовать эндостальное распространение, но основная масса опухоли находится вне кости. Гистологически ВЗПОС идентична классической остеосаркоме. Иммуногистохимия не имеет значения для диагностики. При дифференциальной диагностике следует учитывать, что степень цитологической атипии выше, чем при периостальной остеосаркоме. Не должно быть участков низкозлокачественной остеосаркомы.
1.6 Центральная атипичная хондроматоидная опухоль/хондросаркома grade 1
Центральная атипичная хондроматоидная опухоль/хондросаркома 1 степени злокачественности (ЦАХО/ХС1) макроскопически состоит из полупрозрачной, синевато-серой или серовато-белой ткани с желтовато-белыми участками кальцификации. Опухоль четко отграничена и может вызывать эрозию кортикальной пластинки. Распространение в мягкие ткани нехарактерно. Гистологически ЦАХО/ХС1 имеет обильный гиалиновый хрящевой матрикс и дольчатый характер роста. Дольки разделены фиброзными прослойками. Опухолевые дольки пронизывают и захватывают костные трабекулы. Клеточность низкая, ядра однородны по размеру, часто наблюдается двуядерность. Митозы отсутствуют. Могут встречаться зоны миксоматоза и некроза. Иммуногистохимически опухолевые клетки экспрессируют S100. Дифференциальная диагностика между энхондромой и ЦАХО/ХС1 основана на более высокой клеточности, неравномерном распределении клеток, наличии двуядерных клеток и характере роста (захват предшествующей кости и отсутствие инкапсуляции) в ЦАХО/ХС1. Наличие > 20% миксоидных изменений матрикса также свидетельствует в пользу ЦАХО/ХС1. Различие может быть трудным на небольших биоптатах, и необходима клинико-рентгенологическая корреляция. Локализация поражения и возраст пациента играют важную роль. В длинных трубчатых костях описанные изменения указывают на ЦАХО/ХС1, тогда как в коротких трубчатых костях, при энхондроматозе и у пациентов до полового созревания эти признаки допустимы при энхондроме. Хондросаркома 2 степени злокачественности отличается от ЦАХО/ХС1 повышенной клеточностью, митозами, миксоидной дегенерацией матрикса, веретеноклеточными изменениями на периферии долек, усилением васкуляризации и ядерным полиморфизмом.
1.7 Вторичная периферическая атипическая хондроматоидная опухоль/хондросарокома grade 1
При морфологической диагностике вторичной периферической атипической хондроматоидной опухоли/хондросаркомы 1 степени злокачественности следует обращать особое внимание на макроскопическое описание, тщательно документируя толщину хрящевой шапочки, которая обычно превышает 2 см (средняя толщина - 3,9 см). Измерение необходимо проводить перпендикулярно границе кость-хрящ в самой толстой части шапочки, поскольку толщина является одним из важнейших факторов прогрессии остеохондромы. Общепринятых гистологических критериев прогрессии остеохондромы в данную опухоль не существует. Часто выявляются грубые и неравномерные кальцификаты, а также признаки ранее существовавшей остеохондромы. Обычно наблюдается дольчатый рисунок, иногда узлы отделяются от основной массы и располагаются в окружающих мягких тканях. Двуядерные клетки, кистозные изменения (участки кистозных пространств, содержащих слизистый материал) и некроз могут присутствовать в хрящевой шапочке, но не должны интерпретироваться как признаки прогрессии, поскольку также встречаются при остеохондроме. Может наблюдаться усиление васкуляризации. Митозы и ядерный полиморфизм отсутствуют. Инвазия в ножку встречается редко и указывает на прогрессию. Ключевое значение имеет сопоставление клинических и радиологических данных с толщиной хрящевой шапочки. При иммуногистохимическом исследовании опухолевые клетки интенсивно экспрессируют S100. Дифференциальная диагностика между остеохондромой и вторичной периферической атипической хондроматоидной опухолью/хондросаркомой 1 степени злокачественности не может быть проведена только на основании морфологии, поскольку показано, что кистозная дегенерация, узловатость или некроз не указывают на прогрессию. Дифференциальный диагноз должен проводиться на мультидисциплинарном уровне, где толщина хрящевой шапочки имеет наибольшее значение. При вторичной периферической хондросаркоме 2 и 3 степени злокачественности выявляются митозы и ядерный полиморфизм, которые должны отсутствовать при вторичной периферической атипической хондроматоидной опухоли/хондросаркоме 1 степени злокачественности.
1.8 Центральная хондросаркома 2 и 3 степени злокачественности
При макроскопическом исследовании резекционного материала центральная хондросаркома 2 и 3 степени злокачественности имеет полупрозрачную, часто дольчатую, синевато-серую или белую поверхность разреза с возможными кистозными изменениями, участками миксоидного материала и кальцификацией в виде желтовато-белых меловых участков. Часто присутствуют эрозия и разрушение кортикального слоя с распространением в мягкие ткани. Гистологически опухоли высококлеточные с дольчатой структурой, где опухолевые дольки пронизывают и захватывают предшествующие костные трабекулы. Опухолевые клетки располагаются в хрящевом матриксе с миксоидными изменениями. Клеточность выше, чем при АХО/ХС1, присутствуют митозы, ядерная атипия и полиморфизм. В хондросаркомах 3 степени злокачественности клетки по периферии миксоидных долек веретеновидные и менее дифференцированные. Иммуногистохимически клетки опухоли могут экспрессировать S100. Хондросаркома 2 степени злокачественности отличается от АХО/ХС1 повышенной клеточностью, ядерной атипией, гиперхромазией, размером ядер, миксоидными изменениями матрикса и наличием митозов. При дифференциальной диагностике хондросаркому основания черепа следует отличать от хордомы, а хондросаркому 3 степени злокачественности - от хондробластической остеосаркомы.
1.9 Периостальная хондросаркома
Периостальная хондросаркома макроскопически представляет собой большую (часто > 5 см) дольчатую массу, расположенную на поверхности кости. На разрезе опухоль серая и блестящая, часто связана с зернистыми белыми участками кальцификации. Опухоль разрушает или прорастает кортикальный слой; медуллярный канал обычно не вовлечен. Гистологически наблюдается дольчатая, умеренно клеточная хрящевая опухоль с миксоидным матриксом. Могут присутствовать кальцификация и энхондральная оссификация. Часто наблюдается инвазия подлежащего кортикального слоя. В части случаев отмечается интрамедуллярное распространение. Разграничение с мягкими тканями обычно четкое. Дифференциальная диагностика включает также периостальную хондрому, периостальную остеосаркому и паростальную остеосаркому. Различие между периостальной хондромой и хондросаркомой основано на инвазии кортикального слоя. При периостальной хондросаркоме опухоль часто > 5 см. Гистологическое градирование не применимо.
1.10 Светлоклеточная хондросаркома
При макроскопическом исследовании светлоклеточная хондросаркома представляет собой образования диаметром от 2 до 13 см. Опухоль содержат зернистый материал, иногда с кистозными участками. Характерные для гиалинового хряща признаки могут быть очаговыми или отсутствовать. Гистологически опухоли состоят из долек клеток с обильной бледной, прозрачной или слегка эозинофильной цитоплазмой, которые напоминают гипертрофические клетки ростовой пластинки. Клетки имеют отчетливые цитоплазматические мембраны и крупные круглые ядра с незначительной атипией и центральными ядрышками. Митотические фигуры редки. К другим часто наблюдаемым характеристикам относится образование грубоволокнистой кости с перемежающимися остеокластоподобными гигантскими клетками. Примерно в половине случаев могут наблюдаться участки обычной низкозлокачественной хондросаркомы с минимально атипичными ядрами. Гиалиновый хрящ может подвергаться кальцификации и/или оссификации, что может быть обнаружено рентгенологически. Также могут возникать участки кистозной дегенерации, напоминающие аневризмальную костную кисту. Может наблюдаться инфильтративный рост. Иммуногистохимически светлые клетки сильно экспрессируют S100. Также наблюдается аберрантная иммунореактивность к цитокератинам (AE1/AE3 и CK18). Дифференциальная диагностика включает метастатическую светлоклеточную почечно-клеточную карциному, хондробластому и остеосаркому, а также (в зависимости от локализации) нотохордальную опухоль.
1.11 Мезенхимальная хондросаркома
Мезенхимальная хондросаркома макроскопически представляет собой фрагменты ткани различного цвета (серые/белые/розовые), плотной или мягкой консистенции. Гистологически мезенхимальная хондросаркома состоит из мелких и средних низкодифференцированных круглых клеток с высоким ядерно-цитоплазматическим соотношением и характерным сосудистым рисунком в виде оленьих рогов, смешанных в различных пропорциях с островками хорошо дифференцированного гиалинового хряща. Может присутствовать веретеноклеточная морфология. В некоторых участках матрикс может имитировать продукцию остеоида. Иммуногистохимически опухолевые клетки могут быть положительными на S100, CD99 и SOX9, NKX2.2, NKX3.1. Может выявляться аберрантная экспрессия EMA, десмина, миогенина (MYF4) и MYOD1, тогда как SMARCB1 (INI1) сохранен. SMA, GFAP и кератины отрицательны. При биопсии только недифференцированного компонента может возникнуть сложность при дифференциальной диагностики с группой недифференцированных круглоклеточных сарком.
1.12 Дедифференцированная хондросаркома
Дедифференцированная хондросаркома макроскопически демонстрирует хрящевой и нехрящевой компоненты в различных пропорциях. Гистологически наблюдается резкий переход между гиалиновым хрящом и высокозлокачественными саркоматозными компонентами. Хрящевая часть может напоминать энхондрому или хондросаркому 1 - 2 степени злокачественности. Дедифференцированный компонент обычно имеет вид недифференцированной плеоморфной саркомы или остеосаркомы высокой степени злокачественности, реже - ангиосаркомы, лейомиосаркомы или рабдомиосаркомы. Соотношение компонентов варьирует, процент дедифференцированного компонента - от 2% до 98%.
Иммунофенотип нехрящевого компонента соответствует его гистологической дифференцировке. Описаны H3K27me3-дефицитные случаи, напоминающие злокачественные опухоли из оболочек периферических нервов. Может наблюдаться гиперэкспрессия p53 и MDM2, а также экспрессия PDL1.
При дифференциальной диагностике на биопсийном материале важна корреляция с данными визуализации. Анализ мутаций IDH может быть полезен. Цитокератин-позитивность затрудняет отличие от метастатической саркоматоидной карциномы. Тщательное радиологическое и патоморфологическое исследование помогает выявить хрящевой компонент.
1.13 Адамантинома длинных костей
Макроскопически опухоль представляет собой хорошо отграниченное, дольчатое, беловато-серое зернистое образование с периферическим склерозом. Небольшие поражения остаются внутрикортикальными, тогда как более крупные опухоли могут демонстрировать интрамедуллярное распространение и разрушение коркового слоя с инвазией мягких тканей. Часто встречаются кистозные пространства, заполненные соломенного цвета или кровянистой жидкостью. Размер опухоли варьирует от менее 1 см до более 10 см.
Гистологически выделяют два основных подтипа адамантиномы: классическую и ОФД-подобную. В классической адамантиноме преобладает эпителиальный компонент, который может быть трубчатым, плоскоклеточным, базалоидным или веретеноклеточным. Базалоидные клетки обычно демонстрируют периферическую палисадность и центральные звездчатые или веретеновидные клетки. ОФД-подобные участки незаметны. Дедифференцированная адамантинома является самым редким подтипом, в котором участки классической адамантиномы постепенно сливаются с диффузно растущей пролиферацией, утрачивающей характерную эпителиальную дифференцировку и содержащей полиморфные клетки с высокой митотической активностью. Могут наблюдаться хондроидная дифференцировка, отложение остеоида и светлоклеточные изменения.
Иммуногистохимическое исследование показывает, что эпителиальные клетки коэкспрессируют кератин, EMA, виментин, p63 и подопланин. Экспрессия кератина выявляет преимущественно базальную эпителиальную клеточную дифференцировку независимо от подтипа с широким присутствием базальных эпителиальных клеточных кератинов CK5, CK14 и CK19. Кератины CK1, CK13 и CK17 также вариабельно присутствуют, тогда как CK8 и CK18 практически отсутствуют.
Дифференциальная диагностика адамантиномы включает ОФД-подобную адамантиному, синовиальную саркому и саркому Юинга. ОФД-подобная адамантинома содержит преобладание ОФД-подобных участков с лишь небольшими гнездами эпителиальных клеток, которые могут быть трудноразличимы. Классическую адамантиному, состоящую преимущественно из веретеноклеточного эпителиального компонента, необходимо отличать от синовиальной саркомы, поскольку лечение этих опухолей значительно различается. С саркомой Юинга иногда наблюдается морфологическое и иммуногистохимическое перекрытие, однако специфические для саркомы Юинга траслокации отсутствуют при адамантиноме.
ОФД-подобная адамантинома - это вариант адамантиномы длинных костей, в котором преобладают участки, напоминающие остеофиброзную дисплазию (ОФД), с лишь небольшими гнездами эпителиальных клеток. Эти эпителиальные гнезда могут быть трудноразличимы или их сложно отличить от эндотелиальных клеток при световой микроскопии.
Гистологически ОФД-подобные участки характеризуются переплетающимися трабекулами грубоволокнистой кости с остеобластической каймой, погруженными в фиброзную строму, состоящую из веретеновидных клеток. Митозы в этом компоненте крайне редки, хрящ отсутствует.
Иммуногистохимическое исследование ОФД-подобных участков выявляет небольшие гнезда эпителиальных клеток, экспрессирующих кератины. Эти кератин-позитивные эпителиальные гнезда являются ключевым отличием от ОФД, при которой присутствуют лишь единичные кератин-позитивные стромальные клетки. Фиброзная строма ОФД-подобных участков, как и при ОФД, может экспрессировать p63 и в некоторых случаях S100.
Дифференциальная диагностика ОФД-подобной адамантиномы в первую очередь включает ОФД. Наличие небольших гнезд эпителиальных клеток является ключом к диагностике ОФД-подобной адамантиномы. Кроме того, поскольку ОФД-подобная адамантинома представляет собой вариант адамантиномы, при достаточном объеме материала в биоптате могут присутствовать участки классической адамантиномы с более выраженным эпителиальным компонентом, что также помогает в постановке правильного диагноза.
1.14 Саркома Юинга
Макроскопически на разрезе имеет серовато-белый цвет, мягкую консистенцию, с участками кровоизлияний и некрозов.
Гистологически состоит из мелких круглых клеток с мелкозернистыми ядрами, скудной цитоплазмой (классический вариант) или более крупных клеток с выраженными ядрышками (атипичный вариант). Иногда присутствует нейроэктодермальная дифференцировка, что может выражаться в гистологическом строении (формирование розеткообразных структур с тонковолокнистым материалом в центре) и/или иммунофенотипически (экспрессия нейроэндокринных маркеров).
Иммуногистохимически характерна экспрессия CD99 (95% случаев), NKX2-2 (более специфичен), кератина (25%), FLI1 и ERG (при соответствующих генных слияниях), нейроэндокринных маркеров и S100.
Адамантиномоподобная саркома Юинга - подгруппа с такими же генными слияниями, часто экспрессирующая маркеры плоскоклеточной дифференцировки. Ее взаимосвязь с классической саркомой Юинга неясна.
1.15 Круглоклеточные саркомы с перестройками EWSR1-non-ETS
Макроскопически саркомы EWSR1-NFATC2 представляют собой солидные образования различных размеров (от 4 до 18 см в наибольшем измерении), на разрезе желтовато-коричневого цвета, плотной или мягкой консистенции. Большинство опухолей нечетко отграничены и местно деструктивны или инфильтрируют прилежащие ткани, однако некоторые первичные поражения мягких тканей и костей описаны как хорошо очерченные или ограниченные костномозговой полостью. Саркомы EWSR1-PATZ1 представляют собой солидно-кистозные образования размерами от 3,5 до более 10 см.
Гистологически саркомы EWSR1-NFATC2 и FUS-NFATC2 состоят из мелких и средних круглых и/или веретеновидных клеток с небольшим количеством эозинофильной или светлой цитоплазмы, преимущественно расположенных в виде тяжей, мелких гнезд, трабекул и псевдоацинарных структур на фоне фиброгиалиновой или миксоидно-гиалиновой стромы. Реже встречаются бесструктурные скопления клеток. Ядра опухолевых клеток мелкие, круглые, монотонные или выраженно полиморфные, с гладкими или неправильными контурами, плотным гиперхромным или везикулярным хроматином и мелкими или выраженными ядрышками. Некрозы и митотическая активность вариабельны. Опухолевые клетки диффузно экспрессируют CD99 в половине случаев, возможна экспрессия PAX7 и NKX2-2, фокальное точечное окрашивание на кератин AE1/AE3 и фокальная экспрессия CD138. Случаи часто ошибочно диагностировались как миоэпителиальная опухоль, плазмоцитома и лимфома.
Гистологические и иммунофенотипические особенности сарком EWSR1-PATZ1 довольно разнообразны. Опухолевые клетки мелкие, круглые и/или веретеновидные, часто в сочетании с фиброзной стромой. Некрозы и митотическая активность могут присутствовать или отсутствовать. Наблюдается коэкспрессия миогенных маркеров (десмин, миогенин, MYOD1) и нейрогенных маркеров (S100P, SOX10, MITF, GFAP) в различной степени. CD34 может быть положительным. Экспрессия CD99 непостоянна.
1.16 CIC - перестроенная саркома
Макроскопически крупные, хорошо отграниченные, белые или коричневатые, мягкие массы, часто с кровоизлияниями и некрозами.
Гистологически диффузные пласты недифференцированных круглых, чаще эпителиоидных клеток с дольчатым ростом, разделенные фиброзной стромой. Возможно веретеноклеточное строение. Клетки однородные, но с умеренным ядерным полиморфизмом, везикулярным хроматином и выраженными ядрышками. Цитоплазма слабо эозинофильная, иногда с просветлением. Некрозы часты, митозы многочисленны. В трети случаев - миксоидные стромальные изменения с сетчатым или псевдоацинарным расположением клеток. Опухоли с вариантами слияния CIC-non-DUX4 сходны с CIC-DUX4.
Имунофенотип: часто CD99 (очагово), WT1 (90 - 95%), ETV4 (95 - 100%); NKX2-2 обычно негативен. Саркомы CIC-NUTM1 экспрессируют NUT. Кератин, S100, миогенные маркеры редки. Кальретинин и ERG могут быть положительны.
1.17 Саркома с генетической альтерацией гена BCOR
Макроскопически это крупные (> 5 - 10 см), серовато-коричневые, мягкие или мясистые опухоли с некрозами. Поражения костей часто демонстрируют деструкцию коркового слоя и распространение в мягкие ткани. Гистологически наблюдается значительное сходство опухолей семейства BCOR. Саркомы BCOR-CCNB3 обычно состоят из однородной пролиферации примитивных мелких круглых или овоидных клеток, расположенных в виде солидных пластов или с гнездным паттерном, окруженных богатой капиллярной сетью. Могут встречаться менее клеточные участки веретеновидных клеток в миксоидном матриксе или солидные участки крупных веретеновидных клеток, расположенных в виде пучков, напоминающих синовиальную саркому. Ядра имеют мелкодисперсный хроматин, ядрышки обычно неразличимы. Митотическая активность вариабельна. Метастатические/рецидивные поражения иногда демонстрируют полиморфные ядра и отложение остеоида. Опухоли с аномалиями BCOR-ITD демонстрируют различную степень клеточности, от солидных пластов мелких клеток до гипоклеточных участков веретеновидных клеток в миксоидном матриксе с сосудистой сетью. Иммуногистохимически все опухоли с различными генетическими нарушениями BCOR демонстрируют сильную и диффузную ядерную экспрессию BCOR и часто экспрессируют SATB2, TLE1 и циклин D1. CD99 положителен примерно в 50% случаев. Однако экспрессия BCOR неспецифична и часто наблюдается, например, при синовиальной саркоме. Саркомы BCOR-CCNB3 также экспрессируют циклин B3, который не наблюдается в других опухолях семейства BCOR.
1.18 Гигантоклеточная опухоль кости
Макроскопически ГКО - это хорошо отграниченное образование в эпифизе, часто с истончением и разрушением кортикального слоя. На разрезе опухоль мягкая, рыхлая, красновато-коричневого цвета, с участками фиброза. Могут наблюдаться кровоизлияния и кистозные полости. Злокачественная ГКО обычно плотнее и мясистее.
Микроскопически ГКО представляет собой клеточную опухоль с преобладанием неопухолевых гигантских клеток и мономорфными опухолевыми клетками с невыраженной атипией. Типичная гистологическая картина может быть замаскирована некрозом, кровоизлияниями, отложением гемосидерина, аневризматическими изменениями, скоплениями ксантомных клеток и реактивным костеобразованием. Очаговый ядерный полиморфизм в типичной ГКО обычно представляет собой дегенеративные изменения. Окружающая кость часто резорбирована с формированием реактивного ободка по периферии. Описаны легочные метастазы со сходным гистологическим строением.
Первичная злокачественная ГКО - редкое событие, обычно представлена узлом высокополиморфных клеток в обычной ГКО. Чаще встречается злокачественная трансформация ГКО после лечения, в том числе лучевой терапии. Злокачественный компонент представлен недифференцированной саркомой или остеосаркомой. В части случаев злокачественной трансформации опухолевые клетки сохраняют мутацию H3.3 p.Gly34 (G34W). Саркомы кости с такой мутацией без признаков ГКО, вероятно, связаны с ГКО.
ГКО после лечения деносумабом демонстрируют выраженное костеобразование, истощение гигантских клеток и наличие мономорфных веретеновидных клеток. Эти изменения могут имитировать остеосаркому или злокачественную ГКО, однако обычно нет выраженной атипии, высокой митотической активности и инвазии кости.
Иммуногистохимическое выявление мутации H3.3 p.Gly34Trp (G34W) - надежный суррогатный маркер, заменяющий молекулярное исследование.
2. Особенности биопсии новообразований костей у детей
2.1 Планирование биопсии
При планировании биопсии необходимо учитывать биологические особенности сарком костей и мягких тканей. Саркомы растут центростремительно, таким образом, что самая незрелая часть расположена по растущему краю. Между опухолью и сдавливаемыми ее окружающими нормальными тканями формируется реактивная зона. Реактивная зона состоит из индуцированной пролиферации мезенхимальных клеток, неоангиогенеза и воспалительного процесса. Данная зона может быть поражена опухолевыми клетками, скопления которых называется сателлитами, они не являются метастазами. Тип мезенхимальной пролиферации определяется анатомической локализацией опухоли: мягкотканные опухоли стимулируют фиброзную реакцию, а внутрикостные очаги стимулируют костеобразующую реакцию. То есть, один и тот же патологический очаг в разных анатомических областях будет стимулировать разные мезенхимальные реакции. В отличие от сарком, карциномы обычно инфильтрируют окружающие ткани, а не оттесняют их, и обычно не индуцируют формирование реактивной зоны. Таким образом, очаг саркомы более гетерогенный, в то время как очаг карциномы более гомогенный [21]. Для постановки диагноза в случае карциномы, часто достаточно проведения трепанбиопсии. При саркоме это может вести к диагностической ошибке, так как материал будет взят не из репрезентативного очага. В международной литературе это называется "sampling error" - ошибка выборки [21].
В процессе проведения биопсии происходит загрязнение операционной области опухолевыми клетками, что может увеличивать риск локального рецидива. Это обуславливается размером хирургического доступа, грубыми манипуляциями инструментом, неадекватностью гемостаза, отсутствием маркировки биопсийного тракта. Независимо от того, проводилась ли открытая биопсия или трепанбиопсия, в последствии, необходимо исходить из того, что область биопсии загрязнена опухолевыми клетками и следовательно должна быть иссечена с соблюдением всех онкологических правил (широкий отступ, оставление тракта на опухоли, иссечение места стояния дренажа) [23]. Поэтому кожный разрез и биопсийный тракт должны быть расположены строго в соответствии с будущим операционным доступом [21]. Путь к опухоли должен быть, по возможности максимально коротким, проходить не более чем через один мышечный компартмент, и находится на безопасном расстоянии от магистрального сосудисто-нервного пучка [21, 22].
2.2 Операционные доступы при проведении биопсии
Для каждой локализации первичного очага в костях скелета существуют классические операционные доступы для проведения локального контроля. Эти доступы необходимо учитывать при проведении биопсии.
Пояс верхней конечности
Рис. 6.1 Проекция для биопсии лопатки [21]
При проведении биопсии на верхней конечности необходимо учитывать стандартный доступ для операции Тихова-Линберга. В зависимости от локализации и распространенности опухоли используется либо весь доступ, либо его часть.
На Рис. 6.1 изображена задняя часть доступа, которая может быть использована для удаления опухоли лопатки. Эта же линия и является проекцией для выбора места биопсии лопатки.
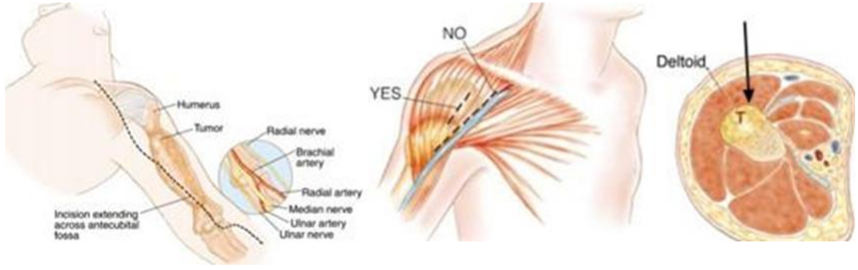
Рис. 6.2 Проекция для биопсии опухоли плеча [21]
На Рис. 6.2 часть доступа, используемая для проведения операции по удалению опухоли плечевой кости, как в проксимальной, так и в дистальной частях.
Линия доступа, используемая для биопсии на предплечье и кисти, как правило выбирается индивидуально, в зависимости от локализации, размеров и планируемой операцией. Так как эти локализации довольно редкие, классических рекомендаций нет.
Пояс нижних конечностей
Биопсия опухолей костей таза сложная процедура ввиду анатомии данной области. Открытая биопсия должна проводиться после тщательного предоперационного планирования и междисциплинарного обсуждения. Если выбрано проведение трепанбиопсии, то последняя должна выполняться под контролем КТ [54].
Для удаления опухолей таза существует унифицированный тазовый доступ (Рис 6.3 и 6.4), так же, как и на верхнем плечевом поясе, в зависимости от локализации и размеров опухоли, он может использоваться полностью, либо могут быть использованы какие-либо его части. Однако, ряд специализированных центров иногда используют его модификации.
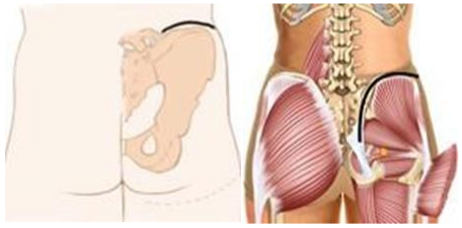
Рис 6.3. Задняя часть унифицированного тазового доступа, при необходимости может быть продлена дистальнее по линии крестцово-подвздошного сочленения [21].
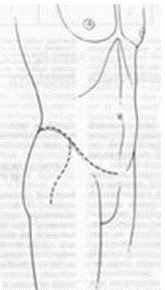
Рис. 6.4 Передняя часть унифицированного тазового доступа.
Проведение биопсии кости (открытой или трепанбиопсии) должно проводится только в проекции унифицированного тазового доступа или его модификации, изображенной на рисунке 6.5 [54]. Выполнение биопсии в проекции других модификаций доступа возможно только в тех центрах, где в дальнейшем будет выполняться операция по удалению опухоли.
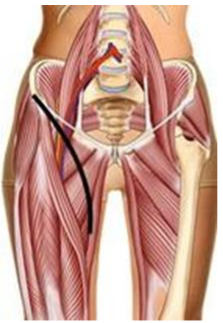
Рис 6.5. Модификация унифицированного тазового доступа. Вместо его паховой части и дополнительного T-образного разреза выполняется его продление дистальнее по медиальной поверхности бедра. Данный доступ более предпочтителен для использования.
При локализации очага на бедре в верхних двух третях предпочтительна биопсия с латеральной стороны (Рис. 6.6). Как правило, с этим не возникает сложностей, так как мышечный массив с латеральной стороны меньше по объему. В нижней трети возможна биопсия как с медиальной, так и с латеральной стороны, в зависимости от локализации мягкотканного компонента.
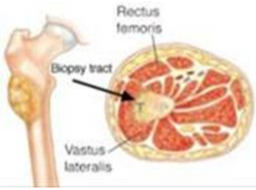
Рис. 6.6 Доступ при локализации очага в проксимальных двух третях бедра [21]
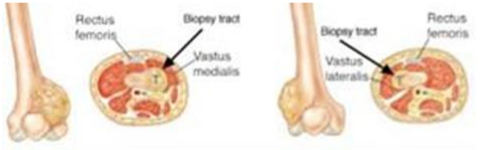
Рис 6.7. Доступ при локализации очага в нижней трети бедра [21]
На голени, из-за дефицита мягких тканей и особенностей кровоснабжения, корректное выполнение биопсии крайне важно. Ошибка выбора доступа, изъязвление места биопсии, не бережное отношение к мягким тканям - могут привести к невозможности проведения органосохраняющей операции.
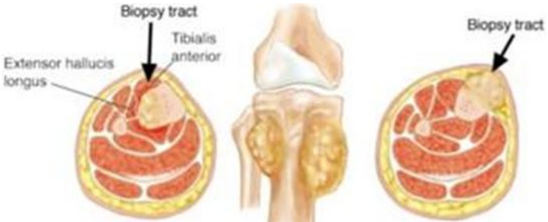
Рис. 6.8 Доступ при локализации опухоли на голени [21].
Предпочтительное место проведения биопсии - переднемедиальный доступ. В редких случаях возможно выполнение биопсии через передний доступ Рис. 6.8. Использование латерального доступа следует максимально избегать, в исключительных случаях может быть использован по согласованию с федеральным центром, где впоследствии будет выполняться этап локального контроля. При опухоли м/берцовой кости выполняется латеральный доступ, при котором крайне важно знать топографию малоберцового нерва Рис. 6.9.
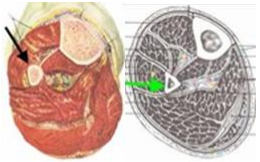
Рис. 6.9 Доступ к опухолям верхней трети (черная стрелка) и дистальным двум третям (зеленая стрелка) малоберцовой кости [21].
Дистальный отдел голени и стопа крайне редкая локализация опухолей. Поэтому в отличие от таких локализация как плечо, или область коленного сустава, в этой области нет таких же широко распространенных методик. Локализация опухоли в дистальном и среднем отделах стопы, как правило, требует проведения ампутации, поэтому доступ для биопсии выбирается индивидуально. Для биопсии пяточной кости предпочтителен медиальный доступ. Однако, при необходимости может быть выбран и латеральный доступ. Таранная кость биопсируется из переднего доступа. Также при необходимости может быть использован медиальный. В связи с появлением новых методик, стало возможным проведение эндопротезирования голеностопного сустава, поэтому тут также важно учитывать будущий доступ для операции. В данной области предпочтителен передне-латеральный доступ. Рис. 6.10.
В связи с выраженным дефицитом мягких тканей, крайне важно избегать их контаминации опухолевыми клетками.
Рис. 6.10 Проекция доступа к дистальному отделу большеберцовой кости
Позвонки
Отдельно стоит сказать о такой сложной локализации как позвонки. Учитывая, что как правило опухоли данной локализации манифестируют с неврологической симптоматики и болевого синдрома, в большинстве случаев пациентам требуется декомпресионная ламинэктомия по жизненным показаниям. Если данная процедура выполняется не в онкологическом, а как часто бывает, в нейрохирургическом стационаре, крайне необходимо, чтобы оперирующий хирург отдал удаляемые, компримирующие, ткани на гистологическое исследование и провел тщательный гемостаз перед ушиванием раны. При наличии дефекта в позвонке, закрыл его гемостатиком, воском или костным цементом [11].
При выявлении опухоли позвонка без распространения в спинномозговой канал, без неврологической симптоматики, выполняется транспедикулярная трепанбиопсия под контролем компьютерной томографии [54] (Рис. 6.11). Выполнение данной процедуры должно проводится в специализированом федеральном центре.
Рис. 6.11 Транспедикулярная трепанбиопсия
Ребра и грудина
При наличии объемного образования костей грудной клетки (ребер/грудины) предпочтительно проведение экстраторакальной биопсии с целью исключения диссеминации опухоли по плевральной полости. Выполнение торакоскопии/торакотомии не приветствуется, однако не исключается полностью и может быть проведено при диссеминированном в пределах гемиторакса опухолевом процессе, при наличии признаков распада опухоли и плеврита.
При наличии выпота в плевральной полости на стороне поражения можно предположить вовлечение париетальной плевры в опухолевый процесс. В таком случае при наличии объема выпота, доступного для проведения пункции плевральной полости и забора жидкости, параллельно с биопсией основного патологического очага проводится торакоцентез. Полученный аспират направляется на цитологическое исследование плевральной жидкости.
При наличии опухоли ребер/грудины с экстраоссальным компонентом предпочтителен забор на биопсию именно мягкотоканного компонента, а не фрагмента костной ткани, что в последующем исключает необходимость проведения этапа декальцинации полученного материала, что в свою очередь позволяет выполнить адекватное молекулярно-генетическое исследование.
При выборе места биопсии необходимо учитывать предполагаемый доступ последующего хирургического лечения, в случае биопсии опухоли ребра разрез кожи должен быть выполнен продольно по ходу ребра, в случае биопсии опухоли грудины - продольно по средней линии тела.
При выполнении биопсии опухоли ребра при подозрении на ЗНО необходимости в сохранении надкостницы ребра нет.
Кости черепа
При наличии объемного образования костей черепа (челюстно-лицевой области, свода черепа) в зависимости от локализации опухолевого процесса основными принципами при выборе доступа являются сохранение функциональных зон в области головы, косметическая составляющая, стремление к мини-инвазивным доступам с целью более быстрого восстановления пациента в раннем послеоперационном периоде.
При выборе места биопсии необходимо учитывать предполагаемый доступ последующего хирургического лечения.
При локализации опухоли в области нижней и верхней челюстей предпочтительно выполнение биопсии образования внутриротовым доступом, как с косметической точки зрения, так и с целью уменьшения вероятности повреждения ветвей лицевого нерва.
При локализации опухоли в области переднего/центрального основания черепа рекомендована трансназальная/трансоральная биопсия опухоли в том числе с использованием навигационных систем.
При наличии опухоли костей черепа (челюстно-лицевой области, свода черепа) с экстраоссальным компонентом предпочтителен забор на гистологическое исследование мягкотканного компонента, что связано с исключением необходимости выполнения декальцинации операционного материала, что позволяет выполнить гистологическое исследование в более короткие сроки и позволяет провести адекватное молекулярно-генетическое исследование.
При наличии связи опухоли с твердой мозговой оболочкой рекомендовано выполнение спинномозговой пункции (люмбальной) с целью исключения опухолевых клеток в ликворной системе.
При наличии данных о метастатическом поражении по данным визуализации рекомендовано рассмотреть возможность проведения биопсии метастатического очага.
3. Общие принципы хирургического лечения злокачественных опухолей костей
Главная цель хирургического лечения - радикальное удаление опухоли, что должно гарантировать отсутствие развития локального рецидива [18, 96, 97].
3.1 Базовые принципы резекции злокачественных опухолей
На сегодняшний день существует 4 базовых принципа резекций злокачественных опухолей [18, 96, 97]:
1. Внутриочаговая резекция - заключается в удалении опухоли по частям, с повреждением псевдокапсулы, с большим риском обсеменения области операции опухолевыми клетками.
2. Краевая резекция - удаление по краю или через псевдокапсулу опухоли. Подобный тип операции может вести к тому, что микроскопически край резекции может проходит по опухолевой ткани.
3. Широкая резекция (en-block) - подразумевает удаление опухоли без повреждения псевдокапсулы и в муфте из визуально неизмененных окружающих тканей.
4. Радикальная резекция - удаление опухоли с целым анатомическим компартментом, в котором она расположена.
Современная онкоортопедия рекомендует использование широкой резекции или радикальной резекции при удалении злокачественных опухолей костей. Однако ширина муфты из неизмененных тканей и отступ по кости до сих пор дискутабельны. Ряд источников рекомендует отступ от 3 до 7 см, что проблематично применять у пациентов детского возраста, ввиду их антропометрических данных. Ряд современных источников, в том числе рекомендации ESMO, советуют безопасную границу резекции 2 см на "свежем" удаленном препарате и 1 см после его фиксации. В первую очередь, это касается таких нозологий, как остеосаркома, хондросаркома. При саркоме Юинга желателен отступ не менее 3 - 5 см по кости и не менее 2 - 3 см по мягким тканям [13, 98].
Радикальная резекция также применима, особенно в случаях, когда у пациента выявлены skip-mts [18, 97].
На сегодняшний день появились исследования, допускающие краевую резекцию при злокачественных опухолях костей, особенно при остеосаркоме низкой степени злокачественности, но не при саркоме Юинга. Однако, ввиду малого числа исследований, большинство из которых ретроспективные и имеют период наблюдения менее 5 лет, применять данный тип хирургического лечения не целесообразно [13, 98].
Важно отметить, что в некоторых случаях показана экстраартикулярная резекция - сегментарная резекция опухоли вместе с близрасположенным суставом, без вскрытия капсулы последнего. Показанием к данной процедуре являются: прохождение биопсийного тракта через полость сустава, распространение опухоли по внутрисуставным связкам и капсуле сустава, патологический перелом с контаминацией сустава, расположение опухоли в полости сустава, опухоль, расположенная в области дорсальной поверхности мыщелков бедра и вовлекающая место прикрепления головок икроножных мышц. Учитывая редкость и сложность выполнения операции, необходимость мышечной пластики, данная процедура должна выполняться в специализированном центре с большим опытом подобных операций.
Внутриочаговая резекция противопоказана при злокачественных опухолях костей. Исключением может быть гигантоклеточная опухоль, особенно при положительном эффекте от терапии препаратом Деносумаб**. До сих пор нет единого мнения о злокачественности данной нозологии. Согласно МКБ-10, данная опухоль относится к доброкачественным, но ряд зарубежных специалистов относит ее к потенциально злокачественным.
3.2 Органоуносящие операции
Принятие решения о проведении органоуносящей операции должно проводиться коллегиально, с участием врача-детского онколога, врача-травматолога-ортопеда, врача-радиотерапевта, специалиста лучевой диагностики, врача-патологоанатома, психолога. Родители должны быть подробнейшим образом оповещены о причинах принятого решения [96].
Виды органоуносящих операций:
1. Ампутация кисти
2. Ампутация на уровне средней трети предплечья
3. Ампутация на уровне средней трети плеча
4. Экзартикуляция в плечевом суставе
5. Межлопаточно-грудная ампутация
6. Ампутация стопы
7. Ампутация голени на уровне средней трети
8. Ампутация бедра на уровне средней трети
9. Экзартикуляция в т/бедренном суставе
10. Межподвздошно-брюшная ампутация (гемипельвэктомия)
3.3 Органосохраняющие лечения
При отсутствии показаний к органоуносящей операции возможно выполнение органосохраняющей операции, разновидностями которых являются:
1. Эндопротезирование
2. Биологическая реконструкция (использование аутотрансплантата малоберцовой кости на сосудистой ножке, аллографта)
3. Реконструктивно-пластические операции
Эндопротезирование
В современной онкоортопедии среди различных способов восстановления дефекта и функции конечности после удаления опухолевого очага ведущее место занимают высокотехнологичные операции с использованием эндопротезов. Использование модульных систем эндопротезирования является предпочтительным способом реконструкции костных дефектов при злокачественных опухолях костей у пациентов подросткового возраста, достигших костной зрелости. Современные технологии позволяют выполнить эндопротезирование практически любой локализации. Для пациентов детского возраста с незрелым скелетом необходимо использовать индивидуально изготовленные, раздвижные эндопротезы, удлиняемые по мере роста пациента [34, 52, 56]. Данные импланты, могут удлиняться механически - при помощи отвертки или специального ключа, для чего необходимо оперативное пособие, чаще из минидоступа. Такие импланты называются инвазивные. Также существует вид имплантов, для удлинения которых операция не требуется - неинвазивные. Удлиняются при помощи специальных устройств, за счет магнитного поля или электрического импульса. Использование неинвазивных раздвижных протезов предпочтительно для пациентов детского возраста.
Выделяют следующие виды реконструктивных операций в объеме эндопротезирования:
- стандартные первичные операции у пациентов подросткового возраста с применением модульных систем эндопротезирования;
- стандартные первичные операции у пациентов детского возраста с применением индивидуально изготовленных раздвижных имплантов;
- эндопротезирование редких анатомических зон конечностей: лучезапястный сустав, локтевой сустав, голеностопный сустав, в том числе с использованием индивидуальных изделий
- ревизионное эндопротезирование (ввиду асептической нестабильности, инфекционных осложнений, поломки элементов эндопротеза, полной выработки механизма удлинения импланта);
- эндопротезирование после резекции костей таза с применением имплантов изготовленных на 3D-принтере;
- эндопротезиование позвонков;
- Эндопротезирование редких анатомических локализация с применением индивидуально изготовленных имплантов, в том числе с использованием аддитивных технологий
Особенности при первичном эндопротезировании у детей и подростков [39, 98, 99, 100]:
- изготовления индивидуального импланта для пациентов с незрелым скелетом, в некоторых случаях без возможности интраоперационного варьирования использования интрамедуллярных ножек и методов фиксации;
- строгое следование предоперационной планировке у пациентов с раздвижными эндопротезами;
- раздвижной механизм эндопротеза (инвазивный и неинвазивный);
- сохранение условий для реэндопротезирования и коррекции дефицита длины конечностей.
Рост количества случаев первичного эндопротезирования и успехи ХТ костных сарком приводят к ежегодному увеличению количества пациентов, нуждающихся в повторных (ревизионных) ортопедических операциях в связи с развитием таких осложнений как асептическая нестабильность, инфекционные осложнения, поломка элементов эндопротеза, полная выработка механизма удлинения импланта, появление блокировки зоны роста или появление деформации оси конечности. Проведение ревизионных операций вне зависимости от их причины требует подготовленной команды онкоортопедов и соответствующего оборудования. Применение модульной системы эндопротезирования у пациентов со зрелым скелетом упрощает выполнение последующих ревизионных операций и увеличивает биологический резерв кости, за счет возможности замены отдельных элементов и установки специальных ревизионных интрамедуллярных ножек. Ревизионный эндопротез для пациентов с незрелым скелетом изготавливается индивидуально, что в редких случаях позволяет, не удаляя весь эндопротез, заменить его часть. Отдельно стоит сказать о ревизионных операциях при инфекционных осложнениях. В случае малого срока с момента операции (до 4 недель), отсутствия дефектов кожных покровов, высеве низковирулентной флоры с хорошей чувствительностью к антибактериальным препаратам системного действия, может быть выполнена одномоментная операция - санация перипротезного ложа, дебридмент, замена пластиковых элементов, при технических возможностях повторная стерелизация импланта. Обязательна длительная антибиотикотерапия. При длительных сроках после операции (более 4 недель), наличии дефектов кожных покровов (свищей), высеве высоковирулентной флоры - рекомендованы двухэтапные операции. Первым этапом - санация перипротезного ложа, дебридмент, удаление всех элементов эндопротеза, установка цементного спейсера с антибактериальным препаратом системного действия. Далее длительная антибактериальная терапия, не менее 4 недель. При отсутствии признаков инфекции (лабораторные показатели, отсутствие высева в пунктате из ложа эндопротеза) - второй этап - удаление цементного спейсера с реэндопротезированием новым эндопротезом. Также при инфекицонных осложнениях положительный эффект может быть достигнут при использовании методики лечения ран отрицательным давлением (вакуум-терапии) [37].
Особенности хирургической техники [21, 39, 99, 100]:
1. оставление биопсийного тракта ad mass с опухолью;
2. соблюдение онкологических правил хирургического лечения сарком (широкая или радикальная резекция)
3. соблюдение ортопедических правил фиксации интрамедуллярных ножек эндопротеза;
4. соблюдение физиологической оси конечности и восстановление ее дооперационной длины;
5. наличие хирургических навыков для выполнения мышечной пластики при необходимости;
6. адекватная реконструкция мышечного компонента для укрытия импланта и восстановления функции.
Биологическая реконструкция
При локализации опухолевого очага в диафизе сегмента конечности, по возможности, необходимо сохранить суставы пациента. Для этого проводится удаление только диафиза - интеркалярная резекция [101, 102]. Замещение пострезекционного дефекта в этом случае может быть проведено при помощи эндопротеза, а также при помощи биологической реконструкции - использования аутотрансплантата малоберцовой кости на сосудистой ножке, при необходимости аллографта, а также остеосинтеза одной или двумя пластинами с угловой стабильностью [903 - 105].
Для возможности проведения данной операции должны быть соблюдены следующие условия [92, 93]:
7. Возможность соблюдения всех онкологических правил резекции
8. Наличие у пациента возможности забора аутотрансплантата малоберцовой кости
9. Наличие в стационаре микрохирургической бригады и микрохирургического оборудования
10. Владение навыками остеосинтеза
Операции при локализации объемного образования в ребрах и грудине
При саркоме Юинга ребра предпочтительным объемом операции является торакотомия с экстирпацией пораженного ребра и резекцией (реже экстирпацией) смежных ребер при наличии признаков вовлечения их в патологический процесс. Резекция пораженного ребра рассматривается возможной при наличии непротяженной по длине ребра опухоли и отсутствии распространения опухолевого поражения по костномозговому каналу за пределы опухоли по данным МРТ с внутривенным контрастным усилением.
Опухоль ребра должна удаляться полнослойно единым блоком с иссечением постбиопсийного рубца/тракта.
С целью оценки вовлеченности мягких тканей межреберных промежутков рекомендуется проведение интраоперационного срочного гистологического исследования краев резекции опухоли по мягким тканям смежных межреберных промежутков. При отсутствии данных за поражение смежных ребер "верхняя" и "нижняя" границы резекции опухоли должны проходить по нижнему краю вышележащего ребра и по верхнему краю нижележащего ребра, соответственно, с забором надкостницы. После удаления макропрепарата обязательно производится маркировка краев резекции (предпочтительно обозначать 5 краев - верхний, нижний, передний, задний и внутренний).
Реконструкция дефекта грудной стенки с использованием биоматериалов, синтетических сеток/пластин, металлических сеток/конструкций или их комбинации должна проводиться при наличии дефекта > 1 ребра в передних и боковых отделах грудной стенки, > 2 - 3 ребер в задних отделах грудной стенки, а также при наличии дефекта грудины. В иных случаях возможно проведение реконструкции с пластикой дефекта местными тканями.
Операции при локализации объемного образования в костях черепа
Для пациентов с локализацией объемного образования в костях черепа (челюстно-лицевой области, свода черепа) объем хирургического вмешательства определяется в рамках междисциплинарного консилиума. Планирование локального контроля должно начинаться за 1,5 - 2 месяца до момента хирургического вмешательства в связи с необходимостью индивидуального планирования реконструкции послеоперационного дефекта.
При локализации злокачественного новообразования в нижней или верхней челюсти предпочтительным объемом оперативного лечения является проведение резекции верхней или нижней челюсти реконструктивно-пластическим компонентом. Выбор метода реконструкции зависит от локализации опухоли, размера образования и наличия экстраоссального компонента. При наличии экстраоссального компонента опухоли рекомендовано проведение интраоперационного срочного гистологического исследования краев резекции опухоли по мягким тканям в области наибольшего подрастания к опухоли.
При остеосаркоме костей черепа (челюстно-лицевой области, свода черепа), опухоль должна быть единым блоком с иссечением постбиопсийного рубца/тракта.
При саркоме Юинга костей черепа или другой недифференцированной мелкокруглоклеточной саркоме кости (челюстно-лицевой области, свода черепа) при невозможности проведения En-block резекции в связи с локализацией и распространением опухоли, в связи с вовлечением в опухолевый процесс критически важных анатомических структур, целесообразно междисциплинарное обсуждение возможности R1 резекции в с связи с возможностью проведения адъювантной лучевой терапии.
После удаления макропрепарата обязательно производится маркировка краев резекции.
Хирургическое лечение метастатического поражения легких
Хирургическое лечение является основным методом локального контроля метастазов ОС, в первую очередь метастазов в легких. Излечение пациента от метастатической формы ОС возможно только в случае достижения хирургической ремиссии. 5-летняя общая выживаемость после полной резекции метастатических очагов легких варьирует от 32 до 39%, при невозможности проведения полной резекции - от 0 до 2% [39, 40]. Попытка проведения полного удаления метастазов должна предприниматься всякий раз, но при соблюдении двух важных условий: полного контроля над первичной опухолью и сохранения достаточного для жизнедеятельности объема легочной ткани после резекции [94]
Если пациент с метастатическим поражением легких проходит лечение с куративной целью, все очаги должны быть полностью удалены, вне зависимости от их количества и расположения.
"Золотым" стандартом лечения метастатического поражения легких при ОС остается торакотомия, позволяющая провести мануальную пальпацию легкого и обнаружить маленькие и глубоко расположенные метастазы, не выявленные на предоперационной МСКТ.
В настоящее время при унилатеральном поражении легких при ОС большей частью исследователей признан следующий подход: проведение унилатеральной торакотомии с резекцией всех выявленных очагов и тщательное наблюдение после операции. Проведение эксплоративной торакотомии с контрлатеральной стороны при унилатеральном поражении признано нецелесообразным.
При билатеральном поражении легких хирургические опции включают в себя симультанные билатеральные торакотомии (синхронные), этапные билатеральные торакотомии, разделенные во времени (метахронные), и срединную стернотомию. Каждый вариант имеет как преимущества, так и недостатки. Преимуществом симультанных билатеральных торакотомий является возможность адекватно осмотреть каждый гемиторакс и провести две операций за одно анестезиологическое пособие. Недостатком является длительность анестезиологического пособия, включающая в себя необходимость обеспечения восстановления адекватной сердечно-легочной деятельности при переходе с однолегочной вентиляции с одной стороны на однолегочную вентиляцию с противоположной стороны. Фактором, ограничивающим проведение синхронных торакотомий, является множественное поражение легких, а именно наличие 10-ти и более очагов в одном/обоих легких по данным предоперационной КТ органов грудной полости с внутривенным болюсным контрастированием. Наиболее общепринятым и рекомендуемым является проведение этапных билатеральных торакотомий, которые обеспечивают возможность адекватно осмотреть каждый гемиторакс и не сопровождаются таким длительным анестезиологическим пособием, как при симультанных торакотомиях. Кроме того, такой вид оперативного вмешательства показан при множественном поражении легких. Недостатком этапных операций является вероятность задержки проведения следующей торакотомии из-за медленного восстановления и послеоперационных осложнений, что может привести к прогрессии заболевания и к увеличению объема последующей резекции. Некоторые хирурги предпочитают проводить срединную стернотомию [74 - 76]. Для этого операционного доступа есть ряд противопоказаний, а именно: преимущественная локализация метастазов в задних отделах легких, большие и/или множественные метастазы в нижней доле левого легкого, предшествующие операции на грудной клетке. Кроме того, этот доступ требует большего взаимодействия между хирургом и анестезиологом на протяжении всего оперативного вмешательства. Также следует отметить большую травматичность повторной стернотомии, если таковая потребуется [70]. Преимуществами стернотомии считаются проведение одного доступа для двусторонней экспозиции и резекции и менее выраженный по сравнению с торакотомией болевой синдром в послеоперационном периоде. В исследовании Abbo O описывается проведение билатеральной передней стерноторакотомии (разреза по типу "раковины моллюска") у детей с метастазами ОС в легкие [68].
Множественность (>= 5) очагов не должна являться противопоказанием к проведению хирургического вмешательства. Операция должна проводиться строго на коллабированнном легкого в условиях однолегочной вентиляции. При наличии субплеврально расположенных очагов показано проведение атипичных клиновидных резекций легкого для сохранения большего объема паренхимы, при локализации очагов в прикорневых отделах показано проведение анатомических резекций (лобэктомии/билобэктомии/пульмонэктомии) [77].
4. Особенности проведения курсов химиотерапии
Перед началом каждого курса ПХТ необходимо выполнить:
1. Антропометрические исследования (измерение роста, измерение массы тела, площади поверхности тела)
2. Физикальный осмотр пациента
3. Общий анализ крови с лейкоцитарной формулой
4. анализ крови биохимический общетерапевтический (исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, исследование уровня общего магния в сыворотке крови, определение активности щелочной фосфатазы в крови, исследование уровня общего белка в крови, определение активности аланинаминотрансферазы в крови, определение активности аспартатаминотрансферазы в крови, исследование уровня C-реактивного белка в сыворотке крови, исследование уровня общего билирубина в крови)
5. ЭХО-КГ, ЭКГ (перед курсом с доксорубицинном**)
5. Особенности лучевой терапии при саркоме Юинга
5.1 Технические требования к оборудованию для ДЛТ
Линейный ускоритель электронов с энергией фотонов 6 - 10 МэВ, оснащенный многолепестковым коллиматором и, крайне желательно, системой/системами визуального контроля укладки: компьютерной томографией в коническом пучке (CBCT), портальной визуализацией.
Фиксирующие приспособления для головы и тела (термопластические маски, вакуумные матрасы и др.).
Рентгеновский компьютерный томограф для топометрии, имеющий плоскую деку с возможностью крепления и индексацией систем фиксации.
Система 3-D планирования облучения и, крайне желательно, с возможностью расчета облучения с применением методик модулированной по интенсивности лучевой терапии в статическом и динамическом режимах (IMRT/VMAT).
5.2 Предлучевая подготовка
Выполнение КТ-топометрии должно проводиться на рентгеновском компьютерном томографе, приспособленном для нужд радиотерапии.
Разметка проводится с использованием индивидуальных средств фиксации:
- при локализации в области головы и шеи - термопластических масок и вакуумного матраса,
- при локализации в области средостения, брюшной полости и полости малого таза - вакуумного матраса и др.
Послеоперационные, постбиопсийные рубцы должны быть помечены рентгенконтрастными метками.
Сканирование проводится с толщиной среза:
- в области головы и шеи - 1 - 3 мм,
- в области средостения, брюшной полости и малого таза - 2 - 5 мм.
Величина поля изображения (Field Of View, FOV) должна быть максимальной для включения всех частей тела и систем фиксации.
Необходимо предусмотреть, что при топометрии и лучевой терапии пациентов младше 5 лет может потребоваться общая анестезия.
Планирование проводится на нативной серии КТ-топометрии.
5.3 Определение объемов облучения
Макроскопический объем опухоли (GTV) определяется как максимальное распространение опухоли - до начала терапии или прогресса на фоне лечения.
Для его уточнения необходимо совмещение разметочных КТ-грамм и диагностических КТ или МРТ-изображений, данных ПЭТ/КТ, проведенных перед началом всего курса лечения или на фоне прогресса заболевания.
Клинический объем мишени (CTV) включает GTV с отступом 2 см с учетом анатомических барьеров распространения опухоли. Область послеоперационного рубца от биопсии или резекции должна быть включена в объем облучения [82].
Исключение: см раздел "Лучевая терапия отдельных локализаций опухоли".
Планируемый объем мишени (PTV) включает CTV с дополнительным отступом 3 - 10 мм в соответствии с внутренними стандартами клиники и должен составлять:
- для головы и шеи - 3 - 7 мм
- для средостения, забрюшинного пространства и малом тазу - 5 - 10 мм
- для конечностей - 10 мм
Допустимо уменьшение отступов на PTV при выполнении ежедневного контроля укладки с помощью компьютерной томографии в коническом пучке (CBCT) перед сеансом облучения.
5.4 Фракционирование
Обычное фракционирование (одна фракция в сутки, пять фракций в неделю, с разовой дозой 1,8 - 2,0 Гр) является приоритетным режимом фракционирования.
Только нормальное фракционирование допустимо при вовлечении большого объема кишечника в поле облучения. Также оно является строго обязательным, если в поле облучения входят структуры ЦНС (например, для опухолей позвоночника), так как для восстановления тканей ЦНС требуются более длительные интервалы между фракциями.
5.5 Совместное использование лучевой терапии и химиотерапии
Дактиномицин должен быть исключен из схемы лечения на время проведения лучевой терапии.
Доксорубицин**: при возникновении сильной кожной или кишечной реакции, доза доксорубицина** должна быть снижена или полностью исключена при последующих курсах во время лучевой терапии.
Бусульфан**: облучение легких как до, так и после применения бусульфана** может вызвать тяжелый фиброз легкого. Тотальное облучение легких должно быть исключено. Локальное облучение возможно при незначительном вовлечении легочной ткани в объем облучения. При расположении первичной опухоли в области грудной стенки, стойким злокачественным плевральным выпотом или после нерадикальной резекции опухоли возможность применения лучевой терапии в сочетании с бусульфаном** требует дополнительного обсуждения. Стоит избегать включения больших объемов кишечника в зону. Если это необходимо, лучевая терапия должна проводиться не ранее 8 - 10 недель после введения бусульфана** [82]. При вовлечении структур ЦНС в объем облучения, доза на них не должна превышать 30 Гр [83].
5.6 Предоперационная лучевая терапия
Показания:
- прогрессирование на фоне неоадъювантной химиотерапии
- невозможность проведения оперативного лечения в объеме R0
- наличие патологических состояний требующих срочной коррекции, таких как компрессия спинного мозга (при условии невозможности коррекции с помощью других лечебных опций).
Проводится совместно с 3 - 4 или 5 - 6 курсом индукционной химиотерапии.
При обычном фракционировании суммарная очаговая доза составляет 54,0 Гр [107].
5.7 Послеоперационная лучевая терапия
Показания:
- плохой гистологический ответ на неоадьювантную химотерапию (10% или более жизнеспособных опухолевых клеток) [108, 109].
- позитивные края резекции после операции (R1 или R2 резекция)
- оперативное лечение на этапе диагностики, если в последующем не была выполнена "second look" операция.
- расположение опухоли в паравертебральной области или области таза [110, 111].
Пациентам, которым показан послеоперационный курс лучевой терапии, сначала продолжают курсы послеоперационной (консолидирующей) химиотерапии.
Лучевая терапия должна быть начата после заживления послеоперационных ран, обычно после 2 - 4 цикла консолидирующей терапии.
У пациентов с макроскопическим или микроскопическим остатком, лучевая терапия может быть начата ранее.
При послеоперационной лучевой терапии дозы зависят от края резекции и ответа опухоли на проводимую индукционную (неоадъювантную) химиотерапию:
- R2 резекция - 45 - 54 Гр (с возможностью эскалации дозы до 60,0 Гр на остаточную опухоль, в зависимости от размера и локализации первичной опухоли, а также возраста пациента)
- R1 резекция с плохим гистологическим ответом (10% или более жизнеспособных опухолевых клеток) - 54 Гр
- R1 резекция с хорошим гистологический ответом (менее 10% жизнеспособных опухолевых клеток) - 45 Гр
- R0 резекция с плохим гистологическим ответом (10% или более жизнеспособных опухолевых клеток) - 45 Гр [107]
5.8 Радикальная лучевая терапия
Радикальная лучевая терапия применяется только для неоперабельных больных. Лучевая терапия начинается после окончания неоадьювантной химиотерапии.
Суммарные дозы составляют 54 - 60 Гр. После достижения дозы 45 Гр следует сократить объем облучения (CTVboost = GTV).
У детей младше 10 лет, с благоприятными прогностическими факторами (маленький размер опухоли < 100 мл, полный ответ на химиотерапию по данным МРТ или биопсии "second look"), доза может быть редуцирована.
5.9 Лучевая терапия отдельных локализаций опухоли.
Опухоли конечностей
Безопасные отступы на CTV в проксимальном и дистальном направлении должны быть не менее 3 - 5 см, и не менее 2 см в боковых направлениях.
В случае наличия признаков обширного интрамедуллярного поражения целесообразно облучение всей кости.
Область операции и послеоперационный рубец должны входить в поле облучения.
При облучении после эндопротезирования, протез должен быть включен в область облучения с безопасным краем 2 см.
Если возможно, следует редуцировать дозу облучения на область метаэпифизарных пластинок (зон роста кости) до 20 Гр.
Чтобы избежать развития фиброза, следует снижать дозу на участок кожи и подкожной клетчатки со стороны максимально удаленной от места первичной опухоли на всем протяжении мишени.
При облучении областей рядом с суставом, доза на последний не должна превышать 45 Гр.
При облучении в высоких дозах, после достижения 45 Гр следует уменьшить поля до объема максимального распространение опухоли - до начала терапии или прогресса на фоне лечения (GTV) с безопасным краем в проксимальном и дистальном направлении 2 см, и не менее 1 - 2 см в боковых направлениях (CTV).
Опухоли туловища, головы и шеи/черепа
Безопасный край во всех направления должен составлять не менее 2-х см с учетом анатомических барьеров. Меньшие отступы допускаются, если в объем входят критические структуры без инвазии в них опухоли.
Опухоли таза и грудной стенки
Опухоли данной локализации часто имеют большую внутрибрюшную или внутригрудную распространенность, которые хорошо сокращаются на химиотерапии.
Клинический объем мишени (CTV) должен включать объем распространения опухоли в мягких тканях и костях на момент начала терапии (GTV) с отступом 2 см во все стороны и корректироваться в отношении возможного распространения в брюшную и плевральную полость.
Если опухоль инфильтрирует плевральную полость показано облучение всего легкого с пораженной стороны:
- у пациентов младше 14 лет с РОД 1,5 Гр до СОД 15 Гр;
- у пациентов старше 14 лет с РОД 1,8 Гр до СОД 19,8 Гр
Зона первичной опухоли должна облучаться до суммарной дозы 45 Гр. Возможна эскалация дозы до 54 Гр в области максимального риска рецидива опухоли.
Важно! У пациентов с опухолями грудной стенки, которые получают химиотерапию, содержащую бусульфан**, следует избегать облучения больших объемов легочной ткани и требует дополнительного обсуждения.
Позвоночник
Объем облучения (CTV) должен включать в себя по одному здоровому позвонку выше и ниже опухоли, а также паравертебральный мягкотканый компонент с безопасным краем 2 см.
Приоритетными способами облучения являются: конформное облучение в динамической арке, или многопольное облучение (IMRT).
Лопатка
При опухолях в верхней части лопатки, включение плечевого сустава и головки плечевой кости обязательно.
Тотальное облучение обоих легких
Облучение легких показано пациентам с метастазами в легкие на этапе постановки диагноза [87].
Оба легких должны быть облучены:
- у пациентов младше 14 лет с РОД 1,5 Гр в СОД 15 Гр
- у пациентов младше 14 лет с РОД 1,5 Гр в СОД 18 Гр.
Возможно дополнительное облучение отдельных метастатических очагов до эквивалентных доз 45 Гр.
Важно! Исключить тотальное облучения легких у пациентов в схемах, содержащих бусульфан**.
Облучение костных метастазов
Облучение костных метастазов требует дополнительного обсуждения. Показаны эквивалентные дозы не менее 45 Гр без использования широких отступов.
У пациентов, получавших бусульфан**, лучевая терапия должна проводиться через 8 - 10 недель после окончания высокодозной химиотерапии [107, 112].
Метастазы в головной мозг
Тотальное облучение головного мозга в дозе в режиме классического фракционирования с РОД 2 Гр до СОД 30 Гр.
Возможен буст на отдельные очаги до дозы 50 Гр, если имеется не более 2-х очагов и размер их не превышает 2 - 3 см.
Толерантные дозы на здоровые ткани
- Спинной мозг: максимальная доза не более 40 Гр (Dmax < 40 Гр). Исключением являются опухоли позвоночника где максимальная допустимая доза составляет 50 - 54 Гр. При использовании Бусульфана** доза на спинной и головной мозг не должна превышать 30 Гр.
- Сердце: Dmean < 30 Гр.
- Печень: объем ткани печени получающей дозу 20 Гр и более не должен превышать 33% (V20 < 33%)
- Почки:
- средняя доза не более 15 Гр (D mean < 15 Гр),
- объем ткани почек получающей дозу 20 Гр и более не должен превышать 32% (V20 < 32%),
- при единственной сохраненной почке - максимальная доза менее 12 Гр (Dmax < 12 Гр),
- объем ткани почки получающий 10 Гр и более - не больше 25 - 30% (V10 < 25 - 30%)
5.10 Побочные эффекты
Острые лучевые осложнения возникают во время облучения и в первые 90 дней после его окончания. Эти эффекты специфичны для облучаемых тканей и обычно хорошо переносятся пациентами. Однако иногда они могут быть достаточно серьезными, требовать дополнительной медикаментозной коррекции и перерыва в лечении. Острые эффекты большей частью являются временными и не вызывают стойкого ухудшения состояния тканей и органов.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Пациенту с подозрением на ЗНО кости выполнена рентгенография области первичного очага с захватом двух смежных суставов в двух проекциях
Да/Нет
2.
Пациенту с подозрением на ЗНО кости выполнена МРТ пораженной области с контрастным усилением
Да/Нет
3.
Пациенту с подозрением на ЗНО кости выполнена биопсия кости (объемного образования) и патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов (при установлении диагноза)
Да/Нет
4.
Выполнена компьютерная томография органов грудной полости с внутривенным болюсным контрастированием (при отсутствии медицинских противопоказаний) (при установлении диагноза)
Да/Нет
5.
Выполнен общий (клинический) анализ крови развернутый
Да/Нет
6.
Выполнен анализ крови биохимический общетерапевтический с включением следующих параметров: определение активности лактатдегидрогеназы в крови (ЛДГ), определение активности аланинаминорансферазы в крови (АЛТ), определение активности аспартатаминотрансферазы в крови (АСТ), исследование уровня общего билирубина в крови, определение активности щелочной фосфатазы в крови, исследование общего белка в крови, исследование уровня альбумина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня калия в крови, исследование уровня натрия в крови, исследование уровня хлоридов в крови, исследование уровня кальция в крови)
Да/Нет
7.
Выполнено ПЭТ/КТ всего тела
Да/Нет
8.
Выполнено цитологическое исследование мазка костного мозга (миелограмма) (при установлении диагноза)
Да/Нет
9.
Пациенту с установленным диагнозом остеосаркома назначена предоперационная полихимиотерапия
Да/Нет
10.
Пациенту с установленным диагнозом саркома Юинга или другой недифференцированной мелкокруглоклеточной саркомы кости назначена предоперационная полихимиотерапия
Да/Нет
11.
Выполнено хирургическое лечение и/или лучевая терапия (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний)
Да/Нет
Список литературы
1. WHO Classification of Tumours Editorial Board. WHO Classification of Tumours. Soft tissue and bone tumours, 5th ed. Vol. 3. Lyon: IARC; 2020.
2. Stiller CA, Bielack SS, Jundt G et al. Bone tumours in European children and adolescents, 1978 - 1997. Report form the Automated Childhood Cancer Infromation System project. Eur J Cancer 2006; 42: 2124 - 2135.
3. Delattre O, Zucman J, Melot T, Garau XS, Zucker JM, Lenoir GM, Ambros PF, Sheer D, Turc-Carel C, Triche TJ, et al. The Ewing family of tumors--a subgroup of small-round-cell tumors defined by specific chimeric transcripts. N Engl J Med. 1994 Aug 4; 331(5): 294 - 9. doi: 10.1056/NEJM199408043310503. PMID: 8022439.
4. Calvert GT, Randall RL, Jones KB, Cannon-Albright L, Lessnick S, Schiffman JD. At-risk populations for osteosarcoma: the syndromes and beyond. Sarcoma. 2012; 2012: 152382. doi: 10.1155/2012/152382. Epub 2012 Mar 12. PMID: 22550413; PMCID: PMC3329649.
5. Kalra S, Grimer RJ, Spooner D, Carter SR, Tillman RM, Abudu A. Radiation-induced sarcomas of bone: factors that affect outcome. J Bone Joint Surg Br. 2007 Jun; 89(6): 808 - 13. doi: 10.1302/0301-620X.89B6.18729. PMID: 17613509.
6. SEER Cancer Statistics Fact Sheets: Bone and Joint Cancer. Bethesda, MD: National Cancer Institute; 2021. Available at: http://seer.cancer.gov/statfacts/html/bones.html. Accessed September 8, 2021.
7. Mirabello L, Troisi RJ, Savage SA. Osteosarcoma incidence and survival rates from 1973 to 2004: data from the Surveillance, Epidemiology, and End Results Program. Cancer. 2009 Apr 1; 115(7): 1531 - 43. doi: 10.1002/cncr.24121. PMID: 19197972; PMCID: PMC2813207.
8. Gurney J.G., Young J.L., Roffers S.D. Malignant Bone Tumors//Cancer Incidence and Survival among Children and Adolescents: United States SEER Program 1975 - 1995, National Cancer Institute, SEER Program. 1999. P. 99 - 110.
9. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Version 2.2024, 03/12/24. National Comprehensive Cancer Network (NCCN)
10. Chow WA. Chondrosarcoma: biology, genetics, and epigenetics. F1000Res. 2018 Nov 20; 7: F1000 Faculty Rev-1826. doi: 10.12688/f1000research.15953.1. PMID: 30519452; PMCID: PMC6248264.
11. El Abiad JM, Robbins SM, Cohen B, Levin AS, Valle DL, Morris CD, de Macena Sobreira NL. Natural history of Ollier disease and Maffucci syndrome: Patient survey and review of clinical literature. Am J Med Genet A. 2020 May; 182(5): 1093 - 1103. doi: 10.1002/ajmg.a.61530. Epub 2020 Mar 7. PMID: 32144835; PMCID: PMC8164175.
12. Валиев А.К., Тепляков В.В., Мусаев Э.Р., Рогожин Д.В., Сушенцов Е.А., Мачак Г.Н. и соавт. Практические рекомендации по лечению первичных злокачественных опухолей костей. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2022 (том 12). 307 - 329.
13. Amin MB, Edge SB, Greene FL, et al. AJCC Cancer Staging Manual, 8th edition. New York: Springer; 2017.
14. Casali PG, Bielack S, Abecassis N, et al. Bone sarcomas: ESMO-PaedCan-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018 Oct 1; 29(Suppl 4): iv79 - 95. PMID: 30285218
15. Grimer R, Athanasou N, Gerrand C, et al. UK guidelines for the management of bone sarcomas. Sarcoma. 2010; 2010: 317462. PMID: 21253474
16. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. М.: Издательская группа РОНЦ. Практическая медицина, 2012. 684 p.
17. Румянцев А.Г., Масчан А.А., Самочатова Е.В. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. Москва: МЕДПРАКТИКА-М, 2009, 448 с.
18. Трахтман П.Е., Старостин Н.Н., Новичкова Г.А., Ворожцов И.Н. Трансфузионная терапия в клинической практике: учебно-методическое пособие для врачей, ординаторов, аспирантов/Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Д. Рогачева, Кафедра трансфузиологии и клинической лабораторной диагностики. Москва, 2021, 76 с.
19. Tal A.L., Doshi H., Parkar F., Abraham T., Love C., Ye K., et al. The Utility of 18FDG PET/CT Versus Bone Scan for Identi cation of Bone Metastases in a Pediatric Sarcoma Population and a Review of the Literature. J Pediatr Hematol Oncol 2021; 43 (2): 52 - 8.
20. М.Я. Ядгаров, Е.Д. Киреева, Кайлаш, М.М. Дунайкин, Ю.Н. Ликарь. "Диагностическая роль ПЭТ/КТ с 18F-ФДГ и сцинтиграфии костей скелета у детей и молодых взрослых с костными саркомами: систематический обзор и метаанализ" Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2023; 22(4): 158 - 169 https://doi.org/10.24287/1726-1708-2023-22-4-158-169).
21. Трякин А.А., Бесова Н.С., Волков Н.М., Гладков О.А., Карасева В.В., Сакаева Д.Д. и соавт. Общие принципы проведения противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 1. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 28 - 41.
22. Peled Y, Levin D, Shiran S, Manisterski M, Shukrun R, Elhasid R. Prevalence and management of methotrexate-induced neurotoxicity in pediatric patients with osteosarcoma: a single-center experience. Int J Clin Oncol. 2022 Aug; 27(8): 1372 - 1378. doi: 10.1007/s10147-022-02184-y. Epub 2022 May 31. PMID: 35639227.
23. Lien HH, Blomlie V, Saeter G, Solheim O, ![]() SD. Osteogenic sarcoma: MR signal abnormalities of the brain in asymptomatic patients treated with high-dose methotrexate. Radiology. 1991 May; 179(2): 547 - 50. doi: 10.1148/radiology.179.2.2014309. PMID: 2014309.
SD. Osteogenic sarcoma: MR signal abnormalities of the brain in asymptomatic patients treated with high-dose methotrexate. Radiology. 1991 May; 179(2): 547 - 50. doi: 10.1148/radiology.179.2.2014309. PMID: 2014309.
24. Inaba H, Khan RB, Laningham FH, Crews KR, Pui CH, Daw NC. Clinical and radiological characteristics of methotrexate-induced acute encephalopathy in pediatric patients with cancer. Ann Oncol. 2008 Jan; 19(1): 178 - 84. doi: 10.1093/annonc/mdm466. Epub 2007 Oct 17. PMID: 17947226.
25. Латипова Д.Х., Андреев В.В., Маслова Д.А., Новик А.В., Проценко С.А. Неврологические осложнения противоопухолевой лекарственной терапии. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 304 - 314
26. Tajino T, Kikuchi S, Yamada H, Takeda A, Konno S. Ifosfamide encephalopathy associated with chemotherapy for musculoskeletal sarcomas: incidence, severity, and risk factors. J Orthop Sci. 2010 Jan; 15(1): 104 - 11. doi: 10.1007/s00776-009-1431-y. Epub 2010 Feb 12. PMID: 20151259.
27. Malawer M.M., Sugarbaker P.H. Musculoskeletal Cancer Surgery - Treatment of Sarcomas and Allied Diseases. Springer, 2001. 626 p.
28. Traina F. et al. Current concepts in the biopsy of musculoskeletal tumors: AAOS exhibit selection//J. Bone Jt. Surg. - Am. Vol. Journal of Bone and Joint Surgery Inc., 2015. Vol. 97, N 2. P. e7(1).
29. Kubo T. et al. A meta-analysis supports core needle biopsy by radiologists for better histological diagnosis in soft tissue and bone sarcomas//Medicine (United States). Lippincott Williams and Wilkins, 2018. Vol. 97, N 29. P. e11567.
30. Мацко Д.Е. Саркомы костей: классификация, гистологическое строение, особенности морфологической диагностики//Практическая онкология. 2010. Vol. 11, N 1. P. 1 - 10.
31. Pohlig F. et al. Percutaneous core needle biopsy versus open biopsy in diagnostics of bone and soft tissue sarcoma: a retrospective study.//Eur. J. Med. Res. 2012. Vol. 17. P. 29.
32. Mankin H.J., Mankin C.J., Simon M.A. The hazards of the biopsy, revisited: For the members of the musculoskeletal tumor society//J. Bone Jt. Surg. - Ser. A. 1996. Vol. 78, N 5. P. 656 - 663.
33. Алиев М.Д. Злокачественные опухоли костей. Саркомы костей, мягких тканей и опухоли кожи 2010; 2: 3 - 8
34. Ritter J, Bielack S.S Osteosarcoma//Ann. Oncol. 2010. Vol 21. P. 320 - 325
35. Bielack S,  H, Jundt G et al. Osteosarcoma: the COSS experience. Cancer Treat Res 2009; 152: 289 - 308.
H, Jundt G et al. Osteosarcoma: the COSS experience. Cancer Treat Res 2009; 152: 289 - 308.
36. Marina NM, Smeland S, Bielack SS, et al. Comparison of MAPIE versus MAP in patients with a poor response to preoperative chemotherapy for newly diagnosed high-grade osteosarcoma (EURAMOS-1): an open-label, international, randomised controlled trial. Lancet Oncol. 2016; 17(10): 1396 - 1408.
37. Whelan JS, Bielack SS, Marina N, et al. EURAMOS-1, an international randomised study for osteosarcoma: results from pre-randomisation treatment. Ann Oncol. 2015; 26(2): 407 - 414.
38. Ferrari S, Smeland S, Mercuri M, et al. Neoadjuvant chemotherapy with high-dose Ifosfamide, high-dose methotrexate, cisplatin, and doxorubicin for patients with localized osteosarcoma of the extremity: a joint study by the Italian and Scandinavian Sarcoma Groups. J Clin Oncol. 2005; 23(34): 8845 - 8852.
39. EURAMOS-1 protocol, a randomized trial of the European and American Osteosarcoma Srudy Group to optimize treatment strategies for resectable osteosarcoma based on histological response to pre-operative chemotherapy. Appendix B.
40. Jaffe N, Keifer R 3rd, Robertson R, Cangir A, Wang A. Renal toxicity with cumulative doses of cis-diamminedichloroplatinum-II in pediatric patients with osteosarcoma. Effect on creatinine clearance and methotrexate excretion. Cancer. 1987 May 1; 59(9): 1577 - 81. doi: 10.1002/1097-0142(19870501)59:9<1577::aid-cncr2820590908>3.0.co; 2-p. PMID: 3470110.
41. Laitinen M. et al. The prognostic and therapeutic factors which influence the oncological outcome of parosteal osteosarcoma//Bone Jt. J. British Editorial Society of Bone and Joint Surgery, 2015. Vol. 97B, N 12. P. 1698 - 1703.
42. Cesari M. et al. Periosteal osteosarcoma//Cancer. 2011. Vol. 117, N 8. P. 1731 - 1735.
43. Ruengwanichayakun P, Gambarotti M, Frisoni T, et al. Parosteal osteosarcoma: a monocentric retrospective analysis of 195 patients. Hum Pathol. 2019; 91: 11 - 18.
44. Grimer RJ, Bielack S, Flege S, et al. Periosteal osteosarcomaea European review of outcome. Eur J Cancer. 2005; 41(18): 2806 - 2811.
45. Gitelis S. et al. Principles of limb salvage surgery//Chapman's Orthopaedic Surgery, 3rd edition. 2001. P. 3309 - 3381.
46. Marulanda G.A. et al. Use of extendable prostheses: A limb-salvaging alternative for patients with malignant bone tumors//Expert Review of Medical Devices. 2008. Vol. 5, N 4. P. 467 - 474.
47. Heck R.K. General principles of tumors//Campbells Operative Orthopaedics. 10th edition. 2004. P. 733 - 792.
48. Carrle D, Bielack S. Osteosarcoma lung metastases detection and principles of multimodal therapy. Cancer Treat Res. 2009; 152: 165 - 84. doi: 10.1007/978-1-4419-0284-9_8. PMID: 20213390.
49. Kempf-Bielack B, Bielack SS,  H et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J Clin Oncol 2005; 20: 559 - 568.
H et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J Clin Oncol 2005; 20: 559 - 568.
50. Bielack SS, Kempf-Bielack B, Branscheid D et al. Second and subsequent recurrences of osteosarcoma: presentation, treatment, and outcomes of 249 consecutive Cooperative Osteosarcoma Study Group patients. J Clin Oncol 2009; 27: 557 - 565.
51. Gaspar N, Campbell-Hewson Q, Huang J, Okpara CE, Bautista F. OLIE, ITCC-082: a Phase II trial of lenvatinib plus ifosfamide and etoposide in relapsed/refractory osteosarcoma. Future Oncol. 2021 Nov; 17(32): 4249 - 4261. doi: 10.2217/fon-2021-0743. Epub 2021 Aug 12. PMID: 34382412.
52. Gaspar N, Venkatramani R, Hecker-Nolting S, Melcon SG, Locatelli F, Bautista F, Longhi A, Lervat C, Entz-Werle N, Casanova M, Aerts I, Strauss SJ, Thebaud E, Morland B, Nieto AC, Marec-Berard P, Gambart M, Rossig C, Okpara CE, He C, Dutta L, Campbell-Hewson Q. Lenvatinib with etoposide plus ifosfamide in patients with refractory or relapsed osteosarcoma (ITCC-050): a multicentre, open-label, multicohort, phase 1/2 study. Lancet Oncol. 2021 Sep; 22(9): 1312 - 1321. doi: 10.1016/S1470-2045(21)00387-9. Epub 2021 Aug 17. PMID: 34416158.
53. Palmerini E, Setola E, Grignani G, D'Ambrosio L, Comandone A, Righi A, Longhi A, Cesari M, Paioli A, Hakim R, Pierini M, Marchesi E, Vanel D, Pignochino Y, Donati DM, Picci P, Ferrari S. High Dose Ifosfamide in Relapsed and Unresectable High-Grade Osteosarcoma Patients: A Retrospective Series. Cells. 2020 Oct 31; 9(11): 2389. doi: 10.3390/cells9112389. PMID: 33142760; PMCID: PMC7692098.
54. Palmerini E, Jones RL, Marchesi E, Paioli A, Cesari M, Longhi A, Meazza C, Coccoli L, Fagioli F, Asaftei S, Grignani G, Tamburini A, Pollack SM, Picci P, Ferrari S. Gemcitabine and docetaxel in relapsed and unresectable high-grade osteosarcoma and spindle cell sarcoma of bone. BMC Cancer. 2016 Apr 20; 16: 280. doi: 10.1186/s12885-016-2312-3. PMID: 27098543; PMCID: PMC4839113.
55. Navid F, Willert JR, McCarville MB, et al. Combination of gemcitabine and docetaxel in the treatment of children and young adults with refractory bone sarcoma. Cancer 2008; 113: 419 - 425.
56. Song BS, Seo J, Kim DH, Lim JS, Yoo JY, Lee JA. Gemcitabine and docetaxel for the treatment of children and adolescents with recurrent or refractory osteosarcoma: Korea Cancer Center Hospital experience. Pediatr Blood Cancer. 2014 Aug; 61(8): 1376 - 81. doi: 10.1002/pbc.25035. Epub 2014 Apr 1. PMID: 24692087.
57. Raciborska A, Bilska K. Sorafenib in patients with progressed and refractory bone tumors. Med Oncol. 2018 Aug 16; 35(10): 126. doi: 10.1007/s12032-018-1180-x. PMID: 30116912; PMCID: PMC6097021.
58. Grignani G, Palmerini E, Dileo P, et al. A phase II trial of sorafenib in relapsed and unresectable high-grade osteosarcoma after failure of standard multimodal therapy: an Italian Sarcoma Group study. Ann Oncol 2012; 23: 508 - 516.
59. Sugiyama M, Arakawa A, Shirakawa N, Tao K, Tanimura K, Nakajima M, Watanabe Y, Kumamoto T, Maniwa J, Yoneda A, Iwata S, Kobayashi E, Kawai A, Ogawa C. Safety and efficacy of multiple tyrosine kinase inhibitors in pediatric/adolescent and young adult patients with relapsed or refractory osteosarcomas: A singlei nstitution retrospective analysis. Pediatr Blood Cancer. 2023 Jul; 70(7): e30360. doi: 10.1002/pbc.30360. Epub 2023 Apr 19. PMID: 37073613
60. Peretz Soroka H, Vora T, Noujaim J, Marcoux N, Cohen-Gogo S, Alcindor T, Holloway C, Rodrigues C, Karachiwala H, Alvi S, Lee U, Cheng S, Banerji S, Oberoi S, Feng X, Smrke A, Simmons C, Razak AA, Gupta AA. Real-world experience of tyrosine kinase inhibitors in children, adolescents and adults with relapsed or refractory bone tumours: A Canadian Sarcoma Research and Clinical Collaboration (CanSaRCC) study. Cancer Med. 2023 Sep; 12(18): 18872 - 18881. doi: 10.1002/cam4.6515. Epub 2023 Sep 19. PMID: 37724607; PMCID: PMC10557866.
61. Davis LE, Bolejack V, Ryan CW, et al. Randomized double-blind phase II study of regorafenib in patients with metastatic osteosarcoma. J Clin Oncol 2019; 37: 1424 - 1431.
62. Grier HE, Krailo MD, Tarbell NJ, et al. Addition of ifosfamide and etoposide to standard chemotherapy for Ewing's sarcoma and primitive neuroectodermal tumor of bone. N Engl J Med 2003; 348: 694 - 701.
63. Womer RB, West DC, Krailo MD, et al. Randomized controlled trial of interval-compressed chemotherapy for the treatment of localized Ewing sarcoma: a report from the Children's Oncology Group. J Clin Oncol 2012; 30: 4148 - 4154.
64. Brennan B, Kirton L,  P, Gaspar N, Laurence V,
P, Gaspar N, Laurence V,  J, Sastre A, Gelderblom H, Owens C, Fenwick N, Strauss S, Moroz V, Whelan J, Wheatley K. Comparison of two chemotherapy regimens in patients with newly diagnosed Ewing sarcoma (EE2012): an open-label, randomised, phase 3 trial. Lancet. 2022 Oct 29; 400(10362): 1513 - 1521. doi: 10.1016/S0140-6736(22)01790-1. PMID: 36522207.
J, Sastre A, Gelderblom H, Owens C, Fenwick N, Strauss S, Moroz V, Whelan J, Wheatley K. Comparison of two chemotherapy regimens in patients with newly diagnosed Ewing sarcoma (EE2012): an open-label, randomised, phase 3 trial. Lancet. 2022 Oct 29; 400(10362): 1513 - 1521. doi: 10.1016/S0140-6736(22)01790-1. PMID: 36522207.
65. Anderton J, Moroz V,  P, Gaspar N, Laurence V,
P, Gaspar N, Laurence V,  J, Sastre A, Gelderblom H, Owens C, Kaiser S,
J, Sastre A, Gelderblom H, Owens C, Kaiser S,  M, Fenwick N, Evans A, Strauss S, Whelan J, Wheatley K, Brennan B. International randomised controlled trial for the treatment of newly diagnosed EWING sarcoma family of tumours - EURO EWING 2012 Protocol. Trials. 2020 Jan 17; 21(1): 96. doi: 10.1186/s13063-019-4026-8. PMID: 31952545; PMCID: PMC6969439.
M, Fenwick N, Evans A, Strauss S, Whelan J, Wheatley K, Brennan B. International randomised controlled trial for the treatment of newly diagnosed EWING sarcoma family of tumours - EURO EWING 2012 Protocol. Trials. 2020 Jan 17; 21(1): 96. doi: 10.1186/s13063-019-4026-8. PMID: 31952545; PMCID: PMC6969439.
66. International Randomised Controlled Trial for the Treatment of Newly Diagnosed Ewing's Sarcoma Family of Tumours. Euro Ewing 2012.
67. Романцова О.М. Интенсификация режимов индукционной химиотерапии у детей с саркомой Юинга: авторефер. Дис канд мед. Наук: ФГБУ "НМИЦ онкологии им. Н.Н. Блохина"; 2024
68. Ladenstein R. et al. Primary disseminated multifocal Ewing sarcoma: Results of the Euro-EWING 99 trial//J. Clin. Oncol. 2010. Vol. 28, N 20. P. 3284 - 3291.
69. Tenneti P. et al. Role of High-Dose Chemotherapy and Autologous Hematopoietic Cell Transplantation for Children and Young Adults with Relapsed Ewing's Sarcoma: A Systematic Review
70. Whelan J, Le Deley MC, Dirksen U, Le Teuff G, Brennan B, Gaspar N, Hawkins DS, Amler S, Bauer S, Bielack S, Blay JY, Burdach S, Castex MP, Dilloo D, Eggert A, Gelderblom H, Gentet JC, Hartmann W, Hassenpflug WA, Hjorth L, Jimenez M, Klingebiel T, Kontny U, Kruseova J, Ladenstein R, Laurence V, Lervat C, Marec-Berard P, Marreaud S, Michon J, Morland B, Paulussen M, Ranft A, Reichardt P, van den Berg H, Wheatley K, Judson I, Lewis I, Craft A, Juergens H, Oberlin O; Euro-E.W.I.N.G.99 and EWING-2008 Investigators. High-Dose Chemotherapy and Blood Autologous Stem-Cell Rescue Compared With Standard Chemotherapy in Localized High-Risk Ewing Sarcoma: Results of Euro-E.W.I.N.G.99 and Ewing-2008. J Clin Oncol. 2018 Sep 6; 36(31): JCO2018782516. doi: 10.1200/JCO.2018.78.2516. Epub ahead of print. PMID: 30188789; PMCID: PMC6209090.
71. Koscielniak E. et al. Results of treatment for soft tissue sarcoma in childhood and adolescence: A final report of the German cooperative soft tissue sarcoma study CWS-86//J. Clin. Oncol. American Society of Clinical Oncology, 1999. Vol. 17, N 12. P. 3706 - 3719.
72. Breneman J. et al. Local control with reduced-dose radiotherapy for low-risk rhabdomyosarcoma: A report from the Children'S Oncology Group D9602 study//Int. J. Radiat. Oncol. Biol. Phys. Int J Radiat Oncol Biol Phys, 2012. Vol. 83, N 2. P. 720 - 726.
73. Gupta A, Riedel RF, Shah C, Borinstein SC, Isakoff MS, Chugh R, Rosenblum JM, Murphy ES, Campbell SR, Albert CM, Zahler S, Thomas SM, Trucco M. Consensus recommendations in the management of Ewing sarcoma from the National Ewing Sarcoma Tumor Board. Cancer. 2023 Nov 1; 129(21): 3363 - 3371. doi: 10.1002/cncr.34942. Epub 2023 Jul 5. PMID: 37403815.
74. Richey SL, Rao P, Wood CG, Patel S, Tannir NM. Metastatic extraosseous Ewing's sarcoma (EES)/primitive neuroectodermal tumor (PNET) of the kidney: 8-year durable response after induction and maintenance chemotherapy. Clin Genitourin Cancer. 2012 Sep; 10(3): 210 - 2. doi: 10.1016/j.clgc.2012.03.004. Epub 2012 Apr 13. PMID: 22503609; PMCID: PMC4121061.
75. Meyers PA, Ambati SR, Slotkin EK, Cruz FD, Wexler LH. The addition of cycles of irinotecan/temozolomide (i/T) to cycles of vincristine, doxorubicin, cyclophosphamide (VDC) and cycles of ifosfamide, etoposide (IE) for the treatment of Ewing sarcoma (ES) [abstract]. J Clin Oncol. 2018; 36(15 suppl): 10533. doi: 10.1200/JCO.2018.36.15_ suppl.10533
76. Raciborska A, Bilska K, Rodriguez-Galindo C. Maintenance treatment with trofosfamide in patients with primary bone Ewing sarcoma-single center experience. Dev Period Med. 2019; 23: 39 - 44. doi: 10.34763/devperiodmed.20192301.3944
77. Tamura A, Yamamoto N, Nino N, et al. Pazopanib maintenance therapy after tandem high-dose chemotherapy for disseminated Ewing sarcoma. Int Cancer Conf J. 2019; 8(3): 95 - 100. doi: 10.1007/s13691-019-00362-w7
78. Minard-Colin V, Ichante JL, Nguyen L, Paci A, Orbach D, Bergeron C, Defachelles AS, ![]() N, Corradini N, Schmitt C, Tabone MD, Blouin P, Sirvent N, Goma G, Geoerger B, Oberlin O. Phase II study of vinorelbine and continuous low doses cyclophosphamide in children and young adults with a relapsed or refractory malignant solid tumour: good tolerance profile and efficacy in rhabdomyosarcoma--a report from the
N, Corradini N, Schmitt C, Tabone MD, Blouin P, Sirvent N, Goma G, Geoerger B, Oberlin O. Phase II study of vinorelbine and continuous low doses cyclophosphamide in children and young adults with a relapsed or refractory malignant solid tumour: good tolerance profile and efficacy in rhabdomyosarcoma--a report from the  des Cancers et
des Cancers et  de l'Enfant et de l'adolescent (SFCE). Eur J Cancer. 2012 Oct; 48(15): 2409 - 16. doi: 10.1016/j.ejca.2012.04.012. Epub 2012 May 25. PMID: 22633624.
de l'Enfant et de l'adolescent (SFCE). Eur J Cancer. 2012 Oct; 48(15): 2409 - 16. doi: 10.1016/j.ejca.2012.04.012. Epub 2012 May 25. PMID: 22633624.
79. Ju HY, Park M, Lee JA, Park HJ, Park SY, Kim JH, Kang HG, Yang HC, Park BK. Vincristine, Irinotecan, and Temozolomide as a Salvage Regimen for Relapsed or Refractory Sarcoma in Children and Young Adults. Cancer Res Treat. 2022 Apr; 54(2): 563 - 571. doi: 10.4143/crt.2021.178. Epub 2021 Jun 14. PMID: 34126703; PMCID: PMC9016305.
80.  Bay S, Kebudi R,
Bay S, Kebudi R,  O,
O,  B, Darendeliler E,
B, Darendeliler E, ![]() FB. Vincristine, irinotecan, and temozolomide treatment for refractory/relapsed pediatric solid tumors: A single center experience. J Oncol Pharm Pract. 2019 Sep; 25(6): 1343 - 1348. doi: 10.1177/1078155218790798. Epub 2018 Aug 6. PMID: 30080131.
FB. Vincristine, irinotecan, and temozolomide treatment for refractory/relapsed pediatric solid tumors: A single center experience. J Oncol Pharm Pract. 2019 Sep; 25(6): 1343 - 1348. doi: 10.1177/1078155218790798. Epub 2018 Aug 6. PMID: 30080131.
81. Raciborska A, Bilska K, Drabko K, et al. Vincristine, irinotecan, and temozolomide in patients with relapsed and refractory Ewing sarcoma. Pediatr Blood Cancer 2013; 60: 1621 - 1625
82. Hunold A, Weddeling N, Paulussen M, et al. Topotecan and cyclophosphamide in patients with refractory or relapsed Ewing tumors. Pediatr Blood Cancer 2006; 47: 795 - 800.
83. Kushner BH, Kramer K, Meyers PA, et al. Pilot study of topotecan and high-dose cyclophosphamide for resistant pediatric solid tumors. Med Pediatr Oncol 2000; 35: 468 - 474.
84. Saylors RL 3rd, Stine KC, Sullivan J, et al. Cyclophosphamide plus topotecan in children with recurrent or refractory solid tumors: a Pediatric Oncology Group phase II study. J Clin Oncol 2001; 19: 3463 - 3469
85. Martin McCabe et al., Phase III assessment of topotecan and cyclophosphamide and high-dose ifosfamide in rEECur: An international randomized controlled trial of chemotherapy for the treatment of recurrent and primary refractory Ewing sarcoma (RR-ES). JCO 40, LBA2-LBA2(2022). DOI: 10.1200/JCO.2022.40.17_suppl.LBA2
86. Mori Y, Kinoshita S, Kanamori T, Kataoka H, Joh T, Iida S, Takemoto M, Kondo M, Kuroda J, Komatsu H. The Successful Treatment of Metastatic Extraosseous Ewing Sarcoma with Pazopanib. Intern Med. 2018 Sep 15; 57(18): 2753 - 2757. doi: 10.2169/internalmedicine.9879-17. Epub 2018 May 18. PMID: 29780156; PMCID: PMC6191593.
87. Attia S, Bolejack V, Ganjoo K, et al. A phase II trial of regorafenib in patients with advanced Ewing sarcoma and related tumors of soft tissue and bone: SARC024 trial results. Cancer Med 2023; 12: 1532 - 1539.
88. Романцова О.М., Нисиченко Д.В., Хестанов Д.Б., Хайруллова В.В., Дзампаев А.З., Киргизов К.И. Лечение рецидивов саркомы Юинга у детей и подростков: современный взгляд. Российский журнал детской гематологии и онкологии (РЖДГиО). 2021. - Т. - 8, N 3. - С. 30 - 42.
89. Юхта Т.В., Казанцев И.В., Геворгян А.Г. и др. Эффективность высокодозной полихимиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток в лечении детей и молодых взрослых с саркомой Юинга. Онкогематология - 2019. - Т. 14, N 4. - С. 47 - 58.
90. Chawla S, Henshaw R, Seeger L, et al. Safety and efficacy of Denosumab for adults and skeletally mature adolescents with giant cell tumour of bone: interim analysis of an open-label, parallel-group, phase 2 study. Lancet Oncol 2013; 14: 901 - 8
91. Martin-Broto J, Cleeland CS, Glare PA, et al. Effects of Denosumab on pain and analgesic use in giant cell tumor of bone: interim results from a phase II study. Acta Oncol 2014; 53: 1173 - 9.
92. Reddy K, Ramirez L, Kukreja K, Venkatramani R. Response to Denosumab in 2 Children With Recurrent Giant Cell Tumor of the Bone With Pulmonary Metastasis. J Pediatr Hematol Oncol. 2021 Mar 1; 43(2): e215 - e218. doi: 10.1097/MPH.0000000000001654. PMID: 31714440.
93. Bercovitz RS., Josephson CD. Transfusion considerations in pediatric hematology and oncology patients. Hematol Oncol Clin North Am. 2016; 30(3): 695 - 709. doi: 10.106/j.hoc.2016.01.010.
94. Steiner ME, Zantek ND, Stanworth SJ, Parker RI, et al. Recommendations on RBC Transfusion Support in Children With Hematologic and Oncologic Diagnoses From the Pediatric Critical Care Transfusion and Anemia Expertise Initiative. Pediatr Crit Care Med. 2018 Sep; 19(9S Suppl 1): 149 - 156.
95. Shah N., Andrews J., Goodnough LT. Transfusions for anemia in adult and pediatric patients with malignancies. Blood Reviews. 2015; 29(5): 291 - 299. doi: 10.106/j.blre.2015.02.001
96. Nellis ME, Goel R, Karam O. Transfusion Management in Pediatric Oncology Patients. Hematol Oncol Clin North Am. 2019; 33(5): 903 - 913. doi: 10.1016/j.hoc.2019.05.011.
97. World Health Organization. (2021). Educational modules on clinical use of blood. https://www.who.int/publications/i/item/9789240033733
98. Долгов ВВ., Свирин ПВ. Лабораторная диагностика нарушений гемостаза. Москва: Триада, 2005 - с 150. ISBN 5-94789-114-x.
99. Кречетова А.В. Нарушение гемостаза при сепсисе у онкогематологических больных с миелотоксическим агранулоцитозом: автореф. Дис канд мед. наук. М.: Гематологический научный центр; 2011
100. Kozek-langenecker S.A., Afshari A., Albaladejo P., et al. Management of severe perioperative bleeding Guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol. 2013; 30: 270 - 382. DOI: 10.1097/EJA.0b013e32835f4d5.
101. O'Shaughnessy D., Atterbury C., Bolton Maggs P., et al. Guidelines for the use of fresh-frozen plasma, cryoprecipitate and cryosupernatant. Br J Hematol. 2004; 126(1): 11 - 28. DOI: 10.1111/j.1365-2141,2004.04972.x.
102. Галстян Г.М., Гапонова Т.В., Жибурт Е.Б., Балашова Е.Н., Берковский А.Л., Быстрых О.А., Купряшов А.А., Оловникова Н.И., Ошоров А.В., Рыбка М.М., Троицкая В.В., Буланов А.Ю., Журавель С.В., Лубнин А.Ю., Мазурок В.А., Недомолкин С.В., Певцов Д.Э., Рогачевский О.В., Салимов Э.Л., Трахтман П.Е., Чжао А.В., Шерстнев Ф.С., Савченко В.Г. Клиническое использование криопреципитата. Гематология и трансфузиология. 2020; 65(1): 87 - 114. doi.org/10.35754/0234-5730-2020-65-1-87-114
103. Patel P. Interventions for the prevention of acute phase chemotherapy-induced nausea and vomiting in adult and pediatric patients: a systematic review and meta-analysis.//Patel P, Robinson PD, Wahib N [et al]//Support Care Cancer. 2022 Nov; 30(11): 8855 - 8869. doi: 10.1007/s00520-022-07287-w
104. Hesketh, P.J. Antiemetics: ASCO Guideline Update/P.J. Hesketh, M.G. Kris, E. Basch [et al.]//J Clin Oncol. - 2020. - JCO2001296. - doi: 10.1200/JCO.20.01296.] и COG (Children's Oncology Group)
105. Ramavath, D.N. Olanzapine for Prevention of Vomiting in Children and Adolescents Receiving Highly Emetogenic Chemotherapy: Investigator-Initiated, Randomized, Open-Label Trial/D.N. Ramavath, V. Sreenivas, S. Vishwajeet [et al.]//Journal of Clinical Oncology. - 2020. - Vol. 38 (32). - P. 3785 - 3793. - doi: 10.1200/JCO.20.00871;
106. Жуков, Н.В. Эффективность и безопасность малых доз оланзапина в профилактике тошноты и рвоты у детей и подростков, получающих высокоэметогенную химиотерапию. Промежуточные результаты рандомизированного исследования/Н.В. Жуков, Л.Л. Рабаева, Д.В. Литвинов//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2022. - N 4. - С. 70 - 82. doi: 10.24287/1726-1708-2022-21-4-70-82
107. Owais Mohammed. Efficacy, safety and cost effectiveness of reduced-dose olanzapine versus aprepitant as a part of triple-antiemetic therapy in the prevention of chemotherapy induced nausea and vomiting/Owais Mohammed, Narender kumar Thota//Journal of Clinical Oncology - 2022. Vol. 40 (16) - doi: 10.1200/JCO.2022.40.16_suppl.e24078;
108. Rudolph M. Navari. Olanzapine with or without an NK-1 receptor antagonist for preventing chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy: A phase III randomized, double-blind, placebo-controlled trial (ALLIANCE A221602)./Rudolph M. Navari, Jennifer Le-Rademacher, Fabrice Smieliauskas [et al]// - 2022. Vol. 40 (16) - https://doi.org/10.1200/JCO.2022.40.16_suppl.12107
109. Patil, V. Comparison of antiemetic efficacy and safety of palonosetron vs ondansetron in the prevention of chemotherapy-induced nausea and vomiting in children/V. Patil, H. Prasada, K. Prasad [et al.]//J Community Support Oncol. - 2015. - Vol. 13 (6). - P. 209 - 213. - doi: 10.12788/jcso.0139;
110. Chaudhary, N.K. Palonosetron is a Better Choice Compared with Ondansetron for the Prevention of Chemotherapy-induced Nausea and Vomiting (CINV) in a Resource-limited Pediatric Oncology Center: Results from a Randomized Control Trial/N.K. Chaudhary, R.R. John, D. Boddu [et al.]//J Pediatr Hematol Oncol. - 2019. - Vol. 41 (4). - P. 294 - 297. - doi: 10.1097/MPH.0000000000001357
111. Flank, J. Guideline for the Treatment of Breakthrough and the Prevention of Refractory Chemotherapy-Induced Nausea and Vomiting in Children with Cancer/J. Flank, P.D. Robinson, M. Holdsworth [et al.]//Pediatr Blood Cancer. - 2016. - Vol. 63 (7). - P. 1144 - 1151. - doi: 10.1002/pbc.25955
112. Langford P, Chrisp P. Fosaprepitant and aprepitant: an update of the evidence for their place in the prevention of chemotherapy-induced nausea and vomiting. Core Evid. 2010 Oct 21; 5: 77 - 90. doi: 10.2147/ce.s6012. PMID: 21042544; PMCID: PMC2963924/
113. Приказ МЗ РФ от 23.09.2020 N 1008н "Об утверждении порядка обеспечения пациентов лечебным питанием"
114. Muscaritoli M, Arends J, Bachmann P, Baracos V, Barthelemy N, Bertz H, Bozzetti F,  E, Isenring E, Kaasa S, Krznaric Z, Laird B, Larsson M, Laviano A,
E, Isenring E, Kaasa S, Krznaric Z, Laird B, Larsson M, Laviano A,  S, Oldervoll L, Ravasco P, Solheim TS, Strasser F, de van der Schueren M, Preiser JC, Bischoff SC. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutr. 2021; 40(5): 2898 - 2913. doi: 10.1016/j.clnu.2021.02.005
S, Oldervoll L, Ravasco P, Solheim TS, Strasser F, de van der Schueren M, Preiser JC, Bischoff SC. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutr. 2021; 40(5): 2898 - 2913. doi: 10.1016/j.clnu.2021.02.005
115. Вашура А.Ю. Нутритивная недостаточность, ее причины и пути коррекции у детей с опухолями ЦНС на этапе активной терапии и после ее окончания. Фарматека. 2019; 26 (10): 8 - 14
116. Парентеральное и энтеральное питание: национальное руководство/под ред. М.Ш. Хубутия, Т.С. Поповой, А.И. Салтанова. - М.: ГЭОТАР-Медиа, 2014. - 800 с.
117. Mehta NM, Corkins MR, Lyman B, Malone A, Goday PS, Carney LN, Monczka JL, Plogsted SW, Schwenk WF; American Society for Parenteral and Enteral Nutrition Board of Directors. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions. JPEN J Parenter Enteral Nutr. 2013; 37(4): 460 - 81. doi: 10.1177/0148607113479972
118. Алымова Ю.А., Вашура А.Ю. Адекватная оценка нутритивного статуса в детской онкологии и гематологии - первый этап нутритивного сопровождения. Трудный пациент. 2019; Т. 17. N 8 (9). С. 54 - 59.
119. Martin L. et al. Diagnostic criteria for the classification of cancer-associated weight loss//J. Clin. Oncol. American Society of Clinical Oncology, 2015. Vol. 33, N 1. P. 90 - 99
120. Kondrup J. et al. ESPEN guidelines for nutrition screening 2002//Clin. Nutr. Churchill Livingstone, 2003. Vol. 22, N 4. P. 415 - 421; Arends J. et al. ESPEN guidelines on nutrition in cancer patients//Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, N 1. P. 11 - 48
121. Вашура АЮ, Кучер МА, Ковтун ТА, Алымова ЮА, Литвинов ДВ, Зубаровская ЛС, Кулагин АД. Роль и актуальность нутрициологического диагноза в онкопедиатрии. Медицинский Совет. 2023; (12): 99 - 109
122. Yaprak D.S, ![]() B.,
B., ![]() A.A.,
A.A.,  M. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins. Pediatr Blood Cancer. 2021; 68(1): 28752
M. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins. Pediatr Blood Cancer. 2021; 68(1): 28752
123. Методические указания. Порядок проведения клинических исследований для оценки эффективности специализированной пищевой продукции диетического лечебного и диетического профилактического питания/ФГБУН "ФИЦ питания и биотехнологии", Роспотребнадзор, Минздрав России, ФГБУН "ФНЦГ им. Ф.Ф. Эрисмана" Роспотребнадзора. - Москва. - 2023. - 28 с.
124. Методическое руководство. Стандарты лечебного питания/ФГБУН "ФИЦ питания и биотехнологии". - Москва. - 2017. - 338 с.
125. Вашура А.Ю., Пятаева А.А., Карелин А.Ф. Питание и нутритивная поддержка детей со злокачественными новообразованиями после завершения лечения: основные аспекты. Вопросы детской диетологии. 2022; 20(6): 64 - 70
126. Rayar M., Webber C.E., Nayiager T., Sala A., Barr R.D. Sarcopenia in children with acute lymphoblastic leukemia. J Pediatr Hematol Oncol. 2013; 35: 98 - 102; Pietila S., Makipernaa A., Sievanen H., Koivisto A.M., Wigren T., Lenko H.L. Obesity and metabolic changes are common in young childhood brain tumor survivors. Pediatr Blood Cancer. 2009; 52: 853 - 9
127. Joosten K, Embleton N, Yan W, Senterre T; ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Energy. Clin Nutr. 2018; 37(6 Pt B): 2309 - 2314. doi: 10.1016/j.clnu.2018.06.944
128. Особенности нутриционной поддержки больных в педиатрии. В кн.: Клиническое питание больных в интенсивной медицине: практическое руководство/под ред. Луфта В.М., Багненко С.Ф., издание второе, дополненное. СПб.: Арт-Экспресс, 2013 - 460.
129. Парентеральное и энтеральное питание детей. Практические рекомендации. Под ред. Ерпулевой Ю.В., Чубаровой А.И., Чугуновой Ю.Л. ГЭОТАР-Медиа, 2016 г. 304 с.; Arends J. et al. ESPEN guidelines on nutrition in cancer patients//Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, N 1. P. 11 - 48
130. Современные рекомендации по питанию детей/под ред. Проф. Ю.Г. Мухиной, проф. И.Я. Коня. - М.: ИД "МЕДПРАКТИКА-М", 2010, 568 с.
131. Ерпулева Ю.В. Парентеральное питание у детей Российский вестник детской хирургии, анестезиологии и реаниматологии. 2018; 8(1): 49 - 56
132. Viani K., Trehan A., Manzoli B., Schoeman J. Assessment of nutritional status in children with cancer: A narrative review. Pediatr Blood Cancer. 2020; 67 Suppl 3: e28211. https://doi: 10.1002/pbc.2821
133. Koletzko B., Goulet O., Hunt J., Krohn K., Shamir R. for the Parenteral Nutrition Guidelines Working Group. Guidelines on Paediatric Parenteral nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paeditric Research (ESPR). J. Pediatr. Gastroenterol. Nutr. 2005; 41: Suppl. 2: S1S87. DOI: 10.1097/01.mpg.0000181841.07090.f4
134. L'Hotta AJ, Randolph SB, Reader B, Lipsey K, King AA. Clinical practice guideline and expert consensus recommendations for rehabilitation among children with cancer: A systematic review. CA Cancer J Clin. 2023; 73(5): 524 - 545. doi: 10.3322/caac.21783
135. Fischmeister, G., Riedl, D., Sanio, G. et al. Rehabilitation for children and adolescents after cancer: importance and implementation in Austria. memo 14, 278 - 283 (2021). https://doi.org/10.1007/s12254-021-00729-x
136. Ospina PA, McComb A, Pritchard-Wiart LE, Eisenstat DD, McNeely ML. Physical therapy interventions, other than general physical exercise interventions, in children and adolescents before, during and following treatment for cancer. Cochrane Database Syst Rev. 2021 Aug 3; 8(8): CD012924. doi: 10.1002/14651858.CD012924.pub2. PMID: 34343340; PMCID: PMC8407387.
137. Berrak SG, Pearson M,  S, Ilhan IE, Jaffe N. High-dose ifosfamide in relapsed pediatric osteosarcoma: therapeutic effects and renal toxicity. Pediatr Blood Cancer. 2005 Mar; 44(3): 215 - 9. doi: 10.1002/pbc.20228. PMID: 15503294.
S, Ilhan IE, Jaffe N. High-dose ifosfamide in relapsed pediatric osteosarcoma: therapeutic effects and renal toxicity. Pediatr Blood Cancer. 2005 Mar; 44(3): 215 - 9. doi: 10.1002/pbc.20228. PMID: 15503294.
138. Pawlowska AB, Sun V, Calvert GT, Karras NA, Sato JK, Anderson CP, Cheng JC, DiMundo JF, Femino JD, Lu J, Yang D, Dagis A, Miser JS, Rosenthal J. Long-Term Follow-up of High-Dose Chemotherapy with Autologous Stem Cell Transplantation in Children and Young Adults with Metastatic or Relapsed Ewing Sarcoma: A Single-Institution Experience. Transplant Cell Ther. 2021 Jan; 27(1): 72.e1 - 72.e7. doi: 10.1016/j.bbmt.2020.09.029. Epub 2020 Sep 29. PMID: 33007495
139. Fox E, Patel S, Wathen JK, et al. Phase II study of sequential gemcitabine followed by docetaxel for recurrent Ewing sarcoma, osteosarcoma, or unresectable or locally recurrent chondrosarcoma: results of Sarcoma Alliance for Research Through Collaboration Study 003. Oncologist. 2012; 17: 321. doi: 10.1634/theoncologist.2010-0265
140. Gosiengfiao Y, Reichek J, Woodman J, et al. Gemcitabine with or without docetaxel and resection for recurrent osteosarcoma: the experience at Children's Memorial Hospital. J Pediatr Hematol Oncol. 2012; 34: e63 - e65. doi: 10.1097/MPH.0b013e3182331ee8
141. He AN, Tang LN, Shen Z, et al. Efficacy and safety of gemcitabine-docetaxel combination therapy for recurrent or refractory high-grade osteosarcoma in China: a retrospective study of 18 patientб, s. Jpn J Clin Oncol. 2012; 42: 427 - 431. doi: 10.1093/jjco/hyr19
142. Wagner L, et al., Pilot study of vincristine, oral irinotecan, and temozolomide (VOIT regimen) combined with bevacizumab in pediatric patients with recurrent solid tumors or brain tumors. Pediatr Blood Cancer, 2013. 60(9): p. 1447 - 51.
143. Chybicka A,  J,
J,  B,
B,  J, Armata J, Balcerska A, Balwierz W, Bubala H, Drabko K, Eliasinska A, Kedziora M,
J, Armata J, Balcerska A, Balwierz W, Bubala H, Drabko K, Eliasinska A, Kedziora M,  D, Sopylo B,
D, Sopylo B,  P, Kowalczyk J, Matysiak M, Rokicka-Milewska R, Stefaniak MJ,
P, Kowalczyk J, Matysiak M, Rokicka-Milewska R, Stefaniak MJ,  E, Stencel D, Wysocki M,
E, Stencel D, Wysocki M,  A. G-CSF i GM-CSF w leczeniu neutropenii po chemioterapii
A. G-CSF i GM-CSF w leczeniu neutropenii po chemioterapii  u dzieci [G-CSF and GM-CSF in treatment of neutropaenia after chemotherapy in children with neoplasms]. Med Wieku Rozwoj. 2000; 4(1 Suppl 2): 121 - 9. Polish. PMID: 12021471.
u dzieci [G-CSF and GM-CSF in treatment of neutropaenia after chemotherapy in children with neoplasms]. Med Wieku Rozwoj. 2000; 4(1 Suppl 2): 121 - 9. Polish. PMID: 12021471.
144. Inteernational randomized controlled trial of chemotherapy for the treatment of reccurent and primary refractory Ewing Sarcoma. Version 5.0. 2016
145. Haveman LM, van Ewijk R, van Dalen EC, Breunis WB, Kremer LC, van den Berg H, Dirksen U, Merks JH. High-dose chemotherapy followed by autologous haematopoietic cell transplantation for children, adolescents, and young adults with first recurrence of Ewing sarcoma. Cochrane Database Syst Rev. 2021 Sep 2; 9(9): CD011406. doi: 10.1002/14651858.CD011406.pub2. PMID: 34472084; PMCID: PMC8411193.
146. Koch R, Gelderblom H, Haveman L, Brichard B,  H, Cyprova S, van den Berg H, Hassenpflug W, Raciborska A, Ek T, Baumhoer D, Egerer G, Eich HT, Renard M, Hauser P, Burdach S, Bovee J, Bonar F, Reichardt P, Kruseova J, Hardes J,
H, Cyprova S, van den Berg H, Hassenpflug W, Raciborska A, Ek T, Baumhoer D, Egerer G, Eich HT, Renard M, Hauser P, Burdach S, Bovee J, Bonar F, Reichardt P, Kruseova J, Hardes J, ![]() T, Kessler T, Collaud S, Bernkopf M,
T, Kessler T, Collaud S, Bernkopf M,  T, Dhooge C, Bauer S, Kiss J, Paulussen M, Hong A, Ranft A, Timmermann B, Rascon J, Vieth V, Kanerva J, Faldum A, Metzler M, Hartmann W, Hjorth L, Bhadri V, Dirksen U. High-Dose Treosulfan and Melphalan as Consolidation Therapy Versus Standard Therapy for High-Risk (Metastatic) Ewing Sarcoma. J Clin Oncol. 2022 Jul 20; 40(21): 2307 - 2320. doi: 10.1200/JCO.21.01942. Epub 2022 Apr 15. PMID: 35427190.
T, Dhooge C, Bauer S, Kiss J, Paulussen M, Hong A, Ranft A, Timmermann B, Rascon J, Vieth V, Kanerva J, Faldum A, Metzler M, Hartmann W, Hjorth L, Bhadri V, Dirksen U. High-Dose Treosulfan and Melphalan as Consolidation Therapy Versus Standard Therapy for High-Risk (Metastatic) Ewing Sarcoma. J Clin Oncol. 2022 Jul 20; 40(21): 2307 - 2320. doi: 10.1200/JCO.21.01942. Epub 2022 Apr 15. PMID: 35427190.
147. Жуков Н.В., Казакова Л.Л., Новичкова Г.А. Профилактика и лечение тошноты и рвоты у детей и подростков, получающих противоопухолевую терапию. Текущее состояние и потенциальные пути улучшения. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2020; 19(4): 205 - 223. https://doi.org/10.24287/1726-1708-2020-19-4-205-223
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Карачунский Александр Исаакович профессор, доктор медицинских наук, директор Института онкологии, радиологии и ядерной медицина ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
2. Грачев Николай Сергеевич профессор, доктор медицинских наук, генеральный директор ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
3. Варфоломеева Светлана Рафаэлевна профессор, доктор медицинских наук, директор Научно-исследовательского института детской онкологии и гематологии им. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
4. Киргизов Кирилл Игоревич, кандидат медицинских наук, заместитель директора по научной работе Научно-исследовательского института детской онкологии и гематологии им. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
5. Коноплева Елена Ивановна, врач-детский онколог, научный сотрудник отдела исследования сарком опорно-двигательного аппарата ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
6. Большаков Николай Анатольевич, кандидат медицинских наук, заведующий отделением онкологии и детской хирургии, заведующий отделом онкоортопедии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
7. Ускова Наталья Геннадьевна, кандидат медицинских наук, врач-детский хирург, научный сотрудник отдела торакоабдоминальной хирургии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
8. Нечеснюк Алексей Владимирович, кандидат медицинских наук, заведующий отделением лучевой терапии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
9. Ликарь Юрий Николаевич, кандидат медицинских наук, заведующий отделением радионуклидной диагностики ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
10. Сидоров Илья Владимирович, врач-патологоанатом ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
11. Терещенко Галина Викторовна, кандидат медицинских наук, заведующая отделением лучевой диагностики ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
12. Горбунова Татьяна Викторовна, кандидат медицинских наук, заместитель главного врача Научно-исследовательского института детской онкологии и гематологии им. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
13. Романцова Ольга Михайловна, врач-детский онколог, заведующая детским онкологическим отделением N 2 (химиотерапии опухолей опорно-двигательного аппарата) Научно-исследовательского института детской онкологии и гематологии им. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
14. Вашура Андрей Юрьевич, кандидат медицинских наук, заведующий отделом научных основ питания и нутритивно-метаболической терапии
15. Хестанов Денис Борисович, кандидат медицинских наук, старший научный сотрудник детского онкологического отделения N 2 (химиотерапии опухолей опорно-двигательного аппарата) Научно-исследовательского института детской онкологии и гематологии им. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
16. Григоренко Василий Андреевич, заведующий отделением лучевой терапии Научно-исследовательского института детской онкологии и гематологии им. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-детские онкологи;
2. Студенты медицинских ВУЗов, ординаторы, аспиранты.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств: поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0,3.
Поиск в электронных базах данных.
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных метаанализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А1 - А3).
В настоящих клинических рекомендациях приведены уровни достоверности доказательств и уровни убедительности рекомендаций в соответствии рекомендациями по разработке и актуализации клинических рекомендаций (приказ Минздрава России от 28.02.2019 г. N 103н).
Таблица 10. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 11. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 12. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ПРОФИЛАКТИКА
И ЛЕЧЕНИЕ ТОШНОТЫ И РВОТЫ, ОБУСЛОВЛЕННЫХ ПРОВЕДЕНИЕМ
ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
А3.1.1. Определение уровня эметогенности и варианта профилактики ТИР
Для выбора адекватного режима профилактики ТИР на первом этапе необходимо определение уровня эметогенности (риска развития ТИР) режима противоопухолевой терапии, который планируется использовать у пациента. Уровень эметогенности влияет на выбор препаратов для профилактики ТИР, их дозы и длительность применения. В Приложении А3.1.2 (Таблица 1) представлена общая классификация эметогенности препаратов химиотерапии согласно рекомендациям ASCO (American Society of Clinical Oncology) и рекомендациям COG (Children Oncology Group) [103 - 111].
А3.1.2. Таблица 1 - Уровень эметогенности противоопухолевых препаратов
Степень эметогенности (риск развития рвоты)
Рекомендации COG 2022 (педиатрические)
+
Рекомендации ASCO 2020 (общие для взрослых и детей)
Высокая
(> 90%)
Монотерапия
Аспарагиназа** (в/в) >= 20 000 МЕ/м2
Бусульфан (в/в) >= 0,8 мг/кг
Бусульфан** (р.о.) >= 1 мг/кг
Дакарбазин** (в/в)
Дактиномицин (в/в) >= 1,35 мг/м2
Доксорубицин** (в/в) >= 30 мг/м2
Идарубицин (р.о.) >= 30 мг/м2
Карбоплатин** (в/в) >= 175 мг/м2
Кармустин** (в/в)
Мелфалан** (в/в)
Метотрексат** (в/в) >= 12 г/м2
Цисплатин** (в/в) >= 12 мг/м2
Циклофосфамид** (в/в) >= 1200 мг/м2
Цитарабин** (в/в) >= 3 г/м2/сутки
Комбинированные режимы
Дактиномицин 900 мкг/м2 (в/в) + ифосфамид** 3 г/м2
Циклофосфамид** > 600 мг/м2 + дактиномицин >= 1 мг/м2
Циклофосфамид** >= 400 мг/м2 + доксорубицин** >= 40 мг/м2
Цитарабин** >= 90 мг/м2 (в/в) + метотрексат** (в/в) >= 150 мг/м2
Этопозид** (в/в) >= 60 мг/м2 + ифосфамид** (в/в) >= 1,2 г/м2
Этопозид** (в/в) >= 250 мг/м2 +
тиотепа (в/в) >= 300 мг/м2
Умеренная
(31 - 90%)
Монотерапия
Алемтузумаб** (в/в)
Бендамустин** (в/в)
Дактиномицин (в/в) 10 мг/кг
Даунорубицин** (в/в)
Доксорубицин** (в/в) 25 мг/м2
Идарубицин** (в/в)
Иксабепилон** (в/в) 3 - 10 мг/м2
Иматиниб** (р.о.) > 260 мг/м2/сутки
Интерферон альфа** (в/в) 15 - 30 млнМЕ/м2/сутки
Иринотекан** (в/в)
Ифосфамид** (в/в)
Карбоплатин** (в/в)
Клофарабин (в/в)
Метотрексат** (в/в) 5 г/м2
Метотрексат** (и/т)
Оксалиплатин** (в/в)
Темозоломид** (в/в)
Тиотепа (в/в)
Циклосфамид** (в/в) 1000 мг/м2
Цитарабин** (в/в) 75 мг/м2
Эпирубицин** (в/в)
Комбинированные режимы
Цитарабин** (в/в) 100 мг/м2 +
Даунорубицин** (в/в) 45 мг/м2 +
Этопозид** (в/в) 100 мг/м2 +
Преднизолон** (р.о.)
Цитарабин** 60 или 90 мг/м2 +
Метотрексат** 120 мг/м2
Низкая
(10 - 30%)
Монотерапия
Афлиберцепт** (в/в)
Блинатумомаб** (в/в)
Бортезомид** (в/в)
Децитабин (в/в)
Доцетаксел** (в/в)
Гемцитабин** (в/в)
Гефитиниб** (р.о.) 150 - 500 мг/м2/сутки
Иматиниб** (р.о.) 260 мг/м2/сутки
Инотузумаб озогамицин (в/в)
Кабазитаксел** (в/в)
Карфилзомиб** (в/в)
Мелфалан** (р.о.) 0,2 мг/г
Меркаптопурин** (р.о.) <= 4,2 мг/кг
Метотрексат** (в/в) 38 - 83 мг/м2
Митоксантрон** (в/в) <= 33 мг/м2
Митомицин** (в/в)
Неларабин** (в/в)
Паклитаксел** (в/в)
Панитумумаб** (в/в)
Пегилированный липосомальный доксорубицин** (в/в)
Пеметрексед** (в/в)
Пертузумаб** (в/в)
Прокарбазин** (р.о.) 50 - 100 мг/м2/сути
Руксолитиниб** (р.о.) 15 - 21 мг/м2
Селуметиниб (р.о.) 20 - 30 мг/м2
Сорафениб** (р.о.) 150 - 325 мг/м2
Темозоломид** (р.о.) 200 мг/м2
Темсиролимус (в/в)
Топотекан (в/в)
Фторурацил** (в/в)
Цетуксимаб** (в/в)
Циклофосфамид** (в/в) 500 мг/м2
Циклофосфамид** (р.о.) 2 - 3 мг/кг
Эверолимус** (р.о.) 0,8 - 9 мг/м2/сутки
Элотузумаб** (в/в)
Энфортумаб ведотин (в/в)
Эрлотиниб** (р.о.) 35 - 150 мг/м2/сутки
Эрибулин** (в/в)
Этопозид** (в/в)
Комбинированная терапия
Цитарабин** (в/в) 60 мг/м2 + метотрексат** (в/в) 90 мг/м2
Минимальная
(< 10%)
Монотерапия
Авелумаб** (в/в)
Атезолизумаб** (в/в)
Бевацизумаб** (в/в)
Блеомицин** (в/в)
Бусульфан** (в/в)
Винбластин** (в/в)
Винкристин** (в/в) <= 1,5 мг/м2
Винорелбин** (в/в)
Даратумумаб (в/в)
Доксорубицин** (в/в) 10 мг/м2
Дурвалумаб** (в/в)
Ипилимумаб** (в/в)
Кладрибин (в/в)
Липосомальный доксорубицин** (в/в) <= 50 мг/м2
Меркаптопурин** (р.о.) <= 4.2 мг/кг
Метотрексат** (р.о.) <= 10 мг/м2
Ниволумаб** (в/в)
Обинутузумаб** (в/в)
Офатумумаб (в/в)
Пембролизумаб** (в/в)
Полатузумаб ведотин (в/в)
Рамуцирумаб** (в/в)
Ритуксимаб** (в/в)
Трастузумаб (в/в)
Хлорамбуцил** (р.о.) <= 0.2 мг/кг/сутки
Флударабин** (в/в)
Комбинированные режимы
Меркаптопурин** (р.о.) <= 2.5 мг/кг + метотрексат** (р.о.) <= 0.1 мг/кг/сутки
Цисплатин** <= 60 мг/м2 (в/а) + доксорубицин** <= 30 мг/м2 (в/а)
А3.1.3. Профилактика тошноты и рвоты на фоне высокоэметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, для детей в возрасте от 5 лет и/или массой 15 кг и более использование четырехкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов, антагонист NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты), #дексаметазон**, и #оланзапин** [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется. Использование #оланзапина** у детей в возрасте менее 5 лет и/или массой тела менее 15 кг не исследовалось и не может быть рекомендовано.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 3-х дней после завершения введения препаратов химиотерапии, использование комбинации #дексаметазона** и #оланзапина** [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
В случае отсутствия возможности назначения антагониста NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты) использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов, #дексаметазона** и #оланзапина** [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
В случае отсутствия возможности назначения #дексаметазона** в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов используется палоносетрона** в комбинации с антагонистом NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты) (при возможности назначения) и #оланзапином** [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
А3.1.4. Таблица 2 - Дозы и режимы противорвотных препаратов [147]
Степень эметогенности
Режимы
Дозы
Высокая
Блокаторы серотониновых 5HT3-рецепторов
+
Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
+
Оланзапин**
I. #Дексаметазон**
1. Дети, получающие высокоэметогенную химиотерапию: 6 мг/м2 внутривенно/перорально все дни химиотерапии и три дня после ее завершения;
2. Дети, получающие химиотерапию с умеренной эметогенной активностью:
<= 0,6 м2: 2 мг внутривенно/перорально каждые 12 часов [147]
> 0,6 м2: 4 мг внутривенно/перорально каждые 12 часов.
При одновременном применении с #апрепитантом необходимо уменьшение дозы дексаметазона на 50%.
II. Блокаторы серотониновых 5HT3-рецепторов
#Гранисетрон
1. Дети, получающие высокоэметогенную химиотерапию: 40 мкг/кг внутривенно однократно.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 40 мкг/кг внутривенно однократно.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 40 мкг/кг внутривенно однократно.
#Ондансетрон**
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 (0,15 мг/кг) внутривенно/перорально перед терапией однократно, а затем каждые 8 часов.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 5 мг/м2 (0,15 мг/кг; максимум 8 мг) внутривенно/перорально перед терапией однократно, а затем каждые 12 часов.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 10 мг/м2 (0,3 мг/кг; максимум 16 мг внутривенно или 24 мг перорально) до начала терапии однократно.
Палоносетрон
1. Дети от 1 месяца до 17 лет: 0,02 мг/кг (максимум 1,5 мг) внутривенно один раз перед терапией [147]
2. Дети 17 лет и старше: 0,5 мг внутривенно однократно перед терапией.
III. Антагонисты NK-1 рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты)
#Апрепитант
Дети старше 6 месяцев:
- 1-й день: 3 мг/кг (максимум 125 мг) перорально 1 раз в сутки
за 1 час до химиотерапии
- 2-й и 3-й дни: 2 мг/кг (максимум 80 мг) перорально один раз в сутки.
#Фосапрепитант
1. Дети от 6 месяцев до 2-х лет: 5 мг/кг (максимальная доза 150 мг) внутривенно в течение 60 минут за 30 минут до начала химиотерапии в первый день;
2. Дети от 2-х до 12 лет: 4 мг/кг (максимальная доза 150 мг) внутривенно в течение 60 минут за 30 минут до начала химиотерапии в первый день;
3. Дети от 12 до 17 лет: 150 мг внутривенно в течение 30 минут за 30 минут до начала химиотерапии в первый день
Комбинация #апрепитант + #фосапрепитант [147]
1. Дети от 6 месяцев до 12 лет:
- 3 мг/кг (максимальная доза 115 мг) внутривенно в течение 60 минут за 30 минут до начала химиотерапии в первый день;
- 2 мг/кг (максимальная доза 80 мг) перорально, дни 2, 3;
2. Дети от 12 до 17 лет:
- 115 мг внутривенно в течение 60 минут за 30 минут до начала химиотерапии в первый день
- 80 мг перорально, дни 2, 3.
IV. #Оланзапин** [106]
1. Дети весом от 30 кг - 0,07 мг/кг (от 30 до 55 кг - 2,5 мг/сут, свыше 55 кг - 5 мг/сут) перорально за 1 час до введения цитостатиков, все дни химиотерапии и три дня после ее завершения [106];
2. Дети весом > 15 и < 30 кг - 2,5 мг/сут перорально за 1 час до введения цитостатиков, все дни химиотерапии и три дня после ее завершения;
Для детей весом менее 15 кг и/или возрастом менее 5 лет - неприменимо в силу отсутствия данных исследований об эффективности и безопасности оланзапина.
Блокаторы серотониновых 5HT3-рецепторов +
Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов +
Дексаметазон**
+
Оланзапин**
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
+
Оланзапин**
+/-
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Умеренная
Блокаторы серотониновых 5HT3-рецепторов +
Дексаметазон**
Блокаторы серотониновых 5HT3-рецепторов +
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
Низкая
Блокаторы серотониновых 5HT3-рецепторов
Минимальная
Блокаторы серотониновых 5HT3-рецепторов или отсутствие профилактики
А3.1.5. Профилактика тошноты и рвот на фоне умеренно эметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, использование двухкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов и #дексаметазон** [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 1 дня после завершения введения цитостатиков (по АТХ классификации L: Противоопухолевые препараты и иммуномодуляторы), использование #дексаметазона** [103 - 111]. Режимы и дозы представлены в Приложении А3.1.2 (Таблица 1).
В случае отсутствия возможности назначения #дексаметазона** использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторови антагониста NK1-рецептора (по АТХ классификации A04AD: Другие противорвотные препараты) [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
В случае отсутствия возможности назначения и #дексаметазона**, и антагониста NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты), в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов использование палоносетрона [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
А3.1.6. Профилактика тошноты и рвоты на фоне низко- и минимально эметогенной химиотерапии
Профилактика ТИР на фоне низко- и минимально эметогенной химиотерапии включает в себя однокомпонентную профилактику, включающей антагониста 5HT3-рецепторов, при низкоэметогенной терапии или же вовсе отсутствие ее в случае химиотерапии с минимальной эметогенной активностью [103 - 111]. Режимы и дозы представлены в Приложении А3.1.4 (Таблица 2).
А3.1.7. Лечение прорывной и рефрактерной рвоты
Пациентам с прорывной и рефрактерной рвотой на фоне цитостатической терапии рекомендовано:
1. Если прорывная ТИР возникла на фоне цитостатической терапии (и соответственно профилактики), относящейся к минимально, низко- или среднеэметогенному уровню, то необходимо использовать препараты, предусмотренные следующим, более высоким уровнем профилактики.
2. Если пациент и так получает профилактику, предусмотренную для высокоэметогенной терапии, то при возникновении прорывной ТИР необходимо рассмотреть вопрос о добавлении #оланзапина** (если он не применялся ранее в связи с неподходящим возрастом или массой тела). При невозможности использовать #оланзапин** в качестве альтернативы может быть применен метоклопрамид**.
3. В случае, если у пациента наблюдается рефрактерная ТИР и он еще не получает максимальный уровень профилактики, то необходимо провести эскалацию противорвотной терапии. Если рефрактерная ТИР наблюдается на фоне максимального уровня профилактики, возможна замена использующегося блокатора серотониновых 5HT3-рецепторов на палоносетрон, введение дополнительных доз блокаторов серотониновых 5HT3-рецепторов. При неудаче этих подходов к профилактике рекомендуется на постоянной основе добавить #оланзапин**, метоклопрамид** или другие препараты, показавшие у пациента эффективность при лечении прорывной рвоты [103 - 111].
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Схема 4. Алгоритм действий врача при подозрении на ЗНО кости
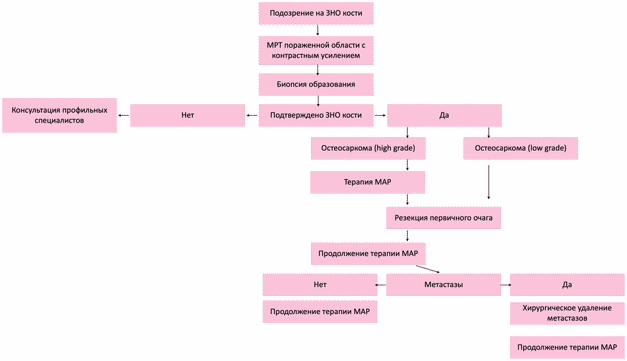
Схема 5. Алгоритм действий врача при подозрении на ЗНО кости
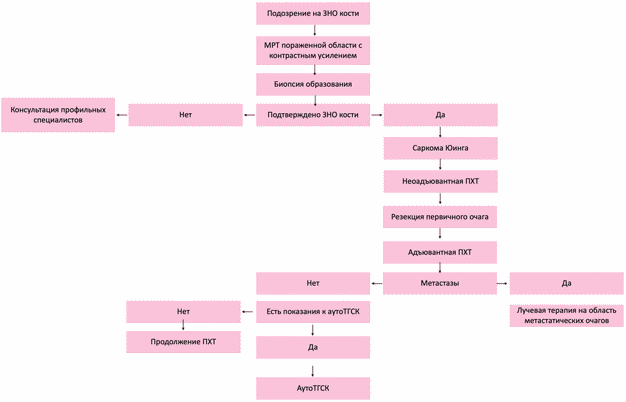
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Злокачественные новообразования костей представляют собой разнообразную по своему происхождению, биологическому поведению группу опухолей, лечение которых требует привлечения специалистов разных областей медицины - детских онкологов, хирургов-ортопедов, нейрохирургов, врачей лучевой диагностики, патологоанатомов, радиотерапевтов, реабилитологов и др.
Клинические проявления болезни обусловлены локализацией и размерами опухоли, и распространенности заболевания, но чаще ведущим симптомом является боль в области образования, которая беспокоит преимущественно в ночное время. В дальнейшем может присоединиться хромота, движения в прилежащем суставе из-за размеров образования могут быть затруднены, появляется припухлость в области пораженной кости.
При подозрении на наличие объемного образования кости на первом этапе проводится рентгенография. По результатам рентгенографии определяется участок деструкции кости. Для уточнения характера образования, решения вопроса о месте биопсии проводится компьютерная томография и магнитно-резононсная томография пораженной кости.
Компьютерная томография (КТ) позволяет точнее изучить опухоль, причем как внутрикостный компонент, так и распространение в окружающие мягкие ткани (внекостный компонент). Магнитно-резонансная томография (МРТ) дает дополнительную информацию о размерах образования, вовлечения мягких тканей и его взаимосвязи с сосудами и нервами. По результатам проведенного обследования проводится биопсия образования с последующим микроскопическим исследованием, иммуногистохимическим и при необходимости цитогенетическим исследованием.
Самыми частыми злокачественными новообразованиями костей у детей и подростков является остеосаркома и саркома Юинга.
Остеосаркома представляет собой высокоагрессивное злокачественное новообразование кости. Данный тип опухоли может встречаться в любом возрасте, однако чаще заболевают пациенты в возрасте 10 - 15 лет, что связано с периодом быстрого роста ребенка и в частности костей скелета. Кроме того, повышенный риск остеосаркомы наблюдается при некоторых генетических аномалиях. Например, эта опухоль чаще встречается у детей с наследственной ретинобластомой (опухолью сетчатки), синдром Ли-Фраумени. Развитие остеосаркомы возможно, если ранее ребенку проводилась лучевая терапия, например, в ходе лечения другого образования. Однако в большинстве случаев болезнь возникает у детей и молодых людей, у которых нет ни одного из перечисленных факторов риска.
Первичный очаг остеосаркомы чаще расположен в длинных трубчатых костях конечностей - верхних и нижних, однако излюбленной локализацией первичного очага являются отделы нижней конечности, формирующие коленный сустав.
Обладая крайне агрессивным поведением, остеосаркома, разрушая кость, формирует внекостный (мягкотканный) компонент, который прорастает прилежащие к пораженному отделу кости мышцы, сосуды и нервы. С кровотоком, опухолевые клетки могут распространятся в отдаленные участки организма формируя отдаленные метастазы. Наиболее частой локализацией метастазов являются легкие, реже возникает метастатическое (вторичное) поражение других костей скелета. Оценить наличие отдаленный метастатических очагов помогают КТ органов грудной клетки с контрастным усилением, ПЭТ/КТ всего тела или сцинтиграфия костей скелета с Tc99.
На основании результатов гистологического исследования, проведенных обследования, пациенту устанавливается стадия заболевания, которая в дальнейшем будет определять тактику лечения ребенка. Краеугольным камнем в лечении пациентов с остеосаркомой является хирургическая резекция опухоли. В случае невозможности его проведения прогноз существенно ухудшается. При наличии отдаленных метастазов в легких или костях скелета, также проводится их хирургическое удаление. Вторым ключевым методом лечения пациентов с остеосаркомой является проведение специфической терапии или иначе - полихимиотерапии. Специфическая терапия проводится непосредственно после биопсии образования - предоперационная (неоадъювантная химиотерапия), и после хирургической резекции опухоли - послеоперационная (адъювантная химиотерапия).
Лучевая терапия применяется очень редко, так как клетки остеосаркомы малочувствительны к облучению. Иногда облучение используют при невозможности полного удаления опухоли.
Саркома Юинга - злокачественная опухоль, обычно поражающая кости. Среди злокачественных опухолей костей у детей она по частоте встречаемости занимает второе место после остеосаркомы. Чаще всего она возникает в длинных трубчатых костях (таких как бедренная, большеберцовая, малоберцовая, плечевая), а также в костях таза, ребрах, позвонках, лопатках и т.п. Поражение плоских костей, таких как кости таза, ребра или лопатки, при саркоме Юинга встречается намного чаще, чем при остеосаркоме. Из первичного костного очага опухоль быстро распространяется в окружающие мягкие ткани, включая мышцы и сухожилия.
Иногда первичная опухоль при саркоме Юинга возникает не в кости, а в мягких тканях. В этих случаях говорят о внекостной (экстраоссальной) саркоме Юинга.
Существует целое семейство сходных агрессивных злокачественных опухолей, родственных саркоме Юинга. Поэтому говорят об "опухолях семейства саркомы Юинга". Кроме костной и внекостной саркомы Юинга, к нему относятся также периферические примитивные нейроэктодермальные опухоли - ПНЭО (необходимо отличать их от ПНЭО головного мозга, которые имеют другую природу!). Особой формой ПНЭО является так называемая опухоль Аскина.
Клетки саркомы Юинга и ПНЭО не полностью идентичны друг другу, но имеют сходные молекулярно-биологические и цитогенетические характеристики - так, в подавляющем большинстве случаев в опухолевых клетках присутствует транслокация t(11;22). Стратегии лечения этих опухолей также сходны.
Для саркомы Юинга различают локализованную и метастатическую стадии болезни. Это важно для планирования лечения и для оценки прогноза заболевания. При локализованной стадии опухоль может распространяться из первичного очага на окружающие мягкие ткани, но при этом обычные методы исследования не обнаруживают отдаленных метастазов. О метастатической стадии говорят, когда опухоль уже распространилась в другие части тела. Типичны метастазы в легкие, кости и костный мозг; возможно также метастазирование в лимфоузлы, центральную нервную систему, печень и т.п.
Саркома Юинга - вторая по частоте встречаемости (после остеосаркомы) опухоль костей у детей. В европейских странах общая заболеваемость опухолями семейства саркомы Юинга составляет около 2 - 3 случаев на 1 миллион населения в возрасте до 20 лет. При этом большинство случаев относится к костной саркоме Юинга, и лишь около 15% приходится на внекостную саркому Юинга и ПНЭО.
Саркома Юинга редко встречается у детей младше 5 лет и у взрослых старше 30 лет. Чаще всего она возникает у подростков 10 - 15 лет. Мальчики болеют несколько чаще девочек. Среди европейцев эта опухоль встречается в несколько раз чаще, чем среди выходцев из стран Азии и Африки.
Есть данные, что риск саркомы Юинга несколько повышен при наличии некоторых доброкачественных костных опухолей (таких как энхондрома) и определенных аномалий мочеполовой системы. Саркома Юинга не является генетически обусловленным заболеванием, но в редких случаях можно говорить о наследственной предрасположенности - например, известны случаи возникновения ПНЭО у детей в одной и той же семье. Образ жизни детей и их родителей, по-видимому, не играет роли в возникновении саркомы Юинга.
Распространено мнение, что развитие костных сарком, включая саркому Юинга, часто провоцируется травмой. Однако промежутки времени между травмой и обнаружением опухоли могут быть очень разными, и трудно надежно доказать связь между возникновением саркомы и предшествующими ушибами и переломами. Не исключено, что часто травма просто заставляет обратить внимание на этот участок тела, и в результате обнаруживается опухоль, которая на самом деле существовала и раньше.
Характерный симптом костной саркомы Юинга - боли в пораженном участке кости. В отличие от болей, обусловленных травмой, они не стихают при фиксации конечности, а с течением времени не ослабевают, а усиливаются. Иногда эти боли принимают за признак воспаления, но прием антибиотиков не приводит к их прекращению.
У большинства больных костной саркомой Юинга и практически у всех больных с внекостной саркомой постепенно возникает припухлость на месте опухоли. Отечность может распространиться на ближайший сустав, нарушая его функции. Зона припухлости обычно болезненна при ощупывании (пальпации) и быстро увеличивается в размерах с течением времени. Примерно в 1/3 случаев наблюдается местное повышение температуры, то есть можно почувствовать, что зона опухоли теплее окружающих тканей. Кожа над пораженным участком может быть покрасневшей, с проступающими расширенными венами.
При значительном опухолевом поражении кости может возникнуть патологический (то есть вызванный болезнью) перелом этой кости.
Если опухоль поражает позвоночник или окружающие его ткани, то возможны двигательные нарушения и/или нарушения функций тазовых органов.
По мере распространения опухоли в организме (метастазирования) возникают симптомы "общего" характера: слабость, утомляемость, потеря веса, повышение температуры тела.
Часто саркому Юинга удается диагностировать довольно поздно, лишь через несколько месяцев после появления первых симптомов. Это связано с тем, что первоначально боль и припухлость считают результатом травмы или воспаления. Поэтому при долго сохраняющихся необъяснимых костных болях целесообразна консультация врача-онколога или детского онколога.
Рентгенография пораженного участка кости обычно является первым исследованием, позволяющим обнаружить саркому Юинга. Эта опухоль имеет характерный вид на рентгенограммах, что позволяет поставить предварительный диагноз. Ультразвуковое исследование (УЗИ) этой же области применяется для оценки размеров и характера мягкотканного компонента опухоли.
Более подробную информацию о распространении опухоли можно получить с помощью других визуализирующих методов, таких как рентгеновская компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Эти методы позволяют уточнить локализацию и размеры опухоли, выявить степень поражения мягких тканей вокруг пораженной кости, оценить состояние костномозгового канала, обнаружить метастазы. Может производиться также позитронно-эмиссионная томография (ПЭТ).
Для уточнения природы обнаруженной опухоли необходима биопсия мягкотканного компонента или самого пораженного участка кости. Производятся различные исследования клеток, включая иммуногистохимическое, а также цитогенетический анализ на присутствие транслокации t(11;22) и других хромосомных изменений.
Так как саркома Юинга часто дает метастазы в легкие, для их обнаружения целесообразно проведение рентгенографии и компьютерной томографии грудной клетки. Саркома Юинга также может давать множественные метастазы в кости, для обнаружения которых используется остеосцинтиграфия.
При саркоме Юинга нередко встречается поражение костного мозга. Для его выявления используется костномозговая пункция или трепанбиопсия с последующим анализом полученных образцов костного мозга на присутствие опухолевых клеток.
Проводятся и обычные лабораторные исследования. Могут наблюдаться изменения в клиническом анализе крови: лейкоцитоз, анемия, повышение СОЭ. В биохимическом анализе крови важен уровень лактатдегидрогеназы (ЛДГ, LDH), так как его повышение чаще наблюдается при более агрессивном течении болезни.
К сожалению, в 20 - 30% всех случаев саркома Юинга диагностируется тогда, когда она уже успела дать метастазы, обнаруживаемые обычными методами исследования.
Саркома Юинга - высокоагрессивная опухоль, быстро дающая микрометастазы. Поэтому ее лечение обязательно включает в себя системное воздействие на весь организм, для чего используется полихимиотерапия - иначе рецидивы практически неизбежны. Кроме того, необходимы хирургическое лечение и/или лучевая терапия.
Во многих случаях при саркоме Юинга возможно хирургическое удаление опухоли - например, если она поражает кости нижних или верхних конечностей, ребра, лопатки и т.п. Удаляется как пораженный участок кости, так и мягкотканный компонент опухоли, причем удаленный участок кости заменяется эндопротезом. Иногда, к сожалению, бывает необходима ампутация руки или ноги, но часто современные методы лечения позволяют ее избежать. После удаления опухоли может проводиться лучевая терапия участка, где она была расположена, для уничтожения оставшихся опухолевых клеток.
Если полное хирургическое удаление опухоли невозможно, то врачи пытаются контролировать ее при помощи лучевой терапии, так как клетки саркомы Юинга чувствительны к этому виду лечения. Однако в этих случаях повышается риск рецидива болезни. Химиотерапия в современных протоколах лечения саркомы Юинга применяется как до, так и после операции. После удаления опухоли производится ее исследование для оценки ответа на предшествующую химиотерапию и выбора стратегии последующего лечения.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ПО ИНДЕКСУ КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название: Karnofsky Performance Status.
Источник: Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949: 191 - 205 [45].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т.д.).
Содержание:
Таблица 1. Оценка общего состояния по индексу Карновского
Нормальная физическая активность, больной не нуждается в специальном уходе
100%
Состояние нормальное, нет жалоб и симптомов заболевания
90%
Нормальная активность сохранена, но имеются незначительные симптомы заболевания
80%
Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания
Ограничение нормальной активности при сохранении полной независимости больного
70%
Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе
60%
Больной иногда нуждается в помощи, но в основном обслуживает себя сам
50%
Больному часто требуется помощь и медицинское обслуживание
Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация
40%
Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь
30%
Больной прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно
20%
Сильные проявления болезни, необходима госпитализация и поддерживающая терапия
10%
Умирающий больной, быстрое прогрессирование заболевания
0%
Смерть
Приложение Г2
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ БОЛЬНОГО ECOG
Название на русском языке: шкала оценки общего состояния пациента ECOG
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5(6): 649 - 65 [46]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание:
Таблица 2. Шкала оценки общего состояния больного ECOG
0
Больной полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Приложение Г3
ИНТЕРПРЕТАЦИЯ
НУТРИТИВНОГО СТАТУСА НА ОСНОВАНИИ Z-SCORE
СОГЛАСНО РЕФЕРЕНСНЫМ ДАННЫМ ВОЗ
Название на русском: Интерпретация нутритивного статуса на основании Z-score согласно референсным данным ВОЗ
Источник: Вашура АЮ, Кучер МА, Ковтун ТА, Алымова ЮА, Литвинов ДВ, Зубаровская ЛС, Кулагин АД. Роль и актуальность нутрициологического диагноза в онкопедиатрии. Медицинский Совет. 2023; (12): 99 - 109 [121]
Тип: шкала оценки
Содержание:
Таблица 1. Интерпретация нутритивного статуса на основании Z-score согласно референсным данным ВОЗ
Степень/Форма
(варианты интерпретации)
Z-скор, SDS
Показатели <*>
Ожирение морбидное
+4,00 и выше
--------------------------------
Примечания: нутритивный статус в онкопедиатрии оценивается по совокупным данным (клинические, лабораторные, инструментальные), с учетом нутритивного риска, антропометрические показатели позволяют критериально ориентироваться в определении нутритивного статуса и не могут быть единственно определяющими; <*> - в определении нутритивного статуса используется показатель с минимальным SDS; SDS - standard deviation score (величина стандартного отклонения), ожирение - простое; гипоталамическое; при нейроэндокринных заболеваниях; ятрогенное; моногенное; синдромальное
Приложение Г4
ФАКТОРЫ РИСКА РАЗВИТИЯ НАРУШЕНИЙ НУТРИТИВНОГО СТАТУСА
Название на русском: Шкала оценки риска развития нарушений нутритивного статуса
Источник: Вашура АЮ, Кучер МА, Ковтун ТА, Алымова ЮА, Литвинов ДВ, Зубаровская ЛС, Кулагин АД. Роль и актуальность нутрициологического диагноза в онкопедиатрии. Медицинский Совет. 2023; (12): 99 - 109 [121]
Тип: шкала оценки риска развития нарушений нутритивного статуса
Содержание:
Таблица 2. Факторы высокого риска развития нарушений нутритивного статуса
Критерии
1.
Нарушения аппетита в течение ближайшей недели или особенности аппетита (избирательность, привередливость в питании, нестабильный и непостоянный аппетит и др.), выявленные анамнестически, свойственные данному ребенку с раннего возраста
2.
Снижение объема потребления пищи на 1/3 - 1/2 и более от рекомендуемых возрастных норм (или снижение частоты/объема питания в динамике за неделю по данным опроса или данным пищевого дневника)
3.
Потеря более 2% массы тела за неделю или более 5% за месяц
4.
Исходная гастроинтестинальная дисфункция (хронические заболевания ЖКТ, непереносимость компонентов пищи и пищевая аллергия) или сформировавшаяся на фоне противоопухолевого лечения
5.
Заболевания обмена веществ и/или эндокринные заболевания
6.
Опухоли брюшной полости, малого таза, локализованные забрюшинно, опухоли головы и шеи
7.
Предстоящая ТГСК и ранний - до 3-х месяцев - посттрансплантационный период
8.
Возраст менее 3 лет
При наличии минимум двух вышеперечисленных критериев пациент относится к группе высокого нутритивного риска - вне зависимости от текущего нутритивного статуса, его текущего питания и клинической ситуации
