"Клинические рекомендации "Рак носоглотки"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК НОСОГЛОТКИ
Год утверждения (частота пересмотра): 2024 Пересмотр не позднее: 2026
ID: 66_4
Возрастная категория: Дети
Специальность:
Разработчик клинической рекомендации Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
5-HT3 - блокаторы серотониновых 5HT3-рецепторов
АЛАТ - аланинаминотрансфераза
АСАТ - аспартатаминотрансфераза
БЛРС - бета-лактамазы с расширенным спектром действия
ВЭБ - вирус Эпштейн-Барра
ГГТ - гамма-глутамилтрансфераза
ЗНО - злокачественные новообразования
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
ЛТ - лучевая терапия
МРЗС - метициллин-резистентный золотистый стафилококк
МРТ - магнитно-резонансная томография
НФК - назофарингеальная карцинома
ПБ - прогрессия болезни
ПО - полный ответ
ПЦР - полимеразная цепная реакция
ПХТ - полихимиотерапия
РОД - разовая очаговая доза
СБ - стабилизация болезни
СКФ - скорость клубочковой фильтрации
СОД - суммарная очаговая доза
ФН - фебрильная нейтропения
ЧО - частичный ответ
Эхо-КГ - эхокардиография
AJCC (American Joint Committee on Cancer) - Американский объединенный комитет
AUC (area under curve) - концентрация в плазме крови
CTV (Clinical Target Volume) - клинический объем опухоли
GPOH (Gesellschaft ![]()
 Onkologie und
Onkologie und  ) - Общество детской онкологии и гематологии
) - Общество детской онкологии и гематологии
GTV (Gross Tumor Volume) - определяемый объем опухоли
IMRT (Intensity Modulated Radiotherapy) - модулированная по интенсивности лучевая терапия
LN (lymph node) - регионарные лимфатические узлы
NK1 - нейрокининовые рецепторы 1-го типа (прочие противорвотные препараты)
PTV (Planning Target Volume) - планируемый объем мишени
UICC (Union for International Cancer Control) - Международный противораковый союз
Термины и определения
Общая выживаемость - время, прошедшее с момента постановки диагноза НФК до смерти пациента от любых причин или до последнего наблюдения за пациентом.
Бессобытийная выживаемость - время, прошедшее с момента постановки диагноза НФК до неблагоприятного события, под которым понимают прогрессию, рецидив (в случае достижения полного ответа), развитие вторичной злокачественной опухоли, смерть от любой причины, или даты последнего наблюдения за пациентом.
Полный ответ - исчезновение всех очагов. Любой из прежде увеличенных лимфатических узлов должен иметь короткую ось менее 10 мм.
Частичный ответ - уменьшение суммы диаметров очагов не менее чем на 30%.
Прогрессия заболевания - появление любого нового опухолевого очага; увеличение любого доступного измерению очага > 20%.
Рецидив заболевания - появление любых новых опухолевых очагов у пациентов, достигших ранее полного ответа согласно критериям оценки ответа на терапию у пациентов с НФК.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Рак носоглотки (назофарингеальная карцинома) - злокачественное эпителиальное новообразование носоглотки [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В детском и подростковом возрасте ВЭБ является этиологическим фактором в подавляющем большинстве случаев - его серологические признаки имеются у 98% больных, у большинства из них в клетках опухоли присутствует ДНК ВЭБ, а на их поверхности - антигены вируса [2, 3]. В ряде случаев определение циркулирующей ДНК ВЭБ может оказать определенную помощь в дифференциальной диагностике, определении прогноза (который значимо ухудшается при увеличении вирусной нагрузки) и последующем мониторинге противоопухолевого эффекта в процессе лечения [2, 3]. Немаловажным является и наличие генетических особенностей. О генетической предрасположенности к развитию НФК может свидетельствовать связь определенных вариантов HLA (например, гаплотип A2Bsin2) с более высоким уровнем заболеваемости этой опухолью [1, 2].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Злокачественные опухоли носоглотки составляют от 1 до 3% от общего числа детей со злокачественными новообразованиями [1, 4]. Среди всех злокачественных образований носоглотки назофарингеальная карцинома встречается в 26,4%. Недифференцированный рак занимает основное место (97%) среди злокачественных эпителиальных новообразований носоглотки [1].
Заболеваемость НФК значимо варьирует в зависимости от региона (от 1 - 2 случаев на 1 млн. населения в странах Европы и США до 20 случаев на 1 млн населения в Китае, Юго-Восточной Азии, Северной Африке и некоторых участках Средиземноморского региона) и этнических особенностей (в пределах одной страны или региона представители разных этносов могут иметь различные показатели) [1, 2].
НФК почти не встречается среди детей в возрасте до 10 лет, в то время как в возрасте от 10 до 14 лет заболеваемость увеличивается до 0,8 на 1 млн в год, а в возрасте от 15 до 19 лет - до 1,3 на 1 млн в год [5].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Злокачественные новообразования (ЗНО) носоглотки (C11):
C11.0 - ЗНО верхней стенки носоглотки
C11.1 - ЗНО задней стенки носоглотки
C11.2 - ЗНО боковой стенки носоглотки
C11.3 - ЗНО передней стенки носоглотки
C11.8 - Поражение носоглотки, выходящее за пределы одной и более вышеуказанных областей
C11.9 - Неуточненные локализации ЗНО носоглотки
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1 Международная гистологическая классификация НФК
Классификация ВОЗ выделяет несколько морфологических типов НФК, которые в ее исходном варианте от 1978 г. обозначались как плоскоклеточный ороговевающий рак (тип I), неороговевающий рак (тип II) и недифференцированная карцинома (тип III) [6]. В рамках обновленной классификации (2005 год) выделены подтип IIa - дифференцированный плосклеточный неороговевающий рак и подтип IIb - недифференцированный плосколкеточный неороговевающий рак. Также в классификации 2005 г. был выделен новый, ранее не описанный, крайне редкий подтип - базалоидный плоскоклеточный рак (тип IV) [7].
Классификация НФК (ВОЗ 2005 г.)
I. Плоскоклеточный ороговевающий рак.
IIa. Дифференцированный плоскоклеточный неороговевающий рак.
IIb. Недифференцированный плоскоклеточный неороговевающий рак.
III. Недифференцированная карцинома.
IV. Базалоидный плоскоклеточный рак.
1.5.2 Международная клиническая классификация НФК
Стадирование НФК у детей и подростков, как и во взрослой популяции, осуществляется по системе TNM. Согласно переизданной в 2016 году Классификации злокачественных опухолей UICC/AJCC (8-е издание) изменилось клиническое стадирование пациентов, в первую очередь изменения коснулись IV стадии - объединение IVA и IVB в единую IVA, IVC - в IVB [8].
Первичная опухоль (T):
Tx - первичная опухоль не может быть оценена.
T0 - опухоль не обнаружена, но имеются увеличенные лимфатические узлы, в которых обнаружены опухолевые клетки НФК, ассоциированные с ЭБВ.
T1 - опухоль локализуется в носоглотке, ротоглотке или полости носа без окологлоточного распространения.
T2 - опухоль с распространением в парафарингеальное пространство, поражение прилегающих мягких тканей.
T3 - распространение опухоли в костные структуры (основание черепа, шейный позвонок) и/или придаточные пазухи носа.
T4 - внутричерепное распространение опухоли, поражение черепных нервов, гипофаринкса, орбиты, обширное поражение мягких тканей.
Регионарные лимфатические узлы (N):
Nx - регионарные лимфатические узлы не могут быть оценены.
N0 - отсутствие метастазирования в регионарные лимфатические узлы;
N1 - односторонние шейные, одно- или двусторонние заглоточные лимфатические узлы диаметром <= 6 см выше перстневидного хряща.
N2 - двустороннее поражение лимфатических узлов, лимфатические узлы размером <= 6 см в наибольшем измерении, выше перстневидного хряща.
N3 - лимфатические узлы диаметром > 6 см и/или ниже перстневидного хряща (независимо от латеральности).
Отдаленные метастазы (M):
M0 - нет отдаленных метастазов.
M1 - наличие отдаленных метастазов.
Таблица - 1. Клиническая классификация НФК (8-ое издание классификации UICC/AJCC)
Стадия
T
N
M
I
1
0
0
II
1
0
0
2
0
0
2
1
0
III
1
2
0
2
2
0
3
0
0
3
1
0
IVA
1
3
0
2
3
0
3
3
0
4
0
0
4
1
0
4
2
0
IVB
Любая T
Любая N
1
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В клинической картине ведущим симптомом является одно- или двусторонняя лимфаденопатия, которая обнаруживается ранее симптомов опухоли в носоглотке.
Локальная симптоматика проявляется носовыми кровотечениями, заложенностью носа, выделениями различного характера. В связи с блокадой устьев слуховых труб больных беспокоят отоалгия и рецидивирующие средние отиты. Проявлением опухолевой интоксикации и реактивного воспаления является головная боль. При распространении опухоли на крыловидные и/или жевательные мышцы возникает тризм [1, 3, 9].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии со шкалами оценки УДД и УРР) по причине отсутствия посвященных им клинических исследований. Не взирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Все дети с подозрением на опухоль должны направляться в детские онкологические центры, оснащенные необходимым оборудованием для постановки диагноза.
Критерии установления диагноза/состояния: диагноз устанавливается на основании патогномоничных данных:
1) анамнестических данных;
2) физикального обследования;
3) лабораторных исследований;
4) инструментального обследования;
5) данные прижизненного патологоанатомического исследования операционного материала.
2.1 Жалобы и анамнез
- Всем пациентам с подозрением на НФК или с выявленной НФК при первичном приеме рекомендуется подробный сбор анамнеза [1, 3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: сбор анамнеза должен включать подробный сбор семейного анамнеза, детальное выяснение развития пациента от рождения до момента обследования, уточнение онкологического анамнеза - наличие доброкачественных, или злокачественных опухолей у членов семьи.
- Всем пациентам с подозрением на НФК или с выявленной НФК при первичном приеме, а также при каждом приеме (осмотре, консультации) врача - детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется подробный сбор жалоб [3, 10, 11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: условно все симптомы злокачественных опухолей носоглотки можно разделить на 4 основные группы: носовые, ушные, неврологические и метастатические. Ранними считаются первые две группы симптомов, которые являются собственно носоглоточными, т.к. обусловлены ростом опухоли в пределах носоглотки. Неврологические симптомы и регионарные метастазы свидетельствуют о распространении процесса за пределы органа и вовлечении регионарного лимфатического коллектора. При раке носоглотки метастатическое поражение лимфатических узлов появляется в течение первых месяцев заболевания. Для недифференцированного рака носоглотки характерно быстрое, агрессивное течение, с инфильтрирующим ростом и вовлечением в процесс окружающих анатомических структур. С ростом опухоли появляются слизистые и гнойные выделения из носа, а с присоединением вторичной инфекции и в далеко зашедших стадиях заболевания - ихорозный запах, примесь крови и некротические массы. Изъязвление и распад опухоли вызывают периодические спонтанные носовые кровотечения.
2.2 Физикальное обследование
- Всем пациентам с подозрением на НФК или выявленной НФК при первичном приеме, а также при каждом приеме (осмотре, консультации) врача - детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется визуальный осмотр пациента, измерения роста, массы тела, пальпация органов брюшной полости, аускультация сердца и легких [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с НФК при первичном приеме, а также при каждом приеме (осмотре, консультации) врача - детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется оценка общего состояния пациента (Приложение Г1, Г2) [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с подозрением на НФК или выявленной НФК при первичном приеме, а также при каждом приеме (осмотре, консультации) у врача - детского онколога (B01.009.001, B01.009.002) для оценки эффективности лечения обследование на этапе контроля эффективности лечения и при каждом последующем визите рекомендуется проведение пальпации шейных, надключичных лимфатических узлов для выявления измененных лимфатических узлов и их динамики на фоне лечения [1, 3, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: первичное обследование пациента направлено на оценку общего статуса пациента, наличия интоксикационного синдрома, возможного наличия метастазов и определение объема инициального обследования.
Осмотр должен включать в себя:
- антропометрические измерения (вес, рост и площадь поверхности тела), оценку нутритивного статуса (процентили), оценку физического развития;
- оценку кожных покровов и слизистых;
- оценку костно-мышечной системы (выявление наличия болевого синдрома, выявление нарушения функции конечностей);
- оценку функции сердечно-сосудистой системы;
- оценку функции легочной системы;
- пальпацию живота;
- оценку размеров шейных и надключичных лимфатических узлов.
Комментарии: в 90% случаев всех НФК наблюдается поражение шейных лимфатических узлов, при распространенных стадиях болезни в процесс могут вовлекаться также над- и подключичные лимфатические узлы. Отдаленные метастазы при НФК у детей и подростков составляют не более 25 - 30% случаев.
- Рекомендуется всем пациентам с болевым синдромом в области лица, отоалгией выполнить исследование черепно-мозговых нервов (электродиагностика (определение электровозбудимости (функциональных свойств лицевого и тройничного нервов, мимических и жевательных мышц)) для исключения их поражения [1, 3, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам с подозрением на НФК или выявленной НФК при первичном приеме для оценки распространения опухоли проводить прием (осмотр, консультация) врача-оториноларинголога первичный [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Оториноларингологический осмотр включает:
- Осмотр наружного носа - возможно выявление деформации в области наружного носа, проекции околоносовых пазух;
- Передняя риноскопия - в задних и верхних отделах полости носа возможно обнаружение опухолевых масс;
- Задняя риноскопия - позволяет выявить опухолевые массы в области носоглотки, перекрывающие частично или полностью хоаны;
- Осмотр ротоглотки - рост опухоли в ротоглотку вызывает смещение кпереди и асимметрию мягкого неба, гнусавый оттенок голоса, при больших размерах - затруднение дыхания;
- Осмотр органа слуха (отоскопия) - отоскопическая картина соответствует хроническому экссудативному отиту или тубоотиту.
2.3 Лабораторные диагностические исследования
- Всем пациентам с подозрением на НФК или выявленной НФК при первичном приеме, а также при каждом приеме (осмотре, консультации) врача - детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и динамическом наблюдении рекомендуется для уточнения состояния пациента, планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии выполнение следующих лабораторных исследовании [11]:
- общий (клинический) анализ крови развернутый;
- анализ крови биохимический общетерапевтический с включением следующих параметров: определение активности ЛДГ, АЛАТ, АСАТ, ГГТ в крови, исследование уровня общего билирубина в крови, определение активности щелочной фосфатазы в крови, исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровней калия, натрия, хлоридов, общего кальция в крови (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
- коагулограмма (ориентировочное исследование системы гемостаза)
- общий (клинический) анализ мочи;
- определение скорость клубочковой фильтрации.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с подозрением на НФК или выявленной НФК при первичном приеме, а также при каждом приеме у врача - детского онколога, при оценке ответа на проведенную терапию в процессе лечения и динамическом наблюдении определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови, определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови, определение антител класса G (IgG) к ядерному антигену (NA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови для определения активности вирусной инфекции [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Серологическое тестирование на ВЭБ проводятся при первичной постановке диагноза и при последующем наблюдении, так как в крови больных увеличен титр антител против ВЭБ, а также повышены титры антигена вирусного капсида (VCA), диффузного (D) компонента раннего антигенного (EA) комплекса (D-EA). Титры IgG VCA и D-EA, как правило, повышаются и убывают соответственно степени активности болезни.
2.4 Инструментальные диагностические исследования
- Всем пациентам с подозрением на НФК или выявленной НФК при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и динамическом наблюдении, а также при подозрении на рецидив/прогрессию заболевания рекомендуется выполнение магнитно-резонансной томографии мягких тканей головы с внутривенным контрастированием и магнитно-резонансной томографии шеи с внутривенным контрастированием [1, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: инициальная визуализация очень важна для оценки размера, объема и точной распространенности опухоли; ее связи с кровеносными сосудами (включая сосуды, питающие опухоль), нервами и близлежащими структурами; изменений в костной системе и васкуляризации (визуализация с контрастированием). Визуализация зоны расположения первичной опухоли должна включать в себя исследование региональных лимфатических узлов.
Для достоверной оценки необходимо использовать томографы с напряженностью магнитного поля от 1.0T до 3.0T.
- Всем пациентам с подозрением на НФК или выявленной НФК при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и динамическом наблюдении, а также при подозрении на рецидив/прогрессию заболевания рекомендуется выполнение компьютерной томографии мягких тканей головы с контрастированием для оценки деструкции костей черепа [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Всем пациентам с подозрением на НФК или выявленной НФК при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение КТ органов грудной полости с внутривенным болюсным контрастированием для исключения метастатического поражения легких [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: КТ органов грудной полости обязательна для всех пациентов. Учитывая проведение КТ для исключения метастатического поражения легких целесообразно проведение исследования с в/в болюсным контрастированием.
- Всем пациентам с подозрением на НФК или выявленной НФК при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и динамическом наблюдении, а также при подозрении на рецидив/прогрессию заболевания рекомендуется выполнение  ультразвуковое исследование лимфатических узлов (одна анатомическая зона) шеи [11].
ультразвуковое исследование лимфатических узлов (одна анатомическая зона) шеи [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с подозрением на НФК или выявленной НФК проведение эндоскопического исследования носоглотки (эпифарингоскопии) для уточнения распространения опухоли на своды носоглотки [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Эпифарингоскопия позволяет детально обследовать все стенки носоглотки, выявить направление роста опухоли и, что самое ценное, провести прицельную биопсию для морфологического подтверждения диагноза. При недифференцированном раке носоглотки отмечается экзофитная форма роста опухоли с изъязвлением поверхности, опухоль чаще всего локализуется на боковых стенках носоглотки, инфильтрируя и распространяясь по ним в ротоглотку и даже в гортаноглотку, реже поражается изолированно купол носоглотки. При росте новообразования кпереди опухолевые массы определяются при эндоскопическом осмотре в полости носа.
- Рекомендуется всем пациентам с подозрением на НФК или выявленной НФК сочетать эндоскопическую эндоназальную ревизию полости носа, носоглотки с проведением биопсии слизистой оболочки носоглотки под контролем эндоскопического исследования для получения материала для патолого-анатомического исследования [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Эндоскопический осмотр и биопсия опухоли носоглотки (биопсия слизистой оболочки носоглотки под контролем эндоскопического исследования) при подозрении на рак носоглотки у пациентов младшего возраста проводится в условиях седации, что требует предварительной консультации и сопровождения врача-анестезиолога-реаниматолога.
Эндоскопический осмотр и биопсия опухоли носоглотки (биопсия слизистой оболочки носоглотки под контролем эндоскопического исследования) у детей старшего возраста и подростков, при не тяжелом общем состоянии пациента, возможно проводить амбулаторно с использованием местной аппликационной анестезии.
- Рекомендуется всем пациентам с подозрением на НФК или выявленной НФК выполнение позитронной эмиссионной томографии, совмещенной с компьютерной томографией с туморотропными РФП [10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП позволяет оценить наличие отдаленных метастазов, а также динамику опухолевого процесса на фоне проводимой терапии.
2.5 Иные диагностические исследования
- Рекомендуется всем пациентам с подозрением на НФК, у которых не была проведена биопсия при эпифарингоскопии или при ней не был получен диагностический материал, проведение биопсии опухоли носоглотки (биопсия слизистой оболочки носоглотки под контролем эндоскопического исследования). В случае наличия клинически пораженных шейных лимфатических узлов для морфологической верификации диагноза может быть рекомендована биопсия измененного шейного лимфатического узла (биопсия лимафтического узла), так же может рассматриваться биопсия других подозрительных зон метастазирования [10, 11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: биопсия опухоли носоглотки (биопсия слизистой носоглотки под контролем эндоскопического исследования) и/или биопсия измененного шейного лимфатического узла (биопсия лимфатического узла) необходима для получения материала с целью проведения гистологического и иммуногистохимического исследования. Морфологическая верификация диагноза необходима всем пациентам.
- Рекомендуется всем пациентам с подозрением на рак носоглотки проводить патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов с использованием тканевых маркеров - панцитокератина, цитокератинов, p63, маркеров ВЭБ-инфекции для морфологического подтверждения диагноза [3, 10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: морфологическое исследования завершают комплексную диагностику. С учетом того, что довольно часто появление метастатически измененных лимфоузлов на шее является первым симптомом рака носоглотки, материал для исследования получают при пункции или биопсии шейного лимфоузла (пункция и биопсия лимфатического узла). При отсутствии метастазов проводится биопсия опухоли носоглотки (биопсия слизистой оболочки носоглотки под контролем эндоскопического исследования) с использованием одного из вышеперечисленных методов.
- Рекомендуется всем пациентам с подозрением на рак носоглотки проведение тональной аудиометрии при подозрении на тугоухость [17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам с установленным диагнозом рак носоглотки генетическое консультирование при выявлении случаев заболевания раком носоглотки у ближайших родственников для выявления семейных случаев [18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.6 Обследования в процессе терапии
По возможности обследование в процессе терапии рекомендовано производить, используя те же методы, что и при инициальном обследовании.
- Для всех пациентов с верифицированной НФК, которые получают терапию по режиму лечения N 1 (см. 3.1), рекомендуется после 2, 4, 6, 7 курсов ПХТ проведение МРТ мягких тканей головы и шеи с внутривенным контрастированием, КТ грудной полости с внутривенным болюсным контрастированием,  определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП - после 4 и 7 курсов ПХТ в случае наличия инициальных отдаленных метастатических очагов или подозрения на их появление в процессе лечения [1, 16, 19].
определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП - после 4 и 7 курсов ПХТ в случае наличия инициальных отдаленных метастатических очагов или подозрения на их появление в процессе лечения [1, 16, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Для всех пациентов с верифицированной НФК, которые получают терапию по режиму лечения N 2 и N 3 (см. 3.2 и 3.3), рекомендуется не ранее чем через 15 дней от начала последнего курса (3 или 4) индукционной химиотерапии проведение МРТ мягких тканей головы с внутривенным контрастированием и МРТ шеи с внутривенным контрастированием, КТ грудной полости с внутривенным болюсным контрастированием, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование +/- Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием в случае наличия инициальных отдаленных метастатических очагов или подозрения на их появление в процессе лечения [1, 16, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: объем контрольных обследований определяется индивидуально для каждого пациента исходя из клинической ситуации и опухолевого распространения на усмотрение врача.
2.7 Оценка ответа на терапию
- Рекомендуется всем пациентам с НФК при оценке ответа на проводимую терапию в процессе лечения оценивать динамику первичного и метастатических очагов согласно критеряим RECIST 1.1 [17].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Критерии ответа опухоли на терапию (RECIST 1.1) [20] см. 7.3
ЧО - уменьшение суммы диаметров очагов не менее чем на 30%.
ПО - исчезновение всех очагов. Любой из прежде увеличенных лимфатических узлов должен иметь короткую ось менее 10 мм.
ПБ - увеличение на 20% и более суммы диаметров основных очагов (> 5 мм); появление одного или нескольких новых очагов; безусловная прогрессия нетаргетных очагов.
СБ - все остальное.
2.8 Исследования перед завершением терапии
- Обследования перед завершением терапии рекомендовано проводить после окончания этапа лучевой терапии [3, 11].
Объем обследований после завершения терапии включает:
- Детальное физикальное и неврологическое обследование (по показаниям осмотр узких специалистов)
- Контроль лабораторных показателей (общий (клинический) анализ крови, биохимический анализ крови общетерапевтический, общий (клинический) анализ мочи, коагулограмма (ориентировочное исследование системы гемостаза).
- ЭхоКГ.
- Регистрация электрокардиограммы.
- Другие исследования по показаниям (например, электроэнцефалография, тональная аудиометрия, биомикроскопия глазного дна, цитологическое исследование клеток спинномозговой жидкости, гормональный статус).
- Инструментальные исследования МРТ головного мозга с контрастированием, МРТ шеи с внутривенным контрастированием, КТ головного мозга с внутривенным контрастированием, КТ шеи с внутривенным болюсным контрастированием, КТ органов грудной полости с внутривенным болюсным контрастированием, УЗИ органов брюшной полости (комплексное), КТ органов брюшной полости, прицельная рентгенография органов грудной клетки, позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием в случае наличия инициальных отдаленных метастатических очагов или подозрения на их появление в процессе лечения).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: проведение МРТ головного мозга с контрастированием, МРТ шеи с внутривенным контрастированием, КТ головного мозга с внутривенным контрастированием, КТ шеи с внутривенным болюсным контрастированием через 6 недель после окончания лучевой терапии, позитронной эмиссионной томографии, совмещенной с компьютерной томографией с туморотропными РФП - не ранее, чем 3 месяца после окончания лучевой терапии
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
При выборе тактики и проведении терапии следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Терапия пациентов с НФК основывается на мультидисциплинарном подходе и должна осуществляться под контролем специализированных центров, имеющих опыт лечения данной группы пациентов. Основу терапии первичных пациентов с верифицированной НФК составляет системная химиотерапия и лучевая терапия.
В рамках настоящих клинических рекомендаций приведены несколько режимов индукционной химиотерапии, а также химиолучевой терапии, продемонстрировавших свою эффективность при НФК у детей и подростков.
3.1 Режим лечения N 1 - Химиотерапия + Лучевая терапия
Индукционный этап лечения
Показания к началу индукционной химиотерапии:
- Наличие гистологической верификации диагноза;
- Уровень лейкоцитов выше 2 x 109, тромбоцитов выше 75 x 109;
- Отсутствие хронических заболеваний в стадии декомпенсации, тяжелых органных дисфункций;
- Отсутствие инфекционных осложнений;
- Отсутствие аллергической реакции в анамнезе на #винбластин**, #циклофосфамид**, доксорубицин**, #блеомицин**.
- Рекомендуется всем пациентам с установленным диагнозом НФК проводить 4 курса индукционной химиотерапии по схеме #винбластин** + #циклофосфамид** + доксорубицин** + #блеомицин** с интервалами между курсами 21 - 28 дней как для сокращения размеров первичной опухоли и регионарных метастазов, так и для профилактики отдаленных метастазов [21, 22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Таблица 2 - Схема индукционного режима химиотерапии [22]:
Препарат
Разовая доза
Длительность инфузии
Дни
#Винбластин**
5 мг/м2
внутривенно струйно
1, 8, 15
#Циклофосфамид**
600 мг/м2
за 1 час
1
Доксорубицин**
20 мг/м2
за 1 час
1, 8
#Блеомицин**
10 мг/м2
за 1 час
2, 4
При достижении суммарной дозы #блеомицина** в 300 мг/м2 данный препарат исключают.
- Рекомендуется всем пациентам с установленным диагнозом НФК на 7 день от начала курса введение #оксодигидроакридинилацетата натрия в дозе 5 мг/кг в сутки однократно с интервалом 48 часов (возможно введение с раствором прокаина** 0,25 - 0,5% - 2 мл) для улучшения ответа опухоли на химиотерапевтическое лечение. Курс включает 5 - 7 инъекций с интервалом 2 недели. Суммарно проводится 4 курса #оксодигидроакридинилацетата натрия на фоне 4 первых курсов ПХТ и ЛТ [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с установленным диагнозом НФК при достижении полного или частичного ответа на индукционную химиотерапию установленного на основании комплексного обследования, проведение 4 курсов консолидирующй химиотерапии [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Таблица 3 - Схема консолидирующего этапа химиотерапии [22]:
Препарат
Разовая доза
Длительность инфузии
Дни
#Винбластин**
5 мг/м2
внутривенно струйно
1, 8, 15
#Циклофосфамид**
500 мг/м2
за 1 час
1, 8
#Дактиномицин
1200 мг/м2
внутривенно струйно
1
#Дактиномицин не вводится во время проведения лучевой терапии. Максимальная разовая доза #дактиномицина - 2,5 мг. Интервалы между курсами 21 - 28 дней. Перед началом проведения 5 и последующих курсов следует выполнить комплекс диагностических исследований (см. обследование на этапе контроля эффективности лечения).
Лучевая терапия
- Рекомендуется всем пациентам с установленным диагнозом рак носоглотки выполнение лучевой терапии на первичную опухоль носоглотки (СОД 50 Гр), регионарные лимфатические узлы (СОД 45,6 в случае подтвержденного метастатического поражения лимфоузлов и СОД 36 Гр при отсутствии признаков поражения лимфоузлов) и зоны отдаленного метастазирования (при поражении легких - крупнопольное облучение легких в СОД 12 Гр после завершения ЛТ на первичный очаг, при наличии одиночных метастатических очагов в костях и мягких тканях - СОД до 36 - 50 Гр на пораженные области) для достижения противоопухолевого эффекта [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Коментарий: ЛТ на первичный очаг и лимфатические узлы целесообразно начинать после 6 неоадъювантных курсов ПХТ
3.2 Режим лечения N 2 - Химиотерапия + Химиолучевая терапия
Индукционный этап лечения
Показания к началу индукционной химиотерапии:
- Наличие гистологической верификации диагноза;
- Уровень лейкоцитов выше 2 x 109 и гранулоцитов выше 0,75 x 109, тромбоцитов выше 75 x 109;
- Отсутствие хронических заболеваний в стадии декомпенсации, тяжелых органных дисфункций;
- Отсутствие неконтролируемых инфекционных осложнений;
- Отсутствие нарушений со стороны мочевыделительной системы.
- Отсутствие аллергической реакции в анамнезе на #фторурацил** и цисплатин**.
- Рекомендуется всем пациентам с установленным диагнозом НФК и стадией II, III, IVA проведение 3 курсов индукционной химиотерапии по схеме #фторурацил** + цисплатин** с интервалами между курсами 21 - 28 дней как для сокращения размеров первичной опухоли и регионарных метастазов, так и для профилактики отдаленных метастазов [23 - 26].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
- Рекомендуется всем пациентам с установленным диагнозом НФК и стадией IVB проведение 4 курсов индукционной химиотерапии по схеме #фторурацил** + цисплатин** с интервалами между курсами 21 - 28 дней как для сокращения размеров первичной опухоли и регионарных метастазов, так и для профилактики и лечения отдаленных метастазов [26, 27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Таблица 4 - Схема индукционного режима химиотерапии [24, 25]
Препарат
Разовая доза
Длительность инфузии
Дни
#Фторурацил*
1000 мг/м2
за 24 часа
1 - 5
Цисплатин**
100 мг/м2
6 часов
1
Химиолучевая терапия
- Всем пациентам с верифицированным диагнозом НФК и I стадией рекомендуется проведение лучевой терапии без предшествующего индукционного лечения цитостатическими агентами (СОД = 66,6 Гр) и профилактическое облучение регионарных лимфатических узлов (СОД = 45 Гр) [28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с верифицированным диагнозом НФК и стадией II, III, IVA рекомендуется проведение лучевой терапии на зону первичной опухоли и лимфатические узлы шеи. Первичная опухоль и ретрофарингеальные л/у: GTV - опухоль до начала терапии. CTV = GTV + 1 см с коррекцией на анатомические барьеры распространения опухоли. РОД 1,8 Гр, СОД 54 Гр. При локальной прогрессии на фоне ПХТ СОД должна составлять 66,6 Гр. При наличии остаточной опухоли после окончания неоадъювантной ПХТ - облучение остаточной опухоли (GTV_boost) с отступом на PTV до 59,4 Гр. Лимфатические узлы шеи: лимфатические коллекторы шеи уровней IB - V РОД 1,8 Гр, СОД 45 Гр, пораженные л/коллекторы до СОД 54 Гр, остаточные пораженные л/у (при их наличии после окончания неоадъювантной ПХТ) с отступом на CTV 5 мм до СОД 59,4 Гр [10]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с верифицированным диагнозом НФК и стадией II, III, IVA в первые 3 и последние 3 дня лучевой терапии рекомендуется цисплатин** 20 мг/м2 внутривенно за 1 ч [25 - 27].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
3.3 Режим лечения N 3 - Химиотерапия + Химиолучевая терапия
Индукционный этап лечения
Показания к началу индукционной химиотерапии:
- Наличие гистологической верификации диагноза;
- Уровень лейкоцитов выше 2 x 109 и гранулоцитов выше 0,75 x 109, тромбоцитов выше 75 x 109;
- Отсутствие хронических заболеваний в стадии декомпенсации, тяжелых органных дисфункций;
- Отсутствие неконтролируемых инфекционных осложнений;
- Отсутствие нарушений со стороны мочевыделительной системы.
- Отсутствие аллергической реакции в анамнезе на #гемцитабин** и цисплатин**.
- Рекомендуется всем пациентам с установленным диагнозом НФК и стадией II, III, IVA проведение 3 курсов индукционной химиотерапии по схеме #гемцитабин** + цисплатин** с интервалами между курсами 21 день как для сокращения размеров первичной опухоли и регионарных метастазов, так и для профилактики отдаленных метастазов [29, 30].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Таблица 5 - Схема индукционного режима химиотерапии [27, 28]
Препарат
Разовая доза
Длительность инфузии
Дни
#Гемцитабин**
1000 мг/м2
30 мин.
1, 8
Цисплатин**
80 мг/м2
4 ч
1
- Рекомендуется всем пациентам с установленным диагнозом НФК и стадией IVB проведение 4 курсов индукционной комбинированной химиоиммунотерапии по схеме #гемцитабин** + цисплатин** + #пембролизумаб** с интервалами между курсами 21 день как для сокращения размеров первичной опухоли и регионарных метастазов, так и для профилактики и лечения отдаленных метастазов [31, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: добавление #пембролизумаба** в схему лечения возможно при наличии Федерального консилиума
Таблица 6 - Схема индукционного режима химиотерапии [29, 30]
Препарат
Разовая доза
Длительность инфузии
Дни
#Гемцитабин**
1000 мг/м2
30 мин.
1, 8
Цисплатин**
80 мг/м2
4 ч
1
#Пембролизумаб**
2 мг/кг (макс. 200 мг)
30 мин.
1
Химиолучевая терапия
- Всем пациентам с верифицированным диагнозом НФК и I стадией рекомендуется проведение лучевой терапии без предшествующего индукционного лечения цитостатическими агентами (СОД = 66,6 Гр) и профилактическое облучение регионарных лимфатических узлов (СОД = 45 Гр) [28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с верифицированным диагнозом НФК рекомендуется лучевая терапия на зону первичной опухоли и лимфатические узлы шеи. Первичная опухоль и ретрофарингеальные л/у: GTV - опухоль до начала терапии. CTV = GTV + 1 см с коррекцией на анатомические барьеры распространения опухоли. РОД 1,8 Гр, СОД 54 Гр. При локальной прогрессии на фоне ПХТ СОД должна составлять 66,6 Гр. При наличии остаточной опухоли после окончания неоадъювантной ПХТ - облучение остаточной опухоли (GTV_boost) с отступом на PTV до 59,4 Гр. Лимфатические узлы шеи: лимфатические коллекторы шеи уровней IB - V РОД 1,8 Гр, СОД 45 Гр, пораженные л/коллекторы до СОД 54 Гр, остаточные пораженные л/у (при их наличии после окончания неоадъювантной ПХТ) с отступом на CTV 5 мм до СОД 59,4 Гр [10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Всем пациентам с верифицированным диагнозом НФК и стадией II, III, IVA в первые 3 и последние 3 дня лучевой терапии рекомендуется цисплатин** 20 мг/м2 внутривенно за 1 ч [25, 26].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
3.4 Поддерживающая терапия
- Всем пациентам с верифицированным диагнозом НФК и I стадией после завершения лучевой терапии рекомендуется наблюдение без последующей поддерживающей терапии [25, 27].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
- Всем пациентам с верифицированным диагнозом НФК и II, III, IVA и VIB стадией рекомендуется после завершения лучевой терапии поддерживающей терапией #интерфероном бета-1b** в течение 6 мес [25, 27].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3).
Таблица 8 - Схема поддерживающей терапии [23, 25]
Препарат
Разовая доза
Метод введения
Кратность
Длительность
#Интерферон бета-1b**
100 тыс. МЕ/кг
подкожно
3 раза в неделю
6 мес.
3.4 Химиотерапия второй линии
- Всем пациентам с подтвержденной прогрессией или рецидивом НФК рекомендуется обращение в федеральные центры для выбора оптимального режима второй линии терапии [33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3.6 Хирургическое лечение
- Всем пациентам с диагнозом НФК при значительных размерах метастатически пораженных лимфатических узлов шеи, вызывающих сдавление близлежащих структур с развитием жизнеугрожающих состояний рекомендуется обращение в федеральные центры для рассмотрения вопроса о проведении хирургического лечения в объеме шейной лимфдиссекции [34].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
3.7 Профилактика осложнений, возникающих в ходе проведения специального лечения (сопроводительная терапия)
3.7.1 Нутрициологическое сопровождение
- Всем пациентам младше 18 лет с онкологическим заболеванием НФК на период лечения и реабилитации рекомендуется оценивать нутритивный статус с проведением его коррекции при выявлении нутритивных нарушений (см. Приложение А3.1.) [35, 36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3.7.2 Профилактика и лечение тошноты и рвоты на фоне противоопухолевой терапии
- Всем пациентам младше 18 лет с онкологическим заболеванием НФК на период лечения в целях лечения и профилактики тошноты и рвоты, обусловленных проведением противоопухолевой терапии, рекомендуется оценивать уровень эметогенности лекарственных препаратов, проводить лечение и профилактику тошноты и рвоты с использованием лекарственных препаратов (см. Приложение А3.2.) [37].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
3.7.3 Гемотрансфузионная поддержка
- Всем пациентам младше 18 лет с онкологическим заболеванием НФК в период лечения при развитии анемического синдрома, кровотечения, высокого риска геморрагического синдрома рекомендуется проведение гемотрансфузионной поддержки препаратами крови (см. Приложение А3.3) [38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
3.7.4 Особенности венозного доступа в обеспечении успешных диагностических и лечебных мероприятий
- Всем пациентам младше 18 лет с НФК на период [интенсивной терапии/реабилитации] рекомендуется установка порта/катетера инфузионного/инъекционного имплантируемого*** (см. Приложение А 3.4.) [39]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: наличие центрального венозного катетера, обеспечивающего возможность мониторинга ЦВД, частых заборов крови и высокую скорость введения жидкостей является абсолютно необходимым на начальных этапах терапии и у пациентов группы высокого риска, получающих интенсивную высокодозную химиотерапию.
3.7.5 Профилактика и лечение инфекций
- Всем пациентам с НФК при развитии инфекционных осложнений рекомендуется грамотное и рациональное назначение антибактериальных препаратов системного действия (см. Приложение А 3.5) [40, 41].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Объем, длительность и характер реабилитационных мероприятий зависит от возраста пациента на момент постановки первичного диагноза и времени проведения реабилитационных мероприятий, объема проведенного, сопутствующей патологии. Начало реабилитационных мероприятий зависит от стадии, группы риска, и начинается на этапах проведения первичной полихимиотерапии и продолжается после ее окончания на всех этапах динамического наблюдения. Реабилитационные мероприятия проходят под контролем детского онколога, медицинского учреждения, где больной получал все основные этапы терапии. Реабилитация делится на медицинскую, психологическую, социальную и др. В программе принимают участие педагоги (дошкольного и школьного образования), социальные работники, психологи и врачи разных специальностей (реабилитологи, неврологи, эндокринологи, кардиологи, ортопеды и т.д.). Реабилитация проводится в региональных центрах на базе поликлиник и в специализированных лечебно-реабилитационных центрах. Кратность реабилитации 2 - 3 раза в год и может быть увеличена в зависимости от психосоматического статуса пациента [42, 43].
- Рекомендуется всем пациентам с установленным диагнозом рак носоглотки при жалобах на снижение слуха, а также в случае наследственной тугоухости, для улучшения качества жизни, провести прием (осмотр, консультация) врача-сурдолога-оториноларинголога первичный и, при необходимости, сурдологическую коррекцию [17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам с установленным диагнозом рак носоглотки, после завершения специального лечения, для своевременной коррекции гипофункций желез внутренней секреции (щитовидная железа, гипофиз) прием (осмотр, консультация) врача - детского эндокринолога первичный и диспансерное наблюдение [44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Всем пациентам с установленным диагнозом НФК после окончания лечения рекомендуется прием (осмотр, консультация) врача - детского онколога повторный в установленные сроки [22, 45].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Таблица 9 - обследования пациентов с НФК после окончания терапии [19, 39]
Исследование
Год
1-й
2-й
3-й
4-й
5-й
Клинический осмотр
1 раз в 3 мес.
1 раз в 4 мес.
1 раз в 6 мес.
1 раз в год
1 раз в год
Общий (клинический) анализ крови
1 раз в 3 мес.
1 раз в 4 месяца
1 раз в 6 мес.
1 раз в год
1 раз в год
Анализ крови биохимический общетерапевтический
1 раз в 3 мес.
1 раз в 4 месяца
1 раз в 6 мес.
1 раз в год
1 раз в год
Общий (клинический) анализ мочи
1 раз в 3 мес.
1 раз в 4 мес.
1 раз в 6 мес.
1 раз в год
1 раз в год
Исследование функции нефронов по клиренсу креатинина (проба Реберга)
1 раз в год
1 раз в год
1 раз в год
1 раз в год
1 раз в год
Ультразвуковое исследование лимфатических узлов шеи (одна анатомическая зона)
1 раз в 3 мес.
1 раз в 4 мес.
1 раз в 6 мес.
1 раз в год
1 раз в год
МРТ головного мозга с контрастированием, МРТ шеи с внутривенным контрастированием, КТ головного мозга с внутривенным контрастированием, КТ шеи с внутривенным болюсным контрастированием
1 раз в 3 мес.
1 раз в 4 мес.
1 раз в 6 мес.
1 раз в год
1 раз в год
КТ органов грудной полости с внутривенным болюсным контрастированием
1 раз в 3 мес.
1 раз в 6 мес.
1 раз в 6 мес.
1 раз в год
1 раз в год
Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием
1 раз в год
1 раз в год
по показаниям
по показаниям
по показаниям
Регистрация электрокардиограммы/Эхо-КГ
1 раз в год
1 раз в год
по показаниям
по показаниям
по показаниям
Тональная аудиометрия
1 раз в год
1 раз в год
по показаниям
по показаниям
по показаниям
--------------------------------
<*> При I, II стадии заболевания ПЭТ-КТ с Флудезоксиглюкозой [18F] необязательна
6. Организация оказания медицинской помощи
Показания для плановой госпитализации в специализированное детское онкологическое отделение:
1) Необходимость проведения  биопсия опухоли носоглотки (биопсия слизистой носоглотки под контролем эндоскопического исследования) и/или биопсия измененного шейного лимфатического узла (биопсия лимфатического узла) для морфологической верификации диагноза
биопсия опухоли носоглотки (биопсия слизистой носоглотки под контролем эндоскопического исследования) и/или биопсия измененного шейного лимфатического узла (биопсия лимфатического узла) для морфологической верификации диагноза
2) Проведение курсов химиотерапии
3) Проведение лучевой терапии
Показания для экстренной госпитализации в специализированное детское онкологическое отделение:
1) Развитие фебрильной нейтропении
2) Развитие стоматита 3 - 4 степени
3) Развитие токсичности 2 - 4 степени, требующей коррекции в условиях стационара
Показание к выписке из стационара специализированного детского онкологического отделения:
1) Отсутствие признаков токсичности химиолучевой терапии 2 - 4 степени
2) Отсутствие показаний к проведению химиолучевой терапии (перерыв между курсами химиотерапии, между этапами лечения)
3) Отказ родителей/законных представителей/пациента старше 14 лет от проведения специального лечения
4) Показания для симптоматической терапии при неэффективность специального лечения и отсутствии признаков токсичности химиолучевой терапии 2 - 4 степени
5) Проведение диагностических мероприятий на этапе постановки диагноза и в период между курсами химиотерапии может осуществляться в амбулаторных условиях. Проведение химиотерапии детям старшего возраста и подросткам может осуществляться в условиях дневного стационара. Проведение курса лучевой терапии возможно амбулаторно или в условиях дневного стационара при отсутствии необходимости в анестезиологическом сопровождении и до периода развития осложнений, требующих антибактериальной, инфузионной или другой сопроводительной терапии. В случае развития осложнений ребенок переводится на стационарное лечение. Химиотерапевтическое лечение, лучевую терапию у детей дошкольного и младшего школьного возраста стоит проводить в условиях специализированных отделений стационара.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1 Неблагоприятные факторы при НФК для последующего прогноза:
1. Наличие отдаленных метастатических очагов;
2. Проведение химиотерапии со снижением доз препаратов химиотерапии;
3. Отказ от проведения лучевой терапии;
4. Удлинение сроков между курсами химиотерапии более 28 дней;
5. Присоединения инфекционных осложнений;
6. Распространение опухоли на латеральную крылонебную мышцу.
7.2 Основы лучевой терапии при НФК
Технические требования к оборудованию для ДЛТ
Линейный ускоритель электронов с энергией фотонов 6 - 10 МэВ, оснащенный многолепестковым коллиматором и, крайне желательно, системой/системами визуального контроля укладки: компьютерной томографией в коническом пучке (CBCT), портальной визуализацией. Возможно применение протонотерапии сканирующим пучком с использованием методов контроля укладки пациента перед сеансом облучения.
Фиксирующие приспособления для головы и тела (термопластические маски, вакуумные матрасы и др.).
Рентгеновский компьютерный томограф для топометрии, имеющий плоскую деку с возможностью крепления и индексацией систем фиксации.
Система 3D планирования облучения и, крайне желательно, с возможностью расчета облучения с применением методик модулированной по интенсивности лучевой терапии в статическом и динамическом режимах (IMRT/VMAT).
Предлучевая подготовка
Выполнение КТ-топометрии должно проводиться на рентгеновском компьютерном томографе, приспособленном для нужд радиотерапии.
Разметка проводится с использованием индивидуальных средств фиксации: термопластических масок и, возможно, вакуумного матраса.
В область сканирования должна входить вся голова, шея и средостение до уровня бифуркации трахеи. Сканирование проводится с толщиной среза: 1 - 3 мм,
Величина поля изображения (Field Of View, FOV) должна быть адекватной для включения всех частей тела и систем фиксации.
Необходимо предусмотреть, что при топометрии и лучевой терапии пациентов младше 5 лет может потребоваться общая анестезия.
Планирование проводится на нативной серии КТ-топометрии. Применение методик IMRT [46] или протонотерапии сканирующим пучком предпочтительнее.
7.3 Критерии ответа опухоли на терапию (RECIST 1.1) [20]
Современными критериями ответа опухоли на терапию являются критерии RECIST 1.1 (2009 г.).
Критерии RECIST 1.1 - это набор критериев, которые используют для оценки ответа опухоли на проводимую терапию. Основу оценки составляет определение размера опухоли с помощью методов лучевой диагностики (рентгенографии, КТ, МРТ, ультразвукового исследования) и эндоскопических методов.
Опухолевые очаги
В соответствии с критериями RECIST 1.1 опухолевые очаги подразделяются на два типа:
1) измеряемые очаги - очаги, выявляемые и составляющие по наибольшему диаметру:
>= 10 мм при КТ (КТ головного мозга с внутривенным контрастированием, КТ шеи с внутривенным болюсным контрастированием, КТ грудной полости с внутривенным болюсным контрастированием) - при реконструкции срезов толщиной 5 мм;
>= 20 мм при КТ (КТ головного мозга с внутривенным контрастированием, КТ шеи с внутривенным болюсным контрастированием, КТ грудной полости с внутривенным болюсным контрастированием) - при реконструкции срезов толщиной 10 мм;
>= 20 мм при прицельной рентгенографии органов грудной клетки;
2) неизмеряемые очаги - очаги, выявляемые и составляющие по наибольшему диаметру при КТ (КТ головного мозга с внутривенным контрастированием, КТ шеи с внутривенным болюсным контрастированием, КТ грудной полости с внутривенным болюсным контрастированием) с толщиной срезов 10 мм < 20 мм, а при КТ (КТ головного мозга с внутривенным контрастированием, КТ шеи с внутривенным болюсным контрастированием, КТ грудной полости с внутривенным болюсным контрастированием) с толщиной срезов 5 мм < 10 мм.
К неизмеряемым очагам относятся: мелкие очаги (< 10 мм), лептоменингеальные метастазы, плеврит, асцит, перикардит, кисты, лимфогенный канцероматоз кожи или легких, костные метастазы, воспалительные изменения молочных желез, очаги с кистозной и некротической трансформацией, увеличение размеров органов (гепатоспленомегалия), перитонеальные импланты.
Алгоритм оценки
В первую очередь измеряемые очаги оцениваются количественно.
Следующим шагом нужно выбрать таргетные очаги, которые в процессе терапии будут использоваться для контроля. Таргетный очаг сохраняется на протяжении всех повторных исследований таргетным, если даже размеры очага уменьшатся до предела погрешности метода исследования.
Таргетные и нетаргетные очаги
Таргетные очаги:
- измеряемые очаги, максимально до 5 очагов на орган, в сумме до 10 очагов, очаги, отражающие пораженный орган, должны соответствовать критериям таргетного очага;
- выбираются, исходя из их размеров (с наибольшим диаметром) и пригодности для точного повторного измерения;
- очаги в подвижных органах (например, желудочно-кишечном тракте, яичниках) могут быть неподходящими для оценки;
- указываются только аксиальные размеры.
Нетаргетные очаги:
- могут включать как измеряемые, так и неизмеряемые очаги;
- к измеряемым очагам относят все очаги, которые превышают максимально допустимое количество таргетных очагов (до 5 очагов на орган, не более 10 очагов на весь организм);
- нетаргетные очаги не обязательно должны быть измеряемыми;
- в идеале должны включать все очаги, не отнесенные к таргетным очагам.
Критерии оценки ответа:
- ЧО - уменьшение суммы диаметров очагов не менее чем на 30%.
- ПО - исчезновение всех очагов. Любой из прежде увеличенных лимфатических узлов должен иметь короткую ось менее 10 мм.
- ПБ - увеличение на 20% и более суммы диаметров основных очагов (> 5 мм); появление одного или нескольких новых очагов; безусловная прогрессия нетаргетных очагов.
- СБ - все остальное.
Общий ответ
Таргетные очаги
Нетаргетные очаги
Новые очаги
ПО
ПО
ПО
Нет
ЧО
ПО
ЧО/СБ
Нет
ЧО
ЧО
Отсутствие ПБ
Нет
СБ
СБ
Отсутствие ПБ
Нет
ПБ
ПБ
Любой ответ
Есть или нет
ПБ
Любой ответ
ПБ
Есть или нет
ПБ
Любой ответ
Любой ответ
Есть
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Пациенту с подозрением на рак носоглотки при постановке диагноза, а также пациенту с установленным диагнозом рак носоглотки для оценки эффективности лечения обследование на этапе контроля эффективности лечения и при каждом последующем визите проведен визуальный осмотр, измерение роста, массы тела, пальпация органов брюшной полости, аускультация сердца и легких.
Да/Нет
2.
Пациенту перед началом специального лечения, а также на этапе контроля эффективности лечения выполнен общий (клинический) анализ крови развернутый.
Да/Нет
4.
Пациенту перед началом специального лечения, а также на этапе контроля эффективности лечения выполнен анализ крови биохимический общетерапевтический: исследование уровня общего белка, альбумина, мочевины, креатинина в крови, определение активности АЛТ, АСТ в крови, исследование уровня натрия, калия, хлоридов в крови).
Да/Нет
6.
Пациенту с подозрением на рак носоглотки выполнено определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein - Barr virus) в крови, определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови, определение антител класса G (IgG) к ядерному антигену (NA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови
Да/Нет
8.
Пациенту с подозрением на рак носоглотки проведены биопсия опухоли носоглотки (биопсия слизистой носоглотки под контролем эндоскопического исследования) и/или биопсия измененного шейного лимфатического узла (биопсия лимфатического узла) и патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов
Да/Нет
9.
Пациенту с подозрением на рак носоглотки, а также на этапе контроля эффективности лечения выполнена компьютерная томография органов грудной полости
Да/Нет
10
Пациенту с подозрением на рак носоглотки проведено эндоскопическое исследование носоглотки (эпифарингоскопии)
Да/Нет
11.
Пациенту с подозрением на рак носоглотки, а также на этапе контроля эффективности лечения проведена магнитно-резонансная томография головного мозга, в том числе с внутривенным контрастированием
Да/Нет
Список литературы
1. Board P.P.T.E. Rare Cancers of Childhood Treatment (![]() )//PDQ Cancer Information Summaries [Internet]. - National Cancer Institute (US), 2024.
)//PDQ Cancer Information Summaries [Internet]. - National Cancer Institute (US), 2024.
2. Song C., Yang S. A meta-analysis on the EBV DNA and VCA-IgA in diagnosis of Nasopharyngeal Carcinoma//Pakistan Journal of Medical Sciences. - 2013. - Т. 29. - N 3. - С. 885 - 890.
3. Kontny U., Franzen S., Behrends U., Buehrlen M., Christiansen H., Delecluse H., Eble M., Feuchtinger T., Gademann G., Granzen B., Kratz C.P., Lassay L., Leuschner I., Mottaghy F.M., Schmitt C., Staatz G., Timmermann B., Vorwerk P., Wilop S., Wolff H.A., Mertens R. Diagnosis and Treatment of Nasopharyngeal Carcinoma in Children and Adolescents - Recommendations of the GPOH-NPC Study Group//Klinische Padiatrie. - 2016. - Т. 228. - N 3. - С. 105 - 112.
4. Richards M.K., Dahl J.P., Gow K., Goldin A.B., Doski J., Goldfarb M., Nuchtern J., Langer M., Beierle E.A., Vasudevan S., Hawkins D.S., Parikh S.R. Factors Associated With Mortality in Pediatric vs Adult Nasopharyngeal Carcinoma//JAMA Otolaryngology-Head & Neck Surgery. - 2016. - Т. 142. - N 3. - С. 217 - 222.
5. Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries//CA: A Cancer Journal for Clinicians. - 2018. - Vol. 68. - Global cancer statistics 2018. - No. 6. - P. 394 - 424.
6. Shanmugaratnam K. Histological typing of nasopharyngeal carcinoma//IARC scientific publications. - 1978. - N 20. - С. 3 - 12.
7. Thompson L. World Health Organization classification of tumours: pathology and genetics of head and neck tumours//Ear, Nose, & Throat Journal. - 2006. - Т. 85. - World Health Organization classification of tumours. - N 2. - С. 74.
8. O'Sullivan B., Brierley J., Byrd D., Bosman F., Kehoe S., Kossary C.,  M., Van Eycken E., Weir H.K., Gospodarowicz M. The TNM classification of malignant tumours-towards common understanding and reasonable expectations//The Lancet. Oncology. - 2017. - Т. 18. - N 7. - С. 849 - 851.
M., Van Eycken E., Weir H.K., Gospodarowicz M. The TNM classification of malignant tumours-towards common understanding and reasonable expectations//The Lancet. Oncology. - 2017. - Т. 18. - N 7. - С. 849 - 851.
9. Yan Z., Xia L., Huang Y., Chen P., Jiang L., Zhang B. Nasopharyngeal carcinoma in children and adolescents in an endemic area: A report of 185 cases//International Journal of Pediatric Otorhinolaryngology. - 2013. - Т. 77. - Nasopharyngeal carcinoma in children and adolescents in an endemic area. - N 9. - С. 1454 - 1460.
10. Ben-Ami T., Kontny U., Surun A., Brecht I.B., Almaraz R.L., Dragomir M., Pourtsidis A., Casanova M., Fresneau B., Bisogno G., Schneider D.T., Reguerre Y., Bien E., Stachowicz-Stencel T.,  G., Wygoda M., Janssens G.O., Zsiros J., Jehanno N., Brisse H.J., Gandola L., Christiansen H., Claude L., Ferrari A., Rodriguez-Galindo C., Orbach D. Nasopharyngeal carcinoma in children and adolescents: The EXPeRT/PARTNER diagnostic and therapeutic recommendations//Pediatric Blood & Cancer. - 2021. - Vol. 68. - Nasopharyngeal carcinoma in children and adolescents. - No. S4. - P. e29018.
G., Wygoda M., Janssens G.O., Zsiros J., Jehanno N., Brisse H.J., Gandola L., Christiansen H., Claude L., Ferrari A., Rodriguez-Galindo C., Orbach D. Nasopharyngeal carcinoma in children and adolescents: The EXPeRT/PARTNER diagnostic and therapeutic recommendations//Pediatric Blood & Cancer. - 2021. - Vol. 68. - Nasopharyngeal carcinoma in children and adolescents. - No. S4. - P. e29018.
11. Детская онкология. Национальное руководство. - URL: https://medprint.ru/978-5-98811-228-0 (дата обращения: 02.08.2024).
12. Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer.//Evaluation of chemotherapeutic agents./ред. C. MacLeod. - New York: Columbia University Press, 1949. - С. 191 - 205.
13. Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group//American Journal of Clinical Oncology. - 1982. - Т. 5. - N 6. - С. 649 - 655.
14. Cao K., Li Y., Xie G., Hong M. [Prognostic factors in nasopharyngeal carcinoma in childhood and adolescence]//Zhonghua Zhong Liu Za Zhi [Chinese Journal of Oncology]. - 2006. - Т. 28. - N 2. - С. 134 - 137.
15. Turgut M., ![]() O., Saygi S., Ozcan O.E. Importance of cranial nerve involvement in nasopharyngeal carcinoma. A clinical study comprising 124 cases with special reference to clinical presentation and prognosis//Neurosurgical Review. - 1998. - Т. 21. - N 4. - С. 243 - 248.
O., Saygi S., Ozcan O.E. Importance of cranial nerve involvement in nasopharyngeal carcinoma. A clinical study comprising 124 cases with special reference to clinical presentation and prognosis//Neurosurgical Review. - 1998. - Т. 21. - N 4. - С. 243 - 248.
16. King A.D. MR Imaging of Nasopharyngeal Carcinoma//Magnetic Resonance Imaging Clinics. - 2022. - Т. 30. - N 1. - С. 19 - 33.
17. Yip P.L., Mok K.C.J., Ho H.S., Lee W.Y.V., Wong A.C.L., Lau C.T., Wong F.C.S., Yeung K.W., Lee S.F. Sensorineural Hearing Loss in Nasopharyngeal Carcinoma Survivors in the Modern Treatment Era - The Early and Late Effects of Radiation and Cisplatin//Clinical Oncology. - 2022. - Т. 34. - N 4. - С. e160 - e167.
18. Druker H., Zelley K., McGee R.B., Scollon S.R., Kohlmann W.K., Schneider K.A., Wolfe Schneider K. Genetic Counselor Recommendations for Cancer Predisposition Evaluation and Surveillance in the Pediatric Oncology Patient//Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. - 2017. - Т. 23. - N 13. - С. e91 - e97.
19. Li H., Kong Z., Xiang Y., Zheng R., Liu S. The role of PET/CT in radiotherapy for nasopharyngeal carcinoma//Frontiers in Oncology. - 2022. - Vol. 12.
20. Padhani A.R., Ollivier L. The RECIST (Response Evaluation Criteria in Solid Tumors) criteria: implications for diagnostic radiologists//The British Journal of Radiology. - 2001. - Т. 74. - The RECIST (Response Evaluation Criteria in Solid Tumors) criteria. - N 887. - С. 983 - 986.
21. Ribassin-Majed L., Marguet S., Lee A.W.M., Ng W.T., Ma J., Chan A.T.C., Huang P.-Y., Zhu G., Chua D.T.T., Chen Y., Mai H.-Q., Kwong D.L.W., Cheah S.-L., Moon J., Tung Y., Chi K.-H., Fountzilas G., Bourhis J., Pignon J.P., Blanchard P. What Is the Best Treatment of Locally Advanced Nasopharyngeal Carcinoma? An Inpidual Patient Data Network Meta-Analysis//Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. - 2017. - Т. 35. - What Is the Best Treatment of Locally Advanced Nasopharyngeal Carcinoma? - N 5. - С. 498 - 505.
22. Викторовна Г.Т., Али А.-А.Г. А., Викторович Г.И., Александровна С.Н., Владимирович Ш.Р., Владимировна И.Н., Георгиевич П.В. Анализ результатов лечения пациентов детского возраста с раком носоглотки: ретроспективное когортное исследование//Онкопедиатрия. - 2018. - Т. 5. - Анализ результатов лечения пациентов детского возраста с раком носоглотки. - N 4. - С. 257 - 267.
23. Rodriguez-Galindo C., Krailo M.D., Krasin M.J., Huang L., McCarville M.B., Hicks J., Pashankar F., Pappo A.S. Treatment of Childhood Nasopharyngeal Carcinoma With Induction Chemotherapy and Concurrent Chemoradiotherapy: Results of the Children's Oncology Group ARAR0331 Study//Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. - 2019. - Т. 37. - Treatment of Childhood Nasopharyngeal Carcinoma With Induction Chemotherapy and Concurrent Chemoradiotherapy. - N 35. - С. 3369 - 3376.
24. Casanova M., Bisogno G., Gandola L., Cecchetto G., Di Cataldo A., Basso E., Indolfi P., D'Angelo P., Favini F., Collini P., Potepan P., Ferrari A., Rare Tumors in Pediatric Age Group A prospective protocol for nasopharyngeal carcinoma in children and adolescents: the Italian Rare Tumors in Pediatric Age (TREP) project//Cancer. - 2012. - Т. 118. - A prospective protocol for nasopharyngeal carcinoma in children and adolescents. - N 10. - С. 2718 - 2725.
25. Buehrlen M., Zwaan C.M., Granzen B., Lassay L., Deutz P., Vorwerk P., Staatz G., Gademann G., Christiansen H., Oldenburger F., Tamm M., Mertens R. Multimodal treatment, including interferon beta, of nasopharyngeal carcinoma in children and young adults: preliminary results from the prospective, multicenter study NPC-2003-GPOH/DCOG//Cancer. - 2012. - Т. 118. - Multimodal treatment, including interferon beta, of nasopharyngeal carcinoma in children and young adults. - N 19. - С. 4892 - 4900.
26. Жуков Н.В., Рабаева Л.Л. Назофарингеальная карцинома у детей и подростков. Обзор литературы и собственные данные//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2022. - Т. 21. - N 2. - С. 66 - 77.
27. ![]() T., Franzen S., Kravets H., Farrag A., Makowska A., Christiansen H., Eble M.J., Timmermann B., Staatz G., Mottaghy F.M.,
T., Franzen S., Kravets H., Farrag A., Makowska A., Christiansen H., Eble M.J., Timmermann B., Staatz G., Mottaghy F.M.,  M., Hagenah U., Puzik A., Driever P.H., Greiner J., Jorch N., Tippelt S., Schneider D.T., Kropshofer G., Overbeck T.R., Christiansen H., Brozou T., Escherich G., Becker M., Friesenbichler W., Feuchtinger T., Puppe W., Heussen N., Hilgers R.D., Kontny U. Multimodal Treatment of Nasopharyngeal Carcinoma in Children, Adolescents and Young Adults-Extended Follow-Up of the NPC-2003-GPOH Study Cohort and Patients of the Interim Cohort//Cancers. - 2022. - Т. 14. - N 5. - С. 1261.
M., Hagenah U., Puzik A., Driever P.H., Greiner J., Jorch N., Tippelt S., Schneider D.T., Kropshofer G., Overbeck T.R., Christiansen H., Brozou T., Escherich G., Becker M., Friesenbichler W., Feuchtinger T., Puppe W., Heussen N., Hilgers R.D., Kontny U. Multimodal Treatment of Nasopharyngeal Carcinoma in Children, Adolescents and Young Adults-Extended Follow-Up of the NPC-2003-GPOH Study Cohort and Patients of the Interim Cohort//Cancers. - 2022. - Т. 14. - N 5. - С. 1261.
28. Kontny U., Franzen S., Behrends U.,  M., Christiansen H., Delecluse H., Eble M., Feuchtinger T., Gademann G., Granzen B., Kratz C., Lassay L., Leuschner I., Mottaghy F., Schmitt C., Staatz G., Timmermann B., Vorwerk P., Wilop S., Wolff H., Mertens R. Diagnosis and Treatment of Nasopharyngeal Carcinoma in Children and Adolescents - Recommendations of the GPOH-NPC Study Group//Klinische
M., Christiansen H., Delecluse H., Eble M., Feuchtinger T., Gademann G., Granzen B., Kratz C., Lassay L., Leuschner I., Mottaghy F., Schmitt C., Staatz G., Timmermann B., Vorwerk P., Wilop S., Wolff H., Mertens R. Diagnosis and Treatment of Nasopharyngeal Carcinoma in Children and Adolescents - Recommendations of the GPOH-NPC Study Group//Klinische  . - 2016. - Vol. 228. - No. 03. - P. 105 - 112.
. - 2016. - Vol. 228. - No. 03. - P. 105 - 112.
29. Zhang L., Huang Y., Hong S., Yang Y., Yu G., Jia J., Peng P., Wu X., Lin Q., Xi X., Peng J., Xu M., Chen D., Lu X., Wang R., Cao X., Chen X., Lin Z., Xiong J., Lin Q., Xie C., Li Z., Pan J., Li J., Wu S., Lian Y., Yang Q., Zhao C. Gemcitabine plus cisplatin versus fluorouracil plus cisplatin in recurrent or metastatic nasopharyngeal carcinoma: a multicentre, randomised, open-label, phase 3 trial//Lancet (London, England). - 2016. - Т. 388. - Gemcitabine plus cisplatin versus fluorouracil plus cisplatin in recurrent or metastatic nasopharyngeal carcinoma. - N 10054. - С. 1883 - 1892.
30. Zhang Y., Chen L., Hu G.-Q., Zhang N., Zhu X.-D., Yang K.-Y., Jin F., Shi M., Chen Y.-P., Hu W.-H., Cheng Z.-B., Wang S.-Y., Tian Y., Wang X.-C., Sun Y., Li J.-G., Li W.-F., Li Y.-H., Tang L.-L., Mao Y.-P., Zhou G.-Q., Sun R., Liu X., Guo R., Long G.-X., Liang S.-Q., Li L., Huang J., Long J.-H., Zang J., Liu Q.-D., Zou L., Su Q.-F., Zheng B.-M., Xiao Y., Guo Y., Han F., Mo H.-Y., Lv J.-W., Du X.-J., Xu C., Liu N., Li Y.-Q., Chua M.L.K., Xie F.-Y., Sun Y., Ma J. Gemcitabine and Cisplatin Induction Chemotherapy in Nasopharyngeal Carcinoma//The New England Journal of Medicine. - 2019. - Т. 381. - N 12. - С. 1124 - 1135.
31. Liu X., Shen H., Zhang L., Huang W., Zhang S., Zhang B. Immunotherapy for recurrent or metastatic nasopharyngeal carcinoma//npj Precision Oncology. - 2024. - Vol. 8. - No. 1. - P. 1 - 9.
32. Yang Y., Qu S., Li J., Hu C., Xu M., Li W., Zhou T., Shen L., Wu H., Lang J., Hu G., Luo Z., Fu Z., Qu S., Feng W., Chen X., Lin S., Zhang W., Li X., Sun Y., Lin Z., Lin Q., Lei F., Long J., Hong J., Huang X., Zeng L., Wang P., He X., Zhang B., Yang Q., Zhang X., Zou J., Fang W., Zhang L. Camrelizumab versus placebo in combination with gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (CAPTAIN-1st): a multicentre, randomised, double-blind, phase 3 trial//The Lancet. Oncology. - 2021. - Т. 22. - Camrelizumab versus placebo in combination with gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (CAPTAIN-1st). - N 8. - С. 1162 - 1174.
33. Salvage regimens for pediatric patients with relapsed nasopharyngeal carcinoma - DeRenzo - 2019 - Pediatric Blood & Cancer - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1002/pbc.27469 (дата обращения: 02.08.2024).
34. Zhang L., Zhu Y., Wang Y., Huang C., Wu Y., Ji Q. Salvage Surgery for Neck Residue or Recurrence of Nasopharyngeal Carcinoma: A 10-Year Experience//Annals of Surgical Oncology. - 2011. - Т. 18. - Salvage Surgery for Neck Residue or Recurrence of Nasopharyngeal Carcinoma. - N 1. - С. 233 - 238.
35. Muscaritoli M., Arends J., Bachmann P., Baracos V., Barthelemy N., Bertz H., Bozzetti F.,  E., Isenring E., Kaasa S., Krznaric Z., Laird B., Larsson M., Laviano A.,
E., Isenring E., Kaasa S., Krznaric Z., Laird B., Larsson M., Laviano A.,  S., Oldervoll L., Ravasco P., Solheim T.S., Strasser F., de van der Schueren M., Preiser J.-C., Bischoff S.C. ESPEN practical guideline: Clinical Nutrition in cancer//Clinical Nutrition (Edinburgh, Scotland). - 2021. - Т. 40. - ESPEN practical guideline. - N 5. - С. 2898 - 2913.
S., Oldervoll L., Ravasco P., Solheim T.S., Strasser F., de van der Schueren M., Preiser J.-C., Bischoff S.C. ESPEN practical guideline: Clinical Nutrition in cancer//Clinical Nutrition (Edinburgh, Scotland). - 2021. - Т. 40. - ESPEN practical guideline. - N 5. - С. 2898 - 2913.
36. Joosten K., Embleton N., Yan W., Senterre T., ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Energy//Clinical Nutrition (Edinburgh, Scotland). - 2018. - Т. 37. - ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition. - N 6 Pt B. - С. 2309 - 2314.
37. Patel P., Robinson P.D., Wahib N., Cheung P., Wong T., Cabral S., Parker A., Cohen M., Devine K., Gibson P., Holdsworth M.T., Neumann E., Orsey A., Phillips R., Spinelli D., Thackray J., van de Wetering M., Woods D., Sung L., Dupuis L.L. Interventions for the prevention of acute phase chemotherapy-induced nausea and vomiting in adult and pediatric patients: a systematic review and meta-analysis//Supportive Care in Cancer: Official Journal of the Multinational Association of Supportive Care in Cancer. - 2022. - Т. 30. - Interventions for the prevention of acute phase chemotherapy-induced nausea and vomiting in adult and pediatric patients. - N 11. - С. 8855 - 8869.
38. Stevenson J., DeGroote N.P., Keller F., Brock K.E., Bergsagel D.J., Miller T.P., Cornwell P., Fasano R., Chonat S., Castellino S.M. Characteristics and outcomes of pediatric oncology patients at risk for guardians declining transfusion of blood components//Cancer Reports. - 2022. - Т. 6. - N 1. - С. e1665.
39. Crocoli A., Martucci C., Persano G., De Pasquale M.D., Serra A., Accinni A., Aloi I.P., Bertocchini A., Frediani S., Madafferi S., Pardi V., Inserra A. Vascular Access in Pediatric Oncology and Hematology: State of the Art//Children. - 2022. - Т. 9. - Vascular Access in Pediatric Oncology and Hematology. - N 1. - С. 70.
40. Lyman G.H., Rolston K.V.I. How We Treat Febrile Neutropenia in Patients Receiving Cancer Chemotherapy//Journal of Oncology Practice. - 2010. - Т. 6. - N 3. - С. 149 - 152.
41. Mikulska M., Viscoli C., Orasch C., Livermore D.M., Averbuch D., Cordonnier C., Akova M. Aetiology and resistance in bacteraemias among adult and paediatric haematology and cancer patients//Journal of Infection. - 2014. - Т. 68. - N 4. - С. 321 - 331.
42. Ospina P.A., Wiart L., Eisenstat D.D., McNeely M.L. Physical Rehabilitation Practices for Children and Adolescents with Cancer in Canada//Physiotherapy Canada. Physiotherapie Canada. - 2020. - Т. 72. - N 2. - С. 207 - 216.
43. L'Hotta A.J., Randolph S.B., Reader B., Lipsey K., King A.A. Clinical practice guideline and expert consensus recommendations for rehabilitation among children with cancer: A systematic review//CA: a cancer journal for clinicians. - 2023. - Т. 73. - Clinical practice guideline and expert consensus recommendations for rehabilitation among children with cancer. - N 5. - С. 524 - 545.
44. ![]()
![]() .,
., ![]() Z., Yildiz F.,
Z., Yildiz F., ![]() E. Incidence of hypothyroidism after radiotherapy for nasopharyngeal carcinoma//Medical Oncology. - 2007. - Vol. 24. - No. 1. - P. 91 - 94.
E. Incidence of hypothyroidism after radiotherapy for nasopharyngeal carcinoma//Medical Oncology. - 2007. - Vol. 24. - No. 1. - P. 91 - 94.
45. Psyrri A., Kwong M., DiStasio S., Lekakis L., Kassar M., Sasaki C., Wilson L.D., Haffty B.G., Son Y.H., Ross D.A., Weinberger P.M., Chung G.G., Zelterman D., Burtness B.A., Cooper D.L. Cisplatin, fluorouracil, and leucovorin induction chemotherapy followed by concurrent cisplatin chemoradiotherapy for organ preservation and cure in patients with advanced head and neck cancer: long-term follow-up//Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. - 2004. - Т. 22. - Cisplatin, fluorouracil, and leucovorin induction chemotherapy followed by concurrent cisplatin chemoradiotherapy for organ preservation and cure in patients with advanced head and neck cancer. - N 15. - С. 3061 - 3069.
46. Lee N., Xia P., Quivey J.M., Sultanem K., Poon I., Akazawa C., Akazawa P., Weinberg V., Fu K.K. Intensity-modulated radiotherapy in the treatment of nasopharyngeal carcinoma: an update of the UCSF experience//International Journal of Radiation Oncology, Biology, Physics. - 2002. - Т. 53. - Intensity-modulated radiotherapy in the treatment of nasopharyngeal carcinoma. - N 1. - С. 12 - 22.
47. Парентеральное и энтеральное питание детей: практические рекомендации купить - Mybooks.by - книжный интернет-магазин. У нас можно купить книги с доставкой по Минску и Беларуси. - URL: https://mybooks.by/medicinskaya_literatura/pediatriya/Parenteralnoe_i_enteralnoe_pitanie_detey_Prakticheskie_rekomendacii/(дата обращения: 01.06.2024).
48. Mehta N.M., Corkins M.R., Lyman B., Malone A., Goday P.S., Carney L.N., Monczka J.L., Plogsted S.W., Schwenk W.F., American Society for Parenteral and Enteral Nutrition Board of Directors Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions//JPEN. Journal of parenteral and enteral nutrition. - 2013. - Т. 37. - Defining pediatric malnutrition. - N 4. - С. 460 - 481.
49. Jang R.W., Caraiscos V.B., Swami N., Banerjee S., Mak E., Kaya E., Rodin G., Bryson J., Ridley J.Z., Le L.W., Zimmermann C. Simple prognostic model for patients with advanced cancer based on performance status//Journal of Oncology Practice. - 2014. - Т. 10. - N 5. - С. e335 - 341.
50. Martin L., Senesse P., Gioulbasanis I., Antoun S., Bozzetti F., Deans C., Strasser F., Thoresen L., Jagoe R.T., Chasen M., Lundholm K., Bosaeus I., Fearon K.H., Baracos V.E. Diagnostic criteria for the classification of cancer-associated weight loss//Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. - 2015. - Т. 33. - N 1. - С. 90 - 99.
51. Kondrup J., Allison S.P., Elia M., Vellas B., Plauth M., Educational and Clinical Practice Committee, European Society of Parenteral and Enteral Nutrition (ESPEN) ESPEN guidelines for nutrition screening 2002//Clinical Nutrition (Edinburgh, Scotland). - 2003. - Т. 22. - N 4. - С. 415 - 421.
52. Yaprak D.S., ![]() B.,
B., ![]() A.A.,
A.A.,  M. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins//Pediatric Blood & Cancer. - 2021. - Т. 68. - Assessment of nutritional status in children with cancer. - N 1. - С. e28752.
M. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins//Pediatric Blood & Cancer. - 2021. - Т. 68. - Assessment of nutritional status in children with cancer. - N 1. - С. e28752.
53. Joosten K.F.M., Kerklaan D., Verbruggen S.C.A.T. Nutritional support and the role of the stress response in critically ill children//Current Opinion in Clinical Nutrition and Metabolic Care. - 2016. - Т. 19. - N 3. - С. 226 - 233.
54. Elia M., Normand C., Laviano A., Norman K. A systematic review of the cost and cost effectiveness of using standard oral nutritional supplements in community and care home settings//Clinical Nutrition (Edinburgh, Scotland). - 2016. - Т. 35. - N 1. - С. 125 - 137.
55. Langius J.A.E., Zandbergen M.C., Eerenstein S.E.J., van Tulder M.W., Leemans C.R., Kramer M.H.H., Weijs P.J.M. Effect of nutritional interventions on nutritional status, quality of life and mortality in patients with head and neck cancer receiving (chemo)radiotherapy: a systematic review//Clinical Nutrition (Edinburgh, Scotland). - 2013. - Т. 32. - Effect of nutritional interventions on nutritional status, quality of life and mortality in patients with head and neck cancer receiving (chemo)radiotherapy. - N 5. - С. 671 - 678.
56. Arends J., Bachmann P., Baracos V., Barthelemy N., Bertz H., Bozzetti F., Fearon K.,  E., Isenring E., Kaasa S., Krznaric Z., Laird B., Larsson M., Laviano A.,
E., Isenring E., Kaasa S., Krznaric Z., Laird B., Larsson M., Laviano A.,  S., Muscaritoli M., Oldervoll L., Ravasco P., Solheim T., Strasser F., de van der Schueren M., Preiser J.-C. ESPEN guidelines on nutrition in cancer patients//Clinical Nutrition (Edinburgh, Scotland). - 2017. - Т. 36. - N 1. - С. 11 - 48.
S., Muscaritoli M., Oldervoll L., Ravasco P., Solheim T., Strasser F., de van der Schueren M., Preiser J.-C. ESPEN guidelines on nutrition in cancer patients//Clinical Nutrition (Edinburgh, Scotland). - 2017. - Т. 36. - N 1. - С. 11 - 48.
57. Viani K., Trehan A., Manzoli B., Schoeman J. Assessment of nutritional status in children with cancer: A narrative review//Pediatric Blood & Cancer. - 2020. - Т. 67 Suppl 3. - Assessment of nutritional status in children with cancer. - С. e28211.
58. Hesketh P.J., Kris M.G., Basch E., Bohlke K., Barbour S.Y., Clark-Snow R.A., Danso M.A., Dennis K., Dupuis L.L., Dusetzina S.B., Eng C., Feyer P.C., Jordan K., Noonan K., Sparacio D., Lyman G.H. Antiemetics: ASCO Guideline Update//Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. - 2020. - Т. 38. - Antiemetics. - N 24. - С. 2782 - 2797.
59. Prevention and treatment of anticipatory chemotherapy-induced nausea and vomiting in pediatric cancer patients and hematopoietic stem cell recipients: Clinical practice guideline update - Patel - 2021 - Pediatric Blood & Cancer - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1002/pbc.28947 (дата обращения: 03.08.2024).
60. Dexamethasone dosing for prevention of acute chemotherapy-induced vomiting in pediatric patients: A systematic review - Patel - 2020 - Pediatric Blood & Cancer - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1002/pbc.28716 (дата обращения: 03.08.2024).
61. Jain S., Kapoor G., Koneru S., Vishwakarma G. A randomized, open-label non-inferiority study to compare palonosetron and ondansetron for prevention of acute chemotherapy-induced vomiting in children with cancer receiving moderate or high emetogenic chemotherapy//Supportive Care in Cancer. - 2018. - Vol. 26. - No. 9. - P. 3091 - 3097.
62. Жуков Н.В., Рабаева Л.Л., Литвинов Д.В. Эффективность и безопасность малых доз оланзапина в профилактике тошноты и рвоты у детей и подростков, получающих высокоэметогенную химиотерапию. Промежуточные результаты рандомизированного исследования//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2022. - Т. 21. - N 4. - С. 70 - 82.
63. Naik R.D., V S., Singh V., Pillai A.S., Dhawan D., Bakhshi S. Olanzapine for Prevention of Vomiting in Children and Adolescents Receiving Highly Emetogenic Chemotherapy: Investigator-Initiated, Randomized, Open-Label Trial//Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. - 2020. - Т. 38. - Olanzapine for Prevention of Vomiting in Children and Adolescents Receiving Highly Emetogenic Chemotherapy. - N 32. - С. 3785 - 3793.
64. Prevention and treatment of anticipatory chemotherapy-induced nausea and vomiting in pediatric cancer patients and hematopoietic stem cell recipients: Clinical practice guideline update - PubMed. - URL: https://pubmed.ncbi.nlm.nih.gov/33686754/(дата обращения: 03.08.2024).
65. Chaudhary N.K., John R.R., Boddu D., Mahasampath G., Nesadeepam N., Mathew L.G. Palonosetron is a Better Choice Compared With Ondansetron for the Prevention of Chemotherapy-induced Nausea and Vomiting (CINV) in a Resource-limited Pediatric Oncology Center: Results From a Randomized Control Trial//Journal of Pediatric Hematology/Oncology. - 2019. - Т. 41. - Palonosetron is a Better Choice Compared With Ondansetron for the Prevention of Chemotherapy-induced Nausea and Vomiting (CINV) in a Resource-limited Pediatric Oncology Center. - N 4. - С. 294 - 297.
66. Flank J., Robinson P.D., Holdsworth M., Phillips R., Portwine C., Gibson P., Maan C., Stefin N., Sung L., Dupuis L.L. Guideline for the Treatment of Breakthrough and the Prevention of Refractory Chemotherapy-Induced Nausea and Vomiting in Children With Cancer//Pediatric Blood & Cancer. - 2016. - Т. 63. - N 7. - С. 1144 - 1151.
67. Steiner M.E., Zantek N.D., Stanworth S.J., Parker R.I., Valentine S.L., Lehmann L.E., Josephson C.D., Bateman S.T., Luban N.L.C., Pediatric Critical Care Transfusion and Anemia Expertise Initiative (TAXI), Pediatric Critical Care Blood Research Network (BloodNet), and the Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Recommendations on RBC Transfusion Support in Children With Hematologic and Oncologic Diagnoses From the Pediatric Critical Care Transfusion and Anemia Expertise Initiative//Pediatric Critical Care Medicine: A Journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies. - 2018. - Т. 19. - N 9S Suppl 1. - С. S149 - S156.
68. Nellis M.E., Goel R., Karam O. Transfusion Management in Pediatric Oncology Patients//Hematology/Oncology Clinics of North America. - 2019. - Т. 33. - N 5. - С. 903 - 913.
69. Галстян Г.М., Гапонова Т.В., Жибурт Е.Б., Балашова Е.Н., Берковский А.Л., Быстрых О.А., Купряшов А.А., Оловникова Н.И., Ошоров А.В., Рыбка М.М., Троицкая В.В., Буланов А.Ю., Журавель С.В., Лубнин А.Ю., Мазурок В.А., Недомолкин С.В., Певцов Д.Э., Рогачевский О.В., Салимов Э.Л., Трахтман П.Е., Чжао А.В., Шерстнев Ф.С., Савченко В.Г. Клиническое использование криопреципитата//Гематология и трансфузиология. - 2020. - Т. 65. - N 1. - С. 87 - 114.
70. Cellini M., Bergadano A., Crocoli A., Badino C., Carraro F., Sidro L., Botta D., Pancaldi A., Rossetti F., Pitta F., Cesaro S. Guidelines of the Italian Association of Pediatric Hematology and Oncology for the management of the central venous access devices in pediatric patients with onco-hematological disease//The Journal of Vascular Access. - 2022. - Т. 23. - N 1. - С. 3 - 17.
71. Schiffer C.A., Mangu P.B., Wade J.C., Camp-Sorrell D., Cope D.G., El-Rayes B.F., Gorman M., Ligibel J., Mansfield P., Levine M. Central venous catheter care for the patient with cancer: American Society of Clinical Oncology clinical practice guideline//Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. - 2013. - Т. 31. - Central venous catheter care for the patient with cancer. - N 10. - С. 1357 - 1370.
72. Bonciarelli G., Batacchi S., Biffi R., Buononato M., Damascelli B., Ghibaudo F., Orsi F., Pittiruti M., Scoppettuolo G., ![]() A., Borasi G., De Cicco M., Dosio R., Gazzo P., Maso R., Roman A., Ticha V., Venier G., Blackburn P., Goossens G.A., Bowen Santolucito J., Stas M., Van Boxtel T., Vesely T.M., de Lutio E., Gruppo Aperto di Studio Accessi Venosi Centrali a Lungo Termine (Study Group on Long-Term Central Venous Access) GAVeCeLT* consensus statement on the correct use of totally implantable venous access devices for diagnostic radiology procedures//The Journal of Vascular Access. - 2011. - Т. 12. - N 4. - С. 292 - 305.
A., Borasi G., De Cicco M., Dosio R., Gazzo P., Maso R., Roman A., Ticha V., Venier G., Blackburn P., Goossens G.A., Bowen Santolucito J., Stas M., Van Boxtel T., Vesely T.M., de Lutio E., Gruppo Aperto di Studio Accessi Venosi Centrali a Lungo Termine (Study Group on Long-Term Central Venous Access) GAVeCeLT* consensus statement on the correct use of totally implantable venous access devices for diagnostic radiology procedures//The Journal of Vascular Access. - 2011. - Т. 12. - N 4. - С. 292 - 305.
73. Burbridge B., Plewes C., Stoneham G., Szkup P., Otani R., Babyn P., Bryce R. Randomized Clinical Trial Evaluating Complications and Complication-Related Removal of Arm-Situated Power-Injectable and Non-Power-Injectable Totally Implanted Venous Access Devices among Cancer Patients//Journal of vascular and interventional radiology: JVIR. - 2018. - Т. 29. - N 5. - С. 648 - 656.e3.
74. Thurman C.B., Abbott M., Liu J., Larson E. Risk for Health Care-Associated Bloodstream Infections in Pediatric Oncology Patients With Various Malignancies//Journal of Pediatric Oncology Nursing: Official Journal of the Association of Pediatric Oncology Nurses. - 2017. - Т. 34. - N 3. - С. 196 - 202.
75. Skinner R., Koller K., McIntosh N., McCarthy A., Pizer B., United Kingdom Children's Cancer Study Group (UKCCSG), Paediatric Oncology Nursing Forum (PONF) Supportive Care Group Prevention and management of central venous catheter occlusion and thrombosis in children with cancer//Pediatric Blood & Cancer. - 2008. - Т. 50. - N 4. - С. 826 - 830.
76. Cameron G.S. Central venous catheters for children with malignant disease: surgical issues//Journal of Pediatric Surgery. - 1987. - Т. 22. - Central venous catheters for children with malignant disease. - N 8. - С. 702 - 704.
77. Di Puccio F., Giacomarro D., Mattei L., Pittiruti M., Scoppettuolo G. Experimental study on the chemico-physical interaction between a two-component cyanoacrylate glue and the material of PICCs//The Journal of Vascular Access. - 2018. - Т. 19. - N 1. - С. 58 - 62.
78. European recommendations on the proper indication and use of peripheral venous access devices (the ERPIUP consensus): A WoCoVA project - Mauro Pittiruti, Ton Van Boxtel, Giancarlo Scoppettuolo, Peter Carr, Evangelos Konstantinou, Gloria Ortiz Miluy, Massimo Lamperti, Godelieve Alice Goossens, Liz Simcock, Christian Dupont, Sheila Inwood, Sergio Bertoglio, Jackie Nicholson, Fulvio Pinelli, Gilda Pepe, 2023. - URL: https://journals.sagepub.com/doi/full/10.1177/11297298211023274 (дата обращения: 01.06.2024).
79. Nickel B., Gorski L., Kleidon T., Kyes A., DeVries M., Keogh S., Meyer B., Sarver M.J., Crickman R., Ong J., Clare S., Hagle M.E. Infusion Therapy Standards of Practice, 9th Edition//Journal of Infusion Nursing: The Official Publication of the Infusion Nurses Society. - 2024. - Т. 47. - N 1S Suppl 1. - С. S1 - S285.
80. Simon A.,  R., Graf N., Laws H.J., Voigt S., Piening B., Geffers C., Agyeman P., Ammann R.A. Surveillance of bloodstream infections in pediatric cancer centers - what have we learned and how do we move on?//GMS Hygiene and Infection Control. - 2016. - Т. 11. - С. Doc11.
R., Graf N., Laws H.J., Voigt S., Piening B., Geffers C., Agyeman P., Ammann R.A. Surveillance of bloodstream infections in pediatric cancer centers - what have we learned and how do we move on?//GMS Hygiene and Infection Control. - 2016. - Т. 11. - С. Doc11.
81. Dien Bard J., McElvania TeKippe E. Diagnosis of Bloodstream Infections in Children//Journal of Clinical Microbiology. - 2016. - Т. 54. - N 6. - С. 1418 - 1424.
82. Repeated Blood Cultures in Pediatric Febrile Neutropenia: Would Following the Guidelines Alter the Outcome? - Petty - 2016 - Pediatric Blood & Cancer - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1002/pbc.25965 (дата обращения: 03.08.2024).
83. Scheler M., Lehrnbecher T., Groll A.H., Volland R., Laws H.-J., Ammann R.A., Agyeman P., Attarbaschi A., Lux M., Simon A. Management of children with fever and neutropenia: results of a survey in 51 pediatric cancer centers in Germany, Austria, and Switzerland//Infection. - 2020. - Т. 48. - Management of children with fever and neutropenia. - N 4. - С. 607 - 618.
84. Consensus guidelines for the use of empiric and diagnostic-driven antifungal treatment strategies in haematological malignancy, 2014 - Morrissey - 2014 - Internal Medicine Journal - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1111/imj.12596 (дата обращения: 03.08.2024).
85. Ison M.G., Hirsch H.H. Community-Acquired Respiratory Viruses in Transplant Patients: Diversity, Impact, Unmet Clinical Needs//Clinical Microbiology Reviews. - 2019. - Т. 32. - Community-Acquired Respiratory Viruses in Transplant Patients. - N 4. - С. e00042 - 19.
86. Hermann B., Lehners N., Brodhun M., Boden K., Hochhaus A., Kochanek M., Meckel K., Mayer K., Rachow T., Rieger C., Schalk E., Weber T.,  A., Schlattmann P., Teschner D., von Lilienfeld-Toal M. Influenza virus infections in patients with malignancies - characteristics and outcome of the season 2014/15. A survey conducted by the Infectious Diseases Working Party (AGIHO) of the German Society of Haematology and Medical Oncology (DGHO)//European Journal of Clinical Microbiology & Infectious Diseases. - 2017. - Т. 36. - N 3. - С. 565 - 573.
A., Schlattmann P., Teschner D., von Lilienfeld-Toal M. Influenza virus infections in patients with malignancies - characteristics and outcome of the season 2014/15. A survey conducted by the Infectious Diseases Working Party (AGIHO) of the German Society of Haematology and Medical Oncology (DGHO)//European Journal of Clinical Microbiology & Infectious Diseases. - 2017. - Т. 36. - N 3. - С. 565 - 573.
87. Солопова Г.Г., Цыганова Е.В., Кондрашова А.В., Гордеева Г.Н., Розанцева Е.В., Бегунова С.В., Воронин К.А., Копосова А.О., Новичкова Г.А. Особенности течения новой коронавирусной инфекции COVID-19 у детей с онкологическими, онкогематологическими и тяжелыми иммунологическими заболеваниями. Опыт НМИЦ ДГОИ им. Дмитрия Рогачева//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2021. - Т. 20. - N 4. - С. 89 - 99.
88. Spruit J.L., Knight T., Sweeney C., Salimnia H.,  S. Clostridium difficile infection in a children's hospital with specific patterns among pediatric oncology and hematopoietic stem cell transplantation populations//Pediatric Hematology and Oncology. - 2020.
S. Clostridium difficile infection in a children's hospital with specific patterns among pediatric oncology and hematopoietic stem cell transplantation populations//Pediatric Hematology and Oncology. - 2020.
89. Castagnola E., Ruberto E., Guarino A. Gastrointestinal and liver infections in children undergoing antineoplastic chemotherapy in the years 2000//World Journal of Gastroenterology. - 2016. - Т. 22. - N 25. - С. 5853 - 5866.
90. Lehrnbecher T., Robinson P.D., Fisher B.T., Castagnola E., Groll A.H., Steinbach W.J., Zaoutis T.E., Negeri Z.F., Beyene J., Phillips B., Sung L. Galactomannan,  , and Polymerase Chain Reaction-Based Assays for the Diagnosis of Invasive Fungal Disease in Pediatric Cancer and Hematopoietic Stem Cell Transplantation: A Systematic Review and Meta-Analysis//Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. - 2016. - Galactomannan,
, and Polymerase Chain Reaction-Based Assays for the Diagnosis of Invasive Fungal Disease in Pediatric Cancer and Hematopoietic Stem Cell Transplantation: A Systematic Review and Meta-Analysis//Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. - 2016. - Galactomannan,  , and Polymerase Chain Reaction-Based Assays for the Diagnosis of Invasive Fungal Disease in Pediatric Cancer and Hematopoietic Stem Cell Transplantation. - P. 1340 - 1348.
, and Polymerase Chain Reaction-Based Assays for the Diagnosis of Invasive Fungal Disease in Pediatric Cancer and Hematopoietic Stem Cell Transplantation. - P. 1340 - 1348.
91. Warris A., Lehrnbecher T. Progress in the Diagnosis of Invasive Fungal Disease in Children//Current Fungal Infection Reports. - 2017. - Т. 11. - N 2. - С. 35 - 44.
92. Gupta A., Capoor M.R., Shende T., Sharma B., Mohindra R., Suri J.C., Gupta D.K. Comparative evaluation of galactomannan test with bronchoalveolar lavage and serum for the diagnosis of invasive aspergillosis in patients with hematological malignancies//Journal of Laboratory Physicians. - 2017. - Т. 9. - N 4. - С. 234 - 238.
93. Mikulska M., Calandra T., Sanguinetti M., Poulain D., Viscoli C. The use of mannan antigen and anti-mannan antibodies in the diagnosis of invasive candidiasis: recommendations from the Third European Conference on Infections in Leukemia//Critical Care. - 2010. - Т. 14. - The use of mannan antigen and anti-mannan antibodies in the diagnosis of invasive candidiasis. - N 6. - С. R222.
94. Specificity of mannan antigen and anti-mannan antibody screening in patients with haematological malignancies at risk for fungal infection - Duettmann - 2016 - Mycoses - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1111/myc.12482 (дата обращения: 03.08.2024).
95. Use of empiric antimicrobial therapy in neutropenic fever - Tam - 2011 - Internal Medicine Journal - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1111/j.1445-5994.2010.02340.x (дата обращения: 04.08.2024).
96. Guideline for the Management of Fever and Neutropenia in Children With Cancer and/or Undergoing Hematopoietic Stem-Cell Transplantation | Journal of Clinical Oncology. - URL: https://ascopubs.org/doi/10.1200/JCO.2012.42.7161?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed (дата обращения: 04.08.2024).
97. Солопова Г.Г., Новичкова Г.А. Опыт внедрения алгоритма эмпирической антибактериальной терапии при развитии фебрильной нейтропении в Центре детской гематологии/онкологии//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2017. - Т. 16. - N 3. - С. 35 - 47.
98. Guideline for the Management of Fever and Neutropenia in Pediatric Patients With Cancer and Hematopoietic Cell Transplantation Recipients: 2023 Update | Journal of Clinical Oncology. - URL: https://ascopubs.org/doi/10.1200/JCO.22.02224?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed (дата обращения: 04.08.2024).
99.  Campos L.,
Campos L.,  P., Ferres Ramis L.,
P., Ferres Ramis L.,  E.M., Mendoza-Palomar N., Soler-Palacin P., Aguilera-Alonso D. Consensus document on the management of febrile neutropenia in paediatric haematology and oncology patients of the Spanish Society of Pediatric Infectious Diseases (SEIP) and the Spanish Society of Pediatric Hematology and Oncology (SEHOP)//Anales de
E.M., Mendoza-Palomar N., Soler-Palacin P., Aguilera-Alonso D. Consensus document on the management of febrile neutropenia in paediatric haematology and oncology patients of the Spanish Society of Pediatric Infectious Diseases (SEIP) and the Spanish Society of Pediatric Hematology and Oncology (SEHOP)//Anales de  (English Edition). - 2023. - Vol. 98. - No. 6. - P. 446 - 459.
(English Edition). - 2023. - Vol. 98. - No. 6. - P. 446 - 459.
100. Campbell C.T., Poisson M.O., Hand E.O. An Updated Review of Clostridium difficile Treatment in Pediatrics//The Journal of Pediatric Pharmacology and Therapeutics: JPPT. - 2019. - Т. 24. - N 2. - С. 90 - 98.
101. Safety of levofloxacin as an antibiotic prophylaxis in the induction phase of children newly diagnosed with acute lymphoblastic leukemia: an interim analysis of a randomized, open-label trial in Brazil | The Brazilian Journal of Infectious Diseases. - URL: https://www.bjid.org.br/en-safety-levofloxacin-as-an-antibiotic-articulo-S1413867023000053 (дата обращения: 10.09.2024).
102. Appropriate use of colistin in neonates, infants and children: Interim guidance - PMC. - URL: https://pmc.ncbi.nlm.nih.gov/articles/PMC10784269/(дата обращения: 05.11.2024).
103. Iosifidis E., Violaki A., Michalopoulou E., Volakli E., Diamanti E., Koliouskas D., Antachopoulos C., Drossou-Agakidou V., Sdougka M., Roilides E. Use of Tigecycline in Pediatric Patients With Infections Predominantly Due to Extensively Drug-Resistant Gram-Negative Bacteria//Journal of the Pediatric Infectious Diseases Society. - 2017. - Т. 6. - N 2. - С. 123 - 128.
104. Araujo da Silva A.R., Quijada R. Use of Ceftazidime-Avibactam in Children Admitted to Pediatric Intensive Care Units//Children. - 2024. - Т. 11. - N 6. - С. 664.
105. Consensus guidelines for the use of empiric and diagnostic-driven antifungal treatment strategies in haematological malignancy, 2014 - Morrissey - 2014 - Internal Medicine Journal - Wiley Online Library. - URL: https://onlinelibrary.wiley.com/doi/10.1111/imj.12596 (дата обращения: 04.08.2024).
106. Ruhnke M., Schwartz S. Recent developments in the management of invasive fungal infections in patients with oncohematological diseases//Therapeutic Advances in Hematology. - 2016. - Т. 7. - N 6. - С. 345 - 359.
107. Empirical versus Preemptive Antifungal Therapy for High-Risk, Febrile, Neutropenic Patients: A Randomized, Controlled Trial | Clinical Infectious Diseases | Oxford Academic. - URL: https://academic.oup.com/cid/article/48/8/1042/334819?login=true (дата обращения: 04.08.2024).
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Указаны в алфавитном порядке
1. Клинические онкологи
Варфоломеева Светлана Рафаэлевна, профессор, доктор медицинских наук, президент РОДОГ, директор НИИ детской онкологии и гематологии им. акад. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, профессор кафедры детской онкологии ФГБОУ ДПО РМАНПО Минздрава России.
Горбунова Татьяна Викторовна, доктор медицинских наук, заместитель главного врача НИИ ДОиГ им. акад. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Жуков Николай Владимирович, доктор медицинских наук, руководитель отдела междисциплинарной онкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Рабаева Лилия Леонидовна, кандидат медицинских наук, заведующий отделением онкологии и гематологии старшего возраста и нейроонкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
2. Лучевые терапевты
Нечеснюк Алексей Владимирович, кандидат медицинских наук, заведующий отделением лучевой терапии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
3. Хирургическая группа
Грачев Николай Сергеевич, профессор, доктор медицинских наук, генеральный директор ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Оганесян Раиса Суреновна, врач-детский хирург отделения детской онкологии, хирургии головы и шеи и нейрохирургии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Поляков Владимир Георгиевич, академик РАН, д.м.н., профессор, заместитель директора, заведующий отделением опухолей головы и шеи НИИ ДОиГ им. акад. Л.А. Дурнова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, заведующий кафедрой детской онкологии ФГБОУ ДО РМАПО Минздрава России, главный внештатный детский специалист онколог Минздрава России
4. Группа сопроводительной терапии
Вашура А.Ю., к.м.н., врач-диетолог, заведующий отделом научных основ питания и нутритивно-метаболической терапии ФГБУ "НМИЦ ДГОИ им. Дм. Рогачева" Минздрава России
Жарков Павел Александрович, доктор медицинских наук, заведующий лабораторией патологии гемостаза ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Климова Н.А., старшая медицинская сестра отделения детской гематологии/онкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Коровина И.В., врач-диетолог ФГБУ "НМИЦ ДГОИ им. Дм. Рогачева" Минздрава России
Пименова О.В., главная медицинская сестра ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Сацук А.В., к.м.н., заведующий отделом повышения квалификации среднего медицинского персонала, врач-эпидемиолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, старший научный сотрудник лаборатории профилактики внутрибольничных инфекций ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
Солопова Г.Г., к.м.н., заместитель главного врача по инфекционному контролю, заведующий отделением инфекционного контроля, врач-гематолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Сорокина Л.Ф., медицинская сестра отделения детской онкологии, хирургии головы и шеи и нейрохирургии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Трахтман П.Е., д.м.н., профессор, врач-транфузиолог, заведующий отделением трансфузиологии, заготовки и процессинга гемопоэтических стволовых клеток ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Щемелинская Ю.Л., врач-эпидемиолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Щукин В.В., к.м.н., заведующий отделением анестезиологии и реанимации с операционным блоком, врач анестезиолог-реаниматолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-детские онкологи;
2. Студенты медицинских ВУЗов, ординаторы, аспиранты.
Таблица 10 - Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 11 - Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 12 - Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
РЕКОМЕНДАЦИИ ПО ОЦЕНКЕ НУТРИТИВНОГО СТАТУСА И ЕГО КОРРЕКЦИИ
А3.1.1 Диетотерапия
Лечебное питание является неотъемлемым компонентом лечебного процесса и профилактических мероприятий и включает в себя пищевые рационы, которые имеют установленный химический состав, энергетическую ценность, состоят из определенных продуктов, в т.ч. специализированных продуктов лечебного питания, включая смеси белковые композитные сухие и витаминно-минеральные комплексы, подвергаемых соответствующей технологической обработке, а также лечебные продукты энтерального питания (лечебные питательные смеси).
Лечебное питание рекомендуется к назначению пациентам при поступлении в медицинскую организацию для оказания медицинской помощи в стационарных условиях. Лечебное питание назначается лечащим врачом или дежурным врачом медицинской организации в соответствии с нозологической формой заболевания по основному и/или сопутствующему диагнозу. Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) показано проведение нутритивной поддержки [35, 47].
А3.1.2 Нутритивный скрининг и мониторинг (оценка нутритивного статуса)
Всем пациентам с НФК при поступлении в стационар и далее от 1 до 4 раз в месяц показана оценка нутритивного статуса с целью выявления белково-энергетической недостаточности либо риска ее развития [48, 49]. Выявление нутритивных нарушений на ранних этапах их развития, особенно до начала противоопухолевой терапии позволяет своевременно начать нутритивную коррекцию. Критерии белково-энергетической недостаточности, ожирения и факторы нутритивного риска - см. приложение. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/инструментов для проведения нутритивного скрининга [50]. Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [51].
Для проведения нутритивного скрининга необходимо использовать специальные валидированные опросники/инструменты, особенно актуальным их использование является на этапе первичного поступления в стационар и/или на (очередном) этапе поступления в клиническое отделение [35].
В своем большинстве скрининговые инструменты ориентированы на объединение данных об основном диагнозе, клиническом статусе, антропометрических показателях, динамике массы тела, состоянии питания и интеграции этих данных в общий балл с последующим разделением пациентов на 2 или 3 когорты: не нуждаются в нутритивной коррекции (поддержке); требуют повторного скрининга в динамике ("тревожная" группа); нуждаются в нутритивной коррекции (поддержке). Клиническое подразделение (или учреждение) вправе использовать тот инструмент, или комбинацию инструментов, которую посчитает наиболее приемлемой для проведения нутритивного скрининга среди своих пациентов. Необходимо помнить, что существующие скрининговые инструменты не предназначены для ответа на вопрос об объеме и способе необходимой нутритивной поддержки, не несут в себе прогностической информации для конкретного пациента, поскольку их применение нацелено исключительно на медицинскую сортировку. К тому же, универсального инструмента для скрининга в педиатрии не существует
Для первичной (общей) оценки нутритивного статуса и выявления нутритивного риска необходимо учитывать антропометрические показатели, изменение массы тела за определенный период (3, 6 или 12 месяцев), данные о питании (режим, привычный состав питания, особенности приема пищи, возможные нарушения приема пищи, наличие непереносимости/аллергии на компоненты пищи), об эндокринном статусе (данные о выявленных эндокринных нарушениях у ребенка), данные о выявленных гастроинтестинальных нарушениях [51].
В качестве обязательного минимума основных антропометрических параметров для первичной и регулярной оценки нутритивного статуса необходимо использовать следующие: масса тела, рост (длина тела), индекс массы тела [35, 48].
В качестве дополнительных антропометрических параметров в случае потребности в детальном антропометрическом исследовании для первичной и регулярной оценки нутритивного статуса используются следующие: измерение окружностей, длин, толщины складок, кистевая динамометрия [35, 48]
Для соотнесения полученных данных антропометрии (рост, масса тела, индекс массы тела, окружность плеча) с нормативными значениями по педиатрической популяции используются референсные значения (шкалы), либо локальных (отечественных) референсов, либо мировых общеиспользуемых номограмм: центильные значения/перцентили, либо величина отклонения полученного значения от среднего по популяции (SDS или z-score) [48]
Часто используемыми "по умолчанию" в РФ являются референсы ВОЗ (WHO growth charts), для удобства работы с которыми существуют свободно доступные программы (WHO anthro и WHO anthro plus), которые быстро позволяют высчитать ключевые антропометрические параметры в соотнесении их с референсными данными ВОЗ. Однако возможно использование и других референтных данных для соотнесения данных пациента с нормативами - в таком случае необходимо указывать, какие конкретно референсы применялись.
Пациентам с выявленными нутритивными нарушениями при первичном скрининге рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный осмотр и опрос на предмет выявления нутритивно-метаболических нарушений и их предикторов [51]
Пациентам, получающим нутритивную поддержку, необходимо проведение нутритивного мониторинга - опрос, антропометрия, анализ тканевого состава тела, лабораторные показатели (анализ крови биохимический общетерапевтический, копрологическое исследование [35, 52].
А3.1.3 Нутритивная поддержка
Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) показано проведение нутритивной поддержки (НП) [35].
При выборе формы, метода, вида и объема нутритивной поддержки необходимо руководствоваться, в первую очередь, принципом индивидуального пациент-ориентированного подхода - сообразно клинической ситуации и логике [35].
Расчет объема нутритивной поддержки необходимо осуществлять посредством расчета нутритивной потребности или тотального расхода энергии (ТРЭ) [35, 36].
Расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО x КК, где ЭОО - энергия основного обмена, КК - конверсионный коэффициент.
Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield) [53]. Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК = 0,85 - 1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации.
При выборе пути нутритивной поддержки приоритетным является использование энтерального питания (ЭП) [54, 55].
ЭП является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, препятствует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание.
В случае, если пациент не может/не хочет/не готов принимать назначенный объем смеси в необходимом режиме самостоятельно показано использование для энтерального питания назогастрального (-еюнального) зонда или гастростомы [35, 55].
При текущей или потенциальной необходимости проведения зондового питания продолжительностью более 6 недель, необходимо наложение гастростомы [35]
В случае, когда выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), возможно превентивное наложение гастростомы, минуя этап зондового питания
В случаях наличия у ребенка тяжелой хронической белково-энергетической недостаточности, с высоким риском ее усугубления в дальнейшем, особенно если ему еще предстоит продолжение противоопухолевого лечения необходима постановка гастростомы, минуя этап зондового питания и даже сипинга [56].
Пациентам с гастроинтестинальной дисфункцией, или длительно (более 3 недель) не получавших регулярного питания энтерально начинать энтеральную нутритивную поддержку показано с изокалорической смеси, и, если необходимо, с последующим переходом на гиперкалорическую (под контролем переносимости) [47]
Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем и/или в случаях, когда ЭП не может обеспечить потребности энергии основного обмена, показано назначение парентерального питания. В числе этих пациентов особое внимание должно уделяться детям с имеющейся белково-энергетической недостаточностью, особенно умеренной и тяжелой степени [35, 36].
Ключевым показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность (как минимум, на уровне энергопотребности основного обмена) пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе.
Начало парентерального питания необходимо производить постепенно, ступенчато увеличивая объем (и скорость) суточной инфузии, начиная от трети/половины расчетного целевого объема и, под мониторингом показателей биохимии крови (прежде всего, глюкоза, прямой билирубин, мочевина) и КЩС, за несколько суток (скорость достижения целевого объема определяется индивидуально по клинической ситуации) довести объем до целевого. Отмену парентерального питания показано производить также постепенно, ступенчато, в обратном порядке [35, 47].
А3.1.3. Справочно-информационные таблицы по оценке нутритивного статуса и его коррекции.
Таблица 13 - Интерпретация нутритивного статуса на основании Z-score согласно референсным данным ВОЗ [48]
Степень/Форма
(варианты интерпретации)
Z-скор, SDS
Показатели <*>
Ожирение морбидное
+4,00 и выше
Примечания: нутритивный статус в онкопедиатрии оценивается по совокупным данным (клинические, лабораторные, инструментальные), с учетом нутритивного риска, антропометрические показатели позволяют критериально ориентироваться в определении нутритивного статуса и не могут быть единственно определяющими [35]; <*> - в определении нутритивного статуса используется показатель с минимальным SDS; SDS - standard deviation score (величина стандартного отклонения), ожирение - простое; гипоталамическое; при нейроэндокринных заболеваниях; ятрогенное; моногенное; синдромальное.
Таблица 14 - Факторы высокого риска развития нарушений нутритивного статуса [35]
Критерии
1. Нарушения аппетита в течение ближайшей недели или особенности аппетита (избирательность, привередливость в питании, нестабильный и непостоянный аппетит и др.), выявленные анамнестически, свойственные данному ребенку с раннего возраста
2. Снижение объема потребления пищи на 1/3 - 1/2 и более от рекомендуемых возрастных норм (или снижение частоты/объема питания в динамике за неделю по данным опроса или данным пищевого дневника)
3. Потеря более 2% массы тела за неделю или более 5% за месяц
4. Исходная гастроинтестинальная дисфункция (хронические заболевания ЖКТ, непереносимость компонентов пищи и пищевая аллергия) или сформировавшаяся на фоне противоопухолевого лечения
5. Заболевания обмена веществ и/или эндокринные заболевания
6. Опухоли брюшной полости, малого таза, локализованные забрюшинно, опухоли головы и шеи
7. Предстоящая ТГСК и ранний - до 3-х месяцев - посттрансплантационный период
8. Возраст менее 3 лет
При наличии минимум двух вышеперечисленных критериев пациент относится к группе высокого нутритивного риска - вне зависимости от текущего нутритивного статуса, его текущего питания и клинической ситуации
Таблица 15 - Основные скрининговые инструменты для выявления риска нутритивных нарушений в педиатрии [57]
Скрининговый инструмент
Данные, необходимые для оценки риска
Определение степени острой и хронической БЭН
Антропометрические данные
Простая педиатрическая шкала для выявления детей с риском недоедания (PNRS)
Антропометрические данные
Прием пищи
Желудочно-кишечная дисфункция Симптомы, которые могут нарушать аппетит (боль, одышка, депрессия)
Тяжесть основного заболевания
Инструмент скрининга для оценки недоедания в педиатрии (STAMP)
Антропометрические данные
Прием пищи
Тяжесть основного заболевания
Инструмент скрининга нутритивного риска у детей в стационаре (STRONGkids)
Прием пищи
Субъективная клиническая оценка
Тяжесть основного заболевания
Потеря веса
Детская шкала недоедания по Йоркиллу (PYMS)
Индекс массы тела
Потеря веса
Изменения в приеме пищи
Инструмент нутритивного скрининга для детской онкологии (SCAN)
Тип онкологического заболевания
Интенсивность лечения (химиотерапия, лучевая терапия, ТГСК)
Желудочно-кишечная дисфункция
Прием пищи
Потеря веса
Субъективная клиническая оценка
Субъективная глобальная оценка питания (SGNA)
Антропометрические данные
Потеря веса
Желудочно-кишечная дисфункция
Клинический статус
Прием пищи
Таблица 16 - Рекомендуемые потребности детей в основных нутриентах и энергии (на кг массы тела в сутки) при расчете диетотерапии и энтерального питания [47]
Возраст
Белки,
г/кг в сутки
Жиры, г/кг в сутки
Углеводы, г/кг в сутки
Энергия, ккал/кг в сутки
Новорожденные
1,5 - 4
3 - 4
18
110 - 120
до 1 года
1 - 2,5
3 - 4
16 - 18
90 - 100
1 - 2 года
1 - 2
2 - 3
12 - 14
75 - 90
3 - 6 лет
10 - 12
75 - 90
7 - 12 лет
до 12
60 - 75
13 - 18 лет
до 10
30 - 60
Примечания: Потребности приведены для ориентировки расчета и назначения энтерального питания; они не отменяют и не заменяют пациент-ориентированный подход в назначении нутритивной поддержки: в каждом конкретном случае следует учитывать клиническую картину, возможные метаболические и органные дисфункции и корректировать поступление нутриентов с учетом возможности и переносимости ребенком.
Приложение А3.2
ПРОФИЛАКТИКА
И ЛЕЧЕНИЕ ТОШНОТЫ И РВОТЫ, ОБУСЛОВЛЕННЫХ ПРОВЕДЕНИЕМ
ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
А3.2.1 Определение уровня эметогенности и варианта профилактики ТИР
Для выбора адекватного режима профилактики ТИР на первом этапе необходимо определение уровня эметогенности (риска развития ТИР) режима противоопухолевой терапии, который планируется использовать у пациента. Уровень эметогенности влияет на выбор препаратов для профилактики ТИР, их дозы и длительность применения [37]. В Приложении А3.2.6. (Таблица 17) представлена общая классификация эметогенности препаратов химиотерапии согласно рекомендациям ASCO (American Society of Clinical Oncology [58] и рекомендациям COG (Children Oncology Group) [37]
А3.2.2 Профилактика тошноты и рвоты на фоне высокоэметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, для детей в возрасте от 5 лет и/или массой 15 кг и более использование четырехкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов, прочие противорвотные препараты (A04AD), #дексаметазон**, и #оланзапин** [59 - 62]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
Если в режим противоопухолевой терапии входит кортикостероиды системного действия (H02) в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения кортикостероида системного действия (H02) для профилактики ТИР в этот день не требуется. Использование #оланзапина** у детей в возрасте менее 5 лет и/или массой тела менее 15 кг не исследовалось и не может быть рекомендовано.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 3-х дней после завершения введения препаратов химиотерапии, использование комбинации #дексаметазона** и #оланзапина** [62, 63]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
В случае отсутствия возможности назначения прочих противорвотных препаратов (A04AD), использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов, #дексаметазона** и #оланзапина** [60, 62, 64]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
В случае отсутствия возможности назначения #дексаметазона** в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов используется палоносетрона** в комбинации с прочими противорвотными препаратами (A04AD), (при возможности назначения) и #оланзапином** [37, 65]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
А3.2.3 Профилактика тошноты и рвот на фоне умеренно эметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, использование двухкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов и #дексаметазон** [37, 61]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
Если в режим противоопухолевой терапии входит кортикостероид системного действия (HO2) в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения кортикостероида системного действия (HO2) для профилактики ТИР в этот день не требуется.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 1 дня после завершения введения цитостатиков (по АТХ классификации L: Противоопухолевые препараты и иммуномодуляторы), использование #дексаметазона** [37, 61]. Режимы и дозы представлены в Приложении А3.2.6 (Таблица 17).
В случае отсутствия возможности назначения #дексаметазона** использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов и прочих противорвотных препараты (A04AD) [37, 61]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
В случае отсутствия возможности назначения и #дексаметазона**, и прочих противорвотных препараты (A04AD) в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов использование палоносетрона** [37, 61]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
А3.2.4 Профилактика тошноты и рвоты на фоне низко- и минимально эметогенной химиотерапии
Профилактика ТИР на фоне низко- и минимально эметогенной химиотерапии включает в себя однокомпонентную профилактику, включающей блокатор серотониновых 5HT3-рецепторов, при низкоэметогенной терапии или же вовсе отсутствие ее в случае химиотерапии с минимальной эметогенной активностью [37]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 18).
А3.2.5 Лечение прорывной и рефрактерной рвоты
Пациентам с прорывной и рефрактерной рвотой на фоне цитостатической терапии рекомендовано:
1. Если прорывная ТИР возникла на фоне цитостатической терапии (и соответственно профилактики), относящейся к минимально, низко- или среднеэметогенному уровню, то необходимо использовать препараты, предусмотренные следующим, более высоким уровнем профилактики.
2. Если пациент и так получает профилактику, предусмотренную для высокоэметогенной терапии, то при возникновении прорывной ТИР необходимо рассмотреть вопрос о добавлении #оланзапина** (если он не применялся ранее в связи с неподходящим возрастом или массой тела). При невозможности использовать #оланзапин** в качестве альтернативы может быть применен метоклопрамид**.
3. В случае, если у пациента наблюдается рефрактерная ТИР и он еще не получает максимальный уровень профилактики, то необходимо провести эскалацию противорвотной терапии. Если рефрактерная ТИР наблюдается на фоне максимального уровня профилактики, возможна замена использующегося блокатора серотониновых 5HT3-рецепторов на палоносетрон, введение дополнительных доз блокаторов серотониновых 5HT3-рецепторов. При неудаче этих подходов к профилактике рекомендуется на постоянной основе добавить #оланзапин**, метоклопрамид** или другие препараты, показавшие у пациента эффективность при лечении прорывной рвоты [66].
А3.2.6 Таблица 17 - Уровень эметогенности противоопухолевых препаратов
Степень эметогенности (риск развития рвоты)
Рекомендации COG 2022 (педиатрические)
+
Рекомендации ASCO 2020 (общие для взрослых и детей)
Высокая (> 90%)
Монотерапия
#Аспарагиназа** (в/в) >= 20 000 МЕ/м2
#Бусульфан** (в/в) >= 0,8 мг/кг
#Бусульфан** (р.о.) >= 1 мг/кг
#Дакарбазин** (в/в)
#Дактиномицин (в/в) >= 1,35 мг/м2
Доксорубицин** (в/в) >= 30 мг/м2
#Идарубицин** (р.о.) >= 30 мг/м2
#Карбоплатин** (в/в) >= 175 мг/м2
#Кармустин** (в/в)
#Мелфалан** (в/в)
Метотрексат** (в/в) >= 12 г/м2
Цисплатин** (в/в) >= 12 мг/м2
#Циклофосфамид** (в/в) >= 1200 мг/м2
#Цитарабин** (в/в) >= 3 г/м2/сутки
Комбинированные режимы
#Дакарбазин** >= 250 мг/м2 (в/в) + доксорубицин** (в/в) >= 60 мг/м2
#Дактиномицин** 900 мкг/м2 (в/в) + #ифосфамид** 3 г/м2
#Циклофосфамид** > 600 мг/м2 + #дактиномицин** >= 1 мг/м2
#Циклофосфамид** >= 400 мг/м2 + доксорубицин** >= 40 мг/м2
#Цитарабин** >= 90 мг/м2 (в/в) +
метотрексат** (в/в) >= 150 мг/м2
#Этопозид** (в/в) >= 60 мг/м2 +
#ифосфамид** (в/в) >= 1,2 г/м2
#Этопозид** (в/в) >= 250 мг/м2 +
тиотепа (в/в) >= 300 мг/м2
Умеренная
(31 - 90%)
Монотерапия
#Алемтузумаб** (в/в)
#Бендамустин** (в/в)
#Дактиномицин (в/в) 10 мг/кг
#Даунорубицин** (в/в)
Доксорубицин** (в/в) 25 мг/м2
#Идарубицин** (в/в)
#Иксабепилон** (в/в) 3 - 10 мг/м2
#Иматиниб** (р.о.) > 260 мг/м2/сутки
#Интерферон альфа** (в/в) 15 - 30 млнМЕ/м2/сутки
#Иринотекан** (в/в)
#Ифосфамид** (в/в)
#Карбоплатин** (в/в)
#Клофарабин (в/в)
Метотрексат** (в/в) 5 г/м2
Метотрексат** (и/т)
#Оксалиплатин** (в/в)
#Темозоломид** (в/в)
Тиотепа (в/в)
#Циклосфамид** (в/в) 1000 мг/м2
#Цитарабин** (в/в) 75 мг/м2
Эпирубицин** (в/в)
Комбинированные режимы
#Цитарабин** (в/в) 100 мг/м2 +
#Даунорубицин** (в/в) 45 мг/м2 +
#Этопозид** (в/в) 100 мг/м2 +
#Преднизолон** (р.о.)
#Цитарабин** 60 или 90 мг/м2 +
Метотрексат** 120 мг/м2
Низкая
(10 - 30%)
Монотерапия
#Афлиберцепт** (в/в)
#Блинатумомаб** (в/в)
#Децитабин (в/в)
#Доцетаксел** (в/в)
#Гемцитабин** (в/в)
#Гефитиниб** (р.о.) 150 - 500 мг/м2/сутки
#Иматиниб** (р.о.) 260 мг/м2/сутки
#Инотузумаб озогамицин (в/в)
#Кабазитаксел** (в/в)
#Карфилзомиб** (в/в)
#Мелфалан** (р.о.) 0,2 мг/г
#Меркаптопурин** (р.о.) <= 4,2 мг/кг
Метотрексат** (в/в) 38 - 83 мг/м2
#Митоксантрон** (в/в) <= 33 мг/м2
Митомицин** (в/в)
#Неларабин** (в/в)
#Паклитаксел** (в/в)
#Панитумумаб** (в/в)
#Доксорубицин** (в/в)
#Пеметрексед** (в/в)
#Пертузумаб** (в/в)
#Прокарбазин (р.о.) 50 - 100 мг/м2/сути
#Руксолитиниб** (р.о.) 15 - 21 мг/м2
#Селуметиниб (р.о.) 20 - 30 мг/м2
#Сорафениб** (р.о.) 150 - 325 мг/м2
#Темозоломид** (р.о.) 200 мг/м2
#Темсиролимус (в/в)
#Топотекан** (в/в)
#Фторурацил** (в/в)
#Цетуксимаб** (в/в)
#Циклофосфамид** (в/в) 500 мг/м2
#Циклофосфамид** (р.о.) 2 - 3 мг/кг
#Эверолимус** (р.о.) 0,8 - 9 мг/м2/сутки
#Элотузумаб** (в/в)
#Энфортумаб ведотин (в/в)
#Эрлотиниб** (р.о.) 35 - 150 мг/м2/сутки
#Эрибулин** (в/в)
#Этопозид** (в/в)
Комбинированная терапия
#Цитарабин** (в/в) 60 мг/м2 + метотрексат** (в/в) 90 мг/м2
Минимальная (< 10%)
Монотерапия
#Авелумаб** (в/в)
#Атезолизумаб** (в/в)
#Бевацизумаб** (в/в)
Блеомицин** (в/в)
#Бусульфан** (в/в)
#Винбластин** (в/в)
#Винкристин** (в/в) <= 1,5 мг/м2
#Винорелбин** (в/в)
#Даратумумаб** (в/в)
#Доксорубицин** (в/в) 10 мг/м2
#Дурвалумаб** (в/в)
#Ипилимумаб** (в/в)
#Кладрибин** (в/в)
#Доксорубицин** (в/в) <= 50 мг/м2
#Меркаптопурин** (р.о.) <= 4.2 мг/кг
Метотрексат** (р.о.) <= 10 мг/м2
Ниволумаб** (в/в)
#Обинутузумаб** (в/в)
#Офатумумаб (в/в)
#Пембролизумаб** (в/в)
#Полатузумаб ведотин (в/в)
#Рамуцирумаб** (в/в)
#Ритуксимаб** (в/в)
#Трастузумаб** (в/в)
#Хлорамбуцил** (р.о.) <= 0.2 мг/кг/сутки
#Флударабин** (в/в)
Комбинированные режимы
#Меркаптопурин** (р.о.) <= 2.5 мг/кг + метотрексат** (р.о.) <= 0.1 мг/кг/сутки
Цисплатин** <= 60 мг/м2 (в/а) + доксорубицин** <= 30 мг/м2 (в/а)
А3.2.7 Таблица 18 - Дозы и режимы противорвотных препаратов
Степень эметогенности
Режимы
Дозы
Высокая
Блокаторы серотониновых 5HT3-рецепторов
+
#Дексаметазон**
+
Прочие противорвотные препараты (A04AD)
+
#Оланзапин**
I. #Дексаметазон**
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 внутривенно/перорально все дни химиотерапии и три дня после ее завершения;
2. Дети, получающие химиотерапию с умеренной эметогенной активностью:
<= 0,6 м2: 2 мг внутривенно/перорально каждые 12 часов;
> 0,6 м2: 4 мг внутривенно/перорально каждые 12 часов.
При одновременном применении с #апрепитантом необходимо уменьшение дозы #дексаметазона** на 50%.
II. Блокаторы серотониновых 5HT3-рецепторов
#Гранисетрон
1. Дети, получающие высокоэметогенную химиотерапию: 40 мкг/кг внутривенно однократно.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 40 мкг/кг внутривенно однократно.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 40 мкг/кг внутривенно однократно.
#Ондансетрон**
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 (0,15 мг/кг) внутривенно/перорально перед терапией однократно, а затем каждые 8 часов.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 5 мг/м2 (0,15 мг/кг; максимум 8 мг) внутривенно/перорально перед терапией однократно, а затем каждые 12 часов.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 10 мг/м2 (0,3 мг/кг; максимум 16 мг внутривенно или 24 мг перорально) до начала терапии однократно.
Палоносетрон**
1. Дети от 1 месяца до 17 лет: 0,02 мг/кг (максимум 1,5 мг) внутривенно один раз перед терапией.
2. Дети 17 лет и старше: 0,5 мг внутривенно однократно перед терапией.
III. Прочие противорвотные препараты (A04AD)
#Апрепитант
Дети старше 6 месяцев:
- 1-й день: 3 мг/кг (максимум 125 мг) перорально 1 раз в сутки за 1 час до химиотерапии
- 2-й и 3-й дни: 2 мг/кг (максимум 80 мг) перорально один раз в сутки.
Блокаторы серотониновых 5HT3-рецепторов +
#Дексаметазон**
+
Прочие противорвотные препараты (A04AD)
Блокаторы серотониновых 5HT3-рецепторов +
#Дексаметазон**
+
#Оланзапин**
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
+
#Оланзапин**
+/-
Прочие противорвотные препараты (A04AD)
Умеренная
Блокаторы серотониновых 5HT3-рецепторов
+
#Дексаметазон**
Блокаторы серотониновых 5HT3-рецепторов
+
Прочие противорвотные препараты (A04AD)
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон**)
Низкая
Блокаторы серотониновых 5HT3-рецепторов
Минимальная
Блокаторы серотониновых 5HT3-рецепторовили
отсутствие профилактики
#Фосапрепитант
1. Дети от 6 месяцев до 2-х лет: 5 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
2. Дети от 2-х до 12 лет: 4 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
3. Дети от 12 до 17 лет: 150 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день
Комбинация #апрепитант + #фосапрепитант
1. Дети от 6 месяцев до 12 лет:
- 3 мг/кг (максимальная доза 115 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
- 2 мг/кг (максимальная доза 80 мг) перорально, дни 2, 3;
2. Дети от 12 до 17 лет:
- 115 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день
- 80 мг перорально, дни 2, 3.
IV. #Оланзапин**
1. Дети весом от 30 кг - 0,07 мг/кг (от 30 до 55 кг - 2,5 мг/сут, свыше 55 кг - 5 мг/сут) перорально за 1 час до введения противоопухолевых препаратов и иммуномодуляторов (L), все дни химиотерапии и три дня после ее завершения;
2. Дети весом > 15 и < 30 кг - 2,5 мг/сут перорально за 1 час до введения противоопухолевых препаратов и иммуномодуляторов (L), все дни химиотерапии и три дня после ее завершения;
Для детей весом менее 15 кг и/или возрастом менее 5 лет - неприменимо в силу отсутствия данных исследований об эффективности и безопасности #оланзапина**.
Приложение А3.3
ГЕМОТРАНСФУЗИОННАЯ ПОДДЕРЖКА
Приказ Министерства здравоохранения РФ от 28 октября 2020 г. N 1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология", зарег. в Минюсте РФ 27.11.2020 N 61123 регламентирует порядок гемотрансфузионной поддержки пациентов, нуждающихся в оказании такого рода медицинской помощи.
Эритроцитные компоненты крови
Детям со злокачественными новообразованиями, получающими химио- и/или лучевую терапию, при тяжелой анемии (Hв < 70 г/л, Ht < 25%) с проявлениями симптомов и признаков анемической гипоксии и без кровотечений рекомендуются трансфузии эритроцитных компонентов крови [67]. Трансфузии могут не потребоваться для хорошо компенсированных пациентов, восстанавливающихся после индуцированной аплазии. Однако, в случае предстоящей интенсивной химиотерапии в отсутствие клинических проявлений анемического синдрома трансфузии эритроцитных компонентов крови могут быть оправданы. Решение о применении трансфузий должно обосновываться, прежде всего, клиническими, а не лабораторными данными [67]. Стабильным пациентам детского возраста со злокачественными новообразованиями в отсутствие кровотечений рекомендуется проводить трансфузии эритроцитных компонентов в дозе 10 - 15 мл на кг массы тела [68]. Пациентам детского возраста с онкологическими заболеваниями рекомендуется проводить трансфузии лейкоредуцированных компонентов крови [68]. Было показано, что применение лейкоредуцированных компонентов крови позволяет снизить частоту фебрильных негемолитических трансфузионных реакций, а также существенно снижает вероятность HLA-аллоиммунизации пациента и передачу некоторых гемотрансмиссивных инфекций (цитомегаловирус, вирус Эбштейн-Барра).
Тромбоцитный концентрат
У детей со злокачественными новообразованиями и гипопролиферативной тромбоцитопенией, вызванной основным заболеванием и/или его лечением, рекомендуются профилактические трансфузии тромбоцитного концентрата при следующих условиях [68]:
- стабильным новорожденным при снижении количества тромбоцитов <= 25 x 109/л;
- стабильным пациентам при снижении количества тромбоцитов <= 10 x 109/л;
- пациентам с лихорадкой при снижении количества тромбоцитов <= 15 x 109/л;
- у пациентов с повышенным риском кровотечений при снижении количества тромбоцитов <= 20 x 109/л;
- перед выполнением малой хирургической манипуляции в некритических локусах при снижении количества тромбоцитов <= 20 x 109/л;
- перед выполнением люмбальной пункции, при снижении количества тромбоцитов <= 40 x 109/л;
- перед выполнением чрескожной биопсии печени, если количество тромбоцитов <= 50 x 109/л;
- при хирургических вмешательства в критических сайтах (например, центральная нервная система), если количество тромбоцитов <= 75 - 100 x 109/л;
- перед иными оперативными вмешательствами при количестве тромбоцитов <= 50 x 109/л
Повышенный риск кровотечений имеют пациенты получающие антикоагулянты (антитромботические средства), пациенты с ДВС, сепсисом и др.
Трансфузии тромбоцитного концентрата у детей с гипопролиферативной тромбоцитопенией и геморрагическим синдромом рекомендуются при [68]:
- малом геморрагическом синдроме и снижении количества тромбоцитов <= 10 x 109/л;
- умеренном геморрагическом синдроме и снижении количестве тромбоцитов <= 20 x 109/л;
- тяжелом геморрагическом синдроме и снижении количестве тромбоцитов <= 30 x 109/л;
- при кровотечении в критически важной локализации (например, ЦНС) синдроме и снижении количестве тромбоцитов <= 100 x 109/л
Трансфузии тромбоцитов у детей со злокачественными новообразованиями рекомендуются в следующей дозе [68]:
- новорожденные 10 - 15 мл/кг
- дети с массой тела более 10 кг: 10 мл/кг
Донорская плазма
Трансфузии донорской плазмы крови рекомендуются детям с онкологическими заболеваниями при наличии клинически-значимого кровотечения в сочетании с повышением активированного частичного тромбопластинового времени (АЧТВ) и/или международного нормализованного отношения (МНО) более чем в 1,5 раза от верхней границы нормы [68].
Трансфузии донорской плазмы детям со злокачественными новообразованиями рекомендованы в дозе 15 мл/кг массы тела [68].
Криопреципитат (фактор свертывания крови VIII**)
- Трансфузии криопреципитата (фактор свертывания крови VIII**) у детей с онкологическими заболеваниями рекомендуются при снижении концентрации фибриногена менее 1 - 1.5 г/л.
- Трансфузии криопреципитата (фактор свертывания крови VIII**) при приобретенном дефиците фибриногена, вызванном различными причинами, рекомендуются при снижении его концентрации в сыворотке менее 1 г/л.
- Трансфузии криопреципитата (фактор свертывания крови VIII**) при снижении его концентрации в крови ниже 1,5 г/л рекомендованы для пациентов при тяжелом интраоперационном кровотечении и у пациентов с сепсисом при развитии геморрагического синдрома.
- Трансфузии криопреципитата (фактор свертывания крови VIII**) рекомендованы в дозе 1 единица на каждые 5 кг массы тела больного [69].
Приложение А3.4
ОСОБЕННОСТИ
ВЕНОЗНОГО ДОСТУПА В ОБЕСПЕЧЕНИИ УСПЕШНЫХ ДИАГНОСТИЧЕСКИХ
И ЛЕЧЕБНЫХ МЕРОПРИЯТИЙ
3.4.1 Общие особенности венозного доступа.
Прилагаемая производителем инструкция и документация к устройству венозного доступа позволяет предоставить ключевую информацию об устройстве, возможных скоростях и ограничении давления при введении, объеме заполнения устройства всему персоналу занимающемуся ежедневным уходом за пациентом или проводящим диагностические процедуры [70]. Данная документация должна быть быстро и постоянна доступна персоналу, работающему с пациентом.
3.4.2 Рекомендации по выбору устройства
Выбор устройства венозного доступа должен основываться на потребностях пациента и учитывать:
- Диагноз, план ведения и ожидаемую продолжительность внутривенного лечения;
- Возраст пациента;
- Возможные предпочтения пациента в отношении типа или расположения устройства;
- Состояние вен пациента;
- Доступные ресурсы для установки и поддержания работоспособности устройства.
Не существует достаточных доказательств для однозначного преимущества одного устройства перед другим для каждой категории пациентов. Желательно использовать катетер с наименьшим числом просветов [71].
При наличии противопоказаний к введению катетера через вены бассейна верхней полой вены используются бедренно-вводимые центральные катетеры.
Для постоянного использования (ежедневно или хотя бы один раз в неделю) рекомендуется применять внешние катетеры такие как PICC, CICC и FICC, для периодического использования (реже одного раза в неделю) - полностью имплантированные системы (порт) [70].
3.4.3 Рекомендации по установке устройства
Устройство центрального венозного доступа вводится по срочным и плановым показаниям в условиях асептического операционного зала. Подробное описание имеется в клинических рекомендациях ФАР.
Выбор вены зависит от состояния венозной системы пациента. Предпочтительнее использовать устройства, позволяющие вводить высокие потоки и контрастные средства [72, 73]. Следует стремиться чтобы соотношение диаметра катетера к диаметру вены не превышало 1/3.
Использование многопросветных катетеров, хоть и показано некоторым специфическим категориям пациентов, но при этом связано с повышенным риском инфицирования [74, 75].
Выбирать материал катетера необходимо, основываясь на высоких характеристиках потока и сопротивления давлению, а также долговечности устройств.
Введение катетера путем хирургического разреза вены не желательно у пациентов, страдающих онкогематологическими заболеваниями [76]. Для катетеров из полиуретана используется цианакрилатный тканевой клей, для силиконовых катетеров он в практике не используется [77].
3.4.4 Уход за венозным доступом и его удаление.
Уход за венозным доступом осуществляется с соблюдением правил асептики и антисептики, показана периодическая смена повязки, промывание венозного доступа, его "закрытие" в случае прерывистого характера лечения, удаление в соответствие с показаниями [78, 79].
Приложение А3.5
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ИНФЕКЦИЙ
3.5.1 Используемые стандартные определения [81 - 83]
Нейтропения определяется количеством гранулоцитов менее 0,5 x 109/л, либо менее 1,0 x 109/л с ожидаемым снижением в течение нескольких последующих дней.
Фебрилитет - однократный подъем температуры тела >= 38,3 °C или температура тела >= 37,8 °C, сохраняющаяся в течение одного и более часа.
Гипотермия - снижение температуры тела менее 36 °C. Данный показатель является важным признаком инфекционного процесса, особенно у детей младшего возраста и у пациентов, получающих глюкокортикостероиды.
Лихорадка неясной этиологии - состояние, характеризующееся фебрилитетом при отсутствии клинико-рентгенологических проявлений инфекции и микробиологических данных.
Бактериемия - идентификация микроорганизма из гемокультуры, взятой во время фебрильного эпизода, не являющегося присевным. К ложной бактериемии относится идентификация так называемых присевных микроорганизмов - комменсалов кожи рук: коагулазонегативных стафилококков, Propionibacterium spp., Micrococcus spp., и др. - в случае их однократной идентификации.
Доказанной является инфекция, при которой имеется идентификация микроорганизма из стерильных субстратов организма (кровь, ликвор, моча, биопсийный материал) при наличии симптомов воспалительной реакции, либо изоляция патогена из нестерильных субстратов (кожа, слизистые, желудочно-кишечный тракт) при соответствующей локальной клинической картине инфекции.
Вероятной является инфекция, при которой нет идентификации микроорганизма из исследуемых сред, а имеются клинические и/или радиологические признаки инфекции с быстрым ответом на противоинфекционную терапию.
Фебрильная нейтропения - симптомокомплекс, сочетающий развитие фебрилитета или гипотермии у пациента с критериями нейтропении. Является наиболее ожидаемым инфекционным осложнением и развивается у подавляющего большинства пациентов группы высокого риска, реже - у пациентов стандартного риска.
Пациенты с НФК относятся к стандартной группе риска. В данной группе ожидаемая продолжительность нейтропении менее 7 дней.
3.5.2 Пациентам с НФК при подозрении на фебрильную лихорадку показано:
1. Проведение гемокультивирования (микробиологического исследования крови на стерильность) [80 - 83].
2. Определение при положительном результате микробиологического исследования крови чувствительности к антибактериальным препаратам микроорганизмов, выделенных из крови и/или определение чувствительности к противогрибковым препаратам грибов, выделенных из крови, для назначения адекватного лечения [80 - 83].
3. Проведение при болях в животе и/или задержке стула более 3-х дней - ультразвуковое исследование органов брюшной полости и почек; при наличии респираторной симптоматики в виде кашля, одышки, десатурации, болей в грудной клетке - компьютерную томографию органов грудной полости, при признаках синусита - компьютерной томографии придаточных пазух носа [84].
4. Проведение вирусологического исследования мазков слизистой носоглотки и ротоглотки на респираторные вирусы, включая новую коронавирусную инфекцию COVID-19 [85 - 87].
5. Проведение микробиологического исследования при наличии симптомов мукозита/гингивита мазка слизистой ротоглотки, а также ПЦР вируса простого герпеса [85 - 87].
6. Определение токсинов A и B клостридиум диффициле (Clostridium difficile) в образцах кала, а также определение группы "кишечных" вирусов: ротавирус, норовирус, аденовирус (методом ПЦР или иммунохроматографии) при наличии диареи [88, 89].
7. Проведение мониторинга определения галактоманнанового антигена грибов рода аспергилл (Aspergillus spp) при длительности ФН от 7 дней и более [90 - 92].
8. Проведение определения галактоманнанового антигена грибов рода аспергилл (Aspergillus spp) в жидкости БАЛ при выявлении пневмонии [90 - 92].
9. Определение маннанового антигена грибов рода кандида (Candida spp.) в крови и определение антител к грибам рода кандида (Candida spp.) в крови для исключения диссеминированного/инвазивного кандидоза при наличии очагов в печени [93, 94].
3.5.3 Антибиотикотерапия
При развитии фебрильной нейтропении после забора крови для гемокультивирования показано незамедлительное внутривенное назначение антибактериальных препаратов системного действия (J01) - при стабильном состоянии пациентов максимально допустимый интервал не должен превышать 60 минут, а в случае нестабильной гемодинамики 30 минут [80, 95, 96]. Все остальное обследование в необходимом объеме должно быть проведено после назначения стартовой терапии.
При развитии ФН необходимо инициировать эмпирическую антибиотикотерапию широкого спектра с активностью против грамположительных и грамотрицательных бактерий, включая синегнойную палочку. Выбор стартовой терапии зависит от группы риска, соматического состояния пациента, локальных эпидемиологических данных и рекомендаций, а также результатов скрининга и предшествующего инфекционного анамнеза пациента [80, 96, 97]. Для пациентов стандартной группы риска показано назначение цефалоспоринов 3-го поколения (J01DD) [97, 98].
Целесообразные варианты эмпирической антибиотикотерапии:
- #Пиперациллин + [Тазобактам] (по 4,5 каждые 6 часов либо 300 (400) мг/кг/сут за 3 - 4 введения или непрерывной инфузией +/- #амикацин** 15 - 20 мг/кг/сут за одно введение) [99];
- цефепим** (по 2 г x 3 раза либо 100 - 150 мг/кг/сут за 3 введения +/- #амикацин** 15 - 20 мг/кг/сут за одно введение) [99];
- цефоперазон + [сульбактам]** (4 г x 2 раза либо 160 мг/кг/сут по цефоперазону за 3 введения +/- #амикацин** 15 - 20 мг/кг/сут за одно введение) [99];
- цефтазидим** (по 2 г x 3 раза либо 100 - 150 мг/кг/сут за 3 введения)
1. В клиниках с низкой частотой детекции энтеробактерий с продукцией БЛРС допустимо назначение:
- цефепим** (по 2 г x 3 раза либо 100 - 150 мг/кг/сут за 3 введения);
- цефтазидим** (2 г x 3 раза, внутривенно либо 100 - 150 мг/кг/сут за 3 введения).
Назначение ванкомицина** в дополнение к базовому препарату в первой линии терапии показано при развитии язвенно-некротического стоматита, поражении мягких тканей, подозрении на катетерную инфекцию (до получения микробиологического подтверждения), у пациентов после проведения ХТ с применением высоких доз цитарабина**, а также в случае предшествующей колонизации пациента метициллин-резистентным золотистым стафилококком (МРЗС);
2. При тяжелой инфекции в 1-й линии терапии могут быть назначены карбапенемы (интра-абдоминальная инфекция, поражение мягких тканей параректальной области и др.):
- #Имипенем + [Циластатин]** (по 0,5 - 1,0 гр каждые 6 - 8 часов либо 80 - 100 мг/кг/сут за 3 - 4 введения + #амикацин 15 - 20 мг/кг/сут за одно введение) [99];
- #Меропенем** (по 2,0 каждые 8 часов либо 100 - 120 мг/кг/сут за 3 введения + #амикацин** 15 - 20 мг/кг/сут за одно введение) [99];
3. При подозрении на развитие анаэробной инфекции (гингивит, целлюлит периоральной области, интраабдоминальная или параректальная инфекция) необходимо назначение антибиотиков, обладающих антианаэробной активностью (#пиперациллин + [тазобактам], #имипенем + [циластатин]**, #метронидазол**, #клиндамицин**).
4. При развитии клостридиальной инфекции или диареи при невозможности определения токсина C. difficile в кале - #метронидазол** (0,5 г каждые 8 часов, внутривенно или 10 мг/кг каждые 8 часов. При тяжелом течении энтероколита возможно пероральное назначение ванкомицина** в суточной дозе 500 мг [100].
5. При аллергии на бета-лактамные антибактериальные: пенициллины в качестве альтернативной схемы могут быть назначены фторхинолоны:
#Левофлоксацин** (750 мг/сут либо 10 мг/кг x 2 р/сут - детям до 5 лет, далее по 10 мг/кг/сут за одно введение) [101]
Модификация противомикробной терапии проводится на основании клинических симптомов, инструментальных и микробиологических исследований. При сохранении фебрилитета и стабильном клиническом состоянии пациентов, допустимо ожидать клинического ответа на стартовую антибактериальную терапию в течение 48 - 72-х часов, поскольку лихорадка не является единственным показателем тяжести инфекционного процесса. У больных с персистирующей фебрильной нейтропенией и отрицательной гемокультурой при модификации учитывают чувствительность грамотрицательных бактерий, колонизирующих слизистую оболочку кишечника. Препаратами резервной группы являются колистиметат натрия, полимиксин B**, #тигециклин**, #цефтолозан + [тазобактам]**, цефтазидим + [авибактам]** (в некоторых ситуациях в комбинации с азтреонамом**).
Рекомендованные дозы:
- #Колистиметат натрия - нагрузочная доза 118 000 МЕ/кг (максимально 720 мг) за 4 часа, далее по 75 000 МЕ/кг каждые 12 часов (максимально 320 мг x 2 р/сут) [102]
- Полимиксин B** (2,5 мг/кг/сут за 2 введения; у детей до 1 года 4 мг/кг/сут за 2 введения)
- #Тигециклин** - нагрузочная доза 2 мг/кг (100 мг), далее по 1,2 мг/кг (50 мг) каждые 12 часов [103]
- #Цефтазидим + [авибактам]** 2,5 г x 3 р/сут или 120 - 150 мг/кг/сут по ЦФ за 3 введения - каждое введение 2 - 3 часа [104]
- При необходимости назначения #цефтазидим + [авибактам]** в комбинации с азтреонамом** препараты должны вводиться одновременно параллельными инфузиями.
При развитии признаков сепсиса и септического шока следует назначить антибактериальные препараты системного действия: карбапенемы в сочетании с аминогликозидами и ванкомицином**, а пациентам с известной колонизацией - препараты группы резерва. При развитии тяжелых инфекционных осложнений и/или сепсиса антибактериальные препараты назначаются в максимальных дозах, предпочтительно пролонгированными инфузиями в связи с нарушением клиренса и перераспределением жидкости в организме [45 - 48].
При развитии инфекций, ассоциированных с грамположительной флорой, выбор антибактериальных препаратов должен проходить с учетом данных чувствительности и наибольшей эффективности в контексте конкретной клинической ситуации:
При инфекции кровотока, эндокардите, инфекции, ассоциированной с инородным устройством предпочтение необходимо отдавать препаратам, обладающим бактерицидной активностью - ванкомицину**, даптомицину** (8 - 10 мг/кг/сут за одно введение), цефтаролину фосамилу** (600 мг x 3 р/сут или 12 мг/кг x 3 р/сут);
При развитии пневмонии - препаратам, обладающим большей биодоступностью в ткань легких - линезолиду** (600 мг x 2 р/сут или 10 мг/кг x 3 р/сут детям младше 12 лет), ванкомицину**;
При поражении мягких тканей - линезолиду**, даптомицину**, #тигециклину**, ванкомицину**
3.5.4 Эмпирическое назначение противогрибковых препаратов
При сохранении фебрилитета в течение 96 - 120 часов, несмотря на проводимую эмпирическую антибактериальную терапию первой и второй линий, и отсутствие очагов инфекции начало эмпирической противогрибковой терапии [105 - 107]:
- Каспофунгин** 70 мг в первые сутки, далее по 50 мг внутривенно 1 раз в сутки или 70 мг/м2 в первые сутки и далее по 50 мг/м2/сут)
- Амфотерицин B [липосомальный] (3 мг/кг/сут за 1 введение)
- Альтернативными препаратами являются другие противогрибковые препараты системного действия (микафунгин** 100 мг один раз в сутки внутривенно или 2 - 4 мг/кг в сутки (детям первого месяца жизни доза может быть увеличена до 10 мг/кг/сут); анидулафунгин** (препарат выбора для пациентов с печеночной недостаточностью) 200 мг в первые сутки, далее по 100 мг 1 раз в сутки или 3 мг/кг в первые сутки, далее 1,5 мг/кг/сутки);
- Амфотерицин B [липидный комплекс] (5 мг/кг/сут за 1 введение).
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Схема N 1. Алгоритм лечения пациента с НФК
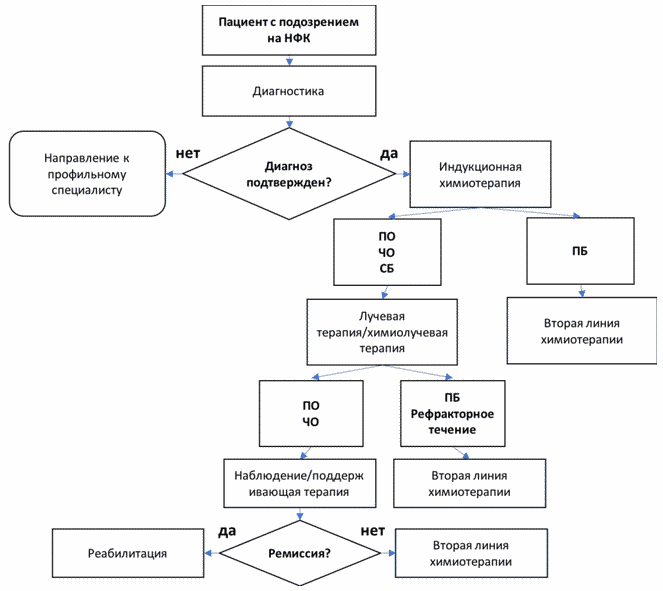
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое назофарингеальная карцинома?
Назофарингеальная карцинома - это злокачественное эпителиальное новообразование носоглотки. В 98% случаев назофарингеальная карцинома ассоциирована с вирусом Эпштейн-Барр. В структуре детской онкологии рак носоглотки встречается крайне редко. Однако, несмотря на редкость, назофарингеальная карцинома является одной из немногих эпителиальных злокачественных опухолей, довольно часто встречающихся в детском и подростковом возрасте.
Симптомы назофарингеальной карциномы
В связи с локализацией назофарингеальная карцинома крайне редко дает симптомы на ранних стадиях, в случае же их возникновения чаще всего они неспецифичны. Условно все симптомы можно разделить на четыре основные группы: носовые, ушные, неврологические и симптомы, ассоциированные с метастазированием.
Ранними считаются первые две группы симптомов, которые являются собственно носоглоточными, так как обусловлены ростом опухоли в пределах носоглотки. Ранние симптомы практически невозможно отличить от проявлений острых респираторных заболеваний. Настораживающим фактором может явиться длительное рецидивирующее течение, отсутствие эффекта от симптоматической и патогенетической терапии. Неврологические симптомы и регионарные метастазы свидетельствуют о распространении процесса за пределы носоглотки и вовлечении регионарного лимфатического коллектора.
1. Ранние симптомы - симптомы острого респираторного заболевания (носовые и ушные):
- Длительный рецидивирующий насморк;
- Кашель;
- Субфебрильная температура.
- Затруднение носового дыхания;
- Выделения из носа;
- Частые носовые кровотечения;
- Гнусавость;
2. Поздние симптомы (неврологические):
- Головные боли;
- Снижение слуха;
- Увеличение шейных лимфатических узлов;
- Деформация ротоглотки, лица и шеи;
- Черепно-мозговые и офтальмологические расстройства;
- Ихорозный запах;
- Некротические массы из носовых ходов.
Диагностика
Ранняя диагностика назофарингеальной карциномы включает лабораторные, инструментальные обследования и консультации узких специалистов. В рамках лабораторной диагностики целесообразно оценить клинический анализ крови, в котором обычно наблюдается лейкоцитоз, снижение уровня гемоглобина и эритроцитов, а также проводится серологическое тестирование на вирус Эпштейн-Барр.
Следующим этапом диагностики является рентгенологическое исследование, а именно боковой снимок носоглотки и прямой снимок придаточных пазух носа. В случае выявления подозрительной рентгенологической картины необходимо проведение компьютерной томографии или магнитно-резонансной томографии головы с контрастным усилением.
Еще одним важным этапом в диагностике является консультация отоларинголога с последующей эпифарингоскопией.
В подавляющем большинстве случаев (80%) при назофарингеальной карциноме поражаются регионарные лимфатические узлы. При раке носоглотки метастатическое поражение лимфатических узлов шеи появляется в течение первых месяцев заболевания. В большинстве случаев первыми признаками рака носоглотки, ведущими к постановке диагноза, являются именно увеличенные шейные лимфатические узлы. Пораженные лимфатические узлы шеи пальпируются вдоль переднего края грудино-ключично-сосцевидной мышцы в виде плотных безболезненных конгломератов. При назофарингеальной карциноме выявляется как одностороннее, так и двустороннее поражение лимфатических узлов шеи. Увеличенные лимфатические узлы шеи в комбинации с вышеперечисленными жалобами является однозначным показанием для более углубленного обследования ребенка.
Отдаленные метастазы при первичной назофарингеальной карциноме у детей встречаются лишь в 10% случаев от всех верифицированных случаев рака носоглотки. Наиболее часто отдаленные метастазы локализуются в костях скелета и печени, менее - в легких и нерегионарных лимфатических узлах.
Диагноз устанавливается на основании гистологического исследования, а также после проведения обследования, которое включает осмотр первичной опухоли носоглотки и оценку регионарных и отдаленных метастазов. Морфологическое подтверждение опухоли выполняется по результатам биопсии пораженного лимфатического узла и/или опухоли носоглотки.
Формы проявления болезни
- Локализованная форма (опухоль находится в носоглотке и в близлежащих структурах);
- Местно-распространенная форма (опухоль находится в носоглотке и поражены шейные лимфатические узлы);
- Метастатическая форма (есть отдаленные метастазы, например, в легких, печени, костях скелета и т.д.)
Лечение
Из-за локализации опухолевого процесса (носоглотка) и местно-распространенного характера (поражение шейных лимфатических узлов) заболевания уже на этапе первичной диагностики у большинства пациентов с назофарингеальной карциномой хирургическое лечение малоприменимо. Гистологические типы назофарингеальной карциномы, встречающиеся у детей и подростков, обладают высокой химио- и радиочувствительностью, в связи с чем стандартом лечения на сегодняшний день является системная химиотерапия с последующим химиолучевым лечением.
Прогноз
Современные протоколы лечения, предусматривающие проведение индукционной химиотерапии с последующей химиолучевой терапией, позволяют излечить большинство пациентов с локализованными и местно-распространенными стадиями болезни (более 80%). Прогноз пациентов с отдаленными метастазами гораздо менее благоприятный. Однако на сегодняшний день появляются новые методы лечения (иммунотерапия), которые позволяют надеяться на улучшение результатов лечения и в этой группе пациентов. Несомненно, залог хорошего прогноза - слаженная работа врачей и родителей.
Приложение Г1 - ГN
ШКАЛЫ
ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ПО ИНДЕКСУ КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название: Karnofsky Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией):
Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949: 191 - 205 [12].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т.д.).
Таблица 19. Оценка общего состояния по индексу Карновского
Нормальная физическая активность, больной не нуждается в специальном уходе
100%
Состояние нормальное, нет жалоб и симптомов заболевания
90%
Нормальная активность сохранена, но имеются незначительные симптомы заболевания
80%
Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания
Ограничение нормальной активности при сохранении полной независимости больного
70%
Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе
60%
Больной иногда нуждается в помощи, но в основном обслуживает себя сам
50%
Больному часто требуется помощь и медицинское обслуживание
Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация
40%
Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь
30%
Больной прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно
20%
Сильные проявления болезни, необходима госпитализация и поддерживающая терапия
10%
Умирающий больной, быстрое прогрессирование заболевания
0%
Смерть
Пояснения: всем пациентам с НФК при первичном приеме, а также при каждом приеме (осмотре, консультации) врача - детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении проводится оценка общего состояния пациента.
Приложение Г2
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ БОЛЬНОГО ECOG
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5(6): 649 - 65 [13]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Таблица 20. Шкала оценки общего состояния больного ECOG
0
Больной полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Пояснения: всем пациентам с НФК при первичном приеме, а также при каждом приеме (осмотре, консультации) врача - детского онколога (B01.009.001, B01.009.002), перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении проводится оценка общего состояния пациента.
