"Клинические рекомендации "Гломерулярные болезни: иммуноглобулин А-нефропатия"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ГЛОМЕРУЛЯРНЫЕ БОЛЕЗНИ: ИММУНОГЛОБУЛИН А-НЕФРОПАТИЯ
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 894_1
Возрастная категория: Взрослые, Дети
Специальность:
Разработчик клинической рекомендации
Союз педиатров России, Творческое объединение детских нефрологов, Национальная Ассоциация нефрологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
БРА - блокаторы рецепторов ангиотензина-II (АТХ классификация: "Антагонисты рецепторов ангиотензина II")
ДИ - доверительный интервал
ЗПТ - заместительная почечная терапия
иАПФ - ингибиторы ангиотензин-превращающего фермента (АТХ классификация: "Ингибиторы АПФ")
ИК - иммунные комплексы
ИСТ - иммуносупрессивная терапия
МА - мета-анализ
МКБ - Международная классификация болезней
ОПП - острое повреждение почек
РГ - рабочая группа
РКИ - рандомизированное клиническое исследование
СКФ - скорость клубочковой фильтрации
рСКФ - расчетная скорость клубочковой фильтрации
ТПН - терминальная почечная недостаточность
ХБП - хроническая болезнь почек
Gd-IgA - галактозодефицитный иммуноглобулин А1
IgA - иммуноглобулин А
IgA1 - иммуноглобулин А1
IgAN - иммуноглобулин А-нефропатия
IgG - иммуноглобулин G
IgM - иммуноглобулин M
MHC - главный комплекс гистосовместимости
Термины и определения
Быстропрогрессирующий нефритический синдром - снижение расчетной скорости клубочковой фильтрации >= 50% в течение 3 месяцев или менее на фоне персистирования протеинурии, гематурии и активного/некротизирующего воспаления клубочков и при исключении других причин развития/прогрессирования дисфункции органа.
Иммуноглобулин А-нефропатия - хроническая гломерулярная болезнь, связанная с воспалительным поражением почечных клубочков, опосредованным депозицией иммунных комплексов, содержащих аберрантный секреторный иммуноглобулин А и приводящая к развитию необратимых фиброплатических иземенений органа.
Нефритический синдром - симптомокомплекс, представленный изменениями мочевого осадка (гематурией и/или цилиндурией) в сочетании с умеренной протеинурией (< 3,5 г/сут/1,73 м2) и экстраренальными симптомами - отеками (нефритические), артериальной гипертензией, дисфункцией почек; по течению бывает острым, хроническим, подострым (быстропрогрессирующим).
Нефротический синдром - симптомокомплекс, обусловленный нарушением гломерулярно-базального барьера с развитием массивной (нефротической) протеинурии, критериями которого являются: протеинурия > 3,5 г/сут/1,73 м2, гипоальбуминемия (альбумин в крови < 30 г/л).
Скорость клубочковой (гломерулярной) фильтрации - это количество миллилитров плазмы крови, профильтровавшейся во всех клубочках почек за одну минуту, величина скорости клубочковой фильтрации выражается в мл/мин, определяется величинами почечного плазматока, фильтрационного давления, фильтрационной поверхности и зависит от массы действующих нефронов и используется, как интегральный показатель функционального состояния почек и стандартизуется на площадь поверхности тела.
Терминальная почечная недостаточность - это патологическое состояние, характеризующееся величиной скорости клубочковой фильтрации менее 15 мл/мин/1,73 м2, что соответствует 5-й стадии хронической болезни почек.
Хроническая болезнь почек - это персистирующее в течение трех месяцев или более поражение органа вследствие действия различных этиологических факторов, анатомической основой которого является процесс замещения нормальных анатомических структур фиброзом, приводящий к его дисфункции.
1. Краткая информация
1.1 Определение заболевания или состояния
Иммуноглобулин А-нефропатия (IgAN) - хроническая гломерулярная болезнь, связанная с воспалительным поражением почечных клубочков, опосредованным депозицией иммунных комплексов, содержащих аберрантный секреторный иммуноглобулин А (IgA) и приводящая к развитию необратимых фибропластических изменений органа [1, 2].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
IgAN является наиболее распространенной иммунной гломерулопатией в мире [3], которая патогенетически представляет собой повреждение почки в результате изменений иммунного ответа слизистых оболочек. Ключевым моментом в развитии болезни является минорная молекулярная перестройка в шарнирном участке секреторного иммуноглобулина А1 (IgA1), проявляющаяся в виде нарушения галактозилирования в структуре О-гликана [4, 5], что приводит к изменению конформации молекулы и приобретению свойств аутоантигена [6]. Необходимым условием для гиперпродукции галактозодефицитного IgA1 (Gd-IgA1) является активация иммунных реакций слизистых и нарушение процессов секреции [7, 8]. Увеличение пула Gd-IgA1 в циркуляции приводит к образованию иммунных комплексов (ИК), основу которых составляют аутоантитела классов IgG, IgA (иммуноглобулин G, A соответственно) или IgM (иммуноглобулин М) к Gd-IgA1, CD89 (Fc![]() RI) и комплемента [9, 10]. Gd-IgA1-содержащие ИК вследствие большого молекулярного радиуса не могут быть подвергнуты естественному клиренсу в гепатоцитах [11]. В результате накопления Gd-IgA1 в циркуляции, происходит депозиция IgA-содержащих ИК в мезангии и их взаимодействие с CD71 (рецептором к трансферрину), что вызывает пролиферацию мезангиоцитов с последующей активацией системы комплемента, иммунных клеток и других резидентных клеточных популяций, приводя к повреждению органа и формированию типичной морфологической картины болезни [12, 13]. Аналогичные изменения были выявлены и у детей с IgAN или IgA-васкулитом (пурпура Шенлейн-Геноха) и нефритом [100]. Распространенность, клинико-морфологические проявления и прогноз IgAN имеют значительные географические и расовые различия [14 - 18]. Многолетние клинические наблюдения течения случаев IgAN позволяют считать, что болезнь в российской популяции может иметь существенные особенности распространенности, клинических и морфологических проявлений, а также прогноза [19].
RI) и комплемента [9, 10]. Gd-IgA1-содержащие ИК вследствие большого молекулярного радиуса не могут быть подвергнуты естественному клиренсу в гепатоцитах [11]. В результате накопления Gd-IgA1 в циркуляции, происходит депозиция IgA-содержащих ИК в мезангии и их взаимодействие с CD71 (рецептором к трансферрину), что вызывает пролиферацию мезангиоцитов с последующей активацией системы комплемента, иммунных клеток и других резидентных клеточных популяций, приводя к повреждению органа и формированию типичной морфологической картины болезни [12, 13]. Аналогичные изменения были выявлены и у детей с IgAN или IgA-васкулитом (пурпура Шенлейн-Геноха) и нефритом [100]. Распространенность, клинико-морфологические проявления и прогноз IgAN имеют значительные географические и расовые различия [14 - 18]. Многолетние клинические наблюдения течения случаев IgAN позволяют считать, что болезнь в российской популяции может иметь существенные особенности распространенности, клинических и морфологических проявлений, а также прогноза [19].
Несмотря на то, что IgAN считается спорадическим заболеванием, редкие семейные случаи были описаны в Соединенных Штатах (в восточном Кентукки), а также в других регионах. С высокой вероятностью можно предполагать, что IgAN является генетически гетерогенным заболеванием, вовлекающим как дефекты главного комплекса гистосовместимости (MHC), так и аллели, не относящиеся к MHC [101].
1.3 Эпидемиология заболевания или состояния
Распространенность гломерулярных и интерстициальных болезней почек в России составляет около 1500 случаев на 100000 населения [20]. Отдельных данных официальной статистики и популяционных исследований о распространенности, заболеваемости, смертности по гломерулярным заболеваниям, включая IgAN, не представлено. Предполагается, что доля иммунных гломерулопатий, к которым относится IgAN, среди всех гломерулярных и интерстициальных болезней почек составляет 20 - 30% с распространенностью 300 - 450 на 100000.
Анализ популяционных исследований, проведенных на основании данных национальных европейских регистров за период с 1990 по 2020 гг., показал, что заболеваемость IgAN в целом составляет 0,34 - 1,93 на 100000 населения. Среди детей и пожилых заболевание регистрируется еще реже: 0,2 и 0,3 случая на 100000 соответствующего населения [102]. По данным японских исследователей, заболеваемость IgAN составляет 4,5 случаев на 100 000 детей до 15 лет в год [103]. Необходимо отметить, что различия в распространенности заболевания могут являться отражением особенностей региональных подходов к скринингу заболеваний почек и показаниям для биопсии почек, в том числе в различных возрастных популяциях.
Распространенность, клинико-морфологические проявления и прогноз IgAN имеют значительные географические и расовые различия [14 - 18]. В России IgAN у взрослых выявляют в 41,5% среди первичных иммунных гломерулопатий с ожидаемой распространенностью 100 - 200 случаев на 100000. Имеющиеся данные [19] свидетельствуют о том, что IgAN в России, как и других регионах мира, является наиболее частым вариантом иммунных гломерулопатий и наиболее частой патологией, выявляемой при детальной клинико-морфологической диагностике с отчетливым трендом к увеличению доли вновь выявленных случаев болезни, которая существенно возросла в пределах сроков исследования, достигнув 41,5% среди первичных иммунных гломерулопатий и представляя почти каждый четвертый случай среди выполненных по всем показаниям биопсий почки. По этому показателю Россия существенно опережает большинство стран Азии, Европы и Америки [3, 18, 21, 22].
Полученные данные позволяют сделать предварительные заключения о возможной заболеваемости IgAN. Принимая во внимание то, что в последнее пятилетие в Научно-исследовательском институте нефрологии ежегодно выявляется около 45 случаев IgAN у резидентов Санкт-Петербурга, заболеваемость может составлять 8 - 10 случаев на миллион населения, что сопоставимо с европейскими данными [3, 19]. Вместе с тем, данная оценка может быть значительно заниженной, поскольку далеко не все случаи, имеющие характерные проявления болезни, подвергаются необходимой клинико-морфологической диагностике. Об этом свидетельствуют данные длительности периода персистирования симптомов IgAN до установления диагноза, медиана которого составила 41 месяц [19]. Основными объяснениями, по нашему опыту, являются недостаточная осведомленность практикующих врачей-нефрологов о данной проблеме, как следствие, низкая активность в отношении скрининга и выявления подозрительных случаев, и настойчивость в подтверждении диагноза. Существенным ограничением ведения пациентов с IgAN в отечественной нефрологии также является распространенная и неприемлемая практика эмпирического синдромального лечения и низкая доля случаев гломерулопатий, подвергаемых клинико-морфологической диагностике, из-за отсутствия соответствующих ресурсов. С учетом высокой вероятности существенных региональных отличий распространенности и заболеваемости, эпидемиология IgAN в России должна стать предметом отдельных мультицентровых популяционных исследований. Такие данные могут быть критичны для планирования развития современной нефрологии в рамках превентивных подходов.
В России эпидемиологические исследования у детей не проводились из-за малой доступности клинико-морфологической диагностики в регионах.
Несмотря на относительную низкую распространенность, иммунные гломерулопатии в России - наиболее частая причина развития терминальной почечной недостаточности (ТПН) и необходимости проведения дорогостоящей заместительной почечной терапии (ЗПТ) методами диализа и трансплантации почки [23], потребляющей существенную долю бюджета здравоохранения. Недостаточный контроль аутоиммунного воспалительного процесса в почке является основным фактором прогрессирующих фибропластических изменений и утраты функций органа.
1.4 Особенности кодирования заболевания или состояния
С учетом разнообразия клинических и морфологических проявлений IgAN, для ее кодирования по Международной классификации болезней (МКБ-10) следует применять сочетания соответствующих кодов, отражающих клинические синдромы и гистологию. Трехзначные рубрики (N00, N01, N02, N03, N04, N06) основаны на клинических синдромах. С ними следует использовать четвертые знаки, классифицирующие морфологические изменения (подрубрики.1, .3, .4, .7, .8). Последние указываются через точку после кода клинического синдрома (например, N 02.3). Подрубрики не следует использовать, если для идентификации поражений не были проведены специальные исследования (например, биопсия или аутопсия почек) (табл. 1).
Таблица 1. Кодирование IgAN по МКБ-10
Клинические проявления (отметить доминирующую форму)
Код МКБ-10
Морфологические проявления (отметить доминирующую форму)
Код МКБ-10
Изолированная протеинурия
N06
Диффузный мезангиальный пролиферативный гломерулонефрит
.3
Рецидивирующая и устойчивая гематурия
N02
Диффузный эндокапиллярный пролиферативный гломерулонефрит
.4
Острый нефритический синдром
N00
Экстракапиллярный гломерулонефрит
.7
Быстропрогрессирующий нефритический синдром
N01
Другие пролиферативные изменения (Пролиферативный гломерулонефрит без дополнительных уточнений)
.8
Хронический нефритический синдром
N03
Нефротический синдром
N04
Очаговые и сегментарные гломерулярные нарушения (Очаговый и сегментарный (гиалиноз/склероз) или очаговый гломерулонефрит)
.1
Случаи IgAN при пурпуре Геноха-Шенлейна следует кодировать как N08.2 (Гломерулярные поражения при болезнях крови и иммунных нарушениях).
IgAN, по определению, является хроническим повреждением почки, поэтому все случаи этого заболевания должны быть классифицированы в соответствии с рекомендациями по хронической болезни почек (ХБП) [24, 104].
Для обозначения стадий ХБП следует использовать коды N18.1 - N18.5 (табл. 2), а расчет скорости клубочковой фильтрации (СКФ) необходимо выполнять по формуле CKD-EPI в специальных калькуляторах на основании концентрации креатинина в сыворотке крови, пола, возраста и расы пациента ("Приложение Г1") [25, 26].
Таблица 2. Классификация стадий ХБП по уровню СКФ и соответствие кодировке МКБ-10
Обозначение стадий ХБП
Уровень СКФ, мл/мин/1,73 м2
Код МКБ-10 <*>
Название
С1
> 90
N 18.1
Хроническая болезнь почек, стадия 1
С2
60 - 89
N 18.2
Хроническая болезнь почек, стадия 2
С3а
45 - 59
N 18.3
Хроническая болезнь почек, стадия 3
С3б
30 - 44
С4
15 - 29
N 18.4
Хроническая болезнь почек, стадия 4
С5
< 15
N 18.5
Хроническая болезнь почек, стадия 5
Примечание: * - кодом N 18.9 обозначаются случаи ХБП с неуточненной стадией.
1.5 Классификация заболевания или состояния
Классификация IgAN основана на оценке выраженности гистологических изменений клубочков [27, 28]: мезангиальной пролиферациии (М0 - не более чем в 50% клубочков, М1 - 50% и более; более трех клеток в мезангиальной области), эндокапиллярной пролиферации (Е0 - отсутствует, Е1 - указывает на наличие), сегментарного склероза или адгезии петель капилляров к капсуле клубочка (S0 - нет, S1 - указывает на наличие), тубулярной атрофии/интерстициального фиброза (Т0 - менее чем 25% кортикальной зоны, Т1 - 26 - 50% кортикальной зоны, Т2 - более 50% кортикальной зоны; клеточных или фиброзно-клеточных полулуний (С0 - нет, С1 - менее 25% клубочков, С2 - 25% и более клубочков).
1.6 Клиническая картина заболевания или состояния
Основные признаки, позволяющие предполагать наличие IgAN, представлены в табл. 3.
Таблица 3. Основные признаки, позволяющие предполагать наличие IgAN
Маркер
Примечания
Жалобы, анамнез, физикальные данные
Жалобы
Изменения цвета мочи (особенно, в связи с респираторными инфекциями), изменения объема диуреза (олигурия, полиурия), никтурия
Данные анамнеза и анализа медицинской документации
Указания на выявленные ранее изменения мочи - протеинурия и гематурия, наличие нефритического или нефротического синдромов; хронические воспалительные процессы слизистых
Физикальное обследование
Увеличение размера почек, симптомы уремии, периферические и полостные отеки, изменение цвета и объема мочи, артериальная гипертензия; геморрагическая сыпь, поражение суставов, абдоминальные боли, нарушения стула, поражение легких и бронхов, изменения печени; типичные признаки хронических воспалительных заболеваний слизистых
Лабораторные данные
Повышенная альбуминурия/протеинурия
Маркеры увеличения клубочковой проницаемости и тубулярной дисфункции
Стойкое снижение скорости клубочковой фильтрации менее 60 мл/мин/1,73 м2
Индекс, тесно коррелирующий с парциальными функциями почек
Стойкие изменения в клеточном осадке мочи
Эритроцитурия (гематурия), эритроцитарные цилиндры
Другие изменения состава крови и мочи
Азотемия, уремия, изменения сывороточной и мочевой концентрации электролитов, нарушения кислотно-щелочного равновесия, повышение уровня IgA в циркуляции
Изменения почек по данным лучевых методов исследования
Изменение размеров почек, нарушение интраренальной гемодинамики
Изменения в ткани почек, выявленные при прижизненном морфологическом исследовании органа
Признаки активного повреждения почечных структур, специфические для IgAN, и универсальные маркеры фиброза компартментов органа, указывающие на "хронификацию" патологического процесса
Клиническая презентация на момент верификации диагноза
IgAN преобладает у лиц молодого возраста обоих полов и характеризуется типичными клиническими проявлениями гломерулярного повреждения и прогрессирующей дисфункции почек. В большинстве случаев дебютирует лабораторными изменениями мочи (протеинурией и микрогематурией), хроническим нефритическим синдромом и/или эпизодом макрогематурии. Большинство пациентов на момент биопсии почки имеют существенную эритроцитурию и протеинурию. Последняя в трети случаев превышает нефротический уровень, а в каждом десятом случае наблюдают развитие нефротического синдрома.
Прогрессирование болезни, как правило, медленное, однако в России течение IgAN может быть менее благоприятным в сравнении с другими регионами мира [19]. Особенностью российской популяции больных с IgAN в сравнении с когортами из других регионов мира была существенно более выраженная протеинурия, более низкие значения расчетной СКФ (рСКФ), а также распространенность дисфункции почек и гипертензии. В изучаемой когорте по сравнению с европейскими данными были также более выражены гистологические изменения, связанные с активными пролиферативными реакциями. Иммуноморфологическими особенностями IgAN в России были: отложения IgA в стенке клубочковых капилляров, выявленные в каждом шестом случае, могут отражать течение более тяжелых форм болезни с формированием мембранопролиферативного паттерна и ухудшением прогноза; значительная распространенность экстрагломерулярных изменений; существенная частота выявления воспалительной инфильтрации интерстиция и воспаления перитубулярных капилляров, тесно связанных с основными клиническими проявлениями - артериальной гипертензией, дисфункцией почек, протеинурией и гематурией. Перитубулярный капиллярит был определен как независимый фактор, ассоциированный с риском прогрессирования болезни [19].
В целом, почечная выживаемость в российской популяции существенно ниже, чем в азиатских регионах и в сравнении с европейской популяцией за счет значительно более выраженных гистологических изменений, связанных с активными пролиферативными реакциями, что позволяет предполагать менее благоприятное течение болезни и, вероятно, требует более активной терапии.
В значительной пропорции случаев были выявлены клинические признаки активации иммунных реакций слизистых - хронические воспалительные заболевания желудочно-кишечного тракта, верхних дыхательных путей, в том числе тонзиллит. Реже встречали инфекции нижних отделов мочевыделительной системы, генитального тракта.
У детей с IgAN макрогематурия встречается чаще, чем у взрослых, рецидивируя на фоне респираторных инфекций - "синфарингитная" макрогематурия [105 - 107].
В отличие от взрослых, у которых обычно наблюдается линейное снижение рСКФ, у детей наблюдается первоначальное повышение рСКФ, которое может длиться до нескольких лет, за которым следует такое же линейное снижение, как у взрослых пациентов [108].
Риск прогрессирования IgAN
Для расчета риска прогрессирования IgAN (снижение рСКФ на 50% или развитие ТПН) разработан калькулятор, включающий ряд клинических параметров на момент выполнения биопсии, а также результаты гистологического исследования ("Приложение Г2") [29].
2. Диагностика
Общие подходы к диагностике IgAN (см. раздел "Приложение Б", п. 1)
Диагностика IgAN должна включать два основных направления для выбора необходимого лечения: 1) выявление специфических иммунологических альтераций и оценку их выраженности; 2) определение первичности или вторичности болезни; и 3) выявление и оценку степени выраженности острой и/или хронической дисфункции почек. Основой первого направления является морфологическое исследование почек, без которого диагноз IgAN не может быть установлен. Второе направление предполагает поиск экстраренальных патологических процессов, которые могут быть причиной вторичной IgAN, отличающейся по прогнозу и подходам к терапии. Диагноз первичной IgAN следует устанавливать при исключении причин вторичных вариантов болезни (табл. 4). Третье направление детально изложено в соответствующих рекомендациях по острому повреждению почек (ОПП) и ХБП, ссылки на которые будут приведены ниже там, где это необходимо.
Тактика диагностического поиска у пациентов детского возраста с предполагаемой IgAN и взрослых, в целом, не отличаются [111, 112]. Особенности диагностики IgAN у детей приведены в соответствующих подразделах и в разделе "Приложение А3", п. 2, п. 3.
- У пациентов с подтвержденной морфологически IgAN мы рекомендуем проведение клинической диагностики в соответствии с действующими рекомендациями и стандартами для выявления экстраренальной патологии, которая может быть причиной развития вторичной IgAN (табл. 4), и определения объема необходимого лечения [1, 2, 30].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: У пациентов с известной IgAN или подозрением на IgAN мы рекомендуем проведение диагностики стандартными методами для выявления хронических воспалительных процессов в пределах слизистых и других патологических процессов, которые могут быть причинами развития вторичных форм болезни (табл. 4) [31].
Таблица 4. Основные причины развития вторичной IgAN, требующие проведения диагностики
Желудочно-кишечный тракт и печень
Болезни печени (цирроз, вирусный гепатит С, неалкогольный стеатогепатит)
Целиакия
Болезнь Крона
Язвенный колит
Вирусные инфекции
Вирус иммунодефицита человека
Цитомегаловирус
Гепатит B
Гепатит C
Другие инфекции
Хронические инфекции слизистых разной этиологии
Болезнь Лайма
Chlamydia pneumoniaе
Малярия
Шистосомоз
Аутоиммунные болезни
Анкилозирующий спондилит
Ревматоидный артрит
Системная красная волчанка
Герпетиформный дерматит
Синдром Шегрена
Псориаз
Респираторный тракт
Хронический обструктивный альвеолит
Идиопатический фиброз легких
Муковисцидоз
Опухоли
IgA миелома
Лимфомы (включая MALT)
Рак легкого
Почечно-клеточный рак
Также причинами развития вторичной IgAN могут быть: атрезии желчевыводящих путей, диссеминированный туберкулез, дефицит альфа-1 антитрипсина, описаны случаи сочетания IgAN с болезнью Фабри [109, 110].
- Мы рекомендуем врачам-нефрологам устанавливать диагноз первичной IgAN после исключения всех вероятных причин вторичных вариантов болезни для оценки прогноза и последующего выбора терапии [1, 2, 31].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У пациентов с известной IgAN или подозрением на IgAN мы рекомендуем назначение приема (осмотра, консультации) врача-оториноларинголога для диагностики воспаления миндалин и определения объема необходимого лечения, включая тонизилэктомию [32, 33].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Тонзилэктомия может быть одним из эффективных лечебных подходов при IgAN (см. раздел 3.2).
С целью максимально раннего выявления IgAN врачам всех специальностей мы рекомендуем направлять пациентов с наличием стойкой протеинурии и/или стойкой гематурии и/или рецидивов макрогематурии к врачу-нефрологу для проведения специализированной нефрологической диагностики [24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Рекомендация отражает стандартные подходы к маршрутизации пациентов с подозрением на IgAN и другие иммунные гломерулопатии, являющиеся частным вариантом ХБП, и, как правило, требующие оказания специализированной медицинской помощи.
- Мы рекомендуем детям с подозрением на IgAN провести сбор семейного анамнеза (для исключения наследственных болезней, например, синдрома Альпорта) и анамнеза болезни на предмет почечных и системных проявлений, подробный физикальный осмотр, подтверждающую диагностику, а также - дифференциальную диагностику с заболеваниями, при которых может наблюдаться вторичная IgAN [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: перечень обследований размещен в разделе "Приложение А3", п. 2 и п. 3.
В первую очередь следует исключить IgA-васкулит и IgAN, вторичные по отношению к заболеваниям печени, вирусным заболеваниям и воспалительным заболеваниям кишечника, а также системным аутоиммунным заболеваниям (или в их составе) и постинфекционном гломерулонефриту перед диагностикой первичного IgAN [111].
При диагностике первичной IgAN (в т.ч., с проведением биопсии почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек) следует ориентироваться на наличие гематурии (макроскопической и/или микроскопической), сохраняющейся в течение 2 - 3 недель по крайней мере в двух порциях мочи с интервалом в 1 - 2 недели при исключении как источника данных изменений другой патологии почек и мочевыводящих путей (гиперкальциурия, гипоцитратурия, камни в почках и нижних мочевыводящих путях, инфекции) с протеинурией (соотношение альбумин/креатинин в моче >= 0,2 мг/мг или 20 мг/ммоль) или признаков системного заболевания, при нормальном уровне С3 фракции комплемента в сыворотке крови, а также данный диагноз следует иметь в виду в случае постоянной (> 2 - 3 недель) или рецидивирующей (> 2 - 3 раз) макрогематурии, возникающей во время инфекции верхних дыхательных путей [112].
2.1 Жалобы и анамнез
Клинические данные, полученные при анализе жалоб и анамнеза и указывающие на вероятное наличие IgAN, приведены в разделе 1.6.
2.2 Физикальное обследование
Данные физикального обследования, указывающие на вероятное наличие IgAN, приведены в разделе 1.6.
2.3 Лабораторные исследования
2.3.1 Лабораторные диагностические исследования у взрослых пациентов с IgAN
- Для оценки выраженности дисфункции почек, прогноза и определения объема неиммуносупрессивной терапии у пациентов с подозрением на IgAN мы рекомендуем проведение лабораторной диагностики в базовом объеме, предусмотренном рекомендациями по ХБП [24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: В клинических рекомендациях "Хроническая болезнь почек (ХБП)" детально отражены подходы к диагностике наличия и выраженности дисфункции почек, которые полностью применимы для пациентов с IgAN.
- Для оценки прогноза и выбора терапии у пациентов с IgAN при первичной диагностике мы рекомендуем определение количества белка в суточной моче и микроскопическое исследование осадка мочи [34, 35, 36].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
- Для оценки прогноза и эффективности лечения у пациентов с IgAN мы рекомендуем регулярное определение количества белка в суточной моче и выполнение микроскопического исследования осадка мочи, не реже 2 раз в год [34, 35, 36].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: По данным мета-анализа (МА) рандомизированных клинических исследований (РКИ) средние значения количества белка в суточной моче и его динамика на фоне лечения являются надежным предиктором неблагоприятных исходов IgAN вне зависимости от характера проводимого лечения. После начала лечения в течение полугода определение количества белка в суточной моче следует осуществлять не реже, чем каждые 2 месяца, а впоследствии 2 раза в год. Частоту обследований следует определять в зависимости от стадии ХБП и градации альбуминурии/протеинурии. Альтернативой определению количества белка в суточной моче может быть определение альбумина в моче и исследование уровня креатинина в моче с расчетом отношения альбумин/креатинин [24].
- У пациента с подозрением на IgAN или с известной IgAN в целях дифференциальной диагностики мы рекомендуем, чтобы любое лабораторное исследование гематурии включало определение дисморфных (измененных) клеток и эритроцитарных цилиндров в рамках микроскопического исследования осадка мочи [37].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Макро- или микрогематурия напрямую связана с патогенезом IgAN, отражая степень воспалительной реакции в клубочках и интерстиции, и имеет критическое значение для оценки активности IgAN и ее динамики на фоне терапии и выбора последней. Использование тест-полосок может определить наличие или отсутствие микрогематурии, однако микроскопическая идентификация дисморфных (измененных) клеток и эритроцитарных цилиндров имеет существенное значение для дифференциальной диагностики гематурии. Следует учитывать, что морфологическая оценка гематурии чувствительна к времени между сбором образца мочи и проведением исследования (требует "свежего" образца), а также - к концентрации мочи, pH мочи, подготовке осадка и опыту исследователя. В цитируемом МА средние значения и 95% доверительные интервалы (ДИ) чувствительности и специфичности доли дисморфных (измененных) клеток и эритроцитарных цилиндров для гломерулярной патологии составили 0,88 (0,86 - 0,90) и 0,95 (0,93 - 0,97), соответственно, в сравнении с референсом (биопсией почки).
- У пациентов с подтвержденной морфологически IgAN мы рекомендуем исследование уровня C3 фракции комплемента, исследование уровня C4 фракции комплемента и исследование уровня иммуноглобулина A в крови для оценки активности патологического процесса и прогноза [38 - 42].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
2.3.2 Лабораторные диагностические исследования у детей с IgAN
- Для диагностики IgAN у детей мы рекомендуем проведение лабораторных диагностических исследований аналогично взрослым пациентам [104, 111].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: диагностические вмешательства, в том числе, для динамического наблюдения, по своему объему и наполнению у взрослых и детей концептуально не отличаются.
Подробнее необходимые исследования для диагностики и динамического наблюдения, а также перечень нозологий и обследований для дифференциальной диагностики детям с клиническими признаками IgAN и установленным диагнозом IgAN изложены в разделе "Приложение А3", п. 2 и п. 3.
СКФ у детей следует рассчитывать с использованием формулы Шварца и ее модификаций (подробнее - см. клинические рекомендации "Хроническая болезнь почек" (возрастная категория - дети)) [104].
2.4 Инструментальные исследования
2.4.1 Инструментальные диагностические исследования у взрослых пациентов с IgAN
- У пациентов с подозрением на IgAN или с подтвержденным диагнозом IgAN мы рекомендуем выполнение инструментальной диагностики в объеме, предусмотренном рекомендациями по ХБП, для оценки выраженности структурных изменений почек, а также других органов и систем, поражение которых ассоциировано со снижением функции почек и рисками других неблагоприятных событий [24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
2.4.2 Инструментальные диагностические исследования у детей с IgAN
Для диагностики IgAN у детей мы рекомендуем проведение инструментальных диагностических исследований аналогично взрослым пациентам [104, 111, 112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: диагностические вмешательства, в том числе, для динамического наблюдения, по своему объему и наполнению у взрослых и детей концептуально не отличаются.
Следует отметить, что в целом клинических исследований с участием детской категории пациентов с IgAN меньше, чем у взрослых.
Подробнее необходимые исследования для диагностики и динамического наблюдения, а также перечень нозологий и обследований для дифференциальной диагностики детям с клиническими признаками IgAN и установленным диагнозом IgAN изложены в разделе "Приложение А3", п. 2 и п. 3.
2.5 Иные исследования
2.5.1 Иные диагностические исследования у взрослых пациентов с IgAN
- У пациентов с подозрением на IgAN в отсутствии противопоказаний мы рекомендуем выполнение биопсии почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почки для подтверждения диагноза, оценки выраженности ренальных повреждений и прогноза, а также выбора терапии [43, 44].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
- В тех случаях известной IgAN, в которых возникает необходимость ревизии диагноза и/или уточнения выраженности гистологических изменений и/или прогноза для принятия решения о выборе или изменении терапии, мы рекомендуем в отсутствии противопоказаний рассмотреть повторное выполнение биопсии почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почки [45 - 48].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
- У пациентов с подозрением на IgAN мы рекомендуем, чтобы в рамках выполнения патолого-анатомического исследования биопсийного (операционного) материала почки с применением иммуногистохимических методов были определены гломерулярные депозиты IgA, IgM, IgG, фракций комплемента (C3, C1q) и легких цепей Ig (каппа, ламбда) для использования результатов исследования в диагностике и оценке прогноза болезни [49 - 54].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
- С целью унификации диагностики IgAN мы рекомендуем для всех клинических случаев считать надежным критерием этого диагноза доминирующие или ко-доминирующие гломерулярные депозиты IgA [49, 55].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
- Для оценки прогноза и выбора терапии мы рекомендуем, чтобы у пациентов с диагнозом IgAN при патолого-анатомическом исследовании биопсийного (операционного) материала почки были определены и отражены в заключении, как минимум, следующие классификационные критерии: выраженность мезангиальной пролиферации; выраженность эндокапиллярной гиперклеточности; наличие сегментарного гломерулосклероза или адгезии петель капилляров к капсуле клубочка; выраженность тубулярной атрофии/интерстициального фиброза; наличие клеточных, фиброзных, фиброзно-клеточных полулуний (табл. 5) [43, 44].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Оксфордская классификация IgAN, которую следует использовать для описания результатов патолого-анатомическоого исследования биопсийного (операционного) материала почки, представлена в табл. 5.
Таблица 5. Оксфордская классификация IgAN
Признак
Индекс
Описание
Выраженность мезангиальной пролиферации
M0
< 50% клубочков
M1
50% и более
Выраженность эндокапиллярной пролиферации
E0
отсутствует
E1
есть
Наличие сегментарного гломерулосклероза или адгезии петель капилляров к капсуле клубочка
S0
нет
S1
указывает на наличие
Выраженность тубулярной атрофии/интерстициального фиброза
T0
менее чем 25%
T1
26 - 50% кортикальной зоны
T2
более 50% кортикальной зоны
Наличие клеточных или фиброзно-клеточных полулуний
C0
нет
C1
< 25% клубочков
C2
![]() 25% клубочков
25% клубочков
- У пациентов с первичной IgAN для оценки риска прогрессирования и принятия решения о выборе терапии, наряду с суточной протеинурией и результатами патолого-анатомического исследования биопсийного (операционного) материала почки, мы рекомендуем использовать специальный калькулятор (см. "Приложение Г2") [29].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: При значениях расчета риска прогрессии в течение 5 лет > 11% следует оценивать риск как высокий, наряду с протеинурией > 1 г/сутки в сочетании с гематурией и гистологическими признаками активного воспаления (М1, Е1, С1-2 (см. табл. 5)). В таких случаях, как правило, оправдано проведение иммуносупрессивной терапии для улучшения прогноза.
2.5.2 Иные диагностические исследования у детей с IgAN
- Для диагностики IgAN у детей мы рекомендуем проведение иных диагностических исследований аналогично взрослым пациентам [104, 111, 112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: диагностические вмешательства, в том числе, для динамического наблюдения, по своему объему и наполнению у взрослых и детей концептуально не отличаются.
Следует отметить, что в целом клинических исследований с участием детской категории пациентов с IgAN меньше, чем у взрослых.
Подробнее необходимые исследования для диагностики и динамического наблюдения, а также перечень нозологий и обследований для дифференциальной диагностики детям с клиническими признаками IgAN и установленным диагнозом IgAN изложены в разделе "Приложение А3", п. 2 и п. 3.
- Мы рекомендуем выполнение биопсии почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек детям с подозрением на IgAN (острым нефритическим синдромом изолированно или с протеинурией/нефротическим синдромом) после исключения острого постинфекционного ГН [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: цель - предотвращение неоправданного применения инвазивного обследования детям.
Для острого постстрептококкового гломерулонефрита, наряду с острым нефритическим синдромом, характерны низкий уровень С3 в сыворотке, повышенный уровень антистрептолизина-О, высев бета-гемолитического стрептококка из зева или с кожи при стрептодермии (подробнее исследования представлены в разделе "Приложение А3", п. 3).
- Мы рекомендуем выполнять биопсию почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек с целью подтверждения диагноза IgAN, оценки характера и выраженности повреждений почечной паренхимы и прогноза, а также выбора терапии по следующим показаниям: (1) незамедлительно у детей с персистирующей (> 2 - 3 недель) или рецидивирующей гематурией и протеинурией нефротического уровня (отношение альбумин/креатинин > 2 мг/мг или 200 мг/ммоль) и/или сниженной СКФ (< 90 мл/мин/1,73 м2); (2) в плановом порядке у детей с персистирующей (> 2 - 3 недель) или рецидивирующей гематурией и отношением альбумин/креатинин > 0,5 мг/мг (50 мг/ммоль) по крайней мере в двух пробах мочи с интервалом в 1 - 2 недели; (3) в плановом порядке у детей с персистирующей (> 2 - 3 недель) или рецидивирующей гематурией и отношением альбумин/креатинин от 0,2 до 0,5 мг/мг (20 - 50 мг/ ммоль) по крайней мере в трех пробах мочи с интервалом в 1 - 2 недели [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Мы рекомендуем при обнаружении в биоптате почки у ребенка с нефритическим синдромом преобладающих депозитов IgA проводить оценку выраженности морфологических изменений по критериям MEST-C (Оксфордская классификация IgAN - см. раздел 2.5, табл. 5) для планирования оптимального терапевтического режима [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У детей с подозрением на IgAN и положительным семейным анамнезом гематурии и ХБП или у детей с диагнозом IgAN без ответа на адекватное лечение, мы рекомендуем проведение осмотра (консультации) врача-генетика первичного и проведение молекулярно-генетического исследования с дифференциально-диагностической целью (в том числе с обязательным поиском мутаций, определяющих патологию коллагена IV типа [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: диагностические вмешательства, в том числе, для динамического наблюдения, по своему объему и наполнению у взрослых и детей концептуально не отличаются.
Следует отметить, что в целом клинических исследований с участием детской категории пациентов с IgAN меньше, чем у взрослых.
Подробнее необходимые исследования для диагностики и динамического наблюдения, а также перечень нозологий и обследований для дифференциальной диагностики детям с клиническими признаками IgAN и установленным диагнозом IgAN изложены в разделе "Приложение А3", п. 2 и п. 3.
3. Лечение
3.1 Общие подходы к лечению IgAN у взрослых
- У пациентов с диагнозом IgAN мы рекомендуем проводить неиммуносупрессивную ренопротективную терапию по показаниям и в объеме, предусмотренном рекомендациями по ХБП, для снижения протеинурии и темпов прогрессирования болезни, предупреждения и лечения осложнений дисфункции почек [24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У пациентов с диагнозом вторичной IgAN мы рекомендуем проводить терапию ассоциированной с поражением почек патологии по показаниям и в объеме, предусмотренном соответствующими клиническими рекомендациями, а также с привлечением необходимых специалистов на междисциплинарной основе для индукции ремиссии и снижения темпов прогрессирования болезни [1, 2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: см. табл. 4.
- У пациентов с IgAN и протеинурией > 0,5 г/сутки мы рекомендуем лечение ингибиторами ангиотензин-превращающего фермента (иАПФ) или антагонистами рецепторов ангиотензина II (БРА) - для снижения протеинурии и темпов прогрессирования болезни [56 - 58].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
- У пациентов с первичной IgAN и протеинурией > 1 г/сутки (несмотря на проводимую и адекватную неиммуносупрессивную ренопротективную терапию) при отсутствии быстропрогрессирующего нефритического синдрома и противопоказаний мы рекомендуем рассмотреть лечение #гидроксихлорохином** для снижения протеинурии и индукции ремиссии болезни [59, 60, 150].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 1)
Комментарии: #Гидроксихлорохин** следует назначать в течение 6 месяцев в следующих режимах: 200 мг перорально два раза в день для рСКФ > 60 мл/мин/1,73 м2, 100 мг перорально 3 раза в день для пациентов с рСКФ от 45 до 60 мл/мин/1,73 м2 и 100 мг перорально два раза в день для пациентов с рСКФ от 30 до 45 мл/мин/1,73 м2[59, 60, 150, 151, 152]. Дозу препарата следует снизить до 100 мг в день для пациентов со снижением рСКФ на > 25% или до <30 мл/мин/1,73 м2.
Кроме пигментации кожи, существенного увеличения риска других побочных эффектов применения препарата в недавнем МА не выявдено, что не отменяет необходимости индивидуального подхода к оценке вероятных побочных эффектов, включая офтальмологические [61].
- У пациентов с первичной IgAN мы рекомендуем провести лечение клинически значимого инфеционного и/или аутоиммунного воспаления слизистых любой локализации для снижения активности патологического процесса в клубочках и индукции ремиссии болезни [62 - 65].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Чаще IgAN ассоциирована с хроническим рецидивирующим или прогрессирующим воспалением слизистых респираторного и желудочно-кишечного трактов [66] (см. табл. 4). Нарушение проницаемости слизистых при воздействии микробов и/или аллергенов является фактором активации локальной иммунной системы и повышенного образования патологического IgA1 [67 - 69]. С учетом этих представлений, мы предполагаем, что выявление и адекватный контроль воспаления слизистых может положительно влиять на течение IgAN и снижать риск инфекционных осложнений при применении глюкокортикоидов (также см. раздел 3.3, рекомендации по тонзилэктомии).
3.2 Общие подходы к лечению IgAN у детей
При IgAN с минимальными изменениями (по данным биопсии почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек) у детей возможна спонтанная ремиссия более чем в 50% случаев [113].
При этом детям следует продолжать проводить регулярную оценку состояния в динамике (см. раздел "Приложение А3", п. 2), поскольку возможно развитие рецидива (риск развития рецидива может измениться с течением времени).
Цели терапии: добиться ремиссии или снизить активность болезни до степени, минимизирующей дальнейшее повреждение почек. Необходимо отметить, что невыраженная гематурия (микрогематурия) может персистировать в течение жизни, не приводя к прогрессированию болезни. Факторами, способствующими прогрессированию почечного поражения и, соответственно, ухудшению почечных функций, являются протеинурия и артериальная гипертензия.
Целевая протеинурия: отсутствие или <= 200 мг/сут (<= 400 мг/1,73 м2/сут) или соотношение белок/креатинин <= 200 мг/г (<= 0,2 г/г [<= 20 мг/ммоль]).
Целевое систолическое артериальное давление - < 90-го процентиля для возраста, пола и роста (в соответствии с клиническими рекомендациями по хронической болезни почек у детей и артериальной гипертензии у детей).
- У детей с IgAN и протеинурией > 0,2 г/сутки (или отношением альбумин/креатинин 200 мг/г (0,2 мг/мг или 20 мг/ммоль)) мы рекомендуем оптимизацию диеты при участии (консультация) врача-диетолога (при возможности) и ограничение потребления поваренной соли ниже 3 - 5 г в день, с целью уменьшения активации ренин-ангиотензиновой системы и уровня артериального давления [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Мы рекомендуем детям с IgAN регулярно проводить лечебную физкультуру при заболеваниях почек и мочевыделительного тракта для поддержания оптимальной массы тела [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Также пациентам следует придерживаться здорового образа жизни, в т.ч., необходим отказ от курения.
- У детей с IgAN и протеинурией > 0,2 г/сутки (или при отношении альбумин/креатинин 200 мг/г (0,2 мг/мг или 20 мг/ммоль)) мы рекомендуем лечение иАПФ или БРА в максимально переносимых дозах с целью снижения протеинурии и темпов прогрессирования болезни [111, 114 - 118].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Имеются убедительные доказательства, свидетельствующие о пользе блокады ренин-ангиотензиновой системы у детей. Дозы иАПФ или БРА подбираются индивидуально.
Например: #Эналаприл** - дети и подростки: начальная доза: 0,2 мг/кг/день; титровать до ответа с интервалом от 4 до 12 недель до достижения эффекта (в среднем, диапазон доз: от 0,2 до 0,6 мг/кг/день; максимальная суточная доза: 20 мг/день); перекрестное сравнительное исследование доз показало, что эффекты в отношении протеинурии зависят от дозы [119, 149] или #лозартан** - детям в средней дозе 0,8 мг/кг/сут, в среднем, до 2,8 лет [115] или #лозартан** - детям в возрасте 6 - 9 лет в стартовой дозе 0,7 мг/кг - 1р/сут, через 2 и 4 недели - постепенное увеличение дозы при условии сохранения протеинурии и отсутствии нежелательных явлений - до максимальной - 1,5 мг/кг/сут или 100 мг/сут; детям младше 6 лет - могут быть использованы дозы 0,1 - 0,7 мг/сут, до 1,4 мг/кг [116] или #лизиноприл** - детям 4 - 15 лет в начальной разовой суточной дозе 0,1 - 0,2 мг/кг массы тела (максимум 10 мг/день) ежедневно и после отсутствия нежелательных явлений в течение 1 недели - увеличение до разовой суточной дозы 0,4 мг/кг (максимум 20 мг/день), курсом 24 мес [117, 118].
Коррекция дозировки для одновременно назначаемых лекарственных препаратов: следует оценить возможные значительные лекарственные взаимодействия, требующие корректировки дозы/частоты или полной невозможности назначения лекарственного препарата в соответствии с базами данных лекарственных взаимодействий для получения дополнительной информации. Например, следует избегать одновременного назначения иАПФ или БРА, соблюдать осторожность при одновременном назначении иАПФ и ингибиторов кальциневрина из-за бОльшего риска развития гиперкалиемии и нефротоксичности [116].
Следует контролировать артериальное давление (измерение артериального давления на периферических артериях).
При нефротическом уровне протеинурии назначают иАПФ или БРА в сочетании с иммуносупрессивной терапией (см. раздел 3.4).
При развитии нефротического синдрома при IgAN, в целом, у детей следует руководствоваться соответствующими рекомендациями исходя из морфологических изменений по данным биопсии почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек [120, 121].
3.3 Иммуносупрессивная и сопутствующая терапия у взрослых пациентов с IgAN
- У пациентов с первичной IgAN при отсутствии быстропрогрессирующего нефритического синдрома, но с исходно высокими рисками прогрессии на фоне клинических и/или гистологических признаков воспаления (персистирующей протеинурией > 1 г/сутки в сочетании с гематурией, вероятностью развития 50%-ного снижения рСКФ или ТПН > 11%, М1, Е1, С1-2) или с персистирующей протеинурией > 1 г/сутки в сочетании с гематурией, несмотря на проводимую адекватную неиммуносупрессивную ренопротективную терапию в течение 3 месяцев, мы рекомендуем лечение глюкокортикоидами для индукции ремиссии болезни и снижения темпов ее прогрессирования [70, 71 - 75].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Преднизолон** следует применять внутрь, в дозе 0,4 - 0,6 мг/кг массы тела/сутки не более 40 мг в течение 2 - 8 недель, с последующим в течение 4 месяцев снижением суточной дозы на 20% каждый месяц до отмены в течение 6 месяцев. Другие глюкокортикоиды можно применять в эквивалентных преднизолону** дозах. Инициальные дозы, темпы их снижения и длительность применения глюкокортикоидов могут быть индивидуализированы у конкретного пациента. В случаях сочетания высокой протеинурии/гематурии с активными гистологическими проявлениями болезни (М1, Е1, С1-2) допустимо на индивидуальной основе рассмотреть начало лечения глюкокортикоидами (метилпреднизолон** или другие в эквивалентной дозе) с внутривенного введения в дозе 250 - 1000 мг в течение 3-х дней [153 - 155].
Эффективность глюкокортикоидов для индукции ремиссии и торможения прогрессирования болезни более очевидна при значениях протеинурии более 2 г/сутки [19].
С применением глюкокортикоидов связано значительное увеличение вероятностей развития ремиссии и снижения развития ТПН, но также 2 - 3 кратное увеличение частоты побочных эффектов ("Приложение А3", п. 1) - желудочно-кишечных, гематологических, дерматологических, мочеполовых инфекций, а также нарушения толерантности к глюкозе или диабета, что следует учитывать при назначении терапии, информировании пациента и планировании профилактических мероприятий. Риски осложнений терапии существенно возрастают при рСКФ <50 мл/мин/1,73 м2. Эффективность глюкокортикоидов увеличивается в комбинации с иАПФ или БРА и/или тонзилэктомией.
Подходы к лечению первичной IgAN представлены в разделе "Приложение Б", п. 2.
- Для снижения вероятности развития побочных эффектов мы рекомендуем, чтобы решение о лечении глюкокортикоидами в сочетании или без сочетания с другими иммуносупрессивными лекарственными препаратами (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы") у пациентов с IgAN было принято с учетом рисков осложнений, включая инфекционные, и после индивидуального обсуждения с пациентом пользы и рисков применения этой терапии [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: К ситуациям, ассоциированным с повышением рисков тяжелых осложнений иммуносупрессивной терапии (ИСТ), относятся нижеперечисленные (но не ограничиваются ими): сахарный диабет, цирроз печени, латентные инфекции, индекс массы тела > 30 кг/м2, эрозивное или язвенное поражение желудочно-кишечного тракта, выраженный остеопороз, вероятность развития психического расстройства.
- Мы рекомендуем, чтобы лечение глюкокортикоидами в сочетании или без сочетания с другими иммуносупрессивными лекарственными препаратами (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы") у пациентов с IgAN сопровождалось поддерживающей профилактической терапией, направленной на предупреждение пневмоцитной пневмонии и других инфекций, развития и прогрессирования остеопороза, поражения желудочно-кишечного тракта в соответствии с действующими рекомендациями [1, 76, 77].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У пациентов с диагнозом первичной IgAN, которым запланировано проведение ИСТ, мы рекомендуем вакцинацию с использованием инактивированных вакцин против пневмококка и гемофильной палочки для снижения рисков инфекционных осложнений [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У пациентов с диагнозом первичной IgAN, которым запланировано проведение ИСТ глюкокортикоидами в сочетании или без сочетания с другими иммуносупрессивными лекарственными препаратами (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы"), мы рекомендуем в отсутствии противопоказаний выполнение тонзилэктомии для повышения эффективности лечения в отношении индукции ремиссии и снижения прогрессирования и рисков ТПН [32, 33, 56].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Доказательная база эффективности тонзилэктомии основана, главным образом, на данных азиатских исследований. Для европейской популяции пациентов с IgAN проблема не была подвергнута серьезному изучению. Вместе с тем, позитивный эффект тонзилэктомии в сочетании с глюкокортикоидами для индукции ремиссии и торможения прогрессирования болезни был продемонстрирован в крупном когортном исследовании пациентов с IgAN в России [78, 79].
Тонзилэктомию следует выполнять до или сразу после завершения индукционной терапии глюкокортикоидами для предупреждения реконституции герминативных центров миндалин после прекращения лечения [79].
- У пациентов с диагнозом первичной IgAN, протеинурией >1 г/сутки и высоким риском прогрессирования (вне быстропрогрессирующего нефритического синдрома), мы не рекомендуем в качестве ИСТ первой линии рутинное применение других иммуносупрессивных лекарственных препаратов (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы"), кроме глюкокортикоидов, для индукции ремиссии болезни и/или снижения темпов ее прогрессирования [70, 71, 73, 75, 80 - 82].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: В большинстве цитируемых МА РКИ не было убедительно показано преимуществ других иммуносупрессивных лекарственных препаратов (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы") (в т.ч. в комбинации с глюкокортикоидами) перед монотерапией глюкокортикоидами. Вместе с тем, мы допускаем возможность применения комбинированной ИСТ в отдельных случаях IgAN, не поддающихся лечению глюкокортикоидами, в рамках персонифицированного подхода с обсуждением вероятных рисков наступления побочных явлений [83 - 87].
- У отдельных пациентов с первичной IgAN и высоким риском прогрессии, но без признаков быстропрогрессирующего нефритического синдрома, мы рекомендуем рассмотреть возможность комбинированного применения глюкокортикоидов и #микофенолата мофетила** для индукции ремиссии и снижения риска прогрессирования [84, 88].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: МА РКИ продемонстрировали более высокую эффективность этой комбинации в сравнении с поддерживающей терапией без ИСТ и другими вариантами ИСТ в отношении твердых конечных точек прогноза при сравнимой или меньшей частоте побочных эффектов лечения. Ориентировочный режим дозирования #микофенолата мофетила**, примененный в ряде РКИ: индукционная терапия (длительность до 6 месяцев) - прием внутрь, 1,5 - 2,0 г/сутки (по 750 - 1000 мг 2 раза в день); поддерживающая терапия (длительность до 6 - 18 месяцев) - прием внутрь, 0,75 - 1,0 г/сутки (суточную дозу разделить на 2 приема) [84, 88, 96, 97, 98]. Преднизолон** в комбинации с #микофенолата мофетилом** следует применять внутрь, 0,4 - 0,6 мг/кг массы тела/сутки в течение 2 месяцев, затем - в течение четырех месяцев со снижением суточной дозы на 20% каждый месяц [99]. Другие глюкокортикоиды можно применять в эквивалентных преднизолону** дозах. Инициальные дозы, темпы их снижения и длительность применения глюкокортикоидов могут быть индивидуализированы у конкретного пациента. Комбинированное применение глюкокортикоидов и #микофенолата мофетила** не следует рассматривать как рутиный подход к терапии. Он требует тщательного отбора пициентов, оценки рисков осложнений и разработки плана их профилактики (как правило, в условиях экспертного центра).
- У пациентов с диагнозом первичной или вторичной IgAN с быстропрогрессирующим нефритическим синдромом на фоне выраженной пролиферативной активности и/или и клеточных полулуний по данным патолого-анатомического исследования биопсийного (операционного) материала почки, мы рекомендуем проведение комбинированной ИСТ глюкокортикоидами в сочетании с циклофосфамидом** для индукции ремиссии болезни и снижения темпов ее прогрессирования [89].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2)
Комментарии: Рекомендация основана на данных РКИ [89], которые подтверждаются другими наблюдениями [84, 90 - 93]. Лечение целессобразно начинать с внутривенного введения глюкокортикоидов в дозе 250 - 1000 мг (метилпреднизолон** или другие в эквивалентной дозе) в течение 3-х дней [91, 111] (иницальная доза может быть индивидуализирована у конкретного пациента).
- У пациентов с IgAN на фоне системного IgA-васкулита мы рекомендуем проводить такое же лечение, как для первичной IgAN с целью достижения ремиссии болезни и снижения темпов ее прогрессирования [1,2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- При отсутствии эффекта от проводимой терапии у пациентов с IgAN на фоне системного IgA-васкулита мы рекомендуем рассмотреть применение #ритуксимаба** с целью достижения ремиссии болезни [94].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: В отсутствие РКИ, по данным систематического обзора с МА наблюдательных исследований, #ритуксимаб** может быть безопасным и полезным агентом для индукции ремиссии заболевания и снижения иммуносупрессивной нагрузки у пациентов с IgA-васкулитом, резистентных к глюкокортикоидам или другим иммуносупрессивным лекарственным препаратам (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы"), а также у тех пациентов, которым эти препараты противопоказаны. Режим дозирования препарата: 375 мг/м2 1 раз в неделю, 4 введения; или 1000 мг 1 раз в 2 недели, 2 введения [94]. Правила приготовления, хранения, введения #ритуксимаба** соответствуют инструкции по применению лекарственного препарата.
- У пациентов с вторичной IgAN без признаков быстропрогрессирирующего нефритического синдрома, нефротического синдрома, выраженной пролиферативной активности и/или и клеточных полулуний мы рекомендуем лечение основного патологического процесса с целью достижения ремиссии болезни [31].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Стратегия лечения вторичной IgAN не определена надежными данными. В большинстве наблюдательных исследований предлагают лечить основное заболевание в сочетании с применением универсальных подходов к лечению ХБП. В случаях целиакии и воспалительных заболеваний кишечника, их лечение у некоторых пациентов может приводить к разрешению клинико-морфологических проявлений IgAN. У пациентов с другими причинами вторичной IgAN ответ на лечение недостаточно документирован.
3.4 Иммуносупрессивная и сопутствующая терапия у детей с IgAN
- Мы не рекомендуем рутинное назначение стероидной и/или иммуносупрессивной терапии детям с IgAN при отсутствии риска прогрессирования, то есть при изолированной микрогематурии, ликвидации макрогематурии, случившегося на фоне острой респираторной инфекции при условии регулярного наблюдения для динамической оценки рисков [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Цель - избежать неоправданное назначение препаратов и развитие неблагоприятных эффектов. Назначение глюкокортикоидов показано у детей с клиническим риском прогрессирования нефропатии:
1) с протеинурией нефротического уровня или нефротическим синдромом с учетом морфологических изменений в почечной ткани;
2) с протеинурией (при соотношении альбумин/креатинин - 0,5 - 1 мг/мг (50 - 100 мг/ммоль), сохраняющейся несмотря на 3 - 6 месяцев блокады ренин-ангиотензиновой системы;
3) с протеинурией (при соотношении альбумин/креатинин > 1 мг/мг (100 мг/ммоль) несмотря на 4 месяца терапии иАПФ;
4) патолого-анатомическими показателями активности по MEST-C (1 или более по следующим показателям: M1, E1, S1 с подоцитарными изменениями, C1) и стойкой протеинурией > 1 мг/мг (100 мг/ммоль) в течение 3 недель и более.
- Детям с IgAN мы рекомендуем рассмотреть проведение иммуносупрессии с применением преимущественно глюкокортикоидов с целью индукции ремиссии/снижения активности болезни [106, 111, 112, 114].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
- Мы рекомендуем рассмотреть 4 - 6 месячный курс терапии глюкокортикоидами, например, преднизолон** в дозе 2 мг/кг в сутки (не более 60 мг в день) (или эквивалентного препарата) длительностью не более 4 недель с последующим переходом на альтернирующий режим с постепенным снижением дозы до полной отмены через 5 - 6 месяцев детям с первичной IgAN и (1) персистирующей протеинурией несмотря на проводимую адекватную неиммуносупрессивную ренопротективную терапию, при соотношении альбумин/креатинин > 0,5 - 1 г/г (50 - 100 мг/ммоль) в течение 3 - 6 месяцев; (2) персистирующей протеинурией несмотря на проводимую адекватную неиммуносупрессивную ренопротективную терапию (при отношении альбумин/креатинин > 1г/г (100 мг/ммоль)) более 4 недель; (3) наличии показателей активности по MEST-C (1 или более из следующих оценок: M1, E1, S1 с поражениями подоцитов, C1) и/или отношение альбумин/креатинин последовательно (т. е. сохраняющиеся в течение 2 - 3 недель в минимум двух измерениях с интервалом в 1 - 2 недели) > 1 мг/мг (100 мг/ммоль) - с целью индукции ремиссии/снижения активности болезни (в первую очередь, снижения протеинурии и снижения темпов ее прогрессирования) [106, 111, 122].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Показано, что глюкокортикоиды в значительной степени уменьшают мезангиальную пролиферацию у детей [106]. Продолжительность лечения индивидуальна, но обычно это 4 недели перорального приема преднизолона** в дозе 1 - 2 мг/кг/сут (или эквивалента), с последующим снижением дозы через день в течение 4 - 6 месяцев. В редких случаях применяются более длительные курсы. На основании экстраполяции исследований, проведенных у взрослых, возможно рассмотреть более низкие дозы: 0,4 мг/кг/сут преднизолона** в течение 2 месяцев с постепенным снижением в течение 6 месяцев [112] или перорально с 14 лет #метилпреднизолон** 0,4 мг/кг/день в течение 2 месяцев (максимальная доза 32 мг/сут длительностью 2 мес) с последующим снижением дозы на 4 мг/день ежемесячно в течение 6 - 9 месяцев (с проведением профилактики пневмоцистной пневмонии в течение первых 12 недель периода лечения) [123, 124].
- Мы рекомендуем рассмотреть режим пульс-терапии #метилпреднизолоном** (внутривенно) у детей с IgAN с высоким клиническим и патолого-анатомическим (патоморфологическим) риском прогрессирования, таких как: (1) острое начало IgAN и снижением функции почек (СКФ <90 мл/мин/1,73 м2) и/или отношением альбумин/креатинин >1 мг/мг (100 мг/ммоль) с активными тяжелыми баллами MEST-C (2 или более из следующих баллов: M1, E1, S1 с поражениями подоцитов, C1); (2) наличие IgAN с полулуниями (C2) - независимо от протеинурии [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: #Метилпреднизолон** вводится внутривенно в дозе 15 мг/кг/сут (максимальная доза 500 мг/сут) в течение 3 последовательных дней (пульс-терапия) или через день с последующим пероральным применением преднизолона** по схеме и в дозах, описанных выше [112].
Следует учесть, что с применением глюкокортикоидов связано значительное увеличение вероятности развития ремиссии и снижения риска развития ХБП С 4 - 5, но также 2 - 3 кратное увеличение частоты побочных эффектов (раздел "Приложение А3", п. 1) - желудочно-кишечных, гематологических, дерматологических, мочеполовых инфекций, выраженный остеопороз, вероятность развития психического расстройства, а также нарушения толерантности к глюкозе или диабета, что следует учитывать при назначении терапии, информировании пациента и планировании профилактических мероприятий.
В отдельных случаях можно рассмотреть применение глюкокортикоидов одновременно с иАПФ, особенно при наличии протеинурии нефротического диапазона, сниженной СКФ и наличии полулуний или активного воспаления по данным патолого-анатомического исследования.
Следует рассмотреть возможность избегания глюкокортикоидов, когда тубулоинтерстициальный склероз превышает 50% коркового слоя (T2) при отсутствии активных поражений ввиду заведомой высокой вероятностью неэффективности и необоснованным риском развития у пациента побочных эффектов.
- У детей с первичной IgAN и протеинурией > 0,5 г/м2 /сут (или при отношении альбумин/креатинин 0,5 г/г) несмотря на проводимую и адекватную неиммуносупрессивную нефропротективную и/или стероидную терапию при отсутствии быстропрогрессирующего нефритического синдрома и противопоказаний мы рекомендуем проведение лечения #будесонидом** (АТХ классификация, код A07EA06) с целью индукции ремиссии/снижения активности болезни [125, 126].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: В описании двух клинических случаев #будесонид** успешно назначали детям, у которых не было получено эффекта от системной терапии глюкокортикоидами: в одной публикации - ребенку 12 лет со стойкой протеинурией нефротического уровня #будесонид** назначали в дозе 3 мг ежедневно - 4 недели, далее 6 мг после нормализации уровня креатинина в крови - постепенная отмена до 3 мг в день через день в течение 6 месяцев [125], в другом сообщении - 13-летнему пациенту в стартовой дозе 9 мг/сут, через 5 месяцев из-за снижения уровня кортизола доза была снижена по 3 мг каждые 3 месяца с полной отменой через 1 год [126].
- Мы рекомендуем проведение дополнительно иммуносупрессивной терапии (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы") при неэффективности иАПФ/БРА и глюкокортикоидов при наличии высоких рисков прогрессирования нефропатии с целью индукции ремиссии/снижения активности болезни: (1) быстропрогрессирующий нефритический синдром со снижением СКФ более чем на 50% за период менее 3 месяцев, наличием эндокапиллярной пролиферации и полулуний в 25% и более гломерул (E1 и C2 по MEST-C). В этой ситуации рассматривается применение #циклофосфамида** или #микофенолата мофетила** (дозы см. в комментарии); (2) проявления нефротического синдрома либо нефротический уровень протеинурии (> 2 мг/мг креатинина, 200 мг/ммоль), резистентного к терапии преднизолоном** в дозе 2 мг/кг/сут длительностью не менее 4 недель. В этой ситуации рекомендуется назначение ингибиторов кальциневрина или #микофенолата мофетила** (дозы см. в комментарии) [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: При достижении ремиссии протеинурии и восстановлении/улучшении почечной функции следует продолжать иммуносупрессивную терапию не менее 6 - 12 месяцев при отсутствии выраженных побочных эффектов. После отмены терапию иАПФ/БРА необходимо сохранить. В случае рецидива следует рассмотреть возобновление предшествовавшей терапии, оказавшей эффект.
Иммуносупрессивная терапия назначается в случае отсутствия значимой эффективности глюкокортикоидов или повышении уровня протеинурии > 1 г/м2/сут. Препаратом иммуносупрессии второй линии (в комбинации с глюкокортикоидами (например, преднизолоном**) и, как правило, с иАПФ или БРА [127] могут быть выбраны, например: (1) #азатиоприн** - в дозе 2 мг/кг/сут однократно в течение 24 мес [112, 127] или (2) #циклофосфамид** - может быть назначен пациентам с быстропрогрессирующим нефритическим синдромом на фоне выраженной пролиферативной активности и/или полулуний по данным патолого-анатомического исследования биопсийного (операционного) материала почек (в виде пульс-терапии при неэффективности глюкокортикоидов 3 или 6 внутривенных пульсов по 500 мг/1,73 м2 [128] или 500 мг/м2 на пульс - ежемесячно, курсом 6 мес [127, 129, 130]) или (3) #микофенолата мофетил** - при наличии пролиферативных изменений (мезангиальной пролиферации и/или полулуний) - может быть проведена терапия (перорально) 1,2 г/м2/ сутки, но не более 2 г/сут в 2 приема курсом 6 - 12 мес, затем доза снижается вдвое - поддерживающая терапия, в среднем, - в течение 6 - 12 мес [133] или #микофенолата мофетил** 20 - 30 мг/кг/сут - в среднем 12 месяцев в зависимости от клинического ответа [112, 127, 131, 132] или ингибитор кальциневрина: (назначается, главным образом, при признаках нефротического синдрома и сегментарном склерозе гломерул): (4) #циклоспорин** (дозы #циклоспорина** отрабатываются, при возможности, под контролем исследования уровня циклоспорина А: (перед приемом утренней дозы (С0) и через два часа после (С2), но часто используют в С0 - до приема утренней дозы, то есть через 12 часов после приема препарата вечером) (до 100 - 150 (в среднем, 183,8+/-48,3 нг/мл - еженедельно в начале лечения и затем каждый месяц под контролем уровня креатинина в крови). В среднем, пациенты получают #циклоспорин** 4 - 5 мг/кг/сут в 2 приема каждые 12 часов равными дозами, в течение, в среднем, 9 мес. в сочетании с преднизолоном** 0,4 - 0,6 мг/кг/сут до 2 мг/кг/сут в течение 6 - 8 недель). Одновременно могут применяться иАПФ (дозы см. выше) [112, 134, 135] или (5) #такролимус** (0,1 - 0,5 мг/кг/сут в 2 приема каждые 12 часов равными дозами, под контролем уровня #такролимуса** (исследование уровня лекарственных препаратов в крови) до утреннего приема - 5 - 8 нг/мл) в сочетании с преднизолоном** 0,4 - 0,6 мг/кг/сут в течение 6 - 8 недель [135, 136, 137].
Следует помнить, что, как иАПФ и БРА, так и ингибиторы кальциневрина могут вызвать гиперкалиемию. Поэтому сочетанное использование этих препаратов увеличивает риск развития гиперкалиемии, требующий мониторинга уровня калия в крови (исследование уровня калия в крови).
Следует проводить регулярный контроль токсичности препаратов - согласно соответствующим Инструкциям.
- Мы рекомендуем, чтобы лечение глюкокортикоидами в сочетании или без сочетания с другими иммуносупрессивными лекарственными препаратами (АТХ классификация: "Противоопухолевые препараты и иммуномодуляторы") у детей с IgAN сопровождалось поддерживающей профилактической терапией, направленной на предупреждение неблагоприятных эффектов терапии, в том числе, развития и прогрессирования остеопороза и поражения желудочно-кишечного тракта в соответствии с действующими рекомендациями [111].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У детей с диагнозом первичной IgAN, при повторяющихся эпизодах гематурии, ассоциированных с рецидивами острого тонзиллита или при наличии хирургических показаний, мы рекомендуем при отсутствии противопоказаний рассмотреть выполнение тонзилэктомии для повышения эффективности лечения в отношении индукции ремиссии и снижения прогрессирования поражения почек и рисков терминальной почечной недостаточности [112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: показана эффективность тонзилэктомии в сочетании с пульс-терапией #метилпреднизолоном** при стероидрезистентном варианте IgAN [138, 139, 140] и в сочетании с иными вариантами иммуносупрессивной терапии [141].
По мнению детских нефрологов из Японии - проведение тонзилэктомии возможно рассмотреть в дополнение к пульс-терапии #метилпреднизолоном** у детей с впервые диагностированным IgAN при высокой активности заболевания, наличии хронического тонзиллита и макрогематурии после инфекции верхних дыхательных путей [142].
При рефрактерности к иАПФ или БРА, лечению глюкокортикоидами или иммуносупрессивной терапии, пациента следует направить в федеральный центр для оптимизации лечебного подхода либо включения в клинические исследования.
4. Реабилитация
Специфическая медицинская реабилитация для пациентов с IgAN не разработана.
- У взрослых пациентов с первичной или вторичной IgAN мы рекомендуем проводить медицинскую реабилитацию по показаниям и в объеме, предусмотренном рекомендациями по ХБП, для улучшения исходов болезни [24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- У детей с первичной или вторичной IgAN мы рекомендуем проводить медицинскую реабилитацию по показаниям и в объеме, предусмотренном рекомендациями по ХБП, для улучшения исходов болезни [104].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
5. Профилактика
Методы и подходы к первичной профилактике IgAN не разработаны.
- У взрослых пациентов с первичной или вторичной IgAN мы рекомендуем проводить профилактические мероприятия, направленные на предупреждение осложнений дисфункции почек и ОПП, и диспансерное наблюдение в объеме, предусмотренном рекомендациями по ХБП, для улучшения исходов болезни [24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Детей с IgAN мы рекомендуем наблюдать и после достижения полной ремиссии, поскольку у них может развиться рецидив даже через много лет [112, 113].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 4)
Комментарии: пациенты подлежат диспансерному наблюдению у врача-педиатра/врача-нефролога и наблюдению в медицинской организации, имеющей опыт по IgAN. Исследования, проводимые в динамике представлены в разделе "Приложение А3", п. 2.
Вакцинопрофилактика для детей с IgAN
Всем пациентам с IgAN следует выполнить оценку вакцинального статуса (проверить полноту проведения иммунизации в соответствии с национальным календарем профилактических прививок и уточнить получал ли ребенок дополнительные вакцины) на этапе установления диагноза с последующим его регулярным мониторингом в ходе дальнейшего консультирования.
- Мы рекомендуем для детей с IgAN проведение иммунопрофилактики инфекционных болезней с использованием вакцин (инактивированных) с целью обеспечения защиты от вакциноуправляемых инфекций [111, 143].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Мы рекомендуем всем детям с IgAN вакцинацию против гриппа (Вакциной для профилактики гриппа (инактивированной))** и пневмококка (Вакциной для профилактики пневмококковых инфекций** (конъюгированной) и Вакциной для профилактики пневмококковых инфекций** (полисахаридной)) с профилактической целью [111, 143].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: вакцинация против пневмококка разными вакцинами проводится с соблюдением общепринятых для этих вакцин интервалов.
- Мы не рекомендуем использовать живые вакцины детям с IgAN, которые получают иммуносупрессивную терапию, с целью предотвращения возможных нежелательных явлений [111, 143].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: иммунный ответ на вакцинацию у имуносупрессированных пациентов может быть снижен.
Пациентам, получающим иммуносупрессивную терапию, инактивированные вакцины назначаются без ограничений.
Дозой глюкокортикоидов, вызывающей иммуносупрессию, является для преднизолона** 2 мг/кг/сут, принимаемая в течение 14 дней и более; введение живых вакцин этим пациентам допускается через 1 месяц и более после окончания терапии [144]. Использование такой дозы в течение менее 2 недель или меньших доз в течение более длительного периода не ведет к развитию выраженной иммуносупрессии.
При возможности, кроме вакцин (живых), включенных в национальный календарь профилактических прививок, детям с IgAN следует провести вакцинацию против ветряной оспы.
В настоящее время нет однозначных данных об оптимальном интервале между возможным применением живых вакцин после завершения иммуносупрессивной терапии. Клинические рекомендации KDIGO 2021 рекомендуют иммунизацию вакцинами (живыми) через 1 - 3 мес. после прекращения иммуносупрессивной терапии [111].
Следует вакцинировать родных и близких (при отсутствии противопоказаний), в т.ч. ежегодно против гриппа, тесно контактирующих с больными IgAN, что является важной стратегией защиты пациентов от тяжелых вакцинопредотвратимых инфекций [111]. Этот подход называется "кокон-вакцинацией".
Необходимо избегать контактов ребенка с IgAN с выделениями лиц, иммунизированных вакцинами (живыми) в течение 3 - 6 недель после вакцинации [111].
Имеются данные о том, что IgAN стала диагностироваться чаще с началом пандемии коронавирусной инфекции нового типа (COVID-19), что может свидетельствовать о триггерной роли данного патогена, наравне с ранее известными возбудителями респираторных инфекций [145]. Вместе с тем, были описаны случаи дебюта клинических проявлений IgAN или обострения заболевания, в том числе, у детей, после вакцинации от коронавирусной инфекции нового типа (COVID-19) зарубежными вакцинами (мРНК и векторной вакциной). Данные случаи исключительно редки, исходы у большинства пациентов благоприятны, доказательства причинно-следственной связи продолжают изучаться. Тем не менее, признается, что потенциальная польза от вакцинации превышает возможные нежелательные явления [146, 147, 148]. Таким образом, вакцинацию от коронавирусной инфекции нового типа (COVID-19) следует проводить в соответствии с действующими рекомендациями и Инструкциями к соответствующим препаратам. Нужно контролировать симптомы и, при необходимости, проводить лабораторные диагностические исследования с целью своевременной диагностики и лечения вероятных осложнений.
6. Организация оказания медицинской помощи
Пациентам с IgAN, в зависимости от необходимости, может быть оказана медицинская помощь любого вида, условия, формы, предусмотренных законодательством Российской Федерации.
Основные показания к экстренной госпитализации в стационар пациентов с IgAN:
1) Развитие или подозрение на развитие ОПП (снижение темпов диуреза < 0,5 мл/кг/час в течение > 6 часов или повышение креатинина крови > 50% от исходного за 7 дней или повышение креатинина крови на > 26 мкмоль/л за 48 часов;
2) быстропрогрессирующее снижение СКФ и/или повышение уровня креатинина крови (на > 50% в течение 3 месяцев) (для взрослых); впервые выявленное снижение СКФ >= 50% (для детей);
3) острый нефритический синдром;
4) водно-электролитные нарушения и ацидоз (потеря жидкости и гиповолемия, гиперкалиемия, гипокалиемия, гипонатриемия, метаболический ацидоз, декомпенсированный);
5) любое из следующих осложнений, требующее экстренной терапии, включая начало диализа: нарушение функций центральной нервной системы; серозиты; декомпенсация метаболического ацидоза; гиперкалиемия; неконтролируемая гипергидратация (анасарка, отек легких) и артериальная гипертензия; тяжелая белково-энергетическая недостаточность;
6) резистентная к амбулаторному лечению артериальная гипертензия (включая гипертензивный криз);
7) впервые выявленное снижение СКФ < 30 мл/мин/1,73 м2.
Основные показания к выписке пациента из стационара после экстренной госпитализации пациентов с IgAN:
1) Подтвержден или исключен диагноз ОПП; при подтверждении - установлена этиология ОПП;
2) проведено лечение ОПП в полном объеме, завершившееся исходом (регресс, прогрессирование ХБП, ТПН);
3) установлена причина быстропрогрессирующего снижения СКФ и/или повышения уровня креатинина крови (на > 50% в течение 2 - 6 месяцев) и проведено лечение, завершившееся исходом (регресс, прогрессирование ХБП, ТПН);
4) купированы проявления острого нефритического синдрома, установлена его причина;
5) проведено лечение клинически значимых осложнений дисфункции почек: водно-электролитных нарушений, нарушений кислотно-основного состояния крови: купированы или компенсированы гиповолемия, гиперкалиемия, гипокалиемия, гипонатриемия, метаболический ацидоз, метаболический алкалоз (консервативными методами или методами диализа);
6) снижено артериальное давление, устранены жизнеугрожающие проявления гипертензии и оптимизирована антигипертензивная терапия у пациентов ХБП С1-С5Д;
7) при впервые выявленном снижении СКФ < 30 мл/мин/1,73 м2 - проведены диагностика и лечение основных осложнений дисфункции почек.
Основные показания к плановой госпитализации в стационар:
1) Первичная диагностика при подозрении на IgAN;
2) у пациентов с известным диагнозом IgAN:
a. нарастание протеинурии и/или гематурии;
b. впервые выявленный нефротический синдром (сочетание гипоальбуминемии и протеинурии > 3,5 г/сутки/1,73 м2);
c. необходимость диагностики/дифференциальной диагностики с применением биопсии почек или других диагностических исследований, требующих госпитализации;
3) формирование доступа для диализа;
4) на фоне беременности;
5) проведение ИСТ IgAN и/или лечение ассоциированных патологических процессов;
6) подготовка к проведению оперативного лечения по разным показаниям.
Основные показания к выписке пациента из стационара после плановой госпитализации:
1) Подтвержден или опровергнут диагноз IgAN, проведены лечение и первичная диагностика с применением биопсии почек или других диагностических исследований в соответствии с рекомендациями;
2) подтвержден или опровергнут диагноз обострения/рецидива, проведено лечение в соответствии с рекомендациями;
3) проведена диагностика причин вторичной IgAN в соответствии с рекомендациями;
4) сформирован доступ для диализа;
5) IgAN на фоне беременности - определен почечный прогноз, проведены лечение и диагностика в соответствии с рекомендациями, исключено применение тератогенных препаратов;
6) проведение индукционной ИСТ - проведен цикл или госпитальная фаза ИСТ, выполнена диагностика и лечение осложнений ИСТ, осуществлен контроль функционального состояния почек, проведены диагностика и лечение осложнений дисфункции почек (если таковые были выявлены);
7) подготовка к проведению оперативного лечения - осуществлена необходимая диагностика и коррекция осложнений ХБП, влияющих на риски оперативного вмешательства (консервативно или методами диализа).
Организация диетического питания пациентов при стационарном лечении в медицинских организациях проводится в соответствии с Приложением 3 приказа Минздрава России от 23.09.2020 N 1008н "Об утверждении порядка обеспечения пациентов лечебным питанием".
Принципы организации амбулаторной помощи:
Амбулаторное ведение пациентов с IgAN должно быть организовано в соответствии с принципами, изложенными в рекомендациях по ХБП [24].
7. Дополнительная информация
На течение и исход IgAN оказывают влияние многочисленные факторы, ассоциированные с нарушениями функций почек. Мультифакториальный подход к улучшению пациент-ориентированных исходов составляет основу ведения пациентов с IgAN, а подходы к коррекции/модификации факторов риска прогрессирующей дисфункции почек подробно освящены в рекомендациях "Хроническая болезнь почек" [24] и "Острое повреждение почек" [95].
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
У взрослых пациентов с IgAN
1.
Пациенту с подозрением на IgAN при отсутствии противопоказаний проведена биопсия почки под контролем ультразвукового исследования c последующим патолого-анатомическим исследованием биопсийного (операционного) материала почки
Да/Нет
2.
Пациенту с IgAN и протеинурией > 0,5 г/сутки назначено лечение препаратами - иАПФ или БРА
Да/Нет
3.
У пациента с IgAN проведена консультация врача-оториноларинголога
Да/Нет
4.
У пациента с IgAN при первичной диагностике выполнено определение количества белка в суточной моче и микроскопическое исследование осадка мочи
Да/Нет
5.
У пациента с IgAN, находящегося под амбулаторным наблюдением, проведено определение количества белка в суточной моче и выполнено микроскопическое исследование осадка мочи, не реже 2 раз в год
Да/Нет
6.
У пациента с подозрением на IgAN патолого-анатомическое исследование биопсийного (операционного) материала почки выполнено с применением иммуногистохимических методов и определением гломерулярных депозитов IgA, IgM, IgG, фракций комплемента (C3, C1q) и легких цепей Ig (каппа, ламбда)
Да/Нет
7.
Пациенту с первичной IgAN высокого риска прогрессирования или с персистирующей протеинурией > 1 г/сутки и гематурией, несмотря на проводимую адекватную неиммуносупрессивную ренопротективную терапию, начато или проведено лечение глюкокортикоидами
Да/Нет
8.
Пациенту с диагнозом первичной IgAN, которому запланировано или проведено лечение глюкокортикоидами, выполнена тонзилэктомия или рекомендовано ее выполнение при отсутствии противопоказаний
Да/Нет
У детей с IgAN
9.
Ребенку с подозрением на IgAN при отсутствии противопоказаний проведена биопсия почки под контролем ультразвукового исследования с последующим с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек
Да/Нет
10.
При обнаружении в биоптате почки у ребенка с нефритическим синдромом преобладающих депозитов IgA проведена оценка выраженности морфологических изменений по критериям MEST-C (Оксфордская класификация IgAN)
Да/Нет
11.
Ребенку с IgAN назначено лечение иАПФ или БРА и/или глюкокортикоидами и/или препаратами группы "Противоопухолевые препараты и иммуномодуляторы" в зависимости от медицинских показаний и противопоказаний
Да/Нет
Список литературы
1. Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for Glomerulonephritis. Kidney Int Suppl 2012; 2:139-274. https://kdigo.org/wp-content/uploads/2017/02/KDIGO-2012-GN-Guideline-English.pdf
2. Нефрология. Клинические рекомендации. По ред. Шилов Е.М., Смирнов А.В., Козловская Н.Л. ГОЭТАР-Медиа, 2016
3. Schena FP, Nistor I. Epidemiology of IgA Nephropathy: A Global Perspective. Semin Nephrol 2018; 38: 435 - 442. doi: 10.1016/j.semnephrol.2018.05.013
4. Reily C, Ueda H, Huang ZQ et al. Cellular Signaling and Production of Galactose-Deficient IgA1 in IgA Nephropathy, an Autoimmune Disease. Journal of Immunology Research 2014(2): 197548. doi: 10.1155/2014/197548
5. Hiki Y, Odani H, Takahashi M et al. Mass spectrometry proves under-O-glycosylation of glomerular IgA1 in IgA nephropathy. Kidney Int 2001; 59(3):1077-1085. doi: 10.1046/j.1523-1755.2001.0590031077.x
6. Tomana M, Novak J, Julian B et al. Circulating immune complexes in IgA nephropathy consist of IgA1 with galactose-deficient hinge region and antiglycan antibodies. J Clin Invest 1999; 104(1): 73 - 81. doi: 10.1172/JCI5535
7. Boyaka PN. Inducing Mucosal IgA: A Challenge for Vaccine Adjuvants and Delivery Systems. J Immunol 2017; 199: 9 - 16. doi: 10.4049/jimmunol.1601775
8. Muto M, Manfroi B, Suzuki H et al. Toll-Like Receptor 9 Stimulation Induces Aberrant Expression of a Proliferation-Inducing Ligand by Tonsillar Germinal Center B Cells in IgA Nephropathy. J Am Soc Nephrol 2017; 28(4): 1227 - 1238. doi: 10.1681/ASN.2016050496
9. Robert T, Berthelot L, Cambier A et al. Molecular Insights into the Pathogenesis of IgA Nephropathy. Trend Mol Med 2015; 12: 762 - 775. doi: 10.1016/j.molmed.2015.10.003
10. Ben Mkaddem S, Benhamou M, Monteiro RC. Understanding Fc Receptor Involvement in Inflammatory Diseases: From Mechanisms to New Therapeutic Tools. Front Immunol 2019; 10: 1 - 12. doi: 10.3389/fimmu.2019.00811
11. Novak J, Julian BA, Tomana M et al. IgA Glycosylation and IgA Immune Complexes in the Pathogenesis of IgA Nephropathy. Semin Nephrol 2008; 28(1): 78 - 87. doi: 10.1016/j.semnephrol.2007.10.009
12. Wyatt RJ, Julian BA. IgA Nephropathy. N Engl J Med 2013; 368: 2402 - 2414. doi: 10.1056/NEJMra1206793
13. Novak J, Tomana M, Matousovic K et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney Int 2005; 67: 504 - 513. doi: 10.1111/j.1523-1755.2005.67107.x
14. Kiryluk K, Li Y, Sanna-Cherchi S et al. Geographic Differences in Genetic Susceptibility to IgA Nephropathy: GWAS Replication Study and Geospatial Risk Analysis. PLoS Genet 2012; 8(6):e1002765. doi: 10.1371/journal.pgen.1002765
15. Moriyama T, Tanaka K, Iwasaki C et al. Prognosis in IgA Nephropathy: 30-Year Analysis of 1,012 Patients at a Single Center in Japan. PLOS ONE 2014; 9(3):e91756. doi: 10.1371/journal.pone.0091756
16. Lee H, Kim DK, Oh KH et al. Mortality of IgA Nephropathy Patients: A Single Center in Korea. Experience over 30 Years. PLoS ONE 2012; 7(12): e51225. doi: 10.1371/journal.pone.0051225
17. Le W, Liang S, Hu Y et al. Long-term renal survival and related risk factors in patients with IgA nephropathy: results from a cohort of 1155 cases in a Chinese adult population. Nephrol Dial Transplant 2012; 27: 1479 - 1485. doi: 10.1093/ndt/gfr527
18. Coppo R, Troyanov S, Bellur S et al. Validation of the Oxford classification of IgA-nephropathy in cohorts with different presentations and treatments. Kidney Int 2014; 86: 828 - 836. doi: 10.1038/ki.2014.63
19. Добронравов В.А., Мужецкая Т.О., Лин Д.И., Кочоян З.Ш. Иммуноглобулин А-нефропатия в российской популяции: клинико-морфологическая презентация и отдаленный прогноз. Нефрология 2019; 23(6): 45 - 60. doi: 10.36485/1561-6274-2019-236-45-60
20. Сурсякова К.И., Сафьянова Т.В. Некоторые эпидемиологические особенности заболеваемости гломерулярными и тубулоинтерстициальными болезнями почек и инфекциями мочевыводящих путей в Алтайском крае. Экспериментальная и клиническая урология 2017; 4: 6 - 11
21. Yeo SC, Goh SM, Barratt J. Is immunoglobulin A nephropathy different in different ethnic populations? Nephrology (Carlton) 2019; 24(9): 885 - 895. doi: 10.1111/nep.13592
22. Chang JH, Kim DK, Kim HW et al. Changing prevalence of glomerular diseases in Korean adults: a review of 20 years of experience. Nephrol Dial Transplant 2009; 24(8): 2406 - 2410. doi: 10.1093/ndt/gfp091
23. Андрусев А.М., Томилина Н.А., Перегудова Н.Г., Шинкарев М.Б. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации 2014 - 2018 гг. Отчет по данным Общероссийского Регистра заместительной почечной терапии Российского диализного общества. http://nephro.ru/index.php?r=site/pageView&id=298%20,%20journal.nephro.ru/index.php?r=journal/pageView&id=298
24. Хроническая болезнь почек (ХБП). Клинические рекомендации. https://rusnephrology.org/wp-content/uploads/2020/12/CKD_final.pdf
25. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150(9): 604 - 12. doi: 10.7326/0003-4819-150-9-200905050-00006
26. Levey AS, Stevens LA. Estimating GFR using the CKD Epidemiology Collaboration (CKD-EPI) creatinine equation: more accurate GFR estimates, lower CKD prevalence estimates, and better risk predictions. Am J Kidney Dis 2010; 55(4): 622 - 7. doi: 10.1053/j.ajkd.2010.02.337
27. Cattran DC, Coppo R, Cook HT et al. The Oxford classification of IgA nephropathy: rationale, clinicopathological correlations, and classification. A Working Group of the International IgA Nephropathy Network and the Renal Pathology Society. Kidney Int 2009; 76(5): 534 - 545. doi: 10.1038/ki.2014.63
28. Trimarchi H, Barratt J, Cattran DC et al. IgAN Classification Working Group of the International IgA Nephropathy Network and the Renal Pathology Society; Conference Participants. Oxford Classification of IgA nephropathy 2016: an update from the IgA Nephropathy Classification Working Group. Kidney Int 2017; 91(5): 1014 - 1021. doi: 10.1016/j.kint.2017.02.003
29. Barbour SJ, Coppo R, Zhang H et al. Evaluating a New International Risk-Prediction Tool in IgA Nephropathy. JAMA Intern Med 2019; 179(7): 942 - 952. doi: 10.1001/jamainternmed.2019.0600
30. Wang M, Lv J, Zhang X et al. Secondary IgA Nephropathy Shares the Same Immune Features With Primary IgA Nephropathy. Kidney Int Rep 2019; 5(2): 165 - 172. doi: 10.1016/j.ekir.2019.10.012
31. Saha MK, Julian BA, Novak J, Rizk DV. Secondary IgA nephropathy. Kidney Int 2018; 94(4): 674 - 681. doi: 10.1016/j.kint.2018.02.030
32. Liu LL, Wang LN, Jiang Y et al. Tonsillectomy for IgA nephropathy: a meta-analysis. Am J Kidney Dis 2015; 65(1): 80 - 7. doi: 10.1053/j.ajkd.2014.06.036
33. Duan J, Liu D, Duan G, Liu Z. Long-term efficacy of tonsillectomy as a treatment in patients with IgA nephropathy: a meta-analysis. Int Urol Nephrol 2017; 49(1): 103 - 112. doi: 10.1007/s11255-016-1432-7
34. Inker LA, Mondal H, Greene T et al. Early Change in Urine Protein as a Surrogate End Point in Studies of IgA Nephropathy: An Inpidual-Patient Meta-analysis. Am J Kidney Dis 2016; 68(3): 392 - 401. doi: 10.1053/j.ajkd.2016.02.042
35. Thompson A, Carroll K, A Inker L et al. Proteinuria Reduction as a Surrogate End Point in Trials of IgA Nephropathy. Clin J Am Soc Nephrol 2019; 14(3): 469 - 481. doi: 10.2215/CJN.08600718
36. He P, Wang H, Huang C, He L. Hematuria was a high risk for renal progression and ESRD in immunoglobulin a nephropathy: a systematic review and meta-analysis. Ren Fail 2021; 43(1): 488 - 499. doi: 10.1080/0886022X.2021.1879852
37. Offringa M, Benbassat J. The value of urinary red cell shape in the diagnosis of glomerular and post-glomerular haematuria. A meta-analysis. Postgrad Med J 1992; 68(802): 648 - 54. doi: 10.1136/pgmj.68.802.648
38. Bi TD, Zheng JN, Zhang JX et al. Serum complement C4 is an important prognostic factor for IgA nephropathy: a retrospective study. BMC Nephrol 2019; 20(1): 244. doi: 10.1186/s12882-019-1420-0
39. Pan M, Zhou Q, Zheng S et al. Serum C3/C4 ratio is a novel predictor of renal prognosis in patients with IgA nephropathy: a retrospective study. Immunol Res 2018; 66(3): 381 - 391. doi: 10.1007/s12026-018-8995-6
40. Pan M, Zhang J, Li Z et al. Increased C4 and decreased C3 levels are associated with a poor prognosis in patients with immunoglobulin A nephropathy: a retrospective study. BMC Nephrol 2017; 18(1): 231. doi: 10.1186/s12882-017-0658-7
41. Zhang Y, Duan SW, Chen P et al. Relationship between serum C3/C4 ratio and prognosis of immunoglobulin A nephropathy based on propensity score matching. Chin Med J (Engl) 2020; 133(6): 631 - 637. doi: 10.1097/CM9.0000000000000674
42. Zhang J, Wang C, Tang Y et al. Serum immunoglobulin A/C3 ratio predicts progression of immunoglobulin A nephropathy. Nephrology (Carlton) 2013; 18(2): 125 - 31. doi: 10.1111/nep.12010
43. Lv J, Shi S, Xu D et al. Evaluation of the Oxford Classification of IgA nephropathy: a systematic review and meta-analysis. Am J Kidney Dis 2013; 62(5): 891 - 9. doi: 10.1053/j.ajkd.2013.04.021
44. Shao X, Li B, Cao L et al. Evaluation of crescent formation as a predictive marker in immunoglobulin A nephropathy: a systematic review and meta-analysis. Oncotarget 2017; 8(28): 46436 - 46448. doi: 10.18632/oncotarget.17502
45. Luo MN, Yao CW, Xu BH et al. Continuation of immunosuppressive treatment may be necessary in IgA nephropathy patients with remission of proteinuria: Evaluation by repeat renal biopsy. Exp Ther Med 2014; 7(3): 553 - 559. doi: 10.3892/etm.2013.1467
46. Shen XH, Liang SS, Chen HM et al. Reversal of active glomerular lesions after immunosuppressive therapy in patients with IgA nephropathy: a repeat-biopsy based observation. J Nephrol 2015; 28(4): 441 - 9. doi: 10.1007/s40620-014-0165-x
47. Luo MN, Pan Q, Huang ZQ et al. IgA nephropathy patients with partial crescent formation benefit from immunosuppressants: evidence from repeat renal biopsy. Discov Med 2020; 30(159): 19 - 25
48. Jullien P, Laurent B, Berthoux F et al. Repeat renal biopsy improves the Oxford classification-based prediction of immunoglobulin A nephropathy outcome. Nephrol Dial Transplant 2020; 35(7): 1179 - 1186. doi: 10.1093/ndt/gfy341
49. Khairwa A. Indian scenario of IgA nephropathy: a systematic review and meta-analysis. Afr Health Sci 2021; 21(1): 159 - 165. doi: 10.4314/ahs.v21i1.21
50. Okpechi IG, Ameh OI, Bello AK et al. Epidemiology of Histologically Proven Glomerulonephritis in Africa: A Systematic Review and Meta-Analysis. PLoS One 2016; 11(3): e0152203. doi: 10.1371/journal.pone.0152203
51. Katafuchi R, Nagae H, Masutani K et al. Comprehensive evaluation of the significance of immunofluorescent findings on clinicopathological features in IgA nephropathy. Clin Exp Nephrol 2019; 23(2): 169 - 181. doi: 10.1007/s10157-018-1619-6
52. Tan L, Tang Y, Pei G et al. A multicenter, prospective, observational study to determine association of mesangial C1q deposition with renal outcomes in IgA nephropathy. Sci Rep 2021; 11(1): 5467. doi: 10.1038/s41598-021-84715-7
53. Wu J, Hu Z, Wang Y et al. Severe glomerular C3 deposition indicates severe renal lesions and a poor prognosis in patients with immunoglobulin A nephropathy. Histopathology 2021; 78(6): 882 - 895. doi: 10.1111/his.14318
54. Sun S, Di W, Li R et al. The clinicopathological characteristics and outcomes of IgA nephropathy with predominant lambda or kappa light-chain deposition. Int Urol Nephrol 2021 Nov 18. doi: 10.1007/s11255-021-03062-8
55. Nakamoto Y, Asano Y, Dohi K et al. Primary IgA glomerulonephritis and Sch nlein-Henoch purpura nephritis: Clinicopathological and immunohistological characteristics. Q J Med 1978; 47(188): 495 - 516
56. Yang P, Zou H, Xiao B, Xu G. Comparative Efficacy and Safety of Therapies in IgA Nephropathy: A Network Meta-analysis of Randomized Controlled Trials. Kidney Int Rep 2018; 3(4): 794 - 803. doi: 10.1016/j.ekir.2018.03.006
57. Zhao Y, Fan H, Bao BY. Efficacy and Safety of Renin-Angiotensin Aldosterone System Inhibitor in Patients with IgA Nephropathy: A Meta-Analysis of Randomized Controlled Trials. Iran J Public Health 2019; 48(9): 1577 - 1588
58. Ji Y, Yang K, Xiao B, Lin J et al. Efficacy and safety of angiotensin-converting enzyme inhibitors/angiotensin receptor blocker therapy for IgA nephropathy: A meta-analysis of randomized controlled trials. J Cell Biochem 2019; 120(3): 3689 - 3695. doi: 10.1002/jcb.27648
59. Han S, Yao T, Lu Y et al. Efficacy and Safety of Immunosuppressive Monotherapy Agents for IgA Nephropathy: A Network Meta-Analysis. Front Pharmacol 2021; 11: 539545. doi: 10.3389/fphar.2020.539545
60. Liu LJ, Yang YZ, Shi SF et al. Effects of Hydroxychloroquine on Proteinuria in IgA Nephropathy: A Randomized Controlled Trial. Am J Kidney Dis 2019; 74(1): 15 - 22. doi: 10.1053/j.ajkd.2019.01.026
61. Eljaaly K, Alireza KH, Alshehri S, Al-Tawfiq JA. Hydroxychloroquine safety: A meta-analysis of randomized controlled trials. Travel Med Infect Dis 2020; 36: 101812. doi: 10.1016/j.tmaid.2020.101812
62. Rollino C, Vischini G, Coppo R. IgA nephropathy and infections. J Nephrol 2016; 29(4): 463-8. doi: 10.1007/s40620-016-0265-x
63. Rehnberg J, Symreng A, Ludvigsson JF, Emilsson L. Inflammatory Bowel Disease Is More Common in Patients with IgA Nephropathy and Predicts Progression of ESKD: A Swedish Population-Based Cohort Study. J Am Soc Nephrol 2021; 32(2): 411 - 423. doi: 10.1681/ASN.2020060848
64. Liu XZ, Zhang YM, Jia NY, Zhang H. Helicobacter pylori infection is associated with elevated galactose-deficient IgA1 in IgA nephropathy. Ren Fail 2020; 42(1): 539 - 546. doi: 10.1080/0886022X.2020.1772295
65. Pipili C, Michopoulos S, Sotiropoulou M et al. Is there any association between IgA nephropathy, Crohn's disease and Helicobacter pylori infection? Ren Fail 2012; 34(4): 506 - 9. doi: 10.3109/0886022X.2011.653774
66. Jiang J, Wang XX, Shen PC et al. Clinical investigation of mucosal immune system in IgA nephropathy patients. J Dalian Med Univ 2016; 38: 558 - 61
67. Chairatana P, Nolan EM. Defensins, lectins, mucins, and secretory immunoglobulin a: microbe-binding biomolecules that contribute to mucosal immunity in the human gut. Crit Rev Biochem Mol Biol 2017; 52: 45 - 56. doi: 10.1080/10409238.2016.1243654
68. Russell MW, Mestecky J, Julian BA, Galla JH. IgA-associated renal diseases: antibodies to environmental antigens in sera and deposition of immunoglobulins and antigens in glomeruli. J Clin Immunol 1986; 6: 74 - 86. doi: 10.1007/BF00915367
69. Chang S, Li XK. The Role of Immune Modulation in Pathogenesis of IgA Nephropathy. Front Med (Lausanne) 2020; 7: 92. doi: 10.3389/fmed.2020.00092
70. Han S, Yao T, Lu Y et al. Efficacy and Safety of Immunosuppressive Monotherapy Agents for IgA Nephropathy: A Network Meta-Analysis. Front Pharmacol 2021; 11: 539545. doi: 10.3389/fphar.2020.539545
71. Natale P, Palmer SC, Ruospo M et al. Immunosuppressive agents for treating IgA nephropathy. Cochrane Database Syst Rev 2020; 3(3): CD003965. doi: 10.1002/14651858
72. Yang P, Wang Q, Xie C et al. Efficacy and Safety of Agents in IgA Nephropathy: An Update Network Meta-Analysis. Kidney Blood Press Res 2018; 43(6): 1890 - 1897. doi: 10.1159/000496000
73. Tan J, Dong L, Ye D et al. The efficacy and safety of immunosuppressive therapies in the treatment of IgA nephropathy: A network meta-analysis. Sci Rep 2020; 10(1): 6062. doi: 10.1038/s41598-020-63170-w
74. Zhang Z, Yang Y, Jiang SM, Li WG. Efficacy and safety of immunosuppressive treatment in IgA nephropathy: a meta-analysis of randomized controlled trials. BMC Nephrol 2019; 20(1): 333. doi: 10.1186/s12882-019-1519-3
75. Tian L, Shao X, Xie Y et al. The long-term efficacy and safety of immunosuppressive therapy on the progression of IgA nephropathy: a meta-analysis of controlled clinical trials with more than 5-year follow-up. Expert Opin Pharmacother 2015; 16(8): 1137 - 47. doi: 10.1517/14656566.2015.1038238
76. Avino LJ, Naylor SM, Roecker AM. Pneumocystis jirovecii Pneumonia in the Non-HIV-Infected Population. Ann Pharmacother 2016; 50(8): 673 - 9. doi: 10.1177/1060028016650107
77. Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я. и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза. Проблемы эндокринологии 2017; 63(6): 392 - 426. doi: 10.14341/probl2017636392-426
78. Добронравов В.А., Кочоян З.Ш., Мужецкая Т.О., Лин ДИ. Анализ эффективности терапии иммуноглобулин А-нефропатии. Терапевтический архив 2020; 92(6): 23-32. doi: 10.26442/00403660.2020.06.000669
79. Кочоян З.Ш., Лиева А.З., Гальковская Т.О., Добронравов В.А. Иммуносупрессия, тонзиллэктомия и ремиссии иммуноглобулин А-нефропатии высокого риска. Терапевтический архив 2024; 96(6): 600 - 605. doi: 10.26442/00403660.2024.06.202728
80. Zheng JN, Bi TD, Zhu LB, Liu LL. Efficacy and safety of mycophenolate mofetil for IgA nephropathy: An updated meta-analysis of randomized controlled trials. Exp Ther Med 2018; 16(3): 1882 - 1890. doi: 10.3892/etm.2018.6418
81. Liu Y, Xiao J, Shi X et al. Immunosuppressive agents versus steroids in the treatment of IgA nephropathy-induced proteinuria: A meta-analysis. Exp Ther Med 2016; 11(1): 49 - 56. doi: 10.3892/etm.2015.2860. Erratum in: Exp Ther Med 2019; 17(4):2877
82. Zheng J, Gong X, Wu Z. Immunosuppressive agents in the treatment of IgA nephropathy: A meta-analysis of clinical randomized controlled literature. Niger J Clin Pract 2020; 23(4): 437 - 449. doi: 10.4103/njcp.njcp_112_18
83. Ma F, Yang X, Zhou M et al. Treatment for IgA nephropathy with stage 3 or 4 chronic kidney disease: low-dose corticosteroids combined with oral cyclophosphamide. J Nephrol 2020; 33(6): 1241 - 1250. doi: 10.1007/s40620-020-00752-x
84. Du B, Jia Y, Zhou W, Min X, Miao L, Cui W. Efficacy and safety of mycophenolate mofetil in patients with IgA nephropathy: an update meta-analysis. BMC Nephrol 2017; 18(1): 245. doi: 10.1186/s12882-017-0647-x
85. Chen Y, Li Y, Yang S, Li Y, Liang M. Efficacy and safety of mycophenolate mofetil treatment in IgA nephropathy: a systematic review. BMC Nephrol 2014; 15: 193. doi: 10.1186/1471-2369-15-193
86. Schena FP, Montenegro M, Scivittaro V. Meta-analysis of randomised controlled trials in patients with primary IgA nephropathy (Berger's disease). Nephrol Dial Transplant 1990; 5 Suppl 1:47-52. doi: 10.1093/ndt/5.suppl_1.47
87. Sarcina C, Tinelli C, Ferrario F et al. Changes in Proteinuria and Side Effects of Corticosteroids Alone or in Combination with Azathioprine at Different Stages of IgA Nephropathy. Clin J Am Soc Nephrol 2016; 11(6): 973 - 81. doi: 10.2215/CJN.02300215
88. Liu T, Wang Y, Mao H et al. Efficacy and safety of immunosuppressive therapies in the treatment of high-risk IgA nephropathy: A network meta-analysis. Medicine (Baltimore) 2021; 100(8): e24541. doi: 10.1097/MD.0000000000024541
89. Ballardie FW, Roberts IS. Controlled prospective trial of prednisolone and cytotoxics in progressive IgA nephropathy. J Am Soc Nephrol 2002; 13(1): 142 - 8
90. McIntyre CW, Fluck RJ, Lambie SH. Steroid and cyclophosphamide therapy for IgA nephropathy associated with crescenteric change: an effective treatment. Clin Nephrol 2001; 56(3): 193 - 8
91. Tumlin JA, Lohavichan V, Hennigar R. Crescentic, proliferative IgA nephropathy: clinical and histological response to methylprednisolone and intravenous cyclophosphamide. Nephrol Dial Transplant 2003; 18(7): 1321 - 1329
92. Ramachandran R, Doddi P, Nandakrishna B et al. Combination of pulse cyclophosphamide and steroids in crescentic IgA nephropathy. Int Urol Nephrol 2015; 47(11): 1917 - 1918. doi: 10.1007/s11255-015-1076-z
93. Liu X, Dewei D, Sun S et al. Treatment of severe IgA nephropathy: mycophenolate mofetil/prednisone compared to cyclophosphamide/prednisone. Int J Clin Pharmacol Ther 2014; 52(2): 95 - 102. doi: 10.5414/CP201887
94. Hern ndez-Rodr guez J, Carbonell C, Mir n-Canelo JA et al. Rituximab treatment for IgA vasculitis: A systematic review. Autoimmun Rev 2020; 19(4): 102490. doi: 10.1016/j.autrev.2020.102490
95. Острое повреждение почек (ОПП). Клинические рекомендации. https://rusnephrology.org/wp-content/uploads/2020/12/AKI_final.pdf
96. Liu X, Dewei D, Sun S et al. Treatment of severe IgA nephropathy: mycophenolate mofetil/prednisone compared to cyclophosphamide/prednisone. Int J Clin Pharmacol Ther 2014; 52(2): 95 - 102. doi: 10.5414/CP201887
97. Liu XW, Li DM, Xu GS, Sun SR. Comparison of the therapeutic effects of leflunomide and mycophenolate mofetil in the treatment of immunoglobulin a nephropathy manifesting with nephrotic syndrome. Int J Clin Pharmacol Ther 2010; 48(8): 509 - 513. doi: 10.5414/CPP48509
98. Chen X, Chen P, Cai G et al. A randomized control trial of mycophenolate mofeil treatment in severe IgA nephropathy. Int J Clin Pharmacol Ther 2014; 52(2): 95 - 102. doi: 10.5414/CP201887
99. Hou J-H, Le W-B, Chen N et al. Mycophenolate Mofetil Combined With Prednisone Versus Full-Dose Prednisone in IgA Nephropathy With Active Proliferative Lesions: A Randomized Controlled Trial. Am J Kidney Dis 2017; 69(6): 788 - 795. doi: 10.1053/j.ajkd.2016.11.027
100. Lau KK, Wyatt RJ, Moldoveanu Z et al. Serum levels of galactose-deficient IgA in children with IgA nephropathy and Henoch-Sch nlein purpura. Pediatr Nephrol 2007; 22: 2067
101. Kiryluk K, Sanchez-Rodriguez E, Zhou XJ et al. Genome-wide association analyses define pathogenic signaling pathways and prioritize drug targets for IgA nephropathy. Nat Genet 2023; 55(7): 1091 - 1105. doi: 10.1038/s41588-023-01422-x
102. Willey CJ, Coppo R, Schaefer F et al. The incidence and prevalence of IgA nephropathy in Europe. Nephrol Dial Transplant 2023; 38(10): 2340 - 2349. doi: 10.1093/ndt/gfad082
103. Utsunomiya Y, Koda T, Kado T et al. Incidence of pediatric IgA nephropathy. Pediatr Nephrol 2003; 18(6): 511 - 5. doi: 10.1007/s00467-003-1127-z
104. Хроническая болезнь почек. Клинические рекомендации, 2022 год, возрастная категория: дети. https://cr.minzdrav.gov.ru/recomend/713_1
105. Selewski DT, Ambruzs JM, Appel GB et al. Clinical Characteristics and Treatment Patterns of Children and Adults With IgA Nephropathy or IgA Vasculitis: Findings From the CureGN Study. Kidney Int Rep 2018; 3: 1373
106. Yata N, Nakanishi K, Shima Y et al. Improved renal survival in Japanese children with IgA nephropathy. Pediatr Nephrol 2008; 23: 905
107. Su B, Jiang Y, Li Z et al. Are children with IgA nephropathy different from adult patients? Pediatr Nephrol 2024; 39(8): 2403 - 2412. doi: 10.1007/s00467-024-06361-1
108. Barbour SJ, Coppo R, Er L et al. Updating the International IgA Nephropathy. Prediction Tool for use in children. Kidney Int 2021; 99: 1439
109. https://www.uptodate.com/contents/iga-nephropathy-clinical-features-and-diagnosis. IgA nephropathy: Clinical features and diagnosis
110. Maixnerov D, Tesa V, Ry av R et al. The coincidence of IgA nephropathy and Fabry disease. BMC Nephrol 2013; 14: 6. doi: 10.1186/1471-2369-14-6
111. Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int 2021; 100(4S): S1 - S276. doi: 10.1016/j.kint.2021.05.021
112. Vivarelli M, Samuel S, Coppo R et al.; International Pediatric Nephrology Association. IPNA clinical practice recommendations for the diagnosis and management of children with IgA nephropathy and IgA vasculitis nephritis. Pediatr Nephrol 2024. doi: 10.1007/s00467-024-06502-6
113. Shima Y, Nakanishi K, Hama T et al. Spontaneous remission in children with IgA nephropathy. Pediatr Nephrol 2013; 28: 71 - 76. doi: 10.1007/s00467-012-2294-6
114. Yang Y, Ohta K, Shimizu M et al. Treatment with low-dose angiotensin-converting enzyme inhibitor (ACEI) plus angiotensin II receptor blocker (ARB) in pediatric patients with IgA nephropathy. Clin Nephrol 2005; 64: 35 - 40. doi: 10.5414/cnp64035
115. Ellis D, Vats A, Moritz ML, et al. Long-term antiproteinuric and renoprotective efficacy and safety of losartan in children with proteinuria. J Pediatr 2003; 143(1): 89-97. doi: 10.1016/S0022-3476(03) 00279-8
116. Hyun H, Ahn YH, Park E, et al. Efficacy and safety of losartan in childhood immunoglobulin A nephropathy: a prospective multicenter study. Child Kidney Dis 2023; 27(2): 97 - 104. doi: 10.3339/ckd.23.006
117. Nakanishi K, Iijima K, Ishikura K et al. Efficacy and safety of lisinopril for mild childhood IgA nephropathy: a pilot study. Pediatr Nephrol 2009; 24: 845 - 849. doi: 10.1007/s00467-008-1006-8
118. Shima Y, Nakanishi K, Sako M, et al. Lisinopril versus lisinopril and losartan for mild childhood IgA nephropathy: a randomized controlled trial (JSKDC01 study). Pediatr Nephrol 2019; 34(5): 837 - 846. doi: 10.1007/s00467-018-4099-8
119. Enalapril: Drug information 2024 UpToDate https://medilib.ir/uptodate/show/9405
120. Trautmann A, Boyer O, Hodson E et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-sensitive nephrotic syndrome. Pediatr Nephrol 2023; 38: 877 - 919. doi: 10.1007/s00467-022-05739-3
121. Trautmann A, Vivarelli M, Samuel S et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr Nephrol 2020; 35(8): 1529 - 1561. doi: 10.1007/s00467-020-04519-1
122. Yoshikawa N, Honda M, Iijima K et al. Steroid treatment for severe childhood IgA nephropathy: a randomized, controlled trial. Clin J Am Soc Nephrol 2006; 1: 511 - 517
123. Wong MG, Lv J, Hladunewich MA, et al. The Therapeutic Evaluation of Steroids in IgA Nephropathy Global (TESTING) Study: Trial Design and Baseline Characteristics. Am J Nephrol 2021; 52(10-11): 827 - 836. doi: 10.1159/000519812
124. Lv J, Wong MG, Hladunewich MA, et al. Effect of Oral Methylprednisolone on Decline in Kidney Function or Kidney Failure in Patients With IgA Nephropathy: The TESTING Randomized Clinical Trial. JAMA 2022; 327(19): 1888 - 1898. doi: 10.1001/jama.2022.5368
125. Venettacci O, Larkins N, Willis F. Childhood IgA Nephropathy Successfully Treated with Targeted-Release Budesonide: A Case Report. J Paediatr Child Health 2018; 54(12): 1403. doi: 10.1111/jpc.14259
126. Antonucci L, Colucci M, Emma F, Vivarelli M. A pediatric case of IgA nephropathy benefitting from targeted release formulation-budesonide. Pediatr Nephrol 2023; 38: 3849 - 3852. doi: 10.1007/s00467-023-05968-0
127. Mao Y, Zhou W, Zhou Z, et al. Treatment and outcome of IgA nephropathy in children from one single center experience. BMC Pediatr 2023; 23(1): 377. doi: 10.1186/s12887-023-04195-8
128. Cambier A, Rabant M, Peuchmaur M et al. Immunosuppressive treatment in children with IgA nephropathy and the clinical value of podocytopathic features. Kidney Int Rep 2018; 3: 916 - 925
129. Roccatello D, Ferro M, Coppo R et al. Report on intensive treatment of extracapillary glomerulonephritis with focus on crescentic IgA nephropathy. Nephrol Dial Transplant 1995; 10: 2054 - 2059
130. Jiang X-Y, Mo Y, Sun L-Z et al. Efficacy of Methylprednisolone, Cyclophosphamide in Pediatric IgA Nephropathy Assessed by Renal Biopsy. Clin Nephrol 2009; 71: 625 - 631
131. Hogg RJ, Bay RС, Jennette JC et al. Randomized Controlled Trial of Mycophenolate Mofetil in Children, Adolescents, and Adults with IgA Nephropathy. Am J Kidney Dis 2015; 66: 783 - 791
132. Kang Z, Li Z, Duan C et al. Mycophenolate mofetil therapy for steroid-resistant IgA nephropathy with the nephrotic syndrome in children. Pediatr Nephrol 2015; 30: 1121 - 1129
133. Ананьин П.В., Милованова Т.В., Вашурина Т.В. Течение IgA-нефропатии у детей и ограниченные возможности иммуносупрессивной терапии. Педиатрия. Журнал им. Г.Н. Сперанского 2023; 102(4): 40 - 45
134. Shin JI, Lim BJ, Kim PK et al. Effects of cyclosporin A therapy combined with steroids and angiotensin converting enzyme inhibitors on childhood IgA nephropathy. J Korean Med Sci 2010; 25(5): 723-7. doi: 10.3346/jkms.2010.25.5.723
135. Song Y-H, Cai G-Y, Xiao Y-F et al. Efficacy and safety of calcineurin inhibitor treatment for IgA nephropathy: A meta-analysis. BMC Nephrol 2017; 18: 61
136. Zhang J-J, Wang Q, Dou W-J et al. Clinical effect of tacrolimus combined with glucocorticoid in the treatment of IgA nephropathy in children. Zhongguo Dang Dai Er Ke Za Zhi Chin J Contemp Pediatr 2019; 21: 265 - 270
137. Zhang Y, Luo J, Hu B et al. Efficacy and safety of tacrolimus combined with glucocorticoid treatment for IgA nephropathy: A meta-analysis. J Int Med Res 2018; 46: 3236 - 3250. doi: 10.1177/0300060518776566
138. Kawamura T, Yoshimura M, Miyazaki Y et al. A multicenter randomized controlled trial of tonsillectomy combined with steroid pulse therapy in patients with immunoglobulin A nephropathy. Nephrol Dial Transplant 2014; 29(8): 1546-53. doi: 10.1093/ndt/gfu020
139. Kawasaki Y, Suyama K, Abe Y et al. Tonsillectomy with methylprednisolone pulse therapy as rescue treatment for steroid-resistant IgA nephropathy in children. Tohoku J Exp Med 2009; 218(1): 11-6. doi: 10.1620/tjem.218.11
140. Kawasaki Y. Treatment strategy with multidrug therapy and tonsillectomy pulse therapy for childhood-onset severe IgA nephropathy. Clin Exp Nephrol 2022; 26(6): 501-511. doi: 10.1007/s10157-022-02187-z
141. Enya T, Miyazaki K, Miyazawa T et al. Early tonsillectomy for severe immunoglobulin A nephropathy significantly reduces proteinuria. Pediatr Int 2020; 62(9): 1054 - 1057. doi: 10.1111/ped.14264
142. Matsuzaki K, Suzuki H, Kikuchi M et al. Current treatment status of IgA nephropathy in Japan: a questionnaire survey. Clin Exp Nephrol 2023; 27(12): 1032 - 1041. doi: 10.1007/s10157-023-02396-0
143. Isbel NM. Glomerulonephritis Management in general practice. Aust Fam Physician 2005; 34(11): 907-13
144. Методические указания МУ 3.3.1.1095-02 "Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок", утв. 09.01.2002 г.
145. Leow EH, Chong SL, Yap CJY et al. IgA nephropathy in children: before and after the start of COVID-19. Pediatr Nephrol 2024; 39(4): 1161 - 1167. doi: 10.1007/s00467-023-06196-2
146. Wu HHL, Shenoy M, Kalra PA, Chinnadurai R. Intrinsic Kidney Pathology in Children and Adolescents Following COVID-19 Vaccination: A Systematic Review. Children (Basel) 2022; 9(10): 1467. doi: 10.3390/children9101467
147. Ma Y, Xu G. New-onset IgA nephropathy following COVID-19 vaccination. QJM 2023; 116(1): 26 - 39. doi: 10.1093/qjmed/hcac185
148. Chen CH, Chiu YW, Chen BD et al. De Novo Biopsy-Proven Glomerular Disease Following COVID-19 Vaccination. J Clin Med 2024; 13(15): 4494. doi: 10.3390/jcm13154494
149. Sasinka MA, Podracka L, Boor A et al. Enalapril treatment of proteinuria in normotensive children. Bratisl Lek Listy 1999; 100(9): 476-80
150. Zhang J, Lu X, Feng J et al. Effects of Hydroxychloroquine on Proteinuria in IgA Nephropathy: A Systematic Review and Meta-Analysis. Biomed Res Int 2021 Dec 3; 2021: 9171715. doi: 10.1155/2021/9171715
151. Liu LJ, Yang YZ, Shi SF et al. Effects of hydroxychloroquine on proteinuria in IgA nephropathy: a randomized controlled trial. American Journal of Kidney Diseases 2019; 74(1): 15 - 22. doi: 10.1053/j.ajkd.2019.01.026
152. Tang C, Lv JC, Shi SF et al. Long-term safety and efficacy of hydroxychloroquine in patients with IgA nephropathy: a single-center experience. Journal of Nephrology 2021. doi: 10.1007/s40620-021-00988-1
153. Keskinis Ch, Moysidou E, Christodoulou M et al. Diagnosing and Treating IgAN: Steroids, Budesonide, or Maybe Both? Diagnostics 2024; 14(5): 512. doi: 10.3390/diagnostics14050512
154. Hotta O, Miyazaki M, Furuta T et al. Tonsillectomy and steroid pulse therapy significantly impact on clinical remission in patients with IgA nephropathy. Am J Kidney Dis 2001; 38(4): 736-43. doi: 10.1053/ajkd.2001.27690
155. Laranjinha I, Matias P, Cassis J et al. IGA nephropathy - Are intravenous steroid pulses more effective than oral steroids in relapse prevention? Nefrologia (Engl Ed) 2018; 38(4): 355-360. doi: 10.1016/j.nefro.2017.08.004
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
От Национальной Ассоциации нефрологов (для взрослых):
Добронравов В.А. (руководитель рабочей группы) - д.м.н., проф., директор научно-исследовательского института нефрологии, профессор кафедры пропедевтики внутренних болезней с клиникой, Первый Санкт-Петербургский государственный медицинский университета им. акад. И.П. Павлова, Санкт-Петербург. Вице-Президент Национальной Ассоциации нефрологов.
Бобкова И.Н. - д.м.н., проф., профессор кафедры внутренних, профессиональных болезней и ревматологии, Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва. Член Правления Национальной Ассоциации нефрологов.
Ватазин А.В. - д.м.н., проф., руководитель хирургического отделения трансплантации почки, зав. кафедрой трансплантологии, нефрологии и искусственных органов, Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского, Москва. Главный внештатный специалист нефролог Минздрава РФ по ЦФО. Президент Национальной Ассоциации нефрологов. Заслуженный врач РФ. Заслуженный деятель науки РФ.
Захарова Е.В. - к.м.н., доцент кафедры нефрологии и диализа Российской медицинской академии непрерывного профессионального образования, доцент кафедры нефрологии Московского государственного медико-стоматологический университета им. А.И. Евдокимова, заведующая отделением нефрологии Городской клинической больницы им. С.П. Боткина, Москва. Председатель Российского диализного общества.
Карунная А.В. (секретарь рабочей группы) - врач-нефролог, заведующая отделением хронического гемодиализа клиники научно-исследовательского института нефрологии, Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург. Член Национальной Ассоциации нефрологов.
Козловская Н.Л. - д.м.н., проф., кафедра внутренних болезней с курсом функциональной диагностики и кардиологии им. акад. В.С. Моисеева, Российский университет дружбы народов, руководитель центра помощи беременным с патологией почек, Городская клиническая больница им. А.К. Ерамишанцева, Москва. Член Национальной Ассоциации нефрологов.
От Союза педиатров России и Творческого объединения детских нефрологов (дополнения для детей):
Баранов А.А. - акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ N 2 РНЦХ им. акад. Б.В. Петровского, профессор кафедры педиатрии и детской ревматологии, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России.
Намазова-Баранова Л.С. - акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ N 2 РНЦХ им. акад. Б.В. Петровского, заведующая кафедрой факультетской педиатрии педиатрического факультета РНИМУ им. Н.И. Пирогова, главный внештатный детский специалист по профилактической медицине Минздрава России.
Петросян Э.К. - д.м.н., профессор кафедры госпитальной педиатрии им. академика В.А. Таболина педиатрического факультета РНИМУ им. Н.И. Пирогова, заведующая отделением нефрологии РДКБ.
Маргиева Т.В. - к.м.н., главный специалист Методического центра аккредитации специалистов, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), врач-нефролог, член Союза педиатров России.
Вишнева Е.А. - д.м.н., профессор РАН, заместитель руководителя НИИ педиатрии и охраны здоровья детей НКЦ N 2 РНЦХ им. акад. Б.В. Петровского по научной работе, профессор кафедры факультетской педиатрии педиатрического факультета РНИМУ им. Н.И. Пирогова, член Союза педиатров России.
Эмирова Х.М. - к.м.н., профессор кафедры педиатрии Московского государственного медико-стоматологического университета имени А.И. Евдокимова; врач-нефролог Центра гравитационной хирургии крови и гемодиализа, Детская городская клиническая больница св. Владимира, член Творческого объединения детских нефрологов, Российского диализного общества.
Зокиров Н.З. - д.м.н., заведующий кафедрой Академии последипломного образования ФНКЦ ФМБА России, ФНКЦ детей и подростков ФМБА России, член Союза педиатров России.
Цыгин А.Н. - д.м.н., профессор, заведующий нефрологическим отделением НМИЦ здоровья детей, профессор кафедры нефрологии НОИ Клинической медицины им. Н.А.Семашко Российского университета медицины, президент МОО "Творческое объединение детских нефрологов".
Ананьин П.В. - к.м.н., врач-нефролог нефрологического отделения, старший научный сотрудник НМИЦ здоровья детей.
Конфликт интересов: отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Процесс подготовки рекомендаций состоял из следующих этапов: выбор руководителя, членов рабочей группы (РГ) и секретариата; определение в ходе дискуссий наиболее важных для реальной клинической практики областей, которые должны покрывать рекомендации; определение частных вопросов для исследования и формулировки рекомендаций; разработки приемов поиска доказательной базы; формирование окончательного перечня рекомендаций и его структуры. Указания, представленные в настоящих рекомендациях, основаны на выполненном членами группы анализе исследований в нефрологии и смежных областях медицины, их систематических обзоров и МА, опубликованных до июня 2024 г. Исходный проект КР 2021 г. касался только взрослой популяции (как это было заявлено Национальной ассоциацией нефрологов). В 2024 г. по настоянию МЗ РФ он был дополнен тезисами для детей, подготовленных детскими нефрологами и представленными в отдельных подразделах.
Члены РГ стремились, чтобы каждая рекомендация базировалась на максимально возможных уровнях достоверности и убедительности рекомендаций. Тем не менее, РГ сочла необходимым оставить ряд рекомендаций, формально имеющих низкий уровень доказательности или основанных на экспертной оценке, с учетом многолетнего опыта ведения пациентов соответствующего профиля и того, что эти рекомендации могут иметь существенное значение для практической работы.
Для оценки качества и силы рекомендации использовали уровни достоверности доказательств и убедительности рекомендаций (табл. 1 - 3).
Целевая аудитория данных клинических рекомендаций:
1. Врач-нефролог.
2. Врач-терапевт.
3. Врач-терапевт участковый.
4. Врач общей практики (семейный врач).
5. Врач-уролог.
6. Врач-оториноларинголог.
7. Врач-педиатр.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ
1. Побочное действие глюкокортикоидов.
Частота развития и выраженность побочных эффектов зависит от длительности применения, величины используемой дозы, соблюдения циркадного ритма назначения препарата.
При применении препаратов могут отмечаться следующие побочные эффекты:
- со стороны эндокринной системы: снижение толерантности к глюкозе, стероидный сахарный диабет или манифестация латентного сахарного диабета, угнетение функции надпочечников, синдром Иценко-Кушинга;
- со стороны пищеварительной системы: тошнота, рвота, стероидная язва желудка и двенадцатиперстной кишки, эрозивный эзофагит, желудочно-кишечные кровотечения, повышение или снижение аппетита;
- со стороны кожных покровов и слизистых оболочек: замедленное заживление ран, петехии, гипер- или гипопигментация кожи, угри, стрии, склонность к развитию пиодермии и кандидозов;
- со стороны опорно-двигательного аппарата: остеопороз, стероидная миопатия, снижение мышечной массы;
- обусловленные минералокортикоидной активностью: задержка жидкости и натрия в организме, гипернатриемия, гипокалиемический синдром.
Полный перечень представлен в инструкции по применению лекарственного препарата (см. Государственный реестр лекарственных средств, http://grls.rosminzdrav.ru).
2. Первичное обследование, а также последующее наблюдение за детьми с IgA-нефропатией
Примерный объем первичного обследования и последующего наблюдения за детьми с IgA-нефропатией (модификация из рекомендаций по клинической практике IPNA для детей со стероидрезистентным нефротическим синдромом) [112] с изменениями
Исследование
При диагностике
Мониторинг при динамическом наблюдении
Клиническая оценка
Анамнез и клинические проявления у пациента
- наличие/отсутствие сыпи,
- эпизоды макрогематурии,
- эпизоды лихорадки,
- боль, дискомфорт в животе,
- отеки,
- повседневные функции: физическая активность, усталость, посещение школы и т.д.
V
В среднем, каждые 3 месяца, при необходимости - чаще <1>
Поиск вторичных причин IgAN
V
- ВИЧ-инфекция,
- хронический гепатит,
- воспалительное заболевание кишечника,
аутоиммунное заболевание, цирроз печени и постинфекционный гломерулонефрит (согласно соответствующим клиническим рекомендациям)
V
По мере необходимости, согласно соответствующим клиническим рекомендациям
Диагностика туберкулезной инфекции в эндемичных районах перед началом иммуносупрессивной терапии
Внутрикожная проба с туберкулезным аллергеном (согласно показаниям) и/или IGRA-тесты (Interferon-![]() release assays) - иммунологические методы, основанные на стимуляции T-лимфоцитов пептидными антигенами и выработке интерферона
release assays) - иммунологические методы, основанные на стимуляции T-лимфоцитов пептидными антигенами и выработке интерферона ![]() -, секретируемого клетками крови инфицированного M. tuberculosis человека (Исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови
-, секретируемого клетками крови инфицированного M. tuberculosis человека (Исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови
V
По мере необходимости
Физикальный осмотр (Визуальный осмотр терапевтический, пальпация терапевтическая, аускультация терапевтическая, перкуссия терапевтическая)
Оценка наличия отеков
V
При каждом визите (в среднем 1 раз 3 месяца, по показаниям - чаще <1>
Оценка неблагоприятных явлений терапии глюкокортикоидами: наличие/отсутствие синдрома Кушинга, катаракта, непереносимость глюкозы, задержка роста, остеопороз, артериальная гипертензия, инфекции.
V
Каждые 3 месяца для тех, кто получает стероидную терапию
Оценка экстраренальных признаков
- сыпь
- язвы полости рта
- увеличение в объеме суставов
V
По мере необходимости
Жизненно важные параметры:
Измерение артериального давления на периферических артериях
V
При каждом визите (в среднем, каждые 3 месяца, по показаниям - чаще <1>);
Ежегодное суточное мониторирование артериального давления у пациентов с артериальной гипертензией, при возможности
Антропометрия (измерение роста, измерение массы тела) (с расчетом индекса массы тела и годовой скорости роста)
V
Каждые 6 месяцев
Моча
Соотношение белка и креатинина (Определение альбумина в моче и Исследование уровня креатинина в моче) в первой утренней моче
Или
Определение количества белка в суточной моче
V
В среднем, каждые 3 месяца или чаще по показаниям <1>
Осадок мочи для подсчета и морфологии эритроцитов (Микроскопическое исследование осадка мочи)
Кровь
Общий (клинический) анализ крови развернутый
V
Каждые 6 месяцев (чаще при ХБП 4 - 5 стадии - см. соответствующие клинические рекомендации)
Исследование уровня креатинина в крови, Исследование уровня мочевины в крови
- Электролиты (Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня неорганического фосфора в крови, Исследование уровня хлоридов в крови)
Исследование уровня общего белка в крови
Исследование уровня альбумина в крови
Исследование уровня C-реактивного белка в сыворотке крови
V
По мере необходимости (в зависимости от клинической ситуации)
Оценка СКФ (Исследование функции нефронов по клиренсу креатинина (проба Реберга) - расчет по формуле Шварца (см. раздел "Лабораторные диагностические методы исследования))
V
Каждые 6 месяцев (чаще при ХБП стадии 4 - 5) (см. соответствующие клинические рекомендации)
Определение активности щелочной фосфатазы в крови, Исследование уровня паратиреоидного гормона в крови, Исследование уровня 25-OH витамина Д в крови
V Каждые 12 месяцев
чаще у пациентов с ХБП
3 - 5 стадий - см. клинические рекомендации по ХБП у детей
Липидный профиль (исследование уровня холестерина липопротеинов низкой плотности, исследование уровня холестерина липопротеинов высокой плотности в крови, исследование уровня триглицеридов в крови)
V
каждые 12 месяцев или по мере необходимости <1>
Базовые тесты на коагуляцию:
Коагулограмма (ориентировочное исследование системы гемостаза, в т.ч., Определение протромбинового (тромбопластинового) времени в крови или в плазме, Определение международного нормализованного отношения (MHO), Активированное частичное тромбопластиновое время,
Исследование уровня фибриногена в крови, Определение активности антитромбина III в крови, Дополнительные исследования у пациентов с зарегистрированными предыдущими тромботическими событиями, центральными венозными катетерами, постоянной нефротической протеинурией и/или отягощенным семейным анамнезом тромботических событий
- в рамках соответствующих клинических рекомендаций
V
При постановке диагноза и затем по мере необходимости
Функция щитовидной железы (Исследование уровня свободного трийодтиронина (СТ3) в крови, Исследование уровня свободного тироксина (СТ4) сыворотки крови, Исследование уровня тиреотропного гормона (ТТГ) в крови)
Для пациентов с протеинурией нефротического уровня
По мере необходимости, особенно у пациентов с персистирующей протеинурией нефротического уровня
Исследование уровня иммуноглобулина A в крови, Исследование уровня С3 фракции комплемента
V При постановке диагноза
Визуализация
Ультразвуковое исследование почек: (эхогенность и размер почек)
V
При необходимости
Ультразвуковое исследование органов брюшной полости (комплексное) и Ультразвуковое исследование плевральной полости (асцит, выпот, тромбоз)
Для пациентов с нефротической протеинурией
По мере необходимости, особенно у пациентов с стойкой нефротической протеинурией
Рентгенография легких/рентгенография легких цифровая
V
По показаниям
Биопсия почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек
V
При постановке диагноза и впоследствии по показаниям: в случае необъяснимого снижения СКФ, необъяснимого увеличения протеинурии
Оценка диеты
Осмотр врача-диетолога (или врача-нефролога/врача-педиатра) и рекомендации относительно потребления соли, калия, белка и калорийности
V
Каждые 3 месяца (чаще у истощенных пациентов и пациентов с ХБП 4 - 5 стадий)
--------------------------------
<1> Показания для внепланового визита: признаки обострения, ухудшение состояния, появление новых жалоб, нарастание протеинурии, ухудшение почечных функций и др.
3. Основные нозологии для дифференциальной диагностики IgAN и необходимые обследования
Основные нозологии для дифференциальной диагностики IgAN у детей и необходимые обследования для их исключения/подтверждения, по [112] с изменениями
Состояние
Клиническая картина
Необходимые обследования
Болезнь тонких базальных мембран
Стойкая гломерулярная гематурия (микроскопическая ![]() макроскопическая), может быть (
макроскопическая), может быть (![]() ) минимальная протеинурия
) минимальная протеинурия
Биопсия почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек (с применением электронной микроскопии) показывает диффузно тонкие гломерулярные базальные мембраны для возраста пациента
Синдром Альпорта (аутосомно-рецессивный или сцепленный с X-хромосомой)
Рецидивирующая макрогематурия, стойкая микроскопическая гематурия с или без протеинурии и/или сенсоневральной тугоухости и/или глазных аномалий (т.е. лентиконус), чаще всего у мальчиков
Молекулярно-генетическое исследование (мутации в генах COL4A5, COL4A3 или COL4A4),
Биопсия почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек (с применениемэлектронной микроскопии) показывает расщепленную, неравномерную гломерулярную базальную мембрану
Постинфекционный гломерулонефрит
Микроскопическая ![]() макрогематурия, начинающаяся с 1 - 3 недель после инфекции верхних дыхательных путей, обычно с протеинурией, часто артериальной гипертензией, снижением функций почек, снижением сывороточного уровня С3-компонента комплемента, отеком
макрогематурия, начинающаяся с 1 - 3 недель после инфекции верхних дыхательных путей, обычно с протеинурией, часто артериальной гипертензией, снижением функций почек, снижением сывороточного уровня С3-компонента комплемента, отеком
Низкий уровень сывороточного C3-фракции комплемента, повышенный титр антистрептококковых антител (антистрептолизин-O), Биопсия почки под контролем ультразвукового исследования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала почек показывает диффузный гломерулонефрит, отложения C3 ![]() IgG, субэпителиальные "горбы" при электронной микроскопии
IgG, субэпителиальные "горбы" при электронной микроскопии
Волчаночный нефрит
Светочувствительная сыпь, артралгии, гематурия, протеинурия, нормальная или сниженная функция почек, +/- артериальная гипертензия
ANA, анти-dsDNA положительные, низкие уровни сывороточного C3 и C4, биопсия почек с различными гистологическими данными, но "Full house" (IgG, IgA, IgM, C1q, C3)
иммунные отложения
(Определение содержания антител к антигенам ядра клетки и ДНК (концентрации),
Определение содержания антител к ДНК нативной, Определение содержания антител к экстрагируемым ядерным антигенам в крови - положительные,
Исследование уровня C3 фракции комплемента, Исследование уровня C4 фракции комплемента, и др. согласно соответствующим клиническим рекомендациям)
IgA-васкулит - ассоциированный нефрит
Сыпь (пальпируемая пурпура) преимущественно на нижних конечностях и туловище, ![]() боль в животе и суставах, гематурия часто с протеинурией, нормальная или сниженная функция почек
боль в животе и суставах, гематурия часто с протеинурией, нормальная или сниженная функция почек
Клинические критерии EULAR/PRES, нормальный уровень C3-фракции комплемента в сыворотке крови, биопсия кожи (пораженных участков) с последующим патолого-анатомическим исследованием биопсийного (операционного) материала кожи
ANCA-ассоциированный васкулит
Снижение функции почек, часто быстро прогрессирующее, с разной степени выраженности гематурией и протеинурией, могут быть признаки системного васкулита
Серология положительная на антитела к миелопероксидазе (услуга отсутствует в действующей Номенклатуре услуг) или антитела к протеиназе 3 (анти-PR3) (услуга отсутствует в Номенклатуре услуг), нормальный уровень C3-фракции комплемента в сыворотке крови, патолого-анатомическое исследование биопсийного (операционного) материала почек с различными сочетанными гистологическими данными. Показывает ГН с очагами некроза/полулуниями с небольшим количеством или без иммунных отложений (при использовании иммунофлуоресцентной и электронной микроскопии)
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
1. Общие подходы к диагностике иммуноглобулин А-нефропатии
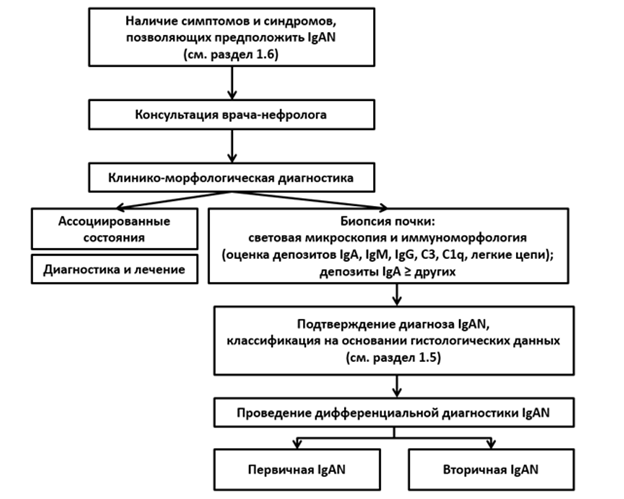
2. Подходы к лечению первичной иммуноглобулин А-нефропатии у взрослых
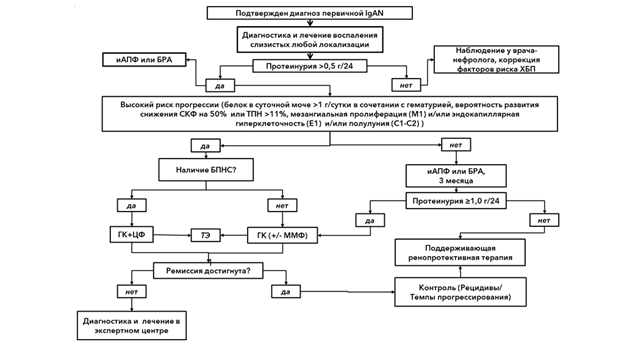
Примечание: БПНС - быстропрогрессирующий нефритический синдром; ГК - глюкокортикоиды; ЦФ - циклофосфамид**; ММФ - #микофенолата мофетил**; ТЭ - тонзилэктомия (может быть выполнена до или по завершению ИСТ).
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Иммуноглобулин А-нефропатия (IgAN) - хроническое поражение почек, вызванное отложением в них "неправильных" иммуноглобулинов, приводящее к необратимым изменениям в органе, снижению функции почек.
В значительной доле случаев заболевание возникает после перенесенных инфекций (ангина, простуда, инфекции желудочно-кишечного тракта и др.), во время которых организм увеличивает выработку иммуноглобулинов, предназначенных для борьбы с возбудителем. Основная проблема состоит в том, что образующиеся в слизистых оболочках иммуноглобулины являются "неправильными" и, вместо выделения на поверхность слизистых, попадают в кровь, а затем в почки, вызывая их воспаление.
IgAN может развиваться также на фоне других аутоиммунных заболеваний (например, саркоидоз, псориаз и др.) - в этом случае заболевание является вторичным.
Отсутствие лечения заболевания может привести к полной утрате функции почек, сроки наступления которой определяются особенностями течения болезни в каждом конкретном случае. По мере снижения функции почек в организме развивается целый ряд изменений со стороны других органов и систем, что влияет на качество и продолжительность жизни, требует наблюдении и соответствующего лечения, включая проведение диализа. По данным В.А. Добронравова и соавторов [19] в России 16 и 25% пациентам с IgA требуется проведение диализа через 5 и 10 лет после установления диагноза, соответственно.
Диагностика должна включать целый ряд вмешательств, направленных на: а) подтверждение диагноза болезни; б) уточнение степени повреждения почек; в) выявление воспалительных изменений слизистых оболочек и других заболеваний, которые способствуют развитию и прогрессированию IgAN (см. выше).
Единственным способом подтверждения диагноза IgAN, оценки прогноза заболевания, выбора оптимального лечения необходимо выполнение биопсии почки и проведение специальных микроскопических исследований образца почек.
Биопсия почки - это рутинная диагностическая процедура, без которой нельзя установить диагноз болезни. Ее выполняют специальной иглой через кожу в пояснице для забора 2 - 3 небольших образов ткани почки (длиной 5 - 10 мм, шириной менее 1 мм) для последующего проведения исследований под микроскопом.
Процедуру делают под местной анестезией в положении пациента лежа на животе. Под контролем ультразвукового аппарата специальная игла через прокол в коже проводится к почке, осуществляется пункция почки с получением необходимых образов ткани.
После процедуры в течение суток необходимо соблюдать постельный режим для того, чтобы в местах пункции образовался тромб.
Риски проведения в основном связаны с возможностью кровотечения из почки и образования околопочечной гематомы (скопления крови). В подавляющем большинстве случаев такие гематомы не представляет существенной угрозы и проходят самостоятельно. В редких случаях (примерно 1 на 500 - 1000 процедур) может потребоваться переливание крови или хирургическое вмешательство для прекращения кровотечения.
Для того, чтобы минимизировать риски кровотечений, перед проведением процедуры проводят исследования свертываемости крови, которое в момент вмешательства должно быть нормальным.
В подавляющем большинстве случаев польза от получения важной информации о заболевании почек, которая определяет прогноз и объем лечения, значительно перевешивает потенциальные риски осложнений биопсии.
Лечение IgAN должно быть проведено под контролем врача-нефролога. Перед началом лечения врача-нефрологу и пациенту следует обсудить предложенное лечение, чтобы четко понимать ожидаемую пользу от него и знать вероятные побочные эффекты. IgAN является частным вариантом т.н. "хронической болезни почек", поэтому общие подходы к лечению патологии почек применимы также и для пациентов с IgAN. В случае неблагоприятного течения IgAN ее лечение может потребовать и специфических подходов, которые включают назначение лекарств, подавляющих неправильные иммунные реакции, а также выполнение тонзилэктомии (оперативное вмешательство, суть которого заключается в удалении небных миндалин).
Применение лекарственных препаратов, подавляющих неправильные иммунные реакции, имеет положительные эффекты в виде существенного снижения активности болезни и торможения снижения функции почек, но также имеет и ряд побочных эффектов (см. раздел "Приложение А3"). Баланс пользы-риска при назначении лечения должен быть определен врачом-нефрологом в каждом случае индивидуально, а пациент должен получить об этом полную информацию, прежде, чем дать согласие на проведение лечения.
Одним из моментов лечения IgAN является выполнение тонзилэктомии (см. выше). Наличие очагов воспаления в миндалинах может негативно влиять на прогрессирование болезни, напротив, их удаление вместе с другим лечением может остановить развитие IgAN. Тонзилэктомию проводит в условиях стационара врач-оториноларинголог под местным или общим наркозом. Реабилитация после нее в большинстве случаев проходит с минимальным количеством осложнений.
Приложение Г1 - Г...
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ
Приложение Г1
НАЗВАНИЕ
НА РУССКОМ ЯЗЫКЕ: ФОРМУЛА ДЛЯ РАСЧЕТА СКФ, ПРЕДЛОЖЕННАЯ
РАБОЧЕЙ ГРУППОЙ ПО ИССЛЕДОВАНИЮ ЭПИДЕМИОЛОГИИ ХРОНИЧЕСКОЙ
БОЛЕЗНИ ПОЧЕК (CHRONIC KIDNEY DISEASE-EPIDEMIOLOGY
COLLABORATION, CKD-EPI) [25, 26]
Оригинальное название: CKD-EPI equation to estimate the glomerular filtration rate (CKD-EPI formula)
Источник (официальный сайт разработчиков, публикация с валидацией):
https://pubmed.ncbi.nlm.nih.gov/19414839/
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить): формула
Назначение: определение величины СКФ
Содержание (шаблон):
СКФ = 141 * мин (Креатинин в сыворотке крови / каппа, 1) альфа * макс (Креатинин в сыворотке крови / каппа, 1) 1.209 * 0.993Возраст * Пол * Раса,
для женщин используются следующие значения:
пол = 1.018; альфа = - 0.329; каппа = 0.7;
для мужчин используются следующие значения: пол = 1; альфа = - 0.411;
каппа = 0.9;
для представителей негроидной расы: коэффициент "раса" = 1.159.
Ключ (интерпретация): определение стадии ХБП в зависимости от уровня СКФ (таблица 2, раздел 1.4)
Пояснения: для удобства расчета созданы онлайн калькулятор:
https://www.kidney.org/professionals/KDOQI/gfr_calculator
Приложение Г2
НАЗВАНИЕ
НА РУССКОМ ЯЗЫКЕ: КАЛЬКУЛЯТОР РАСЧЕТА РИСКА ПРОГРЕССИРОВАНИЯ
IGAN [29]
Оригинальное название: International IgAN Prediction Tool at biopsy - Adults
Источник (официальный сайт разработчиков, публикация с валидацией): https://pubmed.ncbi.nlm.nih.gov/30980653/
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить): калькулятор
Назначение: расчет риска прогрессирования IgAN
Содержание (шаблон):
Для использования калькулятора необходимы следующие данные: на момент биопсии - возраст пациента, рСКФ, артериальное давление (систолическое и диастолическое), определение количества белка в суточной моче, информация о применении иАПФ/БРА, и проведении ИСТ (до или во время биопсии); данные гистологического исследования - MEST (см. раздел 1.5); раса пациента. Для расчета риска необходимо также ввести количество месяцев после биопсии (максимально - 80).
Пояснения: для удобства расчета создан онлайн калькулятор:
https://qxmd.com/calculate/calculator_499/international-igan-prediction-tool-adults
