"Клинические рекомендации "Хронический миелоидный лейкоз"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ХРОНИЧЕСКИЙ МИЕЛОИДНЫЙ ЛЕЙКОЗ
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 889_1
Возрастная категория: Взрослые, Дети
Специальность:
Разработчик клинической рекомендации
Национальное общество детских гематологов, онкологов, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
аллоТГСК - трансплантация аллогенных гемопоэтических стволовых клеток
АЧН - абсолютное число нейтрофилов
БК - бластный криз
БМО - большой молекулярный ответ
ВГН - верхняя граница нормы
ВОЗ - Всемирная организация здравоохранения
ГлМО - глубокий молекулярный ответ
Г-КСФ - гранулоцитарный колониестимулирующий фактор (L03AA Колониестимулирующие факторы)
ГСК - гемопоэтические стволовые клетки
ДХА - дополнительные хромосомные аберрации
ИТК - ингибиторы тирозинкиназы BCR-ABL
ИТК1 - ингибиторы тирозинкиназы BCR-ABL первого поколения
ИТК2 - ингибиторы тирозинкиназы BCR-ABL второго поколения
ИФ - - интерферон-альфа (интерферона альфа-2b**)
КСФ - колониестимулирующий фактор
КТ - компьютерная томография
ЛАГ - легочная артериальная гипертензия
ЛПНП - липопротеины низкой плотности
ЛВПН - липопротеины высокой плотности
МО - молекулярный ответ
мРНК - матричная РНК
НГН - нижняя граница нормы
ОТ-ПЦР - полимеразная цепная реакция с обратной транскрипцией
ПГО - полный гематологический ответ
ПЦО - полный цитогенетический ответ
ПЦР - полимеразная цепная реакция
ПЦР-РВ - ПЦР в режиме реального времени
РБЛ - ремиссия без лечения
СЦИ - стандартное цитогенетическое исследование
ССЗ - сердечно-сосудистые заболевания
ТКМ - трансплантация костного мозга
УЗИ - ультразвуковое исследование
УУР - уровень убедительности рекомендаций
УДД - уровень достоверности доказательств
ФА - фаза акселерации
ХГЧ - хорионический гонадотропин человека
ХМЛ - хронический миелоидный лейкоз
ХФ - хроническая фаза
ЦО - цитогенетический ответ
ЭКГ - электрокардиография/электрокардиограмма
Ara-C - цитарабин**
BCR::ABL1 - химерный ген, результат транслокации между 9 и 22 хромосомами
BCR::ABL1 - белок с повышенной тирозинкиназной активностью, продукт гена BCR::ABL1
EBMT - Европейское общество по трансплантации костного мозга (European Group for Blood and Marrow Transplantation)
ELN - Европейская организация по лечению лейкозов (European Leukemia Net)
ESMO - Европейское общество медицинской онкологии (European Society for Medical Oncology)
FISH - флуоресцентная гибридизация in situ (Fluorescence in situ hybridization)
HLA - человеческие лейкоцитарные антигены, главный комплекс гистосовместимости (Human Leukocyte Antigens)
IS - лабораторный стандарт определения процентного соотношения уровня экспрессии исследуемого гена BCR::ABL1 и контрольного гена, иначе именуемый как "международная шкала" (International Scale)
NCCN - Национальная онкологическая сеть США (National Comprehensive Cancer Network)
NCI CTCAE - шкала токсичности Национального института рака США (Критерии общей терминологии нежелательных явлений) (National Cancer Institute Common Terminology Criteria for Adverse Events)
Ph - филадельфийская хромосома - укороченная хромосома 22, образующаяся в результате транслокации t(9;22)(q34;q11)
Ph+ - клетки, содержащие филадельфийскую хромосому
Ph- - клетки, не содержащие филадельфийскую хромосому
RUSSCO - Российское общество клинической онкологии (Russian society of clinical oncology)
** - жизненно необходимые и важнейшие лекарственные препараты
Термины и определения
Анализ мутаций гена BCR::ABL1 - определение точечных мутаций гена BCR::ABL1
Гематологическая токсичность - снижение уровня гемоглобина, нейтропения и тромбоцитопения, связанная с терапией ИТК.
Гематологический ответ, цитогенетический ответ, молекулярный ответ - виды ответов на терапию, характеризующие объем опухолевого клона и определяемые соответственно на основании результатов клинического анализа крови, цитогенетического и молекулярно-генетического исследований.
Группа риска - характеристика, оцениваемая только на момент диагностики заболевания, до начала терапии на основании прогностически значимых характеристик у пациентов с хронической фазой (ХФ) ХМЛ.
Дополнительные хромосомные аберрации - дополнительные аномалии кариотипа в Ph+ клетках, выявляемые при стандартном цитогенетическом исследовании.
Другие хромосомные аберрации - аномалии кариотипа в Ph- клетках, выявляемые при стандартном цитогенетическом исследовании.
Ингибитор тирозинкиназ - препарат, обладающий возможностью ингибировать ферментативную активность тирозинкиназы BCR::ABL1
Исследование методом FISH - исследование клеток методом флуоресцентной гибридизации in situ с использованием меченных флуорофорами ДНК-зондов.
Международная шкала (International Scale, IS) - стандартизованная, с учетом фактора конверсии, шкала представления количественного уровня экспрессии гена BCR::ABL1
Молекулярно-генетическое исследование уровня BCR::ABL1 - измерение экспрессии химерного гена BCR::ABL1 методом количественной ПЦР в режиме реального времени.
Непереносимость терапии - наличие нежелательных явлений терапии, которые делают невозможным ее проведение в рекомендованном режиме.
Неудача терапии - ответ на терапию ИТК, недостаточный для предотвращения риска прогрессирования заболевания и смерти пациента - показание для смены лечения на другой ИТК или проведение алло-ТКМ.
Оптимальный ответ - ответ на терапию, при котором продолжение лечения данным ИТК максимально снижает риск прогрессирования ХМЛ и смерти пациента.
Предупреждение - ответ на терапию ИТК, указывающий на необходимость тщательного мониторинга ответа, рассмотрение вопроса о смене ИТК или готовность к смене лечения в случае появления признаков неудачи терапии.
Приверженность к терапии - соблюдение пациентом рекомендаций врача по обследованию и лечению.
Стандартное цитогенетическое исследование (СЦИ) - исследование количества и структуры хромосом в клетках костного мозга после G-окрашивания
Фаза хронического миелолейкоза - характеристика, определяющая стадию ХМЛ и прогноз; оценивается в дебюте заболевания, при его прогрессировании или изменении лечения.
1. Краткая информация
1.1 Определение заболевания или состояния
Хронический миелоидный лейкоз (ХМЛ) - это клональное опухолевое миелопролиферативное новообразование, обусловленное злокачественным перерождением стволовых гемопоэтических клеток и характеризующееся усилением пролиферации гранулоцитарного ростка без потери способности к дифференцировке, гиперплазией миелоидной ткани, миелоидной метаплазией кроветворных органов, ассоциированное с хромосомной аномалией-транслокацией t(9;22)(q34;q11), в результате которой образуется химерный ген BCR::ABL1.
Ранее данный химерный ген имел обозначение BCR-ABL1, однако в 2021 году комитет по номенклатуре генов HUGO (HGNC) опубликовал свои рекомендации по обозначению слитных генов, включая химерные, в котором указал на необходимость разделять две части слитного гена новым способом - двойным двоеточием [103].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология заболевания не установлена. Обсуждается роль различных факторов - ионизирующего излучения, инфекций, токсинов, однако четкой взаимосвязи между ними и возникновением ХМЛ не выявлено.
Патогенетически ХМЛ представляет собой клональный миелопролиферативный процесс, развивающийся в результате злокачественной трансформации в ранних гемопоэтических стволовых клетках. Возникновение транслокации t(9;22)(q34;q11) - так называемой "филадельфийской хромосомы" (Ph-хромосомы) - и соответственно химерного гена BCR::ABL1 лежат в основе патогенеза заболевания. Продукт гена BCR::ABL1 представляет собой тирозинкиназу с аномально повышенной активностью, регулирующую сигналы, ответственные за клеточный рост, активацию, дифференцировку, адгезию и апоптоз [1]. В зависимости от локализации точки разрыва могут выявляться более 10 разных вариантов химерного транскрипта BCR::ABL1 с различной молекулярной массой. Наиболее распространенными являются химерные транскрипты образующиеся при слиянии 13-го или 14-го экзонов гена BCR со 2-м экзоном гена ABL1. В первом случае образуется химерный транскрипт e13a2 (ранее известный как b2a2), во втором e14a2 (b3a2). Суммарно на варианты e13a2 и e14a2 приходится более 98% случаев ХМЛ. Оба они приводят к образованию химерного белка с молекулярной массой 210 кДа, обозначаемого как p210. Остальные варианты транскриптов BCR::ABL1 у пациентов с ХМЛ носят название атипичные. Среди них чаще других выявляются варианты, образующиеся при слиянии 1-го экзона BCR со 2-м экзоном гена ABL1 (e1a2), ведущий к образованию белка с молекулярной массой 190 кДа (p190) или 19-го экзона BCR со 2-м экзоном ABL1 (e19a2, p230).
Аномальная тирозинкиназная активность химерного белка BCR::ABL1 определяет не только повышенную частоту деления клеток, но и их преимущества для роста, независимого от сигналов, блокирование апоптоза как механизма клеточного самоуничтожения, в результате чего опухолевое кроветворение получает преимущество перед нормальным и постепенно вытесняет его по мере нарастания объема опухолевой массы проявляется клиническая симптоматика, связанная с гиперплазией миелоидной ткани; в дальнейшем по мере развития генетической нестабильности появляются новые субклоны, развивается прогрессирование заболевания до фазы бластной трансформации - БК ХМЛ.
1.3 Эпидемиология заболевания или состояния
Хронический миелоидный лейкоз (ХМЛ) - редкое заболевание. По данным популяционного исследования в 6 регионах Российской Федерации, нормированная на стандартную популяцию ВОЗ заболеваемость составляет 0,7 на 100 000 взрослого населения [2]. Медиана возраста у взрослых пациентов составляет 50 лет (от 18 до 82), пик заболеваемости приходится на возраст 50 - 59 лет, однако значительной является доля молодых пациентов в возрасте до 40 лет - до 33%. Заболевание может быть выявлено в любом возрасте. В 2016 г. в Российском регистре больных хроническим миелолейкозом содержалась информация о 7609 пациентах с ХМЛ, при этом заболевание было диагностировано в хронической фазе у 6560 (93,8%) пациентов, в фазе акселерации у 380 (5,5%) больных и в фазе бластного криза - в 47 (0,7%) случаев [3].
ХМЛ у пациентов младше 18 лет (далее - детей) является чрезвычайно редкой патологией, с годовой заболеваемостью в среднем 1:1 000 000 детей в год, то есть в десять раз ниже, чем во взрослой популяции. Согласно имеющимся данным медиана возраста составляет 13,2 года (1 - 18 лет) [114, 115, 116].
1.4 Особенности кодирования заболевания или состояния
C92.1 - хронический миелоидный лейкоз [CML], BCR::ABL1-положительный
- Филадельфийская хромосома (Ph) положительная
- t(9;22)(q34;q11)
- с бластным кризом.
1.5 Классификация заболевания или состояния
По фазам заболевания
В течении ХМЛ выделяют 3 фазы, отражающие степень прогрессирования заболевания. Заболевание может быть диагностировано на любом этапе.
- Хроническая фаза (ХФ) является начальной стадией ХМЛ и диагностируется у большинства (до 94%) впервые выявленных пациентов [1, 4]. Диагноз ХФ устанавливают при отсутствии признаков ФА и БК.
- Фаза акселерации (ФА) определяется у 3 - 5% первичных пациентов с ХМЛ и является более продвинутым по сравнению с ХФ этапом развития патологического процесса при ХМЛ. ФА может также развиться при прогрессировании заболевания.
- Бластный криз (БК) является наиболее агрессивной стадией ХМЛ. Дебют болезни с БК является неблагоприятным прогностическим признаком и наблюдается у 1 - 2% пациентов с ХМЛ. Медиана продолжительности жизни при БК ХМЛ составляет 6 - 12 месяцев [1, 4].
Оценка фазы выполняется в дебюте заболевания, при прогрессировании заболевания и при изменении терапии. Дифференциально-диагностические критерии фаз ХМЛ приведены в табл. 1.
Таблица 1. Фазы ХМЛ по классификации ELN.
Фаза ХМЛ
Классификация ELN
Хроническая
Отсутствие признаков ФА или БК
Акселерации <**>
-
15 - 29% бластных клеток в периферической крови и/или костном мозге;
-
сумма бластов и промиелоцитов ![]() 30% (при этом бластов < 30%);
30% (при этом бластов < 30%);
-
количество базофилов в крови ![]() 20%;
20%;
-
персистирующая тромбоцитопения < 100 x 109/л, не связанная с терапией;
-
ДХА высокого риска <*> в Ph+ клетках, выявленные в ходе терапии
Бластный криз <**>
-
наличие в периферической крови или в костном мозге ![]() 30% бластных клеток
30% бластных клеток
-
появление экстрамедуллярных инфильтратов бластных клеток
--------------------------------
<*> Трисомии 8, 19; удвоение Ph-хромосомы; изохромосома 17; моносомия 7; делеция 7q; перестройки хромосомного района 3q26.2, а также комплексные аберрации, включающие 2 ДХА и более. Из этого числа наиболее прогностически неблагоприятными являются - 7/7q-; перестройки 3q26.2, а также комплексные аберрации, включающие 2 ДХА и более [5, 104].
<**> ФА или БК устанавливают при наличии хотя бы одного критерия.
По группе риска для ХФ ХМЛ
Группа риска ХМЛ рассчитывается на основании прогностически значимых клинико-гематологических характеристик и оценивается у пациентов с ХФ на момент диагностики заболевания, до начала терапии;
Группа риска по J.E. Sokal (прогнозирует вероятность общей выживаемости) [6]
- низкий риск;
- промежуточный риск;
- высокий риск.
Группа риска ELTS (прогнозирует вероятность общей выживаемости, выживаемости без прогрессирования и вероятности достижения глубокого молекулярного ответа) [9]
- низкий риск,
- промежуточный риск,
- высокий риск.
Совокупность критериев, характеризующих группы риска по системам Sokal, и ELTS представлена в табл. 2.
Таблица 2. Определение групп риска ХМЛ по J.E. Sokal и ELTS
Признак
Критерии J.E. Sokal
Критерии ELTS
Возраст, годы
0,0116 x (возраст - 43,4)
0,0025 x (возраст/10)3
Селезенка
(см из-под реберной дуги)
0,0345 x (размер селезенки, см из-под реберной дуги - 7,51)
0,0615 x (размер селезенки, см из-под реберной дуги)
Тромбоциты (x 109/л)
0,188 x [((число тромбоцитов x 109/л) /700)2 - 0,563]
0,4104 x (число тромбоцитов x 109/л) /1000-0,5
Бласты
(костного мозга)
0,0887 x (% бластов - 2,10)
0,1052 x (% бластов)
Индекс относительного риска
Экспонента суммы <1>
Сумма <2>
Группы риска
Низкий
< 0,8
![]() 1,5680
1,5680
Промежуточный
0,8 - 1,2
> 1,5680, но ![]() 2,2185
2,2185
Высокий
> 1,2
> 2,218
--------------------------------
<*> Автоматический подсчет доступен на сайтах: http://bloodref.com/myeloid/cml/sokal-hasford и http://www.leukemia-net.org/content/leukemias/cml/elts_score/index_eng.html
1.6 Клиническая картина заболевания или состояния
Клиническая картина при ХМЛ в большинстве случаев может характеризоваться бессимптомным течением; начальный период болезни у большинства пациентов может протекать в течение ряда лет. Нередко признаки заболевания на момент установления диагноза представлены только изменениями в общем анализе крови (самыми частыми из которых являются лейкоцитоз, миелоцитарный сдвиг, базофильно-эозинофильная ассоциация) и спленомегалией, которые могут обнаруживаться при проведении профилактического осмотра или обращении к врачу по поводу другой патологии [4].
2. Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Диагноз ХМЛ может быть окончательно установлен только при выявлении специфической для данного заболевания генетической аномалии: транслокации t(9;22)(q34;q11) методом СЦИ и/или химерного гена BCR::ABL1 методами ПЦР или FISH.
2.1 Жалобы и анамнез
- Рекомендуется всем пациентам с подозрением или с установленным ХМЛ проводить сбор анамнеза жизни и жалоб для верификации диагноза [10, 129]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: при сборе жалоб и анамнеза необходимо оценить:
1. Синдром опухолевой интоксикации (слабость, снижение аппетита, потеря массы тела, потливость, субфебрильная температура).
2. Синдром опухолевой пролиферации (боль и чувство тяжести в подреберьях при гепато- и спленомегалии).
3. Анемический синдром (общая слабость, одышка, снижение толерантности к физической нагрузке, бледность кожи и слизистых, тахикардия).
4. Тромботические осложнения при гипертромбоцитозе.
5. Геморрагический синдром, обусловленный тромбоцитопенией или гипертромбоцитозом.
6. Неврологическую симптоматику, в особенности при дебюте болезни с ФА или БК.
7. Сопутствующие заболевания.
8. Сопутствующую терапию.
9. Наличие сиблингов (для оценки возможностей по выполнению аллоТГСК).
Общее состояние пациента должно оцениваться по шкале оценки - ВОЗ/ECOG (см. приложения Г1 данных рекомендаций).
Клиническая симптоматика при ХМЛ не является специфической, появление указанных синдромов наиболее характерно для продвинутых фаз заболевания (ФА и БК). У большинства пациентов в ХФ жалобы и клиническая симптоматика отсутствуют либо являются неспецифическими, и признаки заболевания на момент установления диагноза могут быть представлены лишь изменениями в клиническом анализе крови (лейкоцитоз, миелоцитарный сдвиг, базофильно-эозинофильная ассоциация) при проведении профилактического осмотра или обращении к врачу по поводу другой патологии. С учетом того, что лекарственная терапия при ХМЛ назначается на длительный срок, при ее выборе учитывается спектр сопутствующей патологии, а также возможность межлекарственных взаимодействий.
2.2 Физикальное обследование
- Рекомендуется всем пациентам с подозрением на ХМЛ или установленным диагнозом ХМЛ для верификации диагноза при физикальном обследовании проводить [10, 129, 130]:
1. Осмотр кожи и видимых слизистых оболочек.
2. Пальпацию периферических лимфоузлов.
3. Определение размеров печени и селезенки (перкуторно и пальпаторно, в сантиметрах из-под края реберной дуги).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.3 Лабораторные исследования
- Рекомендуется всем пациентам при установлении диагноза ХМЛ проводить общий (клинический) анализ крови (развернутый) с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы) и исследованием уровня тромбоцитов в крови для верификации диагноза [10, 11, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам при установлении диагноза ХМЛ проводить биохимический общетерапевтический анализ крови: исследование уровня общего билирубина в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности лактатдегидрогеназы в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня креатинина в крови, исследование уровня общего белка в крови, исследование уровня альбумина в крови, определение активности щелочной фосфатазы в крови, электролиты (исследование уровня калия в крови, исследование уровня натрия в крови, исследование уровня общего кальция в крови, исследование уровня неорганического фосфора в крови, исследование уровня общего магния в сыворотке крови), определение активности амилазы в крови, определение активности липазы в сыворотке крови, исследование уровня глюкозы в крови, исследование уровня холестерина в крови, исследование уровня липопротеинов в крови и исследование уровня холестерина липопротеинов низкой плотности, при анемическом синдроме дополнительно: исследование обмена железа, фолиевая кислота, B12 для оценки функции органов и систем на момент установления диагноза и дальнейшего контроля возможной токсичности терапии ИТК [10, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам при установлении диагноза ХМЛ проводить цитологическое исследование мазка костного мозга (миелограмма) для определения стадии заболевания [1, 10, 11, 128, 129].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам при установлении диагноза ХМЛ, проводить цитогенетическое исследование (кариотип) клеток костного мозга для подтверждения наличия транслокации t(9;22)(q34;q11) (Ph-хромосомы). [1, 10, 11, 101, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий. Желательно полное кариотипирование не менее 20 метафаз для исключения ДХА. Молекулярно-генетическое исследование (FISH-метод) на одну пару хромосом для выявления химерного гена BCR::ABL1 рекомендуется при неинформативности стандартного цитогенетического исследования (нет митозов, неудовлетворительное качество материала), при криптических (скрытых) перестройках, выявлении вариантных транслокаций (сложных транслокаций с вовлечением трех и более хромосом), а также отсутствии экспрессии BCR::ABL1 p210 и невозможности выявления атипичных вариантов химерных транскриптов методом ПЦР [1, 12, 13, 105].
- Рекомендуется всем пациентам при установлении диагноза ХМЛ проводить определение типа химерного транскрипта BCR::ABL1 методом ПЦР, а также определение экспрессии мРНК BCR-ABL p210 (количественное) для химерных транскриптов e13a2 или e14a2 с целью дальнейшего корректного мониторинга молекулярного ответа на терапию препаратами ИТК. [1, 10, 11, 13 - 17, 129, 130].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарий. В случае отсутствия типичных для ХМЛ химерных транскриптов BCR::ABL1 p210 следует выполнить качественное определение атипичных типов транскриптов BCR::ABL1 p190 и p230, а в случаях их отсутствия и других более редких в лабораториях, владеющих данными методиками, либо провести исследование методом FISH - Молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом для выявления химерного гена BCR::ABL1. [13 - 17].
- Рекомендуется проведение пациентам в фазе акселерации или бластном кризе ХМЛ для определения оптимальной тактики терапии по показаниям следующих дополнительных исследований [1, 10, 11, 129, 130]:
1. Определение HLA-антигенов или молекулярно-генетическое исследование гистосовместимости (HLA) высокого разрешения при помощи секвенирования для подбора донора костного мозга.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий. Исследование выполняются после консультации в трансплантационной клинике. У больных с БК ХМЛ исследование проводится при достижении 2-й ХФ, в случае, если пациент моложе 65 лет.
2. Цитохимическое исследование микропрепарата костного мозга: миелопероксидаза, липиды, PAS-реакция, альфа-нафтилэстераза при бластном кризе ХМЛ для определения линейной направленности бластных клеток при невозможности выполнения иммунофенотипирования костного мозга.
3. Иммунофенотипирование биологического материала для выявления маркеров гемобластозов при бластном кризе ХМЛ для определения линейной направленности бластных клеток.
4. Патологоанатомическое исследование биопсийного (операционного) материала костного мозга (трепанобиопсия) с определением клеточности и степени фиброза при цитопении.
5. У пациентов с БК ХМЛ - спинномозговая пункция с последующим цитологическим исследованием и/или иммунофенотипированием биологического материала для выявления маркеров гемобластозов
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: HLA-типирование проводится для поиска HLA-совместимого донора пациентам, которым показано выполнение аллогенной ТГСК. Цитохимическое и иммунофенотипическое исследования бластных клеток при бластном кризе ХМЛ требуются для определения линейной направленности бластных клеток и выбора оптимальной схемы химиотерапевтического воздействия. Гистологическое исследование костного мозга необходимо для определения причины развития цитопении и выбора оптимальной тактики ее коррекции.
2.4 Инструментальные исследования
- Рекомендуется проводить всем пациентам при подозрении на ХМЛ ультразвуковое исследование (УЗИ) селезенки с целью определения ее размеров для оценки объема опухолевой массы и стадирования процесса [10, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.5 Иные исследования
- Рекомендуются для всех пациентов прием (осмотр, консультация) врачей-специалистов по показаниям, которые обусловлены наличием сопутствующей патологии (врача-кардиолога, врача-эндокринолога, врача-акушера-гинеколога и др.), при назначении ИТК для оптимального выбора препарата [10, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: особое внимание следует уделить оценке кардиоваскулярных рисков.
3. Лечение
Общие принципы лечения
Цель современной терапии ХМЛ - максимальное подавление Ph-положительного опухолевого клона, предупреждение развития резистентности и обеспечение длительной выживаемости при хорошем качестве жизни. Основным средством терапии и стандартом лечения в настоящее время является применение ингибиторов тирозинкиназы BCR-ABL (ИТК). Данные препараты обладают способностью таргетного (целенаправленного) воздействия на BCR::ABL1-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза ХМЛ. Механизм действия ИТК обусловлен блокадой АТФ-связывающего кармана молекулы BCR::ABL1, что лишает белок BCR::ABL1 тирозинкиназной активности, дающей опухолевым клеткам пролиферативное преимущество.
Соблюдение принципа непрерывного и постоянного воздействия на опухолевый клон является основой эффективности лечения. Перерывы в приеме ИТК могут способствовать снижению эффективности терапии. Регулярный контроль результатов терапии с помощью молекулярно-генетических методов, своевременная оценка ответа на лечение и переключение на следующую линию ИТК в случае резистентности к проводимой терапии являются ключевыми факторами, влияющим на отдаленные результаты выживаемости при ХМЛ. Аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК) рассматривается для пациентов ХМЛ ХФ с неудачей терапии 2-х и более линий ИТК, в продвинутых фазах ХМЛ (ФА и БК), при наличии мутации T315I в гене BCR::ABL1 и неэффективности понатиниба или асциминиба, а также при непереносимости всех доступных ИТК.
Терапия ИТК показана всем пациентам ХМЛ. Режим приема ежедневно, длительно, постоянно. Начальная доза их не зависит от пола, массы тела, роста, расы пациента. Прием препаратов можно начинать при любом числе лейкоцитов. Возможность отмены ИТК у пациентов со стабильным глубоким МО описана в разделе 6.
При постоянном воздействии ИТК происходят редукция опухолевого клона и восстановление нормального гемопоэза, снижается риск прогрессирования заболевания, увеличивается длительная выживаемость пациентов. Достижение большого молекулярного ответа (БМО) является основным целевым результатом терапии и прогностически благоприятным фактором длительной выживаемости без прогрессирования при условии постоянной терапии.
Критерии определения гематологического цитогенетического, молекулярного ответов при терапии ИТК у всех пациентов с ХМЛ представлены в табл. 3.
Таблица 3. Критерии гематологического, цитогенетического и молекулярного ответов [1, 10, 11, 129, 130].
Вид ответа
Определение
Гематологический (клинико-гематологический)
Полный (ПГО)
Лейкоциты менее 10 x 109/л
Базофилы менее 5%
В гемограмме нет миелоцитов, промиелоцитов, миелобластов
Тромбоциты менее 450 x 109/л
Селезенка не пальпируется
Цитогенетический <1>
Полный (ПЦО)
Ph-хромосома в метафазах не определяется (Ph+ 0%)
Частичный (ЧЦО)
Ph-хромосома в 1 - 35% метафаз (Ph+ 1 - 35%)
Малый (МЦО)
Ph-хромосома в 36 - 65% метафаз (Ph+ 36 - 65%)
Минимальный (МинЦО)
Ph-хромосома в 66 - 95% метафаз (Ph+ 66 - 95%)
Отсутствие (нет ЦО)
Ph-хромосома в более 95% метафаз (Ph+ > 95%)
Молекулярный <3>
БМО (МО3,0)
Соотношение BCR::ABL1 /ABL1 ![]() 0,1% и > 0,01% по международной шкале (IS)
0,1% и > 0,01% по международной шкале (IS)
Глубокий МО
МО 4,0
Соотношение BCR::ABL1/ABL BCR::ABL1 ![]() 0,01% и > 0,0032% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1
0,01% и > 0,0032% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1 ![]() 10000 и < 32000 копий
10000 и < 32000 копий
МО 4,5
Соотношение BCR::ABL1/ABL1 ![]() 0,0032% и > 0,001% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1
0,0032% и > 0,001% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1 ![]() 32 000 и < 100 000 копий
32 000 и < 100 000 копий
МО 5,0
Соотношение BCR::ABL1/ABL1 ![]() 0,001% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1
0,001% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1 ![]() 100 000 копий
100 000 копий
3.1. Лекарственное лечение у взрослых пациентов
3.1.1. Препараты для терапии ХМЛ и режим дозирования
Выбор ИТК у всех больных выполняется с учетом сопутствующей патологии, мутационного статуса, фазы ХМЛ.
В Российской Федерации для лечения ХМЛ у взрослых в настоящее время зарегистрированы ИТК BCR-ABL первого поколения (ИТК1) иматиниб** и ИТК второго поколения (ИТК2) нилотиниб**, дазатиниб**, бозутиниб**. У взрослых больных все указанные ИТК зарегистрированы для терапии в первой и последующих линиях терапии.
3.1.2. Первая линия терапии ИТК пациентов с ХМЛ
- Рекомендуется всем пациентам при впервые выявленном положительном по филадельфийской хромосоме ХМЛ в ХФ, использование иматиниба** как препарата 1 линии для терапии ХМЛ в режиме монотерапии [18 - 19]. (см. таб. 5)
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендуется всем пациентам при впервые выявленном положительном по филадельфийской хромосоме ХМЛ в ФА использование иматиниба** как препарата 1 линии для терапии ХМЛ в режиме монотерапии и всем пациентам в БК как препарата 1 линии в режиме монотерапии и в комбинации с другими противоопухолевыми препаратами [20 - 24].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: иматиниб** - ИТК первого поколения с селективностью в отношении BCR::ABL1 тирозинкиназы, также способен ингибировать c-KIT, PDGFR-киназную активность. При применении иматиниба** в 1 линии терапии общая выживаемость к 11 годам составляет 83%, выживаемость без прогрессирования до ФА и БК - 92%, частота прогрессирования болезни к 11 годам терапии не превышает 7%. Полный цитогенетический (ПЦО) достигается у 83% пациентов [19].
У большинства пациентов сохраняются хорошее качество жизни и трудоспособность.
Абсолютных противопоказаний для применения иматиниба** не зарегистрировано,
Следует тщательно наблюдать за пациентами с низкой фракцией выброса сердца
Следует тщательно наблюдать за пациентами с низкой скоростью клубочковой фильтрации
Наиболее частыми причинами плохой переносимости иматиниба** являются:
- задержка жидкости,
- симптомы со стороны желудочно-кишечного тракта,
- мышечные спазмы,
- боли в суставах,
- кожная сыпь
- повышенная утомляемость
Многие из этих нежелательных явлений проходят со временем или после короткого прерывания лечения. У пациентов с хронической токсичностью 1 - 2 степени возможно длительное снижение дозы иматиниба** при условии достижения и сохранения БМО [101].
Доза составляет 400 мг иматиниба** в сутки для ХФ и 600 мг иматиниба** в сутки для ФА и БК [19 - 23]. Препарат рекомендовано принимать однократно во время еды, запивая полным стаканом воды. Дозы препарата для взрослых в зависимости от фазы ХМЛ указаны в табл. 4.
Снижение дозы необходимо проводить при развитии явлений токсичности.
Таблица 4. Дозы иматиниба** при лечении взрослых пациентов с ХМЛ.
Доза
ХФ
ФА и БК
Стартовая доза
400 мг/сут
600 мг/сут
Повышение дозы (+1)
600 мг/сут
800 мг /сут
Повышение дозы (+2)
800 мг/сут
-
Снижение дозы (-1)
300 мг/сут
400 мг/сут
- Рекомендуется всем взрослым пациентам в ХФ использование нилотиниба** как препарата первой линии для терапии ХМЛ в режиме монотерапии [25]. (см. таб. 5)
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: нилотиниб** - мощный, высокоселективный ингибитор BCR-ABL1 тирозинкиназы. Имеет большее сродство к ней по сравнению с иматинибом**, активен в отношении большинства мутаций BCR-ABL1. Выпускается в виде капсул по 150 и 200 мг. В 1 линии терапии показан пациентам с ХФ ХМЛ в начальной дозе 600 мг/сут [25]. Прием осуществляется по 300 мг 2 раза в сутки с интервалом примерно 12 часов. Рекомендован прием препарата строго натощак, так как пища значительно увеличивает биодоступность препарата (до 80%), что ведет к увеличению концентрации нилотиниба** в плазме. Принимать препарат следует не ранее чем через 2 часа после еды; после приема нилотиниба** пищу следует принимать не ранее чем через 1 час. Капсулы необходимо запивать достаточным количеством воды.
При развитии токсических явлений доза нилотиниба** может быть снижена до 400 мг 1 раз в сутки (табл. 5).
При терапии нилотинибом** следует мониторировать показатели состояния сердечно-сосудистой системы.
Наличие в анамнезе ишемической болезни сердца, цереброваскулярных болезней, окклюзионных заболеваний периферических артерий является строгим противопоказанием для применения нилотиниба** в качестве первой линии терапии.
Пациенты с артериальной гипертензией, гиперхолестеринемией и сахарным диабетом также имеют повышенный риск при применении нилотиниба** [101]
- Рекомендуется всем пациентам в ХФ использование дазатиниба** как препарата первой линии для терапии ХМЛ в режиме монотерапии [26]. (см. таб. 5)
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: дазатиниб** - многоцелевой препарат, взаимодействующий со многими тирозинкиназными и нетирозинкиназными белками. Он ингибирует следующие тирозинкиназы: BCR::ABL и семейства SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2, PDGFR, PDGFR. Способен in vitro ингибировать рост клеточных линий с гиперэкспрессией BCR::ABL, активацией альтернативных онкогенных путей, включающих киназы семейства SRC (LYN, HCK). Показана возможность препарата проникать через гематоэнцефалический барьер.
Рекомендуемая доза дазатиниба** для ХФ составляет 100 мг/сут [26]. При явлениях токсичности доза дазатиниба** пациентам в ХФ может быть снижена до 50 мг 1 раз (табл. 5). Данных об эффективности повышения дозы дазатиниба** до 140 мг/сут при резистентности к стандартной дозе нет. В связи с этим в клинической практике увеличение дозы препарата при недостаточной эффективности его стандартной дозы нецелесообразно.
Терапия дазатинибом** сопряжена с повышенным риском развития плевральных выпотов (до 37%), которые могут развиваться даже после нескольких лет ранее неосложненного лечения. В редких случаях развивается легочная артериальная гипертензия. Наличие в анамнезе плевро-пульмональных или перикардиальных заболеваний являются строгими противопоказаниями к применению дазатиниба** в качестве препарата первой линии терапии [101].
- Рекомендуется всем взрослым пациентам в ХФ использование бозутиниба** как препарата первой линии для терапии ХМЛ в режиме монотерапии [100]. (см. таб. 5)
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: Бозутиниб** - ингибитор киназы BCR-ABL1, а также киназ семейства SRC, в том числе SRC, LYN и HCK. Препарат обладает минимальной ингибирующей активностью в отношении рецепторов PDGFR. Стандартная доза для терапии в 1-ой линии у пациентов в ХФ составляет 400 мг в сутки. В случае нежелательных явлений, препятствующих продолжению терапии в стандартной дозе, доза может быть снижена до 300 мг 1 раз в сутки (табл. 5). Нет данных об эффективности повышения дозы бозутиниба** при неэффективности стандартной дозы препарата. В связи с этим в клинической практике увеличение дозы препарата при недостаточной эффективности его стандартной дозы нецелесообразно.
Никаких сопутствующих состояний и серьезных противопоказаний для терапии бозутинибом** не выявлено.
Обычно преходящая диарея встречается у 30% пациентов, что может быть беспокоящим побочным эффектом.
Может наблюдаться временное повышение активности аминотрансфераз, в основном в первые недели или месяцы лечения [101].
Применение ИТК2 (нилотиниб**, дазатиниб**, бозутиниб**) в 1 линии лечения по сравнению с иматинибом** достоверно более эффективно по снижению вероятности прогрессирования ХМЛ и более высокой частоте достижения глубокого МО в более ранние сроки. Применение нилотиниба** в первой линии в дозе 600 мг/сут позволило через 1 год терапии достичь БМО у 77% пациентов по сравнению с достижением БМО у 60% пациентов, получавших 400 мг/сут иматиниба**. К 5 годам терапии глубокий МО4,5 достигнут у 54% пациентов в группе нилотиниба** 600 мг/сут в сравнении с 31% пациентов в группе иматиниба** [25]. Сравнение дазатиниба** в дозе 100 мг/сут с иматинибом** в дозе 400 мг/сут в 1 линии также показало преимущество в достижении БМО к 1 году лечения: у 76% пациентов, получавших дазатиниб**, против 64% пациентов на терапии иматинибом** [26]. Применение бозутиниба** в первой линии в дозе 400 мг/сут позволило через 2 года терапии достичь БМО у 67% пациентов по сравнению с достижением БМО у 57,5% пациентов, получавших 400 мг/сут иматиниба**
Нилотиниб** и дазатиниб** обеспечивают более высокую частоту достижения МО4 и МО4,5 по сравнению с иматинибом**, что может увеличить число пациентов, готовых в перспективе к контролируемому наблюдению без терапии. К 5 годам терапии глубокий МО4,5 достигнут у 42% пациентов в группе дазатиниба** в сравнении с 33% пациентов в группе иматиниба** [25, 26]. Также имеются данные и о большей частоте МО4,5 при лечении бозутинибом** по сравнению с иматинибом**: 47,4% и 36,6% соответственно к 5 году терапии [106]. При этом возможность развития неблагоприятных событий (например, окклюзии периферических сосудов при применении нилотиниба**, развитие плеврального выпота при длительной терапии дазатинибом**) требует оценки соответствующих факторов риска у пациентов [26, 29 - 31]. Профиль токсичности иматиниба** является наиболее безопасным, а опыт применения в 1 линии лечения - наиболее длительным в сравнении с другими ИТК. Также это наиболее доступный на сегодняшний день препарат. Однако, вероятность быстрого достижения БМО и глубокого МО при лечении иматинибом** по сравнению с ИТК2 ниже [25, 26]. Иматиниб** может быть оптимальной терапией для пациентов с группой низкого риска, больных старше 60 лет и/или пациентов с сопутствующими заболеваниями, ограничивающими назначение ИТК2.
3.1.3. Вторая и следующие линии терапии ИТК пациентов с ХМЛ
- Рекомендуется взрослым пациентам в ХФ использование нилотиниба**, дазатиниба** и бозутиниба** как препаратов 2-й и последующих линий для терапии ХМЛ в режиме монотерапии. [32 - 34, 37] (см. таб. 5)
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4) - для нилотиниба** и бозутиниба** у взрослых.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2) - для дазатиниба** у взрослых.
- Рекомендуется взрослым пациентам в ФА использование нилотиниба**, дазатиниба** и бозутиниба** как препаратов 2-й и последующих линий для терапии ХМЛ в режиме монотерапии. [36, 111 - 113]. (см. таб. 5)
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4) - для нилотиниба** и бозутиниба** у взрослых.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2) - для дазатиниба** у взрослых
- Рекомендуется взрослым пациентам в БК использование дазатиниба** и бозутиниба** как препаратов 2 и последующих линий в режиме монотерапии, а также в комбинации с другими противоопухолевыми препаратами [35, 36]. (см. таб. 5)
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4) - для бозутиниба** у взрослых.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2) - для дазатиниба** у взрослых.
Комментарии: применение ИТК2 во 2-ой линии терапии ХМЛ эффективно как при непереносимости, так и при резистентности к иматинибу**. Во 2-ой линии терапии нилотиниб** назначается в дозе 800 мг/сут в ХФ и ФА [34]. Применение дазатиниба** во 2-ой линии терапии у пациентов в ХФ ХМЛ при непереносимости или резистентности к иматинибу** позволило добиться БМО у 55% пациентов при непереносимости и у 43% - при резистентности [32]. Использование дазатиниба** в ФА позволило достичь ПЦО у 24% больных [27]. Применение этого препарата при БК позволило получить большой цитогенетический ответ у 25% пациентов с миелоидным БК и 50% пациентов с лимфоидным БК в течение 24 месяцев, однако эти ответы не были длительными [35]. Рекомендуемая доза дазатиниба** во 2-ой и последующих линиях для ХФ составляет 100 мг/сут, а для ФА и БК 140 мг/сут.
Бозутиниб** также оказался эффективным у пациентов с резистентностью или непереносимостью предшествующей терапии иматинибом**. При медиане наблюдения ![]() 24 мес. кумулятивная частота достижения ПГО и ПЦО составила 77% и 46% соответственно, БМО и глубокий МО были получены у 35% и 28% [37]. Бозутиниб** также показал эффективность у пациентов с неудачей терапии не только иматинибом**, но и ИТК2 (дазатиниб**, нилотиниб**). ПГО, ПЦО и БМО достигли 62/86 (72%), 16/72 (22%) и 20/78 (25%) пациентов соответственно после терапии иматинибом** и дазатинибом**. Эти же показатели были зарегистрированы у 20/26 (77%), 5/24 (21%) и 1/19 (5%) пациентов, ранее получавших иматиниб** и нилотиниб** [33]. Таким образом, небольшая доля пациентов с предшествующей неудачей терапии двумя ИТК на фоне приема бозутиниба** могла достигать не только ПГО, но и более глубоких (цитогенетических и молекулярных) ответов.
24 мес. кумулятивная частота достижения ПГО и ПЦО составила 77% и 46% соответственно, БМО и глубокий МО были получены у 35% и 28% [37]. Бозутиниб** также показал эффективность у пациентов с неудачей терапии не только иматинибом**, но и ИТК2 (дазатиниб**, нилотиниб**). ПГО, ПЦО и БМО достигли 62/86 (72%), 16/72 (22%) и 20/78 (25%) пациентов соответственно после терапии иматинибом** и дазатинибом**. Эти же показатели были зарегистрированы у 20/26 (77%), 5/24 (21%) и 1/19 (5%) пациентов, ранее получавших иматиниб** и нилотиниб** [33]. Таким образом, небольшая доля пациентов с предшествующей неудачей терапии двумя ИТК на фоне приема бозутиниба** могла достигать не только ПГО, но и более глубоких (цитогенетических и молекулярных) ответов.
- Рекомендуется терапия понатинибом пациентам в ХФ, ФА и БК ХМЛ с резистентностью или непереносимостью ИТК2, а также всем пациентам с мутацией T315I в гене BCR::ABL1 вне зависимости от предшествующей терапии [107, 108]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: понатиниб относится к 3-ему поколению ИТК. Понатиниб показал эффективность в том числе и у пациентов с мутацией T315I в гене BCR::ABL1. У пациентов с резистентностью к ИТК2 понатиниб предпочтительнее, чем альтернативный ИТК2, при условии отсутствия факторов риска сердечно-сосудистых осложнений [107, 108]. Рекомендуемая изначальная доза понатиниба составляет 45 мг 1 раз в сутки. Сердечно-сосудистые нежелательные реакции (артериальные окклюзии или венозные тромбозы) возникают примерно в 30% случаев и имеют дозозависимый характер. При достижении полного цитогенетического ответа доза понатиниба может быть снижена до 15 мг в сутки. У пациентов в ХФ ХМЛ без мутации T315I и при наличии факторов риска сердечно-сосудистых событий целесообразно снижение начальной дозы понатиниба до 30 мг или 15 мг 1 раз в сутки. Повышение дозы до 45 мг в сутки может быть рассмотрено у пациентов без оптимального ответа на терапию понатинибом в сниженных дозах при наличии клинической целесообразности с учетом факторов сердечно-сосудистого риска.
- Рекомендуется терапия асциминибом пациентам в ХФ ХМЛ с резистентностью или непереносимостью двух или более ИТК, а также всем пациентам с мутацией T315I в гене BCR::ABL1 вне зависимости от предшествующей терапии [109, 110]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: Асциминиб представляет собой STAMP-ингибитор (специально нацеленный на миристоиловый карман ABL), который показал высокую эффективность и хороший профиль безопасности по результатами исследований фазы I и III у пациентов с хроническим миелоидным лейкозом с неудачей к предшествующей терапии ИТК, в том числе и у пациентов с мутацией T315I в гене BCR::ABL1 [109, 110]. У пациентов с резистентностью к ИТК2 асциминиб предпочтительнее, чем альтернативный ИТК2. У пациентов в ХФ ХМЛ с мутацией T315I в гене BCR::ABL1 и факторами риска сердечно-сосудистых осложнений асциминиб предпочтительнее понатиниба. Рекомендуемая суточная доза асциминиба составляет 80 мг у пациентов без мутации T315I в гене BCR::ABL1. Препарат асциминиб можно принимать внутрь либо в дозе 80 мг один раз в сутки примерно в одно и то же время каждый день, либо в дозе 40 мг два раза в сутки примерно через 12-часовые интервалы. У пациентов в ХФ ХМЛ с мутацией T315I в гене BCR::ABL1 суточная доза составляет 400 мг в сутки в режиме приема 200 мг внутрь два раза в сутки примерно через 12-часовые интервалы. Для коррекции нежелательных реакций дозу асциминиба можно снизить до 40 мг в сутки (40 мг в один прием или 20 мг два раза в сутки) у пациентов без мутации T315I в гене BCR::ABL1 и до 160 мг 2 раза в сутки у пациентов с мутацией T315I в гене BCR::ABL1.
3.1.4. Принципы выбора ИТК при смене терапии
- Рекомендуется выбор ИТК с учетом сопутствующей патологии для предотвращения нежелательных явлений при терапии у пациентов с ХМЛ [10, 11, 38].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: С учетом профиля токсичности ИТК применяют с осторожностью при некоторых перечисленных ниже заболеваниях и состояниях.
Нилотиниб**
- Панкреатит с клинической симптоматикой в анамнезе - в редких случаях отмечено обострение панкреатита, может наблюдаться повышение активности амилазы, липазы
- Сахарный диабет - на фоне терапии нилотинибом** возможно появление гипергликемии
- Атеросклеротическое поражение сосудов, кардиоваскулярные ишемические события, окклюзионная болезнь периферических артерий - продемонстрирована повышенная вероятность их развития у пациентов с уже имеющимися факторами риска развития сердечно-сосудистых заболеваний по сравнению с имеющейся в общей популяции [39].
Дазатиниб**
- Хронические сердечно-сосудистые заболевания, хронические обструктивные заболевания легких, бронхиальная астма, плевральный или перикардиальный выпоты в анамнезе, пневмония, травма грудной клетки - факторы, влияющие на частоту развития плевральных выпотов [26, 29, 30, 40]
- Хронические заболевания ЖКТ с высоким риском развития кровотечений, постоянный прием антиагрегантов (АТХ B01AC Антиагреганты кроме гепарина) - дазатиниб** обладает антиагрегантным эффектом [41].
Бозутиниб**
- тяжелое нарушение функции печени и почек [42].
Понатиниб
- Атеросклеротическое поражение сосудов, кардиоваскулярные ишемические события, окклюзионная болезнь периферических артерий, наличие тромбозов в анамнезе - продемонстрирована повышенная вероятность развития артериальных окклюзий [42].
Все ИТК следует применять с осторожностью у пациентов с удлиненным интервалом QT, а также с клинически выраженной сердечной недостаточностью, дисфункцией левого желудочка, аритмиями. Следует избегать одновременного применения ИТК как с индукторами, так и ингибиторами изофермента CYP3A, а также с препаратами, удлиняющими интервал QT [43].
- Рекомендуется выбор ИТК при терапии ХМЛ с учетом мутаций гена BCR::ABL1 по результатам молекулярно-генетического исследования точечных мутаций гена bcr-abl (химерный ген, образованный слиянием области кластера разрывов на 22 хромосоме и гена тирозин-киназы Абельсона на 9 хромосоме) [44 - 50].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: мутации BCR::ABL определяют чувствительность лейкозных клеток к воздействию определенного ИТК. На момент диагностики мутационный статус целесообразно определять при дебюте ХМЛ в ФА и БК. Также наличие мутаций тирозинкиназного домена BCR::ABL1 необходимо исследовать при неудаче терапии и перед сменой ИТК. Исследование точечных мутаций BCR::ABL1 может быть выполнено методом секвенирования по Сэнгеру или методом высокопроизводительного секвенирования (NGS). Наиболее часто встречающиеся мутации могут быть также определены при помощи аллель-специфичной ПЦР. Следует отметить, что чувствительность данных методов существенно различается и составляет 15% - 20% для секвенирования по Сэнгеру, 2 - 3% для высокопроизводительного секвенирования [ELN 2020] и 1% для аллель-специфичной ПЦР
Выбор ИТК в зависимости от выявленных мутаций BCR::ABL1:
- F317L/V/I/C, T315A-нилотиниб**, бозутиниб**, асциминиб или понатиниб
- V299L - нилотиниб**, асциминиб или понатиниб
- Y253H, E255V/K, F359V/I/C - дазатиниб**, бозутиниб**, асциминиб или понатиниб
- T315I - асциминиб или понатиниб
Терапия ИТК 1-ого и 2-ого поколения (иматиниб**, нилотиниб**, дазатиниб**, бозутиниб**) малоэффективна при наличии мутации T315I [50, 51]. При выявлении данной мутации рекомендуются терапия ИТК 3-его поколения понатинибом или STAMP-ингибитором асциминибом. [107, 108, 109, 110]
- При невозможности переключения на понатиниб или асциминиб взрослым пациентам рекомендован поиск HLA-идентичного донора и выполнение аллоТГСК [52 - 54].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: До выполнения аллоТГСК или переключения на ИТК, потенциально эффективных при наличии мутации T315I, возможно продолжение терапии препаратом, который обеспечивает максимальный клинический эффект (сохранение ПГО, хорошая переносимость)
Таблица 5. Дозы нилотиниба**, дазатиниба** и бозутиниба** для взрослых пациентов с ХМЛ (см. соответствующие тезисы-рекомендации).
Доза препарата
Нилотиниб**
Дазатиниб**
Бозутиниб**
1-я линия терапии ХФ
2-я линия терапии ХФ и ФА
1 и 2 линии терапии ХФ
1 и 2 линии терапии ФА и БК
1-я линия терапии ХФ
2 и последующие линии терапии ХФ, ФА и БК
Стартовая доза
600 мг в сут (300 мг x 2 раза в сут)
800 мг в сут (400 мг x 2 раза в сут)
100 мг x 1 раз в сут
140 мг x 1 раз в сут
400 мг x 1 раз в сут
500 мг x 1 раз в сут
Снижение дозы согласно инструкции по применению
400 мг x 1 раз в сут
400 мг x 1 раз в сут
50 мг x 1 раз в сут
100 мг x 1 раз в сут
300 мг x 1 раз в сут
400 мг x 1 раз в сут 300 мг x 1 раз в сут
3.1.5. Диагностика на этапе лечения (мониторинг результатов терапии ИТК у пациентов с ХМЛ)
- Рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента для оценки эффективности и переносимости терапии ИТК [11 - 13, 15, 55, 56, 101].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется при длительной глубокой цитопении на фоне лечения ИТК вне зависимости от стадии ХМЛ рекомендуется выполнение трепанобиопсии с последующим патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга [10, 101].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: для своевременной оценки результатов терапии и возможных нежелательных явлений терапии необходимо регулярно выполнять мониторинг клинико-лабораторных показателей (табл. 6). Принимая во внимание необходимость длительного приема препаратов, целесообразна регулярная беседа с пациентом с целью контроля приверженности терапии.
Таблица 6. Частота динамического обследования пациентов с ХМЛ, получающих ИТК.
Исследование
Периодичность мониторинга
Общий (клинический) анализ крови
Каждые 15 дней до достижения и подтверждения ПГО, далее - как минимум каждые 3 месяца или чаще по мере необходимости
Цитогенетическое исследование биопсийного (операционного) материала костного мозга (кариотип (не менее 20 метафаз) <1>, <5>
1.
На 3-м, 6-м и 12-м месяцах терапии. В случае достижения ПЦО на 3-м месяце и подтверждении на 6-м месяце - исследование на 12 мес. может не выполняться
2.
В случае неудачи терапии по данным молекулярного мониторинга на любом этапе терапии.
3.
При наличии ДХА высокого риска, выявленных в дебюте или в ходе терапии, в Ph+ клетках целесообразен цитогенетический мониторинг не реже 1 раза в год
Если в ходе количественной ПЦР-РВ соотношение BCR::ABL1/ABL1 составляет менее 1%, то выполнение исследования нецелесообразно
-
Определение экспрессии мРНК BCR-ABLp210 (количественное) <2>, <3>
Каждые 3 мес до достижения БМО, затем постоянно не реже 1 раза в 6 месяцев 4
или
-
Определение экспрессии мРНК BCR-ABLp190 (количественное) - в случае транскрипта р190 <2>, <3>
Молекулярно-генетическое исследование точечных мутаций гена bcr-abl (химерный ген, образованный слиянием области кластера разрывов на 22 хромосоме и гена тирозин-киназы Абельсона на 9 хромосоме)
При неудаче терапии первой или последующих линий ИТК, при переходе на другие ИТК или другие виды терапии, в дебюте заболевания у больных с ФА или БК
Анализ крови биохимический общетерапевтический
Каждые 15 дней в течение 1-го месяца терапии; 1 раз в месяц в течение первых 3-х месяцев терапии; далее 1 раз в 3 - 6 месяцев.
При необходимости мониторинга токсичности показан более частый контроль
Регистрация электрокардиограммы.
На первом году 1 раз в 3 - 6 месяцев для контроля интервала QT. При нормальных показателях - далее 1 раз в год. У пациентов с факторами риска сердечно-сосудистых событий рекомендован мониторинг по клиническим показаниям.
При переходе на другие ИТК: перед началом нового ИТК и через неделю приема нового ИТК
Прицельная рентгенография органов грудной клетки или флюорография легких.
1 раз в год или чаще по клиническим показаниям
Примечания:
<1> у пациентов с атипичными транскриптами BCR::ABL1, а также криптическими вариантами транслокации t(9;22) рекомендуется применение метода FISH для мониторинга. Следует подчеркнуть, что значения менее или равные 1% BCR::ABL-позитивных клеток соответствуют ПЦО (0% Ph <+>). Однако при величинах более 1% по данным FISH корреляции между результатами СЦИ и FISH нет [N. Testoni et al 2009].
<2> результаты определения экспрессии BCR::ABL1 следует выдавать в процентах по международной шкале (IS). Этого можно достичь тремя способами: использованием фактора конверсии, получаемого лабораторией при проведении стандартизации; применением аттестованных калибраторов или коммерческих тест-систем, представляющих свои результаты в % по IS.
<3> Необходимо указывать количество копий контрольного гена ABL1. При количестве копий контрольного гена ABL1 менее 10 000 копий результат не может быть выдан, и анализ должен быть проведен повторно.
<4> Возможен более частый контроль для оценки стабильности глубокого молекулярного ответа перед фазой ремиссии без лечения. См "Возможность отмены терапии ИТК у пациентов с глубоким молекулярным ответом" в разделе 7
<5> Для пациентов без неудачи терапии стандартное цитогенетическое исследование костного мозга выполняется в тех случаях, когда стандартизированный молекулярный мониторинг невозможен.
3.1.6. Тактика ведения в зависимости от результатов терапии
- Рекомендуется взрослым пациентам с неудачей терапии иматинибом** переход на ИТК2 (нилотиниб**, дазатиниб**, бозутиниб**) [27, 32 - 34, 36, 37, 101].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: эффект терапии 1 линии может быть расценен как оптимальный, неудача терапии, предупреждение (табл. 7).
При неудаче терапии иматинибом** в 1 линии показан переход на ИТК2 с учетом переносимости и мутационного статуса. В условиях ограниченного доступа ИТК2 при неудаче терапии иматинибом** в 1 линии необходимо безотлагательно повысить дозу иматиниба** до 600 - 800 мг с учетом переносимости, в качестве временной меры до перевода на ИТК2. У пациентов с высокой группой риска по J.E. Sokal или ELTS (табл. 2), ДХА в Ph-положительных клетках (которые являются прогностически неблагоприятными факторами) предпочтительнее быстрое переключение на ИТК2, чем повышение дозы иматиниба**.
При неудаче терапии ИТК2 в 1 линии лечения показана смена препарата на другой ИТК2; в интересах пациентов рассмотреть варианты экспериментального лечения в рамках клинических исследований, показано выполнить HLA-типирование сиблингов при их наличии. Эффективность увеличения дозы ИТК2 в 1 линии недостаточно доказана и поэтому нецелесообразна.
При оптимальном ответе продолжают лечение тем же препаратом ИТК.
При отсутствии оптимального ответа рекомендовано проверить приверженность пациента к терапии и возможное лекарственное взаимодействие.
При констатации предупреждения на терапии иматинибом** и ИТК2 целесообразно рассмотреть вопрос о смене терапии или продолжить прием препарата в прежней дозе на фоне тщательного мониторинга эффективности терапии и обеспечить готовность к смене терапии в случае констатации неудачи.
Таблица 7. Критерии ответа на терапию ИТК в первой и второй линиях лечения у пациентов в ХФ и ФА.
Срок терапии
Оптимальный ответ
Предупреждение
Неудача терапии
На момент диагноза
ДХА высокого риска в Ph+ клетках, группа высокого риска по ELTS
3 месяца
BCR::ABL1 ![]() 10%
10%
Ph+ ![]() 35%
35%
BCR::ABL1 > 10%
при однократном исследовании
Ph+ 36 - 95%
Нет ПГО
BCR::ABL1 > 10%, подтвержденный повторным анализом через 1 - 3 месяца
Ph+ > 95%
6 месяцев
BCR::ABL1 ![]() 1%
1%
Ph+ 0%
BCR::ABL1 > 1% - 10%
Ph+ 1 - 35%
BCR::ABL1 > 10%
Ph+ > 35%
12 месяцев
BCR::ABL1 ![]() 0,1% (БМО)
0,1% (БМО)
Ph+ 0%
BCR::ABL1 > 0,1 - 1%
Ph+ 0%
BCR::ABL1 > 1%
Ph+ > 0%
В дальнейшем и в любое время
BCR::ABL1 ![]() 0,1%
0,1%
BCR::ABL1 > 0,1 - 1%
BCR::ABL1 > 1%
Мутации BCR::ABL1, приводящие к резистентности
ДХА высокого риска в Ph+ клетках
Примечания. Под значением экспрессии BCR::ABL1, указанным в таблице, понимается соотношение BCR::ABL1/ABL1 по международной шкале
Для пациентов, планирующих ремиссию без лечения, оптимальный ответ (в любое время) составляет BCR::ABL1<= 0,01% (МО4).
3.1.8. Терапия при неудаче второй и последующих линий лечения
- Рекомендуется пациентам с неудачей двух и более линий терапии ХМЛ переход на другой ИТК или выполнение аллоТГСК [33, 60, 61].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2).
Комментарий: Критерии ответа на терапию ИТК в первой и второй линиях представлены в таблице 7. Возможности терапии при неудаче 2-х и более линий терапии ИТК ограничены. В качестве терапевтических опций рассматриваются перевод на другой ИТК2, выполнение аллоТГСК, включение пациента в клинические исследования или программы раннего доступа к незарегистрированным в России ИТК третьего и последующих поколений. При отсутствии альтернатив, регулярный прием ИТК показан в том числе и в случае отсутствия цитогенетического ответа на терапию для уменьшения рисков прогрессирования и смерти по сравнению с терапией только цитостатическими препаратами. Все зарегистрированные препараты ИТК могут быть использованы в качестве второй или последующих линий терапии. [101]
3.1.9. Циторедуктивная и цитостатическая терапия
- Рекомендуется циторедуктивная терапия для уменьшения опухолевой массы в дебюте заболевания до верификации диагноза и начала терапии ИТК, циторедуктивная и цитостатическая терапии при отсутствии гематологического ответа на терапии всеми доступными ИТК, невозможности другой терапии, с паллиативной целью в том числе и в сочетании с ИТК [10, 11, 62 - 66].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: В ХФ ХМЛ применение химиопрепаратов проводится в режиме монохимиотерапии, которая назначается в следующих случаях:
- для уменьшения массы опухоли на период обследования до получения результатов цитогенетического исследования или молекулярно-генетического исследования и для поддержания гематологического ответа;
- когда проведение другой терапии невозможно: непереносимость всех ИТК.
С циторедуктивной целью у взрослых применяется гидроксикарбамид** в дозе 20 - 30 мг/кг/сут, с учетом показателей анализа крови, меркаптопурин**. Прием гидроксикарбамида** должен быть регулярным, так как при отмене препарата уровень лейкоцитов вновь быстро увеличивается. Исследование уровня лейкоцитов в крови и других показателей гемограммы (исследование уровня общего гемоглобина в крови + исследование уровня тромбоцитов в крови + дифференцированный подсчет лейкоцитов (лейкоцитарная формула).) необходимо осуществлять еженедельно.
Для лечения осложнений, связанных с синдромом лизиса опухоли (гиперурикемии, нефропатии) в период циторедукции, обязательным является введение адекватного объема жидкости (до 2 - 2,5 л/м2 поверхности тела при отсутствии сердечной недостаточности), аллопуринола**) в дозе 300 - 600 мг/сут. В случае признаков лейкостаза (нарушения микроциркуляции: энцефалопатия, снижение зрения, почечная недостаточность) с симптоматической целью показан лейкаферез.
- Рекомендуется пациентам с БК ХМЛ проведение полихимиотерапии по схемам лечения острых лейкозов в зависимости от фенотипа бластов в комбинации с наиболее эффективным для конкретного пациента ИТК. Возможна монотерапия ИТК при невозможности проведения сочетанной терапии [62 - 66].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: Выбор интенсивности терапии зависит от текущего соматического статуса пациента, возраста и перспектив проведения Алло-ТГСК. Проведение АллоТГСК показано только после достижения гематологической ремиссии БК.
3.1.10. Терапия препаратами интерферона
- Рекомендуется взрослым пациентам монотерапия препаратами #интерферона альфа-2b** (ИФ-![]() **) в дозировках от 3 млн. МЕ через день до 6 млн. МЕ ежедневно в период беременности, при непереносимости всех доступных ИТК. [11, 67, 102, 127].
**) в дозировках от 3 млн. МЕ через день до 6 млн. МЕ ежедневно в период беременности, при непереносимости всех доступных ИТК. [11, 67, 102, 127].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: терапия препаратами #ИФ-![]() ** проводится в особых случаях, когда терапия ИТК не показана. Применение #ИФ-
** проводится в особых случаях, когда терапия ИТК не показана. Применение #ИФ-![]() ** возможно в период беременности, в случае непереносимости всех доступных ИТК у больных в ХФ. Эффективность #ИФ-
** возможно в период беременности, в случае непереносимости всех доступных ИТК у больных в ХФ. Эффективность #ИФ-![]() ** при ФА и БК не доказана.
** при ФА и БК не доказана.
3.2. Иное лечение
3.2.1. Показания к аллогенной ТГСК при ХМЛ
- Рекомендуется аллогенная ТГСК: при неудаче терапии 2-х линий ИТК или при неудаче ИТК2 в первой линии; при затяжных рецидивирующих цитопениях на фоне терапии ИТК; при наличии мутации T315I и неэффективности понатиниба и/или асциминиба; при БК в дебюте ХМЛ или в случае прогрессирования до БК на фоне терапии (только после достижении второй ХФ); в случае прогрессирования до ФА на фоне терапии (только после достижении второй ХФ) [53, 54, 68 - 72].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: аллогенная ТГСК показана в ХФ ХМЛ - при неудаче терапии 2-х линий ИТК или ИТК-2ого поколения в первой линии и/или при наличии мутации T315I (при неэффективности или отсутствии возможности назначения понатиниба или асциминиба) и/или в случае непереносимости ИТК (рецидивирующие затяжные цитопении 3 - 4ст на любой линии терапии в особенности при выявлении дополнительных хромосомных аномалий в Ph-негативных клетках, а также в случае аплазии или фиброза костного мозга по данным морфологического исследования трепанобиоптата костного мозга, негематологическая персистирующая токсичность 2 - 4ст на всех доступных ИТК) в отсутствии оптимального ответа [52, 53].
В случае дебюта ХМЛ в ФА - при неудаче терапии первой линии ИТК и/или недостижении оптимального ответа на 2-х линиях ИТК и/или в любое время при наличии мутации T315I (при неэффективности или отсутствии возможности назначения понатиниба). В случае дебюта ХМЛ в БК или при прогрессии в БК.
В ФА, развившейся в ходе терапии ИТК, а также в БК - всем пациентам сразу после достижения ХФ на фоне ИТК и/или сочетания ИТК с химиотерапией. Выполнение аллоТГСК вне гематологического ответа (редукция бластоза < 10% в крови и костном мозге, регресс всех экстрамедуллярных очагов и санация ликвора) не показано. [73, 74].
3.2.2. Сопроводительная терапия
При возникновении острого или хронического болевого синдрома пациенту проводится обезболивающая терапия согласно существующим протоколам обезболивания [77, 78].
При развитии цитопенического или геморрагического синдрома в ходе проведении терапии ИТК или другими противоопухолевыми препаратами может возникнуть необходимость в заместительных гемотрансфузиях компонентов крови.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
3.3. Лекарственная терапия ХМЛ у детей
В целом, так же как у взрослых пациентов молодого и среднего возраста начальной терапией всех пациентов в ХФ и ФА является применения ИТК, а при лечении пациентов, диагностированных в фазе БК - сочетанное применение ИТК2 в сочетании с химиотерапией, диктуемой линейной принадлежностью бластной популяции (лимфобластная, миелобластная, смешанно-линейная). В настоящее время для применения у детей с ХМЛ зарегистрированы ИТК иматиниб** (у детей старше 2 лет), дазатиниб** (у детей старше 3 лет) и #нилотиниб**. Исследования по применению бозутиниба**, асциминиба и понатиниба в популяции лиц младше 18 лет продолжаются.
- Алло-ТГСК на современном этапе рекомендуется пациентам, диагностированным в БК после проведения химиотерапии в сочетании с ИТК2. Также выполнение аллоТГСК рекомендовано пациентам, отвечающим критериям неудачи терапии после переключения на ИТК2, в случае если неудача терапии не обусловлена нарушениями приверженности к лечению.. [114, 115, 116]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Первая линия терапии ИТК детей с ХФ ХМЛ
- Рекомендуется детям в ХФ использование иматиниба**, #нилотиниба** или дазатиниба** как препарата 1 линии для терапии ХМЛ в ХФ в режиме монотерапии. [117, 118, 119, 120, 121]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: В отношении всех трех препаратов проведены исследования 1, 2 и 3-й фазы, показавшие одинаковую эффективность в отношении выживаемости; при этом вероятность достижения критериев оптимального ответа была несколько выше в группах пациентов, получавших ИТК2. Дозировки лекарственных препаратов указаны в Таблице 13 [117, 118, 119, 120, 121].
В связи с отсутствием рандомизированных исследований, критерии выбора стартового препарата для терапии пациентов в ХФ являются в большей мере немедицинскими - наличие гарантий своевременного и непрерывного обеспечения и удобство приема препарата. В частности, #нилотиниб**, прием которого, в отличие от иматиниба** и дазатиниба**, должен осуществляться дважды в день натощак, может представлять существенные проблемы для применения в возрастной группе до 18 лет.
Таблица 13. Дозировка ИТК в терапии первой линии детей с ХФ ХМЛ [120].
Препарат
Максимальная доза
Иматиниб** (у детей старше 2 лет)
600 мг
340 мг/м2 x 1 раз в день
300 мг/м2 x 1 раз в день
260 мг/м2 x 1 раз в день
#Нилотиниб**
230 мг/м2 x 2 раза в день
400 мг
Дазатиниб** (у детей старше 3 лет)
Вес тела 10 - 20 кг - 40 мг
20 - 30 кг - 60 мг
30 - 45 кг - 70 мг
100 мг при весе от 45 кг
Примечание: Пациентам, не имеющим возможности проглотить капсулу целиком прием препарата допускается в разведенном виде, для этого используют воду или яблочный сок.
Исследования 1 фазы не выявили максимально переносимых дозировок иматиниба** в диапазоне 200 - 570 мг/м2 в сутки; также применение различных дозировок иматиниба** не показало значимых преимуществ в достижении критериев оптимального ответа.
Сопроводительная терапия детей с ХМЛ, начинающих терапию ИТК, проводится в соответствие с рекомендациями для взрослых, и направлена на предотвращение синдрома лизиса опухоли (см. выше).
Существенным побочным эффектом терапии ИТК, в частности иматиниба**, у детей является задержка роста, особенно в препубертатном периоде [122]. Дополнительным фактором, который может оказывать на рост и развитие ребенка, является повышенный риск развития гипотиреоза при применении ИТК [123]. Помимо ранее озвученных нарушений, эндокринная дисфункция может проявляться гипергликемией, бесплодием, низким уровнем витамина Д [127].
Вторая линия терапии ИТК детей с ХФ ХМЛ
- В случае недостижения оптимального ответа через 12 месяцев от начала терапии, неудаче лечения на любом этапе (см критерии оценки ответа выше) или непереносимости иматиниба рекомендуется смена терапии на ИТК2, после проведения исследования мутаций киназного домена BCR::ABL1. При их наличии выбирается тот ИТК, к которому мутация/мутации чувствительна [128, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В случае недостижения оптимального ответа или неудаче лечения ИТК2 (см. выше) рекомендуется назначение альтернативного ИТК2 (дазатиниб** (у детей старше 3 лет) или #нилотиниб**) если мутационный анализ не выявил "резистентных" мутаций киназного домена BCR::ABL1 [128, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В случае непереносимости ИТК2 рекомендуется назначение альтернативного ИТК2 или иматиниба** (у детей старше 2 лет) [128, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Третья и более линии терапии детей с ХФ ХМЛ
В случае неудачи лечения на любом этапе (см. критерии выше) или непереносимости иматиниба**, #нилотиниба** и дазатиниба** пациент является кандидатом на проведение аллоТГСК. По решению врачебной комиссии может быть назначен любой из ИТК3 в соответствии с мутационным статусом BCR::ABL1 [128, 129, 130].
Первая линия терапии ИТК детей, впервые диагностированных в ФА ХМЛ
- Всем детям, диагностированным в ФА ХМЛ рекомендуется лечение ИТК2. Дозировка препаратов ИТК2: #нилотиниба** 230 мг/м2 x 2 раза в сутки (макс 400 мг x 2 раза в сутки) [124], дазатиниба** (у детей старше 3 лет) в дозах, указанных в Таблице 13. Коррекция дозы осуществляется в соответствии с инструкцией к лекарственному препарату ИТК [128, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Критерии эффективности ИТК2, диагностированных в ФА ХМЛ - те же, что и при лечении ИТК2 у взрослых. При недостижении оптимального ответа в "точках" контроля эффективности или при прогрессии заболевания пациент является кандидатом на аллоТГСК и сдерживающую терапию ("бридж-терапия") ИТК3.
Первая линия терапии ИТК детей, впервые диагностированных в БК ХМЛ
- Всем детям, диагностированным в БК ХМЛ, рекомендуется лечение ИТК2. Дозировка #нилотиниба** 230 мг/м2 x 2 раза в сутки (макс 400 мг x 2 раза в сутки), дазатиниба** (у детей старше 3 лет) в дозах, указанных в Таблице 13 в сочетании с химиотерапией, в соответствии с линейной принадлежностью бластных клеток. При лимфоидном БК предпочтительно применение дазатиниба** в связи с его лучшим проникновением в ЦНС и потенциально лучшей активностью в отношении возможной нейролейкемии [128, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Критерии эффективности ИТК2 у детей, диагностированных в ФА ХМЛ, те же, что и при лечении ИТК2 у взрослых. При недостижении оптимального ответа в "точках" контроля эффективности или при прогрессии заболевания пациент является кандидатом на алло-ТГСК и сдерживающую терапию ("бридж-терапия") ИТК3.
Терапия детей с прогрессией в ФА или БК на фоне терапии ИТК.
Пациенты с прогрессией на фоне терапии ИТК являются кандидатами на аллоТГСК, которая должна быть выполнена в кратчайшие сроки. Сдерживающая терапия альтернативными ИТК в таких случаях должна основываться на результатах мутационного анализа BCR::ABL1, а дополнительная химиотерапия - на результатах молекулярно-генетического анализа и данных СЦИ [128, 129, 130].
4. Реабилитация
- Рекомендуется проведение реабилитации пациентам при возникновении осложнений в процессе терапии ХМЛ в рамках соответствующих нозологий [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: специальных методов реабилитации при ХМЛ не существует. Реабилитация пациентов с ХМЛ должна носить комплексный характер, охватывая медицинские и социально-психологические аспекты адаптации пациента к нормальной жизни. Объем медицинской реабилитации разрабатывается индивидуально для каждого пациента врачом по медицинской реабилитации при участии врача-гематолога и зависит от течения и проявлений заболевания и проведенных вмешательств (ТГСК, осложнения после ПХТ при БК ХМЛ, нарушения функций органов и систем при проведении терапии ИТК). Кроме того, программа реабилитации должна учитывать социальные и психологические проблемы пациента и требует кроме медицинской помощи обязательного участия социальных работников и психологов. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
- Рекомендуется санаторно-курортное лечение в санаториях общего профиля пациентам с оптимальным уровнем ответа на терапию ХМЛ [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Традиционные представления о наличии противопоказаний к любому виду физиотерапевтического и санаторно-курортного лечения пациентов с ХМЛ в эпоху до внедрения ИТК в настоящее время подвергаются пересмотру. Общепринятых рекомендаций в настоящее время не существует, однако, при наличии у пациентов глубоких уровней ответа (ПЦО, БМО) следует допустить лечение таких пациентов в местных санаториях с использованием физиотерапевтических методов локального воздействия. Возможными провоцирующими факторами ухудшения течения заболевания могут быть ультрафиолетовое облучение (инсоляция), методы электромагнитного воздействия. Дополнительными противопоказаниями могут являться проявления побочных эффектов терапии ИТК.
5. Профилактика
В связи с невозможностью в настоящее время выделить этиологические факторы заболевания разработка конкретных рекомендаций по первичной профилактике ХМЛ в настоящее время невозможна.
После выявления заболевания наиболее важными факторами сохранения жизни и здоровья пациентов являются как можно более быстрое начало терапии ИТК и строгая приверженность пациента к выполнению рекомендаций по лечению и мониторингу ответа на терапию [10, 11].
Современное медикаментозное лечение пациентов с ХМЛ является высокоэффективным у подавляющего большинства пациентов. Имеющиеся рекомендации по контролю нежелательных явлений ИТК и возможность альтернативного выбора препаратов позволяет практически полностью сохранить физическое состояние и повседневный уровень активности.
- Рекомендуется всем пациентам с ХМЛ профилактика фоновых предопухолевых заболеваний и состояний, приверженность здоровому образу жизни, исключение хронических интоксикаций, ограничение контакта с вредными производственными факторами, участие в мероприятиях диспансеризации [10, 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с ХМЛ диспансерное наблюдение для оценки эффективности терапии, контроля побочных действий и лекарственной токсичности [10, 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Диспансерное наблюдение проводится врачом-гематологом, врачом-детским онкологом-гематологом, а при его отсутствии врачом-онкологом, врачом-детским онкологом, врачом-педиатром или врачом-терапевтом. Динамическое наблюдение необходимо проводить не реже 1 раза в триместр на протяжении первого года терапии и не реже 1 раза в полугодие в последующем периоде терапии.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "гематология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
При выявлении у больного ХМЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют больного на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая фазу заболевания и группу риска.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь больным с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении ХМЛ или подозрении на него в ходе оказания скорой медицинской помощи больного переводят или направляют в медицинские организации, оказывающие медицинскую помощь больным с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь больным ХМЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь больным ХМЛ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости - с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию больного.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "гематология" определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
1. проведение плановых трансфузий компонентов крови при анемии, тромбоцитопении 3 степени;
2. коррекция побочных эффектов терапии ХМЛ, включая терапию ингибиторами тирозинкиназ BCR-ABL, противоопухолевыми препаратами;
3. необходимость проведения обследования в условиях стационара с целью выбора оптимальной тактики ведения пациента;
4. проведение плановой терапии ингибиторами тирозинкиназ BCR-ABL, цитостатической терапии у пациентов с комплексной сопутствующей патологией, требующей наблюдения в условиях стационара.
Показания для экстренной госпитализации:
1. проведение срочных трансфузий компонентов крови при тромбоцитопении, сопровождающейся геморрагическим синдромом, анемии с гипоксическим синдромом
2. остро возникшие состояния, включая инфекционные осложнения и токсичность терапии 3 - 4 степени после проведенных курсов терапии цитостатическими препаратами или ингибиторами тирозинкиназ BCR-ABL;
3. коррекция жизнеугрожающих состояний.
Показания к выписке пациента из стационара:
1. купирование острых, жизнеугрожающих и иных состояний, приведших к госпитализации;
2. возможность продолжения лечения в амбулаторных условиях;
3. отказ больного или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей медицинскую помощь по профилю "гематология" при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
4. в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
5. необходимость перевода больного в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами-специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация
Тактика ведения пациента при развитии нежелательных явлений терапии ИТК (взрослая популяция)
Антилейкемический эффект является безусловным приоритетом терапии ХМЛ. Однако для сохранения принципа максимального и постоянного воздействия на опухолевый клон важно свести к минимуму нежелательные эффекты терапии, учитывая необходимость длительного приема препаратов [10, 11].
Большинство нежелательных эффектов терапии ИТК являются хорошо контролируемыми, низкой степени токсичности. Отдаленные результаты применения иматиниба** в течение более 15 лет не выявили дополнительных или жизнеугрожающих явлений токсичности. Применение ИТК2 имеет меньший срок наблюдения, данные о новых нежелательных явлениях продолжают накапливаться и в настоящее время.
Токсичность терапии на фоне применения ИТК можно разделить на гематологическую и негематологическую. Степень выраженности нежелательных явлений оценивают в соответствии с критериями токсичности CTCAE ver 5.0 [79]. Некоторые виды токсичности ИТК представлены в приложении Г2.
Гематологическая токсичность
К гематологической токсичности относится снижение уровня гемоглобина, нейтропения и тромбоцитопения.
Анемия 1 - 3 степени во всех фазах ХМЛ не является показанием к прерыванию терапии ИТК. Показано дополнительное обследование пациента для исключения других причин анемии, с учетом клинической ситуации. При клинически значимых проявлениях анемического синдрома показаны заместительные трансфузии эритроцитарной массы (взвеси). Целесообразность назначения препаратов эритропоэтина (B03XA Другие антианемические препараты) является спорной. При нейтропении и тромбоцитопении 1 - 2 степени в любой фазе ХМЛ снижения дозы ИТК и перерывов в лечении не требуется. В ХФ ХМЛ при 3 - 4 степени нейтропении и/или тромбоцитопении показана временная отмена ИТК с контролем клинического анализа крови один раз в неделю [10, 11].
После восстановления абсолютного числа нейтрофилов (АЧН) до уровня более 1,0 x 109/л, тромбоцитов более 50 x 109/л возобновить терапию ИТК) [10, 11].
- если перерыв в лечении составит менее 2 недель, лечение возобновляется в прежней дозе, при перерыве более 2 недель - в сниженной на один уровень дозе (см. табл. 4 и табл. 5 - дозы ИТК);
- если доза ИТК ранее была снижена, при стабильных показателях гемограммы через 1 месяц целесообразно возвращение к стандартной дозировке;
- при длительных нейтропениях возможно кратковременное применение гранулоцитарного колониестимулирующего фактора (Г-КСФ) (L03AA Колониестимулирующие факторы): филграстим** в дозе 5 мкг/кг/сут подкожно, при отсутствии эффекта от введения Г-КСФ необходима редукция дозы или смена ИТК, принимая во внимание результаты оценки лейкозного клона - уровень BCR::ABL1;
- при длительных повторных цитопениях необходимо провести обследование (цитологическое исследование мазка костного мозга (миелограмма), получение гистологического препарата костного мозга) с целью исключения прогрессирования заболевания, развития фиброза костного мозга.
В ФА и БК ХМЛ даже при наличии нейтропении и тромбоцитопении 3 - 4 степеней с целью индукции ремиссии в течение первых 4 недель терапия ИТК не должна прерываться. При тромбоцитопении 3 - 4 степени, геморрагическом синдроме показаны трансфузии тромбоцитарного концентрата. Если миелосупрессия сохраняется после 1 месяца терапии, показано получение цитологического препарата костного мозга путем пункции (стернальная пункция) с подсчетом миелограммы для исключения прогрессирования заболевания [10, 11].
При числе бластных клеток менее 5% и снижении клеточности костного мозга следует продолжить перерыв в терапии. Контроль общего (клинического) анализа крови проводить не реже 1 раза в неделю. Возобновить терапию после восстановления АЧН до уровня более 0,5 x 109/л и тромбоцитов более 50 x 109/л. При повторном возникновении миелосупрессии доза ИТК должна быть снижена. При длительных и/или повторных эпизодах нейтропении и отсутствии бластоза в периферической крови и костном мозге возможно применение Г-КСФ [80];
При наличии более 5% бластов и гиперклеточном костном мозге должен быть обсужден вопрос об изменении тактики терапии. При переключении с одного ИТК на другой существует вероятность развития перекрестной гематологической токсичности, так как развитие цитопений у пациентов с ХМЛ, по-видимому, в большей степени связано не столько с особенностями действия конкретного ИТК, сколько со снижением резервов нормального кроветворения. Это особенно ярко проявляется у пациентов с продвинутыми фазами ХМЛ, а также у пациентов с резистентностью к 1 - 2 линии терапии ИТК. При повторных цитопениях 3 - 4 степени, которые затрудняют проведение терапии ИТК в непрерывном режиме и, соответственно, способствуют снижению эффективности лечения, показано обсуждение вопроса о выполнении аллоТГСК.
Негематологическая токсичность
Помимо гематологической токсичности терапия ИТК может осложняться и другими побочными эффектами. Наиболее частыми побочными эффектами лечения ИТК являются тошнота, рвота, диарея, задержка жидкости с развитием отеков, кожная сыпь, зуд, слабость, нарушения сна, боли в мышцах и суставах, изменения лабораторных показателей. Особенное значение данные побочные явления приобретают в связи с необходимостью постоянного приема препаратов ИТК. Даже небольшая выраженность постоянно существующих побочных эффектов может приводить к снижению приверженности к лечению (комплаентности) - пропускам приема либо снижению дозы препарата пациентами, что ведет к снижению эффективности терапии. Профили негематологической токсичности иматиниба**, нилотиниба**, дазатиниба** и бозутиниба** отличаются.
При возникновении негематологической токсичности следует дифференцировать побочные эффекты терапии ИТК от возможных клинических проявлений сопутствующих заболеваний. Целесообразно дополнительное обследование пациента для исключения другой патологии. Для минимизации явлений токсичности требуется адекватная симптоматическая терапия.
Общая тактика ведения пациентов при различных проявлениях негематологической токсичности на фоне ИТК представлена в табл. 10. Следует подчеркнуть, что перерывы в лечении и снижение дозы допустимы при длительных и/или повторных эпизодах токсичности 2 степени и при однократной токсичности 3 - 4 степени. Непереносимость терапии ИТК возможно констатировать при длительном (более 2 - 3 мес.) сохранении явлений токсичности 2 степени при условии адекватной сопроводительной терапии, а также при повторных явлениях токсичности 3 - 4 степени. Непереносимость терапии является показанием к переводу на другой ИТК, так как профиль негематологической токсичности у препаратов разный, и перекрестная непереносимость минимальная [10, 11].
Таблица 10. Общая тактика терапии при негематологической токсичности ИТК.
Степень токсичности
Тактика терапии
Степень 1
Перерывов в лечении и снижения дозы не требуется
Степень 2:
- длительность < 7 дней
- длительность > 7 дней или при повторных возникновениях токсичности
Перерывов в лечении и снижения дозы не требуется
Возможна отмена лечения; после разрешения токсичности менее 2 степени возобновить лечение
При перерыве менее 28 дней возобновить лечение в прежней дозе, более 28 дней - снижение дозы на один уровень
Если нет нарастания токсичности на фоне сниженной дозы в течение 1 месяца, целесообразен возврат к стандартной дозе
Степень 3 или 4
Отменить лечение; после уменьшения токсичности < 2 степени возобновить лечение в сниженной на один уровень дозе
При длительности токсичности более 28 дней, повторных эпизодах того же вида токсичности показан перевод на другую терапию
Следует отметить, что превышение некоторых параметров (таких как уровень холестерина) формально определяемых в пределах I - II степени по критериям CTCAE, при терапии нилотинибом** требует особого внимания и коррекции, с учетом повышенной вероятности развития ишемических сосудистых событий при применении этого препарата [31, 39]. Плевральные выпоты при терапии дазатинибом**, несмотря на определяемую по CTCAE низкую степень токсичности, не всегда позволяют продолжить терапию в постоянном режиме из-за рецидивирующего характера [26, 29]. Диарея 1 - 2 степени по CTCAE при терапии бозутинибом** может значительно ухудшать качество жизни пациентов, однако хорошо поддается коррекции со снижением степени выраженности и частоты развития в ходе лечения [33].
Тактика терапии при отдельных видах негематологической токсичности требует отдельного рассмотрения.
Наиболее частые явления негематологической токсичности
Гиперхолестеринемия и риск ишемических сосудистых событий
Нарушение метаболизма липидов и гиперхолестеринемия отмечены у 22% пациентов при применении нилотиниба**, тогда как при применении иматиниба** только у 3%; это нежелательное явление может быть зарегистрировано уже через 3 месяца приема нилотиниба** и было ассоциировано с возникновением ишемических сосудистых событий, в частности окклюзией периферических артерий [31, 39]. Уровень холестерина более 240 мг/дл (6,2 ммоль/л) признан показателем высокого риска. В соответствии с руководством Американской ассоциации клинических эндокринологов (AACE) гиперхолестеринемия также является одним из факторов, включенных в шкалу риска смерти от сосудистых событий [81].
Гиперхолестеринемия может быть снижена при комплексном применении немедикаментозных методов: диета, физическая нагрузка, а также успешно поддается медикаментозной коррекции при применении различных гиполипидемических средств, к примеру, ингибиторов ГМГ-КоА редуктазы (статинов). Следовательно, действия, направленные на снижение уровня холестерина, являются целесообразными для снижения риска сосудистых ишемических событий у пациентов с ХМЛ. Целевые уровни холестерина и его атерогенных фракций (ЛПНП) подробно освещены в Российских рекомендациях по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза [82]. Решение о проведении гиполипидемической терапии должно проводиться после консультации врача-кардиолога.
При проведении терапии нилотинибом** по жизненным показаниям должна быть обеспечена соответствующая коррекция неблагоприятных факторов риска. При необходимости показано постоянное наблюдение врачей-специалистов (врач-кардиолог, врач-эндокринолог), которые устанавливают окончательный объем обследования и дополнительные методы оценки в каждом конкретном случае: определение лодыжечно-плечевого индекса, выявление атеросклеротических бляшек при дуплексном ангиосканировании, выполнение КТ и пр.
В случае высокого риска развития ССЗ предпочтительней терапия иматинибом**, дазатинибом**, бозутинибом** [39].
Плевральный выпот и накопление жидкости в серозных полостях (наиболее часто - плевральная полость, реже - перикардиальная, брюшная)
Данное нежелательное явление наиболее характерно для терапии дазатинибом**, чаще встречается при применении дозы 140 мг в сутки по сравнению с более низкими дозировками, реже может встречаться у пациентов, получающих терапию другими ИТК. При терапии дазатинибом** вероятность развития составляет от 14% до 37% по данным различных исследований [29, 26]. Пациенты должны быть предупреждены о том, что в случае появления у них симптомов плеврального выпота (одышка, кашель, тахикардия), необходим срочный осмотр врача и дополнительная диагностика: перкуторное определение границ легких, аускультация легких, прицельная рентгенография органов грудной клетки, УЗИ плевральных полостей с целью оценки объема плеврального выпота. Данное нежелательное явление может развиться в различные отдаленные сроки терапии (через 2,5 - 5,5 лет лечения), в том числе у пациентов с ранее хорошей переносимостью дазатиниба** [29]. Объем выпота может быть оценен по рентгенологическим критериям и по данным ультразвуковой диагностики в зависимости от занимаемого объема плевральной полости (табл. 11).
Таблица 11. Классификация степеней плеврального выпота.
Степень
Клинические симптомы и применяемая терапия
Объем жидкости в плевральной полости
0
Отсутствует
-
1
Асимптоматический и не требующий лечения
< 10% объема плевральной полости
2
Клинически выраженный, требующий применения диуретиков или не более двух плевральных пункций
11 - 25% объема плевральной полости
3
Клинически выраженный, требующий оксигенотерапии, более двух плевральных пункций и/или установления плеврального дренажа, плевродеза
26 - 50% объема плевральной полости
4
Угрожающий жизни, сопровождающийся нарушением гемодинамики или требующий искусственной вентиляции легких
51 - 75% объема плевральной полости
Наличие симптомов и объем накопленной жидкости часто могут не совпадать. Для определения лечебной тактики большее значение имеет наличие клинических симптомов и степень выраженности дыхательной недостаточности.
- Рекомендуется при возникновении плеврального выпота, вызванного применением дазатиниба**, следующая тактика:
- перерыв в терапии, в дальнейшем возможно возобновление приема препарата в сниженной дозе;
- назначение диуретиков (фуросемид**, торасемид, в соответствии с инструкцией по применению, в зависимости от лекарственной формы, учитывая возрастную категорию) с контролем уровня электролитов (Исследование уровня натрия, калия в крови);
- при необходимости - оксигенотерапия;
- при тяжелых формах плеврального выпота (3 - 4 степени, наблюдающиеся у 4% пациентов) с дыхательной недостаточностью II - III степеней - торакоцентез с эвакуацией жидкости.
- проведение плевральной пункции при угрожающих жизни состояниях (смещение средостения, выраженная одышка в покое) или с диагностической целью, когда причина плеврального выпота неясна. [10]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: сам по себе факт появления плеврального выпота не ухудшает прогноз. При оптимальном ответе на терапию возможно снизить дозу препарата. Если же ответ на лечение недостаточный, показан перевод пациента на альтернативный ИТК. Учитывая, что плевральный выпот нередко носит рецидивирующий характер, в таких случаях целесообразен перевод на другой ИТК.
Легочная артериальная гипертензия (ЛАГ)
Крайне редкое (0,45% случаев), но при этом тяжелое осложнение, которое встречается при применении дазатиниба**. На момент установления этого диагноза у большинства пациентов отмечались значительные нарушения гемодинамики, а также сердечная недостаточность, требовавшая наблюдения в отделении интенсивной терапии. Медиана срока развития ЛАГ составляет 34 мес. (8 - 48 мес.) терапии дазатинибом** [30, 40]. Может выявляться как у пациентов с плевральным выпотом (68% случаев), так и без него. Одышка и обмороки являются ведущими в клинической картине, также могут присутствовать слабость, утомляемость, боли в области сердца, не купирующиеся приемом органических нитратов. На ЭКГ могут выявляться признаки гипертрофии и перегрузки правых отделов сердца Диагностические методы для подтверждения ЛАГ: трансторакальная эхокардиография, катетеризация правых отделов сердца.
Установлено, что данное явление может быть обратимо при отмене дазатиниба**. При развитии ЛАГ показано прекращение терапии дазатинибом** и назначение других ИТК.
Пневмонит
Является крайне редким осложнением, требующим дифференциального диагноза. В большинстве случаев описан при применении иматиниба**, а также чаще встречается в странах Азии; может быть обратимым или необратимым [82 - 84].
При применении дазатиниба** во 2 линии в дозе 70 мг 2 раза в день у 17% пациентов описаны изменения легочной паренхимы, по типу "матового стекла" либо утолщение септальных перегородок. Целесообразен перевод на другие ИТК.
Тошнота
- Рекомендуется при возникновении тошноты на терапии иматинибом** применение противорвотных препаратов: метоклопрамид** (препарат для лечения функциональных нарушений желудочно-кишечного тракта), ондансетрон** (противорвотные препараты, А04А), в соответствии с инструкцией по применению, в зависимости от лекарственной формы, учитывая возрастную категорию. [10]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: развитие тошноты наиболее характерно при применении иматиниба** или бозутиниба**. Нилотиниб** и дазатиниб** вызывают тошноту редко. При тошноте следует исключить прием иматиниба** натощак, рекомендовать принимать препарат с приемом пищи, запивать большим количеством воды. Последний прием иматиниба** должен быть не позднее чем за 2 часа до сна, особенно у пациентов с эзофагитом в анамнезе. Если токсичность, несмотря на все предпринятые мероприятия, составляет ![]() 2 степени, целесообразно назначение противорвотных препаратов: метоклопрамид**, ондансетрон**, другие. Однако следует учитывать, что противорвотные препараты могут удлинять интервал QT. Антациды снижают эффективность ИТК.
2 степени, целесообразно назначение противорвотных препаратов: метоклопрамид**, ондансетрон**, другие. Однако следует учитывать, что противорвотные препараты могут удлинять интервал QT. Антациды снижают эффективность ИТК.
Задержка жидкости с развитием отеков
Следует ограничить прием соли в рационе, уменьшить объем употребляемой жидкости. В более тяжелых случаях назначают диуретики, препараты подбирают индивидуально.
Мышечные спазмы
Симптом, характерный для лечения иматинибом**. Чаще встречается в начале терапии, но может быть и очень длительным. Спазмы (чаще икроножных мышц, мышц стопы) возникают, как правило, в ночное время, после физической нагрузки. Устранение дефицита минералов (калий, кальций, магний, фосфор) может облегчить спастический эффект от иматиниба**. При выраженных проявлениях токсичности (3 - 4 степени) возможен перерыв приема ИТК (3 - 5 дней), который часто уменьшает клинические проявления или временное снижение дозы препарата на 1 уровень.
Боли в костях и суставах
Обычно возникают в начале лечения, частота их уменьшается через 1 - 2 месяца терапии. Кратковременный (на 3 - 5 дней) перерыв в приеме препарата и короткий курс нестероидных противовоспалительных и противоревматических препаратов могут купировать эти явления.
Кожные высыпания
Обычно купируются при назначении антигистаминных средств системного действия, хлорида кальция и/или при местной обработке глюкокортикоидными мазями. При более выраженном дерматите возникает необходимость прерывать прием ИТК. У пациентов с большим количеством базофилов (> 30%) в крови причиной появления уртикарных высыпаний может быть высвобождение гистаминоподобных субстанций из базофильных гранул, по мере снижения количества базофилов интенсивность сыпи уменьшается.
Умеренные кожные высыпания при терапии нилотинибом** - частое нежелательное явление, которое не сопровождается зудом, дискомфортом и редко требует коррекции дозы препарата.
Кровотечения и кровоизлияния
Наиболее часто наблюдаются кровотечения - из желудочно-кишечного тракта (у 4% пациентов), реже - кровоизлияния в головной мозг (тяжелые - менее чем у 1% пациентов). Наблюдаются преимущественно при лечении дазатинибом**. Как правило, они возникают при выраженной тромбоцитопении. В большинстве случаев, с кровотечением удается справиться с помощью приостановки приема препарата и применения трансфузий компонентов крови, в первую очередь, тромбоконцентрата.
При терапии иматинибом** в 11% случаев могут отмечаться кровоизлияния в склеру, как правило, проходящие после короткого перерыва в лечении или снижения доз.
Диарея
Купируется диетой с исключением продуктов, усиливающих моторику кишечника, назначением симптоматических противодиарейных, кишечных противовоспалительных и противомикробных препаратов. При терапии бозутинибом** эффективно купируется временным снижением дозы препарата.
Гепатотоксичность
Повышение активности "печеночных" аминотрансфераз может наступить в различные сроки лечения ИТК. В некоторых случаях описано тяжелое повреждение печени при применении иматиниба** и парацетамола**, а также при вирусном гепатите В. Поэтому показано исключить наличие вирусного гепатита, отменить потенциальные гепатотоксины (алкоголь, консервы, лекарственные препараты с гепатотоксичным действием). При возникновении гепатотоксичности ИТК применимы общие принципы терапии токсического (лекарственного) гепатита. При сохраняющейся гепатотоксичности 2 степени после ее разрешения дозу препарата целесообразно временно снизить. При повторном развитии печеночной токсичности необходимо провести более тщательное исследование функции печени; показано обсуждение вопроса о переходе на терапию другими ИТК, с учетом отсутствия перекрестной гепатотоксичности.
Увеличение массы тела
Небольшое увеличение веса может быть обусловлено задержкой жидкости, в части случаев - улучшением общего самочувствия на фоне регрессии симптомов интоксикации и нормализации аппетита. Пациентов с избыточным весом необходимо предупреждать о возможности его увеличения при приеме ИТК и рекомендовать ограничение употребления соли, низкокалорийную диету и увеличение уровня физических нагрузок.
Удлинение интервала QTcF
Все ИТК являются препаратами, способными удлинять длительность интервала QT. При значительном удлинении QT (более 480 мс) существует риск развития жизнеугрожающей аритмии - тахикардии по типу "пируэт". При оценке интервала QT следует обязательно использовать скорректированные (с учетом ЧСС) значения, например, QTcF (QT, корригированный по методу Фредерика (Frederic)). Случаи удлинения QTcF встречаются крайне редко - менее чем у 1% пациентов. Пациенты с изначальным удлинением QTcF, а также с сопутствующей кардиальной патологией должны оставаться в зоне внимания с точки зрения мониторинга изменений на ЭКГ. До начала лечения ИТК следует по возможности исключить факторы, также влияющие на удлинения данного интервала. В частности, должны быть нормализованы уровни калия и магния; при приеме препаратов, также удлиняющих QT по поводу сопутствующих заболеваний, должна быть рассмотрена возможность замены последних. Следует помнить о существовании врожденного удлинения QT, что требует особого внимания к таким пациентам при лечении ИТК. Алгоритм ведения пациентов с удлинением QTcF приведен в табл. 12.
Таблица 12. Тактика ведения пациентов при удлинении интервала QTcF на фоне терапии ИТК.
Удлинение QTcF
Тактика терапии
> 480 мс
- временно прекратить прием ИТК
- исследование уровня калия в крови и исследование уровня ионизированного магния в крови. При дефиците восполнить их уровень до нормы.
- проанализировать принимаемые пациентом сопутствующие препараты и исключить средства, удлиняющие интервал QT
- если интервал QTcF остается > 480 мс, повторять ЭКГ (регистрация электрокардиограммы) по клиническим показаниям, как минимум 1 раз в сутки, пока QTcF не будет < 480 мс
- терапия ИТК может быть возобновлена в той же дозе, если причина увеличения QT установлена и устранена, и QTcF в течение 2 недель возвратился до значения < 450 мс и находится в пределах 20 мс от значения на исходном уровне
- если при повторном определении значение QTcF выходит за пределы 20 мс от значения на исходном уровне или оказывается между 450 и ![]() 480 мс, доза ИТК должна быть снижена на 1 уровень
480 мс, доза ИТК должна быть снижена на 1 уровень
- при возобновлении лечения ИТК в той же или уменьшенной дозе после временного прекращения лечения по причине увеличения QTcF до > 480 мс, необходимо провести ЭКГ (регистрация электрокардиограммы) на 2-й, 3-й и на 8-й день после возобновления лечения
- в случае повторного увеличения QTcF до > 480 мс прекратить прием препарата, требуется смена терапии
Гипербилирубинемия
Наиболее частое лабораторное отклонение, встречающееся при лечении нилотинибом** (69% - любой степени, 7% - 3 - 4 степени). Данное явление связано с нарушением конъюгации непрямого билирубина, поэтому повышение происходит преимущественно за счет этой фракции. Чаще встречается у пациентов с полиморфизмом промоторной области гена UGT1A1 (фенотипы (ТА) 7/(ТА) 7; (ТА) 7/(ТА) 6 и др.)), характерным для доброкачественных гипербилирубинемий (Жильбера, Ротора, Дабина-Джонсона). Если гемолиз исключен, активность амилазы и липазы не повышена, а степень билирубинемии составляет 1 - 2, лечение нилотинибом** следует продолжить в прежней дозе. По мнению большинства исследователей, даже токсичность 3 степени не является поводом к прекращению терапии и снижению дозы. При длительной гипербилирубинемии целесообразно назначение препаратов для лечения заболеваний желчного пузыря.
Бессимптомное повышении активности амилазы и/или липазы
Могут часто наблюдаться при лечении нилотинибом**. Явления панкреатита (абдоминальные симптомы в сочетании с лабораторными изменениями) наблюдались менее чем у 1% пациентов во II фазе клинических исследований. При 1 - 2 степени выраженности данных явлений необходимо наблюдение в динамике (повторные биохимические тесты, оценка клинической картины). При развитии 3 - 4 степени токсичности следует прекратить терапию, провести КТ брюшной полости с контрастированием для исключения патологии поджелудочной железы; при выявлении признаков панкреатита - его лечение. При нормальной КТ-картине после уменьшения симптомов до ![]() 1 степени следует возобновить лечение нилотинибом** в сниженной дозе (400 мг/сут). При повторном бессимптомном повышении активности амилазы и липазы до 3 - 4 степени лечение нилотинибом** может быть отменено или продолжено по решению врача.
1 степени следует возобновить лечение нилотинибом** в сниженной дозе (400 мг/сут). При повторном бессимптомном повышении активности амилазы и липазы до 3 - 4 степени лечение нилотинибом** может быть отменено или продолжено по решению врача.
Гипергликемия
Также встречается только при лечении нилотинибом**. При любой степени данного побочного явления коррекция должна начинаться сразу при его выявлении (гипогликемическая диета). При отсутствии нормализации уровня глюкозы на фоне диеты показан прием (осмотр, консультация) врача-эндокринолога первичный для исключения сахарного диабета.
Гипофосфатемия
Встречается при терапии всеми ИТК, как правило, клинически незначима (низкая степень, быстрая нормализация). Рекомендованы диета с увеличением в рационе богатых фосфором молочных и рыбных продуктов, сокращением глюкозы; назначение внутрь препаратов, содержащих фосфаты (витамины, пищевые добавки).
Гипокальциемия
Рекомендована диета с включением продуктов с повышенным содержанием кальция (молочные продукты), уменьшение потребления углеводов. При необходимости - назначение препаратов кальция внутрь.
Гипомагниемия, гипокалиемия
Учитывая опасность удлинения интервала QT при дефиците электролитов требуется коррекция их уровня в плазме.
Лекарственные взаимодействия при терапии ИТК
Метаболизм всех ИТК осуществляется преимущественно в печени с участием ферментов, относящихся к системе цитохрома P450; в основном через CYP3A4, в меньшей степени - другими его изоформами, такими, как CYP1A2, CYP2D6, CYP2C9 [43].
Одновременный прием препаратов, активирующих или подавляющих активность цитохрома P450, может приводить к изменению концентрации как ИТК, так и принимаемого совместно лекарства, что следует учитывать в клинической практике. В случае, если пациент с ХМЛ принимает одновременно несколько препаратов в качестве сопутствующей терапии, и при этом наблюдается неэффективность лечения либо тяжелая токсичность терапии, можно заподозрить наличие лекарственных взаимодействий, влияющих на уровень ИТК в крови. Поэтому с целью максимальной эффективности терапии при возникновении или утяжелении токсичности, важно исключить или свести к минимуму одновременный прием препаратов, активирующих или подавляющих активность цитохрома P450, отдавать предпочтение аналогам с другими путями метаболизма.
При одновременном приеме препаратов, повышающих активность CYP3A4 p450, может наблюдаться снижение концентрации ИТК в плазме крови, что уменьшает эффективность ИТК. Соответственно, ингибиторы фермента CYP3A4 p450 могут приводить к повышению концентрации ИТК в плазме, что выражается клинически в усилении проявлений токсичности терапии.
Кроме того, как отмечено выше, ИТК потенциально могут удлинять интервал QT. В связи с этим не рекомендовано их применение одновременно с другими препаратами, влияющими на удлинение интервала QT.
Репродуктивная функция при хроническом миелолейкозе
С пациентами детородного возраста рекомендовано обсудить вопросы планирования семьи при подробной беседе.
Отцовство при ХМЛ
Зарегистрированные к применению при ХМЛ препараты ИТК не имеют генотоксического действия. В некоторых случаях описаны изменения спермограммы при терапии иматинибом**, однако снижения фертильности не отмечено. Увеличения числа врожденных аномалий у детей партнерш, получавших терапию ИТК, не отмечено [85, 86].
Прерывание приема ИТК у мужчин с ХМЛ для зачатия не требуется. В случае если беременность не наступает, показано дообследование с целью поиска известных факторов, приводящих к бесплодию.
Беременность у женщин с ХМЛ
По результатам доклинических исследований, у всех ИТК, кроме нилотиниба**, отмечена возможность развития врожденных аномалий плода. Наибольший риск применения ИТК наблюдается в I триместре в период основного органогенеза (6 - 12 неделя беременности), для дазатиниба** риск существует на любом сроке беременности [86, 87]. При этом в инструкциях по применению всех ИТК имеются противопоказания для приема во время беременности. С другой стороны, отмена ИТК на период беременности может привести к увеличению объема опухолевого клона и развитию рецидива ХМЛ.
Планирование беременности
Планирование беременности и отмена ИТК наиболее безопасны при сохранении глубокого МО (МО4,5) в течение 2 лет. Учитывая, что беременность может не наступить сразу, отмена ИТК для зачатия является предметом дискуссии. В 50 - 70% случаев беременность диагностируется на фоне терапии ИТК [88], при отмене ИТК сразу после подтверждения беременности отмечается ее нормальное течение и рождение здоровых детей. В связи с этим допустимо зачатие на фоне терапии ИТК с немедленной отменой ИТК сразу после подтверждения беременности на ранних сроках (ХГЧ, УЗ-исследование).
Вплоть до 15 недели беременности (до установления гемато-плацентарного барьера), проводится наблюдение без терапии ИТК. При наличии показаний к проведению терапии во II - III триместре беременности возможно рассматривать применение #иматиниба** в дозе 400 мг и #нилотиниба** в дозе 400 мг в том же режиме, что и у небеременных пациенток [88, 89, 102], учитывая ограниченное проникновение этих ИТК через плаценту. Дазатиниб** и любые другие ИТК противопоказаны на любом сроке беременности.
Альтернативной терапией во время беременности может быть применение #Интерферона альфа-2b** в дозе 3 - 6 млн МЕ ежедневно [90]. Данный подход наиболее эффективен при небольшой опухолевой массе. С циторедуктивной целью при уровне лейкоцитов более 100 тыс. возможно применение лейкафереза (симптоматический эффект).
Ведение беременности при отсутствии стабильного глубокого МО
Глубокий МО сроком менее 2 лет и БМО могут быть приемлемыми клиническими ситуациями для наблюдения без терапии либо применения #интерферона альфа-2b**. При отсутствии БМО перерывы в терапии ИТК является прогностически неблагоприятным для последующего ответа на терапию. При потере МО2 и росте уровня BCR-ABL > 1% во время беременности целесообразно рассмотреть применение #иматиниба** или #нилотиниба** после 15 недель беременности [88, 89, 102].
ХМЛ, выявленный впервые во время беременности
При диагностировании ХМЛ в I триместре беременности необходимо обсудить с пациенткой прерывание или сохранение беременности с учетом ее индивидуальных особенностей (возраст, социальные особенности, сопутствующие состояния) и фазы заболевания. При ХФ ХМЛ возможно сохранение беременности. При ФА и БК ХМЛ показано прерывание. На ранних сроках беременности возможно наблюдение без терапии или терапия #Интерферона альфа-2b** в дозе 3 - 6 млн МЕ ежедневно [90], после 15 недели беременности рекомендовано начать терапию #иматинибом** в том же режиме, что и у небеременных пациенток [88, 89, 102]. При выявлении ХМЛ во II - III триместре беременности рекомендовано сохранение беременности и проведение терапии #иматинибом** в том же режиме, что и у небеременных пациенток. При выявлении ХМЛ в III триместре, относительно небольшом лейкоцитозе и ожидаемому сроку родов в течение 1 - 2 месяцев, возможно отложить начало терапии до родов. При тромбоцитозе возможно назначение антиагрегантов, кроме гепарина.
Роды и кормление
Сроки и способ родоразрешения выбирают с учетом акушерских показаний. Если достаточный контроль клинических проявлений ХМЛ сохраняется, показаний к проведению родоразрешения раньше срока нет. При прогрессировании ХМЛ следует решить вопрос о досрочном родоразрешении. Возобновление терапии ИТК после родов при отсутствии или потере БМО рекомендуется безотлагательно.
ИТК проникают в грудное молоко. Установлено, что дозы ИТК иматиниба** и нилотиниба**, которые может получить ребенок при грудном кормлении, значительно ниже терапевтических [91], однако эффекты воздействия даже малых доз ИТК на детей первого года жизни неизвестны. При необходимости проведения терапии сразу после родов рекомендовано подавлять лактацию.
Если к моменту родов сохраняется глубокий МО, возможно продление перерыва в терапии и грудное вскармливание при молекулярном мониторинге 1 раз в 4 - 6 недель и готовности пациентки завершить кормление при возобновлении терапии ИТК.
Возможность отмены терапии ИТК у пациентов с глубоким молекулярным ответом
Исследования относительно возможности сохранения молекулярной ремиссии после отмены терапии ИТК показывают, что около 40 - 60% больных ХМЛ, с достигнутым стабильным глубоким МО, могут безопасно прекратить терапию ИТК без возникновения рецидива. При возникновении молекулярного рецидива, своевременный возврат к терапии ИТК позволяет вновь достичь глубокого МО у подавляющего большинства пациентов [92 - 94]. Молекулярным рецидивом после прекращения терапии считается однократное повышение относительной экспрессии BCR::ABL1 более 0,1% по IS (потеря БМО). Основываясь на накопленной информации о ремиссии без лечения (РБЛ), в современных рекомендациях предлагается изменить тактику ведения тех больных ХМЛ, у которых был получен стабильный глубокий МО на фоне длительной терапии ИТК.
Необходимые обязательные критерии и условия для наблюдения пациентов с ХМЛ в молекулярной ремиссии без терапии ИТК в условиях клинической практики:
- Возраст старше 18 лет
- Наличие хронической фазы ХМЛ
- Общая длительность терапии у пациентов, получавших иматиниб** в качестве первой линии > 5 лет, ИТК2 в первой линии > 4 лет.
- Наличие в анамнезе подтвержденного количественной ПЦР-РВ типичного транскрипта p210 (b3a2(14a2) или b2a2(e13a2)).
- Стабильный глубокий молекулярный ответ (не менее МО4; BCR::ABL1 ![]() 0,01% по IS) на протяжении как минимум 2 лет.
0,01% по IS) на протяжении как минимум 2 лет.
- Подтвержденный МО4,5 (BCR::ABL1 ![]() 0,0032% по IS) как минимум в 2 анализах на протяжении года до отмены, в том числе обязательно в лаборатории, стандартизированной по IS с чувствительностью не менее МО4,5.
0,0032% по IS) как минимум в 2 анализах на протяжении года до отмены, в том числе обязательно в лаборатории, стандартизированной по IS с чувствительностью не менее МО4,5.
- Возможность проведения молекулярного мониторинга после прекращения терапии в лаборатории, стандартизированной по IS (чувствительность не менее МО4,5), с кратностью ежемесячно в первые 6 месяцев наблюдения, каждые 2 месяца в период от 6 месяцев до года и далее каждые 3 месяца в период после года отмены ИТК.
- Наличие возможности возобновления терапии в течение месяца в случае молекулярного рецидива (однократная потеря БМО/ BCR::ABL1 ![]() 0,1% по IS, не требует повторного анализа для подтверждения) после отмены терапии и продолжения молекулярного мониторинга каждые три месяца до восстановления глубокого МО после возобновления лечения.
0,1% по IS, не требует повторного анализа для подтверждения) после отмены терапии и продолжения молекулярного мониторинга каждые три месяца до восстановления глубокого МО после возобновления лечения.
Наблюдение пациентов с ХМЛ в молекулярной ремиссии без терапии ИТК в условиях клинической практики не показано:
- Пациентам моложе 18 лет
- Пациентам с ФА или БК в анамнезе
- При общей длительности терапии менее 5 лет
- При общей длительности глубокого МО менее 2 лет
- При отсутствии подтвержденного количественным ПЦР типичного транскрипта BCR::ABL1 p210 (b3a2(14a2) или b2a2(e13a2)) или при наличии атипичных BCR::ABL1 транскриптов p190 (e1a2), p230 (e19a2).
- При отсутствии возможности проведения регулярного молекулярного мониторинга после прекращения терапии в лаборатории, стандартизированной по IS (чувствительность не менее МО4,5).
Факторы сохранения ремиссии и селекция пациентов для прекращения терапии ИТК
Благоприятные факторы, свидетельствующие о возможности поддержания РБЛ, в настоящее время являются предметом для обсуждения. В большинстве исследований показано, что уровень молекулярного ответа МО4,5 и глубже, а также более длительный срок лечения и/или длительность глубокого МО ассоциирован с большей вероятностью поддержания РБЛ [92, 94]. Противоречивые данные получены в отношении таких факторов, как: резистентность к предшествующей терапии ИТК, высокая группа риска по Sokal, возраст, глубина молекулярного ответа перед отменой ИТК, а также поколение ИТК в первой линии терапии [92, 94 - 97]. Следует избегать обобщения прогностической ценности какого-либо одного фактора и в каждом случае оценивать риск и пользу прекращения терапии у конкретного пациента по совокупности всех данных.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Выполнено цитогенетическое исследование биопсийного (операционного) материала костного мозга или исследование костного мозга методом FISH для выявления химерного гена BCR-ABL и/или качественное или количественное определение химерного транскрипта BCR-ABL р210 (или p190) в крови, методом ПЦР (при установлении диагноза)
да/нет
2.
Проведена терапия лекарственными препаратами группы ИТК
да/нет
3.
Выполнено цитогенетическое исследование биопсийного (операционного) материала костного мозга и/или количественное определение химерного транскрипта BCR-ABL р210 (или p190) в крови, методом ПЦР не реже чем 1 раз в 3 месяца после начала терапии ИТК
да/нет
Список литературы
1. Hehlmann R., Hochhaus A., Baccarani M. Chronic myeloid leukaemia//Lancet. 2007. Vol. 370, N 9584. P. 342 - 350.
2. Куликов С.М. et al. Заболеваемость хроническим миелолейкозом в 6 регионах России по данным популяционного исследования 2009 - 2012 гг.//Терапевтический архив. 2014. Vol. 86, N 7. P. 24 - 30.
3. Туркина А.Г., Новицкая Н.В. Г.А.К. и др. Регистр больных хроническим миелолейкозом в Российской Федерации: от наблюдательного исследования к оценке эффективности терапии в клинической практике//Клиническая онкогематология. 2017. Vol. 10, N 3. P. 390 - 401.
4. Hoffmann V.S. et al. Treatment and outcome of 2904 CML patients from the EUTOS population-based registry//Leukemia. Nature Publishing Group, 2017. Vol. 31, N 3. P. 593 - 601.
5. Fabarius A. et al. Impact of additional cytogenetic aberrations at diagnosis on prognosis of CML: Long-term observation of 1151 patients from the randomized CML Study IV//Blood. 2011. Vol. 118, N 26. P. 6760 - 6768.
6. Sokal J.E. et al. Prognostic discrimination in "good-risk" chronic granulocytic leukemia//Blood. 1984. Vol. 63, N 4. P. 789 - 799.
7. Hasford J. et al. Predicting complete cytogenetic response and subsequent progression-free survival in 2060 patients with CML on imatinib treatment: The EUTOS score//Blood. 2011. Vol. 118, N 3. P. 686 - 692.
8. Marin D., Ibrahim A.R., Goldman J.M. European Treatment and Outcome Study (EUTOS) score for chronic myeloid leukemia still requires more confirmation//Journal of Clinical Oncology. 2011. Vol. 29, N 29. P. 3944 - 3945.
9. Pfirrmann M. et al. Prognosis of long-term survival considering disease-specific death in patients with chronic myeloid leukemia//Leukemia. 2016. Vol. 30, N 1. P. 48 - 56.
10. Туркина А.Г. et al. Клинические рекомендации по диагностике и лечению хронического миелолейкоза//Клиническая онкогематология. 2017. Vol. 10, N 3. P. 294 - 316.
11. Baccarani M. et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013//Blood. 2013. Vol. 122, N 6. P. 872 - 884.
12. Dewald G.W. et al. Highly sensitive fluorescence in situ hybridization method to detect double BCR/ABL fusion and monitor response to therapy in chronic myeloid leukemia//Blood. American Society of Hematology, 1998. Vol. 91, N 9. P. 3357 - 3365.
13. Lima L. et al. Peripheral blood monitoring of chronic myeloid leukemia during treatment with imatinib, second-line agents, and beyond//Cancer. 2011. Vol. 117, N 6. P. 1245 - 1252.
14. Kantarjian H.M. et al. Quantitative polymerase chain reaction monitoring of BCR-ABL during therapy with imatinib mesylate (STI571; gleevec) in chronic-phase chronic myelogenous leukemia.//Clin. Cancer Res. 2003. Vol. 9, N 1. P. 160 - 166.
15. Hughes T. et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results//Blood. 2006. Vol. 108, N 1. P. 28 - 37.
16. Branford S., Hughes T.P., Rudzki Z. Monitoring chronic myeloid leukaemia therapy by real-time quantitative PCR in blood is a reliable alternative to bone marrow cytogenetics//Br. J. Haematol. Blackwell Publishing Ltd., 1999. Vol. 107, N 3. P. 587 - 599.
17. Wang L. et al. Serial monitoring of BCR-ABL by peripheral blood real-time polymerase chain reaction predicts the marrow cytogenetic response to imatinib mesylate in chronic myeloid leukaemia//Br. J. Haematol. 2002. Vol. 118, N 3. P. 771 - 777.
18. Hoffmann V.S. et al. Systematic review and meta-analysis of standard-dose imatinib vs. high-dose imatinib and second generation tyrosine kinase inhibitors for chronic myeloid leukemia//J. Cancer Res. Clin. Oncol. Springer Verlag, 2017. Vol. 143, N 7. P. 1311 - 1318.
19. Hochhaus A. et al. Long-Term Outcomes of Imatinib Treatment for Chronic Myeloid Leukemia//N. Engl. J. Med. 2017. Vol. 376, N 10. P. 917 - 927.
20. Talpaz M. et al. Imatinib induces durable hematologic and cytogenetic responses in patients with accelerated phase chronic myeloid leukemia: Results of a phase 2 study//Blood. 2002. Vol. 99, N 6. P. 1928 - 1937.
21. Kantarjian H.M. et al. Imatinib mesylate (STI571) therapy for Philadelphia chromosome-positive chronic myelogenous leukemia in blast phase.//Blood. 2002. Vol. 99, N 10. P. 3547 - 3553.
22. Sawyers C.L. et al. Imatinib induces hematologic and cytogenetic responses in patients with chronic myelogenous leukemia in myeloid blast crisis: results of a phase II study.//Blood. 2002. Vol. 99, N 10. P. 3530 - 3539.
23. Palandri F. et al. The long-term durability of cytogenetic responses in patients with accelerated phase chronic myeloid leukemia treated with imatinib 600 mg: The GIMEMA CML Working Party experience after a 7-year follow-up//Haematologica. 2009. Vol. 94, N 2. P. 205 - 212.
24. O'Brien S.G. et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia//N. Engl. J. Med. 2003. Vol. 348, N 11. P. 994 - 1004.
25. Hochhaus A. et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial//Leukemia. Nature Publishing Group, 2016. Vol. 30, N 5. P. 1044 - 1054.
26. Cortes J. et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Na ve Chronic Myeloid Leukemia Patients Trial//J. Clin. Oncol. 2016. Vol. 34, N 20. P. 2333 - 2341.
27. Kantarjian H. et al. Phase 3 study of dasatinib 140 mg once daily versus 70 mg twice daily in patients with chronic myeloid leukemia in accelerated phase resistant or intolerant to imatinib: 15-month median follow-up//Blood. 2009. Vol. 113, N 25. P. 6322 - 6329.
28. Cortes J. et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or -intolerant chronic myeloid leukemia in blast crisis//Blood. 2007. Vol. 109, N 8. P. 3207 - 3213.
29. Porkka K. et al. Dasatinib 100 mg once daily minimizes the occurrence of pleural effusion in patients with chronic myeloid leukemia in chronic phase and efficacy is unaffected in patients who develop pleural effusion//Cancer. 2010. Vol. 116, N 2. P. 377 - 386.
30. Orlandi E.M. et al. Reversible pulmonary arterial hypertension likely related to long-term, low-dose dasatinib treatment for chronic myeloid leukaemia//Leukemia Research. 2012. Vol. 36, N 1.
31. Giles F.J. et al. Rates of peripheral arterial occlusive disease in patients with chronic myeloid leukemia in the chronic phase treated with imatinib, nilotinib, or non-tyrosine kinase therapy: A retrospective cohort analysis//Leukemia. 2013. Vol. 27, N 6. P. 1310 - 1315.
32. Shah N.P. et al. Dasatinib in imatinib-resistant or -intolerant chronic-phase, chronic myeloid leukemia patients: 7-year follow-up of study CA180-034//Am. J. Hematol. 2016. Vol. 91, N 9. P. 869 - 874.
33. Cortes J.E. et al. Long term bosutinib for chronic phase chronic myeloid leukemia after failure of imatinib plus dasatinib and/or nilotinib//Am. J. Hematol. 2016. Vol. 91, N 12. P. 1206 - 1214.
34. Giles F.J. et al. Nilotinib in imatinib-resistant or imatinib-intolerant patients with chronic myeloid leukemia in chronic phase: 48-month follow-up results of a phase II study//Leukemia. 2013. Vol. 27, N 1. P. 107 - 112.
35. Saglio G. et al. Dasatinib in imatinib-resistant or imatinib-intolerant chronic myeloid leukemia in blast phase after 2 years of follow-up in a phase 3 study//Cancer. 2010. Vol. 116, N 16. P. 3852 - 3861.
36. Gambacorti-Passerini C. et al. Long-term efficacy and safety of bosutinib in patients with advanced leukemia following resistance/intolerance to imatinib and other tyrosine kinase inhibitors//Am. J. Hematol. Wiley-Liss Inc., 2015. Vol. 90, N 9. P. 755 - 768.
37. Gambacorti-Passerini C. et al. Bosutinib efficacy and safety in chronic phase chronic myeloid leukemia after imatinib resistance or intolerance: Minimum 24-month follow-up//Am. J. Hematol. 2014. Vol. 89, N 7. P. 732 - 742.
38. Steegmann J.L. et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia//Leukemia. 2016. Vol. 30, N 8. P. 1648 - 1671.
39. Chai-Adisaksopha C., Lam W., Hillis C. Major arterial events in patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors: A meta-analysis//Leuk. Lymphoma. Taylor and Francis Ltd, 2016. Vol. 57, N 6. P. 1300 - 1310.
40. Montani D. et al. Pulmonary Arterial Hypertension in Patients Treated by Dasatinib//Circulation. 2012. Vol. 125, N 17. P. 2128 - 2137.
41. Quintas-Cardama A. et al. Tyrosine kinase inhibitor-induced platelet dysfunction in patients with chronic myeloid leukemia//Blood. 2009. Vol. 114, N 2. P. 261 - 263.
42. Cortes J.E. et al. Bosutinib Versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia: Results From the Randomized BFORE Trial//J. Clin. Oncol. 2018. Vol. 36, N 3. P. 231 - 237.
43. Haouala A. et al. Drug interactions with the tyrosine kinase inhibitors imatinib, dasatinib, and nilotinib//Blood. 2011. Vol. 117, N 8. P. e75-e87.
44. Ursan I.D. et al. Emergence of BCR-ABL Kinase Domain Mutations Associated with Newly Diagnosed Chronic Myeloid Leukemia: A Meta-Analysis of Clinical Trials of Tyrosine Kinase Inhibitors//J. Manag. Care Spec. Pharm. 2015. Vol. 21, N 2. P. 114 - 122.
45. Branford S. et al. Detection of BCR-ABL mutations in patients with CML treated with imatinib is virtually always accompanied by clinical resistance, and mutations in the ATP phosphate-binding loop (P-loop) are associated with a poor prognosis//Blood. American Society of Hematology, 2003. Vol. 102, N 1. P. 276 - 283.
46. Soverini S. et al. ABL mutations in late chronic phase chronic myeloid leukemia patients with up-front cytogenetic resistance to imatinib are associated with a greater likelihood of progression to blast crisis and shorter survival: a study by the GIMEMA Working Party on Chronic Myeloid Leukemia.//J. Clin. Oncol. 2005. Vol. 23, N 18. P. 4100 - 4109.
47. Nicolini F.E. et al. Mutation status and clinical outcome of 89 imatinib mesylate-resistant chronic myelogenous leukemia patients: A retrospective analysis from the French intergroup of CML (Fi()-LMC GROUP)//Leukemia. Nature Publishing Group, 2006. Vol. 20, N 6. P. 1061 - 1066.
48. Soverini S. et al. Contribution of ABL kinase domain mutations to imatinib resistance in different subsets of Philadelphia-positive patients: By the GIMEMA working party on chronic myeloid leukemia//Clin. Cancer Res. 2006. Vol. 12, N 24. P. 7374 - 7379.
49. Khorashad J.S. et al. Finding of kinase domain mutations in patients with chronic phase chronic myeloid leukemia responding to imatinib may identify those at high risk of disease progression//J. Clin. Oncol. 2008. Vol. 26, N 29. P. 4806 - 4813.
50. Nicolini F.E. et al. Clinical outcome of 27 imatinib mesylate-resistant chronic myelogenous leukemia patients harboring a T315I BCR-ABL mutation.//Haematologica. 2007. Vol. 92, N 9. P. 1238 - 1241.
51. Jabbour E. et al. Characteristics and outcomes of patients with Chronic myeloid leukemia and T315I mutation following failure of imatinib mesylate therapy//Blood. 2008. Vol. 112, N 1. P. 53 - 55.
52. Velev N. et al. Stem cell transplantation for patients with chronic myeloid leukemia resistant to tyrosine kinase inhibitors with BCR-ABL kinase domain mutation T315I//Cancer. 2010. Vol. 116, N 15. P. 3631 - 3637.
53. Jabbour E. et al. Results of allogeneic hematopoietic stem cell transplantation for chronic myelogenous leukemia patients who failed tyrosine kinase inhibitors after developing BCR-ABL1 kinase domain mutations//Blood. 2011. Vol. 117, N 13. P. 3641 - 3647.
54. Nicolini F.E. et al. Allogeneic stem cell transplantation for patients harboring T315I BCR-ABL mutated leukemias//Blood. 2011. Vol. 118, N 20. P. 5697 - 5700.
55. Branford S. et al. Rationale for the recommendations for harmonizing current methodology for detecting BCR-ABL transcripts in patients with chronic myeloid leukaemia//Leukemia. Nature Publishing Group, 2006. Vol. 20, N 11. P. 1925 - 1930.
56. Gu rin A. et al. Association between regular molecular monitoring and tyrosine kinase inhibitor therapy adherence in chronic myelogenous leukemia in the chronic phase//Curr. Med. Res. Opin. Informa Healthcare, 2014. Vol. 30, N 7. P. 1345 - 1352.
57. Yeung D.T. et al. TIDEL-Ii: First-line use of imatinib in CML with early switch to nilotinib for failure to achieve time-dependent molecular targets//Blood. American Society of Hematology, 2015. Vol. 125, N 6. P. 915 - 923.
58. Cortes J.E. et al. Switching to nilotinib versus imatinib dose escalation in patients with chronic myeloid leukaemia in chronic phase with suboptimal response to imatinib (LASOR): a randomised, open-label trial//Lancet Haematol. Elsevier Ltd, 2016. Vol. 3, N 12. P. e581-e591.
59. Cervantes F. et al. Early intervention during imatinib therapy in patients with newly diagnosed chronic-phase chronic myeloid leukemia: A study of the Spanish PETHEMA group//Haematologica. 2010. Vol. 95, N 8. P. 1317 - 1324.
60. Cortes J.E. et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial//Blood. American Society of Hematology, 2018. Vol. 132, N 4. P. 393 - 404.
61. Lipton J.H. et al. Comparative Efficacy Among 3rd Line Post-Imatinib Chronic Phase-Chronic Myeloid Leukemia (CP-CML) Patients after Failure of Dasatinib or Nilotinib Tyrosine Kinase Inhibitors//Blood. American Society of Hematology, 2014. Vol. 124, N 21. P. 4551 - 4551.
62. Oki Y. et al. Phase II study of low-dose decitabine in combination with imatinib mesylate in patients with accelerated or myeloid blastic phase of chronic myelogenous leukemia//Cancer. 2007. Vol. 109, N 5. P. 899 - 906.
63. Quint s-Cardama A. et al. A pilot study of imatinib, low-dose cytarabine and idarubicin for patients with chronic myeloid leukemia in myeloid blast phase//Leukemia and Lymphoma. 2007. Vol. 48, N 2. P. 283 - 289.
64. Fruehauf S. et al. Imatinib combined with mitoxantrone/etoposide and cytarabine is an effective induction therapy for patients with chronic myeloid leukemia in myeloid blast crisis//Cancer. 2007. Vol. 109, N 8. P. 1543 - 1549.
65. Deau B. et al. The addition of daunorubicin to imatinib mesylate in combination with cytarabine improves the response rate and the survival of patients with myeloid blast crisis chronic myelogenous leukemia (AFR01 study)//Leuk. Res. 2011. Vol. 35, N 6. P. 777 - 782.
66. Benjamini O. et al. Phase II trial of HyperCVAD and Dasatinib in patients with relapsed Philadelphia chromosome positive acute lymphoblastic leukemia or blast phase chronic myeloid leukemia//Am. J. Hematol. 2014. Vol. 89, N 3. P. 282 - 287.
67. Talpaz, M., Hehlmann, R., Quint s-Cardama, A. et al. Re-emergence of interferon- in the treatment of chronic myeloid leukemia. Leukemia 27, 803 - 812 (2013).
68. Nair A.P. et al. Allogeneic Hematopoietic Stem Cell Transplantation Is an Effective Salvage Therapy for Patients with Chronic Myeloid Leukemia Presenting with Advanced Disease or Failing Treatment with Tyrosine Kinase Inhibitors//Biol. Blood Marrow Transplant. Elsevier Inc., 2015. Vol. 21, N 8. P. 1437 - 1444.
69. Oehler V.G. et al. The effects of imatinib mesylate treatment before allogeneic transplantation for chronic myeloid leukemia//Blood. 2007. Vol. 109, N 4. P. 1782 - 1789.
70. Jabbour E. et al. Novel tyrosine kinase inhibitor therapy before allogeneic stem cell transplantation in patients with chronic myeloid leukemia: No evidence for increased transplant-related toxicity//Cancer. 2007. Vol. 110, N 2. P. 340 - 344.
71. Shimoni A. et al. Prior treatment with the tyrosine kinase inhibitors dasatinib and nilotinib allows stem cell transplantation (SCT) in a less advanced disease phase and does not increase SCT toxicity in patients with chronic myelogenous leukemia and Philadelphia positive acute lymphoblastic leukemia//Leukemia. Nature Publishing Group, 2009. Vol. 23, N 1. P. 190 - 194.
72. Breccia M. et al. Second-generation tyrosine kinase inhibitors before allogeneic stem cell transplantation in patients with chronic myeloid leukemia resistant to imatinib//Leuk. Res. 2010. Vol. 34, N 2. P. 143 - 147.
73. Pavl J. et al. Optimizing patient selection for myeloablative allogeneic hematopoietic cell transplantation in chronic myeloid leukemia in chronic phase//Blood. 2010. Vol. 115, N 20. P. 4018 - 4020.
74. Saussele S. et al. Allogeneic hematopoietic stem cell transplantation (allo SCT) for chronic myeloid leukemia in the imatinib era: Evaluation of its impact within a subgroup of the randomized German CML study IV//Blood. 2010. Vol. 115, N 10. P. 1880 - 1885.
75. Lee S.E. et al. Prognostic factors for outcomes of allogeneic stem cell transplantation in chronic phase chronic myeloid leukemia in the era of tyrosine kinase inhibitors//Hematology. Maney Publishing, 2014. Vol. 19, N 2. P. 63 - 72.
76. Gratwohl A. et al. Risk assessment for patients with chronic myeloid leukaemia before allogeneic blood or marrow transplantation. Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation.//Lancet (London, England). 1998. Vol. 352, N 9134. P. 1087 - 1092.
77. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
78. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278 - 288.
79. NCI CTC AE ver 5 [Electronic resource]//November 27, 2017. 2017. P. 155.
80. Quintas-Cardama A. et al. Granulocyte-colony-stimulating factor (filgrastim) may overcome imatinib-induced neutropenia in patients with chronic-phase chronic myelogenous leukemia//Cancer. 2004. Vol. 100, N 12. P. 2592 - 2597.
81. Jellinger P.S. et al. American Association Of Clinical Endocrinologists And American College Of Endocrinology Guidelines For Management Of Dyslipidemia And Prevention Of Cardiovascular Disease//Endocr. Pract. 2017. Vol. 23, N 2.
82. Бойцов С.А. et al. Кардиоваскулярная профилактика 2017. Российские национальные рекомендации//Российский кардиологический журнал. 2018. Vol. 6. P. 1 - 118.
83. Lee N.-R. et al. Imatinib mesylate-induced interstitial lung disease in a patient with prior history of Mycobacterium tuberculosis infection//Korean J. Intern. Med. Korean Association of Internal Medicine, 2015. Vol. 30, N 4. P. 550.
84. Rajda J., Phatak P.D. Reversible drug-induced interstitial pneumonitis following imatinib mesylate therapy//American Journal of Hematology. 2005. Vol. 79, N 1. P. 80 - 81.
85. Carlier P. et al. Pregnancy outcome among partners of male patients receiving imatinib, dasatinib or nilotinib in chronic myeloid leukemia: reports collected by the French network pharmacovigilance centers//Archives of gynecology and obstetrics. NLM (Medline), 2017. Vol. 295, N 2. P. 269 - 271.
86. Cortes J.E. et al. The impact of dasatinib on pregnancy outcomes//Am. J. Hematol. Wiley-Liss Inc., 2015. Vol. 90, N 12. P. 1111 - 1115.
87. Abruzzese E. et al. Back to the future: Treatment-free remission and pregnancy in chronic myeloid leukemia//European Journal of Haematology. Blackwell Publishing Ltd, 2019. Vol. 102, N 2. P. 197 - 199.
88. Abruzzese E., De Fabritiis P., Trawinska M.M. GIMEMA Registry of conception/pregnancy in adult Italian patients diagnosed with chronic myeloid leukemia (CML): report on 166 outcomes//60th Congress of the American Society of Hematology. 2018. P. Abstract 43.
89. Chelysheva E., Turkina A. Risks and challenges of CML management during pregnancy: Looking for a balanced decision//European Journal of Haematology. Blackwell Publishing Ltd, 2019. Vol. 102, N 4. P. 378 - 379.
90. Mubarak A.A.S. et al. Normal outcome of pregnancy in chronic myeloid leukemia treated with interferon- in 1st trimester: Report of 3 cases and review of the literature//Am. J. Hematol. Wiley-Liss Inc., 2002. Vol. 69, N 2. P. 115 - 118.
91. Chelysheva E. et al. Breastfeeding in patients with chronic myeloid leukaemia: Case series with measurements of drug concentrations in maternal milk and literature review//Mediterr. J. Hematol. Infect. Dis. Universita Cattolica del Sacro Cuore, 2018. Vol. 10, N 1.
92. Campiotti L. et al. Imatinib discontinuation in chronic myeloid leukaemia patients with undetectable BCR-ABL transcript level: A systematic review and a meta-analysis//European Journal of Cancer. Elsevier Ltd, 2017. Vol. 77. P. 48 - 56.
93. Mahon F.X. et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial//Lancet Oncol. Lancet Publishing Group, 2010. Vol. 11, N 11. P. 1029 - 1035.
94. Saussele S. et al. Discontinuation of tyrosine kinase inhibitor therapy in chronic myeloid leukaemia (EURO-SKI): a prespecified interim analysis of a prospective, multicentre, non-randomised, trial//Lancet Oncol. Lancet Publishing Group, 2018. Vol. 19, N 6. P. 747 - 757.
95. Rea D. et al. Discontinuation of dasatinib or nilotinib in chronic myeloid leukemia: Interim analysis of the STOP 2G-TKI study//Blood. American Society of Hematology, 2017. Vol. 129, N 7. P. 846 - 854.
96. Hochhaus A. et al. Treatment-free remission following frontline nilotinib in patients with chronic myeloid leukemia in chronic phase: Results from the ENESTfreedom study//Leukemia. Nature Publishing Group, 2017. Vol. 31, N 7. P. 1525 - 1531.
97. Mahon F.X. Treatment-free remission in CML: Who, how, and why?//Hematology. American Society of Hematology, 2017. Vol. 2017, N 1. P. 102 - 109.
98. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
99. Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer.//Evaluation of chemotherapeutic agents./ed. MacLeod C. New York: Columbia University Press, 1949. P. 191 - 205.
100. Jorge E. Cortes et al Bosutinib vs imatinib for newly diagnosed chronic myeloid leukemia in the BFORE trial: 24-month follow-up.Journal of Clinical Oncology 2018 36:15_suppl, 7002 - 7002
101. Hochhaus A. et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia//Leukemia. - 2020. - Т. 34. - N. 4. - С. 966 - 984.
102. Abruzzese E. et al. Tyrosine kinase inhibitors and pregnancy in chronic myeloid leukemia: opinion, evidence, and recommendations//Therapeutic Advances in Hematology. - 2020. - Т. 11. - С. 2040620720966120.
103. Bruford E. A. et al. HUGO Gene Nomenclature Committee (HGNC) recommendations for the designation of gene fusions//Leukemia. - 2021. - Т. 35. - N. 11. - С. 3040 - 3043.
104. Wang W. et al. Risk stratification of chromosomal abnormalities in chronic myelogenous leukemia in the era of tyrosine kinase inhibitor therapy//Blood, The Journal of the American Society of Hematology. - 2016. - Т. 127. - N. 22. - С. 2742 - 2750.
105. Rack K. A. et al. European recommendations and quality assurance for cytogenomic analysis of haematological neoplasms//Leukemia. - 2019. - Т. 33. - N. 8. - С. 1851 - 1867.
106. Br mmendorf T. H. et al. Bosutinib (BOS) versus imatinib for newly diagnosed chronic phase (CP) chronic myeloid leukemia (CML): final 5-year results from the bfore trial//Blood. - 2020. - Т. 136. - С. 41 - 42
107. Cortes J. E. et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial//Blood, The Journal of the American Society of Hematology. - 2018. - Т. 132. - N. 4. - С. 393 - 404.
108. Cortes J. et al. Ponatinib dose-ranging study in chronic-phase chronic myeloid leukemia: a randomized, open-label phase 2 clinical trial//Blood, The Journal of the American Society of Hematology. - 2021. - Т. 138. - N. 21. - С. 2042 - 2050.
109. Hochhaus A. et al. Efficacy and Safety Results from ASCEMBL, a Multicenter, Open-Label, Phase 3 Study of Asciminib, a First-in-Class STAMP Inhibitor, vs Bosutinib (BOS) in Patients (Pts) with Chronic Myeloid Leukemia in Chronic Phase (CML-CP) Previously Treated with ![]() 2 Tyrosine Kinase Inhibitors (TKIs//Blood. - 2020. - Т. 136. - С. LBA-4.
2 Tyrosine Kinase Inhibitors (TKIs//Blood. - 2020. - Т. 136. - С. LBA-4.
110. Cortes J. E. et al. Asciminib, a first-in-class STAMP inhibitor, provides durable molecular response in patients (pts) with chronic myeloid leukemia (CML) harboring the T315I mutation: primary efficacy and safety results from a phase 1 trial//Blood. - 2020. - Т. 136. - С. 47 - 50.
111. Kantarjian H. et al. Phase 3 study of dasatinib 140 mg once daily versus 70 mg twice daily in patients with chronic myeloid leukemia in accelerated phase resistant or intolerant to imatinib: 15-month median follow-up//Blood, The Journal of the American Society of Hematology. - 2009. - Т. 113. - N. 25. - С. 6322 - 6329.
112. Giles F. J. et al. Nilotinib is active in chronic and accelerated phase chronic myeloid leukemia following failure of imatinib and dasatinib therapy//Leukemia. - 2010. - Т. 24. - N. 7. - С. 1299 - 1301.
113. Le Coutre P. D. et al. Nilotinib in patients with Ph+ chronic myeloid leukemia in accelerated phase following imatinib resistance or intolerance: 24-month follow-up results//Leukemia. - 2012. - Т. 26. - N. 6. - С. 1189 - 1194.
114. Athale U, Hijiya N, Patterson BC, Bergsagel J, Andolina JR, Bittencourt H, Schultz KR, Burke MJ, Redell MS, Kolb EA, Johnston DL. Management of chronic myeloid leukemia in children and adolescents: Recommendations from the Children's Oncology Group CML Working Group. Pediatr Blood Cancer. 2019 Sep; 66(9): e27827.
115. Hijiya N, Suttorp M. How I treat chronic myeloid leukemia in children and adolescents. Blood. 2019 May 30; 133(22): 2374 - 2384.
116. Menger JM, Sathianathen RS, Sakamoto KM, Hijiya N. BCR/ABL-Positive Chronic Myeloid Leukemia in Children: Current Treatment Approach. Curr Oncol Rep. 2024 Mar; 26(3): 250 - 257.
117. Suttorp M, Schulze P, Glauche I, G hring G, von Neuhoff N, et al. Front-line imatinib treatment in children and adolescents with chronic myeloid leukemia: results from a phase III trial. Leukemia. 2018 Jul; 32(7): 1657 - 1669.
118. Champagne MA, Fu CH, Chang M, Chen H, Gerbing RB, et al. Higher dose imatinib for children with de novo chronic phase chronic myelogenous leukemia: a report from the Children's Oncology Group. Pediatr Blood Cancer. 2011 Jul 15; 57(1): 56 - 62.
119. Gore L, Kearns PR, de Martino ML, Lee, De Souza CA, et al. Dasatinib in Pediatric Patients With Chronic Myeloid Leukemia in Chronic Phase: Results From a Phase II Trial. J Clin Oncol. 2018 May 1; 36(13): 1330 - 1338.
120. Hijiya N, Maschan A, Rizzari C, Shimada H, Dufour et al. The long- term efficacy and safety of nilotinib in pediatric patients with CML: a 5-year update of the DIALOG study. Blood Adv. 2023 Dec 12; 7(23): 7279 - 7289.
121. Hijiya N, Maschan A, Rizzari C, Shimada H, Dufour C, et al. A phase 2 study of nilotinib in pediatric patients with CML: long-term update on growth retardation and safety. Blood Adv. 2021 Jul 27; 5(14): 2925 - 2934.
122. Boddu, D., Thankamony, P., Guruprasad, C. S., Nair, M., Rajeswari, B., & Seetharam, S. (2019). Effect of imatinib on growth in children with chronic myeloid leukemia. Pediatric Hematology and Oncology, 36(4), 189 - 197. https://doi.org/10.1080/08880018.2019.1610119
123. Hartmann, J. T., Haap, M., Kopp, H. G., & Lipp, H. P. (2009). Tyrosine kinase inhibitors-a review on pharmacology, metabolism and side effects. Current drug metabolism, 10(5), 470 - 481.
124. Hijiya, N., Maschan, A., Rizzari, C., Shimada, H., Dufour, C., Goto, H.,... & Sosothikul, D. (2021). A phase 2 study of nilotinib in pediatric patients with CML: long-term update on growth retardation and safety. Blood advances, 5(14), 2925 - 2934. Miller, B. S.
125. Sarafoglou, K., & Addo, O. Y. (2020). Development of Tanner stage-age adjusted CDC height curves for research and clinical applications. Journal of the Endocrine Society, 4(9), bvaa098.
126. Karow, A., G hring, G., Sembill, S., Lutterloh, F., Neuhaus, F., Callies, S.,... & Metzler, M. (2022). The cytogenetic landscape of pediatric chronic myeloid leukemia diagnosed in chronic phase. Cancers, 14(7), 1712.
127. Chelysheva E, Apperley J, Turkina A, Yassin MA, Rea D, Nicolini FE, Barraco D, Kazakbaeva K, Saliev S, Abulafia AS, Al-Kindi S, Byrne J, Robertson HF, Cerrano M, Shmakov R, Polushkina E, de Fabritiis P, Trawinska MM, Abruzzese E. Chronic myeloid leukemia diagnosed in pregnancy: management and outcome of 87 patients reported to the European LeukemiaNet international registry. Leukemia. 2024 Apr; 38(4): 788 - 795.
128. Suttorp, M., Metzler, M. (2021). Side Effects and Sequelae of Treatment for Chronic Myeloid Leukemia in Childhood and Adolescence. In: Beck, J.D., Bokemeyer, C., Langer, T. (eds) Late Treatment Effects and Cancer Survivor Care in the Young. Springer, Cham. https://doi.org/10.1007/978-3-030-49140-6_20
129. Athale U., Hijiya N., Patterson B.C., Bergsagel J., Andolina J.R., Bittencourt H., et al. Management of chronic myeloid leukemia in children and adolescents: Recommendations from the Children's Oncology Group CML Working Group. Pediatr Blood Cancer 2019; 66 (9): e27827. DOI: 10.1002/pbc.27827
130. Бойченко Э.Г. Хронический миелолейкоз у детей: редкая и уникальная болезнь//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2022. - Т. 21. - N. 1. - С. 156 - 172.
131. Al Bahar S., Pandita R., Nath S. V. Pregnancy in chronic myeloid leukemia patients treated with alpha interferon//International Journal of Gynecology & Obstetrics. - 2004. - Т. 85. - N. 3. - С. 281 - 282.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Аль-Ради Любовь Саттаровна, к.м.н., с.н.с. отдела диагностики и лечения гематологических заболеваний ФБГУ "НМИЦ гематологии" Минздрава России, член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
2. Виноградова Ольга Юрьевна, д.м.н., проф. кафедры гематологии, онкологии и лучевой терапии ГБОУВПО "Российский научно-исследовательский медицинский университет" им. Н.И. Пирогова МЗ России, зав. Московским городским гематологическим центром ГБУЗ ГКБ им. С.П. Боткина, г.н.с. ФГБУ "Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Д. Рогачева" Минздрава России, член Российского профессионального общества онкогематологов, ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
3. Кузьмина Лариса Анатольевна, к.м.н., зав. научно-клиническим отделением высокодозной химиотерапии и трансплантации костного мозга ФГБУ "НМИЦ гематологии" Минздрава России, эксперт РАН, член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
4. Ломаиа Елза Галактионовна, к.м.н., в.н.с. НИЛ онкогематологии Института гематологии ФГБУ "СЗФМИЦ им. В.А. Алмазова", член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество" (Санкт-Петербург, Россия).
5. Мартынкевич Ирина Степановна, д.б.н., руководитель лаборатории молекулярной генетики ФГБУ "Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства", член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
6. Морозова Елена Владиславовна, к.м.н., руководитель отдела онкологии, гематологии и трансплантологии для подростков и взрослых НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, доцент кафедры гематологии, трансфузиологии и трансплантологии ПСПбГМУ им. И.П. Павлова, член European Leukemia Net (ELN) (Санкт-Петербург, Россия).
7. Обухова Татьяна Никифоровна, к.м.н., врач - лабораторный генетик, заведующий лабораторией кариологии ФГБУ "НМИЦ гематологии" Минздрава России, член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество", Российского общества онкогематологов, Европейского общества цитогенетиков
8. Поспелова Татьяна Ивановна, д.м.н., проф., заслуженный врач России, проректор по научной работе ФГБОУ ВО "Новосибирский государственный медицинский университет" Минздрава России, зав. кафедрой терапии, гематологии и трансфузиологии ФПК и ППВ ФГБОУ ВО НГМУ Минздрава России, руководитель Городского гематологического центра г. Новосибирска, главный гематолог Сибирского Федерального Округа и Новосибирской области, председатель МОО "Ассоциация врачей-гематологов" (Новосибирск, Россия).
9. Судариков Андрей Борисович, д.б.н., зав. лабораторией молекулярной онкологии ФГБУ "НМИЦ гематологии" Минздрава России, эксперт РФФИ, РНФ, ФСВОК.
10. Туркина Анна Григорьевна, д.м.н., проф., зав. клинико-диагностическим отделением гематологии миелопролиферативных заболеваний ФБГУ ГНЦ Минздрава РФ, председатель рабочей исследовательской группы по хроническому миелолейкозу ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество" (НГО), руководитель Российской группы и член экспертного совета ELN, Европейского гематологического общества по изучению лейкозов, член-представитель России в международном комитете по изучению лейкозов и ассоциированных с ним заболеваний, IACRLRD World Committee, член Европейской исследовательской группы по изучению хронического миелолейкоза (EICML), американской ассоциации гематологов ASH (American society of hematology), Сибирского общества гематологов.
11. Цаур Григорий Анатольевич, д.м.н., зав. лабораторией молекулярной биологии, иммунофенотипирования и патоморфологии ГАУЗ СО "Областная детская клиническая больница", г. Екатеринбург, врач клинической лабораторной диагностики ГАУЗ СО "Институт медицинских клеточных технологий", г. Екатеринбург, член Национального общества детских гематологов и онкологов, член ELN.
12. Челышева Екатерина Юрьевна, д.м.н., в.н.с. отдела диагностики и лечения гематологических заболеваний ФГБУ "НМИЦ гематологии" Минздрава России, член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество", ELN.
13. Шуваев Василий Анатольевич, д.м.н., врач-гематолог отделения противоопухолевой лекарственной терапии МРНЦ им. А.Ф. Цыба-филиал "НМИЦ радиологии" Минздрава России, профессор кафедры гематологии и трансфузиологии ФГБОУ ДПО РМАНПО МЗ РФ. член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
14. Шухов Олег Александрович, к.м.н., начальник отдела анализа обеспечения лекарственными препаратами и обращения медицинских изделий в субъектах РФ, ст.н.с. отдела диагностики и лечения гематологических заболеваний ФГБУ "НМИЦ гематологии", Минздрава России, член ассоциации содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество", член ЕНА, ELN.
15. Масчан Алексей Александрович, д.м.н., профессор, директор Института гематологии, иммунологии и клеточных технологий ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Конфликт интересов: отсутствует у всех членов рабочей группы.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория клинических рекомендаций: специалисты, имеющие высшее медицинское образование по следующим специальностям:
1. Врачи-гематологи
2. Врачи-онкологи.
3. Врачи-детские онкологи-гематологи
4. Врачи-детские онкологи
5. Врачи-педиатры
6. Врачи-терапевты
7. Врачи-акушеры-гинекологи.
8. Врачи общей практики.
9. Врачи-клинические фармакологи.
10. Студенты медицинских вузов, ординаторы и аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методы, использованные для сбора/селекции доказательств:
- поиск в электронных базах данных;
- анализ современных научных разработок по проблеме рака пищевода в РФ и за рубежом;
- обобщение практического опыта российских и зарубежных специалистов.
Для оценки уровня УУР и УДД по каждому тезису-рекомендации выполнен отдельный систематический обзор доказательств эффективности и/или безопасности медицинского вмешательства, включающий следующие этапы:
1. Определение критериев поиска и отбора публикаций о клинических исследованиях (КИ) эффективности и/или безопасности медицинского вмешательства, описанного в тезисе-рекомендации.
2. Систематический поиск и отбор публикаций о КИ в соответствии с определенными ранее критериями.
3. Определение УДД и УУР на основании результатов систематического поиска и отбора публикаций о КИ.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов
- Оценка УДД и УУР проводится на основании единых шкал, представленных в (табл. П1-3).
Таблица П1. Шкала оценки уровней УДД для методов диагностики (диагностических вмешательств)/
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом
или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала оценки уровней УДД для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)/
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П3. Шкала оценки уровней УУР для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)/
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества; все рассматриваемые критерии эффективности (исходы) не являются важными, все исследования имеют низкое методологическое качество
и их выводы по интересующим исходам не являются согласованными)
Индикаторы доброкачественной клинической практики (Good Practice Points - GPPs):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Экономический анализ: анализ стоимости не проводился, публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать прежде всего доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Минздрава России от 10 мая 2017 г. N 203н "Об утверждении критериев оценки качества медицинской помощи".
2. Приказ Минздрава России от 15 ноября 2012 г. N 930н "Об утверждении Порядка оказания медицинской помощи населению по профилю "гематология".
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
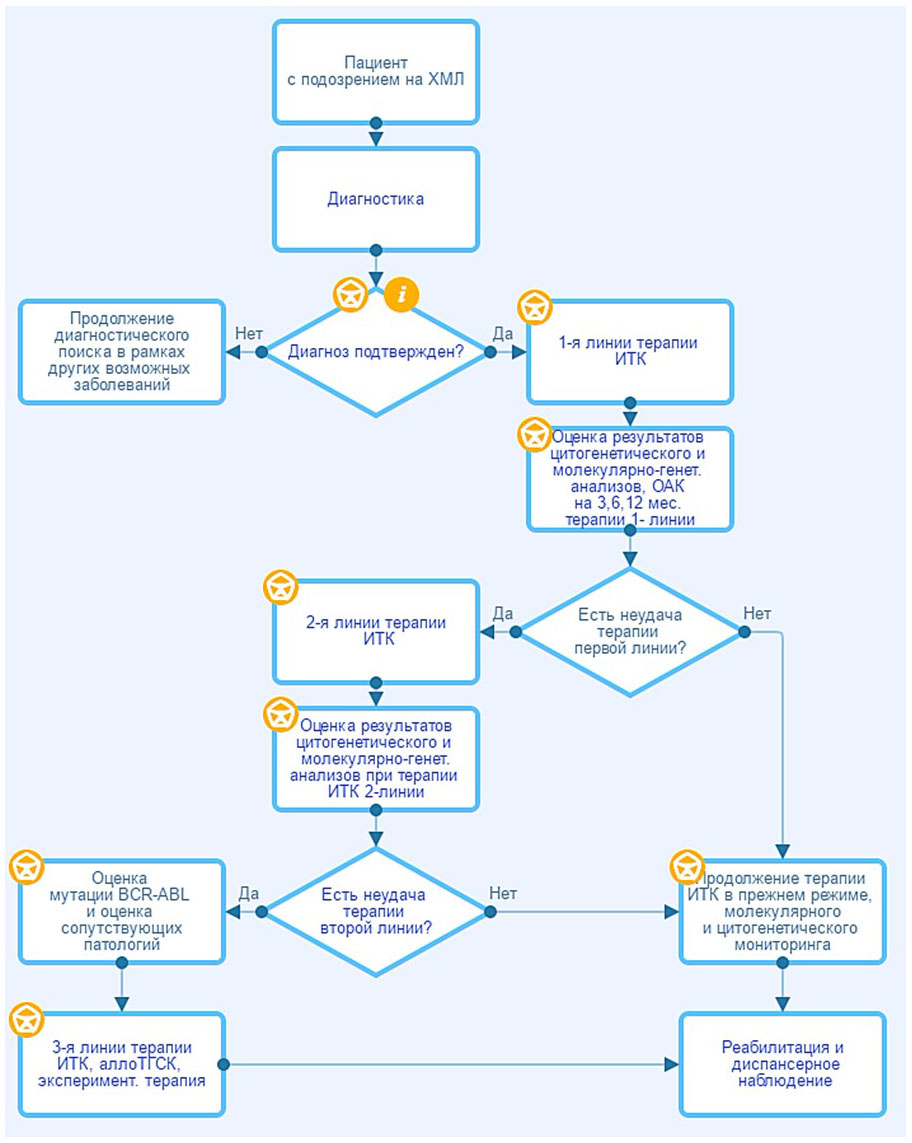
Алгоритм выбора терапии при ХМЛ
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Глубокоуважаемый ...!
У Вас выявлено заболевание - хронический миелолейкоз. При развитии ХМЛ возникает клон лейкозных клеток, который вытесняет клетки нормального кроветворения в костном мозге. Лейкозные клетки содержат маркер этого заболевания - филадельфийскую хромосому (Ph+) и/или транскрипт BCR::ABL1. Данные маркеры выявляются при цитогенетическом исследовании костного мозга или молекулярно-генетическом исследовании периферической крови. ХМЛ нередко выявляется при случайном анализе крови, и клинические симптомы заболевания на момент его диагностики могут отсутствовать. Однако в случае отсутствия специфического лечения неизбежно происходит постепенная прогрессия заболевания.
Для лечения пациентов с ХМЛ применяют современную целенаправленную терапию - препараты ингибиторы тирозинкиназ (ИТК), что позволяет добиться значительного уменьшения числа лейкозных клеток и определяет благоприятный долговременный прогноз заболевания. В настоящее время в Российской Федерации доступны ингибиторы тирозинкиназы BCR-ABL 1 и 2 поколения. Выбор препарата для Вашего лечения терапии осуществляется с учетом фазы заболевания, сопутствующей патологии и побочных эффектов каждого ИТК, в соответствии с современными рекомендациями по терапии ХМЛ. В большинстве случаев ХМЛ выявляется в хронической фазе (ХФ), и лечение проводится амбулаторно. Однако при наличии показаний может осуществляться госпитализация.
Основной принцип терапии ХМЛ - индукция ответа на лечение и подавление клона лейкемических Ph+ клеток с целью снижения риска прогрессии заболевания. Результаты только общего анализа крови после достижения полной гематологической ремиссии не являются достаточно информативными для оценки ответа на терапию. Основными методами оценки объема лейкозного клона и параметрами, характеризующими эффективность терапии при ХМЛ, являются цитогенетические и молекулярно-генетические методы исследования
Ключевым при ХМЛ является своевременное переключение на более эффективные препараты при неудаче терапии первой линии и своевременное решение вопроса о выполнении аллогенной трансплантации кроветворных клеток костного мозга. Для того чтобы определить показания к продолжению лечения или к смене терапии, ответ на лечение при ХМЛ определяют, как оптимальный, неудача или предупреждение. На каждом сроке наблюдения существуют свои критерии для этих определений.
Оптимальным ответом на лечение при ХМЛ считают: снижение уровня транскрипта BCR::ABL1 ![]() 10% через 3 месяца,
10% через 3 месяца, ![]() 1% через 6 месяцев и
1% через 6 месяцев и ![]() 0,1% через 12 месяцев лечения. Оптимальный ответ при хорошей переносимости лечения, свидетельствует о благоприятном прогнозе и длительной выживаемости без прогрессирования. При оптимальном ответе терапия будет продолжена в прежнем режиме.
0,1% через 12 месяцев лечения. Оптимальный ответ при хорошей переносимости лечения, свидетельствует о благоприятном прогнозе и длительной выживаемости без прогрессирования. При оптимальном ответе терапия будет продолжена в прежнем режиме.
Неудача терапии предполагает повышенный риск прогрессии заболевания и является основой для обсуждения вопроса о целесообразности изменения терапии. Критериями неудачи терапии являются: уровень BCR::ABL1 > 10%, подтвержденный повторным анализом через 1 - 3 месяца, Ph+ > 95% или отсутствие гематологического ответа через 3 месяца; BCR::ABL1 ![]() 10% через 6 месяцев; BCR::ABL1
10% через 6 месяцев; BCR::ABL1 ![]() 1% через 12 месяцев. Если недостаточный ответ не связан с нарушением приема препарата, будет проводится анализ мутаций гена BCR::ABL1. При терапии иматинибом** будет выполнено переключение на ИТК2 либо повышение дозы иматиниба**. Выбор ИТК при изменении лечения будет осуществляться с учетом сопутствующей патологии, побочных эффектов и анализа мутаций BCR::ABL1.
1% через 12 месяцев. Если недостаточный ответ не связан с нарушением приема препарата, будет проводится анализ мутаций гена BCR::ABL1. При терапии иматинибом** будет выполнено переключение на ИТК2 либо повышение дозы иматиниба**. Выбор ИТК при изменении лечения будет осуществляться с учетом сопутствующей патологии, побочных эффектов и анализа мутаций BCR::ABL1.
К категории предупреждения относятся промежуточные значения ответов. При наличии неблагоприятных факторов и группы высокого риска, для этой категории пациентов рассматривают увеличение дозы или замену ИТК.
Таким образом, эффективность терапии у Вас планируется оценивать через 3, 6 и 12 месяцев от начала лечения ИТК. Будет регулярно осуществляться забор периферической крови и определение относительной экспрессии BCR::ABL1, а пункция костного мозга будет выполняться только в особых клинических ситуациях по решению вашего врача.
На каждом визите к врачу предусмотрено оценивать переносимость терапии ИТК, по результатам беседы с пациентом, физикального осмотра и оценки клинико-лабораторных параметров: общего анализа крови, биохимического анализа крови. В случае возникновения токсичности будут даны дополнительные рекомендации, с учетом степеней токсичности и ее длительности.
В настоящее время ХМЛ относится к тем заболеваниям, которые хорошо контролируются с помощью терапии ИТК. Получение глубокой ремиссии заболевания - так называемого глубокого молекулярного ответа, при котором уровень экспрессии BCR::ABL1 не определяется, может быть констатировано после нескольких лет терапии. При стабильном глубоком молекулярном ответе может быть рассмотрена возможность ведения ремиссии без терапии ИТК в случае, если будет соответствие всем необходимым критериям для безопасной отмены лечения.
Важно отметить, что успех лечения во многом будет зависеть от Вашей приверженности терапии - т.е. следования рекомендациям специалиста и постоянному приему препаратов с учетом того, что лечение будет проводиться на протяжении ряда лет. Учитывая оптимистичные результаты длительной выживаемости пациентов (12-летняя общая выживаемость до 85%), существует реальная перспектива общей продолжительности жизни, сопоставимой с таковой в обычной популяции.
В случае развития резистентности заболевания, нечувствительности к проводимому лечению, непереносимости лечения, будут приняты все меры по выбору дальнейшей оптимальной тактике Вашего ведения. Наблюдающие Вас врачи всегда готовы оказать Вам консультативную и лечебно-диагностическую поддержку.
Приложение Г1 - Г...
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ
Приложение Г1
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status;
Oken M.M., Creech R.H., Tormey D.C. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5(6): 649 - 55 [98].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т.д.).
Содержание (шаблон):
Балл
Описание
0
Пациент полностью активен, способен выполнять все действия, как и до заболевания
1
Пациент неспособен выполнять тяжелую работу, но может выполнять легкую или сидячую (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Смерть
Ключ (интерпретация): приведен в самой шкале.
Приложение Г2
КРИТЕРИИ ТОКСИЧНОСТИ NCI CTCAE
Название на русском языке: Критерии токсичности Национального института рака
Оригинальное название (если есть): National Cancer Institute Common Toxicity Criteria
Источник (официальный сайт разработчиков, публикация с валидацией): https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm
Тип: шкала оценки
Назначение: Критерии токсичности NCI CTCAE v 5.0 помогают определить степень токсичности нежелательного явления, с целью определения тактики ведения. В таблице Г2.1 представлены критерии гематологической и негематологической токсичности, которая может наблюдаться при терапии ИТК.
Оценочный инструмент, содержание, ключ (интерпретация): см. табл. Г2.1
Таблица Г2.1. Критерии токсичности NCI CTCAE v 5.0 (избранное)/
Нежелательное явление
Степени токсичности
ГЕМАТОЛОГИЧЕСКАЯ ТОКСИЧНОСТЬ
Гемоглобин
НГН* - 100 г/л
100 - 80 г/л
Менее 80 г/л
Жизнеугрожающие осложнения, необходима неотложная терапия
Лейкоциты
НГН - 3,0 x 09/л
3,0 - 2.0 x 109/л
2,0 - 1,0 x 109/л
< 1,0 x 109/л
Нейтрофилы
НГН - 1,5 x 09/л
1,5 - 1,0 x 109/л
1,0 - 0,5 x 109/л
< 0,5 x 109/л
Тромбоциты
НГН - 75,0 x 109/л
75,0 - 50,0 x 109/л
50,0 - 25,0 x 109/л
< 25,0 x 109/л
НГН - нижняя граница нормы
ЛАБОРАТОРНЫЕ ОТКЛОНЕНИЯ
Щелочная фосфатаза
ВГН* - 2,5 x ВГН
2,5 - 5,0 x ВГН
5,0 - 20,0 x ВГН
> 20,0 x ВГН
Билирубин
ВГН - 1,5 x ВГН
1,5 - 3,0 x ВГН
3,0 - 10,0 x ВГН
> 10,0 x ВГН
АСТ
ВГН - 3,0 x ВГН
3,0 - 5,0 x ВГН
5,0 - 20,0 x ВГН
> 20,0 x ВГН
АЛТ
ВГН - 3,0 x ВГН
3,0 - 5,0 x ВГН
5,0 - 20,0 x ВГН
> 20,0 x ВГН
Липаза
ВГН - 1,5 x ВГН
1,5 - 2,0 x ВГН
2,0 - 5,0 x ВГН
> 5,0 x ВГН
Гипергликемия
Уровень глюкозы натощак ВГН - 8,9 ммоль/л
Уровень глюкозы натощак 8,9 - 13,9 ммоль/л
13,9 - 27,8 ммоль/л, необходима госпитализация
> 27,8 ммоль/л, жизнеугрожающие осложнения
--------------------------------
<*> ВГН - верхняя граница нормы.
ОТЕКИ (ПЕРИФЕРИЧЕСКИЕ)
Отеки лица
Локализованные отеки лица
Умеренные отеки лица, ограничивающие повседневную активность
Тяжелые отеки, ограничивающие повседневную активность и способность к самообслуживанию
-
Отеки туловища
Отечность или сглаживание анатомических образований при местном осмотре
Заметное сглаживание анатомических образований, заполнение кожных складок, заметное искажение анатомических контуров, ограничение повседневной активности
Тяжелые отеки, ограничивающие повседневную активность и способность к самообслуживанию
-
Отеки конечностей
5 - 10% разница в окружностях конечностей, отечность или сглаживание анатомических образований при местном осмотре
10 - 30% разница в окружностях конечностей, заметное сглаживание анатомических образований, заполнение кожных складок, заметное искажение анатомических контуров, ограничение повседневной активности
> 30% разница в окружностях конечностей Тяжелые отеки, ограничивающие повседневную активность и способность к самообслуживанию
-
ТОКСИЧНОСТЬ СО СТОРОНЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Тошнота
Потеря аппетита без изменения обычной диеты
Снижение приема пищи без значимого снижения массы тела, дегидратации или недостаточности питания
Недостаточное потребление калорий или пищи, необходимость зондового питания, парентерального питания или госпитализации
-
Рвота
1 - 2 эпизода (с интервалом не менее 5 минут) в течение 24 часов
3 - 5 эпизодов (с интервалом не менее 5 минут) в течение 24 часов
![]() 6 эпизодов (с интервалом не менее 5 минут) в течение 24 часов, необходимость зондового питания, парентерального питания или госпитализации
6 эпизодов (с интервалом не менее 5 минут) в течение 24 часов, необходимость зондового питания, парентерального питания или госпитализации
Жизнеугрожающие осложнения, необходима неотложная терапия
Диарея
Учащение стула менее 4 раз в день; легкое
Учащение стула до 4 - 6 раз в день;
Учащение стула 7 и более раз в день; недержание стула; необходимость госпитализации;
Жизнеугрожающие осложнения, необходима неотложная терапия
Запор
Периодические или редкие проявления; редкое применение препаратов, изменяющих консистенцию стула или слабительных, клизмы; изменение диеты
Персистирующие симптомы с регулярным использованием препаратов, изменяющих консистенцию стула или слабительных, клизмы; ограничение повседневной активности
Запоры с необходимостью ручной эвакуации, ограничивающие повседневную активность и способность к самообслуживанию
Жизнеугрожающие осложнения, необходима неотложная терапия
Стоматит
симптомов нет или невыраженные; вмешательство не требуется
Умеренная боль, не влияющая на потребление пищи, необходимо изменение диеты
Выраженная боль, влияющая на потребление пищи через рот
Жизнеугрожающие осложнения, необходима неотложная терапия
БОЛЬ
Артралгия (боли в суставах)
Незначительная боль
Умеренная боль, ограничивающая повседневную активности
Выраженная боль, ограничивающие повседневную активность и способность к самообслуживанию
-
Боль в костях
Незначительная боль
Умеренная боль, ограничивающая повседневную активности
Выраженная боль, ограничивающая повседневную активность и способность к самообслуживанию
-
Миалгия (мышечная боль)
Незначительная боль
Умеренная боль, ограничивающая повседневную активности
Выраженная боль, ограничивающая повседневную активность и способность к самообслуживанию
-
Головная боль
Незначительная боль
Умеренная боль, ограничивающая повседневную активность
Выраженная боль, ограничивающая повседневную активность и способность к самообслуживанию
-
КОНСТИТУЦИОНАЛЬНАЯ ТОКСИЧНОСТЬ
Слабость
Слабость проходит после отдыха
Слабость не проходит после отдыха, ограничивает повседневную активность
Слабость не проходит после отдыха, ограничивает повседневную активность и способность к самообслуживанию
-
Лихорадка
38,0 - 39,0 °C
39,0 - 40,0 °C
> 40,0 °C продолжительностью менее 24 часов
> 40,0 °C продолжительностью более 24 часов
Увеличение массы тела
5 - 10% от исходной массы
10 - 20% от исходной массы
![]() 20% от исходной массы
20% от исходной массы
-
Потеря массы тела
5 - 10% от исходной массы, вмешательство не требуется
10 - 20% от исходной массы, необходима нутриционная поддержка
![]() 20% от исходной массы, необходимо зондовое или парентеральное питание
20% от исходной массы, необходимо зондовое или парентеральное питание
-
КАРДИОВАСКУЛЯРНАЯ ТОКСИЧНОСТЬ
Гипертензия
Прегипертензия (систолическое АД 120 - 139 мм рт. ст. или диастолическое АД 80 - 89 мм рт.ст.)
Артериальная гипертензия I степени (систолическое АД 140 - 159 мм. рт. ст. или диастолическое АД 90 - 99 мм рт.ст.); необходимо медикаментозное воздействие; рецидивирующее или постоянное (более 24 ч); симптоматический подъем диастолического давления свыше 20 мм рт. ст. или более 140/90 мм рт.ст., если ранее было в пределах нормы; требует монотерапии
Артериальная гипертензия II степени (систолическое АД более 160 мм рт.ст. или диастолическое АД более 100 мм рт.ст.); необходимо медикаментозное воздействие; необходимо более одного лекарственного препарата или более интенсивная терапия чем ранее
Жизнеугрожающие осложнения (злокачественная гипертензия, преходящие или постоянный неврологический дефицит, гипертонический криз), необходима неотложная терапия
ДЕРМАТОЛОГИЧЕСКАЯ ТОКСИЧНОСТЬ/КОЖНЫЕ ПОКРОВЫ
Алопеция
Потеря волос до 50% от нормального количества незаметное на расстоянии, возможно скрыть с помощью прически, шиньона или парика
Потеря волос более 50% от нормального количества, заметное для окружающих, необходим шиньон или парик, связанная с психосоциальным дискомфортом
-
-
Сухость кожи
Менее 10% поверхности тела, не связано с эритемой или зудом
Покрывает 10 - 30% поверхности тела и связано с эритемой или зудом, ограничивает повседневную активность
Покрывает более 30% поверхности тела и связано с зудом, ограничивает повседневную активность и способность к самообслуживанию
-
Зуд
Слабый или локализованный зуд, необходима местная терапия
Интенсивный или разлитой преходящий зуд, следы расчесов (отек, сыпь, ссадины, лихенификация), необходима системная терапия, ограничивает повседневную активность
Интенсивный или разлитой постоянный ограничивает способность к самообслуживанию или сон, необходимы прием кортикостероидов или иммуносупрессивная терапия
-
Пятнисто-папулезная сыпь
Пятнистые или папулезные высыпания, покрывающие менее 10% поверхности тела с наличием симптомов или без симптомов (зуд, жжение, напряженность)
Пятнистые или папулезные высыпания, покрывающие 10 - 30% поверхности тела с наличием симптомов или без симптомов (зуд, жжение, напряженность), ограничивающие повседневную активность
Покрывает более 30% поверхности тела с наличием симптомов или без симптомов, ограничивающие повседневную активность и способность к самообслуживанию
-
