"Клинические рекомендации "Инфекция, ассоциированная с ортопедическими имплантатами"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ИНФЕКЦИЯ, АССОЦИИРОВАННАЯ С ОРТОПЕДИЧЕСКИМИ ИМПЛАНТАТАМИ
Год утверждения (частота пересмотра): Пересмотр не позднее: 2
ID: 844_1
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Ассоциация травматологов-ортопедов России
Одобрены
Список сокращений
АЛТ - аланинаминотрансфераза
АБП - антибактериальный препарат системного действия (АТХ J01);
АБТ - антибактериальная терапия;
АТХ - анатомо-химическая классификация
в/в - внутривенно;
в/м - внутримышечно;
ГИОХВ - глубокая инфекция области хирургического вмешательства;
Гр(+) - грамположительные микроорганизмы;
Гр(-) - грамотрицательные микроорганизмы;
ЖВНЛП - жизненно необходимые и важнейшие лекарственные препараты;
ИАИ - имплантат-ассоциированная инфекция;
КС - коленный сустав;
МНН - международное непатентованное наименование;
МО - медицинская организация;
МРТ - магнитно-резонансная томография;
НПВП - Нестероидные противовоспалительные и противоревматические препараты (М01А)
ПАИ - перелом-ассоциированная инфекция
ПКТ - прокальцитонин
ППИ - перипротезная инфекция;
РСЭП - ревизия с сохранением эндопротеза;
реОс - ревизионный остеосинтез;
реЭП - ревизионное эндопротезирование;
РХО - расширенная хирургическая обработка;
СКТ - спиральная компьютерная томография;
ССВР - синдром системной воспалительной реакции;
ПММА - полиметилметакрилат;
СРБ - С-реактивный белок;
СОЭ - скорость оседания эритроцитов
ТБС - тазобедренный сустав;
ТЭВ - трудные для эрадикации возбудители;
УЗИ - ультразвуковое исследование;
ЭП - эндопротезирование;
MRS - метициллинорезистентные стафилококки;
MRSA - метициллинорезистентный S. aureus;
MRSE - метициллинорезистентный S. epidermidis;
MS - метициллиночувствительный;
MSSA - метициллиночувствительный S. aureus;
MSSE - метициллиночувствительный S. epidermidis;
VRE - ванкомицин-резистентный энтерококк.
Термины и определения
Имплантат-ассоциированная инфекция - инфекция области установки ортопедического имплантата, риск развития которой сохраняется в течение всего срока его существования в организме пациента.
Перелом-ассоциированная инфекция - острый или хронический инфекционный процесс в области перелома костей, элементов остеосинтезирующего устройства (пластина, стержень, аппарат внешней фиксации и т.д.) и окружающих тканей.
Инфицированный ложный сустав - инфекционный процесс в области перелома костей и окружающих тканей без клинико-рентгенологических признаков консолидации отломков через 2 средних срока сращения после остеосинтеза.
Остеомиелит - острое или хроническое инфекционное воспаление, охватывающее на том или ином протяжении кость и окружающие ее ткани с морфологическими и функциональными изменениями в других органах и системах организма, является последовательным этапом развития хронической импланат-ассоциированной инфекции при отсутствии рационального лечения и сохранения инфицированной конструкции.
Перипротезная инфекция - острая или хроническая инфекция области хирургического вмешательства, развившаяся после имплантации эндопротеза сустава, представляет собой частный случай имплантат-ассоциированной инфекции.
Купирование инфекционного процесса - отсутствие локальных и системных признаков инфекционного процесса после выполнения радикальной санирующей операции и курса этиотропной антибактериальной терапии.
Ревизия с сохранением имплантата - ревизионная операция, включающая в себя радикальную хирургическую обработку очага инфекции с сохранением хорошо фиксированных имплантатов и, в случае ППИ, с обязательной заменой мобильных компонентов эндопротеза.
Одноэтапное ревизионное вмешательство - ревизионная операция, включающая в себя одномоментную радикальную хирургическую обработку очага инфекции, тщательное удаление всех инородных тел, включая костный цемент, и установку нового имплантата.
Двухэтапное ревизионное эндопротезирование - хирургическое лечение ППИ, при котором радикальная (вторичная) хирургическая обработка очага инфекции с удалением всех компонентов эндопротеза включает установку временного антимикробного спейсера, а последующее удаление спейсера и установка постоянного эндопротеза выполняется после купирования инфекционного процесса.
Двухэтапный ревизионный остеосинтез - хирургическое лечение ПАИ, при котором на первом этапе выполняют радикальную хирургическую обработку очага инфекции с удалением инфицированного имплантата и стабилизацию оперированного сегмента конечности (цементным спейсером с антибактериальными препаратами и/или аппаратом внешней фиксации), а также пластическое замещение мягкотканых дефектов при их наличии, а вторым этапом после купирования инфекционного процесса восполняют дефект кости.
Спейсер - имплантат, предназначенный для временной замены эндопротеза или замещения дефекта костной ткани при ревизионной операции по поводу имплантат-ассоциированной инфекции и/или остеомиелита. Чаще всего, представляет собой индивидуально изготовленное (вручную или с применением 3-D печати) ортопедическое устройство, может содержать в своем составе костный цемент на основе полиметилметакрилата, импрегнированный веществами с антимикробной активностью, с целью местной санации инфицированных тканей и частичной стабилизации оперированного сегмента конечности (костного дефекта и/или полости сустава), имеет различные размеры и конфигурации, которые определяет врач - хирург индивидуально для каждого клинического случая.
Спейсер артикулирующий - временный эндопротез, компоненты которого фиксированы на костный цемент, импрегнированный дополнительно веществами с антимиробной активностью, сохраняет функцию пораженного сустава.
Спейсер блоковидный - изготовленная вручную конструкция из костного цемента, не имеющая артикулирующих поверхностей, обеспечивает локальное антибактериальное действие, и частичную стабилизацию оперированного сегмента конечности, в случае имплантации в область пораженного сустава не обеспечивает его функцию.
Трудные для эрадикации возбудители (ТЭВ) - штаммы микробных патогенов, устойчивые к антибиотикам, обладающим антибиопленочной активностью, и вызывающие хроническую (рецидивирующую) ИАИ; к ним относят штаммы стафилококков, устойчивых к рифампицину**, энтерококков - к ампициллину** и грамотрицательных бактерий - к ципрофлоксацину**, а также грибы рода Candida, резистентные к флуконазолу**.
Трудноизлечимая перипротезная инфекция - хроническая рецидивирующая перипротезная инфекция, обусловленная трудными для эрадикации возбудителями.
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Перипротезная инфекция (ППИ) - острая или хроническая инфекция области хирургического вмешательства, резвившаяся после имплантации эндопротеза, представляет собой частный случай имплантат-ассоциированной инфекции. Синонимы: инфекция протезированного сустава, периимплантная инфекция, глубокая инфекция области хирургического вмешательства после эндопротезирования сустава.
Перелом-ассоциированная инфекция (ПАИ) - острый или хронический инфекционный процесс в области перелома костей, элементов остеосинтезирующего устройства (пластина, стержень, аппарат внешней фиксации и т.д.) и окружающих тканей, представляет собой частный случай имплантат-ассоциированной инфекции. Синонимы: Остеосинтез-ассоциированная инфекция, инфицированный псевдоартроз, периимплантная инфекция, послеоперационный остеомиелит, посттравматический остеомиелит, инфекция области хирургического вмешательства после остеосинтеза.
Стандартное определение случая ИАИ, как ИОХВ
Необходимо отметить существующие разногласия в терминологии. Развитие любой ИАИ является, по сути, частным случаем ИОХВ, и, следовательно, инфекцией, связанной с оказанием медицинской помощи [1]. Действующее санитарное законодательство (СанПиН 3.3686-21) определяет, что инкубационный период ИОХВ при наличии имплантата в месте операции может быть год и более. По мнению профессионального сообщества врачей-травматологов-ортопедов РФ, как и большинства стран, стандартное определение ИОХВ при наличии имплантата, как послеоперационного осложнения, устанавливает срок 90 дней после операции [2, 3]. В тоже время известно, что большая часть случаев развития ППИ, обусловлена эндогенным путем инфицирования, а риск развития любой ИАИ сохраняется в течение всего времени установки имплантата, следовательно, при наличии эндопротеза - пожизненно.
Имплантат-ассоциированная инфекция (ППИ и ПАИ)
I. Должна соответствовать следующим критериям:
- имеет связь с хирургическим вмешательством;
- не является закономерным развитием основного заболевания;
- в случае срока развития инфекции до 90 дней инфицирование считается послеоперационным, более 90 дней - эндогенным (гематогенным, лимфогенным, контактным или путем транслокации);
- вовлекает в гнойный процесс периимплантные ткани, с вовлечением костной ткани, фасциального и мышечного слоев, подкожной клетчатки, редко кожи.
II. Кроме того, пациент имеет, по крайней мере, один из следующих признаков:
- свищевой ход, идущий в полость сустава;
- гнойное отделяемое из дренажа, установленного в полость протезированного сустава;
- выделение микроорганизмов из жидкости или ткани, полученной асептически из области протезированного сустава любым методом;
- дополнительно для ППИ - количество лейкоцитов > 3000 /мкл и/или доля нейтрофильных гранулоцитов > 70% в суставном аспирате при цитологическом исследовании;
III. при непосредственном осмотре, во время повторной операции, при микробиологическом, патолого-анатомическом или рентгенологическом исследовании (фистулографии) обнаружение признаков инфекции, вовлекающей область протезированного сустава или вовлекающей область перелома и/или остеосинтеза.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Ведущими возбудителями ИАИ, являются стафилококки: Staphylococcus aureus и Staphylococcus epidermidis [1 - 4]. Обладая скудным набором вирулентных свойств, S. epidermidis не может вызвать инфекцию в иммунокомпетентном организме, однако, в условиях травмы и хирургического стресса на фоне операций эндопротезирования суставов и реконструктивных операций на костях, особенно сопровождающихся массивной кровопотерей, иммунореактивность снижается, и это способствует проявлению вирулентных свойств условно-патогенными микроорганизмами, вследствие чего развивается гнойно-септическая инфекция. Наиболее проблемными для лечения являются инфекции, вызванные метициллинорезистентными (MR) штаммами S. aureus (MRSA) и S. epidermidis (MRSE). Ведущая роль S. aureus и S. epidermidis, в этиологии ортопедической инфекции во многом обусловлена их способностью быстро формировать многоуровневые микробные биопленки на поверхности искусственных имплантатов (эндопротезов, пластин, стержней и т.д.) [5 - 7]. Существование возбудителей в составе биопленок затрудняет диагностику ИАИ и снижает эффективность антибактериальной терапии, в том числе, препаратами, высокоактивными в отношении MR-стафилококков [8, 9]. Известно также, что стафилококки способны проникать и колонизировать остеобласты и иммунные клетки, такие как макрофаги и нейтрофилы [10], что затрудняет не только диагностику, но и лечение.
Доля других грамположительных возбудителей, стрептококков и энтерококков, составляет в среднем 10% в этиологической структуре ортопедической инфекции. В 8 - 10% случаев возбудителями ИАИ могут быть Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Proteus spp., Enterobacter spp., Acinetobacter spp. [1, 2, 4]. Полимикробная инфекция является причиной ИАИ в 16 - 32% случаев [13 - 15].
Успешное лечение большинства инфекционных заболеваний благодаря антибактериальной терапии, до настоящего времени не характерно для лечения инфекций костей и суставов, в том числе после ортопедических операций [9]. Основной причиной неудач считают физиологические и анатомические особенности костей, а также участие в патогенезе микробных биопленок, которые могут формироваться не только на имплантатах, но и на биологических тканях, к примеру, на отломках костей, секвестрах при развитии остеомиелита. Необходимо отметить, что в случае развития ПАИ наличие микроорганизмов в зоне перелома замедляет консолидацию и стимулирует резорбцию кости, что приводит к формированию псевдоартрозов и нестабильности синтезирующего устройства. Эти процессы обусловлены накоплением в зоне инфицированного перелома мембранного белка RANKL (Receptor Activator of Nuclear Factor Kappa-B Ligand), который является ключевым фактором дифференцировки и активации остеокластов. Белок экспрессируется на Т-лимфоцитах, активация которых приводит к производству цитокина, повышению остеокластогенеза и потере костной ткани [16 - 18].
Известно, что этиология ИАИ существенно влияет на выбор тактики лечения и прогноз его эффективности. Несмотря на незначительную долю грамотрицательных бактерий в общем спектре возбудителей ортопедической инфекции, их участие в этиологии существенно осложняет прогноз на выздоровление в связи с нарастающей во всем мире устойчивостью этой группы патогенов к антибиотикам [5, 19, 20]. Кроме того, для выбора хирургической тактики и антимикробной терапии значимой является идентификация трудных для эрадикации возбудителей, выбывающих трудноизлечимую перипротезную инфекцию (DTT - "Difficult-To-Treat"). К проблемным микробам относят рифампицин-устойчивые стафилококки, фторхинолон-устойчивые грамотрицательные бактерии и грибы (Candida sp.). В настоящее время не существует системных антибиотиков, активных в отношении указанных возбудителей в составе микробной биопленки, и поэтому следует выбирать длительный интервал (![]() 6 недель) между санирующей операцией с удалением эндопротеза и повторной его установкой или альтернативные методы хирургического лечения, к примеру, такие как резекционная артропластика тазобедренного сустава с мышечной пластикой несвободным мышечным лоскутом m. Vastus lateralis [21, 22]. Чувствительные к рифампицину** метициллиноустойчивые стафилококки в настоящее время также не относят к проблемным возбудителям, поскольку в отношении сформированных ими биопленок эффективна комбинированная терапия, включающая, как правило, ванкомицин** или даптомицин** в сочетании с рифампицином**.
6 недель) между санирующей операцией с удалением эндопротеза и повторной его установкой или альтернативные методы хирургического лечения, к примеру, такие как резекционная артропластика тазобедренного сустава с мышечной пластикой несвободным мышечным лоскутом m. Vastus lateralis [21, 22]. Чувствительные к рифампицину** метициллиноустойчивые стафилококки в настоящее время также не относят к проблемным возбудителям, поскольку в отношении сформированных ими биопленок эффективна комбинированная терапия, включающая, как правило, ванкомицин** или даптомицин** в сочетании с рифампицином**.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Гнойно-септические осложнения после переломов и операций на костях и суставах, в частности ППИ и ПАИ, создают значительную нагрузку на пациента, лечащего врача и систему здравоохранения в целом [23]. Имплантированные инородные тела являются серьезным пожизненным фактором риска развития бактериальной и грибковой инфекции. Ортопедические имплантаты в основном используются для фиксации костей при переломах и для эндопротезирования суставов. Принципиальным различием этих процедур является то, что внутренние фиксаторы нужны только временно и могут быть удалены после сращения перелома, а компоненты эндопротеза необратимо замещают поврежденный сустав [4].
Частота инфекционных осложнений после остеосинтеза переломов варьируется от 1,8% до 27% в зависимости от локализации и типа перелома. Закрытые и открытые переломы типа Густило I имеют самую низкую частоту инфицирования (1,8%), в то время как тяжелые высокоэнергетические открытые переломы нижних конечностей характеризуются высокой частотой инфицирования (27%), причем наиболее часто поражается большеберцовая кость [24]. Классификация открытых переломов Orthopaedic Trauma Association (OTA-OFC, 2010), по мнению международных экспертов, отвечает всем современным требованиям и позволяет прогнозировать вероятные осложнения [25]. Предрасполагающими факторами для возникновения инфекции после проведенного остеосинтеза являются: сахарный диабет, атеросклероз, алкоголизм, ожирение, курение, преклонный возраст, нарушение целостности кожных покровов над переломом [26 - 28].
Перипротезная инфекция является основной причиной ревизионных операций после ЭП КС и третьей - после ЭП ТБС, серьезной угрозой здоровью пациентов и составляет значительную долю расходов учреждений здравоохранения [23]. По данным Российского регистра эндопротезирования тазобедренного сустава НМИЦ ТО им. Р.Р. Вредена данная патология занимает ведущее место среди причин ревизионных операций [29]. Разнообразные клинические проявления ППИ, множество факторов, влияющих на развитие инфекционного процесса и эффективность лечения, скудные данные, полученные в ходе рандомизированных контролируемых исследований, являются причинами того, что многие вопросы лечения данного осложнения продолжают до сих пор оставаться актуальной темой дискуссий специалистов [30]. В настоящее время основными факторами риска развития ППИ считают сахарный диабет, инфекцию мочевыделительной системы, ВИЧ-инфекцию, онкологические заболевания, хронические болезни почек в стадии декомпенсации, ожирение, а также предшествующие операции в области эндопротезирования [30].
Несмотря на относительно невысокую частоту развития ППИ после первичного эндопротезирования (0,3 - 2,2%), в случаях повторных (ревизионных) операций риск развития ППИ возрастает в несколько раз, достигая 5,9 - 13,6%, а частота рецидивов при лечении уже существующей ППИ составляет 23,2 - 31,5% [7, 15, 16]. Экономическое бремя ППИ неуклонно растет, потому что количество пациентов с протезированными суставами постоянно увеличивается, а при наличии постоянного имплантата в организме риск развития гематогенной инфекции сохраняется пожизненно [9]. Несмотря на относительно низкую заболеваемость, инфекционные осложнения значительно ухудшают состояние больного, а финансовые затраты на их лечение остаются огромными: в США расходы на борьбу с перипротезной инфекцией увеличились с $320 млн. в 2001 г. до $566 млн. в 2009 г., а к 2020 г. их рост прогнозируют до $1,620 млрд. [33].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
T84.5 - Инфекция и воспалительная реакция, обусловленные эндопротезированием
T84.6 - Инфекция и воспалительная реакция, обусловленные внутренним фиксирующим устройством (любой локализации);
T84.7 - Инфекция и воспалительная реакция, обусловленные другими внутренними ортопедическими протезными устройствами, имплантатами и трансплантатами;
Z96.6 - Наличие ортопедических имплантатов суставов.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Любая классификация должна быть предназначена для рационального выбора тактики и определения прогноза лечения пациента. Кроме того, предполагается, что она сможет служить надежным инструментом для сравнения результатов лечения аналогичных клинических наблюдений в различных независимых группах больных. До настоящего времени нет единой классификации ни ППИ, ни ПАИ, объединяющей все необходимые признаки, которые лечащий доктор должен учитывать в ходе лечения.
1.5.1 Классификация ППИ
По глубине расположения инфекционного процесса ППИ, как и любую ИОХВ, можно разделить на [1]:
- поверхностную - включает только кожу и подкожную клетчатку,
- глубокую - вовлекает в инфекционный процесс периимплантные ткани, с вовлечением костной ткани, фасциального и мышечного слоев.
В настоящее время ряд исследователей указывает на отсутствие достоверных различий между поверхностной и глубокой ИОХВ в случае имплантат-ассоциированной инфекции [6, 34, 35]. Однако представляется преждевременным отказываться в повседневной работе от накопленного клинического опыта. Разделение ИОХВ, включая ППИ, на поверхностную и глубокую, позволяет в отдельных клинических случаях своевременно диагностировать поверхностную ИОХВ, уменьшить хирургическое вмешательство до иссечения пораженных мягких тканей в пределах фасции и отказаться от ревизии эндопротеза с сохранением функционирующего имплантата. Глубокая ИОХВ всегда требует ревизии эндопротеза при этом методику операции выбирают индивидуально в каждом конкретном случае.
По пути инфицирования эндопротеза патогенными микроорганизмами выделяют экзогенную и эндогенную ППИ. Основным путем экзогенного проникновения патогенов является интраоперационная контаминация раны и/или эндопротеза, в связи с чем данный тип ППИ называют послеоперационной. В большинстве стран данный путь развития ППИ считают основным в течение 90 дней после операции при отсутствии у больного других очевидных источников инфекции и рассматривают развившуюся инфекцию как осложнение операции [1, 2]. Эндогенное инфицирование реализуется перемещением патогенных микроорганизмов гематогенным или лимфогенным путем из имеющихся у пациента очагов хронической или острой инфекции, а также их транслокацией из просвета кишки. Риск развития эндогенной ППИ у пациента с постоянным ортопедическим имплантатом сохраняется пожизненно.
На сегодняшний день более рациональной представляется классификация, учитывающая современное представление о патогенезе инфекционного процесса [36], в основе которой лежит предложенное Zimmerli W. (2014) разделение ППИ на острую и хроническую [6]. Данная классификация является достаточно простой для использования и предполагает выбор оптимального хирургического вмешательства в зависимости от степени зрелости микробных биопленок на имплантате, которая определяется сроком манифестации инфекции и периодом существования симптомов (табл. 1).
Таблица 1 Классификация перипротезной инфекции по Zimmerli W. (2014) [6] с дополнениями Li at al. (2018) [36]
Характеристики
Тип перипротезной инфекции
Патогенез
Послеоперационная
(< 90 сут. после операции)
Острая
< 4 недель после операции (ранняя)
Хроническая
> 4 недель после операции (отсроченная, низко-вирулентная)
Гематогенная
(> 90 сут. после операции)
Острая
< 3 недель с момента манифестации симптомов
Хроническая
> 3 недель с момента манифестации симптомов
Зрелость биопленки
Острая
незрелая
Хроническая
зрелая
Хирургическое лечение
Острая
Санация инфекционного очага с заменой всех мобильных и сохранением фиксированных компонентов эндопротеза
Хроническая
Полное удаление эндопротеза (одно-, двух- или многоэтапная замена)
Широкое использование в рутинной клинической практике классификации ППИ D.T. Tsukayama (1996), основанной на времени манифестации инфекции и предполагаемом механизме инфицирования [37], показало, что отсутствие среди классификационных критериев периода существования инфекции с момента ее манифестации до оказания специализированной помощи не позволяет выбрать адекватную тактику хирургического лечения. Данное обстоятельство ставит под сомнение все потенциальные достоинства данной классификации и делает некорректным ее дальнейшее клиническое применение в условиях системы ортопедической помощи Российской Федерации. Существующая классификация McPherson E.J. et al. (2002) [38] учитывает также состояние пациента и локальный статус мягких тканей в области предстоящей операции. Однако временная характеристика ППИ в данной классификации не соответствует современному взгляду на патогенез ИАИ, что не позволяет рекомендовать ее для широкого применения.
1.5.2. Классификация ПАИ
В настоящее время профессиональным сообществом согласовано решение объединить всю инфекцию, развивающуюся в результате травм и/или их лечения в одно понятие перелом-ассоциированной инфекции (ПАИ) (https://icmphilly.com/trauma/). К сожалению, на сегодняшний день отсутствует общепризнанная согласованная классификация ПАИ. Однако мы посчитали необходимым ниже указать наиболее встречаемые классификационные критерии ПАИ в профильных публикациях.
По глубине инфекции целесообразно разделять ПАИ на поверхностную - поражение воспалительным процессом кожи и мягких тканей до фасции, и глубокую - подфасциальное поражение мягких тканей и кости [39].
Наибольшее распространение получило разделение ПАИ по времени манифестации на острую (до 2 недель после операции), отсроченную (3 - 10 недель) и позднюю инфекция (более 10 недель) [39 - 42], однако, наибольшую практическую значимость для выбора хирургической тактики имеет выделение именно острой инфекции.
Кроме того, существенную роль в определении тактики лечения играют вид и стабильность остеосинтеза: погружной или наружный, стабильный или нестабильный, а также определятся или не определяется консолидация перелома - наличие клинико-рентгенологических признаков костной мозоли (классификация-ICS Romano с соавторами, 2011 [43]). Кроме того, крайне важными моментами являются локальный статус тканей в области остеосинтеза, и общее состояние больного, что нашло свое отражение в актуальной до настоящего времени классификации хронического остеомиелита Cierny-Mader (1985 г.) [44]. Все вышеперечисленные характеристики ПАИ позволяют врачу - хирургу получить наиболее полную информацию о складывающейся клинической ситуации и принять решение о необходимом варианте лечения [16, 45, 46].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина ИАИ во многом определяется типом инфекции. В случае развития острой ИАИ присутствуют классические клинические симптомы воспаления, такие как локальный отек тканей, болезненность при пальпации, местное повышение температуры, гиперемия кожных покровов, нарушение функции, в совокупности с системными признаками инфекционного процесса: лихорадкой, повышением СРБ, СОЭ, лейкоцитозам. В случае развития хронической инфекции единственным неспецифическим симптомом неблагополучия может быть боль. Наиболее специфическими признаками развития ИАИ являются признаки глубокого поражения тканей: свищевой ход, гнойное отделяемое, абсцессы и обширный некроз.
2. Диагностика
Диагностика перипротезной и перелом-ассоциированной инфекции, особенно при ее хроническом течении, требует настороженности и профессионализма врача, так как никаких специфических симптомов может не быть [47]. Диагностический подход у пациентов с подозрением на ИАИ может быть вариабелен в разных МО, в зависимости от опыта врачей, наличия оборудования и локальных рекомендаций. Однако первым этапом является клиническое обследование и лабораторные исследования крови вместе рентгенографией. Следующим этапом у пациентов с подозрением на инфекционный процесс выполняют пункцию (существенно реже биопсию) возможного гнойного очага с микробиологическим (культуральным) исследованием раневого (гнойного) отделяемого в случае ПАИ или синовиальной жидкости при подозрении на ППИ, в последнем случае также целесообразно цитологическое исследование полученной синовиальной жидкости.
2.1 Жалобы и анамнез
Жалобы пациента с подозрением на ИАИ могут существенно различаться в зависимости от характера инфекционного процесса (острое или хроническое), от локализации и типа имплантата. При острых проявлениях пациентов могут беспокоить повышение температуры тела, боль, отек, гиперемия и гипертермия области установки имплантата. Однако наиболее чувствительным, но наименее специфичным клиническим симптомом ППИ является боль в области протезированного сустава [30] при отсутствии других проявлений инфекционного процесса. Каждый случай с болевым синдромом в области протезированного сустава, особенно в течение первых 2 - 3 лет после имплантации, должен рассматриваться как потенциально инфекционное осложнение вплоть до доказательства обратного. В раннем послеоперационном периоде после эндопротезирования или остеосинтеза перелома признаком неблагополучия может быть только длительное раневое отделяемое. При длительном течении не диагностированного ранее инфекционного процесса пациент может обратиться с жалобами на наличие свищевого хода, гнойного отделяемого и некроза в области, перенесенной ранее операции. Необходимо иметь в виду, что у пациентов с иммуносупрессией картина клинических проявлений инфекционного процесса часто бывает стертой [49].
Собирая анамнез при подозрении на ИАИ целесообразно выяснить дату предшествующей травмы/операции, наличие проблем с заживлением раны после имплантации, тип эндопротеза, уточнить наличие инфекции других локализаций, оценить клинические симптомы при обращении и их продолжительность, переносимость лекарственных препаратов, сопутствующую патологию, предшествующие результаты микробиологического исследования при их наличии и курсы полученной АБ терапии, включая местную антибактериальную терапию. [30, 31].
Признаки глубокого поражения тканей являются наиболее специфическими признаками. Важно отметить, что клинические результаты различаются в значительной степени в зависимости от типа вовлеченного крупного сустава, а также времени и манифестации ППИ (т. е. ранняя послеоперационная, острая гематогенная и хроническая) [48]. При подозрении на гематогенную ППИ необходим поиск возможных удаленных очагов инфекции, то есть проводится обследование кожных покровов, периодонта, верхних и нижних дыхательных путей, мочевыводящих путей. Существенное значение имеет наличие факторов риска, таких как иммуносупрессия, вследствие заболеваний или приема медикаментов, ревматические заболевания или предыдущие операции на тазобедренном суставе. ПАИ в отличие от перипротезной инфекции не имеет четких диагностических критериев и единого нозологического определения среди врачей. Это обусловлено тяжестью и разнообразием скелетной травмы, а также вариабельностью вариантов ее хирургического лечения [22, 28 - 31].
2.2 Физикальное обследование
- Врачу-травматологу-ортопеду или врачу-хирургу рекомендуется провести общий осмотр больного с подозрением на ИАИ на предмет выявления классических системных и локальных клинических симптомов воспаления [23, 24].
УДД 5 УУР С
Комментарии: при осмотре пациента с подозрением на ИАИ целесообразно оценить наличие признаков синдрома системной воспалительной реакции (SIRS), характеризующимся наличием как минимум двух из четырех клинических признаков: 1) температура выше 38 °C или ниже 36 °C 2) частота сердечных сокращений более 90 ударов в 1 минуту; 3) частота дыхания более 20 дыханий в 1 минуту; 4) количество лейкоцитов выше 12 x 109 или меньше 4 x 109 или количество незрелых форм нейтрофилов превышает 10% [56]. Наличие SIRS, как правило, требует проведения неотложных мероприятий по дренированию гнойного очага и назначения антибактериальной терапии для предупреждения дальнейшей генерализации инфекции. Несмотря на то, что в настоящее время нет исследований по оценке роли микробиологического исследования крови в диагностике перипротезной и перелом-ассоциированной инфекции. Однако, учитывая частое гематогенное происхождение любой ИАИ, у пациентов с лихорадкой и подозрением на инфекцию [115] целесообразно выполнить посев крови на стерильность.
Выполнение визуальной и пальпаторной оценки локального статуса в области установленного ранее имплантата позволит оценить состояние мягких тканей [26, 57]. Развитие ИАИ может сопровождаться классическими признаками воспаления: ограниченной припухлостью, локальной болезненностью, местным повышением температуры тканей, гиперемией кожных покровов и нарушением функции, расхождением краев раны и наличием свищевого хода, сообщающихся с костью и/или имплантатом, а также гнойного отделямого в области перелома и/или установки имплантата Наличие свищевого хода, связанного с костью или имплантатом, и\или гнойного отделяемого в области перелома, остеосинтеза или установки эндопротеза без другой известной причины, является абсолютным критерием наличия как перипротезной, так и перелом-ассоциированной инфекции [54]. Свищевой ход может быть охарактеризован как: (1) патологический канал в мягких тканях между костью или эндопротезом сустава и внешней средой, который точно или предположительно колонизирован бактериями; (2) его наличие может быть подтверждено прямой визуализацией кости или протеза, сообщением с внешней средой - выполнением фистулографии, УЗИ, КТ или МРТ [48]. В настоящее время нет сравнительных исследований, доказывающих, что свищевой ход с гнойными выделениями является абсолютным признаком ППИ, однако, с учетом естественной колонизации кожи, бактерии, безусловно, колонизируют открытый имплантат или кость. О значимости данных критериев свидетельствует их включение диагностические алгоритмы всех национальных профессиональных сообществ врачей, оказывающих помощь пациентам с ИАИ [30, 58 - 60].
- Пациентам с подозрением на ПАИ рекомендуется провести осмотр смежных суставов синтезированного сегмента конечности [39].
УДД 5 УУР С
Комментарии: Врачу - хирургу необходимо учитывать, что последствием инфицирования синтезирующего устройства может быть септический артрит смежных суставов, особенно в случаях непосредственного контакта имплантата и анатомических структур сустава.
2.3 Лабораторные диагностические исследования
2.3.1 Дооперационная диагностика
- Всем пациентам, поступившим для планового ревизионного эндопротезирования суставов, рекомендуется выполнение скрининга на наличие маркеров воспаления в сыворотке крови: исследования уровня C-реактивного белка в сыворотке крови и скорости оседания эритроцитов [61 - 64].
УДД 1 УУР А
- Всем пациентам с подозрением на ИАИ рекомендуется исследование уровня С-реактивного белка (СРБ) в сыворотке крови и исследование скорости оседания эритроцитов (СОЭ) [62, 63, 65].
УДД 3 УУР В
Комментарии: СРБ и СОЭ являются наиболее общепринятыми скрининговыми тестами в диагностике ППИ, они хорошо изучены и имеют высокую чувствительность. Их сочетание демонстрирует высокую диагностическую значимость для диагностики и последующего наблюдения за результатами лечения [61, 63, 66, 67]. Для диагностических целей рекомендовано пороговое значение 10 мг/л для СРБ и 30 мм/ч для СОЭ [30, 60]. В настоящее время в отношении ПАИ достоверность данных маркеров ограничена, поэтому полученные результаты необходимо интерпретировать взвешенно. По мнению большинства специалистов, для диагностики ПАИ наиболее чувствительным сывороточным маркером является СРБ [62, 65]. Несмотря на то, что на оба маркера могут влиять многочисленные факторы (неопластические и воспалительные заболевания, возраст и технические детали), если один из этих маркеров находится выше порогового значения, следует провести дальнейшие диагностические тесты для подтверждения или исключения ИАИ. Следует также отметить, что в настоящее время диагностика ИАИ не может основываться исключительно на серологических тестах [48], т.к. их нормальные значения не исключают ее наличие [59], а повышенные - не всегда являются проявлением инфекционного процесса, к примеру, у пациентов с системными заболеваниями (ревматоидный артрит, системная красная волчанка и пр.).
- Пациентам с подозрением на ППИ не рекомендуется исследование уровня прокальцитонина (ПКТ) в крови для подтверждения или исключения инфекционного процесса [68 - 70].
УДД 1 УУР А
Комментарии. В нескольких исследованиях, включающих и мета-анализ, не было установлено преимущества исследования уровня ПКТ в сравнении с СРБ и/или интерлейкина - 6 [68 - 70]. Определение ПКТ является обоснованным в случае подозрения на генерализацию инфекционного процесса у пациента с ИАИ (наличие признаков SIRS) для исключения или подтверждения сепсиса, а также для оценки эффективности его лечения.
- Пациентам с подозрением на ППИ не рекомендуется использовать определение концентрации Д-димера (D-димер) в крови для подтверждения или исключения инфекционного процесса [71].
УДД 3 УУР В
Комментарии. Несмотря на появление публикаций, предлагающих с целым рядом ограничений рассматривать D-димер как один из критериев хронической ППИ тазобедренного или коленного сустава [72], другие исследования не показывают его значимости в сравнении с традиционными маркерами воспаления (СОЭ и СРБ) [71]. D-димер повышается при ДВС-синдроме, легочной эмболии, тромбозе вен, заболеваниях сердца, ожогах, обширных хирургических вмешательствах, у беременных, пожилых людей, при онкологии, а также у лежачих больных (при продолжительной иммобилизации), при ревматоидном артрите. В связи с вышесказанным представляется нецелесообразным рутинно применять данный показатель для диагностики ИАИ.
- Пациентам с ИАИ с открытыми ранами и/или свищевыми ходами не рекомендуется брать тупфером (тампоном) образцы раневого (гнойного) отделяемого для его микробиологического (культурального) исследования на аэробные и факультативно-анаэробные микроорганизмы [73, 74, 113].
УДД 2 УУР В
Комментарии. При указанном способе взятия образца часто выявляется микрофлора кожных покровов, контаминирующая свищевой ход или открытую рану, в связи с чем полученные результаты могут быть неправильно интерпретированы [54, 74, 113, 114].
- Всем пациентам с подозрением на ППИ, а также поступившим для ревизионного эндопротезирования, рекомендуется выполнить пункцию синовиальной сумки сустава для проведения цитологического и/или микробиологического (культурального) исследования синовиальной жидкости на аэробные и факультативно-анаэробные микроорганизмы с целью подтверждения или исключения инфекционного процесса [77, 79].
УДД 3 УУР В
Комментарии. В настоящее время нет четких противопоказаний к пункции коленного или тазобедренного сустава, выполняемой в рамках обследования пациента с инфекцией [30]. Представляется целесообразным выполнение пункции при подозрении на острую ППИ, если диагноз не очевиден клинически; пациентам с хронической болью в протезированном суставе; а также больным, у которых повышен уровень СОЭ и/или СРБ или есть клинические признаки на ППИ. Цитологическое исследование синовиальной жидкости должно включать подсчет количества лейкоцитов и доли ПЯН, демонстрирующих в большинстве исследований и систематических обзорах высокую диагностическую значимость [46, 76 - 79]. Обоснованным представляется пороговое значение для количества лейкоцитов > 3000 клеток/мкл (по данным разных авторов от 1700 клеток/мкл до 5000 клеток/мкл), доля ПЯН > 70% является значимым критерием для установки диагноза ППИ (диапазон 65 - 80%) [58]. Цитологическое исследование синовиальной может быть выполнено в амбулаторных условиях, на его результаты в отличие от бактериального исследования не влияет антимикробная терапия [80]. Необходимо помнить, что у пациентов с перипротезными переломами и в первые 6 недель после эндопротезирования сустава, а также у пациентов с ревматоидным артритом, перипротезным переломом или при наличии пары трения металл-металл цитологическое исследование синовиальной жидкости может давать ложноположительные результаты [36, 81].
Многочисленные исследования и опубликованный систематический обзор демонстрируют для микробиологического (культурального) исследования синовиальной жидкости умеренную или высокую диагностическую чувствительность (43,5 - 100%) и высокую специфичность (81,2 - 100%) [62, 78, 82 - 89]. Рекомендуемое время инкубации образцов должно составлять не менее 7 дней, некоторые исследования рекомендуют продлить период инкубации до 2 недель [67, 74]. Следует учесть, что результаты культурального исследования могут быть ложноотрицательными из-за предшествующего использования антибиотиков, малого количества микроорганизмов, использования неподходящей питательной среды, наличия инфекции, обусловленной прихотливыми микроорганизмами, разведением синовиальной жидкости анестетиком или нарушениями правил транспортировки образцов в лабораторию. Известно, что диагностическая чувствительность культурального исследования на фоне антибактериальной терапии существенно снижается [74, 91, 92]. Приостановка антибактериальной терапии как минимум за 2 недели до тия синовиальной жидкости, а также четкое соблюдение методологии культурального исследования и правил доставки образцов в лабораторию повышает вероятность выделения возбудителей.
В плане установления микробиологического диагноза молекулярные методы исследования (ПЦР) показали преимущество над традиционным культуральным исследованием только в случае обследования пациентов с инфекцией, обусловленной низковирулентными возбудителями [93, 94]. Кроме того, в случаях обследования пациентов с культуронегативной ИАИ определенную роль отводят секвенированию следующего поколения (next-generation sequencing - NGS).
- Пациентам, у которых предшествующий диагностический поиск не дал убедительных результатов за или против наличия ППИ, рекомендуется с целью подтверждения или исключения инфекционного процесса определить в синовиальной жидкости один из биомаркеров воспаления: альфа-дефензин [48, 64 - 67], лейкоцитарную эстеразу [97 - 100], ИЛ-6 [90, 96, 101 - 104], D-лактат [105, 106] и С-реактивный белок [63, 66, 76, 97, 107, 108]
УДД1 УУР А
Комментарии. Определение биомаркеров характеризуется высокой диагностической значимостью, однако, надо помнить, что наличие в аспирационной жидкости следов крови может привести к ложно-положительным, а наличие у пациента свищевого хода - ложно-отрицательным результатам. Предполагают, что данные маркеры подвергаются меньшему влиянию предшествующей антибактериальной терапии, чем результаты микробиологического исследования. Большинство исследований с использованием альфа-дефензина демонстрирует высокую чувствительность и специфичность (95,5 - 100% и 95 - 100% соответственно) данного метода [48, 64 - 67], однако, данный тест является дорогостоящим и не может быть доступен в каждом МО. Кроме того, при инфекции, обусловленной некоторыми низковирулентными бактериями, к примеру, Cutibacterium acnes (ранее Propionibacterium acnes), может не наблюдаться повышение уровня альфа-дефензина [109].
Лейкоцитарная эстераза, также демонстрирует высокую диагностическую значимость, с чувствительностью 66 - 100% и специфичностью 77 - 100% в нескольких исследованиях [97 - 100] при невысокой стоимости, простоте выполнения анализа и возможности предоставления результатов в режиме реального времени.
ИЛ-6 показал лучшую диагностическую значимость при определении его в синовиальной жидкости, чем в сыворотке крови. Несколько исследований высокого уровня показали для данного маркера чувствительность 62,5 - 97% и специфичность 85.7 - 100% [90, 96, 101 - 104]. Однако данный тест также отличается высокой стоимостью. Еще одним серологическим маркером, который можно использовать для диагностики ППИ, является D-лактат, повышенное количество которого в синовиальной жидкости свидетельствует о наличии бактериальной инфекции [105, 106]. Однако до настоящего времени широкого применения данный тест не нашел.
Уровень СРБ можно измерить в сыворотке крови и в синовиальной жидкости. СРБ в синовиальной жидкости продемонстрировал диагностическую чувствительность 70 - 97,3% и специфичность 78,6 - 100% в целом ряде исследований высокого уровня [63, 66, 76, 97, 107, 108]. Однако, необходимо помнить, что нормальный уровень СРБ в синовиальной жидкости не исключает ППИ, так как СРБ вырабатывается в печени, а не в суставах, и принимать во внимание результаты физикального обследования и анамнез, поскольку СРБ - это неспецифический маркер острого воспаления.
- Пацентам с ПАИ или подозрением на нее рекомендуется выполнить пункцию возможного гнойного очага с последующим микробиологическим (культуральным) исследованием раневого (гнойного) отделяемого на аэробные и факультативно-анаэробные микроорганизмы [60, 110, 112].
УДД 5 УУР C
Комментарии. В настоящее время двукратное выделение одинаковых микроорганизмов из области перелома или остеосинтеза принято считать одним из абсолютных признаков ПАИ. При наличии патологического экссудата в зоне перелома и/или полости смежного сустава, его необходимо пунктировать и отправить для микробиологического (культурального) исследования [39, 60, 110, 112].
- Пациентам с диагностированной ИАИ рекомендуется выполнение перед операцией и в послеоперационном периоде на фоне антибактериальной терапии проведение лабораторного обследования в объеме: общий (клинический) анализ крови, исследование уровня СРБ в сыворотке крови, исследование СОЭ, исследование уровня общего белка в крови, исследование уровня креатинина в крови, исследование уровня общего билирубина в крови, исследование уровня глюкозы в крови, а также определение активности аланинаминотрансферазы (АЛТ) в крови [31].
УДД 5 УУР С
2.3.2 Интраоперационная диагностика
- Пациентам с ортопедическими имплантатами при выполнении ревизионной операции, в том числе реэндопротезирования, при подозрении на ИАИ рекомендуется выполнить при наличии возможности срочное интраоперационное патолого-анатомическое исследование операционного материала (периимплантных тканей), для подтверждения или исключения инфекционного процесса и возможного изменения тактики хирургического лечения [116, 117].
УДД 2УУР А
Комментарии. Наличие картины острого воспаления при срочном патолого-анатомическом исследовании замороженных образцов перипротезных тканей, описываемой врачом-патоморфологом, с высокой вероятностью свидетельствует о наличии ППИ. В настоящее время разработаны гистологические критерии для подтверждения инфекционного процесса в тканях. Так согласно критерию Фельдмана - выявление более 5 нейтрофилов не менее чем в 5 полях зрения при микроскопном увеличении x400, свидетельствует о наличии ИАИ [116, 117]. Кроме того, патолого-анатомическое исследование операционного материал с использованием специфических методов окрашивания позволяет идентифицировать бактерии и грибы [118].
- Пациенту с подтвержденной или подозреваемой ИАИ рекомендуется интраоперационное взятие не менее трех образцов перипротезных тканей, а также удаленные имплантаты для дальнейшего микробиологического (культурального) исследования гнойного отделяемого на аэробные и факультативно-анаэробные микроорганизмы [74, 119, 120].
УДД 2 УУР B
Комментарии. Культуральное исследование образцов тканей, а также соникационной жидкости после обработки удаленных имплантатов ультразвуком имеет важное значение для дифференцировки контаминации от инфекции. При проведении культивирования тканевых биопратов во флаконах для культивирования крови достаточно трех биоплатов, при использовании стандартных методик культивирования не менее четырех образцов периимплантной ткани [120]. Рост вирулентного микроорганизма (например, S. aureus, K. pneumoniae) хотя бы в одном из образцов биоматериала (аспират, тканевой биоптат, удаленный компонент) является диагностическим критерием ППИ. Выделение одного и того же низковирулентного микроорганизма (к примеру, S.epidermidis, Propionibacterium acnes), неотличимого на основании результатов общепринятых лабораторных тестов, включая генную и специальную идентификацию и антибиотикограмму, из двух и более тканевых биоптатов или из синовиальной жидкости и одного интраоперационного тканевого биоптата или удаленного имплантата (компонента эндопротеза) подтверждают наличие ИАИ [32, 39, 54, 74]. При этом выделение низковирулентного возбудителя из одного образца биоматериала или удаленной конструкции не рекомендовано однозначно расценивать как подтверждение ИАИ и следует оценивать в комплексе с другими результатами обследования. Культуральное исследование жидкости после ультразвуковой обработки удаленных имплантатов может повысить точность микробиологического диагноза, в том числе у пациентов, получающих антимикробную терапию [92, 112, 121, 122]. Полученные результаты позволят в раннем послеоперационном периоде установить окончательный микробиологический диагноз и скорректировать антибактериальную терапию [4].
- Пациенту с ортопедическим имплантатом во время выполнения ревизионной операции по его замене рекомендуется взятие нескольких образцов перипротезных тканей для дальнейшего патолого-анатомического исследования операционного материала [117, 123 - 125].
УДД 2 УУР В
Комментарии. В соответствии с международными критериями патолого-анатомическое исследование биопсийных/операционных материалов является составной частью диагностики ИАИ [50, 60, 123]. Среди существующих методик подсчета клеток наибольшую значимость для диагностики инфекции продемонстрировал метод определения нейтрофильных гранулоцитов с применением разных видов окрашивания в нескольких полях зрения при микроскопии с большим увеличением - HighPower-Fields (HPF). В настоящее время доказано наличие прямой корреляционной связи между количеством нейтрофильных гранулоцитов и наличием бактериальной инфекции, а также определены диагностические критерии. В основе диагностики ППИ лежит метод подсчета нейтрофильных гранулоцитов в SLIM (synovial-like interface membrane = синовиально-подобной поверхностной мембране) и согласно классификации Кренна и Моравица [125] наличие мембраны II (инфекционного) или III (смешанного) типа свидетельствует о перипротезной инфекции, даже без каких-либо других клинических или лабораторных проявлений [21, 125].
2.4 Инструментальные диагностические исследования
- Всем пациентам с подозрением на ИАИ рекомендуется выполнить рентгенографию пораженного сегмента скелета (А06.03.057) с установленным имплантатом [126, 127].
УДД 5 УУР С
Комментарии. Рентгенологическое обследование пораженного сегмента скелета при развитии перипротезной или перелом-ассоциированной инфекции в раннем послеоперационном периоде, как правило, диагностически незначимо, но может помочь исключить другие заболевания сустава [19, 21, 25].
В настоящее время имеется ограниченное количество исследований, посвященных специфическим рентгенологическим признакам для диагностики хронической ПАИ, при рентгенологическом обследовании необходимо обращать внимание на признаки остеолиза, миграцию имплантата, секвестрацию, отсутствие консолидации, периостальную реакцию вне зоны перелома.
При хронической ППИ рентгенография может показывать расшатывание компонентов эндопротеза, однако, как правило, при отсутствии остеомиелита по одной рентгенологической картине очень затруднительно провести дифференциальную диагностику между инфекционным процессом и асептическим расшатыванием компонентов эндопротеза. Признаки расшатывания эндопротеза, выявленные на ранних сроках после установки протеза, могут служить косвенным признаком инфекционной природы патологического процесса [48].
При свищевых формах ПАИ и ППИ обязательным методом исследования является фистулография, позволяющая уточнить расположение свищевых ходов, локализацию гнойных затеков и их связь с очагами деструкции в костях путем заполнения их контрастным веществом с последующей рентгенографией [32, 54]. На основании контрастной фистулографии возможна дифференциальная диагностика поверхностной и глубокой форм ИАИ. Рекомендуемые показания для выполнения фистулографии:
1. необходимость уточнения протяженности свищей и разветвлений свищевого хода;
2. подозрение на соединение свищевого хода с органами и тканями;
3. необходимость обнаружения затеков в мягкие ткани.
Противопоказаниями к выполнению являются: тяжелое общее состояние больного и непереносимость рентгенконтрастных веществ. Контрастные вещества, которые используют при фистулографии, могут быть масляными растворами органических соединений йода (йодолипол, липийодол) или его водорастворимыми соединениями (кардиотраст, урографин).
- Пациентам с подозрением на ИАИ, у которых не удалось получить синовиальную жидкость/раневое отделяемое из очага предполагаемой инфекции, рекомендуется выполнить повторную пункцию синовиальной сумки сустава и/или пункцию мягких тканей под контролем ультразвукового исследования (УЗИ) для получения синовиальной жидкости и/или раневого (гнойного) отделяемого и его последующего микробиологического (культурального) исследования на аэробные и факультативно-анаэробные микроорганизмы [128, 129]
УДД 2 УУР B
Комментарии. Выполнение пункции области предполагаемого очага инфекции под контролем УЗИ помогает определить месторасположение инфицированной гематомы или абсцесса и получить необходимые образцы патологического содержимого для микробиологического исследования и верификации возбудителя [54, 124].
- Пациентам с подозрением на ИАИ не рекомендуется рутинно использовать для выявления инфекционного процесса спиральную компьютерную томографию (СКТ) (А06.14.017 компьютерная томография сустава или A07.03.003 однофотонная эмиссионная компьютерная томография костей), магнитно-резонансную томографию (А05.04.001 магнитно-резонансная томография суставов (один сустав) или A05.03.001 магнитно-резонансная томография костной ткани (одна область)), трехфазную сцинтиграфию мягких тканей и костей, сцинтиграфию с туморотропными РФП полипозиционную, однофотонную эмиссионную компьютерную томографию с туморотропными РФП, позитронную эмиссионную томографию, совмещенную с компьютерной томографией с туморотропными РФП с контрастированием [54, 81, 130].
УДД 5 УУР С
Комментарии: Однозначным показанием к выполнению СКТ при ППИ служит дефект костей, образующих вертлужную впадину. При смещении вертлужного компонента кнутри от линии Келлера рекомендовано выполнение СКТ в сосудистом режиме с целью изучения взаимного расположения конструкций эндопротеза и внутритазовых органов. СКТ необходима для планирования хирургического вмешательства, обеспечивает подробными данными об архитектуре кости, характере перелома, признаках остеогенеза, остеонекроза, нестабильности имплантата. Кроме того, СКТ выявляет дополнительные симптомы ИАИ: периостальную реакцию кортикальной кости, наличие секвестров, внутрикостного свища или образование абсцесса в кости или прилегающих мягких тканях [131 - 133].
Магнитно-резонансная томография пораженной части скелета является методом выбора, позволяет оценить локализацию, границы поражения мягких тканей, дает дополнительную информацию о развитии инфекционного воспаления в костномозговом канале [41]. Однако в случае ИАИ, артефакты от металла затрудняют интерпретацию данных в то время, как рубцы, послеоперационный отек, посттравматические дефекты кости могут имитировать инфекцию [134].
Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием - существенно расширяет возможности диагностики точной локализации ИАИ, указывает границу инфекционного воспаления кости и мягких тканей, позволяет оценить консолидацию перелома, ремоделирование кости, реакцию тканей на воспаление [135]. Помимо визуального анализа (расположение зон поглощения, полостей поглощения, степень поглощения), метод делает доступной также полуколичественную оценку путем измерения стандартизированных значений поглощения при реконструкции изображений [136]. Системные обзоры литературы установили широкие колебания диапазона чувствительности 28% - 91% и специфичности 34% - 97%, что связано с различиями в дизайне исследования и критериями интерпретации данных. Еще одним ограничением методики является период времени после операции. Так, выполнение данного исследования менее чем через один месяц после хирургического вмешательства было связано со значительным увеличением ложноположительных результатов [136], что не позволяет окончательно определить его роль в диагностике ИАИ, что подлежит уточнению в дальнейшем [137 - 139].
Трехфазная сцинтиграфия до последнего времени наиболее широко применялась, как метод скрининговой диагностики ИАИ. Однако в течение 5 лет после имплантации эндопротеза тазобедренного или коленного сустава диагностическая точность сцинтиграфии у пациентов с подозрением на инфекцию остается низкой, так как метод не позволяет дифференцировать ИАИ и посттравматические изменения кости [140].
2.5 Иные диагностические исследования
Своевременно выявление у пациента после установки ортопедического имплантата признаков развития инфекции в области хирургического вмешательства и проведение последующих лечебных мероприятий в большинстве случаев позволяет сохранить имплантат, предупредить развитие глубокой ИАИ или хронизацию инфекционного процесса
- Пациентам с установленным имплантатом рекомендуется расценивать развитие в раннем послеоперационном периоде местных и системных клинико-лабораторных признаков инфекционно-воспалительного процесса, а также наличие отделяемого из раны более 72 часов после операции, как признак начинающейся ИАИ [48]
УДД 5 УУР С
Комментарии: Развитие местных (гиперемемия, отек, гипертермия, нарушение функции) и системных (лихорадка, вираж СРБ после 5-х суток после операции, нарастание лейкоцитоза и пр.) признаков инфекционно-воспалительного процесса при отсрочке адекватного лечения, включая ревизию послеоперационной раны при необходимости, в значительной доли случаев ведут в последствии к развитию хронической ИАИ. Указанные признаки могут быть манифестацией не только ранней послеоперационной, но и острой гематогенной инфекции, если их продолжительность длится не более 3 недель [36].
- При подозрении на ИОХВ в раннем послеоперационном периоде у пациента с установленным ортопедическим имплантатом рекомендуется выполнить микробиологическое (культуральное) исследование гнойного (раневого) отделяемого и/или тканевых биоптатов жизнеспособных тканей на аэробные и факультативно-анаэробные микроорганизмы [48].
УДД 5 УУР C
Комментарии. Необходимо выполнить взятие биоматериала до начала антибактериальной терапии или непосредственно перед введением очередной дозы антибиотика [1]. Отсутствие роста микроорганизмов не означает отсутствие инфекции. При этом само по себе обнаружение в ране бактерий не может служить подтверждением наличия раневой инфекции. Наиболее важным критерием наличия инфекционного процесса в ране является клиническая картина. Выделение микроорганизма (или ассоциации) на фоне отека, гиперемии, боли в области острой раны свидетельствует в пользу его этиологической значимости. Выделение бактерий из раны на фоне активного репарационного процесса свидетельствует лишь о колонизации раневой поверхности или ее контаминации [1].
- У пациентов перенесших эндопотезирование в течение первых 6 недель после операции не рекомендуется проведение цитологического исследования синовиальной жидкости с целью подтверждения или исключения ППИ [142].
УДД 3 УУР В
Комментарии. Выполнение подсчета лейкоцитов в первые 6 недель после эндопротезирования приведет к получению недостоверных результатов [142].
3. Лечение
Окончательное решение по варианту лечения должен принимать врач-травматолог-ортопед, в сложных случаях совместно с другими специалистами (например, врачом - пластическим хирургом, врачом - клиническим фармакологом, врачом - инфекционистом). Успешное лечение ИАИ включает комбинацию адекватной хирургической тактики и антимикробной терапии, активной в отношении возбудителей данного инфекционного процесса. Выбор неверной хирургической тактики и/или нерациональное применение антибиотиков являются наиболее частыми причинами персистирующего и рецидивирующего характера течения инфекционного процесса. Во многом выбор тактики лечения определятся патогенезом ИАИ, а именно стадией зрелости микробной биопленки, о чем говорилось ранее. Необходимо отметить, что между ППИ и ПАИ существует целый ряд принципиальных отличий, оказывающих влияние на тактику лечения. В настоящее время отсутствуют общепринятые критерии и стандартные подходы для лечения ПАИ. При этом в сравнении с ППИ перелом-ассоциированная инфекция, как правило, характеризуется:
- худшим состоянием перифокальных тканей, что определяется характером и тяжестью травмы,
- необходимостью повторных операций для коррекции фиксации, закрытия мягкотканых дефектов и т.д.,
- необходимостью обеспечения биомеханической стабильности поврежденного сегмента конечности,
- более частым назначением стартовой эмпирической антибактериальной терапии, в связи с выделением возбудителя в большинстве случаев только из интраоперационно забранных образцов.
Существенным преимуществом в сравнении с ППИ является то, что внутренние и фиксирующие устройства при ПАИ могут быть удалены по достижении сращения перелома.
3.1 Консервативное лечение
Консервативное лечение на дооперационном этапе должно быть направлено на купирование болевого синдрома с применением в зависимости от его выраженности - НПВП и/или парацетамола**, при их неэффективности - опиоидные анальгетики, а также на подготовку пациента к большому оперативному вмешательству, что подразумевает компенсацию сопутствующей патологии [49, 54]. После ревизионных операций по поводу ИАИ на костях и суставах нижних конечностей и позвоночнике, как и после любых больших ортопедических операциях на опорно-двигательном аппарате пациенту необходимо проводить фармакологическую профилактику венозных тромбоэмболических осложнений с применением антитромботических препаратов (АТХВ01А) [111], а также симптоматическую терапию, включающую адекватное обезболивание, нутриционную поддержку, препараты железа и системную антибактериальную терапию [203], инфузионная терапия для коррекции ОЦК и электролитных нарушений; а также при необходимости препараты для терапии сопутствующей патологии.
- Пациентам, с гипопротеинемией и/или снижением нутриционного статуса, рекомендуется коррекция этих нарушений для снижения риска неблагоприятного исхода лечения [143, 144].
УДД 5 УУР C
Комментарии. В настоящее время неопровержимым является факт, что снижение нутриционного статуса, в том числе гипоальбуминемия, являются неблагоприятным прогностическими признаками для исхода ревизионных операций [143, 144], что является основанием для назначения таким пациентам нутритивной поддержки (АТХ B05BA01 Аминокислоты**, АТХ B05AA01 Альбумин**) и препаратов железа для парентерального применения (АТХ B03AC).
- Всем пациентам с умеренным или выраженном болевом синдроме после ревизионных операций на опорно-двигательном аппарате рекомендуется назначение обезболивающих: НПВП, парацетамола**, опиоидных анальгетиков [145];
УДД 2 УУР А
Комментарии. Мультимодальная анальгезия, определяемая как использование различных анальгетических препаратов и методов, нацеленных на различные механизмы действия в периферической и/или центральной нервной системе, может иметь аддитивные или синергические эффекты и более эффективное облегчение боли по сравнению с одномодальными методами. Для каждой конкретной ситуации возможны различные мультимодальные комбинации и режимы в зависимости от объема конкретной операции и индивидуальных особенностей пациента. Системная терапия может сочетаться с локальным введением местных анестетиков, а также выполнением регионарной или нейроаксиальной анестезии, особенно для предупреждения интенсивных болей в раннем послеоперационном периоде. Системные опиоиды требуются не всем пациентам [145].
- Пациентам с ИАИ в большинстве случаев при отсутствии противопоказаний рекомендуется назначение комбинированной длительной (не менее 6 недель) большедозной антибактериальной терапии для усиления антимикробного эффекта, активности в отношении микробных биопленок и внутриклеточно расположенных возбудителей [146 - 155].
УДД 2 УУР А
- Пациентов с ИАИ в послеоперационном периоде при положительной клинико-лабораторной динамике на фоне курса парентеральной антибактериальной терапии рекомендуется переводить на пероральный прием антибактериальных препаратов системного действия с высокой биодоступностью [156].
УДД 2 УУР В
- Пациентам, у которых ИАИ вызвана полирезистентными штаммами возбудителей, при рецидивирующем течении инфекции, а также при наличии противопоказаний или развитии нежелательных явлений при приеме антибактериальных препаратов рекомендовано выполнить консультацию специалиста по антимикробной химиотерапии (клинического фармаколога или инфекциониста) [157].
УДД 5 УУР C
Комментарии. Основой антибактериальной терапии ИАИ является стационарное внутривенное введение (продолжительностью 7 - 14 дней) препаратов с последующим переходом на пероральный прием преимущественно бактерицидных антибиотиков с хорошей биодоступностью [158]. Для пациентов с ППИ, которым выполнена санирующая операция с сохранением имплантата или его одноэтапной заменой рекомендуется продленный до 3-месяцев курс лечения [155, 319]. Данная продолжительность комбинированной терапии показала сходную эффективность в сравнении с 6 месячным курсом терапии у пациентов с сохранением эндопротеза коленного или тазобедренного сустава в нескольких клинических исследованиях, включая рандомизированные [147, 148, 151]. В случае двухэтапного лечения ППИ общепринятой является продолжительность курса АБТ до 6 - 8 недель после каждого этапа в зависимости от характера инфекционного процесса [21, 54, 159]. На основе собственных разработок [4, 21, 54] и рекомендаций европейских коллег [159] сформированы перечни препаратов для этиотропной антибактериальной терапии (Приложение А3.1), которые составлены с учетом накопленных к настоящему времени знаний о патогенезе ППИ, результатах мониторинга чувствительности возбудителей АИА к антибиотикам и известных способах воздействия на микробные биопленки.
В отношении ПАИ не существует сравнительных исследований, определяющих продолжительность антибактериального лечения. Согласительные рекомендации экспертов предлагаю назначать АБТ при удалении имплантата и лечении остеомиелита в течение 6 недель, при одно- или двухэтапной замене имплантата - 12 недель [158, 159]. У пациентов с отсроченной инфекцией продолжительность курса антибиотиков индивидуальна и может продолжаться в течение всего периода сращения перелома и 1 - 2 недели после удаления фиксирующей системы ортопедической [158]. Необходимо регулярно оценивать консолидацию кости и удалить имплантат после сращения перелома, что может существенно сократить курс АБТ. Помимо активности антибактериального препарата в отношении установленного возбудителя инфекции, необходимо учесть со стороны пациента: лекарственную непереносимость в анамнезе, функцию почек и печени, возможность принимать препарат внутрь. Для профилактики антибиотико-ассоциированного колита целесообразно рассмотреть назначение препаратов из группы противодиарейных микроорганизмов.
На фоне длительных курсов антибактериальной терапии показан периодический мониторинг их эффективности (исследование СОЭ в крови, уровня СРБ в сыворотке крови) и безопасности (выполнение в зависимости от выбранных препаратов исследования уровня креатинина в сыворотке крови и/или определение активности АЛТ, а также выполнение общего (клинического) анализа крови), для своевременного выявления нежелательных реакций со стороны почек, печени или костного мозга [32, 54].
- Пациентам с ИАИ рекомендуется назначение стартовой эмпирической антибактериальной терапии широкого спектра, включающего метициллин-резистентные стафилококки и с учетом результатов дооперационного микробиологического (культурального) исследования синовиальной жидкости и/или раневого (гнойного) отделяемого, и последующей коррекцией после получения результатов микробиологического (культурального) исследования костной ткани на аэробные и факультативно-анаэробные микроорганизмы и, если применимо, удаленного имплантата [160].
УДД 4 УУР C
Комментарии: Антибактериальная терапия может быть: эмпирической и этиотропной. Эмпирическую АБТ проводят активными в отношении ведущих грамположительных и грамотрицательных возбудителей ИАИ препаратами, перечень которых определяется на основе локального микробиологического мониторинга в МО. Однако с учетом ведущей роли стафилококков в этиологии ортопедической инфекции и распространенности метициллинорезистентных штаммов, целесообразно включать в состав эмпирической терапии препараты активные в отношении данных возбудителей. В настоящее время отмечают снижение клинической эффективности ванкомицина**, в связи с чем необходимо рассмотреть возможность назначения альтернативных препаратов с анти-MRS-активностью, к примеру, #даптомицина** (в дозе 8 - 10 мг/кг/сут внутривенно [150, 151] или #линезолида** (в дозе 600 мг 2 раза в сутки внутривенно) [161, 162]. Несмотря на то, что ни один из них не имеет зарегистрированного показания при лечении инфекции костей и суставов, уже накоплен практический опыт их применения при лечении профильных больных. Данные препараты демонстрируют хорошее проникновение в костную ткань и эффективность при назначении в составе комбинированной терапии, к примеру, с рифампицином** [149 - 152]. Однако инфекции костей и суставов обычно требуют длительного лечения, в связи с чем применение #линезолида** более 4 недель остается спорным, т.к. необходимо учитывать серьезные побочные эффекты при его длительном приеме: периферическую невропатию, неврит зрительного нерва и угнетение костного мозга. Что касается #даптомицина** (в дозе 8 - 10 мг/кг/сут внутривенно [150, 151], то в настоящий момент недостаточно клинических данных, чтобы окончательно оценить его роль в лечении ИАИ. Так имеющиеся данные указывают на схемы лечения с дозами от 8 мг/кг до 10 мг/кг один раз в день и комбинацией с рифампицином** [12], но при этом требуется мониторинг его серьезных нежелательных эффектов.
В отношении грамотрицательных возбудителей ИАИ наибольшую активность проявляют цефоперазон + [сульбактам]** и препараты группы карбапенемов [5, 7, 48]. После получения результатов культурального исследования тканевых биоптатов и удаленных конструкций проводят коррекцию АБТ с переходом с эмпирической на этиотропную. В связи с частым выделением микробных ассоциаций именно из тканевых биоптатов, только после получения результатов их интраоперационных посевов целесообразно считать этиологию инфекции окончательно установленной.
Пероральным АБП, высокоактивным в отношении стафилококковых биопленок, является рифампицин**, который в связи с быстрым развитием к нему резистентности необходимо (согласно инструкции к применению) назначать только в составе комбинированной терапии. Наиболее активной комбинацией пероральных препаратов при стафилококковой ИАИ является комбинация рифампицина** с фторхинолонами [163]: #левофлоксацином** (в дозе 0,5 г 2 раза в сутки или 0,75 г 1 раз в сутки внутрь [21, 146, 283]) или #моксифлоксацином** (в дозе 400 мг 1 раз в сутки внутрь [164]). Бактериостатических АБП, таких как клиндамицин** при ППИ следует избегать, если есть возможность назначения препаратов с бактерицидным действием.
Применение высоких доз АБП является еще одной особенностью антибактериальной терапии ИАИ, что связано с необходимостью создания в очаге инфекции концентраций препаратов, активных не только в отношении планктонных, но и сессильных форм бактерий в составе биопленок. На фоне длительной высокодозной антибактериальной терапии рекомендован контроль функции печени и/или почек для своевременного выявления нежелательных эффектов не только на стационарном, но и амбулаторном этапе.
Из-за образования микробной биопленки и перехода бактерий в сессильную фазу с пониженным метаболизмом в терапии ИАИ эффективным в отношении них может быть только ограниченный перечень АБП, обладающих антибиоптеночной активностью. В настоящее время в него включены: активный в отношении стафилококков рифампицин**, в отношении грамотрицательных бактерий - фторхинолоны и проявляющий высокую эффективность при энтерококковых инфекциях #фосфомицин**. Устойчивые к указанным препаратам штаммы в настоящее время классифицируют как трудные для эрадикации возбудители (ТЭВ-возбудители). Лекарственных средств, высоко активных в отношении биопленок, сформированных указанными патогенами, на современном этапе развития медицины не существует [21, 159]. Наибольшую проблему представляет выбор препаратов для антибаткриальной терапии ИАИ, обусловленной фторхинолон-резистентными штаммами грамотрицательных возбудителей (представители сем. Enrerobacteriaceae, P.aeruginosa, Acinetobacter spp. и др.) или микробными ассоциациями с их участием. Причиной этого является невозможность назначения этиотропной пероральной пролонгированной антибактериальной терапии на амбулаторном этапе [5]. Этим обусловлена более низкая эффективность лечения инфекции, вызванной данными возбудителями [5, 48, 165 - 167]. У пациентов с рецидивирующей ИАИ, обусловленной полирезистентными, включая карбапенем-устойчивые, и панрезистентными штаммами целесообразно рассмотреть включение в состав терапии альтернативные антибактериальные препараты, обладающие активностью в отношении выделенных возбудителей, или комбинацию 2 - 3 препаратов в максимально возможных дозах, в спектр активности которых входят выделенные патогены, для преодоления механизмов их резистентности (Приложение А3.1) [5, 168]
- При ревизии и санации гнойного очага пациенту с ИАИ рекомендуется начинать антибактериальную терапию интраоперационно после взятия образцов на микробиологическое (культуральное) исследование клинического материала и удаленных конструкций, если состояние больного не требует немедленного начала терапии [7, 48, 54].
УДД 5 УУР C
- Пациенту с ИАИ при отсутствии тяжелого течения инфекции с риском генерализации процесса и развитием системной воспалительной реакции, сепсиса, не рекомендуется назначение антибактериальной терапии до санирующей операции и взятия образцов биоматериала и удаленных имплантатов для микробиологического (культурального) исследования [7, 48, 54].
УДД 5 УУР C
Комментарии. Консервативное лечение ИАИ при отсутствии адекватной санации очага инфекции не позволяет купировать инфекционный процесс. Без удаления инфицированного имплантата антибактериальную терапию следует назначать только тем пациентам с хронической ППИ и ПАИ, у которых высокий риск генерализации процесса, или, которые могут не перенести оперативное вмешательство (септическое состояние и/или выраженная сопутствующая патология и т.д.) до стабилизации состояния или длительно, иногда пожизненно. Также назначение АБТ возможно в случае ПАИ, когда имплантат обеспечивает стабильную фиксацию перелома и сращение кости возможно на фоне инфекционного процесса, контролируемого АБТ [159]. На этапе реимплантации эндопротеза при двухэтапном лечении ППИ введение антибиотиков целесообразно начинать за 30 - 40 мин. до разреза, согласно принципам профилактики хирургических инфекций. При этом выбор препаратов необходимо основывать на выделенном ранее возбудителе [32, 53, 154].
- Пациентам с тяжелым течением сопутствующих заболеваний, которые могут не перенести оперативное вмешательство рекомендуется назначение супрессивной пероральной антибактериальной терапии постоянно (от нескольких месяцев до пожизненной) АБТ без выполнения радикального хирургического вмешательства по решению мультидисциплинарной группы специалистов [170 - 172].
УДД 4 УУР C
Комментарии: Решение о выборе данного метода лечения целесообразно принимать мультидисциплинарной группой врачей, когда у пациента с тяжелыми сопутствующими заболеваниями в стадии декомпенсации невозможно выполнение радикального хирургического вмешательства [36, 173]. Основными задачами такого подхода является снижение симптомов острого инфекционного процесса, предотвращение генерализации инфекции и поддержка функционирования сустава. Эффективность супрессивной антибактериальной терапии без хирургической санации гнойного очага не выше 25%. В случаях, когда была выполнена хирургическая обработка очага ППИ с сохранением эндопротеза, последующим длительным (в течение нескольких недель) курсом парентеральной АБТ с переходом на пероральную комбинированную терапию с рифампицином**, и только после этого назначением хроническую супрессивную терапию, результаты лечения были более обнадеживающими [174]. Еще одним подходом может быть формирование постоянного свищевого хода с постоянным назначением низких доз АБП, при этом надо понимать, что в 80% после отмены антибиотика наблюдается рецидив инфекции [173]. Более подробно эта методика описана в разделе 3.2.1. Хирургическое лечение ППИ.
Данный подход можно рекомендовать только при наличии следующих условий:
- у пациента нет признаков системной инфекции;
- выполнение полноценной санации гнойного очага с удалением инфицированного эндопротеза невозможно из-за ослабленного состояния пациента;
- протез стабилен;
- этиология инфекции обусловлена низковирулентным возбудителем с хорошей чувствительностью к пероральным АБП;
- достигнута договоренность врача и пациента, который готов принимать рекомендованные препараты в течение длительного времени.
Применение супрессивной терапии у больных молодого возраста является спорным, и показания для лечения должны быть определены индивидуально в каждом конкретном случае. При назначении постоянной антибактериальной терапии врач должен учитывать возможную токсичность препаратов при длительном применении и риск селекции устойчивых микроорганизмов в случае развития рецидива.
Препаратами выбора для данной стратегии являются бета-лактамные АБП, препараты их групп фторхинолонов, тетрациклинов или ко-тримоксазол**, клиндамицин**, в зависимости от чувствительности возбудителя и переносимости препарата пациентов [170 - 172]. Не рекомендовано использовать для супрессивной антибактериальной монотерапии #линезолид**, рифампицин** и фузидовую кислоту. Это обусловлено, с одной стороны, высоким риском развития нежелательных реакций (более чем 4-недельная длительность применения #линезолида** существенно усиливает риск развития обратимой миелосупрессии в 40% случаев) и необратимой периферической невропатии (в 5% случаях). С другой стороны, при монотерапии рифампицином** или фузидовой кислотой у возбудителей быстро развивается резистентность к данным препаратам.
- Пациентам с ИАИ в составе комплексного лечения ИАИ рекомендуется применение локальной антимикробной терапии с целью создания эффективных концентраций антибактериальных препаратов в области гнойного очага в костной ткани [175, 178].
УДД 3 УУР C
- При импрегнации костного цемента предназначенного для фиксации компонентов постоянного эндопротеза не рекомендуется применять более 5 мас% антимикробного препарата для системного действия [48, 54, 176].
УДД 5 УУР C
Комментарии. Известно, что минимальные концентрации антибиотиков для эрадикации биопленок превышают минимальные подавляющие концентрации (МПК) для планктонных форм бактерий в тысячи раз [177], в связи с чем эрадикацию патогено в очаге остеомиелита пожно получить только комбинацией системной и местной антибактериальной терапии. Считается, что антибиотик, высвобождающийся непосредственно в очаге инфекции в концентрации, превышающей МПК для конкретного микроорганизма, напрямую уничтожает планктонные формы бактерий и дополнительно повреждает микробные биопленки, повышая эффективность антибактериальной терапии в целом. Высокая локальная концентрация позволяет препаратам проникать в некротизированные ткани и участки с плохим кровоснабжением путем диффузии. При ИАИ общепринятой методикой является импрегнация АМП костного цемента для установки антимикробного спейсера, при остеомиелите, в том числе после ПАИ в ряде случаев используют биокерамику на основе сульфатов или фосфатов кальция, гидроксиапатита. При выборе АМП для применения в составе костного цемента необходимо учитывать результаты дооперационного микробиологического исследования синовиальной жидкости (аспирата) или предполагаемый характер возбудителя (Приложение А3.3). К примеру, в случае ИАИ, вызванной MSSA для смешивания с костным цементом можно применять #цефуроксим**, а случае MRSA - #ванкомицин**. В настоящее время выделяют несколько групп остеозамещающих материалов, которые могут применяться в очаге ИАИ: нерассасывающиеся (цементы на основе полиметилметакрилата) и биодеградируемые материалы (костные трансплантаты, деминерализованный костный матрикс, материалы на основе биокерамики, природные и синтетические полимеры, комбинированные транспортные системы для антимикробных средств) [48,176,178].
3.2 Хирургическое лечение
- При сохранении стойкого раневого отделяемого в течение 72 часов у пациента после операции с установкой ортопедического имплантата рекомендуется последовательное проведение консервативного и при необходимости оперативного лечения [144, 179, 202].
УДД 4 УУР С
Комментарии. До настоящего времени нет валидированного определения "стойкого раневого отделяемого". При отсутствии таких данных, консенсус международных экспертов по лечению ППИ определяет постоянное отделяемое как любое продолжающееся выделение жидкости из области хирургического вмешательства более 72 часов после операции [48]. Лечение ран со стойким отделяемым после установки ортопедического имплантата состоит из двух основных этапов: неоперативного и оперативного. Неоперативные меры включают: модификацию профилактики венозных тромбоэмболий (ВТЭ), локальные мероприятия (такие как терапия раны отрицательным давлением) и ограничение подвижности. Если отделяемое продолжается более 3 - 7 дней после начала неоперативных мероприятий, необходимо рассмотреть возможность оперативного вмешательства. В зависимости от клинической ситуации это может включать в себя промывание и санацию, иссечение суставной сумки (синовэктомию), замену мобильных компонентов эндопротеза или, если требуется, одноэтапную замену эндопротеза. В некоторых ситуациях может быть показано только поверхностное промывание раны. В большинстве случаев своевременно выполненная ревизия области хирургического вмешательства в раннем послеоперационном периоде позволяет сохранить имплантат и предупредить хронизацию инфекционного процесса [179, 202].
- Пациентам с выраженными острыми симптомами инфекционно-воспалительного процесса на фоне ИАИ при отсутствии возможности выполнить радикальное хирургическое вмешательство в полном объеме, для снижения риска генерализации инфекции рекомендуется выполнить вскрытие и дренирование синовиальной сумки/флегмоны (абсцесса) в условиях любого отделения хирургического профиля, назначить антибактериальную терапию с последующим направлением в профильный травматолого-ортопедический стационар [180].
УДД 5 УУР C
- Пациентам с ИАИ, нуждающимся в оказания неотложной медицинской помощи в связи с риском генерализации инфекции, при отсутствии возможности выполнить радикальное хирургическое вмешательство в полном объеме не рекомендуется проведение только консервативного лечения [181].
Комментарии. В настоящее время отсутствуют публикации об оказании помощи пациентам с ИАИ в непрофильных отделениях. Однако участие микробных биопленок в патогенезе ИАИ однозначно определяет невозможность купирования инфекционного процесса назначением антибактериальной терапией при отсутствии хирургической санации гнойного очага у пациента и имплантатом [7, 48, 54]. Невозможность выполнения радикального хирургического вмешательства пациенту с ИАИ может быть обусловлена отсутствием технической возможности (отсутствие материально-технического оснащения и/или квалифицированного медицинского персонала в МО по месту жительства пациента), а также состоянием пациента, который может не перенести обширное хирургическое вмешательство (септическое состояние и/или выраженная декомпенсация сопутствующей патологии и т.д.). Наиболее рациональной тактикой в таких случаях является вскрытие и дренирование гнойного очага для снижения микробной нагрузки на организм, с коротким курсом антибактериальной терапии до снятия остроты процесса, и последующим направлением пациента в профильный стационар.
- Пациентам с острой послеоперационной (<4 недель после операции) или острой гематогенной (<3 недель с момента манифестации) ППИ рекомендуется выполнение радикальной хирургической обработки с промыванием раны, сохранением хорошо фиксированных компонентов эндопротеза (РСЭП) и длительной антибактериальной терапией при соответствии следующим критериям [182 - 184]:
- компоненты эндопротеза стабильны;
- отсутствует неотграниченное инфекционное воспаление мягких тканей (целлюлит, фасциит и пр.);
- отсутствует возбудитель, устойчивый к пероральным АМП;
- возможен длительный (до 3 мес.) курс антибактериальной терапии.
УДД 2 УУР A
- Пациентам с ППИ, не отвечающим указанным выше критериям, но для которых другая хирургическая тактика неприемлема или несет высокий риск для жизни может быть также рекомендована хирургическая санация с сохранением эндопротеза, но рецидив более вероятен [185 - 187].
УДД 2 УУР B
Комментарии. Недавнее исследование показало сходную эффективность РСЭП при лечении ранней послеоперационной инфекцией (85%) и острой гематогенной инфекцией (79%) [185]. Строгое соблюдение рекомендованных критериев крайне важно для эффективности РСЭП. До настоящего времени четко не установлен срок созревания микробной пленки в организме человека и период 3 - 4 недели с момента операции или манифестации определен, как наиболее оптимальный, в большинстве профильных публикаций и рекомендаций. Однако некоторые исследователи считают, что РСЭП можно рассматривать как операцию выбора только у пациентов с симптомами инфекции, которые длятся менее 5-и дней [186]. В целом ряде систематических обзоров доказано, что выполнение РСЭП при острых послеоперационных и гематогенных инфекциях должно быть своевременным и агрессивным (с заменой модульных частей), т.к. каждый дополнительный день ожидания снижает шансы на успешный результат [187 - 190]. К наиболее значимым факторам успешного исхода после проведения РСЭП относят период времени от появления симптомов до ревизионного эндопротезирования до 7 дней, замену модульных компонентов эндопротеза (141740 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава, не ограничивающий движения, полиэтиленовый***, 218470 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава керамический***, 241970 Вкладыш для эндопротеза коленного сустава одномыщелковый***, 290010 Вкладыш для эндопротеза ацетабулярного компонента тазобедренного сустава ограничивающий полиэтиленовый***) [48, 187], а также отсутствие у пациента тяжелой сопутствующей патологии [185] и дооперационной анемии [191]. Существенное влияние также оказывает и характер возбудителя, в связи с чем, выполнение РСЭП пациентам с ИАИ, обусловленной полирезистентными штаммами патогенов (MRSA и MRSE, особенно резистентные в рифампицину**, грамотрицательные палочки, устойчивые к фторхинолонам, ванкомицин-резистентный энтерококк (VRE) и др.), характеризуется крайне низкой эффективностью [189, 192 - 194].
Необходимо учитывать, что острая гематогенная инфекция может быть проявлением общего плохого состояния здоровья пациента, т.к. почти половина из них страдает тяжелой сопутствующей патологией, которая может не только предрасполагать к развитию инфекции, но и приводить к высокому риску развития сепсиса и смертности около 20% в течение 2 лет от операции [195, 196].
- Для пациентов с хронической ППИ при наличии хорошего состояния мягких тканей в области инфекции, идентифицированным до операции возбудителем, чувствительным к пероральным АБП с высокой биодоступностью, рекомендуется одноэтапное ревизионное эндопротезирование в случае, если позволяет материально-техническое оснащение стационара и уровень квалификации медперсонала [197, 198].
УДД 2 УУР A
- Для пациентов с культуронегативной хронической ППИ при наличии хорошего состояния мягких тканей в области инфекции, рекомендуется одноэтапное ревизионное эндопротезирование в случае, если позволяет материально-техническое оснащение стационара и уровень квалификации медперсонала [262]
УДД 2 УУР В
Комментарии: Одноэтапная замена эндопротеза (107830 Ножка удлиняющая для эндопротеза коленного сустава***, 109390 Клин для эндопротеза коленного сустава***, 114100 Заглушка для ацетабулярного компонента эндопротеза тазобедренного сустава***, 114130 Оболочка ацетабулярного компонента эндопротеза тазобедренного сустава***, 128870 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, модульный***, 128880 Компонент эндопротеза коленного сустава тибиальный непокрытый, полиэтиленовый***, 128910 Компонент эндопротеза коленного сустава феморальный непокрытый***, 128940 Компонент эндопротеза голеностопного сустава тибиальный непокрытый***, 128950 Компонент эндопротеза локтевого сустава плечевой непокрытый***, 128960 Компонент эндопротеза коленного сустава тибиальный непокрытый, металлический***, 128990 Компонент эндопротеза голеностопного сустава таранный непокрытый***, 129010 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, однокомпонентный***, 129080 Компонент эндопротеза коленного сустава тибиальный непокрытый с вкладышем***, 129120 Компонент эндопротеза коленного сустава тибиальный одномыщелковый непокрытый, металлический***, 141740 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава, не ограничивающий движения, полиэтиленовый***, 151960 Компонент эндопротеза коленного сустава феморальный трабекулярный***, 151980 Компонент эндопротеза коленного сустава тибиальный трабекулярный с вкладышем***, 152030 Эндопротез плечевого компонента локтевого сустава покрытый***, 152060 Компонент эндопротеза тазобедренного сустава феморальный, покрытый, модульный***, 152110 Компонент эндопротеза коленного сустава феморальный, покрытый***, 152120 Компонент эндопротеза коленного сустава тибиальный покрытый***, 152130 Компонент эндопротеза коленного сустава тибиальный покрытый с вкладышем***, 152350 Эндопротез локтевого сустава тотальный шарнирный***, 152390 Компонент эндопротеза коленного сустава феморальный одномыщелковый покрытый***, 161180 Эндопротез коленного сустава тотальный с задней стабилизацией***, 165410 Компонент эндопротеза тазобедренного сустава ацетабулярный полиэтиленовый***, 165420 Компонент эндопротеза локтевого сустава локтевой полиэтиленовый***, 178660 Компонент эндопротеза коленного сустава феморальный поверхностный частичный***, 178800 Эндопротез коленного сустава тотальный с сохранением крестообразной связки***, 206730 Эндопротез плечевого сустава тотальный***, 207700 Компонент эндопротеза локтевого сустава локтевой с металлическим покрытием***, 208890 Компонент эндопротеза плечевого сустава гленоидный***, 210090 Эндопротез коленного сустава тотальный с мобильной платформой***, 214680 Эндопротез тазобедренного сустава тотальный с парой трения металл-полиэтилен***, 214690 Эндопротез тазобедренного сустава тотальный с парой трения металл-металл***, 218470 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава керамический***, 218500 Эндопротез тазобедренного сустава тотальный с парой трения керамика-керамика***, 218510 Эндопротез тазобедренного сустава тотальный с парой трения керамика-полиэтилен***, 218520 Эндопротез тазобедренного сустава тотальный с парой трения керамика-металл***, 221510 Эндопротез коленного сустава двухкомпонентный***, 54990 Головка эндопротеза плечевого сустава с анкерным типом крепления***, 269390 Эндопротез плечевого сустава тотальный реверсивный***, 269420 Чашка реверсивного эндопротеза плечевого сустава полиэтиленовая***, 269440 Головка реверсивного эндопротеза плечевого сустава***, 272800 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, модульный***, 272810 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, однокомпонентный***, 273600 Компонент эндопротеза тазобедренного сустава феморальный ревизионный покрытый***, 273730 Компонент эндопротеза тазобедренного сустава феморальный ревизионный непокрытый***, 284590 Эндопротез коленного сустава тотальный шарнирный***, 290010 Вкладыш для эндопротеза ацетабулярного компонента тазобедренного сустава ограничивающий полиэтиленовый***, 320760 Тело реверсивного эндопротеза плечевого сустава***, 321740 Компонент эндопротеза тазобедренного сустава ацетабулярный из комбинированного материала***, 321750 Компонент эндопротеза тазобедренного сустава ацетабулярный металлический***, 321760 Эндопротез ацетабулярного компонента тазобедренного сустава керамический***, 322360 Чашка реверсивного эндопротеза плечевого сустава металлическая***) включает радикальную хирургическую обработку мягких тканей, тщательное удаление костного цемента и всех других инородных тел, создание локального депо АБП, имплантацию нового эндопротеза, а также длительную послеоперационную АБТ (до 3 мес.) [32, 48, 54]. Как правило, одноэтапное реЭП выполняют с цементной фиксацией компонентов и с применением цемента костного, содержащего лекарственные средства***. Возможно также применение импрегнированного антибиотиком костного матрикса (имплантата костного матрикса, композитного***, синтетического антибактериального***, животного*** или человеческого происхождения***,) или внутрисуставных катетеров для местной АБТ, которые обеспечивают успешные результаты одноэтапного реЭП до 92% [200, 201].
Противопоказаниями к одноэтапному реЭП являются: неограниченное инфекционное воспаление мягких тканей (целлюлит, фасциит, затеки в мягкие ткани, в полость малого таза и область сосудисто-нервных пучков); синдром системной воспалительной реакции (ССВР); недостаточный объем мягких тканей для закрытия операционной раны; дефекты и плохое качество кости (склероз/остеопороз), не позволяющие имплантировать стандартные конструкции эндопротезов; наличие других, не санированных очагов инфекции (трофические язвы, мочеполовая инфекция, инфекция полости рта и др.); наличие в анамнезе больного ревизионных операций, в том числе по поводу ППИ, и (или) курсов АБТ по поводу ППИ; невозможность проведения длительной (до 3 мес.) пероральной АТБ [202 - 208]. Кроме того, больные с рецидивом ППИ после одноэтапного реЭП, не могут быть кандидатами для повторного одноэтапного реЭП [209]. Как показывают два мета-анализа, одноэтапное реЭП позволяет достичь статистически сопоставимого с двухэтапным вмешательством риска рецидива инфекции вне зависимости от локализации инфекции в тазобедренном или коленном суставах [197, 198]. В случае же тщательного отбора пациентов для операции показатель успешных исходов одноэтапного реЭП достигал 100% [210]. Недавний мета-анализ не показал существенных различий в эффективности лечения при сравнении 1- и 2-этапной методик у пациентов с культуронегативной ППИ [199, 262].
- Пациентам с хронической, в том числе рецидивирующей ППИ, вызванной резистентными патогенами, а также с острой ППИ при наличии противопоказаний к выполнению других типов оперативного вмешательства, рекомендуется двухэтапное ревизионное ЭП, при условии, что общее состояние пациента позволяет перенести несколько хирургических вмешательств с прогнозируемым удовлетворительным функциональным результатом лечения [211 - 213].
УДД 2 УУР A
Комментарии. Двухэтапное лечение остается наиболее распространенным методом хирургического лечения хронической ППИ [159, 203, 211]. Основными показаниями к двухэтапному реЭП являются: хроническая послеоперационная (продолжительность симптомов более 4-х недель) или гематогенная (продолжительность симптомов более 3-х недель), в том числе рецидивирующая ППИ; острое воспаление перипротезных мягких тканей; наличие других не санированных очагов инфекции; высокий уровень резистентности возбудителей к АБ, а также невозможность выполнения операций другого типа при острой ППИ [32, 54]. Противопоказаниями к двухэтапному реЭП являются: декомпенсация сопутствующих заболеваний; неограниченное естественными барьерами инфекционное воспаление мягких тканей (острый некротический фасциит, гнойные затеки в межфасциальные пространства, к сосудисто-нервным пучкам и др.); дефицит мягких тканей, которых недостаточно для укрытия послеоперационной раны; обширные дефекты кости, не позволяющие в дальнейшем имплантировать постоянный эндопротез; многократные (более 3-х) рецидивы ППИ после реЭП по поводу инфекционных осложнений; панрезистентные возбудители; отказ больного от этапных операций [32, 54].
Цель первого этапа - купирование инфекции, а при наличии условий сохранение (восстановление) функции нижней конечности. Единого стандарта выполнения санирующего этапа двухэтапного ревизионного эндопротезирования не существует, так как ход операции во многом зависит от области распространенности инфекционного процесса, общего состояния пациента, состояния окружающих эндопротез мягких тканей и т.д. [48, 203]. Обязательным требованиями первого этапа являются: тотальное иссечение пораженной кости, некрэктомия; направление на микробиологическое (культуральное) исследование костной ткани на аэробные и факультативно-анаэробные микроорганизмы (3 - 5 образцов) и патолого-анатомическое исследование операционного материала, а также отправка для микробиологического (культурального) исследования удаленных компонентов эндопротеза; промывание операционной раны значительным количеством антисептиков (до 10 - 12 л) с помощью специальных технических средств для хирургической обработки раневой поверхности; заполнение дефектов тканей временными конструкциями (спейсерами), сформированными из цемента костного, содержащего лекарственные средства***, последующее послойное ушивание тканей, профилактика послеоперационных гематом [31].
В зависимости от восстановления биомеханической цепи нижней конечности имеется два варианта спейсеров из костного цемента: с наличием (артикулирующие) и без (блоковидные) артикулирующих поверхностей. Выбор типа спейсера, с учетом имеющихся достоинств и недостатков для каждого конкретного случая, осуществляет оперирующий врач - травматолог-ортопед [214 - 220]. При изготовлении спейсеров целесообразно добавлять в цемент костный, содержащий лекарственные средства *** дополнительный АБ на основании предоперационной антибиотикограммы, к примеру, цефуроксим** при инфекции, вызванной MSSA. Перечень антибактериальных препаратов и их дозы, которые могут быть добавлены в костный цемент представлен в Приложении А3.3. Возможно в качестве спейсеров использовать протезы тазобедренного сустава временные***, а также компоненты эндопротеза пораженного сустава с цементной фиксацией (107830 Ножка удлиняющая для эндопротеза коленного сустава***, Компонент эндопротеза тазобедренного сустава феморальный непокрытый, модульный***, 128910 Компонент эндопротеза коленного сустава феморальный непокрытый***, 128940 Компонент эндопротеза голеностопного сустава тибиальный непокрытый***, 128950 Компонент эндопротеза локтевого сустава плечевой непокрытый***, 128960 Компонент эндопротеза коленного сустава тибиальный непокрытый, металлический***, 128990 Компонент эндопротеза голеностопного сустава таранный непокрытый***, 129010 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, однокомпонентный***, 273730 Компонент эндопротеза тазобедренного сустава феморальный ревизионный непокрытый***). Основные принципы локальной антибактериальной терапии описаны в разделе 3.1 Консервативное лечение и приложении А3.3. Полностью цементный антимикробный спейсер активен в течение ограниченного периода времени и должен быть удален [203, 221 - 223].
В исключительных случаях при удалении в ходе санирующей операции хорошо фиксированных компонентов эндопротеза, особенно индивидуальных конструкций, онкологических протезов, выполнение остеотомии может привести к формированию массивных дефектов кости, что в дальнейшем вызывает технические сложности со стабильной фиксацией компонентов ЭП на этапе реимплантации и в конечном итоге может привести к стойкому нарушению функции конечности [224 - 226]. При лечении данной категории пациентов в специализированных центрах, имеющих в своем составе мультидисциплинарную группу врачей, занимающихся лечением ППИ, возможно рассмотреть вариант выполнения таким пациентам неполного (субтотального) удаления ЭП [224, 225, 227 - 229]. В случае выявления каким-либо способом (рентгенологически, по данным КТ, визуально интраоперационно) нестабильности компонентов ЭП, при наличии свища, заболеваний, приводящих к иммуносупрессии (сахарный диабет, ревматоидный артрит и др.), а также при неустановленном до операции возбудителем инфекции или при его резистентности к антибиотикам с антибиопленочной активностью [224] выполнение неполного удаления ЭП строго противопоказано. Жесткое соблюдение критериев отбора приводит к крайне редкому применению данной методики, однако, позволяет достичь купирования инфекции в подавляющем большинстве случаев: в сериях из 18, 15 и 5 наблюдений соответственно в 84% [224], 93,3% [229] и 100% случаев [225].
Сегодня не существует однозначных рекомендаций по выбору оптимального интервала времени межу этапами реЭП [48,203]. В тоже время, в течение десятилетий ортопедическим сообществом накоплен успешный опыт реимплантации эндопротеза (107830 Ножка удлиняющая для эндопротеза коленного сустава***, 109390 Клин для эндопротеза коленного сустава***, 114100 Заглушка для ацетабулярного компонента эндопротеза тазобедренного сустава***, 114130 Оболочка ацетабулярного компонента эндопротеза тазобедренного сустава***, 128870 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, модульный***, 128880 Компонент эндопротеза коленного сустава тибиальный непокрытый, полиэтиленовый***, 128910 Компонент эндопротеза коленного сустава феморальный непокрытый***, 128940 Компонент эндопротеза голеностопного сустава тибиальный непокрытый***, 128950 Компонент эндопротеза локтевого сустава плечевой непокрытый***, 128960 Компонент эндопротеза коленного сустава тибиальный непокрытый, металлический***, 128990 Компонент эндопротеза голеностопного сустава таранный непокрытый***, 129010 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, однокомпонентный***, 129080 Компонент эндопротеза коленного сустава тибиальный непокрытый с вкладышем***, 129120 Компонент эндопротеза коленного сустава тибиальный одномыщелковый непокрытый, металлический***, 141740 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава, не ограничивающий движения, полиэтиленовый***, 151960 Компонент эндопротеза коленного сустава феморальный трабекулярный***, 151980 Компонент эндопротеза коленного сустава тибиальный трабекулярный с вкладышем***, 152030 Эндопротез плечевого компонента локтевого сустава покрытый***, 152060 Компонент эндопротеза тазобедренного сустава феморальный, покрытый, модульный***, 152110 Компонент эндопротеза коленного сустава феморальный, покрытый***, 152120 Компонент эндопротеза коленного сустава тибиальный покрытый***, 152130 Компонент эндопротеза коленного сустава тибиальный покрытый с вкладышем***, 152350 Эндопротез локтевого сустава тотальный шарнирный***, 152390 Компонент эндопротеза коленного сустава феморальный одномыщелковый покрытый***, 161180 Эндопротез коленного сустава тотальный с задней стабилизацией***, 165410 Компонент эндопротеза тазобедренного сустава ацетабулярный полиэтиленовый***, 165420 Компонент эндопротеза локтевого сустава локтевой полиэтиленовый***, 178660 Компонент эндопротеза коленного сустава феморальный поверхностный частичный***, 178800 Эндопротез коленного сустава тотальный с сохранением крестообразной связки***, 206730 Эндопротез плечевого сустава тотальный***, 207700 Компонент эндопротеза локтевого сустава локтевой с металлическим покрытием***, 208890 Компонент эндопротеза плечевого сустава гленоидный***, 210090 Эндопротез коленного сустава тотальный с мобильной платформой***, 214680 Эндопротез тазобедренного сустава тотальный с парой трения металл-полиэтилен***, 214690 Эндопротез тазобедренного сустава тотальный с парой трения металл-металл***, 218470 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава керамический***, 218500 Эндопротез тазобедренного сустава тотальный с парой трения керамика-керамика***, 218510 Эндопротез тазобедренного сустава тотальный с парой трения керамика-полиэтилен***, 218520 Эндопротез тазобедренного сустава тотальный с парой трения керамика-металл***, 221510 Эндопротез коленного сустава двухкомпонентный***, 54990 Головка эндопротеза плечевого сустава с анкерным типом крепления***, 269390 Эндопротез плечевого сустава тотальный реверсивный***, 269420 Чашка реверсивного эндопротеза плечевого сустава полиэтиленовая***, 269440 Головка реверсивного эндопротеза плечевого сустава***, 272800 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, модульный***, 272810 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, однокомпонентный***, 273600 Компонент эндопротеза тазобедренного сустава феморальный ревизионный покрытый***, 273730 Компонент эндопротеза тазобедренного сустава феморальный ревизионный непокрытый***, 284590 Эндопротез коленного сустава тотальный шарнирный***, 290010 Вкладыш для эндопротеза ацетабулярного компонента тазобедренного сустава ограничивающий полиэтиленовый***, 320760 Тело реверсивного эндопротеза плечевого сустава***, 321740 Компонент эндопротеза тазобедренного сустава ацетабулярный из комбинированного материала***, 321750 Компонент эндопротеза тазобедренного сустава ацетабулярный металлический***, 321760 Эндопротез ацетабулярного компонента тазобедренного сустава керамический***, 322360 Чашка реверсивного эндопротеза плечевого сустава металлическая***) пораженного сустава через 2 - 12 месяцев после удаления имплантатов [203, 230 - 232]. Однако длительное ожидание второго этапа увеличивает период нетрудоспособности больных, функциональной несостоятельности и стоимости лечения. Помимо механических осложнений при несвоевременной замене временной конструкции на постоянный протез сустава, в научной литературе описаны единичные случаи развития нарушений функции почек после установки спейсеров, импрегнированных большими дозами нефротоксичных АБП, в частности ванкомицина** [233 - 235]. В настоящее время случае отсутствия дефектов параартикулярных тканей и чувствительности выявленного возбудителя к АБ для перорального приема считают возможным сокращение интервала между этапами лечения до 2 - 3 недель за счет эффективного применения этиотропной АБТ [236 - 238].
Во время второго этапа ревизионного эндопротезирования возможно применение конструкций цементной или бесцементной фиксации [54, 203, 239, 240]. В ходе операции выполняют повторную хирургическую обработку, забирают 3 - 5 образов на микробиологическое (культуральное) исследование костной ткани на аэробные и факультативно-анаэробные микроорганизмы, а также образцы для патолого-анатомического исследования операционного материала. Удаленный спейсер так же направляют на микробиологическое исследование [32, 54]. В среднем применение данной методики позволяет достичь контроля инфекции в 75 - 80% случаев [241, 242], однако, может снижаться до 30 - 50% у пациентов с выраженной сопутствующей патологией, а также при инфекции, вызванной резистентными возбудителями [167, 243, 244].
- Пациентам с хронической рецидивирующей ППИ области тазобедренного сустава при неэффективности других методов лечения, в особенности в случае инфекции, обусловленной трудными для эрадикации возбудителями, рекомендуется выполнение резекционной артропластики, в том числе с мышечной пластикой несвободным мышечным лоскутом, которую в случае сохранения анатомических возможностей следует рассматривать как санирующий этап для возможной после достижения стойкой ремиссии инфекционного процесса имплантации ЭП [22, 245].
УДД 3 УУР С
Комментарии.: до настоящего времени единые взгляды на тактику ведения пациентов с многократно рецидивирующей ППИ, в том числе обусловленной сложными возбудителями отсутствуют, в таких случаях врачи - хирурги отказываются на время или навсегда от выполнения реЭП. Методом выбора для лечения данной категории пациентов следует считать резекционную артропластику. Показаниями для резекционной артропластики являются: дефицит мягких тканей, не позволяющий закрыть операционную рану после реЭП (более 100 см2); неоднократные (![]() 3) рецидивы ППИ; хронический вторичный остеомиелит костей, образующих сустав; противопоказания к АБТ (полиорганная недостаточность, поливалентная аллергия, др.); этиология ППИ, включающая ТЭВ [32, 54]. К группе ТЭВ в настоящее время относят рифампицин-устойчивые стафилококки и/или ампициллин-резистентные энтерококки и/или ципрофлоксацин-устойчивые грамотрицательные бактерии и/или грибы рода Candida, устойчивые к флуконазолу** [21].
3) рецидивы ППИ; хронический вторичный остеомиелит костей, образующих сустав; противопоказания к АБТ (полиорганная недостаточность, поливалентная аллергия, др.); этиология ППИ, включающая ТЭВ [32, 54]. К группе ТЭВ в настоящее время относят рифампицин-устойчивые стафилококки и/или ампициллин-резистентные энтерококки и/или ципрофлоксацин-устойчивые грамотрицательные бактерии и/или грибы рода Candida, устойчивые к флуконазолу** [21].
Целью резекционной артропластики служит восполнение дефекта мягких тканей в области сустава, компенсация тяжелых сопутствующих заболеваний, лечение хронического остеомиелита, эрадикация патогенной микрофлоры. Суть оперативного вмешательства заключается в пластике несвободным мышечным лоскутом дефекта кости, мягких тканей или укрытии местными тканями и дренировании послеоперационной раны (к примеру, операция Girdlestone). При этом спейсеры не используют. Применение резекционной артропластики ТБС в сочетании с несвободной мышечной пластикой (Патент RU 2735651 C1) позволяет достичь стойкой ремиссии ППИ более чем в 90% наблюдений, несмотря на длительное и тяжелое течение инфекции, обусловленной ТЭВ [22, 245]. Во многом это обусловлено тем, что при несвободной пересадке островкового мышечного лоскута гарантировано высокое кровоснабжение перемещенного фрагмента мышечной ткани, способствующего хорошей доставке лейкоцитов, кислорода и антибиотиков в инфекционный очаг [246]. Все это позволяет рассматривать данный тип хирургического вмешательства как операцию выбора при развитии рецидива трудноизлечимой ППИ с возможным выполнением реЭП на фоне стойкой ремиссии инфекционного воспаления. Однако следует учитывать возможные и достаточно частые осложнения, развивающиеся в раннем послеоперационном периоде: формирование культуронегативных гематом, рецидив инфекции, частичный или полный некроз мышечного лоскута [22]. Кроме того, в случае выполнения резекционной артропластики как окончательного этапа лечения, большинство пациентов в отдаленном предъявляют жалобы на боль в области сустава при движении, его нестабильность, необходимость использовать постоянно внешние фиксаторы и дополнительную опору при ходьбе [247].
- Пациентам с хронической многократно рецидивирующей ППИ коленного сустава рекомендуется выполнение артродеза коленного сустава при отсутствии показаний для дальнейшей этапной имплантации ЭП и имеющейся возможности сохранить часть функций конечности путем обездвиживания сустава в функционально удобном положении [248 - 250].
УДД 1 УУР А
Комментарии. Среди больных, перенесших одно и двухэтапное реЭП коленного сустава, 22,7 - 39,7% пациентов нуждаются в повторных ревизионных хирургических вмешательствах по поводу рецидива ППИ [242, 251]. У иммунокомпрометированных пациентов или при инфекции, вызванной полирезистентными возбудителями, данный показатель достигает 50 - 75% [243, 244]. В этих обстоятельствах выполнение артродеза КС позволяет сформировать безболезненную опорную конечность у большинства пациентов [247, 249], обеспечивает контроль инфекции у 78 - 89% пациентов [241, 252, 253], лучший уровень социальной адаптации и снижение летальности в сравнении с исходами ампутации и протезирования конечности [254 - 256]. Показаниями к артродезу являются: дефект капсулы, связок, разгибательного аппарата сустава; дефицит окружающих сустав мягких тканей, не позволяющий закрыть операционную рану после реЭП; тяжелые сопутствующие заболевания, иммуносупрессия, исключающие дальнейшее оперативное лечение; хронический вторичный остеомиелит костей, образующих сустав; трудные для эрадикации возбудители; категорический отказ больного от эндопротезирования в дальнейшем. Противопоказаниями к артродезу являются тяжелая патология смежных суставов и значительные дефекты суставных концов сочленяющихся кости. Необходимо помнить, что даже после хорошей консолидации фрагментов кости, функциональном положении конечности, у ряда пациентов сохраняется неудовлетворенность отсутствием движений в суставе [257].
- Пациентам с жизнеугрожающим течением хронической рецидивирующей ППИ при исчерпании возможностей всех других методов лечения рекомендуется выполнить ампутацию/экзартикуляцию конечности, направленную на спасение жизни больного или обеспечение ухода за ним [258, 259].
УДД 4 УУР С
Комментарии. После многократных безуспешных ревизионных операциях при тяжелом течении инфекционного воспаления, развитии ССВР (сепсиса) операцию выполняют по жизненным показаниям [247, 259]. В других случаях показаниями к ампутации (экзартикуляции) являются: рецидивирующее течение хронической ППИ, которое привело к полной утрате функции конечности, инвалидизации больного; некротический фасциит, резистентный к расширенной хирургической обработке (РХО); нарастающая полиорганная недостаточность, как результат обострения хронической рецидивирующей ППИ; осложнения заболеваний сосудов, угрожающие жизни больного; дефект мягких тканей и/или кости, не подлежащие ортопедической коррекции и восстановлению функции конечности; выраженный некупируемый, болевой синдром, причиняющий непереносимые страдания больному; настойчивые требования больного прекратить дальнейшие попытки хирургического лечения.
Уровень ампутации (экзартикуляции) определяют необходимостью резекции области инфекционного воспаления и обеспечения последующего протезирования [247], что имеет существенное значение для дальнейшего восстановления функции конечности [256]. В настоящее время в ряде случаев ампутация при ППИ коленного сустава с последующим протезированием современными высокотехнологичными протезами может превосходить артродезирование в плане восстановления функции конечности и качества жизни пациента [253]. За исключением экстренных случаев выполнять ампутации рекомендуется в многопрофильных хирургических стационарах по месту жительства больного, после заключения о необходимости данной операции междисциплинарной группой врачей специализированного центра, обладающего опытом лечения ППИ.
- Пациентам с развитием ССВР или сепсиса на фоне ППИ рекомендуется назначение парентеральной антибактериальной терапии и выполнение хирургического вмешательства, направленного на снижение микробной нагрузки, исходя из состояния больного, его локального статуса и возможности последующего этапного лечения [48].
УДД 4 УУР С
Комментарии. Развитие ССВР иили сепсиса на фоне ППИ существенно ухудшает прогноз лечения и увеличивает риск летальности [260 - 263] С учетом необходимости снижения микробной нагрузки, оценки возможности пациента перенести определенный объем оперативного вмешательства, а также перспектив дальнейшей имплантации ЭП возможно выполнение вскрытия и дренирования или вторичной хирургической обработки гнойного очага с сохранением имплантатов или с удалением его компонентов (если это показано и безопасно для больного), или выполнение ампутации (экзартикуляции) по жизненным показаниям [48]. Обязательным компонентом должна быть эмпирическая или этиотропная АБТ, которую начинают сразу, после выявления ССВР или сепсиса [264].
- Пациентам с хронической рецидивирующей ППИ в случаях, когда другие хирургические методы лечения по заключению междисциплинарной группы врачей противопоказаны, рекомендуется формирование постоянной фистулы (ПФ) и назначение в дальнейшем длительной или пожизненной супрессивной пероральной АБТ (см. раздел 3.1) [173, 265, 266].
УДД 3 УУР С
Коментарии. Основные показания к назначению супрессивной пероральной АБТ и ее особенности описаны в п. 3.1 Консервативное лечение. Для формирования постоянного свищевого хода проводят короткий разрез по старому послеоперационному рубцу для доступа к полости сустава и ЭП; вводят в полость сустава дренажную трубку (дренаж по Редону, или полутрубка диаметром 10 мм, или др.); выводят дренажную трубку из полости сустава дистальнее нижнего угла раны и подшивают ее к коже нерассасывающейся хирургической нитью [173]. Дренажную трубку предпочтительнее сохранять в ране пожизненно или возможно ее удаление не менее чем через 6 недель после эпителизации стенок свищевого хода, нов среднем после формирования постоянного свищевого хода, выполняют до 3-х ревизионных операций для восстановления его функции [173].
- Пациентам с хронической ППИ рекомендуется проводить хирургическое лечение, требующее удаления или замены компонентов эндопротеза в условиях стационаров и отделений, кадровое и материально-техническое обеспечение, которых позволяет выполнение ревизионного эндопротезирования, а также которые укомплектованны мультидисциплинарной командой специалистов [48, 157, 267, 268].
УДД 4 УУР С
Комментарии. Несмотря на отсутствие научных публикаций об оказании помощи пациентам с ИАИ в непрофильных отделениях, очевидно, что удаление хорошо фиксированных компонентов эндопротеза и цементной мантии требует наличия специализированных инструментов, которые отсутствуют в стационарах и отделениях общехирургического профиля, и наличия специалиста - врача-травматолога-ортопеда, владеющего техникой ревизионного эндопротезирования. Как указано выше в отделениях общехирургического профиля возможно выполнение вскрытия и дренирования гнойного очага при развитии острого состояния с коротким курсом антибактериальной терапии до снятия остроты процесса и последующим направлением пациента с ППИ в специализированное учреждение, а также выполнение ампутации или экзартикуляции по жизненным или плановым показаниям. Наличие команды врачей различных специальностей помимо врачей-травматологов-ортопедов, специализирующихся на лечении ИАИ (врачей - реаниматологов, врачей - медицинских микробиологов, врачей - клинических фармакологов, врачей - пластических хирургов, врачей - врачей клинической-лабораторной диагностики и пр.), существенно улучшает результаты лечения профильных пациентов [156, 157, 267, 268].
Выбор типа оперативного вмешательства при ПАИ зависит от нескольких факторов: типа инфекции (острая или хроническая), консолидации перелома, качества репозиции отломков, стабильности имплантата, состояния мягких тканей, характера возбудителя и способности пациента перенести операцию [274]. На сегодняшний день представляется учитывать при выборе метода лечения ПАИ тип остеомиелита на момент выполнения вмешательства с применением классификации Cierny и Mader (1984). Данная классификационная система предполагает выбор стратегии лечения остеомиелита в зависимости от типа поражения костей, характера распространения гнойного процесса (медуллярный, поверхностный, локализованный или диффузный), а также соматического статуса больного и состояния его иммунной системы [44, 286].
- Пациентам с острой ПАИ (срок манифестации менее 2 недель) при отсутствии консолидации перелома, удовлетворительной репозиции отломков при условии стабильности имплантата, удовлетворительного состояния мягких тканей и идентифицированного возбудителя, чувствительного к пероральным препаратам для пролонгированной АБТ, рекомендуется радикальная хирургическая обработка раны или инфицированной ткани (дебридмент) с сохранением имплантата, замещением сформированных костных дефектов антимикробным спейсером и пролонгированная АБТ [269 - 271].
УДД 5 УУР C
Комментарии. Крайне важным при выполнении ревизии с сохранением имплантата является тщательное удаление некротизированных тканей и некровоснабжаемых фрагментов кости; с применением системы обработки раны пульсирующей струей (объем жидкости не менее 6 - 9 литров) [28, 270].
- Пациентам с острой или хронической ПАИ при отсутствии консолидации перелома и клинико-рентгенологических признаков нестабильности остеосинтеза, при условии достаточного для ушивания послеоперационной раны объема мягких тканей и идентифицированного возбудителя, чувствительного к пероральным препаратам для пролонгированной АБТ, рекомендуется одноэтапный ревизионный остеосинтез (реОС) с реконструкцией дефектов костей и мягких тканей, при необходимости с удалением внутреннего фиксирующего устройства и установкой наружного фиксирующего устройства (конверсия фиксации), а также пролонгированная АБТ [269, 271 - 273].
УДД 3 УУР C
Комментарии. В данной клинической ситуации выполняют одномоментную (частичную в случаях аппаратов внешней фиксации) замену спиц и стержней в наружном фиксирующем устройстве, радикальную хирургическую обработку раны или инфицированной ткани, некрэктомию и обильное промывание раны растворами антисептиков (объем жидкости не менее 6 - 9 литров) [270]. Для реостеосинтеза нередко используют стержень костный ортопедический, нерассасывающийся***, который устанавливают интрамедуллярно предварительно покрывая костным цементом, содержащим лекарственные средства*** (антибактериальные препараты), или накладывают аппарат внешней фиксации [16, 272, 273]. Интрамедулярный стержень с цементной мантией оказывает местный санирующий эффект, а также стабилизирует зону перелома. Такой тип фиксации может быть окончательным до полной консолидации отломков. Необходимо помнить, что существенным недостатком погружных видов остеосинтеза (стержней, пластин) при лечении ПАИ является то, что они остаются в зоне санированного инфекционного очага. Радикальная хирургическая обработка раны или инфицированной ткани не обеспечивает полную стерильность оперированных тканей. Небольшие колонии бактерий могут повторно контаминировать поверхность импланта с последующим формированием биопленки.
Альтерантивным вариантом цементному стержню являются аппараты внешней фиксации (монолатеральные и циркулярные). Их основное преимущество заключается во внешней (вне зоны воспаления) фиксации отломков костей; возможности ранней полной нагрузки на оперированную конечность; коррекции оси конечности в послеоперационном периоде. Однако длительное ношение аппарата внешней фиксации может осложниться воспалением мягких тканей спиц и/или стержней, а также контрактурой смежных суставов [273].
Рассмотрев показания и особенности выполнения одноэтапной ревизии, стоит отметить, что врачи - травматологи-ортопеды нередко вынуждены прибегать к значительным резекциям нежизнеспособных фрагментов костей для достижения полноценной санации [276]. Такие сложные клинические ситуации практически невозможно разрешить без укорочения конечности, используя методику одноэтапного лечения.
- Пациентам с острой или хронической ПАИ с распространенным очагом патологического процесса, неконсолидированным переломом с неудовлетворительным стоянием отломков, значительным поражением костной ткани, требующим резекции и замещения пострезекционного дефекта, объемом мягких тканей, недостаточным для укрытия послеоперационной раны, а также полирезистентным штаммом возбудителя рекомендуется выполнение двухэтапного реОС с реконструкцией дефектов кости и мягких тканей при необходимости с конверсией метода фиксации и АБТ [16, 45, 271, 274, 277, 278].
УДД 2 УУР В
Комментарии. Двухэтапный реОС является наиболее широко распространенной методикой лечения ПАИ. Основной задачей первого этапа является купирование инфекционного процесса посредством удаления инфицированного имплантата, резекции нежизнеспособных фрагментов костной ткани, ирригацию тканей растворами антисептиков и стабилизацию оперированного сегмента конечности (цементным спейсером с антибактериальными препаратами и/или аппаратом внешней фиксации), а также пластическое замещение мягкотканых дефектов при их наличии. Второй этап хирургического лечения выполняют отсрочено, через 2 - 10 недель. Его задачей является восполнение пострезекционного дефекта кости ауто -, аллокостью (технология Маскуле и ее модификации) или другими имплантатами костного матрикса (композитного***, синтетического антибактериального***, животного*** или человеческого происхождения***), или остеотомированного фрагмента кости по технологии Илизарова [16, 45, 271, 274, 277 - 280].
Существуют также гибридные варианты остеосинтеза, когда на период дистракции остеотомированного фрагмента используют компоненты систем внешней ортопедический фиксации, после чего осуществляют замену внешней фиксации на внутреннюю - установку стержня интрамедуллярного (111890 Стержень большеберцовый интрамедуллярный, нестерильный***, 111880 Стержень большеберцовый интрамедуллярный, стерильный***, 328090 Стержень для удлинения эндопротеза бедренной/большеберцовой кости, непокрытый***, 258660 Стержень интрамедуллярный бедренный, нестерильный***, 258670 Стержень интрамедуллярный бедренный, стерильный***, 318410 Стержень интрамедуллярный для артродеза, нестерильный***, 267030 Стержень интрамедуллярный для артродеза, стерильный***, 270050 Стержень интрамедуллярный плечевой, нестерильный***, 270030 Стержень интрамедуллярный плечевой, стерильный***, 245700 Стержень костный ортопедический, нерассасывающийся***) [281, 282].
- Пациентам с ПАИ, неконсолидированным переломом и противопоказаниями к ревизионному остеосинтезу при идентифицированном возбудителе, чувствительном к пероральным препаратам, рекомендовано выполнение РХО гнойного очага с последующим формированием постоянной фистулы и назначение супрессивной АБТ [271, 275].
УДД 3 УУР С
Комментарии. При наличии противопоказаний к реОС, целесообразно проведение радикальной (по возможности) хирургической обработки очага инфекции с сохранением стабильного имплантата; ирригации тканей с помощью УЗ кавитации и пульсирующей струей с общим объемом жидкости не менее 9 литров; этиотропная пероральная АБТ на весь период до появления клинико-рентгенологических признаков консолидации отломков костей. Данный вариант лечения не предусматривает использование дополнительных имплантатов (ПММК, костных трансплантатов и остеозамещающих материалов) и, по сути, направлен на предупреждение (или профилактику) септического состояния больного и снижение бактериальной контаминации зоны перелома до момента консолидации поврежденной кости. После компенсации сопутствующих заболеваний и достижения консолидации возможно удаление внутреннего фиксирующего устройства [26, 28, 45, 284, 285].
- Пациентам с ПАИ и консолидированным переломом рекомендуется удаление внутреннего фиксирующего устройства и при необходимости лечение остеомиелита, хирургическое вмешательство, объем которого зависит от конкретной клинической ситуации, в комплексе с этиотропной антибактериальной терапией [283].
УДД 5 УУР С
4. Реабилитация
- Пациентов с ИАИ после выполнения санирующей операции для профилактики осложнений, связанных с застойными явлениями в легких, рекомендуется обучить дренирующим дыхательным упражнениям [31, 49].
УДД 5 УУР С
Реабилитация и методики физиолечения в рутинной практике хирургического лечения перипротезной и переломассоциированной инфекции не имеют широкого применения. Дополнительно пациентам может быть назначен массаж грудной клетки медицинский также с целью профилактики осложнений, связанных с застойными явлениями в легких [31, 49]. Кроме того, программа немедикаментозной профилактики ВТЭО включает эластическую компрессию нижних конечностей в виде использования чулок, гольф, эластичных бинтов, пневматических шин, которые одевают больному после большой операции на костях и суставах нижних конечностей. Срок использования компрессионного трикотажа - до восстановления тонуса мышц конечностей, то есть до тех пор, пока больной пользуется дополнительными средствами опоры или иммобилизацией.
Восстановление тонуса мышц, амплитуды движений необходимо начинать после уменьшения болевого синдрома, стабилизации общего состояния больного и, как правило, удаления мочевого катетера, дренажей из послеоперационной раны. Известно, что, тугоподвижность сустава и, как следствие, нарушение функции конечности являются наиболее распространенным осложнением после операции. Это особенно актуально при реализации двухэтапной методики лечения. Необходимо искать компромисс в каждом наблюдении ППИ, между иммобилизацией больного со структурными дефектами конечностей и необходимостью разработки движений, восстановления способности к самообслуживанию.
Программа реабилитации при ППИ составляется в зависимости от выполненной операции. В случае имплантации артикулирующего или преформированного спейсера (кинематическая цепь в суставе сохранена), она не отличается от стандартной после эндопротезирования сустава. Применение статических спейсеров не позволяет разрешить функциональную нагрузку, сопровождается сохранением значительной разницы длин конечностей. Однако во всех случаях после имплантации спейсера (временных конструкций) функциональная нагрузка должна быть ограничена.
Как правило, в раннем послеоперационном периоде реабилитационные мероприятия ограничивают ранней мобилизацией больного. Пациентам с ППИ дозированную нагрузку на конечность определяют в зависимости от особенностей операции, дефектов мягких тканей, кости, наличия аллотрансплантатов, а также вида имплантата (спейсера, эндопротеза). После операции по поводу ППИ тазобедренного сустава, активная реабилитация возможна при отсутствии дефицита мягких тканей, классификации дефектов вертлужной впадины и бедра до Paprosky 2, имплантации конструкций цементной фиксации. Рекомендовано в каждом случае разрабатывать план индивидуального реабилитационного лечения больного. Его составление зависит от степени поражения мягких тканей, дефекта кости, наличия инфекционного воспаления, остеомиелита и различных частных обстоятельств, связанных с личностью пациента.
Реабилитационные мероприятия больных после радикального лечения ПАИ зависят от типа выполненного остеосинтеза и включают в себя комплекс мероприятий, направленных на восстановление опороспособности конечности и функции смежных суставов с помощью лечебной физкультуры при заболеваниях и травмах суставов, массажа, физиотерапевтических процедур, санаторно-курортного лечения, различных ортопедических пособий: стельки, обувь, туторы, ортезы, протезы [287]. Однако к обострению и рецидиву гнойного процесса могут привести перегревание или переохлаждение пораженного участка, в связи с чем больным в период ремиссии противопоказаны все виды тепловых процедур, воздействующих непосредственно на больную конечность. После проведенного хирургического лечения больных с ППИ можно направить на бальнео- и климатолечебные курорты - Сочи, Пятигорск, Хмельник, Мироновка, Липецк, Пушкино (Московской области) и другие не ранее чем через 6 месяцев после операции. В работе необходимо использовать указания Приказа Минздрава России от 05.05.2016 N 281н "Об утверждении перечней медицинских показаний и противопоказаний для санаторно-курортного лечения" (Зарегистрировано в Минюсте России 27.05.2016 N 42304) в части, касающейся инфекционных заболеваний кости, что связано с тем, что в большинстве случаев ППИ сопровождается развитием остеомиелита (табл. 6). Согласно данному Приказу медицинскими противопоказаниями для санаторно-курортного лечения являются заболевания в острой и подострой стадии, в том числе острые инфекционные заболевания до окончания периода изоляции, и хронические заболевания в стадии обострения.
5. Профилактика
- Пациентам, которым выполняют операции с установкой металлоконструкций (эндопротезирование, остеосинтез переломов и пр.), рекомендовано проведение периоперационной антибиотикопрофилактики инфекции области хирургического вмешательства [288 - 290].
УДД 1 УУР А
- Пациентам, которым выполняют плановое эндопротезирование крупных суставов, не рекомендуется локальное применение антибактериальных препаратов системного действия для профилактики инфекции области хирургического вмешательства [291].
УДД 3 УУР А
Комментарии. Эндопротезирование суставов относят к чистым операциям, при которых развитие осложнений сопровождается высоким риском нанесения ущерба здоровью и жизни пациента. Рекомендуется выбор антимикробных препаратов для периоперационной антибиотикопрофилактики (ПАП) основывать на наличии их активности в отношении наиболее вероятных возбудителей ИОХВ при конкретной операции. Основными препаратами для ПАП при ортопедических операциях являются цефазолин** или цефуроксим**, при непереносимости цефалоспоринов - #клиндамицин**, ванкомицин** [1, 288]. Последний также является препаратом выбора при риске развития инфекции, вызванной MRSA. В случае высокого риска развития инфекционного осложнения (иммунокомпроментированный пациент, инфекции в анамнезе, перенесенный курс АБТ в течение 2 месяцев до операции и пр.) целесообразно проконсультировать пациента с клиническим фармакологом при его наличии в стационаре. Подробно все особенности проведения периоперационной антибиотикопрофилактики при плановом эндопротезировании рассмотрены в методических рекомендациях "Профилактика инфекций области хирургического вмешательства" [1].
В случае открытых переломов профилактическое введение АБП эффективно для предупреждения ранней инфекции. Препаратов выбора является цефазолин**, который следует вводить как можно скорее после травмы. Однако пациентам с открытыми переломами III типа по Gustilo и Anderson [292] (диафизарные переломы с расхождением и потерей сегмента; с повреждением магистральных сосудов; сильно загрязненные раны; травмы, полученные при действии высококинетической энергии) целесообразно расширить спектр активности назначаемой АБТ за счет препаратов, действующих на Гр(-) возбудителей. В таких случаях целесообразно рассматривать добавление к цефазолину** #гентамицина** [293 - 295] или монотерапию препаратов #ампициллин+[сульбактам]** (в дозе 3,0 г каждые 8 часов в течение 3 сут) [296], последний, особенно актуален в случае риска развития клостридиальной инфекции. По мнению большинства исследователей при открытых переломах III типа по Gustilo и Anderson АБТ не следует продолжать более 72 часов после закрытия мягкотканной раны [297].
После окончания лечения и выполнения реимплантации эндопротеза целесообразно в течение 3 лет динамическое наблюдение врача-травматолога-ортопеда в первые полгода 1 раз в 3 месяца, затем через 6 месяцев и далее 1 раз в год [32, 54]. Обследование при диспансерном наблюдении включает рентгенографию пораженной части скелета; клинический (общий) анализ крови; исследование уровня СРБ в крови и консультацию врача-травматолога-ортопеда.
Несмотря на пожизненно сохраняющийся риск развития ППИ у пациентов с эндопротезами суставов, применение антибиотикопрофилактики при проведении стоматологических процедур, колоноскопии и других инвазивных процедурах должно быть индивидуальным и проводиться с учетом факторов риска пациента и сложности самой инвазивной процедуры. К группам риска относят пациентов с системными заболеваниями (ревматоидный артрит СКВ и другие), в состоянии иммуносупрессии (лекарственной, радиационной), диабетом I типа, гемофилией, инфекцией других органов [48, 247, 298].
Развитие раннего послеоперационного поверхностного или глубокого нагноения после оперативного вмешательства у больных с ППИ трудно назвать осложнением после хирургического лечения. Следствием такого исхода могут быть трудности с подбором этиотропной антибактериальной терапии, обусловленные резистентностью возбудителя или непереносимостью пациента, невозможность тщательной хирургической санации гнойного очага из-за технических трудностей и/или состояния пациента, выбор неадекватной лечебной тактики, иммунокомпроментированное состояние пациента (из-за сопутствующей патологии, многочисленных оперативных вмешательствах в анамнезе, старческого возраста и пр.). Рецидив ППИ может быть обусловлен также выраженным остеопорозом, обширным инфекционным поражением и трофическими изменениями мягких тканей в области сустава, ограниченными ресурсами пластических тканей в непосредственной близости от очага. Однако рецидив может быть следствием небрежного отношения пациента к состоянию собственного здоровья и недобросовестному отношению пациента к проводимому лечению (нарушение лечебного режима, прерывание курса антибактериальной терапии и пр.).
6. Дополнительная информация, влияющая на течение и исход заболевания
Форма помощи
Несмотря на планирование проведения диагностических и лечебных мероприятий пациентам при имплантат-ассоциированной инфекции, помощь носит неотложный характер. Отсрочка начала лечения или нарушение сроков проведения этапов лечения приводит к снижению показателей эффективности лечения у этих пациентов и утяжеляет прогноз на успешное купирование инфекции у конкретного больного, а в ряде случаев при генерализации инфекционного процесса может приводить к летальному исходу.
Условия оказания медицинских услуг
Проведения диагностических мероприятий на этапе постановки диагноза и в период между этапами лечения может осуществляться в амбулаторных условиях. Проведение этапов хирургического лечения требует стационарного лечения, включающего анестезиологическое сопровождение, антибактериальную, инфузионную и другую сопроводительную терапию. Рабочая группа рекомендует оказание помощи пациентам с перипротезной и перелом-ассоциированной инфекцией в условиях специализированных отделений стационара, врачами травматологами-ортопедами, владеющими методами эндопротезирования крупных суставов и остеосинтеза.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Отсутствие до настоящего времени клинических рекомендаций и алгоритмов по лечению ИАИ с высоким уровнем убедительности и достоверности доказательств во многом связано с отсутствием убедительной доказательной базы для выбора того или иного метода лечения, что определяется сложностью подбора репрезентативных групп пациентов с этой патологией. Значительную роль в исходе лечения данного осложнения играют обоснованность выбранной методики оперативного вмешательства, радикальность выполненной операции, возможность назначения рациональной АБТ, активными в отношении патогенна препаратами, в нужных дозировках и необходимой продолжительности. Развитие, характер течения ИАИ, а также эффективность его лечения зависят от множества факторов, таких как характер возбудителя и уровень его устойчивости к антибиотикам, сроки манифестации и длительность существования инфекционного процесса, состояния костей и мягких тканей, и, следовательно, объема санирующего вмешательства, состояния пациента, выраженности его сопутствующей патологии, включая его нутритивный статус. Несмотря на то, что при длительно текущем хроническом инфекционном процессе, которым, по сути, является ППИ и ПАИ, происходит повышенный распад (гиперкатаболизм) и увеличенное потребление аминокислот, жиров и углеводов (гиперметаболизм) до настоящего времени вопросам нутритивной поддержки пациентов с ППИ не уделяют должного внимания. Известно, что рациональное восполнение энергетических затрат больных способствует ускорению выздоровления, сокращению срока пребывания пациентов в стационаре и приводит к существенной экономии финансовых затрат [299], для чего необходимо разрабатывать локальные протоколы нутритивной поддержки пациентов. Необходимо помнить о том, что даже правильно проведенное лечение ИАИ не гарантирует успеха во всех случаях, и, несмотря на успехи современной ортопедии, частота развития рецидивов ИАИ остается высокой - в среднем 15 - 35%, а при участии высокорезистентных возбудителей, особенно в составе микробных ассоциаций достигая 60 - 75% [165, 167, 203].
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Проведен первичный прием (осмотр, консультация) и постановка диагноза врачом - травматологом-ортопедом или врачом-хирургом
да/нет
2
Выполнено исследование уровня СРБ в сыворотке крови и исследование СОЭ
да/нет
3
Выполнена пункция гнойного очага/синовиальной сумки сустава/области перелома
да/нет
4
Выполнено микробиологическое (культуральное) исследование на аэробные и факультативно-анаэробные микроорганизмы полученной при пункции синовиальной жидкости/раневого (гнойного) отделяемого
да/нет
1
Во время операции не менее трех образцов перипротезных тканей для микробиологического (культурального) исследования на аэробные и факультативно-анаэробные микроорганизмы
да/нет
2
Выполнено патолого-анатомическое исследование операционного материала
да/нет
3
Назначенная стартовая эмпирическая антибактериальная терапия включает препарат, действующий на метициллин-резистентные стафилококки
да/нет
4
Выполнено купирование послеоперационного болевого синдрома
да/нет
1
Пациенту с хронической ППИ выполнено удаление инфицированного эндопротеза в ходе одно- или двухэтапного ревизионного эндопротезирования
да/нет
2
Выполнен перевод на пероральные анибактериальные препараты системного действия
да/нет
1
Пациент в первые сутки после операции обучен дыхательным упражнениям дренирующим
да/нет
Список литературы
1. Брико Н.И. и др. Профилактика инфекций области хирургического вмешательства. Методические рекомендации. / Национальная ассоциация специалистов по контролю инфекций: [сайт]. - 2022. - URL: // https://nasci.ru/?id=102733&download=1 (Дата обращения 23.10.2023).
2.  и др. Centers for disease control and prevention guideline for the prevention of surgical site infection, 2017 // JAMA Surg. 2017. Т. 152, N 8. С. 784-791.
и др. Centers for disease control and prevention guideline for the prevention of surgical site infection, 2017 // JAMA Surg. 2017. Т. 152, N 8. С. 784-791.
3. Centers for Disease and Control. CDC/NHSN Surveillance Definitions for Specific Types of Infections: Surveillance Definitions. Cdc. 2020. January. 1-36.
4. Божкова С.А. и др. Профиль резистентности возбудителей как основа выбора эффективного антибиотика при стафилококковых инфекциях протезированных суставов. Травматология и ортопедия России. 2013; 15 (2): 115-123.
5. Божкова С.А. и др. Неблагоприятные тенденции в этиологии ортопедической инфекции: результаты 6-летнего мониторинга структуры и резистентности ведущих возбудителей. Травматология и ортопедия России. 2018; 24 (4): 20-31.
6. Zimmerli W. Clinical presentation and treatment of orthopaedic implant-associated infection. J. Intern. Med. 2014; 276 (2): 111-119.
7. Божкова С.А. и др. Ортопедическая имплантат-ассоциированная инфекция: ведущие возбудители, локальная резистентность и рекомендации по антибактериальной терапии. Травматология и ортопедия России. 2013; 4 (70): 5-15.
8.  J. REVIEW Management of infections of osteoarticular prosthesis. Clin. Microbiol. Infect. 2006; 12: 93-101.
J. REVIEW Management of infections of osteoarticular prosthesis. Clin. Microbiol. Infect. 2006; 12: 93-101.
9. Zimmerli W., Clauss M. Periprosthetic joint infection after total hip and knee arthroplasty. Bone Jt. Infect. From Microbiol. Diagnostics Treat. 2015: 131-150.
10. Garzoni C., Kelley W.L. Return of the Trojan horse: intracellular phenotype switching and immune evasion by Staphylococcus aureus. EMBO Mol. Med. 2011; 3 (3): 115-117.
11. Abad L. и др. Evaluation of the ability of linezolid and tedizolid to eradicate intraosteoblastic and biofilm-embedded Staphylococcus aureus in the bone and joint infection setting. J. Antimicrob. Chemother. 2019; 74 (3): 625-632.
12. Lora-Tamayo J. и др. High doses of daptomycin (10 mg/kg/d) plus rifampin for the treatment of staphylococcal prosthetic joint infection managed with implant retention: A comparative study. Diagn. Microbiol. Infect. Dis. 2014; 80 (1): 66-71.
13. Fagotti L. и др. Risk Factors and Treatment Options for Failure of a Two-Stage Exchange Curr. Rev. Musculoskelet. Med. 2018; 11 (3): 420-427.
14. Bozhkova S. и др. Failure of the first step of two-stage revision due to polymicrobial prosthetic joint infection of the hip. J. Orthop. Traumatol. 2016; 17 (4): 369-376.
15. Bonnevialle P. и др. Early surgical site infection in adult appendicular skeleton trauma surgery: A multicenter prospective series. Orthop. Traumatol. Surg. Res. 2012; 98 (6): 684-689.
16.  и др. ICS classification system of infected osteosynthesis: Long-term results. Injury. 2018; 49 (3): 564-569.
и др. ICS classification system of infected osteosynthesis: Long-term results. Injury. 2018; 49 (3): 564-569.
17. Kavanagh N. и др. Staphylococcal osteomyelitis: Disease progression, treatment challenges, and future directions. Clin. Microbiol. Rev. 2018; 31 (2).
18. Zhang Y.H. и др. Tumor necrosis  (TNF) stimulates RANKL-induced osteoclastogenesis via coupling of TNF type 1 receptor and RANK signaling pathways. J. Biol. Chem. J Biol Chem. 2001; 276 (1): 563-568.
(TNF) stimulates RANKL-induced osteoclastogenesis via coupling of TNF type 1 receptor and RANK signaling pathways. J. Biol. Chem. J Biol Chem. 2001; 276 (1): 563-568.
19. Bene N., Li X., Nandi S. Factors affecting failure of irrigation and debridement with liner exchange in total knee arthroplasty infection. Knee. 2018; 25 (5): 932-938.
20. Tikhilov R. и др. Risk factors and a prognostic model of hip periprosthetic infection recurrence after surgical treatment using articulating and non-articulating spacers. Int. Orthop. 2016; 40 (7).
21. Винклер Т. и др. Классификация и алгоритм диагностики и лечения перипротезной инфекции тазобедренного сустава. Травматол. Ортопед. России. 2016; 1 (1): 33-45.
22. Ливенцов В.Н. и др. Трудноизлечимая перипротезная инфекция тазобедренного сустава: результаты санирующих операций. Травматол. Ортопед. России. 2019; 25 (4): 88-97.
23. Shirwaiker R.A. и др. A Clinical Perspective on Musculoskeletal Infection Treatment Strategies and Challenges. J. Am. Acad. Orthop. Surg. 2015; 23 (Suppl.1): S44-S54.
24. Birt M.C. и др. Osteomyelitis: Recent advances in pathophysiology and therapeutic strategies. J. Orthop. 2017; 14 (1): 45-52.
25. Orthopaedic Trauma Association: Open Fracture Study Group. A new classification scheme for open fractures. J. Orthop. Trauma. 2010; 24 (8): 457-464.
26. Rightmire E., Zurakowski D., Vrahas M. Acute infections after fracture repair: Management with hardware in place. Clin. Orthop. Relat. Res. 2008; 466 (2): 466-472.
27. Parkkinen M. и др. Risk factors for deep infection following plate fixation of proximal tibial fractures. J. Bone Jt. Surg. (A). 2016; 98 (15): 1292-1297.
28. Bonnevialle P. Operative treatment of early infection after internal fixation of limb fractures (exclusive of severe open fractures). Orthop. Traumatol. Surg. Res. 2017; 103 (1): S67-S73.
29. Шубняков И.И. и др. Что изменилось в структуре ревизионного эндопротезирования тазобедренного сустава в последние годы? Травматол. Ортопед. России. 2019; 25 (4): 9-27.
30. Материалы Второй международной согласительной конференции по лечению скелетно-мышечной инфекции/под ред. пер. с англ.; под общ. ред. Р.М. Тихилова, С.А. Божковой, И.И. Шубнякова. СПб.: РНИИТО им. Р.Р.Вредена, 2019. 314 с.
31. Артюх В.А. и др. Диагностика и лечение перипротезной инфекции тазобедренного сустава // Руководство по хирургии тазобедренного сустава. 2-е изд. / под ред. Тихилова Р.М., Шубнякова И.И. СПб: РНИИТО им.Р.Р.Вредена, 2015. С. 208-256.
32. Куляба Т.А. и др. Лечение инфекционных осложнений после эндопротезирования коленного сустава // Первичное тотальное эндопротезирование коленного сустава / под ред. Куляба Т.А., Корнилова Н.Н. Киев: Основа, 2019. С. 425-486.
33. Kurtz S.M. и др. Economic burden of periprosthetic joint infection in the United States. J. Arthroplasty. 2012; 27 (8, Suppl.): 61-65.e1.
34. Florschutz A. V и др. Surgical site infection risk factors and risk stratification. J. Am. Acad. Orthop. Surg. 2015; 23 (Suppl.): S8-S11.
35. Kunutsor S. и др. Systematic review of risk prediction scores for surgical site infection or periprosthetic joint infection following joint arthroplasty. Epidemiol Infect. 2017; 145: 1738-1749.
36. Li C., Renz N., Trampuz A. Management of periprosthetic joint infection. Hip Pelvis. 2018; 30 (2): 139-146.
37. Tsukayama D.T., Estrada R., Gustilo R.B. Infection after total hip arthroplasty: A study of the treatment of one hundred and six infections. J. Bone Jt. Surg. (A). 1996; 78 (4): 512-523.
38. McPherson E. и др. Periprosthetic total hip infection: outcomes using a staging system. Clin Orthop Relat Res. 2002; 403: 8-15.
39. Metsemakers W.J. и др. Fracture-related infection: A consensus on definition from an international expert group. Injury. 2018; 49 (3): 505-510.
40. Borens O., Helmy N. Infected osteosynthesis. Chirurg. 2016; 87 (10): 822-830.
41. Kleber C., Schaser K.D., Trampuz A. Komplikationsmanagement bei infizierter Osteosynthese: Therapiealgorithmus bei  Infektionen. Chirurg. 2015; 86 (10): 925-934.
Infektionen. Chirurg. 2015; 86 (10): 925-934.
42. Zimmerli W., Sendi P. Orthopaedic biofilm infections. APMIS. 2017; 125 (4).
43.  и др. Bone and joint infections in adults: A comprehensive classification proposal. Eur. Orthop. Traumatol. 2011; 1 (6): 207-217.
и др. Bone and joint infections in adults: A comprehensive classification proposal. Eur. Orthop. Traumatol. 2011; 1 (6): 207-217.
44. Cierny G., Mader J.T., Penninck J.J. A clinical staging system for adult osteomyelitis. Clin. Orthop. Relat. Res. 2003; 414: 7-24.
45. Metsemakers W.J. и др. Infection after fracture fixation: Current surgical and microbiological concepts. Injury. 2018; 49 (3): 511-522.
46. Trampuz A., Zimmerli W. Diagnosis and treatment of implantassociated septic arthritis and osteomyelitis. Curr. Infect. Dis. Rep. 2008; 10 (5): 394-403.
47.  и др. Clinical and epidemiological differences between implant-associated and implant-free orthopaedic infections. Eur. J. Orthop. Surg. Traumatol. 2017; 27 (2): 229-231.
и др. Clinical and epidemiological differences between implant-associated and implant-free orthopaedic infections. Eur. J. Orthop. Surg. Traumatol. 2017; 27 (2): 229-231.
48. Парвизи Д., Торстен Г. Материалы Второй международной согласительной конференции по скелетно-мышечной инфекции /Тихилов Р.М., Божкова С.А., Шубняков И.И. (ред.). Санкт-Петербург: РНИИТО, 2019. 314 с.
49. Артюх В.А., Божкова С. Клинические рекомендации. Лечение параэндопротезной инфекции тазобедренного сустава. Санкт-Петербург, 2013. 40 с.
50. Metsemakers W.J. и др. Fracture-related infection: A consensus on definition from an international expert group. Injury. 2018; 49 (3): 505-510.
51. Parvizi J. и др. The 2018 Definition of periprosthetic hip and knee infection: an evidence-based and validated criteria. J. Arthroplasty. 2018; 33 (5): 1309-1314.
52. Thakore R. V. и др. Surgical site infection in orthopedic trauma: A case-control study evaluating risk factors and cost. J. Clin. Orthop. Trauma. 2015; 6 (4): 220-226.
53. Morgenstern M. и др. International survey among orthopaedic trauma surgeons: Lack of a definition of fracture-related infection. Injury. 2018; 49 (3): 491-496.
54. Тихилов Р.М., Божкова С.А., Артюх В.А. Перипротезная инфекция в области крупных суставов конечностей. Ортопедия. Клинические рекомендации / под ред. акад. РАН С.П. Миронова. Москва, 2018. С.719-746.
55. Osmon D.R. и др. Diagnosis and management of prosthetic joint infection: Clinical practice guidelines by the Infectious Diseases Society of America. Clin. Infect. Dis. 2013; 56 (1): 1-25.
56. Seymour C.W. и др. Assessment of clinical criteria for sepsis for the third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016; 315 (8): 762-774.
57. Котельников Г.П., Миронов С.П., Мирошниченко В.Ф. Травматология и ортопедия: учебник. ГОЭТАР-Мед. Москва, 2009. 400 с.
58. Signore A. и др. Consensus document for the diagnosis of prosthetic joint infections: a joint paper by the EANM, EBJIS, and ESR (with ESCMID endorsement). Eur. J. Nucl. Med. Mol. Imaging. 2019; 46 (4): 971-988.
59. Romano L.C. и др. The WAIOT definition of high-grade and low-grade peri-prosthetic joint infection. J. Clin. Med. 2019; 8 (650): 1-13.
60. McNally M. и др. The EBJIS definition of periprosthetic joint infection: A practical guide for clinicians. Bone Jt. J. 2021; 103 (1): 18-25.
61. Berbari E. и др. Inflammatory blood laboratory levels as markers of prosthetic joint infection: A systematic review and meta-analysis. J. Bone Jt Surg. (A). 2010; 92 (11): 2102-2109.
62. Wang S. и др. Evaluating the use of serum inflammatory markers for preoperative diagnosis of infection in patients with nonunions. Biomed Res. Int. 2017; (2017): 10-14.
63. Alijanipour P., Bakhshi H., Parvizi J. Diagnosis of periprosthetic joint infection: The threshold for serological markers. Clin. Orthop. Relat. Res. 2013; 471 (10): 3186-3195.
64. Spangehl M.J. и др. Prospective analysis of preoperative and intraoperative investigations for the diagnosis of infection at the sites of two hundred and two revision total hip arthroplasties. J. Bone Joint Surg. (A). 1999; 81 (5): 672-683.
65. Bosch P. и др. Limited predictive value of serum inflammatory markers for diagnosing fracture-related infections: results of a large retrospective multicenter cohort study. J. Bone Jt. Infect. 2018; 3 (3): 130-137.
66. Omar M. и др. Synovial C-reactive protein as a marker for chronic periprosthetic infection in total hip arthroplasty. Bone Jt. J. 2015; 97-B (2): 173-176.
67. Ettinger M. и др. Circulating biomarkers for discrimination between aseptic joint failure, low-grade infection, and high-grade septic failure. 2015.
68. Drago L. и др. Procalcitonin, c-reactive protein, interleukin-6, and soluble intercellular adhesion molecule-1 as markers of postoperative orthopaedic joint prosthesis infections. Int. J. Immunopathol. Pharmacol. 2011; (24): 433-440.
69. Yoon J.R., Yang S.H., Shin Y.S.. Diagnostic accuracy of interleukin-6 and procalcitonin in patients with periprosthetic joint infection: a systematic review and meta-analysis. Int. Orthop. 2018; 42: 1213-1226.
70. Yuan K. и др. Comparison of procalcitonin and C-reactive protein for the diagnosis of periprosthetic joint infection before revision total hip arthroplasty. Surg. Infect. (Larchmt). 2015; 16 (2): 146-150.
71. Xu H. и др. Plasma fibrin degradation product and D-dimer are of limited value for diagnosing periprosthetic joint infection. J. Arthroplasty. 2019; 34 (10): 2454-2460.
72. Shahi A. и др. Serum D-dimer test is promising for the diagnosis of periprosthetic joint infection and timing of reimplantation. J. Bone Jt. Surg. (A). 2017; 99 (17): 1419-1427.
73. Aggarwal V.K. и др. Swab cultures are not as effective as tissue cultures for diagnosis of periprosthetic joint infection. Clin. Orthop. Relat. Res. 2013; 471 (10): 3196-3203.
74. Drago L. и др. The World Association against Infection in Orthopaedics and Trauma (WAIOT) procedures for microbiological sampling and processing for periprosthetic joint infections (PJIs) and other. J. Clin. Med. 2019; 8 (933): 1-16.
75. Declercq P. и др. Preoperative joint aspiration culture results and causative pathogens in total hip and knee prosthesis infections: mind the gap. Acta Clin. Belg. 2020; 75 (4): 284-292.
76. Cipriano C.A. и др. Serum and synovial fluid analysis for diagnosing chronic periprosthetic infection in patients with inflammatory arthritis. J Bone Jt. Surg. Am. 2012; 94 (7): 594-600.
77. Carli A.V. и др Diagnostic accuracy of serum, synovial, and tissue testing for chronic periprosthetic joint infection after hip and knee replacements: a systematic review. J. Bone Joint Surg Amer. 2019; 101 (7): 635-649.
78. Schinsky, M.F. и др. Perioperative testing for joint infection in patients undergoing revision total hip arthroplasty. J Bone Jt. Surg Am. 2008; 90 (9): 1869-1875.
79. Zmistowsky B. и др. Periprosthetic joint infection diagnosis: a complete understanding of white blood cell count and differential. J. Arthroplast. 2012; 27 (9): 1589-1593.
80. Vasoo S. и др. Evaluation of the film array blood culture ID panel on biofilms dislodged from explanted arthroplasties for prosthetic joint infection diagnosis. J. Clin. Microbiol. 2015; 53 (8): 2790-2792.
81. Tande A.J., Patel R. Prosthetic joint infection. Clin. Microbiol. Rev. 2014; 27 (2): 302-345.
82. Atkins B.L. и др. Prospective evaluation of criteria for microbiological diagnosis of prosthetic-joint infection at revision arthroplasty. J. Clin. Microbiol. 1998; 36 (10): 2932-2939.
83. Cazanave C. и др. Rapid molecular microbiologic diagnosis of prosthetic joint infection. J. Clin. Microbiol. 2013; 51 (7): 2280-2287.
84. Esteban J. и др. Evaluation of quantitative analysis of cultures from sonicated retrieved orthopedic implants in diagnosis of orthopedic infection. J. Clin. Microbiol. 2008; 46 (2): 488-492.
85. Frangiamore S. и др. Alfa-defensin accuracy to diagnose periprosthetic joint infection - best available test? J. Arthroplast. 2016; 31 (2): 456-460.
86. Janz V. и др. Improved identification of polymicrobial infection in total knee arthroplasty through sonicate fluid cultures. Arch. Orthop. Trauma Surg. 2015; 135 (10): 1453-1457.
87. Minassian A. и др. Use of an automated blood culture system (BD BACTEC) for the diagnosis of prosthetic joint infections: easy and fast. BMC Infect Dis. 2014; 14: 233.
88. Tomas X. и др. Accuracy of CT-guided joint aspiration in patients with suspected infection status post-total hip arthroplasty. Skelet Radiol. 2011; 40 (1): 57-64.
89. Hindle P., Davidson E., Biant L.C. Septic arthritis of the knee: the use and effect of antibiotics prior to diagnostic aspiration. Ann. R. Coll. Surg. Engl. 2012; 94 (5): 351-355.
90. Hoell S. и др. Interleukin-6 in two-stage revision arthroplasty: what is the threshold value to exclude persistent infection before re-implantation? Bone Jt. J. 2015; 97-B (1): 71-75.
91. Trampuz A. и др. Sonication of removed hip and knee prostheses for diagnosis of infection. N. Engl. J. Med. 2007; 357 (7): 654-663.
92. Trampuz A. и др. Sonication of explanted prosthetic components in bags for diagnosis of prosthetic joint infection is associated with risk of contamination. J. Clin. Microbiol. 2006; 44 (2): 628-631.
93. Suda A.J. и др. Diagnosis of periprosthetic joint infection using alpha-defensin test or multiplex-PCR: ideal diagnostic test still not found. Int. Orthop. 2017; 41 (7): 1307-1313.
94. Morgenstern C. и др. Synovial fluid multiplex PCR is superior to culture for detection of low-virulent pathogens causing periprosthetic joint infection. Diagn. Microbiol. Infect. Dis. 2018; 90 (2): 115-119.
95. Bingham J. и др. The alpha defensin-1 biomarker assay can be used to evaluate the potentially infected total joint arthroplasty. Clin. Orthop. Relat. Res. 2014; 472 (12): 4006-4009.
96. Lenski M., Scherer M.A. Synovial IL-6 AS inflammatory marker in periprosthetic joint infections. J. Arthroplasty. 2014; 29 (6): 1105-1109.
97. Deirmengian C. и др. Combined measurement of synovial fluid a-defensin and C-reactive protein levels: Highly accurate for diagnosing periprosthetic joint infection. J. Bone Jt. Surg. (A). 2014; 96 (17): 1439-1445.
98. Deirmengian C. и др. Diagnosing periprosthetic joint infection: has the era of the biomarker arrived? Clin. Orthop. Relat. Res. 2014; 472 (11): 3254-3262.
99. Achermann Y. и др. Improved diagnosis of periprosthetic joint infection by multiplex PCR of sonication fluid from removed implants. J. Clin. Microbiol. 2010; 48 (4): 1208-1214.
100. Wetters N.G. и др. Leukocyte esterase reagent strips for the rapid diagnosis of periprosthetic joint infection. J. Arthroplasty. 2012; 27 (8, Suppl.): 8-11.
101. Goswami K., Parvizi J., Maxwell Courtney P. Current recommendations for the diagnosis of acute and chronic PJI for hip and knee-cell counts, alpha-defensin, leukocyte esterase, next-generation sequencing. Curr. Rev. Musculoskelet. Med. 2018; 11 (3): 428-438.
102. Lee Y.S. и др. Synovial fluid biomarkers for the diagnosis of periprosthetic joint infection: A systematic review and meta-analysis. J. Bone Jt. Surg. (A). 2017; 99 (24).
103. Carli A. V. и др. Diagnostic accuracy of serum, synovial, and tissue testing for chronic periprosthetic joint infection after hip and knee replacements: a systematic review. J. Bone Jt. Surg. (A). 2019; 101 (7).
104. Frangiamore S.J. и др. Synovial fluid interleukin-6 as a predictor of periprosthetic shoulder infection. J. Bone Jt. Surg. (A). 2015; 97 (1): 63-70.
105. Карбышева С.Б. и др. D-лактат - маркер бактериального воспаления нативных и протезированных суставов. Травматол. Ортопед. России. 2017; 23 (2): 6-14.
106. Karbysheva S. и др. New methods in the diagnosis of prosthetic joint infection. Traumatol. Orthop. Russ. 2019; 25 (4): 56-63.
107. De Vecchi E. и др. Alpha defensin, leukocyte esterase, C-reactive protein, and leukocyte count in synovial fluid for pre-operative diagnosis of periprosthetic infection. Int. J. Immunopathol. Pharmacol. 2018; 32: 2058738418806072.
108. Parvizi J. и др. Mark B. Coventry award. Clin. Orthop. Relat. Res. 2012; 470 (1): 54-60.
109. Weigelt L., Plate A., Stadler L. et al. Alpha-defensin lateral flow test does not appear to be useful in predicting shoulder periprosthetic joint infections. Int Orthop. 2020; 44(6): 1023-1029.
110. Onsea J. и др. Accuracy of tissue and sonication fluid sampling for the diagnosis of fracture-related infection: a systematic review and critical appraisal. J. Bone Jt. Infect. 2018; 3 (4): 173-181.
111. Божкова С.А. и др. Профилактика, диагностика и лечение тромбоэмболических осложнений в травматологии и ортопедии: методические рекомендации. Травматол. Ортопед. России. 2022; 28 (3): 136-166.
112. Govaert G.A.M. и др. Diagnosing fracture-related infection: current concepts and recommendations. J. Orthop. Trauma. 2020; 34 (1): 8-17.
113. Burns T.C. и др. Microbiology and injury characteristics in severe open tibia fractures from combat. J. Trauma Acute Care Surg. 2012; 72 (4): 1062-1067.
114. Li C. и др. Twenty common errors in the diagnosis and treatment of periprosthetic joint infection. Int. Orthop. 2020; 44 (1): 3-14.
115. Zimmerli W. Clinical presentation and treatment of orthopaedic implant-associated infection. J. Intern. Med. 2014; 276 (2): 111-119.
116. Boettner F. и др. The rule of histology in the diagnosis of periprosthetic infection: specific granulocyte counting methods and new immunohistologic staining techniques may increase the diagnostic value. Open Orthop. J. 2017; 10 (1): 457-465.
117. Morgenstern M. и др. The value of quantitative histology in the diagnosis of fracture-related infection. Bone Jt. J. 2018; 100B (7): 966-972.
118. Omar M. и др. Higher sensitivity of swab polymerase chain reaction compared with tissue cultures for diagnosing periprosthetic joint infection. J. Orthop. Surg. (Hong Kong). 2018; 26 (1): 2309499018765296.
119.  и др. How many samples and how many culture media to diagnose a prosthetic joint infection: A clinical and microbiological prospective multicenter study. J. Clin. Microbiol. 2016; 54 (2): 385-391.
и др. How many samples and how many culture media to diagnose a prosthetic joint infection: A clinical and microbiological prospective multicenter study. J. Clin. Microbiol. 2016; 54 (2): 385-391.
120. Peel T.N. и др. Optimal periprosthetic tissue specimen number for diagnosis of prosthetic joint infection. J. Clin. Microbiol. 2017; 55 (1).
121. Janz V. и др. Reduced culture time and improved isolation rate through culture of sonicate fluid in blood culture bottles. Technol. Heal. Care. 2017; 25 (4): 635-640.
122. Rothenberg A.C. и др. Sonication of arthroplasty implants improves accuracy of periprosthetic joint infection cultures. Clin. Orthop. Relat. Res. 2017; 475 (7): 1827-1836.
123. Кренн Ф. и др. Новый алгоритм гистопатологической диагностики перипротезной инфекции с применением шкалы cd15 focus score и компьютерной программы cd15 Quantifier. Травматол. Ортопед. России. 2015; 3 (3): 76-85.
124. Куковенко Г.А. и др. Важность выполнения алгоритма диагностики поздней глубокой перипротезной инфекции тазобедренного сустава. Травматол. Ортопед. России. 2019; 25 (4): 75-87.
125. Krenn V. и др. Revised histopathological consensus classification of joint implant related pathology. Pathol Res Pr. 2014; 210 (12): 779-786.
126. Math K.R. и др. Imaging of total knee arthroplasty. Semin. Musculoskelet. Radiol. 2006; 10 (1): 47-63.
127. Van Holsbeeck M.T. и др. Detection of infection in loosened hip prostheses: efficacy of sonography. Am. J. Roentgenol. 1994; 163 (2): 381-384.
128. Eisler T. и др. Ultrasound for diagnosis of infection in revision total hip arthroplasty. J. Arthroplasty. 2001; 16 (8): 1010-1017.
129. Battaglia M. и др. Validity of preoperative ultrasound-guided aspiration in the revision of hip prosthesis. Ultrasound Med. Biol. 2011; 37 (12): 1977-1983.
130. Sconfienza L.M. и др. Diagnosis of peripheral bone and prosthetic joint infections: overview on the consensus documents by the EANM, EBJIS, and ESR (with ESCMID endorsement). Eur. Radiol. 2019; 29 (12): 6425-6438.
131. Patzakis M.J., Zalavras C.G. Chronic posttraumatic osteomyelitis and infected nonunion of the tibia: current management concepts. J. Am. Acad. Orthop. Surg. 2005; 13 (6): 417-427.
132. Gross T. и др. Current concepts in posttraumatic osteomyelitis: a diagnostic challenge with new imaging options. J. Trauma. 2002; 52 (6): 1210-1219.
133. Perlepe V. и др. Semi-quantitative CT assessment of fracture healing: How many and which CT reformats should be analyzed? Eur. J. Radiol. 2019; 118: 181-186.
134. Ledermann H. и др. Pitfalls and limitations of magnetic resonance imaging in chronic posttraumatic osteomyelitis. Eur. Radiol. 2000; 10 (11): 1815-1823.
135. Love C., Palestro C.J. Nuclear medicine imaging of bone infections. Clin. Radiol. 2016; 71 (7): 632-646.
136. Glaudemans A.W.J.M. и др. Diagnosing fracture-related infections: can we optimize our nuclear imaging techniques? Eur. J. Nucl. Med. Mol. Imaging. 2019; 46 (8): 1583-1587.
137. Gemmel F. и др. Prosthetic joint infections: Radionuclide state-of-the-art imaging. Eur. J. Nucl. Med. Mol. Imaging. 2012; 39 (5): 892-909.
138. Reinartz P. FDG-PET in patients with painful hip and knee arthroplasty: Technical breakthrough or just more of the same Q. J. Nucl. Med. Mol. Imaging. 2009; 53 (1): 41-50.
139. Jamar F. и др. EANM/SNMMI guideline for 18F-FDG use in inflammation and infection J. Nucl. Med. 2013; 54 (4): 647-658.
140. van der Bruggen W. и др. PET and SPECT in osteomyelitis and prosthetic bone and joint infections: a systematic review. Semin. Nucl. Med. 2010; 40 (1): 3-15.
141. Valenziano C.P. и др. Efficacy of primary wound cultures in long bone open extremity fractures: Are they of any value? Arch. Orthop. Trauma Surg. 2002; 122 (5): 259-261.
142. Xu C. и др. Reevaluating current cutoffs for acute periprosthetic joint infection: current thresholds are insensitive. J. Arthroplasty. 2019; 34 (11): 2744-2748.
143. Yi P.H. et al. Is potential malnutrition associated with septic failure and acute infection after revision total joint arthroplasty? Clin Orthop Relat Res. 2015; 473: 175-182.
144. Jaberi F.M. et al. Procrastination of wound drainage and malnutrition affect the outcome of joint arthroplasty. Clin Orthop Relat Res. 2008; 466 (6): 1368-71.
145. Chou R. и др. Management of postoperative pain: A clinical practice guideline from the American pain society, the American society of regional anesthesia and pain medicine, and the American society of anesthesiologists' committee on regional anesthesia, executive committee, and administrative council. J. Pain. 2016; 17 (2): 131-157.
146. Lora-Tamayo J. и др. Short- versus long-duration levofloxacin plus rifampicin for acute staphylococcal prosthetic joint infection managed with implant retention: a randomised clinical trial. Int. J. Antimicrob. Agents. 2016; 48 (3): 310-316.
147. Puhto A.P., Puhto T., Syrjala H. Short-course antibiotics for prosthetic joint infections treated with prosthesis retention. Clin. Microbiol. Infect. 2012; 18 (11): 1143-1148.
148. Chaussade H. и др. Antibiotic therapy duration for prosthetic joint infections treated by Debridement and Implant Retention (DAIR): Similar long-term remission for 6 weeks as compared to 12 weeks. Int. J. Infect. Dis. 2017; 63: 37-42.
149. Legout L. и др. Tolerability of prolonged linezolid therapy in bone and joint infection: Protective effect of rifampicin on the occurrence of anaemia? J. Antimicrob. Chemother. 2010; 65 (10): 2224-2230.
150. Chang Y.J. et al. Daptomycin treatment in patients with resistant staphylococcal periprosthetic joint infection. BMC Infect Dis. 2017; 17: 736.
151. Lora-Tamayo J. и др. High doses of daptomycin (10 mg/kg/d) plus rifampin for the treatment of staphylococcal prosthetic joint infection managed with implant retention: A comparative study. Diagn. Microbiol. Infect. Dis. 2014; 80 (1): 66-71.
152. Thabit A.K. и др. Antibiotic penetration into bone and joints: An updated review. Int. J. Infect. Dis. 2019; 81.
153. Lesens O. и др. Should we expand the indications for the DAIR (debridement, antibiotic therapy, and implant retention) procedure for Staphylococcus aureus prosthetic joint infections? A multicenter retrospective study. Eur. J. Clin. Microbiol. Infect. Dis. 2018; 37 (10): 1949-1956.
154. Scheper H. и др. Outcome of debridement, antibiotics, and implant retention for staphylococcal hip and knee prosthetic joint infections, focused on rifampicin use: a systematic review and meta-analysis. Open forum Infect. Dis. 2021; 8 (7): ofab298.
155. Becker A. и др. Duration of rifampin therapy is a key determinant of improved outcomes in early-onset acute prosthetic joint infection due to Staphylococcus treated with a debridement, antibiotics and implant retention (DAIR): a retrospective multicenter study in France. J. bone Jt. Infect. 2020; 5 (1): 28-34.
156. Scarborough M. et al. Oral versus intravenous antibiotics for bone and joint infections: the OVIVA non-inferiority RCT. Health Technol Assess. 2019; 23 (38): 1-92.
157. Perez-Jorge C. и др. Drug treatments for prosthetic joint infections in the era of multidrug resistance. Expert Opin. Pharmacother. 2016; 17 (9): 1233-1246.
158. Depypere M. и др. Recommendations for Systemic antimicrobial therapy in fracture-related infection: a consensus from an International Expert Group. J. Orthop. Trauma. 2020; 34 (1): 30-41.
159. Zimmerli W., Sendi P. 105 - Orthopedic implant-associated infections //Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 9th Ed. Elsevier Inc., 2020: 1430-1442.
160. Davis J.S. и др. Proposed empiric antibiotic therapy for prosthetic joint infections: an analysis of the Prosthetic Joint Infection in Australia and New Zealand, Observational (PIANO) cohort. Intern. Med. J. 2022; 52 (2): 322-325.
161. Mao An M. и др. Linezolid versus vancomycin for meticillin-resistant Staphylococcus aureus infection: a meta-analysis of randomised controlled trials. Int. J. Antimicrob. Agents. 2013; 41: 426-433.
162. Theil C. et al. Clinical use of linezolid in periprosthetic joint infections - a systematic review. J Bone Jt Infect. 2020; 6 (1): 7-16.
163. Perez-Jorge C. и др. Drug treatments for prosthetic joint infections in the era of multidrug resistance. Expert Opinion Pharmacother. 2016; 17 (9): 1233-1246.
164. Wouthuyzen-Bakker M. и др. Moxifloxacin plus rifampin as an alternative for levofloxacin plus rifampin in the treatment of a prosthetic joint infection with Staphylococcus aureus. Int. J. Antimicrob. Agents. 2018; 51 (1): 38-42.
165. Papadopoulos A. и др. Multidrug-resistant and extensively drug-resistant Gram-negative prosthetic joint infections: Role of surgery and impact of colistin administration. Int. J. Antimicrob. Agents. 2019; 53 (3): 294-301.
166. Kalbian I.L. и др. Treatment outcomes and attrition in gram-negative periprosthetic joint infection. J. Arthroplasty. 2020; 35 (3): 849-854.
167. Bozhkova S. и др. Failure of the first step of two-stage revision due to polymicrobial prosthetic joint infection of the hip. J. Orthop. Traumatol. 2016; 17 (4).
168. Boyle K.K. и др. General assembly, treatment, antimicrobials: proceedings of International Consensus on Orthopedic Infections. J. Arthroplasty. 2019; 34 (2): S225-S237.
169. Backes M. и др. Effect of antibiotic prophylaxis on surgical site infections following removal of orthopedic implants used for treatment of foot, ankle, and lower leg fractures a randomized clinical trial. JAMA. 2017; 318 (24): 2438-2445.
170. Pradier M. и др. Suppressive antibiotic therapy with oral tetracyclines for prosthetic joint infections: a retrospective study of 78 patients. Infection. 2018; 46 (1): 39-47.
171. Pradier M. и др. Suppressive antibiotic therapy with oral doxycycline for Staphylococcus aureus prosthetic joint infection: a retrospective study of 39 patients. Int. J. Antimicrob. Agents. 2017; 50 (3): 447-452.
172. Siqueira M.B.P. и др. Chronic suppression of periprosthetic joint infections with oral antibiotics increases infection-free survivorship. J. Bone Jt. Surg. (A). 2014; 97 (15): 1220-1232.
173. Troendlin F. и др. Persistent fistula for treatment of a failed periprosthetic joint infection: relic from the past or a viable salvage procedure? J. Arthroplasty. 2020; 35 (2): 544-549.
174. Rao N. и др. Long term suppression of infection in total joint arthroplasty. Clin. Orthop. 2003; 414: 55-60.
175. Vees T., Hofmann G.O. Early periprosthetic infection: dilution, jet dilution or local antibiotics. Which way to go? A meta-analysis on 575 patients. GMS Interdiscip. Plast. Reconstr. Surg. DGPW. 2020; 9: Doc03.
176. Божкова С.А., Новокшонова А.А., Конев В.А. Современные возможности локальной антибиотикотерапии перипротезной инфекции и остеомиелита (Обзор литературы). Травматол. Ортопед. России. 2015; 77 (3): 92-107.
177. Argenson J.N. и др. Hip and knee section, treatment, debridement and retention of implant: Proceedings of International Consensus on Orthopedic Infections. J. Arthroplasty. 2019; 34 (2): S399-S419.
178.  и др. Local antibacterial implant protection in orthopedics and trauma: what's new? Travmatol. Ortop. Ross. 2019; 25 (4): 64-74.
и др. Local antibacterial implant protection in orthopedics and trauma: what's new? Travmatol. Ortop. Ross. 2019; 25 (4): 64-74.
179. Proceedings of the International Consensus Meeting on Periprosthetic Joint Infection. Foreword. J Orthop Res. 2014. S2-S3.
180. Acute Management of Peri-prosthetic Joint Infection. 2023 https://www.boa.ac.uk/static/1d7d2f54-34b7-4c96-8a0eb80bae3e3a07/e277bd57-a872-4f3d-bb61d6fae28edc51/BOAST-Acute-Management-of-PJI.pdf (дата обращения 21.02.2024).
181. Сепсис: классификация, клинико-диагностическая концепция и лечение. 4-е изд. Под ред. Акад. РАН Б.Р. Гельфанда. М., 2017: С.66-70,
182. Ghnaimat M. и др. Is DAIR still an effective way to eradicate acute prosthetic joint infections? our experience in the Jordanian Royal Medical Services. Med. Arch. 2021; 75 (6): 451-455.
183. Nurmohamed F.R.H.A. и др. One-year infection control rates of a DAIR (debridement, antibiotics and implant retention) procedure after primary and prosthetic-joint-infection-related revision arthroplasty - a retrospective cohort study. J. Bone Jt. Infect. 2021; 6 (4): 91-97.
184. van der Ende B. и др. Timing of debridement, antibiotics, and implant retention (DAIR) for early post-surgical hip and knee prosthetic joint infection (PJI) does not affect 1-year re-revision rates: data from the Dutch Arthroplasty Register. J. Bone Jt. Infect. 2021; 6 (8): 329-336.
185. Bryan A.J. и др. Irrigation and debridement with component retention for acute infection after hip arthroplasty: Improved results with contemporary management. J. Bone Jt. Surg. (A). 2017; 99 (23): 2011-2018.
186. Son W.S. и др. Efficacy of open debridement and polyethylene exchange in strictly selected patients with infection after total knee arthroplasty. Knee Surg. Relat. Res. 2017; 29 (3): 172-179.
187. Tsang S.T.J. и др. Outcomes following debridement, antibiotics and implant retention in the management of periprosthetic infections of the hip: A review of cohort studies. Bone Jt J. (Br). 2017; 99B (11): 1458-1466.
188. Triantafyllopoulos G.K. и др. Implant retention after acute and hematogenous periprosthetic hip and knee infections: Whom, when and how? World J. Orthop. 2016; 7 (9): 546-552.
189. Buller L.T. и др. The preoperative prediction of success following irrigation and debridement with polyethylene exchange for hip and knee prosthetic joint infections. J. Arthroplasty. 2012; 27 (6).
190. Volpin A. и др. Aggressive early debridement in treatment of acute periprosthetic joint infections after hip and knee replacements. Open Orthop. J. 2016; 10 (1): 669-678.
191. Swenson R.D. и др. Preoperative anemia is associated with failure of open debridement polyethylene exchange in acute and acute hematogenous prosthetic joint infection. J. Arthroplasty. 2018; 33 (6): 1855-1860.
192. Triantafyllopoulos G.K. и др. Implant retention after acute and hematogenous periprosthetic hip and knee infections: Whom, when and how? World J. Orthop. 2016; 7 (9): 546-552.
193.  и др. Gram-negative prosthetic joint infection: Outcome of a debridement, antibiotics and implant retention approach. A large multicentre study. Clin. Microbiol. Infect. 2014; 20 (11): O911-O919.
и др. Gram-negative prosthetic joint infection: Outcome of a debridement, antibiotics and implant retention approach. A large multicentre study. Clin. Microbiol. Infect. 2014; 20 (11): O911-O919.
194. Vilchez F. и др. Outcome and predictors of treatment failure in early post-surgical prosthetic joint infections due to Staphylococcus aureus treated with debridement. Clin. Microbiol. Infect. 2011; 17 (3): 439-444.
195. Konigsberg B.S. и др. Acute hematogenous infection following total hip and knee arthroplasty. J. Arthroplasty. 2014; 29 (3): 469-472.
196. Sendi P. и др. Clinical comparison between exogenous and haematogenous periprosthetic joint infections caused by Staphylococcus aureus. Clin. Microbiol. Infect. 2011; 17 (7): 1098-1100.
197. Goud A.L., Harlianto N.I., Ezzafzafi S. et al. Reinfection rates after one- and two-stage revision surgery for hip and knee arthroplasty: a systematic review and meta-analysis. Arch Orthop Trauma Surg. 2023; 143(2): 829-838.
198. Kunutsor S.K. и др. Re-infection outcomes following one- and two-stage surgical revision of infected knee prosthesis: A systematic review and meta-analysis. PLoS One. 2016; 11 (3).
199. Van Den Kieboom J. и др. One-stage revision is as effective as twostage revision for chronic culture-negative periprosthetic joint infection after total hip and knee arthroplasty a retrospective cohort study. Bone Jt. J. (Br). 2021; 103-B (3): 515-521.
200. Winkler H. и др. One stage uncemented revision of infected total hip replacement using cancellous allograft bone impregnated with antibiotics. J. Bone Jt. Surg. (Br.). 2008; 90 (12): 1580-1584.
201. Whiteside L.A., Roy M.E. One-stage revision with catheter infusion of intraarticular antibiotics successfully treats infected THA. Clin. Orthop. Relat. Res. 2017; 475 (2): 419-429.
202. Gehrke T., Zahar A., Kendoff D. One-stage exchange: it all began here. Bone Joint J. 2013; 95-B (11): 77-83.
203. Hip & Knee - ICM Philly [Электронный ресурс]. URL: https://icmphilly.com/hip-knee/ (дата обращения: 22.05.2022).
204. Zahar A. и др. Ten-year results following one-stage septic hip exchange in the management of periprosthetic joint infection. J. Arthroplasty. 2019; 34 (6): 1221-1226.
205. Bori G. и др. Preliminary results after changing from two-stage to one-stage revision arthroplasty protocol using cementless arthroplasty for chronic infected hip replacements. J. Arthroplasty. 2018; 33 (2): 527-532.
206. Jenny J.Y. и др. Routine one-stage exchange for chronic infection after total hip replacement. Int. Orthop. 2014; 38 (12): 2477-2481.
207. Jenny J.Y. и др. High infection control rate and function after routine one-stage exchange for chronically infected TKA knee. Clin. Orthop. Relat. Res. 2013; 471 (1): 238-243.
208. Wolf M. и др. Prosthetic joint infection following total hip replacement: Results of one-stage versus two-stage exchange. Int. Orthop. 2014; 38 (7): 1363-1368.
209. Zahar A., Gehrke T.A. One-stage revision for infected total hip arthroplasty. Orthop. Clin. N. Am. 2016; 47 (1): 11-18.
210. Klouche S. и др. Infected total hip arthroplasty revision: One- or two-stage procedure? Orthop. Traumatol. Surg. Res. 2012; 98 (2): 144-150.
211.  и др. Outcome of hip and knee periprosthetic joint infections caused by pathogens resistant to biofilm-active antibiotics: results from a prospective cohort study. Arch. Orthop. Trauma Surg. 2018; 138 (5): 635-642.
и др. Outcome of hip and knee periprosthetic joint infections caused by pathogens resistant to biofilm-active antibiotics: results from a prospective cohort study. Arch. Orthop. Trauma Surg. 2018; 138 (5): 635-642.
212. Kunutsor S.K. и др. Clinical effectiveness of treatment strategies for prosthetic joint infection following total ankle replacement: a systematic review and meta-analysis. J. Foot Ankle Surg. 2020; 59 (2): 367-372.
213. Kunutsor S.K. и др. Re-infection outcomes following one- and two-stage surgical revision of infected knee prosthesis: A systematic review and meta-analysis. PLoS ONE. 2016; 11 (3).
214. Lichstein P. и др. Treatment of periprosthetic knee infection with a two-stage protocol using static spacers. Clin. Orthop. Relat. Res. 2016; 474 (1): 120-125.
215. Park S.J. и др. Comparison of static and mobile antibiotic-impregnated cement spacers for the treatment of infected total knee arthroplasty. Int. Orthop. 2010; 34 (8): 1181-1186.
216. Chiang E.R. и др. Comparison of articulating and static spacers regarding infection with resistant organisms in total knee arthroplasty. Acta Orthop. 2011; 82 (4): 460-464.
217. Van Thiel G.S. и др. Intraoperative molds to create an articulating spacer for the infected knee arthroplasty. Clin. Orthop. Relat. Res. 2011; 469 (4): 994-1001.
218. Choi H.R., Malchau H. Are prosthetic spacers safe to use in 2-stage treatment for infected total knee arthroplasty? J. Arthroplasty. 2012; 27 (8).
219. Hofmann A.A. и др. Ten-year experience using an articulating antibiotic cement hip spacer for the treatment of chronically infected total hip. J. Arthroplasty. 2005; 20 (7): 874-879.
220. Citak M. и др. Are preformed articulating spacers superior to surgeon-made articulating spacers in the treatment of PJI in THA? A literature review. Open Orthop. J. 2015; 9 (1): 255-261.
221. Cabo J. и др. Clinical outcome and microbiological findings using antibiotic-loaded spacers in two-stage revision of prosthetic joint infections. J. Infect. 2011; 63 (1): 23-31.
222.  и др. The relationship between microbiology results in the second of a two-stage exchange procedure using cement spacers and the outcome after revision total joint replacement for infection: The use of sonication to aid bacteriological analysis. J. Bone Jt. Surg. (B). 2012; 94 B (2): 249-253.
и др. The relationship between microbiology results in the second of a two-stage exchange procedure using cement spacers and the outcome after revision total joint replacement for infection: The use of sonication to aid bacteriological analysis. J. Bone Jt. Surg. (B). 2012; 94 B (2): 249-253.
223. Nelson C.L. и др. Sonication of antibiotic spacers predicts failure during two-stage revision for prosthetic knee and hip infections. Clin. Orthop. Relat. Res. 2014; 472 (7): 2208-2214.
224. El-Husseiny M., Haddad F.S. The role of highly selective implant retention in the infected hip arthroplasty. Clin. Orthop. Relat. Res. 2016; 474 (10): 2157-2163.
225. Fukui K. и др. Should well-fixed uncemented femoral components be revised in infected hip arthroplasty? Report of five trial cases. J. Orthop. 2016; 13 (4): 437-442.
226. Miner T.M. и др. The extended trochanteric osteotomy in revision hip arthroplasty: A critical review of 166 cases at mean 3-year, 9-month follow-up. J. Arthroplasty. 2001; 16 (8, Suppl. 1): 188-194.
227. Struhl S. и др. Infected uncemented hip arthroplasty. Preserving the femoral stem with a two-stage revision procedure. Orthop Rev. 1989; 18 (6): 707-712.
228. Ji B. и др. Retention of the well-fixed implant in the single-stage exchange for chronic infected total hip arthroplasty: an average of five years of follow-up. Int. Orthop. 2017; 41 (5): 901-909.
229. Rahman W.A., Kazi H.A., Gollish J.D. Results of single stage exchange arthroplasty with retention of well fixed cement-less femoral component in management of infected total hip arthroplasty. World J. Orthop. 2017; 8 (3): 264-270.
230. Triantafyllopoulos G.K. и др. Periprosthetic infection recurrence after 2-stage exchange arthroplasty: failure or fate? J. Arthroplasty. 2017; 32 (2): 526-531.
231. Babis G.C. и др. Two-stage revision protocol in multidrug resistant periprosthetic infection following total hip arthroplasty using a long interval between stages. J. Arthroplasty. 2015; 30 (9): 1602-1606.
232. Лю Б. и др. Эффективность первого этапа двухэтапной ревизии при параэндопротезной инфекции тазобедренного сустава. Травматол. Ортопед. России. 2014; 73 (3): 5-14.
233. Edelstein A.I. и др. Nephrotoxicity after the treatment of periprosthetic joint infection with antibiotic-loaded cement spacers. J. Arthroplasty. 2018; 33 (7): 2225-2229.
234. Geller J.A. и др. Acute kidney injury after first-stage joint revision for infection: risk factors and the impact of antibiotic dosing. J. Arthroplasty. 2017; 32 (10): 3120-3125.
235. James A., Larson T. Acute renal failure after high-dose antibiotic bone cement: case report and review of the literature. Ren. Fail. 2015; 37 (6): 1061-1066.
236. Winkler T. и др. Outcome of short versus long interval in two-stage exchange for periprosthetic joint infection: a prospective cohort study. Arch. Orthop. Trauma Surg. 2019; 139 (3): 295-303.
237. Karczewski D. и др. A standardized interdisciplinary algorithm for the treatment of prosthetic joint infections. Bone Jt J. 2019; 101-B (2): 132-139.
238. Preininger B. и др. Inadequacy of joint aspiration for detection of persistent periprosthetic infection during two-stage septic revision knee surgery. Orthopedics. 2017; 40 (4): 231-234.
239. Wechter J. и др. Improved survival of uncemented versus cemented femoral stems in patients aged < 70 years in a community total joint registry. Clin. Orthop. Relat. Res. 2013; 471 (11): 3588-3595.
240. Edwards P.K. и др. Are cementless stems more durable than cemented stems in two-stage revisions of infected total knee arthroplasties? Infection. Clin. Orthop. Relat. Res. 2014; 472 (1): 206-211.
241. Gathen M. и др. Comparison of two-stage revision arthroplasty and intramedullary arthrodesis in patients with failed infected knee arthroplasty. Arch. Orthop. Trauma Surg. 2018; 138 (10): 1443-1452.
242. Cochran A.R. и др. Risk of reinfection after treatment of infected total knee arthroplasty. J. Arthroplasty. 2016; 31 (9): 156-161.
243. Fehring K.A. и др. Repeat two-stage exchange arthroplasty for periprosthetic knee infection is dependent on host grade. J. Bone Jt Surg. (A). 2017; 99 (1): 19-24.
244. Byren I. и др. Randomized controlled trial of the safety and efficacy of daptomycin versus standard-of-care therapy for management of patients with osteomyelitis associated with prosthetic devices undergoing two-stage revision arthroplasty. Antimicrob. Agents Chemother. 2012; 56 (11): 5626-5632.
245. Божкова С.А. и др. Резекционная артропластика с пересадкой островкового мы-шечного лоскута у больных с перипротезной инфекцией. Хирургия. Журн. Им. Н.И. Пирогова. 2020; (2): 32-38.
246. Choa R. и др. Successful management of recalcitrant infection related to total hip replacement using pedicled rectus femoris or vastus lateralis muscle flaps. J. Bone Jt. Surg. (B). 2011; 93 B (6): 751-754.
247. Куляба Т.А., Корнилов Н.Н. Ревизионная артропластика коленного сустава. СПб.: РНИИТО им. Р.Р.Вредена, 2016. 168 с.
248. Balato G. и др. Re-infection rates and clinical outcomes following arthrodesis with intramedullary nail and external fixator for infected knee prosthesis: A systematic review and meta-analysis. BMC Musculoskelet. Disord. 2018; 19 (1).
249. Соломин Л.Н. и др. Сравнительный анализ артродезирования коленного сустава длинными блокируемыми стержнями и аппаратом илизарова при последствиях глубокой инфекции после эндопротезирования. Травматол. Ортопед. России. 2020; 26 (3): 109-118.
250. Gathen M. и др. Comparison of two-stage revision arthroplasty and intramedullary arthrodesis in patients with failed infected knee arthroplasty. Arch. Orthop. Trauma Surg. 2018; 138 (10): 1443-1452.
251. Azzam K. и др. Outcome of a second two-stage reimplantation for periprosthetic knee infection. Clin. Orthop. Relat. Res. 2009; 467 (7): 1706-1714.
252. Hawi N. и др. Septic single-stage knee arthrodesis after failed total knee arthroplasty using a cemented coupled nail. Bone Jt. J. (B) 2015; 97-B (5): 649-653.
253. Hungerer S. и др. Knee arthrodesis versus above-the-knee amputation after septic failure of revision total knee arthroplasty: Comparison of functional outcome and complication rates. BMC Musculoskelet. Disord. 2017; 18 (1).
254. Wu C.H., Gray C.F., Lee G.C. Arthrodesis should be strongly considered after failed two-stage reimplantation TKA. Clin. Orthop. Relat. Res. 2014; 472 (11): 3295-3304.
255. Chen A.F. и др. Better function for fusions versus above-the-knee amputations for recurrent periprosthetic knee infection infection. Clin. Orthop. Rel. Res. 2012; 470 (10): 2737-2745.
256. Rodriguez-Merchan E.C. Knee Fusion or above-the-knee amputation after failed two-stage reimplantation total knee arthroplasty. Arch. Bone Jt. Surg. 2015; 3 (4): 241.
257. Backe H.A., Wolff D.A., Windsor R.E. Total knee replacement infection after 2-stage reimplantation: Results of subsequent 2-stage. Clin. Orthop. Relat. Res. 1996; 331: 125-131.
258. Moura D.L., Garru o A. Hip disarticulation - case series analysis and literature review. Rev. Bras. Ortop. 2017; 52 (2): 154-158.
259. Ghazavi M. Hip and knee section, treatment, salvage: proceedings of international consensus on orthopedic infections. J. Arthroplasty. 2019; 34 (2S): S459-S462.
260. Kuo F.C. и др. Positive blood cultures decrease the treatment success in acute hematogenous periprosthetic joint infection treated with debridement, antibiotics, and implant retention. J. Arthroplasty. 2019; 34 (12): 3030-3034.
261. Klement M.R. и др. Positive blood cultures in periprosthetic joint infection decrease rate of treatment success. J. Arthroplasty. 2018; 33 (1): 200-204.
262. Bohl D.D. at al. Incidence, risk factors, and sources of sepsis following total joint arthroplasty. J. Arthroplasty. 2016; 31 (12): 2875-2879.
263. Patel K.M. и др. Sepsis and total joint arthroplasty. Orthop. Clin. North Am. 2022; 53 (1): 13-24.
264. Lenguerrand E. и др. Risk factors associated with revision for prosthetic joint infection following knee replacement: an observational cohort study from England and Wales. Lancet Infect. Dis. 2019; 19 (6).
265. Lensen K.J. и др. Chronic prosthetic joint infections with a draining sinus. Who should receive suppressive antibiotic treatment? J. Bone Jt. Infect. 2020; 6 (2): 43-45.
266. Lensen K.J.D.F. и др. The efficacy of suppressive antibiotic treatment in patients managed non-operatively for periprosthetic joint infection and a draining sinus. J. Bone Jt. Infect. 2021; 6 (7): 313-319.
267. Ferry T. и др. The CRIOAc healthcare network in France: A nationwide Health Ministry program to improve the management of bone and joint infection. Orthop. Traumatol. Surg. Res. 2019; 105 (1): 185-190.
268. Laurent E. и др. Multidisciplinary team meeting for complex bone and joint infections diagnosis: The PHICTOS study. Rev. Epidemiol. 2019; 67 (3): 149-154.
269. Fang C. и др. Infection after fracture osteosynthesis - Part II: Treatment. J. Orthop. Surg. 2017; 25 (1): 1-11.
270. Mote G.A., Malay D.S. Efficacy of power-pulsed lavage in lower extremity wound infections: a prospective observational study. J. Foot Ankle Surg. 2010; 49 (2): 135-142.
271. Bezstarosti H. и др. Insights into treatment and outcome of fracture-related infection: a systematic literature review. Arch. Orthop. Trauma Surg. 2019; 139 (1): 61-72.
272. Hake M.E. и др. Local antibiotic therapy strategies in orthopaedic trauma: Practical tips and tricks and review of the literature. Injury. 2015; 46 (8): 1447-1456.
273. Zhang Y. и др. Double-level bone transport for large post-traumatic tibial bone defects: a single centre experience of sixteen cases. Int. Orthop. 2018; 42 (5): 1157-1164.
274. Metsemakers W.J. et al. Fracture-Related Infection (FRI) group. General treatment principles for fracture-related infection: recommendations from an international expert group. Arch. Orthop. Trauma Surg. 2020; 140 (8): 1013-1027.
275.  et al. Posttraumatic and postoperative osteomyelitis: surgical revision strategy with persisting fistula. Arch. Orthop. Trauma Surg. 2014; 134 (2): 159-165.
et al. Posttraumatic and postoperative osteomyelitis: surgical revision strategy with persisting fistula. Arch. Orthop. Trauma Surg. 2014; 134 (2): 159-165.
276. Щепкина Е.А. и др. Сравнительная оценка замещения посттравматических дефектов бедренной и большеберцовой костей по илизарову и поверх интрамедуллярного стержня. Медико-биолог. и социально-психолог. проблемы безопасности в чрезвычайных ситуациях. 2021; (2): 80-88.
277. Kadhim M. и др. Treatment options for nonunion with segmental bone defects: systematic review and quantitative evidence synthesis. J. Orthop. Trauma. 2017; 31 (2): 111-119.
278. McNally M. et al. What factors affect outcome in the treatment of fracture-related infection? Antibiotics (Basel). 2022; 11 (7): 946.
279. Morgenstern M. et al. The effect of local antibiotic prophylaxis when treating open limb fractures: a systematic review and meta-analysis. Bone Jt Res. 2018; 7(7): 447-456.
280. McKee M.D. и др. A prospective, randomized clinical trial comparing an antibiotic-impregnated bioabsorbable bone substitute with standard antibiotic-impregnated cement beads in the treatment of chronic osteomyelitis and infected nonunion. J. Orthop. Trauma. 2010; 24 (8): 483-490.
281. Kocaoglu M. и др. Reconstruction of segmental bone defects due to chronic osteomyelitis with use of an external fixator and an intramedullary nail. J. Bone Jt. Surg. (A). 2006; 88 (10): 2137-2145.
282. Li Z. и др. Distraction osteogenesis technique using an intramedullary nail and a monolateral external fixator in the reconstruction of massive postosteomyelitis skeletal defects of the femur. Can. J. Surg. 2009; 52 (2).
283. Depypere M. et al. Fracture-related Infection (FRI) Consensus Group. Recommendations for systemic antimicrobial therapy in fracture-related infection: a consensus from an International Expert Group. J. Orthop. Trauma. 2020; 4 (1): 30-41.
284. Berkes M. и др. Maintenance of hardware after early postoperative infection following fracture internal fixation. J. Bone Jt. Surg. (A). 2010; 92 (4): 823-828.
285. Metsemakers W.J. и др. Evidence-based recommendations for local antimicrobial strategies and dead space management in fracture-related infection. J. Orthop. Trauma. 2020; 34 (1): 18-29.
286. Cierny G. Surgical treatment of osteomyelitis. Plast. Reconstr. Surg. 2011; 127 (Suppl. 1).
287. Клюшин Н.М. и др. Клинические рекомендации "Остеомиелит" [Электронный ресурс]. 2016. Т. 2016. С. 68. URL: http://kokb45.ru/wp-content/uploads/2018/06/Osteomielit.pdf.
288. Siddiqi A. и др. Perioperative antibiotic prophylaxis in total joint arthroplasty: A systematic review and meta-analysis. J. Bone Jt. Surg. (A). 2019; 101 (9): 828-842.
289. Backes M. и др. Wound infections following implant removal below the knee: The effect of antibiotic prophylaxis; The WIFI-trial, a multi-centre randomized controlled trial. BMC Surg. 2015; 15 (1).
290. Sanders F.R.K. и др. Comparison of 2g vs 1 g of prophylactic cefazolin in surgical site infections in trauma surgery below the knee. Foot Ankle Int. 2020; 41 (5): 582-589.
291. Wong M.T. Can topical vancomycin prevent periprosthetic joint infection in hip and knee arthroplasty? a systematic review. Clin Orthop Relat Res. 2021; 479 (8): 1655-1664.
292. Kim P.H., Leopold S.S. Gustilo-Anderson classification. Clin. Orthop. Relat. Res. 2012; 470 (11): 3270-3274.
293. Sorger J.I. и др. Once daily, high dose versus pided, low dose gentamicin for open fractures. Clin. Orthop. Relat. Res. 1999; 366: 197-204.
294. Hoff W.S. и др. East practice management guidelines work group: Update to practice management guidelines for prophylactic antibiotic use in open fractures. J. Trauma - Inj. Infect. Crit. Care. 2011; 70 (3): 751-754.
295. Murray C.K. и др. Prevention of infections associated with combat-related extremity injuries. J. Trauma Inj. Infect. Crit. Care. 2011; 71 (2).
296. Takahara S. и др. Ampicillin/sulbactam versus cefazolin plus aminoglycosides for antimicrobial prophylaxis in management of Gustilo type IIIA open fractures: A retrospective cohort study. Injury. 2022; 53 (4): 1517-1522.
297. Trauma - ICM Philly [Электронный ресурс]. URL: https://icmphilly.com/trauma/ (дата обращения: 25.05.2020).
298. Парвизи Д., Торстен Г. Материалы международной согласительной конференции по перипротезной инфекции /Под ред. Р.М. Тихилова. СПб.: РНИИТО, 2014. 355 с.
299. Elia M. и др. A systematic review of the cost and cost effectiveness of using standard oral nutritional supplements in the hospital setting. Clin. Nutr. 2016; 35 (2): 370-380.
300. Metsemakers W.J. и др. General treatment principles for fracture-related infection: recommendations from an international expert group. Arch. Orthop. Trauma Surg. 2020; 140 (8): 1013-1027.
301. Pani A. et al. Off-label use of ceftaroline fosamil: A systematic review. Int. J. Antimicrob. Agents. 2019; 54 (5): 562-571.
302. Barber K.E. и др. Evaluation of ceftaroline alone and in combination against biofilm-producing methicillin-resistant Staphylococcus aureus with reduced susceptibility to daptomycin and vancomycin in an in vitro pharmacokinetic/pharmacodynamic model. Antimicrob. Agents Chemother. 2015; 59 (8): 4497-4503.
303. Garrigues G.E. и др. Proceedings from the 2018 International Consensus Meeting on Orthopedic Infections: evaluation of periprosthetic shoulder infection. J. Shoulder Elb. Surg. 2019; 28 (6).
304. Tang H. и др. In vitro efficacy of fosfomycin-containing regimens against methicillin-resistant Staphylococcus aureus in biofilms. J. Antimicrob. Chemother. 2012; 67 (4): 944-950.
305. Soriano A. и др. Efficacy and tolerability of prolonged linezolid therapy in the treatment of orthopedic implant infections. Eur. J. Clin. Microbiol. Infect. Dis. 2007; 26 (5): 353-356.
306. Rao N., Hamilton C.W. Efficacy and safety of linezolid for Gram-positive orthopedic infections: a prospective case series. Diagn. Microbiol. Infect. Dis. 2007; 59 (2): 173-179.
307. Benavent E. et al. Long-term use of tedizolid in osteoarticular infections: benefits among oxazolidinone drugs. Antibiotics. 2021; 10 (1): 53
308. Park K.H. et al. Activity of Tedizolid in methicillin-resistant Staphylococcus aureus experimen-tal foreign body-associated osteomyelitis. Antimicrob. Agents Chemother. 2016; 60: 6568-6572.
309. Assis L.M.,  , Dessen A. New strategies for targeting and treatment of multi-drug resistant Staphylococcus aureus. Drug Resist. Updat. 2017; 31 (2017): 1-14.
, Dessen A. New strategies for targeting and treatment of multi-drug resistant Staphylococcus aureus. Drug Resist. Updat. 2017; 31 (2017): 1-14.
310. Holmberg A., Rasmussen M. Antibiotic regimens with rifampicin for treatment of Enterococcus faecium in biofilms. Int. J. Antimicrob. Agents. 2014; 44 (1): 78-80.
311. Lomas J. Antimicrobial treatment in bone and joint infections. Orthop. Trauma. 2019; 33 (3): 153-159.
312. Lastinger A. et al. Clinical experience with tigecycline in the treatment of prosthetic joint infections. J. Bone Jt Infect. 2019; 4 (3): 126-132.
313. Tsuji B.T. et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy. 2019; 39 (1): 10-39.
314. de Sanctis J. et al. Complex prosthetic joint infections due to carbapenemase-producing Klebsiella pneumoniae: a unique challenge in the era of untreatable infections. Int. J. Infect. Dis. 2014; 25: 73-78.
315. Конев В.А. и др. Результаты применения фосфомицина для импрегнации остеозамещающих материалов при лечении хронического остеомиелита. Травматол. Ортопед. России 2016; 22 (2): 43-56.
316. Божкова С.А. и др. Фосфомицин - возможности применения для локальной терапии перипротезной инфекции. Клин. Микробиол. Антимикроб. химиотерапия. 2016; 18 (2): 104-112.
317. Божкова С.А. и др. Клинико-экономическая эффективность использования фосфомицина и ванкомицина для импрегнации спейсеров при хирургическом лечении пациентов с перипротезной инфекцией. Травматол. Ортопед. России. 2017; 23 (2): 122-131.
318. Артюх В.А. и др. Способ изготовления цементного спейсера для этиотропной местной антибактериальной терапии при инфекционных поражениях костей и суставов. Патент на изобретение RU 2754075 C1. 25.08.2021. Бюл. N 24 Заявка N 2020139552 от 01.12.2020.
319. Bernard L. и др. Antibiotic therapy for 6 or 12 weeks for prosthetic joint infection. N. Engl. J. Med. 2021; 384 (21): 1991-2001.
320. Pradier M.et al. Suppressive antibiotic therapy with oral doxycycline for Staphylococcus aureus prosthetic joint infection: a retrospective study of 39 patients. Int. J. Antimicrob. Agents. 2017; 50 (3): 447-452.
321. Rempenault C. et al. Treatment of bone and joint infections by ceftazidime/avibactam and ceftolozane/tazobactam: a cohort study. J. Glob. Antimicrob. Resist. 2021; 25: 282-286.
322. Schimmenti A. Prosthetic joint infection from carbapenemase-resistant Klebsiella pneumoniae successfully treated with ceftazidime-avibactam. Case Rep Infect Dis. 2018; 1854805.
323. Toor R., Garcia E. 607: Ceftazidime-avibactam and aztreonam against multidrug-resistant Pseudomonas aeruginosa. Crit. Care Med. 2020; 48 (1): 284
324. Mularoni A. et al. Combination of aztreonam, ceftazidime-avibactam and amikacin in the treatment of VIM-1 Pseudomonas aeruginosa ST235 osteomyelitis. Int. J. Infect. Dis. 2021; 108: 510-512.
325. Oliveira P. R. et al. Tigecycline versus colistin in the treatment of carbapenem-resistant Acinetobacter baumannii complex osteomyelitis. J. Bone Jt Infect. 2020; 5: 60-66.
326. Tabaja H, Tai DBG, Beam E, Abdel MP, Tande AJ. Clinical Profile of Monomicrobial Corynebacterium Hip and Knee Periprosthetic Joint Infections. Open Forum Infect Dis. 2022 Apr 14;9(7):ofac193. doi: 10.1093/ofid/ofac193.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Божкова Светлана Анатольевна (Санкт-Петербург) - доктор медицинских наук, доцент, заведующая научным отделением профилактики и лечения раневой инфекции и отделением клинической фармакологии, профессор кафедры травматологии и ортопедии ФГБУ "НМИЦ ТО им. Р.Р. Вредена" Минздрава России; делегат РФ в комитет стран EBJIS, член научного комитета World Association against Infection in Orthopedics and Trauma (WAIOT), член МАКМАХ; конфликт интересов отсутствует.
2. Тихилов Рашид Муртузалиевич (Санкт-Петербург) - член-корреспондент РАН, доктор медицинских наук, профессор, директор ФГБУ "НМИЦ ТО им. Р.Р. Вредена" Минздрава России, главный травматолог-ортопед Комитета по здравоохранению Санкт-Петербурга, вице-президент АТОР, член European Hip Society, член International Hip Society; конфликт интересов отсутствует.
3. Артюх Василий Алексеевич (Санкт-Петербург) - доктор медицинских наук, заведующий отделением гнойной хирургии ФГБУ "НМИЦ ТО им. Р.Р. Вредена" Минздрава России, член EJBIS и WAIOT; конфликт интересов отсутствует.
4. Бурцев Александр Владимирович (Курган) - доктор медицинских наук, директор ФГБУ "НМИЦ ТО имени академика Г.А. Илизарова" Минздрава России, главный внештатный травматолог-ортопед УрФО, член ASAMI и АТОР; конфликт интересов отсутствует.
5. Ермаков Артем Михайлович (Курган) - доктор медицинских наук, руководитель клиники костно-суставной инфекции ФГБУ "НМИЦ ТО имени академика Г.А. Илизарова" Минздрава России, научный сотрудник лаборатории Клиники костно-суставной инфекции (гнойной остеологии), врач I категории гнойного травматолого-ортопедического отделения N 1, член АТОР, EJBIS, ASAMI; конфликт интересов отсутствует.
6. Касимова Алина Рашидовна (Санкт-Петербург) - кандидат медицинских наук, врач-клинический фармаколог отделения клинической фармакологии ФГБУ "НМИЦ ТО им. Р.Р. Вредена" Минздрава России; доцент кафедры клинической фармакологии и доказательной медицины ФГБОУ ВО ПСПбГМУ им. И.П.Павлова Минздрава России; конфликт интересов отсутствует.
7. Коюшков Андрей Николаевич (Курган) - врач высшей категории гнойного травматолого-ортопедического отделения N 1 ФГБУ "НМИЦ ТО имени академика Г.А. Илизарова" Минздрава России, член АТОР.
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. врачи-травматологи-ортопеды
2. врачи-хирурги
3. врачи-клинические фармакологи
4. врачи-инфекционисты
5. организаторы здравоохранения
6. студенты медицинских ВУЗов, ординаторы, аспиранты
Методы, используемые для сбора/выбора доказательств:
1. Поиск в отечественных и международных электронных базах данных: eLibrary, MedLine, PubMed, базу Cohrane, материалы издательства Elsevier. Глубина поиска - 20 лет.
2. Материалы отечественных, международных рекомендаций и консенсусных соглашений по профилактике и оказанию помощи при перипротезной и прелом-ассоциированной инфекции [1, 2, 39, 48, 54, 130, 139, 287, 298, 300].
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме. Группа использовала методику оценки уровня убедительности рекомендаций и степени достоверности доказательств согласно Приложению "2 к Требованиям к структуре клинических рекомендаций, составу и научной обоснованности, включаемой в клинические рекомендации информации, утвержденным приказом Минздрава России от 28.02.2019 г. N 1034
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Уровень достоверности
Тип данных
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или рандомизированные клинические исследования (РКИ) и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования любого дизайна
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности
Тип данных
1
Систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования любого дизайна
4
Несравнительные, описание клинического случая или серии случаев, исследование "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П3. Шкала определения уровней убедительности рекомендаций
Категория
Описание
A
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходамт являются согласованными)
B
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам не являются согласованными)
C
Низкая (слабая) рекомендация - отсутствие доказательств надлежащего качетства (все исследования имеют низкое методологическое качество, их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Приложение А3.1
АНТИБАКТЕРИАЛЬНЫЕ ПРЕПАРАТЫ ДЛЯ ЭТИОТРОПНОЙ ТЕРАПИИ ИАИ
Составлено на основе результатов мониторинга спектра ведущих возбудителей ортопедической инфекции и их антибиотикочувствительности за период 2012 - 2018 гг. [5, 54] и научных публикаций [21, 159].
Возбудитель
МНН
(непосредственный выбор препаратов выполняется по результатам антибиотикограммы с учетом функции почек и печени пациента)
Staphylococcus spp. метициллин-чувствительные
оксациллин ** <1> (АТХ J01CF04);
цефалоспорины I - II поколения <1> (АТХ J01DA)
ампициллин+[сульбактам] <1> **(АТХ J01CR01); амоксициллин+[клавулановая кислота] <1> ** (АТХ J01CR02) <1>;
клиндамицин <1>, <а> ** (АТХ J01FF01) <1>, <а>;
#моксифлоксацин <1> ** (АТХ J01MA14),
#левофлоксацин <1> **(АТХ J01MA12)
MRSA, MRSE
ванкомицин **(АТХ A07AA09) <1>
#даптомицин **(АТХ J01XX09) <1> в дозе 8 - 10 мг/кг/сут внутривенно [150, 151];
#линезолид **(АТХ J01XX08) <1> в дозе 600 мг 2 раза в сутки внутривенно [161, 162];
фосфомицин **(АТХ J01XX01) <1>;
#моксифлоксацин <1> **(АТХ J01MA14)
#левофлоксацин <1> **(АТХ J01MA12)
#доксициклин **(АТХ J01AA02) - по 100 мг каждые 12 ч внутрь [320];
Enterococcus spp. ампициллин- или амоксициллин-чувствительные
Ампициллин **(АТХ J01CA01),
Амоксициллин **(АТХ J01CA04)
ампициллин+[сульбактам] <1> **(АТХ J01CR01);
амоксициллин+[клавуланат] **(АТХ J01CR02);
#моксифлоксацин** <а> (АТХ J01MA14);
#левофлоксацин** <а> (АТХ J01MA12)
E. faecalis ампициллин- или амоксициллин-резистентные
ванкомицин **(АТХ A07AA09) <2>, <3>
#линезолид **(АТХ J01XX08) в дозе 600 мг 2 раза в сутки внутривенно [161, 162];
#даптомицин **(АТХ J01XX09) <2>, <3> в дозе 8 - 10 мг/кг/сут внутривенно [150, 151]
фосфомицин **(АТХ J01XX01) <2>;
имипенем +[циластатин]** (АТХ J01DH51) (![]() ) <2>;
) <2>;
фторхинолоны (АТХ J01MA) <2>, предпочтительнее #моксифлоксацин** <а> (АТХ J01MA14); #левофлоксацин** <а> (АТХ J01MA12)
E. faecium ампициллино-резистентные
ванкомицин **(АТХ A07AA09) <2>, <3>;
#линезолид **(АТХ J01XX08) в дозе 600 мг 2 раза в сутки внутривенно [161, 162];
#даптомицин **(АТХ J01XX09) в дозе 8 - 10 мг/кг/сут внутривенно [150, 151];
фосфомицин **(АТХ J01XX01)
Enterobacteriacae spp. (E. cloacae, E. coli, K. pneumonia) чувствительный к цефалоспоринам третьего поколения и/или фторхинолонам
ципрофлоксацин** (АТХ J01MA02);
цефалоспорины III поколения (АТХ J01DD) или цефалоспорины IV поколения (АТХ J01DE)
ампициллин+[сульбактам] **(АТХ J01CR01); амоксициллин+[клавулановая кислота]** (АТХ J01CR02)
Enterobacteriacae spp. <4> (E. cloacae, E. coli, K. pneumonia) фторхинолон-резистентные
Целесообразно применение комбинированной терапии двумя препаратами из разных групп в зависимости от состояния пациента и чувствительности штамма-возбудителя:
пиперациллин +[тазобактам] (АТХ J01CR05) <2>;
фосфомицин** (АТХ J01XX01) <2>;
карбапенемы (АТХ J01DH); <2>
аминогликозиды:
амикацин **(АТХ J01GB06)
P. aeruginosa <4>
Целесообразно применение комбинированной терапии двумя препаратами из разных групп в зависимости от состояния пациента и чувствительности штамма-возбудителя:
антисинегнойные ЦП:
цефтазидим** (АТХ J01DD02),
цефоперазон** (АТХ J01DD12),
цефепим** (АТХ J01DE01),
цефоперазон + [сульбактам]** (АТХ J01DD62);
фторхинолоны (АТХ J01MA):
ципрофлоксацин** (АТХ J01MA02),
#левофлоксацин **(АТХ J01MA12);
карбапенемы:
имипенем + [циластатин]** (АТХ J01DH51),
меропенем** (АТХ J01DH02);
аминогликозиды:
амикацин **(АТХ J01GB06)
A. calcoaceticus/baumannii complex <4>
Целесообразно применение комбинированной терапии двумя препаратами из разных групп в зависимости от чувствительности штамма-возбудителя:
ципрофлоксацин** (АТХ J01MA02);
цефоперазон + [сульбактам] **(АТХ J01DD62);
пиперациллин +[тазобактам] **(АТХ J01CR05);
имипенем +[циластатин] **(АТХ J01DH51),
меропенем **(АТХ J01DH02);
Streptococcus spp.
бензилпенициллин **(АТХ J01CE01);
цефтриаксон **(АТХ J01DD04);
амоксициллин **(АТХ J01CA04) ) - по 1,0 г 3 - 4 раза в сутки внутрь [283];
клиндамицин **(АТХ J01FF01) <а>;
ванкомицин **(АТХ A07AA09) <а>
Cutibacterium spp. (ранее Propionibacterium acnes)
#цефтриаксон **(АТХ J01DD04) - по 2.0 г 1 раз в сутки в/в [55, 283];
#амоксициллин **(АТХ J01CA04) - по 1,0 г 3 - 4 раза в сутки внутрь [283];
клиндамицин **(АТХ J01FF01);
#доксициклин **(АТХ J01AA02) - по 100 мг каждые 12 ч внутрь [283];
ванкомицин **(АТХ A07AA09)
Corinebacterium spp.
ванкомицин **(АТХ A07AA09)
# доксициклин **(АТХ J01AA02) - по 100 мг каждые 12 ч внутрь [283, 326];
фторхинолоны (АТХ J01MA)
Примечания здесь и далее:
** - препарат включен в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2023 год (Приложение N 1 к распоряжению Правительства Российской Федерации от 24 декабря 2022 года N 2406-р)
# - в перечне зарегистрированных показаний к применению препарата отсутствует показание - инфекция костей и суставов.
<а> При аллергии на 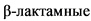 антибиотики;
антибиотики;
<1> Для усиления активности в отношении биопленок (особенно при налисии имплантата), внутриклеточно расположенных бактерий в комбинации с рифампицином**, при его отсутствии или устойчивости к нему возбудителя рассмотреть комбинацию с ко-тримоксазолом** или #доксициклином** или фузидовой кислотой или фосфомицином**;
<2> Возможно, в комбинации с гентамицином** или амикацином**;
<3> При комбинации ванкомицина** с гентамицином** происходит усиление нефротоксичности, требуется постоянный мониторинг функции почек;
<4> При выделении карбапенем-устойчивых штаммов см Приложение А3.2.
Приложение А3.2
ОРИЕНТИРОВОЧНЫЙ ПЕРЕЧЕНЬ
АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ И ИХ КОМБИНАЦИИ
ДЛЯ ЛЕЧЕНИЯ ИАИ, ВЫЗВАННОЙ ВОЗБУДИТЕЛЯМИ С ВЫСОКИМ
УРОВНЕМ РЕЗИСТЕНТНОСТИ
Составлено на основе научных публикаций
Возбудитель
МНН
Staphylococcus spp. рифампицин-резистентные
#Цефтаролина фосамил** - в дозе по 600 каждые 12 часов [301, 302] + #даптомицин** в дозе 8 - 10 мг/кг/сут внутривенно [150, 151]
Фосфомицин** + #даптомицин** или ванкомицин** или #линезолид** в дозе 600 мг 2 раза в сутки внутривенно [161, 162] или тейкопланин [128 - 130]
#Линезолид** в монотерапии [305, 306]
#Тедизолид** в дозе 200 мг каждые 24 часа в/в [307 - 309]
Enterococcus spp. ванкомицин-резистентные
Фосфомицин** + гентамицин**
#Тигециклин** нагрузочная доза 100 мг, затем 50 мг в/в каждые 12 часов [310, 311, 312]
Грамотрицательные бактерии (Cem.Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter spp.) с экстремальной поли- и панрезистентностью
Комбинация 2 или более препаратов [5, 168]:
Азтреонам в дозе по 2 г каждые 8 часов,
#Полимиксин В** - нагрузочная доза 2,0 - 2,5 мг/кг, исходя из общей массы тела (эквивалентно 20 000 - 25 000 МЕ/кг) в течение 1 часа, далее каждые 12 часов по 1,25 - 1,5 мг/кг (эквивалентно 12 500 - 15 000 МЕ/кг массы тела) [313, 314].
Колистиметат натрия
Гидроксиметилхиноксалиндиоксид;
Фосфомицин**,
#Тигециклин** нагрузочная доза 100 мг, затем 50 мг в/в каждые 12 часов [311, 325],
Карбапенемы,
Цефтазидим+[авибактам]** в дозе 2000 мг/ 500 мг каждые 8 часов в виде продленной 2-х часовой инфузии в том числе в комбинации с азтреонамом в дозе по 2 г каждые 8 часов [321, 323, 324],
#Цефтолозан+[тазобактам]** в дозе 3,0 г каждые 8 часов внутривенно [321],
Аминогликозиды
Приложение А3.3
ПЕРЕЧЕНЬ
АНТИМИКРОБНЫХ ПРЕПАРАТОВ ДЛЯ ИМПРЕГНАЦИИ КОСТНОГО ЦЕМЕНТА
ПРИ ФОРМИРОВАНИИ СПЕЙСЕРА
Перечень составлен на основе результатов собственных исследований [315 - 318] и рекомендаций зарубежных экспертов [48, 298].
Этиология инфекции
МНН
Ориентировочная доза на 40 гр. цемента (в граммах)
Только Гр(+) бактерии
включая метициллинорезистентные (MR) стафилококки, анаэробы
#Ванкомицин**
4
#Даптомицин**
2
исключая MR-стафилококки, анаэробы
#Клиндамицин**
1 - 2
Только Гр(-) бактерии
включая Pseudomonas
#Цефтазидим**
2
#Азтреонам
4
#Полимиксин B**
0,24
При микробных ассоциациях
Преимущественно Гр(+) и некоторые чувствительные Гр(-) бактерии, исключая Pseudomonas и MR-стафилококки
#Цефазолин**
1 - 2
#Цефуроксим**
1,5 - 2
Преимущественно Гр(-) бактерии, исключая Pseudomonas, MR-стафилококки,
#Цефотаксим**
2
Преимущественно Гр(-) бактерии, включая Pseudomonas, MS-стафилококки,
#Меропенем**
до 4
Гр(+) бактерии, включая MR-стафилококки, Гр(-) бактерии, включая некоторые штаммы Pseudomonas.
#Фосфомицин**
до 8
Микотическая этиология
Большинство грибов
#Амфотерицин В**
0,2
#Вориконазол**
0,3 - 0,6
# - в официальной инструкции к применению препарата отсутствует путь введения - в составе костного цемента
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
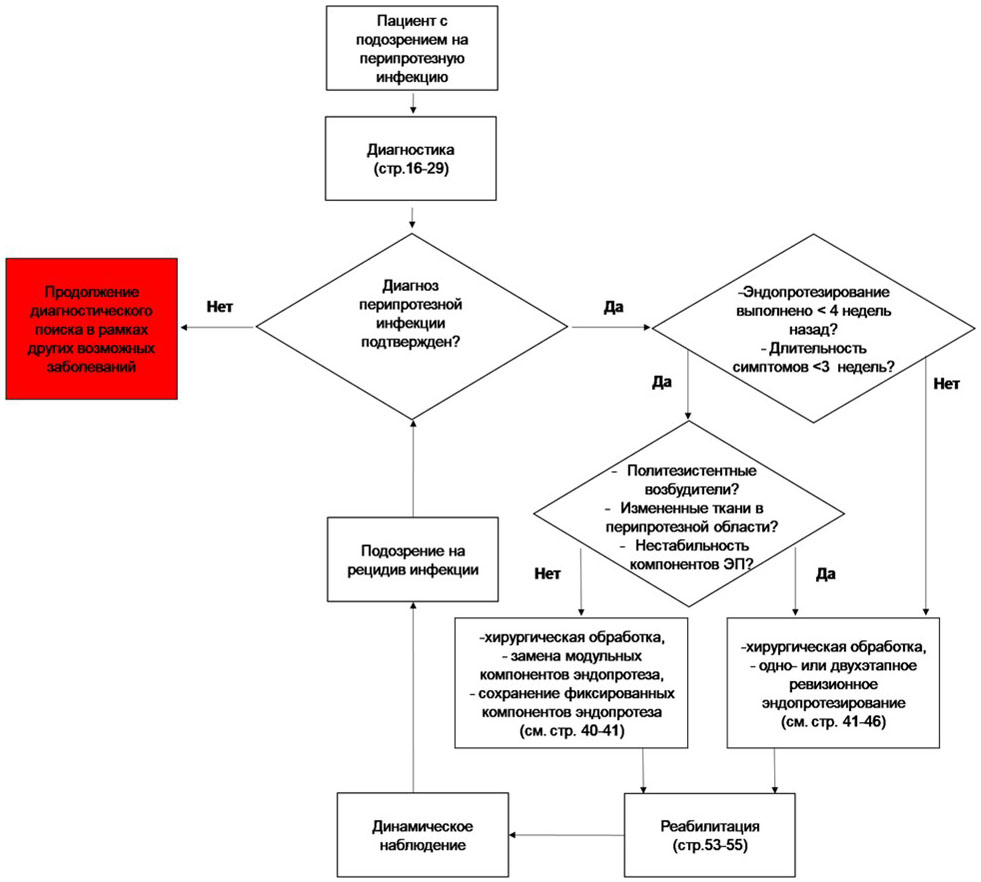
Название алгоритма 1 в клинических рекомендациях "Инфекция, ассоциированная с ортопедическими имплантатами": 1. Алгоритм выбора тактики лечения больных перипротезной инфекцией с сохранением эндопротеза
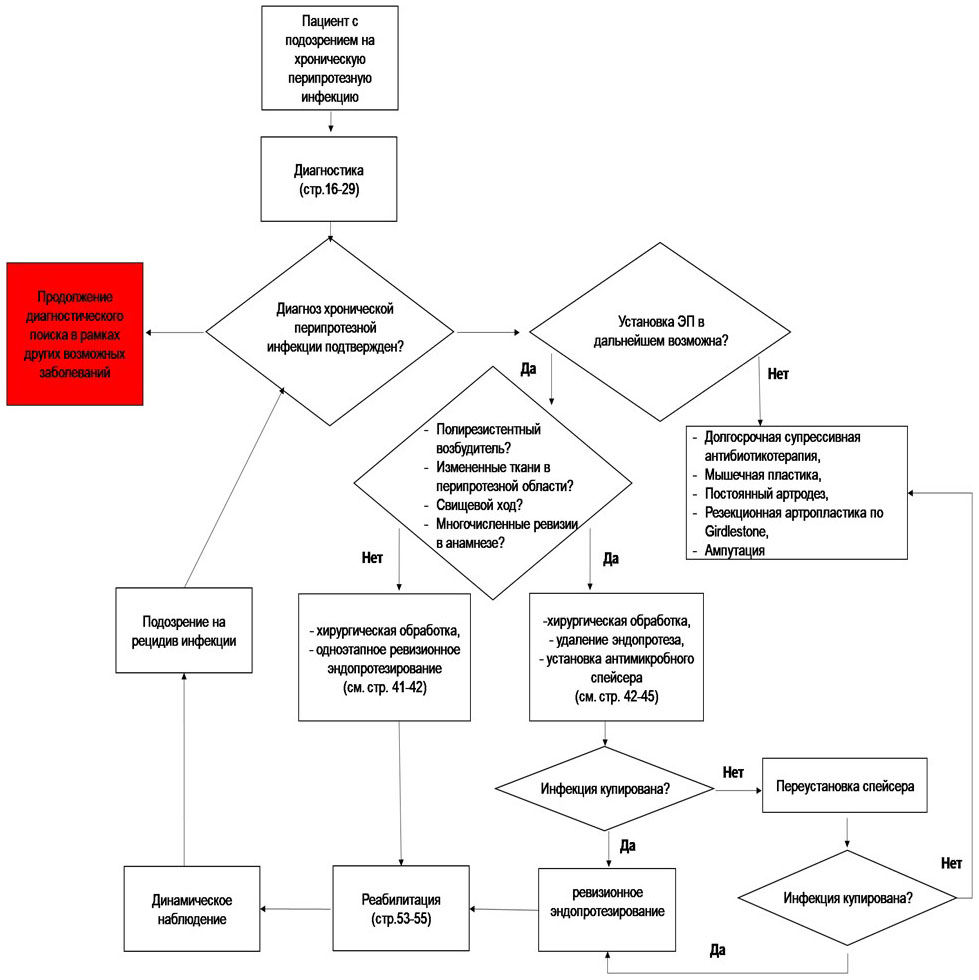
Название алгоритма 2 в клинических рекомендациях "Инфекция, ассоциированная с ортопедическими имплантатами": 2. Алгоритм выбора тактики хирургического лечения больных перипротезной инфекцией с удалением эндопротеза
Название алгоритма 3 в клинических рекомендациях "Инфекция, ассоциированная с ортопедическими имплантатами": 3. Алгоритм выбора тактики хирургического лечения больных с перелом-ассоциированной инфекцией
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
После проведенного лечения перипротезной или перелом-ассоциированной инфекции и возвращении домой необходимо исключить:
- резкие температурные колебания - переохлаждение (одеваться-обуваться по сезону), перегревание (парные, бани, загорание на солнце),
- чрезмерную, особенно постоянную, физическую нагрузку, удары, ушибы, вибрацию.
Пациенты после успешно проведенного хирургического лечения ППИ или ПАИ и купирования инфекционного процесса могут посещать бальнео- и климатолечебные курорты не ранее чем через 6 месяцев после операции. Спокойный, размеренный образ жизни, умеренные посильные психофизические нагрузки, исключение алкоголя, курения, прогулки на свежем воздухе и здоровая пища - есть образ жизни пациентов с ППИ. Большое значение для успешного результата имеет выполнение в послеоперационном периоде рекомендаций врача по медикаментозному, физиотерапевтическому лечению и лечебной гимнастики.
Медикаментозная терапия включает прием рекомендованных врачом антибактериальных препаратов, анальгетиков, антитромботических препаратов, нутриционную поддержку, а также профилактику язвенной болезни и, при необходимости средства от запоров. Необходимо регулярно, раз в 2 - 3 недели, контролировать эффективность лечения. Пациент должен контролировать температуру тела, выполнять анализы крови и мочи. Больному необходимо разъяснить важность своевременного лечения и профилактики развития очагов хронической инфекции на поверхности кожи, в полости рта и других.
В качестве средства профилактики вывихов спейсера широко используют ортопедические подушки, с помощью которых конечности придается функционально удобное положение. Пациента должен соблюдать правила безопасного поведения в быту, правильного положения конечностей. Например, при операции на тазобедренном суставе необходимо не скрещивать ноги, не садится на низкие стулья, не наклоняться низко в перед, не сгибать бедро более 90 градусов. Дополнительную информацию о правилах охранительного двигательного и нагрузочного режима предоставляет больному лечащий врач или сотрудник отделения реабилитации в стационаре. После заживления операционной раны, восстановления удовлетворительного состояния органов и систем необходимо принять меры по борьбе с избыточным или недостаточным весом. К моменту следующего ортопедического вмешательства, масса больного должна быть близка к физиологической норме.
Приложение Г
Нет
