"Клинические рекомендации "Острые миелоидные лейкозы"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОСТРЫЕ МИЕЛОИДНЫЕ ЛЕЙКОЗЫ
Год утверждения (частота пересмотра): 2024 Пересмотр не позднее: 2026
ID: 131_2
Возрастная категория: Взрослые
Специальность:
Разработчик клинической рекомендации
Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество"
Одобрены
Список сокращений
алло-ТГСК - трансплантация аллогенных гемопоэтических стволовых клеток
алло-ТКМ - трансплантация аллогенного костного мозга
ауто-ТГСК - трансплантация аутологичных гемопоэтических стволовых клеток
в/в - внутривенный
ВОЗ - Всемирная организация здравоохранения
ИФТ - иммунофенотипическое исследование
КТ - компьютерная томография
МДС - миелодиспластический синдром
МОБ - минимальная остаточная болезнь
МПЗ - миелопролиферативное заболевание
ОЛ - острый лейкоз
ОЛСФ - острый лейкоз смешанного фенотипа
ОМЛ - острый миелоидный лейкоз
п/к - подкожно
ПР - полная ремиссия
ПЦР - полимеразная цепная реакция
ТГСК - трансплантация гемопоэтических стволовых клеток
ТКМ - трансплантация костного мозга
УЗИ - ультразвуковое исследование
ХТ - химиотерапия
ECOG - (Eastern Cooperative Oncology Group) Восточная объединенная онкологическая группа
FAB-классификация - французско-американско-британская классификация
FISH - флуоресцентная in situ гибридизация
MPO (myeloperoxidase) - миелопероксидаза
NCCN - (National Comprehensive Cancer Network) Национальная общественная противораковая сеть
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Острые миелоидные лейкозы (ОМЛ) - клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток [1, 2].
Полной ремиссией (ПР) ОМЛ принято называть состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, отсутствуют бластные клетки с палочками Ауэра и экстрамедуллярные очаги при количестве нейтрофилов в периферической крови ![]() 1,0 * 109/л, при количестве тромбоцитов
1,0 * 109/л, при количестве тромбоцитов ![]() 100 * 109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Указанные показатели должны сохраняться в стабильном состоянии в течение > 1 месяца. Устанавливается при отсутствии данных о статусе минимальной остаточной болезни (МОБ).
100 * 109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Указанные показатели должны сохраняться в стабильном состоянии в течение > 1 месяца. Устанавливается при отсутствии данных о статусе минимальной остаточной болезни (МОБ).
Полная ремиссия с отсутствием МОБ - ПР с отсутствием в пунктате костного мозга, обнаруженного в дебюте ОМЛ генетического маркера (методом полимеразной цепной реакции (ПЦР)) или клеток с аберрантным иммунофенотипом (методом проточной цитометрии).
Минимальная остаточная болезнь - небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 104-6 исследуемых.
Полная ремиссия с неполным восстановлением - ПР при сохраняющейся нейтропении (< 1 * 109/л) или тромбоцитопении (< 100 * 109/л).
Частичная ремиссия - все гематологические критерии ПР; снижение процента бластных клеток в пунктате костного мозга до 5 - 25%; снижение числа бластных клеток в пунктате костного мозга не менее чем на 50% от исходного до начала лечения. Данный критерий используется для оценки эффективности лечения ОМЛ преимущественно в ходе клинических исследований I - II фазы.
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, которым начали лечение. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Этот анализ позволяет оценить число реально оставшихся в живых пациентов с ОМЛ на фоне проведенной терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута ПР. Точкой отсчета считается дата достижения ПР. Событиями считаются рецидив и смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в ПР в момент проведения анализа.
Вероятность сохранения ПР (обратное от вероятности развития рецидива). При оценке вероятности сохранения ПР учитываются данные только тех пациентов, у которых достигнута ПР. При этом точкой отсчета служит дата достижения ПР. Событием считается только рецидив заболевания. Цензурируют всех пациентов, кто жив в ПР в момент проведения анализа. Пациенты, умершие в период ПР от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как пациентов, находившихся в ПР.
Вероятность сохранения ПР является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех пациентов, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения ПР через 2 месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии (ХТ) или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута ПР в течение первых 2 курсов ХТ, и они остаются живыми, сохраняя ПР, на момент проведения анализа.
Резистентная форма ОМЛ, по мнению большинства российских экспертов, констатируется при отсутствии ПР после завершения 2 курсов индукционной терапии. Важно отметить, что, по международным критериям, резистентность при ОМЛ можно оценивать лишь через 7 дней после завершения курса полихимиотерапии. Если пациент умирает в течение курса ХТ или в течение 7 дней после него, определить, резистентная у него форма лейкоза или нет, нельзя, и пациентов в этом случае относят к категории неудач в лечении как неопределенный исход.
Смерть в аплазии - смерть пациента в период индукционной терапии (1 - 2 курса). Этот критерий объединяет понятие "смерть в аплазии" - смерть пациента, прожившего после окончания курса ХТ ![]() 7 дней, в период миелотоксического агранулоцитоза и аплазии кроветворной ткани, при отсутствии персистенции лейкемии, доказанной пункцией костного мозга.
7 дней, в период миелотоксического агранулоцитоза и аплазии кроветворной ткани, при отсутствии персистенции лейкемии, доказанной пункцией костного мозга.
Смерть от неопределенной причины - 1) смерть пациента до завершения терапии; 2) смерть пациента в период < 7 дней после завершения ХТ; в) смерть пациента, у которого в периферической крови не выявляются бластные клетки, но пункция костного мозга не выполнена, через ![]() 7 дней после завершения индукционной терапии.
7 дней после завершения индукционной терапии.
В настоящее время нередко пользуются понятиями 30-дневная и 60-дневная летальность, т.е. смерть от любых причин в указанные периоды времени, совпадающие с 1-м и 2-м курсом индукции; 60-дневную летальность ранее определяли, как "ранняя летальность".
Рецидив гематологический - обнаружение в пунктате костного мозга более 5% бластных клеток и/или экстрамедуллярного очага опухоли, в том числе нейролейкемии.
Рецидив молекулярный/иммунологический - выявление МОБ методом проточной цитометрии и/или ПЦР при условии анализа аберрантного иммунофенотипа или выполнения молекулярного исследования до начала терапии.
Индукция ремиссии - период начального лечения, целью которого являются максимально быстрое и существенное сокращение опухолевой массы и достижение ПР, (обычно 1 - 2 курса). Именно в этот период на фоне применения противоопухолевых препаратов противоопухолевых средств средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т.е. в момент констатации ПР в костном мозге морфологически определяется менее 5% опухолевых клеток.
Консолидация ремиссии. Вторым этапом терапии острого лейкоза (ОЛ) является закрепление достигнутого противоопухолевого эффекта (обычно 1 - 2 курса). В настоящее время в большинстве случаев консолидация - наиболее агрессивный и высокодозный этап при лечении ОЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение - продолжение цитостатического воздействия в меньших дозах, чем в период индукции/консолидации ремиссии, или иного (таргетного) воздействия на возможно остающийся опухолевый клон.
Профилактика или, при необходимости, лечение нейролейкемии. Этот этап распределяется на все периоды программного лечения - индукцию ремиссии, консолидацию и поддерживающее лечение.
Трансплантация костного мозга (ТКМ). Под этим термином объединены трансплантация гемопоэтических стволовых клеток (ТГСК) костного мозга периферической крови и пуповинной (плацентарной) крови.
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Острые миелоидные лейкозы (ОМЛ) - клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток [1, 2]
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ОМЛ является следствием повреждения (мутации) в генетическом материале клоногенной кроветворной клетки. В результате этого происходят нарушение контроля за клеточным циклом, изменение процесса транскрипции и продукции ряда ключевых белков. Вследствие бесконтрольной пролиферации в отсутствие дифференцировки происходит накопление патологических клеток. Тот факт, что патогенез ОЛ связан с генетическими поломками, довольно часто подтверждается обнаружением различных хромосомных аберраций (транслокаций, делеций, инверсий и т.д.). В большинстве случаев конкретная причина возникновения ОМЛ остается неизвестной. Однако существует несколько предрасполагающих факторов, которые значительно увеличивают риск развития этого заболевания. Четко доказанная связь ионизирующей радиации при взрыве атомной бомбы, а также химио- и радиотерапии по поводу других опухолей с повышенным риском возникновения ОЛ заставила изучить другие возможные лейкемогенные факторы (низкие дозы радиации, химические вещества, курение, электромагнитные волны). Доказано, что между курением и риском развития ОЛ существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет. Ряд исследователей предполагают, что около 20% случаев ОМЛ являются следствием курения. Бензол при длительном воздействии на организм человека дает лейкемогенный эффект, но при небольших концентрациях этого вещества, с которыми чаще всего сталкиваются люди на производстве, не доказана взаимосвязь с повышенным риском возникновения ОМЛ. При изучении постоянного воздействия малых доз радиации пока не получено доказательств в пользу увеличения частоты заболеваемости ОЛ. Впервые взаимосвязь между предшествующей ХТ, лучевым лечением каких-либо других опухолевых заболеваний и увеличенным риском развития ОМЛ была отмечена у пациентов, излеченных от лимфомы Ходжкина. Доказано, что не столько кумулятивная доза, сколько интенсивность дозового воздействия обусловливает повышение частоты заболеваемости ОМЛ. Риск развития вторичного ОМЛ наиболее высок в период от 2 до 9 лет после завершения предшествующей ХТ. В 85% случаев вторичные лейкозы возникают в сроки до 10 лет от окончания лечения [1, 2]. Этиология и специфические факторы, приводящие к развитию вторичных миелоидных опухолей, полностью не изучены. В патогенез вовлечены многие генетические пути и кооперативные мутации. Вторичные ОМЛ, ассоциированные с применением алкилирующих средств, часто дебютируют с моносомией или частичной делецией хромосом 5 и 7. Этот тип ОМЛ возникает относительно поздно, в среднем через 5 - 7 лет после лечения первичной опухоли.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Считается, что ОМЛ заболевают в среднем 3 - 5 человек на 100 тыс. населения в год. При этом заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12 - 13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет. Медиана возраста этого заболевания составляет 65 лет. При численности населения 140 млн жителей в России расчетный показатель заболеваемости (по данным Европейских и Американских исследователей) должен составлять около 5 тыс. заболевших [3].
По результатам регистрационного исследования, выполненного российской исследовательской группой по изучению ОЛ в ряде регионов России, медиана возраста диагностики ОМЛ составляет 53 года, что более чем на 10 лет меньше, чем в западных странах. Эти показатели свидетельствуют как о недостаточной диагностике ОМЛ у пациентов старшей возрастной группы, так и о меньшей продолжительности жизни населения в нашей стране. Заболеваемость, по данным регистрационного исследования, составила 1,32 случая на 100 тыс. взрослого населения. И несмотря на то, что ОМЛ относят к орфанным заболеваниям, социальная значимость лечения этого самого грозного заболевания системы крови определяет необходимость организации адекватной специализированной помощи, предусматривающей взаимодействие многих медицинских дисциплин, совокупность клинических, лабораторных, инструментальных и научных исследований, преемственность стационарной и амбулаторной помощи [1, 2]
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C92.0 - Острый миелоидный лейкоз
Исключение: обострение хронического миелоидного лейкоза (C92.1)
C92.3 - Миелоидная саркома (хлорома, гранулоцитарная саркома)
C92.5 - Острый миеломоноцитарный лейкоз
C92.6 - Острый миелоидный лейкоз с 11q23-аномалией
C92.7 - Другой миелоидный лейкоз
C92.8 - Острая миелоидная лейкемия с мультилинейной дисплазией
C92.9 - Миелоидный лейкоз неуточненный
C93.0 - Острый моноцитарный лейкоз
C94.0 - Острая эритремия и эритролейкоз
C94.2 - Острый мегакариобластный лейкоз
C94.7 - Другой уточненный лейкоз
C95.0 - Острый лейкоз неуточненного клеточного типа
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Перечень вариантов острого миелоидного лейкоза (Всемирная организация здравоохранения (ВОЗ), 2016) [4].
Классификация Всемирной организации здравоохранения (ВОЗ) (2017) подразделяет все ОМЛ, основываясь на их цитогенетических и молекулярно-генетических особенностях, и именно эти особенности формируют клинико-патологические группы:
- ОМЛ с устойчиво выявляемыми генетическими аномалиями
ОМЛ с t(8;21)(q22;q22); RUNX1::RUNX1T1
ОМЛ с inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB::MYH11
Острый промиелоцитарный лейкоз с t(15;17)(q22;q12); PML::RARA
ОМЛ с t(9;11)(p22;q23); MLLT3::KMT2A
ОМЛ с t(6;9)(p23;q34); DEK::NUP214
ОМЛ с inv(3)(q21q26.2) или t(3;3)(q21;q26.2); RPN1::EVI1
ОМЛ (мегакариобластный) с t(1;22)(p13;q13); RBM15::MKL1
ОМЛ с BCR::ABL1
ОМЛ с мутированным геном NPM1
ОМЛ с биаллельной мутацией гена CEBPA
ОМЛ с мутированным геном RUNX1
- ОМЛ с изменениями, связанными с миелодисплазией
- Миелоидные неоплазии, связанные с предшествующей ХТ
- ОМЛ, по-другому не специфицированные (NOS)
Острый миелоидный лейкоз с минимальной дифференцировкой
Острый миелоидный лейкоз без созревания
Острый миелоидный лейкоз с созреванием
Острый миеломоноцитарный лейкоз
Острый монобластный/моноцитарный лейкоз
Истинный эритроидный лейкоз
Острый мегакариобластный лейкоз
Острый базофильный лейкоз
Острый панмиелоз с миелофиброзом (синоним: острый миелофиброз, острый миелосклероз)
- Миелоидная саркома (синоним: экстрамедуллярная миелоидная опухоль, гранулоцитарная саркома, хлорома)
- Миелоидные опухоли, связанные с синдромом Дауна
Транзиторный аномальный миелопоэз (синоним: транзиторное миелопролиферативное заболевание (МПЗ))
Миелоидный лейкоз, связанный с синдромом Дауна
Подгруппа "ОМЛ с устойчиво выявляемыми хромосомными аномалиями" объединяет несколько вариантов ОМЛ:
- ОМЛ с t(8;21)(q22;q22); RUNX1::RUNX1T1;
- ОМЛ с inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB::MYH11 (при выявлении указанных хромосомных перестроек, несмотря на число бластных клеток в пунктате костного мозга, всегда устанавливают диагноз ОМЛ);
- Острый промиелоцитарный лейкоз с t(15;17)(q22;q12); PML::RARA; транслокации RARA с другими партнерами выделяются в отдельные формы ОМЛ, например ОМЛ с t(11;17)(q23;q12); ZBTB16::RARA; ОМЛ с t(11;17)(q13; q12); NUMA1::RARA; ОМЛ с t(5;17)(q35;q12); NPM1::RARA; ОМЛ с STAT5B::RARA.
Ранее выделяемая категория "ОМЛ с аномалиями 11q23 KMT2A (MLL), была переведена в категорию "ОМЛ с t(9;11)(p22;q23); MLLT3::KMT2A". Другие транслокации, отличающиеся от тех, что включают MLLT3, должны быть отдельно указаны в диагнозе, например ОМЛ с t(6;11)(q27;q23); MLLT4:: KMT2A; ОМЛ с t(11;19)(q23;p13.3); KMT2A::MLLT1; ОМЛ с t(11;19)(q23;p13.1); KMT2A::ELL; ОМЛ с t(10;11)(p12;q23); MLLT10:: KMT2A.
Были выделены 3 новых подгруппы:
- ОМЛ с t(6;9)(p23;q34); DEK::NUP214;
- ОМЛ с inv(3)(q21q26.2) или t(3;3)(q21; q26.2); RPN1::EVI1;
- ОМЛ (мегакариобластный) с t(1;22)(p13;q13); RBM15::MKL1, редкий вариант ОЛ, наиболее часто диагностируемый у детей.
У пациентов ОМЛ с нормальным кариотипом были выделены 2 новые категории:
- ОМЛ с мутированным геном NPM1 (нуклеофозмин (ядерный фосфопротеин B23, нуматрин));
- ОМЛ с мутированным геном CEBPA (белок, связывающий энхансер CCAAT альфа (CCAAT/enhancer binding protein (C/EBP) alpha)). Накапливается все больше доказательств в пользу того, что эти мутации определяют нарушения дифференцировки гемопоэтических клеток, и относятся к так называемым мутациям 2-го класса.
Мутации в гене fms-связанной тирозинкиназы 3 (fms-related tyrosine kinase, FLT3) обнаруживают при многих вариантах ОМЛ, и их относят к мутациям 1-го класса, т.е. к тем, которые определяют преимущество опухолевых клеток в пролиферации и/или выживании. ОМЛ с мутациями FLT3 не выделяются в отдельную категорию, однако необходимо определять эти мутации, так как они имеют прогностическую значимость. Рекомендуется не только определять наличие FLT3-ITD, но и определять, так называемое аллельное соотношение. Аллельное соотношение считается высоким при значениях ![]() 0,5 и низким - при значениях < 0,5.
0,5 и низким - при значениях < 0,5.
Ранее выделяемая подгруппа "ОМЛ с мультилинейной дисплазией" в классификации ВОЗ (2016) определяется как "ОМЛ с изменениями, связанными с миелодисплазией". ОМЛ могут относиться к категории "ОМЛ с изменениями, связанными с миелодисплазией" если выявляется 20% бластных клеток в костном мозге или периферической крови и:
- существует предшествующая история МДС или иного МПЗ;
- существуют цитогенетические аномалии, ассоциированные с миелодисплазией:
-- комплексный кариотип (3 хромосомных аномалии и более);
-- несбалансрованные перестройки: -7 или del(7q); -5 или del(5q); i(17q) или t(17p); -13 или del(13q); del(11q); del(12p) или t(12p); del(9q); idic(X)(q13);
-- сбалансированные перестройки (транслокации): t(11;16)(q23;p13.3); t(3;21)(q26.2;q22.1); t(1;3)(p36.3;q21.1); t(2;11)(p21;q23); t(5;12)(q33;p12); t(5;7)(q33;q11.2); t(5;17)(q33;p13); t(5;10)(q33;q21); t(3;5)(q25;q34).
- мультилинейная дисплазия;
- отсутствуют "устойчиво выявляемые хромосомные аномалии";
- ранее не проводилась ХТ по поводу другого заболевания.
Острый миелоидный лейкоз, как другие миелоидные опухоли, возникшие вследствие ранее проводимой ХТ по поводу других заболеваний, в отдельную форму ОМЛ не выделяются.
В 2022 году опубликована статья, посвященная 5 пересмотру ВОЗ классификации острых миелоидных лейкозов, однако, до выхода полноценной печатной версии применять на практике на данный момент целесообразно классификацию ВОЗ 2017 [5].
Прогностические факторы
Прогностические факторы могут быть подразделены на группы [6]:
1-я группа - факторы, основанные на характеристиках пациента и состоянии его общего здоровья;
2-я группа - факторы, обусловленные биологическими характеристиками лейкемического клона;
3-я группа, отмеченная в этой главе, является не объективным критерием, а субъективным, но исключительно принципиальным фактором, особенно в условиях России - адекватность проводимой ХТ.
Факторы прогноза, связанные с пациентом. Возраст является одним из универсальных, независимых и устойчивых факторов прогноза. Долгосрочные результаты лечения пациентов с ОМЛ в возрасте старше 60 лет в целом значительно хуже по сравнению с таковыми у пациентов моложе 60 лет. Фактически сопоставимыми с результатами у пациентов моложе 60 лет являются таковые у пациентов в возрасте 60 - 65 лет, если им проводят терапию по протоколам лечения, принятым у более молодых.
Это обусловлено как минимум двумя причинами. Во-первых, увеличением с возрастом частоты неблагоприятных цитогенетических поломок: отмечается постепенное нарастание случаев с несбалансированными хромосомными аберрациями, с комплексным и моносомным кариотипом. Одновременно с этим снижается частота обнаружения сбалансированных аберраций, включая такие благоприятные варианты, как транслокации t(8;21), t(15;17) и инверсия хромосомы 16 inv(16). Не исключено, что данный феномен может быть обусловлен тем, что с возрастом увеличивается частота возникновения ОМЛ из предшествующего МДС. Другой признак, который определяет отрицательное влияние возраста на прогноз ОМЛ, - присоединение сопутствующих заболеваний, наличие которых при прочих равных условиях определяет значительное ухудшение общесоматического статуса по сравнению с молодыми пациентами.
Факторы прогноза, связанные с заболеванием (ОМЛ). Факторы, связанные с заболеванием и влияющие на результаты терапии, следует анализировать на всех этапах лечения. Это обусловлено тем, что лейкозассоциированные факторы прогноза позволяют оценить объем опухолевой массы, чувствительность бластных клеток к противоопухолевым препаратам, скорость элиминации лейкемических клеток и объем МОБ.
Прежде всего, необходимо учитывать такие вполне доступные клинико-гематологические параметры, ассоциированные с неблагоприятным течением ОМЛ, как лейкоцитоз > 100 * 109/л, недостижение ПР после первого индукционного курса.
Одним из важнейших факторов прогноза, сопряженных с ОМЛ, является кариотип лейкемических клеток. Исследование кариотипа необходимо проводить в обязательном порядке всем пациентам с подозрением на ОМЛ. Данные цитогенетического исследования позволяют верифицировать ОМЛ в случаях, когда принципиальным является не количество бластных клеток (меньше или больше 20%), а обнаружение характерных хромосомных аберраций. Речь идет, в частности, о так называемом CBF (Core Binding Factor) ОМЛ, который объединяет случаи с транслокацией t(8;21) и инверсией inv(16), независимо от отсутствия или наличия дополнительных хромосомных аберраций, а классификация ВОЗ 2022 расширит данную категорию ОМЛ, где от выявленных молекулярно-генетических маркеров будет зависеть не только установление верного диагноза, стратификация на риски, но и применяемая терапия.
Помимо этого, на основании исследования кариотипа представляется возможным стратифицировать пациентов с ОМЛ на 3 основные группы: благоприятного, промежуточного и неблагоприятного прогноза (см. Приложение Г1). Подразделение пациентов ОМЛ на эти группы целесообразно с точки зрения выбора тактики постремиссионной терапии: выбор индукционной терапии, назначения таргентой терапии, применение цитарабина** в высоких дозах, использование аллогенной ТГСК (алло-ТГСК). В последнее время ряд российских и американских экспертов пациентам с неблагоприятными аномалиями кариотипа вообще не рекомендуют стандартную ХТ вследствие ее низкой эффективности, а предлагают иные низкодозные и таргетные воздействия, а также сочетание интенсивного воздействия с таргетными препаратами с 1-го курса индукции [7 - 9].
Следует отметить, что у половины пациентов с ОМЛ определяется нормальный кариотип клеток аспирата костного мозга. Это может служить основанием в ряде случаев для проведения исследования методом флуоресцентной in situ гибридизации (FISH) или молекулярно-генетических исследований в целях поиска отдельных химерных генов или нарушений кариотипа, ассоциированных с определенным клинико-гематологическим фенотипом ОМЛ и прогнозом: RUNX1::RUNX1T1 (t(8;21)), CBFB::MYH11 (inv16), PML::RARA (t(15;17)), KMT2A::MLLT3 (t(9;11)), DEK::NUP214, моносомии 5, 7, инверсии хромосомы 3 и ряда других.
Вместе с тем, необходимым является и поиск у пациентов с ОМЛ с нормальным кариотипом мутаций отдельных генов с установленным прогностическим потенциалом. Молекулярно-генетическая стратификация пациентов с ОМЛ на группы риска представлена в Приложении Г1.
Факторы прогноза, связанные с неадекватной ХТ. В России, к сожалению, существует такой фактор неблагоприятного прогноза, как неадекватное цитостатическое воздействие в период индукции/консолидации (уменьшение расчетных доз цитостатических препаратов и значительное удлинение интервалов между курсами), или неадекватная предлеченность. Еще в начале 1970-х годов, на первых этапах становления ХТ ОМЛ американскими исследователями было доказано, что эффективность программы "5 + 2" статистически значимо хуже, чем программы "7 + 3". Более 20 лет назад в российских исследованиях было продемонстрировано, что уменьшение доз антрациклинов и родственных соединений и цитарабина** в классической программе "7 + 3" приводит к существенному ухудшению показателей общей и безрецидивной выживаемости [1].
В тех ситуациях, когда цитогенетическое и/или молекулярное исследование не выполнено, определить группу риска у пациента не представляется возможным. Однако можно ориентироваться на "синтетические" (объединяющие молекулярно-генетические и клинические признаки ОМЛ) рекомендации европейских экспертов, которые подразделяют пациентов на 2 основные группы: благоприятного и неблагоприятного прогноза. Эти рекомендации с добавлениями от российских экспертов представлены в Приложении Г2 [1, 2, 7, 8]. Тем не менее хотелось бы подчеркнуть, что без молекулярно-генетических исследований, выполненных в дебюте заболевания, современное лечение ОМЛ невозможно.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В основном клинические проявления связаны с замещением нормальной гемопоэтической ткани опухолевыми клетками (анемия, тромбоцитопения, гранулоцитопения), инфильтрацией ими различных органов и продукцией различных цитокинов [10]. Дебют ОМЛ может быть острым со значительным повышением температуры тела, резкой слабостью, интоксикацией, кровоточивостью, тяжелыми инфекциями. Однако нередко диагноз устанавливают случайно при профилактическом осмотре или в случае госпитализации по другой причине. У пожилых пациентов нередко на фоне анемизации появляется или усугубляется стенокардия, возникают нарушения ритма, в связи с чем их госпитализируют в кардиологическое отделение.
При объективном обследовании может не наблюдаться никаких симптомов. Но довольно часто выявляется увеличение периферических лимфатических узлов, печени, селезенки (что наиболее характерно для миеломоно- и моноцитарного лейкоза), гиперплазия десен (при миеломоно- и моноцитарных вариантах), инфильтрация кожи (при миеломоно- и моноцитарных вариантах), геморрагический синдром различной степени тяжести (от петехиальных высыпаний до тяжелых кровотечений), боли в костях, артралгии, неврологическая симптоматика (менингеальные знаки - головная боль, ригидность затылочных мышц, симптом Кернига, парез лицевого, глазодвигательного и других нервов, парезы нижних конечностей и т.д.). В анализах крови могут быть неспецифические изменения: трехростковая цитопения или анемия, или только лейкопения или лейкоцитоз, или тромбоцитопения. Бластные клетки могут не определяться в анализе периферической крови и, наоборот, составлять 90 - 95% всех лейкоцитов. Количество лейкоцитов также варьирует от менее 1,0 до 200 - 300 * 109/л. Примерно в 15% случаев в дебюте заболевания определяется лейкоцитоз > 100 * 109/л.
Дифференциальная диагностика ОМЛ проста, поскольку, если есть его морфологическое подтверждение (бластные клетки в пунктате и/или в периферической крови), диагноз очевиден. Трудности возникают на первых этапах - при анализе мазков периферической крови, когда бластных клеток нет. Увеличение числа лейкоцитов со сдвигом формулы влево при различных инфекционных процессах, а также тромбоцитопения, анемия и геморрагический синдром при тяжелых инфекциях и сепсисе могут вызывать сомнения в диагнозе ОЛ, но в таких случаях никогда не обнаруживаются типичные бластные клетки. Нередко требуется дифференциальная диагностика с инфекционным мононуклеозом и некоторыми другими вирусными инфекциями, тем более что клиническая симптоматика (повышение температуры тела, боли в горле, увеличение лимфатических узлов, печени, селезенки) может напоминать таковую при ОЛ. Следует также дифференцировать ОМЛ с бластным кризом хронического миелолейкоза (присутствие филадельфийской хромосомы не всегда помогает, так как этот маркер может обнаруживаться и при впервые диагностированных ОЛ).
Особого внимания заслуживают внекостномозговые проявления ОЛ, особенно нейролейкемия, которая может определяться и в момент диагностики ОЛ. Возникновение нейролейкемии обусловлено метастазированием лейкозных клеток в паутинную и мягкую мозговые оболочки головного и спинного мозга. В ряде случаев наблюдается лейкозная инфильтрация периферических нервов с разнообразными двигательными и чувствительными нарушениями или обнаруживается очаговое поражение вещества головного мозга. Нейролейкемия характеризуется менингеальным и гипертензивным синдромом: отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, могут быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляются ригидность затылочных мышц, симптом Кернига. При ОМЛ нейролейкемия довольно редка в дебюте болезни, тем не менее встречается ОМЛ с моноцитарной линией дифференцировки (миеломоноцитарном, моноцитарном/монобластном вариантах), особенно при тех формах лейкозов, когда обнаруживают inv(16) (у 30% таких пациентов при отсутствии профилактики возникает нейролейкемия). При ОМЛ к экстрамедуллярным относят поражения кожи (лейкемиды - чаще всего это багрово-синюшные уплотнения, узелки в коже), сетчатки, десен, яичек, яичников. Описаны поражения лимфатических узлов, легких, кишечника, сердечной мышцы, мочеточников. При ОМЛ экстрамедуллярные поражения мягких тканей ранее называли "хлоромой". В настоящее время для обозначения поражения мягких тканей и органов используют термин "миелоидная или гранулоцитарная саркома" [1].
2. Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу в соответствии со шкалами оценки уровня достоверности доказательств и уровня убедительности рекомендаций по причине отсутствия посвященных им клинических исследований. Несмотря на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза: Диагноз ОМЛ устанавливают на основании обнаружения в пунктате костного мозга или в периферической крови не менее 20% бластных клеток либо независимо от процентного содержания бластных клеток при наличии патогномоничных для ОМЛ хромосомных аномалий: t(8;21)(q22;q22) RUNX1::RUNX1T1, t(15;17)(q24;q21) PML::RARA, inv(16) или t(16;16)(p12;q23) CBFB::MYH11.
2.1 Жалобы и анамнез
Клинические проявления при ОМЛ обычно связаны с изменениями в гемограмме - цитопенией:
- Нейтропения - бактериальные инфекции, проявляющиеся, как правило, лихорадкой.
- Анемия - слабость, утомляемость. Общая слабость присутствует у большинства пациентов и может наблюдаться за несколько месяцев до установления диагноза.
- Тромбоцитопения - геморрагический синдром в виде петехий, кровоточивости десен, рецидивирующих носовых кровотечений, мено- и метроррагии.
- В некоторых случаях могут наблюдаться оссалгии, В-симптомы (лихорадка, снижение массы тела, выраженная потливость).
- В ряде случаев у пациентов в течение нескольких месяцев до обращения может наблюдаться немотивированная слабость.
При остром миеломоноцитарном лейкозе и остром моноцитарном лейкозе характерна гиперплазия десен и пациенты могут первоначально обращаться к врачу-стоматологу.
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ тщательный сбор анамнеза заболевания с уточнением терапии, которая проводилась в связи с этим заболеванием или по поводу других заболеваний ранее, семейного анамнеза, а также подробное описание жалоб пациента для верификации диагноза [1, 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.2 Физикальное обследование
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ проводить физикальное обследование, включающее измерение роста и массы тела, термометрию общую; оценку состояния кожных покровов, костно-суставной системы; выявление признаков геморрагического синдрома; наличие гепатоспленомегалии, лимфаденопатии; наличие признаков дисфункции сердца, легких, печени, органов эндокринной, нервной системы для верификации диагноза и оценки статуса по шкалам Восточной объединенной онкологической группы (ECOG)/ВОЗ (см. Приложение Г3) [1, 7, 12 - 15].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: при физикальном обследовании у части пациентов (в основном, с острым миеломоноцитарным лейкозом, острым моноцитарным лейкозом, бластным кризом хронического миелолейкоза) выявляют признаки "пролиферативного" синдрома - спленомегалия, увеличение лимфатических узлов, кожные лейкемиды. Лейкемиды выявляют в 13% случаев и имеют вид узлов с измененным цветом кожи над ними [16]. При миелоидной саркоме выявляют экстрамедуллярные опухолевые образования различной локализации [17]. В остальном проявления малоспецифичны и включают симптомы, связанные с анемией и тромбоцитопенией.
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам при подозрении, диагностике ОМЛ, а также в ходе терапии с частотой от ежедневного до ежемесячного выполнение общего (клинического) анализа крови развернутого с подсчетом лейкоцитарной формулы и определением числа тромбоцитов для верификации диагноза и определения дальнейшей тактики ведения пациента [1, 2, 7, 8, 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: как правило, в дебюте ОМЛ выявляется нормохромная, нормоцитарная анемия различной степени тяжести. Количество ретикулоцитов в пределах нормы или снижено. Примерно у 75% пациентов имеется тромбоцитопения. Средний уровень лейкоцитов на этапе установления диагноза составляет около 15 * 109/л; 20% пациентов имеют лейкоцитоз > 100 * 109/л.
Подсчет лейкоцитарной формулы необходимо выполнять не на автоматическом анализаторе. Рекомендовано исследовать как минимум 200 лейкоцитов в мазке периферической крови.
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой от 1 - 3 раз неделю до ежемесячного выполнить анализ крови биохимический общетерапевтический расширенный (Исследование уровня общего белка в крови, Определение соотношения белковых фракций методом электрофореза, Исследование уровня мочевины, креатинина, общего билирубина, натрия, калия, общего кальция, глюкозы в крови, Определение активности аланинаминотрансферазы, аспартатаминотрансферазы в крови, Исследование уровня общего магния в сыворотке крови) для диагностики сопутствующей патологии (заболеваний) и определения тактики сопроводительной терапии [1, 2, 7, 8, 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: дополнительно при наличии показаний на любом этапе диагностики и лечения ОМЛ могут исследоваться другие показатели крови: исследование уровня/активности изоферментов щелочной фосфатазы в крови, определение активности панкреатической амилазы в крови, соотношения белковых фракций методом электрофореза, исследование уровня железа, трансферрина сыворотки крови, уровня иммуноглобулинов в крови, уровня эритропоэтина крови, уровня парапротеинов в крови, уровня кальцитонина в крови, тропонинов I, T в крови, прокальцитонина в крови, фолиевой кислоты в сыворотке крови, исследование функции нефронов по клиренсу креатинина (проба Реберга), тесты тубулярной реабсорбции, и другие.
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой от 1 - 2 раз в неделю до ежемесячного выполнять коагулограмму (ориентировочное исследование системы гемостаза) (активированное частичное тромбопластиновое время, протромбин по Квику, тромбиновое время, фибриноген для диагностики сопутствующей патологии и осложнений, а также определения тактики сопроводительной терапии [1, 7, 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: при выявлении изменений в результатах скрининговых исследований и наличии клинических показаний исследуются другие параметры коагуляции.
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии выполнять общий (клинический) анализ мочи с частотой от еженедельного до ежемесячного для диагностики сопутствующей патологии и определения тактики сопроводительной терапии [1, 7, 20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: при наличии показаний выполняются дополнительные исследования мочи, например, для исключения инфекции и уточнения типа возбудителя - исследование мочи методом Нечипоренко, исследование мочи методом Зимницкого, различные микробиологические (культуральные) исследования мочи и микроскопическое исследование мочи. Также по показаниям выполняются на любом этапе диагностики и лечения ОМЛ определение гемосидерина в моче, определение концентрации свободного кортизола в моче, активности альфа-амилазы в моче, и другие.
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой 1 раз в 3 - 6 месяцев определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии [1, 7, 21].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой 1 раз в 3 - 6 месяцев выполнять определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови и антигена вируса гепатита C (Hepatitis C virus) в крови и, при необходимости, молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и гепатита C (Hepatitis C virus) в целях уточнения риска реактивации вирусного гепатита и, в случае необходимости, ее профилактики [1, 7, 22, 23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ по показаниям с целью уточнения риска и в случае необходимости профилактики реактивации вирусного гепатита В выполнение развернутого вирусологического исследования для выявления маркеров вирусов гепатита B, которое должно включать определение [24]:
-- антигена (HbsAg) вируса гепатита B в крови;
-- антител к поверхностному антигену (HBsAg) вируса гепатита B в крови;
-- антител к ядерному антигену (HBcAg) вируса гепатита B в крови;
-- ДНК вируса гепатита B в крови методом полимеразной цепной реакции (качественное исследование).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам при подозрении и при установленном ОМЛ выполнение молекулярно-биологического исследования крови на вирусы простого герпеса (Herpes simplex virus), цитомегаловирус (Cytomegalovirus), Эпштейна-Барра (Epstein-Barr virus) в целях уточнения риска развития герпетической инфекции и, в случае необходимости, ее профилактики [1, 25 - 29].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуются всем пациентам при подозрении и при установленном ОМЛ выполнять микробиологическое (культуральное) исследование крови на стерильность в целях проведения прецизионной антибиотической терапии в ходе лечения при возниконовении фебрильной лихорадки и инфекционных осложнений [1, 2, 30, 31].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: может проводиться микробиологическое (культуральное) исследование (дисбактериоз) с применением автоматизированного посева, микробиологическое (культуральное) исследование отделяемого из полости рта, микробиоценоза кишечника культуральными методами, крови на стерильность, мочи на бактериальные патогены.
- Рекомендуется при подозрении и при установленном ОМЛ, в процессе лечения по показаниям, а также в случае развития рецидива и после выполнения алло-ТГСК выполнение необходимых исследований и проб для гемотрансфузии, включающих [1, 32]:
- всем пациентам:
-- определение основных групп по системе AB0;
-- определение антигена D системы Резус (резус-фактор);
-- определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy;
-- проба на совместимость перед переливанием компонентов крови;
-- определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител;
- при необходимости:
-- определение HLA-антигенов;
-- определение содержания мембранных иммуноглобулинов;
-- определение содержания антилейкоцитарных антител;
-- определение содержания антитромбоцитарных антител;
-- определение содержания антител к антигенам эритроцитов в сыворотке крови.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: назначение необходимых исследований и проб, а также выбор конкретного вида компонента крови для гемотрансфузии (тип эритроцитосодержащего компонента крови, тип концентрата тромбоцитов, тип препарата плазмы) осуществляется лечащим врачом или врачом-трансфузиологом в соответствии с клинической ситуаций и на основании Приказа Минздрава России от 28.10.2020 N 1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология", Приказа Минздрава России от 20.10.2020 N 1134н "О порядке медицинского обследования реципиента, проведения проб на индивидуальную совместимость, включая биологическую пробу, при трансфузии донорской крови и (или) ее компонентов", рекомендациями "Клиническое использование эритроцитсодержащих компонентов крови" (2018 г.), Постановления от 22.06.2019 г. N 797 "Об утверждении правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации", другими нормативными актами (см. Приложение А3.9).
- Рекомендуется всем пациентам получение цитологического препарата костного мозга путем пункции и цитологическое исследование мазка костного мозга (миелограмма) при подозрении на ОМЛ, а также пациентам с верифицированным ОМЛ в процессе лечения, после окончания программы индукции, консолидации, в ходе проведения поддерживающей терапии (1 раз в 2 - 3 месяца), перед выполнением ТГСК, после завершения всей запланированной программы лечения, а также при выявлении изменений в гемограмме вне связи с проводимым лечением и/или подозрении на рецидив ОМЛ [1, 7, 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется при констатации рецидива (независимо от процентного содержания бластных клеток в периферической крови) получение цитологического препарата костного мозга путем пункции и цитологическое исследование мазка костного мозга (миелограмма) и цитохимическое исследование микропрепарата костного мозга, или, при невозможности получения аспирата, получение гистологического препарата костного мозга и цитологическое и цитохимическое исследование отпечатков трепанобиоптата костного мозга для подтверждения рецидива и идентификации клеточной дифференцировки [1, 7, 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: пункционное исследование (аспирация) костного мозга является обязательной рутинной диагностической процедурой. Мазки костного мозга исследуют с помощью окраски по Маю-Грюнвальду, Паппенгейму или Райту-Гимзе. Выполнение трепанобиопсии не является обязательным, за исключением ситуаций с так называемым "сухим проколом" или очень скудным пунктатом костного мозга. Рекомендовано исследовать как минимум 500 ядросодержащих клеток в мазке костного мозга.
Для установления диагноза ОМЛ в мазке периферической крови или костного мозга необходимо наличие 20% бластных клеток и более. При ОМЛ с t(15;17), t(8;21), inv(16) или t(16;16) доля бластных клеток может быть менее 20%. В соответствии с актуальной классификацией ВОЗ (2016) процент бластных клеток подсчитывают вне зависимости от доли красного ростка.
Миелобласты, монобласты и мегакариобласты включают в общее число бластных клеток. В случаях ОМЛ с моноцитарной и миеломоноцитарной дифференцировкой промоноциты (но не атипические/зрелые моноциты) также считают эквивалентами бластных клеток. Эритробласты не включают в общее число бластных клеток.
При оценке степени выраженности дисплазии за мультилинейную дисплазию считают наличие признаков дисплазии в 50% и более клеток в 2-х или 3-х ростках кроветворения. При этом необходимо оценить не менее 25 эритрокариоцитов, 25 гранулоцитов и 6 мегакариоцитов.
Для верификации диагноза истинного эритроидного лейкоза при подсчете пунктата костного мозга клетки эритроидного ряда должны составлять > 80% от всех клеток костного мозга, при этом проэритробласты должны быть ![]() 30%, без учета миелобластов. В соответствии с номенклатурой ВОЗ проэритробласты - незрелые эритрокариоциты, при этом, в соответствии с терминологией клеток эритропоэза по И.А. Кассирскому и Г.А. Алексееву, - это эритробласты и пронормобласты. При истинном эритробластном лейкозе дисмегакароцитопоэз встречается часто, в то время как дисгранулоцитопоэз - редко. При разведении пунктата костного мозга периферической кровью и количестве клеток красного ряда менее 80% его оценка может проводиться по трепанобиоптату [33].
30%, без учета миелобластов. В соответствии с номенклатурой ВОЗ проэритробласты - незрелые эритрокариоциты, при этом, в соответствии с терминологией клеток эритропоэза по И.А. Кассирскому и Г.А. Алексееву, - это эритробласты и пронормобласты. При истинном эритробластном лейкозе дисмегакароцитопоэз встречается часто, в то время как дисгранулоцитопоэз - редко. При разведении пунктата костного мозга периферической кровью и количестве клеток красного ряда менее 80% его оценка может проводиться по трепанобиоптату [33].
Выполнение цитохимического анализа клеток костного мозга необходимо, даже если определяется высокое содержание бластных клеток в периферической крови. Это связано с тем, что в ряде случаев цитохимические реакции могут давать различные результаты в клетках периферической крови и костного мозга, что может повлечь за собой установление ошибочного диагноза. Диагноз основывают на результатах исследования, полученного на клетках костного мозга. Используют реакции на миелопероксидазу (МПО) или судановый черный, неспецифическую эстеразу (альфа-нафтилацетатэстеразу, подавляемую или нет фторидом натрия) и ШИК (шифф-йодную кислоту) или PAS (Periodic Acid Schiff). Обнаружение МПО в 3% бластных клеток и более указывает на миелоидную линию дифференцировки. В то же время ее отсутствие не исключает миелоидную направленность клеток, потому что в ранних миелобластах и монобластах, а также мегакариобластах и эритробластах МПО < 3% или не определяется. Окраска судановым черным аналогична МПО, но является менее специфичной. Ее проводят только в тех случаях, когда невозможно выполнить реакцию на миелопероксидазу. Неспецифическая эстераза имеет высокую диффузную или гранулярную цитоплазматическую активность (в зависимости от методики проведения реакции) в монобластах и промоноцитах, которая должна подавляться полностью или значительно фторидом натрия. ШИК-реакция в миелобластах определяется в диффузном виде, в монобластах и промоноцитах - в диффузно-гранулярном, в эритробластах - в виде гранул или блоков. На основании морфоцитохимического исследования бластных клеток может быть диагностировано около 90% случаев ОМЛ, при отсутствии активности МПО и неспецифической эстеразы необходимо проведение иммунофенотипического (ИФТ) исследования методом проточной цитофлуориметрии.
- Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ выполнять иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге (ИФТ-исследование) для определения принадлежности бластных клеток к той или иной линии клеточной дифференцировки ОЛ [1, 2, 4, 7, 8, 34].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: ИФТ-исследование выполняется всегда на клетках костного мозга, даже если определяется высокое содержание бластных клеток в периферической крови. Определение процента бластных клеток методом проточной цитофлуориметрии при первичной диагностике не является заменой морфологического подсчета, так как результаты этих двух исследований могут не совпадать [34].
Для подтверждения миелоидной направленности опухолевых клеток необходимо оценить экспрессию миелоидных антигенов. MPO - линейно-специфический маркер миелоидной линии, лизосомальный фермент гранулоцитов. К менее специфичным миелоидассоциированным антигенам относятся CD11b, CD11c, CD13, CD15, CD16, CD33, CD64, CD65, CD66b, лизоцим и др. Диагноз ОМЛ может быть установлен и в том случае, если MPO не выявляется, а опухолевые клетки экспрессируют другие, менее специфичные миелоидные маркеры, и исключен лимфобластный вариант ОЛ.
Между морфоцитохимической классификацией французско-американско-британской (FAB) и ИФТ-признаками нет четкой корреляции. Большинство миелоидных маркеров могут быть как положительными, так и отрицательными при разных вариантах ОМЛ по FAB-классификации, за исключением специфических антигенов CD41a и CD61, которые характерны только для мегакариоцитарной/тромбоцитарной линии. Даже гликофорин А (CD235a), маркер эритроидной линии, может быть отрицательным при эритробластном лейкозе, если опухолевые клетки происходят из более ранних предшественников. Таким образом, по данным ИФТ-исследования нельзя определять FAB-вариант ОМЛ.
Бластные клетки считаются положительными по экспрессии мембранного антигена, если он определяется на 20% бластных клеток и более (пороговое значение). Для цитоплазматических маркеров (таких как цитоплазматический CD3, MPO, лизоцим, ядерная TdT и др.) используют более низкий порог - 10%.
В случае невозможности получения аспирата костного мозга выполнют иммуногистохимическое исследование трепанобиоптата костного мозга.
ИФТ-исследование проводят с помощью мультипараметрической проточной цитофлуориметрии (обычно как минимум 6-цветной). В случае анализа трепанобиоптата выполняется его иммуногистохимическое исследование. Особенно ИФТ-исследование необходимо для установления диагноза ОМЛ с минимальной дифференцировкой, острого мегакариоцитарного лейкоза и ОЛ с неопределенной дифференцировкой. ОЛ неясной линейности являются редкими типами лейкозов и включают случаи, которые не имеют признаков принадлежности к какой-либо клеточной линии (острый недифференцированный лейкоз) или такие случаи, бластные клетки которых экспрессируют маркеры более чем одной линии дифференцировки. В классификации Европейской группы по иммунологическому описанию лейкозов (EGIL) ОЛСФ подразделяют на острый бифенотипический лейкоз, когда одна опухолевая популяция экспрессирует антигены нескольких линий дифференцировки, и острый билинейный лейкоз, при котором существуют 2 и более популяции бластных клеток разной линейности. В классификации ВОЗ эти варианты объединены в ОЛСФ.
- Рекомендуется всем пациентам при первичной диагностике ОЛ, по показаниям - на любом этапе во время/после лечения, а также при обследовании по поводу диагностированного рецидива ОМЛ выполнить цитогенетическое исследование (кариотип) аспирата костного мозга в целях выявления аномалии кариотипа и стратификации пациентов по группам риска, а также для определения тактики лечения [1, 2, 4, 7, 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: стандартное цитогенетическое исследование является необходимым компонентом диагностических процедур у пациента с подозрением на ОЛ. Хромосомные аномалии выявляются примерно у половины пациентов с ОМЛ. Несколько транслокаций и инверсий (и их варианты) относятся ВОЗ в категорию "ОМЛ с устойчиво выявляемыми хромосомными аномалиями". Более того, обнаружение некоторых генетических аномалий при наличии 20% бластных клеток и более в костном мозге является достаточным для установления диагноза "ОМЛ с признаками миелодисплазии". Для определения кариотипа достоверным считается исследование как минимум 20 метафаз. Аномалии кариотипа могут устанавливаться и на основании исследования клеток периферической крови. Определение тех или иных цитогенетических аномалий уже на момент диагностики ОМЛ может определить терапевтическую тактику для конкретного пациента, например выявление комплексных изменений кариотипа или моносомного кариотипа свидетельствует о необходимости применения отличного от стандартного цитостатического воздействия и обязательного обсуждения вопроса о возможности предельно раннего включения алло-ТГСК в программу лечения ОМЛ, вплоть до проведения алло-ТГСК в аплазии после 1-го индукционного курса.
- Рекомендуется всем пациентам при первичной диагностике ОМЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, которым не выполнено стандартное цитогенетическое исследование (мало материала, не было получено митозов или получено менее 20 митозов) или у которых получен нормальный кариотип, но при этом выявляются яркие клинико-лабораторные симптомы, характерные для определенных вариантов ОМЛ, провести исследование с применением метода флуоресцентной гибридизации in situ (FISH) на одну или несколько пар хромосом для детекции реаранжировок генов в аспирате костного мозга [1, 7, 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при ОМЛ исследуются RUNX1::RUNX1T1, CBFB::MYH11, PML::RARA, KMT2A и EVI1 или потеря хромосом 5q и 7. FISH зачастую необходим для идентификации слияний KMT2A при транслокациях региона 11q23. Возможно также проведение FISH на морфологических и гистологических препаратах костного мозга.
- Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, в случае выявления при стандартном цитогенетическом исследовании (кариотипе) костного мозга или молекулярно-генетическом исследовании транслокации t(8;21) в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH) транслокации t(8;21) или инверсии хромосомы 16 при определении инверсии inv(16) в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH), выполнить молекулярно-генетические исследования на наличие химерных транскриптов RUNX1::RUNX1T1 или CBFB::MYH11 методом ПЦР в реальном времени для дальнейшего мониторинга МОБ [7 - 9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5)
- Всем пациентам с подтвержденным диагнозом ОМЛ для определения прогноза заболевания в ряде случаев тактики терапии рекомендуется молекулярно-генетическое исследование крови или КМ для выявления мутаций генов NPM1, CEBPa, FLT3, TP53, ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, ZRSR2 [9]
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5)
- Всем пациентам в момент рецидива ОМЛ или констатации рефрактерного течения заболевания рекомендовано повторное молекулярно-генетическое исследование мутаций в гене FLT3-ITD и FLT3-TKD с целью определения необходимости назначения ингибиторов тирозинкиназ [1, 7, 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Перечисленные исследования выполняются на аспирате костного мозга для стратификации пациентов по группам риска и определения тактики лечения, а также в целях выявления маркера для мониторинга динамики опухолевого клона на фоне терапии. В случае невозможности забора образца костного мозга допускается определение мутаций в генах на материале периферической крови пациента.
Молекулярно-генетическое исследование мутаций в гене FLT3 является обязательным, поскольку современные подходы к лечению ОМЛ предусматривают использование ингибиторов протеинкиназы у больных с FLT3-позитивным вариантом заболевания. ОМЛ с мутациями в генах NPM1 или CEBPA определены ВОЗ как отдельные категории. Мутация NPM1 является маркером для оценки МОБ. Экспрессия генов ERG, MN1, EVI1, BAALC, мутации генов WT1, KIT, RAS, TET2, DNMT3A, IDH1, IDH2B могут быть изучены в рамках клинических исследований и в редких случаях при констатации рефрактерности или рецидива с целью поиска новых терапевтических подходов. В современной молекулярной диагностике ОМЛ широко применяется и метод секвенирования нового поколения, созданы так называемые диагностические панели из нескольких десятков генов, вовлеченных в патогенез ОМЛ, которые позволяют четко отнести исследуемый ОМЛ к той или иной категории риска
- Рекомендуется всем пациентам при первичной диагностике ОМЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, которым не выполнено стандартное цитогенетическое исследование (мало материала, не было получено митозов или получено менее 20 митозов) или у которых получен нормальный кариотип, но при этом выявляются яркие клинико-лабораторные симптомы, характерные для определенных вариантов ОМЛ, провести патолого-анатомическое исследование биопсийного (операционного) материала тканей костного мозга с применением метода флуоресцентной гибридизации in situ (FISH) на одну пару хромосом для детекции реаранжировок генов в аспирате костного мозга [1, 7, 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при ОМЛ исследуются RUNX1::RUNX1T1, CBFB::MYH11, PML::RARA, KMT2A и EVI1 или потеря хромосом 5q и 7. FISH зачастую необходим для идентификации слияний KMT2A при транслокациях региона 11q23. Возможно также проведение FISH на морфологических и гистологических препаратах костного мозга.
- Рекомендуется всем пациентам, у которых имеется информация о наличии молекулярного маркера или известен аберрантный иммунофенотип (выявленные на момент диагностики ОМЛ), ИФТ-исследование биологического материала для выявления маркеров МОБ при гемобластозах или молекулярно-генетическое исследование МОБ при лейкозах для контроля за лечением и определения тактики постиндукционной терапии [1, 2, 7, 8, 35].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: для подтверждения полноты достигнутого ответа на терапию и его сохранение, в соответствии с современными международными рекомендациями, необходимо выполнять в контрольные точки оценку МОБ методом проточной цитофлуорометрии (аберрантный иммунофенотип), а для CBF-ОМЛ - только молекулярное исследование МОБ методом ПЦР (количественная оценка экспрессии RUNX1::RUNX1T1, CBFB::MYH1, мутации NPM1). МОБ методом проточной цитофлуориметрии должна быть оценена в специализированной лаборатории (не менее чем на 8-цветном цитометре) с использованием всех необходимых моноклональных антител для достижения высокой чувствительности и специфичности с сочетанием двух подходов: 1. определение лейкоз-ассоциированного иммунофенотипа в период диагностики заболевания; 2. метод "пустых мест", заключающийся в поиске клеток, отличных от нормальных прототипов [35, 36].
Определение МОБ-статуса в процессе лечения может изменить прогноз больного и во время определить целесообразность выполнения пациентам алло-ТГСК [37].
- Рекомендуется всем пациентам выполнить спинномозговую пункцию с выполнением цитологического исследования клеток спинномозговой жидкости, микроскопического исследования спинномозговой жидкости, подсчета клеток в счетной камере (определение цитоза) и общего (клинического) анализа спинномозговой жидкости в целях диагностики нейролейкемии и нейропрофилактики [1, 2, 7, 8, 38].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: микроскопическое исследование спинномозговой жидкости необходимо выполнять всем пациентам при цитозе ![]() 5/мкл. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов спинномозговой жидкости цитологическую центрифугу.
5/мкл. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов спинномозговой жидкости цитологическую центрифугу.
При ОМЛ, в целом, вовлечение центральной нервной системы встречается менее чем у 5% пациентов, однако при ряде вариантов ОМЛ, особенно с моноцитарной дифференцировкой, вероятность вовлечения в процесс оболочек головного мозга выше.
Желательно поддерживать число тромбоцитов перед выполнением спинномозговой пункции 30'109/л и выше. Если уровень тромбоцитов не удается повысить до 30 * 109/л и выше, при отсутствии клинических признаков поражения центральной нервной системы от пункции можно воздержаться до повышения тромбоцитов в гемограмме выше 30 * 109/л.
Если у пациента определяется лейкоцитоз выше 100 * 109/л, первую спинномозговую пункцию следует отложить до редукции числа лейкоцитов менее 30 - 40 * 09/л.
Нейролейкемию диагностируют при обнаружении в спинномозговой жидкости, полученной при первой диагностической спинномозговой пункции, любого количества бластных клеток при любом цитозе или цитоза 15/3 и более (т.е. более 5 клеток в 1 мкл).
- Рекомендуется всем пациентам выделять первичную ДНК и РНК из клеток костного мозга и сохранять ее в биобанке либо направлять материал на хранение в лаборатории Федеральных центров для возможности последующего выполнения молекулярных исследований [1, 2, 7].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: сохранение первичного биологического материала осуществляется в виде ДНК и/или РНК, выделенных из костномозговых клеток или замороженных клеток. Материал может в последующем понадобиться для проведения молекулярных исследований, позволяющих определить группы риска, а также в рамках клинических исследований.
- Рекомендуется всем пациентам с ОМЛ при проведении биопсии любого органа и ткани для дифференциальной диагностики специфического лейкозного и иного типа поражения [1, 2, 7]:
-- Цитологическое исследование препарата
-- При выявлении бластных клеток выполнение цитохимического исследования бластных клеток для определения линии дифференцировки (включая по показаниям цитохимическое исследование препарата крови
-- Иммунофенотипирование биологического материала для выявления маркеров гемобластозов
-- Исследование биологического материала методом проточной цитофлуориметрии
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: наиболее часто выполняется пункция плевральной полости с цитологическим исследованием плевральной жидкости, бронхо-альвеолярный лаваж с цитологическим исследованием лаважной жидкости, спинномозговая пункция с цитологическим исследованием клеток спинномозговой жидкости, однако по показаниям может выполняться биопсия любого доступного органа и ткани с последующим цитологическим осследованием, в том числе - микропрепарата тканей полости рта, перитонеальной жидкости, микропрепарата кожи, препарата тканей лимфоузла, биоптатов опухолей, опухолеподобных образований костей, тканей печени, тканей толстой кишки, аспирата из полости матки, тканей влагалища, тканей матки, тканей предстательной железы, тканей яичка, почки, мочевого пузыря, пунктатов и отпечатков биоптатов опухолей забрюшинного пространства.
- Рекомендуется всем пациентам с ОМЛ при проведении пункции с получением эксудата (жидкого биологического материала) выполнение дополнительных исследований для дифференциальной диагностики специфического лейкозного, инфекционного и иного типа поражения [1, 2, 7]:
- При исследовании спинномозговой жидкости (ликвора):
-- Микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза)
-- Определение крови в спинномозговой жидкости
-- Исследование уровня глюкозы в спинномозговой жидкости
-- Исследование уровня белка в спинномозговой жидкости
-- Тесты на аномальный белок в спинномозговой жидкости
-- Определение концентрации водородных ионов (pH) в спинномозговой жидкости
-- Исследование уровня хлоридов в спинномозговой жидкости
-- Микробиологическое (культуральное) исследование спинномозговой жидкости на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы
-- Микробиологическое (культуральное) исследование спинномозговой жидкости на неспорообразующие анаэробные микроорганизмы
-- Молекулярно-биологическое исследование спинномозговой жидкости на вирус простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2)
-- Определение ДНК вируса простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) в спинномозговой жидкости методом ПЦР
-- При цитозе ![]() 5/мкл выполнять цитологическое исследование клеток спинномозговой жидкости. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов ликвора цитологическую центрифугу
5/мкл выполнять цитологическое исследование клеток спинномозговой жидкости. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов ликвора цитологическую центрифугу
- При исследовании плевральной жидкости
-- Микроскопическое исследование нативного и окрашенного препарата плевральной жидкости
-- Исследование уровня белка в плевральной жидкости
-- Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы
- При исследовании лаважной или асцитической жидкости
-- Цитологическое исследование лаважной жидкости
-- Микроскопическое исследование лаважной жидкости
-- Микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы
-- Микроскопическое исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелиальные)
-- Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважной жидкости на цитомегаловирус (Cytomegalovirus)
-- Определение ДНК цитомегаловируса (Cytomegalovirus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР
-- Определение ДНК Pneumocystis jirovecii в мокроте, эндотрахеальном аспирате, бронхоальвеолярной лаважной жидкости методом ПЦР, количественное исследование
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: наиболее часто выполняется биопсия очага поражения кожи, костного мозга (трепанобиопсия), лимфоузла. Однако по показаниям может выполняться биопсия любого органа и ткани, в том числе, слизистой полости рта, слизистой оболочки полости носа, тканей легкого, опухоли средостения, селезенки, печени, пищевода, желудка, толстой кишки, молочной железы, кости, женских половых органов, предстательной железы, мужских половых органов, мочевого пузыря, почки, тканей забрюшинного пространства.
- Рекомендуется всем пациентам с ОМЛ на любом этапе диагностики и лечения по показаниям выполнять исследование кала на скрытую кровь для исключения кишечного кровотечения как осложнения цитопении при ОМЛ [1, 2, 7].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам, которые потенциально могут рассматриваться как кандидаты на выполнение алло-ТГСК, после достижения 1-й ремиссии ОМЛ, а также их сиблингам определение HLA-антигенов в целях поиска потенциального донора с консультацией в трансплантационном центре для определения целесообразности и возможности выполнения алло-ТГСК [1, 2, 7, 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии и в ходе лечения с частотой от 1 раза в неделю до ежемесячного (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения регистрация, расшифровка, описание и интерпретация электрокардиографических данных для выявления и/или мониторинга нарушений проводимости импульсов в сердечной мышце [1, 7, 39].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии и в ходе лечения с частотой от 1 раза в неделю до ежемесячного (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение эхокардиографии для оценки функционального состояния сердечной мышцы [1, 39].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: рутинно применяется регистрация электрокардиограммы, при наличии клинических показаний также проводятся регистрация электрической активности проводящей системы сердца, холтеровское мониторирование сердечного ритма, мониторирование электрокардиографических данных, кардиотокография плода.
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии и в ходе лечения с частотой от 1 раза в 2 - 3 недели до 1 раза в 2 - 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение компьютерной томографии (КТ) головного мозга без контраста для выявления и/или мониторинга изменений в структурах головного мозга [1, 2, 8, 40 - 42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии и в ходе лечения с частотой от 1 раза в 2 - 3 недели до 1 раза в 2 - 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение рентгенографии и/или КТ органов грудной клетки для выявления изменений легочной ткани и органов средостения [1, 2, 7, 8, 17, 40 - 42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОМЛ на любом этапе ведения с подозрением на наличие экстрамедуллярных очагов выполнение КТ и/или магнитно-резонансной томографии с контрастированием, вовлеченных в опухолевый процесс регионов для уточнения распространенности заболевания или диагностики экстрамедуллярного рецидива [1, 2, 8, 40 - 42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: наиболее часто проводятся МРТ-исследования костной ткани, головного мозга с контрастированием, спинного мозга с контрастированием, органов малого таза, позвоночника с контрастированием; и КТ-исследования лицевого отдела черепа, позвоночника, придаточных пазух носа, гортани, верхних дыхательных путей и шеи, КТ-ангиография одной анатомической области, органов малого таза у женщин, органов таза у мужчин, головного мозга, органов брюшной полости, органов брюшной полости с внутривенным болюсным контрастированием, забрюшинного пространства.
- Рекомендуется всем пациентам с ОМЛ до начала специфической терапии и в ходе лечения с частотой от 1 раза в 2 - 3 недели до 1 раза в 2 - 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения для определения объема опухолевой массы, диагностики и мониторинга сопутствующей патологии выполнение ультразвукового исследование (УЗИ) органов брюшной полости (комплексного) с определением размеров печени, селезенки и внутрибрюшных лимфатических узлов, а также оценка состояния органов брюшной полости и выполнение УЗИ органов малого таза у женщин и предстательной железы у мужчин [1, 2, 40].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: также при наличии клинических показаний на любом этапе диагностики и лечения ОМЛ выполняется УЗИ иных анатомических областей (наиболее часто - УЗИ мягких тканей, сустава, лимфатических узлов, плевральной полости, средостения, допплерография сосудов (артерий и вен) верхних конечностей, сосудов (артерий и вен) нижних конечностей, толстой кишки, матки и придатков трансабдоминальное, исследование матки и придатков трансвагиальное, молочных желез, щитовидной железы и паращитовидных желез, паращитовидных желез, почек и надпочечников, мочевыводящих путей, забрюшинного пространства).
- Рекомендуется всем пациентам с ОМЛ на любом этапе диагностики и лечения при наличии клинических показаний проведение необходимых инструментальных исследований (ларингоскопия, бронхоскопия, трахеоскопия, торакоскопия, эзофагогастродуоденоскопия, колоноскопия, цистоскопия и других) для уточнения типа поражения и контроля лечения [1, 2, 7].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется беременным женщинам выполнять полный объем инструментальных диагностических исследований при ОМЛ, как и у не беременных (см. клинические руководства по ведению беременных пациенток) [1, 43].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: В диагностических целях при беременности целесообразно применение магнитно-резонансных методов исследования, а также УЗИ, в том числе легочной ткани. Нежелательно выполнение стандартных рентгенологических методов обследования при беременности в связи с возможностью отрицательного воздействия рентгеновских лучей на плод [44].
- Рекомендуется беременным женщинам в ходе ХТ регулярно выполнять ультразвуковое исследование матки и плода и фетальную кардиотокографию плода [1, 42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.5 Иные диагностические исследования
- Рекомендуется женщинам репродуктивного возраста выполнение теста на беременность в целях выявления возможной беременности и принятия решения о необходимости модификации диагностического алгоритма и терапии [1, 7, 43].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуются всем пациентам с ОМЛ при наличии показаний и определении сопутствующей патологии (с коморбидностью, которая может повлиять на выбор программы противоопухолевой терапии), на любом этапе диагностики и лечения прием (осмотр, консультация) соответствующего врача-специалиста (врача-хирурга, врача-сердечно-сосудистого хирурга, врача-кардиолога, врача-невролога, врача-нейрохирурга, врача-оториноларинолога, врача-офтальмолога, врача-уролога, врача-нефролога, врача-колопроктолога, врача-эндокринолога, врача-пульмонолога, врача-фтизиатра, врача-гастроэнтеролога, врача-дерматовенеролога врача-стоматолога-терапевта, врача-стоматолога-хирурга, врача-травматолога-ортопеда, врача-психиатра и др. - первичный и повторный), всем женщинам - прием (осмотр, консультация) врача-акушера-гинеколога первичный [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ОМЛ с учетом возможной интенсивной трансфузионной/гемотрансфузионной терапии перед началом и в процессе лечения рекомендуется осмотр (консультация) врачом-анестезиолога-реаниматологом первичный для оценки сосудистого доступа и при показаниях установления центрального венозного катетера [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ОМЛ на любом этапе диагностики, наблюдения, лечения, при подозрении на развитие инфекционного осложнения рекомендуется выполнение диагностических исследований для уточнения локализации инфекции, типа возбудителя инфекции, динамического контроля в процессе лечения (см. разделы 7.8 - 7.10) [45 - 47].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: инфекции являются одними из ведущих осложнений при лечении ОМЛ, особенно на этапах индукции и консолидации ремиссии, в период нейтропении. Инфекционные осложнения учащаются при резистентном варианте опухоли, при высокодозной химиотерапии, при сопутствующей гипогаммаглобулинемии, в период вынужденной гиподинамии и постоянного постельного режима.
Инфекционные осложнения у пациентов с гематологическими заболеваниями характеризуются разнообразием как по этиологии, так и по локализации инфекционного процесса, и требует применения комплекса лабораторных исследований для диагностики инфекционных осложнений и особых подходов к их терапии, которые отличаются от тактики лечения инфекционных проявлений у пациентов без онкогематологического заболевания. Основным фактором, определяющим развитие инфекционных осложнений, является нейтропения (нейтрофилы < 0,5 x 109/л) или лейкопения (лейкоциты ![]() 1,000 x 109/л), а также темп снижения количества нейтрофилов и длительность нейтропении. Риск развития инфекций возрастает при повреждении слизистых оболочек желудочно-кишечного тракта (особенно мукозитах III - IV степени), наличии центрального венозного катетера (ЦВК).
1,000 x 109/л), а также темп снижения количества нейтрофилов и длительность нейтропении. Риск развития инфекций возрастает при повреждении слизистых оболочек желудочно-кишечного тракта (особенно мукозитах III - IV степени), наличии центрального венозного катетера (ЦВК).
При ОМЛ могут развиваться различные вирусные, бактериальные, грибковые инфекционные осложнения, в том числе, оппортунистические инфекции, своевременная диагностика и лечение которых является важнейшим компонентом успешного лечения пациентов. Диагностические исследования включают необходимые исследования лучевой диагностики (КТ и магнитно-резонансная томография вовлеченных областей, в том числе, по показаниям - компьютерная томография головного мозга); эндоскопические, пункционные и биопсийные исследования (в том числе, по показаниям - бронхо-альвеолярный лаваж, пункция плевральной полости, спинномозговая пункция); лабораторные исследования (в том числе, по показаниям - исследование кислотно-основного состояния и газов крови, исследование уровня прокальцитонина в крови), посевы и другие микробиологические (культуральные), молекулярно-биологические, микроскопические и иные бактериологические исследования на аэробные и факультативно-анаэробные микроорганизмы (в том числе, аэробные и факультативно-анаэробные условно-патогенные микроорганизмы), пнвмоцисты, микоплазму, легионеллу, микобактерии туберкулеза, грибы (дрожжевые и мицелильные), клостридии, и другие.
- Всем пациентам с ОМЛ на любом этапе диагностики, наблюдения, лечения, по показаниям для исключения очага поражения головного мозга с патологической электрической активностью рекомендуется выполнение электроэнцефалографии [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ОМЛ на любом этапе диагностики, наблюдения, лечения, по показаниям для исключения очага поражения или развития осложнения рекомендуется выполнение рентгенографии пораженной области [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: наиболее часто применяется рентгенография всего черепа, в одной или более проекциях, придаточных пазух носа (в том числе, придаточных пазух носа с контрастированием), позвоночника, таза, бедренной кости, перикарда, средостения, почек и мочевыводящих путей, обзорный снимок брюшной полости и органов малого таза, а также рентгеноскопия легких.
3. Лечение
Основной принцип лечения больных ОМЛ - максимум эффективности (за счет специфичности и адекватности воздействия) при минимуме токсичности (за счет грамотной сопроводительной терапии). Долгосрочные результаты лечения ОМЛ взрослых в течение последних 20 лет, несмотря на совершенствование терапии выхаживания и использования ряда новых препаратов, принципиально не изменились. В среднем 5-летняя общая выживаемость пациентов в возрасте до 60 лет, по данным больших кооперативных исследовательских групп, составляет 35 - 50%, варьируя от 10 до 90%, в зависимости от молекулярно-генетических особенностей опухолевого клона. Доля летальных исходов, связанных с лечением, у этих пациентов составляет 3 - 18%. В лечении пожилых пациентов долгосрочные результаты не претерпели практически никаких изменений в течение 3 последних десятилетий, и 5-летняя выживаемость не превышает 10 - 12%. ОМЛ является той областью клинической гематологии, в которой продолжаются интенсивные исследования, направленные на поиск новых терапевтических возможностей [1, 2, 7, 8].
В 2017 и 2022 гг. были опубликованы Рекомендации европейских экспертов по диагностике и лечению ОМЛ [7, 9]. В течение десятка лет в США разрабатываются и постоянно обновляются рекомендации так называемой Национальной общественной противораковой сети (NCCN) [8]. В последние годы был достигнут значительный прогресс в понимании молекулярно-генетических и эпигенетических основ развития ОМЛ, что позволило определить новые диагностические и прогностические маркеры заболевания. В классификации ВОЗ (2017, 2022) учтены генетические и молекулярные варианты ОМЛ [9]. Изданы Европейские рекомендации по оптимальной интеграции аллогенной ТКМ (алло-ТКМ) в программную терапию ОМЛ [48].
При всех ОЛ существует несколько основных этапов терапии - индукция ремиссии, консолидация, поддерживающая терапия (см. Приложение А3.1) и профилактика нейролейкемии для некоторых вариантов ОЛ [1, 2]. Период начального лечения, целью которого являются максимально быстрое и существенное уменьшение опухолевой массы и достижение ПР, называется периодом индукции ремиссии (обычно 1 - 2 курса). Если ПР после 2 курсов индукции не достигнута, констатируется первичная резистентность (рефрактерность), и пациентам проводят терапию по программам лечения рефрактерных форм лейкемии. Сразу же необходимо подчеркнуть, что недостижение ПР после 1-го индукционного курса является достоверным фактором плохого долгосрочного прогноза ОМЛ, поэтому уже сразу после 1-го курса (при условии адекватности доз и длительности цитостатического воздействия) пациенты должны рассматриваться в качестве потенциальных кандидатов для выполнения алло-ТКМ [1, 2, 47].
Вторым этапом терапии ОЛ является консолидация ремиссии (закрепление достигнутого противоопухолевого эффекта). В настоящее время в большинстве случаев консолидация - наиболее агрессивный и высокодозный этап при лечении ОЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. После консолидации (обычно 1 - 2 курса) следует период противорецидивного или поддерживающего лечения. При разных вариантах ОЛ длительность, интенсивность и состав поддерживающей терапии различны.
Принципиальным этапом при лечении некоторых вариантов ОМЛ (промиелоцитарных с лейкоцитозом > 10 * 109/л, миеломоно- и монобластных, ОМЛ с экстрамедуллярными поражениями, ОМЛ с инициальным лейкоцитозом 30 * 109/л и более) является профилактика или, при необходимости, лечение нейролейкемии.
Для многих пациентов с ОМЛ ключевым этапом лечения является алло-ТГСК. Под этим термином объединена ТГСК костного мозга, периферической крови, пуповинной (плацентарной) крови. Этот этап обладает наиболее высокой эффективностью при выполнении в период 1-й (реже 2-й) ПР ОМЛ. Результаты алло-ТГСК вне ПР крайне неудовлетворительны. Группа российских экспертов полагает, что алло-ТГСК показана всем пациентам с ОМЛ в 1-й ПР в возрасте моложе 60 лет, которым не выполнены молекулярно-генетические исследования, естественно, с учетом трансплантационных рисков и коморбидностей. Если цитогенетические и молекулярные исследования были выполнены, показания к выполнению алло-ТГСК в 1-й ПР ОМЛ рассматриваются в рамках международных критериев. Представленная в Приложении Г4 информация может служить руководством в принятии решения о выполнении ТГСК у пациента с ОМЛ в 1-й ПР. Если риск развития рецидива превышает на ХТ интегрированные риски после алло-ТГСК, решение принимается в пользу ТГСК [47].
Принципы лечения ОМЛ и протоколы определяются возрастом пациента.
3.1. Лечение пациентов с острым миелоидным лейкозом в возрасте 18 - 60 лет
- Рекомендуется индукционную терапию ОМЛ начинать сразу после того, как будут завершены все диагностические мероприятия. Допустимо отложить начало ХТ до получения результатов всех лабораторных исследований, что позволит более детально характеризовать заболевание и определить правильную тактику терапии [49, 50].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: отсрочка начала терапии на короткий период (5 - 7 дней) от начала диагностики заболевания не влияет на эффективность терапии, показатели ранней летальности, а также отдаленные результаты терапии ОМЛ.
- Не рекомендуется пациентам с ОМЛ начинать немедленно проведение цитостатической терапии, если у пациента имеется:
-- тяжелая застойная сердечная недостаточность (фракция выброса менее 50%), нестабильная стенокардия, грубые нарушения ритма и проводимости с нестабильностью гемодинамики, острый инфаркт миокарда (анамнез менее 1 месяца);
-- почечная недостаточность (показатель сывороточного креатинина > 0,2 ммоль/л (или > 200 мг/мкл), за исключением случаев, обусловленных лейкемической инфильтрацией почек);
-- печеночная недостаточность (за исключением случаев, обусловленных лейкемической инфильтрацией органа), острый вирусный гепатит B или C;
-- тяжелая пневмония (дыхательная недостаточность - одышка > 30 дыхательных движений в минуту, артериальная гипоксемия < 80 мм.рт.ст., при этом следует иметь в виду, что, если в течение 2 - 3 дней не удается стабилизировать состояние пациента, курс ХТ должен быть начат, поскольку нередко диагностируется исходное поражение легочной ткани лейкемическими клетками, и без специфической терапии шансы на излечение пневмонии чрезвычайно малы);
-- сепсис (при нестабильности гемодинамики); только высокая лихорадка без характерных признаков сепсиса не может служить поводом к отсрочке ХТ;
-- угрожающие жизни кровотечения (желудочно-кишечный тракт, профузное маточное, кровоизлияние в головной мозг);
-- тяжелые психические нарушения (бред, тяжелый депрессивный синдром и другие проявления продуктивной симптоматики);
-- физическая несостоятельность, требующая постоянного ухода, кахексия (показатель общего белка < 35 г/л);
-- декомпенсированный сахарный диабет (уровень глюкозы крови > 15 ммоль/л);
-- неконтролируемое течение сопутствующего онкологического заболевания [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: если на момент поступления у пациента было одно из вышеуказанных состояний, но его в результате интенсивного симптоматического лечения удается купировать или контролировать, то пациенту по истечении 3 - 7 дней может быть начата цитостатическая ХТ. Если в ходе симптоматического лечения сопутствующей патологии отмечается прогрессирование ОМЛ в виде увеличение числа лейкоцитов, процентного содержания бластных клеток в периферической крови или исходно уровень лейкоцитов составляет 100 * 109/л и более, целесообразно к терапии осложнений добавить #гидроксикарбамид** в дозе 100 мг/кг в день [50, 51] и/или лейкоцитаферезы и, в случае необходимости, для профилактики тумор-лизис-синдрома выполнить плазмаферез. Если состояние пациента вследствие крайне тяжелых осложнений, связанных с заболеванием, или вследствие тяжелой сопутствующей патологии не удается стабилизировать в течение максимум 7 дней, допускается рассмотреть вопрос о паллиативном цитостатическом воздействии (например, цитарабин** в малых дозах).
- Рекомендуется всем пациентам, которым возможно проведение интенсивной ХТ, выполнение 1-го курса индукции по схеме "7 + 3" [52, 53]. Пациентам с экспрессией CD33 из группы благоприятного и промежуточного молекулярно-генетического риска при отсутствии мутации FLT3 возможно включение в схему "7 + 3" гемтузумаба озогамицина (Приложение А3.1) [54 - 56].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: Включение в программы химиотерапии гемтузумаба озогамицина наиболее оправдано при CBF-ОМЛ и ОМЛ с мутированным NPM1, то есть благоприятных вариантах ОМЛ. 7-дневное введение цитарабина** может быть выполнено в дозе 100 - 200 мг/м2 либо 2 раза в сутки (по 100 мг/м2) как короткая инфузия, либо в виде непрерывной внутривенной (в/в) инфузии (200 мг/м2) в сочетании с 3-дневным введением антрациклинов и родственных соединений в виде короткой инфузии (даунорубицина** в дозе как минимум 60 мг/м2 или идарубицина** в дозе 12 мг/м2, или #митоксантрона** в дозе 10 мг/м2). Выбор конкретного препарата (даунорубицин**, идарубицин** или митоксантрон**) существенно не влияет на конечные результаты. Доксорубицин** не применяется при проведении курса "7 + 3" в индукции ремиссии ОМЛ. Гемтузумаб озогамицин в сочетании с "7 + 3" вводится внутривенно один раз в день в 1, 4, 7 дни курса в дозе 3 мг/м2 (максимум один флакон 5 мг). Возможен альтернативный режим введения гемтузумаба озогамицина: в дозе 3мг/м2 (максимум один флакон 5 мг) внутривенно однократно в один из первых 4-х дней курса "7 + 3" (день 1, или день 2, или день 3, или день 4 (Приложение А3.1) [54 - 57, 58 - 60].
- Не рекомендуется использовать цитарабин** в высоких дозах в индукционных курсах при ОМЛ [55, 61].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
Комментарий: с учетом отсутствия данных о повышении частоты достижения ремиссии при достоверно более высокой токсичности лечения. Это возможно только в рамках клинических исследований.
- Рекомендуется всем пациентам, которым возможно провести интенсивную ХТ, и которым выполнено 1 или 2 курса ХТ индукции ремиссии (в зависимости от того, после какого курса - 1-го или 2-го - достигается ПР), проведение 2 - 3 курсов консолидации высокими/средними дозами цитарабина** в качестве монотерапии или в сочетании с антрациклинами и родственными соединениями и/или #флударабином** [53].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Рекомендуется включение Гемтузумаба озогамицина в схему консолидации высокими/средними дозами цитарабина**. Применение Гемтузумаба озогамицина во второй индукции (т.е. в случае недостижения ремиссии после первого курса "7 + 3" с Гемтузумабом озогамицином) не рекомендуется (см. Приложение А3.1) [54 - 56].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1)
Комментарий: возможные варианты дозировок #цитарабина** при проведении курсов консолидации ремиссии - 1 г/м2, или 1,5 г/м2, или 3 г/м2 2 раза в день в 1, 3, 5-й дни (дозировки 1,5 и 1 г/м2 - вне зарегистрированных показаний). В настоящее время существуют некоторые разногласия в рекомендациях дозировок цитарабина** европейскими и американскими исследователями. Европейские исследователи пришли к единому мнению о том, что оптимальной дозой #цитарабина** в курсах консолидации является 1 - 1,5 г/м2 [7], а американские исследователи в рекомендациях NCCN оставляют дозу 1,5 - 3 г/м2 [8]. Гемтузумаб озогамицин в сочетании с высокими/средними дозами цитарабина** вводится в дозе 3 мг/м2 (максимум один флакон 5 мг) однократно в первый день цикла [54 - 56]. Если нет возможности выполнить высокодозную консолидацию, как дополнительный вариант может рассматриваться выполнение еще 2 курсов консолидации "7 + 3" с идарубицином** или #митоксантроном** в индукционных дозах без Гемтузумаба озогамицмна из-за возможной сочетанной токсичности с антрациклинами и родственными соединениями (см. Приложение А3.1).
- Рекомендуется всем пациентам с миеломонобластным (М4) и монобластным (М5) вариантами ОМЛ, при всех формах ОМЛ с лейкоцитозом в дебюте заболевания выше 30*109/л и/или наличием экстрамедуллярных образований, а также при миелоидной саркоме выполнять профилактику нейролейкемии - спинномозговые пункций с интратекальным введением стандартного набора препаратов (#метотрексат** вводится в дозе 12,5 мг/м2, максимальная доза - 15 мг, концентрация его в растворе должна быть 1,5 мг/мл, то есть объем раствора должен составлять 10 мл; цитарабин** 20 мг/м2, объем раствора должен составлять 3 мл; #дексаметазон** 4 мг, объем раствора должен составлять 3 мл) (см. Приложение А3.6) [1, 2, 62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Основной этап профилактики - 5 спинномозговых пункций в период индукции/консолидации ремиссии и далее еще 3 пункции каждые 3 мес. в ходе поддерживающей терапии - итого всего 8 спинномозговых пункций с интратекальным введением 3 препаратов. Зарубежные исследователи не рекомендуют выполнять профилактику нейролейкемии у пациентов без неврологической симптоматики, однако российские исследователи считают профилактику нейролейкемии обязательным этапом лечения ОМЛ в вышеописанных ситуациях.
- Рекомендуется всем пациентам при диагностике нейролейкемии проведение терапии нейролейкемии - выполнение спинномозговых пункций с интратекальными введением стандартного набора препаратов (#метотрексат** вводится в дозе 12,5 мг/м2, максимальная доза - 15 мг, концентрация его в растворе должна быть 1,5 мг/мл, то есть объем раствора должен составлять 10 мл; цитарабин** 20 мг/м2, объем раствора должен составлять 3 мл; #дексаметазон** 4 мг, объем раствора должен составлять 3 мл) с интервалом каждые 3 дня. После нормализации показателей ликвора должно быть сделано минимум 3 пункции с таким же интервалом между введениями, в дальнейшем пункции выполняют перед каждым курсом запланированного протокола [1, 2, 62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется при развитии у пациента после 1-го индукционного курса жизнеугрожающих осложнений, потребовавших реанимационных мероприятий (септический шок, инфаркт миокарда, миокардит и др.), или тяжелого инвазивного микоза временно (до реабилитации пациента) заменить курсы (1 - 2) интенсивной индукции/консолидации курсами #цитарабином** в малых дозах, или сочетанием малых доз цитарабина** с идарубицином** и #децитабином либо #азацитидином**, или венетоклакс** - содержащие комбинации (см. Приложение А3.1) [8, 61, 63, 64, 65 - 67, 68].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: после выполнения 1 - 2 курсов цитарабином** в малых дозах и купирования всех осложнений целесообразно вернуться к высокодозной консолидации в объеме минимум 2 курсов. Цитарабин** в малых дозах может остаться основной терапией в течение 3 лет только у пациентов с острым эритроидным лейкозом и мегакариобластным лейкозом.
- Рекомендуется пациентам с ОМЛ в возрасте 18 - 60 лет, которым невозможно проведение интенсивной ХТ в связи с наличием сопутствующих заболеваний или при выявлении неблагоприятных цитогенетических аномалий (комплексный или моносомный кариотип, вовлечение гена MECOM, del(5q) или потеря (5q) из-за несбалансированной транслокации, -7 или del(7q) или потеря (7q) из-за несбалансированной транслокации, del(11q), del(12p) или потеря (12p) из-за несбалансированной транслокации, -13 или del(13q), del(17)p или потеря (17р) из-за несбалансированной транслокации, idic(X)(q13)), либо установленном диагнозе ОМЛ, связанный с миелодисплазией по данным анамнеза (то есть с предшествующим анамнезом МДС или цитопенией, длительностью более 3 месяцев), а также при ОМЛ, развившимся после проведения химио-, лучевой терапии по поводу другой опухоли в качестве терапии выбора проведение терапии венетоклаксом** в сочетании с азацитидином**, децитабином или малыми дозами цитарабина** (см. Приложение А3.1) [8, 69, 70, 67, 68, 71].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: терапию венетоклаксом** в дозе 400 - 600 мг проводят в сочетании с азацитидином** 75 мг/м2 в течение 7 дней, децитабином 20 мг/м2 5 дней или малыми дозами #цитарабина** 20 мг/м2/сутки 10 дней (см. Приложение А3.1). Необходима коррекция дозы венетоклакса** при сочетанном применении препаратов-ингибиторов CYP3A (в соответствии с инструкцией к препарату). В целях профилактики массивного цитолиза опухоли предусмотрено ступенчатое повышение дозы венетоклакса** в начале его приема с приостановкой терапии до разрешения симптоматики при появлении клинически значимых лабораторных/клинических признаков синдрома лизиса опухоли.
- Рекомендуется у пациентов с ОМЛ с мутациями FLT3 добавление к программе лечения, начиная с индукции, препаратов FLT3-ингибиторов (ингибиторов протеинкиназы) - мидостаурина** или #сорафениба** [8, 72].
#Сорафениб** Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2) и мидостаурин** С (уровень достоверности доказательств - 5), соответственно.
Комментарий: режим дозирования мидостаурина: 50 мг 2 раза в день внутрь 8-21-й дни курса одновременно с индукционной терапией "7 + 3" и 4 консолидирующими курсами цитарабином** в высоких дозах с последующей поддерживающей терапией мидостаурином** 50 мг 2 раза в день в течение как минимум 1 года. Поддерживающая терапия мидостаурином** предусматривается и после выполнения алло-ТГСК. Длительность поддерживающей терапии мидостаурином** может быть увеличена до 2х лет, независимо от того выполнена ли или нет алло-ТГСК.
Режим дозирования #сорафениба** у молодых пациентов: 400 мг 2 раза в день внутрь 10 - 19-й дни каждого индукционного курса; далее - 400 мг 2 раза в день, начиная с 8-го дня каждого курса консолидации, далее - поддерживающая терапия #сорафенибом** 400 мг 2 раза в день в течение как минимум 1 года (независимо от того выполнена алло-ТГСК или нет).
Режим дозирования #сорафениба** у пожилых пациентов: 400 мг 2 раза в день внутрь 1 - 7-й дни каждого индукционного курса; далее - 400 мг 2 раза в день внутрь 1 - 28-й дни два 28-дневных курса одновременно с 2 курсами консолидации средними дозами цитарабина** (2 г/м2/сутки, 1-й и 5-й дни 28-дневного курса), далее - поддерживающая терапия #сорафенибом** 400 мг 2 раза в день внутрь в течение года.
- Рекомендуется пациентам с ОМЛ, достигшим ПР после индукционной терапии, которые не являются кандидатами на выполнение алло-ТГСК, проведение поддерживающей терапии (см. Приложение А3.1) [73, 74].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: поддерживающая цитостатическая, гипометилирующая или таргетная терапия (в зависимости от того, по какой программе пациенту была проведена индукция и консолидация ремиссии ОМЛ) должна выполняться в течение как минимум 1 года от начала лечения (4 курса индукции/консолидации и 6 курсов поддерживающей терапии) или в течение 2 лет от начала терапии (4 курса индукции/консолидации и 9 - 12 курсов поддерживающей терапии) (см. Приложение А3.1).
- Не рекомендуется у пациентов с ОМЛ выполнение аутологичной ТГСК (ауто-ТГСК)/аутологичной ТКМ [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: рядом зарубежных исследователей ауто-ТГСК рассматривается в качестве опции постиндукционной терапии у пациентов группы промежуточного риска в случае достижения МОБ-негативной ремиссии ОМЛ [73]. Однако российской группой экспертов выполнение ауто-ТГСК не рассматривается в качестве варианта постремиссионного лечения пациентов с ОМЛ в связи с тем, что ауто-ТГСК может стать этапом терапии только при условии абсолютно адекватно выполненного индукционного и консолидирующего лечения и обязательного отслеживания МОБ. Ее можно рекомендовать только в рамках клинических исследований.
- Рекомендуется пациентам, достигшим ПР после индукционного этапа лечения, консультация в трансплантационном центре в течение 3 месяцев от момента достижения ПР для решения вопроса о возможности и целесообразности выполнения алло-ТКМ/алло-ТГСК [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется выполнение алло-ТКМ/алло-ТГСК в 1-й ПР ОМЛ как этапа постремиссионной терапии пациентам групп высокого и промежуточного риска с нормальным кариотипом и неблагоприятными молекулярными маркерами либо пациентам, которым при установлении диагноза не выполнены цитогенетические и молекулярно-генетические исследования, а также пациентам группы благоприятного риска, у которых ПР была получена не после 1-го курса индукции, либо в случаях персистенции МОБ [75].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1)
Комментарий: Для пациентов из группы высокого риска, в том числе с FLT3-ITD, алло-ТГСК следует рассматривать как обязательный этап лечения. Именно для этой группы пациентов крайне важно выполнение HLA-типирования пациента до начала 1-го индукционного курса, а после достижения 1-й ПР - начало поиска потенциальных доноров. Однако эту рекомендацию ограничивает несколько факторов: возраст, соматический статус пациента, наличие донора и организационная возможность выполнить процедуру алло-ТГСК. Если риск развития рецидива превышает на ХТ интегрированные риски после алло-ТГСК, то решение принимается в пользу ТГСК.
Интегрированные риски, связанные с трансплантационной летальностью, приведены в Приложении Г4. Для окончательного решения этого вопроса необходимо направить пациента на консультацию в трансплантационный центр.
- Не рекомендуется выполнение алло-ТКМ/алло-ТГСК в период 1-й ПР ОМЛ пациентам из группы благоприятного цитогенетического риска [73].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: за исключением случаев ОМЛ с t(8;21) и с inv16 с персистенцией МОБ на высоком уровне, для которых алло-ТГСК является оптимальным вариантом. Алло-ТГСК рекомендуется также пациентам с ОМЛ с нормальным кариотипом и благоприятным молекулярным профилем, но с гиперлейкоцитозом ![]() 100'109/л и/или наличием лейкемидов и при диагностике ОМЛ на фоне беременности.
100'109/л и/или наличием лейкемидов и при диагностике ОМЛ на фоне беременности.
- Рекомендуется у пациентов с вторичным ОМЛ придерживаться алгоритма выбора терапевтической тактики как при впервые диагностированном ОМЛ [76].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: выбор тактики лечения вторичного ОМЛ должен проводиться с учетом цитогенетического варианта лейкоза, типа предшествующей терапии, возраста и соматического статуса пациента и наличия осложнений. В случае доступности HLA-совместимого донора пациент должен быть ориентирован на проведение алло-ТГСК.
- Рекомендуется пациентам из группы неблагоприятного прогноза ОМЛ (по данным цитогенетического исследования или с ОМЛ, связанным с миелодисплазией, либо при вторичном ОМЛ - см. Приложения Г1, Г2) в качестве 1-го курса или, особенно при неэффективности стандартной индукционной ХТ, вне зависимости от возраста выполнение комбинированной низкодозной ХТ с использованием азацитидина** либо децитабина, или венетоклакса** в сочетании с азацитидином** (см. Приложение А3.1) [8, 66 - 68, 71, 77 - 79].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: при достижении ПР в случае доступности HLA-совместимого донора пациент должен быть ориентирован на проведение алло-ТГСК в максимально короткие сроки от момента достижения ремиссии.
- Рекомендуется у пациентов с ОМЛ после алло-ТГСК в случае развития гипофункции трансплантата рассмотреть возможность проведения терапии гипофункции трансплантата с использованием селектированных донорских CD34+-клеток (КА 2019-47-13) [80].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
3.2. Лечение пациентов с острым миелоидным лейкозом старшей возрастной группы (> 60 лет)
Выделяют 3 основных "технологии" лечения ОМЛ у пациентов старше 60 лет. Первый подход - интенсивная ХТ, подобная таковой у молодых, представляющая собой в большинстве случаев сочетание цитарабина** с антрациклинами и родственными соединениями и направленная на достижение ПР. Алло-ТГСК является оптимальной постремиссионной опцией в рамках этой концепции. Второй подход - низкоинтенсивная терапия, в частности применение низкодозного цитарабина**, эффективность которого, по крайней мере, у пациентов в возрасте 70 лет и старше, можно повысить с помощью пролонгированного использования в течение 28 дней, и аналоги пиримидина (азацитидин**, децитабин), том числе в сочетании с венетоклаксом**. Третий выбор - симптоматическая (сопроводительная) терапия, направленная на уменьшение клинической симптоматики и улучшение качества жизни [1, 2, 7, 8]. Оценка возможности проведения того или иного варианта терапии ОМЛ у пациента старше 60 лет должна строиться на основании учета возраста пациента, объективного определения тяжести состояния, цитогенетического и молекулярно-генетического вариантов заболевания и анализа сопутствующей патологии.
- Рекомендуется пациентов с ОМЛ в возрасте старше 60 лет рассматривать в качестве кандидатов на выполнение стандартных программ интенсивного лечения ("7 + 3"), если это позволяет тяжесть их состояния (см. Приложение А3.1) [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: выбор конкретного препарата из группы антрациклинов и родственных соединений (даунорубицин**, идарубицин** или митоксантрон**) существенно не влияет на конечные результаты [81]. Стандартной считается доза даунорубицина** 60 мг/м2 [82].
- Рекомендуется для пациентов с ОМЛ старше 65 лет проведение низкоинтенсивной терапии: малые дозы #цитарабина** 10 мг/м2/сутки 28 дней с интервалом 28 - 30 дней либо монотерапия азацитидином**, или комбинированная терапия цитарабином** в малых дозах в сочетании с идарубицином** и азацитидином** либо децитабином (см. Приложение А3.1), или азацитидином** либо децитабином в сочетании с #венетоклаксом** [8, 63, 65 - 69, 71, 83, 84].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: кандидатами для низкоинтенсивной терапии также являются пациенты в возрасте от 60 лет и старше с плохим соматическим статусом, наличием коморбидностей или дисфункцией органов.
- Не рекомендуется проведение курса цитарабина** в малых дозах пациентам с ОМЛ старше 60 лет из группы неблагоприятного прогноза (комплексный кариотип, -7, inv3 и т.д.; см. приложения Г1, Г2) [85, 86].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: для этой группы пациентов в качестве низкодозного цитостатического воздействия предпочтительной является гипометилирующая терапия в сочетании с венетоклаксом** [69] или же применение комбинированной терапии цитарабином** в малых дозах в сочетании с азацитидином** и идарубицином** (см. Приложение А3.1).
- Для пациентов с ОМЛ старше 60 лет можно рекомендовать в качестве терапии выбора проведение терапии азацитидином** в сочетании с венетоклаксом**, в некоторых случаях - монотерапию азацитидином** (см. Приложение А3.1) [67, 69, 87].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Для пациентов с ОМЛ старше 65 лет можно рекомендовать в качестве терапии выбора проведение монотерапии децитабином (см. Приложение А3.1) [84].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: терапия децитабином в дозе 20 мг/м2 5 дней в/в с интервалом 28 день.
- Для пациентов с ОМЛ старше 60 лет можно рекомендовать проведение терапии венетоклаксом** в сочетании с азацитидином** или децитабином, или цитарабином** в малых дозах [8, 64, 67, 69, 71].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: терапия азацитидином** в дозе 75 мг/м2 7 дней п/к, децитабином 20 мг/м2 5 дней в/в или малыми дозами #цитарабина** 20 мг/м2/сутки 10 дней п/к с венетоклаксом** 400 - 600 мг до развития непереносимости или прогрессирования заболевания (см. Приложение А3.1).
- Рекомендуется выполнение алло-ТКМ/алло-ТГСК в 1-й ПР ОМЛ как этапа постремиссионной терапии всем пациентам старше 60 лет [8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.3. Терапия рецидивов и резистентных форм острого миелоидного лейкоза
К сожалению, у большинства пациентов (60 - 70%), у которых достигнута ПР ОМЛ, в течение 3 лет развивается рецидив заболевания. В целом прогноз у пациентов при развитии рецидива неблагоприятен и терапевтических подходов крайне мало. Долгосрочная выживаемость зависит от возможности достижения повторной ремиссии и выполнения ТГСК в качестве консолидации. Пациенты с очень ранним рецидивом (длительностью ремиссии менее полугода), неблагоприятными цитогенетическими аномалиями и старшего возраста имеют плохой прогноз [1, 7]. Из-за неблагоприятного прогноза пациентов в рецидиве необходимо оценивать, насколько терапия может быть выполнена у конкретного пациента. Оценка перспективы долгосрочной выживаемости может быть сделана на основе прогностического индекса рецидива [88] (Приложение Г5). Прогностический индекс можно использовать при определении лечебной тактики у конкретного пациента: 1) проведение терапии, направленной на "излечение" с использованием ТГСК; 2) включение в клиническое исследование по применению новых лекарственных препаратов; 3) паллиативная терапия.
В рекомендациях NCCN, которых придерживаются и российские эксперты, используется более простой принцип определения прогноза ОМЛ после развития рецидива: если рецидив ранний (продолжительность ПР менее 12 месяцев) - прогноз неблагоприятный, поздний (продолжительность ПР 12 месяцев и более) - прогноз более благоприятный [8]. Оба подхода (прогностический индекс и деление рецидивов на ранние и поздние) к классификации рецидива ОМЛ используются в российских исследовательских центрах.
- Рекомендуется пациентам при констатации первичной резистентности ОМЛ проведение терапии по программам лечения рефрактерных форм и рецидивов ОМЛ (см. Приложение А3.1) [89].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: терапия цитарабином** в высоких дозах (если его не применяли в 1-й линии индукции) в сочетании с антрациклинами и родственными соединениями может рассматриваться в качестве индукции ремиссии перед алло-ТГСК. Для улучшения результатов ТГСК у пациентов с рефрактерными ОМЛ используют режимы кондиционирования - последовательное применение интенсивной ХТ и через 3 дня - режим кондиционирования пониженной интенсивности с последующей алло-ТГСК (так называемый протокол FLAMSA-RIC) и в дальнейшем - профилактическое использование трансфузий донорских лимфоцитов и/или терапия азацитидином**.
- Рекомендуется пациентам при недостижении ПР после 1-го индукционного курса руководствоваться в выборе 2-го индукционного курса клинической ситуацией. Возможны 3 варианта: 1) повторение курса, аналогичного 1-му; 2) изменение интенсивности ХТ-воздействия - выполнение высокодозного курса ХТ (FLAG-Ida, НАМ, MEC и др.); 3) или низкодозного курса ХТ: а) #цитарабином** в малых дозах (10 мг/м2 2 раза в день п/к 28 дней) в сочетании с азацитидином** и идарубицином** или без них, б) венетоклаксом** в сочетании с азацитидином** или децитабином (см. Приложение А3.1) [1, 7, 8, 63, 65 - 68, 71, 90 - 94].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: повторение индукционного курса ХТ целесообразно при снижении на 25%, в сравнении с исходными показателями, числа бластных клеток в миелограмме. В случае прогрессирования заболевания (сохранение прежнего или увеличение процента бластных клеток, появление ранее не выявляемых экстрамедуллярных очагов) в качестве 2-го индукционного курса целесообразно выполнение курса ХТ цитарабином** в высоких дозах в сочетании с новыми антрациклинами и родственными соединениями (см. Приложение А3.1).
В ряде случаев как 2-я линия терапии ОМЛ при первичной резистентности может быть использована неинтенсивная терапия #цитарабином** в малых дозах (10 мг/м2 2 раза п/к) либо в качестве монотерапии (28 дней) или в сочетании с малыми дозами антрациклинов и родственных соединений (в частности, идарубицина**) с гипометилирующей предфазой (Dec-Ida-Ara-c) либо терапия венетоклаксом** в сочетании с аналогами пиримидина (см. Приложение А3.1): 1) у тех пациентов, у которых в связи с коморбидностью или возрастом невозможно использовать высокодозный подход; 2) у пациентов с острым эритробластным и мегакариобластным лейкозами при недостижении ПР на стандартных курсах; 3) у пациентов из группы неблагоприятного молекулярно-генетического прогноза.
- Не рекомендуется выполнение ТГСК пациентам, у которых не достигнута ремиссия после нескольких линий индукционной терапии [95].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: эти пациенты являются кандидатами на включение в клинические исследования по изучению новых лекарственных препаратов.
- Рекомендуется у пациентов при констатации позднего рецидива ОМЛ (продолжительность 1-й ПР более 1 года) в выборе терапевтической тактики руководствоваться информацией о ранее проведенной ХТ, на которой была получена 1-я ПР [1, 7, 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: классическим выбором является повторение 1-й индукционной программы (см. Приложение А3.1). Также может быть использовано сочетание цитарабина** в стандартных дозах (100 мг/м2 каждые 12 ч 7 дней подряд или 200 мг/м2 в день непрерывно в 1-7-й дни) и идарубицина** (12 мг/м2 1 раз в день в 1-3-й дни). Шансы достижения 2-й ПР достаточно высокие (~ 70%).
- Рекомендуется пациентам при развитии раннего рецидива ОМЛ (продолжительность 1-й ПР менее 1 года) в качестве 2-й линии терапии использовать #цитарабин** в средней (1 г/м2) [60, 96 - 98] или высокой (3 г/м2) дозе в сочетании с антрациклинами и родственными соединениями [89, 99, 100], либо применение #цитарабина** в малых дозах в сочетании с азацитидином** и идарубицином** или без них, а также венетоклакса** в сочетании с азацитидином** или децитабином (см. Приложение А3.1) [1, 7, 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: для пациентов с ожидаемой избыточной токсичностью ХТ возможной опцией являются низкоинтенсивные программы лечения (см. Приложение А3.1).
- Рекомендуется пациентам при достижении очередной ремиссии ОМЛ в качестве консолидирующей терапии выполнение алло-ТГСК [101].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: если выполнение алло-ТГСК невозможно (например, из-за отсутствия подходящего донора), ауто-ТГСК может рассматриваться в качестве 2-й линии терапии, но ее эффективность четко не определена.
- Рекомендуется у пациентов с тяжелым соматическим статусом, особенно в возрасте старше 45 - 50 лет, длительными периодами цитопении на индукционных курсах, а также при наличии неблагоприятных хромосомных аномалий проведение программы низкодозного воздействия с гипометилирующим праймингом (децитабин/азацитидин**, идарубицин**, цитарабин**), либо венетоклакс**-содержащие комбинации (см. Приложение А3.1) [102].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: выполняют 2 индукционных курса и, если получена ПР, еще 2 консолидирующих. В дальнейшем осуществляют постоянную поддерживающую терапию в течение 3 лет аналогичными курсами без идарубицина**.
- Рекомендуется для терапии рефрактерных форм и рецидивов у пациентов с мутациями гена FLT3 использовать ингибитор протеинкиназ гилтеритиниб (120 мг в сутки в 1 прием) либо в монотерапии, либо в комбинации с цитостатическим воздействием, или аналогами пиримидина (азацитидин** либо децитабин) и/или венетоклаксом** до развития непереносимой токсичности или прогрессирования заболевания [8, 67, 71].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: Ответ на монотерапию гилтеритинибом может иметь отсроченный характер, то есть при использовании препарата в назначенной дозе до получения клинического ответа может пройти до 6 месяцев. При отсутствии ответа на лечение через 4 недели терапии доза может быть увеличена до 200 мг в сутки в один прием. При достижении второй ремиссии и невозможности проведения ТКМ терапия должна быть продолжена на протяжении 2-х лет. У пациентов, перенесших трансплантацию гемопоэтических стволовых клеток, лечение гилтеритинибом может быть возобновлено после восстановления донорского кроветворения. Прием гилтеритиниба рекомендуется продолжать в течение 2-х лет. В случае развития осложнений суточная доза гилтеритиниба может быть снижена с 120 мг до 80 мг или с 200 мг до 120 мг. Прервать лечение гилтеритинибом следует при появлении связанных с его использованием симптомов токсичности 3 или более степени. При разрешении токсических явлений или улучшении их до степени тяжести 1 возобновить использование препарата в меньшей дозе.
- Рекомендуется у пациентов с ОМЛ с мутациями гена FLT3 или с высокой экспрессией немутированного FLT3 (CD135) использовать ингибитор протеинкиназы #сорафениб** (800 мг/сутки в 2 приема) в комбинации с цитостатическим воздействием и с полностью трансретиноевой кислотой (#третиноин** 45 мг/м2/сутки) в качестве постоянного воздействия до прогрессирования или неприемлемой токсичности [72, 103 - 105].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: в случае развития осложнений препараты временно отменяются и через 2 - 3 недели прием возобновляют в сниженной дозировке с последующим постепенным возвращением к лечебной дозе.
- Рекомендуется у пациентов с ОМЛ с мутациями гена c-kit или высокой экспрессией на бластных клетках CD117 рассмотреть возможность назначения ингибитора протеинкиназ #дазатиниба** (140 мг/сутки постоянно) к различным схемам химиотерапии (см. Приложение А3.1) [106].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуется у пациентов с ОМЛ из группы благоприятного цитогенетического прогноза рассмотреть возможность назначения #дазатиниба** (140 мг/сутки 14 дней с момента окончания курса ХТ) [106].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуется у пациентов с ОМЛ из группы высокого риска развития рецидива после алло-ТГСК рассмотреть возможность проведения курсов трансфузий лимфоцитов донора в комбинации с #азацитидином** (32 мг/сутки 1 - 4 дни курса каждые 28 дней) (КА 2019-47-8) [107].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам при развитии рецидива ОМЛ после алло-ТГСК прекращение иммуносупрессивной терапии и проведение реиндукционного курса "7 + 3" с выполнением в период аплазии на 7-й день после курса трансфузий лимфоцитов донора [108].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: пациентам с поздним рецидивом (более 1 года после алло-ТГСК) может быть выполнена 2-я алло-ТГСК после достижения повторной ремиссии.
3.4. Ведение пациентов с особыми ситуациями
3.4.1. Острый миелоидный лейкоз с гиперлейкоцитозом
- Рекомендуется при диагностике ОМЛ с гиперлейкоцитозом назначение #гидроксикарбамида** в дозе от 50 до 100 мг/кг в день (не более 3 дней) и при снижении лейкоцитов до 50 * 109/л начинать курс ХТ. Если число лейкоцитов в крови не уменьшается в течение 2 дней, рекомендуется начать ХТ без дальнейшего приема #гидроксикарбамида** [50, 109].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: гиперлейкоцитозом обычно считают число лейкоцитов 100*109/л, и это состояние закономерно связано с увеличением показателя смертности в индукции из-за геморрагических осложнений, синдрома лизиса опухоли и инфекционных осложнений [1].
Если на фоне гиперлейкоцитоза (> 100 * 109/л) имеются очевидные признаки "лейкоцитарных стазов", наряду с назначением #гидроксикарбамида** целесообразно проведение 2 - 3 сеансов лейкоцитафереза. При появлении признаков тумор-лизис-синдрома на фоне цитолитического синдрома рекомендуется выполнение плазмафереза в небольшом объеме (1 - 1,2 л) с замещением альбумином человека** и плазмой в целях профилактики легочного дистресс-синдрома и острой почечной недостаточности. Для того чтобы избежать "обвального" цитолиза в указанной ситуации, можно сначала ввести только цитарабин** и затем выполнить плазмаферез, а введение даунорубицина** отложить на 5 - 7-й дни курса, а в первые дни курса выполнять плазмаферезы через 2 - 3 ч после введения цитарабина** или прерывая на время проведения процедуры постоянную инфузию цитарабина**. Если в схему лечения включен гемтузумаб озогамицин, то введение препарата переносят на 3, 6, 9 дни курса. Если предусмотрено однократное введение Гемтузумаба озогамицина, его переносят на последний день курса "7 + 3". Подробный терапевтический алгоритм индукции ремиссии у больных ОМЛ с инициальным гиперлейкоцитозом приведен в Приложении А3.2.
3.4.2. Миелоидная саркома
- Рекомендуется пациентам с верифицированной миелоидной саркомой использовать те же терапевтические подходы, что и у пациентов с ОМЛ [110].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при миелоидной саркоме показано проведение программы нейропрофилактики. Миелоидная саркома (синоним: экстрамедуллярная миелоидная опухоль, гранулоцитарная саркома, хлорома) - опухоль, состоящая из миелоидных клеток-предшественниц, возникающая в любом месте, отличном от костного мозга (наиболее часто в коже, лимфатических узлах, желудочно-кишечном тракте, костях, мягких тканях и яичках). Миелоидная саркома может развиваться de novo, предшествуя ОМЛ, возникать параллельно развитию ОМЛ или презентировать в качестве бластной трансформации МДС, МПЗ или МДС/МПЗ. Диагноз устанавливают на основании биопсии опухолевого образования и использования в дальнейшем цитохимических (отпечатки) и иммуногистохимических (биоптат) методов [1].
3.4.3. Лечение острого миелоидного лейкоза на фоне беременности
Лечение ОМЛ на фоне беременности проводится в стационаре мульдисциплинарной командой врачей, включающей врача-гематолога, врача-акушера-гинеколога, врача-анестезиолога-реаниматолога и имеющей возможности оказания акушерской помощи родоразрешения в экстренных ситуациях [111].
- Не рекомендуется пациенткам длительная отсрочка (> 7 дней) начала лечения ОМЛ при установлении диагноза во время беременности в связи с возможным отрицательным влиянием задержки в начале лечения на течение ОМЛ со снижением эффективности терапии данного заболевания [111].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Рекомендуется пациенткам при диагностике ОМЛ в течение I триместра беременности выполнить искусственное прерывание беременности по медицинским показаниям в связи с повышенным риском смерти плода или спонтанных абортов у женщин, получающих химиотерапию, в первом триместре по сравнению со вторым и третьим триместрами [111].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: если женщина и ее семья настаивают на пролонгировании беременности, лечение может быть начато и в I триметре беременности.
- Рекомендуется пациенткам при диагностике ОМЛ на сроке беременности 13 - 34 недели (после завершения I триместра беременности) проведение ХТ по программе "7 + 3" (см Приложение А3.1) на фоне беременности при условии адекватного мониторинга плода и акушерской помощи [111].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Рекомендуется пациенткам при диагностике ОМЛ после 36-й недели выполнить родоразрешение до начала ХТ [111, 112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: при наличии гиперлейкоцитоза родоразрешение выполняется в ходе циторедуктивной терапии.
- Рекомендуется пациенткам в выборе лекарственных веществ во время беременности, в том числе противоопухолевых препаратов и антибактериальных препаратов системного действия, руководствоваться соотношением риска - пользы для матери и плода [111].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: противоопухолевые препараты рассчитываются в соответствии с выбранной программой лечения (без редукции доз) на поверхность тела пациентки до беременности с корректировкой по массе тела во время лечения. При жизнеугрожающих осложнениях у матери возможно назначение антибактериальных препаратов системного действия без учета их возможного тератогенного воздействия на плод.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется планировать срок родоразрешения с учетом дней введения противоопухолевых препаратов - не ранее чем через 2 - 3 недели после введения противоопухолевых препаратов - в целях уменьшения вероятности миелосупрессии у плода [112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуется беременным пациенткам выполнять родоразрешение методом кесарева сечения [112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: выбор способа родоразрешения определяется состоянием плода, соматическим статусом пациентки, гематологическими показателями и строго в соответствии с акушерскими показаниями. Самопроизвольные роды могут быть выбраны как способ родоразрешения только при наличии у пациентки ремиссии ОМЛ, удовлетворительных показателей гемограммы, хорошем соматическом статусе пациентки и состоянии плода.
- Не рекомендуется пациенткам с учетом возможности развития геморрагических и инфекционных осложнений выполнять при родоразрешении эпидуральную анестезию при тромбоцитопении < 100 * 109/л [113].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется при плановом преждевременном родоразрешении на сроке 24 - 35 недели проводить профилактику синдрома острого респираторного дистресса у новорожденного - в/в введение #дексаметазона** 12 мг в сутки в течение 2 дней перед родами [114].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
3.5. Сопроводительная терапия
- Рекомендуется всем пациентам при проведении ХТ профилактика и лечение тошноты и рвоты в зависимости от эметогенного потенциала проводимого лечения согласно существующим профильным рекомендациям [115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуется пациентам с ОМЛ после проведения курсов интенсивной полихимиотерапии, у которых ожидается длительный период нейтропении и в связи с этим высокая вероятность тяжелых инфекционных осложнений, для уменьшения длительности периода нейтропении использование колониестимулирующих факторов [116].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Не рекомендуется всем пациентам с учетом высокой вероятности формирования резистентной микрофлоры, а также высокой частоты инфекций, вызванных энтеробактериями с продукцией бета-лактамаз расширенного спектра, проведение первичной профилактики бактериальных инфекций при ОМЛ антибактериальными препаратами системного лействия (селективная деконтаминация кишечника) [29, 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам в ходе проведения интенсивной индукционной ХТ выполнение профилактики инвазивных микозов позаконазолом** в клиниках, в которых частота возникновения инвазивного аспергиллеза превышает 10% [29, 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: пациентам, у которых на предшествующих курсах ХТ был диагностирован инвазивный аспергиллез, проводится вторичная противогрибковая профилактика и используют тот препарат, при назначении которого было достигнуто излечение от инвазивного аспергиллеза. В большинстве случаев с этой целью применяют вориконазол**.
- Рекомендуется в качестве антибиотиков 1-го этапа при фебрильной нейтропении использовать антибактериальные препараты в режиме дозирования в соответствии с зарегистрированными показаниями [30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: модификацию антимикробной терапии проводят в соответствии с данными проведенного обследования (КТ, микробиологические исследования и т.д.). Назначение карбапенемов в качестве препаратов 1-го этапа при фебрильной нейтропении обосновано у пациентов с септическим шоком, а также в клиниках, где в этиологии инфекций преобладают энтеробактерии с продукцией бета-лактамаз расширенного спектра.
- Рекомендуется при наличии гуморального иммунодефицита и тяжелых инфекционных осложнений (сепсис), в том числе вирусных (цитомегаловирусная) инфекций, трансфузии препаратов в/в иммуноглобулина человека нормального** [117, 118].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется выполнение трансфузии тромбоконцентратов при количестве тромбоцитов в периферической крови < 20 * 109/л [119].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: любое проявление геморрагического синдрома (петехиальные высыпания, особенно на слизистой оболочке полости рта, лице и передней поверхности грудной клетки, любые кровотечения) и/или повышение температуры тела выше 37,5 °C даже в отсутствие явного очага инфекции требуют выполнения трансфузии тромбоконцентратов даже при количестве тромбоцитов в периферической крови 20 * 109/л. Аналогичные показания для трансфузии тромбоконцентратов при подготовке пациента перед выполнением инвазивных процедур.
- Рекомендуется пациентам при выявлении признаков аллосенсибилизации переливать концентраты тромбоцитов по подбору. В целях преодоления аллосенсибилизации можно рекомендовать и выполнение серии (не менее 4 - 5) плазмаферезов (0,5 объема циркулирующей плазмы за сеанс с замещением альбумином человека**) и выполнение трансфузий  (12 - 16), чем средние (6 - 8) дозы тромбоконцентратов [120].
(12 - 16), чем средние (6 - 8) дозы тромбоконцентратов [120].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется у пациентов с ОМЛ поддерживать целевые показатели гемоглобина трансфузиями эритроцитсодержащих сред на уровне не ниже 80 г/л (гематокрит не менее 20%) [121].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Рекомендуется при наличии нарушений плазменного гемостаза (гипо- и гиперкоагуляция) выполнение трансфузии препаратов и компонентов крови (свежезамороженная плазма и др.) [122].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: показания и объем трансфузионной поддержки определяются показателями коагулограммы и клинической ситуацией.
4. Реабилитация
Специальных методов реабилитации при ОМЛ не существует.
- Рекомендуется проведение реабилитации пациентам при возникновении осложнений после завершения программы терапии ОМЛ в рамках соответствующих нозологий [123].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при проведении полихимиотерапии возможна кардио-, гепато-, нейро-, нефро- и другая токсичность, последствия которой могут проявляться и после ее окончания. После окончания лечения вести здоровый образ жизни, исключить инсоляцию и физиотерапевтические процедуры.
5. Профилактика
Специфической профилактики возникновения ОМЛ не существует.
- Рекомендуется пациентам в рамках диспансерного наблюдения после окончания программы терапии ОМЛ выполнять исследование общего (клинического) анализа крови каждый месяц в течение первых 2 лет и затем - 1 раз в 2 - 3 месяца до 5 лет от начала лечения; выполнять пункции костного мозга в течение 1-го года 1 раз в 3 месяца, далее - 1 раз в 6 месяцев в течение 2-го года, далее - 1 раз в год до 5 лет наблюдения для контроля эффективности лечения и своевременного выявления рецидива [1].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: внеплановое исследование гемограммы показано при любых изменениях в состоянии пациента. Внеплановое исследование костного мозга показано при выявлении любых изменений гемограммы. Большинство рецидивов происходят в течение 1 - 3 лет после окончания терапии. Стандартизованные временные точки взятия костного мозга необходимы при мониторинге МОБ.
6. Дополнительная информация, влияющая на течение и исход заболевания
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 08.08.2024) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "гематология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ОМЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь пациентам с гематологическими заболеваниями, для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении ОМЛ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь пациентам с ОМЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ОМЛ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "гематология", определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
- подозрение/установление диагноза ОЛ;
- диагностика рецидива ОМЛ;
- проведение очередного курса ХТ в условиях круглосуточного либо дневного стационара;
- проведение запланированной ТГСК;
- выполнение плановых хирургических вмешательств;
- выполнение плановых экстракорпоральных методов очищения крови и заместительной почечной терапии;
- проведение заместительной гемокомпонентной терапии.
Показания для экстренной госпитализации:
- неотложные состояния у пациентов с ОМЛ и при подозрении на ОЛ:
- лейкоцитоз > 100 x 109/л;
- фебрильная лихорадка и инфекционные осложнения на фоне нейтропении после курса ХТ;
- геморрагический синдром;
- тромботические осложнения;
- необходимость проведения экстренной заместительной гемокомпонентной терапии;
- другие системные нарушения, обусловленные течением основного заболевания или резвившиеся вследствие проведенного лечения.
Показания к выписке пациента из стационара:
- восстановление показателей периферической крови (уровень лейкоцитов > 1 x 109/л, гранулоцитов > 0,5 x 109/л, тромбоцитов > 50 x 109/л, гемоглобина > 80 г/л) после очередного курса ХТ;
- нормотермия в течение 3 - 5 сутки и отсутствие неконтролируемых инфекционных осложнений в послекурсовом периоде;
- купирование геморрагических осложнений;
- купирование тромботических осложнений;
- купирование системных нарушения, обусловленных течением основного заболевания или развившихся вследствие проведенного лечения.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1 Профилактика, диагностика и лечение геморрагических осложнений у пациентов с лейкозом
Геморрагические проявления у пациентов с ОМЛ отличаются многообразием и могут быть обусловлены как самим заболеванием, так и его осложнениями, в том числе вследствие проведения специфической терапии, а также появиться в результате проводимой антитромботической терапии. Геморрагические проявления могут встречаться на любом этапе диагностики и лечения заболевания ОМЛ. Для предотвращения геморрагических нарушений требуется динамический лабораторный контроль за показателями периферической крови и коагулограммы, своевременное выполнение соответствующих инструментальных исследований [124, 125 - 127].
Особенности диагностики и лечения геморрагического синдрома у больных ОМЛ приведены в разделе "Профилактика, диагностика и лечение геморрагических и тромботических осложнений у пациентов с гематологическими заболеваниями" руководства "Сопроводительная терапия при лечении заболеваний системы крови" [128].
7.2 Профилактика, диагностика и лечение тромботических осложнений
При лейкозах, как первично, так и в процессе их химиотерапевтического и иного лечения часто возникают тромботические осложнения, требующие профилактики и терапии. Частота тромботических нарушений при опухолях системы крови различна, проведение химиотерапии увеличивает частоту тромботических осложнений практически в 2 раза с 2.21% до 4.24% относительно исходного уровня [124, 129 - 134].
Особенности диагностики и лечения геморрагического синдрома у больных ОМЛ приведены в разделе "Профилактика, диагностика и лечение геморрагических и тромботических осложнений у пациентов с гематологическими заболеваниями" руководства "Сопроводительная терапия при лечении заболеваний системы крови" [128].
7.3 Профилактика и лечение кардиологических осложнений у пациентов с лейкозом
Опыт длительного наблюдения и лечения пациентов с лейкозами показывает, что кардиологические проблемы не только влияют на выбор гематологической терапии и возможность ее продолжения, но и существенно влияют на качество и продолжительность жизни, поэтому вопросы сопроводительного кардиологического ведения в гематологической практике крайне актуальны и важны [129 - 138].
Особенности диагностики и лечения кардиальной патологии у больных ОМЛ приведены в разделе "Сопроводительная терапия у пациентов с гематологическими заболеваниями" руководства "Сопроводительная терапия при лечении заболеваний системы крови" [139].
7.4 Диагностика и лечение неврологических проявлений при лейкозе
Неврологические проявления вовлечения центральной нервной системы (ЦНС) и периферической нервной системы могут быть как проявлением специфического поражения нервной системы (опухолевое поражение ЦНС), так и проявлением осложнений лейкоза и его лечения (геморрагические, тромботические, токсические поражения нервной системы). Для диагностики и лечения неврологических проявлений и осложнений при лейкозе применяется комплекс неврологических исследований и терапия сообразно виду нарушения, с учетом характера основного гематологического заболевания [140 - 146].
Особенности диагностики и лечения неврологической патологии у больных ОМЛ приведены в разделе "Сопроводительная терапия у пациентов с гематологическими заболеваниями" руководства "Сопроводительная терапия при лечении заболеваний системы крови" [147].
7.5 Диагностика и лечение инфекционных осложнений
Инфекции являются ведущими осложнениями при лечении заболеваний системы крови. Наиболее высокая частота определяется у пациентов с острыми лейкозами и у реципиентов аллогенных гемопоэтических стволовых клеток (алло-ГСК), варьирует от 30 до 90%. Так, у пациентов с острыми миелоидными лейкозами инфекционные осложнения составляют 80 - 90% на этапах индукции и консолидации ремиссии; у реципиентов аллогенных ТГСК - в период гранулоцитопении на этапе приживления гемопоэтических клеток (40 - 70%) и при развитии реакции "трансплантат против хозяина" (10 - 70%). Частота инфекционных осложнений выше в период индукции ремиссии, при резистентном варианте опухоли, при высокодозной химиотерапии, при сопуствующей гипогаммаглобулинемии, в период вынужденной гиподинамии и постоянного постельного режима.
Основным фактором, определяющим развитие инфекционных осложнений у гематологических пациентов, является нейтропения (нейтрофилы < 0,5 x 109/л) или лейкопения (лейкоциты ![]() 1 000 x 109/л), а также длительность нейтропении - частота инфекций существенно возрастает при длительности нейтропении более 10 дней. Помимо бактериальных инфекций нередко развиваются также и вирусные инфекции [29, 45, 148 - 155]. Кроме того, особенности иммунодефицита у пациентов с лейкозами ассоциированы с увеличением частоты оппортунистических инфекций и прежде всего инфекционных осложнений, вызванных грибами [150, 151, 156 - 163].
1 000 x 109/л), а также длительность нейтропении - частота инфекций существенно возрастает при длительности нейтропении более 10 дней. Помимо бактериальных инфекций нередко развиваются также и вирусные инфекции [29, 45, 148 - 155]. Кроме того, особенности иммунодефицита у пациентов с лейкозами ассоциированы с увеличением частоты оппортунистических инфекций и прежде всего инфекционных осложнений, вызванных грибами [150, 151, 156 - 163].
Особенности диагностики, профилактики и лечения инфекционных осложнений у больных ОМЛ приведены в разделе "Профилактика, диагностика и лечение инфекционных
7.6 Диагностика и лечение болевого синдрома у пациентов с ОМЛ
Международная организация по изучению боли IASP определяет боль как неприятное сенсорное или эмоциональное переживание, связанное с фактическим или потенциальным повреждением тканей, или описываемое в терминах такого повреждения [122, 164 - 168]. Боль зачастую вызывает серьезные страдания, оказывает значительное влияние на качество жизни пациента и его семьи. Боль у гематологических пациентов достаточно распространена: может являться как проявлением самого тяжелого недуга, так и осложнением лечения. Для эффективной терапии боли необходимо определение ее причины, интенсивности, вида.
Особенности диагностики и лечения болевого синдрома у больных ОМЛ приведены в разделе "Сопроводительная терапия у пациентов с гематологическими заболеваниями" руководства "Сопроводительная терапия при лечении заболеваний системы крови" [169].
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнены сбор жалоб, анамнеза и оценка объективного статуса
Да/Нет
2
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен общий (клинический) анализ крови развернутый с подсчетом лейкоцитарной формулы и числа тромбоцитов
Да/Нет
3
У пациента с подозрением на ОМЛ получен цитологический препарат костного мозга путем пункции и выполнено цитологическое исследование мазка костного мозга (миелограмма), или, при невозможности получения аспирата, получен гистологический препарат костного мозга и выполнено цитологическое и иммуноцитохимическое исследование отпечатков трепанобиоптата костного мозга
Да/Нет
4
У пациента с подозрением на ОМЛ выполнено цитогенетическое исследование (кариотип) аспирата костного мозга
Да/Нет
5
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен анализ крови биохимический общетерапевтический расширенный (исследование уровня общего белка в крови, определение соотношения белковых фракций методом электрофореза, исследование уровня мочевины, креатинина, общего билирубина, натрия, калия, общего кальция, глюкозы в крови, определение активности аланинаминотрансферазы, аспартатаминотрансферазы в крови, исследование уровня общего магния в сыворотке крови)
Да/Нет
6.
У пациента с подозрением на ОМЛ выполнена спинномозговая пункция с выполнением цитологического исследования клеток спинномозговой жидкости, микроскопического исследования спинномозговой жидкости, подсчета клеток в счетной камере (определение цитоза) и общего (клинического) анализа спинномозговой жидкости
Да/Нет
7
У пациента с ОМЛ до начала специфической терапии выполнена рентгенография органов грудной клетки и/или КТ органов грудной клетки и/или головного мозга
Да/Нет
8
У пациента с впервые диагностированным ОМЛ после завершения всех диагностических мероприятий проведена индукционная терапия
Да/Нет
9
У пациента с верифицированным ОМЛ, достигшего ПР после индукционного этапа терапии, выполнена программа консолидации ремиссии
Да/Нет
10
У пациента с верифицированным ОМЛ, достигшего ПР после индукционного этапа терапии, проведена консультация в трансплантационном центре в течение 3 месяцев от момента достижения ПР для решения вопроса о возможности и целесообразности выполнения алло-ТКМ/алло-ТГСК
Да/Нет
11
У пациента, получающего терапию по поводу верифицированного ОМЛ, после окончания консолидации ремиссии проведено цитологическое исследование аспирата костного мозга
Да/Нет
12
У пациента, получающего терапию по поводу верифицированного ОМЛ, после завершения всей программы терапии проведено цитологическое исследование аспирата костного мозга
Да/Нет
13
У пациента с констатированным резистентным течением ОМЛ выполнена смена терапии на программу лечения резистентных форм ОМЛ
Да/Нет
14
У пациента с констатированным рецидивом проведена терапия по программе лечения рецидива ОМЛ
Да/Нет
Список литературы
1. Савченко В.Г., Паровичникова Е.Н. Острые лейкозы // Клиническая онкогематология: руководство для врачей. Под ред. Волковой М.А. 2-е изд., перераб. и доп. 2007. P. 409 - 502.
2. Паровичникова Е.Н. et al. Клинический протокол ОМЛ-01.10 по лечению острых миелоидных лейкозов взрослых // Программное лечение заболеваний крови, под ред. Савченко В.Г. М.: Практика, 2012. P. 153 - 207.
3. Shallis R.M. et al. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges. // Blood Rev. 2019. Vol. 36. P. 70 - 87.
4. Arber D.A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia // Blood. American Society of Hematology, 2016. Vol. 127, N 20. P. 2391 - 2405.
5. Khoury J. D. et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms // Leukemia, 2022. Vol. 36. P. 1703 - 1719.
6. Grimwade D., Hills R.K. Independent prognostic factors for AML outcome. // Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2009. P. 385 - 395.
7. D hner H. et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel // Blood. 2017. Vol. 129, N 4. P. 424 - 447.
8. Pollyea D.A. et al. Acute Myeloid Leukemia, Version 3.2023, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2023 May;21(5):503-513. doi: 10.6004/jnccn.2023.0025.
9. D hner H. et al. Diagnosis and management of AML in adults: recommendations from an international expert panel on behalf of the ELN. Blood (2022) 140 (12): 1345 - 1377. doi.org/10.1182/blood.2022016867
10. Kulsoom B. et al. Clinical presentation of acute myeloid leukaemia - A decade-long institutional follow-up. // J. Pak. Med. Assoc. 2017. Vol. 67, N 12. P. 1837 - 1842.
11. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
12. Roila F. et al. Intra and interobserver variability in cancer patients' performance status assessed according to Karnofsky and ECOG scales // Ann. Oncol. Oxford University Press (OUP), 1991. Vol. 2, N 6. P. 437 - 439.
13. Wass M. et al. Value of different comorbidity indices for predicting outcome in patients with acute myeloid leukemia // PLoS One. 2016. Vol. 11, N 10. P. e0164587.
14. Mohammadi M. et al. The impact of comorbid disease history on all-cause and cancer-specific mortality in myeloid leukemia and myeloma - a Swedish population-based study. // BMC Cancer. 2015. Vol. 15. P. 850.
15. Agis H. et al. A comparative study on demographic, hematological, and cytogenetic findings and prognosis in acute myeloid leukemia with and without leukemia cutis. // Ann. Hematol. 2002. Vol. 81, N 2. P. 90 - 95.
16. Avni B. et al. Clinical implications of acute myeloid leukemia presenting as myeloid sarcoma. // Hematol. Oncol. 2012. Vol. 30, N 1. P. 34 - 40.
17. D hner H. et al. Diagnosis and management of acute myeloid leukemia in adults: Recommendations from an international expert panel, on behalf of the European LeukemiaNet // Blood. Blood, 2010. Vol. 115, N 3. P. 453 - 474.
18. Ku G.H. et al. Venous thromboembolism in patients with acute leukemia: Incidence, risk factors, and effect on survival // Blood. 2009. Vol. 113, N 17. P. 3911 - 3917.
19. Lahoti A. et al. Predictors and outcome of acute kidney injury in patients with acute myelogenous leukemia or high-risk myelodysplastic syndrome // Cancer. 2010. Vol. 116, N 17. P. 4063 - 4068.
20. Fang R.C., Aboulafia D.M. HIV infection and myelodysplastic syndrome/acute myeloid leukemia // HIV-Associated Hematological Malignancies. 2016. P. 133 - 144.
21. Freeman A.J. et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. // Hepatology. 2001. Vol. 34, N 4 Pt 1. P. 809 - 816.
22. Ribas A. et al. How important is hepatitis C virus (HCV)-infection in persons with acute leukemia? // Leuk. Res. 1997. Vol. 21, N 8. P. 785 - 788.
23. Rossi D. et al. Occult hepatitis B virus infection of peripheral blood mononuclear cells among  patients with chronic lymphocytic leukemia // Leuk. Lymphoma. 2009. Vol. 50, N 4. P. 604 - 611.
patients with chronic lymphocytic leukemia // Leuk. Lymphoma. 2009. Vol. 50, N 4. P. 604 - 611.
24. Chen CY, Huang SY, Cheng A, et al. High Risk of Hepatitis B Reactivation among Patients with Acute Myeloid Leukemia. PLoS One. 2015;10(5):e0126037.
25. Lam M.T. et al. Herpes simplex infection in acute myelogenous leukemia and other hematologic malignancies: a prospective study. // Cancer. 1981. Vol. 48, N 10. P. 2168 - 2171.
26. Bernson E. et al. Cytomegalovirus serostatus affects autoreactive NK cells and outcomes of IL2-based immunotherapy in acute myeloid leukemia // Cancer Immunol. Res. American Association for Cancer Research Inc., 2018. Vol. 6, N 9. P. 1110 - 1119.
27. Guan H. et al. Correlations between Epstein-Barr virus and acute leukemia // J. Med. Virol. John Wiley and Sons Inc., 2017. Vol. 89, N 8. P. 1453 - 1460.
28. Elmaagacli A.H., Koldehoff M. Cytomegalovirus replication reduces the relapse incidence in patients with acute myeloid leukemia // Blood. American Society of Hematology, 2016. Vol. 128, N 3. P. 456 - 459.
29. Averbuch D. et al. Targeted therapy against multi-resistant bacteria in leukemic and hematopoietic stem cell transplant recipients: Guidelines of the 4th European conference on Infections in Leukemia (ECIL-4, 2011) // Haematologica. Ferrata Storti Foundation, 2013. Vol. 98, N 12. P. 1836 - 1847.
30. Averbuch D. et al. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: Summary of the 2011 4th European Conference on Infections in Leukemia // Haematologica. Ferrata Storti Foundation, 2013. Vol. 98, N 12. P. 1826 - 1835.
31. Leahy M.F., Mukhtar S.A. From blood transfusion to patient blood management: a new paradigm for patient care and cost assessment of blood transfusion practice. // Intern. Med. J. 2012. Vol. 42, N 3. P. 332 - 338.
32. Olsen R.J. et al. Acute leukemia immunohistochemistry: a systematic diagnostic approach. // Arch. Pathol. Lab. Med. 2008. Vol. 132, N 3. P. 462 - 475.
33. Bene M.C. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). // Leukemia. 1995. Vol. 9, N 10. P. 1783 - 1786.
34. Ravandi F., Walter R.B., Freeman S.D. Evaluating measurable residual disease in acute myeloid leukemia. // Blood Adv. 2018. Vol. 2, N 11. P. 1356 - 1366.
35. Лобанова Т.И., Гальцева И.В., Паровичникова Е.Н. Исследование минимальной остаточной болезни у пациентов с острыми миелоидными лейкозами методом многоцветной проточной цитофлуориметрии (обзор литературы) // Онкогематология. 2018. Vol. 13, N 1. P. 83 - 102.
36. Лобанова Т.И. "Клиренс опухолевого клона у пациентов с разными молекулярно-генетическими вариантами острых миелоидных лейкозов": диссертация ... кандидата медицинских наук: 14.01.21. 2018. 166 p.
37. Del Principe M.I. et al. Involvement of central nervous system in adult patients with acute myeloid leukemia: Incidence and impact on outcome // Seminars in Hematology. W.B. Saunders, 2018. Vol. 55, N 4. P. 209 - 214.
38. Herrmann J. et al. Evaluation and management of patients with heart disease and cancer: Cardio-oncology // Mayo Clin. Proc. 2014. Vol. 89, N 9. P. 1287 - 1306.
39. Roberts A.S. et al. Extramedullary haematopoiesis: radiological imaging features // Clinical Radiology. 2016. Vol. 71, N 9. P. 807 - 814.
40. Fritz J. et al. Radiologic spectrum of extramedullary relapse of myelogenous leukemia in adults. // AJR. Am. J. Roentgenol. 2007. Vol. 189, N 1. P. 209 - 218.
41. Arrigan M. et al. Imaging findings in recurrent extramedullary leukaemias // Cancer Imaging. 2013. Vol. 13, N 1. P. 26 - 35.
42. Seegars M.B., Powell B.L., Howard D.S. Acute Myeloid Leukemia in Pregnancy // Blood. 2017. Vol. 130, N Suppl 1. P. 5035.
43. Woitek R. et al. Radiological staging in pregnant patients with cancer // ESMO Open. 2016. Vol. 1, N 1. P. e000017.
44. Bodey G.P., Kontoyiannis D., Keating M.J. Infections in Patients With Chronic Lymphocytic Leukemia // Chronic Lymphocytic Leukemia. Totowa, NJ: Humana Press, 2004. P. 343 - 359.
45. Клясова Г.А. et al. Возбудители сепсиса у иммунокомпрометированных больных: структура и проблемы антибиотикорезистентности (результаты многоцентрового исследования) // Гематология и трансфузиология. 2007. Vol. 52, N 1. P. 11 - 18.
46. Cornelissen J.J. et al. The European LeukemiaNet AML Working Party consensus statement on allogeneic HSCT for patients with AML in remission: An integrated-risk adapted approach // Nature Reviews Clinical Oncology. 2012. Vol. 9, N 10. P. 579 - 590.
47. Сопроводительная терапия при лечении заболеваний системы крови. Практическое руководство / под ред. Е.Н. Паровичниковой, Г.М. Галстяна. М.: Практика, 2024. 512 с.
48. Bertoli S. et al. Time from diagnosis to intensive chemotherapy initiation does not adversely impact the outcome of patients with acute myeloid leukemia. // Blood. 2013. Vol. 121, N 14. P. 2618 - 2626.
49. Sekeres M.A. et al. Time from diagnosis to treatment initiation predicts survival in younger, but not older, acute myeloid leukemia patients // Blood. 2009. Vol. 113, N 1. P. 28 - 36.
50. Petti M.C. et al. High-dose hydroxyurea in the treatment of poor-risk myeloid leukemias // Ann. Hematol. 2003. Vol. 82, N 8. P. 476 - 480.
51. Kimby E., Nygren P., Glimelius B. A Systematic Overview of Chemotherapy Effects in Acute Myeloid Leukaemia // Acta Oncol. (Madr). 2001. Vol. 40, N 3. P. 231 - 252.
52. Wang J. et al. Meta-Analysis of Randomised Clinical Trials Comparing Idarubicin + Cytarabine with Daunorubicin + Cytarabine as the Induction Chemotherapy in Patients with Newly Diagnosed Acute Myeloid Leukaemia // PLoS One. 2013. Vol. 8, N 4. P. e60699.
53. Burnett A.K. et al. A randomized comparison of daunorubicin 90 mg/m2 vs 60 mg/m2in AML induction: Results from the UK NCRI AML17 trial in 1206 patients // Blood. 2015. Vol. 125, N 25. P. 3878 - 3885.
54. Hills RK, Castaigne S, Appelbaum FR et al: Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia: a meta-analysis of inpidual patient data from randomised controlled trials. Lancet Oncol 15:986-996, 2014. DOI:10.1016/S1470-2045(14) 70281-5.
55. Lambert J, Pautas C, Terr C et al.: Gemtuzumab ozogamicin for de novo acute myeloid leukemia: final efficacy and safety updates from the open-label, phase 3 ALFA-0701 trial. Haematologica 104:113-119, 2019, DOI:10.3324/haematol.2018.188888
56. National Comprehensive Cancer Network (NCCN) Guidelines. 2-2022. [Electronic resource]. URL: https://www.nccn.org/professionals/physician_gls/pdf/aml.pdf
57. Wu D. et al. Efficacy and safety of different doses of cytarabine in consolidation therapy for adult acute myeloid leukemia patients: A network meta-analysis // Sci. Rep. 2017. Vol. 7, N 1. P. 9509.
58. Paciucci PA, Dutcher JP, Cuttner J, et al (1987) Mitoxantrone and ara-C in previously treated patients with acute myelogenous leukemia. Leukemia 1: 565 - 567.
59. Rodriguez-Morales A, Lopez JL, Sanchez P, et al (1991) Mitoxantrone (MTZ) and ARA-C high remission rate as first line therapy for acute myeloid leukemia (AML). Haematologica 76 [Suppl 4]: 127a.
60. Lambert J. et al. Gemtuzumab ozogamicin for de novo acute myeloid leukemia: final efficacy and safety updates from the open-label, phase III ALFA-0701 trial. Haematologica. 2019 Jan;104(1):113-119.
61. Bashir Y. et al. Role of low dose cytarabine in elderly patients with acute myeloid leukemia: An experience // South Asian J. Cancer. Medknow, 2015. Vol. 4, N 1. P. 4.
62. Fong B., Van Bendegon J.M. Lumbar puncture. Neurologic and neurosurgical procedures // Rechman, E.F., Simon, R.R., eds. Emergency Medicine Procedures. New York: McGraw-Hill, 2004. P. 859 - 880.
63. Ye X.-N. et al. Epigenetic priming with decitabine followed by low-dose idarubicin/cytarabine has an increased anti-leukemic effect compared to traditional chemotherapy in high-risk myeloid neoplasms. // Leuk. Lymphoma. 2016. Vol. 57, N 6. P. 1311 - 1318.
64. Wei A.H. et al. Venetoclax Combined With Low-Dose Cytarabine for Previously Untreated Patients With Acute Myeloid Leukemia: Results From a Phase Ib/II Study. // J. Clin. Oncol. 2019. Vol. 37, N 15. P. 1277 - 1284.
65. Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под ред. Е.Н. Паровичниковой. Том 1. - М.: Практика, 2024. - 928 с.
66. Кохно А.В. и соавт. Эффективность низкодозной терапии с гипометилирующим праймингом у больных МДС с избытком бластов (мдс-иб) и ОМЛ с изменениями, связанными с миелодисплазией (омл-мд) // Гематология и трансфузиология. 2020. NS1.
67. Pratz K. et al. Long-term follow-up of VIALE-A: Venetoclax and azacitidine in chemotherapy-ineligible untreated acute myeloid leukemia. Am J Hematol. 2024 Apr;99(4):615-624.
68. Dillon R. et al. Venetoclax combined with low dose cytarabine compared to standard of care intensive chemotherapy for the treatment of favourable risk adult acute myeloid leukaemia (VICTOR): Study protocol for an international, open-label, multicentre, molecularly-guided randomised, phase II trial. BMC Cancer 22, 1174 (2022).
69. DiNardo C.D. et al. Venetoclax combined with decitabine or azacitidine in treatment-naive, elderly patients with acute myeloid leukemia. // Blood. 2019. Vol. 133, N 1. P. 7 - 17.
70. Stone R.M. et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation // N. Engl. J. Med. 2017. Vol. 377, N 5. P. 454 - 464.
71. DiNardo CD et al. 10-day decitabine with venetoclax for newly diagnosed intensive chemotherapy ineligible, and relapsed or refractory acute myeloid leukaemia: a single-centre, phase 2 trial. Lancet Haematol. 2020 Oct;7(10):e724-e736.
72. R llig C. et al. Addition of sorafenib versus placebo to standard therapy in patients aged 60 years or younger with newly diagnosed acute myeloid leukaemia (SORAML): A multicentre, phase 2, randomised controlled trial // Lancet Oncol. 2015. Vol. 16, N 16. P. 1691 - 1699.
73. Buchner T. et al. Long-term results in patients with acute myeloid leukemia (AML): The influence of high-dose AraC, G-CSF priming, autologous transplantation, prolonged maintenance, age, history, cytogenetics, and mutation status. Data of the AMLCG 1999 trial // Blood. 2009. Vol. 114, N 22. P. Abstract 485.
74. Соколов А.Н. et al. Долгосрочные результаты лечения острых миелоидных лейкозов у взрослых в многоцентровом клиническом исследовании ОМЛ 06.06 // Клиническая онкогематология. 2012. Vol. 5, N 1. P. 30 - 38.
75. Koreth J. et al. Allogeneic stem cell transplantation for acute myeloid leukemia in first complete remission: Systematic review and meta-analysis of prospective clinical trials // JAMA - J. Am. Med. Assoc. 2009. Vol. 301, N 22. P. 2349 - 2361.
76. Godley L.A., Larson R.A. Therapy-Related Myeloid Leukemia // Semin. Oncol. 2008. Vol. 35, N 4. P. 418 - 429.
77. Fenaux P. et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study // Lancet Oncol. 2009. Vol. 10, N 3. P. 223 - 232.
78. Craddock C. et al. Clinical activity of azacitidine in patients who relapse after allogeneic stem cell transplantation for acute myeloid leukemia // Haematologica. 2016. Vol. 101, N 7. P. 879 - 883.
79. Aldoss I. et al. Efficacy of the combination of venetoclax and hypomethylating agents in relapsed/refractory acute myeloid leukemia // Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, N 9. P. e404 - e407.
80. Min CK, Kim DW, Lee JW, Min WS, Kim CC. Additional stem cell therapy for graft failure after allogeneic bone marrow transplantation. Acta Haematologica. 2000;104(4):185-92.
81. Rowe J.M. et al. A phase 3 study of three induction regimens and of priming with GM-CSF in older adults with acute myeloid leukemia: a trial by the Eastern Cooperative Oncology Group. // Blood. 2004. Vol. 103, N 2. P. 479 - 485.
82. Pophali P., Litzow M. What Is the Best Daunorubicin Dose and Schedule for Acute Myeloid Leukemia Induction? // Current Treatment Options in Oncology. 2017. Vol. 18, N 1. P. 3.
83. Medeiros B.C. et al. Randomized study of continuous high-dose Lenalidomide, sequential Azacitidine and Lenalidomide, or azacitidine in persons 65 years and over with newly-diagnosed acute myeloid leukemia // Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, N 1. P. 101 - 106.
84. He P.-F.F. et al. Efficacy and safety of decitabine in treatment of elderly patients with acute myeloid leukemia: A systematic review and meta-analysis // Oncotarget. Impact Journals LLC, 2017. Vol. 8, N 25. P. 41498 - 41507.
85. Burnett A.K. et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. // Cancer. 2007. Vol. 109, N 6. P. 1114 - 1124.
86. Cortes J.E. et al. Randomized comparison of low dose cytarabine with or without glasdegib in patients with newly diagnosed acute myeloid leukemia or high-risk myelodysplastic syndrome // Leukemia. Nature Publishing Group, 2019. Vol. 33, N 2. P. 379 - 389.
87. Bell J.A. et al. Effectiveness and Safety of Therapeutic Regimens for Elderly Patients With Acute Myeloid Leukemia: A Systematic Literature Review // Clin. Lymphoma, Myeloma Leuk. 2018. Vol. 18, N 7. P. e303 - e314.
88. Giles F. et al. Validation of the European Prognostic Index for younger adult patients with acute myeloid leukaemia in first relapse // Br. J. Haematol. Blackwell Publishing Ltd, 2006. Vol. 134, N 1. P. 58 - 60.
89. Thol F. et al. How I treat refractory and early relapsed acute myeloid leukemia // Blood. 2015. Vol. 126, N 3. P. 319 - 327.
90. Pastore D. et al. FLAG-IDA in the treatment of refractory/relapsed acute myeloid leukemia: Single-center experience // Ann. Hematol. 2003. Vol. 82, N 4. P. 231 - 235.
91. Hiddemann W. et al. High-dose cytosine arabinoside and mitoxantrone (Ham) for the treatment of refractory acute lymphoblastic leukemia // Oncol. Res. Treat. 1987. Vol. 10, N 1. P. 11 - 12.
92. Herzig R. et al. High-dose cytosine arabinoside therapy with and without anthracycline antibiotics for remission reinduction of acute nonlymphoblastic leukemia. J Clin Oncol. 1985 Jul;3(7):992-7.
93. Marconi G. et al. MEC (mitoxantrone, etoposide, and cytarabine) induces complete remission and is an effective bridge to transplant in acute myeloid leukemia. Eur J Haematol. 2020 Jul;105(1):47-55.
94. Zhou X. et al. Epigenetic priming with decitabine followed by low dose idarubicin and cytarabine in acute myeloid leukemia evolving from myelodysplastic syndromes and higher-risk myelodysplastic syndromes: a prospective multicenter single-arm trial. Hematol Oncol. 2020 Oct;38(4):531-540.
95. Craddock C. et al. Factors predicting outcome after unrelated donor stem cell transplantation in primary refractory acute myeloid leukaemia // Leukemia. 2011. Vol. 25, N 5. P. 808 - 813.
96. Galtier J. et al. Intermediate-dose cytarabine or standard-dose cytarabine plus single-dose anthracycline as post-remission therapy in older patients with acute myeloid leukemia: impact on health care resource consumption and outcomes. Blood Cancer J. 2021 Nov 13;11(11):180.
97. Ye L. et al. Intermediate dose cytarabine improves survival and relapse-free rate compared with standard-dose cytarabine as post-remission treatment for acute myeloid leukemia: A retrospection study. Medicine (Baltimore). 2021 Jan 22;100(3):e24273.
98. National Comprehensive Cancer Network (NCCN) Guidelines: Acute Myeloid Leukemia. Version 3.2024 - May 17, 2024. [Electronic resource]. URL: https://www.nccn.org/professionals/physician_gls/pdf/aml.pdf
99. Fopp M. et al. Post-remission therapy of adult acute myeloid leukaemia: one cycle of high-dose versus standard-dose cytarabine. Leukaemia Project Group of the Swiss Group for Clinical Cancer Research (SAKK). // Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 1997. Vol. 8, N 3. P. 251 - 257.
100. Hsu H.C. et al. Post-remission intensive consolidation with high-dose cytarabine-based chemotherapy and granulocyte colony-stimulatory factor in adults with acute myelogenous leukemia: a preliminary report. // Zhonghua Yi Xue Za Zhi (Taipei). 1995. Vol. 56, N 5. P. 305 - 311.
101. Frazer J. et al. Characteristics predicting outcomes of allogeneic Stem-Cell transplantation in relapsed acute myelogenous leukemia // Curr. Oncol. 2017. Vol. 24, N 2. P. e123 - e130.
102. Cruijsen M. et al. Clinical Results of Hypomethylating Agents in AML Treatment // J. Clin. Med. 2014. Vol. 4, N 1. P. 1 - 17.
103. Serve H. et al. Sorafenib in combination with intensive chemotherapy in elderly patients with acute myeloid leukemia: Results from a randomized, placebo-controlled trial // J. Clin. Oncol. American Society of Clinical Oncology, 2013. Vol. 31, N 25. P. 3110 - 3118.
104. Sasaki K, Kantarjian HM, Kadia T, et al. Sorafenib plus intensive chemotherapy improves survival in patients with newly diagnosed, FLT3-internal tandem duplication mutation-positive acute myeloid leukemia. Cancer. 2019;125(21):3755-3766.
105. Guenounou S, Delabesse E,  C. Sorafenib plus all-trans retinoic acid for AML patients with FLT3-ITD and NPM1 mutations. Eur J Haematol. 2014;93(6):533-536.
C. Sorafenib plus all-trans retinoic acid for AML patients with FLT3-ITD and NPM1 mutations. Eur J Haematol. 2014;93(6):533-536.
106. Boissel N. et al. Dasatinib in high-risk core binding factor acute myeloid leukemia in first complete remission: A french acute myeloid leukemia intergroup trial // Haematologica. Ferrata Storti Foundation, 2015. Vol. 100, N 6. P. 780 - 785.
107. Трансплантация аллогенных гемопоэтических стволовых клеток. Практическое руководство. Под ред. Е.Н. Паровичниковой, Т.В. Гапоновой, М.Ю. Дрокова. - М.: Практика, 2024. с. 619 - 643 с.
108. Rautenberg C. et al. Relapse of acute myeloid leukemia after allogeneic stem cell transplantation: Prevention, detection, and treatment // International Journal of Molecular Sciences. 2019. Vol. 20, N 1. P. 228.
109. Mamez A.C. et al. Pre-treatment with oral hydroxyurea prior to intensive chemotherapy improves early survival of patients with high hyperleukocytosis in acute myeloid leukemia. // Leuk. Lymphoma. 2016. Vol. 57, N 10. P. 2281 - 2288.
110. Bakst R.L. et al. How I treat extramedullary acute myeloid leukemia // Blood. 2011. Vol. 118, N 14. P. 3785 - 3793.
111. Chang A., Patel S. Treatment of Acute Myeloid Leukemia During Pregnancy // Annals of Pharmacotherapy. 2015. Vol. 49, N 1. P. 48 - 68.
112. Nakajima Y. et al. Acute leukemia during pregnancy: an investigative survey of the past 11 years // Int. J. Lab. Hematol. 2015. Vol. 37, N 2. P. 174 - 180.
113. Rolbin S.H. et al. Epidural anesthesia in pregnant patients with low platelet counts. // Obstet. Gynecol. 1988. Vol. 71, N 6 Pt 1. P. 918 - 920.
114. Salem M.N., Abbas A.M., Ashry M. Dexamethasone for the prevention of neonatal respiratory morbidity before elective cesarean section at term // Proc. Obstet. Gynecol. 2016. Vol. 6, N 3. P. 1 - 10.
115.  J. et al. Chemotherapy-induced nausea and vomiting in acute leukemia and stem cell transplant patients: results of a multicenter, observational study. // Haematologica. 2006. Vol. 91, N 1. P. 84 - 91.
J. et al. Chemotherapy-induced nausea and vomiting in acute leukemia and stem cell transplant patients: results of a multicenter, observational study. // Haematologica. 2006. Vol. 91, N 1. P. 84 - 91.
116. Kang K.-W. et al. Impact of G-CSF for Outcomes of Non-M3 AML Patients Who Were Treated By Anthracycline-Based Induction (7 + 3 regimen) Chemotherapies // Blood. 2015. Vol. 126, N 23. P. 4889 - 4889.
117. Delforge M. et al. Recommended indications for the administration of polyclonal immunoglobulin preparations // Acta Clin. Belg. 2011. Vol. 66, N 5. P. 346 - 360.
118. Anderson D. et al. Guidelines on the use of intravenous immune globulin for hematologic conditions. // Transfus. Med. Rev. 2007. Vol. 21, N 2 Suppl 1. P. S9 - 56.
119. Blumberg N. et al. Platelet transfusion and survival in adults with acute leukemia // Leukemia. Nature Publishing Group, 2008. Vol. 22, N 3. P. 631 - 635.
120. Delaflor-Weiss E., Mintz P.D. The evaluation and management of platelet refractoriness and alloimmunization // Transfus. Med. Rev. 2000. Vol. 14, N 2. P. 180 - 196.
121. DeZern A.E. et al. Red blood cell transfusion triggers in acute leukemia: a randomized pilot study // Transfusion. 2016. Vol. 56, N 7. P. 1750 - 1757.
122. Szczepiorkowski Z.M., Dunbar N.M. Transfusion guidelines: when to transfuse. // Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2013. Vol. 2013. P. 638 - 644.
123. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies. // Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
124. Пантелеев М.А. et al. Практическая коагулология. 2010. 192 p.
125. Чернуха Г.Е. Аномальные маточные кровотечения репродуктивного периода // Гинекология: национальное руководство. Краткое издание. Под ред. Г.М. Савельевой. Г.Т. Сухих, В.Н. Серова, В.Е. Радзинского, И.Б. Манухина. М.: ГЭОТАР-Медиа, 2020. P. 170 - 175.
126. Доброхотова Ю.Э. et al. Аномальные маточные кровотечения: алгоритмы ведения, методы терапии // РМЖ. Мать и дитя. 2020. Vol. 3, N 1. P. 55 - 60.
127. Мамонов В.Е. Неотложная нейрохирургия внутричерепных кровоизлияний у пациентов гематологического стационара // Гематология и трансфузиология. 2020. Vol. 65, N S1. P. 174 - 175.
128. Сопроводительная терапия при лечении заболеваний системы крови. Практическое руководство. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. - 512 с. стр. 145 - 173.
129. Annibali O. et al. Incidence of venous thromboembolism and use of anticoagulation in hematological malignancies: Critical review of the literature // Critical Reviews in Oncology/Hematology. Elsevier Ireland Ltd, 2018. Vol. 124. P. 41 - 50.
130. Falanga A., Marchetti M., Russo L. Venous thromboembolism in the hematologic malignancies // Current Opinion in Oncology. Curr Opin Oncol, 2012. Vol. 24, N 6. P. 702 - 710.
131. Воробьев А.И. et al. Гиперкоагуляционный синдром: классификация, патогенез, диагностика, терапия // Гематология и трансфузиология. 2016. Vol. 61, N 3. P. 116 - 122.
132. Greenberg C.S. The role of D-dimer testing in clinical hematology and oncology // Clin. Adv. Hematol. Oncol. 2017. Vol. 15, N 8. P. 580 - 583.
133. Weitz I.C. et al. Chemotherapy-induced activation of hemostasis: effect of a low molecular weight heparin (dalteparin sodium) on plasma markers of hemostatic activation // Thromb. Haemost. 2002. Vol. 88, N 2. P. 213 - 220.
134. Sharifi M. et al. New oral anticoagulants in the treatment of heparin - Induced thrombocytopenia // Thromb. Res. Elsevier Ltd, 2015. Vol. 135, N 4. P. 607 - 609.
135. Гендлин Г.Е. et al. Современный взгляд на кардиотоксичность химиотерапии онкологических заболеваний, включающей антрациклиновые антибиотики. // Российский кардиологический журнал. 2017. Vol. 143, N 3. P. 145 - 154.
136. Васюк Ю.А. et al. Возможности современных эхокардиографических технологий в ранней диагностике кардиотоксического действия химиотерапевтических препаратов антрациклинового ряда у онкологических больных. // Кардиология. 2017. Vol. 57, N S4. P. 31 - 17.
137. Zamorano J.L. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines // European Heart Journal. Oxford University Press, 2016. Vol. 37, N 36. P. 2768 - 2801.
138. Larsen C.M., Mulvagh S.L. Cardio-oncology: What you need to know now for clinical practice and echocardiography // Echo Research and Practice. BioScientifica Ltd., 2017. Vol. 4, N 1. P. R33 - R41.
139. Сопроводительная терапия при лечении заболеваний системы крови. Практическое руководство. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. - 512 с. стр. 247 - 262.
140. Narum S., Westergren T., Klemp M. Corticosteroids and risk of gastrointestinal bleeding: A systematic review and meta-analysis // BMJ Open. BMJ Publishing Group, 2014. Vol. 4, N 5.
141. Conn H.O., Poynard T. Corticosteroids and peptic ulcer: meta-analysis of adverse events during steroid therapy. // J. Intern. Med. J Intern Med, 1994. Vol. 236, N 6. P. 619 - 632.
142. Burget D.W., Chiverton S.G., Hunt R.H. Is there an optimal degree of acid suppression for healing of duodenal ulcers? A model of the relationship between ulcer healing and acid suppression // Gastroenterology. Gastroenterology, 1990. Vol. 99, N 2. P. 345 - 351.
143. Ивашкин В.Т. et al. Диагностика и лечение язвенной болезни у взрослых (Клинические рекомендации Российской гастроэнтерологической ассоциации, Российского общества колоректальных хирургов и Российского эндоскопического общества). // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2020. Vol. 30, N 1. P. 49 - 70.
144. Scally B. et al. Effects of gastroprotectant drugs for the prevention and treatment of peptic ulcer disease and its complications: a meta-analysis of randomised trials // Lancet Gastroenterol. Hepatol. Elsevier Ltd, 2018. Vol. 3, N 4. P. 231 - 241.
145. Hu Z.-H. et al. Efficacy of proton pump inhibitors for patients with duodenal ulcers: A pairwise and network meta-analysis of randomized controlled trials // Saudi J. Gastroenterol. Medknow Publications, 2017. Vol. 23, N 1. P. 11.
146. Poynard T., Lemaire M., Agostini H. Meta-analysis of randomized clinical trials comparing lansoprazole with ranitidine or famotidine in the treatment of acute duodenal ulcer // Eur. J. Gastroenterol. Hepatol. 1995. Vol. 7, N 7. P. 661 - 665.
147. Сопроводительная терапия при лечении заболеваний системы крови. Практическое руководство. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. - 512 с. стр. 293 - 310.
148. Охмат В.А. et al. Спектр и этиология инфекционных осложнений у больных острыми миелоидными лейкозами на этапах индукции и консолидации ремиссии // Гематология и трансфузиология. 2017. Vol. 62, N 1. P. 9 - 15.
149. Охмат В.А. et al. Инфекционные осложнения у взрослых больных острыми лимфобластными лейкозами на разных этапах химиотерапии по протоколу ОЛЛ-2009. // Онкогематология. 2017. Vol. 12, N 3. P. 31 - 40.
150. Клясова Г.А., Охмат В.А. Антимикробная терапия // Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Под редакцией Савченко В.Г. Москва: Практика, 2018. P. 1067 - 1114.
151. Maertens J. et al. European guidelines for antifungal management in leukemia and hematopoietic stem cell transplant recipients: Summary of the ECIL 32009 update // Bone Marrow Transplant. Nature Publishing Group, 2011. Vol. 46, N 5. P. 709 - 718.
152. Kollef M.H. et al. Ceftolozane-tazobactam versus meropenem for treatment of nosocomial pneumonia (ASPECT-NP): a randomised, controlled, double-blind, phase 3, non-inferiority trial // Lancet Infect. Dis. Lancet Publishing Group, 2019. Vol. 19, N 12. P. 1299 - 1311.
153. Debast S.B. et al. European society of clinical microbiology and infectious diseases: Update of the treatment guidance document for Clostridium difficile infection // Clin. Microbiol. Infect. Blackwell Publishing Ltd, 2014. Vol. 20, N S2. P. 1 - 26.
154. Styczynski J. et al. Management of HSV, VZV and EBV infections in patients with hematological malignancies and after SCT: Guidelines from the Second European Conference on Infections in Leukemia // Bone Marrow Transplant. Bone Marrow Transplant, 2009. Vol. 43, N 10. P. 757 - 770.
155. Ljungman P. et al. Management of CMV, HHV-6, HHV-7 and Kaposi-sarcoma herpesvirus (HHV-8) infections in patients with hematological malignancies and after SCT // Bone Marrow Transplant. Bone Marrow Transplant, 2008. Vol. 42, N 4. P. 227 - 240.
156. Arendrup M.C. et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of rare invasive yeast infections // Clin. Microbiol. Infect. Blackwell Publishing Ltd, 2014. Vol. 20, N S3. P. 76 - 98.
157. Tissot F. et al. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients // Haematologica. Ferrata Storti Foundation, 2017. Vol. 102, N 3. P. 433 - 444.
158. Мальчикова А.О., Клясова Г.А. Формирование биопленок у изолятов Candida spp, выделенных из гемокультуры от больных с опухолями системы крови // Клиническая микробиология и антимикробная химиотерапия. 2018. Vol. 20, N 2. P. 126 - 130.
159. Ullmann A.J. et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline // Clin. Microbiol. Infect. Elsevier B.V., 2018. Vol. 24. P. e1 - e38.
160. Cornely O.A. et al. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium // The Lancet Infectious Diseases. Lancet Publishing Group, 2019. Vol. 19, N 12. P. e405 - e421.
161. Tortorano A.M. et al. ESCMID and ECMM joint guidelines on diagnosis and management of hyalohyphomycosis: Fusarium spp., Scedosporium spp. and others // Clin. Microbiol. Infect. Blackwell Publishing Ltd, 2014. Vol. 20, N S3. P. 27 - 46.
162. Maschmeyer G. et al. ECIL guidelines for treatment of Pneumocystis jirovecii pneumonia in non-HIV-infected haematology patients // J. Antimicrob. Chemother. J Antimicrob Chemother, 2016. Vol. 71, N 9. P. 2405 - 2413.
163. Maertens J. et al. ECIL guidelines for preventing Pneumocystis jirovecii pneumonia in patients with haematological malignancies and stem cell transplant recipients // Journal of Antimicrobial Chemotherapy. Oxford University Press, 2016. Vol. 71, N 9. P. 1 - 8.
164. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278 - 288.
165. Когония Л.М. et al. Практические рекомендации по лечению хронического болевого синдрома у онкологических больных. // Злокачественные опухоли: Практические рекомендации RUSSCO. 2018. P. 617 - 635.
166. Fallon M. et al. Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines. // Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2018. Vol. 29, N Suppl 4. P. iv166 - iv191.
167. Авыдов О.С. et al. Невропатическая боль: клинические рекомендации по диагностике и лечению Российского общества по изучению боли // Российский журнал боли. 2018. Vol. 4. P. 5 - 40.
168. Baer M.R. et al. Cytarabine, Daunorubicin and Etoposide (ADE) Chemotherapy in Acute Myeloid Leukemia (AML) Patients ![]() 60 Years (CALGB 9720). // Blood. American Society of Hematology, 2007. Vol. 110, N 11. P. 296 - 296.
60 Years (CALGB 9720). // Blood. American Society of Hematology, 2007. Vol. 110, N 11. P. 296 - 296.
169. Сопроводительная терапия при лечении заболеваний системы крови. Практическое руководство. Под ред. Е.Н. Паровичниковой и Г.М. Галстяна. - М.: Практика, 2024. - 512 с. стр. 235 - 246.
170. Hann IM, Stevens RF, Goldstone AH, et al. Randomized comparison of DAT versus ADE as induction chemotherapy in children and younger adults with acute myeloid leukemia. Results of the Medical Research Council"s 10th AML trial (MRC AML10). Adult and Childhood Leukaemia Working Parties of the Medical Research Council. Blood. 1997;89(7):2311-2318.
171. Holowiecki, J. et al. (1997). Idarubicin, Cytarabine, Etoposide Versus Risk-Adjusted Daunorubicin Plus Cytosine Arabinoside for Induction Treatment of Acute Myeloid Leukemia: A Randomized Multicenter Trial. In: B chner, T., Schellong, G., Ritter, J., Creutzig, U., Hiddemann, W.,  , B. (eds) Acute Leukemias VI. Haematology and Blood Transfusion /
, B. (eds) Acute Leukemias VI. Haematology and Blood Transfusion /  und Bluttransfusion, vol 38. Springer, Berlin, Heidelberg.
und Bluttransfusion, vol 38. Springer, Berlin, Heidelberg.
172. Moore JO et al. Sequential multiagent chemotherapy is not superior to high-dose cytarabine alone as postremission intensification therapy for acute myeloid leukemia in adults under 60 years of age: Cancer and Leukemia Group B Study 9222. Blood. 2005 May 1;105(9):3420-7.
173. Fleischmann M, Jentzsch M, Brioli A, et al. Azacitidine in combination with shortened venetoclax treatment cycles in patients with acute myeloid leukemia. Ann Hematol. Published online October 25, 2024.
174. Kern W. et al. Superiority of high-dose over intermediate-dose cytosine arabinoside in the treatment of patients with high-risk acute myeloid leukemia: results of an age-adjusted prospective randomized comparison. Leukemia. 1998 Jul;12(7):1049-55.
175. Wei AH et al. Venetoclax plus LDAC for newly diagnosed AML ineligible for intensive chemotherapy: a phase 3 randomized placebo-controlled trial. Blood. 2020 Jun 11;135(24):2137-2145.
176. Perl AE et al. Selective inhibition of FLT3 by gilteritinib in relapsed or refractory acute myeloid leukaemia: a multicentre, first-in-human, open-label, phase 1 - 2 study. Lancet Oncol. 2017 Aug;18(8):1061-1075. Erratum in: Lancet Oncol. 2017 Dec;18(12):e711. Erratum in: Lancet Oncol. 2018 Jul;19(7):e335. Erratum in: Lancet Oncol. 2019 Jun;20(6):e293.
177. Perl A.E. et al. Gilteritinib or Chemotherapy for Relapsed or Refractory FLT3-Mutated AML // N Engl J Med. 2019. P. 1728 - 1740.
178. Short NJ et al. Azacitidine, Venetoclax, and Gilteritinib in Newly Diagnosed and Relapsed or Refractory FLT3-Mutated AML. J Clin Oncol. 2024 May 1;42(13):1499-1508.
179. Daver N. et al. Venetoclax Plus Gilteritinib for FLT3-Mutated Relapsed/Refractory Acute Myeloid Leukemia. J Clin Oncol. 2022 Dec 10;40(35):4048-4059.
180. Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под ред. Е.Н. Паровичниковой. Том 1. - М.: Практика, 2024. стр. 621 - 680.
181. Bazinet A. et al. Reduced dose azacitidine plus venetoclax as maintenance therapy in acute myeloid leukaemia following intensive or low-intensity induction: a single-centre, single-arm, phase 2 trial. Lancet Haematol. 2024 Apr;11(4):e287-e298.
182. Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под ред. Е.Н. Паровичниковой. Том 1. - М.: Практика, 2024. стр. 681 - 712.
183. Mark J. Levis et al., Gilteritinib as Post-Transplant Maintenance for AML With Internal Tandem Duplication Mutation of FLT3. JCO 42, 1766-1775(2024).
184. Chew S, Mackey MC, Jabbour E. Gilteritinib in the treatment of relapsed and refractory acute myeloid leukemia with a FLT3 mutation. Ther Adv Hematol. 2020 Jun 3;11:2040620720930614.
185. Троицкая В.В. et al. Протокол индукционной фазы лечения острых лейкозов, протекающих с гиперлейкоцитозом // Алгоритмы диагностики и протоколы лечения заболеваний системы крови. НМИЦ Гематологии. Под ред. В.Г. Савченко. Практика, 2018. P. 731 - 752.
186. Giammarco S. et al. Hyperleukocytosis and leukostasis: management of a medical emergency // Expert Review of Hematology. Taylor and Francis Ltd, 2017. Vol. 10, N 2. P. 147 - 154.
187. R llig C, Ehninger G. How I treat hyperleukocytosis in acute myeloid leukemia. Blood. 2015;125(21):3246-3252.
188. Mamez A.C. et al. Pre-treatment with oral hydroxyurea prior to intensive chemotherapy improves early survival of patients with high hyperleukocytosis in acute myeloid leukemia // Leuk. Lymphoma. Taylor and Francis Ltd, 2016. Vol. 57, N 10. P. 2281 - 2288.
189. Ganzel C. et al. Hyperleukocytosis, leukostasis and leukapheresis: Practice management // Blood Rev. Blood Rev, 2012. Vol. 26, N 3. P. 117 - 122.
190. SPIRIN M., GALSTYAN G., DROKOV M. Central venous access in lymphoma patients (pts) with superior vena cava syndrome (SVCS) // INTENSIVE CARE Med. Exp. 2019. Vol. 7, N Suppl. 3:001341. P. 388 - 389.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Аль-Ради Л.С., к.м.н., старший научный сотрудник клинико-диагностического отделения гематологии и химиотерапии с дневным стационаром ФГБУ "Национальный медицинский исследовательский центр гематологии" Минздрава России, член Национального гематологического общества.
2. Баранова О.Ю., к.м.н., старший научный сотрудник отделения трансплантации костного мозга ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, Москва, член Национального гематологического общества.
3. Бондаренко С.Н., к.м.н., руководитель отдела онкологии, гематологии и трансплантологии для подростков и взрослых НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова" Минздрава России, член Национального гематологического общества.
4. Гапонова Т.В., к.м.н., главный внештатный специалист-трансфузиолог Минздрава России, первый заместитель генерального директора ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
5. Кашлакова А.И., врач-гематолог отделения химиотерапии гемобластозов и депрессий кроветворения с блоком трансплантации костного мозга и гемопоэтических стволовых клеток, ФГБУ "Национальный медицинский исследовательский центр гематологии" Минздрава России, член Национального гематологического общества
6. Капланов К.Д., д.м.н., заведующий гематологическим отделением N 11 ГБУЗ ГКБ им. С.П. Боткина ДЗМ
7. Капорская Т.С., к.м.н., заведующая отделением гематологии ГБУЗ "Иркутская ордена "Знак Почета" областная клиническая больница", член Национального гематологического общества.
8. Клясова Г.А., д.м.н., профессор, заведующая лабораторией клинической бактериологии, микологии и антибиотической терапии ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
9. Константинова Т.С., к.м.н., ГБУЗ СО "Областной гематологический центр Свердловской областной клинической больницы N 1", член Национального гематологического общества.
10. Кузьмина Л.А., к.м.н., заведующая отделением интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным стационаром ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
11. Лапин В.А., к.м.н., заведующий отделением гематологии ГБУЗ ЯО "Областная клиническая больница", член Национального гематологического общества.
12. Лукьянова И.А., к.м.н., заведующий дневным стационаром онкологии и химиотерапии гемобластозов и депрессий кроветворения ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
13. Паровичникова Е.Н., д.м.н., главный внештатный специалист-гематолог Минздрава России, генеральный директор ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
14. Птушкин В.В., д.м.н., профессор, главный внештатный специалист-гематолог ДЗМ, заместитель главного врача по гематологии ГБУЗ ГКБ им. С.П. Боткина ДЗМ
15. Савченко В.Г., академик РАН, д.м.н., профессор
16. Самойлова О.С., к.м.н., заведующая отделением гематологии ГБУЗ НО "Нижегородская областная клиническая больница им. Н.А. Семашко", член Национального гематологического общества.
17. Семочкин С.В., д.м.н., профессор кафедры онкологии, гематологии и лучевой терапии ФГБОУ ВО "Российский национальный исследовательский медицинский университет им. Н.И. Пирогова" Минздрава России, член Национального гематологического общества.
18. Соколов А.Н., к.м.н., старший научный сотрудник отдела химиотерапии гемобластозов, депрессий кроветворения и трансплантации костного мозга ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
19. Троицкая В.В., д.м.н., первый заместитель генерального директора ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества.
- Блок по трансплантации аллогенных гемопоэтических стволовых клеток
20. Дроков М.Ю., к.м.н., руководитель сектора по изучению иммунных воздействий и осложнений после ТКМ ФГБУ "НМИЦ гематологии" Минздрава России
21. Васильева В.А., к.м.н., заведующая отделением иммунохимиотерапии с дневным стационаром для больных после ТКМ ФГБУ "НМИЦ гематологии" Минздрава России
22. Власова Ю.Ю., к.м.н., зав. отделением транспантации костного мозга для взрослых НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации
23. Зарицкий А.Ю., д.м.н, профессор
24. Зюзгин И.С., заведующий отделением гематологии и трансплантации костного мозга ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России
25. Кулагин А.Д., д.м.н., директор НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации,
26. Минаева Н.В., зам. директора по лечебной работе ФГБУН КНИИ ГПК ФМБА России
27. Моисеев И.С., д.м.н., зам. директора по науке НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации
28. Морозова Е.В., к.м.н., руководитель отдела гематологии, онкологии и трансплантации для взрослых НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации
29. Петрова Г.Д., к.м.н., заведующая отделением трансплантации костного мозга и гемопоэтических стволовых клеток отдела гематологии и трансплантации костного мозга ФГБУ "НМИЦ онкологии им Н.Н. Блохина" Минздрава России,
30. Попова М.О., к.м.н., доцент кафедры гематологии, трансфузиологии и трансплантологии ФПО ПСПбГМУ им. И.П. Павлова
31. Эстрина М.А., к.м.н., зав. отделением клинической трансфузиологии НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации
Конфликта интересов нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория клинических рекомендаций:
- врачи-гематологи;
- врачи-онкологи;
- врачи-терапевты;
- врачи-акушеры-гинекологи;
- врачи-анестезиологи-реаниматологи;
- клинические фармакологи.
Методология сбора доказательств. Методы, использованные для сбора/селекции доказательств:
- поиск публикаций в специализированных периодических печатных изданиях;
- поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств. Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MedLine. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных мета-анализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. 2 - 4).
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 4. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациентов, страдающих ОМЛ, но не чаще чем раз в 6 месяцев. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Приложение А3.1
ВАРИАНТЫ КУРСОВ ХИМИОТЕРАПИИ ПРИ ОМЛ
Таблица 1. Варианты курсов индукции и консолидации ремиссии ОМЛ
Программа индукции/консолидации
Препарат
7 + 3 (1)
[9, 17, 58]
Цитарабин** 100 мг/м2 в/в 2 раза в сутки в 1 - 7-й дни в комбинации с одним из следующих ЛП:
- Даунорубицин** 60 мг/м2 в/в 1 раз в день в 1 - 3-й дни или
- Митоксантрон** 10 мг/м2 в/в 1 раз в день в 1 - 3-й дни
или
- Идарубицин** 12 мг/м2 в/в 1 раз в день в 1 - 3-й дни
7 + 3 (2)
[9, 17, 58]
Цитарабин** 200 мг/м2 в/в круглосуточно в 1 - 7-й дни в комбинации с одним из следующих ЛП:
- Даунорубицин** 60 мг/м2 в/в 1 раз в день в 1 - 3-й дни,
или
- #Митоксантрон** 10 мг/м2 в/в 1 раз в день в 1 - 3-й дни,
или
- Идарубицин** 12 мг/м2 в/в 1 раз в день в 1 - 3-й дни
7 + 3 с мидостаурином**
[8, 9]
Цитарабин** 200 мг/м2 в/в круглосуточно в 1 - 7-й дни в комбинации с одним из следующих ЛП:
Даунорубицин** 60 мг/м2 в/в 1 раз в день в 1 - 3-й дни
или
Мидостаурин** 50 мг внутрь 2 раза в день с 8 по 21 дни
7 + 3 с гемтузумабом озогамицином
[54, 55, 60]
Цитарабин** 200 мг/м2 в/в круглосуточно в 1 - 7-й дни в комбинации с одним из следующих ЛП:
- Даунорубицин** 60 мг/м2 в/в 1 раз в день в 1 - 3-й дни или
- Гемтузумаб озогамицин 3 мг/м2 (максимально 1 флакон - 5 мг) в/в 1 раз в день в течение 2 часов в 1, 4, 7 дни курса
Альтернативная схема: Гемтузумаб озогамицин 3 мг/м2 (максимально 1 флакон - 5 мг) в/в в течение 2 часов в один из 4-х дней курса (день 1, или день 2, или день 3, или день 4)
ADE [170]
Цитарабин** 100 мг/м2 в/в 2 раза в сутки в 1 - 10-й дни
Даунорубицин** 50 мг/м2 в/в 1 раз в день в 1, 3, 5 дни
Этопозид** 100 мг/м2 в/в 1 раз в день в 1 - 5-й дни
ICE [171]
#Идарубицин** 10 мг/м2 в/в 1 раз в день в 1, 3, 5-й дни
Цитарабин** 100 мг/м2 в/в 24-часовая инфузия в 1 - 7-й дни
Этопозид** 100 мг/м2 в/в 1 раз в день в 1 - 5-й дни
FLAG-IDA [90]
#Филграстим** 5 мкг/кг п/к в 1 - 7-й дни
#Флударабин** 30 мг/м2 30-минутная инфузия во 2 - 6-й дни
Цитарабин** 2000 мг/м2 в/в 4-часовая инфузия через 4 ч после введения #флударабина** во 2 - 6-й дни
#Идарубицин** 10 мг/м2 в/в 1 раз в день в 4 - 6-й дни
Цитарабин** в высоких дозах [96, 172]
#Цитарабин** 1,5 - 3 г/м2 в/в каждые 12 ч в дни 1, 3, 5 или дни 1 - 3
Цитарабин** в высоких дозах
с мидостаурином** [98]
#Цитарабин** 1,5 - 3 г/м2 в/в каждые 12 ч в дни 1, 3, 5 или дни 1 - 3
Мидостаурин** 50 мг внутрь 2 раза в день с 8 по 21 дни
Цитарабин** в высоких дозах
с гемтузумабом озогамицином
[98]
#Цитарабин** 1,5 - 3 г/м2 в/в каждые 12 ч 1, 3, 5 дни или 1, 2, 3 дни
#Гемтузумаб озогамицин 3 мг/м2 (максимум 1 флакон 5 мг) в/в в 1-й день
#Цитарабин** в средних дозах [96, 98]
#Цитарабин** 1,0 - 1,5 г/м2 в/в каждые 12 ч 3 дня (1, 3, 5 или 1, 2, 3 дни) или
#Цитарабин** в средних дозах с мидостаурином [98]
#Цитарабин** 1,0 - 1,5 г/м2 в/в каждые 12 ч 3 дня (1, 3, 5 или 1, 2, 3 дни) или
Мидостаурин 50 мг внутрь 2 раза в день с 8 по 21 дни
FLAG [65]
#Флударабин** 25 мг/м2 30-минутная инфузия 1 раз в день в 1 - 5-й дни
#Цитарабин** 1500 мг/м2 в/в 3-часовая инфузия через 4 ч после введения #флударабина** 1 раз в день в 1 - 5-й дни
Филграстим** 5 мкг/кг п/к 1 раз в день, начиная с 8 дня до выхода из цитопении
FLAG с мидостаурином [65]
#Флударабин** 25 мг/м2 30-минутная инфузия 1 раз в день в 1 - 5-й дни
#Цитарабин** 1500 мг/м2 в/в 3-часовая инфузия через 4 ч после введения #флударабина** 1 раз в день в 1 - 5-й дни
Филграстим** 5 мкг/кг п/к 1 раз в день, начиная с 8 дня до выхода из цитопении
Мидостаурин 50 мг внутрь 2 раза в день с 6 по 19 дни
Азацитидин**
Азацитидин** 75 мг/м2 п/к 1 раз в день 7 дней, интервал 21 день
Децитабин [84]
Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 5 дни или #децитабин 20 мг/м2 в/в 1 раз в день, 1 - 10 дни
Dec-Ida-Ara-C [63]
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 3 дни
#Идарубицин** 3 мг/м2 в/в струйно 1 раз в день, 4 - 10 дни
#Цитарабин** 15 мг/м2 x 2р/сут, 4 - 17 дни, подкожно
Aza-Ida-Ara-C [65, 66]
#Азацитидин 75 мг/м2 п/к 1 раз в день, 1 - 3 дни
#Идарубицин** 3 мг/м2 в/в струйно 1 раз в день, 4 - 10 дни
#Цитарабин** 15 мг/м2 x 2р/сут, 4 - 17 дни, подкожно
Малые дозы #цитарабина** [65]
#Цитарабин** 10 мг/м2 п/к 2 раза в сутки 28 дней
#Венетоклакс** с азацитидином** [8]
Азацитидин** 75 мг/м2 7 дней п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1 день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с азацитидином** [67, 173]
Азацитидин** 75 мг/м2 7 дней, п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1 день, 200 мг во 2-й день, 400 мг внутрь в один прием в 3 - 7 дни
#Венетоклакс** с азацитидином** [67, 173]
Азацитидин** 75 мг/м2 7 дней, п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1 день, 200 мг во 2-й день, 400 мг внутрь в один прием в 3 - 14 дни
#Венетоклакс** с децитабином [8]
Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 5 дни
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с #децитабином [71]
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 10 дни
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с малыми дозами #цитарабина** [68]
#Цитарабин** 20 мг/м2 п/к 1 раз в сутки 10 дней (или 10 мг/м2 п/к 2 раза в сутки 10 дней)
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг 3 день, 600 мг внутрь в один прием 4 - 28 дни
Таблица 2. Варианты курсов терапии рефрактерных форм и рецидивов ОМЛ, используемые разными исследовательскими группами
Программа
Препарат
MidAC [174]
#Цитарабин** 1 г/м2 в/в 2 раза в день в 1, 2, 8 дни
#Митоксантрон** 10 мг/м2 в/в 1 раз в день в 3, 4, 10, 11 дни
НАМ (1) [65]
Цитарабин** 3 г/м2 в/в 2 раза в день в 1 - 3-й дни
#Митоксантрон** 10 мг/м2 в/в 1 раз в день в 3 - 5-й дни
FLAG-IDA [90, 98]
#Филграстим** 5 мкг/кг п/к в 1 - 7-й дни
#Флударабин** 30 мг/м2 30-минутная инфузия во 2 - 6-й дни
Цитарабин** 2000 мг/м2 в/в 4-часовая инфузия через 4 ч после введения #флударабина** во 2 - 6-й дни
#Идарубицин** 8 - 10 мг/м2 в/в 1 раз в день в 4 - 6-й дни
HAM (2) [91]
Цитарабин** 3 г/м2 в/в 3-часовая инфузия 2 раза в день в 1 - 4-й дни
#Митоксантрон** 10 мг/м2 в/в 1 раз в день в 2 - 6-й дни
IMA [72]
#Цитарабин** 1 г/м2 в/в 2-часовая инфузия 2 раза в дни в 1, 3, 5, 7
#Митоксантрон** 10 мг/м2 в/в 1 раз в день в 1 - 3-й дни
МЕС [93]
#Митоксантрон** 6 мг/м2 в/в болюсно 1 раз в день через 3 часа после окончания введения цитарабина** с 1 - 6-й дни
Этопозид** 100 мг/м2 в/в, 1 раз в день длительностью 1 час с 1 - 6-й дни
#Цитарабин 1000 мг/м2 в/в длительно в течение 6 часов через 1 час после введения этопозида** 1 раз в день в 1 - 6-й дни
Dec-Ida-Ara-C [63, 94]
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 3 дни
#Идарубицин** 6 мг/м2 в/в струйно 1 раз в день, 4 - 6 дни
#Цитарабин** 25 мг/м2 x 2 р/сут, 4 - 17 дни, подкожно
или
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 3 дни
#Идарубицин** 3 мг/м2 в/в струйно 1 раз в день через 24 часа после окончания введения децитабина, 5 - 7 дни
#Цитарабин** 30 мг/м2 x 2 р/сут, 7 - 14 дни, подкожно
Aza-Ida-Ara-C [66]
#Азацитидин** 75 мг/м2 п/к 1 раз в день, 1 - 3 дни
#Идарубицин** 3 мг/м2 в/в струйно 1 раз в день, 4 - 10 дни
#Цитарабин** 20 мг/м2 1 раз в день, 4 - 17 дни, подкожно
Малые дозы #цитарабина** [61]
#Цитарабин** 10 мг/м2 п/к 2 раза в день 28 дней
#Венетоклакс** с азацитидином** [69]
Азацитидин** 75 мг/м2 7 дней п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с децитабином [69]
Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 5 дни
#Венетоклакс** 400 мг внутрь в один прием, 1 - 28 дней
#Венетоклакс** с #децитабином [71]
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 10 дни
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с малыми дозами #цитарабина** [175, 98]
#Цитарабин** 20 мг/м2 п/к 1 раз в день, 10 дней
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг в 3-й день, 600 мг внутрь в один прием 4 - 28 дней
Гилтеритиниб [176, 177]
Гилтеритиниб 120 мг внутрь 1 раз в день 1 - 28 дни
Гилтеритиниб [176, 177]
Гилтеритиниб 200 мг внутрь 1 раз в день 1 - 28 дни
#Гилтеритиниб с азацитидином** и венетоклаксом** [178]
#Гилтеритиниб 80 мг внутрь 1 раз в день 1 - 28 дни
Азацитидин** 75 мг/м2 7 дней п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Гилтеритиниб с венетоклаксом** [179]
#Гилтеритиниб 80 мг внутрь 1 раз в день 1 - 28 дни
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
Таблица 3. Варианты курсов поддерживающего лечения
Программа
Препарат
5 + 6-МП [180]
#Цитарабин** 100 мг/м2 в/в 2 раза в день в 1 - 5-й дни или 50 - 100 мг/м2 п/к 2 раза в день в 1 - 5-й дни
#Меркаптопурин** 60 мг/м2 в сутки в 2 приема внутрь в 1 - 5-й дни
5 + 6-МП с мидостаурином** [65]
#Цитарабин** 100 мг/м2 в/в 2 раза в день в 1 - 5-й дни или 50 - 100 мг/м2 п/к 2 раза в день в 1 - 5-й дни
#Меркаптопурин** 60 мг/м2 в сутки в 2 приема внутрь в 1 - 5-й дни Мидостаурин** 50 мг 2 раза в день внутрь в один прием с 8 по 21 дни
Азацитидин**
Азацитидин** 75 мг/м2 7 дней, интервал 21 день
Децитабин [84]
Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 5 дни или #децитабин 20 мг/м2 в/в 1 раз в день 1 - 10 дни
Малые дозы #цитарабина** [61]
#Цитарабин** 10 мг/м2 п/к 2 раза в день 21 - 28 дней
#Венетоклакс** с азацитидином** [65, 181]
Азацитидин** 50 мг/м2 5 дней, п/к 1 раз в день, интервал 21 день
#Венетоклакс** 400 мг внутрь в один прием 1 - 7 дни
#Венетоклакс** с азацитидином** [65, 181]
Азацитидин** 50 мг/м2 5 дней, п/к 1 раз в день, интервал 21 день
#Венетоклакс** 400 мг внутрь в один прием 1 - 14 дни
#Венетоклакс** с децитабином [69]
Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 5 дни
#Венетоклакс** 400 мг внутрь в один прием 1 - 28 дней
Aza-Ara-C [182]
#Азацитидин 75 мг/м2 п/к 1 раз в день, 1 - 3 дни
#Цитарабин** 10 мг/м2 x 2 р/сут, 4 - 17 дни, подкожно
Dec-Ara-C [182]
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 3 дни
#Цитарабин** 10 мг/м2 x 2 р/сут, 4 - 17 дни, подкожно
Мидостаурин** [8]
Мидостаурин** 50 мг 2 раза в день в один прием с 1 по 28 дни
Гилтеритиниб [177, 183]
Гилтеритиниб 120 мг внутрь 1 раз в день 1 - 28 дни
Гилтеритиниб [177, 184]
Гилтеритиниб 200 мг внутрь 1 раз в день 1 - 28 дни
Таблица 4. Варианты неинтенсивных курсов индукции и консолидации ремисси для больных ОМЛ из старшей возрастной группы, либо для больных, не являющихся кандидатами на интенсивное лечение
Программа индукции/консолидации
Препарат
Азацитидин**
Азацитидин** 75 мг/м2 п/к 1 раз в день 7 дней, интервал 21 день
Децитабин [84]
Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 5 дни или #децитабин 20 мг/м2 в/в 1 раз в день, 1 - 10 дни
Dec-Ida-Ara-C [63]
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 3 дни
#Идарубицин** 3 мг/м2 в/в струйно 1 раз в день, 4 - 10 дни
#Цитарабин** 15 мг/м2 x 2р/сут, 4 - 17 дни, подкожно
Aza-Ida-Ara-C [65, 66]
#Азацитидин 75 мг/м2 п/к 1 раз в день, 1 - 3 дни
#Идарубицин** 3 мг/м2 в/в струйно 1 раз в день, 4 - 10 дни
#Цитарабин** 20 мг/м2 1 раз в день, 4 - 17 дни, подкожно
Малые дозы #цитарабина** [65]
#Цитарабин** 10 мг/м2 п/к 2 раза в сутки 28 дней
#Венетоклакс** с азацитидином** [8, 69]
Азацитидин** 75 мг/м2 7 дней п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с азацитидином** [274, 305]
Азацитидин** 75 мг/м2 7 дней, п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1 день, 200 мг во 2-й день, 400 мг внутрь в один прием в 3 - 7 дни
#Венетоклакс** с азацитидином** [67, 173]
Азацитидин** 75 мг/м2 7 дней, п/к 1 раз в день, интервал 21 день
#Венетоклакс** 100 мг в 1 день, 200 мг во 2-й день, 400 мг внутрь в один прием в 3 - 14 дни
#Венетоклакс** с децитабином [8]
Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 5 дни
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с #децитабином [71]
#Децитабин 20 мг/м2 в/в 1 раз в день, 1 - 10 дни
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг внутрь в один прием 3 - 28 дней
#Венетоклакс** с малыми дозами #цитарабина** [68]
#Цитарабин** 20 мг/м2 п/к 1 раз в сутки 10 дней (или 10 мг/м2 п/к 2 раза в сутки 10 дней)
#Венетоклакс** 100 мг в 1-й день, 200 мг во 2-й день, 400 мг 3 день, 600 мг внутрь в один прием 4 - 28 дни
Приложение А3.2
ПРОТОКОЛ ИНДУКЦИОННОЙ ФАЗЫ ЛЕЧЕНИЯ ОМЛ С ГИПЕРЛЕЙКОЦИТОЗОМ
Гиперлейкоцитоз при ОМЛ - это неотложное состояние, сопряженное с тяжелыми, опасными для жизни осложнениями и требующее экстренных специальных лечебных мероприятий.
Факторы, ассоциированные с гиперлейкоцитозом при ОМЛ, приведены в Таблице 1.
Таблица 1. Факторы, ассоциированные с гиперлейкоцитозом при ОМЛ
Возраст меньше 1 года
М4 И М5 вариант по FAB
Микрогранулярный вариант острого промиелоцитарного лейкоза М3v
Перестройка 11q23
inv(16)(p13q23)
Комплексный кариотип
Экспрессия белка легочной резистентности (LRP)
Алгоритм терапевтической тактики при индукции ремиссии ОМЛ, протекающего с гиперлейкоцитозом [185, 186].
- Химиотерапия осуществляется по протоколам, предусмотренным для конкретных вариантов заболевания, в соответствии с возрастом больного и иммунофенотипом/генотипом опухолевых клеток.
- Перед началом индукционной терапии обязательна установка центрального венозного катетера.
- С целью лечения гиперурикемии назначают аллопуринол** в дозах, согласно инструкции препарата [98, 187].
- С первого дня курса объем вводимой жидкости увеличивают до 1,5 - 2,0 л/м2 в сутки (соотношение растворов декстрозы** и натрия хлорида** 1:1). При большой опухолевой массе (в т.ч. органомегалии) объем вводимой жидкости (включая все переливаемые среды) может быть увеличен до 3 л/м2 со стимуляцией диуреза диуретиками, обязательным контролем диуреза и ЦВД.
Синдром лейкостазов диагностируют до начала химиотерапии у больных ОМЛ вне зависимости от количества лейкоцитов (он может проявляться и при количестве лейкоцитов менее 100 x 109/л), если выявляются загруженность, сонливость, невозможность сконцентрироваться, дыхательная недостаточность, тяжелые нарушения свертывания, тяжелый геморрагический синдром, не связанный напрямую с тромбоцитопенией, метаболические нарушения.
- При ОМЛ с существенным лейкоцитозом (свыше 70 x 109/л), необходимо назначение #гидрокарбамида** в дозе 50 - 75 мг/кг/сут (при необходимости доза может быть увеличена до 150 мг/кг/сут) [188].
Если вариант лейкоза еще не определен, можно рекомендовать назначение #гидроксикарбамида** в дозе 50 - 75 мг/кг/сут (в 3 - 4 приема) до момента диагностики варианта острого лейкоза (при подозрении на ОПЛ гидроксикарбамид** не показан). Курс химиотерапии возможно начинать при снижении лейкоцитоза до 50 - 70 x 109/л.
- Если имеются очевидные признаки лейкостазов (спутанное сознание, интерстициальное поражение легких за счет сосудистого компонента, одышка) наряду с обязательным приемом #гидроксикарбамида** на фоне волемической нагрузки необходимо проведение 1 - 2 сеансов лейкоцитафереза с целью быстрой редукции опухолевой массы [188, 189]
Если количество лейкоцитов больше 100 x 109/л, но менее 150 x 109/л и нет синдрома лейкостазов, то от процедуры лейкоцитафереза можно воздержаться. Если количество лейкоцитов у больных с острым миелобластным лейкозом превышает 150 x 109/л, то лейкоцитаферезы можно считать необходимой процедурой в сочетании со всеми остальными методами циторедукции и профилактики/лечения цитолитического синдрома.
- В случае уменьшения объема опухолевой массы на 30 - 40% после первого сеанса лейкоцитафереза (количества лейкоцитов менее 100 x 109/л) показано начало курса химиотерапии [190].
В план лечения обязательно включают выполнение плазмафереза в объеме 0,8 - 1,5 л после введения противоопухолевых препаратов. В указанной ситуации целесообразно сначала ввести цитарабин** и выполнить плазмаферез, а введение антрациклинов и родственных соединений отложить на дни 3 - 5 или 5 - 7, а первые два-три дня выполнять плазмаферезы в дни введения цитарабина**. Так как клиренс цитарабина** очень высок, то плазмаферез не повлияет на его концентрацию в плазме, в то же время плазмаферез может повлиять на концентрацию антрациклинов и родственных соединений, у которых период полувыведения достаточно длительный.
- На время проведения плазмафереза в случае постоянной инфузии цитарабина** введение препарата необходимо прерывать, а по окончанию процедуры возобновлять с пересчетом скорости введения препарата на оставшееся время в рамках 24-часовой инфузии.
В случае введения цитарабина** дважды в сутки процедура плазмафереза выполняется через 3 - 4 ч после введения препарата.
- Возможно выполнение плазмаферезов и при более низком количестве лейкоцитов, если на фоне введения противоопухолевых препаратов развивается синдром лизиса опухоли: высокая лихорадка, дыхательная недостаточность, признаки печеночной и почечной недостаточности, загруженность, нарушения сознания, усиление геморрагического синдрома и др.
- На фоне терапии гиперлейкоцитоза необходимо проводить следующие лабораторные и инструментальные исследования:
-- общий (клинический) анализ крови (на фоне терапии гиперлейкоцитоза - 2 раза в сутки);
-- коагулограмма (ориентировочное исследование системы гемостаза) - в первую неделю 1 - 2 раза в сутки;
-- анализ крови биохимический общетерапевтический (исследование уровня общего белка в крови, определение соотношения белковых фракций методом электрофореза, исследование уровня мочевины, креатинина, общего билирубина, натрия, калия, общего кальция, глюкозы в крови, определение активности аланинаминотрансферазы, аспартатаминотрансферазы в крови, исследование уровня общего магния в сыворотке крови) - ежедневно;
-- исследование кислотно-основного состояния и газов крови;
-- компьютерная томография органов грудной полости
-- компьютерная томография головного мозга
- Если на фоне терапии гиперлейкоцитоза и лизиса опухолевых клеток развивается острая почечная недостаточность, необходимо проводить гемодиализ до полного восстановления функции почек.
Гемодиализ не является противопоказанием к выполнению или завершению программной химиотерапии. Наличие гиперлейкоцитоза в дебюте острого лейкоза в большинстве случаев подразумевает наличие нейролейкемии, что требует увеличения количества сспинномозговых пункций с интратекальным введением стандартного набора препаратов.
- Диагностика нарушениий гемостаза при остром лейкозе с гиперлейкоцитозом должна включать в себя как традиционные коагулогические, так и интегральные тесты. Одним из частых нарушений является гипофибриногенемия.
- Пациентам с ОМЛ, протекающим с гиперлейкоцитозом, на фоне всех лечебных мероприятий показано проведение массивных трансфузий тромбоцитов (при однократном введении следует вводить 8 - 10 доз).
Низкие показатели гемоглобина, тромбоцитов, альбумина не должны являться противопоказанием к выполнению плазмаферезов, но к этой процедуре необходимо подготовить должный объем заместительной терапии (трансфузии эритроцитной взвеси, тромбоконцентрата, альбумина человека**, СЗП).
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Рис. 1. Стандартный алгоритм выбора терапии у пациента с ОМЛ моложе 60 лет
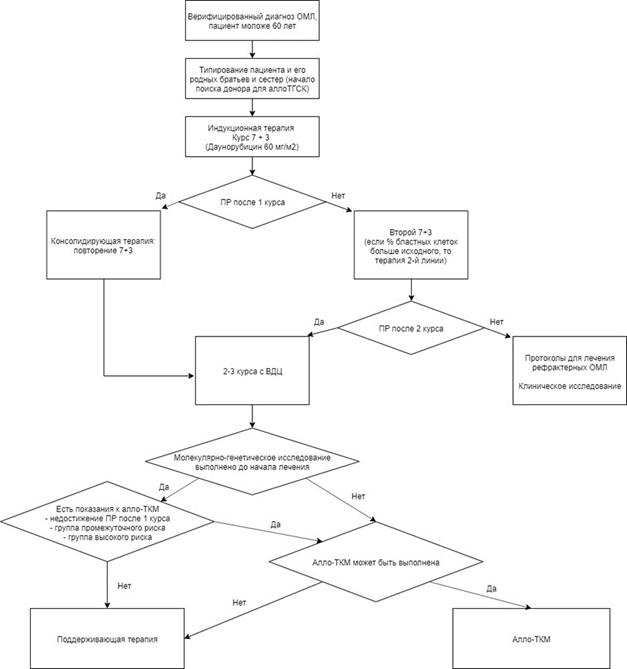
Рис. 2. Стандартный алгоритм выбора терапии у пациента с ОМЛ старше 60 лет
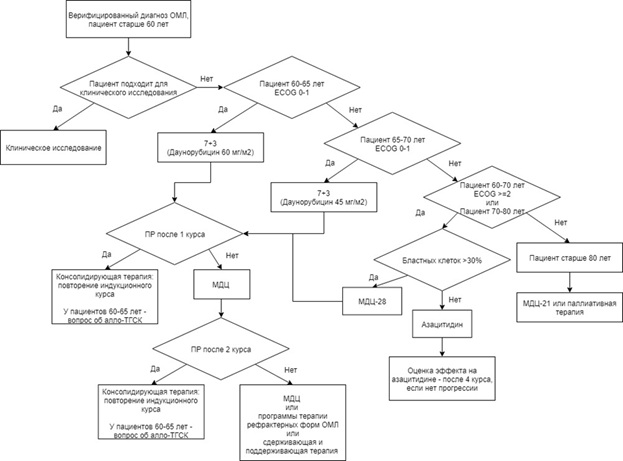
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Острый миелоидный лейкоз (ОМЛ) называется также острым миелобластным лейкозом и острым нелимфобластным лейкозом. ОМЛ развивается, когда возникает дефект ДНК в незрелых клетках костного мозга. Точная причина ОМЛ неизвестна. ОМЛ проявляются в любом возрасте и являются наиболее частой формой ОЛ у взрослых. ОМЛ вызывают неконтролируемый рост бластных, т.е. незрелых клеток крови и костного мозга, которые не могут нормально функционировать. Пациенты с ОМЛ имеют пониженное количество зрелых здоровых клеток крови всех типов: эритроцитов, тромбоцитов и лейкоцитов. В зависимости от типа клеток, на которые болезнь главным образом воздействует, ОМЛ делятся на несколько видов. Точный диагноз устанавливают после исследования образцов крови и костного мозга. Выбор лечения при ОМЛ зависит от разновидности болезни и других факторов, таких как наличие и тип хромосомных нарушений. Симптомы ОМЛ также зависят от разновидности болезни. У пациентов с пониженным содержанием эритроцитов проявляются классические симптомы анемии: быстрая утомляемость, одышка, бледный цвет лица. У пациентов с низким содержанием тромбоцитов могут возникать длительные кровотечения и образовываться синяки.
Пациенты с ОМЛ почти всегда получают ХТ, которая начинается сразу после установления диагноза. Цель такого лечения, называемого индукционной терапией, добиться ремиссии и восстановить нормальное кроветворение. Ремиссия ОЛ - нивелирование патологических проявлений процесса под воздействием противолейкозной терапии. ХТ очень интенсивна и влияет не только на злокачественные, но и на здоровые клетки крови, в результате чего пациенты, получающие индукционную терапию, могут страдать от различных побочных эффектов, таких как тошнота, слабость, повышенная чувствительность к инфекциям. У большинства пациентов в течение нескольких недель после индукционной терапии восстанавливается нормальное кроветворение и констатируется ремиссия ОМЛ. В этот момент принимается решение о применении того или иного метода дальнейшего лечения. Это может быть продолжение ХТ в целях консолидации (закрепления) ремиссии, направленное на более полное уничтожение лейкозных клеток, и поддерживающая терапия.
Другой метод лечения - проведение алло-ТКМ. В качестве источника гемопоэтических стволовых клеток (незрелые клетки - предшественницы кроветворения, из которых впоследствии развиваются 3 типа клеток крови: лейкоциты, эритроциты и тромбоциты) в настоящее время используют костный мозг, пуповинную кровь или периферическую кровь донора. Какой бы источник не использовался, стволовые клетки вводятся в/в в организм пациента после проведения высокодозной ХТ или лучевой терапии, призванной полностью уничтожить лейкозные клетки пациента. Предтрансплантационная ХТ уничтожает также иммунную систему пациента, которую вводимые клетки донора должны восстановить.
Аллогенная трансплантация требует наличия родственного или неродственного донора, гистосовместимого с пациентом по системе HLA. В качестве родственного донора обычно выступает родной брат или сестра. Если родственный донор не найден, врач проводит поиск в базах данных российских и/или зарубежных регистров доноров. Независимо от того, родственный или неродственный донор найден, процедура трансплантации одна и та же: производится забор гемопоэтических стволовых клеток донора, которые затем в/в вводятся пациенту.
Приложение Г
Приложение Г1
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ
ОСТРЫХ МИЕЛОИДНЫХ ЛЕЙКОЗОВ
Название на русском: European Leukemia Net (ELN) молекулярно-генетическая классификация ОМЛ (2017)
Оригинальное название: 2017 ELN risk stratification by genetics
Источник (официальный сайт разработчиков, публикация с валидацией): D hner H., Estey E., Grimwade D. et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 2017; 129(4): 424-47 [8]
Тип: шкала оценки
Назначение: прогностическая оценка состояния пациента
Содержание и интерпретация:
Категория риска
Молекулярно-генетическая характеристика
Благоприятный прогноз
t(8;21)(q22;q22.1); RUNX1::RUNX1T1
inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB::MYH11
Мутации NPM1 без FLT3-ITD или с FLT3-ITD и низким аллельным отношением <*>
Биаллельная мутация CEBPA
Промежуточный прогноз
Мутации NPM1 и FLT3-ITD с высоким аллельным отношением <**>
Дикий тип гена NPM1 без FLT3-ITD или с FLT3-ITD и с низким аллельным отношением (при отсутствии цитогенетических критериев неблагоприятного прогноза)
t(9;11)(p21.3;q23.3); KMT2A::MLLT3
Цитогенетические аномалии, которые не относятся к категории благоприятного прогноза или неблагоприятного прогноза
Неблагоприятный прогноз
t(6;9)(p23;q34.1); DEK::NUP214
t(v;11q23.3); перестройки KMT2A
t(9;22)(q34.1;q11.2); BCR::ABL1
inv(3)(q21.3q26.2) или t(3;3)(q21.3;q26.2); GATA2, MECOM(EVI1)
-5 или del(5q); -7; -17/abn(17p)
Комплексный кариотип
Моносомный кариотип
Дикий тип гена NPM1 и FLT3-ITD с высоким аллельным отношением <**>
Мутации RUNX1 <***>
Мутации ASXL1 <***>
Мутации TP53
--------------------------------
Пояснения:
<*> Низкое аллельное отношение (0,5).
<**> Высокое аллельное отношение (![]() 0,5).
0,5).
<***> Если указанные мутации обнаруживают у пациентов с благоприятными цитогенетическими аномалиями, то их обнаружение не имеет значимости.
Приложение Г2
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ
ОСТРЫХ МИЕЛОИДНЫХ ЛЕЙКОЗОВ
Название на русском: Молекулярно-генетическая стратификационная шкала острых миелоидных лейкозов Европейской сети по изучению лейкозов 2022 года (European LeukemiaNet, ELN 2022)
Оригинальное название: 2022 European LeukemiaNet (ELN) risk classification by genetics at initial diagnosis
Источник (официальный сайт разработчиков, публикация с валидацией): D hner H, Wei AH, Appelbaum FR et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood 2022; 140(12):1345-1377. DOI:10.1182/blood.2022016867.
Тип: шкала оценки
Назначение: определение прогноза заболевания больного
Содержание и интерпретация:
Прогностическая категория
Молекулярно-генетическая характеристика
Благоприятный прогноз
- Мутация NPM1 без FLT3-ITD
- Биаллельная мутация CEBPA, мутация bZIP CEBPa
- t(8;21)(q22;q22); RUNX1::RUNX1T1
- инв(16)(p13.1;q22) или t(16;16)(p13.1;q22); CBFB::MYH11
Промежуточный прогноз
- Мутация NPM1 с FLT3-ITD
- NPM1-WT с FLT3-ITD (в отсутствие неблагоприятных генетический аномалий)
- t(9;11) (p21.3; q23.3) MLLT3::KMT2A
- Цитогенетические аномалии, не классифицированные как благоприятные или неблагоприятные
Неблагоприятный прогноз
- Комплексный кариотип
- Моносомный кариотип
- -5 или дел(5q); -7; -17/abn(17p)
- t(v;11q23.3); KMT2A (перегруппированный аллельный сегмент)
- инв(3)(q21.3;q26.2) или t(3;3)(q21.3;q26.2); GATA2, MECOM(EVI1)
- t(3q26.2;v)/MECOM(EVI1)-реарранжировки
- t(6;9)(p23;q34.1); DEK::NUP214
- t(9;22)(q34.1;q11.2); BCR::ABL1
- t(8;16)(p11;p13)/KAT6A::KREBBP
- Мутированный TP53
- Мутированные ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, ZRSR2
Приложение Г3
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ECOG
Название на русском: Шкала оценки общего состояния пациента Восточной объединенной онкологической группы
Оригинальное название: The ECOG Scale of Performance Status
Источник (официальный сайт разработчиков, публикация с валидацией): Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 65 [11]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Смерть
Приложение Г4
ФАКТОРЫ РИСКА,
АССОЦИИРОВАННЫЕ С ТРАНСПЛАНТАЦИОННОЙ ЛЕТАЛЬНОСТЬЮ
Название на русском: Факторы риска, ассоциированные с трансплантационной летальностью
Оригинальное название: Prognostic factors for allogeneic-HSCT-related nonrelapse mortality
Источник (официальный сайт разработчиков, публикация с валидацией): Cornelissen, J., Gratwohl, A., Schlenk, R. et al. The European LeukemiaNet AML Working Party consensus statement on allogeneic HSCT for patients with AML in remission: an integrated-risk adapted approach. Nat Rev Clin Oncol 9, 579 - 590 (2012) doi: 10.1038/nrclinonc.2012.150
Тип: шкала оценки
Назначение: прогностическая оценка состояния пациента
Содержание и интерпретация:
Предтрансплантационный показатель
Перитрансплантационный показатель
Посттрансплантационный показатель
Благоприятный фактор:
Немиелоаблативное кондиционирование
Источник стволовых клеток (костный мозг или периферическая кровь)
Т-делеция трансплантата
Ранняя иммунная реконституция
-
родственный HLA-совместимый донор
-
более короткий срок между диагностикой ОЛ и ТГСК
-
принадлежность к белой расе
Неблагоприятный фактор:
Миелоаблативный режим кондиционирования
Альтернативный источник трансплантата (пуповинная кровь)
Тяжелая острая реакция "трансплантат против хозяина" (III - IV)
Персистирующая хроническая реакция "трансплантат против хозяина" экстенсивной формы
-
старший возраст реципиента
-
пол донора и реципиента
-
коморбидность
-
цитомегаловирусный серостатус
-
полиморфизм генов цитокинов
-
неродственный донор
-
HLA-несовместимость
-
физикальный статус
-
рефрактерная лейкемия
-
ОМЛ, ассоциированный с предшествующей ХТ
Приложение Г5
ПРОГНОСТИЧЕСКИЙ ИНДЕКС
ДЛЯ МОЛОДЫХ ПАЦИЕНТОВ С РЕЦИДИВОМ ОСТРОГО
МИЕЛОИДНОГО ЛЕЙКОЗА
Название на русском: Прогностический индекс для молодых пациентов с рецидивом острого миелоидного лейкоза
Оригинальное название: European Prognostic Score for acute myeloid leukaemia at rst relapse.
Источник (официальный сайт разработчиков, публикация с валидацией): Giles F., Verstovsek S., Garcia-Manero G. et al. Validation of the European Prognostic Index for younger adult patients with acute myeloid leukaemia in first relapse. Br J Haematol 2006; 134(1):58-60 [69].
Тип: индекс
Назначение: Прогностический индекс для молодых пациентов с рецидивом ОМЛ (15 - 60 лет, исключая острый промиелоцитарный лейкоз t(15;17))
Содержание интерпретация:
Вычисляется в соответствии со следующими факторами:
- продолжительность ремиссии до рецидива: 18 месяцев - 0 баллов, 7 - 17 месяцев - 3 балла, ![]() 6 месяцев - 5 баллов;
6 месяцев - 5 баллов;
- цитогенетические аномалии на момент инициального диагноза: inv(16) или t(16;16) - 0 баллов, t(8;21) - 3 балла, другие - 5 баллов;
- предшествующая ТГСК: нет - 0 баллов, да - 2 балла;
- возраст на момент рецидива: 35 лет и менее - 0 баллов, 36 - 45 лет - 1 балл, старше 45 лет - 2 балла.
Риск
Суммарный индекс, баллы
Вероятность выживаемости, %
к 1-му году
к 5 годам
Благоприятный (9% пациентов)
0 - 6
70
46
Промежуточный (25% пациентов)
7 - 9
49
18
Неблагоприятный (66% пациентов)
10 - 14
16
4
