"Клинические рекомендации "Злокачественные новообразования почек, почечных лоханок, мочеточника, других и неуточненных мочевых органов"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ
ПОЧЕК, ПОЧЕЧНЫХ ЛОХАНОК, МОЧЕТОЧНИКА, ДРУГИХ И НЕУТОЧНЕННЫХ
МОЧЕВЫХ ОРГАНОВ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C64, C65, C66, C68
Год утверждения (частота пересмотра): 2024
Возрастная категория: Дети
Пересмотр не позднее: 2026
ID: 67
Разработчик клинической рекомендации
- Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
EU-RHAB - European Rhabdoid Registry (Европейский регистр рабдоидных опухолей)
SIOP - The International Society of Paediatric Oncology (Международное общество детских онкологов)
NSS - органосохраняющая операция
PD - прогрессия заболевания
SD - стабилизация заболевания
WAGR Syndrome - Wilms tumor - Aniridia - Genital anomalies - mental Retardation Syndrome (Нефробластома - Аниридия - Аномалии мочеполового тракта - Умственная отсталость)
АГ - ангиография
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БСВ - бессобытийная выживаемость
ВМК - ванилил-миндальная кислота
ВМН - врожденная мезобластная нефрома
в/в кап. - внутривенно капельно
в/в стр. - внутривенно струйно
ГВК - гомованилиновая кислота
Гр - грей
ЗНО - злокачественное образование
ЗРО почки - злокачественная рабдоидная опухоль почки
КТ - компьютерная томография
к/у - контрастное усиление
ЛДГ - лактатдегидрогеназа
ЛТ - лучевая терапия
л/у - лимфатические узлы
мг/кг - миллиграмм на килограмм
мг/м2 - миллиграмм на метр квадратный
МЗ РФ - Министерство здравоохранения Российской Федерации
мкг/кг - микрограмм на килограмм
мкг/м2 - микрограмм на метр квадратный
МНО - международное нормализованное отношение
МРТ - магнитно-резонансная томография
НБ - нефробластома
НПВ - нижняя полая вена
ОБП - органы брюшной полости
ОВ - опухоль Вильмса
ОГК - органы грудной клетки
ПЭП - парентеральное питание
ПЭТ-КТ - позитронно-эмиссионная компьютерная терапия
ПХТ - полихимиотерапия
РАН - Российская академия наук
РИД - радиоизотопная диагностика
РКИ - рандомизированное контролируемое исследование
РОД - разовая очаговая доза
РФ - Российская Федерация
СКС - светлоклеточная саркома
ТВ - тромбиновое время
ТО - тотальное облучение
ТОЛ - тотальное облучение легких
СОД - суммарная очаговая доза
УЗИ - ультразвуковое исследование
ХТ - химиотерапия
ЧЛС - чашечно-лоханочная система
ЩФ - щелочная фосфатаза
ЭКГ - электрокардиограмма
Эхо-КГ - эхокардиография
99mTc - Натрия пертехнетат [99mTc]
Термины и определения
Бессобытийная выживаемость (БСВ) - время наблюдения от момента диагностики заболевания до момента возникновения события
Билатеральная нефробластома - двустороннее поражение почек нефробластомой
Общая выживаемость - время наблюдения от начала лечения до смерти больного
Полихимиотерапия - схема введения нескольких химиопрепаратов, в которой учитывается доза, кратность, дни и способ введения цитостатика
Прогрессирование заболевания - появление нового поражения и/или любой рост первичных поражений более чем на 25%
Лучевая терапия - метод локального лучевого воздействия на опухоль/ткани/органы
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Нефробластома или опухоль Вильмса (НБ) - злокачественная эмбриональная опухоль почки у детей, развивающаяся из плюрипотентных клеток-предшественников нефрогенной ткани [1].
Злокачественная рабдоидная опухоль почки (ЗРО почки) - высокозлокачественное, имеющее агрессивное течение новообразование, развивающееся преимущественно в когорте детей раннего возраста и обладающее крайне неблагоприятным прогнозом для жизни [2].
Светлоклеточная саркома почки (СКС почки) - редкая злокачественная опухоль почек у детей, на долю которой приходится 2 - 5% всех детских опухолей почек [3].
Врожденная мезобластная нефрома (ВМН) - редкое ЗНО, составляющее 3% всех новообразований почек у детей. ВМН наиболее распространенная опухоль почки у детей первых 6 месяцев жизни [4; 5].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
НБ. Почка образуется из трех источников: нефрогенной ткани/бластемы (образует строму и дифференцируется в почечные канальцы путем мезенхимально-эпителиального перехода), мезонефрального протока (дает начало мочеточнику, почечной лоханке, почечным чашечкам, сосочковым каналам и собирательным трубкам) и мезенхимы (сосудистая система). Бластема обычно исчезает к 36 неделе гестации, однако приблизительно у 1% детей нефрогенные остатки могут персистировать после рождения [6; 1; 7]. Остатки нефрогенной стромы имеют высокий потенциал к озлокачествлению и обнаруживаются у 40% пациентов с нефробластомой [8; 9].
В мировой литературе описано до 40 генов, альтерации которых приводят к развитию нефробластомы, наиболее изученными из них являются гены WT1, WT2, ассоциированные с рядом генетических синдромов, таких как: синдромы Беквита-Видемана, Дениса-Драша, Перлмана, изолированная гемигипертрофия, WAGR-синдром [10; 11]. Генетические синдромы встречаются в 5 - 10% случаев нефробластом и в основном представляют собой сочетание опухоли с пороками развития мочеполовой системы, нефропатию, макросомию [10; 11; 12].
Клиническими критериями наследственного характера развития НБ являются: билатеральность (до 10% в структуре нефробластомы) и мультифокальность поражения, ранний детский возраст клинической манифестации заболевания, наличие аналогичной опухоли у других членов семьи (семейная форма встречается в 1% случаев), сочетание опухоли с генетическими синдромами [6; 7].
ЗРО почки. Биаллельная инактивация гена-супрессора опухолевого роста SMARCB1 является "молекулярным маркером" заболевания. Ген кодирует одну из центральных субъединиц АТФ-зависимого хроматин-ремоделирующего комплекса SWI/SNF, BAF43 [13]. В редком проценте случаев причиной развития ЗРО служат изменения гена SMARCA4 [14; 15].
Около 30% пациентов характеризуются наличием герминальных событий в генах, что обуславливает выделение синдромов предрасположенности (СПЗРО1 и СПЗРО2 типов) [16; 17; 18]. Клиническими критериями наследственного характера развития ЗРО почки являются: распространенные стадии процесса, включая специфический характер метастазирования в виде подкожных узлов, мультифокальность или синхронность развития нескольких опухолей; более ранний детский возраст клинической манифестации заболевания или его врожденный характер; наличие аналогичной опухоли у других членов семьи (семейная форма описана в единичных случаях заболевания) или опухолей ассоциированных с альтерациями генов SMARCB1 или SMARCA4 [17; 18].
СКС почки. В настоящее время описаны молекулярно-генетические маркеры, включающие внутренние тандемные дупликации гена BCOR (далее BCOR-internal tandem duplication, BCOR-ITD) [19] и хромосомную транслокацию t(10,17), приводящую к образованию химерных генов YWHAE-NUTM2, что отличает СКСП от других опухолей почек детского возраста. Тандемные дупликации гена BCOR рассматриваются как основное молекулярно-генетическое событие при СКСП у детей, впервые описанное в 2015 г. тремя независимыми исследовательскими группами. Частота выявления BCOR-ITD варьировала от 85 до 100% [20; 21; 22]. Транслокация t(10;17) (химерный ген YWHAE-NUTM2) выявляется в 6,4 - 12% случаев [23; 24], при этом клинически данное молекулярно-генетическое событие коррелирует с ранним возрастом, меньшей медианой объема опухоли и отсутствием I стадии заболевания [24]. BCOR-ITD и YWHAE-NUTM2 рассматриваются как взаимоисключающие генетические события, но не объясняют все случаи заболевания СКСП [23]. Так, в качестве третьего молекулярного события у пациентов со СКСП описан химерный ген BCOR-CCBN3 [25]. Интересным является то, что как BCOR-ITD, так и химерный ген YWHAE-NUTM2 описан у детей раннего возраста с опухолями мягких тканей, включая недифференцированную круглоклеточную саркому и примитивную миксоидную мезенхимальную опухоль младенцев, что указывает на общность патогенеза данных заболеваний со СКСП [26].
ВМН почки. Для ВМН характерно наличие реципрокной транслокации t(12;15) (p13, q25) с формированием химерного гена ETV6/NTRK3 у пациентов с клеточным и смешанным типами ВМН. Клеточный и классический типы ВМН рассматриваются как почечный аналог инфантильной фибросаркомы с поражением мягких тканей, учитывая схожую гистологическую картину и молекулярно-генетические особенности этих видов новообразований (ген ETV6/NTRK3) [27; 28; 29].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
НБ. Частота встречаемости 0,7 - 0,8 до 1 на 100 000 населения детского возраста до 14 лет, что составляет около 5% от общего числа злокачественных новообразований детского возраста. На долю нефробластомы приходится примерно 90% случаев опухолей почек у детей. Около 80% случаев диагностируется в возрасте до 5 лет, из них 15% до 1 года, медиана возраста составляет 3,5 года. Частота заболевания у девочек и мальчиков приблизительно одинакова. В 5 - 10% случаев встречается билатеральное поражение почек. Описаны случаи поражения единственной подковообразной почки, а также случаи экстраренального расположения НБ [30; 31].
ЗРО почки. Манифестация заболевания обычно приходится на первые 2 года жизни с медианой возраста на момент постановки диагноза 16 - 24 мес. [32]. В структуре опухолей почек на долю ЗРО приходится около 1% [33]. Показатель выживаемости варьирует около цифры 0,019 на 100 000 детей в год у пациентов в возрасте до 15 лет [34]. В структуре заболеваемости превалирования определенного пола нет, по различным данным соотношение м:д варьирует в пределах 0,86 - 1,2:1 [34; 32].
СКС почки. На долю СКСП приходится 3% от всех случаев опухолей почек у детей 0 - 14 лет за период 2001 - 2010 гг. (n = 431), стандартизованный показатель заболеваемости составил 0,02 на 100 тыс. детского населения [35]. СКСП характерна для детей в возрасте от 2 до 3 лет, на данный возрастной интервал приходится 50% случаев заболевания, при этом опухоль крайне редко встречается у детей первых 6 месяцев жизни. Медиана возраста на момент постановки диагноза составляет 36 месяцев [36]. В отличие от нефробластомы, для СКСП характерно преобладание лиц мужского пола (соотношение мальчики: девочки варьирует от 1,8:1 до 2,04:1) [35].
ВМН почки. Редкая первичная опухоль почки у детей раннего возраста, характеризующаяся промежуточным биологическим поведением [4; 27]. На долю ВМН приходится 3% всех случаев опухолей почек у детей. ВМН диагностируется у детей первых 6 месяцев жизни, в данной когорте пациентов в 50% случаев всех новообразований почек диагностируются именно ВМН. В 15% случаев они обнаруживаются пренатально или в первые дни жизни ребенка, что демонстрирует эмбриональное происхождение опухоли. Чаще ВМН встречается у мальчиков, чем у девочек [27].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C64 - Злокачественные новообразования (ЗНО) мочевых путей, кроме почечной лоханки;
C65 - ЗНО почечной лоханки;
C66 - ЗНО мочеточника;
C68 - ЗНО других и неуточненных мочевых органов.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Международная классификация опухолей у детей ВОЗ, разработанная в 2022 году, выделяет различные типы опухолей почек на основании гистологических и молекулярных характеристик (табл. 1) [37]
Таблица 1. Классификация опухолей почек (ВОЗ, 2022 г.)
Нефробластические и родственные опухоли
Кистозная нефрома у детей
Нефробластома
Опухоли почек с изученными молекулярными характеристиками
Почечно-клеточный рак с транслокациями MIT
ALK-зависимый почечно-клеточный рак
Эозинофильный, солидный и кистозный (ESC) почечно-клеточный рак (связанный с TSC)
Медуллярная карцинома почки с дефицитом SMARCB1
Метанефральные опухоли
Метанефральная аденома
Метанефральная аденофиброма
Метанефральная стромальная опухоль
Мезенхимальные опухоли почек
Оссифицирующая опухоль почки у младенцев
Мезобластная нефрома
Светлоклеточная саркома почек
Злокачественная рабдоидная опухоль почки
Анапластическая саркома почки
Саркома Юинга почки
НБ классифицируется по гистологическому типу опухоли (см. раздел 1.5.1 Международная гистологическая классификация НБ), по стадиям в зависимости от радикальности оперативного вмешательства (см. раздел 1.5.2 Классификация послеоперационного стадирования), по группам риска согласно гистологическому варианту опухоли (см. раздел 1.5.3 Группы риска согласно гистологическому варианту опухоли). Классификации основаны на рекомендациях SIOP [33, 38].
ЗРО почки классифицируется по стадиям в зависимости от радикальности оперативного вмешательства (см. раздел 1.5.2 Классификация послеоперационного стадирования), как опухоль высокой группы риска согласно гистологическому варианту (см. раздел 1.5.3 Группы риска согласно гистологическому варианту опухоли). Классификации основаны на рекомендациях SIOP [9, 33].
СКС почки классифицируется по стадиям в зависимости от радикальности оперативного вмешательства (см. раздел 1.5.2 Классификация послеоперационного стадирования), как опухоль высокой группы риска согласно гистологическому варианту (см. раздел 1.5.3 Группы риска согласно гистологическому варианту опухоли). Классификации основаны на рекомендациях SIOP [9, 33].
ВМН почки классифицируется по стадиям в зависимости от радикальности оперативного вмешательства (см. раздел 1.5.2 Классификация послеоперационного стадирования), как опухоль низкой группы риска согласно гистологическому варианту (см. раздел 1.5.3 Группы риска согласно гистологическому варианту опухоли). Классификации основаны на рекомендациях SIOP [9, 33].
1.5.1 Международная гистологическая классификация НБ
Гистологическая классификация основана на результатах патолого-анатомического исследования ткани опухоли (таб. 2).
Таблица 2. Гистологическая классификация НБ
Гистологические особенности (в % от объема опухоли)
Терапевтически индуцированные изменения
Эпителий
Строма
Бластема
Гистологический тип опухоли
Тотально некротизированный
100%
0
0
0
Регрессивный
> 66%
0 - 100%
0 - 100%
0 - 100%
Смешанный
< 66%
0 - 65%
0 - 65%
0 - 65%
< 66%
11 - 65%
0 - 89%
0 - 89%
Эпителиальный
< 66%
66 - 100%
0 - 33%
0 - 10%
Стромальный
< 66%
0 - 33%
66 - 100%
0 - 10%
Бластемный
< 66%
0 - 33%
0 - 33%
66 - 100%
1.5.2 Классификация послеоперационного стадирования
Классификация основана на радикальности оперативного вмешательства, а также на распространенности процесса. При метастатической форме или билатеральной форме, локальная стадия может не совпадать с клинической (например, стадия IV, локальная стадия III).
Стадия I:
- Опухоль ограничена почкой или окружена капсулой/псевдокапсулой, если выходит за контуры почки. Капсула/псевдокапсула могут быть инфильтрированы опухолью, но неопластическая ткань не достигает наружной ее границы;
- Опухоль может пролабировать в лоханку (так называемое "выпячивание") или "провисать" в мочеточник, не инфильтрируя его стенки;
- Сосуды почечного синуса интактны;
- Возможны инвазия и опухолевые эмболы в сосудах паренхимы почки.
Для НБ наличие зрелых тубулярных структур в мягких тканях почечного синуса не свидетельствует о его инфильтрации и представляет собой структуры интралобарных остатков нефрогенной стромы. Перилобарные остатки нефрогенной стромы могут так же быть иногда обнаружены в мягких тканях почечного синуса. Истинной инфильтрацией мягких тканей почечного синуса/ворот почки является обнаружение очагов бластемы в непосредственной близости к нервным стволикам.
Аспирационная или игольная ("tru-cut", трепан-биопсия) биопсия в анамнезе не повышает стадию.
Наличие некроза или признаков терапевтического патоморфоза (гемосидероз, инфильтрация пенистыми макрофагами) в мягких тканях почечного синуса, почечной вене и/или в периренальной жировой ткани не повышает стадию.
Инфильтрация надпочечника не повышает стадию, если наружная поверхность капсулы его не вовлечена в опухолевый процесс.
Опухоль может прилежать к капсуле печени, что не является инфильтрацией прилежащих органов. Только наличие истинной инфильтрации паренхимы печени должно быть расценено как стадия III.
Стадия II:
- Витальная опухоль визуализируется в периренальной жировой ткани и не покрыта капсулой/псевдокапсулой, но удалена радикально ("чистые" края резекции);
- Витальная опухоль инфильтрирует мягкие ткани почечного синуса;
- Витальная опухоль инфильтрирует кровеносные и лимфатические сосуды почечного синуса или почечной вены, или визуализируется в периренальных мягких тканях, но удалена радикально;
- Витальная опухоль инфильтрирует стенку мочеточника;
- Витальная опухоль инфильтрирует прилежащие органы или нижнюю полую вену, но удалена радикально.
Только наличие нервов в мягких тканях, наряду с сосудами, дает основание считать визуализируемые структуры почечным синусом.
Стадия III:
- Витальная опухоль визуализируется в маркированных краях резекции ("опухоль в краске"). При наличии опухоли с патоморфозом в крае резекции стадия III выставляется при условии обнаружения витальной опухоли менее чем в 5 мм от маркированного краской края резекции. При наличии витальной опухоли более чем в 5 мм от маркированного краской края резекции стадия не повышается до III. Расстояние минимум 5 мм от витальной опухоли до края резекции с патоморфозом должно быть подтверждено несколькими блоками фрагментов, выделенных из этой области;
- Любые абдоминальные лимфатические узлы поражены витальной опухолью или опухолью с терапевтическим патоморфозом;
- Пре- или интраоперационый разрыв опухоли, видимый при патоморфологическом исследовании, вне зависимости от остальных критериев стадирования;
- Наличие опухолевого тромба в крае резекции мочеточника, почечной вены или нижней полой вены (края резекции в этом случае всегда обсуждаются с хирургом);
- Опухолевый тромб, вплотную прилежащий к стенке нижней полой вены, удален хирургом частями;
- Открытая/клиновидная биопсия опухоли до предоперационной химиотерапии или хирургического этапа лечения;
- Витальная опухоль или опухоль с патоморфозом проникают за пределы забрюшинного пространства;
- Опухолевые импланты (витальные или с патоморфозом) найдены в любом месте брюшной полости/забрюшинного пространства.
Сокращение почечной вены: зачастую опухолевый тромб пролабирует в почечную вену и выходит за макроскопические края резекции. Это в большей степени заметно после хирургической резекции с последующей фиксацией. Такие случаи в обязательном порядке обсуждаются с хирургом, для того, чтобы выяснить, легко ли тромб был им выделен и удален или же вплотную был прикреплен к стенке нижней полой вены; прилагал ли хирург дополнительные усилия для его отделения или даже инструменты. Если хирург лишь с легкостью вытянул тромб, то пролабирующий в краях резекции тромб не означает стадию III. Стадия III выставляется только при условии фрагментации тромба в процессе выделения или же если выделение вызвало значительные затруднения со стороны хирурга.
Наличие некротизированной опухоли или опухоли с патоморфозом в лимфатических узлах расценивается как предсуществовавший витальный метастаз и выставляется стадия III (возможно витальная опухоль имеет место быть за пределами исследуемого лимфатического узла). Регрессивные (терапевтически индуцированные) изменения в лимфатическом узле должны иметь форму предсуществовавшего метастаза. Интрасинусоидальное распределение пенистых макрофагов не расценивается как опухоль с патоморфозом.
Иногда в ткани лимфатического узла могут быть обнаружены зрелые тубулярные структуры, что ассоциировано с депозитами белка Тамм-Хорсфалла, но также встречается и без него. Данное явление не расценивается как метастаз.
Наличие повреждения/разрыва опухоли расценивается как значимое для стадии III только если визуализируется при нефрэктомии. Если нет, то стадирование проводится согласно остальным критериям, а случай обязательно обсуждается на междисциплинарной конференции/консилиуме.
Стадия IV:
Гематогенные метастазы (легкие, печень, кости, головной мозг и др.) или метастазы в отдаленные лимфатические узлы (вне брюшной полости и полости таза).
Стадия V:
Двустороннее поражение почек.
Опухоль с каждой стороны стадируется согласно описанным критериям отдельно.
1.5.3 Группы риска (согласно гистологическому варианту опухоли)
Гистологическое разделение на группы риска для НБ зависит от факта наличия или отсутствия предоперационной химиотерапии; ЗРО почки и СКС почки в любом случае относятся к высокой гистологической группе риска.
Гистологическая классификация в случае проведения предоперационной химиотерапии:
Группа низкого риска:
- Кистозная частично дифференцированная НБ;
- Полностью некротизированная НБ;
- Врожденная мезобластная нефрома.
Группа промежуточного риска:
- Эпителиальный тип;
- Стромальный тип;
- Смешанный тип;
- Регрессивный тип;
- Фокальная анаплазия.
Группа высокого риска:
- Бластемный тип;
- Диффузная анаплазия;
- ЗРО почки;
- СКС почки.
Гистологическая классификация в случае нефрэктомии на первом этапе лечения:
Группа низкого риска:
- Кистозная частично дифференцированная НБ;
- Врожденная мезобластная нефрома.
Группа промежуточного риска:
- НБ без анаплазии и ее варианты;
- Фокальной анаплазия.
Группа высокого риска:
- Диффузная анаплазия;
- ЗРО почки;
- СКС почки.
В дополнении к анаплазированным типам НБ, для последующей терапии необходимо выделять три основных типа: тотально некротизированный (группа низкого риска), бластемный тип (группа высокого риска) и остальные типы (промежуточный риск). Тем не менее, прогностически важно указывать соотношение каждого компонента опухоли в процентном соотношении. Кистозная частично дифференцированная нефробластома диагностируется методами визуализации и единственным методом лечения является хирургический.
1.5.4 Стадирование нефробластомы в случае органосохраняющей операции [33; 38]:
R0: Интактная паренхима почки по краю опухоли (исключая нефробластоматоз);
R1: Интактная псевдокапсула по краю опухоли;
R2: Опухоль в крае резекции.
В данных случаях необходимо аккуратно и прицельно исследовать края резекции, так как зачастую очаги удаляются с небольшим ободком почечной паренхимы по краю (особенно в случаях мультинодулярного поражения почки).
Используемые хирургические термины:
- резекция/частичная нефрэктомия - удаление очага с ободком почечной паренхимы;
- энуклеация - выделение опухолевого узла без паренхимы почки;
Должно быть выполнено патолого-анатомическое исследование всего края резекции по почке. В случае небольшого объема узла, он забирается в работу полностью. Должно быть указано минимальное расстояние до края резекции. Интактный край (паренхима почки) не должен быть меньше 1 мм. В случае обнаружения остатков нефрогенной стромы в крае резекции такой край не считается вовлеченным в опухолевый процесс и стадия не повышается [33; 38].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина может складываться из общих и местных симптомов. Выраженность симптомов будет зависеть от локализации опухоли в почке, ее размеров, а также наличия отдаленного метастазирования. При опухолях небольших размеров без вовлечения ЧЛС, опухоль может стать случайной находкой на УЗИ, тогда как образование больших размеров с прорастанием ЧЛС и вовлечением близлежащих структур может сопровождаться макро-/микрогематурией, артериальной гипертензией ввиду вовлечения ренальных сосудов, рвотой при поддавливании желудка большим образованием левой почки. Общая симптоматика может включать симптомы интоксикации, боли в животе. При локализации отдаленного метастазирования в легких возможно развитие респираторной симптоматики.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Предварительный диагноз ЗНО почки устанавливается на основании клиники (см. раздел 1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний) и данных инструментальных исследований. Окончательный гистологический диагноз устанавливается на основании патолого-анатомического и иммуногистохимического исследований согласно алгоритмам патологоанатомической диагностики опухолей почек [33].
Алгоритм первичной диагностики представлен в приложении Б1 [33].
2.1 Жалобы и анамнез
- У всех пациентов с ЗНО почки необходим сбор жалоб, выявление длительности симптомов. Рекомендуется детальное выяснение акушерского анамнеза матери, особенностей течения беременности и развития пациента [7; 33; 38; 39; 40].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: целесообразно выяснить подробный семейный онкологический анамнез - наличие доброкачественных или злокачественных опухолей у членов семьи, а также наличие в семье или у пациента врожденных пороков развития. Выявление случаев опухолевого заболевания в семье требует проведения медико-генетического консультирования для выявления генетических механизмов, лежащих в основе предрасположенности [7; 11].
Общее состояние пациента должно быть оценено по шкале ECOG (см. приложение Г3) и/или по шкале Lansky (см. приложение Г4)
2.2 Физикальное обследование
- Всем пациентам с подозрением на ЗНО почки при первичном обследовании рекомендуется клинический осмотр (прием (осмотр, консультация) врача-онколога первичный)) с измерением роста, массы тела; размеров, консистенции и подвижности пальпируемых опухолевых узлов; оценкой органной недостаточности [33; 38; 39].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Измерение артериального давления на периферических артериях настоятельно рекомендуется производить всем пациентам с ЗНО почки с целью выявления ренальной гипертензии [33; 38; 39; 40].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Особое внимание при осмотре рекомендуется обратить на наличие стигм дисэмбриогенеза и врожденных пороков развития, особенно урогенитального тракта [33; 38; 39; 40; 41].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Врожденные пороки развития - аниридия, гемигипертрофия, крипторхизм, гипоспадия [41] требуют также проведения медико-генетического консультирования (прием (осмотр, консультация) врача-генетика первичный) для выявления генетических механизмов, лежащих в основе предрасположенности.
2.3 Лабораторные диагностические исследования
- Всем пациентам с опухолью, исходящей из верхнего полюса почки, с целью дифференциальной диагностики между нефробластомой и нейробластомой при наличии технических возможностей рекомендовано исследование уровня метаболитов катехоламинов мочи (исследование уровня ванилил-миндальной кислоты в моче, исследование уровня гомованилиновой кислоты в моче) а также уровня нейрон-специфической энолазы (NSE) [33; 39; 42; 43].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с ЗНО почки рекомендовано проведение следующих лабораторных исследований для оценки общесоматического статуса пациента [33; 44; 45]:
- развернутого клинического анализа крови (исследование уровня общего гемоглобина в крови; исследование уровня эритроцитов в крови; исследование уровня тромбоцитов в крови; исследование уровня лейкоцитов в крови) - перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, в процессе лечения на 0, 15, 28 дни терапии (для локализованных стадий) или на 0, 15, 28, 42 дни терапии (для генерализованных стадий), на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов);
- биохимического общетерапевтического анализа крови (исследование уровня мочевины в крови, исследование уровня креатинина в крови, исследование уровня натрия в крови, исследование уровня натрия в крови, исследование уровня хлоридов в крови, исследование уровня глюкозы в крови, определение активности лактатдегидрогеназы в крови, определение активности аланинаминотрансферазы в крови, определение активности аспартатаминотрансферазы в крови, исследование уровня общего билирубина в крови, исследование уровня билирубина связанного (конъюгированного) в крови, определение активности щелочной фосфатазы в крови, исследование уровня общего белка в крови, исследование уровня альбумина в крови) - перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, в процессе лечения на 0, 15, 28 дни терапии (для локализованных стадий) или на 0, 15, 28, 42 дни терапии (для генерализованных стадий), на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов);
- коагулограммы (уровень протромбина, исследование уровня фибриногена в крови, определение активности антитромбина III в крови, определение международного нормализованного отношения (МНО), активированное частичное тромбопластиновое время (АЧТВ), Определение протромбинового (тромбопластинового) времени в крови или в плазме (ТВ)) - перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии;
- определение основных групп крови по системе AB0, определение антигена D системы резус (резус-фактора), определение фенотипа антигенов эритроцитов (определение фенотипа антигенов эритроцитов системы MNS и/или определение фенотипа антигенов эритроцитов системы Lewis) для возможности выполнения гемотрансфузии при наличии показаний - перед началом лечения на этапе предоперационной терапии;
- общего (клинического) анализа мочи - перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов);
- госпитальный скрининг при госпитализации в медицинскую организацию - определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, качественное исследование, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови [36];
- пациентам с ЗРО почки показано проведение генетического консультирования (прием (осмотр, консультация) врача-генетика первичный) с целью определения объема обследования для выявления СПЗРО [16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: наиболее частыми клиническими и лабораторным проявлением опухолей почек является макро-/микрогематурия вследствие кровотечения в чашечно-лоханочную систему почки, сопровождающаяся развитием анемического синдрома [39].
На фоне проводимой терапии возможно развитие индуцированной аплазии кроветворения, что может потребовать терапии колониестимулирующими факторами, а также трансфузий компонентов крови.
2.4 Инструментальные диагностические исследования
- Пациентам с ЗНО почки рекомендовано для оценки распространенности процесса УЗИ органов брюшной полости и забрюшинного пространства (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование почек и надпочечников) в следующих ситуациях [33; 39; 46]:
- всем пациентам - перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
- пациентам с генерализованной формой ЗНО почки на этапе предоперационной терапии - на 0, 15, 28, 42 дни терапии
- пациентам с генерализованной формой НБ на этапе послеоперационной терапии - на 1, 6, 10, 24 неделе и в конце терапии
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1, 4, 8, 12 неделе и в конце терапии
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной метрономной терапии - на 12 неделе и в конце терапии
- пациентам с генерализованной формой СКС почки на этапе послеоперационной терапии на 1, 9, 18, 27 неделе и в конце терапии
- пациентам с локализованной формой ЗНО почки на этапе предоперационной терапии - на 0, 15, пациентам с генерализованной формой СКС почки на этапе послеоперационной терапии на 1, 9, 18, 27 неделе и в конце терапии
- пациентам с локализованной формой НБ на этапе послеоперационной терапии - на 1, 6, 10, 24 неделе и в конце терапии
- пациентам с локализованной формой ЗРО почки на этапе послеоперационной терапии - на 1, 4, 8, 12 неделе и в конце терапии
- пациентам с локализованной формой СКС почки на этапе послеоперационной терапии на 1, 9, 18, 27 неделе и в конце терапии
- пациенты с локализованной формой ВМП почки не нуждаются в послеоперационной химиотерапии, в случае показаний к ее назначению, тактика обследования и терапии обсуждается с федеральным/национальным центром
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: обследовать необходимо всю брюшную полость, обязательно детальное исследование контралатеральной почки (также в положении лежа на спине и на боку) на предмет двусторонней опухоли, нефрогенных остатков или других патологических изменений, которые могут повлиять на функцию почек. Необходимо проводить скрининг паренхимы печени на предмет метастазов (ультразвуковое исследование печени). УЗИ является исследованием выбора при изучении почечной вены и нижней полой вены на предмет внутривенного опухолевого тромба, как с помощью 2D УЗИ, так и посредством цветного допплеровского картирования (дуплексное сканирование нижней полой вены и вен портальной системы), а также для оценки взаимоотношения опухоли с прилежащими органами в режиме реального времени.
- Пациентам с ЗНО почки рекомендована МРТ органов брюшной полости с внутривенным контрастированием и МРТ почек с внутривенным контрастированием (или как альтернатива - Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием, если невозможно МРТ исследование) для оценки распространенности процесса в следующих ситуациях [16; 33; 46; 47; 48; 49; 50]:
- всем пациентам - перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
- пациентам с генерализованной формой ЗНО почки на этапе предоперационной терапии - на 0, 42 дни терапии
- пациентам с генерализованной формой НБ на этапе послеоперационной терапии - только при подозрении на наличие остаточного компонента опухоли и/или при прогрессировании по данным УЗИ (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование почек и надпочечников)
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1, 4, 8, 12 неделе и в конце терапии
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной метрономной терапии - на 12 неделе и в конце терапии
- пациентам с генерализованной формой СКС почки на этапе послеоперационной терапии на 1, 9, 18, 27 неделе и в конце терапии
- пациентам с локализованной формой ЗНО почки на этапе предоперационной терапии - на 0, 28 дни терапии
- пациентам с локализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1, 4, 8, 12 неделе и в конце терапии
- пациентам с локализованной формой ЗРО почки на этапе послеоперационной метрономной терапии - на 12 неделе и в конце терапии
- пациентам с локализованной формой СКС почки на этапе послеоперационной терапии на 1, 9, 18, 27 неделе и в конце терапии
- пациенты с локализованной формой ВМП почки не нуждаются в послеоперационной химиотерапии, в случае показаний к ее назначению, тактика обследования и терапии обсуждается с федеральным/национальным центром
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: исследование проводится с целью определения топографии и органной принадлежности образования, выявление опухоли в трех измерениях и определение объема опухоли, поиск очагов отдаленного метастазирования. Благодаря отсутствию ионизирующего излучения и высокой контрастности мягких тканей, МРТ является более предпочтительным методом по сравнению с КТ. Обследовать необходимо всю брюшную полость (от купола печени до полости таза включительно). Протокол исследования должен выполняться МРТ-рентгенологами, имеющими опыт в проведении детской МРТ брюшной полости. При выполнении процедуры у детей младшего возраста рекомендуется применение седации или общей анестезии - в соответствии с принятой местной практикой. Введение гадолиния рекомендовано, но не является обязательным. КТ брюшной полости является дополнительным к УЗИ исследованием "второго выбора". Введение внутривенного йодированного контрастного вещества является обязательным условием проведения исследования. Необходимо провести объемную съемку первой (портально-венозной) фазы. Обследовать необходимо всю брюшную полость (включая печень целиком и полость таза).
- Пациентам с ЗНО почки рекомендована для оценки распространенности процесса КТ органов грудной полости (или как альтернатива - рентгенография легких в 2-х проекциях, если невозможно проведение КТ исследование) в следующих ситуациях [16; 33; 39; 46; 47; 48; 50]:
- всем пациентам - перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
- пациентам с генерализованной формой ЗНО почки на этапе предоперационной терапии - на 0 (КТ и рентгенография), 28 (рентгенография), 42 (КТ) дни терапии
- пациентам с генерализованной формой НБ на этапе послеоперационной терапии - на 10 неделе и в конце терапии (если на 10 неделе не было достигнуто полной санации очагов)
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1, 8 неделе и в конце терапии
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной метрономной терапии - на 12 неделе и в конце терапии
- пациентам с генерализованной формой СКС почки на этапе послеоперационной терапии на 1, 9, 18, 27 неделе и в конце терапии
- пациентам с локализованной формой ЗНО почки на этапе предоперационной терапии - на 0, 28 дни терапии
- пациентам с локализованной формой НБ на этапе послеоперационной терапии - рентгенография на 10 неделе и в конце терапии, КТ - только в случае подозрения на появление метастатических очагов по рентгену ОГК
- пациентам с локализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1, 8 неделе в конце терапии
- пациентам с локализованной формой ЗРО почки на этапе послеоперационной метрономной терапии - на 12 неделе и в конце терапии
- пациентам с локализованной формой СКС почки на этапе послеоперационной терапии на 1, 9, 18, 27 неделе и в конце терапии
- пациенты с локализованной формой ВМП почки не нуждаются в послеоперационной химиотерапии, в случае показаний к ее назначению, тактика обследования и терапии обсуждается с федеральным/национальным центром
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: нативная КТ грудной клетки является обязательной диагностической процедурой, необходимой для оценки наличия легочных метастазов. Внутривенное контрастирование необязательно (но может применяться, если КТ ОГК проводится в сочетании с КТ брюшной полости, а не с МРТ брюшной полости).
Наиболее частыми органами-мишенями для отдаленного метастазирования являются легкие. Согласно рекомендациям SIOP имеются определенные характеристики очагового поражения легких, трактующегося как метастатическое или неметастатическое:
- округлые солидные очаги размерами 1 - 2 мм не классифицируются как метастазы, эти пациенты получают предоперационную ХТ, как при локальных стадиях;
- округлые солидные очаги размерами 3 - 5 мм классифицируются как метастазы, такие пациенты получают предоперационную ХТ, как при генерализованной форме заболевания. Перед нефрэктомией проводится оценка динамики со стороны легочных метастазов (КТ). При сохранении очагов в легких рекомендуется их оперативное удаление после нефрэктомии. Если гистология удаленных очагов выявляет отсутствие опухолевых клеток или тотальный некроз - послеоперационное лечение проводится согласно локальной стадии. Если в метастазах выявляются живые опухолевые клетки - продолжение лечения согласно рекомендациям для IV стадии;
- очаги размером > 5 мм классифицируются как метастазы. Такие пациенты получают предоперационную ХТ, как при генерализованной форме заболевания. Перед нефрэктомией проводится оценка динамики со стороны легочных метастазов (КТ).
- Пациентам с ЗРО почки или СКС почки для поиска метастатических очагов в головном мозге, а также синхронных/метахронных опухолей (ЗРО почки) рекомендовано проведение МРТ головного мозга с контрастным усилением (магнитно-резонансная томография головного мозга с контрастированием) (или как альтернатива - КТ головного мозга с контрастным усилением (компьютерная томография головного мозга с внутривенным контрастированием), если невозможно проведение МРТ исследования) в следующих ситуациях [16; 33; 39; 50; 51]:
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной метрономной терапии - в конце терапии;
- пациентам с генерализованной формой СКС почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
- пациентам с локализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
- пациентам с локализованной формой СКС почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В случае обнаружения метастатического поражения головного мозга по результатам МРТ/КТ головного мозга с контрастным усилением (магнитно-резонансная томография головного мозга с контрастированием; компьютерная томография головного мозга с внутривенным контрастированием) у пациентов с ЗРО почки и СКС почки рекомендовано выполнение МРТ спинного мозга с контрастированием (все отделы по отдельности, согласно НМУ)/КТ спинного мозга с контрастным усилением (КТ позвоночника с внутривенным контрастированием) также проведение люмбальной пункции для оценки распространения опухолевого процесса в пределах ЦНС [16; 33; 39; 50; 51]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с ЗРО почки и СКС почки для поиска метастатических очагов в костях рекомендовано проведение ПЭТ/КТ (позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) с 18F-ФДГ (флудезоксиглюкоза) или остеосцинтиграфии с #99mTc (сцинтиграфия костей всего тела) в следующих ситуациях [16; 33; 50]:
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
- пациентам с генерализованной формой ЗРО почки на этапе послеоперационной метрономной терапии - в конце терапии;
- пациентам с генерализованной формой СКС почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
- пациентам с локализованной формой ЗРО почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
- пациентам с локализованной формой СКС почки на этапе послеоперационной интенсивной терапии - на 1 неделе и в конце интенсивной терапии;
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с подозрением на ЗНО почки, если нельзя исключить нейробластому, рекомендовано проведение сцинтиграфии (сцинтиграфия с туморотропными РФП в режиме "все тело") с 123I-метайодбензилгуанидином (Йобенгуан [123I]) перед началом специфической терапии [33; 47; 48; 52].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: подозрения на нейробластому могут быть в случаях, если по результатам методов визуализации (КТ/МРТ ОБП): нет вовлечения почечных чашечек или почечной лоханки в процесс; есть вовлечение в процесс крупных сосудов брюшной полости; в опухоли встречаются кальцинаты; образование вовлекает в процесс всю почку. Уровень катехоламинов в моче повышен.
- Рекомендовано в целях оценки размера и локализации опухоли, вовлеченности сосудов при планировании хирургического лечения проведение ангиографии сосудов почек, а также реносцинтиграфии (сцинтиграфия почек и мочевыделительной системы) пациентам с двусторонними опухолями почек, опухолями подковообразной почки, а также иных состояниях на усмотрение врача-хирурга при планировании частичной нефрэктомии [30; 33; 44];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: предпочтительно, чтобы ее проводил опытный врач-рентгенолог, непосредственно перед операцией.
- Всем пациентам с ЗНО почки перед началом терапии для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой системы и оценки рисков лечения, определения безопасной тактики лечения рекомендуется выполнение электрокардиографии (регистрация электрокардиограммы) и эхокардиографии [33; 39; 53; 54; 55]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: показатели фракции укорочения, фракции выброса и конечно-систолического напряжения стенки должны быть документально зафиксированы перед введением первой дозы #Доксорубицина** всем пациентам, которые планируют получать #Доксорубицин**, т.е. пациентам с IV стадией заболевания и гистологической группой высокого риска.
- Пациентам с ЗНО почки рекомендовано выполнение эхокардиографии в следующих ситуациях [16; 33; 39]:
- пациентам с генерализованной формой ЗНО почки на этапе предоперационной терапии на 0, 42 сутки;
- пациентам с генерализованной формой НБ на этапе послеоперационной терапии - на 10 неделе и в конце терапии;
- пациентам с ЗРО почки на этапе послеоперационной терапии - на 0, 6, 9 неделе и в конце терапии;
- пациентам с СКС почки с генерализованной формой на этапе предоперационной терапии на 0 неделе, перед неделями 19 и 30, и в конце терапии;
- пациентам с СКС почки с локализованной формой на этапе предоперационной терапии на 0 неделе, перед неделями 19 и 30, и в конце терапии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: показатели фракции укорочения, фракции выброса и конечно-систолического напряжения стенки должны быть документально зафиксированы перед введением первой дозы #доксорубицина** всем пациентам, которые планируют получать #доксорубицин**, т.е. пациентам с IV стадией заболевания и гистологической группой высокого риска НБ перед началом терапии для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой системы и оценки рисков лечения, определения безопасной тактики лечения рекомендуется выполнение эхокардиографии.
- Рекомендовано проведение нижеперечисленных методов аудиологического тестирования на 1 неделе терапии и в конце терапии у детей, получавших в ходе лечения платиносодержащие препараты (#карбоплатин**) для выявления тугоухости, вызванной ототоксическим действием лекарственных препаратов с возможным использованием следующих методов [33; 56; 57]:
- Тональная аудиометрия в стандартном и расширенном диапазоне частот до 16 - 20 кГц (методика определения тональных порогов слуха зависит от возраста и уровня развития ребенка: аудиометрия со зрительным подкреплением от 6 до 24 мес., игровая аудиометрия от 2 до 5 лет или стандартная аудиометрия от 5 лет). Регистрация отоакустической эмиссии (Исследование вызванной отоакустической эмиссии) на частоте продукта искажения в диапазоне частот до 8 - 10 кГц.
- Импедансометрия.
- Регистрация коротколатентных и тоно-специфичных слуховых вызванных потенциалов (Регистрация вызванных акустических ответов мозга на постоянные модулированные тоны (ASSR тест)) для детей раннего возраста при отсутствии отоакустической эмиссии и невозможности проведения тональной пороговой аудиометрии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: объем возможного акустического обследования зависит от оснащенности стационара.
Желательные сроки проведения аудиологического тестирования:
- Базовое тестирование перед началом лечения.
- Через 4 - 6 недель после завершения лечения (последнего введения #карбоплатина**).
- 1 - 2 раза в год в течение 3 - 5 лет после завершения лечения для пациентов с нормой слуха.
При выявлении тугоухости пациент направляется к врачу-оториноларингологу (врачу-сурдологу-оториноларингологу) для определения индивидуальной программы наблюдения, лечения, реабилитации.
2.5 Иные диагностические исследования
- Пациентам с подозрением на НБ рекомендовано проведение биопсии с последующим патолого-анатомическим исследованием биопсийного (операционного) материала в случае невозможности исключения других опухолей почки/экстрапочечной этиологии на основании данных визуализации и клинической картины, а именно в следующих случаях [33; 58; 59]:
- наблюдается необычная клиническая картина: Возраст > 6 лет (риск опухолей почки другой этиологии); имеется инфекция мочеполовых путей или септицемия (подозрение на абсцесс); инфильтрация поясничной мышцы (подозрение на нейробластому); наличие метастазов в легких у пациентов младше 2 лет, экстрапеченочные и экстрапульмональные метастазы (подозрение на ЗРО почки);
- есть необычные находки по результатам визуализации: многочисленные кальцинаты (подозрение на нейробластому); обширная лимфаденопатия (подозрение на ЗРО), паренхима почек не визуализируется; практически полностью экстраренальный процесс.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: трепан-биопсия не должна применяться в случаях, если возраст пациента 6 месяцев и младше, в данной ситуации предусмотрена первичная хирургическая операция, а также при наличии опухоли, представленной только кистозным компонентом (следует рассмотреть возможность проведения первичной хирургической операции, высок риск разрыва капсулы опухоли в процессе биопсии). Проведение открытой биопсии не рекомендовано. Открытая биопсия опухоли почки в постхирургическом стадировании трактуется как 3 стадия и требует проведения локальной лучевой терапии (см. раздел 3.3 Лучевая терапия).
У пациентов с кистозным вариантом опухоли высок риск разрыва капсулы опухоли в процессе биопсии.
Сводные рекомендации к проведению диагностической пункционной биопсии новообразований почек у пациентов без генетической предрасположенности представлены в таблице 3 [60].
Таблица 3. Сводные рекомендации к проведению диагностической пункционной биопсии новообразований почек у пациентов без генетической предрасположенности [60]
Биопсия не требуется (все критерии НБ соблюдены)
Биопсия НЕ рекомендуется при ЛЮБОМ из этих критериев
Биопсия РЕКОМЕНДУЕТСЯ при ЛЮБОМ из этих критериев
ЛЮБОЙ из этих критериев требует обсуждения коллегиально
Клинические критерии
Возраст 6 мес. - 7 лет;
Отсутствие инфекции.
Возраст до 3 мес. (первичная операция).
Возраст 10 лет и старше;
Возраст 7 - 10 лет, объем опухоли < 200 мл.
Возраст 3 - 6 мес.;
Инфекционный синдром;
Инфекция мочевыводящих путей.
Радиологические критерии
Почка;
Односторонняя опухоль;
Солидная или солидно-кистозная структура;
Нет кальцинатов;
Метастазы отсутствуют или только в легких и возраст старше 2 лет.
Полностью кистозная опухоль (первичная операция, если показано);
Двусторонние опухоли почки и/или
Нефробластоматоз (возраст 6 мес. - 7 лет, предполагаемая химиотерапия).
Возможно, не почка;
Атипичные
метастазы:
- Кости (любой возраст)
- ЦНС (любой возраст)
- Легкие (до 2 лет).
Кальцинаты;
Объем опухоли менее 80 мл;
Большая некротическая аденопатия;
Двусторонние опухоли почек, возраст 7 лет или старше.
Биохимические критерии
Уровень катехоламинов мочи в норме;
Уровень кальция в крови в норме;
ЛДГ менее 4х норм.
Уровень катехоламинов мочи выше нормы;
Гиперкальциемия и возраст < 4 лет.
ЛДГ выше 4х норм.
- Рекомендовано в целях подтверждения диагноза и для принятия решения о тактике адъювантной терапии выполнение патолого-анатомического исследования операционного материала во всех случаях [33; 39].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: референс должен осуществляться в сроки до 2-х недель от оперативного вмешательства для принятия решения о тактике адъювантной терапии.
- Всем пациентам с ЗНО почки рекомендована консультация врача-диетолога с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей в целях обеспечения адекватной и своевременной нутритивной поддержки (см. раздел 7.2) [61]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- При наличии у пациента с ЗНО почки стигм дисэмбриогенеза и врожденных пороков развития, особенно урогенитального тракта, аниридии, макросомии, гемигипертрофии, а также при подозрении на билатеральное поражение, рекомендована консультация врача-генетика (прием (осмотр, консультация) врача-генетика первичный), так как генетические синдромы встречаются в 5 - 10% случаев НБ и в основном представляют собой сочетание опухоли с пороками развития мочеполовой системы, нефропатию, макросомию [10; 11; 12; 39; 41].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с ЗРО почки рекомендована консультация врача-генетика для определения показаний и объема проведения молекулярно-генетического обследования, так как в 30% случаев ЗРО почки развивается на фоне синдромов предрасположенности (СПЗРО1 и СПЗРО2 типов) [16; 17; 18]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с ЗНО почки с коморбидностью, которая может повлиять на выбор тактики противоопухолевого лечения, перед началом терапии рекомендуется прием (осмотр, консультация) первичная соответствующего врача-специалиста (врача-детского кардиолога, врача-невролога, врача-офтальмолога и др.) [41; 44].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: пациенты с подозрением на генетические синдромы должны быть осмотрены узкими специалистами в зависимости от органов-мишеней (например, пациенты с подозрением на WAGR-синдром и аниридией должны быть консультированы врачом-офтальмологом) [41].
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Терапия ЗНО почки базируется на химиотерапии и оперативном лечении. Очень небольшая часть пациентов нуждается в лучевой терапии. Выбор тактики лечения зависит от гистологического типа опухоли и группы риска, стадии заболевания и возраста пациента [33; 64].
- Пациентам с ЗНО почки младше 7 месяцев или пациентам старше 16 лет, а также пациентам с кистозным вариантам опухоли в качестве первого этапа лечения рекомендовано хирургическое вмешательство [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: У детей младше 7 месяцев чаще всего наблюдается врожденная мезобластная нефрома, для излечения которой достаточно лишь хирургического вмешательства.
У пациентов старше 16 лет необходимо исключить почечно-клеточную карциному, требующую проведения первичной операции во всех случаях, когда это возможно.
У пациентов с кистозным вариантом опухоли высок риск разрыва капсулы опухоли в процессе биопсии.
- Всем пациентам младше 18 лет с ЗНО почки в период лечения при развитии анемического синдрома, кровотечения, высокого риска геморрагического синдрома рекомендуется проведение гемотрансфузионной поддержки препаратами крови [62].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам младше 18 лет с ЗНО почки на период лечения в целях лечения и профилактики тошноты и рвоты, обусловленных проведением противоопухолевой терапии, рекомендуется оценивать уровень эметогенности лекарственных препаратов, проводить лечение и профилактику тошноты и рвоты с использованием лекарственных препаратов (см. раздел 5.1) [63].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
3.1 Неоадъювантная химиотерапия
- Всем пациентам с верифицированным ЗНО почки, которым на первом этапе лечения не была показана операция, рекомендовано проведение предоперационной (неоадъюватной) химиотерапии [33; 64; 65].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При локализованной форме ЗНО почки (стадии I - III) рекомендована неоадъювантная химиотерапия в режиме AV, 4 недели: #винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3 недели (см. приложение А3.1) [33; 64; 66].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: максимальная разовая доза #винкристина** 2 мг. #Дактиномицин не применяется у детей весом менее 5 кг и менее 3 месяцев жизни. Редукция доз препаратов в зависимости от возраста представлена в таблицах 15 и 16. Хирургическое лечение проводится на 5 - 6-й неделе. В случае задержки операции, рекомендуется введение дополнительного #винкристина** [9; 38].
- При метастатической форме ЗНО почки (стадия IV) рекомендована неоадъювантная химиотерапия в режиме AVD, 6 недель: #винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5 и 6 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3 и 5 недели; доксорубицин** 50 мг/м2/сут, 2 - 6 часовая инфузия - 1, 5 недели (см. приложение А3.1) [33; 64; 66].
Для опухоли Вильмса - Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Для злокачественной рабдоидной опухоли почки (ЗРО почки), светлоклеточной саркомы почки (СКС почки), мезобластной нефромы (ВМН) - Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Максимальная разовая доза #винкристина** 2 мг. #Дактиномицин не применяется у детей весом менее 5 кг и менее 3 месяцев жизни. Редукция доз препаратов в зависимости от возраста представлена в таблицах 15 и 16. Хирургическое лечение проводится на 7 - 8-й неделе. В случае задержки операции, рекомендуется введение дополнительного #винкристина** [9; 38].
- Пациентам, у которых диагноз ЗРО почки или СКС почки был поставлен на основании результатов толстоигольной биопсии, показано начало неоадъювантной химиотерапии в рамках схем лечения в соответствии с гистологическим типом (см. раздел 3.3) [16; 33; 51].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Редукция доз препаратов в зависимости от возраста представлена в таблице 16. Хирургическое лечение проводится через 1 - 2 курса терапии.
3.2 Хирургическое лечение
3.2.1 Рекомендации по хирургическому лечению первичного очага
- Всем пациентам с унилатеральной ЗНО почки после неоадъювантной терапии рекомендовано проведение нефруретерэктомии [33; 65; 67; 68; 69];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам, у которых диагноз ЗРО почки или СКС почки был поставлен на основании результатов толстоигольной биопсии, показано проведение хирургического лечения через 1 - 2 курса неоадъювантной химиотерапии в рамках схем лечения в соответствии с гистологическим типом [16; 33; 51];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с предположительным диагнозом ВМН почки полная нефрэктомия является предпочтительным методом лечения при локализованном заболевании и должна проводиться согласно общим рекомендациям по хирургическому лечению, приведенным выше. Необходимо всегда удалять околопочечный жир, поскольку врожденная мезобластная нефрома имеет склонность к инфильтрации окружающих тканей. В случае неполной резекции опухоли или неполного удаления околопочечного жира необходимо провести повторную резекцию. Метастазэктомия рекомендуется в исключительных случаях при наличии солитарных метастазов [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при проведении нефрэктомии руководствоваться следующими принципами:
- Срединная или поперечная лапаротомия в качестве хирургического доступа.
- Проведение ревизии брюшной полости выполняется до нефрэктомии. Необходимо исследовать печень, лимфатические узлы и брюшину на предмет метастатического поражения и внутрибрюшных метастазов. Любое подозрительное в отношении опухоли новообразование иссекается или выполняется биопсия при ее нерезектабельности. Это касается и биопсии лимфатических узлов, даже, если они макроскопически выглядят непораженными.
- Нефрэктомию целесообразно начинать с лигирования почечных сосудов. Почечная артерия перевязывается первой с целью предотвращения разрыва опухоли из-за ее хрупкости и возможности диссеминации через перинефральные перфорантные вены. В протоколе операции регистрируются этапы мобилизации. Если опухоль больших размеров и доступ к сосудам затруднен, то вначале производят ее выделение из окружающих тканей, а сосуды лигируются по возможности.
- Пересечение мочеточника производится максимально близко к мочевому пузырю;
- Удалять опухоль почки целесообразно с окружающей клетчаткой и пораженными структурами;
- Необходимо тщательное исследование контралатерального ретроперитонеального пространства при билатеральном поражении;
- Необходима тщательная ревизия почечной вены и нижней полой вены (НПВ) во время операции - непротяженный тромб почечной вены резецируется вместе с веной. Тромбы инфрапеченочного сегмента НПВ удаляются через венотомию. При наличии большого тромба и инфильтрации стенки НПВ выполнение радикального удаления невозможно, в послеоперационном периоде эта область должна быть включена в поле облучения [65; 68].
- Всем пациентам с ЗНО почки рекомендована биопсия лимфатических узлов с последующим патолого-анатомическим исследованием для корректного стадирования и назначения адекватной последующей терапии [33; 65; 69; 70].
Для опухоли Вильмса (НБ) - Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Для злокачественной рабдоидной опухоли почки (ЗРО почки), светлоклеточной саркомы почки (СКС почки), мезобластной нефромы (ВМН) - Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: лимфатические узлы ворот почки, почечной артерии у места ее отхождения от аорты (регионарные узлы), верхние и нижние парааортальные (экстрарегионарные) должны быть направлены на патолого-анатомическое исследование даже если выглядят неизмененными. Лимфатические узлы должны быть удалены без нарушения их целостности. Каждый удаленный лимфоузел должен быть маркирован с описанием точного расположения и послан врачу-патологоанатому отдельно. На исследование должно быть взято не менее 7 лимфатических узлов.
- Всем пациентам с ЗНО почки нефруретерэктомия с использованием видеоэндоскопических технологий рекомендована при соблюдении следующих критериев [33; 65; 67; 71; 74; 75]:
- объемные образования в почке, размерами не превышающие объем здоровой почки, без видимых на МРТ/КТ увеличенных контралатеральных лимфоузлов;
- резекция должна быть проведена в соответствии с онкологическими принципами и включать биопсию лимфатических узлов;
- наличие центрально расположенных опухолей с четкой границей с "нормальной" тканью почки, окружающей опухоль;
- извлечение опухоли должно быть произведено посредством мешка без повреждения капсулы опухоли через адекватное отверстие в брюшной стенке не только для профилактики диссеминации опухоли, но и для обеспечения адекватного стадирования;
- если возможно проведение органосохраняющей операции - необходимо ее проведение путем лапаротомии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Малоинвазивные и органосохраняющие операции должны проводиться в федеральных центрах, имеющих опыт проведения подобных операций [65; 72]!
Во всех возможных случаях проведения лапароскопической радикальной нефрэктомии необходимо получение мнения специалиста референсного хирургического центра, так же подтверждающего необходимость направления пациента для проведения лапароскопической операции в центр, сотрудники которого имеют соответствующий опыт.
Противопоказания к проведению лапароскопической нефрэктомии [33]:
- Опухоль, инфильтрирующая экстраренальные структуры или распространяющаяся за ипсилатеральную границу позвоночного столба;
- Тромб в почечной или полой вене;
- Расположение опухоли на периферии почки, при которой невозможно проведение органосохраняющей операции;
- Опухоль, не отвечающая на химиотерапию, ввиду риска разрыва капсулы опухоли;
- Отсутствие достаточного опыта проведения лапароскопической нефрэктомии.
- Проведение органосохраняющего хирургического вмешательства рекомендовано при унилатеральной нефробластоме, без генетической предрасположенности, при соблюдении следующих критериев [33; 65; 67; 72; 73]:
- Опухоль, ограниченная одним полюсом почки или расположенная на периферии почки;
- Объем опухоли менее 300 мл на момент постановки диагноза (риск наличия метастатического поражения регионарных лимфоузлов около 2%);
- Отсутствие данных за инициальный разрыв капсулы опухоли;
- Отсутствие вовлечения в процесс лоханки;
- Отсутствие инвазии в окружающие органы;
- Отсутствие тромба в почечной или полой венах;
- Отсутствие мультифокального характера опухоли;
- Органосохраняющая операция возможна только с соблюдением онкологических правил безопасного отступа от края опухоли;
- Ожидается, что остаточная паренхима почки будет достаточной для адекватного функционирования;
- Необходимо сохранить не менее 66% почечной паренхимы после резекции опухоли для исключения гиперперфузии. Для определения функционального резерва почки необходимо проведение предоперационного радиоизотопного исследования.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Резекция почки возможна и при унилатеральном поражении почки, однако необходимо четко оценивать преимущества данного хирургического метода (процент оставшейся паренхимы почки, риск возникновения локального рецидива).
Преимущества от проведения органосохраняющих операций могут быть получены при наличии урологических и нефрологических нарушений в контралатеральной почке, а также при наличии генетических синдромов, ассоциированных с риском развития НБ (что повышает риск возможной операции на контрлатеральной почке в случае развития метахронной опухоли).
Энуклеация (резекция опухоли без неизмененной почечной паренхимы) не является надлежащей локальной терапией. В случае неполной резекции с микроскопической остаточной опухолью проведение дальнейшей локальной терапии зависит от ряда факторов и должно быть вынесено на обсуждение с многопрофильной группой специалистов. Однако, полная нефрэктомия при неблагоприятных подтипах ренальных опухолей (в частности, ЗРО почки и СКС почки) представляется необходимой.
Положительные ЛУ при патологическом исследовании после проведения органосохраняющих операций указывают на необходимость проведения лучевой терапии, но не обязательно нефрэктомии.
После резекции почки следует осуществлять тщательный последующий мониторинг функционального состояния (краткосрочный и долгосрочный): допплерография почечных сосудов через 2 дня после операции. Спустя 6 месяцев следует оценить функциональный резерв сохраненной почечной ткани по реносцинтиграфии. Необходимо проводить оценку клиренса креатинина, исключение ренальной гипертензии, признаков почечной недостаточности. Эта информация важна для определения наличия или отсутствия потенциальных преимуществ органосохраняющей операции для функции почек в отсроченном периоде.
Нефробластоматоз в почечной паренхиме в препарате, полученном при органосохраняющей операции, может способствовать развитию метахронной нефробластомы в оставшейся почке. Следует осуществлять тщательное наблюдение за этими пациентами.
3.2.2 Рекомендации по хирургическому лечению метастазов
- Всем пациентам с ЗНО почки метастазэктомия рекомендуется проводить после нефрэктомии и после 1 - 2 курсов послеоперационной ПХТ [65; 71].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЗНО почки при метастазировании опухоли в легкие при наличии возможности рекомендуется хирургическое удаление метастазов [33; 65; 71].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: торакоскопия может быть применима только при субплевральном расположении метастазов. Предпочтение отдается торакотомии. Предпочтительно - клиновидная резекция с достижением "чистых" краев резекции. Если путем клиновидной резекции не достичь радикального удаления, возможно проведение сегмент- или лобэктомии. Пульмонэктомия не оправдана.
Метастазы в печень
- Всем пациентам с ЗНО почки для изолированных метастазов в печень рекомендуется проведение клиновидной резекции [40; 65; 71].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Не рекомендуется проведение обширных и потенциально калечащих резекций до изучения вопроса о возможности проведения дальнейшей химиотерапии [33; 65; 71].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: метастазы в других местах должны быть радикально удалены без калечащих операций.
3.3 Послеоперационная терапия
Послеоперационное лечение зависит от гистологического типа и объема опухоли после неоадъювантной химиотерапии, стадии процесса, и основано на рекомендациях SIOP (НБ, СКС почки) и EU-RHAB (ЗРО почки) [16; 33; 64].
3.3.1 Адъювантная терапия для локализованной НБ
Послеоперационную ХТ целесообразно начать в течение 2-х недель после оперативного лечения. Объем послеоперационной терапии при локализованной форме заболевания - см. табл. 4.
Таблица 4. Объем послеоперационной терапии при локализованной форме заболевания
Стадия процесса
Стадия I
Стадия II
Стадия III
Группа риска
Объем опухоли (мл) после неоХТ
Низкий риск (только ТН)
Любой
Лечение закончено
AV2
AV2
Промежуточный риск
< 500
AV1
AV2
AV2 + ЛТ
Промежуточный риск <*>
> 500
AV1
AVD
AVD + ЛТ
Высокий риск, бластемный тип
Любой
AVD
HR-1
HR + ЛТ
Высокий риск, диффузная анаплазия
Любой
AVD
HR-1 + ЛТ (фланк+)
HR-1 + ЛТ
--------------------------------
ТН - тотальный некроз; A - #Дактиномицин; V - Винкристин**; D - Доксорубицин** (кумулятивная доза 250 мг/м2); HR - блоковая химиотерапия; ЛТ - лучевая терапия.
<*> - кроме стромального и эпителиального подтипов (лечение не зависит от размера опухоли: AV1 - при стадии I и AV2 при стадии II); + - фланк - половина брюшной полости
- Адъювантная терапия рекомендована следующим категориям пациентов с локализованной НБ (режимы терапии - см. приложение А3.1) [33; 40; 64]:
- I стадия, группа промежуточного риска - по режиму AV1, 4 недели химиотерапии: винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2 неделя.
- I стадия, группа высокого риска - по режиму AVD - 27 недель химиотерапии: винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели; доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2, 8, 14, 20, 26 недели;
- II/III стадии, группы низкого и промежуточного риска - по режиму AV-2: винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели или AVD - 27 недель химиотерапии: винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели; доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2, 8, 14, 20, 26 недели (см. комментарии);
- II/III стадии, группа высокого риска - по режиму HR-1 - 34 недели химиотерапии: 1 курс - циклофосфамид** + доксорубицин** (всего 6 курсов): циклофосфамид** 450 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 1, 7, 13, 19, 25, 31; доксорубицин** 50 мг/м2/сут в/в капельно за 2 - 6 часов - 1 день, в недели 1, 7, 13, 19, 25, 31; 2 курс - #этопозид** + #карбоплатин** (всего 6 курсов): #этопозид** 150 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 16, 22, 28, 34; #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 16, 22, 28, 34.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: адъювантная терапия не проводится для пациентов I стадии из группы низкого риска (тотальный некроз). Наличие тотально-некротизированного типа должно быть подтверждено пересмотром гистологического материала в условиях референс-центра.
Большая часть пациентов II/III стадии, группы низкого и промежуточного риска получает терапию по схеме AV-2, у пациентов, имеющих гистологический тип опухоли фокальная анаплазия, смешанный или регрессивный, и объем опухоли после завершения неоадъювантной химиотерапии > 500 мл, в режим AV-2 добавляют доксорубицин** (лечение по режиму AVD, как для опухолей стадии I высокого риска).
Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии. #Дактиномицин не применяется у детей весом менее 5 кг и до 3 месяцев жизни. Редукция доз препаратов в зависимости от возраста представлена в таблицах 15 и 16.
Циклофосфамид** вводится на фоне введения Месны**, дозы которой рассчитываются согласно инструкциям ГРЛС, а именно, для данной дозы химиопрепарата - 90 мг/м2/сут в/в болюсно непосредственно перед введением циклофосфамида** и 360 мг/м2/сут в/в капельно за 24 часа - 1, 2, 3 дни в недели 1, 7, 13, 19, 25, 31.
3.3.2 Адъювантная терапия для генерализованной НБ [33]:
Послеоперационная химиотерапия проводится в зависимости от гистологического типа опухоли и ответа первичного очага и метастазов на предоперационное лечение - см. табл. 5.
Таблица 5. Оценка метастазов перед проведением операции
Целевое поражение (>= 5 мм)
Нецелевое поражение (первоначально < 3 мм) <*>
Общий ответ
ПО
ПО
ПО
Отсутствие поражений > 2 мм и отсутствие новых поражений
нет ПРЗ или СБЗ, отсутствие новых поражений
ОХЧО
Ответ > 30% и отсутствие новых поражений
нет ПРЗ и новых поражений
ЧО
СБЗ и отсутствие новых поражений
нет ПРЗ и новых поражений
СБЗ
Увеличение > 20% или появление новых поражений
ПРЗ или появление новых поражений
ПРЗ
--------------------------------
<*> В случае с целевыми поражениями размером 3 - 5 мм, единственными вариантами ответа являются полный ответ (ПО) и неполный ответ (не-ПО).
Сокращения: ПО - полный ответ, ЧО - частичный ответ, ОХЧО - очень хороший частичный ответ, ПРЗ - прогрессирование заболевания, СБЗ - стабилизация заболевания.
Послеоперационная химиотерапия при размерах легочных очагов менее 3 мм:
- Пациентам с генерализованной НБ с исходными легочными очагами менее 3 мм в случае исчезновения очагов (на КТ) после предоперационной ХТ лечение рекомендовано проводить в соответствии с локальной стадией и гистологическим подтипом [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с генерализованной НБ с исходными легочными очагами менее 3 мм в случае сохранения очагов в легких рекомендовано их полное хирургическое удаление (если возможно), или хотя бы резекция наиболее крупного очага для последующего патолого-анатомического исследования и принятие решения о дальнейшей тактике лечения (схемы терапии - см. приложение А3.1) [33; 64]:
- если при патолого-анатомическом исследовании удаленных метастазов не выявляется живой опухолевой ткани или тотального некроза - проводится лечение в соответствии с локальной стадией и гистологическим подтипом;
- если по гистологии сохраняется витальная опухоль или отмечается тотальный некроз - лечение по программе AVD 250 (см. приложение А3.1). При сохранении микрометастазов на 10 неделе послеоперационного лечения - показано тотальное облучение обоих легких;
- при выявлении диффузной анаплазии - показано тотальное облучение легких в случае, если метастазы гистологически подтверждены;
- если биопсия невозможна - продолжение химиотерапии в соответствии с гистологическим подтипом (как минимум, AV2), независимо от стадии. Оценка динамики очагов в легких на 10 неделе послеоперационной терапии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с генерализованной НБ с исходными легочными очагами менее 3 мм в случае увеличения размеров метастазов по КТ, рекомендована резекция хотя бы одного узла для последующего патолого-анатомического исследования операционного материала и принятие решения о дальнейшей тактике лечения (схемы терапии - см. приложение А3.1) [33; 64]:
- Если при гистологическом исследовании удаленных метастазов не выявляется живой опухолевой ткани или тотального некроза - проводится лечение в соответствии с локальной стадией и гистологическим подтипом (минимум AV2);
- Если по гистологии сохраняется витальная опухоль или выявляется тотальный некроз - лечение по программе AVD. При сохранении микрометастазов на 10 неделе послеоперационного лечения - показано тотальное облучение обоих легких;
- При выявлении диффузной анаплазии - показано тотальное облучение легких в случае, если метастазы гистологически подтверждены;
- Если биопсия невозможна - продолжение химиотерапии в соответствии с гистологическим подтипом (не менее AVD), независимо от стадии. Контрольное обследование на 10 неделе.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Послеоперационная химиотерапия при наличии легочных очагов более 3 мм:
- Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм группы А (метастазы (очаги) отсутствуют или полностью удалены) с гистологическими подтипами низкого и промежуточного риска рекомендованы следующие терапевтических подходы, в зависимости от размеров метастазов и гистологического подтипа опухоли (схемы терапии - см. приложение А3.1) [33; 64]:
- А1. Легочные узлы более 3 мм, но менее 5 мм в момент диагностики с гистологией низкого или промежуточного риска: лечение режимом AVD 150. Если при гистологическом исследовании выявляется живая опухолевая ткань - показано тотальное облучение легких;
- А2. Легочные узлы более 5 мм в момент диагностики и с гистологией низкого или промежуточного риска: лечение режимом AVD 250. Если при гистологическом исследовании выявляется живая опухолевая ткань - показано облучение легких;
- А3. Полное хирургическое удаление узлов и не получено гистологического подтверждения о наличии метастазов (не выявлена витальная опухоль или тотальный некроз) - лечение по локальной стадии и в соответствии с гистологическим подтипом.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм группы B (локальной стадии I/II/III с гистологией низкого риска с множественными нерезектабельными очагами или неполностью удаленными хирургически очагами) рекомендованы следующие терапевтических подходы, в зависимости от результатов оперативного вмешательства и патолого-анатомического исследования (схемы терапии - см. приложение А3.1) [33; 64]:
- Если гистологически не доказано наличие метастазов (исключены витальные метастазы и тотальный некроз) - лечение по локальной стадии;
- Если гистологически нет живой опухолевой ткани, но выявлен тотальный некроз - лечение по режиму AVD 250, 27 недель химиотерапии: винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели; доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2, 8, 14 недели. Оценка динамики по данным КТ ОГП проводится на 10 неделе. В случае сохранения очагов - рекомендуется полное хирургическое удаление. Тотальное облучение легких не проводится;
- Если гистологически выявляется живая опухолевая ткань - лечение по режиму AVD 250, 27 недель химиотерапии: винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели; доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2, 8, 14 недели, с облучением легких;
- Если легочные очаги не могут быть резецированы - лечение по режиму AVD 250. Если при обследовании на 10 неделе послеоперационной ХТ легочные очаги все еще определяются - повторная биопсия. Дополнительно - облучение легких, поскольку легочные узлы могут быть с гистологией не низкого риска.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: редукция доз препаратов в зависимости от возраста представлена в таблице 16. При необходимости облучения ложа опухоли и легких целесообразно проводить лучевую терапию одновременно для предотвращения перекрытия полей облучения. В связи с этим лучевая терапия может быть отложена до 10 недели. #Дактиномицин не применяется у детей весом менее 5 кг и до 3 месяцев жизни. Редукция доз препаратов в зависимости от возраста представлена в таблице 16.
- Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм группы C (локальной стадии I/II/III с гистологией промежуточного риска с множественными нерезектабельными очагами или неполностью удаленными хирургически очагами) рекомендованы следующие терапевтических подходы, в зависимости от результатов оперативного вмешательства и патолого-анатомического исследования (схемы терапии - см. приложение А3.1) [33; 64]:
- Если гистологически не доказано наличие метастазов (отсутствуют витальные метастазы или тотальный некроз) - лечение в соответствии с локальной стадией, но, если множественные узлы в легких исчезли после предоперационной химиотерапии AVD, а оставшиеся узлы признаны незлокачественными - продолжение терапии по режиму AVD 250;
- Если гистологически не найдено живой опухолевой ткани, но присутствует тотальный некроз - лечение по режиму AVD 250 в течение 27 недель. Если на 10 неделе послеоперационной ХТ легочные узлы персистируют - повторная резекция или облучение легких. При выявлении жизнеспособной опухолевой ткани - облучение легких;
- Если гистологически в удаленных узлах выявляется живая опухолевая ткань - переход на лечение по HR2, 34 недели химиотерапии: 1 курс - циклофосфамид** + доксорубицин** (всего 4 курса): циклофосфамид** 450 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 1, 7, 19, 31; доксорубицин** 50 мг/м2/сут в/в капельно за 2 - 6 часов - 1 день, в недели 1, 7, 19, 31; 2 курс - #этопозид** + #карбоплатин** (всего 8 курсов): #этопозид** 150 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 13, 16, 22, 25, 28, 34; #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 13, 16, 22, 25, 28, 34, с тотальным облучением легких, независимо от состояния легких на 10 неделе лечения;
- Если легочные узлы не могут быть резецированы - проведение терапии по HR2 и облучение легких, при сохранении очагов на 10 неделе;
- Если метастатические очаги в других кроме легких и печени местах не могут быть радикально удалены, они должны подвергнуться облучению, независимо от ответа на химиотерапию;
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Редукция доз препаратов в зависимости от возраста представлена в таблицах 15 и 16. Циклофосфамид** вводится на фоне введения Месны** 90 мг/м2/сут в/в болюсно непосредственно перед введением циклофосфамида** и 360 мг/м2/сут в/в капельно за 24 часа - 1, 2, 3 дни в недели 1, 7, 13, 19, 25, 31. Данная схема введения месны и дозы рассчитаны согласно инструкциям ГРЛС, а именно, для данной дозы химиопрепарата.
Пациенты с локальной стадией III получают лучевую терапию на соответствующую половину брюшной полости. Лучевая терапия может быть отложена до 10 недели (оценка персистирующих очагов) для комбинации с тотальным облучение легких, если это необходимо (для избежания наложения полей облучения).
- Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм группы D (с гистологией высокого риска независимо от степени распространения) рекомендована консультация с экспертами федерального профильного центра для индивидуального подбора терапии пациента [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.3.3 Адъювантная терапия для пациентов с НБ после первичного оперативного вмешательства без неоадъюватной (предоперационной) химиотерапии
- Пациентам с НБ низкого гистологического риска, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, не рекомендовано проведение послеоперационной химиотерапии [33; 76; 77; 78; 79; 80].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: в случае стадии III необходима консультация федерального/национального центра для получения дальнейших рекомендаций.
- Пациентам с НБ промежуточного гистологического риска (за исключением фокальной анаплазии), стадия I, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение послеоперационной химиотерапии по схеме Режим 1 (интенсивный VCR): винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 недели (всего 10 доз) - см. приложение А3.1 [76; 77; 78; 79; 80].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 14 дней от оперативного вмешательства. Младенцам и детям весом < 12 кг следует вводить полную дозу винкристина**, если используется только один этот препарат и не наблюдается признаков токсичности. В случае токсических явлений последующая доза должна быть уменьшена на 50%, после чего дозы можно осторожно увеличивать (при хорошей переносимости).
- Пациентам с НБ промежуточного гистологического риска (фокальная анаплазия), стадия I и промежуточного гистологического риска стадия II, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение послеоперационной химиотерапии по схеме Режим 2 (AV): винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, далее 14, 17, 20, 23 и 26 недели (всего 16 доз); #дактиномицин 45 мкг/кг/сут, в/в в 2, 5, 8, 11, 14, 17, 20, 23 и 26 недели (всего 9 доз) - см. приложение А3.1 [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 14 дней от оперативного вмешательства. Младенцы и дети весом < 12 кг получают терапию в возрастных дозировках (Редукция доз препаратов в зависимости от возраста представлена в таблицах 15 и 16). Применение #дактиномицина должно быть обсуждено в этой группе с федеральным центром.
- Пациентам с НБ промежуточного гистологического риска стадия III, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение послеоперационной химиотерапии по схеме Режим 3 (AVD): винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, далее 13, 16, 19, 22, 25 и 28 недель (всего 16 доз); #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2/3 дозы на неделе 2, затем полная доза на неделях 10, 16, 22, 28 (всего 5 доз); доксорубицин** 50 мг/м2/сут, в/в капельно 4 - 6 часовая инфузия - на 7, 13, 19, 25 неделе) - см. приложение А3.1 [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 14 дней от оперативного вмешательства. Младенцы и дети весом < 12 кг получают терапию в возрастных дозировках (Редукция доз препаратов в зависимости от возраста представлена в таблицах 15 и 16). Применение #дактиномицина должно быть обсуждено в этой группе с федеральным центром.
- Пациентам с НБ стадии IV, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение терапии по следующей схеме [33]:
- послеоперационная химиотерапия согласно "предоперационной" химиотерапии, схема AVD 6 недель - см. приложение А3.1;
- оценка ответа со стороны метастазов на неделе 6 с помощью КТ органов грудной полости;
- последующая химиотерапия в зависимости от того, была ли достигнута полная ремиссия со стороны метастазов с помощью химиотерапии +/- хирургического вмешательства, в соответствии с основными рекомендациями по адъювантной терапии для генерализованной НБ, см. приложение А3.3.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Опухоли с преобладанием бластемного компонента после первичной хирургической операции относятся к группе промежуточного риска.
- Пациентам с НБ I - IV стадии с гистологическим типом "диффузная анаплазия", группы высокого риска, независимо от локальной стадии процесса рекомендовано проведение послеоперационной химиотерапии в соответствии с рекомендациями по адъювантной терапии для высокой группы риска (для пациентов с локализованной стадией - режим HR-1 - 34 недели химиотерапии, для пациентов с генерализованной стадией - режим HR-2 - 34 недели химиотерапии) - см. приложение А3.1 [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: лучевая терапия брюшной полости назначается пациентам с локальными абдоминальными стадиями II и III. Лучевая терапия легких проводится всем пациентам с опухолями IV стадии с легочными метастазами, независимо от ответа метастазов на химиотерапию/хирургическое вмешательство.
3.3.4 Адъювантная терапия для ЗРО почки
Всем пациентам с ЗРО почки независимо от формы и стадии процесса показано проведение адъювантной химиотерапии согласно рекомендациям EU-RHAB [16].
- Всем пациентам показано проведение: 9 курсов интенсивной химиотерапии с интервалом в 14 дней: 1 курс - #доксорубицин** (всего 3 курса): #доксорубицин** 37,5 мг/м2/сут в/в капельно за 24 часа - 1, 2 дни, в недели 1, 7, 13; 2 курс - #ифосфамид** + #карбоплатин** + #этопозид** (всего 3 курса): #ифосфамид** 2000 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 3, 9, 15; #карбоплатин** 500 мг/м2/сут в/в капельно за 1 час - 1 день, в недели 3, 9, 15; #этопозид** 100 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 3, 9, 15; 3 курс - #винкристин** + #циклофосфамид** + #дактиномицин (всего 3 курса): #винкристин** 1,5 мг/м2/сут в/в болюсно - 1, 8 дни, в недели 5, 11, 17; #дактиномицин 25 мкг/кг/сут в/в болюсно - 1, 2 дни, в недели 5, 11, 17; #циклофосфамид** 1500 мг/м2/сут в/в капельно за 1 час - 1 день, в недели 5, 11, 17 - схемы терапии - см. приложение А3.1.
- Пациентам с локализованной формой заболевания в случае невозможности проведения радикального хирургического вмешательства (стадия III) с сохранением макроскопически остаточной опухоли после 9 курсов интенсивной химиотерапии рекомендована консультация в Федеральных национальных центрах с определением показаний к проведению метрономной химиотерапии, 6 курсов по 28 дней [50]: #циклофосфамид** 25 мг/м2/сут перорально - дни 1 - 28 без перерыва, недели 1, 5, 9, 13, 17, 21; #винорелбин** 25 мг/м2/сут в/в за 5 - 10 минут, недели 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23 - см. приложение А3.1.
- Пациентам с метастатической формой заболевания после 9 курсов интенсивной химиотерапии рекомендована консультация в Федеральных национальных центрах с определением показаний к проведению метрономной химиотерапии, 6 курсов по 28 дней [50]: #циклофосфамид** 25 мг/м2/сут перорально - дни 1 - 28 без перерыва, недели 1, 5, 9, 13, 17, 21; #винорелбин** 25 мг/м2/сут в/в за 5 - 10 минут, недели 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23 - см. приложение А3.1.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии:
Максимальная разовая доза #винкристина** 2 мг. Первое введение #винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии.
Доза #Дактиномицина у детей младше 1 года и/или весом менее 10 кг редуцируется на 1/3. В случае хорошей переносимости, в последующих курсах доза препарата может быть увеличена до долженствующей. Редукция доз препаратов в зависимости от возраста представлена в таблицах 15 и 16.
#Ифосфамид** вводится на фоне введения Месны** 400 мг/м2/сут в/в болюсно непосредственно перед введением #ифосфамида** - 1,2,3 дни, в недели 3, 9, 15; 1600 мг/м2/сут в/в капельно за 24 часа - 1, 2, 3 дни, в недели 3, 9, 15. Данная схема введения месны и дозы рассчитаны согласно инструкциям ГРЛС, а именно, для данной дозы химиопрепарата.
#Циклофосфамид** вводится на фоне введения Месны** 500 мг/м2/сут в/в болюсно непосредственно перед введением #циклофосфамида** - 1 день, в недели 5, 11, 17; 1500 мг/м2/сут в/в капельно за 24 часа - 1, 2 дни, в недели 5, 11, 17. Данная схема введения месны и дозы рассчитаны согласно инструкциям ГРЛС, а именно, для данной дозы химиопрепарата.
Метрономная химиотерапия начинается через 2 недели от последнего курса интенсивной химиотерапии. При невозможности перорального приема таблеток #циклофосфамида** возможно применение препарата #циклофосфамид** в дозировке 87,5 мг/м2/сут внутривенно капельно за 1 час - 1 и 4 дни, недели 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24. В случае внутривенного применения препарата #циклофосфамид**, в дни его введения проводится профилактика геморрагического цистита с введением препарата Месна** в дозировке 30 мг/м2/сут внутривенно струйно или перорально в 0, 4 и 8 часы от начала введения #циклофосфамида**. Данная схема введения месны и дозы рассчитаны согласно инструкциям ГРЛС, а именно, для данной дозы химиопрепарата.
3.3.5 Адъювантная терапия для СКС почки
Всем пациентам со СКС почки независимо от формы и стадии процесса показано проведение адъювантной химиотерапии согласно рекомендациям SIOP [33].
- Всем пациентам со СКСП с I - IV стадией заболевания показано проведение: 12 курсов интенсивной химиотерапии с интервалом в 21 день: 1 курс - циклофосфамид** + доксорубицин** (всего 3 курса): циклофосфамид** 450 мг/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни, в 1, 13, 25 недели; доксорубицин** 50 мг/м2/сутки в/в капельно за 4 - 6 часов - 1 день в 1 неделю; 2 курс - #этопозид** + #карбоплатин** (всего 6 курса): #этопозид** 150 мг/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни в недели 4, 16, 28; #карбоплатин** 200 мг/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни в недели 4, 16, 28; 3 курс - ифосфамид** + доксорубицин** (всего 3 курса): ифосфамид** 2000 мг/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни в недели 7, 19, 31; доксорубицин** 50 мг/м2/сутки в/в капельно за 4 - 6 часов - 1 день в недели 7, 19, 31; - см. приложение А3.1 [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии:
Ифосфамид** вводится на фоне введения Месны** 400 мг/м2/сут в/в болюсно непосредственно перед введением ифосфамида** - 1, 2, 3 дни, в недели 7, 19, 31; 1600 мг/м2/сут в/в капельно за 24 часа - 1, 2, 3, 4 дни, в недели 7, 19, 31. Данная схема введения месны и дозы рассчитаны согласно инструкциям ГРЛС, а именно, для данной дозы химиопрепарата.
Циклофосфамид** вводится на фоне введения Месны** 90 мг/м2/сут в/в болюсно непосредственно перед введением циклофосфамида** - 1, 2, 3 день, в 1 неделю; 360 мг/м2/сут в/в капельно за 24 часа - 1, 2, 3 дни, в 1 неделю. Данная схема введения месны и дозы рассчитаны согласно инструкциям ГРЛС, а именно, для данной дозы химиопрепарата.
Доксорубицин** 50 мг/м2/сутки в/в капельно за 4 - 6 часов - 1 день в 1 неделю непосредственно перед введением первой дозы циклофосфамида**. (Всего 5 курса, максимальная кумулятивная доза доксорубицина** не должна превышать 250 мг/м2 при I - III стадии заболевания (при IV стадии максимальная кумулятивная доза доксорубицина** 300 мг/м2; в случае превышения кумулятивной дозы доксорубицина** более 300 мг/м2 необходимо заменить введение дозы доксорубицина** на введение дозы #винкристина** 1,5 мг/м2 в/в болюсно 1 день, максимальная доза #винкристина** 2 мг/м2).
3.3.6 Адъювантная терапия для ВМН почки
Показано ведение пациентов с ВМН согласно рекомендациям SIOP.
- Рекомендуется пациентам с ВМН, у которых было осуществлено оперативное вмешательство с достижением чистых краев резекции (I стадия, II стадия) или наличие хотя бы одного свободного от опухоли края резекции (III стадия) не проводить адъювантную химиотерапию [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с III стадией ВМН без свободных от опухоли краев резекции рассмотрение повторного оперативного вмешательства [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с ВМН в случае невозможности достижения чистых краев резекции у пациентов с III стадией без свободных от опухоли краев резекции после повторного оперативного вмешательства, рассмотрение проведения адъювантной химиотерапии согласно рекомендациям SIOP после согласования с федеральным/национальным центром по схеме AV-2: #винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели - см. приложение А3.1 [33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.4 Лучевая терапия
3.4.1 Лучевая терапия при локализованных формах НБ
При локализованной НБ, стадии II (диффузная анаплазия) и III (промежуточная и высокая группы гистологического риска) стадии, после органосохраняющих оперативных вмешательств, целесообразна консультация в специализированном федеральном/национальном медицинском центре для определения показаний и объема лучевой терапии.
Суммарные рекомендации по лучевой терапии брюшной полости представлены в таблице 6 [33; 64].
Таблица 6. Суммарные рекомендации по лучевой терапии брюшной полости НБ
Локальная стадия
Гистологический тип
Стадия II
Стадия III (кроме большого разрыва)
Стадия III (при большом разрыве)
Промежуточный риск
Нет показаний
14.4 Гр +/- 10.8 Гр буст
Весь живот 15 Гр +/- 10.8 Гр буст
Высокий риск
Диффузная анаплазия
25.2 Гр +/- 10.8 Гр буст
25.2 Гр +/- 10.8 Гр буст
Весь живот 19.5 Гр +/- 10.8 Гр буст
Высокий риск
Бластемный тип
Нет показаний
25.2 Гр +/- 10.8 Гр буст
Весь живот 19.5 Гр +/- 10.8 Гр буст
Комментарии: #дактиномицин и доксорубицин** не вводятся 1 неделю до ЛТ и 2 недели после ЛТ.
- Локальное послеоперационное облучение или облучение половины брюшной полости (фланк) рекомендовано проводить через 2 - 4 недели после операции следующим группам пациентов с локализованной формой НБ [33; 64]:
- НБ промежуточного гистологического риска, стадия III (пораженные парааортальные лимфатические узлы, наличие остаточной опухоли после операции, разрывы опухоли): локальное облучение в СОД 14.4 Гр на половину брюшной полости, буст на макроскопическую резидуальную опухоль 10,8 Гр;
- НБ высокого гистологического риска (кроме бластемного типа), стадия II: локальное облучение в СОД 25,2 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр;
- НБ высокого гистологического риска, стадия III (все гистологические подтипы): локальное облучение в СОД 25,2 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при планируемой ЛТ на легкие, облучение живота можно отложить, чтобы проводить ЛТ на живот и легкие одним полем.
- У пациентов с двухсторонней НБ рекомендовано проведение лучевой терапии в соответствии с локальной стадией [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Не рекомендовано проведение облучения парааортальных лимфоузлов у пациентов без макроскопически значимых увеличенных лимфоузлов [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Послеоперационное облучение всей брюшной полости рекомендовано проводить через 2 - 4 недели после операции следующим группам пациентов с локализованной формой НБ [33; 64]:
- диффузное интраабдоминальное распространение (стадия III ввиду макроскопических метастазов по брюшине): облучение всей брюшной полости в СОД 19,5 Гр, на ограниченные зоны макроскопического метастазирования возможен буст до СОД 25 Гр (гистологическая промежуточная группа риска) или 30,6 Гр (гистологическая высокая группа риска);
- массивный пре- или интраоперационный разрыв опухоли (стадия III ввиду разрыва опухоли): облучение всей брюшной полости в дозе 15 Гр (гистологическая промежуточная группа риска) или 19.5 Гр (гистологическая высокая группа риска);
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: у детей до 2-х лет предусмотрена редукция дозы до 12 Гр.
- Пациентам с локализованной НБ, стадии II (диффузная анаплазия) и III (промежуточная и высокая группы гистологического риска) стадии после органосохраняющих оперативных вмешательств рекомендовано обращение в федеральные/национальные центры для определения показаний и объема лучевой терапии [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: необходимо помнить о функциональной асплении и рассматривать возможность вакцинации перед облучением селезенки, а также антибиотикопрофилактику в случаях, когда на селезенку приходится более 10 Гр средней дозы [81].
3.4.2 Лучевая терапия при локализованных формах ЗРО [16]
Суммарные рекомендации по лучевой терапии брюшной полости представлены в таблице 7.
Таблица 7. Суммарные рекомендации по лучевой терапии брюшной полости
Локальная стадия
Возраст
Стадия I - III (кроме большого разрыва)
Стадия III (при большом разрыве)
>= 12 мес
19.8 Гр +/- 10.8 Гр буст
Весь живот 19.5 Гр +/- 10.8 Гр буст
< 12 мес
10.8 Гр +/- 10.8 Гр буст
Весь живот 10.5 Гр +/- 10.8 Гр буст
Комментарии: у пациентов с ЗРО почки перед и после лучевой терапии: исключается #дактиномицин за 2 недели до и 2 недели после ЛТ; исключается #доксорубицин** за 2 недели до и 4 недели после ЛТ. На фоне ЛТ дозировка #циклофосфамида** может быть редуцирована на 35% с последующим повышением дозы до 100% в зависимости от предыдущей переносимости. В курсе ICE: дозировка #ифосфамида** рассчитывается 1500 мг/м2/сут в 1 и 2 дни, в 3 день препарат не вводится; дозировка #карбоплатина** редуцируется на 50% - 250 мг/м2/сут в 1 день; дозировка #этопозида** редуцируется на 30% - 75 мг/м2/сут в 1 и 2 дни, в 3 день препарат не вводится.
- Локальное послеоперационное облучение или облучение половины брюшной полости (фланк) рекомендовано проводить через 2 - 4 недели после операции всем пациентам с ЗРО почки [16; 33; 64]:
- Пациентам >= 12 мес показано локальное облучение в СОД 19.8 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр;
- Пациентам < 12 мес показано локальное облучение в СОД 10.8 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр;
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Послеоперационное облучение всей брюшной полости рекомендовано проводить через 2 - 4 недели после операции следующим группам пациентов с ЗРО почки [16; 64]:
- Пациентам >= 12 мес с диффузное интраабдоминальным распространением или массивным разрывом опухоли: облучение всей брюшной полости в СОД 19,5 Гр, на ограниченные зоны макроскопического метастазирования возможен буст 10,8 Гр;
- Пациентам < 12 мес с диффузное интраабдоминальным распространением или массивным разрывом опухоли: облучение всей брюшной полости в СОД 10,5 Гр, на ограниченные зоны макроскопического метастазирования возможен буст 10,8 Гр;
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при планируемой ЛТ на легкие, облучение живота можно отложить, чтобы проводить ЛТ на живот и легкие одним полем.
3.4.3 Лучевая терапия при локализованных формах СКС почки.
- Локальное послеоперационное облучение или облучение половины брюшной полости (фланк) рекомендовано проводить через 2 - 4 недели после операции следующим группам пациентов с локализованной формой СКС почки [33]:
- Рекомендуется пациентам со СКС почки II стадии локальное облучение в СОД 10,8 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр;
- Рекомендуется пациентам со СКС почки III стадии локальное облучение в СОД 10.8 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр;
- Рекомендуется пациентам с диффузным внутрибрюшным опухолевым поражением и/или массивным интраоперационным разрывом опухоли: облучение всей брюшной полости в СОД 10,5 Гр, на ограниченные зоны макроскопического метастазирования возможен буст 10,8 Гр;
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.4.4 Лучевая терапия метастазов
При наличии НБ низкой группы гистологического риска, а также в случае, если пациент меньше 2 лет с метастазами в легкие или метастазы НБ представлены жизнеспособной опухолевой тканью (после ХТ и операции), при генерализованной форме НБ, стадии II (диффузная анаплазия) и III (промежуточная и высокая группы гистологического риска) стадии, после органосохраняющих оперативных вмешательств, целесообразна консультация в специализированном федеральном/национальном медицинском центре для определения показаний и объема лучевой терапии [33; 64].
Все случаи ЗРО почки с первичными метастазами в легких, вне зависимости от ответа на химиотерапию или хирургическое лечение, должны получать ЛТ в объеме тотального облучения легких, СОД 15 Гр [16].
Суммарные рекомендации по лучевой терапии метастазов НБ и ЗРО почки представлены в таблице 8.
Таблица 8. Суммарные рекомендации по лучевой терапии метастазов [16; 33; 51; 64].
Локализация
Гистологический тип
Легкие
Печень (неполная резекция)
Головной мозг
Кости
Промежуточный риск
СКС почки
ТО легких 12 Гр
ТО печени 14.4 - 20 Гр +/- 10.8 Гр буст
ТО головного мозга 15 Гр +/- 10.8 Гр буст
Локально 30 - 36 Гр
Высокий риск НБ
ЗРО почки
ТО легких 15 Гр
ТО печени 20 - 25.2 Гр +/- 10.8 Гр буст
ТО головного мозга 25,2 Гр +/- 10.8 Гр буст
Локально 30 - 36 Гр
ТО - тотальное облучение
Комментарии: для пациентов с НБ #дактиномицин и доксорубицин** не вводятся 1 неделю до ЛТ и 2 недели после ЛТ.
У пациентов с ЗРО почки перед и после лучевой терапией: исключается #дактиномицин за 2 недели до и 2 недели после ЛТ; исключается #доксорубицин** за 2 недели до и 4 недели после ЛТ. На фоне ЛТ дозировка #циклофосфамида** может быть редуцирована на 35% с последующим повышением дозы до 100% в зависимости от предыдущей переносимости. В курсе ICE: дозировка #ифосфамида** рассчитывается 1500 мг/м2/сут в 1 и 2 дни, в 3 день препарат не вводится; дозировка #карбоплатина** редуцируется на 50% - 250 мг/м2/сут в 1 день; дозировка #этопозида** редуцируется на 30% - 75 мг/м2/сут в 1 и 2 дни, в 3 день препарат не вводится.
- У пациентов с генерализованной формой НБ рекомендовано проводить облучение легких в следующих случаях [33; 64]:
- отсутствие полной санации метастазов в легких по результатам КТ грудной клетки на 10 неделе послеоперационной терапии;
- если метастазы НБ представлены жизнеспособной опухолевой тканью (после ХТ и операции) гистологической промежуточной группы риска, показано проведение ЛТ в объеме тотального облучения легких в СОД 12 Гр;
- все случаи НБ с первичными метастазами в легких, вне зависимости от ответа на химиотерапию или хирургическое лечение, гистологической высокой группы риска, должны получать ЛТ в объеме тотального облучения легких, СОД 15 Гр;
- в случае необходимости проведения облучения брюшной полости и легких, рекомендуется проводить облучение грудной клетки и брюшной полости одновременно в рамках одной процедуры планирования (с одного поля) во избежание возникновения перерыва в лечении или наложения обоих полей;
- в случае стадии III (макроскопически остаточная опухоль), с высокой вероятностью локального рецидива, как случаи с гистологическим вариантом диффузной анаплазии, облучение брюшной полости может проводиться после операции, а облучение легких - позднее, с отдельного поля.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам после инициальной нефрэктомии с гистологическим типом опухоли "диффузная анаплазия", при наличии метастатитического поражения легких рекомендовано выполнение лучевой терапии легких независимо от ответа метастазов на химиотерапию/хирургическое вмешательство [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Все случаи ЗРО почки с первичными метастазами в легких, вне зависимости от ответа на химиотерапию или хирургическое лечение, должны получать ЛТ в объеме тотального облучения легких, СОД 15 Гр [16; 33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Все случаи СКС почки с первичными метастазами в легких, вне зависимости от ответа на химиотерапию или хирургическое лечение, должны получать ЛТ в объеме тотального облучения легких, СОД 12 Гр [33; 51].
- Облучение печени у пациентов с генерализованной формой ЗНО почки рекомендовано в следующих случаях [16; 33; 64]:
- Наличие метастазов в печени, которые сохранились после ХТ и которые не могут быть радикально удалены;
- Для пациентов с НБ гистологической группой промежуточного риска в СОД 14,4 Гр на всю печень и буст на остаточные метастазы до 25,2 Гр;
- Для пациентов с НБ гистологической группой высокого риска и ЗРО почки в СОД 19,8 Гр на всю печень и буст на остаточные метастазы до 30,6 Гр.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: СОД на область всей печени не должна превышать 20 Гр.
- У пациентов с генерализованной формой НБ или ЗРО почки при наличии отдаленного гематогенного метастазирования в другие органы, кроме печени и легких, рекомендовано проведение лучевой терапии в следующих случаях [16; 33; 64]:
- метастазирование в головной мозг, вне зависимости от ответа на химиотерапию в СОД при тотальном облучении головного мозга 15.0 Гр для НБ гистологической группы промежуточного риска с бустом до 25.2 Гр и в СОД при тотальном облучении головного мозга 25,2 Гр для НБ гистологической группы высокого риска и ЗРО почки с бустом до 30,6 Гр;
- Метастазирование в кости, вне зависимости от ответа на химиотерапию. Доза облучения костных метастазов составляет 30 или 30.6 Гр.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: учитывая редкость наличия гематогенного метастазирования вне печени и головного мозга, ситуация требует обсуждения с федеральным/национальным центром.
3.5 Тактика ведения пациентов с двусторонними опухолями (стадия V), а также с односторонней нефробластомой с генетической предрасположенностью к двусторонней локализации
Тактика терапии двухсторонней нефробластомы базируется на 3 пунктах:
1. Предоперационная ХТ для уменьшения опухолевого объема насколько это возможно;
2. Органосохраняющая операция, насколько возможно;
3. Послеоперационная ХТ - по наивысшей стадии и наихудшей гистологии [33; 64].
- Пациентам с билатеральной нефробластомой рекомендована следующая тактика лечения [33; 51; 64; 82 - 85]:
- длительность предоперационной ХТ должна составлять не более 12 недель;
- первоначальное лечение: неоадъювантная терапия в режиме VA, 6 недель - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3, 5 недели (см. приложение А3.1);
- первая оценка ответа с использованием МРТ (КТ) ОБП с к/у;
- если возможно по результатам оценки ответа - оперативное лечение (органосохраняющая операция) хотя бы на одной почке;
- при частичной ремиссии - продолжение ХТ по той же программе - 6 недель в режиме VA (см. приложение А3.1);
- при отсутствии ответа или прогрессировании, если органосохраняющая операция невозможна - рекомендовано изменить схему ХТ на режим #Карбоплатин**/#Этопозид**: #этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели; #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели (см. приложение А3.1) - 2 цикла
- вторая оценка ответа: МРТ (КТ) ОБП с к/у после еще 6 недель VA или 2 циклов #карбоплатин**/#этопозид**;
- обсуждение возможности проведения 2 этапа операции;
- послеоперационное лечение - по наивысшей стадии и наихудшей гистологии (см. раздел 3.3. Послеоперационная терапия).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: у пациентов с генерализованным заболеванием, предоперационная терапия проходит по схеме AVD. (см. раздел 3.1. неоадъювантная химиотерапия для метастатической формы заболевания). Требуется консультация в федеральном/национальном центре для определения последующей тактики ведения пациента.
- Пациентам с односторонней нефробластомой и контрлатеральным нефробластоматозом рекомендована следующая тактика лечения [[33; 51; 64; 82 - 85]:
- Неоадъювантная терапия в режиме VA, 6 недель - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3, 5 недели; (см. приложение А3.1);
- Первая оценка ответа: МРТ (КТ) ОБП с к/у после 6 недель ХТ;
- Если возможно - оперативное лечение (органосохраняющая операция) хотя бы на одной почке;
- При частичной ремиссии - продолжение ХТ по той же программе - 6 недель в режиме VA (см. приложение А3.1);
- При отсутствии ответа или прогрессировании, если органосохраняющая операция невозможна - рекомендовано изменить схему ХТ на режим #карбоплатин**/#этопозид**: #этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели; #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели (см. приложение А3.1) - 2 цикла;
- Вторая оценка ответа: МРТ (КТ) ОБП с к/у после еще 6 недель VA или 2 циклов #Карбоплатин**/#Этопозид**;
- Обсуждение возможности проведения 2 этапа операции;
- Послеоперационное лечение - по наивысшей стадии и наихудшей гистологии (см. Раздел 3.3. Послеоперационная терапия).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с односторонним или двухсторонним нефробластоматозом рекомендована следующая тактика лечения [[33; 51; 64; 82 - 85]:
- Неоадъювантная терапия в режиме VA, 6 недель: - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3, 5 недели (см. приложение А3.1);
- Первая оценка ответа: МРТ (КТ) ОБП с к/у после 6 недель VA;
- Дальнейшая терапия зависит от ответа на индукционную химиотерапию и подробно представлена на схеме алгоритма терапии пациентов с односторонним или двухсторонним нефробластоматозом, см. приложение Б5 [33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: у пациентов с односторонней нефробластомой и контрлатеральным нефробластоматозом с IV стадией процесса, предоперационная терапия проходит по схеме AVD (см. раздел 3.1. неоадъювантная химиотерапия для метастатической формы заболевания). Требуется консультация в федеральном/национальном центре для определения последующей тактики ведения пациента.
- Пациентам с односторонней нефробластомой и синдромом предрасположенности к развитию опухоли рекомендована следующая тактика лечения [33; 51; 64; 82 - 85]:
- Неоадъювантная терапия в режиме VA, 6 недель - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели; #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3, 5 недели (см. приложение А3.1);
- Первая оценка ответа: МРТ (КТ) ОБП с к/у после 6 недель ХТ;
- Если возможно - оперативное лечение (органосохраняющая операция) хотя бы на одной почке;
- При частичной ремиссии - продолжение ХТ по той же программе - 6 недель в режиме VA (см. приложение А3.1);
- При отсутствии ответа или прогрессировании, если органосохраняющая операция невозможна - рекомендовано изменить схему ХТ на режим #Карбоплатин**/#Этопозид** - #этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели; #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели (см. приложение А3.1) - 2 цикла;
- Вторая оценка ответа: МРТ (КТ) ОБП с к/у после 6 еще недель VA или 2 циклов #Карбоплатин**/#Этопозид**;
- Обсуждение возможности проведения 2 этапа операции;
- Послеоперационное лечение - согласно локальной стадии и группы риска (см. Раздел 3.3. Послеоперационная терапия).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: эти пациенты относятся к группе высокого риска развития метахронной двусторонней опухоли, и им должна помочь стратегия лечения, подразумевающая проведение по возможности нефронсохраняющей операции. Поэтому к ним применимы варианты лечения, предусмотренные для двустороннего заболевания.
3.5.1 Хирургическое лечение при билатеральной нефробластоме
Лечение таких пациентов требует индивидуального подхода. Хирургическое лечение должно проводиться опытной хирургической командой после консультации в федеральном/национальном центре [82 - 85].
- При билатеральной нефробластоме рекомендовано проведение органосохраняющей операции после ответа опухолей на химиотерапию: при уменьшении размеров или визуализирующих признаках наличия некроза в опухолях [33; 82 - 85];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: хирургическое лечение должно проводиться в отделениях, имеющих опыт органосохраняющих операций. Цель лечения - максимальное сохранение функционирующей почечной паренхимы. Первый оперативный этап проводится на наименее пораженной почке, второй оперативный этап - на наиболее пораженной почке. Допускается проведение полной нефрэктомии на одной стороне и резекция почки - на другой, при условии, что будет сохранен достаточный объем функциональной почечной ткани. При необходимости можно проводить несколько операций с целью достижения полной резекции.
3.5.2 Лучевая терапия у пациентов с билатеральной нефробластомой
Рекомендации по дозам и области облучения аналогичны рекомендациям для одностороннего заболевания. По показаниям лучевая терапия может быть начата одновременно с началом адъювантной терапии (см. раздел 3.4 Лучевая терапия) [33; 64].
3.6 Нутритивный скрининг и мониторинг
Лечебное питание является неотъемлемым компонентом лечебного процесса и профилактических мероприятий и включает в себя пищевые рационы, которые имеют установленный химический состав, энергетическую ценность, состоят из определенных продуктов, в т.ч. специализированных продуктов лечебного питания, включая смеси белковые композитные сухие и витаминно-минеральные комплексы, подвергаемых соответствующей технологической обработке, а также лечебные продукты энтерального питания (лечебные питательные смеси).
- Лечебное питание рекомендуется к назначению пациентам с ЗНО при поступлении в медицинскую организацию для оказания медицинской помощи в стационарных условиях. Лечебное питание назначается лечащим врачом или дежурным врачом медицинской организации в соответствии с нозологической формой заболевания по основному и/или сопутствующему диагнозу [61].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Вариант диеты зависит от состояния пациента, гастро-интестинальных и метаболических нарушений, основной или сопутствующей патологии и регламентируется приложением N 3 "К порядку обеспечения пациентов лечебным питанием", утвержденному приказом Министерства здравоохранения РФ от 23.09.2020 N 1008н
- Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (НП) [61, 86, 87].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: наличие белково-энергетической недостаточности или высокого риска ее развития у детей с ЗНО в процессе противоопухолевого лечения обуславливает связанные с этим риски увеличения инвалидизации, увеличения длительности и объема основного и сопроводительного лечения, низкой успешности проводимого лечения, увеличения смертности и общих финансовых затрат на лечебно-реабилитационные мероприятия - в процессе активного противоопухолевого лечения и после его окончания. Скрытая БЭН (например, скрытая избытком жировой массы на фоне длительного приема глюкокортикостероидов системного действия) сопровождается такими же рисками. Поэтому, учитывая высокую вероятность усугубления нутритивных проблем на фоне лечения, пациентам целесообразно назначать нутритивную поддержку в дополнение к существующему рациону или заменяя его.
Нутритивный скрининг и мониторинг (оценка нутритивного статуса)
- Рекомендуется всем пациентам при поступлении в стационар и далее регулярно проводить нутритивный скрининг (скрининговую оценку нутритивного статуса) с целью выявления белково-энергетической недостаточности либо риска ее развития [88; 89].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: выявление нутритивных нарушений на ранних этапах их развития, особенно до начала противоопухолевой терапии позволяет своевременно начать нутритивную коррекцию. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/инструментов для проведения нутритивного скрининга [90]. Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [91].
- Рекомендуется для проведения нутритивного скрининга использовать специальные валидированные опросники, особенно актуальным их использование является на этапе первичного поступления в стационар и/или на (очередном) этапе поступления в клиническое отделение [61; 92].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: в своем большинстве скрининговые инструменты (опросники) ориентированы на объединение данных об основном диагнозе, клиническом статусе, антропометрических показателях, динамике массы тела, состоянии питания и интеграции этих данных в общий балл с последующим разделением пациентов на 2 или 3 когорты: не нуждаются в нутритивной коррекции (поддержке); требуют повторного скрининга в динамике ("тревожная" группа); нуждаются в нутритивной коррекции (поддержке). Клиническое подразделение (или учреждение) вправе использовать тот инструмент, или комбинацию инструментов, которую посчитает наиболее приемлемой для проведения нутритивного скрининга среди своих пациентов. Необходимо помнить, что существующие скрининговые инструменты не предназначены для ответа на вопрос об объеме и способе необходимой нутритивной поддержки, не несут в себе прогностической информации для конкретного пациента, поскольку их применение нацелено исключительно на медицинскую сортировку. К тому же, универсального инструмента для скрининга в педиатрии не существует
- Рекомендуется для первичной (общей) оценки нутритивного статуса и выявления нутритивного риска учитывать антропометрические показатели, изменение массы тела за определенный период (3, 6 или 12 месяцев), данные о питании (режим, привычный состав питания, особенности приема пищи, возможные нарушения приема пищи, наличие непереносимости/аллергии на компоненты пищи), об эндокринном статусе (данные о выявленных эндокринных нарушениях у ребенка), данные о выявленных гастроинтестинальных нарушениях [91; 92]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется в качестве обязательного минимума основных антропометрических параметров для первичной и регулярной оценки нутритивного статуса использовать следующие: измерение массы тела, измерение роста (длины тела), вычисление индекса массы тела [61; 88].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- В случае потребности в детальном антропометрическом исследовании для первичной и регулярной оценки нутритивного статуса в качестве дополнительных антропометрических параметров рекомендуется использовать следующие: измерение основных антропометрических окружностей, длин, толщины кожной складки (пликометрия) кистевая динамометрия (измерение силы мышц кисти) [61; 88; 92].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется для соотнесения полученных данных антропометрии (измерение роста, массы тела, индекс массы тела, окружность плеча) с нормативными значениями по педиатрической популяции использовать референсные значения (шкалы), либо локальных (отечественных) референсов, либо мировых общеиспользуемых номограмм: центильные значения/перцентили, либо величина отклонения полученного значения от среднего по популяции (SDS или z-score) [88; 92].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Часто используемыми "по умолчанию" в РФ являются референсы ВОЗ (WHO growth charts), для удобства работы с которыми существуют свободно доступные программы (WHO anthro и WHO anthro plus), которые быстро позволяют высчитать ключевые антропометрические параметры в соотнесении их с референсными данными ВОЗ. Однако возможно использование и других референтных данных для соотнесения данных пациента с нормативами - в таком случае необходимо указывать, какие конкретно референсы применялись.
- Пациентам с нутритивными нарушениями или пациентам с высоким нутритивным риском, выявленными при первичном скрининге, рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка лабораторных показателей, а также детальный физикальный осмотр и опрос на предмет выявления нутритивно-метаболических нарушений и их предикторов [91 - 93].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Рекомендуется в виду высокой распространенности в детской популяции с онкологическими заболеваниями нарушений состава тела, тканевого дисбаланса в виде скрытой белково-энергетической недостаточности (саркопении), скрытого ожирения (накопления жировой массы), в виду распространенности отеков (в том числе и скрытых), а также нарушений распределения компартментов жидкости, в качестве дополнительного уточняющего метода оценки нутритивного статуса оценка состава тела различными имеющимися методами: биоимпедансный анализ (определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансметра), двухэнергетическая рентгеновская абсорбциометрия (рентгеновская денситометрия всего тела), МРТ, КТ - для уточняющей и углубленной оценки состава тела в группах риска. Эти группы следующие: хроническая белково-энергетическая недостаточность, длительная, более 2 месяцев, необходимость в парентеральном питании, включение в терапию гормональных препаратов, опухоли ЦНС, хронические расстройства приема пищи (пищевого поведения), реципиенты ГСК при выявленных антропометрически нутритивных нарушениях [89; 92]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам, получающим нутритивную поддержку, рекомендуется проводить нутритивный мониторинг, который включает опрос, антропометрию, и при необходимости - анализ тканевого состава тела (определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансметра), лабораторные показатели (анализ крови биохимический общетерапевтический, копрологическое исследование) [61; 89; 93]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Нутритивная поддержка
Нутритивная поддержка проводится посредством назначения специализированных продуктов энтерального питания. Пищевая продукция энтерального питания или лечебная питательная смесь - жидкая или сухая (восстановленная до готовой к употреблению) пищевая продукция диетического лечебного или диетического профилактического питания, предназначенная для перорального употребления непосредственно или введения через зонд при невозможности обеспечения организма в пищевых веществах и энергии обычным способом [94]. Лечебные смеси - специально разработанные пищевые продукты с заданным химическим составом, энергетической ценностью, физическими свойствами и доказанным лечебным эффектом, отвечающие физиологическим потребностям организма, учитывающие нарушения процессов метаболизма больного человека [95]. При выборе формы, метода, вида и объема нутритивной поддержки рекомендуется руководствоваться, в первую очередь, принципом индивидуального пациент-ориентированного подхода - сообразно клинической ситуации и логике [61; 96]
- У пациентов с ожирением (избытком жировой массы) возможно развитие скрытой белково-энергетической недостаточности, определяемой дефицитом безжировой массы тела и критическим уменьшением ее скелетно-мышечного компартмента, в связи с чем рекомендуется проведение коррекции данного вида дефицита, наличие ожирения само по себе не является противопоказанием для проведения нутритивной поддержки энтеральным или парентеральным путем [92; 96; 97].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Расчет объема нутритивной поддержки рекомендуется осуществлять посредством расчета нутритивной потребности, или тотального расхода энергии (ТРЭ) [61; 98]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО x КК, где ЭОО - энергия основного обмена, КК - конверсионный коэффициент. Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield) [98]. Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК = 0,85 - 1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации.
- При выборе пути нутритивной поддержки рекомендуется в качестве приоритетного использование энтерального питания (ЭП) [87; 99]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: ЭП является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, препятствует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание
- В случае если пациент не может/не хочет/не готов принимать назначенный объем смеси в необходимом режиме самостоятельно рекомендуется использование для энтерального питания назогастрального(-еюнального) зонда или гастростомы [87; 96; 99]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через назогастральный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) - в этих случаях показана реализация ЭП через назоеюнальный зонд.
- При текущей или потенциальной необходимости проведения зондового питания продолжительностью более 6 недель, рекомендуется наложение гастростомы [99]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: в случае, когда выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), возможно превентивное наложение гастростомы, минуя этап зондового питания
- Рекомендуется постановка гастростомы в случае невозможности адекватной алиментации другими методами ЭП, при отсутствии противопоказаний для проведения ЭП и самой гастростомии [96; 100]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- В случаях наличия у ребенка тяжелой хронической белково-энергетической недостаточности, с высоким риском ее усугубления в дальнейшем, особенно если ему еще предстоит продолжение противоопухолевого лечения рекомендуется постановка гастростомы, минуя этап зондового питания и даже сипинга [96; 100]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Пациентам с гастроинтестинальными нарушениями начинать энтеральную нутритивную поддержку рекомендуется со специализированной лечебной питательной смеси для энтерального питания с калорической плотностью 1 ккал/мл (изокалорическая смесь), и, если необходимо, с последующим переходом на лечебную питательную смесь для энтерального питания с калорической плотностью более 1 ккал/мл (гиперкалорической) - под контролем переносимости [87]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: смеси по своей энергетической плотности делятся на изокалорические (1 ккал/мл для детей старше года и 0,67 - 0,69 ккал/мл для детей до года) и гиперкалорические (более 1 ккал/мл для детей старше года, и 1 ккал/мл для детей до года). Начинать нутритивную поддержку, особенно детям с имеющимися в анамнезе или в настоящее время гастроинтестинальными нарушениями и/или никогда до этого не получавшими энтерального питания, целесообразно с изокалорических формул
- При наличии явлений мальабсорбции/тяжелых гастроинтестинальных нарушений (но отсутствии противопоказаний для проведения ЭП), тяжелой пищевой аллергии (или аллергии к белкам коровьего молока) рекомендуется назначение полуэлементной/олигомерной (или, по показаниям, элементной) специализированной лечебной питательной смеси для энтерального питания [87; 101]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: смеси по своему химическому составу делятся на полимерные (в своей основе содержат цельный белок) и олигомерные (содержат гидролизат белка) или полуэлементные. Элементные смеси не содержат белок как таковой: белковый компонент в них представлен аминокислотами. Обычно элементные смеси назначаются при установленной аллергии к белкам коровьего молока
- Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем и/или в случаях, когда ЭП не может обеспечить потребности энергии основного обмена, рекомендуется назначение парентерального питания (при отсутствии противопоказаний для проведения парентерального питания). В числе этих пациентов особое внимание должно уделяться детям с имеющейся белково-энергетической недостаточностью, особенно умеренной и тяжелой степени [98; 102].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: ключевым показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность (как минимум, на уровне энергопотребности основного обмена) пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе.
- Начало парентерального питания рекомендуется производить постепенно, ступенчато увеличивая объем (и скорость) суточной инфузии, начиная от трети/половины расчетного целевого объема и, под мониторингом показателей анализа крови биохимического общетерапевтического (прежде всего, глюкоза, прямой билирубин, мочевина) и кислотно-основного состояния и газов крови, за несколько суток (скорость достижения целевого объема определяется индивидуально по клинической ситуации) довести объем до целевого. Отмену парентерального питания рекомендуется производить также постепенно, ступенчато, в обратном порядке [61; 87; 100]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: крайне нежелательно назначение парентерального питания сразу в полном объеме, равно как разовая ("со следующих суток") отмена полного парентерального питания. Особенно опасным является назначение полного парентерального питания больным с длительным отсутствием алиментации - в виду возможного развития рефидинг-синдрома. Объем ПП должно постепенно (ступенчато) увеличивать под параллельным контролем КЩС, электролитов, глюкозы, мочевины, прямого билирубина в крови. При необходимости, объем и состав ПП должны корректироваться.
Таблица 3.6.1. Интерпретация нутритивного статуса на основании Z-score согласно референсным данным ВОЗ [115, 119]
Степень/Форма
(варианты интерпретации)
Z-скор, SDS
Показатели <*>
Недостаточность питания тяжелой степени/Белково-энергетическая недостаточность тяжелой степени
-3,00 и ниже
Масса тела на возраст,
ИМТ на возраст, окружность плеча на возраст
Недостаточность питания умеренной степени/Белково-энергетическая недостаточность умеренной степени
От -2,00 до -2,99
Недостаточность питания легкой степени/Белково-энергетическая недостаточность легкой степени
От -1,00 до -1,99
Эутрофия/Нормотрофия/Нормальный нутритивный статус
От -0,99 до +0,99
Избыточное питание
От +1,00 до +1,99
Ожирение 1 степени
От +2,00 до +2,49
Ожирение 2 степени
От +2,50 до +2,99
Ожирение 3 степени
От +3,00 до +3,99
Ожирение морбидное
+4,00 и выше
Примечания: нутритивный статус в онкопедиатрии оценивается по совокупным данным (клинические, лабораторные, инструментальные), с учетом нутритивного риска, антропометрические показатели позволяют критериально ориентироваться в определении нутритивного статуса и не могут быть единственно определяющими [119]; <*> - в определении нутритивного статуса используется показатель с минимальным SDS; SDS - standard deviation score (величина стандартного отклонения)
Таблица 3.6.2. Факторы высокого риска развития нарушений нутритивного статуса детей с ЗНО [119]
Критерии
1. Нарушения аппетита в течение ближайшей недели или особенности аппетита (избирательность, привередливость в питании, нестабильный и непостоянный аппетит и др.), выявленные анамнестически, свойственные данному ребенку с раннего возраста
2. Снижение объема потребления пищи на 1/3 - 1/2 и более от рекомендуемых возрастных норм (или снижение частоты/объема питания в динамике за неделю по данным опроса или данным пищевого дневника)
3. Потеря более 2% массы тела за неделю или более 5% за месяц
4. Исходная гастроинтестинальная дисфункция (хронические заболевания ЖКТ, непереносимость компонентов пищи и пищевая аллергия) или сформировавшаяся на фоне противоопухолевого лечения
5. Сопутствующие нарушения обмена веществ и/или эндокринные заболевания
6. Опухоли брюшной полости, малого таза, локализованные забрюшинно, опухоли головы и шеи
7. Предстоящая ТГСК и ранний - до 3-х месяцев - посттрансплантационный период
8. Возраст менее 3 лет
При наличии минимум двух вышеперечисленных критериев пациент относится к группе высокого нутритивного риска - вне зависимости от текущего нутритивного статуса, его текущего питания и клинической ситуации
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам с НБ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также при необходимости сопроводительная терапия для улучшения результатов лечения и качества жизни пациента, в зависимости от коморбидной патологии и осложнений основной терапии [63].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: специальных методов реабилитации при ЗНО почек не существует. Реабилитация пациентов должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия психологов. Программы реабилитации разрабатываются индивидуально в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем. Реабилитация при возникновении осложнений заболевания и лечения проводится в рамках соответствующих нозологий. Врач-детский онколог по месту жительства руководствуется рекомендациями, которые даны специалистами учреждения, проводившего лечение.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Методов профилактики НБ, ЗРО почки и СКС почки в настоящее время не существует, поскольку большинство случаев развития имеет спорадический характер.
- Пациентам у которых проводилось/проводится лечение по поводу НБ, ЗРО почки и СКС почки рекомендуется проведение регулярных плановых скрининговых обследований из-за риска развития рецидива, вторых опухолей (см. таблицу 9, таблицу 10, таблицу 11) [16; 33; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Таблица 9. Лабораторная и инструментальная диагностика на этапе динамического наблюдения НБ, ВМН
Период наблюдения
1 год
2-й год
3-й год
4-й год
5-й год
После 5 лет
Обследование
Прием (осмотр, консультация) врача-детского онколога первичный
Каждые 3 мес.
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
Каждые 6 мес.
1 раз в год
Измерение артериального давления на периферических артериях
Обследование для выявления рецидива
Ультразвуковое исследование органов брюшной полости (комплексное) + Ультразвуковое исследование почек и надпочечников/Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием/Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием
Каждые 3 мес.
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
Каждые 6 мес.
1 раз в год
Рентгенография легких/Компьютерная томография органов грудной полости с внутривенным болюсным контрастированием
Каждые 3 - 4 мес.
Каждые 3 - 4 мес.
Каждые 4 мес.
Каждые 6 мес.
1 раз в год
Опционно, в случае подозрения на рецидив
Обследование для выявления осложнений и последствий лечения
Общий (клинический) анализ мочи
Каждые 3 мес.
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
1 раз в год
1 раз в год
Общий (клинический) анализ крови
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
Каждые 6 мес.
1 раз в год
1 раз в год
Анализ крови биохимический общетерапевтический
Регистрация электрокардиограммы
После применения антрациклиновых антибиотиков, тотального облучения легких и высокого АД - ежегодно
Эхокардиография
Исследование неспровоцированных дыхательных объемов и потоков
После тотального облучения легких - ежегодно
Аудиометрия, опционно:
Аудиологическое обследование - см. раздел "инструментальная диагностика"
Тональная аудиометрия
Исследование вызванной отоакустической эмиссии
Импедансометрия
Регистрация вызванных акустических ответов мозга на постоянные модулированные тоны (ASSR тест)
Таблица 10. Лабораторная и инструментальная диагностика на этапе динамического наблюдения ЗРО почки
Период наблюдения
1 - 2 год
3 - 5 год
6 - 10 год
> 10 лет
Обследование
Прием (осмотр, консультация) врача-детского онколога первичный
Каждые 2 мес.
Каждые 6 мес.
Каждые 6 - 12 мес.
1 раз в год
Измерение артериального давления на периферических артериях
Обследование для выявления рецидива
Ультразвуковое исследование органов брюшной полости (комплексное) + Ультразвуковое исследование почек и надпочечников
Каждые 3 мес.
Каждые 3 мес.
При наличии симптомов
При наличии симптомов
Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием/Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием
Каждые 3 мес.
2 - 4 раза в год
1 раз в год
При наличии симптомов
Компьютерная томография органов грудной полости с внутривенным болюсным контрастированием
Каждые 6 мес.
При наличии симптомов
При наличии симптомов
При наличии симптомов
Магнитно-резонансная томография головного мозга с контрастированием
В конце терапии
Только при наличии метастазов
Только при наличии метастазов
Только при наличии метастазов
Компьютерная томография головного мозга с внутривенным контрастированием
Сцинтиграфия костей с 99mTc (Сцинтиграфия с туморотропными РФП в режиме "все тело")/Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием
В конце терапии
Только при наличии метастазов
Только при наличии метастазов
Только при наличии метастазов
Обследование для выявления осложнений и последствий лечения
Общий (клинический) анализ мочи
Каждые 2 мес.
Каждые 6 мес.
1 раз в год
1 раз в год
Общий (клинический) анализ крови
Каждые 2 мес.
Каждые 6 мес.
1 раз в год
1 раз в год
Анализ крови биохимический общетерапевтический
Регистрация электрокардиограммы
После применения антрациклиновых антибиотиков, тотального облучения легких и высокого АД - ежегодно
Эхокардиография
Исследование неспровоцированных дыхательных объемов и потоков
После тотального облучения легких - ежегодно
Аудиометрия, опционно:
Аудиологическое обследование - см. раздел "инструментальная диагностика"
Тональная аудиометрия
Исследование вызванной отоакустической эмиссии
Импедансометрия
Регистрация вызванных акустических ответов мозга на постоянные модулированные тоны (ASSR тест)
Таблица 11. Лабораторная и инструментальная диагностика на этапе динамического наблюдения СКС почки [33].
Период наблюдения
1 год
2-й год
3-й год
4-й год
5-й год
После 5 лет
Обследование
Прием (осмотр, консультация) врача-детского онколога первичный
Каждые 3 мес.
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
Каждые 6 мес.
1 раз в год
Измерение артериального давления на периферических артериях
Обследование для выявления рецидива
Ультразвуковое исследование органов брюшной полости (комплексное) + Ультразвуковое исследование почек и надпочечников
Каждые 3 мес.
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
Каждые 6 мес.
1 раз в год
Рентгенография легких/Компьютерная томография органов грудной полости с внутривенным болюсным контрастированием
Каждые 3 - 4 мес.
Каждые 3 - 4 мес.
Каждые 4 мес.
Каждые 6 мес.
1 раз в год
Опционно, в случае подозрения на рецидив
Магнитно-резонансная томография головного мозга с контрастированием
Только в случае рецидива СКС почки или изначального наличия метастазов в головном
Компьютерная томография головного мозга с внутривенным контрастированием
Сцинтиграфия костей с 99mTc (Сцинтиграфия с туморотропными РФП в режиме "все тело"?)/Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием
Только в случае рецидива СКС почки или изначального наличия метастазов в головном
Обследование для выявления осложнений и последствий лечения
Общий (клинический) анализ мочи
Каждые 3 мес.
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
1 раз в год
1 раз в год
Общий (клинический) анализ крови
Каждые 3 мес.
Каждые 4 мес.
Каждые 6 мес.
Каждые 6 мес.
1 раз в год
1 раз в год
Анализ крови биохимический общетерапевтический
Регистрация электрокардиограммы
После применения антрациклиновых антибиотиков, тотального облучения легких и высокого АД - ежегодно
Эхокардиография
Исследование неспровоцированных дыхательных объемов и потоков
После тотального облучения легких - ежегодно
Аудиометрия, опционно:
Аудиологическое обследование - см. раздел "инструментальная диагностика"
Тональная аудиометрия
Исследование вызванной отоакустической эмиссии
Импедансометрия
Регистрация вызванных акустических ответов мозга на постоянные модулированные тоны (ASSR тест)
5.1 Профилактика и лечение тошноты и рвоты, обусловленных проведением противоопухолевой терапии
- Всем пациентам с ЗНО почки для определения уровня эметогенности и варианта профилактики тошноты и рвоты (ТИР) для выбора адекватного режима профилактики ТИР на первом этапе необходимо определение уровня эметогенности (риска развития ТИР) режима противоопухолевой терапии, который планируется использовать у пациента. Уровень эметогенности влияет на выбор препаратов для профилактики ТИР, их дозы и длительность применения [63].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
Комментарии: в Приложении А3.4 представлена общая классификация эметогенности препаратов химиотерапии согласно рекомендациям ASCO (American Society of Clinical Oncology) и рекомендациям COG (Children Oncology Group) [63; 103].
- Всем пациентам с ЗНО почки на фоне высокоэметогенной химиотерапии для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, для детей в возрасте от 5 лет и/или массой 15 кг и более показано использование четырехкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов, антагонист NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты), #дексаметазон**, и #оланзапин** [104 - 106]. Режимы и дозы представлены в Приложении А3.4
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется. Использование #оланзапина** у детей в возрасте менее 5 лет и/или массой тела менее 15 кг не исследовалось и не может быть рекомендовано.
- Всем пациентам с ЗНО почки на фоне высокоэметогенной химиотерапии для оптимальной профилактики отсроченной ТИР, проводимой в течение 3-х дней после завершения введения препаратов химиотерапии, показано использование комбинации #дексаметазона** и #оланзапина** [104; 107]. Режимы и дозы представлены в Приложении А3.4.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: в случае отсутствия возможности назначения антагониста NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты) использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов, #дексаметазона** и #оланзапина** [103; 104; 106]. Режимы и дозы представлены в Приложении А3.4.
В случае отсутствия возможности назначения #дексаметазона** в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов используется палоносетрона в комбинации с антагонистом NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты) (при возможности назначения) и #оланзапином** [63; 108]. Режимы и дозы представлены в Приложении А3.4
- Всем пациентам с ЗНО почки на фоне умеренноэметогенной химиотерапии для оптимальной профилактики острой ТИР, возникающей в день/дни введения препаратов химиотерапии, показано использование двухкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов и #дексаметазон** [63; 105]. Режимы и дозы представлены в Приложении А3.4.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется.
- Всем пациентам с ЗНО почки на фоне умеренноэметогенной химиотерапии для оптимальной профилактики отсроченной ТИР, проводимой в течение 1 дня после завершения введения цитостатиков (по АТХ классификации L: Противоопухолевые препараты и иммуномодуляторы), показано использование #дексаметазона** [63; 105]. Режимы и дозы представлены в Приложении А3.4.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: в случае отсутствия возможности назначения #дексаметазона** использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов и антагониста NK1-рецептора (по АТХ классификации A04AD: Другие противорвотные препараты) [63; 105]. Режимы и дозы представлены в Приложении А3.4.
В случае отсутствия возможности назначения и #дексаметазона**, и антагониста NK1-рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты), в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов использование палоносетрона [63; 105]. Режимы и дозы представлены в Приложении А3.4.
- Всем пациентам с ЗНО почки на фоне низко- и минимально эметогенной химиотерапии для оптимальной профилактики показана однокомпонентная терапия, включающей блокатор серотониновых 5HT3-рецепторов, при низкоэметогенной терапии или же вовсе отсутствие ее в случае химиотерапии с минимальной эметогенной активностью [63]. Режимы и дозы представлены в Приложении А3.4.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с ЗНО почки с прорывной и рефрактерной рвотой на фоне цитостатической терапии рекомендовано [63; 109]:
1. использование препаратов, предусмотренных следующим, более высоким уровнем профилактики если прорывная ТИР возникла на фоне цитостатической терапии (и соответственно профилактики), относящейся к минимально, низко- или среднеэметогенному уровню;
2. рассмотреть вопрос о добавлении #оланзапина** (если он не применялся ранее в связи с неподходящим возрастом или массой тела) если пациент и так получает профилактику, предусмотренную для высокоэметогенной терапии. При невозможности использовать #оланзапин** в качестве альтернативы может быть применен метоклопрамид**;
3. Провести эскалацию противорвотной терапии в случае, если у пациента наблюдается рефрактерная ТИР, и он еще не получает максимальный уровень профилактики.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1)
Комментарии: Если рефрактерная ТИР наблюдается на фоне максимального уровня профилактики, возможна замена использующегося блокатора серотониновых 5HT3-рецепторов на палоносетрон, введение дополнительных доз блокаторов серотониновых 5HT3-рецепторов. При неудаче этих подходов к профилактике рекомендуется на постоянной основе добавить #оланзапин**, метоклопрамид** или другие препараты, показавшие у пациента эффективность при лечении прорывной рвоты [105; 109]
6. Организация оказания медицинской помощи
Госпитализация в круглосуточный стационар по профилю "детская онкология/гематология" осуществляется по следующим показаниям:
- в случае подозрения на ЗНО почки (первичная диагностика);
- при установленном гистологическом диагнозе для проведения или продолжения оперативного лечения или этапной терапии;
- при установленном гистологическом диагнозе для проведения контрольного обследования для оценки статуса по основному заболеванию и оценке токсичности терапии
Требования к условиям пребывания пациента в стационаре и терапии:
- Желательно наличие в палатах воздухоочистителей или центральной вентиляции;
- Необходимо наличие в структуре ЛПУ, проводящего лечение пациентов со злокачественными опухолями, в том числе с ЗНО почки, отделения или палаты интенсивной терапии, оснащенного всеми необходимыми препаратами и оборудованием для ведения больного с тяжелой дыхательной и сердечно-сосудистой недостаточностью, септическим и др. видами шока, геморрагическим синдромом, почечной недостаточностью и др. Необходимо иметь возможность проведения экстракорпоральной детоксикации (гемодиализ), аппаратной ИВЛ;
Требования к наличию специалистов и лечебно-диагностических площадок смежных специальностей:
- ЛПУ, проводящее лечение пациента с ЗНО почки должно иметь в структуре отделение (палату) анестезиологии-реанимации, отделение хирургии, способное выполнять торакальные и абдоминальные операции любой степени сложности. Кроме того, необходимо иметь в штате эндокринолога, невролога, окулиста, ЛОР-врача. Обязательно наличие цитологической, иммунологической, бактериологической, биохимической и экспресс-лаборатории;
- В случае отсутствие вышеперечисленных условий или невозможности проведения ряда лечебных процедур, пациенты должны быть направлены в профильные медицинские учреждения более высокого уровня (федеральные, национальные центры);
Показанием для выписки пациента из стационара является завершение всей проводимой терапии или одного из этапов лечения при удовлетворительном соматическом статусе.
Пациент передается педиатру (если есть должность - гематологу/онкологу) по месту жительства после завершения этапа или всего протокола лечения. Педиатр (гематолог/онколог) по месту жительства руководствуется рекомендациями, данными специалистами учреждения, проводившего основные этапы лечения.
Диспансерный учет педиатром, детским онкологом/гематологом ведется до передачи пациента во взрослую сеть.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1 Этапы патолого-анатомического исследования операционного материала
Операционный материал направляется на исследование непосредственно сразу после вмешательства интактным. Недопустимо вскрытие хирургом ни одного из образцов, выделенных фрагментов.
Этапы патолого-анатомического исследования:
1. Макроскопическое описание с обязательным указанием всех видимых наружных повреждений - разрывы капсулы, видимая опухоль с поверхности почки. Недопустимо отделять фиброзную капсулу почки (остается со всем объемом паранефральной жировой ткани).
2. Измерение, взвешивание.
3. Все лимфатические узлы, помимо выделенных хирургом, должны быть выделены и маркированы отдельно с указанием локализации.
4. Почечные вена и артерия и мочеточник описываются дополнительно. Края их резекции (наиболее дистально расположенный поперечно выделенный фрагмент) маркируются отдельно.
5. Маркировка краской всего препарата по периферии, включая синус. В отдельных случаях отек паранефральной жировой ткани или капсулы почки/опухоли не позволяет закрепиться маркировочной краске на поверхности образца. В таком случае рекомендуется предфиксация в 10% формалине в течение 15 - 20 минут с последующей маркировкой краской.
6. Продольное вскрытие почки через опухоль от полюса к полюсу после того, как маркировочная краска полностью высохнет. Описание топографии опухоли относительно капсулы, синуса. Обязательное указание макроскопически видимых очагов некроза с указанием в процентах от площади среза опухоли.
7. Измерение опухоли в трех проекциях (для последующего расчета объема опухоли и объема бластемного компонента).
8. Выделение нескольких фрагментов, визуально различных, для биобанка и генетического исследования. Указанные фрагменты рассекаются пополам - одна часть отправляется в лаборатории, другая - в плановую проводку (позволяет идентифицировать компоненты в каждом из взятых образцов, о чем сообщается генетикам).
9. Разрезанная пополам почка фиксируется в 10% забуференном формалине от 12 до 48 часов. При больших размерах почки для лучшей фиксации возможно выполнение нескольких параллельных центральному разрезов. Для уменьшения времени предподготовки и ускорения диагностики - фиксация продольной пластины толщиной до 1 - 1,5 см в 20% забуференном формалине до 12 часов максимум.
10. Выделение фрагментов для гистологического исследования:
- как минимум одна продольная пластина должна быть выделена для гистологического исследования и забирается в плановую проводку целиком;
- срез через почку обязательно проходит через почечный синус;
- из пластины выделяются фрагменты толщиной до 3 мм, что не допускает неполноценной проводки;
- размер фрагментов соответствует площади используемых гистологических кассет (так, использование мега кассет ускоряет этап просмотра и экономит время как врача, так и лаборанта);
11. Для гистологического исследования должны быть выделены (в дополнение к выше указанному, если отсутствуют):
- макроскопически различные по виду очаги опухоли;
- все вызывающие подозрение очаги, маркированные хирургом отдельно (маркируются краской, отличающейся по цвету от основной);
- лимфатические узлы синуса почки;
- мягкие ткани почечного синуса, края резекции мочеточника, сосудов ворот;
- каждый узел опухоли, отельный от основного объема (при мультифокальном поражении);
- часть капсулы опухоли/почки, подозрительные в отношении опухолевого роста;
- минимум два фрагмента визуально интактной почки (для возможного обнаружения остатков нефрогенной стромы).
12. Для пересмотра материала в других лабораториях необходимо предоставить макрофотографии почки до и после первого разреза, фото выделенной для исследования пластины, карту блоков. Все фрагменты, выделенные для исследования, раскладываются согласно локализации в почке, им присваиваются порядковые номера, проводится фото документирование.
13. Гистологический тип и стадия выставляется согласно протоколу SIOP, раздел патоморфологии.
Критерии оценки качества медицинской помощи
Критерии качества
Оценка выполнения
1
Пациенту с НБ выполнен развернутый клинический анализ крови с определением уровня гемоглобина, количества эритроцитов, тромбоцитов, лейкоцитов перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, в процессе лечения на 0, 15, 28 дни терапии (для локализованных стадий) или на 0, 15, 28, 42 дни терапии (для генерализованных стадий), на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов)
Да/нет
2
Пациенту с НБ выполнен биохимический общетерапевтический анализ крови (мочевина, креатинин, электролиты, глюкоза, лактатдегидрогеназа, аланинаминотрансфераза, аспартатаминотрансфераза, биллирубин общий и прямой, щелочная фосфатаза, общий белок, альбумин) перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, в процессе лечения на 0, 15, 28 дни терапии (для локализованных стадий) или на 0, 15, 28, 42 дни терапии (для генерализованных стадий), на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю
Да/нет
3
Пациенту с НБ выполнен общий (клинический) анализ мочи перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов)
Да/нет
4
Пациенту с ЗРО почки выполнено Ультразвуковое исследование органов брюшной полости (комплексное) и забрюшинного пространства перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
Да/нет
5
Пациенту с СКС выполнена Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием (или как альтернатива - Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием, если невозможно МРТ исследование) перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
Да/нет
6
Пациенту с ВМН выполнено патолого-анатомическое исследование операционного материала
Да/нет
Список литературы
1. Davidoff A.M. Wilms' tumor. Т. 21/A.M. Davidoff. - Curr Opin Pediatr, 2009.
2. Agrons G.A. Rhabdoid tumor of the kidney in children: a comparative study of 21 cases/G.A. Agrons, K.D. Kingsman, B.J. Wagner, C. Sotelo-Avila//AJR. American journal of roentgenology. - 1997. - Т. 168. - Rhabdoid tumor of the kidney in children. - N 2. - С. 447 - 451.
3. Gooskens S.L.M. Clear cell sarcoma of the kidney: a review/S.L.M. Gooskens, R.  , G.M. Vujanic, J.S. Dome, N. Graf, M.M. van den Heuvel-Eibrink//European Journal of Cancer (Oxford, England: 1990). - 2012. - Т. 48. - Clear cell sarcoma of the kidney. - N 14. - С. 2219 - 2226.
, G.M. Vujanic, J.S. Dome, N. Graf, M.M. van den Heuvel-Eibrink//European Journal of Cancer (Oxford, England: 1990). - 2012. - Т. 48. - Clear cell sarcoma of the kidney. - N 14. - С. 2219 - 2226.
4. Pettinato G. Classical and cellular (atypical) congenital mesoblastic nephroma: a clinicopathologic, ultrastructural, immunohistochemical, and flow cytometric study/G. Pettinato, J.C. Manivel, M.R. Wick, L.P. Dehner//Human Pathology. - 1989. - Т. 20. - Classical and cellular (atypical) congenital mesoblastic nephroma. - N 7. - С. 682 - 690.
5. Reinhard H. Results of the SIOP 93-01/GPOH trial and study for the treatment of patients with unilateral nonmetastatic Wilms Tumor/H. Reinhard, O. Semler, D. ![]() , U. Bode, M. Flentje, U.
, U. Bode, M. Flentje, U. ![]() , P. Gutjahr, I. Leuschner, E. Maass, F. Niggli, H.G. Scheel-Walter, M.
, P. Gutjahr, I. Leuschner, E. Maass, F. Niggli, H.G. Scheel-Walter, M.  , J.W.
, J.W.  , J.
, J. ![]() , A. Weirich, D. von Schweinitz, A. Zoubek, N. Graf//Klinische Padiatrie. - 2004. - Т. 216. - N 3. - С. 132 - 140.
, A. Weirich, D. von Schweinitz, A. Zoubek, N. Graf//Klinische Padiatrie. - 2004. - Т. 216. - N 3. - С. 132 - 140.
6. Buckley K.S. Pediatric genitourinary tumors./K.S. Buckley//Current opinion in oncology. - 2011. - Т. 23. - N 3. - С. 297 - 302.
7. Rivera M.N. Wilms' tumour: Connecting tumorigenesis and organ development in the kidney. Т. 5/M.N. Rivera, D.A. Haber. - Nature Publishing Group, 2005.
8. Beckwith J.B. Nephrogenic rests, nephroblastomatosis, and the pathogenesis of wilms' tumor/J.B. Beckwith, N.B. Kiviat, J.F. Bonadio//Fetal and Pediatric Pathology. - 1990. - Т. 10. - N 1 - 2. - С. 1 - 36.
9. Breslow N.E. Age distributions, birth weights, nephrogenic rests, and heterogeneity in the pathogenesis of Wilms tumor/N.E. Breslow, J.B. Beckwith, E.J. Perlman, A.E. Reeve//Pediatric Blood and Cancer. - 2006. - Т. 47. - N 3. - С. 260 - 267.
10. Gadd S. A Children's Oncology Group and TARGET initiative exploring the genetic landscape of Wilms tumor/S. Gadd, V. Huff, A.L. Walz, A.H.A.G. Ooms, A.E. Armstrong, D.S. Gerhard, M.A. Smith, J.M. Guidry Auvil, D. Meerzaman, Q.R. Chen, C.H. Hsu, C. Yan, C. Nguyen, Y. Hu, L.C. Hermida, T. Davidsen, P. Gesuwan, Y. Ma, Z. Zong, A.J. Mungall, R.A. Moore, M.A. Marra, J.S. Dome, C.G. Mullighan, J. Ma, D.A. Wheeler, O.A. Hampton, N. Ross, J.M. Gastier-Foster, S.T. Arold, E.J. Perlman//Nature Genetics. - 2017. - Т. 49. - N 10. - С. 1487 - 1494.
11. Szychot E. Wilms' tumor: biology, diagnosis and treatment./E. Szychot, J. Apps, K. Pritchard-Jones//Translational pediatrics. - 2014. - Т. 3. - N 1. - С. 12 - 24.
12. Szychot E. Review of Current Approaches to the Management of Wilms' Tumor/E. Szychot, A. Brodkiewicz, K. Pritchard-Jones//International Journal of Clinical Reviews. - 2012.
13. Versteege I. Truncating mutations of hSNF5/INI1 in aggressive paediatric cancer/I. Versteege, N.  , J. Lange, M.F. Rousseau-Merck, P. Ambros, R. Handgretinger, A. Aurias, O. Delattre//Nature. - 1998. - Т. 394. - N 6689. - С. 203 - 206.
, J. Lange, M.F. Rousseau-Merck, P. Ambros, R. Handgretinger, A. Aurias, O. Delattre//Nature. - 1998. - Т. 394. - N 6689. - С. 203 - 206.
14.  M.C. Non-linkage of familial rhabdoid tumors to SMARCB1 implies a second locus for the rhabdoid tumor predisposition syndrome/M.C.
M.C. Non-linkage of familial rhabdoid tumors to SMARCB1 implies a second locus for the rhabdoid tumor predisposition syndrome/M.C.  , M. Hasselblatt, S. Wirth, G.
, M. Hasselblatt, S. Wirth, G. ![]() , R. Schneppenheim, J.I.M. Subero, R. Siebert, U. Kordes, H.
, R. Schneppenheim, J.I.M. Subero, R. Siebert, U. Kordes, H.  , J. Vormoor//Pediatric Blood & Cancer. - 2006. - Т. 47. - N 3. - С. 273 - 278.
, J. Vormoor//Pediatric Blood & Cancer. - 2006. - Т. 47. - N 3. - С. 273 - 278.
15. Андреева Н.А. SMARCA4-ассоциированные злокачественные рабдоидные опухоли: описание клинического случая и обзор литературы/Н.А. Андреева, Э.И. Людовских, Д.М. Коновалов, М.В. Телешова, А.М. Митрофанова, М.А. Курникова, Л.А. Ясько, А.Е. Друй, М.Ю. Горошкова//РЖДГиО. - 2022. - Т. 9. - N 2. - С. 75 - 84.
16. Lechner I. A multinational registry for rhabdoid tumors of any anatomical site/I. Lechner. - 2021.
17. Biegel J.A. Alterations of the hSNF5/INI1 gene in central nervous system atypical teratoid/rhabdoid tumors and renal and extrarenal rhabdoid tumors/J.A. Biegel, L. Tan, F. Zhang, L. Wainwright, P. Russo, L.B. Rorke//Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. - 2002. - Т. 8. - N 11. - С. 3461 - 3467.
18. Schneppenheim R. Germline nonsense mutation and somatic inactivation of SMARCA4/BRG1 in a family with rhabdoid tumor predisposition syndrome/R. Schneppenheim, M.C.  , S. Gesk, M. Hasselblatt, A. Jeibmann, U. Kordes, M. Kreuz, I. Leuschner, J.I. Martin Subero, T. Obser, F. Oyen, I. Vater, R. Siebert//American Journal of Human Genetics. - 2010. - Т. 86. - N 2. - С. 279 - 284.
, S. Gesk, M. Hasselblatt, A. Jeibmann, U. Kordes, M. Kreuz, I. Leuschner, J.I. Martin Subero, T. Obser, F. Oyen, I. Vater, R. Siebert//American Journal of Human Genetics. - 2010. - Т. 86. - N 2. - С. 279 - 284.
19. Gooskens S.L. Position paper: Rationale for the treatment of children with CCSK in the UMBRELLA SIOP-RTSG 2016 protocol/S.L. Gooskens, N. Graf, R.  , F. Spreafico, C. Bergeron, G.L.
, F. Spreafico, C. Bergeron, G.L.  , J. Godzinski, C.
, J. Godzinski, C. ![]() , G.O. Janssens, G.M. Vujanic, I. Leuschner, A. Coulomb-L'Hermine, A.M. Smets, B. de Camargo, S. Stoneham, H. van Tinteren, K. Pritchard-Jones, M.M. van den Heuvel-Eibrink, International Society of Paediatric Oncology-Renal Tumour Study Group (SIOP-RTSG)//Nature Reviews. Urology. - 2018. - Т. 15. - Position paper. - N 5. - С. 309 - 319.
, G.O. Janssens, G.M. Vujanic, I. Leuschner, A. Coulomb-L'Hermine, A.M. Smets, B. de Camargo, S. Stoneham, H. van Tinteren, K. Pritchard-Jones, M.M. van den Heuvel-Eibrink, International Society of Paediatric Oncology-Renal Tumour Study Group (SIOP-RTSG)//Nature Reviews. Urology. - 2018. - Т. 15. - Position paper. - N 5. - С. 309 - 319.
20. Astolfi A. Whole transcriptome sequencing identifies BCOR internal tandem duplication as a common feature of clear cell sarcoma of the kidney/A. Astolfi, F. Melchionda, D. Perotti, M. Fois, V. Indio, M. Urbini, C.G. Genovese, P. Collini, N. Salfi, M. Nantron, P. D'Angelo, F. Spreafico, A. Pession//Oncotarget. - 2015. - Т. 6. - N 38. - С. 40934 - 40939.
21. Roy A. Recurrent internal tandem duplications of BCOR in clear cell sarcoma of the kidney/A. Roy, V. Kumar, B. Zorman, E. Fang, K.M. Haines, H. Doddapaneni, O.A. Hampton, S. White, A.A. Bavle, N.R. Patel, K.W. Eldin, M. John Hicks, D. Rakheja, P.J. Leavey, S.X. Skapek, J.F. Amatruda, J.G. Nuchtern, M.M. Chintagumpala, D.A. Wheeler, S.E. Plon, P. Sumazin, D.W. Parsons//Nature Communications. - 2015. - Т. 6. - С. 8891.
22. Ueno-Yokohata H. Consistent in-frame internal tandem duplications of BCOR characterize clear cell sarcoma of the kidney/H. Ueno-Yokohata, H. Okita, K. Nakasato, S. Akimoto, J. Hata, T. Koshinaga, M. Fukuzawa, N. Kiyokawa//Nature Genetics. - 2015. - Т. 47. - N 8. - С. 861 - 863.
23. Kenny C. Mutually exclusive BCOR internal tandem duplications and YWHAE-NUTM2 fusions in clear cell sarcoma of kidney: not the full story/C. Kenny, S. Bausenwein, A. Lazaro, R.  , S.L.M. Gooskens, M. van den Heuvel Eibrink, C. Vokuhl, I. Leuschner, N. Graf, M. Gessler, M.J. O'Sullivan//The Journal of Pathology. - 2016. - Т. 238. - Mutually exclusive BCOR internal tandem duplications and YWHAE-NUTM2 fusions in clear cell sarcoma of kidney. - N 5. - С. 617 - 620.
, S.L.M. Gooskens, M. van den Heuvel Eibrink, C. Vokuhl, I. Leuschner, N. Graf, M. Gessler, M.J. O'Sullivan//The Journal of Pathology. - 2016. - Т. 238. - Mutually exclusive BCOR internal tandem duplications and YWHAE-NUTM2 fusions in clear cell sarcoma of kidney. - N 5. - С. 617 - 620.
24. O'Meara E. Characterization of the chromosomal translocation t (10; 17) (q22; p13) in clear cell sarcoma of kidney/E. O'Meara, D. Stack, C.-H. Lee, A.J. Garvin, T. Morris, P. Argani, J.S. Han, J. Karlsson, D. Gisselson, I. Leuschner, M. Gessler, N. Graf, J.A. Fletcher, M.J. O'Sullivan//The Journal of Pathology. - 2012. - Т. 227. - N 1. - С. 72 - 80.
25. Han H. BCOR-CCNB3 fusion-positive clear cell sarcoma of the kidney/H. Han, K.C. Bertrand, K.R. Patel, K.E. Fisher, A. Roy, J.A. Muscal, R. Venkatramani//Pediatric Blood & Cancer. - 2020. - Т. 67. - N 4. - С. e28151.
26. Antonescu C.R. Undifferentiated round cell sarcoma with BCOR internal tandem duplications (ITD) or YWHAE fusions: a clinicopathologic and molecular study/C.R. Antonescu, Y.-C. Kao, B. Xu, Y. Fujisawa, C. Chung, C.D.M. Fletcher, N. Graf, A.J. Suurmeijer, A. Zin, L.H. Wexler, A. Ferrari, G. Bisogno, R. Alaggio//Modern Pathology: An Official Journal of the United States and Canadian Academy of Pathology, Inc. - 2020. - Т. 33. - Undifferentiated round cell sarcoma with BCOR internal tandem duplications (ITD) or YWHAE fusions. - N 9. - С. 1669 - 1677.
27. Сагоян Г.Б. Врожденная мезобластная нефрома. Собственный опыт НИИ детской онкологии и гематологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России/Сагоян Г.Б., Рубанская М.В., Шевцов Д.В., Рубанский М.А., Керимов П.А., Сулейманова А.М., Пименов Р.И., Темный А.С., Кириллова О.А., Захарова Е.В., Близнюков О.П., Жуманиезов Х.И., Казанцев А.П., Варфоломеева С.Р. Российский журнал детской гематологии и онкологии 2019; 6(4): 25 - 32.
28. ETV6-NTRK3 gene fusions and trisomy 11 establish a histogenetic link between mesoblastic nephroma and congenital fibrosarcoma - PubMed [Электронный ресурс]. - URL: https://pubmed.ncbi.nlm.nih.gov/9823307/(дата обращения: 28.05.2024).
29. Watanabe N. Duplication of the paternal IGF2 allele in trisomy 11 and elevated expression levels of IGF2 mRNA in congenital mesoblastic nephroma of the cellular or mixed type/N. Watanabe, M. Haruta, H. Soejima, D. Fukushi, K. Yokomori, H. Nakadate, H. Okita, J. Hata, M. Fukuzawa, Y. Kaneko//Genes, Chromosomes & Cancer. - 2007. - Т. 46. - N 10. - С. 929 - 935.
30. Chu A. Wilms' tumour: A systematic review of risk factors and meta-analysis. Т. 24/A. Chu, J.E. Heck, K.B. Ribeiro, P. Brennan, P. Boffetta, P. Buffler, R.J. Hung. - 2010.
31. Spreafico F. Wilms' tumor: Past, present and (possibly) future. T. 6/F. Spreafico, F.F. Bellani. - Expert Rev Anticancer Ther, 2006.
32. Sultan I. Age, stage, and radiotherapy, but not primary tumor site, affects the outcome of patients with malignant rhabdoid tumors/I. Sultan, I. Qaddoumi, C.  , A.A. Nassan, K. Ghandour, M. Al-Hussaini//Pediatric Blood & Cancer. - 2010. - Т. 54. - N 1. - С. 35 - 40.
, A.A. Nassan, K. Ghandour, M. Al-Hussaini//Pediatric Blood & Cancer. - 2010. - Т. 54. - N 1. - С. 35 - 40.
33. UMBRELLA Protocol SIOP-RTSG 2016 [Электронный ресурс]. - URL: http://www.fnkc.ru/docs/SIOP-RTSG2016.pdf.
34. Heck J.E. Epidemiology of Rhabdoid Tumors of Early Childhood/J.E. Heck, C.A. Lombardi, M. Cockburn, T.J. Meyers, M. Wilhelm, B. Ritz//Pediatric blood & cancer. - 2013. - Т. 60. - N 1. - С. 77 - 81.
35. Nakata K. Incidence of childhood renal tumours: An international population-based study/K. Nakata, M. Colombet, C.A. Stiller, K. Pritchard-Jones, E. Steliarova-Foucher, IICC-3 Contributors//International Journal of Cancer. - 2020. - Т. 147. - Incidence of childhood renal tumours. - N 12. - С. 3313 - 3327.
36. Argani P. Clear cell sarcoma of the kidney: a review of 351 cases from the National Wilms Tumor Study Group Pathology Center/P. Argani, E.J. Perlman, N.E. Breslow, N.G. Browning, D.M. Green, G.J. D'Angio, J.B. Beckwith//The American Journal of Surgical Pathology. - 2000. - Т. 24. - Clear cell sarcoma of the kidney. - N 1. - С. 4 - 18.
37. Reza Alaghehbandan. What's new in the WHO 2022 classification of kidney tumours?/Reza Alaghehbandan, Farshid Siadat, Kiril Trpkov//Pathologica. 2023 Feb; 115(1): 8 - 22.
38. Beckwith J.B. National Wilms Tumor Study: An update for pathologists/J.B. Beckwith//Pediatric and Developmental Pathology. - 1998. - Т. 1. - N 1. - С. 79 - 84.
39. Green D.M. Wilms' Tumor/D.M. Green//Diagnosis and Management of Malignant Solid Tumors in Infants and Children. - Springer US, 1985. - С. 129 - 186.
40. Israels T. SIOP PODC: Clinical guidelines for the management of children with Wilms tumour in a low income setting/T. Israels, C. Moreira, T. Scanlan, L. Molyneux, S. Kampondeni, P. Hesseling, H. Heij, E. Borgstein, G. Vujanic, K. Pritchard-Jones, L. Hadley//Pediatric Blood and Cancer. - 2013. - Т. 60. - N 1. - С. 5 - 11.
41. Scott R.H. Syndromes and constitutional chromosomal abnormalities associated with Wilms tumour. Т. 43/R.H. Scott, C.A. Stiller, L. Walker, N. Rahman. - BMJ Publishing Group, 2006.
42. Magee F. Neural differentiation in Wilms' tumor./F. Magee, R.G. Mah, G.P. Taylor, J.E. Dimmick//Human pathology. - 1987. - Т. 18. - N 1. - С. 33 - 7.
43. Sandoval J.A. Clinical significance of serum biomarkers in pediatric solid mediastinal and abdominal tumors/J.A. Sandoval, L.H. Malkas, R.J. Hickey//International Journal of Molecular Sciences. - 2012. - Т. 13. - N 1. - С. 1126 - 1153.
44. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. - М.: Издательская группа РОНЦ. Практическая медицина, 2012. - 684 с.
45. Zamperlini-Netto G. PO-60 - Renal tumors with extensive vascular disease: management challenges in a pediatric series from the Hospital for Sick Children./G. Zamperlini-Netto, A. Zanette, E. Wehbi, S. Williams, R.M. Grant, L.R. Brandao//Thrombosis research. - 2016. - Т. 140 Suppl 1. - С. S198 - 9.
46. Riccabona M. Imaging of renal tumours in infancy and childhood. Т. 13/M. Riccabona. - 2003.
47. Grundy P.E. Clinical significance of pulmonary nodules detected by CT and Not CXR in patients treated for favorable histology Wilms tumor on national Wilms tumor studies-4 and -5: A report from the Children's Oncology Group/P.E. Grundy, D.M. Green, A.C. Dirks, A.E. Berendt, N.E. Breslow, J.R. Anderson, J.S. Dome//Pediatric Blood and Cancer. - 2012. - Т. 59. - N 4. - С. 631 - 635.
48. Smets A.M.J.B. The contribution of chest CT-scan at diagnosis in children with unilateral Wilms' tumour. Results of the SIOP 2001 study/A.M.J.B. Smets, H. Van Tinteren, C. Bergeron, B. De Camargo, N. Graf, K. Pritchard-Jones, J. De Kraker//European Journal of Cancer. - 2012. - Т. 48. - N 7. - С. 1060 - 1065.
49. Stanescu A.L. Pediatric Renal Neoplasms:: MR Imaging-Based Practical Diagnostic Approach. Т. 27/A.L. Stanescu, P.T. Acharya, E.Y. Lee, G.S. Phillips. - W.B. Saunders, 2019.
50. Casanova M. Vinorelbine and low-dose cyclophosphamide in the treatment of pediatric sarcomas: pilot study for the upcoming European Rhabdomyosarcoma Protocol/M. Casanova, A. Ferrari, G. Bisogno, J.H.M. Merks, G.L. De Salvo, C. Meazza, K. Tettoni, M. Provenzi, I. Mazzarino, M. Carli//Cancer. - 2004. - Т. 101. - Vinorelbine and low-dose cyclophosphamide in the treatment of pediatric sarcomas. - N 7. - С. 1664 - 1671.
51. Heuvel-Eibrink M.M. van den. Position paper: Rationale for the treatment of Wilms tumour in the UMBRELLA SIOP-RTSG 2016 protocol/M.M. van den Heuvel-Eibrink, J.A. Hol, K. Pritchard-Jones, H. van Tinteren, R.  , A.C. Verschuur, G.M. Vujanic, I. Leuschner, J. Brok, C.
, A.C. Verschuur, G.M. Vujanic, I. Leuschner, J. Brok, C. ![]() , A.M. Smets, G.O. Janssens, J. Godzinski, G.L.
, A.M. Smets, G.O. Janssens, J. Godzinski, G.L.  , B. de Camargo, H. Segers, P. Collini, M. Gessler, C. Bergeron, F. Spreafico, N. Graf, International Society of Paediatric Oncology - Renal Tumour Study Group (SIOP-RTSG)//Nature Reviews. Urology. - 2017. - Т. 14. - Position paper. - N 12. - С. 743 - 752.
, B. de Camargo, H. Segers, P. Collini, M. Gessler, C. Bergeron, F. Spreafico, N. Graf, International Society of Paediatric Oncology - Renal Tumour Study Group (SIOP-RTSG)//Nature Reviews. Urology. - 2017. - Т. 14. - Position paper. - N 12. - С. 743 - 752.
52. Voss S.D. Staging and following common pediatric malignancies: MRI versus CT versus functional imaging. Т. 48/S.D. Voss. - Springer Verlag, 2018.
53. Agarwala S. High incidence of adriamycin cardiotoxicity in children even at low cumulative doses: Role of radionuclide cardiac angiography/S. Agarwala, R. Kumar, V. Bhatnagar, M. Bajpai, D.K. Gupta, D.K. Mitra//Journal of Pediatric Surgery. - 2000. - Т. 35. - N 12. - С. 1786 - 1789.
54. Blatt J. Pilot study of cardiac function after treatment of childhood wilms' tumor with doxorubicin/J. Blatt, C. Delaat, F.J. Fricker, J.E. Janosky//Pediatric Hematology and Oncology. - 1995. - Т. 12. - N 1. - С. 61 - 66.
55. Massin M.M. Acute arrhythmogenicity of first-dose chemotherapeutic agents in children/M.M. Massin, M.F. Dresse, V. Schmitz, C. Hoyoux, J.M. Chantraine, P. Lepage//Medical and Pediatric Oncology. - 2002. - Т. 39. - N 2. - С. 93 - 98.
56. 13. Brooks B. Ototoxicity monitoring in children treated with platinum chemotherapy/B. Brooks, K. Knight//International Journal of Audiology. - 2018. - Т. 57. - N sup4. - С. S34 - S40.
57. Durrant J.D. American Academy of Audiology Position Statement and Clinical Practice Guidelines: Ototoxicity Monitoring Task Force Members/J.D. Durrant, K. Campbell, S. Fausti, G. Jacobson, B.L. Lonsbury-Martin, L. Linda. - 2009.
58. ![]() E. Twenty children with non-wilms renal tumors from a reference center in central anatolia, Turkey/E.
E. Twenty children with non-wilms renal tumors from a reference center in central anatolia, Turkey/E. ![]() , E. Yilmaz, A.
, E. Yilmaz, A. ![]() , B.
, B. ![]() , M.
, M.  , C. Turan, H.
, C. Turan, H. ![]() , F.
, F. ![]() , A.
, A.  , M.A.
, M.A.  , T.
, T.  //Turkish Journal of Medical Sciences. - 2020. - Т. 50. - N 1. - С. 18 - 24.
//Turkish Journal of Medical Sciences. - 2020. - Т. 50. - N 1. - С. 18 - 24.
59.  G.M. The role of biopsy in the diagnosis of renal tumors of childhood: Results of the UKCCSG Wilms Tumor Study 3/G.M.
G.M. The role of biopsy in the diagnosis of renal tumors of childhood: Results of the UKCCSG Wilms Tumor Study 3/G.M.  , A. Kelsey, C. Mitchell, R.S. Shannon, P. Gornall//Medical and Pediatric Oncology. - 2003. - Т. 40. - N 1. - С. 18 - 22.
, A. Kelsey, C. Mitchell, R.S. Shannon, P. Gornall//Medical and Pediatric Oncology. - 2003. - Т. 40. - N 1. - С. 18 - 22.
60. Jackson T.J. How we approach paediatric renal tumour core needle biopsy in the setting of preoperative chemotherapy: A Review from the SIOP Renal Tumour Study Group/T.J. Jackson, H.J. Brisse, K. Pritchard-Jones, K. Nakata, C. Morosi, T. Oue, S. Irtan, G. Vujanic, M.M. van den Heuvel-Eibrink, N. Graf, T. Chowdhury, SIOP RTSG Biopsy Working Group//Pediatric Blood & Cancer. - 2022. - Т. 69. - How we approach paediatric renal tumour core needle biopsy in the setting of preoperative chemotherapy. - N 9. - С. e29702.
61. Muscaritoli M, Arends J, Bachmann P, Baracos V, Barthelemy N, Bertz H, Bozzetti F,  E, Isenring E, Kaasa S, Krznaric Z, Laird B, Larsson M, Laviano A,
E, Isenring E, Kaasa S, Krznaric Z, Laird B, Larsson M, Laviano A,  S, Oldervoll L, Ravasco P, Solheim TS, Strasser F, de van der Schueren M, Preiser JC, Bischoff SC. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutr. 2021; 40(5): 2898 - 2913. doi: 10.1016/j.clnu.2021.02.005.
S, Oldervoll L, Ravasco P, Solheim TS, Strasser F, de van der Schueren M, Preiser JC, Bischoff SC. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutr. 2021; 40(5): 2898 - 2913. doi: 10.1016/j.clnu.2021.02.005.
62. Трахтман П.Е., Старостин Н.Н., Новичкова Г.А., Ворожцов И.Н. Трансфузионная терапия в клинической практике: учеб. пособие/Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Д. Рогачева. Москва, 2021. 76 с.
63. Patel P. Interventions for the prevention of acute phase chemotherapy-induced nausea and vomiting in adult and pediatric patients: a systematic review and meta-analysis.//Patel P, Robinson PD, Wahib N [et al]//Support Care Cancer. 2022 Nov; 30(11): 8855 - 8869. doi: 10.1007/s00520-022-07287-w.
64. Heuvel-Eibrink M.M. Van Den. Position Paper: Rationale for the treatment of Wilms tumour in the UMBRELLA SIOP-RTSG 2016 protocol/M.M. Van Den Heuvel-Eibrink, J.A. Hol, K. Pritchard-Jones, H. Van Tinteren, R.  , A.C. Verschuur, G.M. Vujanic, I. Leuschner, J. Brok, C.
, A.C. Verschuur, G.M. Vujanic, I. Leuschner, J. Brok, C. ![]() , A.M. Smets, G.O. Janssens, J. Godzinski, G.L.
, A.M. Smets, G.O. Janssens, J. Godzinski, G.L.  , B. De Camargo, H. Segers, P. Collini, M. Gessler, C. Bergeron, F. Spreafico, N. Graf//Nature Reviews Urology. - 2017. - Т. 14. - N 12. - С. 743 - 752.
, B. De Camargo, H. Segers, P. Collini, M. Gessler, C. Bergeron, F. Spreafico, N. Graf//Nature Reviews Urology. - 2017. - Т. 14. - N 12. - С. 743 - 752.
65. Kieran K. Current surgical standards of care in Wilms tumor. Т. 34/K. Kieran, P.F. Ehrlich. - Elsevier Inc., 2016.
66. Israels T. The efficacy and toxicity of SIOP preoperative chemotherapy in Malawian children with a Wilms tumour/T. Israels, G. Chagaluka, D. Pidini, H. Caron, J. de Kraker, S. Kamiza, E. Borgstein, L. Molyneux//Pediatric Blood and Cancer. - 2012. - Т. 59. - N 4. - С. 636 - 641.
67. Alkazemi M.H. Partial and radical nephrectomy in children, adolescents, and young adults: Equivalent readmissions and postoperative complications/M.H. Alkazemi, Z.R. Dionise, R. Jiang, S. Wolf, G.M. Pomann, E.T. Tracy, H.E. Rice, J.C. Routh//Journal of Pediatric Surgery. - 2019. - Т. 54. - N 11. - С. 2343 - 2347.
68. Cox S. Surgery for the complex Wilms tumour/S. Cox, C.  , A.J.W. Millar//Pediatric Surgery International. - 2020. - Т. 36. - N 2. - С. 113 - 127.
, A.J.W. Millar//Pediatric Surgery International. - 2020. - Т. 36. - N 2. - С. 113 - 127.
69. Fuchs J. Surgical aspects in the treatment of patients with unilateral wilms tumor: A report from the SIOP 93-01/German society of pediatric oncology and hematology/J. Fuchs, K. Kienecker, R.  , S.W. Warmann, D.
, S.W. Warmann, D. ![]() , J.W.
, J.W.  , J. Hager, N. Graf//Annals of Surgery. - 2009. - Т. 249. - N 4. - С. 666 - 671.
, J. Hager, N. Graf//Annals of Surgery. - 2009. - Т. 249. - N 4. - С. 666 - 671.
70. Walker J.P. Factors affecting lymph node sampling patterns and the impact on survival of lymph node density in patients with Wilms tumor: a Surveillance, Epidemiology, and End Result (SEER) database review/J.P. Walker, J.S. Johnson, M.M. Eguchi, A.F. Saltzman, M. Cockburn, N.G. Cost//Journal of Pediatric Urology. - 2019.
71. Godzinski J. Current concepts in surgery for Wilms tumor-the risk and function-adapted strategy. Т. 24/J. Godzinski, N. Graf, G. Audry. - Georg Thieme Verlag, 2014.
72. Godzinski J. The current status of treatment of Wilms' tumor as per the SIOP trials. Т. 20/J. Godzinski. - Medknow Publications, 2014.
73. Kieran K. Repeat nephron-sparing surgery for children with bilateral Wilms tumor/K. Kieran, M.A. Williams, L.M. McGregor, J.S. Dome, M.J. Krasin, A.M. Davidoff//Journal of Pediatric Surgery. - 2014. - Т. 49. - N 1. - С. 149 - 153.
74. Varlet F. Laparoscopic radical nephrectomy for unilateral renal cancer in children/F. Varlet, J.L. Stephan, E. Guye, R. Allary, C. Berger, M. Lopez//Surgical Laparoscopy, Endoscopy and Percutaneous Techniques. - 2009. - Т. 19. - N 2. - С. 148 - 152.
75. Varlet F. Laparoscopic treatment of renal cancer in children: A multicentric study and review of oncologic and surgical complications/F. Varlet, T. Petit, M.D. Leclair, H. Lardy, S. Geiss, F. Becmeur, P. Ravasse, J. Rod, G. De Lambert, K. Braik, F. Lardellier-Reynaud, M. Lopez//Journal of Pediatric Urology. - 2014. - Т. 10. - N 3. - С. 500 - 505.
76. Dome J.S. Treatment of anaplastic histology Wilms' tumor: Results from the fifth National Wilms' Tumor Study/J.S. Dome, C.A. Cotton, E.J. Perlman, N.E. Breslow, J.A. Kalapurakal, M.L. Ritchey, P.E. Grundy, M. Malogolowkin, J.B. Beckwith, R.C. Shamberger, G.M. Haase, M.J. Coppes, P. Coccia, M. Kletzel, R.M. Weetman, M. Donaldson, R.M. Macklis, D.M. Green//Journal of Clinical Oncology. - 2006. - Т. 24. - N 15. - С. 2352 - 2358.
77. Green D.M. Effect of duration of treatment on treatment outcome and cost of treatment for Wilms' tumor: A report from the National Wilms' Tumor Study Group/D.M. Green, N.E. Breslow, J.B. Beckwith, J.Z. Finklestein, P. Grundy, P.R. Thomas, T. Kim, S. Shochat, G. Haase, M. Ritchey, P. Kelalis, G.J. D'Angio//Journal of Clinical Oncology. - 1998. - Т. 16. - N 12. - С. 3744 - 3751.
78. Malogolowkin M. Treatment of Wilms tumor relapsing after initial treatment with vincristine, actinomycin D, and doxorubicin. A report from the national Wilms tumor study group/M. Malogolowkin, C.A. Cotton, D.M. Green, N.E. Breslow, E. Perlman, J. Miser, M.L. Ritchey, P.R.M. Thomas, P.E. Grundy, G.J. D'Angio, J.B. Beckwith, R.C. Shamberger, G.M. Haase, M. Donaldson, R. Weetman, M.J. Coppes, P. Shearer, P. Coccia, M. Kletzel, R. Macklis, G. Tomlinson, V. Huff, R. Newbury, D. Weeks//Pediatric Blood and Cancer. - 2008. - Т. 50. - N 2. - С. 236 - 241.
79. Mitchell C. The treatment of Wilms' tumour: Results of the United Kingdom Children's Cancer Study Group (UKCCSG) second Wilms' tumour study/C. Mitchell, P. Morris Jones, A. Kelsey, G.M. Vujanic, B. Marsden, R. Shannon, P. Gornall, C. Owens, R. Taylor, J. Imeson, H. Middleton, J. Pritchard//British Journal of Cancer. - 2000. - Т. 83. - N 5. - С. 602 - 608.
80. Pritchard J. Results of the United Kingdom Children's Cancer Study Group first Wilms' tumor study/J. Pritchard, J. Imeson, J. Barnes, S. Cotterlll, D. Gough, H.B. Marsden, P. Morris-Jones, D. Pearson//Journal of Clinical Oncology. - 1995. - Т. 13. - N 1. - С. 124 - 133.
81. Arunagiri N. The spleen as an organ at risk in paediatric radiotherapy: A SIOP-Europe Radiation Oncology Working Group report/N. Arunagiri, S.M. Kelly, C. Dunlea, O. Dixon, J. Cantwell, P. Bhudia, T. Boterberg, G.O. Janssens, J.E. Gains, Y.-C. Chang, M.N. Gaze, SIOP-Europe Radiation Oncology Working Group//European Journal of Cancer (Oxford, England: 1990). - 2021. - Т. 143. - The spleen as an organ at risk in paediatric radiotherapy. - С. 1 - 10.
82. Hamilton T.E. The management of synchronous bilateral wilms tumor: A report from the National Wilms Tumor Study Group/T.E. Hamilton, M.L. Ritchey, G.M. Haase, P. Argani, S.M. Peterson, J.R. Anderson, D.M. Green, R.C. Shamberger//Annals of Surgery. - 2011. - Т. 253. - N 5. - С. 1004 - 1010.
83. Indolfi P. Synchronous bilateral Wilms tumor: A report from the Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP)/P. Indolfi, A. Jenkner, M. Terenziani, A. Crocoli, A. Serra, P. Collini, D. Biasoni, L. Gandola, G. Bisogno, G. Cecchetto, M. Di Martino, P. D'Angelo, M. Bianchi, M. Conte, A. Inserra, A. Pession, F. Spreafico//Cancer. - 2013. - Т. 119. - N 8. - С. 1586 - 1592.
84. Owens C.M. Bilateral disease and new trends in Wilms tumour/C.M. Owens, H.J. Brisse, ![]() Olsen, J. Begent, A.M. Smets//Pediatric Radiology. - Pediatr Radiol, 2008. - Т. 38. - С. 30 - 39.
Olsen, J. Begent, A.M. Smets//Pediatric Radiology. - Pediatr Radiol, 2008. - Т. 38. - С. 30 - 39.
85. Sudour H. Bilateral Wilms tumors (WT) treated with the SIOP 93 protocol in France: Epidemiological survey and patient outcome/H. Sudour, G. Audry, G. Schleimacher, C. Patte, S. Dussart, C. Bergeron//Pediatric Blood and Cancer. - 2012. - Т. 59. - N 1. - С. 57 - 61.
86. Вашура А.Ю. Нутритивная недостаточность, ее причины и пути коррекции у детей с опухолями ЦНС на этапе активной терапии и после ее окончания. Фарматека. 2019; 26 (10): 8 - 14.
87. Парентеральное и энтеральное питание: национальное руководство/под ред. М.Ш. Хубутия, Т.С. Поповой, А.И. Салтанова. - М.: ГЭОТАР-Медиа, 2014. - 800 с.
88. Mehta NM, Corkins MR, Lyman B, Malone A, Goday PS, Carney LN, Monczka JL, Plogsted SW, Schwenk WF; American Society for Parenteral and Enteral Nutrition Board of Directors. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions. JPEN J Parenter Enteral Nutr. 2013; 37(4): 460 - 81. doi: 10.1177/0148607113479972.
89. Алымова Ю.А., Вашура А.Ю. Адекватная оценка нутритивного статуса в детской онкологии и гематологии - первый этап нутритивного сопровождения. Трудный пациент. 2019; Т. 17. N 8 (9). С. 54 - 59.
90. Martin L. et al. Diagnostic criteria for the classification of cancer-associated weight loss//J. Clin. Oncol. American Society of Clinical Oncology, 2015. Vol. 33, N 1. P. 90 - 99.
91. Kondrup J. et al. ESPEN guidelines for nutrition screening 2002//Clin. Nutr. Churchill Livingstone, 2003. Vol. 22, N 4. P. 415 - 421; Arends J. et al. ESPEN guidelines on nutrition in cancer patients//Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, N 1. P. 11 - 48.
92. Вашура АЮ, Кучер МА, Ковтун ТА, Алымова ЮА, Литвинов ДВ, Зубаровская ЛС, Кулагин АД. Роль и актуальность нутрициологического диагноза в онкопедиатрии. Медицинский Совет. 2023; (12): 99 - 109.
93. Yaprak D.S, ![]() B.,
B., ![]() A.A.,
A.A., 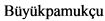 M. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins. Pediatr Blood Cancer. 2021; 68(1): 28752.
M. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins. Pediatr Blood Cancer. 2021; 68(1): 28752.
94. Методические указания. Порядок проведения клинических исследований для оценки эффективности специализированной пищевой продукции диетического лечебного и диетического профилактического питания/ФГБУН "ФИЦ питания и биотехнологии", Роспотребнадзор, Минздрав России, ФГБУН "ФНЦГ им. Ф.Ф. Эрисмана" Роспотребнадзора. - Москва. - 2023. - 28 с.
95. Методическое руководство. Стандарты лечебного питания/ФГБУН "ФИЦ питания и биотехнологии". - Москва. - 2017. - 338 с.
96. Вашура А.Ю., Пятаева А.А., Карелин А.Ф. Питание и нутритивная поддержка детей со злокачественными новообразованиями после завершения лечения: основные аспекты. Вопросы детской диетологии. 2022; 20(6): 64 - 70.
97. Rayar M., Webber C.E., Nayiager T., Sala A., Barr R.D. Sarcopenia in children with acute lymphoblastic leukemia. J Pediatr Hematol Oncol. 2013; 35: 98 - 102; Pietila S., Makipernaa A., Sievanen H., Koivisto A.M., Wigren T., Lenko H.L. Obesity and metabolic changes are common in young childhood brain tumor survivors. Pediatr Blood Cancer. 2009; 52: 853 - 9.
98. Joosten K, Embleton N, Yan W, Senterre T; ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Energy. Clin Nutr. 2018; 37(6 Pt B): 2309 - 2314. doi: 10.1016/j.clnu.2018.06.944.
99. Особенности нутриционной поддержки больных в педиатрии. В кн.: Клиническое питание больных в интенсивной медицине: практическое руководство/под ред. Луфта В.М., Багненко С.Ф., издание второе, дополненное. СПб.: Арт-Экспресс, 2013 - 460.
100. Парентеральное и энтеральное питание детей. Практические рекомендации. Под ред. Ерпулевой Ю.В., Чубаровой А.И., Чугуновой Ю.Л. ГЭОТАР-Медиа, 2016 г. 304 с.; Arends J. et al. ESPEN guidelines on nutrition in cancer patients//Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, N 1. P. 11 - 48.
101. Современные рекомендации по питанию детей/под ред. Проф. Ю.Г. Мухиной, проф. И.Я. Коня. - М.: ИД "МЕДПРАКТИКА-М", 2010, 568 с.
102. Ерпулева Ю.В. Парентеральное питание у детей Российский вестник детской хирургии, анестезиологии и реаниматологии. 2018; 8(1): 49 - 56
103. Hesketh, P.J. Antiemetics: ASCO Guideline Update/P.J. Hesketh, M.G. Kris, E. Basch [et al.]//J Clin Oncol. - 2020. - JCO2001296. - doi: 10.1200/JCO.20.01296
104. Жуков, Н.В. Эффективность и безопасность малых доз оланзапина в профилактике тошноты и рвоты у детей и подростков, получающих высокоэметогенную химиотерапию. Промежуточные результаты рандомизированного исследования/Н.В. Жуков, Л.Л. Рабаева, Д.В. Литвинов//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2022. - N 4. - С. 70 - 82. doi: 10.24287/1726-1708-2022-21-4-70-82;
105. Jain S. A randomized, open-label non-inferiority study to compare palonosetron and ondansetron for prevention of acute chemotherapy-induced vomiting in children with cancer receiving moderate or high emetogenic chemotherapy/Jain S., Kapoor G, Koneru S, Vishwakarma G//Support Care Cancer - 2018 Sep; 26(9): 3091 - 3097. doi: 10.1007/s00520-018-4158-5;
106. Patel P. Dexamethasone dosing for prevention of acute chemotherapy-induced vomiting in pediatric patients: A systematic review/Patel P, Olteanu A, Cabral S, Santesso N, Robinson PD, Dupuis LL.//Pediatr Blood Cancer. 2020 Dec; 67(12): e28716. doi: 10.1002/pbc.28716.
107. Ramavath, D.N. Olanzapine for Prevention of Vomiting in Children and Adolescents Receiving Highly Emetogenic Chemotherapy: Investigator-Initiated, Randomized, Open-Label Trial/D.N. Ramavath, V. Sreenivas, S. Vishwajeet [et al.]//Journal of Clinical Oncology. - 2020. - Vol. 38 (32). - P. 3785 - 3793. - doi: 10.1200/JCO.20.00871.
108. Chaudhary, N.K. Palonosetron is a Better Choice Compared with Ondansetron for the Prevention of Chemotherapy-induced Nausea and Vomiting (CINV) in a Resource-limited Pediatric Oncology Center: Results from a Randomized Control Trial/N.K. Chaudhary, R.R. John, D. Boddu [et al.]//J Pediatr Hematol Oncol. - 2019. - Vol. 41 (4). - P. 294 - 297. - doi: 10.1097/MPH.0000000000001357.
109. Flank, J. Guideline for the Treatment of Breakthrough and the Prevention of Refractory Chemotherapy-Induced Nausea and Vomiting in Children with Cancer/J. Flank, P.D. Robinson, M. Holdsworth [et al.]//Pediatr Blood Cancer. - 2016. - Vol. 63 (7). - P. 1144 - 1151. - doi: 10.1002/pbc.25955.
110. Paw Cho Sing E, Robinson PD, Flank J, Holdsworth M, Thackray J, Freedman J, Gibson P, Orsey AD, Patel P, Phillips R, Portwine C, Raybin JL, Cabral S, Sung L, Dupuis LL. Classification of the acute emetogenicity of chemotherapy in pediatric patients: A clinical practice guideline. Pediatr Blood Cancer. 2019 May; 66(5): e27646. doi: 10.1002/pbc.27646. Epub 2019 Feb 7. Erratum in: Pediatr Blood Cancer. 2021 May; 68(5): e28990. doi: 10.1002/pbc.28990. PMID: 30729654.
111. Жуков, Н.В. Профилактика и лечение тошноты и рвоты у детей и подростков, получающих противоопухолевую терапию. Текущее состояние и потенциальные пути улучшения/Н.В. Жуков, Л.Л. Казакова, Г.А. Новичкова//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2020. - Т. 19, N 4. - С. 205 - 223. doi: 10.24287/1726-1708-2020-19-4-205-223.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Клинические онкологи:
Белогурова Маргарита Борисовна (руководитель), д.м.н., проф., член РОДОГ, зав. отделением химиотерапии (противоопухолевой лекарственной терапии) и комбинированного лечения опухолей у детей ГБУЗ СПб КНпЦСВМП(о) им. Н.П. Напалкова, профессор кафедры педиатрии ФГБУ ФНОЦ МСЭ и Р им. Г.А. Альбрехта
Варфоломеева Светлана Рафаэлевна, д.м.н., проф., заместитель директора по научной и лечебной работе - директор НИИ ДОиГ им. Л.А. Дурнова ФГБУ НМИЦ онкологии им. Н.Н. Блохина, президент РОДОГ
Грачев Николай Сергеевич, д.м.н., проф., генеральный директор ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
Качанов Денис Юрьевич, д.м.н., член РОДОГ, заведующий отделением клинической онкологии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева, зам. директора Института онкологии, радиологии и ядерной медицины ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
Киргизов Кирилл Игоревич, к.м.н., член РОДОГ, заместитель директора по научной работе НИИ ДОиГ имени академика РАМН Л.А. Дурнова, и.о. заведующего отделением, ведущий научный сотрудник отделения детской трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
Новичкова Галина Анатольевна, д.м.н., проф., главный внештатный детский специалист онколог-гематолог Министерства Здравоохранения Российской Федерации
Рубанская Марина Владимировна, кандидат медицинских наук, заведующая детским онкологическим отделением N 1 (химиотерапии опухолей торакоабдоминальной локализации) НИИ детской онкологии и гематологии имени академика РАМН Л.А. Дурнова (НИИ ДОиГ) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
Сагоян Гарик Барисович, врач-детский онколог, старший научный сотрудник детского онкологического отделения N 1 (химиотерапии опухолей торакоабдоминальной локализации) НИИ детской онкологии и гематологии имени академика РАМН Л.А. Дурнова (НИИ ДОиГ) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
Смирнова Лилия Андреевна, врач-детский онколог отделения клинической онкологии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
Сулейманова Амина Магомедовна, врач-детский онколог, старший научный сотрудник детского онкологического отделения N 1 (химиотерапии опухолей торакоабдоминальной локализации) НИИ детской онкологии и гематологии имени академика РАМН Л.А. Дурнова (НИИ ДОиГ) ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
Телешова Маргарита Викторовна, член РОДОГ, врач-детский онколог отделения клинической онкологии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
2. Хирургическая группа:
Меркулов Николай Николаевич, член РОДОГ, врач-детский хирург отделения онкологии и детской хирургии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
Рубанский Михаил Александрович, к.м.н., член РОДОГ, врач-детский онколог хирургического отделения N 2 НИИ ДОиГ им. Л.А. Дурнова НМИЦ онкологии им. Н.Н. Блохина
3. Лучевые терапевты:
Григоренко Василий Андреевич, заведующий отделением радиотерапевтическим НИИ ДОиГ НМИЦ онкологии им. Н.Н. Блохина
Канестри Франческа Янисовна, врач-радиотерапевт отделения лучевой терапии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
Нечеснюк Алексей Владимирович, к.м.н., заведующий отделением лучевой терапии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
4. Лаборатория патологической анатомии
Митрофанова Анна Михайловна, член РОДОГ, врач отделения патологической анатомии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
5. Профилактика и лечение тошноты и рвоты:
Жуков Николай Владимирович, д.м.н., руководитель отдела междисциплинарной онкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Литвинов Дмитрий Витальевич, д.м.н., главный врач ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
Рабаева Лилия Леонидовна, к.м.н., врач-детский онколог отделения гематологии/онкологии старшего возраста и нейроонкологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России.
6. Нутритивная поддержка:
Вашура Андрей Юрьевич, к.м.н., врач-диетолог, заведующий отделом научных основ питания и нутритивно-метаболической терапии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Коровина Ирина Васильевна, врач-диетолог ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-детские онкологи;
2. Врачи-педиатры;
3. Врачи-генетики;
4. Студенты медицинских ВУЗов, ординаторы, аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств: поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0,3.
Поиск в электронных базах данных.
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных метаанализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. 12 - 14).
Таблица 12. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 13. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 14. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
СХЕМЫ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ ЗНО ПОЧКИ
Схема неоадъювантной химиотерапии AV у пациентов с локализованной формой НБ [33; 64]:
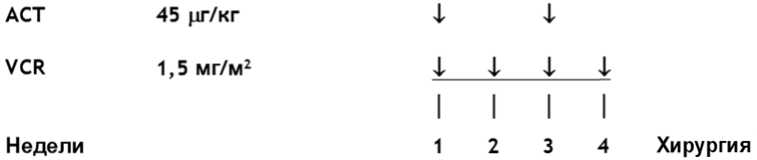
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1 - 4 недели;
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3 недели.
Схема неоадъювантной химиотерапии AVD у пациентов с метастатической формой НБ [33; 64]:
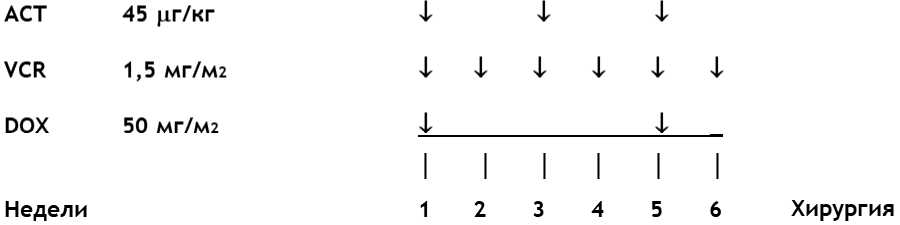
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5 и 6 недели;
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3 и 5 недели;
DOX - доксорубицин** 50 мг/м2/сут, 2 - 6 часовая инфузия - 1, 5 недели.
Схема AV1 адъювантной химиотерапии у пациентов с локализованной формой НБ, I стадия, группа промежуточного риска [33; 40; 64]:

VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно в 1 - 4 недели;
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 1 неделя.
Схема AVD адъювантной химиотерапии у пациентов с локализованной формой НБ, I стадия, группа высокого риска [33; 64]:

VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - еженедельно в течение 8 недель (8 доз), а затем в первый день недели 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 (в общем 20 доз)
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели;
DOX - доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2, 8, 14, 20, 26 недели.
Примечание: доксорубицин** - всего 5 доз, общая кумулятивная доза: 250 мг/м2.
Схема AV-2 адъювантной химиотерапии у пациентов с локализованной формой НБ, II/III стадия, группа промежуточного риска (кроме опухолей с фокальной анаплазией, смешанным или регрессивным типом при объеме опухоли после завершения неоадъювантной химиотерапии > 500 мл) [33; 64]:
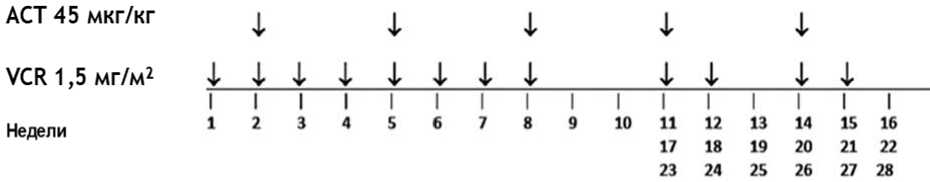
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели;
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели.
Схема AVD 250 адъювантной химиотерапии у пациентов с локализованной формой НБ, II/III стадия, группа промежуточного риска (для опухолей с фокальной анаплазией, смешанным или регрессивным типом при объем опухоли после завершения неоадъювантной химиотерапии > 500 мл) [33; 64]:
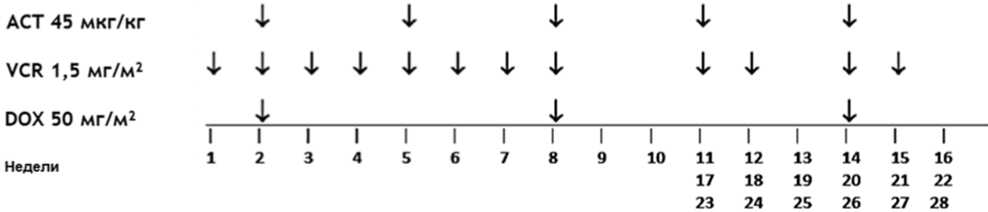
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели;
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели;
DOX - доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2, 8, 14 недели.
Примечание: максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии; #дактиномицин не применяется у детей весом менее 5 кг; с учетом предоперационной ХТ кумулятивная доза доксорубицина** составляет 250 мг/м2; во время проведения лучевой терапии доксорубицин** не вводится, доза #дактиномицина снижается на 1/3.
Схема HR-1 - адъювантной химиотерапии у пациентов с локализованной формой НБ, II/III стадия, группа высокого риска [33; 64]:
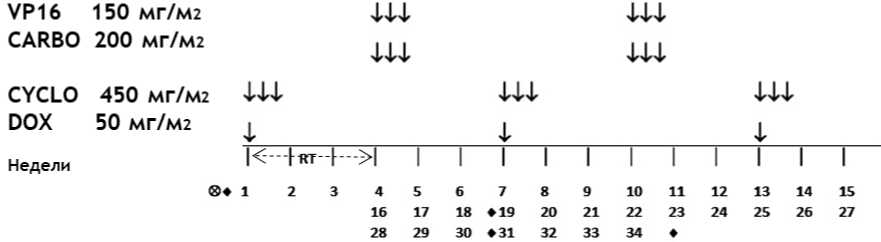
CYCLO - циклофосфамид** 450 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 1, 7, 13, 19, 25, 31;
DOX - доксорубицин** 50 мг/м2/сут в/в капельно за 2 - 6 часов - 1 день, в недели 1, 7, 13, 19, 25, 31;
VP16 - #этопозид** 150 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 16, 22, 28, 34;
CARBO - #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 16, 22, 28, 34;
![]() - Эхокардиография: в начале лечения, перед неделями 19, 31 и в конце лечения;
- Эхокардиография: в начале лечения, перед неделями 19, 31 и в конце лечения;
![]() - скорость клубочковой фильтрации (СКФ) (измерять при проведении каждого третьего курса или чаще при наличии признаков ренальной дисфункции).
- скорость клубочковой фильтрации (СКФ) (измерять при проведении каждого третьего курса или чаще при наличии признаков ренальной дисфункции).
Примечание: первый курс должен быть начат не позднее 21 дня после окончания предоперационной химиотерапии. Доксорубицин** вводится в 1 день после циклофосфамида**
Схема AVD 150 - 27 недель химиотерапии [33; 64]:
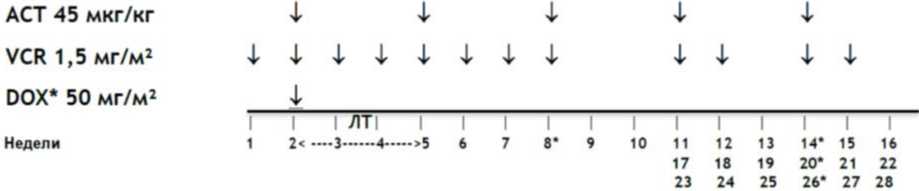
--------------------------------
<*> Доксорубицин не вводится на неделях 8, 14, 20 и 26; кумулятивная доза - 150 мг/м2.
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели;
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели;
DOX - доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2 неделя.
Примечание: максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии; #дактиномицин не применяется у детей весом менее 5 кг и возрастом до 3 месяцев; с учетом предоперационной ХТ кумулятивная доза доксорубицина** составляет 150 мг/м2; во время проведения лучевой терапии доксорубицин** не вводится, доза #дактиномицина снижается на 1/3.
Схема AVD 250 - 27 недель химиотерапии [33; 64]:
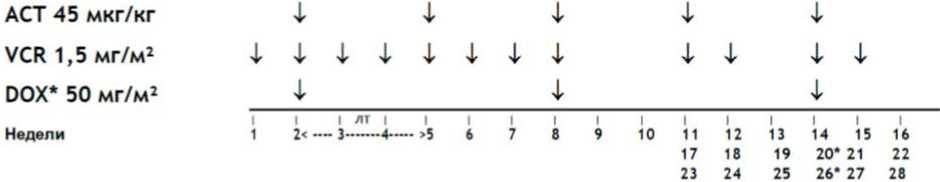
--------------------------------
<*> Доксорубицин не вводится на неделях 20 и 26; кумулятивная доза составляет 250 мг/м2.
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели;
ACT - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели;
DOX - доксорубицин** 50 мг/м2/сут, в/в капельно 2 - 6 часовая инфузия - 2, 8, 14 недели.
Примечание: максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии; #дактиномицин не применяется у детей весом менее 5 кг; с учетом предоперационной ХТ кумулятивная доза доксорубицина** составляет 250 мг/м2; во время проведения лучевой терапии доксорубицин** не вводится, доза #Дактиномицина снижается на 1/3.
Схема HR-2 - 34 недели химиотерапии [33; 64]:
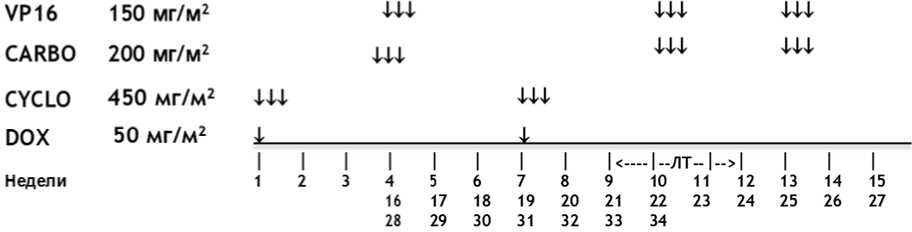
CYCLO - циклофосфамид** 450 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 1, 7, 19, 31;
DOX - доксорубицин** 50 мг/м2/сут в/в капельно за 2 - 6 часов - 1 день (после циклофосфамида**), в недели 1, 7, 19, 31;
VP16 - #этопозид** 150 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 13, 16, 22, 25, 28, 34;
CARBO - #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 13, 16, 22, 25, 28, 34.
Режим 1 (интенсивный VCR) [33]:

VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 недели (всего 10 доз)
Примечание: максимальная разовая доза винкристина** 2 мг. Младенцам и детям весом < 12 кг следует вводить полную дозу винкристина
Режим 2 (AV) [33]:
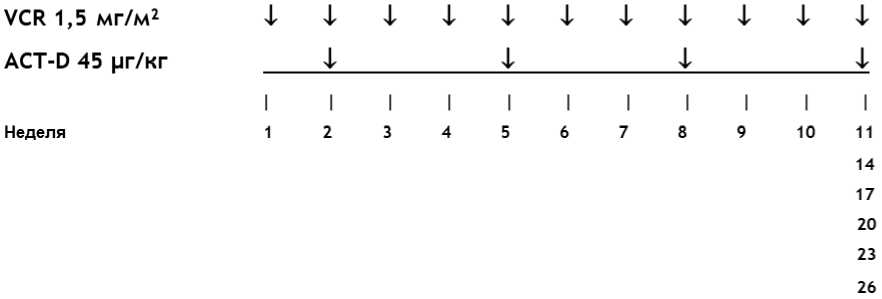
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, далее 14, 17, 20, 23 и 26 недели (всего 16 доз);
ACT-D - #дактиномицин 45 мкг/кг/сут, в/в в 2, 5, 8, 11, 14, 17, 20, 23 и 26 недели (всего 9 доз)
Примечание: максимальная разовая доза винкристина** 2 мг.
Режим 3 (AVD) [33]:
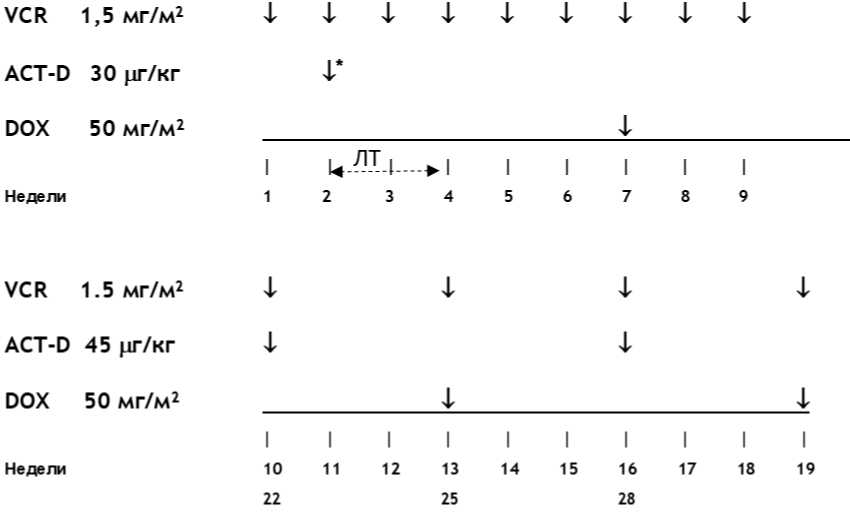
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, далее 13, 16, 19, 22, 25 и 28 недель (всего 16 доз);
ACT-D - #дактиномицин 45 мкг/кг/сут, в/в болюсно - 2/3 дозы на неделе 2, затем полная доза на неделях 10, 16, 22, 28 (всего 5 доз);
DOX - доксорубицин** 50 мг/м2/сут, в/в капельно 4 - 6 часовая инфузия - на 7, 13, 19, 25 неделе)
* Примечание: 2/3 дозы #дактиномицина на неделе 2 в связи с тем, что в ближайшее время предусмотрено проведение лучевой терапии
Схема VA (при билатеральном поражении почек) [33]:
Винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели;
#Дактиномицин 45 мкг/кг/сут, в/в болюсно - 1, 3, 5 недели.
Общая продолжительность курса - 6 недель.
Схема #Карбоплатин**/#Этопозид** (при билатеральном поражении почек) [33]:
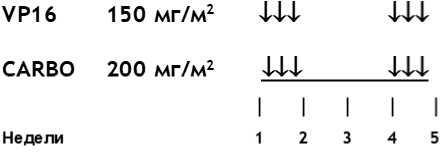
VP16 - #этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели;
CARBO - #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели. Проводится 2 таких цикла.
Схема EU-RHAB и метрономной терапии для пациентов с ЗРО почки [16; 50]:
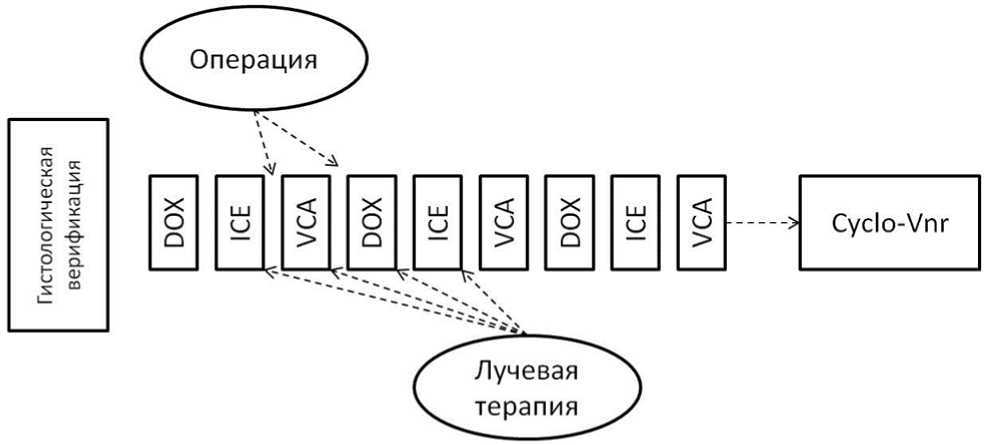
Интенсивная химиотерапия:
1 курс (DOX) - #доксорубицин** (всего 3 курса):
#доксорубицин** 37,5 мг/м2/сут в/в капельно за 24 часа - 1, 2 дни, в недели 1, 7, 13;
2 курс (ICE) - #ифосфамид** + #карбоплатин** + #этопозид** (всего 3 курса):
#ифосфамид** 2000 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 3, 9, 15;
#карбоплатин** 500 мг/м2/сут в/в капельно за 1 час - 1 день, в недели 3, 9, 15;
#этопозид** 100 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 3, 9, 15;
3 курс (VCA) - #винкристин** + #циклофосфамид** + #дактиномицин (всего 3 курса):
#винкристин** 1,5 мг/м2/сут в/в болюсно - 1, 8 дни, в недели 5, 11, 17;
#дактиномицин 25 мкг/кг/сут в/в болюсно - 1, 2 дни, в недели 5, 11, 17;
#циклофосфамид** 1500 мг/м2/сут в/в капельно за 1 час - 1 день, в недели 5, 11, 17.
Схема метрономной химиотерапии Vnr/Cyclo для пациентов с ЗРО почки [50]:
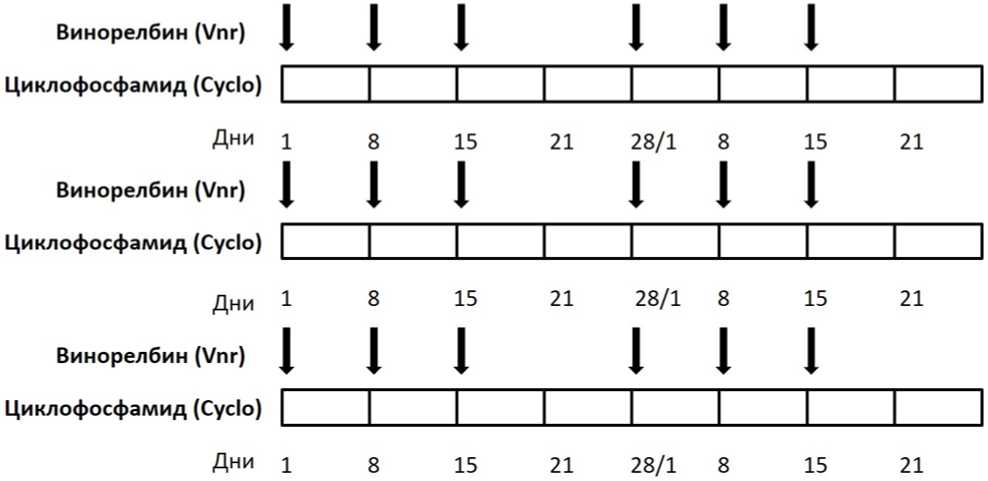
#циклофосфамид** 25 мг/м2/сут перорально - дни 1 - 28 без перерыва, недели 1, 5, 9, 13, 17, 21;
#винорелбин** 25 мг/м2/сут в/в за 5 - 10 минут, недели 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23.
Схема интенсивной терапии SIOP для пациентов со СКС почки [33]:
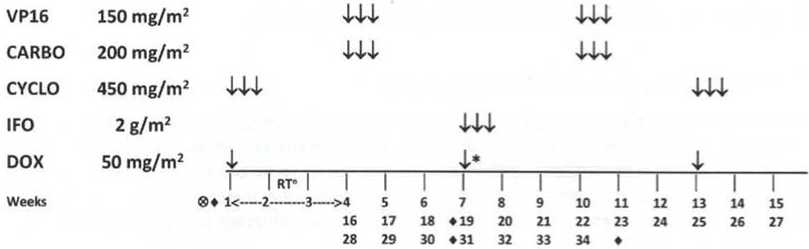
1 курс (CYCLO/DOX) - циклофосфамид** + доксорубицин** (всего 3 курса): циклофосфамид** 450 мг/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни, в 1 неделю; доксорубицин** 50 мг/м2/сутки в/в капельно за 4 - 6 часов - 1 день в 1, 13, 25 недели;
2 курс (VP16/CARBO) - #этопозид** + #карбоплатин** (всего 6 курса): #этопозид** 150 мг/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни в недели 4, 16, 28; #карбоплатин** 200 мг/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни в недели 4, 16, 28;
3 курс (IFO/DOX) - ифосфамид** + доксорубицин** (всего 3 курса): ифосфамид** 2 г/м2/сутки в/в капельно за 1 час - 1, 2, 3 дни в недели 7, 19, 31; # доксорубицин** 50 мг/м2/сутки в/в капельно за 4 - 6 часов - 1 день в недели 7, 19, 31.
Схема терапии SIOP для пациентов с ВМН [33]:
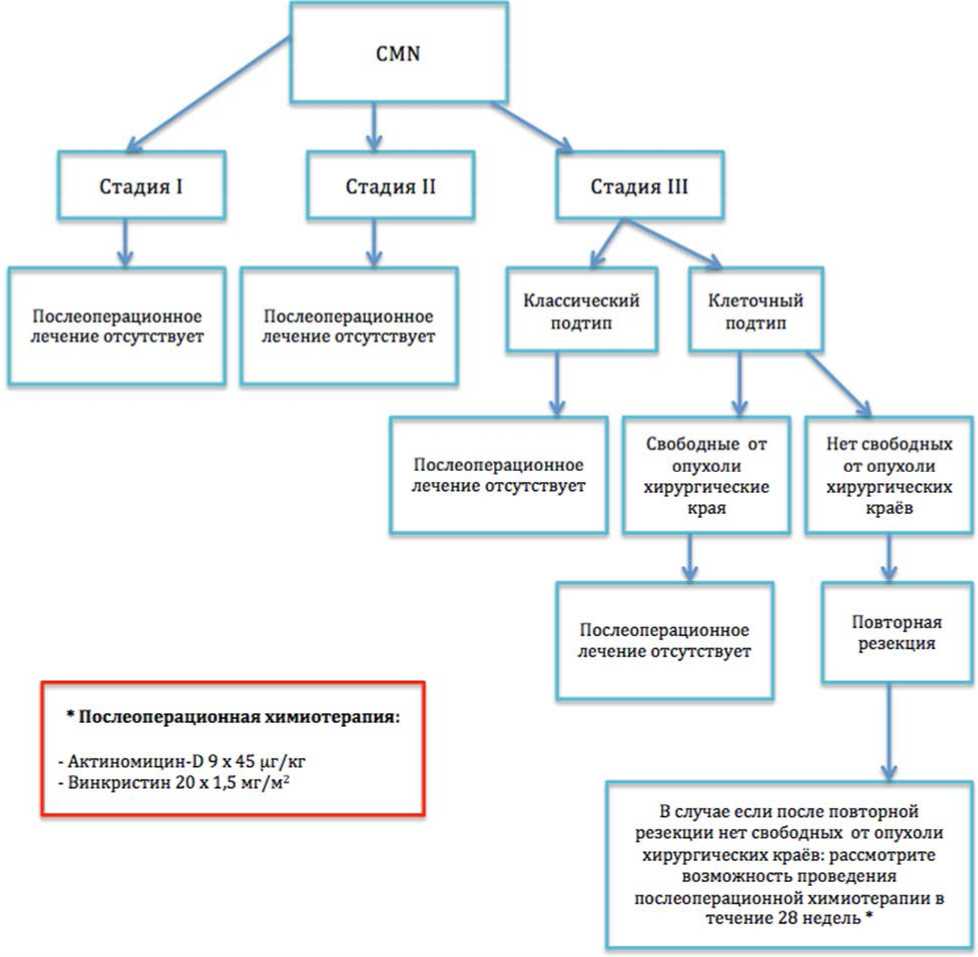
#Дактиномицин 45 мкг/кг 9 доз
#Винкристин** 1,5 мг/м2 20 доз
Приложение А3.2
ТОКСИЧНОСТЬ ТЕРАПИИ И ПРАВИЛА
ПРИМЕНЕНИЯ ХИМИОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ И ВОЗРАСТНЫЕ
ДОЗИРОВКИ [33]
Гематологическая токсичность:
Нейтропения: абсолютное число нейтрофилов (ANC) должно быть больше 1000/мм3, чтобы можно было начать курс с #Дактиномицин или #Доксорубицином**, #Циклофосфамидом**, #Ифосфамидом**, #Карбоплатином**. Лечение #Винкристином** можно продолжить без учета ANC, если пациент находится в хорошем клиническом состоянии.
Тромбоцитопения: содержание тромбоцитов должно быть > 100.000/мм3, чтобы можно было начать курс лечения. Уже проводимый курс лечения следует прервать, если содержание тромбоцитов станет меньше 50.000/мм3. В случае внезапного падения уровня тромбоцитов следует вести мониторинг пациента на предмет признаков веноокклюзионной болезни ВОБ или сепсиса/инфицирования катетера. При кровотечениях всегда показано переливание тромбоцитов.
Изолированную анемию в случае необходимости лечат посредством переливания крови (гемоглобин < 70 г/л). Развитие анемии не является основанием для модификации схемы лечения.
Фебрильная нейтропения - температура (при ректальном измерении) > 38,5 °C или температура > 38,0 °C, измеренная четырехкратно в течение 24 ч с интервалом более 4 часов, и число нейтрофилов < 500/мкл.
Изолированные осложнения со стороны ЖКТ:
Рвота, продолжающаяся несколько часов, может наблюдаться в первую очередь после введения #Дактиномицина или #Доксорубицина**. Обычно достаточно симптоматического лечения, и лишь в редких случаях возникает необходимость в модификации терапии.
Диарея, сопровождающаяся или не сопровождающаяся рвотой, может возникнуть в первую очередь после облучения всей брюшной полости у детей младшего возраста. В этом случае может потребоваться приостановка лечения на несколько дней, а иногда даже отмена лучевой терапии.
Запоры - частое явление на фоне терапии #Винкристином**. Необходимо назначить слабительные средства и убедиться, что у пациента появился неоформленный стул. При возникновении паралитической кишечной непроходимости лекарства следует отменить и возобновить прием с половины дозы.
Осложнения со стороны печени:
Осложнения со стороны печени могут возникать на фоне лечения #Дактиномицином, #Винкристином** или #Доксорубицином**. К факторам риска, ассоциированным главным образом с #Дактиномицином, относится нефробластома правой почки и облучение всей брюшной полости или правого бока. Необходим тщательный мониторинг пациентов с симптомами дисфункции печени.
Пациентам с веноокклюзионной болезнью (ВОБ) #Дактиномицин не следует применять, пока не исчезнут основные патологические явления, при этом при проведении первого из последующих курсов химиотерапии следует использовать половину первоначальной дозы. Если во время терапии #Дактиномицином симптомы возникают повторно, препарат следует отменить совсем. Терапия #Винкристином** может привести к обострению заболеваний печени.
Кардиотоксичность:
Общепринятых рекомендаций по модификации дозировки #Доксорубицина** не существует. Перед каждым введением #Доксорубицина** необходимо проводить ЭХО-КГ мониторинг. Следует рассмотреть возможность прерывания лечения #Доксорубицином**, если фракция укорочения у пациента составляет менее 28% или если между двумя подряд приемами #Доксорубицина** наблюдается снижение > 10%. В таких случаях следует продолжать химиотерапию, оставив только #Винкристин** и #Дактиномицин. По прошествии 3 недель повторите ЭХО-КГ и, если показатель улучшился, продолжите терапию с #Доксорубицином**, но повторяйте эхокардиограмму перед каждым введением данного препарата. Снижение фракции укорочения более чем на 20% от базисного значения является основанием для приостановки лечения #Доксорубицином** до восстановления показателя до его первоначального значения. Остерегайтесь развития анемии, которая может повлиять на показатель фракции укорочения.
Кардиотоксичность чаще возникает у пациентов, которым проводилась лучевая терапия грудной клетки и у которых левосторонняя нефробластома стадии III.
Нейротоксичность:
Основными побочными эффектами #Винкристина** являются мышечная слабость и гипорефлексия. Могут возникать боли в челюстях, боль при глотании и охриплость. В случае развития паралича периферических нервов, свисания стопы, тяжелого неврита следует пропустить одну или две инъекции #Винкристина**, а следующую дозу снизить до 2/3 от первоначальной дозы.
Для подтверждения наличия развившихся аномалий, типичных для терапии #Ифосфамидом**, следует провести ЭЭГ.
Токсические эффекты со стороны мочевого пузыря и почек:
При несоблюдении особенностей назначения #Циклофосфамид** и #Ифосфамид** могут вызвать геморрагический цистит. Рекомендовано регулярное применение Месны*. В случае макроскопически выявляемой и повторяющейся гематурии химиотерапию следует прервать. Для увеличения диуреза следует рассмотреть возможность проведения инфузионной гипергидратации (3 л/м2) и применения диуретика (Фуросемид**, Маннитол**).
При повышении уровня креатинина в сыворотке крови или при развитии тубулопатии следует рассмотреть возможность модификации доз.
Как правило, в случае с #Ифосфамидом** можно действовать следующим образом:
1. Введение #Ифосфамида** в течение 24 часов вместо короткой инфузии;
2. Снижение дозы #Ифосфамида** примерно на 1/3;
3. Применение #Циклофосфамида** вместо #Ифосфамида**.
Токсические эффекты со стороны половых желез
Токсические эффекты со стороны половых желез (гонадотоксичность) возникают главным образом после применения алкилирующих агентов и облучения брюшной полости. Во всех случаях необходимо рассматривать возможность проведения консультаций по вопросам бесплодия и осуществления мер по сохранению фертильности. Это особенно актуально в случае с пациентами, которым проводилось облучение всей брюшной полости (после обсеменения).
Тяжелая непереносимость предоперационной терапии
Если во время предоперационной химиотерапии возникают следующие осложнения, то после купирования токсических эффектов пациентам следует провести нефрэктомию при условии, что проведение операции возможно и сопровождается допустимым уровнем риска, в противном случае можно рассмотреть возможность применения альтернативных химиотерапевтических препаратов перед операцией. В большинстве случаев, послеоперационная химиотерапия по-прежнему должна быть проведена - в соответствии со стадией и гистологическим типом опухоли. Исключением являются опухоли с гистологией низкого риска и невысокой стадией и/или случаи, когда в условиях конкретной клинической ситуации продолжение химиотерапии невозможно. Альтернативные химиотерапевтические препараты следует обсудить с национальным координатором. В некоторых случаях (например, при лечении #Дактиномицин) возможно проведение терапии с тем же препаратом, но со снижением дозировки; в то время как в случае с другими препаратами, для которых ключевым фактором токсичности является кумулятивная доза (например, для #Доксорубицина**), требуется их полная отмена:
a. Глубокая тромбоцитопения (тромбоциты < 50 x 109/л) с кровотечением или без, ассоциированная с ВОБ: боли в животе с диареей, асцит, отеки, значительное увеличение печени в размерах, олигурия, жар и желтуха
b. Или с кожной эритемой с шелушением, соответствующей синдрому Стивенса-Джонсона
c. Тяжелые неврологические осложнения, такие как непереносимая парестезия с параличом, конвульсиями; или амавроз.
Редукция доз препаратов или изменения тайминга должна осуществляться по следующим критериям [33]:
1. Введение #дактиномицина, #доксорубицина**, #циклофосфамида**, #этопозида** и #карбоплатина** должно быть отложено до восстановления показателей: нейтрофилы - более 1,0 x 109/л, тромбоциты - более 100 x 109/л [64];
2. Введение #дактиномицина должно быть отложено: при повышении уровня билирубина выше 1,5 от нормы; при повышении уровня АЛТ выше 5 от нормы; при клинических признаках веноокклюзионной болезни [64];
3. Введение #доксорубицина** должно быть отложено: при повышении билирубина выше 2 от нормы; при повышении АЛТ выше 5 от нормы: при наличии мукозита 1 степени и выше [64];
4. Если следующий курс начинается с задержкой более 1 недели, необходимо обсудить снижение дозы препаратов на 33% [64];
5. Дозы химиопрепаратов рассчитываются в зависимости от веса пациента и представлены в таблицах 15 и 16 [64].
Таблица 15. Дозы химиопрепаратов для детей с НБ и СКС почки в соответствии с их весом [33; 64]:
Препарат
< 5 кг
5 - 12 кг
> 12 кг (полная доза)
#Винкристин**
0.033 мг/кг (50%)
0.05 мг/кг (66%)
1.5 мг/м2
#Дактиномицин
Исключен, также у пациентов до 3 мес.
30 мкг/кг (66%)
45 мкг/кг
Доксорубицин**
1.1 мг/кг (50%)
1.66 мг/кг (66%)
50 мг/кг
#Карбоплатин**
4.4 мг/кг (50%)
6.6 мг/кг (66%)
200 мг/м2
Циклофосфамид**
10 мг/кг (50%)
15 мг/кг (66%)
450 мг/м2
#Ифосфамид**
50%
66%
100%
#Этопозид**
Исключен (из-за этанола), возможен этопофос
5 мг/кг (66%)
150 мг/м2
Таблица 16. Дозы химиопрепаратов для детей с ЗРО почки в соответствии с их весом [16]:
Препарат
<= 10 кг и/или <= 6 мес
> 10 кг и > 6 мес (полная доза)
#Доксорубицин**
1.25 мг/кг/сут (70%)
37,5 мг/м2/сут
#Ифосфамид**
66,7 мг/кг/сут (70%)
2000 мг/м2/сут
#Карбоплатин**
16,7 мг/кг (70%)
500 мг/м2/сут
#Этопозид**
3,33 мг/кг/сут (70%), возможен этопофос
100 мг/м2/сут
#Винкристин**
0.05 мг/кг/сут (70%)
1.5 мг/м2/сут (max 2 мг)
#Циклофосфамид**
50 мг/кг/сут (70%)
1500 мг/м2/сут
#Дактиномицин
Дополнительная редукция при весе < 10 кг и/или < 12 мес
17,5 мкг/кг/сут
25 мкг/кг/сут
Приложение А3.3
ОБЪЕМ
ПОСЛЕОПЕРАЦИОННОЙ ТЕРАПИИ ПРИ ГЕНЕРАЛИЗОВАННОЙ ФОРМЕ НБ [33]
Общий ответ
Хирургическое лечение при метастазах
Гистология
Лечение
ПО/ОХЧО
Полная хирургическая резекция при необходимости
НГР/ПГР и легочные узлы 3 - 5 мм
AVD150, ЛТ легких не назначается, если не проведена полная резекция все еще жизнеспособных метастазов ![]() ЛТ легких
ЛТ легких
НГР/ПГР, узлы в легких > 5 мм или имеются узлы другой локализации
AVD250 ЛТ легких не назначается, если не проведена полная резекция все еще жизнеспособных метастазов ![]() ЛТ легких
ЛТ легких
НГР/ПГР
Признаки жизнеспособной опухоли отсутствуют
Лечение как для локализованных опухолей
ЧО/СБЗ
Резекция репрезентативных узлов осуществима
НГР
Наличие жизнеспособных метастазов подтверждено
AVD250, ЛТ легких/метастазов, КТ на неделе 10
![]() если узлы сохраняются
если узлы сохраняются ![]() следует по возможности провести хирургическую операцию для достижения полного ответа
следует по возможности провести хирургическую операцию для достижения полного ответа
Метастазы, состоящие исключительно из некротической ткани
AVD150, КТ на неделе 10 ![]() если узлы сохраняются
если узлы сохраняются ![]() следует по возможности провести хирургическую операцию для достижения полного ответа
следует по возможности провести хирургическую операцию для достижения полного ответа
НГР/ПГР
Признаки жизнеспособных метастазов или метастазов с некротическим компонентом отсутствуют
Связаться с ведущим исследователем; потенциально лечение как для локализованных опухолей или AVD250, КТ на неделе 10 ![]() если узлы сохраняются
если узлы сохраняются ![]() если узлы сохраняются следует по возможности провести хирургическую операцию для достижения полного ответа, ЛТ на локализацию(и) метастазов не проводится
если узлы сохраняются следует по возможности провести хирургическую операцию для достижения полного ответа, ЛТ на локализацию(и) метастазов не проводится
НГР
Метастазы, состоящие исключительно из некротической ткани
Режим AVD250, КТ на неделе 10 ![]() если узлы сохраняются
если узлы сохраняются ![]() следует по возможности провести хирургическую операцию для достижения полного ответа
следует по возможности провести хирургическую операцию для достижения полного ответа
Резекция неосуществима
НГР
AVD250, КТ на неделе 10 ![]() если узлы сохраняются, повторно рассмотреть возможность резекции и обсудить проведение ЛТ метастазов
если узлы сохраняются, повторно рассмотреть возможность резекции и обсудить проведение ЛТ метастазов
ПГР
Схема с применением 4 препаратов (HR), КТ на неделе 10 ![]() если узлы сохраняются, показана ЛТ метастазов
если узлы сохраняются, показана ЛТ метастазов
ПР
Резекция репрезентативных узлов осуществима
ПГР
Наличие метастазов подтверждено
Схема с применением 4 препаратов (HR), ЛТ метастазов. КТ на неделе 10 ![]() если узлы сохраняются
если узлы сохраняются ![]() следует по возможности провести хирургическую операцию для достижения полного ответа
следует по возможности провести хирургическую операцию для достижения полного ответа
Признаки жизнеспособной или некротической опухолевой ткани отсутствуют
AVD250, КТ на неделе 10 ![]() если узлы сохраняются
если узлы сохраняются ![]() хирургическое вмешательство
хирургическое вмешательство ![]() если обнаруживаются жизнеспособные метастазы
если обнаруживаются жизнеспособные метастазы ![]() показан режим CDCV + ЛТ метастазов: следует связаться с ведущим исследователем (такие ситуации возникают очень редко).
показан режим CDCV + ЛТ метастазов: следует связаться с ведущим исследователем (такие ситуации возникают очень редко).
Все варианты
Все варианты
ВГР
Обратитесь за советом в федеральный/национальных центр) ЛТ метастазов, КТ на неделе 10 ![]() если узлы сохраняются, следует рассмотреть возможность резекции, если таковая осуществима
если узлы сохраняются, следует рассмотреть возможность резекции, если таковая осуществима
СО
Показано
Необходимо подтвердить метастатическую болезнь с помощью патолого-анатомического исследования ![]() в случае наличия метастазов
в случае наличия метастазов ![]() проводить лечение в соответствии с самой неблагоприятной гистологией и самым неблагоприятным ответом
проводить лечение в соответствии с самой неблагоприятной гистологией и самым неблагоприятным ответом
НГР - низкая группа риска
ПГР - промежуточная группа риска
ВГР - высокая группа риска
Приложение А3.4
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ
ТОШНОТЫ И РВОТЫ, ОБУСЛОВЛЕННЫХ ПРОВЕДЕНИЕМ
ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
Таб. А3.4.1. Уровень эметогенности противоопухолевых препаратов [110]
Степень эметогенности (риск развития рвоты)
Рекомендации COG 2022 (педиатрические)
+
Рекомендации ASCO 2020 (общие для взрослых и детей)
Высокая (> 90%)
Монотерапия
#Дактиномицин (в/в) >= 1,35 мг/м2
#Доксорубицин** (в/в) >= 30 мг/м2
#Карбоплатин** (в/в) >= 175 мг/м2
#Циклофосфамид** (в/в) >= 1200 мг/м2
Комбинированные режимы
#Дактиномицин 900 мкг/м2 (в/в) + #ифосфамид** 3 г/м2
#Циклофосфамид** > 600 мг/м2 + #дактиномицин >= 1 мг/м2
#Циклофосфамид** >= 400 мг/м2 + #доксорубицин** >= 40 мг/м2
#Этопозид** (в/в) >= 60 мг/м2 + #ифосфамид** (в/в) >= 1,2 г/м2
Умеренная (31 - 90%)
Монотерапия
#Дактиномицин (в/в) 10 мг/кг
#Доксорубицин** (в/в) 25 мг/м2
#Ифосфамид** (в/в)
#Карбоплатин** (в/в)
#Циклофосфамид** (в/в) 1000 мг/м2
Низкая (10 - 30%)
Монотерапия
#Циклофосфамид** (в/в) 500 мг/м2
#Циклофосфамид** (р.о.) 2 - 3 мг/кг
#Этопозид** (в/в)
Минимальная (< 10%)
Монотерапия
#Винкристин** (в/в) <= 1,5 мг/м2
Таб. А3.4.2. Дозы и режимы противорвотных препаратов [63; 106; 111]
Степень эметогенности
Режимы
Дозы
Высокая
Блокаторы серотониновых 5HT3-рецепторов
+
#Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
+
#Оланзапин**
I. #Дексаметазон** [106]
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 внутривенно/перорально все дни химиотерапии и три дня после ее завершения;
2. Дети, получающие химиотерапию с умеренной эметогенной активностью:
<= 0,6 м2: 2 мг внутривенно/перорально каждые 12 часов;
> 0,6 м2: 4 мг внутривенно/перорально каждые 12 часов.
При одновременном применении с #апрепитантом необходимо уменьшение дозы дексаметазона на 50%.
II. Блокаторы серотониновых 5HT3-рецепторов #Гранисетрон [106]
1. Дети, получающие высокоэметогенную химиотерапию: 40 мкг/кг внутривенно однократно.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 40 мкг/кг внутривенно однократно.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 40 мкг/кг внутривенно однократно.
#Ондансетрон** (противопоказан детям в возрасте до 6 месяцев для в/в форм, 2 года для таблеток)
1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 (0,15 мг/кг) внутривенно/перорально перед терапией однократно, а затем каждые 8 часов.
2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 5 мг/м2 (0,15 мг/кг; максимум 8 мг) внутривенно/перорально перед терапией однократно, а затем каждые 12 часов.
3. Дети, получающие химиотерапию с низкой эметогенной активностью: 10 мг/м2 (0,3 мг/кг; максимум 16 мг внутривенно или 24 мг перорально) до начала терапии однократно.
Палоносетрон
1. Дети от 1 месяца до 17 лет: 0,02 мг/кг (максимум 1,5 мг) внутривенно один раз перед терапией, за 30 мин.
2. Дети 17 лет и старше: 0,5 мг внутривенно однократно перед терапией.
III. Антагонисты NK-1 рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты)
#Апрепитант
Дети старше 6 месяцев:
- 1-й день: 3 мг/кг (максимум 125 мг) перорально 1 раз в сутки
за 1 час до химиотерапии
- 2-й и 3-й дни: 2 мг/кг (максимум 80 мг) перорально один раз в сутки.
#Фосапрепитант
1. Дети от 6 месяцев до 2-х лет: 5 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
2. Дети от 2-х до 12 лет: 4 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
3. Дети от 12 до 17 лет: 150 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день
Комбинация #фосапрепитант + #апрепитант
1. Дети от 6 месяцев до 12 лет:
- 3 мг/кг (максимальная доза 115 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день;
- 2 мг/кг (максимальная доза 80 мг) перорально, дни 2, 3;
2. Дети от 12 до 17 лет:
- 115 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день
- 80 мг перорально, дни 2, 3.
IV. #Оланзапин**
1. Дети весом от 30 кг - 0,07 мг/кг (от 30 до 55 кг - 2,5 мг/сут, свыше 55 кг - 5 мг/сут) перорально за 1 час до введения цитостатиков, все дни химиотерапии и три дня после ее завершения;
2. Дети весом > 15 и < 30 кг - 2,5 мг/сут перорально за 1 час до введения цитостатиков, все дни химиотерапии и три дня после ее завершения;
Для детей весом менее 15 кг и/или возрастом менее 5 лет - неприменимо в силу отсутствия данных исследований об эффективности и безопасности #оланзапина**.
Блокаторы серотониновых 5HT3-рецепторов + #Дексаметазон**
+
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов + #Дексаметазон**
+
#Оланзапин**
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
+
#Оланзапин**
+/-
NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Умеренная
Блокаторы серотониновых 5HT3-рецепторов + #Дексаметазон**
Блокаторы серотониновых 5HT3-рецепторов + NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты)
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон)
Низкая
Блокаторы серотониновых 5HT3-рецепторов
Минимальная
Блокаторы серотониновых 5HT3-рецепторов или отсутствие профилактики
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Приложение Б1
АЛГОРИТМ ПЕРВИЧНОЙ ДИАГНОСТИКИ ЗНО ПОЧКИ
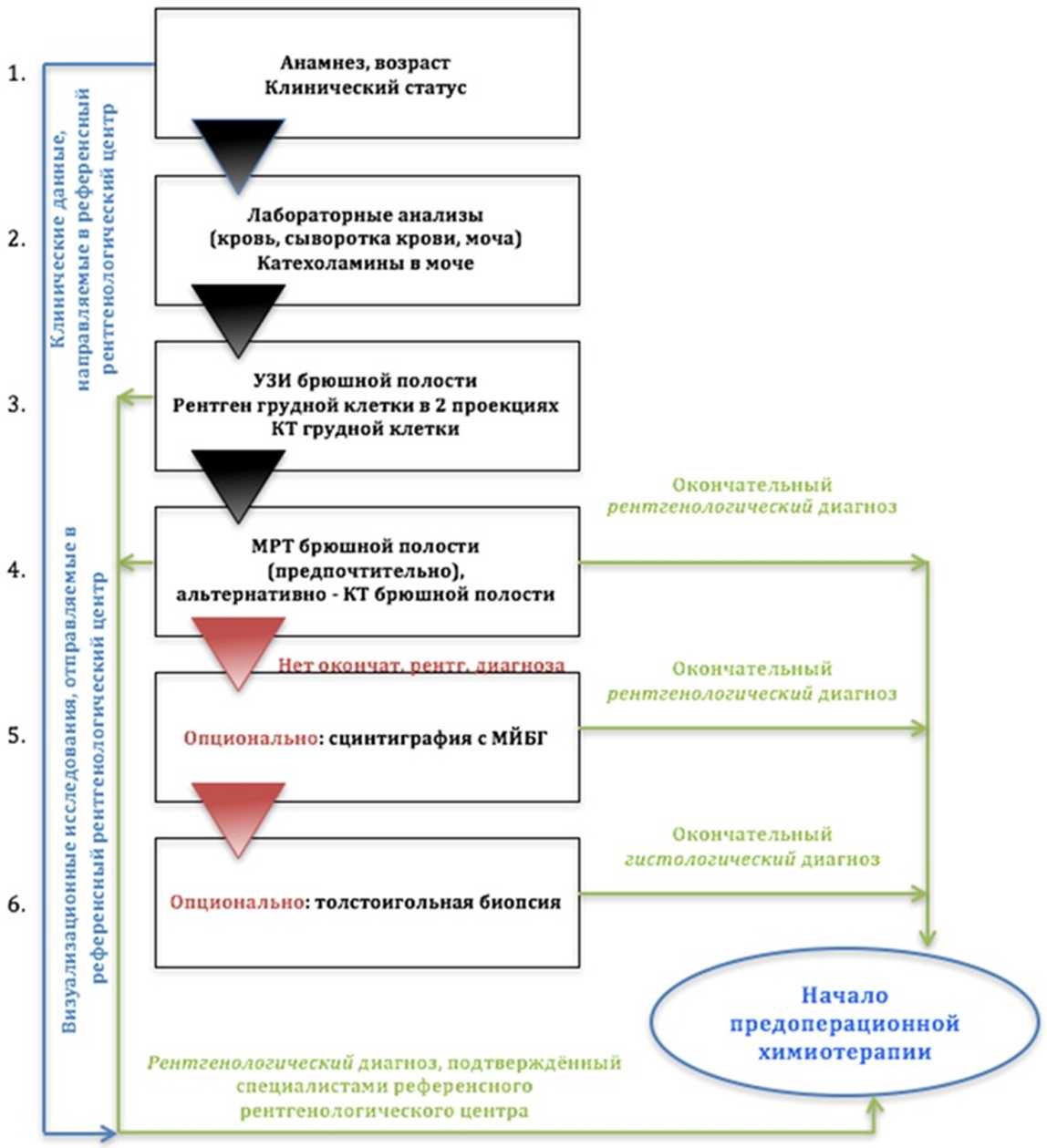
Приложение Б2
АЛГОРИТМ ВЕДЕНИЯ ПАЦИЕНТА С НБ
Приложение Б3
АЛГОРИТМ
ВЕДЕНИЯ ПАЦИЕНТОВ С ДВУСТОРОННЕЙ НЕФРОБЛАСТОМОЙ [33]
Приложение Б4
АЛГОРИТМ
ВЕДЕНИЯ ПАЦИЕНТОВ С ОДНОСТОРОННЕЙ НЕФРОБЛАСТОМОЙ
И КОНТРАЛАТЕРАЛЬНЫМ НЕФРОБЛАСТОМАТОЗОМ [33]
Приложение Б5
АЛГОРИТМ
ВЕДЕНИЯ ПАЦИЕНТОВ С ДВУСТОРОННИМ ИЛИ ОДНОСТОРОННИМ
НЕФРОБЛАСТОМАТОЗОМ [33]
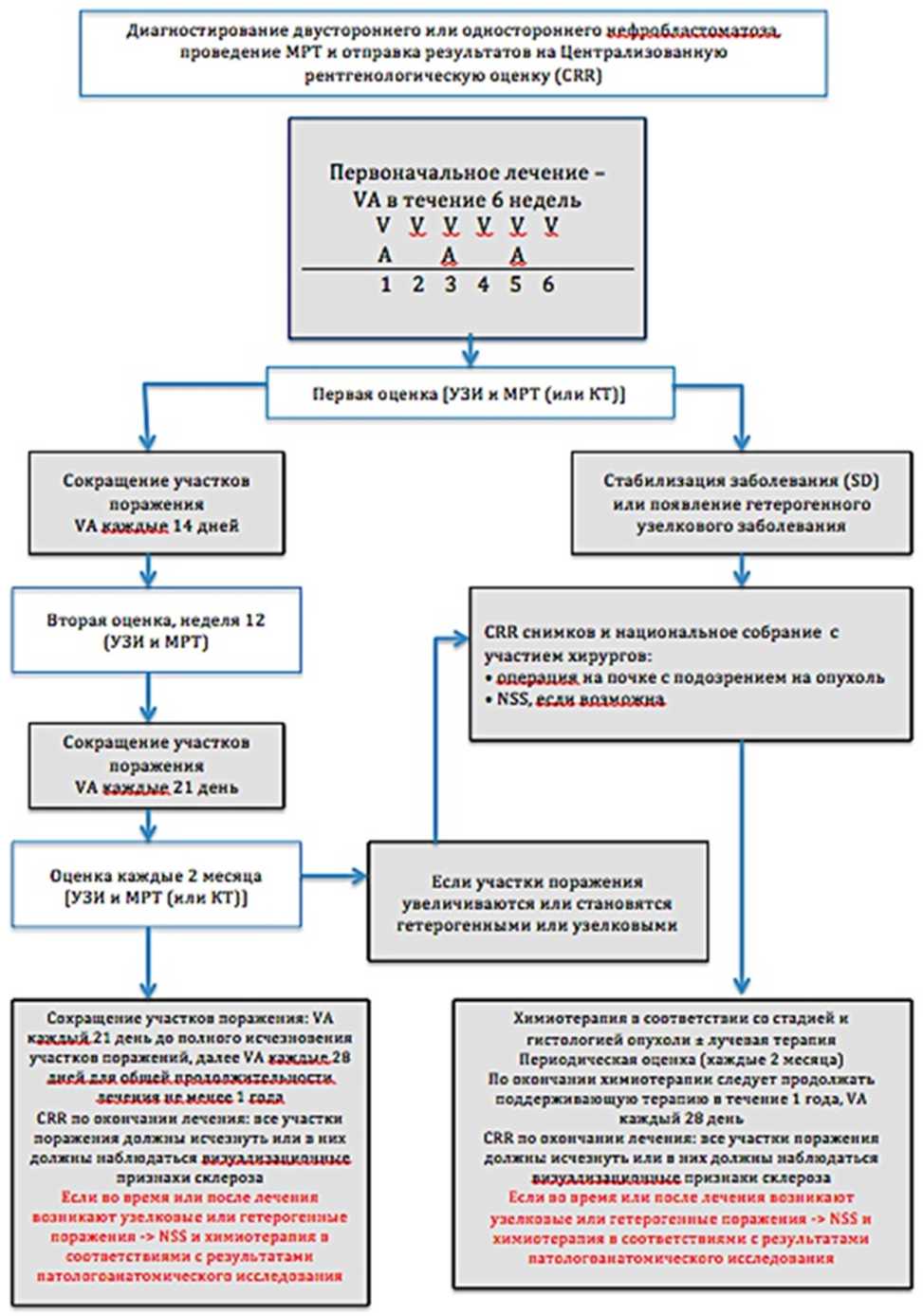
Приложение Б6
АЛГОРИТМ
ВЕДЕНИЯ ПАЦИЕНТОВ С ОДНОСТОРОННЕЙ ОПУХОЛЬЮ И СИНДРОМОМ
ПРЕДРАСПОЛОЖЕННОСТИ К РАЗВИТИЮ ОПУХОЛИ [33]
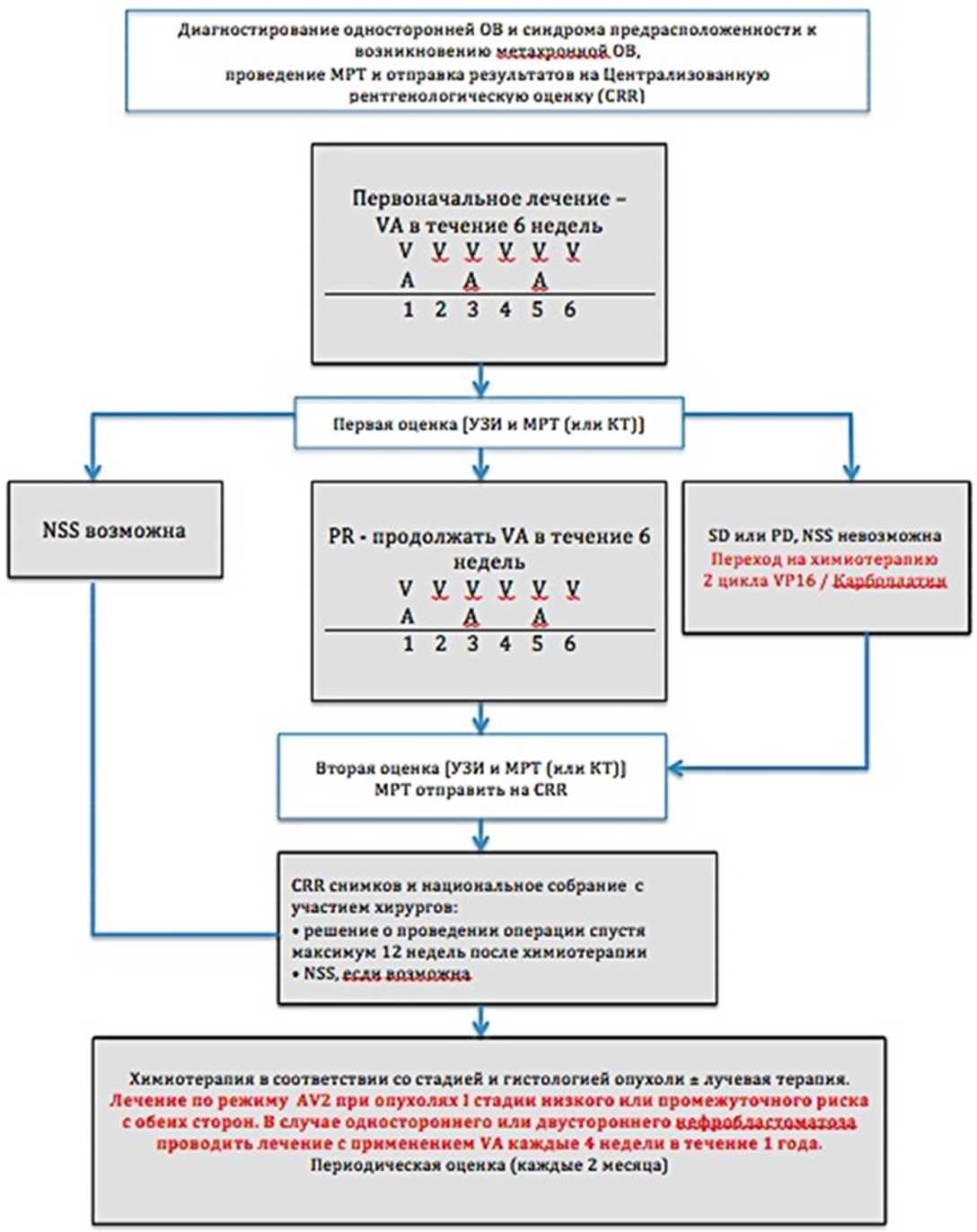
Приложение Б7
АЛГОРИТМ АУДИОЛОГИЧЕСКОГО ОБСЛЕДОВАНИЯ
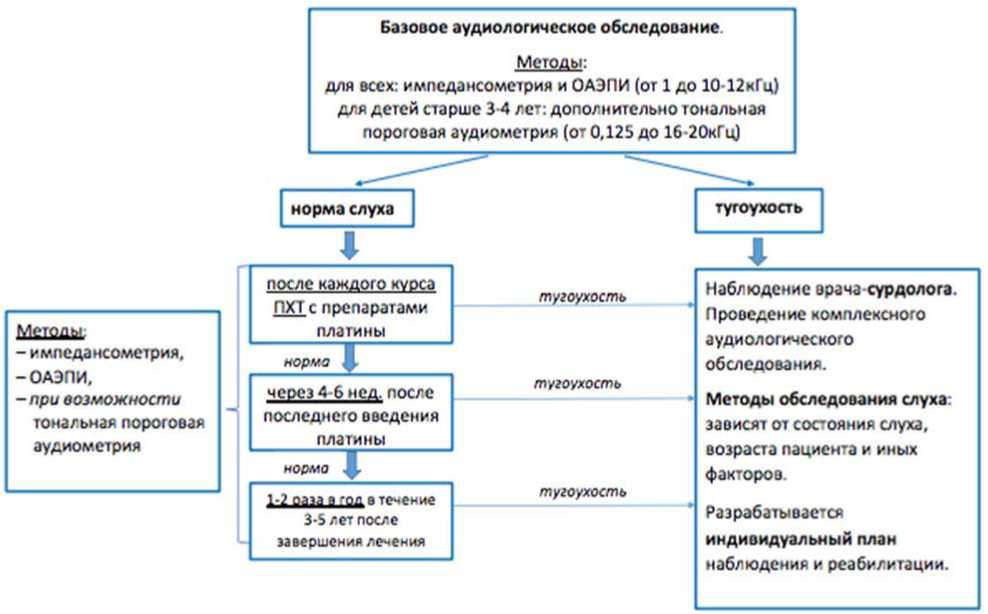
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Нефробластома (опухоль Вилмса) - это высокозлокачественная солидная опухоль почек. Она также называется нефробластома (часть слова "нефро" обозначает почку, а "бластома" обозначает опухоль). Опухоль названа по имени немецкого хирурга из Гейдельберга Макса Вилмса. На рубеже прошлого века Макс Вилмс занимался этой болезнью и впервые ее подробно описал.
Нефробластома возникает из зародышевой ткани, которая начинает развиваться в период внутриутробного развития организма. В ней может быть несколько типов, поэтому нефробластому называют "смешанной опухолью", но основной из них - клетки-предшественники почечной ткани.
У 90% пациентов опухоль имеет локализованную форму, однако, примерно у 10% детей на момент диагноза уже есть метастазы, это могут быть близлежащие лимфатические узлы, а также легкие и печень, и более редкие локализации. У некоторых детей (около 5%) нефробластома сразу поражает обе почки. Обычно у этих детей опухоль вырастает из клеток-предшественников почечной ткани, которая не регрессировала в необходимые сроки, и имеет название - нефробластоматоз (незрелая эмбриональная ткань почек). Чаще, чем при других онкологических болезнях в детском возрасте, нефробластомой болеют дети с определенными аномалиями развития и/или с наследственными онкологическими синдромами.
Нефробластома - самая частая опухоль почки детского возраста, пик заболеваемости приходится на возраст от 2 до 5 лет. Но нефробластома бывает также и у пациентов более младшего возраста, и подростков.
Опухоль связана с изменениями определенных генов и хромосом, наиболее изученным из которых является ген 1 опухоли Вилмса [ген WT1].
Нефробластома часто встречается у детей, у которых уже есть врожденный опухолевый синдром, например, синдром WAGR (объединяет несколько симптомов неправильного развития), синдром Беквита-Видемана (увеличивается масса тела и внутренних органов), синдром Дениса Дрэша (недоразвитие половых органов). У детей с этими болезнями есть нарушения в развитии и повышен риск заболеть раком. Если в семье у кого-то была нефробластома, то у ребенка из этой семьи также повышается вероятность заболеть нефробластомой. "Семейные" случаи встречаются довольно редко (примерно около 1%), и у этих детей опухоль обычно поражает обе почки или нефробластома имеет многоочаговый характер. Однако, в большинстве случаев нефробластома носит спорадический характер.
У заболевших детей живот увеличивается в размерах, и опухоль - случайная находка на УЗИ. Могут быть боли в животе, кровь в моче. Также ребенок может худеть, у него может быть высокая температура. Если у ребенка уже есть определенные генетические синдромы и аномалии развития, то они помогают заподозрить у него нефробластому.
После клинико-рентгенологического подтверждения того, что опухоль исходит из почки, в большинстве случаев начинается предоперационная терапия. Гистологическая верификация до начала лечения применяется только при сильных сомнениях в отношении диагноза нефробластома. У части пациентов (дети младше 6 месяцев и старше 7 - 10 лет) проводят гистологическое исследование ткани до терапии ввиду риска отличной от нефробластомы опухоли.
После того, как поставили окончательный диагноз (после хирургического вмешательства после предоперационной химиотерапии), врачи составляют план лечения. Специалисты, которые ведут пациента, составляют индивидуальную программу лечения (т.н. риск-адаптированное лечение), в которой учитываются определенные моменты. Их называют факторами риска (прогностические факторы), и они влияют на прогноз развития болезни.
Важнейшие прогностические факторы у детей с нефробластомой это: стадия болезни (насколько опухоль распространилась по организму к моменту диагноза, и в каком объеме ее можно удалить хирургическим путем), гистологический вариант нефробластомы (по ним можно понять, как опухоль растет, то есть какая у нее степень злокачественности), ответ опухоли на химиотерапию.
Лечение детей с нефробластомой комбинированное. Это значит, оно состоит в основном из операции и химиотерапии. Чаще всего детей начинают лечить курсом химиотерапии, чтобы уменьшить размер опухоли. Тогда опухоль становится более операбельной. У некоторых детей лечение сразу начинается с операции. Цель хирургической операции - удалить опухоль и возможные метастазы. Как правило, после операции продолжается (или начинается) химиотерапия. В зависимости от стадии опухоли после операции и/или в зависимости от того, есть ли еще метастазы, дополнительно могут назначать облучение опухолевого региона. Во всех крупных лечебных центрах детей и подростков с нефробластомой лечат по стандартизированным протоколам. Цель всех программ - увеличить долговременную выживаемость и одновременно снизить отдаленные последствия на организм ребенка.
Шансы вылечить ребенка от нефробластомы очень хорошие. Благодаря высокоточным новым методам диагностики и стандартизированным протоколам комбинированной терапии выздоравливают примерно 90% больных. Однако, у каждого конкретного ребенка прогноз зависит в первую очередь от того, каким вариантом нефробластомы он заболел и насколько болезнь успела распространиться к моменту диагноза (стадия заболевания). У детей с опухолью высокой степени злокачественности прогноз менее благоприятный. Однако, даже у детей на поздних стадиях нефробластомы при определенных условиях могут быть хорошие шансы на выздоровление. Необходимо понимать, что каждый ребенок индивидуален, и статистика не сможет предсказать выздоровеет он или нет, однако относительно прогноза при том или ином варианте заболевания, необходимо спросить лечащего врача.
ЗРО почки, СКС почки - это редкие агрессивные опухоли почек у детей раннего возраста и чаще всего дифференциальный диагноз проводится с нефробластомой. Светлоклеточная саркома почки характерна для детей в возрасте от 2 до 3 лет и крайне редко встречается у детей первых 6 месяцев жизни. ЗРО почки наиболее часто встречается у детей первых лет жизни и может быть ассоциирована с генетическим синдромом предрасположенности. Клинические симптомы неспецифичны и аналогичны клиническим проявлениям как при нефробластоме. Данные виды опухолей нуждаются в проведении более интенсивной химиотерапии, учитывая их злокачественных потенциал. Лечение пациентов с данными новообразованиями всегда включает в себя интенсивную курсовую химиотерапию, агрессивный локальный контроль с применением хирургических методов лечения и лучевой терапии.
ВМН редкое опухолевое заболевание почки с преимущественным поражением детей первых месяцев жизни. Большая часть опухолей требует только хирургического лечения с последующим динамическим наблюдением. Однако в случае нерадикальности оперативного лечения возможны местнораспространенные рецидивы. Сведения о метастатическом характере заболевания единичны.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ТОКСИЧНОСТЬ
(THE COMMON TERMINOLOGY CRITERIA FOR ADVERSE EVENTS,
VERSION 3.0 AND 5.0)
Название на русском языке: шкала токсичности по критериям CTC AE
Оригинальное название (если есть): Common Terminology Criteria for Adverse Events
Источник (официальный сайт разработчиков, публикация с валидацией): Common Terminology Criteria for Adverse Events (CTCAE) v5.0 Publish Date: November 27, 2017 (http://ctep.cancer.gov).
Степень
0
1
2
3
4
5
Общее состояние
Нормальная активность
Незначительно нарушено
Значительное нарушение активности (например, не посещает школу)
Прикован к постели
Критическое состояние
Смерть
Аллергические реакции
Аллергия
Нет
Транзиторная сыпь, лекарственная лихорадка < 38
Сыпь, крапивница, диспноэ, лекарственная лихорадка > 38
Симптоматический бронхоспазм с или без крапивницы, парентеральное введение препаратов, ангионевротический отек, гипотензия
Анафилаксия
Смерть
Гематологическая токсичность
Гемоглобин (г/л)
Норма (N)
100 - < N
80 - < 100
65 - < 80
< 65
Смерть
Лейкоциты (109/л)
> 4.0 (или >= N)
3.0 - < N
2.0 - < 3.0
1.0 - < 2.0
< 1.0
Смерть
Гранулоциты (109/л)
>= 2.0
1.5 - < N
1.0 - < 1.5
0.5 - < 1.0
< 0.5
Смерть
Тромбоциты (109/л)
>= 100
75 - < N
50 - < 75
25 - < 50
< 25
Смерть
Инфекционные осложнения
Инфекция
Нет
Легкая
Средней тяжести, негативные посевы, в/в антибактериальные препараты системного действия
Тяжелая инфекция, микробиологическая верификация, в/в антибактериальные препараты системного действия
Жизнеугрожающая инфекция (напр., гипотензия, септический шок)
Смерть
Лихорадка
< 38
38 - 39
> 39 - 40
> 40 < 24 ч
> 40 >= 24 ч
Смерть
Гастроинтестинальная токсичность
Тошнота
Нет
Достаточный прием пищи
Может есть, прием пищи ограничен
Практические не принимает пищу
ПЭП, жизнеугрожающее состояние
Смерть
Рвота (эпизоды/24 ч)
Нет
1
2 - 5
> 6
ПЭП, жизнеугрожающее состояние
Смерть
Стоматит/мукозит
Нет
Безболезненные эрозии, эритема, минимальный дискомфорт
Болезненные эритема/язвы, возможен прием пищи, очаговое поражение слизистой, может требоваться обезболивание
Болезненные эритема/язвы, прием пищи невозможен, значительное поражение слизистой, требующее обезболивания
ПЭП из-за стоматита, жизнеугрожающее состояние
Смерть
Диарея (стул/день)
Не изменился
< 4 раз чаще обычной кратности
На 4 - 6 раз чаще обычной кратности, инфузионная терапия < 24 ч
На >= 7 раз чаще обычной кратности, инфузионная терапия > 24 ч, госпитализация
Жизнеугрожающее состояние (напр., гемодинамические нарушения)
Смерть
Колит
Нет
Бессимптомный, только гистологические или рентгенологические признаки
Боли в животе, слизь или кровь в стуле
Боли в животе, лихорадка, перитонеальные симптомы, нарушение моторики (илеус)
Жизнеугрожающие симптомы (перфорация, некроз, токсический мегаколон, кровотечение, ишемия)
Смерть
Запоры
Нет
Непостоянные и перемежающиеся запоры, иногда прием слабительных
Персистирующие симптомы, требующие постоянно приема слабительных или клизм
Симптомы, нарушающие обычную дневную активность, запоры, требующие мануальной эвакуации
Жизнеугрожающие симптомы (непроходимость, токсический мегаколон)
Смерть
Печеночная токсичность
Билирубин
N
> N - 1.5 x N
> 1.5 - 3.0 x N
> 3.0 - 10.0 x N
> 10.0 x N
Смерть
АСТ
N
> N - 2.5 x N
> 2.5 - 5.0 x N
> 5.0 - 20.0 x N
> 20.0 x N
Смерть
Почечная токсичность
Креатинин
N
> N - 1.5 x N
> 1.5 - 3.0 x N
> 3.0 - 6.0 x N
> 6.0
Смерть
Протеинурия
(г/24 ч)
N
< 1
1 - 3.5
> 3.5
Нефротический синдром
Смерть
Гематурия/гемоглобинурия
N
Да
Смерть
Клиренс по креатинину (мл/мин/1,73 м2)
>= 90
60 - 89
40 - 59
20 - 39
<= 19
Смерть
Тубулярная токсичность
Смерть
Кардиотоксичность
Аритмии
Норма
Легкая дисфункция (асимптоматическая)
Средней тяжести (не требует терапии)
Тяжелая (требует терапии)
Жизнеугрожающая, инвалидизация
Смерть
Сердечная функция
Норма
Асимптоматическая, в покое EF < 50 - 60%, SF < 24 - 30%
Асимптоматическая, EF < 40 - 50%, SF 15 - 24%
Симптоматическая, ответ на терапию, EF < 20 - 40%, SF < 15%
Тяжелая, рефрактерная застойная сердечная недостаточность или потребность в интубации
Смерть
Неврологическая токсичность
Нейротоксичность центральная
Нет
Транзиторное нарушение сознания
Не влияет на обычную дневную активность
Влияет на обычную дневную активность
Жизнеугрожающие симптомы, инвалидизация (кома)
Смерть
Нейротоксичность периферическая
Нет
Парестезии, легкая субъективная слабость
Тяжелые парестезии, легкая слабость, не влияет на обычную дневную активность
Невыносимая тяжелая слабость, влияет на обычную дневную активность
Жизнеугрожающие симптомы, инвалидизация (паралич)
Смерть
Ототоксичность
Нет
Изменение порога или потеря 15 - 25 Дб при 2 последовательных тестах
Изменение порога или потеря > 25 - 90 Дб при 2 последовательных тестах
Потеря слуха, требующая терапевтического вмешательства, в том числе слуховых аппаратов (например, двухстороннее нарушение слуха с речевых частотах >= 20 Дб; >= 30 Дб одностороннее снижение слуха; необходимость дополнительных речевых занятий)
Аудиологические показания для кохлеарного импланта, речевые занятия
Смерть
Другое
Приложение Г2
ШКАЛА ECOG
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5(6): 649 - 65 [49]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Оценка статуса больного по шкале ECOG
0
Больной полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Приложение Г3
ШКАЛА KARNOFSKY, МОДИФИКАЦИЯ LANSKY
Оригинальное название: Lansky Performance Scale
Источник: Lansky SB, List MA, Lansky LL, Ritter-Sterr C, Miller DR (1987). "The measurement of performance in childhood cancer patients". Cancer. 60 (7): 1651 - 6 [55]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента в зависимости от возраста (шкала Karnovsky - для пациентов 16 лет и старше, шкала Lansky - для пациентов моложе 16 лет)
Содержание и интерпретация:
Шкала Karnofsky (возраст реципиента >= 16 лет)
Шкала Lansky (возраст реципиента < 16 лет)
Сохранена нормальная ежедневная активность;
медицинская помощь не требуется
Способен самостоятельно поддерживать нормальную активность, не нуждается в специальном уходе
100
Практически здоров: жалоб нет; признаков заболевания нет
100
Полная активность, норма
90
Сохранена нормальная ежедневная активность
90
Минимальные ограничения в активных играх
80
Нормальная ежедневная активность
80
Ограничен а активных играх, устает быстрее, в остальном полностью активен
Утрата трудоспособности, возможно проживание в домашних условиях; большей частью способен себя обслужить; требуется уход в различном объеме
Незначительные или умеренные ограничения
70
Способен себя обслужить; не способен поддерживать нормальную ежедневную активность или выполнять активную работу
70
Более выраженные ограничения активности и меньше времени, проводимого в играх
60
Большей частью способен себя обслужить, однако в отдельных случаях нуждается в уходе
60
Нуждается в амбулаторном наблюдении до 50% времени, минимальная активность в подвижных играх
50
Частично способен себя обслужить, частично нуждается в уходе, часто требуется медицинская помощь
50
Требуется значительная помощь в играх, не играет активно, способен участвовать в спокойных играх
Не способен себя обслужить, требуется госпитальная помощь; возможна быстрая прогрессия заболевания
Умеренные или серьезные ограничения
40
Не способен себя обслуживать, требуются специальный уход и медицинская помощь
40
 часть времени лежит в кровати, но может заниматься спокойными играми
часть времени лежит в кровати, но может заниматься спокойными играми
30
Не способен себя обслуживать, показана госпитализация, хотя непосредственная угроза для жизни отсутствует
30
 часть времени спит, нуждается в помощи даже в самых тихих играх
часть времени спит, нуждается в помощи даже в самых тихих играх
20
Тяжелое заболевание: необходима госпитализация, необходима активная поддерживающая терапия
20
 часть времени спит, способен только на самые пассивные занятия (напр. TV)
часть времени спит, способен только на самые пассивные занятия (напр. TV)
10
Терминальный период: быстро прогрессирующий фатальный процесс
10
Не играет, не встает с кровати
