"Клинические рекомендации "Забрюшинные неорганные саркомы"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЗАБРЮШИННЫЕ НЕОРГАННЫЕ САРКОМЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C48.0, C48.8
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 618
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Общероссийская общественная организация "Российское общество клинической онкологии"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АЛТ - аланинаминотрансфераза
АПХТ - адъювантная полихимиотерапия
АСТ - аспартатаминотрансфераза
АФП - альфа-фетопротеин
БДУ - без дополнительных уточнений
БРВ - безрецидивная выживаемость
ВАШ - Визуально-аналоговая шкала оценки болевого синдрома
ВБП - время без прогрессирования
в/в - внутривенно(ый)
ВОЗ - Всемирная организация здравоохранения
рчГ-КСФ - рекомбинантный гранулоцитарный колониестимулирующий фактор человека [рчГ-КСФ]
ДИ - доверительный интервал
ЖКТ - желудочно-кишечный тракт
ЗНО - злокачественные новообразования
ЗНС - забрюшинная неорганная саркома
ИГХ - иммуногистохимия/иммуногистохимическое исследование
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
ЛМС - лейомиосаркома
ЛС - липосаркома
ЛТ - лучевая терапия (радиотерапия)
ЛФК - лечебная физкультура
МКБ-10 - Международная классификация болезней 10-го пересмотра
МКБ-О - Международная классификация онкологических заболеваний
МОВ - медиана общей выживаемости
МРТ - магнитно-резонансная томография
НАПХТ - неоадъювантная полихимиотерапия
НПВ - нижняя полая вена
ОВ - общая выживаемость
ОО - общий ответ
ОШ - отношение шансов
ПЭТ - позитронно-эмиссионная томография
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией
РОД - разовая очаговая доза
РПЗ - репрезентативные поля зрения
РЭА - раковый эмбриональный антиген
СД - суммарная доза
СМТ - саркома мягких тканей
СОД - суммарная очаговая доза
СФО - солитарная фиброзная опухоль
УЗИ - ультразвуковое исследование
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
ХГ - хорионический гонадотропин
ХТ - химиотерапия
ЭГДС - эзофагогастродуоденоскопия
ЭКГ - электрокардиография
эндоУЗИ - эндоскопическое ультразвуковое исследование
ECOG - Eastern Cooperative Oncology Group (Восточная объединенная группа онкологов)
FDA - Food and Drug Administration (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США)
FISH - fluorescence in situ hybridization (флуоресцентная гибридизация in situ)
MSI - microsatellite instability (микросателлитная нестабильность)
mTOR - mammalian target of rapamycin (мишень рапамицина млекопитающих)
NGS - next generation sequencing (секвенирование нового поколения)
RECIST - Response Evaluation Criteria In Solid Tumors (критерии оценки эффекта при солидных опухолях)
TMB-H - опухолевая мутационная нагрузка высокого уровня (high tumor mutational burden)
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (off-label, офф-лейбл)
Термины и определения
Адъювантная химиотерапия - вид химиотерапии, проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
Безрецидивная выживаемость (БРВ) (RFS, relapse free survival) - интервал времени от начала лечения до прогрессирования болезни, развития второй опухоли или смерти пациента от любой причины. Определяется в случае радикального лечения при локализованном процессе.
Время до прогрессирования болезни (ВДП) (TTP, time to progression) - интервал времени от начала лечения (или даты рандомизации в клинических исследованиях) до даты прогрессирования болезни без учета смерти пациента от причин, не связанных с прогрессированием процесса.
Второй этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Выживаемость без прогрессирования болезни (ВБП) (PFS, progression free survival) - интервал времени от начала лечения (или даты рандомизации в клинических исследованиях) до даты прогрессирования болезни или смерти пациента от любой причины.
Конформная лучевая терапия - техника дистанционной лучевой терапии высокой точности, основанная на определении трехмерного объема опухоли и анатомии критических органов.
Курс (цикл) химиотерапии - период времени, исчисляемый с первого до последнего дня введения цитостатиков.
Неоадъювантная химиотерапия - вид химиотерапии, проводимый непосредственно перед хирургическим удалением первичной опухоли для улучшения результатов операции/лучевой терапии и для предотвращения образования метастазов.
Неоптимальная циторедуктивная операция - экстирпации матки с придатками, удаление большого сальника, проявлений опухолевого процесса с макроскопически определяемыми остаточными узлами, из которых хотя бы один более 10 мм в диаметре.
Общая выживаемость (ОВ) (OS, overall survival) - интервал времени от начала лечения до смерти пациента от любой причины.
Операция в объеме R1 - удаление пораженного органа в пределах здоровых тканей вместе с зонами регионарного метастазирования с наличием микроскопически определяемой остаточной опухоли (в краях резекции)
Оптимальная циторедуктивная операция - выполнение экстирпации матки с придатками, удаление большого сальника, а также видимых проявлений опухолевого процесса с макроскопически определяемыми остаточными опухолевыми узлами, каждый из которых имеет диаметр не более 10 мм.
Полная циторедуктивная операция - выполнение экстирпации матки с придатками, удаление большого сальника, а также всех видимых проявлений опухолевого процесса без макроскопически определяемых остаточных опухолевых масс.
Пререабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Полный эффект (ПЭ), или полная регрессия опухоли (ПР) (CR, complete response) - исчезновение всех очагов поражение на срок не менее 4-х недель.
Прогрессирование болезни (ПБ) (PD, progression disease) - увеличение суммы измеряемых очагов на 20% и более по сравнению с наименьшей суммой, зарегистрированной в процессе лечения и/или наблюдения, или появление хотя бы одного нового очага.
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания;
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в т.ч. в условиях санаторно-курортных организаций).
Радикальная операция (R0) - удаление пораженного органа в пределах здоровых тканей вместе с зонами регионарного метастазирования без остаточных проявлений опухолевого процесса.
Симптоматическое лечение - комплекс лечебных мероприятий, направленных на устранение наиболее тягостных проявлений опухолевого процесса, либо на лечение осложнений или коррекцию последствий, связанных с противоопухолевым лечением.
Стабилизация болезни (СБ) - уменьшение суммы измеряемых очагов менее чем на 30% или увеличение суммы измеряемых очагов менее чем на 20% при отсутствии новых очагов или явного прогрессирования со стороны неизмеряемых очагов.
Таргетная терапия - вид противоопухолевой терапии, которая блокирует рост раковых клеток с помощью вмешательства в механизм действия конкретных целевых (таргетных) молекул, необходимых для канцерогенеза и роста опухоли.
Уровни достоверности доказательств - отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам, достоверность доказательств определяется по 3 основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций - в отличие от уровней достоверности доказательств отражают степень уверенности не только в достоверности эффекта вмешательства, но и в том, что следование рекомендациям принесет в конкретной ситуации больше пользы, чем негативных последствий.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Забрюшинные неорганные саркомы (ЗНС) - группа неорганных мезенхимальных опухолей с различными линиями дифференцировки и вариабельным потенциалом злокачественности.
Данная группа новообразований не включает:
- опухоли коры надпочечника (адренокортикальная аденома/рак);
- опухоли мозгового вещества надпочечника (феохромоцитома, нейробластома);
- опухоли забрюшинных параганглиев (параганглиомы, ганглионеврома);
- мезенхимальные опухоли органов малого таза.
Независимо от анатомической локализации мезенхимальные новообразования могут быть классифицированы в зависимости от:
- линии дифференцировки;
- биологического потенциала;
- драйверных генетических аномалий;
- степени злокачественности (шкала FNCLCC).
Комментарий: в связи с тем, что для отдельных мезенхимальных опухолей до сих пор не установлен нормальный клеточный аналог, правильнее говорить не о гистогенезе, а о линии дифференцировки, если таковая известна [119].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
На сегодняшний день не установлены этиологические факторы развития забрюшинных сарком. Липосаркомы представляют собой злокачественные мезенхимальные опухоли из опухолевых липоцитов/липобластов разной степени дифференцировки. Гистогенетическим источником их развития чаще всего является жировая ткань паранефральной клетчатки, брыжейки ободочной или тонкой кишки. Лейомиосаркомы - вторая по частоте после липосарком группа забрюшинных опухолей [1]. Это злокачественные мезенхимальные опухоли из гладкомышечных клеток. Они имеют два гистогенетических источника развития забрюшинной локализации - миоциты брыжейки тонкой кишки и мышечные клетки стенки нижней полой вены и ее висцеральных ветвей. В соответствии с этим выделены забрюшинные неорганные лейомиосаркомы и лейомиосаркомы нижней полой вены и почечных вен. Злокачественные опухоли из клеток оболочек периферических нервов (злокачественные шванномы) - третья по распространенности группа забрюшинных неорганных опухолей. Это опухоли нейроэктодермального происхождения, формирующиеся из шванновских клеток и периневральных фибробластов (нейрофибросаркомы). Другие гистологические типы встречаются значительно реже.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В России отсутствуют эпидемиологические данные о заболеваемости ЗНС.
Пациенты забрюшинными неорганными саркомами составляют около 15% от пациентов мягкотканными саркомами [156]. Этиологические факторы и патогенез забрюшинных сарком остается до конца не изученным. Основные генетические аномалии, выявляемые в забрюшинных неорганных саркомах, представлены в разделе 1.4.3.
Возникновение некоторых видов сарком ассоциировано с наследственными синдромами. Приблизительно у 5% пациентов с нейрофиброматозом возникают мягкотканные саркомы и наиболее частыми новообразованиями являются злокачественные опухоли из оболочек периферических нервов. Десмоидные опухоли встречаются у 7.5% - 16% пациентов семейным полипозом [157].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Особенностью кодирования ЗНС является тот факт, что данные опухоли относятся к мягкотканным саркомам. Многие гистологические формы мягкотканных сарком крайне редко диагностируются забрюшинно у взрослых пациентов. По Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10) ЗНС имеют код: C48.0 [119].
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Международная гистологическая классификация
В таблице N 1 приведены гистологические типы мезенхимальных опухолей, которые могут локализоваться забрюшинно [119].
Таблица N 1. Гистологические типы мезенхимальных новообразований с первичной забрюшинной локализацией
Линия дифференцировки
Код МКБ-О
Гистологический тип опухоли
Липогенная
8851/3
Липосаркома высокодифференцированная
8858/3
Липосаркома дедифференцированная
8852/3
Липосаркома миксоидная
8854/3
Липосаркома плеоморфная
8859/3
Липосаркома миксоидная плеоморфная
Гладкомышечная
8890/3
Лейомиосаркома
Скелетно-мышечная
8910/3
Рабдомиосаркома эмбриональная
8920/3
Рабдомиосаркома альвеолярная
8912/3
Рабдомиосаркома веретеноклеточная/склерозирующая
8901/3
Рабдомиосаркома плеоморфная
Фибробластическая
8815/1
Солитарная фиброзная опухоль
8815/3
Солитарная фиброзная опухоль, злокачественная
8825/1
Воспалительная миофибробластическая опухоль
Оболочки периферических нервов
9540/3
Злокачественная опухоль оболочек периферических нервов
Эндотелиальная
9120/3
Ангиосаркома
Неизвестная
8714/3
Периваскулярная эпителиоидная опухоль (ПЭКома)
9040/3
Синовиальная саркома
8804/3
Эпителиоидная саркома, проксимальный тип
9260/3
Саркома Юинга, внескелетная
8963/3
Внепочечная рабдоидная опухоль
8806/3
Десмопластическая мелкокруглоклеточная опухоль
8803/3
Недифференцированная круглоклеточная саркома
8802/3
Недифференцированная плеоморфная саркома
8801/3
Недифференцированная веретеноклеточная саркома
В соответствии с критериями Классификаций опухолей мягких тканей и костей ВОЗ [2, 120] принято выделять 4 клинико-прогностические группы мезенхимальных новообразований (см. таблицу N 2).
Таблица N 2. Клинико-прогностические группы мезенхимальных новообразований
Группа
Типичный представитель
Доброкачественные опухоли
Липома, шваннома, лейомиома
Инфильтративные, неметастазирующие опухоли
Атипичная липоматозная опухоль
(высокодифференцированная липосаркома)
Инфильтративные, редко метастазирующие опухоли <*>
Солитарная фиброзная опухоль
Воспалительная миофибробластическая опухоль
Злокачественные опухоли <**>
Дедифференцированная липосаркома
Лейомиосаркома
Злокачественная опухоль оболочек периферических нервов
--------------------------------
<*> - частота метастазирования в данной группе не превышает 2% случаев.
<**> - истинные саркомы с частотой метастазирования 20 - 100%.
1.5.2. Стадирование
В настоящее время стадирование забрюшинных неорганных сарком осуществляется по системе стадирования сарком мягких тканей TNM (8 издание, 2017 г.).
В основу стадирования включены размер опухоли, степень злокачественности и наличие (отсутствие) отдаленных метастазов.
Размер опухоли
T1 - опухоль <= 5 см;
T2 - опухоль > 5 см <= 10 см;
T3 - опухоль > 10 см <= 15 см;
T4 - опухоль > 15 см.
Степень злокачественности (G)
G1 - низкая степень злокачественности;
G2, G3 - высокая степень злокачественности.
Таблица N 3. Стадирование забрюшинных неорганных сарком по системе TNM (8 издание, 2017 г.)
Стадия
T
N
M
Степень злокачественности
IA
T1
N0
M0
Низкая, GX
IB
T2, T3, T4
N0
M0
Низкая, GX
II
T1
N0
M0
Высокая
IIIA
T2
N0
M0
Высокая
IIIB
T3, T4
N0
M0
Высокая
IIIB
Любая T
N1
M0
Любая
IV
Любая T
Любая N
M1
Любая
1.5.3. Генетические аномалии забрюшинных сарком
В целом все мезенхимальные опухоли в зависимости от генетической аномалии, лежащей в основе их развития, условно могут быть разделены на две большие группы: саркомы с простым ("транслокационные") и сложным кариотипом ("нетранслокационные" саркомы). В частности, для первой группы типичным видом драйверных мутаций являются транслокации, для второй - иные мутации.
В сложных диагностических случаях оценка генетических аномалий способна уточнить гистологический тип опухоли.
Комментарий: целесообразно выполнение молекулярно-генетического исследования с целью уточнения подтипа опухоли.
В таблице N 4 приведен список диагностически значимых генетических аномалий мезенхимальных новообразований забрюшинного пространства, способных оказать существенную помощь в верификации гистологического типа опухоли [2, 120].
Таблица N 4. Основные генетические аномалии мезенхимальных новообразований забрюшинного пространства
Гистологический тип опухоли
Диагностически значимая генетическая аномалия
Основные методы диагностики
Липосаркома высоко- и дедифференцированная
Амплификация гена MDM2
FISH
Амплификация гена CDK4
FISH
Липосаркома миксоидная
Транслокация FUS-DDIT3
FISH
Транслокация EWSR1-DDIT3
FISH
Липосаркома плеоморфная
Отсутствие амплификации генов MDM2 и CDK4
FISH
Липосаркома миксоидная плеоморфная
Отсутствие транслокаций FUS/EWSR1-DDIT3 и отсутствие амплификации гена MDM2
Диагностика синдрома Ли-Фраумени (мутация гена TP53)
FISH, секвенирование по Сэнгеру
Лейомиосаркома
Факультативно: диагностика наследственных синдромов: синдром Ли-Фраумени (мутация гена TP53), ретинобластома (мутации гена RB1)
NGS
Рабдомиосаркома эмбриональная
Отсутствие транслокаций гена FOXO1
Диагностика наследственных синдромов: синдром Кастелло (мутации гена HRAS), нейрофиброматоз 1 типа (мутации гена NF1), синдром Нунана, синдром Беквита-Видемана, синдром Ли-Фраумени (мутация гена TP53)
FISH, ПЦР, секвенирование по Сэнгеру, NGS
Рабдомиосаркома альвеолярная
Транслокация PAX3-FOXO1
FISH
Транслокация PAX7-FOXO1
FISH
Рабдомиосаркома плеоморфная
Нет
-
Солитарная фиброзная опухоль (в т.ч. злокачественная и дедифференцированная)
Транслокация NAB2-STAT6
ИГХ, FISH
Воспалительная миофибробластическая опухоль
Перестройка гена ALK
ИГХ, FISH
Факультативно: перестройка генов ROS1 и NTRK3
ИГХ, FISH
Злокачественная опухоль оболочек периферических нервов
Диагностика наследственного синдрома - нейрофиброматоз 1 типа (мутации гена NF1)
NGS
Ангиосаркома
Факультативно: амплификация гена MYC при ангиосаркомах, ассоциированных с лимфостазом, и после лучевой терапии
FISH
ПЭКома
Перестройка гена TFE3
FISH
Синовиальная саркома
Транслокация SS18-SSX1
FISH
Транслокация SS18-SSX2
FISH
Транслокация SS18-SSX4
FISH
Эпителиоидная саркома
Утрата гена SMARCB1 (INI1)
ИГХ
Саркома Юинга
Транслокация EWSR1-FLI1
Транслокация EWSR1-ERG
и другие редкие транслокации с участием генов EWSR1 или FUS
FISH
Внепочечная рабдоидная опухоль
Диагностика наследственных синдромов: синдром предрасположенности к рабдоидной опухоли 1 (мутации в гене SMARCB1), реже - синдром предрасположенности к рабдоидной опухоли 2 (мутации в гене SMARCA4)
NGS
Десмопластическая мелкокруглоклеточная опухоль
Транслокации гена EWSR1
FISH, ПЦР
Недифференцированная плеоморфная саркома
Отсутствие мутаций в генах IDH1 и IDH2,
мутации в генах H3F3A, H3F3B
ПЦР
1.5.4. Степень злокачественности сарком
В соответствии с рекомендациями Классификаций ВОЗ [2, 120] для определения гистологической степени злокачественности саркомы при исследовании биопсийного и операционного материала патологоанатомом должна использоваться система  Nationale des Centers de Lutte Contre le Cancer (FNCLCC).
Nationale des Centers de Lutte Contre le Cancer (FNCLCC).
Все мезенхимальные новообразования, по своему биологическому потенциалу относящиеся ко 2-й и 3-й клинико-прогностическим группам (т.е. не являющиеся истинными саркомами), не подлежат градации по системе FNCLCC: атипичная липоматозная опухоль (синоним - высокодифференцированная липосаркома), воспалительная миофибробластическая опухоль, солитарная фиброзная опухоль (СФО).
Система FNCLCC основана на полуколичественной оценке таких морфологических параметров как степень дифференцировки клеток опухоли, числа митозов в 10 полях зрения при увеличении x400, объема очагов некроза в опухоли (таблица N 5).
Для наиболее часто встречающихся гистологических типов сарком в таблице N 6 приведена балльная система оценки уровня дифференцировки опухоли.
Как было отмечено в п. 1.4.2, трехступенчатая система градации FNCLCC сопоставима с бинарной градацией сарком [2, 119], подразделяющей их на опухоли низкой (low grade, что эквивалентно G1 по FNCLCC) и высокой степени злокачественности (high grade, эквивалент G2 - G3 по FNCLCC).
Таблица N 5. Система гистологической градации FNCLCC
Оценка
(баллы/Grade)
Дифференцировка опухоли
1
Клетки опухоли в значительной степени сходны с нормальным зрелым аналогом
2
Опухоль имеет известную линию дифференцировки
3
Эмбриональные и недифференцированные опухоли, а также опухоли с неизвестной линией дифференцировки
Митотический индекс
1
0 - 9 митозов
2
10 - 19 митозов
3
>= 20 митозов
Объем некроза в опухоли
0
Некроз отсутствует
1
< 50%
2
> 50%
Степень злокачественности
(дифференцировка + митотический индекс + объем некроза = сумма баллов)
Grade 1
2 - 3
Grade 2
4 - 5
Grade 3
6 - 8
Таблица N 6. Балльная система оценки степени дифференцировки сарком (FNCLCC)
Гистологический тип саркомы
Дифференцировка (баллы)
Высокодифференцированная липосаркома
1
Высокодифференцированная лейомиосаркома
1
Высокодифференцированная злокачественная опухоль оболочек периферических нервов
1
Миксоидная липосаркома
2
Типичная лейомиосаркома
2
Типичная злокачественная опухоль оболочек периферических нервов
2
Круглоклеточная (миксоидная) липосаркома
3
Плеоморфная липосаркома
3
Дедифференцированная липосаркома
3
Рабдомиосаркома
3
Низкодифференцированная/плеоморфная лейомиосаркома
3
Низкодифференцированная/эпителиоидная ангиосаркома
3
Низкодифференцированная злокачественная опухоль оболочек периферических нервов
3
Синовиальная саркома
3
Саркома Юинга
3
Эпителиоидная саркома
3
Рабдоидная опухоль
3
Недифференцированная плеоморфная саркома
3
Комментарий: необходимо отметить, что, как и любая прогностическая шкала, система FNCLCC имеет ограниченное применение и не способна предсказать клиническое течение абсолютно всех сарком, независимо от их анатомической локализации [2, 119].
Так, у ряда сарком степень злокачественности способна возрастать по мере прогрессирования заболевания (лейомиосаркома, миксоидная липосаркома, ангиосаркома, злокачественная опухоль оболочек периферических нервов): G1 > G2 > G3. В связи с этим в морфологическом заключении после исследования биопсийного или операционного материала патологоанатомом должен быть отмечен факт увеличения злокачественного потенциала опухоли.
В свою очередь, у других сарком высокая степень злокачественности (G3) независимо от гистологического варианта опухоли или статуса прогрессирования всегда остается неизменной (синовиальная саркома, эпителиоидная саркома, все плеоморфные саркомы, рабдоидная опухоль, семейство сарком Юинга).
Следует отметить, что ни для одной из сарком не типично снижение степени злокачественности, т.е. повышение клеточной дифференцировки.
В связи с неэффективностью системы FNCLCC не нуждаются в градации степени злокачественности такие новообразования, как малигнизированная СФО, неорганная ПЭКома [2, 119].
Комментарий: оценка риска метастазирования при СФО имеет свои особенности.
В разные годы понимание экспертного комитета ВОЗ клинических и гистологических признаков, отражающих биологический потенциал СФО, неоднократно менялось. Так, в предшествующей Классификации ВОЗ опухолей костей и мягких тканей отмечалось, что "злокачественная СФО обычно является гиперклеточной опухолью, с митотическим индексом более 4/10 РПЗ, вариабельной клеточной атипией, очагами некроза и/или инфильтративным ростом; причем из всех признаков только митотический индекс наиболее ассоциирован с прогнозом" [2].
В свою очередь, в последней редакции Классификации [119] экспертный совет предложил взамен многолетнего деления СФО на "незлокачественную" и "злокачественную" формы использовать стратификацию по группам низкого, промежуточного и высокого риска метастазирования. Кроме того, настоящая схема стратификации рекомендована ВОЗ для оценки риска метастазирования взамен традиционного стадирования в зависимости от анатомической локализации. В таблице N 7 приведена одобренная ВОЗ шкала оценки риска метастазирования СФО, разработанная Demicco E.G. и соавт. [119, 120].
Таблица N 7. Модифицированная шкала оценки риска метастазирования солитарной фиброзной опухоли (2017)
Признак (фактор риска)
Пороговое значение признака
Значение признака (баллы)
Возраст на момент постановки диагноза
< 55
0
>= 55
1
Число митозов в 10 полях зрения при x400
0
0
1 - 3
1
4
2
Максимальный размер опухоли, см
0 - 4,9
0
5 - 9,9
1
10 - 14,9
2
>= 15
3
Доля очагов некроза в опухоли
< 10%
0
>= 10%
1
Риск метастазирования (сумма баллов)
Низкий
0 - 3
Умеренный
4 - 5
Высокий
6 - 7
1.5.5. Оценка степени морфологического регресса сарком
В соответствии с рекомендациями Коллегии американских патологов (CAP, 2021) [131] и International Collaboration on Cancer Reporting (ICCR, 2021) [132] патоморфологическая оценка выраженности лечебного патоморфоза мягкотканной саркомы проводится путем подсчета доли жизнеспособных опухолевых клеток в остаточной опухоли. Данный показатель должен быть отражен патологоанатомом в гистологическом заключении при исследовании операционного материала радикально удаленной саркомы в виде непрерывной шкалы (от 0 до 100%).
Принимая во внимание крупные размеры большинства сарком, оценку объема массивных очагов некроза рекомендуется проводить в 2 этапа:
- макроскопически - при вырезке операционного материала,
- микроскопически - при исследовании гистологических препаратов.
На препаратах трепанобиопсий или инцизионных биопсий оценка лечебного патоморфоза сарком после неоадъювантного лечения не выполняется [131, 132].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
ЗНС представляют собой гетерогенную группу заболеваний. Одной из особенностей их является медленный экспансивный рост с минимальными клиническими проявлениями. Отсутствие болевого синдрома "позволяет" опухолям достичь больших (> 20 - 30 см в диаметре) размеров. В зависимости от типа и темпа роста, гистологической структуры такие опухоли могут либо прорастать соседние органы, либо, наоборот, смещать их в сторону, что позволяет в ряде случаев выполнять органосохранные операции. Липосаркомы чаще развиваются без болевого синдрома, их труднее диагностировать с помощью ультразвукового исследования. Лейомиосаркомы могут возникать из мелких, либо крупных вен (нижней полой вены), обладают большим потенциалом злокачественности и склонностью к гематогенному метастазированию. Злокачественная опухоль оболочек периферических нервов чаще всего локализуются паравертебрально, либо вдоль крупных нервных стволов, их рост (в случае вовлечения нервов) может сопровождаться болевым синдромом. При тазовой локализации необходимо провести диагностический поиск с целью исключения органной принадлежности опухоли (образования матки, яичников, прямой кишки, предстательной железы, мочевого пузыря).
Таким образом, получение максимальной информации до операции не только о формальных размерах опухоли, но и о ее биологической природе является приоритетом в лечении ЗНС.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
1. данные анамнеза;
2. данные физикального обследования;
3. данные лучевых методов обследования (КТ, МРТ);
4. данные прижизненного патологоанатомического исследования биопсийного/операционного материала и/или иммуногистохимического исследования.
2.1 Жалобы и анамнез
- Рекомендуется сбор жалоб и анамнеза у пациента с подозрением на ЗНС с целью выявления симптомов заболевания [6 - 13].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.2 Физикальное обследование
- Рекомендуется тщательный осмотр пациента при первом обращении с симптомами заболевания. В большинстве случаев ЗНС на ранних стадиях не имеют специфических симптомов и достигают больших размеров, что позволяет в некоторых случаях пальпировать образование [6 - 13].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.3 Лабораторные диагностические исследования
- Всем пациентам с подозрением на ЗНС рекомендуется стандартное обследование, включающее в себя общий (клинический) анализ мочи, общий (клинический) анализ крови, анализ крови биохимический общетерапевтический, коагулограмма (ориентировочное исследование системы гемостаза). Поскольку не существует патогномоничных лабораторных признаков ЗНС, дальнейшее обследование зависит от дифференциально-диагностического ряда, выстраиваемого клиницистом. [151, 153]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: в случае проведения дифференциального диагноза с метастазами герминогенных опухолей или лимфомой с поражением забрюшинных ЛУ целесообразно провести определение активности лактатдегидрогеназы в крови, исследование уровня альфа-фетопротеина (АФП) в сыворотке крови и исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови. Значительное повышение ЛДГ позволяет заподозрить лимфопролиферативное заболевание (в случае подозрения на увеличенные ЛУ), а повышение уровней АФП и ХГ - герминогенные опухоли с поражением забрюшинных ЛУ, особенно у пациентов молодого возраста. Повышение уровней катехоламинов крови или мочи может свидетельствовать об опухолях из хромаффинной ткани (вненадпочечниковая феохромоцитома) [7, 9, 12, 14 - 18, 31, 34, 35, 38, 103, 112].
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам при подозрении на ЗНС выполнение компьютерной томографии (КТ) органов грудной клетки, брюшной полости и малого таза [31] с внутривенным и пероральным контрастированием для первичной диагностики [9, 14, 18, 19 - 21, 31, 34, 85, 103, 112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется всем пациентам выполнение сцинтиграфии почек и мочевыделительной системы при высоком риске развития почечной недостаточности, особенно в тех случаях, когда планируется нефрэктомия на стороне поражения, с целью оценки функции контралатеральной почки [23, 139 152].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: следует заранее обсудить с профильными специалистами возможность проведения сеансов высокопоточного интерметирующего гемодиализа либо в учреждении, где проводится оперативное вмешательство, либо по месту жительства пациента).
- Рекомендуется выполнение магнитно-резонансной томографии (МРТ) органов малого таза при локализации опухоли в малом тазу или проникновении в спинномозговой канал [14, 19 - 21, 31, 34, 103, 112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Не рекомендуется рутинное выполнение ПЭТ/КТ, КТ или МРТ головного мозга, сцинтиграфия костей всего тела [14, 31].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется на первом этапе диагностики и лечения пациента с подозрением на ЗНС выполнение пункционной чрескожной биопсии (core-биопсия) опухоли; на основании морфологического заключения определяется дальнейшая тактика лечения [6 - 14, 31, 103, 112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: биопсия может выполняться под ультразвуковым контролем, либо под контролем КТ или ЭГДС + эндоУЗИ. Выполнение чрескожной биопсии под УЗИ/КТ-навигацией следует осуществлять с помощью иглы размером 14 - 18G, брать не менее 4 фрагментов (столбиков) материала; необходимо выполнять пункцию наиболее  участка. В случае неинформативности полученного материала, необходимо выполнение повторной биопсии [31].
участка. В случае неинформативности полученного материала, необходимо выполнение повторной биопсии [31].
- Не рекомендуется выполнение лапаротомии и открытой или лапароскопической биопсии опухоли [31].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: выполнение открытой или лапароскопической биопсии может привести к диссеминации опухолевого процесса. Возможно выполнение лапаротомии/лапароскопии и интраоперационной core-биопсии в случае технической невозможности пункции под контролем УЗИ [31].
2.5 Иные диагностические исследования
- Рекомендуется патолого-анатомическое исследование биопсийного (операционного) препарата с указанием степени злокачественности (G), а также степени патоморфоза (в случае если проводилась предоперационная лучевая или химиотерапия) с целью определения дальнейшей тактики лечения [14, 31].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется проводить дифференциальную диагностику с первичными органными опухолями забрюшинной и тазовой локализации, метастазами опухолей в забрюшинных ЛУ [6 - 13, 25 - 28, 31, 112].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: наиболее важно исключить лимфопролиферативное поражение забрюшинных ЛУ, либо метастазирование герминогенных опухолей в забрюшинных ЛУ, а также метастазирование иных эпителиальных опухолей в забрюшинных ЛУ.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
ЗНС являются гистологически гетерогенным и редким видом злокачественных опухолей, в связи с чем каждая клиническая ситуация должна быть рассмотрена на мультидисциплинарном консилиуме с участием специалистов высокопрофильных медицинских учреждений, аккумулирующих пациентов с ЗНС.
- Пациентам с ЗНС рекомендуется проведение мультидисциплинарного консилиума в составе врача-хирурга, врача-онколога, врача-радиотерапевта, врача-рентгенолога, врача-патологоанатома для выработки плана лечения [10, 14, 19, 31, 112, 124].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.1. Хирургическое лечение пациентов с забрюшинными неорганными саркомами
Хирургическое удаление опухоли является основным методом, позволяющим достичь излечения. Целью хирургического лечения является полное ("en-block") удаление опухоли - R0/R1-операция [14, 31, 103, 112]. Для выполнения R0-операции оправдано выполнение комбинированных вмешательств. Признаком нерезектабельности ЗНС является, как правило, муфтообразное вовлечение брыжеечных сосудов (артерии и/или вены). В то же время тесное прилежание к сосуду не всегда свидетельствует об инвазии опухоли.
Бессимптомное течение ранних этапов опухолевого процесса, а также анатомическая сложность области обусловливают частое местное рецидивирование. Локорегионарный рецидив следует оперировать по принципам удаления первичной опухоли. Мультифокальный рецидив (особенно с распространением в другие анатомические зоны) свидетельствует, как правило, о прогрессировании, при котором мультивисцеральные резекции не повышают радикальность операции [1, 6, 7, 9, 14, 16 - 18, 29 - 31, 34].
- Лечение больных ЗНС рекомендуется проводить в высокоспециализированных федеральных онкологических центрах (не менее 13 пациентов в год), что обеспечивает оптимальные показатели выживаемости [14, 31, 99, 104, 112, 124].
Комментарий: целесообразно выполнение компьютерной томографии органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием через 1 месяц после хирургического лечения с целью объективизации результатов лечения и последующего динамического наблюдения.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам лейомиосаркомой НПВ проводить операцию в объеме удаления опухоли в пределах здоровых тканей и обеспечения адекватного кровотока по нижней полой вене и ее висцеральным притокам (почечным и печеночным венам). При необходимости рекомендуется применять элементы сосудистой пластики, включая протезирование сосуда [15].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- В случае выявления нерезектабельной забрюшинной неорганной саркомы, по данным предоперационного обследования или интраоперационной ревизии, рекомендуется консультация в высокоспециализированном онкологическом центре [113].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется рассмотреть хирургическое лечение олигометастазов забрюшинных липо-, лейомиосарком [14, 31, 122 - 124].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
Комментарий: в случае выявления отдаленных метастазов (1 - 4 метастаза) в пределах одного органа рекомендуется рассмотреть на консилиуме вопрос о хирургическом их удалении [31, 34, 98].
При определении тактики лечения следует учитывать следующие благоприятные прогностические факторы: метахронное появление метастазов, поражение метастазами только одного органа, безрецидивный период более 12 мес. отсутствие локального рецидива, если ранее было выполнено радикальное хирургическое вмешательство по поводу первичной опухоли; хороший функциональный статус пациента, отсутствие прогрессирования в случае проведения системной ХТ в течение 6 и более мес. у больных с олигометастазами забрюшинных липо- и лейомиосарком начиная с момента начала курса ХТ [31, 121 - 145].
3.2. Химиотерапия в лечении пациентов с операбельными забрюшинными неорганными саркомами
Резектабельные ЗНС
- Не рекомендуется проведение предоперационной или послеоперационной химиотерапии у больных первичными или рецидивными забрюшинными липосаркомами, которые подлежат или которым выполнена операция в объеме R0/R1-удаление опухоли [14, 31, 103, 112].
Комментарий: отдельных проспективных рандомизированных исследований, касающихся оценки роли ХТ у пациентов с резектабельными ЗНС, к настоящему времени нет. Представлены данные работ, оценивающих эффективность режимов лечения при саркомах мягких тканей (СМТ) и их подгрупповых анализов. Обсуждение алгоритма выбора тактики лечения в ходе мультидисциплинарного консилиума с участием врача-хирурга, врача-радиотерапевта и химиотерапевта является предпочтительным. Возможно рассмотрение вопроса о проведении НАПХТ при миксоидной липосаркоме, плеоморфной липосаркоме и синовиальной саркоме.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Лекарственная терапия нерезектабельных и диссеминированных ЗНС
- Всем пациентам ЗНС, получающим терапию, рекомендуется каждые 2 - 3 курса проводить контрольные исследования с оценкой эффекта по критериям RECIST 1.1 (Приложение Г2). Критерии оценки ответа солидных опухолей на лечение RECIST 1.1) [19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется проведение системной ХТ при нерезектабельных и диссеминированных ЗНС [19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Алгоритм выбора режима лекарственной терапии у пациентов с местно-распространенными и диссеминированными ЗНС
Лекарственная терапия 1 линии
Немногочисленные работы оценивают результаты системной лекарственной терапии у пациентов с ЗНС. Представленные данные экстраполированы из исследований, изучающих эффективность ХТ при СМТ.
Принципы системной лекарственной терапии 1 линии
- В 1 линии лечения пациентов с ЗНС G2 - G3 рекомендуется назначение режимов на основе доксорубицина** [38, 39].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
При выборе режима ХТ необходимо учитывать общее состояние пациента, токсический профиль режима, количество и тяжесть сопутствующих заболеваний.
1. У пациентов с ECOG 0 - 1 и при чувствительных к химиотерапии подтипах ЗНС рекомендуется назначение доксорубицина** в комбинации с ифосфамидом** (схемы AI или HD AI, режим представлен в таблице N 8) [44, 45].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
2. Режим HD AI (режим представлен в таблице N 8) рекомендуется пациентам в общем удовлетворительном состоянии (ECOG 0), без клинически значимых сопутствующих заболеваний, без нарушения функции внутренних органов; обязательным условием является возможность еженедельного мониторинга побочных эффектов и своевременное назначение сопроводительной терапии [44].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: в исследование III фазы по сравнению доксорубицина** в дозе 75 мг/м2 и комбинации доксорубицина** 75 мг/м с ифосфамидом** 10 г/м2 были включены 228 пациентов с местно-распространенными и диссеминированными СМТ. Медиана ВБП была выше в группе комбинации (7,4 и 4,6 мес) (ОШ 0,74; ДИ 95% 0,60 - 0,90; p = 0,003), непосредственная эффективность также в пользу комбинации (60 и 31%); ОВ, хотя и не достигла статистически значимого преимущества, была выше в группе HD AI (14,3 и 12,8 мес) (ОШ 0,83; ДИ 95% 0,67 - 1,03; p = 0,076) [7, 44, 45].
3. Рекомендуется, в качестве одной из опций терапии, рассмотреть назначение режима GemTax (представлен в таблице N 8) при лейомиосаркомах G2 - 3 в 1 линии лечения [42, 47].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
4. Рекомендуется, в качестве одной из опций терапии, рассмотреть комбинацию доксорубицина** с #дакарбазином** (схема ADIC, представлена в таблице N 8) в 1 линии лечения лейомиосарком G2 - 3 при наличии противопоказаний к применению режима AI или GemTax [41].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: в исследовании 18 EORTC-STBSG изучалась эффективность режима ADIC в сравнении с монотерапией доксорубицином** и доксорубицином** (A) в комбинации с ифосфамидом** (AI) в 1 линии терапии при диссеминированной лейомиосаркоме. В лечебных группах медианы ВБП достигли 9,2, 4,8 и 8,2 мес (p = 0,0723) соответственно, при ЧОО в 30,9, 19,5 и 25,6%. Медиана ОВ в когорте пациентов, получавших ХТ по схеме ADIC, достигла 35,4 мес против 29,3 при режиме AI и 21,4 мес при назначении доксорубицина** в монорежиме [125]. В небольшом исследовании было показано, что назначения режима GemTax в 1 линии терапии при диссеминированных лейомиосаркомах позволяет достигнуть ОО у 53% пациентов [126].
5. Рекомендуется использовать монохимиотерапию доксорубицином** при наличии противопоказаний для применения комбинированного режима [61, 62].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
6. Пазопаниб** рекомендуется в 1 линии лечения при химиорезистентных гистотипах (светлоклеточная СМТ, СФО), режим представлен в таблице N 8 [48].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
7. Рекомендуется использование #эверолимуса** 10 мг в день в лечении неоперабельных форм злокачественных ПЭКом (режим представлен в таблице N 8) [64]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: исследования показали, что mTOR-ингибиторы (L01EG: Киназы ингибиторы мишени рапамицина у млекопитающих (mTOR)) нормализуют клеточную пролиферацию и ангиогенез. Ретроспективные исследования применения ингибиторов mTOR (L01EG: Киназы ингибиторы мишени рапамицина у млекопитающих (mTOR)) показали эффект лечения в виде стабилизации. У ряда пациентов достигнут частичный ответ (режим представлен в таблице N 8) [59, 64].
8. При ECOG 3, наличии тяжелых сопутствующих заболеваний рекомендуется симптоматическая терапия. Возможно, рассмотреть на консилиуме вопрос о проведении системного лечения у пациентов с высокочувствительными к ХТ ЗНС (синовиальная саркома, саркома Юинга, миксоидная липосаркома) [19, 98].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
9. #Паклитаксел** рекомендован пациентам с неоперабельными ангиосаркомами в 1 линии терапии (режим представлен в таблице N 8) [57].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Лекарственная терапия во 2 и последующих линиях лечения
1. Рекомендуется проведение ХТ 2 линии пациентам со статусом ECOG 0 - 2. При отсутствии противопоказаний возможно применение комбинированных режимов [55, 63, 100, 101, 51, 52, 111].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: решение о том, какой режим предпочесть при метастатической ЗНС, зависит в первую очередь от состояния пациента и гистологического подтипа опухоли [98].
2. Ифосфамид** в монорежиме рекомендуется для дедифференцированной липосаркомы, синовиальной саркомы и злокачественной опухоли из оболочек периферических нервов (режим представлен в таблице N 8) [36, 39, 90, 98, 154].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3. У пациентов с синовиальной саркомой и ECOG 0 рекомендуется рассмотреть вопрос о назначении HD I (режим представлен в таблице N 8). Обязательным условием является возможность еженедельного мониторинга побочных эффектов и своевременное назначение сопроводительной терапии [39, 90, 117].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
4. Трабектедин во 2 и последующих линиях терапии может быть рекомендован для лечения лейомиосарком (режим представлен в таблице N 8) [51, 52, 111].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: в исследовании II фазы изучался трабектедин в дозе 1,5 мг/м2 в качестве 24-часовой инфузии у пациентов с нерезектабельной диссеминированной СМТ после прогрессирования на фоне ифосфамида** и доксорубицина**. При медиане наблюдения 34 мес ЧОО достигла 8,1% (частичный ответ был зарегистрирован у пациентов с лейомиосаркомой (56%), синовиальной саркомой (61%), липосаркомой (40%) и злокачественной фиброзной гистиоцитомой ЗФГ (83%)).
В исследование II фазы были включены только пациенты с липо- и лейомиосаркомами. Рандомизация проводилась на две группы с разными режимами введения трабектедина - в 1-й группе применялась 24-часовая непрерывная инфузия в дозе 1,5 мг/м2 1 раз в 3 нед, во 2-й использовался еженедельный режим 3-часовой инфузии в дозе 0,58 мг/м2 3 нед подряд с 2-недельным интервалом. Медиана ВБП была статистически значимо выше в группе суточной инфузии 3,7 мес против 2,3 (p = 0,0302, ОШ 0,0734; 95% ДИ 0,554 - 0,970, p = 0,0028). Однолетняя выживаемость достигла 60% при 24-часовом и 50% - при 3-часовом введении (p = 0,09), но значимых различий в медианах ОВ достигнуто не было - 13,9 и 11,8 мес (ОШ 0,843; 95% ДИ 0,635 - 1,090, p = 0,192) [51, 52].
5. Эрибулин** рекомендован пациентам с липосаркомами во 2 и последующих линиях терапии (режим представлен в таблице N 8) [63, 99, 100].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: в рандомизированное исследование III фазы были включены пациенты с нерезектабельной или метастатической липо- или лейомиосаркомой, получившие как минимум две линии терапии, одна из которых была на основе антрациклинов (L01DB: Антрациклины и родственные соединения). В первой группе пациентов вводился эрибулин** (1,4 мг/м2 в 1 и 8 дни) каждые 3 нед, во второй - #дакарбазин** (850 - 1200 мг/м2 в 1 день) каждые 3 нед. МОВ в общей группе с эрибулином** достигла 13,5 мес. с #дакарбазином** - 11,3 мес (ОШ 0,75; 95% ДИ: 0,61 - 0,94; p = 0,011). При анализе показано, что у пациентов с липосаркомой терапия эрибулином** позволяет достигнуть МОВ в 15,6 мес., назначение #дакарбазина** - 8,4 мес. (ОШ 0,51; 95% ДИ 0,35 - 0,75). Аналогичное преимущество выявлено в отношении медианы ВБП (2,9 и 1,7 мес.) (ОШ 0,52; 95% ДИ: 0,35 - 0,78). При подгрупповом анализе у пациентов с лейомиосаркомой разницы в медианах ОВ и ВБП выявлено не было [63].
6. Рекомендуется Пазопаниб** [Возможно назначение пациентам с G1 при химиорезистентных гистотипах (альвеолярная и светлоклеточная СМТ, СФО/гемангиоэндотелиома)] пациентам ЗНС, за исключением больных с липосаркомами, с контролем эффективности после 2 мес. приема (режим представлен в таблице N 8) [48].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: в рандомизированном исследовании III фазы PALETTE пациенты с диссеминированной СМТ после прогрессирования на стандартном лечении получали пазопаниб** в дозе 800 мг/сут ежедневно либо плацебо. Было выявлено достоверное увеличение медианы ВБП в группе пазопаниба** по сравнению с группой плацебо - 4,6 и 1,6 мес соответственно (ОШ 0,31; 95% ДИ 0,24 - 0,40, p < 0,0001). Тем не менее статистически значимого преимущества в МОВ достигнуто не было - 12,5 и 10,7 мес соответственно (ОШ 0,86; 95% ДИ 0,67 - 1,11, p = 0,25). Факторами неблагоприятного прогноза в отношении ВБП оказались ECOG 1 (p = 0,03), 2 и более предшествующие линии ПХТ (p = 0,04), Grade 3 (p = 0,004) [48].
7. Рекомендуется пациентам с ECOG 0 - 1 при лейомиосаркоме и дедифференцированной плеоморфной саркоме назначение #гемцитабина** в комбинации с #доцетакселом** или #дакарбазином** (режим представлен в таблице N 8) [53, 54].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарий: в рандомизированном исследовании II фазы по сравнению комбинации GemTax и монотерапии #гемцитабином** у пациентов с диссеминированной СМТ (n = 122) было продемонстрировано преимущество комбинированного режима: медианы ВБП и ОВ составили 3,0 и 11,5 мес в группе монотерапии, 6,2 и 17,9 мес. - в группе GemTax. Необходимо обратить внимание на высокую гематологическую токсичность: анемия 3-й степени наблюдалась у 13% пациентов в группе #гемцитабина** и у 7% пациентов в группе GemTax, тромбоцитопения 3 - 4-й степени - у 35 и 40%, фебрильная нейтропения - в 7 и 5% случаев соответственно (несмотря на профилактическое введение рчГ-КСФ). Подгрупповой анализ выявил максимальную активность комбинации при лейомиосаркоме, дедифференцированной плеоморфной саркоме [53, 55].
8. Пациентам со статусом ECOG 2 рекомендуется монохимиотерапия #дакарбазином** (режим представлен в таблице N 8) [53, 55].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
9. #Палбоциклиб** [Возможно назначение пациентам с липосаркомами G1] рекомендуется пациентам с липосаркомами в 3 и последующих линиях терапии (режим представлен в таблице N 8) [56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: #палбоциклиб** является обратимым пероральным ингибитором циклинзависимых киназ 4 и 6 (CDK4/6) (L01EF: Ингибиторы циклинзависимой киназы (CDK)). В исследовании II фазы было показано, что назначение #палбоциклиба** пациентам с высокодифференцированными и дедифференцироваными липосаркомами позволяет достигнуть 12-недельной ВБП в 66% при медиане ВБП 18 нед [56].
10. #Абемациклиб** рекомендуется пациентам с дедифференцироваными липосаркомами в 3 и последующих линиях терапии (режим представлен в таблице N 8) [128, 150].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарий: #абемациклиб** является обратимым пероральным ингибитором циклинзависимых киназ 4 и 6 (CDK4/6) (L01EF: Ингибиторы циклинзависимой киназы (CDK)). В исследовании II фазы было показано, что назначение #абемациклиба** пациентам с высокодифференцированными и дедифференцироваными липосаркомами позволяет достигнуть 12-недельной ВБП в 76% при медиане ВБП 30,4 нед [128].
11. #Гемцитабин** рекомендован в качестве 3 и последующих линий лечения ангиосарком (режим представлен в таблице N 8) [58].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
12. #Пембролизумаб** может быть рекомендован в качестве одной из линий терапии при TMB-H >= 10 при недифференцированной плеоморфной саркоме (режим представлен в таблице N 8) [130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
13. #Кризотиниб** может быть рекомендован в качестве 1 линии терапии при воспалительной миофибробластической опухоли с транслокацией ALK [133].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Режимы химиотерапии сарком мягких тканей
Таблица N 8. Рекомендуемые режимы химиотерапии при лечении пациентов с саркомами мягких тканей
Комбинированные режимы лечения
Режим
Препараты
Режим введения
Дни
Длительность цикла
Ссылка
GemTax
#Гемцитабин**
900 мг/м2 в/в кап. 90 мин (675 мг/м2, если проводилась лучевая терапия на кости таза)
1, 8
21 день
[41 - 43, 53, 109]
#Доцетаксел**
100 мг/м2 в/в кап. 60 мин (75 мг/м2, если проводилась лучевая терапия на кости таза), после введения #гемцитабина**
8
Филграстим**
или
5 мкг/кг п/к 1 раз в день
9 - 15
Пэгфилграстим**
в соответствии с инструкцией
9
ADIC
Доксорубицин**
60 мг/м2 суммарно в/в непрерывная инфузия 72 ч
1 - 4
21 день
[41]
#Дакарбазин**
Суммарно 750 мг/м2 в/в непрерывная инфузия 72 ч;
раствор #дакарбазина** совместим с раствором доксорубицина**
1 - 4
#Гемцитабин** + #дакарбазин**
#Гемцитабин**
1800 мг/м2 (фиксированная скорость инфузии 10 мг/м2/мин)
1
14 день
[54]
#Дакарбазин**
500 мг/м2 в/в кап
1
AI
Доксорубицин**
60 мг/м2 в/в
1
21 день
[89]
Ифосфамид**
1,5 г/м2/сут (общая доза за цикл 6 г/м2)
1 - 4
Месна**
900 мг/м2/сут
Разовая доза составляет 20% от разовой дозы ифосфамида**. Первое введение проводят одновременно с первым введением ифосфамида**, вторую и третью инъекции - через 4 и 8 ч после введения ифосфамида**
1 - 4
Филграстим**
5 мкг/кг п/к 1 раз в день
5 - 15
HD AI
Доксорубицин**
75 мг/м2 в/в кап
или
25 мг/м2/день в/в 5 - 20 мин
1
или
1 - 3
21 день
[44]
Ифосфамид**
10 г/м2 суммарно в/в кап (по 2,5 г/м2 в день)
1 - 4
Месна**
2,5 г/м2/сут (СД = 10 г/м2)
Разовая доза составляет 100 - 120% от разовой дозы ифосфамида**. Первое введение проводят одновременно с первым введением ифосфамида**, вторую и третью инъекции - через 4 и 8 ч после введения ифосфамида**
1 - 4
Пэгфилграстим** или
в соответствии с инструкцией
5
филграстим**
5 мкг/кг п/к 1 раз в день
5 - 16
Монотерапия
Режим
Препараты
Режим введения
Дни
Длительность цикла
Ссылка
Доксорубицин**
Доксорубицин**
60 мг/м2, в/в 5 - 20 мин
1
21 день
[61]
75 мг/м2, в/в 5 - 20 мин
1
21 день
[61, 62]
25 мг/м2 в/в/сут 5 - 20 мин, или в виде непрерывной инфузии
1 - 3
21 день
[62]
Ифосфамид**
Ифосфамид**
9000 мг/м2 (3000 мг/м2 в сут - 4-часовая инфузия)
1 - 3
21 день
[38, 154]
Месна**
600 мг2/сут перед введением ифосфамида**, затем 1500 мг/м2/сут параллельно с инфузией ифосфамида 4 ч и 1200 мг/м2/сут через 4 и 8 ч после завершения введения ифосфамида**
1 - 3
HD I
Ифосфамид**
14 г/м2 суммарно в/в, непрерывная инфузия
1 - 7
21 день
[39, 90]
Месна**
14,0 - 16,8 г/м2 в/в непрерывная инфузия
При непрерывной инфузии месну** следует вводить в дозе 20% от дозы цитостатика в начале инфузии, затем - в дозе 100% от дозы цитостатика в период инфузии и по окончании введения цитостатика введение месны** продолжают еще 6 - 12 ч в той же дозе
1 - 7
Пэгфилграстим** или
в соответствии с инструкцией
8
Филграстим**
5 мкг/кг п/к 1 раз в день
8 - 18
Трабектедин
Трабектедин
1,5 мг/м2 в/в кап 24 ч
1
21 день
[127, 51, 52]
#Дакарбазин**
#Дакарбазин**
1200 мг/м2 в/в кап 20 мин
1
21 день
[52, 63]
Эрибулин**
Эрибулин**
1,4 мг/м2 в/в 2 - 5 мин
1, 8
21 день
[63]
Пазопаниб**
Пазопаниб**
800 мг 1 раз в день per os
ежедневно
ежедневно
[48]
#Палбоциклиб**
#Палбоциклиб**
125 мг per os
1 - 21
28 дней
[56]
#Паклитаксел**
#Паклитаксел**
80 мг/м2 в/в кап. 60 мин
1, 8, 15
28 дней
[57]
#Гемцитабин**
#Гемцитабин**
1000 мг/м2 в/в кап. 30 мин
1, 8, 15
28 дней
[58]
#Эверолимус**
#Эверолимус**
10 мг per os
1 р/день
ежедневно
[59, 64]
#Абемациклиб**
#Абемациклиб**
200 мг per os
2 р/день
Ежедневно, цикл 4 недели
[128, 150]
#Пембролизумаб**
#Пембролизумаб**
200 мг в/в кап 30 мин
1
21 день
[130]
#Кризотиниб**
#Кризотиниб**
250 мг per os
2 р/день
ежедневно
[133]
Таблица N 9. Чувствительность различных подтипов сарком мягких тканей к лекарственной терапии
Гистологический подтип
Химиотерапия
Таргетная терапия
Ссылка
Лейомиосаркома
#Гемцитабин** + #доцетаксел**, трабектедин, #дакарбазин**
Пазопаниб**
[43, 48]
Дедифференцированная липосаркома
Ифосфамид**, трабектедин, эрибулин**
#Палбоциклиб**
[45, 48 - 52, 56, 63, 127]
Миксоидная липосаркома
Трабектедин, эрибулин**
-
[49 - 52, 63, 127]
Синовиальная саркома
Ифосфамид**, трабектедин
Пазопаниб**
[38, 45, 48, 52]
Эпителиоидная саркома
#Гемцитабин**
Пазопаниб**
[48]
Ангиосаркома
#Паклитаксел**, #гемцитабин**
Пазопаниб**
[48, 57, 58]
Солитарная фиброзная опухоль
#Дакарбазин**
Пазопаниб**
[48]
Светлоклеточная саркома
-
Пазопаниб**
[48]
Экстраскелетная миксоидная хондросаркома
-
Пазопаниб**
[48]
Опухоли из периваскулярных клеток (ПЭКомы)
-
#Эверолимус**
[59, 64, 100]
Недифференцированная плеоморфная саркома
Ифосфамид**
-
[49]
Воспалительная миофибробластическая опухоль с транслокацией ALK
-
#Кризотиниб**
[133]
3.3. Лучевая терапия пациентов с забрюшинными неорганными саркомами
- Рутинно не рекомендуется неоадъювантная ЛТ при забрюшинных саркомах [31, 103].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: рассмотреть вопрос о проведении неоадъювантной ЛТ больным первичными липосаркомами G1 [31, 103]. Возможно проведение предоперационной ЛТ в СОД 50 Гр, в режиме стандартного фракционирования 1,8 - 2,0 Гр за 1 фракцию (134). Предпочтительно проведение конформной ЛТ по методике IMRT всем пациентам при условии соответствующей технической оснащенности отделения (135).
- Не рекомендуется проведение адъювантной ЛТ (послеоперационной) [31, 103].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5.
- Рекомендуется: в случае возникновения местного рецидива липосарком, вне зависимости от степени злокачественности, необходимо рассмотреть проведение предоперационной ЛТ [31, 103].
Комментарий: при наличии мультифокального рецидива в нескольких несмежных анатомических областях ЛТ не проводится.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.4. Обезболивание
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов ЗНС с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях "Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи" [155]. Интенсивность боли оценивается по различным шкалам, наиболее часто используется визуально-аналоговая шкала (ВАШ), представляющая собой отрезок 10 см без градуировки и отражающая силу боли в миллиметрах от 0 до 100 мм (см. Приложение Г3, Визуальная аналоговая шкала оценки болевого синдрома). [140]
3.5. Сопутствующая терапия у пациентов с ЗНС
Принципы лечения и профилактики тошноты и рвоты у пациентов ЗНС соответствуют принципам, изложенным в методических рекомендациях "Профилактика и лечение тошноты и рвоты" [141]
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов ЗНС соответствуют принципам, изложенным в методических рекомендациях "Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов" [142]
Принципы профилактики и лечения гепатотоксичности у пациентов ЗНС соответствуют принципам, изложенным в методических рекомендациях "Коррекция гепатотоксичности" [143]
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях "Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии" [144]
Принципы нутритивной поддержки у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях "Практические рекомендации по нутритивной поддержке онкологических больных" [145]
Принципы профилактики и лечения нефротоксичности у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях "Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов" [146]
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях "Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных" [147]
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях "Рекомендации по лечению последствий экстравазации противоопухолевых препаратов" [148]
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях "Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями" [149]
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с ЗНС. Данные рекомендации сделаны на основании того, что во многих исследованиях, в т.ч. метаанализах (Steffens D. et al., 2018 и др.) и систематических обзорах (Stout N.L. et al., 2017 и. Segal R. et al., 2017 и др.) доказано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими ЗНО.
4.1. Предреабилитация
- Рекомендуется проведение предреабилитации всем пациентам с ЗНС в целях ускорения функционального восстановления, сокращения сроков пребывания в стационаре после операции, снижения частоты развития осложнений и летальных исходов на фоне лечения ЗНС. Предреабилитация включает физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование пациентов [72].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: рекомендуется советовать пациенту увеличить физическую активность за 2 нед до операции в целях снижения сроков пребывания в стационаре и риска развития послеоперационных осложнений, а также повышения качества жизни в послеоперационном периоде [73].
4.2. Реабилитация при хирургическом лечении
- Рекомендуется мультидисциплинарный подход при проведении реабилитации пациентов с ЗНС включением двигательной реабилитации, психологической поддержки, работы со специалистами по трудовой терапии (инструкторами по трудотерапии) [74].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется при возникновении лимфедемы проводить полную противоотечную терапию, включающую мануальный лимфодренаж (медицинский массаж нижней или верхней конечности), ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [75].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется выполнение и постепенное расширение комплекса ЛФК с включением аэробной нагрузки, что улучшает результаты комбинированного лечения ЗНО и качество жизни, особенно в случаях нарушения функции конечностей [76].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3).
- Рекомендован медицинский массаж для улучшения качества жизни, уменьшения болевого синдрома, слабости, тревоги [77].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
4.3. Реабилитация при химиотерапии
- Рекомендуется раннее начало физических нагрузок на фоне ХТ, что помогает профилактике мышечной слабости, гипотрофии, снижения толерантности к физической нагрузке [78].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Данная рекомендация сделана на основании результатов проведенных систематических обзоров (Stout N.L. et al., 2017 и Segal R. et al., 2017 и др.) влияния физических упражнений на пациентов с другими ЗНО - рекомендуется применение аэробной нагрузки на фоне ХТ, что повышает уровень гемоглобина, эритроцитов и снижает длительность лейко- и тромбоцитопении, а также повышает вероятность завершить запланированный курс ХТ [79, 80].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендуется проведение ЛФК на фоне ХТ, что позволяет уменьшать слабость и депрессию. Сочетание ЛФК с психологической поддержкой в лечении слабости и депрессии на фоне ХТ более эффективно, чем только медикаментозная коррекция [81].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
4.4. Реабилитация при лучевой терапии
- Рекомендуется выполнение комплекса ЛФК (аэробной нагрузки в сочетании с силовой) на фоне ЛТ, что позволяет проводить профилактику слабости и улучшает качество жизни пациентов на фоне ЛТ [82].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
4.5. Принципы психологической реабилитации пациентов с ЗНС
- Рекомендуется добиваться комбинированного эффекта совладающего поведения и воспринимаемой социальной поддержки, что приводит к меньшему количеству навязчивых и избегающих мыслей до лечения и обеспечивает лучшую психологическую адаптацию пациента через 1 мес после лечения [83].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Рекомендуются пациентам психообразовательные мероприятия и психологическая поддержка (самодиагностика патологических психических реакций; способы совладания со стрессом; отслеживание взаимовлияния психических реакций и физического состояния), что может рассматриваться как основной механизм трансформации стрессовых событий в личный опыт, способствующий социальной и психической адаптации в условиях заболевания и лечения [84].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется выполнение КТ грудной клетки, брюшной полости и малого таза с внутривенным и пероральным контрастированием в течение 2 нед после операции, затем через 3 мес, далее каждые 6 мес; через 5 лет - каждый год [19, 124].
Комментарий: выполнение КТ в течение 2 нед после операции рекомендуется для выявления остаточной опухоли и с целью оценки динамики подозрительных опухолевых узлов.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на ЗНС у пациента или ее выявлении врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи - врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на ЗНС или ее выявлении в ходе оказания скорой медицинской помощи пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "онкология" определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
- завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или данным предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Показания для направления пациента в другую медицинскую организацию:
- исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациентам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи (например, отсутствует возможность проведения процедуры биопсии сторожевого лимфатического узла), рекомендуется воспользоваться системой маршрутизации в другие медицинские организации, в том числе за пределы субъекта федерации, в том числе в федеральные центры, имеющие соответствующую оснащенность и кадры;
- клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне применения рекомендуемых видов лечения и т.д.), рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения;
- выявление или обострение сопутствующей патологии, не относящейся к профилю онкологического учреждения, которая препятствует проведению данного этапа лечения (например, острый инфаркт миокарда, острое нарушение мозгового кровообращения и др.) требует маршрутизации в профильные медицинские организации.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Факторами прогноза при ЗНС являются: гистологический тип опухоли, степень злокачественности, стадия, радикальность операции.
Критерии оценки качества медицинской помощи
Критерии оценки качества специализированной медицинской помощи взрослым пациентам при ЗНС указаны в таблице N 10.
Таблица N 10. Критерии оценки качества медицинской помощи
N
Критерии качества
Выполнение
1.
Выполнена компьютерная томография грудной клетки, брюшной полости и малого таза с внутривенным и пероральным контрастированием
да/нет
3.
Выполнена сцинтиграфия почек при высоком риске развития почечной недостаточности, особенно в тех случаях, когда планируется нефрэктомия на стороне поражения, с целью оценки функции контралатеральной почки
да/нет
4.
Выполнена предоперационная чрескожная core-биопсия у пациента с местно-распространенным процессом с указанием гистологического типа и степени злокачественности (G)
да/нет
5.
Выполнено радикальное хирургическое вмешательство пациенту с операбельным локализованным или местно-распространенным процессом, способному перенести операцию
да/нет
6.
Проведен мультидисциплинарный консилиум в составе врача-хирурга, врача-онколога, врача-радиотерапевта, врача-рентгенолога, врача-патологоанатома перед операцией
да/нет
7.
Выполнено патолого-анатомическое исследование биопсийного (операционного) препарата с указанием параметров в соответствии с рекомендациями (у пациентов, получивших хирургическое лечение), указанием степени злокачественности (G), степени патоморфоза (в случае если проводилась предоперационная лучевая или химиотерапия)
да/нет
8.
Назначена лекарственная терапия при нерезектабельной/метастатической опухоли
да/нет
Список литературы
1. Bautista N., Su W., O'Connell T.X. Retroperitoneal soft-tissue sarcomas: prognosis and treatment of primary and recurrent disease. Am J Surg. 2000; 66: 832 - 6.
2. Fletcher C.D.M., Bridge J.A., Hogendoorn P.C.W., Mertens F. (eds.) WHO Classification of Tumours of Soft Tissue and Bone. IARC. Lyon.; 2013.
3. Trojani M., Contesso G., Coindre J.M., et al. Soft-tissue sarcomas of adults; study of pathological prognostic variables and definition of a pathological grading system. Int J Cancer 1984, 33: 37 - 42.
4. Carpentieri D.F., Qualman S.J., Bowen J., Krausz T., et al. Protocol for the examination of specimens from pediatric and adult patients with osseous and extraosseous Ewing sarcoma family of tumors, including peripheral primitive neuroectodermal tumor and Ewing sarcoma. Arch Pathol Lab Med. 2005; 129(7): 866 - 73.
5. Криволапов Ю.А. (ред.). Макроскопическое исследование биопсийного и операционного материала: руководство для патологоанатомов. М.: Практическая Медицина; 2019.
6. Стилиди И.С., Неред С.Н., Болотский В.И., Огородникова Е.В. Результаты радикальных и паллиативных хирургических вмешательств при забрюшинных неорганных липосаркомах. Паллиативная медицина и реабилитация. 2011; 2: 9 - 12.
7. Стилиди И.С., Никулин М.П., Давыдов М.М., и др "Нефросохранные" операции в лечении больных неорганными забрюшинными опухолями. Анналы хирургии. 2014; 3: 47 - 52.
8. Стилиди И.С., Цвелодуб С.Б., Матвеев В.Б., Давыдов М.М., и др. Хирургическое лечение больных с лейомиосаркомой нижней полой вены. Анналы хирургии. 2013; 5: 41 - 8.
9. Клименков А.А., Губина Г.И. Неорганные забрюшинные опухоли: основные принципы диагностики и хирургической тактики. Практ. онкол. 2004; 5(4): 285 - 90.
10. An J.Y., Heo J.S., Noh J.H., et al. Primary malignant retroperitoneal tumors: Analysis of a single institutional experience. EJSO. 2007; 33: 376 - 82.
11. Неред С.Н., Стилиди И.С., Клименков А.А., Болотский В.И., Анурова О.А. Клинико-морфологические особенности и результаты хирургического лечения забрюшинных неорганных липосарком. Вопр. онкол. 2012; 58(1): 94 - 100.
12. Меликов С.А. Современные методы диагностики и лечения нейрогенных опухолей забрюшинного пространства. Рус. Мед. журн. 2012; (2, прил.): 47 - 56.
13. Бугаев В.Е., Никулин М.П., Меликов С.А. Особенности диагностики и хирургического лечения больных забрюшинными шванномами. Совр. онкол. 2017; 28 - 35.
14. Trans-Atlantic RPS Working Group. Management of primary retroperitoneal sarcoma (RPS) in the adult: a consensus approach from the Trans-Atlantic RPS Working Group. Ann Surg Oncol. 2015; 22: 256 - 63.
15. Цвелодуб С.В., Стилиди И.С. Лейомиосаркома нижней полой вены: обзор литературы. Часть I. Анналы хирургии. 2013; 1: 5 - 9.
16. Gronchi A., Strauss D.C., Miceli R., et al. Variability in patterns of recurrence after resection of primary retroperitoneal sarcoma (RPS): a report on 1007 patients from the multi-institutional collaborative RPS Working Group. Ann Surg. 2016; 263: 1002 - 9.
17. Lewis J.J., Leung D., Woodruff J.M., Brennan M.F. Retroperitoneal soft-tissue sarcoma: analysis of 500 patients treated and followed at a single institution. Ann Surg 1998; 228: 355 - 65.
18. Стилиди И.С., Никулин М.П., Губина Г.И., Давыдов М.М., и др. Опыт хирургического лечения больных с неорганными забрюшинными саркомами с инвазией подвздошных артерий. Анналы хирургии. 2012; 6: 31 - 7.
19. Casali P.G., Abecassis N., Bauer S., Biagini R., Bielack S., Bonvalot S., et al. Soft tissue and visceral sarcomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018; 29 (Suppl_4): iv51 - iv67. DOI: 10.1093/annonc/mdy096
20. Вашакмадзе Л.А., Черемисов В.В., Хомяков В.М. Современные аспекты клиники, диагностики и лечения неорганных опухолей забрюшинного пространств. Онкохирургия. 2011; 3(1): 44 - 54.
21. Какиашвили Н.Н. Методы лучевой диагностики в оптимизации диагностической и хирургической тактики при неорганных забрюшинных опухолях: автореф. дис. ... канд. мед. наук. РОНЦ им. Н.Н. Блохина Российской академии медицинских наук. М.; 2008.
22. Hull M.A., Niemierko A., Haynes A.B., et al. Post-operative renal function following nephrectomy as part of en bloc resection of retroperitoneal sarcoma (RPS). J Surg Oncol. 2015; 112: 98 - 102.
23. Кит О.И., Максимова Н.А., Агаркова Е.И., Ильченко М.Г. Применение комплексной ультразвуковой диагностики и динамической реносцинтиграфии у пациентов с опухолевым поражением почки в предоперационном периоде при планировании хирургического лечения. Совр. пробл. науки и образования. 2015; 6: 200.
24. Стилиди И.С., Абгарян М.Г., Калинин А.Е., Бердников С.Н. Хирургическое лечение больных лейомиосаркомой нижней полой вены. Хирургия. Журн. им. Н.И. Пирогова. 2017; 10: 4 - 12.
25. Стилиди И.С., Абгарян М.Г., Никулин М.П., и др. Ангиопластика в хирургическом лечении больных забрюшинными неорганными саркомами. Хирургия. 2017; 5: 14 - 8.
26. Стилиди И.С., Абгарян М.Г., Бохян В.Ю., Никулин М.П., и др. Резекция и протезирование бифуркации аорты по поводу забрюшинной гломусной опухоли. Онкология. Журн. им. П.А. Герцена. 2017; 1; 53 - 6.
27. Давыдов М.М. Стратегия хирургии внеорганных сарком торакоабдоминальной локализации: автореферат дис. ... д-ра мед. наук. М.; 2015.
28. Бугаев В.Е., Никулин М.П., Петросян А.П., и др. Хирургическое лечение пациентов с забрюшинными шванномами. Вестн. РОНЦ. 2018; 29: 9 - 14.
29. Gronchi A., Miceli R., Colombo C., et al. Frontline extended surgery is associated with improved survival in retroperitoneal low-to-intermediate-grade soft tissue sarcomas. Ann Oncol 2012; 23: 1067 - 73.
30. Bonvalot S., Rivoire M., Castaing M., et al. Primary retroperitoneal sarcomas: a multivariate analysis of surgical factors associated with local control. J Clin Oncol. 2009; 27: 31 - 7.
31. Trans-Atlantic RPS Working Group. Management of primary retroperitoneal sarcoma (RPS) in the adult: An Updated consensus approach from the Trans-Atlantic RPS Working Group. Ann Surg Oncol. 2021; 28(12): 7873 - 88. DOI: 10.1245/s10434-021-09654-z. Epub 2021 Apr 14.
32. Von Mehren M., Randall R.L., Benjamin R.S., Boles S., Bui M.M., Ganjoo K.N., et al. Soft Tissue Sarcoma, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2018; 16(5): 536 - 63.
33. Каприн А.Д., Рябов А.Б., Хомяков В.М., и др. Резекция нижней полой вены при местно-распространенных неорганных забрюшинных опухолях. Онкология. Журн. им. П.А. Герцена. 2017; 6(1): 28 - 38.
34. MacNeill A.J., Miceli R., Strauss D.C., et al. Post-relapse outcomes after primary extended resection of retroperitoneal sarcoma: a report from the Trans-Atlantic RPS Working Group. Cancer. 2017; 123: 1971 - 8.
35. Palassini E., Ferrari S., Verderio P., et al. Feasibility of preoperative chemotherapy with or without radiation therapy in localized soft tissue sarcomas of limbs and superficial trunk in the Italian Sarcoma Group/Grupo  de
de  en Sarcomas randomized clinical trial: three versus five cycles of full-dose epirubicin plus ifosfamide. J Clin Oncol. 2015; 33: 3628 - 34.
en Sarcomas randomized clinical trial: three versus five cycles of full-dose epirubicin plus ifosfamide. J Clin Oncol. 2015; 33: 3628 - 34.
36. Gronchi A., Ferrari S., Quagliuolo V., et al. Histotype-tailored neoadjuvant chemotherapy versus standard chemotherapy in patients with high-risk soft-tissue sarcomas (ISG-STS 1001): an international, open-label, randomised, controlled, phase 3, multicentre trial. Lancet Oncol 2017; 18: 812 - 22.
37. Frustaci S., Gherlinzoni F., De Paoli A., et al. Adjuvant chemotherapy for adult soft tissue sarcomas of the extremities and girdles: results of the Italian randomized cooperative trial. J Clin Oncol 2001; 19: 1238 - 47.
38. Lorigan P., Verweij J., Papai Z., Rodenhuis S., Le Cesne A., Leahy M.G., et al. Phase III trial of two investigational schedules of ifosfamide compared with standard-dose doxorubicin in advanced or metastatic soft tissue sarcoma: a European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Study. J Clin Oncol 2007; 25(21): 3144 - 50.
39. Patel S.R., Vadhan-Raj S., Papadopolous N., Plager C., Burgess M.A., Hays C., et al. High-dose ifosfamide in bone and soft tissue sarcomas: results of phase II and pilot studies--dose-response and schedule dependence. J Clin Oncol. 1997; 15(6): 2378 - 84.
40. Nielsen O.S., Dombernowsky P., Mouridsen H., Daugaard S., Van Glabbeke M., Kirkpatrick A., et al. Epirubicin is not Superior to Doxorubicin in the Treatment of Advanced Soft Tissue Sarcomas. The Experience of the EORTC Soft Tissue and Bone Sarcoma Group. Sarcoma. 2000; 4: 1 - 5.
41. Zalupski M., Metch B., Balcerzak S., Fletcher W.S., Chapman R., Bonnet J.D., et al. Phase III Comparison of Doxorubicin and Dacarbazine Given by Bolus Versus Infusionin Patients with Soft-Tissue Sarcomas: A Southwest Oncology Group Study. J Natl Cancer Inst. 1991; 83(13): 926 - 32.
42. Judson I., Verweij J., Gelderblom H., Hartmann J.T.,  P., Blay J.Y., et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomized controlled phase 3 trial. Lancet Oncol 2014; 15: 415 - 23.
P., Blay J.Y., et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomized controlled phase 3 trial. Lancet Oncol 2014; 15: 415 - 23.
43. Hensley M.L., Maki R., Venkatraman E., Geller G., Lovegren M., Aghajanian C., et al. Gemcitabine and docetaxel in patients with unresectable leiomyosarcoma: results of a phase II trial. J Clin Oncol. 20 (12) (2002) 2824 - 31.
44. Judson I., Verweij J., Gelderblom H., Fisher C., Hogendoorn P.C., Dei Tos A.P., et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol 2014; 15: 415 - 23.
45. Worden F.P., Taylor J.M.G., Biermann J.S., Sondak V.K., Leu K.M., Chugh R. Randomized phase II evaluation of 6 g/m2 of ifosfamide plus doxorubicin and granulocyte colony-stimulating factor (G-CSF) compared with 12 g/m2 of ifosfamide plus doxorubicin and G-CSF in the treatment of poor-prognosis soft tissue sarcoma. J Clin Oncol. 2005; 23(1): 105 - 12.
46. Noujaim J., Constantinidou A., Messiou C., Thway K., Miah A., Benson C., et al. Successful Ifosfamide Rechallenge in Soft-Tissue Sarcoma. Am J Clin Oncol. 2015; 00: 00.
47. Seddon B.M., Whelan J., Strauss S.J., et al. GeDDiS: a prospective random controlled phase III trial of gemcitabine and docetaxel compared with doxorubicin as first-line treatment in previously untreated advanced unresectable or metastatic soft tissue sarcomas (EudraCT 2009-014907-29). J Clin Oncol. 2015; 33 (Suppl 15); Abstr 10500.
48. Van der Graaf W.T., Blay J.Y., Chawla S.P., et al. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomized, double-blind, placebo-controlled phase 3 trial. Lancet. 2012; 379: 1879 - 86.
49. Le Cesne A., Antoine E., Spielmann M., et al. High-dose ifosfamide: circumvention of resistance to standard-dose ifosfamide in advanced soft tissue sarcomas. J Clin Oncol. 1995; 13: 1600 - 8.
50. Martin-Liberal J., Alam S., Constantinidou A., et al. Clinical activity and tolerability of a 14-day infusional ifosfamide schedule in soft-tissue sarcoma. Sarcoma 2013; 2013: 868973.
51. Demetri G.D., Chawla S.P., von Mehren M., et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leio-myosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules. J Clin Oncol. 2009; 27: 4188 - 96.
52. Demetri G.D., von Mehren M., Jones R.L., et al. Efficacy and safety of trabectedin or dacarbazine for metastatic liposarcoma or leiomyosarcoma after failure of conventional chemotherapy: results of a phase III randomized multicenter clinical trial. J Clin Oncol. 2016; 34: 786 - 93.
53. Maki R.G., Wathen J.K., Patel S.R., et al. Randomized phase II study of gemcitabine and docetaxel compared with gemcitabine alone in patients with metastatic soft tissue sarcomas: results of sarcoma alliance for research through collaboration study 002 [corrected]. J Clin Oncol. 2007; 25: 2755 - 63.
54.  X.,
X.,  A., Maurel J.,
A., Maurel J., ![]() J.,
J.,  J., Casado A., et al., Spanish Group for Research on Sarcomas. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. J Clin Oncol. 2011; 29: 2528 - 33.
J., Casado A., et al., Spanish Group for Research on Sarcomas. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. J Clin Oncol. 2011; 29: 2528 - 33.
55.  X,
X,  A, Maurel J,
A, Maurel J,  A, Fra J, Cruz J, et al. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. J Clin Oncol. 2011; 29(18): 2528 - 33.
A, Fra J, Cruz J, et al. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. J Clin Oncol. 2011; 29(18): 2528 - 33.
56. Dickson M.A., Schwartz G.K., Keohan M.L., D'Angelo S.P., Gounder M.M., Chi P., et al. Progression-Free Survival Among Patients with Well-Differentiated or Dedifferentiated Liposarcoma Treated with CDK4 Inhibitor Palbociclib: A Phase 2 Clinical Trial. JAMA Oncol. 2016 Jul 1; 2(7): 937 - 40.
57. Penel N., Bui B.N., Bay J.-O., Cupissol D., Ray-Coquard I., Piperno-Neumann S., et al. Phase II trial of weekly paclitaxel for unresectable angiosarcoma: the ANGIOTAX Study. J Clin Oncol. 2008; 26(32): 5269 - 74.
58. Stacchiotti S., Palassini E., Sanfilippo R., Vincenzi B., Arena M.G., Bochicchio A.M., et al. Gemcitabine in advanced angiosarcoma: a retrospective case series analysis from the Italian Rare Cancer Network. Ann Oncol. 2012; 23(2): 501 - 8.
59. Wagner A.J., Malinowska-Kolodziej I., Morgan J.A., et al. Clinical activity of mTOR inhibition with sirolimus in malignant perivascular epithelioid cell tumors: targeting the pathogenic activation of mTORC1 in tumors. J Clin Oncol. 2010; 28(5): 835 - 40.
60. Переводчикова Н.И. (ред.) Руководство по химиотерапии опухолевых заболеваний. М.: Практическая Медицина; 2005.
61. Benjamin R.S., Wiernik P.H., Bachur N.R. Adriamycin: a new effective agent in the therapy of disseminated sarcomas. Med Pediatr Oncol. 1975; 1(1): 63 - 76.
62. Borden E.C., Amato D.A., Rosenbaum C., Enterline H.T., Shiraki M.J., Creech R.H., et al. Randomized comparison of three adriamycin regimens for metastatic soft tissue sarcomas. J Clin Oncol. 1987; 5(6): 840 - 50.
63. Schoffski P., Chawla S., Maki R.G., et al. Eribulin versus dacarbazine in previously treated patients with advanced liposarcoma or leiomyosarcoma: a randomised, open-label, multicentre, phase 3 trial. Lancet. 2016; 387: 1629 - 37.
64. Gennatas C., Michalaki V., Kairi P.V., Kondi-Paphiti A., Voros D. Successful treatment with the mTOR inhibitor everolimus in a patient with Perivascular epithelioid cell tumor World J Surg Oncol. 2012; 10: 181.
65. Treatment Guidelines for Preoperative Radiation Therapy for Retroperitoneal Sarcoma: Preliminary Consensus of an International Expert Panel. Int J Radiation Oncol Biol Phys. 2015; 92(3): 602 - 12.
66. Baldini E.H., Bosch W., Kane J.M. 3rd, et al. Retroperitoneal sarcoma (RPS) high risk gross tumor volume boost (HR GTV boost) contour delineation agreement among NRG sarcoma radiation and surgical oncologists. Ann Surg Oncol. 2015; 22: 2846 - 52.
67. Tuan J., Vitolo V., Vischioni B., et al. Radiation therapy for retroperitoneal sarcoma. Radiol Med. 2014; 119(10): 790 - 802.
68. Cosper P.F., Olsen J., De Wees T., Van Tine B.A., Hawkins W., Michalski J., et al. Intensity-modulated radiation therapy and surgery for Management of Retroperitoneal Sarcomas: a single-institute experience. Radiat Oncol. 2017; 12: 198.
69. Tzeng C.W., Fiveash J.B., Popple R.A., et al. Preoperative radiation therapy with selective dose escalation to the margin at risk for retroperitoneal sarcoma. Cancer. 2006; 107: 371 - 79.
70. Musat E., Kantor G., Caron J., et al. Comparison of intensity-modulated postoperative radiotherapy with conventional postoperative radiotherapy for retroperitoneal sarcoma. Cancer Radiother. 2004; 8: 255 - 61.
71. Swanson E.L., Indelicato D.J., Louis D., et al. Comparison of three-dimensional (3D) conformal proton radiotherapy (RT), 3D conformal photon RT, and intensity-modulated RT for retroperitoneal and intra-abdominal sarcomas. Int J Radiat Oncol Biol Phys. 2012; 83(5): 1549 - 57.
72. Silver J.K., Baima J. Cancer prehabilitation: an opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil. 2013; 92(8): 715 - 27.
73. Nilsson H., Angeras U., Bock D., Borjesson M., Onerup A., Fagevik Olsen M., et al. Is preoperative physical activity related to post-surgery recovery? A cohort study of patients with breast cancer. BMJ open. 2016; 6(1): e007997.
74. Siegel G.W., Biermann J.S., Chugh R., Jacobson J.A., Lucas D., Feng M., et al. The multidisciplinary management of bone and soft tissue sarcoma: an essential organizational framework. J Multidiscip Healthc 2015; 8: 109 - 15.
75. The diagnosis and treatment of lymphedema. Position Statement of the National Lymphedema Network Committee. NMA 2011: 1 - 19.
76. Segal R., Zwaal C., Green E., Tomasone J.R., Loblaw A., Petrella T. Exercise for People with Cancer Guideline Development G: Exercise for people with cancer: a systematic review. Curr Oncol. 2017; 24(4): e290 - e315.
77. Boyd C., Crawford C., Paat C.F., Price A., Xenakis L., Zhang W. Evidence for Massage Therapy Working G: The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized Controlled Trials: Part II, Cancer Pain Populations. Pain Med. 2016; 17(8): 1553 - 68.
78. Stout N.L., Baima J., Swisher A.K., Winters-Stone K.M., Welsh J. A Systematic Review of Exercise Systematic Reviews in the Cancer Literature (2005 - 2017). PM R 2017; 9(9S2): S347 - S384.
79. Hu M., Lin W. Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol. 2012; 127(3): 156 - 64.
80. Bland K.A., Zadravec K., Landry T., Weller S., Meyers L., Campbell K.L. Impact of exercise on chemotherapy completion rate: A systematic review of the evidence and recommendations for future exercise oncology research. Crit Rev Oncol Hematol. 2019; 136: 79 - 85.
81. Mustian K.M., Alfano C.M., Heckler C., Kleckner A.S., Kleckner I.R., Leach C.R., et al. Comparison of Pharmaceutical, Psychological, and Exercise Treatments for Cancer-Related Fatigue: A Meta-analysis. JAMA Oncol. 2017; 3(7): 961 - 8.
82. Kessels E., Husson O., van der Feltz-Cornelis C.M. The effect of exercise on cancer-related fatigue in cancer survivors: a systematic review and meta-analysis. Neuropsychiatr Dis Treat. 2018; 14: 479 - 94.
83. Devine D., Parker P.A., Fouladi R.T., Cohen L. The association between social support, intrusive thoughts, avoidance, and adjustment following an experimental cancer treatment. Psychooncology 2003; 12(5): 453 - 62.
84. Беляев А.М., Чулкова В.А., Семиглазова Т.Ю., Рогачев М.В. (ред.). Онкопсихология для врачей-онкологов и медицинских психологов. Руководство. СПб.: Любавич; 2017.
85. Gamboa A.C., Ethun C.G, Switchenko J.M., et al. Lung Surveillance Strategy for High-Grade Soft Tissue Sarcomas: Chest X-Rayor CT Scan? J Am Coll Surg. 2019; 229(5): 449 - 57.
86. Edmonson J.H., Ryan L.M., Blum R.H., et al. Randomized comparison of doxorubicin alone versus ifosfamide plus doxorubicin or mitomycin, doxorubicin, and cisplatin against advanced soft tissue sarcomas. J Clin Oncol. 1993; 11: 1269 - 75.
87. Adjuvant chemotherapy for localized resectable soft-tissue sarcoma of adults: Meta-analysis of inpidual data. Sarcoma Meta-analysis Collaboration. Lancet. 1997; 350: 1647 - 54.
88. Pervaiz N., Colterjohn N., Farrokhyar F., et al. A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer. 2008; 113: 573 - 81.
89. Francis P. Worden, Jeremy M.G. Taylor, Janet S. Biermann et al. Randomized Phase II Evaluation of 6 g/m2 of Ifosfamide Plus Doxorubicin and Granulocyte Colony-Stimulating Factor (G-CSF) Compared With 12 g/m2 of Ifosfamide Plus Doxorubicin and G-CSF in the Treatment of Poor-Prognosis Soft Tissue Sarcoma. J Clin Oncol. 2005 Jan 1; 23(1): 105 - 12. doi: 10.1200/JCO.2005.05.108.
90. Le Cesne A., Antoine E., Spielmann M., et al. High-dose ifosfamide: circumvention of resistance to standard-dose ifosfamide in advanced soft tissue sarcomas. J Clin Oncol. 1995; 13: 1600 - 8.
91. Горбунова В.А., Феденко А.А., Истомин И.А., Бохян Б.Ю., Губина Г.И. Высокодозный ифосфамид в комбинации с доксорубицином в лечении сарком мягких тканей. Саркомы костей, мягких тканей и опухоли кожи. 2010; 1: 26 - 31.
92. Ravi V., Patel S., Benjamin R.S. Chemotherapy for Soft-Tissue Sarcomas. Oncology (Williston Park). 2015; 29(1) 43 - 50.
93. Trans-Atlantic RPS Working Group. Management of primary retroperitoneal sarcoma (RPS) in the adult: a consensus approach from the Trans-Atlantic RPS Working Group. Ann Surg Oncol. 2015; 22(1): 256e63.
94. Grobmyer S.R., Wilson J.P., Apel B., et al. Recurrent retroperitoneal sarcoma: impact of biology and therapy on outcomes. J Am Coll Surg. 2010; 210: 602 - 8.
95. Gronchi A., Miceli R., Allard M.A., et al. Personalizing the approach to retroperitoneal soft tissue sarcoma: histology-specific patterns of failure and post-relapse outcome after primary extended resection. Ann Surg Oncol. 2015; 22(5): 1447 - 54.
96. Pervaiz N., Colterjohn N., Farrokhyar F., et al. A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer. 2008; 113: 573 - 81.
97. Woll P.J., Reichardt P., Le Cesne A., et al. Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial. Lancet Oncol. 2012; 13: 1045 - 54.
98. Ahlen J., Ahuja N., Albertsmeier M. Management of metastatic retroperitoneal sarcoma: a consensus approach from the Trans-Atlantic Retroperitoneal Sarcoma Working Group (TARPSWG). Ann Oncol. 2018; 29: 857 - 71. DOI: 10.1093/annonc/mdy052
99.  P., Ray-Coquard I.L., Cioffi A., et al. Activity of eribulin mesylate in patients with soft-tissue sarcoma: a phase 2 study in four independent histological subtypes. Lancet Oncol. 2011; 12(11): 1045 - 52.
P., Ray-Coquard I.L., Cioffi A., et al. Activity of eribulin mesylate in patients with soft-tissue sarcoma: a phase 2 study in four independent histological subtypes. Lancet Oncol. 2011; 12(11): 1045 - 52.
100. Chawla S. Subtype specific activity in liposarcoma (LPS) patients (pts) from a phase 3, open label, randomised study of eribulin (ERI) versus dacarbazine (DTIC) in patients with advanced LPS and leiomyosarcoma (LMS). In: American Society for Clinical Oncology Annual Meeting 2016; Abstract #11037.
101. Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.) Evaluation of chemotherapeutic agents. NY: Columbia University Press; 1949: 191 - 205.
102. Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982; 5(6): 649 - 55.
103. NCCN Guidelines Version 2.2022. Soft Tissue Sarcoma.
104. Datta J., Ecker B.L., Neuwirth M.G., Geha R.C., Fraker D.L., Roses R.E., et al. Contemporary reappraisal of the efficacy of adjuvant chemotherapy in resected retroperitoneal sarcoma: Evidence from a nationwide clinical oncology database and review of the literature. Surg Oncol. 2017; 26(2): 117 - 24.
105. Miura J.T., Charlson J., Gamblin T.C, Eastwood D., Banerjee A., Johnston F.M., et al. Impact of chemotherapy on survival in surgically resected retroperitoneal sarcoma. Eur J Surg Oncol (EJSO). 2015; 41(10): 1386 - 92.
106. Pervaiz N., Colterjohn N., Farrokhyar F., et al. A systematic metaanalysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer. 2008; 113: 573 - 81.
107. Bremjit P.J., Jones R.L., Chai X, et al. A contemporary large single-institution evaluation of resected retroperitoneal sarcoma. Ann Surg Oncol. 2013; 21: 2150 - 8.
108. Davis E.J., Chugh R., Zhao L., Lucas D.R., Biermann J.S., Zalupski M.M., et al. A randomised, open-label, phase II study of neo/adjuvant doxorubicin and ifosfamide versus gemcitabine and docetaxel in patients with localised, high-risk, soft tissue sarcoma. Eur J Cancer. 2015; 51(13): 1794 - 802.
109. Stacchiotti S., Grosso F., Negri T., et al. Tumor response to sunitinib malate observed in clear-cell sarcoma. Ann Oncol. 2010; 21: 1130 - 1.
110. Mir O., Boudou-Rouquette P., Larousserie F., et al. Objective response to sorafenib in advanced clear-cell sarcoma. Ann. Oncol. 2012; 23: 807 - 9.
111. Martin-Broto J., Pousa A.L., de Las Penas R., et al. Randomized Phase II Study of Trabectedin and Doxorubicin Compared with Doxorubicin Alone as First-Line Treatment in Patients with Advanced Soft Tissue Sarcomas: A Spanish Group for Research on Sarcoma Study. J Clin Oncol. 2016; 34: 2294 - 302.
112. D'Ambrosio L., Touati N., Blay J.Y. Doxorubicin plus dacarbazine, doxorubicin plus ifosfamide, or doxorubicin alone as a first-line treatment for advanced leiomyosarcoma: a propensity score matching analysis from the European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group. Cancer 2020; 126(11): 2637 - 47.
113. Gronchi A., Miah A.B., Dei Tos A.P., et al. ESMO Guidelines Committee, EURACAN and GENTURIS. Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021; 32(11): 1348 - 65. DOI: 10.1016/j.annonc.2021.07.006. Epub 2021 Jul 22.
114. Pervaiz N., Colterjohn N., Farrokhyar F., Tozer R., Figueredo A., Ghert M. A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer. 2008; 113(3): 573.
115. Van Winkle P., Angiolillo A., Krailo M., Cheung Y.-K., Anderson B., Davenport V., et al. Ifosfamide, carboplatin, and etoposide (ICE) reinduction chemotherapy in a large cohort of children and adolescents with recurrent/refractory sarcoma: the Children's Cancer Group (CCG) experience. Pediatr Blood Cancer. 2005; 44(4): 338 - 47.
116. Minchom A., Jones R.L, Fisher C., Al-Muderis O., Ashley S., Scurr M., et al. Clinical benefit of second-line palliative chemotherapy in advanced soft-tissue sarcoma. Sarcoma 2010; 2010: 264360.
117. Lee S.H., Chang M.H., Baek K.K., Han B., Lim T., Lee J., et al. High-dose ifosfamide as second- or third-line chemotherapy in refractory bone and soft tissue sarcoma patients. Oncology 2011; 80(3 - 4): 257 - 61.
118. Гележе П.В., Морозов С.П., Мандельблат Ю.Э., Либсон Е.И. Современные критерии лучевой диагностики в оценке эффективности специального противоопухолевого лечения. Росс. Онкол. Журн. 2014; 3: 39 - 45.
119. WHO Classification of Tumours Editorial board. Soft Tissue and Bone Tumours. Lyon (France): IARC; 2020.
120. Demicco E.G., Wagner M.J., Maki R.G., Gupta V., Iofin I., Lazar A.J., Wang W.L. Risk assessment in solitary fibrous tumors: validation and refinement of a risk stratification model. Mod Pathol. 2017; 30(10): 1433 - 42.
121. Bonvalot S., Gronchi A., Le  C., et al. Preoperative radiotherapy plus surgery versus surgery alone for patients with primary retroperitoneal sarcoma (EORTC-62092: STRASS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020; 21(10): 1366 - 77. DOI: 10.1016/S1470-2045(20)30446-0. Epub 2020 Sep 14.
C., et al. Preoperative radiotherapy plus surgery versus surgery alone for patients with primary retroperitoneal sarcoma (EORTC-62092: STRASS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020; 21(10): 1366 - 77. DOI: 10.1016/S1470-2045(20)30446-0. Epub 2020 Sep 14.
122. Tirotta F., Hodson J., Parete A., et al Liver resection for sarcoma metastases: A systematic review and experience from two European centres. Eur J Surg Oncol. 2020; 46(10 Pt A): 1807 - 13. DOI: 10.1016/j.ejso.2020.05.024. Epub 2020 Jun 4.
123. Goumard C., Marcal P.L., Wang W.-L., et al. Long-Term Survival According to Histology and Radiologic Response to Preoperative Chemotherapy in 126 Patients Undergoing Resection of Non-GIST Sarcoma Liver Metastases. Ann Surg Oncol. 2018; 25(1): 107 - 16. DOI: 10.1245/s10434-017-6144-4. Epub 2017 Nov 7.
124. Siew C.C.H., Cardona K., van Houd W.J. Management of recurrent retroperitoneal sarcomas. Eur J Surg Oncol. 2022; 1 - 10. DOI: 10.1016/j.ejso.2022.06.008
125. Kazuhiro Tanaka, Junki Mizusawa, Haruhiko Fukuda et al. Perioperative chemotherapy with ifosfamide and doxorubicin for high-grade soft tissue sarcomas in the extremities (JCOG0304) Jpn J Clin Oncol. 2015 Jun; 45(6): 555 - 61. doi: 10.1093/jjco/hyv042.
126. Hensley M.L., Maki R., Venkatraman E., et al. Gemcitabine and Docetaxel in Patients with Unresectable Leiomyosarcoma: Results of a Phase II Trial. J Clinl Oncol. 2002; 20(12): 2824 - 31. DOI: 10.1200/JCO.2002.11.050
127. Grosso F., Jones R.L., Demetri G.D., et al. Efficacy of trabectedin (ecteinascidin-743) in advanced pretreated myxoid liposarcomas: a retrospective study. Lancet Oncol. 2007; 8: 595 - 602. Published Online June 21, 2007. DOI: 10.1016/S1470-2045(07)70175-4
128. Dickson M.A., Koff A., D'Angelo S.P., et al. Phase 2 study of the CDK4 inhibitor abemaciclib in dedifferentiated liposarcoma. J Clin Oncol. 2019; 37 (15_suppl): 11004 - 11004. DOI: 10.1200/JCO.2019.37.15_suppl.11004
129. Nussbaum D.P., Rushing C.N., Lane W.O., Cardona D.M., Kirsch D.G., Peterson B.L., et al. Preoperative or postoperative radiotherapy versus surgery alone for retroperitoneal sarcoma: a case-control, propensity score-matched analysis of a nationwide clinical oncology database. Lancet Oncol. 2016; 17(7): 966 - 75. DOI: 10.1016/S1470-2045(16)30050-X
130. Tawbi H.A., Burgess M., Bolejack V., et al. Pembrolizumab in advanced soft-tissue sarcoma and bone sarcoma (SARC028): a multicentre, two-cohort, single-arm, open-label, phase 2 trial. Lancet Oncol. 2017; 18(11): 1493 - 501. DOI: 10.1016/S1470-2045(17)30624-1. Epub 2017 Oct 4.
131. Laurini J.A., et al. Protocol for the Examination of Resection Specimens from Patients with Soft Tissue Tumors (2021). College of American Pathologists (CAP). https://documents.cap.org/protocols/Soft.Tissue_4.1.0.0.REL_CAPCP.pdf.
132. Dei Tos A.P., Agaimy A., ![]() J.V.M.G., Dickson B.C., Doyle L.A., Dry S.M., et al. Soft Tissue Sarcoma Histopathology Reporting Guide - Resection Specimens. International Collaboration on Cancer Reporting; Sydney, Australia. 2021. ISBN: 978-1-922324-19-1.
J.V.M.G., Dickson B.C., Doyle L.A., Dry S.M., et al. Soft Tissue Sarcoma Histopathology Reporting Guide - Resection Specimens. International Collaboration on Cancer Reporting; Sydney, Australia. 2021. ISBN: 978-1-922324-19-1.
133. Butrynski J.E., D'Adamo D.R., Hornick J.L., et al. Crizotinib in ALK-rearranged inflammatory myofibroblastic tumor. N Engl J Med. 2010; 363(18): 1727 - 33. DOI: 10.1056/NEJMoa1007056
134. Kraybill W.G., Harris J., Spiro I.J., et al. Phase II study of neoadjuvant chemotherapy and radiation therapy in the management of high-risk, high-grade, soft tissue sarcomas of the extremities and body wall: Radiation Therapy Oncology Group Trial 9514. J Clin Oncol. 2006; 24: 619 - 25.
135. Alektiar K.M., Brennan M.F., Healey J.H., Singer S. Impact of intensity-modulated radiation therapy on local control in primary soft-tissue sarcoma of the extremity. J Clin Oncol. 2008; 26: 3440 - 4.
136. Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2): 228 - 47. DOI: 10.1016/j.ejca.2008.10.026
137. Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res. (Hoboken) 2011; 63 (Suppl 11): S240 - 52.
138. Smrke A, Frezza AM, Giani C, et al. Systemic treatment of advanced clear cell sarcoma: results from a retrospective international series from the world sarcoma network. ESMO Open 2022; 7: 100522.
139. Wang Y. et al. The Role of Tc-99m DTPA Renal Dynamic Scintigraphy in Retroperito-neal Liposarcoma//BioMed Research International. - 2020. - Т. 2020. - N. 1. - С. 9765162
140. Аглуллин И.Р. и др. Реконструктивные вмешательства на магистральных сосудах в онкологии//Поволжский онкологический вестник. - 2016. - N. 3 (25). - С. 24 - 29
141. Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 502 - 511
142. Сакаева Д.Д., Орлова Р.В., Шабаева М.М. Практические рекомендации по лечению инфекционных осложнений фебрильной нейтропении и назначению колониестимулирующих факторов у онкологических больных//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 521 - 530
143. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 531 - 544
144. Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавскея М.Г. и соавт. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 545 - 563
145. Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. Практические рекомендации по нутритивной поддержке онкологических больных//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 575 - 583
146. Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 591 - 603
147. Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 604 - 609
148. Буйденок Ю.В. Рекомендации по лечению последствий экстравазации противоопухолевых препаратов//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 610 - 616
149. Проценко С.А., Антимоник Н.Ю., Баллюзек М.Ф., Берштейн Л.М., Жукова Н.В., Новик А.В. и соавт. Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2022 (том 12). 203 - 241.
150. Caroline E. Gleason, Mark A. Dickson, Mary E. Klein (Dooley) et al. Therapy-Induced Senescence Contributes to the Efficacy of Abemaciclib in Patients with Dedifferentiated Liposarcoma Clin Cancer Res. 2024 Feb 16; 30(4): 703 - 718. doi: 10.1158/1078-0432.CCR-23-2378
151. Стилиди, И.С., Никулин, М.П., Калинин, А.Е., Абгарян, М.Г., Вашакмадзе, Л.А., Файнштейн, И.А., П.П. Архири, Салимова, А.А. (2022). Современная стратегия лечения больных забрюшинными саркомами. Современная онкология, 24(2), 157 - 162.
152. Клименков А.А. и др. Основные принципы хирургического лечения неорганных забрюшинных опухолей//Вестник РОНЦ им. НН Блохина РАМН. - 2001. - Т. 12. - N. 3. - С. 48 - 52
153. Крылов Н., Ноггев П., Баканов А., Винничук Д. Врач. 2013. N 11. С. 10 - 13
154. Benjamin R.S., Legha S.S., Patel S.R., Nicaise C. Single-agent ifosfamide studies in sarcomas of soft tissue and bone: the M.D. Anderson experience. Cancer Chemother Pharmacol. 1993; 31 (Suppl 2): S174 - S179.
155. Клинические рекомендации "Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи". Ассоциация профессиональных участников хосписной помощи. Некоммерческое партнерство "Ассоциация Междисциплинарной Медицины". Межрегиональная общественная организация "Общество специалистов доказательной медицины". Общероссийская общественная организация "Российское научное медицинское общество терапевтов". Год утверждения: 2023. URL:
156. Raut C.P., Pisters P.W.T. Retroperitoneal sarcomas: combined-modality treatment approaches//Journal of surgical oncology. - 2006. - Т. 94. - N. 1. - С. 81 - 87
157. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines![]() ). Soft Tissue Sarcoma. Version 3.2024
). Soft Tissue Sarcoma. Version 3.2024
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Стилиди И.С., д.м.н., чл.-корр. РАН, профессор, директор ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, заведующий отделением абдоминальной онкологии НИИ КО им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России. i.stilidi@front.ru
2. Неред С.Н., д.м.н., ведущий научный сотрудник хирургического отделения N 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, nered@mail.ru
3. Никулин М.П., к.м.н., старший научный сотрудник хирургического отделения N 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, maximpetrovich@mai.ru
4. Абгарян М.Г., к.м.н., старший научный сотрудник хирургического отделения N 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, abgaryan.mikael@gmail.ru
5. Архири П.П., врач-хирург хирургического отделения N 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, arhiri@mail.ru
6. Калинин А.Е., к.м.н., старший научный сотрудник хирургического отделения N 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России main2001@inbox.ru
7. Хомяков В.М., к.м.н., заведующий торакоабдоминальным хирургическим отделением, отделом торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, vladimirkhom@mail.ru
8. Зиновьев Г.В., к.м.н., заведующий хирургическим отделением опухолей костей, мягких тканей и кожи ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Министерства здравоохранения России, zinovevgrigory@gmail.com
9. Козлов Н.А., врач-патологоанатом, патологоанатомическое отделение отдела морфологической и молекулярно-генетической диагностики НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, newbox13@mail.ru
10. Савелов Н.А., заведующий патологоанатомическим отделением ГБУЗ "Московская городская онкологическая больница N 62 ДЗМ (МГОБ N 62) ДЗМ".
11. Строганова А.М., заведующая молекулярно-биологической лабораторией, врач - лабораторный генетик отдела морфологической и молекулярно-генетической диагностики опухолей НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, stroganova_am@mail.ru
12. Артамонова Е.В., д.м.н., заведующий онкологическим отделением лекарственных методов лечения (химиотерапевтического) N 1 Научно-исследовательского института клинической онкологии имени академика РАН и РАМН Н.Н. Трапезникова, ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения Российской Федерации, artamonovae@mail.ru
13. Титова Т.А., к.м.н., научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) N 1 Научно-исследовательского института клинической онкологии имени академика РАН и РАМН Н.Н. Трапезникова, ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения Российской Федерации, tatiana.titovadoc@gmail.com
14. Черных М.В., к.м.н., заместитель директора по лечебной работе НИИ КиЭР, заведующая отделением радиотерапии, НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения России, dr.chernich@mail.ru
15. Владимирова Л.Ю., д.м.н., проф., заведующая отделом лекарственного лечения опухолей ФГБУ НМИЦ онкологии Минздрава России, lubovurievna@gmail.com
Блок по медицинской реабилитации:
1. Обухова О.А., к.м.н., врач физической и реабилитационной медицины заведующая отделением медицинской реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Российской ассоциации клинического питания и метаболизма (RSPEN).
Ткаченко Г.А., кандидат психологических наук, медицинский психолог центра реабилитации ФГБУ "Центральная клиническая больница с поликлиникой" Управления делами Президента Российской Федерации; доцент кафедры психиатрии ФГБУ "Центральная государственная медицинская академия" Управления делами Президента Российской Федерации, г. Москва, obukhova0404@yandex.ru
2. Семиглазова Т.Ю., д.м.н., ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент кафедры онкологии ФГБОУ ВО "СЗГМУ им. И.И. Мечникова" Минздрава России, г. Санкт-Петербург, tsemiglazova@mail.ru
3. Иванова Г.Е., профессор, д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ, заведующая кафедрой медицинской реабилитации ФДПО ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, г. Москва, g.ivanova@rehabrus.ru
4. Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, врач-онколог, г. Москва, derkul23@yandex.ru
Блок по организации медицинской помощи:
1. Невольских А.А., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
2. Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
3. Иванов С.А., д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "Национальный медицинский исследовательский центр радиологии" Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Минздрава России. t.gevorkian@ronc.ru
Конфликт интересов:
Ни у кого из членов рабочей группы при разработке настоящих клинических рекомендаций не возникло конфликта интересов, а именно персональной заинтересованности в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей, а также иных обязанностей, в том числе связанных с разработкой и рассмотрением клинических рекомендаций, вследствие противоречия между личной заинтересованностью указанных лиц и интересами пациентов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. врачи-радиотерапевты;
2. врачи-онкологи;
3. врачи-рентгенологи;
4. врачи-радиологи;
5. врачи-хирурги;
6. врачи - анестезиологи-реаниматологи;
7. врачи-терапевты;
8. врачи общей врачебной практики (семейной медицины);
9. врачи-генетики;
10. врачи-патологоанатомы;
11. врачи организации здравоохранения и общественного здоровья;
12. врачи физической и реабилитационной медицины;
13. врачи - клинические фармакологи;
14. студенты медицинских ВУЗов, ординаторы и аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РЯ в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Индикаторы доброкачественной клинической практики (Good Practice Points - GPPs): доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка:
Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Федеральный закон от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации".
2. Приказ Минздрава России от 19.02.2021 N 116н "Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях"
3. Приказ Минздрава России от 13.10.2017 N 804н "Об утверждении номенклатуры медицинских услуг" (Зарегистрировано в Минюсте России 07.11.2017 N 48808).
4. Письмо Федерального фонда обязательного медицинского страхования от 23.04.2019 N 5071/26-2/и. http://www.ffoms.ru/documents/the-orders-oms/.
5. Приказ Минздравсоцразвития России от 23.07.2010 N 541н "Об утверждении Единого квалификационного справочника должностей руководителей, специалистов и служащих, раздел "Квалификационные характеристики должностей работников в сфере здравоохранения".
6. Федеральный закон от 25.12.2018 N 489-ФЗ "О внесении изменений в статью 40 Федерального закона "Об обязательном медицинском страховании в Российской Федерации" и Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам клинических рекомендаций".
7. Приказ Минздрава России N 103н от 28.02.2019 "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации".
8. Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru.
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти в Государственном реестре лекарственных средств, размещенном на сайте Минздрава России: http://grls.rosminzdrav.ru, а также на сайте RUSSCO.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Рис. 1. Схема лечения пациентов локализованными забрюшинными неорганными саркомами
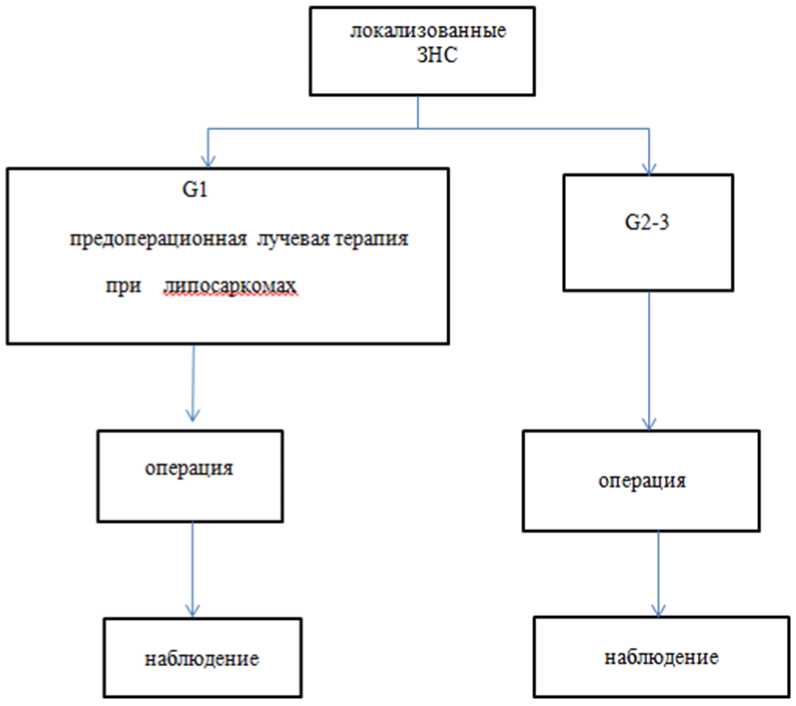
Рис. 2. Схема лечения пациентов рецидивными локализованными забрюшинными неорганными саркомами
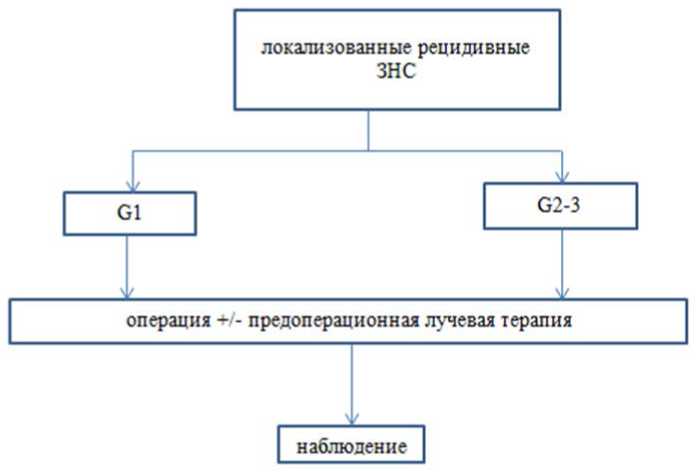
Рис. 3. Схема лечения пациентов нерезектабельными/метастатическими забрюшинными неорганными саркомами
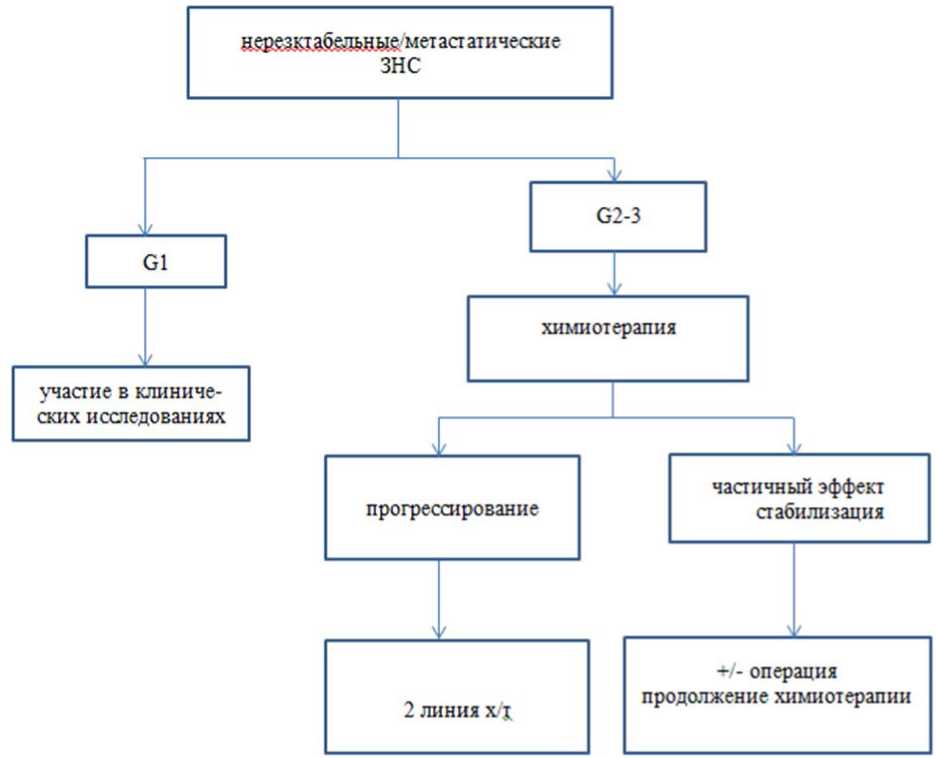
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Пациента информируют о клинической картине и методах диагностики/стадирования ЗНС, знакомят с различными методами лечения и их потенциальными результатами/осложнениями. Выбор метода лечения следует выполнять в результате такого собеседования после того, как пациент имел возможность задать все интересующие его вопросы.
Необходимо убедить пациента не испытывать психологического дискомфорта в связи с заболеванием.
Следует информировать пациента о характере последующего наблюдения после лечения, важности регулярного обследования.
Пациентов следует также информировать о проводимых в Российской Федерации клинических исследованиях у пациентов с соответствующими нозологическими формами.
Самостоятельный контроль за течением заболевания со стороны пациента невозможен; частота посещения врача определяется в индивидуальном порядке в каждом конкретном случае.
Преимущества отказа от табакокурения и потребления алкоголя:
- Более высокие показатели выживаемости
-  эффективность лечения
эффективность лечения
- Меньшее количество и выраженность побочных эффектов противоопухолевого лечения (сердечно-легочные осложнения, утомляемость, снижение массы тела, мукозиты, потеря вкуса)
- Ускоренное восстановление общего состояния после лечения
- Ниже риск рецидива
- Меньший риск вторых опухолей
- Меньший риск инфекций
- Выше качество жизни
Рекомендации при осложнениях химиотерапии/лучевой терапии - связаться с онкологом/химиотерапевтом/лучевым терапевтом!
1) При повышении температуры тела 38 °C и выше:
- Рекомендовано применение противомикробной терапии по рекомендации онколога/химиотерапевта.
2) При стоматите:
- Диета - механическое, термическое щажение;
- Частое полоскание полости рта (каждый час) - ромашка, кора дуба, шалфей; смазывать слизистую полости рта облепиховым (персиковым) маслом;
- Обрабатывать полость рта по рекомендации онколога/химиотерапевта.
3) При диарее:
- Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- Принимать препараты по рекомендации онколога/химиотерапевта.
4) При тошноте:
- Принимать препараты по рекомендации врача-онколога (химиотерапевта).
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status.
Оригинальная публикация: Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982; 5(6): 649 - 55 [102].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент не способен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Смерть
Ключ (интерпретация): приведен в самой шкале.
Приложение Г2
КРИТЕРИИ
ОЦЕНКИ ОТВЕТА СОЛИДНЫХ ОПУХОЛЕЙ НА ЛЕЧЕНИЕ RECIST 1.1
(RESPONSE EVALUATION CRITERIA IN SOLID TUMORS 1.1)
Название на русском языке: Критерии оценки ответа солидных опухолей на лечение 1.1.
Оригинальное название (если есть): Response Evaluation Criteria In Solid Tumors 1.1 (RECIST).
Источник (официальный сайт разработчиков, публикация с валидацией): Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2): 228 - 47. DOI: 10.1016/j.ejca.2008.10.026 [136].
Тип: шкала оценки.
Назначение: унификация оценки ответа солидных опухолей на лечение.
Содержание (шаблон):
Ответ на лечение
RECIST 1.1
Полный ответ
Отсутствие всех целевых образований или лимфоузлов >= 10 мм по короткой оси
Частичный ответ
Уменьшение сумм наибольших диаметров целевых очагов на >= 30%
Прогрессирование
Увеличение сумм наибольших диаметров целевых очагов на >= 20% с абсолютным приростом >= 5 мм
Появление новых очагов
Стабилизация
Ничего из перечисленного
Ключ (интерпретация): приведен в самой шкале.
Содержание представлено в методических рекомендациях N 46 ГБУЗ "Научно-практический центр медицинской радиологии" департамента здравоохранения города Москвы и доступно на веб-сайте: http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf.
Приложение Г3
ВИЗУАЛЬНО-АНАЛОГОВАЯ ШКАЛА ОЦЕНКИ БОЛЕВОГО СИНДРОМА
Название на русском языке: Визуально-аналоговая шкала оценки болевого синдрома.
Оригинальное название: Visual Analog Scale for Pain (VAS Pain).
Источник (официальный сайт разработчиков, публикация с валидацией): Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res. (Hoboken) 2011; 63 (Suppl 11): S240 - 52 [137].
Тип: шкала оценки.
Назначение: предназначена для количественной оценки болевого синдрома с учетом субъективных ощущений больного и подбора анальгезирующей терапии.
Содержание (шаблон):
"Оцените по шкале выраженность боли, где 0 - отсутствие боли, а 10 - нестерпимая боль максимальной выраженности".
Инструкция: больному на 10-сантиметровой линии предлагается отметить степень выраженности боли по шкале от 0 до 10.
Ключ: 1 - 3 балла - слабая боль; 4 - 7 баллов - умеренная боль; 8 и более баллов - сильная боль.
Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
