"Клинические рекомендации "Апластическая анемия"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
АПЛАСТИЧЕСКАЯ АНЕМИЯ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D61.1, D61.3, D61.8, D61.9
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 121
Разработчик клинической рекомендации
- Национальное гематологическое общество
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АА - апластическая анемия
АллоТГСК - трансплантация аллогенных гемопоэтических стволовых клеток
АТГ - иммуноглобулин антитимоцитарный**
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
ВГН - верхняя граница нормы
ГАА - гепатитассоциированная апластическая анемия
Г-КСФ - колониестимулирующие факторы (L03AA по АТХ классификации)
ГФИ - гликозилфосфатидилинозитол
ИЛ - интерлейкин
ИСТ - иммуносупрессивная терапия
![]() - интерферон гамма**
- интерферон гамма**
КИ - клинические исследования
КМ - костный мозг
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
МДС - миелодиспластический синдром
МонАТ - моноклональные антитела
НАА - нетяжелая апластическая анемия
ПНГ - пароксизмальная ночная гемоглобинурия
ОМЛ - острый миелобластный лейкоз
ПР - полная ремиссия
ПТИ - протромбиновый индекс
СТАА - сверхтяжелая апластическая анемия
СКК - стволовая кроветворная клетка
ТАА - тяжелая апластическая анемия
ТГСК - трансплантация гемопоэтических стволовых клеток
УДД - уровень достоверности доказательств
УЗИ - ультразвуковое исследование
УУР - уровень убедительности рекомендаций
![]() - фактор некроза опухоли
- фактор некроза опухоли ![]()
Цс - #циклоспорин**
ЧР - частичная ремиссия
ЭКГ - электрокардиография
ЭхоКГ - эхокардиография
CD - кластеры дифференцировки
HLA - человеческие лейкоцитарные антигены
PIG-A - фосфатидилинозитолфосфат A
Th - T-хелперы
Treg - T-регуляторные клетки
NK - натуральные киллеры
FISH - флуоресцентная гибридизация in situ
Термины и определения
Апластическая анемия (АА) - заболевание системы крови, характеризующееся панцитопенией, обусловленной аплазией костного мозга, связанной с нарушением иммунных механизмов регуляции кроветворения, количественным дефицитом и функциональными дефектами стволовых кроветворных клеток.
Комбинированная иммуносупрессивная терапия (ИСТ) у пациентов с АА проводится по протоколу, включающему иммуноглобулин анти-T лимфоцитарный животного происхождения для применения у человека (АТГ)** и циклоспорин (Цс)**.
Программное лечение пациентов с АА - это комплекс лечебных мероприятий, проводимых поэтапно, начиная с момента диагностики заболевания, осуществляемый в определенном алгоритме, включающий АТГ**, Цс**, при необходимости - повторные курсы АТГ и другие методы терапии, позволяющие добиться длительной выживаемости пациентов.
Клон пароксизмальной ночной гемоглобинурии (ПНГ-клон) - клон стволовой клетки крови (СКК) с мутацией в PIG-A гене, приводящей к нарушению синтеза гликозилфосфатидилинозитола (ГФИ).
Ремиссия полная - полная нормализация показателей гемограммы.
Ремиссия частичная - частичная нормализация показателей гемограммы (гемоглобин 90 - 100,0 г/л, гранулоциты > 1,0 - 1,5 x 109/л, тромбоциты > 100 x 109/л) и отсутствие потребности в заместительной терапии компонентами крови.
Клинико-гематологическое улучшение (минимальный гематологический ответ) - улучшение показателей гемограммы (гемоглобин 70,0 - 85 г/л, гранулоциты > 0,5 - 1,0 x 109/л, тромбоциты > 20,0 x 109/л), исчезновение или значительное уменьшение зависимости от трансфузий компонентов крови.
Рефрактерная АА диагностируется в случае отсутствия эффекта от проводимой комбинированной ИСТ через 6 - 9 месяцев от начала ИСТ лечения или после II этапа лечения (после второго курса АТГ**).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Апластическая анемия - заболевание системы крови, характеризующееся панцитопенией, обусловленной аплазией костного мозга, связанной с нарушением иммунных механизмов регуляции кроветворения, количественным дефицитом и функциональными дефектами СКК.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Одним из ведущих механизмов поражения кроветворения при АА считается иммунная агрессия, направленная на клетки - предшественницы гемопоэза [1].
Костномозговая недостаточность при АА развивается в результате подавления пролиферации гемопоэтических клеток-предшественниц активированными T-лимфоцитами и естественными киллерами. Активация T-лимфоцитов, экспансия цитотоксических T-клонов и выброс медиаторов иммунной супрессии кроветворения (интерферон ![]()
 , фактор некроза опухолей
, фактор некроза опухолей ![]() ) или стимулирующих пролиферацию и активацию T-лимфоцитов (интерлейкин 2), приводят к нарушению процессов пролиферации и к стимуляции апоптоза клеток-предшественниц, вследствие чего происходит значительное уменьшение пула гемопоэтических клеток и развитие аплазии костного мозга [1 - 3].
) или стимулирующих пролиферацию и активацию T-лимфоцитов (интерлейкин 2), приводят к нарушению процессов пролиферации и к стимуляции апоптоза клеток-предшественниц, вследствие чего происходит значительное уменьшение пула гемопоэтических клеток и развитие аплазии костного мозга [1 - 3].
Уменьшение пула гемопоэтических клеток костного мозга сопровождается нарушением обмена железа и отложением токсического железа, как в костном мозге, так и в миокарде и печени, что вызывает нарушение функции этих органов [1].
Основными клиническими проявлениями болезни являются анемический, геморрагический синдромы, а также тяжелые инфекционные осложнения [2]. Кроме того, течение АА может осложниться развитием таких клональных заболеваний как пароксизмальная ночная гемоглобинурия (ПНГ), миелодиспластический синдром (МДС), острый миелобластный лейкоз (ОМЛ). Частота развития клональных осложнений может достигать 32% в течение 10 лет [3, 4]. Появление клонального кроветворения может быть выявлено и на более ранних этапах течения АА. В первую очередь речь идет об АА, протекающей с ПНГ-клоном [5, 6]. При этом выявление клона с дефицитом гликозилфосфатидилинозитол (ГФИ) белков не означает развитие ПНГ как самостоятельного заболевания с картиной классического внутрисосудистого гемолиза. Размер ПНГ-клона в процессе течения АА может меняться до полного исчезновения [7]. Эволюция в классическую ПНГ, по данным различных авторов, составляет 11 - 17% [8 - 10].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Апластическая анемия, по данным эпидемиологических исследований, встречается с различной частотой в таких регионах, как Европа, Северная Америка, Дальний и Ближний Восток; при этом, по данным Интернационального исследования агранулоцитозов и АА, в Европейских странах распространенность АА составляет 2 на 1 млн населения в год при колебании этого показателя, в зависимости от конкретной страны, от 0,6 до 3 и более на 1 млн населения в год [11].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Другие апластические анемии (D61)
D61.1 - Медикаментозная АА
D61.3 - Идиопатическая АА
D61.8 - Другие уточненные АА
D61.9 - Апластическая анемия неуточненная
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Приобретенная АА:
1. Идиопатическая АА
2. Вторичные АА
- Радиация
- Лекарственные препараты и химические токсины
- Вирусы
- Иммунопатология
- Беременность
Выделяют следующие критерии тяжести приобретенной АА:
- нетяжелая АА: гранулоцитопения > 0,5 x 109/л;
- тяжелая АА: гранулоцитопения < 0,5 x 109/л, тромбоцитопения < 20,0 x 109/л);
- сверхтяжелая (очень тяжелая) АА: гранулоцитопения < 0,2 x 109/л.
При определении тяжести АА учитываются результаты не менее трех анализов периферической крови на момент диагностики заболевания до начала лечения [12, 13].
Также принято выделять три варианта течения АА, в зависимости от выявления ПНГ-клона:
- АА, протекающая без ПНГ-клона
- АА, протекающая с ПНГ-клоном
- АА, протекающая с синдромом ПНГ (субклинические или клинические признаки внутрисосудистого гемолиза)
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Манифестация клинических проявлений АА сопровождается жалобами анемического характера, развитием геморрагического синдрома различной интенсивности и инфекционных осложнений на фоне глубокой трехростковой цитопении. Данные проявления могут развиться остро или постепенно нарастать, в зависимости от тяжести АА.
На клиническую картину АА, особенно при тяжелой и сверхтяжелой форме заболевания, могут влиять клинические симптомы осложнений, в том числе, жизнеугрожающих, часто развивающихся у пациентов с АА как до начала лечения, так и в его процессе. К наиболее часто встречающимся осложнениям относятся бактериальные, вирусные и грибковые инфекции, в том числе септический шок, почечная недостаточность, геморрагические осложнения, в том числе внутричерепные кровоизлияния и меноррагии, неврологические и психиатрические нарушения; на фоне терапии глюкокортикостероидами могут развиваться язвенная болезнь желудка и/или асептические остеонекрозы.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу в соответствии со шкалами оценки уровня достоверности доказательств (УДД), уровня убедительности рекомендаций (УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Диагноз АА устанавливается на основании клинических проявлений и данных лабораторного обследования.
- Трехростковая цитопения: анемия (гемоглобин < 110 г/л), гранулоцитопения (гранулоциты < 2,0 x 109/л), тромбоцитопения (тромбоциты < 100,0 x 109/л).
- Снижение клеточности костного мозга (КМ) и отсутствие мегакариоцитов по данным пунктата КМ.
- Аплазия КМ в биоптате подвздошной кости (преобладание жирового КМ).
Выделяют следующие критерии тяжести АА:
- нетяжелая АА: гранулоцитопения > 0,5 x 109/л;
- тяжелая АА: гранулоцитопения < 0,5 x 109/л, тромбоцитопения < 20,0 x 109/л);
- сверхтяжелая (очень тяжелая) АА: гранулоцитопения < 0,2 x 109/л).
При определении тяжести АА учитываются результаты не менее трех анализов периферической крови на момент диагностики заболевания до начала лечения [14, 15].
2.1 Жалобы и анамнез
- Рекомендуется всем пациентам при подозрении на АА сбор анамнеза и жалоб при подозрении и выявленной АА, из анамнестических данных следует выявлять связь с возможными токсическими, лекарственными агентами или ассоциацию с вирусными гепатитами В и С. Необходим тщательный сбор семейного анамнеза для исключения врожденных аномалий, а также уточнение наличия сиблингов (родных братьев и/или сестер) для рассмотрения возможности проведения трансплантации аллогенных гемопоэтических стволовых клеток (аллоТГСК) [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: в анамнезе заболевания должны быть описаны все эпизоды инфекционных осложнений, проведенная антибактериальная терапия, данные бактериологических посевов. Необходимо полное описание частоты и потребности в проводимой трансфузионной терапии, сбор данных об осложнениях после трансфузий.
- Рекомендуется всем пациентам при подозрении на АА проведение приема (осмотр, консультация) врача-гематолога первичного для установления диагноза [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
2.2 Физикальное обследование
- Рекомендуется всем пациентам при подозрении на АА, а также всем пациентам с АА при каждом приеме (осмотр, консультация): физикальный осмотр (в том числе слизистой оболочки полости рта и миндалин), измерение роста и массы тела, температуры тела, оценка состояния костно-суставной системы, выявление признаков геморрагического синдрома, аускультация сердца и легких, пальпация периферических лимфоузлов, щитовидной железы и органов брюшной полости с целью оценки негематологических аномалий, которые могут указывать на наличие конституциональной АА [13, 14, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: при физикальном обследовании необходимо дифференцировать аномалии, характерные для конституциональных форм АА (рост, форма лица, пигментация кожных покровов, дистрофия ногтей, лейкоплакия слизистых, аномалии развития глаз, аномалии зубов, раннее поседение и выпадение волос, гипогонадизм и т.д.).
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам при подозрении на АА, всем пациентам с установленной АА 1 раз в неделю до достижения ответа, в дальнейшем - 1 раз в месяц, а также при развитии геморрагического синдрома выполнение следующих исследований для верификации диагноза и оценки динамики заболевания: общий (клинический) анализ крови развернутый, исследование уровня ретикулоцитов в крови, исследование уровня тромбоцитов в крови [13, 17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: для определения тяжести АА необходимо проведение 3 последовательных анализов крови. При контроле лечения общий (клинический) анализ крови проводится 2 раза в неделю до достижения ответа, в дальнейшем - 1 раз в месяц [12].
- Рекомендуется всем пациентам при подозрении на АА, всем пациентам с установленной АА 2 раза в неделю до достижения ответа, в том числе перед каждым курсом терапии, а также при развитии геморрагического синдрома: анализ крови биохимический общетерапевтический (исследование уровня общего билирубина в крови, исследование уровня мочевины в крови, исследование уровня креатинина в крови, определение активности аланинаминотрансферазы в крови (АЛТ), определение активности аспартатаминотрансферазы в крови (АСТ), определение активности лактатдегидрогеназы в крови (ЛДГ)), для оценки общего состояния пациента, функций органов и систем, а также для контроля за осложнениями ИСТ [13, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с АА при первичном обследовании больного, до начала проведения специфической терапии, в том числе перед каждым курсом АТГ (по показаниям), а также в случае развития геморрагических осложнений на любом этапе наблюдения и лечения гематологического пациента выполнение коагулограммы (ориентировочного исследования системы гемостаза) с исследованием следующих показателей: активированное частичное тромбопластиновое время (АЧТВ), определение протромбинового (тромбопластинового) времени в крови или плазме, исследование уровня фибриногена в крови [19, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: для исследования показателей гемостаза забор крови производят строго натощак, с помощью вакуумных пробирок. Забор крови из катетеров запрещен. Кровь набирают в пробирки, содержащие 3,2% цитрат натрия в соотношении 1:9. Исследование должно проводиться не позднее 2-х часов после забора крови. Достоверность результатов агрегабельности тромбоцитов можно оценить только при содержании в крови тромбоцитов >= 100 x 109/л.
- Рекомендуется всем пациентам при подозрении на АА, а также получающим терапию (в особенности заместительную гемокомпонентную терапию) по поводу АА: исследование уровня ферритина в крови, комплекса исследований для диагностики железодефицитной анемии для оценки степени перегрузки железом [1, 21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: в результате частых трансфузий донорских эритроцитов возможно развитие вторичного гемосидероза органов и тканей.
- Рекомендуется всем пациентам при диагностике АА, а также в процессе терапии АА каждые 6 - 12 месяцев до достижения ответа: получение цитологического препарата путем пункции (стернальная пункция) и цитологическое исследование мазка костного мозга (миелограммы) для оценки клеточного состава костномозгового кроветворения - исключения гемобластозов и поражения костного мозга метастазами солидных опухолей [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: при АА пунктат КМ малоклеточный, определяется относительный лимфоцитоз, отсутствуют мегакариоциты. Пункция грудины может быть выполнена у пациентов с глубокой тромбоцитопенией без предварительной трансфузионной подготовки [23].
- Рекомендуется всем пациентам при диагностике АА стандартное цитогенетическое исследование (кариотип) клеток КМ и молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом (FISH исследование на наличие моносомии 7) для дифференциальной диагностики с МДС [24 - 26].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: выявление клональных аберраций, характерных для МДС, исключает диагноз приобретенной АА. Выполнение FISH-исследования необходимо с зондами, наиболее характерными для МДС/ОМЛ (для определения аномалий 7 хромосомы, трисомии 8, делеции 5q), несмотря на отсутствие цитогенетических аберраций или митозов при стандартном цитогенетическом исследовании.
- Рекомендуется всем пациентам при диагностике АА, а также в процессе терапии АА каждые 6 - 12 месяцев до достижения ответа получение гистологического препарата костного мозга и выполнение патолого-анатомическое исследования биопсийного (операционного) материала костного мозга [12, 13, 27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: необходимо выполнение билатеральной трепанобиопсии передних или задних остей подвздошных костей.
- Рекомендуется всем пациентам с подозрением на АА и с выявленным в пунктате костного мозга расширенным красным ростком цитохимическое исследование микропрепарата костного мозга [28 - 30].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: определение количества сидеробластов и сидероцитов цитохимическим методом. Выявление кольцевых сидеробластов в количестве более 5% требует дополнительного обследования для исключения МДС.
- Рекомендуется всем пациентам при подозрении на АА, а также всем пациентам с выявленной АА каждые 6 - 12 мес. проводить иммунофенотипирование клеток периферической крови для диагностики пароксизмальной ночной гемоглобинурии расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин) с целью выявления ПНГ-клона; определение активности лактатдегидрогеназы в крови с целью оценки клинико-лабораторных признаков гемолиза [10, 31 - 33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: выявление ПНГ-клона вне зависимости от процентного содержания ГФИ-дефектных клеток среди гранулоцитов, эритроцитов и моноцитов не исключает диагноз АА.
- Рекомендуется всем пациентам при диагностике АА проведение прямого антиглобулинового теста (прямой пробы Кумбса) для исключения аутоиммунной гемолитической анемии [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: наличие положительной пробы сомнительно для диагноза АА.
- Рекомендуется всем пациентам при диагностике АА, а также всем пациентам с установленной АА 1 раз в 2 - 4 недели до достижения ответа, в дальнейшем - 1 раз в месяц: проведение общего (клинического) анализа мочи для выявления сопутствующей патологии и оценки токсичности терапии [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам при диагностике АА обследование на сифилис, ВИЧ, вирусные гепатиты, герпес-вирусы для исключения сопутствующей патологии или осложнений [12, 34]:
1) Определение антител к бледной трепонеме (Treponema pallidum) иммуноферментным методом (ИФА) в крови) или определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови;
2) Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови;
3) Определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови и определение антител к вирусу гепатита C (Hepatitis C virus) в крови;
4) Определение антител к вирусу простого герпеса (Herpes simplex virus) в крови; определение антител к вирусу герпеса человека 6 типа (Herpes-virus 6) в крови; определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein - Barr virus) в крови; определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с АА, которым планируется ИСТ, при госпитализации микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: определение колонизации ротовой полости условно патогенными антибиотикорезистентными штаммами бактерий необходимо для подбора адекватной антибактериальной терапии, а также возможной антибактериальной профилактики.
- Рекомендуется пациентам с АА, которым планируется ИСТ, при госпитализации микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: определение колонизации кишечника условно патогенными антибиотикорезистентными штаммами бактерий необходимо для подбора адекватной антибактериальной терапии, а также возможной антибактериальной профилактики.
- Рекомендуется всем пациентам с АА определение основных групп по системе AB0; определение антигена D системы Резус (резус-фактор); определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител с целью подбора трансфузионных сред и минимизации трансфузионных реакций [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Учитывая высокую частоту трансфузий и развивающиеся впоследствии сенсибилизацию к донорским компонентам крови и эритроцитарный химеризм, проведение трансфузий эритроцитной массы должно проводиться с учетом фенотипа.
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам при диагностике АА, а также на протяжении всего периода проведения иммуносупрессивной терапии и при появлении показаний, выполнить регистрацию электрокардиограммы для уточнения функции сердца и выявления возможных противопоказаний для специфического лечения. [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с АА и/или получающим ИСТ по поводу АА для исключения геморрагического инсульта или инфекционного поражения головного мозга - компьютерную томографию (КТ) головного мозга [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам с АА и получающим ИСТ с подозрением на инфекционные осложнения ИСТ проведение компьютерной томографии органов грудной полости [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: с целью определения инфекционных очагов мелкого калибра, не визуализируемых при рентгенографии в соответствии алгоритмами, представленными в Приложении А.
- Рекомендуется всем пациентам, обследуемым по поводу АА, ультразвуковое исследование органов брюшной полости (комплексное), почек, органов малого таза комплексное (трансвагинальное и трансабдоминальное) у женщин старше 18 лет и ультразвуковое исследование предстательной железы у мужчин после 40 лет, ультразвуковое исследование лимфатических узлов (одна анатомическая зона) для выявления сопутствующей патологии [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: УЗИ органов брюшной полости (комплексное), проводится для оценки размеров печени, селезенки и наличия лимфаденопатии; малого таза у женщин и предстательной железы у мужчин - для исключения патологических новообразований; периферических и внутрибрюшных лимфоузлов - с целью исключения лимфаденопатии.
- Рекомендуется всем пациентам, обследуемым по поводу АА эхокардиография (ЭХО-КГ) для выявления сопутствующей патологии [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с АА с геморрагическим синдромом для уточнения его распространенности и тяжести по показаниям выполнение одного или нескольких из следующих исследований (в зависимости от локализации геморрагий) [19, 20]:
1. эзофагогастродуоденоскопия (ЭГДС);
2. колоноскопия;
3. бронхоскопия;
4. ультразвуковое исследование (УЗИ) органов брюшной полости (комплексное), мочевыводящих путей, забрюшинного пространства, органов малого таза комплексное (трансвагинальное и трансабдоминальное), суставов (при наличии гемартрозов);
5. компьютерная томография (КТ) органов грудной полости, головного мозга, органов брюшной полости;
6. магнитно-резонансная томография (МРТ) головного мозга.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
2.5 Иные диагностические исследования
У пациентов с АА, особенно при тяжелой и сверхтяжелой форме заболевания, часто могут развиваться осложнения, в том числе, жизнеугрожающие, требующие проведения диагностических исследований и лечения непосредственно в гематологическом отделении, в процессе диагностики и лечения АА, в связи с особенностями подходов, применяемых в гематологии.
- Рекомендуется всем пациентам старше 18 лет при диагностике АА: определение содержания антител к антигенам ядра клетки и ДНК для исключения системных коллагенозов [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам с рефрактерным к ИСТ течением АА: исследование клеток костного мозга методом дифференциальной окраски хромосом для выявления клональных опухолевых клеток с целью исключения генетических аномалий, характерных для миелодиспластического синдрома [25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендуется всем пациентам при подозрении на конституциональную АА: проведение теста на ломкость хромосом с использованием бифункционального алкилирующего агента (диэпоксибутан) для исключения анемии Фанкони и секвенирования панели генов анемии Фанкони и врожденного дискератоза [13, 36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется всем пациентам при диагностике АА, констатации рефрактерности АА а также их сиблингам молекулярно-генетическое исследование гистосовместимости (HLA высокого разрешения при помощи секвенирования) для подбора родственного донора костного мозга и консультация в трансплантационном центре с целью выбора метода лечения [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам при диагностике АА при наличии клинических и/или лабораторных показаний прием (осмотр, консультация) врача-ревматолога первичный для дифференциальной диагностики с системными коллагенозами [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам при диагностике АА при наличии геморрагического синдрома прием (осмотр, консультация) врача-офтальмолога первичный для диагностики сопутствующей патологии [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам при диагностике АА при наличии инфекционных, геморрагических и иных осложнений со стороны ЛОР-органов прием (осмотр, консультация) врача-оториноларинголога первичный для диагностики сопутствующей патологии [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам при диагностике АА при наличии геморрагического, инфекционного или иного поражения нервной системы прием (осмотр, консультация) врача-невролога первичный для диагностики сопутствующей патологии [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется пациентам АА на фоне программной иммуносупрессивной терапии клинический и лабораторный контроль за терапией иммуносупрессантами (аллергологические и анафилактические реакции во время введения АТГ** и сывороточная болезнь) [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: основные осложнения терапии АТГ: аллергологические и анафилактические реакции во время введения АТГ** и сывороточная болезнь. Аллергические и анафилактические реакции: озноб, лихорадка, эритематозная или уртикарная сыпь встречаются у 30 - 60% пациентов. В этих случаях увеличивают дозы вводимых глюкокортикоидов и антигистаминные средства системного действия в 1,5 - 2 раза и, по возможности, продолжают введение АТГ**.
Значительно реже (у 2 - 3% больных) развиваются бронхоспазм, отек Квинке, артериальная гипотензия. В этих случаях прекращают введение АТГ** и проводят соответствующее лечение.
Сывороточная болезнь обычно развивается на 7 - 14-й день (5 - 20-й день) от начала терапии более чем у 50% пациентов. Лихорадка, папулезные высыпания на коже, кожный зуд, полиартралгии, миалгии, головная боль, тошнота - наиболее часто встречающиеся симптомы сывороточной болезни; реже наблюдаются транзиторное повышение активности аминотрансфераз, повышение артериального давления, желудочно-кишечные расстройства; в 1 - 2% случаев могут иметь место эпилептические судороги. Назначение антигистаминных средств системного действия (блокаторов H1-рецепторов) и глюкокортикоидов (преднизолон** 30 - 60 мг/сут) в течение 1 - 2 недель, как правило, купирует сывороточную болезнь. В тяжелых случаях проводят сеансы плазмафереза.
Для предупреждения развития тяжелых аллергических осложнений рекомендуется непосредственно перед введением АТГ** обязательно проводить внутрикожные тесты на чувствительность пациента к препарату.
Усиление геморрагического синдрома на фоне введения или после введения АТГ** требует интенсивной заместительной терапии трансфузиями тромбоконцентрата и свежезамороженной плазмы.
Основные осложнения терапии #циклоспорином**
Наиболее часто встречающимся осложнением можно считать нарушение функции почек, связанное с нефротоксичностью препарата; при этом наблюдаются повышение содержания креатинина в сыворотке, периферические отеки и олигурия. Нередко повышается артериальное давление, появляются тремор пальцев рук, парестезии, головные боли, в редких случаях - энцефалопатия. У трети пациентов отмечается гиперплазия десен. Тошнота, рвота, боли в животе, диарея встречаются в 10 - 13% случаев. Гипербилирубинемию можно обнаружить у 30% пациентов, но повышение активности печеночных аминотрансфераз наблюдается значительно реже. Могут иметь место электролитные нарушения: гиперкалиемия, гипомагниемия. В некоторых случаях наблюдаются гинекомастия, гипертрихоз, а также аллергические реакции (аллергическая сыпь). Следует отметить, что чаще всего перечисленные осложнения появляются на фоне приема максимальной дозы #циклоспорина** (10 мг/кг/сут) в первые 2 - 3 недели терапии.
Токсические осложнения терапии #циклоспорином**, как правило, корректируются уменьшением суточной дозы (на 25 - 50%) или временной отменой препарата. В ряде случаев необходима сопутствующая симптоматическая терапия.
Диагностика инфекционных осложнений.
- Рекомендуется пациентам АА при развитии инфекционных осложнений соблюдать диагностический алгоритм верификации очагов инфекции применительно к пациентам в состоянии глубокой нейтропении [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Инфекционные осложнения при проведении ИСТ возникают у большинства пациентов АА. На первых этапах терапии преобладают инфекции, вызванные бактериями, в дальнейшем, по мере удлинения периода гранулоцитопении и усиления иммуносупрессии, доминируют оппортунистические инфекции, обусловленные грибами, прежде Aspergillus spp., пневмоцистами, герпесвирусами [2, 9].
К особенностям инфекционных осложнений, регистрируемых при АА, относят высокую частоту выявления возбудителя (микробиологически подтвержденные инфекции составляют до 75%) и преобладание смешанной микрофлоры в этиологии инфекционного процесса. Инфекции, вызванные разными микроорганизмами, могут регистрироваться как на "старте" возникновения инфекционных осложнений, так и возникать последовательно в процессе терапии этих осложнений. Первым симптомом инфекции является лихорадка. Лихорадка при гранулоцитопении (нейтропении) расценивается как инфекционная, если температура тела поднимается выше 38 °C, сохраняется в течение 2 часов и не связана с введением пирогенных препаратов.
Самыми частыми инфекционными осложнениями, развивающимися на фоне приема #циклоспорина**, являются пневмоцистная пневмония и герпетические инфекции. Поражение легких, вызванное данными микроорганизмами, диагностируется при проведении бронхоальвеолярного лаважа с использованием комплекса исследований, включающего иммуноферментный метод и ПЦР [12, 37]
- Рекомендуется пациентам АА при развитии фебрильной лихорадки соблюдать диагностический алгоритм верификации возбудителя применительно к пациентам в состоянии глубокой нейтропении [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: основным фактором, определяющим развитие инфекционных осложнений у гематологических пациентов, является нейтропения (нейтрофилы < 0,5 x 109/л) или лейкопения (лейкоциты <= 1,0 x 109/л), а также длительность нейтропении - частота инфекций существенно возрастает при длительности нейтропении более 10 дней. Риск развития инфекций возрастает при нарушении фагоцитарной функции нейтрофилов, при дефектах клеточного и гуморального иммунитета, повреждении слизистых оболочек желудочно-кишечного тракта (особенно мукозитах III - IV степени), наличии центрального венозного катетера (ЦВК). Источником развития инфекции, как правило, является желудочно-кишечный тракт, когда активно происходит транслокация микроорганизмов со слизистой оболочки, поврежденной в результате химиотерапии. Другие основные входные ворота инфекции при нейтропении - ЦВК.
Этиологическая структура возбудителей у гематологических пациентов разнообразна и включает бактерии, грибы (дрожжевые и плесневые), герпесвирусы. В первые 7 - 10 дней инфекционный процесс, как правило, бывает обусловлен бактериями, а по мере удлинения нейтропении возрастает риск возникновения инвазивного аспергиллеза [75]. В этиологии инфекций кровотока на долю грамотрицательных бактерий приходится 49,7%, грамположительных бактерий - 42,7%, дрожжеподобных грибов - 7,4% [77]. Основными возбудителями сепсиса являются Escherichia coli (17,8%), коагулазонегативные стафилококки (17,4%), Enterococcus spp. (10,3%), Pseudomonas aeruginosa (7,6%), Klebsiella pneumoniae (8,2%). В последние годы увеличилась детекция Acinetobacter spp. и Stenotrophomonas maltophilia, и они входят в число пяти ведущих грамотрицательных бактерий при инфекциях кровотока после E. coli, K. pneumoniae, P. aeruginosa.
Основными механизмами устойчивости у энтеробактерий являются продукция бета-лактамаз расширенного спектра (БЛРС) - в 40 - 50% случаев, и детекция карбапенемаз, преимущественно у K. pneumoniae (10 - 30%). Устойчивость P. aeruginosa составляет к карбапенемам и колистину 40 - 50% и 29%, соответственно, штаммов Acinetobacter baumannii к карбапенемам - 65 - 70% [78]. Среди грамположительных бактерий отмечена устойчивость Enterococcus faecium к ванкомицину (15%). Для грибов рода Candida характерно снижение доли С. albicans до 30% и широкое видовое разнообразие Candida non-albicans [77].
Для инфекций периода нейтропении/лейкопении характерными признаками являются
- скудность клинических проявлений;
- вероятность наличия одновременно разных возбудителей и разной локализации инфекционного процесса;
- возможность появления других возбудителей и другого по локализации инфекционного процесса по мере удлинения периода нейтропении.
Под лихорадкой подразумевают однократно зарегистрированное повышение температуры тела >= 38,0 °C, не связанное с другими причинами (реакции на трансфузии компонентов крови, на вводимые медикаменты, опухолевая лихорадка).
Существует обобщающий термин "фебрильная нейтропения", включающий все случаи фебрильной температуры у пациентов с нейтропенией/лейкопенией. К клинически доказанным относят случаи инфекции, которые удается верифицировать с помощью физикальных или инструментальных методов диагностики при отсутствии микробиологического подтверждения. Наиболее частыми проявлениями клинически доказанных инфекций являются пневмония, инфекция мягких тканей, инфекция промежности (в т.ч. парапроктит). Микробиологическим подтверждением инфекции в период гранулоцитопении в большинстве случаев является выделение микроорганизмов из гемокультуры.
- Рекомендуется во всех случаях вероятного или установленного инфекционного процесса у пациентов АА активно проводить диагностику, направленную на выявление как очагов инфекции, так и этиологических агентов [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: при подозрении на инфекцию образцы клинического материала от пациента должны быть взяты незамедлительно. Необходимо пристальное внимания и проведение тщательных микробиологических исследований у пациентов, принимающих глюкокортикоиды, и у лиц пожилого возраста, так как у этой группы пациентов у 70% тяжелобольных в возрасте старше 66 лет септицемия может протекать с нормотермией или умеренным субфебрилитетом.
При нейтропении ежедневно проводят тщательный осмотр пациента, который наряду с обычными терапевтическими стандартами обследования включает следующие подходы:
- активный опрос больного относительно возможных симптомов инфекции, включая наличие болей по ходу пищевода, в промежности;
- ежедневный осмотр слизистой оболочки полости рта при нейтропении, особенно периодонта. Обращают внимание на рыхлость, отек слизистой оболочки (мукозит), наличие налетов, язв;
- осмотр кожи в отношении возможного появления септикопиемических очагов при лихорадке, даже в отсутствие жалоб (при лечении глюкокортикоидами септикопиемические очаги могут быть при нормальной температуре тела);
- осмотр места установки венозного катетера;
- внимательная аускультация грудной клетки (жесткое дыхание в отсутствие хрипов, минимальное количество влажных хрипов на ограниченном участке могут быть начальным проявлением пневмонии);
- тщательная пальпация живота (первые симптомы псевдомембранозного колита - появление боли или "урчание" при пальпации в правой подвздошной области (область слепой кишки).
- Рекомендуется у пациентов АА с температурой >= 38 °C или наличии септикопиемических очагов на коже проведение микробиологического (культурального) исследования крови на стерильность с использованием автоматического анализатора для гемокультур [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: кровь берут одновременно из вены и из ЦВК или из двух разных вен в 2 - 4 флакона (аэробы/анаэробы), предназначенных для инкубирования в автоматическом анализаторе для гемокультур. На основании разницы во времени регистрации положительной гемокультуры, взятой одновременно из ЦВК и из вены может быть заподозрено инфицирование ЦВК. В этом случае положительная гемокультура, взятая из ЦВК, опережает на 2 часа и более положительную гемокультуру из вены. Кровь для микробиологического исследования проводят с максимальным соблюдением правил асептики, в каждый флакон вводят 10 мл крови пациента. Введение меньшего объема крови снижает вероятность получения положительной гемокультуры. При инфекции кровотока выделение коагулазонегативных стафилококков и Corynebacterium spp. должно быть подтверждено двумя положительными гемокультурами, поскольку эти микроорганизмы принадлежат к облигатной микрофлоре, и детекция их только в одном из двух флаконов расценивается как контаминация исследуемых образцов крови (облигатная микрофлора).
Центральный венозный катетер (ЦВК) удаляют и направляют на микробиологическое исследование при подозрении на катетер-ассоциированную инфекцию (разница во времени детекции положительной гемокультуры, взятой одновременно из вены и из ЦВК), при выделении из гемокультуры дрожжевых или плесневых грибов, при переводе пациента из другого стационара с ЦВК (высокая вероятность инфицирования ЦВК). Для бактериологического исследования в лабораторию направляют асептически удаленный дистальный отрезок катетера длиной 5 - 6 см в стерильной емкости. Исследование ЦВК проводят полуколичественным (метод Маки) или количественным методом. Диагностически значимым подтверждением инфицирования ЦВК является выделение микроорганизмов в количестве >= 15 колониеобразующих единиц (КОЕ) при полуколичественном исследовании, или >= 103 КОЕ/мл - при количественном исследовании.
- Рекомендуется у пациентов АА при наличии клинических симптомов инфекции мочевыводящих путей, лейкоцитурии, температуры более 5 дней в период нейтропении проведение микробиологического (культурального) исследования мочи на бактериальные патогены с применением автоматизированного посева [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: для микробиологического исследования направляют утреннюю среднюю порцию мочи, проводят исследования на наличие различных бактериальных патогенов, начиная с наиболее частых в гематологической практике (см. ниже). Бактериурия является диагностически значимой, если выделен один микроорганизм в количестве >= 103 КОЕ/мл. Микробиологическое исследование мочи повторяют на следующий день, если выделены два микроорганизма в количестве >= 103 КОЕ/мл. Повторное выделение тех же микроорганизмов, как в первом исследовании, подтверждает наличие инфекции мочевыводящих путей. В гематологии наиболее частыми возбудителями инфекции мочевыводящих путей в стационаре являются энтеробактерии, среди них E. coli, далее следуют Enterococcus spp., P. aeruginosa. Неоднократное выделение из мочи Candida spp. у пациентов с фебрильной нейтропенией может свидетельствовать о высокой вероятности наличия диссеминированного инвазивного кандидоза. Выполняют экспресс-определение чувствительности к антибиотикам эндотоксинов в моче всех микроорганизмов, выделенных в диагностически значимых количествах.
- Рекомендуется у пациентов АА при наличии симптомов менингита, "мозговой" симптоматики на фоне фебрильной нейтропении, обнаружении очага (очагов) в головном мозге при компьютерной томографии/спиральной компьютерной томографии (КТ/СКТ) или магнитно-резонансной томографии (МРТ) проведение микроскопического исследования спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза), микробиологическое (культуральное) исследование спинномозговой жидкости на криптококк (Cryptococcus neoformans), определение ДНК вируса простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) в спинномозговой жидкости методом ПЦР, молекулярно-биологическое исследование спинномозговой жидкости на пневмококк (Streptococcus pneumoniae) (при наличии цитоза), молекулярно-биологическое исследование спинномозговой жидкости на гемофильную палочку (Haemophilus influenzae) (при наличии цитоза), микробиологическое (культуральное) исследование спинномозговой жидкости на менингококк (Neisseria meningitidis) (при наличии цитоза), Молекулярно-биологическое исследование спинномозговой жидкости на Streptococcus agalactiae (SGB) (при наличии цитоза), определение ДНК токсоплазмы (Toxoplasma gondii) в спинномозговой жидкости методом ПЦР (при наличии очагов в головном мозге) [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов АА при наличии диареи исследование кала на наличие токсина клостридии диффициле (Clostridium difficile), если результат этого теста оказывается отрицательным, проводят микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: у пациентов с персистирующей фебрильной нейтропенией и отсутствием положительной гемокультуры эти микроорганизмы могут быть причиной инфекции.
- Рекомендуется у пациентов АА при наличии признаков стоматита (мукозита) проводить микробиологическое исследование мазка с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: При выделении грамотрицательных бактерий осуществляют идентификацию до вида, определение чувствительности к антибактериальным препаратам системного действия, детекцию продукции ![]() -лактамаз расширенного спектра (БЛРС) у энтеробактерий, постановку теста modified carbapenem inactivation method (mCIM) или carbapenem inactivation method (CIM) для определения продукции карбапенемаз среди карбапенемоустойчивых энтеробактерий и P. aeruginosa, выявление генов приобретенных карбапенемаз групп КРС и ОХА-48-подобных в мазках со слизистой оболочки ротоглотки методом ПЦР при положительном тесте mCIM (или CIM). При выделении дрожжевых грибов со слизистой оболочки ротоглотки проводят только идентификацию до вида.
-лактамаз расширенного спектра (БЛРС) у энтеробактерий, постановку теста modified carbapenem inactivation method (mCIM) или carbapenem inactivation method (CIM) для определения продукции карбапенемаз среди карбапенемоустойчивых энтеробактерий и P. aeruginosa, выявление генов приобретенных карбапенемаз групп КРС и ОХА-48-подобных в мазках со слизистой оболочки ротоглотки методом ПЦР при положительном тесте mCIM (или CIM). При выделении дрожжевых грибов со слизистой оболочки ротоглотки проводят только идентификацию до вида.
- Рекомендуется у пациентов АА при инфекции промежности, воспалении или повреждении слизистой прямой кишки (трещина, парапроктит и др.), у пациентов с персистирующей фебрильной нейтропенией длительностью от 4 - 5 дней и отсутствием диагностически значимых результатов исследований, а также в качестве скрининга в группе высокого риска развития инфекций при поступлении в стационар, затем каждые 7 дней до восстановления гранулоцитов в крови или лейкоцитов > 1,0 x 109/л проведение микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы и на грибы рода кандида (Candida spp.) [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: с учетом выделенных микроорганизмов может быть проведена коррекция антимикробной терапии при отсутствии диагностически значимых результатов исследований из клинически значимых образцов у пациентов с персистирующей фебрильной нейтропенией. Обращают внимание на выделение полирезистентных грамотрицательных бактерий - P. aeruginosa, A. baumannii, S. maltophilia, энтеробактерий с продукцией БЛРС или карбапенемаз.
- Рекомендуется у пациентов с АА при наличии некроза слизистой оболочки носового хода выполнение микробиологического (культурального) исследования носоглоточных смывов на мицелиальные грибы и молекулярно-биологическое исследование мазков со слизистой оболочки носоглотки на Staphylococcus aureus у больных с пиодермией [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов АА при наличии септикопиемических очагов кожи (инфильтраты в дерме любых размеров, возникшие при гипертермии) или других образований на коже проведение патолого-анатомического исследования биопсийного (операционного) материала кожи, молекулярно-биологического исследования отделяемого пораженных участков кожи на Pseudomonas aeruginosa, молекулярно-биологическое исследование отделяемого пораженных участков кожи на Streptococcus pyogenes (SGA), молекулярно-биологического исследования отделяемого пораженных участков кожи на метициллин-чувствительные и метициллин-резистентные Staphilicoccus aureus, метициллин-резистентные Staphilicoccus spp., микробиологического (культурального) исследования соскоба с кожи на грибы (дрожжевые, плесневые, дерматомицеты), микробиологического (культурального) исследования отделяемого высыпных элементов кожи на чувствительность к антибактериальным и противогрибковым препаратам, микробиологического (культурального) исследования пунктата пролежня кожи на микобактерий туберкулеза (Mycobacterium tuberculosis complex) [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов АА при наличии изменений в легких выполнение бронхо-альвеолярного лаважа, цитологическое исследование лаважной жидкости, микроскопическое исследование лаважной жидкости, микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные), молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на Pneumocystis jirovecii, молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на Mycobacterium tuberculosis complex (микобактерии туберкулеза), определение ДНК Mycoplasma pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР, определение ДНК Chlamydophila pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов АА определение антигена возбудителя легионеллеза Legionella pneumophila в моче при наличии пневмонии с очагами консолидации [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов АА в период нейтропении если не проводится профилактики противогрибковыми препаратами системного действия, активными в отношении плесневых грибов; при клинико-радиологических признаках, подозрительных в отношении инвазивного аспергиллеза, независимо от нейтропении определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови (галактоманнан), в жидкости БАЛ в качестве мониторинга [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: исследование проводят не менее двух раз в течение 5 дней. Антиген Aspergillus исследуют до назначения противогрибковых препаратов системного действия, активных в отношении мицелиальных грибов. Тест включен в критерии диагностики инвазивного аспергиллеза. Положительные значения индекса оптической плотности определения антигена Aspergillus в сыворотке крови: >= 0,5, в жидкости БАЛ: >= 1,0, в СМЖ: >= 1,0 [79].
- Рекомендуется у пациентов с АА с длительной (более 7 - 10 дней) персистирующей фебрильной температурой исследование антигена Candida (маннан) и антител Candida (антиманнан) в сыворотке крови при выявлении множественных очагов в печени и/или селезенке для исключения гепатолиенального кандидоза или предполагаемого инвазивного кандидоза [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: образец для исследования - кровь. Результат исследования считается положительным при следующих значениях: антиген Candida (маннан) >= 125 пг/мл; антитела Candida (антиманнан) >= 10 МЕ/мл. Тест не включен в критерии диагностики инвазивного кандидоза. Тест имеет высокое отрицательное прогностическое значение. При положительных значениях нельзя исключить наличие инвазивного кандидоза. Чувствительность и специфичность составляют около 50 - 60%. У пациентов с колонизацией слизистых оболочек Candida spp могут быть положительные значения антиманнана.
- Рекомендуется у пациентов АА с подозрением на инфекцию, вызванную криптококком, определение антигена криптококка (Cryptococcus neoformans) в крови [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: пациенты с АА составляют группу риска возникновения этой инфекции в связи с Т-клеточным иммунодефицитом. Проводят определение антигена грибов рода Криптококкус (Cryptococcus spp.) в спинномозговой жидкости и определение антигена криптококка (Cryptococcus neoformans) в крови. Тест включен в критерии диагностики инвазивного криптоккоза. Исследование проводят с помощью латекс-теста (качественный анализ).
- Рекомендуется у пациентов АА при подозрении на пневмонию, возникшую амбулаторно, определение антител классов A, M, G (IgA, IgM, IgG) к хламидии пневмонии (Chlamydia pheumoniae) в крови и определение антител классов M, G (IgM, IgG) к микоплазме пневмонии (Mycoplasma pneumoniae) в крови [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов с АА при наличии аускультативных признаков пневмонии; персистирующей фебрильной нейтропении от 3 дней и более, независимо от физикальной картины в легких; для контроля выявленных изменений в легких через 7 - 14 дней в зависимости от состояния больного и диагностированной инфекции - повторное проведение КТ органов грудной полости [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: КТ во всех случаях проводят без предварительной прицельной рентгенографии органов грудной клетки. Прицельная рентгенография органов грудной клетки относится к малоинформативным методам исследования у гематологических пациентов, предпочтительно для диагностики инфекционных осложнений применять КТ.
- Рекомендуется у пациентов с АА с подозрением на инфекционный процесс повторное проведение УЗИ, КТ или МРТ органов брюшной полости для уточнения локализации инфекционного процесса по клиническим показаниям [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: клиническими показаниями являются: сохраняющаяся лихорадка (колебания температуры в течение суток от 37 до 39 °C), особенно у больных вне лейкопении (для диагностики гепатолиенального кандидоза); при диагностированном аспергиллезе легких или мукормикозе (для исключения диссеминации); для контроля выявленных ранее изменений при диагностике гепатолиенального кандидоза контрольное исследование проводят не ранее чем через 1 мес. терапии противогрибковыми препаратами системного действия, вне лейкопении.
- Рекомендуется у пациентов АА с симптомами поражения центральной нервной системы (ЦНС) или с подозрением на инвазивный аспергиллез легких/околоносовых пазух или мукормикоз повторное проведение КТ или МРТ головного мозга для исключения инфекционного поражения головного мозга или диссеминации. [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов АА с подозрением на бактериальный эндокардит проведение ЭхоКГ, включая чреспищеводную ЭхоКГ [12, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: особенно важными данные исследования являются в случае микробиологически подтвержденной инфекции, вызванная S. Aureus и длительной (более 10 - 14 дней) персистирующей гипертермии, особенно у больных вне лейкопении. Чреспищеводную ЭхоКГ назначают при сохраняющейся гипертермии и отрицательных результатах ЭхоКГ.
- Рекомендуется у пациентов АА при наличии признаков инфекции (лихорадка больше 38 градусов) определение ДНК вируса простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в биологических жидкостях, качественное исследование [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: HSV вызывают у пациентов гематологическими заболеваниями прежде всего повреждение слизистых оболочек (мукозиты), чаще HSV 1 тип.
- Рекомендуется у пациентов АА при наличии признаков инфекции (лихорадка больше 38 градусов) молекулярно-биологическое исследование крови на цитомегаловирус (Cytomegalovirus), определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется у пациентов с АА при наличии признаков инфекции (лихорадка больше 38 градусов) проведение молекулярно-биологического исследования периферической на вирус герпеса 6 типа (HHV6), молекулярно-биологическое исследование спинномозговой жидкости на вирус герпеса 6 типа (HHV6) (при подозрении на нейроинфекцию) [12, 13, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: среди HHV6 выделяют тип A и тип B. Реактивация вируса может приводить к развитию энцефалита, угнетению костномозгового кроветворения, пневмонии, быть причиной диареи. Энцефалит, вызванный HHV6, является редким проявлением инфекции, описаны случаи при неродственной ТГСК. В СМЖ пациентов с энцефалитом HHV-6 определяется повышенный уровень белка, в половине случаев бывает плеоцитоз. Компьютерная томография головного мозга может быть нормальной, изменения определяются при магнитно-резонансной томографии.
Диагностика иных осложнений
- Рекомендуется пациентам с АА с подозрением на язвенное поражение ЖКТ выполнение эзофагодуоденоскопии, при необходимости с биопсийным исследованием и тестом на наличие H. Pylori [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: формирование язв ЖКТ может проявляться диспепсическими явлениями и абдоминальными болями, но нередко протекает и бессимптомно, манифестируя кровотечением или перфорацией.
- Рекомендуется пациентам с АА при подозрении на асептический некроз головок бедренных костей проведение рентгенографии таза в прямой проекции и/или магнитно-резонансная томография суставов (один сустав) [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: характерным признаком асептического некроза головки бедренной кости является наличие географической формы тонкой линии остеосклероза, которая формируется при прорастании костной ткани из непораженного участка в очаг остеонекроза. При секвестрировании выявляется полоска просветления по форме очага. Рентгенография и МРТ костей и суставов используются также при планировании оперативных вмешательств на поздних стадиях остеонекроза при развитии деформации суставного отдела длинной трубчатой кости. Дополнить инструментальную диагностику может двухэнергетическая рентгеноденситометрия, которая позволяет выявить проявления системного остеопороза и состояние костной ткани в области установленных имплантов, если пациентам выполнялось эндопротезирование суставов.
- Рекомендуется пациентам АА при подозрении на развитие асептического некроза головки бедренной кости выполнение исследования маркеров костного метаболизма (исследование уровня общего кальция в крови, исследование уровня кальция в моче, исследование уровня паратиреоидного гормона в крови, определение активности щелочной фосфатазы в крови, исследование уровня 1,25-OH витамина Д в крови, исследование уровня дезоксипиридинолина в моче, исследование уровня остеокальцина в крови [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: исследуемые маркеры могут помочь в определении тактики дальнейшего сопроводительного лечения и назначении специфической терапии остеопороза.
- Рекомендуется пациентам АА при подозрении на развитие осложнений, связанных с трансфузией (переливанием) компонентов донорской крови, выполнение следующих исследований [38]:
- при подозрении на острое обусловленное трансфузией повреждение легких: прицельная рентгенография органов грудной клетки, определение содержания антилейкоцитарных антител, определение содержания антител к цитоплазме нейтрофилов в крови
- при подозрении на анафилактический шок: оценка уровня сывороточного IgA у реципиента
- при подозрении на гипертермическую (фебрильную) негемолитическую реакцию: микробиологическое (культуральное) исследование крови на стерильность; определение содержания антилейкоцитарных антител, определение содержания антитромбоцитарных антител, определение содержания антител к цитоплазме нейтрофилов в крови
- при подозрении на острый или отсроченный гемолиз: исследование уровня свободного гемоглобина в плазме крови, исследование уровня свободного и связанного билирубина в крови, обнаружение гемоглобина в моче, определение гемосидерина в моче, прямой антиглобулиновый тест (прямая проба Кумбса)
- при подозрении на посттрансфузионную реакцию "трансплантат против хозяина": общий (клинический) анализ крови, анализ крови биохимический общетерапевтический (АЛТ, АСТ, щелочная фосфатаза, свободный и связанный билирубин), коагулограмма (ориентировочное исследование системы гемостаза), патолого-анатомическое исследование биопсийного (операционного) материала кожи (при наличии кожной эритемы), молекулярно-генетическое исследование химеризма кроветворения после неродственной трансплантации костного мозга, ультразвуковое исследование органов брюшной полости (комплексное)
- при подозрении на посттрансфузионную пурпуру: общий (клинический) анализ крови, определение содержания антилейкоцитарных антител, определение содержания антитромбоцитарных антител
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Программа лечения взрослых пациентов с апластической анемией - это комбинированная иммуносупрессивная терапия, проводимая с использованием двух основных препаратов, обладающих выраженным иммуносупрессивным действием: АТГ** и #циклоспорин**, и/или трансплантация гемопоэтических стволовых клеток (ТГСК) [12, 39 - 41]
Современная патогенетическая терапия пациентов с апластической анемией может включать кроме препаратов с иммуносупрессивным действием (АТГ**, #циклоспорин**) лекарственные препараты, направленные на активацию пролиферации клеток-предшественниц кроветворения и одновременное подавление активации цитотоксических клеток. Многочисленными клиническими исследованиями было показано значительное улучшение гематологических показателей под влиянием элтромбопага** [41, 42]. Элтромбопаг** по механизму действия является агонистом тромбопоэтиновых рецепторов, которые локализуются не только на мегакариоцитах, но и на стволовых клетках крови. Элтромбопаг** связывается с трансмембранным доменом тромбопоэтиновых рецепторов, не конкурируя с эндогенным тромбопоэтином, и обладает иммуномодулирующими свойствами посредством активации T-регуляторных клеток. Кроме того элтромбопаг** обладает хелаторной активностью и способствует выведению токсического железа из клеток печени, сердца и других внутренних органов при перегрузке железом у пациентов с АА, зависимых от трансфузий донорских эритроцитов [43]. Клиническое использование элтромбопага** может сопровождаться моно-, би-, трехлинейным гематологическим ответом у пациентов с рефрактерной апластической анемией, а его использование в программах комбинированной терапии апластической анемии достоверно повышает частоту достижения полного ответа и общую выживаемость пациентов [41]. Программа лечения может включать и другие терапевтические воздействия, в частности хелаторную терапию, а также спленэктомию [2, 12, 44]. Огромную роль в реализации программы лечения больных апластической анемией играет заместительная гемотрансфузионная терапия: трансфузии донорских клеток крови (эритроцитная взвесь и тромбоконцентраты) [12, 17, 23].
ТГСК в рамках алгоритма лечения пациентов с АА занимает определенное место: наличие HLA-идентичного родственного донора, молодой возраст, короткий гемотрансфузионный анамнез и тяжелая форма заболевания - условия, при которых ТГСК может рассматриваться как терапия выбора (терапия 1 линии) [45]. Существенным недостатком этого метода является ограниченная возможность применения, связанная с отсутствием родственного донора костного мозга у большинства взрослых больных. Тем не менее, ТГСК в настоящее время рассматривается как терапия выбора на первом этапе лечения молодых больных тяжелой апластической анемией, имеющих HLA-идентичного родственного донора костного мозга [46, 47]. Поэтому, уже при диагностировании АА необходимо выполнение HLA-типирования пациентов и поиск возможного родственного донора. Абсолютным показанием к проведению ТГСК при АА на любом этапе течения болезни является выявление при цитогенетическом исследовании неблагоприятных хромосомных аберраций и, прежде всего, моносомии 7 хромосомы, свидетельствующие о прогрессии в МДС или ОМЛ.
Совершенствование иммуносупрессивной терапии, реализация программы на ранних этапах течения болезни позволили значительно повысить эффективность лечения апластической анемии: вероятность длительной выживаемости пациентов с апластической анемией возросла до 80 - 90% [48, 49]. Эффективность лечения в первую очередь зависит от своевременной диагностики апластической анемии, от тяжести заболевания, от возраста пациента, сопутствующей патологии и возможности проведения комбинированной иммуносупрессивной терапии или ТГСК уже на первых этапах лечения [12, 17, 50, 51]. Использование при лечении пациентов апластической анемией глюкокортикоидов как основного метода терапии, неконтролируемой длительной монотерапии #циклоспорином** (более 6 месяцев) и необоснованное применение колониестимулирующих факторов создают неблагоприятные условия для начала комбинированной иммуносупрессивной терапии и ухудшают ее эффективность [12, 13].
Анализ эффективности комбинированной иммуносупрессивной терапии взрослых пациентов с апластической анемией, представленный в систематических обзорах клинических исследований в 2010 - 2019 гг., посвященных проблеме лечения пациентов с апластической анемией, позволяет рекомендовать разработанный алгоритм лечения как основной протокол иммуносупрессивной терапии взрослых пациентов с апластической анемией [13, 27, 39, 52, 53].
Программная комбинированная ИСТ проводится у пациентов с приобретенной АА, установленной на основании данных комплексного обследования, в т.ч. анализа периферической крови, миелограммы (стернальная пункция), просмотра гистологических препаратов КМ (билатеральная трепанобиопсия подвздошной кости), исключения клональных заболеваний (цитогенетическое исследование клеток КМ) при отсутствии клинических противопоказаний.
3.1 Консервативная терапия
- Рекомендуется пациентам с АА моложе 40 лет и наличием HLA-идентичного родственного донора проведение трансплантации костного мозга (аллоТГСК) в первой линии терапии для достижения излечения, при отсутствии клинических противопоказаний как у пациента, так и у донора [45, 122].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: HLA-типирование пациентов с АА и сиблингов должно проводиться сразу после установления диагноза. При наличии родственного полностью совместимого донора должна быть проведена консультация пациентов с АА в трансплантационном центре.
- Рекомендуется пациентам с АА без родственного HLA-идентичного донора проведение курса терапии иммуноглобулином антитимоцитарным лошадиным [12, 13, 17, 46, 47, 54, 55]
Доза #иммуноглобулина антитимоцитарного лошадиного составляет 20 мг/кг/сутки или 40 мг/кг/сутки (что соответствует отечественным и мировым протоколам лечения), при продолжительности курса 5 или 4 дня соответственно, включает непрерывное введение суточной дозы препарата 12-ти часовой инфузией. #АТГ лошадиный должен назначаться в рамках Протокола N 1 (см. Приложение А3) [12, 13, 17, 39, 52, 55, 56]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Учитывая данные многоцентровых исследований, демонстрирующих терапевтический эффект #АТГ лошадиного, превосходящий кроличий, представленные рекомендации включают лишь протокол лечения #АТГ лошадиного [57].
В связи с высоким риском развития инфекционных осложнений в курсовом и посткурсовом периоде, курс терапии #АТГ лошадиным рекомендуется проводить в условиях асептической одноместной палаты. Также пациенту рекомендуется пребывание в ней в течение 21 - 28 дней после окончания курса.
- Рекомендуется пациентам, которым проводится курс #АТГ лошадиного, проведение сопроводительной терапии в возрастных дозировках, включающей профилактику инфекционных осложнений в соответствии с зарегистрированными показаниями (Ко-тримоксазол [Сульфаметоксазол + Триметоприм]**, флуконазол**, ацикловир**), профилактику развития аллергических реакций, в том числе и сывороточной болезни [12, 17, 37].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: проведение профилактики возможных осложнений на курсе начинается за 2 дня от начала терапии и продолжается 2 недели после окончания курса.
- Рекомендуется пациентам с АА без родственного HLA-идентичного донора или старше 40 лет длительная терапия #циклоспорином** [17, 58, 59].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1)
Комментарии: #циклоспорин**, назначается с 14 дня курса АТГ** в зависимости от функции почек и эффективности контроля артериального давления. Начальная доза препарата - 5 мг/кг в сутки внутрь или в/в. У пациентов старше 60 лет стартовая доза может быть снижена до 3 мг/кг в сутки. В дальнейшем суточная доза изменяется в зависимости от индивидуальной фармакокинетики и индивидуальной переносимости препарата. Целевая резидуальная (то есть взятая перед приемом) концентрация #циклоспорина** в цельной крови составляет 200 - 400 нг/мл. При развитии почечной токсичности (повышение мочевины и креатинина), неконтролируемой двумя препаратами артериальной гипертензии и печеночной токсичности #циклоспорин** останавливается полностью, независимо от дозы и концентрации в крови. После полного купирования токсичности #циклоспорина** возобновляется в суточной дозе, равной 1/2 дозы на которой развилась токсичность. При повышении уровня #циклоспорина** в плазме выше 400 нг/мл проводится снижение суточной дозы для вхождения в терапевтический коридор. Средняя суточная доза #циклоспорина** на протяжении курса лечения определяется переносимостью и уровнем достигнутой концентрации. Не рекомендуется повышать дозу до терапевтической при плохой переносимости. Терапия #циклоспорином** продолжается 2 года с медленной отменой.
- Рекомендуется применение хелаторной терапии деферазироксом** (таблетки, покрытые пленочной оболочкой) у пациентов с АА и наличием хронической посттрансфузионной перегрузки железом в начальной дозе 14 мг/кг/сутки внутрь, с дальнейшим постепенным увеличением дозы при неэффективности до 28 мг/кг/сутки и отсутствии признаков токсичности для купирования перегрузки железом [17, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: перегрузка железом в результате множественных гемотрансфузий служит показанием к проведению хелаторной терапии. При повышении ферритина сыворотки > 1000 нг/мл в программу лечения пациентов с рефрактерной АА рекомендуется включить деферазирокс**. Деферазирокс** назначают внутрь в таблетках в максимальной суточной дозе 28 мг/кг; в зависимости от уровня ферритина сыворотки, переносимости терапии препаратом и сопутствующей патологии, возможно уменьшение или увеличение дозы на 4 - 8 мг/кг/сут. При сочетанном применении с #циклоспорином** необходим более тщательный мониторинг состояния функции почек.
- Рекомендуется пациентам с впервые выявленной тяжелой формой АА проведение терапии элтромбопагом** в дозе до 150 мг/сут с первого дня курса #АТГ лошадиного, в течение 6 месяцев и более до достижении ремиссии [17, 60, 125].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: проведение терапии элтромбопагом** возможно в первой линии терапии или при отсутствии эффекта от проведенного курса #АТГ лошадиным в сочетании с #циклоспорином** и отсутствии возможности проведения алло-ТКМ.
- Рекомендуется пациентам с впервые выявленной тяжелой формой АА или рефрактерной АА проведение терапии элтромбопагом** в дозе от 50 до 150 мг/сут в течение 6 месяцев и более при достижении гематологического эффекта [60].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Также терапия элтромбопагом** возможна как при сохранении одноростковой цитопении (тромбоцитопении), так и панцитопении для улучшения полученных результатов лечения.
- Рекомендуется рефрактерным пациентам проведение повторного курса терапии #АТГ лошадиным через 3 - 6 месяцев при отсутствии эффективности после 1-го курса. В некоторых случаях может быть обсужден вопрос о возможности проведения сочетанной терапии с элтромбопагом** в первой линии [54, 61].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: в настоящее время для повторного курса терапией выбора является также #АТГ лошадиный.
- Пациентам с констатированной рефрактерностью к 1-му курсу терапии АТГ** рекомендуется консультация в трансплантационном центре с целью оценки возможности проведения трансплантации аллогенных гемопоэтических клеток крови или костного мозга от неродственного или гаплоидентичного донора [62, 122, 123].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам с циклоспоринзависимым рецидивом (развитием рецидива на фоне постепенного снижения дозы или сразу после полной отмены - возобновление терапии #циклоспорином** в дозе 5 мг/кг/сут при отсутствии трансфузионной зависимости [12, 54, 58, 59].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: при отсутствии эффекта через 2 - 3 месяца - обсуждение вопроса о проведении курса #АТГ**.
- Рекомендуется пациентам при развитии рецидива АА проведение повторного курса #АТГ лошадиного в прежнем режиме дозирования [2, 54].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Не рекомендуется пациентам с АА проведение монотерапии глюкокортикоидами [12, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: монотерапия глюкокортикоидами не является патогенетической для АА.
- Рекомендуется всем пациентам с АА при наличии показаний проведение заместительной трансфузионной терапии компонентами крови для купирования анемического и геморрагического синдромов (см. раздел 7.3 данных рекомендаций) [12, 13, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: применяется эритроцитная взвесь и тромбоконцентрат, алгоритм применения которых определяется тяжестью течения болезни, то есть выраженностью анемического и геморрагического синдромов и этапом терапии.
Для купирования анемического синдрома при АА должна использоваться эритроцитная масса, очищенная от лейкоцитов и тромбоцитов, с учетом фенотипа эритроцитов донора и реципиента. Для однократного переливания донорских тромбоцитов используют не менее 6 - 10 доз (одна доза - 0,5 - 0,7 x 1011) тромбоконцентрата, полученного от одного донора; трансфузии проводят с частотой от 1 раза в неделю до 1 раза в день в зависимости от следующих факторов: проведение терапии #АТГ** (в дни введения), наличие кровоточивости, лечение антитромботическими средствами, наличие активной инфекции, адекватность трансфузионного прироста. Использование тромбоконцентратов, приготовленных при тромбоцитаферезе, позволяет значительно уменьшить число доноров тромбоцитов на реципиента и снизить риск аллосенсибилизации пациентов. При тяжелом геморрагическом синдроме, характеризующимся маточными, желудочно-кишечными кровотечениями, сопровождающимся развитием ДВС-синдрома, необходимо использовать свежезамороженную плазму.
Тактика использования компонентов крови зависит от этапа ИСТ.
В период подготовки к курсу лечения #АТГ лошадиным необходимо купировать геморрагический синдром, если он имеет место, и повысить количество тромбоцитов выше 30,0 x 109/л, а уровень гемоглобина - выше 90,0 г/л (кровотечение лучше останавливается при хорошем гемоглобине!!!) Частота переливаний определяется индивидуально.
Тактика гемотрансфузионной терапии в период индукции ремиссии на фоне приема #циклоспорина** вырабатывается индивидуально и зависит от минимально оптимальных для данного пациента уровней гемоглобина и тромбоцитов.
Тактика заместительной трансфузионной терапии компонентами крови (донорские эритроциты и тромбоциты) при рефрактерной АА определяется степенью трансфузионной зависимости пациента.
3.2 Хирургическое лечение
- Рекомендуется проведение лапароскопической спленэктомии рефрактерным пациентам после неэффективной ИСТ в сочетании с элтромбопагом** и отсутствии возможности проведения трансплантации костного мозга от альтернативного донора, а также в ряде случаев необходимости проведения дифференциальной диагностики (см. Приложение 3.8) [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: в случаях непереносимости АТГ**, при констатации рефрактерной АА, отсутствии других терапевтических опций и возможности проведения трансплантации костного мозга в программу лечения может быть включена спленэктомия.
- Не рекомендуется проведение лапароскопической спленэктомии у пациентов с выявленными аномалиями кариотипа [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: высокая частота трансформации в МДС/ОМЛ.
3.3 Сопутствующая и сопроводительная терапия
- Рекомендуется всем пациентам с АА на фоне курса терапии АТГ** проведение профилактики язвенной болезни желудка и 12-перстной кишки [63, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: язва желудка или двенадцатиперстной кишки является одним из серьезных побочных эффектов терапии ГКС (включены в профилактику осложнений АТГ**). Механизм ульцерогенного действия ГКС заключается в повышении секреции соляной кислоты в желудке, изменении качественного состава слизи, торможении регенерации поверхностного эпителия. В связи с ульцерогенностью, при использовании ГКС необходимо проводить антисекреторную терапию с целью профилактики стероидных язв.
По результатам метаанализа 300 работ [64], язвы желудка и двенадцатиперстной кишки рубцуются практически во всех случаях, если pH внутрижелудочного содержимого поддерживается более 3 в течение суток на протяжении 18 часов. С учетом указанного правила в качестве противоязвенной терапии в настоящее время могут рассматриваться антациды, блокаторы H2-гистаминовых рецепторов и ингибиторы протонного насоса (ИПН). Согласно одному из последних метаанализов, при использовании ИПН или блокаторов H2-гистаминовых рецепторов достоверно эффективнее достигается рубцевание язвенного дефекта, а также снижается риск повторного кровотечения. Лишь препараты этих двух групп позволяют достигать и поддерживать необходимую pH-среду желудка, при которой происходит заживление гастродуоденальных язв.
В настоящее время с антисекреторной целью для профилактики язвенной болезни желудка и двенадцатиперстной кишки, в том числе на фоне терапии глюкокортикоидами, применяются два класса препаратов: ингибиторы протонного насоса и блокаторы H2-гистаминовых рецепторов [65, 66].
- Рекомендуется всем пациентам с АА на фоне курса терапии АТГ** проведение профилактики бактериальной инфекции [12, 67, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: перед назначением фторхинолонов для профилактики необходимо исследовать мазок со слизистой прямой кишки, исследование повторяют каждые 7 дней. Профилактику отменяют при назначении антибактериальных препаратов системного действия по поводу лихорадки в период нейтропении. Для профилактики используют фторхинолоны, например, ципрофлоксацин** по 0,5 г внутрь 2 раза в сутки.
- Рекомендуется всем пациентам с АА на фоне курса терапии АТГ** проведение профилактики пневмоцистной пневмонии [12, 17, 67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: препаратом выбора для профилактики пневмоцистной пневмонии является #ко-тримоксазол [сульфаметоксазол + триметоприм]**, назначают по 480 мг ежедневно. Пациенты, инфицированные Pneumocystis jirovecii, не должны находиться в одной палате с другими иммунокомпрометированными пациентами.
- Рекомендуется всем пациентам с АА на фоне курса терапии АТГ** проведение первичной противогрибковой профилактики противогрибковыми препаратами системного действия [12, 17, 67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: противогрибковые препараты системного применения назначают за 2 дня до введения АТГ** (в день назначения #преднизолона**).
- Рекомендуется всем пациентам с АА, имевшим в анамнезе инвазивный микоз, вызванный плесневыми грибами (инвазивный аспергиллез, мукормикоз и др.), а также диссеминированный инвазивный кандидоз (инвазия в органы), проведение вторичной противогрибковой профилактики [12, 17, 67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: для вторичной профилактики назначают препарат, при использовании которого было достигнуто излечение от инвазивного микоза, с 1-го дня послекурсового периода или при количестве гранулоцитов <= 0,5 x 109/л, а также в течение всего периода применения иммунодепрессантов.
- Рекомендуется всем пациентам с АА проведение профилактики вирусных инфекций во время проведения курса АТГ** [12, 67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: противовирусную профилактику применяют в течение 3 - 5 недель. Перевод с пероральной на внутривенную форму проводят у больных с мукозитом.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специальных методов реабилитации при АА не существует. Реабилитация пациентов с АА должна носить комплексный характер, охватывая медицинские и социально-психологические аспекты адаптации пациента к нормальной жизни. Объем медицинской реабилитации разрабатывается индивидуально для каждого пациента врачом-реабилитологом при участии врача-гематолога. Кроме этого, программа реабилитации должна учитывать социальные и психологические проблемы пациента и включать социальных работников и медицинских психологов. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Методов профилактики АА в настоящее время не существует.
- Рекомендуется всем пациентам с АА диспансерный прием (осмотр, консультация) врача-гематолога (режим определяется в индивидуальном порядке) для ранней диагностики рецидивов и своевременного начала их лечения [12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: частота наблюдения пациентов с АА после завершения лечения не регламентирована. В течение первого года после завершения лечения пациент должен наблюдаться у врача-гематолога не реже 1 раза в 3 месяца. Далее частота наблюдения устанавливается врачом-гематологом индивидуально, в зависимости от общего состояния и самочувствия пациента, осложнений проведенной терапии, достигнутого ответа на терапию, но не должна быть реже 1 раза в год. При диспансерном наблюдении, кроме осмотра пациента и сбора анамнеза и жалоб, необходимо выполнять общий анализ крови с исследованием лейкоцитарной формулы. Остальные методы обследования могут применяться на усмотрение врача-гематолога.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
6. Организация оказания медицинской помощи
Показания для плановой госпитализации:
1) Проведение курса терапии АТГ**;
2) Проведение трансплантации костного мозга;
3) Профилактические трансфузии донорских компонентов крови
4) Обследование пациента, в том числе включающее биопсии и инвазивные вмешательства, в случаях, когда оно не может быть проведено амбулаторно
5) Плановое хирургическое вмешательство
Показания для экстренной госпитализации:
1) Развитие инфекционных и/или геморрагических осложнений;
2) Глубокая тромбоцитопения и/или анемия, требующие экстренных заместительных трансфузий;
Показания к выписке пациента из стационара:
1) После проведенного курса АТГ** или трансплантации костного мозга - наблюдение в амбулаторном режиме;
2) Купирование геморрагических и/или инфекционных осложнений в полном объеме.
3) Выполненный комплекс диагностических мероприятий
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
нет
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Пациенту при подозрении на АА выполнен сбор анамнеза и жалоб, физикальное обследование
Да/Нет
2.
Пациенту при подозрении на АА, или с установленной АА 1 раз в неделю до достижения ответа, в дальнейшем - 1 раз в месяц, а также при развитии геморрагического синдрома выполнены следующие исследования для верификации диагноза и оценки динамики заболевания: общий (клинический) анализ крови развернутый, исследование уровня ретикулоцитов в крови, исследование уровня тромбоцитов в крови
Да/Нет
3.
Пациенту при диагностике АА, а также в процессе терапии АА каждые 6 - 12 месяцев до достижения ответа: получение цитологического препарата путем пункции (стернальная пункция) и цитологическое исследование мазка костного мозга (миелограммы) для оценки клеточного состава костномозгового кроветворения, гистологического препарата костного мозга и выполнение патолого-анатомическое исследования биопсийного (операционного) материала костного мозга
Да/Нет
4.
Пациенту при диагностике АА выполнено стандартное цитогенетическое исследование (кариотип) клеток КМ и молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом (FISH исследование на наличие моносомии 7) для дифференциальной диагностики с МДС
Оценка выполнения
5.
Пациенту при диагностике АА, констатации рефрактерности АА а также их сиблингам молекулярно-генетическое исследование гистосовместимости (HLA высокого разрешения при помощи секвенирования) для подбора родственного донора костного мозга и консультация в трансплантационном центре с целью выбора метода лечения
Да/Нет
7.
Пациенту с установленной АА проведено иммунофенотипирование клеток периферической крови для диагностики пароксизмальной ночной гемоглобинурии расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин) с целью выявления ПНГ-клона; определение активности лактатдегидрогеназы в крови с целью оценки клинико-лабораторных признаков гемолиза
Да/Нет
Список литературы
1. Isidori A. et al. Iron toxicity - Its effect on the bone marrow.//Blood Rev. England, 2018. Vol. 32, N 6. P. 473 - 479.
2. Marsh J.C.W., Kulasekararaj A.G. Management of the refractory aplastic anemia patient: what are the options?//Blood. 2013. Vol. 122, N 22. P. 3561 - 3567.
3. Frickhofen N. et al. Antithymocyte globulin with or without cyclosporin A: 11-Year follow-up of a randomized trial comparing treatments of aplastic anemia//Blood. 2003. Vol. 101, N 4. P. 1236 - 1242.
4. Kulasekararaj A.G. et al. Somatic mutations identify a subgroup of aplastic anemia patients who progress to myelodysplastic syndrome//Blood. 2014. Vol. 124, N 17. P. 2698 - 2704.
5. Afable M.G., Tiu R. V, Maciejewski J.P. Clonal Evolution in Aplastic Anemia//Hematology. 2011. N 1. P. 90 - 95.
6. Pu J.J. et al. Natural history of paroxysmal nocturnal hemoglobinuria clones in patients presenting as aplastic anemia//Eur. J. Haematol. 2011. Vol. 87, N 1. P. 37 - 45.
7. ![]() G. et al. Paroxysmal nocturnal haemoglobinuria: long-term follow-up and prognostic factors//Lancet. 1996. Vol. 348, N 9027. P. 573 - 577.
G. et al. Paroxysmal nocturnal haemoglobinuria: long-term follow-up and prognostic factors//Lancet. 1996. Vol. 348, N 9027. P. 573 - 577.
8. Kulagin A. et al. Prognostic value of paroxysmal nocturnal haemoglobinuria clone presence in aplastic anaemia patients treated with combined immunosuppression: Results of two-centre prospective study//Br. J. Haematol. 2014. Vol. 164, N 4. P. 546 - 554.
9. Li Y. et al. Long-term follow-up of clonal evolutions in 802 aplastic anemia patients: A single-center experience//Ann. Hematol. 2011. Vol. 90, N 5. P. 529 - 537.
10. Кулагин А.Д., Лисуков И.А., Птушкин В.В., Шилова Е.Р., Цветаева Н.В. М.Е.А. Национальные рекомендации по диагностике и лечению проксизмальной ночной гемоглобинурии//Онкогематология. 2014. Vol. 2. P. 20 - 28.
11. Kaufman D.W. et al. Relative incidence of agranulocytosis and aplastic anemia//Am. J. Hematol. 2006.
12. Михайлова Е.А., Фидарова З.Т., и др. Протокол комбинированной иммуносупрессивной терапии больных апластической анемией (редакция 2024 г.)//Алгоритмы диагностики и протоколы лечения заболеваний системы крови: в двух томах. Под ред. Е.Н. Паровичниковой. Том 1. - М.: Практика, 2024. стр. 271 - 287.
13. Killick S.B. et al. Guidelines for the diagnosis and management of adult aplastic anaemia.//Br. J. Haematol. England, 2016. Vol. 172, N 2. P. 187 - 207.
14. Soulier J. Fanconi anemia.//Hematology Am. Soc. Hematol. Educ. Program. 2011. Vol. 2011. P. 492 - 497.
15. Camitta B.M. What is the definition of cure for aplastic anemia?//Acta Haematologica. 2000. Vol. 103, N 1. P. 16 - 18.
16. Dokal I. Dyskeratosis congenita.//Hematology. 2011. Vol. 2011. P. 480 - 486.
17. Kulasekararaj A, Cavenagh J, Dokal I, Foukaneli T, Gandhi S, Garg M, et al. Guidelines for the diagnosis and management of adultaplastic anaemia: A British Society for HaematologyGuideline. Br J Haematol. 2024; 204(3): 784 - 804. https://doi.org/10.1111/bjh.19236
18. Peslak S.A., Olson T., Babushok D.V. Diagnosis and Treatment of Aplastic Anemia//Current Treatment Options in Oncology. Springer New York LLC, 2017. Vol. 18, N 12.
19. Пантелеев М.А. et al. Практическая коагулология. 2010. 192 p.
20. Hayward C.P.M. How I investigate for bleeding disorders//International Journal of Laboratory Hematology. Blackwell Publishing Ltd, 2018. Vol. 40. P. 6 - 14.
21. Nielsen P. et al. Iron Stores in Patients with Myelodysplasia and Aplastic Anemia.//Blood. 2006. Vol. 108, N 11. P. 3726 - 3726.
22. DeZern A.E., Churpek J.E. Approach to the diagnosis of aplastic anemia//Blood Adv. American Society of Hematology, 2021. Vol. 5, N 12. P. 2660 - 2671.
23. Kelsey P. et al. Guidelines for the use of platelet transfusions//Br. J. Haematol. 2003. Vol. 122, N 1. P. 10 - 23.
24. Maciejewski J.P., Mufti G.J. Whole genome scanning as a cytogenetic tool in hematologic malignancies//Blood. 2008. Vol. 112, N 4. P. 965 - 974.
25. Maciejewski J.P. et al. Distinct clinical outcomes for cytogenetic abnormalities evolving from aplastic anemia//Blood. 2002. Vol. 99, N 9. P. 3129 - 3135.
26. Gupta V. et al. Clinical relevance of cytogenetic abnormalities at diagnosis of acquired aplastic anaemia in adults//Br. J. Haematol. 2006. Vol. 134, N 1. P. 95 - 99.
27. Miano M., Dufour C. The diagnosis and treatment of aplastic anemia: a review//Int. J. Hematol. 2015. Vol. 101, N 6. P. 527 - 535.
28. Dumitriu B. et al. Red cells, iron, and erythropoiesis: Telomere attrition and candidate gene mutations preceding monosomy 7 in aplastic anemia//Blood. 2015. Vol. 125, N 4. P. 706 - 709.
29. Jerez A. et al. STAT3 mutations indicate the presence of subclinical T-cell clones in a subset of aplastic anemia and myelodysplastic syndrome patients//Blood. 2013. Vol. 122, N 14. P. 2453 - 2459.
30. Du Y. et al. Observational Monitoring of Patients with Aplastic Anemia and Low/Intermediate-1 Risk of Myelodysplastic Syndromes Complicated with Iron Overload.//Acta Haematol. Switzerland, 2017. Vol. 138, N 2. P. 119 - 128.
31. Borowitz M.J. et al. Guidelines for the diagnosis and monitoring of paroxysmal nocturnal hemoglobinuria and related disorders by flow cytometry//Cytom. Part B - Clin. Cytom. Wiley-Liss Inc., 2010. Vol. 78, N 4. P. 211 - 230.
32. Ogawa S. Clonal hematopoiesis in acquired aplastic anemia//Blood. 2016. Vol. 128, N 3. P. 337 - 347.
33. Parker C.J. Update on the diagnosis and management of paroxysmal nocturnal hemoglobinuria.//Hematology. United States, 2016. Vol. 2016, N 1. P. 208 - 216.
34. Brown K.E. et al. Hepatitis-associated aplastic anemia//N. Engl. J. Med. 1997. Vol. 336, N 15. P. 1059 - 1064.
35. Карагюлян С.Р. et al. Технические сложности выполнения спленэктомии при заболеваниях системы крови//Клиническая онкогематология. 2017. Vol. 10, N 1. P. 101 - 107.
36. Alter B.P. Diagnosis, genetics, and management of inherited bone marrow failure syndromes.//Hematology. 2007. P. 29 - 39.
37. Михайлова Е.А. et al. Клинические рекомендации по диагностике и лечению апластической анемии (редакция 2019 г.)//Гематология и трансфузилогия. 2020. Vol. 65, N 2. P. 208 - 226.
38. Smith L.G. Reactions to blood transfusions//Am. J. Nurs. 1984. Vol. 84, N 9. P. 1096 - 1101.
39. Scheinberg P. Aplastic anemia: therapeutic updates in immunosuppression and transplantation.//Hematology. 2012. P. 292 - 300.
40. Townsley D.M., Winkler T. Nontransplant therapy for bone marrow failure//ASH Educ. Progr. B. 2016. Vol. 2016, N 1. P. 83 - 89.
41. Desmond R. et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug//Blood. 2014. Vol. 123, N 12. P. 1818 - 1825.
42. Desmond R. et al. Eltrombopag in Aplastic Anemia//Seminars in Hematology. 2015. Vol. 52, N 1. P. 31 - 37.
43. Fattizzo B. et al. Iron mobilization in a real life cohort of aplastic anemia patients treated with eltrombopag.//American journal of hematology. United States, 2019.
44. Lee J.W. et al. Iron chelation therapy with deferasirox in patients with aplastic anemia: A subgroup analysis of 116 patients from the EPIC trial//Blood. 2010. Vol. 116, N 14. P. 2448 - 2454.
45. Bacigalupo A. et al. Treatment of acquired severe aplastic anemia: Bone marrow transplantation compared with immunosuppressive therapy - The European Group for blood and marrow transplantation experience//Semin. Hematol. 2000. Vol. 37, N 1. P. 69 - 80.
46. Bacigalupo A. et al. Long-term follow-up of severe aplastic anaemia patients treated with antithymocyte globulin//Br. J. Haematol. 1989. Vol. 73, N 1. P. 121 - 126.
47. Rosenfeld S. et al. Antithymocyte Globulin and Cyclosporine for Severe Aplastic Anemia: Association between Hematologic Response and Long-term Outcome//J. Am. Med. Assoc. 2003. Vol. 289, N 9. P. 1130 - 1135.
48. Михайлова Е.А., Фидарова З.Т., Устинова Е.Н., Троицкая В.В., Гальцева И.В., Шитарева И.В. и др. Комбинированная иммуносупрессивная терапия у больных апластической анемией: эффективность повторных курсов.//Гематология и трансфузиология. 2014. Vol. 59, N 4. P. 11 - 18.
49. Scheinberg P. et al. Predicting response to immunosuppressive therapy and survival in severe aplastic anaemia//Br. J. Haematol. 2009. Vol. 144, N 2. P. 206 - 216.
50.  C., Dowsett M., Reis-Filho J.S. Revisiting the technical validation of tumour biomarker assays: How to open a Pandora's box//BMC Med. 2011. Vol. 9.
C., Dowsett M., Reis-Filho J.S. Revisiting the technical validation of tumour biomarker assays: How to open a Pandora's box//BMC Med. 2011. Vol. 9.
51. Bacigalupo A. et al. Bone marrow transplantation (BMT) versus immunosuppression for the treatment of severe aplastic anaemia (SAA): A report of the EBMT SAA Working Party//Br. J. Haematol. 1988. Vol. 70, N 2. P. 177 - 182.
52. Scheinberg P. et al. Horse antithymocyte globulin as salvage therapy after rabbit antithymocyte globulin for severe aplastic anemia//Am. J. Hematol. 2014. Vol. 89, N 5. P. 467 - 469.
53. Peffault de Latour R. et al. Nationwide survey on the use of horse antithymocyte globulins (ATGAM) in patients with acquired aplastic anemia: A report on behalf of the French Reference Center for Aplastic Anemia.//Am. J. Hematol. United States, 2018. Vol. 93, N 5. P. 635 - 642.
54. Михайлова Е.А. et al. Комбинированная иммуносупрессивная терапия больных апластической анемией: повторные курсы антитимоцитарного глобулина//ГЕМАТОЛОГИЯ И ТРАНСФУЗИОЛОГИЯ. 2014. Vol. 59, N 4. P. 11 - 18.
55. Bacigalupo A. How I treat acquired aplastic anemia//Blood. 2017. Vol. 129, N 11. P. 1428 - 1436.
56. Scheinberg P., Young N.S. How I treat acquired aplastic anemia.//Blood. 2012. Vol. 120, N 6. P. 1185 - 1196.
57. Scheinberg P. et al. Horse versus rabbit antithymocyte globulin in acquired aplastic anemia//N. Engl. J. Med. 2011. Vol. 365, N 5. P. 430 - 438.
58. Gafter-Gvili A. et al. ATG plus cyclosporine reduces all-cause mortality in patients with severe aplastic anemia--systematic review and meta-analysis//Acta Haematol. Acta Haematol, 2008. Vol. 120, N 4. P. 237 - 243.
59. Yamazaki H. et al. Cyclosporine Therapy for Acquired Aplastic Anemia: Predictive Factors for the Response and Long-term Prognosis//Int. J. Hematol. 2007 853. Springer, 2007. Vol. 85, N 3. P. 186 - 190.
60. Hong Y. et al. Efficacy and Safety of Eltrombopag for Aplastic Anemia: A Systematic Review and Meta-analysis.//Clin. Drug Investig. 2019. Vol. 39, N 2. P. 141 - 156.
61. Olnes M.J. et al. Eltrombopag and improved hematopoiesis in refractory aplastic anemia.//N. Engl. J. Med. 2012. Vol. 367, N 1. P. 11 - 19.
62. Dietz A.C. et al. Evolving Hematopoietic Stem Cell Transplantation Strategies in Severe Aplastic Anemia//Curr. Opin. Pediatr. NIH Public Access, 2016. Vol. 28, N 1. P. 3.
63. Park Y.B. et al. Incidence and etiology of overt gastrointestinal bleeding in adult patients with aplastic anemia//Dig. Dis. Sci. Dig Dis Sci, 2010. Vol. 55, N 1. P. 73 - 81.
64. Burget D.W., Chiverton S.G., Hunt R.H. Is there an optimal degree of acid suppression for healing of duodenal ulcers? A model of the relationship between ulcer healing and acid suppression//Gastroenterology. Gastroenterology, 1990. Vol. 99, N 2. P. 345 - 351.
65. Ивашкин В.Т. et al. Диагностика и лечение язвенной болезни у взрослых (Клинические рекомендации Российской гастроэнтерологической ассоциации, Российского общества колоректальных хирургов и Российского эндоскопического общества).//Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2020. Vol. 30, N 1. P. 49 - 70.
66. Scally B. et al. Effects of gastroprotectant drugs for the prevention and treatment of peptic ulcer disease and its complications: a meta-analysis of randomised trials//Lancet Gastroenterol. Hepatol. Elsevier Ltd, 2018. Vol. 3, N 4. P. 231 - 241.
67.  B. et al. Supportive care in severe and very severe aplastic anemia//Bone Marrow Transplantation. 2013. Vol. 48, N 2. P. 168 - 173.
B. et al. Supportive care in severe and very severe aplastic anemia//Bone Marrow Transplantation. 2013. Vol. 48, N 2. P. 168 - 173.
68. Fan E., Brodie D., Slutsky A.S. Acute respiratory distress syndrome advances in diagnosis and treatment//JAMA - Journal of the American Medical Association. American Medical Association, 2018. Vol. 319, N 7. P. 698 - 710.
69. Young P. et al. Effect of a buffered crystalloid solution vs saline on acute kidney injury among patients in the intensive care unit: The SPLIT randomized clinical trial//JAMA - J. Am. Med. Assoc. American Medical Association, 2015. Vol. 314, N 16. P. 1701 - 1710.
70. Hoorn E.J. Intravenous fluids: balancing solutions//Journal of Nephrology. Springer New York LLC, 2017. Vol. 30, N 4. P. 485 - 492.
71. Arends J. et al. ESPEN guidelines on nutrition in cancer patients//Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, N 1. P. 11 - 48.
72. Шихмирзаев Т.А. et al. Фармакопрофилактика трансфузионных реакций//Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2018. Vol. 13, N 2. P. 95 - 99.
73. Аксельрод Б.А. et al. Клиническое использование эритроцитсодержащих компонентов донорской крови//Гематология и трансфузиология. 2018. Vol. 63, N 4. P. 372 - 435.
74. Криволапов Ю.А. Технические аспекты выполнения трепанобиопсий костного мозга. Клиническая онкогематология 2014; 7: 290 - 295//Клиническая онкогематология. 2014. Vol. 7. P. 290 - 295.
75. Wang J. et al. Diagnostic utility of bilateral bone marrow examination: Significance of morphologic and ancillary technique study in malignancy//Cancer. Cancer, 2002. Vol. 94, N 5. P. 1522 - 1531.
76. SPIRIN M., GALSTYAN G., DROKOV M. Central venous access in lymphoma patients (pts) with superior vena cava syndrome (SVCS)//INTENSIVE CARE Med. Exp. 2019. Vol. 7, N Suppl. 3:001341. P. 388 - 389.
77. Pluschnig U. et al. Extravasation emergencies: state-of-the-art management and progress in clinical research.//Memo. Springer, 2016. Vol. 9, N 4. P. 226 - 230.
78. Zeidler K. et al. Optimal preprocedural platelet transfusion threshold for central venous catheter insertions in patients with thrombocytopenia.//Transfusion. 2011. Vol. 51, N 11. P. 2269 - 2276.
79. Zerati A.E. et al. Totally implantable venous catheters: history, implantation technique and complications.//J Vasc Bras. 2017. Vol. 16, N 2. P. 128 - 139.
80. Gow K.W., Tapper D., Hickman R.O. Between the lines: The 50th anniversary of long-term central venous catheters//Am. J. Surg. Elsevier Ltd, 2017. Vol. 213, N 5. P. 837 - 848.
81. Yeral M. et al. Tunnelled central venous catheter-related problems in the early phase of haematopoietic stem cell transplantation and effects on transplant outcome.//Turkish J. Haematol. Off. J. Turkish Soc. Haematol. Galenos Yayinevi, 2015. Vol. 32, N 1. P. 51 - 57.
82. Maki D.G., Kluger D.M., Crnich C.J. The Risk of Bloodstream Infection in Adults With Different Intravascular Devices: A Systematic Review of 200 Published Prospective Studies//Mayo Clin. Proc. Elsevier, 2006. Vol. 81, N 9. P. 1159 - 1171.
83. Hamilton H. Central Venous Catheters/ed. Bodenham A.R. Oxford, UK: Wiley-Blackwell, 2009.
84. Biffi R. Introduction and Overview of PICC History//Peripherally Inserted Central Venous Catheters. Milano: Springer Milan, 2014. P. 1 - 6.
85. Linenberger M.L. Catheter-related thrombosis: risks, diagnosis, and management.//J. Natl. Compr. Canc. Netw. 2006. Vol. 4, N 9. P. 889 - 901.
86. Lee A.Y.Y., Kamphuisen P.W. Epidemiology and prevention of catheter-related thrombosis in patients with cancer//J. Thromb. Haemost. 2012. N 10. P. 1491 - 1499.
87. Цепенщинков Л., Лядов В.К. Периферически имплантируемый центральный венозный катетер: обзор литературы.//Клиническая онкогематология. 2014. Vol. 7, N 2. P. 220 - 228.
88. Linder L.E. et al. Material thrombogenicity in central venous catheterization: a comparison between soft, antebrachial catheters of silicone elastomer and polyurethane.//JPEN. J. Parenter. Enteral Nutr. 1984. Vol. 8, N 4. P. 399 - 406.
89. Watters V.A., Grant J.P. Use of Electrocardiogram to Position Right Atrial Catheters During Surgery//Ann. Surg. Vol. 225, N 2. P. 165 - 171.
90. Taal M.W., Chesterton L.J., McIntyre C.W. Venography at insertion of tunnelled internal jugular vein dialysis catheters reveals significant occult stenosis//Nephrol. Dial. Transplant. Oxford University Press, 2004. Vol. 19, N 6. P. 1542 - 1545.
91. Lobato E.B. et al. Cross-sectional area of the right and left internal jugular veins.//J. Cardiothorac. Vasc. Anesth. 1999. Vol. 13, N 2. P. 136 - 138.
92. Червонцева А.М. Повреждение сосудистого эндотелия в процессе лечения острых миелоидных лейкозов. 2008.
93. Багирова Н.С. Инфекции, связанные с внутрисосудистыми устройствами: терминология, диагностика, профилактика и терапия//Злокачественные опухоли. 2014. N 3. P. 164 - 171.
94. Bannon M.P., Heller S.F., Rivera M. Anatomic considerations for central venous cannulation.//Risk Manag. Healthc. Policy. Dove Press, 2011. Vol. 4. P. 27 - 39.
95. Milling T.J. et al. Randomized, controlled clinical trial of point-of-care limited ultrasonography assistance of central venous cannulation: The Third Sonography Outcomes Assessment Program (SOAP-3) Trial*//Crit. Care Med. 2005. Vol. 33, N 8. P. 1764 - 1769.
96. Зозуля Н.И., Кумскова М.А. Протокол диагностики и лечения гемофилии.//Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Том 1. Практика/ed. Савченко В.Г. Москва, 2018. P. 333 - 358.
97. Галстян Г.М. НАРУШЕНИЯ ГЕМОСТАЗА, ОБУСЛОВЛЕННЫЕ ДЕФИЦИТОМ ВИТАМИН К-ЗАВИСИМЫХ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ - ПАТОГЕНЕЗ, СПОСОБЫ КОРРЕКЦИИ И РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ.//Гематология и трансфузиология. 2012. Vol. 27, N 2. P. 7 - 21.
98. Habermalz B. et al. Laparoscopic splenectomy: The clinical practice guidelines of the European Association for Endoscopic Surgery (EAES)//Surgical Endoscopy and Other Interventional Techniques. Surg Endosc, 2008. Vol. 22, N 4. P. 821 - 848.
99. Воробьев А.И. et al. Критические состояния при гемобластозах (типичные формы и выживаемость в условиях отделения реанимации).//Терапевтический архив. 1993. Vol. 65, N 7. P. 3 - 6.
100. Галстян Г.М., Городецкий В.М. Опыт работы отделения реанимации и интенсивной терапии ФГБУ ГНЦ МЗиСР РФ//Клиническая онкогематология. 2011. Vol. 4, N 1. P. 75 - 78.
101. Lamia B. et al. Changes in severity and organ failure scores as prognostic factors in onco-hematological malignancy patients admitted to the ICU//Intensive Care Med. Intensive Care Med, 2006. Vol. 32, N 10. P. 1560 - 1568.
102. Evison J.M. et al. Intensive care unit admission in patients with haematological disease: incidence, outcome and prognostic factors. 2001.
103. Silfvast T. et al. Multiple organ failure and outcome of critically ill patients with haematological malignancy//Acta Anaesthesiol. Scand. Acta Anaesthesiol Scand, 2003. Vol. 47, N 3. P. 301 - 306.
104. Benoit D.D. et al. Outcome and early prognostic indicators in patients with a hematologic malignancy admitted to the intensive care unit for a life-threatening complication//Crit. Care Med. Crit Care Med, 2003. Vol. 31, N 1. P. 104 - 112.
105. Schellongowski P. et al. Prognostic factors for intensive care unit admission, intensive care outcome, and post-intensive care survival in patients with de novo acute myeloid leukemia: a single center experience//Haematologica. 2011. Vol. 96, N 2. P. 231 - 237.
106. ![]() M.G. et al. Hematologic malignancies in the medical intensive care unit - Outcomes and prognostic factors//Hematology. Maney Publishing, 2015. Vol. 20, N 5. P. 247 - 253.
M.G. et al. Hematologic malignancies in the medical intensive care unit - Outcomes and prognostic factors//Hematology. Maney Publishing, 2015. Vol. 20, N 5. P. 247 - 253.
107. Jackson K. et al. Outcomes and prognostic factors for patients with acute myeloid leukemia admitted to the intensive care unit//Leuk. Lymphoma. Leuk Lymphoma, 2013. Vol. 55, N April. P. 1 - 8.
108. Ahmed T. et al. Outcomes and changes in code status of patients with acute myeloid leukemia undergoing induction chemotherapy who were transferred to the intensive care unit//Leuk. Res. Elsevier Ltd, 2017. Vol. 62. P. 51 - 55.
109. Протоколы трансплантации аллогенных гепомоэтических стволовых клеток. Под ред. В.Г. Савченко. М.: Практика, 2020. 320 p.
110. Willis L. et al. Recent developments in drug therapy for aplastic anemia//Ann. Pharmacother. Ann Pharmacother, 2014. Vol. 48, N 11. P. 1469 - 1478.
111. Bonfim C. et al. Bone Marrow Transplantation (BMT) for heavily Transfused Patients (pts) with Severe Aplastic Anemia (SAA): 147 pts treated at the same institution with Busulfan (BU) + Cyclophosphamide (CY)//Biol. Blood Marrow Transplant. Elsevier, 2006. Vol. 12, N 2. P. 28.
112. de Latour R.P., Risitano A.M., Dufour C. Severe Aplastic Anemia and PNH//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 579 - 587.
113. Michonneau D., ![]() G. GVHD Prophylaxis (Immunosuppression)//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 177 - 183.
G. GVHD Prophylaxis (Immunosuppression)//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 177 - 183.
114. Nagler A., Shimoni A. Conditioning//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 99 - 109.
115. Baron F. et al. Anti-thymocyte globulin as graft-versus-host disease prevention in the setting of allogeneic peripheral blood stem cell transplantation: a review from the Acute Leukemia Working Party of the European Society for Blood and Marrow Transplantation//Haematologica. 2017. Vol. 102, N 2.
116. Basak G.W. Gastrointestinal Complications//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 2019. P. 381 - 386.
117. Chaturvedi S., George B., Savani B.N. Bleeding and Thrombotic Complications//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 2019. P. 301 - 306.
118. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
119. Gratwohl A. The EBMT risk score//Bone Marrow Transplantation. Nature Publishing Group, 2012. Vol. 47, N 6. P. 749 - 756.
120. Sorror M.L. et al. Prospective Validation of the Predictive Power of the Hematopoietic Cell Transplantation Comorbidity Index: A Center for International Blood and Marrow Transplant Research Study//Biol. Blood Marrow Transplant. Elsevier Inc., 2015. Vol. 21, N 8. P. 1479 - 1487.
121. Сопроводительная терапия при лечении заболеваний системы крови. Практическое руководство/под ред. Е.Н. Паровичниковой, Г.М. Галстяна. М.: Практика, 2024. 512 с.
122. Трансплантация аллогенных гемопоэтических стволовых клеток. Практическое руководство. Под ред. Е.Н. Паровичниковой, Т.В. Гапоновой, М.Ю. Дрокова. - М.: Практика, 2024. - 640 с.
123. Дроков М.Ю, Моисеев И.С., Олейник Ю.А. Эффективность и безопасность метода трансплантации аллогенных гемопоэтических стволовых клеток и костного мозга у взрослых пациентов с заболеваниями системы крови: опрос экспертов трансплантационных центров Российской Федерации, CTT JOURNAL, March (13) с. 49 - 92
124. Scheinberg P, Rios O, Scheinberg P, Weinstein B, Wu CO, Young NS. Prolonged cyclosporine administration after antithymocyteglobulin delays but does not prevent relapse in severe aplastic anemia. Am J Hematol. 2014; 89(6): 571 - 4.
125. Peffault de Latour R, Kulasekararaj A, Iacobelli S, Terwel SR, Cook R, Griffin M, et al. Eltrombopag added to immunosuppression insevere aplastic anemia. N Engl J Med. 2022; 386(1): 11 - 23
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Паровичникова Е.Н. д.м.н., генеральный директор ФГБУ НМИЦ гематологии Минздрава России, Москва, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
2. Михайлова Е.А. д.м.н., профессор, ведущий научный сотрудник отделения химиотерапии гемобластозов и депрессий кроветворения ФГБУ НМИЦ гематологии Минздрава России, Москва, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
3. Фидарова З.Т. к.м.н., заведующий отделением химиотерапии гемобластозов и депрессий кроветворения с блоком трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ НМИЦ гематологии Минздрава России, Москва, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
4. Троицкая В.В. д.м.н., первый заместитель генерального директора ФГБУ НМИЦ гематологии Минздрава России, Москва, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
5. Гапонова Т.В. д.м.н., первый заместитель Генерального директора ФГБУ НМИЦ гематологии Минздрава России, Москва, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
6. Клясова Г.А. д.м.н., профессор, заведующая научно-клинической лабораторией микробиологии ФГБУ НМИЦ гематологии Минздрава России, Москва, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
7. Кулагин А.Д. д.м.н., проф., директор НИИ детской гематологии и трансплантологии им. Р.М. Горбачевой, Санкт-Петербург. Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
8. Лапин В.А. врач-гематолог ГБУЗ ЯО Областная клиническая больница, Ярославль, главный гематолог Ярославской области, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
9. Самойлова О.С. к.м.н., заведующая отделением гематологии ГБУЗ Нижегородской области Нижегородская областная клиническая больница им. Н.А. Семашко, Нижний Новгород, Ассоциация содействия развитию гематологии, трансфузиологии и трансплантации костного мозга "Национальное гематологическое общество".
10. Войцеховский В.В. д.м.н., доцент, заведующий кафедрой госпитальной терапии с курсом фармакологии Амурской государственной медицинской академии, Благовещенск, Амурская область.
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория клинических рекомендаций:
1. Врачи-гематологи;
2. Врачи-онкологи;
3. Врачи-терапевты.
Методы, использованные для оценки качества и силы доказательств:
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных КИ с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2.2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных КИ с применением метаанализа
2
Отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Описание метода валидации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена и участковых терапевтов в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций, как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев, с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации, регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Предварительная версия была выставлена для широкого обсуждения на сайте Национального гематологического общества с целью широкого обсуждения и совершенствовании рекомендаций.
Проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ПРОТОКОЛ ПРИМЕНЕНИЯ АТГ** ПРИ АА N 1 [12, 17, 54]
За 2 дня до начала терапии АТГ
#Ко-тримоксазол [сульфаметоксазол + триметоприм]**
480 мг внутрь 1 раз в сутки
#Преднизолон**
30 мг в сутки внутрь
Ежедневно в течение 5 дней (4 дней при дозе 40 мг/кг/сут)
#АТГ <1> лошадиный
20 мг/кг (или 40 мг/кг) в сутки внутривенно капельно в течение 12 часов <2>
Глюкокортикоиды
#Преднизолон**, 60 мг, или #Метилпреднизолон**, 125 - 250 мг, 2 раза в сутки внутривенно капельно (до и после АТГ**)
Антигистаминные средства системного действия
2 раза в сутки внутривенно капельно (до и после АТГ**) в соответствии с зарегистрированными показаниями
Трансфузионная терапия
Донорские тромбоциты
Тромбоконцентрат, при тромбоцитах менее 20,0 x 109/л и при геморрагическом синдроме ежедневно
Донорские эритроциты
Эритроцитная масса, при гемоглобине менее 80 г/л ежедневно или через день
С 14-го дня курса <3> (при отсутствии или после исчезновения клиники сывороточной болезни) начинают постепенное снижение суточной дозы #преднизолона**, принимаемого внутрь, до полной отмены на 21 - 24-й день.
--------------------------------
<1> Перед первым введением АТГ** проверяется индивидуальная чувствительность пациента к белку с помощью двукратной внутрикожной пробы с антитоксином столбнячным**.
<2> Суточная доза препарата вводится в 1200 - 1500 мл физиологического раствора (раствор натрия хлорида**).
<3> Первый день курса - день первого введения АТГ**.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
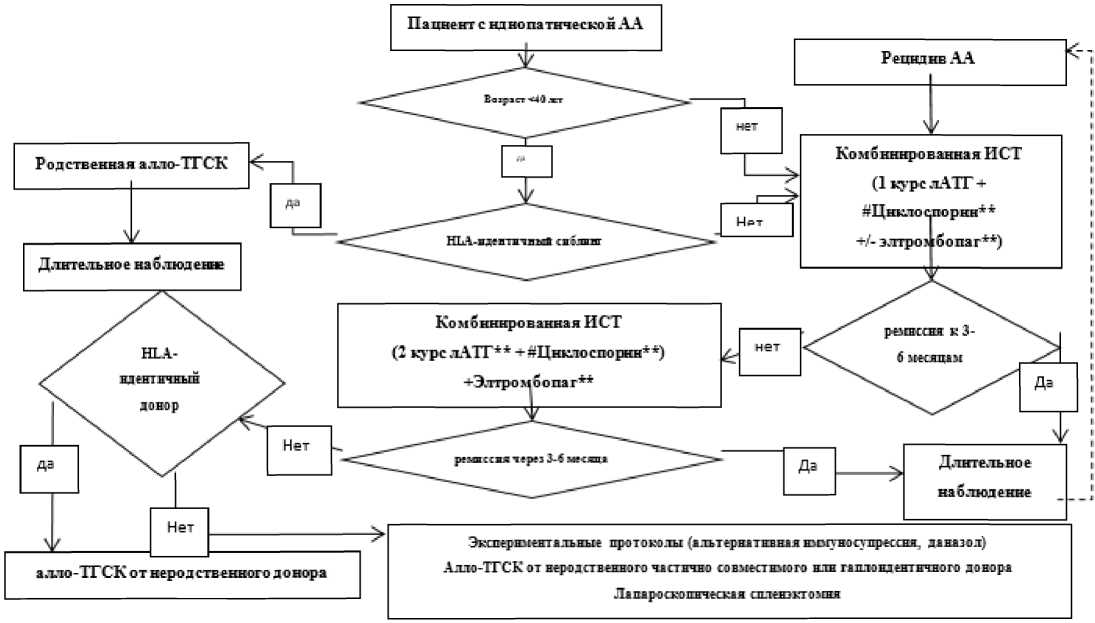
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Апластическая анемия - редкое и опасное для жизни заболевание системы крови, вызванное неправильной работой костного мозга. У людей с апластической анемией костный мозг не вырабатывает достаточное количество всех трех типов клеток крови - эритроцитов, лейкоцитов и тромбоцитов.
Эритроциты необходимы для переноса кислорода по организму. Лейкоциты помогают нам бороться с инфекциями, микробами и другими патогенными микроорганизмами. Тромбоциты отвечают за остановку кровотечений и заживление гематом.
Слово "апластический" означает неспособность организма создавать новые клетки, в результате чего гемопоэтическая ткань не может расти или регенерировать.
Апластическая анемия может возникнуть у человека любого возраста, но чаще всего встречается у молодых (от 10 до 20 лет) и пожилых (старше 60 лет) людей.
По оценкам, в Великобритании ежегодно диагностируется от 100 до 150 человек. Это около 2 человек на 1 000 000 населения. Это делает апластическую анемию крайне редким заболеванием. Точное время возникновения заболевания неизвестно, и для установления исходной цифры необходимы дополнительные исследования.
Апластическая анемия может передаваться по наследству (относиться только к конституциональным формам АА), но чаще всего это приобретенное заболевание, которое развивается на определенном этапе жизни человека.
Считается, что во многих случаях приобретенная апластическая анемия возникает из-за повреждения стволовых клеток крови аутоиммунной реакцией в организме. Аутоиммунная реакция - это когда иммунная система организма борется с собственными клетками, ошибочно считая их поврежденными или дефектными. Когда это происходит, функция костного мозга начинает замедляться, что приводит к снижению производства всех типов клеток крови. Аутоиммунные реакции могут иметь скрытую причину - примерно один из десяти человек с апластической анемией недавно перенес вирусную инфекцию. Другие потенциальные триггеры были идентифицированы как воздействие определенных лекарств или химикатов, а также воздействие радиации. Однако во многих случаях причина остается неизвестной. Когда нет очевидной причины для иммунной системы повреждать стволовые клетки таким образом, устанавливается диагноз идиопатическая апластическая анемия.
Наиболее распространенными симптомами апластической анемии являются анемия, вызванная снижением количества эритроцитов, с сопутствующим чувством усталости, одышкой, головными болями и, иногда, болями в груди. Недостаток лейкоцитов может привести к инфекциям, таким как инфекции придаточных пазух носа, горла и легких, кишечные инфекции. Низкое количество тромбоцитов приводит к склонности к легким кровотечениям, например, из носа или десен, может привести к необъяснимым гематомам, кровяным волдырям во рту, а также к серьезным кровотечениям, например, в мозг или кишечник.
Так как АА предположительно имеет аутоиммунную природу, то для ее лечения широко применяется иммуносупрессивная терапия - то есть терапия, которая направлена на подавление иммунной системы, "атакующей" клетки костного мозга. Обычно такая терапия включает в себя иммуноглобулинантитимоцитарный** (АТГ) в сочетании с #циклоспорином**; для профилактики побочных действий АТГ могут использоваться глюкокортикоиды, такие как метилпреднизолон**. Ответ на эту терапию, как правило, возникает медленно: в случае успеха костный мозг постепенно восстанавливается через несколько недель или месяцев после введения лекарств и начинает производить здоровые клетки.
Для проведения курса иммуносупрессивной терапии АТГ обычно необходима госпитализация. Основные осложнения в ходе лечения - это инфекции и кровотечения. Если нет ответа на первый курс терапии, может быть проведен повторный курс. Иммуносупрессивная терапия эффективна приблизительно в 70% случаев. К сожалению, у части больных после нее возникают рецидивы болезни.
Трансплантация аллогенных гемопоэтических стволовых клеток в случае успеха приводит к полному излечению. Трансплантация особенно предпочтительна в случаях, когда больной молод и у него есть полностью совместимый родственный донор (брат или сестра). В отсутствие родственного донора допустимо использование совместимого неродственного донора или наполовину совместимого родственного донора (гаплотрансплантация). Ранее считалось, что трансплантации от неродственных или частично совместимых доноров при АА являются очень рискованными, но сейчас их результаты существенно улучшились.
В ходе лечения АА нередко нужна интенсивная заместительная терапия компонентами крови (переливания донорских тромбоцитов, эритроцитов. Однако если планируется трансплантация костного мозга, то нужно помнить, что множественные переливания перед трансплантацией повышают вероятность отторжения трансплантата.
Очень важны профилактика и лечение бактериальных, вирусных и грибковых инфекций, которые представляют большую опасность для больных АА. Для лечения применяют сочетания эффективных антибактериальных препаратов системного действия и противогрибковых препаратов системного действия, иногда на протяжении долгого времени.
В качестве дополнительной терапии используются также факторы роста - препараты, помогающие костному мозгу производить нужные клетки. Среди них можно назвать элтромбопаг**, стимулирующий стволовые клетки крови и выработку всех трех линий клеток крови.
Без лечения больные тяжелыми формами апластической анемии погибают в течение нескольких месяцев. Однако при современном адекватном лечении прогноз довольно хороший.
Как уже говорилось, во многих случаях эффективна иммуносупрессивная терапия. Больные после такой терапии могут продолжительное время чувствовать себя хорошо, однако у некоторых из них возникает рецидив (возвращение) болезни. Для своевременного обнаружения рецидива необходимы регулярные проверки, в первую очередь, анализы крови.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не применяются.
