"Клинические рекомендации "Синдром гипоплазии левых отделов сердца"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
СИНДРОМ ГИПОПЛАЗИИ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: Q23.4
Год утверждения (частота пересмотра): 2024
Возрастная категория: Дети
Пересмотр не позднее: 2026
ID: 602
Разработчик клинической рекомендации
- Ассоциация сердечно-сосудистых хирургов России
- Всероссийская общественная организация "Ассоциация детских кардиологов России"
- Общероссийская общественная организация содействия развитию лучевой диагностики и терапии "Российское общество рентгенологов и радиологов"
- Национальная ассоциация экспертов по санаторно-курортному лечению
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
Ао - аорта
АД - артериальное давление
АК - аортальный клапан
АКГ - ангиокардиография
ВОЛЖ - выводной отдел левого желудочка
ДКПА - двунаправленный кавопульмональный анастомоз
ДМЖП - дефект межжелудочковой перегородки
ДМПП - дефект межпредсердной перегородки
ИВЛ - искусственная вентиляция легких
иКДО - индекс конечно-диастолического объема
КА - коарктация аорты
КТ - компьютерная томография
ЛЖ - левый желудочек
ЛП - левое предсердие
МК - митральный клапан
МПС - межпредсердное сообщение
МРТ - магнитно-резонансная томография
НК - недостаточность кровообращения
ОАП - открытый артериальный проток
ООО - открытое овальное окно
ОРИТН - отделение реанимации и интенсивной терапии новорожденных
ПТФЭ - политетрафторэтилен
СГЛС - синдром гипоплазии левых отделов сердца
СПОН - синдром полиорганной недостаточности
ЧДД - частота дыхательных движений
ЭКГ - электрокардиография
ЭхоКГ - эхокардиография
Термины и определения
Гипоплазия - термин, означающий недоразвитие ткани, органа или целого организма, обусловленное нарушениями в процессе эмбриогенеза.
Стеноз - аномальное сужение какого-либо просвета или отверстия, например, кровеносного сосуда или сердечного клапана.
Атрезия - врожденное отсутствие или приобретенное заращение естественных отверстий и каналов в организме.
Катетеризация полостей сердца и ангиокардиография - инвазивнный метод диагностики и оценки центральной гемодинамики, предполагающий непосредственное измерение давления в полостях сердца, получение проб крови из них для оценки газового состава и их контрастирование.
"Левое сердце" является условной морфологической единицей, которая включает в себя левое предсердие, митральный клапан, левый желудочек, аортальный клапан и аорту. Каждая из перечисленных структур играет важную роль в обеспечении адекватного функционирования левых отделов сердца.
Гибридный I этап хирургической коррекции СГЛС - вариант первого этапа хирургической гемодинамической коррекции СГЛС, заключающийся в раздельном суживании легочных артерий и стентировании открытого артериального протока.
Комплекс гипоплазии левых отделов сердца - представляет различное сочетание следующих шести критериев: гипоплазия митрального клапана без выраженного стеноза, гипоплазия левого желудочка, сужение выводного отдела левого желудочка, гипоплазия аортального клапана без выраженного стеноза, гипоплазия дуги аорты и наличие антеградного тока крови через левые отделы сердца и восходящую аорту. Сочетание таких аномалий обычно не приводит к тяжелому нарушению функции левого желудочка, что создает предпосылки к последующей хирургической конверсии гемодинамики по двухжелудочковому пути.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Синдром гипоплазии левых отделов сердца (СГЛС) - термин, используемый для описания вариантов врожденного порока сердца, который представлен широким спектром недоразвития структур "левого сердца". Основной анатомической чертой, объединяющей весь спектр патологий левого сердца в единый синдром гипоплазии левого сердца, является - патология аортального и/или митрального клапана, (чаще атрезия) и как следствие - недоразвитие (гипоплазия) структур левого сердца, восходящей аорты и дуги аорты [1 - 5, 151].
Определение синдром гипоплазии левых отделов сердца является функциональным, а не морфологическим, несмотря на то, что морфологические аномалии являются основной причиной функциональной несостоятельности левых отделов сердца.
Синдром гипоплазии левых отделов сердца с физиологической точки зрения - это неспособность "левого сердца" поддерживать адекватный сердечный выброс сразу после рождения из-за недоразвития одной или нескольких структур левой половины сердца (до выполнения хирургического или медицинского вмешательства). Важным аспектом в данной ситуации является то, что "левое сердце" неспособно поддерживать системный сердечный выброс, что требует выполнения последующей хирургической конверсии гемодинамики по одножелудочковому пути или требует выполнения трансплантации сердца для сохранения двухжелудочковой гемодинамики [5].
Морфологические критерии порока [5]:
СГЛС включает в себя различные комбинации шести следующих поражений и недоразвитий структур сердечно-сосудистой системы в сочетании с гипоплазией левого желудочка сердца:
1. порок митрального клапана (выраженная гипоплазия; стеноз; атрезия);
2. фиброэластоз структур левых отделов;
3. порок аортального клапана (выраженная гипоплазия; стеноз; атрезия);
4. гипоплазия восходящей аорты;
5. гипоплазия/перерыв дуги аорты;
6. коарктация аорты;
Определенная гипоплазия левых отделов сердца присутствует в пределах широкого спектра поражений "левого сердца". Этот спектр варьирует от простых изолированных поражений (например, дискретная коарктация) до сложных многоуровневых поражений (например, сочетание атрезии аорты, митральной атрезии и рудиментарного левого желудочка). Таким образом, СГЛС может развиться как в результате тяжелой аномалии одной структуры левого желудочка (например, митральной атрезии), так и за счет комбинации нескольких более легких аномалий (например, митрального стеноза, гипоплазии левого желудочка и аортального стеноза).
Сопутствующие пороки:
Частота сопутствующих пороков сердца на фоне СГЛС составляет около 25% [1, 6]. Сопутствующие аномалии сердца вариабельны и играют важную роль в определении тактики лечения. Сопутствующая внутрисердечная патология может, как осложнять, так и "облегчать" течение СГЛС. К порокам, улучшающим прогноз, может относится дефект межжелудочковой перегородки (ДМЖП, ДМПП, частичный или тотальный аномальный дренаж легочных вен). К факторам, значительно ухудшающим прогноз течения и лечения СГЛС, относятся структурные отклонения правых отделов сердца, а именно поражение трехстворчатого клапана и клапана легочной артерии; рестриктивное МПС или интактная межпредсердная перегородка.
Остальные сопутствующие аномалии встречаются значительно реже и представлены следующими патологиями:
- общий открытый атрио-вентрикулярный канал (несбалансированная форма);
- тотальный аномальный дренаж легочных вен;
- дискордантное вентрикуло-артериальное соединение;
- атрезия коронарного синуса;
- атрезия легочных вен;
- четырехстворчатый клапан легочной артерии;
- двойное отверстие легочного клапана
- вентрикуло-коронарные фистулы и др. [1, 5 - 7, 66, 139, 140].
Синдром гипоплазии левых отделов сердца с рестриктивной или интактной межпредсердной перегородкой:
Рестриктивная или интактная межпредсердная перегородка встречается у 6 - 20% плодов с СГЛС [141 - 142]. Как правило, такие дети имеют один из трех типов левого предсердия:
Тип A: относительно большое левое предсердие с толстой вторичной перегородкой и тонкой первичной перегородкой, сросшимися друг с другом, массивно расширенными легочными венами. Путь декомпрессии от левого предсердия (ЛП) может идти к безымянной вене, правой верхней полой вене и правому предсердию (аномальный дренаж легочных вен).
Тип B: небольшое гипертрофированное ЛП с утолщением стенок предсердий по окружности и толстой мышечной межпредсердной перегородкой без различия между первичной и вторичной перегородкой. Легочные вены обычно небольшого размера.
Тип C: гигантское левое предсердие с тонкой, выпуклой вправо межпредсердной перегородкой на фоне тяжелой митральной регургитации. Легочные вены обычно увеличены в размере [60, 143 - 144].
После рождения у детей с СГЛС и интактной межпредсердной перегородкой кровоток через легкие увеличивается в 5 раз по сравнению с внутриутробной гемодинамикой, что приводит к резкой гипоксемии и высокому риску летального исхода. Чаще всего левопредсердная гипертензия приводит к отеку легких, которая в свою очередь увеличивает сопротивление антеградному легочному кровотоку, усугубляя гипоксемию [145].
Внутриутробное повышение давления в легочных сосудах приводит к "мускатным легким" - терминальному повреждению. Микроскопически главным признаком "мускатного легкого" является лимфангиэктазия (увеличенные лимфатические сосуды), макроскопически легкие приобретают "булыжный характер". Из-за плохого оттока крови из левого предсердия происходит стремительное ухудшение состояния и без оперативного лечения такие дети погибают в первые 3 суток [147 - 150].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
На сегодняшний день этиопатогенез СГЛС до конца не изучен. Неясно одинакова ли этиология для всех случаев данной патологии или нет. Часто отмечается аномальное формирование и смещение первичной перегородки влево, что может быть одной из причин развития СГЛС. Однако наиболее вероятной причиной развития СГЛС является патология аортального и митрального клапанов [7, 53]. Согласно патологоанатомическим исследованиям, практически во всех случаях развития СГЛС имеется поражение аортального и/или митрального клапана. Степень их поражения может значительно варьировать от случая к случаю [5, 7]. Также доказано влияние генетических факторов на формирование СГЛС у некоторых пациентов, но данные факторы многочисленны, сложны и плохо изучены в настоящее время [51, 54].
Некоторые ученые предлагают еще один эмбриональный механизм возникновения СГЛС: первичное нарушение формирования открытого овального окна с его рестрикцией либо атрезией на ранних стадиях развития плода, что приводит к уменьшению либо отсутствию потока крови через левые отделы сердца, что в свою очередь приводит к их недоразвитию [7, 52].
Формирование дуги аорты и брахиоцефальных артерий в подавляющем количестве случаев СГЛС протекает без особенностей, а гипоплазия восходящей аорты и дуги обусловлена отсутствием или резким снижением антеградного кровотока в них за счет стеноза аортального клапана как другого первичного механизма развития СГЛС. Нарушения формирования дуги возможны в случаях сочетания с перерывом дуги или коарктацией аорты [5, 7, 52].
Генетические синдромы
Генетические синдромы присутствуют у ~10 - 25% пациентов с СГЛС. Наиболее часто встречаются следующие синдромы: Тернера, Нунана, Холт-Орама, трисомические аномалии, ассоциацию CHARGE и синдром Якобсена [152 - 154].
Патофизиология
При атрезии аортального и митральных клапанов или при атрезии аортального клапана с митральным стеноз, системное кровообращение поддерживается с помощью правого желудочка ретроградным кровотоком в дуге аорты через открытый артериальный проток. У пациентов с более легкой формой СГЛС с аортальным и митральным стенозом, системное кровообращение может лишь частично зависеть от функции правого желудочка и открытого артериального протока, поскольку антеградный поток в восходящем отделе и дуге аорты обеспечивается левым желудочком. В редких случаях при пограничных размерах левого желудочка и умеренных клапанных стенозах митрального и аортальных клапанов системное кровоснабжение может полностью осуществляться левым желудочком, хотя у таких пациентов обычно наблюдается тяжелая застойная сердечная недостаточность, требующая хирургического вмешательства [145].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
СГЛС является четвертым по частоте встречаемости среди врожденных пороков сердца, выявляемых в периоде новорожденности и самым частым пороком с одножелудочковой гемодинамикой. Частота его в структуре всех врожденных пороков составляет от 1.4 до 9%. Распространенность данного синдрома на 1000 живорожденных составляет 0.16 - 0.2, причем у мальчиков данный ВПС встречается в два раза чаще, чем у девочек [8 - 11, 55, 58].
Течение порока во многом зависит от степени гипоплазии структур левых отделов сердца. Без хирургического вмешательства практически все дети с СГЛС погибают к 6 месяцам жизни, а 25% смертей приходится на первую неделю жизни [10, 56 - 57, 146].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Q23.4 - Синдром левосторонней гипоплазии сердца.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Общепризнанной классификации синдрома гипоплазии левых отделов сердца не существует. В практике используется классификация, основанная на морфологии клапанов левых отделов сердца. Выделяют пять анатомических подтипов СГЛС:
- аортальный и митральный стеноз;
- аортальная и митральная атрезия;
- аортальная атрезия и митральный стеноз;
- аортальный стеноз и митральная атрезия
- комплекс гипоплазии левых отделов сердца [5, 33].
Наиболее тяжелой формой СГЛС является вариант атрезии митрального и аортального клапанов, что приводит к отсутствию антеградного кровотока в восходящей аорте. Существование системной гемодинамики в такой ситуации возможно лишь при условии наличия фетальных коммуникаций, а именно: открытого артериального протока и межпредсердного сообщения.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина после рождения ребенка может значительно варьировать в зависимости от морфологического подтипа СГЛС, но, несмотря на это пациентам с СГЛС часто характерны такие признаки как:
1. тахикардия;
2. одышка;
3. акроцианоз/цианоз, усиливающийся при беспокойстве;
4. увеличение границ печени
5. низкое артериальное давление
В периоде новорожденности детям с СГЛС обычно характерен легкий цианоз, респираторный дистресс-синдром и тахикардия. Если не принять поддерживающих мер (поддержания функционирования фетальных коммуникаций: овального окна и артериального протока), может наступить быстрое ухудшение состояния с быстрым прогрессированием сердечной недостаточности и смертью пациента (за счет легочной гиперперфузии - с развитием отека легкого и критической системной гипоперфузии). При этом периферическая пульсация резко ослаблена (или не определяется), и отмечаются признаки снижения периферической перфузии и централизации кровообращения, низкое артериальное давление. Пальпаторно отмечается увеличение границ печени.
Спонтанное закрытие артериального протока без инфузии простагландинов - неминуемо, но сроки естественного закрытия протока варьируют от часов до недель, а порой и месяцев. И как было написано ранее, закрытие артериального протока сопровождается быстрым циркуляторным коллапсом.
Приблизительно от 5% до 6% детей с СГЛС имеет значимую обструкцию кровотоку на уровне межпредсердной перегородки (рестриктивное межпредсердное сообщение). Данная обструкция, при ее наличии, приводит к резкому затруднению оттока крови из левого предсердия (особенно при атрезии или критическом стенозе митрального клапана). Далее это приводит к нарушению оттока крови по легочным венам, что в свою очередь приводит к посткапиллярной легочной гипертензии и повреждению легких. Новорожденные с выраженной обструкцией кровотока на уровне межпредсердной перегородки обычно характеризуются критически низким уровнем системной оксигенации крови и почти всегда у них отмечаются признаки развития и прогрессирования отека легких. Данная ситуация является критической и требует неотложного хирургического вмешательства (проведение атриосептостомии) [59 - 61].
При аускультации для СГЛС характерен умеренный систолический шум по левому краю грудины за счет функционирующего открытого артериального протока. При сердечной недостаточности или рестриктивном овальном окне над легочными полями выслушиваются крепитирующие хрипы.
Анализ газового состава капиллярной крови крайне важен для оценки степени тяжести состояния пациента и позволяет оценить сбалансированность кровотока между системой малого и большого кругов кровообращения (подробнее см. в разделе лабораторной диагностики).
На обзорной рентгенографии обычно выявляется кардиомегалия за счет увеличенных правых отделов сердца. По легочным полям - признаки гиперволемии малого круга кровообращения.
Изменения на ЭКГ обычно неспецифические и проявляются признаками перегрузки правых отделов сердца.
Эхокардиография - является основным методом диагностики СГЛС, и позволяет визуализировать признаки порока, с высокой степенью достоверности как постнатально, так и пренатально, начиная с 16 недели беременности. Эхокардиография позволяет выявить все необходимые признаки порока, а именно: гипоплазию и аномальное строение митрального и аортального клапанов; гипоплазию восходящей аорты; выявить или исключить наличие антеградного потока через митральный и аортальный клапаны и восходящую аорту; определить линейные размеры левого желудочка; определить степень фиброэластоза левого желудочка; размеры межпредсердного сообщения и др. [5, 7, 10, 12].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Важное значение имеет пренатальное эхокардиографическое исследование, которое позволяет заподозрить СГЛС на 16 - 18-й неделе беременности [12]. Сразу после рождения подавляющее большинство новорожденных находятся в критическом состоянии, что требует максимально быстрого перевода пациента в специализированное учреждение.
Диагностические критерии постановки диагноза
Жалобы:
- одышка;
- учащенное сердцебиение.
Анамнез: пренатальная диагностика ВПС.
Физикальное обследование:
- тахикардия;
- одышка;
- дыхательные расстройства;
- хрипы в легких;
- гепатомегалия;
- цианоз различной степени;
- пневматоз кишечника, свободная жидкости в брюшной полости (признаки развития энтероколита);
- умеренный систолический шум по левому краю грудины (второй тон над аортой однокомпонентный, часто ослаблен или отсутствует).
Лабораторные исследования: не предоставляют характерной информации для СГЛС.
Инструментальные исследования:
Прицельная рентгенография органов грудной клетки:
- полнокровие с интерстициальным или альвеолярным отеком легких (или без отека).
- также прицельная рентгенография грудной клетки позволяет выявить сопутствующие заболевания легких (пневмонию, мекониальную аспирацию, ателектазы и др.).
ЭКГ (регистрация электрокардиограммы, расшифровка, описание и интерпретация электрокардиографических данных)
- изменения на ЭКГ неспецифические и проявляются признаками перегрузки правых отделов сердца, а именно:
1. остроконечные, расширенные зубцы P во II, III, и AVF отведениях;
2. отклонение электрической оси сердца вправо;
3. признаки увеличения правого желудочка с появлением зубцов R в V1, или qR в правых грудных отведениях, зубцы rS в V5 - V6.
ЭхоКГ с применением режима цветного допплеровского картирования:
- позволяет выявить гипоплазию, аномальное строение, стеноз или атрезию митрального клапана; гипоплазию, стеноз или атрезию аортального клапана; гипоплазию восходящей аорты, дуги аорты и/или перешейка аорты; выявить или исключить наличие антеградного потока через митральный и аортальный клапаны; определить линейные размеры левого желудочка и степень выраженности фиброэластоза; размеры межпредсердного сообщения и открытого артериального протока; оценить кровоток в брюшной аорте, оценить функцию правого желудочка и трехстворчатого клапана.
2.1 Жалобы и анамнез
- На этапе уточнения диагноза рекомендуется осмотр, тщательный сбор анамнеза и жалоб у всех пациентов (родителей пациентов) с подозрением на СГЛС с целью определения тяжести состояния и тактики лечения [5, 7, 10].
УДД 5, УУР C
2.2 Физикальное обследование
- Всем пациентам с СГЛС рекомендовано проведение осмотра врача-кардиолога или врача-сердечно-сосудистого хирурга (кардиохирурга) (прием (осмотр, консультация) врача-кардиолога первичный, прием (осмотр, консультация) врача - детского кардиолога первичный, прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный) для оценки степени тяжести состояния пациента [5, 7, 10].
УДД 5, УУР C
- Всем пациентам с СГЛС при физикальном обследовании рекомендовано обращать внимание на наличие одышки, цианоза и помнить о высокой частоте дыхательных расстройств у данной группы пациентов в течение первых дней жизни [5, 7, 10].
УДД 5, УУР C
Комментарии: Важно понимать, что клиническая картина после рождения ребенка может значительно варьировать в зависимости от класса и анатомического подтипа СГЛС. У пациентов с данным диагнозом почти всегда присутствуют признаки недостаточности кровообращения и/или дыхательной недостаточности (тахикардия; одышка; хрипы в легких; цианоз; увеличение границ печени). В большинстве случаев отмечается снижение перфузии тканей и органов, что сопровождается периферическим спазмом и низким артериальным давлением. При выраженной сердечной деятельности быстро развивается синдром полиорганной недостаточности (СПОН). Нет прямой корреляции между степенью тяжести состояния и степенью выраженности цианоза. Выраженный цианоз часто обусловлен рестрикцией кровотока через ООО, либо сопутствующей сердечной/внесердечной патологией (тотальный аномальный дренаж легочных вен со стенозом коллектора, диафрагмальные грыжи и др.).
- Всем пациентам с подозрением СГЛС при аускультации сердца (аускультация при патологии сердца и перикарда) рекомендовано обращать внимание на наличие шумов сердца [5, 7, 10].
УДД 5, УУР C
Комментарии: при СГЛС характерен умеренный систолический шум по левому краю грудины (второй тон над аортой однокомпонентный, часто ослаблен или отсутствует) [5, 7, 10].
Всем пациентам с СГЛС рекомендуется проводить измерение артериального давления для оценки систолического и диастолического давления [1, 4 - 5, 7, 10].
УДД 5, УУР C
Комментарии: в связи с отсутствием прямого выброса (критическим снижением выброса) крови через восходящую аорту, артериальное давление в большом круге кровообращения зависит от наличия и размеров ОАП, а также величины соотношения легочного и системного сосудистых сопротивлений
- У новорожденных детей с СГЛС, рекомендовано оценивать перистальтику путем аускультации живота. Также необходимо проводить перкуссию и пальпацию живота для выявления пневматоза кишечника, свободной жидкости в брюшной полости (признаки развития энтероколита) [5, 7, 10, 58 - 59, 75].
УДД 5, УУР C
Комментарии: сразу после рождения, когда легочное сосудистое сопротивление остается относительно высоким, а артериальный проток широким, результаты физикального обследования чаще всего близки к норме (с адекватной оксигенацией и системной перфузией). Это происходит за счет баланса между объемом кровотока, направляющимся в малый круг кровообращения для оксигенации, и объемом, доставляемым в большой круг кровообращения. Однако по мере того, как сопротивление легочных сосудов естественным образом падает, больше крови шунтируется через легочное сосудистое русло в ущерб системного кровообращения, что приводит к тахипноэ, относительной гипотензии и развитию ацидоза. Когда артериальный проток начинает закрываться, системная перфузия еще сильнее ухудшается. Клиника у таких новорожденных обычно проявляется в первые несколько часов жизни или в возрасте от 2 до 3 дней и начинается признаков энтероколита и респираторного дистресс-синдромом, и без вмешательства они быстро прогрессируют до сердечной недостаточности и шока.
2.3 Лабораторные диагностические исследования
Специфической лабораторной диагностики для СГЛС нет.
- Всем пациентам с СГЛС рекомендуется исследование кислотно-основного состояния и газов крови (pH, BE, pCO2, PO2, Lac - анализ капиллярной/артериальной/венозной проб) с целью оценки тяжести гипоксемии и степени выраженности метаболических нарушений (предпочтительны одномоментные пробы крови из верхней и нижней конечностей) [5, 7, 10, 12].
УДД 5, УУР C
Комментарии: анализ газового состава капиллярной крови позволяет оценить сбалансированность кровотока между системой малого и большого кругов кровообращения:
1. если до начала лечения насыщение артериальной крови кислородом находится в пределах 75 - 90%, pH колеблется в пределах допустимых значений и pCO2 находится на уровне 40 - 50 мм рт.ст., то данная ситуация говорит о том, что кровотоки сбалансированы
2. если уровень насыщение артериальной крови кислородом более 90 - 93% в сочетании с метаболическим ацидозом (pH < 7.3) и pCO2 находится на уровне 30 - 40 мм рт.ст., то ситуацию надо расценивать, как смещение равновесия в сторону легочного кровотока и провести соответствующую коррекцию терапии, о которой далее будет рассказано.
- Всем пациентам с СГЛС рекомендуется проведение общего (клинического) анализа мочи и общего (клинического) анализа крови с исследованием уровня общего гемоглобина в крови и оценкой гематокрита, исследованием уровня эритроцитов, лейкоцитов, тромбоцитов в крови, исследованием скорости оседания эритроцитов в рамках первичного обследования, при поступлении в стационар, в т.ч. для оперативного лечения, в процессе динамического наблюдения не менее 1 раза в год, а также в послеоперационном периоде при необходимости [5, 10, 62 - 63].
УДД 5, УУР C
- Всем пациентам с СГЛС, поступающим в профильный стационар для оперативного лечения порока, которым предполагается переливание донорской крови и (или) ее компонентов, рекомендуется определение основных групп по системе AB0, антигена D системы Резус (резус-фактор), фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител [5, 10, 62, 176 - 177].
УДД 5, УУР C
- Всем пациентам с СГЛС, поступающим в стационар для оперативного лечения рекомендуется определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови; определение антител к вирусу гепатита C (Hepatitis C virus) в крови; определение антител к бледной трепонеме (Treponema pallidum) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV-2) в крови для исключения ассоциации с ВИЧ-инфекцией, гепатитом и сифилисом [5, 10, 62, 174 - 175].
УДД 5, УУР C
- Перед выполнением оперативного вмешательства всем пациентам с СГЛС рекомендуется выполнение коагулограммы (ориентировочное исследование системы гемостаза) (определение активированного частичного тромбопластинового времени, определение международного нормализованного отношения (МНО), исследование уровня фибриногена в крови) с целью исключения врожденных и приобретенных нарушений в системе свертывания крови, прогноза послеоперационных тромбозов и кровотечений [5, 7, 10, 62, 178 - 179].
УДД 5, УУР C
Комментарии: при наличии у больного в предоперационном периоде геморрагического синдрома и/или лабораторных признаков нарушения свертывания крови. оперативное вмешательство целесообразно отсрочить до установления причины этих нарушений и их устранения.
- Всем пациентам с СГЛС рекомендуется проведение анализа крови биохимического общетерапевтического (исследование уровня калия, натрия, хлоридов, глюкозы, креатинина, общего белка, альбумина, мочевины, общего и связанного (конъюгированного) билирубина в крови, исследование уровня железа сыворотки крови, определение активности аспартатаминотрансферазы и аланинаминотрансферазы в крови) для оценки почечной и печеночной функции в рамках первичного обследования, при поступлении в стационар, в т.ч. для оперативного лечения, в процессе динамического наблюдения не менее 1 раза в год, а также в послеоперационном периоде при необходимости [5, 10, 43, 44].
УДД 5, УУР C
- Всем пациентам с СГЛС, которым после оперативного лечения проводится тромбопрофилактика препаратами гепарина (B01AB Группа гепарина), рекомендуется лабораторный контроль эффективности применения лекарственных препаратов [178, 179, 197, 198].
УДД 5, УУР C
Комментарии: При применении нефракционированного гепарина (B01AB Группа гепарина) рекомендуется определение АЧТВ (Активированное частичное тромбопластиновое время) (оптимальный диапазон значений у детей - 60 - 85 сек) и исследование уровня гепарина в крови (определение анти-Xa): оптимальный диапазон - 0,35 - 0,7. При применении препаратов низкомолекулярного гепарина (B01AB Группа гепарина) рекомендуется исследование уровня гепарина в крови (определение анти-Xa): оптимальный диапазон - 0,5 - 1,0 [178, 179, 197, 198].
2.4 Инструментальные диагностические исследования
Окончательный диагноз СГЛС ставится при помощи визуализирующих методов исследования, подтверждающих морфологические признаки порока и функциональную несостоятельность левого желудочка сердца. Целью инструментальной диагностики также является выявление сопутствующих врожденных пороков развития (при их наличии).
- Всем пациентам с подозрением на СГЛС рекомендуется трансторакальное эхокардиографическое исследование (ЭхоКГ) с применением режима цветного допплеровского картирования для определения анатомических особенностей порока и выбора оптимальной хирургической тактики лечения [7, 10, 13 - 15, 62 - 64].
УДД 4, УУР C
Комментарии: данное исследование позволяет выявить все необходимые признаки порока: гипоплазию, аномальное строение, стеноз или атрезию митрального клапана; гипоплазию, стеноз или атрезию аортального клапана; гипоплазию восходящей аорты, дуги аорты и/или перешейка аорты; выявить или исключить наличие антеградного потока через митральный и аортальный клапаны; определить линейные размеры левого желудочка и степень выраженности фиброэластоза; размеры межпредсердного сообщения и открытого артериального протока; оценить кровоток в брюшной аорте, оценить функцию правого желудочка и трехстворчатого клапана.
- Рекомендуется ЭхоКГ чреспищеводная при клинической необходимости с недостаточно информативной визуализацией эхокардиографии (трансторакальной) с целью детальной оценки состояния клапанного аппарата, а также в случае оперативного лечения интраоперационно для оценки результатов операции и при необходимости в пред- и послеоперационном периоде [7, 10, 13 - 15, 180 - 181].
УДД 5, УУР C
- Новорожденным пациентам с СГЛС не рекомендовано выполнять чрезвенозную катетеризацию сердца и панаортографию [5, 10, 55, 182].
УДД 5, УУР C
Комментарии: Следует помнить, что введение даже незначительного объема контрастного вещества пациентам с СГЛС приводит к усугублению и без того существующей почечной недостаточности. Новорожденным с СГЛС выполнение АКГ может быть показано в случаях, когда по данным ЭхоКГ и/или компьютерной томографии возникают подозрения на аномалии развития коронарных артерий или аномалии расположения брахиоцефальных сосудов [10].
- В тех случаях, когда данных ЭхоКГ недостаточно для верификации диагноза или они противоречивы, пациентам с подозрением на СГЛС рекомендуется проведение компьютерной томографии сердца с контрастированием (КТ) или магнитно-резонансной томографии сердца и магистральных сосудов (МРТ) исследования [16 - 17].
УДД 4, УУР C - для КТ
УДД 5, УУР C - для МРТ
Комментарии: МРТ и КТ помогают уточнить морфологию порока, определить пространственное взаимоотношение структур сердца и крупных сосудов, а также важны для диагностики сопутствующих внутрисердечных/внесердечных аномалий развития. Также томографические методики применяются при пограничных размерах левых отделов сердца, что позволяет уточнить возможность выполнения операций двухжелудочковой коррекции и хирургическую тактику у данной группы пациентов.
- Всем пациентам с подозрением на СГЛС рекомендуется проведение прицельной рентгенографии органов грудной клетки для исключения иных заболеваний сердца и крупных сосудов, а также внесердечной патологии (патологии других органов средостения, легких, плевры), уточнения анатомических особенностей данного ВПС, состояния малого круга кровообращения и выявления легочного застоя, а также в случае оперативного лечения при необходимости в пред- и/или послеоперационном периоде [5, 7, 10, 13, 55, 155].
УДД 5, УУР C
Комментарии: на обзорной рентгенограмме практически всегда отмечается полнокровие с интерстициальным или альвеолярным отеком легких (или без отека). Также рентгенография грудной клетки позволяет выявить сопутствующие заболевания легких (пневмонию, мекониальную аспирацию, ателектазы и др.).
- Всем пациентам с СГЛС рекомендуется выполнение электрокардиографии (ЭКГ) (регистрация электрокардиограммы, расшифровка, описание и интерпретация электрокардиографических данных): для оценки сердечного ритма и проводимости [5, 7, 10, 55].
УДД 5, УУР C
Комментарии: Изменения на ЭКГ обычно неспецифические и проявляются признаками перегрузки правых отделов сердца, а именно:
1. остроконечные, расширенные зубцы P во II, III, и AVF отведениях;
2. отклонение электрической оси сердца вправо;
3. признаки увеличения правого желудочка с появлением зубцов R в V1, или qR в правых грудных отведениях, зубцы rS в V5 - V6.
2.5 Иные диагностические исследования
Всем новорожденным пациентам с СГЛС рекомендовано выполнение нейросонографии для исключения аномалий развития головного мозга [45].
УДД 5, УУР C
Комментарии: СГЛС часто сочетается с генетической патологией и аномалиями развития центральной нервной системы. Нейросонография у данных пациентов может выявить грубые структурные нарушения, что позволяет определить оптимальную тактику хирургической коррекции.
- Новорожденному с СГЛС, до и после проведения медикаментозного или оперативного вмешательства (вплоть до выписки из стационара), рекомендуется проведение суточного прикроватного мониторирования жизненно важных функций (измерение частоты сердцебиения, суточное мониторирование артериального давления, пульсоксиметрия) для контроля состояния пациента [10, 64, 74].
УДД 5, УУР C
- Всем пациентам с СГЛС рекомендуется перед окончанием основного этапа операции в условиях искусственного кровообращения с целью контроля качества выполненного оперативного вмешательства выполнить чреспищеводную ЭхоКГ [10, 19, 64].
УДД 5, УУР C
- Всем пациентам с СГЛС рекомендуется перед выпиской из стационара после выполненного оперативного вмешательства выполнить регистрацию электрокардиограммы (расшифровка, описание и интерпретация электрокардиографических данных) для оценки качества проведенного хирургического вмешательства [10, 19, 64].
УДД 5, УУР C
- Всем пациентам с СГЛС и факторами риска развития инфекционных осложнений при поступлении на стационарный этап лечения рекомендуется проведение микробиологического (культурального) исследования слизи с миндалин и задней стенки глотки на аэробные и факультативно анаэробные микроорганизмы, микробиологического (культурального) исследования кала на аэробные и факультативно-анаэробные микроорганизмы и микробиологического (культурального) исследования отделяемого конъюнктивы на аэробные и факультативно-анаэробные условно патогенные микроорганизмы с целью определения колонизации микроорганизмами [183 - 194].
УДД 5, УУР C
Комментарии: послеоперационные инфекционные осложнения у пациентов с врожденными пороками сердца (ВПС) являются серьезной проблемой [183 - 185], поскольку пациенты данной группы имеют ряд характерных факторов риска их развития (частое сочетание ВПС с другими врожденными аномалиями и пороками развития, травматичность и длительность хирургического пособия, применение искусственного кровообращения, кровопотеря, гипотермия и др. [186]. Помимо этого, такие пациенты нередко бывают исходно колонизированными полирезистентной микрофлорой. Это связано с тем, что до поступления на кардиохирургическую операцию большинство детей с ВПС проходят лечение в соматических стационарах, в том числе с применением антибактериальных препаратов системного действия, что является значимым фактором риска колонизации открытых биоценозов организма. При заносе в стационар таких устойчивых к антибактериальным препаратам системного действия микроорганизмов, создаются предпосылки для возникновения госпитальных вспышек, а также ухудшения микробиологического пейзажа стационара [187 - 188]. Известно, что наиболее эффективным способом снижения риска развития инфекционных осложнений является применение комплекса мероприятий инфекционного контроля [189 - 190]. В связи с этим рекомендуется проводить молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на метициллин-чувствительные и метициллин-резистентные Staphylococcus aureus, метициллин-резистентные коагулазонегативные Staphylococcus spp, молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки для выявления генов приобретенных карбапенемаз бактерий, молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на Pseudomonas aeruginosa, молекулярно-биологическое исследование для выявления генов приобретенных карбапенемаз бактерий в мазке со слизистой оболочки прямой кишки методом ПЦР, определение генов приобретенных карбапенемаз бактерий класса 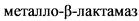 (МБЛ) групп VIM, IMP и NDM в мазке со слизистой оболочки прямой кишки методом ПЦР и выявление генов приобретенных карбапенемаз класса
(МБЛ) групп VIM, IMP и NDM в мазке со слизистой оболочки прямой кишки методом ПЦР и выявление генов приобретенных карбапенемаз класса  (МБЛ) групп VIM, IMP и NDM в мазках со слизистой оболочки ротоглотки методом ПЦР [189, 191 - 193]. Результаты скрининга не должны быть руководством для назначения антимикробной терапии в отсутствие клинической картины инфекционного процесса, но могут быть учтены при назначении эмпирической терапии в случае манифестации инфекции. Данные, получаемые при скрининге, являются частью микробиологического мониторинга и определяют комплекс противоэпидемических мероприятий, которые необходимо провести при госпитализации пациента, колонизированного полирезистентной флорой [194].
(МБЛ) групп VIM, IMP и NDM в мазках со слизистой оболочки ротоглотки методом ПЦР [189, 191 - 193]. Результаты скрининга не должны быть руководством для назначения антимикробной терапии в отсутствие клинической картины инфекционного процесса, но могут быть учтены при назначении эмпирической терапии в случае манифестации инфекции. Данные, получаемые при скрининге, являются частью микробиологического мониторинга и определяют комплекс противоэпидемических мероприятий, которые необходимо провести при госпитализации пациента, колонизированного полирезистентной флорой [194].
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Родоразрешение
Роды должны проходить в стационаре не ниже 3 уровня, с целью более точной первоначальной оценки состояния новорожденного и последующей стабилизации новорожденного (катетеризация кубитальной и других периферических вен или катетеризация подключичной и других центральных вен, и начало инфузии простагландинов, проведение реанимационных мероприятий). Из-за необходимости проведения оперативного вмешательства в неонатальном возрасте роды оптимально проводить в условиях стационара, расположенного рядом со специализированным кардиологическим центром [68]. Родоразрешение может выполняться как в виде естественных родов, так и в виде планового кесарева сечения. Плановые неосложненные роды оптимально проводить в сроке 39 недель (так как роды даже на 37 - 38 неделе сопряжены с более высокими рисками неблагоприятного исхода) [141, 156 - 157].
- Родоразрешение плода с синдромом гипоплазии левых отделов сердца и рестриктивным овальным окном или интактной межпредсердной перегородкой
Родоразрешение плода с СГЛС и рестрективным открытым овальным окном или интактной межпредсердной перегородкой оптимально проводить в специализированном кардиохирургическом центре или непосредственной от него близости, для возможности проведения экстренного вмешательства с целью декомпрессии ЛП (баллонная атриосептостомия или создание дефекта межпредсердной перегородки со стентированием, подключение системы для экстракорпоральной мембранной оксигенации (ЭКМО)). В этом случае может потребоваться плановое кесарево сечение для оптимальной координации многопрофильной помощи [141, 159].
После рождения ребенка, врач-детский кардиолог должен подтвердить диагноз СГЛС и провести консультацию родителей совместно с врачом-сердечно-сосудистый хирургом (детским кардиохирургом). При обнаружении экстракардиальных аномалий показано проведения тестирования на хромосомные аномалии для получения дополнительной информации и уточнения прогноза [145].
В случае пренатально установленного диагноза СГЛС родоразрешение рекомендуется проводить в специализированном стационаре, располагающем отделением реанимации новорожденных, в ближайшей транспортной доступности от кардиохирургического центра [5, 10, 64 - 70].
УДД 4, УУР C
- Всем пациентам с пренатально установленным диагнозом СГЛС сразу после родоразрешения рекомендован перевод в ОРИТН для мониторинга жизненно важных функций (измерение частоты сердцебиения, частоты дыхания, пульсоксиметрия и суточное мониторирование артериального давления) и стабилизации состояния пациента [5, 10, 64 - 70].
УДД 4, УУР C
- Всех новорожденных пациентов с СГЛС после стабилизации состояния в ОРИТН рекомендуется перевести в ближайший кардиохирургический стационар в первые 24 - 48 часов жизни [5, 10, 64 - 70, 116].
УДД 5, УУР C
Комментарии: для нестабильных новорожденных (в том числе с рестриктивными артериальным протоком и межпредсердным сообщением, со стенозом легочных вен): транспортировку оптимально осуществлять в первые 24 часа жизни при условии транспортабельности пациента [160].
3.1 Консервативное лечение
Краткий алгоритм предоперационного ведения стабильных пациентов:
1. минимизация манипуляций [49, 78];
2. организация адекватного мониторинга с контролем ЧДД (частоты дыхательных движений), размера ОАП по ЭхоКГ, ЭКГ, пульсоксиметрия на верхних и нижних конечностях, измерение АД на периферических артериях [161 - 163];
3. начало инфузии препаратов группы C01EA простагландины [48, 49, 64, 65, 72, 101 - 103, 160, 167];
4. волемическая нагрузка в соответствии со стандартными неонатальными рекомендациями при этом гидробаланс следует тщательно контролировать [145];
5. энтеральное питание остается спорным вопросом! Однако, доказано, что энтеральное питание, особенно грудным молоком может снижать риск некротизирующего энтероколита при условии адекватного кровотока в нижней половине туловища [164 - 166].
Краткий алгоритм предоперационного ведения нестабильных пациентов:
1. организация адекватного мониторинга с контролем ЧДД (частоты дыхательных движений), размера ОАП по ЭхоКГ, ЭКГ, пульсоксиметрия на верхних и нижних конечностях, измерение АД на правой верхней конечности [161 - 163];
2. начало инфузии группы C01EA простагландины для поддержание проходимости ОАП и адекватного системного кровообращения. Но надо помнить, что (C01EA) простагландины имеет два клинически значимых дозозависимых побочных эффекта: гипотензия (особенно у больных, находящихся в шоке) и сосудорасширяющий эффект (риск кровотечений и некротического энтероколита). При этом высокие дозы группы C01EA простагландины не приводят к дальнейшему увеличению ОАП, особенно в условиях декомпенсированного ацидоза, поэтому общая тенденция направлена на минимизацию дозы простагландинов [48, 49, 64, 65, 72, 101 - 103, 160, 167];
3. стабилизация состояния путем стремления к нормализации соотношения между легочным (Qp) и системным кровотоком (Qs) к единице (Qp = Qs). При необходимости перевод пациента на искусственную вентиляцию легких (показан режим нормовентиляции с FiO2 21%) [49, 145];
4. коррекция выраженного ацидоза, но следует помнить, что умеренный ацидоз помогает ограничивать легочный кровоток за счет повышения легочного сосудистого сопротивления. Поэтому коррекцию pH следует проводить с осторожностью, иначе может значительно снизиться легочное сосудистое сопротивление и измениться соотношение Qp/Qs в сторону малого круга с уменьшением системного кровотока и последующим отсроченным усилением системного ацидоза. Однако больные, находящиеся в шоке и глубоком метаболическом ацидозе, нуждаются в коррекции дефицита оснований. При введении оснований (натрия гидрокарбонат**) следует добиваться оптимизации Qp/Qs к единице (Qp = Qs) [145, 162, 168];
5. поддерживать адекватную температуру тела и избегать переохлаждения пациента (особенно при транспортировке) [160, 196].
- Всем пациентам с СГЛС рекомендована постановка венозной линии (катетеризация кубитальной и других периферических вен или катетеризация подключичной и других центральных вен) [10, 65, 67, 71].
УДД 3, УУР C
Комментарии: в случае стабильного состояния можно обойтись постановкой одной или двух периферических венозных линий (катетеризация кубитальной и других периферических вен). В случае ухудшения или исходной тяжести состояния (низкие показатели сатурации, лактат-ацидоз, дыхательные нарушения) необходимо постановка центральной венозной линии (катетеризация подключичной и других центральных вен) [10, 65 - 71].
- Всем пациентам с СГЛС сразу после постановки венозного доступа рекомендуется проведение инфузии препаратами группы C01EA простагландины [48, 49, 64, 65, 72, 101 - 103].
УДД 4, УУР C
Комментарии: инфузия #алпростадила** проводится у стабильных пациентов вплоть до оперативного вмешательства из расчета 0,003 - 0,005 мкг/кг/мин. В случае рестриктивного открытого артериального протока (данные ЭхоКГ, снижение сатурации, лактат-ацидоз) рекомендовано увеличение дозы #алпростадила** от 0,01 до 0,05 мкг/кг/мин [10, 48, 49, 64, 65, 72, 76 - 78, 101 - 103, 200].
- Всем пациентам с СГЛС при сохранении показателей сатурации в пределах 75 - 85% не рекомендуется дополнительная оксигенотерапия [5, 10, 72 - 73, 77].
УДД 5, УУР C
- Всем пациентам с СГЛС в случае стабильного состояния и отсутствия выраженных метаболических нарушений не рекомендован перевод на ИВЛ [49, 72].
УДД 4, УУР C
- У пациентов с СГЛС при сатурации > 90% в сочетании с лактат-ацидозом, артериальной гипотензией и олигурией рекомендуется проведение интубации трахеи и перевод на ИВЛ воздухом с фракцией кислорода 21% [5, 10, 49, 65, 71 - 73].
УДД 2, УУР C
Комментарии: в случае сохранения гипероксии и гипокапнии в газовом составе крови в дыхательной смеси концентрация кислорода должна быть снижена до 17 - 19% за счет увеличения фракции азота. ИВЛ необходимо продолжать до стабилизации состояния пациента.
- Консервативное лечение всех пациентов с СГЛС со сниженной функцией правого желудочка (сердечной недостаточностью) рекомендуется проводить по следующему алгоритму: в первую очередь исключить избыточный легочный кровоток, вторым шагом исключить системную гиповолемию, третьим шагом рекомендовано назначение инфузии производных нитроферрицианида или антиадренергических средств периферического действия под контролем артериального давления [5, 7, 10, 72, 76 - 78, 104 - 108].
УДД 5, УУР C
Комментарии: при прогрессивном ухудшении состояния у пациентов с СГЛС, назначается инфузия производных нитроферрицианида, которые обладают системным вазодилатационным эффектом (нитропруссида натрия дигидратата в начальной дозе 0,3 мкг/кг/мин с последующим титрованием дозы под контролем АД и газового состава крови до получения желаемого эффекта) или назначают инфузию #левосимендана** (который относится к другим кардиотоническим средствам и дополнительно обладает вазодилатационным действием) из расчета 0,05 - 0,2 мкг/кг/мин [105, 107 - 108]. В случае отсутствия эффекта рекомендовано начало инфузии кардиотонических средств кроме сердечных гликозидов. При прогрессировании СН необходимо назначение препаратов из фармакотерапевтической группы адренергических и дофаминергических средств: рекомендуемым является добутамин** или допамин** (в дозах внутривенно от 4 - 6 мкг/кг/мин с последующим титрованием дозы до получения желаемого эффекта (максимально 10 мкг/кг/мин)); при недостаточной эффективности вышеописанных препаратов, необходимо дополнительное назначение #эпинефрина** (в начальной дозе 0,01 мкг/кг/мин с последующим титрованием дозы под контролем АД и газового состава крови до получения желаемого эффекта) [72, 104 - 106].
- Не рекомендуется терапия высокими дозами адренергических и дофаминергических средств [5, 7, 10, 72, 76 - 78, 104 - 108].
УДД 5, УУР C
Комментарии: высокие дозы адренергических и дофаминергических средств приводят также к повышению периферического системного сосудистого сопротивления, а это в свою очередь приводит к перенаправлению большей части выброса из единственного функционального правого желудочка в сторону малого круга кровообращения, что еще более усугубляет состояние пациента. Увеличение доз адренергических и дофаминергических средств надо проводить с параллельным увеличением доз системных вазодилататоров.
- Всем пациентам с СГЛС при наличии факторов риска инфекции рекомендовано назначение антибактериальных препаратов системного действия (при необходимости начало терапии в роддоме и продолжение их введения в течение 48 - 72 ч., т.е. до тех пор, пока посевы, сделанные до начала терапии, не окажутся отрицательными) [79 - 80, 109 - 111].
УДД 4, УУР C
Комментарии: к факторам риска реализации инфекции у новорожденного является: острый инфекционный процесс у матери на поздних сроках беременности (непосредственно перед родами); фетоплацентарная недостаточность; выявление у новорожденного перикардиального, плеврального выпота или асцита, наличие кист и петрификатов в головном мозге; лейкоцитоз в общем анализе крови новорожденного (более 20 x 109/л); повышенный уровень C-реактивного белка и/или уровня прокальцитонинав сыворотке крови. В случае выявления возбудителя инфекционного процесса необходимо этиопатогенетическое назначение антибактериальных препаратов системного действия в возрастных дозировках. В случае сочетания факторов риска и отсутствия выявления возбудителя назначаются другие бета-лактамные антибактериальные препараты или бета-лактамные антибактериальные препараты, пенициллины в возрастных дозировках с последующей коррекцией антибактериальной терапии в случае необходимости. В тяжелых случаях целесообразно использование антибактериальных препаратов резерва: карбапенемы, ванкомицин**, фторхинолоны, макролиды, полимиксины. При отсутствии факторов риска антибиотики (антибактериальные препараты системного действия) не назначают [79 - 80, 109 - 111, 188 - 191, 194].
- Всем пациентам с СГЛС с подтвержденным ультразвуковыми методами диагностики рестриктивным межпредсердным сообщением, выраженными метаболическими нарушениями и низким уровнем сатурации рекомендуется проведение интубации трахеи, перевод на ИВЛ, увеличение дозы препаратов группы C01EA простагландины, введение миорелаксантов в расчетных дозах и начало дополнительной оксигенотерапии [5, 7, 10, 72, 76 - 78, 101 - 103].
УДД 4, УУР C
Комментарии: иная интенсивная терапия обычно не эффективна в данной ситуации.
- Пациентам с СГЛС с высоким риском тромбоза после проведенного оперативного лечения рекомендуется тромбопрофилактика препаратами гепарина и его производными (B01AB группа гепарина) [178, 179, 197, 198].
УДД 3, УУР C
Комментарии: К группе высокого риска тромбозов относятся пациенты с эпизодами тромбозов в анамнезе, тромбофилиями, инфекционными осложнениями, полиорганной недостаточностью [179].
Тромбопрофилактика нефракционированным гепарином натрия** должна быть инициирована болюсом, который у детей - 75 Ед/кг с последующей внутривенной инфузией со скоростью: у детей младше 1 года - 28 Ед/кг/ч, у детей старше 1 года - 20 Ед/кг/ч. Коррекция дозы производится на основании результатов лабораторных исследований.
Тромбопрофилактика препаратами низкомолекулярного гепарина (B01AB группа гепарина) проводится из расчета: #эноксапарин натрия ** (off-label у детей до 18 лет) у детей младше 2 месяцев - 0,75 мг/кг, у детей старше 2 месяцев - 0,5 мг/кг, через 12 часов подкожно, далтепарин натрия - у детей от 1 месяца до 2 лет 150 Ед/кг, от 2 до 8 лет - 125 Ед/кг, старше 8 лет - 100 Ед/кг с исследованием уровня гепарина в крови (контроль анти-X) в соответствии с инструкцией, через 12 часов подкожно. Фондапаринукс натрия (off-label у детей до 17 лет); #Фондапаринукс натрия может применяться у детей старше 1 года в дозе 0,1 мг/кг в сутки подкожно. Коррекция дозы производится на основании результатов лабораторных исследований [178, 179, 197, 198].
- Пациентам с СГЛС после выполнения операций Norwood-Blalock или Norwood-Sano рекомендуется тромбопрофилактика [178, 179, 197, 198].
УДД 3, УУР C
Комментарии: в раннем послеоперационном периоде тромбопрофилактика должна осуществляться препаратами гепарина и его производными (B01AB группа гепарина), а в дальнейшем
- Пациентам с СГЛС после выполнения ДКПА или операции Фонтена рекомендуется тромбопрофилактика [178, 179, 197, 198, 199].
УДД 3, УУР C
Комментарии: в раннем послеоперационном периоде тромбопрофилактика должна осуществляться препаратами гепарина и его производными (B01AB группа гепарина), а в дальнейшем - антагонистами витамина K под контролем МНО (оптимальный диапазон - 2,0 - 3,0) [178] или ривароксабаном в гранулах для приготовления суспензии с исследованием уровня гепарина в крови (контроль анти-X), оптимальный диапазон - 0,5 - 1,0 [199].
3.2 Хирургическое лечение
Хирургическое лечение пациентов с СГЛС делится на две большие группы:
1. Традиционное этапное хирургическое паллиативное лечение (где первым этапом выполняется операция Norwood);
2. Модифицированные методы, где видоизменен подход к первичному вмешательству (гибридный подход или выполнение раздельного суживания легочных артерий с пролонгированной инфузией препаратов группы C01EA простагландины до выполнения второго этапа гемодинамической коррекции, который также может отличаться (либо операция Norwood-Blalock, Norwood-Sano или сразу Norwood-двунаправленный кавопульмональный анастомоз).
При этом завершающим этапом во всех случаях должна быть операция Fontan.
Операция Norwood (первый этап для традиционного этапного хирургического лечения и второй этап для модифицированных методик). Основные этапы данной операции остались неизменными с момента ее первого выполнения, а именно: 1) создание беспрепятственного выхода из функционально единственного правого желудочка в реконструированную неоаорту (создание адекватного антеградного системного кровотока); 2) обеспечение беспрепятственного возврата от легочных вен в правое предсердие через межпредсердное сообщение; 3) создание управляемого легочного кровотока (дозированный легочный кровоток) [67, 112]. В то время как первые два этапа операции остались практически неизменными, изменения в основном затронули способы создания контролируемого легочного кровотока. В классической процедуре Norwood модифицированный шунт Blalock-Taussig обеспечивает легочный кровоток за счет создания анастомоза между безымянной или подключичной артерии и легочной артерией (обычно справа) при помощи протеза кровеносного сосуда синтетического*** из политетрафторэтилена (ПТФЭ). При этом шунте имеется непрерывный прямой поток из системного русла в малый круг кровообращения как в систолу, так и в диастолу. При шунте Blalock-Taussig может возникнуть явление "коронарного обкрадывания", поскольку снижается диастолическое давление в системе большого круга кровообращения (70 - 80% коронарного кровотока происходит во время диастолы, поэтому коронарное обкрадывание может играть важную роль, как причина смертности между операциями I и II этапа) [5, 10, 67].
Альтернативой шунту Blalock-Taussig является шунт соединяющий правый желудочек с бифуркацией легочных артерий. Хотя первоначальное описание такого шунта было сделано Norwood и его коллегами в 1981 году [113], популяризирована и модифицирована данная методика была Sano в начале 2000-х годов (и сейчас этот шунт часто называют шунтом Sano или модификацией Sano) [22, 114]. Данный шунт характеризуется потоком лишь в систолу, и как следствие, коронарного обкрадывания нет. Недостатком является необходимость выполнения вентрикулотомии с потенциальным риском нарушения функции единственного желудочка и отдаленного риска возникновения аритмии. Сейчас выбор шунта остается за хирургом [5, 10, 67, 158].
Гибридный I этап был разработан как менее инвазивный подход к паллиативной помощи новорожденным с СГЛС (возможность отсрочки объемного открытого полостного вмешательства как минимум до конца неонатального периода). Gibbs et al. в 1993 г. сообщили о первом удачном одномоментном стентировании открытого артериального протока в сочетании с раздельным двусторонним суживанием легочных артерий и баллонной атриосептостомией в качестве альтернативы первичному вмешательству по методике Norwood [115]. Данная методика подтвердила свою состоятельность в ряде последующих публикаций и где-то даже стала "стандартом" в качестве первого этапа паллиативной хирургической коррекции СГЛС [25 - 27, 97, 100, 116]. Сейчас чрескожную баллонную атриосептостомию стараются отложить до момента выписки пациента после гибридного первого этапа паллиативной коррекции [100, 116]. Независимо от варианта модификации, данная методика требует достижения тех же трех целей, которые изначально были предложены для операции Norwood: адекватный системный кровоток (при помощи стентирования открытого артериального протока), коррекция легочного кровотока (раздельное суживание легочных артерий) и беспрепятственный отток по легочным венам (баллонная атриосептостомия). В современной практике вторым этапом следует выполнение операции Norwood-ДКПА через 3 - 5 месяцев после ранее выполненного гибридного вмешательства [10, 12, 23 - 25, 64 - 67, 96 - 100, 116]. "Ахиллесовой пятой" данной модифицированной II стадии - является высокая частота формирования отсроченных стенозов левой легочной артерии.
Малоинвазивный подход к паллиативной помощи новорожденным с СГЛС возможно выполнять и без гибридных методик, делая в качестве первого этапа лишь раздельное суживание легочных артерий с поддержанием проходимости артериального протока при помощи пролонгированной инфузии простагландинов (от нескольких недель до двух месяцев), с последующим выполнением в качестве второго этапа операции Norwood-Blalock, Norwood-Sano или сразу Norwood с созданием кавопульмонального анастомоза. Данная методика лучше всего подходит пациентам группы высокого риска или пациентам, находящимся в критическом состоянии [26, 47 - 48, 118 - 124, 195 - 196].
- Всем пациентам с СГЛС рекомендовано этапное хирургическое лечение с созданием одножелудочковой гемодинамики и состоящее из трех этапов: 1) операции Норвуд (Norwood); 2) операции ДКПА (Glenn anastomosis); 3) операции Фонтена (Fontan) [18 - 22, 48, 64 - 67, 71, 85 - 86, 114].
УДД 4, УУР C
- Всем пациентам с СГЛС в качестве первого этапа хирургического лечения рекомендуется выполнение операции Norwood - Sano или Norwood - Blalock в течение первой 1 недели жизни после рождения [18 - 22, 64 - 67, 71, 85 - 86, 116 - 117].
УДД 4, УУР C
Комментарии: при выполнении хирургического пособия в более поздние сроки отмечается значительное увеличению послеоперационной летальности и частоты послеоперационных осложнений.
- Пациентам с СГЛС перед выполнением второго этапа хирургического лечения рекомендуется выполнение диагностической чрезвенозной катетеризации сердца с измерением давления в легочной артерии [18 - 22, 64 - 66, 71, 85 - 87, 116 - 117].
УДД 4, УУР C
Комментарии: при снижении систолического давления в легочной артерии менее 25 мм рт.ст. или среднего давления в легочной артерии менее 15 мм рт.ст. принимается решение о выполнении второго этапа хирургической коррекции СГЛС.
- Всем пациентам с СГЛС в качестве второго этапа хирургического лечения рекомендуется выполнение двунаправленного кавопульмонального анастомоза в возрасте 2 - 10 мес. [18 - 22, 64 - 67, 71, 85 - 87, 92, 116 - 124].
УДД 4, УУР C
Комментарии: возраст выполнения второго этапа для каждого ребенка индивидуален и зависит от того, когда у рассматриваемого пациента нормализуется сосудистое сопротивление в системе малого круга кровообращения.
- Всем пациентам с СГЛС в качестве третьего этапа хирургического лечения рекомендуется выполнение операции Fontan в возрасте 18 - 36 месяцев [18 - 22, 48, 64 - 67, 71, 88 - 91, 122 - 124].
УДД 4, УУР C
- Всем пациентам с СГЛС выполнение операции Fontan рекомендуется в модификации экстракардиального кондуита [48, 67, 88 - 91, 93 - 95, 122].
УДД 4, УУР C
- Выполнение гибридного I этапа гемодинамической коррекции перед операцией Norwood в качестве первого этапа хирургического лечения рекомендуется пациентам с СГЛС в следующих случаях: 1) при поступлении в стационар в крайне тяжелом состоянии, 2) при поступлении в стационар в возрасте старше 1 недели жизни, или 3) пациенты с низкой массой тела [5, 7, 10, 12, 23 - 25, 64 - 67, 96 - 100].
УДД 4, УУР C
Комментарии: выполнение гибридного первого этапа также является предпочтительным для пациентов с осложненным инфекционным и/или неврологическим анамнезом, при тяжелой сопутствующей соматической патологии. Низкая масса тела < 2.5 кг также является независимым фактором риска высокой летальности. Однако отмечается, что выживаемость у пациентов с низкой массой тела после гибридного вмешательства на данный момент остается выше по сравнению с операцией Norwood [119, 121, 169 - 173].
- После гибридного I этапа гемодинамической коррекции всем пациентам с СГЛС в качестве второго этапа хирургического лечения рекомендуется выполнение операции Norwood - двунаправленный кавопульмональный анастомоз, либо Norwood - Sano или Norwood - Blalock в возрасте 3 - 5 месяцев [5, 7, 19 - 22, 64 - 67, 96 - 100, 117 - 119].
УДД 4, УУР C
Комментарии: решение о типе операции принимается на основании анализа результатов дооперационного обследования и исходя из опыта клиники.
- В качестве альтернативы гибридного первого этапа рекомендуется рассмотреть возможность выполнения раздельного суживания легочных артерий с пролонгированием инфузии группы C01EA простагландины с целью поддержания артериального протока открытым [26, 47 - 48, 118 - 124]
УДД 4, УУР C
Комментарии: данная методика лучше всего подходит пациентам группы высокого риска (с низкой массой тела при рождении, значимой недостаточностью на трехстворчатом клапане, с сопутствующей сердечной или внесердечной патологией и др.) или пациентам, находящимся в критическом состоянии. Т.е. когда необходимость отсрочить операцию Norwood возникает лишь на относительно короткий промежуток времени (обычно лишь за период новорожденности). Такие пациенты находятся в стационаре до момента выполнения второго этапа гемодинамической коррекции. Продолжение непрерывной инфузии простагландинов более 2 месяцев крайне нежелательно, так как это приводит к резкому повышению риска возникновения фатальных осложнений (вазоплегия и др.). Поэтому если требуется отсрочить оперативное вмешательство по методике Norwood на более продолжительное время, то необходимо провести отсроченное стентирование открытого артериального протока для отмены инфузии простагландинов (перевести в гибридный первый этап) [26, 47 - 48, 118 - 124].
3.3 Рентгенэндоваскулярное лечение
- Баллонная атриосептостомия не рекомендуется пациентам с СГЛС с нерестриктивным дефектом межпредсердной перегородки в дооперационном периоде [5, 10, 25 - 27, 81 - 84].
УДД 4, УУР C
- Всем пациентам с СГЛС с градиентом давления на межпредсердном сообщении больше 10 мм рт. ст. и выраженными метаболическими нарушениями рекомендуется выполнение баллонной атриосептостомии с целью стабилизации состояния [46, 47, 81 - 84].
УДД 4, УУР C
Комментарии: при рестриктивном МПС в качестве первичного вмешательства возможно выполнение операции гемодинамической коррекции по Norwood или гибридного I этапа с атриосептостомией. Если выполнена изолированная атриосептостомия, то выполнение первого этапа одножелудочковой коррекции СГЛС оптимальнее отложить на несколько дней после выполнения данной процедуры. Такая тактика обусловлена необходимостью снижения сосудистого сопротивления в системе малого круга кровообращения. Пациентам с выраженной рестрикцией на межпредсердном сообщении или интактной межпредсердной перегородкой экстренное вмешательство необходимо проводить в первые 3 часа жизни для декомпрессии левого предсердия [82, 84].
- После гибридного I этапа гемодинамической коррекции всем пациентам с СГЛС перед выпиской из стационара рекомендуется выполнение баллонной атриосептостомии открытого овального окна (независимо от его размера) [25 - 27, 81 - 84].
УДД 4, УУР C
Комментарии: идентичной тактики необходимо придерживаться и в случае если ранее было выполнено раздельное суживание легочных артерий с пролонгированной инфузией простагландинов, но в итоге вместо операции Norwood следующим этапом было выполнено стентирование открытого артериального протока.
- В межэтапном периоде в случае возникновения осложнений (появлении стенозов легочных артерий, возникновении обструкции на уровне нисходящей аорты или стентированного протока и др.) рекомендовано использовать чрескожные эндоваскулярные методики [67, 116 - 117].
УДД 5, УУР C
Комментарии: к данным методикам также можно отнести создание дефекта межпредсердной перегородки со стентированием при неэффективности баллонной атриосептостомии, стентирование стенозов легочных артерий или повторное стентирование открытого артериального протока. Что касается обструкции на неоаорте, то предпочтение большинством хирургов отдается открытым методикам.
3.4 Иное лечение
- Пациентам с СГЛС и выраженным нарушением функции правого желудочка и/или выраженной дисфункцией трехстворчатого клапана в качестве единственной альтернативы этапной коррекции рекомендуется выполнение пересадки сердца [28 - 31, 48, 67, 106, 117, 122].
УДД 4, УУР B
Комментарии: при необходимости ожидания донорского сердца, промежуточным этапом лечения может стать гибридный I этап или использование механических средств поддержки гемодинамики (использование системы для экстракорпоральной мембранной оксигенации (ЭКМО) или других искусственных систем поддержки кровообращения).
- Пациентам с формами СГЛС с особой анатомией (сочетание атрезии клапана аорты, при отсутствии выраженной патологии митрального клапана с большим дефектом межжелудочковой перегородки и нормальным внутриутробным развитием полости левого желудочка - иКДО более 20 мл/м2) или существовании комплекса гипоплазии левых отделов сердца рекомендуется выполнение операций, направленных на сохранение двухжелудочковой гемодинамики [32 - 37, 125].
УДД 4, УУР C
Комментарии: так, как двухжелудочковая коррекция возможна лишь в определенных случаях и часто рискованна, выбор тактики хирургического лечения основывается на тщательном анализе дооперационных данных ЭхоКГ, при необходимости выполняется КТ или МРТ исследование. Полученные морфометрические результаты для каждого пациента в сочетании с морфологическими особенностями митрального и аортального клапанов, левого желудочка и гемодинамическими особенностями определяют итоговую хирургическую тактику.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Пациентам с СГЛС после любого из этапов хирургической коррекции рекомендуется в течение 4 - 6 последующих месяцев жизни избегать тракционных нагрузок на верхние конечности [10, 69, 129].
УДД 4, УУР C
- Всем пациентам с СГЛС после каждого этапа хирургического лечения рекомендуется выполнение реабилитационных мероприятий длительностью не менее 6 недель [62, 67, 70 - 71, 116 - 117, 195 - 196].
УДД 4, УУР C
Комментарии: прохождение реабилитации в большинстве случаев возможно на дому при условии периодического контроля состояния пациента педиатром по месту жительства (1 раз в 2 - 3 недели). Оптимальная длительность реабилитационного периода составляет 10 - 12 недель. Если реабилитация неэффективна, требуется подбор индивидуальной программы или частый контроль профильного специалиста, то необходимо рассмотреть вопрос об отправке пациента в специализированный реабилитационный центр.
- Всем пациентам с СГЛС после каждого этапа хирургического лечения рекомендуется подбор индивидуального оптимального режима физической активности на этапе амбулаторного наблюдения [10, 62, 67, 71, 116, 129 - 130].
УДД 4, УУР C
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Всем пациентам с СГЛС после выполнения каждого этапа гемодинамической коррекции рекомендуется диспансерное наблюдение у врача-детского кардиолога (Диспансерный прием (осмотр, консультация) врача - детского кардиолога) (имеющего опыт работы с ВПС) с целью выявления гемодинамических нарушений, которые могут потребовать хирургического лечения [5, 7, 10, 12, 25 - 31, 48, 67, 81 - 84, 96 - 100, 106, 117, 122 - 124].
УДД 4, УУР C
Комментарии: к наиболее частой патологии, требующей выполнения дополнительной коррекции, относится: развитие недостаточности системного атрио-вентрикулярного лапана (трехстворчатого клапана), недостаточность неоаортального клапана, развитие обструкции восходящей аорты и/или дуги аорты после ранее выполненной реконструкции, развитие тенозов легочных артерий, необходимость замены кондуита и др. При развитии данных осложнений необходимо провести оценку возможности устранения развившейся патологии. Если возможно выполнение реконструктивных вмешательств, то они являются методом выбора, однако, в случае невозможности выполнения реконструктивных вмешательств единственно возможным решением остается трансплантация сердца.
- Рекомендуется проводить обучающие школы для всех родителей детей с СГЛС для возможности дополнительного контроля за состоянием ребенка на дому в межэтапном периоде [116 - 117].
УДД 4, УУР C
Комментарии: важную роль играют родители в соблюдении врачебных рекомендаций (более быстрой реабилитации детей) и выявлении ранних признаков ухудшения состояния детей с СГЛС. Поэтому сердечно-сосудистые препараты должны быть безопасными, понятными и простыми в применении. А родителей надо обучать контролировать частоту и характер дыхания во время сна ребенка, объем перорального приема пищи, массу тела (сообщать курирующему врачу обо всех выявленных отклонениях).
- Всем пациентам с СГЛС между этапами хирургического лечения рекомендуется диспансерный прием (осмотр, консультация) врача-педиатра участкового по месту жительства (не реже 1 раза в 2 недели) и диспансерный прием (осмотр, консультация) врача-детского кардиолога (в течение первых 2 месяцев - не реже 1 раза в 7 дней, далее - не реже 1 раза в месяц) [5, 7, 10, 12, 19 - 21, 35, 42, 53, 58, 62, 63, 67, 116, 131 - 138, 145].
УДД 5, УУР C
Комментарии: столь высокая частота контрольных амбулаторных обследований со стороны врачей необходима для своевременного выявления любого гемодинамического дисбаланса на раннем этапе до развития критической ситуации, а также своевременное обнаружение внесердечных осложнений или сопутствующих патологий, которые могут отразиться на конечном результате лечения. При раннем выявлении гемодинамических или других проблем следует активно проводить диагностические и при необходимости интервенционные процедуры, призванные купировать прогрессирование выявленных нарушений.
- Пациентам с СГЛС после каждого этапа хирургического лечения рекомендуется обследование в специализированном кардиохирургическом стационаре с частотой не менее 1 раза в 3 месяца в межэтапном периоде и на протяжении первого года после выполнения операции Fontan [5, 7, 10, 67, 87 - 96, 101, 106, 116 - 117].
УДД 4, УУР C
- Через год после выполнения операции Fontan всем пациентам с СГЛС рекомендовано наблюдаться в специализированном стационаре с частотой не менее 1 раза в год (оптимально 2 раза в год) [5, 10, 62, 67, 87 - 96, 101, 106, 116 - 117, 145].
УДД 4, УУР C
- Всем пациентам с СГЛС при каждом обследовании в специализированном стационаре рекомендовано выполнение ЭхоКГ с контролем сократительной функции единственного функционального желудочка сердца, контроль недостаточности клапана неоаорты и трикуспидального клапана, а также оценкой гемодинамики в неоаорте (исключения обструкции системного кровотока), размеры межпредсердного сообщения и характер кровотока в легочных артериях (исключение обструкции легочного кровотока) [5, 7, 10, 12, 25 - 31, 48, 67, 81 - 84, 96 - 100, 106, 117, 122 - 124].
УДД 4, УУР C
- Всем пациентам с СГЛС рекомендовано диспансерное наблюдение у врача-невролога по месту жительства [40 - 41, 67, 117, 126 - 129, 137 - 138, 145].
УДД 5, УУР C
Комментарии: Rogers et al. опубликовали данные о том, что у 73% детей с СГЛС через 38 месяцев после хирургической коррекции отмечалась микроцефалия, у 45% сохранялся дефицит массы тела. У 64% детей отмечалась различная степень задержки умственного развития и у 73% отмечалась существенная функциональная инвалидность [38]. По данным Kern et al. средний результат IQ (детей в отдаленном периоде с СГЛС) составил 88, у 8.3% пациентов отмечалась значимая задержка умственного развития [39]. Более поздние исследования показали, что дети с СГЛС отстают в психоэмоциональном (IQ = 89) и физическом развитии, но отличия не значительны по сравнению с детьми, у которых отмечаются другие врожденные пороки сердца [40 - 41].
- Всем пациентам с СГЛС после каждого этапа хирургической коррекции рекомендован подбор индивидуальной терапии, направленный на коррекцию недостаточности кровообращения и снижения сосудистого сопротивления в сосудах малого круга кровообращения [5, 7, 65, 67, 70, 80, 86 - 88, 101, 104 - 108, 116 - 117].
УДД 3, УУР C
Комментарии: подбор терапии осуществляется в кардиохирургическом стационаре перед выпиской пациента. В случае необходимости коррекцию терапии осуществляет кардиолог по месту жительства пациента.
6. Организация оказания медицинской помощи
Этапы оказания медицинской помощи и показания к госпитализации:
1. уточнение диагноза;
2. в случае подтверждения диагноза СГЛС (следует понимать, что порок всегда является критическим), необходимо неотложно переводить ребенка в отделение реанимации и интенсивной терапии и начинать консервативную терапию (назначение инфузии C01EA простагландины, при необходимости C01D вазодилататоры для лечения заболеваний сердца и C01C кардиотонические средства кроме сердечных гликозидов, при отсутствии эффекта - перевод на ИВЛ) и организовать экстренный перевод в кардиохирургический стационар для хирургической помощи, тотчас после медикаментозной стабилизации клинического состояния;
3. если состояние пациента стабильное на фоне инфузии C01EA простагландинов, то независимо от этого необходимо в кратчайшие сроки организовать перевод пациента в кардиохирургический стационар, так как декомпенсация состояния может развиться в любой момент времени (при этом пациент должен также находиться в условиях отделения реанимации и интенсивной терапии);
4. подтвержденный СГЛС всегда является абсолютным показанием к кардиохирургическому этапному паллиативному лечению в возрасте 1 - 2 недель жизни, причем предпочтение в качестве первого этапа должно отдаваться операции по методике Norwood, если позволяет стояние пациента. В случае наличия сопутствующей патологии или крайней тяжести состояния, предпочтение в качестве первого этапа может отдаваться гибридному первому этапу гемодинамической коррекции или раздельному суживанию легочных артерий в сочетании с пролонгированной инфузией C01EA простагландинов. Далее всем пациентам выполняются следующие этапы хирургической коррекции по индивидуальному подходу, пока не будет выполнена операция Fontan, которая является завершающим этапом паллиативной коррекции СГЛС.
Основы консервативной терапии
- ключевая роль в предоперационной консервативной терапии отводится внутривенной инфузии (C01EA) простагландинов поддерживающих проходимость артериального протока;
- важно придерживаться следующего алгоритма при стабилизации состояния пациента (в случае прогрессивного ухудшения состояния пациента): в первую очередь исключить избыточный легочный кровоток, вторым шагом исключить системную гиповолемию, третьим шагом рекомендовано назначение инфузии производных нитроферрицианида или антиадренергических средств периферического действия под контролем артериального давления. Далее при необходимости назначаются кардиотонические средства кроме сердечных гликозидов (по возможности следует избегать препаратов с выраженным вазопрессорным эффектом);
- при сатурации > 90% в сочетании с лактат-ацидозом, артериальной гипотензией и олигурией рекомендуется проведение интубации трахеи и перевод на ИВЛ. ИВЛ проводится с высокими параметрами положительного давления в конце выдоха и с фракцией кислорода 21%. В остальных случаях, без крайней необходимости, следует стараться избегать перевода пациента на ИВЛ, так как неоправданный перевод может наоборот ухудшить состояние пациента;
- критериями эффективности предоперационной консервативной терапии являются нормализация кислотно-щелочного равновесия, регресс содержания сывороточного лактата, тенденция к нормализации диуреза и сокращение уровня остаточного азота плазмы крови, уровень оксигенации артериальной крови в интервале 75 - 90%.
Показания к выписке пациента из медицинской организации:
- сбалансированный системный и легочный кровотоки;
- отсутствие необходимости в продолжении дыхательной поддержки и в/в инфузионной терапии;
- отсутствие признаков сердечной недостаточности;
- синусовый ритм сердца.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- Всем пациентам с СГЛС рекомендуется выполнение нейросонографии и/или КТ исследования головного мозга и проведение приема (осмотра, консультации) врача-невролога (повторный) перед каждым этапом хирургической коррекции СГЛС с целью выявления патологических изменений, которые влияют на результат хирургической коррекции и могут повлиять на выбор анестезиологического и перфузионного пособия [5, 7, 10, 40 - 41, 67, 117, 126 - 129, 145].
УДД 5, УУР C
- Всем пациентам с СГЛС при первичном поступлении в специализированный стационар перед первым этапом хирургической коррекции рекомендуется проведение оценки функционального состояния печени и почек. При наличии выраженной почечной и печеночной недостаточности проводится терапия, направленная на нормализацию их функции. После нормализации показателей ставится вопрос о готовности пациента к операции [5, 10, 48, 67, 70, 80, 86 - 88, 101, 104 - 108, 116].
УДД 5, УУР C
- Стационарное лечение всех пациентов с СГЛС рекомендуется проводить в лечебных медицинских учреждениях с большим опытом выполнения данных операций и соответствующим опытом послеоперационного ведения пациентов. Для клиник с большим объемом операций у пациентов с СГЛС более характерна тенденция к снижению летальности [5, 7, 10, 80, 86, 88, 104].
УДД 5, УУР C
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
Этап постановки диагноза
1
Проведен осмотр, выполнен тщательный сбор анамнеза и жалоб
Да/Нет
2
Выполнен прием (осмотр, консультация) врача-кардиолога первичный/прием (осмотр, консультация) врача - детского кардиолога первичный/прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный
Да/Нет
3
Выполнена аускультация при патологии сердца и перикарда
Да/Нет
4
Проведено измерение артериального давления
Да/Нет
5
Оценена перистальтика
Да/Нет
6
Выполнено исследование кислотно-основного состояния и газов крови
Да/Нет
7
Выполнен общий (клинический) анализ крови
Да/Нет
8
Выполнено определение основных групп по системе AB0 и определение антигена D системы Резус (резус-фактор)
Да/Нет
9
Выполнена коагулограмма (ориентировочное исследование системы гемостаза)
Да/Нет
10
Выполнено биохимическое общетерапевтическое исследование крови
Да/Нет
11
Выполнена трансторакальная эхокардиография
Да/Нет
12
Ангиокардиография не выполнялась
Да/Нет
13
В тех случаях, когда данных ЭхоКГ недостаточно для верификации диагноза выполнена магнитно-резонансная томография сердца и магистральных сосудов
Да/Нет
14
Выполнена компьютерная томография сердца с контрастированием, если эхокардиографического исследования недостаточно для верификации диагноза
Да/Нет
15
Выполнена прицельная рентгенография органов грудной клетки
Да/Нет
16
Выполнена регистрация электрокардиограммы
(расшифровка, описание и интерпретация электрокардиографических данных)
Да/Нет
17
Выполнена нейросонография
Да/Нет
Этап консервативного лечения
1
Выполнен перевод в отделение реанимации и интенсивной терапии для мониторинга жизненно важных функций и стабилизации состояния пациентов с пренатально установленным диагнозом СГЛС сразу после родоразрешения
Да/Нет
2
После стабилизации состояния в отделении реанимации и интенсивной терапии новорожденных выполнен перевод в ближайший кардиохирургический стационар
Да/Нет
3
Новорожденному с синдромом гипоплазии левых отделов сердца начата инфузия C01EA простагландинов
Да/Нет
4
Не назначена дополнительная оксигенотерапия при сохранении показателей сатурации в пределах 75 - 85%
Да/Нет
5
Выполнена интубация трахеи и начата искусственная вентиляция легких (фракция кислорода 21%) при сатурации > 90% в сочетании с лактат-ацидозом, артериальной гипотензией и олигурией
Да/Нет
6
При снижении функции правого, функционально единственного желудочка (сердечной недостаточностью), консервативное лечение проведено в соответствии с алгоритмом
Да/Нет
7
Назначены антибактериальные препараты системного действия в роддоме при наличии факторов риска инфекции
Да/Нет
8
При рестриктивном межпредсердном сообщении введены миорелаксанты в расчетных дозах, выполнена интубация трахеи пациента и начата дополнительная оксигенотерапия + увеличены дозы C01EA простагландинов
Да/Нет
Этап хирургического лечения
1
Выполнено оперативное вмешательство по методике Norwood - Sano или Norwood - Blalock в течение первой недели жизни после рождения в качестве первого этапа хирургического лечения
Да/Нет
2
Выполнен гибридный I этап гемодинамической коррекции перед операцией Norwood как первый этап хирургического лечения при поступлении пациента в стационар в крайне тяжелом состоянии или при поступлении в стационар в возрасте старше 1 недели жизни
Да/Нет
3
При поступлении пациента в стационар в крайне тяжелом состоянии выполнено раздельное суживание легочных артерий с пролонгированной инфузией C01EA простагландинов до операции Norwood в качестве первого этапа хирургического лечения
Да/Нет
4
Выполнена операция Norwood - двунаправленный кавопульмональный анастомоз, либо Norwood - Sano или Norwood - Blalock в возрасте 3 - 5 месяцев в случае, если ранее выполнялся гибридный I этап гемодинамической коррекции
Да/Нет
5
Выполнен двунаправленный кавопульмональный анастомоз в возрасте ребенка 2 - 10 месяцев следующим этапом после ранее выполненного вмешательства по методике Norwood-Sano или Norwood-Blalock
Да/Нет
6
Завершающим этапом выполнена операция Fontan, в возрасте 18 - 36 мес.
Да/Нет
7
В дооперационном периоде пациентам с СГЛС и нерестриктивным дефектом межпредсердной перегородки баллонная атриосептостомия не выполнялась
Да/Нет
8
Всем пациентам с СГЛС с градиентом давления на межпредсердном сообщении больше 10 мм рт. ст. выполнена баллонная атриосептостомия
Да/Нет
9
После гибридного I этапа гемодинамической коррекции всем пациентам с СГЛС перед выпиской из стационара выполнена баллонная атриосептостомия
Да/Нет
10
Пациентам с комплексом гипоплазии левых отделов сердца выполнены операции, направленные на сохранение двухжелудочковой гемодинамики
Да/Нет
Этап послеоперационного контроля
1
Всем пациентам с СГЛС после выполнения каждого этапа гемодинамической коррекции диспансерное наблюдение выполняется у врача-детского кардиолога, имеющего опыт работы с ВПС
Да/Нет
2
Проведены обучающие школы для всех родителей детей с СГЛС
Да/Нет
3
Проведен диспансерный прием (осмотр, консультация) врача-педиатра участкового (не реже 1 раза в 2 недели) и диспансерный прием (осмотр, консультация) врача-детского кардиолога в течение первых 2 месяцев - не реже 1 раза в 7 дней, далее - не реже 1 раза в месяц)
Да/Нет
4
Выполнено обследование в специализированном стационаре 1 раз в 3 месяца в межэтапном периоде и на протяжении первого года после выполненной операции Fontan
Да/Нет
5
Выполнена эхокардиография при каждом обследовании в специализированном стационаре
Да/Нет
6
После каждого этапа коррекции выполнен подбор индивидуальной терапии, направленный на коррекцию недостаточности кровообращения и снижения сосудистого сопротивления в сосудах малого круга кровообращения и осуществлен контроль приема назначенной терапии
Да/Нет
7
Пациентам с СГЛС после каждого этапа хирургического лечения (на этапе амбулаторного наблюдения) выполнен подбор индивидуального режима физической активности
Да/Нет
8
Всем пациентам с СГЛС после выполнения третьего этапа хирургического лечения проведено использование опросников качества жизни для разработки индивидуальных схем психологической реабилитации
Да/Нет
9
Всем пациентам с СГЛС проводится диспансерное наблюдение у врача-невролога по месту жительства
Да/Не
Список литературы
1. Nicholls D.G., Ungerleider R.M., Spevak P.J. Hypoplastic left heart syndrome. In: Nicholls D.G., Ungerleider R.M. et al. (eds). Critical Heart Disease in Infants and Children, 2nd ed. Mosby, Philadelphia, 2006, pp 823 - 844.
2. Lev M. Pathologic anatomy and interrelationship of hypoplasia of the aortic tract complexes. Lab Invest 1952; 1: 61 - 70.
3. Tchervenkov C.I., Jacobs J.P., Weinberg P.M., et al. The nomenclature, definition and classification of hypoplastic left heart syndrome. Cardiol Young 2006; 16: 339 - 68.
4. Noonan J.A., Nadas A.S. The hypoplastic left heart syndrome. An analysis of 101 cases. Pediatr Clin North Am 1958; 5: 1029 - 1056.
5. Kirklin J.W., Barratt-Boyes B.G. Aortic atresia and other forms of hypoplastic left heart physiology. In: Kirklin J.W., Barratt-Boyes B.G. (eds). Cardiac Surgery. Fourth edition, 2013, pp 1780 - 1809.
6. Mahowald JM, Lucas RV Jr, Edwards JE. Aortic valvular atresia. Associated cardiovascular anomalies. Pediatr Cardiol 1982; 2: 99.
7. Jonas R.A. Hypoplastic left heart syndrome. In: Jonas R.A. (eds). Comprehensive Surgical Management of Congenital Heart Disease. Hodder Arnold, London, pp. 341 - 354
8. Izukawa T, Mullholland C, Rowe RD et al. Structural heart disease in newborn, changing profile: comparison of 1975 with 1965. Arch Dis Child 1979; 54: 281 - 285.
9. Scott D.J., Rigby M.L., Miller G.AH, Shinebourne E.A. The presentation of symptomatic heart disease in infancy based on 10 years' experience (1973 - 1982): implications for the provision of service. BrHeartJ 1984, 52: 248 - 257.
10. Бокерия Л.А., Шаталов К.В. Детская кардиохирургия: руководство для врачей. М.: НЦССХ им. А.Н. Бакулева 2016; стр. 684 - 700.
11. Hunter LE, Simpson JM. Prenatal screening for structural congenital heart disease. Nat Rev Cardiol. 2014; 11(6): 323 - 34.
12. Anderson R.H., Baker E.J., et al. Hypoplastic left heart syndrome. In: Anderson R.H. et al. (eds). Paediatric cardiology Anderson, 3rd ed. Churchill Livingstone, Philadelphia, 2010, pp. 625 - 645.
13. Mery C.M., Nieto R.M., De ![]() L.E., Morris S.A. et al. The Role of Echocardiography and Intracardiac Exploration in the Evaluation of Candidacy for Biventricular Repair in Patients With Borderline Left Heart Structures. Ann Thorac Surg. 2017 Mar; 103(3): 853 - 861.
L.E., Morris S.A. et al. The Role of Echocardiography and Intracardiac Exploration in the Evaluation of Candidacy for Biventricular Repair in Patients With Borderline Left Heart Structures. Ann Thorac Surg. 2017 Mar; 103(3): 853 - 861.
14. McElhinney D.B., Vogel M., Benson C.B., Marshall A.C. et al. Assessment of left ventricular endocardial fibroelastosis in fetuses with aortic stenosis and evolving hypoplastic left heart syndrome. Am J Cardiol. 2010 Dec 15; 106(12): 1792 - 7.
15. Mahle WT, Weinberg PM, Rychik J. Can echocardiography predict the presence or absence of endocardial fibroelastosis in infants < 1 year of age with left ventricular outflow obstruction? Am J Cardiol 1998; 82(1): 122 - 4.
16. Kim HJ, Goo HW, Park SH, Yun TJ. Left ventricle volume measured by cardiac CT in an infant with a small left ventricle: a new and accurate method in determining uni- or biventricular repair. Pediatr Radiol. 2013 Jan; 43(2): 243 - 6
17. Dillman J.R., Dorfman A.L., Attili A.K., Agarwal P.P. et al. Cardiovascular magnetic resonance imaging of hypoplastic left heart syndrome in children. Pediatr Radiol. 2010 Mar; 40(3): 261 - 74. Theilen U., Shekerdemian L. The intensive care of infants with hypoplastic left heart syndrome. Arch Dis Child Fetal Neonatal Ed 2005; 90: P97 - 102.
18. Theilen U., Shekerdemian L. The intensive care of infants with hypoplastic left heart syndrome. Arch Dis Child Fetal Neonatal Ed 2005; 90: P97 - 102.
19. Feinstein J.A., Benson D.W., Dubin A.M., Cohen M.S. et al. Hypoplastic left heart syndrome: current considerations and expectations. J Am Coll. Cardiol. 2012 Jan 3; 59(1 Suppl): S1 - 42.
20. Nakano T., Kado H., Tatewaki H., Hinokiyama K. et al. Surgical strategy and the results for hypoplastic left heart syndrome. Kyobu Geka. 2014 Apr; 67(4): 299 - 304.
21. Maeda Y., Yamagishi M., Miyazaki T., Yamamoto Y. et al. The treatment strategy for hypoplastic left heart syndrome. Kyobu Geka. 2014 Apr; 67(4): 305 - 9.
22. Sano S, Ishino K, Kawada M, et al. Right ventriclepulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome. J Thorac Cardiovasc Surg. 2003; 126(2): 504 - 9.
23. Bacha EA, Daves S, Hardin J, et al. Single-ventricle palliation for high-risk neonates: the emergence of an alternative hybrid stage I strategy. J Thorac Cardiovasc Surg. 2006; 131(1): 163 - 171.
24. Caldarone CA, Benson L, Holtby H, Li J, Redington AN, Van Arsdell GS. Initial experience with hybrid palliation for neonates with single-ventricle physiology. Ann Thorac Surg. 2007; 84(4): 1294 - 300.
25. Galantowicz M, Cheatham JP, Phillips A, et al. Hybrid approach for hypoplastic left heart syndrome: intermediate results after the learning curve. Ann Thorac Surg. 2008; 85(6): 2063 - 70.
26. Galantowicz M, Cheatham JP. Lessons learned from the development of a new hybrid strategy for the management of hypoplastic left heart syndrome. Pediatr Cardiol 2005; 26: 190 - 9. Erratum in: Pediatr Cardiol 2005; 26:307.
27. Hill SL, Galantowicz M, Cheatham JP. Emerging strategies in the treatment of hlhs: combined transcatheter & surgical techniques. Pediatr Cardiol Today 2003; 1: 1 - 4.
28. Almond CD, Thiagarajan RR, Piercey GE, et al. Waiting list mortality among children listed for heart transplantation in the United States. Circulation 2009; 119: 717 - 27.
29. Boucek RJ, Chrisant M. Cardiac transplantation for hypoplastic left heart syndrome. Cardiol Young 2004; 14: 83 - 7.
30. Kirk R, Edwards LB, Kucheryavaya AY, et al. The Registry of the International Society for Heart and Lung Transplantation: thirteenth official pediatric heart transplantation report-2010. J Heart Lung Transplant 2010; 29: 1119 - 28.
31. Alsoufi B, Deshpande S, McCracken C, Kogon B, Vincent R, Mahle W, Kanter K. Results of heart transplantation following failed staged palliation of hypoplastic left heart syndrome and related single ventricle anomalies. Eur J Cardiothorac Surg. 2015 Nov; 48(5): 792 - 8.
32. Yasui H, Kado H, Nakano E, et al. Primary repair of interrupted aortic arch and severe aortic stenosis in neonates. J Thorac Cardiovasc Surg 1987; 93: 539 - 45.
33. Tchervenkov CI, Tahta Sa, Jutras LC,  MJ. Biventricular Repair in Neonates with Hypoplastic Left Heart Complex. Ann Thorac Surg 1998; 66; 1350 - 7.
MJ. Biventricular Repair in Neonates with Hypoplastic Left Heart Complex. Ann Thorac Surg 1998; 66; 1350 - 7.
34. Бокерия Л.А., Подзолков В.П., Барышникова И.Ю., Симогаева Е.Б., Беришвили Д.О. Двухжелудочковая реконструкция после гибридного I этапа при обструктивных поражениях левого сердца. Детские болезни сердца и сосудов, 2013; 4: 32 - 36.
35. Калашников С.В., Беришвили Д.О. Влияние гипоплазии левых отделов сердца на возможность двухжелудочковой коррекции сложных врожденных пороков сердца периода новорожденности. Детские болезни сердца и сосудов. 2015; (4): 47 - 57.
36. Avitabile CM, Mercer-Rosa L, Ravishankar C, Rome JJ et. al. Experience with biventricular intervention for neonates with mitral valve abnormalities in the setting of critical left-side heart obstruction. Ann Thorac Surg. 2015 Mar; 99(3): 877 - 83.
37. Kanter KR, Kirshbom PM, Kogon BE; Biventricular repair with the Yasui operation (Norwood/Rastelli) for systemic outflow tract obstruction with two adequate ventricles; Ann Thorac Surg. 2012 Jun; 93(6).
38. Rogers BT, Msall ME, Buck GM, et al. Neurodevelopmental outcome of infants with hypoplastic left heart syndrome. J Pediatr 1995; 126: 496 - 8.
39. Kern JH, Hinton VJ, Nereo NE, Hayes CJ, Gersony WM. Early developmental outcome after the Norwood procedure for hypoplastic left heart syndrome. Pediatrics 1998; 102: 1148 - 52.
40. Martin BJ, De Villiers JI, Joffe AR, Bond GY, Acton BV et. al. Hypoplastic left heart syndrome is not associated with worse clinical or neurodevelopmental outcomes than other cardiac pathologies after the Norwood-Sano operation. Pediatr Cardiol. 2017 Jun; 38(5): 922 - 931.
41. Knirsch W, Liamlahi R, Dave H, Kretschmar O, Latal B. Neurodevelopmental Outcome of Children with Hypoplastic Left Heart Syndrome at One and Four Years of Age Comparing Hybrid and Norwood Procedure. Ann Thorac Cardiovasc Surg. 2016 Dec 20; 22(6): 375 - 377.
42. Raat H, Bonsel GJ, Essink-Bot ML, Landgraf JM, Gemke RJ. Reliability and validity of comprehensive health status measures in children: The Child Health Questionnaire in relation to the Health Utilities Index. J Clin Epidemiol 2002; 55: 67 - 76.
43. Garcia RU, Natarajan G, Walters HL, Delius RE, Aggarwal S. Acute kidney injury following first-stage palliation in hypoplastic left heart syndrome: hybrid versus Norwood palliation. Cardiol Young. 2018 Feb; 28(2): 261 - 268.
44. Goldstein BH, Goldstein SL, Devarajan P, Zafar F et al. First-stage palliation strategy for univentricular heart disease may impact risk for acute kidney injury. Cardiol Young. 2018 Jan; 28(1): 93 - 100.
45. Maller VV, Cohen HL. Neurosonography: Assessing the Premature Infant. Pediatr Radiol. 2017 Aug; 47(9): 1031 - 1045.
46. Barker GM, Forbess JM, Guleserian KJ, Nugent AW. Optimization of preoperative status in hypoplastic left heart syndrome with intact atrial septum by left atrial decompression and bilateral pulmonary artery bands. Pediatr Cardiol. 2014 Mar; 35(3): 479 - 84.
47. Gomide M, Furci B, Mimic B, Brown KL et al. Rapid 2-stage Norwood I for high-risk hypoplastic left heart syndrome and variants.J Thorac Cardiovasc Surg. 2013 Nov; 146(5): 1146 - 51; discussion 1151-2.
48. Mitani Y, Takabayashi S, Sawada H, Ohashi H, Hayakawa H, Ikeyama Y et al. Fate of the "opened" arterial duct: Lessons learned from bilateral pulmonary artery banding for hypoplastic left heart.
49. Stieh J, Fischer G, Scheewe J, Uebing A,  P et al. Impact of preoperative treatment strategies on the early perioperative outcome in neonates with hypoplastic left heart syndrome J Thorac Cardiovasc Surg. 2006 May; 131(5): 1122 - 1129. e2.
P et al. Impact of preoperative treatment strategies on the early perioperative outcome in neonates with hypoplastic left heart syndrome J Thorac Cardiovasc Surg. 2006 May; 131(5): 1122 - 1129. e2.
50. Hoffman J.I., Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol (2002) 39: 1890 - 1900.
51. Grossfeld P, Ye M, Harvey R. Hypoplastic left heart syndrome: new genetic insights. J Am Coll Cardiol 2009; 53: 1072 - 4.
52. Sharland GK, Chita SK, Fagg NL, Anderson RH, Tynan M, Cook AC, et al. Left ventricular dysfunction in the fetus: relation to aortic valve anomalies and endocardial fibroelastosis. Br Heart J 1991; 66: 419.
53. Sedmera, D.; Cook, A.C.; Shirali, G.; McQuinn, T.C. Current issues and perspectives in hypoplasia of the left heart. Cardiol. Young 2005, 15, 56 - 72.
54. Krane, M.; Dressen, M.; Santamaria, G.; My, I.; Schneider, C.M.; Dorn, T.; Laue, S.; Mastantuono, E.; Berutti, R.; Rawat, H.; et al. Sequential Defects in Cardiac Lineage Commitment and Maturation Cause
55. Bardo DM, Frankel DG, Applegate KE, Murphy DJ, Saneto RP. Hypoplastic left heart syndrome. Radiographics. 2001 May - Jun; 21(3): 705 - 17.
56. Norwood WI. Hypoplastic left heart syndrome. Cardiol Clin 1989; 7: 377 - 385.
57. Norwood WI. Hypoplastic left heart syndrome. Ann Thorac Surg 1991; 52: 688 - 695.
58. Kritzmire SM, Cossu AE. Hypoplastic Left Heart Syndrome. 2023 Apr 24. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan.
59. Metcalf MK, Rychik J. Outcomes in Hypoplastic Left Heart Syndrome. Pediatr Clin North Am. 2020 Oct; 67(5): 945 - 962.
60. Rychik J, Rome JJ, Collins MH, et al. The hypoplastic left heart syndrome with intact atrial septum: atrial morphology, pulmonary vascular histopathology and outcome. J Am Coll Cardiol 1999; 34: 554 - 60.
61. Glatz JA, Tabbutt S, Gaynor JW, et al. Hypoplastic left heart syndrome with atrial level restriction in the era of prenatal diagnosis. Ann Thorac Surg 2007; 84: 1633 - 8.
62. Saxena A, Relan J, Agarwal R, Awasthy N, Azad S, Chakrabarty M. et all. Indian guidelines for indications and timing of intervention for common congenital heart diseases: Revised and updated consensus statement of the Working group on management of congenital heart diseases. Ann Pediatr Cardiol. 2019 Sep - Dec; 12(3): 254 - 286.
63. DaCruz EM, Ivy D, Jaggers J Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. London, Springer London, 2014. DOI: 10.1007/978-1-4471-4619-3.
64. Feinstein JA, Benson DW, Dubin AM, Cohen MS, Maxey DM et al. Hypoplastic left heart syndrome: current considerations and expectations. J Am Coll Cardiol. 2012 Jan 3; 59(1 Suppl): S1 - 42. Erratum in: J Am Coll Cardiol. 2012 Jan 31; 59(5): 544.
65. Roeleveld PP, Axelrod DM, Klugman D, Jones MB, Chanani NK, Rossano JW, Costello JM. Hypoplastic left heart syndrome: from fetus to Fontan. Cardiol Young. 2018 Nov; 28(11): 1275 - 1288.
66. Liu MY, Zielonka B, Snarr BS, et al. Longitudinal assessment of outcome from prenatal diagnosis through fontan operation for over 500 fetuses with single ventricle-type congenital heart disease: the philadelphia fetus-to-fontan cohort study. J Am Heart Assoc 2018; 7: e009145.
67. Ohye RG, Schranz D, D'Udekem Y. Current therapy for hypoplastic left heart syndrome and related single ventricle lesions. Circulation 2016; 134: 1265 - 1279.
68. Morris SA, Ethen MK, Penny DJ, et al. Prenatal diagnosis, birth location, surgical center, and neonatal mortality in infants with hypoplastic left heart syndrome. Circulation 2014; 129: 285 - 292.
69. Share DA, Campbell DA, Birkmeyer N, Prager RL, Gurm HS, Moscucci M, Udow-Phillips M, Birkmeyer JD. How a regional collaborative of hospitals and physicians in Michigan cut costs and improved the quality of care. Health Aff (Millwood). 2011; 30: 636 - 645.
70. Mahle, WT.; Nicolson, S.; Shekerdemian, LS.; Gaies, MG.; Witte, MK.; Lee, EK.; Goldsworthy, M.; Stark, P.; Burns, KM.; Scheurer, MA.; Cooper, DS.; Thiagarajan, R.; Sivarajan, B.; Hollenbeck-Pringle, D.; Colan, S. American Heart Association Scientific Sessions 2015. Orlando, Florida: Nov 10. 2015 Utilizing a Collaborative Learning Model to Decrease Length of Postoperative Ventilation Following Infant Heart Surgery.
71. Pasquali SK, Ohye RG, Lu M, Kaltman J, Caldarone CA, Pizarro C, Dunbar-Masterson C, Gaynor JW, Jacobs JP, Kaza AK, Newburger J, Rhodes JF, Scheurer M, Silver E, Sleeper LA, Tabbutt S, Tweddell J, Uzark K, Wells W, Mahle WT, Pearson GD, for the Pediatric Heart Network Investigators. Variation in perioperative care across centers for infants undergoing the Norwood procedure. J Thorac Cardiovasc Surg. 2012; 144: 915 - 921.
72. Graham EM, Bradley SM, Atz AM. Preoperative management of hypoplastic left heart syndrome. Expert Opin Pharmacother. 2005 May; 6(5): 687 - 93.
73. abbutt S, Ramamoorthy C, Montenegro LM, et al. Impact of inspired gas mixtures on preoperative infants with hypoplastic left heart syndrome during controlled ventilation. Circulation 2001; 104: I-159-64.
74. Gatelli IF, Vitelli O, Chiesa G, De Rienzo F, Martinelli S. Noninvasive Cardiac Output Monitoring in Newborn with Hypoplastic Left Heart Syndrome. Am J Perinatol. 2020 Sep; 37(S02): S54 - S56.
75. ElHassan NO, Tang X, Gossett J, Zakaria D, Ross A, Kona SK, Prodhan P. Necrotizing Enterocolitis in Infants with Hypoplastic Left Heart Syndrome Following Stage 1 Palliation or Heart Transplant. Pediatr Cardiol. 2018 Apr; 39(4): 774 - 785.
76. Javed R, Cetta F, Said SM, Olson TM, O"Leary PW, Qureshi MY. Hypoplastic Left Heart Syndrome: An Overview for Primary Care Providers. Pediatr Rev. 2019 Jul; 40(7): 344 - 353.
77. Tran NN, Tran M, Lemus RE, Woon J, Lopez J, Dang R, Votava-Smith JK. Preoperative Care of Neonates With Congenital Heart Disease. Neonatal Netw. 2022 Jul 1; 41(4): 200 - 210.
78. Johnson B, Mussatto K, Uhing M, Zimmerman H, Tweddell J, Ghanayem N. Variability in the preoperative management of infants with hypoplastic left heart syndrome. Pediatr Cardiol 2008; 29: 515 - 20.
79.  M, Sacharczuk J, Mleczko M, Skalski JH, Mroczek T. The effect of prenatal diagnosis on antibiotic therapy in neonates with hypoplastic left heart syndrome. Antibiotics in prenatally diagnosed patients with HLHS. Folia Med Cracov. 2019; 59(2): 35 - 44.
M, Sacharczuk J, Mleczko M, Skalski JH, Mroczek T. The effect of prenatal diagnosis on antibiotic therapy in neonates with hypoplastic left heart syndrome. Antibiotics in prenatally diagnosed patients with HLHS. Folia Med Cracov. 2019; 59(2): 35 - 44.
80. Webb G.D., Smallhorn J.F., Th errien J., Redington A.N.: Congenital heart disease. In: Bonow R.O., Mann D.L., Zipes D.P., Libby P., eds. Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine. 9th ed. Philadelphia, PA: Saunders Elsevier; 2011: chap. 65.
81. Fukushima Y, Baba K, Kondo M, Kurita Y, Eitoku T, Shigemitsu Y, Hirai K, Tsukahara H, Iwasaki T, Kasahara S, Kotani Y, Otsuki S. Balloon atrial septostomy in hypoplastic left heart syndrome with restrictive atrial septum. Pediatr Int. 2019 Apr; 61(4): 339 - 344.
82. Vlahos AP, Lock JE, McElhinney DB, van der Velde ME. Hypoplastic left heart syndrome with intact or highly restrictive atrial septum: outcome after neonatal transcatheter atrial septostomy. Circulation. 2004 May 18; 109(19): 2326 - 30.
83. Gossett JG, Rocchini AP, Lloyd TR, Graziano JN. Catheter-based decompression of the left atrium in patients with hypoplastic left heart syndrome and restrictive atrial septum is safe and effective. Catheter Cardiovasc Interv. 2006 Apr; 67(4): 619 - 24.
84. Hoque T, Richmond M, Vincent JA, Bacha E, Torres A. Current outcomes of hypoplastic left heart syndrome with restrictive atrial septum: A single-center experience. Pediatr. Cardiol. 2013; 34: 1181 - 9.
85. Hansen JH, Petko C, Bauer G, Voges I, Kramer H-H, Scheewe J. Fifteen-year single-center experience with the Norwood operation for complex lesions with single-ventricle physiology compared with hypoplastic left heart syndrome. J Thorac Cardiovasc Surg. 2012; 144: 166 - 172.
86. Tabbutt S, Ghanayem N, Ravishankar C, Sleeper LA, Cooper DS, Frank DU, Lu M, Pizarro C, Frommelt P, Goldberg CS, Graham EM, Krawczeski CD, Lai WW, Lewis A, Kirsh JA, Mahony L, Ohye RG, Simsic J, Lodge AJ, Spurrier E, Stylianou M, Laussen P, Investigators PHN. Risk factors for hospital morbidity and mortality after the Norwood procedure: A report from the Pediatric Heart Network Single Ventricle Reconstruction trial. J Thorac Cardiovasc Surg. 2012; 144: 882 - 895.
87. Ghanayem NS, Tweddell JS, Hoffman GM, Mussatto K, Jaquiss RD. Optimal timing of the second stage of palliation for hypoplastic left heart syndrome facilitated through home monitoring, and the results of early cavopulmonary anastomosis. Cardiol Young. 2006 Feb; 16 Suppl 1: 61 - 6.
88. de Leval MR, Deanfield JE. Four decades of Fontan palliation. Nat Rev Cardiol. 2010; 7: 520 - 527.
89. d'Udekem Y, Iyengar AJ, Galati JC, Forsdick V, Weintraub RG, Wheaton GR, Bullock A, Justo RN, Grigg LE, Sholler GF, Hope S, Radford DJ, Gentles TL, Celermajer DS, Winlaw DS. Redefining Expectations of Long-Term Survival After the Fontan Procedure: Twenty-Five Years of Follow-Up From the Entire Population of Australia and New Zealand. Circulation. 2014; 130: S32 - S38.
90. Pundi KN, Johnson JN, Dearani JA, Pundi KN, Li Z, Hinck CA, Dahl SH, Cannon BC, O'Leary PW, Driscoll DJ, Cetta F. 40-Year Follow-Up After the Fontan Operation. J Am Coll Cardiol. 2015; 66: 1700 - 1710.
91. Anderson PAW, Sleeper LA, Mahony L, Colan SD, Atz AM, Breitbart RE, Gersony WM, Gallagher D, Geva T, Margossian R, McCrindle BW, Paridon S, Schwartz M, Stylianou M, Williams RV, Clark BJ, Pediatric Heart Network Investigators. Contemporary outcomes after the Fontan procedure: a Pediatric Heart Network multicenter study. J Am Coll Cardiol. 2008; 52: 85 - 98.
92. Jaquiss RDB, Ghanayem NS, Hoffman GM, et al. Early cavopul-monary anastomosis in very young infants after the Norwood procedure: impact on oxygenation, resource utilization, and mortality. J Thorac Cardiovasc Surg 2004; 127: 982 - 9.
93. Salazar J, Zafar F, Siddiqui K. Fenestration during Fontan palliation: now the exception instead of the rule. J Thorac Cardiovasc Surg 2010; 140: 129 - 36.
94. Robbers-Visser D, Miedema M, Nijveld A, et al. Results of staged total cavopulmonary connection for functionally univentricular hearts; comparison of intra-atrial lateral tunnel and extracardiac conduit. Eur J Cardiothorac Surg 2010; 37: 934 - 41.
95. Fiore AC, Turrentine M, Rodefeld M, et al. Fontan operation: a comparison of lateral tunnel with extracardiac conduit. Ann Thorac Surg 2007; 83: 622 - 30.
96. Rai V, ![]() M,
M,  M, Skalski J. Hypoplastic left heart syndrome [HLHS]: treatment options in present era. Indian J Thorac Cardiovasc Surg. 2019 Apr; 35(2): 196 - 202.
M, Skalski J. Hypoplastic left heart syndrome [HLHS]: treatment options in present era. Indian J Thorac Cardiovasc Surg. 2019 Apr; 35(2): 196 - 202.
97. Galantowicz M, Yates AR. Improved outcomes with the comprehensive stage 2 procedure after an initial hybrid stage 1. J Thorac and Cardiovasc Surg. 2016; 151: 424 - 429.
98. Yerebakan C, Valeske K, Elmontaser H,  U, Mueller M, Thul J, Mann V, Latus H, Villanueva A, Hofmann K, Schranz D, Akintuerk H. Hybrid therapy for hypoplastic left heart syndrome: Myth, alternative, or standard? J Thorac Cardiovasc Surg. 2016; 151: 1112 - 1123.
U, Mueller M, Thul J, Mann V, Latus H, Villanueva A, Hofmann K, Schranz D, Akintuerk H. Hybrid therapy for hypoplastic left heart syndrome: Myth, alternative, or standard? J Thorac Cardiovasc Surg. 2016; 151: 1112 - 1123.
99. Nassar MS, Narayan SA, Nyman A, Salih C, Austin CB, Anderson D, Hussain T. Second stage after initial hybrid palliation for hypoplastic left heart syndrome: Arterial or venous shunt? J Thorac Cardiovasc Surg. 2015 Aug; 150(2): 350 - 7.
100. Akintuerk H, Michel-Behnke I, Valeske K, et al. Stenting of the arterial duct and banding of the pulmonary arteries: basis for combined Norwood stage I and II repair in hypoplastic left heart. Circulation 2002; 105: 1099 - 103.
101. Guidelines for the Management of Congenital Heart Diseases. Cardiology in the Young (2017), 27 (Suppl. 3), S1 - S105.
102. .Vari D, Xiao W, Behere S, Spurrier E, Tsuda T, Baffa JM. Low-dose prostaglandin E1 is safe and effective for critical congenital heart disease: is it time to revisit the dosing guidelines? Cardiol Young. 2021 Jan; 31(1): 63 - 70.
103. .Yucel IK, Cevik A, Bulut MO,  R, Demir
R, Demir ![]() , Erdem A, Celebi A. Efficacy of very low-dose prostaglandin E1 in duct-dependent congenital heart disease. Cardiol Young. 2015 Jan; 25(1): 56 - 62.
, Erdem A, Celebi A. Efficacy of very low-dose prostaglandin E1 in duct-dependent congenital heart disease. Cardiol Young. 2015 Jan; 25(1): 56 - 62.
104. Khalil M, Jux C, Rueblinger L, Behrje J, Esmaeili A, Schranz D. Acute therapy of newborns with critical congenital heart disease. Transl Pediatr. 2019 Apr; 8(2): 114 - 126.
105. Masarone D, Valente F, Rubino M, Vastarella R, Gravino R., Rea A, et al. Pediatric Heart Failure: A Practical Guide to Diagnosis and Management. Pediatr Neonatol. 2017 Aug; 58(4): 303 - 312.
106. Kantor PF, Lougheed J, Dancea A, McGillion M, Barbosa N, Chan C, et al. Presentation, diagnosis, and medical management of heart failure in children: Canadian Cardiovascular Society guidelines. Can J Cardiol. 2013 Dec; 29(12): 1535 - 52.
107. Lechner E, Moosbauer W, Pinter M, Mair R, Tulzer G. Use of levosimendan, a new inodilator, for postoperative myocardial stunning in a premature neonate. Pediatr Crit Care Med. 2007 Jan; 8(1): 61 - 3.
108. Namachivayam P, Crossland DS, Butt WW, Shekerdemian LS. Early experience with Levosimendan in children with ventricular dysfunction. Pediatr Crit Care Med. 2006 Sep; 7(5): 445 - 8.
109. Yu XR, Xu N, Huang ST, Zhang QL, Wang ZC, Cao H, Chen Q. Effects of different oral care strategies on postoperative pneumonia in infants with mechanical ventilation after cardiac surgery: a prospective randomized controlled study. Transl Pediatr. 2021 Feb; 10(2): 359 - 365.
110. Tural-Kara T. et al. Underlying Diseases and Causative Microorganisms of Recurrent Pneumonia in Children: A 13-Year Study in a University Hospital//Journal of tropical pediatrics. - 2019. - Т. 65. - N. 3. - С. 224 - 230.
111. Shi S. S. et al. Perioperative risk factors for prolonged mechanical ventilation following cardiac surgery in neonates and young infants. Chest. - 2008. - Т. 134. - N. 4. - С. 768 - 774.
112. Norwood WI, Kirklin JK, Sanders SP. Hypoplastic left heart syndrome: experience with palliative surgery. Am J Cardiol. 1980; 45: 87 - 91.
113. Norwood WI, Lang P, Casteneda AR, Campbell DN. Experience with operations for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg. 1981; 82: 511 - 519.
114. Sano S, Ishino K, Kawada M, Honjo O. Right ventricle-pulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annual. 2004; 7: 22 - 31.
115. Gibbs JL, Wren C, Watterson KG, Hunter S, Hamilton JR. Stenting of the arterial duct combined with banding of the pulmonary arteries and atrial septectomy or septostomy: a new approach to palliation for the hypoplastic left heart syndrome. Br Heart J. 1993; 69: 551 - 555.
116. Schranz D, Bauer A, Reich B, Steinbrenner B, Recla S, Schmidt D, Apitz C, Thul J, Valeske K, Bauer J, ![]() M, Jux C, Michel-Behnke I,
M, Jux C, Michel-Behnke I,  H. Fifteen-year single center experience with the "Giessen Hybrid" approach for hypoplastic left heart and variants: current strategies and outcomes. Pediatr Cardiol. 2015; 36: 365 - 373.
H. Fifteen-year single center experience with the "Giessen Hybrid" approach for hypoplastic left heart and variants: current strategies and outcomes. Pediatr Cardiol. 2015; 36: 365 - 373.
117. Schranz D, Voelkel NF. "Nihilism" of chronic heart failure therapy in children and why effective therapy is withheld. Eur J Pediatr. 2016; 175: 445 - 455.
118. Sakurai T, Kado H, Nakano T, Hinokiyama K, Shiose A, Kajimoto M, Joo K, Ueda Y. Early results of bilateral pulmonary artery banding for hypoplastic left heart syndrome. Eur J Cardiothorac Surg. 2009 Dec; 36(6): 973 - 9.
119. Pizarro C, Derby CD, Baffa JM, Murdison KA, Radtke WA. Improving the outcome of high-risk neonates with hypoplastic left heart syndrome: hybrid procedure or conventional surgical palliation? Eur J Cardiothorac Surg 2008; 33: 613 - 8.
120. Schulz A, Sinzobahamvya N, Cho MY,  W, Miera O, Redlin M, Ovroutski S, Photiadis J. Bilateral Pulmonary Artery Banding before Norwood Procedure: Survival of High-Risk Patients. Thorac Cardiovasc Surg. 2020 Jan; 68(1): 30 - 37.
W, Miera O, Redlin M, Ovroutski S, Photiadis J. Bilateral Pulmonary Artery Banding before Norwood Procedure: Survival of High-Risk Patients. Thorac Cardiovasc Surg. 2020 Jan; 68(1): 30 - 37.
121. Guleserian KJ, Barker GM, Sharma MS, et al. Bilateral pulmonary artery banding for resuscitation in high-risk, single-ventricle neonates and infants: a single-center experience. J Thorac Cardiovasc Surg 2013; 145(01): 206 - 213, discussion 213 - 214.
122. Hirata Y, Miyata H, Hirahara N, Murakami A, Kado H, Sakamoto K, Sano S, Takamoto S. Long-Term Results of Bilateral Pulmonary Artery Banding Versus Primary Norwood Procedure. Pediatr Cardiol. 2018 Jan; 39(1): 111 - 119.
123. Kitahori K, Murakami A, Takaoka T, Takamoto S, Ono M. Precise evaluation of bilateral pulmonary artery banding for initial palliation in high-risk hypoplastic left heart syndrome. J Thorac Cardiovasc Surg. 2010 Nov; 140(5): 1084 - 91.
124. Sakurai T, Sakurai H, Yamana K, Nonaka T, Noda R, Otsuka R, Osawa T. Expectations and limitations after bilateral pulmonary artery banding. Eur J Cardiothorac Surg. 2016 Oct; 50(4): 626 - 631.
125. Калашников С.В., Бокерия Л.А., Нефедова И.Е. Двухжелудочковая коррекция врожденных пороков сердца у пациентов с гипоплазией структур левых отделов сердца: морфометрические и гемодинамические критерии. Детские болезни сердца и сосудов. 2020; 17 (1): 25 - 37.
126. Licht DJ, Shera DM, Clancy RR, Wernovsky G, Montenegro LM, Nicolson SC, Zimmerman RA, Spray TL, Gaynor JW, Vossough A. Brain maturation is delayed in infants with complex congenital heart defects. J Thorac Cardiovasc Surg. 2009; 137: 536 - 537.
127. Knirsch WL, Liamlahi R, Hug MI, Hoop R, von Rhein M, ![]() R, Kretschmar O, Latal B. Mortality and neurodevelopmental outcome at 1 year of age comparing hybrid and Norwood procedures. Eur J Cardiothorac Surg. 2012; 42:33 - 39.
R, Kretschmar O, Latal B. Mortality and neurodevelopmental outcome at 1 year of age comparing hybrid and Norwood procedures. Eur J Cardiothorac Surg. 2012; 42:33 - 39.
128. Rudd NA, Frommelt MA, Tweddell JS, Hehir DA, Mussatto KA, Frontier KD, Slicker JA, Bartz PJ, Ghanayem NS. Improving interstage survival after Norwood operation: outcomes from 10 years of home monitoring. J Thorac Cardiovasc Surg. 2014; 148: 1540 - 1547.
129. McCrindle BW, Williams RV, Mitchell PD, Hsu DT, Paridon SM, Atz AM, Li JS, Newburger JW, for the Pediatric Heart Network Investigators. Relationship of patient and medical characteristics to health status in children and adolescents after the Fontan procedure. Circulation. 2006; 113: 1123 - 1129.
130. Anderson PAW, Breitbart RE, McCrindle BW, Sleeper LA, Atz AM, Hsu DT, Lu M, Margossian R, Williams RV. The Fontan Patient: Inconsistencies in Medication Therapy Across Seven Pediatric Heart Network Centers. Pediatr Cardiol. 2010; 31: 1219 - 1228.
131. Trivedi B, Smith PB, Barker PCA, Jaggers J, Lodge AJ, Kanter RJ. Arrhythmias in patients with hypoplastic left heart syndrome. Am Heart J. 2011; 161: 138 - 144.
132. Idorn L, Juul K, Jensen AS, Hanel B, Nielsen KG, Andersen H, Reimers JI,  KE,
KE,  L. Arrhythmia and exercise intolerance in Fontan patients: current status and future burden. Int J Cardiol. 2013; 168: 1458 - 1465.
L. Arrhythmia and exercise intolerance in Fontan patients: current status and future burden. Int J Cardiol. 2013; 168: 1458 - 1465.
133. Alsaied T, Alsidawi S, Allen CC, Faircloth J, Palumbo JS, Veldtman GR. Strategies for thromboprophylaxis in Fontan circulation: a meta-analysis. Heart. 2015; 101: 1731 - 1737.
134. Monagle P, Cochrane A, Roberts R, Manlhiot C, Weintraub R, Szechtman B, Hughes M, Andrew M, McCrindle BW, Fontan Anticoagulation Study Group. A multicenter, randomized trial comparing heparin/warfarin and acetylsalicylic acid as primary thromboprophylaxis for 2 years after the Fontan procedure in children. J Am Coll Cardiol. 2011; 58: 645 - 651.
135. Thacker D, Patel A, Dodds K, Goldberg DJ, Semeao E, Rychik J. Use of oral budesonide in the management of protein-losing enteropathy after the Fontan operation. Ann Thorac Surg. 2010; 89: 837 - 842.
136. Anne P, Du W, Mattoo TK, Zilberman MV. Nephropathy in patients after Fontan palliation. Int J Cardiol. 2009; 132: 244 - 247.
137. Van Hare GF, Ackerman MJ, Evangelista J-AK, Kovacs RJ, Myerburg RJ, Shafer KM, Warnes CA, Washington RL, American Heart Association Electrocardiography and Arrhythmias Committee of the Council on Clinical Cardiology, Council on Cardiovascular Disease in the Young, Council on Cardiovascular and Stroke Nursing, Council on Functional Genomics and Translational Biology, and the American College of Cardiology. Eligibility and Disqualification Recommendations for Competitive Athletes With Cardiovascular Abnormalities: Task Force 4: Congenital Heart Disease: A Scientific Statement From the American Heart Association and American College of Cardiology. Circulation. 2015; 132: e281 - 91.
138. Jonas R, Jonas RA. Cardiac surgery and neurological injury in children. Heart Lung Circ. 2000; 9: 16 - 22.
139. Hellmund A, Berg C, Herberg U, Geipel A, Kempe A, Gembruch U. Levoatrial cardinal vein in a series of five prenatal cases with hypoplastic left heart syndrome and intact atrial septum. Ultraschall in Med 2017; 38: 206 - 11.
140. Atz AM, Travison TG, Williams IA, Pearson GD, Laussen PC, Mahle WT et al. Prenatal diagnosis and risk factors for preoperative death in neonates with single right ventricle and systemic outflow obstruction: screening data from the Pediatric Heart Network Single Ventricle Reconstruction trial. J Thorac Cardiovasc Surg 2010; 140: 1245 - 50.
141. Donofrio MT, Moon-Grady AJ, Hornberger LK, Copel JA, Sklansky MS, Abuhamad A et al.; American Heart Association Adults with Congenital Heart Disease Joint Committee of the Council on Cardiovascular Disease in the Young and Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and Council on Cardiovascular and Stroke Nursing. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association. Circulation 2014; 129: 2183 - 242.
142. Herberg U, Berg C, Geipel A, Gembruch U, Breuer J. Foetal therapy: what works? Closed interatrial septum. Cardiol Young 2014; 24: 47 - 54.
143. Vogel M, McElhinney DB, Wilkins-Haug LE, Marshall AC, Benson CB, Juraszek AL et al. Aortic stenosis and severe mitral regurgitation in the fetus resulting in giant left atrium and hydrops: pathophysiology, outcomes, and preliminary experience with pre-natal cardiac intervention. J Am Coll Cardiol 2011; 57: 348 - 55.
144. Barron DJ, Kilby MD, Davies B, Wright JGC, Jones TJ, Brawn WJ. Hypoplastic left heart syndrome. Lancet 2009; 374: 551 - 64.
145. Alphonso N, Angelini A, Barron DJ, Bellsham-Revell H, Blom NA, Brown K, Davis D, Duncan D, Fedrigo M, Galletti L, Hehir D, Herberg U, Jacobs JP, Januszewska K, Karl TR; (Chaiman HLHS Guidelines Task Force); Malec E, Maruszewski B, Montgomerie J, Pizzaro C, Schranz D, Shillingford AJ, Simpson JM. Guidelines for the management of neonates and infants with hypoplastic left heart syndrome: The European Association for Cardio-Thoracic Surgery (EACTS) and the Association for European Paediatric and Congenital Cardiology (AEPC) Hypoplastic Left Heart Syndrome Guidelines Task Force. Eur J Cardiothorac Surg. 2020 Sep 1; 58(3): 416 - 499.
146. Egbe A, Uppu S, Lee S, Stroustrup A, Ho D, Srivastava S. Temporal variation of birth prevalence of congenital heart disease in the United States. Congenit Heart Dis 2015; 10: 43 - 50.
147. Sathanandam SK, Philip R, Gamboa D, Van Bergen A, Ilbawi MN, Knott-Craig C et al. Management of hypoplastic left heart syndrome with intact atrial septum: a two-centre experience. Cardiol Young 2016; 26: 1072 - 81.
148. Arai S, Fujii Y, Kotani Y, Kuroko Y, Kasahara S, Sano S. Surgical outcome of hypoplastic left heart syndrome with intact atrial septum. Asian Cardiovasc Thorac Ann 2015; 23: 1034 - 8.
149. Gellis L, Drogosz M, Lu M, Sleeper LA, Cheng H, Allan C et al. Echocardiographic predictors of neonatal illness severity in fetuses with critical left heart obstruction with intact or restrictive atrial septum. Prenat Diagn 2018; 38: 788 - 94.
150. Saul D, Degenhardt K, Iyoob SD, Surrey LF, Johnson AM, Johnson MP et al. Hypoplastic left heart syndrome and the nutmeg lung pattern in utero: a cause and effect relationship or prognostic indicator? Pediatr Radiol 2016; 46: 483 - 9.
151. Jacobs JP. Hypoplastic Left Heart Syndrome: Definition, Morphology, and Classification. World Journal for Pediatric and Congenital Heart Surgery. 2022; 13(5): 559 - 564.
152. Yagi H, Liu X, Gabriel GC, Wu Y, Peterson K, Murray SA et al. The genetic landscape of hypoplastic left heart syndrome. Pediatr Cardiol 2018; 39: 1069 - 81.
153. Perry DJ, Mullen CR, Carvajal HG, Brar AK, Eghtesady P. Familial screening for left-sided congenital heart disease: what is the evidence? What is the cost? Diseases 2017; 5: 29.
154. Zakaria D, Tang X, Bhakta R, ElHassan NO, Prodhan P. Chromosomal abnormalities affect the surgical outcome in infants with hypoplastic left heart syndrome: a large cohort analysis. Pediatr Cardiol 2018; 39: 11 - 18.
155. Gordon BM, Rodriguez S, Lee M, Chang R-K. Decreasing number of deaths of infants with hypoplastic left heart syndrome. J Pediatr 2008; 153: 354 - 8.
156. Peterson AL, Quartermain MD, Ades A, Khalek N, Johnson MP, Rychik J. Impact of mode of delivery on markers of perinatal hemodynamics in infants with hypoplastic left heart syndrome. J Pediatr 2011; 159: 64 - 9.
157. Costello JM, Pasquali SK, Jacobs JP, He X, Hill KD, Cooper DS et al. Gestational age at birth and outcomes after neonatal cardiac surgery: an analysis of the Society of Thoracic Surgeons Congenital Heart Surgery Database. Circulation 2014; 129: 2511 - 17.
158. Marx GR, Shirali G, Levine JC, Guey LT, Cnota JF, Baffa JM et al. Multicenter study comparing shunt type in the Norwood procedure for single-ventricle lesions: three-dimensional echocardiographic analysis. Circ Cardiovasc Imaging 2013; 6: 934 - 42.
159. Gorbatykh A, Manannikov D, Ivanilova A, Averkin I, Zubarev D, et al. A clinical case of successful palliative endovascular treatment of a patient with a single ventricle, mitral valve atresia, an intact atrial septum and persistent cardinal vein. Egypt Heart J. 2023 May 18; 75(1): 41.
160. Wyckoff MH, Aziz K, Escobedo MB, Kapadia VS, Kattwinkel J, Perlman JM et al. Part 13: neonatal resuscitation: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2015; 132: S543 - 60.
161. Mercer-Rosa L, Goldberg DJ. Prognostic value of serial echocardiography in hypoplastic left heart syndrome: smaller hearts, better results. Circ Cardiovasc Imaging 2018; 11: e008006.
162. Fraser CD, Carberry KE. Congenital heart disease. In: Townsend CM, Beauchamp RD, Evers BM, Mattox KL (eds). Sabiston Textbook of Surgery, 19th edn. Philadelphia: Elsevier, Saunders, 2012, 1611 - 49.
163. Fricker FJ. Hypoplastic left heart syndrome: diagnosis and early management. NeoReviews 2008; 9: e253 - 61.
164. Slicker J, Hehir DA, Horsley M, Monczka J, Stern KW, Roman B et al. Nutrition algorithms for infants with hypoplastic left heart syndrome; birth through the first interstage period. Congenit Heart Dis 2013; 8: 89 - 102.
165. Carpenito K-R, Prusinski R, Kirchner K, Simsic J, Miao Y, Luce W et al. Results of a feeding protocol in patients undergoing the hybrid procedure. Pediatr Cardiol 2016; 37: 852 - 9.
166. Iannucci GJ, Oster ME, Mahle WT. Necrotising enterocolitis in infants with congenital heart disease: the role of enteral feeds. Cardiol Young 2013; 23: 553 - 9.
167. Akkinapally S, Hundalani SG, Kulkarni M, Fernandes CJ, Cabrera AG, Shivanna B et al. Prostaglandin E1 for maintaining ductal patency in neonates with ductal-dependent cardiac lesions. Cochrane Database Syst Rev 2018; 2: CD011417.
168. Karamlou T, Najm HK. Evolution of care pathways for babies with hypoplastic left heart syndrome: integrating mechanistic and clinical process investigation, standardization, and collaborative study. J Thorac Dis. 2020 Mar; 12(3): 1174 - 1183.
169. Gaynor JW, Mahle WT, Cohen MI, Ittenbach RF, DeCampli WM, Steven JM et al. Risk factors for mortality after the Norwood procedure. Eur J Cardiothorac Surg 2002; 22: 82 - 9.
170. Tabbutt S, Dominguez TE, Ravishankar C, Marino BS, Gruber PJ, Wernovsky G et al. Outcomes after the stage I reconstruction comparing the right ventricular to pulmonary artery conduit with the modified Blalock Taussig shunt. Ann Thorac Surg 2005; 80: 1582 - 90; discussion 1590-1.
171. Chowdhury SM, Graham EM, Atz AM, Bradley SM, Kavarana MN, Butts RJ. Validation of a simple score to determine risk of hospital mortality after the Norwood procedure. Semin Thorac Cardiovasc Surg 2016; 28: 425 - 33.
172. Azakie T, Merklinger SL, McCrindle BW, Van Arsdell GS, Lee KJ, Benson LN et al. Evolving strategies and improving outcomes of the modified Norwood procedure: a 10-year single-institution experience.
173. McGuirk SP, Stickley J, Griselli M, Stumper OF, Laker SJ, Barron DJ et al. Risk assessment and early outcome following the Norwood procedure for hypoplastic left heart syndrome. Eur J Cardiothorac Surg 2006; 29: 675 - 81.
174. Национальные рекомендации по ведению детей с врожденными пороками сердца. Ред. Л.А. Бокерия. М., 2014.
175. Постановление Главного государственного санитарного врача РФ от 28 января 2021 г. N 4 "Об утверждении санитарных правил и норм СанПиН 3.3686-21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней".
176. Приказ Минздрава РФ от 20 октября 2020 г. N 1134н "Об утверждении порядка медицинского обследования реципиента, проведения проб на индивидуальную совместимость, включая биологическую пробу, при трансфузии донорской крови и (или) ее компонентов"
177. Аксельрод Б.А., Балашова Е.Н., Баутин А.Е., Баховадинов Б.Б., Бирюкова Л.С. и др. Клиническое использование эритроцитсодержащих компонентов донорской крови. Гематология и трансфузиология. 2018; 63(4): 372 - 435.
178. Monagle P, Chan AKC, Goldenberg NA, Ichord RN, Journeycake JM,  U, Vesely SK. Antithrombotic therapy in neonates and children: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb; 141(2 Suppl): e737S - e801S.
U, Vesely SK. Antithrombotic therapy in neonates and children: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb; 141(2 Suppl): e737S - e801S.
179. Купряшов А.А., Токмакова К.А. Нарушения системы свертывания крови в сердечно-сосудистой хирургии. В кн.: Система гемостаза. Теоретические основы и клиническая практика: Национальное руководство/О.А. Рукавицын, С.В. Игнатьев, А.Г. Румянцев [и др.]. Москва: Общество с ограниченной ответственностью Издательская группа "ГЭОТАР-Медиа", 2024. 944 с. ISBN 978-5-9704-8497-5.
180. Bharucha T, Viola N. The tricuspid valve in hypoplastic left heart syndrome: Echocardiography provides insight into anatomy and function. Front Pediatr. 2023 Mar 27; 11: 1145161
181. Mart CR, Eckhauser AW, Murri M, Su JT. A systematic method for using 3D echocardiography to evaluate tricuspid valve insufficiency in hypoplastic left heart syndrome. Ann Pediatr Cardiol. (2014) 7(3): 193.
182. Rao S, Challapudi G, Chellu N, Bhimani S, Prieto L, Komarlu R. Selective Coronary Artery Angiography in Hypoplastic Left Heart Syndrome. J Invasive Cardiol. 2020 Dec; 32(12): E326 - E330.
183. Murni IK, MacLaren G, Morrow D, et al. Perioperative infections in congenital heart disease. Cardiol Young 2017; 27(S6): S14e21.
184. Wang X, Li S, Huo D, et al. Nosocomial Infections After Pediatric Congenital Heart Disease Surgery: Data from National Center for Cardiovascular Diseases in China. Infect Drug Resist. 2024; 17: 1615 - 1623.
185. Anderson BR, Ciarleglio AJ, Krishnamurthy G, et al. Neonatal hypoplastic left heart syndrome: effects of bloodstream infections on outcomes and costs. Ann Thorac Surg. 2015; 99(5): 1648 - 54.
186. Yu X, Chen M, Liu X. et al. Risk factors of nosocomial infection after cardiac surgery in children with congenital heart disease. BMC Infect Dis. 2020; 20(1): 64. doi: 10.1186/s12879-020-4769-6.
187. Rallis, D.; Giapros, V.; Serbis, A. et al. Fighting Antimicrobial Resistance in Neonatal Intensive Care Units: Rational Use of Antibiotics in Neonatal Sepsis. Antibiotics 2023, 12, 508.
188. Crellen T., Turner P., Pol S., et al. Transmission dynamics and control of multidrug-resistant Klebsiella pneumoniae in neonates in a developing country. Elife. 2019; 3(8): e50468.
189. Guidelines for the prevention and control of carbapenemresistant Enterobacteriaceae, Acinetobacter baumannii and Pseudomonas aeruginosa in health care facilities. Geneva: World Health Organization; 2017. Available at: https://apps.who.int/iris/handle/10665/259462.
190. Lekmanov A.U., Mironov P.I., Aleksandrovich Yu.S., Azovskij D.K., Popov D.A., Pshenisnov K.V., et al. Sepsis in children: Federal clinical guideline (draft). Russian journal of pediatric surgery anesthesia and intensive care. 2021; 11(2): 241 - 292. Russian. (Лекманов А.У., Миронов П.И., Александрович Ю.С., Азовский Д.К., Попов Д.А., Пшениснов К.В. и соавт. Сепсис у детей: федеральные клинические рекомендации (проект). Российский вестник детской хирургии, анестезиологии и реаниматологии. 2021; 2: 241 - 292.).
191. Lee Y.Q., Ahmad K.A., Velayuthan R.D., et al. Clonal relatedness in the acquisition of intestinal carriage and transmission of multidrug resistant (MDR) Klebsiella pneumoniae and Escherichia coli and its risk factors among preterm infants admitted to the neonatal intensive care unit (NICU). Pediatr Neonatol. 2021; 62(2): 129137.
192. Sakai AM, Iensue TNAN, Pereira KO, et al. Colonization by multidrug-resistant microorganisms of hospitalized newborns and their mothers in the neonatal unit context. J Infect Dev Ctries. 2020, 31; 14(7): 765 - 771.
193. Попов Д.А. и соавт. Колонизация слизистых оболочек "проблемной" микрофлорой и этиология послеоперационных инфекционных осложнений у детей первого года жизни с врожденными пороками сердца. Клиническая микробиология и антимикробная химиотерапия. 2022; 2: 139 - 146.
194. Организация и проведение микробиологического мониторинга в медицинских организациях: Методические рекомендации: Министерство здравоохранения Российской Федерации, ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России, 2024. - 38 с.
195. Голухова Е.З., Ким А.И., Завалихина Т.В., Нефедова И.Е. и др. Анализ оказания медицинской помощи детям с врожденными пороками сердца в Российской Федерации и предпосылки к созданию регистра в современную эру цифровых медицинских информационных систем. Креативная кардиология. 2023; 17 (3): 315 - 21.
196. Голухова Е.З., Ким А.И., Завалихина Т.В., Нефедова И.Е., Калашников С.В. Резервы для снижения младенческой смертности от врожденных пороков сердца. Методические рекомендации. М.: ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" Минздрава России; 2024: 64 с. DOI: 10.24022/978-5-7983-0461-8-2024-1-64.
197. Giglia T., Massicotte M., Tweddell J. et al. Prevention and Treatment of Thrombosis in Pediatric and Congenital Heart Disease: A Scientific Statement From the American Heart Association. Circulation. 2013; 128: 2622 - 2703.
198. Boucher AA, Heneghan JA, Jang S, Spillane KA, Abarbanell AM, Steiner ME, Meyer AD. A Narrative review of postoperative anticoagulation therapy for congenital cardiac disease. Front Surg. 2022 Jun 14; 9: 907782.
199. McCrindle BW, Michelson AD, Van Bergen AH, Suzana Horowitz E, Pablo Sandoval J, Justino H, Harris KC, Jefferies JL, Miriam Pina L, Peluso C, Nessel K, Lu W, Li JS; UNIVERSE Study Investigators *. Thromboprophylaxis for Children Post-Fontan Procedure: Insights From the UNIVERSE Study. J Am Heart Assoc. 2021 Nov 16; 10(22): e021765.
200. Roehl, S. L., & Townsend, R. J. (1982). Alprostadil (Prostin VR Pediatric Sterile Solution, the Upjohn Company). Drug Intelligence & Clinical Pharmacy, 16(11), 823 - 832.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ
И ПЕРЕСМОТРУ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Авраменко А.А., (Самара)
2. Апханова Т.В., д.м.н. "Национальная ассоциация экспертов по санаторно-курортному лечению"
3. Архипов А.Н., к.м.н. (Новосибирск)
4. Аракелян В.С., проф. (Москва)
5. Богданов В.Н., (Челябинск)
6. Бокерия Л.А., академик РАН (Москва), "Ассоциация сердечно-сосудистых хирургов России"
7. Борисков М.В., д.м.н. (Краснодар)
8. Гаврилов Р.Ю., (Волгоград), "Ассоциация сердечно-сосудистых хирургов России"
9. Григорян А.М. к.м.н. (Москва) "Российское Научное Общество Специалистов по Рентгенэндоваскулярной Диагностике и Лечению"
10. Горбатиков К.В., д.м.н. (Тюмень)
11. Горбатых Ю.Н., д.м.н. (Новосибирск)
12. Гущин Д.К., к.м.н. (Москва)
13. Калашников С.В., к.м.н. (Москва)
14. Ким А.И., проф. (Москва), "Ассоциация сердечно-сосудистых хирургов России"
15. Ковалев И.А., д.м.н. (Москва), "Ассоциация детских кардиологов России"
16. Кокшенев И.В., проф. (Москва), "Ассоциация сердечно-сосудистых хирургов России"
17. Кончугова Т.В., д.м.н., профессор, "Национальная ассоциация экспертов по санаторно-курортному лечению"
Кривощеков Е.В., д.м.н. (Томск), "Ассоциация сердечно-сосудистых хирургов России
18. Кривощеков Е.В., д.м.н. (Томск), "Ассоциация сердечно-сосудистых хирургов России"
19. Купряшов А.А., проф. (Москва)
20. Мовсесян Р.Р., член-корреспондент РАН, (Санкт-Петербург), "Ассоциация сердечно-сосудистых хирургов России"
21. Налимов К.А., к.м.н. (Хабаровск)
22. Нефедова И.Е., д.м.н. (Москва)
23. Петрушенко Д.Ю., к.м.н. (Казань)
24. Плотников М.В., к.м.н. (Астрахань), "Ассоциация сердечно-сосудистых хирургов России"
25. Подзолков В.П. академик РАН (Москва)
26. Ручьева Н.А., к.м.н. (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии "Российское общество рентгенологов и радиологов"
27. Свободов А.А., проф. (Москва)
28. Синельников Ю.С., д.м.н. (Пермь)
29. Синицын В.Е., д.м.н., профессор (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии "Российское общество рентгенологов и радиологов"
30. Теплов П.В., (Красноярск)
31. Фесюн Анатолий Дмитриевич, д.м.н., доцент, президент Национальной Ассоциации экспертов по санаторно-курортному лечению
32. Шаталов К.В., д.м.н. (Москва)
33. Юрлов И.А., к.м.н., не является членом АССХ (Москва).
34. Яковлев Максим Юрьевич, д.м.н. "Национальная ассоциация экспертов по санаторно-курортному лечению"
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- Врач-педиатр
- Врач-кардиолог
- Врач-детский кардиолог
- Врач-сердечно-сосудистый хирург
- Врач-неонатолог
- Врач ультразвуковой диагностики.
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в базы данных PubMed, Scopus. Глубина поиска составляла 30 лет.
Методы, использованные для оценки качества и силы доказательств
- консенсус экспертов;
- оценка качества рекомендаций в соответствии с рейтинговой схемой (таблица П1).
- оценка силы доказательств в соответствии с рейтинговой схемой (таблица П2).
В ходе разработки КР использована новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы П1, П2 и П3), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровни достоверности доказательств (УДД)
Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации" (зарегистрирован 08.05.2019 N 54588)
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследование "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендации (УУР)
Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации" (зарегистрирован 08.05.2019 N 54588)
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, - а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ
К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ
И ДОЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. Федеральный закон от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации"
2. Приказ Минздрава России от 15.11.2012 N 918н "Об утверждении порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями"
3. Приказ Минтруда России от 27.08.2019 N 585н "О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными
4. Приказ Минздрава России от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации" (Зарегистрировано в Минюсте России 08.05.2019 N 54588);
5. Приказ Министерства здравоохранения Российской Федерации от 13 октября 2017 г. N 804н "Об утверждении номенклатуры медицинских услуг";
6. Приказ Министерства здравоохранения Российской Федерации от 7 октября 2015 г. N 700н "О номенклатуре специальностей специалистов, имеющих высшее медицинское и фармацевтическое образование";
7. Приказ Минздрава России от 02.05.2023 N 205н "Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников"
8. Приказ Минздрава России от 06.06.2012 N 4н "Об утверждении номенклатурной классификации медицинских изделий".
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
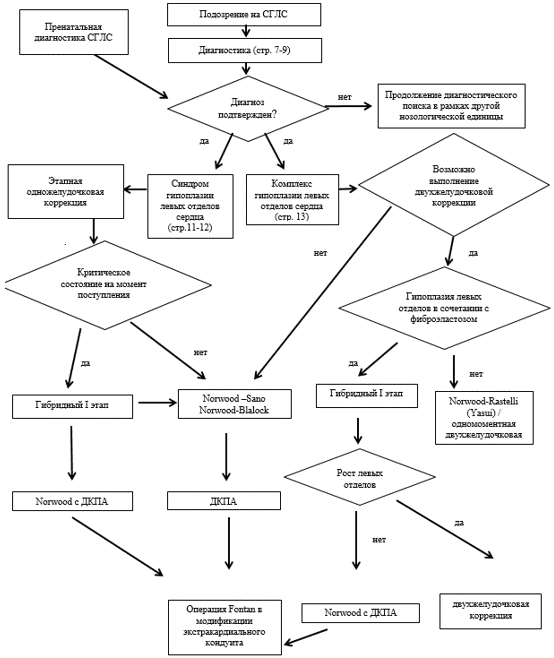
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Уважаемый пациент (родители пациента), результаты обследования выявили у Вас (Вашего ребенка) сложный врожденный порок сердца - синдром гипоплазии левых отделов сердца. Добровольно соглашаясь на операцию, Вы должны понимать цель и опасности операции, о которых Вам расскажет лечащий врач.
СГЛС возникает на ранних этапах развития плода. Причины нарушений эмбриогенеза многочисленны: инфекционные заболевания матери на ранних сроках беременности, хронические заболевания родителей, вредные привычки родителей, экологические и генетические факторы и т.д. В зависимости от размера фетальных коммуникаций (открытое овальное окно, открытый артериальный проток) клинические проявления порока могут существенно варьировать. Однако в любом случае при синдроме гипоплазии левых отделов сердца состояние после рождения будет тяжелым с прогрессивным ухудшением в динамике. Поэтому не следует препятствовать скорейшему переводу ребенка из роддома в кардиохирургический стационар. Для стабилизации состояния и чтобы ребенок смог перенести транспортировку сразу после рождения ребенку будет организован венозный доступ и начато внутривенное введение препаратов группы C01EA простагландины с целью предотвращения закрытия открытого артериального протока, иначе его закрытие приведет к незамедлительной гибели младенца. Назначение этого препарата в большинстве случаев приводит к кратковременной стабилизации, что дает возможность перевести ребенка в кардиохирургический стационар с целью уточнения анатомии порока и подбора оптимального хирургического лечения.
После перевода ребенка будет уточнена степень тяжести состояния, наличие сопутствующей патологии. В случае стабильного состояния оперативное вмешательство обычно выполняется в течение 24 - 48 часов с момента перевода. В случае крайней тяжести состояния первично будут выполняться реанимационные мероприятия, направленные на стабилизацию состояния, и лишь после стабилизации будет решаться вопрос о выполнении хирургического вмешательства.
Синдром гипоплазии левых отделов сердца подразумевает этапный подход к хирургическому лечению и характеризуется невозможностью полного анатомического исправления порока. Этапный подход состоит из трех или четырех оперативных вмешательств и направлен лишь на создание приемлемых условий жизни и развития ребенка. Основная цель реконструктивных вмешательств - разобщение артериального и венозного кровотоков. Поскольку данный врожденный порок сердца является одним из наиболее тяжелых пороков, то следует понимать и высокие риски неблагоприятного исхода при лечении данной патологии. После каждого этапа коррекции, в раннем послеоперационном периоде могут возникать различные осложнения: послеоперационные кровотечения; сердечная недостаточность; дыхательная недостаточность с необходимостью длительной искусственной вентиляции легких; острая почечная недостаточность; инфекционные осложнения и др. Прогрессирование данных осложнений может приводить к необратимым последствиям. Развитие осложнений возможно и в межэтапных периодах.
В большинстве случаев каждая последующая этапная операция приводит к улучшению состояния. Следует понимать, что количество этапов не окончательно и могут потребоваться дополнительные оперативные вмешательства (в случае быстрого ухудшения состояния ребенка).
Альтернативой гемодинамических коррекций может стать операция пересадки сердца или комплекса сердце-легкие. Данная процедура может быть выполнена на любом этапе лечения при наличии жизненно значимых показаний.
Лечение данного врожденного порока сердца зачастую требует длительного нахождения в больничных условиях и частого наблюдения в межэтапном периоде, что также требует понимания и максимальной ответственности родителей.
Важно не пропускать контрольные обследования после операции, для своевременной оценки результатов коррекции и выявления возможных осложнений, следовать рекомендациям врача и своевременно принимать все назначенные препараты.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ,
ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Нет.
