"Клинические рекомендации "Перерыв дуги аорты. Двойная дуга аорты"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПЕРЕРЫВ ДУГИ АОРТЫ. ДВОЙНАЯ ДУГА АОРТЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: Q25.4
Год утверждения (частота пересмотра): 2024
Возрастная категория: Дети
Пересмотр не позднее: 2026
ID: 830
Разработчик клинической рекомендации
- Ассоциация сердечно-сосудистых хирургов России
- Всероссийская общественная организация "Ассоциация детских кардиологов России"
- Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
БКК - большой круг кровообращения
ВПС - врожденные пороки сердца
ДАЛП - дефект аортолегочной перегородки
ДДА - двойная дуга аорты
ДМЖП - дефект межжелудочковой перегородки
ДМПП - дефект межпредсердной перегородки
ЕОК - Европейское общество кардиологов
КТ - компьютерная томография
ЛЖ - левый желудочек
ЛА - легочная артерия
ЛАГ - легочная артериальная гипертензия
ЛГ - легочная гипертензия
ЛП - левое предсердие
ЛСС - легочное сосудистое сопротивление
МКК - малый круг кровообращения
НК - недостаточность кровообращения
ОЛС - общее легочное сопротивление
ОПС - общее периферическое сопротивление
ПДА - перерыв дуги аорты
ПЖ - правый желудочек
ПП - правое предсердие
ПРТ - предсердная ри-ентри тахикардия
СКА - сосудистое кольцо аорты
ТШХ - тест 6-минутной ходьбы
ФП - фибрилляция предсердий
ЭКГ - электрокардиография
ЭхоКГ - эхокардиография
Qp/Qs - соотношение объемов кровотока малого круга кровообращения к большому
Термины и определения
Катетеризация сердца - инвазивная процедура, проводимая с лечебными или диагностическими целями при патологии сердечно-сосудистой системы путем введения катетеров в полость сердца или просвет магистральных сосудов.
Компьютерная томография (КТ) - неинвазивный метод лучевой диагностики, позволяющий получить серию послойных субмиллиметровых аксиальных изображений органов и структур тела человека, основанный на измерении и сложной компьютерной обработке разности ослабления рентгеновского излучения различными по плотности тканями; для улучшения дифференцировки органов друг от друга, а также нормальных и патологических структур. Применяются различные методики контрастного усиления/контрастирования, с использованием рентгеноконтрастных средств, содержащих йод. Для визуализации структур сердечно-сосудистой системы применяют КТ-ангиографию - методику внутривенного болюсного введения контрастных средств в кровоток с помощью системы внутрисосудистого введения контрастных средств, с установленной скоростью и временем введения препарата. На основе полученных данных посредством компьютерной постобработки с 3D-реконструкцией строится трехмерная модель сердца и сосудов.
Магнитно-резонансная томография (МРТ) - неинвазивный метод получения томографических медицинских изображений без ионизирующего излучения для исследования внутренних органов и тканей, основанный на явлении ядерного магнитного резонанса и на измерении электромагнитного отклика атомных ядер, находящихся в сильном постоянном магнитном поле, в ответ на возбуждение их определенным сочетанием электромагнитных волн; такими ядрами являются ядра атомов водорода, присутствующие в теле человека в составе воды и других веществ. МР-ангиография - метод получения изображения просвета сосудов при помощи магнитно-резонансного томографа. Метод позволяет оценивать как анатомические, так и функциональные особенности кровотока. МР-ангиография основана на отличии сигнала от перемещающихся протонов (крови) от окружающих неподвижных тканей, что позволяет получать изображения сосудов без использования каких-либо контрастных средств - бесконтрастная ангиография (например: фазово-контрастная МР-ангиография). В ряде случаев применяется внутривенное болюсное контрастирование с использованием парамагнитных контрастных средств (гадолиний).
Уровень достоверности доказательств (УДД) - степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным [1].
Уровень убедительности рекомендаций (УУР) - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [1].
Фибробронхоскопия - метод исследования, выполняющийся при помощи комплекса специального оборудования (современный набор включает зонд или бронхоскоп, камеру с функцией записи и выведения изображения на экран, манипуляторы и подсветку и пр.) и позволяющий визуально оценивать состояние верхних и нижних дыхательных путей с возможностью проведения лечебных манипуляций.
Эхокардиография - метод ультразвукового исследования, направленный на исследование морфологических и функциональных изменений сердца и его клапанного аппарата.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Врожденные аномалии восходящей аорты и дуги аорты - группа врожденных пороков сердца и сосудов, при которых имеет место нарушение ветвления, расположения, количества или области отхождения дуги и ветвей дуги аорты. К ним, среди прочих, относят перерыв дуги аорты и двойную дугу аорты.
Перерыв дуги аорты (ПДА) - врожденный порок сердца (ВПС), который характеризуется как отсутствие непрерывности внутрисосудистого просвета или полное отсутствие сегмента между восходящей и нисходящей аортой. Кровоток в нисходящую аорту обеспечивается через открытый артериальный проток. Синонимы: врожденное отсутствие дуги аорты, отсутствие аорты [1 - 5].
Двойная дуга аорты подразумевает, напротив, удвоение, когда имеет место дополнительное сохранение правой или левой дуги аорты в различных вариантах (с сохранением просвета, гипоплазией, атрезией) с формированием полного сосудистого кольца вокруг трахеи и пищевода. Синонимы: сосудистое кольцо аорты [1 - 5].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология полностью не установлена, но известно, что, как и в случаях других ВПС, важную роль играют факторы риска, а механизмы формирования, в целом установлены. Нарушения развития при формировании сердца, которые имеют место в первом триместре беременности, являются критическими для сердечно-сосудистой системы. Неблагоприятное воздействие в виде повреждающих факторов реализуется через генные или хромосомные мутации (в совокупности 10%) или полигенно-мультифакториальное наследование (около 90%), что приводит к появлению ВПС, включая перерыв дуги аорты или сосудистое кольцо [2, 3, 4, 5]. Данная патология возникает преимущественно на X - XX стадии развития по классификации Стритера, однако, общепринятой концепции в этом разделе не выработано, и современные представления включают вполне обоснованные понятия мультифакторального наследования, преобладание роли окружающей среды, уникального механизма анатомически разных ВПС, генетической гетерогенности или гетерогенности механизмов формирования одного ВПС и др. [6]. Помимо этого, сегодня известно множество генов, ответственных за развитие того или иного ВПС [7]. В этом аспекте перерыв дуги аорты, как и двойная дуга аорты, может является частью других хромосомных аномалий. Так, типичное сочетания многих ВПС с синдромом микроделеции 22q11.2 не является исключением для перерыва дуги аорты, более чем в 80% случаях сочетаясь с синдромом Ди Джорджи (акроним CATCH 22) [8, 9, 10, 11]. Установленными факторами риска формирования ВПС являются неблагоприятные хронические состояния организма у матери, например, сахарный диабет [9]. Характерным является ассоциация аномалий дуги аорты в целом, и ПДА и сосудистых колец с CHARGE (Колобома, ВПС, атрезия хоан, задержка роста или психического развития, аномалии урогенитального тракта, ушные аномалии) синдромом, вызванным новыми мутациями 8q12.2 [12].
Перерыв дуги аорты характеризуется критическим состоянием, обусловленным выраженными отклонениями от нормальной гемодинамики в большинстве случаев вскоре после рождения. Совокупность нарушений представлена дуктус-зависимостью системного кровотока и патологическим сбросом крови слева направо (за счет внутрисердечного сброса крови), вызывающим объемную перегрузку. Объем сброса крови в легкие определяется почти величиной легочно-сосудистого сопротивления (ЛСС) и соотношения его с общепериферическим сопротивлением (ОПС). Систолическое давление в желудочках сердца, восходящей аорте и ветвях ЛА в типичных случаях является равным сразу после рождения, что приводит, к резкому переполнению сосудов МКК [13, 14]. В первые дни жизни, при условии функционирования ОАП, нарушения гемодинамики могут быть относительно не выражены [5, 6]. Однако, с естественным снижением ЛСС, объем шунтирования крови прогрессивно возрастает, что приводит к гипоперфузии соответствующих внутренних органов. В результате в большинстве случаев, на фоне развития СН, присоединяется метаболический лактат-ацидоз, выраженность которых усугубляется при закрытии ОАП [15]. В итоге состояние становится критическим с развитием кардиогенного шока, внутричерепного кровоизлияния, почечной недостаточности и пр. с крайне высокой летальностью уже в течение первых месяцев жизни [5]. По данным патологоанатомических исследований в 75% случаев возраст умерших не превышает 1 месяца, а медианный возраст умерших составляет от 4 до 10 дней [15, 16]. Коллатерали, обеспечивающие кровоснабжение нижней части туловища после закрытия ОАП, могут присутствовать не более чем в 10% случаев, но даже среди этих больных смертность на первой году жизни составляет не менее 90% [16]. В литературе описаны лишь единичные больные с перерывом дуги аорты, дожившие до подросткового и более старшего возраста [17]. Однако, возможно изначально это не были случаи полного перерыва дуги аорты, а имело место наличие коарктации аорты с постепенно закрывающимся просветом. Часто, на первый план в этих случаях выходит артериальная гипертензия типичная для коарктационного синдрома [18].
Двойная дуга аорты, в отличие от перерыва дуги аорты, несмотря на некоторые эмбриологические сходства в развитии, исходно не сопровождается гемодинамическими нарушениями. В основе этой аномалии лежит нарушение процессов эмбриональной редукции обеих четвертых брахиоцефальных дуг, в результате обе они в дальнейшем персистируют [12]. Патологические изменения данный порок вызывает в виде сдавлений близлежащих структур различной степени выраженности [13]. Именно от степени компрессии зависит прогноз и время манифестации заболевания.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Данная группа заболеваний является редкой даже с учетом суммарной частоты. Соответственно, перерыв дуги аорты относится к редко встречающимся, но характеризующимся высокой естественной летальностью, ВПС. Частота его в клинике варьирует в зависимости от типа, не превышая 0,5% от всех случаев в структуре врожденной сердечной патологии и 1,5% от количества критических ВПС [19, 20]. Различные типы ПДА в пределах самой патологии также имеют различную частоту, при которой ПДА дистальнее левой подключичной артерии может составлять 30 - 41% от перерывов дуги, между подключичной и сонной артериями - 55 - 69%, и перерыв между сонными артериями лишь 4 - 17% [12, 13].
ПДА весьма часто встречается в сочетании с другими ВПС. Частота подобных сочетаний составляет до 98% [20]. Типичным является сочетание с открытым артериальным протоком и межжелудочковым дефектом (не менее 90%), двухстворчатым аортальным клапаном (до 60%), реже с общим артериальным стволом, единственным желудочком сердца, обструкцией выводного отдела левого желудочка (часто из-за заднего смещения конусной перегородки при наличии межжелудочкового дефекта типа "malalignment"), транспозицией магистральных сосудов, аберрантными плече-головными ветвями дуги аорты, реже, аорто-легочным окном [21].
Более редкими являются формы порока, также относящиеся к аномалиям восходящей аорты и дуги аорты в виде сосудистых колец по типу двойной дуги аорты, которая тем не менее, является наиболее часто встречающимся сосудистым кольцом [13, 15]. В основном, это единичные наблюдения или ограниченные серии больных, но по современным данным частота порока выше, составляя 1:15 000 новорожденных [21]. Синдром Ди Джорджи, делеции 22q11 хромосомы наблюдается приблизительно в 20% случаев ДДА. Не частыми, но типичными сопутствующими ВПС являются тетрада Фалло, ДМЖП, ОАС, атрезия легочной артерии [22]. При их наличии диагностический поиск позволяет диагностировать и ДДА. В иных случаях, при отсутствии явной симптоматики, диагноз ДДА может выставляться намного позже, вплоть до достижения взрослого состояния.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Q25.4 - Другие врожденные аномалии аорты (отсутствие аорты, двойная дуга орты, сосудистое кольца аорты) - МКБ 10.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Сосудистые аномалии дуги аорты и ее ветвей классифицируются как:
I. Аномалии левосторонней дуги аорты; II. Аномалии правосторонней дуги аорты; III. Двойная дуга аорты; IV. Персистирование пятой дуги аорты; V. Перерыв дуги аорты; VI. Другие аномалии дуги аорты (классификация Weinberg P.) [13].
Перерыв дуги аорты локализуется в одном из трех сегментов аорты. Соответственно этому данный ВПС и классифицируется.
Классификация перерыва дуги аорты (типы A, B и C по Celoria G.C., Patton R.B., 1959, в модификации Oppenheimer-Dekker. A., 1982) [23, 24].
A - перерыв дистальнее левой подключичной артерии
1. без ретропищеводной или изолированной подключичной артерий
2. с ретропищеводной подключичной артерий
3. с изолированной подключичной артерией
B - перерыв между подключичной и сонной артериями
1. без ретропищеводной или изолированной подключичной артерий
2. с ретропищеводной подключичной артерий
3. с изолированной подключичной артерией
C - перерыв между сонными артериями
1. без ретропищеводной или изолированной подключичной артерий
2. с ретропищеводной подключичной артерий
3. с изолированной подключичной артерией
Данная классификация также используется обществом торакальных хирургов (STS) и является частью Международной Номенклатуры ВПС (Congenital Heart Surgery Nomenclature and Database Project) [25]. По некоторым данным указанное разделение по уровню локализации ПДА имеет значение и в отношении оценки других особенностей порока [26]. При типе A имеющийся ДМЖП может быть различной локализации и типа (мышечный, отточный, центральный мембранозный, приточный) и дуга может атрезирована или отсутствовать. При типе В очень часто ДМЖП отточный, расположен между ножками септального пучка с отсутствием аортально-трехстворчатого продолжения. Сегмент дуги аорты в области перерыва обычно полностью отсутствует. Сопутствующим ВПС для типа A чаще будет открытый атриовентрикулярный канал и транспозиция магистральных сосудов. Для типа B таковыми считаются ОАС и двойное отхождение сосудов от правого желудочка.
Согласно Международной Номенклатуре, сосудистые кольца аорты разделяются на следующие типы [25, 28, 29]:
A. Полные сосудистые кольца
- ДДА
I. Доминантная правая дуга аорты (~= 75% случаев)
II. Доминантная левая дуга аорты (~= 25% случаев)
III. Сбалансированные (без сужений) дуги аорты (~= 5% случаев)
- Правосторонняя (правая) дуга аорты
I. Правосторонняя дуга аорты + аберрантная левая подключичная артерия
II. Правосторонняя (правая) дуга аорты с "зеркальным" расположением
B. Не полные сосудистые кольца (петли)
- Синдром сдавления безымянной артерией
- Слинг легочной артерии
- Аберрантная правая подключичная артерия
Правая дуга при ДДА при этом дает отхождение для правой общей сонной и правой подключичной артерии, левая дуга при ДДА, соответственно, левым общей сонной и подключичной артериям. При полной обструкции просвета соответствующая дуга (обычно левая) может быть представлена связкой, которая и участвует в формировании полного кольца [30].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
При ПДА клинические проявления в виде одышки, респираторного дистресса, признаками сердечной недостаточности (на фоне снижения периферической пульсации, цианоза различной степени) с прогрессированием вплоть до развития шокового состояния часто имеют место, начиная с первых дней жизни [4, 5, 6]. Указанные симптомы характерны для ВПС, при котором имеется массивный сброс крови "слева-направо" с явными признаками гиперволемии МКК и тяжелым течением СН [11, 12]. Типичными признаками являются одышка в покое, усиливающаяся при кормлении, плохая прибавка веса, частые респираторные заболевания [5]. По риску развития ряда тяжелых осложнений ПДД в этом возрасте относится к группе критических ВПС, имеющих крайне плохой прогноз без необходимого лечения. Так, особенно высоким является риск развития некротического энтероколита, присоединение которого ухудшает общий прогноз [31]. Однако, прогноз в случае успешного оперативного лечения кардинально отличается от естественного течения заболевания. Несмотря на сложность, хирургической коррекции в настоящее время разработана, и ранняя летальность обусловлена, в основном, сопутствующими факторами риска и низкой массой тела при рождении [11, 14]. К последним также ряд авторов относит тип B ПДА, необходимость этапного лечения и устранения подаортальной обструкции в момент первой госпитализации [32]. Совершенствование диагностики и хирургической техники, а также разработка новых хирургических методик, в последние годы позволило на порядок уменьшить число летальных послеоперационных осложнений [32, 33, 34, 35]. Отдаленные результаты при этом, как правило, сопровождаются высокой выживаемостью [11, 32].
ДДА не вызывает непосредственных гемодинамических расстройств, в отличие от ПДА. Симптомы при ДДА обусловлены сдавлением трахеи и пищевода [12, 36, 37]. Типичным является их появление в первые 6 месяцев жизни и, нередко, уже в течение первого месяца. Инспираторный стридор также может присутствовать при рождении, часто в сочетании с экспираторным хрипом и тахипноэ. При этом возможно усиление стридора в различных положениях - например, когда ребенок лежит на спине, а не на боку. Часто ребенок может принимать вынужденное положение, когда стридор облегчается, например, при вытягивании шеи. Крик ребенка может быть хриплым, а при отсутствии явного стридора дыхание шумным. Другим частым симптомом является присутствие постоянного лающего кашля. При тяжелой обструкции могут быть эпизоды апноэ, сильного цианоза, потери сознания. При этом часто будет очевидным втяжение подреберья. Типичным на этом фоне будут рецидивирующие респираторные инфекции, которые усугубляют дыхательную обструкцию; когда обструкция менее выражена, обструктивные симптомы могут быть очевидны только в такие моменты. Признаки сдавления пищевода проявляются тем, что ребенок часто плохо ест, и могут быть очевидные трудности с глотанием жидкостей, с эпизодами удушья и усиленной дыхательной обструкцией в эти моменты. Дисфагия твердой пищи является обычным явлением (наиболее тяжелые случаи оперируются до того, как дети становятся достаточно взрослыми, чтобы им предлагали твердую пищу), при этом ребенок отказывается глотать их или задыхается и срыгивает [12, 36, 37].
Резюмируя, можно выделить несколько моментов, на которые необходимо обратить внимание у маленьких детей, имеющих ДДА:
1. Присутствуют инспираторный стридор и проблемы с кормлением различной степени тяжести, начинающиеся в разном возрасте. При двойной дуге аорты симптомы, как правило, появляются в периоде новорожденности или в раннем младенчестве (моложе 3 месяцев), и они более выражены, чем при правой дуге аорты с левой артериальной связкой. Симптомы часто ухудшаются при кормлении. Больные дети часто переразгибают шею, чтобы уменьшить сдавливание трахеи.
2. Часто выявляется анамнез пневмонии.
В отличие от детей, симптоматические сосудистые кольца, проявляющиеся у взрослых, редки, и имеющиеся о них сведения часто подчеркивают дисфагию как преобладающий симптом [38]. Также, сосудистые кольца, возникающие у взрослых, могут имитировать хроническую астму [39].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ПДА или ДДА верифицируется на основании сводных данных жалоб родителей пациентов/пациентов, клинических проявлений порока, данных инструментальных методов исследования.
Диагноз ПДА и ДДА устанавливается на основании данных:
1. Трансторакальной эхокардиографии;
2. Компьютерной томографии сердца с контрастированием, либо магнитно-резонансной томографии сердца и магистральных сосудов (с контрастированием);
3. Чрезвенозной катетеризации сердца (ангиографии легочной артерии и ее ветвей).
2.1 Жалобы и анамнез
- Рекомендуется сбор анамнеза и жалоб у всех пациентов, родителей и ухаживающих за больными детьми с ПДА с целью упрощения верификации врожденного порока сердца и определения степени тяжести состояния пациента [5, 6, 11 - 14].
ЕОК нет (УУР C, УДД 5)
Комментарии: Допускается вариабельность клинического течения ПДА, однако, порок не протекает совсем бессимптомно. Состояние больного зависит от типа порока, функционирования ОАП, величины ЛСС и их изменений с возрастом. В периоде новорожденности, грудном возрасте и раннего детства проводится сбор сведений, касающихся ребенка с подозрением на ВПС со стороны матери или ухаживающих. Следует уточнять наличие у пациентов одышки, сердцебиений, ухудшения переносимости физических нагрузок, плохой прибавки массы тела, частых инфекционных бронхолегочных заболеваний [5, 6, 11 - 14].
- Рекомендуется сбор анамнеза и жалоб у всех пациентов, родителей и ухаживающих за больными детьми с ДДА с целью упрощения верификации врожденного порока сердца и определения степени тяжести состояния пациента [5, 6, 11 - 14, 36, 37, 40].
ЕОК нет (УУР C, УДД 4)
Комментарии: Допускается невыраженная клиническая картина при ДДА, также порок может протекать под маской респираторных заболеваний с трудностями при кормлении. При наличии сопутствующих ВПС (до 25%) проводимая по обследуемому ВПС диагностика позволяет выявить и наличии ДДА. В периоде новорожденности, грудном возрасте и раннего детства проводится сбор сведений, касающихся ребенка с подозрением на ВПС со стороны матери или ухаживающих. Следует уточнять наличие у пациентов одышки, стридорозного дыхания, изменения характера стридора на фоне изменения положения тела, наклона шеи и головы, эпизодов поперхивания, частого и обильного срыгивания, ухудшения переносимости физических нагрузок, плохой прибавки массы тела, частых инфекционных бронхолегочных заболеваний [5, 6, 11 - 14, 36, 37, 40].
- Рекомендуется сбор анамнеза и жалоб у всех взрослых пациентов с ДДА с целью упрощения верификации врожденного порока сердца и определения степени тяжести состояния пациента [5, 6, 11 - 14, 36, 37, 40].
ЕОК нет (УУР C, УДД 4)
Комментарии: Клиническая картина при ДДА у взрослых обычно связана с умеренными симптомами, которые маскируются в периоды ухудшения состояния респираторными заболеваниями, например, по типу пневмонии, длительным кашлем. Следует уделить внимание сбору данных о периоде раннего детства у таких больных на предмет схожих, мало объяснимых в анамнезе симптомов одышки, стридорозного дыхания, изменения характера стридора на фоне изменения положения тела, наклона шеи и головы, эпизодов дисфагии, ухудшения переносимости физических нагрузок, плохой прибавки массы тела, частых инфекционных бронхолегочных заболеваний [5, 6, 11 - 14, 36, 37, 40].
2.2 Физикальное обследование
- У всех пациентов с ПДА рекомендуется проводить физикальный осмотр с определением формы грудной клетки и пальпацией области сердца, оценкой наличия и степени цианоза, пальпацией периферических сосудов с оценкой наличия и характера пульсации для верификации диагноза [4, 5, 6, 11 - 14, 40 - 44].
ЕОК нет (УУР C, УДД 4)
Комментарии: при физикальном осмотре больного топический диагноз ПДА установить невозможно [5, 40]. Физикальное обследование направлено на выявление общих признаков, которые могут свидетельствовать о наличии ВПС: у новорожденных и грудных детей поиск направлен на определение симптомов СН или СЛН при формах порока, сопровождающихся системной гипоперфузией и значимой гиперволемией МКК. Возможен дифференцированный цианоз, который может быть уже с рождения, но в большинстве случаях при наличии ДМЖП признак не выражен или даже отсутствует за счет имеющегося значимого лево-правого сброса [40]. Учитывая высокую частоту синдрома Ди Джорджи, выявление признаков данного синдрома - важный аспект диагностики [4, 41]. Обращают внимание на такие симптомы как гипертелоризм, низко посаженные уши, микрогнатия, маленький "рыбий" рот, короткий губной желобок, двухсторонняя катаракта, наклонные ладонные складки, расщепление губы, высокое, расщепленное небо, деформация или отсутствие ушных раковин, мальформация носа [42]. Пальпация магистральных сосудов при проходимом ОАП не выявляет разницы между верхними и нижними конечностями. Констрикция артериального протока сопровождается ослаблением пульсации на нижних конечностях или левой верхней при типе В ПДА [44]. При аберрантной правой подключичной и ее отхождении ниже месте перерыва, пульсация в этих случаях также будет соответственно ослаблена на правой верхней конечности.
При прекордиальной пальпации типичным будет определение разлитого сердечного правожелудочкового толчка сердца, поскольку легочная гипертензия при наличии ОАП и ДМЖП всегда будет иметь место [40].
- У всех пациентов с ДДА рекомендуется проводить физикальный осмотр с внешней оценкой формы грудной клетки, пальпацией области сердца, определения наличия и степени цианоза, пальпацией и оценкой пульсации периферических сосудов для верификации диагноза или выявления сопутствующей сердечно-сосудистой патологии [5, 6, 27, 37 - 40, 146 - 148].
ЕОК нет (УУР C, УДД 5)
Комментарии: Физикальное обследование часто не выявляет ничего, однако, могут выявляться различной степени хрипы, когда сосудистое кольцо является изолированной аномалией. Но при кардиологическом обследовании, которое в изолированных случаях ДДА обычно нормальное, примерно у 25% пациентов будут присутствуют сопутствующие сердечные аномалии, которые возможны при ДДА [4, 27, 37, 38, 39, 40, 146 - 148].
- Всем пациентам с ПДА рекомендуется выполнить аускультацию сердца с целью оценки степени выраженности сброса крови на ДМЖП слева-направо или через открытый артериальный проток в нисходящую аорту [5, 6, 11 - 14, 45, 46].
ЕОК нет (УУР C, УДД 4)
Комментарии: Несмотря на возможность в целом заподозрить наличие патологии при аускультации, патогномоничной и четкой аускультативной картины порок не имеет. Характерные находки при аускультации у пациентов с ПДА могут быть следующие:
- отсутствие или не выраженный систолический шум ДМЖП, убывающий, не превышающий градацию 3/6 и менее [45].
- диастолический шум на легочной артерии, обусловленный легочной гипертензией и/или усиленный 2 тон на легочной артерии
- непрерывный систоло-диастолический шум коллатерального кровотока между восходящей и нисходящей аортой [46].
- Всем пациентам с ДДА рекомендуется выполнить аускультацию сердца для выявления сопутствующей сердечно-сосудистой патологии [5, 6, 40, 41, 45, 47 - 49].
ЕОК нет (УУР C, УДД 4)
Комментарии: Несмотря на отсутствие внутрисердечных шумов, данные аускультации при ДДА позволяют заподозрить наличие сопутствующей сердечной патологии, (встречающейся до 25%), но патогномоничной и четкой аускультативной картины порок не имеет. Характерные находки при аускультации у пациентов с ПДА могут быть следующие:
- проводные, различного характера, хрипы, приводящиеся на шею, кашель [40, 41, 45, 47 - 49].
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам с ПДА или ДДА, поступающим в стационар для оперативного лечения, которым предполагается переливание донорской крови и (или) ее компонентов, определение группы крови по системе AB0, резус-принадлежности, определение антигенов эритроцитов C, c, E, e системы Rh, антигена K1 системы Kell, а также антиэритроцитарных антител [12, 40, 50 - 54, 124, 126].
ЕОК нет (УУР C, УДД 5)
- Рекомендуется всем пациентам с ПДА или ДДА, поступающим в стационар для оперативного лечения определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови; определение антител к вирусу гепатита C (Hepatitis C virus) в крови; определение антител к бледной трепонеме (Treponema pallidum) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV-2) в крови для исключения ассоциации с ВИЧ-инфекцией, гепатитом и сифилисом [12, 40, 50 - 54, 123, 125].
ЕОК нет (УУР C, УДД 5)
- Рекомендуется у всех пациентов с ПДА и ДДА выполнение общего (клинического) анализа мочи и общего (клинического) анализа крови с исследованием уровня гемоглобина в крови и оценкой гематокрита, исследованием уровня эритроцитов, лейкоцитов, тромбоцитов в крови, исследованием скорости оседания эритроцитов в рамках первичного обследования, при поступлении в стационар, в т.ч. для оперативного лечения, в процессе динамического наблюдения не менее 1 раза в год, а также в послеоперационном периоде при необходимости [12, 40, 50 - 54].
ЕОК IC (УУР C, УДД 5)
Комментарии: изменения в формуле и основных показателях крови могут часто встречаться у пациентов с ВПС, как при развитии ЛГ, так и до присоединения данного осложнения. Также, при различной сопутствующей патологии, изменения в анализах требуют интерпретации и, при необходимости, соответствующего лечения. При планировании оперативного лечения обследование является необходимым на предмет оценки нейтропении, анемии, тромбоцитопении и пр. [35, 51 - 54].
- Рекомендуется всем пациентам с ПДА и ДДА, поступающим в стационар для оперативного лечения, выполнение коагулограммы (ориентировочного исследования гемостаза) (активированное частичное тромбопластиновое время, исследование уровня фибриногена в крови, а также международного нормализованного отношения (МНО)) с целью исключения врожденных и приобретенных нарушений в системе свертывания крови, прогноза послеоперационных тромбозов и кровотечений [35, 51 - 54].
ЕОК IC (УУР C, УДД 5)
Комментарии: У пациентов ПДА или ДДА необходимо исключать нарушения гемостаза, что несет в себе повышенный риск кровотечений и тромбозов при выполнении оперативного вмешательства [51 - 54].
- Рекомендуется проведение анализа крови биохимического общетерапевтического (исследование уровня калия, натрия, хлоридов, глюкозы, креатинина, общего белка, альбумина, мочевины, общего и связанного (конъюгированного) билирубина в крови, железа в сыворотки крови, определение активности аспартатаминотрансферазы и аланинаминотрансферазы в крови) у всех пациентов с ПДА и ДДА, поступающих в стационар для оперативного лечения, у пациентов с осложненным течением порока, при первичном обследовании и динамическом наблюдении каждые 6 - 12 месяцев [35, 51 - 54, 59].
ЕОК IC (УУР C, УДД 5)
Комментарии: у больных с ПДА возможны изменения со стороны биохимических показателей крови, связанные в ряде случаев с общим тяжелым состоянием [59]. При тяжелом течении обструктивного синдрома аналогичные сдвиги могут наблюдаться и при сосудистых кольцах дуги аорты, включая ДДА [35, 51 - 54].
- Рекомендуется проведение биохимического анализа крови у всех пациентов с ПДА или ДДА и подозрением на синдром Ди Джорджи с определением уровня ионизированного кальция, уровня паратиреоидного гормона, уровня общего и свободного трийодтиронина, общего и свободного тироксина в крови, уровня тиреотропного гормона в крови для подтверждения сопутствующей генетической патологии и степени тяжести гормональных и электролитных нарушений [10, 12, 13, 55, 149 - 151].
ЕОК IC (УУР C, УДД 4)
Комментарии: Выявление сопутствующих генетических аномалий направлено на их поиск, как часто ассоциируемых с ПДА или ДДА [10, 12, 13, 55]. Определение соответствующих изменений биохимических показателей требуется для диагностики и лечения возможных осложнений [55, 150 - 151].
- Рекомендуется проведение у всех пациентов с ПДА или ДДА и синдром Ди Джорджи исследования иммунологического статуса при клеточном иммунодефиците с определением уровня иммуноглобулинов крови для оценки степени тяжести иммунных нарушений [10, 12, 13, 55, 149 - 151].
ЕОК IC (УУР C, УДД 4)
Комментарии: Выявление сопутствующих иммунных нарушений при синдроме Ди Джорджи с определением количества нативных T-лимфоцитов, митогенного ответа (T-клеточный пролиферативный ответ на воздействие антигенов) необходимо для выявления соответствующих изменений иммунологических показателей и лечения возможных осложнений [10, 12, 13, 55, 149 - 151].
- Рекомендуется проведение молекулярно-генетического обследования у всех пациентов с ПДА и ДДА, и подозрением на синдром Ди Джорджи или другие генетические аномалии группы CATCH22 для их подтверждения или исключения [10, 12, 13, 55, 149 - 151].
ЕОК IIa B-NR (УУР C, УДД 4)
Комментарии: Определение не ограничено синдромом Ди Джорджи или аномалиями группы CATCH22. При необходимости и фенотипических признаках диагностический поиск осуществляется в отношении синдрома трисомии 21 (синдром Дауна) и синдрома трисомии 18 (синдром Эдвардса) [55 - 57, 151].
2.4 Инструментальные диагностические исследования
- Всем пациентам с ПДА и ДДА рекомендуется выполнение электрокардиографии (ЭКГ) для определения перегрузки левых и правых отделов сердца, оценки сердечного ритма и проводимости [5, 6, 12, 14, 40, 58 - 60, 152].
ЕОК нет (УУР C, УДД 4)
Комментарии: ЭКГ исследование при ДДА в пределах нормы, за исключением сопутствующих ВПС, но во всех случаях исследование позволяет заподозрить, при ее наличии и соответствующих ЭКГ проявлениях, сопутствующую патологию. При ПДА по данным ЭКГ обычно выявляются признаки гипертрофии правого желудочка, нежели левого, также, в типичных случаях, присутствует нормальная ЭОС или ее отклонение вправо с нарушениями проводимости по правой ножке пучка Гиса [5, 6, 12, 14, 40]. При формировании ЛГ также определяются P pulmonale, отклонение электрической оси сердца вправо, гипертрофия правого желудочка, перегрузка правого желудочка по типу "стрейн", блокады правой ножки пучка Гиса, удлинение сегмента QT [58]. Последние два признака свидетельствуют о явной выраженности заболевания, тогда как гипертрофия и признаки перегрузки обладают достаточной чувствительностью и специфичностью для скрининговых исследований [59, 60, 152].
- Всем пациентам с ПДА и ДДА рекомендуется выполнение рентгенографии органов грудной клетки для определения конфигурации сердца и состояния малого круга кровообращения, а также исключения возможной сопутствующей патологии [5, 6, 12, 14, 40, 61 - 63].
ЕОК нет (УУР C, УДД 5)
Комментарии: Данные рентгенологического исследования при ПДА имеют сходство с таковыми у детей до года, имеющих гемодинамически значимые ВПС с массивным лево-правым сбросом [5, 6, 12, 14, 40, 61]. Сосудистая тень магистральных сосудов часто сужена, особенно в отсутствии тимуса при сопутствующем синдроме Ди Джорджи. Легочный сосудистый рисунок усилен за счет артериального и венозного компонентов. Характерно увеличение тени сердца за счет обоих желудочков, особенно резкое увеличение наблюдается в случае закрытия ОАП как результат развития резкой гиперволемии и перегрузки объемом левого желудочка сердца. Контур аорты не имеет "клюва" восходящего сегмента из-за его уменьшения и более вертикального расположения. Трахея не имеет характерного отклонения, вызываемого дугой аорты и, соответственно, имеет срединное расположение. В отсутствие межжелудочкового дефекта и ОАП рентгенологическая картина имеет сходство с коарктацией аорты, в более старшем возрасте возможно появления узураций ребер [40, 62, 63].
При ДДА локализация дуги аорты по данным R-исследования плохо определяется. При выраженном сдавлении трахеи, последнее может определяться в передне-задней или боковой проекциях. Возможны признаки аспирационной пневмонии. При невозможности выполнения компьютерной томографии, контрастная эзофагография с барием является информативной в постановке диагноза, и при ДДА тень контрастированного пищевода будет иметь два вдавления с обеих сторон, чаще более выраженное справа в передне-задней проекции и большее сзади при боковой проекции [11, 12, 40].
- Всем пациентам с подозрением на ПДА или ДДА рекомендуется выполнение трансторакальной эхокардиографии (ЭхоКГ) с применением режима цветного допплеровского картирования, что является основным диагностическим инструментом в постановке диагноза ПДА, определении его типа, функции правого и левого желудочка, функции клапанов сердца, объема и направления шунтирования крови [5, 6, 12, 14, 40, 61, 64, 65].
ЕОК IC (УУР A, УДД 2)
Комментарии: Эхокардиография (ЭхоКГ) - важный метод диагностики для установления диагноза ПДА и оценки анатомии: позволяет получить информацию о локализации, размере ДМЖП, наличии подаортальной обструкции, выраженности объемной перегрузки и гипертрофии желудочков, анатомии дуги аорты, степени ЛГ, взаимоотношения и размеры магистральных сосудов, явную диспропорцию расширенной легочной артерии по отношению к аорте. Точность этого метода для визуализации для ПДА достаточно высокая, что позволяет дифференцировать патологию от коарктации аорты с тубулярной гипоплазией дуги [40, 64]. Метод также позволяет по ряду признаков (направление кровотока в магистральных сосудах, визуализации контура сосудов и т.д.) определить тип перерыва дуги аорты. Исследование коронарного русла по данным ЭХОКГ является сложным, тем не менее, возможные аномалии коронарных артерий подлежат эхокардиографической оценки [64, 65].
Эхокардиография (ЭхоКГ) - также широко используемый метод диагностики для установления диагноза ДДА. Метод позволяет получить информацию о типе ДДА, локализации суженных участков, взаимоотношения и размеров правой и левой дуг. Точность эхокардиографии для визуализации для ДДА достаточно высокая, однако, учитывая высокую частоту различных отклонений от "стандартной" анатомии, часто требуется проведение дополнительных исследований при помощи других методов [40, 64].
- Пренатальная эхокардиография плода (ПЭхоКГ) рекомендуется для обследования беременных, как для первичной диагностики ПДА, так и когда данные требуют дифференциального диагноза при подозрении на ВПС плода [64, 66, 67, 68].
ЕОК IC (УУР A, УДД 2)
Комментарии: Проведение ПЭхоКГ исследования при ПДА имеет высокую информативность с возможностью точной постановки диагноза примерно в 80% [66, 67, 68]. В настоящее время разрешающие способности метода улучшаются, внутриутробно считаются информативными сканирования в четырехкамерной проекции, проекции трех сосудах и трахеи [68].
- Пренатальная эхокардиография плода (ПЭхоКГ) при подозрении на ДДА у плода рекомендуется как для первичной диагностики ДДА, так и когда данные требуют дифференциального диагноза при подозрении на ВПС плода [68, 69, 70 - 75].
ЕОК IC (УУР A, УДД 2)
Комментарии: Проведение ПЭхоКГ исследования по поводу ДДА имеет высокую информативность, точность исследования составляет от 60% до 100% [71 - 75]. Наиболее информативными, как и для большинства сосудистых колец аорты, считаются ультразвуковые срезы из четырехкамерной проекции, проекции трех сосудах и трахеи (3VT) [68, 69, 70, 71]. Важным является не только и не столько факт установления точного диагноза, сколько возможность направлять беременных с подозрением на данную патологию в родильные учреждения, где имеется возможность ведения новорожденных детей с возможным респираторным дистресс-синдромом, как осложнением наличия полного сосудистого кольца [71].
- Чреспищеводная эхокардиография (ЧПЭхоКГ) рекомендуется при необходимости у больных с ПДА и ДДА интраоперационно во время проведения коррекции ВПС [76, 77, 78].
ЕОК нет (УУР C, УДД 5)
Комментарии: Метод описывается как интраоперационное исследование для контроля эффективности проводимого вмешательства при целом ряде ВПС, включая различные аномалии ветвей дуги аорты [70]. В настоящее время внедряются ЭхоКГ-технологии для улучшения диагностики с использованием трехмерных изображений и тканевой допплерЭхоКГ, контрастной ЭхоКГ.
- Рекомендуется выполнение компьютерной томографии сердца с контрастированием (КТ) всем пациентам с ПДА и ДДА для уточнения данных ЭхоКГ (если есть в этом необходимость, либо результаты ЭхоКГ неубедительны) при планировании хирургического лечения [5, 6, 12, 14, 40, 79].
ЕОК IIaC (УУР C, УДД 5)
Комментарии: КТ играет все более важную роль в диагностике ПДА, ДДА и других сосудистых колец, как у детей, так и у взрослых пациентов: обеспечивает высокое пространственное разрешение и быстрое получение данных, позволяет выявить сопутствующие паренхиматозные заболевания легких. Размеры и функцию желудочков можно оценить с меньшими затратами времени в сравнении с МРТ. КТ в настоящее время более широко доступна, чем МРТ, и поэтому играет особую роль в экстренных ситуациях. КТ сердца является альтернативой МРТ у пациентов с имплантированными кардиостимуляторами или дефибрилляторами. Недавние усовершенствования, такие как ЭКГ-синхронизация, новые ротационные техники, уменьшают дозу излучения и делают исследование менее зависимым от частоты сердечных сокращений, что в ближайшие годы может сделать КТ более привлекательным методом визуализации [5, 6, 12, 14, 40, 79].
- Рекомендуется проведение магнитно-резонансной томографии сердца и магистральных сосудов у детей с патологией ветвей дуги аорты, включая ДДА возможно в ряде случаев, так же как и взрослым пациентам с ДДА для оценки их структурно-функциональных изменений [14, 72, 81].
ЕОК нет (УУР C, УДД 5)
Комментарии: Проведение МРТ исследования у новорожденных имеет технические сложности и ограниченную доступность, поэтому рутинно не проводится. В то же время, МРТ сердца улучшает возможности визуализации, особенно для оценки перегрузки желудочков сердца и количественного определения шунтирования крови при наличии септальных дефектов. Метод позволяет получить трехмерные анатомические реконструкции с высоким пространственным и временным разрешением, проводить объемные измерения, оценку сосудов и фиброзных изменений миокарда. МРТ может применяется в следующих клинических ситуациях:
- в качестве альтернативы ЭхоКГ, если этого требует клиническая задача, поскольку МРТ более информативна в сравнении с ЭхоКГ при количественной оценке объемов и фракции выброса правого желудочка (ПЖ), обструкции выносящего тракта ПЖ, легочной регургитации, оценке легочных артерий (стенозов, аневризм) и аорты (аневризма, расслоение, коарктация); системных и легочных вен (аномальный дренаж, обструкции и т.д.), коллатералей и артериовенозных мальформаций (превосходит возможности КТ), при ишемической болезни сердца (уступает КТ), оценке внутри- и экстракардиальных масс (уступает КТ), количественной оценке массы миокарда (левого и правого желудочков), выявление и количественная оценка фиброза миокарда/рубца (при исследовании с гадолинием выявляется улучшение в отсроченную фазу); характеристика ткани (фиброз, жир и т.д.) [72].
- МРТ в целом показано при недостаточной информативности полученных данных при стандартном ЭхоКГ исследовании.
- в МРТ реализована возможность неинвазивного измерения гемодинамических параметров на основе скоростного фазного картирования с определением степени регургитации и отношения Qp/Qs [81].
- Рекомендуется катетеризация камер сердца всем пациентам при повышении давления в легочной артерии по данным ЭхоКГ для определения легочного сосудистого сопротивления и операбельности порока [5, 6, 12, 14, 40, 79].
ЕОК IC-EO (УУР C, УДД 5)
Комментарии: Для диагностики изолированных форм ПДА и ДДА проведение катетеризации сердца сегодня не применяется рутинно [11, 12]. Методика зарезервирована для случаев со сложными сопутствующими ВПС.
Катетеризация сердца и сосудов при ПДА абсолютно показана по достижении возраста без операции 6 мес. и старше [7].
- Рекомендуется выполнение фибробронхоскопии при ДДА для оценки степени обструкции и визуализации сдавления и деформации трахеобронхиального дерева, вызванных сдавлением извне наличием имеющихся сосудистых колец в трудных диагностических ситуациях, а также для исключения иных причин респираторных нарушений [88, 90].
ЕОК IC-EO (УУР C, УДД 4)
Комментарии: Фибробронхоскопия при ПДА и ДДА также рекомендуется, если планируются лечебно-диагностические мероприятия при помощи этого метода [88, 90].
Для диагностики изолированных форм ДДА проведение фибробронхоскопии не применяется рутинно [88]. Методика зарезервирована для случаев, где необходимо оценить степени, уровень и протяженность обструкции, а также прогноз восстановления проходимости трахео-бронхиального дерева и расправления деформированных участков. Также, процедура показана, если планируются лечебные мероприятия, направленные на санацию трахео-бронхиального дерева и иные лечебно-диагностические действия [89, 90]. При ПДА метод может применяться после операции, если имеет место подозрение на развитие бронхиальной обструкции, вызванное изменением положения аорты после коррекции ВПС.
2.5 Иные диагностические исследования
- Перед выпиской из стационара всем пациентам с целью контроля после выполненного оперативного вмешательства рекомендуется выполнить электрокардиографию [11, 12, 152 - 154].
ЕОК нет (УУР C, УДД 5)
- Перед выпиской из стационара всем пациентам с целью контроля после выполненного оперативного вмешательства рекомендуется выполнить эхокардиографию [11, 12, 152].
ЕОК нет (УУР C, УДД 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
Поддерживающая терапия
Тактика лечения ПДА определяется степенью гемодинамически значимых нарушений. Всем пациентам с ПДА показано оперативное лечение. Для детей, поддающихся терапии, возможно отсрочить проведение оперативного вмешательства в случаях высокого риска оперативного лечения или до момента относительной стабилизации состояния пациента.
- У детей первых недель жизни с ПДА при признаках гиперволемии малого круга кровообращения и явлениях недостаточности кровообращения рекомендуется соответствующая медикаментозная терапия с решением вопроса о возможности оперативного лечения [7, 11, 37, 47, 91, 92].
ЕОК I (УУР C, УДД 4)
Комментарии: У пациентов периода новорожденности при высоком риске оперативного лечения по причине сопутствующих ВПС и/или иных отягощающих факторов и с проявлениями сердечной недостаточности целесообразно прибегнуть к консервативной терапии с использованием диуретиков, бета-адреноблокаторов, ингибиторов ангиотензин-превращающего фермента. Лечение должно быть "мостом" до хирургической коррекции ВПС.
- "Петлевые" диуретики рекомендуются пациентам с ПДА и сердечной недостаточностью для купирования отечного синдрома [12, 158 - 161, 166 - 167].
ЕОК нет (УУР C, УДД 5)
Комментарии: Рандомизированные контролируемые исследования по применению диуретиков при ПДА, как и при многих других ВПС, отсутствуют, однако клинические данные демонстрируют отчетливое улучшение симптоматики при использовании "петлевых" диуретиков у пациентов с НК. При назначении диуретиков следует избегать форсированного диуреза и тщательно мониторировать системное АД, уровни электролитов, креатинина, мочевины крови и гематокрита, чтобы избежать гемоконцентрации в ответ на снижение внутрисосудистого объема крови, гипокалиемии, преренальной недостаточности. В условиях выраженной системной гипотонии и анасарки целесообразно внутривенное капельное введение фуросемида** под контролем системного АД, центрального венозного давления и почасового диуреза. При наличии показаний следует рассматривать инотропную поддержку под контролем гемодинамики в условиях реанимационного отделения. Целесообразно сочетание "петлевых" диуретиков (#фуросемид** (твердая лекарственная форма off-label у детей до 3-х лет), #торасемид** (твердая лекарственная форма off-label у детей до 18 лет)) с антагонистами альдостерона (#спиронолактон** (off-label у детей до 3-х лет), #эплеренон** (off-label у детей до 18 лет)) [166 - 167].
- Рекомендуется назначение #дигоксина** (твердая лекарственная форма off-label у детей до 3-х лет) пациентам с ВПС для контроля частоты сердечных сокращений при фибрилляции предсердий [96, 162 - 165].
ЕОК IB (УУР C, УДД 5)
Комментарии: #Дигоксин** (твердая лекарственная форма off-label у детей до 3-х лет) позволяет контролировать частоту сердечных сокращений у больных с наджелудочковыми аритмиями, которые ассоциируются с дисфункцией желудочков. Препарат повышает сократительную функцию ПЖ у больных с ЛГ, при патологии легких и бивентрикулярной хронической сердечной недостаточности [162 - 165].
- Рекомендуется назначение препаратов у пациентов грудного возраста с ВПС и лево-правым сбросом, к которым относится ПДА, при декомпенсации НК для улучшения регионарной перфузии, сократительной способности желудочков сердца и купирования застойных явлений, комбинированной терапии по примерной схеме: бета-адреноблокаторы, #дигоксин** и диуретики [121, 122, 158 - 167].
ЕОК нет (УУР C, УДД 5)
Комментарии: изолированное назначение в этой ситуации #дигоксина** не эффективно и клинический эффект монотерапии существенно ниже, нежели комбинированного лечения [121, 162 - 165].
- Рекомендуется назначение кардиотонических средств, кроме сердечных гликозидов у пациентов с ВПС, включая ПДА, при декомпенсации НК для улучшения сократительной способности желудочков сердца и поддержания перфузионного давления [120, 129, 158 - 161].
ЕОК нет (УУР C, УДД 5)
Комментарии: Для повышения сердечного выброса применяются кардиотонические средства, кроме сердечных гликозидов (#добутамин**, #допамин**, #левосимендан** (off-label у детей до 18 лет)) и, при необходимости, для поддержания артериального давления, норэпинефрин** [129, 158 - 161].
3.2 Хирургическое лечение
Наличие патологии сосудов дуги аорты само по себе является показанием для оперативного лечения во всех случаях при условии операбельности.
- Всем пациентам с ПДА и ДДА, единственным рекомендуемым способом устранения патологии является хирургическое лечение [5, 6, 11, 12, 38, 39, 41, 46, 92, 93].
ЕОК IC (УУР C, УДД 4)
Комментарии: учитывая крайне плохой прогноз без хирургического лечения во всех случаях при ПДА и при наличии ранних клинических проявления при ДДА, своевременное оперативное лечение необходимо проводить у новорожденных при ПДА, у детей грудного возраста при ДДА.
При ДДА возможна элективная коррекция у новорожденных. Сообщается также при ДДА о возможности и необходимости радикального лечения в группах больных в возрасте старше года и даже в подростковом возрасте, если диагноз установлен впервые [46]. Однако, если в первом случае это выборочные и малочисленные группы, то в более старшем это редкие, отдельные наблюдения пациентов [38, 39, 41].
- Хирургическое лечение новорожденным с ПДА, учитывая, что ВПС является критическим, рекомендуется выполнять в срочном порядке, если только больной не признан неоперабельным [11, 84 - 86].
ЕОК IC (УУР C, УДД 5)
Комментарии: В целом, если больной стабилен, операция выполняется в ближайшее время, но экстренности нет.
В критических случаях, когда имеются признаки закрытия ОАП, требуется стабилизация состояния, обязательным компонентом которой является немедленная внутривенная инфузия препаратов группы простагландинов из расчета 0,003 - 0,02 мкг/кг/мин под контролем показателя насыщения капиллярной крови кислородом, появления пульсации на нижних конечностях и купирования явлений лактат-ацидоза, вызванного гипоперфузией нижней половины туловища [85, 86, 127 - 129]. Обычно также требуется перевод ребенка на ИВЛ, избегая при этом вентиляции с повышенной концентрацией кислорода. Применяются также меры для увеличивая сопротивление в малом круге кровообращения (например, увеличение концентрации pCO2). Для стабилизации состояния операция может быть отложена на 6 - 12 часов. Критерием неоперабельности может быть наличие тяжелых хромосомных аномалий с неблагоприятным прогнозом для жизни [11, 127 - 129].
- Всем больным с ДДА, имеющим симптомы выраженной обструкции дыхательных путей, вызванной наличием данного ВПС рекомендуется хирургическая коррекция порока [11, 87, 88, 89, 90].
ЕОК IC (УУР C, УДД 4)
Комментарии: Осложнения, при наличии явных симптомов, обусловленных компрессией верхних дыхательных путей и/или пищевода сосудистым кольцом, которые развиваются без хирургического лечения, включают гипоксические приступы, приступы апноэ, а позже, также поражение трахеи и бронхов [87]. В связи с этим длительная отсрочка оперативного лечения не рекомендуется.
- Всем больным с ДДА при наличии симптомов сдавления трахеи или пищевода в раннем периоде после рождения, рекомендуется ранее выполнение хирургической коррекции порока (в первые месяцы жизни) [11, 87, 88, 89, 90].
ЕОК IC (УУР C, УДД 4)
- При ведении больных с ДДА, имеющих тяжелые формы порока, рекомендуется соблюдать принцип мультидисциплинарного подхода с привлечением при необходимости смежных специалистов (торакальных хирургов, врачей-эндоскопистов и пр.) [11, 87, 91, 154 - 157].
ЕОК IC (УУР C, УДД 5)
Комментарии: Некоторые формы сосудистых патологий дуги аорты представляют собой особые сложности для коррекции, например, сочетание "ринг-слинг" комплекса с сопутствующими ВПС, когда оперативное лечение не только включает устранение сосудистой аномалии, но и вмешательства на трахее [91, 154 - 157].
- Одномоментное хирургическое лечение рекомендуется пациентам с ПДА (в том числе, при сочетании с другими ВПС), при возможности их коррекции [6, 11, 32 - 36, 92 - 101].
ЕОК IC (УУР C, УДД 5)
Комментарии: операция выполняется в условиях искусственного кровообращения с раздельной канюляцией восходящей и нисходящей аорты, через ОАП, что обычно не требует глубокой гипотермии. В этих случаях этап реконструкции дуги аорты может выполняться в условиях селективной перфузии головного мозга.
При использовании методики одной аортальной канюли с последующим циркуляторным арестом, уровень применяемой гипотермии является углубленным (в некоторых случаях до 18 °C).
После рассечения аорты необходимо максимально возможное удаление дуктальных тканей [11, 92]. В зависимости от анатомии и предпочтений хирурга, реконструкция дуги аорты может выполняться при помощи собственных тканей аорты с анастомозом конец-в-бок или с использованием иных методик [94].
При значительном расстоянии в области перерыва дуги аорты, высоком риске сдавления левого главного бронха в случае избыточного натяжения анастомоза на дуге аорты, и для достижения формы дуги аорты, близкой к нативной ("романической"), возможно использование тканей гомографта или бесклапанного гомографта, аутотканей легочной артерии [32 - 36, 95 - 101].
- При радикальной коррекции ПДА при использовании дополнительных материалов для реконструкции дуги аорты и с целью устранения сопутствующих септальных дефектов вмешательство рекомендуется выполнять с применением собственных тканей или любого сертифицированного материала (медицинского изделия, имеющего регистрационное удостоверение: заплата, кондуит, гомографт) [4, 7, 32 - 35, 101].
ЕОК IC (УУР C, УДД 5)
Комментарии: коррекция ПДА с применением дополнительных материалов предполагает применение тканей гомографта или собственной легочной артерии для реконструкции дуги аорты и, при наличии сопутствующего дефекта межжелудочковой перегородки, заплаты из синтетического или биологического материала с фиксацией непрерывным или отдельными швами [4, 7, 101].
- Двухэтапное хирургическое лечение рекомендуется пациентам с ПДА в том числе, при сочетании с другими ВПС, при невозможности их одномоментной коррекции [7, 84, 101, 102 - 106].
ЕОК IC (УУР C, УДД 5)
Комментарии: в случаях, когда радикальная коррекция в условиях искусственного кровообращения сопряжена с чрезмерным риском (низкая масса тела, недоношенность, сложная анатомия сопутствующих ВПС и др.), рассматривается возможность этапного паллиативного лечения [101 - 106].
- Гибридное хирургическое лечение рекомендуется выборочно больным с ПДА в сочетании с коморбидной патологией, когда необходимо избежать операции в условиях искусственного кровообращения [107, 108].
ЕОК IC (УУР C, УДД 4)
Комментарии: гибридный метод является разновидностью этапного хирургического лечения, в случаях, когда радикальная коррекция в условиях искусственного кровообращения сопряжена с чрезмерным риском (низкая масса тела, недоношенность, сложная анатомия сопутствующих ВПС и др.), и предполагается как "мост" к радикальной коррекции, которая выполняется обычно через 2 - 8 месяцев после первого этапа [107, 108].
- У больных после ранее перенесенной радикальной операции по поводу ПДА при развитии в последующем повторной обструкции на реконструированной нео-дуге аорты или выводном отделе левого желудочка при наличии умеренного или более выраженного стеноза рекомендуется повторное вмешательство, если присутствуют жалобы на снижение физической активности или наличие нарушений ритма сердца [6, 11, 12, 109 - 113].
ЕОК IIa B-NR (УУР C, УДД 4)
Комментарии: Резидуальные или вновь возникающие нарушения со стороны нео-дуги аорты и/или выводного тракта левого желудочка после коррекции ПДА, широко известная проблема. Реоперации при данном пороке возможны при использовании любой методики при первичной коррекции, включая технику анастомозирования "конец-в-бок", имплантацию кондуита, расширение дуги при помощи заплаты или аутотканей легочной артерии. Может также наблюдаться как новая обструкция, так и прогрессирование уже имевшейся, но до этого незначительной обструкции выводного отдела левого желудочка [6, 11, 12, 109 - 113].
- У взрослых больных после ранее перенесенной радикальной операции по поводу ПДА при отсутствии симптомов и при наличии выраженного стеноза на нео-дуге рекомендуется повторное вмешательство, если выявляется снижение фракции выброса левого желудочка или его дилатация [11, 12, 113 - 115].
ЕОК IIb B-NR (УУР C, УДД 5)
Комментарии: Высокая предрасположенность к повторным вмешательствам после радикальной коррекции ПДА обусловлена исходной анатомией порока и отсутствием универсальной "идеальной" методики, с необходимостью использования в ряде случаев, кондуитов. Своевременная повторная операция для устранения прогрессирующей обструкции на дуге аорты или выводном отделе левого желудочка позволяет предупредить патологические изменения со стороны миокарда, кардиомегалию и нарушения ритма сердца. Повторные вмешательства включают в себя как открытые, так и эндоваскулярные и гибридные операции [113 - 115].
3.3 Эндоваскулярные вмешательства
- У больных после ранее перенесенной радикальной операции по поводу ПДА при помощи кондуита или иной методики при наличии гемодинамически значимой обструкции рекомендуется эндоваскулярная баллонная дилатация, как паллиативная мера для устранения обструкции, или как пробная процедура для оценки податливости области обструкции перед имплантацией стента в зону обструкции [116 - 119].
ЕОК IIbC (УУР C, УДД 5)
Комментарии: Чрескожная баллонная дилатация области дуги нео-аорты, подвергшейся рестенозу, сегодня рассматривается как процедура, имеющая сравнительно кратковременный и, не всегда достижимый, положительный эффект [118]. Это объясняется природой обструкции, особенно при использовании при первичной операции кондуита в отдаленные сроки, включающей перерост кондуита, пролиферацию интимы, кинкинг и внешнее сдавление, кальциноз и дегенерацию клапана [118, 119].
- Чрескожная имплантация стента у больных после радикальной коррекции ПДА рекомендуется взрослым пациентам при гемодинамически значимой обструкции дуги нео-аорты и подходящей для этого анатомией [116 - 119].
ЕОК IB (УУР C, УДД 5)
Комментарии: имплантация стента выполняется, когда предполагается, что (а) данная процедура существенно уменьшит обструкцию (или продлит функцию кондуита если последний применялся) до того момента, когда потребуется последующее вмешательство, (б) имплантация стента не вызовет деформации области бифуркации ветвей легочной артерии и не скомпрометирует трахео-бронхиальное дерево (в) не скомпрометирует ветви дуги аорты.
Чрескожная имплантация стента в нео-аорту представляет собой определенную альтернативу открытому хирургическому лечению у взрослых пациентов с повторной обструкцией на дуге. Несмотря на малоинвазивный характер, далеко не все случаи анатомически подходят для данной процедуры [118, 119].
3.4 Иное лечение
Нет.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется в течение 6 месяцев после выполнения хирургической коррекции ПДА или ДДА пациенту с осложненным течением послеоперационного периода пройти реабилитацию в условиях специализированного лечебного учреждения кардиологического профиля [11, 12, 109, 113 - 119, 130 - 141].
ЕОК нет, УУР C, УДД 5
Комментарии: После радикальной коррекции порока могут встречаться следующие состояния:
- Посткардиотомный синдром и тампонада сердца могут возникнуть через несколько недель после хирургической коррекции ПДА. В связи с чем, могут появиться такие симптомы, как, повышение температуры тела, утомляемость, рвота, боль в груди или абдоминальная боль. Необходимо незамедлительное выполнение ЭхоКГ с целью исключения этого осложнения. Наблюдение и (при необходимости) лечение в соответствии с принятыми рекомендациями.
- Резидуальный сброс между желудочками при устранении ПДА с ДМЖП может встречаться до 5% случаев после коррекции порока. Реоперация показана при гемодинамически значимом шунтировании крови.
- Стенозы нео-аорты могут встречаться после коррекции порока. В подобных случаях реоперация показана при гемодинамически значимой степени обструкции. Возможно катетерное вмешательство при наличии технической возможности и соответствующей морфологии участка стеноза.
- Нарушения ритма и проводимости сердца (атрио-вентрикулярные блокады, суправентрикулярные тахиаритмии и внезапная сердечная смерть) могут возникать как непосредственно после хирургической коррекции ПДА, так и в более отдаленные сроки.
- Резидуальная ЛАГ может сохраняться до 5% случаев после коррекции порока (особенно при поздней хирургической коррекции ПДА). Наблюдение и (при необходимости) назначение ЛАГ специфической терапии осуществляются на основании принятых рекомендация по ЛГ.
- Неврологические нарушения - энцефалопатия, судорожный синдром и т.д. встречаются до 2% случаев и требуют динамического наблюдения невролога по месту жительства [11, 12, 109, 113 - 119, 130 - 141].
- Рекомендуется ограничить физическую нагрузку всем пациентам после проведения хирургической коррекции в течение 3 - 6 месяцев с момента выписки из стационара при неосложненном течении послеоперационного периода [11, 12, 109, 113 - 119, 130 - 141].
ЕОК нет, УУР C, УДД 5
Комментарии: Через 1 год после радикальной коррекции пациенты, оперированные по поводу устранения ДДА, могут быть допущены к занятиям всеми соревновательными видами спорта при отсутствии: 1) признаков обструкции трахеи и пищевода, 2) значимой обструкции дуги аорты, 3) нарушений ритма, 4) признаков дисфункции миокарда желудочков, 5) признаков ЛГ.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Прогноз после хирургической коррекции ПДА и ДДА (в большинстве случаев) благоприятный при условии своевременной коррекции ВПС. Продолжительность жизни и физическая работоспособность могут быть ограничены при наличии ятрогенных остаточных осложнений [11, 12, 109, 113 - 119, 130 - 141].
- Рекомендуется всем пациентам с ПДА и ДДА после хирургической коррекции порока пожизненное диспансерное наблюдение врача детского кардиолога до 18 лет и врача-кардиолога/врача общей практики, врача терапевта после 18 лет для определения частоты визитов, контроля за выполнением предписанных рекомендаций, своевременного изменения терапии, оценки риска сердечно-сосудистых осложнений, направления на дополнительные исследования, при необходимости, на госпитализацию [11, 12, 109, 113 - 119, 130 - 141].
ЕОК/РКО II A, УУР C, УДД 5
Комментарии: Частота диспансерного наблюдения у врача-детского кардиолога и врача взрослого кардиолога через 3 (при наличии показаний), 6 и 12 месяцев после операции. Целесообразно регулярное наблюдение в течение первых 2 лет, а затем, в зависимости от результатов медицинского вмешательства, каждые 12 - 60 месяцев и проводится до достижения 18 лет, затем пациент переходит во взрослую поликлинику, где продолжает наблюдаться с прежней частотой при наличии показаний врачом-кардиологом, врачом-терапевтом общей практики, врачом-терапевтом. В комплекс диспансерного наблюдения включаются ЭКГ, ЭхоКГ, холтеровское мониторирование сердечного ритма, а также при необходимости, пульсоксиметрия.
Пациенты с дисфункцией желудочков, остаточным межпредсердным шунтом, стенозом и окклюзией полых вен и легочных вен, венозным тромбозом, нарушениями ритма и проводимости сердца, ЛАГ, неврологическими нарушениями, должны наблюдаться ежегодно в специализированных центрах.
При определении кратности наблюдения следует руководствоваться наличием симптомов сердечной недостаточности, состоянием гемодинамики, наличием нарушений ритма сердца, гипоксемии и др. В зависимости от этих факторов всех пациентов с ВПС можно разделить на четыре группы (A, B, C, D):
Группа A
- сердечная недостаточность ФК I;
- отсутствие анатомических гемодинамических нарушений;
- отсутствие нарушений ритма сердца;
- нормальная функция печени, почек и легких.
Группа B
- сердечная недостаточность ФК II;
- минимальный стеноз и/или недостаточность клапанов (I степени),
- незначительная дилатация аорты или желудочка (-ов);
- ФВ ЛЖ не менее 50%, ФВ правого желудочка не менее 40%;
- гемодинамически не значимые внутрисердечные шунты (Qp/Qs < 1,5);
- отсутствие гипоксемии;
- нарушения ритма сердца, не требующие лечения;
- отсутствие признаков ЛГ;
- нормальная функция почек и печени.
Группа C
- сердечная недостаточность ФК III;
- умеренный или значительный стеноз и/или недостаточность клапанов (II - III степени), стенозы артерий или вен, умеренная дилатация аорты или желудочка (-ов);
- ФВ ЛЖ 40 - 49%, ФВ ПЖ 35 - 39%;
- гемодинамически значимые внутрисердечные шунты (Qp/Qs >= 1,5);
- умеренно выраженная гипоксемия (SatpO2 >= 85%);
- нарушения ритма сердца, контролируемые терапией;
- легочная гипертензия (ФК легочной гипертензии I - II);
- нарушения функций внутренних органов, контролируемые терапией.
Группа D
- сердечная недостаточность ФК IV;
- значительная дилатация аорты;
- выраженная гипоксемии (SatpO2 < 85%);
- нарушения ритма сердца, рефрактерные к терапии;
- легочная гипертензия (ФК легочной гипертензии III - IV);
- нарушения функций внутренних органов рефрактерные к проводимой терапии.
В зависимости от принадлежности пациента с корригированным или некорригированным пороком к тому или иному функциональному классу, рекомендуется различная кратность наблюдения и объем необходимых при этом инструментальных исследований:
Кратность наблюдения (мес.)/методы исследования
I ФК
(группа A)
II ФК
(группа B)
III ФК
(группа C)
VI ФК
(группа D)
Осмотр врача-детского кардиолога
12
12
6
3
Электрокардиография
12
12
6 - 12
3 - 6
Холтеровское мониторирование сердечного ритма (при наличии нарушений ритма сердца)
12
12
6
6
Эхокардиография (при необходимости ЧПЭхоКГ)
12
12
6 - 12
3 - 6
МРТ/КТ сердца и магистральных сосудов с контрастированием (при необходимости)
36
36
12
12
Пульсоксиметрия
12
12
6
3
Определение типа реакции сердечно-сосудистой системы на физическую нагрузку (тест 6-минутной ходьбы, при необходимости теста с физической нагрузкой с использованием эргометра)
36
24
12 - 24
6 - 12
- Рекомендуется всем пациентам подросткового возраста с ПДА проводить диспансерное наблюдение до и после операции у врача детского кардиолога с последующей передачей пациентов врачу-взрослому кардиологу [11, 12, 109, 113 - 119, 130 - 141].
ЕОК/РКО IC, УУР C, УДД
- Рекомендуется всем пациентам с ПДА, и реже с ДДА при динамическом наблюдении оценивать клинический статус, толерантность к физической нагрузке [11, 12, 109, 113 - 119, 130 - 141].
ЕОК IIA, УУР C, УДД 5
Комментарии: Исследование необходимо для определения объема оптимальной физической нагрузки, объективной оценки функциональной способности сердца и наличия потенциальных аритмий. Исследование проводится с использованием велоэргометрической пробы, тредмил-теста, возможно использование теста 6-минутной ходьбы с оценкой одышки по 10-балльной шкале Борга и проведением пульсоксиметрии.
- Рекомендуется всем пациентам с ПДА после хирургической коррекции в процессе динамического наблюдения не менее 1 раза в год проведение общего (клинического) анализа мочи (для оценки почечной дисфункции) и общего (клинического) анализа крови с исследованием уровня общего гемоглобина, эритроцитов, лейкоцитов, тромбоцитов в крови, оценка гематокрита, исследование скорости оседания эритроцитов (для исключения анемии и воспалительного процесса) [12, 40, 50 - 54].
ЕОК/РКО IC, УУР C, УДД 5
- Рекомендуется всем пациентам с ПДА после хирургической коррекции, а также на контрольном визите при динамическом наблюдении проведение анализа крови биохимического общетерапевтического (исследование уровня калия, натрия, хлоридов, глюкозы, креатинина, общего белка, альбумина, мочевины, общего билирубина в крови, свободного и связанного билирубина, определение активности лактатдегидрогеназы, аспартатаминотрансферазы и аланинаминотрансферазы в крови, исследование уровня C-реактивного белка в сыворотке крови) для оценки почечной и печеночной функции, исключения воспалительного процесса [35, 51 - 54, 59].
ЕОК/РКО IC, УУР C, УДД 5
- Рекомендуется всем пациентам с ПДА старше 25 лет (в более раннем возрасте при развитии СН), а также после хирургического лечения, при наличии показаний, исследование уровня N-терминального фрагмента мозгового натрийуретического пропептида (NT-proBNP) в крови с целью стратификации риска летальности [142 - 145].
ЕОК/РКО IIaC, УУР C, УДД 5
- Рекомендуется пациентам после хирургического лечения регистрация электрокардиограммы в покое, расшифровка, описание и интерпретация электрокардиографических данных 1 раз в год при контрольном визите и дополнительно при появлении аритмии, а также выполнение ЭКГ всем пациентам 1 раз в год при назначении/изменении лечения, влияющего на внутрисердечную электрическую проводимость [5, 6, 12, 14, 40, 59 - 60, 148, 152].
ЕОК/РКО IB, УУР C, УДД 4
Комментарии: ЭКГ должна выполняться для оценки сердечного ритма и ЧСС. У пациентов, перенесших радикальную коррекцию могут регистрироваться слабость синусового узла со снижением ЧСС в дневное время менее 40/мин. и паузами более 3 секунд, а также при предсердной ри-ентри тахикардии (ПРТ)/ФП с быстрым проведением на желудочки и возможным развитием желудочковой тахикардии, что является фактором риска внезапной сердечной смерти. Выявление ТП и ФП, пароксизмов желудочковой тахикардии - косвенно свидетельствует о выраженных нарушениях внутрисердечной гемодинамики.
- Рекомендуется проведение холтеровского мониторирования сердечного ритма (24 часа) всем пациентам с сопутствующими нарушениями ритма и/или проводимости сердца с целью выявления последних, и при необходимости подбора и коррекции терапии 1 раз в год [5, 6, 12, 14, 40, 58 - 60, 109, 113 - 119, 130 - 141].
ЕОК/РКО IIa C, УУР C, УДД 5
Комментарии: Проведение холтеровкого мониторирования сердечного ритма необходимо для исключения нарушений ритма и проводимости сердца, которые могут регистрироваться после радикальной коррекции ПДА. Самыми тяжелыми являются те нарушения при которых отмечается снижение ЧСС в дневное время менее 40/мин. и паузами более 3 секунд, а также ПРТ/ФП с быстрым проведением на желудочки и возможным развитием желудочковой тахикардии, которые могут стать причиной внезапной сердечной смерти. Для пациентов с непродолжительными желудочковыми тахикардиями без нарушения гемодинамики в большинстве случаев специфическое лечение не проводится, либо назначаются препараты, подавляющие активность эктопического очага (бета-адреноблокаторы). У больных с синкопальными или пресинкопальными состояниями проводится более "агрессивное" лечение. Оно включает антиаритмическую терапию, имплантацию автоматического кардиовертора-дефибриллятора, что является единственным методом профилактики внезапной кардиогенной смерти у данной категории пациентов.
Пациентам с ПРТ и ФП после радикальной коррекции ПДА консервативное лечение малоэффективно. В таких случаях необходимо всем пациентам проводить внутрисердечное электрофизиологическое исследование и радиочастотную аблацию.
При снижении ЧСС в дневное время менее 40/мин. и паузами более 3 секунд, необходима имплантация электрокардиостимулятора [5, 6, 12, 14, 40, 58 - 60, 109, 113 - 119, 130 - 141].
- Рекомендуется всем пациентам с ПДА и ДДА проведение трансторакальной ЭхоКГ и УЗИ плевральных полостей через 2 - 4 недели после выписки из стационара с осложненным течение до операции и в послеоперационном периоде, а также при динамическом наблюдении каждые 6 месяцев в течение 2 лет после операции. При более отдаленном динамическом наблюдении не реже 1 раза в 3 года при отсутствии осложненного течения. При осложненном течении до операции и в послеоперационном периоде контроль ЭхоКГ и УЗИ плевральных полостей проводится в зависимости от функционального класса СН каждые 3 - 12 месяцев ежегодно [109, 113 - 119, 130 - 141].
ЕОК/РКО IA, УУР C, УДД 5
Комментарий: Полученные данные позволяют своевременно провести коррекцию консервативной терапии или решить вопрос о необходимости повторной операции при наличии показаний [109, 113 - 119, 130 - 141].
- Рекомендуется пациентам с ПДА после хирургического лечения проведение прицельной рентгенографии органов грудной клетки по строгим показаниям и при проведении профилактических осмотров [5, 6, 12, 14, 40, 61 - 63].
ЕОК/РКО нет, УУР C, УДД 5
- Рекомендуется всем пациентам с ПДА в послеоперационном периоде при выявлении остаточных осложнений после коррекции порока выполнять МРТ/КТ сердца и магистральных сосудов с контрастированием [5, 6, 12, 14, 40, 72, 79, 81].
ЕОК/РКО IIa C, УУР C, УДД 5
- Рекомендуется всем пациентам с ПДА после хирургического лечения антибактериальная профилактика инфекционного эндокардита в течение 6 месяцев [134].
ЕОК/РКО нет, УУР C, УДД 5
Комментарии: При любом типе врожденного порока сердца при коррекции которого использовались синтетические материалы/протезы, при наличии показаний осуществляется профилактика бактериального эндокардита в течение 6 месяцев после операции или пожизненно, если сохраняются резидуальные шунты или регургитация на клапанах. Профилактика эндокардита проводится при выполнении стоматологических вмешательств, сопровождающихся повреждением слизистой оболочки ротовой полости (экстракция зуба, манипуляции в периапикальной зоне зуба и т.д.) [134].
- Рекомендуется пациентам, перенесшим операцию по коррекции ПДА или ДДА, выполнять вакцинацию не ранее, чем через три месяца после выписки [50, 134].
ЕОК/РКО IIaC, УУР C, УДД 5
6. Организация оказания медицинской помощи
Этапы оказания медицинской помощи:
1. Первичное звено здравоохранения;
2. Специализированная амбулаторная помощь;
3. Специализированная медицинская помощь в стационаре и/или высокотехнологичная помощь в стационаре;
4. Этап послеоперационной реабилитации, динамическое наблюдение;
5. Вид медицинской помощи: специализированная медицинская помощь, первичная медико-санитарная помощь, скорая медицинская помощь;
6. Условия оказания медицинской помощи: стационарно, амбулаторно, вне медицинской организации;
7. Форма оказания медицинской помощи: плановая, экстренная.
Показания для плановой госпитализации:
1. Наличие врожденного порока сердца (ДДА);
2. Наличие симптомов недостаточности кровообращения;
3. Наличие легочной гипертензии;
4. Наличие суправентрикулярных нарушений ритма и проводимости сердца;
5. Неясность диагноза и необходимость в специальных методах исследования (использование диагностических процедур, проведение которых невозможно или нецелесообразно в условиях поликлиники) для уточнения причины и тяжести ДДА или скорректированного ПДА;
6. Плановое хирургическое вмешательство по поводу ДДА или повторное плановое у пациентов с ПДА.
Показания для экстренной госпитализации:
1. Выявленный пренатально или постнатально перерыв дуги аорты;
2. Жизнеугрожающие осложнения после устранения ПДА или ДДА;
3. Пароксизм суправентрикулярных или желудочковых аритмий, или тяжелые нарушения проводимости сердца с синкопальными и пресинкопальными состояниями;
4. Декомпенсация хронической сердечной недостаточности.
Показания к выписке пациента из стационара:
1. Выполненная операция по поводу хирургической коррекции ПДА или ДДА с завершенным периодом послеоперационного наблюдения, курацией периоперационных осложнений;
2. Подобранная медикаментозная терапия ХСН, антиаритмическая и ЛАГ специфическая терапия при наличии показаний;
3. Компенсация явлений сердечной недостаточности.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- Пациентам с ПДА и развитием послеоперационных осложнений рекомендуется избегать избыточной физической активности до устранения возникших осложнений [109, 113 - 119, 130 - 141].
ЕОК IB (УУР C, УДД 5)
- Рекомендуется иммунизация против вируса гриппа и пневмококковой инфекции пациентам с остаточной ЛГ для предупреждения прогрессирования заболевания на фоне интеркуррентной инфекции [50, 134].
ЕОК нет (УУР C, УДД 5)
- У пациентов с инфекционным эндокардитом в анамнезе, а также с резидуальным шунтом на ДМЖП, рекомендуется профилактика инфекционного эндокардита [130 - 141].
ЕОК IA (УУР C, УДД 5)
Беременность и роды
Беременность и роды обычно хорошо переносятся [130 - 141]:
- на фоне корригированного ДДА и ПДА;
- у пациентов с сохраненной функцией ЛЖ;
- при I - II функциональных классах NYHA;
- при отсутствии значимой легочной гипертензии и значимой обструкции выводного отдела правого желудочка;
Критерии оценки качества медицинской помощи
N
Критерии качества
ЕОК
УУР
УДД
Этап постановки диагноза
1
Выполнен сбор анамнеза и жалоб пациента
нет
C
5
2
Выполнена аускультация сердца
нет
C
5
3
Выполнена электрокардиография
нет
C
5
4
Выполнена рентгенография органов грудной клетки
нет
C
5
5
Выполнена эхокардиография с применением режима цветного допплеровского картирования
I C
A
2
6
Выполнено зондирование камер сердца при наличии показаний
I C
A
2
Этап консервативного и хирургического лечения
1
Назначены диуретики при наличии симптомов сердечной недостаточности
нет
A
2
2
Выполнено хирургическое лечение по устранению ПДА или ДДА
I C
C
5
Этап послеоперационного контроля
1
Выполнена электрокардиография перед выпиской из стационара
нет
C
5
2
Выполнена эхокардиография перед выпиской из стационара
нет
C
5
Список литературы
1. Андреева Н.С., Реброва О.Ю., Зорин Н.А., др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор 2012; 4: 10 - 24.
2. Kalisch-Smith J.I., Ved N., Sparrow D.B. Environmental Risk Factors for Congenital Heart Disease. Cold Spring Harb Perspect Biol. 2020 Mar 2; 12(3): a037234. doi: 10.1101/cshperspect.a037234.
3. Kloesel B., DiNardo J.A., Body S.C. Cardiac Embryology and Molecular Mechanisms of Congenital Heart Disease: A Primer for Anesthesiologists. Anesth Analg. 2016 Sep; 123(3): 551 - 69. doi: 10.1213/ANE.0000000000001451.
4. Джонс Кеннет Л. Наследственные синдромы по Дэвиду Смиту. Атлас-справочник. Москва. Практика. 2011.
5. Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца. Москва. Медицина. 1991.
6. Бокерия Л.А., Шаталов К.В. Детская кардиохирургия. Руководство для врачей. Москва. НЦССХ им. А.Н. Бакулева. 2016.
7. Bajollea F., Zaffranb S., Bonnet D. Genetics and embryological mechanisms of congenital heart diseases  et
et  embryologiques des cardiopathies
embryologiques des cardiopathies  . Archives of Cardiovascular Disease (2009) 102, 59 - 63
. Archives of Cardiovascular Disease (2009) 102, 59 - 63
8. Bajolle F., Bonnet D. Left heart defects and genetics. Arch Mal Coeur 2006; 99: 494 - 6
9. Liu S., Joseph K.S., Lisonkova S., Rouleau J., Van den Hof M., Sauve R., Kramer M.S. Association between maternal chronic conditions and congenital heart defects: a population-based cohort study. Circulation. 2013; 128: 583 - 589.
10. Goldmuntz E., Driscoll D., Budarf M.L., et al. Microdeletions of chromosomal region 22q11 in patients with congenital conotruncal cardiac defects. J Med Genet. 1993; 30(10): 807 - 812. doi: 10.1136/jmg.30.10.807
11. Kouchoukos N.T., Blackstone E.H., Hanley F.L., Kirklin J.K. Kirklin/Barratt-Boyes cardiac surgery: morphology, diagnostic criteria, natural history, techniques, results, and indications. - 4th ed. Philadelphia: Elsevier; 2013.
12. Myung K. Park. Miscellaneous Congenital Cardiac Conditions in Pediatric Cardiology for Practitioners (Fifth Edition), 2008
13. Allen H.D., Driscoll D.J., Shaddy R.E., Feltes T.F. Moss and Adams' Heart Disease in infants, Children and Adolescences including the fetus and young adults. Seventh edition. Wolters Kluwer. 2008. V. 1. P. 730.
14. Бураковский В.И., Бокерия Л.А. Руководство по сердечно-сосудистой хирургии. Москва. Медицина 1994.
15. Bharati S., Lev M. The Pathology of Congenital Heart Disease. A personal expierence of more than 6.300 Congenitally Malformed Hearts. Volume 1. P. 658.
16. Dische M.R., Tsai M., Baltaxe H.A. Solitary interruption of the arch of the aorta. Am J Cardiol 1975; 35: 271
17. Gordon E.A., Person T., Kavarana M., Ikonomidis J.S. Interrupted aortic arch in the adult. J Card Surg. 2011; 26: 405 - 409.
18. Messner G., Reul G.J., Flamm S.D., Gregoric I.D., Opfermann U.T. Interrupted aortic arch in an adult single-stage extra-anatomic repair. Tex Heart Inst J. 2002; 29: 118 - 121.
19. Hoffman J.I., Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol 2002; 39: 1890 - 900.
20. Varghese R., Saheed S.B., Omoregbee B., Ninan B., Pavithran S., Kothandam S. Surgical repair of interrupted aortic arch and interrupted pulmonary artery. Ann Thorac Surg 2015; 100: e139 - 40.
21. Noguchi K., Hori D., Nomura Y., Tanaka H. Double aortic arch in an adult. Interact Cardiovasc Thorac Surg. 2012; 14: 900 - 902.
22. Trobo D., Bravo C., Alvarez T., ![]() R.,
R., ![]() F., De
F., De  J. Prenatal sonographic features of a double aortic arch: literature review and perinatal management. J Ultrasound Med. 2015; 34: 1921 - 1927.
J. Prenatal sonographic features of a double aortic arch: literature review and perinatal management. J Ultrasound Med. 2015; 34: 1921 - 1927.
23. Celoria G.C., Patton R.B. (1959) Congenital absence of the aortic arch. Am Heart J 58, 407 - 413
24. Oppenheimer-Dekker A., Gittenberger-de Groot A.C., Roozendaal H. (1982) The ductus arteriosus and associated cardiac anomalies in interruption of aortic arch. Pediatr Cardiol 2, 185 - 193.
25. Backer C.L. and Mavroudis С. Congenital Heart Surgery Nomenclature and Database Project: Patent Ductus Arteriosus, Coarctation of the Aorta, Interrupted Aortic. Arch Ann Thorac Surg 2000; 69: S298 - 307
26. Mostefa Kara M., Houyel L., Bonnet D. A new anatomic approach of the ventricular septal defect in the interruption of the aortic arch. J Anat. 2019 Feb; 234(2): 193 - 200. doi: 10.1111/joa.12911.
27. Backer CL,  MC, Popescu AR, Eltayeb OM, Rastatter JC, Rigsby CK. Vascular rings. Semin Pediatr Surg. 2016 Jun; 25(3): 165 - 75.
MC, Popescu AR, Eltayeb OM, Rastatter JC, Rigsby CK. Vascular rings. Semin Pediatr Surg. 2016 Jun; 25(3): 165 - 75.
28. Felson B., Palayew M.J. The two types of right aortic arch. Radiology 1963; 81: 745 - 59.
29. Backer C.L., Mavroudis C. Surgical approach to vascular rings. In: Karp RB, ed. Advances in cardiac surgery, vol. 9, St. Louis: Mosby Year-Book, 1997: 29 - 64.
30. Langlois J, Binet JP, DeBrux JL. Aortic arch anomalies. In: Fallis MC, Filler RM, Lemoine G, eds. Pediatric thoracic surgery. New York: Elsevier Science Publishing Co, 1991: 172 - 91.
31. Kocjancic L., ![]() C., Berger F., Boos V. Effect of a Dual-Strain Probiotic on Necrotizing Enterocolitis in Neonates with Ductal-Dependent Congenital Heart Disease: A Retrospective Cohort Study. Neonatology. 2020; 117(5): 569 - 576. doi: 10.1159/000508831.
C., Berger F., Boos V. Effect of a Dual-Strain Probiotic on Necrotizing Enterocolitis in Neonates with Ductal-Dependent Congenital Heart Disease: A Retrospective Cohort Study. Neonatology. 2020; 117(5): 569 - 576. doi: 10.1159/000508831.
32. Miller J.C., Velani R.N., Miller W.D., Thomas A.S., Shaw F.R., Kochilas L. Long-term Outcomes After Interrupted Aortic Arch Repair. Ann Thorac Surg. 2024 Aug; 118(2): 469 - 477. doi: 10.1016/j.athoracsur.2024.02.009.
33. Ким А.И., Черногривов А.Е., Нефедова И.Е., Есаян А.А., Шахназарян Э.А. Реконструкция дуги аорты по методике "Бакулевский мост" у новорожденных Грудная и сердечно-сосудистая хирургия. 2023. Т. 65. N 1. С. 88 - 94.
34. Ким А.И., Черногривов А.Е., Нефедова И.Е., Есаян А.А., Тагаев А.Э. Способ хирургического лечения врожденного перерыва дуги аорты у детей грудного возраста и новорожденных. Патент на изобретение RU 2784770 C1, 29.11.2022. Заявка N 2022109954 от 13.04.2022.
35. Ким А.И., Черногривов А.Е., Нефедова И.Е., Есаян А.А., Шахназарян Э.А. способ хирургического лечения врожденного перерыва дуги аорты у детей грудного возраста и новорожденных. Патент на изобретение RU 2784772 C1, 29.11.2022. Заявка N 2022112426 от 06.05.2022.
36. Alsenaidi K., Gurofsky R., Karamlou T., Williams W.G., McCrindle B.W. Management and outcomes of double aortic arch in 81 patients. Pediatrics 2006; 118: e1336 - 41.
37. Mastard W.T., Trimble A.W., Trusler G.A. Mediastinal vascular anomalies causing tracheal and esophageal compression and obstruction in childhood. Can Med Assoc J 1962; 87: 1301.
38. Grothwohl K.W., Afifi A.Y., Dillard T.A., Olson J.P., Heric B.R. Vascular rings of the thoracic aorta in adults. Am Surg 1999; 65: 1077.
39. Hickey E.J., Khan A., Anderson D., Lang-Lazdunski L. Complete vascular ring presenting in adulthood: an unusual management dilemma. J Thorac Cardiovasc Surg 2007; 134: 235 - 6.
40. Perloff Joseph K. Clinical recognition of Congenital Heart Disease. Fifth Edition. Saunders. 2003.
41. Lee W.J., Shah Y.K., Ku A., Patel N.R., Maldjian P.D. Double Aortic Arch in an Asymptomatic Adult. Cureus. 2023 Apr 11; 15(4): e37437. doi: 10.7759/cureus.37437.
42. Freedom R.M., Rosen F.S., Nadas A.S. Congenital cardiovascular disease and anomalies of the third and fourth pharyngeal pouch. Circulation. 1972 Jul; 46(1): 165 - 72. doi: 10.1161/01.cir.46.1.165.
43. Farrell M.J., Stadt H., Wallis K.T., Scambler P., Hixon R.L., Wolfe R., Leatherbury L., Kirby M.L. HIRA, a DiGeorge syndrome candidate gene, is required for cardiac outflow tract septation. Circ Res. 1999 Feb 5; 84(2): 127 - 35. doi: 10.1161/01.res.84.2.127.
44. Higgins C.B., French J.W. et al. Interruption of the aortic arch: pre-operative and postoperative clinical, hemodynamic and angiographic features. Am J Cardiol 39: 563, 1977.
45. Merril D.L., Webster C.A., Samson P.C.: Congenital absence of the aortic isthmus. J Thorac Cardiovasc Surgery 33: 311, 1957.
46. Roberts W.C., Morrow A.C., Braunwald E.: Complete interruption of the aortic arch. Circulation 26: 39, 1962.
47. Backer C.L., Mavroudis C., Rigsby C.K., Holinger L.D. Trends in vascular ring surgery. J Thorac Cardiovasc Surg. 2005 Jun; 129(6): 1339 - 47.
48. Lee M., Kumar T.K.S., Paudel G. Double aortic arch presenting as neonatal respiratory failure in the delivery room. Cardiol Young. 2018 Mar; 28(3): 476 - 478.
49. Mokoka M.C., Ullah K., Curran D.R., O'Connor T.M. Rare causes of persistent wheeze that mimic poorly controlled asthma. BMJ Case Rep. 2013 Sep 26; 2013
50. Galie N., Hoeper M.M., Humbert M., et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J. 2009. 30: 2493 - 2537.
51. Hutton R.D. The effect of iron deficiency on whole blood viscosity in polycythaemic patients. Br. J. Haematol. 1979; 43: 191 - 199.
52. Mokoka M.C., Ullah K., Curran D.R., O"Connor T.M. Rare causes of persistent wheeze that mimic poorly controlled asthma. BMJ Case Rep. 2013 Sep 26; 2013
53. Mohammadi H., Mohammadpour Ahranjani B., Aghaei Moghadam E., Kompani F., Mirbeyk M., Rezaei N. Hematological indices in pediatric patients with acyanotic congenital heart disease: a cross-sectional study of 248 patients. Egypt J Med Hum Genet. 2022; 23(1): 47. doi: 10.1186/s43042-022-00262-4.
54. Driscoll D., Allen H.D., Atkins D.L., Brenner J., Dunnigan A., Franklin W., Gutgesell H.P., Herndon P., Shaddy R.E., Taubert K.A., et al. Guidelines for evaluation and management of common congenital cardiac problems in infants, children, and adolescents. A statement for healthcare professionals from the Committee on Congenital Cardiac Defects of the Council on Cardiovascular Disease in the Young, American Heart Association. Circulation. 1994 Oct; 90(4): 2180 - 8. doi: 10.1161/01.cir.90.4.2180.
55. Румянцев А.Г., Масчан А.А. Федеральные клинические рекомендации по диагностике и лечению синдрома делеции 22-й хромосомы. Национальное общество детских гематологов, онкологов России. 2014.
56. Marilyn J. Bull, the Committee on Genetics. Health Supervision for Children With Down Syndrome. Pediatrics Aug 2011, 128 (2) 393 - 406; DOI: 10.1542/peds.2011-1605
57. Cereda A., Carey J.C. The trisomy 18 syndrome. Orphanet J Rare Dis. 2012; 7: 81. Published 2012 Oct 23. doi: 10.1186/1750-1172-7-81
58. Чазова И.Е., Мартынюк Т.В., др. Диагностика и лечение легочной гипертензии. Российские рекомендации. Кардиоваскулярная терапия и профилактика 2007; 6: Приложение 2.
59. Bonderman D., Wexberg P., Martischnig A.M., Heinzl H., Lang M.B., Sadushi R., Skoro-Sajer N., Lang I.M. A noninvasive algorithm to exclude pre-capillary pulmonary hypertension. Eur Respir J 2011; 37: 1096 - 1103.
60. Rich J.D., Thenappan T., Freed B., Patel A.R., Thisted R.A., Childers R., Archer S.L. QTc prolongation is associated with impaired right ventricular function and predicts mortality in pulmonary hypertension. Int J Cardiol 2013; 167: 669 - 676.
61. Castaneda A.R., Jonas R.A., Mayer JE Jr, Hanley F.L. Cardiac Surgery of the Neonate and Infant. Philadelphia, PA: W.B. Saunders Company; 1994.
62. Jaffe R.B. Complete interruption of aortic arch: Characteristic aortic radiographic findins in 21 patients. Circulation. 52: 714, 1975.
63. Dische M.R., Tsai M., Baltaxe H.A: Solitary interruption of the arch of the aorta. Am J Cardiol 35: 271, 1975.
64. Armstrong W.F. Ryan Th. Feigenbaum's Echocardiography, 7th Edition. 2010 Lippincott Williams & Wilkins.
65. Tworetzky W., McElhinney D.B., Brook M.M., Reddy V.M., Hanley F.L., Silverman N.H. Echocardiographic diagnosis alone for the complete repair of major congenital heart defects. J Am Coll Cardiol. 1999 Jan; 33(1): 228 - 33. doi: 10.1016/s0735-1097(98)00518-x.
66. Evans W.N., Acherman R.J., Ciccolo M.L., Lehoux J., Rothman A., Galindo A., Restrepo H. Prenatal diagnosis of hypoplastic aortic arch without intracardiac malformations: The nevada experience. J Card Surg. 2022 Nov; 37(11): 3705 - 3710. doi: 10.1111/jocs.16834.
67. Li T.G., Wu W.R., Su X.R., Wang A.L., Wang Y.F. Prenatal diagnosis of interrupted aortic arch using high-definition flow render mode and spatiotemporal image correlation. Echocardiography. 2024 May; 41(5): e15828. doi: 10.1111/echo.15828.
68. Gardiner H., Chaoui R. The fetal three-vessel and tracheal view revisited. Semin Fetal Neonatal Med. 2013 Oct; 18(5): 261 - 8. doi: 10.1016/j.siny.2013.01.007.
69. Guo Qiao, Yifan Kong, Shi Zeng, et al. Fetal double aortic arch: prenatal sonographic and postnatal computed tomography angiography features, associated abnormalities and clinical outcomes. BMC Pregnancy and Childbirth. 2020; 20: 1 - 10.
70. Woods R.K., Sharp R.J., Holcomb G.W. 3rd, et al. Vascular anomalies and tracheoesophageal compression: a single institution's 25-year experience. Ann Thorac Surg. 2001; 72: 434.
71. Bohiltea R.E., Pariza P.C., Stavarache I., Munteanu O., Dima V., Mihai B.M., Georgescu T.A., Cinteza E. Prenatal Ultrasound Diagnosis of Double Aortic Arch versus Right Aortic Arch Variant in Vascular Ring Formation - Case Report and Review of the Literature. Maedica (Bucur). 2021 Dec; 16(4): 717 - 722. doi: 10.26574/maedica.2020.16.4.717.
72. Bornaun H., ![]()
 S., Gedik
S., Gedik  Z.,
Z.,  N.F., Behram M. Prenatal Diagnosis of Double Aortic Arch: Associated Findings and Postnatal Clinical Outcomes. J Ultrasound Med. 2021 Dec; 40(12): 2721 - 2726. doi: 10.1002/jum.15669.
N.F., Behram M. Prenatal Diagnosis of Double Aortic Arch: Associated Findings and Postnatal Clinical Outcomes. J Ultrasound Med. 2021 Dec; 40(12): 2721 - 2726. doi: 10.1002/jum.15669.
73. Achiron R., Rotstein Z., Heggesh J., et al. Anomalies of the fetal aortic arch: a novel sonographic approach toin-uterodiagnosis. Ultrasound Obstet Gynecol 2002; 20: 553 - 557
74. Zidere V., Tsapakis E.G., Huggon I.C., Allan L.D. Right aortic arch in the fetus. Ultrasound Obstet Gynecol 2006; 28: 876 - 881.
75. Berg C, Bender F, Soukup M, et al. Right aortic arch detected in fetal life. Ultrasound Obstet Gynecol 2006; 28: 882 - 889.
76. Randolph G.R., Hagler D.J., Connolly H.M., Dearani J.A., Puga F.J., Danielson G.K., Abel M.D., Pankratz V.S., O'Leary P.W. Intraoperative transesophageal echocardiography during surgery for congenital heart defects. J Thorac Cardiovasc Surg. 2002 Dec; 124(6): 1176 - 82. doi: 10.1067/mtc.2002.125816.
77. Kamra K., Russell I., Miller-Hance W.C. Role of transesophageal echocardiography in the management of pediatric patients with congenital heart disease. Paediatr Anaesth. 2011 May; 21(5): 479 - 93. doi: 10.1111/j.1460-9592.2011.03570.x.
78. Backer C.L., Mavroudis C., Rigsby C.K., Holinger L.D. Trends in vascular ring surgery. J Thorac Cardiovasc Surg. 2005 Jun; 129(6): 1339 - 47. doi: 10.1016/j.jtcvs.2004.10.044.
79. Saremi F. Cardiac CT and MR for Adult Congenital Heart Disease. Springer. 2014.
80. Beerbaum P., Korperich H., Barth P. et al. Non-invasive quantification of left-to-right shunt in pediatric patients. Phasecontrast cine magnetic resonance imaging compared with invasive oximetry. Circulation 2001; 103: 2476 - 2482.
81. Johnson TR, Goldmuntz E, McDonald-McGinn DM, Zackai EH, Fogel MA. Cardiac magnetic resonance imaging for accurate diagnosis of aortic arch anomalies in patients with 22q11.2 deletion. Am J Cardiol. 2005 Dec 15; 96(12): 1726 - 30. doi: 10.1016/j.amjcard.2005.07.084.
82. Oppido G., Pace Napoleone C., Formigari R., Gabbieri D., Pacini D., Frascaroli G., Gargiulo G. Outcome of cardiac surgery in low birth weight and premature infants. Eur J Cardiothorac Surg. 2004 Jul; 26(1): 44 - 53. doi: 10.1016/j.ejcts.2004.04.004.
83. Rao P.S. Management of Congenital Heart Disease: State of the Art-Part II-Cyanotic Heart Defects. Children (Basel). 2019; 6(4): 54. Published 2019 Apr 4. doi: 10.3390/children6040054
84. Saxena A., Relan J., Agarwal R., et al. Working group on Management of Congenital Heart Disease in India. Indian Guidelines for Indications and Timing of Intervention for Common Congenital Heart Diseases: Revised and Updated Consensus Statement of the Working Group on Management of Congenital Heart Diseases. Abridged Secondary Publication. Indian Pediatr. 2020 Feb 15; 57(2): 143 - 157.
85. Neutze J.M., Starling M.B., Elliott R.B., Barratt-Boyes B.G. Palliation of cyanotic congenital heart disease in infancy with E-type prosta[1]glandins. Circulation 1977; 55: 238.
86. Waldhausen J., Whitman V., Pierce W. Coarctation in infants: man[1]agement with prostaglandin E1 and the subclavian flap procedure. Presented at the World Congress of Pediatric Cardiology (abstract). London, 1980.
87. Kaiser L.R., Kron I.L., Spray T.L. Mastery of Cardiothoracic Surgery. Third Edition. 2014 by Lippincot Williams & Wilkins, a Wolters Kluwer. business
88. Mustard W.T., Trimble A.W., Trusler G.A. Mediastinal vascular anom[1]alies causing tracheal and esophageal compression and obstruction in childhood. Can Med Assoc J 1962; 87: 1301.
89. Lemouakni S., Hassani A., Elyajouri H., Kmari M., Ourrai H., Abilkacem R., Agadr A. [Double aortic arch: about two cases]. Pan Afr Med J. 2017; 27: 273.
90. Zhu X., Wu C., He Y., Qin B., Yang H., Huang H., Ji X. 3D-Imaging evaluation of double aortic arch with MSCTA: A case report and mini-review. J Xray Sci Technol. 2018; 26(1): 103 - 109.
91. Matsumoto Y., Kamada M., Nakagawa N., Ishiguchi Y. Double vascular ring: a case report of double aortic arch and concurrent pulmonary artery sling, European Heart Journal - Case Reports, Volume 3, Issue 2, June 2019, ytz036, https://doi.org/10.1093/ehjcr/ytz036
92. Jonas R.A. Comprehensive Surgical Management of Congenital Heart Disease. 2nd Edition/Taylor and Fracnis Group. 2014.
93. Ким А.И., Черногривов А.Е., Нефедова И.Е., Донцова В.И., Шахназарян Э.А.. Врожденная патология дуги аорты в неонатальном возрасте: старые проблемы и новые вопросы. Часть I. Грудная и сердечно-сосудистая хирургия. 2023; 6 (65): 661 - 670. DOI: 10.24022/0236-2791-2023-65-6-661-670
94. Trusler G.A., Izukawa T. Interrupted aortic arch and ventricular septal defect. Direct repair through a median sternotomy incision in a 13-day-old infant. J Thorac Cardiovasc Surg. 1975 Jan; 69(1): 126 - 31.
95. Dong-Man Seo, Jiyoung Park, Hyun Woo Goo, Young Hwue Kim, Jae-Kon Ko, Won Kyoung Jhang, Surgical modification for preventing a gothic arch after aortic arch repair without the use of foreign material, Interactive CardioVascular and Thoracic Surgery, Volume 20, Issue 4, April 2015, Pages 504 - 509, https://doi.org/10.1093/icvts/ivu442
96. Karl T.R., Sano S., Brawn W., Mee R.B.J. Repair of hypoplastic or interrupted aortic arch via sternotomy. Thorac Cardiovasc Surg. 1992 Sep; 104(3): 688 - 95
97. Roussin R., Belli E., Lacour-Gayet F., Godart F., Rey C., Bruniaux J.,  C., Serraf A. Aortic arch reconstruction with pulmonary autograft patch aortoplasty. J Thorac Cardiovasc Surg. 2002 Mar; 123(3): 443 - 8; discussion 449 - 50.
C., Serraf A. Aortic arch reconstruction with pulmonary autograft patch aortoplasty. J Thorac Cardiovasc Surg. 2002 Mar; 123(3): 443 - 8; discussion 449 - 50.
98. Roussin R., Belli E., Lacour-Gayet F., Godart F., Rey C., Bruniaux J.,  C., Serraf A. Aortic arch reconstruction with pulmonary autograft patch aortoplasty. J Thorac Cardiovasc Surg. 2002 Mar; 123(3): 443 - 8; discussion 449 - 50.
C., Serraf A. Aortic arch reconstruction with pulmonary autograft patch aortoplasty. J Thorac Cardiovasc Surg. 2002 Mar; 123(3): 443 - 8; discussion 449 - 50.
99. Mitchell M.B., Campbell D.N., Toews W.H., Khan T.Z. Autograft aortic arch extension and sleeve resection for bronchial compression after interrupted aortic arch repair. Ann Thorac Surg. 2002 Jun; 73(6): 1969 - 71.
100.  E., Bouissou A., Paoli F., Roullet-Renoleau N., Duchalais A., Neville P. A new technique for interrupted aortic arch repair: the Neville tube. Ann Thorac Surg. 2010 Oct; 90(4): 1375 - 6.
E., Bouissou A., Paoli F., Roullet-Renoleau N., Duchalais A., Neville P. A new technique for interrupted aortic arch repair: the Neville tube. Ann Thorac Surg. 2010 Oct; 90(4): 1375 - 6.
101. Болсуновский В.А., Болсуновский А.В. Гомографт сердечно-сосудистой системы (варианты), способ получения гомографта, среда для воздействия на ткани гомографта (варианты). Патент RU2525197C1, заявка 2013125373/14, 28.05.2013
102. Wu S-J, Fan Y-F, Tan Y-H, Chen M-R, Sun S, Chien C-Y, et al. Staged surgical repair for infants with interrupted aortic arch. Asian Journal of Surgery. 2020.
103. Miyamoto T, Yoshii T, Inui A, Ozaki S. Staged repair for aortic arch reconstruction and intracardiac repair following bilateral pulmonary artery banding in 3 critical patients. Interact Cardiovasc Thorac Surg. 2013 Jun; 16(6): 892 - 4. doi: 10.1093/icvts/ivt073.
104. Lee M.L., Chang C.I., Huang S.C., Chen Y.S., Chiu I.S., Wu E.T., Chen C.A., Chiu S.N., Lin M.T., Wang J.K., Wu M.H. Rapid two-stage versus one-stage surgical repair of interrupted aortic arch with ventricular septal defect in neonates. J Formos Med Assoc. 2008 Nov; 107(11): 876 - 84. doi: 10.1016/S0929-6646(08)60204-1.
105. Tlaskal T., Chaloupecky V., Marek J., Kucera V., Janousek J., Skovranek J., Reich O. Primary repair of interrupted aortic arch and associated heart lesions in newborns. J Cardiovasc Surg 1997; 38: 113 - 8.
106. Mainwaring R.D., Lamberti J.J. Mid- to long-term results of the two-stage approach for type B interrupted aortic arch and ventricular septal defect. Ann Thorac Surg 1997; 64: 1782 - 6.
107. Kapravelou E., Anderson D., Morgan G.J. Hybrid Strategy for High-Risk Neonates with Interrupted Aortic Arch: A Can Well Worth Kicking? Int J Angiol. 2018 Mar; 27(1): 50 - 53. doi: 10.1055/s-0037-1602374.
108. Karimi M., Farouk A., Golden A., Gilkeson R. Hybrid palliation of interrupted aortic arch in a high-risk neonate. Ann Pediatr Cardiol. 2010; 3(01): 74 - 76.
109. Brown J.W., Ruzmetov M., Hoyer M.H., Rodefeld M.D., Turrentine M.W. Recurrent coarctation: is surgical repair of recurrent coarctation of the aorta safe and effective? Ann Thorac Surg. 2009; 88: 1923 - 1931.
110. Zoghbi J., Serraf A., Mohammadi S., et al. Is surgical intervention still indicated in recurrent aortic arch obstruction? J Thorac Cardiovasc Surg. 2004; 127: 203 - 212.
111. LaPar D.J., Baird C.W. Surgical considerations in interrupted aortic arch. Semin Cardiothorac Vasc Anesth. 2018; 22(3): 278 - 284.
112. Mery C.M., Khan M.S., Guzman-Pruneda F.A., et al. Contemporary results of surgical repair of recurrent aortic arch obstruction. Ann Thorac Surg. 2014; 98: 133 - 140.
113. Nucera M.,  M., Widenka H., Friess J.O., Siepe M., Kadner A. Hybrid Approach for Correction of Recurrent Aortic Arch Obstruction After Repair of Interrupted Aortic Arch-A Case Report. Struct Heart. 2022 Sep 14; 6(5): 100088. doi: 10.1016/j.shj.2022.100088.
M., Widenka H., Friess J.O., Siepe M., Kadner A. Hybrid Approach for Correction of Recurrent Aortic Arch Obstruction After Repair of Interrupted Aortic Arch-A Case Report. Struct Heart. 2022 Sep 14; 6(5): 100088. doi: 10.1016/j.shj.2022.100088.
114. Andrianova E.I., Naimo P.S., Fricke T.A., Robertson T., Bullock A., Brink J., d'Udekem Y., Brizard C.P., Konstantinov I.E. Outcomes of Interrupted Aortic Arch Repair in Children With Biventricular Circulation. Ann Thorac Surg. 2021 Jun; 111(6): 2050 - 2058. doi: 10.1016/j.athoracsur.2020.05.146.
115. Brown J.W., Ruzmetov M., Okada Y., Vijay P., Rodefeld M.D., Turrentine M.W. Outcomes in patients with interrupted aortic arch and associated anomalies: a 20-year experience. Eur J Cardiothorac Surg. 2006 May; 29(5): 666 - 73; discussion 673 - 4. doi: 10.1016/j.ejcts.2006.01.060.
116. Uzzaman M.M., Khan N.E., Davies B., Stickley J., Jones T.J., Brawn W.J., Barron D.J. Long-Term Outcome of Interrupted Arch Repair With Direct Anastomosis and Homograft Augmentation Patch. Ann Thorac Surg. 2018 Jun; 105(6): 1819 - 1826. doi: 10.1016/j.athoracsur.2018.01.035.
117. McCrindle B.W., Tchervenkov C.I., Konstantinov I.E., Williams W.G., Neirotti R.A., Jacobs M.L., Blackstone E.H.; Congenital Heart Surgeons Society. Risk factors associated with mortality and interventions in 472 neonates with interrupted aortic arch: a Congenital Heart Surgeons Society study. J Thorac Cardiovasc Surg. 2005 Feb; 129(2): 343 - 50. doi: 10.1016/j.jtcvs.2004.10.004.
118. Feltes T.F., Bacha E., Beekman R.H. 3rd, et al. American Heart Association Congenital Cardiac Defects Committee of the Council on Cardiovascular Disease in the Young; Council on Clinical Cardiology; Council on Cardiovascular Radiology and Intervention; American Heart Association. Indications for cardiac catheterization and intervention in pediatric cardiac disease: a scientific statement from the American Heart Association. Circulation. 2011 Jun 7; 123(22): 2607 - 52. doi: 10.1161/CIR.0b013e31821b1f10.
119. Алекян Б.Г. Рентгенэндоваскулярная хирургия. Национальное руководство в 4-х томах//Под ред. Алекяна Б.Г. Издательство "Литтерра". 2017.
120. Marino P.L. ред. А.И. Мартынов. Интенсивная терапия (перевод с англ.). ГЭОТАР Медицина. Москва. 1998
121. Buchhorn R., Hulpke-Wette M., Hilgers R., Bartmus D., Wessel A.,  J. Propranolol treatment of congestive heart failure in infants with congenital heart disease: The CHF-PRO-INFANT Trial. Congestive heart failure in infants treated with propanol. Int J Cardiol. 2001 Jul; 79(2-3): 167 - 73. doi: 10.1016/s0167-5273(01)00413-2.
J. Propranolol treatment of congestive heart failure in infants with congenital heart disease: The CHF-PRO-INFANT Trial. Congestive heart failure in infants treated with propanol. Int J Cardiol. 2001 Jul; 79(2-3): 167 - 73. doi: 10.1016/s0167-5273(01)00413-2.
122. Jain S., Vaidyanathan B. Digoxin in management of heart failure in children: Should it be continued or relegated to the history books?. Ann Pediatr Cardiol. 2009; 2(2): 149 - 152. doi: 10.4103/0974-2069.58317.
123. Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS). EurRespir J. 2015; 46(4): 903 - 75.
124. Приказ Минздрава РФ от 20 октября 2020 г. N 1134н "Об утверждении порядка медицинского обследования реципиента, проведения проб на индивидуальную совместимость, включая биологическую пробу, при трансфузии донорской крови и (или) ее компонентов"
125. Постановление Главного государственного санитарного врача РФ от 28 января 2021 г. N 4 "Об утверждении санитарных правил и норм СанПиН 3.3686-21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней".
126. Аксельрод Б.А., Балашова Е.Н., Баутин А.Е., Баховадинов Б.Б., Бирюкова Л.С., Буланов А.Ю., Быстрых О.А., Виноградова М.А., Галстян Г.М., Гапонова Т.В., Головкина Л.Л., Гороховский В.С., Еременко А.А. и др. Клиническое использование эритроцитсодержащих компонентов донорской крови. Гематология и трансфузиология. 2018; 63(4): 372 - 435.
127. Vari D, Xiao W, Behere S, Spurrier E, Tsuda T, Baffa JM. Low-dose prostaglandin E1 is safe and effective for critical congenital heart disease: is it time to revisit the dosing guidelines? Cardiol Young. 2021 Jan; 31(1): 63 - 70.
128. Yucel IK, Cevik A, Bulut MO,  R, Demir
R, Demir ![]() , Erdem A, Celebi A. Efficacy of very low-dose prostaglandin E1 in duct-dependent congenital heart disease. Cardiol Young. 2015 Jan; 25(1): 56 - 62.
, Erdem A, Celebi A. Efficacy of very low-dose prostaglandin E1 in duct-dependent congenital heart disease. Cardiol Young. 2015 Jan; 25(1): 56 - 62.
129. Khalil M, Jux C, Rueblinger L, Behrje J, Esmaeili A, Schranz D. Acute therapy of newborns with critical congenital heart disease. Transl Pediatr. 2019 Apr; 8(2): 114 - 126.
130. Share DA, Campbell DA, Birkmeyer N, Prager RL, Gurm HS, Moscucci M, Udow-Phillips M, Birkmeyer JD. How a regional collaborative of hospitals and physicians in Michigan cut costs and improved the quality of care. Health Aff (Millwood). 2011; 30: 636 - 645.
131. Национальные рекомендации по ведению детей с врожденными пороками сердца. Ред. Л.А. Бокерия. М., 2014.
132. Schranz D, Voelkel NF. "Nihilism" of chronic heart failure therapy in children and why effective therapy is withheld. Eur J Pediatr. 2016; 175: 445 - 455.
133. Licht DJ, Shera DM, Clancy RR, Wernovsky G, Montenegro LM, Nicolson SC, Zimmerman RA, Spray TL, Gaynor JW, Vossough A. Brain maturation is delayed in infants with complex congenital heart defects. J Thorac Cardiovasc Surg. 2009; 137: 536 - 537.
134. Baumgartner H., De Backer J., Babu-Narayan S.V. et al. 2020 ESC Guidelines for the management of adult congenital heart disease. The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC)//Eur Heart J, Volume 42, Issue 6, 2021, Pages 563 - 645.
135. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, ![]() M, Burri H, Butler J,
M, Burri H, Butler J,  J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022; 24(1): 4 - 131.
J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022; 24(1): 4 - 131.
136. Lai WW, Geva T, Shirali GS, Frommelt PC, Humes RA, Brook MM, et al. Guidelines and standards for performance of a pediatric echocardiogram: a report from the Task Force of the Pediatric Council of the American Society of Echocardiography. J Am Soc Echocardiogr 2006; 19: 1413 - 30.
137. Priori S.G.,  C., Mazzanti A. et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). ESC Scientific Document Group. Eur Heart J. 2015 Nov 1; 36 (41): 2793 - 2867.
C., Mazzanti A. et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). ESC Scientific Document Group. Eur Heart J. 2015 Nov 1; 36 (41): 2793 - 2867.
138. Haas N.A., Schirmer K.R. Guidelines for the Management of congenital heart diseases in Childhood and adolescence.//Cardiolodgy in the young. 2017. 27 (suppl. 3), S.1 - 105
139. Подзолков В.П., Алекян Б.Г., Кокшенев И.В., Чебан В.Н. Повторные операции после коррекции врожденных пороков сердца. М.: НЦССХ им. А.Н. Бакулева РАМН; 2013.
140. Manes A, Palazzini M, Leci E, Bacchi Reggiani ML, Branzi A, Galie N. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. Eur Heart J 2014; 35: 716 - 724.
141. Подзолков В.П., Кассирский Г.И. (ред.). Реабилитация больных после хирургического лечения врожденных пороков сердца. М.: НЦССХ им. А.Н. Бакулева; 2015.
142. Zaphiriou A, Robb S, Murray-Thomas T, Mendez G, Fox K, McDonagh T, Hardman SM, Dargie HJ, Cowie MR. The diagnostic accuracy of plasma BNP and NTproBNP in patients referred from primary care with suspected heart failure: results of the UK natriuretic peptide study. Eur J Heart Fail. 2005 Jun; 7(4): 537 - 41.
143. Fuat A, Murphy JJ, Hungin AP, Curry J, Mehrzad AA, Hetherington A, Johnston JI, Smellie WS, Duffy V, Cawley P. The diagnostic accuracy and utility of a B-type natriuretic peptide test in a community population of patients with suspected heart failure. Br J Gen Pract. 2006 May; 56(526): 327 - 33.
144. Yamamoto K, Burnett JC Jr, Bermudez EA, Jougasaki M, Bailey KR, Redfield MM. Clinical criteria and biochemical markers for the detection of systolic dysfunction. J Card Fail. 2000 Sep; 6(3): 194 - 200.
145. Svobodov A.A., Kupryashov A.A., Dobroserdova T.K., Levchenko E.G., Tumanyan M.R., Anderson A.G. A new approach to the interpretation of B-type natriuretic peptide concentration in children with congenital heart disease. Journal of Laboratory Medicine, 2023; 47(5): 225 - 232.
146. Said SM, Marey G, Knutson S, Rodgers N, Richtsfeld M, Joy B, Griselli M. Outcomes of Surgical Repair of Vascular Rings and Slings in Children: A Word for the Asymptomatic. Semin Thorac Cardiovasc Surg. 2021 Summer; 33(2): 492 - 500.
147. Ceneri NM, Desai MH, Christopher AB, Gerhard EF, Staffa SJ, Zurakowski D, Ramakrishnan K, Donofrio MT. Narrowing Down the Symptomatology of Isolated Vascular Rings in Children. Pediatr Cardiol. 2024 Feb; 45(2): 416 - 425.
148. van Son JA, Julsrud PR, Hagler DJ, Sim EK, Pairolero PC, Puga FJ, Schaff HV, Danielson GK. Surgical treatment of vascular rings: the Mayo Clinic experience. Mayo Clin Proc. 1993 Nov; 68(11): 1056 - 63.
149. Finley JP, Collins GF, de  JP, Williams RL. DiGeorge syndrome presenting as severe congenital heart disease in the newborn. Can Med Assoc J. 1977 Mar 19; 116(6): 635 - 40.
JP, Williams RL. DiGeorge syndrome presenting as severe congenital heart disease in the newborn. Can Med Assoc J. 1977 Mar 19; 116(6): 635 - 40.
150. Carotti A, Digilio MC, Piacentini G, Saffirio C, Di Donato RM, Marino B. Cardiac defects and results of cardiac surgery in 22q11.2 deletion syndrome. Dev Disabil Res Rev. 2008; 14(1): 35 - 42.
151. Goldmuntz E. DiGeorge syndrome: new insights. Clin Perinatol. 2005 Dec; 32(4): 963 - 78, ix - x.
152. O'Byrne ML, Mercer-Rosa L, Zhao H, Zhang X, Yang W, Tanel RE, Marino BS, Cassedy A, Fogel MA, Rychik J, Paridon S, Goldmuntz E. Morbidity in children and adolescents after surgical correction of interrupted aortic arch. Pediatr Cardiol. 2014 Mar; 35(3): 386 - 92.
153. Bae SB, Kang EJ, Choo KS, Lee J, Kim SH, Lim KJ, Kwon H. Aortic Arch Variants and Anomalies: Embryology, Imaging Findings, and Clinical Considerations. J Cardiovasc Imaging. 2022 Oct; 30(4): 231 - 262.
154. Soleimantabar H, Sabouri S, Khedmat L, Salajeghe S, Memari B, Heshmat Ghahderijani B. Assessment of CT angiographic findings in comparison with echocardiography findings of chest among patients with aortic arch anomalies. Monaldi Arch Chest Dis. 2019 Oct 1; 89(3).
155. Colquhoun IW, Pollock JC. Distal tracheal stenosis in two children with double aortic arch and associated tracheomalacia. Eur J Cardiothorac Surg. 1990; 4(5): 287 - 9.
156. Vasko JS, Ahn C. Surgical management of secondary tracheomalacia. Ann Thorac Surg. 1968 Sep; 6(3): 269 - 72.
157. Sebening C, Jakob H, Tochtermann U, Lange R, Vahl CF, Bodegom P, Szabo G, Fleischer F, Schmidt K, Zilow E, Springer W, Ulmer HE, Hagl S. Vascular tracheobronchial compression syndromes--experience in surgical treatment and literature review. Thorac Cardiovasc Surg. 2000 Jun; 48(3): 164 - 74.
158. Masarone D, Valente F, Rubino M, Vastarella R, Gravino R., Rea A, et al. Pediatric Heart Failure: A Practical Guide to Diagnosis and Management. Pediatr Neonatol. 2017 Aug; 58(4): 303 - 312.
159. Kantor PF, Lougheed J, Dancea A, McGillion M, Barbosa N, Chan C, et al. Presentation, diagnosis, and medical management of heart failure in children: Canadian Cardiovascular Society guidelines. Can J Cardiol. 2013 Dec; 29(12): 1535 - 52.
160. Lechner E, Moosbauer W, Pinter M, Mair R, Tulzer G. Use of levosimendan, a new inodilator, for postoperative myocardial stunning in a premature neonate. Pediatr Crit Care Med. 2007 Jan; 8(1): 61 - 3.
161. Namachivayam P, Crossland DS, Butt WW, Shekerdemian LS. Early experience with Levosimendan in children with ventricular dysfunction. Pediatr Crit Care Med. 2006 Sep; 7(5): 445 - 8.
162. Ashrafi AH, Mazwi M, Sweeney N, van Dorn CS, Armsby LB, Eghtesady P, Ringle M, Justice LB, Gray SB, Levy V. Preoperative Management of Neonates With Congenital Heart Disease. Pediatrics. 2022 Nov 1; 150 (Suppl 2): e2022056415F.
163. Gheorghiade M., Patel K., Filippatos G. et al. Effect of oral digoxin in high-risk heart failure patients: a pre-specified subgroup analysis of the DIG trial. Eur J Heart Fail. 2013; 15 (5): 551 - 559
164. Rathore S.S., Curtis J.P., Wang Y. et al. Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA. 2003; 289 (7): 871 - 878.
165. Jain S, Vaidyanathan B. Digoxin in management of heart failure in children: Should it be continued or relegated to the history books? Ann Pediatr Cardiol. 2009 Jul; 2(2): 149 - 52.
166. Nikolaus A.Haas, Karl R.Schirmer/Guidelines for the management of congenital heart diseases in childhood and adolescence/doi: 10.1017/S1047951116001955, Cambridge University press, 2017. S17 - S19
167. Klinge JM, Scharf J, Hofbeck M, Gerling S, Bonakdar S, Singer H. Intermittent administration of furosemide versus continuous infusion in the postoperative management of children following open heart surgery. Intensive Care Med. 1997 Jun; 23(6): 693 - 7.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Авраменко А.А., (Самара)
2. Алекян Б.Г., академик РАН, "Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению", (Москва)
3. Белов В.А., (Пермь)
4. Богданов В.Н., (Челябинск)
5. Бокерия Л.А., академик РАН, "Ассоциация сердечно-сосудистых хирургов России", (Москва)
6. Борисков М.В., д.м.н., (Краснодар)
7. Борисова Н.А., "Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению", (Санкт-Петербург)
8. Бродский А.Г., к.м.н., (Сургут)
9. Гаврилов Р.Ю., "Ассоциация сердечно-сосудистых хирургов России", (Волгоград)
10. Григорян А.М., к.м.н., "Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению", (Москва)
11. Гладышев И.В., (Челябинск)
12. Горбатиков К.В., д.м.н., (Тюмень)
13. Горбатых Ю.Н., д.м.н., (Новосибирск)
14. Гуляев Ю.В., (Москва)
15. Евтушенко А.В., "Российское кардиологическое общество", (Кемерово)
16. Зеленикин М.М., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Москва)
17. Иванов С.Н., д.м.н., "Российское кардиологическое общество", (Новосибирск)
18. Калашников С.В., к.м.н., (Москва)
19. Ким А.И., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Москва)
20. Ковалев И.А., д.м.н., "Ассоциация детских кардиологов России", (Москва)
21. Комиссаров М.И., (Санкт-Петербург)
22. Кривощеков Е.В., д.м.н., (Томск)
23. Крупянко С.М., д.м.н., "Ассоциация детских кардиологов России", (Москва)
24. Купряшов А.А., д.м.н., (Москва)
25. Левченко Е.Г., (Москва)
26. Лежнев А.А., (Москва)
27. Мартынюк Т.В., "Российское кардиологическое общество", (Москва)
28. Мовсесян Р.Р., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Санкт-Петербург)
29. Моисеева О.М., д.м.н., "Российское кардиологическое общество", (Санкт-Петербург)
30. Налимов К.А., (Хабаровск)
31. Никифоров А.Б., (Москва)
32. Петрушенко Д.Ю., (Казань)
33. Плотников М.В., к.м.н., (Астрахань)
34. Подоксенов А.Ю., (Москва)
35. Пурсанов М.Г., д.м.н., (Москва)
36. Свободов А.А., д.м.н., (Москва)
37. Синельников Ю.С., д.м.н., (Пермь)
38. Теплов П.В., (Красноярск)
39. Трунина И.И., д.м.н., "Ассоциация детских кардиологов России", (Москва)
40. Черногривов А.Е., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Москва)
41. Шехмаметьев Р.М., (Пермь)
42. Яковлева А.Н., (Санкт-Петербург)
Конфликт интересов отсутствует.
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врач-детский кардиолог
2. Врач-кардиолог
3. Врач-сердечно-сосудистый хирург
4. Врач-хирург
5. Врач ультразвуковой диагностики
6. Врач-педиатр
7. Врач по рентгенэндоваскулярной диагностике и лечению
В ходе разработки КР использованы международные шкалы уровня убедительности рекомендаций и уровня достоверности доказательств (Таблицы 1 и 2), а также новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы 3, 4 и 5), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций, одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций.
Таблица 1. Классы показаний согласно рекомендациям Европейского общества кардиологов (ЕОК).
Класс рекомендаций ЕОК
Определение
Предлагаемая формулировка
I
Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными
Рекомендовано/показано
II
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения
Целесообразно применять
Можно применять
IIa
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
IIb
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
III
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны /неэффективны, а в ряде случаев могут приносить вред.
Не рекомендуется применять
Таблица 2. Уровни достоверности доказательств согласно рекомендациям Европейского общества кардиологов (ЕОК).
Уровни достоверности доказательств ЕОК
A
Данные многочисленных рандомизированных клинических исследований или метаанализов
B
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
C
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
3
Исследования без последовательного контроля референсным методом, или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 4. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 5. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. Об основах охраны здоровья граждан в Российской Федерации (ФЗ N 323 от 21.11.2011)
2. Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Минздрава России N 918н от 15.11.2012)
3. "О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы" (Приказ Минздрава России N 1024н от 17 декабря 2015 г.)
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
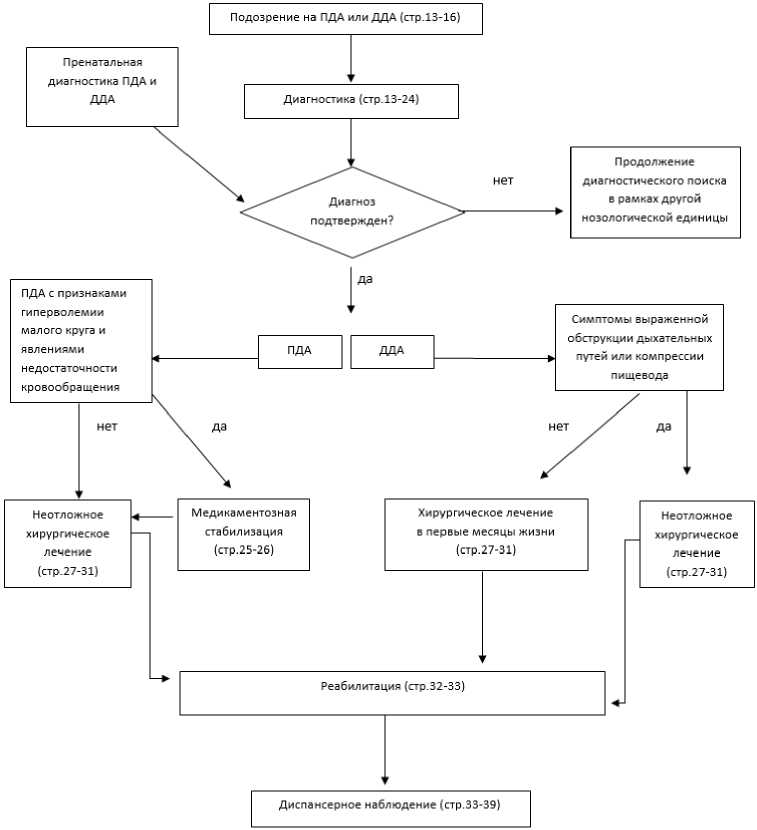
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Перерыв дуги аорты (ПДА) и двойная дуга аорты (ДДА) - врожденные пороки сердца, которые относятся к группе врожденной сосудистой патологии аорты. Пороки встречаются редко, но имеют крайне важное значение, поскольку несвоевременная диагностика, особенно при ПДА, всегда приводит к развитию тяжелых осложнений с высоким риском смерти больного. ДДА характеризуется более благоприятным прогнозом в целом, однако, при наличии выраженной обструкции анатомических структур, в особенности трахеобронхиального дерева, вызванной данным ВПС, прогноз также резко ухудшается. ПДА представляет собой фактически отсутствие, на различном протяжении, тубулярного сегмента аорты. Отсутствие функционального просвета на уровне дуги аорты приводит к потенциально тяжелейшим нарушениям гемодинамики. Нарушение кровотока по дуге аорты сопровождается прекращением кровоснабжения нижней половины туловища, если только не сохраняется функция артериального протока. Только в такой ситуации состояние больного с ПДА может расцениваться как сравнительно компенсированное. Однако, это крайне неустойчивое состояние гемодинамики, поскольку закрытие ОАП может произойти в любой момент без назначения особых лекарственных препаратов. К последним относятся простагландины Е, инфузия которых таким больным требуется постоянно вплоть до выполнения оперативного вмешательства. Очевидно, что назначение таких препаратов необходимо вовремя, и это возможно только при точно установленном диагнозе. Современные диагностические возможности позволяют заподозрить этот, как и многие другие ВПС, уже внутриутробно. Однако, несмотря на высокую разрешающую способность современной ультразвуковой аппаратуры, случаи запоздалой диагностики возможны. Все же, своевременная постановка беременных на учет, проведение обязательных, и если необходимо, экспертных пренатальных исследований плода, позволяет установить диагноз с точностью свыше 90%.
Хирургическое лечение данной патологии сегодня разработано на высоком уровне. Первичная радикальная коррекция является вмешательством выбора и сопровождается вполне приемлемыми результатами. Следует все же учитывать, что ВПС часто сочетается с сопутствующими пороками сердца и сосудов. Этот факт, а также частая необходимость использования при радикальной коррекции дополнительных материалов, создания анастомозов на самой дуге нео-аорты, обусловливает высокую частоту повторных операций в дальнейшем. Вероятность реоперации не является 100%, но с возрастом и по мере роста ребенка, возрастает. В основном, повторные операции вызваны рецидива обструкции или стеноза на аорте. При этом, если речь заходит о повторной операции, то это часто могут быть и эндоваскулярные вмешательства, которые не требуют открытого доступа и являются малотравматичными.
ДДА - это удвоение главного магистрального сосуда, аорты, как видно из его названия, что приводит к формированию полного сосудистого кольца и последующим проблемам.
В отличие от ПДА, данный порок не является ОАП-зависимым. Тем не менее, появление симптомов, вызванных наличием этого полного сосудистого кольца в грудном возрасте часто будет свидетельствовать о тяжести заболевания и неутешительном прогнозе при отсутствии своевременного лечения.
При отсутствии явной клинической картины и жалоб, оперативное лечение в таком случае будет выполняться скорее из профилактических, чем клинических соображений. Тем не менее, сам факт наличия симптомов, даже умеренных, является прогностическим признаков развития тяжелых осложнений в будущем. Только у взрослых больных, у которых данный ВПС является случайной находкой и при отсутствии каких-либо симптомов, операция может быть не показана.
В любом случае, при наличии показаний, хирургическое лечение является единственным методом и позволяет полностью устранить порок и его последствия. Операция устранения ДДА может быть как открытой, так и с использованием торакоскопических методик. При отсутствии осложнений со стороны трахео-бронхиального дерева в виде выраженной деформации, прогноз после операции обычно благоприятный.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Нет.
