"Клинические рекомендации "Макроглобулинемия Вальденстрема"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
МАКРОГЛОБУЛИНЕМИЯ ВАЛЬДЕНСТРЕМА
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C88.0
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 827
Разработчик клинической рекомендации
- Национальное гематологическое общество
- Региональная общественная организация "Общество онкогематологов"
- Ассоциация онкологов России
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
IgM - иммуноглобулин M
аутоТГСК - аутотрансплантация гемопоэтических стволовых клеток
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
ВБП - выживаемость без прогрессии
ВДП - выживаемость до прогрессии
ВДХТ - высокодозная химиотерапия
ВИЧ - вирус иммунодефицита человека
ГСК - гемопоэтические клетки
ИФТ - иммунофенотипирование методом проточной цитофлуориметрии
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
МВ - Макроглобулинемия Вальденстрема
HCV - вирус гепатита C
НХЛ - нехождкинские лимфомы
ОВ - общая выживаемость
ОХЧО - очень хороший частичный ответ
ПЗ - прогрессия заболевания
ПО - полный ответ
Ст - стабилизация заболевания
УЗИ - ультразвуковое исследование
ЧО - частичный ответ
ЭКГ - электрокардиография
Эхо-КГ - эхокардиография
Термины и определения
Макроглобулинемия Вальденстрема (МВ) - В клеточное лимфопролиферативное заболевание, характеризующееся лимфоплазмоцитарной инфильтрацией костного мозга и секрецией моноклонального IgM (PIgM)
Лимфоплазмоцитарная лимфома - это В-клеточная опухоль, образованная мелкими лимфоидными клетками, лимфоидными клетками с плазмоцитарной дифференцировкой, плазматическими клетками.
Иммунофенотипирование - метод, основанный на реакции антиген-антитело и используемый для определения специфических типов клеток в образцах крови, костного мозга, лимфатических узлов и других тканей. Иммунофенотипирование выполняют с помощью мультипараметрической проточной цитофлуориметрии (обычно, как минимум, 4- или 6-цветной).
Ремиссия - период течения заболевания, который характеризуется значительным ослаблением или полным исчезновением симптомов заболевания, в том числе по данным выполненных лабораторных и инструментальных методов исследования.
Рецидив - возврат клиники заболевания, в том числе и по данным лабораторных и инструментальных методов исследований.
Синдром гипервязкости - встречается в случаях, когда уровень патологического IgM превышает 30 г/л. Проявляется повышенной утомляемостью, слабостью, сонливостью, ухудшением зрения, шумом в ушах, кровоточивостью носа и десен.
Трансплантация аутологичных гемопоэтических стволовых клеток - трансфузия заготовленных ранее стволовых клеток самого пациента, которая выполняется после предварительной высокодозной химиотерапии.
1. Краткая информация по заболеванию или состоянию (группы
заболеваний или состояний)
1.1 Определение заболевания или состояния (группы
заболеваний или состояний)
Макроглобулинемия Вальденстрема (МВ) - В клеточное лимфопролиферативное заболевание, характеризующееся лимфоплазмоцитарной инфильтрацией костного мозга и секрецией моноклонального IgM (PIgM). В редких случаях (менее 5%) могут встречаться лимфоплазмоцитарные лимфомы с секрецией IgA, IgG или несекретирующий вариант болезни [1].
1.2 Этиология и патогенез заболевания или состояния (группы
заболеваний или состояний)
Хотя точная этиология МВ остается неясной, считается, что наиболее часто злокачественный клон МВ возникает из B-лимфоцита постгерминального центра, который столкнулся с антигенной стимуляцией, претерпел соматическую гипермутацию и трансформировался до переключения изотипа.
В литературе есть данные, определяющие роль генетической предрасположенности. В клиническом исследовании из 257 пациентов с МВ у 19% пациентов был по крайней мере один родственник первой степени родства, страдающий макроглобулинемией Вальденстрема или другим B-клеточным лимфопролиферативным заболеванием. [2, 3]
Также одним из факторов риска является хроническая антигенная стимуляция, поскольку прослеживается зависимость возникновения лимфопролиферативного заболевания у пациентов с наличием в анамнезе таких аутоиммунных заболеваний как системный склероз, синдром Шегрена, аутоиммунная гемолитическая анемия (как теплового, так и холодового типа), ревматическая полимиалгия и гигантоклеточный артериит. [2, 3]
Важнейшим фактором риска развития МВ является наличие в анамнезе IgM моноклональной гаммапатии неуточненного значения (IgM-MGUS). [2, 3]
Соматические мутации в генах, кодирующем белок MYD88 и хемокиновый рецептор типа 4 (CXCR4), были обнаружены более чем у 90% и 30 - 35% пациентов с МВ соответственно, и было показано, что они играют ключевую роль в онкогенезе при этом заболевании. [2, 3]
1.3 Эпидемиология заболевания или состояния (группы
заболеваний или состояний)
МВ составляет 2% от всех гемобластозов и 60% от всех IgM секретирующих лимфом. Средний возраст на момент установления диагноза - 71 год. Скорректированный по возрасту уровень заболеваемости составляет 0,42 на 100 000 населения в год, с возрастом заболеваемость возрастает и после 75 лет составляет уже 3,2 на 100 000 населения в год. Соотношение мужчин и женщин 3,2:1. [1]
1.4 Особенности кодирования заболевания
или состояния (группы заболеваний или состояний)
по Международной статистической классификации болезней
и проблем, связанных со здоровьем
C88.0 - макроглобулинемия Вальденстрема
1.5 Классификация заболевания или состояния (группы
заболеваний или состояний)
Нет
1.6 Клиническая картина заболевания или состояния (группы
заболеваний или состояний)
Существуют следующие формы течения заболевания:
1. Моноклональная гаммапатия неуточненного значения (PIgM-MGUS) - состояние, которое как правило предшествует болезни, развитие симптоматической формы наблюдается с частотой 2% в год. Терапия не требуется
2. Бессимптомная или тлеющая МВ, не требует специфической терапии.
3. Симптоматическая МВ - подлежит специфической терапии.
Палитра клинических проявлений при симптоматической МВ довольна разнообразна и обусловлена двумя факторами:
1. специфической инфильтрацией костного мозга (КМ) и в ряде случаев других органов.
2. наличием PIgM.
У пациентов могут быть неспецифические B-симптомы, такие как лихорадка, потеря веса, утомляемость, обильный ночной пот. Вовлечение КМ обычно вызывает анемию, которая усугубляется секрецией гепсидина лимфоплазмоцитарными клетками, нередки тромбоцитопения, лейкоцитоз с лимфоцитозом, иногда лейкопения. Примерно у 30% пациентов в дебюте заболевания бывает лимфаденопатия, спленомегалия, гепатомегалия, реже - вовлечение плевры, брюшины, почек, кожи, специфическое поражение центральной нервной системы (ЦНС) - так называемый синдром Бинга-Нила [4].
PIgM может вызывать различные состояния. Прежде всего - синдром повышенной вязкости, который возникает при значениях PIgM более 40 г/л. Это осложнение встречается у 10 - 15% пациентов. Для него характерны геморрагические осложнения - кровоточивость носа и десен, головные боли, головокружения, сердечно-сосудистые нарушения, шум в ушах, нечеткость, а иногда и потеря зрения вследствие кровоизлияний или тромбозов сосудов сетчатки. Повышение вязкости крови, затрагивающее микроциркуляцию, в том числе в ЦНС, может привести к неотложным состояниям [5].
У 10% пациентов PIgM может иметь свойства криоглобулина. Криоглобулинемия типов I и II может клинически проявляться кожными изменениями, такими как пурпура, язвы и ливедо, особенно на нижних конечностях. Наличие криоглобулинемии может усугублять проявления повышенной вязкости. У 5% пациентов может быть непосредственное отложение PIgM в коже, кишечнике, почках. У 10 - 15% больных развивается AL-амилоидоз. Он является редким и тяжелым осложнением при МВ. Наиболее часто поражаются почки, сердце, печень и периферические нервы С иммунной активностью PIgM могут быть связаны тромбоцитопения, аутоиммунная гемолитическая анемия, холодовой гемолиз. У некоторых пациентов можно наблюдать синдром Шницлера, представляющий собой хроническую аутоиммунную крапивницу и другие ревматические проявления, такие как рецидивирующая лихорадка, боль в суставах и костях. [6, 7]
Примерно у 20 - 25% пациентов с МВ развивается полинейропатия из-за сенсорной демиелинизации, связанной с парапротеином IgM (IgM-PN) [8]
МВ с признаками крупноклеточной трансформации является редким, малоизученным вариантом течения заболевания, характеризуется агрессивным клиническим течением и плохим прогнозом. Согласно данным ограниченного количества публикаций, признаки крупноклеточной трансформации наблюдаются у 2 - 10% пациентов с МВ. [9]
2. Диагностика заболевания или состояния
(группы заболеваний или состояний) медицинские показания
и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии со шкалами оценки уровня достоверности доказательств и уровня убедительности рекомендаций) по причине отсутствия посвященных им клинических исследований. Несмотря на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза МВ:
При установлении диагноза МВ должны присутствовать следующие критерии:
1. выявление моноклонального IgM в крови (независимо от уровня парапротеина);
2. инфильтрация костного мозга малыми лимфоцитами, плазмоцитоидными клетками и плазматическими клетками (диффузная, интерстициальная или нодулярная).
3. Наличие мутации L265P в гене белка MYD88 при исследовании периферической крови, костного мозга, лимфатического узла или иного опухолевого субстрата. Следует помнить, что согласно данным исследований мутация L265P в гене белка MYD88 встречается примерно у 90% пациентов с МВ. MYD88 отрицательные случаи также встречаются. Таким образом, отсутствие мутации L265P в гене белка MYD88 не отрицает диагноз МВ при наличии всех остальных лабораторных и клинических критериев заболевания. В случае секреции IgA и IgG заболевание диагностируется как лимфоплазмоцитарная лимфома.
2.1 Жалобы и анамнез
- Пациентам с подозрением на МВ, а также всем пациентам с верифицированной МВ при каждом приеме рекомендуется сбор анамнеза и жалоб для оценки состояния пациента, а также для установления факторов, которые могут оказать влияние на определение лечебной тактики пациента [2, 3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: жалобы носят неспецифический характер, обусловлены лимфоплазмоцитарной инфильтрацией органов и тканей и циркуляцией макроглобулина, приводящего к гипервязкости, криоглобулинемии, холодовой гемолитической анемии, АИГА, иммунной тромбоцитопении, амилоидозу:
- Головные боли, нечеткость или утрата зрения, эпизоды нарушения сознания
- Поражение кожи и слизистых - кровоточивость, крапивница, папулы, дерматит
- Прогрессирующее снижение чувствительности, покалывание, жжение, болезненность в стопах и кистях. Неустойчивая походка, снижение мышечной силы
- Синдром Рейно, акроцианоз, язвы на ногах
- Диарея, боли в животе
- Может определяться бессимптомное увеличение лимфоузлов любой локализации.
- Необходим сбор анамнеза (в т.ч. семейного).
2.2 Физикальное обследование
- Пациентам с подозрением на МВ или выявленной МВ при первичном или повторном приеме, при контрольных обследованиях, и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической для уточнения распространенности заболевания и оценки состояния пациента по органам и системам [2, 3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: при осмотре пациента
- измерение роста и массы тела, выполнение термометрии общей; оценку состояния кожных покровов, костно-суставной системы; выявление признаков геморрагического синдрома; наличие гепатоспленомегалии, лимфоаденопатии; наличие признаков дисфункции сердца, легких, печени, органов эндокринной системы.
- определение наличия B-симптомов.
- определение статуса по ECOG (0 - 4)
2.3 Лабораторные диагностические исследования
- Пациентам с МВ перед проведением первой линии противоопухолевой терапии рекомендуется выполнить определение соотношения белковых фракций методом электрофореза в крови и в моче и исследование моноклональности иммуноглобулинов в крови и в моче методом иммунофиксации для выявления моноклонального иммуноглобулина [2, 3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: выявление моноклонального иммуноглобулина M независимо от его величины является одним из основных диагностических критериев МВ. Кроме того, необходимо определение уровня нормальных Ig сыворотки крови [2, 3].
- Пациентам с МВ перед проведением первой линии противоопухолевой терапии рекомендуется выполнить молекулярно-генетическое исследование точечной мутации p.L265P в гене MYD88 методом ПЦР в лимфоплазмоцитарных клетках. [10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: эта мутация встречается у 90% пациентов с МВ и значительно реже при других ЛПЗ, поэтому, в совокупности с другими лабораторными и клиническими признаками МВ, она является диагностически значимой. Однако, отсутствие данной мутации не исключает диагноза МВ, при наличии иных клинических и лабораторных признаков заболевания. Мутация L265P может обнаруживаться в любом опухолевом субстрат; чаще исследуется костный мозг, реже - кровь, лимфоузел, экстранодальный субстрат.
- Пациентам с МВ перед проведением противоопухолевой терапии рекомендуется выполнить общий (клинический) анализ крови с исследованием уровня общего гемоглобина крови, уровня эритроцитов в крови, уровня тромбоцитов в крови, уровня лейкоцитов в крови, дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы), исследование уровня ретикулоцитов в крови для уточнения состояния пациента, активности заболевания и возможности проведения противоопухолевого лечения [2, 3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам с МВ перед проведением противоопухолевой терапии рекомендуется выполнить анализ крови биохимический общетерапевтический, включающий обязательное определение активности лактатдегидрогеназы, аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы в крови, определение уровня мочевой кислоты, мочевины, креатинина, общего белка, альбумина, общего билирубина, свободного билирубина, связанного билирубина в крови, исследование уровня калия, а также уровня общего и ионизированного кальция для уточнения состояния пациента, активности заболевания и возможности проведения противоопухолевого лечения [2, 3, 8, 9, 10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с МВ перед проведением противоопухолевой терапии рекомендуется выполнить общий (клинический) анализ мочи для уточнения состояния пациента, активности заболевания и возможности проведения противоопухолевого лечения. [44]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с МВ перед проведением противоопухолевой терапии рекомендуется выполнить коагулограмму (ориентировочное исследование системы гемостаза) с определением следующих параметров:, определение протромбинового (тромбопластинового) времени (АЧТВ) в крови или в плазме, определение тромбинового времени в крови, определение уровня фибриногена в крови для уточнения состояния свертывающей системы пациента и риска геморрагических осложнений [44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с МВ при диагностике и/или перед проведением противоопухолевой терапии рекомендуется выполнить определение группы крови и резус-фактора, определение антигена (HbeAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови для уточнения наличия сопутствующей патологии у пациента и возможной необходимости модификации противоопухолевой терапии или проведения сопутствующего лечения [44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с МВ при диагностике и/или перед проведением противоопухолевой терапии с целью стадирования по шкалам IPSSWM\Revised IPSSWM рекомендуется выполнить исследование уровня бета-2-микроглобулина, криоглобулинов в крови [44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с МВ при диагностике и/или перед проведением противоопухолевой терапии рекомендуется выполнить исследование вязкости крови, с целью идентификации возможного синдрома гипервязкости крови и прогнозирования возможных осложнений с ним связанных [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
2.4 Инструментальные диагностические исследования
- Пациентам с МВ при диагностике и/или перед проведением противоопухолевой терапии рекомендуется выполнить рентгенографию костей скелета или компьютерную томографию костей скелета для уточнения возможного специфического поражения. [11, 12, 13, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с МВ при диагностике и/или перед проведением противоопухолевой терапии рекомендуется выполнить компьютерную томографию органов грудной полости или прицельную рентгенографию органов грудной клетки для выявления изменений легочной ткани и органов средостения [11, 12, 13, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с МВ при диагностике и/или перед проведением противоопухолевой терапии рекомендуется выполнение компьютерной томографии органов брюшной полости или ультразвукового исследования органов брюшной полости (комплексного), ультразвукового исследования всех групп периферических, внутрибрюшных и забрюшинных лимфатических узлов, органов брюшной полости и забрюшинного пространства, определение размеров печени, селезенки и внутрибрюшных лимфатических узлов для оценки состояния органов брюшной полости и уточнения возможного специфического поражения. [11, 12, 13, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: пациентам с МВ перед началом терапии возможно выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией с туморотропными РФП с контрастированием, как метода позволяющего достоверно оценить распространенность специфического поражения, оценить дополнительные риски, конкретизировать показания для начала лечения и в ряде случаев выбрать оптимальную программу терапии.
2.5 Иные диагностические исследования
- Пациентам с МВ перед проведением при диагностике и/или противоопухолевой терапии рекомендуется выполнить получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма) для обнаружения лимфоплазмоцитарной инфильтрации [11, 12, 13, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с МВ при диагностике и/или перед проведением противоопухолевой терапии рекомендуется выполнить получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов и/или иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге (ИФТ), клеток аспирата костного мозга [11, 12, 13, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Клетки опухолевого субстрата при МВ экспресссируют PIgM как на своей поверхности (sIgM), так и внутри цитоплазмы (cIgM). Экспрессия sIgM существенно превалирует. Имеет место выраженная экспрессия таких B-клеточных антигенов: CD 19, CD 20, CD 22, CD 79а. Клетки слабо-положительны на наличие CD 10 (может отсутствовать), CD 21, CD 25, CD 38, CDс. Экспрессия CD 5, CD23 не характерна, хотя может встречаться и не является фактором, исключающим МВ.
- Пациентам с МВ при подозрении на амилоидоз с поражением кожи, желудочно-кишечного тракта, почек, костного мозга, печени рекомендуется выполнить - патолого-анатомическое исследование биопсийного материала (биоптатов) этих органов с использованием окраски Конго-красный [6].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с МВ при подозрении на амилоидоз сердца рекомендуется выполнить - исследования уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови и ЭХО-КГ для исключения амилоидоза сердца и определения сердечной функции [15].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Пациентам с МВ с подозрением на наличие синдрома гипервязкости рекомендуется выполнить прием (осмотр, консультация) врача-офтальмолога первичный для диагностики осложнений синдрома гипервязкости [5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: при подозрении на наличие синдрома гипервязкости необходим осмотр периферии глазного дна с использованием трехзеркальной линзы Гольдмана. Также это исследование нужно выполнять при уровне моноклонального IgM ![]() 30 г/л.
30 г/л.
3. Лечение, включая медикаментозную и немедикаментозную
терапии, диетотерапию, обезболивание, медицинские показания
и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинических рекомендациях, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации может определяется не только в соответствии с инструкциями по применению, с реализацией представленных в инструкции мер предосторожности, с возможной коррекцией доз и режима применения с учетом состояния пациента.
Следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
3.1 Показания к началу лечения
Стратегия лечения определяется на этапе установления диагноза. Выбор программы лечения зависит от возраста пациента, группы риска по IPSSWM\Revised IPSSWM, особенностей течения МВ, а именно - наличия цитопений, наличия экстрамедуллярного/экстранодального вовлечения, наличия/отсутствия нейропатии как симптома болезни, необходимости более быстрой редукции опухоли, сопутствующих заболеваний. Пациенты до 65 лет с высоким и промежуточным риском по IPSSWM\Revised IPSSWM представляют особую группу, которым могут быть применены комбинированнные режимы иммунохимиотерапии в сочетании с ингибиторами тирозинкиназы Брутона, а также обсуждена высокодозная консолидация с поддержкой АутоСКК в первой линии. Данный поход может применяться в рамках клинических исследований, в условиях научных центров [16].
- Рекомендуется начинать терапию при быстром нарастании уровня IgM в крови или при появлении клинических симптомов [2]:
- Рецидивирующая лихорадка, ночная потливость, потеря веса, слабость.
- Синдром гипервязкости.
- Лимфаденопатия или массивное увеличение размеров лимфоузлов (![]() 5 см).
5 см).
- Гепатомегалия и/или спленомегалия.
- Периферическая нейропатия, связанная с МВ.
- Симптомная криоглобулинемия
- Анемия с уровнем Hb ![]() 10 г/дл.
10 г/дл.
- Тромбоцитопения с уровнем тромбоцитов 100 x 109 /л и менее.
- Гемолитическая анемия (обусловленная наличием холодовых антител).
- Почечная недостаточность, связанная с МВ.
- Амилоидоз, связанный с МВ.
- Уровень моноклонального IgM > 50 г/л, даже при отсутствии симптомов.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Не рекомендуется начинать специфическую терапию пациентам с тлеющей (бессимптомной) МВ [2, 17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
3.2 Лечение пациентов с впервые диагностированной МВ
- Плазмаферез.
Симптоматическая гипервязкость редко наблюдается у пациентов с концентрацией PIgM менее 40 г/л. При наличии повышенной вязкости плазмаферез следует рассматривать как временную меру до тех пор, пока системная терапия не приведет к снижению массы опухоли и, таким образом, снижению концентрации парапротеина в сыворотке. Однократного плазмафереза часто бывает достаточно для облегчения симптомов и безопасного начала системной терапии [2, 5].
CD20 (кластеры дифференцировки 20) ингибиторы (#ритуксимаб**) [18, 19], алкилирующие средства (#бендамустин**, #циклофосфамид**), ингибиторы протеасомы (#бортезомиб** - АТХ L01XX Прочие противоопухолевые препараты) [20, 21, 22], ингибиторы тирозинкиназы Брутона (BTK) (ибрутиниб** АТХ L01XE, #занубрутиниб, #акалабрутиниб) [23, 24], являются безопасными и эффективными вариантами лечения пациентов с МВ. При терапии МВ может быть использован ингибитор BCL2 (#венетоклакс** АТХ L01XX прочие противоопухолевые препараты) [25], противоопухолевые препараты и иммуномодуляторы [26, 27]. Макроглобулинемия Вальденстрема характеризуется накоплением злокачественных иммуноглобулин М-секретирующих лимфоцитов в костном мозге и других органах. CD38 является надежным маркером плазмоцитарной дифференцировки и экспрессируется в клетках МВ. Использование CD38 (кластеры дифференцировки 38) ингибитора #даратумумаба** в сочетании с препаратами, нацеленными на B-клетки, такими как CD20 (кластеры дифференцировки 20) ингибиторы или ингибиторы тирозинкиназы Брутона (BTK) представляет несомненную клиническую пользу. [28, 29]
- #Ритуксимаб**
Монотерапия #ритуксимабом** уступает практически всем зарегистрированным комбинированным схемам [30, 31]. Частота достижения общего ответа большая при комбинированной терапии, чем при монотерапии #ритуксимабом** (73% против 44%) [31, 32].
Безусловно, #ритуксимаб** является основой лечения, однако практически всегда его следует использовать в сочетании с другими агентами, такими как ингибиторы протеасомы, алкилирующими средствами, аналогами пурина, противоопухолевыми препаратами и иммуномодуляторами, ингибиторами тирозинкиназы Брутона (ВТК) [34, 35, 36]. Монотерапию #ритуксимабом** целесообразно использовать лишь у пациентов с изолированной периферической нейропатией, связанной с активностью IgM-антимиелин-ассоциированного гликопротеина, без иных симптомов МВ [8]. Во всех остальных случаях, когда требуется уменьшение массы опухоли, используется мультиагентная терапия [35, 36].
Особенностью терапии #ритуксимабом** является транзиторное повышение уровня моноклонального IgM, которое может сопровождаться синдромом гипервязкости (так называемый феномен "вспышки" парапротеина). Перед введением #ритуксимаба** у пациентов с уровнем моноклонального IgM ![]() 50 г/л целесообразно провести сеанс плазмафереза для профилактики феномена "вспышки" парапротеина и усугубления проявлений гипервискозного синдрома [2].
50 г/л целесообразно провести сеанс плазмафереза для профилактики феномена "вспышки" парапротеина и усугубления проявлений гипервискозного синдрома [2].
В настоящее время терапевтический алгоритм сводится к следующему: схемы #ритуксимаб** + #бендамустин** (BR) или #ритуксимаб** + #циклофосфамид** + #дексаметазон** (RCD) являются основным выбором для пациентов с цитопениями, вызванными МВ, умеренной или тяжелой органомегалией или массивной лимфаденопатией [4, 30, 35]
Для пациентов с тяжелой симптоматической гипервязкостью, криоглобулинемией или холодовой агглютинемией требуется упреждающий плазмаферез перед введением препарата, особенно для пациентов с уровнем IgM в сыворотке не менее 4000 мг/дл, чтобы избежать обострения IgM. Затем предпочтительнее схема с ингибиторами протеасомы (еженедельное подкожное введение #бортезомиба**) - программа #бортезомиб** + #ритуксимаб** + #дексаметазон**) [4, 5, 38].
Схема #флударабин** + #циклофосфамид** + #ритуксимаб** (FCR) также эффективна, однако длительная терапия аналогами пурина обычно сопровождается миелосупрессией, иммуносупрессией с развитием инфекционных осложнений. Кроме того, имеются сообщения, указывающие на увеличение риска трансформации МВ в агрессивные лимфомы, и увеличение развития вторичного острого миелобластного лейкоза и миелодисплазии. Поэтому использование аналогов пурина следует ограничить, особенно у молодых пациентов, которым, возможно, потребуется сбор ауто СКК для последующей ТГСК [39].
Для пациентов с нейропатией, связанной с парапротеинами, плазмаферез также необходим, но его не следует использовать в качестве постоянного метода. Схемы RCD, CP-R, FCR или BR при нейропатии эффективны. Следует избегать комбинированных схем, содержащих нейротоксические агенты, такие как #бортезомиб** и #винкристин** [8, 32].
В 2015 г. опубликованы результаты исследовании II фазы по оценке эффективности ибрутиниба** (ингибитор тирозинкиназы Брутона (BTK)) у пациентов, получивших не менее одного варианта лечения. Ибрутиниб** назначали в суточной дозе 420 мг. Общая эффективность лечения составила 90,5%, большой ответ получен у 73% пациентов. Показатели 2-х летней ВБП и ОВ составили 69,1 и 95,2% соответственно [41]. Наилучших результатов удалось добиться у пациентов с мутацией MYD88. В настоящее время ибрутиниб** в дозе 420 мг/сутки также рекомендован к использованию в первой линии терапии у пациентов с МВ, которым невозможно проведение химиотерапии или как терапия рецидива [41].
Интенсивная полихимиотерапия с последующей трансплантацией аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) рекомендована в настоящее время международной рабочей группой по изучению ВМ как метод терапии для пациентов моложе 65 лет с непрерывно рецидивирующим или первично резистентным течением МВ. Пациентам моложе 60 лет после проведения терапии предпочтительно выполнить мобилизацию и сбор аутологичных стволовых клеток крови (ауто-СКК) для возможности выполнения высокодозной химиотерапии с поддержкой стволовыми клетками в дальнейшем. [42].
Для пациентов моложе 65 лет из группы высокого и промежуточного риска по IPSSWM\Revised IPSSWM возможно использование сочетания иммунохимиотерапии с ибрутинибом, например, ротирующей схемы R-EPOCH + ибрутиниб** / R-BAC + ибрутиниб** с последующей высокодозной консолидацией по программе CEAM +\- #Даратумумаб** с поддержкой ауто СКК у пациентов моложе 65 лет из группы высокого и промежуточного риска по IPSSWM\Revised IPSSWM. Этот протокол состоит из четырех ротирующихся курсов R-EPOCH/R-BAC в комбинации с ибрутинибом** с последующей высокодозной консолидацией по программе СEAM или #Даратумумаб** + СEAM с поддержкой ауто-ТГСК. Эффективность и безопасность данного лечебного подхода была продемонстрирована в результате реализованного в ФГБУ "НМИЦ гематологии" МЗ РФ протокола клинической апробации "Повышение эффективности индукционной терапии для пациентов с Макроглобулинемией Вальденстрема - применение ингибитора тирозинкиназы Брутона в комбинации с иммунохимиотерапией". Проанализированы результаты терапии 30 пациентов. Общий ответ на терапию составил 100%, очень хорошие частичные ответы - 71%, полный ответ - 32%. Кумулятивная частота достижения полного ответа оказалась больше у пациентов, получавших консолидирущий режим Dara-CEAM, чем у пациентов, получавших программу CEAM без #даратумумаба**, - 59% и 18% соответственно, различия оказались статистически не значимыми в силу небольшого числа пациентов в подгруппе с #даратумумабом** (p = 0,11), однако продемонстрирована тенденция большей эффективности высокодозной химиотерапии в сочетании с CD38 (кластеры дифференцировки 38) ингибитором. Особенностью метода является чередование программ R-EPOCH и R-BAC. Прием ибрутиниба** по 420 мг в сутки - с 1 по 14 дни каждого курса. После четвертого курса (второй по программе R-BAC) производится мобилизация и сбор ауто-СКК. При удавшемся сборе ауто-СКК пациенту проводится высокодозная терапия по программе CEAM либо #Даратумумаб** + CEAM c поддержкой ауто-ТГСК. При выборе режима консолидирующей терапии и принятии решения о добавлении к ней #даратумумаба** следует руководствоваться результатами проточной цитофлуориметрии. При наличии в костном мозге популяции аберрантных плазматических клеток, экспрессирующих CD38, использование комбинированной схемы #Даратумумаб** + CEAM предпочтительною. [43, 44].
Для пациентов старше 65 лет из группы высокого и промежуточного риска по IPSSWM\Revised IPSSWM возможно использование комбинированной программы, содержащей #ритуксимаб**, #бортезомиб**, #бендамустин** и #дексаметазон** - схема RBBd [44, 46]. Протокол терапии RBBd создан путем объединения двух рекомендованных стандартных программ терапии - #ритуксимаб** + #бендамустин** (RB) и #ритуксимаб** + #бортезомиб** + #дексаметазон** (RBd). На основании опыта, полученного в ФГБУ "НМИЦ гематологии" МЗ РФ, можно говорить об эффективности этой программы. При анализе результатов терапии 20 пациентов - общий ответ (ОО) - 100%, частичный ответ (ЧО) был получен у 57% пациентов, глубоких ответов, объединивших очень хороший частичный ответ (ОХЧО) и полный ответ (ПО) было 43%. Выживаемость без прогрессии в течение 36 месяцев - 100%. При сравнении с наиболее распространенными стандартными программами, такими как RB и RBd было показано преимущество программы RBBd. [44, 46].
При наличии гистологических признаков крупноклеточной трансформации возможно использование программы R-EPOCH/R-BAC в комбинации с ибрутинибом** и ингибитором BCL2 #венетоклаксом** - АТХ L01XX Прочие противоопухолевые препараты, с последующей высокодозной консолидацией с поддержкой ауто-СКК. В ФГБУ "НМИЦ гематологии" МЗ РФ проанализированы результаты терапии трех пациентов с доказанной трансформацией МВ в ДБККЛ, у всех достигнут полный ответ, при медиане наблюдения 12 месяцев после окончания терапии признаков прогрессии не было. См. приложение А3, стр. 52 [43, 46].
Лечение периферической нейропатии
Периферическая полинейропатия при МВ встречается с частотой от 10 до 20%. При сложности механизмов развития полинейропатии в качестве основного обсуждается иммунная активность моноклонального IgM, направленная против миелинассоциированного гликопротеина (MAG) и других антигенов нервной ткани. Поэтому периферическая полинейропатия при МВ рассматривается в большинстве случаев как IgM-ассоциированная.
Для лечения IgM-ассоциированной периферической полинейропатии выполняют процедуры плазмафереза.
- Рекомендуется при тяжелой периферической полинейропатии применять комбинации CP-R и RCD для более выраженного снижения парапротеина (см. приложение А3). [8, 11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Ведение пациентов с синдромом гипервязкости
- Рекомендуется у пациентов МВ при наличии синдрома гипервязкости, криоглобулинемии лечение начинать терапию с плазмафереза для быстрого снижения уровня моноклонального белка [5, 48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: обычно выполняют 2 - 3 процедуры плазмафереза для снижения уровня IgM на 30 - 60%. После сеансов плазмафереза в ближайшее время начинают специфическое лечение, так как в течение 4 - 5 недель уровень парапротеина может возвратиться к исходному уровню.
- Пациентам с впервые верифицированной МВ рекомендуются программы, включающие #ритуксимаб**. [4, 11, 32, 35, 36]
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
- Пациентам с впервые верифицированной МВ с синдромом гипервязкости рекомендуются #бортезомиб**-содержащие курсы [4, 5, 38, 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: при синдроме гипервязкости в качестве программы выбора применяются #бортезомиб**-содержащий режим RBD (#ритуксимаб**, #бортезомиб**, #дексаметазон**). см. Приложение А3
- Пациентам с впервые верифицированной МВ с синдромом гипервязкости, большими размерами л/у или селезенки, криоглобулинемией, когда необходима быстрая редукция опухоли рекомендуются программы с включением #бендамустина**, #циклофосфамида**, #бортезомиба** - (RB, RBD, RCD) [4, 11, 38]. см. приложение А3
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5). Для схемы терапии RBD Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с впервые верифицированной МВ с цитопениями (особенно с тромбоцитопенией) рекомендуется лечение по программам программы с включением #бендамустина**, #циклофосфамида**, #бортезомиба** - (RB, RBD, RCD) [4, 11, 23, 37, 38]. см. приложение А3.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4), для схемы RB Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам с впервые верифицированной МВ с генерализованными формами заболевания рекомендуется сочетание #ритуксимаба** с аналогами пуринов (#флударабин**) с #циклофосфамидом** или без него [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с впервые верифицированной МВ с низким уровнем моноклонального белка, медленно прогрессирующей болезнью, а также с сопутствующей патологией рекомендуется #ритуксимаб** в монорежиме [11, 47]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с впервые верифицированной МВ, которым не может быть назначена химиотерапия, рекомендуется ибрутиниб**в монорежиме [4, 41].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Не рекомендуется начало терапии молодых пациентов с МВ с препаратов - аналогов пуринов #флударабин**, хлорамбуцилом** [47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: данные препараты не следует использовать в качестве терапии первой линии, так как это может помешать адекватному сбору ГСК в случае принятия решения о проведении высокодозной химиотерапии с ТГСК при рецидиве заболевания в группе молодых соматически-сохранных пациентов.
- Пациентам с МВ моложе 65 лет из группы высокого и промежуточного риска по IPSSWM\Revised IPSSWM, при необходимости интенсификации лечения, может быть рекомендован комбинированный режим иммунохимиотерапии в сочетании с ибрутинибом** - ротирующая схема R-EPOCH + ибрутиниб**/R-BAC + ибрутиниб** с последующей высокодозной консолидацией по программе СEAM или #даратумумаб** + CEAM с поддержкой ауто СКК. [43, 44, 45] см. приложение А3.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: данные об эффективности этого подхода пока ограничены, однако высокая эффективность программы и отсутствие стандарта терапии молодых пациентов с факторами неблагоприятного прогноза, позволяют рекомендовать этот метод.
- Пациентам с МВ старше 65 лет из группы высокого и промежуточного риска по IPSSWM\Revised IPSSWM возможно использование комбинированной программы, содержащей #ритуксимаб**, #бортезомиб**, #бендамустин** и #дексаметазон** (схема RBBd) см. приложение А3 [44, 46]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: данные о данном подходе ограничены, однако высокая эффективность, продемонстрированная на небольшой группе пациентов, позволяет рекомендовать этот метод.
- Пациентам с МВ моложе 65 лет из группы высокого и промежуточного риска с гистологическими признаками крупноклеточной трансформации может быть рекомендован комбинированный режим иммунохимиотерапии - ротирующая схема R-EPOCH + ибрутиниб** + #венетоклакс**/R-BAC + ибрутиниб** + #венетоклакс** с последующей высокодозной консолидацией по программе CEAM или #даратумумаб** + CEAM с поддержкой ауто СКК см. приложение А3. [43, 44, 47]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: данные об эффективности этого подхода пока ограничены, однако высокая эффективность программы и отсутствие стандарта терапии молодых пациентов с признаками гистологической крупноклеточной трансформации, позволяют использовать этот метод.
3.3 Поддерживающая терапия
- Рекомендуется #ритуксимаб** по 375 мг/м2 каждые 3 месяца в течение 2 лет [49].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии: Вопрос о поддерживающей терапии #ритуксимабом** при МВ обсуждается. В отдельных центрах назначают #ритуксимаб** пациентам МВ после успешного лечения по программах с включением этого препарата по 375 мг/м2 каждые 3 месяца в течение 2 лет. В одном исследовании было показано, что назначение #ритуксимаба** в качестве поддерживающей терапии улучшает общую эффективность лечения, ВБП и ОВ. Однако при длительном лечении #ритуксимабом** отмечено увеличение инфекционных осложнений, по сравнению с группой пациентов, не получавших поддерживающей терапии. [48] Поддерживающая терапия #ритуксимабом** может быть рекомендована пациентам, у которых получен полный или очень хороший частичный ответ на индукционной #ритуксимаб**-содержащей терапии
3.4 Лечение рецидивов МВ
Пациенты с рецидивом МВ должны быть обследованы в том же объеме, что и первичные пациенты.
Выбор программы лечения рецидивов МВ зависит от эффективности предшествующей терапии, длительности ремиссии, состояния и возраста пациента, сопутствующей патологии и осложнений, сопровождавших первоначальную терапию. При поздних рецидивах, развившихся через год и более после достижения противоопухолевого ответа, возможно использование применявшихся ранее методов лечения. Для лечения ранних рецидивов МВ (при длительности ремиссии менее 1 года), а также при рефрактерном течении болезни следует использовать альтернативную программу. Эти программы должны включать лекарственные препараты других групп, могут быть использованы как в монорежиме, так и в виде комбинации препаратов.
- Пациентам с рецидивами МВ рекомендуются программы с включением #бортезомиба** - схема RBD см. приложение А3 [4, 11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: использование программ с включением #бортезомиба** при рецидивах МВ позволяет получить противоопухолевый эффект у 60% пациентов, при сочетании с #дексаметазоном** или #ритуксимабом** в 60 - 70% случаев.
- Пациентам с рецидивами МВ рекомендуются программы на основе #бендамустина** см. приложение А3 [37].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: наиболее эффективен при рецидивах и рефрактерной МВ #бендамустин** в сочетании с #ритуксимабом**. Как было показано в исследовании II фазы, противоопухолевый эффект получен у 83,3% пациентов, медиана ВБП составила 13,2 мес.
- Пациентам старше 18 лет с рецидивами МВ рекомендуется монотерапия ибрутинибом** [4, 41].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: в 2015 г. опубликованы результаты исследовании II фазы по оценке эффективности ибрутиниба** у пациентов, получивших не менее одного варианта лечения. Ибрутиниб** назначали по 420 мг в день. Общая эффективность лечения составила 90,5%, большой ответ получен у 73% пациентов. Показатели 2-х летней ВБП и ОВ составили 69,1 и 95,2% соответственно.
- Пациентам с рецидивами МВ рекомендуются программы FR (#флударабин**, #ритуксимаб**) или FCR (#флударабин**, #циклофосфамид**, #ритуксимаб**) [11, 39]. см. приложение А3.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: данные схемы терапии зарекомендовали себя как высоко эффективные программы. Результаты исследования лечения по схеме FR, используемой как у пациентов с впервые диагностированной МВ, так и ранее получавших терапию, показали общую эффективность лечения у 95% пациентов. В 86% случаев получены ПР и ЧР. При длительности наблюдения 40,1 мес. медиана ВДП составила 51,2 мес., медиана ОВ не достигнута. Учитывая частоту развития и длительность цитопений, авторы исследования предлагают использовать 4-дневное введение #флударабина** и ограничить число курсов до 4.
- Пациентам с рецидивами МВ рекомендуются программы IB (ибрутиниб**, #ритуксимаб**) см. приложение А3. [4, 42].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с рецидивами МВ рекомендуется рассмотрение варианта осуществления высокодозной химиотерапии (ВДХТ) с последующей ауто ТГСК [11, 43].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: в настоящее время проводятся исследования по оценке эффективности высокодозной химиотерапии с аутоТГСК при МВ. Обсуждается целесообразность использования этого метода лечения у молодых пациентов с множественными рецидивами или первично рефрактерной болезнью. ВДХТ при рецидивах у молодых пациентов МВ может быть использована в отдельных случаях по согласованию с трансплантационным центром.
4. Медицинская реабилитация и санаторно-курортное
лечение, медицинские показания и противопоказания
к применению методов медицинской реабилитации,
в том числе основанных на использовании
природных лечебных факторов
Специальных методов реабилитации при МВ не существует. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий. Рекомендуется вести здоровый образ жизни, исключить избыточную инсоляцию и тепловые физиопроцедуры.
5. Профилактика и диспансерное наблюдение,
медицинские показания и противопоказания к применению
методов профилактики
Методов профилактики МВ в настоящее время не существует, поскольку неизвестен этиологический фактор(ы), ведущие к развитию заболевания. Диспансерное наблюдение врачом-гематологом или врачом-онкологом осуществляется в период лечения и после окончания терапии макроглобулинемии Вальденстрема.
В процессе наблюдения определение соотношения белковых фракций методом электрофореза в крови и в моче и исследование моноклональности иммуноглобулинов в крови и в моче методом иммунофиксации для выявления моноклонального иммуноглобулина необходимо выполнять каждые 3 месяца. Цитологическое исследование мазка костного мозга (миелограмма), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов, выполняется только для подтверждения ПР, а также при рецидиве/прогрессии. Рентгенографию костей скелета или компьютерную томографию костей скелета выполняется по клиническим показаниям. Компьютерную томографию органов брюшной полости или ультразвуковое исследования органов брюшной полости (комплексное), ультразвуковое исследование всех групп периферических, внутрибрюшных и забрюшинных лимфатических узлов, органов брюшной полости (комплексное) и забрюшинного пространства, определение размеров печени, селезенки и внутрибрюшных лимфатических узлов выполняются при исходном увеличении лимфоузлов или поражении органов - для оценки эффективности лечения и по клиническим показаниям.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 08.08.2024) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "гематология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента МВ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь пациентам с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении МВ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь пациентам с МВ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с МВ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости - с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "гематология", определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания к экстренной госпитализации:
1. Развитие тяжелой инфекции (возможна госпитализация в терапевтический стационар).
2. Развитие угрожающих жизни цитопений (глубокой анемии, геморрагического синдрома, нейтропении).
3. Развитие осложнений МВ, угрожающих жизни.
4. Развитие осложнений терапии, включая синдром лизиса опухоли, тяжелые инфузионные реакции, миелотоксический агранулоцитоз с лихорадкой и другие осложнения, угрожающие жизни.
Показания к плановой госпитализации:
1. Проведение терапии в случаях, требующих круглосуточного наблюдения за пациентом по причине тяжести состояния, обусловленного опухолью, или по причине риска осложнений, связанных с программой лечения или сопутствующими заболеваниями.
2. Обследование пациента, включающее биопсию и инвазивные вмешательства, в случаях, когда оно не может быть проведено амбулаторно.
Показания к выписке пациента из медицинской организации:
1. Завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
2. Отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
3. Необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
4. Решение врачебной комиссии об отсутствии показаний к пребыванию пациента в стационаре в связи с бесперспективностью лечения и необходимостью оказания только паллиативной помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие
на исход заболевания или состояния)
7.1 Факторы прогноза
К основным факторам неблагоприятного прогноза при установлении диагноза МВ относятся: возраст старше 65 лет, уровень Hb ![]() 11,5 г/дл, уровень тромбоцитов
11,5 г/дл, уровень тромбоцитов ![]() 100 x 109/л,
100 x 109/л, ![]() -2 микроглобулин сыворотки крови > 3 мг/л, концентрация моноклонального IgM > 70 г/л. Эти признаки болезни и возраст пациентов включены в международную прогностическую систему - International prognostic scoring system for Waldenstrom's makroglobulinemia (IPSSWM). (Приложение Г2).
-2 микроглобулин сыворотки крови > 3 мг/л, концентрация моноклонального IgM > 70 г/л. Эти признаки болезни и возраст пациентов включены в международную прогностическую систему - International prognostic scoring system for Waldenstrom's makroglobulinemia (IPSSWM). (Приложение Г2).
Использование этой системы позволяет прогнозировать продолжительность жизни пациентов и ответ на терапию, но не являются определяющими при выборе тактика лечения. Пятилетняя выживаемость пациентов МВ в зависимости от количества неблагоприятных признаков составляет от 87 до 36% [50].
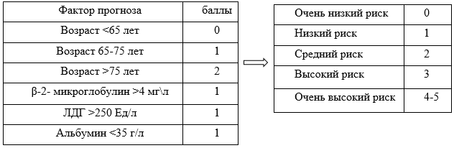
В 2020 году международная рабочая группа по изучению МВ представила Revised IPSSWM, см. приложение Г3. Согласно Revised IPSSWM пациенты разделяются на 5 прогностических групп по совокупности баллов при наличии таких критериев как возраст пациента - менее 65 лет, 65 - 75 лет, более 75 лет, - 2 микроглобулин более 4 мг\л, ЛДГ - более 250 Е\л, альбумин менее 35 г\л. Пятилетняя общая выживаемость пациентов в зависимости от прогностической группы составила 36%, 47%; 78%; 86%; 95%. [51]
Десятилетняя общая выживаемость пациентов в зависимости от прогностической группы составила 9%; 19%; 37%; 59%; 84%. [51]
7.2 Оценка эффективности лечения
Оценка эффективности лечения МВ проводится согласно международным критериям, предложенным на 6 международном рабочем совещании по МВ, по изменению уровня моноклонального IgM в сыворотке крови и моче, динамике размеров лимфоузлов и пораженных органов. При ПР необходимо выполнение стернальной пункции и трепанобиопсии подвздошной кости.
Полный ответ (ПО): нормальный уровень IgM, отсутствие моноклонального белка в сыворотке крови и моче по данным иммунофиксации; отсутствие инфильтрации костного мозга по данным гистологического исследования, отсутствие лимфоаденопатии и органомегалии (если определялись исходно) по данным КТ, отсутствие симптомов МВ. Для подтверждения ПР необходимо повторное исследование М-градиента методом иммунофиксации.
Очень хороший частичный ответ (ОХЧО): снижение уровня моноклонального IgM сыворотки крови на 90% и более и уменьшение размеров лимфоаденопатии/органомегалии (если определялись исходно), по данным физикального обследования или КТ. Отсутствие новых симптомов активной МВ.
Частичный ответ (ЧО): снижение уровня моноклонального IgM сыворотки крови на 50% и более и уменьшение размеров лимфоаденопатии/органомегалии (если определялись исходно), по данным физикального обследования или КТ. Отсутствие новых симптомов активной МВ.
Минимальный ответ: снижение уровня моноклонального IgM сыворотки крови на 25% и более, но менее 50% Отсутствие новых симптомов активной МВ.
Стабилизация (Ст): снижение менее 25% или увеличение менее 25% уровня моноклонального IgM сыворотки крови менее 25% без признаков нарастания лимфоаденопатии/органомегалии, цитопений или клинически значимых симптомов, связанных с МВ.
Прогрессия заболевания (ПЗ): увеличение уровня моноклонального IgM сыворотки крови на 25% и более при повторном исследовании или прогрессирование клинически значимых симптомов болезни (необъяснимая лихорадка 38,4 C, ночная потливость, потеря веса тела на 10% и более или синдром гипервязкости, нейропатия, симптоматическая криоглобулинемия или амилоидоз), связанные с МВ.
7.3 Профилактика, диагностика и лечение
тромботических осложнений
При гематологических заболеваниях, и при МВ в частности, как первично, так и в процессе лечения часто возникают тромботические осложнения, требующие профилактики и терапии. Частота тромботических нарушений при опухолях системы крови различна, проведение химиотерапии (ХТ) увеличивает частоту тромботических осложнений практически в 2 раза с 2.21% до 4.24% относительно исходного уровня.
Тромботические осложнения имеют гетерогенные проявления и подтверждаются различными общепринятыми лабораторными (коагулологическими, молекулярно-генетическими, биохимическими, цитологическими) и инструментальными методами.
Оценка риска, профилактика, диагностика и терапия тромботических осложнений проводится с учетом рекомендаций данных в руководстве по сопроводительной терапии при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой [53].
7.4 Диагностика и лечение инфекционных осложнений
Инфекции являются ведущими осложнениями при лечении заболеваний системы крови. У пациентов с лимфомами частота инфекционных осложнений варьирует от 10 до 30%, она выше в период индукции ремиссии, при резистентном варианте опухоли, при высокодозной химиотерапии, при сопутствующей гипогаммаглобулинемии, в период вынужденной гиподинамии и постоянного постельного режима
Диагностика и терапия инфекционных осложнений проводится с учетом рекомендаций данных в руководстве по сопроводительной терапии при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой [54].
7.5 Профилактика инфекционных осложнений у пациентов с МВ
Оценка риска и профилактика инфекционных осложнений проводится с учетом рекомендаций данных в руководстве по сопроводительной терапии при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой [54].
Критерии оценки качества медицинской помощи
N п/п
Критерии оценки качества
Оценка выполнения
1
Выполнен общий (клинический) анализ крови развернутый (при установлении диагноза, в случае, если не выполнено в амбулаторных условиях)
Да/Нет
2
Выполнен анализ крови биохимический общетерапевтический, с определением активности лактатдегидрогеназы, аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы в крови, уровня мочевой кислоты, мочевины, креатинина, общего белка, альбумина, общего билирубина, свободного билирубина, связанного билирубина, калия, общего и ионизированного кальция (при установлении диагноза, в случае, если не выполнено в амбулаторных условиях)
Да/Нет
3
Выполнена коагулограмма (ориентировочное исследование системы гемостаза) с определением следующих параметров: определение протромбинового (тромбопластинового) времени (АЧТВ) в крови или в плазме, определение тромбинового времени в крови, определение уровня фибриногена в крови (при установлении диагноза, в случае, если не выполнено в амбулаторных условиях)
Да/Нет
4
Выполнено исследование моноклональности иммуноглобулинов в крови и моче методом иммунофиксации (при установлении диагноза, после завершения терапии, при подозрении на рецидив заболевания, в случае, если не выполнено в амбулаторных условиях)
Да/Нет
5
Выполнено цитологическое исследование мазка костного мозга (миелограмма) и патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов или иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге (при установлении диагноза, после завершения терапии, при подозрении на рецидив заболевания в случае, если не выполнено в амбулаторных условиях)
6
Выполнена компьютерная томография органов брюшной полости и забрюшинного пространства или ультразвуковое исследование (периферических, внутрибрюшных и забрюшинных лимфатических узлов) (при установлении диагноза, при подозрении на рецидив заболевания, в случае, если не выполнено в амбулаторных условиях)
Да/Нет
7
Выполнено ультразвуковое исследование (периферических, внутрибрюшных и забрюшинных лимфатических узлов) (при установлении диагноза, в случае, если не выполнено в амбулаторных условиях)
Да/Нет
8
Проведено противоопухолевое лечение (при показаниях)
Да/Нет
Список литературы
1. Nelson S, Boise LH, Kaufman JL et al. Changing epidemiology and improved survival in patients with Waldenstrom macroglobulinemia: review of surveillance, epidemiology, and end results (SEER). Blood 2013; 122(21): 3135.
2. Kapoor P, Paludo J, Vallumsetla N, Greipp PR. Waldenstr m macroglobulinemia: What a hematologist needs to know. Blood Rev 2015; 29(5): 301 - 319.
3. Yun S, Johnson AC, Okolo ON et al. Waldenstr m macroglobulinemia: review of pathogenesis and management. Clin Lymphoma Myeloma Leuk. 2017; 17(5): 252 - 262.
4. Gertz MA. Waldenstr m macroglobulinemia: 2023 update on diagnosis, risk stratification, and management. Am J Hematol 2023; 98(2): 348 - 358.
5. Gustine JN, Meid K, Dubeau T et al. Serum IgM level as predictor of symptomatic hyperviscosity in patients with Waldenstr m macroglobulinaemia. Br J Haematol 2017; 177(5): 717 - 725.
6. Lu R, Richards T. A Focus on Waldenstr m macroglobulinemia and AL amyloidosis. J Adv Pract Oncol 2022; 13 (Suppl 4): 45 - 56.
7. Bockorny B, Atienza JA, Dasanu CA. Autoimmune manifestations in patients with Waldenstr m macroglobulinemia. Clin Lymphoma Myeloma Leuk 2014; 14(6): 456 - 459.
8. Norioka N, Kurita N, Kamura Y et al. Waldenstr m macroglobulinemia complicated by peripheral neuropathy due to neural infiltration. Rinsho Ketsueki 2023; 64(1): 18 - 22.
9. Durot E, Tomowiak C, Michallet AS et al. Transformed Waldenstr m macroglobulinaemia: clinical presentation and outcome. A multi - institutional retrospective study of 77 cases from the French Innovative Leukemia Organization (FILO). Br J Haematol 2017; 179(3): 439 - 448.
10. Treon SP, Cao Y, Xu L et al. Somatic mutations in MYD88 and CXCR4 are determinants of clinical presentation and overall survival in Waldenstr m macroglobulinemia. Blood 2014; 123(18): 2791 - 2796.
11. Kumar S.K. et al. Waldenstro m Macroglobulinemia/Lymphoplasmacytic Lymphoma. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines(R)). 2020.
12. Балакирева Т.В., Андреева Н.Е. Макроглобулинемия Вальденстрема//Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2009. Vol. 2, N 2. P. 121 - 136.
13. Kastritis E. et al. Waldenstr m's macroglobulinaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow - up//Ann. Oncol. 2018. Vol. 29, N Supp. 4. P. iv41 - iv50.
14. Демина Е.А. et al. Общие принципы диагностики лимфом//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 9 - 27.
15. Palladini G. et al. Serum N - terminal pro - brain natriuretic peptide is a sensitive marker of myocardial dysfunction in AL amyloidosis//Circulation. Lippincott Williams and Wilkins, 2003. Vol. 107, N 19. P. 2440 - 2445.
16. Грачев А.Е., Грибанова Е.О., Рыжко В.В., Гальцева И.В., Капранов Н.М., Накастоев И.М., Бальжанова Я.Б., Королева Д.А., Шухов О.А., Звонков Е.Е. Первичная интенсификация терапии Макроглобулинемии Вальденстрема высокого риска.; Гематология и трансфузиология. 2022. Т. 67. N s2. С. 188 - 189.
17. Kyle R.A. et al. Prognostic markers and criteria to initiate therapy in Waldenstrom's macroglobulinemia: Consensus panel recommendations from the Second International Workshop on Waldenstrom's Macroglobulinemia//Seminars in Oncology. W.B. Saunders, 2003. Vol. 30, N 2. P. 116 - 120.
18. Buske C. Ofatumumab: another way to target CD20 in Waldenstrom"s macroglobulinaemia?. Lancet Haematol. 2017 Jan; 4(1): e4 - e5. doi: 10.1016/S2352 - 3026(16) 30163 - 6. Epub 2016 Dec 1. PMID: 27914970.
19. Gavriatopoulou M, Kastritis E, Kyrtsonis MC, Vassilakopoulos TP, Roussou M, Fotiou D, Migkou M, Mpakiri M, Tasidou A, Terpos E, Dimopoulos MA.Leuk. Phase 2 study of ofatumumab, fludarabine and cyclophosphamide in relapsed/refractory Waldenstrom"s macroglobulinemia. Lymphoma. 2017 Jun; 58(6): 1506 - 1508. doi: 10.1080/10428194.2016.1233541. Epub 2016 Oct 10. PMID: 27724158.
20. Chaudhry M, Steiner R, Claussen C, Patel K, Lee H, Weber D, Thomas S, Feng C, Amini B, Orlowski R, Feng L, Manasanch EE. Carfilzomib - based combination regimens are highly effective frontline therapies for multiple myeloma and Waldenstrom"s macroglobulinemia. Leuk Lymphoma. 2019 Apr; 60(4): 964 - 970. doi: 10.1080/10428194.2018.1508668. Epub 2018 Sep 19. PMID: 30227761.
21. Vesole DH, Richter J, Biran N, McBride L, Anand P, Huang M, Kumeli AZ, Klippel Z, Iskander K, Siegel DS. Carfilzomib as salvage therapy in Waldenstrom macroglobulinemia: a case series. Leuk Lymphoma. 2018 Jan; 59(1): 259 - 261. doi: 10.1080/10428194.2017.1321749. Epub 2017 Jun 5. PMID: 28583038.
22. Castillo JJ, Meid K, Flynn CA, Chen J, Demos MG, Guerrera ML, Kofides A, Liu X, Munshi M, Tsakmaklis N, Patterson CJ, Yang G, Hunter Z, Treon SP. Ixazomib, dexamethasone, and rituximab in treatment - naive patients with Waldenstrom macroglobulinemia: long - term follow - up..Blood Adv. 2020 Aug 25; 4(16): 3952 - 3959. doi: 10.1182/bloodadvances.2020001963. PMID: 32822482.
23. Owen RG, McCarthy H, Rule S, D"Sa S, et al. Acalabrutinib monotherapy in patients with Waldenstrom macroglobulinemia: a single - arm, multicentre, phase 2 study. Haematol. 2020 Feb; 7(2): e112 - e121. doi: 10.1016/S2352 - 3026(19) 30210 - 8. Epub 2019 Dec 19. PMID: 31866281.
24. Sarosiek S, Sermer D, Branagan AR, Treon SP, Castillo JJ. Zanubrutinib for the treatment of adults with Waldenstrom macroglobulinemia. Expert Rev Anticancer Ther. 2022 May; 22(5): 471 - 478. doi: 10.1080/14737140.2022.2064849. Epub 2022 Apr 22. PMID: 35404729.
25. Castillo JJ, Allan JN, Siddiqi T, Advani RH et al. Venetoclax in Previously Treated Waldenstrom Macroglobulinemia. J Clin Oncol. 2022 Jan 1; 40(1): 63 - 71. doi: 10.1200/JCO.21.01194. Epub 2021 Nov 18. PMID: 34793256.
26. Fouquet G, Guidez S, Petillon MO, Louni C, Ohyba B, Dib M, et al. Lenalidomide is safe and active in Waldenstrom macroglobulinemia.. J Hematol. 2015 Nov; 90(11): 1055 - 9. doi: 10.1002/ajh.24175. Epub 2015 Oct 6. PMID: 26284823.
27. Bertrand E, Jouy N, Manier S, Fouquet G, Guidez S, Boyle E, Noel S, Tomowiak C, Herbaux C, Schraen S, Preudhomme C, Quesnel B, Poulain S, Leleu X. Role of IRF4 in resistance to immunomodulatory (IMid) compounds() in Waldenstrom"s macroglobulinemia. Oncotarget. 2017 Dec 4; 8(68): 112917 - 112927. doi: 10.18632/oncotarget.22872. eCollection 2017 Dec 22. PMID: 29348877.
28. Paulus A, Manna A, Akhtar S, Paulus SM, at al. Targeting CD38 with daratumumab is lethal to Waldenstrom macroglobulinaemia cells.. J Haematol. 2018 Oct; 183(2): 196 - 211. doi: 10.1111/bjh.15515. Epub 2018 Aug 6. PMID: 30080238.
29. Castillo JJ, Libby EN, Ansell SM, Palomba ML, Meid K, Flynn CA, Leventoff C, Hergott CB, Sewastianik T, Morgan EA, Carrasco R, Fromm JR, Yang G, Hunter Z, Treon SP. Multicenter phase 2 study of daratumumab monotherapy in patients with previously treated Waldenstrom macroglobulinemia. Blood Adv. 2020 Oct 27; 4(20): 5089 - 5092. doi: 10.1182/bloodadvances.2020003087. PMID: 3308575.
30. Advani P, Paulus A, Ailawadhi S. Updates in prognostication and treatment of Waldenstr m"s macroglobulinemia. Hematol Oncol Stem Cell Ther 2019; 12(4): 179 - 188.
31. Dimopoulos M.A. et al. Predictive factors for response to rituximab in Waldenstrom's macroglobulinemia.//Clin. Lymphoma. 2005. Vol. 5, N 4. P. 270 - 272.
32. Dimopoulos M.A. et al. Primary treatment of Waldenstr m macroglobulinemia with dexamethasone, rituximab, and cyclophosphamide//J. Clin. Oncol. 2007. Vol. 25, N 22. P. 3344 - 3349.
33. Buske C. et al. The addition of rituximab to front - line therapy with CHOP (R - CHOP) results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: Results of a randomized trial of the German Low - Grade Lymphoma Study Group (GLSG)//Leukemia. Nature Publishing Group, 2009. Vol. 23, N 1. P. 153 - 161.
34. Paludo J. et al. Bendamustine and rituximab (BR) versus dexamethasone, rituximab, and cyclophosphamide (DRC) in patients with Waldenstr m macroglobulinemia//Ann. Hematol. Springer Verlag, 2018. Vol. 97, N 8. P. 1417 - 1425.
35. Yan - Hua Zheng, Li Xu, Chun Cao, Juan Feng, Hai - Long Tang, Mi - Mi Shu, Guang - Xun Gao, and Xie - Qun Chen Rituximab - based combination therapy in patients with Waldenstr m macroglobulinemia: a systematic review and meta - analysis. Onco Targets Ther. 2019; 12: 2751 - 2766.
36. Leukothea Ioakimidis, Christopher J. Patterson et al. Comparative outcomes following CP - R, CVP - R, and CHOP - R in Waldenstrom macroglobulinemia. Clin Lymphoma Myeloma. 2009 Mar; 9(1): 62 - 6. doi: 10.3816/CLM.2009.n.016.
37. Treon S.P. et al. Bendamustine therapy in patients with relapsed or refractory Waldenstr m's macroglobulinemia//Clinical Lymphoma, Myeloma and Leukemia. 2011. Vol. 11, N 1. P. 133 - 135.
38. Treon S.P. et al. Primary therapy of Waldenstr m macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05 - 180//J. Clin. Oncol. 2009. Vol. 27, N 23. P. 3830 - 3835.
39. Tedeschi A, Benevolo G, Varettoni M et al. Fludarabine plus cyclophosphamide and rituximab in waldenstrom macroglobulinemia: An effective but myelosuppressive regimen to be offered to patients with advanced disease. Cancer 2012; 118(2): 434 - 443.
40. Kyle R.A. et al. Waldenstrom's macroglobulinaemia: A prospective study comparing daily intermittent oral chlorambucil//Br. J. Haematol. 2000. Vol. 108, N 4. P. 737 - 742.
41. Treon S.P. et al. Ibrutinib monotherapy in symptomatic, treatment - na ve patients with waldenstr m macroglobulinemia//J. Clin. Oncol. American Society of Clinical Oncology, 2018. Vol. 36, N 27. P. 2755 - 2761.
42. Migkou M, Fotiou D, Gavriatopoulou M, Dimopoulos MA. Ibrutinib plus rituximab for the treatment of adult patients with Waldenstrom"s macroglobulinemia: a safety evaluation. Expert Opin Drug Saf. 2021 Sep; 20(9): 987 - 995. doi: 10.1080/14740338.2021.1945031. Epub 2021 Aug 11. PMID: 34137347.
43. Kyriakou C, Canals C, Sibon D, Cahn JY, Kazmi M, Arcese W, Kolbe K, Gorin NC, Thomson K, Milpied N, Niederwieser D, Indr k K, Corradini P, Sureda A, Schmitz N. High - dose therapy and autologous stem - cell transplantation in Waldenstrom macroglobulinemia: the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol. 2010 May 1; 28(13): 2227 - 32. doi: 10.1200/JCO.2009.24.4905. Epub 2010 Apr 5. PMID: 20368570.
44. Алгоритмы диагнтстики и протоколы лечения заболеваний системы крови под редакцией Е.Н. Паровичниковой 2024 года, том - 2, стр 174 - 203.
45. Грачев А.Е., Грибанова Е.О., Рыжко В.В., Гальцева И.В., Капранов, Цой Ю.А, Королева Д.А., Звонков Е.Е.; Терапия Макроглобулинемии Вальденстрема у пациентов моложе 65 лет с факторами неблагоприятного прогноза. Гематология и трансфузиология. Приложение 69.2.2024. С. 32.
46. Грачев А.Е., Грибанова Е.О., Рыжко В.В., Гальцева И.В., Капранов, Цой Ю.А, Королева Д.А., Звонков Е.Е. Интенсификация терапии макроглобулинемии Вальденстрема выского риска для пациентов старше 65 лет. Гематология и трансфузиология. Приложение 69.2.2024. С. 201.
47. Грачев А.Е., Грибанова Е.О., Рыжко В.В., Гальцева И.В., Капранов, Цой Ю.А, Королева Д.А., Звонков Е.Е. Трансформация Макроглобулинемии Вальденстрема в ДБККЛ - новый взгляд на терапию. Гематология и трансфузиология. Приложение 69.2.2024. С. 202.
48. Treon S.P. How I treat Waldenstr m macroglobulinemia//Blood. 2009. Vol. 114, N 12. P. 2375 - 2385.
49. Treon S.P. et al. Maintenance Rituximab is associated with improved clinical outcome in rituximab na ve patients with Waldenstrom Macroglobulinaemia who respond to a rituximab - containing regimen//Br. J. Haematol. 2011. Vol. 154, N 3. P. 357 - 362.
50. Morel P, Duhamel A, Gobbi P et al. International prognostic scoring system for Waldenstr m macroglobulinemia. Blood 2009; 113(18): 4163 - 4170.
51. Kastritis E, Morel P, Duhamel A, DimopoulosMA. et al. A revised international prognostic score system for Waldenstrom"s macroglobulinemia. Leukemia. 2019 Nov; 33(11): 2654 - 2661. doi: 10.1038/s41375 - 019 - 0431 - y. Epub 2019 May 22.
52. Kim SJ, Kim K, Kim BS, Lee HJ et all. Bortezomib and the increased incidence of herpes zoster in patients with multiple myeloma.Korean Multiple Myeloma Working Party.Clin Lymphoma Myeloma. 2008 Aug; 8(4): 237 - 40. doi: 10.3816/CLM.2008.n.031. PMID: 18765311.
53. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Глава 11 - профилактика, диагностика и лечение тромботических осложнений при гематологических заболеваниях. стр. 173 - 199.
54. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Часть II - профилактика, диагностика и лечение инфекционных осложнений у пациентов с гематологическими заболеваниями, главы 3 - 7 стр. 59 - 135.
55. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Часть V, глава 20 - сопроводительная терапия при введении моноклональных антител у пациентов с гематологическими заболеваниями стр. 317 - 339.
56. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Часть I, глава 1 - профилактика и лечение тошноты и рвоты у пациентов с гематологическими заболеваниями стр. 23 - 35.
57. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Часть V, глава 21 - особенности сопроводительной терапии при назначении глюкокортикоидов пациентам с гематологическими заболеваниями стр. 339 - 361.
58. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Часть VI, глава 30 - инфузионная терапия у пациентов с гематологическими заболеваниями, стр. 495 - 501.
59. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Часть VI, глава 24 - трансфузии донорской крови и (или) ее компонентов у взрослых пациентов с гематологическими заболеваниями, стр. 387 - 407.
60. Сопроводительная терапия при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна. 2024 г. Часть VII, глава 29 - алгоритм обеспечения сосудистого доступа в гематологии стр. 487 - 495.
61. Shaji K Kumar. Waldenstr m Macroglobulinemia/Lymphoplasmacytic Lymphoma, Version 2.2024, NCCN Clinical Practice Guidelines in Oncology, PMID: 38244272 DOI: 10.6004/jnccn.2024.0001.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Паровичникова Елена Николаевна - д.м.н., генеральный директор ФГБУ "НМИЦ гематологии" Минздрава России, председатель ассоциации содействия развитию гематологии и трансплантации костного мозга "Национальное гематологическое общество", главный внештатный специалист гематолог Минздрава России.
2. Поддубная Ирина Владимировна - академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов.
3. Менделеева Лариса Павловна - доктор медицинских наук, заместитель генерального директора ФГБУ ГНЦ МЗ РФ по научной работе и инновациям, член Национального гематологического общества, член Российского профессионального общества онкогематологов.
4. Звонков Евгений Евгеньевич - д.м.н., руководитель отдела лимфопролиферативных заболеваний, заведующий отделением гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ "НМИЦ гематологии" Минздрава России, член Ассоциации содействия развитию гематологии и трансплантации костного мозга "Национальное гематологическое общество".
5. Грачев Александр Евгеньевич - к.м.н. врач - гематолог отделения химиотерапии гематологических заболеваний ФГБУ "НМИЦ гематологии" Минздрава России.
6. Аль Ради Любовь Саттаровна - к.м.н. С.Н.С. отделения диагностики и лечения гематологических заболеваний ФГБУ "НМИЦ гематологии" Минздрава России.
7. Вотякова Ольга Михайловна - кандидат медицинских наук, старший научный сотрудник ФГБУ РОНЦ МЗ РФ, член Российского профессионального общества онкогематологов.
8. Стадник Елена Александровна - к.м.н., доцент кафедры факультетской терапии ФГБОУ ВО "ПСПбГМУ им. И.П. Павлова" Минздрава России, старший научный сотрудник ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России, член Российского общества онкогематологов.
9. Фалалеева Наталья Александровна - д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов.
10. Стефанов Дмитрий Николаевич - научный сотрудник, зав. научно-организационным отделом, ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член Российского общества онкогематологов.
11. Мякова Наталья Валерьевна - д.м.н., профессор, Заместитель главного врача по лечебной работе, зав. отделением онкогематологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член Национального общества детских гематологов и онкологов.
12. Невольских Алексей Алексеевич - д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
13. Иванов Сергей Анатольевич - профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
14. Хайлова Жанна Владимировна - кандидат медицинских наук, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
15. Геворкян Тигран Гагикович - заместитель директора НИИ КЭР ФГБУ "НМИЦ онкологии им. Н.Н. Блохина".
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гематологи
2. Врачи-онкологи
3. Врачи-детские гематологи-онкологи
4. Студенты медицинских ВУЗов
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0.3, поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- Обзоры опубликованных мета-анализов;
- Систематические обзоры с таблицами доказательств.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
РЕЖИМЫ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ МВ
Монотерапия #ритуксимабом** [31, 36]
#Ритуксимаб** - 375 мг/м2 в/в кап, 1 р/нед в течение 4 недель.
Курс повторяют через 12 недель
RBD [38]
#Ритуксимаб** - 375 мг/м2 в/в, день 1
#Бортезомиб** - 1,3 мг/м2 п/к, дни 1, 4, 8, 11
#Дексаметазон** - 40 мг в/в, дни 1, 4, 8, 11
Лечение возобновляется на 22-й день. Проводится 4 - 6 курсов
RB [34]
#Ритуксимаб** - 375 мг/м2 в/в, день 0
#Бендамустин** - 90 мг /м2 в\в в дни 1 и 2
Лечение возобновляется на 28-й день, проводится 4 - 6 курсов.
RBВd [44, 46]
#Бортезомиб** - 1,3 мг/м2 п/к, дни 1, 4, 8, 11
#Бендамустин** - 90 мг /м2 в\в в дни 1 и 2
#Дексаметазон** - 20 мг в/в или внутрь в дни 1, 4, 8, 11
#Ритуксимаб** - 375 мг/м2 в/в, день 1
Лечение возобновляется на 18 - 21-й день (перерыв между курсами 7 - 10 дней), проводится 4 - 6 курсов.
R-EPOCH + ибрутиниб**/R-BAC + ибрутиниб** (ротирующие курсы) [44, 45]
R-EPOCH + ибрутиниб**
- #Ритуксимаб** - 375 мг/м2 в/в, день - 0
- #Винкристин** 0.4 мг/м2/сут в/в дни 1 - 4 (непрерывная 96 часовая инфузия)
- #Циклофосфамид** 750 мг/м2/сут в/в, в 5-й день
- #Преднизолон** 60 мг/м2/сут в/в в дни 1 - 5
- Ибрутиниб** 420 мг\сут внутрь ежедневно с 0 по 14 дни
На 22 - й день начинается курс R-BAC + ибрутиниб**
- #Ритуксимаб** - 375 мг/м2 в/в, день - 0
- #Бендамустин** - 90 мг /м2 в\в в дни 1 и 2
- #Цитарабин** 500 мг/м2 в\в в дни 1, 2, 3
- Ибрутиниб** 420 мг\сут внутрь ежедневно с 0 по 14 дни
На 29-й день снова начинается курс R-EPOCH + #ибрутиниб**, после которого на 22-й день проводится R-BAC + #ибрутиниб**.
R-EPOCH + ибрутиниб** + #венетоклакс**/R-BAC + ибрутиниб**+ #венетоклакс** (ротирующие курсы) [44, 47]
R-EPOCH + ибрутиниб**+ #венетоклакс**
- #Ритуксимаб** - 375 мг/м2 в/в, день - 0
- #Винкристин** 0.4 мг/м2/сут в/в дни 1 - 4 (непрерывная 96 часовая инфузия)
- #Циклофосфамид** 750 мг/м2/сут в/в, в 5-й день
- #Преднизолон** 60 мг/м2/сут в/в в дни 1 - 5
- Ибрутиниб** 420 мг\сут внутрь ежедневно с 0 по 14 дни
- #Венетоклакс** 400 мг\сут внутрь ежедневно с 0 по 14 дни
На 22-й день начинается курс R-BAC + ибрутиниб** + #венетоклакс**
- #Ритуксимаб** - 375 мг/м2 в/в, день - 0
- #Бендамустин** - 90 мг/м2 в\в в дни 1 и 2
- #Цитарабин** 500 мг/м2 в\в в дни 1, 2, 3
- Ибрутиниб** 420 мг\сут внутрь ежедневно с 0 по 14 дни
- #Венетоклакс** 400 мг\сут внутрь ежедневно с 0 по 14 дни
На 29-й день снова начинается курс R-EPOCH + ибрутиниб** #венетоклакс**, после которого на 22-й день проводится R-BAC + ибрутиниб**+ #венетоклакс**.
Всего проводится 4 курса иммунохимиотерапии по ротирующей схеме R-EPOCH +ибрутиниб** + #венетоклакс/R-BAC+ибрутиниб** + #венетоклакс**
RCD [32, 34]
#Ритуксимаб** - 375 мг/м2 в/в, день 1
Циклофосфамид** - 100 мг/м2 внутрь 2 р/день, дни 1 - 5
#Дексаметазон** - 20 мг в/в, день 1
Лечение возобновляется на 22-й день. Проводят 6 курсов
CP-R [36]
#Ритуксимаб** - 375 мг/м2 в/в, день1
Циклофосфамид** - 1000 мг/м2 в\в в 1-й день курса (дозу циклофосфамида можно уменьшать в зависимости от особенностей клинической ситуации)
#Преднизолон** - 100 мг внутрь, дни 1 - 5
Лечение возобновляется на 22-й день. Проводят 4 - 6 курсов.
FCR [39]
#Ритуксимаб** - 375 мг/м2 в/в в день 1
#Флударабин** - 25 мг/м2 в/в, в дни 2 - 4
#Циклофосфамид** - 250 мг/м2 в/в, дни 2 - 4
Лечение возобновляется на 29-й день. Проводят 6 курсов
Монотерапия хлорамбуцилом** [40]
#Хлорамбуцил** - 0,1 мг/кг внутрь длительно под контролем клинического анализа крови до фазы плато
Терапия ибрутинибом** [41, 61]
Ибрутиниб** 420 мг внутрь, ежедневно, до прогрессирования или развития непереносимой токсичности
Ибрутиниб** + #Ритуксимаб** [42, 61]
Ибрутиниб** 420 мг внутрь, ежедневно, до прогрессирования или развития непереносимой токсичности; #ритуксимаб** 375 мг/м2 в/в в первый день 1, 2, 3, 4 и 17, 18, 19, 20 недель терапии
Терапия #занубрутинибом [24]
#Занубрутиниб** 160 мг внутрь каждые 12 часов, ежедневно, до прогрессирования или развития токсичности терапии
Монотерапия #акалабрутинибом [23]
#Акалабрутиниб** 100 мг внутрь каждые 12 часов, ежедневно, до прогрессирования или развития токсичности терапии
Приложение А3.2
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ТОШНОТЫ И РВОТЫ
Одним из частых клинически значимых побочных эффектов ПХТ является тошнота и рвота. Эти побочные явления приводят не только к ухудшению самочувствия пациента, снижению качества жизни, но и препятствуют применению лекарственных препаратов в пероральной форме, а также приему пищи. Появление новых комбинаций противоопухолевых препаратов приводит к улучшению результатов терапии онкогематологических больных, однако выраженная тошнота и рвота могут ограничивать применение противоопухолевых препаратов в полных дозах, отрицательно влиять на приверженность больных лечению. В связи с этим контроль тошноты и рвоты играет жизненно важную роль в сопроводительной терапии больных гемобластозами.
Профилактика и лечение тошноты и рвоты проводится с учетом рекомендаций данных в руководстве по сопроводительной терапии при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна [56]
Приложение А3.3
ИНФУЗИОННАЯ ТЕРАПИЯ У ГЕМАТОЛОГИЧЕСКИХ ПАЦИЕНТОВ
Особое место в сопроводительной терапии пациентов с онкогематологическими заболеваниями занимает инфузионная терапия (ИТ). Она используется почти у всех пациентов, находящихся на стационарном лечении.
Инфузионная терапия проводится с учетом рекомендаций данных в руководстве по сопроводительной терапии при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна [58]
Приложение А3.4
ПРИМЕНЕНИЕ
КОМПОНЕНТОВ ДОНОРСКОЙ КРОВИ У ГЕМАТОЛОГИЧЕСКИХ ПАЦИЕНТОВ
Основным медицинским показанием к трансфузии эритроцитов у гематологических пациентов является неадекватная оксигенация органов и тканей и связанный с этим риск осложнений. Переливание донорских тромбоцитов гематологическим пациентам проводят с целью профилактики спонтанных геморрагических осложнений на фоне глубокой тромбоцитопении, индуцированной проведением интенсивной химиотерапии, или с лечебной целью пациентам с уже имеющимися геморрагическими осложнениями. При необходимости восполнения дефицита факторов свертывания универсальным препаратом на сегодняшний день является свежезамороженная плазма (СЗП). Выбор конкретного вида компонента крови для гемотрансфузии (тип эритроцитосодержащего компонента крови, тип концентрата тромбоцитов, тип препарата плазмы) осуществляется лечащим врачом или врачом-трансфузиологом в соответствии с клинической ситуаций и на основании Приказа Минздрава России от 28.10.2020 N 1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология", Приказа Минздрава России от 20.10.2020 N 1134н "О порядке медицинского обследования реципиента, проведения проб на индивидуальную совместимость, включая биологическую пробу, при трансфузии донорской крови и (или) ее компонентов", рекомендациями "Клиническое использование эритроцитсодержащих компонентов крови" (2018 г.), Постановления от 22.06.2019 г. N 797 "Об утверждении правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации", другими нормативными актами.
Заместительная гемотрансфузионная терапия проводится с учетом рекомендаций данных в руководстве по сопроводительной терапии при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна [59]
Приложение А3.5
ОБЕСПЕЧЕНИЕ СОСУДИСТОГО ДОСТУПА
Обеспечение сосудистого доступа является неотъемлемой составляющей частью современной химиотерапии онкогематологических больных. Через центральный венозный катетер (ЦВК) вводятся противоопухолевые препараты, корригируются электролитные нарушения, проводится парентеральное питание, осуществляется взятие образцов крови для исследования и т.д.
Сосудистый доступ определяется с учетом рекомендаций данных в руководстве по сопроводительной терапии при лечении заболеваний системы крови под редакцией Е.Н. Паровичниковой, Г.М. Галстяна [60].
Приложение А3.6
ТРАНСПЛАНТАЦИЯ
АУТОЛОГИЧНЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК. МОБИЛИЗАЦИЯ
И СБОР АУТОСКК
Трансплантация аутологичных гемопоэтических стволовых клеток при терапии МВ в настоящее время рассматривается как опция при рефрактерно\рецидивирующем течении заболевания. Сбор клеток желательно выполнить пациентам моложе 60 лет после проведения эффективной терапии первой линии.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Алгоритм ведения пациента с впервые выявленной МВ:
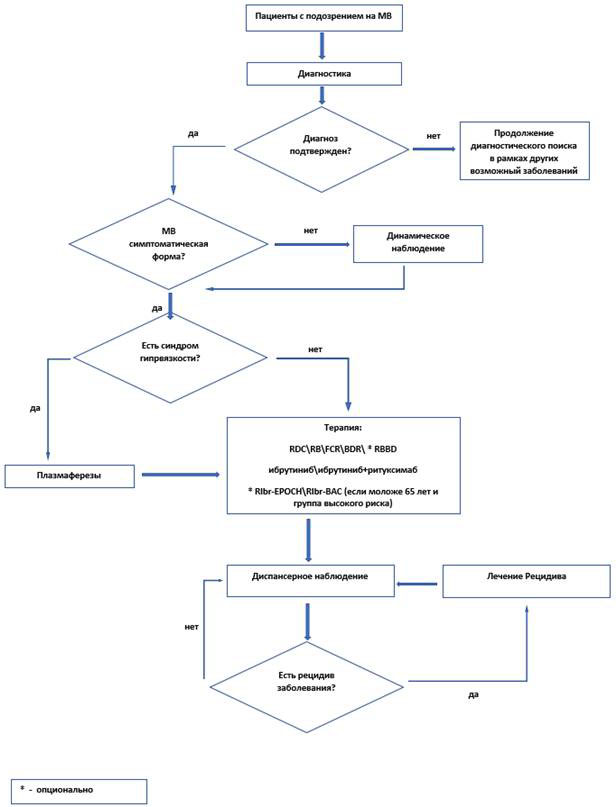
Терапевтический алгоритм.
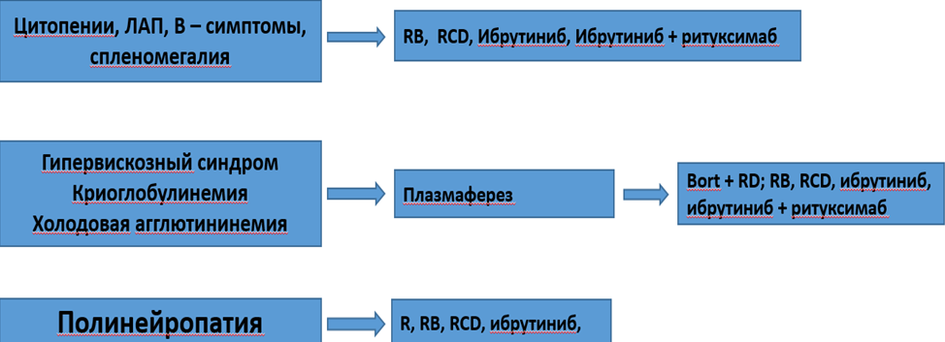
Алгоритм ведения пациента с рецидивами МВ.
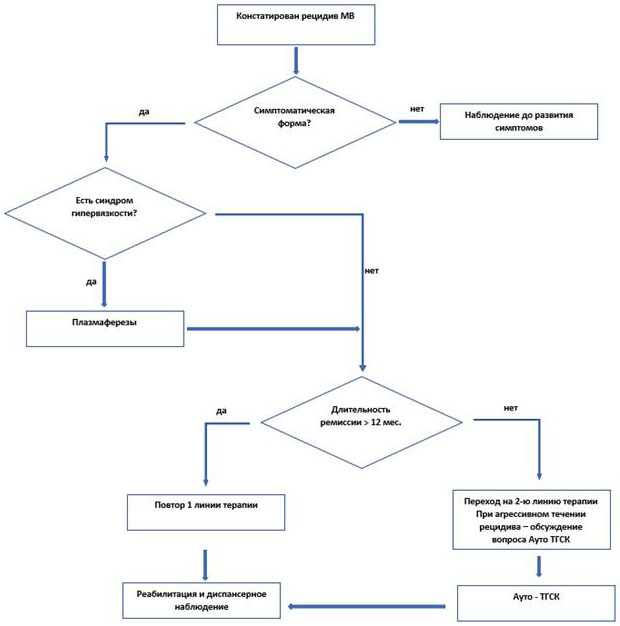
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Макроглобулинемия Вальденстрема (или болезнь Вальденстрема) - это вялотекущее, медленно развивающееся заболевание опухолевой природы, являющееся одной из разновидностей лимфом. На сегодняшний момент это заболевание рассматривается как неизлечимое, но современные инновационные лечебные методики, включающие новые лекарственные препараты и трансплантацию аутологичных гемопоэтических стволовых клеток, позволяют достигать глубоких противоопухолевых ответов, контролировать заболевание и обеспечивать длительную выживаемость с сохранением качества жизни.
Клинические симптомы макроглобулинемии Вальденстрема разнообразны, возникают неожиданно и могут восприниматься пациентами как проявление каких-либо сопутствующих хронических заболеваний. При появлении выраженной слабости, бледности кожных покровов, повышенной кровоточивости, нарушении зрения, неврологической симптоматики необходимо обратиться к врачу и пройти диагностическое обследование.
Обследование включает в себя специальные методики исследования крови и мочи, исследование костного мозга, УЗИ и рентгенологическое исследование. Результаты обследования помогут определить характер заболевания, уточнить тактику терапии и сроки начала специфического лечения.
В некоторых случаях при минимальных проявлениях заболевания от начала специфической терапии возможно временно воздержаться. Но при этом пациент должен находиться под наблюдением гематолога по месту жительства и проходить контрольное обследование каждые 3 - 6 месяцев. При проведении лечения (независимо от метода, избранного лечащим врачом), а также после завершения необходимого объема терапии пациент регулярно должен сдавать анализы крови для оценки эффективности и продолжительности лечения.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ECOG
Клиническая оценка общего состояния пациента с МВ проводится по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group)
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 65
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Смерть
Приложение Г2
МЕЖДУНАРОДНАЯ ПРОГНОСТИЧЕСКАЯ ШКАЛА
Оригинальное название: International prognostic scoring system for Waldenstrom's makroglobulinemia (IPSSWM)
Источник: Morel P, Duhamel A, Gobbi P et al. International prognostic scoring system for  macroglobulinemia. Blood 2009; 113(18): 4163 - 4170. [50]
macroglobulinemia. Blood 2009; 113(18): 4163 - 4170. [50]
Тип: шкала оценки
Назначение: оценка факторов неблагоприятного прогноза при установлении диагноза МВ
Содержание и интерпретация:
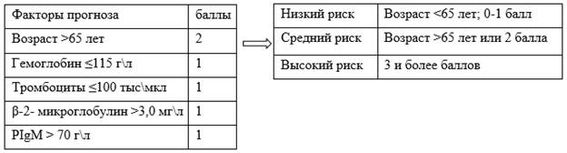
Приложение Г3
ОБНОВЛЕННАЯ МЕЖДУНАРОДНАЯ ПРОГНОСТИЧЕСКАЯ ШКАЛА
Оригинальное название: Revised International prognostic scoring system for Waldenstrom's makroglobulinemia (Revised IPSSWM)
Источник: Kastritis E, Morel P, Duhamel A, DimopoulosMA. et al. A revised international prognostic score system for Waldenstrom"s macroglobulinemia. Leukemia. 2019 Nov; 33(11): 2654 - 2661. doi: 10.1038/s41375-019-0431-y. Epub 2019 May 22. [51]
Тип: шкала оценки
Назначение: оценка факторов неблагоприятного прогноза при установлении диагноза МВ
Содержание и интерпретация: