"Клинические рекомендации "Приобретенная чистая красноклеточная аплазия (эритробластопения)"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПРИОБРЕТЕННАЯ ЧИСТАЯ
КРАСНОКЛЕТОЧНАЯ АПЛАЗИЯ (ЭРИТРОБЛАСТОПЕНИЯ)
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D60.0, D60.1, D60.8, D60.9
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
ID: 804
Разработчик клинической рекомендации
- Национальное гематологическое общество
- Национальное общество детских гематологов, онкологов
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ПККА - парциальная красноклеточная аплазия костного мозга
АДБ - анемия Даймонда-Блекфена
ВИЧ - вирус иммунодефицита человека
ДНК - дезоксирибонуклеиновая кислота
МДС - миелодиспластический синдром
АИГА - аутоиммунная гемолитическая анемия
ОЖСС - общая железосвязывающая способность сыворотки
НТЖ - насыщение трансферрина железом
T-БГЛ - T-клеточный лейкоз из больших гранулярных лимфоцитов
ХЛЛ - хронический лимфолейкоз
Алло-ТГСК - аллогенная трансплантация гемопоэтических стволовых клеток
РТПХ - реакция трансплантат против хозяина
Термины и определения
Парциальная красноклеточная аплазия костного мозга (ПККА) - синдром, характеризующийся изолированной редукцией эритроидных предшественников в костном мозге (эритрокариоциты < 5%), который проявляется развитием изолированной гипорегенераторной анемии.
Анемия Даймонда-Блекфена - редкая форма врожденной аплазии кроветворения, в основном красноклеточной (эритроидной), раннего и детского возраста, развивающаяся в результате дефекта биогенеза рибосом, сопровождающегося апоптозом эритроидных предшественников в костном мозге.
Анемия - снижение концентрации гемоглобина и эритроцитов.
Гипорегенераторная анемия - анемия, протекающая с абсолютной ретикулоцитопенией.
Парвовирус B19 - ДНК-вирус из семейства Parvoviridae, обладающий тропностью к мембранному рецептору эритроидных клеток.
Миелодиспластический синдром - гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации гемопоэтической стволовой клетки и характеризующихся цитопенией, признаками дисмиелопоэза и высоким риском трансформации в острый лейкоз.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
ПККА - синдром, характеризующийся изолированной редукцией эритроидных предшественников в костном мозге (эритрокариоциты < 5%), что проявляется развитием изолированной гипорегенераторной анемии [1, 2].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ПККА представляет собой редкий гематологический синдром, реализующийся вследствие различных патофизиологических механизмов. Принято выделять приобретенную и врожденную форму ПККА [1, 3]. Врожденной формой ПККА является анемия Даймонда-Блекфена, которая имеет ряд уникальных патофизиологических и фенотипических отличий от приобретенных вариантов ПККА. В основе патогенеза анемии Даймонда-Блекфена, наследуемой по аутосомно-доминантному типу, лежат мутации/делеции генов, регулирующих биогенез рибосом, что приводит к развитию макроцитарной гипо- или арегенераторной анемии и врожденных пороков развития (наиболее часто - аномалии лицевого черепа, верхних конечностей, сердца и мочеполовой системы), заболевание дебютирует в раннем детском возрасте [4].
К особой инфекционно-опосредованной форме ПККА относят транзиторный апластический криз, вызванный парвовирусом B19 - состояние, характерное для иммунологически скомпрометированных больных (например, при ВИЧ-инфекции или тяжелом комбинированном иммунодефиците), а также для пациентов с наследственными гемолитическими анемиями [5]. Тропность парвовируса B19 к эритроидным предшественникам обусловлена способностью вируса связываться с мембранным антигеном P (известны случаи устойчивости к парвовирусу B19 у пациентов, чьи эритроидные предшественники не экспрессируют данный антиген) [6]. Предполагается, что отдельные случаи ПККА, в особенности у пациентов с иммунодефицитом, могут иметь патогенетическую взаимосвязь с репликацией вируса Эпштейна-Барр или цитомегаловируса (что косвенно подтверждается эффективностью терапии внутривенным иммуноглобулином у пациентов с ПККА, не имеющих репликации парвовируса B19), однако, в большинстве случаев вирусный агент остается неустановленным.
У детей наиболее часто встречающимся вариантом ПКАА является транзиторная эритробластопения детского возраста (ТЭД). Это доброкачественное заболевание, чаще всего наблюдается в возрасте 18 - 26 месяцев, однако описана у младенцев младше 6 месяцев и у детей в возрасте старше 10 лет. Этиология данного заболевания не известна, предположительная роль вирусной инфекции [7]
За исключением АДБ и транзиторного апластического криза, ассоциированного с парвовирусом B19, большинство случаев ПККА считаются идиопатическими (первичными) и патогенетически-связанными с аутоагрессией T-лимфоцитов, направленной против ранних эритроидных предшественников в костном мозге под действием неизвестных триггеров [1, 8, 9]. Данная концепция подтверждается эффективностью иммуносупрессивной терапии, направленной на T-лимфоциты.
Кроме того, известна ассоциация ПККА с рядом заболеваний, в случае диагностики которых ПККА считают вторичной:
- ПККА на фоне аутоиммунных заболеваний (системная красная волчанка, ревматоидный артрит и другие) [10];
- ПККА после алло-ТГКС [11];
- ПККА, ассоциированная с лимфопролиферативными заболеваниями (хронический лимфоцитарный лейкоз, лейкоз из больших гранулярных лимфоцитов, лимфома Ходжкина, неходжкинские лимфомы и другие) [12 - 14];
- ПККА, ассоциированная с другими онкогематологическими заболеваниями (хронический миелоидный лейкоз и другие) [15];
- ПККА, ассоциированная с солидными опухолями (тимома и другие) [16];
- ПККА, ассоциированная с инфекциями (парвовирус B19, ВИЧ, вирусные гепатиты B и C, туберкулез и другие) [5];
- лекарственно-индуцированная ПККА (Эпоэтин альфа** и другие препараты - табл. 1.) [1, 17];
- ПККА, ассоциированная с беременностью [18].
Таблица 1. Лекарственные препараты, ассоциированные с развитием вторичной ПККА (согласно обзору базы данных PubMed. Включены зарегистрированные на территории России препараты, имеющие более одного упоминания в научных публикациях).
Наименование лекарственного препарата
Механизм развития ПККА установлен
Аллопуринол**
-
Азатиоприн**
+
Карбамазепин**
-
Эпоэтин альфа**
+
Флударабин**
-
Интерферон альфа-2b**
-
Изониазид**
+
Ламивудин**
-
Лейпрорелин**
-
Линезолид**
-
Микофенолата мофетил**
-
Пеницилламин**
-
Прокаинамид**
-
Рибавирин**
-
Сульфасалазин**
-
Такролимус**
-
Ко-тримоксазол [Сульфаметоксазол + Триметоприм]**
-
Вальпроевая кислота**
+
Зидовудин**
-
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ПККА является редким заболеванием, в связи с чем количество эпидемиологических исследований ограничено. По данным одного из моноэтнических исследований заболеваемость приобретенной ПККА составляет 1,06 случая на 1 миллион населения в год [19].
По данным исследования из США, обобщившего результаты наблюдения за 62 пациентами с ПККА в течение 16 лет, медиана возраста больных составила 62 года (диапазон 25 - 87 лет), 52% пациентов имели идиопатическую ПККА, реже регистрировалась ПККА, ассоциированная с тимомой и лейкозом из больших гранулярных лимфоцитов [20].
В ряде публикаций приводится частота развития вторичной ПККА при различных нозологиях. В частности, ПККА являлась осложнением у 1,8 - 14,3% пациентов с тимомой [21 - 24], 28,8 - 68,2% пациентов с лейкозом из больших гранулярных лимфоцитов [25 - 27], 0,5 - 1,5% пациентов с хроническим лимфоцитарным лейкозом [28, 29], 7,5 - 10,5% пациентов, перенесших алло-ТГКС [11, 30].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Рубрики, присвоенные приобретенной чистой красноклеточной аплазии (эритробластопении) в Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10), представлены в табл. 2. [31]
Таблица 2. Рубрики в МКБ-10, присвоенные приобретенной чистой красноклеточной аплазии (эритробластопении).
Нозологическая форма
Рубрика по МКБ-10
Хроническая приобретенная чистая красноклеточная аплазия
D60.0
Преходящая приобретенная чистая красноклеточная аплазия
D60.1
Другие приобретенные чистые красноклеточные аплазии
D60.8
Приобретенная чистая красноклеточная аплазия неуточненнная
D60.9
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В настоящее время не разработана единая классификация ПККА, принимающая во внимания все классификационные признаки, включая этиологию, патогенез заболевания и особенности клинического фенотипа.
В российской литературе используется классификация 1997 г. (табл. 3) [32].
Таблица 3. Отечественная классификация ПККА 1997 г.
1. Идиопатическая ПККА у взрослых
2. Врожденная ПККА (анемия Даймонда-Блекфена)
3. Аутоиммунная гемолитическая анемия, протекающая как ПККА (АИГА-ПККА)
a. Первичная
b. Симптоматическая при:
Ревматоидном артрите
- Системной красной волчанке
- Тиреоидите
- Микротромбоваскулите
- Острых лейкозах
4. Сочетанная с M-градиентом у взрослых
5. Симптоматическая при:
a. Миелопролиферативном синдроме без Ph-хромосомы
b. -5q синдроме
c. Остром лейкозе
d. Хроническом миелолейкозе
e. Хроническом моноцитарном лейкозе
f. Лимфопролиферативных заболеваниях, включая лейкоз из больших гранулярных лимфоцитов
g. Тимоме
h. Парвовирусе B19
В зарубежных публикациях наибольшее распространение получила классификация Wintrobe и Darry M. Williams в модификации J. Lipton и соавторов (табл. 4) [1, 3].
Таблица 4. Классификация ПККА, предложенная Wintrobe и Darry M. Williams в модификации J. Lipton.
1. Врожденная ПККА
- Анемия Даймонда-Блекфена
2. Приобретенная ПККА
- Первичная аутоиммунная ПККА (включая транзиторную эритробластопению детского возраста)
- Первичная миелодиспластическая ПККА
3. Вторичная ПККА, ассоциированная с
- Системными заболеваниями соединительной ткани
i. Системной красной волчанкой
ii. Ревматоидным артритом
iii. Воспалительными заболеваниями кишечника (болезнь Крона, неспецифический язвенный колит)
- Другими иммунными механизмами
i. Алло-ТГКС
ii. Гангренозной пиодермией
- Лимфопролиферативными заболеваниями
i. Хроническим лимфоцитарным лейкозом
ii. Лейкозом из больших гранулярных лимфоцитов
iii. Лимфомой Ходжкина
iv. Неходжскинскими лимфомами
v. Ангиоиммунобластной T-клеточной лимфомой
vi. Множественной миеломой
vii. Макроглобулинемией Вальденстрема
viii. Болезнью Кастлемана
- Другими онкогематологическими заболеваниями
i. Хроническим миелолейкозом
ii. Хроническим миеломоноцитарным лейкозом
iii. Миелофиброзом с миелоидной метаплазией
iv. Эссенциальной тромбоцитемией
v. Острым лимфобластным лейкозом
- Солидными опухолями
i. Тимомой
ii. Раком желудка
iii. Раком легких
iv. Раком молочных желез
v. Холангиокарциномой
vi. Раком щитовидной железы
vii. Почечно-клеточным раком
viii. Карциномой неустановленной первичной локализации
- Инфекционными заболеваниями
i. Парвовирусом B19
ii. ВИЧ
iii. Инфекционным мононуклеозом
iv. Вирусными гепатитами
v. Цитомегаловирусом
vi. Стрептококком группы C
vii. Туберкулезом
viii. Бактериальным сепсисом
- Воздействием лекарственных препаратов/токсинов
i. ПККА, ассоциированная с антителами к эритропоэтину
ii. С другими лекарственными препаратами
- Другими заболеваниями/состояниями
i. Беременностью
ii. Дефицитом рибофлавина
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Специфической клинической картины идиопатической (первичной) ПККА не существует. Пациенты отмечают симптомы гипоксического синдрома, включающие бледность, усиленное сердцебиение, шум в ушах, головную боль, слабость и снижение толерантности к физическим нагрузкам. Постепенное снижение концентрации гемоглобина может способствовать адаптации к анемии, вследствие чего симптомы гипоксии могут быть менее выражены [1].
У пациентов с вторичной ПККА в клинической картине могут доминировать симптомы, обусловленные основным заболеванием [1].
У пациентов с ПККА при массивной гемотрансфузионной нагрузке и отсутствии адекватной хелаторной терапии могут отмечаться симптомы, обусловленные вторичным гемохроматозом: пигментация кожи и слизистых оболочек, эндокринопатия (чаще - сахарный диабет, гипотиреоз, гипогонадизм), нарушение ритма сердца, артралгии, развитие цирроза печени [33].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ПККА основывается на характерной клинико-лабораторной картине заболевания и верифицируется результатами исследования костного мозга, регистрирующими парциальную редукцию эритроидных предшественников.
2.1 Жалобы и анамнез
См. раздел "клиническая картина"
2.2 Физикальное обследование
- Рекомендуется всем пациентам с подозрением на ПККА проведение полного физикального обследования с целью выявления признаков анемического синдрома, клинических проявлений заболеваний, ассоциированных с развитием вторичной ПККА, а также для дифференциальной диагностики с анемией Даймонда-Блекфена [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при физикальном осмотре необходимо обращать внимание на следующие признаки и симптомы заболевания:
- проявления анемического синдрома (слабость, головокружение, головная боль, снижение толерантности к физическим нагрузкам, бледность кожных покровов и видимых слизистых оболочек, тахикардия);
- наличие лимфаденопатии, спленомегалии, синдрома компрессии верхней полой вены с целью дифференциальной диагностики с лимфопролиферативными заболеваниями;
- наличие симптомов опухолевой интоксикации (лихорадка, профузное ночное потоотделение, потеря массы тела > 10% в течение 6 месяцев), характерных для гемобластозов и солидных опухолей;
- кашель, одышка, боли в грудной клетке, дисфагия, проявления компрессионного синдрома, нарушение сердечного ритма, приступы удушья, цианоз, характерные для тимомы;
- признаки полиорганного поражения, характерного для системных заболеваний соединительной ткани (в том числе поражение кожи и слизистых оболочек, суставов и мышц, легких, почек, нервной системы);
- наличие врожденных пороков развития, характерных для анемии Даймонда-Блекфена (аномалии развития черепа, в том числе: гипертелоризм, готическое небо, небная расщелина, плоская спинка носа, микрогнатия, микроцефалия, микроотия, низко расположенные ушные раковины; аномалии кистей рук; патология развития мочеполовой системы).
- симптомы вторичного гемохроматоза, включающие пигментацию кожи и слизистых оболочек, эндокринопатию (чаще - сахарный диабет, гипотиреоз, гипогонадизм), нарушение ритма сердца, артралгии, развитие цирроза печени.
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам с подозрением на ПККА выполнение общего (клинического) анализа крови развернутого, исследования уровня эритроцитов в крови, исследования уровня ретикулоцитов в крови, определение размеров эритроцитов с целью верификации диагноза и дифференциальной диагностики с другими заболеваниями системы крови [1, 2, 34].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: приобретенная ПККА характеризуется развитием изолированной нормохромной, нормоцитарной анемии с резким снижением количества ретикулоцитов (в типичных случаях менее 10,000 клеток/мкл, в относительном выражении < 1%). Количество тромбоцитов и лейкоцитов, лейкоцитарная формула в случае идиопатической ПККА не изменены, в случае вторичной ПККА - зависят от характера основного заболевания [1, 2].
- Рекомендуется всем пациентам с подозрением на ПККА выполнение комплекса биохимических исследований с целью дифференциальной диагностики с анемиями другой этиологии [34]:
- исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, определение активности лактатдегидрогеназы в крови с целью дифференциальной диагностики ПККА с гемолитическими анемиями;
- определение уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня эритропоэтина крови с целью исключения анемии, ассоциированной с заболеванием почек
- определение уровня витамина B12 (цианокобаламин) в крови, исследование уровня фолиевой кислоты в сыворотке крови с целью исключения дефицитного состояния как причины развития гипорегенераторной анемии.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
- Рекомендуется всем пациентам с подозрением на ПККА определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови с целью исключения ВИЧ-инфекции как причины развития вторичной ПККА [35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем взрослым пациентам с подозрением на ПККА определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови с целью исключения вирусного гепатита как причины развития вторичной ПККА [36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется всем пациентам с подозрением на ПККА исследовать сывороточные показатели обмена железа - исследование уровня ферритина в крови, исследование уровня трансферрина сыворотки крови, исследование железосвязывающей способности сыворотки (ОЖСС), исследование уровня железа сыворотки крови и исследование насыщения трансферрина железом (НТЖ) для исключения железодефицитного состояния и верификации вторичного гемохроматоза (у пациентов, которым проводится заместительная терапия эритроцитсодержащими компонентами крови) [9, 37].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: пациенты с ПККА, зависимые от заместительной гемотрансфузионной терапии, находятся в группе высокого риска развития вторичного гемохроматоза [9, 37]. С целью своевременной диагностики данного состояния необходимо контролировать лабораторные параметры обмена железа. При выявлении признаков вторичного гемохроматоза показано назначение хелаторной терапии (раздел 3.1 - консервативное лечение).
- Рекомендуется всем пациентам с подозрением на ПККА получение цитологического препарата путем пункции (стернальная пункция) и цитологическое исследование мазка костного мозга (миелограммы) для оценки клеточного состава костномозгового кроветворения с целью верификации диагноза ПККА и дифференциальной диагностики с анемиями другой этиологии [1, 2, 9].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: верификация диагноза ПККА основана на исследовании костного мозга. При идиопатической (первичной) ПККА клеточность костного мозга не изменена. Патогномоничным признаком ПККА является практически полное отсутствие эритробластов в костном мозге (< 1% эритробластов при дифференцированном подсчете клеток) при отсутствии аномалий других ростков кроветворения [1, 2, 9]. В некоторых случаях может регистрироваться некоторое количество проэритробластов и/или базофильных эритробластов, суммарно не превышающих 5% от дифференцированного подсчета клеток. Крупные проэритробласты с вакуолизированнной цитоплазмой и псевдоподиями являются косвенным признаком ПККА, ассоциированной с парвовирусом B19 [1].
- Рекомендуется всем пациентам с подозрением на ПККА выполнение исследования клеток костного мозга методом дифференциальной окраски хромосом с целью исключения клональных заболеваний системы крови [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при идиопатический (первичной) ПККА цитогенетические нарушения отсутствуют. Выявление клональных аберраций, характерных для МДС, исключает диагноз первичной (идиопатической) ПККА.
- Рекомендуется всем пациентам с подозрением на ПККА определение ДНК парвовируса B19 (Parvovirus B19) в пунктате костного мозга, количественное исследование (A26.30.012.002) и/или определение антител класса M (IgM) к парвовирусу B19 (Parvovirus B19) в крови с целью диагностики ПККА, ассоциированной с парвовирусом B19 [1, 9].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с подозрением на ПККА получение гистологического препарата костного мозга и выполнение патолого-анатомического исследования биопсийного (операционного) материала костного мозга с целью верификации диагноза ПККА и исключения заболеваний системы крови, ассоциированных с развитием вторичной ПККА [1, 2, 9].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с диагностированной ПККА с подозрением на T-клеточный лейкоз из больших гранулярных лимфоцитов проведение иммунофенотипирования периферической крови для выявления субпопуляционного состава лимфоцитов (основные) для верификации диагноза [1, 2, 9].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: T-БГЛ является самой частой причиной развития вторичной приобретенной ПККА и встречается в 15 - 20% случаев [25 - 27].
- Рекомендуется всем взрослым пациентам с диагностированной ПККА проводить исследование уровня иммуноглобулинов в крови: исследование уровня иммуноглобулина A в крови, исследование уровня иммуноглобулина M в крови, исследование уровня иммуноглобулина G в крови, исследование уровня парапротеинов в крови с целью исключения первичного иммунодефицита и дифференциальной диагностики с вторичной ПККА, ассоциированной с парапротеинемией (при болезни Вальденстрема, множественной миеломе или ином заболевании системы крови) [38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: особенности лабораторных диагностических исследований при ПККА после трансплантации аллогенных гемопоэтических стволовых клеток [39, 40]:
Устанавливается на сроке +2 месяца после алло-ТГСК, после исключения вирусных инфекций (парвовирус B19, герпесвирусы), рецидива заболевания, лекарственной токсичности, дефицита железа, фолатов, витамина B12. Наиболее часто развивается при большой несовместимости по системе AB0 реципиента и донора после алло-ТГСК в 30% случаев большой несовместимости (таблица 5).
Критерии диагноза:
- Нормоцитарная анемия с зависимостью от трансфузий эритроцитсодержащих сред.
- Отсутствие ретикулоцитоза в периферической крови (менее 1%).
- Редукция эритроидного ростка или его полное отсутствие при цитологическом исследовании костного мозга (менее 5%).
- Донорский химеризм 95 - 100%.
- Повышение титров изогемагглютининов в периферической крови более чем в 2 раза от исходного значения.
Таблица 5. Виды несовместимости в зависимости от группы крови пар донор-реципиент
Несовместимость по системе AB0
Группа крови
Реципиент
Донор
Малая
A, B, AB
0
AB
A, B
Двунаправленная
A
B
B
A
Большая
0
A, B, AB
A, B
AB
2.4 Инструментальные диагностические исследования
- Рекомендуется: всем пациентам с впервые диагностированной ПККА выполнять компьютерную томографию органов грудной полости для исключения тимомы [32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: частота выявления тимомы у пациентов с ПККА составляет от 7 до 10%. ПККА может как предшествовать диагностике тимомы, так и развиваться уже после тимомэктомии. Для интерпретации исследований могут применяться технологии искусственного интеллекта (при наличии и адаптированности для диагностики при тимоме).
2.5 Иные диагностические исследования
Нет.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
Цель лечения ПККА - достижение нормальной концентрации гемоглобина без потребности в заместительных трансфузиях эритроцитсодержащих компонентов крови. В качестве частичного ответа рассматривается достижение независимости от гемотрансфузионной терапии с клинически-приемлемой концентрацией гемоглобина [1].
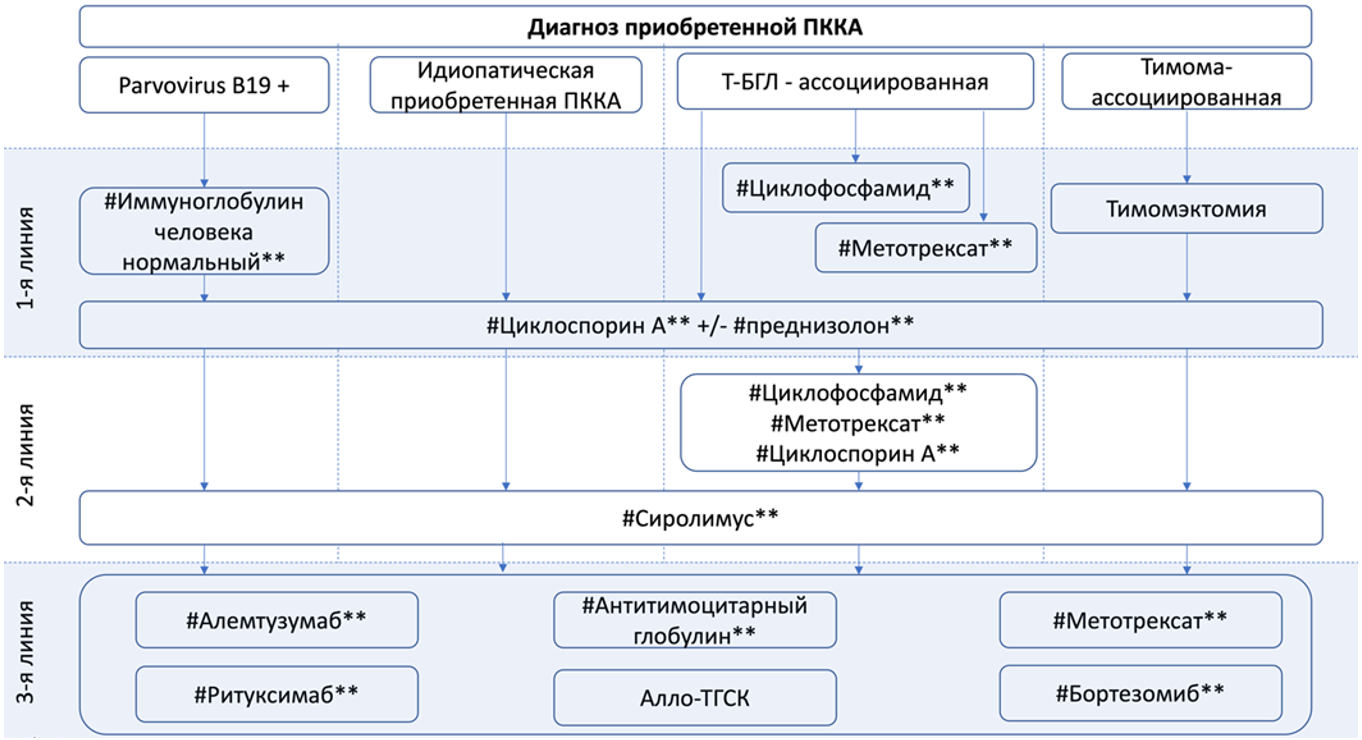
В качестве терапии первой линии у пациентов с идиопатической (первичной) ПККА и вторичными формами ПККА, ассоциированными с T-БГЛ и солидными опухолями применяют иммуносупрессивную терапию. Иммуносупрессивная терапия также применяется у пациентов с вторичной ПККА, рефрактерной к терапии основного заболевания [8, 41, 42]. Препаратом выбора при лечении ПККА, ассоциированной с парвовирусом B19, является внутривенный иммуноглобулин (#иммуноглобулин человека нормальный**) [5, 43].
Большинство детей с транзиторной эритробластопенией детского возраста даже с тяжелой анемией выздоравливают самостоятельно в течение 1 - 2 месяцев после дебюта заболевания, в связи с чем необходимость в терапии отсутствует [7]
Лечение пациентов с вторичной ПККА начинают с терапии основного заболевания. В случае диагностики инфекционного заболевания, ассоциированного с развитием ПККА (ВИЧ-инфекция, вирусные гепатиты, туберкулез и другие), проводят специфическую терапию этого заболевания. Аналогично в случае, если ПККА осложняет течение ХЛЛ, лимфомы Ходжкина, неходжскинской лимфомы или другого лимфопролиферативного заболевания - показано проведение противоопухолевой терапии [1]. В случае приема лекарственных препаратов, ассоциированных с развитием ПККА (табл. 1), целесообразно рассмотреть возможность отмены препарата [1, 44].
ПККА, ассоциированная с беременностью, является редким синдромом и, как правило, разрешается после окончания беременности. У некоторых больных возникает необходимость в проведении заместительной гемотрансфузионной терапии, отдельным показанием к которой является нарушение оксигенации плода. Рекомендуется избегать применения иммунодепрессантов в период беременности в связи с потенциальным негативным воздействием на плод (исключением является #преднизолон**) [18].
- Рекомендуется пациентам с ПККА, ассоциированной с парвовирусом B19, проводить терапию #иммуноглобулином человека нормальным** в суммарной курсовой дозе 2 г/кг (вводимой в течение 2 - 5 дней) внутривенно [5, 43, 45, 46].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: специфическая противовирусная терапия для лечения инфекции, вызванной парвовирусом B19, в настоящее время отсутствует. Терапия #иммуноглобулином человека нормальным** является высокоэффективной при парвовирус-ассоциированной ПККА, однако, у 1/3 пациентов могут возникать рецидивы ПККА, требующие проведения повторных курсов терапии препаратом. Пациенты с доказанным иммунодефицитным состоянием должны получать заместительную терапию #иммуноглобулином человека нормальным** в постоянном режиме в соответствии с клиническими рекомендациями по лечению первичных и вторичных иммунодефицитов.
- Рекомендуется всем пациентам с идиопатической (первичной) ПККА, а также при рефрактерных к терапии основного заболевания вторичных формах ПККА (в том числе, при неэффективности терапии #иммуноглобулином человека нормальным** у пациентов с парвовирус-ассоциированной ПККА), проведение терапии #циклоспорином** в начальной дозе 3 - 5 мг/кг/сутки внутрь в режиме монотерапии или в сочетании с #преднизолоном** 30 мг/сутки внутрь (для детей доза #преднизолона** может быть ниже в соответствии с инструкцией к препарату) [8, 47, 48].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии: суточную дозу #циклоспорина** разделяют на два приема с интервалом в 12 часов. На фоне терапии #циклоспорином** необходим контроль концентрации препарата в крови. Целевая концентрация #циклоспорина** в крови составляет 150 - 250 нг/мл. Для достижения оптимальной концентрации возможна коррекция дозы как в большую, так и в меньшую сторону. Необходимо помнить о потенциальном нефротоксическом действии #циклоспорина** и с осторожностью применять его у пациентов с нарушением функции почек.
После достижения ответа целесообразно быстрое снижение дозы #преднизолона** с последующей полной отменой.
Точная длительность терапии #циклоспорином** в настоящее время не определена, однако, как правило, постепенную отмену препарата начинают не ранее чем через 4 - 6 месяцев после достижения ответа. У ряда пациентов может наблюдаться зависимость от #циклоспорина**, требующая постоянной длительной терапии в поддерживающих дозах. Снижение дозы #циклоспорина** осуществляют постепенно, по 25 - 50 мг (20% от дозы, у пациентов детского возраста) в месяц под контролем показателей крови.
- Рекомендуется всем взрослым пациентам с ПККА при неэффективности терапии #циклоспорином** или при противопоказаниях к терапии #циклоспорином** проводить терапию #сиролимусом в начальной дозе 2 мг/сутки режима монотерапии [47, 49 - 51].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии: целевая концентрация #сиролимуса в крови составляет 4 - 15 нг/мл. Оптимальная длительность терапии не определена. #Сиролимус может использоваться у пациентов со сниженной функцией почек, так как в меньшей степени чем #циклоспорин** влияет на скорость клубочковой фильтрации и выводится преимущественно через кишечник. В процессе терапии #сиролимусом необходимо контролировать показатели функции печени.
- Рекомендуется всем взрослым пациентам с ПККА, ассоциированной с T-БГЛ, проводить терапию одним из следующих препаратов [47]:
#циклофосфамид** 50 - 100 мг/сутки перорально курсом длительностью до 12 месяцев;
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
#метотрексат** 7,5 - 20 мг перорально 1 раз в неделю [52];
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
#циклоспорин** 3 - 5 мг/кг/сутки внутрь ежедневно.
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
- Рекомендуется взрослым пациентам с ПККА, рефрактерной к терапии #циклоспорином** и/или #сиролимусом, проводить терапию одним из следующих препаратов:
- #ритуксимаб** в дозе 375 мг/м2, внутривенно капельно, 4 введения [10, 20, 53];
- #бортезомиб** в дозе 1,3 мг/м2 подкожно, 1 раз в неделю в течение 4 недель [54];
- #иммуноглобулин антитимоцитарный лошадиный 40 мг/кг/сутки, внутривенно капельно в течение 4 дней [47, 55, 56];
- #метотрексат** 7,5 - 20 мг, внутрь, 1 раз в неделю [20, 52];
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- #циклофосфамид** 50 - 100 мг/сутки, внутрь, курсом длительностью до 12 месяцев [47];
- #алемтузумаб** 10 мг в неделю, внутривенно капельно, в течение 4 - 6 недель [20, 47]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Комментарии: в качестве третьей линии терапии могут быть использованы различные иммунодепрессанты. Данные по эффективности и оптимальному режиму применения этих препаратов при ПККА ограничены. Выбор терапии осуществляется клиницистами исходя из соматического статуса пациента, наличия противопоказаний к применению отдельных препаратов.
#Бортезомиб** может быть эффективен при ПККА, развившейся после алло-ТГКС от донора, несовместимого по системе групп крови AB0 или при ассоциированной моноклональной гаммапатии [38, 54].
Эффективность #ритуксимаба** описана при ПККА, ассоциированной с лимфопролиферативными заболеваниями и при посттрансплантационной лимфопролиферативной болезни [53].
- Рекомендуется всем пациентам с ПККА (старше 2 лет) с вторичным (посттрансфузионным) гемохроматозом проведение хелаторной терапии деферазироксом** в начальной дозе 20 - 30 мг/кг/сутки внутрь для лекарственной формы таблетка диспергируемая или таблетки, покрытые оболочкой в дозировке, соответствующей инструкции [32, 33, 57].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
- Рекомендуется у взрослых пациентов моложе 40 лет с ПККА, рефрактерной к двум и более линиям терапии, рассматривать возможность проведения трансплантации костного мозга (A16.05.001) от родственного или неродственного донора [58, 59]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: алло-ТГКС может рассматриваться в качестве терапии спасения у пациентов с резистентным течением ПККА. Пятилетняя общая выживаемость после алло-ТГСК при ПККА составляет 51%, бессобытийная - 40% [59]. Решение о трансплантации должно приниматься трансплантационным центром, имеющим опыт проведения алло-ТГСК у пациентов с синдромами костномозговой недостаточности.
- Рекомендуется у всех пациентов с подозрением на лекарственно-индуцированную ПККА проводить полную отмену (при возможности) или замену лекарственного препарата, который мог стать причиной развития ПККА [44]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: сроки развития лекарственно-индуцированной ПККА могут варьировать от нескольких дней до нескольких месяцев. Список наиболее часто вызывающих ПККА препаратов представлен в таблице 1. Основой тактикой лечения является полная отмена препарата, который вызвал ПККА. При невозможности отмены (прием по жизненным показаниям) необходимо рассмотреть возможность замены на препарат с иным механизмом действия в пределах данного показания. При отсутствии восстановления гемопоэза после отмены предполагаемого препарата - необходимо проведение иммуносупрессивной терапии.
Лечение ПККА после алло-ТГКС у пациентов старше 18 лет:
При выборе метода терапии рекомендуется учитывать риск развития рецидива основного заболевания, наличие реакции "трансплантат против хозяина" (РТПХ), гипофункции трансплантата. Существует несколько терапевтических подходов - проведение процедур плазмафереза с замещением донорской плазмы AB (IV) группы в объеме 2000 мл, при которой происходит механическое удаление изогемагглютининов. Аналогичным методом терапии является селективная плазмосорбция, которая проводится с помощью иммуносорбционных колонок, специфичны для одного антигена A, B или сразу для 2-х антигенов AB. Процедуры проводят с частотой 2 - 3 раза в неделю, суммарно 6 - 8 процедур. Ответ оценивают через 3 - 4 недели от начала терапии [60, 61].
- Рекомендуется взрослым пациентам с ПККА, развившейся после алло-ТГСК, при неэффективности плазмаферезов применение следующих линий терапии:
Введение #ритуксимаба** в дозе 150 - 375 мг/м2 1 раз в неделю, 2 введения. Ответ оценивают через 3 - 4 недели [62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Терапия агонистами тромбоэтиновых рецепторов (АТХ B02BX Другие системные гемостатики) - #элтромбопаг** в начальной дозе 75 мг в сутки в первую неделю, далее 150 мг/сутки. Ответ оценивают через 3 - 4 недели [63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Терапия #даратумумабом** - моноклональным антителом IgG1, анти-CD38 (АТХ L01FC CD38 (кластеры дифференцировки 38) ингибиторы), вводится в дозе 16 мг/кг 1 раз в неделю в течение 4 недель [64, 65].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Трансфузия лимфоцитов донора рекомендуется при наличии гипофункции трансплантата и отсутствии признаков РТПХ [66].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- При возникновении аплазии кроветворения в сочетании с ПККА применяют селектированные CD34+ клетки [30, 67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Введение иммуноглобулина антитимоцитарного**; использование мезенхимальных стромальных клеток; #бортезомиб** в дозе 1,3 г/м2 1 раз в неделю, 4 введения; глюкокортикоиды [67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
3.2 Хирургическое лечение
- Рекомендуется взрослым пациентам с тимома-ассоциированной ПККА в качестве первого этапа лечения проводить хирургическую тимомэктомию с последующим морфологическим исследованием операционного материала (B03.027.033 - комплекс исследований для диагностики злокачественных новообразований вилочковой железы) [21, 32, 68 - 70].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: у пациентов с тимома-ассоциированной ПККА сама по себе тимомэктомия редко приводит к ремиссии ПККА и в большинстве случаев после хирургического лечения требуется назначение дополнительной иммуносупрессивной терапии. Несмотря на это, удаление тимомы с гистологической верификацией диагноза должно проводиться на первом этапе терапии тимома-ассоциированной ПККА. Необходимо помнить, что ПККА может как предшествовать диагностике тимомы, так и развиваться уже после тимомэктомии.
3.3 Гемотрансфузионная терапия
- Рекомендуется проведение гемотрансфузионной терапии эритроцитсодержащими компонентами крови пациентам с ПККА по индивидуальным показаниям с учетом степени тяжести анемии (ориентировочным показанием для выполнения гемотрансфузии является концентрация гемоглобина < 70 г/л), степени адаптации к анемии и характера сопутствующей патологии [1, 57].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: показания для начала гемотрансфузионной терапии должны определяться лечащим врачом в индивидуальном порядке. При определении показаний к трансфузии следует принимать во внимание наличие у пациента сопутствующей патологии, например, ишемической болезни сердца, что может потребовать проведения гемотрансфузионной терапии даже при умеренном снижении гемоглобина. Для пациентов моложе 18 лет и беременных целесообразно использовать лейкоредуцированную эритроцитную взвесь.
Гемотрансфузионная терапия при ПККА после трансплантации аллогенных гемопоэтических стволовых клеток.
Учитывая несовместимость групп крови донора и реципиента, проведение гемотрансфузионной терапии эритроцитсодержащими компонентами крови осуществляется по совместимости по системе AB0 и резус принадлежности, указанных в таблице 6, 7 [71, 72]
Таблица 6. Совместимость по системе AB0 при трансфузиях компонентов крови при AB0-несовместимой алло-ТКМ и алло-ТГСК.
Группа крови реципиента
Группа крови донора
Группа крови для гемотрансфузионной терапии
0
A
0
0
B
0
0
AB
0
A
AB
A, 0
B
AB
B, 0
A
0
0
B
0
0
AB
0
0
AB
A
A, 0
AB
B
B, 0
A
B
0
B
A
0
A2
0
0
A2
A
0
A2
B
0
A2
AB
0
0
A2
0
AB
A2
0
B
A2
0
A
A2
0
A2B
AB
0, B
A2B
0
0
A2B
A
0
A2B
B
B, 0
0
A2B
0
AB
A2B
0, B
A
A2B
0
B
A2B
0, B
Таблица 7. Совместимость при трансфузиях эритроцитсодержащих компонентов крови при несовместимой по резус-принадлежности алло-ТКМ и алло-ТГСК.
Антигены эритроцитов
Резус-принадлежность для гемотрансфузионной терапии
Реципиент КМ и ГСК
Донор КМ и ГСК
D
dd
dd
dd
D
dd
Dweak/Dparcial
D
dd
Dweak/Dparcial
dd
dd
D
Dweak/Dparcial
dd
dd
Dweak/Dparcial
dd
CC
Cc
CC
CC
cc
cc, Cc
Cc
CC
CC
Cc
cc
cc, Cc
cc
CC
CC
cc
Cc
Cc, cc
EE
Ee
EE, Ee
EE
ee
ee
Ee
EE
EE, Ee
Ee
ee
ee
ee
EE
EE, Ee
ee
Ee
Ee, ee, EE
3.4 Диетотерапия
Организация диетического лечебного питания пациентов с ПККА при стационарном лечении в медицинских организациях проводится в соответствии с действующими приказами Министерства здравоохранения Российской Федерации, с учетом соматического статуса и коморбидности пациента, наличия и выраженности цитопении.
3.5. Иное лечение
Не применяется.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специальных методов реабилитации при ПККА не разработано.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Методов профилактики ПККА в настоящее время не существует.
- Рекомендуется всем пациентам с ПККА диспансерный прием (осмотр, консультация) врача-гематолога или врача детского онколога-гематолога (режим определяется в индивидуальном порядке) для ранней диагностики рецидивов и своевременного начала их лечения [57].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: частота наблюдения пациентов с ПККА после завершения лечения не регламентирована. В течение первого года после завершения лечения пациент должен наблюдаться у врача-гематолога или врача детского онколога-гематолога не реже 1 раза в 3 месяца. Далее частота наблюдения устанавливается врачом-гематологом (врачом детским онкологом-гематологом) индивидуально, в зависимости от общего состояния и самочувствия пациента, осложнений проведенной терапии, достигнутого ответа на терапию, но не должна быть реже 1 раза в год. При диспансерном наблюдении, кроме осмотра пациента и сбора анамнеза и жалоб, необходимо выполнение общего (клинического) анализа крови развернутого. Остальные методы обследования могут применяться на усмотрение врача-гематолога или врача детского онколога-гематолога.
6. Организация оказания медицинской помощи
Показания для экстренной госпитализации в медицинскую организацию:
1. Анемия тяжелой степени, требующая экстренных заместительных гемотрансфузий эритроцитсодержащих компонентов крови
Показания для плановой госпитализации в медицинскую организацию:
1. Проведение профилактических трансфузий донорских компонентов крови
2. Обследование пациента с целью верификации диагноза, в том числе включающее проведение биопсии и инвазивных вмешательств, в случаях, когда оно не может быть проведено амбулаторно;
3. Проведение плановых хирургических вмешательств;
4. Проведение алло-ТГКС.
Показания к выписке пациента из медицинской организации
1. регресс симптомов декомпенсации анемии, окончание обследования для верификации диагноза ПККА.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Нет.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Всем пациентам с подозрением на ПККА выполнены общий (клинический) анализ крови развернутый, оценка гематокрита, исследование уровня эритроцитов в крови, исследование уровня ретикулоцитов в крови, определение среднего содержания и средней концентрации гемоглобина в эритроцитах, определение размеров эритроцитов
да/нет
2.
Всем пациентам с подозрением на ПККА выполнен комплекс биохимических исследований:
1) исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, определение активности лактатдегидрогеназы в крови;
2) определение уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня эритропоэтина в крови;
3) определение уровня витамина B12 (цианокобаламин) в крови, исследование уровня фолиевой кислоты в сыворотке крови с целью исключения дефицитного состояния как причины развития гипорегенераторной анемии
да/нет
3.
Всем пациентам с подозрением на ПККА выполнено определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2)
да/нет
4.
Всем пациентам с подозрением на ПККА выполнено определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови
да/нет
5.
Всем пациентам с подозрением на ПККА выполнено исследование сывороточных показателей обмена железа - исследование уровня ферритина в крови, исследование уровня трансферрина сыворотки крови, исследование железосвязывающей способность сыворотки (ОЖСС), исследование уровня железа сыворотки крови и исследование насыщения трансферрина железом (НТЖ) для исключения железодефицитного состояния и верификации вторичного гемохроматоза
да/нет
6.
Всем пациентам с подозрением на ПККА выполнено получение цитологического препарата путем пункции (стернальная пункция) и цитологическое исследование мазка костного мозга (миелограммы)
да/нет
7.
Всем пациентам с подозрением на ПККА выполнено определение ДНК парвовируса B19 (Parvovirus B19) в пунктате костного мозга, количественное исследование и/или определение антител класса M (IgM) к парвовирусу B19 (Parvovirus B19) в крови
да/нет
8.
Всем пациентам с впервые диагностированной ПККА выполнена компьютерная томография органов грудной полости для исключения тимомы
да/нет
9.
Всем взрослым пациентам с ПККА, ассоциированной с парвовирусом B19, проведена терапия #иммуноглобулином человека нормальным**
да/нет
10.
Всем взрослым пациентам с идиопатической (первичной) ПККА, а также при рефрактерных к терапии основного заболевания вторичных формах ПККА (в том числе, при неэффективности терапии #иммуноглобулином человека нормальным** у пациентов с парвовирус-ассоциированной ПККА), проведена терапия #циклоспорином** в режиме монотерапии или в сочетании с #преднизолоном**
да/нет
11.
Всем пациентам с ПККА с вторичным (посттрансфузионным) гемохроматозом назначена хелаторная терапия деферазироксом**
да/нет
Список литературы
1. Means R.T. Pure red cell aplasia//Blood. 2016. Vol. 128, N 21.
2. Means R.T. Pure red cell aplasia: The second hundred years//American Journal of the Medical Sciences. 2023. Vol. 366, N 3.
3. Narla A., Lipton J.M., Means R.T. Red cell aplasia: Acquired and congenital disorders//Wintrobe's Clinical Hematology: Fourteenth Edition. 2018.
4. Ruggero D., Shimamura A. Marrow failure: A window into ribosome biology//Blood. 2014. Vol. 124, N 18.
5. Frickhofen N. et al. Parvovirus B19 as a cause of acquired chronic pure red cell aplasia//Br J Haematol. 1994. Vol. 87, N 4.
6. Brown K.E. et al. Resistance to Parvovirus B19 Infection Due to Lack of Virus Receptor (Erythrocyte P Antigen)//New England Journal of Medicine. 1994. Vol. 330, N 17.
7. Жукова Л.Ю. Х.А.В., К.О.Л., С.Н.Е., Т.А.Н. Транзиторная эритробластопения детского возраста: обзор 39 случаев//Педиатр. 2015. Vol. 6, N 15. P. 44 - 53.
8. Sawada K., Fujishima N., Hirokawa M. Acquired pure red cell aplasia: Updated review of treatment//British Journal of Haematology. 2008. Vol. 142, N 4.
9. Gurnari C., Maciejewski J.P. How I manage acquired pure red cell aplasia in adults//Blood. 2021. Vol. 137, N 15.
10. Lobbes H. et al. Pure red cell aplasia in systemic lupus erythematosus, a nationwide retrospective cohort and review of the literature//Rheumatology (United Kingdom). 2022. Vol. 61, N 1.
11. Aung F.M. et al. Incidence and natural history of pure red cell aplasia in major ABO-mismatched haematopoietic cell transplantation//Br J Haematol. 2013. Vol. 160, N 6.
12. Masuda M. et al. Clonal T cells of pure red-cell aplasia//Am J Hematol. 2005. Vol. 79, N 4.
13. Visco C. et al. Autoimmune cytopenias in chronic lymphocytic leukemia//American Journal of Hematology. 2014. Vol. 89, N 11.
14. Fujishima N. et al. Long-term responses and outcomes following immunosuppressive therapy in large granular lymphocyte leukemia-associated pure red cell aplasia: A Nationwide Cohort Study in Japan for the PRCA Collaborative Study Group//Haematologica. 2008. Vol. 93, N 10.
15. Mijovic A. et al. Chronic myeloid leukemia associated with pure red cell aplasia and terminating in promyelocytic transformation//Am J Hematol. 1989. Vol. 31, N 2.
16. Bernard C. et al. Thymoma associated with autoimmune diseases: 85 cases and literature review//Autoimmunity Reviews. 2016. Vol. 15, N 1.
17. Carson K.R. et al. Clinical characteristics of erythropoietin-associated pure red cell aplasia//Best Practice and Research: Clinical Haematology. 2005. Vol. 18, N 3 SPEC. ISS.
18. Choudry M.A., Moffett B.K., Laber D.A. Pure red-cell aplasia secondary to pregnancy, characterization of a syndrome//Ann Hematol. 2007. Vol. 86, N 4.
19. Nakazawa H. et al. Incidence of acquired pure red cell aplasia: a nationwide epidemiologic analysis with 2 registry databases in Japan//Blood Adv. 2022. Vol. 6, N 24.
20. Balasubramanian S.K. et al. Rational management approach to pure red cell aplasia//Haematologica. 2018. Vol. 103, N 2.
21. Masaoka A. et al. Thymomas associated with pure red cell aplasia. Histologic and follow-up studies//Cancer. 1989. Vol. 64, N 9.
22. Seifi S. et al. Thymoma recurrence and its predisposing factors in Iranian population: A single center study//Tanaffos. 2019. Vol. 18, N 4.
23. Hishida T. et al. Clinical features and prognostic impact of coexisting autoimmune disease other than myasthenia gravis in resected thymomas: Analysis of a Japanese multi-institutional retrospective database//European Journal of Cardio-thoracic Surgery. 2021. Vol. 59, N 3.
24. Maggi G. et al. Thymoma: Results of 241 operated cases//The Annals of Thoracic Surgery. 1991. Vol. 51, N 1.
25. Qiu Z.Y. et al. Methotrexate therapy of T-cell large granular lymphocytic leukemia impact of STAT3 mutation//Oncotarget. 2016. Vol. 7, N 38.
26. Kawahara S. et al. Clinical analysis of 52 patients with granular lymphocyte proliferative disorder (GLPD) showed frequent anemia in indolent T-cell GLPD in Japan//Eur J Haematol. 2009. Vol. 82, N 4.
27. Kwong Y.L. et al. T-cell large granular lymphocyte leukemia: An Asian perspective//Annals of Hematology. 2010. Vol. 89, N 4.
28. Hampel P.J. et al. Autoimmune cytopenias in patients with chronic lymphocytic leukaemia treated with ibrutinib in routine clinical practice at an academic medical centre//Br J Haematol. 2018. Vol. 183, N 3.
29. Tsang M. et al. Pure Red Cell Aplasia (PRCA) in Chronic Lymphocytic Leukemia (CLL): Etiology, Therapy, and Outcomes//Blood. 2015. Vol. 126, N 23.
30. Longval T. et al. Treatment for pure red cell aplasia after major ABO-incompatible allogeneic stem cell transplantation: a multicentre study//Br J Haematol. 2021. Vol. 193, N 4.
31. World Health Organization. ICD-10: international statistical classification of diseases and related health problems: tenth revision. 2nd ed. Geneva PP - Geneva: World Health Organization.
32. Petrenko A.A. et al. Pure red cell aplasia of the bone marrow in combination with thymoma. A literature review and own data//Ter Arkh. 2019. Vol. 91, N 7.
33. Shimizu R. et al. Efficacy and safety of oral deferasirox treatment for transfusional iron overload in pure red cell aplasia patients after allogeneic stem cell transplantation//Annals of Hematology. 2019. Vol. 98, N 7.
34. Hevessy Z. et al. Algorithm of differential diagnosis of anemia involving laboratory medicine specialists to advance diagnostic excellence//Clin Chem Lab Med. 2024. Vol. 62, N 3.
35. Soma P., Ellemdin S., Mashoeshoe K.S. The differential diagnosis of HIV related anaemia should include pure red cell aplasia//HIV and AIDS Review. 2013. Vol. 12, N 4.
36. Teague D. et al. Hepatitis C Infection Associated with Acquired Pure Red Cell Aplasia//Trop Med Infect Dis. 2023. Vol. 8, N 1.
37. Fu R. et al. The clinical characteristics and therapy response of patients with acquired pure red cell aplasia//Hematology. 2018. Vol. 23, N 9.
38. Pivnik A. V. et al. Pure red cell aplasia with M-gradient: A literature review and clinical experience//Klinicheskaya Onkogematologiya/Clinical Oncohematology. 2018. Vol. 11, N 3.
39. Zhu P. et al. Prevalence of Pure Red Cell Aplasia Following Major ABO-Incompatible Hematopoietic Stem Cell Transplantation//Front Immunol. 2022. Vol. 13.
40. Shokrgozar N., Tamaddon G. ABO blood grouping mismatch in hematopoietic stem cell transplantation and clinical guides//International Journal of Hematology-Oncology and Stem Cell Research. 2018. Vol. 12, N 4.
41. Charles R.J. et al. The pathophysiology of pure red cell aplasia: Implications for therapy//Blood. 1996. Vol. 87, N 11.
42. Lacy M.Q., Kurtin P.J., Tefferi A. Pure red cell aplasia: Association with large granular lymphocyte leukemia and the prognostic value of cytogenetic abnormalities//Blood. 1996. Vol. 87, N 7.
43. Crabol Y. et al. Intravenous immunoglobulin therapy for pure red cell aplasia related to human parvovirus B19 infection: A retrospective study of 10 patients and review of the literature//Clinical Infectious Diseases. 2013. Vol. 56, N 7.
44. Thompson D.F., Gales M.A. Drug-Induced Pure Red Cell Aplasia//Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 1996. Vol. 16, N 6.
45. Mouthon L., Guillevin L., Tellier Z. Intravenous immunoglobulins in autoimmune- or parvovirus B19-mediated pure red-cell aplasia//Autoimmunity Reviews. 2005. Vol. 4, N 5.
46. Kurhade K. et al. Multiple modalities in treating pediatric pure red cell aplasia: A case series//Pediatric Hematology Oncology Journal. 2023. Vol. 8, N 3.
47. Lobbes H. et al. Treatment strategy for acquired pure red cell aplasia: a systematic review and meta-analysis//Blood Advances. 2023. Vol. 7, N 21.
48. Biswal N., Narayanan P., Chetan G. Cyclosporine A responsive pure red cell aplasia in a child with systemic lupus erythematosus//Indian Journal of Hematology and Blood Transfusion. 2007. Vol. 23, N 3-4.
49. Long Z. et al. Successful treatment of refractory/relapsed acquired pure red cell aplasia with sirolimus//Ann Hematol. 2018. Vol. 97, N 11.
50. Huang Y. et al. Sirolimus is effective for refractory/relapsed/intolerant acquired pure red cell aplasia: results of a prospective single-institutional trial//Leukemia. 2022. Vol. 36, N 5.
51. Yang Y. et al. Sirolimus versus cyclosporine A in patients with primary acquired pure red cell aplasia: a prospective cohort study//Blood Cancer Journal. 2023. Vol. 13, N 1.
52. Salama Y. et al. Isolated anemia in patients with large granular lymphocytic leukemia (LGLL)//Blood Cancer J. 2022. Vol. 12, N 2.
53. Ghazal H. Successful treatment of pure red cell aplasia with rituximab in patients with chronic lymphocytic leukemia//Blood. 2002. Vol. 99, N 3.
54. Khan F. et al. Subcutaneous bortezomib is highly effective for pure red cell aplasia after ABO-incompatible haematopoietic stem cell transplantation//Transfusion Medicine. 2014. Vol. 24, N 3.
55. Harris S.I., Weinberg J.B. Treatment of red cell aplasia with antithymocyte globulin: Repeated inductions of complete remissions in two patients//Am J Hematol. 1985. Vol. 20, N 2.
56. Gomez-Arteaga A. et al. Use of anti-thymocyte globulin (ATG) for the treatment of pure red cell aplasia and immune-mediated cytopenias after allogeneic hematopoietic cell transplantation: a case series//Bone Marrow Transplantation. 2020. Vol. 55, N 12.
57. Mangla A H.H. Pure red cell aplasia//Treasure Island, FL: FL: StatPearls Publishing. 2021.
58. Passweg J.R., Rabusin M. Hematopoetic stem cell transplantation for immune thrombocytopenia and other refractory autoimmune cytopenias//Autoimmunity. 2008. Vol. 41, N 8.
59. Halkes C. et al. Allogeneic stem cell transplantation for acquired pure red cell aplasia//American Journal of Hematology. 2019. Vol. 94, N 11.
60. Кузьмина Л.А. Петинати Н.А. Л.Л.С. и др. Применение избирательной сорбции изогемагглютининов альфа у больной парциальной красноклеточной аплазией после трансплантации аллогенного костного мозга//Гематология и трансфузиология. 2011. P. 40 - 44.
61. Dellacasa C.M. et al. Efficacy of plasmapheresis for the treatment of pure red blood cell aplasia after allogeneic stem cell transplantation//Transfusion (Paris). 2015. Vol. 55, N 12.
62. Zhidong W., Hongmin Y., Hengxiang W. Successful treatment of pure red cell aplasia with a single low dose of rituximab in two patients after major ABO incompatible peripheral blood allogeneic stem cell transplantation//Transfusion Medicine. 2012. Vol. 22, N 4.
63. Busca A. et al. Eltrombopag for the Treatment of Refractory Pure RBC Aplasia after Major ABO Incompatible Hematopoietic Stem Cell Transplantation//Biology of Blood and Marrow Transplantation. 2018. Vol. 24, N 8.
64. Rautenberg C. et al. Daratumumab for treatment of pure red cell aplasia after allogeneic stem cell transplantation//Bone Marrow Transplantation. 2020. Vol. 55, N 6.
65. Martino R.,  I., Esquirol A. Daratumumab may be the most effective treatment for post-engraftment pure red cell aplasia due to persistent anti-donor isohemagglutinins after major ABO-mismatched allogeneic transplantation//Bone Marrow Transplantation. 2022. Vol. 57, N 2.
I., Esquirol A. Daratumumab may be the most effective treatment for post-engraftment pure red cell aplasia due to persistent anti-donor isohemagglutinins after major ABO-mismatched allogeneic transplantation//Bone Marrow Transplantation. 2022. Vol. 57, N 2.
66. Verholen F. et al. Resistant pure red cell aplasia after allogeneic stem cell transplantation with major ABO mismatch treated by escalating dose donor leukocyte infusion//Eur J Haematol. 2004. Vol. 73, N 6.
67. Marco-Ayala J. et al. Pure red cell aplasia after major or bidirectional ABO incompatible hematopoietic stem cell transplantation: to treat or not to treat, that is the question//Bone Marrow Transplantation. 2021. Vol. 56, N 4.
68. Thompson C.A., Steensma D.P. Pure red cell aplasia associated with thymoma: Clinical insights from a 50-year single-institution experience//Br J Haematol. 2006. Vol. 135, N 3.
69. Yen C.C. et al. Pure Red Cell Aplasia and Other Haematological Diseases Associated With Thymoma: A Case Series and Systematic Review//Front Med (Lausanne). 2021. Vol. 8.
70. Moriyama S. et al. Pure red cell aplasia associated with thymoma: A report of a single-center experience//J Thorac Dis. 2018. Vol. 10, N 8.
71. Камельских Д. В К.М.Е. Подбор компонентов донорской крови в случае трансплантации аллогенного костного мозга и/или аллогенных гемопоэтических стволовых клеток//Гематология и трансфузиология. 2022. P. 112 - 113.
72. Carreras E D.C.M.M.K.N. (editors). The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies, 7th edition. Cham (CH): Springer. 2019. 163 - 169 p.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Члены ассоциации содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество"
1. Паровичникова Е.Н., д.м.н., генеральный директор ФГБУ "НМИЦ гематологии" Минздрава России, главный внештатный специалист-гематолог Минздрава России
2. Лукина Е.А., д.м.н., профессор, зав. отделом орфанных заболеваний ФГБУ "НМИЦ гематологии" Минздрава России
3. Пономарев Р.В., к.м.н., руководитель сектора изучения неопухолевых заболеваний системы крови ФГБУ "НМИЦ гематологии" Минздрава России
4. Латышев В.Д., зав. дневным стационаром гематологии для пациентов с наследственными метаболическими заболеваниями ФГБУ "НМИЦ гематологии" Минздрава России
5. Кузьмина Л.А., к.м.н., заведующая отделением химиотерапии гемобластозов и трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ "НМИЦ гематологии" Минздрава России
6. Королева О.М., врач-гематолог дневного стационара иммунохимиотерапии после трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ "НМИЦ гематологии" Минздрава России
7. Кулагин А.Д., д.м.н., директор Научно-исследовательского института детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова" Минздрава России, главный внештатный специалист-гематолог СЗФО
Члены Российского общества детских гематологов и онкологов:
8. Сметанина Н.С., д.м.н., профессор, заместитель директора Института гематологии, иммунологии и клеточных технологий ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
9. Зубаровская Л.С., д.м.н., профессор, заместитель директора по трансплантации клиники НИИДОГиТ им. Р.М. Горбачевой ФГБОУ ВО Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова Минздрава России
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
a. Врачи-гематологи
b. Врачи-онкологи
c. Врачи-детские онкологи-гематологи
d. Врачи-терапевты
e. Врачи-педиатры
f. Врачи-хирурги
g. Врачи-детские хирурги
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
- Поиск публикаций в специализированных периодических печатных изданиях
- Поиск в электронных базах данных.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств проводилась в соответствии со шкалой оценки уровней достоверности доказательств (УДД) для методов диагностики (Табл. А1) и для методов профилактики, лечения и реабилитации (Табл. А2).
Таблица А1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Описание методики анализа доказательств и разработки рекомендаций:
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в соответствии ее принципам доказательной медицины. Результат изучения влиял на уровень доказательности, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Методологическое изучение фокусировалось на особенностях дизайна исследования, которые оказывали существенное влияние на качество результатов и выводов.
С целью исключения влияния субъективных факторов каждое исследование оценивалось независимо, как минимум двумя независимыми членами авторского коллектива. Различия в оценке обсуждались на совещаниях рабочей группы авторского коллектива данных рекомендаций.
На основании анализа доказательств последовательно были разработаны разделы клинических рекомендаций с оценкой силы в соответствии с рейтинговой схемой рекомендаций (табл. 3).
Методы, использованные для формулирования рекомендаций:
- Консенсус экспертов;
- Оценка значимости рекомендаций в соответствии с рейтинговой схемой (табл. А3).
Таблица А3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Окончательная редакция
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" от 21.11.2011. N 323-ФЗ.
2. Приказ Министерства здравоохранения Российской Федерации от 10.05.2017 N 203н. "Об утверждении критериев оценки качества медицинской помощи".
3. Приказ Минздрава России от 13.10.2017 N 804н (ред. от 16.04.2019 г.) "Об утверждении номенклатуры медицинских услуг"
4. Постановление Правительства РФ от 22 июня 2019 г. N 797 "Об утверждении Правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации"
5. Приказ Минздрава России от 28 октября 2020 г. N 1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "Трансфузиология"
6. Приказ Минздрава России от 26.10.2020 N 1148н "Об утверждении требований к организации системы безопасности деятельности субъектов обращения донорской крови и (или) ее компонентов при заготовке, хранении, транспортировке и клиническом использовании донорской крови и (или) ее компонентов".
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое парциальная красноклеточная аплазия костного мозга (ПККА)?
ПККА - это редкое состояние, которое наблюдается преимущественно у взрослых пациентов. Оно характеризуется развитием анемии (снижением концентрации гемоглобина и количества эритроцитов) при нормальном количестве тромбоцитов и лейкоцитов. Причиной данных нарушений является снижение способности костного мозга к производству эритроцитов.
Что вызывает ПККА?
В настоящее время считается, что большинство случаев ПККА имеет аутоиммунную природу, то есть развитие заболевания является результатом агрессии клеток иммунной системы пациента (в частности, T-лимфоцитов), направленной против собственных стволовых кроветворных клеток. В таком случае ПККА считают первичной или идиопатической. Однако, существуют и другие более редкие причины развития ПККА, к которым относят:
- Аутоиммунные заболевания (такие как системная красная волчанка, ревматоидный артрит и другие);
- Заболевания системы крови, в особенности некоторые варианты лимфом;
- Опухоли вилочковой железы (тимомы);
- Вирусные заболевания, в частности парвовирус-B19;
- Прием лекарственных препаратов, способных нарушать продукцию эритроцитов в костном мозге.
При диагностике этих заболеваний ПККА считают вторичной - т.е. развившейся на фоне основного заболевания.
Какие симптомы характерны для ПККА?
Согласно определению, все пациенты с ПККА имеют анемию. Симптомы анемии включают:
- Слабость;
- Бледность кожи;
- Головокружение;
- Одышку;
- Учащенное сердцебиение.
При вторичной ПККА могут наблюдаться и другие симптомы, связанные с основным заболеванием.
Как устанавливается диагноз ПККА?
Методы диагностики ПККА включают:
- Физический осмотр и сбор анамнеза (истории заболевания);
- Общий (клинический) анализ крови развернутый. Позволяет оценить количество и некоторые морфологические особенности клеток периферической крови. Снижение количества молодых эритроцитов (ретикулоцитов) является важным диагностическим признаком ПККА. Количество тромбоцитов и лейкоцитов при ПККА, как правило, не изменено;
- Исследование костного мозга, включающее пункцию и трепанобиопсию. Несмотря на наличии характерных изменений в общем анализе крови, диагноз ПККА не может быть установлен без исследования костного мозга. При ПККА наблюдается резкое снижение количества эритроидных предшественников в костном мозге, что позволяет верифицировать диагноз;
- Дополнительные лабораторные и инструментальные исследования, которые назначают с целью определения причины развития ПККА и выбора оптимальной тактики лечения.
Как лечится ПККА?
Целью лечения ПККА является восстановление продукции эритроцитов в костном мозге. В зависимости от причины развития ПККА подходы к терапии могут отличаться:
- Для лечения первичной (идиопатической) ПККА, а также для лечения некоторых форм вторичной ПККА применяют препараты, подавляющие чрезмерную активацию иммунной системы (иммуносупрессивная терапия);
- Для лечения ПККА, связанной с парвовирусом B19, применяют препараты внутривенного иммуноглобулина;
- В случае вторичной ПККА, эффективностью может обладать терапия, направленная против основного заболевания;
- Для поддержания концентрации гемоглобина по показаниям могут проводиться трансфузии эритроцитсодержащих компонентов крови;
- Пациентам, которым проводятся регулярные гемотрансфузии, может потребоваться назначение терапии, направленной на выведение железа (хелаторная терапия).
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ,
ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Нет.
